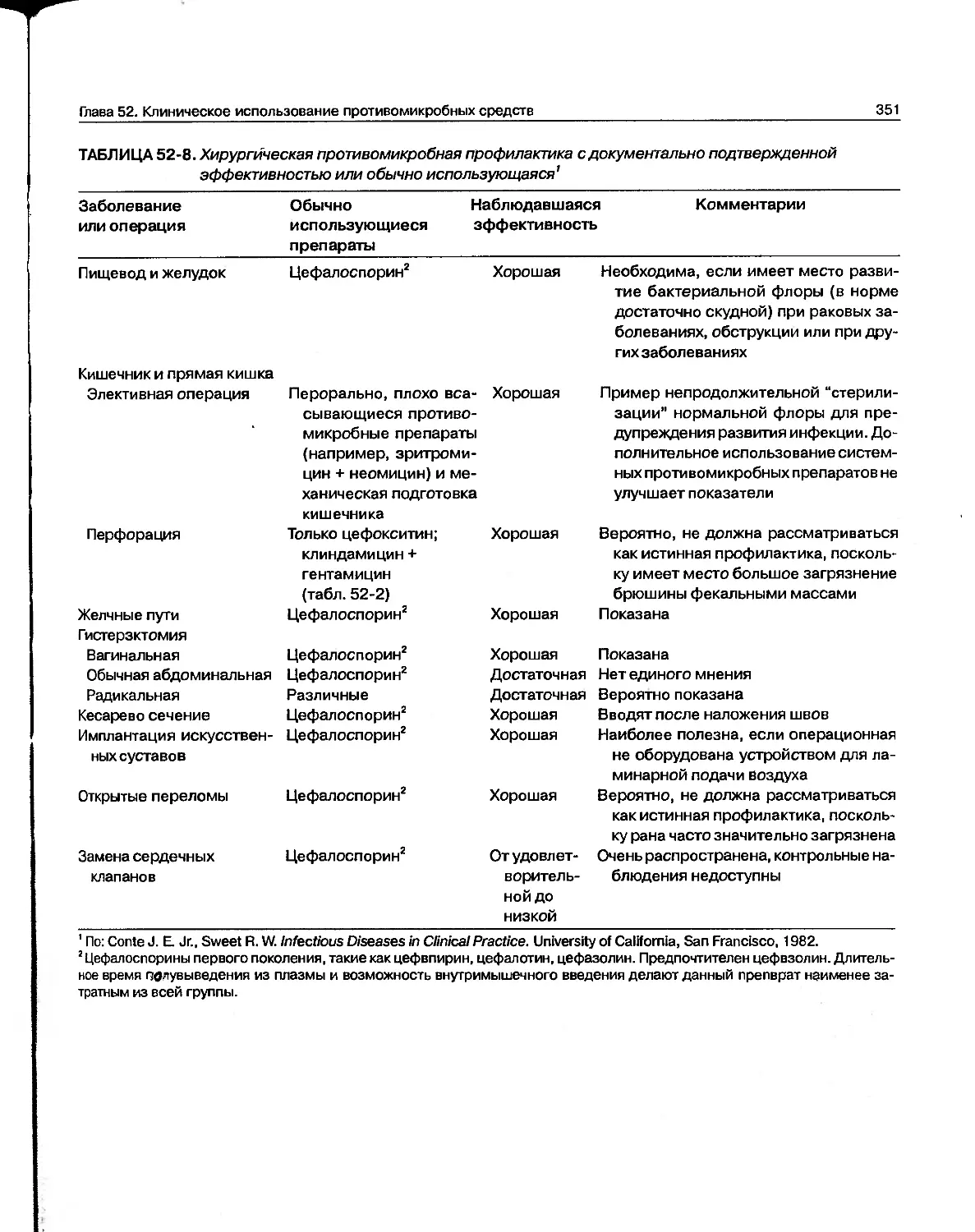
Текст
Раздел VI.
Препараты, применяемые для лечения заболеваний крови, воспаления и подагры Препараты, применяемые для лечения анемий; 32
гемопоэтические факторы роста
КуртА. Райс, Даниэль В. Санти
Железо, витамин В)2 и фолиевая кислота — это химически не связанные между собой компоненты питания, которые необходимы для нормального кроветворения. Недостаточность любого из этих веществ приводит к тяжелой анемии. Железо требуется для синтеза гемоглобина; при отсутствии необходимого количества железа образуются эритроциты с недостаточным содержанием гемоглобина, что и служит причиной развития гипохромной микроцитарной анемии. Витамин В12 и фолиевая кислота необходимы для нормального синтеза ДНК. Недостаток одного из этих витаминов вызывает нарушение синтеза и созревания клеток-предшественников эритроцитов. В результате развивается характерная картина изменений периферической крови и костного мозга, известная под названием мегалобластической анемии.
Эритропоэтин и колониестимулирующие факторы — это гормоны, регулирующие развитие и пролиферацию клеток крови в костном мозге. Они присутствуют в тканях человека в таких минимальных концентрациях, что до недавнего времени не удава
лось получить их для исследований в достаточном количестве. Технология рекомбинантной ДНК позволила решить эту проблему, что кардинально изменило подходы к терапии некоторых заболеваний.
Железо
Общая фармакология
Железо входит в состав ядра железопорфиринового кольца гема, который затем, соединяясь с цепями глобина, формирует гемоглобин. Гемоглобин — это белок, структура которого позволяет ему обратимо связываться с кислородом, осуществляя важнейшую реакцию организма — перенос кислорода из легких в другие ткани. Хотя железо присутствует и в дру гих жизненно важных белках (миоглобин, цитохромы и др.), большая его часть находится в гемоглобине, поэтому главным проявлением дефицита железа является анемия.
Распределение железа у взрослых представлено в табл. 32-1. Примерно 70 % железа в организме че
ловека входит в состав гемоглобина в эритроцитах, 10-20 % депонировано в форме ферритина и гемосидерина. Женщины репродуктивного возраста обычно имеют меньшие запасы железа, чем мужчины, вследствие потерь железа при менструациях и беременностях. Примерно 10 % железа включается в гем-содержащий белок мышц миоглобин. Оставшаяся часть (< 1 %) определяется в следовых количествах в цитохромах и других железосодержащих ферментах, а также в транспортном белке трансферрине.
Фармакокинетика
Железо поступает в организм с пищей в составе гема или в комплексе с органическими соединениями. Лекарственные же препараты железа обычно являются его солями или комплексами с неорганическими соединениями. Такие различия отражаются на абсорбции.
А. Абсорбция. Железо всасывается преимущественно в двенадцатиперстной кишке и в проксимальной части тощей кишки, хотя всасывание может осуществляться и в более дистальных отделах кишечника. Обычная диета американцев содержит примерно 10-15 мг элементарного железа в день. Здоровый человек без дефицита железа абсорбирует 5-10 % этого железа, то есть около 0.5-1 мгв день. Всасывание повышается в случае снижения запасов железа или повышения потребности в нем. Общее всасывание железа достигает 1-2 мг/день у здоровых женщин репродуктивного периода и 3-4 мг/день у беременных. Потребность в железе повышена у новорожденных и подростков в периоды бурного роста. Железо присутствует в разных пищевых продуктах, но больше всего его в белках мяса. Это гемическое железо гемоглобина и миоглобина мяса лучше всасывается, так как в данном случае не требуется распада гемина (феррической формы гема) до элементарного железа. В других пищевых продуктах железо часто прочно связано с фитатами или другими комплексными веществами, поэтому оно всасывается хуже. Негемическое железо в пищевых продуктах и неорганических солях и комплексах железа перед всасыванием в слизистой оболочке кишечника должно сначала превратиться в ферро-форму железа. Его абсорбция снижается в присутствии хелатных или комплексообразующих соединений в просвете кишечника и повышается в присутствии НС1 и витамина С. Резекция желудка снижает абсорбцию железа вследствие угнетения или прекра
щения продукции НС1 и (что, возможно, еще более важно) из-за отсутствия места переваривания пищи с превращением железа в формы, доступные для всасывания в двенадцатиперстной и тощей кишке.
Железо активно транспортируется через слизистую оболочку кишечника. Абсорбированное трехвалентное железо в клетках слизистой оболочки переводится в двухвалентное. Вместе с другими свободными молекулами двухвалентного железа абсорбированное железо либо быстро попадает в плазму в составе трансферрина, либо связывается с ферритином и хранится в слизистой оболочке. При снижении запасов железа или повышении потребности в нем вновь абсорбированное железо немедленно транспортируется из слизистой оболочки в костный мозг для синтеза гемоглобина.
Б. Распределение. Транспортной формой железа является 0-глобулин плазмы — трансферрин, специфически связывающий Fe2+. В составе трансферрина железо попадает из мест хранения в печени или селезенке к развивающимся клеткам эритроидного ростка в костном мозге. Комплекс железа и трансферрина поступает к эритроидным клеткам через особый рецепторный механизм. Рецепторы трансферрина, которые являются интегральными мембранными гликопротеинами и присутствуют в больших количествах на пролиферирующих эритроидных клетках, связываются с комплексом железа и трансферрина и захватывают железо внутрь клетки. Освободившийся от железа трансферрин и
ТАБЛИЦА 32-1. Распределение железа у взрослого здорового человека'-2
Железосодержащие белки Содержание железа (мг)
Мужчины Женщины
Гемоглобин 3050 1700
Миоглобин 430 300
Ферменты 10 8
Транспорт (трансферрин) 8 6
Хранение
(ферритин и гемосидерин) 750 300
Всего 4248 2314
1 Из: Brown Е. В. Iron deficiency anemia. In: Cecil Textbook of Medicine, 16th ed. Wyngaarden J. B., Smith L. H. (eds). Saunders, 1982.
2 Значения взяты из разных источников при допущении, что у “среднего” мужчины масса тела составляет 80 кг и уровень гемоглобина 160 г/л, а у “средней” женщины масса тела составляет 55 кг и уровень гемоглобина 140 г/л.
рецептор трансферрина участвуют в этом процессе снова и снова, являясь эффективным механизмом попадания железа в гемоглобин развивающихся эритроцитов.
В. Хранение. Железо может храниться в двух формах: в составе белков ферритина и гемосидерина. Более доступной формой депонирования железа является ферритин, представляющий собой водорастворимый комплекс, состоящий из центрального кристалла гидроксида двухвалентного железа, покрытого белковой “скорлупой” из апоферритина. Гемосидерин — это твердое вещество, состоящее из агрегатов кристаллов двухвалентного железа, которые совсем или почти совсем не имеют апоферритинового покрытия. И ферритин, и гемосидерин хранятся в макрофагах печени, селезенки и костного мозга. Ферритин присутствует также в слизистой оболочке кишечника и в плазме. Так как существует равновесие между концентрациями ферритина в плазме и в депо (то есть в ретикулоэндотелиальной системе), определение содержания ферритина в плазме (сыворотке) можно использовать для оценки общего количества железа в депо организма.
Г. Выведение. Специального механизма выведения железа не существует. Небольшие его количества теряются с эпителиальными клетками слизистой оболочки кишечника, следовые количества выводятся с желчью, мочой и потом. Однако все эти потери составляют не более 1 мг железа в день. Так как способность организма к выведению железа ограничена, регуляция уровня железа достигается изменением кишечной абсорбции железа в зависимости от потребностей организма.
Д. Регуляция фармакокинетики железа. Абсорбция железа регулируется количеством железа в депо, особенно количеством ферритина в слизистой кишечника, а также скоростью эритропоэза. Усиление эритропоэза приводит к повышению количества трансферриновых рецепторов на развивающихся эритроидных клетках, что, в свою очередь, в определенной степени усиливает всасывание железа в кишечнике. В слизистой оболочке кишечника присутствуют и трансферрин, и ферритин, и оба они регулируют всасывание железа. При дефиците железа количество трансферрина повышается, а количество ферритина понижается, что активизирует всасывание железа. При увеличении количества поступающего железа происходят обратные процессы: уровень трансферрина понижается, а уровень
ферритина повышается, что подавляет дальнейшее всасывание железа.
Клиническая фармакология
А. Показания к применению железа. Единственное показание к применению препаратов железа — это лечение или профилактика железодефицитных анемий. Дефицит железа часто встречается у новорожденных, особенно у недоношенных, у детей в периоды бурного роста, а также у женщин в периоды беременности и лактации. Все эти ситуации связаны с повышением потребности в железе, и таким пациентам часто назначают пероральные препараты железа. Дефицит железа возникает также после гастрэктомии и у пациентов с тяжелыми заболеваниями тонкого кишечника, которые приводят к синдрому генерализованной мальабсорбции. Дефицит железа в таких случаях связан с неадекватным его всасыванием. Однако самая частая причина дефицита железа у взрослых — кровопотеря. Женщины теряют примерно 30 мг железа во время каждой менструации, а при обильных менструациях — еще больше. Главный источник бессимптомной потери крови — это ЖКТ. Поэтому пациентов с железодефицитной анемией неясного генеза следует обследовать на предмет бессимптомного кровотечения в ЖКТ, особенно для исключения рака, который на ранних стадиях, когда опухоль еще можно удалить хирургически, может проявляться только анемией. Истинная алиментарная недостаточность железа, обусловленная плохим питанием, у взрослых встречается редко и не должна считаться причиной до того, как все другие причины исключены самым тщательным образом.
При подозрении на дефицит железа лечение препаратами железа начинают только после подтверждения диагноза. С развитием дефицита железа его количество в депо снижается до нуля, в последующем уменьшается уровень ферритина в сыворотке крови. После этого понижается содержание железа сыворотки и повышается железосвязывающая способность плазмы (трансферрин), то есть понижается насыщение сыворотки железом. В результате развивается анемия. Показатели красной крови (средний корпускулярный объем: норма = 80-100 фл; средняя корпускулярная концентрация гемоглобина: норма = 320-360 г/л) при анемии легкой степени обычно находятся у нижней границы нормы, но по мере прогрессирования заболевания
размеры клеток уменьшаются до микроцитарных, и нарастает гипохромия. К моменту диагностики дефицита железа его уровень в сыворотке уже обычно ниже 400 мкг/л, общая железосвязывающая способность сыворотки превышает 40 мкг/л; насыщение сыворотки железом, как правило, меньше 10 %, а уровень ферритина сыворотки ниже 10 мкг/л. Один из самых чувствительных методов ранней диагностики дефицита железа — это оценка окрашенного препарата костного мозга для определения наличия или отсутствия депо железа.
Б. Лечение. Лечение больных железодефицитными анемиями проводится пероральным или парентеральным введением препаратов железа. Если абсорбция железа из ЖКТ сохранена, при введении внутрь препараты действуют так же быстро и полно, как и при парентеральном введении.
1. Пероральная терапия железом. Существует большой выбор пероральных препаратов железа. Так как железо всасывается лучше всего в ферроформе, используют его соли. Сульфат, глюконат, фумарат железа являются недорогими эффективными препаратами и рекомендуются большинству пациентов. Добавления витамина С и других веществ обычно не требуется. Препараты пролонгированного действия и препараты для растворения в кишечнике использовать не следует, так как железо преимущественно всасывается в двенадцатиперстной кишке и проксимальном отделе тощей кишки.
Разные соли железа содержат разное количество элементарного железа (табл. 32-2). При дефиците этого элемента за день в гемоглобин может попадать примерно 50-100 мт железа, а всасывается примерно 25 % пероральной дозы, принятой в виде той или иной соли. Поэтому для наиболее быстрой коррекции дефицита следует давать ежедневно 200-400 мг элементарного железа.
Пациентам, которые не могут переносить такие большие дозы железа, можно назначать более низкие. В этом случае коррекция дефицита наступит позднее, но все равно будет полной.
Пероральная терапия железом должна продолжаться в течение 3-6 месяцев. Это не только поможет коррекции анемии, но и заново пополнит запасы железа в депо. Первое заметное улучшение в ответ на терапию можно заметить менее чем через неделю. В это время возникает ретикулоцитоз, когда новые молодые полные гемоглобина красные кровяные клетки выходят из костного мозга в кровоток. Уровень гемоглобина значительно повышается через 2-4 недели и, как правило, достигает нормы (для мужчин — 140-180 г/л, дляженщин — 120— 160 r/л) через 1-3 месяца. Причинами неэффективности пероральной терапии могут быть неправильный диагноз (другой вид анемии), продолжающаяся потеря железа (обычно при продолжении потери крови), сопутствующий воспалительный процесс или другая причина подавления активности костного мозга, а также неспособность пациента принимать или абсорбировать препарат.
Побочные эффекты терапии железом обычно проявляются тошнотой, дискомфортом в эпигастральной области, спастическими болями в животе, запором и диареей. Эти эффекты, как правило, дозозависимы и проходят при снижении дозы или при приеме таблеток во время или сразу после еды. У некоторых пациентов нарушения ЖКТ менее выражены при приеме определенных форм железа, поэтому можно попробовать поменять препарат. У пациентов, принимающих железо перорально, кал становится черным; этот эффект не имеет клинического значения, но может затруднить постановку диагноза хронического кровотечения в ЖКТ.
2. Парентеральная терапия железом. Парентеральную терапию следует применять только в слу
ТАБЛ ИЦА 32-2. Некоторые из часто применяемых пероральных препаратов железа
Препарат Количество мг в таблетке Количество элементарного железа в одной таблетке (мг) Обычная доза для взрослых (таблеток в день)
Железа сульфат
(гидратированный) 325 65 3-4
Железа сульфат (сухой) 200 65 3-4
Железа глюконат 320 37 3-4
Железа фумарат 200 66 3-4
Железа фумарат 325 106 2-3
чаях доказанного дефицита железа при невозможности больного переносить или абсорбировать пероральное железо и у пациентов с хронической кровопотерей, которым недостаточно эффекта принимаемого перорально железа. Речь идет о пациентах после резекции желудка и тонкой кишки, с воспалительными заболеваниями проксимальной части тонкой кишки, мальабсорбцией, значительной хронической кровопотерей из повреждений, которые нельзя резецировать, например при наследственной геморрагической телеангиэктазии.
Декстран железа — это стабильный комплекс гидроксида железа и низкомолекулярного декстрана, который содержит 50 мг элементарного железа в 1 мл раствора. Его вводят либо путем глубоких внутримышечных инъекций (с введением шприца по типу буквы “Z”, чтобы не произошло локального окрашивания местных тканей), либо внутривенной инфузией. Побочные эффекты парентерального введения железа включают местную болезненность, коричневое окрашивание тканей в месте инъекции, головную боль, головокружение, лихорадку, артралгии, тошноту, рвоту, боль в спине, покраснение кожи, крапивницу, бронхоспазм и редко — анафилактическую реакцию и смерть.
Общее количество парентерального железа, необходимого для коррекции железодефицитной анемии и для восстановления депо железа у взрослого человека с массой тела 70 кг, можно рассчитать по следующей формуле: требуемое количество железа (г) = 0.25 х (уровень гемоглобина в норме - уровень гемоглобина пациента). Большинству взрослых с железодефицитной анемией, таким образом, требуется 1 -2 г заместительного железа, то есть 20-40 мл декстрана железа. Хотя это количество можно ввести за 10-20 ежедневных внутримышечных инъекций, большинство врачей предпочитают вводить всю дозу одной внутривенной инфузией в 200-400 мл физраствора в течение 1-2 часов. Внутривенное введение не дает локальной болезненности и окрашивания тканей, которые часто присутствуют при внутримышечном введении, кроме того, оно позволяет ввести всю дозу железа, необходимую для коррекции анемии, за один раз. Нет сведений о том, что какие-либо из побочных эффектов, в том числе и анафилактические реакции, возникают чаще при внутривенном введении, чем при внутримышечном.
До проведения инъекции полной дозы декстрана железа вводят небольшую пробную дозу (0.25-
0.5 мл) глубоко в мышцу или медленно внутривенно в виде инфузии сильно разведенного раствора в течение 30-60 минут. Если появляются признаки реакции гиперчувствительности немедленного типа, то введение железа прекращают и рассматривают альтернативные виды терапии. Реакции гиперчувствительности на парентеральное введение декстрана железа чаще возникают у пациентов с аллергией в анамнезе, а также у тех, кто ранее получал железо парентерально.
Токсичность
А. Острая токсичность железа. Острые токсические реакции на железо возникают почти исключительно у детей. Если взрослые переносят большие дозы перорального железа без серьезных последствий, у детей прием всего десяти таблеток препаратов железа может привести к летальному исходу. Поэтому все препараты железа следует хранить в плотно закрытых контейнерах вдали от детей.
Большие количества перорального железа могут вызвать некротический гастроэнтерит с рвотой, болью в животе и кровавой диареей, за которыми следуют одышка, нарушение сознания и шок. Часто после этого наступает некоторое улучшение, но за ним могут последовать тяжелый метаболический ацидоз, кома и смерть. При острой интоксикации железом, особенно у маленьких детей, необходимо принимать неотложные меры. Следует проводить аспирацию желудочного содержимого и лаваж карбонатными растворами для образования нерастворимых солей железа. Для связывания уже всосавшегося железа и для усиления его выведения с калом и мочой вводят эффективное хелатное соединение дефероксамин несколькими внутримышечными инъекциями или продолжительной внутривенной инфузией. Некоторые врачи проводят инстилляцию дефероксамина в желудок для связывания оставшегося свободного железа в кишечнике, но эта методика вызывает споры. Дополнительно необходимо соответствующее поддерживающее лечение кровотечения из ЖКТ, метаболического ацидоза и шока (глава 60).
Б. Хроническая токсичность железа. Хроническая токсичность железа (перегрузка), известная как гемохроматоз или гемосидероз, характеризуется отложением избытка железа в сердце, печени, поджелудочной железе и в других органах, что может привести к органной недостаточности и смерти. Чаще
такая ситуация возникает при гемохроматозе — наследуемом заболевании, при котором повышено всасывание железа, атакже у больных, получающих многократные переливания эритроцитной массы (в каждой трансфузии примерно 250 мг железа) в течение длительного периода времени. Вызывает сомнение возможность возникновения перегрузки железом у здорового человека при длительном приеме больших количеств железа, так как существуют защитные механизмы регуляции его абсорбции, атакже вследствие того, что для перегрузки должно накопиться очень большое количество избыточного железа. Однако постоянный прием избытка железа может привести к проявлениям токсичности у людей с усиленной абсорбцией железа из-за наличия наследственных факторов (субклинический гемохроматоз и т. п.) либо иных, не железодефицитных видов анемии (анемия при хронических заболеваниях, гемолитическая анемия и т. д.).
Хроническая перегрузка железом при отсутствии анемии лучше всего лечится периодической флеботомией: единица объема крови (она содержит 250 мг железа) удаляется приблизительно 1 раз в неделю до полного выведения излишков железа. Железосвязывающая терапия с использованием парентерального дефероксамина значительно менее эффективна и более сложна, дорогостояща и опасна, однако она может помочь при тяжелой перегрузке железом, которую нельзя устранить флеботомией.
Витамин В12 и фолиевая кислота
Общая фармакология
Витамин В12 и фолиевая кислота — химически различные витамины, необходимые для биосинтеза ДНК. Их нехватка приводит к нарушению этого процесса, подавлению нормального митоза и к аномальному созреванию и функционированию образующихся клеток. Эти изменения особенно заметны в тканях, клетки которых быстро делятся, например в костном мозге и эпителии ЖКТ, но в той или иной степени повреждаются все делящиеся клетки. Главное проявление дефицита витамина В12 или фолиевой кислоты — это тяжелая анемия, но возможны также панцитопения (снижение образования как эритроцитов, так и лейкоцитов и тромбоцитов) и нарушения со стороны ЖКТ. При де
фиците витамина B)2, но не фолиевой кислоты, могут наблюдаться неврологические нарушения (раздел “Клиническая фармакология”).
Анемии, вызванные недостатком витамина В)2 или фолиевой кислоты, характеризуются определенными изменениями периферической крови и костного мозга, которые называются мегалобластической анемией. Так как основным дефектом при этих авитаминозах является нарушение синтеза ДНК, то подавляется деление клетки при сохраненном синтезе белка и РНК. Это приводит к образованию крупных (макроцитарных) эритроцитов с высоким показателем РНК : ДНК. Такие эритроциты аномальны и крайне чувствительны к деструктивным воздействиям. При морфологическом исследовании костного мозга отмечается обилие клеток, повышение количества аномальных предшественников эритроцитов (мегалобластов), но крайне малое количество клеток, которые созревают до нормальных эритроцитов. При мегалобластической анемии на фоне дефектов в процессах созревания ядра и деления клетки нормально протекают созревание цитоплазмы эритроцитов костного мозга и синтез гемоглобина.
Теоретически мегалобластическая анемия может возникнуть вследствие любого нарушения синтеза ДНК, на практике же почти все случаи связаны с дефицитом витамина В)2 или фолиевой кислоты. Биохимические и физиологические основы этих нарушений сейчас хорошо известны, механизмы развития этих анемий можно описать на молекулярном уровне.
Химия
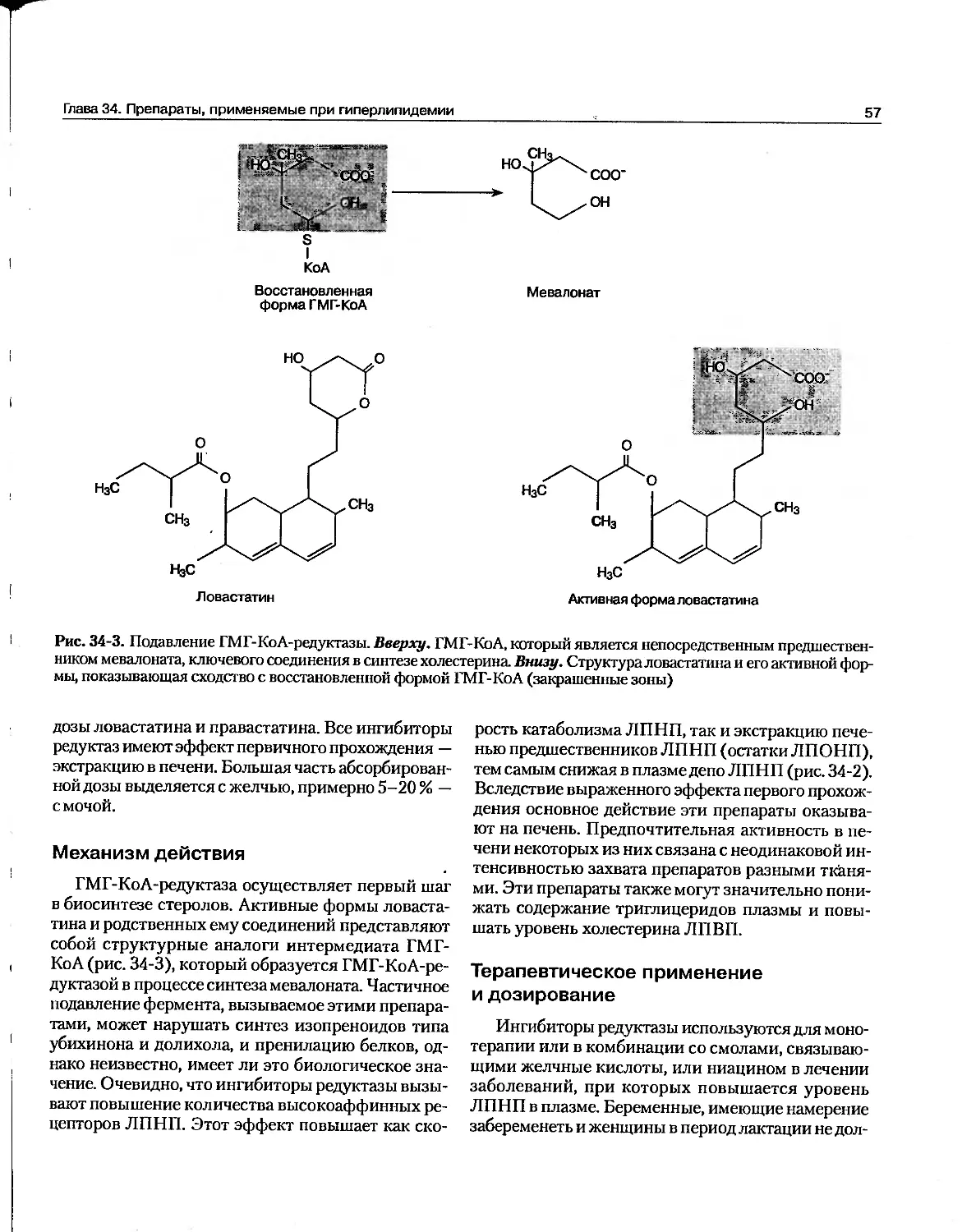
А. Витамин Bi2. Этот витамин состоит из порфириноподобного кольца с центральным атомом кобальта, связанным с нуклеотидом (рис. 32-1). С атомом кобальта могут связываться ковалентными связями различные лиганды, формируя разные кобаламины. У человека активными формами витамина Выявляются дезоксиаденозилкобаламин и метилкобаламин. Цианокобаламин и гидроксикобаламин (оба применяются в клинике) и другие кобаламины, которые находятся в пищевых продуктах, могут превращаться в эти активные формы. Главный источник витамина ВГ2 — микробный синтез; этот витамин не синтезируется растениями или животными. В пище витамин В12, синтезированный микробами, содержится преимущественно в мясе
Рис. 32-1. Цианокобаламин — витамин В12 (R = CN) (Из: Martin D.W. Jr et al. Harper's Review of Biochemistry, 22nd ed. Appleton & Lange, 1990.)
(особенно печени), яйцах и молочных продуктах. Витамин В)2 иногда называют внешним фактором в отличие от внутреннего фактора, который секретируется в желудке.
Б. Фолиевая кислота. Фолиевая кислота (птероилглутаминовая кислота) — это вещество, состоящее из птеридинового гетероцикла, р-аминобен-зойной кислоты и глутаминовой кислоты (рис. 32-2). К птероильной части молекулы может быть присоединено разное количество молекул глутаминовой кислоты. При этом образуются моноглутаматы, диглутаматы и триглутаматы. Полностью окисленное птеридиновое кольцо фолиевой кислоты может восстанавливаться под действием фермента дигидрофолатредуктазы с образованием 7,8-дигидрофолиевой кислоты (Н2-фолат), а затем с образованием полностью восстановленной 5,6,7,8-тет-рагидрофолиевой кислоты (Н4-фолат) (рис. 32-3). Нгфолат может затем образовать кофакторы, содержащие одноуглеродные фрагменты, присоединенные к атому N 5 (5-СН3-Н4-фолат и 5-СНО—Н4-фолат), атому N 10 (Ю-СНО—Нгфолат) или в оба положения (5,10-СН2-Н4-фолат и 5,10-СН+=Н4-фолат) (рис. 32-4). Кофакторы не изменяются в
различных ферментативных реакциях и выполняют важную биохимическую функцию: отдают одноуглеродные фрагменты на разных этапах окисления. В большинстве случаев Н„-фолат регенерируется в этих реакциях и затем снова может утилизироваться. В разных растительных и животных тканях присутствуют разные формы фолиевой кис-
H2N
ОН
Птеридин
„ УСОО'
9 I
СН2 СН2
СН2
\ 1 н 1
L J-C-N-CH и । ПАБК о ООО"
Глутаминовая кислота
Птероил (птероевая кислота)
Фолиевая кислота
Рис. 32-2. Структура и нумерация атомов фолиевой кислоты (Из: Martin D.W. Jr et al. Harper’s Review of Biochemistry, 22nd ed. Appleton & Lange, 1990.)
Тетрагидрофол иевая кислота
Рис. 32-3. Восстановление фолиевой кислоты до тетра-гидрофолиевой кислоты ферментом дигидрофолатредук-тазой (Из: Martin D.W. Jr et al. Harper’s Review of Biochemistry, 22nd ed. Appleton & Lange, 1990.)
лоты; самые богатые источники витамина — дрожжи, печень, почки и зеленые овощи.
Фармакокинетика
А. Витамин В12. Диета американца содержит в среднем 5-30 мкг витамина В12 в день, из которых обычно всасывается 1-5 мкг. Значительные количества витамина хранятся преимущественно в печени (у взрослого примерно 3000-5000 мкг). С мочой и калом теряются только следовые количества. Так как нормальные потребности в витамине В12 составляют всего 2 мкг в день, потребуется целых 5 лет, чтобы в случае прекращения абсорбции витамина В12 организм израсходовал все его запасы и
развилась мегалобластная анемия. Витамин В12 всасывается в физиологических количествах только в присутствии внутреннего фактора. Внутренний фактор — это гликопротеид с мол. м. приблизительно 50 000, который секретируется париетальными клетками слизистой оболочки желудка. В комплексе с витамином В)2, высвобожденным из пищевых источников в желудке и двенадцатиперстной кишке, он всасывается в дистальном отделе слепой кишки путем высокоспецифичного рецепторного транспортного механизма. Дефицит витамина В)2 у человека чаще всего обусловлен его мальабсорбцией вследствие недостатка внутреннего фактора или нарушения специфического механизма абсорбции в дистальном отделе слепой кишки.
После абсорбции витамин В12, связанный с гликопротеидом плазмы транскобаламином II, транспортируется по всему организму. Избыток витамина депонируется в печени. Значительное выделение витамина В)2 с мочой происходит только в тех случаях, когда его парентерально вводят в очень больших количествах, превосходящих связывающую способность транскобаламинов (50-100 мкг).
Б. Фолиевая кислота. Диета американца содержит в среднем 500-700 мкг фолатов в день, из них в зависимости от метаболических потребностей всасывается 50-200 мкг (беременные могут абсорбировать до 300-400 мкг в день). Обычно примерно 5-20 мг фолатов хранится в печени и других тканях. Фолаты выделяются с мочой и калом, а также разрушаются катаболически, то есть после прекращения приема уровень кислоты в крови снижается. Так как запасы витамина в организме низкие, а потребность в нем высока, через 1-6 месяцев после прекращения поступления фолиевой кислоты в организм (в зависимости от питания пациента и скорости утилизации фолата) могут развиться дефицит фолиевой кислоты и мегалобластическая анемия.
Фолиевая кислота легко и полностью всасывается в проксимальном отделе тощей кишки. Однако фолаты пищи в основном состоят из полиглута-матных форм 5-СН3—Нгфолата и лишь очень небольшого количества неизмененного фолата. До абсорбции все, кроме одного глутаматного остатка полиглутаматов, должны быть гидролизованы ферментом a-L-глутаматтрансферазой (“конъюгазой") в пределах реснитчатой каемки слизистой оболочки кишечника. Моноглутамат 5-СН3—ЬД-фолат затем попадает в кровяное русло путем активного или
Н4 фолат
-Серин Глицин
Н2 Н
СН2
-О
Формиат
№, М10-метилен-Н4-фолат (5,10-СН2 —Н4-фолат)
НАДФН + Н+
№ -метил-Н4-фолат (5-СНз—Н4-фолат)
N10 -формил-Н4-фолат (Ю-СНО —Н4-фолат)
№, М10-метенил-Н4-фолат (5,10-СН+=Н4-фолат)
н
N^xH2 к LH
Й ?2 n10 Й,Э'-
№ -формил-Н4-фолат (5-СНО—Н4-фолат)
Рис. 32-4. Превращения одноуглеродных фрагментов, присоединенных к тетрагидрофолату (Из: Martin D.W. Jret al. Harper’s Review of Biochemistry, 20th ed. Lange, 1985.)
пассивного транспорта и далее распространяется по всему организму.
Фармакодинамика
А. Витамин В12. У человека существуют две основные ферментативные реакции, которые требуют присутствия витамина Bt2 (рис. 32-5). В одной из них дезоксиаденозилкобаламин является необходимым кофактором превращения метилмалонил-СоА в сук-цинил-СоА ферментом метилмалонил-СоА-мута-зой. При дефиците витамина В12 реакция не идет, и накапливается субстрат — метилмалонил-СоА. В результате синтезируются аномальные жирные кислоты, встраивающиеся в мембраны клеток. Считается, что в ЦНС это нарушение приводит к неврологическим проявлениям дефицита витамина В12.
Другая ферментативная реакция, для которой требуется витамин В12, — это превращение 5-СН3—
Нгфолата в Н4-фолат и гомоцистеина в метионин ферментом 5-СН3—Нгфолат-гомоцистеин-метил-трансферазой (рис. 32-5Б). В этой реакции кобаламин и метилкобаламин переходят друг в друга, и витамин можно считать истинным катализатором. При дефиците витамина В12 превращение основного пищевого и хранящегося в депо 5-СН3—Н4-фо-лата в предшественник кофакторов, Нгфолат, произойти не может. В результате аккумулируется 5-СН3—Н4-фолат и развивается дефицит кофакторов, необходимых для синтеза ДНК. Этот биохимический механизм (так называемая “метилфола-товая ловушка”) соединяет витамин В|2 и фолиевую кислоту и объясняет, почему при дефиците витамина В12 мегалобластическая анемия (но не неврологические нарушения) может быть частично устранена с помощью фолиевой кислоты.
Б. Фолиевая кислота. Как уже упоминалось, основная роль фолатов — это образование кофакторов,
А. Метилмалонил-СоА-мутаза
СОгН Дезоксиаденозил-
I кобаламин
СН3СНСО~СоА----------------> НО2ССН2СН2СО~ СоА
L -Метилмалонил- Сукцинил-СоА
СоА
В. 5СН3— Нд-фолат-гомоцистеин-метилтрансфераза
Рис. 32-5. Ферментативные реакции с участием витамина В|2
необходимых для реакций переноса одноуглеродных фрагментов в ходе синтеза азотистых оснований ДНК. Такой синтез пуринов de novo включает две ферментативные реакции с участием этих кофакторов. В них Ю-СНО—Нгфолат и 5,10-СН+=Н4-фо-лат (рис. 32-4) становятся донорами одноуглеродных фрагментов, чтобы в конечном итоге образовать атомы С2 и С8 пуринового гетероцикла. В обеих этих реакциях Нгфолат снова регенерируется и может опять принимать на себя одноуглеродные фрагменты и становиться кофактором.
Другая важная реакция, для которой необходим фолат,— синтез тимидиловой кислоты (2'-дезокси-тимидинмонофосфата — дТМФ), важного предшественника ДНК. В этой реакции фермент тимиди-латсинтетаза катализирует перенос одноуглеродных фрагментов 5,10-СН2—Нгфолата в положение С5 пиримидина 2'-дезоксиуридинмонофосфата (дУМФ) с образованием дТМФ (рис. 32-6). В отличие от других ферментативных реакций с учас
2’-Дезоксиуридил ат (ДУМФ)
№, Ь110-метилен-Н4-фолат
Метотрексат
Дигидрофолат
Тимидилат-синтетаза
2’-Дезокситимидилат (ДТМФ)
Рис. 32-6. Перенос метильной группы с №,№°-метилен-Н4-фолата на дезоксиуридилат с образованием дезокситимидилата и дигидрофолата (Н2-фолата) (Из: Martin D.W. Jr et al. Harper’s Review of Biochemistry, 20th ed. Lange, 1985.)
тием фолатных кофакторов в этой реакции кофактор окисляется до Н2-фолата, и на каждый моль образованного дТМФ потребляется моль Н<фола-та. В быстро пролиферирующих тканях в этой реакции потребляются значительные количества Н4-фолата, и постоянный синтез ДНК требует постоянного восстановления Н2-фолата в Н4-фолат (эта реакция катализируется дигидрофолатредуктазой). Образуемый Н4-фолат может затем снова превращаться в кофактор СН2—Нрфолат с помощью сериновых трансгидрометилаз, регулируя таким образом синтез дТМФ. Комплекс реакций, катализируемых дТМФ-синтетазой, дигидрофолатредуктазой и сериновой трансгидрометилазой, часто называют циклом синтеза дТМФ (рис. 32-7).
Клиническая фармакология
Витамин В12 и фолиевая кислота должны применяться только для лечения или профилактики их недостаточности. Не доказано, что инъекции витамина В(2 полезны тем, у кого нет недостаточности этого витамина. Однако прием фолиевой кислоты может помочь предотвратить ее дефицит у пациентов группы риска с высокими потребностями в фолиевой кислоте.
Самое характерное проявление дефицита витамина В12 и фолиевой кислоты — мегалобластическая анемия. Любого пациента с макроцитозом при наличии или отсутствии анемии следует обследовать на предмет недостаточности витамина В(2 или фолиевой кислоты. Хотя у большинства пациентов
Рис. 32-7. Цикл синтеза дТМФ. 1 — дТМФ-синтетаза; 2 — редуктаза Н2-фолата; 3 — трансгидроксиметилаза серина
с неврологическими нарушениями при дефиците В]2 при первом же осмотре обнаруживается выраженная мегалобластическая анемия, у отдельных больных не выявляются значительные гематологические нарушения, что затрудняет постановку диагноза. Особенно важно отличать дефицит витамина Bi2 от других форм мегалобластической анемии, так как лечение витамином В12 в большинстве случаев продолжается пожизненно. Коррекция гематологических проявлений дефицита витамина В12 может частично проводиться и большими дозами фолиевой кислоты, однако неврологические нарушения при этом будут только прогрессировать и становиться необратимыми.
Типичное клиническое проявление мегалобластической анемии — это макроцитарная анемия (средний корпускулярный объем (MCV) обычно превышает 120 фл), часто с сопутствующими умеренными лейкопенией или тромбоцитопенией (или их сочетанием) и с характерной гиперцеллюлярно-стью костного мозга с мегалобластным созреванием эритроидных и других клеток-предшественников. Как только поставлен диагноз мегалобластической анемии, следует определить, связана ли она с дефицитом витамина Bi2 или фолиевой кислоты (другие причины мегалобластической анемии встречаются крайне редко). Это можно сделать с помощью измерения концентраций витаминов в сыворотке, хотя это исследование и дает иногда ложноположительные или ложноотрицательные результаты. Уровень фолиевой кислоты в эритроцитах имеет большее диагностическое значение, чем сывороточный уровень, так как последний очень лабилен и не всегда отражает содержание фолиевой кислоты в тканях. Для дальнейшего определения механизма мальабсорбции витамина В12при выявлении его дефицита можно использовать тест Шиллинга, который позволяет измерить абсорбцию и почечную экскрецию меченного радиоактивным изотопом витамина В12.
А. Дефицит витамина В12. Дефицит витамина В,2 почти всегда вызван его мальабсорбцией либо вследствие нехватки внутреннего фактора, либо из-за дефектов абсорбции комплекса внутренний фак-тор-витамин В i2 в дистальной части слепой кишки. Самые частые причины дефицита витамина В)2— это пернициозная анемия, частичная или полная гастрэктомия, а также заболевания дистальной части слепой кишки, например синдромы мальабсорбции, воспалительные заболевания кишечника или
резекция тонкой кишки. Алиментарная нехватка витамина В12 встречается редко, но иногда возникает у строгих вегетарианцев после многих лет исключения из пищи мяса, яиц или молочных продуктов.
Пернициозная анемия является следствием нарушения секреции внутреннего фактора клетками слизистой оболочки желудка. Особенно часто она встречается у пожилых людей, живущих в Северной Европе, но может возникать у людей любого возраста и расы. У больных пернициозной анемией развивается атрофия слизистой оболочки желудка с нарушением секреции хлороводородной кислоты (так же, как и внутреннего фактора). Тест Шиллинга показывает снижение всасывания витамина B)2, меченного радиоактивным изотопом, которое корректируется при введении искусственного внутреннего фактора. Пернициозная анемия — пожизненное заболевание, требующее постоянных инъекций витамина Bi2.
При полной или частичной гастрэктомии отсутствует часть желудка, содержащая париетальные клетки, секретирующие внутренний фактор, что приводит к мальабсорбции витамина Bi2, похожей на таковую при пернициозной анемии. Так как запасы витамина В12 сохраняются еще в течение пяти лет после гастрэктомии, мегалобластная анемия до этого времени обычно не развивается. Тем не менее многие клиницисты сразу после гастрэктомии назначают инъекции витамина B(2 во избежание развития его дефицита в дальнейшем.
Дефицит витамина Bi2 возникает и при повреждении дистальной части подвздошной кишки, в которой происходит всасывание комплекса внутренний фактор-витамин В12, например при воспалительных заболеваниях кишечника, тропическом спру, резекции подвздошной кишки. В этих случаях витамин В12, меченный радиоактивными изотопами, не всасывается в тесте Шиллинга даже при добавлении внутреннего фактора. Другие редкие причины дефицита витамина В)2 — это рост бактерий в тонкой кишке, синдром слепой петли, инвазия широкого лентеца, хронический панкреатит и заболевания щитовидной железы. У детей возможна врожденная нехватка внутреннего фактора или селективная мальабсорбция витамина В)2 в связи с рецепторными особенностями слепой кишки.
Так как в основном дефицит витамина В12 связан с нарушением его всасывания, для лечения необходимы парентеральные инъекции витамина. У людей с потенциально обратимыми заболевани
ями (инвазия широкого лентеца, тропическое спру, синдром слепой петли) причину следует устранить, проводя соответствующее лечение, после начальной парентеральной терапии витамином В]2. Однако большинству пациентов требуется пожизненное лечение витамином В12, поскольку причина дефицита у них необратима.
Витамин Bp для парентеральных инъекций имеется в виде цианокобаламина или гидроксикобаламина. Предпочтителен гидроксикобаламин, так как он лучше связывается с белками и поэтому дольше циркулирует в организме. Начальная терапия состоит из 100—1000 мкг витамина В)2 внутримышечно ежедневно или через день в течение 1-2 недель для восстановления его запасов в организме. При поддерживающей терапии 100-1000 мкг витамина В|2 вводят раз в месяц в течение всей жизни. Для коррекции неврологических нарушений инъекции следует назначать один раз в 1-2 недели в течение 6 месяцев с последующим переходом на инъекции один раз в месяц. При дефиците витамина Bi2 не рекомендуется использовать пероральные микстуры комплекса витамина B]2h внутреннего фактора или экстрактов печени. Однако для лечения пациентов с пернициозной анемией, которые отказываются от инъекций или не могут их переносить, обычно достаточно 1000 мкг витамина В(2 в день перорально.
Гематологическая реакция на витамин В12 возникает очень быстро. Костный мозг нормализуется, как правило, в течение 48 часов. Ретикулоцитоз возникает на второй или третий день и достигает максимума к пятому-десятому дням. Содержание гемоглобина начинает повышаться на первой неделе приема и достигает нормы к концу первого-второго месяца. Неполная коррекция анемии может быть связана с сохранением дефицита других факторов (например, при смешанном дефиците витамина В12 и железа) или с наличием воспалительного или другого заболевания, которое подавляет эритропоэз.
Б. Дефицит фолиевой кислоты. В отличие от дефицита витамина B)2 дефицит фолиевой кислоты нередко вызывается неадекватным ее потреблением с пищей. Пожилые пациенты, люди с финансовыми затруднениями и те, у кого в диете отсутствуют овощи, яйца и мясо, часто страдают дефицитом фолиевой кислоты. Длительная термообработка овощей разрушает фолаты и может привести к дефициту фолиевой кислоты при отсутствии других пищевых источников этого витамина. Алкоголики
и больные с заболеваниями печени страдают дефицитом фолиевой кислоты вследствие плохого питания и нарушения ее печеночного депонирования. Имеющиеся данные подтверждают то, что алкоголь и поражения печени нарушают всасывание и метаболизм фолатов. Беременные и больные с гемолитической анемией имеют повышенную потребность в фолатах, и при недостаточном их потреблении у них может развиться дефицит. В недавних исследованиях установлена связь дефицита фолиевой кислоты у матери и дефекта развития нервной трубки у новорожденного (например, spina bifida). Пациенты с тропическим спру и другими синдромами мальабсорбции также часто страдают дефицитом фолиевой кислоты, может быть, в связи с недостаточностью кишечной конъюгазы. Дефицит фолиевой кислоты иногда наблюдается при онкологических заболеваниях, лейкозе, миелопролиферативных заболеваниях, некоторых хронических заболеваниях кожи, а также при других тяжелых хронических болезнях. Возникает дефицит фолиевой кислоты и у больных, проходящих диализ, так как фолаты остаются в диализате при каждой процедуре.
Дефицит фолиевой кислоты может быть вызван препаратами, которые нарушают абсорбцию или метаболизм фолата. Фенитоин и некоторые другие противосудорожные препараты, оральные контрацептивы и изониазид могут нарушать всасывание фолиевой кислоты, возможно, путем ингибирования кишечных конъюгаз. Препараты типа метотрексата и, в меньшей степени, триметоприма и периметамина подавляют дигидрофолатредуктазу и могут привести к дефициту фолатных кофакторов и в конце концов — к мегалобластической анемии (рис. 32-3).
Парентеральное введение фолиевой кислоты требуется редко, так как она хорошо всасывается перорально, даже при мальабсорбции. Для лечения мегалобластической анемии и восстановления депо фолатов почти у всех пациентов достаточно 1 мг препарата перорально в день. Лечение следует продолжать до коррекции причинного заболевания. Больным с неадекватной диетой или с мальабсорбцией может потребоваться пожизненное лечение. Пациентам группы риска, например беременным, алкоголикам и пациентам с гемолитической анемией, заболеваниями печени, некоторыми кожными заболеваниями и находящимся на почечном диализе, целесообразно проводить поддерживающую терапию фолиевой кислотой.
Реакция пациентов с дефицитом фолиевой кислоты на ее пероральное введение очень быстрая и полная и напоминает реакцию на витамин В12 при коррекции его дефицита. Уровень гемоглобина начинает подниматься уже на первой неделе лечения, а полная коррекция анемии достигается в течение 1-2 месяцев.
Клиническая токсикология
Витамин В12 и фолиевая кислота не вызывают известных токсических эффектов даже при введении в очень больших количествах. Эти витамины легко выводятся с мочой и в меньшей степени — с калом, то есть длительного повышения их концентраций в тканях не возникает. Цианкобаламин даже в огромных дозах не вызывает отравления цианидами.
Гемопоэтические факторы роста
Гемопоэтические факторы роста — это гликопротеиновые гормоны, которые регулируют пролиферацию и дифференцировку клеток-предшественников гемопоэза в костном мозге. Первые открытые факторы роста были названы колониестимулирующими, так как in vitro они стимулировали рост колоний разных гемопоэтических клеток-предшественников. За последнее десятилетие многие из этих факторов роста были выделены и клонированы, а их действие на гемопоэз детально изучено (табл. 32-3). С помощью технологии рекомбинантных ДНК были получены достаточные для клинического использования количества факторов роста.
Из всех известных гемопоэтических факторов роста в клинической практике в настоящее время применяются эритропоэтин, колониестимулирующий фактор гранулоцитов (granulocyte-stimulating factor — G-CSF) и колониестимулирующий фактор гранулоцитов-макрофагов (granulocyte-macrophage colony-stimulating factor — GM-CSF). Интер-лейкин-3 (IL-3), фактор стволовых клеток (stem cell factor — SCF) и колониестимулирующий фактор моноцитов-макрофагов (granulocyte-macrophage colony-stimulating factor — M-CSF) сейчас проходят клинические испытания и, возможно, будут использоваться в последующие годы. Другие потенциально полезные гемопоэтические факторы, пере
численные в табл. 32-3; пока находятся в стадии доклинического изучения.
Эритропоэтин
Химические свойства и фармакокинетика
Эритропоэтин был выделен первым из всех гемопоэтических факторов (впервые получен из мочи больных с тяжелой анемией). Сейчас с использованием технологии рекомбинантной ДНК в культуре клеток млекопитающих получают рекомбинантный человеческий эритропоэтин (rHuEpo, эпоэтин альфа). Это в значительной степени гликозилированный полипептид, состоящий из 165 аминокислот с мол. м. 30 400. При внутривенном введении эритропоэтин обладает периодом полувыведения 4-13 часов у пациентов с хронической почечной недостаточностью. Он не выводится диализом. Количественно измеряется в международных единицах (ME).
Фармакодинамика
Эритропоэтин стимулирует пролиферацию и дифференцировку клеток эритроидного ростка, действуя на специфичные рецепторы эритропоэтина, имеющиеся на предшественниках эритроцитов
в костном мозге. Эндогенный эритропоэтин выделяется в почках в ответ на тканевую гипоксию. При анемии выделяется больше эритропоэтина, что стимулирует образование эритроцитов в костном мозге и приводит к коррекции анемии, если при этом нет функциональных нарушений эритроцитов, как, например, при железодефицитной анемии, первичных заболеваниях костного мозга и подавлении функции костного мозга лекарственными средствами или при хронических заболеваниях.
В норме существует обратная зависимость между гематокритным числом или уровнем гемоглобина и содержанием эритропоэтина. У здоровых людей уровень эритропоэтина в сыворотке не превышает 20 МЕ/л. С понижением гематокритного числа и уровня гемоглобина концентрация эритропоэтина экспоненциально повышается. При умеренно тяжелых анемиях уровень эритропоэтина колеблется в пределах 100-500 МЕ/л, а при тяжелых анемиях достигает нескольких тысяч МЕ/л. Исключением является анемия при хронической почечной недостаточности. У пациентов с заболеваниями почек уровень эритропоэтина обычно низкий, так как в этих условиях почки не могут его вырабатывать. У таких больных наблюдается наибольший эффект от терапии экзогенным эритропоэтином. При большинстве первичных заболеваний костного мозга (апластической анемии, лейкозах, миелопролифера
ТАБЛИЦА 32-3. Гемопоэтические факторы роста
Фактор роста Стимулируемые линии клеток-предшественников
Эритроциты Гранулоциты Моноциты- Мегакариоциты-макрофаги тромбоциты Другие
ЕРО G-CSF M-CSF GM-CSF + + + + + + + Эозинофилы
IL-3 + + + + Эозинофилы, базофилы
SCF + + + 4- Эозинофилы, базофилы,
IL-6 + + + лимфоциты Лимфоциты
IL-9,IL-11 + Лимфоциты
Примечание.
ЕРО — эритропоэтин;
G-CSF — колониестимулирующий фактор гранулоцитов (филграстим);
M-CSF — колониестимулирующий фактор моноцитов-макрофагов;
GM-CSF — колониестимулирующий фактор гранулоцитов-макрофагов (сарграмостим);
IL — интерлейкин;
SCF — фактор стволовых клеток.
тивных или миелодиспластических заболеваниях и пр.) и вторичных анемий уровень эритропоэтина достаточно высок, то есть эффект терапии экзогенным препаратом будет менее выражен.
Клиническая фармакология
Эритропоэтин показан больным с почечной недостаточностью и выраженной анемией. Он повышает уровень гемоглобина и гематокритное число и обычно снимает необходимость в переливаниях крови у этих пациентов. Повышение количества ретикулоцитов, как правило, начинается на десятый день, а содержания гемоглобина и гематокритного числа — на второй-шестой неделе терапии. У большинства пациентов гематокритное число поддерживается на уровне 35 % при дозе эритропоэтина 50-150 МЕ/кг внутривенно или подкожно 3 раза в неделю. Отсутствие реакции на эритропоэтин чаще всего объясняется дефицитом железа, что можно корректировать назначением пероральных препаратов железа. Некоторым больным необходима также фолиевая кислота.
Эритропоэтин может быть полезен и для лечения больных с анемиями, обусловленными первичными заболеваниями костного мозга, а иногда и при вторичных анемиях. В эту группу попадают пациенты с апластической анемией и иными заболеваниями костного мозга, миелопролиферативными и миелодис-пластическими заболеваниями, миеломной болезнью и, возможно, с другими злокачественными заболеваниями костного мозга, анемией при хроническом воспалении, СПИДе и раке. Такие пациенты с низким уровнем эритропоэтина лучше других pearl |руют на терапию этим фактором роста. Лучше всего поддаются лечению пациенты с концентрацией эндогенного эритропоэтина ниже 100 МЕ/л, хотя иногда хорошая реакция наблюдается и при уровнях 100-500 МЕ/л. В последнем случае для достижения эффекта требуются более высокие дозы эритропоэтина (150-300 МЕ/кг 3 раза в день), и тем не менее эффект у таких больных менее выражен.
Эритропоэтин также успешно применяют для коррекции анемии, вызванной зидовудином, назначаемым пациентам с ВИЧ-инфекцией, и при анемии у недоношенных детей. Его можно использовать и для ускорения эритропоэза после флеботомий, когда кровь собирают для аутологичных трансфузий при хирургических операциях, а также для лечения больных с перегрузкой железом (гемохроматозом).
Токсичность
Самые частые побочные эффекты эритропоэтина обусловлены слишком быстрым повышением гематокритного числа и уровня гемоглобина и проявляются гипертензией и тромботическими осложнениями. Эти проблемы можно свести до минимума, медленно повышая гематокритное число и содержание гемоглобина и мониторируя и корригируя гипертензию. Аллергические реакции встречаются редко и не являются серьезными.
Миелоидные факторы роста
Химические свойства и фармакокинетика
G-CSF и GM-CSF, единственные используемые в настоящее время миелоидные факторы роста, исходно выделены из культуры клеток человека. Рекомбинантный человеческий G-CSF (rHu G-CSF; филграстим) синтезируют в бактериальной системе экспрессии с использованием технологии рекомбинантных ДНК. Это негликозилированный полипептид из 175 аминокислот с мол. м. 18 800. Для наработки рекомбинантного человеческого GM-CSF (RHu GM-CSF; сарграмостима) по той же технологии используют дрожжевую культуру. Фактор представляет собой частично гликозилированный полипептид из 127 аминокислот трех молекулярных подвидов с мол. м. 15 500,15 800 и 19 500. Оба препарата при внутривенном введении имеют период полувыведения 2-4 часа.
M-CSF, IL-3, SCF и другие интерлейкины, обладающие активностью миелоидных факторов роста (табл. 32-3), также выделены, очищены, клонированы и вырабатываются в разных экспресси-онных системах с помощью технологии рекомбинантной ДНК. Они пока еще не применяются в клинике.
Фармакодинамика
Миелоидные факторы роста стимулируют пролиферацию и дифференцировку соответствующих клеточных линий, действуя на специфичные рецепторы, найденные на разных миелоидных клетках-предшественниках. G-CSF и M-CSF — это клоно-специфичные факторы роста, активизирующие пролиферацию и дифференцировку тех
клеток-предшественников, которые образуют нейтрофилы и моноциты-макрофаги соответственно. GM-CSF и IL-3 — это полипотентные гемопоэтические факторы роста ранних и поздних предшественников гранулоцитов, а также эритроцитов и мегакариоцитов. SCF — это так называемый самый ранний гемопоэтический фактор роста, то есть он действует на неспецифичные стволовые клетки и на самые ранние предшественники гранулоцитарного, эритроидного, лимфоидного и ме-гакариоцитарного ростков. Ранние факторы роста потенцируют действие поздних факторов роста вследствие синергизма их эффектов по усилению пролиферации. Как ранние, так и поздние факторы роста (кроме SCF) оказывают и прямое действие на зрелые клетки-мишени в крови и тканях, усиливая функции нейтрофилов и моноцитов-макрофагов.
Клиническая фармакология
G-CSF и GM-CSF ускоряют восстановление гранулоцитов после мощной химиотерапии, подавившей костный мозг, а также после трансплантации костного мозга. Это снижает риск инфекций и длительность госпитализации пациентов. G-CSF (5 мкг/кг/день) или GM-CSF (250 мкг/м2/день) обычно назначают в первые дни после завершения химиотерапии или через день после трансплантации костного мозга и продолжают применять до тех пор, пока абсолютное количество нейтрофилов не достигнет 2000-5000/мкл. Хотя GM-CSF действует на несколько клеточных линий, в этих ситуациях он не оказывает значительного влияния на эритроциты или тромбоциты.
G-CSF и GM-CSF в этих же или более высоких дозах могут быть эффективны для коррекции гра-нулоцитопении при миелодисплазии, апластической анемии, врожденной нейтропении, циклической нейтропении, волосато-клеточного лейкоза и других злокачественных заболеваниях костного мозга, ВИЧ-инфекции, лейкопении, вызванной зидовудином, и других нейтропениях. Многие пациенты реагируют значительным и быстрым повышением количества гранулоцитов и иногда снижением частоты инфекций. Влияние на гематокритное число и концентрацию гемоглобина, а также на количество тромбоцитов незначительно.
Сочетание миелоидных факторов роста, особенно действующих на ранние и поздние предшествен
ники, может значительно усиливать пролиферативное действие на гранулоцитарный, эритроидный и мегакариоцитарный ростки. IL-3 и SCF, возможно, будут использоваться с этой целью, и есть надежда, что их применение приведет к восстановлению многих клеточных линий. Интерлейкины-6,9 и 11 представляют особый интерес вследствие их способности стимулировать пролиферацию мегакариоцитов и продукцию тромбоцитов. Однако интерлейкины (кроме IL-3) обладают также комплексом влияний на иммунную систему, что может ограничить их использование в качестве факторов роста мегакариоцитов или тромбоцитов в некоторых клинических ситуациях.
Токсичность
Побочные эффекты применения G-CSF и GM-CSF незначительны и немногочисленны. G-CSF может спровоцировать боли в костях, которые исчезают при прекращении приема препарата. GM-CSF, особенно при использовании в высоких дозах, может вызывать более серьезные побочные эффекты: лихорадку, недомогание, артралгии, миалгии и синдром повышения проницаемости капилляров, который характеризуется периферическими отеками и выпотами в плевру и перикард. Возможны аллергические реакции, но они редки.
Препараты
Эпоэтин альфа (эритропоэтин, Эпо)
(Эпоген, Прокрит)
Парентерально: флаконы 2000, 3000,4000 и 10 000 МЕ/мл для в/в и п/к инъекций
Дефероксамин (Десферал)
Парентерально: флаконы по 500 мгдля в/в, п/к и в/м инъекций
Филграстим (G-CSF) (Неупоген)
Парентерально: флаконы по 300,480 мкг для в/в и п/к инъекций
Фолиевая кислота (фолацин, птероилглутаминовая кислота)(генерик)
Перорально: таблетки по 0.1, 0.4, 0.8,1 мг Парентерально: 5,10 мг/мл для инъекций
Железо (генерик)
Перорально: данные в табл. 32-2 Парентерально (Железо Декстран) (InFeD): 50 мг элементарного железа /мл
Сарграмостин (GM-CSF) (Лейкин, прокин) Парентерально: флаконы по 250, 500 мкг для в/в вливания Витамин В12 (генерик, цианокобаламин или гидроксикобаламин) Перорально (цианокобаламин): таблетки по 25,50,100, 250, 500,1000 мкг Парентерально (цианокобаламин): 30,100, 1000 мкг/мл для в/м или п/к инъекций Парентерально (гидроксикобаламин): 1000 мкг/мл только для в/м инъекций Избранная литература Anthony А. С. Megaloblastic anemias. In: Hematology: Basic Principles and Practice, Hoffman R. et al. (eds). Churchull Livingstone, 1991. Crosier P. S., Clark S. C. Basic biology of the hemato-poetic growth factors. Semin. Oncol. 1992; 19:249. Jandl J. H. Iron deficiency anemia. In: Blood: Textbook of Hematology. Little, Brown, 1987.
Препараты, применяемые при нарушениях коагуляции
Роберт А. О’Рейлли
33
Кровотечения и тромбозы являются следствием нарушений системы гемостаза. Угнетение гемостаза приводит к спонтанным кровотечениям, а стимуляция — к тромбообразованию. В этой главе обсуждаются препараты, применяемые для остановки кровотечения и для предотвращения и устранения тромбоза.
Механизмы свертывания крови
Тромбогенез
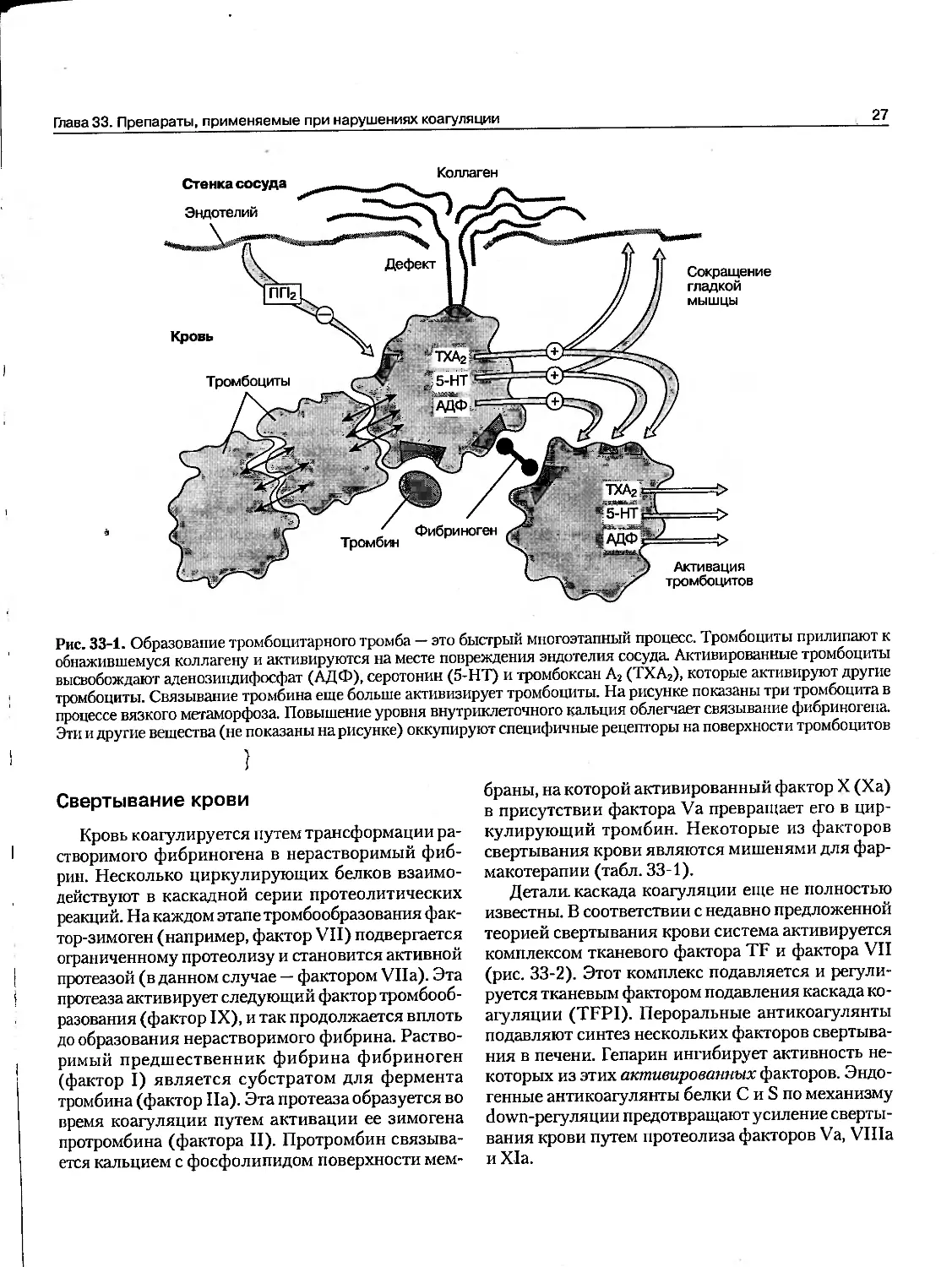
Гемостаз — это спонтанная остановка кровотечения из поврежденного сосуда. Нормальные эндотелиальные клетки сосудов не являются тромбогенными, и циркулирующие тромбоциты и факторы тромбообразования не адгезируются на них. Немедленный гемостатический ответ поврежденного сосуда —это вазоспазм. В пределах нескольких секунд тромбоциты прилипают к обнажившемуся коллагену поврежденного эндотелия (адгезия тромбоцитов) и друг к другу (агрегация тромбоцитов). Затем тромбоциты теряют свои мембраны и образуют гелеобразную массу в процессе вязкого метаморфоза. Эти массы тромбоцитов быстро прекращают кровотечение, но для обеспечения длительной эффективности они должны закрепляться фибрином. Закрепление фибрином возникает в результате действия местных стимулов к свертыванию крови: обнаженных коллагеновых волокон поврежденных сосудов, мембран и высвобождаемого содержимого тромбоцитов (рис. 33-1). Местное образование тромбина не только высвобождает из тромбоцитов АДФ, который является сильным индуктором их аг
регации, но и стимулирует синтез простагландинов из арахидоновой кислоты мембран тромбоцитов. Эти активные вещества, относящиеся к эйкозаноидам (глава 18), делятся на две группы, которые дают противоположный эффект на тромбогенез. Тромбоксан А2 (ТХА2) синтезируется в тромбоцитах и вызывает тромбогенез и вазоконстрикцию. Простациклин (ПГ12) синтезируется в стенке сосудов и подавляет тромбогенез. Серотонин (5-НТ) также высвобождается из тромбоцитов, стимулируя дальнейшую агрегацию и вазоконстрикцию.
Тромбоцит играет центральную роль в нормальном гемостазе и всех тромбоэмболических заболеваниях. Белый тромб образуется в артериях, где имеется высокое давление, путем прилипания циркулирующих тромбоцитов к участкам аномального эндотелия описанным выше путем. Растущий тромб, состоящий из агрегирующихся тромбоцитов, препятствует кровотоку. Этот локальный стаз вызывает образование фибрина, и вокруг осевого белого тромба формируется красный тромб.
Красный тромб может образоваться вокруг белого по описанному механизму или de novo в венах с низким давлением путем прилипания тромбоцитов (как в артериях), но в сочетании с другими механизмами гемостаза. В итоге тромб состоит из сети фибрина с заключенными в ней эритроцитами и имеет удлиненный вид (типа хвоста). Этот “хвост” легко отсоединяется и в качестве эмбола попадает в легочные артерии. Хотя все тромбы являются смешанными, в артериях чаще всего встречаются тромбы с белым ядром, а в венах — с фибриновым хвостом. Артериальные тромбы приводят к серьезным заболеваниям, вызывая местную окклюзионную ишемию, а венозные тромбы могут вызвать эмболизацию отдаленных сосудов.
Рис. 33-1. Образование тромбоцитарного тромба — это быстрый многоэтапный процесс. Тромбоциты прилипают к обнажившемуся коллагену и активируются на месте повреждения эндотелия сосуда. Активированные тромбоциты высвобождают аденозиндифосфат (АДФ), серотонин (5-НТ) и тромбоксан А2 (ТХА2), которые активируют другие тромбоциты. Связывание тромбина еще больше активизирует тромбоциты. На рисунке показаны три тромбоцита в процессе вязкого метаморфоза. Повышение уровня внутриклеточного кальция облегчает связывание фибриногена. Эти и другие вещества (не показаны на рисунке) оккупируют специфичные рецепторы на поверхности тромбоцитов
Свертывание крови
Кровь коагулируется путем трансформации растворимого фибриногена в нерастворимый фибрин. Несколько циркулирующих белков взаимодействуют в каскадной серии протеолитических реакций. На каждом этапе тромбообразования фактор-зимоген (например, фактор VII) подвергается ограниченному протеолизу и становится активной протеазой (в данном случае — фактором Vila). Эта протеаза активирует следующий фактор тромбообразования (фактор IX), и так продолжается вплоть до образования нерастворимого фибрина. Растворимый предшественник фибрина фибриноген (фактор I) является субстратом для фермента тромбина (фактор Па). Эта протеаза образуется во время коагуляции путем активации ее зимогена протромбина (фактора II). Протромбин связывается кальцием с фосфолипидом поверхности мем
браны, на которой активированный фактор X (Ха) в присутствии фактора Va превращает его в циркулирующий тромбин. Некоторые из факторов свертывания крови являются мишенями для фармакотерапии (табл. 33-1).
Детали, каскада коагуляции еще не полностью известны. В соответствии с недавно предложенной теорией свертывания крови система активируется комплексом тканевого фактора TF и фактора VII (рис. 33-2). Этот комплекс подавляется и регулируется тканевым фактором подавления каскада коагуляции (TFPI). Пероральные антикоагулянты подавляют синтез нескольких факторов свертывания в печени. Гепарин ингибирует активность некоторых из этих активированных факторов. Эндогенные антикоагулянты белки С и S по механизму down-регуляции предотвращают усиление свертывания крови путем протеолиза факторов Va, Villa и Xia.
ТАБЛИЦА 33-1. Факторы свертываемости крови
и препараты, которые на них действуют'
Компонент Используемый Препараты,
или фактор синоним действующие на этот фактор
I Фибриноген Гепарин (Па); вар-фарин (синтез)
II Протромбин
III Тканевой тромбопластин
IV Кальций
V Проакцелерин Гепарин (Vila); вар-фарин (синтез)
VII Проконвертин
VIII Антигемофильный глобулин (AHG)
IX Фактор Кристмаса, Гепарин (IXa); вар-
компонент плазменного тромбопластина (РТС) фарин (синтез)
X Фактор Стюарта- Гепарин (Ха); вар-
Прауэра фарин (синтез)
XI Предшественник плазменного тромбопластина (РТА)
XII Фактор Хагемана
XIII Фибринстабилизи-рующий фактор
Белки С и S Варфарин (синтез)
Плазминоген Тромболитические ферменты, аминокапроновая кислота
’ На рис. 33-2 и в тексте даны дополнительные детали.
Регуляция коагуляции и фибринолиза
Коагуляция крови и тромбообразование должны происходить на минимальной площади, чтобы обеспечить максимальный местный гемостаз в ответ на травму или операцию и избежать диссеминированной коагуляции или нарушения кровотока. Регулируют и ограничивают эти процессы две основные системы: ингибирование фибрина и фибринолиз.
Плазма содержит ингибиторы протеаз, которые быстро инактивируют коагуляционные белки, ког
да они выходят за пределы зоны повреждения сосуда. Самые главные белки этой системы — а,-ан-типротеаза, а2-макроглобулин, а2-антиплазмин и антитромбин III. Если эта система перегружена, то возникает диссеминированное внутрисосудистое свертывание (ДВС-синдром), наблюдающееся после тяжелого поражения тканей, лизиса клеток при злокачественных новообразованиях, акушерских неотложных состояниях, например при отслоении плаценты, а также при бактериальном сепсисе.
Центральный процесс фибринолиза — это превращение неактивного плазминогена в протеолитический фермент плазмин. Поврежденные клетки высвобождают активаторы плазминогена. Плазмин изменяет вид тромба и ограничивает распространение тромбоза протеолитическим разрушением фибрина.
Для терапии важна регуляция протеолитической системы. Эффективным методом терапшСтром-ботических поражений является усиление фибринолиза. Фибринолитическую систему активируют тканевые активаторы плазминогена (t-PA), урокиназа и стрептокиназа (рис. 33-3). Наоборот, ингибирование фибринолиза защищает тромбы от лизиса и уменьшает кровотечение, обусловленное нарушением гемостаза. В клинике применяют такой ингибитор фибринолиза, как аминокапроновая кислота. Гепарин и пероральные антикоагулянты не влияют на механизм фибринолиза.
I. Базисная фармакология антикоагулянтов
Гепарин
Химические свойства и механизм действия
Гепарин — это гетерогенная смесь сульфатированных мукополисахаридов. Он связывается с поверхностью эндотелиальных клеток. Его биологическая активность зависит от плазменного ингибитора протеаз антитромбина III. Антитромбин ингибирует протеазы факторов свертывания, образуя с ними эквимолярные стабильные комплексы. При отсутствии гепарина эти реакции идут медленно, в присутствии гепарина их скорость возрастает в тысячу раз. В коммерческом гепарине только одна треть молекул дает этот ускоряющий эффект и, еле-
Рис. 33-2. Модель системы коагуляции крови. Вместе с тканевым фактором (TF) фактор VII образует активированный комплекс (VIIa-TF), который катализирует превращение фактора IX в активный фактор 1Ха. Эту же реакцию катализирует активированный фактор Х1а. Ингибитор пути тканевого фактора (TFPI) подавляет каталитическое действие комплекса VIIa-TF. Каскад функционирует по пути, показанному на рисунке, и на конечном этапе заканчивается превращением фибриногена в фибрин, который является необходимым компонентом тромба. Два основных антикоагулянта, гепарин и варфарнн (пероральный антикоагулянт), ингибируют свертывание крови по-разному. Гепарин действует в крови и напрямую активирует противосвертывающую систему, особенно антитромбин III, который инактивирует факторы, помещенные на этой схеме в прямоугольники. Варфарин, действуя в печени, подавляет синтез факторов, заключенных на схеме в кружочки. Белки С и S дают противосвертывающий эффект, разрушая активированные факторы Va, Villa и Xia
довательно, обладает антикоагулянтной активностью. Активные молекулы гепарина прочно связываются с антитромбином и вызывают изменения конформации. При этом обнажаются его активные участки, которые быстро связываются с протеазами — активированными факторами свертывания. Таким образом, гепарин катализирует антитром-бин-протеазную реакцию и при этом не расходуется в ней. Как только образуется антитромбин-про-теазный комплекс, гепарин высвобождается в интактной форме и способен снова связываться с новой молекулой антитромбина.
Антитромбинсвязывагощая часть коммерческого гепарина состоит из повторяющихся сульфатированных дисахаридных единиц (D-глюкозамин-Ь-идуроновой кислоты и О-глюкозамин-В-глюкуро-
новой кислоты) (рис. 33-4). Фракции гепарина с высокой мол. м. и высокой аффинностью к антитромбину выражение подавляют коагуляцию крови. Мол. м. этих фракций варьирует в пределах 5000-30 000. Фракции с низкой мол. м. подавляют активированный фактор X, но дают меньший эффект по отношению к тромбину и коагуляции в целом, чем фракции высокомолекулярного гепарина. Эноксапарин, представляющий собой одну из многих фракций гепарина с низкой мол. м., одобрен FDA для первичной профилактики тромбоза глубоких вен после восстановительных операций на бедре. Мол. м. эноксапарина находится в пределах 2000-6000. Некоторые из гепаринов с низкой мол. м. по сравнению с обычным гепарином обладают такой же или большей эффективностью; для
Активация
Различные стимулы
Плазменный проактиватор
Плазминоген
Ингибирование
Антиактиваторы
Аминокапроновая ~ кислота
Стрептокиназа
Проактиватор
Анистреплаза
Продукты деградации
Фибриноген
| Плазмин")
| Тромбин")
Продукты
-►Фибрин----►расщепления
фибрина
Рис. 33-3. Схема фибринолитической системы. Плазмин — это активный фибринолитический фермент. Слева жирным шрифтом показано несколько используемых в клинике активаторов. Анистреплаза представляет собой комбинацию стрептокиназы и проактиватора плазминогена. Аминокапроновая кислота (справа) подавляет превращение плазминогена в активный плазмин и эффективна при некоторых кровотечениях
них характерны меньшая частота кровотечений, более высокая биодоступность при подкожных инъекциях, меньшая необходимость в мониторировании и менее частые приемы (достаточно одного или двух раз в день).
Так как коммерческий гепарин состоит из целого семейства молекул с разной мол. м., корреляция
между концентрацией гепарина и его влиянием на коагуляцию обычно достаточно низкая. Поэтому активность обычного гепарина (высокомолекулярного) стандартизируется путем биологического исследования. Гепарин натрия (USP) должен содержать по меньшей мере 120 USP единиц в 1 мг. Обычно используют натриевую соль гепарина, но в той же степени эффективна и кальциевая соль. Литиевая соль гепарина применяется in vitro как антикоагулянт для проведения анализов крови. Коммерческий гепарин получают из слизистой оболочки кишечника свиней и из бычьего легкого. Энок-сапарин производят из того же сырья, что и обычный гепарин, но дозы измеряют в миллиграммах.
Токсичность
Главный побочный эффект гепарина — кровотечения. Риск можно снизить путем тщательного отбора пациентов, контролем дозы и измерением парциального тромбопластинового времени (ПТВ). Особенно часто подвержены этому осложнению пожилые женщины и пациенты с почечной недостаточностью. Так как гепарин имеет животное происхождение, он должен аккуратно использоваться у больных, склонных к аллергии. У некоторых больных отмечали повышенное выпадение волос и обратимую алопецию. При длительной гепаринотера-пии могут возникнуть остеопороз и спонтанные переломы. Гепарин ускоряет липидемию после приема пищи, влияя на высвобождение липопротеид-липазы из тканей.
У 25 % пациентов гепарин вызывает преходящую тромбоцитопению, а у 5 % — тяжелую тромбоцитопению. Незначительное снижение количества тромбоцитов возникает вследствие вызванной ге-
HNSO3' OSO3' HNSO3‘ ОН HNSO3" ОН HNAc
GlcN IdUA GlcN IdUA GlcN GlcUA GIcNAc
Рис. 33-4. Структура гепарина. Приведенный отрезок полимера иллюстрирует структурные особенности гепарина, но последовательность дисахаридных мономеров выбрана произвольно. Кроме представленных здесь мономеров, в молекулу могут быть включены не О-сульфатированные или З-О-сульфатированные глюкозамины. Гепарин обладает свойствами сильной кислоты, так как содержит большое количество анионов сульфата и карбоксильных групп. GlcN — глюкозамин; IdUA — идуроновая кислота; GlcUA — глюкуроновая кислота (Из: Lindahl U. et al. Structure and biosynthesis of heparinlike polysaccharides. Fed. Proc. 1977; 36:19.)
парином агрегации, а значительное — из-за образования антител к тромбоцитам. Следствием вызванной гепарином агрегации тромбоцитов может быть парадоксальная тромбоэмболия. При назначении гепарина нужно учитывать следующие моменты: необходимо регулярно исследовать количество тромбоцитов; гепарин может вызвать серьезную тромбоцитопению, приводящую к кровотечениям; образование любого нового тромба может быть связано с использованием гепарина; тромбоэмболические осложнения, которые предположительно вызваны применением гепарина, лечатся прекращением его введения и назначением при необходимости оральных антикоагулянтов.
Противопоказания
Гепарин противопоказан пациентам с гиперчувствительностью к нему, при активных кровотечениях, гемофилии, тромбоцитопении, пурпуре, тяжелой гипертензии, внутричерепном кровоизлиянии, инфекционном эндокардите, активном туберкулезе, язвенных поражениях ЖКТ, угрозе прерывания беременности, висцеральной карциноме, тяжелых заболеваниях печени или почек. Гепарин не следует давать пациентам во время или после операции на головном или спинном мозге или глазах, при люмбальной пункции или региональной анестезии. Беременным гепарин следует назначать только по строгим показаниям, несмотря на незначительное прохождение препарата через плаценту.
Пути введения и дозирование
Показания к применению гепарина приведены в разделе, посвященном клинической фармакологии. Обычно при концентрации гепарина в плазме 0.2 ЕД/мл предотвращается развитие легочных эмболов у пациентов с венозным тромбозом. Такая концентрация гепарина продлевает ПТВ в 2-2.5 раза по сравнению с контролем. Степень антикоагуляции следует поддерживать постоянной на протяжении курса непрерывной внутривенной терапии гепарином. При периодическом назначении гепарина ПТВ необходимо измерять непосредственно перед каждым введением гепарина для коррекции дозы, чтобы показатель в 2-2.5 раза превышал контрольные значения.
Постоянное внутривенное введение гепарина проводится инфузионным насосом. После началь
ной болюсной инъекции 5000-10 000 ЕД для поддержания ПТВ на необходимом уровне требуется постоянное введение примерно 900 ЕД/ч, или 10-15 ЕД/кг/ч. Пациентам в острой стадии легочной эмболии в связи с повышенным клиренсом гепарина в течение первых нескольких суток требуются большие дозы. При периодическом внутривенном введении гепарина каждые 4 часа необходимо 75-100 ЕД/кг. Подкожное введение гепарина для профилактики проводится малыми дозами по 5000 ЕД каждые восемь или двенадцать часов. Гепарин не следует вводить внутримышечно из-за опасности развития гематомы в месте инъекции. Эноксапарин назначают в дозе 30 мг два раза в сутки перед операциями на бедре.
Обратимость действия гепарина
Избыточное антикоагулянтное действие гепарина лечат прекращением введения препарата. При возникновении кровотечения показано введение антагониста типа протамина сульфата. Протамин — это пептид с сильными основными свойствами, который соединяется с гепарином в ионную пару с образованием стабильного комплекса, не обладающего антикоагулянтной активностью. На каждые 100 ЕД гепарина, которые требуется нейтрализовать, вводят 1 мг протамина сульфата внутривенно; скорость введения не должна превышать 50 мг за 10 минут. Не следует вводить избыток протамина, так как это тоже может вызвать антикоагулянтный эффект.
Гирудин
В течение ряда лет хирурги использовали медицинских пиявок (Hirudo medicinalis) для предотвращения тромбоэмболий мелких сосудов при пластических операциях на кисти. Гирудин — это сильный и специфический ингибитор тромбина, получаемый из пиявок, а в настоящее время и с использованием технологии рекомбинантной ДНК. Его действие не зависит от антитромбина III, следовательно, он может инактивировать связанный с фибрином тромбин в тромбах. Гирудин не дает значительного эффекта на тромбоциты или время кровотечения. Как и гепарин, его применяют парентерально, мониторируя ПТВ. Гирудин уже прошел доклинические испытания на животных и теперь исследуется в клинических условиях.
Варфарин и кумариновые антикоагулянты
Химические свойства и фармакокинетика
Клиническое применение кумариновых антикоагулянтов началось с открытия антикоагулянтного действия вещества, которое образуется в загрязненном сладком клеверном силосе. Вещество вызывало дефицит протромбина плазмы с последующими геморрагическими осложнениями у скота. Это токсическое соединение оказалось бисгидрок-сикумарином и затем было синтезировано как ди-кумарол. Дикумарол и родственные ему соединения, особенно варфарин (рис. 33-5), не только применяются как антикоагулянты, но и широко используются для уничтожения грызунов. Эти средства часто называют “пероральными антикоагулянтами”, так как в отличие от гепарина их применяют перорально. Самый надежный препарат этой группы — варфарин, другие же родственные ему средства почти не применяются в США.
Варфарин обычно назначают в виде натриевой соли, имеющей биодоступность 100 %. Более 99 % рацемической смеси варфарина связывается с альбумином плазмы, что может быть причиной неболь
шого объема распределения (захват альбумином), длительного периода полувыведения из плазмы (36 часов) и незначительной экскреции неизмененной формы с мочой. Варфарин, применяемый в клинике, является рацемической смесью, состоящей из равных количеств двух оптических изомеров. Левовращающий 5-варфарин в 4 раза сильнее правовращающего Я-варфарина. Это полезно знать для понимания стереоселективных взаимодействий варфарина и некоторых других препаратов.
Механизм действия
Кумариновые антикоагулянты блокируют у-карбоксилирование нескольких глутаминовых остатков протромбина, а также факторов VII, IX и X и эндогенного антикоагулянтного белка С (рис. 33-2). Блокада приводит к образованию неполных молекул, которые являются биологически неактивными в процессе коагуляции. Это карбоксилирование физиологически связано с окислительной дезактивацией витамина К. Антикоагулянты ингибируют восстановление неактивного эпоксида витамина К в его активную гидрохиноновую форму (рис. 33-6). Мутационные изменения основного фермента, катализирующего эту реакцию (специфической редуктазы), могут привести к генети-
Фениндион
Фитонадион (витамин Ki)
Рис. 33-5, .Структура некоторых пероральных антикоагулянтов и витамина К. Отмеченный звездочкой атом углерода варфарина является асимметричным центром
Рис. 33-6. Цикл витамина К — метаболические превращения витамина, связанные с синтезом витамин К-зави-симых факторов свертывания крови. Витамины К! или К2 активируются восстановлением до гидрохиноновой формы (КН2). Ступенчатая активация до эпоксидной формы витамина К (КО) связана с карбоксилированием протромбина ферментом карбоксилазой. Реактивация эпоксида витамина К — это варфаринзависимый этап. R в молекуле витамина К является 20-углеродной фитильной боковой цепью витамина К, и 30—65-углеродпой полипренильной боковой цепью витамина К2
ческой резистентности к варфарину у человека и, особенно, у крыс.
Действие варфарина начинается отсроченно — через 8-12 часов после приема. Его антикоагулянтный эффект является следствием изменения баланса между частичным подавлением синтеза активного витамина К и неизмененной деградацией четырех витамин К-зависимых факторов свертывания. Возникающее подавление коагуляции зависит от скорости их деградации в кровотоке (рис. 33-7). Периоды полувыведения факторов VII, IX, X и II равны, соответственно, 6, 24, 40 и 60 часов. Более высокие начальные дозы варфарина (почти до 0.75 мг/кг) ускоряют начало антикоагулянтного действия. В еще более высоких дозах исчезает зависимость времени начала действия от дозы. Единственный эффект, который при этом достигается,— более длительное повышение концентрации препарата в плазме выше уровня, требуемого для подав
ления синтеза факторов свертывания. Задержка максимального проявления гипопротромбинеми-ческого эффекта от одного до трех дней после достижения пиковых концентраций в плазме может быть описана моделью, которая основана на соотношении концентрации препарата в плазме и снижения синтеза факторов свертывания. Разные пероральные антикоагулянты отличаются только периодом полувыведения из плазмы.
Токсичность
Варфарин легко проникает через плаценту и может вызывать геморрагические нарушения у плода. Более того, варфарин может действовать на белки плода, имеющие у-карбоксиглутаматные остатки; этот препарат может приводить к серьезным аномалиям развития плода, обусловленным нарушениями развития костей. Следовательно, варфарин противопоказан при беременности. Иногда во время первых недель терапии при снижении активности белка С возникает некроз кожи. В редких случаях эта же причина приводит к развитию инфарктов груди, жировых тканей, кишечника и конечностей. Патологические повреждения при геморрагическом инфаркте связаны с тромбозом вен. Это позволяет предположить, что причиной инфаркта является вызванное варфарином снижение синтеза белка С.
Введение и дозирование
Лечение варфарином следует начинать с малых доз 2-5 мг, а не с принятых в прошлом больших нагрузочных доз. Начальная коррекция протромбинового времени занимает примерно одну неделю, что обычно достигается при переходе на поддерживающую дозу 5-7 мг/день. Протромбиновое время следует повышать до уровня, который составляет 25 % от нормальной активности; на этом уровне обычно проводится поддерживающая терапия. Когда активность падает ниже 20 %, дозу варфарина надо сократить до увеличения активности выше 20 %.
Недавно было предложено выражать в единицах международного нормализованного отношения (International Normalized Ratio — INR) терапевтический диапазон для пероральных антикоагулянтов. INR — это соотношение протромбинового времени у больного и в контроле, полученном при использовании чувствительного тромбопластина мозга человека (а не менее чувствительного тромбо-
Время (часы)
Протромбиновое время -ф— Фактор II ж Фактор VII (ИНР)
—в— Фактор IX —х— Фактор X
Рис. 33-7. Активность четырех витамин К-зависимых факторов свертывания и протромбиновое время, выраженное в единицах INR, как функция времени после начала введения варфарина. Истинный протромбин (фактор II) обладает периодом полувыведения 60 часов, поэтому для достижения терапевтических концентраций требуется несколько дней лечения
пластина мозга кролика, применяемого в Северной Америке) (Poller, 1992). Рандомизированные проспективные исследования с использованием системы INR обосновали применение меньших, чем обычно, доз антикоагулянтов с меньшей частотой геморрагических осложнений без проигрыша в эффективности при использовании по многим терапевтическим показаниям. Анализ результатов нескольких клинических испытаний позволил дать рекомендации по коррекции доз препарата для достижения INR 2.5-3.5 (Eckman, 1993). (INR, равное 3, соответствует соотношению протромбинового времени 1.6 в лабораториях Северной Америки.)
Лекарственные взаимодействия
Пероральные антикоагулянты часто взаимодействуют с другими препаратами и изменяют свой эффект при разных заболеваниях. Эти взаимодействия можно разделить на фармакокинетические и фармакодинамические (табл. 33-2). Механизмы фармакокинетического взаимодействия включают индукцию ферментов, ингибирование ферментов
и снижение связывания ферментов белками плазмы. К фармакодинамическим механизмам относятся синергизм (нарушение гемостаза, снижение синтеза факторов свертывания, например при заболевании печени), конкурентный антагонизм (витамин К) и нарушение механизма физиологического контроля уровня витамина К (наследственная резистентность к пероральным антикоагулянтам).
Самые серьезные взаимодействия с варфари-ном — это те, которые повышают его антикоагулянтное действие и риск кровотечений. Наиболее опасными из них являются фармакокинетические реакции с пиразолонами — фенилбутазоном и сульфин-пиразоном. Эти препараты не только усиливают гипопротромбинемию, но и подавляют функцию тромбоцитов и могут вызывать образование язв в ЖКТ (глава 35). Механизм их гипопротромбине-мического действия — стереоселективное подавление окислительной метаболической трансформации 5-варфарина и вытеснение связанного с альбумином варфарина с соответствующим ростом его свободной фракции. Метронидазол, миконазол и триметоприм-сульфаметоксазол также стереосе
лективно подавляют метаболическую трансформацию 5-варфарина, а амиодарон, дисульфирам и циметидин ингибируют метаболизм обоих его изомеров. При приеме аспирина, заболеваниях печени и гипертиреоидизме происходит фармакодинамическое усиление эффектов варфарина: в первом случае путем действия на функцию тромбоцитов, в двух остальных — путем повышения скорости метаболизма факторов свертывания. Цефалоспорины третьего поколения уничтожают бактериальную флору ЖКТ, которая синтезирует витамин К, и, как и варфарин, напрямую подавляют редуктазу эпоксида витамина К. Гепарин продлевает протромбиновое время, ингибируя активность некоторых факторов свертывания.
Барбитураты и рифампин вызывают значительное снижение антикоагулянтного эффекта, индуцируя ферменты печени, которые отвечают за трансформацию рацемического варфарина. Холестирамин связывает варфарин в кишечнике и снижает его абсорбцию и биодоступность.
Фармакодинамическое ослабление антикоагулянтного эффекта происходит при применении витамина К (повышение синтеза факторов свертывания), диуретиков хлорталидона и спиронолактона (концентрирование факторов свертывания), при наследственной резистентности (мутационное изменение основного фермента цикла реактивации витамина К) и гипотиреоидизме (снижение скорости метаболизма факторов свертывания).
Этанол, фенотиазины, бензодиазепины, ацетаминофен, наркотики, индометацин и большинство
антибиотиков не оказывают значительного влияния на эффективность антикоагулянтной терапии.
Устранение эффекта
Избыточный антикоагулянтный эффект и кровотечения вследствие приема варфарина можно устранить при прекращении приема препарата и введении больших доз витамина Kt (фитонадиона) и свежезамороженной плазмы или концентратов фактора IX (например, Конин или Проплекс), которые также содержат большое количество протромбинового комплекса. Исчезновение эффекта коррелирует не с концентрацией варфарина в плазме, а с восстановлением нормальной активности факторов свертывания. Незначительный избыток антикоагулянтного действия корректируется просто прекращением приема препарата. При серьезных кровотечениях требуются большие дозы витамина Kf внутривенно инфузиями по 50 мг, концентратов фактора IX, а иногда даже трансфузии цельной крови.
Аналоги и варианты
Другие антагонисты витамина К, кроме варфарина, применяются редко, так как они либо менее эффективны, либо более токсичны. Дикумарол всасывается неполностью и часто вызывает неприятные симптомы со стороны ЖКТ. Фенпрокоумон обладает длительным периодом полувыведения -6 дней. Препараты индандионовой группы (фенин-
ТАБЛИЦА 33-2. Фармакокинетические и фармакодинамические влияния лекарств и состояния организма
на действие пероральных антикоагулянтов
Повышение протромбинового времени Снижение протромбинового времени
Фармакокинетическое Фармакодинамическое Фармакокинетическое Фармакодинамическое
Амиодарон Препараты Барбитураты Препараты
Циметидин Аспирин Холестирамин Диуретики
Дисульфирам (высокие дозы) Рифампин Витамин К
Метронидазол1 Цефалоспорины Факторы организма
Миконазол1 (третье поколение) Наследственная
Фенилбутазон’ Гепарин резистентность
Сульфинпиразон1 Факторы организма Гипотиреоидизм
Триметоприм- Заболевания печени
сульфаметоксазол1 Гипертиреоидизм
' Стереоселективно подавляет окислительный метаболизм S-варфарина в рацемическом варфарине.
дион и дифенадион) имеют потенциально серьезные побочные эффекты в отношении почек и печени и практически не используются в клинике.
II. Базисная фармакология фибринолитиков
Фибринолитические препараты быстро лизируют тромбы, катализируя образование сериновой протеазы плазмина из ее предшественника-зимогена — плазминогена (рис. 33-3). Эти препараты при внутривенном введении вызывают общую литическую реакцию. Вследствие этого разрушаются как тромбоэмболические тромбы (собственно мишени), так и защитные гемостатические тромбы. Для снижения неселективных системных эффектов было предложено два подхода. Первый заключается в интраартериальном введении фибринолитика, например в коронарные артерии, что снижает системный эффект, локализуя действие препарата. При втором используются лекарства нового поколения фибринолитиков — активаторы тканевого плазминогена, что вызывает лизис тромбов с менее выраженным системным разрушением фибриногена. К сожалению, их отличия от препаратов первого поколения (стрептокиназы) незначительны.
Стрептокиназа, анистреплаза, тканевой активатор плазминогена и урокиназа
Фармакология
Стрептокиназа — это белок, синтезируемый стрептококками, который связывается с проактиватором плазминогена. Этот ферментный комплекс катализирует конверсию неактивного плазминогена в активный плазмин. Урокиназа — фермент человека, синтезируемый почками и напрямую превращающий плазминоген в плазмин. Наличие в крови ингибиторов плазмина делает невозможным его применение для лизиса тромбов, а отсутствие ингибиторов урокиназы и стрептоки-наза-проактиваторного комплекса позволяют их использовать с этой целью. Образуемый этими активаторами внутри тромба плазмин защищен от антиплазминов крови, что позволяет ему разрушать тромб изнутри. Анистреплаза (анизоилиро-
ванный плазминоген-стрептокиназный активатор-ный комплекс, anisoylated plasminogen streptokinase activator complex — APSAC) состоит из очищенного человеческого плазминогена и бактериальной стрептокиназы, ацилированной для защиты активной группы. При введении анистреплазы ацильная группа спонтанно гидролизуется, освобождая активированный стрептокиназа-проакти-ваторный комплекс. Этот препарат дает возможность проводить быстрые внутривенные инъекции, имеет большую селективность в отношении разрушения тромба (то есть в большей степени действует на плазминоген, связанный с тромбами, чем на свободный плазминоген крови) и большую тромболитическую активность.
Плазминоген может активироваться и эндогенно тканевыми активаторами плазминогена (t-PA). Эти активаторы действуют преимущественно на плазминоген, связанный с фибрином, который (теоретически) ограничивает фибринолиз только в местах образования тромбов, что позволяет избежать системных эффектов. Человеческий t-PA производится по технологии рекомбинантной ДНК.
Показания и дозирование
Внутривенное использование фибринолитиков показано в случаях множественной легочной эмболии, которая в то же время недостаточно массивна для хирургического вмешательства. Внутривенные фибринолитики используют и в случаях тромбоза центральных глубоких вен, например при синдроме верхней полой вены и восходящем тромбофлебите подвздошно-бедренных вен. Они также применяются интраартериально, особенно при заболеваниях периферических сосудов.
Тромболитическая терапия при остром инфаркте миокарда требует тщательного отбора пациентов, использования специфических тромболитиков и продуманной вспомогательной терапии. По вопросу безопасности и эффективности t-PA по сравнению с другими тромболитиками существуют значительные разногласия. Были проведены обширные рандомизированные клинические испытания, в которых t-PA сравнивалась со стрептокиназой по показателям рестеноза, функции желудочков и смертности (Cobbe, 1992). В одном из них установлено, что t-PA более эффективен в остром периоде (Topol, 1993), в другом — нет (ISIS-3, 1992).' Более того, частота геморрагических инсультов при примене
нии t-PA в 2 раза превышала таковую при использовании стрептокиназы. Таким образом, преимущество какого-либо препарата пока не является очевидным. Однако стрептокиназа в 5-10 раз дешевле, чем другие препараты. 0-Блокаторы и аспирин улучшают результаты тромболитической терапии, а подкожное введение гепарина не дает эффекта.
Стрептокиназа вводится путем внутривенной инфузии в нагрузочной дозе 250 000 ЕД, а затем в дозе 100 000 ЕД/ч в течение 24-72 часов. У пациентов с антистрептококковыми антителами могут появиться лихорадка, аллергические реакции и развиться терапевтическая резистентность. Урокиназу вводят в нагрузочной дозе 300 000 ЕД за 10 минут, потом дают поддерживающую дозу 300 000 ЕД/ч в течение 12 часов. Нагрузочная доза альтеплазы (t-PA) при внутривенной инфузии составляет 60 мг в течение 1 часа, затем вводят 40 мг со скоростью 20 мг/ч. Анистреплазу дают в виде одной внутривенной инъекции в количестве 30 ЕД за 3-5 минут. Курс фибринолитической терапии стоит дорого: сотни долларов при использовании стрептокиназы, тысячи — при использовании урокиназы, анистреплазы или t-PA. По окончании фибринолитической терапии следует вводить гепарин, а затем переходить на варфарин. Эффективность тромболитической терапии в отношении снижения смертности и необходимости в последующей чрескожной коронарной ангиопластике еще не определена. Интракоронарное введение тромболитических препаратов задерживает начало терапии, усложняет клинический анализ и может снизить эффективность.
III. Базисная фармакология антитромбоцитарных средств
Функция тромбоцитов регулируется тремя типами веществ. Первая группа состоит из соединений, образуемых вне тромбоцитов, которые затем взаимодействуют с их мембранными рецепторами (например, катехоламины, коллаген, тромбин и простациклин). Ко второй категории относятся вещества, образуемые в тромбоците, которые тоже взаимодействуют с рецепторами мембраны, например АДФ, простагландин D2, простагландин Е2 и серотонин (рис. 33-1). К третьей категории принадлежат агенты, образуемые внутри тромбоцитов и
действующие внутри них, например простагландиновые эндоперикиси и тромбоксан А2, цАМФ и цГМФ, а также ион кальция. Из этого списка веществ можно определить две мишени для действия средств, ингибирующих тромбоциты: подавление метаболизма простагландинов (аспирин) и подавление АДФ-стимулируемой агрегации тромбоцитов (тиклопидин).
Аспирин
Простагландин тромбоксан А2 — это продукт превращения арахидоновой кислоты, который заставляет тромбоциты менять форму, высвобождать гранулы и агрегировать (глава 18). Препараты, которые подавляют эти реакции, вмешиваются в процесс агрегации тромбоцитов in vitro и продлевают время кровотечения in vivo. Аспирин является прототипом этого класса средств. Те вещества, которые модулируют концентрацию цАМФ в тромбоцитах, не продлевают время кровотечения. Однако для профилактики тромбозов можно использовать коррекцию диеты. Ненасыщенная жирная эйкозапен-таеновая кислота, содержание которой высоко в пище эскимосов, вызывает образование простагландина 13—антиагреганта, похожего на простациклин.
Аспирин подавляет синтез тромбоксана А2 путем необратимого ацетилирования фермента циклооксигеназы (глава 18). Так как безъядерные тромбоциты не могут синтезировать белки, то в течение их 10-дневной жизни они не будут образовывать новые ферменты. Другие нестероидные противовоспалительные средства (в том числе другие салицилаты) также подавляют циклооксигеназу, но их ингибиторное действие короче, так как они не ацетилируют фермент, то есть их эффект обратим.
С целью оценки применения аспирина для первичной профилактики смертности от сердечнососудистых заболеваний (то есть для предотвращения первого инфаркта миокарда) были проведены два больших проспективных рандомизированных исследования на здоровых американских и британских врачах в течение 4-5 лет. В американском исследовании установлено значительное снижение частоты несмертельного инфаркта миокарда (и было досрочно завершено вследствие этого результата), а британское исследование не выявило значительных изменений. Более того, оно подтвердило имевшиеся ранее доказательства того, что прием 500 мг в день аспирина повышает частоту развития язвенной бо
лезни и желудочно-кишечных кровотечений. Таким образом, соотношение риска и пользы употребления аспирина в качестве профилактического препарата, продающегося без рецепта, не вполне очевидно при наличии гипертензии или язвенной болезни.
FDA одобрила применение 325 мг/день аспирина для первичной профилактики инфаркта миокарда, но требует осторожности при таком приеме аспирина, кроме тех случаев, когда он дополняется прекращением курения, снижением холестерина плазмы крови и снижением артериального давления. Значительное (в 8 раз) уменьшение частоты ожидаемых смертей от сердечно-сосудистых заболеваний для контрольной и экспериментальной групп в плацебо-контролируемом двойном слепом американском исследовании показало высокую значимость здорового образа жизни образованных и заинтересованных в своем здоровье врачей. Метаанализ многих опубликованных исследований по аспирину и другим антитромбоцитарным средствам подтверждает ценность этих мер при вторичной профилактике сосудистых осложнений у пациентов с подобными нарушениями в анамнезе.
Тиклопидин
Тиклопидин подавляет агрегацию тромбоцитов, ингибируя АД Ф-зависимые реакции тромбоцитов. В отличие от аспирина этот препарат не действует на метаболизм простагландинов. В рандомизированных клинических испытаниях тиклопидина установлено, что он эффективен для предотвращения сосудистых осложнений у пациентов с преходящими ишемическими приступами, инсультами и нестабильной стенокардией. Побочные эффекты включают тошноту, диспепсию и диарею почти у 20 % больных, геморрагии у 5 %, лейкопению у 1 % пациентов. Лейкопению диагностируют при регулярных наблюдениях за показателями белой крови в течение первых трех месяцев лечения. Принимают тиклопидин по 250 мг два раза в день. Он особенно полезен пациентам, которые не переносят аспирин. Могут быть эффективными дозы тиклопидина менее 500 мг/день, при этом возникает меньше осложнений.
Р-Адреноблокаторы
Были проведены многочисленные клинические испытания по оценке эффекта Р-адреноблокаторов при вторичной профилактике инфаркта миокарда
или других изменений сердечно-сосудистой системы после первого инфаркта. В норвежском многоцентровом исследовании тимолола были использованы надежные исследовательские и статистические методы. Установлено, что назначение тимолола приводит к достоверному снижению общего числа смертей (рис. 10-8), и препарат был одобрен FDA для использования в качестве профилактического средства после инфаркта миокарда. Является ли этот эффект результатом прямого действия на коагуляцию, неизвестно.
IV. Клиническая фармакология препаратов, применяемых для лечения тромбоза
История лекарственной терапии тромбоэмболий полна примеров неосуществленных обещаний вследствие злоупотребления новыми антитромбо-тическими препаратами. Средства появлялись и исчезали до того, как становилась возможной полновесная их оценка, как, например, в случае применения пероральных антикоагулянтов при инфаркте миокарда и при операциях на бедре. Профилактический прием низких доз гепарина в общей хирургии был скомпрометирован его чрезмерным использованием сразу после появления доказательств его эффективности. Антиагреганты широко применяли еще до того, как была доказана их эффективность.
Венозный тромбоз
Антитромботическое лечение
А. Профилактика. Первичная профилактика венозного тромбоза уменьшает частоту возникновения и смертность от эмболии легочных сосудов. С этой целью используют гепарин. Периодическое подкожное введение низких доз гепарина является эффективной профилактической мерой. Эффективны также пероральные антикоагулянты, но риск кровотечения и необходимость лабораторного контроля протромбинового времени ограничивают их использование с целью профилактики (исключение — больные с искусственными клапанами серд
ца). Раннее начало активных движений после операции уменьшает венозный застой. Периодическая наружная пневматическая компрессия ног также является эффективным методом послеоперационной профилактики. В настоящее время эноксапа-рин (низкомолекулярный гепарин) одобрен для профилактики только у пациентов при протезировании тазобедренного сустава. Тромбоциты играют меньшую роль при венозном тромбозе, чем при артериальном; эффективность антитромбоцитарных препаратов при венозном тромбозе непостоянна.
Б. Лечение имеющегося заболевания. Имеющийся венозный тромбоз лечат максимальными дозами гепарина и варфарина. Гепарин используют в течение первых 7-10 дней, причем в последние 3-5 из этих дней начинают прием варфарина. Лечение варфарином продолжается после выписки из больницы еще от шести недель (после первого эпизода) до шести месяцев (после повторных эпизодов). Эмболии легочных сосудов лечат таким же образом. Маленькие тромбы в венах голени часто лечат без антикоагулянтов. Риск, стоимость и неудобство ненужного антикоагулянтного лечения значительно превышают таковые при венографии, которая является точным диагностическим тестом. Только одна треть пациентов с подозрением на тромбоз глубоких вен на самом деле страдает этой патологией.
У пациентов с повторными тромбозами и наличием такой же патологии в семейном анамнезе следует подозревать дефицит белков С или S. Таким больным может быть полезен концентрат антитромбина III. Он помогает преодолеть резистентность к гепарину при дефиците антитромбина III.
Беременность
Варфарин хорошо проходит через плаценту. Он может вызывать кровотечения в любом триместре беременности, а также дефекты развития при введении в первом триместре. Поэтому тромбоэмболии у беременных следует лечить гепарином, лучше всего подкожно. При беременности необходимо лабораторное мониторирование антикоагулянтного эффекта.
Фибринолитическая терапия
Раннее лечение фибринолитиками не очень массивной эмболии легочной артерии может повысить выживаемость и сохранить легочную функцию.
Стандартный курс фибринолитической терапии затем дополняется назначением антикоагулянтов: гепарина и варфарина. Из-за возможности кровотечений следует избегать сочетания такого лечения с хирургическим. Эти препараты противопоказаны после недавней операции и пациентам с метастазами рака, инсультом или геморрагическими заболеваниями.
Артериальный тромбоз
У пациентов с артериальными тромбами происходит избыточное потребление тромбоцитов. Таким образом, при транзиторных ишемических приступах, инсультах или нестабильной стенокардии и остром инфаркте миокарда показано лечение анти-тромбоцитарными препаратами типа аспирина или тиклопидина. При стенокардии или инфаркте эти средства часто сочетают с p-блокаторами или блокаторами кальциевых каналов и фибринолитической терапией.
V. Антигеморрагические средства
Витамин К
Витамин К действует на протромбин и факторы VII, IX и X, участвуя в их пострибосомальной модификации. Тяжелая печеночная недостаточность приводит к снижению синтеза белка и геморрагическому диатезу, который не реагирует на лечение витамином К.
Витамин К — это жирорастворимое вещество, которое в больших количествах содержится в зеленых листьях овощей. Потребность организма в витамине К низкая, так как он синтезируется еще и бактериальной флорой кишечника. Существуют две естественные формы витамина — Kt и К2. Витамин К! (рис. 33-5) присутствует в пище и называется фитонадионом. Витамин К2 находят в тканях человека, он синтезируется бактериями кишечника и называется менахиноном.
Витамины К| и К2 всасываются только с солями желчных кислот. Витамин Kf выпускается в таблетках по 5 мг и ампулах по 50 мг. Эффект проявляется только через 6 часов, но развивается полностью уже через 24 часа, когда происходит коррек
ция снижения активности протромбина из-за избытка варфарина или недостатка витамина К. Внутривенное введение витамина Kt должно проводиться медленно, так как быстрое введение может вызвать одышку, боли в груди, спине и даже смерть. Витамин Kt в настоящее время вводят всем новорожденным для предотвращения геморрагий при дефиците витамина К, которые особенно часто встречаются у недоношенных новорожденных. Водорастворимую соль витамина К3 (менадион) нельзя применять в клинике. Она особенно неэффективна при лечении передозировки варфарина. Дефицит витамина К часто возникает у госпитальных больных в отделениях интенсивной терапии вследствие плохого питания, особенно парентерального, недавних операций, множественной ан-тибиотикотсрапии и уремии.
Фракции плазмы
Дефицит факторов коагуляции может вызвать кровотечение (табл. 33-3). Спонтанное кровотечение возникает, когда уровень фактора становится ниже 5 % от нормы. Дефицит фактора VIII (классическая гемофилия, или гемофилия А) и дефицит фактора IX (болезнь Кристмаса, или гемофилия В) являются наиболее частыми наследуемыми дефектами коагуляции. Для их лечения применяют концентрированные фракции плазмы. Однако боязнь вирусного гепатита и СПИДа привела к снижению популярности такой терапии. Для оптимального использования терапевтических средств необходима постановка специфического диагноза дефицита фактора и определение его активности в плазме. Существует много наследственных и приобретен
ТАБЛИЦА 33-3. Лечебные средства для коррекции нарушений коагуляции'
Фактор Патологическое состояние(болезнь) Концентрация(%) относительно нормы для гемостаза2 Период полувыведения (дни) инфузируемого фактора Лечебное средство
I Афибриногенемия, синдром отсутствия фибрина 40 4 Фибриноген плазмы, криопреципитат
II Дефицит протромбина 40 3 Концентрат (фактор IX—протромбиновый комплекс)
V Дефицит фактора V 20 1 Свежезамороженная плазма
VII Дефицит фактора VII Неизвестна ’А Концентрат (некоторые препараты фактора IX)
VIII Гемофилия А (классическая) 25-35 7г Плазма, криопреципитат и
Болезнь Виллебранда 30 Неизвестен другие концентраты фактора VIII3
IX Гемофилия В (болезнь Кристмаса) 25 1 Плазма, фактор IX—протромбиновый комплекс
X Дефект фактора Стюарта-Прауэра 25 1% Плазма, концентрат (некоторые препараты фактора IX)
XI Дефицит РТА Неизвестна 3 Свежезамороженная плазма
XII Дефект фактора Хагемана Не требуется Неизвестен Лечения не требуется
XIII Дефицит фибринстабилизи-рующего фактора 2 6 Свежезамороженная плазма
AT III Антитромбин III 80 3 Концентрат (АТ Ш-специфи-
ческий)
1 Из: Biggs R. (ed.): Human Blood Coagulation, Haemostasis, and Thrombosis, 2nd ed. Blackwell, 1976.
2 Непосредственно после инфузии в зависимости от степени недостаточности может потребоваться значительно более высокий уровень.
3 Для лечения болезни Виллебранда не должны использоваться высокоочищенные препараты фактора VIII без специального подтверждения их эффективности.
ных нарушений функций тромбоцитов. Синтезирован и успешно прошел клинические испытания рекомбинантный фактор VIII, хотя он еще не одобрен для клинического применения. Его высокая стоимость может нейтрализовать пользу от снижения риска заражения вирусным заболеванием.
1. ФАКТОР VIII
Существуют два препарата концентрированного человеческого фактора VIII. Криопреципитат — это фракция белков плазмы, получаемая из цельной крови. Он используется для коррекции дефицита фактора VIII при гемофилии и болезни Виллебранда, а также иногда как источник фибриногена. Для инфузии замороженный криопреципитат размораживают и растворяют в небольшом объеме цитратнофизиологического раствора. Женщины репродуктивного возраста с резус-отрицательной кровью должны получать только резус-отрицательный криопреципитат, чтобы избежать контаминации продуктами с резус-положительными клетками. Лиофильные концентраты фактора VIII готовят из большого объема плазмы. Криопреципитат крови от одного донора, скорее всего, более безопасен. Риск заражения вирусными заболеваниями типа гепатита В, С и СПИДа снижается или полностью снимается пастеризацией и экстракцией плазмы растворителями и детергентами. Ультрафиолетовое облучение концентратов фактора VIII уменьшает вероятность заражения вирусом СПИДа. Ультраочищенный концентрат фактора VIII, приготовленный с помощью моноклональных антител и технологии рекомбинантной ДНК, стоит очень дорого. Коммерческие замороженные и высушенные концентраты не всегда подходят для лечения болезни Виллебранда, так как полимерная структура фактора VIII в белке Виллебранда, которая поддерживает адгезию тромбоцитов, может быть утеряна в процессе приготовления.
Неосложненное суставное кровотечение лечат замещением фактора VIII до, по меньшей мере, 5 % нормальной концентрации в течение 24 часов. Гематомы мягких тканей требуют минимум 10 % активности в течение семи дней. При гематурии необходим минимум 10 % активности в течение трех дней. Операция или серьезная травма требуют минимум 30 % активности в течение 10 дней после нагрузочной дозы 50 ЕД/кгдля достижения 100 % активности фактора VIII (табл. 33-3). Каждая единица фактора VIII на 1 кг поднимает его активность в
плазме на 2 %. Заместительная терапия должна проводиться каждые 12 часов.
Десмопрессин-ацетат (аргинин-вазопрессин) повышает активность фактора VIII у пациентов с легкой формой гемофилии А или болезнью Виллебранда. Его можно использовать при малых операциях, например при удалении зуба, без заместительного введения фактора. Ослабленный андрогенный препарат даназол, который также повышает активность фактора VIII, успешно применяли в экспериментальном лечении легкой формы гемофилии.
Концентраты фактора VII и криопреципитат не используют для коррекции дефицита витамин К-зависимых факторов.
2. ФАКТОР IX
Замороженные сухие концентраты плазмы, содержащие протромбин, факторы IX, X и разные количества фактора VII (проплекс и конин), производятся для лечения дефицита этих факторов (табл. 33-3). Каждая ЕД/кг фактора IX повышает его активность в плазме на 1.5 %. При этом часто назначается гепарин для подавления факторов коагуляции, активирующихся во время производства. Однако добавление гепарина не предотвращает тромбоэмболии. Тем не менее у больных, получающих высокоочищенные препараты фактора IX, которые были инактивированы на случай присутствия вирусов растворителями и детергентами, возникает меньше тромбозов после операций.
Некоторые препараты концентрата фактора IX содержат активированные факторы свертывания, что является обоснованием их использования у пациентов, имеющих ингибиторы или антитела к факторам VIII и IX. Для этой цели применяют два специальных препарата: аутоплекс (с коррекцией активности фактора VIII) и фейба (с активностью, не подавляемой ингибитором фактора VIII). Эти препараты неодинаково эффективны в остановке кровотечения, а титры ингибитора часто повышаются после их применения.
3. ФИБРИНОГЕН
Фибриноген можно вводить пациентам в виде плазмы, криопреципитата фактора VIII или лиофильного концентрата фактора VIII. Единица криопреципитата содержит 300 мг фибриногена. Богаты фибриногеном и лиофильные концентраты фактора VIII.
Ингибиторы фибринолиза: аминокапроновая кислота
Аминокапроновая кислота, химически сходная с аминокислотой лизином, является синтетическим ингибитором фибринолиза. Она конкурентно ингибирует активацию плазминогена (рис. 33-3). Кислота быстро всасывается при пероральном приеме и выводится почками. Обычная пероральная доза препарата — 6 г четыре раза в день. При внутривенном введении нагрузочная доза 5 г вводится в течение 30 минут для избегания гипотензивной реакции. Транексамовая кислота является аналогом амино-капроновой кислоты и обладает такими же свойствами. Она вводится перорально в нагрузочной дозе 15 мг/кг, а затем по 30 мг/кг каждые 6 часов.
Показания к клиническому применению ами-нокапроновой кислоты — это адъювантная терапия гемофилии, лечение кровотечений вследствие фибринолитической терапии и профилактика повторного кровотечения из аневризм интракраниальных сосудов. Хороший эффект наблюдается и при лечении послеоперационных желудочно-кишечных кровотечений и кровотечений после удаления предстательной железы, а также при кровотечении из мочевого пузыря при цистите, вызванном лекарственными препаратами или радиацией. Побочные эффекты препарата включают внутрисосудистый тромбоз из-за подавления ингибитора плазминогена, гипотензию, миопатию, дискомфорт в области живота, диарею и заложенность носа.
Препараты
Аминокапроновая кислота (генерик, Амикар)
Перорально: таблетки по 500 мг;
сироп 250 мг/мл
Парентерально: 250 мг/мл для в/в инъекций Рекомбинантная альтеплаза [t-PA] (Активаза)
Парентерально: лиофилизированные порошки по 20, 50 мг для в/в инъекций
Анистреплаза (Эминаза)
Парентерально: лиофилизированный порошок (30 ЕД) для в/в инъекций
Антигемофильный фактор [Фактор VIII, AHF] (Гемофил М, коат-HS, коат-НТ, моноклат) Парентерально: во флаконах
Антиингибиторный коагулянтный комплекс (Аутоплекс Т, фейба VH иммуно) Парентерально: во флаконах
Антитромбин III (АТнатив)
порошок (500 ME) для в/в инъекций
Дипиридамол (Перзантин)
Перорально: таблетки по 25, 50,75 мг
Эноксапарин (низкомолекулярный гепарин, ловенокс)
Парентерально: 30 мг/0.3 мл только для п/к инъекций
Комплекс фактора IX, человеческий (Конин-НТ, Профилнин термообработанный, Проплекс Т, Проплекс SX-T)
Парентерально: во флаконах
Гепарин натрия (генерик, Ликвемин)
Парентерально: 1000, 5000, 10 000, 20 000, 40 000 ЕД/мл для инъекций
Гепарин кальция (Кальципарин) Парентерально: 5000 ЕД/на дозу
Фитонадион [KJ (Мефитон, водный Мефитон, Конакион)
Перорально: таблетки по 5 мг
Парентерально: 2, 10 мг/мл водного коллоидного раствора или суспензии для инъекций
Протамин (генерик)
Парентерально: 10 мг/мл для инъекций
Стрептокиназа (Кабикиназа, Стрептаза)
Парентерально: 250 000, 600 000, 750 000,
1 500 000 ME порошка во флаконе для инъекций
Тиклопидин (Тиклид)
Перорально: таблетки по 250 мг
Транексамовая кислота (Циклокапрон)
Перорально: таблетки по 500 мг
Парентерально: 100 мг/мл для инъекций
Урокиназа (Аббокиназа)
Парентерально: 250 000 ME во флаконе;
порошок развести до 5000 МЕ/мл для инъекций
Варфарин (генерик, Коумадин)
Перорально: таблетки по 2, 2.5, 5, 7.5, 10 мг
Парентерально: 50 мг во флаконе + ампула с 2 мл растворителя для инъекций
Препараты, применяемые при гиперлипидемии
34
Мэри Дж. Меллой, Джон П. Кейн
Почти все липиды плазмы человека транспортируются в комплексе с белками. Кроме жирных кислот, которые связываются преимущественно с альбуминами, все липиды переносятся в составе специальных макромолекулярных комплексов, называемых липопротеидами. Поэтому нарушения метаболизма, при которых повышается содержание липопротеидов плазмы, названы пшерлипопроте-идемиями. Термин гиперлипемия применяют в тех случаях, когда повышается концентрация триглицеридов плазмы. Понятие гиперлипидемия включает обе группы состояний.
Два основных следствия гиперлипопротеиде-мии — это острый панкреатит и атеросклероз. Острый панкреатит возникает при выраженной ги-перлипемии. У таких пациентов контроль уровня триглицеридов помогает предотвратить повторные обострения этого угрожающего жизни заболевания.
Атеросклероз — ведущая причина смерти в США и других странах Запада. С атерогенезом связаны определенные виды липопротеидов. Липопротеиды, содержащие аполипопротеид (Апо) В-100, выполняют транспортную функцию доставки холестерина в стенку артерий. Эти атерогенные липопротеиды являются липопротеидами низкой (ЛПНП), промежуточной (ЛППП), очень низкой плотности (ЛПОНП) и Лп(а) липопротеидами. Эфиры холестерина, которые находят в “пенистых” клетках атеромы, также располагаются во внеклеточном матриксе и вызывают образование коллагена фибробластами. Ключевую роль в атерогенезе выполняют макрофаги и гладкомышечные клетки. К захвату липопротеидов через специфические рецепторы на этих клетках (“рецепторы-уборщики”) приводит их окисление, что формирует “пенистые” клетки, в которых кумулируются эфиры холестерина. Для образования атеромы имеют значение и
Сокращения, используемые в этой главе
АХАТ Аци л- КоА:хо пестери н -ацил-трансфераза
ГМГ-КоА З-Гидрокси-З-метилглутарил-кофермент А
Лп(а) Липопротеин(а)
ЛПВП Липопротеиды высокой плотности
ЛПЛ Липопротеинлипаза
ЛПНП Липопротеиды низкой плотности
ЛПОНП Липопротеиды очень низкой плотности
ЛППП Липопротеиды промежуточной плотности
ЛХАТ Лецитин:холестерин-ацил-трансфераза
Аро Аполипопротеин
СЕТР Белок переноса холестериновых эфиров
другие факторы. Они включают гипертензию, низкий уровень липопротеидов высокой плотности (ЛПВП) , которые участвуют в выведении холестерина из атеромы, а также курение и диабет.
Атеросклероз коронарных и периферических артерий является динамическим процессом. Недавние исследования у человека с помощью ангиографического метода продемонстрировали, что общая регрессия повреждения коронарных артерий обусловлена терапией, направленной на снижение уровня липидов. Частота возникновения новых нарушений коронарного кровообращения снижалась при этом лечении. Поэтому своевременные диагности
ка и лечение гиперлипидемии снижает заболеваемость и смертность вследствие нарушения коронарного кровообращения.
При многих гиперлипидемиях развиваются ксантомы. Эти изменения, которые характеризуются отложением липидов в сухожилия или кожу, могут быть болезненны или создают косметические проблемы для пациента. Так как ксантомы регрессируют на фоне терапии, снижающей уровень липидов, это является еще одним показанием к ее применению.
Понимание биологии липопротеидов и патофизиологии разных гиперлипидемических состояний необходимо для рационального выбора терапии.
Патофизиология гиперлипопротеидемии
Нормальный метаболизм липопротеидов
Структура
Основные липопротеиды плазмы представляют собой сферические частицы с гидрофобным центром, содержащим холестериновые эфиры и триглицериды. Этот центр окружает монослой неэтерифи-
цированного холестерина и фосфолипидов. Специфические белки (аполипопротеиды) расположены на поверхности. Некоторые липопротеиды содержат аполипопротеины с очень высокой мол. м. (В-протеины), которые не мигрируют из одной частицы в другую, как это делают мелкие аполипопротеиды. Существуют две основные формы АпоВ: В-48, образующийся в кишечнике и обнаруживаемый в составе хиломикронов и их остатков; и В-100, который синтезируется в печени и входит в состав ЛПОНП, их остатков (ЛППП), ЛПНП (которые образуются из ЛПОНП) и Лп(а) липопротеидов.
Более мелкие аполипопротеиды распределяются в разном количестве средн липопротеидов. АпоА-I является кофактором лецитин:холестерин-ацил-трансферазы (ЛХАТ). АпоС-П — необходимый кофактор липопротеидлипазы. Известно несколько изоформ АпоЕ (в соответствии с замещением отдельных аминокислот). Изоформы этого белка должны узнаваться рецепторами печени для захвата ею остатков липопротеидов.
Характеристики разных липопротеидовых комплексов показаны в табл. 34-1.
Синтез и катаболизм
А. Хиломикроны. Хиломикроны, самые большие из липопротеидов, образуются в кишечнике и содержат триглицериды пищевого происхождения.
ТАБЛИЦА 34-1. Основные липопротеиды сыворотки человека
Подвижность при электрофорезе в агарозном геле Интервал плотности (г/см3) Центральные липиды Диаметр (нм) Аполипопротеиды в порядке количественного содержания
лпвп a 1.063-1.21 Эфиры холестерина 7.5-10.5 A-I, А-ll, С, Е, D
ЛПНП Р 1.019-1.063 Эфиры холестерина 21-22 В-100
ЛППП Р 1.006-1.019 Эфиры холестерина, триглицериды 25-30 В-100, Е, С
ЛПОНП Пре-p, частично “медленные пре-Р” < 1.006 Триглицериды, некоторое количество эфиров холестерина 30-100 Различные С, В-100, Е
Хиломикроны Остаются на исходном уровне <1.006 Триглицериды, некоторое количество эфиров холестерина 80-500 В-48, С, Е, A-I, A-II
Лп(а) липопротеиды Пре-Р 1.04-1.08 Эфиры холестерина 21-30 В-100, Лп(а)
В своей центральной части они содержат и некоторое количество холестерина, этерифицированного ацил-КоА:холестерин-ацилтрансферазной (АХАТ) системой. Фосфолипиды и свободный холестерин вместе с заново синтезированными АпоВ-48б A-I, А-П и другими протеидами образуют поверхностный монослой. Хиломикроны переходят во внеклеточное лимфатическое пространство и по кишечным лимфатическим протокам и грудному протоку переносятся в кровоток.
Триглицериды выводятся из состава хиломикронов в тканях (кроме печени) тем же путем, что и из ЛПОНП, то есть гидролизом липопротеидлипазной системой (ЛПЛ). Гепарин и АпоС-П являются кофакторами этой реакции. При снижении количества центральных триглицеридов уменьшается размер частицы. Поверхностные липиды, АпоА-1, АпоА-П и АпоС переносятся к ЛПВП. Образующиеся хиломикроновые “остатки” захватываются рецепторным эндоцитозом в гепатоциты. Эфиры холестерина гидролизуются в лизосомах, холестерин затем выводится с желчью, окисляется и выводится в форме желчных кислот или секретируется в плазму в липопротеидах.
Б. Липопротеиды очень низкой плотности (ЛПОНП). ЛПОНП образуются в печени и несут в себе синтезируемые там триглицериды (рис. 34-1). ЛПОНП содержат АпоВ-100 и немного АпоС. Большее количество АпоС затем захватывается из ЛПВП плазмы. Вне печени триглицериды гидролизуются липопротеидлипазой, образуя свободные жирные кислоты, которые в последующем депонируются в жировой ткани и окисляются в таких тканях, как сердечная и скелетная мышцы. Это приводит к снижению количества триглицеридов в ЛПОНП с образованием меньших по размеру частиц-остатков, называемых липопротеидами промежуточной плотности (ЛППП). Некоторые из этих ЛППП путем эн-доцитоза попадают прямо в печень. Другие конвертируются в ЛПНП путем дальнейшего метаболизма триглицеридов. Этот процесс объясняет клинический феномен “P-сдвига”, то есть повышения уровня ЛПНП (Р-липопротеидов) в сыворотке после завершения гипертриглицеридемической стадии. Повышение уровня ЛПНП в плазме может быть вызвано увеличением секреции их предшественника ЛПОНП, а также снижением катаболизма ЛПНП.
В. Липопротеиды низкой плотности (ЛПНП). Главный путь катаболизма ЛПНП в гепатоцитах и большинстве других ядросодержащих клеток — это
высокоаффинный рецепторный эндоцитоз. Эфиры холестерина из центра ЛПНП гидролизуются с образованием свободного холестерина, используемого для синтеза клеточных мембран. Клетки также получают холестерин синтезом de novo через образование мевалоновой кислоты ГМГ-КоА-редукта-зой. Образование этого фермента и рецепторов ЛПНП регулируется на транскрипционном уровне содержанием холестерина в клетке.
Г. Липопротеиды высокой плотности (ЛПВП). Аполипопротеиды ЛПВП синтезируются в печени и в кишечнике. Большая часть липидов ЛПВП происходит из поверхностных монослоев хиломикронов и ЛПОНП посредством липолиза. ЛПВП также получают холестерин из периферических тканей, тем самым регулируя гомеостаз холестерина в клетке. В этом процессе холестерин, абсорбированный из клеточных мембран, попадает в маленькую частицу, пре-Р-ЛПВП. Затем холестерин этерифи-цируется лецитингхолестерин-ацилтрансферазой (ЛХАТ), приводя к образованию крупных ЛПВП. Эфиры холестерина переносятся к ЛПОНП, ЛППП, ЛПНП и хиломикроновым остаткам с помощью белка переноса эфиров холестерина (СЕТР). Большая часть переносимого таким образом холестерина затем попадает в печень путем эндоцитоза акцепторных липопротеидов (рис. 34-1).
Г иперлипопротеидемические состояния
Наличие гиперлипопротеидемии определяется измерением количества липидов сыворотки после голодания в течение вечера и ночи. С повышением уровня ЛПНП риск атеросклеротического поражения сердца повышается, на него влияют и другие факторы риска (табл. 34-2). В идеале уровень триглицеридов должен быть ниже 150 мг/дл. Дифференцировка требует определения типа липопротеидов, который вызвал это повышение (табл. 34-3). Для установления диагноза заболевания, связанного с первичным специфическим липопротеидом, обычно требуется сбор дальнейших клинических и генетических данных, а также исключение заболеваний, которые могут вызывать вторичную гиперлипидемию (табл. 34-4). Различные виды нарушений описаны в следующем подразделе. Препараты, приведенные в таблице, описаны в главах по общей и клинической фармакологии.
Гепатоцит
Кровь
Эндотелий
Шероховатый j ,, дпПарат5
эндоплазматический’ | Гольджи
ретикулум ’
В-100
АпоЕ
капилляра
©
АпоС
ЛПВП
АпоВ, АпоЕ, АпоС
ЛПОНП
Липопротеид-липаза
Холестерин®
. | Лизосома,
ЛПНП-рецептор
Остаток
ЛПОНП (ЛППП)
ФФА
Мевалоновая г-Ц -кислота '
ЛПВП
ГМГ-КоА-редуктаза
ЛПНП
I Ацетил-। КоА
Периферическая клетка
Путь биосинтеза холестерина
Рис. 34-1. Метаболизм липопротеидов печени. Главные реакции выделены. ЛПОНП секретируются аппаратом Гольджи. Они получают дополнительные липопротеиды С и АпоЕ из ЛПВП. ЛПОНП конвертируются в остатки ЛПОНП (ЛППП) путем липолиза липопротеинлипазой в сосудах периферических тканей. В процессе этого С-аполппопроте-иды и часть АпоЕ отдаются обратно ЛПВП. Некоторые из остатков ЛПОНП переходят в ЛПНП путем дальнейшей потери триглицеридов и АпоЕ. Основной путь деградации ЛПНП — это эндоцитоз ЛПНП их рецепторами в печени и периферических тканях, для которых АпоВ-100 является лигандом. (Темным цветом обозначены эфиры холестерина; светлым — триглицериды; звездочка — функциональный лиганд для ЛПНП; треугольники — аполипопротеид Е; кружки и квадраты — С-аполипопротеиды.). (Из: KaneJ., Malloy М. Disorders of lipoproteins. In: The Molecular and Genetic Basis of Neurological Disease. Rosenberg R. N. et al. (eds). Butterworth-Heinemann, 1993.)
Первичные
гипертриглицеридемии
Хотя эпидемиологические исследования показали только незначительную связь гипертриглицеридемии и поражения коронарных артерий, в некоторых семьях атеросклероз тесно связан с гипертриглицеридемией. Поэтому пациенты в этих семьях
должны получать фармакотерапию, в то время как другим людям, у которых уровень триглицеридов не превышает 500 мг/дл, терапия не требуется.
Первичная хиломикронемия
Хиломикроны в норме отсутствуют в сыворотке крови после голодания. Аутосомно-рецессивный дефицит ЛИЛ и ее кофактора обычно приводят к тя-
ТАБЛИЦА 34-2. Национальная образовательная
программа по холестерину: указания по лечению взрослых (1993)
Уровень Общий холестерин, мг/дл Холестерин ЛПНП, мг/дл
Желательный <200 < 130
Погранично-высокий1 200-239 130-159
Высокий >240 >160
' Уровень считается высоким, если имеется поражение коронарных артерий или более двух факторов риска. Уровень ЛПВП ниже 35 мг/дл считается значительным фактором риска. У пациентов с поражением коронарных артерий желательное содержание холестерина ЛПНП меньше или равно 100 мг/дл.
желой липемии (2000-25 000 мг/дл триглицеридов при нормальной диете американца). Часто впервые диагноз ставят после приступа острого панкреатита. У пациентов наблюдаются вскрывающиеся ксантомы, гепатоспленомегалия, гиперспленизм и выявляются полные липидов “пенистые” клетки в костном мозге, печени и селезенке. Липемия усугубляется эстрогенами, так как они стимулируют продукцию ЛПОНП в печени, а беременность может вызвать значительное повышение уровня триглицеридов, несмотря на строгую диету. Хотя в основном у этих пациентов отмечается хиломикронемия, содержание ЛПОНП также может быть умеренно повышено, что проявляется как смешанная липемия (хиломикронемия после голодания и повышение ЛПОНП). Дефицит ЛПЛ диагностируется in vitro
ТАБЛИЦА 34-3. Первичные гиперлипопротеидемии и их лекарственная терапия
Нарушение Проявления Монотерапия’ Комбинации препаратов
Первичная хиломикронемия (семейный дефицит ЛПЛ Повышен уровень хиломикронов, ЛПОНП Диета
или кофактора) Семейная гипертриглицеридемия
Тяжелая Умеренная Семейная сочетанная ги- Повышен уровень ЛПОНП, хиломикронов Повышен уровень ЛПОНП и, может быть, хиломикронов Повышен уровень ЛПОНП Ниацин, гемфиброзил Ниацин, гемфиброзил Ниацин, гемфиброзил Ниацин + гемфиброзил
перлипопротеидемия Повышен уровень ЛПНП Повышен уровень ЛПОНП и ЛПНП Ниацин,ингибитор редуктазы, смолы Ниацин,ингибитор редуктазы Ниацин + смолы или ингибитор редуктазы Ниацин + смолы или ингибитор редуктазы
Семейная дисбеталипопро-теидемия Семейная гиперхолестери- Повышен уровень остатков ЛПОНП и хиломикронов Ниацин, гемфиброзил Гемфиброзил + ниацин или ниацин + ингибитор редуктазы
немия
Гетерозиготная Повышен уровень ЛПНП Смолы, ингибитор редуктазы, ниацин 2 или 3 из препаратов монотерапии
Гомозиготная Повышен уровень ЛПНП Пробукол, ниацин Смолы + ниацин + ингибитор редуктазы; пробукол + перечисленные препараты
Лп(а)-гиперлипопротеиде-мия Неклассифицированная гиперхолестеринемия Повышен уровень Лп(а) Ниацин Смолы, ниацин, ингибитор редуктазы Ниацин + ингибитор редуктазы
1 Следует проводить монотерапию до назначения комбинации препаратов.
ТАБЛИЦА 34-4. Вторичные причины
гиперлипопротеидемии
Гипертриглицеридемия Гиперхолестеринемия
Сахарный диабет Употребление алкоголя Тяжелый нефроз Эстрогены Уремия Избыток кортикостероидов Гипотиреоидизм Гликогенопатии Гипопитуитаризм Акромегалия Нарушения комплекса иммуноглобулин-липопротеин Гипотиреоидизм Ранний нефроз Разрешающаяся липемия Нарушения комплекса иммуноглобулин-липопротеин Нервная анорексия Холестаз Гипопитуитаризм Избыток кортикостероидов
по липолитической активности плазмы после внутривенной инъекции гепарина, дефицит кофактора ЛПЛ выявляется изоэлектрическим фокусированием белков ЛПОНП. Предположительный диагноз этих заболеваний ставится при выявлении значительного повышения уровня триглицеридов плазмы через несколько дней после строгого ограничения потребления пищевого жира. Эффективным методом длительного лечения является снижение потребления жира. Фармакотерапия не показана.
Семейная гипертриглицеридемия
А. Тяжелая (обычно смешанная липемия). Смешанная липемия обычно возникает из-за нарушения выведения липопротеидов, богатых триглицеридами, хотя факторы, которые повышают продукцию ЛПОНП, усугубляют липемию, так как ЛПОНП и хиломикроны конкурируют за ЛПЛ. Первичные смешанные липемии, возможно, наследуются разными путями. У большинства больных наблюдается центрипетальное ожирение со снижением чувствительности к инсулину. Кроме ожирения, повышать секрецию ЛПОНП и ухудшать липемию могут дру-гие факторы. В зависимости от степени тяжести липемии с разной частотой встречаются ксантомы, липемия сетчатки, эпигастральные боли и панкреатит. Лечение заключается в диете с ограничением жира, в исключении алкоголя, снижении массы тела до желательного уровня. Некоторым пациентам требуется лечение гемфиброзилом или ниацином.
Б. Умеренная (эндогенная липемия). Первичное повышение содержания ЛПОНП, возможно, отражает несколько генетических детерминант и усугубляется при наличии факторов, которые повышают скорость секреции ЛПОНП печенью, то есть при гипертрофическом ожирении, приеме алкоголя, диабете и применении экзогенных эстрогенов. Главным показанием для лечения является наличие атеросклероза у пациента или у его родственников. Лечение включает снижение массы тела до желательного уровня, ограничение пищевого жира, исключение алкоголя. Гемфиброзил или ниацин обычно вызывают дальнейшее снижение уровня триглицеридов, если диетой не удается уменьшить их концентрацию в плазме до 500 мг/дл и ниже.
Семейная сочетанная гиперлипопротеидемия
В крови пациентов из семей с этим поражением могут быть повышены ЛПОНП, ЛПНП или оба этих липопротеида, и их сочетание может меняться со временем. Общие факторы, которые повышают уровень триглицеридов сыворотки при других нарушениях, действуют и при этой патологии. Повышение холестерина и триглицеридов сыворотки умеренное, ксантом обычно не наблюдается. Однако вследствие повышенного риска коронарного атеросклероза требуется медикаментозное лечение, кроме того, только диета не обеспечивает достаточного снижения уровня липидов. Пациенты с повышенным уровнем ЛПОНП обычно хорошо реагируют на лечение ниацином.
Семейная дисбеталипопротеидемия
При семейной дисбеталипопротеидемии кумулируются остатки хиломикронов и ЛПОНП. Содержание ЛПНП обычно снижено. Так как эти остатки богаты эфирами холестерина, уровень холестерина сыворотки может достигать уровня триглицеридов. Диагноз подтверждается отсутствием Е3 и Е4 изоформ АпоЕ. У пациентов часто появляются бугорковые или бугорково-вскрывающиеся ксантомы, а также характерные плоские ксантомы в складках ладоней. Как правило, развивается ожирение и нарушается толерантность к глюкозе. Эти факторы вместе с гипотиреоидизмом усугубляют липемию. С повышенной частотой возникает коронарный и периферический атеросклероз. Достаточным лечением является диета со снижением массы тела
вместе со снижением потребления холестерина и алкоголя. В некоторых случаях требуются малые дозы гемфиброзила или ниацина.
Первичные
гиперхолестеринемии
Семейная гиперхолестеринемия
Это заболевание является аутосомно-доминантным. Хотя уровни ЛПНП в детском возрасте имеют тенденцию к повышению, диагноз часто можно поставить на основании повышенной концентрации холестерина в крови, взятой из пупочного канатика. У большинства гетерозиготных взрослых концентрация холестерина в сыворотке колеблется от 280 до 500 мг/дл. Уровень триглицеридов обычно нормальный, часто определяются сухожильные ксантомы, на третьей декаде жизни появляются arcus сотеае и ксантелазмы. Обычно рано возникает коронарный атеросклероз. Гомозиготная семейная гиперхолестеринемия, которая может приводить к коронарному атеросклерозу в детском возрасте, характеризуется очень высокими уровнями холестерина сыворотки (часто выше 1000 мг/дл) и ранними бугорковыми и сухожильными ксантомами. У этих пациентов могут возникать приподнятые бляшкоподобные ксантомы сухожилий пальцев, ягодиц и конечностей.
В основе этого заболевания лежит дефект высокоаффинных рецепторов ЛПНП. У гетерозигот количество рецепторов в 2 раза меньше нормального, а у некоторых отмечается смешанная гетерозиготность для аллелей, кодирующих синтез нефункционирующих и плохо функционирующих рецепторов. Уровни ЛПНП у гетерозиготных пациентов, которые готовы соблюдать назначения врача, могут быть снижены до нормы комбинациями препаратов (рис. 34-2).
Пациенты, у которых рецепторы сохраняют хотя бы минимальную функцию, могут частично прореагировать на лечение смолами или ингибиторами редуктазы. Пациентам с нефункциональными рецепторами показана терапия ниацином или пробуколом.
Семейная патология лиганда аполипопротеида В
Дефекты лигандного комплекса АпоВ-100 (части, которая связывается с рецептором ЛПНП) нарушают эндоцитоз ЛПНП, приводя к умеренной
гиперхолестеринемии. Могут возникать сухожильные ксантомы. Считается, что уровень ЛПНП должен быть чувствителен к действию ниацина. Реакция на ингибиторы ГМГ-КоА-редуктазы может быть различной.
Семейная сочетанная
гиперлипопротеидемия
Как уже было описано, в некоторых семьях с этим заболеванием наблюдается только повышение уровня ЛПНП. Уровни холестерина сыворотки обычно ниже 350 мг/дл. Часто встречается раннее начало поражения коронарных артерий. Показаны диета и фармакотерапия ниацином или ингибитором редуктазы. Для нормализации уровня ЛПНП или для снижения концентрации триглицеридов при проведении лечения смолами часто возникает необходимость добавлять ниацин.
Лп(а)-гиперлипопротеидемия
Семейное заболевание, связанное с повышением атерогенеза, частично определяется генами, ко-
Рис. 34-2. Места действия ингибитора редуктазы ГМГ-КоА, ниацина и смол в лечении гиперлипидемий. Количество рецепторов ЛПНП (R ) повышается при лечении смолами и ингибиторами ГМГ-КоА-редуктазы
торые вызывают повышение образования Лп(а)-ли-попротеида. Метаболические дефекты, которые сопровождаются подавлением выведения ЛПНП, повышают плазменные уровни Лп(а). В предварительных исследованиях установлено, что ниацин может снижать уровни Лп(а) у некоторых пациентов.
Неклассифицируемая гиперхолестеринемия
Встречаются не определенные до настоящего времени типы гиперхолестеринемии, которые часто являются семейными, но менее тяжелыми, чем вышеописанные заболевания. В некоторых семьях с повышенным содержанием ЛПНП к очень хорошим результатам приводит диета.
Дефицит ЛПВП
При некоторых редких генетических заболеваниях в сыворотке имеются крайне низкие уровни ЛПВП. Это такие заболевания, как болезнь Танжера и дефекты Л ХАТ. Семейная гипоальфалипопро-теидемия — нарушение обмена ЛПВП, которое встречается более часто, при нем уровень холестерина ЛПВП обычно ниже 35 мг/дл и очевиден кодоминантный механизм наследования. У этих па-циетов рано возникает атеросклероз коронарных артерий, и низкий уровень ЛПВП может быть единственным определяемым фактором риска. В настоящее время лечение состоит из особых мер по исключению факторов риска поражения коронарных артерий. Ниацин повышает уровень холестерина ЛПВП у многих из этих пациентов.
При наличии гипертриглицеридемии уровни холестерина ЛПВП низкие вследствие переноса эфиров холестерина с ЛПВП на богатые триглицеридами липопротеиды. Это может оказать дополнительный атерогенный эффект. У большинства больных лечение гипертриглицеридемии приводит к нормализации уровней холестерина ЛПВП.
Вторичная
гиперлипопротеидемия
До постановки диагноза первичной гиперлипо-протеидемии необходимо исключить вторичные фенотипические причины. Наиболее частые заболевания, вызывающие гиперлипопротеидемию, приве
дены в табл. 34-4. Аномалии липопротеидов обычно проходят после лечения основного заболевания.
У некоторых людей (часто с легкой липемией) развивается выраженная гипертриглицеридемия после приема даже небольших доз эстрогенов, например в составе оральных контрацептивов. Этот эффект менее выражен, когда малые дозы эстрогенов комбинируются с прогестинами. Если клинически необходима терапия эстрогенами, предпочтительно их трансдермальное введение, так как оно приводит к менее выраженному гипертриглицери-демическому эффекту вследствие отсутствия экстракции при первом прохождении через печень.
При хроническом нефротическом синдроме лечение гиперлипидемии обязательно, так как очень часто происходит поражение коронарных артерий. Диета дает минимальный эффект. С осторожностью необходимо использовать гемфиброзил, поскольку он может обострить миопатию при гипо-альбуминемии. В настоящее время препаратами выбора являются смолы, связывающие желчные кислоты, в сочетании с ниацином. Могут быть также эффективны ингибиторы редуктазы. Хорошее действие на некоторых пациентов с нефротическим синдромом, у которых имеется дефицит триптофана, оказывают добавки этой аминокислоты.
Гиперлипидемия, обусловленная холестазом, характеризуется аномальными липопротеидами, в том числе ЛП-Х-пузырьками, полными неэтерифи-цированного холестерина и фосфолипидов; и ЛП-Y, который содержит триглицериды и АпоВ. Показанием для лечения этой гиперлипидемии является нейропатия, вызванная ксантоматозным повреждением нервов. Хотя наиболее эффективен плазмаферез, могут быть использованы и смолы, связывающие желчные кислоты. Гемфиброзил противопоказан, так как он может вызвать у этих пациентов повышение уровня холестерина.
Диетотерапия
при гиперлипопротеидемии
При принятии решения о лечении гиперлипопротеидемии диета почти всегда назначается первой и этого может оказаться достаточно для терапии без назначения лекарств. Исключением являются пациенты с семейной гиперхолестеринемией или семейной сочетанной гиперлипидемией, у ко
торых диета и препараты должны назначаться сразу и вместе. Холестерин и насыщенные жиры являются главными пищевыми факторами, которые влияют на уровни липопротеидов в плазме. Пищевой холестерин и насыщенные жиры повышают концентрацию ЛПНП по независимым механизмам.
Уровни липопротеидов тоже нарушаются, хотя и в меньшей степени, другими диетическими факторами. Транзиторные повышения ЛПОНП происходят при внезапном потреблении большого количества углеводов. Сахароза и другие простые сахара могут повысить уровень ЛПОНП у больного с периодическими гипертриглицеридемиями. Некоторые виды пищевой клетчатки, например содержащейся в овсянке или рисе, могут в некоторой степени снижать уровень ЛПНП. Алкоголь часто вызывает значительную гипертриглицеридемию, повышая печеночную секрецию ЛПОНП. Синтез и секреция ЛПОНП повышаются и при избыточном питании. Ограничение калорийности питания, особенно при ожирении, снижает уровень триглицеридов ЛПОНП и ЛПНП. В течение периода умень-. шения массы тела ЛПНП и ЛПОНП находятся на более низком уровне, чем при пищевом балансе. Поэтому заключение о том, что диета может быть единственным и достаточным методом лечения, можно сделать только после стабильного поддержания массы тела в течение одного месяца.
Большинство пациентов с гиперлипидемией можно успешно лечить диетой с ограничением холестерина и насыщенного жира при достаточном количестве калорий для достижения и поддержания идеальной массы тела. Общее число получаемых за счет жира калорий должно быть 20-25 %, при этом пациент должен получать с насыщенным жиром менее 8 % всех калорий, а холестерина — менее 200 мг/день. При такой диете холестерин сыворотки снижается на 10-20 %. Рекомендуется повышение количества сложных углеводов и клетчатки; если разрешено применение жира, то следует выбирать мононенасыщенные жиры. Уменьшение массы тела и ограничение количества потребляемых калорий особенно важны для пациентов с повышенным уровнем ЛПОНП и ЛППП. Пациентам с гипертриглицеридемией следует исключить из диеты алкоголь.
Эффект пищевого жира на пациентов с гипертриглицеридемией в значительной степени зависит от расположения двойных связей в жирных кислотах углеродной цепи. В рыбных маслах со-3-жирные кислоты могут значительно снижать триглицери
ды у некоторых пациентов с эндогенной или смешанной липемией. В отличие от этого со-6-жирные кислоты растительных масел могут вызывать повышение уровня триглицеридов у этих пациентов.
Пациенты с первичной хиломикронемией и люди со смешанной липемией должны значительно ограничивать потребление жира: 10-15 г/день, из которых 5 г должны быть в составе растительных масел, богатых незаменимыми жирными кислотами. Следует также назначать жирорастворимые витамины.
Общая и клиническая фармакология препаратов, используемых
при гиперлипидемии
Решение о проведении фармакотерапии гиперлипидемии должно быть основано на специфике метаболических нарушений и вероятности развития атеросклероза или панкреатита. Препараты для лечения первичных гиперлипопротеидемий представлены в табл. 34-3. Для достижения наиболее полного эффекта фармакотерапии как часть лечения необходима диета. Препараты не следует назначать женщинам в период лактации или при планировании беременности. Детям с гетерозиготной семейной гиперхолестеринемией можно назначать смолы, связывающие жирные кислоты, обычно после 7-8-лет-него возраста, когда миелинизация нервной системы почти закончена. Решение о лечении ребенка должно основываться на уровне ЛПНП плазмы, семейном анамнезе и возрасте ребенка.
Ниацин (никотиновая кислота)
Ниацин (но не ниацинамид) снижает уровни ЛПОНП и ЛПНП в плазме у пациентов с разными гиперлипидемиями.
Химические свойства и фармакокинетика
Ниацин — это водорастворимый витамин. В организме он превращается в амин, который встраивается в никотинамидадениндинуклеотид (НАД). Он выводится в неизмененной форме с мочой в виде
ниацинамида, М-метил-2-пиридон-З-карбоксамида, М-метил-2-пиридон-5-карбоксамида и других меньших по количеству метаболитов.
Механизм действия
Основной механизм действия ниацина, скорее всего, включает подавление синтеза ЛПОНП, которые в свою очередь снижают продукцию ЛПНП (рис. 34-2). Установлено снижение встраивания аминокислот в аполипопротеиды ЛПОНП. Повышение клиренса ЛПОНП под действием ЛПЛ играет роль в способности ниацина снижать уровень триглицеридов. Препарат не действует на продукцию желчных кислот. При его приеме остро повышается экскреция нейтральных стеролов с калом, когда холестерин мобилизуется из тканевого депо. Затем достигается новое состояние равновесия во время постоянного приема препарата. Холестеро-генез подавляется, и этот эффект сохраняется при назначении связывающих желчные кислоты смол. Снижение синтеза холестерина в печени может повысить захват ЛПНП печенью для поддержания активного синтеза желчных кислот, вызванного смолами. Снижается скорость катаболизма ЛПВП с последующим повышением ЛПВП2-субфракции и высокими уровнями холестерина и АпоА-1-ЛПВП. Значительное снижение уровней циркулирующего фибриногена, вызванное ниацином, оказывает влияние на процессы атерогенеза и тромбо-образования. Кроме того, повышается уровень тканевого активатора плазминогена. Ниацин является сильным ингибитором внутриклеточной липазной системы жировой ткани, возможно, за счет снижения продукции ЛПОНП путем уменьшения поступления свободных жирных кислот в печень. Однако доказательств продолжительного подавления липолиза еще нет.
Терапевтическое применение и дозировка
Установлено, что в сочетании со смолой, связывающей желчные кислоты, ниацин нормализует уровни ЛПНП у большинства пациентов с гетерозиготной семейной гиперхолестеринемией. Это сочетание препаратов также эффективно в некоторых случаях нефроза. При тяжелой смешанной липе-мии, которая не полностью реагирует на диетотерапию, ниацин часто способствует значительному
снижению уровня триглицеридов плазмы. Полезен ниацин пациентам с сочетанными гиперлипо-протеидемиями и при семейной дисбеталипо-протеидемии. Он может использоваться в качестве эффективной монотерапии или для сочетанного лечения с ингибиторами редуктазы или неомицином для лечения гиперхолестеринемии. Ниацин является наиболее эффективным препаратом для повышения уровней холестерина ЛПВП.
Для комбинированного лечения гетерозиготной семейной гиперхолестеринемии большинству пациентов требуется 2-6.5 г ниацина в день перорально; более высокие дозы назначать не следует. Для других типов гиперхолестеринемии и гипертриглицеридемии часто бывает достаточно 1.5-3.5 г в день перорально. Препарат следует применять вместе с приемами пищи начиная со 100 мг два или три раза в день, постепенно повышая дозу.
Токсичность
У большинства пациентов возникает безвредная кожная вазодилатация и неприятное ощущение жара после каждой дозы в период начала приема препарата или повышения дозы. Прием 0.3 г аспирина за полчаса до ниацина сглаживает этот простагландиновый эффект. Ибупрофен (1 раз в день) тоже уменьшает подобные приливы. Тахифилаксия на этот эффект обычно развивается через несколько дней при применении любой дозы. Врачу следует предупредить больного о возможности сопутствующих эффектов и объяснить, что это следствие безвредного расширения капилляров кожи. В качестве побочных эффектов этого препарата также описаны зуд, сыпь, сухость кожи и acanthosis nigricans. У некоторых пациентов развивается тошнота и абдоминальный дискомфорт. Многие при этом могут продолжать прием препарата в сниженной дозе или в сочетании с антацидами, не содержащими алюминий. Однако больным с тяжелой язвенной болезнью ниацин противопоказан. Умеренное повышение уровня трансаминаз или щелочной фосфатазы происходит вне связи с какой-либо значительной печеночной токсичностью препарата. Несмотря на это, следует регулярно следить за функцией печени. Гепатотропные эффекты минимальны и обратимы, если дозу ниацина повышают не более чем на 2.5 г в месяц. В редких случаях развивается тяжелая гепатотоксичность, которая становится показанием к прекращению приема препа
рата. Противопоказанием для применения препаратов ниацина пролонгированного действия является опасность серьезных поражений печени (в том числе острого некроза) в связи с их использованием. Толерантность к углеводам может быть умеренно снижена, но, как правило, обратимо. Однако у пациентов с латентным диабетом этот эффект может быть более выраженным и не полностью обратимым. Гиперурикемия возникает у */5 пациентов и иногда ухудшает течение подагры. Описаны такие редкие побочные эффекты ниацина, как аритмии, преимущественно предсердные, и обратимая токсическая амблиопия. Пациентов следует проинструктировать, чтобы они сообщали врачу о любых возникающих нарушениях зрения. Возможна также гипотензия, особенно у пациентов, получающих антигипертензивную терапию.
Гемфиброзил
Гемфиброзил является родственным препаратом деривата фиброевой кислоты — клофибрата. Фармакологически он напоминает родительский препарат, так как снижает уровни ЛПОНП и повышает активность ЛПЛ.
Химические свойства
и фармакокинетика
Молекула гемфиброзила отличается от клофибрата алифатической цепью и присутствием двух метильных групп вместо атома хлора на феноксигруппе. Препарат используется в виде свободной карбоксильной кислоты. Гемфиброзил всасывается в кишечнике и прочно связывается с белками
СН3
z--/ СН3
V о—сн2—сн2—сн2—с—соон
\ / I
>==/ сн3
н3с
Гемфиброзил
Клофибрат
плазмы. Он попадает в энтеропеченочную циркуляцию и легко проходит через плаценту. Период полусуществования препарата в плазме 1.5 часа, 70 % его выводится через почки почти в неизмененном виде. Однако в печени происходит изменение части молекулы гемфиброзила в области метильной группы (замена на гидроксиметил или карбоксил) и превращение части препарата в хинол.
Механизм действия
Гемфиброзил повышает липолиз липопротеидовых триглицеридов за счет активации ЛПЛ. Внутриклеточный липолиз в жировой ткани снижен. Отмечается снижение уровней ЛПОНП в плазме, может быть, частично потому, что снижается их секреция печенью. У большинства пациентов наблюдается только небольшое снижение уровней ЛПНП. Однако у некоторых больных (особенно при сочетанной гиперлипидемии) уровень ЛПНП часто повышается. Отмечается умеренное снижение уровня холестерина ЛПВП. Отчасти повышение содержания ЛПНП является прямым следствием снижения концентрации триглицеридов плазмы с уменьшением обмена триглицеридов на эфиры холестерина в ЛПВП. Наблюдается и некоторое повышение белка ЛПВП.
Терапевтическое применение и дозы
Препарат применяется для коррекции гипертриглицеридемий, при которых доминируют ЛПОНП, и при дисбеталипопротеидемиях. Обычная доза гемфиброзила составляет 600 мг и назначается перорально 1-2 раза в день.
Токсичность
При применении этого препарата могут появляться кожная сыпь, симптомы со стороны ЖКТ и мышц, аритмии, гипокалиемия и повышение активности трансаминаз или щелочной фосфатазы в крови. У некоторых пациентов снижаются показатели белой крови и гематокритное число. Гемфиброзил потенцирует действие кумариновых и индандионо-вых антикоагулянтов. Дозы этих препаратов следует корригировать во время лечения гемфиброзилом. При сочетании гемфиброзила и ловастатина существует риск миопатии. В редких случаях может возникнуть рабдомиолиз. Гемфиброзил противопока
зан при печеночной или почечной недостаточности. С применением этого препарата также связано небольшое повышение частоты образования желчных камней. Гемфиброзил следует очень осторожно применять у больных с заболеваниями желчных путей или с факторами риска желчнокаменной болезни (у женщин, при ожирении). Результаты программы “Исследование сердца” (Хельсинки) и дополнительные исследования показали, что гемфиброзил не следует применять у больных с сочетанной гиперлипидемией при наличии симптомов атеросклеротического поражения сердца (Manninen, 1992).
Другие дериваты фиброевой кислоты
Клофибрат редко используется, поскольку он повышает риск неоплазии гепатобилиарной системы и ЖКТ. Фенофибрат очень похож на него по действию, но может быть более эффективным в снижении уровня ЛПНП. Он гидролизуется в анион и выделяется в основном почками. Его назначают в дозе 100 мг 3 раза в день.
Безафибрат по эффектам на ЛПОНП похож на клофибрат и гемфиброзил и, как фенофибрат, несколько более активен в отношении снижения уровня ЛПНП. Он назначается в дозе 200 мг 3 раза в день.
Смолы, связывающие
желчные кислоты
Колестипол и холестирамин полезны только при гиперлипопротеидемиях с повышением ЛПНП. У пациентов с сопутствующим повышением содержания триглицеридов при терапии смолами может повышаться уровень ЛПОНП.
Химические свойства
и фармакокинетика
Колестипол и холестирамин — это очень большие полимерные катионные обменные смолы, не растворимые в воде. Они связывают желчные кислоты в просвете кишечника и предотвращают их реабсорбцию. Хлорид высвобождается из связи с катионным четвертичным аммонием в обмен на желчные кислоты, но сама смола не всасывается.
Механизм действия
Желчные кислоты, являющиеся метаболитами холестерина, в норме реабсорбируются в тощей кишке с эффективностью 95 % (рис. 34-2). Их экскреция при приеме смол может повышаться в 10 раз. Повышенный клиренс приводит к усилению превращения холестерина в желчные кислоты в печени через 7ос-гидроксилирование, которое в норме регулируется посредством отрицательной обратной связи желчными кислотами. Повышение захвата ЛПНП из плазмы при приеме смол возникает вследствие up-регуляции (повышения количества и активности) высокоаффинных рецепторов ЛПНП на клеточных мембранах, особенно в печени. Следовательно, смолы не эффективны у пациентов с гомозиготной семейной гиперхолестеринемией, у которых нет функционирующих рецепторов, но они могут быть полезны для гетерозиготных пациентов с двумя группами рецепторов, одна из которых функционирующая.
Терапевтическое применение и дозировка
Смолы применяются при лечении пациентов с гетерозиготной семейной гиперхолестеринемией, у которых можно достичь приблизительно 20 % сокращения количества холестерина ЛПНП при приеме препаратов в максимальной дозе. Больший эффект при приеме меньших доз можно ожидать у пациентов с менее выраженными формами гиперхолестеринемии. Если смолы используют для коррекции повышения ЛПНП при комбинированной гиперлипидемии, то они могут вызвать повышение ЛПОНП, которое потребует назначения второго препарата типа ниацина. Смолы также добавляют к другим препаратам для усиления ги-похолестеринемического эффекта. Кроме их применения при гиперлипидемии, смолы могут быть полезны при холестазе и кумуляции желчных кислот. Их способность связывать гликозиды наперстянки используют для ускорения выведения последних из ЖКТ при тяжелой гликозидной интоксикации.
Колестипол и холестирамин являются гранулированными препаратами в пакетах по 5 г и 4 г, соотг ветственно, в порошке или в таблетках. Рекомендуется постепенное повышение дозы от 5 или 4 г/день до 20 г/день перорально. Для максималь
ного эффекта может потребоваться общая доза 30-32 г/день. Обычная детская доза составляет 10-20 r/день. Смолы смешивают с соком или водой и оставляют пропитаться на 1 минуту. Их следует принимать с едой в 2-3 приема.
Токсичность
Наиболее частые жалобы при приеме смол — это запор и ощущение вздутия живота, которые обычно быстро проходят при увеличении количества пищевой клетчатки или при добавлении семян псиллиума к смолам. Иногда могут возникнуть изжога и диарея. У пациентов с заболеваниями кишечника или холестазом может развиться стеаторея. В редких случаях возникает мальабсорбция витамина К, приводящая к гипопротромбинемии. В связи с этим у пациентов, принимающих смолы вместе с антикоагулянтами, следует регулярно измерять протромбиновое время. Изредка также возникает мальабсорбция фолиевой кислоты. Ускорение образования желчных камней, особенно при ожирении, было предсказано как побочный эффект смол, однако на практике это встречается редко. Иногда наблюдаются сухая кожа и шелушение; при этих эффектах помогают аппликации ланолина. При применении смол может нарушаться абсорбция определенных препаратов, имеющих заряд. К этим препаратам относятся гликозиды, тиазиды, гидро-хлортиазид, варфарин, тетрациклин, ванкомицин, тироксин, соли железа, правастатин, флувастатин, фолиевая кислота, фенилбутазон, аспирин и аскорбиновая кислота. Любой дополнительный препарат (кроме ниацина) следует принимать за 1 час до и по меньшей мере через 2 часа после приема смолы для обеспечения адекватной абсорбции.
Неомицин
Фармакокинетика и механизм действия
Этот плохо всасываемый аминогликозидный антибиотик подавляет реабсорбцию холестерина и желчных кислот и вызывает умеренное снижение уровня ЛПНП. Экскреция желчных кислот повышается, общее количество холестерина в организме снижается. Небольшие количества препарата, которые всасываются, выводятся через почки. Неомицин не утвержден FD А для лечения гиперлипидемии.
Терапевтическое применение и дозировка
Возможно, неомицин имеет особое значение при применении вместе с другими препаратами для лечения первичных гиперхолестеринемий. Он не действует на уровень триглицеридов. Общая дневная доза равна 0.5-2 г, обычно ее делят на 2 приема вместе с пищей.
Токсичность
Доза неомицина ограничивается его выраженными побочными эффектами. Даже при приеме низких доз возникают тошнота, спастические боли в животе, диарея и мальабсорбция. Рост резистентных микроорганизмов может привести к энтероколиту. При заболеваниях кишечника абсорбция препарата может быть усилена, и тогда токсическое действие на слух, печень и кроветворение проявляется с большей частотой.
При нормальной функции кишечника эти эффекты обычно не встречаются при приеме менее 2 г/сутки. Неомицин также нарушает всасывание гликозидов наперстянки. Его не следует давать пациентам с заболеваниями почек.
Конкурентные ингибиторы ГМГ-КоА-редуктазы (ингибиторы редуктазы)
Эти вещества являются структурными аналогами ГМГ-КоА (З-гидрокси-З-метилглутарил-кофер-мента А). Первым препаратом этого класса был компактин. Широко применяется его близкий родственник ловастатин (рис. 34-3). Похожими препаратами являются симвастатин, правастатин и флувастатин.
Химические свойства и фармакокинетика
Ловастатин и симвастатин являются неактивными лактоновыми предшественниками препаратов, которые гидролизуются в ЖКТ до активных (^-гидроксильных дериватов. Правастатин и флувастатин исходно являются активными препаратами. В отличие от флувастатина, который абсорбируется почти полностью, абсорбируется примерно 30-50 %
Восстановленная форма ГМГ-КоА
Рис. 34-3. Подавление ГМГ-КоА-редуктазы. Вверху. ГМГ-КоА, который является непосредственным предшественником мевалоната, ключевого соединения в синтезе холестерина. Внизу. Структура ловастатина и его активной формы, показывающая сходство с восстановленной формой ГМГ-КоА (закрашенные зоны)
Мевалонат
Активная форма ловастатина
дозы ловастатина и правастатина. Все ингибиторы редуктаз имеют эффект первичного прохождения — экстракцию в печени. Большая часть абсорбированной дозы выделяется с желчью, примерно 5-20 % — с мочой.
Механизм действия
ГМГ-КоА-редуктаза осуществляет первый шаг в биосинтезе стеролов. Активные формы ловастатина и родственных ему соединений представляют собой структурные аналоги интермедиата ГМГ-КоА (рис. 34-3), который образуется ГМГ-КоА-ре-дуктазой в процессе синтеза мевалоната. Частичное подавление фермента, вызываемое этими препаратами, может нарушать синтез изопреноидов типа убихинона и долихола, и пренилацию белков, однако неизвестно, имеет ли это биологическое значение. Очевидно, что ингибиторы редуктазы вызывают повышение количества высокоаффинных рецепторов ЛПНП. Этот эффект повышает как ско
рость катаболизма ЛПНП, так и экстракцию печенью предшественников ЛПНП (остатки ЛПОНП), тем самым снижая в плазме депо ЛПНП (рис. 34-2). Вследствие выраженного эффекта первого прохождения основное действие эти препараты оказывают на печень. Предпочтительная активность в печени некоторых из них связана с неодинаковой интенсивностью захвата препаратов разными тканями. Эти препараты также могут значительно понижать содержание триглицеридов плазмы и повышать уровень холестерина ЛПВП.
Терапевтическое применение
и дозирование
Ингибиторы редуктазы используются для монотерапии или в комбинации со смолами, связывающими желчные кислоты, или ниацином в лечении заболеваний, при которых повышается уровень ЛПНП в плазме. Беременные, имеющие намерение забеременеть и женщины в период лактации не дол
жны принимать эти препараты. Более того, их нельзя давать детям, кроме тех, кто страдает гомозиготной семейной гиперхолестеринемией с резидуальной рецепторной активностью.
Вследствие дневных колебаний биосинтеза холестерина ингибиторы редуктазы следует назначать вечером (если препарат назначают в один прием). Всасывание облегчается при приеме вместе с едой. Суточные дозы ловастатина колеблются от 10 до 80 мг. Умеренно повышенный уровень ЛПНП часто поддается лечению при дозе 20 мг препарата в сутки на один прием вечером. У пациентов с гетерозиготной семейной гиперхолестеринемией 20 мг ловастатина 1 или 2 раза в день снижают уровень холестерина на 19 % и 34 % соответственно. Правастатин так же эффективен, как и ловастатин, вплоть до максимальной рекомендуемой дневой дозы 40 мг. Симвастатин в 2 раза сильнее и назначается по 5-40 мг в день. Флувастатин в 2 раза менее эффективный, чем ловастатин, его назначают по 10-40 мг в день.
Токсичность
У некоторых пациентов возникает небольшое повышение активности трансаминаз (максимум в 3 раза). Это повышение наблюдается периодически и не связано с печеночной токсичностью. При таких изменениях лечение можно продолжать, но необходимо регулярно измерять активность трансаминаз. Примерно у 2 % пациентов активность трансаминаз может повышаться в 3 раза, при этом у некоторых из них в анамнезе имеется заболевание печени или злоупотребление алкоголем. Этот эффект, который может возникать в любой момент после начала терапии, предвещает серьезное токсическое воздействие на печень. Если активность трансаминаз остается на уровне выше трехкратного увеличения, то препарат отменяют. У пациентов с заболеваниями паренхимы печени следует снижать дозу ингибиторов редуктазы. В целом активность трансаминаз следует измерять до начала лечения и затем через каждые 2-4 месяца.
Небольшие повышения активности креатинки-назы плазмы возникают у 10 % пациентов, они обычно непостоянные. Такие повышения часто связаны со значительной физической активностью. В редких случаях при приеме ловастатина, симвастатина или правастатина возникают значительные повышения активности креатинкиназы, сопровож
даемые болями в скелетных мышцах. Если прием препарата не прекращен, то может развиться рабдомиолиз и миоглобинурия, которая может привести даже к почечной недостаточности. Не исключена миопатия, хотя при применении флувастати-на она пока не описана. Миопатия может возникнуть при монотерапии, но чаще — при сочетании ингибитора редуктазы с циклоспорином, дериватами фиброевой кислоты, эритромицином и, возможно, ниацином. Большинство пациентов, получающих циклоспорин, адекватно реагируют на 10 мг ловастатина или правастатина в день. У таких пациентов следует регулярно измерять активность креатинкиназы. Другие препараты, применяемые с ингибиторами редуктазы, также способны вызывать миопатию, поэтому, пока не накопится опыт применения этих комбинаций, необходимо быть осторожными. Уровень креатинкиназы следует измерять до лечения и затем каждые 4 месяца во время лечения. При появлении значительных болей в мышцах или слабости необходимо сразу измерить активность креатинкиназы и прекратить прием препарата, если активность превышает норму в 2 раза. При прекращении терапии миопатия проходит полностью. Если связь побочного эффекта с применением препарата неясна, то можно сделать повторную попытку приема препарата под наблюдением врача. В редких случаях возникают синдромы гиперчувствительности, которые включают, например, люпус-синдром. Вследствие структурного и механического сходства эти препараты вызывают перекрестную чувствительность.
При серьезных заболеваниях, травме или операциях лечение этими препаратами следует на время прекращать.
Пробукол
Химическая структура пробукола не похожа на таковую других препаратов, используемых для снижения уровня липопротеидов. Механизмы его действия неясны, но, возможно, он подавляет синтез стерола и облегчает транспорт холестерина в печень. Пробукол липофилен и распределяется в жировую ткань, находясь там в течение длительного времени. Он значительно снижает уровни холестерина ЛПВП и Апо A-I в плазме. Это может быть отражением улучшения переноса эфиров холестерина с ЛПВП на акцепторные липопротеиды вследствие повышения активности белка переноса эфи
ров холестерина (СЕТР). Уровень холестерина ЛПНП снижается только незначительно. Однако у некоторых больных, особенно с повышенным уровнем ЛПНП, снижение может быть более выраженным. Обычная доза препарата составляет 500 мг 2 раза в сутки.
Исследования на животных показали, что пробукол может ингибировать атерогенез путем, отличным от снижения уровня липидов. Его антиоксидантное действие защищает липопротеиды от пероксидации, подавляя таким образом образование “пенистых” клеток в интиме артерий. Так как он эффективно замедляет атерогенез у кроликов с генетическим дефицитом ЛПНП-рецепторов и у пациентов с гомозиготной семейной гиперхолестеринемией, он может оказаться эффективным и при других формах гиперхолестеринемии с интенсивным атерогенезом. В то же время, поскольку у животных наблюдалась выраженная токсичность (аритмии, удлинение QT), а также нет полной картины его действия по снижению ЛПВП, пробукол не следует использовать при менее тяжелых формах гиперлипидемии до появления более точной информации. У человека также отмечается удлинение QT. Пробукол не следует назначать пациентам с удлиненным QT или принимающим сердечные гликозиды, хинидин, соталол и эритромицин, которые тоже удлиняют QT. Менее частые побочные эффекты пробукола — это аномальные изменения печеночных тестов, миопатии, гипер-урикемия, гипергликемия, тромбоцитопения и нейропатия. Чаще отмечаются легкие нарушения со стороны ЖКТ.
Комбинированная терапия
Комбинированная терапия полезна, когда: 1) содержание ЛПОНП значительно повышается при лечении гиперхолестеринемии с применением смол, связывающих желчные кислоты; 2) исходно повышены уровни ЛПНП и ЛПОНП; 3) уровень ЛПНП не нормализуется под действием монотерапии.
1. ГЕМФИБРОЗИЛ И СМОЛЫ, СВЯЗЫВАЮЩИЕ ЖЕЛЧНЫЕ КИСЛОТЫ
Это сочетание иногда полезно при лечении семейной сочетанной гиперлипидемии. Однако оно повышает риск развития холелитиаза.
2. ИНГИБИТОРЫ ГМГ-КоА-РЕДУКТАЗЫ И СМОЛЫ, СВЯЗЫВАЮЩИЕ ЖЕЛЧНЫЕ КИСЛОТЫ
Ингибиторы ГМГ-КоА-редуктазы действуют вместе со смолами, связывающими желчные кислоты, по эффективному синергистическому механизму. Это сочетание эффективно при лечении семейной гиперхолестеринемии, но может быть недостаточным для контроля ЛПОНП у некоторых пациентов с семейной сочетанной гиперлипидемией. Правастатин и флувастатин, для успешной их абсорбции, следует назначать за 1 час до или по меньшей мере через 4 часа после приема смолы.
3. НИАЦИН И СМОЛЫ, СВЯЗЫВАЮЩИЕ ЖЕЛЧНЫЕ КИСЛОТЫ
В таком сочетании удается эффективно контролировать ЛПОНП при семейной сочетанной гиперлипидемии или других заболеваниях с повышением уровней ЛПОНП и ЛПНП. При исходно повышенных уровнях ЛПОНП и ЛПНП дозы ниацина 1-3 г в сутки может быть достаточно для лечения в сочетании со смолами.
Сочетание ниацина и колестипола дает хороший результат в лечении гетерозиготной семейной гиперхолестеринемии. Это, возможно, является отражением сочетанного действия: 1) повышенного катаболизма ЛПНП под действием смол; 2) снижения синтеза их предшественника ЛПОНП под действием ниацина, а также, возможно, 3) способности ниацина подавлять синтез холестерина в печени. Ниацин также достоверно повышает уровень холестерина ЛПВП.
Были получены количественные доказательства обратимости поражения коронарных артерий при приеме препаратов по этой схеме. Эффекты по коррекции уровня липопротеидов продолжительны, и сочетание препаратов не приводит к возникновению новых побочных эффектов, кроме тех, которые отмечались при монотерапии. Смолы нейтрализуют кислоту, поэтому их прием с ниацином уменьшает его раздражающее действие на желудок у некоторых пациентов. Эти препараты можно применять вместе, так как ниацин не связывается со смолами. Уровень ЛПНП при гетерозиготной семейной гиперхолестеринемии обычно нормализуется при назначении до 6.5 г ниацина и 24-30 г смол в день.
4. НИАЦИН И ИНГИБИТОРЫ РЕДУКТАЗЫ
Это сочетание более эффективно, чем каждый из препаратов в отдельности, в лечении семейной сочетанной гиперлипидемии и семейной гиперхолестеринемии. Так как опыт применения такого сочетания ограничен, следует регулярно измерять активность трансаминаз и креатинкиназы.
5. НЕОМИЦИН И НИАЦИН
Неомицин и ниацин дополняют друг друга в лечении пациентов с гиперхолестеринемией при семейной гиперхолестеринемии или семейной сочетанной гиперлипидемии. Это сочетание можно использовать для пациентов, которые плохо переносят другие схемы лечения.
6. ТРОЙНОЕ СОЧЕТАНИЕ СМОЛЫ, НИАЦИНА И ИНГИБИТОРОВ РЕДУКТАЗЫ
Данные препараты дополняют друг друга в снижении уровня холестерина сыворотки крови до нижней границы нормы у пациентов с тяжелыми заболеваниями с повышением содержания ЛПНП. Эффекты этого сочетания продолжительны, токсичность минимальна. Эффективные дозы отдельных препаратов могут быть ниже, чем при монотерапии, например, всего 1-2 г ниацина может значительно повысить эффект двух других препаратов.
Препараты
Холестирамин
Перорально: 4 г холестираминовой смолы на 5 г порошка (Квестран лайт); в пакетах по 9 г и банках по 378 г (Квестран); как плитки для жевания: 4 г/на плитку (Холибар)
Клофибрат (генерик, Атромид-S)
Перорально: капсулы по 500 мг
Холестипол (Холестид)
Перорально: гранулы, пакеты по 5 г;
бутыли по 300,500 г
Фенофибрат (Липидил)
Перорально: 100 мг
Флувастатин (Лескол)
Перорально: капсулы по 20, 40 мг
Гемфиброзил (Лопид)
Перорально: капсулы по 300 мг;
таблетки по 600 мг
Ловастатин (Мевакор)
Перорально: таблетки по 10, 20,40 мг
Неомицин (генерик)
Перорально: таблетки по 500 мг
Ниацин, Никотиновая кислота, витамин В3 (генерик, др.)
Перорально: таблетки по 25, 50, 100, 250, 500, 1000 мг
Правастатин (Правахол)
Перорально: таблетки по 10, 20 мг
Пробукол (Лорелко)
Перорально: таблетки по 250, 500 мг
Симвастатин (Зокор)
Перорально: таблетки по 5, 10, 20,40 мг
Избранная литература
Adult Treatment Panel II: Summary of the second report on detection, evaluation, and treatment of high blood cholesterol. JAMA, 1993; 269:3015.
Cashin-Hemphill J. et al. Benefical effects of colestipol-niacin on coronary atherosclerosis. A 4-year follow-up. JAMA, 1990; 264: 3013.
Fuster V. et al. Mechanisms of disease: The pathogenesis of coronary artery disease and the acute coronary syndrome. (Two parts.) N. Engl. J. Med. 1992:326:242,310.
Kane J. P., Malloy M. J. Disorders of lipoprotein metabolism. In: Basic & Clinical Endocrinology, 4th ed. Greenspan F. S. (ed.). Appleton & Lange, 1993.
Kane J. P„ Havel R. J. In: The Metabolic Basis of Inherited Disease, 7th ed. Seri ver C. R. et al. (eds). McGraw-Hill, 1994; chapter 57.
Malloy M. J., Kane J. P. Medical management of hyperlipidemic states. Adv. Intern. Med. 1994; 39: 603.
Steinberg D. et al. Beyond cholesterol: Modifications of low density lipoprotein that increase its atherogenicity. N. Engl. J. Med. 1989; 320: 915.
Watts G. F. et al. Effects on coronary artery disease of lipid-lowering diet, or diet plus cholisteramine in the St. Thomas Atherosclerosis Regression Study. Lancet, 1992; 339: 563.
Нестероидные противовоспалительные средства. Неопиоидные аналгетики. ос
Препараты, применяемые при подагре
Дональд Г. Пайен, Бертрам Г. Катцунг
Воспалительная реакция
В воспалительном процессе традиционно выделяют три фазы: острое воспаление, иммунную реакцию и хроническое воспаление. Острое воспаление является первоначальным ответом на повреждение тканей. Оно опосредуется высвобождением аутакоидов и обычно проявляется до развития иммунной реакции. Некоторые из аутакоидов приведены в табл. 35-1. Иммунный ответ возникает тогда, когда иммунологически компетентные клетки активируются в присутствии чужеродных организмов или антигенов, высвобождаемых во время острого или хронического воспаления. Исход иммунного ответа может быть благоприятным для больного, например, когда он заканчивается фагоцитозом или нейтрализацией чужеродного организма, и неблагоприятным, если он приводит к хроническому воспалению без устранения причины повреждающего процесса. При хроническом
воспалении высвобождается целый ряд специфических медиаторов, которые не являются ведущими в развитии острого воспаления. Некоторые из этих факторов приведены в табл. 35-2. Одно из наиболее важных состояний с участием этих медиаторов — ревматоидный артрит, при котором хроническое воспаление вызывает боль и деструкцию кости и хряща, что может привести к тяжелой инвалидности и возникновению системных изменений, которые сокращают продолжительность жизни.
Повреждение клеток при воспалении затрагивает клеточные мембраны, и лейкоциты высвобождают лизосомальные ферменты. Далее из предшественников образуется арахидоновая кислота и синтезируются различные эйкозаноиды (глава 18).
Простагландины действуют на кровеносные сосуды, нервные окончания и на клетки, участвующие в воспалении. Лейкотриены дают значительный хемотаксический эффект на эозинофилы, нейтрофилы и макрофаги, вызывая бронхоспазм и повы-
ТАБЛ ИЦА 35-1. Некоторые медиаторы острого воспаления и их эффекты
Медиатор Вазодилатация Сосудистая проницаемость Хемотаксис Боль
Гистамин +4- ПТ — —
Серотонин +/- т - —
Брадикинин +++ т — +++
Простагландины +++ т +++ +
Лейкотриены - нт +++ -
ТАБЛИЦА 35-2. Некоторые медиаторы хронического
воспаления, например воспаления при ревматоидном артрите
Медиатор Источник Основные эффекты
Интерлей- Макрофаги, Активация лимфоци-
кины 1,2 и 3 Т-лимфоциты тов, продукция простагландина
GM-CSF1 Т-лимфоциты, эндотелиальные клетки, фибробласты Активация макрофагов и гранулоцитов
TNF-a2 Макрофаги Продукция простагландинов
Интерфероны Макрофаги, эндотелиальные клетки, Т-лимфоциты Множество
PDGF3 Макрофаги, эндотелиальные клетки, фибробласты, тромбоциты Хемотаксис фибробластов, пролиферация
1 Фактор, стимулирующий колонии гранулоцитов-макрофагов.
2 а-Фактор некроза опухолей.
3 Фактор роста, продуцируемый тромбоцитами.
шая проницаемость сосудов. Недавно полученные сведения о том, что циклооксигеназа (СОХ II), которая отвечает за продукцию простагландинов клетками, участвующими в воспалении, не идентична циклооксигеназе большинства других клеток организма (СОХ I). Селективный блокатор изофермента СОХ II был бы оптимальным средством лечения воспаления, так как он не оказывал бы действия на другие функции простагландинов. Предполагается, что кортикостероиды являются именно такими селективными блокаторами.
При повреждении тканей высвобождаются также кинины, нейропептиды, гистамин, компоненты комплемента, цитокины и другие продукты лейкоцитов и тромбоцитов. Возбуждение мембран нейтрофилов вызывает образование свободных радикалов кислорода. Путем восстановления молекулярного кислорода образуется супероксид-анион, который может стимулировать продукцию других реактивных молекул, например перекиси водорода и гидроксильных радикалов. Их взаимодействие с
арахидоновой кислотой приводит к образованию хемотаксических веществ, усиливая таким образом воспалительный процесс.
Терапевтические стратегии
Лечение больных с воспалением преследует две основные цели: во-первых, уменьшение боли, которая часто является главным симптомом и основной жалобой пациента; во-вторых, замедление и, в теории, прекращение повреждающего процесса. Угнетение воспаления противовоспалительными средствами часто снимает боль на длительный период. Более того, большинство неопиоидных аналгетиков (аспирин и т. д.) также дают противовоспалительные эффекты и показаны как при остром, так и при хроническом воспалении.
Сильный противовоспалительный эффект дают глюкокортикоиды. На первых порах глюкокортикоидную терапию считали долгожданным эффективным методом лечения ревматоидного артрита. К сожалению, токсичность, связанная с хроническим применением стероидов, ограничивает их использование случаями обострения заболеваний суставов. Поэтому при лечении больных, страдающих ревматоидным артритом, главную роль играют псстероидные противовоспалительные средства.
Другая важная группа противовоспалительных средств называется антиревматическими препаратами медленного действия или препаратами, изменяющими течение заболевания. О механизмах их действия известно очень мало. К сожалению, они гораздо более токсичны, чем нестероидные противовоспалительные средства (НПВС).
I. Нестероидные противовоспалительные средства
Салицилаты и другие препараты для лечения ревматического поражения способны подавлять симптомы и признаки воспаления. Часть этих лекарств обладает дополнительно жаропонижающим и аналгетическим свойствами, но именно противовоспалительный эффект делает их незаменимыми в терапии заболеваний, при которых сила болевых ощущений зависит от интенсивности воспаления.
Некоторые из новых НПВС (индометацин, фенил-бутазон и кеторолак) применяются по специальным показаниям. Они рассматриваются отдельно.
Аспирин
и другие салицилаты
Аспирин и все, кроме одного, новые НПВС (ибупрофен, напроксен и пр.) химически схожи в том, что являются слабыми органическими кислотами. Исключение составляет набуметон, который представляет собой кетон и является предшественником активного препарата с кислотными свойствами. Все эти средства подавляют синтез простагландинов. Они также могут снижать продукцию свободных радикалов и супероксида и взаимодействовать с аденилатциклазой с последующим изменением внутриклеточной концентрации цАМФ. Хотя эти препараты эффективно ингибируют воспалительный процесс, нет данных о том, что они (в отличие, например, от метотрексата и пеницилламина) влияют на течение артрита. Длительная история применения аспирина и возможность получения его без рецепта делают его менее “модным”, чем более новые препараты. Однако вследствие своей низкой цены и подтвержденной временем безопасности аспирин остается главным препаратом выбора при лечении большинства суставных и скелетномышечных заболеваний. Аспирин является стандартом, с которым сравниваются все противовоспалительные средства (табл. 35-3), и о нем не следует забывать, если только у больного нет специфических противопоказаний для его применения или другое НПВС имеет какое-либо очевидное преимущество.
Историческая справка
Одним из самых старинных средств для снятия боли и жара является хинин из коры хинного дерева. В течение многих лет в народной медицине по тем же показаниям использовали кору ивы. В 1763 г. Эдмунд Стоун в письме президенту Королевского Общества описал свой успех в лечении лихорадки порошком коры ивы. Он отметил, что его горький вкус напоминает вкус коры хинного дерева, из которой получают хинин. Активный ингредиент коры ивы, салицин, образующий после гидролиза салициловую кислоту, был позже най-
ТАБЛИЦА 35-3. Свойства аспирина и некоторых
более новых нестероидных противовоспалительных средств
Препарат Период ; Выде- Рекомендуемые
полу- ление в противовоспали-
выве- неизме- тельные дозы
дения ненном в сутки
(часы) виде с мочой (%)
Аспирин 0.25 < 2 1200-1500 мг 3 раза
Салицилат1 2-19 2-30 Сноска 2
Апазон 15 62 600 мг 2 раза
Диклофенак 1.1 < 1 50-75 мг 4 раза
Дифлунизал 13 3-9 500 мг 2 раза
Этодолак 6.5 < 1 200-300 мг 4 раза
Фенопрофен 2.5 30 600 мг 4 раза
Флюрбипро- 3.8 < 1 300 мг 3 раза
фен
Ибупрофен 2 < 15 600 мг 4 раза
Индометацин 4-5 16 50-70 мгЗ раза
Кетопрофен 1.8 < 1 70 мг 3 раза
Кеторолак 4-10 58 10 мг 4 раза3
Меклофенамат 3 2-4 100 мг 4 раза
Набуметон4 26 1 1000-2000 мг 1 раз5
Напроксен 14 < 1 375 мг 2 раза
Оксапрозин 58 1-4 1200-1800 мг 1 раз5
Фенилбутазон® 68 1-3 100 мг4 раза
Пироксикам 57 4-10 20 мг 1 раз5
Сулиндак 8 7 200 мг 2 раза
Толметин 1 7 400 мг 4 раза
’ Основной противовоспалительный метаболит аспирина.
2 Салицилат обычно назначают в форме аспирина.
3 Рекомендуется только для лечения острой (например, хирургической) боли.
4 Набуметон — предшественник активного вещества; период полувыведения и показатель выведения с мочой даны для его активного метаболита.
5 Единичная ежедневная доза достаточна в связи с длительным периодом полувыведения вещества.
6 Фенилбутазон не рекомендован для хронического использования; указанная доза применяется при остром приступе подагрического артрита и не должна назначаться дольше одной недели; она может предшествовать единичной насыщающей дозе 400 мг.
ден и в других естественных источниках. Ацетилсалициловая кислота была синтезирована в 1853 г., но препарат не применяли до 1899 г., когда стало известно, что он эффективен при артрите и хорошо переносится. Тогда и появилось название “аспирин”, от немецкого, acetylspirsaure {Spirea — родовое название ивы, и Saure — кислота по-немецки). Аспирин вследствие его большей эффективности и дешевизны быстро вытеснил другие использовавшиеся тогда естественные продукты и последние 90 лет остается наиболее широко применяемым препаратом.
Химические свойства и фармакокинетика
Салициловая кислота — это простая органическая кислота с рКа3.0. Аспирин (ацетилсалициловая кислота — АСК) имеет рКа 3.5 (табл. 1-2). Он на 50 % сильнее, чем натрия салицилат, который вызывает меньшее раздражение слизистой оболочки желудка.
Салицилаты (рис. 35-1) быстро всасываются в желудке и верхней части тонкого кишечника, пиковая концентрация лекарства в крови достигается в течение 1 -2 часов. Кислая среда желудка способствует сохранению большей части салицилатов в неионизированной форме, что повышает всасывание. Однако когда большое количество салицилата накапливается в клетках слизистой оболочки, препарат может повреждать слизистый барьер. Если pH желудка повышают с помощью подходящего буфера до 3.5 или выше, то раздражения слизистой оболочки почти не происходит.
Аспирин всасывается в неизмененном виде и гидролизуется до уксусной кислоты и салицилатов эстеразами тканей и крови. Салицилаты связываются с альбуминами, но с повышением концентрации салицилатов в сыворотке большая их часть остается в несвязанной форме, доступной для тканей. Потребляемые или полученные гидролизом аспирина салицилаты могут выводиться в неизмененной форме, но большинство из них превращается в водорастворимые конъюгаты, которые быстро выводятся почками (рис. 35-1). При насыщении этого пути выведения даже небольшое повышение дозы аспирина приводит к значительному возрастанию его концентрации в крови. Ощелачивание мочи увеличивает скорость выведения свободного салицилата. При использовании малых доз (600 мг) аспи
рина выведение соответствует правилам кинетики первого порядка, а период полувыведения равен 3-5 часам. При более высоких дозах преобладает кинетика нулевого порядка: при приеме в противовоспалительной дозе (> 4 г/день) период полувыведения препарата возрастает до 15 часов и более. Этот эффект возникает примерно через неделю терапии и связан с насыщением ферментов печени, которые катализируют образование метаболитов салицилата: салицилфенилглюкуропидов и салицилуровой кислоты.
Фармакодинамика
А. Механизм действия. Эффективность аспирина в основном связана с его способностью подавлять биосинтез простагландинов (глава 18). Она основана на необратимой блокаде фермента циклооксигеназы (простагландинсинтазы), который катализирует превращение арахидоновой кислоты в эндоперекиси. В определенных дозах препарат снижает образование как простагландинов, так и тромбоксана А2, но не лейкотриенов (рис. 35-2). Не существует данных о том, что аспирин является селективным ингибитором СОХ II. Большая часть противовоспалительной дозы аспирина быстро деацетилируется с образованием активного метаболита — салицилата. Салицилат обратимо ингибирует синтез простагландинов.
Б. Противовоспалительные эффекты. Наряду с ингибированием синтеза эйкозаноидных медиаторов аспирин также вмешивается в медиаторную каллик-реин-кининовую систему (глава 17). В результате этого препарат подавляет прилипание гранулоцитов к месту повреждения в сосуде, стабилизирует лизосомы и угнетает миграцию полиморфноядерных лейкоцитов и макрофагов к месту воспаления.
В. Аналгетический эффект. Аспирин наиболее эффективно снимает боль легкой и умеренной интенсивности. Он уменьшает боль, вызванную разными причинами, например мышечную, сосудистую, зубную, при послеродовых состояниях, при артрите и бурсите. Аспирин действует периферически, подавляя воспаление, но, возможно, и на подкорковом уровне, ослабляя болевые стимулы.
Г. Жаропонижающий эффект. Аспирин снижает повышенную температуру, в то время как нормальная температура тела при его приеме меняется очень мало. Снижение температуры связано с усилением излучения тепла вследствие вазодилатации
О
Натрия салицилат
С —ОН
О —С —СНз II
Аспирин О
Салицилуровая кислота
Гентизиновая кислота
Рис. 35-1. Структура и метаболизм салицилатов (Из: Meyers F. Н., Jawetz Е., Goldfien A. Review of Medical Pharmacology, 7thed. Lange, 1980.)
поверхностных сосудов кожи. Этот процесс может сопровождаться значительным потоотделением.
Считается, что лихорадка при инфекциях возникает по двум причинам. Первая — это активация синтеза простагландинов в ЦНС в ответ на бактериальные пирогены. Вторая — это действие интерлейкина-1 на гипоталамус. Интерлейкин-1 продуцируется макрофагами и выделяется при воспалении, его основная роль — активация лимфоцитов (табл. 35-2). Аспирин блокирует как вызванную пирогеном продукцию простагландинов, так и ответ со стороны ЦНС на интерлейкин-1, то есть “перестраивает” температурный контроль в гипоталамусе, усиливая таким образом излучение тепла через вазодилатацию.
Д. Влияние на тромбоциты. Аспирин влияет на гемостаз. Однократный прием вызывает некоторое увеличение времени кровотечения, которое повышается в 2 раза при введении препарата в течение недели. Причиной этого эффекта является угнетение агрегации тромбоцитов вследствие ингибирования синтеза тромбоксана (глава 33). Так как действие аспирина необратимо, агрегация тромбоцитов подавляется на 8 дней (до образования новых тромбоцитов). Если есть основания для беспокойства по поводу кровотечений (например, при опе
рации), прием аспирина следует прекратить за неделю до операции.
Аспирин дает более длительный эффект, чем многие другие соединения, которые угнетают агрегацию тромбоцитов, например тиклопидин, фенил-бутазон и дипиридамол.
Клиническое применение
А. Аналгезия и противовоспалительное действие. Аспирин — это один из наиболее часто используемых препаратов для снятия боли легкой или умеренной интенсивности разного генеза. Его сочетают с другими аналгетиками, примерно 200 таких препаратов можно купить без рецепта. Нет никаких доказательств, что эти более дорогие комбинированные препараты эффективнее или менее токсичны, чем аспирин, кроме того, значительно труднее лечить передозировку этими средствами. Известно также, что фенацетин, содержащийся во многих комбинированных препаратах, может вызвать интерстициальный нефрит с серьезным нарушением функции почек. Аспирин неэффективен для снятия сильной висцеральной боли, например при “остром животе”, почечной колике, перикардите или инфаркте миокарда.
Рис. 35-2. Медиаторы воспаления — производные арахидоновой кислоты и мишени для действия лекарственных средств
Противовоспалительные свойства высоких доз салицилатов лежат в основе их использования для начальной терапии ревматоидного артрита и других воспалительных заболеваний суставов. При артрите легкой степени салицилаты можно применять для монотерапии.
Б. Другие показания
1. Жаропонижающее действие. Только для некоторых заболеваний (например, нейросифилиса, хронического бруцеллеза) установлено, что повышение температуры является полезным механизмом защиты. С другой стороны, редко существует необходимость в снижении легко или умеренно повышенной температуры у взрослых (Styrt, 1990). Аспирин является самым лучшим средством для снижения температуры, когда это необходимо и когда нет противопоказаний для его применения.
2. Подавление агрегации тромбоцитов (глава 33). Аспирин снижает частоту возникновения
транзиторных ишемических приступов и нестабильной стенокардии у мужчин и используется для профилактики этих состояний. Он также эффективен для снижения вероятности тромбоза протеза коронарных артерий. Результаты нескольких клинических испытаний аспирина у пациентов высокой степени риска коронарного тромбоза или восстанавливающихся после инфаркта миокарда подтвердили его эффективность. В одном из обширных исследований установлено, что аспирин в дозе 325 мг, принимаемый через день, на 40 % уменьшает частоту инфарктов миокарда у мужчин-врачей.
3. Другое применение. По некоторым данным, аспирин может замедлять образование катаракты; результаты других исследований противоречат этому заключению (Chew, 1992). Эпидемиологическое изучение показало также, что длительное применение аспирина в низких дозах снижает частоту развития рака толстой кишки (Thun, 1991).
Глава 35. НПВС. Неопиоидные аналгетики. Препараты, применяемые при подагре
67
Дозирование
Оптимальная аналгетическая и жаропонижающая доза аспирина — менее 0.6 г перорально. Ее можно повторять каждые 4 часа, а меньшие дозы (0.3 г) — каждые 3 часа. Доза для детей составляет 50-75 мг/кг/день на несколько приемов.
Средняя противовоспалительная доза 4 г в день хорошо переносится большинством взрослых. У детей введение 50-75 мг/кг/день обычно поддерживает терапевтическую концентрацию лекарства в крови. Она составляет 150-300 мг/л и обеспечивает противовоспалительный эффект. Имеется простой и надежный метод определения уровня салицилатов в крови, поэтому препарат можно титровать до достижения желаемого уровня. Из-за большого периода полувыведения активных метаболитов аспирина (примерно 12 часов) частый дробный прием препарата не нужен, если общая доза составляет 4 г или более. Удобно разбивать дозу на 3 приема в соответствии с приемом пищи.
Соотношение уровня салицилата в крови, терапевтического эффекта и токсичности показано на рис. 35-3.
Выбор препарата
Аспирин выпускается многими производителями. И хотя он отличается по внешнему виду и консистенции, его количество во всех препаратах одинаково. Судя по результатам дезинтеграционного теста, являющегося официальным стандартом, между разными таблетками нет значительных различий. Самый популярный забуференный аспирин на самом деле не содержит достаточно щелочи, чтобы предотвратить раздражение желудка. Нет сведений о том, что какой-то определенный препарат дает более высокие концентрации аспирина в плазме, более эффективен или дает меньше побочных эффектов. Аспирин в кишечнорастворимой оболочке, которая не позволяет таблеткам растворяться в желудке, может быть полезным для пациентов, у которых добавление буфера не помогает контролировать развитие гастрита. Терапевтические концентрации, достигаемые при использовании этого препарата, сходны с таковыми при применении малых доз обычного аспирина. Кишечнорастворимая оболочка повышает цену аспирина, но все же это менее дорогое средство, чем новые НПВС. Сопутствующее применение Н2-блокаторов и других препа-
Эффект
Осложнения
X
J3
>- Интоксикация
Почечная и дыхательная недостаточность
Сосудистый коллапс Кома
Г ипопротромбинемия
Лихорадка, дегидратация Метабол ический ацидоз
Центральная гипервентиляция
Звон в ушах
Противовоспалительное
действие
Урикозурический эффект
Лечение ревматоидного
10— артрита
Аналгезия Жаропонижающий эффект Антитромбоцитарный эффект
Желудочные расстройства, кровотечение Гиперчувствительность Нарушение гемостаза
Рис. 35-3. Приблизительное соотношение концентраций салицилатов в плазме с их фармакодинамикой и осложнениями (Из: Hollander J., McCarty D. Jr. Arthritis and Allied Conditions. Lea & Febiger, 1972.)
ратов для лечения и профилактики язвенной болезни не снижает частоту повреждения ЖКТ под действием НПВС. Дериват простагландина Et мизопростол подавляет вызванное НПВС язвообразо-вание, но этот препарат стоит дорого и у многих пациентов вызывает диарею.
Побочные эффекты
А. Действие на ЖКТ. При приеме обычных доз аспирина главный побочный эффект — это нарушение функции желудка. Его можно свести до минимума, назначая адекватный буфер (например, принимать аспирин после еды совместно с антацидами или запивая стаканом воды). Возникающий гастрит может быть обусловлем раздражением слизистой оболочки желудка под действием нерассосавшейся таблетки, с абсорбцией в желудке неионизирован-ного салицилата или с ингибированием синтеза за-
щитных простагландинов. У животных образование язв можно спровоцировать парентеральным введением аспирина, а предотвратить развитие аспириновых эрозий — введением простагландинов. Эти наблюдения позволяют предположить, что недостаток простагландинов делает слизистую оболочку более ранимой. Как уже отмечалось, мизопростол уменьшает частоту повторного язвообразования у пациентов, принимающих большие дозы НПВС, но и сам дает токсический эффект.
Хотя способность аспирина вызывать образование язв у людей до сих пор не показана с достаточной очевидностью, экспериментальные и эпидемиологические исследования предлагают множество доказательств повышения частоты возникновения язв желудка (и в меньшей степени — двенадцатиперстной кишки) при активном применении аспирина или новых НПВС (Ivey, 1986). Кровотечение из верхних отделов ЖКТ при приеме аспирина обычно связано с эрозивным гастритом. При использовании аспирина, как правило, отмечают небольшое увеличение потерь крови с калом: если в норме с калом теряется около 1 мл крови в день, то при приеме терапевтических доэ аспирина это количество повышается до 4 мл. С другой стороны, при проведении правильной терапии язвы она заживает даже при одновременном приеме аспирина. И все же больным язвенной болезнью следует остерегаться назначения аспирина либо принимать его вместе с буфером или простагландинами.
После абсорбции больших доз аспирина как результат стимуляции ЦНС может возникать рвота.
Б. Действие на ЦНС. При применении высоких доз у пациентов может развиваться “салицилизм” (звон в ушах, снижение слуха и головокружение), который прекращается при снижении дозы. Дальнейшее увеличение доз вызывает гиперпноэ как следствие прямого воздействия на продолговатый мозг. На нижней границе токсических уровней салицилатов вследствие гипервентиляции может появиться дыхательный алкалоэ. Позже из-за кумуляции дериватов салициловой кислоты и подавления дыхательного центра возникает ацидоз.
В. Другие побочные эффекты. Прием аспирина в дозе 2 г в день и менее обычно повышает уровень мочевой кислоты в крови, а в дозе свыше 4 г в день снижает концентрацию уратов ниже 25 мг/л (раздел “Препараты, применяемые при подагре”).
Аспирин может вызывать невыраженный, бессимптомный гепатит, особенно у пациентов с таки
ми заболеваниями, как системная красная волчанка и ювенильный или взрослый ревматоидный артрит.
Салицилаты могут обратимо снижать гломерулярную фильтрацию у пациентов с заболеваниями почек и реже — у людей со здоровыми почками.
В лечебных дозах аспирин вызывает лишь очень незначительное изменение толерантности к глюкозе. Токсические количества препарата оказывают прямое влияние на сердечно-сосудистую систему и могут подавлять функцию сердца и расширять периферические сосуды. Большие дозы прямо действуют и на гладкие мышцы.
У пациентов с астмой и полипозом носа при приеме аспирина возможны реакции гиперчувствительности, проявляющиеся бронхоспазмом и шоком. Эти реакции, скорее всего, опосредованы лейкотриенами.
Аспирин противопоказан больным гемофилией. Его не рекомендуется принимать беременным. Однако в ряде исследований было установлено, что аспирин в низких дозах может быть полезен определенным группам беременных, например при высокой степени риска гипертензии или других осложнений беременности (Schiff, 1989).
Использование аспирина у детей во время или сразу после вирусной инфекции способствует повышению частоты возникновения синдрома Рея (Hurwits, 1987,1989). В этих случаях вместо аспирина следует применять ацетаминофен.
Токсичность при передозировке
Аспирин имеется в каждой домашней аптечке, поэтому так часты отравления им маленьких детей. Тяжелая интоксикация возникает тогда, когда доза превышает 150-175 мг/кг. Со времени появления защищенных от детей упаковок отмечается значительное снижение частоты смертельных отравлений аспирином.
Большая часть препаратов аспирина продается и применяется без рецепта. Их надо хранить в недоступных для детей местах и в защищенных от детей упаковках, в которых они продаются. Красочные, ароматизированные и жидкие формы следует хранить в закрытых шкафах.
При передозировке, случайной или с суицидными намерениями, рекомендуется провести промывание желудка (глава 60). Гипертермию можно лечить спиртовыми губками или льдом. Важно поддерживать достаточный диурез и корректировать
аномалии кислотно-основного баланса. При тяжелых токсических реакциях может потребоваться искусственная вентиляция легких. Инфузии натрия бикарбоната способствуют ощелачиванию мочи, что может повысить экскрецию салицилатов.
Лекарственные взаимодействия
Ацетазоламид и хлорид аммония усугубляют течение интоксикации салицилатами. А алкоголь — вызванные салицилатами кровотечения из ЖКТ. Аспирин вытесняет такие препараты, как толбутамид, хлорпропамид, НПВС, метотрексат, фенитоин и пробенецид из комплексов с белками плазмы. Кортикостероиды могут снижать концентрацию салицилатов. Аспирин уменьшает фармакологическую активность спиронолактона, конкурирует с пенициллином G за почечную тубулярную секрецию и подавляет урикозурический эффект суль-финпиразона и пробенецида.
Дифлунизал
Дифлунизал — это более новое НПВС, являющееся производным салициловой кислоты. Период его полувыведения приблизительно равен таковому у салицилатов, постоянство уровней в плазме достигается через несколько дней приема. Как и аспирин, он дает аналгетический и противовоспалительный эффект, но в отличие от аспирина оказывает очень слабое жаропонижающее действие.
Показания к применению дифлунизала — боль, остеоартрит и ревматоидный артрит. Побочные эффекты сходны с эффектами других НПВС.
Другие нестероидные противовоспалительные средства
Наличие побочных эффектов у аспирина и других салицилатов (особенно раздражения слизистой оболочки желудка при приеме больших доз) подтолкнули к поиску новых соединений. После появления в 1949 г. в США для лечения ревматоидного артрита или остеоартрита фенилбутазона было одобрено множество препаратов с аспириноподобными свойствами (так называемые нестероидные противовоспалительные средства — НПВС)
(табл. 35-3). Некоторые из этих НПВС рекомендованы для применения по другим показаниям, о чем еще пойдет речь.
Химические свойства
НПВС классифицируют в соответствии с их химической структурой (рис. 35-4). Различия в химическом строении обусловливают существенную разницу фармакокинетических характеристик, поэтому их удобнее всего рассматривать отдельно для каждого препарата.
Фармакодинамика
Противовоспалительная активность новых НПВС по механизму похожа на действие аспирина и осуществляется главным образом через подавление биосинтеза простагландинов. Однако в отличие от аспирина эти препараты являются обратимыми ингибиторами циклооксигеназы. Их селективность относительно СОХ I и СОХ II варьирует. Например, в исследованиях, выполненных с использованием ферментов мышей, выявлено, что аспирин, индометацин, пироксикам и сулиндак значительно более эффективно ингибируют СОХ I, ибупрофен и меклофенамат подавляют оба фермента в одинаковой степени, а активный метаболит на-буметона обладает большей селективностью в отношении СОХ II (Meade, 1993). Подавление липо-оксигеназного пути (желательное для проявления противовоспалительного действия) новыми НПВС ограничено, но может быть более выражено, чем у аспирина. Значительно подавляет синтез лейкотриенов одно из новых НПВС беноксапрофен, но он был снят с производства вследствие высокой токсичности. Из имеющихся в настоящее время НПВС индометацин и диклофенак ингибируют синтез и простагландинов, и лейкотриенов. Скорее всего, поиск новых НПВС будет продолжаться до тех пор, пока значимость угнетения СОХ II и липооксиге-назы не будет оценена с помощью более селективных ингибиторов.
При применении этих препаратов воспаление подавляется благодаря уменьшению высвобождения медиаторов из гранулоцитов, базофилов и тучных клеток. НПВС снижают чувствительность сосудов к брадикинину и гистамину, влияют на синтез лимфокинов Т-лимфоцитами и снимают вазодилатацию. Все новые НПВС в разной степени об-
Производные пропионовой кислоты
СООН
Ибупрофен
Производные пирролалкановой кислоты
О СН3 СООН
Толметин
Производные фенилалкановой кислоты
Флурбипрофен
Производные фенилуксусной кислоты
Производные индола
Индометацин
Класс фенаматов
Производные пиразолона
Фенилбутазон
Диклофенак
СООН
N —Н
Оксикамы
Пироксикам
Меклофенамовая кислота
Предшественники нафтилуксусной кислоты
Рис. 35-4. Химическая структура некоторых НПВС
ладают аналгетическим, противовоспалительным, жаропонижающим свойствами и подавляют агрегацию тромбоцитов. Они в меньшей степени раздражают желудок, чем аспирин. Все чаще сообщается о нефротоксичности широко используемых противовоспалительных средств.
Ибупрофен
Ибупрофен является простым дериватом фенилпропионовой кислоты. В дозах более 2400 мг в день он эквивалентен по противовоспалительному эффекту 4 г аспирина. Ибупрофен часто применяют в меньших дозах, в которых он обладает хорошими аналгетическими, но более слабыми противовоспа
лительными свойствами. Продается несколько безрецептурных препаратов, содержащих низкие дозы ибупрофена. Лекарство активно метаболизируется в печени, только малая его часть выводится в неизмененном виде. Возможны раздражение слизистой оболочки ЖКТ и кровотечения, хотя реже, чем при использовании аспирина. При совместном применении ибупрофена и аспирина общий противовоспалительный эффект снижается. Препарат противопоказан при полипозе носа, отеке Квинке и бронхоспастической реакции на аспирин. Кроме желудочно-кишечных симптомов (которые можно ослабить, принимая препарат во время еды), могут появиться сыпь, зуд, звон в ушах, головокружение, головная боль, тревожность, асептический менин
гит и задержка жидкости. Взаимодействие с антикоагулянтами возникает редко. Тяжелые гематологические реакции, спровоцированные приемом ибупрофена, включают агранулоцитоз и апластическую анемию. Могут наблюдаться и нежелатель-' ные реакции со стороны почек (как и у всех других НПВС): острая почечная недостаточность, интерстициальный нефрит и нефротический синдром.
Напроксен и фенопрофен
Напроксен представляет собой нафтилпропионовую кислоту, которая легко связывается с белками плазмы и имеет долгий период полувыведения (табл. 35-3). Антациды замедляют его абсорбцию. Напроксен выделяется с мочой в виде неактивного глюкуронида. Как и ибупрофен, напроксен конкурирует с аспирином за связь с белками плазмы. Он также продлевает протромбиновое время.
Другое производное пропионовой кислоты фенопрофен имеет короткий период полувыведения, поэтому требует частого приема.
Побочные эффекты и лекарственные взаимодействия напроксена и фенопрофена похожи на таковые ибупрофена. При их использовании могут возникать нефротоксический эффект, желтуха, тошнота, диспепсия, периферические отеки, сыпь, зуд, нарушения сердечно-сосудистой системы и ЦНС, звон в ушах.
Флурбипрофен
Флурбипрофен — еще один дериват пропионовой кислоты, который имеет промежуточный период полувыведения (относительно напроксена и фенопрофена). Он хорошо всасывается и достигает высокой концентрации в синовиальной жидкости. После выраженной метаболической деградации может подвергаться кишечно-печеночной рециркуляции до того, как будет выведен почками. Эффективность флурбипрофена в клинических испытаниях у пациентов с ревматоидным артритом, анкилозирующим спондилитом и остеоартритом оказалась сравнимой с таковой для аспирина и других НПВС. Существует также лекарственная форма флурбипрофена для местного применения в офтальмологии с целью подавления миоза во время операции.
При пероральном приеме препарата у 15-20 % пациентов возникают нарушения со стороны ЖКТ,
характерные для противовоспалительных средств. Не отмечается учащения возникновения побочных эффектов у пожилых людей.
Кетопрофен
Кетопрофен также относится к производным пропионовой кислоты. Он обладает некоторой способностью подавлять как циклооксигеназу, так и липооксигеназу. Препарат быстро всасывается, но период его полувыведения достаточно короток. Он полностью метаболизируется в печени. Несмотря на то, что кетопрофен на 99 % связывается с белками плазмы, он не влияет на активность ни варфарина, ни дигоксина. Обратное явление наблюдается при его совместном применении с пробенецидом, который поднимает уровень кетопрофена и продлевает его период полувыведения.
Эффективность кетопрофена в терапии ревматоидного артрита и остеоартрита эквивалентна эффективности других НПВС и аспирина. Несмотря на двойное действие на простагландины и лейкотриены, кетопрофен не имеет преимуществ перед другими НПВС. Его главные побочные эффекты затрагивают ЦНС и ЖКТ.
Оксапрозин
Оксапрозин является одним из самых новых НПВС-дериватов пропионовой кислоты. Как показано в табл. 35-3, его основное отличие от других членов этой подгруппы — большой период полувыведения; оксапрозин можно принимать всего один раз в день. Из-за этой особенности препарата изменять дозу следует не чаще, чем через 10—14 дней. Оксапрозин обладает такими же основными и побочными эффектами, как и другие НПВС.
Диклофенак
Диклофенак — простое производное фенилуксусной кислоты. Он напоминает флурбипрофен и меклофенамат. Это сильный ингибитор циклооксигеназы, обладающий противовоспалительными, аналгетическими и жаропонижающими свойствами. Препарат быстро всасывается после перорального приема и имеет короткий период полувыведения. Как и флурбипрофен, он накапливается в синовиальной жидкости. Активность диклофенака выше, чем активность напроксена. Препарат реко
мендован при хронических воспалительных заболеваниях типа ревматоидного артрита и остеоартрита, а также для снятия острой скелетно-мышечной боли. Побочные эффекты возникают примерно у 20 % пациентов и включают желудочно-кишечные расстройства, скрытое кровотечение из ЖКТ и язвы желудка.
Лекарственная офтальмологическая форма препарата показана для предотвращения послеоперационного воспаления.
Сулиндак
Сульфоксид сулиндак является пролекарством. Его активный метаболит, как и диклофенак, представляет собой дериват уксусной кислоты. Препарат эффективен только после превращения в печени в сульфид, который выделяется с желчью и затем реабсорбируется в кишечнике. Печеночно-кишечная циркуляция препарата увеличивает длительность его действия до 16 часов.
Показания к применению и побочные эффекты сулиндака похожи на таковые для других НПВС. Из наиболее серьезных токсических реакций могут развиться синдром эпидермального некролиза Стивенса-Джонсона, тромбоцитопения, агранулоцитоз и нефротический синдром.
Толметин
Толметин, дериват пирролуксусной кислоты, близок к аспирину по эффективности при ювенильном и взрослом ревматоидном артрите и остеоартрите. Препарат имеет короткий период полувыведения и должен назначаться несколько раз в день.
Этодолак
Этодолак является новым производным уксусной кислоты со средним периодом полувыведения (табл. 35-3). Как и некоторые другие НПВС, он представляет собой рацемическую смесь R- и 5-форм, при этом Д-форма лишена активности. Препарат хорошо всасывается с биодоступностью приблизительно 80 % и прочно связывается с белками плазмы (> 90 %). О других различиях, кроме фармакокинетических, относительно иных НПВС данных нет.
Набуметон
Набуметон — это лекарственный предшественник. Он представляет собой кетон (рис. 35-4), который в организме превращается в дериват уксусной кислоты. Его период полувыведения, превышающий 24 часа (табл. 35-3), допускает однократный прием. В остальном свойства набуметона очень похожи на свойства других НПВС.
Меклофенамат
и мефенамовая кислота
Производное фенамовой кислоты меклофенамат достигает пиковой концентрации в плазме через 30-60 минут после приема и имеет короткий период полувыведения. Препарат выделяется с мочой, в основном в виде глюкуронида. Хотя опыт применения меклофенамата еще небольшой, можно сказать, что по побочным эффектам он не отличается от других НПВС и не имеет перед ними преимуществ. Этот препарат усиливает эффект пероральных антикоагулянтов. Меклофенамат противопоказан во время беременности; его эффективность и безопасность не определены у маленьких детей.
Другой фенамат, мефенамовая кислота, обладает аналгетическим свойствами, но, скорее всего, уступает аспирину как противовоспалительное средство. Кроме того, мефенамовая кислота намного более токсична. Ее не следует применять дольше одной недели и нельзя назначать детям.
Пироксикам
Пироксикам, относящийся к оксикамам, является НПВС новой структуры (рис. 35-4). У него длительный период полувыведения, позволяющий принимать препарат 1 раз в день, что положительно влияет на соблюдение назначений врача. Он быстро всасывается в желудке и в проксимальной части тонкой кишки: через один час его концентрация в плазме равна 80 % от максимальной концентрации. Выводится в виде глюкуронида и в меньшем количестве — в неизмененном виде.
Нарушения со стороны ЖКТ возникают у 20 % пациентов. Другие побочные эффекты включают головокружение, звон в ушах, головную боль и сыпь.'Препарат можно применять в терапии ревматоидного артрита, анкилозирующего спондилита и остеоартрита.
Апазон и карпрофен
Эти препараты применяются во многих странах, но не в США. Апазон (азапропазон), дериват пира-золона, структурно близок к фенилбутазону, но реже вызывает агранулоцитоз. Его период полувыведения равен 12-16 часам. При снижении функции почек (например, у пожилых пациентов) период полувыведения может увеличиваться в 2 раза. Карпрофен — это производное пропионовой кислоты с периодом полувыведения 10—16 часов. Показания к применению и побочные эффекты апазона и карпрофена типичны для НПВС.
НПВС, применяемые по специальным показаниям
Индометацин
Индометацин, появившийся в 1963 г., является производным индола (рис. 35-4). Он более токсичен, но при определенных обстоятельствах более эффективен, чем аспирин или другие НПВС. В лабораторных условиях это один из наиболее сильных ингибиторов синтеза простагландинов. Индометацин хорошо всасывается после перорального приема и активно связывается с белками плазмы. Метаболизируется в печени; неизмененный препарат и неактивные метаболиты выводятся с желчью и мочой.
Клиническое применение
Индометацин не рекомендуется для применения в качестве аналгетика. У детей он должен использоваться только для лечения незаращения боталло-ва протока. Препарат используют в строго определенных ситуациях: при остром подагрическом артрите, анкилозирующем спондилите и остеоартрите бедра, а также в случаях внесуставного воспаления (перикардите и плеврите при синдроме Барттера). При острой подагре индометацин полностью заменил колхицин как препарат первого выбора (раздел “Препараты, применяемые при подагре”).
Особое показание к применению индометацина — лечение незаращения боталлова протока {ductus arteriosus) у недоношенных новорожденных. Этот проток остается открытым у плода вследствие постоянного образования простагландинов, его закрытие у недоношенного ребенка можно ускорить
внутривенной инфузией индометацина. В данной ситуации образование простагландинов не является следствием воспалительного процесса и, возможно, в большей степени зависит от активности СОХ I, чем СОХ II. Как уже отмечалось, индометацин относительно селективно действует на СОХ I. Во многих случаях применение препарата позволяет избежать операции.
Индометацин рекомендован в качестве токолитического средства при преждевременных родах ранее 32 недель беременности (Morales, 1989): подавление синтеза простагландинов снижает частоту и силу сокращений матки. Однако некоторые врачи оспаривают это показание, так как обнаружено токсическое действие препарата на мать и плод (Norton, 1993). В таких ситуациях, по-видимому, следует предпочесть блокаторы кальциевых каналов (глава 12).
Побочные эффекты
Индометацин с большой частотой вызывает дозозависимые токсические эффекты. При приеме высоких доз по меньшей мере у одной трети пациентов возникают какие-либо побочные эффекты, требующие прекращения приема препарата. Желудочно-кишечные симптомы могут включать боль в животе, диарею, кровотечение из ЖКТ и панкреатит. Тяжелые головные боли возникают у 20-25 % пациентов и могут сопровождаться головокружением, нарушением мышления и депрессией. В редких случаях развивается психоз с галлюцинациями. Печеночная симптоматика возникает редко. Отмечено развитие тяжелых гематологических реакций, в том числе тромбоцитопений и апластических анемий. Зафиксированы случаи коронарного вазоспазма. Сообщалось о гиперкалиемии, связанной с нарушением синтеза простагландинов в почках. Возможны взаимодействия индометацина с некоторыми препаратами (Приложение II). Его опасно принимать пациентам с полипозом носа или отеком Квинке, у которых может обостриться астма. Препарат противопоказан при беременности и должен осторожно применяться при язвенной болезни или психических нарушениях.
Фенилбутазон
Фенилбутазон, являющийся дериватом пиразо-лона, после появления в 1949 г. быстро приобрел популярность как средство для лечения ревматоид
ного артрита, анкилозирующего спондилита, острого подагрического артрита и различных скелетно-мышечных заболеваний. Он дает очень сильный противовоспалительный эффект и поэтому часто применяется и сейчас, хотя аспирин и новые НПВС превосходят его во многих отношениях. Оксифенбутазон — это активный метаболит фенилбутазона со сходными свойствами, выпускаемый в виде отдельного препарата.
Фенилбутазон вызывает многие серьезные побочные эффекты. Наиболее опасные из них — агранулоцитоз и апластическая анемия, которые привели к нескольким смертельным исходам. Фенилбутазон вызывает также гемолитическую анемию, нефротический синдром, неврит зрительного нерва, глухоту, серьезные аллергические реакции, эксфолиативный дерматит и некроз печени и почечных канальцев. Главное показание к применению фенилбутазона — краткосрочное лечение таких болезненных состояний, как острый подагрический артрит и тромбофлебит поверхностных вен. Однако при этих состояниях эффективны и более безопасные препараты типа индометацина.
Кеторолак
Кеторолак — это НПВС средней продолжительности действия. Его предлагают для системного применения, в основном в качестве аналгетика, а не противовоспалительного препарата (хотя кеторолак дает все типичные эффекты НПВС). Препарат действительно обладает значительными аналгети-ческими свойствами и в некоторых случаях используется вместо морфина при послеоперационной боли легкой и средней степени тяжести. Наиболее часто его вводят парентерально, но возможен и пероральный прием. В офтальмологии применяют противовоспалительные глазные капли.
Клиническая фармакология НПВС
Большинство пациентов с воспалительными заболеваниями суставов получают положительный эффект от приема аспирина в дозе 4 г или более при принятии специальных мер (введение буфера) для предупреждения раздражения слизистой оболочки желудка. Приблизительно у 15 % пациентов аспирин вызывает побочные эффекты; именно этим па
циентам имеет смысл назначать новые НПВС. Препараты этой новой группы меньше раздражают желудок. Режим приема некоторых из них проще для пациента (одна таблетка 1-2 раза в день). Выбирая препарат, следует помнить, что стоимость лечения для пациента составляет 60-200 долл, на 60-дневный прием новых препаратов.или 10 долл, для генерика аспирина, продающегося без рецепта. Кроме того, для определения терапевтической концентрации салицилатов в крови имеется надежный метод, а для новых препаратов такого метода нет. Перед назначением нужно тщательно взвесить преимущества и недостатки аспирина в сравнении с новыми НПВС. Установлено, что большинству пациентов с воспалительным артритом назначают новые НПВС без адекватной проверки эффективности салицилатов, хотя нет достоверных доказательств превосходства новых средств перед аспирином. Более того, хотя эти препараты и вызывают менее выраженное раздражение ЖКТ, многие из них дают другие токсические эффекты.
Так как при приеме НПВС часто возникают нарушения со стороны ЖКТ, были приложены большие усилия для предотвращения развития этого осложнения и снижения степени его тяжести. Установлено, что аналог простагландина Е( мизопростол в определенной дозе подавляет секрецию кислоты в желудке и, возможно, повышает секрецию слизистой оболочкой желудка таких защитных факторов, как бикарбонат (главы 18 и 64). Мизопростол зарегистрирован в США как препарат для сочетанного применения с НПВС у пациентов со склонностью к язвообразованию.
Новые НПВС во многих случаях приводили к развитию острой почечной недостаточности и нефротического синдрома, которые развиваются постепенно и не зависят ни от длительности применения препарата, ни от дозировки. Реакции гиперчувствительности возникают редко, поэтому нарушения функции почек могут протекать незаметно.
Если принимается решение использовать новые НПВС, важно учитывать их побочные эффекты, стоимость и дозы. Невозможно знать, какой пациент и каким образом прореагирует на определенное НПВС, так как некоторым людям избирательно помогает какой-то определенный препарат. Трудно оценить, чем обусловлена такая избирательность: самим препаратом, индивидуальными особенностями метаболизма или эффектом плацебо. Когда соблюдение назначений является про
блемой для пациента, выписывают препараты типа пироксикама, напроксена, сулиндака и оксапрози-на, так как их нужно принимать всего 1-2 раза в сутки. Если пациент одновременно пользуется гипогликемическим средством или варфарином, можно назначать толметин или ибупрофен, так как эти НПВС в отличие от сулиндака не потенцируют их эффекты. Однако гиперчувствительность к фенилпропионовой или фенилуксусной кислотам не позволяет использовать их дериваты. Следует назначать препараты в дозах, предписанных производителем, однако иногда требуется использовать более высокую дозу, и пациент переносит ее хорошо. И все же до появления метода определения уровней этих препаратов в крови безопаснее придерживаться предписанных доз.
Противоревматические препараты медленного действия (ПРПМД)
Тщательные клинические и эпидемиологические исследования показали, что ревматоидный артрит не только вызывает заболевание суставов, которое снижает подвижность человека и качество жизни, но и приводит к выраженным системным изменениям, укорачивающим продолжительность жизни. НПВС являются только симптоматическими средствами: они подавляют воспаление и вызываемую им боль, но не оказывают значительного действия на прогрессирование деструкции кости и хряща. Поэтому за последние годы вновь возрос интерес к препаратам, которые могут остановить или, по крайней мере, замедлить это прогрессирование, изменяя течение самого заболевания. Эффект такой патогенетической терапии обычно проявляется не сразу. На это требуется от четырех недель до одного года лечения, то есть они действуют медленно по сравнению с НПВС. К препаратам этой группы относятся иммунодепрессанты (метотрексат, азатиоприн), хелатные соединения (пеницилламин), антималярийные средства (гидроксихлорохин и хлорохин) и другие. Существует много противоречий относительно оценки долгосрочной эффективности этих средств. Открытие, продемонстрировавшее присутствие многих цитокинов в пораженных суставах (табл. 35-2), позволяет предположить, что один или многие из них
могут быть важными мишенями патогенетической терапии.
Метотрексат и другие иммунодепрессанты
Иммунодепрессанты (глава 57) использовались в терапии ревматических заболеваний в течение многих десятилетий, но обычно их назначали только в очень тяжелой инвалидизирующей стадии заболевания, когда традиционные средства уже не давали эффекта. В качестве одного из путей предотвращения серьезных проявлений ревматоидного артрита было предложено более агрессивное раннее лечение метотрексатом на этапе до развития необратимых изменений. Однако вследствие потенциальной токсичности иммунодепрессантов они должны применяться только в том случае, если врач хорошо знаком со всеми аспектами их действия. Надежных методов правильного выбора препарата не существует, так как не проводилось контролируемых исследований эффективности для большинства из этих препаратов. Тем не менее в нескольких клинических испытаниях установлено, что из всех противоревматических препаратов медленного действия (ПРПМД) метотрексат имеет наилучшее соотношение пользы и риска, то есть меньше пациентов прекращают его прием вследствие развития токсических эффектов или отсутствия эффективности (Felson, 1990; Wolfe, 1990).
Иммунодепрессанты эффективны при волчаночном нефрите, при серопозитивном прогрессирующем ревматоидном артрите и иногда — при других ревматических заболеваниях, а также при васкулитах, например при гранулематозе Вегенера и панартериите. Вследствие тяжести побочных эффектов, особенно онкогенных, гепатотоксических, подавления функции костного мозга, иммунодепрессанты следует назначать только тогда, когда другие препараты оказались неэффективными.
Метотрексат, ингибитор дигидрофолатредукта-зы и сильный иммунодепрессант (глава 57), при ревматоидном артрите дает эффект в малых еженедельных пероральных дозах (“низкодозная пуль-стерапия”). Максимальная рекомендуемая с этой целью доза равна 7.5 мг в неделю. Но даже в такой низкой дозе этот препарат обладает значительной токсичностью. В большом сравнительном исследо
вании по применению ПРПМД при ревматоидном артрите наиболее часто встречались такие токсические эффекты, как тошнота и язвы слизистых оболочек (Singh, 1991). Почти у 40 % пациентов при длительном лечении метотрексатом возникает прогрессирующая дозозависимая гепатотоксичность в форме изменения активности ферментов, фиброза и цирроза. Недавно были получены сведения о том, что токсичность метотрексата можно уменьшить без снижения его эффективности в отношении ревматоидного артрита, назначая через 24 часа после каждой недельной дозы метотрексата лейковорин (Shiroky, 1993).
Другие иммунодепрессанты, применявшиеся для лечения ревматоидного артрита, в частности алкилирующие соединения мехлорэтамин, циклофосфамид, хлорамбуцил и антагонист пуринов аза-тиоприн, в настоящее время одобрены FDA для применения по этому показанию.
Противомалярийные препараты
(хлорохин, гидроксихлорохин)
Фармакология дериватов 4-аминохинолона более подробно рассматривается в главе 54. Хлорохин и гидроксихлорохин применяют для лечения ревматоидного артрита и системной красной волчанки с 1950-х гг.; их эффективность в инициации ремиссии подтверждена в тщательно контролируемых испытаниях. После длительного лечения хлорохином у многих пациентов снижается содержание ревматоидного фактора, маркера интенсивности заболевания. Однако нет подтверждений того, что хлорохин останавливает прогрессирование эрозивных изменений костей.
Механизм противовоспалительного действия хлорохина и гидроксихлорохина при ревматических заболеваниях неясен. Они подавляют реактивность Т-лимфоцитов в отношении митогенов, угнетают хемотаксис лейкоцитов, стабилизируют лизосомальные мембраны, ингибируют синтез ДНК и РНК и захватывают свободные радикалы. Один или более из этих эффектов могут быть лечебными. Действие препаратов проявляется только после латентного периода в 4-12 недель. Препараты часто применяют для адъювантной терапии совместно с НПВС, они не вступают во взаимодействие с другими противоревматическими средствами.
Показания к применению
Противомалярийные препараты часто назначаются тем пациентам с ревматоидным артритом, у которых не получен достаточный эффект от применения салицилатов и НПВС. Кроме того, их противовоспалительные свойства успешно используют при хроническом ювенильном артрите, синдроме Шегрена и системной красной волчанке (при которых они оказывают положительное влияние как на изменения суставов, так и на поражения кожи). Антималярийные препараты нельзя применять при псориатическом артрите вследствие опасности развития эксфолиативного дерматита.
Побочные эффекты
Они описаны в главе 54.
Дозирование
Предпочтительно назначать гидроксихлорохина сульфат. Начальная доза — 400 мг перорально. При достижении клинического улучшения дозу можно снизить до 200 мг в сутки.
Препараты золота
Соединения золота впервые стали применять при ревматоидном артрите в 1920-е гг., но только в 1960 г. на основании результатов обширного двойного слепого клинического испытания было показано, что соли золота дают положительный, хотя и скромный, эффект. Большинство последующих контролируемых исследований подтвердило тот факт, что препараты золота для парентерального введения действительно ослабляют проявление болезненных симптомов и замедляют развитие заболевания. В некоторых исследованиях с рентгенологическим контролем было продемонстрировано, что эти препараты замедляют прогрессирование деструкции кости и хряща. Росту популярности солей золота способствовали появившиеся сведения о возможности применения препарата в течение нескольких лет, несмотря на существование представления об их токсичности в связи с кумуляцией. Тем не менее тщательный анализ многочисленных клинических испытаний показал, что в их проведении было много неточностей. В результате снова встал вопрос о роли препаратов золота для парентераль
ного введения в терапии ревматоидного артрита (Epstein, 1991). Главный недостаток терапии золотом — высокая частота прекращения терапии: через два года вероятность продолжения лечения будет менее 60 %, через семь лет — менее 10 %. В большинстве случаев прекращение лечения связано с токсичностью.
С появлением пероральных препаратов золота (ауранофин) в 1980-е гг. было проведено множество клинических испытаний. Оказалось, что ауранофин дает в лучшем случае незначительный эффект и что его действие при некоторых видах артрита не отличается принципиально от действия НПВС, хотя токсичность значительно выше (Carette et al., 1989; Giannini et al., 1990).
Химические свойства
Препараты золота — это ауротиомалат и ауротиоглюкоза, которые вводят внутримышечно в виде водорастворимых солей, содержащих 50 % элементарного золота. Пероральный препарат ауранофин представляет собой производное тиоглюкозы с замещением молекулами золота (29 % золота).
Фармакокинетика
Соли золота связываются с транспортными белками плазмы примерно на 95 %. Они концентрируются главным образом в синовиальных мембранах, но попадают в печень, почки, селезенку, надпочечники, лимфатические узлы и костный мозг. После внутримышечного введения пиковая концентрация достигается через 2-6 часов. В течение недели выводится 40 % лекарства: две трети с мочой и одна треть с калом. Через месяц после внутримышечного введения 50 мг препарата он на 75-80 % выводится из организма. После перорального приема аурано-фина всасывается только 25 % дозы. Некоторые ткани, например эпителий почечных канальцев, имеют особое сродство к золоту и хранят его частицы в течение многих лет после окончания лечения. В большинстве исследований не удалось показать корреляции между концентрацией золота в сыворотке и его терапевтическим эффектом или токсичностью.
Фармакодинамика
Точный механизм действия солей золота при ревматоидном артрите и подобных заболеваниях
неизвестен. Золото изменяет морфологию и функции макрофагов человека. Возможно, это и есть основной механизм его действия. Золоту приписывают также другие эффекты: ингибирование активности лизосомальных ферментов и высвобождения гистамина из тучных клеток, инактивация (^-компонента комплемента, подавление фагоцитарной активности полиморфноядерных лейкоцитов и подавление феномена Шварцмана. Наряду с этим ауротиомалат снижает количество циркулирующих лимфоцитов, а ауранофин угнетает высвобождение простагландина Е2 из синовиальных клеток и высвобождение лейкотриенов В4 и С4 из полиморфноядерных лейкоцитов.
Показания и противопоказания
Терапия золотом показана при активном ревматоидном артрите пациентам, у которых после 3-4-месячного курса терапии НПВС сохранились признаки активного синовита. Кандидатами для терапии золотом являются и больные с активным воспалением и эрозивными изменениями костей, находящиеся на более поздних стадиях заболевания. Препараты золота назначают также пациенам с ревматоидным артритом при наличии синдрома Шегрена и пациентам с ювенильным ревматоидным артритом. Роль золота в лечении псориатического артрита неясна.
Основные противопоказания для терапии золотом — это анамнестические данные о его токсическом действии, серьезные нарушения функции печени и почек, болезни крови. Золото не назначают вместе с пеницилламином, так как этот хелатный препарат выводит золото из организма.
Побочные эффекты
Приблизительно у одной трети пациентов, получающих препараты золота, возникают симптомы интоксикации. Наиболее частым побочным эффектом, возникающим у 15-20 % больных, является дерматит, обычно зудящий. Могут наблюдаться поражения кожи с предшествующей или сопутствующей эозинофилией. У 1-10 % пациентов возникают аномалии крови, в том числе тромбоцитопения, лейкопения и панцитопения. Апластическая анемия встречается редко, но может быть фатальной. Примерно у 8-10 % пациентов развивается протеинурия, которая в некоторых случаях может
прогрессировать до нефротического синдрома. Другие побочные эффекты включают стоматит, металлический привкус во рту, пигментацию кожи, энтероколит, холестатическую желтуху, периферическую нейропатию, легочные инфильтраты и отложения золота в роговице глаза. Возможны также нитритоидные реакции (потливость, обмороки, вегетативные приливы и головные боли), особенно при применении тиомалата золота; считается, что они связаны, скорее, с растворителем в составе препарата, чем собственно с солями золота. После инъекций золота может возникнуть временное ухудшение течения артрита. Наиболее частыми побочными эффектами терапии золотом являются нарушения со стороны ЖКТ (особенно диарея) и дерматиты.
Дозирование
Парентеральные препараты золота обычно назначают в дозе 50 мг внутримышечно 1 раз в неделю до достижения курсовой дозы 1000 мг (если улучшение возникает после введения 600-700 мг, то прием препарата можно прекратить). Если после введения 1 г золота не возникает серьезных осложнений и наблюдается хорошая реакция, то терапию можно продолжать неограниченное время, увеличивая интервалы между приемами до двух, трех и затем — до четырех недель. Пероральное золото назначается в дозе 6 мг в день с постепенным ее повышением до 9 мг/день, если улучшения не наступает после трех месяцев терапии. Клиническое улучшение обычно наблюдается после нескольких месяцев (вплоть до четырех). Во время лечения необходимо тщательное клиническое и лабораторное мониторирование.
Пеницилламин
Метаболит пенициллина пеницилламин является аналогом аминокислоты цистеина. Препарат существует в D- и L-формах, в клинике используется D-изомер.
СНз Н I I
HS — с—с — соон
I I
СНз nh2
Пеницилламин
Фармакокинетика
После перорального приема пеницилламина всасывается примерно половина дозы. Абсорбция максимальна при приеме препарата через полтора часа после еды. Свободный пеницилламин и его метаболиты выделяются с калом и мочой. В течение 24 часов экскретируется около 60 % препарата. Удовлетворительного метода определения уровня препарата в крови не имеется.
Фармакодинамика
Механизм действия пеницилламина при ревматоидном артрите неясен. На экспериментальных моделях препарат подавляет артропатию и взаимодействует с рецепторами мембран лимфоцитов. Он может вмешиваться в синтез ДНК, коллагена и мукополисахаридов. Титры ревматоидного фактора снижаются после введения препарата, видимо, вследствие разрушения дисульфидных мостков макроглобулинов, но, вероятно, также из-за основного эффекта препарата — воздействия на иммунную систему. По латентному периоду действия (3-4 месяца) и по противовоспалительному эффекту пеницилламин похож на золото. Как и препараты золота, он может замедлять прогрессирование деструкции кости и хряща.
Показания
Пеницилламин показан пациентам с активными, прогрессирующими эрозивными ревматоидными поражениями, которые не поддаются лечению консервативной терапией. Его обычно назначают больным, которые не прореагировали на терапию золотом. При серонегативных артропатиях препарат не применяют. Требуется осторожность при одновременном введении других препаратов, так как пеницилламин нарушает абсорбцию многих из них и затрудняет достижение их терапевтических концентраций в крови.
Побочные эффекты
Токсические эффекты пеницилламина ограничивают его применение. Исследования на животных показали, что он подавляет заживление ран и повреждает сосуды и мышцы. У человека можно ослабить проявления побочных эффектов, назначая
невысокие дозы и постепенно повышая их до поддерживающих. У 20 % пациентов возникает протеинурия, у 4% пациентов — иммунокомплексный нефрит (он часто бывает обратим при отмене препарата). На любом этапе терапии могут возникнуть лейкопения и тромбоцитопения, предвещая апластическую анемию. Большинство смертей при лечении пеницилламином связано с апластической анемией. Повреждения кожи и слизистых оболочек (как самый частый побочный эффект) также появляются независимо от стадии лечения и могут исчезать при снижении дозы. Лекарственная лихорадка, являющаяся ранней реакцией на пеницилламин, часто сопровождается поражениями кожи.
Применение пеницилламина может провоцировать различные аутоиммунные заболевания, в том числе миастению, синдром Гудпасчера, системную красную волчанку, гемолитическую анемию и тиреоидит. При возникновении любого из этих заболеваний прием препарата следует прекратить.
Могут развиваться потеря вкуса или металлический привкус во рту. Притупление вкуса связывают с хелатированием цинка. Возможны анорексия, тошнота и рвота, а также гиперплазия молочных желез, алопеция и психические нарушения.
Пеницилламин противопоказан при беременности и при почечной недостаточности. Его нельзя назначать в сочетании с препаратами золота, цитотоксическими средствами или фенилбутазоном.
Побочные эффекты, требующие прекращения лечения, возникают у 40 % пациентов. Необходимо проводить клинический анализ крови (плюс содержание тромбоцитов) и мочи 2 раза в месяц в течение 4-6 месяцев, затем — один раз в месяц. При уровне тромбоцитов менее 100 000 в 1 мкл или количестве лейкоцитов менее 3000 в 1 мкл препарат следует отменить. Аллергия на пенициллин в анамнезе не является противопоказанием к приему пеницилламина. Пациентам с повреждениями почек, лекарственной лихорадкой, аутоиммунными синдромами и нарушениями со стороны крови препарат повторно не назначают.
Дозирование
Пеницилламин принимают перорально через полтора часа после еды. Эффект от лечения, как правило, проявляется не позднее чем через 6 месяцев. Сначала назначают 125 мг или 250 мг в день в течение 1-3 месяцев; если не возникает побочных
эффектов и не отмечается улучшения, то дозу удваивают. Если эффект не отмечается через 3-4 месяца, дозу поэтапно (1 раз в месяц) повышают до 750 мг в день (250 мг 3 раза в день). Больших доз обычно не требуется. В случае улучшения терапию прекращают. У большинства пациентов обострение возникает в течение 6 месяцев.
Сульфасалазин
Сульфасалазин, исходно предложенный для лечения язвенного колита, иногда дает эффект и при ревматоидном артрите. Он эффективен в той же степени, что и пеницилламин, но вызывает меньше побочных эффектов (Felson, 1990). Это показание к его применению не зарегистрировано.
Токсические проявления возникают при лечении ревматоидного артрита чаще, чем у больных с язвенным колитом. Это нарушения ЖКТ, головокружение и фоточувствительность. В редких случаях может потребоваться прекращение приема препарата из-за нейтропении.
Обычная доза составляет 2 г в сутки на четыре приема.
Левамизол
Антигельминтный препарат (особенно эффективный в отношении Ascaris lumbricoides) левамизол обладает иммуностимулирующими свойствами, что послужило предпосылкой к его применению при ревматических заболеваниях, при которых повышение иммунитета, как это ни парадоксально, считается полезным. Левамизол восстанавливает иммунные реакции при артрите, вызванном инъекциями адъюванта у крыс. Препарат активирует хемотаксис и фагоцитоз макрофагов и полиморфноядерных лейкоцитов и повышает функцию Т-лимфоцитов, особенно при нарушении механизмов гиперчувствительности замедленного типа.
Эффективность левамизола при ревматоидном артрите была доказана в двойных слепых рандомизированных испытаниях, но он не зарегистрирован для применения по этому показанию.
Самым частым побочным эффектом левамизола является сыпь. Более серьезные реакции включают лейкопению, агранулоцитоз и тромбоцитопению. Возможны гриппоподобные состояния, язвы ротовой полости, тошнота и рвота. Описаны случаи обратимого иммунокомплексного гломерулонефрита.
Обычная дозировка левамизола — 40-50 мг в сутки перорально в течение первой недели, на второй неделе дозу повышают до 80-100 мг в сутки, а далее — до 120-150 мг в сутки.
Глюкокортикоиды
Фармакология глюкокортикоидов и их применение описаны в главе 38.
Эффект преднизолона и других глюкокортикоидов при ревматоидном артрите ярко выражен. Они ингибируют фосфолипазу А2 — фермент, отвечающий за высвобождение арахидоновой кислоты из мембранных липидов (глава 18). Кроме того, недавно было установлено, что глюкокортикоиды подавляют экспрессию СОХ II (Kujubu, 1992; Winn, 1993). Однако длительное применение этих препаратов приводит к тяжелым инвалидизирующим побочным эффектам. Кортикостероиды не влияют на общий ход заболевания, то есть, несмотря на угнетение воспаления, деструкция кости и хряща продолжается. Их назначают при серьезных внесустав-ных воспалительных процессах, например при перикардите или поражениях глаз, а также во время обострения ревматоидного артрита. Когда преднизолон применяется для долгосрочной терапии, его доза не должна превышать 10 мг в день, и нужно стараться постепенно ее снижать. Прием кортикостероидов через день при ревматоидном артрите неэффективен: у пациентов вновь появляются симптомы заболевания в тот день, когда они не принимают препарат.
Кортикостероиды, вводимые в суставы, часто снимают болевой синдром. Если этот метод помогает, он предпочтителен в сравнении с системным введением.
Диетотерапия воспаления
Арахидоновая кислота представляет собой эй-козатетраеновую кислоту, которая метаболизируется циклооксигеназным и липооксигеназным путями. Она высвобождается из фосфолипидов мембран стимулированных клеток и после окисления образует несколько медиаторов, которые оказывают сильное влияние на развитие и функцию гладких мышц, кровеносных сосудов, эпителия, секреторных желез, лейкоцитов и элементов нервной системы (глава 18).
Может оказаться полезным изменить или дополнить диету пациента для введения в организм ненасыщенных жирных кислот (например, эйкоза-пентаеновой, которая находится в морской рыбе), похожих на арахидоновую. Изменение диеты позволяет дополнительным жирным кислотам метаболизироваться наряду с арахидоновой кислотой, изменяя окончательные продукты реакций. Например, эйкозапентаеновая кислота подавляет захват и встраивание арахидоновой кислоты в фосфолипиды мембран некоторых клеток и “разводит” свободную арахидоновую кислоту как субстрат для окисления. Продукты окисления эйко-запентаеновой кислоты менее активны, чем медиаторы, получаемые при окислении арахидоновой кислоты (иногда даже в несколько раз слабее), а активность последних снижается, так как новые соединения конкурируют с ними за клетки-мишени.
Потребление неочищенной эйкозапентаеновой кислоты человеком приводит к снижению агрегации тромбоцитов и хемотаксической активности и адгезии полиморфноядерных лейкоцитов, вызванной лейкотриеном В4. Результаты первых клинических испытаний показали, что эйкозапентаеновая кислота ослабляет как утреннюю скованность при ревматоидном артрите, так и эритему, связанную с псориазом. Эти предварительные результаты и почти полное отсутствие значительных побочных эффектов позволили предположить, что изменение с целью диеты потребления 1-4 г/день эйкозапентаеновой кислоты является хорошим дополнением к терапии этих заболеваний.
II. Другие аналгетики
Ацетаминофен — один из основных препаратов для лечения боли легкой и средней тяжести в тех случаях, когда нет необходимости в противовоспалительном эффекте. Предшественник ацетаминофена фенацетин более токсичен, чем его активный метаболит и не имеет рациональных показаний к применению.
Ацетаминофен
Ацетаминофен является метаболитом фенацетина, обуславливающего его аналгетический эффект. Это слабый ингибитор синтеза простагландинов в
периферических тканях, не оказывающий значительного противовоспалительного действия.
Фармакокинетика
Ацетаминофен принимают перорально. Скорость его всасывания связана со скоростью опорожнения желудка; пиковая концентрация в крови обычно достигается через 30-60 минут. Ацетаминофен незначительно связывается с белками плазмы, частично метаболизируется микросомальными ферментами печени и конвертируется в соответствующие сульфат и глюкуронид, которые не обладают фармакологической активностью (рис.4-4).Толькоменееб % лекарства выводится в неизмененном виде. Метаболит, присутствующий в малых количествах, но обладающий значительной активностью (N-ацетил-р-бензохинон), приобретает значение при приеме больших доз ацетаминофена, так как обладает нефро- и гепатотоксичностью. Период полувыведения ацетаминофена равен 2-3 часам и почти не зависит от функции почек. В токсических количествах или при заболеваниях печени период полувыведения может повышаться в 2 раза и более.
Показания
Хотя по аналгетическим и жаропонижающим свойствам ацетаминофен эквивалентен аспирину (Styrt, 1990), он отличается маловыраженным противовоспалительным действием. Препарат не влияет на уровень мочевой кислоты ине снижает количество тромбоцитов. Препарат эффективен при болях небольшой и средней силы, например при головных, мышечных, послеродовых и в других ситу-
Фенацетин (ацетофенетидин)
N-ацетил-р-аминофенол (ацетаминофен)
ациях, при которых и аспирин является эффективным аналгетиком. Ацетаминофен сам по себе не может обеспечить адекватную терапию воспалительных заболеваний типа ревматоидного артрита, но может быть использован как дополнение к противовоспалительной терапии с целью аналгезии. При необходимости обезболивания средней силы ацетаминофен служит препаратом выбора для больных с аллергией на аспирин или при плохой переносимости салицилатов. Его применяют вместо аспирина при гемофилии, у больных с язвенной болезнью в анамнезе или с бронхоспастической реакцией на аспирин. В отличие от аспирина ацетаминофен не является антагонистом урикозурических препаратов: его можно использовать вместе с пробенецидом в терапии подагры. Препарат назначают вместо аспирина детям при вирусных инфекциях.
Побочные эффекты
При применении ацетаминофена в терапевтических дозах иногда наблюдается небольшое повышение активности печеночных ферментов, но без развития желтухи. Этот эффект обратим после прекращения приема препарата. В больших дозах препарат вызывает головокружение, возбуждение и нарушение ориентации. Прием 15 г ацетаминофена может быть фатальным: смерть наступает из-за тяжелого токсического гепатита с центролобулярным некрозом, иногда сопровождающегося острым некрозом почечных канальцев (главы 4 и 60). Ранние симптомы поражения печени — тошнота, рвота, диарея и боль в животе. Лечение гораздо менее эффективно, чем при передозировке аспирина. Кроме поддерживающей терапии, эффективным мероприятием является введение соединений, содержащих сульфгидрильные группы, для нейтрализации токсических метаболитов. С этой целью используют ацетилцистеин (главы 4 и 60).
При приеме ацетаминофена редко возникают гемолитическая анемия и метгемоглобинемия, обычные при применении фенацетина. Несмотря на то, что 80 % фенацетина быстро метаболизируется в ацетаминофен, такие тяжелые осложнения терапии фенацетином, как интерстициальный нефрит и папиллярный некроз, пока не зарегистрированы при активном длительном применении ацетаминофена. Ацетаминофен не провоцирует желудочно-кишечных кровотечений. При заболеваниях печени этот препарат следует применять с осторожностью.
Дозировка
При острой боли и повышении температуры принимают 325-500 мг лекарства 4 раза в день. Детям назначают пропорционально более низкие дозы. Равновесные концентрации ацетаминофена достигаются в течение дня.
Фенацетин
Фенацетин запрещен к назначению в США и выведен из состава многих безрецептурных препаратов, в частности анацина и эмпирина. Однако он до сих пор входит в прописи некоторых аналгети-ков в США и используется во многих странах мира. Уже на протяжении 30 лет известна связь между избыточным применением комбинированных анал-гетиков, особенно фенацетин-содержащих, и развитием почечной недостаточности. Считается, что причиной конечной стадии почечной недостаточности у 5-15 % пациентов является злоупотребление аналгетиками. После запрещения использования фенацетина в составе аналгетиков в Финляндии, Шотландии и Канаде число новых случаев аналге-тических нефропатий в этих странах значительно снизилось.
Кристаллы уратов сначала фагоцитируются синовиоцитами, которые в ответ выделяют простагландины, лизосомальные ферменты и интерлейкин-1. Привлекаемые этими медиаторами хемотаксиса полиморфноядерные лейкоциты мигрируют внутрь сустава и усиливают текущее воспаление. В поздней фазе приступа увеличивается количество мононуклеарных фагоцитов (макрофагов), захватывающих кристаллы уратов и дополнительно выделяющих медиаторы воспаления. Эта последовательность событий наводит на мысль, что наиболее эффективными средствами при остром воспалении, вызванном кристаллами уратов, являются препараты, подавляющие различные фазы активации лейкоцитов.
Перед началом хронической терапии подагры пациенты, у которых заболевание ассоциируется с гиперурикемией и уратным кристаллообразованием (литиазом), должны быть четко отграничены от тех, кто имеет только гиперурикемню. У последних эффективность долговременной фармакотерапии не доказана. У некоторых индивидуумов уровни мочевой кислоты в течение жизни мотуг повышаться до двух стандартных отклонений от среднего уровня без нежелательных последствий.
III. Препараты, применяемые при подагре
Подагра — это наследственное метаболическое заболевание, характеризующееся повторными эпизодами острого артрита вследствие отложения урата натрия в суставах и хрящах. При этом возможно образование кристаллов мочевой кислоты в почках. Подагра связана с высоким сывороточным уровнем мочевой кислоты — плохо растворимого соединения, которое является главным конечным продуктом метаболизма пуринов. У большинства млекопитающих существует фермент уриказа, превращающий мочевую кислоту в более растворимый аллантоин; у человека этого фермента нет.
Лечение подагры направлено на снятие острого приступа и на предотвращение повторных обострений и кристаллообразования (уратолитиаза). Купирование острого приступа подагрического артрита основано на современном понимании патофизиологии этого заболевания (рис. 35-5).
Рис. 35-5. Патофизиология подагрического процесса в суставе. Синовиоциты фагоцитируют кристаллы уратов и затем секретируют медиаторы воспаления, которые привлекают и активируют полиморфноядерные фагоциты (ПМЯЛ) и мононуклеарные фагоциты (МИФ, макрофаги). Средства, активные при подагре, угнетают фагоцитоз кристаллов и выделение медиаторов воспаления полиморфноядерными лейкоцитами и макрофагами (ПГ- простагландин; ИЛ, — интерлейкин-1; ЛТВ„ — лейкотриен В„)
Колхицин
Колхицин — алкалоид, выделенный из крокуса осеннего, Colchicum autumnale. Его структура показана на рис. 35-6.
Фармакокинетика
Колхицин легко всасывается после употребления внутрь, его концентрация в плазме достигает пика в течение 2 часов. Метаболиты препарата выделяются желудочно-кишечным трактом и с мочой.
Фармакодинамика
Колхицин значительно облегчает боль и воспаление при подагрическом артрите в течение 12-24 часов без изменения метаболизма или выделения уратов и без других аналгетических эффектов. Он вызывает противовоспалительный эффект, связываясь с внутриклеточным белком тубулином и предотвращая таким образом его полимеризацию в микротубулы, что приводит к угнетению миграции лейкоцитов и фагоцитоза. Препарат угнетает и образование лейкотриена В4. Некоторые нежелательные эффекты колхицина обусловлены его ингибирующим действием на полимеризацию тубулина и клеточный митоз.
Показания к назначению
Колхицин является традиционным средством, применяемым для ограничения воспаления при остром подагрическом артрите. Хотя он более специфичен для подагры, чем НПВС, таким больным часто назначают другие препараты (например, индометацин), поскольку колхициновая терапия приводит к мучительной диарее. Колхицин предпочтителен для профилактики рецидивов приступов подагрического артрита, эффективен для предотвращения приступов острой средиземноморской лихорадки и может оказывать слабое положительное действие при саркоидном артрите и циррозе печени.
Нежелательные эффекты
Колхицин часто вызывает диарею, иногда — тошноту, рвоту и боль в животе, редко — потерю волос и угнетение костного мозга, а также периферические невриты и миопатию.
Пробенецид
Рис. 35-6. Колхицин и урикозурические средства
Острая интоксикация после перорального приема больших (нетерапевтических) доз алкалоида характеризуется жгучей болью в горле, кровавым поносом, шоком, гематурией и олигурией. Сообщалось и о фатальной восходящей депрессии центральной нервной системы. Лечение при передозировке колхицина — поддерживающее, симптоматическое.
Дозирование
Для прекращения приступа подагры колхицин дают в начальной дозе 0.5 или 1 мг, после чего назначают по 0.5 мг каждые 2 часа до облегчения боли или появления тошноты и диареи. Если необходимо, всю дозу можно ввести внутривенно, но при этом нужно помнить, что введение всего 8 мг в те
чение 24 часов может привести к смертельному исходу. Профилактическая доза колхицина — 0.5 мг 1-3 раза в день.
НПВС при подагре
Наряду с угнетением синтеза простагландинов индометацин и фенилбутазон ингибируют фагоцитоз кристаллов уратов. Индометацин можно применять на начальном этапе лечения подагры или как альтернативное средство, если использование колхицина безуспешно или вызывает слишком большой дискомфорт. В настоящее время при острой подагре наиболее часто применяют индометацин. Его назначают в количестве трех или четырех доз по 50 мг каждые 6 часов; при появлении эффекта дозу уменьшают до 25 мг и дают препарат 3-4 раза в день в течение примерно 5 дней.
При острых приступах подагры эффективен также фенилбутазон. Препарат применяется обычно в течение нескольких дней, поэтому серьезные нежелательные эффекты — редки. Стандартная начальная доза — 400 мг, затем принимают по 200 мг каждые 6 часов до утихания приступа. Фенилбутазон не должен применяться больше трех дней.
Другие новые НПВС также успешно используются при остром приступе. Ослабляет атаки ибупрофен в дозе 2400 мг ежедневно. Эти средства, по-видимому, по эффективности и безопасности не отличаются от более старых лекарств.
Урикозурические средства
Пробенецид и сульфинпиразон являются ури-козурическими средствами, применяемыми для снижения содержания уратов в организме больных с подагрическими отложениями или повышающейся частотой приступов подагры. Нужно избегать назначения урикозурических средств больным, у которых выделяются большие количества мочевой кислоты, чтобы не вызвать образование мочевых камней.
Химические свойства
Урикозурические препараты являются органическими кислотами (рис. 35-6) и в связи с этим действуют на транспорт анионов в почечных канальцах (глава 15). Сульфинпиразон — это метаболит аналога фенилбутазона.
Фармакокинетика
Пробенецид полностью реабсорбируется в почечных канальцах и очень медленно метаболизируется. Сульфинпиразон или его активное гидроксилированное производное быстро выделяется почками. Но даже при этом продолжительность его действия после приема внутрь почти так же велика, как у пробенецида.
Фармакодинамика
Мочевая кислота свободно фильтруется клубочками почек. Подобно многим другим слабым кислотам она реабсорбируется и секретируется в среднем сегменте проксимального канальца. Урикозурические средства (пробенецид, сульфинпиразон и аспирин в больших дозах) так влияют на эти активные транспортные зоны, что итоговая реабсорбция мочевой кислоты в проксимальном канальце снижается. Аспирин в малых (аналгетических или жаропонижающих) дозах вызывает задержку мочевой кислоты, угнетая секреторный транспортер, поэтому это средство нельзя применять для обезболивания у больных подагрой. Секреция других слабых кислот, например пенициллина, тоже уменьшается урикозурическими средствами. Пробенецид как раз и был первоначально предложен для удлинения времени циркуляции пенициллина в крови.
Поскольку выделение мочевой кислоты с мочой увеличивается, снижаются запасы уратов, хотя концентрация в плазме может уменьшаться незначительно. У больных, хорошо реагирующих на лечение, подагрические отложения уратов резорбируются с последующим облегчением течения артрита и реминерализацией кости. С увеличением экскреции мочевой кислоты склонность к образованию камней в почках скорее возрастает, чем снижается, поэтому необходимо поддерживать объем мочи на высоком уровне и по крайней мере в начале лечения сохранять pH выше 6.0, применяя щелочное питье.
Показания к назначению
Урикозурическую терапию начинают после нескольких острых приступов подагрического артрита, когда появляются свидетельства подагрических отложений в суставах или уровень мочевой кислоты в плазме больного так высок, что повреж-
денпя тканей почти неизбежны. Терапию нельзя начинать ранее чем через 2-3 недели после острого приступа.
рат назначают отдельными дозами для приема с пищей, чтобы уменьшить нежелательное влияние на желудочно-кишечный тракт.
Нежелательные эффекты
Наличие нежелательных эффектов не позволяет отдать предпочтение одному или другому ури-козурическому средству. Обе эти органические кислоты вызывают раздражение желудочно-кишечного тракта, но сульфинпиразон в большей степени. Пробенецид, вероятно, чаще приводит к развитию аллергических дерматитов, но сыпь может встречаться после применения обоих соединений. Прием пробенецида иногда осложняется нефротическим синдромом. Оба средства могут (хотя и редко) стать причиной апластической анемии.
Противопоказания и предостережения
Для минимизации вероятности образования камней необходимо поддерживать большой объем мочи.
Дозирование
Лечение пробенецидом обычно начинают с дозы 0.5 г внутрь ежедневно дробно, увеличивая ее до 1 г через неделю после начала терапии. Начальная доза сульфинпиразона 200 мг внутрь ежедневно, в дальнейшем она составляет 400-800 мг в день. Препа-
Аллопуринол
Альтернативой активации выведения мочевой кислоты в лечении подагры является ограничение ее синтеза с помощью аллопуринола, ингибирующего ксантиноксидазу.
Химические свойства
Структура аллопуринола, являющегося изомером гипоксантина, показана на рис. 35-7.
Фармакокинетика
После приема внутрь абсорбируется приблизительно 80 % аллопуринола. Аллопуринол метаболизируется ксантиноксидазой. Образующийся в результате аллоксантин сохраняет способность угнетать ксантиноксидазу и действует достаточно длительно, так что аллопуринол принимают один раз в день.
Фармакодинамика
Поступающие с пищей пурины не являются основным источником мочевой кислоты. В организ
Ксантин-оксидаза
Ксантин
Ксантин-оксидаза
Мочевая кислота (2, 6,8 - триоксипурин)
Рис. 35-7. Ингибирование синтеза мочевой кислоты аллопуринолом (Из: Meyers F. Н., Jawetz Е„ Goldfien A. Review of Medical Pharmacology, 7th ed. Lange, 1980.)
ме пурины образуются прежде всего de novo из аминокислот, формильного остатка и двуокиси углерода. Пуриновые рибонуклеотиды, не включившиеся в нуклеиновые кислоты, и те, что образуются при их деградации, превращаются в ксантин или гипоксантин и окисляются (рис. 35-7) до мочевой кислоты. При ингибировании последней стадии аллопуринолом снижается уровень уратов в плазме и их общие запасы на фоне конкурентного повышения концентрации более растворимых ксантина и гипоксантина.
Показания к назначению
Лечение подагры аллопуринолом, как и урикоз-урическими средствами, начинается с понимания того, что оно будет продолжаться годы, если не всю жизнь. Аллопуриноловая терапия подагры показана при следующих обстоятельствах: 1) при хронических подагрических отложениях в суставах, когда реабсорбция отложений более быстрая, чем при использовании урикозурических средств; 2) у больных с подагрой при выделении более 1.1г мочевой кислоты с мочой за 24 часа на фоне безпуриновой диеты; 3) когда пробенецид и сульфинпиразон не могут использоваться из-за нежелательных эффектов или аллергических реакций либо их применение не обеспечивает оптимальный терапевтический эффект; 4) при рецидивах почечнокаменной болезни; 5) у больных с функциональными нарушениями почек; 6) когда уровень уратов в сыворотке чрезвычайно высок. Нужно пытаться уменьшить концентрацию уратов в сыворотке до 65 мг/л и ниже. Аллопуринол применяют также как антипротозой-ное средство (глава 54), кроме того назначают для предотвращения массивной урикозурии вследствие терапии заболеваний крови, которая в противном случае может привести к образованию камней в почках.
Нежелательные эффекты
На начальном этапе лечения аллопуринолом случаются острые приступы подагры, когда кристаллы уходят из тканей и уровень уратов в плазме ниже нормального. Для предотвращения острых приступов в начальный период применения аллопуринола нужно дополнительно назначать колхицин, если аллопуринол не применяется в комбинации с пробенецидом или сульфинпиразоном. Могут встречать
ся желудочно-кишечная непереносимость (тошнота, рвота и диарея), периферические невриты и некротизирующие васкулиты, угнетение элементов костного мозга, изредка — апластическая анемия. Сообщалось о токсических поражениях печени и интерстициальных нефритах. У 3 % больных развивается аллергическая кожная реакция с характерными зудящими макулопапулезными повреждениями. Наблюдались отдельные случаи эксфолиативного дерматита. Аллопуринол может откладываться в хрусталике, что ведет к катаракте.
Противопоказания и предостережения
При сопутствующем применении меркаптопуринов их дозы необходимо уменьшать в среднем до 25 %. Аллопуринол может усиливать также эффект циклофосфамида. Препарат угнетает метаболизм пробенецида и антикоагулянтов для внутреннего применения и может увеличить концентрацию железа в печени. Его безопасность для детей и беременных не установлена.
Дозирование
Начальная доза аллопуринола — 100 мг ежедневно. Ежедневная доза 300 мг достигается через 3 недели и адекватна для большинства больных.
В первые недели терапии аллопуринолом назначают колхицин или индометацин для предотвращения наблюдающихся иногда приступов подагрического артрита.
Препараты
Салицилаты
Аспирин, ацетилсалициловая кислота (генерик, А.С.А. Энзилз, Исприн, др.)
Перорально (с обычной или кишечнорастворимой оболочкой): таблетки по 65,81,324, 325,486, 500 мг; капсулы по 325, 500 мг;
таблетки пролонгированного действия
по 650, 800 мг
Ректально: свечи по 60, 120, 125, 130, 195, 200, 300, 325, 600, 650, 1200 мг
Холина салицилат (Артропан)
Перорально: жидкость 870 мг/5 мл
Дифлунизал (Долобид)
Перорально: таблетки по 250, 500 мг
Магния салицилат (Пилюли Доана, Маган, Мобидин)
Перорально: таблетки по 325, 545,600 мг
Салсалат, салицилсалициловая кислота (генерик, Дисалцид)
Перорально: таблетки по 500,750 мг; капсулы по 500 мг
Натрия салицилат (генерик, Урацел 5) Перорально: таблетки по 324,325, 650 мг; таблетки в кишечнорастворимой оболочке по 325, 650 мг
Натрия тиосалицилат (генерик, Тиоцил, Тузал) Парентерально: 50 мг/мл для инъекций
Новые НПВС
Диклофенак (Вольтарен)
Перорально:таблетки в кишечнорастворимой оболочке по 25, 50,75 мг
Глазные капли: 0.1% раствор
Этодолак (Додин)
Перорально: капсулы по 200,300 мг
Фенопрофен (Налфон)
Перорально: капсулы по 200, 300, 600 мг; таблетки по 600 мг
Флурбипрофен (Ансаид, Фробен, Окуфен) Перорально: таблетки по 50,100 мг Глазные капли: 0.03 % раствор
Ибупрофен (генерик, Мотрин, Руфен, Адвил [ОТС], Нуприн [ОТС], др.)
Перорально: таблетки по 200, 300, 400, 600, 800 мг
Индометацин (генерик, Индоцин, др.) Перорально: капсулы по 10, 25, 50, 75 мг; капсулы пролонгированного действия по 75 мг; суспензия 25 мг/5 мл Ректально: свечи по 50 мг
Кетопрофен (Орудие)
Перорально: капсулы по 25, 50,75 мг
Кеторолак (Торадол)
Перорально: таблетки по 10 мг Парентерально: 15, 30 мг/мл для в/м инъекций
Глазные капли: 0.5 % раствор
Меклофенаматнатрия (генерик, Мекломен) Перорально: таблетки и капсулы по 50, 100 мг
Мефенамбвая кислота (Понстел) Перорально: капсулы по 250 мг
Напроксен (Напросин, Анапрокс, Алев [ОТС]) Перорально: таблетки по 200, 250,375,500 мг; таблетки пролонгированного действия по 550 мг; суспензия 125 мг/5 мл
Напроксен натрия (Анапрокс)
Перорально: таблетки по 275, 550 мг (250,500 мг основы)
Оксапрозин (Даипро)
Перорально: таблетки по 600 мг
Фенилбутазон (генерик, Бутазолидин, Азолид) Перорально: таблетки и капсулы по 100 мг
Пироксикам (Фелден)
Перорально: капсулы по. 10, 20 мг
Сулиндак (Клинорил)
Перорально: таблетки по 150, 200 мг
Толметин (Толектин)
Перорально: таблетки по 200, 600 мг;
капсулы по 400 мг
Противовоспалительные препараты медленного действия
Ауранофин (Ридаура)
Перорально: капсулы по 3 мг
Ауротиоглюкоза (Солганал)
Парентерально: суспензия 50 мг/мл для инъекций
Золота натрий-тиомалат (Миокризин) Парентерально: 25, 50 мг/мл для инъекций
Гидроксихлорохин (Плаквенил) Перорально: таблетки по 200 мг
Метотрексат (генерик, Реуматрекс) Перорально: таблетки по 2.5 мг
Пеницилламин (Купримин, Депен)
Перорально: капсулы по 125, 250 мг; таблетки по 250 мг
Сульфасалазин (генерик, Азульфидин) Перорально: таблетки по 500 мг, таблетки в кишечнорастворимой оболочке по 500 мг; суспензия 250 мг/5 мл
Препараты, используемые при подагре
Аллопуринол (генерик, Зилоприм, др.) Перорально: таблетки по 100,300 мг
Колхицин (генерик)
Перорально: таблетки по 0.5,0.6 мг
Парентерально: 1мг/ 2 мл для инъекций
Пробеницид (генерик, Бенемид, Пробалан) Перорально: таблетки по 500 мг
Сульфинпиразон (генерик, Антуран) Перорально: таблетки по 100 мг; капсулы по 200 мг
Ацетаминофен
Ацетаминофен (генерик, Тиленол, Темпра, Панадол, Ацефен, Ацетаминофен, Юнизертс, др.)
Перорально: таблетки и капсулы по 325, 500 мг; таблетки по 650 мг; эликсир 120,160, 325 мг/5 мл; эликсир 500 мг /15 мл;
раствор 100 мг/мл; раствор 120 мг/2.5 мл Ректально: свечи по 120,125,325,600,650 мг
Избранная литература
Barnes Р. J., Adcock I. Second-line drug therapy for rheumatoid arthritis. N. Engl. J. Med. 1994; 330: 1368.
Black M. Acetaminophen hepatotoxicity. Annu. Rev. Med. 1984; 35:577.
Bonney S. L. et al. Renal safety of two analgesics used over the counter: ibuprofen and aspirin. Clin. Pharmacol. Ther. 1986; 40:373.
Cach J. M., Klippel J. H. Second-line drug therapy for rheumatoid arthritis. N. Engl. J. Med. 1994; 330: 1368.
Chan W. Y. Prostaglandins and nonsteroidal antiinflammatory drugs in dysmenorrhea. Annu. Rev. Pharmacol. Toxicol. 1983; 23:131.
Chew E. Y. et al. Aspirin effects on the development of cataracts in patients with diabetes mellitus. Early treatment diabetic retinopathy study report 16. Arch. Ophthalmol. 1992; 110:339.
Gordon I. J. et al. Algorithm for modified alkaline diuresis in salicylate poisoning. Br. Med. J. 1984; 289:1039.
Harris E. D. Jr. Rheumatoid arthritis. Pathophysiology and implications for therapy. N. Engl. J. Med. 1990; 322:1277.
Hellman D. B. Arthritis and musculoskeletal disorders. In: Current Medical Diagnosis & Treatment 1994. Tierney L. M., McPhee S. T., Papadakis M. A. (eds). Appleton & Lange, 1994.
Hurwitz E. S. Reye’s syndrome. Epidemiologic. Rev. 1989; 11:249.
Star V. L., Hochberg M. C. Prevention and management of gout. Drugs, 1993; 45:212.
Starkebaum G. Review of rhematoid arthritis: Recent developments. Immunol. Allergy. Clin. North Am. 1993; 13: 273.
Thun M. J., Namboodiri M. M., Heath C. W. Jr. Aspirin use and reduced risk of fatal colon cancer. N. Engl. J. Med. 1991; 325:1593.
Vane J., Botting R. Inflammation and the mechanism of action of anti-inflammatory drugs. F. A. S. E. B. J. 1987; 1:89.
Verbeeck R. K. Pharmacokinetic drug interactions with nonsteroidal anti-inflammatory drugs. Clin. Pharmacokinet. 1990; 19:44.
Williams К. M., Day R. O., Briet S. N. Biochemical actions and clinical pharmacology of anti-inflammatory drugs. Adv. Drug Res. 1993; 24:121.
Раздел VII.
1ормональные средства
Гормоны гипоталамуса и гипофиза
Дэвид К. Клонофф, Джон X. Карам
36
Общий уровень метаболизма, роста и некоторых функций репродуктивной системы находится под контролем нервной и эндокринной систем, осуществляемым в гипоталамусе и гипофизе. Средняя масса гипофиза составляет около 0.6 г, он располагается в турецком седле под твердой мозговой оболочкой. Гипофиз связан с вышележащим гипоталамусом посредством содержащего нейросекреторные волокна ствола, который окружен сетью кровеносных сосудов. В нее входит система портальных вен, осуществляющая отток крови из гипоталамуса и перфузирующая переднюю долю гипофиза.
Гипофиз состоит из передней доли (аденогипофиз), средней и задней (нейрогипофиз) долей, которые под влиянием гипоталамуса выделяют ряд гормонов. Гормоны либо контролируют секрецию других эндокринных желез, либо непосредственно влияют на метаболические процессы в тканях-мишенях.
Секреция передней доли гипофиза регулируется гормонами, образующимися в срединном возвышении гипоталамуса и доставляемыми системой гипо-таламо-гипофизарных портальных вен (табл. 36-1). Эти гормоны являются небольшими пептидами, функция которых заключается в усилении или подавлении высвобождения гипофизарных гормонов. Строение некоторых из этих пептидов определено, что позволило синтезировать как сами гормоны, так и их модифицированные формы.
Гормоны задней доли гипофиза синтезируются на самом деле в гипоталамусе и только потом транспортируются нейросекреторными волокнами ство-
Сокращения, используемые в этой главе
АКТГ Адренокортикотропный гормон
ГРГ Гонадотропинрилизинг-гормон
КРГ Кортикотропинрилизинг-гормон
ЛГ Лютеинизирующий гормон
ЛГРГ Рилизинг-гормон лютеинизирующего гормона
р-лт Р-Липотропин
лиг Пролактинингибирующий гормон
пл Пролактин
ПРГ Пролактинрилизинг-гормон
сиг Гормон, ингибирующий соматотропин (соматостатин)
ФСГ Фолликулостимулирующий гормон
стг Соматотропин (гормон роста)
СТРГ Соматотропинрилизинг-гормон
Т4 Тироксин
ТРГ Тиреотропинрилизинг-гормон (протирелин)
пт Тиреостимулирующий гормон (тиротропин)
ла гипофиза в его заднюю долю, откуда и попадают в циркуляцию.
Гормоны средней доли обладают меланоцитсти-мулирующими свойствами, необходимыми для животных, использующих изменение окраски для
ТАБЛ ИЦА 36-1. Связь между гипоталамическими, гипофизарными гормонами и гормонами желез-мишеней'
Гипоталамический гормон Гипофизарный гормон Орган-мишень Гормоны органа-мишени
Соматотропинрилизинг-гормон (СТРГ)(+) Соматотропинингибирующий гормон (СИГ) (-) Гэрмон роста (соматотропин) (СТГ) (+) Гормон роста (соматотропин) (СТГ) (+) Печень Соматомедины
Кортикотропинрилизинг-гормон (КРГ) (+) Адренокортикотропин (АКТГ) (+) Кора надпочечников Глюкокортикоиды, минералокортикоиды, андрогены
Тиреотропинрилизинг-гормон (ТТГ)(+) Тиротропин (ТТГ) (+) Щитовидная железа Тироксин (Т4), три-йодтиронин (Т3)
Гонадотропинрилизинг-гормон Фолликулостимулирующий гормон Половые Эстроген, протесте-
(ГРГ, илиЛГРГ)(+) (ФСГ)(+) Лютеинизирующий гормон (ЛГ) (+) железы рон, тестостерон
Пролактинрилизинг-гормон (ПРГ)(+) Пролактинингибирующий гормон (ПИГ, дофамин) (-) Пролактин (ПЛ) (+) Пролактин (ПЛ) (+) Лимфоциты Молочные железы Лимфокины
'(+) — стимулятор, (-) — ингибитор.
адаптации. Они не идентифицированы как отдельные гормоны у людей и в настоящее время не используются в клинической фармакологии.
Лекарственные препараты гипоталамических и гипофизарных пептидных гормонов обычно являются синтетическими, некоторые из них выделяются из человеческих органов или синтезируются микроорганизмами с применением технологии рекомбинантной ДНК. Они могут использоваться в трех областях: 1) как заместительная терапия при гормональном дефиците; 2) как средства для лечения разных заболеваний с использованием фармакологических доз, вызывающих гормональный эффект, который не проявляется при физиологическом уровне гормонов в крови; 3) как диагностические средства для постановки диагноза гипо- или гиперфункциональных состояний эндокринных желез.
Гормоны гипоталамуса и передней доли гипофиза
В настоящее время идентифицированы и в большинстве случаев синтезированы следующие гипоталамические гормоны: соматотропинрилизинг-гормон (СТРГ), соматотропинингибирующий гормон (соматостатин), тиреотропинрилизинг-гормон
(ТРГ), кортикотропинрилизинг-гормон (КРГ), го-надотропинрилизинг-гормон (ГРГ), называемый также рилизинг-гормоном лютеинизирующего гормона (Л ГРГ); пролактинрилизинг-гормон (ПРГ) и пролактинингибирующий гормон (ПИГ, в настоящее время считается, что это дофамин).
Различают шесть гормонов передней доли гипофиза: гормон роста (СТГ), тиротропин (ТТГ), адренокортикотропин (АКТГ), фолликулостимулирующий гормон (ФСГ), лютеинизирующий гормон (ЛГ) и пролактин (ПЛ). Еще один полипептид, p-липотропин (р-ЛТ), является производным того же прогормона (проопиомеланокортина), что и адренокортикотропин. р-Липотропин секретируется гипофизом вместе с адренокортикотропином, но его гормональная функция неизвестна. Он является предшественником опиоидного полипептида р-эн-дорфина (глава 30).
На выделение гипоталамических рилизинг-гор-монов влияют многие факторы. В зависимости от конкретного гормона это влияние могут оказывать нервные импульсы головного мозга, стресс, температура или лекарства. Некоторые гормоны щитовидной железы, коры надпочечников и гонад по механизму отрицательной обратной связи подавляют высвобождение соответствующих тропных гипота-ламо-гипофизарных гормонов, тогда как нейро
трансмиттеры (серотонин, норадреналин и дофамин) влияют непосредственно на выделение гипоталамических гормонов пептидергическими нейронами срединного возвышения.
При дальнейшем обсуждении гипоталамические контролирующие пептиды рассматриваются вместе с соответствующими гипофизарными гормона-: ми-мишенями в том же порядке, в котором они приведены в табл. 36-1.
Соматотропинрилизинг-гормон (СТРГ) (серморелин)
Соматотропинрилизинг-гормон — это гипоталамический гормон, который стимулирует продукцию гипофизарного гормона роста (СТГ).
Химическое строение и фармакокинетика
А. Структура. В 1982 г. независимо в нескольких лабораториях выделили пептид, состоящий из 40 аминокислот, а также более длинную оканчивающуюся карбоксильной группой последовательность из 44 аминокислот; оба пептида стимулировали высвобождение гормона роста. Было обнаружено, что активной частью молекулы являются первые 29 аминокислот. Были исследованы СТРГю, СТРГ.Ц и аналоги СТРГ29.
Б. Абсорбция, метаболизм и выделение. СТРГ можно вводить внутривенно, подкожно или интра-назально. Соотношение активности препарата при этих путях введения (определяющейся по увеличению выделения гормона роста) составляет 300:10:1, соответственно. При внутривенном введении период полувыведения гормона составляет 7 минут.
Фармакодинамика
СТРГ стимулирует секрецию единственного гормона — гормона роста в передней доле гипофиза. Длительность стимуляции СТРГ выделения соматотропина не ограничивается down-регуляцией рецепторов.
Клиническая фармакология
А. Использование в диагностических целях. Реакция гормона роста на введение СТРГ может быть использована с диагностической целью у де
тей низкого роста, для которых характерен пониженный ответ гормона роста на такие стимулы, как вызванная инсулином гипогликемия, пероральный прием леводопы или внутривенное введение аргинина. При нормальном ответе на введение СТРГ можно предположить, что дефицит СТГ вызван дисфункцией гипоталамуса. Пониженный ответ возможен при дисфункции как гипоталамуса, так и гипофиза. Повышение уровня гормона роста свидетельствует о способности соматотрофных клеток синтезировать СТГ и позволяет предсказать благоприятный результат терапии СТРГ. У больных акромегалией отсутствие ответа гормона роста на введение СТРГ после хирургического вмешательства может свидетельствовать об успехе лечения.
Б. Использование в экспериментальной терапии. Вероятно, целесообразно его назначать больным с дефицитом гормона роста, у которых гипофизарные соматотрофные клетки чувствительны к СТРГ. Потенциальные преимущества применения СТРГ по сравнению с применением гормона роста у таких больных с дефицитом СТГ заключаются в сохранении обратной связи с гипофизом, возможном восстановлении нормальной гипофизарной регуляции, приводящей к восстановлению роста даже после окончания лечения, и, по всей видимости, в более низкой стоимости синтетического СТРГ, молекула которого много меньше молекулы гормона роста. К недостаткам такой терапии по сравнению с использованием гормона роста относятся необходимость тщательного отбора детей по чувствительности к СТРГ, а также неудобство многократных инъекций СТРГ в течение дня (в то время как гормон роста вводят один раз в день или через день). Данных по сравнению этих двух способов лечения пока недостаточно.
Препараты и дозы
Однократная внутривенная инъекция СТРГ,.29 в дозе 1 мкг/кг с измерением уровня гормона роста в точках 0, 15,30,45 и 60 минут позволяет определить способность соматотрофных клеток синтезировать гормон роста. Нормальный ответ не исключает наличия дефицита гормона, так как этот дефицит может быть вызван дисфункцией гипоталамуса при сохраненной функциональной способности гипофиза. Применение СТРГ в терапии находится на стадии исследования. Эффективными являются дозы 2-5 мкг/кг подкожно каждые 3-12 часов.
Токсичность
Возможно покраснение лица и боль в месте введения.
Соматостатин (соматотропин-ингибирующий гормон)
Тетрадекапептид, соматостатин, был выделен из гипоталамуса и других участков центральной нервной системы. После определения его аминокислотной последовательности (рис. 36-1) гормон был синтезирован. Выявлено, что у здоровых людей эта субстанция подавляет вызываемое различными стимулами выделение гормона роста. Соматостатин снижает концентрацию инсулина в крови и способность тиреотропинрилизинг-гормона высвобождать тиротропин. СИГ был обнаружен и в поджелудочной железе, и в других отделах желудочно-кишечного тракта. Установлено, что он подавляет выделение глюкагона, инсулина и гастрина.
Соматостатин взаимодействуете клеточной мембраной. С помощью молекулярного клонирования обнаружено, что высокоаффинные рецепторы соматостатина состоят из четырех структурносвязанных внутримембранных гликопротеинов (Bell, 1993).
Предшественником соматостатина (просоматостатином) считается выделенный из кишечника и гипоталамуса пептид, состоящий из 28 аминокислот. Он в десять раз активнее соматостатина в ингибировании секреции инсулина у крыс, но его эффект па секрецию глюкагона лишь в два раза выше, чем у соматостатина. Более высокая активность и более длительное действие прогормона делают его незаменимым для анализа механизмов гормонального контроля.
После экзогенного введения соматостатин быстро выводится из крови, период его полувыведения равен 1-3 минутам. Важную роль в процессах его метаболизма и экскреции играют почки.
Соматостатин эффективно снижает высвобождение гормона роста у пациентов с акромегалией. Однако его не используют в терапии этого заболевания из-за отсутствия специфичности и слишком короткой длительности действия. Вместо соматостатина применяют его аналог октреотид, имеющий больший период полувыведения.
Были синтезированы пептиды, обладающие отдельными эффектами соматостатина. Производное 7-аминогептановой кислоты, содержащее только 4
из 14 аминокислот соматостатина, способно блокировать его эффект.
Клиническая фармакология октреотида (аналог соматостатина, SMS 201-995)
Тетрадекапептид соматостатин имеет ограниченное терапевтическое использование из-за короткой длительности действия и его разнообразных эффектов в отношении многих секреторных систем. Среди нескольких синтезированных аналогов соматостатина наиболее эффективным в терапии различных клинических расстройств оказался октреотид (рис. 36-1).
Октреотид в 45 раз активнее соматостатина ингибирует высвобождение гормона роста у интактных субъектов и только в 2 раза активнее подавляет секрецию инсулина. Благодаря относительно слабому воздействию на р-клетки поджелудочной железы, октреотид оказался особенно полезным в лечении акромегалии и других гормонсекретирую-щих опухолевых заболеваний, так как не провоцирует развитие гипергликемии. Более высокая активность октреотида в сравнении с соматостатином определяется не различной аффинностью к рецепторам соматостатина, а более низким клиренсом и большим периодом полувыведения октреотида. Последний показатель у людей составляет около 80 минут, т. е. он в 30 раз больше, чем для соматостатина. Разная степень влияния на высвобождение СТГ и инсулина у октреотида и соматостатина пока не нашла объяснения.
Было установлено, что октреотид в дозах 50-100 мкг, вводимый подкожно каждые 12 часов, уменьшает симптомы различных гормонсекретиру-
Рис. 36-1. Вверху: аминокислотная последовательность соматостатина. Внизу: аминокислотная последовательность его синтетического аналога октреотида (SMS 201-995)
ющих опухолей у больных с акромегалией, карциноидным синдромом, гастриномой, глюкагономой, гиперплазией панкреатических островков, водной диареей, гипокалиемией и ахлоргидрией (WDHA-синдромом), “диабетической диареей”. Оказалось, что и пероральный прием октреотида эффективно снижает уровень гормона роста при акромегалии, однако для этого требуются дозы до 24 мг в день в отличие от исчисляемых микрограммами парентеральных доз.
К побочным эффектам терапии относятся тошнота с рвотой или без нее, рези в животе, газообразование, вспучивание живота, стеаторея с повышением перистальтики. После 6 месяцев введения у 18 % пациентов возникает холестаз и образуются желчные камни. Иногда в начале курса лечения отмечается преходящее снижение толерантности к глюкозе.
Гормон роста
(соматотропин, СТГ)
Гормон роста является пептидным гормоном, синтезируемым передней долей гипофиза. СТГ оказывает непосредственное метаболическое действие на липолиз в жировой ткани, влияет на действие инсулина, а также оказывает и непрямое анаболическое действие, опосредованное другим классом факторов, известных как соматомедины.
Химическое строение и фармакокинетика
А. Структура. Гормон роста — это пептид, состоящий из 191 аминокислоты с двумя сульфгидрильными мостиками. Его структура напоминает структуру пролактина и плацентарного гормона человека — хорионического соматомаммотропина. Для фармакологического использования с помощью технологии рекомбинантной ДНК синтезируют либо собственно гормон роста (соматотропин), либо вещество, содержащее в дополнение к 191 аминокислоте СТГ метнониновый остаток с ЫН2-кон-ца молекулы (соматрем).
Б. Абсорбция, метаболизм и экскреция. Эндогенный гормон роста имеет период полувыведения 20-25 минут и выводится преимущественно печенью. Человеческий СТГ можно вводить внутримышечно: его максимальная концентрация в плазме
отмечается через 2-4 часа, а активность сохраняется в течение 36 часов.
Фармакодинамика
Гормон роста связывается с рецепторами мембраны клетки и вызывает их активацию без явного вовлечения известных в настоящее время вторичных посредников (цАМФ, Са2+ и т. д.). Его действие включает как прямой (метаболический), так и непрямой (анаболический) эффекты. По всем известным показателям соматрем эквипотенциален натуральному и биосинтетическому гипофизарным гормонам. Влияние фармакологических доз гормона роста на метаболизм заключается в первоначальном инсулиноподобном эффекте с повышением захвата глюкозы и аминокислот тканями и в угнетении липолиза. Через несколько часов наблюдается периферический инсулинантагонистический эффект с уменьшением захвата глюкозы и активацией липолиза.
Основным анаболическим следствием введения фармакологических доз гормона роста является увеличение роста. Этот эффект опосредован другим классом пептидных гормонов — соматомедипа-ми, или инсулиноподобными факторами роста (ИФР). Гормон роста стимулирует синтез сомато-мединов ИФР-I и ИФР-П (преимущественно в печени), которые повышают захват сульфатов хрящами и, возможно, являются непосредственными медиаторами клеточных процессов, связанных с ростом костей. Этот рост можно проследить на клеточном уровне по активации включения тимидина в структуру ДНК и уридина в РНК (что указывает на пролиферацию клеток) одновременно с интенсификацией превращения пролина в гидроксипролин (что свидетельствует о синтезе хрящей).
Давно известно, что дефицит гормона роста приводит к недостаточной продукции соматомединов и к возникновению карликовости. В некоторых случаях карликовости повышенный уровень гормона роста в плазме не вызывает адекватной продукции соматомединов.
Клиническая фармакология
А. Дефицит гормона роста. Своевременная заместительная терапия гормоном роста у детей с его дефицитом позволяет достигнуть нормального роста во взрослом состоянии. Критериями диагноза де
фицита СТГ обычно являются увеличение роста меньше чем на 4 см за год и отсутствие реакции со стороны гормона роста (по его концентрации в плазме) на введение двух препаратов, усиливающих его секрецию. Частота врожденного дефицита гормона роста равна приблизительно 1:4000. Дефицит может быть связан с заболеванием гипоталамо-гипо-физарной области (например, краниофарингиома), но чаще объясняется отсутствием гипоталамического СТРГ, что и приводит к гипофизарной карликовости. У новорожденных с дефицитом гормона роста могут возникать гипогликемия и даже судороги.
Кроме изолированного дефицита гормона роста, приблизительно с такой же частотой, встречается врожденный дефицит нескольких гипофизарных гормонов. Этих пациентов так же, как и больных с приобретенным дефицитом гормона роста, при котором часто имеет место множественная гормональная недостаточность, можно успешно лечить с помощью заместительной терапии СТГ и при необходимости — другими гормонами, что позволяет контролировать процесс, лежащий в основе заболевания.
Б. Состояния, чувствительные к гормону роста. У некоторых низкорослых детей с задержкой созревания костной ткани и медленным ростом, но без дефицита соматотропина кратковременная терапия СТГ позволяет увеличить рост. Неизвестно, можно ли увеличить рост таких больных во взрослом состоянии с помощью длительной терапии. Некоторым детям невысокого роста, который может считаться вариантом нормы, назначают курс гормона роста после нескольких контрольных измерений, подтверждающих субнормальную скорость роста. Для продолжения терапии необходимо, чтобы в течение первых шести месяцев назначения препарата увеличение роста составляло 2 см в год. Национальный Институт здоровья детей и развития человека проводит 10-летнее исследование (окончание в 1999 г.), которое позволит оценить отдаленный эффект и окончательный взрослый рост после терапии СТГ невысоких детей без классического дефицита гормона роста. Хорошо поддаются терапии гормоном роста девочки с синдромом Турнера.
В. Экспериментальное использование. В настоящее время изучается возможность применения СТГ для увеличения роста у низкорослых детей с внутриутробной задержкой роста и хронической почечной недостаточностью и для предотвращения атрофии мышц при таких катаболических состоя
ниях, как терапия кортикостероидами, ожоги и недостаточное питание.
Кратковременная терапия взрослых с дефицитом СТГ и истощением приводит к повышению массы тела, снижению массы жира и улучшению психологического состояния. Безопасность длительной гормональной терапии у взрослых еще исследуется.
В 1993 г. FDA рекомендовала вводить рекомбинантный бычий гормон роста (рСТГ) коровам для повышения продукции молока. Хотя мясо и молоко от коров, получавших рСТГ, оказалось безопасным, у них более высока вероятность возникновения мастита, что может привести к повышению использования антибиотиков и большему их накоплению в молоке и мясе. Изучается возможное косвенное влияние этого явления на здоровье людей.
Дозирование
Препараты гормона роста животного происхождения неэффективны у людей. Ранее лечению детей человеческим СТГ препятствовали его малая доступность и дороговизна. Вплоть до 1985 г. весь имеющийся в коммерческой сети гормон роста (соматотропин) экстрагировался из замороженных человеческих гипофизов. Использование этого препарата было прекращено в 1985 г. из-за возможности возникновения заражений, о которых пойдет речь далее. Его заменил биосинтетический гормон роста.
В 1985 г. соматрем стал вторым (после человеческого инсулина) биосинтетическим фармацевтическим продуктом, рекомендованным FDA к использованию. В 1987 г. FD А утвердила также применение биосинтетического соматотропина. Его рекомендуют назначать в дозах до 0.1 мг/кг (0.26 МЕ/кг) подкожно или внутримышечно 3 раза в неделю. Хотя сравнительных исследований двух биосинтетических гормонов не проводилось, они, по-видимому, обладают одинаковым потенциалом. Годовая стоимость терапии детей с дефицитом СТГ зависит от массы ребенка и обычно составляет 10 000-30 000 долл.
Токсичность и противопоказания
В 1985 г. в рамках Национальной программы по изучению гормонов и гипофиза (National Hormone and Pituitary Program) было запрещено применение гормона роста, выделяемого из человеческих гипо
физов, так как поступили сообщения, что три пациента, получавшие препарат за несколько лет до этого, умерли от болезни Якоба-Крейтцфельдта (дегенерация кортикостриоспинальная). Позже в мире было описано тринадцать подобных случаев. Предполагают, что больные были заражены нейротоксическим вирусом, содержавшимся в препаратах СТГ.
При лечении биосинтетическим гормоном роста у 30 % пациентов формируются антитела к нему, однако это практически не влияет на активность гормона. В результате быстрого роста под действием гормональной терапии может наблюдаться отставание главного феморального эпифиза, что приводит к хромоте и болям в нижних конечностях. Обнаружено незначительное увеличение случаев лейкоза при терапии гормоном роста, однако причинно-следственная связь этих явлений не установлена.
Гормон роста противопоказан при закрытых эпифизах или при макроцефалии. Пациенты, получающие его, должны регулярно проходить обследования на симптомы гипотиреоза и диабета. Если рост замедляется без повышения титра антител, должна быть исключена гипоактивность гипофиза. Нелеченый гипотиреоз и избыточная глюкокортикоидная заместительная терапия мохут нарушать рост.
Тиреотропинрилизинг-гормон (протирелин, ТРГ)
Тиреотропинрилизинг-гормон, или протирелин,— это трипептидный гормон, обнаруженный как в гипоталамусе, так и в других частях мозга. ТРГ секретируется в портальную венозную систему и стимулирует продукцию тиротропина (ТТГ) гипофизом, который в свою очередь стимулирует продукцию тироксина (Тл) щитовидной железой. Вызываемая ТРГ стимуляция секреции тиротропина блокируется тироксином и потенцируется его отсутствием, так что ответ тиротропина на ТРГ-выз-ванную стимуляцию является диагностическим критерием при использовании ТРГ в качестве диагностического препарата для выявления гипертиреоидных и гипотиреоидных состояний.
Химическое строение и фармакокинетика
ТРГ имеет следующую структуру: (pyro)Glu-His-Pro-NH2. Его обычно вводят внутривенно, при этом
происходит быстрая инактивация в плазме. Период полувыведения гормона составляет 4-5 минут.
Фармакодинамика
ТРГ стимулирует продукцию тиротропина гипофизом, возможно, посредством активации мембранного рецептора, связанного через G-белок с инози-толтрифосфатным каскадом (глава 2). Вызванная ТРГ стимуляция секреции тиротропина может устраняться предварительным введением тироксина, кортикостероидов и соматостатина, тогда как вызванная им же стимуляция продукции пролактина не блокируется предварительным введением тироксина. ТРГ может также функционировать как нейротрансмиттер центральной нервной системы.
Пик уровня тиротропина в крови достигается через 20-30 минут после внутривенного введения здоровым индивидам. При гипертиреозе высокий уровень тироксина в крови сглаживает ответ тиротропина на введение ТРГ. При первичном гипотиреозе исходный уровень тиротропина высок, и реакция гипофиза на введение ТРГ при этом может быть усилена и проявляется особенно мощным выбросом дополнительного тиротропина. При вторичном (гипофизарном) гипотиреозе исходный уровень тиротропина низок и не повышается при введении ТРГ. При третичном (гипоталамическом) гипотиреозе базовый уровень тиротропина может быть низким или нормальным, и тиротропиновый ответ на ТРГ может быть замедленным во времени.
Введение ТРГ стимулирует выделение пролактина у здоровых испытуемых и не оказывает действия на продукцию гормона роста и АКТЕ Однако неопластические клетки некоторых опухолей гипофиза могут неадекватно реагировать на введение ТРГ: увеличивать выброс гормона роста при акромегалии, высвобождать АКТГ при синдроме Кушинга или не вызывать выделения пролактина при пролактиноме. Иногда введение высоких доз ТРГ может вызывать ухудшение при поражениях спинного мозга (Ceylan, 1992). Это свойство гормона исследуется в настоящее время. Механизм его неизвестен.
Клиническая фармакология
В настоящее время ТРГ используют только в диагностических целях: при гипертиреозе повышение уровня ТТГ после введения ТРГ сглажено, тогда как при гипотиреозе имеет место усиленная реакция.
Тест на введение ТРГ — это очень чувствительный метод диагностики умеренного гипер- и гипотиреоза у пациентов с минимальной симптоматикой и неопределенными уровнями тироксина или тиротропина. Несмотря на то, что реакции при гипо- и гипертиреозе, а также в норме часто совпадают, у определенной группы пациентов тест достаточно надежен.
Методы определения ТТГ, развившиеся от первого поколения радиоиммунных определений до второго поколения иммунометрических определений в середине 1980-х гг. до третьего и четвертого поколения иммунохемолюминесцентнометрических исследований (IMCAs) и модифицированные IMCA в начале 1990-х гг., устранили необходимость в ТРГ-тестах у некоторых больных с ранее неопределяемым базовым уровнем ТТГ. Современные тесты позволяют отличить гипертиреоидных пациентов с неопределяемым уровнем ТТГ от эутиреоидных пациентов с обычно определяемым уровнем ТТГ.
Сглаженная реакция на введение ТРГ возможна также при униполярной (в отличие от биполярной) депрессии и при других психических заболеваниях. Однако у большинства больных психическими заболеваниями эти тесты не являются достаточно чувствительными, специфичными и достоверными.
Дозирование
Дозы протирелина составляют 500 мкг для взрослого и 7 мкг/кг для ребенка 6 лет и старше (но не превышая дозы для взрослого). Определяют исходный уровень тиротропина и его концентрацию в трех последующих пробах: через 15, 30 и 60 минут после инъекции.
Токсичность
У почти 50 % пациентов наблюдаются побочные эффекты, длящиеся несколько минут: позывы к мочеиспусканию, металлический привкус во рту, головокружение. Возможна кратковременная гипертензия.
Тиреостимулирующий гормон (тиротропин, ТТГ)
Тиротропин — гормон передней доли гипофиза, который регулирует функцию щитовидной железы, стимулируя продукцию тироксина. Диагности
ческое использование тиротропина при различных пограничных состояниях функции щитовидной железы почти вытеснено измерением базальной концентрации тиротропина и определением его ответа на введение ТРГ. В некоторых случаях при карциноме щитовидной железы рекомендуется наряду с разрушением железы с помощью1311 применение тиротропина для повышения захвата органом радиоактивного йода.
Химическое строение и фармакокинетика
А. Структура. Тиротропин состоит из двух пептидов (а и Р), каждый из которых имеет разветвленные углеводородные боковые цепи, необходимые для проявления гормональной активности. Для терапевтических целей тиротропин выделяют из передней доли бычьего гипофиза. У человека и быка а-субъединицы гомологичны на 70 %, а Р — на 90 %. Аминокислотная последовательность а-субъединицы ТТГ человека практически идентична последовательностям а-субъединиц ФСГ, ЛГ и человеческого хорионического гонадотропина (чХГ).
Б. Абсорбция, метаболизм и экскреция. Тиротропин вводится внутримышечно или подкожно. Период его полувыведения составляет приблизительно 1 час, в дальнейшем гормон разрушается в почках. Небольшое количество неизмененного тиротропина обнаруживается в моче.
Фармакодинамика
Тиротропин стимулирует активность аденилат-циклазы клеток щитовидной железы. Повышенная продукция цАМФ усиливает захват йода и соответственно увеличивает выработку тиреоидных гормонов. Тиротропин вызывает увеличение размеров и васкуляризацию щитовидной железы.
Клиническая фармакология
А. Использование в диагностических целях. При гипотиреозе введение тиротропина стимулирует минимально (при первичном гипотиреозе) или значительно (при вторичном и третичном гипотиреозе) захват радиоактивного йода. Этот тест сейчас вытеснен более быстрым и дешевым тестом ТРГ-стимуляции.
В. Терапевтическое использование. Тиротропин используется при лечении метастазирующей карциномы щитовидной железы. После разрушающих опухоль доз ,3,1 пациенты в течение десяти недель получают трийодтиронин с последующей отменой на 3 недели этой заместительной гормональной терапии. После истечения трехнедельного срока больным назначают тиротропин для повышения захвата йода метастазирующей тканью. В это время могут быть назначены дополнительные дозы й,1.
Дозирование
Получаемый из бычьих гипофизов тиротропин назначают внутримышечно и подкожно. Для диагностических целей вводят 5-10 ЕД в день в течение 3 дней; для разрушения карциномы щитовидной железы — 5-10 ЕД в день в течение 3-7 дней совместно с ,3,1.
Токсичность
Часто возникает болезненность в месте введения. Могут отмечаться тошнота, рвота, повышение чувствительности в области щитовидной железы, аллергия и симптомы гипертиреоидизма. Препарат должен применяться с осторожностью при наличии болезней сердца и надпочечниковой недостаточности.
Кортикотропинрилизинг-гормон (КРГ)
Это гипоталамический гормон, стимулирующий высвобождение АКТГ и p-эндорфина гипофизом.
Химическое строение и фармакокинетика
А. Структура. Человеческий КРГ—это пептид, состоящий из 41 аминокислоты. Его аналогом является овечий КРГ, который также содержит 41 аминокислоту. Эти молекулы различаются семью аминокислотами.
В. Абсорбция, метаболизм и экскреция. КРГ назначают внутривенно. Первая фаза полувыведения человеческого и овечьего КРГ составляет 9 и 18 минут соответственно. Пептид метаболизируется в различных тканях; в неизмененном виде с мочой выводится менее 1 %.
Фармакодинамика
КРГстимулирует секрецию АКТГ и р-эндорфи-на культурой клеток гипофиза. Этот эффект связывают с активацией синтеза цАМФ. Предварительная обработка клеток дексаметазоном подавляет их гормональный ответ.
Клиническая фармакология
КРГ используют только в диагностических целях. При синдроме Кушинга с помощью КРГ можно отличить болезнь Кушинга от эктопической секреции АКТГ. Известно, что клетки АКТГ-продуци-рующей опухоли гипофиза (но не эктопических очагов) демонстрируют достаточный уровень ответа на физиологическую стимуляцию или подавление. Так, высокие дозы дексаметазона полностью подавляют продукцию кортикостероидов, а КРГ усиливает секрецию АКТГ и кортизола при болезни Кушинга, но не при эктопическом АКТГ-синд-роме. Однонаправленная положительная или отрицательная реакция на комбинацию дексаметазопо-вого и КРГ-тестов позволяет поставить диагноз достаточно точно. Однако при эктопической АКТГ-продуцирующей опухоли легких может парадоксально возрастать выброс гормона на введение КРГ одновременно с подавлением ответа высокими дозами дексаметазона, тогда как в отдельных случаях болезни Кушинга может не возникать ответа на КРГ-стимуляцию. Установлено, что у пациентов с болезнью Кушинга при КРГ-стимуляции содержание АКТГ в билатеральном нижнем каменистом синусе значительно больше, чем в периферических венах. При эктопическом АКТГ-синдроме эта разница не столь значительна.
У некоторых пациентов психическая депрессия обусловлена повышением секреции кортизола. У части из них стимуляция КРГ повышает только уровень кортизола, в то время как при болезни Кушинга происходит повышение и содержания кортизола, и уровня АКТГ. По уровню секреции АКТГ в ответ на введение КРГ можно различать удачно прооперированных пациентов с болезнью Кушинга (сниженный или нормальный ответ) от неудачно прооперированных (повышенный ответ). При недостаточности надпочечников этот тест позволяет отдифференцировать поражение гипоталамуса (нормальный ответ) от нарушения функции гипофиза (сглаженный ответ).
Препараты и дозы
Для исследовательских целей доступны синтетические человеческий и овечий КРГ. Чаще используют овечий КРГ, так как он имеет больший период полувыведения и несколько более высокую активность. КРГ растворяется в воде или разведенной кислоте, но не в изотоническом растворе натрия хлорида. В диагностических тестах применяется доза 1 мкг/кг.
Токсичность
Внутривенное болюсное введение 1 мкг/кг вызывает временное покраснение лица и изредка — нарушение дыхания.
Адренокортикотропин (кортикотропин, АКТГ)
Адрепокортикотропин — это пептидный гормон, продуцируемый передней долей гипофиза. Его основная эндокринная функция — стимулировать синтез и высвобождение гормонов коры надпочечников. При введении кортикотропина повышается продукция не только кортизола, но и надпочечниковых андрогенов и минералокортикоидов. Кортикотропин может использоваться в терапевтических целях, но основная область его применения — оценка реактивности надпочечников. Пониженный ответ надпочечников на введение экзогенного кортикотропина указывает на надпочечниковую недостаточность.
Химическое строение и фармакокинетика
А. Структура. Человеческий АКТГ — это одиночная полипептидная цепь, состоящая из 39 аминокислот (рис. 36-2). Для проявления биологической активности необходимо наличие первых 24 аминокислот с NH^-конца молекулы. Остальные аминокислоты (25-39) определяют видовую специфич-
1 2 3 4 5 6 7 8 9 10 11 12 13 --------
ность. Для терапевтического использования АКТГ выделяют из гипофизов свиней. Структурно он отличается от человеческого только в области, не являющейся необходимой (25-39). Синтетический человеческий АКТГ^ известен под названием ко-синтропин. Аминокислоты 1-13 с КН2-конца этого препарата идентичны меланостимулирующему гормону (а-МСТ), который обнаружен у животных, но не у людей. При состояниях с повышенной гипофизарной секрецией АКТГ наблюдается гиперпигментация, обусловленная а-МСТ фрагментом АКТГ.
Активность АКТГ животного происхождения измеряется биологическим методом по снижению концентрации аскорбиновой кислоты в надпочечниках, которое следует за подкожным введением АКТГ. Активность синтетического АКТГ определяется в массовых единицах. Стероидогенная активность! ЕД свиного АКТГ приблизительно равна активности 10 мкг кортикотропина.
Б. Абсорбция, метаболизм и экскреция. Как свиной, так и синтетический кортикотропин хорошо абсорбируются после внутримышечного введения. Их не назначают перорально из-за протеолиза в желудочно-кишечном тракте.
Биологический период полувыведения АКТГ^щ и АКТГ|.И меньше 20 минут. Тканевый захват происходит в печени и почках. АКТГ^ превращается в биологически неактивное вещество, возможно за счет модификации боковой цепи. АКТГ не экскретируется с мочой в значительных количествах. Действие пролонгированных форм свиного кортикотропина продолжается до 18 часов за счет комплекса полипептида с желатином и до нескольких суток за счет комплекса с гидроксидом цинка.
Фармакодинамика
В коре надпочечников АКТГ взаимодействует с рецепторами, связанными с G-белком, и повышает образование цАМФ. Это стимулирует продукцию корой надпочечников глюкокортикоидов, минералокортикоидов и андрогенов. АКТГ повышает ак-
25 26 27 28 29 30 31 32 33 34 35 36 37 38 39
Ser Туг Ser Met Glu His Phe Arg Trp Gly Lys Pro Vai (Человек) Asp Ala Gly Glu Asp Gin Ser Ala Glu Ala Phe Pro Leu Glu Phe
Ser Tyr Ser Met Glu His Phe Arg Trp Gly Lys Pro Vai (Свинья) Asp Gly Ala Glu Asp Gin Leu Ala Glu
Ser Tyr Ser Met Glu His Phe Arg Trp Gly Lys Pro Vai (Корова) Asp Gly Glu Ala Glu Asp Ser Ala Gin
Ser Tyr Ser Met Glu His Phe Arg Trp Gly Lys Pro Vai (Баран) Ala Gly Glu Asp Asp Glu Ala Ser Glu
Рис. 36-2. Последовательность аминокислот в человеческом, свином, коровьем и овечьем адренокортикотропине. Аминокислоты 1-13 также присутствуют в а-МСГ. Аминокислоты 14-24 (не показаны) идентичны для всех четырех видов
тивность холестеринэстеразы — фермента, катализирующего ключевую реакцию синтеза стероидных гормонов: холестерин —> прегненолон. Введение АКТГ может привести к гипертрофии и гиперплазии надпочечников. В фармакологических дозах кортикотропин вызывает липолиз жировой ткани и повышение пигментации кожи.
Клиническая фармакология
А. Диагностическое использование. При надпочечниковой недостаточности введение АКТГ не вызовет обычной стимуляции. Для быстрого выявления недостаточности применяется косиптропин. Концентрация кортизола в плазме измеряется до и через 30 или 60 минут после внутримышечной или внутривенной инъекции 0.25 мг косинтропина. При нормальном физиологическом ответе прирост концентрации кортизола под действием стимуляции составляет не менее 7 мкг/дл, а пиковая концентрация превышает 18 мкг/дл. Субнормальный ответ свидетельствует о наличии первичной или вторичной надпочечниковой недостаточности, которые могут быть дифференцированы по эндогенному уровню АКТГ в плазме (он повышен при первичной надпочечниковой недостаточности и понижен при вторичной). Увеличение содержания альдостерона в плазме после стимуляции косннтропином обычно наблюдается при вторичной, но не первичной надпочечниковой недостаточности.
У многих женщин с гирсутизмом имеет место нарушение продукции стероидов, несмотря на нормальный уровень андрогенов в надпочечниках. С помощью АКТГ-стимуляции можно отличить три формы поздно проявляющейся (неклассической) врожденной гиперплазии надпочечников от состояний яичникового гиперандрогенизма. Все эти нарушения могут быть ассоциированы с гирсутизмом. У пациентов с дефицитом 21-гидроксилазы АКТГ-стимуляция вызывает увеличение концентрации 17-гидроксипрогестерона в плазме. У пациентов с дефицитом И-гидроксилазы повышается концентрация И-дезоксикортизола, тогда как при дефиците ЗР-гидрокси-Д5-стероидгидроксилазы увеличивается уровень 17-гидроксипрегненолона в ответ на введение АКТГ.
Б. Терапевтическое использование. Кортикотропин может назначаться пациентам с нормальной функцией надпочечников в случае необходимости повышения концентрации глюкокортикоидов. При
выборе между назначением глюкокортикоидов или АКТГ нужно учитывать их побочные эффекты, так как эффективность гормонов одинакова. Недостатки АКТГ-терапии (особенно необходимость парентерального введения), как правило, превосходят ее достоинства, делая глюкокортикоиды препаратами выбора, если показана длительная противовоспалительная и иммуносупрессивная терапия. Было установлено, что аналог АКТГ^ предотвращает нейропатию, вызываемую цисплатином или алкалоидами барвинка при химиотерапии рака.
Дозирование
Косинтропин — наиболее предпочтительный препарат для диагностических целей. Его стандартная доза в этих случаях составляет 0.25 мг, что эквивалентно 25 ЕД свиного кортикотропина. Для терапии используют АКТГ в дозах 10-20 ЕД 4 раза в день. 40-80 ЕД пролонгированного АКТГ можно назначать каждые 24-72 часа.
Токсичность и противопоказания
Токсичность АКТГ сходна с токсичностью глюкокортикоидов. Иногда у пациентов образуются антитела к животному АКТГ или пролонгированному косиггтропину (в настоящее время препарат не примеггяется в США), что может вызвать анафилактические реакции или нечувствительность к АКТГ-терапии. Болезненные инфильтраты в месте инъекций чаще возникают при введении цинкгидрок-сидных депо-препаратов, чем желатиновых. Противопоказания идентичны противопоказаниям для глюкокортикоидов. Необходимо свести к минимуму применение АКТГ во время беременности. Если требуется немедленный эффект, более предпочтительны глюкокортикоиды.
»
Гонадотропинрилизинг-гормон (ГРГ) (рилизинг-гормон лютеинизирующего гормона, РГЛГ; гонадорелина гидрохлорид)
Гонадотропинрилизинг-гормон продуцируется дугообразными ядрами гипоталамуса и контролирует высвобождение гонадотропинов ФСГ и ЛГ из
гипофизарных клеток трех типов: ФСГ-, ЛГ- и ФСГ/ЛГ-гонадотрофных клеток. Частота пульсации секреции ГРГ, селективно регулирующая транскрипцию генов гонадотропина, является единым механизмом продукции двух различных гормонов.
Химическое строение и фармакокинетика
А. Структура. Декапептид ГРГ обнаружен у всех млекопитающих. В медицинских целях используется синтетический ГРГ. Аналоги гормона (леупро-лид, нафарелин, бусерелин, госерелин и гистрелин), содержащие D-аминокислоты в положении 6 и этиламидзамещающий глицин в положении 10, более активны и имеют большую продолжительность действия, чем нативный ГРГ.
5-O-Pro-His-Trp-Ser-Tyr-Gly-Leu-Arg-Pro-Gly-NH2
ГРГ
5-O-Pro-His-Trp-Ser-Tyr-D-Leu-Leu-Arg-Pro--NHCH2CH3
Леупролид
5-O-Pro-His-Trp-Ser-Tyr-D-Nal-*Leu-Arg-Pro--Gly-NH2
Нафарелин
5-O-Pro-His-Trp-Ser-Tyr-D-Ser(f-Bu)-Leu-Arg--Pro- NHNHCONH2
Госерелин
5-O-Pro-His-Trp-Ser-Tyr-D-His(NT-PhCH2-)-Leu--Arg-Pro-NHCH2CH3
Гистрелин
Б. Абсорбция, метаболизм и экскреция. ГРГ вводят внутривенно и подкожно. Аналоги ГРГ можно вводить подкожно, внутримышечно или в виде назального аэрозоля. Период полувыведения ГРГ при внутривенном введении составляет 4 минуты, при подкожном или интраназальном введении аналогов — 3 часа. Разрушение происходит в гипоталамусе и гипофизе. Аналоги ГРГ имеют повышенный аффинитет к его рецепторам и в меньшей степени подвергаются разрушению.
* o-Nal = о-3-(2-нафтил)-аланин.
Фармакодинамика
ГРГ связывается с рецепторами на гипофизарных гонадотропоцитах. Периодическое болюсное внутривенное введение гормона каждые 1-4 часа стимулирует секрецию ФСГ и ЛГ. Напротив, длительное введение ГРГ или назначение его аналогов в пролонгированных формах подавляет высвобождение гонадотропинов.
Клиническая фармакология
А. Применение в диагностике. Замедленное половое созревание подростков с гипогонадотропиз-мом может быть следствием конституционной задержки или гипогонадотропного гипогонадизма. Реакция ЛГ (но не ФСГ) в ответ на введение ГРГ дает возможность различить эти два состояния. Уровень ЛГ в сыворотке измеряется до и через 15, 30,45,60 и 120 минут после внутривенного или подкожного болюсного введения 100 мкг ГРГ. Пик концентрации ЛГ, превышающий 15.6 мЕД/мл, нормален и свидетельствует о половой зрелости, тогда как сниженный Л Г-ответ указывает на гипогонадотроп-ный гипогонадизм, являющийся следствием заболевания гипофиза или гипоталамуса.
Б. Терапевтическое использование.
1. Стимуляция. ГРГ может стимулировать гипофизарную функцию и используется при гипогона-дотропном гипогонадизме у обоих полов, задержке полового созревания и крипторхизме. Система для внутривенного введения ГРГ была одобрена FD А в 1990 г. Комплект, содержащий программируемую помпу на батарейках и внутривенные канюли, дает возможность “пульсирующего” введения ГРГ каждые 90 минут во время фолликулярной фазы и фазы желтого тела.
2. Подавление. Леупролид, нафарелин, госери-лин и гистрелин являются ГРГ-подобными агонистами, которые при длительном введении вызывают биохимическую кастрацию у взрослых при раке предстательной железы, фиброзах матки, эндометриозе, поликистозе яичника и преждевременном половом созревании у детей. Многие программы по in vitro фертилизации вначале используют аналоги ГРГ для подавления высвобождения эндогенного гонадотропина, а затем экзогенные гонадотропины для синхронизации созревания фолликулов.
Терапия аналогами ГРГ для подавления функции гипофиза приводит к временному повышению кон
центрации половых гормонов в течение первых двух недель лечения. Это может быть вредно при лечении некоторых заболеваний, таких как рак предстательной железы. В настоящее время исследуются несколько антагонистов аналогов ГРГ. Эти вещества вызывают немедленное подавление гипофизарной функции через полную блокаду рецепторов.
Дозирование
Рекомендуемые для леупролида дозы — 1 мг в день подкожно (Лупрон) или 7.5 мг/месяц внутримышечно (Лупрон Депо) при раке предстательной железы, или 3.75 мг/месяц внутривенно при эндометриозе. Нафарелин назначается в виде аэрозоля по одной или две дозы (200 мкг/доза) интраназаль-но два раза в день. Госерелин вводят из предварительно заполненного шприца в виде подкожного имплантата в дозе 3.6 мг каждые 28 дней. Гистре-лин вводят подкожно в дозе 10 мкг/кг ежедневно.
Гонадорелин назначают внутривенно в дозе 5 мкг каждые 90 минут в течение 14-21 дня до наступления овуляции, в противном случае дозу повышают. Желтое тело может сохраняться еще 14 дней за счет введения гонадорелина или серией инъекций человеческого хорионического гонадотропина (чХГ). Необходимо менять места внутривенных введений и исследовать ультразвуковым методом тазовую область.
Токсичность
I
ГРГ, используемый для диагностических целей, редко вызывает головные боли, абдоминальный дискомфорт или приливы к лицу. Аналоги ГРГ могут значительно усилить боли в костях у пациентов с раком предстательной железы и вызвать горячие приливы у пациентов обоих полов. Их использование у женщин должно ограничиваться шестью месяцами из-за риска возникновения остеопороза. Внутривенное введение ГРГ с целью вызова овуляции реже приводит к гиперстимуляции яичников и многоплодной беременности, чем применение человеческого менопаузного гонадотропина.
Фолликулостимулирующий гормон (ФСГ)
Фолликулостимулирующий гормон — это гликопротеиновый гормон, продуцируемый передней долей гипофиза, который совместно с ЛГ регули
рует функцию гонад, повышая продукцию цАМФ в тканях-мишенях. Он состоит из двух связанных пептидных цепочек. Основной функцией ФСГ является стимуляция гаметогенеза и развития фолликулов у женщин и сперматогенеза у мужчин. ФСГ воздействует на незрелые клетки фолликулов в яичниках и вызывает развитие зрелых фолликулов и ооцитов. Как и ЛГ, ФСГ необходим для нормального стероидогенеза в яичниках. ЛГ стимулирует продукцию андрогенов этими клетками, а ФСГ — превращение андрогенов в эстрогены гранулезными клетками. В яичках ФСГ воздействует на клетки Сертоли и стимулирует продукцию ими андрогенсвязывающего белка.
Для терапевтического использования доступны естественные модифицированные формы ФСГ. Моча женщин в постменопаузном периоде содержит вещество с ФСГ-подобными свойствами (но с активностью только 4 %) и ЛГ-подобное вещество. Комбинация ФСГ-ЛГ известна как менотропины. Другой препарат человеческого ФСГ, выделенный из мочи женщин в период менопаузы, практически не содержит ЛГ и известен как урофоллитропин. Использование этих двух гонадотропиновых препаратов обсуждается далее.
Лютеинизирующий гормон (ЛГ)
Лютеинизирующий гормон — гликопротеиновый гормон, состоящий из двух цепей и, так же как и ФСГ, продуцируемый передней долей гипофиза. ЛГ в первую очередь отвечает за продукцию половых стероидных гормонов. ЛГ воздействует на тестикулярные клетки Лейдига, стимулируя синтез тестостерона. В яичниках ЛГ совместно с ФСГ активирует развитие фолликулов. ЛГ воздействует на зрелые фолликулы, вызывая овуляцию, а также стимулирует желтое тело в лютеиновой фазе менструального цикла, вызывая продукцию прогестерона и андрогенов.
В настоящее время не существует препаратов ЛГ, доступных для клинического использования. Для его замены при многих гонадотропиндефицит-ных состояниях можно использовать человеческий хорионический гонадотропин, имеющий практически идентичную структуру.
Гонадотропины (чМГ, менотропины и ФСГ, урофоллитропин)
Человеческие менопаузные гонадотропины (чМГ) — это смесь частично катаболизированных ЛГ и ФСГ, выделенных из мочи женщин, находящихся в периоде постменопаузы. Коммерческие препараты чМГ, или менотропины, так же как и человеческий ФСГ, или урофоллитропин, биологически стандартизируются по содержанию ФСГ и ЛГ. Они используются при бесплодии для стимуляции развития фолликулов у женщин и активизации сперматогенеза у мужчин. Пациентам обоих полов их назначают совместно с лютеинизирующим гормоном, т. е. с человеческим хорионическим гонадотропином (чХГ), для разрешения овуляции и имплантации яйцеклетки у женщин и для выработки тестостерона и полной маскулинизации у мужчин.
Фармакокинетика
После 7-12-дневного курса ежедневного введения чМГ для имитации фолликулярной фазы овариального цикла у женщин, страдающих гипоталамической аменореей, уровень ФСГ постепенно повышается в два раза, а уровень ЛГ — в 1.5 раза по отношению к исходным. Урофоллитропин не влияет на уровни этих гормонов.
Фармакодинамика
Во время чМГ- или ФСГ-терапии у женщин с дефицитом гонадотропина происходит рост и созревание фолликулов в яичниках. После завершения созревания фолликулов для того, чтобы произошла овуляция, требуется назначение хорионического гонадотропина.
У мужчин с дефицитом гонадотропина предварительное введение хорионического гонадотропина вызывает внешнее половое созревание; последующий добавочный курс чМГ стимулирует сперматогенез и способствует фертильности.
Клиническая фармакология
Человеческий менопаузный гонадотропин показан при гипофизарном и гипоталамическом гипогонадизме с бесплодием. Удачное лечение женщин
с отсутствием овуляции с помощью чМГ возможно в случаях первичной аменореи, вторичной аменореи, поликистоза яичников и ановуляторного цикла. Как чМГ, так и ФСГ используются в программах искусственного (in vitro) оплодотворения для контролируемой гиперстимуляции яичников.
Более 50 % мужчин с гипогонадотропным гипогонадизмом становятся фертильными после назначения чМГ.
Дозирование
Ампулы менотропина содержат 75 или 150 ЕД ФСГ и равное количество ЛГ. 1 ЕД ЛГ приблизительно эквивалентна 0.5 ЕД чХГ. Ампула урофол-литропина содержит 75 ЕД ФСГ и менее 1 ЕД ЛГ. Человеческие менопаузные гонадотропины, ФСГ и чХГ назначаются внутримышечно.
А. Женщины. При гипоталамическом гипогонадизме и при оплодотворении in vitro назначают 1 —2 ампулы ежедневно в течение 5-12 дней до обнаружения признаков адекватного созревания фолликулов. Каждые 1-2 дня необходимо измерять уровень эстрадиола и исследовать шейку матки. При достижении полного созревания фолликулов прекращают введение чМГ или ФСГ; для того чтобы вызвать овуляцию, на следующий день внутримышечно вводят чХГ (5000-10 000 ЕД).
Б. Мужчины. После предварительной терапии (5000 ЕД чХГ 3 раза в неделю в течение нескольких месяцев, до 6, для достижения маскулинизации и нормального уровня тестостерона в крови) назначают менотропины по 1 ампуле 3 раза в неделю в комбинации с чХГ (2000 ЕД два раза в неделю). Обычно требуется не менее четырех месяцев комбинированной терапии до появления сперматозоидов в эякуляте. При отсутствии результатов доза менотропинов может быть удвоена, а доза чХГ не изменяется.
Токсичность и противопоказания
Избыточная стимуляция яичников чМГ приводит к неосложненному увеличению яичников у почти 20 % пациентов. Это явление обычно спонтанно исчезает. Более серьезное осложнение — “гиперстимуляционный синдром” — встречается у 0.5-4 % больных. Он характеризуется вызванным чМГуве-личением яичников, асцитом, гидротораксом и гиповолемией, иногда вплоть до появления призна
ков шока. Возможны кровоизлияния в брюшину (из-за разрыва кисты яичников), лихорадка и артериальные тромбоэмболии. Частота многоплодных беременностей близка к 20 %. Обнаруженная у 25 % женщин склонность к самопроизвольным абортам, возможно, объясняется более ранней диагностикой беременности у пациенток, проходящих лечение, по сравнению с не проходящими его, и распознаванием очень ранних абортов. Однако у некоторых пациенток, получающих терапию, существует также вероятность ненормального развития желтого тела с последующей его дегенерацией до наступления периода созревания. У мужчин возможна гинекомастия. Описана связь между раком яичника и фертильными препаратами (Spirtas, 1993). Однако причинная связь между использованием фертильных препаратов и возникновением рака не выявлена.
Человеческий менопаузный гонадотропин и уро-фоллитропин может назначать только врач, имеющий опыт в лечении бесплодия. До лечения женщина должна пройти полное гинекологическое обследование для исключения заболеваний матки, труб и яичников, а также беременности. В случае нерегулярных кровотечений нужно исключить рак матки.
Человеческий хорионический гонадотропин (чХГ)
Человеческий хорионический гонадотропин — это гормон, продуцируемый плацентой человека и выделяемый в мочу, откуда он может быть экстрагирован и очищен. Функцией чХГявляется стимуляция выработки прогестерона желтым телом и поддержание развития плаценты. По структуре он очень похож на Л Г и применяется у мужчин и женщин с дефицитом Л Г.
Человеческий хорионический гонадотропин представляет собой глюкопротеин, состоящий из а-цепи (92 аминокислоты), которая практически идентична такой же цепи ФСГ, ЛГ и ТТГ, и [3-цепи (145 аминокислот), которая напоминает таковую у ЛГ, за исключением карбоксильной терминальной последовательности из 30 аминокислот,отсутствующей у лютеинизирующего гормона.
Фармакокинетика
Человеческий хорионический гонадотропин хорошо всасывается после внутримышечного введения и имеет период полувыведения 8 часов в отли
чие от 30 минут у Л Г. Эта разница может объясняться высоким содержанием сиаловой кислоты в чХГ. До выведения с мочой препарат, очевидно, Модифицируется в организме, так как период его полувыведения, измеряемый иммунологическим методом, намного превышает соответствующий показатель, определяемый по биологической активности.
Фармакодинамика
Человеческий хорионический гонадотропин стимулирует продугвдию половых стероидных гормонов. Клетки интерстиция и желтого тела у женщин вырабатывают прогестерон, а клетки Лейдига у мужчин продуцируют тестостерон. чХГ может использоваться для имитации резкого повышения ЛГ в середине цикла и вызова овуляции у женщин с гипогонадотропией.
Человеческий хорионический гонадотропин не влияет на аппетит или мобилизацию и распределение жиров в организме. Предлагавшееся ранее применение его в качестве дополнения к диетотерапии больных с ожирением необоснованно.
Клиническая фармакология
А. Диагностическое использование. У мальчиков с неопущением яичек в пубертатном периоде чХГ может быть использован для того, чтобы различить истинный крипторхизм от задержки опущения яичек (псевдокрипторхизм). Положительные результаты в процессе лечения чХГ позволяют предсказать постоянное опущение яичек (семенников) в пубертатный период, когда уровень циркулирующего Л Г возрастет. Отсутствие эпизодов опущения в ходе терапии обычно означает необходимость орхиопексии в пубертатный период для сохранения сперматогенеза.
Используя повторную чХГ-стимуляцию, можно отграничивать пациентов с конституциональной задержкой начала полового созревания от больных с гипогонадотропическим гипогонадизмом. В первой группе уровень тестостерона и эстрадиола повышается после стимуляции, во второй — нет.
Б. Терапевтическое использование. Как уже обсуждалось, чХГ можно использовать в комбинации с человеческими менотропинами для вызова овуляции у женщин с вторичным гипогонадизмом или как часть программы оплодотворения in vitro, а также у мужчин с вторичным гипогонадизмом.
Дозирование
Дозы, применяемые при мужском и женском бесплодии, указаны в подразделе, посвященном дозированию чМГ. При препубертатном крипторхизме предлагаются дозы 500-4000 ЕД 3 раза в неделю курсом до шести недель.
Токсичность и противопоказания
Отрицательные эффекты включают головную боль, депрессию, отеки, преждевременное половое созревание, гинекомастию и й редких случаях — выработку антител к чХГ.
Человеческий хорионический гонадотропин для лечения бесплодия должен назначаться только врачом, имеющим опыт вэтой области. Андрогензависи-мая неоплазия и преждевременное половое созревание являются противопоказаниями к применению.
Пролактин
Пролактин — это пептидный гормон, состоящий из 198 аминокислот и продуцируемый передней долей гипофиза. Его структура напоминает структуру гормона роста. Это основной гормон, отвечающий за лактацию. Пролактин стимулирует продукцию молока, когда имеется необходимый для этого уровень циркулирующих эстрогенов, гестагенов, кортикостероидов и инсулина. Пролактин стимулирует также митогенную активность лимфоцитов; утверждают, что он играет роль в развитии аутоиммунных заболеваний. Дефицит пролактина, который возникает при угнетении функции гипофиза, проявляется в снижении лактации или нарушении лютеиновой фазы цикла. При поражении гипоталамуса уровень пролактина может быть повышен в результате нарушения транспорта пролактинингибирующего гормона (дофамина) к гипофизу. Гиперпролактинемия нередко вызывает галакторею и гипогонадизм и может сопровождаться увеличением массы гипофиза. У пациентов с симптомами гиперпролактинемии секрецию пролактина можно блокировать агонистом дофамина — бромокриптином. Препаратов для лечения пролактинового дефицита не существует.
Бромокриптин
Хотя бромокриптин не является гормоном, он оказывает заслуживающее внимания ингибирующее действие на гипофиз.
Бромокриптин является производным алкалоидов спорыньи со свойствами агониста дофамина, снижающим уровень пролактина. Его химическая структура и фармакокинетические свойства представлены в главе 16.
Бромокриптин снижает гипофизарную секрецию пролактина посредством дофаминмиметичес-кого эффекта в отношении гипофиза, действуя в двух местах центральной нервной системы. Во-первых, он уменьшает оборот дофамина в нейронах дугообразного ядра, повышая уровень дофамина в гипофизе; во-вторых, прямо воздействует на дофаминовые рецепторы гипофиза, подавляя спонтанное и вызываемое тиреотропинрилизинг-гормоном высвобождение пролактина.
Бромокриптин стимулирует высвобождение гормона роста гипофизом у здоровых испытуемых и парадоксальным образом по непонятной причине подавляет этот процесс у страдающих акромегалией. Бромокриптин является единственным препаратом, одобренным FDA для лечения гиперпролактинемии. Однако по этому показанию используют и перголид — другой агонист дофамина, одобренный FDA как антипаркинсоническое средство. При гиперпролактинемии его назначают один раз в сутки. В настоящее время проходят испытания еще два средства для лечения гиперпролактинемии: производное алкалоида спорыньи — каберголин, назначаемое один или два раза в неделю; и не относящийся к производным спорыньи агонист дофамина хинаголид (CV 205502), назначаемый один раз в день.
Клиническая фармакология
А. Пролактиномы. Бромокриптин нашел широкое применение в начальной терапии пролактином. Использование препарата приводит к значительному снижению как размеров опухоли, так и концентрации пролактина в сыворотке. Для радикальной терапии таких опухолей, возможно, остается необходимым хирургическое иссечение в сочетании с радиационной терапией или без нее, так как эффект длительного применения бромокриптина неизвестен и возможно резкое увеличение опухоли при прекращении его приема.
Б. Аменорея и галакторея. Бромокриптин одобрен для лечения связанных с гиперпролактинемией дисфункциональных состояний, включая аменорею, галакторею, бесплодие и гипогонадизм. Лече
нию бромокриптином хорошо поддаются как про-лактинсекретирующие аденомы гипофиза, так и идиопатическая гиперпролактинемия. После прекращения терапии гиперпролактинемия и галакто-рея обычно возобновляются.
В. Физиологическая лактация. Бромокриптин подавляет секрецию пролактина, возникающую после родов и аборта, и используется для предотвращения увеличения молочных желез, когда кормление грудью нежелательно.
Г. Акромегалия. При акромегалии можно использовать монотерапию бромокриптином, а также ее комбинацию с хирургическим вмешательством и облучением гипофиза. Однако в данном случае реже наблюдается ослабление выраженности симптоматики и клиническая ремиссия, чем у больных с пролактиномой. Роль бромокриптина в лечении акромегалии все еще не определена.
Д. Болезнь Паркинсона. Использование бромокриптина при болезни Паркинсона обсуждается в главе 27.
Е. Кокаиновая абстиненция. Симптомы кокаиновой абстиненции, возможно, являются следствием гиперчувствительности тормозных рецепторов дофаминергических нейронов. В условиях эксперимента бромокриптин уменьшает потребность в приеме кокаина.
Препараты и дозы
Период полувыведения бромокриптина составляет 3 часа; суточную дозу препарата делят на несколько приемов и назначают с пищей. Большинство ги-попролактинемических состояний, так же как и состояние физиологической лактации, реагирует на дозы 2.5-7.5 мг в день. При больших пролактиномах дневная потребность в препарате может достигать 20 мг, а при акромегалии — 30 мг. Препараты бромокриптина длительного действия для перорального приема (Парлодел SRO) и внутримышечного введения (Парлодел L.A.R.) используются в Европе.
Токсичность и противопоказания
В дозах до 10 мг/день бромокриптин может вызывать тошноту, легкие головокружения, ортостатическую гипотензию и запор. Прием свыше 10 мг вдень может привести к холодовому периферическому вазоспазму в пальцах, нейропсихическим расстройствам и реже — к пептическим язвам.
Хотя терапия бромокриптином в первые три недели беременности не повышает риск спонтанных абортов или врожденных уродств, данных о безопасности приема лекарства во время беременности пока мало. Поэтому при установленной беременности бромокриптин желательно не назначать. Если у женщины, получающей бромокриптин, наблюдается задержка менструации, то необходимо провести тест на беременность. Если она страдает аменореей, тесты на беременность должны проводиться регулярно, так как овуляция может произойти до возобновления менструаций.
Гормоны задней доли гипофиза
Известны два гормона задней доли гипофиза: вазопрессин и окситоцин. Их структуры очень схожи, возможно, они имеют общего предшественника. Секреция вазопрессина и окситоцина не регулируется гипоталамическими рилизинг-гормона-ми, как в случае гормонов передней доли. Гормоны задней доли на самом деле синтезируются в гипоталамусе и лишь затем транспортируются в гипофиз, где они депонируются и далее высвобождаются в кровь.
Окситоцин
Окситоцин — это пептид, секретируемый задней долей гипофиза и вызывающий выделение молока у кормящих женщин. В фармакологических дозах его можно использовать для вызова сокращений матки и родостимуляции, однако при физиологическом уровне гормона в крови его вклад в родовую деятельность незначителен.
Химическое строение и фармакокинетика
А. Структура. Окситоцин — пептид из 9 аминокислот, 6 из которых замыкаются в кольцо с помощью дисульфидного мостика, а оставшиеся три образуют хвост, заканчивающийся С-концевым гли-цинамидом (рис. 36-3). Окситоцин и вазопрессин отличаются от вазотоцина — единственного гормона задней доли гипофиза, обнаруженного у позвоночных, не относящихся к классу млекопитающих, только по одной аминокислоте.
p-S--------S---1
Cys-Tyr-Phe-Gln-Asn-Cys-Pro-Arg-Gly-NH2
123 45 67 89
Аргининвазопрессин
rs sn
Cys-Tyr-lle-Gln-Asn-Cys-Pro-Leu-Gly-NH2
12345 67 8 9
Окситоцин
Рис. 36-3. Аргининвазопрессин и окситоцин. У некоторых видов лизин в положении 8 молекулы вазопрессина заменяется на аргинин. (Из: Ganon W. F.: Review of Medical Physiology, 15th ed. Appleton &iange, 1991.)
Б. Абсорбция, метаболизм и экскреция. Для стимуляции работы матки окситоцин обычно вводится внутривенно, хотя он может всасываться и трансбуккально. При приеме внутрь он неактивен, так как разрушается в желудочно-кишечном тракте. Окситоцин не связывается с белками плазмы и катаболизируется в печени и почках; период его полувыведения равен 5 минутам.
Фармакодинамика
Окситоцин изменяет трансмембранные ионные токи в клетках гладкой мускулатуры миометрия, способствуя сокращениям матки. С увеличением срока беременности чувствительность матки к окситоцину возрастает. Вызванные им сокращения миометрия можно подавить Р-адреномиметиками, магния сульфатом или ингаляционными анестетиками. Окситоцин вызывает также сокращение миоэпителиальных клеток, окружающих альвеолы молочных желез, что приводит к выделению молока. Без такого сокращения нормальная лактация невозможна. Окситоцин обладает слабой антидиурети-ческой и прессорной активностью.
Клиническая фармакология
А. Использование в диагностике. Инъекции окситоцина на поздних сроках беременности вызывают маточные сокращения, которые снижают снабжение плода кровью. Изменение частоты сердечных сокращений плода в ответ на стандартный
окситоциновый тест дает информацию о резервах плацентарного кровообращения. Ненормальный ответ свидетельствует о задержке внутриутробного развития и может потребовать срочного кесарева сечения.
Б. Терапевтическое использование. Окситоцин используют для вызова родовой деятельности или усиления дисфункциональных родов при следующих состояниях: 1) необходимость досрочных родов (например: при резус-конфликте, диабете матери, преэклампсии), 2) инертность матки и 3) неполный аборт. Окситоцин можно применять также для остановки послеродовых маточных кровотечений и усиления лактации.
В настоящее время исследуются синтетические пептидные и непептидные антагонисты окситаци-на, способные подавлять преждевременные роды.
Дозирование
Для усиления родовой деятельности окситоцин должен вводиться внутривенно через инфузионный насос с соответствующим мониторингом плода. Первоначальная скорость введения — 1 ЕД/мин постепенно повышается до 5-20 ЕД/мин до достижения физиологических сокращений матки. При послеродовых кровотечениях 10-40 ЕД препарата добавляют в 1 л 5 % глюкозы и подбирают такую скорость инфузии, которая устраняет атонию матки. Альтернативный способ — внутримышечное введение 10 ЕД после выхода плаценты. Для увеличения выделения молока за 2-3 минуты до кормления препарат впрыскивается в виде аэрозоля в положении сидя по 1 дозе в каждую ноздрю.
Токсичность и противопоказания
При правильном применении окситоцина серьезные токсические эффекты возникают редко. Тем не менее среди отрицательных реакций на окситоцин описаны смерть матери в результате гипертонического криза, разрыв матки, водная интоксикация и смерть плода. Встречаются случаи афибриногенемии.
Противопоказания включают различные нарушения у плода, преждевременные роды, ненормальное предлежание плода, диспропорции голова-таз и другая предрасположенность к разрыву матки. Симпатомиметики нельзя комбинировать с окситоцином.
Вазопрессин (антидиуретический гормон, АДГ)
Вазопрессин — пептидный гормон, высвобождаемый гипофизом в ответ на повышение осмолярности плазмы и снижение кровяного давления. Вазопрессин обладает антидиуретическими и вазопрессорными свойствами. Дефицит гормона проявляется в виде несахарного диабета (главы 15 и 17).
Химическое строение и фармакокинетика
А. Структура. Вазопрессин — это нонапептид с кольцом из шести аминокислот и боковой цепью, состоящей из трех аминокислот. У людей и у большинства других млекопитающих в позиции 8 располагается аргинин, за исключением свиней и родственных видов, у которых вазопрессин содержит в позиции 8 лизин (рис. 36-3).
Б. Абсорбция, метаболизм и экскреция. Вазопрессин должен назначаться парентерально. Возможны внутривенный, внутримышечный или интраназальный пути введения. Период полувыведения АДГ из плазмы составляет приблизительно 20 минут. В почках и печени он подвергается катаболизму с восстановлением дисульфидных связей и расщеплением пептидов. Небольшое количество вазопрессина экскретируется с мочой в неизмененном виде, но почечный клиренс составляет менее 5 % от клиренса креатинина и не отражает уровень гормона в плазме.
Фармакодинамика
Вазопрессин взаимодействует с двумя типами рецепторов. Vi-рецепторы найдены на клетках гладких мышц сосудов и регулируют вазоконстрикцию. У2-рецепторы обнаружены в клетках почечных канальцев и опосредуют антидиуретическое действие за счет повышения водной проницаемости и реабсорбции воды в собирательных трубочках. Внепо-чечные У2-рецепторы вызывают высвобождение VIIIC-фактора коагуляции и фактора Виллебранда, так же как и снижение кровяного давления и периферического сопротивления.
Десмопрессина ацетат (DDAVP, 1-деамино-8-D-аргининвазопрессин) — синтетический аналог ва
зопрессина длительного действия с минимальной Vi-активностью и соотношением антидиуретичес-кого и прессорного эффекта, в 4000 раз превосходящим таковое у вазопрессина.
Клиническая фармакология
Вазопрессин и десмопрессин — альтернативные препараты выбора для лечения гипофизарного несахарного диабета. Назначение десмопрессина перед сном устраняет ночной энурез за счет снижения ночной продукции мочи. Десмопрессиновый тест может оценить концентрационную способность почек после длительной литиевой терапии. Инфузии вазопрессина эффективны в некоторых случаях кровотечений из варикозных вен пищевода и кровотечений при дивертикулезе кишечника. К сожалению, введение вазопрессина может вызвать вазоконстрикцию коронарных артерий.
Синтетические антагонисты вазопрессина изучаются для использования при вызванной им задержке воды.
Дозирование
Широко используются четыре препарата.
А. Водный вазопрессин. Синтетический водный вазопрессин — короткодействующий препарат для внутримышечного, подкожного и внутривенного введения. При преходящем несахарном диабете назначают 5-10 ЕД внутримышечно каждые 36 часов, при желудочно-кишечных кровотечениях — внутривенно со скоростью 0.1-0.5 ЕД/мин.
Б. Вазопрессина таннат, растворенный в масле. Масляный раствор вазопрессина танната—длительнодействующая формадля внутримышечного введения. Применяются дозы 2.5-5 ЕД каждые 24-72 час.
В. Лизинвазопрессин. Липрессин — интраназальный спрей короткого действия. Его впрыскивают по 2 ЕД глубоко в одну или обе ноздри каждые 4-6 часов.
Г. Десмопрессина ацетат. Это наиболее предпочтительный препарат для лечения хронического несахарного диабета. Десмопрессин может назначаться интраназально, внутривенно и подкожно. Интраназально вводятся 10-40 мкг (0.1-0.4 мл) ежедневно в 2-3 приема. У инъекционного десмопрессина биодоступность в десять раз больше, чем у интраназального. Инъекционно вводят 2-4 мкг (0.5-1 мл) ежедневно, разделенных на два приема.
При ночном энурезе назначают 10-20 мкг (0.1-0.2 мл) десмопрессина перед сном. Концентрационную способность почек можно оценить введением 20 мкг десмопрессина в каждую ноздрю. Нормальной реакцией считается поддержание в течение 8 часов осмолярности мочи выше 800 мОсм/кг.
Одобрено применение десмопрессина для коррекции коагулопатии при гемофилии типа А и болезни Виллебранда (глава 33).
Токсичность и противопоказания
К побочным реакциям гормона относятся головные боли, тошнота, абдоминальные спазмы и аллергические реакции. Передозировка может вызвать гипонатриемию.
Вазопрессин применяют с осторожностью у пациентов с нарушениями коронарного кровообращения. Эффект вазопрессина потенцируют хлорпро-памид, клофибрат и карбамазепин. При заложенности носа ингаляции вазопрессина могут быть неэффективны.
Препараты
Бромокриптин (Парлодел)
Перорально: таблетки по 2.5 мг, капсулы по 5 мг
Хорионический гонадотропин [чХГ] (генерик,
Профази, A.P.L., Прегнил и др.) Парентерально: порошок для разведения по 200,500,1000,2000 ЕД/мл для инъекций
Кортикотропин (генерик, АКТГ, Актар,
Н.Р. Актар гель и др.)
Парентерально: 25,40 ЕД во флаконе для п/к, в/в и в/м инъекций Пролонгированные препараты: 40,80 ЕД/мл геля для инъекций;
40 ЕД/мл кортикотропина
Косинтропин (Кортросин)
Парентерально: 0.25 мг во флаконе с растворителем для в/в и в/м инъекций
Десмопрессин (DDAVP, Концентраид)
Интраназально: раствор 100 мкг/мл;
аэрозольный дозатор 500 мкг в 5 мл — 50 доз по 10 мкг
Парентерально: 4 мкг/мл, 40 мкг/10 мл раствор для инъекций
Гонадорелина гидрохлорид [ГРГ] (Фактрел) Парентерально: порошок для растворения 100,500 мкг для инъекций
Гонадорелина ацетат [ГРГ] (Лютрепалс)
Парентерально: порошок для инъекций через помпу Лютрепалс (0.8,3.2 мг во флаконах)
Госерелина ацетат (Золадекс)
Парентерально: 3.6 мг имплантируется п/к
Гистрелин (Саппрелин)
Парентерально: 120,300,600 мкг в 0.6 мл для п/к инъекций
Леупролид (Лупрон)
Парентерально: 5 мг/мл для п/к введения Депо-суспензия для парентерального введения (Лупрон Депо) — лионизированные микросферы для в/м введения (3.75,7.5 мг)
Липрессин (Диапид)
Интраназально: спрей 50 ЕД или 0.185 мг/мл
Менотропины [чМГ] (Пергонал)
Парентерально: 75 ЕД ФСГ и 75 ЕД ЛГ, 150 ЕД ФСГ и 150 ЕД ЛГ, каждый
с растворителем
Нафарелин (Синарел )
Интразально: 2 мг/мл; 200 мкг спрей
Октреотид (Сандостатин)
Парентерально: 50,100,500 мкг в ампулах по 1 мл и 200,1000 мкг/мл во флаконах по 5 мл для в/в и п/к введения;
по 200,1000 мкг в 5 мл мультидозы во флаконах для инъекций
Окситоцин (генерик, Питоцин, Синтоцинон) Парентерально: 10 ЕД/мл для инъекций Интраназально: 40 ЕД/мл спрей
Протирелин (Типинон, Релефэкт ТРГ) Парентерально: 500 мкг/мл для инъекций
Серморелин [СТРГ] (Гереф)
Парентерально: порошок для инъекций (50 мкг во флаконе)
Соматрем (Протропин)
Парентерально: 5,10 мг/флакон с растворителем для п/к и в/м инъекций
Соматотропин (Хуматроп)
Парентерально: 5 мг/флакон с растворителем для п/к и в/м инъекций
Тиротропин [ТТГ] (Титропар)
Парентерально: 10 ЕД/флакон с растворителем для инъекций
Урофоллитропин (Метродин)
Парентерально: порошок для инъекций (0.83 мг в ампулах; 75 ЕД с активностью ФСГ)
Вазопрессин (Питрессин синтетический) Парентерально: 20 прессорных ЕД/мл для в/м и п/к введения
Вазопрессина таннат (масляный раствор
Питрессина танната)
Парентерально: 5 прессорных ЕД/мл только для в/м инъекций
Избранная литература
Bengtsson В.-А. et al. Treatment of adults with growth hormone (GH) deficiency with recombinant human GH. J. Clin. Endocrinol. Metab. 1993; 76:309.
Bell G. I., Reisine T. Molecular biology of somatostatin receptors. Trend. Neurosci. 1993; 16:34.
Chrousos G. P. Regulation and dysregulation of the hypothalamic-pituitary-adrenal axis: The corticotropin-releasing hormone perspective. Endocrinol. Metab. Clin. North Am. 1992; 21:833.
Fava M. et al. The thyrotropin response to thyrotropinreleasing hormone as a predictor of response to treatment in depressed outpatients. Acta. Psy-chiatr. Scand. 1992; 86:42.
Lavalie C. Prolactin: A hormone with immuno-regulatory properties that leads to new therapeutic approaches in rheumatic diseases. J. Rheumatol. 1992; 19: 839.
Marbach P. et al. From somatostatin to Sandostatin: pharmacodynamics and pharmacokinetics. Metabolism. 1992; 41 (Suppl. 2): 7.
Tapanainen P., Knip M. Evaluation of growth hormone secretion and treatment. Ann. Med. 1992; 24:237.
Тиреоидные и антитиреоидные
средства
37
Фрэнсис С. Гринспэн, Бетти Дж. Донг
В связи с особенностями анатомического расположения щитовидная железа оказалась одной из первых эндокринных желез, дисфункции которой были правильно соотнесены с соответствующими клиническими проявлениями. Эта железа продуцирует два существенно различных типа гормонов. В данной главе обсуждается фармакология тиреоидных гормонов, необходимых для роста и развития организма, а также для регуляции энергетического обмена: тироксина и трийодтиронина. Кальцитонин, относящийся ко второму типу тиреоидных гормонов, необходим для регуляции метаболизма кальция. О нем рассказывается в главе 41.
Физиология щитовидной железы
Нормальная щитовидная железа секретирует достаточное количество тиреоидных гормонов — трийодтиронина (Т3) и тетрайодтиронина (Т4, тироксина) — для поддержания нормального роста и развития, температуры тела и оптимального энергетического уровня. Эти гормоны содержат как существенную часть молекул 59 % и 65 % йода соответстве! и ю.
Метаболизм йода
Поглощение йодидов (Г)* происходит в основном в желудочно-кишечном тракте из пищи, воды или лекарств. Рекомендуемое ежедневное потребление для взрослых — 150 мкг. Из кишечника ионизированный йод быстро абсорбируется и поступает
* В данной главе под термином “йод” подразумеваются все формы этого элемента; а термин “йодид” обозначает только ионизированную форму Г.
во внеклеточную жидкость. Щитовидная железа забирает из этого пула около 75 мкг для поддержания секреции гормона, а остальное выводится с мочой. Если потребление йодида повышается, захватываемая щитовидной железой доля йода уменьшается.
Биосинтез тиреоидных гормонов
Захваченные щитовидной железой ионы йода претерпевают серию ферментативных реакций и превращаются в активный тиреоидный гормон (рис. 37-1). Первым шагом является транспорт йодида в щитовидную железу, называемый захватом йодидов. Он подавляется такими анионами, как SCN", BFT, NO.-f и С1О4”. Затем йодид окисляется тиреоидной пероксидазой до элементарного йода; в этой форме он быстро йодирует тирозиновые остатки молекулы тиреоглобулина с образованием монойодтирозина (МИТ) и дийодтирозина (ДИТ). Этот процесс называется органификацией йодида. Две молекулы ДИТ взаимодействуют друг с другом внутри молекулы тиреоглобулина с образованием L-тироксина (ТД одна молекула МИТ и одна молекула ДИТ — с образованием Т3. В щитовидной железе кроме тиреоглобулина могут быть йодированы и другие белки, но эти йодопротеины не обладают гормональной активностью. Тиреоидные гормоны высвобождаются из связи с тиреоглобулином в области апикальной границы коллоида посредством экзоцитоза и протеолиза. Коллоидные капли тиреоглобулина сливаются с лизосомами, содержащими протеолитические ферменты, которые гидролизуют тиреоглобулин и высвобождают Т3, Ть МИТ и ДИТ. МИТ и ДИТ дейодируются внутри железы, и йод утилизируется заново. Помимо Т3 и Т4 секретируется небольшое количество тиреоглобулина, тирозина и йодида. Соотношение Т</Т3 внутри тиреоглобулина составляет приблизитель-
Рис. 37-1. Синтез тиреоидных гормонов в фолликулах щитовидной железы (включая клетки щитовидной железы и просвет фолликулов). (Г — ионы йода; Г — активный йод; МИТ — монойодтирозин; ДИТ — дийодтиро-зин; Т3 — трийодтиронин; Т4 — тироксин; Туг — тирозин.) (Из: Greenspan F. S. In: Basic and Clinical Endocrinology, 4th ed. Greenspan F. S. [ed.]. Appleton & Lange, 1993.)
но 5:1, так что большую часть выделяемого гормона составляет тироксин. Основная часть циркулирующего в крови Т3 образуется в результате периферического метаболизма тироксина.
Транспорт тиреоидных гормонов
В плазме Т3 и Т4 обратимо связываются преимущественно с тироксинсвязывающим глобулином (ТСГ). Около 0.04 % всего Т„ и 0.4 % Т3 циркулирует в свободной форме.
Многие физиологические и патологические состояния и лекарственные средства влияют на Т3, Т4 и их транспорт. Однако фактический уровень свободного гормона, контролируемый по механизму обратной связи, как правило, остается нормальным.
Периферический метаболизм тиреоидных гормонов
Небольшое количество тироксина биологически инактивируется путем дезаминирования, декарбоксилирования или конъюгации и экскреции в виде глюкуронидов и сульфатов. Но основным путем периферического метаболизма тироксина является дейодирование. Дейодирование Т4 может происходить за счет монодейодирования внешнего кольца, в результате чего образуется 3,5,3'-трийод-тиронин (Т3), который в 3-4 раза активнее, чем Т4. Альтернативный путь метаболизма — дейодирование внутреннего кольца с образованием метаболически неактивного 3,3',5'-трийодтиронина (реверсивный Т3, или гТ3, рис. 37-2).
ИНАКТИВАЦИЯ
Дезаминирование
>. Декарбоксилирование Конъюгация (глюкуронид или сульфат)
Рис. 37-2. Периферический метаболизм тироксина. (Из: Greenspan F. S. In: Gynecologic Endocrinology, 3rd Gold J. J., Josimovich J. B. [eds] Harper & Row, 1980.)
На рис. 37-3 показано, в каких количествах продуцируются и метаболизируются тиреоидные гормоны в течение одного дня у взрослых. В табл. 37-1 представлены нормальные уровни тиреоидных гормонов (низкий уровень Т3 и гТ3 в крови объясняется высоким метаболическим клиренсом этих двух соединений).
Регуляция функции щитовидной железы
Тесты, оценивающие функцию щитовидной железы, представлены в табл. 37-2.
А. Взаимоотношения гипофиз-щитовидная железа. Как известно, клетки гипоталамуса выделяют тиреотропинрилизинг-гормон (ТРГ) (рис. 37-4), который попадает в капилляры портальной венозной системы гипофиза и активирует синтез гипофизарного тиреостимулирующего, или тиреотропного, гормона (ТТГ). ТТГ в свою очередь стимулирует аденилатциклазный механизм клеток щитовидной железы и усиливает синтез и высвобождение Т4 и Т3. Эти тиреоидные гормоны по механизму отрицательной обратной связи воздействуют на гипофиз, блокируя действие ТРГ, и подавляют синтез и секрецию ТРГ в гипоталамусе. Регуляция функции щитовидной железы через обратную связь “щитовидная железа-гипофиз” обсуждается также в главе 36. На высвобождение ТРГ и ТТГ могут также влиять другие гормоны или лекарства.
15 мкг (другие метаболиты)
Рис. 37-3. Количественные характеристики продукции и метаболизма тиреоидных гормонов у здоровых взрослых людей
ТАБЛИЦА 37-1. Кинетика тиреоидных гормонов
Кинетический показатель Т4 Тз
Объем распределения Юл 40 л
Экстрагиреоидный пул 800 мкг 54 мкг
Суточная продукция 80 мкг 30 мкг
Фракционный 10% 60%
кругооборот за одни сутки
Метаболический клиренс, 1.1л 24 л
в сутки
Период полувыведения 7 дней 1 день
Концентрация 5-11 мкг/дл 95-190 нг/дл
в сыворотке (64- (1.5-
142 нмоль/л) 2.9 нмоль/л)
Связанное количество 99.96 % 99.6 %
Биологическая активность 1 4
Абсорбция 75-90 % 95%
при приеме внутрь
Б. Ауторегуляция щитовидной железы. Щитовидная железа регулирует также захват йодидов и синтез тиреоидных гормонов посредством внутренних механизмов, не зависящих от ТТГ. Эти механизмы в первую очередь связаны с концентрацией йода в крови. Большие дозы йода подавляют органифи-кацию йодида. В определенных состояниях (например, при тиреоидите Хашимото) этот эффект может проявиться в подавлении синтеза тиреоидного гормона, что в конечном итоге приводит к гипотиреозу.
В. Аномальные стимуляторы щитовидной железы. При болезни Грейвса (о ней еще пойдет речь) лимфоциты секретируют антитела, стимулирующие ТТГ-рецепторы (TIT-R Ат[стим.]), известные как тиреоидстимулирующий иммуноглобулин (ТСИ). Этот иммуноглобулин связывается с ТТГ-рецепто-рами и воздействует на железу точно так же, как сам ТТГ, но значительно длительнее, чем гормон.
I. Базисная фармакология тиреоидных
и антитиреоидных средств
Тиреоидные гормоны
Химическое строение
Структурные формулы тироксина (Т4), трийод-тиронина (Т3) и реверсивного трийодтиронина (гТ3) представлены на рис. 37-2. Все эти природные
ТАБЛИЦА 37-2. Нормальные показатели функциональных тестов щитовидной железы
Название теста Нормальные значения1 Уровень при гипотиреозе Уровень при гипертиреозе
Общее количество тироксина по результатам радиоиммунного анализа (ТДРИА]) 5-11 мкг/дл (64-142 нмоль/л) Низкий Высокий
Общее количество трийодтиронина по результатам радиоиммунного анализа <Т3[РИА]) 95-190 нг/дл (1.5-2.9 нмоль/л) Нормальный или низкий Высокий
Захват Т3 ионообменной смолой (ЗТ3) 25-35 % Низкий Высокий
Индекс свободного тироксина (ИСТ4)’ 6.5-12.5 Низкий Высокий
Индекс свободного Т3 (ИСТ3) 20-63 Нормальный или низкий Высокий
Свободный ТДСТлД)2 0.9-2.0 пг/дл (12-26 пмоль/л) Низкий Высокий
Тиреотропный гормон (ТТГ) 0.3-5.0 мкЕД/мл (0.3-5.0 мЕД/л) Высокий Низкий
Захват 1231 за 24 часа 5-35 % Низкий Высокий
Антитиреоглобулиновые антитела Титр < 1:10 Часто присут- Обычно при-
(Атг-Ат) ствуют сутствуют
Антимикросомальные антитела Титр < 1:100 Часто присут- Обычно при-
(АМ-Ат) ствуют сутствуют
Тиреотропинрилизинг-гормон (ТРГ) Уровень ТТГ в сыворотке через 45 минут после инъекции возрастает более чем на 6 мкЕД/мл. Улюдей старше 40 лет ответ ТТГ сглаженный - < 2 мкЕД/мл Чрезмерно высокий подъем Нет ответа
Изотопное сканирование 1231 или 99пТсО4 Нормальный вид Тест не показан Диффузно увеличенная железа
Тонкоигольная аспирационная биопсия (ТИА) Нормальный вид Тест не показан Тест не показан
Тиреоглобулин в крови < 40 нг/мл Низкий Высокий
1 Результаты могут отличаться в разных лабораториях.
2 Свободный тироксин, определяемый диализом.
молекулы являются левовращающими (L) изомерами. Синтетический правовращающий (D) изомер тироксина, декстротироксин, обладает только 4 % активности L-тироксина, определяемой по способности подавлять секрецию ТТГ и устранять гипотиреоз.
Фармакокинетика
Данные об абсорбции тиреоидных гормонов при приеме внутрь получены на основании изучения судьбы экзогенно вводимых гормонов. Т4 лучше всего абсорбируется из двенадцатиперстной и тощей кишки. Всасывание зависит от характера пищи, приема соответствующих лекарств (например, алю
минийсодержащих антацидов, железа) и кишечной флоры. Абсорбция первых препаратов L-тироксина при пероральном приеме варьировала от 35 до 65 %; современные препараты абсорбируются лучше: в среднем на 80 % (табл. 37-1). Т3, напротив, всасывается практически полностью (95 %), на этот процесс минимальное влияние оказывает связывание с белками в просвете кишечника. Гипотиреоз средней тяжести не оказывает влияния на абсорбцию Т3 и Т4, но при тяжелой форме микседемы она может быть нарушена. Эти факторы важны при переходе от пероральной к парентеральной терапии. При необходимости парентерального введения для обоих гормонов предпочтительнее использовать внутривенный способ.
Острый Циркадные психоз и пульсирующие ритмы
Рис. 37-4. Система гипоталамус-гипофиз-щитовидная железа. Острый психоз или длительный холод активируют эту систему. Гипоталамический ТРГ стимулирует высвобождение гипофизарного ТТГ, тогда как соматостатин и дофамин подавляют его. ТТГ стимулирует синтез и высвобождение Т4 и Т3 из щитовидной железы, а они в свою очередь подавляют синтез и высвобождение ТТГ и ТРГ. Небольшое количество йодида необходимо для продукции гормона, но большие количества подавляют продукцию и высвобождение Т4 и Т3. (Сплошные стрелки - стимулирующее действие; пунктирные - ингибирующее действие.)
У больных с гипертиреозом повышен уровень метаболического клиренса Т4 и Т3, а период полувыведения снижен; противоположное явление наблюдается при гипотиреозе. Препараты, которые вызывают индукцию микросомальных ферментов печени (например, рифампин, фенобарбитал, карбамазепин, фенитоин), повышают метаболизм как Т4, так и Т3. Несмотря на эти изменения клиренса, у эутиреоидных пациентов поддерживается нормальная концентрация гормона за счет компенсаторной гиперфункции щитовидной железы. Однако больным, получающим заместительную терапию Тъ могут потребоваться повышенные дозы тироксина для поддержания ее клинической эффектив
ности. Аналогичная компенсация происходит при изменении числа мест связывания Т3 и Т4. Если число мест связывания на ТСГ увеличивается при беременности, под действием эстрогенов или оральных контрацептивов, наряду со сдвигом нормального соотношения свободный/связанный гормон в сторону возрастания связанной фракции происходит замедление его элиминации до восстановления нормальной концентрации. Таким образом, при повышении общей концентрации гормона (свободная и связанная фракции) концентрация свободного гормона и уровень стационарного состояния остаются нормальными. При снижении числа мест связывания тиреоидных гормонов наблюдается обратный эффект.
Механизм действия
На рис. 37-5 представлена модель механизма действия тиреоидного гормона. Согласно этой модели, тиреоидный гормон Т3 связывается с рецепторным белком на клеточной мембране, что повышает поступление глюкозы и аминокислот в клетку. Т3 путем диффузии может проникать также внутрь клетки. Оказавшись в клетке, Т3 связывается с цитозольным связывающим белком (ЦСБ) в определенной пропорции по отношению к свободной фракции. Внутри клетки Т3 может взаимодействовать с рецепторами, находящимися в митохондриях или на ядерном хроматине. Ядерный рецеп-тортиреоидных гормонов принадлежит к семейству рецепторов, которые гомологичны с-егЬ-А онкогену, к другим членам этого семейства относятся рецепторы стероидных гормонов и рецепторы для витаминов А и D. Т3-рецептор существует в двух формах - а и Ь, которые по-разному функционируют в различных тканях, что определяет характер проявления эффектов Т3 в разных тканях.
Реакции, следующие за взаимодействием гормона с рецептором, разнообразны. В ядре активация РНК-полимеразы и транскрипции ДНК приводит к усилению синтеза иРНК, увеличению синтеза белков, в том числе различных ферментов, то есть к повышению активности клетки. Взаимодействие с рецепторами митохондрий может оказывать прямое влияние на энергетический обмен и непрямое — на синтез белков. Тиреоидные гормоны прямо стимулируют мембранную Ка+,К+-АТФазу, повышая транспорт Na+ и К+ (натриевая помпа) и утилизацию кислорода.
Рис. 37-5. Предполагаемый механизм действия тиреоидных гормонов. Тиреоидный гормон (в данном случае трийодтиронин, или Т3) связывается с рецепторными белками (R) на поверхности клетки и повышает захват глюкозы и аминокислот. Т3 также проникает внутрь клетки, где взаимодействует с цитоплазматическим связывающим белком (ЦСБ) и рецепторами на хроматине и митохондриях. В ядре образование комплекса Т3-рецептор приводит к синтезу новых белков
В основном влияние гормонов щитовидной железы на процессы метаболизма, как оказалось, связано с активацией ядерных рецепторов, что приводит к образованию РНК и последующему синтезу белков. Например, усиление синтеза белка На+,К+-АТФазы и соответствующее повышение кругооборота АТФ и потребления кислорода являются причиной некоторых калоригенных эффектов тиреоидных гормонов. Это согласуется с наблюдением, что эффекты тиреоидных гормонов in vivo проявляются с запаздыванием во времени на часы или даже дни после назначения препаратов.
В тканях, реагирующих на тиреоидные гормоны (гипофиз, печень, почки, сердце, скелетные мышцы, легкие и кишечник), найдено большое количество рецепторов к ним, тогда как в не реагирующих на гормоны тканях (селезенка, семенники) обнаружено лишь незначительное число рецепторных мест связывания. Мозг, на который Т3 не оказывает анаболического эффекта, содержит проме
жуточное количество рецепторов. В соответствии с биологической активностью гормонов аффинитет рецепторов к Т4 почти в десять раз ниже, чем к Т3. Количество ядерных рецепторов может изменяться в целях поддержания гомеостаза организма. Например, голодание снижает как концентрацию циркулирующего Т3, так и число его клеточных рецепторов.
Эффекты тиреоидных гормонов
Тиреоидные гормоны отвечают за оптимальный рост, развитие, функционирование и поддержание всех тканей организма (табл. 37-3). Так как Т3 и Т< качественно подобны, в дальнейшем обсуждении они будут рассматриваться как один гормон.
Тиреоидный гормон имеет большое значение для нервной, скелетной и репродуктивной тканей. Его эффекты опосредованы синтезом белков, так же как и усилением секреции и действия гормона роста. Дефицит тиреоидных гормонов в раннем детстве приводит к необратимой задержке умственного развития и карликовости — типичным симптомам врожденного кретинизма.
Действие на рост и калоригенез сочетается с влиянием на метаболизм лекарств, а также углеводов, жиров, белков и витаминов. Многие из этих изменений зависят от активности других гормонов. И наоборот, состояние щитовидной железы влияет на уровни секреции и разрушения практически всех других гормонов, включая катехоламины, кортизол, эстрогены, тестостерон и инсулин.
Многие проявления гипертиреоза напоминают гиперактивность симпатической нервной системы, хотя уровень катехоламинов не повышается. Вероятно, это объясняется повышением числа [3-рецепторов или усилением реактивности 0-рецепто-ров без увеличения их количества. При нарушениях функции щитовидной железы, судя по уровню цАМФ, изменяется активность стимулируемой катехоламинами аденилатциклазы. Наиболее ярко эта гиперактивность катехоламиновой системы проявляется в отношении сердечно-сосудистых реакций. Другие клинические симптомы, напоминающие повышенную адренергическую активность и частично купируемые антагонистами адренорецепторов, включают неполное закрытие глазной щели и ретракцию век, тремор, усиленную потливость, тревожность, повышенную нервную возбудимость и мышечную слабость. Противопо-
ТАБЛИЦА 37-3. Эффекты тиреоидных гормонов
Система Тиреотоксикоз Гипотиреоз
Кожа и ее произ- Теплая блажная кожа, потливость, непере- Бледная, холодная, отекшая кожа, сухие и
водные носимость повышения температуры, тонкие мягкие волосы, ногти Пламмера, дермопатия й претибиальной области (болезнь Грейвса) ломкие волосы, ломкие ногти
Глаза, лицо Ретракция верхнего Века с увеличением глазной щели, периорбитальный отек, экзофтальм, диплопия (болезнь Грейвса) Опускание век, периорбитальный отек, выпадение волос в височной части бровей, одутловатость, безучастное выражение лица, увеличенный язык
Сердечно-сосудис- Повышение периферического сопротивле- Снижение периферического сосудистого
тая система ния сосудов, ЧСС, ударного и минутного объема, систолического давления; сердечная недостаточность переполнения с высоким минутным объемом, повышенные инотропный и хронотропный эффекты; аритмии; стенокардия сопротивления, ЧСС, ударного и минутного объема, систолического давления; застойная сердечная недостаточность с низким минутным объемом; на ЭКГ: брадикардия, удлиненный интервал PR, снижение зубца Т, низкий вольтаж; выпотевание жидкости в перикард
Дыхательная Одышка, снижение жизненного объема Выпотевание жидкости в плевру, гиповен-
система легких тиляция и задержка СО2
Желудочно-кишеч- Повышенный аппетит; повышенная перис- Пониженный аппетит; сниженная перис-
ный тракт тальтика кишечника; гипопротеинемия тальтика кишечника; асцит
Центральная Повышенная нервная возбудимость; ги- Заторможенность; общее замедление ум-
нервная система перкинезия; эмоциональная лабильность ственной деятельности; невропатии
Опорно-двигатель- Слабость и мышечная утомляемость, повы- Мышечная ригидность и утомляемость;
ная система шение глубоких сухожильных рефлексов; гиперкальциемия; остеопороз снижение глубоких сухожильных рефлексов; повышение активности щелочной фосфатазы, ЛДГ, ACT
Почки Умеренная полиурия; повышенный почечный кровоток; повышение скорости клубочковой фильтрации Сниженная экскреция воды; пониженный почечный кровоток; снижение скорости клубочковой фильтрации
Гемопоэз Повышенный эритропоэз; анемия' Сниженный эритропоэз; анемия'
Репродуктивная Нарушения менструального цикла; пони- Гиперменорея; бесплодие; пониженное ли-
система женная фертильность; повышенный метаболизм половых стероидов бидр; импотенция; олигоспермия; пониженный метаболизм половых стероидов
Метаболизм Повышение основного обмена; отрицательный азотистый баланс; гипергликемия, повышенный уровень свободных жирных кислот; снижение уровня холестерина и триглицеридов; усиление деградации гормонов; увеличенная потребность в жиро- и водорастворимых витаминах; ускоренная детоксикация лекарств Понижение основного обмена; незначительный положительный азотистый баланс; замедленное разрушение инсулина с увеличением чувствительности к нему; повышенное содержание триглицеридов и холестерина; снижение скорости деградации гормонов; уменьшенная потребность в жиро- и водорастворимых витаминах; замедленная детоксикация лекарств
1 Анемия при гипертиреозе обычно является нормохромной и вызывается повышенным кругооборотом эритроцитов. Анемия при гипотиреозе может быть нормохромной, гиперхромной или гипохромной вследствие замедления продукции эритроцитов, понижения всасывания железа, уменьшения всасывания фолиевой кислоты или как результат аутоиммунной пернициозной анемии.
ложное сочетание симптомов наблюдается при гипотиреозе (табл. 37-3).
Тиреоидные препараты
Список имеющихся препаратов представлен в конце данной главы. Они могут быть как синтетического (левотироксин, лиотиронин, лиотрикс), так и животного происхождения (высушенная ткань щитовидной железы).
Синтетический левотироксин является препаратом выбора для заместительной или супрессивной терапии благодаря его стабильности, однородности, низкой стоимости, отсутствию чужеродных аллергенных белков, простоте лабораторного измерения его концентрации в сыворотке и длительному периоду полувыведения (7 дней), что позволяет назначать его один раз в сутки. Кроме того, Т4 внутри клеток превращается в Т3, следовательно, назначение Т4 позволяет получить оба гормона. Преимущества использования препаратов-генериков левотироксина заключаются в их сопоставимой эффективности и более низкой стоимости по сравнению с патентованными средствами.
Хотя лиотиронин в три или четыре раза активнее, чем левотироксин, он не рекомендуется для обычной заместительной терапии из-за более короткого периода полувыведения (24 часа), что требует многоразового назначения в сутки, более высокой цены и более сложного мониторинга адекватности заместительной терапии обычными лабораторными тестами. Кроме того, из-за более высокой активности и, следовательно, большей кардиотоксичности необходимо избегать назначения Т3 больным с заболеваниями сердца. Его использование наиболее обосновано в качестве диагностического средства в тесте супрессии Т3 и для непродолжительного подавления ТТГ.
Так как нет необходимости принимать внутрь Т3, использовать более дорогой лиотрикс вместо левотироксина нецелесообразно. Отметим, что Эутроид на 20 % активнее, чем Тиролар, если сравнивать их эффективность в эквивалентных количествах.
Назначение препаратов высушенной щитовидной железы вместо синтетических препаратов необоснованно, так как проблемы, связанные с антигенностью белков, нестабильностью, вариабельностью концентрации гормонов и сложностью лабораторного мониторинга, перевешивают преимущество низкой цены. Значительные количества Т3, обнару
живаемые в некоторых экстрактах щитовидной железы и лиотриксе, могут вызвать существенное повышение уровня Т3 и токсическое действие. 100 мг (1.5 грана) тиреоглобулина или высушенной щитовидной железы эквивалентны 100 мкг левотироксина и 37.5 мкг лиотиронина.
Срок годности синтетических препаратов гормона около двух лет, особенно при хранении в темной посуде для минимизации спонтанного дейодирования. Срок годности препаратов высушенной щитовидной железы точно не определен, но известно, что при хранении в сухом виде ее активность сохраняется лучше.
Антитиреоидные препараты
Снижение активности щитовидной железы и эффектов ее гормонов может быть достигнуто препаратами, нарушающими их синтез, средствами, изменяющими реакцию тканей на тиреоидные гормоны, а также деструкцией железы с помощью радиации или хирургического лечения. “Зобогенными” являются средства, подавляющие секрецию Т3 и Т4 до субнормального уровня и тем самым повышающие секрецию ТТГ, который в свою очередь вызывает увеличение железы (зоб). К антитиреоидным средствам, используемым в клинике и рассматриваемым в этой главе, относятся тиоамиды, йодиды и радиоактивный йод.
1. ТИОАМИДЫ
Тиоамиды метимазол и пропилтиоурацил — основные средства для лечения тиреотоксикоза. В Великобритании широко используется карбима-зол, превращающийся iti vivo в метимазол. Метимазол примерно в десять раз активнее, чем пропилтиоурацил.
Химическая структура этих препаратов показана на рис. 37-6. Для проявления антитиреоидной активности существенна тиокарбамидная группа:
S
—N—С—R
СНз
Пропилтиоурацил Метимазол
О II С —О—с2н5
I СНз
Карбимазол
Рис. 37-6. Строение тиоамидов
Фармакокинетика
Пропилтиоурацил быстро абсорбируется, достигая пика концентрации в сыворотке через 1 час после введения. Его биодоступность составляет 50-80 %, возможно, из-за неполной абсорбции или значительного эффекта первого прохождения через печень. Объем распределения соответствует объему воды в организме с накоплением в щитовидной железе. Большая часть дозы пропилтиоурацила через 24 часа после приема внутрь экскретируется почками в виде неактивного глюкуронида.
Метимазол, наоборот, абсорбируется полностью, но с вариабельной скоростью. Он активно аккумулируется щитовидной железой, объем его распределения сходен с соответствующим показателем для пропилтиоурацила. Экскреция метимазола более медленная, чем у пропилтиоурацила: через 48 часов с мочой выводится 65-70 % дозы.
Короткий период полувыведения этих препаратов (1.5 часа для пропилтиоурацила и 6 часов для метимазола) мало влияет на длительность антитиреоидного действия и интервал между введениями, так как оба препарата аккумулируются щитовидной железой. Пропилтиоурацил вводят каждые 6 часов, так как однократная доза 100 мг подавляет органификацию йода на 60 % в течение 7 часов. Однократное введение 30 мг метимазола оказыва
ет антитиреоидное действие более 24 часов, поэтому ежедневное введение одной дозы эффективно при лечении гипертиреоза легкой и средней степени тяжести.
Так как оба тиоамида проникают через плацентарный барьер и накапливаются щитовидной железой плода, беременные должны применять их с осторожностью. При беременности из этих двух лекарств предпочтителен пропилтиоурацил: он сильнее связывается с белками и хуже проникает через плаценту. Более того, он не секретируется в больших количествах в грудное молоко, что исключает потребление препарата младенцем с молоком матери.
Фармакодинамика
Тиоамиды обладают несколькими механизмами действия. Основным является предотвращение синтеза гормона за счет подавления катализируемых тиреоидной пероксидазой реакций, что тормозит органификацию йода. Кроме того, они блокируют конъюгацию молекул йодотирозинов. Эти препараты не нарушают процесс захвата йода железой. Пропилтиоурацил и в гораздо меньшей степени метимазол ингибируют периферическое дейодирование Т3 и Т4. Так как препараты больше влияют на синтез, чем на высвобождение гормона, их эффект проявляется медленно: обычно проходит 3-4 недели до истощения депо Т4.
Токсичность
У 3-12 % больных наблюдаются побочные эффекты тиоамидов. Большинство реакций проявляется достаточно рано. К наиболее частым побочным эффектам относится макулопапулезная кожная сыпь, иногда сопровождающаяся такими системными явлениями, как лихорадка. Реже встречаются уртикарная сыпь, васкулиты, артралгии, волчаночноподобные реакции, холестатическая желтуха, гепатит, лимфаденопатия, гипопротромбинемия и полисерозиты. Наиболее опасным осложнением является агранулоцитоз — нечастая, но потенциально смертельная побочная реакция. Она отмечается у 0.3-0.6 % больных, получающих тиоамиды, но у пожилых больных и у больных, принимающих высокие дозы метимазола (более 40 мг/сут), риск возрастает. Это побочное действие обычно быстрообратимо при прекращении лечения, но при наслоении инфекции может потребоваться антибиотике-
терапия. В 50 % случаев к действию пропилтиоурацила и метимазола возникает перекрестная сенсибилизация, поэтому заменять один препарат на другой при выраженных аллергических реакциях не рекомендуется.
2. АНИОННЫЕ ИНГИБИТОРЫ
Такие моновалентные анионы, как перхлорат (С1О4 ), пертехнетат (ТсО4“) и тиоцианат (SCN ), могут нарушать захват йодида железой за счет конкурентного торможения механизма его транспорта. Так как эти эффекты могут устраняться большими дозами йодида, эффективность такого воздействия не всегда предсказуема.
Вследствие высокой токсичности большинство анионных ингибиторов используется в клинике только для диагностических целей. Перхлорат калия достаточно широко применяли для лечения тиреотоксикоза до тех пор, пока не было установлено, что он вызывает апластическую анемию.
3. ЙОДИДЫ
С 1920 г. известно, что йодиды оказывают множественное действие на шитовидную железу. До введения в 1940-х гг. в клиническую практику тиоамидов йодиды были основными антитиреоидными препаратами. Сегодня они редко используются для монотерапии.
Фармакодинамика
Йодиды обладают несколькими эффектами в отношении щитовидной железы. Они подавляют органификацию, высвобождение гормона, уменьшают размер и васкуляризацию гиперпластической железы. У чувствительных индивидуумов йодиды могут вызвать гипертиреоз (Базедова болезнь) или гипотиреоз.
Основным действием йодидов в фармакологических дозах (> 6 мг ежедневно) является ингибирование высвобождения гормона, возможно, за счет подавления протеолиза тиреоглобулина. В течение 2-7 дней происходит быстрое устранение симптомов тиреотоксикоза, поэтому терапия йодидами весьма успешна при тиреотоксическом кризе. Кроме того, йодиды снижают васкуляризацию, размер и чувствительность гиперпластической железы к механическим воздействиям, что делает их важным компонентом предоперационной подготовки больных.
Клиническое использование йодидов
Недостатками йодидной терапии является повышение депонирования йода в железе, что может замедлить проявление клинического эффекта тио-амидной терапии и задержать применение терапии радиоактивным йодом на несколько недель. Таким образом, йодиды необходимо применять после начала тиоамидной терапии и их не следует назначать при планировании лечения радиоактивным йодом. Йодиды не должны использоваться в качестве монотерапии, так как железа в течение 2-8 недель перестает реагировать на их блокирующее действие, а их отмена может привести к резкому усилению проявлений тиреотоксикоза на фоне обогащенной йодом железы. Нужно избегать длительного применения йодидов у беременных, так как они проникают через плацентарный барьер и могут вызывать появление зоба у плода.
Токсикология
Побочные реакции на йодиды (йодизм) встречаются редко и в большинстве случаев обратимы при прекращении приема. Симптомы включают угревидную сыпь (подобную сыпи при бромизме), увеличение слюнных желез, изъязвления слизистой оболочки полости рта, конъюнктивиты, рино-рею, лекарственную лихорадку, металлический привкус во рту, кровотечения и редко — анафилактические реакции.
4. ЙОДИРОВАННЫЕ КОНТРАСТНЫЕ СРЕДСТВА
Иодированные контрастные вещества — иподат и йопановая кислота — являются эффективными средствами для лечения гипертиреоза, хотя их применение по этим показаниям не утверждено FDA. Эти вещества быстро подавляют превращение Т< в Т3 в печени, почках, гипофизе и мозгу, что сопровождается существенным субъективным и объективным улучшением. Например, снижение частоты сердечных сокращений наблюдается уже через 3 дня перорального приема 0.5-1 г/сут. За это время уровень Т3 часто возвращается к нормальному. Длительное снижение секреции Т4и Т3 может указывать на то, что дополнительным механизмом действия, возможно, является высвобождение йода. Достоинством такого лечения является относительно низкая ток
сичность. Эти препараты являются полезными вспомогательными средствами терапии тиреотоксичес-кого криза и адекватными альтернативными препаратами, если применение тиоамидов и йодидов противопоказано. Удивительно, но эти вещества не влияют на задержку ,3,1 в такой степени, как йодиды, несмотря на высокое содержание йода. Их токсичность близка к токсичности йодидов, а безопасность применения при беременности не изучена.
5. РАДИОАКТИВНЫЙ ЙОД
1311 является единственным изотопом, используемым для лечения тиреотоксикоза. При пероральном приеме в виде раствора Na,31I он быстро всасывается, накапливается в щитовидной железе и включается в депо фолликулов. Его терапевтический эффект связан с эмиссией p-излучения, период полувыведения составляет 5 дней, а проникающая способность равна 400-2000 мкм. Через несколько недель после введения разрушение тиреоидной паренхимы проявляется набуханием и некрозом эпителия, разрывом фолликулов, отеком и лейкоцитарной инфильтрацией. Преимуществами терапии радиоактивным йодом являются простота введения, эффективность, низкая стоимость и отсутствие болевых ощущений. Опасения появления радиационных генетических нарушений, лейкозов и злокачественных новообразований вынудили некоторые клиники ограничить применение радиоактивного йода для лечения гипертиреоза у взрослых старше 40 лет. Однако более чем 30-летний опыт клинического использования радиоактивного йода эти страхи не подтверждает. Радиоактивный йод не должен применяться у беременных и кормящих женщин, так как проникает через плаценту и в молоко.
6. БЛОКАТОРЫ АДРЕНЕРГИЧЕСКИХ РЕЦЕПТОРОВ
Многие симптомы тиреотоксикоза напоминают проявления симпатической активации, поэтому такие симпатолитикн, как гуанетидип или р-блока-торы, применяют как вспомогательные терапевтические средства, р-Адрепоблокаторы являются препаратами выбора, так как они эффективны у больных, нечувствительных к гуанетидину и резерпину. К наиболее широко используемым для лечения тиреотоксикоза и изученным препаратам этой группы относится пропранолол.
II. Клиническая фармакология тиреоидных и антитиреоидных средств
Гипотиреоз
Гипотиреоз — это синдром, вызываемый дефицитом тиреоидных гормонов и проявляющийся в основном обратимым замедлением всех функций организма (табл. 37-3). У новорожденных и детей развивается выраженная задержка роста и развития, приводящая к карликовости и необратимой умственной отсталости.
Этиология и патогенез гипотиреоза приведены в табл. 37-4. Гипотиреоз может протекать с увеличением щитовидной железы (зоб) или без него. У взрослых он легко диагностируется с использованием лабораторных тестов по сочетанию показателей низкого уровня свободного тироксина (низкий индекс свободного тироксина) и повышенного уровня ТТГ в сыворотке (рис. 37-2).
Наиболее частой причиной гипотиреоза в США в настоящее время является тиреоидит Хашимо-то — иммунологическое нарушение у генетически предрасположенных индивидуумов. В этих условиях имеет место гуморальная иммунологическая реакция в присутствии антитиреоидных антител и при сенситизации лимфоцитов к тиреоидным антигенам.
Терапия гипотиреоза
За исключением гипотиреоза, вызванного лекарствами (табл. 37-4), который лечится простой отменой вещества, подавляющего функцию щитовидной железы, обычной стратегией лечения при гипофункции щитовидной железы является заместительная терапия. Более других удовлетворяет требованиям такой терапии левотироксин. Младенцам и детям требуется больше Т4 на 1 кгмассы тела, чем взрослым. Средняя доза для младенцев в возрасте 1-6 месяцев составляет 10-15 мкг/кг/сутки, тогда как средняя доза для взрослых —1.7 мкг/кг/сутки. Существует Некоторая вариабельность абсорбции тироксина, поэтому его дозы могут отличаться у разных больных. Так как период полувыведения левотироксина достаточно большой, он может назначаться 1 раз в сутки. Во время лечения необходимо
постоянное наолюдение за нормальным ростом и развитием ребенка. Через равные промежутки времени следует измерять уровень ТТГ в крови и индекс свободного тироксина, чтобы поддерживать их на нормальном уровне. Только через 6-8 недель после начала терапии уровень тироксина в крови достигает стабильного состояния. Поэтому изменять дозы необходимо очень медленно.
Пожилым людям с длительно существующим гипотиреозом и пациентам с заболеваниями сердца настоятельно рекомендуется начинать лечение с пониженных доз. Таким взрослым больным назначают 0.0125-0.250 мг/день левотироксина в течение двух недель и дозу повышают на 0.025 мг каждые 2 недели до достижения эутиреоидного состояния или появления токсических эффектов. У пожилых больных сердце очень чувствительно к уровню циркулирующего тироксина, поэтому при развитии приступов стенокардии или сердечной аритмии необходимо срочно снизить дозу или прекратить прием тироксина. Более молодым пациентам или больным с заболеванием легкой или средней тяжести можно сразу назначить полную заместительную терапию.
Токсичность тироксина находится в прямой зависимости от уровня гормона. Признаками токсического действия тироксина у детей может быть беспокойство, бессонница и ускоренный рост и созревание костей. У взрослых симптомами тиреоток-сичности будут повышенная нервная возбудимость, сердечные нарушения, эпизоды трепетаний и тахикардии или необъяснимое снижение массы тела. Если эти симптомы наблюдаются, необходимо из
ТАБЛИЦА 37-4. Этиология и патогенез гипотиреоза
мерение индекса свободного тироксина для определения, являются ди они следствием повышенного уровня тироксина в крови.
Особые проблемы терапии гипотиреоза
А. Микседема и заболевания коронарных артерий. Так как микседема часто возникает у людей пожилого возраста, она нередко сопровождается коронарной болезнью. В этой ситуации низкий уровень циркулирующих тиреоидных гормонов практически защищает сердце от повышения потребности в кислороде, которое может приводить к приступам стенокардии или инфаркту миокарда. Коррекцию микседемы необходимо проводить осторожно для того, чтобы избежать провокации ари тмий, приступов стенокардии или острого инфаркта миокарда. Без проведения коронарного шунтирования, нормализующего коронарное кровообращение, полное восстановление эутиреоидного состояния у больных с выраженными заболеваниями коронарных артерий невозможно.
Б. Кома при микседеме. Нелеченный гипотиреоз заканчивается комой. Ее проявления включают прогрессирующую слабость, ступор, гипотермию, гиповентиляцию, гипогликемию, гипонатриемию, водную интоксикацию, шок и смерть. Симптомы обычно развиваются медленно, с постепенным усилением заторможенности, от ступора к коме.
Патофизиология комы включает три главных аспекта: 1) задержку СОа и гипоксию, обусловленную снижением чувствительности дыхательного центра; 2) водно-электролитные нарушения с гипо
Причина Патогенез Зоб Степень гипотиреоза
Болезнь Хашимото Аутоиммунное повреждение щитовид- Имеется в ранней От мягкой до тяжелой
Действие лекарств1 ной железы стадии, отсутству- ет в поздней Нарушение выработки гормонов Имеется От легкой до средней
Дисморфогенез Нарушенный синтез Т4 вследствие недо- Имеется От легкой до тяжелой
Радиация,'3'! статочности ферментов Деструкция железы Отсутствует Тяжелая
Врожденная Отсутствие или эктопическая щитовид- Отсутствует или Тяжелая
(кретинизм) Вторичная (дефицит ТТГ) ная железа; антитела, блокирующие имеется ТТГ-рецепторы Заболевание гипофиза или гипоталаму- Отсутствует са Легкая
1 Йодиды, литий, фториды, тиоамиды, аминосалициловая кислота, фенилбутазон, амиодарон и т. д.
натриемией; 3) выраженную гипотермию с понижением температуры тела до 24 °C. Сывороточные тесты показывают выраженный гипотиреоз.
Кома при микседеме требует экстренной помощи. Терапия должна проводиться в блоке интенсивной терапии, так как может потребоваться интубация трахеи и искусственная вентиляция легких. Такие сопутствующие заболевания, как сердечная недостаточность или инфекция, требуют соответствующего лечения. Важно все препараты вводить внутривенно, так как у больных с микседемой лекарства плохо абсорбируются при других способах введения. Внутривенные жидкости должны вводиться с осторожностью во избежание чрезмерного поступления в организм воды. У этих больных имеет место большое количество свободных мест связывания для Т3 и Т4 в сыворотке, которые должны быть насыщены до того, как образуется адекватное количество действующего на метаболизм свободного тироксина. Согласно этому для лечения комы при микседеме средством выбора является внутривенное введение левотироксина в начальной дозе 300-400 мкг с последующим переходом на прием 50 мкг ежедневно. Можно использовать и внутривенный Т3, однако этот препарат более кардиотоксичен и его труднее мониторировать. Пациентам с надпочечниковой и гипофизарной недостаточностью показано внутривенное введение гидрокортизона, но оно не является необходимым у больных с первичной микседемой. Наркотики и седативные препараты должны использоваться с чрезвычайной осторожностью.
Свидетельством клинического улучшения будет повышение температуры тела и выход из коматозного состояния. После восстановления самостоятельного дыхания искусственная вентиляция может быть отключена, за чем следует постепенное улучшение.
В. Гипотиреоз и беременность. Женщины, страдающие гипотиреозом, часто имеют ановуляторный цикл и поэтому относительно бесплодны до восстановления эутиреоидного состояния. Это явление привело к широкому использованию тиреоидного гормона для терапии бесплодия, хотя доказательств их эффективности у инфертильных больных с эутиреоидным состоянием нет. Исключительно важно, чтобы беременные, страдающие гипотиреозом, получали адекватную ежедневную дозу тироксина, так как ранние этапы развития мозга плода зависят от тироксина матери. Многим гипотиреоидным больным во время беременности требуется неболь
шое повышение дозы тироксина (около 20 %) для нормализации уровня ТТГ в сыворотке. Вследствие повышенного уровня материнского ТСГ для мониторинга тироксина у матери нужно пользоваться индексом свободного тироксина (ИСТО или определять свободный тироксин, используя метод диализа (СТ4Д).
Гипертиреоз
Гипертиреоз (тиреотоксикоз) — это клинический синдром, который проявляется, если ткани длительно подвергаются воздействию высоких концентраций тиреоидного гормона.
1.БОЛЕЗНЬ ГРЕЙВСА
Наиболее часто встречающейся формой гипертиреоза является болезнь Грейвса, или диффузный токсический зоб. Основные симптомы болезни Грейвса представлены в табл. 37-3.
Патофизиология
Считается, что болезнь Грейвса—это аутоиммунное заболевание, при котором наблюдается генетический дефект Т-супрессоров, а Т-хелперы стимулируют синтез В-лимфоцитами антител к тиреоидным антигенам. Одно из этих антител, ТТГ-рецепторсти-мулирующее антитело (ТТГ-R Ат[стим.]), называемое также тиреоидстимулирующим иммуноглобулином (ТСИ), комплементарно рецепторным местам связывания ТТГ на мембранах клеток щитовидной железы и способно стимулировать эти клетки.
Лабораторная диагностика
У большинства больных, страдающих гипертиреозом, повышены уровни Т3, Т4, ЗТ3, СТ4 Д и ИСТ4, а уровень ТТГ понижен (табл. 37-2). Кроме того, обычно значительно увеличен захват радиоактивного йода. Часто присутствуют антитела к тиреоглобулину, антимикросомальные антитела и ТТГ-R Ат[стим.].
Лечение болезни Грейвса
Для лечения гипертиреоза существуют три основных метода: терапия антитиреоидными средствами, хирургическая тиреоидэктомия и деструкция железы радиоактивным йодом.
А. Терапия антитиреоидными средствами. Лекарственная терапия чаще всего используется у молодых больных с маленькой железой и заболеванием средней тяжести. Метимазол или пропилтиоурацил принимаются до достижения спонтанной ремиссии заболевания, которая может продолжаться от t года до 15 лет. Это единственный вид терапии, оставляющий щитовидную железу интактной, но для него требуется длительное время и наблюдение в течение 1-2 лет. При этом у 60-70 % больных возможны рецидивы. Рецидивов бывает намного меньше, если антитиреоидные средства применяются совместно с левотироксином.
Терапия антитиреоидными средствами обычно начинается с больших, разделенных на несколько приемов, доз с переходом на поддерживающую терапию одноразовой дозой в сутки, когда уровень тиреоидных гормонов у больных нормализуется. Тиреотоксикоз легкой или средней степени тяжести можно также контролировать однократной утренней дозой 30-40 мг метимазола, тем более что такой режим больным соблюдать легче. Для поддерживающей терапии вводят 5-15 мг метимазола один раз в день. Применяют и другой метод: терапия начинается с приема 100-150 мг пропилтио-урацила каждые 6 часов, затем в течение 4-8 недель доза снижается до достижения поддерживающего уровня — 50-150 мг один раз в день. Помимо подавления органификации йода, пропилтиоурацил также ингибирует превращение Т4 в Т3. Таким образом, этот препарат снижает уровень активного тиреоидного гормона быстрее, чем метимазол. Лучшим показателем ремиссии будет уменьшение размеров зоба. Объективными лабораторными тестами для мониторинга являются показатели уровня Т3 в крови (метод РИИ), СТ4Д или ИСТ4, а также уровень ТТГ в сыворотке.
Когда при поддерживающей терапии дозу антитиреоидных средств снижают и ТТГ начинает управлять работой железы, происходит реактивация аутоиммунного процесса. Предотвратить высвобождение ТТГ можно ежедневным назначением 0.05-0.15 мг левотироксина совместно с 5-15 мг метимазол а или 50-150 мгпропилтиоурацила на втором году терапии. При прекращении приема антитиреоидных средств левотироксин необходимо продолжать принимать еще в течение года. При такой схеме частота рецидивов снижается до 20 %.
Побочные реакции на антитиреоидные средства уже были описаны. Небольшие кожные вы
сыпания можно лечить антигистаминными средствами. Так как наиболее опасному явлению агранулоцитоза обычно предшествуют боли в горле и сильная лихорадка, пациентов, получающих антитиреоидные средства, необходимо проинструктировать, что при появлении таких симптомов нужно прекратить прием лекарств и срочно обратиться за медицинской помощью. В этих случаях следует определить количество лейкоцитов и лейкоцитарную формулу, а также выделить культуру возбудителя со слизистой оболочки горла для последующей адекватной антибиотикотерапии. Более редкие побочные реакции на антитиреоидные средства, требующие прекращения терапии, включают уртикарную сыпь, холестатическую желтуху, гепатоцеллюлярную токсичность, эксфолиативный дерматит и острую артралгию.
Б. Тиреоидэктомия. Субтотальная тиреоидэктомия является терапией выбора для больных с очень большой железой или многоузловым зобом. Пациенты получают антитиреоидные препараты до достижения эутиреоидного состояния (около 6 недель). В дополнение к этому за две недели до хирургического вмешательства им назначают насыщенный раствор калия йодида по 5 капель два раза в день для уменьшения васкуляризации железы и упрощения хирургической операции. Почти 50-60 % больных потребуется введение тиреоидных гормонов после неполной тиреоидэктомии.
В. Радиоактивный йод. У большинства больных в возрасте старше 21 года предпочтительным является лечение изотопом радиоактивного йода ,3,1. При отсутствии заболеваний сердца назначают сразу 80-120 мкКи в пересчете на грамм расчетной массы железы. У больных с заболеваниями сердца или с тяжелой формой тиреотоксикоза, а также у пожилых людей желательна предварительная терапия антитиреоидными средствами до достижения эутиреоидного состояния. Назначение препаратов прекращается за 5-7 дней до введения |3|1. Необходимо избегать назначения йодидов для того, чтобы обеспечить максимальный захват |3,1. Через 6-12 недель после введения радиоактивного йода щитовидная железа уменьшается в размерах, и у пациентов обычно развивается эутиреоидное состояние. Некоторым больным может потребоваться введение повторной дозы. Основным осложнением терапии радиоактивным йодом, возникающим в 80 % случаев, является гипотиреоз. Необходимо определение в динамике уровня СТ< и ТТГ в крови. При
развитии гипотиреоза показана пероральная заместительная терапия левотироксином ежедневно в дозе 0.1-0.15 мг.
Г. Дополнения к антитиреоидной терапии. В течение острой фазы тиреотоксикоза значительную помощь могут оказать Р-адреноблокаторы. Пропранолол при введении 20-40 мг внутрь каждые 6 часов предотвращает тахикардию, гипертензию и фибрилляцию предсердий. Дозу пропранолола постепенно снижают до тех пор, пока концентрация тироксина в сыворотке не возвратится к норме. Для устранения тахикардии у больных, которым противопоказаны Р-блокаторы, например при астме, может быть использован дилтиазем (90-120 мг 3-4 раза в день). Интересно, что другие блокаторы кальциевых каналов, как правило, неэффективны. Существенным является адекватное питание и получение витаминных добавок. Могут оказаться полезными барбитураты, которые наряду с седативным действием ускоряют разрушение Т4 (за счет индукции печеночных ферментов).
2. ОДНОУЗЛОВОЙ И МНОГОУЗЛОВОЙ ТОКСИЧЕСКИЙ ЗОБ
Эти формы гипертиреоза часто возникают у пожилых женщин с узловым зобом. Уровень СТ4 умеренно повышен или иногда нормален, тогда как уровень Тз, по данным РИИ, значительно увеличен. Единичную токсическую аденому можно лечить либо хирургическим удалением, либо радиоактивным йодом. Многоузловой токсический зоб обычно сочетается с большими размерами Зоба, и лучшим способом терапии в этом случае будет назначение метимазола и пропилтиоурацила после субтотальной тиреоидэктомии.
3. ПОДОСТРЫЙ ТИРЕОИДИТ
Во время острой фазы вирусной инфекции щитовидной железы повышается продукция тиреоидного гормона, что приводит к преходящему тиреотоксикозу. Этот синдром назван “спонтанно проходящий гипертиреоз”. Вспомогательная терапия в этом случае включает такие препараты, как пропранолол, устраняющий тахикардию, и аспирин или другие НПВС для уменьшения местных болей и лихорадки. В тяжелых случаях для ликвидации воспаления могут потребоваться кортикостероиды.
4. ИСКУССТВЕННЫЙ ТИРЕОТОКСИКОЗ
Он возникает вследствие приема избыточного количества тиреоидных гормонов (как случайного, так и намеренного). Лечение состоит в использовании средств симптоматической терапии и прекращении введения препаратов в избыточно высоких дозах.
5. СПЕЦИАЛЬНЫЕ ПРОБЛЕМЫ
Тиреотоксический криз
Тиреотоксический криз — это внезапное обострение всех симптомов тиреотоксикоза, представляющее собой опасный для жизни синдром. Клинические проявления вариабельны по интенсивности, но все они отражают резко повышенный метаболизм и избыточную активность адренергической системы. Возникает лихорадка, часто сопровождающаяся приливами к лицу и потливостью. Обычно наблюдается тахикардия, нередко с фибрилляцией предсердий, высоким пульсовым давлением и иногда — с сердечной недостаточностью. Симптомы нарушений центральной нервной системы включают выраженную ажитацию, беспокойство, делирий и кому. Симптомы со стороны желудочно-кишечного тракта — это тошнота, рвота, диарея и желтуха. Из-за развития сердечной недостаточности и шока возможна смерть.
Обязательна энергичная терапия. Для купирования выраженных сердечно-сосудистых проявлений необходимо вводить пропранолол в дозе 1-2 мг внутривенно медленно или 40-80 мг внутрь каждые 6 часов. Если пропранолол противопоказан из-за выраженной сердечной недостаточности или астмы, гипертензию и тахикардию можно купировать дилтиаземом, который вводят внутрь в дозе 90-120 мг 3-4 раза в день или внутривенно 5-10 мг/ч (только для астматиков), а также с помощью резерпина (внутрь 1 мг каждые 6-12 часов) или гуане-тидина (внутрь 1-2 мг/кг в несколько приемов). Высвобождение щитовидной железой тиреоидных гормонов замедляется назначением 10 капель внутрь ежедневно насыщенного раствора калия йодида или 1 г внутрь ежедневно натрия иподата. Последний препарат будет также блокировать превращение Т4 в Тз на периферии. Синтез гормонов ингибируют назначением внутрь 250 мг каждые 6 часов пропилтиоурацила. Если пациент не способен принимать пропилтиоурацил через рот, может
быть приготовлена ректальная форма, которая назначается по 400 мг каждые 6 часов в виде клизм. Для ректального введения может также использоваться метимазол в дозе 25 мг каждые 6 часов1. Назначение гидрокортизона 50 мг внутривенно каждые 6 часов защитит пациента от развития шока и блокирует превращение в Т3, быстро снижая концентрацию тиреоактивных веществ в крови.
Для устранения лихорадки, предупреждения развития сердечной недостаточности или обострения сопутствующих заболеваний, которые могут провоцировать острый криз, необходима вспомогательная терапия. В редких ситуациях, когда описанные методы не устраняют возникающих проблем, для понижения уровня циркулирующего тироксина используют плазмаферез или перитонеальный диализ.
Офтальмопатия
Тяжелые формы офтальмопатии достаточно редки, и они трудно поддаются лечению. Для этого необходима эффективная терапия заболевания щитовидной железы, обычно полное ее удаление хирургическим путем или введением |3,1. Кроме того, может понадобиться местная терапия, например приподнятое положение головы во время сна для минимизации периорбитального отека и искусственные слезы для снижения сухости роговой оболочки. Для предотвращения прогрессирования офтальмопатии рекомендуется прекращение курения. При выраженных острых воспалительных реакциях может быть эффективным короткий курс преднизолона: 60-100 мг ежедневно внутрь в течение недели, затем 60-100 мг через день, снижая дозу в течение 6-12 недель. Если стероидная терапия не приносит улучшения или противопоказана, облучение задней стенки глазницы хорошо сфокусированными рентгеновскими лучами высокой энергии часто вызывает существенное улучшение при остром процессе. Угроза потери зрения является по
1 Приготовление ректальной формы пропилтиоурацила: для первой дозы 400 мг растворяют в 60 мл минерального масла Фл ита, для последующих клизм 400 мг растворяют в 60 мл фосфосоды Флита. Приготовление метимазола для ректального введения: метимазол (1200 мг) растворяют в 12 мл воды, куда добавляют смесь двух капель Span 80 в 52 мл масла какао, разогретого до 37 "С. Смесь перемешивают до состояния водно-масляной эмульсии, рвзливают в формы для свечей по 2.6 мл и охлаждают (Nabil, 1982).
казанием для хирургической декомпрессии глазной впадины. Для коррекции последствий устранения острого процесса могут потребоваться хирургические операции на веке или глазных мышцах.
Дермопатия
Дермопатия или микседема претибиальной области обычно поддается лечению местными кортикостероидами, они наносятся непосредственно на затронутую поверхность и закрываются давящей повязкой.
Тиреотоксикоз при беременности
В идеале женщинам в детородном возрасте с тяжелой формой заболевания должна быть проведена терапия ,311 или неполная тиреоидэктомия до возникновения беременности для предотвращения обострения заболевания в период вынашивания плода и после родов. Если тиреотоксикоз развивается во время беременности, радиоактивный йод противопоказан, так как он проникает через плацентарный барьер и может разрушить щитовидную железу плода. В течение первого триместра беременности пациентке может быть проведена подготовка пропилтиоурацилом и затем, во время второго триместра, возможна безопасная неполная тиреоидэктомия. Важно продолжать лечение тиреоидными гормонами в оставшийся период беременности. Однако в большинстве случаев больным назначают пропилтиоурацил в течение беременности, а решение относительно дальнейшего лечения откладывают на время после родов. Нужно придерживаться минимальных доз пропилтиоурацила, позволяющих контролировать заболевание (< 300 мг ежедневно), так как этот препарат может оказать влияние на щитовидную железу плода. Метимазол не рекомендуется из-за риска возникновения дефектов у плода.
Болезнь Грейвса у новорожденных
Болезнь Грейвса может возникнуть у новорожденных либо в связи с проникновен нем ’ГГ Г- R Ат| с пim. j через плаценту, что стимулирует щитовидную железу новорожденного, либо вследствие передачи ге -нетического дефекта плоду. Лабораторные исследования показывают повышение уровня свободного тироксина, значительно увеличенный уровень Т3
и низкую концентрацию ТТГ в сравнении с показателем здоровых младенцев, у которых уровень ТТГ повышается при рождении. ТТГ-R Ат[стим.] обычно обнаруживают в сыворотке и матери, и больного ребенка.
Если заболевание вызвано материнскими ТТГ-R Ат[стим.], оно обычно имеет самоограничи-вающий характер и постепенно затихает в течение 4-12 недель, что совпадает по времени со снижением уровня ТТГ-R Ат[стим.] у ребенка. Однако лечение необходимо, так как младенец подвергается сильному метаболическому стрессу. Терапия включает прием пропилтиоурацила 5-10 мг/кг/день, разделенный несколько раз с 8-часовыми интервалами, 1 каплю раствора Люголя (8 мг йодида) каждые 8 часов и 2 мг/кг/день пропранолола в несколько приемов. Необходима осторожная вспомогательная терапия. Если состояние ребенка очень тяжелое, назначают преднизолон внутрь в суточной дозе 2 мг/кг/день в несколько приемов, который блокирует превращение Т4 в Т3. При улучшении клинической картины дозу этого препарата постепенно снижают и через 6-12 недель его можно отменить.
Нетоксический зоб
Нетоксический зоб — это синдром увеличенной щитовидной железы без повышенной продукции тиреоидных гормонов. Увеличение щитовидной железы обычно происходит из-за усиления ТТГ-сти-муляции вследствие неадекватного синтеза тиреоидных гормонов. Наиболее частой причиной нетоксического зоба в мире является дефицит йода, но в США это прежде всего тиреоидит Хашимото. Реже к причинам заболевания можно отнести погрешности в диете, гормональные нарушения и новообразования.
Образование зоба в результате дефицита йода лучше всего предотвращается профилактическим назначением йодидов. Оптимальное количество ежедневно потребляемых йодидов составляет 150— 300 мкг. Йодированная соль и йодат, используемый в качестве консервантов в муке и хлебе, — прекрасные источники йода в пище. В районах, где сложно достать йодированную соль или йодаты, в качестве источника поступления неорганического йода может использоваться внутримышечное введение раствора йодированного масла маковых зерен.
Зоб, вызываемый потреблением зобогенных веществ с пищей, лечится прекращением их потреб
ления и добавлением достаточного количества тироксина для прекращения ТТГ-стимуляции. Аналогично, при тиреоидите Хашимото и дисгормоно-генезе адекватная терапия тироксином, 0.15-0.2 мг/день внутрь, будет подавлять выделение гипофизом ТТГ, что приводит к медленной регрессии зоба и коррекции гипотиреоза.
Новообразования щитовидной железы
Новообразования в щитовидной железе могут быть доброкачественными (аденомы) и злокачественными. Тонкоигольная аспирационная биопсия позволяет достоверно дифференцировать доброкачественное заболевание от злокачественного. Некоторые аденомы могут подвергаться обратному развитию при терапии тироксином; они не требуют повторной биопсии или хирургического удаления. При тиреоидной карциноме необходима почти полная тиреоидэктомия (в отдельных случаях — послеоперационная терапия радиоактивным йодом) и пожизненная заместительная терапия левотироксином.
Препараты
Тиреоидные средства
Левотироксин (генерик, Синтроид, Левотроид,
Левоксин)
Перорально: таблетки по 0.025, 0.05, 0.075, 0.088, 0.1, 0.112, 0.125, 0.137, 0.15, 0.175,0.2, 0.3 мг
Парентерально: 200, 500 мкг во флаконах (100 мкг/мл при растворении) для инъекций
Лиотиронин (генерик, Цитомел, Триостат) Перорально: таблетки по 5, 25, 50 мкг Парентерально: 10 мкг/мл
Лиотрикс [отношение Т4/Т3 равно 4:1] (Эутроид, Тиролар)
Перорально: таблетки по 12.5, 25, 30,50, 60, 100,120, 150, 180 мкг Т4 и '/ от этих количеств Т3
Щитовидная железа высушенная [USP] (генерик, Armour Thyroid, Thyroid Strong, Thyrar, S-P-T)
Перорально: таблетки по 15, 30, 60, 90,120, 180, 240,300 мг; капсулы (S-P-T) по 120, 180, 300 мг
Антитиреоидные средства
Натрия йодид (1311) (Йодотоп, Натрия йодид 1311 терапевтический)
Перорально: капсулы или раствор
Йопановая кислота* (Телепаква)
Перорально: таблетки по 500 мг
Натрия иподат* (Натрия Ораграфин, Биливист) Перорально: капсулы по 500 мг
Метимазол (Тапазол)
Перорально: таблетки по 5, 10 мг
Раствор калия йодида
Раствор (генерик, SSKI) 1 г/мл для приема внутрь
Раствор (раствор Люголя): 100 мг/мл
калия йодида + 50 мг/мл йода для приема внутрь
Сироп (Пима): 325 мг/5 мл
Таблетки (Йодо-Ниацин): 135 мг калия йодида + 25 мг ниацинамида гидройодида
Пропилтиоурацил [PTU] (генерик) Перорально: таблетки по 50 мг
Избранная литература
Bahn R. S. et al. Diagnosis and management of Graves’ ophtalmopathy. (Clinical Reviewes 13.) J. Clin. Endocrinol. Metab. 1990; 71:559.
Bastenie P. A., Bonnyns M., Vanhaelst L. Natural history of primary myxedema. Am. J. Med. 1985; 79:91.
Berghout A. et al. Comparison of placebo with L-thyro-xine alone or with carbimazole for treatment of sporadic nontoxic goiter. Lancet, 1990; 336:193.
Braverman L. E., Utiger R. D. (eds). Werner and Ingbar’s The Thyroid: A Fundamental and Clinical Text, 6th ed. Lippincott, 1991.
Franklyn J. A. The management of hyperthyroidism. N. Engl. J. Med. 1994; 300: 1731.
Greenspan F. S. The problem of the nodular goiter. Med. Clin. North Am. 1991; 19:195.
Greenspan F. S. Thyroid Gland. In: Basic & Clinical Endocrinology, 4th ed. Greenspan F. S., Baxter J. D. (eds). Appleton & Lange, 1993.
Greer M. A. (ed.). The Thyroid Gland. Comprehensive Endocrinology Series. Martini L. (ed.). Raven Press, 1990.
Robuschi G. et al. Hypothyroidism in the elderly. Endocr. Rev. 1987; 8:492.
Toft A. D. Thyroxine replacement therapy. Clin. Endocrinol. 1991; 34: 103.
Volpe R. Autoimmune thyroid disease. Endocrinol. Metab. Clin. North. Am. 1991; 20: 565.
* Данное показание к применению в инструкции к препарату не указано.
Адренокортикостероиды и их антагонисты
38
Алан Голдфин
Естественные адренокортикоидные гормоны являются стероидными молекулами, которые синтезируются и выделяются корой надпочечников. Как природные, так и синтетические кортикостероиды используются для диагностики и терапии нарушений функции надпочечников. Их также применяют (более часто и в гораздо более высоких дозах) при различных воспалительных процессах и заболеваниях иммунной системы.
Секреция адренокортикостероидов контролируется посредством высвобождения гипофизом кортикотропина, или адренокортикотропного гормона (АКТГ). На секрецию натрийзадерживающего гормона альдостерона оказывает влияние ангиотензин.
Кортикотропин обладает некоторыми эффектами, которые не зависят от его влияния на секрецию андренокортикоидов. Однако его фармакологическое значение как противовоспалительного средства и его использование для определения функционального состояния надпочечников зависят от его трофического действия. Фармакология АКТГ обсуждалась в главе 36 и будет еще раз рассматриваться совместно с фармакологией гормонов коры надпочечников.
При лечении некоторых опухолей необходимы антагонисты синтеза или действия адренокортикостероидов. Эти вещества будут рассмотрены в конце данной главы.
Адренокортикостероиды
Кора надпочечников выделяет в кровеносное русло большое число стероидов. Некоторые из них имеют минимальную биологическую активность и функционируют в основном как предшественники, среди них есть и такие, функция которыхчге установлена. Гормональные стероиды можно классифи-
цировать по их эффекту: оказывающие выраженный эффект на промежуточный метаболизм (глюкокортикоиды), обладающие преимущественно на-трийзадерживающей активностью (минералокортикоиды), а также андрогенной или эстрогенной активностью (глава 39). У людей основной глюкокортикоид — это кортизол, а основной минералокортикоид — альдостерон. По объему секреции основным андрогеном является дегидроэпиандростерон (ДГЭА), так как ежедневно секретируется около 20 мг этого гормона, частично в виде сульфата. Однако как ДГЭА, так и андростендион обладают очень слабыми андрогенными свойствами. Надпочечники выделяют небольшое количество тестостерона, андрогенное действие которого более существенно. Мало известно об эстрогенах, секретируемых надпочечниками. Тем не менее показано, что небольшие количества тестостерона и андростендиона в неэндокринных тканях могут превращаться в эстрон и что они являются основным эндогенным источником эстрогенов у женщин в постменопаузном периоде, а также у некоторых больных с нарушением функции яичников.
Природные глюкокортикоиды, кортизол (гидрокортизон)
Фармакокинетика
Кортизол — это основной глюкокортикоид у людей. Он синтезируется из холестерина (рис. 38-1) клетками сетчатой и пучковой зон и под влиянием АКТГ выделяется в кровь. Механизм, контролирующий его секрецию, описан в главе 36.
У здоровых взрослых людей при отсутствии стресса ежедневно секретируется 10-20 мг кортизола. Уровень секреции изменяется в соответствии
Холестерин
(АКТГ?)
Ацетат
С=О
•...НДЦФ-Н
17а-Гидроксилаза
СНз НАДФ-Н, О2
СНз 0 = 0
-ОН
17-Гидрокси-прегненолон
СНз
О
Дигидрозпи-андростерон
О
11 p-Гидроксилаза >
надф-н,о2 >
СН2ОН СНОС = О
Альдостерон
Прегненолон
НО
21 р-Гидроксилаза НАДФ-Н,О2
СНз
С = 0
Зр-Дегидрогеназа Д5,Д4-Изомераза НАД*
О
С = О г-ОН
11-Дезокси-кортикостерон
СН2ОН °
Прогестерон
СН2ОН 0
С = О
17-Гидрокси-прогестерон
СНгОН 0
С = О
Г- ОН
Д4-Андростен-13,17-дион
Кортикостерон
Минералокортикоидный путь
1 ip-Дезокси-кортизол
СН2ОН
Тестостерон
О
г-ОН
Кортизол
Эстрадиол
Глюкокортикоидный Путь образования андрогенов
путь и эстрогенов
Рис. 38-1. Схема основных путей биосинтеза гормонов коры надпочечников. Выделены главные секретируемые вещества. Прегненолон — основной предшественник кортикостерона и альдостерона, 17-гидроксипрегненолон — предшественник кортизола. Ферменты и кофакторы реакций показаны слева и вверху рисунка. При дефиците конкретного фермента продукция гормона блокируется в точках, обозначенных заштрихованными полосами. (По: Welikey et al. Из: Ganong W.F.: Review of Medical Physiology, 15th ed. Appleton & Lange, 1991.)
с циркадным ритмом, который управляется колебаниями концентрации АКТГ, достигающей максимума в ранние утренние часы и после приема пищи. Секреция АКТГ зависит от освещенности (рис. 38-2). В плазме кортизол связывается с белками. Кор-тикостероидсвязывающий а2-глобулин (КСГ), синтезируемый печенью, в норме связывает 75 % гормона. Оставшаяся часть находится в свободной форме (примерно 20 %) или слабо связана с альбуминами (примерно 5 %) и способна воздействовать на клетки-мишени. Когда концентрация кортизола в плазме превышает 20-30 мкг/дл, происходит насыщение КСГ и концентрация свободного корти
зола быстро повышается. Содержание КСГ увеличивается при беременности и приеме эстрогенов, которые активизируют его синтез в печени, а также при гипертиреозе. Его концентрация снижается при гипотиреозе, генетических нарушениях синтеза и при дефиците белков. Альбумины имеют большую емкость, но низкий аффинитет к кортизолу. С альбуминами в основном связываются синтетические стероиды, например дексаметазон.
Период полувыведения кортизола из крови обычно составляет около 60-90 минут, он может увеличиваться при назначении больших доз гидрокортизона (фармацевтический препарат кортизола), при
5. Заказ 3252
8
о>
Легкая Легкая
J200 ^180 §fl60 W S 140 В о 120 § 100
80
. 60 . 40
20
0‘............................
Полдень 1600 20°° Середина 400
-i25
-20
- 15
10
Зеетрак
I i со §
I
Illi 800 Полдень
5
5
£ о I
ночи
Рис. 38-2. Колебания концентрации АКТГ и глюкокортикоидов в плазме в течение дня у здоровой девочки 16 лет. Концентрация АКТГ измеряласьиммунологичес-кими методами, а глюкокортикоидов — по содержанию 11-оксистероидов. Обратите внимание на подъем концентрации АКТГ и глюкокортикоидов в утренние часы перед пробуждением (Из: Krieger D.T. et al.: Characterization of the normal temporal pattern of plasma corticosteroid levels. J. Clin. Endocrinol. Metab. 1971; 32; 266.)
стрессе, гипотиреозе или заболеваниях печени. Только 1% экскретируется с мочой в неизменном виде. Примерно 20 % кортизола под действием 11-гидроксистероиддегидрогеназы в почках и других тканях, имеющих минералокортикоидные рецепторы, превращается в кортизон до того, как гормон попадает в печень. Большая часть кортизона и оставшегося кортизола инактивируется в печени за счет восстановления двойной связи 4,5 кольца А и последующего превращения под действием 3-гидроксистероиддегидрогеназы в тетрагидрокортизол и тетрагидрокортизон. Частично происходит превращение в кортол и кортолон при восстановлении кетона при С20. В небольших количествах обнаруживаются и другие метаболиты. У 5-10 % кортизола боковая цепочка (при С20 и С21) отщепляется, а образующиеся соединения в дальнейшем метаболизируются и выводятся в мочу в виде 11 -окси-17-кетостероидов. В печени эти метаболиты присоединяют глюкуроновую кислоту или сульфат, соответственно к гидроксильным группам у СЗ или С21, возвращаются в циркуляцию и экскретируются почками.
У некоторых видов животных (например, у крыс) основным глюкокортикоидом является кор
тикостерон. Он менее прочно связывается с белками и поэтому быстрее метаболизируется. Пути его деградации сходны с таковыми для кортизола.
Фармакодинамика
А. Механизм действия. После проникновения в ткани глюкокортикоиды диффундируют или транспортируются через клеточные мембраны и связываются с цитоплазматическим комплексом, состоящим из глюкокортикоидного рецептора и белка теплового шока. Белок теплового шока высвобождается, и комплекс гормон-рецептор транспортируется в ядро, где взаимодействует с глюкокортикоидными эффекторными элементами (GRE) на различных генах и с другими регуляторными белками (специфичными для разных клеток), которые стимулируют или ингибируют их экспрессию. В отсутствие гормона связывание рецепторного белка с ДНК подавлено; таким образом, гормон вызывает реактивацию всей системы. Различия в действии глюкокортикоидов на разные ткани определяются другими тканеспецифичными белками, которые также должны связаться с геном, чтобы обеспечить экспрессию конкретного GRE.
Кроме того, глюкокортикоиды дают некоторые эффекты (например, ингибирование “быстрой обратной связи”), которые развиваются слишком быстро и не могут быть объяснены экспрессией генов. Эти эффекты могут быть опосредованы нетранс-крипторными механизмами.
Б. Физиологические эффекты. Глюкокортикоиды дают множество эффектов, так как влияют на большинство клеток организма. Основные метаболические последствия секреции глюкокортикоидов или их введения определяются прямым действием этих гормонов на клетку. Однако некоторые важные эффекты являются результатом гомеостатических реакций, опосредованных инсулином и глюкагоном. Хотя многие из этих эффектов дозозависи-мы и становятся весьма выраженными лишь при введении в терапевтических целях больших доз, существуют также и “пермиссивные” эффекты. Другими словами, многие нормальные реакции, которые проявляются только в присутствии кортикоидов, не стимулируются в большей степени при увеличении дозы кортикоидов. Например, чувстви-* тельность сосудов и бронхов к катехоламинам снижена при отсутствии кортизола и восстанавливается физиологическим количеством этого глюкокор
тикоида. Липолитическая реакция жировых клеток на катехоламины, АКТГ и гормон роста также снижена в отсутствие глюкокортикоидов. Механизм этого явления пока не определен.
В. Метаболические эффекты. Глюкокортикоиды оказывают выраженное дозозависимое действие на метаболизм углеводов, белков и жиров. С этими эффектами связаны некоторые серьезные побочные реакции использования гормонов в терапевтических дозах. Глюкокортикоиды стимулируют глюконеогенез и необходимы для его осуществления при диабете и голодании. Они увеличивают также захват аминокислот печенью и почками и повышают активность ферментов глюконеогенеза.
В печени глюкокортикоиды усиливают депонирование гликогена, стимулируя активность глико-генсинтетазы и синтез глюкозы из продуктов белкового обмена. Повышение содержания глюкозы в крови активизирует выделение инсулина.
Глюкокортикоиды подавляют захват глюкозы жировыми клетками, что приводит к активации липолиза. Однако упомянутое уже увеличение секреции инсулина стимулирует липогенез, что в результате ведет к накоплению жира.
Итог этих эффектов наиболее очевиден при голодании, когда снабжение глюкозой за счет глюконеогенеза, высвобождение аминокислот в процессе мышечного катаболизма, подавление захвата глюкозы на периферии и стимуляция липолиза способствуют поддержанию адекватного снабжения мозга глюкозой.
Г. Катаболический эффект. Хотя глюкокортикоиды стимулируют синтез РНК и белков в печени, они оказывают катаболическое действие в лимфоидной и соединительной ткани, мышцах, жировой ткани и коже. Превышение физиологической нормы глюкокортикоидов приводит к снижению мышечной массы и слабости. Катаболический эффект в костной ткани может вызывать остеопороз при синдроме Кушинга и является главным фактором, ограничивающим длительную терапию глюкокортикоидами. Катаболический эффект избыточных количеств глюкокортикоидов может подавлять рост детей. Этот эффект не предотвращается назначением гормона роста.
Д. Противовоспалительное и иммунодепрессивное действие. Глюкокортикоиды обладают способностью существенно подавлять проявления воспаления. Это связано с их выраженным дей
ствием на концентрацию, распределение и функцию периферических лейкоцитов и подавлением активности фосфолипазы А2. После однократного введения глюкокортикоида короткого действия повышается концентрация нейтрофилов, тогда как количество циркулирующих в крови лимфоцитов (Т- и В-клеток), моноцитов, эозинофилов и базофилов снижается. Такие изменения максимальны через 6 часов и исчезают через 24 часа. Повышение числа нейтрофилов происходит как за счет увеличения их поступления из костного мозга, так и за счет ограничения миграции из кровеносных сосудов, что приводит к снижению количества клеток в месте воспаления. Уменьшение числа циркулирующих лимфоцитов, моноцитов, эозинофилов и базофилов является результатом их перемещения из сосудистого русла в лимфоидную ткань.
Глюкокортикоиды подавляют функции лейкоцитов и тканевых макрофагов: способность этих клеток реагировать на антигены и митогены снижается. Особенно выражено воздействие на макрофаги, что ограничивает их способность фагоцитировать и убивать микроорганизмы, вырабатывать интерлейкин-1, пироген, коллагеназу, эластазу, фактор некроза опухоли и активатор плазминогена. Лимфоциты производят меньше интерлейкина-2. Существуют данные, хотя и противоречивые, что глюкокортикоиды в высоких дозах стабилизируют лизосомальные мембраны, снижая тем самым концентрацию протеолитических ферментов в месте воспаления.
В дополнение к их действию на функцию лейкоцитов глюкокортикоиды влияют на процесс воспаления, подавляя связанный с активацией фосфолипазы А2 синтез простагландинов и лейкотриенов. Глюкокортикоиды повышают концентрацию тех мембранных фосфолипидов, которые угнетают синтез простагландинов и лейкотриенов. Кортикостероиды также увеличивают концентрацию липокортинов, которые входят в отдельную группу белков, снижающих доступность фосфолипидных субстратов для фосфолипазы А2. Наконец, глюкокортикоиды способны снижать экспрессию циклооксигеназы, уменьшая таким образом количество фермента для выработки простагландинов. Недавние исследования показали, что существуют гены для двух изоформ циклооксигеназы: СОХ I и СОХ II (глава 18). Глюкокортикоиды, по-видимому, подавляют экспрессию СОХ II — фер
мента, в большей степени вовлеченного в реализацию воспалительных эффектов эйкозаноидов. Действие глюкокортикоидов на экспрессию СОХ I намного слабее.
При непосредственной аппликации на сосуды глюкокортикоиды вызывают вазоконстрикцию. Подавляя активность кининов и бактериальных токсинов, ограничивая высвобождение гистамина базофилами, они снижают проницаемость капилляров.
Антииммунное действие глюкокортикоидов основано на уже описанных эффектах. У людей не затрагивается активация комплемента, но его эффекты подавляются. Продукция антигенов может быть снижена высокими дозами стероидов, хотя не изменяется под действием средних доз (20 мг преднизолона в день). Тем не менее подавление продукции и эффектов интерлейкина-2 и блокада эффектов фактора, ингибирующего миграцию макрофагов, ослабляют реакции гиперчувствительности замедленного типа. Эффективность этих стероидов для предотвращения отторжения трансплантатов увеличивается благодаря их способности снижать высвобождение антигенов из пересаженной ткани, замедлять реваскуляризацию и препятствовать сенситизации вырабатывающих антитела клеток.
Противовоспалительное и иммуносупрессивное действие этих веществ широко используют в терапии, хотя оно же является и причиной некоторых наиболее серьезных побочных эффектов.
Е. Другие эффекты. Глюкокортикоиды оказывают важное действие на нервную систему. Надпочечниковая недостаточность значительно замедляет a-ритм на ЭЭГ. Повышенное количество гормонов снижает порог вызваемые электрошоком судорог у крыс и часто провоцирует нарушение поведения у людей. Большие дозы глюкокортикоидов иногда могут вызывать повышение внутричерепного давления (псевдоопухоли мозга).
Глюкокортикоиды подавляют высвобождение гипофизом АКТГ и 0-липотропина, но не снижают уровень циркулирующего 0-эндорфина (глава 36). Они угнетают также секрецию ТТГ и ФСГ.
Большие дозы глюкокортикоидов стимулируют избыточную продукцию кислоты и пепсина в желудке и способствуют развитию пептической язвы. Они усиливают всасывание жиров и, по-видимому, уменьшают влияние витамина D на всасывание кальция. Глюкокортикоиды оказывают важное дей
ствие на систему гемопоэза. Помимо уже описанного действия на лейкоциты, они повышают количество эритроцитов и тромбоцитов.
При недостатке кортизола нарушается функция почек (особенно клубочковая фильтрация) и снижается выведение жидкости.
Глюкокортикоиды оказывают некоторое действие на развитие плода. Они активируют структурные и функциональные изменения в легких в конце беременности, включая продукцию необходимого для дыхания легочного поверхностно-активного вещества — сурфактанта.
Синтетические
адренокортикостероиды
АКГГ и стероиды, обладающие глюкокортикоидной активностью, стали необходимыми для терапии различных воспалительных и аллергических заболеваний препаратами. Это стимулировало создание большого числа синтетических стероидов с противовоспалительной активностью.
Фармакокинетика
А. Источник. Хотя естественные кортикостероиды можно получать из надпочечников животных, их обычно синтезируют из холевой кислоты (получаемой из крупного рогатого скота) или стероидных сапогенинов, в частности дпосгенина, который найден в растениях семейств Liliaceae и Dioscoreaceae. Дальнейшая модификация этих стероидов привела к появлению на рынке большой группы синтетических стероидов с особыми свойствами, которые важны для фармакологии и терапии (табл. 38-1, рис. 38-3).
Б. Метаболизм. Синтетические кортикостероиды для приема внутрь (табл. 38-1) в большинстве случаев всасываются быстро и полностью. Хотя в целом они транспортируются и метаболизируются так же, как и эндогенные стероиды, существуют важные отличия. Видоизменения молекул влияют на их сродство к глюкокортикоидным и минералокортикоидным рецепторам, а также на способность связываться с белками, стабильность боковых цепей, скорость разрушения и характер продуктов метаболизма. Галогенирование в положении 9, ненасыщенность связи D1-2 кольца А и метилирование по С2 или С16 увеличивают период полувыведения
ТАБЛИЦА 38-1. Некоторые широко используемые препараты естественных и синтетических кортикостероидов
Препарат Активность1 Эквивалентные Имеющиеся
Противовоспалительная Поверхностная Задержка натрия пероральные дозы (мг) лекарственные формы
Глюкокортикоиды короткой и средней продолжительности действия Гидрокортизон (кортизол) Кортизон Преднизон Преднизолон ФлюокортОлон2 Метилпреднизолон Мепреднизон2 Глюкокортикоиды средней длительности действия Триамцинолон Параметазон2 Флупреднизолон Глюкокортикоиды длительного действия Бетаметазон Дексаметазон Минералокортикоиды Флудрокортизон Дезоксикортикостерона ацетат 1 0.8 4 5 5 5 5 10 15 25-40 30 10 0 1 0 0 4 5 5* 7 10 10 10 0 1 0.8 0.3 0.3 0 0 0 0 0 0 0 250 20 20 25 5 5 5 4 4 4 2 1.5 0.6 0.75 2 Пероральная, инъекционная, местная Пероральная, инъекционная, местная Пероральная Пероральная, инъекционная, местная Пероральная, местная Пероральная, инъекционная, местная Пероральная, инъекционная Пероральная, инъекционная, местная Пероральная, инъекционная Пероральная Пероральная, инъекционная, местная Пероральная, инъекционная, местная Пероральная, инъекционная, местная Инъекционная, гранулы
' Активность относительно гидрокортизона. 2 В США не применяется. • Для ацетонида до 100.
более чем на 50 %. Наличие гидроксильной группы в положении 11 также замедляет деструкцию, так как период полувыведения И-дезоксикортизола в 2 раза меньше, чем у кортизола. D1-соединения экскретируются в свободном виде. В некоторых случаях вещество является пролекарством, например преднизон, который в организме быстро превращается в преднизолон.
Фармакодинамика
Действие синтетических стероидов сходно с эффектами кортизола. Они связываются со специфическими внутриклеточными рецепторными белками и вызывают те же эффекты, но обладают различным соотношением глюкокортикоидной и минералокортикоидной активности (табл. 38-1).
Гидрокортизон
СН2ОН
Бетаметазон
Триамцинолон (ацетонидная часть затемнена)
Рис. 38-3. Химическая структура некоторых глюкокортикоидов. Ацетонидзамещенные производные (например, триамцинолона ацетонид) являются поверхностно-активными веществами и используются в дерматологии
Клиническая фармакология
А. Диагностика и лечение нарушенной функции надпочечников:
1. Недостаточность коры надпочечников.
а. Хроническая недостаточность (болезнь Аддисона). Хроническая адренокортикальная недостаточность характеризуется гиперпигментацией, слабостью, усталостью, снижением массы тела, гипотензией и неспособностью поддерживать концентрацию глюкозы во время голодания. У таких больных минимальное повреждающее, травматическое воздействие или инфекция могут вызвать острую надпочечниковую недостаточность, шок и, наконец, смерть.
При первичной надпочечниковой недостаточности и после удаления надпочечников необходимо назначать 20-30 мг кортизола в день с повышением дозы в периоды стресса. Хотя кортизол обладает некоторой минералокортикоидной активностью, его назначение должно сопровождаться приемом достаточного количества задерживающего натрий гормона, например флудрокортизона. Именно поэтому
глюкокортикоиды, лишенные натрийзадерживаю-щей активности, не используются у таких больных.
б. Острая недостаточность. При подозрении на острую надпочечниковую недостаточность лечение должно начинаться немедленно. Помимо назначения больших парентеральных доз кортизола, терапия включает коррекцию содержания жидкости и электролитов и вызывающих недостаточность факторов.
Кортизола гемисукцинат или фосфат вводят внутривенно в дозе 100 мг каждые 6-8 часов до стабилизации состояния. В дальнейшем дозу снижают постепенно в течение пяти дней до достижения поддерживающей. Назначение натрийсберегающе-го гормона прекращают, когда суммарная доза кортизола снижена до 50 мг в день.
2. Гиперфункция надпочечников.
а. Врожденная гиперплазия надпочечников. Эта группа заболеваний характеризуется специфическим дефектом синтеза кортизола. У беременных с высокой вероятностью врожденной гиперплазии надпочечников плод может быть защищен от возникновения патологии половых органов назначением матери дексаметазона. Наиболее часто встреча
ющимся дефектом является снижение или отсутствие активности Р-450с21 (21р-гидроксилазы)*. Как показано на рис. 38-1, это приводит к угнетению синтеза кортизола и вызывает компенсаторное увеличение высвобождения АКТГ. При достаточной активности ферментов в ответ на повышенный уровень АКТГ продуцировалось бы нормальное количество кортизола, но в данном случае возникает гиперплазия железы и синтезируется ненормально большое количество предшественников, в частности 17-гидроксипрогестерона, который может метаболизироваться по андрогенному пути, приводя к вирилизации. В результате дальнейших метаболических превращений в печени это вещество конвертируется в прегнанэтриол, экскретируемый в больших количествах с мочой, что используют для диагностики заболевания.
При дефекте 11-гидроксилирования продуцируется большое количество дезоксикортикостерона и возникает выраженная гипертензия. Нарушение в надпочечниках и гонадах процесса 17-гидроксилирования приводит к гипогонадизму. В то же время синтезируется повышенное количество 11 -дезоксикортикостерона и обнаруживаются симптомы, связанные с избыточной минералокортикоидной активностью, прежде всего гипертензия и гипокалиемия.
У детей врожденная гиперплазия надпочечников впервые может проявиться развитием приступа острой надпочечниковой недостаточности. Ее необходимо купировать уже описанным способом, используя внутривенное введение кортизола, минералокортикоидов и, если потребуется, соответствующих электролитных растворов. После стабилизации состояния пациента начинают вводить гидрокортизон в дозе 12-18 мг/м2 в день, разделенной на три приема. Затем дозу уточняют с целью сохранения нормального роста и развития костей и предотвращения превышения нормальной концентрации андрогенов. Используют и чередование гидрокортизона с преднизоном через день. Пациентам с повышенной потерей солей требуется введение внутрь 0.05-0.1 мг/день флудрокортизона и добавление солей для сохранения нормального кровяного давления, электролитного баланса и активности ренина в плазме. *
• Названия ферментов синтеза надпочечниковых стероидов:
Р-450с11 (1 ф-гидроксилаза);
Р-450с17 (17а-гидроксилаза);
Р-450с21 (21р-гидроксилаза).
б. Синдром Кушинга. Синдром Кушинга обычно является следствием двусторонней гиперплазии надпочечников, вторичной по отношению к аденоме гипофиза (болезнь Кушинга), но иногда возникает в результате опухоли или узелковой гиперплазии надпочечников или эктопической продукции АКТГ другими опухолями. Его проявления связаны с повышением уровня глюкокортикоидов. При выраженных изменениях у больного наблюдается круглое, полнокровное лицо, ожирение туловища. В целом обнаруживаются проявления потери белков: снижение мышечной массы, истончение кожи, стрии, быстрое возникновение синяков, медленное заживление ран и остеопороз. К другим серьезным нарушениям относятся расстройства психики, гипертензия и диабет. Это заболевание лечат путем хирургического удаления опухоли, продуцирующей гормон, радиационной терапией или удалением микроаденомы гипофиза, продуцирующей АКТГ, а также резекцией гиперпластических надпочечников. Такие пациенты должны получать высокие дозы кортизола во время и после операции. В день операции 300 мг растворимого гидрокортизона вводят в виде длительной внутривенной инфузии. Дозу необходимо понижать до нормального заместительного уровня медленно, так как быстрое снижение может вызывать лихорадку и боли в суставах. После удаления надпочечников проводится длительная поддерживающая терапия, аналогичная описанной для лечения надпочечниковой недостаточности.
в. Альдостеронизм. Первичный альдостеронизм обычно является следствием повышенной продукции альдостерона аденомой надпочечников. Однако это может быть и результатом усиления секреции гиперпластической железы или развития злокачественной опухоли. Клинические проявления, заключающиеся в гипертензии, полиурии, полидипсии, слабости и тетании, связаны с продолжительной почечной потерей калия, которая приводит к гипокалиемии, алкалозу и гипернатриемии. Этот синдром может быть вызван также нарушением биосинтеза стероидов в надпочечниках, а именно повышенной секрецией дезоксикортикостерона, кортикостерона или 18-гидроксикортикостерона.
В отличие от больных с вторичным альдостеронизмом у этих пациентов имеет место снижение концентрации ангиотензина II и активности ренина в плазме. При введении дезоксикортикостерона ацетата (20 мг/день внутримышечно в течение 3
дней) или флудрокортизона (0.2 мг внутрь два раза в день в течение 3 дней) у этих больных не отмечается усиления задержки натрия и существенного снижения секреции альдостерона. При лечении спиронолактоном наблюдается значительное улучшение, что имеет диагностическое и терапевтическое значение.
3. Использование глюкокортикоидов для диагностических целей. Иногда для выяснения источника определенного гормона или способности АКТГ влиять на его продукцию необходимо подавить секрецию АКТГ. Применение с этой целью очень активного препарата дексаметазона имеет большие преимущества, так как использование малых доз снижает вероятность ошибок при интерпретации результатов гормональных исследований в моче и крови. Например, если полное подавление секреции АКТГ достигается при использовании 50 мг кортизола, то содержание 17-гидроксикорти-костероидов в моче (одна треть от полученной дозы) составит 15-18 мг/сут. Если применить эквивалентную дозу дексаметазона (1.5 мг), экскреция с мочой составит только 0.5 мг/сут при низком уровне гормона в крови.
Дексаметазоновый подавляющий тест используют для диагностики синдрома Кушинга, а также для дифференциальной диагностики депрессивных состояний в психиатрии. С этой целью дексаметазон в дозе 1 мг/кг назначается внутрь в 11 часов вечера, а утром забирают пробу плазмы. У здоровых испытуемых концентрация кортизола не превышает 5 мкг/дл, тогда как при синдроме Кушинга этот уровень обычно выше 10 мкг/дл. При депрессии, тревоге, болезни и других стрессовых состояниях результаты теста ненадежны. Однако декса-метазоновая проба позволяет отличить больных, которым диагноз синдрома Кушинга установлен клинически и подтвержден высоким уровнем свободного кортизола в моче, от больных с гормон-продуцирующими опухолями коры надпочечников и с синдромом эктопической продукции АКТГ. Для этого дексаметазон в дозе 2 мг принимают перорально каждые 6 часов в течение двух дней с последующим определением уровня кортизола или его метаболитов в моче. Второй метод заключается в однократном приеме 8 мг дексаметазона в 11 часов вечера с определением концентрации кортизола в плазме крови в 8 часов утра следующего дня. У больных с болезнью Кушинга дексаметазон обычно вызывает снижение содержания гормона на 50 %.
Сочетание неизмененной концентрации кортизола с низкой концентрацией АКТГ свидетельствует о наличии у больного кортизолпродуцирующей опухоли, а с высокой концентрацией АКТГ — об эктопической продукции АКТГ опухолью.
Подавление активности надпочечников глюкокортикоидами и яичников эстрогенами можно использовать для определения источника продукции андрогенов у женщин при гирсутизме, если измерить концентрацию андрогенов до и во время назначения гормона.
Б. Адренокортикостероиды и стимуляция развития легких у плода. Развитие легких у плода регулируется фетальной продукцией кортизола. Лечение матери большими дозами глюкокортикоидов снижает частоту возникновения синдрома дыхательного дистресса у недоношенных младенцев. При преждевременных родах в срок до 34 недель беременности обычно назначают 12 мг бетаметазона и затем дополнительно 12 мг через 18-24 часа. Этот кортикостероид в меньшей степени связывается с белками, чем кортизол, что позволяет усилить его проникновение через плаценту к плоду. Концентрация кортикостероидов у плода достигает уровня, эквивалентного наблюдаемому при стрессе плода.
В. Адренокортикоиды и ненадпочечниковые заболевания. Кортизол и его синтетические аналоги применяют для лечения различных групп заболеваний, не связанных с какими-либо известными нарушениями функции надпочечников (табл. 38-2). Использование кортикостероидов при этих заболеваниях определяется их способностью подавлять воспалительные и иммунные реакции. Эти вещества полезны в том случае, если данные реакции являются основными проявлениями заболевания. Если же воспалительный и иммунный ответ необходимы для подавления патологического процесса, назначение кортикостероидов может быть опасно, однако целесообразно сочетать прием кортикостероидов со специфической терапией заболевания для предотвращения необратимых нарушений, вызываемых воспалительным процессом.
Так как кортикостероиды обычно не устраняют причину заболевания, патологический процесс может прогрессировать, хотя его проявления будут подавлены. Поэтому длительную терапию этими препаратами нужно применять с большой осторожностью и только тогда, когда серьезность заболевания требует их использования, а все менее опасные методы не дали эффекта.
ТАБЛИЦА. 38-2. Некоторые показания к применению глюкокортикоидов, не связанные с заболеваниями надпочечников
Нарушения Примеры
Аллергические реакции Ангионевротический отек, астма, укусы пчел, контактный дерматит, реакции на лекарства, аллергические риниты, сывороточная болезнь, кожные высыпания
Коллагенозы Гигантоклеточный артериит, красная волчанка, смешанные синдромы поражения соединительной ткани, полимиозиты, ревматическая полимиалгия, ревматоидный артрит, темпоральный артериит
Заболевания глаз Острый увеит, аллергический конъюнктивит, воспаление сетчатки, неврит зрительного нерва
Заболевания желудочно-кишечного тракта Гематологические нарушения Воспалительное заболевание кишечника, глютеновая энтеропатия, подострый некроз печени Приобретенная гемолитическая анемия, острая аллергическая пурпура, лейкозы, аутоиммунная гемолитическая анемия, идиопатическая тромбоцитопеническая пурпура, множественная миелома
Инфекции Грамотрицательная септицемия; иногда используются для подавления сильного воспаления
Воспаление костей и суставов Неврологические заболевания Артриты,бурситы,тендосиновиты Отек мозга (после операций на мозге назначают большие дозы дексаметазона для предотвращения отека мозга в послеоперационном периоде), множественный склероз
Трансплантация органов Пульмонологические заболевания Предотвращение отторжения (иммунодепрессия) Аспирационная пневмония, бронхиальная астма, предотвращение младенческого синдрома респираторного дистресса, саркоидоз
Заболевания почек Кожные заболевания Нефротический синдром Атопический дерматит, дерматозы, простой хронический лишай (локализованный нейродерматит), грибковые микозы, пузырчатка, себорейные дерматиты, кератозы
Заболевания щитовидной железы Другие состояния Злокачественный экзофтальм, подострый тиреоидит Гиперкальциемия, горная болезнь
Необходимо пытаться контролировать патологический процесс короткодействующими глюкокортикоидами, а также применять вспомогательные средства для уменьшения дозы гормонов. По возможности используют альтернирующую терапию. Нельзя резко снижать или прекращать прием препарата. Если предполагается длительное лечение, делают рентгенограмму грудной клетки и проводят туберкулиновую пробу. Исключают наличие сахарного диабета, пептических язв, остеопороза и психических нарушений, оценивают состояние сердечно-сосудистой системы.
Необходимо принять следующие вспомогательные меры: для предотвращения электролитных нарушений обогатить диету калием и снизить в ней
содержание натрия; для предотвращения ожирения проводить контроль калорийности диеты, а повышенное разрушение белков в результате активации глюконеогенеза компенсировать достаточным их поступлением. Пациенты со склонностью к заболеваниям желудка должны принимать антациды три или четыре раза в день. При приеме кортикостероидов трудно предотвратить возникновение остеопороза: он вызван подавлением остеогенеза при сохранении резорбции костной ткани на неизменном уровне, что не связано с изменением функции паратиреоидного гормона и витамина D. Для ограничения остеопороза, вызванного глюкокортикоидами, рекомендуются физиотерапия и андрогены, но их эффективность не доказана.
Токсичность
Эффективность глюкокортикоидов варьирует в широких пределах. Учитывая их сильное поливалентное действие, для конкретного пациента должна быть тщательно взвешена потенциальная выгода лечения. Главные отрицательные эффекты глюкокортикоидов связаны с их гормональным действием и приводят к клинической картине ятрогенного синдрома Кушинга.
При непродолжительном использовании (менее 1 недели) даже умеренно больших доз глюкокортикоидов серьезные отрицательные эффекты обычно не проявляются. Однако иногда после нескольких дней лечения наблюдаются изменения поведения и возникают острые пептические язвы.
А. Метаболические эффекты. У большинства больных, получающих кортизол в дневной дозе 100 мг или более (или эквивалентное количество синтетических стероидов) дольше двух недель, возникает комплекс нарушений, называемых ятрогенным синдромом Кушинга. Скорость развития изменений зависит от дозы. Изменяется внешность: лицо округляется, становится одутловатым и отечным. Происходит перераспределение жира с конечностей на туловище и лицо. Усиливается рост тонких волос на бедрах, теле и иногда — на лице. Могут появиться угри или увеличиться их количество. Отмечаются бессонница и повышенный аппетит. При опасных или вызывающих инвалидизацию заболеваниях эти изменения не являются показанием к прекращению терапии. Однако скрытые метаболические дефекты, сопровождающие их, могут быть достаточно серьезными еще до того, как станут очевидными. Продолжающееся разрушение белков и использование аминокислот для продукции глюкозы повышает потребность в инсулине и через некоторое время проявляется в увеличении массы тела, отложении жира, потере мышечной массы, истончении кожи, образование стрий и кровоподтеков, гипергликемии и в конечном итоге — остеопорозе, диабете и асептическом некрозе бедра. В этих условиях нарушается также процесс заживления ран. Возникающий диабет лечат с помощью диеты и инсулином. Такие больные часто резистентны к инсулиновой терапии, но кетоацидоз возникает редко. В общем случае пациентов, получающих кортикостероиды, держат на высокобелковой диете с повышенным содержанием калия, назначая им при необходимости анаболические стероиды.
Б. Другие осложнения. К другим серьезным побочным эффектам относятся пептические язвы и их осложнения. При использовании больших доз кортикостероиды могут маскировать клинические проявления других заболеваний, особенно бактериальных и грибковых инфекций, что требует тщательного наблюдения за больными. У некоторых пациентов развиваются миопатии, природа которых неизвестна. Частота миопатий выше при лечении три-амциналоном. При назначении этого средства (как и метилпреднизолона) иногда возникают тошнота, головокружение и уменьшение массы тела. Эти явления требуют замены препаратов, снижения доз и повышения потребления калия и белков.
У больных, особенно получающих высокие дозы кортикостероидов, возможны психозы. Длительная терапия приводит к развитию задней посткапсулярной катаракты. Таким пациентам рекомендованы периодические осмотры с помощью щелевой лампы. Повышение внутриглазного давления — довольно частое явление, возможно развитие глаукомы. Иногда незначительно повышается внутричерепное давление. При приеме в дозах выше 45 мг/м2/день задерживается рост у детей.
Превышение физиологических количеств таких стероидов, как кортизол и гидрокортизон, оказывающих помимо глюкокортикоидного и минералокортикоидное действие, вызывает задержку натрия и воды, потерю калия. У больных с нормальной функцией сердечно-сосудистой системы и почек это приводит к гипокалиемическому и гипо-хлоремическому алкалозу и повышению кровяного давления. При наличии гипопротеинемии, заболеваний почек и печени могут возникнуть отеки. У больных с заболеваниями сердца даже небольшая задержка натрия может привести к сердечной недостаточности. Эти эффекты можно минимизировать ограничением потребления натрия и разумным увеличением потребления калия.
В. Подавление функции надпочечников. Когда кортикостероиды принимают дольше нескольких дней, происходит подавление функции надпочечников. Если лечение продолжается недели и месяцы, пациентам во время сильного стресса, например такого, как неожиданная травма или операция, должна проводиться дополнительная терапия. При необходимости снизить дозу кортикоидов это нужно делать медленно. Если требуется прекратить терапию, процесс снижения дозы до достижения заместительного уровня должен быть очень медлен
ным. Для нормализаций реактивности гипофиза требуется 2-3 месяца, а уровень кортизола может не вернуться к норме еще 6-9 месяцев. Назначение АКТГ не ускоряет существенно восстановление нормальной функции.
Если дозы снижают слишком быстро, то симптомы заболевания могут появиться снова или усилиться. Даже у больных, не имеющих выраженных расстройств (например, леченый синдром Кушинга), при быстром снижении уровня кортикоидов возникает характерная симптоматика. Эти симптомы включают анорексию, тошноту или рвоту, уменьшение массы тела, вялость, головную боль, лихорадку, боль в суставах и мышцах и ортостатические реакции. Несмотря на то, что эти симптомы свидетельствуют о надпочечниковой недостаточности, они могут наблюдаться при нормальной или даже повышенной концентрации кортизола.
Противопоказания и предостережения
А. Специальные меры предосторожности. Необходимо тщательное наблюдение за пациентами, получающими эти препараты, в связи с вероятностью развития гипергликемии, глюкозурии, задержки натрия с отеками и гипертензией, гипокалиемии, пептических язв, остеопороза и скрытых инфекций.
Целесообразно использовать как можно более низкие дозы, чередовать прием препарата или назначать через день, если при такой схеме назначения можно получить удовлетворительный терапевтический результат. Пациентам, получающим относительно низкие дозы кортикостероидов, может потребоваться дополнительная терапия в период стресса, например при проведении хирургических процедур или при травме.
Б. Противопоказания. Больным с пептическими язвами, болезнями сердца или гипертензией с сердечной недостаточностью, инфекционными заболеваниями, психозами, диабетом, остеопорозом, глаукомой, простым герпесом эти средства следует назначать с большой осторожностью.
Выбор доз и схем введения
Так как препараты различаются по относительной противовоспалительной и минералокортикоидной активности (табл. 38-1), длительности действия, стоимости, формам выпуска, эти факторы должны учитываться при выборе лекарства для использования.
А. АКТГ в сравнении со стероидами надпочечников. Больным с нормальной функцией надпочечников для стимуляции продукции эндогенного кортизола и получения адекватного эффекта ранее назначали АКТГ. Однако за исключением тех случаев, когда необходимо повышение концентрации андрогенов, использование АКТГ как терапевтического средства необоснованно. Тогда же, когда эффект АКТГ расценивался как более высокий по сравнению с эффектом глюкокортикоидов, вероятно, назначались более низкие дозы кортикоидов, чем то их количество, которое продуцировалось в ответ на введение дозы АКТГ.
Б. Дозирование. При выборе режима приема врачи должны принимать во внимание тяжесть заболевания, количество препарата, требуемое для получения желаемого эффекта, и длительность терапии. При некоторых заболеваниях количество препарата, необходимое для поддержания желаемого терапевтического эффекта, ниже, чем то, которое требуется для получения первоначального эффекта. Минимальную поддерживающую дозу можно определить постепенным ее снижением до усиления признаков или симптомов заболевания.
При назначении глюкокортикоидов используют много различных схем назначения. При необходимости постоянно поддерживать повышенный уровень кортикоидов для подавления выделения АКТГ используют либо парентеральное введение медленно абсорбирующегося препарата, либо частое введение небольших доз. Противоположная ситуация возникает при необходимости применения глюкокортикоидов для лечения воспалительных и аллергических заболеваний. При одинаковом суммарном количестве препарата введение сравнительно высоких доз в несколько приемов может оказаться более эффективным, чем многократное введение маленьких доз или парентеральное введение медленно абсорбируемой большой дозы.
Тяжелые формы аутоиммунных заболеваний, затрагивающие жизненно важные органы, требуют интенсивной терапии. В этих случаях недостаточное лечение так же опасно, как и передозировка гормонов. Для минимизации отложения иммунных комплексов и выброса лейкоцитов и макрофагов необходимо начинать терапию с введения 1 мг/кгв день преднизона в несколько приемов. Такой режим соблюдают до тех пор, пока сохраняются тяжелые проявления заболевания. Затем дозу можно постепенно снизить.
При необходимости длительного введения больших доз после устранения острых проявлений заболевания может быть испробована альтернирующая (через день) схема введения препарата. При ее использовании большое количество препарата (например, 100 мг преднизона) дает минимум отрицательных эффектов, так как между приемами сохраняется период покоя для восстановления нарушенных функций. Переход на альтернирующую схему возможен только после установления контроля над процессом заболевания. Он должен происходить постепенно и с привлечением дополнительных вспомогательных мер на время между приемами. Типичная схема перехода для больных, получавших поддерживающее лечение преднизоном в суточной дозе 50 мг, имеет следующий вид:
День 1-й 50 мг День 7-й 75 мг
2-й 40 мг 8-й 5 мг
3-й 60 мг 9-й 70 мг
4-й 30 мг 10-й 5 мг
5-й 70 мг 11-й 65 мг
6-й 10 мг 12-й 5 мг и т. д.
При выборе препарата для использования в больших дозах предпочтение отдают препаратам короткого действия с минимальным минералокортикоидным эффектом. По возможности лекарство назначают в виде однократной утренней дозы.
Сообщалось, что внутривенное введение 1 г метилпреднизолона в течение 30-60 минут с месячным интервалом дало положительный эффект в нескольких случаях ревматоидного артрита. Однако показания для такой схемы введения не установлены.
В. Использование специальных лекарственных форм. Использование локальной терапии, например местных препаратов при заболеваниях кожи, офтальмологических лекарственных форм при заболеваниях глаз, внутрисуставных инъекций при болезнях суставов и гидрокортизоновых клизм при язвенном колите, позволяет доставить большое количество стероидов к больной ткани с минимальными системными эффектами.
Аналогичным образом беклометазона дипропионат и некоторые другие глюкокортикоиды, назначенные в виде аэрозолей, оказались эффективными при лечении астмы (глава 19). Переход от системной терапии к аэрозолям должен проводиться с предосторожностями, так как если функция надпочеч
ников была подавлена, возможно проявление надпочечниковой недостаточности. У этих больных введение аэрозольной терапии должно проводиться на фоне медленного, постепенного снижения системных доз и мониторинга функции надпочечников.
Для местной терапии аллергического ринита существуют назальные спреи беклометазона дипропионата, триамцинолона ацетонида и флунизо-лида. Они эффективны в дозах (1-2 ингаляции 2-3 раза в день), которые у большинства больных не создают концентрации гормонов в плазме, влияющей на функцию надпочечников.
Кортикоиды, введенные в состав мазей, кремов, лосьонов и спреев, широко используются в дерматологии. Более детально эти препараты описываются в главе 63.
Минералокортикоиды (альдостерон,
дезоксикортикостерон, флуд рокортизон)
Альдостерон — наиболее важный минералокортикоид у людей. Наряду с ним синтезируется и высвобождается небольшое количество дезоксикортикостерона (ДОКС). Хотя количество образующегося ДОКС в норме незначительно, раньше его использовали в терапевтических целях. Его основные эффекты и метаболизм такие же, как у альдостерона. Как натрийзадерживающее средство наиболее часто используют синтетический кортикостероид флудрокортизон.
1. АЛЬДОСТЕРОН
Альдостерон синтезируется в основном в клубочковой зоне коры надпочечников. Его структура и синтез представлены на рис. 38-1.
На уровень секреции альдостерона оказывает влияние несколько факторов. АКТГ вызывает умеренное увеличение его высвобождения, но этот эффект в норме не продолжается более нескольких дней. Хотя альдостерон только в три раза менее эффективен в подавлении секреции АКТГ, чем кортизол, количества продуцируемого корой надпочечников альдостерона недостаточно для какого-либо значительного участия в контроле секреции АКТГ по механизму обратной связи.
После удаления гипофиза и полного выведения АКТГ секреция альдостерона постепенно снижается, но не до нуля, а до половины нормального уровня. Это означает, что другие факторы (например, ангиотензин) способны поддерживать и, возможно, регулировать его секрецию (глава 17). Относительная независимость секреции кортизола и альдостерона может быть продемонстрирована и при различных повреждениях нервной системы, в частности децеребрации, которая снижает секрецию гидрокортизона, но повышает секрецию альдостерона.
Физиологические и фармакологические эффекты
Альдостерон и другие стероиды с минералокортикоидными свойствами усиливают реабсорбцию натрия в дистальных отделах почечных канальцев, слабо связанную с секрецией калия и ионов водорода. В целом повышается также реабсорбция натрия в потовых и слюнных железах, слизистой оболочке желудочно-кишечного тракта и через клеточные мембраны. Повышенный уровень альдостерона, продуцируемый опухолями, или передозировка других минералокортикоидов приводит к гипернатриемии, гипокалиемии, метаболическому алкалозу, повышению объема плазмы и гипертензии.
Действие минералокортикоидов обусловлено связыванием с минералокортикоидными рецепторами в цитоплазме клеток-мишеней, в первую очередь в клетках собирательных трубочек почек. Интересно, что эти рецепторы имеют такой же аффинитет к кортизолу, который в более высоких концентрациях присутствует во внеклеточной жидкости. Специфичность этих мест связывания для минералокортикоидов подтверждается наличием 1 ip-гидроксистероиддегидрогеназы, которая превращает кортизол в кортизон, имеющий низкую аффинность к рецепторам.
Метаболизм
В норме у людей, потребляющих среднее количество соли, секретируется 100-200 мкг альдостерона в день. Концентрация в плазме у мужчин (в состоянии покоя) составляет около 0.007 мкг/дл. Период полувыведения альдостерона, принятого в минимальных количествах, составляет около 15-20 минут; не обнаружено, чтобы он значительно связывался с белками.
Метаболизм альдостерона такой же, как у кортизола, примерно 50 мкг/24 ч обнаруживается в моче в виде его конъюгата тетрагидроальдостерона. Приблизительно 5-15 мкг/24 ч экскретируется в свободном виде или в виде 3-оксоглюкуронида.
2. ДЕЗОКСИКОРТИКОСТЕРОН (ДОКС)
Обычно секретируется примерно 200 мкг/день. ДОКС, который является предшественником альдостерона (рис. 38-1). При введении в кровь человека период его полусуществования составляет примерно 70 минут. По предварительной оценке, его концентрация в плазме равна 0.03 мкг/дл. Регуляция секреции ДОКС отличается от таковой альдостерона тем, что его секреция в первую очередь находится под контролем АКТГ. Хотя реакция на АКТГ усиливается ограничением натрия в диете, низкосолевая диета не повышает секреции ДОКС. Значительное повышение его секреции возможно при патологических состояниях, таких как карцинома надпочечников и врожденная гиперплазия надпочечников со сниженной активностью Р-450С11 иР-450с17.
3. ФЛУДРОКОРТИЗОН
Этот сильнодействующий стероид с глюкокортикоидными и минералокортикоидными свойствами является наиболее широко применяемым минералокортикоидом. В дозе 0.1 мг 2-7 раз в неделю он оказывает сильное солезадерживающее действие и используется при лечении надпочечниковой недостаточности. Для проявления выраженного противовоспалительного эффекта эта доза слишком мала.
Флудрокортизон
Андрогены надпочечников
Кора надпочечников секретирует большое количество дегидроэпиандростерона (ДГЭА) и в меньших количествах — андростендион и тестостерон. Хотя считается, что эти андрогены участвуют в процессе нормального полового созревания, они не стимулируют и не поддерживают андрогензависимые изменения у людей в пубертатном периоде. Недавние исследования свидетельствуют о том, что ДГЭА и ДГЭА-сульфат дают другие важные метаболические эффекты, опосредованные ферментами печени. Эти эффекты проявляются в снижении прибавки массы тела и атерогенеза и увеличении продолжительности жизни у экспериментальных животных (кролики) и, возможно, у человека. В настоящее время исследуется возможность терапевтического использования ДГЭА у людей.
Антагонисты адренокортикоидов
Ингибиторы синтеза и антагонисты
глюкокортикоидов
1. МИТОТАН
Митотан (рис. 38-4) вызывает атрофию надпочечников у собак и влияет на пути биосинтеза в коре надпочечников. Это лекарство назначают в дозе 6-12 мг в день внутрь в несколько приемов. У 80 % больных возникают выраженные токсические проявления, требующие снижения дозы. Они включают диарею, тошноту, рвоту, депрессию, сонливость и кожные нарушения. Примерно у */3 больных с карциномой надпочечников происходит снижение массы опухоли. Однако у 2/3 больных снижается продукция стероидов.
2. АМФЕНОН В
Амфенон В — более активный ингибитор синтеза, чем митотан, блокирующий гидроксилирование в положениях 11,17 и 21. Он не оказывает деструктивного действия на ткань надпочечников, а блокада синтеза стероидов приводит к повышению продукции АКТГ и гиперплазии железы. Этот препарат
считается слишком токсичным для использования у людей. Амфенон вызывает депрессию и изменения в желудочно-кишечном тракте и коже, а также нарушает функцию печени и щитовидной железы.
3. МЕТИРАПОН
Метирапон в малых дозах (рис. 38-4) оказывает более селективное действие, чем митотан или амфенон В. Он подавляет гидроксилирование в положении И, вмешивается в синтез кортизола и кортикостерона и вызывает секрецию 11-дезоксикортизола. При нормальной функции гипофиза возникает компенсаторное повышение продукции 11-дезоксикортизола. Этот ответ позволяет измерить способность передней доли гипофиза продуцировать АКТГ и используется в клинике в качестве диагностического теста. Хотя токсичность метира-пона гораздо ниже, чем у препаратов, описанных ранее, он вызывает преходящее головокружение и нарушения желудочно-кишечного тракта. Этот препарат не имеет широкого применения для терапии синдрома Кушинга. Однако у некоторых больных с опухолями надпочечников, синдромом эктопической продукции АКТГ и гиперплазией прием мети-рапона в дозах от 0.25 гдваразавдень до 1 гчетыре раза в день снижает продукцию кортизола до нормального уровня. Он может оказывать лечебное действие при избытке кортизола, пока определяется его причина, или совместно с радиационным и хирургическим лечением. Основными побочными эффектами являются задержка солей и воды и гирсутизм в результате переориентации метаболизма в сторону синтеза ДОКС и андрогенов.
Метирапон наиболее часто используется для определения функции надпочечников. С этой целью до и после введения препарата измеряют концентрацию 11 -дезоксикортизола в крови и уровень экскреции 17-гидроксикортикоидов с мочой. В норме экскреция с мочой 17-гидроксикортикоидов возрастает в два раза или более. Обычно 300-400 мг препарата дают каждые 4 часа (6 доз), а сбор мочи проводят за день и через день после приема препарата. У больных с синдромом Кушинга нормальный ответ на введение метирапона означает, что избыток кортизола не является результатом карциномы надпочечников или автономной аденомы, так как секретируемые этими опухолями гормоны подавляют продукцию АКТГ и вызывают атрофию нормальной коры надпочечников.
I СН3
АМФЕНОНВ
МЕТИРАПОН (Su4885)
КЕТОКОНАЗОЛ
Рис. 38-4. Антагонисты адренокортикоидов
Функция надпочечников может быть протестирована однократным пероральным приемом 2-3 г ме-тирапона в полночь и измерением уровня АКТГ или 11-дезоксикортизола в крови в 8 часов утра или сравнением экскреции 17-гидроксикортикостероидов с мочой за 24-часовые периоды до и после назначения препарата. Если у пациента выявлено или подозревается поражение гипофиза, эта процедура позволит определить его способность продуцировать АКТГ. Оральные контрацептивы подавляют этот ответ.
4. АМИНОГЛЮТЕТИМИД
Аминоглютетимид (рис. 38-4) блокирует превращение холестерина в прегненолон и вызывает
снижение синтеза всех гормонально активных стероидов (рис. 38-1). Он используется совместно с дексаметазоном для снижения или полной блокады продукции эстрогенов и андрогенов у больных с карциномой молочной железы. В дозе 1 г в день препарат хорошо переносится, однако более высокие дозы обычно вызывают сонливость. Его можно использовать совместно с кетоконазолом для подавления секреции у больных с синдромом Кушинга, вызванным раком коры надпочечников, которые не поддаются лечению метотаном.
Аминоглютетимид также отчетливо повышает клиренс некоторых стероидов. Показано, что он усиливает метаболизм дексаметазона, укорачивая период его полувыведения с 264 до 120 минут.
5. КЕТОКОНАЗОЛ
Противогрибковый препарат из группы имидазола — кетоконазол является сильным и неселективным ингибитором синтеза надпочечниковых и половых стероидов. Он тормозит отщепление боковой цепи холестерина и угнетает активность Р-450с17, С17, 20-лиазы, ЗР-гидроксистероидде-гидрогеназы и P-450cl 1 — ферментов, необходимых для синтеза глюкокортикоидов. Чувствительность ферментов тканей млекопитающих к данному препарату много ниже, чем грибковых ферментов, поэтому ингибирующий эффект кетоконазола обнаруживается только в высоких дозах. Это ингибирование компенсируется повышенной продукцией АКТГ, что приводит к увеличению уровня 17-де-зоксистероидов, таких как прогестерон и альдостерон, и подавлению активности ренина в плазме. Кетоконазол имеет и другие эндокринные эффекты. Он вытесняет эстрадиол и дигидротестостерон из их связи с белками, связывающими половые гормоны in vitro, и повышает отношение эстрад иол/тестостерон в плазме in vivo посредством другого механизма. Последнее, возможно, является причиной возникновения гинекомастии, которая иногда появляется при терапии кетоконазолом.
Кетоконазол используется для лечения больных с болезнью Кушинга, обусловленной разными причинами. По предварительным исследованиям, дозы 200-1200 мг/день вызывают снижение концентрации гормонов и существенное клиническое улучшение у некоторых больных.
6. МИФЕПРИСТОН (RU 486)
Мифепристон — синтетический стероид, который связывается как с глюкокортикоидными, так и с прогестероновыми рецепторами и используется в экспериментальной терапии синдрома Кушинга. Его фармакология и применение как антагониста прогестерона у женщин обсуждаются в главе 39.
Антагонисты
минералокортикоидов
Помимо средств, нарушающих синтез альдостерона, таких как амфенон В, существуют препараты, конкурирующие с альдостероном за места связывания или снижающие его эффекты на периферии. Такой активностью, но слабо выраженной, об
ладает прогестерон. Однако было обнаружено, что замещение 17-спиронолактоновой группы на боковую С20-С21 цепочку дезоксикортикостерона приводит к появлению вещества, способного блокировать задержку натрия альдостероном.
Спиронолактон — это 7а-ацетилтиоспиронолак-тон. О его метаболизме известно мало. Эффект препарата начинает проявляться медленно и продолжается около 2-3 дней после прекращения приема. Он используется при лечении первичного альдостеронизма в дозах 50-100 мг/день. Этот препарат устраняет многие проявления альдостеронизма. Он оказался полезным для постановки диагноза у некоторых больных и снижал проявления и симптомы в тех случаях, когда хирургическое удаление аденомы откладывалось. При использовании препарата в диагностических целях для определения альдостеронизма у больных с гипокалиемией и гипертензией назначение 400-500 мг/день при адекватном поступлении калия и натрия в течение 4-8 дней восстанавливает концентрацию калия до нормальной. Этот препарат может быть полезен и для подготовки больных к хирургическим операциям. Для этих целей используются дозы 300-400 мг/день в течение двух недель, что снижает вероятность возникновения аритмий.
Спиронолактон применяют при лечении гирсутизма у женщин. Дозы 50-200 мг/день вызывают снижение количества, толщины и скорости роста волос на лице при идиопатическом гирсутизме или при вторичном гирсутизме из-за высокого уровня андрогенов. Этот эффект обычно становится заметным в течение двух месяцев и достигает максимума через 6 месяцев. Такое действие связано с подавлением продукции андрогенов и прямым влиянием на волосяные фолликулы.
Использование спиронолактона в качестве диуретика обсуждается в главе 15. Описанные побоч-
ные эффекты спиронолактона включают гиперкалиемию, менструальные нарушения, гинекомастию, седацию, головную боль, расстройства желудочно-кишечного тракта и кожную сыпь.
Препараты
Аэрозольные формы глюкокортикоидов: см. главу 19, том 1.
Глюкокортикоиды, используемые в дерматологии: см. главу 63.
Глюкокортикоиды для перорального и парентерального введения
Бетаметазон (Целестон)
Перорально: таблетки по 0.6 мг;
сироп 0.6 мг/5 мл
Бетаметазона натрия фосфат (генерик, Целестон фосфат, Cel-U-Jec)
Парентерально: раствор 4 мг/мл для введения в/в, в/м, в зону повреждений или внутрь суставов
Кортизон (генерик, Кортон ацетат) Перорально: таблетки по 5,10,25 мг
Дексаметазон (генерик, Декадрон, др.) Перорально: таблетки по 0.25, 0.5, 0.75,1, 1.5, 2,4, 6 мг; эликсир 0.5 мг/5мл; растворы 0.5 мг/5 мл, 0.5 мг/0.5 мл
Дексаметазона ацетат (генерик, Декадрон-LA, др.) Парентерально: суспензия 8,16 мг/мл для в/м введения, введения в зону повреждения, внутрисуставного введения
Дексаметазона натрия фосфат (генерик, Декадрон фосфат, др.)
Парентерально: раствор 4,10,20, 24 мг/мл для в/м, в/в, внутрисуставного введения и введения в зону повреждения
Гидрокортизон [кортизол] (генерик, Кортеф) Перорально: таблетки по 5,10, 20 мг
Гидрокортизона ацетат (генерик) Парентерально: суспензия 25,50 мг/мл для введения в места повреждения, в мягкие ткани и внутрь суставов
Гидрокортизона ципионат (Кортеф) Суспензия для перорального приема 10 мг/5 мл
Гидрокортизона натрия фосфат
Парентерально: раствор 50 мг/мл для в/в, в/м и п/к инъекций
Гидрокортизона натрия сукцинат (генерик,
Солю-Кортеф и др.)
Парентерально: раствор 100, 250, 500, 1000 мг/фл для в/в и в/м инъекций
Метилпреднизолон (генерик, Медрол, Мепролон)
Перорально: таблетки по 2,4, 8, 16, 24,32 мг
Метилпреднизолона ацетат (генерик, Депо-
Медрол, др.)
Парентерально: раствор 20,40,80 мг/мл для в/м введения и введения внутрь повреждений и суставов
Метилпреднизолона натрия сукцинат (генерик,
Солю-Медрол, др.)
Парентерально: раствор 40, 125, 500,1000, 2000 мг/фл для инъекций
Преднизолон (генерик, Дельта-Кортеф, Прелон)
Перорально: таблетки по 5 мг;
сироп 15 мг/5 мл
Преднизолона ацетат (генерик, др.)
Парентерально: раствор 25, 50 мг/мл для инъекций
Преднизолона натрия фосфат
Перорально: раствор 5 мг/5мл
Парентерально: раствор 20 мг/мл для в/м введения и введения внутрь повреждений и суставов
Преднизолона тебутат (генерик, Хидельтра-
Т.В.А.,др.)
Парентерально: раствор 20 мг/мл для введения внутрь повреждений и суставов
Преднизон (генерик, Метикортен, др.) Перорально: таблетки по 1, 2.5, 5,10, 20, 50 мг, раствор и сироп 5 мг/5 мл
Триамцинолон (генерик, Аристокорт, Кенакорт,
Атолон)
Перорально: таблетки по 1, 2, 4,8 мг;
сироп 4 мг/5 мл
Триамцинолона ацетонид (генерик, Кеналог и др.)
Парентерально: раствор 3,10,40 мг/мл для в/м введения и введения внутрь повреждений и суставов
Триамцинолона диацетат (генерик, Аристокорт и др.)
Парентерально: раствор 25,40 мг/мл для в/м введения и введения внутрь повреждений и суставов
Трамцинолона гексацетонид (Арнстоспан) Парентерально: раствор 5, 20 мг/мл для введения внутрь повреждения и под участок повреждения
Минералокортикоиды
Флудрокортизона ацетат (Флоринефа ацетат)
Перорально: таблетки по 0.1 мг
Ингибиторы адренокортикоидов
Аминоглютетимид (Цитадрен)
Перорально: таблетки по 250 мг
Кетоконазол (Низорал)
Перорально: таблетки по 200 мг (данные показания в инструкции не указаны)
Метирапон (Метопирон)
Перорально: таблетки по 250 мг
Митотан (Лизодрен)
Перорально: таблетки по 500 мг
Трилостан (Модрастан)
Перорально: капсулы по 30,60 мг
Избранная литература
Barnes Р. J., Adcock I. Anti-inflammatory actions of steroids: Molecular mechanisms. Trends. Pharmacol. Sci. 1993; 14:436.
Bikie D. D. et al. Elevated 1,25-dihydroxyvitamin D levels in patients with chronic obstructive pulmanary disease treated with prednisone. J. Clin. Endocrinol. Metab. 1993; 76:456.
Carella M. J. et al. Hypothalamic-pituitary-adrenal function one week after a short burst of steroid therapy. J. Clin. Endocrinol. Metab. 1993; 76: 1188.
Chin R. Adrenal crisis. Crit. Care Clin. 1991; 7: 23.
Frey В. M., Frey F. J. Clinical pharmacokinetics of prednisone and prednisolone. Clin. Pharma-cokinet. 1990; 19: 126.
Половые гормоны и их ингибиторы
39
Алан Голдфин
I. Яичники (эстрогены, прогестины, другие гормоны яичников, оральные контрацептивы, ингибиторы и антагонисты, вещества, вызывающие овуляцию)
Яичники выполняют важную гаметогенную функцию, интегрированную с их гормональной активностью. У девочек весь период быстрого роста и созревания гонады находятся в относительном покое. В пубертатном возрасте яичники начинают свой 30-40-летний период циклического функционирования, называемый менструальным циклом из-за регулярных кровотечений, которые являются наиболее выраженными его проявлениями. Когда яичники перестают реагировать на секрецию гонадотропинов передней долей гипофиза, циклические кровотечения прекращаются — наступает менопауза.
Вероятно, начало функционирования яичников в пубертатном периоде находится под контролем нервной системы, так как уже имеющиеся в этом возрасте в гипоталамусе гонадотропины могут стимулировать незрелые гонады, а гипофиз способен реагировать на гипоталамический гонадотропин-рилизинг-гормон. Развитие центров головного мозга, таких как миндалевидное тело, устраняет торможение активности клеток срединного возвышения гипоталамуса, позволяя им выделять гона-дотропинрилизинг-гормон (ГРГ) с соответствующими частотой и количеством, что стимулирует
Сокращения, используемые в этой главе
АКТГ Адренокортикотропный гормон ACT Аспартатаминотрансфераза ГРГ Гонадотропинрилизинг-гормон ДГЭА Дегидроэпиандростерон
ДГЭАС Дегидроэпиандростерона сульфат КСГ Кортикостероидсвязывающий глобулин (транскортин)
ЛГ Лютеинизирующий гормон
Л ГРФ Рилизинг-фактор лютеинизирующего гормона
ПГСГ Глобулин, связывающий половые гормоны
ТСГ Тироксинсвязывающий глобулин ФСГ Фолликулостимулирующий гормон чМГ Человеческий менопаузный гонадотропин
чХГ Человеческий хорионический гонадотропин
высвобождение фолликулостимулирующего (ФСГ) и лютинизирующего гормонов (ЛГ) (глава 36). Вначале высвобождается небольшое количество этих двух гормонов, вызывая секрецию незначительных порций эстрогена. Это приводит к развитию молочных желез, изменению в распределении жировой ткани и бурному росту, кульминацией которого является закрытие эпифизов длинных костей.
Приблизительно через год продукция эстрогена становится достаточной, чтобы вызывать изменение эндометрия и периодические кровотечения. После нескольких первых циклов, которые могут
быть ановуляционными, устанавливается нормальная циклическая функция.
В начале каждого цикла разное количество везикулярных фолликулов, каждый из которых содержит яйцеклетку, начинает увеличиваться в размерах в ответ на ФСГ-стимуляцию. Через 5 или 6 дней один из фолликулов начинает развиваться быстрее других. Гранулезные клетки этого фолликула размножаются и под влиянием ЛГ синтезируют эстроген и высвобождают его в возрастающем количестве. Эстрогены подавляют выделение ФСГи способствуют регрессии развития менее зрелых фолликулов. Яичниковый фолликул представляет собой заполненный жидкостью пузырек, ограниченный гранулезными и текальными клетками и содержащий яйцеклетку. Секреция эстрогена достигает максимума перед самой серединой цикла, и гранулезные клетки начинают продуцировать прогестерон. Эти изменения стимулируют короткий подъем высвобождения ЛГ и ФСГ, который предшествует овуляции (и вызывает ее). После разрыва фолликула яйцо попадает в брюшную полость в районе маточных труб. Полость разорвавшегося фолликула заполняется кровью {corpus hemorrhagicum), а лютеинизированная оболочка и гранулезные клетки пролиферируют и замещают кровь, формируя желтое тело. Клетки этой структуры продуцируют эстроген и прогестерон во время оставшейся части цикла и далее, если возникает беременность.
Если оплодотворения яйцеклетки не произошло, желтое тело начинает дегенерировать и прекращает продукцию гормонов, превращаясь в конце концов в белое тело. Причины лютеолизиса у людей неизвестны. Большинство других гормональных событий, имеющих место в течение нормального яичникового цикла, может объясняться механизмом регуляции по типу обратной связи. Эндометрий, который пролиферирует во время фолликулярной фазы и развивает свою железистую структуру во время лютеиновой фазы, отторгается в процессе менструации. Происходящие события представлены на рис. 39-1.
Яичники обычно со временем прекращают свою гаметогенную и эндокринную функцию. Эти изменения сопровождаются прекращением маточных кровотечений (менопаузой), что происходит в среднем в возрасте 52 лет (данные по США). Хотя яичники перестают секретировать эстрогены, у многих женщин они имеются в значительной концентрации вследствие превращения надпочечниковых сте
роидов (андростендиона) в эстрон и эстрадиол в жировой ткани и, возможно, в других неэндокринных тканях.
Нарушения функций яичников
Нарушения циклической функции у женщин достаточно распространены даже в репродуктивном возрасте. Меньшая их часть возникает вследствие процессов воспаления или новообразований, которые вызывают нарушения в матке, яичниках или гипофизе, в то время как причина большинства менструальных расстройств непонятна. Как правило, незначительные расстройства, приводящие к возникновению аменореи или ановуляторного цикла, исчезают самопроизвольно. Они часто связаны с
Рис. 39-1. Менструальный цикл с указанием концентраций гипофизарных и яичниковых гормонов в плазме и соответствующих им гистологических изменений
изменениями внешней среды или с эмоциональными расстройствами и, по-видимому, представляют собой временные нарушения функции центров головного мозга, которые контролируют секрецию гипоталамических рилизинг-факторов. Нормальная функция яичников может изменяться андрогенами, продуцируемыми корой надпочечников или ее опухолями. Андрогенпродуцирующие новообразования могут возникать и в яичниках. К ним относятся арренобластомы и опухоли клеток Лейдига. Способствуют нарушению нормальной функции яичников и эстрогенпродуцирующие опухоли гранулезных клеток.
Эстрогены
Эстрогенной активностью обладает большое количество химических веществ. Помимо различных стероидных эстрогенов животного происхождения синтезировано большое количество нестероидных эстрогенов. Эстрогенная активность характерна для многих фенолов. Она обнаружена у различных биологических образований, найденных в морских отложениях, а также у отдельных видов клевера.
Эстрогены, вырабатываемые организмом
Главными эстрогенами, вырабатываемыми организмом женщины, являются эстрадиол (эстрадиол-170, Е2), эстрон (Е() и эстриол (Е3) (рис. 39-2). Основной продукт секреции яичников — эстрадиол. Хотя некоторое количество эстрона продуцируется яичниками, большая часть эстрона и эстриола образуется преимущественно в печени из эстрадиола или в периферических тканях из андростендиона и других андрогенов. Как уже говорилось, в течение первой части менструального цикла эстрогены продуцируются в фолликулах яичников оболочковыми клетками. После овуляции эстрогены, так же как и прогестерон, синтезируются гранулезными клетками желтого тела; и пути их биосинтеза несколько различаются.
Во время беременности эстрогены в большом количестве синтезируются фетоплацентарным комплексом. Синтезируемый им эстриол высвобождается в кровь матери и экскретируется в мочу. Повторные определения содержания эстриола в материнской моче позволяют оценить состояние плода.
Одним из наиболее богатых естественных источников получения эстрогенных веществ являются жеребцы, у которых этих гормонов вырабатывается больше, чем у беременных кобыл или беременных женщин. Лошадиные эстрогены (эквиленин и эквилин) и родственные им соединения, имеющие ненасыщенные кольца А и В, в больших количествах экскретируются с мочой, из которой их выделяют и используют для медицинских целей.
Количество вырабатывающегося у здоровых женщин эстрадиола изменяется во время менструального цикла: в ранней фолликулярной фазе его концентрация низкая — 50 пг/мл, а во время пре-овуляторного пика увеличивается до 350-850 пг/мл (рис. 39-1).
Синтетические эстрогены
Естественные эстрогены были подвергнуты различным химическим модификациям. Наиболее важным результатом этих изменений было повышение эффективности гормонов при пероральном назначении. Структуры некоторых препаратов показаны на рис. 39-3. Препараты, применяемые с терапевтической целью, перечислены в табл. 39-1.
Помимо стероидных эстрогенов было синтезировано и использовано в клинике большое количество нестероидных препаратов с эстрогенной активностью. Они включают диенэстрол, диэтилстиль-бэстрол, бензэстрол, гексэстрол, метэстрол, метал-ленэстрил и хлоротрианизен (рис. 39-3).
Фармакокинетика
При попадании в циркуляцию эстрадиол прочно связывается с а2-глобулином (глобулином, связывающим половые гормоны — ПГСГ) и с меньшей аффинностью — с альбумином. Связанный эстроген относительно плохо диффундирует в клетку, поэтому физиологически активной является только свободная фракция гормона. В печени и других тканях эстрадиол превращается в эстрон и эстриол (они имеют низкую аффинность к эстрогенным рецепторам) и их 2-гидроксилированные производные и конъюгированные метаболиты (слишком слабо растворимые в липидах, чтобы быстро проникать через клеточную мембрану) и экскретируется в желчь (рис. 39-2). Однако конъюгаты могут гидролизоваться в кишечнике с образованием активных реабсорбируемых соединений. Катехолэстрогены
ФОЛЛИКУЛЯРНАЯ ФАЗА
ЛЮТЕИНОВАЯ ФАЗА
Прегненолон
Прегненолон
17а-Гидроксипрегненолон
Прогестерон
Дегидроэпиандростерон
17<х-П1Дроксипрегненолон
2-Гидроксиэстрон 2-Гидроксиэстрадиол
и другие метаболиты и другие метаболиты
Рис. 39-2. Биосинтез и метаболизм эстрогенов
служат нейротрансмиттерами в центральной нервной системе. Они конкурируют за катехол-О-ме-тилтрансферазу и в высокой концентрации подавляют инактивацию катехоламинов этим ферментом. В небольшом количестве эстрогены экскретируются в грудное молоко кормящих матерей.
Так как основное количество эстрогенов и их активных метаболитов экскретируется в желчь и реабсорбируется из кишечника, при пероральном приеме в результате энтеропеченочной циркуляции наблюдается значительное преобладание печеночных эффектов над периферическими. Печеночные эффекты ответственны (подробнее — см. далее) за некоторые нежелательные воздействия,
например активацию синтеза факторов свертывания крови и субстрата ренина плазмы. Если необходим периферический эффект эстрогенов, в частности у женщин после менопаузы, печеночные эффекты можно минимизировать, используя другие пути введения: вагинальный, трансдермальный или инъекционный.
Физиологические эффекты
А. Механизм действия. Считается, что из плазмы эстрадиол проникает в клетку-мишень путем диффузии и затем транспортируется в ядро, где связывается с эстрогенными рецепторами. Эстроген-
Эстрадиол
Эстрон
СТЕРОИДНЫЕ, СИНТЕТИЧЕСКИЕ
Этинилэстрадиол
Местранол
НЕСТЕРОИДНЫЕ, СИНТЕТИЧЕСКИЕ
Диэтилстильбэстрол
Рис. 39-3. Соединения с эстрогенной активностью
Хлоротрианизен
Металленэстрил
ные рецепторы, найденные в клеточных ядрах, связаны с различными белками теплового шока, которые отсоединяются от рецепторов, когда с последними связывается эстрадиол. Комплекс рецептор-лиганд формирует гомодимер, который связывается с эстроген-эффекторными элементами гена и взаимодействует со специфическими клеточными белками (передающие факторы), что приводит к активации транскрипции и регулирует образование специфической иРНК. Описанные далее эффекты могут быть прямым следствием индукции синтеза белка в клетке. Однако некоторые виды активности эстрогенов являются результатом паракринных эф
фектов, зависящих от факторов роста и цитокинов, высвобождаемых соседними клетками.
Б. Половое созревание женщин. Эстрогены требуются для нормального полового созревания женщин. Они стимулируют развитие влагалища, матки и маточных труб, а также вторичных половых признаков. Эстрогены активируют развитие стромы и протоков молочных желез, ответственны за фазу ускоренного роста и закрытие эпифизов длинных костей, которые происходят в пубертатном периоде, влияют на рост подмышечных и лобковых волос и изменяют распределение жира на теле, что создает женский тип телосложения. Большие коли-
V
ТАБЛИЦА 39-1. Широко используемые эстрогены
Препарат
Средние заместительные дозы
Этинилэстрадиол 0.005-0.02 мг/день
Микронизированный 1-2 мг/день
эстрадиол
Эстрадиола ципионат 2-5 мг каждые 3-4 недели
Эстрадиола валерат 2-20 мг через неделю
Эстропипат 1.25-2.5 мг/день
Конъюгированные
(этерифицированные)
или смешанные
эстрогенные препараты:
Пероральные 0.3-1.25 мг/день
Инъекционные 0.2-2 мг/день
Местные Трансдермальные пластыри
Диэтилстильбэстрол 0.1-0.2 мг/день
Квинэстрол 0.1-0.2 мг/неделю
Диенэстрол
Хлоротрианизен 12-25 мг/день
Металленэстрил 3-9 мг/день
чества эстрогенов стимулируют также развитие пигментации кожи, что более выражено в области сосков и половых органов.
В. Действие на эндометрий. Помимо действия на рост мускулатуры матки эстрогены также играют важную роль в развитии эндометрия. Постоянное и длительное воздействие эстрогенов приводит к аномальной гиперплазии эндометрия, которая обычно сопровождается аномальными кровотечениями. При нормальном менструальном цикле когда продукция эстрогенов правильно скоординирована с продукцией прогестерона, происходят регулярные кровотечения и отторжение эпителия эндометрия.
Г. Метаболические эффекты. Эстрогены дают ряд важных метаболических эффектов. Они частично отвечают за поддержание нормальной структуры кожи и кровеносных сосудов у женщин. Эти гормоны подавляют резорбцию костей, оказывая на них действие, антагонистическое эффекту паратиреоидного гормона, но не стимулируют образование костной ткани. Эстрогены существенно влияют на абсорбцию веществ в кишечнике, так как снижают его перистальтику.
Наряду со стимуляцией синтеза ферментов и факторов роста, приводящих к росту и дифференциации матки, эстрогены оказывают влияние на
продукцию и активность многих белков организма. Особенно важны метаболические изменения в печени, так как в ней наиболее высока концентрация таких белков, как транскортин (КСГ), тироксин-связывающий глобулин (ТСГ); глобулин, связывающий половые гормоны (ПГСГ), трансферрин, субстрат ренина и фибриноген. Эти изменения приводят к повышению концентрации циркулирующих тироксина, эстрогенов, тестостерона, железа, меди и других веществ.
Д. Действие на коагуляцию крови. Эстрогены повышают свертываемость крови. Установлены многочисленные изменения факторов свертываемости при эстрогенной терапии, включая повышение содержания в плазме факторов II, VII, IX и X и снижение содержания антитромбина III частично в результате уже упоминавшихся печеночных эффектов. Описано также увеличение уровня плазминогена и угнетение адгезии тромбоцитов (раздел “Гормональная контрацепция”).
Эстрогены изменяют состав липидов плазмы: повышается содержание липопротеидов высокой плотности (ЛПВП), несколько снижается содержание липопротеидов низкой плотности (ЛПНП), уменьшается концентрация холестерина, а концентрация триглицеридов увеличивается.
Е. Другие эффекты. Эстрогены дают множество других эффектов. Они индуцируют синтез прогестероновых рецепторов. Отвечают за поведение животных во время эструса и влияют на либидо у людей. Способствуют переходу внутрисосудистой жидкости во внеклеточное пространство, вызывая отек. Возникающее снижение объема плазмы приводит к компенсаторной задержке натрия и воды почками. Эстрогены оказывают модулирующее действие на регуляцию симпатической нервной системой тонуса гладкой мускулатуры.
Клиническое использование1
А. Первичный гипогонадизм. Эстрогены широко используются в качестве средства заместительной терапии у больных с дефицитом этих средств в результате первичной недостаточности развития яичников, кастрации или менопаузы.
Лечение первичного гипогонадизма обычно начинают в возрасте 11-13 лет для стимуляции раз
1 Использование эстрогенов для контрацепции обсуждается в специальном разделе.
вития вторичных половых признаков и менструаций, оптимального роста и предотвращения психологических последствий задержки полового созревания. Терапия начинается с низких доз эстрогенов (0.3 мг конъюгированных эстрогенов или 5-10 мкг этинил эстрадиола), которые назначают с первого по двадцать первый день каждого месяца. После завершения роста организма постоянная терапия в основном состоит из назначения эстрогенов и прогестинов.
Б. Гормональная терапия в постменопаузном периоде. Кроме признаков и симптомов, следующих сразу же за прекращением нормальной функции яичников, таких как прекращение менструаций, вазомоторные симптомы и атрофия половых органов, имеют место длительно существующие изменения, которые влияют на здоровье и самочувствие женщин в постменопаузном периоде. Это прежде всего истончение костей, которое может приводить к переломам позвоночника, бедра и запястий; и изменение состава липидов, способствующее развитию сердечно-сосудистых заболеваний. Действие эстрогенов на костную ткань изучено детально, известны результаты снижения уровня гормонов и заместительной терапии. Однако все еще плохо понятна роль эстрогенов и прогестинов в патогенезе сердечно-сосудистых заболеваний и возможности их предотвращения (они являются причиной более 350 000 смертей в год), а также в патогенезе рака молочной железы (35 000 смертей в год).
Когда прекращается нормальное функционирование яичников и концентрация эстрогенов падает в результате менопаузы или овариоэктомии, происходит резкий подъем концентрации в плазме холестерина и ЛПНП с одновременным снижением числа ЛПНП-рецепторов. Концентрация ЛПВП изменяется мало, оставаясь выше, чем у мужчин. Незначительно изменяется также содержание ЛПОНП и триглицеридов. Так как сердечно-сосудистые заболевания являются наиболее частой причиной смертности в данной возрастной группе, риск этих заболеваний составляет главную проблему при решении вопроса о целесообразности проведения гормональной терапии и влияет на выбор назначаемого гормона. Благоприятное действие заместительной эстрогенной терапии на липиды и липопротеиды крови приводит к снижению частоты инфаркта миокарда на 50 % и инсультов на 40 %. Антагонизм прогестинов и эстрогенов в отношении ЛПНП и ЛПВП выражен в разной степени.
Оптимальное лечение постменопаузных больных требует тщательной оценки как всех симптомов, так и возраста и риска возникновения сердечно-сосудистых заболеваний, остеопороза, рака молочной железы и рака эндометрия. Принимая во внимание действие половых гормонов на каждое из этих расстройств, необходимо определить цели терапии и оценить ее риск, а также обсудить эти проблемы с пациентом.
Если основным показанием к назначению препаратов являются сосудистые приливы, рекомендуется симптоматическое лечение минимальными дозами эстрогенов. Лечение может потребоваться только на ограниченный период времени, что позволяет снизить риск возникновения рака молочной железы. После экстирпации матки эстрогены в качестве средства монотерапии могут назначаться 5 дней в неделю или непрерывно, в то время как не требуется назначения прогестинов для снижения риска гиперплазии и рака эндометрия. Хотя приливы, потливость, бессонница и атрофический вагинит обычно облегчаются приемом эстрогенов и многие больные испытывают улучшение самочувствия, редко удается справиться с депрессией и другими психопатологическими нарушениями.
Роль эстрогенов в предотвращении и лечении остеопороза тщательно изучена (глава 41). Максимальное количество костной ткани имеется у молодых активных взрослых людей. Оно начинает снижаться в среднем возрасте как у мужчин, так и у женщин. Развитие остеопороза зависит от количества костной ткани в начале этого процесса, от потребления кальция и от уровня физической активности. Риск остеопороза максимален у худых курильщиков, лиц кавказской расы, у малоактивных людей, при низком потреблении кальция, а также при семейной предрасположенности.
Эстрогены должны использоваться в минимальных эффективных дозах. Женщинам, которым гистерэктомия не проводилась, назначение эстрогенов наиболее целесообразно в первые 21-25 дней каждого месяца. Рекомендуемые дозы составляют 0.3-1.25 мг/день конъюгированных эстрогенов или 0.01-0.02 мг/день этинилэстрадиола. Показано, что средние дозы в данном диапазоне наиболее эффективны для предотвращения снижения плотности костей, встречающегося в периоде менопаузы. С этой точки зрения, для получения максимального эффекта необходимо начать терапию как можно раньше после наступления менопаузы. И этим боль
ным, и не получающим эстроген пациентам будет полезно добавление кальция, восполняющее суточную потребность, которая составляет 1500 мг.
Пациентки с низким риском возникновения остеопороза, у которых проявляется только легкий атрофический вагинит, могут получать терапию местными средствами. Вагинальный путь введения используют и при лечении нарушений мочевого тракта. Важно понимать, что хотя местно назначаемые эстрогены минуют эффект первого прохождения печени (что снижает некоторые нежелательные печеночные эффекты), они почти полностью всасываются и попадают в кровь. Эти препараты необходимо назначать циклами.
Лечение эстрогенами связано с повышением риска возникновения карциномы эндометрия (подробнее — см. далее). Назначение прогестиновых препаратов совместно с эстрогенами предотвращает гиперплазию эндометрия и значительно снижает риск возникновения рака. Если эстроген вводится первые 25 дней месяца и в течение последних 10-14 дней добавляется прогестин медроксипрогестерон (10 мг/день), риск возникновения рака снижается в два раза по сравнению с теми случаями, когда женщина не получает заместительной гормональной терапии. При такой схеме лечения у некоторых женщин возможно рецидивирование болезненных симптомов во время перерыва во введении эстрогенов. Таким больным эстрогены можно вводить постоянно. Если прогестин вызывает седацию или другие нежелательные эффекты, его дозу снижают до 2.5-5 мг в последние 10 дней цикла, что, однако, несколько повышает риск возникновения гиперплазии эндометрия. Эта схема лечения обычно сопровождается кровотечениями в конце каждого цикла. Некоторые женщины жалуются на мигренозные боли в течение последних нескольких дней каждого цикла. Постоянное назначение эстрогенов часто избавляет от таких головных болей. Если у женщин, получающих такое лечение, возникают циклические кровотечения, необходимо рассмотреть вопрос о проведении постоянной терапии. Ежедневное назначение 0.625 мг конъюгированных лошадиных эстрогенов и 2.5-5 мг медроксипрогестерона устраняет циклические кровотечения и вазомоторные симптомы, предотвращает атрофию половых органов, поддерживает плотность костей и улучшает липидный состав плазмы с небольшим снижением концентрации ЛПНП и повышением концентрации ЛПВП. Биопсия у этих женщин по
казывает атрофию эндометрия. В течение первых месяцев почти у половины больных возникают кровотечения. После четырех месяцев терапии у 70-80 % устанавливается и в дальнейшем сохраняется аменорея. Основным недостатком постоянной терапии является необходимость проведения биопсии матки, если после нескольких первых месяцев лечения возникают кровотечения.
Как уже отмечалось, эстрогены можно назначать интравагинально и трансдермально, что снижает соотношение печеночных и периферических эффектов.
Если эстрогеновая заместительная терапия противопоказана, например при наличии эстрогенчувствительных опухолей, вазомоторные симптомы могут устраняться назначением прогестинов или клонидина.
В. Использование в других целях. Эстрогены в комбинации с прогестинами могут использоваться для подавления овуляции у больных с резистентной дисменореей неясного происхождения или с целью угнетения функции яичников для лечения гирсуртизма и аменореи, возникающих в результате повышенной секреции яичниками андрогенов. В этих условиях необходим более сильный эффект, поэтому назначают пероральные контрацептивы, содержащие 50-80 мкг эстрогена, или комбинируют назначение препаратов с низким содержанием эстрогена и подавление выделения ГРГ.
Эстрогены применяют для остановки маточных кровотечений вследствие гиперплазии эндометрия. Для этого дают по 20 мкг этинилэстрадиола через каждые несколько часов или внутривенно вливают 20 мг конъюгированного эстрогена.
Побочные эффекты
При терапевтическом использовании эстрогенов описаны побочные эффекты различной степени тяжести. Большое количество других осложнений, связанных с гормональной контрацепцией, также может быть обусловлено содержащимися в препаратах эстрогенами. Эти осложнения будут рассмотрены в соответствующем разделе.
Частой причиной постменопаузных кровотечений является эстрогенная терапия. К сожалению, в этот период жизни вагинальные кровотечения могут быть вызваны и карциномой эндометрия. Чтобы избежать ошибки в оценке состояния больной, необходимо назначение как можно меньшего коли
чества эстрогенов. Терапия должна проводиться циклически, поскольку в этом случае кровотечения наиболее вероятны только во время отмены. Напомним еще раз, что гиперплазию эндометрия можно предотвратить приемом совместно с эстрогенами прогестиновых препаратов во время каждого цикла.
Довольно часто отмечаются тошнота и огрубление молочных желез, чего можно избежать, максимально снижая дозу. Возможна также гиперпигментация. Эстрогеновая терапия может привести к повышению частоты мигренозных болей, холестазу, гипертензии и заболеваниям желчного пузыря.
Связь эстрогеновой терапии с раком остается предметом активного исследования. Хотя не обнаружено влияния кратковременной терапии на частоту возникновения рака молочной железы, в результате длительного приема эстрагенов возможно небольшое повышение риска развития этого типа опухолей. Несмотря на то, что фактор риска мал (1.25), его необходимо учитывать, поскольку эта опухоль возникает у 10 % женщин. В отношении прогестерона до сих пор нет определенных данных. Исследования показали, что после одностороннего удаления опухоли молочной железы, у женщин, получающих тамоксифен, на 35 % в сравнении с контролем снижается вероятность возникновения контралатерального рака. В этих исследованиях установлено, что тамоксифен хорошо переносится большинством пациенток, вызывает эстрогенподобные изменения концентрации липидов в крови и стабилизирует потерю минералов костями. Продолжаются исследования возможной эффективности тамоксифена у женщин в постменопаузном периоде с высоким риском развития рака молочной железы. Во многих исследованиях выявлено, что у больных, получающих эстроген, повышается риск возникновения карциномы эндометрия. Степень риска изменяется в зависимости от длительности терапии и дозы: так, риск в 15 раз выше у больных, принимающих большие дозы эстрогена в течение 5 лет и более, тогда как у больных, получающих в течение непродолжительного периода низкие дозы, риск повышается только в 2-4 раза. Применяя одновременно прогестин, можно не только предотвратить повышение риска, но фактически снизить частоту возникновения рака эндометрия ниже средней по всей популяции.
Известен ряд случаев развития аденокарциномы влагалища у молодых женщин, чьи матери получа
ли большие дозы диэтилстильбэстрола на ранних сроках беременности. Этот тип рака характерен для женщин в возрасте 14-44 лет. Частота его возникновения у пациенток, получавших диэтилстильб-эстрол, составляет 1:1000 и слишком низка для достоверного установления причинно-следственной связи. Тем не менее его прием увеличивает также вероятность бесплодия, внематочной беременности и преждевременных родов. В настоящее время общепризнанно, что не существует показаний для назначения диэтилстильбэстрола во время беременности. Неизвестно, дают ли другие эстрогены подобный эффект и является ли наблюдаемый феномен специфичным для диэтилстильбэстрола. Этот препарат можно использовать только для лечения рака (например, предстательной железы) или в качестве посткоитального контрацептива (табл. 39-4).
Противопоказания
Эстрогены нельзя назначать больным с эстро-гензависимыми новообразованиями, такими как карцинома эндометрия, или пациенткам с карциномой молочной железы или высоким риском ее развития. Их необходимо избегать при генитальных кровотечениях неустановленной природы, заболеваниях печени или тромбоэмболических нарушениях в анамнезе.
Дозы и препараты
Дозы наиболее распространенных препаратов естественного и синтетического происхождения приведены в табл. 39-1. Хотя эстрогены вызывают практически одинаковые гормональные эффекты, степень их выраженности зависит от конкретного препарата и пути введения. Как уже отмечалось, эстрадиол является наиболее активным эндогенным эстрогеном и имеет наиболее высокий аффинитет к эстрогенным рецепторам. Его метаболиты эстрон и эстриол оказывают слабое действие на матку. Обнаружено, что другой важный метаболит эстрадиола, 2-гидроксиэстрон (катехолэстроген), выполняет в головном мозгу функции нейромедиатора. Кроме того, он конкурирует с катехоламинами за катехол-О-метилтрансферазу и ингибирует ти-розингидроксилазу. Вследствие этого препараты, содержащие эстрон и эстрадиол, дают больше центральных эффектов, чем синтетические эстрогены, метаболизируемые другим путем.
При одинаковом уровне подавления секреции гонадотропина пероральные препараты эстрона и эстрадиола оказывают более сильное действие на КСГ и ПГСГ, чем синтетические препараты. Этот путь введения приводит к усилению концентрирования гормона в печени, что повышает синтез этих связывающих белков. Для предотвращения данного эффекта были созданы трансдермальные формы. Назначение 50-100 мкг эстрадиола трансдермаль-но оказывает на концентрацию гонадотропина, эндометрий и эпителий влагалища такой же эффект, что и введение внутрь 0.625-1.25 мг конъюгированных эстрогенов. С другой стороны, трансдермальные препараты не повышают существенно концентрацию ренинового субстрата, КСГ и ПГСГ и не вызывают характерных для эстрогенов изменений липидного состава крови.
Прогестины
Естественные прогестины: прогестерон
Прогестерон представляет собой основной прогестин у человека. Кроме того, что он оказывает важное гормональное действие, он является предшественником эстрогенов, андрогенов и адренокортикостероидов. Он синтезируется яичниками, семенниками и корой надпочечников из циркулирующего в крови холестерина. Большое количество этого гормона синтезируется и высвобождается плацентой во время беременности.
В яичниках продукция прогестерона в первую очередь синтезируется желтым телом. Здоровые мужчины секретируют 1-5 мг прогестерона в сутки, что создает концентрацию в плазме 0.03 мкг/дл. У женщин во время фолликулярной фазы цикла, когда секреция прогестерона составляет только несколько миллиграммов в день, его уровень лишь немного выше. Во время лютеиновой фазы содержание гормона в плазме повышается с 0.5 мкг/дл до более чем 2 мкг/дл (рис. 39-1).
Синтетические прогестины
Синтезировано большое количество прогестиновых соединений. Некоторые из них активны при приеме внутрь. Это неоднородная группа соединений, каждое из которых отличается от прогестерона в том или ином отношении. В табл. 39-2 представлены некоторые из синтетических прогестинов и их эффек
ты. В целом, 21-углеродные соединения (гидроксипрогестерон, медроксипрогестерон, мегэстрол и ди-метистерон) наиболее близки к прогестерону и фармакологически, и химически. Новая группа синтетических прогестинов (препараты “третьего поколения”) проходит клинические испытания в качестве компонентов оральных контрацептивов. Это 19-нор, 13-этилстероидные соединения — гестоден, норгес-тимат и дезогестрел. Установлено, что они обладают меньшей андрогенной активностью, чем прогестины первых поколений (Bringer, 1992).
Фармакокинетика
Прогестерон быстро абсорбируется при любом пути введения. Период его полувыведения из плазмы составляет приблизительно 5 минут, при этом небольшое количество гормона временно депонируется в жирах организма. Он практически полностью метаболизируется во время первого прохождения через печень и по этой причине практически не дает эффекта при назначении внутрь.
В печени прогестерон метаболизируется до прегнандиола и конъюгирует с глюкуроновой кислотой. В виде глюкуронида прегнандиола он экскретируется в мочу (рис. 39-4). Количество прегнандиола в моче используется как показатель секреции прогестерона. Этот метод весьма полезен, несмотря на то, что доля прогестерона, превращающегося в это соединение, варьирует-день ото дня у одного и того же больного и вариабельна у разных индивидуумов. Помимо прогестерона у человека обнаружены 20а-и 20р-гидроксипрогестерон (20а- и 20Р-гидрокси-4-прегнен-3-он). Эти соединения обладают примерно '/5 от активности прогестерона у людей и других видов животных. Об их физиологическом значении известно мало, но у некоторых видов в больших количествах продуцируется 20а-гидроксипрогестерон, что может иметь биологическое значение.
Обычные пути введения и длительность действия синтетических прогестинов представлены в табл. 39-2. Большинство из этих веществ быстро метаболизируется до неактивных продуктов, которые экскретируются в основном с мочой.
Физиологические эффекты
А. Механизм. Прогестины проникают в клетку и присоединяются к прогестероновым рецепторам, распределенным в ядре и цитоплазме. Комплекс ли
ганд-рецептор связывается с эффекторным элементом, активируя транскрипцию генов. Эффекторный элемент для прогестерона подобен кортикоидному эффекторному элементу; специфичность ответа зависит от того, какой рецептор имеется в данной клетке, а также от других характерных для нее факторов транскрипции. Комплекс прогестерон-рецептор образует димер до того, как связывается с ДНК. Однако в отличие от эстрогеновых рецепторов он может образовывать как гетеро-, так и гомодимеры.
Б. Эффекты прогестерона. Прогестерон оказывает слабое действие на метаболизм белков. Он стимулирует активность липопротеидлипазы и, по-видимому, способствует депонированию жиров. Более выражено действие гормона на метаболизм углеводов. Прогестерон увеличивает базальный уровень инсулина и инсулиновый ответ на колебания содержания глюкозы у больных. Обычно не обнаруживается выраженных изменений толерантности к углеводам. Прогестерон способствует депонированию глюкозы в печени, возможно, за счет активации действия инсулина, а также усиливает кетогенез.
Прогестерон может конкурировать с альдостероном в почечных канальцах, вызывая снижение реабсорбции Na+. Это приводит к повышению секреции альдостерона корой надпочечников (например, при беременности). У людей прогестерон повышает температуру тела. Механизм этого эффекта неизвестен, однако предполагается изменение активности терморегуляторных центров гипоталамуса. Прогестерон влияет и на деятельность центров дыхания. Активизируется респираторный ответ на СО2 (синтетические прогестины, содержащие этинильную группу, не дают респираторных эффектов). Это приводит к заметному снижению Рсо2 в артериях и альвеолах во время беременности и в лютеиновую фазу менструального цикла. Прогестерон и родственные ему стероиды оказывает также центральное угнетающее и гипнотическое действие.
Прогестерон отвечает за развитие альвеол и долек секреторного аппарата молочных желез, за созревание и изменения секреции эндометрия, которые происходят в процессе овуляции (рис. 39-1).
ТАБЛИЦА 39-2. Активность прогестинов
Препарат Путь Длитель- Активность
введе- ность Эстро- Андро- Антиэст- Антианд- Анаболи-
НИЯ действия генная генная рогенная рогенная ческая
Прогестерон и дериваты
Прогестерон В/м 1 день — — + — —
Гидроксипрогестерона капронат В/м 8-14 дней НА НА - - -
Медроксипрогестерона ацетат В/м, 4-12 недель — + + — —
Peros 1-3 дня
Мегэстрола ацетат Peros 1-3 дня - + — + -
Дериваты 17а-этинилтестостерона
Дериваты тестостерона Диметистерон Дериваты 19-нортестостерона Peros 1-3 дня - - НА -
Норэтинодрел' Peros 1-3 дня + — — — —
Линестренол2 Peros 1-3 дня + + — — +
Норэтиндрон' Peros 1 -3 дня НА + + — +
Норэтиндрона ацетат1 Per os 1-3 дня НА + + — +
Этинодиола диацетат1 Peros 1-3 дня НА + + — —
L-Норгестрел’ Peros 1-3 дня - + + +
Примечание.
«+» — активен; «-» — неактивен; НА — низкая активность. Активность оценивалась на различных видах животных при использовании различных методов и может не подходить для людей.
’ Смотри табл. 39-3.
2 Не применяются в США.
Прегнандиол
1 ба-Гидроксиэстрон
Рис. 39-4. Пути синтеза и разрушения прогестерона, андрогенов и эстрогенов. Эти пути идентичны в яичниках, семенниках и надпочечниках (Из: Greenspan F.S. [ed.]. Basic & Clinical Endocrinology, 3rd ed. Appleton & Lange, 1991.)
Гормон снижает уровень многих аминокислот в плазме и усиливает экскрецию азота с мочой. Установлено, что он вызывает изменения в структуре и функции эндоплазматического ретикулума гладкомышечных волокон у экспериментальных животных.
Другие эффекты описаны в разделе “Гормональная контрацепция”.
Б. Синтетические прогестины. Как уже сообщалось, 21-углеродные аналоги прогестерона препятствуют развитию индуцируемой альдостероном задержки ионов натрия и оказывают слабое андрогенное и эстрогенное действие. Остальные соединения (19-углеродные) вызывают отторжение эндометрия, не поддерживают беременность в экспериментах на животных, являются наиболее эффективными ингибиторами секреции гонадотропинов и могут проявлять минимальную эстрогенную, андрогенную и анаболическую активность (табл. 39-2). Иногда их называют “задержанными андрогенами”.
Клиническое использование прогестинов
А. Терапевтическое применение. Прогестиновые гормоны в основном используются для заместительной гормональной терапии и в качестве средств гормональной контрацепции. Кроме того, их назначают для длительного подавления функции яичников в других целях. При парентеральном применении в больших дозах в качестве монотерапии (например, 150 мг медроксипрогестерона ацетата внутримышечно каждые 90 дней) возникает длительное подавление овуляции и аменорея. Такое назначение используется при лечении дисменореи, эндометриоза, гирсутизма и патологических кровотечений, когда противопоказаны эстрогены, а также для контрацепции. Основным недостатком этой схемы является необходимость длительного периода восстановления функции яичников после прекращения приема. Назначать препарат женщинам, планирующим беременность в ближайшем будущем, нельзя. Такая же схема введения устраняет приливы у некоторых пациенток в менопаузе и может использоваться, если противопоказана эстрогеновая терапия.
Прием медроксипрогестерона ацетата по 10-20 мг внутрь два раза в неделю или по 100 мг/м2 внутримышечно каждые 1-2 недели останавливает ускоренное половое созревание у детей.
Прогестины не нашли применения в терапии угрожающего или привычного аборта. Ранние свидетельства в пользу назначения этих препаратов основывались на недоказанном предположении о том, что после нескольких спонтанных абортов вероятность повторного выкидыша превышает 90 %. При назначении прогестиновых препаратов пациентам с предшествующими несколькими спонтанными абортами уровень сохранения беременности достигал 80 %. В настоящее время установлено, что у таких больных аборт происходит только в 20 % случаев даже при отсутствии лечения.
Прогестерон и медроксипрогестерон пытались использовать у женщин с трудностью зачатия и у тех, у кого наблюдается незначительное повышение базальной температуры тела. Однако подобная терапия оказалась неэффективной. Не подтвердился и ожидаемый эффект этих препаратов в лечении предменструального синдрома.
Б. Применение в диагностике. Прогестерон можно использовать для тестирования секреции эстрогенов. Кровотечение, следующее за отменой 5-7-дневного введения 150 мг/день прогестерона или 10 мг/день медроксипрогестерона у больных с аменореей, возникает только в том случае, если эндометрий предварительно стимулируется эстрогенами. Для оценки функциональной реактивности эндометрия у больных с аменореей может быть использована комбинация прогестина и эстрогена.
Противопоказания, предостережения и побочные эффекты
В последних исследованиях прогестиновых соединений и содержащих их комбинированных пероральных контрацептивов установлено, что прогестин в этих веществах способен вызывать у некоторых больных повышение кровяного давления. У женщин наиболее активные прогестины снижают также концентрацию ЛПВП в плазме, что повышает вероятность возникновения инфаркта миокарда (раздел “Гормональная контрацепция”).
Другие гормоны яичников
В норме яичники продуцируют небольшое количество андрогенов, включая тестостерон, андростендион и дегидроэпиандростерон. Из них только тестостерон обладает значительной биологической
активностью, хотя андростендион в периферических тканях может превращаться в эстрон. В норме за 24 часа у женщины продуцируется 200 мкг тестостерона, и примерно /з этого количества синтезируется прямо в яичниках. Физиологическое значение этого небольшого количества андрогенов не установлено, но они отчасти отвечают за нормальный рост волос в период полового созревания и могут оказывать другое важное влияние на метаболизм. Продукция яичниками андрогенов значительно усиливается при некоторых патологических состояниях, что обычно сопровождается возникновением гирсутизма и аменореи.
Яичники продуцируют также ингибин и активин. Эти полипептиды состоят из нескольких комбинаций а- и Р-субъединиц. оф-Димер (ингибин) подавляет секрецию ФСГ, тогда как РР-димер (активин) повышает секрецию этого гормона. Исследования на приматах показали, что ингибин не оказывает прямого влияния на яичниковый стероидогенез, а активин модулирует реакцию на ЛГ и ФСГ. Например, одновременное введение активина и человеческого ФСГ усиливает стимуляцию синтеза прогестерона и активирует ароматазу в гранулезных клетках. При комбинации с ЛГ активин подавляет ЛГ-индуцируемый прогестероновый ответ на 50 %, заметно повышая в то же время базальную и стимулируемую ЛГ активность ароматазы. В других тканях активин может выполнять роль фактора роста. Физиологическая роль этих модуляторов не вполне ясна.
Релаксин — еще один полипептид, эстрагируе-мый из яичников. Трехмерная структура релаксина родственна структуре полипептидов, повышающих рост, и сходна со структурой инсулина. По аминокислотной последовательности релаксин отличается от инсулина, но так же, как и он, состоит из двух цепей, связанных дисульфидными мостиками, отщепляющихся от соответствующего прогормона. Он обнаружен в яичниках, плаценте, матке и крови. Было продемонстрировано, что релаксин синтезируется в лютенизирующих гранулезных клетках желтого тела. Он активирует синтез гликогена и захват воды миометрием и снижает сократительную способность матки. У некоторых видов животных он изменяет механические свойства шейки матки и лобковых связок, облегчая родовой акт.
Содержание релаксина у женщин измеряется с помощью иммунологического метода. Уровни гормона максимальны после выброса ЛГ и во время
менструаций. Его физиологическая роль окончательно не установлена.
Клинические испытания релаксина проводились на больных, страдающих дисменореей. Релаксин назначается также пациенткам с преждевременными или продолжительными родами. При нанесении на шейку матки во время родов он облегчает дилатацию и ускоряет родоразрешение.
Гормональная контрацепция (имплантируемые
и пероральные контрацептивы)
В настоящее время используется большое количество пероральных контрацептивов, содержащих эстрогены или прогестины (или и те, и другие) (табл. 39-3). Эти препараты имеют много сходных свойств, но демонстрируют и определенные различия, зависящие от особенностей их химического строения.
Для пероральной контрацепции используют два типа средств: 1) комбинацию эстрогенов и прогестинов; 2) постоянную прогестиновую терапию без сопутствующего назначения эстрогенов. Все препараты для перорального использования хорошо абсорбируются, причем в комбинированных лекарствах фармакокинетика ни одного из веществ значительно не изменяется под действием другого компонента.
Сейчас доступен только один имплантируемый контрацептив: высвобождаемый из подкожного имплантата норгестрел эффективно подавляет овуляцию. Это вещество используют и в качестве прогестинового компонента пероральных контрацептивов.
Фармакологические эффекты
А. Механизм действия. Комбинация эстрогенов и прогестинов оказывает свое контрацептивное действие главным образом за счет селективного угнетения функции гипофиза, что проявляется в подавлении овуляции. Кроме того, наблюдаемые изменения в слизи шейки матки и эндометрии матки, а также в подвижности и секреции маточных труб снижают вероятность оплодотворения и импланта-
ТАБЛИЦА 39-3. Использование некоторых пероральных и имплантируемых контрацептивных средств. Эстрогенсодержащие препараты представлены в порядке возрастания содержания эстрогена (этинилэстрадиол и местранол обладают одинаковой активностью)
Препараты Эстроген (мг) Прогестин (мг)
Монофазные комбинации (таблетки) Лоэстрин 1/20 Этинилэстрадиол 0.02 Норэтиндрона ацетат 1.0
Лоэстрин 1.5/30 Этинилэстрадиол 0.03 Норэтиндрона ацетат 1.5
Дезоген - Этинилэстрадиол 0.03 Дезогестрел 0.15
Ло/Оврал Этинилэстрадиол 0.03 dl-Норгестрел 0.3
Нордетт Этинилэстрадиол 0.03 L-Норгестрел 0.15
Бревикон, модикон Этинилэстрадиол 0.035 Норэтиндрон 0.5
Демулен 1 /35 Этинилэстрадиол 0.035 Этинодиола диацетат 1.0
Тенора 1/35, Нелова 1/35 Е, Этинилэстрадиол 0.035 Норэтиндрон 1.0
Норинил 1/35, Орто-Новум 1/35 Орто-Циклен Этинилэстрадиол 0.035 Норгестимат 0.25
Овкон 35 Этинилэстрадиол 0.035 Норэтиндрон 0.4
Демулен 1/50 Этинилэстрадиол 0.05 Этинодиола ди ацетат 1.0
Норлестрин 1/50 Этинилэстрадиол 0.05 Норэтиндрона ацетат 1.0
Норлестрин 2.5/50 Этинилэстрадиол 0.05 Норэтиндрона ацетат 2.5
Овкон 50 Этинилэстрадиол 0.05 Норэтиндрон 1.0
Оврал Этинилэстрадиол 0.05 DL-Норгестрел 0.5
Тенора 1/50, Норинил 1/50, Орто-Новум 1/50 Местранол 0.05 Норэтиндрон 1.0
Эновид 5 Местранол 0.075 Норэтинодрел 5.0
Норинил 1 /80, Орто-Новум 1 /80 Местранол 0.08 Норэтиндрон 1.0
Эновид Е Местранол 0.1 Норэтинодрел 2.5
Норинил 2, Орто-Новум 2 Местранол 0.1 Норэтиндрон 2.0
Овулен Местранол 0.1 Этинодиола диацетат 1.0
Двухфазные комбинации (таблетки) Орто-Новум 10/11 Этинилэстрадиол 0.035 . Норэтиндрон 0.5
1-10-й день 11-21-й день Этинилэстрадиол 0.035 Норэтиндрон 1.0
Трехфазные комбинации (таблетки) Трифазил 1-6-й день Этинилэстрадиол 0.03 L-Норгестрел 0.05
7-11-й день Этинилэстрадиол 0.04 L-Норгестрел 0.075
12-21-й день Этинилэстрадиол 0.03 L-Норгестрел 0.125
Орто-Новум 7/7/7 1-7-й день Этинилэстрадиол 0.035 - Норэтиндрон 0.5
8-14-й день Этинилэстрадиол 0.035 Норэтиндрон 0.75
15-21-й день Этинилэстрадиол 0.035 Норэтиндрон 1.0
Три-Норинил 1-7-й день Этинилэстрадиол 0.035 Норэтиндрон 0.5
8-16-й день Этинилэстрадиол 0.035 Норэтиндрон 1.0
17-21-й день Этинилэстрадиол 0.035 Норэтиндрон 0.5
Орто-Три- Циклен 1-7-й день Этинилэстрадиол 0.035 Норгестимат 0.18
8-14-й день Этинилэстрадиол 0.035 Норгестимат 0.215
15-21-й день Этинилэстрадиол 0.035 Норгестимат 0.25
6. Заказ 3252
ТАБЛИЦА 39-3. (Продолжение)
Препараты Эстроген (мг) Прогестин (мг)
Ежедневные прогестины (таблетки) Микронор — Hop-QD — Овретт — Имплантируемые прогестиновые препараты Норплант — Норэтиндрон 0.35 Норэтиндрон 0.35 DL-Норгестрел 0.075 ь-Норгестрел (6 капсул для имплантации по 36 мг в каждой)
ции. Постоянное введение одного прогестина не всегда подавляет овуляцию. При использовании этих препаратов для предотвращения беременности играют роль и другие упомянутые ранее факторы.
Б. Действие на яичники. Постоянное использование комбинированных препаратов подавляет функцию яичников. Развитие фолликулов минимально, отсутствуют такие обычно наблюдаемые у женщин с сохраненной овуляцией морфологические признаки, как желтое тело, большие фолликулы, отек стромы и другие. Яичники становятся меньше, даже если они были увеличены до начала приема препаратов.
У большей части больных при прекращении приема препаратов нормальный менструальный цикл восстанавливается. Примерно у 75 % пациенток овуляция происходит во время первого цикла и у 97 % — после третьего цикла. Примерно в 2 % случаев аменорея сохраняется в течение нескольких лет после прекращения приема препаратов, особенно у женщин, которые уже применяли эту форму контрацепции (у них нередко аменорея сочетается с галактореей).
Результаты цитологических исследований вагинальных выделений зависят от используемых препаратов. Однако практически все комбинированные препараты снижают индекс созревания из-за присутствия прогестинов.
В. Влияние на матку. После продолжительного приема возможна гипертрофия шейки матки и возникновение полипов. Препараты также существенно влияют на слизь шейки матки, делая ее более похожей на постовуляционную, повышая вязкость и уменьшая количество.
Средства, в состав которых входят эстрогены и гестагены, в конце цикла вызывают отторжение
стромы. Препараты, содержащие 19-норпрогести-ны, особенно с низким количеством эстрогенов, способствуют более выраженной атрофии желез эндометрия и делают кровотечения менее обильными.
Г. Влияние на молочные железы. Для большинства женщин, получающих эстрогенсодержащие препараты, характерна стимуляция молочных желез. В целом наблюдается некоторое увеличение размеров груди. Назначение эстрогенов и комбинаций эстрогенов и прогестинов способствует подавлению лактации. Прием низких доз не оказывает заметного влияния на кормление грудью. Предварительные исследования показали, что только небольшое количество пероральных контрацептивов проникает в грудное молоко, что, по-видимому, не имеет существенного значения.
Д. Другие эффекты пероральных контрацептивов.
1. Действие на центральную нервную систему. Действие пероральных контрацептивов на центральную нервную систему человека изучено недостаточно. У животных отмечались разнонаправленные эффекты эстрогенов и прогестерона: эстрогены повышают возбудимость головного мозга, а прогестерон снижает ее. Повышение температуры тела под действием прогестерона и ряда синтетических прогестинов также связывают с его влиянием на ЦНС.
Какие-либо поведенческие или эмоциотропные эффекты данных соединений выявить очень трудно. Хотя частота выраженных изменений настроения, аффекта и поведения невелика, небольшие изменения наблюдаются довольно часто.
2. Действие на эндокринные функции. Уже упоминалось подавление этими препаратами гипофизарной секреции гонадотропинов. Известно также, что эстрогены изменяют структуру и функцию над
почечников. Они повышают концентрацию в плазме «2-глобулина, связывающего гидрокортизон (кортикостероидсвязывающего глобулина). Это не приводит к длительному изменению секреции кортизола, но его концентрация в плазме может в два раза превышать содержание гормона у людей, не получающих препарат. Под действием эстрогенов и пероральных контрацептивов ослабляют реакцию со стороны АКТГ на введение метирапона.
Эти препараты влияют на ангиотензин-альдо-стероновую систему, повышая активность ренина в плазме и усиливая секрецию альдостерона.
Они способствуют увеличению концентрации тироксинсвязывающего глобулина, в результате чего содержание тироксина (Т4) повышается до уровня, наблюдаемого обычно при беременности. Так как больше тироксина связывается с белком, количество свободного Т4 у этих больных нормально.
3. Действие на кровь. Выраженное тромбоэмболическое действие, отмечавшееся у женщин, принимающих пероральные контрацептивы, вызвало большое количество исследований эффектов этих препаратов в отношении свертывающей системы крови. Ясности в этом вопросе до сих пор нет. Пероральные контрацептивы достоверно не изменяют время кровотечения и образования сгустка. Наблюдаемые изменения сходны с теми, которые описаны при беременности. Активируются факторы VII, VIII, IX и X. Для увеличения протромбинового времени у больных, принимающих пероральные контрацептивы, может потребоваться повышенное количество производных кумарина.
Наблюдается возрастание концентрации желе-зав сыворотке и общего связывания железа, подобно тому, как это описано у больных гепатитом.
Определенных существенных изменений со стороны клеточных элементов крови не наблюдалось. У нескольких больных были зарегистрированы фолиеводефицитные анемии.
4. Действие на печень. Женские половые гормоны оказывают выраженное действие на печень. Иногда это приводит к существенному нарушению функции, что будет рассмотрено подробнее в разделе “Побочные эффекты”.
Влияние препаратов на концентрацию белков в крови определяется действием эстрогенов на синтез различных а2-глобулинов и фибриногена. Эстрогены скорее снижают, чем повышают сывороточную концентрацию гаптоглобинов, образующихся
в печени. Изменение метаболических процессов в печени оказывает также некоторое влияние на обмен углеводов и липидов в целом.
Происходит и существенное изменение печеночной экскреции и метаболизма лекарств. Эстрогены в количествах, вырабатываемых во время беременности или попадающих в организм в составе пероральных контрацептивов, замедляют клиренс сульфобромофталеина и снижают выделение желчи. Со-держание холевой кислоты в пуле желчных кислотах повышается, а хенодезоксихолевой кислоты — снижается. Эти изменения, возможно, являются причиной образования желчных камней при использовании данных препаратов.
5. Действие на метаболизм липидов. Известно, что эстрогены повышают сывороточный уровень триглицеридов, а также свободного и этерифици-рованного холестерина. Возрастает содержание фосфолипидов и липопротеидов высокой плотности. Количество липопротеидов низкой плотности обычно снижается. Эти эффекты выражены при введении 100 мкг местранола или этинилэстрадио-ла, а дозы 50 мкг или менее оказывают лишь минимальное действие. Прогестины (особенно дериваты 19-нортестостерона) снижают эти проявления активности эстрогенов. Препараты, содержащие небольшое количество эстрогена и прогестина, могут немного снижать уровень триглицеридов и липопротеидов высокой плотности.
6. Действие на метаболизм углеводов. Введение пероральных контрацептивов вызывает изменение метаболизма углеводов, сходное с наблюдаемым при беременности. Происходит снижение всасывания углеводов из желудочно-кишечного тракта. Прогестерон повышает базальный уровень инсулина и усиливает вызываемое инсулином потребление углеводов. Препараты, содержащие более активные прогестины, такие как норгестрел, через несколько лет приема могут прогрессивно уменьшать толерантность к углеводам. Однако изменение толерантности к глюкозе обратимо при прекращении приема препаратов.
7. Влияние на сердечно-сосудистую систему. Эти препараты вызывают небольшое повышение сердечного выброса, увеличение систолического и диастолического давления и частоты сердечных сокращений. Патологическое повышение кровяного давления описано у небольшого числа больных. При отмене препарата давление возвращается к норме. Хотя у большинства больных изменения
давления незначительны, у некоторых из них они существенны. Поэтому необходимо следить за давлением крови у каждого пациента. Повышение этого показателя наблюдалось в постменопаузе у некоторых женщин, получавших только эстрогены.
8. Влияние на кожу. Под действием пероральных контрацептивов отмечается усиление пигментации кожи (хлоазма). Такое действие более характерно для женщин со смуглой кожей, особенно в условиях повышенной инсоляции. Некоторые ан-дрогенподобные прогестины могут стимулировать продукцию секрета сальных желез, что сопровождается появлением у больных угрей. Но так как угнетается продукция андрогенов яичниками, у большинства пациентов отмечается уменьшение образования угрей и роста волос на конечностях. Последующая пероральная контрацепция с участием эстрогенов часто снижает продукцию секрета сальных желез. Это может быть связано с подавлением продукции андрогенов яичниками.
Клиническое использование
Наиболее важной областью применения комбинации эстрогенов и прогестинов является пероральная контрацепция. Специально для этой цели разработано большое количество препаратов; некоторые из них представлены в табл. 39-3. Для упрощения применения они имеют специальную упаковку. В целом эти средства весьма эффективны: при их использовании в соответствии с указаниями риск зачатия очень мал. Установлено, что частота возникновения беременности при приеме комбинированных препаратов составляет 0.5-1 на 100 женщин в год. Контрацепция может быть неудачной у некоторых больных, принимающих фенитоин или антибиотики, или при пропуске приема одной или нескольких доз.
Прогестины и эстрогены полезны и для лечения пациенток с эндометриозом. В случаях, когда основным симптомом является тяжелая дисменорея, подавление овуляции эстрогенами может устранять болезненность. Однако у большинства больных такой подход к терапии нельзя считать адекватным. Длительное применение больших доз прогестинов или комбинаций прогестинов и эстрогенов предотвращает периодическое отторжение эндометрия, что в некоторых случаях приводит к развитию фиброза эндометрия и в течение продолжительного времени препятствует имплантации.
Характерной особенностью большинства гормональных препаратов является то, что многие нежелательные физиологические эффекты этих средств связаны с их неправильным использованием. Поэтому необходимо применять препараты, содержащие минимальное эффективное количество гормонов.
Побочные эффекты
Частота возникновения серьезных токсических эффектов при использовании этих препаратов низка. Существует ряд обратимых изменений промежуточного метаболизма. Часто наблюдаются слабые побочные эффекты, но большинство из них не имеет выраженного характера и быстро исчезает. Осложнения, связанные с длительным приемом, могут устраняться изменением состава препарата. Хотя прекращение приема по этой причине не всегда является необходимым, более % всех женщин, практикующих пероральную контрацепцию, прерывают терапию по причине, не связанной с планированием беременности.
А. Незначительные побочные эффекты
1. Тошнота, болезненность молочных желез, профузные кровотечения и отеки связаны с количеством эстрогена в препарате. Эти эффекты часто устраняются переходом на прием препаратов, содержащих меньшее количество эстрогена, или средств, в состав которых входят прогестины с более выраженными андрогенными свойствами.
2. Необходимо учитывать возможные изменения белкового состава крови и эффекты препаратов в отношении эндокринной функции в случаях, когда возникает необходимость оценки активности щитовидной железы, надпочечников и гипофиза. Считается, что повышение вязкости крови является следствием увеличения уровня фибриногена.
3. Возможна незначительная и быстро исчезающая головная боль. Часто имеет место обострение мигрени и увеличение частоты спазмов мозговых сосудов. Если прием данных средств сопровождается такими тяжелыми расстройствами, терапию следует прекратить.
4. Иногда во время отмены препаратов не возникает кровотечение, что чаще наблюдается при приеме комбинированных средств и может ошибочно приниматься за возникновение беременности. Если такие явления тревожат пациенток, то можно попробовать назначить другие препараты или выбрать другой метод контрацепции.
Б. Побочные эффекты средней тяжести
Перечислим побочные эффекты, требующие прекращения приема пероральных контрацептивов.
1. При использовании для контрацепции моно-компонентных прогестинов наиболее частой проблемой являются профузные кровотечения. Они возникают почти у 25 % больных. Как правило, это осложнение наблюдается у женщин, получающих низкодозовые препараты; безопаснее комбинированные пилюли с более высоким содержанием прогестинов и эстрогенов. Двухфазные и трехфазные пероральные контрацептивы (табл. 39-3) снижают частоту обильных кровотечений без повышения общего содержания гормона.
2. Чаще всего увеличение массы тела наблюдается при использовании комбинированных препаратов, содержащих андрогенподобные прогестины. Обычно этот эффект устраняется переходом на препараты с минимальным прогестиновым действием или назначением соответствующей диеты.
3. Возможно усиление пигментации кожи, особенно у смуглых женщин. Вероятность этого явления повышается параллельно с длительностью применения: к концу первого года гиперпигментация отмечается у 5 % женщин, а после 8 лет приема препарата — у 40 %. Она усиливается при дефиците витаминов группы В. Эффект часто обратим при прекращении приема препарата, но может исчезать очень медленно.
4. Андрогенподобные прогестины могут вызывать появление угревой сыпи (табл. 39-2), тогда как препараты, содержащие высокую дозу эстрогенов, обычно значительно уменьшают ее появление.
5. Производные 19-нортестостерона могут усиливать гирсутизм. В этом случае предпочтительно назначение комбинированных препаратов, содержащих неандрогенные прогестины.
6. Иногда наблюдается расширение уретры, сходное с изменениями при беременности; более часто возникает бактериурия.
7. У больных, принимающих пероральные контрацептивы, чаще обнаруживаются вагинальные инфекции, которые трудно поддаются терапии.
8. Аменорея. После прекращения приема пероральных контрацептивов у 95 % женщин, имевших ранее нормальный менструальный цикл, он восстанавливается, но у некоторых процесс нормализации длится в течение нескольких месяцев и даже лет. У многих из этих больных наблюдается галакторея. Особенно подвержены продолжительной аменорее
после прекращения терапии пациентки, имевшие нерегулярные менструации до приема пероральных контрацептивов.
В. Тяжелые побочные эффекты
1. Сосудистые нарушения. Первым из описанных и наиболее изученным серьезным нежелательным эффектом является тромбоэмболия.
а. Венозная тромбоэмболия. Тромбоэмболические заболевания поверхностных и глубоких вен у женщин, не принимавших пероральные контрацептивы, возникают с частотой 1 на 1000 в год. Встречаемость этих нарушений у пациенток, пользующихся пероральными контрацептивами в низких дозах, почти в три раза выше. Риск возникновения заболевания повышается в течение первого месяца применения контрацептива и остается постоянным в течение нескольких лет и более. Вероятность развития таких нарушений снижается до исходной через месяц после прекращения приема препарата. Риск венозных тромбозов или легочных эмболий выше у женщин с исходной предрасположенностью к этому заболеванию.
Возникновение данного осложнения связано с эстрогенной, а не прогестиновой составляющей пероральных контрацептивов и не зависит от возраста, количества родов в анамнезе, небольшого избытка массы и курения. Пониженный венозный кровоток, пролиферация эндотелия вен и артерий, повышенная в результате изменения агрегации тромбоцитов и фибринолитической системы свертываемость крови увеличивают вероятность тромбозов. Во время приема пероральных контрацептивов значительно снижается концентрация в плазме антитромбина III — основного ингибитора тромбина. Эти изменения происходят в течение первого месяца и продолжаются в течение приема препаратов, исчезая через месяц после их отмены.
б. Инфаркт миокарда. Использование пероральных контрацептивов связано с небольшим повышением риска инфаркта миокарда у женщин с ожирением, имевших в анамнезе преэклампсию или гипертензию, а также у пациенток, страдающих ги-перлипопротеидемией или диабетом. Риск сильно повышается у курящих женщин. При приеме пероральных контрацептивов у некурящих женщин в возрасте 30-39 лет он составляет 4 случая на 100 000 в год в сравнении со 185 случаями на 100 000 много курящих женщин в возрасте 40-44 лет в год. Считается, что связь с инфарктом миокарда обусловлена усилением атерогенеза из-за снижения толеран
тности к глюкозе, снижением уровня ЛПВП, повышением содержания ЛПНП и увеличением агрегации тромбоцитов. Однако у некоторых больных также может играть роль провокация коронарного спазма. Прогестиновый компонент пероральных контрацептивов снижает уровень холестерина ЛПВП пропорционально андрогенной активности прогестина. Поэтому итоговый эффект будет зависеть от конкретного состава используемых таблеток и чувствительности к нему пациенток. Недавние исследования свидетельствуют, что риск возникновения инфаркта вновь снижается после прекращения приема пероральных контрацептивов.
в. Цереброваскулярные нарушения. Риск возникновения инсульта выше у женщин старше 35 лет. Он возрастает во время приема у тех, кто впервые использует пероральные контрацептивы. Однако увеличение частоты субарахноидальных кровоизлияний обнаружено как у принимающих препараты, так и у принимавших их ранее и может возрастать со временем. Риск тромботического или геморрагического инсульта, связываемый с пероральными контрацептивами (старыми препаратами) составляет 37 случаев на 100 000 принимающих в год. Из этих случаев 10 % были фатальны, и большинство из них имело характер субарахноидальных геморрагий. Данных о влиянии курения и других факторов риска недостаточно.
Повышается также риск подъема кровяного давления: у женщин, пользующихся пероральными контрацептивами, частота выраженной гипертензии возрастает в 3-6 раз.
Таким образом, имеющиеся данные свидетельствуют, что пероральные контрацептивы увеличивают вероятность возникновения различных сердечно-сосудистых заболеваний в любом возрасте как среди курящих, так и среди некурящих пациенток. Особенно резко она повышается у много курящих женщин в возрасте 35 лет и старше. Очевидно, необходимо оценивать факторы риска для каждой конкретной пациентки, которой предполагается назначение пероральных контрацептивов.
2. Расстройства желудочно-кишечного тракта. У женщин, получающих прогестинсодержащие препараты, зарегистрировано большое число случаев холестатической желтухи. Различия во встречаемости этих заболеваний между разными популяциями свидетельствуют о влиянии генетических факторов. Желтуха, вызываемая этими препаратами, сходна с вызываемой другими 17-алкилзамещенны-
ми стероидами. Наиболее часто она наблюдается в течение первых трех циклов и особенно характерна для женщин, имеющих в анамнезе холестатическую желтуху в период беременности. Через 1-8 недель после прекращения приема препаратов желтуха и зуд исчезают.
Эти препараты повышают и частоту симптоматических заболеваний желчного пузыря, включая холецистит и холангит. Возможно, это результат описанных выше изменений, которые вызывают желтуху.
3. Депрессия. Депрессия, требующая прекращения приема гормональных контрацептивов, возникает у 6 % пациенток, принимающих некоторые из этих препаратов.
4. Рак. Возникновение злокачественных опухолей у пациентов, пользующихся оральными контрацептивами, явилось предметом интенсивного изучения. В настоящее время установлено, что эти соединения снижают риск возникновения рака эндометрия и яичников. Пероральные контрацептивы, по-видимому, не оказывают влияния на возникновение в течение жизни рака молочной железы у популяции в целом. Тем не менее некоторые исследования показали повышение риска у более молодых женщин; возможно, возникающие у них опухоли раньше проявляются клинически. Данные о связи между риском возникновения рака шейки матки и применением пероральных контрацептивов все еще противоречивы.
Помимо указанных эффектов, описывался ряд других побочных реакций, для которых причинно-следственная связь не установлена. Они включают алопецию, мультиформную эритему, узелковую эритему и другие заболевания кожи.
Противопоказания и предостережения
Эти препараты противопоказаны больным, страдающим тромбофлебитом, тромбоэмболией и цереброваскулярными нарушениями или имеющим эти заболевания в анамнезе. Их нельзя применять при вагинальных кровотечениях неизвестной этиологии. Необходимо избегать назначения препаратов пациенткам с наличием рака молочной железы или с подозрением на него, а также имеющим другие эстрогензависимые новообразования. Поскольку эти препараты вызывают обострение уже существующих заболеваний, их необходимо избегать или назначать с осторожностью женщинам с забо
леваниями печени, с бронхиальной астмой, экземой, мигренью, диабетом, гипертензией, невритом зрительного нерва, ретробульбарным невритом или судорожными припадками.
Пероральные контрацептивы могут вызывать отеки, и по этой причине они должны применяться с большой осторожностью больными с сердечной недостаточностью или теми, для кого развитие отеков нежелательно или опасно.
Эстрогены могут ускорять рост фибром. В связи с этим для женщин с такими опухолями необходимо выбирать средства, содержащие минимальное количество эстрогенов и прогестины с максимальными андрогенными свойствами. Таким пациенткам особенно полезно использовать для контрацепции препараты, содержащие только прогестины.
Эти препараты противопоказаны подросткам, у которых еще не закончено закрытие эпифизов.
Женщины, применяющие пероральные контрацептивы, должны быть ознакомлены с важными взаимодействиями этих средств с антимикробными препаратами. Нормальная флора желудочно-кишечного тракта повышает энтеропеченочную циркуляцию эстрогенов, поэтому антимикробные препараты, активные в отношении этих микроорганизмов, могут снижать эффективность пероральных контрацептивов.
Прогестиновая моноконтрацепция
В целях контрацепции могут назначаться низкие дозы прогестинов перорально или путем имплантации под кожу. Они особенно показаны тем пациенткам, которым нежелательно назначение эстрогенов. Прогестины почти так же эффективны, как внутри-маточные средства или комбинированные таблетки, содержащие 20-30 мкг этинилэстрадиола. Надо знать, что при этом высока вероятность аномальных кровотечений. Эффективная контрацепция может быть достигнута ежемесячной инъекцией 150 мг депонированного медроксипрогестерона ацетата. Исследуется возможность использования больших доз пероральных прогестинов как средства контрацепции во время половых сношений.
В США применяется гормональная контрацепция с помощью имплантации прогестинов под кожу. Для этого под кожу имплантируют капсулы, содержащие прогестин (L-норгестрел). Эти капсулы высвобождают от '/$ до '/з от количества стероида, содержащегося в пероральных препаратах. Они очень
эффективны, их действие продолжается в течение 5-6 лет. В низких концентрациях гормон оказывает слабое действие на метаболизм липопротеидов и углеводов или кровяное давление. Недостатками являются необходимость хирургического введения и удаления капсул, а также некоторая нерегулярность менструальных кровотечений.
Посткоитальные контрацептивы
Предотвратить беременность после коитуса можно введением одного эстрогена или его комбинацией с прогестинами (контрацепция “утром после”). Если прием осуществляется в пределах 72 часов, метод эффективен в 99 % случаев. Некоторые эффективные схемы назначения представлены в табл. 39-4. Гормоны часто назначают вместе с про-тиворвотными средствами, так как у 40 % женщин возникает тошнота и рвота. Другие побочные эффекты включают головную боль, головокружение, набухание молочных желез и спазмы мышц живота и нижних конечностей.
Установлено, что антагонист прогестероновых (и глюкокортикоидных) рецепторов мифепристон (RU 486) оказывает лютеолитическое действие и может быть полезным в качестве посткоитального контрацептива.
Прочие полезные эффекты пероральных контрацептивов
За последние десять лет стало очевидным, что снижение дозы компонентов пероральных контрацептивов значительно уменьшает вероятность возникновения умеренных и тяжелых побочных эффектов, обеспечивая относительно безопасный и удобный метод контрацепции для многих молодых женщин. Установлено, что применение пероральных
ТАБЛИЦА 39-4. Схемы назначения посткоитальных контрацептивов
Конъюгированные эстрогены: 10 мг 3 раза в день в течение 5 дней
Этинилэстрадиол: 2.5 мг дважды в день в течение
5 дней
Диэтилстильбэстрол: 50 мг ежедневно в течение
5 дней
0.5 мг норгестрела совместно с 0.05 мг этинилзст-радиола (например, Оврал): 2 таблетки + еще 2 таблетки в пределах 12 часов
контрацептивов сопровождается рядом полезных эффектов, не связанных с контрацепцией. Это снижение риска возникновения кисты яичников, рака яичников и эндометрия и доброкачественных опухолей молочных желез. Реже возникают воспалительные заболевания тазовых органов и внематочная беременность. Понижается риск развития дефицита железа, дуоденальных язв и ревматоидного артрита, а также уменьшается вероятность предменструальных симптомов, дисменореи и эндометриоза.
Ингибиторы и антагонисты эстрогена и прогестерона
Тамоксифен
Тамоксифен является конкурентным ингибитором и парциальным агонистом эстрадиола, широко используемым для паллиативного лечения поздних стадий рака молочных желез у женщин в постменопаузном периоде. Это нестероидное вещество (структура — см. рисунок ниже), назначаемое внутрь. Пик концентрации в плазме достигается через несколько часов после его введения. Период полувыведения из плазмы составляет 7-14 часов, экскреция осуществляется в основном печенью. Препарат назначают по 10-20 мг два раза в день. У 25 % пациентов наблюдаются горячие приливы, тошнота и рвота, а также большое количество других незначительных побочных эффектов. В исследованиях на больных, получавших тамоксифен в качестве средства адъювантной терапии ранних стадий рака молочной железы, установлено, что вероятность возникновения контрлатеральной опухоли снижается на 35 %. У этих больных предотвращалось также снижение плотности костной ткани поясничного отдела позвоночника и изменение липидного состава плазмы, что уменьшает риск возникновения атеросклероза после спонтанной или хирургической менопаузы.
Кломифен
Кломифена цитрат является парциальным агонистом эстрогенов со слабой гормональной активностью, который также действует как конкурентный ингибитор эндогенных эстрогенов. Установлена возможность его использования в качестве средства, вызывающего овуляцию.
Мифепристон
Мифепристон (RU 486) представляет собой 19-норстероид, который прочно связывается с прогестероновыми рецепторами и устраняет действие прогестерона. Предварительные исследования показали, что у 80 % женщин при назначении в средней фазе развития желтого тела он проявляет лютеолитичес-кие свойства. Механизм этого эффекта неизвестен, но сам эффект может быть основанием для использования мифепристона в качестве контрацептива (как альтернатива искусственному аборту). Однако соединение имеет большой период полувыведения. Кроме того, в больших дозах мифепристон может удлинять фолликулярную фазу последующего цикла, что затрудняет его длительное использование. Тем не менее однократный прием 600 мг можно рассматривать как эффективное посткоитальное контрацептивное средство срочного действия, хотя существует вероятность задержки начала следующего цикла. Препарат связывается и с глюкокортикоидными рецепторами. На небольшом клиническом материале установлено, что мифепристон полезен при лечении эндометриоза, синдрома Кушинга, рака молочной железы и других новообразований, которые содержат глюкокортикоидные и прогестероновые рецепторы.
Основной областью применения мифепристона до сих пор является прерывание беременности на ранних сроках. Прием 400-600 мг/день в течение четырех дней или 800 мг/день два дня успешно прерывает беременность в 85 % случаев. Основной побочный эффект — это продолжительное кровотечение, не требующее, однако, какого-либо вмешательства. Обнаружено, что комбинация однократной пероральной дозы 600 мг мифепристона и вагинальных пессарий, содержащих 1 мг простагландина Е, или орального мизопростола, эффективно прерывает беременность у 95 % пациенток в течение первых семи недель после оплодотворения. Побочные эффекты препарата проявляются тошнотой, диареей и болью. Почти у 5 % женщин возникают вагинальные кровотечения, требующие вмешательства врача.
Даназол
Изохазоловое производное этистерона (17а-эти-ннлтестостерон) даназол, обладающее слабыми прогестиновыми и андрогенными свойствами, используется для подавления функции яичников. Даназол угнетает повышенное выделение ЛГ и ФСГ в сере-
Тамоксифен
дине цикла и может предотвращать их компенсаторное повышение после кастрации у животных, но существенно не понижает (если вообще подавляет) базальный уровень этих гормонов у здоровых женщин. Даназол связывается с андрогенными, прогестероновыми и глюкокортикоидными рецепторами и может вызывать транслокацию рецептора андрогенов в ядро и инициировать синтез андрогенспеци-фичной РНК. Он не взаимодействует с внутриклеточными эстрогеновыми рецепторами, но образует комплексы с глобулинами, связывающими половые гормоны (ПГСГ) и кортикостероиды (КСГ). Препарат подавляет активность P-450scc (фермента, отщепляющего боковые цепи холестерина), 30-HSD (З-Р-гидроксистероиддегидрогеназы), 17P-HSD (17-а-гидроксистероиддегидрогеназы), 17,21-лиазы, Р-450с17 (17-а-гидроксилазы), Р-450с11 (lip-гидро-ксилазы), Р-450с21 (21-гидроксилазы), но не ингибирует ароматазу. Даназол увеличивает клиренс прогестерона, возможно, за счет конкуренции с гормоном за связывающие белки и может давать аналогичный эффект в отношении других активных стероидных гормонов. Основной метаболит даназола этистерон оказывает как прогестиновое, так и слабое андрогенное действие.
Препарат медленно метаболизируется, период его полувыведения превышает 15 часов. Поэтому введение два раза в сутки обеспечивает стабильную концентрацию лекарства в крови. Высокие концентрации даназола обнаруживаются в печени, надпочечниках и почках; экскреция осуществляется фекалиями и мочой.
Препарат используют для подавления функции гонад, он нашел основное применение в терапии эндометриоза. Для этих целей его назначают в дозе 600 мг/день. Через один месяц ее снижают до
400 мг/день, а через два месяца — до 200 мг/день. Через 3-12 месяцев у 85 % пациенток наблюдается заметное улучшение.
Даназол применяют также в терапии фиброкис-тоза молочных желез и гематологических заболеваний, в том числе гемофилии, болезни Кристмаса, идиопатической тромбоцитопенической пурпуры.
Основными побочными эффектами являются увеличение массы тела, отеки, уменьшение размера молочных желез, угревая сыпь и усиление секреции сальных желез, активация роста волос, огрубление голоса, головная боль, горячие приливы, изменения либидо и мышечные спазмы. Несмотря на то, что незначительные нежелательные явления встречаются довольно часто, сами по себе они редко требуют прекращения терапии.
Людям с нарушениями функции печени даназол надо назначать очень осторожно, так как установлено, что он иногда вызывает легкое или умеренное повреждение клеток печени, о чем свидетельствуют изменения активности печеночных ферментов. Он противопоказан также во время беременности и кормления грудью, поскольку может вызывать урогенитальные нарушения у плода.
Аналоги
гонадотропинрилизинг-гормона (ГРГ)
Периодическое введение ГРГ стимулирует функцию яичников и вызывает овуляцию у женщин с аменореей (подробнее — см. далее). В то же время продолжительное назначение этого гормона подавляет функцию яичников за счет снижения чувстви
тельности рецепторов. Создание активных поли-пептидных аналогов ГРГ, таких как нафарелин и бусерелин, позволило угнетать функцию яичников их ежедневным подкожным или интраназальным введением. Способность к значительному подавлению, вызываемому большими дозами этих препаратов, нашла применение для лечения преждевременного полового созревания и гормонзависимых опухолей. Более низкие дозы оказались эффективными в терапии эндометриоза.
Недавно созданы антагонисты ГРГ с минимальными гистаминвысвобождающими свойствами, предварительные исследования которых дали многообещающие результаты. Их преимуществами являются быстрое подавление функции гонад без начального периода стимуляции, характерного для действия аналогов-агонистов ГРГ, и возможность использования в качестве мужских контрацептивов.
Средства, вызывающие
овуляцию
Кломифен
Кломифена цитрат, являющийся парциальным агонистом эстрогенов, структурно близок эстрогену хлоротрианизену (рис. 39-3). Соединение активно при пероральном приеме, поскольку быстро абсорбируется. О его метаболизме известно очень мало, но выявлено, что примерно половина введенного лекарства экскретируется с калом за 5 дней. Предполагается, что кломифен медленно выводится из энтеропеченочной циркуляции.
Фармакологические эффекты
А. Механизм действия. Кломифен — частичный агонист эстрогеновых рецепторов. Его эстрогенные эффекты наиболее ярко проявляются у животных с гонадным дефицитом. Обнаружено, что кломифен эффективно подавляет активность более сильных эстрогенов. У людей он вызывает повышение секреции гонадотропинов и эстрогенов.
Б. Эффекты. Фармакологическое значение препарата обусловлено его способностью стимулировать овуляцию у женщин, страдающих аменореей и другими нарушениями этого процесса. Конкретный механизм, вызывающий овуляцию, неизвестен. Предполагается, что препарат блокирует влияние
эстрогенов на гипоталамус и повышает продукцию гонадотропинов.
Клиническое использование
Кломифен используется в терапии нарушений овуляции у женщин, желающих забеременеть. Обычно единичный курс лечения вызывает одну овуляцию, поэтому курсы терапии необходимо повторять до достижения беременности. В последующем нормальная овуляторная функция, как правило, не восстанавливается. Препарат неэффективен у больных с недостаточностью яичников или гипофиза.
При назначении кломифена в дозе 100 мг ежедневно в течение 5 дней через несколько суток наблюдается повышение концентрации ЛГ и ФСГ в плазме. В случае успешной терапии за первым гормональным подъемом непосредственно перед овуляцией следует второй пик содержания гонадотропинов в крови.
Побочные эффекты
При лечении этим препаратом наиболее частыми побочными эффектами являются горячие приливы, напоминающие таковые у женщин в менопаузе. Они незначительны и исчезают после прекращения приема препарата. Сообщалось о глазных симптомах из-за усиления и увеличения продолжительности остаточного изображения. Обычно они наблюдаются в течение непродолжительного времени. Иногда возникают головные боли, запоры, кожные аллергические реакции и обратимая потеря волос.
Эффективное использование кломифена сопровождается некоторой стимуляцией яичников и их увеличением. Степень увеличения яичников и частота этого явления выше у больных с исходно увеличенными яичниками.
Сообщалось также о различных других симптомах, таких как тошнота и рвота, повышенное нервное напряжение, депрессия, утомляемость, болезненность молочных желез, увеличение массы тела, учащение мочеиспускания и болезненные менструации. Однако эти симптомы можно отнести скорее за счет гормональных изменений, связанных с овуляционным менструальным циклом, чем с токсическим действием препарата. Вероятность многоплодных беременностей равна приблизительно
10 %. Кломифен не давал побочных эффектов в случаях ошибочного назначения при беременности.
Противопоказания и предосторожности
Особую осторожность необходимо соблюдать при назначении препарата больным с увеличенными яичниками. Считается, что такие женщины наиболее чувствительны к нему и должны получать низкие дозы. Любого пациента с жалобами на симптомы в области живота нужно тщательно обследовать. Максимальная степень увеличения яичников наблюдается после окончания 5-дневного курса: у многих пациенток с седьмого по десятый день пальпируются увеличенные в размерах яичники.
Необходимо учитывать, что связываемые с терапией кломифеном зрительные симптомы могут сделать некоторые виды деятельности, например вождение автомобиля, более опасными.
Дозирование
В начале лечения кломифена цитрат рекомендуется вводить в дозе 50 мг/день в течение 5 дней. Если происходит овуляция, то курс можно повторять до достижения беременности. Если овуляция не происходит, дозу увеличивают в два раза и дают препарат в течение 5 дней. При возникновении овуляции и менструации следующий курс может начинаться на пятый день цикла. Практика показала, что если овуляция не возникает после трех курсов по 100 мг/день кломифена, вряд ли целесообразно продолжать терапию. Однако некоторым женщинам могут помочь более высокие дозы лекарства. Иногда кломифен используется в комбинации с менотропинами.
Примерно у 80 % пациенток с ановуляторными нарушениями или аменореей после терапии возйи-кает овуляционный цикл. Приблизительно половина из них беременеет.
Бромокриптин
У некоторых женщин, страдающих аменореей, причина этого нарушения кроется в повышенном уровне пролактина. У таких пациенток возможно наличие пролактинсекретирующих опухолей или синдрома “пустого седла”, которые необходимо исключить до начала лечения. До сих пор не установлено точных критериев выбора фармакологической,
хирургической или радиационной терапии пролактином.
Производное алкалоидов спорыньи бромокриптин (глава 16) связывается с дофаминовыми рецепторами гипофиза и подавляет секрецию пролактина. У 90 % и более пациенток лечение приводит к возникновению менструации в течение 3-5 недель. Обычно требуемая доза составляет 2.5 мг 2-3 раза в день. Если лечение адекватно, уровень пролактина снижается до нормального. Такая терапия может быть показана и некоторым женщинам с поли-кистозом яичников.
Человеческий менопаузный гонадотропин
(чМГ, менотропины)
Человеческий менопаузный гонадотропин в комбинации с человеческим хорионическим гонадотропином (чХГ) используется для вызова овуляции у тех пациенток, у которых овуляция не происходит, но ткань яичников потенциально способна функционировать. чМГ с успехом применяется для индукции овуляции у женщин с пониженной функцией гипофиза или с другими дефектами секреции гонадотропинов. Его назначают пациенткам с аменореей или ановуляторными циклами и больным с нарушениями овуляции, сочетающимися с галакто-реей или гирсуртизмом. Кроме того, с помощью чМГ инфертильных женщин подготавливают к оплодотворению in vitro.
Препараты человеческого менопаузного гонадотропина могут стимулировать сперматогенез у мужчин с изолированным гонадотропиновым дефицитом. У некоторых из них при использовании чМГ совместно с чХГ могут быть восстановлены эндокринная и гаметогенная функции.
Гонадотропинрилизинг-гормон (ГРГ)
Периодическое введение ГРГ эффективно вызывает овуляцию у больных с гипоталамической аменореей. Это довольно затруднительно, так как требуется использование помпы, выпускающей в кровеносное русло 1 -10 мкг этого гормона каждые 60-
120 минут. Препарат имеет такие важные преимущества, как сохранение нормальной регуляции развития фолликулов, что позволяет избежать осложнений, возникающих при использовании менотро-пинов, и снизить количество многоплодных беременностей.
II. Семенники (андрогены и анаболические стероиды, антиандрогены и мужские контрацептивы)
Семенники, каки яичники, обладают гаметогенной и эндокринной функцией. Гаметогенная функция семенников контролируется в основном гипофизарной секрецией ФСГ. Для продукции спермы в семенных канальцах требуется локальная высокая концентрация андрогенов. Источником продуцируемого семенниками эстрадиола могут быть выстилающие семенные канальцы клетки Сертоли. Андрогены продуцируются в интерстициальных, или Лейдиговых, клетках, располагающихся в промежуточной ткани.
Клетки Сертоли синтезируют, и секретируют большое количество активных белков, включая.фак-тор, ингибирующий мюллеров канал, ингибин и активин. Как и пептиды яичников, ингибин и активин являются продуктами трех генов, продуцирующих общую для них а-субъединицу и две Р-субъединицы, А и В. Активин состоит из двух р-субъединиц (Рд, рв). Существует два ингибина (А и В), каждый из которых содержит а-субъединицу и одну из р-субъединиц. Активин стимулирует высвобождение гипофизом ФСГ и структурно напоминает трансформирующий p-фактор роста, который также повышает высвобождение ФСГ. Ингибины совместно с дигидротестостероном отвечают за торможение секреции ФСГ гипофизом по принципу обратной связи.
Андрогены и анаболические стероиды
Тестостерон — наиболее важный андроген, секретируемый семенниками. Пути его синтеза в семенниках аналогичны описанным ранее для надпочечников и яичников (рис. 38-1,39-2).
У мужчин ежедневно продуцируется приблизительно 8 мг тестостерона. Примерно 95 % гормона вырабатывается клетками Лейдига и только 5 % — надпочечниками. Семенники секретируют также небольшое количество другого активного андрогена, дигидротестостерона, и, кроме того, андростендиона и дигидроэпиандростерона, являющихся слабыми андрогенами. В небольших количествах высвобождаются прегненолон, прогестерон и их 17-гидроксилированные производные. После полового созревания концентрация тестостерона в плазме у мужчин составляет примерно 0.6 мкг/дл, с возрастом она значительно не меняется. Тестостерон присутствует также в плазме у женщин в концентрации, приблизительно равной 0.03 мкг/дл; он в равных количествах вырабатывается яичниками и надпочечниками, а также образуется из других гормонов в периферических тканях.
Примерно 65 % циркулирующего тестостерона ассоциировано с глобулином, связывающим половые гормоны (ПГСГ) — специфическим белком, продуцируемым печенью. Содержание этого белка в плазме повышается под действием эстрогенов, тиреоидного гормона, а также у людей с циррозом печени. Напротив, оно понижено у полных людей и уменьшается под действием андрогенов и гормона роста. Большая часть оставшегося тестостерона связывается с альбуминами. Однако приблизительно 2 % остается свободным и способным проникать в клетки и связываться с внутриклеточными рецепторами.
Г
Метаболизм
Во многих тканях-мишенях тестостерон под действием фермента 5а-редуктазы превращается в дигидротестостерон. В этих тканях он и является основным андрогеном. В некоторых тканях, включая гипоталамус, происходит превращение тестостерона в эстрадиол, что может иметь важное значение в регуляции половой функции.
Основной путь разрушения тестостерона у людей представлен на рис. 39-4. В печени характерное и для других стероидов с Д'’-кетоновой конфигурацией кольца А восстановление двойной связи и кетона в кольце А приводит к образованию неактивных веществ, андростерона и этиохоланолона, которые после конъюгации выводятся с мочой.
У людей в значительном количестве продуцируются также андростендион, дегидроэпиандросте
рон (ДГЭА) и дегидроэпиандростерона сульфат (ДГЭАС), но большей частью надпочечниками, чем семенниками. Хотя считается, что эти гормоны участвуют в процессе нормального полового созревания, они не стимулируют и не поддерживают другие андрогензависимые пубертатные изменения у человека. В недавних исследованиях обнаружено, что ДГЭА и ДГЭАС проявляют важные метаболические эффекты, снижая атерогенез и продлевая жизнь кроликов и, возможно, людей. В настоящее время исследуется возможность их терапевтического использования. В значительной степени они метаболизируются так же, как тестостерон. В периферических тканях эти стероиды, но особенно андростендион, в очень небольших количествах (1-5 %) могут превращаться в эстрон. Фермент Р-450-ароматаза, осуществляющий это превращение, обнаружен также в тканях мозга; считается, что он играет важную роль в развитии организма.
Физиологические эффекты
У здоровых мужчин тестостерон отвечает за множество изменений, происходящих в пубертатный период. Помимо способности андрогенов активировать в целом рост тканей тела, эти гормоны стимулируют развитие пениса и мошонки. Изменения со стороны кожи включают появление волос на лобке, в подмышечных впадинах и на лице. Сальные железы становятся более активными, кожа становится более толстой и жирной. Растет гортань и голосовые связки утолщаются, делая голос более низким. Активизируется рост скелета и ускоряется закрытие эпифизов. Другие эффекты включают развитие предстательной железы и семенных пузырьков, усиление пигментации и кровоснабжения кожи. Происходят психологические и поведенческие изменения.
Синтетические стероиды с андрогенным и анаболическим действием
Тестостерон при назначении внутрь быстро абсорбируется. Однако большая его часть конвертируется в неактивные метаболиты и только примерно '/б от введенной дозы находится в активной форме. Тестостерон можно вводить парентерально, но в этом случае он медленнее всасывается и имеет большую активность после этерификации. Метилтестостерон и флюоксиместерон активны при приеме внутрь.
Тестостерон и его производные используются в качестве анаболических средств, а также для заместительной терапии при дефиците этого гормона. Хотя тестостерон и другие активные стероиды могут быть выделены в чистом виде и дозироваться в массовых единицах, при изучении новых соединений все еще используются методы оценки по биологической активности. В некоторых таких исследованиях на животных можно было отделить анаболический эффект соединений (по их трофическому действию на мышцы, по снижению экскреции азота) от собственно андрогенных эффектов. Это привело к появлению на рынке лекарств, у которых, как утверждалось, высокая анаболическая активность сочетается со слабым андрогенным действием. К сожалению, у людей такая специфичность препаратов значительно менее выражена, чем у животных, используемых при тестировании (табл. 39-5), и все они являются активными андрогенами.
Фармакологические эффекты
А. Механизм действия. Как и другие стероиды, тестостерон действует внутри клеток-мишеней. В коже, предстательной железе, семенных пузырьках и эпидидимусе под действием фермента 5а-ре-дуктазы он превращается в 5а-дигидротестостсрон. В этих тканях дигидротестостерон является доминирующим андрогеном. Ткани плода отличаются по
ТАБЛИЦА 39-5. Относительная андрогенная и анаболическая активность андрогенных препаратов у животных
Препарат Андрогенная/анаболическая
активность
Тестостерон 1 :1
Тестостерона ципионат 1 : 1
Тестостерона энантат 1 : 1
Тестостерона пропионат 1 : 1
Метилтестостерон 1 : 1
Флюоксиместерон 1 :2
Метандростенолон (метандиенон) 1 : 3
Оксиметолон 1 :3
Этилэстренол 1 :4-1 : 8
Оксандролон 1:3-1:13
Нандролона фенпропионат 1 :3-1 : 6
Нандролона деканоат 1 :2.5-1 :4
Станозолол 1 :3-1 : 6
Дромостанолона пропионат 1 :3-1 :4
распределению этого фермента, что имеет важное значение в развитии.
Тестостерон и дигидротестостерон связываются с цитозольными андрогенными рецепторами, инициируя ряд событий, приводящих к росту, дифференциации и синтезу различных ферментов и других функциональных белков.
Б. Эффекты. В период полового созревания у мужчин андрогены вызывают развитие вторичных половых признаков. У взрослых мужчин большие дозы тестостерона или его производных при монотерапии подавляют секрецию гонадотропинов и вызывают некоторую атрофию интерстициальной ткани и семенных канальцев. Так как для подавления секреции гонадотропинов требуются очень большие дозы андрогенов, было высказано предположение, что ингибин вместе с андрогенами принимает участие в регуляции секреции по принципу обратной связи. У женщин андрогены способны вызывать изменения, сходные с теми, которые происходят у мужчин в период полового созревания. Это рост волос на лице и теле, огрубление голоса, увеличение клитора, лобных залысин и скелетной мускулатуры. Естественные андрогены увеличивают продукцию эритроцитов.
Применение андрогенов снижает выделение азота с мочой, что свидетельствует о повышении синтеза белков или снижении их распада в организме. Этот эффект значительно более выражен у женщин и детей, чем у здоровых мужчин.
Клиническое использование
А. Андрогенная заместительная терапия у мужчин. Андрогены используются для замещения или повышения уровня секреции андрогенов у мужчин с гипогонадизмом (табл. 39-6). Даже при наличии гипофизарного дефицита использование андрогенов более предпочтительно, чем применение гонадотропинов, за исключением случаев, когда необходимо достижение нормального сперматогенеза. Если дефицит андрогена возник до завершения полового созревания, требуются большие дозы андрогенов и пероральные средства оказываются недостаточно эффективными. У таких больных необходимо начинать терапию с длительнодействующих препаратов, таких как тестостерона энантат или ципионат в дозах 200 мг внутримышечно через каждые 1-2 недели до завершения полового развития. Затем доза может быть снижена до 200 мг с интер
валом между введениями от двух до трех недель. Несмотря на то, что тестостерона пропионат очень активен, при длительной терапии он неудобен для применения, так как обладает короткой длительностью действия. Развитие полицитемии и гипертензии может потребовать снижения дозы.
Пациентам со снижением функции гипофиза андрогены не вводят в терапию до наступления пубертатного периода, когда их начинают использовать в постепенно возрастающих дозах для достижения ускоренного роста и развития вторичных половых признаков.
Б. Гинекологические заболевания. Иногда андрогены применяют при лечении гинекологических заболеваний, но слишком выраженные побочные эффекты требуют при назначении большой осторожности. Андрогены используются для подавления увеличения молочных желез в послеродовом периоде, как правило, вместе с эстрогенами.
Иногда такие комбинации назначают для заместительной терапии в постменопаузном периоде с целью устранения кровотечений из эндометрия, которые возможны при приеме эстрогенов. Их также используют для химиотерапии рака молочных желез у женщин в пременопаузном периоде.
В. Использование в качестве средств с анаболическим действием на белковый обмен. Для восстановления потери белков после травм, хирурги-
ТАБЛИЦА 39-6. Андрогенные препараты
для заместительной терапии
Препарат Путь введения Доза
Метилтесто- Перорально 25-50 мг/день
стерон Сублингвально (буккально) 5-10 мг/день
Флюоксиме-стерон Перорально 2-10 мг/день
Тестостерона пропионат Сублингвально (буккально) Внутримышечно 5-20 мг/день 0-50 мг 3 раза в неделю
Тестостерона энантат Внутримышечно 200 мг каждые 1-2 недели до завер-
Тестостерона ципионат Внутримышечно шения полового созревания, затем каждые 2-3 недели в качестве поддерживающей терапии
ческих операций или при длительной иммобилизации у ослабленных больных используются андрогены и анаболические стероиды в сочетании с диетой и физическими упражнениями.
Г. Анемия. Большие дозы андрогенов применяются для лечения рефрактерных анемий, вызывая некоторое повышение количества ретикулоцитов и содержания гемоглобина. Необходимость приема высоких доз не позволяет использовать этот метод для женщин. Предполагается, что внедрение в клиническую практику гемопоэтических колониестимулирующих факторов полностью исключит применение андрогенов по этому показанию (глава 32).
Д. Остеопороз. Андрогены и анаболические стероиды, как в качестве средств монотерапии, так и в сочетании с эстрогенами, используются при остеопорозе.
Е. Использование для стимуляции роста. Эти препараты назначают мальчикам в препубертат-ном периоде для стимуляции роста. Если вещества применяются с осторожностью, дети, возможно, достигнут своего предполагаемого взрослого роста (и раньше, чем в норме). Если же лечение проводится слишком интенсивно, то, несмотря на успехи в начале лечения, рост может не достигнуть планируемого уровня вследствие ускорения закрытия эпифизов. Этот тип терапии очень сложно адекватно контролировать, даже проводя частые рентгеновские исследования эпифизов, так как действие гормонов на эпифизные центры может продолжаться многие месяцы после прекращения лечения.
Ж. Злоупотребление анаболическими стероидами и андрогенами в спорте. Во всем мире актуальна проблема использования анаболических стероидов в спорте. Многие атлеты и их тренеры верят, что эти препараты в дозах, в 10-200 раз превышающих нормальные, повышают силу и агрессивность и таким образом улучшают результаты, показываемые на соревнованиях. Хотя у женщин такие эффекты наблюдались, во многих исследованиях не обнаружили однозначных доказательств их действия у мужчин. Эффект плацебо и потенциальный вклад минимальных изменений в результаты соревнований чемпионского уровня затрудняют оценку результатов, полученных в этих исследованиях. Однако побочные эффекты анаболиков однозначно делают их использование нежелательным.
Побочные эффекты
Побочные эффекты этих соединений в основном связаны с их маскулинизирующим действием и наиболее заметны у женщин и детей в препубертатном возрасте. Пероральное введение тестостерона в дозах выше 200-300 мг в месяц у женщин обычно приводит к возникновению угревой сыпи, гирсутизма, нарушениям менструаций, увеличению клитора и огрублению голоса. У некоторых женщин такие изменения могут возникать даже при меньших дозах. Ряд андрогенных стероидов оказывает прогестиновое действие, приводящее к эндометриальным кровотечениям. Эти гормоны изменяют липидный состав крови и метут существенно повышать заболеваемость атеросклерозом у женщин. За исключением чрезвычайных обстоятельств, андрогены не назначают детям. Недавние испытания на животных показали, что введение андрогенов в раннем возрасте оказывает выраженное действие на созревание центров в ЦНС, отвечающих за половое развитие, особенно у самок. Назначение этих препаратов беременным самкам приводит к маскулинизации наружных половых органов у детенышей. Описанные изменения, хотя и менее выраженные, метут наблюдаться также при введении анаболических средств.
Встречаются задержка натрия и отеки, что необходимо иметь в виду, прописывая препараты пациентам с заболеваниями сердца и почек.
Большинство синтетических андрогенов и анаболических средств являются 17-алкилзамещенны-ми стероидами. Введение препаратов с такой структурой часто приводит к нарушениям функции печени, например к угнетению метаболизма сульфобромофталеина и увеличению активности аспартатаминотрансферазы. Возрастает также активность щелочной фосфатазы. Эти изменения обычно возникают в начале курса лечения, и их выраженность пропорциональна дозе. Иногда повышается уровень билирубина вплоть до проявления клинических признаков желтухи. Холестатическая желтуха обратима при прекращении терапии, постоянных изменений не происходит. У пожилых мужчин нередко развивается гиперплазия предстательной железы, нарушающая мочеиспускание.
Противопоказания и предостережения
Назначение андрогенных стероидов противопоказано беременным или женщинам, которые могут забеременеть во время курса терапии.
Андрогены противопоказаны мужчинам с карциномой предстательной или молочной железы. До тех пор пока не станет больше известно о влиянии этих гормонов на центральную нервную систему развивающегося организма, необходимо избегать их назначения младенцам и детям раннего возраста.
Особую осторожность необходимо соблюдать при использовании этих препаратов у детей с целью ускорения роста.
Нужно тщательно взвешивать целесообразность применения средств у пациентов с заболеваниями сердца и почек, имеющих предрасположенность к возникновению отеков. Задержку воды и натрия можно снизить назначением диуретиков.
Метилтестостероновая терапия сопровождается развитием креатинурии, но ее клиническое значение неизвестно.
Предостережения: сообщалось о нескольких случаях гепатоцеллюлярной карциномы у больных с апластической анемией во время лечения андрогенными анаболиками.
Подавление секреции андрогенов и антиандрогены
Подавление секреции андрогенов
Терапия далеко зашедшей стадии карциномы предстательной железы часто требует проведения орхиэктомии или назначения больших доз эстрогенов для снижения уровня андрогенов. Психологические последствия первого метода терапии и развития гинекомастии при использовании второго делает эти подходы нежелательными. Как уже упоминалось, аналоги гонадотропинрилизинг-гор-мона (госелерин, нафарелин, бусерелин и леупро-лида ацетат) при их постоянном, но не изменяющемся уровне в крови вызывают подавление функции гонад (глава 36 и рис. 39-5). Для лечения карциномы предстательной железы леупролида ацетат вводят подкожно в дозе 1 мг в день. Госелерин назначают один раз в 4 недели подкожно в виде лекарственной формы с медленным высвобождением вещества. Хотя через месяц под действием любого из этих препаратов содержание тестостерона
5а-Редуктаза
(4)
Флутамид, ципротерон, (5) спиронолактон
Экспрессия преобладающих генов в андрогенчувствительных клетках
Рис. 39-5. Контроль секреции и действия андрогенов и некоторые точки приложения действия антиандрогенов. (1) — конкурентное ингибирование ГРГ-рецепторов; (2) — стимуляция (+,— импульсное введение) или ингибирование посредством десенситизации ГРГ-рецепторов (-,— длительное назначение); (3) — снижение синтеза тестостерона в семенниках; (4) — снижение синтеза дигидротестостерона за счет ингибирования 5<х-редуктазы; (5) — конкуренция за связывание с цитозольными анд-рогеновыми рецепторами
снижается до 10 % от его-начального уровня, в начале терапии оно значительно повышается. Этот подъем обычно сопровождается повышением активности опухоли и усилением симптомов. Недавние исследования показали, что комбинация агониста ГРГ с флутамидом может предотвратить первоначальную стимуляцию и обеспечивает более эффективное подавление андрогенной активности.
Изучается также возможность использования антагонистов ГРГ, так как они будут иметь преимущества, заключающиеся в отсутствии резкого выброса андрогенов, что наблюдается в начале терапии аналогами ГРГ. Большинство из изучаемых соединений вызывают высвобождение гистамина и по этой причине не пригодны для использования. Однако испытываются новые препараты с меньшей гистаминвысвобождающей активностью.
Антиандрогенные препараты
Потенциальная возможность использования антиандрогенов для лечения больных с повышенной продуцией тестостерона привела к активному поиску эффективных препаратов, которые могут практически применяться для этих целей. Некоторые подходы к решению этой проблемы, особенно ингибирование синтеза и блокада рецепторов, имеют определенные положительные результаты.
Синтез стероидов
Кетоконазол, ранее использовавшийся для лечения грибковых заболеваний, является ингибитором синтеза надпочечниковых и половых стероидов. Это соединение ингибирует P-450scc (фермент, отщепляющий боковые цепи холестерина), Р-450с17 (17а-гидроксилазу и С17,20-лиазу), 30-гидрокси-стероиддегидрогеназу, Р-450с11(1 ip-гидроксилазу). Чувствительность ферментов тканей млекопитающих к этому соединению намного ниже, чем чувствительность грибковых ферментов, так что ингибирующий эффект наблюдается только при приеме в высоких дозах. Кетоконазол дает и другие эндокринные эффекты. Он не влияет на яичниковую ароматазу, но снижает активность плацентарной ароматазы. Препарат вытесняет in vitro эстрадиол и дигидротестостерон из комплекса с белком, связывающим половые гормоны, и повышает соотношение эсградиол/тестостерон в плазме in vivo за счет другого механизма. Последний эффект может быть
причиной гинекомастии, возникающей при терапии кетоконазолом. Это соединение с некоторым успехом используется при лечении больных с синдромом Кушинга. Однако кетоконазол не нашел клинического применения у женщин с повышенным уровнем андрогенов из-за токсичности, связанной с необходимостью длительного использования высоких доз — 400-800 мг/день. Препарат экспериментально применяли для лечения карциномы предстательной железы, но обнадеживающие результаты получены не были. У мужчин, получавших кетоконазол, часто развивается обратимая гинекомастия. Возможно, это является следствием повышения соотношения эстрадиол/тестостерон.
Превращение стероидных предшественников в андрогены
Было создано несколько соединений, подавляющих 17-гидроксилирование прогестерона или прегненолона, предотвращая тем самым действие фермента, расщепляющего боковые цепи, и дальнейшее превращение этих стероидных предшественников в активные андрогены. Некоторые из них проходили клинические исследования, но оказались слишком токсичными для продолжительного использования.
Так как основным андрогеном предстательной железы является именно дигидротестостерон, а не тестостерон, андрогенные эффекты в этой и других аналогичных дигидротестостеронзависимых тканях могут быть снижены ингибированием 5а-ре-дуктазы (рис. 39-5). Стероидоподобный ингибитор этого фермента финастерид активен при приеме внутрь и вызывает снижение уровня дигидротестостерона, которое длится около 24 часов, через 8 часов после введения. Период его полувыведения составляет 8 часов (у пожилых людей он более дли-
О
II
С —NHC(CH3)3
Н
Финастерид
тельный). Примерна 40-50 % введенной дозы метаболизируется, более половины экскретируется с фекалиями. Сообщалось, что препарат умеренно эффективен при доброкачественной гипертрофии предстательной железы, уменьшая размер железы. В США он одобрен для применения в этих целях. Доза составляет 5 мг/день. В настоящее время изучается его использование при далеко зашедших стадиях карциномы предстательной железы. Препарат не рекомендуется назначать женщинам и детям.
Ингибиторы рецепторов
Ципротерон и ципротерона ацетат — эффективные антиандрогены, тормозящие действие андрогенов на уровне органов-мишеней. В форме ацетата препарат оказывает прогестиновое действие, за счет которого подавляется обратная связь, активирующая секрецию Л Г и ФСГ, что приводит к более выраженному антиандрогенному действию. Эти соединения используются для лечения гирсутизма у женщин и снижения патологически повышенного полового влечения у мужчин, а также исследуются в плане возможного применения в других случаях, когда требуется уменьшение эффекта андрогенов. Ципротерона ацетат в дозе 2 мг/день, назначаемый параллельно с эстрогенами, используется для лечения гирсутизма у женщин.
Замещенный анилид флутамид — активный антиандроген, используемый для лечения карциномы предстательной железы. Несмотря на то, что это не стероид, он ведет себя как конкурентный антагонист андрогенных рецепторов. Препарат быстро метаболизируется у людей. Он часто вызывает гинекомастию (возможно, за счет ровышения продукции эстрогенов семенниками), иногда — умеренную обратимую гепатотоксичность. Назначение этого препарата несколько улучшает состояние большинства больных, не получавших ранее эндокринную терапию.
Конкурентный ингибитор альдостерона спиронолактон также конкурирует с дигидротестостероном за андрогенные рецепторы в тканях-мишенях. Он снижает активность 17а-гидроксилазы, умень-
Флутамид
шая концентрацию тестостерона и андростендиона в крови. Препарат используют в дозах 50-200 мг/день для лечения гирсутизма у женщин.
Химическая контрацепция у мужчин
Несмотря на большое количество исследований, до сих пор не найдено эффективных пероральных контрацептивов для мужчин. Например, различные андрогены, включая тестостерон и тестостерона энантат, назначаемые в дозе 400 мг/месяц, вызывают азооспермию менее чем у половины мужчин, получавших препарат. Встречаются незначительные побочные реакции, такие как гинекомастия и угри. Комбинация тестостерона с даназолом хорошо переносится, но не более эффективна, чем один тестостерон. Комбинация андрогенов с прогестинами, в частности с медроксипрогестерона ацетатом, тоже не усиливает эффект. Ципротерона ацетат, являющийся очень активным прогестином и антиандрогеном, хотя и вызывает олигоспермию, но не обеспечивает надежной контрацепции.
В настоящее время все возрастающее внимание привлекают гипофизарные гормоны и мощные антагонисты-аналоги ГРГ. Установлено, что антагонист ГРГ в комбинации с тестостероном вызывает обратимую азооспермию у низших обезьян.
Госсипол
Активные исследования этого производного из семян хлопчатника были проведены в Китае. Это соединение разрушает эпителий семявыводящих путей, но не изменяет эндокринной функции семенников.
В китайских исследованиях большая выборка мужчин получали 20 мг/день госсипола или госси-пола ацетата в течение двух месяцев, а далее вводи-
Госсипол
лась поддерживающая доза 60 мг/нед. При таком режиме введения у 99 % мужчин в анализе спермы было ниже 4 млн/мл сперматозоидов. Предварительные результаты показали, что восстановление (возвращение к нормальным показателям) после прекращения терапии госсиполом происходит в полном объеме у мужчин, у которых показатели не опускались слишком низко и терапия не продолжалась дольше двух лет. Основным побочным эффектом препарата является гипокалиемия, которая может сопровождаться преходящим параличом. Препарат исследовался и как интравагинальный спермицидный контрацептив.
Препараты
(пероральные контрацептивы представлены в табл. 39-3)
Эстрогены
Хлоротрианизен (ТАСЕ)
Перорально: капсулы по 12, 25 мг
Конъюгированные эстрогены
(генерик, Премарин)
Перорально: таблетки по 0.3, 0.625, 0.9,1.25, 2.5 мг
Парентерально: 25 мг/5 мл для в/в и в/м инъекций
Вагинально: 0.625 мг/г на мазевой основе
Диенэстрол (Орто Диенэстрол, DV) Вагинально: 10 мг/г мазь
Диэтилстильбэстрол [DES] (генерик) Перорально: таблетки nol, 5 мг
Эстрадиола ципионат в масле
(генерик, Депо-Эстрадиола Ципионат) Парентерально: 5 мг/мл для в/м инъекций
Эстрадиол (Эстрас)
Перорально: таблетки по 1, 2 мг
Вагинально: 0.1 мг/г мазь
Эстрадиол трансдермальный (Эстрадерм) Трансдермально: 4,8 мг пластырь
Эстрадиола валерат в масле (генерик, др.) Парентерально: 10, 20,40 мг/мл для в/м инъекций
Эстрона водная суспензия
(генерик, Теелин водный, др.)
Парентерально: 2, 5 мг/мл для инъекций
Эстропипат (Оген)
Перорально: таблетки по 0.625,1.25, 2.5, 5 мг
Вагинально: 1.5 мг/г на мазевой основе
Этинилэстрадиол (Этинил, Феминон) Перорально: таблетки по 0.02, 0.05, 0.5 мг
Квинестрол (Эстровис)
Перорально: таблетки по 100 мкг
Прогестины
Гидроксипрогестерона капронат (генерик, Делалютин, др.) Парентерально: 125, 250 мг/мл для в/м инъекций
Левоноргестрел (Норплант)
Набор для подкожного имплантирования: 6 капсул по 36 мг
Медроксипрогестерона ацетат (Провера, др.) Перорально: таблетки по 2.5, 5, 10 мг Парентерально: 100, 400 мг/мл для в/м инъекций
Парентерально депо: 150 мг/мл для в/м инъекций
Мегестрол (генерик, Мегас)
Перорально: таблетки по 20, 40 мг
Норэтиндрон
Перорально: таблетки по 5 мг (Норлютин) Перорально: таблетки по 0.35 мг (Микронор, Hop-Q.D.)
Норэтиндрона ацетат (Норлютат, Аугестин) Перорально: таблетки по 5 мг
Норгестрел (Овретт)
Перорально: таблетки по 0.075 мг
Прогестерон в масле (генерик, др.)
Парентерально: 50 мг/мл для в/м инъекций
Андрогены и анаболические стероиды
Флюоксиместерон (генерик, Галотестин, др.) Перорально: таблетки по 2, 5,10 мг
Метилтестостерон (генерик, Метандрен, др.) Перорально: таблетки по 10,25 мг;. капсулы по 10 мг; защечные таблетки по 10 мг
Нандролона деканоат
(генерик, Дека-Дураболин, др.) Парентерально: 50, 100, 200 мг/мл в масле для в/м инъекций
Нандролона фенпропионат (генерик, Дураболин, др.) Парентерально: 25, 50 мг/мл в масле для в/м инъекций
Оксандролон (Анавар)
Перорально: таблетки по 2.5 мг
Оксиметолон ( Андрол-50)
Перорально: таблетки по 50 мг
Станозолол (Винстрол)
Перорально: таблетки по 2 мг
Тестолактон (Теслак)
Перорально: таблетки по 50 мг
Тестостерон водный (генерик, др.)
Парентерально: 25, 50,100 мг/мл суспензия для в/м инъекций
Тестостерона ципионат в масле (генерик, др.) Парентерально: 100,200 мг/мл для в/м инъекций
Тестостерона энантат в масле (генерик, др.)
Парентерально: 100, 200 мг/мл для в/м инъекций
Тестостерона пропионат в масле (генерик, др.) Парентерально: 100 мг/мл для в/м инъекций
Антагонисты и ингибиторы (см. также главу 36)
Кломифен (Кломид, Серофен) Перорально: таблетки по 50 мг
Даназол (Данокрин)
Перорально: капсулы по 50,100, 200 мг
Финастерид (Проскар)
Перорально: таблетки по 5 мг
Флутамид (Эулексин)
Перорально: капсулы по 125 мг
Госерелин (Золадекс)
Парентерально: 3.6 мг/мл для имплантации
Леупролид
Парентерально (Люпрон): 5 мг/мл для п/к инъекций
Парентерально депо (Люпрон депо):
3.75,7.5 мг/мл для в/м инъекций
Тамоксифен (Нолвадекс)
Перорально: таблетки по 10 мг
Избранная литература
Belchetz Р. Е. Hormonal treatment of postmenopausal women. N. Engl. J. Med. 1994; 330:1062.
Bhasin S. Androgen treatment of hypogonadal men. J. Clin. Endocrinol. Metab. 1993; 74:1221.
Butler G. E. et al. Oral testosterone undecanoate in the management of delayed puberty in boys: Pharmacokinetics and effects on sexual maturation and growth. J. Clin. Endocrinol. Metab. 1992; 75:37.
Casper R. F., Chapdelaine A. Estrogen and interrupted progestin. Am. J. Obstet. Gynecol. 1993; 168: 1186.
Conn M. P., Crowley W. F. Gonadotropin releasing hormone and its analogues. N. Engl. J. Med. 1991; 324: 93.
Davidson N. E. Tamoxifen: Panacea or Pandora’s box? (Editorial.) N. Engl. J. Med. 1992; 326:885.
Gittes R. F. Carcinoma of the prostate. N. Engl. J. Med. 1991; 324: 236.
Golditz G. A., Egan К. M., Stampfer M. J. Hormone replacement therapy and the risk of breast cancer: results from epidemiologic studies. Am. J. Obstet. Gynecol. 1993; 168: 1473.
Peyron R. et al. Early termination of pregnancy with mifepristone (RU 486) and the orally active prostaglandine misoprostol. N. Engl. J. Med. 1993; 328:1509.
Symposium: Current perspectives in the management of the menopausal patient. Obstet. Gynecology 1990; 75 (No. 4 Suppl): 1.
Гормоны поджелудочной железы и антидиабетические средства
40
Джон X. Карам
Эндокринные функции поджелудочной железы
Эндокринные функции поджелудочной железы у взрослых людей выполняет приблизительно 1 млн островков Лангерганса, распределенных по всей железе. В островках идентифицировано не менее четырех типов гормонпродуцирующих клеток (табл. 40-1). К панкреатическим гормонам относятся: инсулин — анаболический и депонирующий гормон; островковый амилоидный полипептид (IAPP, или амилин) с неизвестной метаболической функцией; глюкагон — гипергликемический фактор, мобилизующий депо гликогена; соматостатин — универсальный ингибитор секреторных клеток; панкреатический полипептид — небольшой полипептид, усиливающий процесс пищеварения по непонятному механизму.
Сахарный диабет — наиболее важное заболевание, относящееся к эндокринной функции поджелудочной железы. Для него характерны нарушения метаболизма и неадекватная гипергликемия. Современная “терапевтическая” классификация, рекомендованная Американской диабетической ассоциацией, различает два основных типа заболевания: инсулинзависимый (ИЗСД) и инсулиннезависи-мый (ИНЗСД) сахарный диабет. В США 10 млн человек поставлен диагноз диабета, из них не менее 800 000 человек имеют инсулинзависимый тип.
Диабет I типа (ИЗСД) — тяжелая форма, приводящая к кетозу при отсутствии лечения. Наиболее часто встречается в ювенильном возрасте, но иногда и у взрослых, особенно если нет ожирения и в тех случаях, когда гипергликемия впервые возникает в пожилом возрасте. Это катаболическое нарушение, при котором инсулин фактически от
сутствует в крови, уровень глюкагона в плазме повышен и р-клетки панкреатической железы не способны отвечать на все инсулиногенные стимулы. Вследствие этого требуется введение экзогенного инсулина, для того чтобы обратить катаболическое состояние, предотвратить кетоз и снизить гиперг-люкагонемию и повышенный уровень глюкозы в крови.
Считается, что диабет I типа является результатом инфекции или токсического воздействия внешней среды на людей, чья иммунная система генетически предрасположена к развитию жесткого аутоиммунного ответа, направленного против антигенов р-клеток поджелудочной железы. Внешние факторы, которые могут воздействовать на функцию Р-клеток, включают повреждение, вызываемое вирусами, например вирусом эндемического паротита и вирусом Коксаки В4, токсическими химическими веществами или деструктивными цитотоксинами и антителами, высвобождаемыми из сенсибилизированных иммуноцитов. Предопределять нарушения в р-клетках после перенесенной вирусной инфекции может предсуществующий генетический дефект, имеющий отношение к их размножению или функционированию. Кроме того, специфические гены системы HLA могут повышать восприимчивость к диабетогенным вирусам или взаимодействовать с определенными генами, обеспечивающими иммунный ответ, что предрасполагает больных к деструктивным аутоиммунным реакциям против собственных островковых клеток (аутоагрессия). Недавние наблюдения о том, что такие иммунодепрессивные препараты, как циклоспорин или азатио-прин, при назначении во время первых проявлений диабета I типа снижают разрушение панкреатических р-клеток, подтверждают значение аутоагрессивной реакции иммунной системы как основного фактора патогенеза этого типа диабета.
ТАБЛИЦА 40-1. Панкреатические островковые клетки и продукты их секреции
Типы Приблизительный Продукты секреции клеток процент от массы островков
А-клетки (а) 20 Глюкагон, проглюкагон
В-клетки (0) 75 Инсулин, С-пептид, проинсулин, островковый амилоидный полипептид
D-клетки (Д) 3-5 Соматостатин
F-клетки (РР)' <2 Панкреатический полипептид (РР)
1 Внутри богатых панкреатическим полипептидом долек зрелых островков, расположенных только в задней части головки поджелудочной железы человека, глюкагоновые клетки встречаются редко (менее 0.5 %), а F-клетки составляют 80 % всех клеток.
Диабет II типа (ИНЗСД) представляет собой гетерогенную группу, включающую более легкие формы диабета, которые возникают преимущественно у взрослых, но иногда и в юношеском возрасте. При этой форме заболевания концентрация эндогенного инсулина в крови достаточна для предотвращения кетоацидоза, но часто несколько снижена или относительно неадекватна вследствие нечувствительности к нему тканей. Существенным фактором риска развития ИНЗСД является ожирение, которое приводит к нарушению действия инсулина. Диабетом этого типа чаще болеют тучные люди.
Помимо нечувствительности тканей к инсулину, которая отмечается у большинства больных ИНЗСД независимо от массы тела, у них имеет место снижение реакции 0-клеток поджелудочной железы на глюкозу. Как резистентность тканей к инсулину, так и нарушенная способность Р-клеток реагировать на глюкозу еще больше усугубляются нарастающей гипергликемией. Фармакотерапия, направленная на устранение гипергликемии, до некоторой степени корригирует оба этих дефекта.
Когда диета и попытки снижения массы тела у тучных больных неспособны скорректировать гипергликемию, обычно назначают препараты суль-фонилмочевины. Для достижения удовлетворительной концентрации глюкозы в крови может потребоваться инсулиновая терапия, хотя она и не является необходимой для предотвращения кетоацидоза у больных с ИНЗСД.
Инсулин
Химическое строение
Человеческий инсулин представляет собой небольшой белок с мол. м. 5808. Он состоит из 51 аминокислоты, которые образуют две цепи (А и В), соединенные дисульфидными мостиками. Аминокислотный состав цепей видоспецифичен. Предшественник инсулина продуцируется внутри 0-клеток посредством ДНК- и РНК-управляемого синтеза. Длинная одинарная цепь проинсулина в аппарате Гольджи упаковывается в гранулы, где в результате гидролиза удаляются четыре аминокислоты (обозначены пунктиром на рис. 40-1) с образованием инсулина и связующего сегмента, называемого С-пептидом. Инсулин и С-пептид в эквимолярных концентрациях секретируются в ответ на все стимуляторы секреции инсулина; выделяется также небольшое количество нативного или частично гидролизированного проинсулина. В то время какпро-инсулин оказывает некоторое гипогликемическое действие, физиологическая функция С-пептида неизвестна. В гранулах 0-клеток инсулин депонируется в виде кристаллов, состоящих из двух атомов цинка и шести молекул инсулина. В целом человеческая поджелудочная железа содержит до 8 мг инсулина, что составляет приблизительно 200 биологических “единиц”. Первоначально за единицу принимали определенный гипогликемический эффект инсулина у кроликов. В связи с улучшением методов очистки в настоящее время количество единиц определяют по массе препарата. Существующий инсулиновый стандарт, используемый в аналитических целях, составляет 28 ЕД/мг.
Секреция инсулина
0-Клетки поджелудочной железы постоянно высвобождают небольшое базальное количество инсулина. В ответ на различные стимулы, особенно глюкозу, выработка инсулина значительно повышается. К стимуляторам секреции относятся также другие сахара (например, манноза), некоторые аминокислоты (например, лейцин, аргинин) и повышенная вагусная активность. Один из механизмов стимуляции инсулиновой секреции представлен на рис. 40-2. Как показано на рисунке, в результате гипергликемии повышается внутриклеточный уровень АТФ, что способствует закрытию АТФ-зави-
В30 —► Аланин Аа —> Аланин Аю —> Валин
Рис. 40-1. Структура человеческого проинсулина. Инсулин показан в виде закрашенных полнпептидных цепей А и В. Сравнение человеческого, свиного и бычьего С-пептидов выявило существенные межвидовые различия, гомологичность составляет только приблизительно 40 %. Межвидовые различия в цепях А и В указаны на вставке
симых калиевых каналов. Уменьшение выходящего тока ионов калия через этот канал вызывает деполяризацию Р-клеток и открытие потенциалзависимых кальциевых каналов. В результате происходит повышение внутриклеточного содержания Са2+, запускающее секрецию гормона. Этот механизм, несомненно, намного сложнее, чем приведенное короткое описание, так как известны несколько внутриклеточных посредников, модулирующих его (цАМФ, инозитолтрифосфат, диацилглицерол). Кроме того, инсулиновая реакция на монофазный подъем уровня глюкозы является двухфазной. Считается, что пероральные гипогликемические препараты группы сульфонилмочевины действуют отчасти за счет этого механизма.
Деградация инсулина
Печень и почки — два основных органа, выводящие инсулин из кровеносного русла, предположительно за счет гидролиза дисульфидных связей между цепями А и В под действием глутатиошин-сулинтрансгидрогеназы (инсулиназы). После этого расщепления происходит дальнейшее разрушение гормона за счет протеолиза. Благодаря расположению в конечной точке кровотока портальных вен печень в норме удаляет из крови 60 % секрети
руемого поджелудочной железой инсулина. Приблизительно 35-40 % эндогенного гормона удаляется почками. Однако у инсулинзависимых диабетиков, получающих подкожные инъекции инсулина, это соотношение является обратным: более 60 % экзогенного инсулина удаляется почками и не более 30-40 % — печенью. Период полувыведения инсулина из крови составляет 3-5 минут.
Определение концентрации инсулина в крови
Радиоиммунный анализ позволяет обнаружить инсулин в пикомолярных количествах. Для этого используются антитела, вырабатывающиеся у морских свинок в ответ на введение бычьего или свиного инсулина. Так как человеческий инсулин достаточно сходен с ними, этот метод успешно используется для определения содержания гормона у пациентов. Аналогичные методы разработаны для измерения концентрации всех известных гормонов поджелудочной железы (включая С-пептид и проинсулин).
Базальный уровень инсулина у здоровых людей, определяемый этим методом, составляет 5-15 мкЕД/мл (30-90 пмоль/л) с максимальным увеличением до 60-90 мкЕД/мл (360-540 пмоль/л) во время приема пищи.
184
Раздел VII. Гормональные средства
Транспортер глюкозы
канал
АТФ
Филамент миозина
Л
Инсулин
Са2+-канал (деполяризация открывает)
(Закрывает, деполяризует)
Препараты сульфонилмочевины (блокируют, деполяризуют)
Глюкоза
> Метаболизм
Са2+
Гранулы инсулина
Рис. 40-2. Одна из моделей механизма высвобождения инсулина из р-клеток поджелудочной железы под действием глюкозы и производных сульфонилмочевины. В покоящейся клетке с нормальным (низким) уровнем АТФ К+диффундирует по градиенту концентрации через АТФ-зависимые калиевые каналы (АТФ закрывает каналы), поддерживая отрицательный внутриклеточный потенциал на уровне полной поляризации. Высвобождение инсулина минимально. Если повышается концентрация глюкозы, то увеличивается продукция АТФ, калиевый канал закрывается и происходит деполяризация клеточной мембраны. Так же как это происходит в мышцах и нервах, в ответ на деполяризацию открываются потенциалзависимые кальциевые каналы, что увеличивает поступление ионов кальция в клетку. Повышение содержания Са2+ внутри клеток вызывает увеличение секреции инсулина. Гипогликемические препараты группы сульфонилмочевины блокируют АТФ-зависимые калиевые каналы, что способствует деполяризации мембраны и увеличению секреции инсулина за счет того же механизма. (Из: Basic & Clinical Endocrinology, 3rd ed. Greenspan F. [ed.]. Appleton & Lange, 1994)
Инсулиновый рецептор
Как только инсулин попадает в кровь, он связывается со специфичными рецепторами, которые обнаружены на клеточных мембранах большинства тканей. Одйако биологические реакции, опосредуемые комплексами инсулин-рецептор, идентифицированы только в нескольких тканях-мишенях, например в печени, мышцах и жировой ткани. Рецепторы связывают инсулин в пикомолярных количествах с высокой специфичностью и аффинностью. Полный инсулиновый рецептор состоит из двух гетеродимеров, каждый из которых содержит а-субъединицу, полностью расположенную вне клетки и являющуюся распознающей ча
стью, и 0-субъединицу, которая “прошивает” мембрану (рис. 40-3). В состав 0-субъединицы входит тирозинкиназа. Когда инсулин связывается с а-субъединицей на внешней поверхности клетки, повышается активность тирозинкиназы 0-субъеди-ницы. Хотя а,0-димерная форма рецептора способна связывать инсулин, аффинность к ней намного ниже, чем к тетрамерной 2а,20-форме. Самофос-форилирование 0-части рецептора вызывает одновременно агрегацию а,0-гетеродимеров и стабилизацию активированного состояния рецепторной тирозинкиназы. Это приводит к фосфорилированию других белков внутри клетки, что является по сути дела вторичной передачей, так как стимули-
Рис. 40-3. Схематическое изображение возможной структуры инсулинового рецепторного тетрамера в активированном состоянии
рует перемещение определенных белков (например, транспортера глюкозы) из цитоплазмы к клеточной мембране. В конце концов комплекс инсу-лин-рецептор проникает внутрь клетки. Тем не менее остается не вполне ясным, участвует ли он в дальнейшем действии инсулина или его поглощение клеткой является средством ограничения эффектов гормона посредством последующего переваривания лизосомами.
Различные гормональные вещества (например, гидрокортизон) снижают аффинитет рецепторов к инсулину. Гормон роста, наоборот, немного повышает его. На концентрацию этих специфичных рецепторных молекул, так же как и на их аффинитет к инсулину, влияет количество взаимодействующих с ними молекул инсулина. В эксперименте было установлено, что снижение чувствительности инсулиновых рецепторов развивается в течение четырех часов в условиях in vitro и в пределах 24 часов in vivo. В клинических случаях ожирения или инсулиномы наряду с повышением уровня инсулина в крови уменьшается концентрация инсулиновых рецепторов. Этот регуляторный процесс является внутренним механизмом, посредством которого клетки-мишени ограничивают свой ответ на избыточную концентрацию гормона.
Эффекты инсулина в отношении органов-мишеней
Инсулин способствует депонированию жиров и глюкозы (основных источников энергии) внутри специализированных клеток-мишеней (рис. 40-4), а также влияет на рост клеток и метаболические функции самых различных тканей.
А. Действие инсулина на транспортеры глюкозы. Инсулин дает важный эффект в отношении некоторых транспортных молекул, которые облегчают проникновение глюкозы через мембрану клетки (табл. 40-2). Эти транспортеры могут играть роль в этиологии и проявлениях диабета. Один из них, GLUT 4, наиболее важный для снижения уровня глюкозы в крови, встраивается в мембраны мышечных и жировых клеток, выходя из внутриклеточных депонирующих везикул под действием инсулина. Нарушение опосредованного GLUT 2 транспорта глюкозы внутрь панкреатических 0-клеток вносит свой вклад в снижение секреции инсулина, имеющее место при ИНЗСД.
Б. Действие инсулина на печень (табл. 40-3). Первым важным органом, в который инсулин попадает через портальную систему, является печень, где его действие заключается в усилении депонирования
Рис. 40-4. Инсулин способствует синтезу (из циркулирующих питательных веществ) и депонированию гликогена, триглицеридов и белков в основных тканях-мишенях: печени, жировой ткани и мышцах. Выделение инсулина из поджелудочной железы стимулируется повышенным уровнем глюкозы в крови, увеличением активности блуждающего нерва и другими факторами
ТАБЛИЦА 40-2. Транспортеры глюкозы
Транспортер Ткань 1 <т глюкозы Функция (ммоль/л)
GLUT 1 Все ткани. Особенно эритроциты, головной мозг 1-2 Базальный захват глюкозы; транспорт через гематоэнцефалический барьер
GLUT 2 ₽-Клетки поджелудочной железы, печень, почки, кишечник 15-20 Регуляция высвобождения инсулина, другие стороны гомеостаза глюкозы
GLUT3 Головной мозг, почки, плацента, другие ткани < 1 Захват в нейроны и клетки других тканей
GLUT 4 Мышцы, жиро вая ткань ~5 Опосредованный инсулином захват глюкозы
GLUT 5 Кишечник, почки 1-2 Всасывание фруктозы в кишечнике
глюкозы в виде гликогена и переводе печени в состояние насыщения за счет устранения нескольких катаболических процессов, имеющих место после всасывания питательных веществ: гликогенолиза, кетогенеза и глюконеогенеза. Это действие инсулина отчасти обеспечивается интенсификацией процессов фосфорилирования, что приводит к активации пируваткиназы, фосфофруктокиназы и глюкокиназы, в то время как активность ферментов глюконеогенеза, включая пируваткарбоксилазу, фосфоенол-пируваткарбоксикиназу, фруктозобисфосфатазу и глюкозо-6-фосфатазу, подавляется. Кроме того, инсулин угнетает образование мочевины, катаболизм белков и цАМФ в печени, способствует синтезу триглицеридов и увеличивает захват калия и фосфатов клетками этого органа.
В. Действие инсулина на скелетные мышцы (табл. 40-3). Инсулин активизирует синтез белков, увеличивая транспорт аминокислот и стимулируя рибосомальную активность. Он также способствует синтезу гликогена, восполняя его запасы, которые расходуются при мышечной работе. Это обеспечивается усилением транспорта глюкозы в мышечные клетки, индукцией гликогенсинтазы и угнетением фосфорилазы. В мышечной ткани мужчины массой 70 кг депонировано приблизительно 500-600 г гликогена.
Г. Действие инсулина на жировую ткань (табл. 40-3). Наиболее эффективной формой сохранения энергии в организме являются триглицериды. Эти депо обеспечивают 9 ккал энергии в расчете на 1 г депонированного субстрата и в отличие от гликогена не нуждаются в воде для сохранения внутри клеток. В норме мужчина массой 70 кг имеет 12-14 кг жира, в основном в жировой ткани.
Инсулин снижает содержание свободных жирных кислот в крови и способствует депонированию триглицеридов в жировых клетках за счет трех основных механизмов: 1) индукции липопротеидли-пазы, которая активно гидролизует циркулирующие липопротеиды с высвобождением триглицеридов; 2) транспорта глюкозы в клетки с образованием глицерофосфата, который способствует этерификации жирных кислот, образующихся при гидролизе липопротеидов; 3) угнетения внутриклеточного липолиза депонированных триглицеридов за счет прямого ингибирования внутриклеточной липазы. Эти эффекты, по-видимому, опосредованы подавлением образования цАМФ и дефосфорилированием липаз в жировых клетках.
ТАБЛИЦА 40-3. Эндокринные эффекты инсулина
Действие на печень:
Устранение катаболических проявлений дефицита инсулина
Угнетает гликогенолиз
Тормозит превращение жирных кислот и аминокислот в кетокислоты
Угнетает превращение аминокислот в глюкозу
Анаболическое действие
Способствует депонированию глюкозы в виде гликогена (активирует глюкокиназу и гликогенсин-тазу, ингибирует фосфорилазу)
Активизирует синтез триглицеридов и образование липопротеидов очень низкой плотности
Действие на мышцы:
Активация синтеза белков
Усиливает транспорт аминокислот
Увеличивает рибосомальный синтез белков
Активация синтеза гликогена
Усиливает транспорт глюкозы
Активирует гликогенсинтазу и ингибирует фосфорилазу
Действие на жировую ткань:
Увеличение депонирования триглицеридов
Инсулин вызывает индукцию и активацию липо-протеидлипазы, которая гидролизует липопротеиды с образованием триглицеридов
Транспорт глюкозы в клетку обеспечивает образование глицерофосфата, необходимого для этерификации жирных кислот, образующихся из липопротеидов
Инсулин подавляет активность внутриклеточной липазы
Характеристики доступных препаратов инсулина
Коммерческие препараты инсулина различаются по ряду качеств: виду животных, из которых они получены; чистоте, концентрации и растворимости; времени начала и длительности биологического действия. За последние 12 лет к списку доступных инсулинов добавился ряд препаратов человеческого инсулина, а некоторые препараты животного происхождения были выведены из употребления. Таким образом, в 1994 г. на фармакологическом рынке США было представлено приблизительно 30 различных инсулинов. Если использование препаратов человеческого инсулина будет возрастать, число применяемых инсулинов животного происхождения уменьшится.
А. Основные типы препаратов инсулина и длительность их действия
В настоящее время в продаже имеются инсулины трех основных типов: 1) короткодействующие с быстрым началом действия; 2) средней длительности действия; 3) длительного действия с медленным проявлением эффекта (рис. 40-5, табл. 40-4). К инсулинам короткого действия относится кристаллический комплекс цинк-инсулин, образующий прозрачный раствор при нейтральном значении pH. Все другие коммерческие инсулины модифицированы с целью увеличения длительности действия и при растворении в нейтральной среде образуют суспензии. Они содержат либо протамин в фосфатном
Рис. 40-5. Выраженность и длительность действия инсулинов различных типов (у голодающих диабетиков). Представленная на графиках длительность действия соответствует средним терапевтическим дозам; показатель существенно возрастает при повышении дозы
буфере (протамин-цинк- и НПХ-инсулин), либо различные концентрации цинка в ацетатном буфере (инсулины ультраленте, ленте и семиленте). Производство препаратов протамин-цинк-инсули-на и семиленте недавно было прекращено, поскольку практически не существует клинических показаний для их использования. Общепринятая подкожная инсулиновая терапия в настоящее время заключается во введении смеси инсулинов короткой и средней длительности действия (НПХ или ленте) или в многократном введении инсулина короткого действия перед приемом пищи в сочетании с любой из трех инсулиновых суспензий (НПХ, ленте или ультраленте), продолжительное действие которых обеспечивает поддержание базального уровня инсулина в течение всей ночи.
1. Инсулины короткого действия. Регулярный инсулин представляет собой короткодействующий растворимый кристаллический цинк-инсулин, эффект которого развивается в течение 15 минут после подкожного введения и обычно продолжается 5-7 часов. Как и у всех других форм инсулина, длительность действия и величина эффекта во время пика зависит от вводимой дозы. Короткодействующий растворимый инсулин является единственным типом инсулина, который можно вводить внутривенно или с помощью инфузионной помпы. Он особенно удобен для внутривенного введения при лечении диабетического кетоацидоза и в случаях, когда потребность в инсулине быстро меняется, например после операций или во время острых инфекций.
2. Инсулины ленте и ультраленте. Инсулин ленте — это смесь 30 % инсулина семиленте (аморфный преципитат инсулина с ионами цинка в ацетатном буфере, эффект которого развивается относительно быстро) с 70 % инсулина ультраленте (плохорастворимый кристаллический цинк-инсулин, который имеет замедленное начало и пролонгированное действие). Эти два компонента обеспечивают комбинацию с относительно быстрой абсорбцией и стабильным длительным действием, делая инсулин ленте удобным терапевтическим средством. Хотя в фосфатном буфере все инсулины (свиной, бычий и человеческий) легко образуют кристаллы с цинком, только кристаллы бычьего инсулина обладают достаточной гидрофобностью, чтобы обеспечить замедленное и стабильное высвобождение инсулина, характерное для ультраленте. Несмотря на то, что цинковые кристаллы свиного и бычьего инсулинов внешне практически идентичны, свиной
инсулин растворяется быстрее, его эффект наступает раньше, а длительность действия оказывается короче. Поэтому не существует препарата ультраленте, содержащего только свиной инсулин. Компания “Ново Нордиск” для получения инсулина ультраленте продолжает использовать бычий инсулин. Компания “Эли Лилли” предлагает на рынке препарат человеческого инсулина ультраленте, который, как утверждается, имеет кривую время-эффект, сравнимую с кривой для бычьего инсулина, что весьма спорно.
Инсулин ленте является наиболее широко используемым препаратом этой серии, особенно в терапевтической комбинации с регулярным инсулином, эффект которого наступает быстрее, чем у компонента семиленте. Эффект препаратов ультраленте развивается медленно, а время действия достаточно продолжительно. Считается, что их назначение один или два раза в сутки обеспечивает базальный уровень инсулина, сравнимый с уровнем, достигаемым при нормальной эндогенной секреции или заданной скорости ночной инфузии из инсулиновых помп. Недавно снова начали использовать инсулин ультраленте в комбинации с регулярным инсулином у больных с инсулинзависимым диабетом.
3. НПХ (нейтральный протамин Хагедорна, или изофан)-инсулин. НПХ-инсулин — препарат средней длительности действия, задержка начала действия которого обеспечивается комбинацией определенного количества инсулина и протамина, так что ни один из компонентов не присутствует в некомплексной форме (“изофан"). Протамин, изолированный из молок радужной форели, представляет собой смесь из шести основных и нескольких дополнительных компонентов сходной структуры. Это богатые аргинином белки со средней мол. м. примерно 4400. Для образования изофанового комплекса (в котором ни один из компонентов не имеет свободных мест связывания) требуется весовое соотношение протамина и инсулина, приблизительно равное 1: 10, например 0.3-0.4 мг протамина на 4 мг инсулина (100 ЕД). Это составляет около шести молекул инсулина на одну молекулу протамина. После подкожного введения протеолитические ферменты разрушают протамин, позволяя инсулину всасываться.
Начало и длительность действия инсулина НПХ сравнимы с такими же характеристиками для инсулина ленте (табл. 40-4). Обычно его смешивают
ТАБЛИЦА 40-4. Некоторые препараты инсулина, применяемые в США' 2
Препараты Источник получения Концентрация
Короткодействующие инсулины Стандартные3
Регулярный (“Ново Нордиск”) Свиной 100 ЕД
Регулярный Илетин 1 (“Лилли”) Бычий и свиной 100 ЕД
“Очищенные”4
Регулярный (“Ново Нордиск”)6 Свиной или человеческий 100 ЕД
Регулярный Хумулин (““Лилли””) Человеческий 100 ЕД
Регулярный Илетин II (“Лилли”) Бычий и свиной 100 ЕД, 500* ЕД
Велозулин (“Ново Нордиск”) Человеческий 100 ЕД
Хумулин BR6 Человеческий 100 ЕД
Инсулины средней длительности действия Стандартные3
Изофан НПХ (“Ново Нордиск") Бычий 100 ЕД
Ленте (“Ново Нордиск”) Бычий 100 ЕД
Ленте Илетин 1 (“Лилли”) Бычий и свиной 100 ЕД
НПХ Илетин 1 (“Лилли”) Бычий и свиной 100 ЕД
“Очищенные”4
Ленте Хумулин (“Лилли”) Человеческий 100 ЕД
Ленте Илетин II (“Лилли") Свиной или бычий 100 ЕД
Ленте (“Ново Нордиск”)6 Свиной или человеческий 100 ЕД
НПХ Хумулин (“Лилли”) Человеческий 100 ЕД
НПХ Илетин II (“Лилли”) Свиной или бычий 100 ЕД
НПХ (“Ново Нордиск”)6 Свиной или человеческий 100 ЕД
Смешанные инсулины (70 % НПХ, 30 % регулярного)
Новолин 70/30 (“Ново Нордиск")6 Хумулин 70/30 и 50/50 (“Лилли”) Человеческий Человеческий 100 ЕД 100 ЕД
Инсулины длительного действия Стандартные3 Ультраленте (“Ново Нордиск”)6 Бычий 100 ЕД
Ультраленте Илетин I (“Лилли") Бычий и свиной 40 ЕД, ЮО ЕД
“Очищенные"4 Ультраленте (“Ново Нордиск”)6 Бычий 100 ЕД
Ультраленте Хумулин (“Лилли”) Человеческий 100 ЕД
1 Из: Katzung В. G. [ed.] Drug Therapy, 2nd ed. Appleton & Lange, 1991.
2 Все эти средства доступны без рецепта. Цены для всех препаратов одинаковы.
3 Больше 0.001 %, но меньше 0.0025 % проинсулина.
4 Меньше 0.001 % проинсулина.
5 Человеческие инсулины фирмы “Ново Нордиск” называются Новолин R, L и N.
6 Хумулин BR (регулярный буферный) рекомендуется для использования только с применением помп. Фосфатный буфер, входящий в его состав, снижает риск агрегации молекул инсулина в трубках помпы.
* Препарат 500 ЕД доступен только в виде свиного инсулина.
с регулярным инсулином и назначают больным с инсулинзависимым диабетом, как минимум, два раза в день для заместительной терапии.
4. Инсулиновые смеси. Так как для достижения адекватного терапевтического уровня инсулинам
средней длительности действия требуется несколько часов, при их использовании необходимо дополнительное назначение регулярного инсулина перед приемом пищи. Для удобства их смешивают в одном шприце и вводят подкожно двумя инъекциями
до завтрака и ужина. В этих смесях в качестве компонента средней длительности действия предпочтительнее применять инсулин НПХ, а не инсулин ленте, потому что повышенная концентрация ленте по сравнению с концентрацией регулярного инсулина может замедлить начало эффекта регулярного инсулина, входящего в смесь, особенно если инъекцию делают не сразу после смешивания. Дело в том, что высокое содержание цинка в инсулинах ленте и ультраленте может вызывать выпадение в осадок части растворимого регулярного инсулина при смешивании этих препаратов in vitro (даже в равной пропорции). Это и объясняет некоторое замедление абсорбции и начала биологического эффекта регулярного инсулина при комбинировании с инсулином ленте или ультраленте.
Так как НПХ-инсулин не изменяет фармакокинетический профиль смешиваемого с ним регулярного инсулина, содержание протамина в НПХ-ин-сулине было снижено до 0.4 мг или даже ниже на каждые 4 мг инсулина. Поэтому он предпочтительнее инсулина ленте в качестве компонента средней длительности действия в терапевтических смесях, содержащих регулярный инсулин.
Б. Виды инсулинов.
1. Бычий и свиной инсулины. Большинство коммерческих инсулинов в США в качестве основного компонента содержит бычий инсулин. Он отличается от человеческого тремя аминокислотами, тогда как свиной — только одной (рис. 40-1). Бычий гормон обладает несколько большей антигенностью для человека, чем свиной. В США наиболее часто выписывают препараты, которые являются стандартными смесями, содержащими 70 % бычьего и 30 % свиного инсулина. Однако при необходимости, связанной с инсулиновой аллергией или инсулиновой резистентностью, больного можно обеспечить “моновидовым” свиным или бычьим инсулином.
2. Человеческие инсулины. В настоящее время в массовом производстве человеческого инсулина используют технологию рекомбинантной ДНК, помещая кДНК гена человеческого проинсулина в E.coli или дрожжевую клетку и гидролизуя наработанный проинсулин до молекулы инсулина.
В медицинской практике используют препараты человеческого инсулина из серии Хумулин (“Лилли”). В продаже имеются регулярный, НПХ, ленте и ультраленте Хумулины. Человеческий инсулин, получаемый биосинтетическим способом из
дрожжей, поставляется на рынок фирмой “Ново Нордиск” в виде человеческого инсулина для инъекций (Новолин R), человеческого инсулина моно-тард (Новолин L) и изофановой суспензии человеческого инсулина (Новолин N). Буквы в конце названий R, L и N соответствуют формулам: регулярный, ленте и НПХ, соответственно. Та же фирма производит человеческий инсулин, называемый Ве-лосулин (регулярный), который содержит фосфатный буфер. Он снижает агрегацию молекул регулярного инсулина при использовании в инфузионных помпах, и потому, как и Хумулин BR, рекомендован для такого способа введения. Однако из-за способности фосфатов осаждать ионы цинка, эти два препарата не должны смешиваться с какими-либо инсулинами ленте.
Сейчас доступны готовые комбинированные составы инсулинов (70 % НПХ и 30 % регулярного человеческого инсулина), предназначенные для пожилых людей или тех, у кого могут возникнуть трудности с самостоятельным смешиванием инсулинов: Новолин 70/30, Хумулин 70/30 и Человеческий Инсулин-Микстард. Существует также смешанный человеческий инсулин в пропорции 50/50. Человеческие инсулины столь же эффективны, как и традиционные инсулины животного происхождения, но менее иммуногенны для больных диабетом, чем свиные и особенно — смешанные бычьи или свиные инсулины. Однако в последнее время поднимается вопрос о более высоком риске возникновения гипогликемии при применении человеческих препаратов (раздел “Осложнения инсулиновой терапии”).
Так как треонин содержит гидроксильную группу, которая делает его более полярным, и следовательно, более гидрофильным, чем аланин, присутствие в человеческом инсулине двух треонинов вместо двух аланинов бычьего инсулина (или одного треонина вместо одного аланина свиного инсулина; рис. 40-1) может объяснить, почему человеческий инсулин несколько более быстро абсорбируется и имеет независимо от формы препарата более короткую длительность действия, чем животные инсулины.
В. Чистота инсулина. Улучшение техники очистки (использование гелевых колонок) значительно снизило содержание в препаратах загрязняющих белков с более высокой мол. м., чем у инсулина. К таким белкам относятся проинсулин и частично расщепленные проинсулины, которые метаболически
неактивны, однако способны индуцировать выработку антиинсулиновых антител. Дальнейшая очистка с помощью хроматографии может практически удалить эти большие белки и заметно снизить содержание более мелких загрязняющих пептидов. Отвечающие стандарту препараты инсулина содержат менее 0.005 % проинсулина. Если препарат содержит меньше 0.001 % проинсулина, FDA предписывает маркировать инсулин как “очищенный”.
Г. Концентрация. В настоящее время в США и Канаде продается инсулин в концентрации 100 ЕД/мл, поставляемый во флаконах по 10 мл. В ограниченном количестве выпускается регулярный свиной инсулин с концентрацией 500 ЕД/мл для использования в редких случаях выраженной резистентности к инсулину, когда требуется введение большого количества препарата.
Д. Человеческий проинсулин. С помощью рекомбинантного синтеза ДНК в настоящее время стал доступным человеческий проинсулин, биологическая активность которого составляет 8-12 % от активности человеческого инсулина. Так как период его полувыведения из плазмы в 4-6 раз превышает показатель для человеческого инсулина, предлагается использовать его как альтернативу инсулинов длительного действия. Проинсулин обладает некоторым преимуществом перед НПХ- и лен-те-формами человеческого инсулина в том, что обеспечивает продолжительное инсулиновое действие, не требуя добавления протамина или больших концентраций цинка ацетата для преципитации инсулина. Более того, получены данные, что человеческий проинсулин менее иммуногенен, чем человеческий инсулин, и имеет более стабильные характеристики абсорбции, чем сравнимые с ним по длительности действия преципитированные формы человеческого инсулина (НПХ или ленте). Однако клиническая апробация была приостановлена в связи с повышением количества фатальных сердечно-сосудистых заболеваний в группе больных диабетом, получавших проинсулин. Однозначно роль проинсулина в лечении диабета пока не определена.
Е. Аналоги инсулина. Среди большого числа факторов, влияющих на кинетику абсорбции инсулина, важным является склонность молекул инсулина при введении в фармакологических концентрациях к агрегации в гексамерные формы. Это замедляет начало абсорбции инсулина из подкожных депо почти на 30 минут и уменьшает длительность абсорбции в целом, так как вводимый регулярный
инсулин 100 ЕД/мл должен быть разведен тканевыми жидкостями более чем в 1000 раз до того, как он примет мономерную форму, абсорбируемую более быстро. В настоящее время Исследовательский институт NOVO работает над созданием аналогов инсулина, обладающих способностью оставаться в виде мономеров даже при приеме в терапевтических концентрациях. К ним относятся, например, инсулин с двумя замещенными аминокислотами (Asp В9, Glu В27). Этот и другие аналоги проходят сейчас клинические испытания. Предварительные результаты обнадеживают: наблюдаются быстрая абсорбция после подкожной инъекции, высокая биологическая активность и относительно низкая иммуногенность (Brange et al, 1990; Kang et al, 1991).
Системы доставки инсулина
Обычным способом инсулиновой терапии являются подкожные инъекции с использованием стандартных шприцов и игл. В течение последних двух десятилетий было сделано большое количество попыток разработки других способов введения.
А. Портативный инъектор в виде авторучки. Чтобы облегчить многократное проведение подкожных инъекций, особенно при интенсивной инсулиновой терапии, были созданы портативные инъек-торы размером с авторучку (Novo Pen, Novolin Реп). Они содержат картриджи с человеческим инсулином 100 ЕД/мл и выдвижные иглы. Картриджи могут содержать регулярный инсулин (Novolin R PenFill), НПХ-инсулин (Novolin N PenFill), смесь 70 % НПХ и 30 % регулярного инсулина (Novolin 70/30 PenFill). Эти портативные инъекторы удобны для пациентов, так как нет необходимости все время носить с собой шприцы и флаконы с инсулином.
Б. Системы с “замкнутым циклом”. Автоматизированное введение растворимого инсулина с помощью систем с “замкнутым циклом” (инсулиновые инфузионные системы, контролирующие содержание глюкозы в крови) успешно применяется в острых ситуациях, таких как диабетический кетоацидоз, или для. поддержания баланса инсулина у больных диабетом во время операций. Хроническое их использование невозможно из-за необходимости постоянного забора крови для определения содержания глюкозы и размеров компьютеризированной системы подачи инсулина, используемой в современных моделях.
В. Системы с “открытым циклом” (инсулиновые помпы). Результатом исследования по созданию малогабаритных систем с “открытым циклом” доставки инсулина (инсулиновый резервуар и помпа, запрограммированная для введения регулярного инсулина с рассчитанной скоростью без измерения уровня глюкозы) является разработка действительно портативных помп для подкожных, внутривенных или интраперитонеальных инфузий. Так как методы самоконтроля уровня глюкозы все шире применяются больными, эти помповые системы постепенно становятся системами с менее “открытым циклом” и поэтому потенциально более полезными для лечения инсулинзависимых диабетиков. Однако применяемая сейчас интенсивная терапия, предусматривающая стандартные ежедневные многократные подкожные инъекции растворимого быстродействующего инсулина и однократные инъекции инсулина продолжительного действия, обеспечивает у большинства больных такой же эффективный контроль за содержанием глюкозы в крови, как и любая циклическая система.
Г. Интраназальное введение инсулина. При комбинации инсулина с детергентом и введении в виде аэрозоля на слизистую оболочку носа эффективного уровня препарата в плазме можно достигнуть так же быстро, как и при болюсном внутривенном введении. Если бы было показано, что этот путь введения обеспечивает постоянный и надежный уровень абсорбции при длительном применении без токсического действия на слизистую оболочку носа, он мог бы использоваться для упрощения доставки инсулина в кровь, что снизило бы потребность в инъекциях. Однако существующие в настоящее время формы не соответствуют этим требованиям.
Инсулиновая терапия
В современной классификации диабета выделена группа больных с практически отсутствующей секрецией инсулина, выживание которых зависит от введения экзогенного гормона. Эта “инсулинзависимая” группа (тип I) составляет только 8 % популяции больных диабетом в США. Большинству больных диабетом II типа для выживания не требуется экзогенный инсулин, но экзогенные добавки к эндогенной секреции инсулина могут способствовать существенному улучшению состояния. В США почти 20 % больных с диабетом II типа (1-1.5 млн человек) в настоящее время получает инсулиновую терапию.
Значение контроля концентрации глюкозы в крови при диабете
Длительное рандомизированное проспективное исследование 1441 пациента с ИЗСД в 29 медицинских центрах продемонстрировало, что “практическая нормализация” содержания глюкозы в крови замедляет возникновение и развитие микрососудистых и неврологических осложнений диабета в течение ближайших десяти лет (исследования Группы по изучению диабета и его осложнений — Diabets Control and Complications Trial Research Group — DCCT, 1993).
Использовались многократные инъекции инсулина (66 %) или инсулиновые помпы (34 %) у проходящих интенсивную терапию больных, которых обучали изменять ее в зависимости от результатов постоянного контроля за уровнем глюкозы. Пациенты со стандартной терапией получали не более двух инъекций инсулина в день вне зависимости от уровня гликозилированного гемоглобина или уровня глюкозы.
У больных первой группы средний уровень гликозилированного гемоглобина составлял 7.2 % (при норме < 6 %), а содержание глюкозы в крови — 155 мг/дл, тогда как у пациентов, получавших стандартную терапию, средний уровень гликозилированного гемоглобина приближался к 8.9 % при средней концентрации глюкозы в крови 225 мг/дл. В течение периода наблюдения, который длился в среднем 7 лет, частота возникновения диабетической ретинопатии, нефропатии и нейропатии в группе с жестким контролем содержания глюкозы была приблизительно на 60 % ниже, чем в контроле.
У больных, получающих интенсивную терапию, в три раза выше риск возникновения тяжелых гипогликемических состояний, а также более выражена тенденция к увеличению массы тела. Однако во время исследований подтвержденных летальных исходов от гипогликемии или постгипогликемических неврологических нарушений зарегистрировано не было.
Американская диабетическая ассоциация пришла к заключению, что интенсивная инсулиновая терапия вместе со всесторонним обучением пациентов методам самоконтроля должна стать медицинским стандартом для большинства взрослых больных ИЗСД. Исключение составляют больные с тяжелыми заболеваниями почек и престарелые, так как у этих групп опасность развития гипогликемического состояния превосходит пользу от постоянного контроля за уровнем глюкозы в крови.
У детей в возрасте до 7 лет развивающийся мозг особенно чувствителен к повреждающему действию гипогликемии, что делает невозможным использование интенсивной терапии с частым контролем концентрации глюкозы, тем более что осложнения диабета проявляются только через несколько лет после начала полового созревания.
Хотя в этих испытаниях принимали участие больные с ИНЗСД, нет причин предполагать, что им противопоказан более адекватный контроль содержания глюкозы. Нарушения зрения, функции почек и нервной системы сходны при обеих формах диабета и, очевидно, имеют одинаковые механизмы. Однако у больных с ИНЗСД, получающих интенсивную инсулиновую терапию, могут наблюдаться более выраженное увеличение массы тела, а у пожилых — более опасное развитие гипогликемии. По этой причине целесообразность назначения интенсивной инсулиновой терапии при ИНЗСД должна определяться индивидуально.
Осложнения инсулиновой терапии
А. Гипогликемия.
1. Механизмы и диагностика. Гипогликемические состояния являются самым частым осложнением инсулиновой терапии. Они могут быть результатом несвоевременного приема пищи, необычной физической нагрузки или следствием введения необоснованно высокой дозы инсулина. У многих больных, пытающихся регулировать терапию в зависимости от своего состояния, но без постоянного мониторинга содержания глюкозы в периферической крови, гипогликемия возникает даже более часто. Высказывается предположение, что при использовании человеческого инсулина выраженность симптомов гипогликемии меньше, чем при применении инсулинов животного происхождения (Berger et al., 1989). Если это действительно так, то существует опасность увеличения частоты потенциально серьезных осложнений гипогликемии вследствие нераспознавания первых настораживающих симптомов. Это утверждение сомнительно, поскольку некоторые авторы (Heine et al., 1989; Kern et al., 1990) чисто механически поддерживают его, не имея на то достаточных оснований. Более того, предварительные результаты широких исследований DCCT (в течение более чем 53 000 человеко-месяцев) продемонстрировали, что доля больных с асимптоматической гипогликемией, по
лучавших человеческий инсулин, не отличается статистически значимо от таковой у больных, получавших инсулин животного происхождения (Gorden, 1990). В настоящий момент пришли к соглашению продолжать применение человеческого инсулина до тех пор, пока не будут получены более определенные данные.
У пожилых больных диабетом, а также у тех, кто применяет инсулины длительного действия или у кого часто наблюдались гипогликемические состояния при применении метода жесткого контроля за уровнем сахара, вегетативные предвестники гипогликемии встречаются реже, а основными признаками избытка инсулина являются нарушения функции центральной нервной системы, например спутанность сознания, странное поведение и, наконец, кома. Более быстрое развитие гипогликемии при использовании регулярного инсулина вызывает появление симптомов как симпатической (тахикардия, потливость, тремор), так и парасимпатической (тошнота, чувство голода) вегетативной гиперактивности с последующим развитием судорожного состояния и комы при отсутствии лечения.
Каждый больной диабетом, получающий гипогликемическую лекарственную терапию, должен постоянно носить с собой идентификационные браслеты, кулоны или карточки в бумажнике или кошельке.
2. Лечение. Все проявления гипогликемии быстро купируются назначением глюкозы. В случаях умеренной гипогликемии при сохранении сознания и способности глотать можно дать апельсиновый сок, глюкозу или любой напиток, содержащий сахар. При более выраженной гипогликемии, вызвавшей потерю сознания или ступор, препаратом выбора является внутривенная инфузия 20-50 мл 50 % раствора глюкозы в течение 2-3 минут. При невозможности проведения внутривенной терапии подкожное или внутримышечное введение 1 мг глюкагона позволяет в течение 15 минут восстановить сознание и дать возможность приема сахара per os. Члены семьи или соседи должны быть обучены введению глюкагона в случае необходимости. Если пациент находится в ступоре, а глюкагон недоступен, можно поместить небольшое количество меда или сиропа в защечное пространство. Однако в целом пероральное кормление больных в бессознательном состоянии противопоказано.
Б. Иммунопатологические последствия инсулиновой терапии. В процессе инсулиновой терапии
может вырабатываться, как минимум, пять молекулярных классов антител к инсулину: IgA, IgD, IgE, IgG и IgM. Существует два основных типа иммунных нарушений у таких больных: инсулиновая аллергия и иммунная резистентность к инсулину.
1. Инсулиновая аллергия. Это довольно редкое состояние, при котором возникает локальная или системная сыпь, вызываемая высвобождением гистамина из тучных клеток, сенситизированных ан-тиинсулиновыми антителами IgE (гиперчувствительность немедленного типа). В тяжелых случаях возникают анафилактические реакции. Образование через несколько часов подкожных узелков в месте инъекции инсулина, сохраняющихся в течение суток, относят за счет опосредованной IgG реакции Артюса со связыванием комплемента. Так как наблюдается в основном гиперчувствительность к балластным неинсулиновым белкам, появление новых высокоочищенных инсулинов значительно снизило частоту инсулиновой аллергии, особенно местных реакций. Использование человеческого инсулина с самого начала терапии практически исключает возникновение аллергических реакций. При возникновении аллергии на бычий инсулин замена препарата на инсулин другого происхождения (например, на очищенный свиной или человеческий инсулин) может изменить ситуацию. Могут потребоваться антигистаминные препараты, глюкокортикоиды или даже десенсибилизирующая терапия, особенно при системной гиперчувствительности. Фирма “Эли Лилли” производит специальный набор для десенсибилизации с серией растворов бычьего или свиного инсулина.
2. Иммунная резистентность к инсулину. У большинства больных, получающих инсулин, в крови отмечается низкий титр антиинсулиновых антител IgG, которые в некоторой степени нейтрализуют действие инсулина. Иногда, преимущественно у больных с определенной степенью нечувствительности тканей к инсулину (например, у тучных диабетиков) или имеющих в анамнезе прерванную терапию слабоочищенными бычьими инсулинами, в крови наблюдается высокий титр антиинсулиновых антител IgG. Это проявляется в потребности чрезвычайно высоких доз инсулина, часто более 200 ЕД в день. После внедрения высокоочищенных инсулинов это осложнение становится более редким. Переход на менее антигенные (свиной и человеческий) очищенные инсулины может позволить значительно снизить дозы инсулина или по
крайней мере уменьшить длительность иммунной резистентности. Другие формы терапии включают применение сульфатированного бычьего инсулина (химически модифицированный бычий инсулин, содержащий в среднем шесть сульфатных групп на молекулу) и иммуносупрессию кортикостероидами. У взрослых больных терапию экзогенным инсулином можно полностью прекратить и перейти на лечение только диетой и пероральными препаратами группы сульфонилмочевины. Это возможно лишь в том случае, если циркулирующие антитела не нейтрализуют собственный инсулин больных.
В. Липодистрофия в месте инъекции. В месте инъекции инсулина может наблюдаться атрофия подкожной жировой клетчатки. Этот тип иммунных осложнений в настоящее время встречается редко в связи с созданием высококонцентрированных очищенных свиного и человеческого инсулинов с нейтральным pH. Инъекции этих препаратов непосредственно в участок атрофии часто приводят к восстановлению ткани. Проблема гипертрофии подкожной жировой клетчатки при повторных инъекциях в одно и то же место (даже при применении очищенных инсулинов) остается нерешенной. Однако она легко корригируется отсасыванием жира.
Пероральные гипогликемические средства
Секрецию инсулина способно изменять множество веществ (табл. 40-5), включая препараты, используемые для терапии диабета. Препараты сульфонилмочевины, единственно доступные в США в настоящее время пероральные препараты для лечения инсулиннезависимого диабета, повышают высвобождение эндогенного инсулина и увеличивают эффективность его действия на периферии. В других странах выбор препаратов намного больше, включая второй класс соединений — бигуани-ды, которые снижают уровень глюкозы в крови даже при отсутствии активности Р-клеток поджелудочной железы. Бигуаниды были изъяты из обращения в США в 1977 г., так как сообщалось, что использование фенформина сопровождается высокой частотой возникновения лактоацидоза. Однако в настоящее время закончены клинические испытания наименее токсичного бигуанида — метфор-
ТАБЛИЦА 40-5. Регуляция высвобождения инсулина улюдей'
Стимуляторы высвобождения инсулина
Глюкоза, манноза
Лейцин
Активация блуждающего нерва
Производные сульфонилмочевины
Усилители вызванного глюкозой высвобождения инсулина
1. Кишечные гормоны:
глюкагоноподобный пептид 1(7-37) гастринингибирующий полипептид холецистокинин
секретин,гастрин
2. Нейрогенные усилители: стимуляция p-адренорецепторов
3. Аминокислоты:
аргинин
Ингибиторы высвобождения инсулина
Нейрогенные: а-симпатомиметический эффект катехоламинов
Гуморальные: соматостатин
Препараты: диазоксид, фенитоин, винбластин, колхицин
' Из: Greenspan F. S. (ed.) Basic & Clinical Endocrinology, 3rd ed. Lange, 1991.
мина. Препарат разрешен к применению в США с конца 1994 г. Третий класс препаратов, тиазолидин-дионы, находится на начальной стадии клинических испытаний.
Препараты сульфонилмочевины
С 1955 г. при лечении ИНЗСД широко применяются препараты сульфонилмочевины. Это производные арилсульфонилмочевины с замещениями в бензольной группе и группе мочевины. В табл. 40-6 представлена химическая структура шести производных сульфонилмочевины, применяемых в США, включая два препарата “второго поколения”, обладающих более высокой активностью.
Механизм действия
Предполагают, что имеется, как минимум, три ме-ханизмадействия препаратов сульфонилмочевины: 1) увеличение высвобождения инсулина из р-клеток; 2) снижение уровня глюкагона в сыворотке; 3) вне-
панкреатический эффект, заключающийся в усилении действия инсулина на ткани-мишени.
А. Высвобождение инсулина из клеток поджелудочной железы (рис. 40-2). Производные сульфонилмочевины связываются в мембране р-клеток со специфическими рецепторами, которые ассоциированы с калиевыми каналами. Это связывание подавляет выход ионов калия из клетки через каналы, в результате чего возникает деполяризация. Деполяризация в свою очередь открывает потенциалзависимые кальциевые каналы, что приводит к входу Са2+в клетку и высвобождению готового инсулина. Предотвращать эффекты производных сульфонилмочевины in vitro могут блокаторы кальциевых каналов, но при использовании в концентрациях, в 100-1000 раз превышающих их обычный терапевтический уровень, возможно, потому что кальциевые каналы Р-клеток не идентичны кальциевым каналам L-типа сердечно-сосудистой системы (глава 12). Более того, тиазидоподобный препарат диазоксид, вызывающий открытие калиевых каналов (глава И), противодействует инсулинотропному эффекту производных сульфонилмочевины (так же как и аналогичному эффекту глюкозы). Этот факт дает также одно из объяснений механизма гипергликемического эффекта тиазидных диуретиков.
Синтез инсулина под действием производных сульфонилмочевины не увеличивается и даже может уменьшаться. Усиливается вызванная глюкозой секреция инсулина. Однако в нескольких исследованиях было выявлено, что после длительной терапии этими препаратами концентрация инсулина в крови в ответ на их дальнейшее введение больше не повышается, а может и снижаться. Интерпретация этих наблюдений затруднена тем обстоятельством, что большинство подобных данных получено с помощью метода определения толерантности к глюкозе при ее пероральном введении — нефизиологичного тестирования реактивности поджелудочной железы. После приема смешанной пищи, содержащей как белки, так и углеводы, лечебный эффект длительного введения производных сульфонилмочевины обычно ассоциируется с повышением содержания инсулина в сыворотке крови.
Б. Снижение концентрации глюкагона в крови. В настоящее время установлено, что длительное введение производных сульфонилмочевины больным с инсулиннезависимым типом диабета снижает уровень глюкагона в крови. Этот эффект может вносить вклад в гипогликемическое действие препаратов.
ТАБЛИЦА 40-6. Производные сульфонилмочевины
Производные Химическая структура Суточная Длитель-
сульфонилмочевины доза ность действия (часы)
Толбутамид (Ориназ)
0.5-2 г в несколько приемов
6-12
Толазамид (Толиназ)
Ацетогексамид (Димелор)
Хлорпропамид (Диабинез)
Глибурид (Глибенкла-мид1, Диарета, Микроназ)
Глипизид (Глидиазин-амид', Глюко-трол, Глюко-трол XL)
0.1-1 г однократно или в несколько приемов
0.25-1.5 г однократно или в несколько приемов
0.1-0.5 г однократная доза
0.00125-0.02 г
10-14
12-24
до 60
10-24
10-24* *
’ Вне США.
* Период полуэлиминации короче (подробности в тексте).
Механизм его неясен, однако возможно, что он связан с непрямым угнетением, обусловленным увеличением секреции как инсулина, так и соматостатина, которые подавляют секрецию а-клеток.
С. Потенцирование действия инсулина на ткани-мишени. Установлено, что при диабете II типа введение производных сульфонилмочевины сопровождается повышением связывания инсулина с тканевыми рецепторами. Как описано в главе 2, увеличение числа рецепторов может усилить эффект, получаемый от той же концентрации агониста; такое действие производных сульфонилмочевины должно потенцировать как эффекты незначитель
ных количеств собственного инсулина больного, так и эффекты экзогенного инсулина. Однако этот наблюдаемый in vivo эффект не обнаруживается in vitro при нанесении инсулина на ткани-мишени. Кроме того, у инсулинзависимых больных дибетом с полным отсутствием секреции инсулина лечение препаратами сульфонилмочевины все же способствует контролю уровня глюкозы в крови, повышает чувствительность к вводимому инсулину или увеличивает его связывание с рецепторами.
Эти наблюдения серьезно противоречат утверждению о прямом потенцирующем действии производных сульфонилмочевины на эффекты инсу
лина. Скорее они свидетельствуют о преимущественно вторичном метаболическом действии, обусловленном снижением уровня глюкозы или уровня жирных кислот за счет повышения секреции инсулина производными сульфонилмочевины.
Эффективность и безопасность производных сульфонилмочевины
В 1970 г. Университетская группа по программе изучения диабета (UGDP) сообщила, что смертность от сердечно-сосудистых заболеваний у больных сахарным диабетом, получавших лечение толбутамидом, превышает таковую у больных, принимающих инсулин или плацебо. Однако существуют сомнения в правомерности заключений UGDP в связи с неоднородностью изученной популяции больных и некоторыми условиями проведения эксперимента, например использованием фиксированной дозы толбутамида. Тем не менее в 1984 г. по распоряжению FDA в упаковки всех препаратов сульфонилмочевины были помещены вкладыши с предупреждением о возможном повышении риска смерти от сердечно-сосудистых заболеваний. В связи с сомнениями по поводу выводов названного исследования и некоторыми значительно более мягкими авторитетными заключениями по этому вопросу, приведенными в аннотации к препаратам, производные сульфонилмочевины продолжают широко применяться.
1. ТОЛБУТАМИД
Толбутамид хорошо всасывается, но быстро окисляется в печени. Длительность его действия относительно коротка (6-10 часов), и поэтому он является наиболее безопасным препаратом сульфонилмочевины для использования у пожилых больных диабетом. Толбутамид лучше всего назначать в несколько приемов (например, 500 мг перед каждым приемом пищи и перед сном), однако некоторым пациентам требуется только одна или две таблетки в день. Острые токсические реакции отмечаются редко, иногда возникает кожная сыпь. Описаны редкие случаи длительной гипогликемии в основном у больных, получавших одновременно определенные препараты (например, дикумарол, фенилбутазон или некоторые сульфаниламиды). Эти препараты, по-видимому, конкурируют за окислительные ферменты в печени, в результате
чего повышается концентрация неметаболизиро-ванного активного толбутамида в крови.
2. ХЛОРПРОПАМИД
Период полувыведения хлорпропамида составляет 32 часа. Препарат медленно метаболизируется в печени до продуктов, которые сохраняют некоторую биологическую активность. Приблизительно 20-30 % лекарства экскретируется в неизмененном виде с мочой. Хлорпропамид взаимодействует с теми же препаратами, что и толбутамид, конкурирующими за ферменты окислительного катаболизма в печени. Он противопоказан больным с почечной и печеночной недостаточностью. Средняя поддерживающая доза составляет 250 мг в день на один прием утром. Частота возникновения длительной гипогликемии выше, чем при приеме толбутамида, преимущественно у пожилых больных, за которыми необходимо особое наблюдение в процессе терапии хлорпропамидом. Дозы выше 500 мг в сутки увеличивают вероятность возникновения желтухи, редко встречающейся при применении низких доз. У больных с генетически обусловленной предрасположенностью прием хлорпропамида при одновременном потреблении алкоголя может вызвать резкую гиперемию лица. У некоторых больных терапия хлопропамидом осложняется дилюционной гипонатриемией. Она возникает в результате увеличения секреции вазопрессина и потенцирования его эффектов хлорпропамидом в почечных канальцах. Антидиуретическое действие хлоргфо-памида не связано с сульфонилмочевинной частью его молекулы, так как другие производные сульфонилмочевины (ацетогексамид, толазамид и глибу-рид) оказывают на людей диуретическое действие. Гематологические нарушения (обратимая лейкопения, тромбоцитопения) наблюдаются менее чем у 1 % больных.
3. ТОЛАЗАМИД
Толазамид сравним с хлорпропамидом по силе действия, но имеет меньшую длительность эффекта, близкую к продолжительности действия ацетогексамида. Толазамид медленнее всасывается, чем другие производные сульфонилмочевины, и его действие на концентрацию глюкозы в крови не проявляется в течение нескольких часов. Период его полувыведения сцставляет примерно 7 часов. Me-
таболиты толазамида сохраняют гипогликемическую активность. Если суточная потребность в препарате превышает 500 мг, ежедневную дозу делят на два приема. Увеличение дозы выше 1000 мг в день нецелесообразно, так как не улучшает контроля за уровнем глюкозы в крови.
4. АЦЕТОГЕКСАМИД
Длительность действия ацетогексамида составляет 10-16 часов (промежуточное значение между толбутамидом и хлорпропамидом). Суточная терапевтическая доза составляет 0.25-1.5 г в один или два приема. Препарат метаболизируется в печени до активных метаболитов. Побочные эффекты сходны с таковыми для других производных сульфонилмочевины.
5. ПРОИЗВОДНЫЕ СУЛЬФОНИЛМОЧЕВИНЫ ВТОРОГО ПОКОЛЕНИЯ
Ко второму поколению гипогликемических средств относятся два высокоактивных препарата сульфонилмочевины — глибурид и глипизид. Первоначальное использование глибурида в других странах сопровождалось высокой частотой выраженных гипогликемических реакций и даже привело к нескольким летальным исходам, возможно, из-за неосведомленности пациентов о его сильном действии. Эти препараты должны применяться с осторожностью у больных с сердечно-сосудистыми заболеваниями или у пожилых, для которых гипогликемия особенно опасна.
Если у больных диабетом не возникает клинического улучшения при использовании толбутамида и толазамида, может помочь более активный препарат сульфонилмочевины первого поколения — хлорпропамид или какое-либо из производных сульфонилмочевины второго поколения. В настоящее время достоверно не установлено, что препараты второго поколения более эффективны, чем хлорпропамид.
Глибурид метаболизируется в печени с образованием продуктов, обладающих очень низкой гипогликемической активностью. Хотя специфичные для неметаболизированного препарата методы определения свидетельствуют о его коротком периоде полувыведения, биологические эффекты глибурида у больных диабетом сохраняются в течение
суток после однократного утреннего приема. Обычная начальная доза составляет 2.5 мг/день или менее, а средняя поддерживающая доза — 5-10 мг/день однократно утром. Назначение поддерживающих доз выше 20 мг/день не рекомендуется. В настоящее время на рынке имеется недавно разработанная “микронизированная” форма глибурида (ПресТаб) в таблетках по 1.5,3,4.5 и 6 мг. Однако вопрос о биологической эквивалентности этого препарата в сравнении с немикронизированными формами не вполне ясен, поэтому FD А рекомендует при переходе с приема обычного глибурида или других производных сульфонилмочевины использовать тщательный мониторинг для подбора доз ПресТаб.
Помимо способности вызывать гипогликемию глибурид дает несколько других побочных эффектов. После потребления алкоголя изредка возникает ощущение жара. В отличие от хлорпропамида глибурид не вызывает задержку воды, а наоборот, несколько повышает выведение свободной воды. Глибурид противопоказан прежде всего при заболеваниях печени и почечной недостаточности.
Глипизид имеет самый короткий период полувыведения (2-4 часа) в ряду наиболее эффективных средств. Для максимального снижения возникающей после приема пищи гипергликемии этот препарат необходимо принимать за 30 минут до завтрака, так как быстрое его всасывание замедляется при приеме с пищей. Рекомендуемая начальная доза составляет 5 мг/день с дальнейшим повышением до 15 мг/день в один прием. При необходимости назначения более высоких доз суточную дозу делят на несколько приемов, принимая препарат перед едой. Максимальная рекомендуемая доза составляет 30 мг/день. Недавно создан препарат с замедленным высвобождением (Глюкотрол XL), который обеспечивает действие в течение суток после однократного утреннего приема.
В связи с более коротким периодом полувыведения вероятность возникновения выраженной гипогликемии при использовании глипизида много меньше, чем при использовании глибурида. Не менее 90 % дозы глипизида метаболизируется в печени до неактивных продуктов, а 10 % экскретируется в неизмененном виде с мочой. Вследствие этого назначение глипизида противопоказано пациентам с нарушениями функции печени или почек, у которых выше риск возникновения гипогликемии.
6. ВТОРИЧНАЯ РЕЗИСТЕНТНОСТЬ К ПРЕПАРАТАМ СУЛЬФОНИЛМОЧЕВИНЫ И ТАХИФИЛАКСИЯ
Вторичная резистентность (т. е. невозможность длительного поддержания клинического эффекта при лечении препаратами сульфонилмочевины) остается проблемой лечения диабета II типа. Поскольку частой причиной этого является несоблюдение диеты, можно предположить, что стандартное многократное введение длительнодействующих препаратов сульфонилмочевины, обеспечивающее стабильный уровень сахара в крови, вызывает реф-рактерность р-клеток поджелудочной железы. Этот феномен был обнаружен при изучении непродолжительного высвобождения инсулина после кратковременного действия сульфонилмочевины, что привело к попыткам использования схем прерывистой, или “пульсирующей”, терапии производными сульфонилмочевины, при которой назначается однократная суточная доза короткодействующего препарата.
7. КОМБИНИРОВАННАЯ ТЕРАПИЯ ПРЕПАРАТАМИ СУЛЬФОНИЛМОЧЕВИНЫ И ИНСУЛИНА
Так как производные сульфонилмочевины не только повышают секрецию инсулина р-клетками поджелудочной железы, но и могут восстанавливать чувствительность периферических тканей к инсу
лину, предлагалось использовать их совместно с инсулином для снижения дозы последнего. С другой стороны, рассматривается целесообразность дополнительного назначения больным ИНЗСД, получающим терапию производными сульфонилмочевины с недостаточным эффектом максимальных доз, НПХ-инсулина на ночь. Однако ограниченное на сегодняшний день количество данных соответствующих клинических испытаний не позволяет дать обоснованную оценку эффективности одновременного назначения инсулина и производных сульфонилмочевины при лечении ИНЗСД. Но если состояние пациента не улучшается при назначении более 100 ЕД инсулина в день, совместное назначение инсулина и производных сульфонилмочевины, возможно, предпочтительнее, чем дальнейшее увеличение дозы гормона.
Бигуаниды
Структура бигуанидов представлена в табл. 40-7. Применение фенформина в США прекращено в связи с возможностью возникновения лактоацидоза и отсутствием документированных свидетельств какого-либо длительного улучшения при его использовании. В других странах продолжается применение метформина, буформина и фенформина, хотя в некоторых регионах показания для применения бигуанидов пересматриваются. Клинические исследования метформина в США в настоящее время находятся в стадии завершения.
ТАБЛИЦА 40-7. Бигуаниды
н 1 N / \ 1 1 * о
II II NH NH Бигуанид г 1 I Структура Суточная доза Длительность действия (часы)
Фенформин 1 _ 0.025-0.15 г однократная доза 4-6
(DBI, Мелтрол-50) 1 / ' । -NH — (СН2)2~/ / \ или в несколько приемов 8-14*
Буформин1 1 -NH-(CH2)3-CH3 0.05-0.3 г в несколько приемов 10-12
Метформин1 1 - N - (СН3)2 1-3 г в несколько приемов 10-12
’ Используется в клинической практике за пределами США.
• Капсулы с замедленным выделением препарата.
Механизм действия
Механизм действия бигуанидов не вполне ясен. Их способность снижать уровень глюкозы в крови не зависит от наличия функционирующих 0-клеток поджелудочной железы. Назначение фенформина не снижает уровень глюкозы у здоровых людей после ночного голодания, но существенно ограничивает его возрастание после приема пищи. У больных с ИНЗСД после назначения бигуанидов наблюдается сравнительно невысокий уровень гипергликемии, в том числе во время послеобеденного пика. Сведений о возникновении гипогликемии во время терапии бигуанидами не имеется. Вследствие этого данные препараты более правильно называть “эуглике-мическими”, чем гипогликемическими средствами. Предполагаемый в настоящее время механизм действия включает: 1) непосредственную стимуляцию гликолиза в периферических тканях с активацией удаления глюкозы из крови; 2) ингибирование глюконеогенеза в печени; 3) замедление поглощения глюкозы из желудочно-кишечного тракта; 4) снижение уровня глюкагона в плазме; 5) повышение связывания инсулина с инсулиновыми рецепторами.
Метаболизм и экскреция
Фенформин связывается с белками плазмы, его терапевтический уровень варьирует от 100 до 250 нг/мл. Период полувыведения составляет примерно И часов. Приблизительно ’/3 фенформина метаболизируется, оставшаяся часть экскретируется с мочой в неизмененном виде. У больных с почечной недостаточностью фенформин накапливается, повышая риск возникновения лактоацидоза. Это осложнение носит дозозависимый характер.
Метформин не метаболизируется и экскретируется почками в активной форме. У больных, получающих метформин, лактоацидоз возникает реже, чем при лечении фенформином.
Клиническое использование
Бигуаниды наиболее часто назначают пациентам с тяжелыми формами ожирения, у которых гипергликемия обусловлена угнетением действия инсулина. Другим показанием к их применению является неэффективность монотерапии производными сульфонилмочевины у больных инсулиннезависи-мой формой диабета. В этих случаях используют
комбинированную терапию производными сульфонилмочевины и бигуанидами.
Бигуаниды противопоказаны больным с заболеваниями почек, печени, при алкоголизме, при состояниях с предрасположенностью к тканевой аноксии (например, хронические сердечно-легочные заболевания), что обусловлено повышением риска развития лактоацидоза, вызываемого данными препаратами (особенно фенформином), при наличии этих заболеваний.
В исследованиях UGDP установлено, что фенформин в дозе 100 мг в день имеет минимальные терапевтические преимущества по сравнению с плацебо. У больных, получавших фенформин, отмечалось небольшое повышение артериального давления и частоты сердечных сокращений. Сообщалось также о повышении риска смерти от сердечно-сосудистых заболеваний при приеме препарата.
Наиболее частые токсические эффекты метформина, возникающие почти у 20 % больных, — это нарушения функции желудочно-кишечного тракта (анорексия, тошнота, рвота, дискомфорт в области живота, диарея). Эти эффекты зависят от дозы, возникают большей частью в начале терапии и часто самостоятельно проходят через некоторое время. Однако у 3-5 % больных возникает необходимость в отмене метформина вследствие упорной диареи.
Производные тиазолидиндиона
Этот новый класс антидиабетических средств в настоящее время проходит клинические испытания. Основной механизм их действия заключается в повышении чувствительности тканей-мишеней к инсулину. В исследованиях на животных выявлено, что эти препараты потенцируют действие инсулина, приводящее к повышению захвата глюкозы и ее окислению как в мышечной, так и в жировой ткани, в то же время понижая выход глюкозы из печени и синтез липидов в мышечных и жировых клетках. Данные эффекты возникают in vivo без какого-либо повышения высвобождения инсулина (Hofman, 1992; Suter et al., 1992). К этому классу веществ относятся циглитазон, пиоглитазон, энгли-тазон и соединение CS-045. Недавно доказана эффективность соединения CS-045 при его назначении в течение 12 недель, во время которого препарат уменьшал резистентность к инсулину, снижал инсулинемию и уменьшал гипергликемию как в периоды между приемами пищи, так и непосредствен
но после еды у больных ИНЗСД. Поскольку резистентность к инсулину и гиперинсулинизм рассматриваются как факторы риска в возникновении гипертензии, гиперлипидемии и атеросклероза (Reaven, 1988), имеется хорошая перспектива применения этого класса веществ при ИНЗСД.
Глюкагон
Химическое строение и метаболизм
Глюкагон синтезируется а-клетками островков Лангерганса поджелудочной железы (табл. 40-1). Глюкагон является полипептидом, его строение идентично у всех млекопитающих и представляет собой одиночную цепь из 29 аминокислот (рис. 40-6) смол. м. 3485. Он образуется путем протеолитического расщепления большой молекулы предшественника с мол. м. примерно 18 000. Один из промежуточных предшественников, являющийся полипептидом, состоящим из 69 аминокислот, называется глицентином и содержит в своем составе характерную для глюкагона последовательность аминокислот.
Глюкагон подвергается существенному разрушению в печени и почках, а также в плазме и в области его тканевых рецепторов. Так как гормон быстро инактивируется в плазме, при взятии проб крови для его иммунологического определения необходимо охлаждение лабораторной посуды и добавление ингибиторов протеолитических ферментов. Период его полувыведения из плазмы составляет от 3 до 6 минут и близок к периоду полувыведения инсулина.
Рис. 40-6. Аминокислотная последовательность глюкагонового полипептида
“Кишечный глюкагон”
В клетках тонкого кишечника, а также в а-клет-ках поджелудочной железы и в оттекающей жидкости при ее перфузии была выявлена глицентиновая иммунореактивность. Клетки кишечника секретируют энтероглюкагон, который представляет собой семейство глюкагонподобных пептидов, куда входят глицентин и пептиды 1 и 2 (GLP-1 и GLP-2). В отличие от а-клеток поджелудочной железы в этих клетках кишечника отсутствуют ферменты, осуществляющие превращение предшественников глюкагона в настоящий глюкагон за счет удаления карбоксильного терминального окончания молекулы.
Функция энтероглюкагонов окончательно не выяснена, хотя более мелкие пептиды могут связываться с глюкагоновыми рецепторами в печени, где проявляют парциальную активность. Производное GLP-1, состоящее из 37 аминокислот, у которого отсутствуют шесть первых аминокислот (GLP-1 [7-37]), является мощным стимулятором секреции инсулина. Оно представляет собой преобладающую форму GLP в кишечнике у людей и носит название "инсулинотропин”.
Фармакологические эффекты глюкагона
А. Метаболические эффекты. Первые шесть аминокислот с ЫН2-конца молекулы глюкагона связываются со специфичными рецепторами клеток печени. Это приводит к повышению опосредованной G-белком активности аденилатциклазы и увеличению образования цАМФ, что способствует усилению катаболизма депонированного гликогена и активирует глюконеогенез и кетогенез. Непосредственным фармакологическим эффектом введения глюкагона является возрастание уровня глюкозы в крови за счет расходования запасов гликогена в печени. Он не оказывает действия на гликоген мышц, вероятно, из-за отсутствия в них глюкагоновых рецепторов. Глюкагон в количествах, проявляющих фармакологическое действие, вызывает увеличение секреции инсулина из здоровых р-клеток поджелудочной железы, катехоламинов из феохромоцитомы и кальцитонина из клеток медуллярной карциномы.
Б. Действие на сердце. Глюкагон оказывает мощное инотропное и хронотропное действие на сердце, опосредованное уже описанными цАМФ-механизмами. Таким образом, он дает эффект, подобный таковому агонистов p-адренорецепторов, но без их вовлечения.
В. Действие на гладкие мышцы. Большие дозы глюкагона вызывают сильное расслабление кишечника, не опосредованное активацией аденилатцик-лазы.
Клиническое использование
А. Тяжелая гипогликемия. Важной областью использования глюкагона является его применение при экстренной терапии тяжелых гипогликемических состояний у больных с инсулинзависимой формой диабета, когда потеря сознания исключает прием пищи. В настоящее время он доступен для парентерального введения (Глюкагоновый комплект скорой помощи). Недавно разработанный интраназальный спрей в настоящее время проходит клинические испытания.
Б. Эндокринологическая диагностика. Глюкагон используют для диагностики эндокринологических патофизиологических процессов в ряде диагностических тёстов. В стандартном тесте оценки резервов секреторной способности (3-клеток у больных с инсулинзависимой формой сахарного диабета применяют болюсное внутривенное введение 1 мг глюкагона. Так как у пациентов, получающих инсулин, вырабатываются антитела к инсулину, которые влияют на результаты радиоиммунологичес-кого определения инсулина, в качестве показателя секреторной активности р-клеток используют уровень выделения С-пептида. У здоровых людей стандартная концентрация панкреатического С-пепти-да в крови достигается через 10 минут после инъекции, а у получающих инсулин больных диабетом выявляется недостаточность р-клеток различной степени. У большинства больных с длительно существующим ИЗСД не наблюдается выделения С-пептида в ответ на инъекцию глюкагона.
У больных с предполагаемыми эндокринными опухолями, такими как инсулинома, феохромоцитома или медуллярная карцинома щитовидной железы, болюсное внутривенное введение 0.5-1 мг глюкагона иногда вызывает усиленный выброс гормональных веществ опухоли, отрицательные результаты теста не исключают наличия опухоли.
В. Отравление Р-блокаторами. Иногда глюкагон используется для блокирования эффектов передозировки p-блокаторов на сердце, так как он увеличивает там продукцию цАМФ. Однако при хронической сердечной недостаточности он неэффективен.
Г. Рентгенологическое исследование кишечника. Глюкагон широко используется при рентгенологических исследованиях, поскольку улучшает визуализацию кишечника, вызывая его расслабление.
Побочные реакции
Введение глюкагона иногда может вызывать тошноту и рвоту. Обычно эти явления выражены умеренно; в целом тяжелые побочные эффекты не характерны для глюкагона.
Островковый амилоидный полипептид (IAPP, Амилин)
Островковый амилоидный полипептид (Islet amyloid polypeptide, IAPP) представляет собой состоящий из 37 аминокислот полипептид, который впервые был выделен из амилоидных отложений в островках поджелудочной железы больных с длительно существующим ИНЗСД или инсулиномой. Он вырабатывается (3-клетками поджелудочной железы, содержится там в гранулах в концентрации, составляющей 1 -2 % от продукции инсулина, и секретируется в ответ на стимуляторы секреции (3-клеток. Его физиологический эффект не установлен, однако в фармакологических дозах пептид угнетает действие инсулина на захват глюкозы мышцами. I АРР является членом большого семейства нейро-регуляторных пептидов. Он на 46 % гомологичен полипептиду, связанному с геном кальцитонина,— кокальцигенину (глава 17). В то время как кокал ь-цигенин подавляет секрецию инсулина, IAPP в физиологических концентрациях этим эффектом не обладает. Планируются клинические испытания IAPP как вспомогательного средства при инсулиновой терапии диабета I типа у больных с повторяющимися эпизодами тяжелой инсулинвызванной гипогликемии, которые резистентны к обычным превентивным мерам.
Препараты (препараты инсулина представлены в табл. 40-4)
Производные сульфонилмочевины
Ацетогексамид (генерик, Димелор)
Перорально: таблетки по 250, 500 мг Хлорпропамид (генерик, Диабинез)
Перорально: таблетки по 100,250 мг
Глипизид (Глюкотрол, Глюкотрол XL) Перорально: таблетки по 5,10 мг; таблетки с замедленным высвобождением по 5,10 мг
Глибурид (Диабета, Микроназ, Глиназ ПресТаб) Перорально: таблетки по 1.25,2.5,5 мг;
таблетки “ПресТаб” по 1.5,3,4.5,6 мг
Толазамид (генерик, Толиназ)
Перорально: таблетки по 100,250,500 мг
Толбутамид (генерик, Ориназ) Перорально: таблетки по 250, 500 мг
Глюкагон
Глюкагон (генерик)
Парентерально: лиофилизированные
порошки для приготовления инъекционного раствора по 1,10 мг
Избранная литература
Bailey С. J. Biguanides and NIDDM. Diabetes Care, 1992; 15:755.
Brange J. et al. Monomeric insulins and their experimental and clinical implications. Diabetes Care, 1990; 13: 923.
Bressler R., Johnson D. New pharmacological approaches to therapy of NIDDM. Diabetes Care, 1992; 15:792.
Diabetes Control and Complications Trial Research Group: Epidemiology of severe hypoglycemia in
the diabetes control and complications trial. Am. J. Med. 1991; 90:450.
Diabetes Control and Complications Trial Research Group: The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N. Engl. J. Med. 1993; 329:977.
Galloway J. A. et al. Byosynthetic human proinsulin: review of chemistry, in vitro and in vivo receptor binding, animal and human pharmacology studies, and clinical trial experience. Diabetes Care, 1992; 15: 666.
Hermann L. S. Biguanides and sulfonylureas as combination therapy in NIDDM. Diabetes Care, 1990; 13 (Suppl. 3): 37.
Hofman C. A., Colca J. R. New oral thiazolidinedione antidiabetic agents act as insulin sensitizers. Diabetes Care, 1992; 15:1075.
Lebovitz H. E. (ed.). Therapy for Diabetes Mellitus and Related Disorders. American Diabetes Association, 1991.
Nolte M. S. Insulin therapy in insulin-dependent (type 1) diabetes mellitus. Endocrinol. Metab. North Am. 1992; 21: 281.
Westermark P. et al. Islet amyloid polypeptide: A novel controversy in diabetes research. Diabetologia, 1992; 35:297.
Средства, влияющие на минеральный гомеостаз костной ткани
41
Даниель Д. Байкл
Базисная фармакология
Кальций и фосфат, основные минеральные составляющие костной ткани, являются также двумя наиболее важными минералами, необходимыми для функционирования клеток. В организме существует комплекс тонких регуляторных механизмов, поддерживающих гомеостаз кальция и фосфатов (рис. 41-1). Приблизительно 98 % из 1-2 кг кальция и 85 % из 1 кг фосфора содержатся в костях, которые являются основным резервуаром этих минералов у взрослого человека. Гомеостаз минералов — динамическое состояние, поскольку имеет место постоянная перестройка костной ткани и обмен минералами между костями и внеклеточной жидкостью. Кости выполняют функцию структурной основы тела и являются вместилищем кроветворной ткани. Таким образом, нарушение минерального гомеостаза костей может привести не только к разнообразным нарушениям клеточных функций (например, тетания, кома, мышечная слабость), но и к нарушениям структуры тела (например, вследствие остеопороза и переломов) и к потере способности к гемопоэзу (например, при детском остеопетрозе).
Фосфаты и кальций поступают в организм из кишечника. В среднем с пищей поступает 600-1000 мг кальция в сутки, из которых абсорбируются 100-125 мг. Эта величина характеризует итоговую абсорбцию, так как одновременно происходит абсорбция (в основном в двенадцатиперстной кишке и в верхней части тощей кишки) и секреция (в основном в подвздошной кишке). Обычная диета содержит фосфора почти столько же, сколько и кальция. Однако фосфаты абсорбируются (в основном в тощей кишке) лучше: от 70 до 90 % в зависи
мости от их содержания в пище. В состоянии покоя почечная экскреция кальция и фосфатов и их абсорбция в кишечнике уравновешены. Обычно более 95 % фильтрующегося в почках кальция и 85 % фосфатов реабсорбируется. Перемещения кальция и фосфатов через эпителий кишечника и почек — взаиморегулируемые процессы. Врожденные заболевания кишечника (например, глютеновая энтеропатия) или заболевания почек (хроническая почечная недостаточность) нарушают минеральный гомеостаз костей.
Главными регуляторами кальциевого и фосфатного гомеостаза являются два гормона: полипептид — паратиреоидный гормон (ПТГ) и стероид — витамин D. Витамин D — скорее прогормон, чем гормон, так как для появления биологической активности он должен быть предварительно метаболизирован. Другие гормоны — кальцитонин, пролактин, гормон роста, инсулин, тиреоидные гормоны, глюкокортикоиды и половые стероиды — влияют на кальциевый и фосфатный гомеостаз при определенных физиологических состояниях и могут рассматриваться как вторичные регуляторы. Дефицит или избыток этих вторичных регуляторов в физиологических пределах не вызывает таких нарушений гомеостаза кальция и фосфатов, которые наблюдаются при дефиците или избытке витамина D и ПТГ. Однако некоторые из этих вторичных регуляторов, особенно кальцитонин, глюкокортикоиды и эстрогены, имеют терапевтическое значение при нарушениях фосфорно-кальциевого обмена и будут описаны в соответствующих разделах.
На гомеостаз кальция и фосфатов кроме них самих влияют гормональные регуляторы, ионы натрия, фтора и многие лекарства — бисфосфонаты, пликамицин и диуретики.
Рис. 41-1. Некоторые механизмы, участвующие в поддержании минерального гомеостаза костей. Концентрации кальция и фосфора в сыворотке крови контролируются в основном витамином 1,25(OH)2D3(D) и паратиреоидным гормоном (ПТГ), влияющими на абсорбцию этих элементов из кишечника и костей и экскрецию с мочой. Оба вещества повышают выход кальция и фосфора из костей в кровь, витамин D также повышает их абсорбцию из кишечника. Витамин D снижает экскрецию с мочой как кальция, так и фосфора, тогда как ПТГ уменьшает экскрецию кальция, но повышает экскрецию фосфора. Кальцитонин (КТ) имеет меньшее значение для гомеостаза кальция, но в фармакологических концентрациях он может снижать уровень кальция и фосфора в крови за счет уменьшения процесса резорбции костей и увеличения их почечной экскреции. Эффекты обратной связи не показаны
Основные регуляторы минерального гомеостаза костной ткани
Паратиреоидный гормон
Паратиреоидный гормон (ПТГ) — это одноцепочечный полипептидный гормон, состоящий из 84 аминокислот. Он вырабатывается в паращитовидной железе в форме предшественника, состоящего из 115 аминокислот, от которого перед секрецией отщепляется остаток из 31 аминокислоты. Железа содержит кальцийчувствительную протеазу, способную расщеплять интактный гормон на фрагменты. Биологическая активность обусловлена аминотерминальной частью молекулы, поскольку синтетический ПТГ, содержащий аминокислотную последовательность 1-34, обладает полной активностью. Удаление первых двух аминотерминальных аминокислот приводит к потере большей части биологической активности.
Скорость метаболического клиренса интактного ПТГ у собак составляет 20 мл/мин/кг, а время полувыведения — несколько минут. В основном клиренс осуществляется печенью и почками. Клиренс биологически неактивных фрагментов карбоксильного остатка, образующихся в процессе метаболизма интактного гормона, значительно ниже, особенно при почечной недостаточности. Это частично объясняет очень высокий уровень ПТГ при почечной недостаточности, выявлявшийся ранее при использовании радиоиммунологического метода, основанного на связывании радиоактивной метки с карбоксильным концом молекулы. В настоящее время большинство методов позволяет определить содержание интактного гормона, поэтому высокий уровень ПТГ при почечной недостаточности отмечается редко. Наличие аминоконцевых фрагментов ПТГ в крови выявить сложно, поскольку только небольшое их количество высвобождается в кровь и они быстро выводятся.
ПТГ регулирует проникновение кальция и фосфатов через клеточные мембраны в костях и почках, что проявляется в повышении концентрации кальция и снижении концентрации фосфатов в сыворотке крови. В костной ткани ПТГ повышает активность и количество остеокластов — клеток, отвечающих за резорбцию костей. Однако выявлено, что активация остеокластов не является прямым эффектом. В большей степени ПТГ действует на остеобласты (клетки, формирующие кость), которые, в свою очередь, каким-то образом регулируют активность остеокластов. Так, повышенный обмен минералов в костях или их перестройка — специфическая последовательность клеточных событий, начинающаяся с резорбции кости остеокластами, за которой следует построение костной ткани остеобластами. Кроме того, ПТГ стимулирует дифференциацию предшественников остеокластов, увеличивая таким образом количество самих остеокластов. ПТГ стимулирует как резорбцию, так и формирование костей, но результирующим эффектом избытка ПТГ будет усиление резорбции. ПТГ в низких дозах, наоборот, активирует остеогенез без первоначальной стимуляции резорбции. В действии ПТГ на клеточные элементы костной ткани участвует цАМФ, возможно, в этот процесс включены и другие посредники (в том числе ионы кальция).
В почках ПТГ повышает способность нефрона к реабсорбции кальция и магния, но снижает его спо
собность реабсорбировать фосфат, аминокислоты, бикарбонат, натрий, хлор и сульфат. Хотя ПТГ значительно стимулирует продукцию и экскрецию цАМФ в почках, а через цАМФ опосредуется несколько почечных эффектов ПТГ, цАМФ, возможно,— не единственный посредник эффектов ПТГ на почки. Другим важным эффектом ПТГ в почках является увеличение образования 1,25-дигидрокси-витамина D (1,25[OH]2D).
Недавно у ПТГ обнаружены сосудистые и кар-диотропные эффекты. Это объясняет способность ПТГ быстро повышать уровень клубочковой фильтрации. Остается неизвестным, вносят ли эти эффекты вклад в очевидную взаимосвязь гиперпаратиреоза и гипертензии.
Недавно пептид, содержащий первые 34 аминокислоты ПТГ, стал доступен для биологического изучения в качестве средства для лечения остеопороза.
Витамин D
Витамин D является секостероидом, синтезируемым в коже из 7-дегидрохолестерина под действием ультрафиолетового излучения. Витамин D также содержится в некоторых продуктах питания и используется в качестве дополнения к ежедневному рациону. В продуктах питания присутствует как естественная для человека форма витамина (витамин D3 — холекальциферол), так и форма растительного происхождения (витамин D2 — эргокальциферол). Различие между ними состоит в том, что эргокальциферол имеет двойную связь (С22-23) и дополнительную метильную группу в боковой цепи (рис. 41-2). Для человека эти различия, очевидно, не имеют большого физиологического значения, и последующие комментарии применимы в одинаковой степени к обеим формам витамина D.
Витамин D — это прогормон, который является предшественником большого количества биологически активных метаболитов (рис. 41-2). Сначала он гидроксилируется в печени с образованием 25-гидроксивитамина D (25[OH]D). Этот метаболит в дальнейшем превращается в почках в несколько других форм, из которых наиболее изучены 1,25-дигидроксивитамин D (1,25[OH]2D) и 24,25-дигидроксивитамин D (24,25[OH]2D). Из естественных метаболитов только витамин D, 25(OH)D (как кальцифедиол) и 1,25(OH)2D (как
кальцитриол) доступны для использования в клинике (табл. 41-1), хотя в настоящее время проходит клинические испытания 24,25(OH)2D. Более того, с целью расширить возможности использования метаболита 1,25(OH)2D в различных неклассических случаях было синтезировано несколько его аналогов. Кальципотриол, например, в настоящее время используется для лечения псориаза — гиперпролиферативного заболевания кожи. Регуляция метаболизма витамина D — сложный процесс, в котором участвуют кальций, фосфаты и большое число различных гормонов, наиболее важным из которых является ПТГ.
Витамин D и его метаболиты в плазме крови прочно связываются с белком-переносчиком — витамин D-связывающим протеином. Этот а-глобу-лин обладает высокой аффинностью, сопоставимой у 25(ОН) D и 24,25(OH)2D, и более низкой — к витамину D и 1,25(OH)2D. У здоровых людей период полувыведения кальцифедиола, введенного парентерально, составляет 23 дня, тогда как у пациентов с удаленными почками он больше (42 дня). Период полувыведения 24,25(OH)2D, вероятно, такой же. В исследованиях с меченым витамином D установлено, что он быстро выводится из крови. Клиренс в основном осуществляется печенью. Излишек витамина D депонируется в жировой ткани. Скорость метаболического клиренса свидетельствует о быстром кругообороте кальцетриола, для которого период полувыведения составляет всего несколько часов. Некоторые аналоги 1,25(ОН)2 плохо связываются с витамин D-связывающим белком. В результате они имеют высокую скорость клиренса и период полувыведения, измеряемый минутами. В сравнении с кальцитриолом эти аналоги дают значительно меньший гиперкальциемический и гипер-кальциурический эффекты, что весьма существенно при их использовании для лечения таких состояний, как псориаз.
Механизм действия метаболитов витамина D активно изучается. Установлено, что кальцитриол сильнее, чем другие метаболиты, повышает всасывание кальция и фосфатов из кишечника, а также резорбцию костной ткани. Действие кальцитриола в кишечнике связано как с индукцией синтеза новых белков (например, кальцийсвязывающих протеинов), так и с изменением прохождения кальция через щеточную каемку эпителия кишечника и мембраны митохондрий за счет механизмов, не требующих синтеза новых белков. Молекулярные меха-
Рис. 41-2. Превращение 7-дегидрохолестерина в витамин D3 и метаболизм 1)3до 24,25[OH]2D3h 1,25[OH]2D3. Последний этап контролируется в основном почками, в которых низкий сывороточный уровень фосфора и кальция и высокий уровень паратиреоидного гормона способствуют образованию 1,25[OH]2D3. На вставке представлена боковая цепь эргостерола. Эргостерол подвергается сходным превращениям до витамина D2 (эргокальциферол), который, в свою очередь, метаболизируется до 25OHD2,1,25[OH]2D2 и 24,25[OH]2D2. Соответствующие производные витаминов D2 и D3 у человека обладают одинаковой активностью и дают сходные эффекты. Ссылки в тексте на них даются без нижнего индекса
низмы действия кальцитриола в костной ткани изучены недостаточно. Метаболиты 25(OH)D и 24,25(011)2D гораздо слабее повышают всасывание кальция и фосфатов в кишечнике или резорбцию костей. Однако оказалось, что 25(OH)D более активно, чем 1,25(OH)2D, стимулирует реабсорбцию кальция и фосфатов в почках и, возможно, является основным метаболитом, регулирующим вход кальция в клетку и сократимость мышц. Установлено, что 24,25(OH)2D стимулирует остеогенез. В тканях-мишенях существуют специфические рецепторы для 1,25(OH)2D. Однако данные о роли и даже о существовании рецепторов для 25(OH)D и 24,25(OH)2D противоречивы.
Взаимодействие ПТГ
и витамина D
В табл. 41-2 суммированы главные виды действия ПТГ и витамина D в трех основных тканях-мишенях: кишечнике, почках и костях. Результатом действия ПТГ является повышение концентрации кальция и снижение концентрации фосфатов в сыворотке крови; результат действия витамина D — повышение концентрации обоих этих веществ. Регуляция гомеостаза кальция и фосфатов осуществляется за счет различных механизмов обратной связи. Кальций является основным регулятором сек-
ТАБЛИЦА 41 -1. Витамин D, его применяемые в клинике метаболиты и аналоги
Химическое название Сокращенное название Генерическое название
Витамин D3 D3 Холекальциферол
Витамин D2 d2 Эргокальциферол
25-Гидроксиви- 25(OH)D3 Кальциферол
тамин D3
1,25-Дигидро- 1,25(OH)2D3 Кальцитриол
ксивитамин D3
24,25-Дигидро- 24,25(OH)2D3 Секальцифедиол
ксивитамин D3
Дигидротахи- DHT Дигидротахисте-
стерол рол
реции ПТГ. Он соединяется с распознающим ионы местом связывания, представляющим часть комплекса рецептора и Gq-белка, который является связующим звеном между внутриклеточным свободным кальцием и внеклеточным кальцием. При повышении концентрации кальция в сыворотке он связывается с этим рецептором, уровень внутриклеточного кальция повышается и снижается секреция ПТГ. Фосфаты влияют на секрецию ПТГ опосредованно за счет образования в крови комплексов с кальцием. Поскольку паращитовидная железа распознает только ионизированный кальций, повышение в крови уровня фосфатов снижает концентрацию ионизированного кальция и приводит к повышению секреции ПТГ. Такая регуляция за счет обратной связи приводит к конечному эффекту ПТГ — повышению содержания кальция и уменьшению уровня фосфатов в сыворотке крови. Таким же образом повышение уровня кальция и фосфатов приводит к снижению образования почками 1,25(OH)2D и увеличению продукции 24,25(OH)2D. Поскольку 1,25(OH)2D повышает уровень кальция и фосфатов в крови, а действие 24,25(OH)2D более слабое, то эта обратная связь также оказывает соответствующее регулирующее действие. Сам 1,25(OH)2D непосредственно подавляет секрецию ПТГ (независимо от его эффектов на уровень кальция в крови) за счет прямого действия на транскрипцию гена ПТГ. Это является еще одним контуром отрицательной обратной связи, так как ПТГ представляет собой основной стимул для продукции 1,25(OH)2D. Способность 1,25(OH)2D непосредственно подавлять секрецию ПТГ определяется с помощью аналогов кальцитриола, которые
ТАБЛИЦА 41 -2. Действие ПТГи витамина D на кишечник, кости и почки
ПТГ Витамин D
Кишечник Повышение всасывания кальция и фосфатов (за счет увеличения продукции 1,25(OH)2D) Повышение всасывания кальция и фосфатов (посредством 1,25(OH)2D)
Почки Снижение выведения кальция и повышение выведения фосфатов Выведение кальция и фосфатов может быть снижено под действием 25(OH)D и 1,25(OH)ZD
Кость Высокие дозы ПТГ повышают резорбцию кальция и фосфатов, низкие дозы могут усиливать формирование костей Повышение резорбции кальция и фосфатов под действием 1,25(OH)2D Под действием 24,25(OH)2D может быть ускорено формирование костей
Итоговый Уровень кальция в Уровень и кальция и
эффект плазме повыша- фосфатов в плаз-
на концентрацию в плазме ется, а уровень фосфатов снижается ме повышается
не повышают уровень кальция в крови. Такие препараты дают положительный эффект при лечении вторичного гиперпаратиреоидизма с сопутствующей почечной недостаточностью и даже в некоторых случаях — первичного гиперпаратиреоидизма.
Вторичные гормональные регуляторы минерального гомеостаза костной ткани
Ряд гормонов модулирует регулирующее действие ПТГ и витамина D на минеральный гомеостаз костей. Физиологическое значение такой вторичной регуляции минерального гомеостаза костной ткани в сравнении с действием ПТГ невелико. Од
нако в дозах, дающих фармакологический эффект, некоторые из этих гормонов оказывают действие на минеральный гомеостаз костей, которое может иметь терапевтическое значение.
Кальцитонин
Кальцитонин является полипептидным гормоном, представляющим собой единичную цепь из 32 аминокислот с мол. м. 3600. Он секретируется парафолликулярными клетками щитовидной железы млекопитающих (и ультимобранхиальными тельцами рыб). Дисульфидная связь между положениями 1 и 7 играет существенную роль в биологической активности гормона. Кальцитонин продуцируется этими железами из предшественника с мол. м. 15 000. В крови циркулирует несколько форм кальцитонина, размеры молекул которых варьируют от мономера с мол. м. 3600 до форм, имеющих мол. м. 60 000. Неизвестно, входят ли в эту “смесь” формы-предшественники или олигомеры, соединенные ковалентными связями. В связи с выраженной гетерогенностью активность кальцитонина оценивается биологическим методом на крысах, сравнивается со стандартом, утвержденным Британским медицинским исследовательским советом (British Medical Research Council — MRC), и выражается в MRC-единицах.
Человеческий мономер кальцитонина имеет период полувыведения 10 мин со скоростью метаболического клиренса 8-9 мл/кг/мин. Кальцитонин лосося имеет больший период полувыведения и замедленный метаболический клиренс (3 мл/кг/мин). Большая часть клиренса происходит в почках, хотя только небольшое количество неизмененного кальцитонина обнаруживается в моче.
Основным эффектом кальцитонина является снижение концентрации кальция и фосфатов в крови за счет действия на кости и почки. Кальцитонин подавляет резорбцию костей остеокластами. В начале после введения кальцитонина остеогенез не нарушается, но со временем снижается как остеогенез, так и резорбция костей. Таким образом, надежды на то, что кальцитонин можно использовать для восстановления массы костей, не оправдались.
Кальцитонин подавляет реабсорбцию в почках кальция и фосфатов, так же как и реабсорбцию других ионов, включая натрий, калий и магний. Кальцитонин увеличивает образование цАМФ как в костях, так и в почках, но неизвестно, является ли
цАМФ посредником в проявлении его эффектов. ПТГ также увеличивает содержание цАМФ в этих тканях, несмотря на то, что эффекты кальцитонина и ПТГ противоположны.
Кальцитонин действует не только на кости и почки, но и на другие ткани. В фармакологически-активных количествах кальцитонин снижает секрецию гастрина и соляной кислоты в желудке и повышает секрецию натрия, калия, хлора и воды в кишечнике.
Пентагастрин (так же как и гиперкальциемия) является мощным стимулятором секреции кальцитонина, что свидетельствует о физиологической взаимосвязи между кальцитонином и гастрином. У взрослых людей не возникают выраженные проявления дефицита (вследствие тиреоидэктомии) или избытка (медуллярная карцинома щитовидной железы) кальцитонина. Однако способность кальцитонина уменьшать резорбцию костей и снижать концентрацию кальция в сыворотке крови позволяет использовать его для лечения болезни Педжета (деформирующая остеодистрофия), гиперкальциемии и остеопороза.
Глюкокортикоиды
Глюкокортикоидные гормоны влияют на минеральный гомеостаз костей, препятствуя активирующему действию витамина D на всасывание кальция из кишечника, увеличивая выведение кальция почками, снижая синтез коллагена в костях и усиливая вызываемую ПТГ резорбцию костей (хотя не все признают наличие этого последнего эффекта). Указанные эффекты лежат в основе отрицательного в целом влияния на минеральный гомеостаз костей, но эти гормоны могут быть полезны в двух ситуациях, имеющих отношение к минеральному обмену костей: в среднем периоде лечения гиперкальциемии и при использовании в диагностических целях для выявления причины гиперкальциемии. Длительное лечение глюкокортикоидами является частой причиной возникновения остеопороза у взрослых и нарушения развития скелета у детей.
Эстрогены
Эстрогены способны предотвращать быстрое уменьшение костной массы в начале постменопаузного периода и даже временно увеличивать ее у пациенток во время постменопаузы. Предполага
ется, что эстрогены снижают активируемую ПТГ резорбцию костей. Они повышают уровень 1,25(OH)2D в крови, но не влияют на образование 1,25(OH)2D in vitro. Повышение уровня 1,25(OH)2D in vivo после введения эстрогена может быть результатом снижения уровня кальция и фосфатов в крови и повышения секреции ПТГ. Эстрогеновые рецепторы обнаружены в костях, что может свидетельствовать об их прямом действии на перестройку костей. Основным показанием к применению эстрогенов при нарушениях минерального обмена является профилактика или лечение постменопаузного остеопороза.
Негормональные вещества, влияющие на минеральный гомеостаз костей
Бисфосфонаты
Бисфосфонаты являются аналогами пирофосфата, у которых связь Р-О-Р заменяется негидролизуемой Р-С-Р связью (рис. 41-3). В настоящее время для клинического использования доступны два препарата — этидронат и памидронат. Вероятно, скоро появятся новые лекарства. Лечебный и токсический эффекты Бисфосфонатов, по крайней мере частично, обусловлены их способностью замедлять формирование и растворение кристаллов гидроксиапатита внутри и вне скелетной системы. Однако точный механизм селективного подавления резорбции костей неизвестен.
В исследованиях на животных установлено, что после перорального введения абсорбируется 1-10 % дозы этидроната. Почти половина абсорбируемого препарата аккумулируется в костях, остальное экскретируется в неизмененном виде с мочой. Препарат, связавшийся с костями, сохраняется там в течение нескольких недель, в зависимости от собственного обмена костной ткани.
Этидронат и другие бисфосфонаты оказывают многочисленные эффекты на гомеостаз костей. Их физико-химические свойства определяют способность подавлять образование и растворение гидроксиапатитов, что позволяет использовать эти вещества в клинике. В частности, бисфосфонаты рекомендованы для лечения гиперкальциемии при злокачественных новообразованиях, остеопороза и
ОН ОН
I I
О = Р—О — Р=О Неорганическая пирофосфорная
I | кислота
ОН ОН
ОН СНзОН I I I
О=Р—С—Р=О
I I I
ОН ОН ОН
ОН ОН ОН
I I I О=р—с—Р=О
I I I
он СН2ОН
I сн2
I NH3
Этан-1 -гидроксид-1,1 -бисфосфонат (EHDP, этидронат)
З-амино-1 гидроксипропили-денбисфосфонат (APD, памидронат)
Рис. 41-3. Структура пирофосфата и двух бисфосфонатов, этидроната и памидроната, одобренных для применения н США
синдромов эктопической кальцификации. Установлена эффективность этих препаратов при болезни Педжета. Бисфосфонаты дают множество других клеточных эффектов, включая угнетение образования 1,25(OH)2D, ингибирование всасывания кальция в кишечнике, изменение метаболизма в костных клетках — торможение гликолиза, замедление роста клеток и изменение активности кислой и щелочной фосфатаз. Характер действия зависит от конкретного типа бисфосфоната, что и определяет некоторые отличия клинических эффектов различных бисфосфонатов в отношении минерального гомеостаза костей.
Пликамицин (митрамицин)
Пликамицин — это цитотоксический антибиотик (глава 56), который используется для лечения двух нарушений минерального метаболизма костей: болезни Педжета и гиперкальциемии. Цитотоксическое действие препарата объясняется его связыванием с ДНК и нарушением ДНК-контролируе-мого синтеза РНК. Причина его эффективности при болезни Педжета и гиперкальциемии не ясна; возможно, для процесса резорбции костной ткани необходим синтез белков. Дозы, требующиеся для лечения гиперкальциемии и болезни Педжета, со
ставляют примерно одну десятую от цитотоксических доз.
Тиазиды
Химия и фармакология этой группы препаратов описаны в главе 15. Главным эффектом тиазидов при лечении нарушений минерального гомеостаза костей является снижение почечной экскреции кальция. Тиазиды усиливают действие паратиреоидного гормона, проявляющееся увеличением реабсорбции кальция в почечных канальцах, или оказывают опосредованное действие (вторичное) на реабсорбцию кальция, повышая обратное всасывание натрия в проксимальном канальце. В дистальном канальце тиазиды нарушают реабсорбцию натрия через люминальную мембрану, повышая натрий-кальциевый обмен на базолатеральной мембране, усиливая таким образом в данном месте реабсорбцию кальция в кровь. Тиазиды достаточно эффективно снижают гиперкальциурию и предотвращают образование камней у больных идиопатической гиперкальциурией. Отчасти их способность ограничивать образование камней объясняется снижением экскреции оксалатов с мочой и повышением концентрации в моче магния и цинка.
Фториды
Хорошо известна эффективность фтора в профилактике кариеса зубов. Изучена возможность применения фторидов для лечения остеопорозов. Оба варианта терапевтического использования основываются на эпидемиологических данных, свидетельствующих, что у жителей районов, снабжающихся естественной фторированной водой (0.0001-0.0002 %), снижена вероятность возникновения кариеса и компрессионных переломов позвоночника по сравнению с районами с нефторированной водой. Фтор аккумулируется в костях и зубах, где он стабилизирует кристаллы гидроксиапатита. Этот механизм лежит в основе способности фтора уменьшать развитие кариеса зубов, но он не объясняет увеличение образования новой костной ткани.
Фторирование питьевой воды оказалось наиболее эффективным средством для предотвращения кариеса, если такая вода употребляется до прорезывания постоянных зубов. Оптимальная концентрация фтора в питьевой воде составляет 0.00005-
0.0001 %. Местная аппликация наиболее эффективна, если используется сразу же после прорезывания зубов. Применение фтора после полного формирования постоянных зубов малоэффективно. Избыток фтора в питьевой воде (выше 0.0001 %) приводит к появлению пятен на эмали зубов.
В связи с низкой эффективностью других средств в плане стимуляции роста новой костной ткани у больных с остеопорозом возобновился интерес к использованию в этих целях фторидов (раздел “Остеопороз”). Их назначение без дополнительного введения соответствующего количества кальция приводит к развитию остеомаляции. При введении адекватных количеств кальция наблюдается улучшение кальциевого баланса, повышение минеральной составляющей костной ткани и увеличение объема костных трабекул. Однако два исследования, посвященные влиянию фтора на частоту переломов, дали противоречивые результаты (Riggs, 1990; Рак, 1989). Побочные эффекты применения фтора в дозах, при которых наблюдались эффекты на кости, включали тошноту, рвоту, желудочно-кишечные кровотечения, артралгии и артриты у значительной части больных. Эти эффекты обычно исчезали при снижении дозы или при приеме фторида с пищей (или и того и другого вместе). В настоящее время фториды не разрешены FDA для лечения остеопороза.
Острые отравления, в основном фторсодержащими крысиными ядами, проявляются желудочно-кишечными симптомами и неврологическими нарушениями, характерными для гипокальциемии, поскольку фтор способен связывать кальций. Фтор в токсических дозах может также вызывать сердечно-сосудистый коллапс или дыхательную недостаточность. Хроническое вдыхание пыли, содержащей фториды, может вызвать злокачественный флюороз, характеризующийся утолщением коркового вещества длинных костей и костным экзостозом, особенно на позвоночнике.
II. Клиническая фармакология
При нарушении минерального гомеостаза костей обычно наблюдается аномальный уровень кальция в крови и моче или и то и другое, что часто сопровождается изменением содержания фосфатов в
крови. Эти нарушения'концентрации минералов в свою очередь могут сами вызывать симптомы, требующие немедленной терапии (например, кома при злокачественной гиперкальциемии, тетания при гипокальциемии). Более часто эти симптомы указывают на лежащие в их основе нарушения гормональной регуляции (например, первичный гипер-паратиреоидизм), нарушения ответа тканей-мишеней (например, хроническая почечная недостаточность) или злоупотребление лекарственными средствами (интоксикация витамином D). В таких случаях в первую очередь необходимо лечение основного заболевания.
Основную роль в минеральном гомеостазе костной ткани играют почки и сами кости, поэтому любые воздействия, изменяющие этот гомеостаз, дают в свою очередь вторичный эффект на одну или обе из этих тканей (органов). Действие на костную ткань может приводить к развитию остеопороза (аномальное снижение костной массы при сохранении нормальной гистологии костей), остеомаляции (нарушение минерализации) или фиброзного остеита (повышение резорбции костей с фиброзным замещением образовавшихся полостей). Биохимическими маркерами вовлечения в процесс костной ткани являются изменения сывороточной концентрации скелетных изоферментов щелочной фосфатазы и остеокальцина (отражающих активность остеобластов) и содержания в моче взаимосвязанных гидроксипролина и пири-динолина (отражающих активность остеокластов). Почки вовлекаются в патологический процесс при превышении концентрации в плазме кальций-фосфатных веществ порогового уровня возникновения эктопической кальцификации (часто возникает в почечной паренхиме) или когда содержание кальций-оксалатных (или фосфатных) соединений в моче превышает концентрацию насыщения для этих веществ, что приводит к нефрокальцино-зу и нефролитиазу. Ранними слабовыраженными признаками вовлечения почек в патологический процесс являются полиурия, никтурия и гипосте-нурия. Рентгенологические свидетельства нефро-кальциноза и наличия камней появляются значительно позже. Степень развивающейся почечной недостаточности определяется снижением клиренса креатинина.
Нарушения концентрации кальция и фосфатов в крови
Гиперкальциемия
Гиперкальциемия вызывает угнетение центральной нервной системы, вплоть до развития комы, и, таким образом, потенциально опасна вследствие возможности летального исхода. Кроме использования тиазидных диуретиков, основными причинами гиперкальциемии являются паратиреоидизм и раковые заболевания с метастазами в костях или без них. Реже в основе гиперкальциемии лежит гипервита-миноз D, саркоидоз, тиреотоксикоз, молочно-щелочной синдром, надпочечниковая недостаточность и продолжительная иммобилизация больного. Эти состояния, за исключением, пожалуй, гипервитами-ноза D, редко требуют срочного снижения уровня кальция в крови. Для устранения гиперкальциеми-ческого криза используется несколько подходов.
Салурез
Гиперкальциемия, при которой уже появляется соответствующая симптоматика, требует быстрого снижения концентрации кальция в крови. Первый этап лечения этого состояния включает проведение регидратации изотоническим раствором натрия хлорида и увеличение диуреза с применением фуросемида. У большинства пациентов с тяжелой гиперкальциемией выявляется азотемия внепочечно-го происхождения, которая является следствием дегидратации и нарушает способность почек компенсировать повышение содержания кальция в крови усилением его экскреции с мочой. Таким образом, первоначальное введение изотонического раствора натрия хлорида со скоростью 500-1000 мл/ч для устранения дегидратации и восстановления диуреза само по себе может значительно снизить сывороточную концентрацию кальция. Дополнительное назначение петлевых диуретиков, таких как фуросемид, не только увеличивает диурез, но и снижает реабсорбцию кальция в восходящей части петли Генле (глава 15). Важно постоянное измерение центрального венозного давления для предупреждения развития застойной сердечной недостаточности и отека легких у больных с соответствующей предрасположенностью. Салурез позволяет снизить
уровень кальция в крови до такого значения, когда возможна постановка более точного диагноза и проведение лечения, направленного на устранение причины возникшего состояния. Если этого не происходит или требуется более длительная медикаментозная терапия гиперкальциемии, могут применяться следующие препараты (обсуждаются в порядке предпочтения).
Бисфосфонаты
Выявлена высокая эффективность для лечения гиперкальциемии при злокачественных новообразованиях инфузионного введения этиндроната в дозе 7.5 мг/кг в 250-500 мл физиологического раствора в течение нескольких часов три дня подряд. В последнее время по тем же показаниям предлагается инфузионное введение памидроната в дозе 60-90 мг в 500-750 мл изотонического раствора натрия хлорида в течение 4-24 часов. Такой метод лечения практически не вызывает токсических осложнений. Обычно лечебный эффект сохраняется в течение нескольких недель, но при необходимости лечение можно повторить через 7 дней.
Кальцитонин
У многих больных кальцитонин оказался эффективным средством вспомогательной терапии. Сам по себе кальцитонин редко нормализует уровень кальция, к нему часто развивается толерантность. Однако поскольку он не токсичен, его можно вводить часто и в высоких дозах (200 MRC-единиц или более). Максимальный эффект (снижение содержания кальция в крови) отмечается через 4-6 часов, длительность действия составляет 6-10 часов.
Галлия нитрат
Галлия нитрат разрешен FDA для лечения гиперкальциемии при злокачественных опухолях и проходит клинические испытания для лечения тяжелой формы болезни Педжета. Препарат подавляет резорбцию костей. При длительной инфузии в суточной дозе 200 мг/м2 поверхности тела в 5 % растворе глюкозы в течение 5 дней галлия нитрат снижает уровень кальция в сыворотке крови более эффективно, чем кальцитонин. Препарат оказывает нефротоксическое действие, поэтому перед его назначением больным необходимо ввести достаточ
ное количество жидкости и они должны иметь хорошую почечную фильтрацию.
Пликамицин (митрамицин)
Пликамицин достаточно токсичный препарат, поэтому он не является средством первого выбора при лечении гиперкальциемии. Однако при неэффективности других методов лечения внутривенное введение 25-50 мкг/кг пликамицина обычно существенно снижает уровень кальция в сыворотке крови в течение 24—48 часов. Этот эффект может сохраняться несколько дней, при необходимости лечение повторяют. Наиболее опасным токсическим эффектом является развитие внезапной тромбоцитопении с последующим кровотечением. Также возможно нефро- и гепатотоксическое действие. Появление гипокальциемии, тошноты и рвоты может потребовать отмены препарата. В процессе лечения необходимо постоянно контролировать количество тромбоцитов, функцию почек и печени, уровень кальция в крови.
Фосфаты
Внутривенное введение фосфатов, возможно, является самым быстрым и надёжным методом снижения уровня кальция в крови, но это опасная процедура, если она проводится неправильно. Внутривенное введение фосфатов необходимо использовать только в том случае, когда всеми другими средствами и методами терапии (этиндронат, кальцитонин, увеличение салуреза фуросемидом и пликамицин) не удалось устранить симптоматическую гиперкальциемию. Фосфаты нужно вводить медленно (50 ммоль, или 1.5 г элементарного фосфора, в течение 6-8 часов и более) и, как только симптомы гиперкальциемии исчезнут, пациента необходимо перевести на пероральный прием фосфатов (1-2 г/день элементарного фосфора в виде одной из указанных ниже солей). Осложнения после внутривенного введения фосфатов включают резкую гипокальциемию, эктопическую кальцификацию, острую почечную недостаточность и гипотензию. Если не следить внимательно за уровнем кальция и фосфатов в сыворотке крови, пероральное назначение фосфатов также может привести к возникновению эктопических очагов кальцификации и почечной недостаточности, но вероятность таких осложнений ниже и они возникают намного позже.
Для внутривенного и перорального введения фосфаты применяют в виде натриевых и калиевых солей. Чтобы обеспечить поступление 1 г элементарного фосфора требуется введение следующих доз препаратов:
Внутривенно:
Ин-Фос — 40 мл
Гипер-Фос-К — 15 мл
Внутрь:
Флит Фосфо-Сода — 6.2 мл Нейтра-Фос — 300 мл
Глюкокортикоиды
Глюкокортикоиды не играют существенной роли при экстренном лечении гиперкальциемии. Однако хроническая гиперкальциемия при саркоидозе, интоксикации витамином D и определенных видах злокачественных опухолей может исчезать после нескольких дней терапии глюкокортикоидами. Обычно используют пероральное введение 30-60 мг преднизона в сутки, хотя эквивалентные дозы других глюкокортикоидов также эффективны. Обоснования назначения глюкокортикоидов в этих случаях различны. Гиперкальциемия при саркоидозе вторична по отношению к первоначальному увеличению выработки 1,25(0 Н)2Г), возможно самой сар-коидной тканью. Глюкокортикоидная терапия, направленная на уменьшение саркоидной ткани, нормализует уровень кальция в сыворотке и продукцию 1,25(OH)2D. Лечение гипервитаминоза D глюкокортикоидами, вероятно, существенно не изменяет метаболизм витамина D, но уменьшает опосредованное витамином D всасывание кальция в кишечнике. При этом не исключается уменьшение глюкокортикоидами резорбции кости, вызываемой витамином D. На гиперкальциемию при злокачественных опухолях глюкокортикоиды, возможно, оказывают двойное действие. Злокачественные опухоли, которые лучше реагируют на глюкокортикоиды (например, множественная миелома и родственные ей лимфопролиферативные заболевания), являются чувствительными к литическому действию глюкокортикоидов. Часть эффекта может быть связана со снижением массы опухоли и ее активности. Также было установлено, что глюкокортикоиды угнетают действие фактора, активирующего остеокласты, гуморального вещества или ве
ществ, вырабатываемых множественной миеломой или родственными опухолями, которые стимулируют резорбцию костей остеокластами. Гиперкальциемия, возникающая вследствие других причин, например гиперпаратиреоидизма, не поддается лечению глюкокортикоидами.
Эти различия в реакции разных форм гиперкальциемий на введение глюкокортикоидов лежат в основе супрессивного глюкокортикоидного теста, в котором выраженность изменения (снижения) уровня кальция в крови после перорального введения 60 мг преднизона в течение 10 дней позволяет отграничить первичный гиперпаратиреоидизм от других причин гиперкальциемии, таких как саркоидоз, интоксикация витамином D, или отдельных видов злокачественных опухолей. Этот тест не всегда надежен и не должен использоваться вместо более специфичных тестов выявления первичного гиперпаратиреоидизма, таких как иммунореактивное определение концентрации ПТГ в сыворотке.
Гипокальциемия
Основные проявления гипокальциемии — нервно-мышечные: тетания, парестезии, ларингоспазм, мышечные спазмы и судорожные приступы. Главными причинами гипокальциемии у взрослых являются гипопаратиреоидизм, дефицит витамина D, почечная недостаточность и синдром мальабсорбции. Гипокальциемия новорожденных — это часто встречающееся состояние, которое обычно проходит без лечения. В настоящее время активно исследуется роль ПТГ, витамина D и кальцитонина в генезе этого синдрома новорожденных. Введение большого количества цитратной крови может вызвать гипокальциемию вследствие образования комплексов кальций-цитрат. Кальций и витамин D (или его метаболиты) — основные средства лечения гипокальциемии.
Кальций
В настоящее время существует ряд препаратов кальция для внутривенного, внутримышечного и перорального введения. Внутривенно могут вводиться кальция глюцептат (0.9 мэкв кальция/мл), кальция глюконат (0.45 мэкв кальция/мл) и кальция хлорид (0.68-1.36 мэкв кальция/мл). Наиболее предпочтительным является глюконат кальция, так как он меньше раздражает вены. Пероральные пре
параты включают кальция карбонат (40 % кальция), кальция лактат (13 % кальция), кальция фосфат (25 % кальция) и кальция цитрат (17 % кальция). Препаратом выбора часто является кальция карбонат, так как он содержит большое количество кальция, имеет низкую стоимость, продается в готовых лекарственных формах (например, Turns) и оказывает антацидное действие. При ахлоргидрии кальция карбонат необходимо принимать одновременно с пищей, что увеличивает всасываемость. Существуют комбинированные препараты, содержащие кальций и витамин D, однако фиксированное количественное соотношение компонентов затрудняет индивидуальный подбор дозы при лечении конкретного больного и конкретного заболевания. Для лечения тяжелых симптоматических гипокальциемий можно использовать медленную внутривенную инфузию 5-20 мл 10 % раствора кальция глюконата. Быстрое введение провоцирует сердечные аритмии. Менее тяжелые формы гипокальциемии лучше лечить пероральными формами, обеспечивающими поступление около 400-800 мг элементарного кальция (1-2 г кальция карбоната в день). Чтобы избежать возникновения гиперкальциемии и гиперкаль-циурии, необходимо тщательно подбирать дозы.
Витамин D
В тех случаях, когда требуется быстрое развитие эффекта, препаратом выбора является метаболит витамина D — 1,25(OH)2D3 (кальцитриол) в дозе 0.25-1 мкг в день, так как он способен поднять уровень кальция в сыворотке крови в течение 24-48 часов. Кальцитриол также увеличивает концентрацию фосфатов в сыворотке крови, хотя это действие не проявляется в начале лечения. Совместное влияние кальцитриола и других метаболитов-аналогов витамина D на уровень кальция и фосфатов делает особенно необходимым тщательный контроль за концентрацией этих минералов в сыворотке для предупреждения возникновения эктопических очагов кальцификации. Они возникают вследствие слишком высокого содержания кальций-фосфатных соединений в крови. Выбор соответствующего метаболита витамина D или его аналога для длительного лечения гипокальциемии зависит от природы заболевания, поэтому дальнейшее обсуждение лечения витамином D приводится в разделах, посвященных конкретным патологическим состояниям.
Гиперфосфатемия
Гиперфосфатемия — частое осложнение почечной недостаточности. Это состояние наблюдается также при всех типах гипопаратиреоза (идиопатический, хирургический и псевдо), при интоксикации витамином D и при редко встречающемся синдроме опухолевого кальциноза. Необходимость в экстренном лечении гиперфосфатемии возникает нечасто, однако если она возникает, то хороший результат наблюдается при проведении диализа, внутривенном введении глюкозы и инсулина. В целом, устранение гиперфосфатемии достигается ограничением использования фосфатов в пище и назначением связывающих фосфаты гелей, таких как содержащие А1(ОН)3 антациды, и достаточного количества кальция. Алюминийсодержащие антациды могут вызывать заболевания костей, поэтому их надо применять в небольших количествах и только в тех случаях, когда другие меры оказались неэффективными.
Гипофосфатемия
Многие патологические состояния сопровождаются гипофосфатемией, к ним относятся: первичный гиперпаратиреоз, дефицит витамина D, идиопатическая гиперкальциемия, резистентный к витамину D рахит, различные формы почечной потери фосфатов (например, синдром Фанкони), чрезмерное употребление содержащих А1(ОН)3 антацидов и парентеральное питание с недостаточным содержанием фосфатов. Острая гипофосфатемия может приводить к снижению внутриклеточного содержания высокоэнергетичных органических фосфатов (например, АТФ), нарушению нормального переноса кислорода от гемоглобина в ткань за счет снижения уровня 2,3-дифосфоглицерата в эритроцитах и вызывать рабдомиолиз. Однако клинически значимые острые эффекты гипофосфатемии встречаются редко, и неотложная терапия обычно не требуется. Длительно существующая гипофосфатемия проявляется слабостью проксимальных мышц и нарушением минерализации костей (остеомаляция). Поэтому необходимо избегать развития гипофосфатемии во время проведения других видов терапии и лечить ее при таких состояниях, как резистентный к витамину D рахит, основным симптомом которого она и является. Пероральные формы фосфатов приведены в разделе, посвященном гиперкальциемии.
Специфические нарушения, связанные с регуляторными гормонами минерального обмена костей
Первичный гиперпаратиреоз
Если это относительно часто встречающееся заболевание протекает с выраженной симптоматикой и значительной гиперкальциемией, его лучше лечить хирургическим путем. Были попытки использования пероральных препаратов фосфатов, но этот способ не может быть рекомендован.
Гипопаратиреоз
При отсутствии ПТГ (идиопатический или постхирургический гипопаратиреоз) или нормального ответа тканей-мишеней на ПТГ (псевдогипопаратиреоз) уровень кальция в сыворотке снижается, а уровень фосфатов возрастает. У таких больных уровень 1,25(OH)2D обычно низок, что в основном является следствием отсутствия стимулируемой ПТГ продукции 1,25(OH)2D. У больных с идиопатическим и хирургическим гипопаратиреозом нарушений в костной ткани не наблюдается, за исключением замедления обмена. Иногда при псевдогипопаратиреозе возникает фиброзный остит, свидетельствующий о том, что у таких больных ПТГ в нормальной или повышенной концентрации способен воздействовать на кости, но не на почки. Дифференциальная диагностика псевдогипопаратиреоза и идиопатического гипопаратиреоза основывается на слабом почечном ответе у больных псевдогипопаратиреозом (пониженная экскреция цАМФ или фосфатов) при нормальном или высоком уровне ПТГ.
Главной задачей лечения является восстановление нормокальциемии и нормофосфатемии. В большинстве случаев доста+очным будет назначение витамина D (25 000-100 000 ЕД 3 раза в неделю) и кальциевых добавок к диете. Более быстрое повышение уровня кальция в плазме может быть достигнуто назначением кальцитриола, хотя неясно, имеет ли этот метаболит значительные преимущества перед собственно витамином D при длительной терапии. У многих пациентов, получающих вита
мин D, эпизодически возникает гиперкальциемия. После прекращения терапии это осложнение быстрее исчезает, если лечение проводили кальцитрио-лом, а не витамином D. Данное обстоятельство существенно для больных, у которых часто возникают гиперкальциемические кризы. Мало исследована возможность использования дигидротахистерола и 25(OH)D для лечения гипопаратиреоза, хотя ожидается, что оба препарата могут быть эффективны. Не установлено, имеют ли они достаточные преимущества перед витамином D, позволяющие компенсировать их более высокую стоимость.
Алиментарный рахит
Дефицит витамина D, ранее редко встречавшийся в США, в настоящее время возникает чаще, особенно у детей и пожилых людей, придерживающихся вегетарианской диеты, а также при недостаточной инсоляции. Его можно предотвратить ежедневным приемом 400 ЕД витамина D и вылечить несколько более высокими дозами (4000 ЕД в день). Другие метаболиты применять не рекомендуется. Диета должна содержать достаточное количество кальция и фосфатов.
Хроническая почечная недостаточность
Важными проблемами, которые возникают при хронической почечной недостаточности и способствуют нарушению минерального гомеостаза костей, являются утрата способности вырабатывать 1,25(OH)2D и 24,25(OH)2D и задержка в организме фосфатов, что ведет к снижению уровня ионизированного кальция и возникновению гиперпаратиреоза. Падение выработки 1,25(OH)2D приводит к снижению всасывания кальция в кишечнике и уменьшению резорбции костей под действием ПТГ. В результате возникает гипокальциемия с последующим развитием гиперпаратиреоза. В костях наблюдается сочетание остеомаляции и фиброзного остита.
В отличие от гипокальциемии, которая часто связана с хронической почечной недостаточностью, у некоторых больных может развиваться гиперкальциемия по двум причинам (помимо передозировки препаратов кальция). Наиболее частой является тяжелая форма гиперпаратиреоза (иногда на
зываемая третичным гиперпаратиреозом). В таких случаях уровень ПТГ в крови очень высок. Активность щелочной фосфатазы в сыворотке также оказывается высокой. Часто требуется проведение паратиреоидэктомии.
Более редким состоянием, приводящим к гиперкальциемии, является развитие такой формы остеомаляции, которая характеризуется выраженным снижением активности клеток костной ткани и утратой буферной способности костной ткани в отношении кальция. При этом на фоне почечной недостаточности весь всосавшийся в кишечнике кальций накапливается в крови. Такие больные чрезвычайно чувствительны к гиперкальциемическому действию 1,25(OH)2D. У них уровень кальция в плазме обычно повышен при практически нормальной активности щелочной фосфатазы и концентрации ПТГ. Недавно выявлено, что у таких больных в костях, особенно в поверхностном слое минерализации, высокое содержание алюминия, который способен нарушать процесс нормальной минерализации костей. Хирургическое удаление паращитовидной железы не приводит к желаемым результатам. В настоящее время в качестве средства лечения данного заболевания проходит клиническое испытание дефероксамин — вещество, образующее хелатное соединение с железом, а также связывающее алюминий.
Использование препаратов витамина D
Выбор конкретного препарата витамина D при лечении хронической почечной недостаточности у больных, находящихся на диализе, зависит от типа и выраженности поражения костей и степени гиперпаратиреоза. Не существует единого мнения о необходимости применения конкретного метаболита витамина D у больных до проведения диализа. 1,25(OH)2D3 (кальцитриол) быстро устраняет гипокальциемию и, по крайней мере, частично уменьшает проявления вторичного гиперпаратиреоза и фиброзного остита. У многих больных с мышечной слабостью и болями в костях отмечается улучшение самочувствия.
Дигидротахистерол, аналог 1,25(OH)2D, также может использоваться в клинической практике. Дигидротахистерол равноэффективен с кальцитри-олом, различия наблюдаются только во времени наступления эффекта: кальцитриол повышает уровень кальция в плазме в течение 1 -2 дней, тогда как
дигидротахистеролу требуется 1-2 недели. Стоимость эквипотенциальных доз дигидротахистерола (0.2 мг дигидротахистерола и 0.5 мкг кальци-триола) составляет одну четверть стоимости кальцитриола. Недостатком дигидротахистерола является то, что его содержание в плазме измерить невозможно. У большинства пациентов ни дигидротахистерол, ни кальцитриол не устраняют остеомаляцию при почечной остеодистрофии. Эти препараты не должны использоваться у больных с гиперкальциемией, особенно при первичной остеомаляции.
Использование кальцифедиола (25[ОН]Г)з) может также иметь положительные стороны. Кальци-федиол слабее, чем кальцитриол, стимулирует всасывание кальция в кишечнике, поэтому реже вызывает гиперкальциемию. Как и дигидротахистерол, кальцифедиолу требуется несколько недель для восстановления нормокальциемии у пациентов с гипокальциемией при хронической почечной недостаточности. Для достижения уровня кальцифедиола в плазме, превышающего физиологический и требуемого для эффективного лечения, необходимо назначение высоких доз (50-100 мкг ежедневно), что обусловлено пониженной способностью почек метаболизировать кальцифедиол с образованием более активных метаболитов.
Раньше для лечения почечной остеодистрофии использовали витамин D. Однако больные почечной недостаточностью, как правило, резистентны к лечению витамином D вследствие неспособности конвертировать витамин D в активные метаболиты. Он применяется все реже, так как появились более эффективные препараты.
В настоящее время изучается способность нескольких не вызывающих гиперкальциемии аналогов кальцитриола снижать проявления вторичного гиперпаратиреоза при хронической почечной недостаточности. Их применение наиболее целесообразно при лечении больных, у которых использование кальцитриола может привести к недопустимо высокой концентрации кальция в плазме.
Независимо от используемого препарата требуется уделять большое внимание уровню кальция и фосфатов в плазме. Во время приема метаболитов витамина D необходимо обеспечить достаточное поступление кальция (с пищей и из диализата) и ограничить поступление фосфатов (с пищей, а также за счет перорального приема препаратов, связывающих фосфаты). Для определения эффективно-
ста терапии по устранению или предотвращению вторичного гиперпаратиреоза необходим постоянный контроль за уровнем ПТГ и активностью щелочной фофатазы. Чрескожная биопсия костей и количественная морфогистометрия могут быть полезны при выборе метода лечения и последующей оценке его эффективности. В отличие от быстрых изменений в крови для изменения морфологии костей требуются месяцы и годы. Мониторинг уровня метаболитов витамина D в крови позволяет определить адекватность выбора препарата, его всасывание и метаболизм.
Кишечная остеодистрофия
Ряд заболеваний желудочно-кишечного тракта и печени нарушают гомеостаз кальция и фосфатов, что обязательно приводит к заболеванию костей. У таких больных наблюдается комбинация остеопороза и остеомаляции. Фиброзный остит не возникает (в отличие от почечной остеодистрофии). Важным общим свойством заболеваний этой группы является мальабсорбция кальция и витамина D. Кроме того, заболевания печени могут снизить продукцию 25(OH)D из витамина D, хотя нет единого мнения о важности для больных этого эффекта, за исключением больных с терминальной недостаточностью печени. Мальабсорбция витамина D, возможно, не ограничивается только экзогенным витамином. Печень секретирует в желчь несколько метаболитов и конъюгатов витамина D, которые затем реабсорбируются (преимущественно в дистальном отделе тощей и подвздошной кишки). Нарушение этого процесса приводит к потере организмом эндогенных метаболитов витамина D наряду с уменьшением всасывания витамина, поступающего с пищей.
При легких формах мальабсорбции для достижения нормального уровня 25(OH)D в плазме достаточным будет вводить витамин D в дозе 25 ООО— 50 000 ЕД 3 раза в неделю. Многие больные с тяжелой формой заболевания не поддаются лечению витамином D. Опыт клинического применения других метаболитов ограничен, но как кальцитриол, так и кальцифедиол с успехом использовались в дозах, идентичных тем, которые рекомендованы для лечения остеодистрофии. Теоретически при этих заболеваниях кальцифедиол должен быть препаратом выбора, так как у больных нарушено превращение в почках 25(OH)D в 1,25(OH)2D и 24,25(OH)2D.
И кальцитриол, и кальцифедиол могут быть очень полезны в лечении заболеваний костей. Как и при других заболеваниях, лечение кишечной остеодистрофии витамином D и его метаболитами должно проводиться на фоне поступления достаточного количества кальция с пищей и мониторинга концентрации кальция и фосфатов в сыворотке.
Остеопороз
Остеопороз характеризуется патологическим уменьшением массы костей и предрасположенностью к переломам. Наиболее часто он наблюдается у женщин в менопаузе, но может возникать и у пожилых мужчин. Остеопороз может быть следствием длительного лечения глюкокортикоидами или другими препаратами, проявлением эндокринных заболеваний, таких как тиреотоксикоз или гиперпаратиреоз, составной частью синдрома мальабсорбции, результатом злоупотребления алкоголем или возникать без видимых причин (идиопатический). На рис. 41-4 показана способность некоторых веществ компенсировать снижение плотности костей при остеопорозе. Постменопаузная форма остеопороза сопровождается низким уровнем 1,25(OH)2D и сниженным всасыванием кальция в кишечнике. Эта форма остеопороза возникает в результате дефицита эстрогенов, и лучшим способом лечения является назначение эстрогенов циклами. Необходимо отметить, что максимальное снижение массы костей происходит в течение первых 5 лет после начала менопаузы, а назначение эстрогенов по прошествии этого срока менее эффективно. Кроме того, если эстрогеновая терапия прерывается, процесс потери костной массы ускоряется. Таким образом, лечение эстрогенами должно начинаться сразу после наступления менопаузы и продолжаться в течение всей жизни. При продолжительном приеме эстрогенов, кроме других побочных эффектов, возрастает риск возникновения карциномы эндометрия, поэтому рекомендация лечить эстрогенами всех женщин в постменопаузе многим представляется необоснованной. С внедрением чувствительных методов измерения содержания минералов в костях позвоночника (КТ-сканирование, измерение энергии поглощения рентгеновских лучей) появилась возможность дифференцированного подхода. Эстрогеновая терапия может проводиться только женщинам с пониженным содержанием минералов в костях или тем, у кого происходит быстрая поте
ря костной массы в течение первого года после начала менопаузы. Недавно установлено, что назначение эстрогена циклами совместно с прогестинами снижает или исключает этот добавочный риск возникновения рака. Таким образом, эстрогены необходимо вводить в течение 21 из 28 дней в минимально эффективной дозе (например, 0.625 мг конъюгированных эстрогенов или 25-50 мкг эти-нилэстрадиола) с добавлением прогестиновых препаратов на 14-21-й дни (например, 10 мг медроксипрогестерона ацетата). При проведении такой терапии менструальные кровотечения могут возобновиться, о чем необходимо заранее проинформировать пациенток. Начиная лечение, нужно помнить и о других осложнениях, возникающих вследствие эстрогеновой терапии,— гипертонии и тромбофлебитах.
Для противодействия снижению кишечной абсорбции кальция при остеопорозе, помимо увеличения содержания кальция в пище, часто применяют витамин D. Нет достаточных доказательств того, что прием витамина D в фармакологических дозах что-либо добавляет к эффектам эстрогенов и повышенному содержанию кальция в пище. Однако в последних исследованиях выявлено, что кальци-триол и его аналог laOHD3 повышают массу костей и снижают частоту возникновения переломов.
Несмотря на ранее существовавшее мнение, что фтор может быть полезным в предотвращении развития и лечении постменопаузного остеопороза, исследования, проведенные в 1990 г. (Riggs, 1990), продемонстрировали противоположный эффект. В то же время накапливаются данные, что применение фтора целесообразно для лечения данного заболевания костей (Рак, 1989). Фтор является единственным веществом, способным непосредственно стимулировать формирование костей и приводить к прогрессивному повышению их плотности, как минимум в позвоночнике (рис. 41-4).
Недавно одобрено применение кальцитонина для лечения постменопаузного остеопороза. Остается не вполне ясным, будет ли это вещество, которое быстро снижает резорбцию костей, оказывать длительное действие на массу костей. К тому же кальцитонин дает несколько побочных эффектов.
Показано, что короткие прерывистые курсы этидроната (цикл 2 недели через 12 недель) восстанавливают плотность костей и снижают частоту переломов позвоночника (Watts, 1990; Storm, 1990). Ряд новых бисфосфонатов проходят клинические испытания. Этот вид терапии пристально исследуется, в первую очередь потому, что дает относительно небольшое количество серьезных токсических эффектов.
Время (годы)
Рис. 41-4. Динамика типичных изменений минеральной плотности костей после наступления менопаузы при проведении лечения и без него. При отсутствии лечения с увеличением возраста костную массу теряют как женщины, так и мужчины. Фториды стимулируют новое формирование костей и способны повышать их минеральную плотность у восприимчивых к ним больных в течение всего периода лечения. В отличие от него кальцитонин, эстрогены и бисфосфонаты снижают резорбцию костей. Это приводит к временному повышению минеральной плотности, т. к. формирование костей в первое время не снижается. Однако со временем замедляется как процесс резорбции, так и формирование костей, и минеральная плотность достигает нового плато
Причина идиопатического остеопороза у людей неизвестна. Лечение обычно включает назначение витамина D и повышение количества кальция в пище, но об эффективности этих мер информации пока недостаточно. Необходимо исключить наличие более чувствительных к лечению форм остеопороза, например вызванных использованием глюкокортикоидов, злоупотреблением алкоголя, тиреотоксикозом, мальабсорбцией и скрытой пищевой остеомаляцией.
Рахит, резистентный к витамину D
Это связанное с Х-хромосомой рецессивное заболевание проявляется симптомами рахита и гипофосфатемии у детей. Заболевание может наблюдаться и во взрослом возрасте, представляя собой или легкую форму, или не диагностированное в детстве заболевание. Основной причиной является нарушение почечной реабсорбции фосфатов. Фосфаты необходимы для нормальной минерализации костей, при дефиците фосфатных депо развивается клиническая и патоморфологическая картина, напоминающая рахит, вызываемый дефицитом витамина D. Однако такие дети не поддаются лечению обычными дозами витамина D, применяемыми для лечения алиментарного рахита. Предполагается, что в данном случае нарушена почечная продукция 1,25(OH)2D, поскольку в сыворотке уровень 1,25(OH)2D относительно ниже, чем степень наблюдаемой гипофосфатемии. Низкий уровень фосфатов в сыворотке вместе с низким или нормальным уровнем 1,25(OH)2D является основанием для назначения таким больным пероральных фосфатов (1-3 г в день) и больших доз витамина D (25 000-100 000 ЕД в день). Недавно сообщено о хорошем эффекте применения кальцитриола. Предварительные результаты комбинированного лечения этого заболевания обнадеживают.
Витамин D-зависимый рахит
Это патологическое состояние включает два различных заболевания (тип I и II). Обе формы возникают в детстве п не чувствительны к обычным дозам витамина D. Тип I витамин D-зависи-мого рахита возникает в результате изолирован
ного дефицита продукции 1,25(OH)2D. При этом типе заболевания можно назначать витамин D (4000 ЕД в день) или кальцитриол (0.25-0.5 мкг в день). Второй тип витамин D-зависимого рахита связан с нарушением ответа тканей-мишеней на действие 1,25(OH)2D. Недавно выявлены несколько точковых мутаций в гене, отвечающем за рецептор для 1,25(OH)2D. Эти мутации приводят к нарушению функции рецептора и возникновению синдрома (Hughes, 1988). При заболевании типа II, в отличие от типа I, уровень 1,25(OH)2D в сыворотке очень высок. Считается, что кальцитриол в больших дозах эффективно нормализует содержание кальция в крови. Такие пациенты абсолютно нечувствительны к витамину D. Сообщалось об устранении резистентности к кальцитриолу при назначении 24,25(OH)2D. Эти заболевания встречаются редко.
Нефротический синдром
У больных с нефротическим синдромом может происходить потеря метаболитов витамина D смолой, вероятно, за счет утраты витамин D-связывающего белка. Уровень 25(OH)D в сыворотке у таких пациентов очень низок. У некоторых из них развивается поражение костей. Пока непонятно, какое значение для лечения таких больных может иметь назначение витамина D, так как данное осложнение нефротического синдрома обнаружено недавно и клинические исследования с использованием витамина D (или других его метаболитов) еще не проводились. При данном заболевании нет нарушения метаболизма витамина D, поэтому вряд ли будут получены какие-либо преимущества от использования вместо самого витамина D его более дорогостоящих метаболитов.
Идиопатическая гиперкальциурия
Больные, страдающие этим синдромом, характеризующимся гиперкальциурией и нефролитиазом при сохранении в плазме нормального уровня кальция и ПТГ, делятся на три группы: 1) гиперабсорбирующие — больные с повышенной абсорбцией кальция в кишечнике, что проявляется в высоком либо нормальном уровне кальция в плазме, низком либо нормальном уровне ПТГ и вторичном
повышении концентрации кальция в моче; 2) теряющие кальций в почках — больные с первичнос-ниженной реабсорбцией кальция в почках, что приводит к низкому либо нормальному уровню кальция и высокому либо нормальному уровню ПТГ в плазме; 3) теряющие фосфаты в почках — больные с первичносниженной реабсорбцией фосфатов в почках, что приводит к увеличению продукции 1,25(OH)2D, повышению кишечной абсорбции кальция, повышению уровня ионизированного кальция в сыворотке, низкому либо нормальному уровню ПТГ и вторичному увеличению содержания кальция в моче. По поводу приведенной классификации полного согласия нет, и многие клинические случаи в нее не укладываются. У многих больных наблюдается умеренная гипофосфатемия, и для снижения камнеобразования с определенным успехом использовались пероральные препараты фосфатов. Однако роль фосфатов в лечении этого заболевания не установлена. Рекомендуется применение гидрохлортиазида, до 50 мг два раза в день, хотя и другие тиазидные диуретики в эквивалентных дозах тоже эффективны. Петлевые диуретики, такие как фуросемид и этакриновая кислота, не должны использоваться, так как они повышают экскрецию кальция с мочой. Помимо гипокалиемии, гипомагниемии и гипогликемии, основным нежелательным эффектом тиазидных диуретиков является гиперкальциемия. Последнее — не более чем просто биохимический показатель, если только у больного нет гиперпаратиреоза, при котором обмен веществ костной ткани ускорен. Следовательно, необходимо выявлять пациентов с этим типом заболевания до начала применения тиазидов и следить за уровнем кальция в моче и сыворотке после начала лечения.
Альтернативу тиазидам составляет аллопуринол. Установлено, что гиперурикозурия сопровождается идиопатической гиперкальциемией и что небольшое количество кристаллов мочевой кислоты приводит к формированию оксалатных кальциевых камней, характерных для идиопатической гиперкальциемии. Аллопуринол в дозе 300 мг в день может уменьшать образование камней за счет уменьшения экскреции мочевой кислоты.
Другие нарушения минерального гомеостаза костей
Болезнь Педжета
Болезнь Педжета является локализованным заболеванием костей, характеризующимся неконтролируемой резорбцией остеокластами костей с последующим вторичным ускорением процесса их формирования. Однако эти новые кости плохо организованы. Причина болезни Педжета неясна, хотя предполагают, что в развитии данного заболевания повинны медленные вирусы. Заболевание встречается достаточно часто, хотя яркие проявления симптоматики заболевания костей отмечаются относительно редко. Биохимические показатели, такие как повышенная активность щелочной фосфатазы в сыворотке и гидроксипролина в моче, могут использоваться для диагностики заболевания. Вместе с результатами радиологических исследований и сканирования костей эти биохимические показатели оказались хорошими маркерами, позволяющими оценить эффективность проводящейся терапии. Целью лечения являются снижение болезненности костей и стабилизация или предотвращение других нарушений: прогрессивной деформации, потери слуха, сердечной недостаточности с высоким выбросом и иммобилизационной гиперкальциемии. Лечение данного заболевания включает монотерапию кальцитонином или его комбинации с бисфосфонатами. При резистентности к такой терапии эффективным может оказаться пликамицин. Кальцитонин назначается подкожно или внутримышечно в дозе 50-100МСК-единиц в день или через день. При неэффективности такой терапии рекомендуются более высокие дозы или более частое введение препарата. Для уменьшения болевых ощущений и снижения уровня щелочной фосфатазы в плазме и гидроксипролина в моче может потребоваться от нескольких недель до месяцев. Часто у больных, имевших в начале лечения явное клиническое улучшение, возникает резистентность к кальцитонину. Эта резистентность не обусловлена возникновением антител.
Натрия этидронат является единственным бисфосфонатом, разрешенным для клинического применения в США при этом заболевании. В других
странах используют и другие бисфосфонаты, например памидронат. Рекомендуется пероральное назначение натрия этидроната в дозе 5 мг/кг в день. У больных, реагирующих на лечение этидронатом натрия, может быть длительная ремиссия (от нескольких месяцев до нескольких лет). Продолжительность курса лечения не должна превышать 6 месяцев, но при необходимости через 6 месяцев его повторяют. При значительном превышении дозы этидроната (более 5 мг/кг) развивается остеомаляция и повышается частота возникновения переломов. Другие бисфосфонаты, например памидронат, в этом отношении менее опасны. У некоторых пациентов, получавших этиндронат, отмечаются боли в костях, аналогичные тем, которые имеют место при остеомаляции. Они исчезают после прекращения приема препарата.
Использование потенциально опасных для жизни цитотоксических препаратов, таких как пликамицин, при обычно доброкачественных заболеваниях типа болезни Педжета может быть рекомендовано только в том случае, когда менее токсичные препараты (кальцитонин, этидронат) оказались неэффективны, а также если у больного наблюдается тяжелая форма заболевания. Для того чтобы рекомендовать широкое применение пликамицина, недостаточно клинических данных о результатах его длительного использования. Однако короткие курсы внутривенного введения 15-25 мкг в день в течение 5-10 дней и далее 15 мкг один раз в неделю применялись с достаточной эффективностью.
Кишечная оксалурия
У больных с синдромом короткого кишечника, характеризующимся мальабсорбцией жиров, могут обнаруживаться почечные камни, состоящие из кальция и оксалатов. Характерной особенностью таких больных является нормальный или низкий уровень кальция, но повышенный уровень оксалатов в моче. Считается, что имеется две причины возникновения оксалатурии: 1) кальций, который в данный момент связан с жирами в просвете кишечника не способен связывать оксалаты и не препятствует их всасыванию; 2) кишечная флора, взаимодействуя с повышенным количеством поступающих в толстый кишечник питательных веществ, продуцирует большее количество оксалатов. Хотя увеличение потребления кальция у больных с кальций-оксалатными камнями обычно не применяет
ся, это именно то, что необходимо при кишечной оксалурии. Повышенное количество кальция в кишечнике связывает возросшее количество оксалатов и предотвращает их всасывание. Можно назначать от 1 до 2 г карбоната кальция в день разделенными дозами, при этом необходимо тщательное наблюдение за уровнем кальция и оксалатов в моче, для того чтобы убедиться, что снижение концентрации оксалата не сопровождается опасным повышением концентрации кальция.
Препараты
Витамин D и его метаболиты
Кальцифедиол (Кальдерол)
Внутрь: 20, 50 мкг в капсулах
Кальцитриол
Внутрь (Рокалтрол): 0.25,0.5 мкг в капсулах Парентерально (Кальцижекс): 1,2 мкг/мл для инъекций
Холекальциферол [D3] (витамин D3, Дельта-D) Внутрь: 400,1000 ME в таблетках
Дигидротахистерол [DHT]( DHT, Хитакерол) Внутрь: 0.125 мг в таблетках и капсулах;
0.2,0.4 мг в таблетках; 0.2 мг/мл интенсоловый раствор; 0.25 мг/мл раствор в масле
Эргокальциферол [D2] (витамин D2, Кальциферол, Дрисдол)
Внутрь: 50 000 ME в таблетках и капсулах;
8 000 ME в каплях
Парентерально: 500 000 МЕ/мл для инъекций
Кальций
Кальция ацетат (Фос-Экс, ФосЛо) 250 мг (62.5 мг кальция), 668 мг (167 мг кальция), 1000 мг (250 мг кальция) в таблетках;
500 мг (125 мг кальция) в капсулах
Кальция карбонат [40 % кальция] (генерик, Таме, Кал-Суп, Ос-Кал 500 и др.) Внутрь: большое количество форм
Кальция хлорид [27 % кальция] (генерик) Парентерально: 10 % раствор для в/в инъекций
Кальция цитрат [21 % кальция]
(генерик, Цитракал)
Внутрь: 950 мг (200 мг кальция), 2376 мг (500 мг кальция)
Кальция глюбионат [6.5 % кальция] (Нео-Каглюкон)
Внутрь: 1.8 г (115 мг кальция)/5 мл сиропа
Кальция глюцептат [8 % кальция]
(Кальция глюцептат)
Парентерально: 1.1 г/5 мл раствора для в/м и в/в инъекций
Кальция глюконат [9 % кальция] (генерик) Внутрь: 500 мг (45 мг кальция), 600 мг (58.5 мг кальция), 975 мг (87.75 мг кальция), 1 г (90 мг кальция) в таблетках Парентерально: 10 % раствор для в/в и в/м инъекций
Кальция лактат [13 % кальция] (генерик) Внутрь: 325 мг (42.25 мг кальция), 650 мг (84.5 мг кальция) в таблетках
Двухосновной кальция фосфат дигидрат [23 % кальция] (генерик)
Внутрь: 486 мг (112 мг кальция) в таблетках
Трикальция фосфат [39 % кальция] (Постуре) Внутрь: 300 мг кальция, 600 мг кальция в таблетках (в виде фосфата)
Фосфаты
Фосфат (Флит Фосфо-Сода, Нейтра-Фос) Перорально: раствор, содержащий 815 мг фосфата, 760 м г натрия на 5 мл (Флит Фосфо-Сода);
капсулы, содержащие 250 мг фосфора, 278 мг калия, 164 мг натрия (Нейтра-Фос);
капсулы, содержащие 250 мг фосфора, 556 мг калия, 0 мг натрия (Нейтра-Фос-К) Парентерально (натрия или калия фосфат): 3 мМ фосфата/мл только для в/в введения
Другие препараты
Кальцитонин человеческий (Цибакалцин) Парентерально: 0.5 мг на флакон для инъекций
Кальцитонин лососевый (Кальцимар, Миакаль-цин)
Парентерально: 100, 200 МЕ/мл для инъекций
Этидронат (Дидронел)
Перорально: 200,400 мг в таблетках
Парентерально: 300 мг/6 мл для в/в инъекций
Галлия нитрат (Ганит)
Парентерально: 500 мг/20 мл во флаконах
Памидронат (Аредиа)
Парентерально: 30 мг/флакон
Пликамицин (Митрамицин)(Митрацин) Парентерально: 2.5 мг на флакон, порошок для разведения для инъекций
Натрий фтористый (генерик)
Перорально: 0.55 мг (0.25 мг F), 1.1 мг (0.5 мг F), 2.2 мг (1.0 мг F), в таблетках
Избранная литература
Bilezikian J. Р. Management of acute hypercalcemia. N. Engl. J. Med. 1992; 326:1196.
Brown A., Dusso A., Slatopolsky E. Vitamin D. In: The Kidney: Physiology and Pathophysiology, 2nd ed. Seldin D. W., Giebisch G. (eds). Raven Press, 1992.
Cauley J. A. et al. Effects of thiazide diuretic therapy on bone mass, fractures, and falls. Ann. Intern. Med. 1993; 118: 666.
Felson D. T. et al. The effect of postmenopausal estrogen therapy on bone density in elderly women. N. Engl. J. Med. 1993; 329:1141.
Kleerkoper M., Balena R. Fluorides and osteoporosis. Annu. Rev. Nutr. 1991; 11:309.
Pak C. Y. C. et al. Safe and effective treatment of osteoporosis with intermittent slow release sodium fluoride: Augmentation of vertebral bone mass and inhibition of fracture. J. Clin. Endocrinol. Metab. 1989; 68: 150.
Popopoulos S. E. et al. The use of bisphosphonates in the treatment of osteoporosis. Bone 1992; 13 (Suppl.): S41.
Riggs B. L., Melton L. J. Ill The prevention and treatment of osteoporosis. N. Engl. J. Med. 1992; 327: 620.
Suda T., Takahashi N., Abe E. Role of vitamin D in bone resorption. J. Cell. Biochem. 1992; 49: 53.
Раздел VI11.
Химиотерапевтические средства________________
Принципы действия противомикробных средств
Эрнест Явец
42
Идеальное противомикробное средство должно обладать избирательной токсичностью. Этот термин подразумевает наличие у препарата повреждающих свойств в отношении возбудителя заболевания и отсутствие таковых в отношении организма человека. Во многих случаях такая избирательность токсического действия оказывается скорее относительной, чем абсолютной. Это означает, что препарат губительно действует на возбудителя инфекционного процесса в таких концентрациях, которые являются переносимыми для организма-хозяина.
Избирательность токсического действия обычно связана с угнетением биохимических процессов, которые происходят в микроорганизме и являются существенными для него, но не для организма хозяина. Механизм действия многих антимикробных препаратов не вполне выяснен. Тем не менее с целью обсуждения можно выделить несколько главных направлений механизмов противомикробного действия.
1. Угнетение синтеза клеточной стенки.
2. Нарушение проницаемости клеточной мембраны или активного транспорта через клеточную мембрану.
3. Угнетение синтеза белков (угнетение трансляции и транскрипции генетического материала).
4. Угнетение синтеза нуклеиновых кислот.
Антимикробные препараты часто описываются как бактериостатические или бактерицидные. Термин “бактериостатический” применим к препарату, который временно тормозит рост микроорганизмов. Терапевтическая эффективность этих веществ часто зависит от механизмов собственной защиты организма-хозяина. Кроме того, эффект может быть обратимым, когда при отмене препарата восстанавливается рост микроорганизмов и возобновляется инфекция или заболевание. Типичными бактериостатическими препаратами являются тетрациклины и сульфаниламиды.
Термин “бактерицидные” применим к препаратам, которые вызывают гибель микроорганизмов. Типичными бактерицидными средствами являются P-лактамы (пенициллины, цефалоспорины) и аминогликозиды.
Если механизмы собственной защиты организма-хозяина оказываются неспособными справиться с инфекцией (например, при инфекционном эндокардите), необходимо применение бактерицидных препаратов. В этом случае лечение бактериостатическими веществами приведет к возобновлению заболевания сразу же после их отмены. Если организм хозяина имеет адекватные защитные механизмы (иммунные, фагоцитарные и пр.), то бактериостатический эффект может быть достаточным для излечения инфекционного заболевания.
Термины “бактериостатический” и “бактерицидный” являются относительными. Иногда продолжительное лечение бактериостатическими препаратами может приводить к гибели некоторых микробных популяций (например, применение хлорамфеникола при менингококковой инфекции), в то время как бактерицидные препараты оказываются неспособными сделать это (например, пенициллин G при энтерококковой инфекции) как in vitro, так и in vivo.
Антимикробное действие посредством угнетения синтеза клеточной стенки (бацитрацин, цефалоспорины, циклосерин, пенициллины, ванкомицин)
В противоположность животным клеткам бактерия обладает жестким внешним слоем — клеточной стенкой, которая полностью окружает цитоплазматическую клеточную мембрану. Клеточная стенка придает микроорганизмам форму и является своеобразным “корсетом” бактериальной клетки, которая обладает необычайно высоким внутренним осмотическим давлением. У грамотрицательных бактерий наружная часть клеточной стенки является липидным бислоем, который называется наружной мембраной (рис. 42-1). У грамположитель-ных бактерий внутреннее давление в 3-5 раз выше, чем у грамотрицательных. Повреждение клеточной стенки (например, лизоцимом) или угнетение ее образования может привести к лизису клетки. В условиях гиперосмолярности внешней среды (например, 20 % сахароза) нарушение синтеза клеточной стенки приводит к формированию сферических бактериальных протопластов из грамположи-тельных организмов или сферопластов из грамотрицательных бактерий, которые окружены хрупкой цитоплазматической мембраной. Если такие неустойчивые клетки поместить в среду с обычной осмолярностью, то они, быстро поглощая жидкость, могут разрываться.
Клеточная стенка содержит поперечно сшитый биополимер определенной химической структуры — пептидогликан (муреин, мукопептид), который состоит из полисахаридов и полипептидов. В состав полисахаридов в данном случае входят такие аминосахара, как N-ацетилглюкозамин и ацетилмурамо-
вая кислота. Последнее вещество имеется только у бактерий. С аминосахарами связаны короткие пептидные цепи. Окончательную жесткость клеточной стенке придают поперечные пептидные цепочки (пептидный мостик из пяти остатков глицина, например), которые образуются в реакции транспептиди-рования, катализируемой несколькими ферментами (рис. 42-2). Пептидогликановый слой клеточной стенки у грамположительных бактерий значительно тоньше, чем у грамотрицательных.
Торможение реакции транспептидирования (0-лактамы)
Все пенициллины и цефалоспорины (0-лактам-ные антибиотики) являются селективными ингибиторами синтеза клеточной стенки. Поскольку такой вид активности является единственным для этих препаратов, механизм их действия представляется более понятным, чем таковой других антибиотиков. Первый этап действия препарата заключается в его связывании с клеточными рецепторами. Такими рецепторами являются пенициллинсвязывающие протеины (ПСП) количеством от 3 до 6 (мол. м. 40 000-120 000) у различных бактерий. Отдельные рецепторы (ПСП) могут иметь неодинаковый аффинитет к препарату, и каждый из них может опосредовать различное действие. Так, присоединение пенициллина к одному ПСП может вызывать главным образом аномальное увеличение клетки, в то время как присоединение к другому может приводить к появлению дефекта на поверхности клеточной стенки без последующего лизиса клетки.
ПСП контролируются хромосомами, таким образом мутации могут изменять их количество и аффинитет к отдельным 0-лактамным препаратам. После связывания 0-лактамного препарата с его рецепторами ингибируется реакция транспептидирования и останавливается синтез пептидогликана. Следующий этап, вероятно, включает устранение или инактиваций ингибитора аутолитическими энзимами (гидролазами) в клеточной стенке. Это сопровождается активацией литического энзима у некоторых микроорганизмов и может приводить к лизису клетки в условиях изотоничности окружающей среды. При гипертоничности окружающей среды (например, в 20 % растворе сахарозы) микробы могут трансформироваться в прото- или сфе-ропласты, покрытые только хрупкой клеточной
Рис. 42-1. Упрощенная схема строения оболочки клетки грамотрицательной бактерии. Многие компоненты для простоты восприятия не указаны. Наружная мембрана, являющаяся липидным бислоем, имеется у грамотрицательных, но не у грамположительных бактерий. Она пронизана поринами — специальными белками, которые обеспечивают проникновение гидрофильных веществ к цитоплазматической мембране. Пептидогликановый слой присущ только бактериям и является более тонким у грамположительных организмов, чем у грамотрицательных. Наружная мембрана вместе с пептидогликановым слоем составляют клеточную стенку. Пенициллиисвязывающие протеины (ПСП) являются трансмембранными или поверхностными белками в цитоплазматической мембране и в норме участвуют в синтетических процессах построения пептидогликанового слоя. 0-Лактамазы, если таковые имеются, локализованы в периплазматическом пространстве или на внешней поверхности цитоплазматической мембраны, где они могут разрушать 0-лактамные антибиотики, проникшие через наружную мембрану
мембраной. В таких клетках некоторое время может продолжаться синтез белков и нуклеиновых кислот.
Угнетение активности ферментов реакции транспептидирования пенициллинами и цефалоспоринами может быть обусловлено подобием химического строения этих препаратов со структурой ацил-В-аланил-Б-аланина. Реакция транспептидирования включает отщепление В-аланина от пентапептида (рис. 42-2). Достаточно низкая токсичность 0-лактамных антибиотиков для клеток млекопитающих может объясняться отсутствием в животных клетках клеточной стенки бактериального типа, содержащей пептидогликаны. Различия в
чувствительности грамположительных и грамотрицательных бактерий к антибиотикам группы пенициллинов и цефалоспоринов, вероятно, обусловлены различиями структуры их клеточных стенок в содержании пептидогликанов, наличии рецепторов, пор и липидов, строении поперечных сшивок, активности аутолитических энзимов. Все это определяет проникновение, связывание и активность препаратов.
Восприимчивость бактерии к 0-лактамным антибиотикам зависит от разных структурных и функциональных характеристик. Чтобы достичь рецепторов, препарат должен проникнуть через внешние слои клетки. У грамотрицательных бактерий это-
D-Ala
Рис. 42-2. Транспептидазная реакция у Staphylococcus aureus, которая угнетается 0-лактамными антибиотиками. Клеточная стенка грамположительных бактерий построена из длинной пептидогликановой полимерной цепочки, состоящей из чередующихся остатков аминогексоз N-ацетилглюкозамина (G) и N-ацетилмурамовой кислоты (М) с пентапептидными боковыми цепочками, которые соединены (у 5. aureus) пентаглициновыми мостиками. У разных видов состав боковых цепочек различен. Схема иллюстрирует небольшие сегменты двух таких полимерных цепочек и их аминокислотные боковые цепи. Эти линейные полимеры должны быть соединены поперечными сшивками с помощью реакции транспептиди-рования боковых цепей для прочности, обеспечивающей жизнеспособность клетки, в точках, обозначенных заштрихованным прямоугольником (d-1-GIu — D-изоглута-мин)
|Транспептидаза|
D-Ala
+ D-Ala
му мешает внешняя фосфолипидная мембрана. Если препараты способны пройти через молекулы пор (порины) этого внешнего барьера, то гидрофильные молекулы (например, ампициллин, амоксициллин) могут проходить легче, чем пенициллин G. У грамположительных бактерий внешней фосфолипидной мембраны нет, следовательно, отсутствует и ее барьерная функция.
Амдиноциллин является производным амиди-нопенициллановой кислоты, который связывается только с ПСП 2 и проявляет более высокую активность в отношении грамотрицательных бактерий, чем грамположительных. Амдиноциллин может действовать как синергист с другими 0-лактамны-ми препаратами, которые связываются с иными типами ПСП.
Некоторые бактерии могут подавляться 0-лак-тамными препаратами, так как угнетается образование пептидогликана, но в то же время не подвергаться лизису. Вероятно, эта толерантность обусловлена отсутствием активации аутолитических энзимов (гидролаз) в клеточной стенке. В свою очередь последнее обстоятельство может быть связано с наличием или отсутствием прекурсоров или со свойствами ингибитора энзимов.
Наиболее важным с точки зрения клинического использования механизмом возникновения резистентности к р-лактамным препаратам является выработка бактериями р-лактамаз (рис. 42-1). Эти ферменты разрушают р-лактамное кольцо и устраняют антибактериальный эффект препарата.
Имеется много типов р-лактамаз, большинство из которых находятся под генетическим контролем плазмид. Подобные несущие гены плазмиды широко распространены среди стафилококков и грамотрицательных бактерий кишечной группы. Некоторые р-лактамазы могут прочно связываться такими соединениями, как клавулановая кислота или сульбактам, что предотвращает их взаимодействие с гидролизующимися пенициллинами. Комбинация амоксициллина или тикарциллина с клавулановой кислотой используется для лечения инфекций, вызываемых возбудителями рода Haemophilus. Некоторые р-лактамные антибиотики нерезистентны к Р-лактамазам, поскольку их р-лактамное кольцо стерически защищено метокси- или другими группами (например, метициллин, цефокситин). Такие антибиотики могут действовать на продуцирующие Р-лактамазу бактерии, тормозят в них реакцию транспептидирования и вызывают лизис бактерий.
Природа резистентности некоторых бактерий (например, метициллинрезистентных стафилококков) к указанному типу антибиотиков не выяснена. Это явление может быть связано с вариациями аффинности рецепторов к препарату или с отсутствием соответствующего типа ПСП.
Угнетение синтеза предшественников пептидогликана
Некоторые препараты, включая бацитрацин, ванкомицин и ристоцетин, тормозят ранние этапы биосинтеза пептидогликана (рис. 42-3). Так как ранние стадии протекают внутри цитоплазматической мембраны, для проявления действия этих веществ необходимо проникновение через мембрану. Для этих препаратов угнетение синтеза пептидогликана не является единственным механизмом антибактериального действия.
Циклосерин, аналог D-аланина, также влияет на синтез пептидогликана. Этот препарат блокирует действие рацемазы аланина — фермента, обеспечивающего включение D-аланина в пентапептид ами-ногликана. Фосфонопептиды тоже тормозят активность ферментов, необходимых на ранних этапах синтеза пептидогликанов.
Антимикробное действие посредством нарушения функции клеточной мембраны (амфотерицин В, азолы, полиены, полимиксины)
Цитоплазма всех живых клеток окружена цитоплазматической мембраной, которая является барьером избирательной проницаемости, осуществляет функцию активного транспорта и таким образом контролирует состав внутренней среды клетки. При нарушении функции цитоплазматической мембраны макромолекулы и ионы покидают клетку, что ведет к ее повреждению или гибели. Цитоплазматическая мембрана некоторых бактерий и грибов легче повреждается определенными химическими соединениями, чем мембраны животных клеток. Поэтому становится возможным избирательное химиотерапевтическое воздействие.
Примерами препаратов с таким механизмом являются полимиксины, действующие на грамотри-
А УТФ
Б УДФ-МигИАс-пентапептид
/----- GlcNAc-1-Р
v
УДФ-GlcNAc
z----- Фосфоенолпируват
ФОСФОНОМИЦИН
УДФ-&сНАс-пируватенольный эфир
/----- L-Ala
/-----p-GIn
/----- L-Lys
,----- p-Ala-o-Ala
ШЖ ЦИКЛОСЕРИН
УДФ-МигИАс-пентапептид
> BP-P----->
SSfetS БАЦИТРАЦИН
BP-P-P-MurNAc-GIcNAc
Пентапептид Пентаглицин
,--- Пептидогликан
(растущий конец полимера
— ВР-Р-Р-*____> в клеточной стенке)
Ж ' Ж? ВАНКОМИЦИН
v
Пептидогликан-MurNAc-GlcNAc
Пентапептид
I
Пентаглицин
ПЕНИЦИЛЛИН
Пептидогликан-MurNAc-GlcNAc
I Пентапептид
I Пентаглицин
- поперечная сшивка
Рис. 42-3. Биосинтез пептидогликана клеточной стенки с указанием точек приложения действия пяти антибиотиков (показаны затемненными прямоугольниками). ВР — бактопренол; MurNAc — N-ацетилмурамовая кислота; GlcNAc — N-ацетилглюкозамин). А. Синтез УДФ-ацетилмурамоилпентапептида. Б. Синтез пептидогликана из УДФ-ацетил-мурамоилпентапептида, УДФ-Ы-ацетилглюкозамина и остатков глицина
цательные бактерии (полимиксины избирательно влияют на мембраны, богатые фосфатидилэтанол-амином, и действуют как катионные детергенты) и полиеновые антибиотики, действующие на грибы. При этом полимиксины неактивны в отношении грибов, а полиены не действуют на бактерии. Это объясняется наличием эргостерола в клеточной мембране грибов и отсутствием его в бактериальной клеточной мембране. Для проявления действия полиенов необходим эргостерол в клеточной мембране грибов. Бактериальные клеточные мембраны
не содержат этого стерола и преимущественно по этой причине резистентны к действию полиенов, что является хорошим примером клеточной индивидуальности и избирательной токсичности. Резистентные к полиенам грибы характеризуются низким содержанием эргостерола в мембране или модификациями в его структуре, что не благоприятствует проявлению действия препарата. Противогрибковые азолы (глава 48) способствуют разрушению клеточной мембраны грибов, ингибируя биосинтез мембранных липидов, особенно эргостерола.
Антимикробное действие посредством угнетения синтеза белков (аминогликозиды, тетрациклины, макролиды [эритромицины], хлорамфеникол, линкомицины)
Установлено, что аминогликозиды, тетрациклины, хлорамфеникол, макролиды и линкомицины могут избирательно тормозить синтез белков, действуя на бактериальные рибосомы (рис. 42-4).
Бактерии имеют 70Б-рибосомы, в то время как млекопитающие — SOS-рибосомы. Субъединицы каждого типа рибосом, их химический состав и функциональная специфичность значительно различаются, что позволяет объяснить, почему антимикробные препараты могут тормозить синтез белков на бактериальных рибосомах, не влияя существенно на рибосомы млекопитающих.
В норме при синтезе белков в микробной клетке. имеет место одновременное считывание информации иРНК несколькими рибосомами, которые располагаются вдоль иРНК. Эти комплексы называют полисомами.
Аминогликозиды
Механизм действия стрептомицина изучен гораздо детальнее, чем таковой у других аминогликозидов (канамицин, неомицин, гентамицин, тобрамицин, нетилмицин, сизомицин, амикацин и т. д.), но, вероятно, эти препараты действуют примерно одинаково. Первый этап заключается в присоединении аминогликозида к специфическому рецепторному протеину (Р12 в случае стрептомицина) на ЗОБ-субъединице 708-рибосомы бактерии. Далее (второй этап) аминогликозид блокирует нормальную активность инициаторного комплекса образования белка (иРНК + формил-метионил-тРНК). Во время третьего этапа происходит нарушение считывания информации иРНК на распознающей области рибосомы, что ведет к включению ошибочных аминокислот в пептид и к образованию нефункционального белка. На четвертом этапе присоединение аминогликозида приводит к разрушению полисом и их разделению на моносомы, которые не способны осуществлять синтез белков. Указанные
Суперспираль ДНК
| ДНК-гираза | , | Хинолоны
Деспирализованная ДНК
РНК-полимераза
Рифампин
иРНК
I ДНК-
1 [полимераза ДНК
30S -----
субъединица рибосомы 1 г
30S инициаторный комплекс
50S -----J
субъединица 1 1 1 Аминогликозиды
рибосомы ▼
70S инициаторный комплекс
Пептидил-трансфераза
Хлорамфеникол
Образование пептидной цепи
Эритромицин Клиндамицин
Удлинение пептида
Рис. 42-4. Точки приложения действия препаратов, тормозящих синтез микробных нуклеиновых кислот и пептидов
события имеют место более или менее одновременно, а конечный эффект является необратимым и заключается в гибели клетки.
Хромосомная резистентность микробов к аминогликозидам принципиально может быть связана с исчезновением специфического рецепторного белка на ЗОБ-субъединице рибосомы. Плазмидзави-симая резистентность к аминогликозидам объясняется в основном наработкой микроорганизмом аденилирующих, фосфорилирующих или ацетилирующих ферментов, которые разрушают препараты. Третий тип резистентности связан с нарушением проникновения препарата, изменением наружной мембраны и снижением активного транспорта аминогликозида в клетку, что делает невозможным взаимодействие с рибосомами. По крайней мере в некоторых случаях такой эффект также опосредуется плазмидами. Активный транспорт аминогликозидов в клетку требует энергетического обеспечения и является кислородзависимым. Поэтому
строгие анаэробы относительно нечувствительны к аминогликозидам.
Тетрациклины
Тетрациклины связываются с 308-субъедини-цей микробных рибосом (рис. 42-5). Они ингибируют синтез белков, нарушая связывание амино-ацил-тРНК с рибосомально-матричным комплексом. Таким образом, они препятствуют включению новых аминокислот в строящуюся пептидную цепь. Тетрациклины оказывают обычно бактериостатическое действие, обратимое при отмене препарата.
Резистентность к тетрациклинам возникает в результате изменений в проницаемости оболочки микробной клетки. В чувствительных клетках препарат концентрируется, захватываясь из внешней среды с помощью требующего энергообеспечения активного транспорта, и не очень легко покидает клетку. В резистентных клетках препарат не подвергается активному транспорту внутрь клетки или достаточно быстро выводится, что делает невозможным поддержание ингибирующих концентраций. Эти процессы часто являются плазмидконтро-лируемыми. В клетках млекопитающих активного накопления тетрациклинов не отмечается.
Хлорамфеникол
Хлорамфеникол связывается с 505-субъедини-цей рибосомы (рис. 42-6). Он влияет на включение новых аминокислот в растущую пептидную цепь, в основном за счет угнетения пептидилтрансферазы. Хлорамфеникол является в первую очередь бактериостатическим препаратом. Его действие обратимо: при отмене препарата рост микроорганизмов возобновляется.
Микроорганизмы, резистентные к хлорамфениколу, вырабатывают фермент хлорамфеникол-аце-тилтрансферазу, который инактивирует препарат. Синтез этого фермента обычно контролируется плазмидами.
Макролиды (эритромицины)
Эти препараты связываются с 505-субъединицей рибосомы и могут конкурировать с линкоми-цинами за места связывания (23S рРНК). Макролиды могут влиять на образование инициаторных комплексов синтеза пептидной цепи или на реакцию аминоацилтранслокации (рис. 42-4).
Некоторые резистентные к макролидным антибиотикам бактерии утрачивают соответствующую макролидам конформацию рибосомальных рецепторов в результате метилирования рецепторного сайта. Такое явление может контролироваться плазмидами или хромосомами.
Рис. 42-5. Схематическое изображение мишени действия тетрациклиновых антибиотиков. Связывание тетрациклинов с 308-субъединицей рибосомы препятствует присоединению аминоацил-тРНК к аминоацильному центру SOS-рибосомы, что нарушает синтез белков (ак — аминокислота)
Рис. 42-6. Схематическое изображение мишени действия хлорамфеникола. Связывание с 508-субъединицей рибосомы препятствует действию транспептидазы и нарушает процесс включения новой аминокислоты в строящуюся пептидную цепь (ПТ — пептидилтрансфераза; ак — аминокислота)
Линкомицины (клиндамицин)
Линкомицины связываются с SOS-субъединицей микробной рибосомы и напоминают макролиды по месту связывания, антибактериальной активности и механизму действия (рис. 42-4). Взаимовлияние между этими препаратами объясняется сродством к одному и тому же рецептору.
Хромосомные мутанты резистентны к лйнкоми-цинам благодаря утрате соответствующего места связывания на SOS-субъединице.
Антимикробное действие посредством угнетения синтеза нуклеиновых кислот (хинолоны, пириметамин, рифампин, сульфаниламиды, триметоприм)
Препараты типа актиномицинов являются эффективными ингибиторами синтеза ДНК. Фактически они образуют комплекс с ДНК, связываясь с дезоксигуанозиновыми остатками. Комплекс ДНК-актиномицин ингибирует ДНК-зависимую РНК-полимеразу и нарушает образование мРНК. Актиномицин также ингибирует репликацию ДНК вирусов. Митомицины приводят к прочному поперечному связыванию комплементарных цепей ДНК и соответственно блокируют репликацию ДНК. Как актиномицины, так и митомицин угнетают бактериальные и животные клетки, но не являются достаточно селективными для использования в антибактериальной химиотерапии.
Рифампин тормозит рост бактерий, прочно связываясь с ДНК-зависимой РНК-полимеразой (рис. 42-4). Таким образом, он тормозит синтез бактериальной РНК. Резистентность к рифампину развивается в результате частых хромосомных мутаций, которые приводят к изменениям РНК-поли-меразы.
Все хинолоны и фторхинолоны являются мощными ингибиторами синтеза нуклеиновых кислот. Они блокируют действие ДНК-гиразы (топоизомеразы II типа ) — фермента, осуществляющего закручивание и раскручивание суперспирали ДНК.
Для многих микроорганизмов существенным метаболитом является р-аминобензойная кислота
(ПАБК). Она используется в качестве предшественника в синтезе фолиевой кислоты, которая участвует в образовании нуклеиновых кислот. Специфический вид действия ПАБК, вероятно, включает АТФ-зависимую конденсацию птерина и ПАБК с образованием дигидроптероевой (дигидро-фолиевой) кислоты, которая в дальнейшем превращается в фолиевую кислоту. Сульфаниламиды являются структурными аналогами ПАБК и ингибируют дигидроптератсинтетазу.
Сульфаниламиды встраиваются в указанную реакцию вместо ПАБК в чувствительных к ним бактериях и конкурируют за активный центр фермента. В результате этого образуются нефункциональные аналоги фолиевой кислоты, что предотвращает дальнейший рост бактериальной клетки. Тормозящее действие сульфаниламидов на рост бактерий может устраняться избытком ПАБК в окружающей среде (конкурентное торможение). Животные клетки не могут синтезировать фолиевую кислоту и зависят от внешних источников этого вещества, поэтому они резистентны к действию сульфаниламидов. Некоторые бактерии, как и животные клетки, не угнетаются сульфаниламидами.
Бактерии туберкулеза существенно не угнетаются сульфаниламидами, однако их рост тормозится ПАСК (р-аминосалициловой кислотой). С другой стороны, большинство сульфаниламидчувстви-тельных бактерий резистентны к ПАСК. Это свидетельствует о том, что рецепторный сайт ПАБК различен у разных типов микроорганизмов.
Триметоприм ингибирует дигидрофолатредук-тазу бактерий в 50 000 раз эффективнее, чем соответствующий фермент клеток млекопитающих. Этот фермент восстанавливает дигидрофолиевую кислоту в тетрагидрофолиевую, что является промежуточным этапом синтеза пуринов и соответственно — ДНК. Сульфаниламиды и триметоприм последовательно блокируют этот процесс, значительно потенцируя действие друг друга (синергизм). Такие комбинации (5 частей сульфаниламида + 1 часть триметоприма) используют для лечения пневмонии, вызываемой Pneumocystis carinir, энтерита, вызываемого Shigella', системного сальмонеллеза, а также для лечения многих других инфекций.
Пириметамин ингибирует протозойную дигид-рофолатредуктазу, но в то же время он в некоторой степени действует и на соответствующий фермент клеток млекопитающих. Поэтому он более токси
чен, чем триметоприм. Пириметамин в сочетании с сульфаниламидами является в настоящее время средством выбора в лечении токсоплазмоза и ряда других протозойных инфекций.
Для химиопрофилактики и химиотерапии вирусных инфекций используются многие другие химические соединения, влияющие на синтез вирусных нуклеиновых кислот. Они подробно описаны в главе 49.
Резистентность
к антимикробным препаратам
Как уже упоминалось, существует множество механизмов возникновения резистентности микроорганизмов к лекарственным препаратам. Рассмотрим основные из них.
1. Микроорганизмы вырабатывают ферменты, которые разрушают активное вещество. Примеры. Резистентные к пенициллину G стафилококки вырабатывают р-лактамазу, разрушающую этот препарат. Другие р-лактамазы синтезируются грамот-рицательными микроорганизмами. Устойчивые к аминогликозидам грамотрицательные бактерии (что обычно опосредовано плазмидами) вырабатывают аденилирующие, фосфорилирующие или ацетилирующие ферменты, которые инактивируют лекарства. Грамотрицательные бактерии могут быть резистентными к хлорамфениколу, если они продуцируют хлорамфеникол-ацетилтрансферазу.
2. Микроорганизмы изменяют свою проницаемость для антимикробного препарата. Примеры. Тетрациклины могут накапливаться только в чувствительных, но не в резистентных бактериях. Резистентность к полимиксинам, вероятно, связана с нарушением их проникновения в микробную клетку. Стрептококки имеют естественный барьер, не пропускающий аминогликозиды. Это явление можно частично преодолеть одновременным введением препарата, действующего на клеточную стенку, например пенициллина. Резистентность к амикацину и некоторым другим аминогликозидам может зависеть от утраты способности препарата к проникновению, вызванной изменениями наружной мембраны бактерий, что нарушает активный транспорт внутрь клетки.
3. Микроорганизмы вырабатывают измененную структурную мишень для препарата (ссылка [2] в списке литературы). Примеры. Хромосомная рези
стентность к аминогликозидам связана с утратой (или повреждением) специфического белка в составе 30S-субъединицы бактериальной рибосомы, который служит рецептором для антибиотика в чувствительном микроорганизме. Эритромицинрези-стентные организмы имеют измененный рецепторный сайт на 505-субъединице бактериальной рибосомы, что связано с метилированием 235-ри-босомальной РНК. Устойчивость к некоторым пенициллинам и цефалоспоринам может определяться утратой или изменением ПСП.
4. У микроорганизмов формируются измененные метаболические пути в обход тех реакций, которые угнетаются препаратами. Пример. Некоторые резистентные к сульфаниламидам бактерии не требуют поступления ПАБК извне, но подобно клеткам млекопитающих могут утилизировать готовую фолиевую кислоту.
5. Микроорганизмы вырабатывают измененный фермент, который может должным образом осуществлять метаболическую функцию, но в гораздо меньшей степени повреждается препаратом, чем фермент чувствительного микроорганизма. Пример. У некоторых восприимчивых к сульфаниламидам бактерий дигидроптератсинтетаза обладает более высоким аффинитетом к сульфаниламиду, чем к ПАБК. У резистентных к сульфаниламидам мутантов имеет место противоположное явление.
Происхождение резистентности к препаратам
Лекарственная резистентность может быть как генетического, так и негенетического происхождения.
А. Резистентность негенетического происхождения. Для проявления антибактериального действия большинства препаратов, как правило, требуется активная репликация бактерий. Соответственно, метаболически неактивные микроорганизмы (неразмножающиеся) могут быть резистентны к антибиотикам. Тем не менее во время активного размножения те же бактерии полностью чувствительны к антибактериальной терапии. Пример. Микобактерии туберкулеза часто выживают в тканях в течение многих лет после инфицирования, хотя подавляются защитными силами организма-хозяина и не размножаются. Такие персистирующие микроорганизмы резистентны к лечению и не могут уничтожаться препаратами. Однако, если они
начинают размножаться (например, в результате утраты клеточного иммунитета больного), то оказываются чувствительными к тем же самым препаратам.
Через несколько поколений микроорганизмы могут утрачивать специфические структуры-мишени для воздействия препаратов и становиться резистентными. Пример. Пенициллинчувствительные организмы во время лечения пенициллинами могут трансформироваться в L-форму (протопласты). Утрачивая клеточную стенку, они становятся резистентными к препаратам, нарушающим ее синтез (пенициллинам, цефалоспоринам) и могут оставаться такими на протяжении нескольких поколений, превращаясь в “персистирующие”. Когда происходит возвращение бактерий к их родительским формам с восстановлением продукции клеточной стенки, они становятся .полностью восприимчивыми к пенициллину.
Б. Резистентность генетического происхождения. Громадное число резистентных к антибактериальным препаратам микробов возникло в результате генетических изменений и последующей селекции. Генетические изменения могут быть хромосомными или внехромосомными.
1. Хромосомная резистентность. Она развивается как результат спонтанных мутаций в локусе бактериальной хромосомы, контролирующем чувствительность к данному антибиотику. Присутствие препарата является избирательным механизмом подавления восприимчивости и способствует росту резистентных к нему мутантов. Спонтанные мутации встречаются с частотой от 10~12до 10~7 и поэтому редко являются причиной возникновения клинической лекарственной резистентности у отдельно взятого пациента. Тем не менее у многих бактерий хромосомные мутанты, резистентные к рифампину, встречаются с гораздо более высокой частотой (IO-7—10-5). Вследствие этого монотерапия бактериальных инфекций рифампином оказывается обычно безуспешной.
Хромосомные мутанты могут становиться резистентными и в связи с изменением структуры рецептора к препарату. Примеры. Белок Р12 30S-субъединицы бактериальной рибосомы служит рецептором для присоединения стрептомицина. Мутация гена, контролирующего белок Р12, приводит к резистентности к стрептомицину. Структурные гены, кодирующие целый ряд рецепторов для антибиотиков, в том числе для эритромицина, тетра
циклина, линкомицина, аминогликозидов и других, находятся в весьма ограниченной области бактериальной хромосомы. В результате, мутация у некоторых видов бактерий может, например, приводить к утрате пенициллиновых рецепторов с образованием устойчивых к пенициллинам мутантов. Мутационное изменение структуры Д НК-гиразы обеспечивает резистентность к хинолонам.
2. Внехромосомная резистентность. Бактерии также содержат внехромосомные генетические элементы, называемые плазмидами. Плазмиды — это кольцевые молекулы ДНК, составляющие по массе 1-3 % от бактериальной хромосомы. Они могут свободно существовать в цитоплазме или быть интегрированы в хромосому бактерии. Некоторые из них имеют свои собственные гены для репликации и переноса. Другие же используют гены, находящиеся в других плазмидах.
R-факторы представляют собой класс плазмид, которые несут гены резистентности в отношении одного или более антимикробных препаратов и тяжелых металлов. Плазмидныегены антимикробной резистентности часто контролируют образование ферментов, разрушающих антимикробные препараты. Примеры. Плазмиды, определяющие резистентность к пенициллинам и цефалоспоринам, обладают кодирующими генами р-лактамазы. Плазмиды кодируют также фермент, инактивирующий хлорамфеникол (ацетилтрансфераза); ферменты, которые ацетилируют, аденилируют или фосфорилируют различные аминогликозиды; ферменты, которые определяют проницаемость клеточной оболочки для тетрациклинов, и др.
Хромосомы и плазмиды могут передаваться с помощью следующих механизмов.
а. Трансдукция. Плазмидная ДНК встраивается в бактериальный вирус и переносится им в другую бактерию того же вида.
б. Трансформация. Изолированная ДНК переходит от одной клетки внутри вида к другой, изменяя генотип последней. Это может происходить при таких лабораторных манипуляциях, как технологический процесс рекомбинации ДНК, а также, вероятно, спонтанно.
в. Бактериальная конъюгация. Односторонняя передача генетического материала между бактериями одной и той же или различных генераций встречается во время процесса сцепления (конъюгации). Это особенно важно для распространения резистентности, опосредованной плазмидами.
г. Транспозиция. Между плазмидами или между плазмидой и частью бактериальной хромосомы внутри бактериальной клетки может иметь место обмен короткими фрагментами ДНК (транспозонами), которые несут только несколько генов.
Перекрестная резистентность
Резистентные к определенному препарату микроорганизмы могут быть устойчивыми и к другим антибиотикам со сходными механизмами действия и местами связывания. Такие взаимоотношения существуют в основном между антимикробными агентами, которые имеют химическое сходство (например, полимиксин В — колистин; эритромицин — олеандомицин; неомицин — канамицин), но это явление может также существовать между химически не родственными соединениями (эритромицин — линкомицин). Внутри некоторых классов препаратов разные представители имеют настолько сходные по химическому строению активные группировки, что можно предполагать наличие полной перекрестной резистентности возбудителей к ним.
Избранная литература
Brooks G. F. et al. Jawets, Melnick, & Adelberg’s Medical Microbiology, 20th ed. Appleton & Lange, 1994.
Cohen M. L. Epidemiology of drug resistance: Implications for a post-antimicrobial era. Science, 1992; 257: 1050.
Dever L. A., Dermody T. S. Mechanisms of bacterial resistance to antibiotics. Arch. Intern. Med. 1991; 151: 886.
Jacoby G. A., Archer G. L. New mechanisms of bacterial resistance to agents. N. Engl. J. Med. 1991; 324:601.
Mandell G. L., Douglas R. G., Bennett J. E. (eds). Principles and Practice oflnfectious Diseases, 3rd ed. Wiley, 1989.
Neu H. S. The crisis in antibiotic resistance. Science, 1992; 257: 1064.
Sanders С. C., Weidermann B. Resistance to betalactam antibiotics among non-fastidious gram negative organisms. Rev. Infect. Dis. 1988; 10:679.
Пенициллины и цефалоспорины 43
Эрнест Явец
Пенициллины
В 1929 г. Флеминг сообщил о лизисе колоний стафилококков в среде, зараженной грибами рода Penicillium. Его попытки выделить бактериолити-ческую субстанцию не увенчались успехом, однако в 1940 г. Чейн, Флори и их сотрудники смогли получить значительные количества первого пенициллина из культур Penicillium notatum. Начиная с 1949 г. для клинического использования стали доступными практически неограниченные количества пенициллина G.
Двумя принципиальными недостатками пенициллина G являются его разрушение р-лактамазой (пенициллиназой), а также относительно низкая активность в отношении большинства грамотрицательных бактерий. Интенсивные исследования, выполненные Чейном, Ролинсоном и Батчелором с целью разрешения этих проблем, завершились выделением в 1957 г. 6-аминопенициллановой кислоты в значимых количествах. Таким образом, началась разработка большого ряда полусинтетичес-ких пенициллинов. Это привело к получению препаратов, резистентных к действию Р-лактамазы, кислотоустойчивых средств, а также веществ, активных в отношении как грамположительных, так и грамотрицательных бактерий.
Пенициллины и цефалоспорины являются большой группой лекарственных препаратов, имеющих определенное сходство с точки зрения химического строения, механизма действия, фармакологических и клинических эффектов, а также иммунологических свойств. Эти препараты называются Р-лактамными антибиотиками, что обусловлено наличием в их структуре общего для всей группы четырехчленного лактамного кольца.
Химическое строение
Все пенициллины имеют одинаковое строение основной группы, что показано на рис. 43-1 (верхняя часть). Она представлена тиазолидиновым
кольцом (А), соединенным с р-лактамным кольцом (В), имеющим аминогруппу (R-NH-). Кислотные радикалы (R), показанные на рис. 43-2, могут иметь аминогруппу и отщепляться бактериальными и другими амидазами. Подобной базовой химической структурой, включающей р-лактамное кольцо, обладают цефалоспорины, монобактамы и карбапене-мы (рис. 43-1). Структурное единство ядра 6-аминопенициллановой кислоты существенно для проявления биологической активности молекул. При ферментативном расщеплении Р-лактамного кольца бактериальными Р-лактамазами (пенициллиназами) с образованием неактивной пенициллановой кислоты антибиотик лишается своих антимикробных свойств. Однако образующийся в результате этой реакции продукт имеет присущие пенициллинам антигенные свойства и при связывании с белками организма-хозяина оказывает сенсибилизирующее действие, что может использоваться для проведения внутрикожной пробы. Продукты щелочного гидролиза пенициллинов также участвуют в процессах сенсибилизации.
Присоединение различных радикалов к аминогруппе 6-аминопенициллановой кислоты определяет существенные биологические свойства образующейся при этом молекулы. Важные с точки зрения клинического использования представители ряда пенициллинов по состоянию на 1994 г. можно разделить на несколько групп: 1) обладающие наивысшей активностью в отношении грамположительных микроорганизмов и слабой — в отношении грамотрицательных видов, а также гидролизуемые Р-лактамазами, например пенициллин G; 2) относительно резистентные к действию Р-лактамаз стафилококков, но с более низкой активностью в отношении грамположительных микроорганизмов и не действующие на грамотрицательные, например нафциллин, метициллин; 3) относительно высокоактивные против как грамотрицательных, так и грамположительных микроорганизмов, но разрушаемые р-лактамазами, например карбенициллин, тикарциллин; 4) препараты с относительной кис-
Амидаза-, Н Н Н
X I ' ! \ СНз
RiN —С —С С^СНз ПЕНИЦИЛЛИНЫ
O^CTN С^соон
Лактамаза
Замещенная 6-аминопенициллановая кислота
О Н Н Н и । : ' ^.н
Rt —С—N —С —С С^н ЦЕФАЛОСПОРИНЫ
O^C-N^c<!!#C^CH2-R2
I СООН
Рис. 43-1. Базовая структура четырех групп р-лактамных антибиотиков и клавулановой кислоты. р-Лактамное кольцо в каждой структуре обозначено В. Эффект пенициллинов зависит от метаболизма бактерий, их инактивация амидазами и лактамазами происходит в местах, обозначенных стрелками. Обратите внимание на то, что карбапенемы имеют иную стереохимическую конфи[у-рацию в лактамном кольце, что, очевидно, определяет их резистентность к действию Р-лактамаз. Заместители для различных пенициллинов и цефалоспоринов представлены, соответственно, на рис. 43-2 и 43-3
Замещенная 7-аминоцефалоспорановая кислота
О Н Н Н
и I : :
R —С—N —С —С—СНз
I В I
О^С~ N^SO3H
МОНОБАКТАМЫ
Замещенная З-амино-4-метилмонобактамовая кислота ' (ацтреонам)
НО Н Н
NH КАРБАПЕНЕМЫ II
R:—СН2—СН2 — NH — СН
Замещенная 3-гидроксиэтилкарбапенемовая кислота (имипенем)
Н2С—СН--О
I В I I
О^С—М^С^СИ-СНгОИ
СООН
Клавулановая кислота
Место действия амидазы Н
1 I /СН3
R —N—CH—CH _
© I ® I ® I СНз C-F-N-------сн—соон
Место действия пенициллиназы (разрыв р-лактамного кольца)
6-Аминопенициллановая кислота
При замещении R следующими структурами образуются новые пенициллины:
Пенициллин G (бензилпенициллин):
Высокая активность в отношении грамположительных бактерий, низкая — в отношении грамотрицательных. Некислотоустойчив. Разрушается р-лактамазой.
На 60 % саязывается белками
Оксациллин (нет атомов CI); клоксациллин (один атом CI в структуре); диклоксациллин (два CI в структуре); флуклоксациллин (один CI и один F в структуре) (изоксазолилпенициллины):
Сходны с метициллином по устойчивости к р-лактамазе, но кислотоустойчивы. Можно принимать внутрь. Высокая степень связывания с белками (95-98 %)
NH2
Нафциллин (этоксинафтамидопенициллин):
Сходен с изоксазолилпенициллинами. Менее прочно связывается с белками (90 %). Можно назначать перорально или внутривенно. Резистентен к р-лактамазе стафилококков
Ампициллин(а-аминобензилпенициллин):
Сходен с пенициллином G (разрушается р-лактамазой), но кислотоустойчив и более активен в отношении грамотрицательных бактерий. Карбенициллин имеет
—COONa вместо МН2-группы
ПГ|Н"С“
COONa
Тикарциллин:
Сходен с карбенициллином, но создает более высокие концентрации в крови. Пиперациллин, азлоциллин и мезлоциллин напоминают тикарциллин по действию на грамотрицательные аэробы
Амоксициллин:
Подобен ампициллину, но лучше всасывается, создает более высокие концентрации в крови
Рис. 43-2. Строение некоторых пенициллинов
лотоустойчивостыо и пригодные для перорального применения, например пенициллин V, ампициллин, клоксациллин. Некоторые представители каждой группы представлены на рис. 43-2, где приведены их отличительные свойства.
Большинство пенициллинов производятся в виде натриевых или калиевых солей свободной кислоты. Калиевая соль пенициллина G содержит около 1,7 мЭкв К+на миллион единиц пенициллина (2,8 мЭкв/r). Нафциллин содержит 2,8 мЭкв/r Na+.
Новокаиновые и бензатиновые соли являются депо-препаратами (пролонгированные формы) для внутримышечного введения.
В сухой кристаллической форме пенициллиновые соли достаточно стабильны в течение длительного времени (например, в течение нескольких лет при температуре 4 °C). Растворы быстро теряют свою активность (например, в течение 24 часов при температуре 20 °C) и должны готовиться непосредственно перед введением.
Антимикробная активность р-лактамных препаратов
р-Лактамные вещества имеют общий механизм антимикробного действия, который заключается в повреждении клеточной стенки бактерий (глава 42). Основными этапами реализации этого механизма являются: 1) связывание со специфическими пенициллинсвязывающими протеинами (ПСП), которые служат рецепторами для препарата в бактериях; 2) торможение синтеза клеточной стенки в результате угнетения реакции транс-пептидирования пептидогликана; 3) активация аутолитических ферментов в клеточной стенке, приводящая к повреждениям и гибели бактерий.
Пенициллины и цефалоспорины проявляют бактерицидное действие только во время активного синтеза пептидогликана. Метаболически неактивные клетки не повреждаются.
Различные пенициллины обладают неодинаковой количественной активностью в отношении определенных микроорганизмов. В то время как концентрации пенициллина G 0.002-0.5 мкг/мл являются летальными для большинства чувствительных грамположительных бактерий, нафциллин и другие резистентные к р-лактамазам пенициллины в 10-100 раз менее активны в отношении тех же самых возбудителей. Восприимчивость микроорганизмов к антибиотику частично зависит от их генотипа и является индивидуальным свойством отдельных штаммов. Различия в чувствительности грамположительных и грамотрицательных бактерий отчасти определяются количеством и типом рецепторов к препарату; относительным содержанием пептидогликана (оно обычно гораздо выше у грамположительных организмов); содержанием липидов в клеточной стенке, а также другими химическими особенностями, определяющими связывание, проникновение и резистентность к лизису или
разрыву клетки. Грамотрицательные кокки рода Neisseriae столь же чувствительны к пенициллину G, как и большинство грамположительных организмов.
Активность пенициллина G изначально определялась в единицах действия (ЕД). Кристаллическая натриевая соль пенициллина G содержит приблизительно 1600 ЕД/мг (1 ЕД = 0.6 мкг, 1 млн ЕД пенициллина = 0.6 г). Большинство полусинтети-ческих пенициллинов дозируется в единицах массы, а не в единицах действия.
Резистентность
Существует несколько видов резистентности к пенициллинам.
1. Некоторые бактерии (например, многие штаммы Staphylococcus aureus, некоторые штаммы Haemophilus influenzae и гонококков, большинство представителей грамотрицательной кишечной группы) вырабатывают Р-лактамазы, которые инактивируют некоторые пенициллины, разрушая Р-лактамное кольцо. Генетический контроль синтеза Р-лактамаз (известно примерно 50 видов таких ферментов) осуществляется передающимися плазмидами (глава 42). Другие пенициллины (нафциллин) и цефалоспорины являются устойчивыми к Р-лактамазам, так как их Р-лактамное кольцо частично защищено цепочкой бокового радикала R. Такие пенициллины активны в отношении продуцирующих р-лактамазу организмов.
2. Другие микроорганизмы не вырабатывают Р-лактамазы, но являются нечувствительными к пенициллинам, что связано с отсутствием специфических рецепторов или с низкой проницаемостью внешней оболочки, в результате чего препарат не может достичь рецепторов.
3. Иные возбудители могут быть невосприимчивыми к губительному действию пенициллинов, так как их аутолитические ферменты в клеточной стенке не активируются. Такие “толерантные” микроорганизмы (например, некоторые стафилококки, стрептококки, Listeria) подавляются, но не гибнут.
4. Микроорганизмы, не имеющие клеточной стенки (Mycoplasma, L-формы), или метаболически неактивные возбудители нечувствительны к пенициллинам или к другим ингибиторам клеточной стенки, поскольку они не синтезируют пептидогликаны.
5. Некоторые бактерии (например, стафилококки) могут быть резистентными к таким р-лактамаз-
устойчивым пенициллинам, как метициллин. Механизм этой резистентности, по-видимому, объясняется низким количеством или недоступностью ПСП-рецепторов, он не связан с выработкой какой-либо Р-лактамазы, а частота такой резистентности широко варьирует в различных географических регионах.
Фармакокинетика
После парентерального введения большинство пенициллинов всасывается быстро и полностью. В связи с раздражающим действием и местными болевыми ощущениями при внутримышечной инъекции высоких доз часто предпочтительным является внутривенное введение (дробное болюсное введение в дополнение к продолжительному капельному). Всасывание различных пенициллинов после перорального приема существенно различается, что отчасти зависит от кислотоустойчивости препаратов и связывания с белками. Чтобы минимизировать связывание препаратов с компонентами пищи пероральные пенициллины необходимо назначать натощак или не ранее чем через один час после приема пищи.
После всасывания в кровь пенициллины распределяются в тканях и жидкостях организма. Пенициллины не являются липотропными соединениями и поэтому мало проникают в животные клетки. При парентеральном введении пенициллина G в дозах 3-6г(5-10 млн ЕД; длительное дробное внутривенное введение или внутримышечные инъекции) сывороточная концентрация препарата достигает в среднем 1-10 ЕД (0.6-6 мкг/мл). Для прочих парентеральных пенициллинов используется близкий режим дозировки — 6 г в сутки, что позволяет поддерживать сывороточную концентрацию 1-6 мкг/мл. Пенициллины, имеющие высокую степень связывания с белками плазмы (например, оксациллин, диклоксациллин), создают более низкие концентрации свободного препарата в сыворотке, чем мало связывающиеся с белками вещества (например, пенициллин G, ампициллин). Однако значение степени связывания препарата с белками плазмы для проявления его клинической эффективности не вполе выяснено.
Специальные лекарственные формы пенициллина были разработаны с целью замедления всасывания и поддержания низких концентраций в крови и тканях в течение длительного времени. Ярким
примером такого препарата является пенициллин G бензатин. После однократного внутримышечного введения в дозе 0.75 г (1.2 млн ЕД) сывороточная концентрация препарата достигает 0.03 ЕД/мл и поддерживается в течение 10 дней, а в дальнейшем концентрация до 0.005 ЕД/мл сохраняется в течение 3 недель. Последняя концентрация оказывается достаточной для предотвращения инфекции Р-гемолитическим стрептококком, а предыдущая — для лечения развившегося инфекционного процесса, вызванного этим микроорганизмом. Прокаинпе-нициллин также имеет замедленную абсорбцию и поддерживает терапевтическую концентрацию в течение 12-24 часов после однократного внутримышечного введения.
Во многих тканях концентрация пенициллина равна сывороточной. Более низкие концентрации отмечаются в тканях глаза, предстательной железе и в центральной нервной системе. Тем не менее при воспалении мозговых оболочек, что имеет место при бактериальном менингите, концентрация пенициллина в спинномозговой жидкости достигает 0.2 мкг/мл при использовании суточной парентеральной дозы 12 г. Таким образом, пневмококковый и менингококковый менингиты MOiyr лечиться системными пенициллинами, а интратекальное введение не является необходимым. Вероятно, что создание высоких уровней пенициллинов в спинномозговой жидкости при менингите связано со следующими причинами: 1) повышение проницаемости мозговых оболочек; 2) снижение нормального активного транспорта пенициллина из цереброспинальной жидкости; 3) некоторое связывание пенициллина с белками цереброспинальной жидкости. После всасывания в кровь пенициллины достаточно хорошо проникают в плевральную, перикардиальную и внутрисуставную жидкости, поэтому местное инъекционное введение редко является необходимым.
Большая часть попавшего в кровь пенициллина быстро экскретируется почками, а оставшаяся часть выводится другими путями. Примерно 10 % почечной экскреции осуществляется клубочковой фильтрацией, а 90 % — канальцевой секрецией, при этом максимальная скорость выведения составляет приблизительно 2 г в час у взрослого человека. Время полувыведения пенициллина G в норме составляет 0.5-1 час, а при почечной недостаточности оно может возрастать до 10 часов. Ампициллин экскретируется медленнее, чем пенициллин G. Нафцил-
лин на 80 % экскретируется с желчью и только на 20 % канальцевой секрецией, поэтому его выведение незначительно изменяется при почечной недостаточности. Канальцевая секреция может отчасти уменьшаться пробенецидом, что позволяет достигать более высокой системной концентрации и содержания в спинномозговой жидкости. Поскольку почечный клиренс наименее активен у новорожденных, в этих условиях меньшие дозы создают более высокие системные концентрации, которые сохраняются дольше, чем у взрослых.
Пенициллин также экскретируется со слюной и грудным молоком, создавая при этом концентрации, составляющие 3-15 % от сывороточной. Это характерно как для человека, так и для животных. Присутствие пенициллина в молоке коров, леченных по поводу мастита, создает проблему для аллергологии человека.
Клиническое применение
Пенициллины являются одними из наиболее эффективных и широко применяемых антибиотиков. Все пероральные пенициллины должны применяться не во время приема пищи (за 1 час до или через 1-2 часа после), чтобы снизить связывание с компонентами пищи и кислотную инактивацию препаратов. Оксациллин наиболее прочно связывается с пищей (с белками), а диклоксациллин несколько менее. Для всех пенициллинов уровень в крови может повышаться при одновременном пероральном приеме пробенецида в дозе 0.5 г (10 мг/кг для детей) каждые 6 часов, поскольку этот препарат уменьшает канальцевую секрецию слабых кислот.
А. ПенициллинС. Пенициллин G является препаратом выбора при инфекциях, вызываемых пневмококками, стрептококками, менингококками, не продуцирующими Р-лактамазу стафилококками и гонококками, Treponema pallidum и многими другими спирохетами, Bacillus anthracis и другими грам-положительными палочками, клостридиями, Actinomyces, Listeria, Bacteroides (за исключением Bacteroides fragilis). Большинство из этих инфекций излечиваются пенициллином G при использовании суточной дозы 0.6—10 млн ЕД (0.36-6 г). Обычно используется дробное внутривенное введение препарата. Пероральное введение пенициллина V показано только при малых инфекциях, например при инфекциях дыхательных путей и прилегающих тканей и органов, особенно в детской практике (фарин
гиты, отиты, синуситы) в дневных дозах 1-4 г. На эффективность антибиотика при пероральном назначении могут влиять различные факторы, поэтому такой путь введения обычно не используется у больных с тяжелыми формами инфекционного процесса. У многих гонококков выработалась резистентность к пенициллину, поэтому в настоящее время он не является средством выбора при неосложненных формах гонореи.
Пенициллин G угнетает энтерококки, однако часто необходимо одновременное назначение аминогликозида для получения бактерицидного эффекта, например, при энтерококковых эндокардитах.
Б. Пенициллин G бензатин — это соль с очень слабой растворимостью в воде, предназначенная для внутримышечного введения, создающая низкую, но длительно сохраняющуюся концентрацию в крови. Однократная внутримышечная инъекция 1.2 млн ЕД является достаточной для лечения фарингита, вызываемого Р-гемолитическим стрептококком. Такое же внутримышечное введение один раз каждые 3-4 недели обеспечивает удовлетворительное профилактическое действие против реинфекции р-гемолитическим стрептококком. Пенициллин G бензатин (2.4 млн ЕД внутримышечно один раз в неделю в течение 1-3 недель) является эффективным средством для лечения раннего или латентного сифилиса. Этот препарат никогда не должен назначаться перорально. Прокаинпеницил-лин G (600 000 ЕД внутримышечно два раза в день) используется преимущественно при неосложненной пневмококковой пневмонии.
В. Ампициллин, амоксициллин, карбеницил-лин, тикарциллин, пиперациллин, мезлоциллин, азлоциллин. Эти препараты отличаются от пенициллина G более высокой активностью в отношении грамотрицательных бактерий, однако они инактивируются р-лактамазами.
Ампициллин и амоксициллин имеют одинаковый спектр действия, но амоксициллин лучше всасывается в кишечнике. Так, в дозе 250-500 мг амоксициллин при приеме 3 раза в день равнозначен ампициллину в той же дозе, но принимаемой 4 раза в день. Эти препараты применяются перорально для лечения обычных инфекций мочевыводящего тракта, вызываемых грамотрицательными колиформными бактериями, или при лечении смешанных вторичных бактериальных инфекций дыхательных путей (синуситы, отиты, бронхиты). Ам
пициллин, 300 мг/кг/день внутривенно, ранее являлся препаратом выбора для лечения бактериального менингита у детей, вызываемого Н. influenzae. Однако, в связи с частой встречаемостью 0-лакта-мазпродуцирующих Н. influenzae, в настоящее время предпочтительно использование цефтриаксона.
Ампициллин неэффективен при инфекциях, вызываемых Enterobacter, Pseudomonas, индолполо-жительным Proteus. При системных инфекциях, вызываемых Salmonella (например, брюшной тиф), ампициллин в дозе 6-10 г в день внутривенно может устранять проявления заболевания и ликвидировать микроорганизмы у некоторых бациллоносителей. При тифоидной и паратифоидной лихорадке ампициллин является альтернативным препаратом. Однако при неинвазивных сальмонеллезных гастроэнтеритах он не лучшее средство, и может пролонгировать бациллоносительство.
Бакампициллин высвобожает ампициллин после приема внутрь. Он может назначаться по тем же самым показаниям, что и ампициллин (400-800 мг перорально два раза в день).
Карбенициллин напоминает ампициллин, но обладает более высокой активностью в отношении видов Pseudomonas и Proteus, однако различные виды Klebsiella обычно резистентны к этому препарату. У чувствительных к карбенициллину популяций Pseudomonas может достаточно быстро развиваться резистентность. Поэтому при лечении сепсиса, вызываемого Pseudomonas (например, при ожогах, у больных с иммунодефицитом), карбенициллин в дозе 12-30 г/день внутривенно (300-500 мг/кг в день) обычно комбинируют с аминогликозидом, например, с гентамицином (5-7 мг/кг в день, внутримышечно) для замедления развития резистентности и получения синергического действия. Карбенициллин содержит 4.7 мЭкв/г Na+. Инданилнатриевая соль карбенициллина является кислотоустойчивой и может использоваться энте-рально при инфекциях мочевыводящих путей. Ти-карциллин близок к карбенициллину при монотерапии и в комбинациях, но может использоваться в более низких дозах, например в дозе 200-300 мг/кг в день внутривенно. Пиперациллин, мезлоциллин, азлоциллин и другие близки к тикарциллину и показали специфическую эффективность в отношении грамотрицательных аэробных палочек, включая Pseudomonas. Тем не менее при тяжелых инфекциях, вызываемых Pseudomonas, они должны использоваться в сочетании с аминогликозидами.
Ампициллин, амоксициллин, тикарциллин и другие представители этой группы могут быть защищены от разрушающего действия 0-лактамаз одновременным назначением таких ингибиторов Р-лактамаз, как клавулановая кислота, сульбактам или тазобактам (см. ниже). Подобные комбинации используются против продуцирующих лактамазу Н. influenzae или колиформных организмов. Однако возможные преимущества таких комбинаций в сравнении с соответствующими цефалоспориновыми антибиотиками не вполне очевидны.
Г. Пенициллины, устойчивые к Р-лактамазам. Единственным показанием к их применению является инфекция, вызываемая продуцирующими 0-лактамазу стафилококками.
Оксациллин, клоксациллин, диклоксациллин и нафциллин в дозах 0.25-0.5 г перорально каждые 4-6 часов (50-100 мг/кг в день для детей) могут использоваться для лечения легких форм локализованной стафилококковой инфекции. Все эти препараты являются относительно кислотоустойчивыми и хорошо всасываются в кишечнике. Они в значительной степени связываются с белками плазмы (90-95 %). На всасывание влияет прием пищи, поэтому препараты назначаются за 1 час до или после еды.
При тяжелом течении системной стафилококковой инфекции применяется нафциллин в дозе 8-12 г/день, который вводится внутривенно по 1-2 г каждые 2-4 часа (50-100 мг/кг в день для детей). Метициллин обладает более высокой нефротоксичностью, чем нафциллин, и используется редко.
Побочные реакции
Пенициллины, несомненно, обладают самой низкой токсичностью в ряду антибиотиков. Большинство серьезных побочных эффектов связаны с гиперчувствительностью к ним.
А. Аллергия. Для всех пенициллинов характерны перекрестная сенсибилизация и перекрестные аллергические реакции. Любые препараты, содержащие пенициллин, включая косметические средства и пищевые продукты, могут вызывать сенсибилизацию. В общем виде степень сенсибилизации прямо пропорциональна длительности поступления и суммарной дозе пенициллина. Антигенными детерминантами, по-видимому, являются продукты деградации пенициллинов, особенно пеницил-лоевая кислота и продукты щелочного гидролиза
после связывания с белками организма-хозяина. Кожные пробы с продуктами щелочного гидролиза (пенициллоилполилизином) и базовой структурой пенициллина позволяют выявить значительное число сенсибилизированных людей. Среди людей, имеющих положительную реакцию при проведении кожных тестов, отмечается высокая частота аллергических реакций на пенициллины, что обусловлено наличием связывающихся с клетками антител IgE. Хотя у многих людей вырабатываются антитела IgG к антигенным детерминантам пенициллина, наличие таких антител не коррелирует с аллергической реактивностью (за исключением развития гемолитической анемии) и серологические исследования имеют малое прогностическое значение. Наличие пенициллиновых реакций в анамнезе не является однозначным противопоказанием для использования препарата; известно, что в США примерно 5-8 % людей имели в прошлом подобные реакции. Однако в таких случаях требуется особая осторожность при назначении пенициллина или даже замена препарата на другое средство.
Аллергические реакции на введение пенициллина возникают у 10-15 % людей, имевших ранее подобные проявления. Менее чем у 1 % людей, у которых ранее не отмечалось реакции на пенициллины, возникает аллергическая реакция при повторном введении этих препаратов. Встречаемость аллергических реакций у маленьких детей незначительна.
Аллергические реакции могут протекать как типичный анафилактический шок (редко, 0.05 % реципиентов); в виде реакции с такими проявлениями типа сывороточной болезни, как крапивница, лихорадка, припухание суставов, ангионевротический отек, интенсивный зуд, затруднение дыхания через 7-12 дней после применения препарата (в настоящее время отмечается редко); а также в виде различных высыпаний на коже, наглизистой оболочке полости рта, лихорадки, интерстициального нефрита (аутоиммунная реакция на комплекс пенициллин-протеин), эозинофилии, гемолитической анемии и других гематологических нарушений, васкулитов.
Ранее считалось, что пациент с пенициллиновой гиперчувствительностью может переносить препарат на фоне одновременного введения кортикостероидов. “Десенситизация” с помощью градуально увеличивающихся доз пенициллина показана редко. Большинство аллергиков на пенициллины мо
гут лечиться альтернативными препаратами. Анафилактические реакции на пероральные пенициллины встречаются гораздо реже, чем после парентерального введения.
Б. Токсичность. Действие пенициллинов направлено только на специфическую бактериальную структуру (клеточную стенку), поэтому они практически не оказывают какого-либо действия на большинство животных клеток. Тем не менее все пенициллины являются раздражающими агентами в отношении центральной нервной системы и значительно повышают возбудимость нейронов. По этой причине за одни сутки интратекально можно вводить не более 20 000 ЕД, хотя в настоящее время имеется мало показаний для интрате-кального введения как такового. В редких случаях у пациента, получающего высокие дозы (например, более 20 млн ЕД пенициллина G в день), отмечаются симптомы раздражения коры мозга в результате проникновения пенициллина в центральную нервную систему. При использовании доз такого уровня может иметь место прямая катионная (Na+, К+) токсичность (см. “Химическое строение”), особенно у пациентов с почечной недостаточностью. Местные проявления токсического действия пенициллина G связаны с прямым раздражающим эффектом избыточно высоких концентраций при внутримышечном и внутривенном введении (например, 1 г/мл инъекционного раствора). Такие концентрации могут вызывать местные болевые ощущения, тромбофлебиты или дегенерацию случайно инфильтрированного при инъекции нерва.
Большие дозы пенициллинов при пероральном приеме могут привести к расстройствам желудочно-кишечного тракта в виде тошноты, рвоты и диареи. Это более характерно для препаратов широкого спектра (ампициллин, амоксициллин), чем для других пенициллинов. Применение пероральных препаратов может также осложняться бурным ростом стафилококков, Pseudomonas, Proteus, дрожжеподобных грибов, что иногда приводит к развитию энтеритов. При проведении терапии пенициллинами так же, как и при использовании других антибиотиков, могут возникать суперинфекции в других системах и органах. При применении метициллина, нафциллина и других пенициллинов иногда развивается гранулоцитопения, особенно у детей. Метициллин вызывает нефриты чаще, чем нафциллин. Белок базальной мембраны почечных канальцев
связывает пенициллин, а антитела к антигенам комплекса гаптен-носитель образуют комплекс, с которым связывается комплемент. Карбенициллин может вызывать гипокалиемический алкалоз и повышение активности трансаминазы в сыворотке. Он также может быть причиной нарушения свертываемости крови, что приводит к кровотечениям. Ампициллин часто вызывает кожные сыпи, некоторые из них по природе не являются аллергическими.
Проблемы, связанные с использованием и неправильным применением пенициллинов
Пенициллины являются наиболее широко применяемыми антибиотиками. За последние 40 лет людям было введено несколько тысяч тонн этих препаратов. Поэтому именно с пенициллинами связаны наиболее значимые последствия неправильного применения антибиотиков.
Значительная часть (возможно, 1-5 %) населения многих стран стала гиперчувствительной к этим препаратам. Несомненно, что во многих случаях сенсибилизация возникла тогда, когда пенициллины применялись без соответствующих показаний. Тем не менее гиперчувствительность может быть временной.
Насыщение некоторых мест среды обитания (например, больницы) пенициллинами привело к избирательному “давлению” на пенициллинчувствительные микроорганизмы и к увеличению количества пенициллинрезистентных организмов. Так, в 1950 г. больницы явились основным местом пролиферации и селекции продуцирующих р-лактамазу стафилококков. Сейчас стафилококки, продуцирующие 0-лактамазу, преобладают везде: они дают начало примерно 80 % вызываемых этим сообществом стафилококковых инфекций.
Подавление нормальной флоры создает определенное незанятое пространство, которое регулярно заполняется резистентными к препаратам микроорганизмами. Значительной части пациентов в госпиталях назначают пенициллины, и эти пациенты становятся избирательно восприимчивыми к суперинфекции микроорганизмами, которые происходят из госпитального окружения {Proteus, Pseudomonas, Enterobacter, Serratia, стафилококки, дрожжи и т. д.).
Плазмиды, контролирующие продукцию 0-лактамазы, распространяются с увеличивающейся ча
стотой среди различных родов возбудителей болезней. Neisseria gonorrhoeae получила таких плазмид, вероятно, от микроорганизмов Haemophilus. Резкое увеличение числа продуцирующих 0-лактамазу гонококков наблюдается в западной Африке и на Филиппинах. Местные эндемичные регионы были обнаружены и в США (например, Лос-Анджелес), что создает проблему контроля за ними.
Пневмококи долго считались примером абсолютной чувствительности к пенициллинам, однако в настоящее время это не в полной мере соответствует действительности. В Новой Гвинее и Южной Африке наблюдалось резкое увеличение числа относительно пенициллинрезистентных пневмококков, вызывающих пневмонию и менингит. Эти пневмококки не вырабатывают 0-лактамазу, но для их гибели необходимо более 6 мкг/мл пенициллина G. Такие концентрации пенициллина не могут быть достигнуты в центральной нервной системе, что определяло высокую смертность. Спорадические случаи подобной резистентности отмечались в Испании и США.
Цефалоспорины
Грибы Cephalosporium вырабатывают несколько антибиотиков, которые напоминают пенициллины, но устойчивы к 0-лактамазе и активны в отношении как грамположительных, так и грамотрицательных бактерий. Были разработаны методы получения значительных количеств общего ядра этих соединений — 7-аминоцефалоспорановой кислоты. Это сделало возможным синтез большой группы цефалоспоринов с различающимися свойствами. Цефамицины (продукты ферментации Strepto-myces) и некоторые полностью синтетические препараты типа моксалактама напоминают цефалоспорины.
А
Химическое строение
Ядро цефалоспоринов (7-аминоцефалоспорано-вая кислота) имеет существенное сходство с 6-ами-нопенициллановой кислотой (рис. 43-1), а также с ядром цефамициновых антибиотиков. Собственная антимикробная активность природных цефалоспоринов достаточно низка, однако присоединение различных радикалов Rt и R2 придает препаратам высокую противомикробную активность и низкую токсичность (рис. 43-3).
Цефалоспорины имеют мол. м. примерно 400-450. Они растворимы в воде и относительно устойчивы при изменениях pH и температуры. Устойчивость к Р-лактамазам в ряду этих препаратов различается. Натриевые соли цефалоспоринов содержат 2.4 мЭкв Na+ в одном грамме.
Антимикробная активность
Механизм действия цефалоспоринов аналогичен действию пенициллинов: 1) связывание со специфическими пенициллинсвязывающими протеинами (ПСП), которые служат рецепторами для препаратов в бактериях; 2) торможение синтеза клеточной стенки, связанное с нарушением реакции транспептидирования пептидогликана; 3) активация аутолитических ферментов в клеточной стенке, что вызывает ее повреждение и гибель бактерий.
Резистентность к цефалоспоринам может быть обусловлена следующими причинами: 1) низкое проникновение препарата в бактерии; 2) отсутствие ПСП для конкретного препарата; 3) разрушение препарата 0-лактамазами (цефалоспориназы, существует много видов таких ферментов); 4) появление особых 0-лактамаз во время лечения инфекций, вызываемых некоторыми грамотрицательными палочками (Enterobacter, Serratia, штаммы Pseudomonas'); 5) недостаточная активация аутолитических ферментов в клеточной стенке.
Цефалоспорины традиционно делятся на три большие группы, или “поколения”, по спектру действия и антимикробной активности. Все они не активны в отношении энтерококков и метициллин-резистентных стафилококков.
Цефалоспорины первого поколения
Эта группа включает цефадроксил, цефазолин, цефалексин, цефалотин, цефапирин и цефрадин.
Антимикробная активность
Эти препараты проявляют высокую активность в отношении грамположительных кокков, включая пневмококки, зеленящие стрептококки, гемолитические стрептококки группы А и 5. aureus. Среди грамотрицательных бактерий часто чувствительными являются Escherichia coli, Klebsiella pneumoniae и Proteus mirabilis, однако весьма низкая активность
отмечается против Pseudomonas aeruginosa, индол-положительного Proteus, Enterobacter, Serratia marcescens, Citobacter, Acinetobacter. Обычно чувствительны анаэробные кокки (например, Peptococ-cus, Peptostreptococcus), но не В. fragilis.
Фармакокинетика и дозировка
А. Пероральное введение. Цефалексин, цефрадин и цефадроксил всасываются в кишечнике в различных количествах. После перорального приема в дозах 500 мг сывороточная концентрация составляет 15-20 мкг/мл. Концентрация в моче обычно очень высока, но в большинстве тканей уровень вариабелен и ниже, чем в сыворотке. Цефалексин и цефрадин назначаются внутрь в дозах 0.25-0.5 г 4 раза в день (15-30 мг/кг в день), а цефадроксил в дозах 0.5-1 г два раза в день. Выведение в основном осуществляется путем клубочковой фильтрации и канальцевой секреции в мочу. Препараты, уменьшающие канальцевую секрецию, например пробенецид, могут существенно повышать сывороточный уровень. Для пациентов с нарушениями функции почек необходимо снижать дозировку: при клиренсе креатинина 20-50 мл/мин используется половина дозы; при клиренсе креатинина ниже 20 мл/мин используется одна четвертая нормальной дозы.
Б. Внутривенное введение. После внутривенного введения 1 г максимальная концентрация цефазолина составляет 90-120 мкг/мл, в то время как уровни цефалотина или цефапирина — 40-60 мкг/мл. Обычная внутривенная доза цефазолина для взрослых составляет 1-2 г каждые 8 часов (50-100 мг/кг в день), а для цефалотина или цефапирина она равна 1-2 г каждые 4-6 часов (50-200 мг/кг в день). Экскреция осуществляется почками и при нарушенной ренальной функции необходима такая же корректировка доз, как и для пероральных препаратов.
В. Внутримышечное введение. Этот способ введения сопровождается локальной болезненностью, чаще при использовании цефазолина, чем цефапирина, и поэтому используется редко.
Клиническое применение
Хотя цефалоспорины первого поколения имеют широкий спектр действия и относительно малотоксичны, они редко являются препаратами выбора
Структура ядра 7-аминоцефалоспорановой кислоты. Представленные ниже радикалы могут замещать R, или Rz с образованием указанных производных
Рис. 43-3. Строение некоторых цефалоспоринов
Цефалотин
Цефалексин
Цефазолин
Цефрадин
Цефапирин
Цефамандол
Вд
О II — О—С —СНз
— Н
N-N
-S-А >СНз О
—н
о II
— О —С —СНз
N—N
-sA Л N I СН3
Цефокситин (цефамицин)
Цефотаксим
Цефтриаксон
при любой инфекции. Пероральные препараты могут использоваться для лечения инфекций мочевыводящих путей, при негенерализованных стафилококковых инфекциях или при ограниченных поли-микробных инфекциях, таких как целлюлиты или небольшие абсцессы тканей. При тяжелых системных инфекциях пероральные цефалоспорины применять не следует.
После внутривенного введения цефалоспорины первого поколения хорошо проникают в большинство тканей и являются препаратами выбора для профилактики хирургической инфекции, особенно цефазолин. Цефалоспорины второго и третьего поколения не должны использоваться с этой целью, так как достаточно дороги и не имеют преимуществ с точки зрения профилактики инфекционных осложнений хирургических операций.
Внутривенные цефалоспорины первого поколения могут быть препаратами выбора в тех случаях, когда они являются наименее токсичными средствами (например, при инфекции, вызванной К. pneumoniae), а также у пациентов со слабой пенициллиновой гиперчувствительностью, но не с анафилактическими реакциями на пенициллины в анамнезе. Цефалоспорины первого поколения не проникают в центральную нервную систему и поэтому не используются для лечения менингита.
Цефалоспорины второго поколения
К группе цефалоспоринов второго поколения относятся цефаклор, цефамандол, цефоницид, це-форанид, цефокситин, цефметазол, цефотетан, цефуроксим, цефпрозил, лоракарбеф и цефподоксим.
Антимикробная активность
Это гетерогенная группа препаратов со значительными индивидуальными особенностями активности, фармакокинетики и токсичности. В целом они активны в отношении тех же микроорганизмов, что и препараты первого поколения, но действуют на большее число грамотрицательных бактерий. К цефалоспоринам второго поколения обычно чувствительны Enterobacter, Klebsiella (включая резистентные к цефалотину виды) и индолположитель-ный Proteus. Цефамандол, цефуроксим, цефоницид, цефоранид и цефаклор активны в отношении
Н. influenzae, но не в отношении Serratia или B.fragilis. В противоположность им цефокситин, цефметазол и цефотетан активны в отношении В. fragilis и некоторых Serratia, но не Н. influenzae. Все цефалоспорины второго поколения меньше действуют на грамположительные бактерии, чем препараты первого поколения, и ни один не активен в отношении энтерококков или Р. aeruginosa.
Фармакокинетика и дозировка
А. Пероральное введение. Цефаклор, цефуроксим аксетил, цефпрозил, цефподоксим и лоракарбеф могут приниматься энтерально. Обычные дозы для взрослых составляют 10—15 мг/кг/день в два или четыре приема; детям необходимо назначать 20-40 мг/кг/день в максимальной дозе до 1 г/день.
Б. Внутривенное введение. После внутривенного введения 1 г сывороточная концентрация обычно составляет 75-125 мкг/мл, но она достигает 200-250 мкг/мл для цефоницида. Существуют значительные отличия между препаратами по времени полувыведения, связыванию с белками и интервалу между введениями. Для цефокситина (50-200 мг/кг в день) или цефамандола (75-200 мг/кг в день) интервал между введениями составляет 4-6 часов. Препараты с большим временем полувыведения вводятся менее часто, например цефуроксим — 0.75-1.5 г каждые 8-12 часов; цефотетан — 1-2 г каждые 8-12 часов; цефоницид или цефоранид— 1-2 г (15-30 мг/кг в день) каждые 12-24 часа; цефпрозил — 500 мг каждые 24 часа.
Внутримышечное введение не используется из-за выраженной болезненности. При почечной недостаточности необходима специальная дозировка.
Клиническое применение
В связи с сильным действием на продуцирующие р-лактамазу Н. influenzae и Moraxella catarrhalis цефаклор применяется для лечения синуситов и среднего отита у пациентов с аллергией на ампициллин и амоксициллин или без нее. Цефуроксим является единственным препаратом второго поколения, хорошо проходящим через гематоэнцефалический барьер, и поэтому может применяться для лечения менингита. Необходимо учитывать возможную резистентность Н. influenzae.
Поскольку цефокситин и цефотетан (цефамици-ны) и цефметазол высокоактивны в отношении ана
эробов (включая В. fragilis), эти препараты могут использоваться для лечения смешанных анаэробных инфекций, при перитонитах и дивертикулитах. Цефамандол (или цефуроксим) могут применяться для лечения пневмонии, но имеют мало других показаний.
Цефалоспорины третьего поколения
К препаратам третьего поколения относятся це-фоперазон, цефотаксим, цефазидим, цефтизоксин, цефтриаксон, цефиксим и моксалактам.
Антимикробная активность
Главными отличительными особенностями препаратов этого поколения являются расширение их спектра действия на грамотрицательную флору и способность проникать в центральную нервную систему. В дополнение к тем грамотрицательным бактериям, на которые действуют другие цефалоспорины, препараты третьего поколения весьма активны в отношении Enterobacter, Citobacter, S. marcescens и Procidentia, а также продуцирующих р-лактамазу видов Haemophilus и Neisseria. Хотя цефтазидим и цефоперазон достаточно эффективны в отношении Р. aeruginosa, другие препараты группы угнетают только некоторые разновидности этих микроорганизмов. Только цефтизоксим и моксалактам сильно действуют на В. fragilis.
Фармакокинетика и дозировка
После внутривенного введения 1 г препаратов третьего поколения концентрация в плазме достигает 60-140 мкг/мл. Они хорошо проникают в жидкости и ткани организма, за исключением цефопе-разона, создавая такие концентрации в цереброспинальной жидкости, которые достаточны для угнетения большинства возбудйтелей, в том числе грамотрицательных палочек, за исключением, возможно, Pseudomonas.
Время полувыведения этих препаратов и интервал между приемами значительно варьируют: цефтриаксон (период полувыведения 7-8 часов) может вводиться каждые 12-24 часа в дозе 15-30 мг/кг в день, однако при менингите необходимо введение дозы 30-50 мг/кг в день с интервалом 12 часов. Це
фоперазон (период полувыведения 2 часа) может вводиться каждые 8-12 часов в дозе 25-100 мг/кг в день. Остальные препараты этой группы (время полувыведения 1-1.7 часа) могут вводиться каждые 6-8 часов в дозах от 2 до 12 г/день, в зависимости от тяжести инфекции. Цефиксим может назначаться перорально (400 мг два раза в день) для лечения инфекций респираторного и мочевого трактов.
Экскреция цефоперазона и цефтриаксона осуществляется в основном через желчный тракт, поэтому при почечной недостаточности необходимости корректировки дозы нет. Другие препараты выводятся почками, поэтому для них необходима специальная дозировка при почечной недостаточности.
Побочные эффекты цефалоспоринов
А. Аллергические реакции. Цефалоспорины вызывают сенсибилизацию и могут вызывать различные виды реакции гиперчувствительности, включая анафилаксию, лихорадку, кожные высыпания, нефриты, гранулоцитопению и гемолитическую анемию. Химическое ядро цефалоспоринов значительно отличается от такового у пенициллинов, поэтому пациенты с аллергией к пенициллину в анамнезе могут переносить цефалоспорины. Частота перекрестной аллергогенности между этими двумя группами препаратов точно не определена — примерно 6-18 %. Тем не менее лица с наблюдавшимися в прошлом анафилактическими реакциями на пенициллины не должны получать цефалоспорины.
Б. Токсическое действие. Местное раздражение может вызывать сильные болевые ощущения после внутримышечного введения и тромбофлебиты после внутривенного вливания. Наблюдавшееся при использовании цефалоридина нефротоксическое действие, включая интерстициальный нефрит и даже канальцевый некроз, привело к отказу от него.
Цефалоспорины, содержащие метилтиотетразоловую группу (например, цефамандол, моксалактам, цефметазол, цефотетан, цефоперазон), часто вызывают гипопротромбинемию и нарушения свертываемости крови. Введение витамина К в дозе 10 мг два раза в неделю может предотвращать эти явления. Моксалактам тоже нарушает функцию тромбоцитов и вызывает сильные кровотечения.
В настоящее время этот препарат практически не применяется.
Препараты с метилтиотетразоловым кольцом могут вызывать тяжелые реакции, подобные действию дисульфирама, поэтому при их применении требуется исключение алкоголя и спиртсодержащих лекарств.
Суперинфекция
Многие цефалоспорины второго и, особенно, третьего поколения являются неэффективными в отношении грамположительных бактерий, прежде всего стафилококков и энтерококков. При лечении этими препаратами наблюдается пролиферация резистентных микроорганизмов, а также грибов, что может приводить к суперинфекции.
Прочие p-лактамные препараты
Монобактамы
Это препараты с моноциклическим 0-лактам-ным кольцом (рис. 43-1). Они устойчивы к 0-лак-тамазам и активны в отношении грамотрицательных палочек (включая Pseudomonas и Serratia), но не действуют на грамположительные бактерии и анаэробы. Первым таким препаратом явился азтреонам, который по активности напоминает аминогликозиды. Азтреонам назначают внутривенно каждые 8 часов в дозе 1-2 г, которая создает пиковую концентрацию в плазме 100х мкг/мл. Время полувыведения равняется 1-2 часам и значительно увеличивается при нарушениях функции почек.
Больные с аллергией на пенициллин могут переносить азтреонам без всяких реакций. При введении азтреонама иногда отмечаются кожные высыпания и повышение уровня трансаминазы в сыворотке, но тяжелые токсические явления не развиваются. Наблюдались стафилококковые и энте-рококковые суперинфекции. Клиническое значение азтреонама полностью не определено.
Ингибиторы 0-лактамаз: клавулановая кислота, сульбактам, тазобактам
Эти вещества напоминают 0-лактамные молекулы (рис. 43-1), но сами по себе имеют очень слабые антибактериальные свойства. Тем не менее они являются мощными ингибиторами бактериальных
0-лактамаз и могут защищать гидролизующиеся пенициллины от инактивации этими ферментами. Например, клавулановая кислота в комбинации с амоксициллином или тикарциллином может быть эффективной при лечении респираторных инфекций, вызываемых Н. influenzae. Сульбактам в комбинации с ампициллином эффективен при различных инфекциях, вызываемых продуцирующими 0-лактамазу микроорганизмами, хотя этот препарат менее эффективен при интраабдоминальных и гинекологических смешанных инфекциях, чем клиндамицин в сочетании с аминогликозидом. Весомых доказательств несомненных преимуществ любой из этих комбинаций по сравнению с другими доступными препаратами нет.
Карбапенемы
Карбапенемы являются новым классом препаратов, структурно напоминающих 0-лактамные антибиотики (рис. 43-1). Первым, хорошо изученным в клинике препаратом этого ряда, был имипенем. Он имеет широкий спектр действия и высокую активность в отношении многих грамотрицательных палочек, грамположительных организмов и анаэробов. Препарат устойчив к 0-лактамазам, но инактивируется дигидропептидазами в почечных канальцах, что приводит к низким концентрациям в моче. Поэтому при клиническом применении он вводится вместе с ингибитором почечной дигидропептидазы — циластатином.
Имипенем хорошо проникает в ткани и жидкости организма, включая спинномозговую жидкость. Обычная доза составляет 0.5-1 г внутривенно каждые 6 часов (время полувыведения 1 час). При почечной недостаточности доза должна быть снижена, а после проведения гемодиализа необходимо назначить дополнительную дозу.
Роль имипенема в терапии не вполне определена. Он может быть показан при инфекциях, вызванных чувствительными микроорганизмами, которые резистентны к другим доступным средствам. Так как Pseudomonas может быстро вырабатывать устойчивость к имипенему, требуется одновременное назначение аминогликозида. Сочетание имипенема с аминогликозидом может быть эффективным также при лечении больного с лихорадкой и нейтропенией.
Наиболее частыми побочными эффектами имипенема являются тошнота, рвота, диарея, кожные
сыпи и реакции в местах введения. Высокие уровни препарата у больных с почечной недостаточностью могут приводить к судорогам. У больных с аллергией на пенициллины могут возникать аллергические реакции на имипенем.
Препараты
ПЕНИЦИЛЛИНЫ
Амоксициллин (генерик, Амоксил, др.) Перорально: таблетки для жевания по 125, 250 мг; капсулы по 250,500 мг; порошок для приготовления раствора 50 мг/мл
Амоксициллин/клавуланат калня (Аугментин) Перорально: таблетки по 250,500 мг; таблетки для жевания по 125 и 250 мг; порошок для приготовления суспензий 125,250 мг/5 мл
Ампициллин (генерик, Омнипен, Полициллин, др.) Перорально: капсулы по 250, 500 мг; порошок для приготовления суспензий 100,125,250, 500 мг
Парентерально: порошок для приготовления инъекционных растворов (125, 250,500 мг, 1, 2 г во флаконе; 1, 2 г для внутривенного введения; флаконы по 10 г)
Ампициллин/сульбактам натрия (Унасин) Парентерально: 1, 2 г порошка для растворения и внутривенного или внутримышечного введения
Азлоциллин (Азлин)
Парентерально: порошок для приготовления инъекционных растворов (2,3,4 г во флаконе для внутривенного введения)
Бакампициллин (Спектробид)
Перорально: таблетки по 400 мг (эквивалентные 280 мг ампициллина); порошок для приготовления суспензии 125 мг/5 мл
Карбенициллин (Геоциллин)
Перорально: таблетки по 382 мг Парентерально: порошок для инъекций (1, 2, 5,10 г для внутривенного введения; 10, 20, 30 г во флаконах)
Клоксациллин (генерик, Тегопен)
Перорально: капсулы по 250, 500 мг; порошок для приготовления раствора 125 мг/5 мл
Диклоксациллин (генерик, Динапен)
Перорально: капсулы по 125, 250,500 мг;
порошок для приготовления суспензии 62.5 мг/5 мл
Метициллин (Стафциллин) Парентерально: порошок для инъекций (1,4, 6 г во флаконе для внутривенного введения; 10 г в больших флаконах)
Мезлоциллин (Мезлин)
Парентерально: порошок для инъекций (1,2, 3,4 г во флаконе для внутривенного введения; 20 г в больших флаконах)
Нафциллин (генерик, Унипен, Нафцил, Наллпен) Перорально: капсулы по 250 мг; таблетки по 500 мг; порошок для растворения 250 мг/5 мл Парентерально: порошок для растворения для внутримышечного и внутривенного введения (0.5,1, 2 г во флаконе);
10 г в большом флаконе
Оксациллин (Бактоцилл, Простафлин) Перорально: капсулы по 250,500 мг; порошок для растворения 250 мг/5 мл Парентерально: порошок для инъекций (0.25,0.5,1, 2 г во флаконе; 10 г в больших флаконах)
Пенициллин G (генерик, Пентидс, Пфицерпен) Перорально: 0.2,0.25,0.4, 0.5, 0.8 млн ЕД в таблетке; порошок для приготовления суспензии 400 000 ЕД/5 мл
Парентерально: порошок для приготовления инъекционных растворов (0.2,0.5,1,5,10, 20 млн ЕД)
Пенициллин G бензатин (Пермапен, Бициллин) Перорально: таблетки по 0.2 млн ЕД Парентерально: 0.3, 0.6,1.2, 2.4 млн ЕД на введение
Пенициллин G прокаин (генерик) Парентерально: 0.3, 0.6,1.2, 2.4 млн ЕД только для внутримышечного введения
ПенициллинУ (генерик, V-Циллин, Пен-Ви К, др.) Перорально: таблетки по 125,250,500 мг; порошок для растворения 125,250 мг/5 мл
Пиперациллин (Пипрацил)
Парентерально: порошок для приготовления инъекционных растворов (2,3,4 г для внутривенного введения;
40 г в больших флаконах)
Пиперациллин и тазобактам натрия (Зосин) Парентерально: порошок для приготовления внутривенных инъекционных растворов 2, 3,4 г
Тикарциллин (Тикар)
Парентерально: порошок для приготовления инъекционных растворов (1,3,6 г для внутривенного введения;
20,30 г в больших флаконах)
Тикарциллин и клавуланат калия (Тиментин) Парентерально: порошок для приготовления инъекционного раствора (3 г тикарциллина и 0.1 г клавулановой кислоты во флаконе для внутривенного введения)
ЦЕФАЛОСПОРИНЫ И ДРУГИЕ Р-ЛАКТАМНЫЕ ПРЕПАРАТЫ
Цефалоспорины узкого спектра действия (первого поколения)
Цефадроксил (генерик, Дурицеф, Ультрацеф) Перорально: капсулы по 500 мг; таблетки по 1 г; суспензии 125,250,500 мг/5 мл
Цефазолин (Анцеф, Кефзол)
Парентерально: порошок для приготовления инъекционных растворов (0.25,0.5,1 г для внутривенного введения; 5,10, 20 г в больших флаконах)
Цефалексин (генерик, Кефлекс, др.) Перорально: капсулы и таблетки по 250 и 500 мг; таблетки по 1 г; суспензии 125, 250 мг/5 мл; 100 мг/мл педиатрическая суспензия
Цефалотин (генерик, Кефлин, Сеффин) Парентерально: порошок для приготовления инъекционного раствора и раствор для инъекций (1,2 г в инъекционной упаковке; 10, 20 г в больших флаконах)
Цефапирин (генерик, Цефадил) Парентерально: порошок для приготовления инъекционных растворов (0.5,1,2,4 г во флаконе для внутривенных инъекций; 20 г в больших флаконах)
Цефрадин (генерик, Анспор, Велосеф) Перорально: капсулы по 250 и 500 мг; суспензии 125, 250 мг/5 мл Парентерально: порошок для приготовления инъекционного раствора (0.25,0.5,1,2 г во флаконе)
Цефалоспорины промежуточного спектра действия (второго поколения)
Цефаклор (Цеклор)
Перорально: капсулы по 250 и 500 мг; порошок для приготовления суспензий 125,187, 250, 375 мг/5 мл
Цефамандол (Мандол)
Парентерально: 0.5,1,2, 10 г во флаконе для внутримышечных и внутривенных инъекций
Цефметазол (Цефазон)
Парентерально: порошок 1, 2 г во флаконе для внутривенных инъекций
Цефоницид (Моноцид)
Парентерально: порошок для приготовления инъекционных растворов 0.5,1,10 г во флаконе
Цефоранид (Прецеф)
Парентерально: порошок для приготовления растворов для внутримышечного и внутривенного введения 0.5,1,10 г во флаконе
Цефокситин (Мефоксин)
Парентерально: порошок для приготовления инъекционных растворов 1, 2,10 г во флаконе
Цефподоксим (Вантин)
Перорально: таблетки по 100 и 200 мг;
гранулы для приготовления суспензии 50 и 100 мг/5 мл
Цефпрозил (Цефзил)
Перорально: таблетки по 250 и 500 мг; порошок для приготовления суспензии 125, 250 мг/5 мл
Цефуроксим (Цефтин, Кефурокс, Зинацеф) Перорально: таблетки по 125, 250 и 500 мг Парентерально: порошок для приготовления инъекционных растворов (0.75,1.5,7.5 г во флаконе или инфузионной упаковке)
Лоракарбеф (Лорабид)
Перорально: капсулы по 200 мг; порошок для приготовления суспензии 100 мг/5 мл
Цефалоспорины широкого спектра действия (третьего поколения)
Цефиксим (Супракс)
Перорально: таблетки по 200 и 400 мг; порошок для приготовления суспензии 100 мг/5 мл
Цефоперазон (Цефобид)
Парентерально: порошок для приготовления инъекционных растворов 1, 2 г во флаконе
Цефотаксим (Клафоран)
Парентерально: порошок для приготовления инъекционных растворов 1, 2 и 10 г во флаконе
Цефотетан (Цефотан)
Парентерально: порошок для приготовления инъекционных растворов 1, 2 и 10 г во флаконе
Цефтазидим (Фортаз, Тазидим)
Парентерально: порошок для приготовления инъекционных растворов 0.5,1 и 2 г во флаконе; 6 г в большой упаковке
Цефтизоксим (Цефизокс)
Парентерально: порошок для приготовления инъекционных растворов и раствор для инъекций 0.5,1 и 2 г во флаконе
Цефтриаксон (Роцефин)
Парентерально: порошок для приготовления инъекционных растворов 0.25,0.5,1, 2 и 10 г во флаконе
Карбапенемы
Имипенем/циластатин (Примаксин)
Парентерально: порошок для приготовления инъекционных растворов 250, 500 мг во флаконе
Монобактамы
Азтреонам ( Азактам)
Парентерально: порошок для приготовления инъекционных растворов 0.5,1,2 г
Избранная литература
Donowitz G. R., Mandell G. L. Beta lactam antibiotics. (Two parts.) N. Engl. J. Med. 1988; 318:419,490.
Ellner J. J. (ed.). Cefixime: A new third generation cephalosporin. Am. J. Med. 1988; 85 (ЗА): 1.
Handsfiel H. H. et al. A comparison of single-dose cefixime with ceftriaxone as treatment for uncomplicated gonorrhea. N. Engl. J. Med. 1991; 325: 1337.
International Rheumatic Fever Study Group: Allergic reactions to long-term benzathine penicillin prophilaxis for rheumatic fever. Lancet, 1991; 337: 1308.
Remington J. S. (ed.). Carbapenems: A new class of antibiotics. (Symposium.) Am. J. Med. 1985; 78 (Suppl. 6A): 1.
Sexually transmitted diseases: Treatment guidelines. MMWR Morb. Mortal. Wkly. Rep. 1989; 38: S8.
White R. et al. Halving of mortality of severe melioidosis by ceftazidime. Lancet, 1989; 2:697.
Хлорамфеникол и тетрациклины 44
Эрнест Явец
Хлорамфеникол
Хлорамфеникол первоначально был выделен из культур Streptomyces venezuelae в 1947 г. и впоследствии синтезирован в 1949 г. Он явился первым полностью синтетическим антибиотиком, имеющим коммерческое значение. Это — единственный доступный представитель соединений данного химического типа.
Химическое строение
Кристаллический хлорамфеникол является нейтральным устойчивым соединением со следующей структурой:
_____ ОН СН2ОН о
//1 1 II
OzN-f Ч-C — С— N — С — СНС12
\ / । 1 । н н н
Хлорамфеникол
Хлорамфеникол представляет собой бесцветные кристаллы с очень горьким вкусом. Он хорошо растворим в спирте и плохо в воде. Насыщенные водные растворы (0.25 %) сохраняют активность в течение многих месяцев при хранении в холодильнике или при комнатной температуре в защищенном от света месте. Хлорамфеникол сукцинат хорошо растворим в воде и гидролизуется в тканях с освобождением свободного хлорамфеникола, что позволяет использовать этот препарат для парентерального введения.
Антимикробная активность
Хлорамфеникол — мощный ингибитор микробного белкового синтеза и оказывает незначительное влияние на другие метаболические функции микробов. Он обратимо связывается с клеточным рецеп
тором 508-субъединицы бактериальной рибосомы и нарушает включение аминокислот в строящиеся белки, блокируя действие пептидилтрансферазы (глава 42 и рис. 42-4 и 42-6). Хлорамфеникол также нарушает митохондриальный белковый синтез в клетках костного мозга млекопитающих, но существенно не затрагивает другие неповрежденные клетки.
Препарат является бактериостатическим в отношении многих бактерий и риккетсий, но клинически неэффективен в отношении хламидий. Его действие обратимо после прекращения приема. Большинство грамположительных бактерий угнетаются хлорамфениколом в концентрациях 1-10 мкг/мл, а многие грамотрицательные бактерии — 0.2-5 мкг/мл. Haemophilus influenzae, Neisseria meningitidis и некоторые штаммы Bacteroides высокочувствительны, и на этих возбудителей хлорамфеникол может оказывать бактерицидное действие. Некоторые сальмонеллы чувствительны к хлорамфениколу, однако обусловленная плазмидами резистентность появляется в последнее время с увеличивающейся частотой.
Резистентность
У многих видов бактерий среди значительных популяций хлорамфениколвосприимчивых клеток встречаются случайные устойчивые мутанты, которые являются менее чувствительными к препарату. Эти мутанты обычно только в два-четыре раза более устойчивы, чем родительская популяция, следовательно, они появляются медленно у леченных хлорамфениколом больных. Перекрестной резистентности к хлорамфениколу и другим препаратам не наблюдается, но плазмиды могут передавать множественную резистентность к препаратам (хлорамфеникол, тетрациклин, стрептомицин и пр.) от одной бактерии к другой путем конъюгации (глава 42). Такая опосредованная плазмидами резистентность связана с выработкой хлорамфеникол-
ацетилтрансферазы — бактериального фермента, инактивирующего лекарственное средство. Соответственно резистентность такого плазмидсодержа-щего микроорганизма является достаточно высокой.
Фармакокинетика
После перорального приема кристаллический хлорамфеникол быстро и полностью всасывается. При приеме суточной дозы 2 г перорально концентрация препарата в крови обычно достигает 8 мкг/мл. Хлорамфеникол пальмитат, назначаемый детям в дозах до 50 мг/кг/день перорально, гидролизуется в кишечнике, образуя свободный хлорамфеникол, при этом уровень его в крови редко превышает 10 мкг/мл. При внутривенном или внутримышечном введении хлорамфеникола сукцината в дозах 25-50 мг/кг/день происходит гидролитическое высвобождение хлорамфеникола, создаются несколько более низкие уровни в крови по сравнению с теми, которые достигаются при пероральном приеме. После всасывания хлорамфеникол распределяется практически по всем тканям и жидкостям организма, включая центральную нервную систему и цереброспинальную жидкость. Концентрация хлорамфеникола в мозговой ткани может быть равна таковой в сыворотке, что делает возможным лечение инфекционных заболеваний центральной нервной системы. В крови хлорамфеникол приблизительно на 30 % связан с белками плазмы. Препарат легко проникает через мембраны клетки. Основная часть лекарственного средства инактивируется в организме путем конъюгации с глюкуроновой кислотой (преимущественно в печени) либо путем восстановления с образованием неактивных ариловых аминов. Экскреция активного хлорамфеникола (приблизительно 10 % от общей принятой дозы) и неактивных продуктов метаболизма (приблизительно 90 % от общего количества) осуществляется почками. По-видимому, активное вещество выделяется главным образом посредством гломерулярной фильтрации, а неактивные метаболиты — канальцевой секрецией. Только незначительные количества активного лекарственного вещества экскретируются с желчью или калом. Дозы хлорамфеникола при системном введении не требуют корректировки при почечной недостаточности, но должны быть значительно снижены при печеночной недостаточности.
Клиническое применение
В связи с потенциальной токсичностью и возможностью использования других эффективных препаратов (например, цефалоспоринов) хлорамфеникол является препаратом выбора только при нижеперечисленных инфекционных заболеваниях: 1) симптоматическая сальмонеллезная инфекция, например тифоподобная лихорадка; многие виды Salmonella в настоящее время устойчивы, поэтому часто используется комбинация триметоприм-суль-фаметоксазол; 2) тяжелые инфекционные заболевания, вызываемые Н. influenzae, например менингит, эпиглотит или пневмония; 3) менингококковые или пневмококковые инфекционные поражения центральной нервной системы у больных, гиперчувствительных к р-лактамным антибиотикам; 4) ана- . эробные или смешанные инфекции центральной нервной системы, например абсцесс мозга; 5) редко как альтернатива тетрациклину при тяжелых риккетсиозных инфекциях.
Хлорамфеникол иногда применяется местно для лечения глазных инфекций в связи с широким антибактериальным спектром и проникновением в ткани глаза и внутриглазную жидкость. Однако он не эффективен при хламидийных инфекциях.
А. Сальмонеллез. При сальмонеллезных инфекциях (например, тиф или паратифоидная лихорадка) взрослым назначают хлорамфеникол в дозе 2-3 г ежедневно перорально в течение 14-21 дня, а детям по 30-50 мг/кг/день перорально в течение 14-21 дня. При длительном лечении уменьшается частота рецидивов. К такому лечению следует прибегать при тяжелых риккетсиозных инфекционных заболеваниях (например, сыпной тиф или лихорадка Скалистых гор).
Б. Haemophilus. При менингитах или ларинготрахеитах, вызываемых Н. influenzae (у маленьких детей), или пневмонии (у престарелых), хлорамфеникол применяют в дозах 50-100 мг/кг/день перорально или внутривенно в течение 8-14 дней в зависимости от клинического эффекта и изменений в спинномозговой жидкости. В связи с появлением хлорамфениколустойчивых штаммов Haemophilus в настоящее время препаратами выбора могут быть цефтриаксон или цефотаксим.
В. Другие области применения. При угрожающем жизни сепсисе, происходящем из нижнего отдела кишечника, хлорамфеникол может применяться в дозе 2 г/день, иногда в комбинации с амино
гликозидами (например, с амикацином, 15 мг/кг в день). В связи с хорошим проникновением хлорамфеникола во все отделы центральной нервной системы он иногда используется для лечения энцефалитов, абсцесса мозга или менингита. При менингите у взрослых доза хлорамфеникола составляет 50 мг/кг/день в четыре приема. Сепсис, вызванный некоторыми видами Bacteroides, и тяжелые формы мелиоидоза также могут успешно лечиться хлорамфениколом.
Побочные реакции
А. Желудочно-кишечные расстройства. У взрослых, принимающих хлорамфеникол в дозах 1.5-2.5 г ежедневно, иногда через 2-5 дней после начала лечения возникают тошнота, рвота и понос. У детей эти явления наблюдаются редко. Через 5-10 дней после начала лечения могут возникать нарушения микробной флоры с развитием кандидоза слизистых оболочек (особенно рта и влагалища).
Б. Нарушения функций костного мозга. У взрослых, принимающих хлорамфеникол в дозах более 50 мг/кг/день в течение 1-2 недель, что создает уровень в крови более 25-30 мкг/мл, часто нарушается процесс созревания эритроцитов, что ведет к появлению заметно вакуолизированных клеток эритроидного ряда в костном мозге, анемии и ретикулоцитопении. Эти аномалии обычно исчезают после отмены хлорамфеникола. Имеет место нарушение процесса созревания эритроцитов с одновременным повышением сывороточной концентрации железа и снижением уровня фенилаланина в сыворотке. Подобные явления обычно не связаны с развитием апластической анемии, которая возникает достаточно редко.
Апластическая анемия является редким следствием применения хлорамфеникола при любых путях введения и представляет собой вариант ге-нетически-детерминированной идиосинкразии индивидуума. Ее возникновение не зависит от дозы или срока применения, однако такое осложнение отмечается чаще при более длительном использовании препарата. Апластическая анемия может быть необратимой и даже летальной. Точная частота возникновения фатальной апластической анемии как токсической реакции на введение хлорамфеникола не установлена, но при использовании этого лекарственного средства она отмечается в
13 раз чаще, чем спонтанные формы заболевания. Апластическая анемия, вероятно, развивается у одного из 24 000-40 000 пациентов, принимавших хлорамфеникол. Вслед за развитием гипопластической анемии может возникать лейкоз.
В. Побочные эффекты у новорожденных. Новорожденные не имеют сформировавшегося механизма конъюгации с глюкуроновой кислотой, который необходим для процесса деградации и детоксикации хлорамфеникола. Поэтому при введении новорожденным дозы 75 мг/кг/день или большей препарат может накапливаться в организме, что приводит к развитию “серого синдрома” младенцев, характеризующегося рвотой, вялостью, гипотермией, приобретением кожными покровами серого оттенка, шоковым и коллаптоидным состоянием. Для того чтобы избежать возникновения этого токсического явления, хлорамфеникол должен использоваться в дозе не более 50 мг/кг/день для младенцев и не более 30 мг/кг/день для подростков.
Г. Взаимодействие с другими препаратами. Хлорамфеникол может увеличивать период полувыведения и повышать концентрацию в крови фенитоина, толбутамида, хлорпропамида и варфарина. Это обусловлено угнетением хлорамфениколом микросомальных ферментов печени. Хлорамфеникол может вызывать выпадение в осадок разных препаратов из растворов. Подобно другим бактериостатическим ингибиторам микробного белкового синтеза, хлорамфеникол способен противодействовать бактерицидному действию пенициллинов или аминогликозидов (глава 52).
Медицинское и социальное значение необоснованного применения
В связи с широким спектром действия и отсутствием выраженной токсичности хлорамфеникол необоснованно часто использовался без специальных показаний в период с 1948 по 1951 гг. По приблизительным оценкам более 8 млн людей применяли это лекарственное средство для лечения легких форм разных заболеваний, респираторных (обычно вирусных) инфекций и т. д. Такое необоснованное использование сопровождалось значительным возрастанием числа случаев апластической анемии, что привело к почти полному отказу от применения этого эффективного лекарственного средства.
Тетрациклины
Тетрациклины — большая группа препаратов с общей основной структурой и механизмом действия. Хлортетрациклин, выделенный из Strepto-myces aureofaciens, был внедрен в 1948 г. Окситетрациклин, полученный из Streptomyces rimosus, — в 1950 г. Тетрациклин, полученный методом каталитической дегалогенизации хлортетрациклина, стал доступен с 1953 г. Демеклоциклин получен деметилированием хлортетрациклина. Разработанные в последние годы тетрациклины отличаются хорошим всасыванием и более длительной циркуляцией в крови.
Химическое строение
Все тетрациклины имеют основную структуру, представленную ниже.
клиренс
R? Re Re (мл/мин)
Хлортетрациклин — CI -СНз — н 35
Окситетрациклин — н — СНз — он 90
Тетрациклин — н — СНз — н 65
Демеклоциклин -CI — н — н 35
Метациклин — н =сн2* — он 31
Доксициклин — н -СНз* — он 16
Миноциклин — Ы(СН3)2-Н — н 10
*В позиции 6 у метациклина и доксициклина нет — ОН.
Свободные тетрациклины являются амфотерными кристаллическими веществами с низкой растворимостью. Большей растворимостью обладают их гидрохлориды. Растворы гидрохлоридов тетрациклина имеют кислую реакцию и, за исключением хлортетрациклина, достаточно стабильны. Тетрациклины прочно связываются с двухвалентными ионамй;металлов, образование этих хелатов существенно влияет на всасывание и активность молекулы. Тетрациклины обладают яркой желтой флюоресценцией в ультрафиолетовом свете с длиной волны 360 нм.
Антимикробная активность
Тетрациклины являются прототипом антимикробных препаратов широкого спектра действия. Они оказывают бактериостатическое действие в отношении многих грамположительных и грамотрицательных бактерий, включая некоторых анаэробов, риккетсий, хламидий, микоплазм и L-форм, а также некоторых простейших, например амеб. Равные концентрации тетрациклинов в жидкостях организма или тканях имеют приблизительно одинаковую антимикробную активность. Миноциклин более липофилен, чем другие родственные вещества. Различия в антимикробной активности у отдельных препаратов не очень велики и не имеют существенного значения для выбора препарата. Различия в клинической эффективности обусловлены в значительной степени особенностями всасывания, распределения и выведения конкретных препаратов. Однако чувствительность различных штаммов определенных видов микроорганизмов к препаратам этого ряда неодинакова. Большое значение могут иметь лабораторные тесты на клинических изолятах.
Тетрациклины проникают в микроорганизмы путем пассивной диффузии и частично за счет процесса активного транспорта, требующего энергетического обеспечения. Восприимчивые клетки концентрируют лекарственное средство, в результате чего внутриклеточная концентрация препарата становится намного выше, чем внеклеточная. Внутри клетки тетрациклины обратимо связываются с рецепторами 305-субъединицы бактериальной рибосомы, блокируя связывание аминоацил-тРНК с акцепторным участком рибосомально-матричного комплекса (рис. 42-5). Это предотвращает включение новых аминокислот в строящуюся пептидную цепь и нарушает синтез белка. Избирательность действия в отношении синтеза белка микроорганизмами объясняется низкой способностью клеток млекопитающих концентрировать тетрациклины.
Резистентность
Микробные популяции, содержащие главным образом восприимчивые организмы, также включают небольшие количества организмов, устойчивых к тетрациклинам. Такие микроорганизмы не имеют механизмов активного транспорта тетрацикли-
на через мембрану клетки и не способны концентрировать тетрациклин в клетках. С другой стороны, устойчивые бактерии могут иметь недостаток пассивной диффузии тетрациклинов. Степень устойчивости вариабельна. Среди грамотрицательных видов бактерий (особенно Pseudomonas, Proteus и кишечной группы) селекция высокоустойчивых типов уже произошла, и тетрациклины поэтому потеряли многие полезные свойства. Устойчивость к тетрациклинам обычно передается плазмидами. При широком использовании этих препаратов наблюдается увеличение устойчивости даже среди тех видов возбудителей, которые были исходно высокочувствительными к тетрациклинам (например, пневмококки, Bacteroides).
Обусловленная плазмидами устойчивость может передаваться трансдукцией или конъюгацией. Гены, которые определяют устойчивость к тетрациклинам, тесно связаны с генами, отвечающими за резистентность к другим препаратам, например к аминогликозидам, сульфаниламидам и хлорамфениколу. Поэтому плазмиды обычно передают устойчивость сразу к нескольким типам антибиотиков, а не к одним тетрациклинам.
Фармакокинетика
Тетрациклины неравномерно всасываются из желудочно-кишечного тракта. Часть перорально применяемой дозы тетрациклина остается в просвете кишечника, изменяя кишечную флору, и экскретируется с калом. В то время как только 30 % дозы хлортетрациклина и 60-80 % дозы тетрациклина, окситетрациклина и демеклоциклина всасывается в кишечнике, кишечная абсорбция доксициклина и миноциклина составляет 90-100 %. Всасывание происходит главным образом в верхних отделах тонкого кишечника и лучше при отсутствии пиши. Всасывание нарушается при образовании хелатов с двухвалентными катионами (Ca2+, Mg2+, Fe2+) или с А13+, особенно с содержащимися в молоке и антацидных препаратах, а также при щелочном pH. Содержащие буферные системы растворы тетрациклина специально разработаны для парентерального (обычно внутривенного) введения людям, не способным принимать препараты перорально. Парентеральная дозировка препаратов близка к энтеральным дозам.
В крови 40-80 % всосавшегося количества тетрациклинов связано с белками. При использова
нии пероральной дозы 500 мг каждые 6 часов тетрациклина гидрохлорида и окситетрациклина эти препараты создают пиковую концентрацию в крови 4-6 мкг/мл. Для доксициклина и миноциклина пиковые уровни несколько ниже (2-4 мкг/мл). Тетрациклины, введенные внутривенно, создают несколько более высокие уровни в течение непродолжительного времени. Препараты распределены достаточно широко в тканях и жидкостях организма, однако в цереброспинальной жидкости их концентрации низки. Миноциклин создает очень высокие концентрации в секрете слезных желез и, особенно, в слюне, что позволяет ликвидировать менингококковое носительство. Тетрациклины проникают через плаценту в плод, а также экскретируются с молоком. В результате образования хелатных соединений с кальцием тетрациклины связываются с растущей костной тканью и тканями зуба.
Всосавшиеся тетрациклины экскретируются главным образом с желчью и мочой. Концентрации в желчи в десять раз выше, чем в сыворотке; часть лекарственных средств, экскретируемых с желчью, повторно всасывается в кишечнике (энтеропеченоч-ная циркуляция), что способствует поддержанию концентрации препаратов в сыворотке. От десяти до пятидесяти процентов количества различных тетрациклинов экскретируется в мочу, главным образом с помощью гломерулярной фильтрации. Почечный клиренс тетрациклинов составляет от 10 до 90 мл/мин. С калом экскретируется 10-40 % препарата.
Доксициклин и миноциклин почти полностью всасываются в кишечнике и экскретируются медленнее, создавая устойчивые концентрации в сыворотке. Доксициклин не экскретируется почками и поэтому существенно не кумулирует при почечной недостаточности.
Клиническое применение
Тетрациклины исторически являются первыми антибиотиками широкого спектра действия. Они эффективны в отношении разнообразных микроорганизмов и поэтому часто используются для лечения без бактериологического подтверждения диагноза.
Тетрациклины — препараты выбора при инфекциях, вызываемых Mycoplasma pneumoniae, хламидиями, риккетсиями и некоторым спирохетами.
Оии эффективны при смешанных бактериальных инфекциях дыхательных путей, например при синусите и бронхите, и могут использоваться при различных инфекциях, вызываемых грамположитель-ными и грамотрицательными микроорганизмами, включая представителей семейства Vibrio, если микроорганизм не является устойчивым. При холере тетрациклины быстро останавливают распространение вибрионов, однако при эпидемиях этого заболевания отмечено появление случаев резистентности к тетрациклинам.
Тетрациклины эффективны при большинстве хламидийных инфекций, включая инфекции, передающиеся половым путем. Другие области использования включают лечение угрей, инфекций мочевыводящих путей, обострений бронхита, болезни Лайма, рецидивирующей лихорадки и лептоспироза. Доксициклин эффективен для профилактики лептоспироза.
При бруцеллезе, туляремии и чуме тетрациклины можно назначать в комбинации с аминогликозидами. Тетрациклины иногда используются для лечения протозойных инфекций, вызываемых, например, Entamoeba histolytica или Plasmodium falciparum.
Хотя миноциклин в дозе 200 мг перорально ежедневно в течение 5 дней может устранять менингококковое носительство, предпочтение отдается рифампину. Демеклоциклин тормозит действие АДГ в почечном канальце и может использоваться для лечения при повышении секреции АДГ или подобных пептидов некоторыми опухолями (см. главу 15).
А. Пероральная дозировка. Минимальная эффективная пероральная доза для быстро экскретирующихся тетрациклинов, таких как тетрациклина гидрохлорид, составляет 0.25 г 4 раза в день для взрослых и 20 мг/кг/день для детей. При тяжелых системных инфекционных заболеваниях необходимо использовать дозу в два-три раза большую, по крайней мере в течение 3-5 дней. При передающихся половым путем хламидийных инфекциях рекомендуется лечение в течение 10-14 дней.
Минимальная эффективная суточная доза де-меклоциклина или метациклина составляет 600 мг, для доксициклина — 100 мг и для миноциклина — 200 мг. Тетрациклины образуют хелатные соединения с металлами и поэтому не должны применяться вместе с молоком, антацидами или железа суль
фатом. Чтобы избежать депонирования в растущих костях или зубах, тетрациклины обычно не назначаются беременным или детям в возрасте до 8 лет.
Тетрациклина гидрохлорид в дозе 250-500 мг в сутки обычно используется в течение многих месяцев для лечения угревой сыпи у подростков или взрослых. Эта низкая доза подавляет липазную активность пропионибактерий (глава 63).
Б. Парентеральная дозировка. Некоторые тетрациклины используются для внутривенного введения в дозах 0.1-0.5 г каждые 6-12 часов (10-15 мг/кг в день детям). Внутримышечное введение обычно не применяется из-за болезненности инъекции и возможных местных воспалительных реакций. Имеется очень немного показаний для парентерального введения тетрациклинов (например, лечение пациента с риккетсиозом при бессознательном состоянии).
Побочные эффекты
Аллергические реакции (лихорадка лекарственного происхождения, высыпания на коже) на тетрациклины возникают редко. Большинство побочных эффектов обусловлено прямым токсическим действием и изменениями микробной флоры.
А. Желудочно-кишечные побочные эффекты. Тошнота, рвота и понос являются наиболее частыми причинами, по которым необходимо прекратить применение тетрациклинов. В течение первых нескольких дней приема препарата эти явления, по-видимому, вызваны прямым местным раздражающим действием лекарства на кишечник.
После нескольких дней перорального применения тетрациклины могут изменять нормальную микрофлору. В то время как некоторые бактерии кишечной группы подавляются, Pseudomonas, Proteus, стафилококки, резистентные бактерии кишечной группы, клостридии и грибы рода Candida усиленно размножаются. Это может приводить к функциональным расстройствам кишечника, анальному пруриту, кандидозу влагалища или слизистой оболочки полости рта или даже к развитию энтероколита с шоковым состоянием и летальным исходом.
Возникновение тошноты, анорексии и поноса можно предотвратить или устранить приемом препаратов вместе с пищей или карбоксиметилцеллю-лозой, снижением дозировки препарата или прекращением его приема. Псевдомембранозный энтеро
колит, обусловленный размножением Clostridium difficile или стафилококков, должен быть быстро диагностирован. В этом случае необходимо проводить пероральное лечение ванкомицином (глава 50).
Б. Костная ткань и ткани зуба. Тетрациклины легко связываются с кальцием, депонированным в недавно сформировавшейся костной ткани или в зубах маленьких детей. При назначении препарата во время беременности он может депонироваться в фетальных зубах, приводя к флюоресценции, изменению цвета и дисплазии эмали. Депонирование препарата в костях может приводить к нарушению роста скелета или его деформациям. Если препарат назначается детям в возрасте до 8 лет в течение длительного времени, также возможно развитие подобных изменений.
В. Токсическое действие на печень. Тетрациклины способны нарушать функцию печени, особенно при беременности, у пациентов с печеночной недостаточностью, а также при высокой дозировке и внутривенном введении. Имеются сообщения о развитии некроза печени при использовании внутривенной суточной дозы 4 г или больше.
Г. Токсическое действие на почки. Почечный канальцевый ацидоз и другое повреждающее действие на почки, приводящее к задержке азота, были отмечены при введении препаратов тетрациклина с истекшим сроком годности. При назначении тетрациклинов одновременно с мочегонными средствами может также возникать задержка азота. Тетрациклины, кроме доксициклина, могут кумулировать до токсического уровня у больных с нарушениями функции почек и ухудшать их состояние.
Д. Местное токсическое действие на ткани. Внутривенное введение может приводить к возникновению флеботромбоза. Внутримышечного введения желательно избегать, поскольку оно вызывает болезненное местное раздражение.
Е. Фотосенсибилизация. Системное введение тетрациклинов, особенно демеклоциклина, может повышать чувствительность к солнечному или ультрафиолетовому свету, особенно у светлокожих людей.
Ж. Вестибулярные расстройства. Головокружение, тошнота и рвота особенно характерны при использовании миноциклина. После применения миноциклина в дозах 200-400 мг/день такие реакции наблюдались у 35-70 % пациентов.
Медицинское и социальное значение необоснованного применения
Широко распространенное использование тетрациклинов для лечения нетяжелых заболеваний привело к развитию устойчивости даже у высокочувствительных видов возбудителей, например у пневмококков и стрептококков группы А. Широкомасштабное использование этих препаратов в клиниках стало причиной появления тетрациклинустойчивых организмов в качестве возбудителей суперинфекций. В определенной мере именно с неправильным применением тетрациклинов (в сравнении с другими антибиотиками) связано увеличение частоты грибковой инфекции у госпитализируемых больных с тяжелыми формами различных заболеваний.
Тетрациклины использовались в качестве добавки в корма животных для увеличения скорости роста. Эта практика привела к распространению устойчивых форм бактерий и плазмид, передающих резистентность к тетрациклинам. Такое использование имело следствием возникновение тетрациклинустойчивых инфекционных заболеваний среди фермеров, владельцев животных, рабочих скотобоен и, возможно, широких слоев населения. По этой причине некоторые страны (например, Великобритания) запрещают использование тетрациклинов в кормах.
С другой стороны, тетрациклины весьма полезны не только для лечения острых форм инфекционных заболеваний, но и для профилактики обострений при хроническом бронхите и бронхоэктатической болезни. Их применение значительно снижает число рецидивов у многих людей с хроническими заболеваниями.
Препараты
Хлорамфеникол (генерик, Хлоромицетин)
Перорально: капсулы по 250 мг; 150 мг/5 мл суспензия
Парентерально: порошок для приготовления растворов для инъекций 100 мг/мл
Демеклоциклин (Декломицин)
Перорально: таблетки по 150,300 мг; капсулы по 150 мг
Доксициклин (генерик, Вибрамицин, др.) Перорально: таблетки и капсулы по 50,100 мг; порошок для приготовления суспензий 25,50 мг/5 мл; сироп 50 мг/5 мл
Парентерально: порошок для приготовления инъекционных растворов 100,200 мг во флаконе
Метациклин (Рондомицин)
Перорально: капсулы по 150, 300 мг
Миноциклин (Миноцин)
Перорально: таблетки и капсулы по 50, 100 мг; 50 мг/5 мл суспензия Парентерально: порошок для приготовления инъекционных растворов 100 мг во флаконе
Окситетрациклин (генерик, Террамицин) Перорально: капсулы по 250 мг Парентерально: 50,125 мг/мл для внутримышечного введения; порошок для приготовления растворов для внутривенного введения 250, 500 мг во флаконе
Тетрациклин (генерик, Акромицин V, др.) Перорально: капсулы по 100, 250, 500 мг; таблетки по 250 мг; 125 мг/5 мл суспензия Парентерально: порошок для приготовления растворов для внутримышечного введения 100, 250 мг во флаконе;
порошок для приготовления растворов для внутривенного введения 250,500 мг во флаконе
Избранная литература
Dajani A. S., Kauffman R. Е. The renaissance of chloramphenicol. Pediatr. Clin. North. Am. 1981; 28: 195.
Hughes W. T. et al. Guidelines for the use of antimicrobial agents in neutropenic patients with unexplained fever. J. Infect. Dis. 1990; 161:381.
Chopra I., Hawkey P. M., Hinton M. Tetracyclines, molecular and clinical aspects. J. Antimicrob. Chemother. 1992; 29: 245.
Sexually transmitted diseases: Treatment guidelines. MMWR Morb. Mortal. Wkly. Rep. 1989; 38: S8.
Sigal L. H. Current recommendations for the treatment of Lyme disease. Drugs, 1992; 43: 683.
Speer B. S., Shoemaker M. B., Salyers A. A. Bacterial resistance to tetracycline: Mechanism, transfer, and clinical significance. Clin. Microbiol. Rev. 1992; 5: 387.
АМИНОГЛИКОЗИДЫ И ПОЛИМИКСИНЫ 4-5
Эрнест Явец
Аминогликозиды
Аминогликозиды — группа бактерицидных препаратов, первоначально полученных из различных видов Streptomyces и имеющих общие химические, антимикробные, фармакологические и токсические свойства. В настоящее время в группу аминогликозидов входят стрептомицин, неомицин, канами-цин, амикацин, гентамицин, тобрамицин, сизоми-цин, нетилмицин и другие. Все эти препараты тормозят синтез белка в бактериях, но имеют общий недостаток: микроорганизмы вырабатывают множественные типы лекарственной устойчивости к ним.
Все аминогликозиды являются потенциально ототоксичными и нефротоксичными. Они могут накапливаться в организме при нарушении функции почек, что требует специальной корректировки доз, назначаемых больным с почечной недостаточностью.
Наиболее широко аминогликозиды используются при инфекциях, вызванных грамотрицательны-ми бактериями кишечной группы, особенно при бактериемии, сепсисе, эндокардите. Стрептомицин — самый старый и лучше всего изученный аминогликозид. Гентамицин, тобрамицин и амикацин — наиболее часто применяемые в настоящее время аминогликозиды. Неомицин и канамицин сейчас назначают только местно или энтерально.
Общие свойства аминогликозидов
А. Физические и химические свойства. Аминогликозиды водорастворимы и устойчивы в растворе. Они более активны в щелочной среде, чем в кислой. В их составе выделяют гексозное ядро — стрептидин (в стрептомицине) либо дезоксистреп-тамин (в других аминогликозидах), к которому с помощью гликозидных связей присоединены аминосахара (рис. 45-1 и 45-2). Каждый препарат ха
рактеризуется определенным количеством и видом аминогликозидных групп. In vitro аминогликозиды могут образовывать комплексные соединения с Р-лактамными антибиотиками, утрачивая при этом активность.
Б. Механизм действия. Аминогликозиды относятся к бактерицидным антибиотикам, поскольку необратимо тормозят белковый синтез. Однако точный механизм их бактерицидного эффекта не вполне ясен. Действие антибиотика начинается с проникновения через клеточную оболочку. Этот процесс связан с активным транспортом и частично с пассивной диффузией вещества. Последняя может быть существенно усилена присутствием в клетке препаратов, нарушающих синтез клеточной стенки, например пенициллинов. Так как активный транспорт является кислородзависимым процессом, аминогликозиды сравнительно неэффективны в отношении анаэробов.
После проникновения аминогликозида в клетку он связывается с рецепторами на ЗОБ-субъеди-нице бактериальной рибосомы. Эти рецепторы (некоторые из них были выделены в чистом виде) являются белками, синтез которых находится под хро-
у_________л ч/рНз
Стрептидин Стрептоза N-метил-Ь
глкжозамин
К_________V——________>
Стрептобиозамин
Рис. 45-1. Структура стрептомицина
О ®
н2с—nh2 nh2 NH —R
ОН
ОН
НО
НО NH2 (7
СН2 —ОН
Канамицин R:
—н
О ОН
II I Амикацин R: —С — CH — СН2 — СНг — NH2
Гентамицин, нетилмицин
Гентамицин Ci
Гентамицин С2 Гентамицин Cia Нетилмицин
Кольцо 1 Кольцо II
R1 R2 С4-С5 связь R3
СНз СНз Н Н СНЗ Н н н Одинарная Одинарная Одинарная Двойная Н н н C2H5
Тобрамицин
Рис. 45-2. Химическое строение основных аминоглико-зидных антибиотиков. Кольцо II представлено 2-дезок-систрептамином. Заметно сходство между канамицином и амикацином, а также между гентамицином, нетилми-цином и тобрамицином. Цифры, обведенные кружком в формуле канамицина, указывают на места воздействия контролируемых плазмидами бактериальных ферментов, которые инактивируют этот препарат (1 и 2 — ацетилаза; 3 — фосфорилаза; 4 — аденилилаза). Амикацин устойчив к разрушающему действию 2,3 и 4
мосомным контролем. Аминогликозиды способны тормозить рибосомальный белковый синтез по крайней мере тремя путями: 1) взаимодействуя с инициаторным комплексом синтеза белка; 2) вызывая неправильное чтение кода иРНК, что приводит к включению не тех аминокислот в белок; 3) расщепляя полисомы с образованием нефункциональных моносом.
В. Механизм развития лекарственной устойчивости. Установлено три основных механизма. 1. Микроорганизм приобретает способность вырабатывать ферменты, инактивирующие аминогликозиды аденилированием, ацетилированием или фосфорилированием. Это основной тип устойчивости среди грамотрицательных бактерий кишечной группы, который контролируется плазмидами. Такая трансмиссивная устойчивость имеет большое клиническое и эпидемиологическое значение. 2. Могут возникать изменения в поверхности бактериальной клетки, через которую осуществляется доступ или транспорт аминогликозида в цитоплазму. Такие изменения регулируются хромосомами (например, у энтерококков) или плазмидами (например, у грамотрицательных бактерий). 3. Рецепторный белок 308-субъединицы рибосомы может отсутствовать или быть измененным в результате хромосомной мутации. Кроме того, факультативные микроорганизмы, существующие в анаэробных условиях, обычно устойчивы к аминогликозидам, поскольку у них отсутствует кислородзависимый процесс транспорта препарата внутрь клетки. Это уже фактически четвертый механизм развития устойчивости к аминогликозидам.
Г. Фармакокинетика. Аминогликозиды плохо всасываются или не всасываются вовсе из неповрежденного желудочно-кишечного тракта, но могут всасываться при его изъязвлении. При энтеральном приеме практически вся доза экскретируется с калом. После внутримышечного введения аминогликозиды хорошо всасываются в кровь, создавая пиковые концентрации в плазме в течение 30-90 минут. Только приблизительно 10 % всосавшегося количества связывается с белками плазмы. Иногда аминогликозиды вводят внутривенно.
Будучи высокополярными соединениями, аминогликозиды плохо проникают в клетки и практически не поступают в центральную нервную систему и ткани глаза. Однако при активном воспалительном процессе их уровень в цереброспинальной жидкости достигает 20 % от уровня в плазме,
а пргьменингите у новорожденных обнаруживается еще более высокая концентрация в ликворе. Для создания высоких уровней этих препаратов в цереброспинальной жидкости необходимо интрате-кальное или внутрижелудочковое введение. Даже после парентерального введения концентрации амйногликозидов в большинстве тканей невысоки, кроме коркового вещества почки. Концентрация в основных секретах также незначительна: в желчи она может достигать 30 % от уровня в крови. При длительной терапии диффузия в плевральную или синовиальную жидкость может создавать концентрации, составляющие 50-90 % от таковой в плазме. Эти препараты не подвержены существенному метаболическому разрушению в организме хозяина. Период их полураспада в сыворотке составляет 2-3 часа. Экскретируются аминогликозиды главным образом с помощью гломерулярной фильтрации, которая существенно уменьшается при нарушении функции почек. Аминогликозиды только частично удаляются гемодиализом, например для гентамицина эта часть составляет только 40-60 %, а при перитонеальном диализе — еще меньше.
У пациентов с нарушениями функции почек имеется опасность накопления лекарственного средства и возникновения токсических эффектов. Поэтому при лечении таких больных необходимо либо увеличение интервала между введениями при сохранении обычной дозы лекарственного средства, либо снижение дозы при сохранении обычного интервала. Были построены номограммы и произведены расчеты подбора доз препаратов с учетом уровня креатинина в сыворотке больного. Самая простая формула расчета необходимой для почечного больного дозы заключается в делении дозы, рассчитанной для пациента с нормальной почечной функцией, на уровень креатинина (мг/дл). Так, пациент с массой тела 60 кг при нормальной функции почек может получать 300 мг/день гентамицина, назначаемого по 100 мг каждые 8 часов. Пациент с массой тела 60 кг при уровне креатинина в сыворотке 3 мг/дл должен получать 100 мг/день, т. е. по 33 мг каждые 8 часов. Однако и у различных пациентов с одинаковым уровнем креатинина в сыворотке имеются значительные вариации в концентрации аминогликозидов в ней. Поэтому во избежание серьезных токсических эффектов весьма желательно, особенно при использовании высоких доз препаратов, измерять их уровни в крови. Мак
симальные уровни должны наблюдаться через 0.5-1 час после инфузии, а минимальные — непосредственно перед следующим введением.
Д. Побочные эффекты. Гиперчувствительность к аминогликозидам встречается редко. Все они могут вызывать ототоксические и нефротоксические эффекты различной степени. Ототоксичность проявляется потерей слуха (повреждение улитки), начиная с высокочастотных тонов, или вестибулярной патологией, проявляющейся головокружением, атаксией и нарушениями равновесия. Нефротоксическое действие приводит к повышению уровня сывороточного креатинина или к снижению клиренса креатинина. При использовании очень высоких доз аминогликозиды могут вызвать курареподоб-ный эффект с развитием нервно-мышечной блокады, которая кончается параличом дыхательной мускулатуры. Антидотами в данном случае могут быть кальция глюконат (необходимо быстрое введение) или неостигмин.
Е. Клиническое применение. Наиболее широко аминогликозиды используются при инфекциях, возбудителями которых являются грамотрицатель-ные бактерии кишечной группы, или в случае подозрения на развитие сепсиса. При лечении бактериемии или эндокардита, вызванных фекальным стрептококком или некоторыми грамотрицатель-ными бактериями, аминогликозиды назначаются вместе с пенициллинами, которые увеличивают проницаемость бактериальной стенки. Аминогликозиды выбирают в качестве средств антибиотико-терапии, если недавние лабораторные тесты выявили чувствительность возбудителей к этим антибиотикам в конкретном регионе или больнице, с последующим определением чувствительности выделенных от данного больного бактерий. Все аминогликозиды, будучи положительно заряженными веществами, а также полимиксины нейтрализуются в крови полианетолсульфонатом натрия и другими полианионными детергентами.
Стрептомицин
Стрептомицин (рис. 45-1) был выделен из штамма Streptomyces griseus Ваксманом и его коллегами в 1944 г. Дигидрострептомицин может быть получен каталитическим восстановлением стрептомицина тригидрохлорида. Оба препарата имеют сходное химическое строение и одинаковые антимикробные свойства. Однако дигидрострептомицин
более ототоксичен, чём стрептомицин, и в настоящее время не применяется.
Спектр антимикробной активности стрептомицина и механизмы развития устойчивости к нему возбудителей типичны для всех представителей группы аминогликозидов. В настоящее время у большинства видов появились резистентные к стрептомицину микроорганизмы, что существенно ограничило применение этого препарата (об исключениях речь пойдет далее). Существуют стрептоми-цинзависимые бактерии, которые используют это вещество для своего роста. Такое явление связано с мутацией, приводящей к изменениям рецепторного белка Р12.
Лекарственная устойчивость у ранее чувствительных к стрептомицину микроорганизмов развивается достаточно быстро, поэтому срок лечения этим антибиотиком в качестве единственного лекарственного средства обычно ограничивается пятью днями.
Клиническое применение
А. Инфекционные заболевания, вызываемые микобактериями. В настоящее время стрептомицин редко используется для начальной терапии туберкулеза. При далеко зашедших стадиях туберкулеза, милиарной диссеминации, менингите или тяжелых поражениях органа стрептомицин может применяться в дозе 0.5-1 г (30 мг/кг/день), внутримышечно, в комбинации с другими противоми-кобактериальными препаратами. Такое введение продолжают в течение нескольких недель или месяцев, вначале ежедневно, а позже два раза в неделю (глава 46).
Б. Нетуберкулезные инфекции. При чуме, туляремии и иногда при бруцеллезе стрептомицин вводят внутримышечно в дозе 1 г/день (15 мг/кг в день для детей), в то время как тетрациклины в этих случаях можно назначать внутрь.
В. Комбинированное лечение. При некоторых инфекциях бактерицидный эффект с последующим выздоровлением может давать одновременный прием пенициллина вместе с аминогликозидом. Так вылечивают инфекционный эндокардит, вызванный фекальным стрептококком (энтерококком) или зеленящим стрептококком, а также бактериемии, вызванные некоторыми грамотрицательными аэробными бактериями, например видами Pseudomonas, особенно при иммунодефицитных состояниях.
Побочные реакции
А. Аллергия. Лихорадка, высыпания на коже и другие аллергические проявления могут быть связаны с гиперчувствительностью к стрептомицину. Они чаще отмечаются после длительного контакта с лекарственным средством как у больных, получающих длительный курс лечения (например, при туберкулезе), так и у медицинского персонала, контактирующего с лекарственным средством. (Медсестры, готовящие растворы, должны одевать перчатки.) Иногда в этих случаях оказывается успешной десенсибилизация.
Б. Токсические явления. Обычно отмечается незначительная болезненность в месте введения. Наиболее серьезными токсическими эффектами являются нарушения вестибулярной функции — головокружение и потеря равновесия. Частота и выраженность этих расстройств обычно пропорциональны возрасту пациента, уровню препарата в крови и продолжительности лечения. Вестибулярные нарушения могут возникать после сохранения необычно высоких уровней препарата в крови в течение нескольких недель (например, у больных с нарушенной функцией почек) или при относительно низком уровне препарата в крови, если он поддерживается в течение нескольких месяцев. После отмены препарата нередко наблюдается частичное восстановление нарушенных функций.
Для уменьшения вероятности возникновения ототоксического действия следует избегать одновременного или последовательного применения стрептомицина с другими аминогликозидами. Применение стрептомицина при беременности может вызвать потерю слуха у новорожденного.
Общие медицинские проблемы, связанные с необоснованным применением
Появление и распространение стрептомицинус-тойчивых бактерий связано с широким использованием этого лекарственного средства, особенно в необоснованной комбинации с пенициллином. Достаточно частой является множественная устойчивость возбудителей инфекций мочевыводящих путей, что наряду с внутрибольничной передачей таких микроорганизмов создает серьезные проблемы в лечении. Установлено, что в США до 15 % случаев первичного инфицирования при легочном тубер
кулезе у детей можно отнести за счет стрептоми-цин-устойчивых туберкулезных бацилл.
Гентамицин
Гентамицин является аминогликозидным комплексом (рис. 45-2), выделенным из Micromonospora purpurea. Он эффективен в отношении инфекций, вызываемых как грамположительными, так и грам-отрицательными микроорганизмами, и во многом напоминает по свойствам другие аминогликозиды. Сизомицин в значительной степени подобен компоненту С1агентамицина.
Антимикробная активность
In vitro гентамицина сульфат в концентрациях 2-10 мкг/мл подавляет многие виды стафилококков, представителей кишечной группы и других грамотрицательных бактерий. Одновременное использование карбенициллина или тикарциллина с гентамицином может приводить к синергизму и развитию бактерицидного эффекта в отношении некоторых видов Pseudomonas, Proteus, Enterobacter, Klebsiella и других грамотрицательных палочек, а также зеленящего и фекального стрептококков. Однако пенициллин и гентамицин не смешиваются in vitro.
Устойчивость
Большинство стрептококков устойчиво к гентамицину вследствие слабой способности препарата проникать к рибосомам клеток. Тем не менее такие стрептококки могут погибать при одновременном применении аминогликозида с антибиотиком, действующим на клеточную стенку микроорганизма (например, пенициллином). Устойчивость в ряду грамотрицательных бактерий увеличивается пропорционально суммарному количеству препарата, которое использовалось в данном стационаре. Эту устойчивость микроорганизмов чаще всего объясняют как распространяемую плазмидами, которые отвечают за выработку ферментов, инактивирующих гентамицин. Организмы, резистентные к гентамицину, иногда устойчивы и к тобрамицину, но пока еще редко — к амикацину.
Клиническое применение
А. Внутримышечное или внутривенное введение. В настоящее время гентамицин и тобрамицин
используются главным образом при тяжелых инфекциях (например, при сепсисе и пневмонии), вызываемых грамотрицательными бактериями, которые, вероятно, будут устойчивы к другим антибиотикам. К таким видам относятся прежде всего Pseudomonas, Enterobacter, Serratia, Proteus, Acineto-bacter и Klebsiella. Больные с такими формами инфекционного процесса часто страдают иммунодефицитом, поэтому сочетанное применение аминогликозида с цефалоспоринами или с пенициллином может спасти их жизни. В таких ситуациях гентамицин в дозе 5-7 мг/кг/день вводится внутримышечно или внутривенно в три приема в равных дозах. Гентамицин или тобрамицин назначают также одновременно с пенициллином G для получения бактерицидного эффекта при эндокардите, возбудителями которого являются зеленящий стрептококк или Streptococcus faecalis.
При использовании гентамицина необходим постоянный контроль за функциями почек, органа слуха и вестибулярного аппарата, особенно у пациентов с нарушениями функции почек. В настоящее время разработаны прямые методы ферментативного или радиоиммунного определения уровня гентамицина в сыворотке. При почечной недостаточности дозу нужно значительно уменьшить.
Б. Местное применение. Кремы, мази или растворы, содержащие 0.1-0.3 % гентамицина сульфата, используются для лечения инфицированных ожогов, ран или других поражений кожи и для предотвращения инфекционных осложнений при внутривенной катетеризации. При локальном применении гентамицин частично инактивируется гнойным экссудатом. Такого рода местное использование в стационарах должно быть ограничено, чтобы предотвратить развитие устойчивых бактерий. Для лечения инфекционных заболеваний глаз можно вводить субконъюнктивально 10 мг препарата.
В. Интратекальное введение. Менингит, вызванный грамотрицательными бактериями, можно лечить, используя интратекальное введение гентамицина сульфата в дозах 1-10 мг/день. Тем не менее при менингите у новорожденных ни интратекальное, ни внутрижелудочковое введение гентамицина не дает необходимого лечебного эффекта, а внутрижелудочковое даже оказывает выраженное токсическое действие.
Побочные эффекты
Они аналогичны побочным эффектам стрептомицина и других аминогликозидов. Нефротоксичность препарата обусловливает необходимость точного подбора доз и режима введения, особенно при сниженной выделительной функции почек. При любой возможности определения уровня гентамицина в сыворотке такое исследование необходимо проводить, поскольку значительно облегчает выработку тактики ведения больного в трудных клинических ситуациях. Ототоксичность проявляется в основном в виде вестибулярных нарушений, что, вероятно, связано с деструкцией волосковых клеток при длительном сохранении высоких концентраций препарата (> 10 мкг/мл). Иногда возникает потеря слуха, которая может иметь тяжелый характер и быть необратимой. Частота возникновения аллергических реакций на гентамицин плохо документирована.
Тобрамицин
Спектр антибактериального действия этого аминогликозида (структура приведена на рис. 45-2) подобен спектру гентамицина. Хотя выявлена некоторая перекрестная устойчивость микроорганизмов к гентамицину и тобрамицину, для отдельных штаммов возбудителей этот факт не имеет определенной прогностической ценности в плане предсказания эффективности препарата. В связи с этим необходимо проведение специальных лабораторных тестов на чувствительность конкретного возбудителя к антибиотику.
Фармакологические свойства тобрамицина практически идентичны свойствам гентамицина. Суточная доза тобрамицина составляет 5-7 мг/кг внутримышечно или внутривенно. Эту дозу делят на три равных приема и назначают каждые 8 часов. Приблизительно 80 % лекарственного средства экскретируется из организма с помощью гломерулярной фильтрации с мочой в течение 24 часов после введения. При уремии доза лекарственного средства должна быть уменьшена. Соответствующий расчет производится следующим образом: 1 мг/кг каждые (6 х концентрация креатинина в сыворотке [мг/дл] ) часов. При почечной недостаточности для корректировки конкретной дозы и режима назначения желательно определение концентраций препарата в крови. Некоторое количество тобрами
цина может быть выведено из организма при перитонеальном диализе и приблизительно 50 % — при гемодиализе.
Как и гентамицин, тобрамицин является аминогликозидом, наиболее часто используемым в комбинациях с тикарциллином или цефалоспорином для лечения бактериального сепсиса, вызываемого грамотрицательными бактериями, а также в комбинации с пенициллином G для лечения эндокардита, вызываемого энтерококками.
Подобно другим аминогликозидам, тобрамицин является ототоксичным и нефротоксичным препаратом. Нефротоксичность тобрамицина несколько менее выражена, чем у гентамицина. Он не должен использоваться одновременно с другими препаратами, имеющими подобные побочные эффекты, а также с мочегонными средствами, которые способны повышать концентрацию аминогликозида в тканях.
Амикацин
Амикацин — полусинтетическое производное канамицина, обладающее меньшей токсичностью (рис. 45-2). Он относительно устойчив к нескольким ферментам, инактивирующим гентамицин и тобрамицин, что можно использовать для воздействия на некоторые микроорганизмы, устойчивые к этим препаратам. В то же время резистентность бактерий к амикацину, обусловленная утратой способности проникать в клетку, развивается медленно. Многие грамотрицательные бактерии кишечной группы, включая различные виды Proteus, Pseudomonas, Enterobacter и Serratia, in vitro угнетаются концентрациями амикацина 1-20 мкг/мл. После инъекции 500 мг амикацина каждые 12 часов (15 мг/кг/день) внутримышечно пиковые концентрации в сыворотке составляют 10-30 мкг/мл. Некоторые инфекции, вызванные грамотрицательными бактериями, резистентны к лечению гентамицином, но в то же время поддаются лечению амикацином. При инфекциях центральной нервной системы требуется интратекальное или внутрижелудочковое введение препарата в дозе 3-10 мг ежедневно.
Подобно всем аминогликозидам, амикацин дает нефротоксический и ототоксический (особенно для слуховой части восьмой пары черепных нервов) эффекты. У пациентов с почечной недостаточностью необходимо постоянное определение концентраций этого препарата. Нужно избегать
одновременного применения с петлевыми диуретиками (например, фуросемидом, этакриновой кислотой).
Нетилмицин
Этот аминогликозид появился на фармацевтическом рынке США в 1983 г. По своим характеристикам он во многом напоминает гентамицин и тобрамицин. Однако присоединение этиловой группы к аминогруппе в 1-м положении 2-дезоксистрепта-минового кольца (кольцо II, рис. 45-2) стерически защищает молекулу нетилмицина от ферментативного расщепления в 3-амино- (кольцо II) и 2-гид-роксил- (кольцо III) позициях. Поэтому нетилмицин не может быть инактивирован многими гента-мицинустойчивыми и тобрамицинустойчивыми бактериями.
Дозирование (5-7 мг/кг/день) и пути введения такие же, как у гентамицина. Основным показанием для применения нетилмицина являются ятрогенные инфекции у тяжелых больных с иммунодефицитом при очень высоком риске возникновения грамотрицательного бактериального сепсиса во время стационарного лечения.
Нетилмицин оказывает менее выраженное ото-токсическое, а также, вероятно, наименьшее нефротоксическое действие по сравнению с другими аминогликозидами.
Канамицин и неомицин
Эти препараты достаточно близки. Неомицин был выделен Ваксманом в 1949 г. из культуры Streptomyces fradiae, канамицин (рис. 45-2) — Уме-зава в 1957 г. из Streptomyces kanamyceticus. Другими представителями этой группы являются фрами-цетин и паромомицин. Все они имеют близкие свойства.
Антимикробная активность и устойчивость микроорганизмов
Препараты группы неомицина активны в отношении грамположительных и грамотрицательных бактерий, а также некоторых микобактерий. В целом Pseudomonas и стрептококки устойчивы к ним. Механизмы антибактериального действия этих препаратов и устойчивости возбудителей к ним такие же, как и у других аминогликозидов. Широко рас
пространенное их использование в подготовке кишечника к избирательным хирургическим вмешательствам привело к селекции устойчивых микроорганизмов и появлению вспышек энтероколита в больницах. У некоторых возбудителей имеется полная перекрестная устойчивость к канамицину и неомицину.
Фармакокинетика
Препараты группы неомицина не подвергаются существенному всасыванию из желудочно-кишечного тракта. После перорального приема они вызывают подавление или изменение кишечной флоры, а лекарственное средство экскретируется с калом.
Выведение этих лекарственных средств осуществляется главным образом с мочой с помощью гломерулярной фильтрации.
Клиническое применение
Из-за высокой токсичности применение канами-цина и неомицина ограничено пероральным и местным введением. В настоящее время они не назначаются парентерально.
А. Местное применение. Растворы, содержащие 1-5 мг/мл, используются для нанесения на инфицированные поверхности или для введения в суставы, плевральную полость, местно на ткани или в полости абсцесса, где присутствует инфекция. Суммарная доза лекарственного средства при таком использовании не должна превышать 15 мг/кг в день в связи с возможностью частичного всасывания и системного токсического действия. Мази, содержащие 1-5 мг/г, наносятся на места инфицированных поражений кожи для подавления стафилококковой инфекции. Некоторые мази в дополнение к неомицину содержат полимиксин и бацитрацин.
Б. Пероральное применение. При подготовке к операциям на кишечнике неомицин назначают перорально в дозе 1 г каждые 6-8 часов в течение 1-2 дней, часто в сочетании с 1 г эритромицина. Это приводит к подавлению аэробной флоры кишечника при небольшом влиянии на анаэробную. При печеночной коме возможно длительное угнетение бактерий кишечной флоры назначением 1 г каждые 6-8 часов, что наряду с ограничением приема белка способствует уменьшению интоксикации аммиа
ком. Паромомицин в дозе 1 г каждые 6 часов перорально в течение двух недель эффективен при кишечном амебиазе. Неомицин иногда используют для лечения гиперлипидемии (глава 34).
Побочные эффекты
Все представители группы неомицина оказывают нефротоксическое и ототоксическое действие. Слух страдает в большей степени, чем вестибулярные функции. Имеют место случаи возникновения глухоты, особенно у взрослых пациентов с нарушениями функции почек и длительным сохранением высоких концентраций препаратов в крови.
При стремительном всасывании канамицина, введенного в перитонеальную полость после операции (3-5 г), отмечается возникновение кураре-подобного эффекта с нервно-мышечной блокадой и остановкой дыхания. В подобном случае в качестве антидотов можно использовать кальция глюконат и неостигмин.
Хотя гиперчувствительность в целом — не частое явление для этой группы препаратов, при длительной аппликации на кожу и глаза неомицинсодержащей мази наблюдались тяжелые аллергические реакции.
Спектиномицин
Спектиномицин является аминоциклитольным антибиотиком (родственным аминогликозидам), который выпускается в виде дигидрохлорида пентагидрата для приготовления суспензии для внутримышечного введения. Хотя он активен in vitro в отношении многих грамположительных и грамотрицательных организмов, спектиномицин используется только в качестве альтернативного средства для лечения гонореи у больных, которые могут быть гиперчувствительными к пенициллину, или при устойчивости гонококков к пенициллину и другим препаратам. Большинство гонококков подавляется спектиномицином при концентрациях в крови 6 мкг/мл. Приблизительно 10 % гонококков может быть устойчиво к спектиномицину, но не существует никакой перекрестной резистентности к этим антибиотикам и другим препаратам, используемым при гонорее.
Спектиномицин быстро всасывается после внутримышечного введения. Назначается однократно в дозе 2 г (40 мг/кг). Возможны болевые ощущения
в месте введения, иногда отмечаются лихорадка и тошнота. Редко наблюдаются нефротоксическое действие и развитие анемии.
Полимиксины
Полимиксины — это группа полипептидов, активных в отношении грамотрицательных бактерий. В связи с чрезмерно высокой нефротоксичностью большинство этих препаратов в настоящее время не применяется, за исключением полимиксинов В и Е.
Химическое строение
Полимиксины являются катионными основными полипептидами с мол. м. примерно 1400. Все они содержат жирную D-6-метилоктан-Ьовую кислоту и аминокислоты L-треонин и L-диаминомасляную кислоту. Их сульфаты водорастворимы и очень стабильны. 1 мкг чистого полимиксина В сульфата равняется 10 единицам.
Антимикробная активность и устойчивость микроорганизмов
Полимиксины оказывают бактерицидное действие на многие грамотрицательные палочки, включая Pseudomonas, в концентрациях 1-5 мкг/мл. Они присоединяются к мембранам клетки бактерий, богатым фосфатидилэтаноламином, и нарушают их проницаемость и транспортные механизмы. Это действие тормозится катионами. Таким образом, полимиксины действуют подобно катионным детергентам.
Грамположительные микроорганизмы, Proteusn Neisseria, являются высокоустойчивыми. Это, вероятно, обусловлено неспособностью препаратов проникать во внешнюю мембрану. В чувствительных бактериальных популяциях резистентные к этой группе препаратов мутанты встречаются редко.
Фармакокинетика
Полимиксины не всасываются в кишечнике. После парентерального введения их концентрации в крови и тканях достаточно низки. Полимиксины активно связываются с осколками клеток, кислыми фосфолипидами, компонентами гнойного экс
судата и эндотоксинами грамотрицательных бактерий. Они не проникают в живые клетки.
Выведение осуществляется главным образом через почки, и в моче могут создаваться высокие концентрации. Выведение нарушается при почечной недостаточности.
Клиническое применение
Полимиксины редко рассматриваются как средства для системного введения из-за их слабой способности проникать в ткани и существенной нефротоксичности и нейротоксичности. В настоящее время доступны другие более эффективные и менее токсичные препараты. Поэтому использование полимиксинов теперь ограничено местным назначением.
Растворы с содержанием 1-10 мг/мл полимиксина В сульфата могут наноситься на инфицированные поверхности, вводиться в плевральную полость и полость суставов, использоваться для суб-коныонктивального введения или для вдыхания в виде аэрозоля. Суммарная доза не должна превышать 2.5 мг/кг/день.
Мази с содержанием полимиксина В 0.5 мг/г в смеси с бацитрацином или неомицином (или с обоими веществами) обычно накладываются на инфицированные поверхности при повреждениях кожи. Поскольку полимиксины не всасываются в кишечнике, их можно давать перорально в качестве профилактических средств больным с иммунодефицитом для подавления аэробных грамотрицательных бактерий кишечной флоры.
Побочные эффекты
Нежелательные местные реакции и аллергические проявления при локальном применении отмечаются редко. При всасывании полимиксинов в кровь и при создании определенных уровней в плазме они могут вызвать парестезии, головокружения и нарушения координации движений. Эти явления исчезают после выведения лекарственного средства. Очень высокие концентрации в крови (> 30 мкг/мл) могут вызвать дыхательный паралич, который устраняется введением кальция глюконата. При всасывании полимиксинов возможно появление протеинурии и гематурии, что свидетельствует о нарушении функции почечных канальцев. При почечной недостаточности может развиваться азотемия.
Препараты
Аминогликозиды
Амикацин (генерик, Амикин)
Парентерально: 50,250 мг (во флаконах) для внутримышечного и внутривенного введения Гентамицин (генерик, Гарамицин, Енамицин)
Парентерально: 60, 80,100 мг в системах для внутривенного введения; 10,40 мг/мл во флаконах для внутримышечного и внутривенного введения; 2 мг/мл во флаконах для интратекального введения
Канамицин (генерик, Кантрекс, Клебцил) Перорально: капсулы по 500 мг Парентерально: 500, 1000 мг для внутримышечного, внутривенного введения;
75 мг для инъекций в педиатрии
Неомицин (генерик, Мицифрадин, Необиотик) Перорально: таблетки по 500 мг; 125 мг/5 мл раствор
Парентерально: ггорошок для приготовления растворов для внутримышечного введения (500 мг во флаконе)
Нетилмицин (Нетромицин)
Парентерально: 100 мг/мл
для внутримышечного, внутривенного введения
Паромомицин (Хуматин)
Перорально: капсулы по 250 мг Спектиномицин (Тробицин)
Парентерально: порошок для приготовления растворов для внутримышечного введения (2,4 г во флаконе)
Стрептомицин (генерик)
Парентерально: 400 мг для внутримышечного введения; порошок для приготовления инъекционных растворов
Тобрамицин (генерик, Небцин)
Парентерально: 10,40 мгдля внутримышечного, внутривенного введения; 10, 30,40 мг порошка для приготовления инъекционного раствора
Полимиксины
Колистиметат(Коли-Мицин М)
Парентерально: порошок для приготовления растворов для внутримышечного, внутривенного введения (150 мг во флаконе)
270 Раздел VIII. Химиотерапевтические средстве
Колистин [Полимиксин EJ (Коли-Мицин S) Перорально: порошок для приготовления суспензии 25 мг/5 мл Полимиксин В (генерик, Аэроспорин) Парентерально: порошок для приготовления растворов для внутривенного, интратекаль-ного введения (500 000 ЕД во флаконе) Избранная литература Hughes W. Т. et al. Guidelines for the use of antimicrobial agents in neutropenic patients with unexplained fever. J. Infect. Dis. 1990; 161:381.
Антимикобактериальные препараты
46
Эрнест Явец
Инфекционные заболевания, вызываемые микобактериями, могут протекать с соответствующей симптоматикой или бессимптомно, но обычно имеют отчетливый хронический характер. В связи с этим лечение представляет необычайно сложную проблему. В главе описаны препараты, используемые для лечения туберкулеза (инфекционного заболевания, вызываемого Mycobacterium tuberculosis), инфекций, вызванных различными “атипичными" микобактериями, и лепры (заболевания, обусловленного инфицированием Mycobacterium leprae). Наблюдаемое в течение определенного периода снижение заболеваемости микобактериальными инфекциями (благодаря эффективной химиотерапии и социальным мерам профилактики) во всем мире сменилось увеличением частоты их возникновения вследствие эпидемии СПИДа.
Противотуберкулезные средства
Первым антимикробным лекарственным средством, которое показало поразительную активность в отношении туберкулезных бацилл, был стрептомицин. Он остается важным препаратом -для лечения тяжелых форм туберкулеза, но в настоящее время не относится к средствам выбора для начальной терапии. Препаратами первого ряда теперь являются изониазид, рифампин, этамбутол и пиразин-амид, которые используют на начальном этапе. Стрептомицин же остается альтернативным средством. Некоторые средства, являющиеся препаратами второго ряда при туберкулезе, рассмотрены в настоящей главе лишь кратко.
В лечении туберкулеза и других микобактериальных инфекций существуют своеобразные проб
лемы. Эти инфекционные заболевания имеют обычно очень длительное хроническое течение, но могут вызывать и сверхострые летальные осложнения. Микроорганизмы, как правило, локализуются внутриклеточно, имеют длительные периоды метаболической инертности и характеризуются высокой вероятностью развития устойчивости к любому из применяемых обычно лекарственных препаратов. Все эти моменты обусловливают трудности противотуберкулезной терапии.
Для предотвращения быстрого появления устойчивых форм возбудителя в больших микобактериальных популяциях, что встречается при активной клинической форме туберкулеза, используют комбинации препаратов первого ряда. Если возбудители восприимчивы к этим препаратам, бацилло-выделение обычно прекращается в течение 2-3 недель. В то время как лечение при туберкулезном менингите или милиарном туберкулезе обычно продолжается в течение 18-24 месяцев, при неосложненном легочном туберкулезе, являющемся наиболее частым клиническим вариантом, в такой длительной терапии нет необходимости. При использовании наиболее эффективных комбинаций препаратов, которые включают изониазид и рифампин, “короткий курс” лечения длительностью 6-9 месяцев дает удовлетворительные результаты. Преобладающему большинству пациентов требуется непродолжительная госпитализация.
Изониазид (ГИНК)
Изониазид, введенный в клиническую практику в 1952 г., является наиболее активным лекарственным средством для лечения пациентов, которые могут переносить этот препарат, при условии чувствительности микобактерий.
Химическое строение
Изониазид является гидразидом изоникотиновой кислоты, часто называемой ГИНК. Это небольшая простая молекула (мол. м. 137), легко растворимая в воде. По структуре изониазид напоминает пиридоксин:
conhnh2
Изониазид
Пиридоксин
Антимикобактериальная активность
In vitro ГИНК подавляет большинство туберкулезных палочек в концентрациях 0.2 мкг/мл или менее и оказывает бактерицидное действие на активно растущие микроорганизмы. В отношении многих атипичных микобактерий препарат менее эффективен, хотя Mycobacterium kansasii может быть чувствительной к нему. ГИНК достигает приблизительно одинаковых концентраций как внутри, так и вне животных клеток и поэтому способен действовать как на внутриклеточные микобактерии, так и на внеклеточные.
Механизм действия ГИНК заключается в ингибировании ферментов, необходимых для синтеза миколевых кислот и клеточной стенки микобактерий (Quemard, 1991). ГИНК и пиридоксин — структурные аналоги, и ГИНК проявляет конкурентный антагонизм в пиридоксинкатализируемых реакциях у Escherichia coll. Однако этот механизм не вовлечен в противотуберкулезное действие, поэтому введение больших доз пиридоксина пациентам, получающим ГИНК, не препятствует туберкулостатическому действию изониазида, но предотвращает развитие невритов.
Возникновение устойчивости, по крайней мере в эксперименте, по-видимому, обусловлено утратой
гена (katG), кодирующего ферменты каталазу и пероксидазу у микобактерий. Трансформация устойчивых форм с помощью плазмид, которые содержат ген katG, восстанавливает чувствительность к ГИНК (Zhang и соавт, 1992; Zhang, 1993). Однако в ходе других исследований установлено, что большая часть ГИНК-устойчивых изолятов бактерий, полученных от пациентов в Ныо-Иорке, имеют указанный ген (Stoeckle, 1993), что свидетельствует об участии дополнительных факторов в развитии резистентности. Устойчивые мутанты встречаются в восприимчивых микобактериальных популяциях с частотой примерно 1 :107. Так как туберкулезные очаги в тканях часто содержат более чем 10к туберкулезных палочек, можно предположить, что устойчивые мутанты могут легко возникать при использовании ГИНК в качестве единственного лекарственного средства. Это явление уже имело место в нескольких странах. Перекрестной устойчивости к ГИНК, рифампину и этамбутолу не имеется, поэтому одновременное использование любых двух из этих препаратов существенно задерживает появление устойчивости к каждому из них.
Фармакокинетика
ГИНК легко всасывается из желудочно-кишечного тракта. Введение обычных доз (5 мг/кг в день) приводит к возникновению пиковых концентраций в плазме 3-5 мкг/мл в пределах 1-2 часов. ГИНК легко проникает во все ткани и жидкости организма. Концентрации препарата в центральной нервной системе и цереброспинальной жидкости составляют приблизительно одну пятую от его концентрации в плазме. Внутриклеточные и внеклеточные концентрации близки.
Метаболизм ГИНК, особенно ацетилирование, находится под генетическим контролем (глава 4). В плазме быстрых инактиваторов средняя концентрация активного ГИНК составляет от одной трети до половины таковой у медленных инактиваторов. Средний период полувыведения ГИНК у быстрых инактиваторов меньше 1 ’/2 часа, в то время как у медленных инактиваторов — 3 часа. Утверждалось, что быстрые ацетиляторы более склонны к проявлению печеночной токсичности ГИНК, но в дальнейшем это не подтвердилось. Индивидуальная скорость ацетилирования существенно не влияет на режимы дозирования препарата при ежедневном приеме, но может уменьшать антимикобак-
термальное действие при прерывистом (1-2 раза в неделю) введении ГИНК.
ГИНК выводится преимущественно с мочой, частично в неизмененной, частично — в ацетилированной форме и в виде других конъюгатов. Количество неизмененного свободного ГИНК в моче выше у медленных инактиваторов. При почечной недостаточности могут использоваться обычные дозы ГИНК, но при выраженной печеночной недостаточности дозы необходимо уменьшать.
Клиническое применение
Изониазид, вероятно, является наиболее широко используемым лекарственным средством при туберкулезе. При активном процессе с выраженными клиническими проявлениями он назначается в сочетании с этамбутолом, рифампином или стрептомицином. Обычно доза составляет 5 мг/кг/день (максимум для взрослых — 300 мг в день). При тяжелых формах и менингите иногда дозу увеличивают вдвое, однако данных о том, что у взрослых более высокая доза (10 мг/кг в день) более эффективна, недостаточно. Дети должны получать 10 мг/кг в сутки, а для поддерживающей терапии после начала улучшения им иногда дают препарат по 15 мг/кг два раза в неделю. Для предотвращения развития невритов применяют пиридоксин в дозе 10 мг на 100 мг вводимого изониазида.
Пациентам, у которых отрицательные туберкулиновые кожные пробы изменились на положительные, можно давать ГИНК в дозе 5-10 мг/кг (максимум 300 мг/день) с целью профилактики менингита или милиарного туберкулеза, риск возникновения которых составляет 5-15 %. Для профилактики ГИНК используется как единственное лекарственное средство. Кроме применения у людей с изменившейся кожной пробой без активной формы заболевания, профилактическое использование ГИНК предложено также для других категорий: для лиц, имеющих тесные контакты со свежими случаями активного туберкулеза (особенно дети и лица, проживающие в домах престарелых); лиц с положительными кожными реакциями и инфицированных ВИЧ, а также для больных, получающих иммуносупрессивную или противоопухолевую химиотерапию, если они не получали адекватного противотуберкулезного лечения в прошлом.
ГИНК обычно назначают перорально, но возможно и парентеральное введение в той же самой дозе.
В некоторых регионах мира ГИНК использовался как единственное лекарственное средство для лечения клинически активного туберкулеза при больших популяциях микобактерий. Как и можно было предполагать, это привело к селекции устойчивых мутантов. Наличие таких устойчивых мутантов у мигрантов из Юго-Восточной Азии создает большие проблемы. Лечение туберкулеза у таких мигрантов должно начинаться с применения ГИНК, рифампина, пиразинамида и этамбу-тола до определения чувствительности возбудителя.
Побочные реакции
Частота и тяжесть неблагоприятных реакций на ГИНК связаны с дозой и продолжительностью применения.
А. Аллергические реакции. Иногда возникают лихорадка, высыпания на коже и развивается гепатит.
Б. Прямые токсические эффекты. Наиболее часто токсические эффекты (10-20%) проявляются в отношении периферической и центральной нервной системы. Они объясняются относительным дефицитом пиридоксина, который, вероятно, возникает в связи с конкуренцией ГИНК с пиридоксальфосфатом за фермент апотриптофаназу. Эти токсические реакции включают периферические невриты, бессонницу, беспокойство, мышечные подергивания, задержку мочи и даже судороги и транзиторные психозы. Большинство осложнений можно предотвратить введением пиридоксина. Случайную передозировку ГИНК также можно лечить пиридоксином в дозах, эквивалентных количеству принятого ГИНК.
ГИНК обладает гепатотоксичностью. Наблюдались случаи нарушений функциональных проб печени, развития клинической желтухи и дольчатого некроза печени. В больших группах приблизительно у 1 % людей развивается клинический гепатит, а количество больных с субклиническими расстройствами достигает 10 %. Отмечались также и летальные исходы. Возникновение гепатита с прогрессирующими поражениями печени связано с возрастом больного. Заболевание редко встречается в возрасте до 20 лет, в возрасте между 30 и 50 годами наблюдается в 1.5 % случаев, а в более старшей возрастной группе — в 2.5 % случаев. У алкоголиков риск возникновения гепатита выше.
При дефиците глюкозо-6-фосфатдегидрогеназы ГИНК может вызвать гемолиз. ГИНК может снижать метаболизм фенитоина, повышая его уровень в крови и токсичность.
Рифампин
Рифампин представляет собой крупную молекулу (мол. м. 823), которая является сложным полу-синтетическим производным рифамицина — антибиотика, выделенного из Streptomyces mediterranei. Он активен in vitro в отношении некоторых грамположительных и грамотрицательных кокков, ряда бактерий кишечной группы, микобактерий, хламидий и поксивирусов. Хотя многие менингококки и микобактерии угнетаются при концентрациях менее чем 1 мкг/мл, высокоустойчивые мутанты встречаются во всех микробных популяциях с частотой 1 :107 или большей. Появлению этих высокоустойчивых организмов способствует применение рифампина как единственного лекарственного средства. Перекрестная устойчивость к другим антимикробным препаратам и к рифампину отсутствует. Резистентность к рифампину может быть обусловлена уменьшением проникновения препарата или мутацией ДНК-зависимой РНК-полимеразы.
Антимикобактериальная активность и фармакокинетика
Рифампин прочно связывается с ДНК-зависимой РНК-полимеразой и таким образом тормозит синтез РНК у бактерий и хламидий. На человеческую РНК-полимеразу он не действует. Рифампин блокирует и последнюю стадию формирования поксивирусов, возможно, влияя на образование наружной оболочки. При одновременном введении с ГИНК рифампин обычно оказывает бактерицидное действие на микобактерии и способен стерилизовать инфицированные ткани, полости или мокроту. Рифампин хорошо проникает в фагоциты и может вызывать гибель внутриклеточных микобактерий и других микроорганизмов.
После перорального приема рифампин хорошо всасывается и экскретируется, главным образом, через печень с желчью. После этого он подвергается энтеропеченочной рециркуляции и выводится преимущественно с калом и лишь незначительно — с мочой. Обычные дозы создают концентрацию в сыворотке 5-7 мкг/мл, уровень в цереброспиналь
ной жидкости составляет от 10 до 40 % от концентрации в сыворотке. Рифампин широко распределяется в жидкостях и тканях организма.
Клиническое применение
Для лечения туберкулеза рифампин используют в дозе 600 мг/день (10-20 мг/кг) перорально, обычно в комбинации с ГИНК, этамбутолом или другими противотуберкулезными препаратами для предотвращения появления рифампинустойчивых микобактерий. Подобный режим дозирования также может использоваться в отношении инфекций, вызываемых атипичными микобактериями. В некоторых схемах лечения с коротким курсом рифампин в дозе 600 мг назначают два раза в неделю. Рифампин эффективен и при лепре, где его используют вместе с сульфоном.
Пероральная доза 600 мг два раза в день в течение 2 дней может устранять большинство менингококков у носителей. К сожалению, некоторые высокоустойчивые разновидности менингококков возникли именно в связи с таким использованием. У 10 % носителей менингококков, получающих лечение этим препаратом, могут быть рифампинустой-чивые возбудители. Рифампин в дозе 20 мг/кг/день в течение 4 дней используется с профилактической целью при контактах детей с людьми, чье заболевание вызванно Haemophilus influenzae типа В. Рифампин в комбинации с триметоприм-сульфаметокса-золом иногда может устранять стафилококковое носительство в носоглотке. При инфекциях мочевыводящих путей и хроническом бронхите применение рифампина быстро приводит к селекции устойчивых мутантов и поэтому не находит места в клинической практике.
Побочные реакции
Рифампин вызывает появление неопасного оранжевого окрашивания мочи, пота, слез и контактных линз. Редкими побочными эффектами являются кожные высыпания, тромбоцитопения, нефрит и нарушения функции печени. Рифампин обычно вызывает протеинурию Бенс-Джонса и может нарушать реакцию образования антител. Если препарат применяется реже двух раз в неделю, то возможно появление “гриппоподобного синдрома” неизвестной природы и анемии. Рифампин вызывает индукцию микросомальных ферментов (на
пример, цитохрома Р-450), поэтому он увеличивает элиминацию антикоагулянтов и контрацептивных средств. Таким же образом введение рифампина с кетоконазолом, циклоспорином или хлорамфениколом значительно снижает уровни этих препаратов в сыворотке. Рифампин увеличивает выведение с мочой метадона, снижает его плазменную концентрацию и может приводить к появлению симптомов метадонового синдрома отмены.
Предостережение. Необоснованное использование рифампина для лечения “малых инфекций” может способствовать широкой селекции рифам-пинустойчивых микобактерий и таким образом ограничивать применение этого лекарственного средства.
Этамбутол
Этамбутол является синтетическим водорастворимым термостабильным соединением, его <7-изо-мер, представленный здесь, растворим в виде соли дигидрохлорида.
СН20Н С2Н5
I I
Н —С —NH —(СН2)2 —NH —С —Н
I I
С2Н5 СН2ОН
Этамбутол
Многие штаммы М. tuberculosis и других микобактерий подавляются in vitro этамбутолом в концентрациях 1-5 мкг/мл. Механизм действия неизвестен.
Этамбутол хорошо всасывается в кишечнике. После приема 25 мг/кг пиковая концентрация препарата в крови 2-5 мкг/мл достигается за 2-4 часа. Приблизительно 20 % препарата выводится с калом и 50 % с мочой в неизмененной форме. Выведение замедляется при почечной недостаточности. При менингите концентрация этамбутола в цереброспинальной жидкости составляет 10—40 % от уровня в сыворотке.
Устойчивость микобактерий к этамбутолу появляется очень быстро, если препарат используется в качестве единственного лекарственного средства. Поэтому этамбутол всегда назначается в комбинации с другими противотуберкулезными препаратами.
Этамбутола гидрохлорид в дозе 15 мг/кг обычно применяется один раз в сутки в комбинации с
ГИНК или рифампином. Максимальная суточная доза составляет 25 мг/кг/день.
Аллергические реакции на этамбутол отмечаются редко. Наиболее частыми побочными эффектами являются нарушения зрения: снижение остроты зрения, неврит зрительного нерва и поражения сетчатки. Такие явления могут отмечаться у некоторых больных, получающих препарат в дозе 25 мг/кг/день в течение нескольких месяцев. Большинство из них обратимо после отмены этамбутола, однако во время лечения необходимы периодические проверки остроты зрения. При использовании доз 15 мг/кг/день или меньше нарушения зрения отмечаются очень редко.
Пиразинамид
Это родственное никотинамиду соединение является стабильным, малорастворимым в воде и недорогим. При нейтральных значениях pH оно неактивно in vitro, но при pH 5.0 в концентрации 15 мкг/мл значительно угнетает рост туберкулезных палочек и некоторых других микобактерий. Такие концентрации достигаются при использовании пероральных суточных доз 1.5-2 г (20-30 мг/кг). В этой дозе препарат назначают один раз в день, а в дозе 0.75 г — два раза в день. В некоторых случаях препарат назначают 3 раза в неделю в дозе 50-70 мг/кг.
Пиразинамид хорошо всасывается в желудочно-кишечном тракте и широко распределяется в тканях организма. Туберкулезные палочки вырабатывают устойчивость к пиразинамиду достаточно легко, но перекрестной устойчивости с изониазидом или другими антимикобактериальными препаратами не возникает.
Главными побочными эффектами пиразинами-да являются гепатотоксичность (у 1-5 % пациентов), тошнота, рвота, лихорадка лекарственного происхождения и гиперурикемия.
О
... И
N С-ЫН2 и
Пиразинамид
Стрептомицин
Фармакологические свойства стрептомицина были рассмотрены в главе 45. Большинство туберкулезных палочек угнетается стрептомицином в концентрациях 1-10 мкг/мл in vitro. Большинство “атипичных” микобактерий устойчиво к стрептомицину в фармакологических концентрациях. Все большие популяции туберкулезных палочек содержат некоторые количества стрептомицинустойчи-вых мутантов. В среднем от 1 . 108 до 1:10*° туберкулезных палочек могут быть устойчивыми к стрептомицину при его концентрациях 10-100 мкг/мл. Стрептомицин действует главным образом на внеклеточные туберкулезные палочки. Только приблизительно 10 % лекарственного средства проникает внутрь клеток, которые защищают собой внутриклеточные микроорганизмы. Таким образом, даже если вся микробная популяция является стрептомицинчувствительной, большое количество туберкулезных палочек в любое время не будет затронуто стрептомицином. Поэтому требуется лечение в течение многих месяцев.
Стрептомицина сульфат остается важным средством для лечения туберкулеза. Он применяется преимущественно у больных с тяжелыми, угрожающими жизни формами туберкулеза, особенно при менингите, милиарной диссеминации и серьезных туберкулезных поражениях органов. Обычная доза составляет 0.5-1 г внутримышечно ежедневно для взрослых (20-40 мг/кг/день для детей) в течение нескольких недель, а в последующем — 1 г внутримышечно два или три раза в неделю в течение нескольких месяцев. Для того чтобы задержать появление устойчивых форм всегда одновременно назначают другие препараты.
Интратекальное введение стрептомицина при туберкулезном менингите в настоящее время практически не применяется, поскольку другие препараты типа ГИНК или этамбутола проникают в цереброспинальную жидкость. Однако стрептомицин должен назначаться по-прежнему, особенно при устойчивости микобактерий к ГИНК.
Токсическое действие стрептомицина на восьмую пару черепных нервов при внутримышечном введении в течение многих недель проявляется преимущественно в виде вестибулярных расстройств и глухоты. Последняя часто бывает необратимой, однако иногда возможно некоторое восстановление функции.
Альтернативные препараты второго ряда для лечения туберкулеза
В связи с антимикробной эффективностью и относительной клинической безопасностью препаратами первого ряда для лечения туберкулеза в 1994 г. были изониазид, рифампин, пиразинамид и этамбутол. Альтернативные препараты, о которых пойдет речь, обычно рассматриваются с точки зрения подбора терапии только в определенных ситуациях: 1) в случае устойчивости возбудителя к препаратам первого ряда (что встречается все чаще); 2) в случае недостаточного клинического эффекта от обычной терапии; 3) когда возможно квалифицированное ведение больного при возникновении токсических эффектов. Для большинства препаратов второго ряда дозировки, частота появления устойчивости возбудителя и отдаленные побочные эффекты полностью не установлены.
Капреомицин
Капреомицин — пептидный антибиотик, полученный из Streptomyces capreolus. Ежедневное введение 1 г внутримышечно создает концентрацию в крови 10 мкг/мл или выше. Такие концентрации in vitro подавляют многие микобактерии. Существует некоторая перекрестная резистентность к капре-омицину, виомицину и канамицину. Капреомицин (20 мг/кг/день) может занять место последних препаратов в комплексной противотуберкулезной терапии. Наиболее серьезными токсическими эффектами являются поражения почек, приводящие к азотемии, а также поражение восьмой пары черепных нервов, вызывающее глухоту и вестибулярные расстройства. Токсические эффекты возникают реже при применении дозы 1 г два или три раза в неделю, что иногда используется.
Циклосерин
Циклосерин — антибиотик, сходный с D-аланином. Он ингибирует аланинрацемазу. Концентрации 15-20 мкг/мл угнетают многие разновидности туберкулезных палочек. Наиболее серьезными токсическими эффектами являются различные нарушения функций центральной нервной системы и психотические реакции. Некоторые из них могут
устраняться фенитоином в дозе 100 мг/день перорально.
Дозировка циклосерина при туберкулезе составляет 0.5-1 г/день. Для лечения инфекций мочевых путей циклосерин использовался в дозах 15-20 мг/кг/день.
Циклосерин рассматривается в главе 50.
Этионамид
Это желтое кристаллическое вещество достаточно стабильно и почти нерастворимо в воде. Этионамид — близкий химический родственник изониазида и тоже блокирует синтез миколевых кислот.
Несмотря на сходство, перекрестная устойчивость к изониазиду и этионамиду отсутствует. Большинство туберкулезных палочек угнетается in vitro этионамидом в концентрации 2.5 мкг/мл или ниже. Многие фотохромогенные микобактерии также угнетаются этионамидом в концентрации 10 мкг/мл. Такие концентрации в плазме и тканях достигаются при использовании дозы 1 г/ день. Она эффективна при клиническом лечении туберкулеза, но плохо переносима из-за выраженного раздражения желудка и возникающих неврологических нарушений. Доза 0.5 г перорально в день переносится лучше, однако не очень эффективна. Устойчивость к этионамиду развиваемся быстро in vitro и in vivo.
Аминосалициловая кислота (ПАСК)
Среди нескольких производных салициловой и бензойной кислот р-аминосалициловая кислота имеет наибольшее воздействие на туберкулезные палочки. ПАСК напоминает по строениюр-амино-бензойную кислоту (ПАБК) и сульфаниламиды (глава 47):
ЫН2
Аминосалициловая кислота (ПАСК)
ПАСК — белый кристаллический порошок, малорастворимый в воде и быстро разрушающийся при нагревании. Натриевая соль ПАСК легко растворима в воде и относительно устойчива при комнатной температуре.
На большинство бактерий ПАСК не действует. Туберкулезные палочки in vitro обычно угнетаются ПАСК в концентрациях 1-5 мкг/мл, но “атипичные” микобактерии устойчивы.
Вероятно, ПАСК и ПАБК конкурируют за активный центр фермента, превращающего ПАБК в дигидрофолиевую кислоту. Рецепторы, с которыми взаимодействует ПАБК, должны быть весьма специфичными, поскольку ПАСК неэффективна в отношении большинства бактерий, а сульфаниламиды не действуют на туберкулезные палочки.
ПАСК легко всасывается из желудочно-кишечного тракта. Средние суточные дозы (8-12 г) обычно создают концентрацию препарата в крови примерно 10 мкг/мл или выше. Препарат широко распределяется в тканях и жидкостях организма, кроме цереброспинальной жидкости. ПАСК быстро выводится с мочой, частично в виде активной ПАСК и частично в виде ацетилированных и других метаболитов. Очень высокие концентрации ПАСК создаются в моче. Чтобы избежать кристал-лурии необходимо ее ощелачивание.
Аминосалициловая кислота в прошлом использовалась вместе с изониазидом или стрептомицином, а также в комбинации с двумя препаратами в длительной терапии туберкулеза. В настоящее время она редко применяется, поскольку другие пероральные препараты лучше переносятся. Доза составляет 8-12 г/день перорально для взрослых и 300 мг/кг/день для детей.
При использовании полных доз ПАСК часто возникают желудочно-кишечные нарушения. Анорексия, тошнота, понос, боль в эпигастральной области, ощущение жара могут ослабляться при приеме ПАСК вместе с пищей и антацидами. Могут возникать язвы желудка и кровотечения. Наруше
ния функции почек, печени и щитовидной железы (зоб с микседемой или без нее), а также метаболический ацидоз отмечаются редко.
После 3-8 недель терапии ПАСК часто встречаются такие проявления аллергии, как лихорадка лекарственного происхождения, боли в суставах, высыпания на коже, гранулоцитопения и разнообразные неврологические симптомы, что требует временной или постоянной отмены препарата.
Биомицин
Этот антибиотик продуцируется некоторыми видами Streptomyces. Он представляет собой сложный основной полипептид, нейтральный сульфат которого легко растворим в воде. Большинство разновидностей туберкулезных палочек угнетаются in vitro биомицином в концентрациях 1-10 мкг/мл. Таких концентраций можно достигнуть внутримышечным введением 2 г препарата два раза в неделю. Туберкулезные палочки, устойчивые к виомицину, появляются довольно быстро. При этом наблюдается некоторая перекрестная устойчивость к виомицину, стрептомицину, канами-цину и капреомицину. Наиболее серьезные токсические побочные эффекты — это нарушение функции почек, а также поражение восьмой пары черепных нервов, приводящее к вестибулопатиям и глухоте. Токсические эффекты выражены сильнее, чем у стрептомицина.
Рифабутин (Ансамицин)
Этот антибиотик получен путем модификации молекулы рифамицина и во многом его напоминает. Он имеет выраженную активность в отношении М. avium-intracellulare и М. fortuitum. Доза составляет 0.15-0.5 г/день перорально. Его роль в терапии и токсичность определены недостаточно.
Другие антимикобактериальные препараты
В комплексной терапии туберкулеза используются амикацин, тетрациклины и фторхинолоны. Эти препараты могут угнетать туберкулезные палочки в концентрациях, которые достижимы in vivo, они намного менее эффективны, чем препараты первого ряда, но иногда полезны в лечении инфекций, вызываемых “атипичными” микобактериями.
Химиотерапия туберкулеза с проведением короткого курса
Традиционные программы терапии основываются на 18-24-месячном лечении. Схемы лечения с комбинированным применением лекарственных средств в течение 6-12 месяцев, предписывающие ежедневный прием препаратов или прием два раза в неделю, приводили к хорошим результатам в плане достижения полных ремиссий, по крайней мере при непродолжительном наблюдении.
Необходимо подчеркуть, что эти схемы применимы только к неосложненному легочному туберкулезу и включают совместное назначение как изониазида (ГИНК), так и рифампина наряду с другими препаратами или без таковых. Примерная схема для взрослых состоит из ГИНК, 300 мг ежедневно, плюс рифампин, 600 мг ежедневно, в течение 6 месяцев, а также пиразинамид, 30 мг/кг ежедневно в течение первых 8 недель лечения. Альтернативная схема включает ГИНК (300 мг), рифампин (600 мг) и пиразинамид (1.5-2 г), назначаемые ежедневно в течение 2 недель, затем ГИНК (15 мг/кг), рифампин (600 мг) и пиразинамид (3 г) два раза в неделю в течение следующих 6 недель, а на оставшееся от 6-месячного курса время пиразинамид отменяют. Иногда в течение первых 2 недель назначают внутримышечно стрептомицин в дозе 1-1.25 г. Большой опыт использования подобных схем лечения свидетельствует об удовлетворительных результатах при общей длительности лечения, ограниченной только 6 месяцами.
Препараты, активные в отношении атипичных микобактерий
Приблизительно 10 % микобактериальных инфекционных заболеваний, отмечающихся в клинической практике в США, вызываются не М. tuberculosis или М. leprae, а “атипичными” микобактериями. Эти микроорганизмы имеют отличительные лабораторные характеристики, встречаются в окружающей среде, обычно не передаются от человека человеку и иногда устойчивы к нескольким противотуберкулезным препаратам. Заболевание, вы
званное этими возбудителями, часто не так серьезно и встречается у лиц, не контактировавших с туберкулезом, но имеющих кислотоустойчивые микобактерии в мазках. Рентгенологическое обследование грудной клетки может давать отрицательные результаты. Представители таких патогенных микроорганизмов, клинические проявления заболеваний и препараты, к которым они чувствительны, приведены в табл. 46-1. Некоторые атипичные микобактерии, особенно М. avium, вызывают тяжелое заболевание с диссеминацией при СПИДе. Такие возбудители часто имеют мультилекарственную устойчивость, а лечение вызываемых ими заболеваний проводится с использованием многочисленных комбинаций лекарственных средств. Они могут включать рифампин, этамбутол, клофазимин, амикацин, фторхинолоны (например, ципрофлоксацин или офлоксацин), азитромицин или кларитромицин и рифабутин. С суммарными побочными эффектами таких комбинаций справиться весьма трудно.
Препараты, используемые при лепре
Mycobacterium leprae не способны к росту in vitro, но использование экспериментальных моделей (например, рост возбудителя при введении в подушечки лап мышей) позволило осуществить лаборатор
ную оценку препаратов. Здесь представлены только те препараты, которые имеют самое широкое клиническое применение. В связи с увеличением устойчивости к дапсону в настоящее время общепринятым считается лечение лепры с использованием комбинаций рассматриваемых ниже препаратов.
Дапсон и другие сульфоны
Несколько препаратов, родственных сульфаниламидам, с успехом использовались для длительного лечения лепры. Наиболее широко применяемый препарат “Дапсон” является диаминодифенилсуль-фоном. Вероятно, он угнетает синтез фолата. При использовании очень низких доз возможно появление устойчивости в больших популяциях М. leprae, например при лепроматозной лепре. Поэтому при начальной терапии часто рекомендуется комбинация дапсона с рифампином. Дапсон может также применяться для лечения пневмонии, вызванной Pneumocystis, у больных СПИДом.
ТАБЛИЦА 46-1. Клинические признаки и лечение инфекций, вызываемых атипичными микобактериями
Группа Возбудитель Типичные клинические проявления Возможности лечения
I М. kansasi Напоминает легочный туберкулез Этамбутол + рифампин (+ГИНК); эритромицин, зтионамид
I М. marinum Кожные гранулемы Миноциклин, рифампин
II М. scrofulaceum Цервикальные адениты у детей Амикацин, эритромицин, рифампин, стрептомицин (предпочтительно хирургическое удаление)
III М. avium-intracellulare Периодические заболевания легких; асимптоматическая инфекция; тяжелая или фатальная дис-семинация у больных СПИДом Рифампин или рифабутин, этамбутол, клофазимин, ципрафлоксацин, амикацин, азитромицин
IV М. fortuitum Кожные язвы; редко — заболевания, легких Тетрациклин, амикацин, зтионамид, кап-реомицин, рифабутин
IV М. ulcerans Кожные язвы Рифампин, стрептомицин
Сульфоны хорошо всасываются из желудочно-кишечного тракта и широко распределяются в жидкостях и тканях организма. Период полураспада в сыворотке составляет 1 -2 дня, лекарственное средство может длительно сохраняться в коже, мышцах, печени и почках. Инфицированная М. leprae кожа может накапливать в несколько раз более высокие концентрации препарата, чем здоровая. Сульфоны выводятся с желчью и повторно всасываются в кишечнике. Выделение с мочой вариабельно, при этом основная масса экскретируемого препарата выводится в ацетилированной форме. При почечной недостаточности необходим специальный подбор дозы.
Обычная схема назначения препарата при лепре начинается с одной или двух таблеток дапсона по 25 мг в неделю с еженедельным увеличением количества на одну таблетку вплоть до достижения полной дозы 400-600 мг в неделю. У детей используется пропорционально более низкая доза.
Прием дапсона часто сопровождается неблагоприятными реакциями. У многих больных развивается незначительный гемолиз, особенно при дефиците глюкозо-6-фосфатдегидрогеназы. Часто возникает метгемоглобинемия. Отмечаются явления желудочно-кишечной непереносимости, лихорадка, прурит и различные высыпания. При лечении дап-соном лепроматозной лепры часто развивается узелковая лепрозная эритема, поэтому иногда трудно отличить реакции на препарат от манифестации основной болезни. Узелковая лепрозная эритема может устраняться кортикостероидами или талидомидом.
Ацедапсон (4,4-диацетамидодифенилсульфон) является производным дапсона. При его однократном внутримышечном введении в дозе 300 мг эффективные концентрации дапсона в тканях могут сохраняться до трех месяцев. Используются также и несколько других родственных дапсону сульфонов. Если развивается непереносимость, то она распространяется на все сульфоны.
Рифампин
Этот препарат в дозе 600 мг в сутки может быть исключительно эффективным при лепроматозной лепре. В связи с вероятным риском появления риф-ампинрезистентных М. leprae он обычно назначается в комбинации с дапсоном или другими проти-волепрозными средствами. В этом случае введение один раз в месяц в дозе 600 мг может давать хоро
ший эффект. К сожалению, высокая стоимость рифампина не позволяет использовать его в развивающихся странах, где существует максимальная потребность в препарате.
Клофазимин
Клофазимин является феназиновым красителем, который может использоваться в качестве альтернативы дапсону. Его механизм действия неизвестен, но может заключаться в связывании с ДНК. Препарат относительно дорог.
Всасывание клофазимина в кишечнике вариабельно, основная часть препарата выводится с калом. Клофазимин накапливается в ретикулоэндотелиальной ткани и коже, и его кристаллы могут наблюдаться внутри фагоцитирующих ретикулоэндотелиальных клеток. Он медленно высвобождается из тканей, в связи с чем его период полувыведения из сыворотки составляет приблизительно два месяца. Лишь незначительная часть каждой дозы выводится с мочой или желчью.
Клофазимин показан при сульфонустойчивой лепре или при непереносимости сульфонов. Обычная доза составляет 100-300 мг/день перорально. При комбинированной терапии удовлетворительные результаты дает доза 50-100 мг/день. Клофазимин используется в комбинированной терапии инфекций, вызываемых М. avium-intracellulare, у больных СПИДом. Наиболее заметным нежелательным эффектом является изменение цвета кожи от красно-коричневого до почти черного. Иногда встречается непереносимость препарата при приеме внутрь.
CI
Амитиозон
Амитиозон является тиосемикарбазоном, использующимся как замена дапсона при его непереносимости больными. Он, по-видимому, более эффективен при туберкулоидной, чем при лепрома-тозной лепре. При пероральном приеме 150 мг в сутки или 450 мг два раза в неделю в сыворотке создаются достаточные для подавления микобактерий концентрации, однако при монотерапии возможно развитие устойчивости возбудителя. К препарату иногда возникает непереносимость при приеме внутрь, есть сообщения о частых нарушениях функции печени. В настоящее время в США этот препарат не используется.
Препараты
Препараты для лечения туберкулеза
Аминосалицилат натрия (ПАСК-натрий )
Перорально: таблетки по 0.5 г
Капреомицин (Капастат сульфат)
Парентерально: порошок для приготовления инъекционного раствора (1 г/10 мл во флаконе)
Циклосерин (Серомицинпульвулес)
Перорально: капсулы по 250 мг
Этамбутол (Миамбутол)
Перорально: таблетки по 100,400 мг
Этионамид (Трекатор-SC)
Перорально: таблетки по 250 мг
Изониазид (генерик)
Перорально: таблетки по 50,100,300 мг;
сироп 50 мг/5 мл
Парентерально: 100 мг/мл для инъекций
Пиразинамид (генерик )
Перорально: таблетки по 500 мг
Рифабутин (Микобутин)
Перорально: капсулы по 150 мг
Рифампин (Рифадин, Римактан)
Перорально: капсулы по 150,300 мг Парентерально: 600 мг в порошке для внутривенного введения
Стрептомицин (генерик)
Парентерально: 400 мг для внутримышечного введения; порошок для приготовления инъекционного раствора
Препараты для лечения лепры
Дапсон (генерик)
Перорально: таблетки по 25,100 мг
Клофазимин (Лампрен)
Перорально: капсулы по 50,100 мг
Избранная литература
Dutt А. К„ Moers D., Stead W. W. Short-course chemotherapy for extrapulmonary tuberculosis: Nine years’ experience. Ann. Intern. Med. 1986; 104: 7.
Ellard G. A. Chemotherapy of leprosy. Br. Med. Bull. 1988; 44: 775.
Horsburgh C. R. Mycobacterium avium complex in AIDS. N. Engl. J. Med. 1991; 324: 1332.
Quemard A., Lacave C., Laneelle G. Isoniazid inhibition of mycolic acid synthesis by cell extracts of sensitive and resistant strains of Micobacterium aurum. Antimicrob. Agents Chemother. 1991; 35: 1035.
Snider D. E. Jr. et al. Standart therapy for tuberculosis. Chest, 1985; 87 (Suppl. 2): 117 S.
Snider D. E. et al. Drug-resistant tuberculosis. Am. Rev. Resp. Dis. 1991; 144: 732.
Stoeckle M. Y. et al. Catalase-peroxidase gene sequences in isoniazid-sensitive and -resistant strains of Micobacterium tuberculosis from New York City. J. Infect. Dis. 1993; 168:1063.
Zhang Y. et al. The catalase-peroxidase gene and isoniazid resistance of Micobacterium tuberculosis. Nature, 1992; 358:591.
Zhang Y., Garbe T., Young D. Transformation with katG restores isoniazid sensitivity in Micobacterium tuberculosis isolates resistant to a range of drug concentrations. Molec. Microbiol. 1993; 8: 521.
Сульфаниламиды и триметоприм 47
Эрнест Явец
Сульфаниламиды
В 1932 г. в Германии Кларер и Миетз синтезировали и испытали (in vitro) обычным скрининговым методом антибактериальные свойства красного красителя пронтозила. По этим тестам он оказался неэффективным. Однако в 1935 г. Домагк сообщил о своих исследованиях in vivo, в которых это вещество проявляло высокую активность против гемолитического стрептококка и возбудителей других инфекций. Это было связано с образованием в организме из пронтозила активного лекарственного вещества — сульфаниламида. С тех пор сульфаниламидная молекула многократно химически изменялась включением различных радикалов, что привело к появлению большого количества активных веществ. За всю историю их разработки на фармацевтическом рынке имелось примерно 150 различных модификаций сульфаниламидов, при этом синтез данных соединений осуществлялся в направлении получения препаратов с максимальной антибактериальной активностью, более широким антибактериальным спектром, большей растворимостью в моче, более длительным действием. Несмотря на появление антибиотиков, сульфаниламиды сегодня занимают место в ряду наиболее широко используемых в мире антибактериальных средств, в основном вследствие их дешевизны и относительной эффективности при некоторых распространенных инфекциях. Синергизм сульфаниламидов с триметопримом привел к значительному повсеместному увеличению их использования в течение последнего десятилетия.
Химическое строение
Структура основных сульфаниламидов и ее сходство с р-аминобензойной кислотой (ПАБК) показаны на рис. 47-1.
Все препараты имеют общее ядро, к которому через аминогруппу (-SO2NH-R) присоединены
различные радикалы R. Заместители аминогруппы (NH2) могут отличаться друг от друга. Эти модификации структуры приводят к изменениям физических, химических, фармакологических и антибактериальных свойств. Как правило, сульфаниламиды — белые, не имеющие запаха, горькие, кристаллические слабые кислоты, обладающие намного большей растворимостью при щелочных, чем при кислых значениях pH. В смеси сульфаниламидных препаратов каждое составляющее лекарственное
Сульфаметоксазол
соон
nh2
р-Аминобензойная кислота (ПАБК)
Сульфаталидин (фталилсульфатиазол)
Рис. 47-1. Структура некоторых сульфаниламидов и парааминобензойной кислоты
средство имеет собственную величину растворимости. Поэтому смесь может быть намного более растворимой, по общему количеству сульфаниламида, чем отдельно взятое лекарственное средство. Это явление обусловливает использование трисульфапиримидинов — препаратов, которые создают в моче концентрацию в три раза более высокую, чем отдельное лекарственное средство с сопоставимой растворимостью в моче.
Большинство сульфаниламидов выпускаются в виде солей натрия, что придает препаратам умеренную растворимость и дает возможность внутривенного введения. Такие растворы имеют высокоще-лочую реакцию и не являются стабильными, что может приводить к преципитации вещества из раствора в присутствии полиионных электролитов (например, лактата-хлорида-карбоната). К настоящему времени разработаны некоторые сульфаниламидные молекулы с низкой растворимостью (например, фталилсульфатиазол), такие препараты не всасываются и остаются в просвете кишечника.
Антимикробная активность
Различные сульфаниламиды могут иметь количественные, но не обязательно качественные отличия в противомикробной активности. Сульфаниламиды могут угнетать как грамположительные, так и грам отрицательные бактерии, Nocardia, Chlamydia trachomatis и некоторые простейшие. Эти препараты действуют на ряд бактерий кишечной группы, за исключением Pseudomonas, Serratia, Proteus и других мультирезистентных к препаратам микроорганизмов. В качестве средств монотерапии сульфаниламиды применяются при нелеченных ранее инфекциях мочевыводящих путей, нокардиозах и иногда—при других бактериальных инфекциях. Резистентностью к этим препаратам в настоящее время обладают многие разновидности менингококков, ппевмокков, стрептококков, стафилококков и гонококков. Показания для применения комбинаций сульфаниламид-триметоприм приводятся ниже.
Сульфаниламиды являются структурными аналогами ПАБК. Действие сульфаниламидов — бактериостатическое, оно является обратимым при отмене препарата и устраняется в присутствии избытка ПАБК. Механизм действия сульфаниламидов является типичным примером конкурентного антагонизма. Их бактериостатический эффект основан на том, что чувствительным к этим препара
там микроорганизмам необходима внеклеточная ПАБК для образования фолиевой кислоты (рис. 47-2), которая требуется для синтеза пуринов и последующего синтеза нуклеиновых кислот. Сульфаниламид может вступать в реакцию образования фолиевой кислоты вместо ПАБК, конкурируя за фермент дигидроптероатсинтетазу, что приводит к формированию нефункциональных аналогов фолиевой кислоты. В результате дальнейший рост микроорганизмов прекращается. Однако рост может возобновляться при вытеснении сульфаниламида избытком ПАБК или при отделении препарата от фермента.
Резистентность микроорганизмов
Животные клетки (и некоторые бактерии) не способны синтезировать фолиевую кислоту, но зависят от экзогенных источников ее поступления и по этой причине не восприимчивы к действию сульфаниламидов. Сульфаниламидустойчивые клетки встречаются в большинстве чувствительных популяций микроорганизмов и могут появляться при соответствующем “селекционном давлении”. Резистентность к сульфаниламидам возникает в результате мутаций бактерий, что может проявляться в
р-Аминобензойная кислота
Дигидроптероат-синтетаза
__ Сульфаниламиды (конкурируют с ПАБК)
v
Дигидрофолиевая кислота
Дигидрофолат-редуктаза
Триметоприм
Тетрагидрофолиевая кислота
Пурины
Рис. 47-2. Механизм действия сульфаниламидов и триметоприма
выработке избыточных количеств ПАБК, структурных изменениях синтезирующего фолиевую кислоту фермента со снижением его аффинитета для сульфаниламидов или потере проницаемости бактериальной клетки для этих препаратов. Устойчивость к сульфаниламидам чаще всего обусловлена передающимися плазмидами генетическими механизмами, которые могут быстро и широко диссеминировать. Таким образом, частое использование сульфаниламидов в прошлом для лечения кокковых инфекций (гонококки, менингококки, стрептококки) привело к появлению сульфаниламид-устойчивых разновидностей возбудителей во всем мире. Другие виды микроорганизмов, например многие грамотрицательные палочки кишечной группы, обычно также устойчивы. Необходимо специально упомянуть, что сульфаниламиды не только не угнетают, но фактически стимулируют рост риккетсий.
Фармакокинетика
Сульфаниламиды по времени полувыведения могут быть разделены на три группы (табл. 47-1). Большинство сульфаниламидов используется перорально, они быстро всасываются в желудке и тонком кишечнике и широко распределяются в тканях и жидкостях организма (включая центральную нервную систему и цереброспинальную жидкость, плаценту и плод). От 20 до 90 % всосавшегося количества разных сульфаниламидов связывается с сывороточными белками. Частично препараты также подвергаются ацетилированию или инактивируются другими метаболическими путями. С использованием химических методов в сы
воротке возможно определение свободной (активной) фракции сульфаниламида, ацетилированной (неактивной) формы или общего содержания двух форм. Для проявления терапевтического эффекта после системного введения концентрация сульфаниламида обычно должна достигать уровня 8-12 мг свободного лекарственного вещества в 100 мл крови. Пиковые концентрации в крови обычно создаются через 2-6 часов после перорального введения.
Растворимые сульфаниламиды экскретируются главным образом с помощью гломерулярной фильтрации. Различные препараты характеризуются разной степенью реабсорбции в почечных канальцах, но более активная физиологическая реабсорбция воды приводит к созданию в моче значительной концентрации лекарственного средства. Часть препарата в моче представлена ацетилированным метаболитом, однако там сохраняется и достаточное количество активного лекарственного вещества для эффективного лечения инфекций мочевого тракта (обычно в моче концентрация препарата в 10-20 раз выше, чем в крови). При тяжелой почечной недостаточности доза сульфаниламида должна быть уменьшена.
Натриевые соли сульфаниламидов вследствие их хорошей растворимости используются для внутривенного введения. Для них характерны такое же распределение в организме и экскреция, как и для перорально применяемых препаратов.
“Нерастворимые” сульфаниламиды (например, фталилсульфатиазол) назначаются перорально, незначительно всасываются в кишечнике и экскретируются прежде всего с калом. Их действие направлено в основном на аэробную кишечную фло
ТАБЛ ИЦА 47-1. Фармакокинетические характеристики некоторых сульфаниламидов и триметоприма
Препарат Время полувыведения Всасывание при пероральном приеме
Сульфаниламиды
Сульфацитин Нет данных Быстрое (пиковый уровень через 1-4 часа)
Сульфизоксазол Короткое (6 часов) Быстрое
Сульфаметизол Короткое (9 часов) Быстрое
Сульфадиазин Среднее(10-17 часов) Медленное (пиковый уровень через 4-8 часов)
Сульфаметоксазол Среднее(10-12 часов) Медленное
Сульфапиридин Нет данных Медленное
Сульфадоксин Длительное (7-9 дней) Средняя скорость
Пиримидины
Триметоприм Среднее(11 часов) Быстрое
ру, что используется приподготовке к хирургическим операциям на кишечнике.
“Длительнодействующие” сульфаниламиды, например сульфадоксин и сульфаметоксипирида-зин, хорошо всасываются после перорального приема й широко распределяются в организме, но экскретируются с мочой очень медленно, особенно в свободной форме. Их концентрация в сыворотке сохраняется длительно. Замедленная почечная экскреция объясняется высокой степенью связывания с белками сыворотки (более 85 % препарата) и интенсивной реабсорбцией в почечных канальцах свободной (неацетилированной) фракции лекарственного вещества. Использование этих препаратов часто нецелесообразно в связи с имевшими место случаями высокой токсичности. За исключением сульфадоксина (в препарате Фансидар), они запрещены к применению в США, но пока еще используются в других странах. Сульфаниламиды “средней продолжительности действия”, например сульфаметоксазол, не имеют особенных преимуществ, кроме удобства дозировки, особенно в комбинации с триметопримом (80 мг триметоприма и 400 мг сульфаметоксазола в таблетке).
Бактериальные исследования
При культивировании возбудителей из проб, взятых от пациентов, получающих сульфаниламиды, введение в питательную среду ПАБК (50 мг/л) устраняет ингибирующее действие сульфаниламидов на рост чувствительных микроорганизмов.
Клиническое применение
А. Местное введение. В целом, локальная аппликация сульфаниламидов на кожу, раны или на слизистые оболочки нежелательна в связи с их низкой активностью и высоким риском аллергической сенсибилизации. Исключением может являться аппликация натрия сульфацетамида в виде раствора (30 %) или мази (10 %) на конъюнктиву.
Вторым исключением является мафенида ацетат (р-аминометилбензенсульфаниламид) — сульфаниламид, использующийся для местного нанесения (в виде 10 % мази) на обожженные участки кожи. Вещество абсорбируется из лекарственной формы в ткань в течение трех часов. Было установлено, что применение этого препарата эффективно предотвращало развитие ожогового сепсиса, но
приводило к увеличению ожоговой инфекции грибами и резистентными бактериями. Необходимо отметить, что мафенид вызывает сильную боль в месте аппликации. Сульфадиазин серебра при нанесении на ожоговые раны вызывает относительно неинтенсивные болевые ощущения. Он медленно высвобождается и создает низкие системные концентрации. Сульфадиазин серебра показал хорошую эффективность в отношении большинства ожоговых инфекций, особенно при не слишком глубоких ожогах.
Пероральное введение “нерастворимых” сульфаниламидов в дозе 8-15 г в день приводит к временному местному подавлению кишечной микробной аэробной флоры, что используется для подготовки кишечника к хирургической операции; при этом необходимо, чтобы самые низкие микробные уровни по времени совпали с моментом проведения операции (четвертый-шестой день введения препарата).
Сульфасалазин (салицилазосульфапиридин) широко используется для лечения неспецифического язвенного колита, энтерита и других воспалительных заболеваний кишечника. Это лекарственное средство более эффективно, чем растворимые сульфаниламиды или другие пероральные антимикробные препараты, которые используются при воспалительных заболеваниях кишечника. Сульфасалазин расщепляется кишечной микрофлорой с высвобождением сульфапиридина и 5-аминосали-циловой кислоты. Последняя высвобождается в толстом кишечнике, где создает высокую концентрацию и оказывает свое главное противовоспалительное действие. Сравнительно высокие концентрации салицилата не могут быть достигнуты в толстом кишечнике пероральным введением обычных препаратов группы салицилатов из-за их высокой токсичности для желудочно-кишечного тракта (глава 64). Сульфапиридин всасывается и может вызывать токсические эффекты при дозах сульфасалазина более 4 г в день, особенно у людей, являющихся медленными ацетиляторами. Олсалазин, димер салициловой кислоты, расщепляется бактериями в толстой кишке и эффективен при неспецифическом язвенном колите. Он переносится лучше, чем сульфасалазин (глава 64).
Б. Пероральное применение. Хорошо растворимые и быстро экскретирующиеся сульфаниламиды чаще всего используются по приведенным ниже показаниям.
1. Первичные (ранее не леченные) инфекции мочевыводящих путей. У женщин с неосложненными острыми симптоматическими инфекциями мочевых путей при отсутствии беременности и не лечившихся ранее: однократная доза 1 г сульфизок-сазола или две таблетки триметоприма в комбинации с сульфаметоксазолом два раза в день дают хороший эффект в 80-90 % случаев. Альтернативное лечение заключается в назначении сульфизоксазо-ла в дозе 0.5-1 г 4 раза в день (30-60 мг/кг) в течение 3-7 дней. Сульфизоксазол (150 мг/кг/день) часто оказывается эффективным при первичных инфекциях у детей.
2. Хламидийные инфекции. Инфекции полового тракта, вызываемые Chlamydia trachomatis, а также инфекции глаз или дыхательных путей можно лечить пероральными сульфаниламидами, хотя препаратами выбора являются тетрациклины и эритромицин. Сульфаниламиды неэффективны при орнитозе.
3. Бактериальные инфекции. При нокардиозах препаратами выбора являются сульфизоксазол или сульфадиазин в дозах 6-8 г/день. При других бактериальных инфекциях, включая заболевания, вызываемые Р-гемолитическим стрептококком, менингококками и шигеллами, сульфаниламиды ранее также считались препаратами выбора. Однако в настоящее время среди этих микроорганизмов широко распространена резистентность к сульфаниламидам. В слаборазвитых странах в связи с доступностью и низкой стоимостью сульфаниламидов эти препараты широко используются для лечения инфекций дыхательных путей, синусита, бронхита, пневмонии, среднего отита и бактериальной дизентерии. Комбинации сульфаниламид-триме-топрим широко используются для лечения этих и других бактериальных инфекций повсеместно, однако они являются намного более дорогими, чем монокомпонентные препараты. Лепру лечат сульфонами, например дапсоном (глава 46).
4. Герпетиформный дерматит. Это заболевание не является инфекционным, однако часто успешно лечится сульфапиридином в дозе 2-4 г/день или дапсоном.
В. Внутривенное применение. Натриевые соли сульфаниламидов в водном 5 % растворе глюкозы можно вводить внутривенно. Обычно такое введение используется у больных в коматозном состоянии или при невозможности перорального приема лекарственного средства.
Побочные реакции
Сульфаниламиды могут вызывать разнообразные побочные эффекты, обусловленные аллергиза-цией или прямой токсичностью, что должно учитываться всякий раз при появлении необъяснимых симптомов и явлений у пациентов, получающих эти препараты. До 5 % пациентов имеют такие реакции. Все производные сульфаниламидов обладают перекрестной аллергенностью, включая ингибиторы карбоангидразы, тиазиды, фуросемид, буметанид, диазоксид и пероральные противодиабетические средства из группы производных сульфанилмоче-вины.
Наиболее частыми побочными эффектами являются: лихорадка, высыпания на коже, фотосенсибилизация, крапивница, тошнота, рвота, понос и нарушения в мочевыводящей системе. Реже встречаются стоматиты, конъюнктивиты, артриты, нарушения гемопоэза, гепатит, эксфолиативный дерматит, узелковый полиартериит, синдром Стивенса-Джонсона, психозы и другие нарушения.
А. Нарушения в системе мочевыведения. Сульфаниламиды могут преципитировать в моче, особенно при нейтральных или кислых значениях pH, вызывая кристаллурию, гематурию или даже задержку мочи. Это явление лучше всего предотвращается использованием наиболее растворимых сульфаниламидов (сульфизоксазол, трисульфапиримидины), ощелачиванием мочи (5-15 г натрия бикарбоната ежедневно), увеличением потребления жидкости. В процессе лечения необходимо еженедельное проведение анализов мочи. Сульфаниламиды нельзя назначать одновременно с метенаминовыми соединениями в связи с высокой вероятностью образования преципитата.
Сульфаниламиды также могут способствовать возникновению различных типов нефрозов и аллергического нефрита. Может встречаться нарушение мочеобразующей функции почек.
При почечной недостаточности дозы сульфаниламидов должны быть снижены, а интервал между приемами увеличен.
Б. Нарушения гемопоэза. Сульфаниламиды могут вызывать анемию (гемолитическую или апластическую), гранулоцитопению, тромбоцитопению или лейкемоидные реакции. Такие нарушения возникают редко (исключение — некоторые пациенты с высоким риском). Эти препараты могут вызвать гемолитические реакции, особенно у больных с не
достаточностью глюкозо-6--фосфатдегидрогеназы в эритроцитах. При приеме во вторую половину беременности сульфаниламиды увеличивают риск возникновения желтухи у новорожденных.
Медицинские и общественные аспекты охраны здоровья
Сульфаниламиды являются дешевыми в производстве и доступными препаратами и поэтому широко применяются в качестве основных антимикробных средств во многих развивающихся странах. Они остаются полезными препаратами для лечения таких широко распространенных заболеваний, как инфекции мочевыводящих путей и трахома. Однако появление устойчивых форм микроорганизмов снизило их эффективность при инфекциях, вызываемых стрептококками, гонококками, менингококками, шигеллами и другими возбудителями. Получившее широкомасштабную практику местное применение этих препаратов (инфекции кожи, глаз) способствовало значительной сенсибилизации населения.
Триметоприм и комбинации триметоприм-сульфаметоксазол
Триметоприм (триметоксибензилпиримидин) ингибирует бактериальную дигидрофолатредукта-зу приблизительно в 50 000 раз более эффективно, чем тот же самый фермент в клетках млекопитающих. Пириметамин (другой бензилпиримидин) более активен в отношении дигидрофолатредуктазы простейших, чем к аналогичному ферменту клеток млекопитающих. Дигидрофолатредуктазы — это ферменты, которые превращают дигидрофол иевую кислоту в тетрагидрофолиевую, участвующую в синтезе пуринов и в конечном счете — в синтезе ДНК. Триметоприм и пириметамин в комбинациях с сульфаниламидами вызывают угнетение двух последовательных этапов образования тетрагидро-фолиевой кислоты, что приводит к значительному повышению (синергизму) активности обоих препаратов (рис. 47-2).
Микроорганизмы, у которых отсутствует этап, угнетаемый триметопримом (дигидрофолатредук-таза), могут появляться в результате мутации или при передаче плазмид в ходе конъюгации. Такие
вызывающие устойчивость к триметоприму плазмиды существуют у бактерий кишечной группы, Haemophilus и других микроорганизмов.
Пириметамин
Фармакокинетика
Триметоприм обычно назначается перорально как монопрепарат или в комбинации с сульфаметоксазолом. Этот сульфаниламид выбран в качестве компонента комбинации вследствие близкого времени полувыведения (рис. 47-1). Указанную комбинацию можно также вводить внутривенно. Триметоприм хорошо всасывается в кишечнике и широко распределяется в тканях и жидкостях организма, включая цереброспинальную жидкость. Поскольку триметоприм обладает большей тропнос-тью к липидам, чем сульфаметоксазол, он имеет больший объем распределения, чем последнее вещество. Поэтому, когда 1 часть триметоприма дается с 5 частями сульфаметоксазола (соотношение в комбинированном препарате), пиковые концентрации этих веществ в плазме находятся в отношении 1 : 20, которое является оптимальным для суммирования эффектов этих препаратов in vitro. Приблизительно 65-70 % общего количества каждого компонента этой комбинации связывается с белками плазмы, а 30-50 % сульфаниламида и 50-60 % триметоприма (или их соответствующих метаболитов) экскретируется с мочой в течение 24 часов.
Триметоприм (слабое основание с рК,~ 7.2) концентрируется в простатической и во влагалищной жидкостях, которые имеют более кислую реакцию,
чем плазма. Поэтому препарат проявляет более высокую антибактериальную активность в этих средах, чем многие другие антимикробные препараты.
Клиническое применение
А. Триметоприм для приема внутрь. Триметоприм можно назначать в качестве средства монотерапии (100 мг каждые 12 часов) при острых инфекциях мочевыводящих путей. Большинство микроорганизмов чувствительны к высоким концентрациям в моче (200-600 мкг/мл).
Б. Пероральное применение комбинации триметоприм-сульфаметоксазол. В настоящее время комбинации типа триметоприм-сульфаметоксазол являются средствами выбора для лечения пневмонии, вызванной Pneumocystis carinii, симптоматического энтерита, вызванного Shigella, системных саль-монеллезных инфекций, вызванных ампициллин-или хлорамфениколустойчивыми микроорганизмами, осложненных инфекций мочевыводящего тракта, простатита и многих других заболеваиий.
Две таблетки (триметоприм 80 мг плюс сульфаметоксазол 400 мг), принимаемые каждые 12 часов, могут давать хороший эффект при хронических инфекциях нижних или верхних отделов мочевыводящих путей. Такая же доза может быть эффективна при простатите. Две таблетки ежедневно могут быть достаточны для длительного подавления хронических инфекций мочевого тракта, а половина таблетки 3 раза в неделю в течение многих месяцев может использоваться в качестве профилактического средства при рекуррентных инфекциях мочевых путей у женщин. Прием двух таблеток каждые 12 часов часто эффективен при инфекциях, вызванных Shigella, Salmonella, и при других инфекционных заболеваниях. Доза для детей при лечении шигеллеза, инфекций мочевых путей и среднего отита составляет 8 мг/кг триметоприма и 40 мг/кг сульфаметоксазола каждые 12 часов.
Инфекции, вызванные Р. carinii и некоторыми другими возбудителями, могут лечиться высокими дозами комбинации (триметоприм 20 мг/кг плюс сульфаметоксазол 100мг/кг)ежедневно. В качестве профилактики подобных инфекций больные с иммунодефицитом принимают две обычные таблетки два раза в день. Некоторые случаи сепсиса, вызванного Serratia или другими устойчивыми бактериями, с успехом излечивались комбинацией триметоп-рцм-сульфаметоксазол.
В. Внутривенный триметоприм-сульфаметоксазол. Раствор, содержащий 80 мг триметоприма плюс 400 мг сульфаметоксазола на 5 мл, разбавленный в 125 мл 5 % водного раствора глюкозы, может вводиться внутривенно в течение 60-90 минут. Такое введение показано при тяжелой пневмонии, вызванной Р. carinii, особенно у больных СПИДом, при грамотрицательном бактериальном сепсисе, шигеллезе или инфекциях меченого тракта, а также при неспособности больных принимать препарат перорально. Взрослым назначают 6-12 этих ампул по 5 мл в три или четыре приема в день.
Г. Пероральный пириметамин в сочетании с сульфаниламидом. Эта комбинация используется при паразитарных инфекциях. При лейшманиозе и токсоплазмозе полные дозы сульфаниламида (6-8 г/день) назначают с пириметамином (50 мг/день). При тропической малярии (Р. falciparum) иногда применяют комбинацию пириметамина с сульфаниламидом (Фансидар) или только пириметамин (глава 54).
Побочные эффекты
Триметоприм вызывает предсказуемые побочные эффекты антифол атного препарата, прежде всего мегалобластическую анемию, лейкопению и гранулоцитопению (глава 56). Эти нарушения можно предотвратить одновременным введением фолиевой кислоты в дозе 6-8 мг/день. Кроме того, комбинация триметоприм-сульфаметоксазол может вызвать все неблагойриятные реакции, свойственные сульфаниламидам. Иногда отмечаются тошнота и рвота, лихорадка лекарственного происхождения, васкулит, нарушения функции почек и центральной нервной системы. У больных СПИДом и пневмонией, вызванной Pneumocystis, частота неблагоприятных реакций на комбинацию триметоприм-сульфаметоксазол особенно высока, что проявляется чаще всего лихорадкой, высыпаниями, лейкопенией и диареей.
Препараты
Сульфаниламиды общего назначения
Многокомпонентные сульфаниламиды, трисульфапиримидины (генерики) Перорально: таблетки по 500 мг (общее содержание сульфаниламидов)
Сульфацитин (Реноквид)-Перорально: таблетки по 250 мг
Сульфадиазин (генерик)
Перорально: таблетки по 500 мг
Сульфаметизол (Тиосульфил)
Перорально: таблетки по 500 мг
Сульфаметоксазол (генерик, Гантанол, др.) Перорально: таблетки по 0.5 г; суспензия 500 мг/5 мл
Сульфизоксазол (генерик, Гантрисин) Перорально: таблетки по 500 мг; сироп 500 мг/5 мл
Сульфаниламиды
для специального применения
Мафенид (Сульфамилон)
Местно: крем 85 мг/г
Серебра сульфадиазин (генерик, Сильваден) Местно: крем 10 мг/г
Сульфасалазин (генерик, Азалии, Азульфидин) Перорально: таблетки и кишечнорастворимые таблетки по 500 мг; суспензия 250 мг/5 мл
Триметоприм
Триметоприм (генерик, Пролоприм, Тримпекс) Перорально: таблетки по 100, 200 мг
Триметоприм-сульфаметоксазол [котримоксазол, TMP-SMZ] (генерик, Бактрим, Септра, др.) Перорально: 80 м г триметоприма + 400 мг сульфаметоксазола в таблетке; 160 мг триметоприма +
800 мг сульфаметоксазола в таблетке;
40 мг триметоприма + 200 мг сульфаметоксазола в 5 мл суспензии
Парентерально: 80 мг триметоприма + 400 мг сульфаметоксазола в 5 мл для инъекций (в ампулах по 5 мл и флаконах по 5,10, 20, 30, 50 мл)
Избранная литература
Bartels R. Н., van der Spek J. A., Oosten H. R. Acute pancreatitis due to sulfamethoxazole-trimetho-prim. South Med. J. 1992; 85:1006.
Gordin F. M. et al. Adverse reactions to trimethoprim-sulfamethoxazole in patients with the acquired immunodeficiency syndrome. Ann. Intern. Med. 1984; 100:495.
Heikkila E. et al. Analysis of localization of the type I trimethoprim resistance gene from Escherichia coli isolated in Finland. Antimicrob. Agents Chemo-ther. 1991; 35:1562.
Huovinen P., Wolfston J. S., Hooper D. C. Synergism of trimethoprim and ciprofloxacin in vitro against clinical bacterial isolates. Europ. J. Clin. Microbiol. Infect. Dis. 1992; 11: 255.
Lee B. L. et al. Dapsone, trimethoprim-sulfametho-xazole plasma levels during treatment of Pneumocystis pneumonia in patients with AIDS. Ann. Intern. Med. 1989; 110: 606.
Paradise J. L. Antimicrobical prophylaxis for recurrent acute otitis media. Ann. Otol. Rhinol. Laryngol. 1992; 155 (Suppl.): 33.
Spes С. H. et al. Sulfadiazine therapy for toxoplasmosis in heart transplant recipients decreases cyclosporine concentration. Clin. Invest. 1992; 70:752.
Then R. L., Kohl L, Burdeska A. Frequency and transferability of trimethoprim and sulfonamide resistance in methicillin-resistant Staphylococcus aureus and Staphylococcus epidermidis.J. Chemo-ther. 1992; 4:67.
Противогрибковые средства
48
Эрнест Явец
Большинство грибов устойчиво к действию антибактериальных препаратов. Лишь немногие химические соединения обладают угнетающим действием на патогенные для людей грибы, и большинство из них весьма токсичны. Потребность в эффективных противогрибковых препаратах приобрела особую актуальность в связи с резким возрастанием числа местных и диссеминированных микозов у больных с иммунодефицитом.
Среди противогрибковых препаратов, доступных в настоящее время, амфотерицин В наиболее сложен в применении и имеет много побочных эффектов, но в то же время остается наиболее эффективным для лечения тяжелых системных микозов. С этой же целью перорально можно использовать флуцитозин, но к нему часто развивается устойчивость. Противогрибковые азолы, такие как кетоконазол, флуконазол и некоторые другие, также позволяют проводить пероральную терапию некоторых системных микозов. Миконазол, еще один представитель группы азолов, эффективен при местном применении и в ограниченной степени — при системном. Поскольку азолы ингибируют окислительные ферменты системы цитохрома Р-450 в печени и других органах, они могут изменять метаболизм лекарств и синтез эндогенных веществ. Пероральный прием гризеофульвина помогает при дерматомикозах, но не при системных инфекциях. Нистатин, галопрогин и некоторые другие препараты можно использовать только местно. В связи с большим значением противогрибковых средств в дерматологии некоторые из них также рассматриваются в главе 63.
Противогрибковые препараты для системного применения
Амфотерицин В
Амфотерицины А и В — противогрибковые антибиотики, продуцируемые Streptomyces nodosus, были получены в очищенном виде в 1956 г. Амфотерицин А в качестве лекарственного средства не используется.
Химическое строение
Амфотерицин В — амфотерный полиеновый макролид (“полиен” означает содержащий много двойных связей; “макролид” — содержащий большое лактонное кольцо из двенадцати или более атомов). Он почти нерастворим в воде. Препарат нестабилен при 37 °C, но сохраняет активность в течение нескольких недель при 4 °C. Его лекарственные формы, содержащие микрокристаллы, можно применять в виде аппликаций, но при этом препарат существенно не всасывается. Для получения системного эффекта при внутривенном введении используется коллоидная форма лекарства. В настоящее время разрабатывается липосомная форма этого препарата.
Противогрибковая активность
Амфотерицин В в дозе 0.1-0.8 мкг/мл in vitro угнетает Histoplasma capsulatum, Cryptococcus neo
formans, Coccidioidesimmitis, Candida albicans, Blastomyces dermatitidis, Sporothrix schenckii и некоторые другие микроорганизмы, вызывающие микозы у людей. Он не действует на бактерии, но может успешно использоваться для лечения менингоэнцефалита, вызванного Naegleria.
Механизм действия полиеновых антибиотиков хорошо изучен. Эти препараты прочно связываются с эргостеролом в клеточных мембранах грибов. При этом мембрана клетки гриба повреждается, возможно, за счет образования пор (амфотерицин образует поры в искусственных мембранах), что приводит к потере клеточных макромолекул и ионов, вызывая необратимые нарушения. Бактерии не чувствительны к полиенам, поскольку они не содержат эргостерола, необходимого для связывания этих препаратов с мембраной клетки. Устойчивость к амфотерицину может возникать в результате снижения содержания эргостерола в мембране или модификации его структуры, что приводит к ограничению связывания препарата с мембраной. Вероятно, токсичность амфотерицина В отчасти определяется его частичным связыванием с холестерином в мембранах животных клеток К счастью, такое связывание идет менее интенсивно, чем связывание с эргостеролом в мембранах грибковых клеток.
Фармакокинетика
Амфотерицин В плохо всасывается в желудочно-кишечном тракте, поэтому при пероральном приеме он действует только на грибы в просвете кишечника и не может использоваться в терапии системных микозов. Внутривенное введение 0.6 мг/кг/день амфотерицина В приводит к созданию средних концентраций в крови 0.3-1 мкг/мл. Препарат более чем на 90 % связывается с белками и незначительно удаляется гемодиализом. После инъекции антибиотик медленно экскретируется с мочой в течение нескольких дней. Препарат широко распределяется в тканях, но в спинномозговой жидкости его уровень достигает только 2-3 % от уровня в крови. Поэтому при грибковом менингите необходимо интратекальное введение.
Амфотерицин В может выпускаться в виде липосомальных гранул со средним диаметром 0.5-3.5 мкм. В этой лекарственной форме в дозах вплоть до кумулятивной общей дозы 75 мг/кг он терапевтически эффективен и практически не оказывает нефро- и нейротоксического действия.
Клиническое применение
Для лечения системных микозов амфотерицин В вводится внутривенно медленно в течение 4-6 часов. Начальная доза составляет 1-5 мг/день, с ежедневным увеличением на 5 мг до достижения заключительной дозы 0.4-0.7 мг/кг/день. Такое лечение обычно длится в течение 6-12 недель или более при суточной дозе, редко превышающей 60 мг. После получения первоначальной реакции на лечение препарат назначают только 2 или 3 раза в неделю, часто амбулаторно.
При грибковом менингите интратекальное введение 0.5 мг амфотерицина В производят 3 раза в неделю в течение 10 недель или более. Иногда используется длительное вливание. Грибковый менингит имеет тенденцию к рецидивированию. Все чаще при лечении менингита, вызванного Candida и Cryptococcus, а также системного кандидоза используется комбинация амфотерицина В и флуци-тозина. Это задерживает появление резистентности к флуцитозину и позволяет использовать более низкие дозы амфотерицина В.
Для лечения вызванных грибами язвенных поражений роговицы может применяться закапывание раствора амфотерицина В (1 мг/мл) в конъюнктивальный мешок каждые 30 минут. Другие варианты местного введения включают внутрисуставные инъекции при кокцидиоидозе или споротрихозе, а также орошение мочевого пузыря при цистите, вызванном Candida.
В настоящее время изучается возможность клинического использования липосомальной формы амфотерицина В при различных микозах.
Побочные эффекты
Внутривенное введение амфотерицина В обычно сопровождается ознобом, лихорадкой, рвотой и головной болью. Выраженность побочных реакций может быть уменьшена временным снижением дозы, а также назначением аспирина, фенотиазинов, антигистаминных средств и кортикостероидов или приостановкой использования препарата на несколько дней.
Терапевтически — активные количества амфотерицина В обычно нарушают функцию почек и печени и вызывают анемию. Снижается скорость клубочковой фильтрации и нарушается функция почечных канальцев. Это приводит к снижению
клиренса креатинина и увеличению клиренса калия. Нередко встречаются коллаптоидные проявления, нарушения электролитного баланса (особенно гипокалиемия) и разнообразные неврологические симптомы. При нарушениях функции почек доза амфотерицина В должна быть снижена. Меньшей нефро- и нейротоксичностью обладает липосомальная форма амфотерицина В.
Флуцитозин
Пероральный противогрибковый препарат 5-флуороцитозин (флуцитозин, 5-FC) имеет следующую структуру:
Флуцитозин
Флуцитозин в концентрации 5 мкг/мл in vitro угнетает многие виды Candida, Cryptococcus, Torulopsis и некоторые виды Aspergillus и других грибов. Клетки чувствительны к нему в том случае, если превращают флуцитозин во фторурацил, что приводит к ингибированию тимидилатсинтетазы и синтеза ДНК. Устойчивые к этому препарату мутанты возникают достаточно быстро и часто; их селекция осуществляется в присутствии лекарственного вещества, что ограничивает его полезные свойства. В связи с этим используется комбинированное лечение флуцитозином и амфотерицином В, что повышает противогрибковый эффект при инфекциях, вызванных Candida, Cryptococcus и некоторыми другими возбудителями.
При приеме внутрь в дозе 150 мг/кг/день флуцитозин хорошо всасывается и широко распределяется в тканях, включая спинномозговую жидкость, где его концентрация может достигать 60-80 % от сывороточной, которая составляет приблизительно 50 мкг/мл. Примерно 20 % препарата связывается с белками. Флуцитозин в основном выводится почками. Его концентрации в моче в десять раз выше, чем в сыворотке. При почечной недостаточности препарат может накапливаться в сыворотке в токсических концентрациях, при печеночной
недостаточности этого явления не наблюдается. Флуцитозин удаляется гемодиализом.
Флуцитозин относительно нетоксичен для клеток млекопитающих (возможно, в связи с отсутствием в них специфической пермеазы). Однако длительные высокие сывороточные концентрации часто вызывают угнетение функции костного мозга, выпадение волос и нарушение функции печени. Дополнительное применение урацила может уменьшать отрицательное действие на костный мозг, проявляющееся угнетением гемопоэза, но не оказывает никакого влияния на противогрибковую активность флуцитозина. Неблагоприятные эффекты лекарства связаны с его превращением в организме в 5-фторурацил. Иногда отмечаются тошнота, рвота и кожные высыпания. При использовании препарата в количестве 6—12 г в день в несколько приемов наблюдалась длительная ремиссия при гематогенной грибковой инфекции, сепсисе и менингите, вызванном чувствительными организмами. Предпочтительно совместное использование флуцитозина с амфотерицином В, особенно при крип-тококкозном менингите и системном кандидозе, что позволяет снизить дозу амфотерицина.
Противогрибковые азолы: клотримазол, миконазол, кетоконазол, флуконазол и другие препараты
Синтетические противогрибковые азолы (рис. 48-1) угнетают развитие грибов, блокируя биосинтез грибковых липидов, прежде всего эргостерола, в мембранах клетки. Установлено, что этот эффект связан с торможением Р-450-зависимого 14а-деметилирования ланостерола в грибах. К счастью, аффинитет Р-450-изоферментов млекопитающих к азолам ниже, чем аффинитет грибковых ферментов, однако отмечается существенное угнетение активности нескольких изоферментов млекопитающих.
Клотримазол в виде таблеток по 10 мг при приеме 5 раз в день может устранить оральный кандидоз; в виде 1 % крема он эффективен при дерматомикозе. Препарат также выпускается в форме влагалищных таблеток для лечения кандидоза. Для системного использования он слишком токсичен.
Миконазол длительное время использовался в виде 2 % крема при дерматомикозах и влагалищ
ных кандидозах, не отвечающих на местное лечение нистатином. Его назначали и внутривенно (30 мг/кг/день) при различных диссеминированных микозах, что приводило в некоторых случаях к длительным ремиссиям. Однако существенные побочные эффекты, включающие рвоту, гиперлипидемию, гипонатриемию, тромбофлебит, гематологические и прочие нарушения, весьма ограничили использование этого средства.
Производное имидазола кетоконазол является первым препаратом в этом ряду, который можно назначать перорально; он эффективен при некото
рых системных микозах. Однократная суточная доза 200-400 мг принимается во время еды. Препарат хорошо всасывается и широко распределяется в организме, но его концентрации в центральной нервной системе низки. Суточная доза устраняет кандидоз ротовой полости или влагалища в течение 1-2 недель и дерматомикоз в течение 3-8 недель. Для лечения кожно-слизистого кандидоза у детей с иммунодефицитом требуется 4-10 месяцев.
Кетоконазол (200-600 мг/день) эффективно устраняет клинические проявления системного паракокцидиоидомикоза и бластомикоза, иногда ле-
Рис. 48-1. Структурные формулы некоторых противогрибковых азолов
F
Флуконазол
точные, костные или кожные поражения при гистоплазмозе и кокцидиоидомикозе, но не проявления вызываемого этими грибами менингита. Кетоконазол является препаратом выбора при диссеминированном бластомикозе.
При введении пероральной дозы 200 мг пиковые концентрации кетоконазола составляют 2-3 мкг/мл и сохраняются в течение шести часов и более. К основным токсическим эффектам относятся: тошнота, рвота, высыпания на коже и повышение уровня сывороточной трансаминазы. Очень редко при использовании высоких доз отмечалось прогрессирующее гепатотоксическое действие. Кетоконазол ингибирует некоторые изоферменты системы цитохрома Р-450 млекопитающих. В результате этого угнетается синтез стероидов в надпочечниках и андрогенов (в котором участвуют изоферменты Р-450 — главы 38 и 39) и может развиваться гинекомастия. Кетоконазол увеличивает уровни циклоспорина, тер-фенадина и астемизола (и, вероятно, других препаратов), ингибируя Р-450-метаболизм (CYP ЗА4) в печени. Его действие на метаболизм антигистаминных препаратов иногда приводит к возникновению тяжелых аритмий. Развитие устойчивости к этому лекарственному средству отмечается редко. Всасывание кетоконазола после перорального введения нарушается антацидами, циметидином и рифампином.
Производное бистриазола флуконазол (рис. 48-1) более растворим в воде и лучше всасывается из желудочно-кишечного тракта, чем кетоконазол. После перорального приема флуконазола создаются почти такие же концентрации в плазме, как и после внутривенного введения. Он широко распределяется в тканях и жидкостях организма, в том числе цереброспинальной жидкости, где его содержание может составлять 50-80 % от сывороточного. Препарат экскретируется главным образом с мочой. Период полувыведения флуконазола равняется приблизительно 30 часам и значительно увеличивается у больных с почечной недостаточностью.
При приеме внутрь в дозе 100-200 мг/день флуконазол может устранять проявления кандидоза ротовой полости и пищевода у больных с иммунодефицитом, а также может быть эффективным при системном кандидозе. В дозе 400 мг/день перорально препарат может быть эффективным в лечении криптококкозного менингита у больных СПИДом, однако при этом часто возникают рецидивы, если не продолжить лечение поддерживающими дозами (200 мг/день) в течение нескольких месяцев.
Побочные эффекты флуконазола, как и других азолов, включают рвоту, понос, кожные высыпания и иногда нарушения функции печени. Очевидно, что все азолы должны отменяться при возникновении прогрессирующих нарушений функции печени. Как и кетоконазол, флуконазол угнетает цитохром Р-450 и может увеличивать сывороточные концентрации фенитоина, циклоспорина, пероральных антидиабетических средств и антикоагулянтов. Концентрация флуконазола в сыворотке может снижаться рифампином и повышаться тиазидными диуретиками.
Итраконазол, еще один пероральный препарат из группы азолов, дал многообещающие результаты при лечении распространяющегося аспергиллеза, гистоплазмоза, кокцидиоидозного и криптококкозного менингита и других тяжелых микозов. Как и другие азолы, он угнетает изоферменты цитохрома Р-450 и может вызвать значительное повышение концентраций в плазме таких препаратов, как циклоспорин и терфенадин.
Гидроксистильбамидин
Гидроксистильбамидина изетионат является ароматическим диамидином, активным in vitro и in vivo в отношении Blastomyces dermatitidis. Так как данный препарат может оказывать выраженное ге-пато- и нефротоксическое действие, он был практически заменен на амфотерицин В.
Гризеофульвин
Гризеофульвин — вещество, выделенное из Penicillium griseofulvum в 1939 г.; в 1957 г. он был внедрен в клинику для лечения дерматомикозов.
Химическое строение
Гризеофульвин практически нерастворим в воде, но весьма стабилен при высокой температуре, в том числе при автоклавировании.
Гризеофульвин
Противогрибковая активность
Гризеофульвин угнетает рост дерматофитов, включая Epidermophyton, Microsporum и Trichophyton, в концентрациях 0.5-3 мкг/мл. Он не влияет на бактерии, возбудители глубоких микозов у людей, а также на некоторые грибы, вызывающие поверхностные микозы. У исходно чувствительных к этому препарату дерматофитов может возникать устойчивость (глава 63).
Механизм действия окончательно не выяснен, но, вероятно, гризеофульвин влияет на функцию микротрубочек или на синтез и полимеризацию нуклеиновых кислот. Угнетающее действие на грибы может полностью или частично устраняться пуринами.
Фармакокинетика
Всасывание гризеофульвина сильно зависит от степени дисперсности лекарственного вещества и значительно увеличивается в присутствии жирной пищи. Лекарственные формы, содержащие микрочастицы этого препарата, всасываются в два раза лучше, чем формы, содержащие более крупные частицы. Гризеофульвин в форме микрочастиц в дозе 1 г в день создает у взрослых концентрации в крови, равные 0.5-1.5 мкг/мл. Ультрамикрочастицы гризеофульвина всасываются в два раза лучше, чем микрочастицы. Препарат обладает тропностыо к поврежденной коже и депонируется там, связываясь с кератином. Таким образом это вещество делает кератин устойчивым к росту грибков, а вновь образующиеся волосы или ногти изначально свободны от инфекции. Поскольку содержащие кератин структуры слущиваются, то в процессе обновления они заменяются неинфицированными. В жидкие среды и другие ткани организма попадают незначительные количества гризеофульвина. Большая часть принятого внутрь препарата выводится с калом и только незначительное количество — с мочой.
Клиническое применение
Местное поверхностное использование гризеофульвина оказывает слабое действие.
Препараты, содержащие ультрамикрочастицы гризеофульвина, назначаются взрослым в дозе 0.3-0.6 г/день перорально (7.25 мг/кг/день для детей).
Если поражены только волосы или кожа, лечение должно продолжаться в течение 3-6 недель, а при поражении ногтей его необходимо проводить в течение 3-6 месяцев. Гризеофульвин показан при тяжелых формах эпидермомикозов, трихофитии, онихомикозов, особенно вызванных Trichophyton rubrum, который слабо реагирует на иное лечение. Одновременно необходимо использовать другие противогрибковые препараты для местной терапии.
Гризеофульвин может увеличивать скорость метаболизма варфарина, что требует увеличения дозы антикоагулянта. Фенобарбитал снижает биодоступность гризеофульвина.
Побочные эффекты
Общая частота возникновения побочных эффектов невелика. Однако могут наблюдаться аллергические явления в виде лихорадки, кожных высыпаний, лейкопении и реакции типа сывороточной болезни. Кроме того, известны и проявления прямого токсического действия — головная боль, тошнота, рвота, понос, токсическое влияние на печень, фотосенсибилизация и спутанность сознания. В опытах на лабораторных животных у гризеофульвина обнаружены тератогенный и канцерогенный эффекты.
Противогрибковые препараты для местного применения
Нистатин
Химическое строение и механизм действия
Этот полиеновый макролид стабилен в сухой форме, но быстро разлагается в присутствии воды или плазмы. Нистатин не действует на бактерии или простейшие, но in vitro угнетает многие грибы. In vivo его действие ограничено поверхностями, где он может непосредственно контактировать с дрожжевидными или плесневидными грибами. In vivo устойчивость к нистатину не развивается, однако встречаются резистентные к нему штаммы Candida.
Механизм действия заключается в связывании нистатина со стеролами мембран грибов, преимущественно с эргостеролом. В результате он нару
шает проницаемость и транспорт веществ, вероятно, за счет образования пор. Это приводит к потере клеткой катионов и макромолекул. Устойчивость микроорганизмов связана с уменьшением содержания стеролов в мембране или с изменениями их структуры и степени связывания препарата.
Фармакокинетика
Нистатин существенно не всасывается в кровь с кожи, слизистых оболочек или из желудочно-кишечного тракта. Практически все количество нистатина при пероральном введении экскретируется с калом. Препарат не создает значительных концентраций в крови или тканях после перорального введения и является слишком токсичным для парентерального использования.
Клиническое применение
Нистатин можно применять в виде аппликаций на кожу или слизистые оболочки (слизистая оболочка полости рта, влагалища) в форме кремов, мазей, свеч, суспензий или порошков для лечения местных инфекций, вызываемых Candida. Перорально нистатин назначается для частичного подавления Candida в кишечнике очень маленьким детям или взрослым со сниженной сопротивляемостью организма (сахарный диабет, лейкоз, высокие дозы стероидов), когда существует возможность развития диссеминированного кандидоза. Однако целесообразность комбинированного применения нистатина с пероральными тетрациклинами сомнительна.
Коммерческие лекарственные формы нистатина часто содержат антибактериальные препараты.
Толнафтат и нафтифин
Толнафтат — местное противогрибковое лекарственное средство, применяемое в форме кремов, порошков или растворов для лечения дерматомикозов. Грибы рода Candida устойчивы к этому препарату, однако он угнетает многие виды дерматофитов и для достижения клинического эффекта требуется курс лечения от одной до десяти недель. При местном применении существенной системной абсорбции препарата не отмечается, а токсические и аллергические реакции минимальны.
Нафтифин (производное аллиламина нафтале-на) угнетает фермент скваленэпоксидазу и умень
шает синтез эргостерола. Для лечения дерматомикозов различной локализации эффективен 1 % крем.
Клотримазол
и родственные азолы
Клотримазол и миконазол — эффективные местные противогрибковые средства, однако они токсичны при системном использовании. Эти препараты уже были рассмотрены. Сходные местные азолы — это эконазол, оксиконазол и сульконазол. Они используются главным образом при кандидозе слизистой оболочки полости рта, влагалища или кожи в форме кремов или таблеток. Бутоконазол, терко-назол и тиоконазол применяются только при вульвовагинальном кандидозе.
Натамицин
Натамицин является полиеновым противогрибковым препаратом, активным в отношении различных грибов in vitro. Местное применение 5 % глазной суспензии иногда приводит к хорошему результату при лечении кератита, вызванного Fusarium, Cephalosporium и другими грибами. Препарат показан при подобных заболеваниях, однако необходимо одновременное хирургическое лечение.
Натамицин может оказывать лечебный эффект при кандидозах слизистой оболочки полости рта и влагалища. При локальном применении обладает низкой токсичностью.
Другие противогрибковые препараты для местного применения
Жирные кислоты
Жирные кислоты, в частности ундециленовая кислота и ее соли, являются эффективными местными противогрибковыми средствами (глава 63). Они широко используются при дерматомикозе в виде порошков для припудривания и кремов.
Галопрогин
Галопрогин — препарат для местного применения, активный in vitro в отношении многих дерматофитов и in vivo при эпидермомикозах. Он выпус
кается в форме 1 % крема или раствора. При аппликации 10—20 % препарата может всасываться. Галопрогин иногда вызывает местное раздражение.
Препараты
Препараты для лечения системных или желудочно-кишечных микозов Амфотерицин В (Фунгизон внутривенный)
Парентерально: 50 мг лиофилизата во флаконе для приготовления раствора
Флуконазол (Дифлукан)
Перорально: таблетки по 50,100,200 мг Парентерально: 2 мг/мл во флаконах по 200 и 400 мл
Флуцитозин (Анкобон)
Перорально: капсулы по 250,500 мг
Итраконазол (Споранокс)
Перорально: капсулы по 100 мг
Кетоконазол (Низорал)
Перорально: таблетки по 200 мг
Миконазол (Монистат)
Парентерально: 10 мг/мл для инъекций
Местные противогрибковые средства и гризеофульвин
См. главу 63.
Избранная литература
DeWit S. et al. Comparison of fluconazole and ketoconazole for oropharyngeal candidiasis in AIDS. Lancet, 1989; 1: 746.
Galgiani J. N. et al. Fluconazole therapy for coccidioidal meningitis. Ann. Intern. Med. 1993; 119:28.
Larsen R. A. et al. Fluconazole compared with amphotericin В plus flucytosine for cryptococcal meningitis in AIDS. Ann. Intern. Med. 1990; 113: 183.
Lopez-Berestain G. et al. Treatment of systemic fungal infections with liposomal amphotericin B. Arch. Intern. Med. 1989; 149: 2533.
Противовирусная химиотерапия и профилактика
49
Эрнест Явиц
Вирусы — облигатные внутриклеточные паразиты, чья репликация полностью зависит от процессов синтеза ДНК, РНК и белков в клетке хозяина. В связи с этим многие химические соединения, тормозящие репликацию вирусов, также угнетают некоторые функции клеток хозяина и вызывают выраженные токсические эффекты. Поиск соединений, которые угнетают только специфические вирусные процессы, является одним из активно разрабатываемых направлений фармакологии.
При многих вирусных инфекциях репликация вируса достигает максимума во время появления первых клинических признаков заболевания или даже ранее. Поэтому в подобных случаях вещества, нарушающие репликацию вирусов, должны использоваться до начала заболевания в качестве мер химиопрофилактики. Так применяется амантадин при гриппе типа А и метисазон при инфекциях, вызываемых поксивирусами. При некоторых других инфекциях, особенно вызываемых вирусами герпеса, репликация вирусов продолжается в течение некоторого времени после возникновения клинических признаков заболевания. В этих случаях подавление дальнейшей репликации вирусов препаратами может способствовать выздоровлению. Так действуют ингибиторы репликации ДНК при различных герпетических инфекциях.
Репликация вирусов включает несколько этапов:
1) адсорбция и проникновение в клетку; 2) синтез ранних, неструктурных, белков, например полимераз нуклеиновых кислот; 3) синтез РНК или ДНК; 4) синтез конечных, структурных, белков; 5) сборка (созревание) вирусных частиц и их выход из клетки. Антивирусное действие лекарственного средства может реализовываться на любом из этих этапов (табл. 49-1).
Торможение адсорбции и проникновения в клетки у-Глобулин
Если у-глобулин содержит специфические антитела к поверхностным антигенам данного вируса, он может влиять на вход этой вирусной частицы в клетку, нарушая скорее собственно проникновение, чем адсорбцию. Внутримышечное введение общего у-глобулина (иммуноглобулин USP) в дозе 0.025-0.25 мл/кг массы тела во время раннего инкубационного периода может тормозить развитие инфекции, вызываемой вирусами кори, гепатита, бешенства, полиомиелита и, возможно, других заболеваний. Защитное действие у-глобулина длится 2-3 недели. При инфекциях с длительным инкубационным периодом инъекции препарата могут проводиться 1 раз каждые 3 недели.
Часто репликация вирусов угнетается лишь частично, поэтому развитие активного иммунитета дополняет временную пассивную защиту, которую создает у-глобулин (“активно-пассивная иммунизация”).
Если внутримышечное введение нецелесообразно, может назначаться иммуноглобулин, приготовленный для внутривенного введения. Специальные гипериммунные глобулины (полученные из плазмы людей с высокими уровнями антител) используются по особым показаниям при бешенстве, вак-цинии, опоясывающем лишае, гепатите В и реакции резуснесовместимости.
Адамантанамины
(амантадин и ремантадин)
Амантадин и ремантадин являются трициклическими симметричными адамантанаминами, кото-
ТАБЛИЦА 49-1. Противовирусные вещества и их некоторые свойства
Препарат Вирусная мишень Виды вирусов
Аналоги пуринов и пиримидинов
Ацикловир ДНК-полимераза Herpes simplex, varicella-zoster
Ганцикловир ДНК-полимераза Цитомегаловирус
Рибавирин’ Синтез ДНК Респираторный синцитиальный вирус, ви-
Видарабин ДНК-полимераза русы гриппа типа А, лихорадки Лаоса Herpes simplex, zoster
Идоксу ридин Синтез ДНК Герпес (роговица)
Трифлуридин Синтез ДНК Герпес (роговица)
Дидезоксинуклеоэиды Обратная транскриптаза, синтез ДНК ВИЧ
(АЗТ, ddC, ddl)2 Другие препараты Амантадин, ремантадин Адсорбция,проникновение Вирусы гриппа А, краснухи
Фоскарнет ДНК-полимераза, обратимая транс- Цитомегаловирус, Herpes simplex
у-Глобулин криптаза Адсорбция, проникновение Вирусы гепатита В, бешенства, полиомие-
Интерфероны Синтез белков лита, другие Herpes simplex и zoster, вирусы гепатита В,
Метисазон Синтез белков папилломы, другие Вирус оспы, другие поксивирусы
Рифампин Сборка зрелых вирусных частиц Поксивирусы
'Рибавирин не является пурином, но взаимодействует с гуанозинмонофосфатом.
2 АЗТ — зидовудин; ddC — дидезоксицитидин; ddl — дидезоксиинозин.
рые угнетают “раздевание” некоторых миксовиру-сов, например вируса гриппа типа В (но не типа А), краснухи и некоторых вызывающих опухоли вирусов после проникновения их в клетки хозяина. Эти препараты нарушают репликацию вирусов in vitro и в опытах на экспериментальных животных. Являясь слабыми основаниями, амины, вероятно, действуют отчасти за счет повышения pH эндосом — имеющих мембрану вакуолей, которые окружают вирусные частицы после их проникновения в клетку. Предотвращение ацидификации в этих вакуолях блокирует слияние вирусной оболочки с мембраной эндосомы, предотвращая таким образом передачу вирусного генетического материала в цитоплазму клетки. Данные препараты могут также угнетать выход вирусных частиц из клетки. У людей назначение любого из этих препаратов в суточной дозе 200 мг в течение 2—3 дней до и 6-7 дней после возникновения клинических проявлений гриппа типа А снижает заболеваемость, выраженность симптомов заболевания и степень серологической реакции. Некоторое терапевтическое действие может также проявиться, если лекарственное средство
назначено в пределах 18 часов после возникновения первых симптомов гриппа.
После приема внутрь амантадин почти полностью всасывается в кишечнике. Препарат экскретируется в неизмененном виде в основном почками. У лиц с почечной недостаточностью амантадин может накапливаться в токсических концентрациях, если доза не корригируется пропорционально уменьшению клиренса креатинина. У пожилых людей доза должна быть снижена. При нормальной функции почек период полувыведения составляет приблизительно 12 часов. Для ремантадина характерна близкая фармакокинетика, однако период
NH2
Амантадин
Ремантадин
полувыведения у этого препарата более длительный (приблизительно 30 часов), а скорость элиминации зависит от функции печени.
Химиопрофилактика амантадином может быть эффективна при контактах с заболевшим дома, при распространении инфекции в замкнутых коллективах и при высоком риске возникновения заболевания во время эпидемии гриппа. Однако возможно появление резистентных к препарату вирусных мутантов, которые инфицируют контактирующих лиц. Ремантадин имеет такую же эффективность и не требует корректировки доз при почечной недостаточности.
В некоторых случаях амантадин давал лечебный эффект при болезни Паркинсона (глава 27, том 1).
К наиболее выраженным побочным эффектам амантадина относятся бессонница, нарушения речи, головокружения, атаксия и другие нарушения центральной нервной системы. Препарат может вызвать высвобождение катехоламинов из депо. Опыт клинического применения ремантадина в США ограничен; частота возникновения побочных эффектов со стороны центральной нервной системы у этого препарата ниже, чем у амантадина.
Торможение внутриклеточного синтеза
Торможение синтеза ранних белков
Гуанидин и гидроксибензилбензимидазол способны ингибировать репликацию некоторых РНК-содержащих энтеровирусов. Оба вещества in vitro угнетают формирование РНК-полимераз в безопасных для клеток хозяина концентрациях. При приеме этих препаратов достаточно часто и быстро появляются устойчивые мутанты, селекция которых идет в присутствии препаратов. Поэтому, как и предполагалось, эти средства не имеют существенной терапевтической актив! гости in vivo. Исследования бигуанидинов как потенциальных препаратов для лечения инфекций, вызываемых РНК-содержащи-ми вирусами, не дали положительных результатов.
Торможение синтеза нуклеиновых кислот
А. Рибавирин. Рибавирин (рибофуранозилтри-азолокарбоксамид) может ингибировать репликацию как РНК-, так и ДНК-содержащих вирусов на
экспериментальных моделях. Этот препарат влияет на образование гуанозинмонофосфата и последующий синтез нуклеиновых кислот. В экспериментах на животных и при заболевании гриппом типа А людей рибавирин в дозе 15 мг/кг давал некоторый терапевтический эффект. При использовании этого препарата в форме аэрозоля он ограничивает репликацию респираторного синцитиального вируса у детей и уменьшает выраженность клинических проявлений и продолжительность заболевания. Он также эффективен при лечении гриппа типов А и В, ускоряет выздоровление и ослабляет клинические проявления. Рибавирин использовался для лечения респираторных инфекций и гепатита во многих странах и одобрен для применения при респираторных синцитиальных вирусных инфекциях в США. Медицинские работники должны избегать вдыхания значительных количеств этого вещества.
Рибавирин является препаратом выбора при лихорадке Ласса при условии раннего начала лечения. При бешенстве препарат неэффективен.
Б. Аналоги пиримидина и пурина.
1. Фторурацил (5-фторурацил) и 5-бромура-цил. Эти препараты эффективно угнетают репликацию ДНК-содержащих вирусов в культурах клеток, но они относительно неэффективны in vivo.
2. Идоксуридин. Идоксуридин (5-йодо-2'-дез-оксиуридин, IDU, IUDR) тормозит репликацию вируса Herpes simplex в роговице и таким образом способствует излечению герпетического кератита у людей. Такое действие требует специальных условий, поскольку вирус герпеса пролиферирует в бессосудистом эпителии роговицы и при локальной аппликации препарат не всасывается в кровь и остается в месте введения. В богатой сосудами конъюнктиве препарат малоэффективен, поэтому аденовирусный конъюнктивит не лечат идоксури-дином.
Для лечения герпетического кератита идоксуридин апплицируют на роговицу (0.1 % раствор или 0.5 % мазь). Это способствует ускорению спонтанного выздоровления. Однако синтез ДНК клеток хозяина также нарушается, что при длительном лечении иногда приводит к токсическому действию на клетки роговицы. Идоксуридин может вызывать аллергический контактный дерматит. Для системного введения он слишком токсичен.
Длительная экспозиция вирусов герпеса с идок-суридином может приводить к селекции устойчивых к препарату мутантов.
При глубоком герпетическом стромальном кератите имеет место незначительная репликация вирусов в строме. Уменьшению воспалительной реакции способствуют кортикостероиды. Идоксу-ридин назначают одновременно с 11ими для предотвращения пролиферации вируса герпеса в поверхностном эпителии.
При поражениях кожи вирусом Herpes simplex или при опоясывающем лишае местное применение идоксуридина неэффективно.
3. Цитарабин. Цитарабин (арабинофуранозил-цитозина гидрохлорид, цитозина арабинозид, ара-С; глава 56) также угнетает синтез ДНК и влияет на репликацию ДНК-содержащих вирусов. По соотношению доз он приблизительно в десять раз более эффективен, чем идоксуридин, однако и в десять раз более токсичен для клеток хозяина. Цитарабин в дозах 0.3-2 мг/кг внутривенно при однократном ежедневном введении в течение 5 дней не дал эффекта при диссеминированном герпесе или ветряной оспе.
4. Трифторидин. Трифторидин (5-трифторме-тил-2-дезоксиуридин) угнетает синтез вирусной ДНК аналогично идоксуридину. При нанесении на роговицу, инфицированную вирусом герпеса или вирусом коровьей оспы, 1 % раствор может давать лечебный эффект даже при инфицировании вирусами, устойчивыми к идоксуридину. Системно он не назначается.
5. Видарабин. Видарабин (арабинофуранозил-аденин, ара-А, аденина арабинозид) — наименее токсичный и наиболее эффективный из аналогов пурина.
О II
но он
Рибавирин
Видарабин фосфорилируется в клетке с образованием трифосфатного производного, которое ингибирует вирусную ДНК-полимеразу намного бо
лее эффективно, чем ДНК-полимеразу млекопитающих. In vivo видарабин быстро метаболизируется с образованием гипоксантина арабинозида (который оказывает слабое противовирусное действие) и выводится с мочой. Видарабин-монофосфат ( Ара-АМФ; на стадии изучения) намного более растворим в воде и может вводиться внутривенно.
Видарабин в форме 3 % мази эффективен при герпетическом и вакцинальном кератите. Локальное применение видарабина не оказывает лечебного действия при герпетическом (Herpes simplex') поражении кожи или слизистых оболочек.
Препарат можно также использовать системно вследствие его относительно низкой токсичности. Токсичность повышается при почечной недостаточности. В дозах 10-15 мг/кг/день внутривенно в течение 12-часового периода препарат существенно снижает клинические проявления системной герпетической инфекции. При подтвержденном биопсией герпетическом энцефалите такое системное лечение в течение 10 дней приводило к существенному снижению смертности. Однако только 40 % выживших людей, прошедших курс лечения видарабином, были способны возобновить нормальную жизнь, остальные страдали от тяжелых неврологических расстройств. Наиболее обнадеживающие результаты у больных с герпетическим энцефалитом наблюдались, если лечение было начато до развития комы.
Системное применение видарабина (15 мг/кг в сутки) может останавливать развитие диссеминированного герпеса (Herpes simplex) у новорожденных, герпетического энцефалита и распространение опоясывающего лишая у больных с иммунодефицитом. Однако видарабин менее эффективен, чем ацикловир.
6. Ацикловир. Ацикловир (ациклогуанозин) является производным гуанозина. Вирус герпеса содержит тимидинкиназу, которая присоединяет фосфат к гуанозину и дезоксигуанозину. Этот фермент фосфорилирует ацикловир в 30-100 раз быстрее, чем это делает киназа клеток хозяина. Данная реакция показана на рис. 49-1. Продукт реакции в дальнейшем фосфорилируется с образованием ациклогуанозинтрифосфата, который ингибирует ДНК-полимеразу вирусов герпеса в 10-30 раз сильнее, чем полимеразу клеток хозяина.
При профилактическом назначении перед трансплантацией костного мозга серопозитивным больным ацикловира в дозе 250 мг/м2 каждые 8 часов внутривенно в течение 18 дней он оказывает
Ацикловир
Вирусная тимидинкиназа у ---------------
Ациклогуанозин — Р
Ферменты хозяина
Ациклогуанозин — Р — Р — Р
Угнетение синтеза вирусной ДНК
Рис. 49-1. Этапы активации ацикловира, приводящие к торможению синтеза ДНК вируса герпеса. Неинфициро-ваниые клетки хозяина фосфорилируют ацикловир намного более медленно, поскольку в них отсутствует вирусная тимидинкиназа (Р — фосфатные группы; ферменты хозяина — клеточная ГМФ-киназа и фосфотрансферазы)
значительное защитное действие в отношении возникновения тяжелой герпетической инфекции в течение посттрансплантационной иммуносупрессии. При использовании после трансплантации сердца для предотвращения диссеминации герпеса из существующих герпетических очагов этот препарат ускорял заживление герпетических повреждений, но не предотвращал последующего распространения вируса герпеса. У больных с иммунодефицитом и герпетическими высыпаниями на коже и слизистых оболочках ацикловир способствовал заживлению повреждений и уменьшал распространение вирусов. В этих клинических ситуациях ацикловир в дозе 15 мг/кг/день внутривенно не вызывал каких-либо значимых побочных эффектов при введении в течение 5-18 дней. Та же самая доза ацикловира ускоряет заживление поражений при опоясывающем лишае у больных с иммунодефицитом, но оказывает слабое действие на постгерпетическую боль. Раннее внутривенное введение ацикловира при первичной инфекции Herpes simplex, особенно при генитальном герпесе у женщин, приводит к уменьшению болей, ускоряет заживление поражений и уменьшает распространение герпеса. Однако такое лечение не устраняет латентное носительство вирусов в сенсорных ганглиях и не снижает частоту и выраженность рецидивов. При герпетическом энцефалите и диссеминированном герпесе у новорожденных ацикловир более эффективен, чем видарабин.
При пероральном приеме в дозе 200 мг 5 раз в день ацикловир столь же эффективен, как и при внутривенном введении, в том числе для лечения первичного генитального герпеса. Однако он слабо влияет на течение рецидивирующего герпеса слизистой оболочки полости рта и половых органов. При профилактическом приеме в течение 4-6 месяцев он может уменьшать частоту и тяжесть рецидивов. Ацикловир эффективен и при ветряной оспе.
Местное применение 5 % мази ацикловира может ограничивать распространение поражений кожи и слизистых оболочек при Herpes simplex у больных с иммунодефицитными состояниями, но не оказывает действия, если иммунный статус нормальный. При местном применении ацикловир может укорачивать время заживления дефектов и уменьшать болевые ощущения при условии как можно более ранней аппликации на участки поражения при первичном генитальном герпесе, однако он малоэффективен при часто рецидивирующем герпесе половых органов. Препарат также не влияет на частоту возникновения рецидивов.
Во время лечения возможно появление ацикло-вирустойчивых вирусов герпеса, у которых имеется дефицит тимидинкиназы. Такие штаммы обычно не подавляются ацикловиром, но могут реагировать на лечение фоскарнетом.
Поскольку латентная, или субклиническая, цитомегаловирусная инфекция очень широко распространена, у больных с иммунодефицитом может возникать реактивация и диссеминацня этих вирусов, особенно при лечении противоопухолевыми препаратами, трансплантации органов или при заболевании СПИДом. Так как ацикловир не дает лечебного эффекта (цитомегаловирус не имеет тимидинкиназы), используют другие производные гуанина.
7. Ганцикловир. Ганцикловир — 9-[(1,3-дигид-рокси-2-пропокси)метил]гуанин (ДГПГ) поступает в инфицированные цитомегаловирусом клетки и фосфорилируется с образованием трифосфата, который преимущественно ингибирует ДНК-поли-меразу вируса цитомегалии. После включения трифосфата ганцикловира в ДНК цитомегаловируса этот препарат нарушает удлинение цепи ДНК и тормозит репликацию вируса. При внутривенном введении (5-10 мг/кг в сутки) в течение 14 дней образование вирусов останавливается, что приводит к заметному улучшению состояния больных с цитомегаловирусными ретинитами, пневмонией
или желудочно-кишечными формами заболевания. Однако после прекращения приема препарата репликация цитомегаловирусов возобновляется, что приводит к рецидивам болезни. При использовании поддерживающей дозы 5 мг/кг/день 3-5 раз в неделю клиническое улучшение может сохраняться дольше, а у некоторых больных отмечается полное выздоровление. В течение такого лечения возможно появление ганцикловирустойчивых штаммов цитомегаловирусов.
Главные побочные эффекты ганцикловира — лейкопения, нейтропения, тромбоцитопения, нарушения функции почек и судороги. Эти токсические эффекты в значительной степени лимитируют дозировку и продолжительность лечения препаратом. При почечной недостаточности выведение ганцикловира снижается, а его токсичность возрастает.
8. Зидовудин (АЗТ) и другие дидезоксинуклеозиды. Наиболее страшным смертельным заболеванием, появившимся за два последних десятилетия, считается СПИД — болезнь, вызываемая вирусом иммунодефицита человека (ВИЧ). Этот ретровирус может угнетаться синтетическими дидезоксинуклеозидами. Эти аналоги действуют на вирусную ДНК-полимеразу (обратную транскриптазу), нарушая синтез вирусной ДНК и значительно снижая репликацию вирусов. Обратная транскриптаза ВИЧ в 20-30 раз более чувствительна к ингибирующему действию этих препаратов, чем полимераза клеток млекопитающих. Зидовудин (азидотимидин, АЗТ) является наиболее изученным и широко применяемым препаратом этого ряда.
АЗТ хорошо всасывается в кишечнике и проникает в большинство тканей и жидкостей организма, включая цереброспинальную жидкость, где его концентрация достигает приблизительно 60 % от тако
СН3
НО-НгС
Ацикловир
Н2С сн2
Зидовудин (Азидотимидин)
вой в сыворотке. Время полувыведения из сыворотки составляет всего 1.1 часа, а его активной формы из клетки — 3 часа. 15-20 % дозы АЗТ экскретируется в неизмененной форме с мочой, а 75 % препарата метаболизируется с образованием глюкуронидов в печени с последующим выведением через почки.
Во многих клинических испытаниях с параллельной контрольной группой было установлено, что лечение больных с ВИЧ-инфекцией или ARC (AIDS-related complex) зидовудином (АЗТ) может подавлять репликацию ВИЧ, продлевать жизнь и временно уменьшать заболеваемость, а также снижать частоту и тяжесть инфекционных заболеваний, вызываемых условно-патогенными микроорганизмами (табл. 49-2). Число CD4+ лимфоцитов увеличивалось при лечении АЗТ как при СПИДе, так и при ARC, но при ARC это увеличение сохранялось обычно более длительное время. Неврологические и ментальные проявления заболевания в значительной степени редуцируются. Для такой терапии АЗТ применяется перорально в дозе 100— 200 мг 3-5 раз в день. Возможно назначение препарата и с более длительными интервалами между приемами без существенного снижения эффективности.
АЗТ назначается также профилактически ВИЧ-серопозитивпым, но не имеющим клинических проявлений больным со сниженным количеством CD4+ лимфоцитов. При пероральном использовании препарата в дозе 500 мг/день прогрессирование заболевания у больных СПИДом и ARC значительно приостанавливается по сравнению с контрольной груп
ТАБЛИЦА49-2. Результаты лечения
азидотимидином (АЗТ) больных СПИДом в течение 8-24 недель'
Плацебо АЗТ
Число больных в группе 75 85
Число летальных исходов во время исследования 19 1
Возникновение саркомы Калоши во время исследования 10 3
Оппортунистические инфекции, возникшие во время исследования 45 24
Количество требовавшихся 11 31
трансфузий2(%)
1 Данные из Fischl, 1987.
2 Включая больных с родственным СПИДу комплексом (ARC).
пой и отмечается большее число CD4+ лимфоцитов. Однако такая профилактика не предотвращает надежно репликацию ВИЧ даже при раннем ее начале после установленного инфицирования. Зидовудин-устойчивые штаммы ВИЧ могут возникать у многих больных СПИДом, получавших препарат в течение шести или более месяцев.
Наименее проблематичными побочными эффектами применения АЗТ являются: головная боль, возбуждение, бессонница, диарея, высыпания на коже и лихорадка. Более серьезные побочные эффекты включают угнетение костного мозга с тяжелой анемией (часто требуется переливание крови), грану-лоцитопению и иногда тромбоцитопению. Эти явления вынуждают снизить дозу и ограничить длительность лечения. Токсичность АЗТ может возрастать при одновременном использовании препаратов, которые также подвергаются деградации в печени, например ацетаминофена, пестероидных противовоспалительных средств и сульфаниламидов.
Диданозин (дидезоксиинозин, ddl) изучен недостаточно. Зидовудинустойчивые штаммы ВИЧ чувствительны к этому средству in vitro, а у больных, инфицированных такими штаммами, при использовании ddl возможно улучшение. Хотя токсичность ddl ниже таковой АЗТ, при лечении этим препаратом в дозах 125-300 мг внутрь два раза в день наблюдались периферические невриты и фатальные формы панкреатитов. Вероятно, что препарат эффективен и в более низких дозах и при этом лучше переносится. Место ddl в терапии окончательно не определено. Рекомендуемая в настоящее время дозировка составляет 200 мг два раза в день (для больных с массой тела менее 60 кг — 125 мг два раза в день).
Залцитабин (дидезоксицитидин, ddC) активен in vitro и при клиническом применении, однако в дозе 0.06 мг/кг/день часто вызывает болезненную сенсорную и моторную периферическую нейропатию. Рекомендуемая доза составляет 0.75 мг с одновременным применением зидовудина в дозе 200 мг каждые 8 часов.
Ставудин (З-дезокситимидин-2-ен) в эксперименте подавлял вирус ВИЧ и развитие болезни.
В. Другие ингибиторы синтеза нуклеиновых кислот. Фоскарнет является производным фосфо-ноформиата, которое не нуждается в фосфорилировании для проявления антивирусной активности. Он ингибирует ДНК-полимеразу вируса герпеса даже у ацикловирустойчивых штаммов с дефи
цитом тимидипкиназы. Фоскарнет в дозе 50 мг/кг при введении внутривенно 3 раза в день подавляет развитие ацикловирустойчивой герпетической инфекции у больных с иммунодефицитом при СПИДе и может оказывать некоторое действие непосредственно на ВИЧ.
О II НО —Р —С I ''ОН он
Фоскарнет
Фосфоноуксусная кислота также ингибирует ДНК-полимеразу вируса герпеса. Это вещество эффективно угнетает пролиферацию этого вируса in vitro и в некоторых экспериментальных системах. Клинический потенциал препарата неизвестен.
Интерфероны
Интерфероны — это группа эндогенных гликопротеидов, которые оказывают неспецпфическое противовирусное действие, по крайней мере в гомологичных клетках, влияя на клеточные метаболические процессы синтеза РНК и белка. Первоначально было установлено, что интерфероны вырабатываются клетками, инфицированными вирусами (тип I). В дальнейшем было выявлено, что интерфероны вырабатываются также лимфоцитами в ходе иммунной реакции (тип II). Интерфероны проявляют некоторые виды активности как лимфо-кины и иммуномодуляторы (глава 57). Интерфероны I типа, действующие главным образом как ингибиторы репликации вирусов в клетках, реализуют свой эффект, стимулируя выработку рибосомами клеток хозяина клеточных ферментов. Последние в дальнейшем тормозят продукцию вирусов, нарушая трансляцию вирусной иРНК и синтез вирусных белков.
Интерфероны вырабатываются у большинства видов животных, но проявление их активности видоспецифично, то есть они действуют только у того вида животных, в котором вырабатываются. Описаны три основных человеческих интерферона (ИФН): ИФН-а представляет собой человеческий лейкоцитарный интерферон типа I; ИФН-р — это человеческий фибробластный интерферон типа I; ИФН-у — человеческий иммунный интерферон
(тип II). Такая классификация в настоящее время не является окончательной. Интерфероны, вырабатываемые клетками любого типа, могут различаться по химическому строению и виду активности.
Интерфероны вызывают индукцию трех ферментов: 1) протеинкиназы, фосфорилирующей фактор 2 элонгации, что приводит к нарушению начального этапа построения пептидной цепи; 2) олиго-изоаденилатсинтетазы, что приводит в конечном итоге к активации РНКазы и деградации вирусной иРНК; 3) фосфодиэстеразы, которая может разрушать конечные нуклеотиды тРНК, что ведет к нарушению элонгации пептида.
Так как многие вирусы чувствительны к угнетающему действию интерферонов, эти препараты должны рассматриваться как потенциально ценные противовирусные лекарственные средства. Хотя в настоящее время все еще ведется поиск безопасных и мощных индукторов эндогенного интерферона, были проведены широкомасштабные работы по получению экзогенного человеческого интерферона из культуры лейкоцитов крови, фибробластов и лимфобластов. Сейчас с этой целью используют технологию рекомбинантной ДНК.
Клиническое изучение человеческих интерферонов выявило их активность при некоторых вирусных инфекциях и при опухолях. При раннем применении интерферон может предотвращать диссе-минацию опоясывающего лишая у больных со злокачественными новообразованиями, уменьшать распространение цитомегаловируса после пересадки почки и предотвращать реактивацию простого герпеса после иссечения корня тройничного нерва. При хроническом гепатите типа В и С интерфероны могут временно уменьшать клинические и лабораторные проявления заболевания. Введение в области повреждения интерферона при генитальных кондиломах может ускорять их обратное развитие. При одновременном применении с соединениями пятивалентного мышьяка ИФН-у улучшает результаты лечения при тяжелых формах висцерального лейшманиоза.
При некоторых видах рака интерферон может использоваться в качестве вспомогательного средства. Он одобрен в США для лечения “волосатоклеточного” лейкоза, саркомы Капоши, обусловленной СПИДом, и остроконечных кондилом; выясняется возможное место интерферона в терапии других опухолей.
Доза интерферона варьирует от 106 до 109 единиц в сутки при внутривенном введении. Побочные эффекты включают лихорадку, утомляемость, головные боли, слабость, миалгии, ai гемию и желудочно-кишечные или сердечно-сосудистые нарушения. Окончательный лечебный потенциал интерферона пока не определен.
Угнетение синтеза поздних белков
Некоторые аналоги различных аминокислот (например, фторфенилаланин) угнетают синтез структурных белков оболочки вирусных частиц. Такое же действие оказывает антибиотик пуроми-цин. Однако эти ингибиторы белкового синтеза не обладают избирательностью действия в отношении синтеза вирусного белка и в значительной степени нарушают белковый синтез в клетках хозяина, что придает им высокую токсичность. Поэтому в настоящее время ни одно из этих веществ не применяется в качестве химиотерапевтических препаратов.
У многих поксивирусов различные производные тиосемикарбазона угнетают процесс репликации, влияя на синтез “поздних” структурных белков. В результате сборка нормальных вирусных частиц нарушается. Метисазон (N-метилизатин-р-тиосе-микарбазон) может нарушать репликацию вируса оспы (variola) у людей при назначении в пределах 1-2 дней после контакта с больным. Метисазон в дозе 2-4 г/день перорально (100 мг/кг в сутки для детей) в течение 3-4 дней оказывает выраженное защитное действие в отношении оспы. Возможность использования метисазона явилась важным обстоятельством после отмены оспопрививания. Метисазон может угнетать репликацию вируса вакцинии после возникновения признаков заболевания, например при генерализованной или прогрессирующей вакцинии у больных с иммунодефицитными состояниями. Этот препарат является эффективным химиотерапевтическим средством только при инфекциях, вызываемых поксивирусами.
Некоторые аналоги сахаров могут угнетать синтез специфических вирусных гликопротеидов и гликолипидов. Так, 2-дезокси-D-глюкоза встраивается в гликопротеиды вируса простого герпеса и нарушает синтез в клетке многих вирусных гликопротеидов. К сожалению, ожидаемый клинический эффект не подтвердился в контрольных испытаниях.
Угнетение сборки или выхода вирусных частиц
Сборка интактных частиц может нарушаться многими веществами (например, флоксуридином [5-фтор-2'-дезоксиуридин] или пуромицином), которые вызывают синтез дефектных вирусных компонентов — как нуклеиновых кислот, так и структурных белков.
Рифампин (глава 46) ингибирует ДНК-зависи-мую РНК-полимеразу бактерий и клеток млекопитающих. Он также угнетает поксивирусы, но посредством другого механизма. Рифампин нарушает сборку покрытых оболочкой зрелых вирусных частиц. Это действие, очевидно, развивается на стадии формирования оболочки и обратимо при отмене препарата. Рифампин не используется при лечении поксивирусных инфекций человека, однако местное применение может уменьшать повреждения при вакцинни.
Препараты
Ацикловир (Зовиракс)
Перорально: капсулы по 200 мг;
таблетки по 800 мг; суспензия 200 мг/5 мл Парентерально: порошок для приготовления инъекционного раствора (500, 1000 мг/флакон)
Амантадин (генерик, Симметрел)
Перорально: капсулы по 100 мг;
сироп 50 мг/5 мл
Иммуноглобулин против цитомегаловируса внутривенный (человеческий)
Парентерально: порошок для приготовления инъекционного раствора, 2500 мг ± 250 мг
Диданозин (дидезоксиинозин, ddl) (Видекс)
Перорально: таблетки по 25, 50,100,150 мг; порошки 100,167, 250, 375 мг для приготовления перорального раствора; порошки 2,4 г для приготовления педиатрического раствора
Фоскарнет ( Фоскавир)
Парентерально: 24 мг/мл для внутривенного введения
Ганцикловир (Цитовене)
Парентерально: 500 мг во флаконе, для внутривенного введения
Иммуноглобулин против гепатита В (HBIG) (Н-BIG, др.)
Парентерально: 1,4, 5 мл во флаконе; готовые шприцы по 0.5 мл
Иммуноглобулин внутривенный (IGIV) (Гамимун N, др.)
Парентерально: 5 % по 10, 50,100 мл во флаконе; порошки 0.5,1, 2.5,3, 5,6 г для приготовления внутривенного раствора
Интерферон альфа-2а (Роферон-А)
Парентерально: 3, 6,36 млн ME во флаконе
Интерферон альфа-2Ь (Интрон-А)
Парентерально: 3, 5,10,18, 25 и 50 млн ME во флаконе
Интерферон альфа-нЗ (Алферон N) Парентерально: 5 млн ME во флаконе
Рибавирин (Виразол)
Аэрозоль: порошок для растворения и приготовления аэрозоля 60 г/л
Ремантадин (Флумадин)
Перорально: таблетки по 100 мг;
сироп 50 мг/5 мл
Иммуноглобулин против герпес зостер (человеческий)
Парентерально: 125 единиц глобулина во флаконе 2.5 мл
Видарабин (Вира-А)
Парентерально: 200 мг/мл суспензия для инъекций
Залцитабин (дидезоксицитидин, ddC) (Хивид) Перорально: таблетки по 0.375 и 0.75 мг
Зидовудин (азидотимидин, АЗТ) (Ретровир) Перорально: капсулы по 100 мг;
сироп 50 мг/5 мл
Парентерально: 10 мг/мл
Избранная литература
Alderson Т. New directions for the anti-retroviral chemotherapy of AIDS — A basis for a pharmacological approach to treatment. Biol. Rev. 1993; 68: 265.
Goodrich J. M. et al. Early treatment with ganciclovir to prevent cytomegalovirus disease after allogenic bone marrow transplantation. N. Engl. J. Med. 1991; 325:1601.
Hamilton J. D. et al. A controlled trial of early versus Leventhal B. G. et al. Long-term response of recurrent late treatment with zidovudine in symptomatic respiratory papillomatosis to treatment with human immunodeficiency virus infection. N. Engl. lymphoblastoid interferon alfa-Nl. N. Engl. J.
J. Med. 1992; 326:432. Med. 1991; 325:613.
Препараты для использования по специальным показаниям 50 и антисептики мочевыводящих путей
Эрнест Явиц
Ингибиторы синтеза клеточной стенки
Ванкомицин
Ванкомицин — антибиотик, выделенный из Streptomyces, активный в отношении грамположительных бактерий, особенно стафилококков.
Химическое строение
Ванкомицин является гликопептидом с мол. м. 1500. Он растворим в воде и весьма стабилен.
Антибактериальная активность
Ванкомицин проявляет бактерицидную активность в отношении грамположительных бактерий в концентрациях 0.5-3 мкг/мл. Большинство патогенных стафилококков, в том числе продуцирующие р-лактамазу и устойчивые к нафциллину и метициллину, погибает при концентрации этого препарата 10 мкг/мл или даже менее. Устойчивые мутанты в чувствительных популяциях встречаются очень редко, резистентность возбудителей в клинике развивается медленно. У возбудителей не наблюдается перекрестной устойчивости к данному препарату и другим известным антибиотикам.
Механизм действия заключается в торможении синтеза мукопептидов в клеточной стенке. Ванкомицин нарушает утилизацию дисахарид(-пентапеп-тид)-Р-фосфолипида (рис. 42-3). Очевидно, препарат прочно связывается с карбоксильным окончанием D-Ala-D-Ala цепочки строящегося пептидогликана и нарушает дальнейшее удлинение и обра
зование поперечных сшивок. Прочность пептидогликана при этом снижается, и создаются условия для лизиса клетки. Соответственно нарушаются функции клеточной мембраны.
Ванкомицин может проявлять синергизм с аминогликозидами в отношении некоторых энтерококков и других грамположительных бактерий.
Фармакокинетика (табл. 50-1)
Ванкомицин не всасывается в кишечнике, перорально его назначают только для лечения вызванного антибиотикотерапией энтероколита. Системное действие достигается при внутривенном применении: после введения 0.5 г ванкомицина в крови создается концентрация 10-20 мкг/мл, которая сохраняется в течение 1—2 часов. Препарат широко распределяется в организме. Экскреция осуществляется главным образом через почки с мочой. При почечной недостаточности может иметь место выраженная кумуляция. У больных со значительным снижением функции почек период полувыведения препарата составляет 6-10 дней. Ванкомицин может кумулировать и при печеночной недостаточности. Препарат не удаляется гемодиализом.
Клиническое применение
Главными показаниями для парентерального введения ванкомицина являются сепсис или эндокардит, вызванные устойчивыми к другим препаратам стафилококками. При таких состояниях ванкомицин вводится в дозе 0.5 г внутривенно в течение 20 минут каждые 6-8 часов (20-40 мг/кг в сут-
ТАБЛИЦА 50-1. Фармакокинетические характеристики некоторых противомикробных препаратов, применяемых по специальным показаниям
Препарат Время полувыведения, ч Биодоступность при пероральном приеме Связывание с белками плазмы Основные пути выведения
Ингибиторы клеточной стенки
Ванкомицин 5-6 0 < 10% Почки, печень
Бацитрацин — 0 — Почки
Новобиоцин <6 Высокая > 90 % Печень и желчь
Ингибиторы синтеза белка: Макролиды
Эритромицин 1.4 18-45% 72% Желчь
Азитромицин 40-60 40% 50% Желчь
Кларитромицин 5-7 50% — Желчь
Прочие ингибиторы синтеза белка
Клиндамицин 2.7 Высокая 90% Желчь
Ингибиторы синтеза ДНК: Фторхинолоны
(активный метаболит)
Ципрофлоксацин 3-4.5 50-80 % 15% Почки
Эноксацин 3-6 90% 40% Почки
Ломефлоксацин 8 95% 10% Почки
Норфлоксацин 3.5-5 30-40 % 35% Почки
Офлоксацин 5-7 > 90 % 8% Почки
Препараты с другими механизмами действия
Метронидазол 6-11 80% 10% Метаболизм в печени
ки для детей). Иногда при энтерококковом эндокардите его назначают вместе с аминогликозидами.
Ванкомицин не всегда проникает в центральную нервную систему, тем не менее для лечения менингита и предотвращения развития инфекции применяется внутривенное введение этого препарата. Может быть необходимо дополнительное непосредственное введение лекарства в центральную нервную систему. Пероральное назначение ванкомицина в дозах 0.125-0.5 г каждые 6 часов используется для лечения энтероколита, возникшего после применения антибиотиков, особенно если он вызван Clostridium difficile.
Побочные эффекты
Побочные реакции отмечаются редко. Ванкомицин раздражает ткани, поэтому в месте введения отмечается жжение, возможно развитие флебита и лихорадочного состояния. Иногда отмечается умеренное ототоксическое и нефротоксическое дей
ствие. Быстрое внутривенное введение препарата может вызывать диффузное покраснение кожи (“синдром красного человека”). Это явление, вероятно, связано с выбросом гистамина и может предотвращаться антигистаминными средствами и замедлением скорости введения препарата.
Тейкопланин
Тейкопланин является ингибитором построения клеточной стенки. Он предложен как заменитель ванкомицина для больных с непереносимостью этого препарата. Как и ванкомицин, тейкопланин не всасывается в кишечнике, но в отличие от ванкомицина его можно вводить внутримышечно и внутривенно. Тейкопланин имеет длительный период полувыведения (45-70 часов) и, как было показано, лишен характерного для ванкомицина эффекта высвобождения гистамина. Это лекарственное средство в настоящее время находится на стадии клинического изучения.
Бацитрацин
Бацитрацин представляет собой смесь циклических полипептидов, впервые выделенную из штамма Bacillus subtilis в 1943 г. Препарат активен в отношении грамположительных микроорганизмов. В связи с выраженной токсичностью при системном введении в настоящее время его применение ограничено местным использованием.
Антибактериальная активность
Бацитрацин наиболее активен в отношении грамположительных бактерий, в том числе продуцирующих 0-лактамазу стафилококков. Перекрестной устойчивости бактерий к бацитрацину и другим антимикробным препаратам нет. Бацитрацин угнетает построение клеточной стенки: он нарушает заключительное дефосфорилирование в цикле переносчика изопренилфосфата, который передает мукопептид в строящуюся клеточную стенку (см. рис. 42-3).
Фармакокинетика (табл. 50-1)
Бацитрацин незначительно всасывается из кишечника, с поверхности кожи, ран, плевры или из синовиальной жидкости. Таким образом, локальное введение дает лишь местный эффект без существенной системной токсичности. Из крови бацитрацин удаляется посредством гломерулярной фильтрации.
Клиническое применение
В связи с системной токсичностью бацитрацин в настоящее время применяют только местно. В виде мази с содержанием 500 ЕД/г (часто в комбинации с полимиксином или неомицином) его используют для подавления смешанной бактериальной флоры при поверхностных повреждениях кожи, в ранах или на слизистых оболочках. Растворы бацитрацина с содержанием 100-200 ЕД/мл в изотоническом растворе натрия хлорида можно назначать для введения в суставы, для аппликации на раны или для введения в плевральную полость — часто в сочетании с системным введением других препаратов.
Побочные реакции
Бацитрацин обладает существенной нефротоксичностью при всасывании в кровь, что проявляется протеинурией, гематурией и задержкой азота. Поэтому его системное применение практически не используется. Местное применение редко вызывает аллергические реакции (например, высыпания на коже) или системное токсическое действие.
Новобиоцин
Новобиоцин (другие названия — стрептониви-цин или карделмицин) — это кислый антибиотик, продуцируемый Streptomyces niveus. Он является бактериостатическим ингибитором синтеза клеточной стенки, активным главным образом в отношении грамположительных бактерий.
До появления резистентных к 0-лактамазе пенициллинов и цефалоспоринов новобиоцин использовался при тяжелых стафилококковых инфекциях. Для предотвращения быстрого развития устойчивых штаммов возбудителей новобиоцин назначали в комбинации с другими препаратами, при этом часто возникали побочные эффекты. В настоящее время новобиоцин практически не имеет показаний к применению.
Ингибиторы синтеза белков
Эритромицины (макролиды)
Эритромицины — это группа родственных макролидных соединений, имеющих макроциклическое лактонное кольцо (обычно содержащее 14 или 16 атомов), к которому присоединены сахара. Прототип этого ряда, эритромицин, был получен в 1952 г. из Streptomyces erythreus. Группа включает карбомицин, олеандомицин, спирамицин, азитромицин, кларитромицин и много других препаратов.
Химическое строение
Структурная формула эритромицина включает макролидное кольцо и сахара дезозамин и кла-динозу. Его мол. м. равна 734. Он плохо растворим в воде (0.1 %), но хорошо растворяется в органических растворителях. Растворы достаточно ста-
Эритромицин (R = СНз)
бильны при 4 °C, однако быстро теряют активность при 20 °C и в кислой среде. Растворимыми формами эритромицинов обычно являются их сложные эфиры и соли.
Антимикробная активность
Эритромицины при концентрациях в плазме 0.02-2 мкг/мл активны в отношении грамположительных микроорганизмов, особенно пневмококков, стрептококков, стафилококков и коринебакте-рий. К этим антибиотикам чувствительны также Mycoplasma, Legionella, Chlamydia trachomatis, Helicobacter и некоторые микобактерии (Mycobacterium kansasii, Mycobacterium scrofulaceum).
Антибактериальное действие эритромицинов на чувствительные к ним микроорганизмы может быть как бактериостатическим, так и бактерицидным. Активность повышается при щелочных значениях pH. Нарушение синтеза белка обусловлено действием на 505-единицу рибосом. Рецептором для эритромицинов является 23S рРНК 505-субъеди-ницы. Этот рецептор расположен рядом с рецептором для хлорамфеникола. В экспериментах было установлено, что каждый из этих препаратов может изменять степень связывания другого с рецептором, однако клиническое значение этого явления не определено. Синтез белков угнетается на уровне торможения реакции транслокации аминоацильно-го радикала и нарушения образования инициаторных комплексов.
Устойчивость микроорганизмов
В наиболее чувствительных к эритромицину микробных популяциях возможно появление устойчивых к этому антибиотику микроорганизмов (например, у стафилококков). Иногда встречаются эритромицинрезистентные пневмококки и стрептококки.
Устойчивость к эритромицину обычно возникает в связи с метилированием рРНК-рецептора на 505-единице рибосомы под контролем плазмид. Инактивация препарата в механизмы развития резистентности не вовлечена, за исключением бактерий кишечной группы, где встречаются трансмиссивные плазмиды, которые кодируют гидролизующую лактонное кольцо макролидов эстеразу, что ведет к утрате активности препаратов. У возбудителей имеется практически полная перекрестная устойчивость к представителям группы эритромицина. Может возникать частичная перекрестная устойчивость с линкомицинами.
Фармакокинетика (табл. 50-1)
Так как эритромицин-основание разрушается соляной кислотой желудочного сока, препарат должен применяться в виде лекарственной формы с оболочкой, которая растворяется в тонком кишечнике. Стеараты и сложные эфиры достаточно кислотоустойчивы и относительно хорошо всасываются. Лауриловая соль пропионилового эфира эритромицина (эритромицина эстолат) при пероральном введении всасывается в кишечнике лучше других препаратов. После энтерального приема 2 г в день концентрация в сыворотке достигает 2 мкг/мл. Лекарство в значительных количествах выводится с калом. Препарат широко распределяется в организме, за исключением центральной нервной системы и спинномозговой жидкости. Он проникает через плаценту и попадает в плод.
Эритромицины экскретируются в основном с желчью, где их концентрация может быть в 50 раз выше, чем в крови. Часть лекарственного средства, выводящегося с желчью, повторно всасывается в кишечнике. Только 5 % от введенной дозы экскретируется с мочой. Некоторые из более новых макролидов (например, азитромицин, кларитромицин) имеют более высокую биодоступность при пероральном введении, чем сложные эфиры эритроми
цина, а также более длительный период полувыведения, чем эритромицин.
Клиническое применение
Эритромицины являются препаратами выбора при инфекциях, вызываемых коринебактериями (дифтерия, коринебакгериальный сепсис, эритраз-ма), при инфекциях дыхательных путей, инфекциях новорожденных, глазных и мочеполовых хламидийных инфекциях, а также при пневмониях, вызванных Mycoplasma и Legionella. Выявлена высокая эффективность кларитромицина и азитромицина при лечении диссеминированных инфекций, вызванных Mycobacterium avium-intracellulare, у больных СПИДом. С другой стороны, эритромицины являются наиболее активными заменителями пенициллинов у больных со стрептококковыми или пневмококковыми инфекциями при гиперчувствительности к пенициллинам. Больным ревматизмом, которые получают пенициллины для профилактики ревматических атак, эритромицин необходимо назначать перед проведением стоматологических процедур для предупреждения развития эндокардита. Хотя эритромицина эстолат лучше всех препаратов этой группы всасывается в кишечнике, по этой же причине он чаще других вызывает побочные реакции. Поэтому в некоторых случаях предпочтение отдается стеарату или сукцинату. Эритромицин может повышать перистальтику желудочно-кишечного тракта у больных с диабетическим желудочным парезом.
А. Дозирование при пероральном введении. Используются эритромицин-основание, стеарат или эстолат в дозах 0.25-0.5 г каждые 6 часов (для детей 40 мг/кг в сутки) или эритромицина этилсук-цинат в дозе 0.4-0.6 г каждые 6 часов. При пероральном приеме эритромицин-основание (1г) иногда сочетают с пероральным назначением неомицина или канамицина для предоперационной подготовки толстого кишечника. При инфекции, вызванной М. avium-intracellulare, используют азитромицин или кларитромицин в дозах 250-500 мг перорально два раза в день в комбинации с другим антимикобакте-риальным препаратом (чтобы избежать быстрого развития устойчивости возбудителя).
Б. Дозирование при внутривенном введении. Взрослым — 0.5 г эритромицина глюцептата или лактобионата каждые 8-12 часов; детям — 40 мг/кг в сутки.
Побочные эффекты
А. Желудочно-кишечные эффекты. При пероральном приеме иногда возникают анорексия, тошнота, рвота и диарея.
Б. Токсическое действие на печень. Эритромицины, особенно эстолат, могут вызывать острый холестатический гепатит (лихорадка, желтуха, нарушения функции печени), вероятно, аллергического происхождения. Это явление обратимо у большинства пациентов, однако возможны рецидивы гепатита при повторном применении этих препаратов. Другие аллергические реакции проявляются лихорадкой, эозинофилией и кожными высыпаниями. Эритромицины угнетают цитохром Р-450 и в связи с этим усиливают действие пероральных антикоагулянтов и дигоксина. Они также способствуют увеличению концентрации в крови циклоспорина и антигистаминных средств, таких как терфенадин и астемизол. Повышение концентрации этих антигистаминных препаратов может приводить к появлению тяжелых форм сердечных аритмий.
Линкомицин и клиндамицин (линкозамины)
Линкомицин — это антибиотик, вырабатываемый Streptomyces lincolnensis. Клиндамицин является хлорзамещенным производным линкоми-цина.
Линкомицин напоминает эритромицин по спектру действия, но имеет лишь немного особых показаний к применению. Клиндамицин является более активным препаратом.
Антибактериальная активность
Многие грамположительные кокки угнетаются линкомицинами в концентрациях 0.5-5 мкг/мл. Энтерококки, Haemophilus, нейссерии и Mycoplasma обычно устойчивы (в отличие от эритромицина). Хотя линкомицины лишь слабо действуют на большинство грамотрицательных бактерий, к ним обычно чувствительны Bacteroides и другие анаэробы. Линкомицины угнетают синтез белков, влияя на формирование комплексов инициации и реакцию транслокации аминоацила. Рецептором для линко-мицинов на 508-субъединице бактериальной рибосомы является 23S рРНК, и этот рецептор, возмож
но, идентичен рецептору для эритромицинов. Таким образом, эти два класса антибиотиков могут конкурировать за места связывания. Устойчивость микроорганизмов к линкомицинам появляется медленно и, вероятно, обусловлена хромосомной мутацией. Участие плазмид в развитии устойчивости достоверно не установлено. Резистентность к лин-комицинам не является редким фактом среди стрептококков, пневмококков и стафилококков. Штаммы С. difficile постоянно устойчивы.
Фармакокинетика (табл. 50-1)
При пероральном введении клиндамицина в дозах 0.15-0.3 г каждые 6 часов (10-20 мг/кг в сутки для детей) его концентрация в сыворотке составляет 2-3 мкг/мл. После внутривенного введения клиндамицина в дозе 600 мг каждые 8 часов его концентрация в сыворотке равна 5-15 мкг/мл. Препарат хорошо проникает в различные ткани, за исключением центральной нервной системы. Он приблизительно на 90 % связывается с белками плазмы. Экскретируется преимущественно через печень с желчью, а также с мочой.
Клиническое применение
Вероятно, наиболее важным показанием к применению клиндамицина является лечение тяжелой анаэробной инфекции, вызванной Bacteroides и другими анаэробами, которые часто присутствуют при смешанных инфекциях. Клиндамицин (иногда в комбинации с аминогликозидом или метронидазолом) используют для лечения проникающих ранений брюшной полости и кишечника, при инфекциях женских половых органов, например при септическом аборте и тазовых абсцессах, для лечения аспирационной пневмонии. Линкомицины неэффективны при менингитах.
Побочные эффекты
Наиболее частыми побочными эффектами являются диарея, тошнота и высыпания на коже. Иногда возникают нарушения функции печени (с желтухой или без нее) и нейтропения. После применения клиндамицина отмечались тяжелые формы энтероколита и диарея, что существенно ограничивает возможности его использования.
Колит, возникающий после применения клиндамицина и других антибиотиков, вызывается токсикогенным С. difficile. Этот микроорганизм редко присутствует в нормальной фекальной флоре, но при применении пероральных антибиотиков возможна его селекция. Он пролиферирует в большом количестве в сигмовидной кишке и вырабатывает некротизирующий токсин, вызывающий псевдомембранозный колит. Это потенциально фатальное осложнение должно быть быстро распознано. Оно требует лечения ванкомицином перорально в дозе 0.5 г 4-6 раз в сутки или метронидазолом. Вариации местной распространенности С. difficile определяют разную частоту встречаемости постантибиотического колита.
Ингибиторы синтеза ДНК
Хинолоны
Важные с точки зрения клинического применения хинолоны являются синтетическими фторированными аналогами налидиксовой кислоты. Они активны в отношении большого количества грамположительных и грамотрицательных бактерий. Хинолоны блокируют синтез бактериальной ДНК, ингибируя ДНК-гиразу, предотвращая таким образом раскручивание суперспирали ДНК, что требуется для нормальной транскрипции и дупликации (рис. 42-4).
Исторически более ранние хинолоны (налидиксовая кислота, оксолиновая кислота, циноксацин) не создавали системных антибактериальных концентраций и, таким образом, использовались только в качестве мочевых антисептиков. Более новые фторированные производные (норфлоксацин, ципрофлоксацин и другие; рис. 50-1 и табл. 50-1) оказывают намного более сильное антимикробное действие, создают бактерицидные концентрации в крови и тканях и имеют низкую токсичность.
Антибактериальная активность
Фторхинолоны при сывороточных концентрациях 1-5 мкг/мл угнетают грамотрицательные палочки: Enterobacteriaceae, Pseudomonas, Neisseria и другие. Грамположительные организмы и внутриклеточные возбудители (например, Legionella, Chlamydia и некоторые микобактерии) угнетаются
Норфлоксацин
Эноксацин
Пефлоксацин
Офлоксацин
Рис. 50-1. Структура некоторых фторхинолонов. (По: Brooks G. F., Butel J. S., Omston L. N. Jawetz, Melnick & Adelberg’s Medical Microbiology, 19th ed. Appleton & Lange, 1991.)
несколько более высокими концентрациями этих препаратов, а анаэробы еще менее чувствительны. Частота появления устойчивых микроорганизмов при проведении терапии фторхинолонами составляет около 1 на 109, особенно среди стафилококков, Pseudomonas и Serratia. Возникновение устойчивости микроорганизмов связано либо с изменением мишени для этих препаратов — фермента ДНК-ги-разы, либо с изменениями проницаемости стенки микроорганизма.
Фармакокинетика (табл.50-1)
После перорального приема фторхинолоны хорошо всасываются в кишечнике и широко распределяются в жидкостях и тканях организма, создавая при этом различные концентрации. Период полувыведения из сыворотки находится в пределах от 3 до 7 часов для разных препаратов. После приема внутрь дозы 400-600 мг пиковые сывороточные концентрации составляют 1-3 мкг/мл для ципрофлоксацина, несколько выше для эноксацина и 10 мкг/мл для офлоксацина. Всасывание после перорального введения нарушается двухвалентными катионами, например антацидами. Фторхинолоны экскретируются главным образом почками с помощью канальцевой секреции (этот процесс может угнетаться пробенецидом) и гломерулярной фильт
рации. До 20 % от введенной дозы метаболизируется в печени. При почечной недостаточности может иметь место некоторая кумуляция препаратов.
Клиническое применение
Фторхинолоны имеют высокую противомик-робную активность, однако показания к их применению окончательно не определены. Большинство этих препаратов эффективно при инфекциях мочевыводящих путей даже при множественной лекарственной устойчивости бактерий, например Pseudomonas. Норфлоксацин в дозе 400 мг или ципрофлоксацин в дозе 500 мг перорально два раза в день эффективны при мочевых инфекциях так же, как и при инфекционной диарее (вызванной, например, Shigella, Salmonelld, токсикогенной Е. coli, Helicobacter). Эти препараты используются при инфекциях мягких тканей, костей и суставов, при интрааб-доминальных инфекциях и инфекциях дыхательных путей, а также при заболеваниях, передающихся половым путем (например, при гонококковой и хламидийной инфекциях). Иногда их назначают при микобактериальных заболеваниях. Они могут устранять менингококковое носительство и применяться с профилактической целью у больных с нейтропенией. Ципрофлоксацин, офлоксацин и новые препараты этого ряда можно вводить как перорально, так и внутривенно.
Побочные эффекты
Наиболее значимыми побочными эффектами являются тошнота, рвота и диарея. Иногда отмечаются головная боль, головокружение, бессонница, изменения функциональных показателей печени, кожные высыпания. Одновременное введениетеофилли-наи хинолонов может приводить к повышению концентрации теофиллина и возникновению его токсических эффектов, особенно судорожных состояний. Фторхинолоны могут повреждать растущую хрящевую ткань, поэтому их нельзя назначать пациентам моложе 18 лет. Отмечались случаи развития суперинфекции стрептококками и грибами Candida.
Препараты с неизвестными механизмами действия
Метронидазол
Это противопротозойное лекарственное средство из ряда нитроимидазолов (глава 54) оказывает выраженное антибактериальное действие в отношении большинства анаэробов, включая Bacteroides и клостридии. Препарат хорошо всасывается после перорального приема (табл. 50-1), широко распределяется в тканях и создает сывороточные концентрации 4-6 мкг/мл после приема пероральной дозы 250 мг. Он легко проникает в цереброспинальную жидкость, создавая в ней концентрации, близкие к сывороточным. Метронидазол метаболизируется в печени и может кумулировать при печеночной недостаточности, что требует снижения дозы. Метронидазол можно также вводить внутривенно или ректально в суппозиториях.
Метронидазол используют при анаэробных или смешанных инфекциях в дозе 500 мг 3 раза в день перорально или внутривенно (30 мг/кг в сутки). При вагинитах (Trichomonas, Gardnerella, смешанная инфекция) 250 мг препарата назначают перорально Зраза в день в течение 7-10 дней; в некоторых случаях вагинит излечивается однократным приемом 2 г. При вызванном лечением антибиотиками энтероколите назначают по 500 мг препарата 3 раза в деньэнтерально или внутривенно в качестве альтернативы ванкомицину. В сочетании с пенициллинами или цефалоспоринами метронидазол иногда оказывается эффективным при абсцессе мозга. Метронидазол используется и для предоперационной под
готовки толстого кишечника. Препарат можно применять местно в виде вагинального геля.
Побочные эффекты включают тошноту, диарею, стоматит, а при длительном использовании — поражение периферических нервов. Во время лечения метронидазолом необходимо исключить употребление спиртных напитков, поскольку препарат оказывает дисульфирамподобное действие. В экспериментах на некоторых животных метронидазол давал тератогенный эффект, однако у человека он не обнаружен.
Другие свойства метронидазола обсуждаются в главе 54.
Антисептики мочевыводящих путей
Многие системные антимикробные препараты экскретируются с мочой, где создают высокие концентрации, поэтому в более низких дозах, чем требующиеся для создания системных противомикроб-ных концентраций, они могут давать терапевтический эффект при инфекциях мочевыводящих путей. Иногда короткие курсы лечения или даже однократный прием таких препаратов, как сульфаниламиды, некоторые пенициллины (например, ампициллин, амоксициллин, карбенициллин), аминогликозиды или фторхинолоны, могут излечивать острые инфекции мочевыводящих путей.
В противоположность этому мочевые антисептики — это препараты, которые проявляют проти-вомикробное действие в моче, но не оказывают существенного системного противомикробного действия. Их использование ограничено инфекциями мочевыводящих путей. Весьма желательно длительное применение мочевых антисептиков с целью подавления бактериурии при хронических инфекциях мочевых путей, где устранение инфекции невозможно кратковременной системной терапией.
Нитрофурантоин
Антибактериальная активность
Нитрофураны являются бактериостатическими и бактерицидными препаратами в отношении многих грамположительных и грамотрицательных бактерий. Р. aeruginosa и многие виды Proteus устойчивы к этим препаратам, но в нитрафурантоинчув-
ствительных популяциях устойчивые мутанты встречаются редко. Клиническая устойчивость к препаратам развивается медленно. Перекрестной устойчивости возбудителей к нитрофуранам и другим антимикробным средствам нет.
Механизм действия нитрофуранов неизвестен. Активность нитрафурантоина резко возрастает при pH 5.5 или ниже.
Фармакокинетика
Нитрофурантоин хорошо всасывается после приема внутрь, однако он метаболизируется и экскретируется настолько быстро, что никакое системное антибактериальное действие невозможно. В почках этот препарат экскретируется в мочу как гломерулярной фильтрацией, так и канальцевой секрецией. При использовании средних суточных доз в моче создается концентрация 200 мкг/мл. В условиях почечной недостаточности создающаяся в моче концентрация препарата оказывается недостаточной для проявления антибактериального эффекта, а высокая концентрация в крови может вызвать токсическое действие.
Клиническое применение
Средняя суточная доза для лечения инфекций мочевыводящих путей у взрослых составляет 100 мг перорально 4 раза в день. Препарат принимают во время еды или с молоком. Нитрофурантоин никогда не назначают больным с тяжелой почечной недостаточностью. Перорально нитрофурантоин можно применять в течение нескольких месяцев для лечения хронических инфекций мочевых путей. Желательно поддержание pH мочи ниже 5.5 (подраздел “ Ацидотические вещества"). Применение нитрофурантоина в суточной дозе 100 мг один раз в день может предупреждать рецидивы инфекций мочевыводящих путей у женщин.
Другой нитрофуран — фуразолидон — перорально в дозе 400 мг в сутки (5-8 мг/кг в сутки у детей) может устранять диарею при холере и уменьшать выделение холерных вибрионов. Обычно он оказывается неэффективным при шигеллезе.
Побочные эффекты
А. Прямое токсическое действие. Анорексия, тошнота и рвота являются главными и наиболее частыми побочными эффектами нитрофурантоина.
У больных с дефицитом глюкозо-6-фосфатдегид-рогеназы могут возникать невриты и гемолитическая анемия. Нитрофурантоин ослабляет действие налидиксовой кислоты.
Б. Аллергические реакции. Отмечались различные высыпания на коже, легочная инфильтрация и другие проявления реакции гиперчувствительности.
Налидиксовая кислота, оксолиновая кислота и циноксацин
Налидиксовая кислота, первый антибактериальный хинолон, была внедрена в клиническую практику в 1963 г. Это соединение не является фторированным и слишком быстро экскретируется, поэтому лишено системного антибактериального действия. Оксолиновая кислота и циноксацин по химической структуре и свойствам близки к налидиксовой кислоте.
Антибактериальная активность
Налидиксовая кислота угнетает многие грамот-рицательные бактерии in vitro в концентрациях 1-20 мкг/мл. Для проявления действия на грампо-ложительные микроорганизмы необходимы значительно более высокие концентрации. Большинство штаммов Е. coli чувствительны к этому препарату, как и некоторые штаммы Enterobacter, Klebsiella и Proteus. Pseudomonas обычно устойчивы.
Как и все хинолоны, налидиксовая кислота нарушает синтез бактериальной ДНК, ингибируя ДНК-гиразу.
Быстрое появление устойчивых микроорганизмов при лечении этим препаратом обусловлено как селекцией резистентных мутантов в микробной популяции, так и суперинфекцией лекарственно-устойчивыми организмами других штаммов или видов. Передача плазмидами резистентности к налидиксовой кислоте не установлена. Перекрестной устойчивости возбудителей к налидиксовой кислоте и другим антимикробным препаратам нет.
Фармакокинетика
После приема внутрь препараты этой группы хорошо всасываются в кишечнике, быстро метаболизируются и экскретируются. Поэтому существен
ного системного антибактериального действия не отмечается. Приблизительно 20 % препарата, попавшего в кровь, экскретируется с мочой в активной форме, а 80 % — в виде неактивных конъюгатов с глюкуроновой кислотой. Концентрации активной формы препарата в моче достигают 50-200 мкг/мл.
Клиническое применение
Единственным показанием к применению этих препаратов является инфекция мочевыводящих путей, вызванная колиформными организмами. Доза налидиксовой кислоты для взрослых составляет 1 г перорально 4 раза в день в течение 1-2 недель (для детей — 30-60 мг/кг в сутки). Оксолиновая кислота назначается в дозе 0.75 г два раза в день, а циноксацин — в дозе 1 г/день.
Побочные реакции
Выводящаяся с мочой налидиксовая кислота может вызывать ложноположительную реакцию на глюкозу, но может способствовать и возникновению истинной гипергликемии и глюкозурии. Иногда отмечаются диспепсические явления, кожные высыпания, фотосенсибилизация, нарушения зрения, различные явления со стороны центральной нервной системы, включая судороги. Токсическое действие на центральную нервную систему более характерно для оксолиновой кислоты.
Метенаминй манделат и метенамина гиппурат
Метенамина манделат является солью мандело-вой кислоты и метенамина, свойства этого препарата определяются двумя входящими в его состав мочевыми антисептиками. Метенамина гиппурат — соль гиппуровой кислоты и метенамина. Мандело-вая и гиппуровая кислоты после приема внутрь экскретируются в неизмененном виде в мочу, где эти вещества оказывают бактерицидное действие на некоторые грамотрицательные бактерии при условии поддержания pH мочи ниже 5.5. Метенамин хорошо всасывается после перорального введения и выводится с мочой. При кислой реакции мочи (pH ниже 5.5) метенамин высвобождает формальдегид, который также является противомикробным агентом.
Метенамина манделат в дозе 1 г четыре раза в день или метенамина гиппурат в дозе 1 г два раза в день внутрь (для детей — 30 мг/кг в сутки до 50 мг/кг в сутки) используются только в качестве мочевых антисептиков. При необходимости снижения pH мочи ниже 5.5 возможно назначение ацидо-тических веществ (например, аскорбиновой кислоты в дозе 4-12 г/день). Недопустимо одновременное использование сульфаниламидов, поскольку они могут образовывать нерастворимые соединения с выделяющимся из метенамина формальдегидом. У больных, принимающих метенамина манделат, иногда отмечается псевдоповышение концентрации метаболитов катехоламинов.
Действие метенамина манделата или гиппурата не является узконаправленным, оно распространяется на большое количество различных микроорганизмов и складывается из одновременных эффектов формальдегида и кислот. Микроорганизмы типа Proteus, которые способствуют ощелачиванию мочи за счет выделения аммиака, обычно нечувствительны.
Ацидотические вещества
При хронических инфекциях мочевых путей полное уничтожение микроорганизмов часто оказывается невозможным. Поэтому весьма важно как можно более длительное подавление бактерий.
Любое вещество, снижающее pH мочи ниже 5.5, тормозит развитие бактерий в моче. Для получения такого эффекта могут использоваться кетогенные диеты, аммония хлорид, аскорбиновая кислота, манделовая кислота, метионин и гиппуровая кислота (например, содержащаяся в соке клюквы). Во время лечения необходимо часто определять pH мочи и проводить прямое микроскопическое исследование для подтверждения фактического устранения бактериурии. Длительное подавление патогенной флоры (6-18 месяцев) иногда приводит к излечению заболевания, вероятно, в связи с предупреждением восходящей реинфекции почек из нижних отделов мочевыводящих путей.
Циклосерин
Циклосерин является антибиотиком, вырабатываемым Streptomyces orchidaceus.
Это вещество растворимо в воде и нестабильно при кислых значениях pH. Циклосерин подавляет рост многих микроорганизмов, в том числе бакте-
О NH
NHz О
Циклосерин
рий кишечной группы, Proteus и микобактерий. Циклосерин нарушает включение D-аланина в пептидогликан клеточной стенки бактерий, ингибируя фермент аланинрацемазу. После приема внутрь циклосерина в дозе 0.25 г каждые 6 часов его концентрация в крови достигает 20-30 мкг/мл, что является достаточным для подавления многих штаммов микобактерий и грамотрицательных бактерий. Препарат широко распределяется в тканях. Основная его часть выводится в активной форме в мочу, где создается достаточно высокая концентрация для подавления многих вызывающих инфекции мочевыводящих путей микроорганизмов. Доза для лечения мочевых инфекций составляет 10-20 мг/кг в сутки. Циклосерин иногда используется для лечения рецидивирующего туберкулеза, вызванного резистентными к другим препаратам микобактериями. Пероральная доза составляет 0.25 г два-четыре раза в день.
Циклосерин может оказывать выраженное токсическое действие на центральную нервную систему, что проявляется головными болями, тремором, острыми психотическими реакциями, судорогами. При использовании пероральных доз ниже 0.75 г в сутки таких побочных явлений можно избежать.
Препараты
Бацитрацин (генерик)
Парентерально: порошок для приготовления раствора для инъекций 50 000 ЕД
Циноксацин (Цинобак)
Перорально: капсулы по 250,500 мг
Ципрофлоксацин (Ципро, Ципро I.V.) Перорально: таблетки по 250,500, 750 мг Парентерально: 2,10 мг/мл
Клиндамицин (Клеоцин)
Перорально: капсулы по 75,150,300 мг;
75 мг/5 мл гранулы для приготовления раствора
Парентерально: 150 мг/мл в 2, 4, 6, 60 мл флаконах для инъекций
Эноксацин (Пенетрекс)
Перорально: таблетки по 200, 400 мг Эритромицин (генерик, Илотицин, Илосон, Е-Мицин, Эритроцин, др.)
Перорально (основание): таблетки, покрытые оболочкой, рассасывающиеся в кишечнике, по 250,333,500 мг;
Перорально (основание) с замедленным йысвобождением: таблетки по 333,500 мг; капсулы по 250 мг
Перорально (эстолат): таблетки по 500 мг; капсулы по 250 мг;
125, 250 мг/5 мл суспензия
Перорально (этилсукцинат): таблетки с пленочным покрытием по 200,400 мг; 200,400 мг/5 мл суспензия
Перорально (стеарат): таблетки с пленочным покрытием по 250, 500 мг
Парентерально: лактобионат — порошок для приготовления раствора для внутривенного введения (0.5,1 г во флаконе); глуцеп-тат — порошок для приготовления раствора для внутривенного введения (1 г во флаконе)
Линкомицин (Линкоцин)
Перорально: капсулы по 250, 500 мг Парентерально: 300 мг/мл в 2,10 мл флаконах для внутримышечного или внутривенного введения
Ломефлоксацин (Максаквин)
Перорально: таблетки по 400 мг
Метенамина гиппурат (Гипрекс, Урекс) Перорально: таблетки по 0.5 г
Метенамина манделат (генерик, Манделамин) Перорально: таблетки по 0.5,1 г; таблетки в оболочке для рассасывания в кишечнике по 0.25, 0.5, 1 г; 0.25, 0.5 г/5 мл суспензия; 0.5,1 г гранулы (пакеты)
Метронидазол (генерик, Флагил, др.) Перорально: таблетки по 250, 500 мг Парентерально: 500 мг для инъекций
Налидиксовая кислота (НегГрам)
Перорально: таблетки по 250, 500,1000 мг; 250 мг/5 мл суспензия
Нитрофурантоин (генерик, Фурадантин, др.) Перорально: капсулы и таблетки по 50, 100 мг; 25 мг/5 мл суспензия; 25, 50,100 мг макрокристаллы (Макродантин)
Парентерально: 180 мг порошок
для приготовления раствора для внутривенного введения
Норфлоксацин (Нороксин)
Перорально: таблетки по 400 мг
Новобиоцин (Албамицин)
Перорально: капсулы по 250 мг
Офлоксацин (Флоксин)
Перорально: таблетки по 200,300,400 мг Парентерально: 200 мг в 50 мл флаконах для внутривенного введения
Ванкомицин (генерик, Ванкоцин, Ванколед) Перорально: 125,250 мг порошки;
1,10 г порошок для приготовления раствора Парентерально: 0.5,1, 5,10 г порошок для приготовления раствора для внутривенного введения
Избранная литература
Cunha В. A. Nitrofurantoin — An update. Obstet. Gynecol. Surv. 1989; 44: 399.
Edwards D. I. Nitroimidazole drugs — action and resistance mechanisms. (In two parts) J. Anti-microb. Chemother. 1993; 31: 9, 201.
Martin D. H. et al. A controlled trial of a single dose of azithromycin for the treatment of chlamidial urethritis and cervicitis. N. Engl. J. Med. 1992; 327: 921.
Mazzei T. et al. Chemistry and mode of action of macrolides. J. Antimicrob. Chemother. 1993; 31 (Suppl. C): 1.
Peters D. H., Clissold S. P. Clarithromicin. A review of its antimicrobial activity, pharmacokinetic properties and therapeutic potential. Drugs, 1992; 44:117.
Radanst J. M. et al. Interaction of fluoroquinolones with other drugs: Mechanisms, variability, clinical significance, and management. Clin. Infect. Dis. 1992; 14: 272.
Stamm W. E., Hooten T. M. Management of urinary tract infections in adults. N. Engl. J. Med. 1993; 329:1328.
Средства для дезинфекции и антисептики
51
Эрнест Явиц
Антисептики и дезинфицирующие средства принципиально отличаются от действующих системно химиотерапевтических препаратов отсутствием избирательной токсичности. Большинство этих веществ токсично не только для микроорганизмов, но и для клеток хозяина. Поэтому они могут использоваться с целью уничтожения микробных популяций в окружающей среде, а также применяться местно, но не системно, для подавления возбудителей заболеваний человека.
Термины “дезинфицирующие средства”, “антисептики” и “бактерицидные средства” часто используются взаимозаменяемо, и их определения в литературе в значительной степени перекрываются. Термин “дезинфицирующее средство” обычно означает вещество, которое убивает микроорганизмы в окружающей внешней среде. Термин “антисептик”, как правило, применим к веществу, которое подавляет рост бактерий как in vitro, так и in vivo при нанесении на поверхности тканей, если такой контакт с тканями возможен с учетом свойств вещества.
Противомикробное действие антисептиков и дезинфицирующих средств в значительной степени зависит от концентрации, температуры и длительности экспозиции. В очень низких концентрациях они могут стимулировать рост бактерий, в более высоких — угнетать его, а в еще более высоких — оказывать на некоторые микроорганизмы бактерицидное действие.
Доклиническая оценка антисептиков и дезинфицирующих средств трудна. Методы таких испытаний зачастую спорны, и результаты могут иметь различную интерпретацию. В идеальной ситуации дезинфицирующие средства должны вызывать гибель микроорганизмов в Высоких разведениях, не оказывать нежелательного действия на ткани чело-века или окружающие предметы, быть недорогими,
устойчивыми, не иметь запаха и свойств красителей, действовать быстро и не терять активности даже в присутствии чужеродных белков, экссудатов или различных волокон. Ни один из доступных в настоящее время препаратов полностью не удовлетворяет этим требованиям. Имеется также потребность в эффективных нетоксичных веществах, способных нейтрализовать дезинфицирующие средства in vitro.
Многие антисептики и дезинфицирующие средства в то или иное время использовались в медицинской и хирургической практике. Большинство из них теперь вытеснено химиотерапевтическими препаратами. Мупироцин является более новым, выделенным из Pseudomonas антибактериальным веществом, которое подавляет стафилококки и стрептококки, влияя на синтез РНК и белков. Не оказывая системного действия, он давал эффект при местном применении для лечения кожных инфекций (глава 63). Эффекты большинства антисептиков для поверхностного применения не направлены непосредственно на заживление раны, более того, они часто нарушают процесс заживления. В целом очистка ссадин и поверхностных ран с помощью мыла и воды оказывается гораздо более эффективной и менее повреждающей, чем аппликация локальных антисептиков. Вещества, наносимые местно на кожу или слизистые оболочки, могут неравномерно и часто непредсказуемо всасываться. Давящие повязки с применением пластиковых пленок часто значительно увеличивают абсорбцию. На проникновение препаратов через эпителий кожи существенно влияет относительная влажность и температура.
Приведем краткую характеристику нескольких химических классов дезинфицирующих средств и антисептиков.
Спирты
Алифатические спирты, денатурируя белок, оказывают антимикробное действие различной степени. Этанол (этиловый спирт) в концентрации 70 % вызывает бактерицидный эффект в течение одной-двух минут при 30 °C, однако в более низких или более высоких концентрациях он менее эффективен. Для обработки поверхности кожи в настоящее время в наибольшей степени удовлетворяют требованиям антисептики 70 % этиловый спирт и 90 % изопропиловый спирт (изопропанол). Их можно использовать для стерилизации инструментария, однако они не действуют на споры, и сейчас для этой цели применяют более эффективные средства. Для дезинфекции механических респираторов можно применять аэрозоли 70 % спирта с частицами размером 1 мкм.
Иногда для дезинфекции воздуха (правда, в настоящее время это делают редко) используют пары пропиленгликоля и других гликолей. При этом для получения хорошего антимикробного действия необходимо контролировать влажность воздуха.
Альдегиды
Формальдегид в концентрациях 1-10 % вызывает гибель микроорганизмов и их спор в течение 1-6 часов. Он действует за счет связывания с белками и их преципитации. Выраженный раздражающий эффект не позволяет использовать формальдегид для нанесения на ткани, однако он широко применяется для дезинфекции инструментов. Раствор USP (United States Pharmacopeia) содержит 37 % формальдегида по весу с добавлением метилового спирта для предотвращения полимеризации.
Глутаровый альдегид в виде 2 % щелочного раствора в 70 % изопропаноле (pH 7.5-8.5) используется в качестве жидкого дезинфектанта для ряда оптических и других инструментов, а также некоторых протезных материалов. Он вызывает гибель микроорганизмов в течение 10 минут и спор в течение 3-10 часов, но его раствор нестабилен. Кроме того, необходимо избегать контакта с тканями организма.
После приема метенамина внутрь в кислой моче может появляться формальдегид. Препарат применяется в качестве мочевого антисептика (глава 50).
Кислоты
Некоторые неорганические кислоты применяют для прижигания тканей. Они являются эффек
тивными антимикробными агентами, но повреждающее действие на ткани ограничивает их использование. Для получения антимикробного эффекта на пораженные участки кожи наносят порошок или 5 % водный раствор борной кислоты. Однако при всасывании борная кислота оказывает выраженное токсическое действие, особенно у маленьких детей, в связи с чем такое использование не рекомендуется. Среди органических кислот в качестве пищевого консерванта находит применение 0.1 % раствор бензойной кислоты. Эфиры бензойной кислоты (парабены) используются как антимикробные консерванты некоторых лекарственных препаратов. Уксусная кислота в виде 1 % раствора может использоваться в качестве поверхностного про-тивомикробного вещества при наложении хирургических повязок, в виде 0.25-2 % растворов — как противомикробное средство для обработки наружного уха и орошения нижних отделов мочевыводящих путей. Уксусная кислота особенно активна в отношении аэробных грамотрицательных бактерий, например Pseudomonas. Салициловая, ундециленовая и другие жирные кислоты могут использоваться в качестве фунгицидных средств для обработки кожи. Они применяются в основном для лечения дерматомикозов в областях, подверженных трению, например при так называемой “стопе атлета” (глава 63).
Манделовая кислота после приема внутрь выводится в неизмененном виде с мочой; при применении этого препарата в дозе 12 г в день pH мочи может снижаться до 5.0, что достаточно для проявления противомикробного действия (глава 50).
Галогены и галогенсодержащие соединения
А. Йод. Йод является эффективным бактерицидным веществом. Механизм его действия окончательно не выяснен. Раствор, содержащий йод в соотношении 1:20 000, вызывает гибель бактерий в течение 1 минуты, а спор — в течение 15 минут, при этом его токсическое действие на ткани незначительно. Спиртовая настойка йода USP содержит 2 % йода и 2.4 % натрия йодида. Она является наиболее эффективным антисептическим средством для обработки неповрежденной кожи и используется для дезинфекции кожи перед венопункцией. Основным недостатком препарата является развитие дерматита у больных с повышенной индивиду
альной чувствительностью к йоду. Этого явления можно избежать, быстро обработав кожу этиловым спиртом после нанесения настойки йода.
При присоединении йода к поливинилпирро-лидону образуется йодофор — повидон-йод USP. Он представляет собой водорастворимый комплекс, который в растворе высвобождает свободный йод (например, 1 % свободного йода в 10 % растворе препарата). Это средство широко применяется как антисептик для кожи, особенно при предоперационной подготовке. Повидон-йод является эффективным местным противомикробным препаратом, который вызывает гибель не только вегетативных форм, но и спор. Аллергические реакции отмечаются редко. Повидон-йод выпускается в различных лекарственных формах: растворы, мази, аэрозоли, средства для хирургической обработки, шампуни, средства для очистки кожи, влагалищный гель, устройство для промывания влагалища, индивидуальные ватные тампоны. Растворы пови-дон-йода могут загрязняться Pseudomonas и другими аэробными грамотрицательными бактериями. Для экстренной дезинфекции небольших количеств загрязненной питьевой воды иногда используют несколько капель спиртовой настойки йода.
Б. Хлор. Хлор оказывает противомикробное действие в форме недиссоциированной гипохлор-ной кислоты (НОС1), которая образуется при растворении хлора в воде при нейтральном или кислом значениях pH. В концентрации 0.25 часть/млн хлор бактерициден в отношении многих микроорганизмов, за исключением микобактерий, которые в 500 раз более устойчивы, чем другие. В присутствии органических веществ противомикробный эффект хлора значительно уменьшается. Количество хлора, которое связывается органическими веществами (например, в воде) и таким образом не проявляет антимикробной активности, называется “хлор-потребностью.” Хлор-потребность относительно чистой воды низка, добавление 0.5 часть/млн хлора оказывается достаточным для дезинфекции. Хлор-потребность значительно загрязненной воды может быть очень высокой: для ее обеззараживания требуется 20 часть/млн или большее количество хлора.
Хлорированием в основном дезинфицируют предметы, а также очищают воду. Хлорная известь при растворении образует гипохлорит. Она является дешевым (но нестабильным) веществом для
хлорирования и используется прежде всего для обеззараживания нечистот в полевых условиях. Галазон USP представляет собой хлорамин, применяемый в форме растворимых таблеток для стерилизации небольших количеств питьевой воды. 4-8 мг галазона стерилизуют 1 литр воды в течение 15-60 минут при условии, если она не содержит большого количества органических веществ. Однако при этом не уничтожаются цисты Entamoeba histolytica.
Раствор гипохлорита натрия USP (0.5 % раствор NaOCl, “разбавленный гипохлорит натрия”) содержит около 0.1 г активного хлора в децилитре и может применяться для орошения, очистки и дезинфекции загрязненных ран. Содержащие хлор бытовые отбеливатели могут использоваться для дезинфекции предметов.
Окислители
Антимикробное действие некоторых антисептиков обусловлено их окисляющими свойствами. Большинство окислителей не имеет практического применения, за исключением перекиси водорода, натрия пербората и калия перманганата.
Раствор перекиси водорода USP содержит 3 % Н2О2. При контакте с тканями он выделяет молекулярный кислород и оказывает кратковременное антимикробное действие. В ткани не проникает. Применяется в основном для полоскания полости рта и очистки ран. Раствор перекиси водорода можно использовать для дезинфекции контактных линз. Водный раствор бензоилпероксида USP оказывает бактерицидное действие. При аппликации на кожу в виде лосьона он также оказывает кератолитичес-кое, антисеборейное и раздражающее действие. Этот препарат используется для лечения угрей и себореи, однако он может вызывать контактный дерматит, а при попадании на одежду — обесцвечивание.
Калия перманганат USP представляет собой фиолетовые кристаллы, которые образуют темно-фиолетовые водные растворы, способные окрашивать ткани и одежду в коричневый цвет. Растворы перманганата калия в разбавлении 1:10 000 вызывают гибель многих микроорганизмов в течение 1 часа. Более высокие концентрации оказывают раздражающее действие на ткани. Основное применение калия перманганата — лечение мокнущих дерматитов.
Тяжелые металлы
А. Ртуть. Ион ртути вызывает преципитацию белка и угнетает ферменты, содержащие сульфгидрильные группы. Микроорганизмы, жизнедеятельность которых подавлена ионами ртути, могут реактивироваться тиоловыми веществами (сульфгидрильные соединения). Содержащие ртуть антисептики ингибируют сульфгидрильные ферменты как у бактерий, так и в клетках тканей человека. Поэтому большинство содержащих ртуть соединений высокотоксично при попадании внутрь. Дихлорид ртути NF (1:100) может использоваться как дезинфицирующее средство для обработки инструментария или неповрежденной кожи.
Аммониевая ртутная мазь USP содержит 5 % активного нерастворимого соединения HgNH2Cl. Применяется в качестве антисептика для обработки кожи при лечении импетиго.
Некоторые органические соединения ртути менее токсичны, чем неорганические соли, и обладают более выраженными антибактериальными свойствами. Нитромерсол USP, тимеросал USP (мер-тиолат) и фенилмеркурия ацетат или нитрат выпускаются в виде различных жидких и твердых лекарственных форм и используются как бактериостатические антисептики. Их употребляют также в качестве “консервантов" различных веществ биологического происхождения, что уменьшает вероятность случайного загрязнения препаратов. Мербромин (меркурохром) используется в виде 2 % раствора, который оказывает слабое антисептическое действие, но окрашивает ткани в ярко-красный цвет. Психологическое воздействие такого окрашивания способствовало негативной оценке этого антисептика и ограничило его применение.
Б. Серебро. Ион серебра вызывает преципитацию белка и нарушает важные метаболические процессы в микробной клетке. Растворы неорганических солей серебра оказывают выраженное бактерицидное действие. Серебра нитрат в разведении 1:1000 быстро уничтожает большинство микроорганизмов. Офтальмологический раствор нитрата серебра USP, содержащий 1 % этой соли, применяется для закапывания в глаза новорожденным с целью предупреждения гонококковой инфекции глаз. Препарат весьма эффективен, однако, имея достаточно кислую реакцию, может вызвать химический конъюнктивит, в связи с чем иногда применяют мазь с антибиотиком. Другие неорганические соли
серебра редко используются для получения антимикробного эффекта, поскольку сильно раздражают ткани. При ожогах компрессы с 0.5 % раствором нитрата серебра могут уменьшать развитие инфекции в ране, ускорять образование рубца и снижать летальность. Если нитрат серебра в ожоговой ране под действием бактерий восстанавливается в нитрит, может возникнуть метгемоглобинемия. Сульфадиазин серебра в виде 1 % крема медленно высвобождает сульфадиазин, а также серебро (глава 47), что приводит к подавлению микробной флоры в области ожога. В сравнении с мафенида ацетатом этот препарат имеет некоторые преимущества при лечении ожогов, и его применение менее болезненно, однако иногда он вызывает лейкопению.
Коллоидные растворы серебра оказывают менее выраженное повреждающее действие на поверхностные ткани и обладают существенными бактериостатическими свойствами. Белковое серебро, содержащее приблизительно 20 % серебра, применяется в качестве местного антисептика для обработки слизистых оболочек. Длительное использование любого препарата, содержащего серебро, может приводить к интоксикации серебром (аргирия).
Другие металлы
Соли других металлов (например, цинка сульфат, меди сульфат) обладают выраженными антимикробными свойствами, но редко применяются в медицине в качестве антисептиков.
Мыла
Мыла — это анионные поверхностно-активные вещества, которые обычно являются натриевыми или калиевыми солями некоторых жирных кислот. Они могут иметь различный состав в соответствии с конкретными жирами, маслами и щелочами, использующимися для их производства. Так как NaOH и КОН — сильные щелочи, а большинство жирных кислот относится к слабым кислотам, мыла при растворении в воде в основном имеют сильнощелочную реакцию (pH 8.0-10.0). Следовательно, они могут раздражать кожу, которая имеет pH 5.5-6.5. Специальные мыла (например, Нейтрогена) в качестве щелочи содержат в своем составе триэтаноламин, а при растворении в воде их раствор имеет pH около 7.0. Хотя обычно мыла хорошо переносятся, их чрезмерное использование вызывает су
хость нормальной кожи. Входящие в их состав синтетические ароматизаторы могут раздражать или сенсибилизировать кожу.
Большинство обычных видов мыла устраняет загрязнение и поверхностные выделения, отшелушивающийся эпителий и содержащиеся в них бактерии. Мытье рук с мылом удаляет с кожных покровов бактерии и другие патогенные микроорганизмы. Для усиления противомикробного действия в некоторые сорта добавляют дезинфицирующие вещества (гексахлорофен, фенолы, карбанилиды и т. д.). Эти вещества одновременно могут оказывать как полезное, так и вредное действие.
Фенолы и родственные соединения
Фенол вызывает денатурацию белка. Исторически это был первый антисептик, распыление которого использовалось во время хирургической операции Листером в 1867 г. Для получения антимикробного эффекта требуется как минимум концентрация 1-2 %, в то время как в концентрации 5 % он уже существенно раздражает ткани. В связи с этим фенол используется прежде всего для дезинфекции предметов и выделений. Более эффективными (и более дорогими) дезинфицирующими средствами являются замещенные фенолы. Среди них много патентованных коммерческих препаратов, содержащих крезол и другие алкилзамещенные фенолы. Иногда противомикробные и противовирусные свойства некоторых из этих препаратов (например, лизола) преувеличиваются.
Другие производные фенола, такие как резорцин, тимол, гексилрезорцин, в прошлом были весьма популярными антисептиками. Некоторые хлорсодержащие фенолы являются намного более активными противомикробными средствами.
Гексахлорофен USP представляет собой белый кристаллический порошок, который нерастворим в воде, но растворяется в органических растворителях, разбавленных щелочах и мылах и является эффективным бактериостатическим средством. Жидкое мыло с гексахлорофеном USP и многие содержащие это вещество патентованные составы широко используются в хирургической практике и в качестве дезодорирующих средств. После однократного применения такие препараты не более эффективны, чем обычное мыло, но ежедневное их использование приводит к образованию на коже постоянной осадочной пленки, содержащей гекса
хлорофен, что сопровождается длительным бактериостатическим действием. Таким образом, количество бактерий на коже рук хирурга при ежедневном использовании содержащего гексахлорофен мыла будет значительно более низким, чем при использовании обычного мыла. При этом не следует пользоваться другими мылами, которые могут устранять осадочную гексахлорофеновую пленку.
Мыла или детергенты с содержанием 3 % гексахлорофена эффективно предотвращают колонизацию кожи новорожденных патогенными стафилококками в детских отделениях больниц. Однако повторные купания новорожденных (особенно недоношенных младенцев) с использованием таких средств могут приводить к значительному всасыванию гексахлорофена, что проявляется токсическим действием на центральную нервную систему, как правило, губчатой дегенерацией белого мозгового вещества. По этой причине “применение с целью постоянной профилактики” 3 % гексахлорофеновых средств было прекращено. К сожалению, отказ от использования гексахлорофенсодержащих средств для купания новорожденных сопровождался всплеском стафилококковых инфекций в детских клиниках.
НО ОН
Гексахлорофен
К мылам и детергентам теперь добавляют другие антисептики, например карбанилиды или сали-циланилиды. Трихлорокарбанилид в настоящее время занял место гексахлорофена в качестве добавки в “антисептические мыла”. Регулярное использование таких антисептических мыл может оказывать дезодорирующий эффект, предотвращая бактериальное разложение органических веществ секрета потовых желез. Все антисептические мыла могут вызывать аллергические реакции или фотосенсибилизацию.
Хлоргексидин является бисдигуанидовым антисептиком, который повреждает эндоплазматическую мембрану микроорганизмов, особенно грамположительных. Это вещество применяется для очистки кожи, входит в состав антисептического мыла |
и является компонентом жидкостей для полоскания рта, которые подавляют рост бактерий, образующих зубной налет. Для очистки ран может использоваться 4 % раствор хлоргексидина глюконата. Антисептическое мыло с добавкой этого вещества применяется для обработки рук хирурга и подготовки операционного поля. Систематическое использование хлоргексидинсодержащего мыла приводит к накоплению этого вещества на коже и к кумуляции противомикробного действия. Хлоргекси-дин несколько слабее действует на Pseudomonas и Serratia, чем на бактерии кишечной группы и грам-положительные организмы. В нескольких исследованиях с применением метода двойного слепого контроля было выявлено, что 0.2 % раствор хлоргексидина глюконата уменьшает образование зубного налета и дает лечебный эффект при гингивитах. Для профилактики инфекций новорожденных предложено промывание влагалища роженицы раствором хлоргексидина. Хлороксиленол (хлорза-мещенное производное ксиленола) при нанесении на кожу в концентрациях 0.5-4 % оказывает такое же действие.
Катионные поверхностно-активные вещества
В промышленности и быту в качестве детергентов широко используются поверхностно-активные соединения. Они изменяют поверхностное натяжение. Катионные поверхностно-активные вещества оказывают бактерицидное действие, которое, вероятно, связано с изменением проницаемости клеточной мембраны. Эффект катионных веществ уменьшается анионными поверхностно-активными веществами и, следовательно, они несовместимы с мылами. Катионные вещества также в значительной степени адсорбируются пористыми или волокнистыми материалами, например каучуком или хлопковыми волокнами, и эффективно удаляются такими материалами из растворов.
Для дезинфекции инструментов, слизистых оболочек и кожи применяются разнообразные катионные поверхностно-активные вещества, например бензалкония хлорид USP и цетилпиридиния хлорид USP. Водные растворы 1:10 000-1:1000 проявляют хорошие противомикробные свойства, но имеют существенные недостатки. Действие этих четвертичных аммониевых дезинфицирующих средств ослабляется мылами, поэтому не следует
применять мыла для обработки поверхностей перед использованием четвертичных аммониевых дезинфицирующих средств. Эти вещества адсорбируются хлопковыми волокнами и удаляются из растворов. При нанесении на кожу они образуют пленку, под которой могут остаться живые микроорганизмы. Это явление послужило причиной вспышки тяжелых инфекций, вызванных Pseudomonas и другими грамотрицательными бактериями. Таким образом, вещества данной группы не могут использоваться в качестве антисептиков для обработки кожи и редко применяются для дезинфекции инструментария.
Нитрофураны
Нитрофуразон USP используется в качестве местного противомикробного средства для обработки ран или кожных поражений, а также при хирургических перевязках. Его препараты содержат приблизительно 0.2 % активного вещества и не нарушают процесс заживления раны. Однако приблизительно у 2 % больных возникает сенсибилизация, что может проявляться различными реакциями, в частности аллергическим пневмонитом. Нитрофурантоин USP является антисептиком мочевыводящих путей (глава 50).
Препараты
Бензалконий (генерик, Цефирап, др.)
Местно: 17 % концентрат; 50 % раствор;
1:750 раствор
Хлоргексидина глюконат (Гибикленс, Гибистат, ДР)
Местно: 2,4 % моющие средства, губка;
0.5 % полоскание в 70 % спирте (Перидекс) Полоскание рта: 0.12 %
Гексахлорофен (pHisoHex, Септисол)
Местно: 3 % жидкость, губка; 0.25 % раствор;
0.23 % пена
Водный раствор йода (генерик, раствор Люголя) Местно: 2-5 % в воде с 2.4 % раствором натрия йодида или 10 % раствором калия йодида
Настойка йода (генерик)
Местно: 2 % раствор йода или 2.4 % раствор натрия йодида в 47 % спирте во флаконах по 15,30,120 мл и более
Мербромин (Меркурохром)
Местно: 2 % раствор
Нитрофуразон (генерик, Фурацин)
Местно: 0.2 % раствор, мазь и крем
Оксихлорозен натрий (Хлорпактин)
Местно: порошки по 2 и 5 г для приготовления раствора для орошения, инстилляции или полоскания
Повидон-йод (генерик, Бетадин)
Местно: выпускается во многих формах, включая аэрозоль, мазь, антисептические марлевые прокладки и тампоны, средства очистки кожи (жидкость или пена), раствор
Серебра протеин (Аргирол S. S. 10 %)
Местно: 10 % раствор
Тимеросал (генерик, Мертиолат, Мерсол) Местно: 1:1000 настойка и раствор
Избранная литература
Block S. S. Disinfection, Sterilisation and Preservation, 4th ed. Lea & Febiger, 1991.
Burman L. G. et al. Prevention of excess neonatal morbidity associated with group В streptococci by vaginal chlorhexidine disinfection during labor. Lancet, 1992; 340: 65.
Doebbeling B. N. et al. Comparative efficacy of alternative hand-washing agents in reducing infections in intensive care units. N. Engl. J. Med. 1992; 327:88.
Larson E. Guidelines for use of topical antimicrobial agents. Am. J. Infect. Dis. Control, 1988; 1:91.
Russell A. D., Hugo W. B., Ayliffe G. A. J. (eds). Principles and Practice ofDisinfection, Preservation and Sterilization. Blackwell Scientific, 1982.
Клиническое использование противомикробных средств
52
Стивен Л. Барриер, Ричард А. Якобс
Внедрение противомикробных средств является одним из наиболее важных достижений медицинской науки, поскольку эффективное лечение тяжелых инфекций улучшает качество жизни людей и позволяет решить многие проблемы в различных областях медицины. Например, успех химиотерапии злокачественных новообразований, трансплантации органов, обширных хирургических операций (особенно, протезирования) во многом зависит от использующихся противомикробных препаратов. К счастью, большинство противомикробных средств относительно малотоксично; однако практически все они имеют побочные эффекты (например, аллергические реакции, прямое токсическое действие, изменение нормальной бактериальной флоры), что может создавать определенные проблемы или даже представлять угрозу для жизни больного. Таким образом, как и при всех остальных видах лекарственного лечения, для успеха антимикробной терапии необходимы адекватная клиническая оценка эффективности препарата и всестороннее наблюдение за больным.
Эмпирическая антимикробная терапия
Во многих клинических случаях использования противомикробных средств к моменту начала лечения возбудитель заболевания неизвестен или, если он идентифицирован, не выяснена его чувствительность к определенному препарату. Такое использование противомикробных средств является эмпирическим (оно также иногда называется вероятностной терапией), то есть лечение основано на предположении о наиболее вероятном возбудителе инфекции и большом клиническом опыте наблюдения подобных ситуаций, а не на конкрет
ной информации о возбудителе заболевания у данного больного. Главное оправдание эмпирического использования препаратов — необходимость как можно более раннего начала лечения, что при инфекционных заболеваниях позволяет получить лучшие результаты. Отсрочка назначения антимикробных средств до момента получения подтвержденного бактериологического диагноза и проб чувствительности возбудителя (на что обычно требуется 1 -3 дня) может подвергнуть больного риску развития тяжелой формы заболевания и даже привести к летальному исходу. Например, пациент с выраженной нейтропенией при развитии инфекции может умереть в течение нескольких часов, если не начать эффективную терапию. С другой стороны, врачи должны правильно распознавать такие ситуации, когда эмпирическая терапия не показана и имеется возможность отсрочить назначение противомикробных средств до момента получения данных о возбудителе и его чувствительности. Так, назначение противомикробных препаратов при предполагаемом подостром инфекционном эндокардите целесообразно отложить на 24 часа для получения результатов нескольких посевов крови, что повысит вероятность радикального устранения возбудителя при последующем лечении. Но если у больного отмечается гемодинамическая нестабильность или ухудшаются функции сердца и легких, необходимо быстро получить посевы крови из двух участков, а также сразу же начать антимикробную терапию и рассмотреть возможность хирургической операции по замене клапана.
Эмпирическое лечение имеет два главных недостатка: 1) если у больного не подтверждается наличие инфекционного процесса, расходы на такое лечение и возможные токсические эффекты назначенных антимикробных средств не являются оправданными; 2) если вначале не получены соответствую
щие пробы для постановки бактериологического диагноза, а больной поправился, то диагноз заболевания остается неясным, что в дальнейшем усложняет адекватный выбор лекарственного препарата.
До начала проведения эмпирической (и в определенной степени любой антимикробной) терапии следует выполнить целый ряд процедур.
1. Постановка клинического диагноза микробной инфекции. Используя все доступные данные, клиницист должен сделать заключение о наличии инфекционного процесса и попытаться установить как можно более точную анатомическую локализацию этого процесса (например, пневмония, целлюлит, сепсис).
2. Получение проб для лабораторных исследований. Микроскопическое исследование проб (окрашивание по Граму, другие методы) может в течение часа дать надежную информацию о возбудителе. Выделение культуры микроорганизмов или другие специальные исследования (обнаружение антигена методом иммунофлюоресценции или другие тесты) в большинстве случаев обеспечивают постановку этиологического диагноза в течение одного или двух дней. Обычно берут кровь и получают материалы из очага инфекции (например, моча больного с предполагаемой инфекцией мочевыводящих путей; мокрота больного пневмонией).
Забор проб для микробиологического диагноза лучше осуществлять до назначения противомик-робного препарата, поскольку правильно отобранный препарат устранит или подавит микроорганизмы, вызвавшие инфекционный процесс, что в дальнейшем сделает невозможным постановку точного диагноза. Идентификация возбудителя позволяет улучшить качество антимикробной терапии, снижает вероятность токсических эффектов и уменьшает расходы на лечение.
3. Постановка микробиологического диагноза. Основываясь на анамнезе, данных осмотра и результатах сразу же проведенных лабораторных тестов (окрашивание по Граму мазков мокроты и т. п.), клиницист должен сформулировать как можно более конкретный микробиологический диагноз. В некоторых случаях такой диагноз может быть весьма определенным и точным (например, долевая пневмония, вызванная микроорганизмами, напоминающими пневмококков в окрашенном по Граму мазке мокроты), в других случаях точные данные для постановки микробиологического диагноза могут отсутствовать.
4. Определение необходимости в проведении эмпирического лечения. Необходимость такого лечения отчасти основывается на клиническом опыте. Оно показано в тех случаях, когда отсрочка назначения препаратов с целью получения данных лабораторных тестов о возбудителе инфекции и его чувствительности (на что обычно требуется 1-3 дня) сопряжена с риском развития тяжелой формы заболевания. В настоящее время возможны быстрая идентификация возбудителя и определение его чувствительности, что может значительно сократить этот этап.
5. Выбор препарата. Выбор противомикробно-го препарата может основываться на микробиологическом диагнозе при отсутствии данных о чувствительности возбудителя (окрашенный по Граму мазок или предварительные данные о культуре возбудителя), на клиническом диагнозе без дальнейшей микробиологической информации (например, целлюлит, менингит, пневмония) или на том и другом одновременно. При невозможности получения микробиологической информации спектр противо-микробного действия выбранных препаратов обязательно должен быть более широким, чем в том случае, когда имеются какие-либо данные о возбудителе.
Выбор антимикробного препарата с учетом предполагаемой этиологии заболевания не является однозначным. Отбор из числа нескольких потенциально активных средств определяется несколькими факторами, в частности состоянием больного, фармакологическими свойствами препарата, сведениями о локальной распространенности возбудителя инфекции, а также предпочтениями врача, которые основаны на собственном опыте. Ряд факторов зависит от организма больного. Это анамнестические данные об имевших место побочных эффектах лекарственных средств; индивидуальные особенности элиминации и детоксификации (что обычно определяется функциональным состоянием почек и печени); метаболические или генетические нарушения, предрасполагающие к развитию токсических эффектов препаратов (например, дефицит глюкозо-6-фосфатдегидрогеназы); потенциальное взаимодействие препарата с другими одновременно используемыми лекарственными средствами; возраст больного; беременность. Фармакологические факторы включают кинетику всасывания, распределение, скорость и путь элиминации, проникновение препарата в очаг инфекции, воз
можные токсические эффекты. В выборе препарата также играют роль сведения о локальной распространенности возбудителя и его чувствительности кпротивомикробным средствам (например, причиной внутрибольничной инфекции часто являются метициллинустойчивый S. aureus или грамотрица-тельные микроорганизмы с множественной лекарственной устойчивостью). Наконец, все большее значение приобретает фактор стоимости противомикробных средств.
Краткое руководство по эмпирической терапии, основанной на предполагаемом микробиологическом диагнозе и локализации инфекционного процесса, представлено в табл. 52-1 и 52-2.
В некоторых клинических ситуациях при эмпирическом подборе препаратов требуются изменения рекомендуемых схем лечения. Например, для лечения больного с выраженной лейкопенией часто используют комбинации двух препаратов — обычно пенициллина широкого спектра действия и аминогликозида. При тяжелой форме инфекции, вызванной грамотрицательными возбудителями, даже одновременное применение двух препаратов может оказаться малоэффективным; кроме того, даже использование антибиотиков широкого спектра действия не гарантирует успеха лечения вследствие разнообразия возможных возбудителей.
Антимикробная терапия при установленной этиологии инфекционного заболевания
Интерпретация результатов лабораторных тестов
с выделением культуры
Правильное взятие материала и выделение культуры часто позволяют получить надежную информацию о причине инфекции. В некоторых случаях возбудителя инфекции невозможно вырастить в культуре. Причинами этого могут стать ошибки при взятии и хранении материала для исследования (например, отсылка ошибочного материала для получения культуры), попытки получения культуры после начала антимикробной терапии, отсутствие
стабильного роста у некоторых микроорганизмов (например, стрептококков при дефиците питательных веществ), “некультивируемость” возбудителя {Treponema pallidum, риккетсии) или медленный рост организмов (Brucella, Cardiobacterium hominis), неправильная формулировка требований для получения соответствующей культуры (например, требование на получение культуры бактерий, в то время как инфекция вызванамикобактериями или грибами) или отсутствие указания на необходимость использования специальной питательной среды (например, питательной среды CYE для изоляции Legionella). Возможно также получение культур микроорганизмов, которые не явились причиной заболевания. Это может объясняться загрязнением материала при его взятии или обработке в лаборатории, однако чаще связано с забором материала из нестерильных областей (например, мокрота, кожа), которые обычно колонизируют и другие микроорганизмы. В последнем случае весьма полезным может быть получение полуколичественных культур, поскольку обнаружение большого числа патогенных микроорганизмов (особенно, если обнаружено небольшое количество представителей нормальной флоры) является свидетельством против сопутствующего микроорганизма. Полезно и микроскопическое исследование окрашенных мазков, так как присутствие лейкоцитов и микроорганизмов только одного типа подтверждает их этиологическую роль в развитии заболевания.
Руководство по антимикробной терапии инфекций
с установленной этиологией
Определение чувствительности
Определение чувствительности возбудителя к противомикробным препаратам является широко применяемой клинической процедурой. В таких пробах выясняется концентрация препарата, требующаяся для торможения роста микроорганизма (минимальная подавляющая концентрация, МПК), или концентрация, вызывающая его гибель (минимальная летальная концентрация, МЛК, для бактерий часто обозначаемая как минимальная бактерицидная концентрация, МБК). Для определения лекарственной чувствительности или устойчивости микроорганизмов результаты этих испытаний
ТАБЛИЦА 52-1. Эмпирическая противомикробная терапия, основанная на микробиологической этиологии
Предполагаемое или установленное заболевание или возбудитель Препарат(ы) первого выбора Альтернативные препараты
Грамотрицательные кокки (аэробные) Гонококк Пенициллин (только парентераль- Цефокситин3, цефотетан3, фторхи-но)1, ампициллин2, цефтривксон3 нолоны
Менингококк Пенициллин1, ампициллин Хлорамфеникол, цефуроксим3, це- фотаксим3
Грамположительные кокки (аэробные) Пневмококк Streptococcus, гемолитические группА, В, С, G Зеленящие стрептококки Staphylococcus, не продуцирующий пенициллиназу Staphylococcus, продуцирующий пенициллиназу Staphylococcus, метициллин-резистентный Enterococcus faecalis Пенициллин1 Эритромицин, цефалоспорин4 Пенициллин1 Эритромицин, цефалоспорин4 Пенициллин1 (? + аминогликозид) Цефалоспорин4, ванкомицин Пенициллин1 Цефалоспорин4, ванкомицин Пенициллины, устойчивые к пени- Ванкомицин, цефалоспорин4 циллиназе Ванкомицин ТМП-СМЗ6 или фторхинолон (? + рифампин) Ампициллин или пенициллин + ген- Ванкомицин + гентамицин тамицин
Грамотрицательные палочки (аэробные) Колиформные (Е. coli, Klebsiela, Proteus) Аминогликозид7, цефалоспорины ТМП-СМЗ6, пенициллины широкого третьего поколения8 спектра действия9, ципрофлокса- цин
Enterobacter, Citobacter, Serratia Имипенем, фторхинолоны ТМП-СМЗ6, пенициллины широкого спектра действия9, аминогликозид7
Shigella Salmonella Haemophilus sp. Фторхинолоны ТМП-СМЗ6, ампициллин2 ТМП-СМЗ6, ципрофлоксацин Хлорамфеникол, ампициллин2 Цефуроксим3, цефалоспоринытре- ТМП-СМЗ6, ампициллин2, хлорам-тьего поколения6 феникол, кларитромицин
Brucella Helicobacter sp. Yersiniapestis (чума), Francisella tularensis (туляремия) Vibrio sp. Pseudomonas aeruginosa Тетрациклин10 Стрептомицин + сульфаниламид11 Метронидазол Амоксициллин, тетрациклин10 Тетрациклин'°(? + стрептомицин) Хлорамфеникол, стрептомицин или другой аминогликозид Тетрациклин,10 ТМП-СМЗ6 Ципрофлоксацин Аминогликозид7+ пенициллины ши- Цефтазидим, азтреонам, имипенем рокого спектра действия9 ± аминогликозид; ципрофлокса- цин ± р-лактам
Pseudomonas pseudomallei (мелиоидоз), Pseudomonas mallei (can) Legionella sp. Тетрациклин10 (? + стрептомицин) Хлорамфеникол Эритромицин (? + рифампин) ТМП-СМЗ6, фторхинолон
ТАБЛИЦА 52-1. (Продолжение)
Предполагаемое или установленное заболевание или возбудитель Препарат(ы) первого выбора Альтернативные препараты
Грамположительные палочки (аэробные) Bacillus sp. (например, В. anthrax) Пенициллин' Эритромицин, ванкомицин
Listeria monocytogenes Ампициллинг(? + аминогликозид) Хлорамфеникол, ТМП-СМЗ6
Nocardia Сульфанил амид'' Миноциклин, ТМП-СМЗ6
Анаэробы Грамположительные (пептококки, Пенициллин' Клиндамицин, тетрвциклин'0, цефа-
пептострептококки, клостридии ит. п.) лоспорин4, цефокситин
Bacteroides fragilis (некоторые Метронидазол или клиндвмицин Хлорамфеникол, имипенем, ампи-
В. bivius и В. melaninogenicus) циллин/сульбактам, тикарцил-лин/клавуланат
Грамотрицательные, кроме Пенициллин', метронидазол Клиндамицин, тетрациклин'0, цефа-
В. fragilis (Bacteroides, Fusobacterium) лоспорин4, цефокситин3
Микобактерии Micobacterium tuberculosis Изониазид (ГИНК) + рифампин + Стрептомицин, этамбутол, др.
пиразинамид
Micobacterium leprae Дапсон + рифампин Клофазимин
Спирохеты Borrelia (возвратный тиф) Тетрациклин'0 Пенициллин
Borrelia (болезнь Лайма) Тетрациклин'°(ранняя стадия), цеф- Амоксициллин, доксициклин,
триаксон3 (неврологические формы) хлорамфеникол
Leptospira Пенициллин' Тетрациклин
Treponema (сифилис, другие Пенициллин' Эритромицин, тетрациклин'0
трепанематозы) Mycoplasma pneumoniae Тетрациклин'0 Эритромицин, ципрофлоксацин
Chlamydia trachomatis, Тетрациклин10 Эритромицин
Chlamydia pslttaci Риккетсии Тетрациклин'0 Хлорамфеникол
Грибы Candida sp., Torulopsis Амфотерицин В Флуконазол, кетоконазол'2, флуци-
тозин
Criptococcus neoformans Амфотерицин В + флуцитозин Флуконазол
Кокцидиоидомикоз Амфотерицин В Флуконазол, итраконазол
Гистоплазмоз Итраконазол Амфотерицин В, кетоконазол'2
Бластомикоз Итраконазол Амфотерицин В, кетоконазол'2
Паракокцидиоидомикоз Кетоконазол'2 Амфотерицин В
Споротрихоз Итраконазол Амфотерицин В, кетоконазол'2
Аспергиллез, мукоромикоз Амфотерицин В Итраконазол
’ Пенициллин G является препаратом выбора для парентерального введения, пенициллин V — для перорального. Только при наличии очень чувствительных микроорганизмов лечение можно проводить пероральным пенициллиновым антибиотиком.
сопоставляются с данными о концентрациях препарата в различных компартментах тела и о связи клинической эффективности и МПК или МЛК. Во многих лабораториях обычно определяется только МПК; этот показатель является достаточным основанием для лечения большинства инфекций.
Как правило, используются два метода определения чувствительности: диск-диффузионный метод (в агаре), или метод Керби-Бауэра, и метод раз-ведений в питательной среде. В диск-диффузион-ном методе диск, содержащий стандартизированное количество противомикробного препарата, помещается в агар, зараженный изучаемыми бактериями. Затем при тщательном соблюдении условий наблюдают за ростом бактерий на фоне диффузии антибиотика из диска в агар. Диаметр зоны подавления роста колоний коррелирует с МПК, хотя размеры зоны не сопоставимы для разных препаратов. При использовании метода разведений в питательной среде бактерии инкубируют при разных градуально уменьшающихся концентрациях противомикробного препарата в бульоне, что позволяет прямо определить МПК.
Диск-диффузионный метод приемлем для определения чувствительности многих микроорганизмов к разным препаратам. Постановка таких проб вполне достаточна для выбора препарата, когда имеют место варианты бимодальной чувствительности (то есть либо очень высокая чувствительность, либо очень высокая устойчивость с несколькими промежуточными вариантами), как в случае чувствительности S. aureus к пенициллину G. Однако когда нет четкой грани между чувствительно-
стью и резистентностью микроорганизма к конкретному антибиотику, более целесообразно прямое определение МПК.
Результаты лабораторных тестов по определению чувствительности микроорганизма к антибиотику обычно хорошо коррелируют с клинической эффективностью препарата. Тем не менее у больных инфекционными заболеваниями возможно излечение при применении препаратов, которые в лабораторных тестах in vitro оказались неэффективными. Во многих случаях для выздоровления могут быть достаточными защитные механизмы организма хозяина. Имеются многочисленные свидетельства того, что низкие (субингибирующие) концентрации антимикробных средств могут оказывать защитный эффект, увеличивая, например, захват и лизис бактерий фагоцитами.
Концентрации препаратов в жидкостях организма
Для большинства противомикробных препаратов установлены величины доз, создающие в жидкостях организма определенные концентрации, а Поскольку терапевтический индекс их достаточно высок, необходимость прибегать к определению антимикробных концентраций в жидкостях организма возникает редко. Это приходится делать в следующих случаях: при назначении противомикробных средств с низким терапевтическим индексом (ванкомицин, аминогликозиды); использовании такого пути введения препарата, который не обеспечивает надежного всасывания, особенно при ле-
2 Амоксициллин или ампициллин; эфиры ампициллина (например, гетациллин, бакампициллин) и циклациллин не имеют преимуществ. Доступен также амоксициллин в комбинации с клавуланатом калия (Аугментин).
3 Эффективен в отношении продуцирующих р-лактамазу штаммов.
4 Цефалоспорин первого поколения; цефалотин, цефапирин или цефазолин для парентерального введения; цефалексин или цефрадин для перорального приема.
5 Парентерально: нафциллин, оксациллин или метициллин. Перорально: диклоксациллин, клоксациллин или оксациллин.
6 Триметоприм-сульфаметоксазол (ТМП-СМЗ) содержит 1 часть триметоприма и 5 частей сульфаметоксазола.
7 Гентамицин, тобрамицин, нетилмицин или амикацин. Канамицин используют против ряда микроорганизмов, кроме Pseudomonas sp.; стрептомицин эффективен только в отношении лекарственночувствительных штаммов М. tuberculosis и стрептококков (совместно с пенициллином или ампициллином).
8 Цефотаксим, цефоперазон, цефтизоксим, цефтриаксон или цефтазидим. Цефоперазон неэффективен при менингите.
9 Пенициллины широкого спектра действия: тикарциллин, мезлоциллин, пиперациллин или азлоциллин.
’° Все тетрациклины имеют одинаковую активность в отношении микроорганизмов (за редким исключением), а также сопоставимую терапевтическую эффективность и токсичность. Дозы определяются скоростью всасывания и выведения разных препаратов. Доксициклин легче вводится парентерально и более удобен для перорального приема (хотя и более дорог). "При пероральном назначении трисульфапиримидины имеют преимущество перед сульфадиазином вследствие высокой растворимости в моче; натрия сульфадиазин можно вводить внутривенно тяжелобольным.
12 Кетоконазол не проникает в центральную нервную систему и неэффективен при менингите.
ТАБЛИЦА 52-2. Эмпирическая противомикробная терапия с учетом локализации инфекционного процесса
Предполагаемая локализация инфекционного процесса Наиболее распространенные возбудители Препарат(ы) первого выбора Альтернативные препараты
Бактериальный эндокардит
Острый Стафилококки, стрептококки, аэробные грамотрицательные палочки ПРП + гентамицин Ванкомицин + гентамицин
Подострый Зеленящий стрептококк, энтерококки Пенициллин + гентамицин Ванкомицин + гентамицин
Гематогенный S. aureus ПРП' Клиндамицин, ванкомицин
остеомиелит Септический артрит
У детей Н. influenzae, S. aureus, стрептококки Цефуроксим, цефалоспорин третьего поколения3 Ампициллин-сульбактам
У взрослых N. gonorrhoeae, S. aureus, стрептококки Цефуроксим, цефалоспорин третьего поколения3 Ампициллин-сульбактам
Цистит £ coli, P. mirabilis, S. sap-rophyticus Сульфаниламид, ампициллин ТМП-СМЗ, фторхинолон2
Пиелонефрит Колиформные организмы ТМП-СМЗ Цефалоспорин третьего поколения3, аминогликозид4, фторхинолон2
Средний отит и синусит H. influenzae, стрептококки Амоксициллин, ампициллин Эритромицин + сульфаниламид, ТМП-СМЗ, амоксициллин-клавула-новая кислота, пероральный цефалоспорин5
Бронхит(бактериальный) H. influenzae, пневмококки Эритромицин или более новый макролид Ампициллин, ТМП-СМЗ
Пневмония (бактериальная)6
У новорожденных Стрептококки группы В, Е coli. Listeria Ампициллин + аминогликозид4 Хлорамфеникол; ампициллин + цефалоспорин третьего поколения3
У детей Пневмококки, S. aureus, Н. influenzae Цефуроксим, цефотаксим Ампициллин-сульбактам
У взрослых Пневмококки, Klebsiella, S. aureus Цефалоспорин3, цефуроксим Ампициллин-сульбактам
Целлюлит Стрептококки группы А Пенициллин Цефалоспорин
Абсцесс с целлюлитом Стафилококки ПРП1 или ампициллин-суль-бактам Клиндамицин
Менингит
У новорожденных Стрептококки группы В, £ со//, Listeria Ампициллин + аминогликозид4 Хлорамфеникол; ампициллин + цефалоспорин третьего поколения3
Удетей Н. influenzae, пневмококки, менингококки Цефотаксим, цефтриаксон Цефуроксим, хлорамфеникол
ТАБЛИЦА 52-2. (Продолжение)
Предполагаемая локализация инфекционного процесса Наиболее распространенные возбудители Препарат(ы) первого выбора Альтернативные препараты
У взрослых Пневмококки, менингококки Пенициллин Цефалоспорин третьего поколения3
Перитонит при про- Колиформные организмы, Ампициллин-сульбактам, ти- Клиндамицин + цефало-
бодении внутреннего органа В. fragilis, стрептококки карциллин-клавуланат, ими-пенем спорин третьего поколения3
Септицемия Любые Цефалоспоринтретьего поколения3 (? + аминогликозид4) Клиндамицин + аминогликозид4, пенициллины широкого спектра действия7
Септицемия с гра-нулоцитопенией Любые (редко анаэробы) Пенициллин широкого спектра действия7 + аминогликозид4 или имипенем Цефалоспорин третьего поколения3 + аминогликозид4
’ ПРП — пенициллин, резистентный к пенициллиназе, например нафциллин, оксациллин.
2 Ципрофлоксацин, офлоксацин, ломефлоксацин.
э Цефотаксим, цефоперазон, цефтизоксим, цефтриаксон или цефтазидим. Цефоперазон не применяют при менингите.
4 Гентамицин, тобрамицин, нетилмицин или амикацин.
5 Цефпрозил, лоракарбеф, цефиксим, цефподоксим проксетил, цефуроксим аксетил.
6 Пневмония может быть вызвана самыми различными возбудителями, поэтому выбор эмпирической терапии сложен. См. специализированные издания в списке использованной литературы.
7 Пенициллины широкого спектра действия: тикарциллин, пиперациллин или мезлоциллин.
чении тяжелой инфекции (пероральный путь введения); установлении причин отсутствия клинического эффекта при адекватной антимикробной терапии; при необходимости определения концентраций препарата в особых областях (например, в центральной нервной системе — табл. 52-3).
Имеется несколько методов определения концентраций противомикробных средств. Чаще всего используется метод оценки биологической активности, поскольку он может быть адаптирован к любым противомикробным препаратам. Сущность метода заключается в сравнении степени подавления роста стандартного микроорганизма образцами клинических проб с таким же эффектом нескольких определенных концентраций препарата, что позволяет интерполировать его содержание в биологическом материале. В случаях применения таких противомикробных препаратов, как аминогликозиды и ванкомицин, где требуется частое определение концентрации препарата, используют различные автоматизированные методы, которые принципиально не отличаются от методов определения концентрации других препаратов.
Бактерицидные титры сыворотки
При многих инфекционных заболеваниях (например, инфекционные поражения мягких тканей, пневмонии, энтериты) большой вклад в борьбу с инфекцией вносят собственные механизмы защиты организма-хозяина. В этих условиях для успешного лечения часто достаточно назначения бактериостатических препаратов, которые угнетают только размножение возбудителя. При других заболеваниях (инфекционный эндокардит, бактериемия у больного с иммунодефицитом, бактериальный менингит) собственные механизмы защиты вносят в излечение минимальный вклад. В этих случаях в инфицированной ткани необходимо создание бактерицидных концентраций лекарственных препаратов. Определение титров бактериостатической и бактерицидной активности в жидкостях организма позволяет оценить как чувствительность возбудителя, так и адекватность дозировки препарата, а также его всасывание, используя один простой лабораторный тест. Сыворотку получают от больного в соответствующее время после приема последней дозы препарата и ее серийные разведения
ТАБЛИЦА 52-3. Проникновение некоторых противомикробныхпрепаратов в спинномозговуюжидкость(СМЖ)
Препарат Дозы Установленные концентрации в СМЖ (при воспалении мозговых оболочек) (мкг/мл) Концентрация в плазме (мкг/мл)
Амикацин 15 мг/кг/день 0.8-9.2 5-20
Ампициллин 150-300 мг/кг/день 2-60 16-250
Азтреонам 2 г/день 0.2-8.1 10-107
Цефотаксим 30-150 мг/кг/день 0.3-27 40-100
Цефтазидим 2-3 г/день 3-56 13-100
Цефтриаксон 100 мг/кг/день 0.3-42 3-260
Цефуроксим 200 мг/кг/день 1-17 60-100
Хлорамфеникол 25-100 мг/кг/день 3-40 10-128
Ципрофлоксацин 400-500 мг/день 0.3-0.4 1.6-2.4
Гентамицин 2-7.5 мг/кг/день 0.5-2 0.7-7
Имипенем 100 мг/кг/день 0.7-10 0.6-27
Нафциллин 150-200 мг/кг/день 2.7-88 36-176
Пенициллин G 2-3 х 105ЕД/кг/день 1.7-46 12-740
Сульфаметоксазол 25-50 мг/кг/день 5-40 40-85
Тобрамицин 3-4.5 мг/кг/день 0.5-0.9 0.9-6.5
Триметоприм 5-10 мг/кг/день 0.2-2.4 1.7-3.5
Ванкомицин 20-30 мг/кг/день 0.1-8.5 1.4-30
инкубируют со стандартизированным количеством выделенного у больного возбудителя заболевания. Подавление роста и гибель микроорганизмов при разведении (титре) сыворотки 1 :8 или больше обычно рассматривается как удовлетворительный результат, хотя в этом отношении существуют противоречивые данные. Несмотря на то, что эта процедура полностью не стандартизована, она достаточно проста и полезна для подтверждения правильности выбора и дозировки антимикробных препаратов. Она помогает и в тех случаях, когда необходимо использование бактерицидных противомикробных препаратов, а также при подборе антимикробных комбинаций для получения возможного синергизма.
Специальные методы определения
А. Определение р-лактамазной активности. У некоторых бактерий (например, гонококки, энтерококки, Haemophilus influenzae) характеристики чувствительности разных штаммов близки, за исключением форм, продуцирующих Р-лактамазу, которая обеспечивает устойчивость к различным Р-лактамным антибиотикам. В этих случаях широкое исследование чувствительности может не проводиться и достаточно прямого определения р-лак-
тамазы с использованием Р-лактамного хромогенного субстрата. Этот тест является чувствительным, специфичным, быстрым и надежным.
Б. Изучение синергизма. Проводящиеся in vitro исследования определяют наличие синергизма, суммирования эффектов, антагонистического действия или отсутствие таковых при одновременном использовании нескольких препаратов. Имеющиеся методы не стандартизованы, отсутствует систематическое сопоставление таких данных с клиническими результатами. Более подробные сведения представлены в главе о комбинированной химиотерапии.
Выбор пути введения
При острых формах заболевания, когда для успешного лечения требуется поддержание высоких концентраций препаратов (например, при сифилисе центральной нервной системы), обычно предпочитают парентеральный путь введения. Выбор между внутривенным и внутримышечным введением определяется наличием конкретной лекарственной формы препарата. Некоторые средства (хлорамфеникол, рифампин, триметоприм-сульфаметоксазол, метронидазол, фторхинолоны) настолько хорошо всасываются при пероральном приеме, что отпада
ет необходимость парентерального введения. Для других препаратов более подходит пероральный путь введения при лечении заболеваний легкой или средней степени тяжести или для лечения тяжелых инфекций с установленной этиологией, если всасывание препарата контролируется (например, определяются концентрации или бактерицидные титры сыворотки).
Контроль эффективности лечения, продолжительность лечения
Эффективность лечения подтверждается микробиологическими и клиническими данными. В ходе терапии должно наблюдаться прогрессивное снижение количества возбудителей в пробах из инфицированных участков, которые в итоге должны стать стерильными. Постоянное проведение микробиологических тестов позволяет также вовремя обнаружить суперинфекцию или развитие лекарственной устойчивости. Должно наблюдаться как клиническое улучшение (исчезновение недомогания, лихорадки, лейкоцитоза и т. д.), так и положительная динамика объективных данных (например, при пневмонии просветление инфильтратов на рентгеновских снимках). Скорость развития клинического эффекта при проведении антимикробной терапии обычно обратно пропорциональна продолжительности заболевания до лечения.
Необходимая для излечения продолжительность терапии зависит от вида возбудителя (бактериальные инфекции излечиваются быстрее, чем грибковые или микобактериальные), локализации инфекционного процесса (эндокардит и остеомиелит требуют более длительных курсов лечения, чем инфекции других органов), от состояния защитных механизмов организма хозяина (больным с иммунодефицитными состояниями обычно необходимо более длительное лечение, чем иммунокомпетентным индивидуумам). Точные данные относительно требующейся длительности лечения имеются для таких инфекций, как стрептококковый фарингит, цистит, сифилис, гонорея и туберкулез. Во многих других ситуациях необходимая длительность терапии определяется эмпирически. При тяжелых инфекциях общим полезным правилом является продолжение назначения препаратов в течение 7-10 дней после того, как исчезает лихорадка и микробиологические пробы становятся отрицательными. Исключением из этого правила являются боль
ные с эндокардитом или остеомиелитом, которые должны получать терапию не менее шести недель.
Устранение токсических эффектов противомикробных препаратов
В связи с большим количеством имеющихся на сегодняшний день противомикробных средств при возникновении токсических эффектов какого-либо препарата возможна его замена на другое равноэффективное вещество (табл. 52-1). В тех редких случаях, когда это невозможно, продолжают лечение тем же препаратом и одновременно устраняют его побочные эффекты, хотя это и сопряжено с определенным риском. Например, обусловленный применением противомикробных препаратов колит, вызванный Clostridium difficile, можно вылечить пероральным приемом ванкомицина, метронидазола или бацитрацина, не отменяя вызвавшее это осложнение лекарство. Добавим, что некоторые проявления токсичности препаратов (например, лекарственная лихорадка) могут быть ошибочно приняты за проявления инфекционного заболевания.
Противомикробные препараты часто вызывают аллергические реакции, которые трудно устранить. При наличии лекарственной аллергии следует избегать назначения подозреваемого препарата и выбрать замену (табл. 52-1 и 52-2). Практически в любом случае существует возможность выбора альтернативного равноэффективного средства. Если в анамнезе больного имели место угрожающие жизни реакции на антимикробный препарат (анафилактическая реакция, токсический эпидермальный некролиз), нужно исключить назначение всех родственных препаратов. Так, при сильной сенсибилизации к пенициллину, не следует использовать все Р-лактамные антибиотики, за исключением, пожалуй, азтреонама. При настоятельной необходимости применения антибиотика пенициллинового ряда у больного, имевшего анафилактическую реакцию на пенициллин, можно попытаться провести десенсибилизацию (Wendel, 1985).
Отсутствие клинического эффекта на антимикробную терапию
В том случае, если основанное на определении чувствительности возбудителя in vitro лечение не приводит к клиническому улучшению и нормализации микробиологических проб, должно быть
предпринято изучение причин возникшей проблемы (табл. 52-4). Ошибки в определении чувстви-тельностибывают редко, тем не менее первоначальные результаты нужно подтвердить повторными испытаниями. Необходима проверка точности дозирования. Может помочь прямое определение сывороточных концентраций препарата или бактерицидных титров. Однако отсутствие клинического эффекта редко является фармакологической проблемой.
Необходимо провести ревизию клинических данных для выяснения состоятельности механизмов защиты организма больного (достаточное количество гранулоцитов и т. д.) и исключить наличие абсцессов, требующих дренирования, или инфицированных инородных тел, которые должны быть удалены. Если у больного отмечается хороший клинический эффект, за исключением сохраняющейся лихорадки, можно предположить ее лекарственное происхождение. Наконец, необходимы повторные посевы микроорганизмов и определение их чувствительности. Это позволит исключить воз-
ТАБЛИЦА 52-4. Наиболее частые причины неэффективности противомикробной терапии
Препарат
Неправильный выбор
Неадекватная доза
Неправильный путь введения
Плохое всасывание
Увеличенная скорость выведения или инактивации Плохое проникновение в очаг инфекции (например, головной мозг глаз, предстательная железа)
Организм больного
Недостаточность механизмов защиты (гранулоци-топения, лейкопения, СПИД)
Недренированный гнойный очаг (абсцесс)
Наличие инфицированного инородного тела
Мертвая ткань (например, секвестр)
Возбудитель
Развитие лекарственной устойчивости Суперинфекция другим возбудителем
Исходно двойная инфекция при определении только одного из возбудителей и назначении соответствующего лечения
Лаборатория
Ошибка в определении чувствительности возбудителя
можную суперинфекцию другим микроорганизмом или развитие лекарственной устойчивости у прежнего возбудителя.
Дополнительные мероприятия при лечении инфекций
А. Хирургические мероприятия. Во многих случаях возникает необходимость дренирования абсцессов, устранения инородных тел или постоянных источников инфицирования (например, при перфорации кишечника). Хотя часто делаются попытки отложить хирургические манипуляции до исчезновения или ослабления признаков интоксикации, во многих случаях излечение невозможно без проведения соответствующей хирургической операции. С другой стороны, если имеет место клиническое улучшение и тем более если данные объективных исследований (ультразвуковая эхография, компьютерное сканирование) свидетельствуют об уменьшении абсцесса, хирургическое вмешательство можно отложить. Кроме того, некоторые абсцессы можно дренировать введением чрескожной иглы или катетера под контролем эхографии или сканирования, что позволяет избежать обширного хирургического вмешательства.
Б. Устранение лихорадки. Для уменьшения температуры тела ниже опасного уровня (40.5 °C у большинства взрослых; 39.5 °C у детей, особенно с фебрильными судорогами в анамнезе) и устранения дискомфорта используют жаропонижающие препараты. Если повышение температуры не достигает опасного уровня и удовлетворительно переносится больным, то назначать антипиретики не следует. Опасности “маскировки” инфекции антипиретиками не существует. Обычно при инфекционных заболеваниях жаропонижающие средства снижают температуру, однако при активном инфекционном процессе сохраняется некоторое ее повышение.
Жаропонижающие средства нужно применять регулярно (обычно каждые 4 часа), а не только при повышении температуры. Нерегулярный прием приводит к значительным колебаниям температуры тела, что создает у больного больший дискомфорт, чем собственно повышение температуры.
В. Общеукрепляющие мероприятия. Отдых и правильное питание улучшают самочувствие больного. Тем не менее, за исключением коррекции явного недоедания, эти мероприятия не столь суще
ственны для процесса выздоровления при легких формах заболевания, если проводится адекватная антимикробная терапия.
Лечение сопутствующих инфекционному процессу нарушений является существенным компонентом терапии инфекционных заболеваний. Необходимо поддерживать функции дыхательной и сердечно-сосудистой систем, корригировать нарушения электролитного обмена и кислотно-основного равновесия. В настоящее время изучается роль моноклональных антител к ядерному гликолипиду (эндотоксину) в лечении грамотрицательного сепсиса и шока. Для терапии тяжелого сепсиса может также оказаться полезным антагонист рецептора интерлейкина-1 — белок, предотвращающий его связывание с рецептором. В настоящее время разрабатываются и другие направления фармакологического воздействия, нацеленные на различные этапы воспалительной реакции.
Факторы, влияющие на действие противомикробных препаратов
Заболевания органов, осуществляющих выведение препаратов, а также такие физиологические состояния, как детский возраст или беременность, определенным образом изменяют фармакокинетические характеристики противомикробных и других средств. Некоторые из этих изменений приведены в табл. 52-5 и главе 61. Как известно, фармакокинетика противомикробных препаратов изменяется при многих других клинических состояниях (послеродовой период, ожоги, муковисцидоз). Соответственно, при подборе адекватных доз и схем лечения больных тяжелыми формами инфекций при наличии серьезного основного заболевания весьма желательно определение сывороточных концентраций препаратов или бактерицидных титров.
Взаимодействие противомикробных препаратов
Как и препараты других классов, противомик-робные средства способны взаимодействовать с другими одновременно назначаемыми больному
лекарствами, что может приводить к нежелательным результатам. Некоторые клинически важные варианты такого взаимодействия представлены в приложении II. В дополнение к типам взаимодействия, которые рассматриваются в главе 33, практически все антимикробные препараты широкого спектра действия (кроме рифампина) усиливают эффект кумариновых антикоагулянтов. Ингибирование биотрансформации бактериальных стеролов антимикробными средствами может сопровождаться одновременным уменьшением концентрации гормональных контрацептивов в крови, что снижает эффективность последних.
Комбинации противомикробных препаратов
Возможные показания к применению комбинаций противомикробных препаратов (табл. 52-6)
1. При лечении некоторых тяжелых больных с подозрением на инфекцию неизвестного происхождения может возникнуть необходимость эмпирического назначения больше чем одного противомикробного препарата для подавления всех наиболее вероятных возбудителей. Так, при подозрении на сепсис до получения культуры определенного микроорганизма из проб крови можно назначить антиста-филококковый препарат (например, нафциллин) одновременно с препаратом, активным в отношении аэробных грамотрицательных палочек (гентамицин, тобрамицин или амикацин) (табл. 52-2).
2. При смешанных инфекциях может потребоваться одновременное применение двух или трех препаратов, чтобы “охватить” всех потенциальных или известных возбудителей. Например, при возникшем после перфорации толстой кишки перитоните препарат, эффективный в отношении анаэробов и грамположительных бактерий (клиндамицин), применяют совместно с препаратом, действующим на бактерии кишечной группы (аминогликозид). Однако такая необходимость может отпадать при приеме комбинированных препаратов с ингибиторами Р-лактамаз (ампициллин/сульбактам, пи-перациллин/тазобактам, тикарциллин/клавула-нат) и имипенема.
Выведение препарата указанным путем (%) Ориентировочное время полувыведения, ч Схема дозирования1
Анурия2 Диализ3
Препарат Почки Печень В норме Анурия Начальная Поддерживающая доза
Азитромицин 20 35 120 ... Без изменений Без изменений Азтреонам 60-70 10-20 1.7 6 1-2 г 0.5-1 г каждые 6-8 часов 0.25-0.5 г после ГД Амантадин 90 ... 8-18 Увеличение 100 мг Значительное уменьшение Без изменений Амикацин 95-98 ... 2.5 60-90 7.5 мг/кг См. сноску 4 См. сноску 5 Ампициллин 75-90 5-10 0.8-1.5 8-12 Зг 1 г каждые 6 часов 0.5гпослеГД Амфотерицин В 4-5 5-10 360 Без изменений Без изменений Без изменений Без изменений Ацикловир 30-75 ... 2-5 Увеличение 5 мг/кг 2.5 мг/кг каждые 24 часа 2.5 мг/кг после ГД Ванкомицин 95 ... 4-9 200-240 15 мг/кг 7.5 мг/кгодин раз в неделю8 Без изменений Видарабин 40-50 ... 3-4 ... Суточная доза должна быть снижена на 25 % 5 мг/кг после ГД Ганцикловир 90 10 2.5 28-30 5 мг/кг 2.5 мг/кг каждые 24 часа 2.5 мг/кг после ГД Гентамицин 95-98 ... 2.5 60-80 2 мг/кг См. сноску 4 См. сноску 5 Гризеофульвин <1 ... 10-20 Без изменений Без изменений Без изменений Нет данных Доксициклин 20-50 ... 15-24 Без изменений Без изменений Без изменений Без изменений Изониазид 3-35 ... 1.5 2.5 Без изменений Без изменений Без изменений 5 (у медлен- 10 (у медленных ацетиля- ных ацетилято-торов) ров) Имипенем 70 10-20 0.9 3 0.5-1 г 0.25-0.5 г каждые 12 часов 0.25 г после ГД Итраконазол 20 > 50 21 25 Без изменений Без изменений Без изменений Кетоконазол <5 50 4-8 Без изменений Без изменений Без изменений Нет данных Кларитромицин 30 >50 3-4 15 500 мг 250 мг Без изменений Клиндамицин 15 ... 2-4 4-6 Без изменений Без изменений Без изменений Ломефлоксацин 65 ... 10-12 25 400 мг 200 мг Без изменений Мезлоциллин 40-70 10-20 1 3.5 Зг 2 г каждые 6 часов 2 г после ГД Метронидазол 30-40 ... 6-14 8-15 7.5 мг/кг первоначально; затем — 7.5 мг/кг Без изменений каждые 12-24 часа; может накапливаться активный метаболит Миноциклин <10 ... 14-30 Избегать применения при почечной Без изменений 12-15 недостаточности Нафциллин 30-50 50-70 1 Без изменений Без изменений Без изменений Нетилмицин 90-95 ... 0.5 30-40 2.5 мг/кг См. сноску 4 См. сноску 5 Норфлоксацин 30 60 2.5 6 Без изменений Снижение на 50 % Без изменений Оксациллин 50 50 3.5 1 Без изменений Без изменений Без изменений
Глава 52. Клиническое использование противомикробных средств
Выведение препарата указанным путем (%) Ориентировочное время полувыведения, ч
Препарат Почки Печень В норме Анурия
Офлоксацин 75 ... 0.5 36 Пенициллине 75-90 ... 6-8 6-20 0.5 Пиперациллин 50-90 10-40 1 3-6 Рифампин 5-15 80-90 2-3 3-5 Сульфаметокса- 40-50 ... 9-11 18-24 зол Сульфизоксазол 50 ... 4.5-7 6-12 Тетрациклин 50 20-30 6-12 30-80 Тикарциллин 80-90 5-10 1 10-20 Тобрамицин 95-98 ... 2.5 60-80 Триметоприм 65-80 ... 10-12 24-36 Флуконазол 80 10 22-31 100 Флуцитозин 85-90 ... 3-6 60-80 Фоскарнет >90 ... 3-8 Хлорамфеникол 5-10 ... 2-4 4-6 Цефазолин 95-98 2-5 1.4 35-56 Цефалексин, 80-95 5-10 0.8-2 20-30 цефрадин Цефалотин, 40-60 ... 1 3 цефапирин
Цефамандол 90-95 5-10 0.8-1 15-24
Цефокситин 90 ... 0.5-1 8-30
Цефоницид 95 ... 4.5 48-72
Цефоперазон 25 75 2 2
Цефотаксим 40-60 ... 0.8-1 3-4
Цефотетан 50-70 ... 3.5 20-35
Цефтазидим 60-90 ... 1.9 26-36
Цефтизоксим 95 5-10 1.3 36
Цефтриаксон 40-50 10-60 8 10-12
Схема дозирования1
Анурия2 Диализ3
Начальная доза Поддерживающая
400 мг 200 мг Без изменений
3 млн ЕД 1 млн ЕД каждые 6 часов 0.5 млн ЕД после ГД
Зг 2 г каждые 8 часов 1 г после ГД
Без изменений Без изменений Без изменений
См. сноску 6 См. сноску?
15 мг/кг 7.5 мг/кг каждые 12 часов 7.5 мг/кг после ГД
Избегать применения при почечной Без изменений
недостаточности
Зг 2 г каждые 12 чвсов 2 г после ГД
2 мг/кг См. сноску 4 См. сноску 5
См. сноску 6 См. сноску?
100-400 мг 50-200 мг каждые 48 часов 50-100 мг после ГД
30 мг/кг 25 мг/кг каждые 24 чвса 15 мг/кг после ГД
90-120 мг/кг Нет данных Нет данных
Без изменений Без изменений 0.25 г после ГД
1 г 0.5 г каждые 24 часа 0.5 г после ГД
0.5 г 0.5 г каждые 24 часа 0.25 г после ГД
2г 1 г каждые 8 часов 0.5 г после ГД. Добавить при ПД до требуемой сывороточной концентрации
2г 1 г каждые 12 часов 0.5 г после ГД
2г 1 г каждые 12 часов 0.5 г после ГД
2г 0.25 г два раза в неделю Без изменений
Без изменений Без изменений Без изменений
2г 1 г каждые 6 часов 0.5 г после ГД
1-2 г 0.5-1 г каждые 24 часа 0.25-0.5 г
1-2 г 1 г каждые 24 часа 0.5 г после ГД
1-2 г 1 г каждые 24 часа 0.5 г после ГД
1 г Без изменений Без изменений
340 ____________Раздел VIII. Химиотерапевтические средства
Выведение препарата указанным путем (%) Ориентировочное время полувыведения, ч Схема дозирования1
Анурия2 Диализ3
Препарат Почки Печень В норме Анурия Начальная доза Поддерживающая
Цефуроксим 90-95 ... 1.3 15 1.5г 0.75 г каждые 12 часов 0.75гпослеГД Ципрофлокса- 50-70 20 4 8 Без изменений Снижение на 50 % Без изменений цин Эритромицин 5-15 ... 1.5-3 4-6 Без изменений Без изменений Без изменений Этамбутол 65-80 ... 3-4 18-20 15 мг/кг 5 мг/кг каждые 24 часа 5 мг/кг после ГД
или ПД
1 Указаны дозы для взрослых (70 кг) при тяжелой форме инфекции.
2 Клиренс креатинина ниже 5 мл/мин.
3 ГД — гемодиализ; ПД — перитонеальный диализ.
4 Для поддерживающей терапии можно назначать половину первоначальной дозы с интервалом, соответствующим времени полувыведения. Необходимо определение сывороточной концентрации.
5 После ГД назначают половину первоначальной дозы. При ПД добавляют препарат до необходимой сывороточной концентрации.
6 Суточная доза должна быть снижена до 25 % от обычной дозы.
7 После ГД назначают половину суточной поддерживающей дозы.
6 Необходимо определение сывороточных концентраций.
ТАБЛИЦА 52-6. Некоторые примеры комбинаций противомикробных препаратов и обоснование их использования
Показания к применению Комбинации препаратов Обоснование
Эмпирическая терапия различных забо- Различные Расширение спектра по сравнению с одним пре-
леваний (табл. 52-2) паратом
Инфекции, вызываемые Pseudomonas p-Лактамный антибиотик + амино- Увеличение активности (суммирование или синер-
aeruginosa гликозид гизм). Снижение токсичности. Замедление появления резистентных форм
Энтерококковый эндокардит Пенициллин или ванкомицин + аминогликозид Синергизм: превращение бактериостатического препарата в бактерицидный
Туберкулез Различные, особенно изониазид + рифампин Торможение появления резистентных штаммов. Ускорение развития бактерицидного эффекта, что позволяет уменьшить длительность лечения
Криптококковый менингит Амфотерицин В + флуцитозин Вероятный синергизм и снижение токсичности
Больные с выраженной лейкопенией р-Лактамный антибиотик + аминогликозид Увеличение активности (суммирование или синергизм). Возможное снижение токсичности
Глава 52. Клиническое использование противомикробных средств________________________________________341
3. В некоторых клинических ситуациях быстрое появление устойчивости бактерий к одному препарату снижает шансы излечения. Добавление второго лекарственного средства может замедлять или предотвращать появление устойчивых форм. Такой эффект сочетанного действия однозначно продемонстрирован при лечении туберкулеза, что является основанием для практики использования комбинаций изониазида, этамбутола, рифампина или других препаратов при этом заболевании.
4. Одновременное использование двух препаратов в некоторых ситуациях помогает превзойти результат, достигнутый при приеме любого из них. Один препарат может увеличивать антибактериальную активность другого в отношении определенного микроорганизма, как это происходит, например, в комбинации сульфаниламида с триметопримом. Такое действие можно рассматривать как проявление лекарственного синергизма. К сожалению, он не всегда предсказуем: комбинация препаратов должна быть обоснована лабораторными испытаниями, чтобы ее действие распространялось на определенный штамм данного микроорганизма. Далее в этой главе изложены основные особенности фармакодинамики комбинаций противомикробных препаратов. Наглядным примером синергизма препаратов является лечение комбинацией пенициллина с аминогликозидом вызванного энтерококками (Enterococcus faecalis) инфекционного эндокардита. При использовании пенициллина в качестве средства монотерапии лечение этого заболевания часто оказывается безуспешным.
Динамика взаимодействия противомикробных препаратов in vitro
Проблемы, возникающие при измерении противомикробного эффекта препаратов
Даже будучи технически несложными, химические методы определения концентраций противо-микробиых средств не могут точно отражать антибактериальное действие. Только методы прямой оценки бактериостатической или бактерицидной активности позволяют измерить величину эффектов этих препаратов. Возможно использование не
скольких методов, каждый из которых применим к оценке действия комбинаций препаратов. Результаты одного из этих измерений не обязательно должны совпадать с результатами другого, поскольку различные методы позволяют оценивать разные параметры в изучаемой системе.
А. Бактериостатический эффект. Итоговым результатом исследования является определение минимального количества препарата, необходимого для подавления видимого роста бактерий на данный момент времени.
Б. Бактерицидный эффект, определяемый как скорость гибели микроорганизмов. Степень бактерицидного действия препарата отображает наклон кривой на графике, который показывает связь между количеством видимых выживших микроорганизмов в среде после добавления препарата и временем наблюдения. Это так называемый метод построения кривой “время-гибель” (рис. 52-1).
В. Бактерицидный эффект, определяемый по прекращению гибели микроорганизмов. Результатом является нахождение минимальной концентрации препарата, при которой выживает определенное количество возбудителей (например, <0.1 %) на заданный момент времени, то есть происходит прекращение бактерицидного действия.
Г. Лечебный эффект, определяющийся клиническими исследованиями in vivo. Результаты выражаются в установлении минимальной концентрации препарата, вызывающей у больных или экспериментальных животных полное излечение от инфекции.
Результаты комбинированного применения противомикробных средств
Тип взаимодействия двух антимикробных препаратов можно определить, проанализировав приведенные на рис. 52-1 кривые лекарственной активности. Результаты построения таких кривых (полученных любым методом, описанным в параграфах А-Г) для различных доз каждого из препаратов и их сочетания с использованием определенной популяции микроорганизмов позволяют установить синергизм, суммирование или антагонизм. Эти виды взаимодействия могут иметь место при любой выраженности бактериостатического или бактерицидного эффекта.
I Индифферентность
Часы после инокуляции
Рис. 52-1. Типы взаимодействия противомикробных препаратов, определяемые по бактерицидному эффекту с построением кривой зависимости “время-гибель” микроорганизмов. I — отсутствие взаимодействия (А + Б - Б); II — синергизм (А + Б » А или Б); III — антагонизм (А + В « А)
Индифферентность или суммация эффектов
Чаще всего взаимное влияние отсутствует. Общий эффект препаратов А и Б равен эффекту одного более активного компонента этой комбинации или арифметической сумме эффектов отдельных препаратов в использованных дозах. Такой же эффект мог бы быть получен с помощью одного препарата в дозе, эквивалентной его дозе в комбинации.
Синергизм
Иногда одновременное использование двух препаратов (А + Б) приводит к появлению гораздо более выраженного действия, чем эффект отдельных препаратов А или Б в более высоких дозах, и превышает простое суммирование эффектов этих средств.
Механизм по крайней мере трех типов синергизма противомикробных препаратов достаточно хорошо изучен (глава 42):
А. Нарушение последовательных этапов метаболизма. Лучшим примером является комбинация сульфаниламида и триметоприма. Сульфаниламиды конкурируют с р-аминобензойной кислотой, которая требуется некоторым бактериям для синтеза дигидрофолата. Антагонисты фолата типа триметоприма ингибируют фермент дигидрофолатре-дуктазу, который превращает дигидрофолат в тет
рагидрофолат. Одновременное действие сульфаниламида и триметоприма на последовательные этапы образования тетрагидрофолиевой кислоты и синтеза пуринов и нуклеиновых кислот может сопровождаться более сильным бактериостатическим эффектом, чем при использовании любого из компонентов этой комбинации.
Б. Один препарат ингибирует фермент, который может разрушать второй препарат. Лучший пример такого механизма — неконкурентное ингибирование Р-лактамазы клавулановой кислотой или другими веществами. Продуцирующие Р-лактама-зу микроорганизмы устойчивы к действию пенициллина G, поскольку препарат гидролизуется этим ферментом. Однако при ингибировании р-лактамазы пенициллин G не разрушается и оказывает бактериостатическое или бактерицидное действие. В США доступны комбинации пенициллинов с клавулановой кислотой, сульбактамом или тазобакта-мом (глава 43). Особым вариантом взаимодействия является комбинация имипенема с циластатином: циластатин предотвращает быстрое разрушение имипенема (активного компонента комбинации) дегидропептидазой — ферментом, обнаруженным в клетках почечных канальцев.
В. Один препарат способствует проникновению другого через микробную стенку или клеточную мембрану. Это наиболее распространенный тип синергизма, имеющий большое клиническое значе
ние. Например, для многих стрептококков характерно ограниченное проникновение аминогликозидов. Присутствие препарата, влияющего на клеточную стенку, увеличивает ее проницаемость для аминогликозида, который далее действует на рибосомы и ускоряет гибель клетки. Комбинированное применение противомикробных средств позволяет излечить сепсис или эндокардит, вызванные зеленящим стрептококком, стрептококками группы В и энтерококками группы D, в то время как использование только одного препарата часто оказывается безуспешным.
Антагонизм
Иногда добавление второго препарата уменьшает антибактериальную эффективность первого лекарственного средства, как показано на примере взаимодействия препаратов А и В на рис. 52-1. Этот “антагонизм” может проявляться ослаблением бактериостатического действия или снижением скорости гибели микроорганизмов при использовании комбинации ниже уровня, характерного для одного или каждого из компонентов. Явление антагонизма может иметь место только в том случае, если препараты действуют на способные к размножению микроорганизмы. Оно наиболее заметно при добавлении незначительного количества активного бактериостатического препарата к минимальному количеству второго бактерицидного лекарственного средства. Бактериостатические препараты (тетрациклин, хлорамфеникол, эритромицин и т. д.) приостанавливают рост бактерий; бактерицидные вещества (пенициллины, цефалоспорины или аминогликозиды) для проявления своего действия требуют роста бактериальной клетки (например, процессов синтеза белков или клеточной стенки). Угнетение синтеза белка хлорамфениколом или тетрациклином, действующими на уровне клеточной стенки, определенным образом влияет на выработку некоторых аутолитических ферментов, что имеет важное значение для конечного этапа лизиса клетки. Примером лекарствеНйоЬо антагонизма, причины которого недавно установлены, является сочетанное применение антибиотиков, которые разрушаются Р-лактамазой, в том числе медленно гидролизующихся (например, цефалоспорины третьего поколения), и индукторов р-лактамазы, таких как имипенем, цефокситин, ампициллин или клавула-новая кислота. Эти препараты вызывают индукцию
Р-лактамазы Ричмонда-Сикса типа 1, которая может инактивировать даже цефалоспорины третьего поколения и оказывать антагонистическое действие как in vitro, так и in vivo.
Клинические примеры проявления синергизма или антагонизма противомикробных препаратов
Несмотря на многочисленные наблюдения синергизма и антагонизма противомикробных препаратов in vitro, известно лишь несколько достоверных клинических примеров этого явления (табл. 52-6).
Клинические примеры синергизма
Классическим клиническим примером проявления синергизма антибиотиков является лечение инфекционного эндокардита — заболевания, излечения которого можно добиться лишь путем уничтожения вызвавших его микроорганизмов бактерицидными препаратами. Эндокардит, вызванный энтерококками (Е. faecalis), обычно нельзя вылечить одним пенициллином, так как этот препарат является бактериостатическим, но не бактерицидным для энтерококков. Одновременное назначение пенициллина или ампициллина и аминогликозид-ного антибиотика приводит к резкому повышению бактерицидного действия в отношении многих видов энтерококков (клинический синергизм). Сочетание р-лактамных антибиотиков с аминогликозидами при лечении эндокардита, вызванного стрептококками и стафилококками, также проявляет синергизм, хотя и более слабый. Кроме того, имеются данные о синергическом действии антибиотиков, отобранных с учетом опытов in vitro (обычно р-лак-тамный антибиотик и аминогликозид), при лечении инфекций, вызванных аэробными грамотрицатель-ными палочками, особенно у больных с тяжелой гранулоцитопенией.
Имеются подтвержденные контрольными испытаниями клинические свидетельства того, что сочетание амфотерицина В с флуцитозином оказывается гораздо более эффективным, чем каждый из них отдельно, при лечении криптококкового менингита. Эта комбинация была отобрана на основании подтвержденного in vitro синергизма.
Клинические примеры антагонизма
Воспроизведение антагонизма как in vitro, так и in vivo существенно затруднено фактором частоты введения препарата. Антагонизм легко воспроизводится при однократном введении препаратов животным с экспериментальной инфекцией, но достаточно трудно — при многократном повторении доз. В клинической практике обычным являются назначение избыточно высокой дозы противомикробно-го препарата и многократное введение. Поэтому подтвержденный антагонизм не часто наблюдается в клинической антимикробной терапии. Имеются лишь его немногочисленные зарегистрированные свидетельства. Комбинация пенициллина с хлортетрациклином излечивает меньшее число больных с пневмококковым менингитом, чем те же дозы пенициллина. Аналогичным образом назначение хлорамфеникола в дополнение к ампициллину при бактериальном менингите снижает эффективность терапии по сравнению с использованием одного ампициллина.
Выбор антимикробных комбинаций в клинической практике
Антимикробные комбинации повсеместно используются в клинической практике и часто вполне себя оправдывают (табл. 52-1 и 52-2). Хотя проявления синергизма во многих случаях не являются очевидными, назначение некоторых комбинаций приносит несомненную клиническую пользу. С другой стороны, следует избегать частого использования антимикробных комбинаций, которые не прошли клинических испытаний или, по крайней мере, не изучены in vitro или на животных. Стоимость и токсичность антимикробной терапии прямо пропорциональны числу используемых препаратов. Всякий раз, когда возникает необходимость применения комбинации препаратов и возможно получение клинического микробного изолята, желательно обосновать выбор исследованиями in vitro. Доступность противомикробных средств широкого спектра действия, таких как имипенем и циластатин, цефалоспорины третьего поколения и фторхинолоны, уменьшает потребность в использовании комбинированной терапии.
Противомикробная химиопрофилактика
Химиопрофилактика инфекций — это назначение препаратов для предупреждения инфицирования и развития патогенных микроорганизмов. В более широком смысле она включает также использование препаратов непосредственно после колонизации или внедрения в организм патогенных микроорганизмов, но до развития заболевания.
Несколько главных принципов химиопрофилактики инфекций было разработано после проведения исследований на людях и лабораторных животных.
1. Профилактика должна быть направлена против конкретного возбудителя или определенной группы возбудителей или использоваться для предотвращения инфицирования определенной области. Использование противомикробных препаратов не может устранять все микроорганизмы, заселяющие организм хозяина, и не может предотвращать все типы инфекций.
2. Чем короче продолжительность профилактики, тем шире круг инфекций, которые могут быть предупреждены. Так, предотвращение “всех” инфекций у больных тяжелыми формами лейкозов с использованием химиопрофилактики противомик-робными препаратами широкого спектра действия оказывается успешным только при коротком применении (при длительном использовании развивается устойчивость микроорганизмов), в то время как в отношении стрептококковой инфекции возможна длительная (пожизненная) профилактика.
3. Профилактика оказывается более эффективной и может более широко использоваться в отношении возбудителей, для которых не характерно быстрое развитие лекарственной устойчивости. Возможность проведения достаточно длительной эффективной профилактики с применением пенициллина в отношении стрептококка группы А контрастирует с быстро снижающимся профилактическим эффектом этого препарата в отношении гонококковой инфекции.
4. Профилактическое применение противомикробных препаратов обычно требует таких же доз, как и их терапевтическое использование. Однако поскольку реакция организма больного на процесс колонизации микроорганизмов или на ранние этапы инфекционного процесса может отличаться от
реакции на развившееся заболевание, препараты, эффективные для лечения, могут быть относительно малоэффективными для профилактики, и наоборот. Например, пенициллин высокоэффективен для лечения менингококковой инфекции, но практически неэффективен для профилактики, так как он не устраняет колонизацию носоглотки бактериями. Рифампин имеет высокий профилактический эффект в отношении менингококковых инфекций, однако не рекомендуется для их лечения.
5. Поскольку противомикробная химиопрофилактика имеет определенные отрицательные моменты (высокая стоимость препаратов, появление токсических эффектов, возникновение суперинфекции и развитие устойчивых микроорганизмов), она должна использоваться только в таких ситуациях, где ее эффективность была ранее подтверждена.
Рекомендуемые схемы профилактики при нехирургических инфекциях приведены в табл. 52-7. За исключением профилактики эндокардита при некоторых хирургических вмешательствах, эффективность этих мер подтверждена соответствующими клиническими исследованиями. Предупреждение развития эндокардита профилактическим применением препаратов в настоящее время практикуется настолько широко, что соответствующие контрольные наблюдения практически невозможны. Данные, свидетельствующие в пользу такой практики, получены при ретроспективном изучении клинических случаев, а также в экспериментах с использованием моделей эндокардита на животных. В табл. 52-7 не отражены многочисленные клинические ситуации, в которых антимикробная химиопрофилактика оказывается неэффективной: сердечная недостаточность, вирусные инфекции верхних дыхательных путей, коматозные состояния и т. д.
В хирургии противомикробные препараты назначают при предоперационной подготовке больного для предотвращения послеоперационных инфек
ционных осложнений. Указанные общие принципы химиотерапии распространяются и на хирургическую практику, хотя в этом случае имеются некоторые важные дополнительные принципы предупреждения послеоперационных инфекций.
1. Противомикробный препарат должен быть активным в отношении большинства микроорганизмов, которые могут вызвать послеоперационную инфекцию.
2. Химиопрофилактику следует начать накануне (не менее чем за 1-2 часа) проведения хирургической операции и продолжить не позднее чем через 12-24 часа после операции. Имеются убедительные свидетельства максимальной пользы однократного назначения противомикробного препарата перед операцией. Во время зашивания хирургической раны в нее необходимо ввести активный противомикробный препарат.
3. Противомикробный препарат должен быть нетоксичным и недорогим. Не следует выбирать тот препарат, который используется для лечения тяжелых инфекций.
4. Химиопрофилактика показана при таких хирургических вмешательствах, где частота инфицирования раны (при оптимальных условиях) составляет 5 % или более, за исключением операций с имплантацией инородного тела, при которых она используется обязательно. Наиболее распространенные показания для проведения химиопрофилактики в хирургической практике приведены в табл. 52-8.
Для однократной химиопрофилактики при хирургических вмешательствах предложен целый ряд цефалоспоринов второго и третьего поколения. Однако доказательств их более высокойэффектив-ности по сравнению с однократным назначением цефазолина нет. Использование с этой целью цефалоспоринов третьего поколения под вопросом, так как их применение противоречит нескольким указанным выше принципам, особенно третьему.
ТАБЛИЦА 52-7. Нехирургическая противомикробная профилактика с документально подтвержденной эффективностью
или обычно использующаяся
Предупреждаемые заболевания или инфекции ! Субъекты профилактики Препараты и дозы для взрослых Продолжитель- I ность профи- Е лактики Подтвержден (ая эффектиЕ ность 1- Комментарии !-
Инфекция, визы- 1. Имевшая место ранее 1. Бензатин пеницил- 1.В случае рев- Высокая Не предупреждает разви-
ваемая стрептококками группы А (постстрептококковые осложнения: ревматическая лихорадка или гломерулонефрит) ревматическая лихорадка или диагностированное ревматическое заболевание сердца 2. Эпидемия стрептококкового импетиго лин, 1.2 млн ЕД Внутримышечно один раз в месяц 2. Пенициллин G, 125 мг два раза вдень 3. Сульфадиазин, 1 г вдень матизма профилактика должна проводиться пожизненно 2. В случае импетиго — до прекращения эпидемии (= 95 %) тия эндокардита
Менингококковая Лица, находящиеся в 1. Рифампин, 20 мг/кг Рифампин и суль- Высокая Возможные проблемы:
инфекция тесном контакте с заболевшим (семья, сексуальные партнеры, обслуживающий персонал и т. п.) один раз в день 2. Миноциклин, 100 мг два раза в день 3. Сульфизоксазол, 1 г два раза в день (при чувствительности микроорганизма) фаниламид, 2 дня. Миноциклин, 5 дней (= 80-90%) 1. Устойчивость к рифампину при широком использовании 2. При использовании миноциклина возможны головокружения
Инфекции, вызываемые Haemophilus influenzae Те же, что и при менингококковой инфекции, но в наиболее восприимчивом к этой инфекции возрасте (< 5-7 лет) Рифампин, 20 мг/кг (максимальная доза 600 мг) один раз вдень 4 дня Хорошая Нет единого мнения о необходимости использования. Отмечалось появление лекарственной устойчивости
Туберкулез 1. Лица, находящиеся в тесном контакте (в дополнение к туберкулиновой пробе) 2. Лица с изменившейся туберкулиновой пробой 3. Положительная тубер-кулиновая проба в группах высокого риска (дети и др.) Изониазид (ГИНК), 300 мг/день 6 месяцев Высокая (около 80 %) Определить группу высокого риска сложно. См. American Thoracic Society guidelines для уточнений
Глава 52. Клиническое использование противомикробных средств
Предупреждаемые заболевания или инфекции ! Субъекты профилактики Препараты и дозы для взрослых Продолжитель- Подтвержден- Комментарии ность профи- ная эффектив-
лактики ность
Чума Тесные контакты Тетрациклин, 500 мг два раза в день В течение одной недели после контакта Хорошая
Гонорея Сифилис 1. Контакт с больным 2. Все новорожденные Контакт с больным 1. Как при лечении гонореи 2. Закапывание в глаза раствора нитрата серебра или антибиотика Бензатин пенициллин, 2.4 млн ЕД. Внутримышечно Однократно Однократно Высокая В США профилактика предусмотрена законом Высокая (практи- чески 100%)
Инфекция, вызываемая токси-генной £ со// Лица, попадающие из неэндемичной зоны в эндемичные зоны Эффективны многие препараты. Наиболее популярны фторхинолоны В течение всего периода нахождения в эндемичной зоне Хорошая Нет единого мнения о необходимости использования. Неэффективна в случае устойчивых к лекарствам разновидностей
Риккетсиозы Нахождение в эндемичной зоне (например, сыпной тиф) Тетрациклин(или хлорамфеникол), 1 г/день Все время нахождения в эндемичной зоне Хорошая Возможно распространение инфекции при прекращении профилактики
Малярия Нахождение в эндемичной зоне Хлорохин фосфат, 500 мг в неделю Все время нахождения Высокая 1. Неэффективна в случае хлорохинрезистентного Plasmodium falciparum 2. Возможно распространение инфекции при прекращении профилактики
Грипп типа А Нахождение в эпидемическом очаге или контакт с больным при подтвержденном диагнозе Амантадин, 100 мг два раза в день Все время контакта Хорошая Нет единого мнения о необ-(около ходимости использова- 80 %) ния. Доза 100 мг в день может быть достаточной
Пневмония, вызванная микоплазмой Контакт с больным Тетрациклин, 500 мг 4 раза в день 1 неделя Низкая Нет единого мнения о необходимости использования
348 __________Раздел VIII. Химиотерапевтические средства
Предупреждаемые Субъекты Препараты и дозы Продолжитель- Подтвержден- Комментарии ность профи- ная эффектив-
заболевания или инфекции профилактики для взрослых
лактики ность
Инфекция, вызванная Pneumocystis carinii Африканский трипаносомоз Лица с высоким риском Триметоприм, 5 мг/кг (высокие дозы корти- в сутки (вместе с костероидов, СПИД и сульфаметоксазо- т. п.) лом в определен- ном соотношении) Проживающие в энде- Пентамидин, 3 мг/кг мичной зоне внутримышечно каж- дые 3-6 месяцев Не определена. Вероятно, в течение опасного периода Время проживания в зоне Высокая Хорошая Нет единого мнения о необходимости использования. Альтернативной мерой является применение аэрозоля пентамидина
Эндокардит(эн- Лица с пороками сер- Перед стоматологи- Однократно в Нет Для урологических или гас-
доваскулит) Средний отит дечных клапанов (вы- ческой процедурой: сокийрискэндокарди- амоксициллин, 3 г та) или лица с внутри- внутрь за 1 час до сосудистыми устрой- процедуры и 1.5 г че-ствами при предстоя- рез 6 часов; или щих процедурах, кото- клиндамицин, 300 мг рые могут вызвать бак- внутрь за 1 час до териемию и увеличи- процедуры и 150 мг вают риск развития эн- через 6 часов докардита (например, экстракция зуба) Лица с рецидивами Ампициллин, сульфасреднего отита ниламиды или три- метоприм-сульфаметоксазол каждом случае Около 1 года данных Хорошая троэнтерологических процедур: ампициллин, 2 г внутривенно, или ванкомицин, 1 г внутривенно + гентамицин, 1.5 мг/кг за 30-60 минут до процедуры, после — амоксициллин, 1,5 г через 6 часов
Раны от укусов При укусах людей, Ампициллин или тетракошек, иногда других циклин, 0.5 г 4 раза в животных (например, день верблюда, гориллы) 3-5 дней Достаточная Требуется тщательное обследование несмотря на профилактику
Инфекции мочевыводящих путей Лица с рецидивирующи- Триметоприм-сульфа-ми формами инфек- метоксазол, 1 таб- ций мочевыводящих летка 2 раза в неде- путей лю. Нитрофуранто- ин, 50 мгвдень 1. Длительность не определена 2. После коитуса (в случае посткоитальной инфекции в анамнезе) Высокая Может заменить непосредственное эмпирическое лечение каждого обострения при длительной профилактике
w
<о
Предупреждаемые Субъекты Препараты и дозы Продолжитель- Подтвержден- Комментарии
заболевания или инфекции профилактики для взрослых ность профи- наяэффектив-лактики ность
Обостряющийся Лица с сезонными обо- Тетрациклин, 0.5 г Во время осенне- Хорошая В целом не рекомендуется,
хронический бронхит стрениями хроничес- два раза в день кого бронхита в осенне-зимний период зимнего периода эмпирическое лечение каждого обострения вызывает меньше токсических реакций и более эффективно
Инфекции у лиц с Больные с тяжелой лей- 1. Перорально, невса- Длительность Варна- Обычно не рекомендуется.
иммунодефицитом копенией (число гра- сывающиеся проти- нулоцитов < 500/мкл) вомикробные препа- раты (различные схемы) 2. Триметоприм-сульфаметоксазол внутрь 3. Фторхинолон внутрь лейкопении бельна Требуемые дополнительные меры: ламинарная подача воздуха, стерильное больничное оборудование, стерилизация пищи и т. п.
По: Conte-J. Е. Jr., Sweet R. W. Infectious Diseases in Clinical Practice. University of California, San Francisco, 1982.
Раздел VIII. Химиотерапевтические средства
ТАБЛИЦА 52-8. Хирургическая противомикробная профилактика с документально подтвержденной эффективностью или обычно использующаяся1
Заболевание Обычно Наблюдавшаяся Комментарии
или операция использующиеся препараты эффективность
Пищевод и желудок Цефалоспорин2 Хорошая Необходима, если имеет место разви-
тие бактериальной флоры (в норме достаточно скудной) при раковых заболеваниях, обструкции или при других заболеваниях
Кишечник и прямая кишка
Элективная операция Перорально, плохо всасывающиеся противо-микробные препараты (например, эритромицин + неомицин)и механическая подготовка кишечника Хорошая Пример непродолжительной “стерилизации” нормальной флоры для предупреждения развития инфекции. Дополнительное использование системных противомикробных препаратов не улучшает показатели
Перфорация Только цефокситин; клиндамицин + гентамицин (табл. 52-2) Хорошая Вероятно, не должна рассматриваться как истинная профилактика, поскольку имеет место большое загрязнение брюшины фекальными массами
Желчные пути Цефалоспорин2 Хорошая Показана
Гистерэктомия
Вагинальная Цефалоспорин2 Хорошая Показана
Обычная абдоминальная Цефалоспорин2 Достаточная Нет единого мнения
Радикальная Различные Достаточная Вероятно показана
Кесарево сечение Цефалоспорин2 Хорошая Вводят после наложения швов
Имплантация искусственных суставов Цефалоспорин2 Хорошая Наиболее полезна, если операционная не оборудована устройством для ламинарной подачи воздуха
Открытые переломы Цефалоспорин2 Хорошая Вероятно, не должна рассматриваться как истинная профилактика, поскольку рана часто значительно загрязнена
Замена сердечных клапанов Цефалоспорин2 От удовлетворительной до низкой Очень распространена, контрольные наблюдения недоступны
' По: Conte J. Е. Jr., Sweet R. W. Infectious Diseases in Clinical Practice. University of California, San Francisco, 1982.
2 Цефалоспорины первого поколения, такие как цефвпирин, цефалотин, цефазолин. Предпочтителен цефвзолин. Длительное время полувыведения из плазмы и возможность внутримышечного введения делают данный препврат наименее затратным из всей группы.
Основные принципы химиотерапии паразитарных 53 заболеваний
Чинг Чанг Ванг
В общенаучном смысле термин "паразит" распространяется на всех известных возбудителей инфекционных заболеваний: бактерии, грибы, простейшие и гельминты. В данной и двух последующих главах этот термин используется для обозначения простейших и гельминтов. Подсчитано, что в мире паразитарными заболеваниями страдает три миллиарда человек и гораздо большее количество домашних и диких животных. Несмотря на повсеместную распространенность этих заболеваний, их лечению не уделяется достаточного внимания.
Теоретически лечение паразитарных инфекций должно быть относительно простым, поскольку почти во всех случаях известны этиологические факторы. Кроме того, недавние достижения в области разработки методов клеточных культур сделали возможным культивирование in vitro многих распространенных паразитов. Эти методы не только опровергли традиционные представления о том, что выживание паразитов однозначно зависит от жизнедеятельности организма хозяина, но также позволили изучить возбудителей паразитарных инфекций с использованием подходов, которые применяются при исследованиях бактерий, включая биохимические, молекулярно-биологические и иммунофармаколо-гические. Однако прежде чем станут доступными эффективные химиотерапевтические средства для лечения большинства паразитарных заболеваний, необходимо решить еще многие проблемы.
Цели химиотерапевтического воздействия
Рациональный подход к противопаразитарной химиотерапии требует сравнительных биохимических и физиологических исследований хозяина
и паразита для выявления различий в процессах, существенных для этих организмов, что позволит избирательно угнетать жизнедеятельность паразита, но не хозяина. Можно было бы ожидать, что в организме паразита в связи с приспособлением к паразитическому образу жизни отсутствуют многие метаболические процессы, присущие организму хозяина. Действительно, это предположение оказывается верным для многих возбудителей паразитарных заболеваний. Для выживания паразита обычно необходимо наличие сверхупрощенных метаболических путей, что и является его “уязвимым местом”. Однако это не единственная точка приложения лекарственного воздействия. Хотя паразит живет в метаболически комфортных условиях и может стать “ленивым”, его окружение не вполне дружественно, что вынуждает его иметь механизмы защиты для выживания, например защиту против иммунологического нападения, протеолитического переваривания хозяином и т. п. В некоторых случаях необходимые паразиту питательные вещества не поступают от хозяина, хотя последний получает их с пищей. В такой ситуации у паразита вырабатывается необходимая для выживания способность синтезировать эти продукты. Наконец, большая эволюционная дистанция между хозяином и паразитом часто определяет существенные индивидуальные различия их ферментов и метаболических путей, что делает возможным достаточно избирательное угнетающее воздействие на паразита. Итак, имеются три основные мишени для химиотерапии паразитарных заболеваний: 1) уникальные ферменты, найденные только у паразита; 2) ферменты, имеющиеся как у хозяина, так и у паразита, но являющиеся жизненно необходимыми только для паразита; 3) общие
ТАБЛИЦА 53-1. Мишени химиотерапевтического воздействия у паразитов
Мишень Паразиты Ингибиторы
Уникальные паразитарные ферменты Ферменты синтеза дигидроптероата Пируват:ферродоксиноксидоредуктаза Нуклеозидфосфотрансфераза Трипанотионредуктаза Класс Споровики Анаэробные простейшие Жгутиковые простейшие Кинетопластиды Сульфоны и сульфаниламиды Нитроимидазолы Аллопуринола рибозид и формицин В Меларсопрол В и нифуртимокс
Жизненно необходимые для паразитов Пуринфосфорибозилтрансфераза Орнитиндекарбоксилаза Гликолитические ферменты ферменты Простейшие Простейшие Кинетопластиды Аллопуринол а-Дифторметилорнитин Глицерин + салицилгидроксамовая кислота и сурамин
Общие биохимические механизмы, различающиеся фармакологической чувствительностью Транспортер тиамина Кокцидии Ампролиум Митохондриальный транспортер злект- Кокцидии 4-Гидроксихинолины ронов Микротрубочки Гельминты Бензимидазолы Нервная синаптическая передача Гельминты и эктопаразиты Левамизол, пиперазин, милбемици- ны, авермектины
для хозяина и паразита биохимические процессы, которые, однако, различаются по чувствительности к фармакологическим препаратам. Примеры специфических мишеней и действующих на них препаратов представлены в табл. 53-1. В данной главе обсуждаются механизмы противопаразитар-ного действия указанных средств, а также приводится основополагающая информация по препаратам, описанным в главах 54 и 55.
Ферменты, имеющиеся только у паразитов
На первый взгляд, эти ферменты должны быть самыми подходящими мишенями для действия химиотерапевтических средств. Как в случае ферментов, участвующих в синтезе клеточной стенки бактерий (глава 42), их угнетение не должно оказывать никакого влияния на организм хозяина. К сожалению, у паразитических простейших обнаружено лишь несколько таких ферментов. Кроме того, возможность направленного химиотерапевтического воздействия иногда ограничивается развитием лекарственной устойчивости возбудителя. Рассмотрим подробнее примеры наиболее важных ферментов-мишеней.
Ферменты синтеза дигидроптероата
Такие внутриклеточные спорозоитобразующие паразиты, как Plasmodium, Toxoplasma и Eimeria, длительное время считались чувствительными к сульфаниламидам и сульфонам. В связи с этим предполагали, что их спорозоиты для выживания должны синтезировать свой собственный фолат. В бесклеточных экстрактах возбудителя малярии грызунов Plasmodium chabaudi была воспроизведена реакция связывания 2-амино-4-гидрокси-6-гид-роксиметилдигидроптеридина дифосфата ир-ами-нобензоата с образованием 7,8-дигидроптероата. Идентифицированы, изолированы и очищены также 2-амино-4-гидрокси-6-гидроксиметилдигидро-птеридинпирофосфокиназа и 7,8-дигидроптероат-синтетаза. В качестве конкурентных ингибиторов р-аминобензоата в этой реакции выступают сульфатиазол, сульфагуанидин и сульфаниламид. Выявить наличие дигидрофолатсинтетазной активности у возбудителя малярии не удалось, что позволило сделать предположение о замещении у него роли дигидрофолата 7,8-дигидроптероатом. Подобным образом было установлено отсутствие системы распознавания фолата как субстрата для дигидрофолатредуктазы у паразита цыплят, Eimeria tenella.
Однако невозможность утилизации экзогенного фолата не может полностью объяснить обязательный характер синтеза 7,8-дигидроптероата у Plasmodium, Toxoplasma и Eimeria. Известно, что большинство молекул фолата в цитоплазме клеток млекопитающих связано с полиглутаматами и с трудом проходит через клеточные мембраны. Этот дополнительный фактор может затруднять получение паразитом 7,8-дигидроптероата или дигидрофолата и делает все ферменты, участвующие в их синтезе, потенциальными мишенями противоспорозо-итной химиотерапии.
Сульфоны и сульфаниламиды обладают синергизмом по отношению к ингибиторам дигидрофо-латредуктазы, их комбинации оказываются эффективными для лечения малярии, токсоплазмоза и кокцидиоза. Несмотря на встречающиеся случаи лекарственной устойчивости, особенно среди кок-цидий, эти комбинации с успехом применяют при малярии и токсоплазмозе. Фансидар, представляющий собой комбинацию сульфадоксина и пириметамина, успешно используют для лечения малярии, вызванной некоторыми разновидностями хло-рохинрезистентных штаммов Plasmodium falciparum (глава 54).
Фармакологические свойства паразитарных 7,8-дигидроптероатсинтетаз могут отличаться от свойств бактериальных ферментов. Так, метахло-ридин и 2-этокси-р-аминобензоат неэффективны в отношении чувствительных к сульфаниламидам бактерий, но первый препарат обладает противомалярийной активностью, а второй эффективен при инфекции цыплят, вызываемой Eimeria acervulina. В обоих случаях действие обратимо с помощью р-аминобензоата.
Пируват:ферредоксиноксидоредуктаза
Некоторые анаэробные паразитические простейшие не имеют митохондрий и митохондриального синтеза АТФ. Вместо этого они обладают ферредоксин- или флаводоксинподобными белками транспорта электронов с низким редокс-потенциа-лом, участвующими в превращении пирувата в аце-тил-КоА. У трихомонад и паразитических инфузорий рубца жвачных животных этот процесс протекает в окруженной мембраной органелле, называемой гидрогеносомой. Там под действием пиру-ват:ферредоксиноксидоредуктазы и гидрогеназы в анаэробных условиях образуется Н2, который яв
ляется главным переносчиком электронов. Хотя Entamoeba spp. и Giardia lamblia не имеют гидроге-носом, из Entamoeba histolytica был выделен ферредоксин, а у G. lamblia методом электронного парамагнитного резонанса обнаружены железосеросодержащие и флавиновые центры.
У млекопитающих пируват:ферредоксиноксидо-редуктаза не найдена. В отличие от характерного для них пируватдегидрогеназного комплекса, пиру-ват:ферредоксиноксидоредуктаза из-за низкого окислительно-восстановительного потенциала (приблизительно -400 мВ) не способна восстанавливать пиридиновые нуклеотиды. Однако его достаточно для перемещения электронов от пирувата к нитрогруппам метронидазола и других производных 5-нитроимидазола, что приводит к образованию цитотоксических восстановленных соединений, связывающихся с ДНК и белками. Это явление, очевидно, объясняет высокую чувствительность анаэробных видов простейших к препаратам типа метронидазола. Несмотря на появившиеся недавно сообщения о лекарственной устойчивости у Trichomonas vaginalis и на вероятность канцерогенного действия метронидазола (глава 54), он остается препаратом выбора для лечения анаэробных протозойных паразитарных инфекций.
Нуклеозидфосфотрансферазы
Все протозойные паразиты, изученные к настоящему времени, не способны синтезировать пуриновые нуклеотиды de novo. Для выживания и роста в их метаболизме используются различные обходные пути пуринового обмена. У видов Leishmania был идентифицирован уникальный фермент — фосфотрансфераза пуриновых нуклеозидов (пурин-нуклеозидфосфотрансфераза), который может переносить фосфатную группу от различных моно-фосфатных эфиров, включая р-нитрофенилфосфат, в положение 5' пуриновых нуклеозидов. Этот фермент фосфорилирует и такие аналоги пуриновых нуклеозидов, как аллопуринола рибозид, форми-цин В, 9-деазаинозин и тиопуринола рибозид, превращая их в соответствующие нуклеотиды. Нуклеотиды в дальнейшем преобразуются в трифосфаты и в конечном итоге включаются в нуклеиновую кислоту Leishmania (рис. 53-1) или ингибируют другие ферменты, участвующие в метаболизме пуринов. В соответствии с этим аллопуринола рибозид, формицин В, 9-деазаинозин и тиопуринола
рибозид действуют как мощные противолейшма-ниозные агенты как in vitro, так и in vivo. Особенно интересен аллопуринола рибозид, поскольку он практически не оказывает токсического действия на хозяев паразитарной инфекции — млекопитающих. В настоящее время это вещество проходит клинические испытания как средство для лечения лейшманиоза (Saenz, 1989).
У трихомонад обнаружен недостаток синтеза de novo и пуринов, и пиримидинов, поэтому необходимы источники пополнения и тех, и других соединений. Для Trichomonas foetus (паразит коров), Т. vaginalis и G. lamblia характерна также недостаточность дигидрофолатредуктазной и тимидилатсинтетазной активности, что позволяет им нормально расти в присутствии 0.5 ммоль/л метотрексата, являющегося наиболее мощным антифолатным препаратом. Такой метаболический дефицит компенсируется появлением пути получения тимидин-5'-монофосфата (ТМФ), обособленного от синтеза остальных пиримидиновых рибонуклеотидов. ТМФ образуется из экзогенного тимидина при участии тимидинфосфотрансферазы (рис. 53-2).
Активность этого фермента не изменяется ингибиторами тимидинкиназы типа ацикловира, но снижается под действием гуанозина или 5-фторде-зоксиуридина. Оба эти вещества угнетают рост паразитов in vitro. Таким образом, тимидинфосфотрансфераза может служить объектом химиотерапевтического воздействия при анаэробных протозойных инфекциях. Возможно, определенную перспективу имеет использование не только ингибиторов тимидинфосфотрансферазы, но и ложных субстратов; в обоих случаях должно происходить угнетение синтеза ДНК паразитов.
Трипанотионредуктаза
Необычным свойством некоторых простейших (кинетопластид) является то обстоятельство, что значительная часть их внутриклеточного спермидина и глутатиона представлена в виде уникального конъюгата №-Ы8-(глутатионил)спермидина, который называется трипанотионом. Кинетопласти-ды не имеют ни глутатионредуктазы, ни глутатионпероксидазы для поддержания внутриклеточных тиолов в восстановленном состоянии и удаления перекиси водорода, поэтому трипанотион играет главную роль в защите этих паразитов от окислительного повреждения, а трипанотионредуктаза
является одним из необходимых ферментов для их выживания. Мощным ингибитором трипанотион-редуктазы является нифуртимокс (производное нитрофурана), эффективный при болезни Шагаса, вызываемой Trypanosoma cruzi. В настоящее время изучаются и другие ингибиторы (Jockers-Scherubl, 1989). Соединения трехвалентного мышьяка, оказывающие противотрипаносомное действие, захватываются возбудителем африканского трипаносомоза Trypanosoma brucei и секвестируют трипанотион, что также эффективно блокирует активность трипанотионредуктазы.
Ферменты, жизненно необходимые только для паразитов
Поскольку для паразитов характерно отсутствие многих метаболических процессов, у них имеются ферменты, необходимые только для их выживания и не являющиеся таковыми для хозяина. Наличие альтернативных метаболических процессов в организме хозяина (множественность путей) открывает возможности для противопаразитарной химиотерапии.
Пуринфосфорибозилтрансферазы
Отсутствие у протозойных паразитов и у трематоды Schistosoma mansoni синтеза пуриновых нуклеотидов de novo делает незаменимой гипоксантин-гуанин-фосфорибозилтрансферазу для их жизнедеятельности. У четырех разновидностей Leishmania, Plasmodium bergfiei, Е. tenella, Т. foetus, S. mansoni, Crithidia fasciculata и, возможно, у других организмов для синтеза пуриновых нуклеотидов необходим гипоксантин. Паразитарная гуанин(гипоксантин)-фосфорибозилтрансфераза обладает необычной субстратной специфичностью (рис. 53-1). Leishmania donovani и Trypanosoma cruzi могут использовать в качестве субстрата аллопуринол (глава 35) для образования аллопуринола рибозида, который после аминирования и превращения в трифосфат включается в состав РНК. Такая аномальная РНК неспособна поддерживать нормальный рост паразита (рис. 53-1). Так как аллопуринол не является подходящим субстратом для гуанин(гипоксантин)-фосфорибозилтрансферазы млекопитающих, in vivo он оказывает избирательное противолейшманиоз-
НО ОН
Аллоаденозин-5’-трифосфат
АНОМАЛЬНАЯ РНК
Рис. 53-1. Метаболизм аллопуринола и аллопуринола рибозида у Leishmania и человека. (PRPP — фосфорибозилпирофосфат; PPj — неорганический пирофосфат; ХРО< — донор фосфата.)
А РНК
ТРИХОМОНАДА Обособленные пути
Фосфотрансфераза
Цитидин
Уридин
Р|
Аспартат
Рис. 53-2. Метаболизм пиримидинов у Trichomonas vaginalis (А) и у человека (Б). Обратите внимание на то, что у человека имеются множественные источники тимидинмонофосфата (ТМФ) — важного предшественника в синтезе ДНК Паразит же имеет только один источник. (УТФ, УД Ф, УМФ, ЦТФ и т. п. — соответственно уридинтрифосфат, уридиндифосфат, уридинмонофосфат, цитидин трифосфат и т. п.; PRPP — фосфорибозилпирофосфат; Pi — неорганический фосфат.)
ное и противотрипаносомное действие. Еще один специфичный для L. donovani фермент, а именно ксантинфосфорибозилтрансфераза, отсутствующий у млекопитающих, также может быть мишенью для противолейшманиозной химиотерапии.
G. lamblia имеет чрезвычайно простую систему обеспечения пуринами. Этот паразит обладает только двумя основными ферментами — аденин- и гуанинфосфорибозилтрансферазами, которые превращают экзогенные аденин и гуанин в соответствующие нуклеотиды. У него нет никаких обходных путей для использования гипоксантина, ксантина или пуриновых нуклеозидов, а также возможностей взаимной конверсии между адениловыми и гуаниловыми нуклеотидами. Поэтому для выживания и развития G. lamblia весьма существенны функции двух фосфорибозилтрансфераз (рис. 53-3). Гуанин-фосфорибозилтрансфераза настолько специфична, что не может использовать гипоксантин, ксантин или аденин в качестве субстрата. Высокая субстратная специфичность отличает фермент Giardia от фермента млекопитающих, катализирующего также превращение гипоксантина в ИМФ, и бактериального фермента, который может использовать как субстрат ксантин. Это позволяет создать высокоспецифичный ингибитор фермента G. lamblia.
Орнитиндекарбоксилаза
Полиамины, имеющиеся почти во всех живых организмах, необходимы для клеточной пролиферации и дифференциации. Орнитиндекарбоксилаза — фермент, катализирующий образование полиамина путресцина во многих эукариотических клетках — характеризуется быстрой индукцией и очень коротким временем полусуществования. У многих видов трипаносом основной пул плиами-нов формируют путресцин и спермидин, которые быстро синтезируются из орнитина. При инфицировании животных возбудителем африканского трипаносомоза хороший терапевтический эффект давал а-дифторметилорнитин (ДФМО), обладающий противоопухолевой активностью и являющийся, вероятно, ингибитором орнитиндекарбоксилазы. Это соединение в настоящее время стало доступным для клинического применения; выявлено его положительное лечебное действие при инфекции, вызванной Trypanosoma brucei gambiense.
ДФМО опустошает внутриклеточные запасы полиаминов у Т. brucei, а его действие устраняется пут
ресцином, что объясняется характером влияния препарата на орнитиндекарбоксилазу паразита. Так как в крови млекопитающих полиамины содержатся в небольшом количестве (благодаря высокой активности полиаминоксидазы), действие ДФМО на циркулирующие там трипаносомы необратимо. Таким образом, избирательность токсического эффекта Д Ф МО в отношении возбудителя африканского трипаносомоза определяется прежде всего тем, что он паразитирует в крови млекопитающих. Физиологическим следствием этого действия является изменение формы паразитарной клетки: длинная и тонкая Т. brucei превращается в короткую и толстую, потерявшую способость к делению. Эта неделящаяся форма, очевидно, не может изменять конфигурацию своей гликопротеидной клеточной оболочки и в конечном счете элиминируется иммунной системой хозяина. Несмотря на более высокий аффинитет препарата к орнитиндекарбоксилазе млекопитающих, он менее токсичен для хозяина, что обусловлено более быстрым кругооборотом и восполнением у млекопитающих необратимо ингибированного фермента.
Гликолитические ферменты
У циркулирующей в крови Trypanosoma brucei brucei единственная митохондрия редуцирована до так называемого “периферического канала”, не имеющего ни цитохрома, ни функциональных ферментов цикла Кребса. Единственным источником АТФ для нее является гликолиз. В аэробных условиях одна молекула глюкозы может образовывать только две молекулы АТФ, выделяя в качестве конечного продукта две молекулы пирувата в кровоток хозяина. Этот низкий энергетический выход обусловливает чрезвычайную активность гликолиза у Т. b. brucei для обеспечения деления трипаносомы с частотой один раз каждые 7 часов. Высокая скорость гликоза, которая в 50 раз превышает скорость этого процесса у млекопитающих, определяется не только возможностью избыточной поставки глюкозы из крови хозяина, но и концентрированием большинства гликолитических ферментов паразита в окруженных мембраной микротельцах (органеллах), гликосомах (рис. 53-4). Так как у паразита нет лактатдегидрогеназы, регенерация НАД из НАДН в гликосоме при гликолизе зависит от работы челночного механизма дигидроксиацетонфосфат:глицерол-3-фосфат + глицерол-3-фосфатоксидаза. В анаэроб-
Giardia
Обособленные пути
АТФ ГТФ
к к
1
АДФ ГДФ
L к
АМФ ГМФ
Фосфорибозил-трансферазы
Аденин Гуанин
АТФ
ЧЕЛОВЕК Множественные пути
Рис. 53-3. Метаболизм пуринов у Giardia lamblia (А) и у человека (Б). G. lamhlia не имеет ферментов для синтеза de novo необходимых пуриновых нуклеотидов и для их взаимного превращения. (АМФ, ГМФ, ИМФ и т. п. — аденозинмонофосфат, гуанозинмонофосфат, инозинмонофосфат и т. п.; ФРП-фосфат — фосфорибозилпирофосфат)
Глюкоза АТФ -^1 АДФ<-^
Глюкозо-6-фосфат
ГЛИКОСОМА |
Фруктозо-6-фосфат
Салицилгидроксамовая кислота
МИТОХОНДРИЯ
) 1 1/гОг
|Дегидрогеназный е~ Терминальная S
| компонент оксидаза
Н2О
компонент
Глицерофосфатоксидаза
АТФ ->1
АДФ-е-^ Фруктозо-1,6-дифосфат
Глицеральдегид-3-.<—>. Дигидрокси-фосфат ацетонфосфат
у— НАД+
> НАД.Н z4-!
1,3-дифосфоглицери- Глицерол-3—* новая кислота фосфат
3-фосфоглицери- Глицерин Х' новая кислота_________________/
З-Фосфо^лицери- 2-фосфоглицери-новая кислота новая кислота
ЦИТОПЛАЗМА
АДФ АТФ
Фосфоенол-пируват
Пируват
Рис. 53-4. Гликолитические пути у циркулирующей в крови формы Tripanosoma brucei brucei (длинной, тонкой). Главная точка ингибирующего действия трипаноцидных препаратов указана жирной стрелкой. (Из: Fairlamb А. Biochemistry of trypanosomiasis and rational approaches to chemotherapy. Trends Biochem. Sci. 1982; 7:249.)
ных условиях глицерол-3-фосфат не может снова окисляться в дигидроксиацетонфосфат и накапливается внутри гликосомы. Это накопление вместе с накоплением АДФ из-за истощения пула НАД в конечном итоге приводит к обращению глицеролкиназной реакции в гликосоме и к наработке глицерина и АТФ. Таким образом, при отсутствии кислорода Т. b. brucei производит только одну молекулу АТФ из каждой молекулы глюкозы и в качестве конечных продуктов выделяет эквимолярное количество пирувата и глицерина.
Эта сбалансированная и жизненно необходимая для паразита гликолитическая система является привлекательной целью для антитрипаносомной химиотерапии. Выявлено, что паразитарную глице-рол-3-фосфатоксидазу может угнетать салицилгидроксамовая кислота, переводя Т. b. brucei в анаэробные условия. Далее гликолиз можно заблокировать ингибированием обратимой глицеролкиназной реакции при добавлении глицерина. Эта комбинация (салицилгидроксамовая кислота + глицерин) вызывает лизис циркулирующей в крови формы африканской трипаносомы in vitro в пределах несколь
ких минут и очень эффективно устраняет парази-темию у инфицированных животных.
Мишенями для противотрипаносомной терапии могут также являться системы, участвующие в гли-косомном биогенезе. Препарат сурамин (мол. м. 1429) содержит шесть отрицательно заряженных сульфонильных групп. Благодаря их наличию препарат легко связывается с некоторыми основными аминокислотами, входящими в состав нескольких важных гликосомальных ферментов, что нарушает транспорт ферментов в гликосому и функции гликосомы.
Общие биохимические функции у паразита и хозяина с разным ответом на фармакологическое воздействие
В паразите эти функции достаточно дифференцированы, чтобы послужить возможными мишенями противопаразитарной химиотерапии, но не в результате самой природы паразитического существо
вания, а скорее, как следствие длинной эволюционной дистанции, разделяющей паразита и хозяина. Поэтому такие мишени трудно выявить, изучая метаболические дефициты паразита или его специфические питательные запросы. Они обычно обнаруживаются при исследовании механизмов действия уже известных противопаразитарных средств. Мишенью для таких препаратов, как правило, является не отдельный строго определенный фермент, а специфические процессы, существенные для выживания паразита, например транспортные вещества, рецепторы, структурные компоненты клеток и т. п.
Транспортер тиамина
У кокцидий главным источником энергии является обмен углеводов. Недостаточное поступление тиамина, рибофлавина или никотиновой кислоты (основных кофакторов углеводного обмена) приводит к подавлению паразитарной инвазии цыплят Е. tenella и Е. acervulina. Аналог тиамина ампроли-ум(1-[(4-амино-2-пропил-5-пиримидинил)метил]-2-пиколиниум хлорид) длительное время используется как эффективное и относительно низкотоксичное для хозяина противококцидийное средство у цыплят и рогатого скота. Противопаразитарная активность ампролиума, как сейчас установлено, обусловлена угнетением транспорта тиамина в паразите и устраняется тиамином. К сожалению, ам-пролиум имеет довольно узкий спектр действия; он малоэффективен при родственной паразитарной инфекции — токсоплазмозе.
Митохондриальный транспортер электронов
В митохондрии Е. tenella в качестве конечной оксидазы выступает не цитохром с, а цитохром о-а-цитохромоксидаза, характерная для бактериальной дыхательной цепи. Обнаружено, что такие производные 4-гидроксихинолина, как бихинолат, де-кохинат и метилбензокват, которые длительное время рассматривались как относительно малотоксичные и эффективные противококцидиозные средства, угнетают митохондриальное дыхание. Прямое исследование на изолированной интактной митохондрии Е. tenella показало, что 4-гидроксихи-нолины не влияют на активность Н АДН-оксидазы или сукциноксидазы, но являются очень сильными ингибиторами НАДН- или сукцинатиндуциро-
ванного митохондриального дыхания. С другой стороны, аскорбатиндуцированное митохондриальное дыхание Е. tenella абсолютно нечувствительно к 4-гидроксихинолинам. Следовательно, точка приложения действия этих противококцидиозных средств находится между оксидазами и цитохромом b в цепи транспорта электронов. Какой-то из компонентов этого участка цепи, участвующий в передаче электронов, по-видимому, высокочувствителен к 4-гидроксихинолинам. Этот компонент является потенциальной высокоспецифичной мишенью химиотерапевтического воздействия у Eimeria spp., так как 4-гидроксихинолины не влияют на печень цыпленка и митохондриальное дыхание млекопитающих, а также не действуют ни на каких других паразитов, кроме Eimeria.
Микротрубочки
Микротрубочки, являющиеся важной частью цитоскелета и митотического веретена, состоят из а- и р-тубулиновых белковых субъединиц. Недавно проведенное сравнение а- и Р-тубулинов нескольких видов паразитических нематод выявило присутствие множественных изоформ этих белков с различными изоэлектрическими точками. Эти вариации интересны не только для установления эволюционных отношений между эукариотическими клетками; их изучение позволяет также классифицировать тубулины паразитов с целью определения потенциальных мишеней противопаразитарной химиотерапии. Долгое время в качестве высокоэффективных противогельминтных средств используется группа производных бензимидазола. Один из первых препаратов этого ряда — мебендазол, который действует прежде всего за счет угнетения транспорта секреторных гранул и нарушения перемещения других субклеточных органелл в паразитической нематоде Ascarislumbricoides. Эти процессы сопровождаются исчезновением цитоплазматических микротрубочек из клеток кишечника червя. Микротубу-лярные системы клеток хозяина при лечении не страдают. Мебендазол и еще один противогельмин-тный бензимидазол — фенбендазол конкурируют также с колхицином за связывание с эмбриональными зародышевыми тубулинами A. lumbricoides в 250-400 раз более активно, чем с тубулинами мозга быка. Эти отличия аффинитета по связыванию могут объяснять избирательную токсичность бензимидазолов для паразитических нематод.
Синаптическая передача
Нервная система гельминтов и членистоногих существенно отличается от нервной системы позвоночных. Например, мотонейроны беспозвоночных немиелинизированные и, следовательно, более восприимчивы к повреждению мембран, чем миелинизированные соматические моторные волокна позвоночных. Мышечные волокна членистоногих иннервируются возбуждающими синапсами, в которых нейромедиатором является L-глутаминовая кислота, а также тормозными нервами, где трансмиттер-ную функцию выполняет у-аминомасляная кислота (ГАМК). В центральной нервной системе членистоногих имеется большое количество холинергических нейронов. У свободноживущих видов нематод, например С. elegans, а также у паразитирующих в желудочно-кишечном тракте видов, например у A. lumbricoides, строение нервной системы и синаптическая передача идентичны: и в нервно-мышечных соединениях, и в центральном вентральном нервном стволе обнаружены холинергические возбуждающие и ГАМКергические тормозные синапсы. У млекопитающих же никотиновые рецепторы расположены в основном в нервно-мышечных соединениях (глава 6, том 1), а локализация ГАМКер-гических нейронов ограничена, как правило, центральной нервной системой, защищенной гематоэнцефалическим барьером (глава 20).
Чтобы достигнуть нервной системы паразитирующих у млекопитающих нематод, нейротоксические противогельминтные препараты необходимо вводить системно, но при этом они не должны оказывать токсического действия на нервную систему хозяина. Кроме того, для проявления эффекта эти средства должны проникнуть через толстую кутикулу нематод, что существенно затрудняет их поиск. Тем не менее большинство использующихся в настоящее время противогельминтных препаратов действует именно на нервную систему круглых червей. Существуют две группы этих лекарственных средств: 1) действующие как агонисты никотиновых холинергических рецепторов в ганглиях и 2) действующие как прямые или непрямые агонисты ГАМК. К первой группе относятся левамизол, пи-рантела памоат, эксантела памоат и бефениум. Ацетилхолиновые рецепторы в нервно-мышечных соединениях нематод относятся к рецепторам никотинового типа; указанные агонисты весьма эффективно вызывают сокращение мускулатуры червей. В
эксперименте антагонист ганглионарных никотиновых рецепторов мекамиламин полностью устраняет действие этих противогельминтных препаратов.
Вторая группа состоит только из одного препарата — пиперазина, который является наиболее старым противогельминтным веществом. Он действует в нервно-мышечном соединении как ГАМК-агонист и вызывает у нематод периферический паралич.
Представители важного семейства соединений природного происхождения — милбемицины и авермектины оказывают непрямое ГАМК-потенци-рующее действие на интернейроны вентрального нервного ствола и мотонейроны нематод, вызывая их иммобилизацию, а также на нервно-мышечные соединения членистоногих, парализуя их. В связи с этим, милбемицины и авермектины являются сильными противогельминтными, инсектицидными и противоэктопаразитарными средствами. Особенно важно, что для них не характерна перекрестная резистентность с веществами, действующими на холинергические системы. Все физиологические эффекты этих препаратов устраняет специфический блокатор хлорного канала, регулируемого постсинаптическим связыванием ГАМК, пикротоксин (см. главу 20).
Ивермектин, легко получаемый из смеси авермектина В)аи авермектина В|Ь, успешно используют как противогельминтный препарат у домашних животных. Он также эффективен при лечении онхоцеркоза, поскольку губительно действует на микрофилярии. В настоящее время этот препарат широко применяют в Западной Африке. Так как авермектины плохо проникают через гематоэнцефалический барьер, они оказывают незначительное действие на центральную нервную систему млекопитающих. Однако на модели изолированных синап-тосом и синаптических мембран головного мозга млекопитающих были обнаружены специфические высокоаффинные места связывания для авермектинов в ГАМКергических нейронах. Связывание препарата стимулирует высвобождение ГАМК из пресинаптического окончания ГАМКергического нерва и усиливает постсинаптическое связывание медиатора. Авермектины увеличивают также связывание бензодиазепинов с их рецептором и усугубляют миорелаксирующий эффект диазепама in vivo. Наиболее вероятно, что милбемицины и авермектины действуют на ассоциированные с ГАМК-рецепторами хлорные каналы и усиливают эффект ГАМК. Таким образом, ГАМКергические нейроны
ТАБЛИЦА 53-2. Некоторые важные противопаразитарные препараты
с окончательно не выясненным механизмом действия
Препарат Эффекты, связанные, вероятно, с механизмом действия
Противоамебные средства
Дилоксанида фуроат Неизвестны
Эметин Ингибирование синтеза белка эукариот
Галогенсодержащие гидроксихинолины Неизвестны
Паромомицин Противофасциолезные средства Ингибирование синтеза белка прокариот
Битионол Разобщение окислительного фосфорилирования
Рафоксанид Разобщение окислительного фосфорилирования
Противофиляриозные средства Диэтилкарбамазин Противолейшманиозные средства Ингибирование липооксигеназы
Амфотерицин В Образование потенциалзависимых каналов в клеточной мембране
Соединения пятивалентной сурьмы Противомалярийные средства Неизвестны
Хлорохин Связывание ДНК, нейтрализация лизосом, связывание гемато-
порфирина
Примахин Его хинолиновый хиноновый метаболит является оксидантом
Хинакрин Связывание ДНК и ингибирование флавоновых ферментов
Хинин Противошистосомные средства Связывание ДНК и связывание с мембраной
Празиквантел Открытие Са^-каналов
Гикантон Связывание ДНК
Метрифонат Ингибирование ацетилхолинзстеразы
Ниридазол Метаболиты связываются с ДНК
Оксамнихин Связывание ДНК
Соединения трехвалентной сурьмы Препараты для лечения ленточных Ингибирование фосфофруктокиназы
гельминтозов
Никлозамид Противотрипаносомные средства Разобщение окислительного фосфорилирования
Меларсен оксид Ингибирование трипанотионредуктазы
Ароматические диамидины Транспорт может блокироваться полиаминами; связывание ДНК
беспозвоночных являются привлекательной мишенью для химиотерапевтического воздействия.
Об особенностях функционирования нервной системы у цестод и трематод известно немного, за исключением того, что милбемицины и авермектины не парализуют ее. Однако обнаружено, что высокоэффективный противошистосомный и проти-воцестодный препарат празиквантел (глава 55) увеличивает вход Са2+ и вызывает мышечное сокращение у этих паразитов, но не у нематод или насекомых. Некоторые бензодиазепиновые производные дают сходные с празиквантелом эффекты, не связанные с механизмом анксиолитического действия бензодиазепинов на центральную нервную систему млекопитающих. Таким образом, нервы и мышцы шистосом и плоских червей представляют
собой интересный объект изучения для будущих разработок в области химиотерапии соответствующих паразитарных заболеваний.
Препараты с окончательно не выясненным механизмом действия
Несмотря на значительный прогресс в области изучения механизмов действия рассмотренных здесь препаратов, в понимании механизмов действия других важных противопаразитарных средств все еше имеются существенные пробелы. К таким веществам относятся препараты, представленные в табл. 53-2. Оказалось, что многие из них могут связывать ДНК, а некоторые — разобщать окислительное фосфорилирование у млекопитающих. Эти эффекты, которые
являются токсическими для хозяина, но участвуют в реализации противопаразитарного действия, мо-гут служить критериями оценки при скрининговом отборе новых противопаразитарных средств.
Избранная литература
Blair К. L., Bennett J. L., Pax R. A. Praziquantel: Physiological evidence for its site(s) of action in magnetism-paralysed Schistosoma mansoni. Parasitology, 1992; 104 (Part 1): 59.
Hedstrom L., Cheung K. S., Wang С. C. A novel machanism of mechophenolic acid resistance in the protozoan parasite Trichomonas foetus. Biochem. Pharmacol. 1990; 39:151.
Holden-Dye L., Walker R. J. Avermactin and aver-mactin derivatives and antagonists at the 4-aminobutyric acid (GABA) receptor on the somatic muscle cells of Ascaris; is this the site of anthelmintic action? Parasitology, 1990; 101 (Part 2): 265.
Антипротозойные средства
54
РобертС. Голдсмит
Лечение малярии
У человека паразитируют четыре вида малярийного плазмодия: Plasmodium vivax, Plasmodium malariae, Plasmodium ovale и Plasmodium falciparum. Хотя все они могут быть причиной возникновения серьезных заболеваний, большинство тяжелых осложнений, вплоть до смертельных случаев, вызывает вид Plasmodium falciparum. Эффективность антималярийных средств зависит от вида паразита и от стадии его жизненного цикла. Кроме того, важной терапевтической проблемой является устойчивость паразитов к этим препаратам.
Жизненный цикл развития паразита
При укусе больного человека комар инфицируется через его кровь гамонтами (половая стадия малярийного плазмодия). Развившиеся в результате полового процесса в теле комара спорозоиты вновь способны к заражению человека при следующем укусе. В течение первой, экзоэритроцитарной, стадии развития в человеке спорозоиты попадают в клетки печени, где превращаются в тканевую форму — шизонт. Далее из печени в кровяное русло выходят мерозоиты — многочисленные продукты бесполого размножения шизонта. Во время этой эритроцитарной стадии они внедряются в красные кровяные клетки и превращаются там в эритроцитарные шизонты, которые растут и многократно делятся, образуя спорозоиты. Высвобождение ме-розоитов происходит при разрушении красных кровяных телец. Этот цикл может повторяться несколько раз. Затем из мерозоитов формируются гамонты, выходящие в кровяное русло, откуда они могут попасть в другого комара при укусе.
Виды Р. falciparum и Р. malariae проходят только один цикл инвазии в печень и печеночной шизо
гонии (размножения), заканчивающийся менее чем через 4 недели. После этого размножение паразита происходит только в эритроцитах. Таким образом, при этих инфекциях эффективно лечение, направленное на элиминацию плазмодия из красных кровяных клеток через месяц и более после заражения спорозоитами.
У вида Р. vivax (и, вероятно, у вида Р. ovale) наблюдается дремлющая стадия развития в печени (гипнозоит), которая вызывает последовательные повторения (рецидивы) инфекционного заболевания. Поэтому для лечения этой инфекции необходимы средства, уничтожающие паразитов как в эритроцитах, так и в печени.
Классификация препаратов
На рис. 54-1 представлены основные антималя-рийные средства в соответствии с их принадлежностью к химическим группам. Другие средства включают антибиотики (тетрациклин, доксициклин), га-лофантрин и хингаосу* и его производные. К комбинированным препаратам, используемым при малярии, относятся фансидар (пириметамин и сульфа-доксин) и малоприм* (пириметамин и дапсон).
Антималярийные средства можно классифицировать и по селективности действия на различные фазы жизненного цикла паразита. Препараты, которые подавляют развитие тканевых шизонтов или латентных гипнозоитов в печени (например, примахин), называются тканевыми шизонтицидами. Лекарства, действующие на эритроцитарные шизонты,— это кровяные шизонтициды, или подавляющие средства (хлорохин, амодиахин, прогуанил, пириметамин, мефлохин, хинин). Гаметоциды — препараты, предупреждающие заражение комаров посредством разрушения гамонтов в крови (например, примахин для Р. falciparum и хлорохин для Р. vivax,
* Не разрешен к применению а США.
Мефлохин
\ /
ИНГИБИТОРЫ ДИГИДРОФОЛАТРЕДУКТАЗЫ
4 - АМИНОХИНОЛИНЫ
H2N
Хлоргуанид (прогуанил)
8-АМИНОХИНОЛИН
Триметоприм
СУЛЬФОНЫ И СУЛЬФАНИЛАМИДЫ
Сульфадиазин
Рис. 54-1. Структурные формулы некоторых антималярийных средств
Дапсон (диаминодифенилсульфон, ДДС)
Р. malariae и Р. ovale}. К споронтицидным относятся средства, которые делают гамонты незаразными для комара (пириметамин, прогуанил).
Предотвратить заражение не может ни одно из этих лекарств (ни одно из них не является истинным этиотропным профилактическим препаратом). Исключение составляют антифолаты (пириметамин и прогуанил), которые препятствуют созреванию ранних печеночных шизонтов Р. falciparum. Тем не менее кровяные шизонтициды разрушают циркулирующие в крови плазмодии, что предотвращает приступы малярии, и при достаточно длительном применении (4 недели) излечивают малярию, вызыванную Р. falciparum и Р. malariae. Примахин разрушает персистирующие печеночные гипнозоиты Р. vivax и Р. ovale, и его использование вместе с кровяными шизонтицидами является радикальным методом лечения этих инфекций.
Резистентность паразитов к лекарственным препаратам
Сведения о хлорохинустойчивых штаммах Р. falciparum поступают из разных частей света с возрастающей частотой. Иногда эти штаммы только частично резистентны, что проявляется возобновлением заболевания через несколько дней или недель после временного подавления симптомов и угнетения шизогонии.
Описаны случаи резистентности эритроцитарных шизонтов Р. vivax к хлорохину. В некоторых районах мира выявлена частичная устойчивость печеночных шизонтов Р. vivax к примахину, что требует для лечения более высоких доз препарата.
Резистентных штаммов Р. ovale и Р. malariae к хлорохину не обнаружено.
Химиопрофилактика и лечение
В табл. 54-1 представлены дозы и схемы приема препаратов для химиопрофилактики малярии, а в табл. 54-2 — способы лечения, включая терапию устойчивых к хлорохину форм малярии, вызываемой Р. falciparum. Одновременно с химиопрофилактикой малярии пациентов необходимо обучить методам защиты от укусов комаров.
В последней части данного раздела представлена фармакологическая информация о селективных антималярийных средствах; для более детального
ознакомления приведена литература. Справки по применению данных препаратов в США или приобретению хинидина в экстренных случаях можно получить в Малярийном отделе CDC, Atlanta, 30333; телефон 404-332-4555 в течение дня, 404-639-2888 ночью или по выходным и праздничным дням (только в экстренных случаях). Для получения информации о профилактике заболеваний воспользуйтесь факсом 404-488-7761.
Хлорохин
Хлорохин применяют для химиосупрессии и лечения малярии, за исключением форм, вызванных частично или полностью резистентными штаммами Р. falciparum. Препарат эффективен также при печеночном амебиазе. Производное хлорохина гидроксихлорохин почти полностью идентичен ему по своим свойствам и может использоваться в качестве заменителя, если хлорохин недоступен.
Химия и фармакокинетика
Хлорохин — это синтетический аминохинолин (рис. 54-1), использующийся в форме фосфата для энтерального введения и гидрохлорида — для парентерального. Препарат быстро и полностью всасывается из желудочно-кишечного тракта, достигая максимальной концентрации в плазме через 3 часа (50-65 % связывания с белками), и быстро распределяется в тканях. Так как хлорохин концентрируется в тканях, для него характерен очень большой кажущийся объем распределения — примерно 13 000 л. Из мест концентрации он медленно высвобождается и метаболизируется. Препарат легко проникает через плаценту. Он выводится с мочой, время полувыведения составляет 3-5 дней. Почечная экскреция усиливается при подкислении мочи.
Вследствие очень большого объема распределения нагрузочные дозы препарата назначают только в случае необходимости создания эффективной шизонтицидной концентрации хлорохина в крови для купирования острых приступов. Препарат хорошо всасывается при внутримышечном введении, но для предупреждения угрожающих жизни токсических эффектов его следует вводить дробно несколькими небольшими дозами. Можно использовать и внутривенное введение хлорохина в виде медленных инфузий. Терапевтически эффективная концентрация препарата в плазме составляет
ТАБЛИЦА. 54-1. Предупреждение малярии у путешественников'
ДЛЯ ПРЕДОТВРАЩЕНИЯ ПРИСТУПОВ ВСЕХ ФОРМ МАЛЯРИИ И ИСКОРЕНЕНИЯ ИНФЕКЦИИ, ВЫЗВАННОЙ Р. FALCIPARUM И Р. MALARIAE1 2
РАЙОНЫ С ХЛОРОХИНЧУВСТВИТЕЛЬНОЙ ФОРМОЙ МАЛЯРИИ, ВЫЗВАННОЙ Р. FALCIPARUM: Центральная Америка к западу от Панамского канала, Карибский бассейн, Северная Африка и страны Среднего Востока
Хлорохин3
Доза для взрослых: хлорохина фосфат, 500 мг для соли (300 мгдля основания); доза для детей: от 8.3 мг/кг для соли (5 мг/кг для основания) до взрослой дозы препарата. Прием по одной дозе хлорохина еженедельно, начиная за две недели до въезда в эндемичную зону, во время пребывания там и в течение четырех недель после возвращения
РАЙОНЫ СХЛОРОХИНРЕЗИСТЕНТНОЙ ФОРМОЙ МАЛЯРИИ, ВЫЗЫВАЕМОЙ Р. FALCIPARUM: все другие страны мира
Мефлохин (основной метод)4
Доза для взрослых: по таблетке (250 мгдля соли и 228 мгдля основания); доза для детей: 15-19 кг — '/4 таблетки, 20-30 кг — % таблетки, 31-45 кг — 3/4 таблетки, > 45 кг — таблетка. Прием однократной дозы мефлохина еженедельно, начиная за одну неделю до въезда в эндемичную область, во время пребывания там и в течение четырех недель после возвращения
Доксициклин (альтернативный метод)5 *
Доза для взрослых: 100 мг ежедневно; доза для детей: 2 мг/кг (максимальная — 100 мг) ежедневно. Ежедневный прием в течение двух дней перед отъездом, во время пребывания в эндемичной зоне и в течение четырех недель после выезда из опасного района
Хлорохин (второй альтернативный метод)
Прием хлорохина еженедельно по вышеуказанной схеме
плюс
Прогуанил5 (при наличии)
Доза для взрослых: 200 мг один раз в день. Доза для детей: < 2 лет — 50 мг в день, 2-6 лет — 100 мг в день, 7-10 лет — 150 мг в день, >10 лет — 200 мг в день
плюс
Пириметамин-сульфадоксин (Фансидар)7 (для однократного самолечения предполагаемой инфекции) Только однократный прием. Доза для взрослых: 3 таблетки; доза для детей: 5-10 кг — ’/2 таблетки, 11-20 кг — 1 таблетка, 21-30 кг— 1’/2 таблетки, 31-45 кг — 2 таблетки, > 45 кг — 3 таблетки
ДЛЯ УСТРАНЕНИЯ ИНФЕКЦИИ, ВЫЗВАННОЙ Р. VIVAX И Р. OVALE2
Примахин8
Примахин показан только тем пациентам, которые с высокой вероятностью могут заразиться Р. vivax или Р. ovale. Прием примахина следует начать только после возвращения домой, принимать в течение двух недель в качестве химиопрофилактики. Доза для взрослых: 26.3 мг для соли (15 мг для основания) ежедневно в течение 14 дней; доза для детей: 0.5 мг для соли/кг (0.3 мг для основания/кг) ежедневно в течение 14 дней
1 Дополнительные рекомендации по профилактике можно найти в источниках, приведенных в списке литературы. Кроме того, можно звонить в Центр по контролю и профилактике заболеваний (Centers for Disease Control and Prevention [CDC], Atlanta, GA 30333). Телефон для справок (404) 332-4555 в течение дня, информация по факсу (404) 488-7761.
2 Гематошизонтициды (хлорохин, мефлохин, доксициклин) оказывают действие на чувствительные к ним Р. falciparum и Р. malariae при приеме в течение четырех недель после выезда из эндемичной области, однако для уничтожения персистирующей печеночной стадии Р. vivax и Р. ovale необходимо принимать примахин.
3 Хлорохин могут принимать беременные и маленькие дети.
4 Мефлохин не рекомендуется назначать беременным и детям с массой тела меньше 15 кг или при других обстоятельствах (см. текст). Принимать после еды, запивая водой.
5 Доксициклин противопоказан беременным и детям до 8 лет. Препарат следует принимать с вечерним приемом пищи. К
побочным эффектам относятся фоточувстаительность (профилактические меры: необходимо использовать солнцезащит-
30 мкг/л для чувствительных штаммов Р. falciparum и 15 мкг/л — для Р. vivax.
Антималярийный и другие фармакологические эффекты. Резистентность
А. Антималярийное действие. Хлорохин является высокоэффективным кровяным шизонтицидом и наиболее широко используемым 4-аминохинолином для предотвращения и купирования приступов малярии, вызываемых штаммами Р. vivax, Р. ovale, Р. malariae, а также чувствительными штаммами Р. falciparum. Он проявляет и умеренную эффективность в отношении гамонтов Р. vivax, Р. ovale, Р. malariae, но не Р. falciparum. Хлорохин не действует на преэритроцитарный плазмодий и не является радикальным средством для лечения инфекций, вызванных Р. vivax и Р. ovale, потому что не подавляет персистирующие печеночные стадии этих паразитов.
Б. Механизм антималярийного действия. Точный механизм антималярийного действия препарата неизвестен. Хлорохин может действовать, блокируя ферментативный синтез ДНК и РНК как в человеческих, так и в протозойных клетках, или формируя комплекс с ДНК, что препятствует репликации или транскрипции РНК. Внутри паразита препарат концентрируется в вакуолях и увеличивает pH в этих органеллах, нарушая способность паразита метаболизировать и утилизировать эритроцитарный гемоглобин. Предполагается также вмешательство препарата в обмен фосфолипидов внутри паразита. Избирательная токсичность хлорохина для малярийных паразитов зависит от механизма его концентрирования в паразитарных клетках. Концентрация хлорохина в нормальных эритроцитах в 10-20 раз больше, чем в плазме, а в
зараженных паразитами эритроцитах — в 25 раз больше, чем в нормальных.
В. Резистентность. Хлорохинустойчивые паразиты, по-видимому, выводят хлорохин через мембранный Р-гликопротеиновый насос подобно тому, как это наблюдается при множественной лекарственной резистентности раковых клеток. В условиях in vitro можно устранить резистентность, заблокировав мембранный насос с помощью разных препаратов, включая верапамил и дезипрамин.
Г. Фармакологическое действие. Механизм противовоспалительного действия хлорохина (и гидроксихлорохина), используемого при лечении аутоиммунных расстройств, неизвестен.
Клиническое применение (табл. 54-1,54-2, 54-3)
А. Острыеприступымалярии. Хлорохин обычно подавляетлихорадку (через 24-48 часов) и паразите-мию (через 48-72 часа) при острых приступах малярии, вызываемой Р. vivax, Р. ovale и Р. malariae, а также нерезистентными штаммами Р. falciparum. При лечении малярии, вызываемой Р. vivax и Р. ovale, необходимо сочетанное использование примахина с хлорохиномдляуничтоженияпаразитов, находящихся в персистирующей печеночной стадии развития.
Б. Химиопрофилактика. Хлорохин является наиболее предпочтительным средством для профилактики всех форм малярии, исключая применение в районах распространения устойчивых к 4-амино-хинолинам штаммов Р. falciparum.
В. Амебиаз. Хлорохин используется вместе с эметином в качестве альтернативного лечения амебных абсцессов печени.
Г. Аутоиммунные расстройства. Хлорохин (или гидроксихлорохин) может быть полезен при ауто-
ные средства, задерживающие ультрафиолетовые лучи, и максимально избегать прямого попадания солнечных лучей), желудочно-кишечные симптомы и кандидозные вагиниты.
6 В Восточной Африке и, возможно, в других областях с хлорохинрезистентной формой малярии (кроме Западной Африки) показан сочетанный прием прогуанила (палудрина) с хлорохином. Прогуанил не разрешен к применению в США, но может использоваться в других странах.
7 Фансидар не следует использовать для профилактики заболевания. Рекомендуется применять только для самолечения лихорадки в случае отсутствия квалифицированной врачебной помощи, однако крайне необходимо немедленно показаться врачу. Каждая таблетка фансидара содержит 25 мг пириметамина и 500 мг сульфадоксина. Препарат противопоказан при беременности перед родами, при установленной гиперчувстаительности к сульфаниламидам и детям до 2-месячного возраста. Он неэффективен в Таиланде и в соседних с ним странах.
8 Перед назначением примахина пациент должен обследоааться на предмет дефицита глюкозо-6-фосфатдегидрогеназы. Примахин противопоказан при беременности. В районах, где хлорохин назначают для профилактики, в качестве альтернативного средства можно использовать хлорохина фосфат в дозе 500 мг (соль) + примахина фосфат в дозе 78.9 мг (соль) еженедельно в течение восьми недель.
ТАБЛИЦА 54-2. Лечение малярии у взрослых, восприимчивых к инфекции
Лечение1 инфекции, вызванной всеми видами Лечение1 инфекции, вызванной
паразитов (за исключением хлорохинустойчивых хлорохинустойчивыми штаммами Р. falciparum штаммов Р. falciparum)
Энтеральное лечение малярии, вызванной
Р. falciparum1 2 3 * или Р. malariae
Хлорохина фосфат 1 г (соль)3,4 в качестве начальной дозы, далее 0.5 г через 6, 24 и 48 часов
Энтеральное лечение малярии, вызванной
Р. vivax или Р. ovale
Хлорохин3,4, как указано выше, затем по 0.5 г на 10-й и 17-й дни + примахина фосфат 26.3 мг (соль)5 ежедневно в течение 14 дней, начиная с четвертого дня
Парентеральное лечение тяжелых приступов
Хинина дигидрохлорид6 или хинидина глюконат7. По возможности быстрое начало энтерального приема хлорохина совместно с примахином в случае инфекции, вызванной Р. vivax или Р. ovale
или
Хлорохина гидрохлорид в/м12, повторяя каждые 6 часов. Начать по возможности быстро энтеральную терапию хлорохином в сочетании с примахином в случае инфекции, вызванной Р. vivax или Р. ovale
Энтеральное лечение
Хинина сульфат 10 мг/кг 3 раза в день в течение 3-7 дней8 + одна из следующих схем: 1) однократно пириметамин 75 мг или сульфадоксин 1500 мг (соответствует 3 таблеткам фансидара); 2) пириметамин 25 мг 2 раза в день в течение 3 дней и сульфадиазин 500 мг 4 раза в день в течение 5 дней; 3) тетрациклин9 250-500 мг 4 раза в день в течение 7 дней или клиндамицин9 900 мг 3 раза в день в течение 3 дней
или
Мефлохин10 *15-25 мг/кг (соль) однократно или в два приема с 6-часовым интервалом
или
Галофантрин"
Парентеральное лечение острых приступов
Хинина дигидрохлорид6 или хинидина глюконат7. Как можно быстрее начать энтеральную терапию хинина сульфатом + второй препарат (как сказано выше)
1 Показания и противопоказания по каждому препарату указаны в тексте.
2 В случае малярии, вызванной Р. falciparum, если у пациента не проявляется клинический эффект хлорохина (48-72 часа для умеренной формы инфекции, 24 часа при сильных приступах), то диагностируется устойчивая к хлорохину форма малярии. Прием хлорохина следует прекратить и начать пероральное лечение хинином или мефлохином.
3 500 мг хлорохина фосфата = 300 мг основания.
’ Хлорохин излечивает инфекцию, вызываемую чувствительными штаммами Р. falciparum и Р. malariae, а примахин следует использовать для подавления персистирующих печеночных стадий развития Р. vivax и Р. ovale. Лечение примахином начи-наютпосле восстановления больного от острой формы заболевания, продолжая терапию хлорохином еженедельно совместно с приемом примахина. Перед назначением примахина пациенты должны проверяться на дефицит глюкозо-6-фосфатде-гидрогеназы. Альтернативный метод лечения примахином — это комбинация примахина 78.9 мг (соль) и хлорохина 0.5 г (соль) еженедельно в течение восьми недель.
5 26.3 мг примахина фосфата = 15 мг примахина основания.
’Хинина дигидрохлорид назначают в дозе 10 мг/кг (соль) в 500 мл изотонического раствора NaCI или 5% раствора глюкозы
в/в медленно в течение 4 часов. Повторять каждые 8 часов, пока не станет аозможной энтеральная терапия (максимум 1800 мг/день). Постоянно наблюдать за кровяным давлением и ЭКГ с целью обнаружения аритмий или гипотензии. Боль-
шая начальная ударная доза (20 мг/кг) хинина назначается пациентам, которые заболели в Юго-Восточной Азии, при усло-
вии, если пациенты не принимали препарат. Особая предосторожность необходима при лечении хинином пациентов, ранее принимавших для профилактики мефлохин. В США хинина дигидрохлорид больше не поступает из CDC.
’ При невозможности парентерального использования хинина можно применить хинина глюконат в виде продолжительных инфузий. Ударную дозу 10 мг/кг (соль) (максимум 600 мг) растворяют в 300 мл изотонического раствора NaCI и вводят в
течение 1 -2 часов с последующим введением 0.02 мг/кг/мин (максимум 10 мг/кг каждые 8 часов), пока не будет возможна энтеральная терапия хинином. Постоянно следует наблюдать за кровяным давлением и ЭКГ: при расширении интервала QRS или удлинении интервала Q-T требуется прекращение введения препарата. Хинидина глюконат в США поступает через Centers for Disease Control and Prevention (CDC), Atlanta, GA 30333. Телефон (404) 639-3670 в течение дня, (404) 639-2888 ночью, по выходным и праздничным дням (в экстренных случаях).
“ Хотя хинина сульфат используют обычно в течение 3 дней, терапию можно продолжить до 7 дней у пациентов, заразившихся в Таиланде, где отмечается пониженная чувствительность к хинину.
иммунных расстройствах, в этом случае назначают большие дозы для ежедневного приема в течение нескольких месяцев (глава 35).
Побочные эффекты
Пациенты обычно хорошо переносят хлорохин, принимаемый для профилактики малярии (в том числе при продолжительном использовании) или для лечения. Изредка проявляются желудочно-кишечные симптомы, незначительные головные боли, зуд (особенно у темнокожих), анорексия, состояние дискомфорта, снижение остроты зрения и крапивница. Прием препарата после еды может сгладить некоторые побочные эффекты. В редких случаях наблюдаются гемолиз у пациентов с дефицитом глюкозо-6-фосфатдегидрогеназы, ухудшение слуха, дезориентация, психозы, судороги, патологическое изменение крови, кожные реакции и гипотензия.
Общая кумулятивная доза 100 г (основание) теоретически может вызвать необратимую ретинопатию, поражение слуха и миопатию. Рекомендуется проводить регулярные обследования зрения и нервно-мышечной системы при приеме хлорохина в течение 5 лет и более. Следует прекратить прием препарата при появлении изменений в сетчатке, полях зрения или при развитии мышечной слабости. На ЭКГ хлорохин может вызвать изменения волны Т и удлинение комплекса QRS.
Большие дозы при в/м инъекциях (10 мг/кг) или быстрые внутривенные инфузии могут привести к серьезной гипотензии, угнетению дыхания и остановке сердца.
Противопоказания
и меры предосторожности
Хлорохин противопоказан пациентам с псориазом или порфирией, у которых можно спровоцировать острые приступы этих заболеваний. Препарат не следует комбинировать с другими средствами, вызывающими дерматиты, а также назначать боль
ным с нарушениями функции сетчатки и изменением полей зрения, если только польза лечения не превысит риск.
Рекомендуется осторожно применять у больных с поражениями печени, алкоголизмом, неврологическими или гематологическими расстройствами в анамнезе. На всасывание хлорохина влияют некоторые антацидные и антидиарейные средства (каолин, кальция карбонат, магния трисиликат), поэтому их принимают за 4 часа до или после приема хлорохина.
Хотя безопасность применения хлорохина во время беременности полностью не подтверждена, обширный опыт такого назначения, не выявивший тератогенного эффекта, позволил многим специалистам и представителям ВОЗ заключить, что польза от приема препарата превышает потенциальный риск для плода. Энтеральный прием хлорохина безопасен для маленьких детей. Раствор хлорохина сульфата (нивахин) для детей широко применяется за пределами США.
Мефлохин
Мефлохин используется для лечения и профилактики малярии, вызываемой хлорохинустойчи-выми или с множественной лекарственной резистентностью штаммами Р. falciparum. Препарат эффективен также как профилактическое средство при малярии, вызываемой Р. vivax и, вероятно, Р. ovale и Р. malariae.
Фармакокинетика
Мефлохина гидрохлорид — это синтетическое производное 4-хинолинметанола, химически родственное хинину. Препарат используют только внутрь, так как при парентеральном введении он оказывает выраженное местное раздражающее действие. Он хорошо всасывается, максимальная концентрация в плазме достигается через 7-24 часа. Разовый прием внутрь дозы 250 мг в виде соли соз
9 Противопоказан детям до 8 лет и беременным.
10 В больших дозах назначают в Таиланде и других областях, где обнаружена повышенная резистентность, и детям, так как у них препарат метаболизируется быстрее, чем у взрослых. Тяжелые побочные эффекты встречаются редко. Показания и протиаопоказания даны в тексте. Мефлохин не следует назначать вместе с хинином или хинидином.
11 Доза для взрослых: 1 таблетка (500 мг) каждые 6 часов до трех доз; детям до 40 кг — 8 мг/кг (суспензии) каждые 6 часов до трех доз.
12 С целью избежания возможных тяжелых токсических эффектов назначить хлорохин парентерально в виде а/м инъекции в малой дозе (максимум 3.5 мг/кг [соль] каждые 6 часов).
дает концентрацию в плазме 290-340 нг/мл, а продолжение ежедневного приема препарата — стационарную концентрацию 560-1250 нг/мл. Необходимая концентрация препарата в плазме для подавления инфекции Р. falciparum составляет 200-300 нг/мл. Препарат хорошо связывается с белками плазмы, концентрируется в эритроцитах и широко распределяется в тканях, включая центральную нервную систему. Мефлохин разрушается в печени. Его кислые метаболиты медленно выводятся в основном с фекалиями. Период полувыведения, варьирующий от 13 до 33 дней, имеет тенденцию к укорочению у пациентов с острой формой малярии. Препарат можно обнаружить в крови в течение месяцев после прекращения приема.
Антималярийный и другие фармакологические эффекты
А. Антималярийное действие. Мефлохин обладает высокой гематошизонтицидной активностью в отношении Р. falciparum и Р. vivax и не эффективен в отношении гамонтов Р.falciparum и печеночных гистошизонтов Р. vivax. Информации об эффективности препарата в отношении Р. malariae или Р. ovale недостаточно, но теоретически препарат может действовать на циркулирующих шизонтов этих видов. Механизм действия мефлохина неизвестен.
Б. Резистентность. В Юго-Восточной Азии и Африке выявлены отдельные случаи незначительной устойчивости к действию мефлохина. Резистентность к препарату может возникать достаточно быстро. Обнаружены резистентные штаммы плазмодиев в областях, где препарат никогда не применялся.
В. Фармакологические эффекты. Мефлохин оказывает хинидиноподобное действие на сердце.
Клиническое использование (табл. 54-1)
А. Профилактика в отношении хлорохинустой-чивых штаммов Р. falciparum. Мефлохин эффективен для профилактики в отношении большинства хлорохинустойчивых или пириметамин-сульфа-доксинустойчивых штаммов Р. falciparum и дает лечебный эффект при еженедельном приеме в течение четырех недель после отъезда из эндемичной зоны. Препарат можно использовать и для профилактики в отношении Р. vivax и, вероятно, в отно
шении Р. ovale и Р. malariae. Для уничтожения Р. vivax и Р. ovale требуется проведение курса примахина, чтобы подавить печеночную стадию развития паразитов (подобно использованию в сочетании с хлорохином при инфекции, вызываемой Р. vivax).
Хотя препарат эффективен и против хлорохинчувствительных форм Р. falciparum, его необходимо запасать для использования в малярийных областях, где хлорохин неэффективен.
Б. Лечение хлорохинустойчивой инфекции, вызываемой Р. falciparum. Препарат показан для энтеральной терапии слабых и умеренных форм мефлохинчувствительных инфекций, вызываемых Р. falciparum. Поскольку мефлохин не действует так быстро, как хинин или хинидин, и не может вводиться парентерально, им нельзя заменить эти лекарства при лечении тяжелобольных. Рекомендуется однократная доза 1250 мг; в ближайшем будущем она может быть уменьшена до 15 мг/кг или до общей дозы 1000 мг. (Предостережение: перед использованием ознакомьтесь с рекомендациями производителя.)
Побочные реакции
Частота и выраженность побочных реакций дозозависима. Однако большинство симптомов относятся к проявлениям самой малярии.
А. Профилактические дозы. Второстепенные и преходящие побочные реакции включают желудочно-кишечные расстройства (тошнота, рвота, боль в эпигастральной области, диарея), головную боль, головокружение, обмороки и экстрасистолии с несколько большей частотой, чем при применении плацебо или других противомалярийных средств. Выявлены временные лейкоцитоз, тромбоцитопения и возрастание активности трансаминазы. Сообщалось также об обратимых нейропсихических* расстройствах (судороги, депрессии, психозы).
Б. Терапевтические дозы. При приеме терапевтической дозы, превышающей 1000 мг, наиболее вероятны желудочно-кишечные расстройства и быстрая утомляемость. Частота проявления нейро-психических симптомов (головокружение, головная боль, расстройство зрения, шум в ушах, бессонница, беспокойство, возбуждение, тревожность, депрессия, дезориентация, острые психозы или припадки) составляет около 1 %. Реакции могут развиваться в течение 2-3 недель после последнего приема мефлохина.
В. Токсичность препарата у животных. У животных (но не у людей) выявлены офтальмологические повреждения (помутнение хрусталика, дегенерация сетчатки).
Г. Мутагенное, канцерогенное и тератогенное действие. При проведении различных тестов на канцерогенность и мутагенность препарата получен отрицательный результат. Адекватные контролируемые клинические испытания мефлохина при беременности у человека не проводились.
Противопоказания и меры предосторожности
Мефлохин противопоказан больным с эпилепсией или психическими расстройствами в анамнезе. Препарат нельзя назначать детям с массой тела меньше 15 кг и до 2-летнего возраста, так как в этих группах он плохо переносится и его эффективность не установлена. Противопоказано также сочетанное введение мефлохина с хинином, хинидином, Р-бло-каторами и блокаторами кальциевых каналов или любыми другими средствами, которые пролонгируют или изменяют сердечную проводимость. Если приему мефлохина предшествует терапия хинином или хинидином, то первый прием мефлохина показан только через 12 часов. Вследствие большого периода полувыведения мефлохина необходимо соблюдать повышенную предосторожность при последующем лечении малярии хинином или хинидином.
Препарат лучше не использовать во время беременности, а женщинам детородного возраста, принимающим мефлохин для профилактики малярии, следует применять контрацепцию.
Мефлохин нельзя назначать людям, работа которых требует хорошей координации и пространственной ориентации (например, пилоты авиалиний). У пациентов, принимающих противосудорожные средства (особенно вальпроевую кислоту и натрия дивальпроат), могут наблюдаться судорожные припадки; сочетанный прием мефлохина и хлорохина или хинина увеличивает риск возникновения судорог.
Безопасность приема мефлохина сроком более одного года не изучалась. Поэтому при использовании препарата в течение продолжительного времени рекомендуется периодический анализ функций печени и полное офтальмологическое обследование.
Примахин
Химия и фармакокинетика
Примахина фосфат — это синтетическое производное 8-аминохинолина (рис. 54-1). После приема внутрь препарат хорошо всасывается, достигая максимальной концентрации в плазме через 1-2 часа, затем полностью метаболизируется и выводится с мочой. Период полувыведения примахина из плазмы составляет 3-6 часов, через 24 часа отмечаются только следовые количества препарата. Примахин широко распределяется по тканям, но только в небольших количествах связывается в них. Его основной метаболит представляет собой дезаминированное производное, концентрация которого в плазме в 10 раз больше таковой исходного соединения. Он медленнее разрушается, при ежедневном приеме аккумулирует. Не установлено, что является активным действующим началом: примахин или один из его метаболитов.
Антималярийный и другие фармакологические эффекты
А. Антималярийное действие. Примахин эффективен в отношении поздних печеночных стадий (гипнозоиты и шизонты) плазмодиев видов Р. vivax и Р. ovale, и это действие препарата лежит в основе радикального лечения этих инфекций. Он также высокоактивен на начальной (экзоэритро-цитарной) стадии развития Р. falciparum. При использовании препарата как средства этиотропной профилактики совместно с хлорохином он эффективно защищает от Р. vivax и Р. ovale, но не от хло-рохинустойчивых штаммов Р. falciparum. Примахин оказывает выраженное гаметоцидное действие в отношении всех четырех видов плазмодиев и иногда используется для уничтожения гамонтов Р. falciparum. В нетоксических дозах действие примахина на эритроцитарные шизонты слишком слабое для того, чтобы использовать его для лечения острых приступов.
Б. Механизм действия. Механизм антималя-рийного действия примахина изучен недостаточно хорошо. Хинолин-хиноновые промежуточные метаболиты примахина являются окислительно-восстановительными соединениями, которые могут действовать как оксиданты. Эти производные, вероятно, вызывают большую часть гемолитических
и метгемоглобинемических реакций, связанных с действием примахина.
В. Фармакологические эффекты. В больших дозах примахин может угнетать миелоидные элементы костного мозга. В стандартных дозах может воздействовать на эритроциты у генетически предрасположенных лиц.
Клиническое использование (табл. 54-1 и 54-2)
А. Конечный этап профилактики малярии, вызываемой Р. vivax и Р. ovale. Благодаря действию препарата на персистирующую печеночную стадию Р. vivax и Р. ovale, примахин применяют в сочетании с кровяными шизонтицидами, обычно — с хлорохином, в конце периода потенциального воздействия в отношении данных паразитов (конечная профилактика) для получения радикального эффекта (табл. 54-1).
Б. Радикальное лечение острых форм малярии, вызываемых Р. vivax и Р. ovale. лечения острых инфекций используют сочетание примахина и хлорохина (табл. 54-2). Стандартный курс приема примахина составляет 14 дней.
В. Этиотропная профилактика малярии, вызываемой Р. vivax и Р. ovale. В настоящее время не рекомендуют еженедельный прием комбинации хлорохина и примахина для подавления и уничтожения возбудителя малярии, так как хлорохин сам по себе оказывает адекватное действие.
Г. Гаметоцидное действие. Для обезвреживания гамонтов Р. falciparum достаточно однократно принять внутрь 45 мг примахина (основания).
Д. Пневмония, вызванная Pneumocystis carinii. Для лечения этой формы пневмонии используют комбинированную терапию примахином и клиндамицином.
Побочные эффекты
В рекомендуемых дозах примахин в основном хорошо переносится. Он редко вызывает тошноту, боль в эпигастральной области, абдоминальные спазмы и головную боль. Крайне редки более серьезные побочные эффекты, такие как лейкопения и агранулоцитоз. К другим редким возможным побочным реакциям относятся лейкоцитоз, зуд и аритмии.
Прием стандартных доз примахина может вызвать ограниченный или выраженный гемолиз или
метгемоглобинемию (проявляющуюся цианозом) у лиц с некоторыми вариантами дефицита глюко-зо-6-фосфатдегидрогеназы или с другими наследственными дефектами эритроцитарного пентозо-фосфатного пути. Хотя примахин иногда приводит к развитию метгемоглобинемии у пациентов без энзимопатий, этот эффект более выражен у больных с врожденным дефицитом НАД-метгемогло-бинредуктазы.
Противопоказания
и меры предосторожности
Примахин не следует назначать больным с заболеваниями соединительной ткани и больным с гранулоцитопенией в анамнезе. Препарат нельзя принимать в течение первого триместра беременности и, по возможности, до родов. Препарат не используют парентерально, потому что он может вызвать выраженную гипотензию.
Перед назначением примахина пациентов желательно обследовать на предмет дефицита глюкозо-6-фосфатдегидрогеназы. Прием препарата должен быть прекращен при появлении признаков гемолиза (покраснение или потемнение мочи) или анемии. Тем не менее чувствительные лица нередко хорошо переносят препарат; им назначают 0.5 г хлорохина + 78.9 мг примахина (45 мг основания) один раз в неделю в течение восьми недель.
Пириметамин и прогуанил (хлорогуанид)
Однократный прием пириметамина в фиксированной комбинации с сульфадоксином используют для лечения хлорохинрезистентной малярии, вызываемой Р. falciparum. Из-за токсичности этой комбинации ее больше не используют для профилактики заболевания. Пириметамин назначают и при токсоплазмозе. Прогуанил, не разрешенный в США, в некоторых странах применяется для профилактики малярии, прежде всего в комбинации с хлорохином.
Химия и фармакокинетика
Пириметамин и прогуанил относятся к ингибиторам дигидрофолатредуктазы (антагонисты фолиевой кислоты, антифолаты). Пириметамин явля
ется 2,4-диаминопиримидином, сходным с триметопримом, который используют для лечения бактериальных инфекций (глава 47). Прогуанил представляет собой производное бигуанида. Их структурные формулы представлены на рис. 54-1.
Оба препарата медленно, но достаточно полно всасываются из желудочно-кишечного тракта. Содержание пириметамина в плазме достигает максимальной концентрации через 4-6 часов после энтерального приема. Препарат связывается с белками плазмы, период его полувыведения составляет приблизительно 3.5 дней. Концентрация прогуанила в плазме приближается к максимуму через 5 часов после приема, период его полувыведения равен примерно 16 часам. Поэтому для профилактики заболевания прогуанил назначают ежедневно, в то время как пириметамин — один раз в неделю. Пириметамин активно метаболизируется перед выведением. Прогуанил является пролекарством: фармакологической активностью обладает его триазиновый метаболит циклогуанил.
Антималярийный и другие фармакологические эффекты
А. Антималярийное действие. Пириметамин и прогуанил являются кровяными шизонтицидами, однако из-за их более медленного действия по сравнению с хлорохином и хинином они используются только для профилактики заболевания, а не для лечения. Прогуанил (но не пириметамин) оказывает выраженное действие на начальную тканевую стадию Р. falciparum и поэтому дает этиотропный профилактический эффект, возможно, даже тогда, когда эритроцитарные шизонты устойчивы к нему. Эти препараты не эффективны ни в отношении гамонтов, ни в отношении персистирующей печеночной стадии Р. vivax.
Пириметамин и триазиновый метаболит прогуанила обладают более высоким аффинитетом к ди-гидрофолатредуктазе плазмодия и более эффективно подавляют ее, чем фермент человека. В результате происходит избирательное угнетение процесса восстановления дигидрофолиевой кислоты до тет-рагидрофолиевой (фолиниевой кислоты) у паразита.
Б. Резистентность. Известно, что устойчивые штаммы Р. falciparum широко распространены в мире, в то время как устойчивые штаммы Р. vivax встречаются не так часто. Поэтому для профилак
тики малярии, вызываемой Р. falciparum, не рекомендуется монотерапия. Хотя хлорохинрезистент-ные штаммы Р. falcipanm обычно устойчивы к пириметамину и про1уанилу, их комбинации с сульфаниламидами или сульфонами иногда бывают эффективны.
В. Фармакологические эффекты. В дозах, применяемых для лечения и химиопрофилактики малярии, антифолаты не оказывают фармакологического действия на хозяина. В более высоких дозах, используемых в терапии токсоплазмоза, они могут вызывать макроцитарную анемию и другие побочные эффекты.
Клиническое использование
А. Лечение хлорохинрезистентной малярии, вызываемой Р. falciparum. Пириметамин в фиксированной комбинации с сульфадоксином (фанси-дар) используется для лечения диагностированных или предполагаемых острых приступов хлорохинрезистентной малярии, вызываемой Р. falciparum (табл. 54-2).
Б. Химиопрофилактика хлорохинрезистентной малярии, вызываемой Р. falciparum. Использование фансидара в продолжительной схеме профилактики хлорохинрезистентной малярии, вызываемой Р. falciparum, прекращено вследствие токсичности препарата.
В. Лечение токсоплазмоза. Препаратом выбора является пириметамин в дозе 75 мг/день в течение 3 дней и далее по 25 мг ежедневно в сочетании с трисульфапиримидином (2-6 г/день в 4 приема) или сульфадиазином (100 мг/кг в сутки [максимум 6 г/день] в 4 приема). Продолжительность лечения составляет 3-4 недели. Для избежания гематологических эффектов из-за вызванного пириметамином дефицита фолатов назначают лейковорин-кальций (фолиниевую кислоту) по 10 мг/день в 2-4 приема. По крайней мере два раза в неделю необходимо проводить анализ количества тромбоцитов и лейкоцитов. Должна быть проверена чувствительность пациентов к сульфаниламидам.
Более высокие дозы препарата используют для лечения энцефалита, вызванного токсоплазмозом, у больных СПИДом. Начальную терапию (в течение шести недель и более в случае необходимости) проводят следующим образом: в качестве ударной дозы назначают 200 мг пириметамина в два приема и далее 1-1.5 мг/кг/день, 4-6 г/день сульфадиази
на или трисульфапиримидина в четыре приема. Для поддерживающей терапии применяют пириметамин в дозе 25-50 мг/день + сульфадиазин или трисульфапиримидин 2 г/день в два приема + лейко-ворин-кальций в дозе 5-20 г/день в два приема. Для уменьшения повышенного внутричерепного давления часто добавляют кортикостероиды.
Побочные эффекты
При лечении малярии пациенты обычно хорошо переносят пириметамин и прогуанил. Желудочно-кишечные и аллергические реакции встречаются редко.
Противопоказания
и меры предосторожности
Раньше пириметамин не рекомендовали принимать во время беременности, так как в больших дозах он оказывал тератогенное действие на животных. Однако широкое применение пириметамина у людей в течение более 20 лет не выявило подобного эффекта. Прогуанил считают безопасным для беременных препаратом.
Сульфаниламиды и сульфоны
Сульфаниламиды и сульфоны оказывают гема-тошизонтицидное действие в отношении некоторых штаммов Р. falciparum по тому же механизму, что и для бактерий, а именно, ингибируя синтез дигидро-фолиевой кислоты (глава 47). Однако эти препараты слабо действуют на гематошизонтов Р. vivax и неэффективны в отношении гаметоцитов и печеночной стадии развития Р. falciparum или Р. vivax.
При комбинированном использовании сульфаниламидов или сульфонов с антифолатами у восприимчивых плазмодиев происходит синергическая блокада синтеза фолиевой кислоты (рис. 47-2). Многие комбинации применяются для профилактики и лечения хлорохинрезистентных форм малярии, вызываемой Р. falciparum-, к наиболее эффективным относятся комбинация сульфодоксина и пириметамина (фансидар) и дапсона с пириметамином (мало-прим). Однако во многих странах мира плазмодии вида P.faldparum приобрели устойчивость к данным комбинациям. Кроме возникновения устойчивости кпрепаратам, большим недостатком сульфаниламидов и сульфонов является их медленное гематоши-
зонтицидное действие и многочисленные и иногда серьезные побочные эффекты.
1. ФАНСИДАР (пириметамин-сульфодоксин)
Фармакокинетика
Фансидар хорошо всасывается. Содержание его компонентов в плазме достигает максимал ьной концентрации через 2-8 часов, выводятся они главным образом почками. Средняя продолжительность периода полувыведения составляет 170 часов для сульфодоксина и 80-110 часов для пириметамина.
Антималярийное действие и резистентность
Фансидар эффективен в отношении некоторых видов малярии, вызываемой Р. falciparum. Но при лечении тяжелобольных пациентов одновременно должен назначаться хинин, так как фансидар действует медленно. Фансидар не помогает при малярии, вызываемой Р. vivax, а его действие на плазмодиев Р. ovale и Р. malariae недостаточно изучено.
Во многих странах Юго-Восточной Азии, в бассейне Амазонки и в Восточной Африке наблюдается множественная лекарственная резистентность (к хлорохину и фансидару).
Клиническое применение (табл. 54-1 и 54-2)
А. Лечение хлорохинрезистентной формы малярии, вызываемой P.faldparum. Для лечения острых приступов хлорохинустойчивой малярии, вызываемой!0. falciparum (табл. 54-2), фансидар (медленнодействующий шизонтицид) используют в сочетании с хинином (быстродействующий препарат).
Б. Пробное лечение хлорохинрезистентной формы малярии, вызываемой P.faldparum. Фансидар применяют для пробного самолечения малярии, т. е. в ситуации, когда развиваются маляриеподобные симптомы, но нет возможности немедленно диагностировать и получить медицинскую помощь. В таких случаях рекомендуется самолечение разовой дозой препарата (3 таблетки для взрослых). Однако в последующем необходимо провести медицинское обследование. Данный метод лечения неэффективен в отношении плазмодиев Р. vivax, Р. ovale
и Р. malariae, но может помочь при хлорохинрезис-тентной малярии, вызываемой Р. falciparum, если тяжесть заболевания не требует быстрого применения такого кровяного шизонтицида, как хинин.
Побочные эффекты
Редкие побочные эффекты от приема однократной дозы фансидара обусловлены аллергией на сульфаниламиды и включают гематологические, желудочно-кишечные проявления, реакции со стороны центральной нервной системы, кожные высыпания и действие на почки.
Фансидар больше не используют для длительной профилактики вследствие его выраженных побочных эффектов, в том числе мультиформной эритемы, синдрома Стивенса-Джонсона и токсического эпидермального некролиза, который встречается с небольшой, но статистически достоверной частотой.
Противопоказания
и меры предосторожности
Фансидар противопоказан пациентам с повышенной чувствительностью к сульфаниламидам. Его не следует использовать на поздних сроках беременности, кормящим женщинам или детям в возрасте до двух месяцев. Следует проявлять осторожность при использовании препарата у пациентов с нарушениями функций почек или печени, с дефицитом глюкозо-6-фосфатдегидрогеназы (иногда отмечается гемолиз), а также у пациентов с выраженными аллергическими расстройствами, бронхиальной астмой или с недостаточным питанием.
2. МАЛОПРИМ* (пириметамин-дапсон)
Вследствие потенциально высокой токсичности (летальный агранулоцитоз) препарат не рекомендуемся использовать для профилактики заболевания.
Хинин и хинидин
1. хинин
В течение 300 лет при малярии применяли основной алкалоид коры хинного дерева — хинин. К 1959 г. он был вытеснен другими противомаля
* Не разрешен к применению в США.
рийными средствами, прежде всего хлорохином. В результате последующего широкого распространения устойчивости к хлорохину хинин снова приобрел важное значение как противомалярийное средство. Он в основном используется для энтерального лечения хлорохинрезистентной малярии, вызываемой Р. falciparum, и, если возможно, для парентерального купирования острых приступов малярии, вызываемых Р. falciparum. В США CDC имеет для парентеральной терапии в экстренных случаях хинидина глюконат.
Фармакокинетика
Горький на вкус хинин быстро всасывается, достигая максимальной концентрации в крови через 1-3 часа, и широко распределяется в тканях организма. Около 80 % препарата связывается с белками плазмы. Концентрация хинина в эритроцитах составляет примерно 20 % от таковой в плазме, а в спинномозговой жидкости — 7 %. Период полувыведения хинина у здоровых людей в среднем равен 10 часам и более длительный у инфицированных лиц в зависимости от тяжести заболевания. Приблизительно 80 % препарата метаболизируется в печени, основная его часть выводится с мочой. Экскреция ускоряется при подкислении мочи.
При постоянном приеме ежедневной дозы концентрация препарата в плазме достигает плато на третий день. В норме или при легкой инфекции стандартная энтеральная доза создает в крови концентрацию около 7 мкг/мл, в случае выраженной формы малярии она увеличивается. Средняя концентрация препарата в плазме, необходимая для элиминации в бесполой стадии развития, составляет 5 мкг/мл для вида Р. vivax и немного больше для Р. falciparum. При концентрации менее 2 мкг/мл терапевтический эффект незначителен, а более 7 мкг/мл появляются побочные эффекты (“цинхо-низм”). Из-за узкого диапазона терапевтических доз при лечении малярии, вызываемой Р. falciparum, часто возникают побочные реакции.
Эффективным и безопасным считается внутримышечное введение хинина. Так как инъекции концентрированного (300 мг/мл) раствора довольно болезненны и могут вызвать стерильные абсцессы, то предпочтение отдают разбавленным растворам (50-100 мг/мл). Схема лечения такая же, как при в/в введении, и максимальная концентрация препарата в плазме наблюдается через 4 часа.
Антималярийный и другие фармакологические эффекты, устойчивость к препарату
А. Антималярийное действие. Хинин является быстродействующим, высокоэффективным кровяным шизонтицидом, действующим на все четыре вида плазмодиев. Препарат оказывает гаметоцид-ное действие в отношении Р. vivax и Р. ovale, но недостаточно эффективен в отношении гамонтов Р. falciparum. Хинин не обезвреживает спорозоиты и не оказывает влияния на печеночную стадию ни одного из видов паразитов.
Б. Механизм действия. Молекулярный механизм действия препарата неясен. Известно, что хинин подавляет многие ферментные системы. Кроме того, при помощи водородных связей он образует комплекс с двойной спиралью ДНК и тем самым ингибирует раскручивание ДНК, транскрипцию и синтез белка.
В. Фармакологические эффекты. При энтеральном приеме хинин часто вызывает раздражение желудка. Воздействие препарата на сердечную мышцу сходно с эффектом его D-стереоизомера хинидина, но менее выражено. Хинин оказывает незначительное окситоциноподобное действие на матку беременной, особенно в третьем триместре. В скелетных мышцах препарат дает курареподоб-ный эффект на моторные окончания и, по-видимому, удлиняет рефрактерный период мембран скелетной мышцы. Хинин может ослабить тетанические сокращения, возникающие по разным причинам, и используется для снятия контрактур при врожденной миотонии. К устаревшим способам применения этого препарата относятся диагностический тест на тяжесть миастении и его использование как противовоспалительного и обезболивающего средства. Прием терапевтических доз иногда приводит к гипогликемии вследствие стимуляции р-клеток поджелудочной железы, высвобождающих инсулин, что создает особые проблемы при лечении серьезных форм малярии у беременных пациенток. Слишком быстрые в/в инъекции могут вызвать выраженную, а иногда и смертельную гипотензию.
Г. Резистентность. В Юго-Восточной Азии возрастает резистентность к монотерапии хинином. Однако при введении хинина сочетанно с другим препаратом не было зарегистрировано случаев полного отсутствия реакции.
Клиническое применение (табл. 54-1 и 54-2)
А. Парентеральное лечение острых форм малярии, вызываемой Р. falciparum. При необходимости парентерального лечения тяжелых форм малярии, вызываемой Р. falciparum, чувствительной или резистентной к хлорохину, следует медленно внутривенно вводить хинина дигидрохлорид. Вопреки бытовавшим ранее представлениям, разбавленный хорошо всасывающийся раствор хинина для в/м введения, который практически не вызывает дискомфорта или некроза тканей, и является альтернативой в/в введению.
Б. Энтеральное лечение резистентной к хлорохину малярии, вызываемой Р.falciparum. Для энтерального лечения острых приступов хлорохинрезистентной малярии, вызываемой Р. falciparum (табл. 54-2), используют хинина сульфат с другими препаратами. Несмотря на то, что хинин эффективно ограничивает паразитемию, он не полностью подавляет инфекцию, поэтому необходима комбинированная терапия с другими препаратами. Хинин менее эффективен, чем хлорохин, и не используется при острых приступах малярии, вызываемой Р. vivax, Р. ovale и Р. malariae, а также хлорохинчувствительной малярии, вызываемой Р. falciparum.
В. Профилактика. Вследствие потенциальной токсичности хинин не используют для профилактики малярии. Однако в областях, где/5. falciparum устойчив к действию хлорохина, а мефлохин и доксициклин отсутствуют, хинин применяют и для профилактики заболевания. С этой целью назначают 325 мг препарата ежедневно во время пребывания в эндемичной зоне и в течение четырех недель после возвращения. Для уничтожения инфекции, вызываемой Р. ovale или Р. vivax, необходим курс лечения примахином, но при этом нельзя принимать хинин.
Г. Другие области применения. Хинина сульфат в дозе 200-300 мг иногда эффективен при ночных судорогах ног. Хинин в сочетании с клиндамицином используют при лечении больных с тяжелыми формами бабезиоза, вызываемого Babesia microti.
Побочные эффекты
А. Действие на желудочно-кишечный тракт. Раздражая слизистую оболочку желудка, хинин часто вызывает тошноту, рвоту или боль в эпигастральной области.
Б. Отравление хинином. Реже встречается цин-хонизм — токсическое состояние, которое обычно развивается при концентрации хинина в плазме, превышающей 7-10 мкг/мл. У некоторых пациентов симптомы отравления могут появиться и при более низкой концентрации хинина. Симптомы слабого и умеренного цинхонизма включают головную боль, тошноту, незначительное расстройство зрения, головокружение и слабый шум в ушах. При продолжении лечения они могут ослабевать, и поэтому прерывать терапию не рекомендуется. Если симптомы усиливаются, то следует временно прекратить лечение и измерить концентрацию хинина в плазме.
В. Гематологическое действие. При лечении острых форм малярии у 0.05 % пациентов наблюдается гемолиз, вызываемый непосредственно хинином. Гемолиз может обнаруживаться у пациентов с дефицитом глюкозо-6-фосфатдегидрогеназы. Лейкопения, агранулоцитоз, тромбоцитопеническая пурпура, пурпура Шенлейна-Геноха и гипопротромбинемия встречаются редко.
Г. Гипогликемия. Как уже отмечалось, при приеме терапевтических доз хинина может наблюдаться снижение содержания сахара в крови. Введение глюкозы может усилить дальнейшее высвобождение инсулина с последующим развитием гипогликемии.
Д. Острая токсичность. Выраженное токсическое действие встречается редко; оно проявляется лихорадкой, кожными высыпаниями, глухотой, расстройством зрения, нарушениями со стороны ЦНС и хинидиноподобными эффектами.
Роль хинина в развитии гемоглобинурийной лихорадки неясна, но это заболевание чаще возникало в прошлом, когда практиковался более продолжительный прием препарата. У сенсибилизированных пациентов даже однократная доза может спровоцировать гемолитическую реакцию. Синдром, характеризующийся массивным внутрисосудистым гемолизом, сопровождается гемоглобинурией, потемнением мочи, гипертермией, азотемией, повышенной агрегацией форменных элементов крови в сосудах и коагуляцией, почечной недостаточностью и уремией. Частота смертельных случаев составляет 25-50 %.
Е. Мутагенность и тератогенность. При безрезультатном проведении аборта с использованием хинина в высоких дозах у пациенток могут родиться дети с врожденными пороками развития.
Ж. Другие побочные эффекты. Внутривенное введение хинина и хинидина приводит к тромбофлебитам. Быстрая в/в инфузия вызывает умерен
ную или выраженную гипотензию, судороги, фибрилляцию желудочков и смерть.
Противопоказания
и меры предосторожности
При первых признаках гемолиза следует прекратить прием хинина. При гиперчувствительности к препарату или других выраженных реакциях также отменяют его прием. Хинин нельзя вводить подкожно, назначать во время беременности, пациентам с шумом в ушах, невритом зрительного нерва или миастенией в анамнезе. При почечной недостаточности необходимо измерить концентрацию хинина в плазме и немедленно снизить дозу. Пациенты с сердечными аритмиями должны соблюдать те же предосторожности, что и при приеме хинидина.
Взаимодействие препаратов
Алюминийсодержащие антацидные средства замедляют всасывание хинина. Хинин в свою очередь может тормозить всасывание дигоксина и дигитоксина. Сочетанное применение дигоксина и хинина вызывает увеличение концентрации дигоксина в сыворотке. Под действием хинина возрастает эффективность варфарина и других антикоагулянтов. Он может усилить или рестимулировать нервно-мышечную блокаду у пациентов, получающих блокаторы нервно-мышечной передачи. Циметидин замедляет выведение хинина, а увеличение кислотности мочи повышает его клиренс.
2. ХИНИДИН
Правовращающий стереоизомер хинина хинидин выпускается в виде хинидина глюконата для парентеральной терапии сердечных аритмий (глава 14, том 1). Хинидина глюконат эффективен также для лечения тяжелых форм малярии и используется при отсутствии парентеральной формы хинина. В США хинина сульфат больше не производится, но хинидина глюконат в экстренных случаях можно получить в CDC (404-639-3670).
Препараты других фармакологических групп
В областях, где преобладают резистентные к хлорохину и антифолат-сульфаниламидным комбинациям формы малярии, вызываемой Р. fold-
рагит, применяют альтернативные лекарственные средства. Некоторые из этих препаратов используют для профилактики заболевания. После возвращения пациента из эндемичной зоны для обеспечения радикального эффекта в случае заражения Р. vivax и Р. ovale необходима терапия примахином (согласно схеме).
1. ДОКСИЦИКЛИН
Препарат из группы тетрациклинов доксициклин (глава 44) применяют в основном для профилактики при мультипрепаратной устойчивости Р. falciparum, назначая его в дозах 100 мг/день во время пребывания в эндемичной зоне и в течение четырех недель по возвращении. Монотерапия острых форм малярии не применяется, но эффективной является его комбинация с хинином. Препарат предназначен для краткосрочной профилактики, его эффективность и безопасность при длительном использовании не оценивались. Более подробная информация представлена в главе 44.
2. ГАЛОФАНТРИН*
Галофантрина гидрохлорид является фенантренметанольным соединением, активным в отношении бесполой эритроцитарной стадии развития Р. vivax и в отношении хлорохинчувствительных и хлорохинрезистентных Р. falciparum. Он не влияет наэкзоэритроцитарную стадию развития паразитов и на гамонты. Информация об эффективности галофантрина при малярии, вызванной Р. ovale и Р. malariae, весьма ограничена. Препарат быстро, но неполностью всасывается из желудочно-кишечного тракта (всасывание улучшается при приеме препарата во время еды), широко распределяется по тканям и достигает максимальной концентрации в плазме через 3-5 часов. Время полувыведения препарата составляет 1 -2 дня, а его основного метаболита дезбутилгалофантрина — 3-5 дней. Оба они выводятся в основном с фекалиями.
Препарат используют только для энтеральной терапии острых форм заболевания, преимущественно, церебральной малярии, вызываемой Р. falciparum. Эффективность лечения в этом случае превышает 94 %. Препарат нельзя назначать тяжелобольным пациентам вследствие отсутствия лекар
• Не разрешен к применению в США.
ственной формы для парентерального введения. Энтеральная доза для взрослых составляет 500 мг (для детей с массой тела до 40 кг — 8 мг/кг). Лекарство принимают каждые 6 часов, не более трех доз. У неиммунизированных пациентов лечение повторяют через неделю. В настоящее время препарат не рекомендуется применять для профилактики.
Галофантрин оказывает эмбриотоксическое действие у животных и поэтому противопоказан при беременности, если только польза не превышает риск. Препарат обычно хорошо переносится.
3. КИНГХАОСУ* (артемизинин)
Сесквитерпеновый лакгоноэндопероксид кинг-хаосу — средство китайской травяной медицины (qinghao), использующееся в Китае в качестве антипиретика в течение 2000 лет.
Поскольку препарат только частично растворим в воде и маслах, были синтезированы его более растворимые аналоги: водорастворимый артезунат (формы для энтерального и внутривенного использования) и жирорастворимый артеметер (для энтерального и внутримышечного использования). Сейчас проходит испытание жирорастворимое производное артеэтер, близкое по структуре к артеметер. Фармакологическое изучение кингхаосу и его аналогов выявило, что они хорошо всасываются (максимальная концентрация в плазме наблюдается через 1 час) и подвергаются быстрому гидролизу до биологически активного метаболита — дигидро-кингхаосу. Исходное соединение и метаболит широко распределяются по тканям и быстро выводятся (период полувыведения составляет 4 часа).
Кингхаосу и его аналоги являются эффективными кровяными шизонтицидами в отношении всех видов малярийного плазмодия, включая хлорохин-резистентный Р. falciparum. Они не действуют на печеночную стадию развития паразитов, не излечивают рецидивы малярии и не используются для этиотропной профилактики. Механизм их действия неизвестен. Они особенно эффективны при церебральной малярии, вызываемой Р. falcipanm. Частота возникновения рецидивов составляет 40 % при терапии в течение 1-3 дней, но значительно уменьшается при продолжительности терапии, составляющей 7 дней. Рекомендуемая схема приема большей частью эмпирическая.
Препараты вызывают мало побочных эффектов, но оказывают эмбриотоксическое действие у крыс
и мышей. Поэтому их не следует использовать во время беременности. У животных отмечалось также подавление функций костного мозга, а у людей — уменьшение числа ретикулоцитов.
4. ХИНАКРИН
9-Аминоакридин хинакрин является кровяным шизонтицидом, который эффективно подавляет все четыре разновидности малярии у человека и может быть радикальным средством для лечения малярии, вызываемой Р. malariae и нерезистентными штаммами Р. falciparum. До внедрения в 1945 г. хлорохина хинакрин был основным синтетическим средством, используемым для антималярийной профилактики, но сейчас он утратил это значение. К недостаткам препарата относят образование отложений, которые вызывают пожелтение кожи, и редкие случаи провокации психотических реакций.
Лечение амебиаза
—4--------------------------------------
Амебиаз может проявляться в виде тяжелой кишечной инфекции (дизентерии), слабо или умеренно выраженной бессимптомной кишечной инфекции, а также как амебома, абсцесс печени или другой тип внекишечной инфекции.
Выбор препарата зависит от клинической картины заболевания и от желаемого места его действия, т. е. в просвете кишечника или в тканях. В табл. 54-3 представлены основные и альтернативные методы лечения для каждого клинического типа амебиаза. Дозы препаратов даны в сносках к таблице. Ни один из них не пригоден для эффективной и безопасной химиопрофилактики.
Препараты, используемые для лечения
Все антиамебные средства эффективны в отношении трофозоитов Entamoeba histolytica, но большинство из них не действует па стадию цисты.
А. Тканевые амебициды. Эти препараты уничтожают паразитов главным образом в стенке кишечника, печени и других тканях. Они не действуют на амеб, находящихся в просвете кишки.
1. Нитроимидазолы. Метронидазол, тинида-зол* и орнидазол* высокоэффективны в отношении амеб, паразитирующих в стенке кишечника и в других тканях. Однако их эффективность как по
лостных амебицидов недостаточна. Так, мопотера-пия метронидазолом излечивает кишечные инфекции только в 50 % случаев.
2. Эметины. Эметин идегидроэметин** вводятся в основном внутримышечно. В этой форме они воздействуют на простейших в стенке кишки и других тканях, но не влияют на амеб в просвете кишечника.
3. Хлорохин. Препарат эффективен в основном в отношении амеб, находящихся в печени.
Б. Амебициды, действующие в просвете кишечника. Эти препараты действуют преимущественно в просвете кишечника, а не в его стенке или в других тканях.
1. Дихлороацетамиды. Дилоксанида фуроат**, клефамид*, теклозан*, этофамид*.
2. Галогенированные гидроксихинолины. Йо-дохинол (дийодогидроксихин); клиохинол (йодо-хлоргидроксихин)*.
3. Антибиотики. Энтеральный прием тетрациклинов опосредованно действует на амеб в просвете кишечника за счет уничтожения ассоциированных с Е. histolytica бактерий. Паромомицин и эритромицин оказывают прямое амебицидное действие. За исключением паромомицина ни один из антибиотиков не является высокоэффективным в отношении кишечных организмов и не может применяться для монотерапии. При парентеральном введении антибиотики дают незначительный антиамебный эффект вне зависимости от локализации инфекционного процесса.
Лечение специфических форм амебиаза
А. Бессимптомная кишечная инфекция. Пациентов с бессимптомной формой инфекции необходимо лечить, так как впоследствии симптомы могут проявиться. Кроме того, существует опасность заражения других людей. Препаратами выбора являются дилоксанида фуроат и йодохипол, которые дают положительный эффект в 80-90 % случаев при одном курсе лечения. У дилоксанида меньше побочных эффектов по сравнению с йодохинолом. При лечении бессимптомной инфекции нет необходимости в использовании других тканевых амебицидных препаратов.
* Не разрешен к применению в США.
•• В США распространяется через Centers for Disease Control and Prevention, Atlanta 30333; телефон 404-639-3670.
Альтернативный способ лечения заключается в комбинировании паромомицина или метронидазола с йодохинолом или дилоксанидом.
Б. Слабо и умеренно выраженные кишечные инфекции. На этих стадиях кишечного заболевания необходимо введение и полостных, и тканевых амебицидных средств, поскольку паразиты должны быть уничтожены в полостях, кишечной стенке и печени. Предпочтительна комбинация метронидазола с полостным амебицидом (дилоксанида фуроат или йодохинол), эффективная в 90 % случаев.
Альтернативной является комбинация полостного амебицида (йодохинола или дилоксанида фуроата) с тетрациклином с последующим коротким курсом лечения хлорохином.
В. Тяжелые кишечные инфекции (дизентерия). Амебицидное лечение тяжелой формы амебной дизентерии такое же, как в случае слабой и умеренной инфекции. К необходимым вспомогательным мероприятиям относятся восполнение жидкости и электролитов и введение опиоидов для контроля моторики кишечника.
Г. Абсцессы печени. Обычно необходима госпитализация и постельный режим. Препарат выбора — метронидазол. За 10 дней приема излечивается 95 % пациентов с неосложненным течением болезни. Однако иногда лечение бывает неэффективным. Следует также принимать полостные амебициды (дилоксанида фуроат или йодохинол) для уничтожения кишечной инфекции независимо от того, были ли паразиты найдены в кале. Преимущество метронидазола определяется его влиянием на анаэробные бактерии, которые являются главной причиной, вызывающей бактериальные абсцессы печени.
Д. Амебома и внекишечные формы амебиаза. Препарат выбора — метронидазол. Альтернативным средством является дегидроэметин (эметин). Хлорохин неэффективен из-за низких концентраций в тканях (за исключением печени). Необходимо одновременное проведение курса лечения полостными амебицидами.
Хлорохин
Содержание хлорохина в печени достигает значительного уровня. В сочетании с дегидроэметином (или эметином) он дает хороший терапевтический эффект при лечении или предупреждении амебного абсцесса печени. Хлорохин не применяют в те
рапии кишечного амебиаза, потому что он не действует в просвете кишечника. В диапазоне доз, используемом при лечении амебиазов, не возникает ретинопатии, наблюдающейся обычно при длительном приеме хлорохина.
Эметин и дегидроэметин
Химия и фармакокинетика
Эметин получают из ипекакуаны или синтезируют. Субстанцией для синтеза является рацемат 2-дегидроэметина дигидрохлорида.
Эметин и дегидроэметин вводят парентерально, потому что при энтеральном приеме они плохо всасываются, малоэффективны и могут вызвать рвоту. При парентеральном введении препараты накапливаются в первую очередь в печени, легких, селезенке и почках. Для них характерна кумуляция и медленное выведение почками (следовые количества определяются в моче в течение 1-2 месяцев по окончании терапии).
Фармакологические эффекты
Эметин и дегидроэметин действуют почти на все ткани. Они необратимо блокируют синтез белка у эукариотов, ингибируя движение рибосом вдоль иРНК, и вторично — синтез ДНК. При парентеральном введении лабораторным животным токсических доз эметина наблюдали повреждение клеток печени, почек, скелетных и сердечной мышц. Подавляется сердечная проводимость и сократимость, что может вызвать предсердные и желудочковые аритмии, сердечную дилатацию и смерть. Эметин блокирует также адрено- и холи-норецепторы.
Антиамебное действие
Данные препараты действуют непосредственно на трофозоиты, уничтожая их.
Клиническое применение
Эметин и дегидроэметин не следует применять для лечения бессимптомных и слабо выраженных кишечных инфекций. По возможности предпочтение отдают дегидроэметину, так как он не уступает эметину по эффективности и менее токсичен. Схема лечения представлена в табл. 54-3.
ТАБЛИЦА 54-3. Лечение амебиаза
Форма заболевания Препарат(ы) выбора Альтернативные средства
Бессимптомная кишечная инфекция Дилоксанида фуроат1,2 Йодохинол (дийодогидроксихин)3 или паромомицин4
Слабо и умеренно выраженные кишечные инфекции (недизентерийные колиты) 1) Метронидазол5 плюс 2) Дилоксанида фуроат2 или йодохинол3 1) Дилоксанида фуроат2 или йодохинол3 плюс 2) Тетрациклин6 далее 3)Хлорохин или 1) Паромомицин4 далее 2) Хлорохин7
Тяжелая кишечная инфекция (дизентерия) 1) Метронидазол8 плюс 2) Дилоксанида фуроат2 или йодохинол3 Если исходно необходима парентеральная терапия: 1) Внутривенно метронидазол9 до начала энтеральной терапии; 2) Далее энтерально метронидазол8 плюс дилоксанида фуроат2 или йодохинол3 1) Тетрациклин6 плюс 2) Дилоксанида фуроат2 или йодохинол3 далее 3) Хлорохин10 или 1) Дегидроэметин1'11 или эметин11 далее 2) Тетрациклин6 плюс дилоксанида фуроат2 или йодохинол3 далее 3) Хлорохин10
Абсцессы печени 1) Метронидазол8,9 плюс 2) Дилоксанида фуроат2 или йодохинол3 далее 3) Хлорохин10 1) Дигидроэметин1,12 или эметин12 далее 2) Хлорохин13 плюс 3) Дилоксанида фуроат2 или йодохинол3
Амебома или внеки-шечная инфекция Так же, как при лечении абсцессов печени, кроме приема хлорохина Так же, как при лечении абсцессов печени, кроме приема хлорохина
1 Приобретение в США возможно только через Parasitic Disease Drug Service, Centers for Disease Control and Prevention, Atlanta 30333. Телефонные заявки принимают по центральному номеру (404) 639-3670 днем; (404) 639-2888 по ночам, выходным и праздничным дням (только в экстренных случаях).
2 Дилоксанида фуроат по 500 мг 3 раза в день во время еды в течение десяти дней (детям 20 мг/кг тремя дробными дозами ежедневно в течение десяти дней).
3 Йодохинол (дийодогидроксихин) по 650 мг 3 раза в день в течение 21 дня (детям 30-40 мг/кг [максимум 2 г] тремя дробными дозами ежедневно в течение 21 дня).
4 Паромомицин по 25-35 мг/кг (основание) (максимум 3 г) тремя дробными дозами после еды ежедневно а течение свми дней (детям в той же дозировке).
5 Метронидазол по 750 мг 3 раза в день в течение десяти дней (детям 35 мг/кг тремя дробными дозами ежедневно в течение десяти дней).
6 Тетрациклин по 250 мг 4 раза в день в течение десяти дней; при тяжелой форме дизентерии по 500 мг 4 раза а день в течение первых пяти дней, далее по 250 мг 4 раза в день в течение пяти дней. Тетрациклин не следует применять во время беременности и у детей до 8 лет; более старшим детям назначают 20 мг/кг в день четырьмя дробными дозами в течение десяти дней.
А. Тяжелые кишечные заболевания (амебная дизентерия). Парентеральное введение эметина и дегидроэметина быстро подавляет серьезные кишечные симптомы, но редко приводит к окончательному излечению даже после прохождения полного курса лечения. По этой причине, а также вследствие токсичности препараты назначают на минимально короткий срок, необходимый для снятия выраженных симптомов (обычно 3-5 дней). При приеме менее 7 дней появление признаков острой токсичности маловероятно.
Б. Другие паразитарные инфекции. Эметин и дегидроэметин иногда эффективны в отношении инфекций, вызываемых Balantidium coli, Fasciola hepatica и Paragonimus westermani, однако для начальной терапии рекомендуются более безопасные средства.
Побочные эффекты
При приеме препаратов в течение 3-5 дней отмечаются немногочисленные и обычно слабо выраженные побочные эффекты. С увеличением курса лечения до 10 дней усиливаются их проявления, а прием более 10 дней может привести к серьезным осложнениям. Поэтому противопоказано использование препаратов более 10 дней.
Часто встречаются боль, повышенная чувствительность и мышечная слабость в месте инъекции. Иногда развиваются стерильные абсцессы. Через несколько дней после начала терапии у многих больных появляется или обостряется диарея. Часто на ЭКГ видны незначительные изменения, но случаи выраженного токсического действия на сердце со значительным нарушением проводимости довольно редки. К наиболее серьезным симптомам относятся тахикардия и другие аритмии, пре-кардиальные боли, застойная сердечная недостаточность с одышкой и гипотензией (более подробно —
Goldsmith, Heyneman, 1989). Считают, что изредка наблюдаемые тошнота и рвота имеют центральное происхождение. У многих пациентов выявляется генерализованная мышечная слабость (иногда сопровождающаяся повышенной чувствительностью, ригидностью, болевыми ощущениями или тремором). Нередко отмечаются умеренные парезы.
Противопоказания
и меры предосторожности
Необходима госпитализация и тщательное наблюдение за пациентами. Следует соблюдать осторожность при внутривенных инъекциях, чтобы избежать появления побочных эффектов.
Эметин и дегидроэметин не следует назначать пациентам с заболеваниями почек и сердца, с недавним полиневритом в анамнезе и маленьким детям, кроме случаев неэффективности альтернативной терапии тяжелых форм дизентерии или абсцессов печени. Препараты нельзя принимать во время беременности.
Дилоксанида фуроат
Дилоксанида фуроат — это производное дихлороацетамида. Препарат оказывает прямое амебицидное действие, механизм которого неизвестен. Препарат дает немногочисленные фармакологические эффекты у позвоночных; в очень высоких дозах вызывает выкидыши у экспериментальных животных. Тератогенное действие не отмечалось.
Фармакокинетика
В кишечнике дилоксанида фуроат распадается на дилоксанид и фуроевую кислоту; 90 % дилоксанида быстро всасывается и переходит в форму глюкуронида, который сразу же выводится с мочой. Не
'Хлорохин по 500 мг (соль) ежедневно в течение семи дней (детям 16 мг/кг[соль] ежедневно в течение 7 дней).
8 Метронидазол по 750 мг 3 раза вдень в течение десяти дней (детям 35-50 мг/кг тремя дробными дозами в день в течение десяти дней).
9 Возможно внутривенное ваедение метронидазола; как можно быстрее переходить к энтеральной терапии. Относительно схемы лечения см. рекомендации производителя.
'° Хлорохин по 500 мг (соль) ежедневно в течение 14 дней (детям 16 мг/кг [соль] ежедневно в течение 14 дней).
" Дегидроэметин или эметин по 1 мг/кг подкожно (предпочтительно) или внутримышечно ежеднеано а течение наименьшего числа дней, когда необходимо снять тяжелые симптомы (обычно 3-5 дней) (максимальная ежедневная доза для дегидроэметина — 90 мг, для эметина — 65 мг). Детям ежедневную дозу разделяют на два приема.
12 Использовать дозировку, рекомендуемую в сноске 11, в течение 8-10 дней.
13 Хлорохин по 500 мг (соль) энтерально два раза в день в течение двух дней и далее энтерально по 500 мг ежедневно в течение 19 дней (детям 16 мг/кг[соль] ежедневно в течение 21 дня).
попавший в кровь дилоксанид представляет собой активное антиамебное вещество, не подверженное действию кишечной флоры.
Клиническое применение (табл. 54-3)
А. Бессимптомные и слабо выраженные кишечные амебиазы. Монотерапия дил оксанидом фуроатом применяется для лечения бессимптомных инфекций. Для лечения слабо выраженной кишечной инфекции препарат используется в комбинации с другими средствами.
Б. Другие формы амебиазов. Дилоксанида фуроат менее эффективен при умеренных и тяжелых формах кишечного амебиаза. В терапии абсцессов печени его применяют для уничтожения кишечной инфекции. Препарат неэффективен в отношении паразитов вне просвета кишечника.
Побочные эффекты и противопоказания
Дилоксанида фуроат не вызывает серьезных побочных эффектов, однако характерным является развитие метеоризма. Тошнота и спазмы в брюшной полости встречаются нечасто. Другие токсические эффекты редки.
Препарат не следует принимать во время беременности и детям до двух лет.
Йодохинол
Йодохинол (дийодогидроксихин) — это галогенированный гидроксихинолин, эффективный в отношении паразитов в просвете кишечника, но не действующий на трофозоитов в кишечной стенке или в других тканях.
Химия и фармакокинетика
Йодохинол — неточное название 8-гидрокси-5,7-дийодохинолина. Его фармакокинетика изучена мало. В работах по исследованию метаболизма у
человека показано, что период полу выведения препарата составляет 11-14 часов.
Он может влиять на показатели тиреоидной функции организма, увеличивая концентрацию бе-локсвязанного йода в сыворотке, что приводит к уменьшению захвата ,311.
Антиамебное действие
Механизм действия йодохинола в отношении трофозоитов неизвестен.
Клиническое применение
А. Кишечные амебиазы. Йодохинол является альтернативным препаратом для лечения бессимптомных, слабо выраженных и умеренных кишечных амебиазов. Препарат не проявляет достаточного эффекта при начальной терапии тяжелых кишечных заболеваний, но применяется для последующего уничтожения инфекции. Хотя он не эффективен при амебомах или внекишечных формах заболевания, в том числе амебиазах печени, его используют для подавления сопутствующей кишечной инфекции.
Б. Другие кишечные паразиты. Монотерапия йодохинолом (650 мг три раза в день в течение 10 дней) или его комбинация с тетрациклином (250 мг 4 раза в день в течение 7 дней) применяется для лечения инфекции, вызываемой Dientamoeba fragilis. Выявлен терапевтический эффект йодохинола в лечении некоторых случаев инфекции, вызываемой Giardia lamblia и Е. coli.
Побочные эффекты
Галогенированные гидроксихинолины, включая йодохинол, могут вызвать серьезные нейротоксические эффекты, особенно если они принимаются в дозах, превышающих рекомендуемые, и в течение продолжительного времени. К основным признакам передозировки относят атрофию зрительного нерва, потерю зрения и периферические нейропатии. Хотя, как правило, эти реакции исчезают при прекращении приема препарата, у некоторых пациентов отмечаются необратимые неврологические поражения. Применение аналога йодохинола — клио-хинола — может вызвать нейротоксический синдром, называемый подострой миело-оптической невропатией.
Прием йодохинола по стандартной схеме (650 мг 3 раза в день в течение 21 дня) не осложняется появлением нейротоксических эффектов. Иногда возникают слабо выраженные побочные эффекты, такие как диарея, которая обычно проходит через несколько дней, тошнота и рвота, гастриты, дискомфорт в области брюшной полости, незначительное увеличение щитовидной железы. Йодохинол более токсичен для младенцев и маленьких детей, чем для взрослых.
Противопоказания
и меры предосторожности
Йодохинол не используют для профилактики и лечения диареи путешественников или неспецифической диареи. При лечении амебиаза препарат следует принимать только в течение указанного срока и в рекомендуемом режиме. Прием необходимо прекратить, если появилась стойкая диарея или признаки йодизма. Йодохинол противопоказан пациентам с непереносимостью йода, заболеваниями почек и щитовидной железы и с тяжелыми заболеваниями печени, не обусловленными амебиазом. При лечении маленьких детей необходимо проводить тщательное офтальмологическое обследование до и во время курса терапии.
Метронидазол
Метронидазол применяется преимущественно для лечения внекишечных амебиазов. Он эффективно уничтожает тканевые амебные инфекции (абсцессы печени, поражения кишечной стенки и внекишечные инфекции), но только при совместном применении с полостными амебицидами достигается удовлетворительный эффект лечения инфекций в просвете кишечника. Метронидазол убивает трофозоитов, но не действует на цисты Е. histolytica.
Химия, фармакокинетика, побочные эффекты, показания и противопоказания представлены в разделе “Лечение трихомониазов и лямблиозов”.
Другие нитроимидазолы
К другим производным нитроимидазола относятся тинидазол, ниморазол, секондизол и орнида-зол. Они вызывают сходные побочные эффекты и оказывают такое же мутагенное действие в отноше
нии Salmonella, как и метронидазол. Метронидазол необходимо вводить каждые 8 часов из-за быстрого выведения; другие препараты можно принимать через более продолжительные интервалы времени. Однако, за исключением тинидазола, другие нитроимидазолы оказывают более слабое антиамебное действие, чем метронидазол.
Паромомицина сульфат
Антибиотик широкого спектра действия паромомицина сульфат является альтернативным препаратом для лечения слабо выраженных и умеренных кишечных амебиазов и сейчас проходит испытания в качестве средства местной терапии кожного лейшманиоза. Этот аминогликозид, получаемый из Streptomyces rimosus, сходен по своим свойствам и структуре с неомицином, канами-цином и стрептомицином. Паромомицин оказывает прямое и косвенное амебицидное действие; непрямой эффект связан с подавлением кишечных бактерий.
Паромомицин плохо всасывается из желудочно-кишечного тракта, поэтому его применяют только как полостной амебицид и не используют для лечения внекишечных амебных инфекций. Небольшое количество попавшего в кровь препарата медленно выводится в неизмененном виде, прежде всего с помощью гломерулярной фильтрации; незначительное количество экскретируется с желчью. Некоторое увеличение всасывания наблюдается при язвенных поражениях в кишечнике и, возможно, при нарушениях желудочно-кишечной перистальтики. Почечная недостаточность может привести к накоплению препарата в организме до токсического уровня.
Другие антибиотики
Несмотря на то, что тетрациклины оказывают очень слабое прямое амебицидное действие, влияние на флору кишечника позволяет использовать их (особенно окситетрациклин) вместе с полостными амебицидами для лечения как слабо выраженных, так и тяжелых кишечных инфекций. Однако из-за потенциальной токсичности тетрациклины не рекомендуется принимать беременным и детям до 8 лет. Их можно заменить эритромицина стеаратом, хотя он менее эффективен.
ТАБЛИЦА 54-4. Препараты, используемые для лечения других протозойных инфекций'
Микроорганизм Препарат(ы) выбора Альтернативные препарат(ы)
Trypanosoma brucei gambience, Т. b. rhodesiense Гемолимфатическая стадия Сурамин2 или эфлорнитин3 Пентамидина изетионат
Поздняя стадия Меларсопрол2 или эфлорнитин3 Трипарсамид4 + сурамин2
с вовлечением ЦНС Trypanosoma cruzi Нифуртимокс2 Бензнидазол4
Виды Babesia Клиндамицин5,6 + хинин5,6 Нет
Balantidium coli Тетрациклин5 Йодохинол5 или метронидазол5
Blastocystis hominis Йодохинол5 Метронидазол5
Виды Cryptosporidium Нет Нет
Dientamoeba fragilis Йодохинол5 или паромомицин Тетрациклин5
Giardia lamblia Метронидазол Фуразолцдон или хинакрин
Isosospora belli Триметоприм-сульфаметоксазол5 Нет
Leishmania braziliensis Стибоглюконат натрия2 Амфотерицин В5
Leishmania mexicana Стибоглюконат натрия2 Амфотерицин В 6
Leishmania donovani Стибоглюконат натрия2 Пентамидина изетионат
Leishmania tropica Стибоглюконат натрия2 Препараты местного применения
Pneumocystis carinii Триметоприм-сульфаметоксазол Пентамидина изетионат
Toxoplasma gondii Пириметамин + трисульфапиримидины Спирамицин4
’ Модифицировано и воспроизведено с разрешения Katzung В.: Drug Therapy. Appleton & Lange, 1991.
2 Приобретение в США возможно только через Parasitic Disease Drug Service, Centers for Disease Control and Prevention, Atlanta 30333. Телефон (404) 639-3670 днем; (404) 639-2888 по ночам, выходным и праздничным дням (только в экстренных случаях).
3 Эффективность в случае родезийской инфекции варьирует.
4 Не разрешен к применению в США; используется в некоторых других странах.
5 Применяется в США, но по другим показаниям.
6 Эффективность не изучена.
Другие протозойные инфекции
Перечень препаратов для лечения других протозойных инфекций представлен в табл. 54-4.
Лечение лейшманиозов
Лейшманиозами называют различные заболевания, возбудителями которых являются представители рода Leishmania: висцеральный лейшманиоз (кала-азар), кожные и кожно-слизистые лейшманиозы.
Используемые препараты
Современные методы лечения лейшманиозов нельзя считать удовлетворительными вследствие токсичности применяемых препаратов, длительных курсов лечения, безрезультативности терапии в ряде
случаев, а также частой необходимости госпитализации. Препарат выбора — натриевая соль глюко-сурьмянистой кислоты (натрия стибоглюконат). Иногда приходится прибегать к использованию более токсичных препаратов — амфотерицина В и пентамидина. Некоторые формы кожных лейшманиозов Старого Света не требуют терапии или излечиваются с помощью физических средств (криотерапия, теплотерапия, хирургия).
А. Стибоглюконат натрия (Sb5). Лечение начинают с пробной дозы 200 мг и продолжают далее по 20 мг 5Ь5/кг/день. Препарат можно вводить внутримышечно, но этот путь введения вызывает болевые ощущения в месте инъекции, поэтому при большом объеме лекарства предпочитают внутривенное введение. Препарат принимают в течение 20 дней при кожных формах лейшманиоза и 30 дней при кожно-слизистом и висцеральном лейшманиозах. Немногочисленные побочные эффекты могут появиться в начале терапии, но наиболее вероятны
при кумуляции препарата. Чаще всего встречаются желудочно-кишечные расстройства, лихорадка и сыпь. Гемолитическая анемия, поражения печени, почек и сердца обнаруживаются редко. Рецидивы заболевания излечивают по той же схеме, но увеличивают длительность терапии по крайней мере вдвое. В США препарат можно получить только через CDC, Atlanta 30333 (404-639-3670).
Б. Пентамидина изетионат. Пентамидина изетионат назначают по 2-4 мг/кг внутримышечно (предпочтительно) или внутривенно ежедневно или через день (до 15 инъекций). Для лечения некоторых форм висцеральных лейшманиозов требуется более продолжительный или повторный курс терапии. Побочные эффекты описаны в разделе, посвященном пневмоцистозам.
В. Амфотерицин В. Амфотерицин В вводят внутривенно медленно в течение 6 часов и более через день. Начальную дозу 0.25 мг/кг/день увеличивают до 0.5 мг/кг/день и далее до 1 мг/кг/день до достижения суммарной дозы 30 мг/кг. Пациенты должны находиться под тщательным наблюдением в стационаре, потому что могут возникнуть тяжелые побочные реакции.
Более детальное описание фармакологических эффектов, фармакокинетики и побочных эффектов этих препаратов можно найти в источниках, помещенных в списке литературы в конце главы.
Лечение пневмонии, вызываемой Pneumocystis carinii, и трипаносомозов
Лечение пневмоцистозов
Препарат выбора для лечения пневмоцистозов — триметоприм-сульфаметоксазол (глава 47). Его принимают 4 раза в день в течение четырех дней. Препарат для альтернативной терапии — пентамидина изетионат, который недавно начали использовать в виде аэрозоля для профилактики заболевания.
Лечение трипаносомоза
Препарат выбора для лечения американского трипаносомоза — нифуртимокс. В терапии африканского трипаносомоза используют сурамин, пентамидин и меларсопрол. В США для лечения ме-
нингоэнцефалитной стадии инфекции Т. b. gam-Ыепсе одобрено применение эфлорнитина (более детально Golgsmith, Heyneman, 1989).
Пентамидин
Химия и фармакокинетика
Пентамидин — это ароматический диамидин, изготовляемый в виде солей: изетионата и метан-сульфоната. В США используют только изетионат.
Пентамидин вводят парентерально, так как он плохо всасывается из желудочно-кишечного тракта. Препарат быстро исчезает из кровяного русла и активно связывается с тканями, особенно с тканями печени, селезенки и почек. Он выводится в неизмененном виде, в основном с мочой. Пентамидин не проникает через гематоэнцефалический барьер, но может проникать через плаценту. В центральной нервной системе появляются только следовые количества препарата, поэтому на поздних стадиях африканских трипаносомозов, протекающих с поражением центральной нервной системы, должны быть использованы другие трипаносомоциды.
Антипаразитарное
и фармакологическое действие
А. Антипаразитарное действие. Механизм ан-типаразитарного действия пентамидина недостаточно хорошо изучен. В опытах in vitro установлено, что препарат может влиять на синтез ДНК, РНК, фосфолипидов и белков.
Б. Фармакологические эффекты. Пентамидин вызывает высвобождение гистамина тучными клетками, которое наряду с периферической симпато-плегией является вероятной причиной выраженной гипотензивной реакции при в/в введении. Кроме того, считают, что пентамидин оказывает селективное токсическое действие в отношении островковых Р-клеток поджелудочной железы. Первоначально это вызывает неподавляемое высвобождение инсулина, приводящее к гипогликемии; спустя несколько месяцев могут возникнуть гипергликемия и сахарный диабет.
Клиническое применение
А. Лейшманиоз. Пентамидин применяют в качестве альтернативного средства (по отношению к стибоглюконату натрия) для лечения тяжелых
форм лейшманиоза. Схема лечения: 2-4 мг/кг/день внутримышечно до получения 15 доз препарата.
Б. Трипаносомоз. Пентамидин применяют в качестве альтернативного средства (по отношению к сурамину) для лечения ранних стадий инфекций, вызываемых Trypanosoma brucei gambiense или Trypanosoma brucei rhodesiense. Препарат не используют для лечения заболеваний, протекающих с поражением ЦНС, потому что он не проникает через гематоэнцефалический барьер (подробно о схемах лечения и методах применения препарата — Goldsmith, Heyneman, 1989).
В. Пневмоцистоз. Лечение всегда должно основываться на подтвержденном диагнозе. Тримето-прим-сульфаметоксазол и пентомидина изетионат являются в равной степени эффективными, но у 50 % пациентов, принимающих эти препараты, отмечаются тяжелые побочные эффекты. У больных без СПИДа предпочтительней первый препарат, потому что он вызывает меньше побочных эффектов. У больных СПИДом побочные эффекты наблюдаются в равной степени и выбор препарата зависит от других факторов (энтеральной активности препарата, предшествующего заболевания почек, необходимости в нагрузке жидкостью, чувствительности к сульфаниламидам в анамнезе).
При лечении активных пневмоцистозов препарат вводят внутривенно или внутримышечно в разовой дозе 4 мг/кг/день (соль) в течение 14-21 дня. Некоторые врачи рекомендуют дозу 3 мг/кг, которая может снизить побочные эффекты без уменьшения эффективности действия. Пентамидин в форме аэрозоля проходит клинические испытания.
Профилактика заболевания рекомендуется CDC для всех ВИЧ-инфицированных больных, которые ранее болели пневмоцистозом, и для некоторых других больных. В США комитетом IND разрешено профилактическое применение аэрозоля пентамидина в дозе 300 мг каждые четыре недели с помощью распылителя. Дальнейшую информацию можно получить у производителя по телефону 800-727-7003.
Г. Бластомикозы. Пентамидин иногда применяется для лечения северо-американских бластомикозов.
Побочные эффекты
Характерны болевые ощущения в месте инъекции, изредка развиваются асептические абсцессы и язвы.
К случайным реакциям относят сыпь, нейтропению, изменение показателей функции печени, уменьшение фолатов в сыворотке, гиперкалиемию и гипокальциемию. Могут возникать гипогликемия (часто не проявляющаяся клинически), гипергликемия, гипонатриемия и отдаленное нейротоксическое действие с азотемией.
Поскольку после введения разовой дозы пентамидина может развиться серьезная гипотензия, после приема препарата больным следует лежать. Необходимо измерять кровяное давление во время и после инъекции до его стабилизации. Так как возможна экстренная ситуация, необходимо наличие соответствующего оборудования.
К редким побочным эффектам относятся мегалобластическая анемия, острый панкреатит, тромбоцитопения, тромбоцитопеническая пурпура, токсический эпидермальный некролиз, гиперкалиемия и токсическое действие на почки. Смертельные исходы наступают от гипотензии, гипогликемии или аритмий.
Противопоказания
и меры предосторожности
Следует с осторожностью назначать пентамидин больным с гипотензией, гипертензией, со скрытым или клиническим диабетом, при недостаточном питании, с анемией, тромбоцитопенией, дисфункцией почек или печени.
Атовахон
Атовахон — новое производное хинона с анти-протозойной активностью, особенно выраженной в отношении Р. carinii. Препарат одобрен FDA для лечения слабо выраженных и умеренных пневмоний, вызванных Р. carinii, но еще не прошел испытаний при тяжелых формах заболевания и как профилактическое средство. Предварительное изучение атовахона выявило, что он может быть эффективен и при церебральном токсоплазмозе у больных СПИДом.
Механизм действия атовахона изучен недостаточно. Его биодоступность довольно низка, но увеличивается при приеме во время еды. Препарат связывается с белками более чем на 99 %, время его полувыведения у больных СПИДом составляет 2.2-2.9 дней. Большая часть препарата выводится в неизмененном виде с фекалиями. Принимают по 750 мгтри
раза в день во время еды в течение 21 дня. К часто встречающимся побочным эффектам относятся лихорадка и сыпь, реже наблюдаются кашель, тошнота, рвота, диарея, головная боль и бессонница.
Лечение трихомонозов и лямблиозов
Метронидазол
Метронидазол — препарат выбора для лечения мочеполового трихомоноза и альтернативное средство для терапии инфекций, вызываемых Giardia lamblia, Balantidium coli, Blastocystis hominis, а также кишечных и внекишечных амебиазов. Применение препарата для лечения инфекций, возбудителями которых являются анаэробные бактерии, описано в главах 50 и 52.
Химия и фармакокинетика
При энтеральном приеме метронидазол быстро всасывается и диффузно проникает во все ткани, включая спинномозговую жидкость, грудное молоко и костную ткань. Внутриклеточная концентрация быстро достигает уровня внеклеточной. Период полувыведения неизмененного препарата составляет 7.5 часов. Препарат и его метаболиты выводятся с мочой. Клиренс метронидазола в плазме уменьшен у пациентов с нарушением функции печени.
|4--N°2
N N — СН2СН2ОН
СН3
Метронидазол
Механизм действия
В анаэробных бактериях и чувствительных к метронидазолу простейших клетках нитрогруппа препарата химически восстанавливается ферредоксином (или в опосредованных ферредоксином метаболических процессах). Продукты восстановления убивают микроорганизмы, реагируя с различными внутриклеточными макромолекулами. Таким образом, для реализации бактерицидного (но не бактериостатического) действия препарата в отно
шении анаэробных бактерий необходим процесс восстановления. In vitro метронидазол активен в отношении большинства облигатных анаэробов, но нет достоверных сведений о его влиянии на факультативных анаэробов и облигатных аэробов.
Показательно, что метронидазол радиосенсиби-лизирует опухолевые клетки. Так же, как и в случае антибактериального эффекта, механизм действия препарата зависит от уровня гипоксии клеток-мишеней и может включать взаимодействие со свободными радикалами.
В случае амебиазов метронидазол убивает трофозоитов Entamoeba histolytica, но не цисты.
Клиническое применение
А. Трихомоноз мочеполовой системы. Препарат выбора — метронидазол. Принимают энтераль-но по 250 мг 3 раза в день в течение семи дней. Эффективна также разовая доза 2 г (или 2 раза по 1 г). Необходимо одновременное лечение сексуального партнера в случае обнаружения у него возбудителей заболевания, однако многие врачи проводят курс лечения партнера и при отсутствии у него заражения. Во время первого триместра беременности лечение метронидазолом проводить нежелательно. Описаны метронидазолрезистентные штаммы Trichomonas vaginalis.
Б. Лямблиоз. Энтеральная доза метронидазола для взрослых составляет 250 мг 3 раза в день в течение пяти дней. Детям назначают по 5 мг/кг 3 раза в день в течение пяти дней.
В. Амебиаз. См. выше.
Г. Балантидиаз. В случае неэффективности терапии тетрациклином назначают метронидазол в дозе 750 мг 3 раза в день в течение пяти дней.
Д. Gardnerella vaginalis. Используют только в случае устойчивой инфекции. Метронидазол принимают энтерально по 500 мг 2 раза в день в течение пяти дней.
Е. Анаэробные инфекции. Метронидазол применяют для подавления послеоперационных анаэробных инфекций после аппендэктомии, операций на толстой и прямой кишке и удаления матки. Более того, по-видимому, отчасти из-за способности метронидазола проникать в абсцессы и некротические ткани чувствительными к нему могут оказаться серьезные анаэробные инфекции, вызываемые Bacteroidesfragilis, клостридиями й другими бактериями, устойчивыми к другим средствам.
Ж. Прогрессирующая язва конечностей, острые язвенные гингивиты, рак слизистой оболочки полости рта, пролежни и другие медленно заживающие повреждения. Метронидазол назначают энтерально 3 раза в день по 250 мг вместе с соответствующим препаратом против аэробной инфекции и местным лечением, ускоряющим заживление ран и снижающим боль, воспалительный отек и гнойные выделения.
Побочные эффекты
и взаимодействие препаратов
К наиболее общим побочным эффектам относятся тошнота, головная боль, сухость или металлический привкус во рту. Моча может окрашиваться в темный или красновато-бурый цвет. Редкие (12 %) побочные эффекты включают рвоту, диарею, бессонницу, слабость, головокружение, стоматит, сыпь, чувство жжения в области уретры и парестезии.
Метронидазол дает дисульфирамподобный эффект, поэтому при употреблении алкоголя на фоне приема препарата появляются тошнота и рвота.
Мутагенность и канцерогенность
Метронидазол и его метаболиты, выделенные из мочи принимающих препарат пациентов, оказывают мутагенное действие в отношении некоторых штаммов Salmonella typhimurium (тест Эймса). У мышей хроническое энтеральное введение очень больших доз вызывает статистически достоверное увеличение числа опухолей легких и печени. Этот эффект не был обнаружен у других видов животных, не относящихся к грызунам. Хотя препарат применяется в медицине уже более 20 лет, не было выявлено увеличения частоты врожденных пороков, мертворождений или уменьшения массы тела новорожденных. У пациентов, получавших большие дозы препарата, не возрастает частота хромосомных аберраций.
Противопоказания и меры предосторожности
Следует соблюдать осторожность при назначении препарата многократными курсами или в течение длительного времени, а также пациентам с патологическими изменениями крови в анамнезе. Нецелесообразно принимать метронидазол без до
статочных оснований во время беременности (особенно в первом триместре), кормящим матерям и маленьким детям, хотя четкие противопоказания отсутствуют.
Установлено, что метронидазол способен потенцировать эффект кумариноподобных антикоагулянтов. Фенитоин и фенобарбитал ускоряют выведение препарата, в то время как циметидин уменьшает его плазменный клиренс. Совместное применение увеличивает токсичность препаратов лития. В связи с наличием дисульфирамподобного эффекта все пациенты, принимающие метронидазол, должны быть предупреждены о необходимости воздержания от употребления алкоголя за 24 часа до приема препарата и в течение 48 часов после приема последней дозы.
Препараты
Хлорохина гидрохлорид [80 % хлорохина-основания] (Арален НС1)
Парентерально: 50 мг/мл для инъекций
Хлорохина фосфат [60 % хлорохина-основания]
(генерик, Арален, за пределами США: Авлоклор, Резохин)
Перорально: таблетки по 250 и 500 мг Примечание' хлорохина сульфат выпускается за пределами США как Нивахин
Хлорохина фосфат с примахина фосфатом
Перорально: таблетки, содержащие 500 мг хлорохина фосфата (300 мг основания) и 79 мг примахина фосфата (45 мг основания)
Дегидроэметин (Мебадин)
Парентерально: растворы для инъекций по 30 и 60 мг в ампулах
Примечание: в США можно приобрести только через Centers for Disease Control and Prevention, Atlanta, 404-639-3670
Дилоксанида фуроат (Фурамид)
Перорально: таблетки по 500 мг Примечание: в США можно приобрести только через Centers for Disease Control and Prevention, Atlanta, 404-639-3670 '
Доксициклин (генерик, Вибрамицин, др.) Перорально: таблетки и капсулы по 50 и 100 мг; таблетки в оболочке по 100 мг; суспензии, содержащие по 25 и 50 мг порошка в 5 мл; сироп 50 мг/5 мл
Парентерально: порошок во флаконе для разведения перед инъекцией (флаконы по 100 и 200 мг)
Эметин (генерик)
Парентерально: 65 мг/мл для инъекций Йодохинол [дийодогидроксихин]
(генерик, Йодохин, Мебехин) Перорально: таблетки по 210 и 650 мг; порошок
Примечание-, за пределами США йодохинол продается как Эмбехин, Ланодоксин, Саворхин, Себахин
Мефлохин (Лариам) Перорально: таблетки по 250 мг (228 мг основания)
Метронидазол (генерик, Флагил, др.) Перорально: таблетки по 250 и 500 мг Парентерально: порошок во флаконе для растворения перед инъекцией (флаконы по 500 мг); готовые к применению для инъекций флаконы (500 мг/100 мл) Рекгально: свечи.
Примечание-, не применяется в США
Паромомицин (Гуматин)
Перорально: капсулы по 250 мг
Пентамидина изетионат
Парентерально (Пентам 300): по 300 мг во флаконах для инъекций Ингаляционно (НебуПент): 300 мг на ингаляцию
Примахин (генерик)
Перорально: таблетки по 26.3 мг (эквивалентно 15 мг основания)
Прогуанил [хлорогуанид] (генерик, Палудрин) Перорально: таблетки по 100 мг Примечание- не применяется в США
Пириметамин (Дараприм)
Перорально: таблетки по 25 мг
Пириметамин/дапсон (Малоприм) Перорально: таблетки, содержащие 100 мг дапсона/12.5 мг пириметамина Примечание: не применяется в США
Хинакрин [мепакрин] (Атабрин НС1) Перорально: таблетки по 100 мг
Хинидина глюконат (генерик)
Парентерально: 80 мг/мл соли (50 мг/мл основания)
Хинина дигидрохлорид (генерик)
Примечание: не применяется в США
Хинина сульфат [83 % хинина-основания] (генерик)
Перорально: капсулы по 130,195,200,300, 325 мг; таблетки по 260 и 325 мг
Стибоглюконат
[натриевая соль глюкосурьмянистой кислоты] (Пентостам)
Примечание: В США можно приобрести только через Centers for Disease Control and Prevention, Atlanta, 404-639-3670
Триметоприм-сульфаметоксазол [ко-тримокса-зол, TMP-SMZ] (генерик, Бактрим, Септра) Перорально: таблетки по 80 мг ТМР/400 мг SMZ, 160 мг ТМР/800 мг SMZ Парентерально: 80 мг ТМР + 400 мг SMZ/5 мл для инфузий
Избранная литература
Bruce-Chwatt L. J. Doxycycline prophylaxis in malaria. Lancet, 1987: 2:1487.
Bryceson A. Therapy in man. In: The Leishmaniases. Peters W., Killick-Kendrick R. (eds). Academic Press, 1987.
Bryson H. M., Goa K. L. Halofantrine: A review of its antimalarial activity, pharmacokinetic properties and therapeutic potential. Drugs, 1992; 43: 236.
CDC. Health information for international travel 1992. Atlanta, Georgia: Public Health Service, U. S. Department of Health and Human Services; Publication No. (CDC), 92-8280.
CDC: Recommendation for the prevention of malaria among travelers. MMWR Morb. Mortal. Wkly Rep. 1990; 39: 1.
CDC: Treatment with guinidine gluconate of persons with severe Plasmodium falciparum infection: Discontinuation of parenteral guinine. From CDC Drug Service. MMWR Morb. Mortal. Wkly Rep. 1991; 40: 21.
Dombrowski M. P. et al. Intravenous therapy of metronidazole-resistant Trichomonas vaginalis. Obstet. Gytecol. 1987; 69: 524.
El-On J. et al. Topical treatment of cutaneous leishmaniasis. J. Invest. Dermatol. 1986; 87: 284.
Goldsmith R. S., Heyneman D. (eds). Tropical Medicine and Parasitology. Appleton & Lange, 1989.
Hoffman S. L. Diagnosis, treatment, and prevention of malaria. Med. North Am. 1992; 76:1327.
Keystone J. S. Prevention of malaria. Drugs, 1990; 39: 337.
Krogstad D. J., Schlesinger P. H., Gluzman I. Y. The specificity of chloroguine. Parasitology Today, 1992; 8: 183.
McAuley J. B. et al. Diloxanide furoate for treating asymptomatic Entamoeba histolytica cyst passers: 14 years’ experience in the United States. Clin. Infect. Dis. 1992; 15:464.
Peters W. Chemotherapy and Drug Resistance in Mala -ria, 2nd ed., 2 vols. Academic Press, 1987.
Rediscovering wormwood: Qinghaosu for malaria. (Editorial). Lancet, 1992; 339, 649.
Reed S. Amebiasis: An update. Clin. Infect. Dis. 1992; 14: 385.
Staler A. F. G. Chloroguine: Mechanisms of drug action and resistance in Plasmodium falciparum. Phar-macol.Ther. 1993; 57: 203.
White N.J. Drug treatment and prevention of malaria. Eur. J. Clin. Pharmacol. 1988; 34:1.
Клиническая фармакология противоглистных средств
Роберт С. Пэлдсмит
55
Химиотерапия глистных инвазий
Антигельминтные препараты используются для уничтожения или сокращения числа гельминтов, паразитирующих в кишечном тракте или тканях организма. Как указывалось в главе 53, эти паразиты имеют множество общих с хозяином биохимических и физиологических процессов, хотя существуют тонкие различия, являющиеся объектом фармакологического изучения. Большинство препаратов, описанных далее, открыты традиционными методами скрининга; механизм их действия стал понятен совсем недавно. Эти механизмы (если они известны) рассмотрены в главе 53.
В табл. 55-1 представлен перечень основных глистных инвазий и дана информация о препаратах выбора и альтернативных средствах для каждого вида заражения. Более подробно эти препараты рассмотрены в тексте.
Большинство используемых сегодня антигельминтных средств специфично по отношению к определенным паразитам, некоторые из них токсичны. Поэтому до начала лечения необходимо идентифицировать возбудителя заболевания. Обычно обнаруживают самих паразитов, их яйца или личинки в фекалиях, моче, крови, мокроте или тканях хозяина.
Прием антигельминтных средств
Если нет других указаний, препараты принимают внутрь с водой во время или после еды. После окончания курса лечения кишечных нематодных инвазий необходимо проводить повторные исследования кала в течение примерно 2 недель.
Дозирование у детей
Дозирование у младенцев и детей сложнее, чем у взрослых. Если препарат не назначают в миллиграммах на килограмм массы тела (или другим способом), дозу можно рассчитать по площади поверхности тела или как часть взрослой дозы по правилу Кларка или методом Янга (глава 61).
Противопоказания
Большинство антигельминтных препаратов противопоказано при беременности и язвах желудочно-кишечного тракта. Специальные противопоказания обсуждаются в тексте.
Албендазол
Албендазол относится к энтеральным антигельминтным средствам широкого спектра действия и применяется при заражении острицами, при аскаридозах, трихоцефалезах, стронгилоидозах и инвазиях обоими видами анкилостом. Албендазол является препаратом выбора при эхинококкозе и цистицеркозах. Хотя препарат не разрешен к применению в США, он может быть предоставлен производителем (SmithKline Beecham, 800-366-8900).
Химия и фармакокинетика
Албендазол представляет собой бензимидазола карбамат.
Албендазол
ТАБЛИЦА 55-1. Препараты для лечения глистных инвазий
Гельминт Препарат выбора Альтернативные средства
Круглые черви (нематоды)
Ascaris lumbricoides (аскарида) Пирантела памоат или мебен- Пиперазин, албендазол' или
дазол левамизол2
Trichuris trichiura (власоглав) Мебендазол Албендазол’ или оксантел/ пирантела памоат’
Necatoramericanus (анкилостома), Алсу- Пирантела памоат2 или мебен- Албендазол’ или левамизол2
lostoma duodenale (анкилостома) дазол
Комбинированная инвазия Ascaris, Trichuris и анкилостомами Мебендазол или албендазол1 Оксантела/пирантела памоат1
Комбинированная инвазия Ascaris и ан- Мебендазол и пирантела Албендазол1
килостомами памоат2
Strongyloidesstercoralis (кишечная угрица) Тиабендазол или ивермектин3,4 Албендазол1 или мебендазол3
Enterobius vermicularis (острица) Мебендазол или пирантела памоат Албендазол’
Trichinella spiralis (трихинеллез) Мебендазол2,3 или тиабендазол3, Албендазол3,5, в случае тяже-
в случае тяжелых инвазий до- лых инвазий добавить
бавить кортикостероиды кортикостероиды
Виды Trichostrongylus Пирантела памоат2 или мебендазол2 Албендазол’ или левамизол2
Кожные мигрирующие личинки нематод (перемещающиеся высыпания) Албендазол’ Тиабендазол
Висцеральные мигрирующие личинки Тиабендазол8 или албендазол’3 Мебендазол2,3,8 или ивермек-
нематод тин3,4
Angiostrongylus cantonensis Левамизол2,3 Албендазол1,5 или мебендазол2,3
Wuchereria bancrofti (филяриатоз); Brugia malayi (филяриатоз); тропическая эозинофилия; Loa loa (лоаоз) Диэтилкарбамазин6 Ивермектин3,7
Onchocerca volvulus (онхоцеркоз) Ивермектин7 Диэтилкарбамазин6 + сурамин7
Dracunculus medinensis (ришты) Метронидазол2 Тиабендазол2 или мебендазол2
Capillaria philippinensis (капиллярное кишечника) Трематоды Албендазол’ Мебендазол2 или тиабендазол2
Schistosoma haematobium (шистосомоз) Празиквантел Метрифонат1
Schistosoma mansoni Празиквантел Оксамнихин
Schistosoma japonicum Празиквантел Нет
Clonorchis sinensis (печеночная двуустка); Празиквантел2 Мебендазол2,3 или албенда-
виды Opistorchis зол1,3
Paragonimus westermani (легочная двуустка) Празиквантел2 Битионол7
Fasciola hepatica (печеночная двуустка Битионол7 Празиквантел2,8 или эметин или
овец) дегидроэметин7
Fasciolopsis buski (большая кишечная трематода) Празиквантел2 или никлосамид2 Тетрахлорэтилен’
Heterophyes heterophyes; Metagonimus yokogawai (малые кишечные трематоды) Празиквантел2 или никлосамид2 Тетрахлорэтилен1
ТАБЛИЦА 55-1. (Продолжение)
Гельминт Препарат выбора Альтернативные средства
Ленточные черви (цестоды)
Taenia saginata (бычий цепень) Diphyllobothrium latum (широкий лентец) Taenia solum (свиной цепень) Никлосамид или празиквантел2 Никлосамид или празиквантел2 Никлосамид2 или празиквантел2 Мебендазол2,3
Цистицеркоз (личиночная стадия свиного цепня) Албендазол5 Празиквантел2
Hymenolepis папа (карликовый цепень) Hymenolepis diminuta (крысиный цепень); Dipylidium caninum Празиквантел2 Никлосамид или празиквантел2 Никлосамид
Echinococcus granulosus (эхинококкоз); Echinococcus multilocularis Албендазол5 Мебендазол2
1 Не применяется в США, но используется в других странах.
3 Применяется в США, но по другим показаниям.
3 Эффективность не изучена.
4 В США распространяется через Merck Sharpe & Dohme. Телефон 215-397-2454.
5 В США распространяется только через SmithKline Beecham. Телефон 800-366-8900, Ext 5206.
6 В США распространяется через Lederle Laboratories. Телефон 914-735-5000.
7 В США распространяется только через Parasitic Disease Drug Service, Parasitic Disease Branch, Centers for Disease Control and Prevention, Atlanta 30333. Телефон 404-639-3670 в течение дня; 404-369-2888 по ночам, выходным и праздничным дням (только в экстренных случаях).
6 Низкая эффективность.
После энтерального приема албендазол быстро всасывается и метаболизируется преимущественно до албендазола сульфоксида и в меньшей степени — до других метаболитов. Примерно через 3 часа после энтерального приема 400 мг препарата концентрация сульфоксида в плазме достигает максимального уровня 250-300 нг/мл; период его полувыведения составляет 8-9 часов. Метаболиты выводятся в основном с мочой и в небольших количествах — с фекалиями. Всасывание препарата в 4 раза больше при приеме с жирной пищей, чем натощак.
Противоглистное действие
и другие фармакологические эффекты
А. Противоглистное действие. Албендазол блокирует захват глюкозы восприимчивыми паразитами на личиночной и взрослой стадиях развития, истощая запасы гликогена и ограничивая образование АТФ. В результате происходит иммобилизация и гибель гельминтов. Препарат дает личинко-цидный эффект при некаторозе и ооцидный эффект при аскаридозе, анкилостомозе и трихиуриазе (три-хоцефалезе). У некоторых видов животных препарат оказывает тератогенное и эмбриотокси-ческое действие.
Б. Фармакологическое действие на человека. Албендазол не оказывает фармакологического действия на человека при энтеральном приеме в терапевтических дозах (5 мг/кг).
Клиническое применение
Для избавления от кишечных паразитов албендазол лучше принимать на пустой желудок, а от тканевых паразитов — с жирной пищей.
А. Аскаридозы, трихоцефалез, инвазии анкилостомами и острицами. Для лечения инвазий острицами, анкилостомоза, легких степеней аскаридоза, некатороза или трихоцефалеза у взрослых и детей старше двух лет назначают 400 мг препарата внутрь однократно. В случае заражения острицами прием следует повторить через 2 недели. При инвазии острицами достигается 100 % эффект. При других гельминтозах наблюдается или полное излечение, или заметное снижение репродуктивной функции у оставшихся паразитов (по показателю числа яиц). Хотя до сих пор не определена оптимальная схема терапии для достижения высокого уровня излечивания тяжелых форм аскаридозов или удовлетворительного уменьшения зараженности глистами в случае умеренных и тяжелых нека-
торозов и трихоцефалезов, можно попробовать назначить препарат по 400 мг/день в течение 2-3 дней.
Б. Стронгилоидозы. Задачей терапии при строн-гилоидозе является полное освобождение от паразитов. Схема назначения албендазола для достижения этого эффекта не установлена. Можно попробовать принимать по 400 мг препарата два раза в день в течение 7-14 дней (во время еды). Препарат используют в программах массового лечения населения.
В. Эхинококкоз. Современная схема лечения предусматривает прием препарата по 800 мг/день во время еды в течение 28 дней; курс терапии повторяют три раза с интервалом в 2 недели между курсами. Результаты лечения 253 пациентов с печеночными цистами выглядят следующим образом: у 33 % больных — полное излечение (исчезновение или сморщивание), у 44 % — улучшение, у 21 % — без изменений и у 2 % — ухудшение. У 40 % пациентов с легочными цистами наблюдалось излечение, у 37 % — улучшение состояния, у 22 % — без изменений, у 1 % — ухудшение состояния. Рецидивы у этих пациентов при наблюдении в последующие 7 лет были редки. Костные цисты более рефрактерны к терапии. В настоящее время оценивается эффективность пре- и постоперационного использования албендазола с целью уменьшения риска рецидива, вызванного диссеминацией вследствие оперативного вмешательства.
Г. Нейроцистицеркозы. Консервативное лечение обычно предпочтительнее хирургического вмешательства и наиболее эффективно в отношении паренхиматозных цист, менее эффективно против внутрижелудочковых, субарахноидальных или гроздевидных цист и, вероятно, не оказывает действия на цисты, которые увеличиваются или кальцифицируются. В результате непродолжительных сравнительных испытаний (от 3 до 6 месяцев) было выявлено, что албендазол более эффективен, чем празиквантел, и является препаратом выбора. К другим преимуществам албендазола перед празиквантелом относятся его меньшая стоимость, лучшее проникновение в спинномозговую жидкость и тот факт, что при сопутствующем приеме кортикостероидов концентрация албендазола в плазме увеличивается, тогда как концентрация празиквантела — уменьшается. Рекомендуемый метод лечения состоит в приеме албендазола в сочетании с кортикостероидами; при неадекватной реакции назнача
ют курс лечения празиквантелом. Иногда лечение откладывают на 3 месяца в надежде на спонтанное исчезновение цист. Лечение следует проводить в стационаре.
Прием 15 мг/кг/день албендазола в течение восьми дней так же эффективен, как и 30-дневный курс. В течение нескольких дней после начала терапии отмечаются воспалительные реакции, обусловленные смертью паразитов, в виде головной боли (можно использовать аналгетики в случае умеренных симптомов), рвоты (применяют противорвотные средства), гипертермии, изменений психики и конвульсий; случаи декомпенсации с летальным исходом очень редки. Нет единого мнения по поводу того, назначать ли стероиды для избежания или ослабления этого реактивного воспалительного процесса или только в случае появления (нарастания) выраженной симптоматики. Воспалительная реакция может наблюдаться, даже если стероиды принимались заранее. Одна из применяемых схем рекомендует за 1-2 дня до назначения албендазола начать курс лечения преднизоном (30 мг/день в 2-3 приема) и продолжать его прием в меньших дозах еще 14 дней. Воспалительная реакция обычно спадает через 48-72 часа, при отсутствии улучшения требуется увеличить дозу стероидов, а также назначить маннитол. У 50 % больных наступает полное излечение (исчезновение цист и симптоматики); у остальных отмечается улучшение, в частности снижается внутричерепное давление и урежаются припадки.
Д. Другие виды инфекций. В дозе 200 мг два раза в день албендазол является препаратом выбора для лечения инвазий кожными мигрирующими личинками (ежедневный прием в течение 3-5 дней) и терапии кишечных капилляриозов (10-дневный курс). В дозе 400 мг два раза в день препарат эффективен при гнатостомозах (21-дневный курс) и трихинеллезах (15-дневный курс). В случае тяжелого течения трихинеллеза одновременно назначают 40 мг/день преднизолона в течение трех дней с последующей постепенной отменой препарата. При приеме албендазола в дозе 400 мг два раза в день в течение семи дней уровень излечения клонорхоза составляет 99 %, описторхозов — 33 % с заметным снижением репродуктивной функции у оставшихся паразитов (по показателю числа яиц). Имеются отдельные сообщения об эффективности препарата в лечении микроспоридиоза (Enterocytozoon bieneusi) и токсокароза, и спорные сообщения о его
эффективности при тениозе и в отношении эмбриогенеза у половозрелых паразитов при онхоцеркозе. У животных в эксперименте получены многообещающие данные о действии препарата при фас-циолезе и ангиостронгилезе.
Побочные эффекты
При приеме албендазола в течение 1-3 дней практически не наблюдается значительных побочных эффектов. Умеренные и преходящие неприятные ощущения в эпигастральной области, диарея, головная боль, тошнота, головокружение, утомляемость и бессонница отмечаются при приеме препарата у 6 % пациентов, а в двух клинических испытаниях с плацебо-контролем частота побочных эффектов в опытной и контрольной группах была практически одинаковой.
После 3-месячного курса лечения эхинококкоза наблюдали следующие токсические эффекты: обратимое увеличение аминотрансферазной активности у 17 % пациентов, желтуху у одного пациента, желудочно-кишечные симптомы (тошнота, рвота, боль в животе) у 4 %, облысение у 2 %, сыпь и зуд у 1% и лейкопению (< 2900 кл/мкл) у 2 %. У двух пациентов появилась заметная эозинофилия, вероятно, обусловленная истечением жидкости из цист. Продолжительное изучение токсичности на животных выявило, что такие эффекты, как диарея, анемия, гипотензия, подавление функции костного мозга и печени, видоспецифичны.
Противопоказания
и меры предосторожности
У детей до двух лет безопасность приема албендазола не изучалась. Поскольку препарат оказывает тератогенное и эмбриотоксическое действие у некоторых видов животных, его не следует принимать во время беременности. Возможно, препарат противопоказан при циррозе печени.
Соединения сурьмы
Препараты трехвалентной сурьмы в течение многих лет были основными средствами лечения шистосомоза (бильгарциоза), но из-за токсичности и сложности введения они больше не применяются. Глюконат пятивалентной сурьмы еще используется в терапии лейшманиоза (глава 54).
Битионол
Битионол — препарат выбора для лечения фас-циолеза (овечья печеночная двуустка), хотя относительно немного известно о степени его эффективности. Другие применяемые средства, эметин и дегидроэметин, являются токсичными, а празиквантел обычно неэффективен.
Битионол относится к альтернативным средствам лечения легочных парагонимозов. Проведение одного курса дает 90 % выздоровления. В случае острых церебральных парагонимозов обычно необходимо несколько курсов терапии, но препарат не используют при хронических церебральных парагонимозах. Характер действия битионола в отношении Paragonimus westermani не установлен.
Фармакокинетика
Максимальная концентрация битионола в крови достигается через 4-8 часов после приема. При ежедневном получении внутрь по 50 мг/кг тремя дробными дозами в течение пяти дней в сыворотке поддерживается уровень 50-200 мкг/мл. Препарат выводится главным образом почками.
Клиническое применение
Битионол используется для лечения парагони-моза и фасциолеза в дозах 30-50 мг/кг в два или три приема перорально после еды через день до получения 10-15 доз. При легочном парагонимозе троекратный отрицательный результат исследования мокроты и стула через 3 месяца после завершения лечения указывает на уничтожение паразитов. В пределах 4-6 месяцев на рентгенограмме грудной клетки в 75 % случаев исчезают нарушения.
Побочные реакции
Побочные эффекты, отмечающиеся у 40 % пациентов, являются в основном слабо выраженными и преходящими, но иногда их тяжесть требует прерывания терапии. К наиболее частым относятся диарея и абдоминальные спазмы; они уменьшаются или исчезают через несколько дней лечения. Могут также встречаться анорексия, тошнота, рвота, головокружение и головная боль. Зудящие ур
тикарные или папулезные кожные высыпания более редки и обычно возникают через одну и более недель терапии. Они, по-видимому, имеют аллергическую природу и являются результатом высвобождения антигенов из погибающих глистов. К другим редким реакциям относятся утомляемость, гипертермия, шум в ушах, бессонница, протеинурия и лейкопения. Реакции гиперчувствительности к препарату встречаются редко.
Противопоказания
и меры предосторожности
Битионол следует с осторожностью назначать детям до 8 Лет, потому что опыт использования препарата у больных этой возрастной группы ограничен. Лечение прекращают, если серия анализов функции печени и гематологические тесты выявляют возможное развитие токсического гепатита или лейкопении.
Лечение, очевидно, не ухудшает неврологическое состояние пациентов с церебральным параго-нимозом, но об этой возможности следует помнить и в случае необходимости начать терапию стероидами.
Диэтилкарбамазина цитрат
Диэтилкарбамазин является препаратом выбора для лечения филяриатоза, лоаоза и тропической эозинофилии. Препарат относится к альтернативным средствам терапии онхоцеркоза.
Химия и фармакокинетика
Диэтилкарбамазин является синтетическим производным пиперазина. Он выпускается в форме цитратной соли, содержащей 51 % активного вещества, которая быстро всасывается из желудочно-кишечного тракта. Минимальная эффективная концентрация в крови составляет 0.8-1 мкг/мл. Период полувыведения из плазмы равен 2-3 часам при кислой реакции мочи и примерно 10 часам, если реакция мочи щелочная. Препарат быстро усваивается всеми тканями, исключая жировую. Выводится в основном с мочой неизмененным и в виде метаболитов. Дозу препарата уменьшают для пациентов с постоянным защелачиванием мочи или нарушением функции почек.
Противоглистное действие и другие фармакологические эффекты
Диэтилкарбамазин обездвиживает микрофилярии (что приводит к их выведению из тканей) и изменяет их поверхностную структуру, делая их более чувствительными к разрушению с помощью защитных механизмов организма хозяина. Механизм действия диэтилкарбамазина в отношении взрослых гельминтов неизвестен.
In vivo и in vitro диэтилкарбамазин дает иммуносупрессивный эффект, механизм которого полностью не выяснен. В экспериментах на животных препарат не проявил тератогенных свойств.
Клиническое применение
Препарат следует принимать после еды.
A. Wuchereria bancrofti, Brugia malayi, Brugia timori, Loa loa. Диэтилкарбамазин, являясь препаратом выбора для лечения инвазий всеми этими видами паразитов, имеет высокую терапевтическую эффективность без серьезных токсических осложнений. Микрофилярии всех видов быстро гибнут; взрослые паразиты погибают медленнее, что часто требует проведения нескольких курсов лечения. Препарат высокоэффективен в отношении взрослой стадии вида L. loa, но степень его уничтожающего действия на половозрелые формы видов W. bancrofti, В. malayi неизвестна. Однако, если терапия адекватна, у большинства пациентов, у которых гельминты были уничтожены или полностью стерилизованы, микрофилярии вновь не появляются.
Эти инвазии излечиваются при приеме препарата по 2 мг/кг 3 раза в день в течение трех недель. При инвазии l¥. bancrofti для уменьшения частоты аллергических реакций на погибающих микрофилярий в первый день вводят разовую дозу (2 мг/кг), во второй день — две дозы, в третий и последующие дни — три дозы. Для лечения инфекций, вызы-ваемых L. loa (с риском энцефалопатии) или В. malayi, используют ту же схему дозирования, но можно начать с однократного приема 1 мг/кг в первый день и постепенно увеличивать дозу в последующие 5-6 дней.
Для ослабления аллергических реакций в первые 4-5 дней терапии диэтилкарбамазином можно назначить антигистаминные средства. При появлении тяжелых побочных реакций необходимо при
нимать кортикостероиды, а дозы диэтилкарбамази-на временно уменьшить или прервать прием.
Через несколько недель после окончания терапии необходимо сделать анализ крови на наличие микрофилярий. Курс лечения можно повторить через 3-4 недели. Для полного излечения иногда требуется несколько курсов в течение 1-2 лет.
Макрофилярицидный эффект диэтилкарбама-зина при прерывистом приеме (от еженедельного до ежемесячного) может быть более выражен, чем при ежедневном стандартном приеме. Препарат можно использовать и для профилактики: 300 мг еженедельно против лоаозов и 50 мг ежемесячно против филярий видов W. bancrofti, В. malayi.
Б. Onchocerca volvulus. Диэтилкарбамазин не эффективен в отношении взрослых форм гельминтов, но уничтожает микрофилярии (при монотерапии их число временно уменьшается). Для уничтожения половозрелых гельминтов необходим сочетанный прием с сурамином (токсичный препарат). Из-за высокой частоты возникновения и тяжести протекания побочных реакций во время приема ди-зтилкарбамазина при лечении онхоцеркозов препарат по этому показанию должен назначаться только специалистами, а лечение предпочтительнее проводить в стационаре. (Goldsmith, Heyneman, 1989.)
В. Тропическая эозинофилия. Диэтилкарбамазин назначается энтерально в дозе 2 мг/кг 3 раза в день в течение семи дней.
Г. Другие паразиты. Диэтилкарбамазин эффективен в отношении инвазий Mansonellastreptocerca-. препарат уничтожает и взрослых глистов, и микрофилярии. Имеются ограниченные данные о том, что препарат не оказывает действия на половозрелых Mansonella ozzardi или М. perstans и лишь незначительно действует на микрофилярии этих паразитов. Диэтилкарбамазин неэффективен в отношении Dirofilaria immitis.
Можно попробовать использовать диэтилкарбамазин при токсокарозе, но эффективность такой терапии не установлена. Препарат применяется для лечения инвазий, вызываемых Ascaris и кожными мигрирующими личинками, но предпочтение отдается другим средствам.
Д. Массовая терапия. Важным применением ди-этилкарбамазина является массовое лечение инфекции, вызванной W. bancrofti, с целью уменьшения ее передачи. Общая схема терапии состоит в приеме одной дозы каждую неделю или месяц до получения 12 доз. Часто побочные эффекты отбивают у людей
желание продолжать лечение. Однако введение препарата в малых дозах в качестве добавки к соли (он стабилен при приготовлении пищи) не вызывает побочных эффектов и оказывает микрофилярицидное и, возможно, макрофилярицидное действие.
Побочные реакции
А. Реакции, вызываемые препаратом. Реакции на диэтилкарбамазин слабо выражены и преходящи и начинаются в пределах 2-4 часов. Часто встречаются головная боль, недомогание, анорексия и слабость; тошнота, рвота, головокружение и сонливость наблюдаются реже.
Б. Реакции, вызываемые погибающими паразитами. У чувствительных пациентов побочные реакции развиваются в результате высвобождения чужеродных белков из погибающих микрофилярий или взрослых гельминтов. Обычно усиливаются эозинофилия и лейкоцитоз.
1. Реакции при онхоцеркозах. При онхоцеркозах у большинства пациентов развиваются дерматологические и офтальмологические побочные реакции, могут наблюдаться и системные реакции (Goldsmith, Heyneman, 1989). Побочные эффекты сильно выражены, особенно в случае тяжелых инфекций, сильного зуда или наличия микрофилярий в области глаз. Может наступить стойкое нарушение зрения.
2. Реакции, вызванные инвазиями W. bancrofti, В. malayi, L. loa. Реакции на погибающих микрофилярий обычно слабо выражены (у 25 % пациентов) при инвазиях W. bancrofti, более интенсивны в отношении В. malayi и иногда сильно выражены при заражении L. loa. Это лихорадка, недомогание, папулезная сыпь, головная боль, желудочно-кишечная симптоматика, кашель, боли в области груди и мышечные или суставные боли. Обычен лейкоцитоз, могут наблюдаться эозинофилия и протеинурия. В случае инвазии, вызываемой W. bancrofti, В. malayi, с наибольшей вероятностью симптомы появляются у пациентов с тяжелым заражением микрофиляриями, но могут возникать и у больных с очевидной амикрофиляремией. При лоаозе тяжелые реакции наиболее вероятны, если число микрофилярий превышает 50/мкл крови. Описаны кровоизлияния в сетчатку и редко — поражения центральной нервной системы, которые могут угрожать жизни.
Между третьим и двенадцатым днями лечения иногда наблюдаются местные реакции вблизи места нахождения погибающих взрослых и недоразви
тых гельминтов. При заражении W. bancrofti и В. malayi встречаются лимфангиты с локализованными припухлостями или узлами и лимфатические абсцессы. Небольшие волдыри появляются на коже в области умирающих глистов вида L. 1оа, а плоские папулы — при заражении М. streptocerca.
Противопоказания и меры предосторожности
Абсолютных противопоказаний к приему ди-этилкарбамазина не существует, но рекомендуется соблюдать осторожность пациентам с гипертензией и заболеваниями почек.
При подозрении на малярию больных следует вылечить до назначения диэтилкарбамазина, который может спровоцировать рецидив в случае бессимптомной малярийной инфекции.
Пациентов с приступами лимфангита вследствие заражения W. bancrofti или В. malayi лечат в периоды между приступами.
Эметина гидрохлорид
Эметин и дегидроэметин являются альтернативными средствами для лечения заражений, вызванных Fasciola hepatica. Оба препарата могут эффективно изгонять паразитов, но являются более токсичными, чем битионол (препарат выбора). Дегидроэметин, вероятно, менее токсичен, чем эметин. Основная фармакологическая информация, схема дозирования, показания и противопоказания по применению этих препаратов представлены в главе 54.
Ивермектин
Ивермектин является препаратом выбора для лечения онхоцеркоза. Его используют также в массовой терапии как безопасное и эффективное средство для уменьшения зараженности микрофиляриями. Ивермектин можно успешно использовать и для лечения других форм филяриатоза, стронги-лоидоза, а также для уничтожения кожных мигрирующих личинок.
Химия и фармакокинетика
Ивермектин, полусинтетический макроциклический лактон, является смесью авермектина В1а и Вн,. Его получают из почвенного актиномицета Streptomyces avermitilis.
Людям ивермектин назначают только перорально. Препарат быстро всасывается, достигая максимальной концентрации в плазме (около 50 мкг/л) через 4 часа после приема дозы 12 мг. Он широко распределяется по тканям (объем распределения составляет около 50 л), но медленно и в ограниченном количестве проникает в среды глаза. Период полувыведения равен 28 часам. Выводится почти исключительно с фекалиями.
Противоглистное действие и другие фармакологические эффекты
А. Антигельминтное действие. Известно, что ивермектин обездвиживает нематод и членистоногих (что может вызвать их смерть), усиливая ГАМК-ергическую передачу сигналов в периферических нервах (глава 53). Хорошо изучено микрофиляри-цидное действие ивермектина при онхоцеркозах. Кроме того, в недавних работах показано, что серии курсов лечения с 6-месячными и более интервалами приводят к медленной гибели некоторых взрослых гельминтов. При лечении однократной дозой препарат быстро действует на кожных микрофилярий и медленно (месяцы) — на микрофилярий передней камеры глаза. Ивермектин воздействует также на эмбриогенез у самок глистов (внутриутробное повреждение и дегенерация микрофилярий). В пределах 2-3 дней после приема дозы число кожных микрофилярий быстро уменьшается и остается низким около года. Неясно, что происходит при введении повторных доз ивермектина: необратимо ли стерилизуются (или убиваются) половозрелые гель-мирты или же препарат только обездвиживает микрофилярий, что облегчает их удаление ретикулоэндотелиальной системой хозяина.
Б. Фармакологическое действие у человека. Препарат не дает выраженных фармакологических или токсических эффектов у людей частично потому, что с трудом проникает через гематоэнцефалический барьер.
В экспериментах на животных установлено, что ивермектин имеет широкие границы безопасности. Однако введение высоких доз препарата мышам вызывает иногда необъяснимые случаи материнской смертности и тератогенный эффект.
Клиническое применение
А. Онхоцеркозы. Лечение состоит в энтеральном приеме одной дозы 150 мкг/кг с водой нато
щак. Его повторяют с интервалом в 6-12 месяцев, основываясь на уровне кожных микрофилярий. Однократный прием приводит к заметному уменьшению количества кожных микрофилярий, числа эозинофилов и устранению (через месяцы) микрофилярий из передней камеры глаза; у некоторых пациентов наблюдается улучшение течения заболевания переднего сегмента глаза и дерматитов. Долговременность эффекта повторного лечения при поражении заднего сегмента не определена.
При сравнительном изучении выявлено, что ивермектин так же эффективно, как и диэтилкарбамазин, уменьшает число микрофилярий в коже и передней камере, что определяет симптоматику заболевания, но имеет достоверно меньше системных и глазных побочных реакций. Более того, сниженное число микрофилярий дольше сохраняется. При сравнительном изучении были выявлены зрительные изменения (точечные кератиты, хо-риоретиниты и атрофия зрительного нерва) у пациентов, получавших диэтилкарбамазин, но не ин-вермектин.
Б. Филяриатоз, вызванный W. bancrofti. Сравнение ивермектина и диэтилкарбамазина показало, что оба препарата одинаково эффективно уменьшают зараженность микрофиляриями. В некоторых работах у препаратов обнаружены сходные слабо выраженные побочные эффекты (миалгия, головная боль, лихорадка), другие исследователи считают ивермектин более безопасным. Ивермектин удобно принимать по схеме однократной или двукратной дозы (после оценки очищающего эффекта дозы 20 мкг/кг дают дозу порядка 400 мкг/кг), но он оказывает минимальное макрофилярицидное действие, поэтому для уничтожения половозрелых гельминтов необходим прием диэтилкарбамазина.
В. Другие паразиты. Установлено, что ивермектин эффективен при заражении Mansonella ozzardi, но не дает эффекта при заражениях М. perstans. Однократная доза препарата частично уничтожает микрофилярий Brugia malayi при минимуме побочных эффектов. При лоаозе он может быть полезен пациентам с высокой степенью заражения микрофиляриями, у которых начальная терапия диэтил-карбамазином вызвала осложнения. Получены многообещающие результаты использования ивермектина как средства лечения стронгилоидозов: при применении однократной дозы 200 мкг/кг уровень излечения может превышать 90 %. Препарат, по-
видимому, эффективен и для лечения аскаридоза и, возможно, для уничтожения мигрирующих кожных личинок.
Побочные реакции
Побочный эффект ивермектина напоминает реакцию Мазотти. Максимальное ее проявление обнаруживается через 2 дня после приема однократной энтеральной дозы. Полагают, что реакция вызывается массовой гибелью микрофилярий, а не токсичностью препарата, тем более что ее интенсивность коррелирует с уровнем зараженности кожи паразитами. У туземного населения побочная реакция отмечается в 5-30 % случаев, но она обычно слабо выражена, непродолжительна и подавляется аспирином и антигистаминными средствами. Частота осложнения у взрослого эмигрантского населения (а, возможно, и у местных детей) выше. Реакция Мазотти включает лихорадку (иногда протекающую в течение нескольких дней), головную боль, головокружение, сонливость, слабость, сыпь, усиливающийся зуд, диарею, суставные и мышечные боли, гипотензию, тахикардию, лимфадениты, лимфангиты и периферический отек. Более интенсивно реакция протекает у 1-3 % людей, а тяжелое течение реакции с лихорадкой, гипотензией и бронхоспазмом — у 0.3 % людей. Может быть необходим прием стероидов в течение нескольких дней. Через 1-3 недели у больных отмечаются припухлости и абсцессы, предположительно в местах скопления половозрелых гельминтов.
Через несколько дней лечения у некоторых пациентов развивается точечное помутнение роговицы. К другим редким офтальмологическим реакциям (которые могут быть связаны и с самим заболеванием) относятся отек глазного века, передние увеиты, конъюнктивиты, кератиты, неврит глазного нерва, хориоретиниты и хориоидиты. Эти реакции обычно не бывают тяжелыми, не вызывают потери зрения и не требуют применения кортикостероидов.
Противопоказания
и меры предосторожности
Так как ивермектин увеличивает ГАМКергичес-кую активность, лучше избегать его сочетанного применения с другими препаратами со сходными эффектами, например барбитуратами, бензодиазе
пинами и вальпроевой кислотой. Ивермектин не следует назначать беременным. Безопасность приема препарата у детей до 5 лет не изучалась. Кормить грудью матерям, принимающим препарат, разрешается не ранее одной недели после приема последней дозы препарата.
Ивермектин нельзя вводить пациентам, у которых может быть нарушена проницаемость гематоэнцефалического барьера, например при менингите или африканской сонной болезни.
Левамизол
Левамизола гидрохлорид представляет собой синтетическое производное имидазотиазола и L-изомер D.L-тетрамизола. Он эффективно уничтожает Ascaris и Trichostrongylus и обладает умеренной эффективностью в отношении обоих видов анкилостом. Препарат доступен в США, но применяется только как вспомогательное иммуномодулиру-щее средство при лечении рака толстой кишки фторурацилом.
Мебендазол
Мебендазол — это синтетический бензимидазол, который обладает широким спектром антигельминтной активности и имеет низкую частоту появления побочных эффектов.
Мебендазол
Химия и фармакокинетика
При энтеральном приеме всасывается менее 10 % мебендазола. Препарат связывается с белками крови (> 90 %), быстро метаболизируется (главным образом, в печени) до неактивных метаболитов и выводится в основном с мочой в неизмененном виде или в форме декарбоксилированных производных в течение 24-48 часов. Кроме того, часть попавшего в кровь препарата и его дериватов выводится с желчью. Абсорбция улучшается, если препарат принимают с жирной пищей.
Противопаразитарное действие и другие фармакологические эффекты
Мебендазол подавляет синтез микротрубочек у нематод, что необратимо нарушает захват глюкозы (глава 53). В результате кишечные паразиты обездвиживаются или медленно умирают, их полное удаление из желудочно-кишечного тракта наступает только через несколько дней после лечения. Эффективность препарата варьирует в зависимости от скорости прохождения по желудочно-кишечному тракту, от интенсивности заражения, от того, был ли препарат разжеван, и, возможно, от вида паразита. Препарат уничтожает анкилостом, Ascaris и яйца Trichuris.
На человека мебендазол почти не действует. Нет свидетельств его канцерогенности или тератогенности. Однако у беременных крыс при однократном энтеральном введении в дозе 10 мг/кг препарат оказывал эмбриотоксическое и тератогенное действие.
Клиническое применение
В США мебендазол разрешен для применения при аскаридозе, трихоцефалезе и заражениях анкилостомами и острицами. Изучаются другие показания к его использованию.
Препарат можно принимать до или после еды; перед проглатыванием таблетку надо разжевать. Эффективность терапии уменьшается у пациентов с гипермоторикой желудочно-кишечного тракта. При лечении трихинеллеза, эхинококкоза и дракун-кулеза препарат лучше принимать с едой, содержащей жиры, для увеличения всасывания.
А. Заражение острицами. Мебендазол назначают однократно в дозе 100 мг и повторяют прием через две и четыре недели. Детям и взрослым дают одинаковую дозу. Уровень излечения находится между 90 % и 100 %.
Б. Ascaris lumbricoides, Trichuris trichiura, анкилостомы, Trichostrongylus. Взрослым и детям старше 2 лет назначают по 100 мг два раза в день в течение трех Дней. Лечение можно повторить через 2-3 недели. Применения слабительных средств ни до, ни после лечения не требуется. Аскаридоз и три-хоцефалез излечиваются в 90-100 % случаев. Эффективность препарата при заражении анкилостомами обоих видов ниже (70-95 %), но количество глистов у невылечившихся пациентов заметно
уменьшается. Особенно показан мебендазол при смешанных заражениях этими паразитами.
В. Эхинококкоз. Препаратом выбора является албендазол. Мебендазол относится к альтернативным средствам. Судя по уровню излечения, он менее эффективен, чем албендазол. Кроме того, из-за плохой всасываемости препарата необходимы высокие суточные дозы. Результаты терапии мебендазолом очень вариабельны. При его приеме у большинства пациентов выявлено субъективное улучшение состояния, а у некоторых пациентов уменьшение количества цист. Тем не менее иногда даже после продолжительного курса лечения цисты сохраняли жизнеспособность и продолжали расти. Непредсказуемость концентрации препарата в плазме также вносит свой вклад в вариабельность ответа. Одна из схем лечения состоит в приеме 50 мг/кг тремя дробными дозами ежедневно в течение трех месяцев. Желательно наблюдать за содержанием мебендазола в крови. Для уничтожения паразитов необходимо, чтобы концентрация препарата в сыворотке через 1-3 часа после перорального приема превышала 100 нг/мл.
Г. Другие инвазии. Мебендазол используют в альтернативной терапии кишечного капилляриоза. С этой целью его назначают по 400 мг/день за несколько приемов в течение 21 дней и более.
При трихинеллезе препарат проявляет некоторую активность против половозрелых гельминтов в кишечном тракте, мигрирующих личинок и личинок в мышцах. Рекомендуется следующая ежедневная схема лечения для взрослых: сначала 600 мг, затем ступенчатое увеличение дозы в тече-ниетрех дней до 1200-1500 мг и продолжение приема максимальной дозы в течение десяти дней. Ежедневную дозу делят на три приема.
Мебендазол в дозе 300 мг два раза в день в течение трех дней с различной степенью эффективности применялся для лечения тениоза. При заражении Taenia solium теоретически мебендазол обладает преимуществом перед никлосамидом, так как проглоттиды после терапии мебендазолом изгоняются интактными.
При назначении стандартной 3-дневной терапии уровень излечения стронгилоидозов обычно не превышает 50 %, поэтому исследуются возможности применения более высоких доз и более продолжительных курсов терапии.
Эффективность препарата при лечении дракун-кулеза варьирует и требует дальнейшего изучения.
Исследуется результативность использования мебендазола и его сочетания с левамизолом для лечения филяриатоза, лоаоза, онхоцеркоза и заражений Mansonella perstans. При инвазиях Angyo-strongylus cantonensis и висцеральными мигрирующими личинками мебендазол можно применять по 200-400 мг дробными дозами 5 дней; в случае гна-тостомоза назначают по 200 мг каждые 3 часа в течение шести дней.
Побочные реакции
Прием низких доз мебендазола в течение 1-3 дней при противонематодной терапии кишечника почти не вызывает побочных эффектов даже у ослабленных пациентов. Изредка отмечаются умеренная тошнота, рвота, диарея и боль в абдоминальной области. Чаще эти эффекты наблюдаются у детей с большим количеством паразитов вида Ascaris. Легкая головная боль, головокружения и реакции гиперчувствительности (сыпь, крапивница) появляются редко. Описан выход аскарид через рот и нос у детей до 5 лет.
Редкие побочные эффекты, вызванные приемом больших доз мебендазола при лечении эхинококкоза, включают зуд, сыпь, эозинофилию, обратимую нейтропению, мышечно-суставную боль, лихорадку и острую боль в области нахождения цист. Некоторые из этих признаков могут наблюдаться из-за высвобождения антигена из цист или их разрывов. Описаны также раздражение желудка, кашель, временные нарушения функции печени, облысение, гломерулонефрит и редкие случаи агранулоцитоза, вызванного препаратом (со смертельным исходом).
Противопоказания
и меры предосторожности
Следует помнить, что при тяжелых паренхиматозных заболеваниях печени мебендазол очень медленно метаболизируется. Он противопоказан во время первого триместра беременности, а в поздние сроки предпочтительнее использовать альтернативные средства. Препарат с осторожностью назначают детям в возрасте до 1 года из-за ограниченного опыта такого применения и полученных данных о возникновении конвульсий у детей этой возрастной группы. Прием в сочетании с карбамазепином может снизить концентрацию мебендазола в плазме и
его эффективность, а сопутствующее использование циметидина нередко увеличивает содержание препарата в крови.
Метрифонат
Метрифонат — дешевое и безопасное альтернативное средство для лечения инвазий Schistosoma haematobium. Препарат неактивен в отношении S. mansoni и S.japonicum. В США не применяется.
Химия и фармакокинетика
Метрифонат относится к фосфорорганическим соединениям. Он быстро всасывается после приема внутрь. Максимальная концентрация препарата в крови достигается через 1-2 часа после приема стандартной энтеральной дозы. Период полувыведения метрифоната составляет около полутора часов. Клиренс осуществляется через неферментативное превращение до дихлорвоса, его активного метаболита, содержание которого в плазме приближается к 1 % от уровня метрифоната. Препарат и его метаболиты хорошо распределяются в тканях и полностью выводятся из организма через 24-48 часов.
Противопаразитарное действие и другие фармакологические эффекты
Метрифонат оказывает противопаразитарное действие после биотрансформации до дихлорвоса. Механизм действия дихлорвоса на зрелую и незрелую стадии S. haematobium не установлен, но полагают, что он частично связан с его способностью ингибировать холинэстеразу паразитов. Подавление активности холинэстеразы временно парализует половозрелых гельминтов, что вызывает их перемещение из венозного сплетения мочевого пузыря в малые артериолы легких, где они инкапсулируются и погибают. Препарат не убивает яйца гельминтов S. haematobium, поэтому они будут выходить с мочой еще в течение нескольких месяцев после того, как все половозрелые особи гельминтов будут уничтожены.
В терапевтических дозах метрифонат не вызывает у людей нежелательных физиологических или химических нарушений, исключая ингибирование активности холинэстеразы. Энтеральный прием 7.5-12.5 мг/кг метрифоната почти полностью ингибирует бутирилхолинэстеразу плазмы и заметно
уменьшает (приблизительно на 50 %) активность эритроцитарной ацетилхолинэстеразы. Восстановление холинэстеразы плазмы (на 70 % или более) обычно наступает через две недели, а полное — через четыре недели, а вот восстановление активности фермента эритроцитов может занять до 15 недель.
Метрифонат или, возможно, примеси, связанные с его производством, проявляют слабую мутагенность в прямой тестовой системе на Salmonella typhimurium. Он вызывает мутации у Escherichia coli, но не увеличивает частоту хромосомных нарушений у животных или человека. Токсическое действие препарата на репродуктивные функции не подтвердилось, за исключением предположения о нарушении сперматогенеза.
Клиническое применение
Для лечения инвазий S. haematobium назначают разовую дозу 7.5-10 мг/кг внутрь 3 раза с интервалом в 14 дней. Уровень излечения больных по этой схеме колеблется от 44 до 93 %, при этом заметно уменьшается число яиц гельминтов у неизлечив-шихся пациентов.
Метрифонат проявил также эффективность как профилактическое средство при назначении ежемесячно детям из эндемичных областей. Препарат используют в программах массового лечения. При смешанных инвазиях S. haematobium и S. mansoni метрифонат успешно комбинируют с оксамнихи-ном.
Побочные эффекты
В некоторых исследованиях применения метрифоната не было выявлено побочных эффектов, в других отмечены умеренные и преходящие холинергические симптомы, в том числе тошнота и рвота, диарея, боль в абдоминальной области, бронхоспазм, головная боль, потливость, утомляемость, слабость, головокружение. Эти симптомы могут появиться через 30 минут после приема лекарства и сохраняться до 12 часов. Препарат хорошо переносится пациентами с прогрессирующей гепатоспленальной стадией заболевания.
Был выявлен только один случай типичного фосфорорганического отравления после приема стандартной дозы, при этом пациент хорошо отреагировал на применение атропина.
П роти воп оказан и я
и меры предосторожности
Метрифонат не следует использовать после недавнего контакта с инсектицидами или приема препаратов, которые могут потенцировать подавление активности холинэстеразы. Следует избегать применения миорелаксантов в течение 48 часов после приема препарата. Метрифонат противопоказан при беременности.
Никлосамид
Никлосамид — это препарат выбора для лечения большинства инвазий ленточными червями.
Химия и фармакокинетика
Никлосамид является производным салицил-амида. Считают, что он в минимальной степени всасывается из желудочно-кишечного тракта: ни препарат, ни его метаболиты не определяются в крови или моче.
Противоглистное действие и фармакологические эффекты
После перорального приема ни у животных, ни у человека не было обнаружено гематологических, почечных или печеночных нарушений.
При контакте с никлосамидом быстро уничтожаются сколексы и сегменты цестод, но не их яйца. Это, вероятно, происходит из-за подавления препаратом окислительного фосфорилирования или вследствие стимуляции АТФазы. Со смертью паразита сколекс отцепляется от кишечной стенки и начинается переваривание сегментов.
Канцерогенный и мутагенный потенциал препарата полностью не изучен. У человека выявлено дозозависимое увеличение кластогенеза лимфоцитов и увеличение частоты хромосомных аберраций. Моча мышей, получавших никлосамид, обладает мутагенными свойствами в тесте Эймса.
Клиническое применение
Терапевтическая доза у взрослых составляет 2 г препарата (4 таблетки по 500 мг). Детям с массой тела более 34 кг назначают 3 таблетки, 11-34 кг — 2 таблетки; до 11 кг — 1 таблетку. Никлосамид при
нимают утром на пустой желудок. Таблетки следует тщательно разжевать и проглотить, запивая водой. Маленьким детям таблетки размельчают до порошка и смешивают с водой. Пищу можно принимать через 2 часа. Нет необходимости в назначении слабительных для изгнания глистов после лечения, исключение составляют пациенты с хроническими запорами. Об эффективности терапии с помощью обнаружения сколексов в кале судить трудно, так как сколексы и проглоттиды могут быть частично переварены. При лечении больных с нормальной перистальтикой, зараженных большими ленточными червями, сегменты могут продолжать выходить в течение нескольких дней.
А. Т. saginata (бычий цепень), Т. solium (свиной цепень), Diphyllobothrium latum (широкий лентец). Однократная доза никлосамида вызывает излечение более чем на 85 % при заражении D. latum и приблизительно 95 % при заражении Т. saginata. Препарат, вероятно, примерно так же эффективен в отношении Т. solium, но в этом случае через 2 часа после лечения необходимо принять слабительное (например, 15-30 г магния сульфата) для выведения всех зрелых сегментов перед тем, как могут выделиться яйца. За пациентом нужно наблюдать, чтобы контролировать эвакуацию. После лечения инвазий Т. solium теоретически возможно возникновение цистицеркозов, поскольку вслед за перевариванием сегментов в просвет кишки высвобождаются жизнеспособные яйца. Тем не менее за два десятилетия применения препарата не было выявлено случаев цистицеркоза. Если в ходе терапии тенио-за сколекс не был обнаружен или его поиск не проводился, излечение можно считать окончательным в случае отсутствия восстановленных сегментов цепня через 3-5 месяцев.
Б. Hymenolepis папа (карликовый цепень). Препаратом выбора является празиквантел. -Никлосамид же эффективен в отношении половозрелых паразитов в просвете кишечника, но не уничтожает цистицерки, находящиеся в ворсинках. Поэтому для обеспечения успеха терапии препарат необходимо принимать до тех пор, пока все цистицерки не выйдут в просвет кишечника (около четырех дней). Таким образом, минимальный курс лечения равен семи дням; некоторые врачи повторяют его через 5 дней. Показатель эффективности излечения никлосамидом близок в данном случае к 75 %.
В. Другие ленточные черви. Обнадеживающие результаты были получены при лечении инвазий
Hymenolepis diminuta и Dipylidium camnum. Большинство пациентов излечивается при 7-дневном курсе терапии, лишь немногим требуется повторный курс. Никлосамид не помогает при цистицеркозах или эхинококкозе.
Г. Кишечные инвазии трематодами. Никлосамид применяют как альтернативное средство при инвазиях Fasdolopsis buski, Heterophyes heterophyes и Metagonimusyokogawai. Стандартную дозу назначают через день до получения трех доз.
Побочные реакции
Побочные реакции возникают редко, умеренно выражены и преходящи. Тошнота, рвота, диарея, дискомфорт в абдоминальной области обнаруживаются менее чем у 4 % пациентов. Наблюдаются головная боль, кожные высыпания, крапивница, зуд заднего прохода и головокружение, которые частично связаны с высвобождением антигенной субстанции из перевариваемых паразитов.
Противопоказания
и меры предосторожности
Следует избегать потребления алкоголя в день приема препарата и на следующий день.
Противопоказаний к приему никлосамида нет. Безопасность его применения у детей до двух лет не оценивалась. Результаты экспериментального изучения влияния лекарства на репродуктивную функцию отрицательны, но адекватных исследований его действия на течение беременности женщин не проводилось.
Оксамнихин
Оксамнихин является препаратом выбора для лечения инвазий S. mansoni. Он широко используется и для массовой терапии. Препарат не действует на S. haematobium или S.japonicum.
Фармакокинетика
Оксамнихин — Это полусинтетический тетрагидрохинолин. Он быстро всасывается при приеме внутрь и не вводится внутримышечно, так как вызывает интенсивные и продолжительные боли в месте инъекции. После приема терапевтических доз время его полувыведения из плазмы составляет
около 2.5 часов. Препарат большей частью метаболизируется до неактивных метаболитов и выводится главным образом с мочой.
Отмечается существенная индивидуальная изменчивость концентрации оксамнихина в плазме, что может объяснить некоторые неудачи в лечении. Для уменьшения побочных эффектов препарат принимают с едой, но это замедляет всасывание препарата.
Противоглистное действие и другие фармакологические эффекты
Оксамнихин активен в отношении обеих стадий развития S. mansoni (зрелой и незрелой), но, по-видимому, не дает церкарицидного эффекта. Хотя точный механизм действия препарата неизвестен, он может опосредоваться связыванием с ДНК. В результате паралича гельминты отрываются от терминальных венул брыжейки и перемещаются в печень, где многие погибают, а выжившие самки прекращают откладывать яйца. Препарат не оказывает иммунорегулирующего действия на формирование гранулемы вокруг яиц.
Разновидности S. mansoni в различных странах света варьируют по чувствительности к дозе лекарства. Хотя в эксперименте у мышей можно вызвать резистентность S. mansoni к оксамнихину, при лечении людей этот феномен не обнаружен.
Клиническое применение
Оксамнихин, действующий только в отношении S. mansoni, безопасен и эффективен на всех стадиях заболевания, включая прогрессирующую гепато-спленомегалию. Лечение ослабляет симптоматику при остром синдроме (Катаяма) и в дальнейшем подавляет развитие инфекции.
Препарат обычно менее эффективен у детей, для лечения которых требуются более высокие дозы, чем для взрослых. Он лучше переносится, если принимается с пищей. Интервалы между приемами в течение дня должны составлять 6-8 часов.
Оптимальная схема лечения варьирует в разных регионах мира. В Западном полушарии и Западной Африке доза для взрослых составляет 12-15 мг/кг однократно (детям до 30 кг — 10 мг/кг дважды за один день). В Северной и Южной Африке назначают 15 мг/кг два раза в день в течение двух дней (де
тям с массой тела до 30 кг — два раза в день в течение двух-трех дней). В Восточной Африке и странах Аравийского полуострова прописывают по 15-20 мг/кг на один день в 2 приема. Уровень излечения составляет 70-95 %, при этом у неизлечивших-ся пациентов заметно уменьшается экскреция яиц.
При смешанных инвазиях 5. mansoni и S. haematobium оксамнихин успешно применяют в комбинации с метрифонатом. Выявлена активность ок-самнихина для супрессивной профилактики у животных, у человека пока эти данные не подтверждены.
Побочные реакции
Опыт применения препарата у миллионов пациентов позволяет говорить об отсутствии заметной токсичности. Однако умеренные симптомы, проявляющиеся через 3 часа после приема лекарства и продолжающиеся в течение нескольких часов, встречаются более чем у одной трети пациентов. Наиболее общими являются симптомы со стороны центральной нервной системы (головокружение, головная боль, сонливость). Описаны также тошнота и рвота, диарея, колики, зуд и крапивница. К нечастым побочным эффектам относятся лихорадка, изменение цвета мочи от оранжевого до красного, протеинурия, микрогематурия и временное уменьшение числа лейкоцитов и лимфоцитов. Судорожные припадки редки и обычно наблюдаются в пределах нескольких часов после приема, прежде всего у людей с припадками в анамнезе. Иногда появляются бессонница, амнезия, изменения в поведении и галлюцинации.
Увеличение активности ферментов печени, эозинофилия, преходящие легочные инфильтраты (иногда сопровождающиеся хрипами и кашлем), крапивница и лихорадка (особенно в Египте), которые возникают через несколько дней (до 1 месяца) после лечения, приписывают гибели паразитов и высвобождению антигенов, а не прямому токсическому эффекту препарата.
Оксамнихин проявляет в некоторой степени мутагенные свойства в тестовой системе на S. ty-phimurium и в опытах на мышах, но у других животных и человека хромосомные нарушения не обнаружены. Установлено, что оксамнихин дает эмбрио-цидный эффект у кроликов и мышей при использовании доз, эквивалентных 10-кратным дозам для человека.
Противопоказания
и меры предосторожности
Считается целесообразным наблюдать за пациентом около трех часов после приема препарата для того, чтобы обнаружить признаки возможных нарушений со стороны центральной нервной системы. Пациентов с эпилепсией в анамнезе госпитализируют для лечения или назначают им альтернативную терапию. Так как при приеме препарата многие больные страдают от головокружения и сонливости, его следует использовать с осторожностью (например, не водить машину в течение суток) тогда, когда требуется реакция и внимание. Оксамнихин противопоказан при беременности.
Оксантела памоат
и оксантела/пирантела памоат
Производное тетрагидроксипиримидина оксантела памоат (метаоксифеноловый аналог пиранте-ла памоата) эффективен только при трихоцефале-зе. Поскольку трихоцефалез развивается как множественная инвазия в сочетании с другими передающимися через почву гельминтами, оксантел производится сейчас в комбинации с пирантела памо-атом, который активен в отношении Ascaris и анкилостом. Ни оксантел, ни оксантел/пирантел не дают эффекта при стронгилоидозах. Эти препараты не применяются в США.
Пиперазин
Соли пиперазина являются альтернативным средством терапии аскаридозов. Уровень излечения составляет около 90 % при назначении препарата в течение двух дней. Пиперазин не используют для лечения больных анкилостомозом, трихоцефалезом или стронгилоидозом. Его больше не рекомендуют принимать при энтеробиозе, потому что требуется 7-дневный курс лечения.
Химия и фармакокинетика
Пиперазин выпускается в форме гексагидрата (который содержит около 4 % основания) и в виде разнообразных солей: цитрата, фосфата, адипината, тартрата и других.
Препарат быстро всасывается из желудочно-кишечного тракта, максимальная концентрация в плазме достигается через 2-4 часа. Большая его часть выводится в неизмененном виде с мочой через 2-6 часов, полное выведение осуществляется в пределах 24 часов.
Противоглистное действие
и другие фармакологические эффекты
При пероральном приеме в терапевтических дозах пиперазин почти не оказывает фармакологического действия на организм хозяина. У добровольцев, принимавших терапевтические дозы пиперазина, в содержимом желудка и моче был обнаружен потенциально канцерогенный нитрозаминовый метаболит — N-мононитрозопиперазин. Значение этих данных еще предстоит уточнить.
Пиперазин вызывает паралич у аскарид, блокируя ацетилхолиновую передачу в нервно-мышечных соединениях. Похожее (но более слабое) блокирующее действие на нервно-мышечную передачу он оказывает и в скелетных мышцах млекопитающих. Парализованные пиперазином аскариды не способны удерживаться в организме человека и изгоняются с помощью нормальной кишечной перистальтики.
Клиническое применение
Для лечения аскаридозов пиперазин (в виде гексагидрата) принимают внутрь в дозе 75 мг/кг (максимальная доза 3.5 г) 2 дня подряд, до или после завтрака. При тяжелых инвазиях лечение следует продолжить в течение 3-4 дней или повторить через неделю. Слабительные средства не применяются ни до, ни после лечения. При нехирургических способах лечения кишечной непроходимости, вызванной тяжелым заражением Ascaris, сироп пиперазина вводят через кишечную дренажную трубку.
Побочные эффекты
Имеется большая разница между терапевтическими и токсическими дозами пиперазина. Иногда проявляются умеренно выраженные побочные эффекты, такие как тошнота, рвота, диарея, боль в абдоминальной области и головная боль. При приеме в высоких дозах редко, но встречаются нейротоксические осложнения (сонливость, головокруже
ния, атаксия, судороги, хорея и др.). У пациентов с эпилепсией могут обостриться припадки. Пиперазин является потенциальным аллергеном. В редких случаях через 2-4 дня после начала терапии наблюдали синдром, подобный сывороточной болезни (крапивница, пурпура, лихорадка, экзематозные кожные реакции, бронхоспазм).
Противопоказания
и меры предосторожности
Пиперазиновые соединения не следует назначать пациентам с нарушениями функций почек и печени, с эпилепсией или хроническим неврологическим заболеванием в анамнезе. Нельзя сочетать прием пиперазина и фенотиазинов. Необходимо соблюдать осторожность при лечении пациентов с нарушением питания и с анемией. В связи с частичным превращением в нитрозамин беременным женщинам препарат дают только при наличии четких показаний и недоступности альтернативного средства.
Празиквантел
Празиквантел эффективен для лечения всех видов шистосомозов и большинства других трематод-ных и цестодных инвазий, включая цистицеркозы. Безопасность и эффективность препарата при однократном энтеральном приеме в антигельминтной дозе позволяют проводить массовое лечение различных инвазий. Празиквантел не эффективен в отношении Fasciola hepatica и при эхинококкозах. В США препарат предназначается пока только для лечения шистосомозов, но является препаратом выбора (как лекарство, проходящее клинические испытания) при многих других инвазиях цестода-ми и трематодами.
Химия и фармакокинетика
Празиквантел — это синтетическое производное изохинолин-пиразина. Препарат следует хранить при температуре ниже 30 °C. Он быстро всасывается, биодоступность после энтерального приема составляет около 80 %. Максимальная концентрация неизмененного препарата в сыворотке 0.2-2 мкг/мл достигается через 1-3 часа после приема терапевтической дозы. Примерно 80 % препарата связывается с белками плазмы. Содержание празиквантела в
спинномозговой жидкости равно 14-20 % от концентрации препарата в плазме, а в желчи, грудном молоке и фекалиях — 10-20 %. Большая часть препарата быстро метаболизируется до неактивных моно-и полигидроксилированных продуктов после первого прохождения через печень; период его полувыведения составляет 0.8-1.5 часа, а метаболитов — 4-6 часов. Празиквантел выводится преимущественно через почки (60-80 %) и с желчью (15-35 %).
Фармакологические эффекты
У человека не выявлено существенных изменений в биохимических или гематологических тестах. Иногда наблюдается временное увеличение показателей функциональных тестов печени или некоторые электрокардиографические изменения, но значительных поражений жизненно важных органов не обнаруживается. В случае тяжелой дисфункции печени концентрация препарата в плазме возрастает.
У животных в эксперименте не отмечалось никаких эффектов до 100-кратного увеличения терапевтической дозы, когда начинали проявляться признаки токсического действия на центральную нервную систему.
Всестороннее изучение мутагенности, канцерогенности, эмбриотоксичности и тератогенности препарата дало отрицательные результаты. Однако в единичном исследовании (не подтверждено другими авторами) утверждается, что празиквантел и его метаболит, выделенный из мочи, действуют как мутаген или комутаген в тестовых системах S. typhimurium и клеток млекопитающих. Напротив, по последним данным, празиквантел не представляет токсической опасности для генетического аппарата.
Противоглистное действие
Пороговая терапевтическая концентрация празиквантела в сыворотке составляет приблизительно 0.3 мкг/мл. Несмотря на незначительное время полувыведения, празиквантел является активным средством, тогда как его метаболиты не проявляют активности. Однако очевидно, что для уничтожения тканевых паразитов необходимы также антитела к ним, вырабатываемые в организме хозяина.
Действие празиквантела in vitro на всех плоских червей одинаково: препарат увеличивает про
ницаемость клеточной мембраны для кальция, приводя к заметным сокращениям мускулатуры гельминта, за которыми следует паралич. Происходит вакуолизация и дезинтеграция наружных покровов, что приводит к смерти паразита. Хотя гельминты F. hepatica всасывают препарат, он не оказывает на них никакого действия и инвазия не излечивается.
На модели экспериментального шистосомоза показано, что празиквантел эффективен как в отношении половозрелых гельминтов, так и незрелых гельминтов. Половозрелые шистомы быстро иммобилизируются и затем пассивно перемещаются к печени. При сочетанном введении животным празиквантела в высокой дозе с церкариями в количестве, достаточном для инвазии, все незрелые формы гельминтов уничтожаются, следовательно, празиквантел дает профилактический эффект.
Клиническое применение
Таблетки празиквантела принимают с жидкостью после еды; их необходимо немедленно проглатывать без разжевывания, потому что горький вкус может вызвать позывы на рвоту. Если предусмотрен прием препарата более чем один раз в день, интервал между дозами должен составлять 4-8 часов.
А. Шистосомоз. Празиквантел является препаратом выбора при всех формах шистосомоза. Его принимают по 20 мг/кг с интервалами 4 -6 часов до получения трех доз. В некоторых регионах были эффективны и другие схемы лечения, предусматривающие уменьшение суммарной дозы: 40 мг/кг однократно в отношении 5. haematobium и 40 мг/кг, разделенных на два введения, в отношении S. mansoni. Высокий уровень излечения достигается, когда пациентов наблюдают в течение 3-6 месяцев; даже у не излечившихся полностью пациентов заметно уменьшается число яиц гельминтов» Препарат эффективен у взрослых и детей и в целом хорошо переносится пациентами с гепатоспленальной стадией развития заболевания. Однако неясно, можно ли безопасно использовать препарат во время острой стадии заболевания (лихорадка Катаяма), потому что высвобождение антигенов из неполовозрелых умирающих гельминтов может привести к обострению симптомов. Применение препарата в профилактических целях не изучалось. При шистосомозах резистентность к празиквантелу, видимо, не развивается.
Б. Клонорхоз и описторхоз. Назначение празиквантела по 25 мг/кг 3 раза в день в течение дня при заражении Opisthorchis и в течение двух дней при клонорхозе приводит к почти 100 % излечению.
В. Парагонимоз. При приеме препарата в дозе 25 мг/кг 3 раза в день в течение двух дней эффективность лечения больных легочным парагонимо-зом составляет 89-100 %.
Г. Тениоз и дифиллоботриоз. При инвазии Т. saginata и Т. solium разовый прием 10 мг/кг празиквантела приводит к излечению в 97-100 % случаев. В областях эндемического распространения цистицеркоза может быть более безопасно при равной эффективности использование дозы 2.5 мг/кг. Единичная доза 25 мг/кг дает примерно такие же результаты при инвазиях D. latum. Обычно в пределах 24-48 часов после приема лекарства распадающиеся гельминты выводятся посредством нормальной перистальтики. Нет необходимости принимать слабительные средства до или после лечения. Если сколекс не был найден или его поиск не проводился, излечение можно считать полным только при отсутствии регенерировавших сегментов через 3-5 месяцев после терапии. Для избавления от Т. solium рекомендуется прием эффективного слабительного (например, 15-30 г магния сульфата) через 2 часа после лечения для выведения всех зрелых сегментов до того, как произойдет высвобождение яиц из разрушающихся сегментов. Поскольку празиквантел не уничтожает яиц, теоретически возможно, что личинки, вылупившиеся из яиц в толстой кишке, могут проникнуть в кишечную стенку и вызвать цистицеркоз. Однако, как и при использовании никлосамида, этот риск, вероятно, минимален.
Д. Нейроцистицеркоз. Нейроцистицеркоз необходимо лечить в стационаре при участии врачей-неврологов. По показаниям к применению, мерам предосторожности, возможности сочетания с кортикостероидами и результатам лечения празиквантел сходен с албендазолом. Однако, как уже обсуждалось, предпочтение отдается албендазолу. Празиквантел принимают в дозе 50 мг/кг/день, разделенной натри приема, в течение 14 дней. При наличии соответствующего оборудования целесообразно измерять концентрацию препарата в крови. В случае успеха терапия заканчивается излечением: пропадает симптоматика, обнаруживаются изменения цист на церебральных томограммах (исчезновение, уменьшение в размере или кальцификация),
отсутствуют патологические изменения в спинномозговой жидкости. У других больных наблюдается заметное улучшение, включающее снижение церебральной гипертензии и ослабление судорожных припадков. Тем не менее иногда заболевание не поддается терапии и продолжает прогрессировать.
Е. Н. папа. Празиквантел является препаратом выбора для лечения инвазий Н. папа и по сути дела первым высокоэффективным средством при этом заболевании. Применяется разовая доза 25 мг/кг. Может быть необходимо повторное лечение.
Ж. Другие паразиты. Ограниченные клинические испытания празиквантела по 25 мг/кг 3 раза в день в течение 1-2 дней выявили высокую степень излечиваемости фасциолопсиоза, метагонимоза и других форм гетерофиозов. Однако при лечении фасциолеза празиквантел даже в высоких дозах (25 мг/кг 3 раза в день в течение 3-7 дней), показал низкую эффективность. Что касается эхинококкоза, то в условиях in vitro празиквантел действует на протосколексы Echinococcus granulosus, но in vivo не оказывает действия на зародышевую мембрану. В настоящее время оценивается эффективность применения препарата как вспомогательного средства для защиты от диссеминации цист при хирургическом вмешательстве.
Побочные реакции
С приемом празиквантела обычно связаны умеренно выраженные и преходящие побочные эффекты. Они начинают проявляться через несколько часов после приема препарата внутрь и сохраняются от нескольких часов до одного дня. К наиболее частым осложнениям относятся головная боль, головокружение, сонливость и утомляемость; могут наблюдаться тошнота, рвота, боль в абдоминальной области, неоформленный стул, зуд, крапивница, артралгия, миалгия и субфебрильная лихорадка. Иногда незначительно увеличивается активность ферментов печени. Субфебрильная лихорадка, зуд и кожная сыпь (макулярная или крапивница), иногда сопровождающиеся эозинофилией, могут появиться и через несколько дней после начала медикаментозного лечения, вероятно, вследствие высвобождения чужеродных белков из погибающих гельминтов, а не из-за прямого действия препарата.
Празиквантел, по-видимому, лучше переносится детьми, чем взрослыми. Побочные эффекты возникают чаще у пациентов с тяжелыми инвазиями,
особенно при заражении S. mansoni. Интенсивность и частота осложнений возрастают с увеличением дозы: они слабо выражены и редко встречаются при однократном приеме 10 мг/кг, но их частота увеличивается до 50 % при приеме 25 мг/кг 3 раза в течение дня.
При лечении нейроцистицеркозов описаны два типа побочных реакций: 1) реакции, характерные для применения празиквантела в высоких дозах (уже описанные в этой главе) и 2) новые неврологические реакции или обострение уже имеющихся вследствие воспаления вокруг погибающих паразитов. К наиболее общим побочным эффектам у 90 % пациентов, не принимающих кортикостероиды, относятся головная боль, менингеальные симптомы, тошнота, рвота, изменения психики и припадки, часто сопровождающиеся усилением плеоцитоза спинномозговой жидкости. Эти реакции отмечаются во время или сразу после завершения терапии — продолжаются в течение 48-72 часов. Они обычно умеренно выражены и могут ослабляться применением аналгетиков, противорвотных средств, диуретиков или противосудорожных препаратов. Правда, иногда возникают арахноидиты, гипертермия и внутричерепная гипертензия. Многие врачи для уменьшения воспалительной реакции параллельно назначают дексаметазон, хотя эта тактика противоречива, особенно в связи с недавними наблюдениями, показавшими, что стероиды уменьшают концентрацию празиквантела в плазме. Однако не установлено, что снижение концентрации препарата в крови при применении стероидов уменьшает его эффективность.
Взаимодействие препаратов
При сочетанном применении с дексаметазоном концентрация празиквантела в плазме понижается на 50 %. Биодоступность препарата уменьшается также при комбинации с фенитоином и карбамазепином и увеличивается при приеме циметидина. В опытах на животных выявлен антагонизм по отношению к действию наперстянки.
Противопоказания
и меры предосторожности
Специфическим противопоказанием является только глазной цистицеркоз — уничтожение паразитов в глазу может нанести непоправимый вред. Некоторые врачи предостерегают и от использова
ния препарата при спинальных нейроцистицеркозах. В эндемичных областях пациенты, лечившиеся празиквантелом по иным показаниям, чем цистицеркоз, должны тщательно наблюдаться в стационаре в течение 48 часов после завершения лечения. Препарат можно назначать больным с нарушениями функции печени, но необходимо снизить дозу. Безопасность его применения у детей в возрасте до 4 лет не установлена, хотя никаких специфических педиатрических проблем не выявлено.
Так как празиквантел вызывает головокружение и сонливость, пациенты должны быть об этом предупреждены, если их работа требует координации движений или внимания. После приема препарата не следует управлять автомобилем.
Желательно не принимать празиквантел во время беременности: у крыс, получавших 3-кратную человеческую дозу, обнаружили повышение частоты абортов. Хотя содержание лекарства в молоке составляет '/< от концентрации в плазме, кормящим женщинам можно принимать его при условии, что они не будут кормить младенца в день лечения и в течение трех последующих дней.
Пациентов следует предостеречь от разжевывания горького на вкус препарата; вызываемые им позывы на рвоту могут осложнить лечение инвазий Т. solium вследствие возможной регургитации сегментов.
Пирантела памоат
Пирантела памоат — высокоэффективное антигельминтное средство широкого спектра действия для лечения инвазий острицами, аскаридами, Trichostrongylus orientalis. Препарат проявляет умеренную активность в отношении обоих видов анкилостом и менее эффективен в отношении N. americanus. Он не действует при трихиуриазе (три-хоцефалозе) и стронгилоидозе. Оксантела памоат, являющийся аналогом пирантела, успешно применяется в терапии трихиуриаза.
Химия и фармакокинетика
Пирантела памоат относится к производным тетрагидропиримидина. Он плохо всасывается из желудочно-кишечного тракта, поэтому активен прежде всего в отношении организмов в просвете кишечника. Максимальная концентрация препарата в плазме 50-130 нг/мл достигается через 1-
3 часа. Более половины принятой дозы выходит из организма в неизмененном виде с фекалиями, около 7 % выводится в неизмененном виде и в форме метаболитов с мочой.
Противоглистное действие и другие фармакологические эффекты
Пирантел активен в отношении зрелых и незрелых форм восприимчивых гельминтов в пределах кишечного тракта, но не действует на мигрирующие стадии в тканях. Препарат является блокатором нервно-мышечной передачи деполяризующего действия и вызывает высвобождение ацетилхолина, ингибирует холинэстеразу и стимулирует ганглионарные рецепторы. Хотя пирантел не дает вермицидного (т. е. овицидного) эффекта, парализованные глисты выводятся из кишечного тракта хозяина.
Клиническое применение
Стандартная доза препарата составляет 11 мг/кг в пересчете на основание (максимум 1 г), его принимают с пищей или без нее.
A. Enterobius vermicularis. Пирантел принимают однократно и повторяют прием через 2 и 4 недели. Эффективность лечения превышает 95 %.
Б. A. lumbricoides. Пирантел принимают однократно. Уровень излечения составляет 85-100 %. Лечение необходимо повторить при обнаружении яиц 2 недели спустя.
В. Анкилостомы и Т. orientalis. Прием однократной дозы полностью излечивает более 90 % пациентов с инвазиями Ancylostoma duodenale и Т. orientalis и заметно снижает зараженность глистами у остальных пациентов. В случае инвазии N. americanus эффективность терапии зависит от степени зараженности. Однократная доза дает удовлетворительный результат при легком заражении, но при умеренных и тяжелых инвазиях (> 2000 яиц на 1 г фекалий) необходим 3-дневный курс для достижения 90 % уровня излечения. Зараженность анкилостомами может заметно снизиться, но не всегда это возможно или существенно для облегчения состояния. Если инфекция сопровождается дефицитом железа, необходимо провести терапию препаратами железа и назначить диету с высоким содержанием белка. Курс лечения можно повторить через 2 недели.
Побочные реакции; противопоказания и меры предосторожности
Побочные эффекты, наблюдаемые у 4-20 % пациентов, умеренно выражены и носят временный характер. Они включают тошноту, рвоту, диарею, спазмы в животе, головокружение, сонливость, головную боль, бессонницу, сыпь, лихорадку и слабость. Не выявлено существенного влияния на гематологические показатели и функции почек и печени.
Противопоказаний к приему пирантела нет, но пациентам с дисфункцией печени следует соблюдать осторожность, поскольку у ряда больных отмечалось небольшое и преходящее увеличение активности трансаминазы. Опыт применения препарата у детей до 2 лет ограничен. Хотя в экспериментах на животных был получен отрицательный результат при изучении тератогенного действия препарата, адекватных исследований у беременных женщин не проводилось.
Хинакрина гидрохлорид
Хинакрин ранее использовался как альтернативное средство для лечения инвазий ленточными червями. Его не следует применять из-за высокой токсичности, если доступны никлосамид или другие альтернативные средства (празиквантел, мебендазол или дихлорофен).
Сурам ин
Сурамин является альтернативным средством для уничтожения половозрелых паразитов Onchocerca volvulus и препаратом выбора для лечения гемолимфатической стадии африканского трипаносомоза, вызываемого Trypanosoma brucei gambiense и Trypanosoma brucei rhodesiense. В настоящее время препарат проходит испытания как противоопухолевое средство для лечения рака предстательной железы и молочной железы.
Сурамин является неспецифическим ингибитором многих ферментов. При его приеме часто встречаются токсические реакции (иногда серьезные), включающие тошноту, рвоту, крапивницу, лихорадку, нефротоксическое действие, периферические невриты, анемии, желтуху и эксфолиативный дерматит. Отмечалось несколько смертельных случа
ев. Препарат необходимо применять только под наблюдением специалистов.
Тетрахлорэтилен
Тетрахлорэтилен был внедрен в медицинскую практику в 1925 г. для лечения инвазий анкилостомами Necator americanus и Ancylostoma duodenale. Сейчас предпочитают другие средства с меньшими побочными эффектами, но тетрахлорэтилен остается эффективным и недорогим альтернативным средством с умеренно выраженными побочными реакциями. В США он не применяется.
Тиабендазол
Тиабендазол — препарат выбора для лечения стронгилоидоза и альтернативное средство для уничтожения кожных мигрирующих личинок. Препарат можно использовать в терапии трихинеллеза и висцеральных мигрирующих личинок при отсутствии других эффективных средств. Его больше не рекомендуют для лечения больных, зараженных острицами, аскаридами, власоглавом или анкилостомами, при наличии более безопасных препаратов выбора.
Химия
Тиабендазол относится к бензимидазолам. Он безвкусен и почти нерастворим в воде. Хотя препарат является хелатирующим агентом, который образует стабильные комплексы со многими металлами, включая железо, он не связывает кальций.
Фармакокинетика
Тиабендазол быстро всасывается из кишечника. При приеме стандартной дозы максимальная концентрация препарата в плазме (5 мкг/мл) достигается в пределах 1-2 часов, но уже через 8 часов препарат практически не определяется в крови. Период его полувыведения составляет 1.2 часа. Препарат почти полностью метаболизируется в печени до 5-гидрокси-формы, которая появляется в моче в основном в виде глюкуронидов или сульфатов. С мочой выводится 90 % лекарства. Тиабендазол может всасываться и с поверхности кожи. В некоторых клинических ситуациях может быть полезным измерение концентрации препарата в сыворотке.
Противоглистное действие и другие фармакологические эффекты
Тиабендазол дает противовоспалительный эффект, что может способствовать облегчению симптомов при некоторых паразитарных заболеваниях, особенно драконкулезе. Он оказывает также иммуномодулирующее действие в отношении Т-клеток: стимулирует подавленный при заболевании иммунитет хозяина. Кроме того, у тиабендазола обнаружены жаропонижающие, умеренные противогрибковые и противочесоточные свойства. Препарат, видимо, не является канцерогеном и мутагеном. В большинстве исследований тератогенности тиабендазола были получены отрицательные результаты, но в одной работе, где использовали высокие дозы, у крыс и мышей был выявлен положительный эффект.
Противоглистное действие тиабендазола может быть результатом его вмешательства в агрегацию микротрубочек (глава 53) посредством подавления активности фумаратредуктазы. Препарат уничтожает яйца некоторых паразитов.
Клиническое применение
Стандартная доза составляет 25 мг/кг (максимум 1.5 г). Препарат следует принимать после еды, хорошо разжевывая таблетки. Необходимости в приеме слабительных средств до и после лечения нет.
A. Strongyloides stercoralis. Стандартную дозу принимают два раза в день в течение двух дней. Эффективность составляет 93 %. При необходимости курс лечения можно повторить через неделю. У пациентов с синдромом гиперинфицирования прием стандартной дозы два раза в день продолжают в течение 5-7 дней.
Б. Кожные мигрирующие личинки (дерматит, обусловленный паразитированием в коже личинок гельминтов). Тиабендазол высокоэффективен в лечении инвазии кожных мигрирующих личинок. Стандартную дозу принимают два раза в день в течение двух дней. Если через 2 дня после окончания терапии все еще присутствуют активные повреждения, следует провести второй курс. Великолепные результаты получены при ежедневных аппликациях в течение 5 дней крема, содержащего 15 % тиабендазола на гигроскопичной основе или 2 % раствора в диметилсульфоксиде.
В. Другие инвазии. Для лечения трихинеллеза назначают стандартную дозу два раза в день в течение 2-4 дней, при висцеральных мигрирующих личинках — два раза в день курсом до 7 дней в зависимости от ответной реакции пациента. Данные по эффективности препарата при назначении по этим показаниям ограничены. В течение первых суток после употребления зараженной трихинеллами свинины препарат может подействовать на половозрелых гельминтов, уменьшая высвобождение личинок. Прием тиабендазола во время инвазивной стадии способствует некоторому симптоматическому облегчению; наосновании данных биопсии предполагают, что он разрушает часть личинок в мышцах (хотя не все). Кортикостероиды и АКТГ эффективно ослабляют воспалительные реакции на личинки и могут спасти жизнь пациента при тяжелых инвазиях.
Кишечные капилляриозы успешно излечиваются при приеме тиабендазола в дозе 12 мг/кг два раза в день в течение 30 дней.
Прием препарата в дозе 50-75 мг/кг/сут, разделенной на два раза, в течение 1-3 дней часто помогает при драконкулезе. Местное воспаление быстро проходит, и затем многие гельминты спонтанно изгоняются или могут быть извлечены мануально. Иногда необходимо повторное лечение.
Некоторые авторы указывают на бесполезность местного применения тиабендазола для лечения чесотки и tinea nigrapalmaris.
Побочные реакции
При приеме стандартной дозы 25 мг/кг два раза в день в течение двух дней побочные эффекты встречаются у 7-50 % пациентов. Они начинают обычно проявляться через 3-4 часа после приема препарата и продолжаются в течение 2-8 часов. Более высокие дозы или более длительное лечение увеличивают частоту и интенсивность нежелательных симптомов. Несмотря на то, что переносимость иногда можно улучшить с помощью уменьшения дозировки до 25 мг один раз в день, эффективность терапии при этом, вероятно, уменьшится.
Побочные эффекты, как правило, умеренно выражены и преходящи, но могут быть и тяжелыми. Обычны головокружение, анорексия, тошнота и рвота. Иногда отмечаются боль в эпигастральной области, абдоминальные спазмы, диарея, зуд, головная боль, сонливость и другие нейропсихические
симптомы. Реже обнаруживают перианальные высыпания, шум в ушах, парестезии, брадикардию, гипотензию, гипергликемию, конвульсии, временную лейкопению, гематурию, кристаллурию, расстройства зрения, внутрипеченочный холестаз и поражения паренхимы печени; могут наблюдаться желтуха и нарушения функции печени. У некоторых пациентов моча приобретает запах аспарагина, что не имеет клинического значения.
Реакции гиперчувствительности редки. Это лихорадка, озноб, кожные высыпания, зуд, отек конъюнктивы, ангионевротический отек, лимфоаде-нопатия, токсический эпидермальный некролиз, анафилаксия и мультиформная эритема. У детей встречается фатальный синдром Стивенса-Джонсона.
Противопоказания и меры предосторожности
Опыт применения тиабендазола у детей с массой тела менее 15 кг невелик. Препарат не используют при беременности, кроме случаев опасных для жизни стронгилоидозов. Пациентам с дисфункцией печени или почек лучше назначать альтернативное средство. Препарат следует применять с осторожностью тогда, когда может быть опасна рвота, вызванная его приемом, а также пациентам с тяжелым нарушением питания или анемией. Существует несколько сообщений о приобретении аскаридами гиперподвижности после лечения и появлении их в носу или во рту.
Так как препарат вызывает головокружение и сонливость, его нельзя применять в течение дня пациентам, чья работа или образ жизни требуют концентрации внимания.
Тиабендазол может конкурировать с теофиллином за пути метаболизма в печени. При появлении симптомов гиперчувствительности прием препарата следует немедленно прекратить.
Препараты
Албендазол (Зентал)
Перорально: таблетки по 200 мг; суспензия 100 мг/5 мл
Примечание'. Албендазол не применяется в США, но его можно получить от производителя (SmithKline Beecham, 800-366-8900)
Битионол (Битин)
Перорально: таблетки по 200 мг
Примечание'. Битионол не продается в США, но его можно получить через Parasitic Disease Drug Service, Centers for Disease Control and Prevention, Atlanta, Georgia; 404-639-3670
Диэтилкарбамазин (Гетразан)
Перорально: таблетки по 50, 200,400 мг Примечание: Диэтилкарбамазин больше не продается в США, но его можно получить по заказу из Lederle Laboratories;
914-732-5000
Ивермектин (Мектизан)
Перорально: таблетки по 6 мг
Примечание: Ивермектин коммерчески недоступен, но может быть получен от производителя
(Merck Sharp and Dohme 215-397-2454)
Левамизол (Декарис, Этнор, Кетракс, Соласкил) Перорально: таблетки по 50 и 150 мг; сироп
Мебендазол (Вермокс)
Перорально: таблетки для жевания по 100 мг; за пределами США суспензия 100 мг/5 мл
Метрифонат (Биларкил)
Перорально: таблетки по 100 мг
Примечание: Метрифонат не применяется в США
Никлосамид (Никлосид)
Перорально: таблетки для жевания по 500 мг
Оксамнихин (Вансил, Мансил)
Перорально: капсулы по 250 мг; за пределами США сироп 50 мг/мл
Оксантела памоат (Квантрел); оксантела/пиран-тела памоат (Телопар)
Перорально: таблетки, содержащие по 100 мг каждого препарата (основание); суспензии, содержащие по 20 или 50 мг/кг (основание) Примечание: Оксантела памоат и оксантела/ пирантела памоат не применяются в США
Пиперазин (генерик, Вермизин)
Перорально: таблетки пиперазина цитрата, эквивалентные 250 мг гексагидрата; сироп пиперазина цитрата, эквивалентный 500 мг/5 мл гексагидрата
Празиквантел (Билтрисид; др. за пределами США)
Перорально: таблетки по 600 мг (другие дозы за пределами США)
Пирантела памоат (Антиминт, Комбантрин) Перорально: суспензии 50 мг/мл (основание); таблетки по 125 мг доступны в Канаде и некоторых других странах за исключением США
Сурамин (Bayer 205, др.)
Парентерально: ампулы, содержащие 0.5 или 1 г порошка для растворения в виде 10 % раствора и немедленного использования Примечание: Сурамин не продается в США, но его можно приобрести через Parasitic Disease Drug Service, Centers for Disease Control and Prevention, Atlanta, Georgia;
404-639-3670
Тиабендазол (Минтезол)
Перорально: таблетки для жевания по 500 мг; суспензия 500 мг/мл
Избранная литература
Abdi Y., Gustafsson L. L. Field trial of the efficacy of a simplified and standard metrifonate treatment of Schistosoma haematobium. Eur.J. Clin. Pharmacol. 1989; 37: 371.
Bassiouny H. K. et al. Human fascioliasis in Egypt: Effect of infection and efficacy of bithionol treatment. J. Trop. Med. Hyg. 1991; 94:333.
Bellander В. T. D., Hagmar L. E., Osterdahl B. G. Nitrosation of piperazine in the stomach. Lancet, 1981; 2:372.
Blanshard C. et al. Treatment of intestinal micro-sporiodiosis with albendazole in patients with AIDS. AIDS, 1992; 6: 3.
Cook G. C. Antihelmintic agents: Some recent developments and their clinical application. Postgrad. Med. J. 1991; 67:16.
Davis A. Drug Treatment in Intestinal helminthiases. World Health Organisation, 1973.
Drugs for parasitic infections. Med. Lett. Drugs Ther. 1993; 35: 111.
Duke В. O. Suramin and the time it takes to kill Onchocerca volvulus. Trop. Med. Parasitol. 1991; 42: 346.
Firth M. (ed.). Symposium on albendazole in helminthiasis. Royal Society of Medicine International Congress and Symposium Series, No. 57. The Royal
Химиотерапия рака
56
Сидни И. Салмон, Алан К. Сарторелли
Частота, географическое распределение и развитие особых типов раковых опухолей находятся под влиянием многочисленных факторов, включая нол, возраст, расу, генетическую предрасположенность и подверженность воздействию канцерогенов внешней среды. Из всех этих факторов последний, вероятно, наиболее важен. Установлено, что химические канцерогены (особенно, находящиеся в табачном дыме), так же как и такие агенты, как азокраски, афлатоксины и бензин, связаны с индукцией рака у человека и животных. Идентификация потенциальных канцерогенов, находящихся во внешней среде, была значительно упрощена благодаря широкому распространению “теста Эймса” для определения мутагенных средств. На основе этого анализа мутагенные свойства были выявлены у 90 % канцерогенов. Окончательная идентификация канцерогенов человека требует тестирования, по крайней мере, на двух видах животных.
Некоторые ДНК-вирусы герпеса и папилломной группы и РНК-вирусы типа С были определены как агенты, вызывающие рак у животных. Они могут быть ответственны также за возникновение некоторых видов рака у человека. Оказалось, что все онкогенные РНК-вирусы содержат фермент обратную транскриптазу, который способствует трансляции информации РНК опухолевого вируса в код ДНК инфицированной клетки. Таким образом, информация, определяющая процесс трансформации, может стать постоянной частью генома клетки-хозяина. Экспрессия неоплазии, вызванная вирусом, вероятно, зависит от дополнительного влияния организма хозяина и внешних факторов, которые модулируют процесс трансформации. Специфический вирус лейкоза Т-клеток человека (HTLV-I) идентифицирован в качестве причины возникновения этого специфического типа лейкоза. Вирус (HIV-1), который вызывает СПИД, является близкородственным. Известно, что некоторые гены кле
ток являются гомологичными трансформирующимся генам ретровирусов, семейства РНК-вирусов и вызывают онкогенные превращения. Было выявлено, что эти гены клеток млекопитающих, известные как онкогены, кодируют специфические факторы роста и их рецепторы и могут увеличиваться (увеличенное число генных копий) или модифицироваться с помощью одного нуклеотида в злокачественных клетках.
Другой класс генов, гены-супрессоры опухолевого роста, могут быть уничтожены или повреждены, что ведет к неопластическим изменениям. Установлено, что один ген из этого класса, р53 ген, мутировал из гена-супрессора опухолевого роста в онкоген в большом количестве случаев различных опухолей человека, включая опухоли печени, молочной железы, толстой кишки, легких, шейки матки, мочевого пузыря, предстательной железы и кожи. Нормальный “дикий” тип этого гена, по-видимому, играет важную роль в подавлении неопластических превращений; мутация ставит клетку в условия высокого риска возникновения трансформации (Harris, 1993).
Рак как заболевание клеток
Какова бы ни была причина, рак в основном является заболеванием клеток, характеризующимся сдвигом в механизмах контроля, которые управляют пролиферацией и дифференциацией клеток. Клетки, претерпевшие неопластическое преобразование, экспрессируют поверхностные клеточные антигены, которые, как известно, являются нормальным эмбриональным типом и обладают другими признаками явной “незрелости”. В этих клетках возникают количественные и качественные хромосомные изменения, включая различные транслокации и появление увеличенных генных последовательностей. Такие клетки чрезмерно
пролиферируют и формируют локальные опухоли, которые способны сдавить соседние здоровые структуры или распространиться в них. Небольшая субпопуляция клеток в пределах опухоли может быть описана как стволовые клетки опухоли. Они сохраняют способность подвергаться повторным циклам пролиферации, так же как и мигрировать в другие части тела и образовывать колонии в различных органах с помощью процесса, называемого метастазированием. Таким образом, стволовые клетки опухоли могут проявлять клоногенные свойства, т. е. способность к формированию колоний. Стволовые клетки опухоли часто имеют хромосомные нарушения, отражающие их генетическую нестабильность, которая приводит к прогрессивной селекции субклонов; последние легче выживают в мультиклеточном окружении организма хозяина. Развитие неопластического процесса сопровождается количественными нарушениями различных метаболических путей и клеточных компонентов. Процессы инвазии и метастазирования, а также ряд метаболических нарушений, развивающиеся вследствие злокачественной опухоли, вызывают заболевание и, в конце концов, смерть пациента, если новообразование не будет удалено.
Способы терапевтического воздействия на раковые опухоли
После сердечно-сосудистых заболеваний рак является главной причиной смертей в США, ежегодно вызывая более чем 500 000 фатальных исходов. В настоящее время '/3 пациентов излечивается с помощью локальных воздействий (хирургическое вмешательство или радиационная терапия), которые довольно эффективны, если опухоль к началу лечения еще не метастазировала. Ранняя диагностика может привести к увеличению числа излеченных пациентов. Однако во многих случаях для эффективного излечения рака требуется системный подход, поскольку характерной чертой неоплазм являются ранние микрометастазы. Такой подход предусматривает проведение химиотерапии (часто наряду с хирургическим вмешательством и облучением). В настоящее время при использовании химиотерапии у 17 % больных раком примерно половина из них может быть вылечена.
Современная противоопухолевая химиотерапия позволяет излечивать определенные диссеминированные новообразования, которые распространились значительно или минимально к моменту постановки диагноза. Это такие виды рака, как тестикулярный рак, диффузная крупноклеточная липома, болезнь Ходжкина и хориокарцинома, такие опухоли у детей, как острый лимфобластный лейкоз, лимфома Беркитта, опухоль Вильмса и эмбриональная рабдомиосаркома. Большую важность имеют сведения о том, что длительное применение химиотерапии после первичного хирургического вмешательства позволяет увеличить степень излечиваемое™ на относительно ранней стадии рака молочной железы и остеогенной саркомы. Обычные карциномы легких и толстого кишечника, в основном, не излечиваются современными методами, поскольку ко времени диагностирования они диссеминируют.
В настоящее время химиотерапия обеспечивает скорее паллиативное, чем радикальное лечение в отношении многих других форм диссеминированного рака. Эффективная паллиативная помощь приводит к временному исчезновению симптомов и признаков рака и продлевает полноценную жизнь. В последнее десятилетие развитие противоопухолевой химиотерапии доказало, что химический контроль процесса новообразования может стать реальностью для многих форм рака. Это будет достигнуто в первую очередь благодаря проведению комбинированной терапии, при которой оптималь ля комбинация хирургического вмешательства, радиотерапии и химиотерапии используется для ликвидации как первичной неоплазмы, так и ее скрытых микрометастазов до того, как их значительное распространение можно будет определить физикальными методами или при рентгеновском обследовании. Применение гормональных средств для модуляции роста опухоли играет все возрастающую роль в лечении гормоночувствительных опухолей, поскольку появились антагонисты и парциальные агонисты гормонов. Недавно было установлено, что некоторые рекомбинантные биологические средства являются эффективными препаратами для противоопухолевой терапии. Они включают интерферон и интерлейкин-2. Генная терапия является последним направлением исследований методов лечения рака и сейчас находится в начальной стадии клинических исследований. Делать заключение о ее пользе еще слишком рано.
Разработка противоопухолевых средств
В течение трех десятилетий прилагались значительные усилия по созданию противоопухолевых средств как методом эмпирического скрининга, так и целенаправленной разработкой новых соединений. Последние достижения в этой области включают синтез пептидов и протеинов методами рекомбинантной ДНК и моноклональных антител. Программа разработки препаратов включает тестирование на нескольких подробно изученных трансплантируемых опухолевых системах животных. Разработка метода измерения чувствительности к препарату стволовых клеток опухоли человека in vitro позволит повысить, эффективность и сократить продолжительность тестовых программ в будущем. После выявления противоопухолевой активности у новых препаратов их предоставляют для доклинического токсикологического и ограниченного фармакологического исследования на животных (глава 5). Многообещающие средства, которые не обладают выраженной токсичностью, затем переходят на 1-ю стадию клинических испытаний, где’ их фармакологические и токсические эффекты проверяют чаще у пациентов с прогрессирующим раком, чем у здоровых добровольцев. Остальные клинические испытания сходны с таковыми для других лекарственных средств, но могут быть ускорены.
Идеальное противоопухолевое средство должно уничтожать раковые клетки без повреждения нормальных тканей. К сожалению, в настоящее время не существует средств, отвечающих этому критерию, и клиническое использование противоопухолевых препаратов включает в себя взвешивание всех за и против в поиске благоприятного терапевтического индекса.
Классы препаратов, которые недавно стали разрабатываться, включают: индукторы дифференциации, предназначенные заставить опухолевые клетки миновать блок созревания с тем, чтобы сформировать конечную клеточную стадию с минимальным пролиферативным потенциалом или без него; антиметастатические средства, предназначенные для нарушения поверхностных свойств злокачественных клеток чтобы, таким образом, нарушить их способность к распространению и метастазированию; специфические гипоксические средства про
тив стволовых клеток опухоли, созданные для получения большего объема восстановительных реакций в этих устойчивых к терапии клетках, вызванных дефицитом кислорода в пределах солидной опухоли; средства, увеличивающие радиочувствительность опухолевых клеток; средства радиозащиты клеток нормальных тканей, направленные на увеличение терапевтической эффективности лучевой терапии; и “модификаторы биологического ответа", которые изменяют метаболические и иммунологические взаимодействия опухоли и хозяина.
Значение неопластической предрасположенности клеток
Пациенты с широко распространившимся раком (например, острый лейкоз) могут иметь ко времени постановки диагноза до 10’2 опухолевых клеток по всему телу (рис. 56-1). Если бы переносимые дозы эффективного лекарственного препарата способны были убить 99.9 % клоногенных опухолевых клеток, это вызвало бы клиническую ремиссию, обусловленную симптоматическим улучшением. Однако в теле еще остались бы девять “логарифмов” опухолевых клеток (109), включая некоторые клетки, которые могут быть врожденно устойчивыми к препарату вследствие гетерогенности, и другие, которые могут пребывать в фармакологических убежищах (например, центральная нервная система, яички), где трудно достичь эффективных концентраций препарата. При использовании средств, специфично влияющих на цикл деления клетки (CCS), стволовые клетки опухоли также должны быть в чувствительной фазе клеточного цикла (а не в фазе Go). Таким образом, планирование схемы применения этих средств является особенно важным. При обычных бактериальных инфекциях уменьшение количества микроорганизмов на три логарифма (на три порядка) приводит к излечению, потому что факторы сопротивляемости организма-хозяина способны уничтожить оставшиеся бактерии посредством иммунологических и бактерицидных механизмов. К сожалению, установлено, что механизмы подавления умеренного числа опухолевых клеток у организма-хозяина, как правило, неэффективны.
Комбинации средств с различной токсичностью и механизмами действия часто используют для превышения предельного “логарифма подавления” отдельных противоопухолевых средств. Если препа-
рати мало сходны по токсичности, они могут быть использованы почти в полной дозировке и может быть получен дополнительный цитотоксический эффект при комбинированной химиотерапии. Более того, субклоны, устойчивые только к одному из средств, применяемых в комбинации, потенциально могут быть уничтожены. Полагают, что в некоторых комбинациях противоопухолевых средств наблюдается истинный синергизм, при котором эффект двух препаратов больше, чем простая суммация эффектов. Эффективность комбинированной химиотерапии сейчас обоснована для многих форм рака человека, и рациональность ее применения подтверждена научно. В результате, комбинированная химиотерапия сейчас является стандартным методом для лечения тестикулярного рака и лимфом и улучшает паллиативное лечение многих других типов опухолей. Этот важный терапевтический метод был впервые сформулирован Skipper и Schabel и описан как “гипотеза логарифма подавления” (рис. 56-1).
Значение кинетики
клеточного цикла
Информация о клеточной и популяционной кинетике раковых клеток частично объясняет ограниченную эффективность большинства применяемых противоопухолевых средств. Схематичное изложение кинетики клеточного цикла представлено на рис. 56-2. Эта информация соответствует механизмам действия, показаниям, схеме назначения препаратов, действующих специфически на клеточный цикл (cell cycles-specific) (CCS) и неспецифически действующих на клеточный цикл (CCNS). Средства, не попадающие в эти два основные класса, представлены в табл. 56-1.
CCS-препараты, в основном, оказались наиболее эффективны при гематологических злокачественных заболеваниях и других опухолях, в которых относительно большое количество клеток про-лифелирует или находится во фракции роста. Препараты CCNS (многие из которых связываются с ДНК и повреждают эти макромолекулы) эффективны при лечении медленно растущих фракций “плотных опухолей" так же, как и для быстро растущих фракций опухолей. Во всех примерах эффективные средства нарушают способность к размножению (делению) обеззараживают или инактивируют
Рис. 56-1. “Гипотеза логарифма подавления”. Взаимоотношение между числом опухолевых клеток и временем постановки диагноза, симптомами, лечением и выживанием. Представлены три альтернативных метода медикаментозного лечения в сравнении с ходом роста опухоли при отсутствии лечения (пунктирная линия). Вверху — лечение (указанное стрелками) проводили нерегулярно и результат выражался в продлении выживания, но с повторным появлением симптомов между курсами лечения и смертью пациента. В средней части рисунка — лечение комбинированной химиотерапией началось раньше и было более интенсивным. Уничтожение опухолевых клеток превышает возобновляемый рост, устойчивость к препарату не развивается и в результате наступает “излечение”. В этом примере лечение продолжали после исчезновения всех клинических проявлений рака (в течение 1 -3 лет). Этот метод эффективен в лечении детского острого лейкоза, рака яичек и болезни Ходжкина. В нижней части рисунка — лечение включало раннее хирургическое вмешательство — удаление первичной опухоли и интенсивную вспомогательную химиотерапию в течение продолжительного времени (до 1 года) для уничтожения оставшихся опухолевых клеток, находившихся в скрытых микрометастазах
стволовые клетки опухоли, которые часто являются только малой фракцией клеток в пределах опухоли. Нестволовые клетки (например те, которые необратимо дифференцировались) считаются неспособными к делению по определению и не являются значимым компонентом в решении проблемы раковых заболеваний.
ТАБЛИЦА 56-1. Отношение основных классов препаратов к клеточному циклу
Циклоспецифические препараты (CCS) Циклонеспецифические препараты (CCNS)
Антиметаболиты (азацитидин, цитарабин, фторурацил, меркаптопурин, метотрексат, тиогуанин) Блеомицин, пептидные антибиотики Алкалоиды подофиллина (этопозид, VP-16; тенипозид, VM-26) Растительные алкалоиды (винкристин, винбластин, паклитаксел) Алкилирующие средства (бусульфан, циклофосфамид, мехлорэтамин, мелфалан, тиотэпа) Антибиотики (дактиномицин, даунорубицин, доксорубицин, пликамицин, митомицин) Цисплатин Препараты нитрозомочевины (BCNU, CCNU, ме-тил-CCNU)
Устойчивость к цитотоксическим препаратам
Главной проблемой химиотерапии рака является резистентность к препаратам. Некоторые виды рака, например немелкоклеточный рак легких и рак ободочной кишки, проявляют первичную устойчивость (отсутствие реакции на первое воздействие) к современным используемым стандартным средствам. Приобретенная устойчивость развивается у некоторых чувствительных к препаратам типов опухолей. Экспериментально показано, что устойчивость к препаратам может быть высокоспецифичной к отдельным препаратам и обычно основывается на изменении генетического аппарата опухолевых клеток с амплификацией числа генов или увеличением экспрессии одного или более специфических генов. В других случаях встречается фенотип с множественной устойчивостью к препаратам —устойчивостью к разнообразным противоопухолевым средствам природного происхождения различной структуры, развивающейся после воздействия одного агента. Эта форма множественной лекарственной устойчивости часто обусловлена увеличенной экспрессией нормального гена (ген MDR1) гликопротеина клеточной поверхности (Р-гликопротеин), вовлеченного в выведение препарата. Этот молекулярный транспорт (рис. 56-3)
Рис. 56-2. Клеточный цикл и рак. Схема фаз клеточного цикла, которые должны проходить все клетки, нормальные и неопластические, до и во время деления клетки. Представленные проценты — приблизительное количество времени, проведенного в каждой фазе типичной злокачественной клеткой; продолжительность фазы Gt, однако, может заметно варьировать. Многие эффективные противоопухолевые средства оказывают действие на клетки, проходящие клеточный цикл, и называются циклоспецифическими препаратами (CCS) (табл. 56-1). Вторая группа средств, называемая циклонеспецифическими препаратами (CCNS), может стерилизовать (ликвидировать способность к делению) опухолевые клетки, находятся ли они в фазах цикла или в фазе покоя в компар-тменте Go. Препараты группы CCNS могут уничтожать клетки как в фазы Go, так и в циклическом процессе (хотя клетки в цикле деления более чувствительны)
использует энергию АТФ для удаления различных чужеродных молекул (не ограничиваясь противоопухолевыми средствами) из клетки. Элиминация происходит постоянно в нормальных тканях, таких как эпителиальные клетки почек, толстая кишка и надпочечники, так же, как и в различных опухолях. В эксперименте множественная лекарственная устойчивость может сниматься с помощью блокаторов кальциевых каналов, таких как верапамил, и рядом других средств, которые ингибируют мембранный переносчик. Предварительные клинические результаты свидетельствуют, что устранение резистентности этими средствами возможно и у больных раком. Второй механизм множественной лекарственной резистентности включает качественные и количественные изменения в топоизомеразе II, которая устраняет повреждения, вызванные в ДНК противоопухолевыми препаратами.
Рис. 56-3. Схематическая концепция молекулярного Р-гликопротеинового транспорта препарата, отвечающего за множественную лекарственную резистентность опухолевых клеток. АТФ используется для запуска процесса выведения. Протеин состоит из 12 трансмембранных доменов с двумя местами связывания АТФ, только одно из которых задействуется для транспорта препарата. Верапамил, хинидин, циклоспорин и некоторые другие препараты способны подавить транспорт в низких концентрациях (3 мкмоль/л), действуя, по-видимому, как конкурирующие субстраты
I. Базисная фармакология противоопухолевых химиотерапевтических средств
Полифункциональные алкилирующие средства
Основные используемые в клинике алкилирующие средства (рис. 56-4) имеют структуру, содержащую бис-(хлорэтил)амин, этиленимин или фрагмент нитрозомочевины. Среди бис-(хлорэтил)ами-нов наиболее часто применяют циклофосфамид, мехлорэтамин, мелфалан и хлорамбуцил. Ифосфа-мид близок к циклофосфамиду, но несколько отличается в спектре действия и токсичности. Тиотепа и бусульфан специально предназначены для лечения рака яичников и хронического миелоидного лейкоза, соответственно. К основным препаратам группы нитрозомочевины относятся BCNU (карму-
стин), CCNU (ломустин) и метил-CCNU (семус-тин). В исследовательских целях были синтезированы разнообразные алкилирующие средства, которые связывали различные молекулы переносчики, такие как аминокислоты, основания нуклеиновых кислот, гормоны и части сахаров с группой, способной к алкилированию; однако к настоящему моменту препарата с удачным “узконаправленным” алкилированием не получено.
Как класс алкилирующие средства действуют, вызывая цитотоксические эффекты посредством переноса своих алкильных групп на различные компоненты клетки. Алкилирование ДНК в ядре, возможно, является наиболее важным действием, которое приводит к гибели клетки. Однако эти средства также химически реагируют с сульфгидрильными, амидными, гидроксильными, карбоксильными и фосфатными группами других клеточных нуклеофилов. Основной механизм действия этих средств состоит во внутримолекулярной циклизации с образованием иона этиленимониума, который может прямо или через образование карбоний-ка-тиона (карбкатиона) переносить алкильную труп-
БИС(ХЛОРЭТИЛ)АМИНЫ
СН2СН2С1
R —N \
СН2СН2С1
Циклофосфамид
СН3-
Мехлорзтамин
НИТРОЗОМОЧЕВИНЫ
R /
NH
/
О =С \
N — СН2 — СНгС! /
О =N
Хлорамбуцил
Мелфалан
Рис. 56-4. Структурные формулы основных классов алкилирующих средств
ГдеИ:
— СН2СН2С1
BCNU (кармустин)
АЛ КИЛ СУЛЬФОНАТЫ О
II
СН2 — О — S — СН3
I II
сн2 о
I
сн2 о
I II
СН2—О —S —СНз
II о Бусульфан
ДНК ДНК
ДНК
Перекрестносвязанные остатки гуанина
Алкилированный гуанин
Рис. 56-5. Механизм алкилирования гуанина ДНК. Бис(хлорэтил)амин образует ионы этиленимониума и карбкатиона, которые реагируют с основанием N7 гуанина в ДНК, образуя алкилированный пурин. Алкилирование второго остатка гуанина (по представляемому механизму) приводит к перекрестному связыванию цепочек ДНК
NH О
\ / Р
/ X
О N(CH2CH2CI)2
Циклофосфамид
Цитохром Р-450-оксидаза печени
ОН
tNH О
V
/ X
О N(CH2CH2CI)2
4 - Гидроксициклофосфамид (активный)
О
II
CH h2N JO
СН2 Р
X / \
СН2 —О N(CH2CH2CI)2
H2N О \ /
О Р
II / X
НОС — СН2СН2 — О N(CH2CH2CI)2
Карбоксифосфамид (неактивный)
СН2 = СН —ОНО Акролеин (цитотоксичный) +
h2n о
\ / р
/ X
НО N(CH2CH2CI)2
NH О
О N(CH2CH2CI)2
4 - Кетоциклофосфамид (неактивный)
Фосфорамид (азотистый иприт) (цитотоксичный)
Рис. 56-6. Метаболизм циклофосфамида
пу на клеточные составляющие. Кроме алкилирования, второй механизм, который характерен для нитрозомочевины, включает карбомоилирование лизиновых остатков белков через образование изоцианатов.
Основное место алкилирования ДНК — это позиция N7 гуанина (рис. 56-5); однако и другие основания могут алкилироваться, но в меньшей степени, включая N1 и N3 аденина, N3 цитозина, Об гуанина, так же как и атомы фосфора и протеины, связанные с ДНК. Эти взаимодействия происходят как на одной цепочке ДНК, так и на обеих через перекрестное связывание, поскольку большинство алкилирующих средств являются бифункциональными и имеют две реактивные группы. Алкилирование гуанина может привести к неправильному кодированию через связывание несоответствующего основания с тимином или к депуринизации через удаление остатка гуанина. Последний эффект приводит к разрыву цепочки ДНК посредством разделения сахаро-фосфатной структуры
ДНК. Перекрестное связывание ДНК, по-видимому, представляет наибольшее значение в цитотоксическом действии алкилирующих средств, и клетки в процессе репликации являются наиболее чувствительными к действию этих средств. Таким образом, хотя алкилирующие средства не являются циклоспецифическими препаратами, но клетки наиболее чувствительны к алкилированию в поздней фазе Gi и фазе S клеточного цикла и не реагируют в фазе G2.
Резистентность к препаратам
Механизмы приобретенной устойчивости к алкилирующим средствам могут включать увеличение способности восстанавливать повреждения ДНК, снижение проницаемости мембраны клетки для алкилирующего средства и увеличение продукции глутатиона, который инактивирует алкилирующие средства с помощью реакции конъюгации, катализируемой глутатион-8-трансферазой.
Фармакологические эффекты
Активные алкилирующие средства имеют прямые (кожно-)нарывные эффекты и могут повреждать ткани в месте инъекции и оказывают системное токсическое действие. Токсическое действие, как правило, дозозависимо и отмечается прежде всего в быстрорастущих тканях- костном мозге, желудочно-кишечном тракте и гонадах. После внутривенной инъекции мехлорэтамина, циклофосфамида или BCNU обычно наблюдаются тошнота и рвота в течение 30-60 минут. Рвотный эффект имеет центральное происхождение и может быть уменьшен при предварительном приеме фенотиазина или каннабиноидов (тетрагидроканнабинол, набилон). Подкожные инъекции мехлорэтамина или BCNU вызывают некроз ткани и отторжение некротических масс. Циклофосфамид не оказывает прямого нарывного действия и должен быть активирован до цитотоксической формы микросомальными ферментами (рис. 56-6). Микросомальная система оксидаз смешанной функции печени при участии цитохрома Р-450 превращает циклофосфамид в 4-гид-роксициклофосфамид, который находится в равновесном состоянии с альдофосфамидом. Считают, что эти активные метаболиты переносятся с кровью в опухолевые и нормальные ткани, где происходит неферментное расщепление альдофосфамида до цитотоксической формы — азотистого эфира, фосфо-рамида (азотистый иприт) и акролеина. Печень, по-видимому, защищена посредством ферментативного образования неактивных метаболитов 4-кетоцик-лофосфамида и карбоксифосфамида. Наибольшее токсическое действие алкилирующие средства оказывают на костный мозг, приводя к дозозависимому подавлению миелопоэза. Количество белых форменных элементов крови и абсолютное число гранулоцитов достигает своей нижней точки через 10-12 дней после инъекции мехлорэтамина или циклофосфамида, с последующим восстановлением в течение от 21 (циклофосфамид) до 42 (мехлор-этамин) дней. Самое низкое число белых форменных элементов крови наблюдается через 28 дней после введения нитрозомочевины, с восстановлением через 42 дня. Действие на мегакариоциты и тромбоциты аналогично влиянию на гранулоциты. Вследствие большой продолжительности жизни эритроцита действие на эритропоэз минимально и число красных кровяных клеток уменьшается умеренно. Побочное действие на костный мозг может
быть более тяжелым, когда алкилирующие средства используются вместе с другими миелосупрессивны-ми препаратами или с лучевой терапией. В этом случае часто необходимо уменьшать дозы во избежание чрезмерного токсического действия.
После гематопоэтического восстановления эти алкилирующие средства можно снова назначить по перемежающейся схеме дозировки с достаточными промежутками для восстановления числа форменных элементов крови. Нарушения функций яичек и яичников являются обычными поздними осложнениями терапии алкилирующими средствами, в то время как острый лейкоз — относительно редкое ос-ложнение при применении этих мутагенных средств (Boice, 1983).
Лекарственные формы алкилирующих средств для приема внутрь представляют большую ценность и были созданы с использованием относительно менее реактивных алкилирующих средств. Энтеральный прием циклофосфамида, мелфалана, хлорамбуцила, бусульфана и CCNU представляет собой наиболее обычный способ введения этих средств и вызывает эффекты, сходные с наблюдаемыми при парентеральном введении. В основном, если опухоль устойчива к одному из алкилирующих средств, она будет относительно резистентна и к другим средствам этого класса (хотя это необязательно для нитрозомочевины); однако имеются существенные исключения из этого правила в отношении специфических типов опухолей. В общем циклофосфамид является наиболее эффективным алкилирующим средством, доступным в настоящее время. Бусульфан для энтерального приема обладает большой степенью специфичности для ряда гранулоцитов и поэтому представляет особую ценность в терапии хронического миелогенного лейкоза. Достаточную степень абсорбции препаратов для энтерального приема определяют по выраженности лейкопении. При приеме этих средств необходимы повторные анализы крови, потому что развитие тяжелой лейкопении или тромбоцитопении требует перерыва в проведении лечения.
Препараты нитрозомочевины
Кармустин (BCNU), ломустин (CCNU) и сему-стин (метил-CCNU), по-видимому, не имеют перекрестной активности (как и в отношении устойчивости опухолей) с другими алкилирующими средствами. Для них необходима, вероятно, биотранс
формация, которая происходит посредством неферментативного распада до производных с алкилирующей и карбамоилирующей активностью. Препараты нитрозомочевины хорошо растворяются в липидах и проникают через гематоэнцефалический барьер, что позволяет их применять для лечения опухолей мозга. Механизм действия препаратов нитрозомочевины, по-видимому, состоит в перекрестном связывании ДНК посредством алкилирования. Препараты более эффективны в отношении клеток в фазе плато, чем в отношении экспоненциально растущих клеток, хотя в пределах популяции клеток, находящихся в цикле деления, препараты, по-видимому, замедляют развитие клеток в фазе синтеза ДНК. После энтерального приема CCNU или метил-CCNU количество метаболитов в плазме фактически соответствует принятому количеству препарата, с максимальной концентрацией метаболитов в плазме в первые 1-2 часа и быстрым их проникновением в центральную нервную систему в количестве 30-40 % от концентрации в плазме. Первичное время полусуществования в плазме находится в пределах 6 часов, вторйчный период составляет 1-2 суток. Экскреция с мочой является, по-видимому, основным способом выведения из организма. Единственный природный сахарсодержащий препарат нитрозомочевины, стрептозоцин, интересен тем, что обладает минимальной токсичностью в отношении костного мозга и часто эффективен в лечении карциномы инсулинсекретирующих островковых клеток поджелудочной железы и иногда лимфом, за исключением болезни Ходжкина.
Родственные препараты, действующие, вероятно, как алкилирующие средства
Большое количество соединений имеет алкилирующий механизм действия. К ним, в частности, относятся прокарбазин, дакарбазин, алтретамин (гексаметилмеламин) и цисплатин.
1. ПРОКАРБАЗИН
Средство для энтерального приема прокарбазин — это производное метилгидразина с химиотерапевтической активностью (особенно при болезни Ходжкина). Препарат также обладает лейкемоген-ными, тератогенными и мутагенными свойствами.
Механизм действия прокарбазина не определен; он подавляет синтез ДНК, РНК и белка; удлиняет интерфазу и вызывает разрыв хромосом. Метаболизм этого препарата с помощью микросомальных ферментов приводит к образованию азо-прокарбазина и Н2О2, которые могут отвечать за разделение цепочек ДНК. Другие образующиеся метаболиты препарата могут быть цитотоксичными. Один из них — ингибитор моноамин оксидазы (МАО), поэтому при назначении прокарбазина вместе с другими ингибиторами МАО могут отмечаться побочные эффекты. Кроме тошноты, рвоты и подавления функции костного мозга были выявлены также гемолитическая анемия, легочные реакции и побочные эффекты, вызванные приемом алкоголя (дисульфирамподобные). При приеме прокарбазина вместе с фенитоином наблюдалась кожная сыпь.
Прокарбамазин часто используют в комбинированной химиотерапии болезни Ходжкина; однако наличие лейкемогенных свойств иногда требует его замены другими средствами, которые обладают меньшим канцерогенным потенциалом.
2. ДАКАРБАЗИН
Дакарбазин — это синтетическое соединение, которое действует как алкилирующее средство после метаболической активации микросомальными ферментами печени посредством окислительного N-деметилирования до монометильного производного. Оно спонтанно распадается до 5-аминоими-дазола-4-карбоксамида, который выводится с мочой, и диазометана. Диазометан производит метилуглеродный ион, который, как считают, цитотоксичен. Дакарбазин вводят парентерально и он не является препаратом, требующим строгого соблюдения схемы лечения. Он вызывает заметную тошноту, рвоту и подавляет функции костного мозга Основное показание к применению — лечение меланомы, болезни Ходжкина и некоторых сарком мягких тканей. При лечении двух последних опухолей активность препарата потенцируется с помощью доксорубицина.
3. АЛТРЕТАМИН
(гексаметилмеламин)
Алтретамин имеет сходную структуру с триэти-ленмеламином. Он относительно плохо растворим в воде и применяется только энтерально. Родствен
ное соединение, пентаметилмеламин, который является основным метаболитом гексаэтилмеламина, лучше растворим, и сейчас проходит клинические испытания его форма для внутривенного введения. Оба средства быстро биотрансформируются посредством деметилирования, по-видимому, до активных промежуточных форм. Оба соединения вызывают тошноту, рвоту и нейропатии центральной и периферической нервной системы, но оказывают относительно умеренное миелосупрессивное действие. Алтретамин применяют для лечения карциномы яичников, устойчивой к алкилирующим средствам.
4. ЦИСПЛАТИН
Цисплатин (цмс-диаминдихлорплатин [II]) — это неорганический металлсодержащий комплекс, открытый Розенбергом и его коллегами, которые выявили, что нейтральный платиновый комплекс подавляет деление и вызывает рост филаментов у Escherichia coli. Было синтезировано много платиновых аналогов этого важного препарата. Точный механизм действия цисплатина все еще не установлен, но считают, что он действует аналогично другим алкилирующим средствам. Он убивает клетки во всех стадиях клеточного цикла, ингибирует биосинтез ДНК и связывает ДНК посредством образования межцепочечных перекрестных связей. Первичное место связывания — N7 гуанина, но ковалентные взаимодействия также происходят с аденином и цитозином. Платиновый комплекс, по-видимому, является синергистом некоторых других противоопухолевых средств. После внутривенного введения основные токсические эффекты — это тошнота и рвота. Цисплатин относительно слабо действует на костный мозг, но может вызвать дисфункцию почек и иногда дисфункцию слухового нерва. Гидратация организма только изотоническим раствором или вводимым вместе с маннитолом или с другими диуретиками, по-видимому, уменьшает нефротоксическое действие.
H3N СГ \ / pt2+
H3N7 4 Cl-
Цисплатин
Цисплатин обладает противоопухолевой активностью в отношении разных видов рака мочеполовой системы, особенно рака яичек, яичников и мочевого пузыря. Его применение совместно с винбластином и блеомицином явилось большим достижением в развитии излечивающей терапии недиссеминированного рака яичек. Другие аналоги препарата (карбоплатин) с достоверно меньшим токсическим действием на желудочно-кишечный тракт и почки, но с миелосупрессивной токсичностью являются выгодной альтернативой цисплатину.
Дозировка и токсичность алкилирующих средств
Алкилирующие средства применяются для лечения различных гематологических и плотных (солидных) видов рака, главным образом в качестве компонентов комбинированной химиотерапии. Дозировки и основные токсические эффекты представлены в табл. 56-2.
Тошнота и рвота являются практически всеобщими реакциями на внутривенное введение ме-хлорэтамина, циклофосфамида и кармустина и встречаются с умеренной частотой при энтеральном приеме циклофосфамида.
Серьезный токсический эффект при приеме терапевтических доз практически всех алкилирующих средств — это угнетение функции костного мозга и сопутствующие лейкопения и тромбоцитопения. Тяжелые инфекции и сепсис могут развиться, если гранулоцитопения будет ниже 600 кл./мкл. Снижение содержания тромбоцитов ниже 40 000 кл./мкл может сопровождаться геморрагиями. Циклофосфамид может вызвать облысение от легкого до выраженного у 30 % пациентов. Его прием сопровождается геморрагическим циститом, который часто можно предотвратить адекватной гидратацией больного.
Гематопоэтические эффекты токсических доз алкилирующих средств исчезают при прекращении приема препаратов. Внутривенные вливания эритроцитов и тромбоцитов, а также назначение антибиотиков для подавления инфекций применяются по необходимости, пока не восстановится функция костного мозга.
ТАБЛИЦА 56-2. Полифункциональные алкилирующие средства и вероятные алкилирующие средства:
схема дозировки и токсичность
Алкилирующее средство Схема дозировки для монотерапии препаратом Острая токсичность Поздняя токсичность
Эмбихин (Азотистый иприт) (HN2, мехлор-этамин, Мустарген) 0.4 мг/кг в/в в одной или разделенных дозах Тошнота и рвота Умеренное подавление числа форменных элементов в периферической крови.Чрезмерные
Хлорамбуцил (Лейкеран) 0.1 -0.2 мг/кг/день энтерально; 6-12 мг/день Нет дозы вызывают тяжелое подавление функции костного мозга
Циклофосфамид (Цитоксан) 3.5-5 мг/кг/день энтерально в течение 10 дней; 1 г/м2 в/в разовой дозой Тошнота и рвота с лейкопенией, тромбоцитопенией и кровотечениями. Облысение и геморрагический цис-
Мелфалан (Алкеран) 0.25 мг/кг/день энтерально в течение 4 дней каждые 4-6 недель Нет тит иногда встречаются при применении циклофосфамида. Циститы можно предотвратить
Тиотепа(триэтилентио-фосфорамид) 0.2 мг/кг в/в в течение 5 дней Нет адекватной гидратацией. Применение бусульфана сопро-
Бусульфан (Милеран) 2-8 мг/день энтерально; 150- 250 мг/курс Нет вождается пигментацией кожи, фиброзом легких и недостаточностью надпочечников
Кармустин (BCNU) 200 мг/м2 в/в каждые 6 недель Тошнота и рвота Лейкопения й тромбоцитопения
Ломустин (CCNU) Семустин (метил-CCNU) 150 мг/м2 энтерально каждые 6 недель 150 мг/м2 энтерально каждые 6 недель Тошнота и рвота Тошнота и рвота Редко отмечают гепатиты
Алтретамин (гексаме-тилмеламин) 10 мг/кг/день в течение 21 дня Тошнота и рвота Лейкопения, тромбоцитопения и периферические нейропвтии
Прокарбазин (Матулан) 50-200 мг/день энтерально Тошнота и рвота Подавление функции костного мозга и ЦНС
Дакарбазин 300 мг/м2 ежедневно в/в в течение 5 дней Тошнота и рвота Подавление функции костного мозга
Цисплатин (Платинол) 20 мг/м2/день в/в в течение 5 дней или 50-70 мг/м2 как разовую дозу каждые 3 недели Тошнота и рвота Дисфункция почек. Дисфункция слухового нерва
Карбоплатин (Параплатин) 360 мг/м2 в/в каждые 4 недели Тошнота и рвота Лейкопения и тромбоцитопения. Редко нейропатии и дисфункция печени
Анти метаболиты (структурные аналоги)
Клинически и концептуально было важно создать средства с действием на промежуточный метаболизм пролиферирующих клеток. Еще предстоит открыть биохимические свойства, уникальные для каждого типа раковых клеток, но уже известно,
что метаболизм неопластических (опухолевых) клеток обладает некоторыми количественными отличиями от метаболизма нормальных клеток, и это делает опухолевые клетки более восприимчивыми к некоторым антиметаболитам и структурным аналогам. Многие из этих средств были созданы (синтезированы) целенаправленно на основании знаний о клеточных процессах, хотя некоторые первоначально открыты как антибиотики.
Механизмы действия
Установлено, что биохимические пути, которые наиболее чувствительны к воздействию антиметаболитов, относятся к синтезу нуклеотидов и нуклеиновых кислот. В нескольких случаях, где известно, что фермент оказывает основное действие на метаболические пути, ведущие к клеточной репликации, ингибиторы реакции катализа оказались полезными противоопухолевыми средствами.
Эти препараты, их дозы и токсические эффекты представлены в табл. 56-3. Основные препараты рассматриваются далее.
Метотрексат
Метотрексат (МТХ) — это антагонист фолиевой кислоты, который связывается с активным каталитическим центром дигидрофолатредуктазы (ДФР), нарушая синтез редуцированной формы фолата, которая принимает одноуглеродные остатки. Нехватка этого кофактора прерывает синтез тимидилата, пуриновых нуклеотидов и аминокислот серина и метионина, тем самым вмешиваясь в образование ДНК, РНК и белка. Фермент связывает метотрексат чрезвычайно сильно, и при pH 6.0 дис
ТАБЛИЦА 56-3. Структурные аналоги: схема дозировки и токсичность
Химиотерапевтическое средство Схема дозировки препарата при монотерапии Отсроченная токсичность1
Азацитидин2 200 мг/м2/день в/в в течение 5 дней Тошнота и рвота, диарея, лихорадка, гипотензия, длительная гипоплазия костного мозга
Кладрибин 0.09 мг/кг/день в течение Эдней в/в Тяжелая миелосупрессия в течение
(Леустатин) инфузиями 2 недель после терапии
Цитарабин 100 мг/м2/день в течение 5-10 дней, Тошнота и рвота, подавление функции
(ара-С, цитозар-U) или продолжительными в/в инфузиями, или в/м каждые 8 часов костного мозга, мегалобластоз, лейкопения, тромбоцитопения
Флударабин (Флудара) 25 мг/м2/день в течение 5 дней каждые 28 дней (вводить в/в » 30 мин) Миелосупрессия. Примечание: высокие дозы оказывают сильное нейротоксическое действие
Фторурацил 15 мг/кг/день в/в в течение 5 дней Тошнота, изъязвление ротовой полос-
(5-FU, Адруцил) 24-часовыми инфузиями; 15 мг/кг еженедельно в/в ти и желудочно-кишечного тракта, подавление функции костного мозга
Меркаптопурин (6-МР, Пуринетол) 2.5 мг/кг/день энтерально Обычно хорошо переносится. Высокие дозировки могут вызвать подавление функции костного мозга
Метотрексат 2.5-5 мг/день энтерально (Реумат- Изъязвление ротовой полости и желу-
(аметоптерин, МТХ) реке); 10 мг интратекально (Фо-лекс) один раз или два раза в неделю дочно-кишечного тракта, подавление функции костного мозга, лейкопения и тромбоцитопения
Тиогуанин (6-TG) Поддерживающее средство при применении всех препаратов 2 мг/кг/день энтерально Обычно хорошо переносится. Более высокие дозировки могут вызвать подавление функции костного мозга
Аллопуринол(Зилоприм) 300-800 мг/день энтерально для предотвращения или облегчения гиперурикемии Обычно нет. Увеличивает эффекты и токсичность меркаптопурина при использовании их в комбинации
' Эти препараты не вызывают острой токсичности.
2 Для применения только по одобренным схемам лечения.
социации комплекса фермент—ингибитор (константа ингибирования примерно 1 нмоль/л) фактически не происходит. При физиологическом значении pH имеет место обратимая конкурентная кинетика (константа ингибирования 1 мкмоль/л). Внутриклеточное образование производных полиглутамата, по-видимому, важно для терапевтического действия метотрексата (Jolivet, 1983). Полиглутаматы метотрексата удерживаются клеткой дольше, чем метотрексат, и оказывают повышенное ингибирующее действие на ферменты, вовлеченные в метаболизм фолата, что делает их определяющим фактором продолжительности действия метотрексата.
Резистентность к препаратам
Устойчивые к метотрексату опухолевые клетки обладают следующими свойствами: 1) сниженным транспортом препарата; 2) измененной ДФР с меньшим аффинитетом к метотрексату; 3) сниженным образованием полиглутаматов; 4) повышенным уровнем синтеза ДФР. Рост устойчивости происходит за счет увеличения числа генов и приводит к заметному увеличению копий РНК и ДФР. Еще предстоит выявить, относится ли этот генетический механизм устойчивости к другим противоопухолевым препаратам или только к метотрексату.
Дозирование и токсические эффекты
Метотрексат вводится внутривенно или энте-рально (табл. 56-3). До 90 % от энтеральной дозы выводится с мочой в течение 12 часов. Препарат не подвергается метаболизму и поэтому его содержание в сыворотке пропорционально дозе до тех пор, пока адекватны функция почек и водный баланс. Токсические эффекты на пролиферирующие ткани обычно наблюдаются в костном мозге и, в меньшей степени, на коже и слизистой оболочке желудочно-кишечного тракта. Эффекты метотрексата устраняются введением лейковорина. “Спасение” лейковорином применяется при случайных передозировках или при экспериментальной терапии метотрексатом в высоких дозах, когда надо защитить нормальные клетки, а все еще функционирующие опухолевые клетки подвергнуть его цитотоксическому действию.
Другое применение
Другим важным показанием к применению метотрексата является ревматоидный артрит (глава 35) и псориаз. Клинически испытывается применение препарата для лечения астмы (глава 19) и как средства, вызывающего аборт (вместе с простагландином).
Антагонисты пурина
1. 6-ТИОПУРИНЫ
Меркаптопурин (6-МП) — первый препарат в ряду тиопуринов, у которого обнаружена эффективность как противоопухолевого средства. Подобно другим тиопуринам, он должен метаболизироваться гипоксантин-туанинфосфорибозилтрансферазой нуклеотида (6-тиоинозиновой кислоты), которая, в свою очередь, блокирует несколько ферментов превращения пуринов. Из 6-МП также образуется значительное количество тиогуаниловой кислоты и 6-метилмеркаптопурин риботида (ММПР). Эти метаболиты также могут внести свой вклад в действие меркаптопурина. 6-МП используется, в первую очередь, для лечения детского острого лейкоза, а его близкородственный аналог, азатиопурин, применяется как иммунодепрессивное средство (глава 57).
Тиогуанин (6-ТГ) блокирует отдельные ферменты пурино-нуклеотидного пути обмена. Разные ме
таболические нарушения связаны с цитотоксическим действием пуринотиолов. Они включают: подавление пурин-нуклеотидного превращения; уменьшение внутриклеточного уровня гуаниновых нуклеотидов, что приводит к подавлению синтеза гликопротеинов; вмешательство в образование ДНК и РНК и встраивание пуринотиолов в ДНК и РНК 6-ТГ действует как синергист при сочетанном применении с цитарабином для лечения острого - лейкоза взрослых.
Резистентность к препаратам
Устойчивость к 6-МП и 6-ТГ обычно наступает из-за уменьшения активности гипоксантин-гуанин-фосфорибозилтрансферазы; альтернативный механизм, в случае острого лейкоза, предполагает увеличение концентрации щелочной фосфатазы, что приводит к дефосфорилированию тиопуринового нуклеотида и потере клеткой образующегося рибонуклеозида.
Дозирование и токсические эффекты
Меркаптопурин и тиогуанин назначают внутрь (табл. 56-3) и они выводятся, главным образом, с мочой. Однако 6-МП превращается в неактивный метаболит (6-сульфомочевую кислоту) с помощью окисления, катализируемого ксантиноксидазой, в то время как для 6-ТГ необходимо дезаминирование перед метаболизмом этим ферментом. Это явление имеет важное значение, потому что аналог пурина, аллопуринол, является потенциальным
ингибитором ксантиноксидазы и часто используется в химиотерапии гематологических форм рака для предотвращения гиперурикемии после лизиса опухолевых клеток. Он предупреждает ее, блокируя распад пурина, приводящий к выведению клеточных пуринов, которые являются относительно более растворимыми, чем мочевая кислота. Так предотвращаются нефротоксическое действие и острая подагра, вызываемые чрезмерным количеством мочевой кислоты. Одновременная терапия аллопуринолом и 6-МП может привести к чрезмерному токсическому действию меркаптопурина, если не будет уменьшена его доза на 25-30 % от обычного уровня. Этого эффекта не наблюдается при применении 6-ТГ, который в сочетании с аллопуринолом допустимо использовать в полных дозах.
2. ФЛЮДАРАБИНА ФОСФАТ
Флюдарабина фосфат (2-фтор-арабинофурано-зиладенина монофосфат) быстро дефосфорилиру-ется in vivo до 2-фтор-арабинофуранозиладенина и, затем, фосфорилируется внутри клетки дезоксици-тидинкиназой до трифосфата. Этот продукт влияет на синтез ДНК посредством ингибирования ДНК-полимеразы и рибонуклеотидредуктазы. Флюдарабина фосфат применяется, главным образом, для лечения лимфопролиферативных заболеваний. Флюдарабина фосфат вводят парентерально и он выводится, в основном, с мочой; дозозависимая токсичность препарата проявляется в виде миелосупрессии.
он
Гипоксантин
3.КЛАДРИБИН
Кладрибин (2-хлородезоксиаденозин) достигает высокой внутриклеточной концентрации вследствие своей устойчивости к аденозиндезаминазе; он фосфорилируется дезоксицитидинкиназой и встраивается в ДНК. Кладрибин вызывает разрыв цепочки ДНК (по-видимому, вмешиваясь в восстановление ДНК) и потерю НАД (посредством активации поли[АДФ-рибозо]-синтетазы). Кладрибин рекомендуется для лечения волосато-клеточного лейкоза. Его вводят разовой, продолжающейся в течение 7 дней, инфузией. При данном способе применения токсический эффект, проявляющийся в транзиторном подавлении функции костного мозга, меньше.
Антагонисты пиримидина
1. ФТОРУРАЦИЛ
Фторурацил (5-ФУ) претерпевает биотрансформацию до рибозил- и дезоксирибозилнуклео-тидных метаболитов. Один из этих метаболитов, 5-фтор-2'-дезоксиуридина-5'-фосфат (FdUMP) образует тройной комплекс ковалентных связей с ферментом тимидилатсинтетазой и его кофактором Ь15,10-метилентетрагидрофолатом,— реакция, критически влияющая на синтезт иминовых нуклеотидов. Это приводит к ингибированию синтеза ДНК посредством “безтимийбвой смерти”. 5-ФУ превращается в 5-фторуридинтрифосфат, встраивается в РНК и влияет на процессинг и функции РНК. Таким образом, цитотоксические эффекты 5-ФУ развиваются вследствие его действия как на ДНК, так и на РНК.
Урацил
5-Фторурацил
Обычно 5-ФУ вводят внутривенно (табл. 56-3) и он обладает коротким периодом полувыведения. Хотя препарат активен при энтеральном приеме, его биодоступность при этом пути введения неустойчива. Флоксуридин (5-фтордезоксиуридин) оказывает сходное с 5-ФУ действие и применяется для инфузии в печеночную артерию. 5-ФУ в виде крема применяется местно для лечения рака кожи. Фторурацил применяют системно для лечения разнообразных аденокарцином. К его основным токсическим эффектам относятся миелосупрессия и воспаление слизистых оболочек.
ванию синтеза ДНК, в то время как образование РНК и белка продолжается и приводит к несбалансированному росту. Цитарабин также встраивается в ДНК и РНК. Встраивание в ДНК приводит к вмешательству в процесс удлинения цепочки и неправильному связыванию фрагментов вновь синтезированной ДНК. Время задержки АгаСТР в клетке, по-ввдимому, коррелирует с его летальным действием на злокачественные клетки.
но
Цитозинарабинозид (Цитарабин)
После внутривенного введения (табл. 56-3) препарат быстро элиминируется, большая часть его дезаминируется до неактивной формы. Соотношение анаболического фермента дезоксицитидинки-назы и инактивирующего — цитидиндезаминазы важно для цитотоксического действия цитарабина.
Учитывая специфичность цитарабина в отношении S-фазы клеточного цикла, его эффективность в большой степени зависит от схемы дозировки. Поэтому препарат необходимо вводить или длительной инфузией, или каждые 8-12 часов в течение 5-7 дней. Его применение почти полностью ограничивается лечением острого миелогенного лейкоза, при котором он является основным препаратом. Побочные эффекты включают тошноту, тяжелую ми-елосупрессию, стоматиты и облысение разной степени тяжести.
2. ЦИТАРАБИН
Цитарабин (цитозинарабинозид, ара-С) — это антиметаболит со специфическим действием на фазу S клеточного цикла, который конвертируется дезоксицитидинкиназой до 5'-мононуклеотида (АгаСМР). АгаСМР далее метаболизируется до трифосфата (АгаСТР), который конкурентно ингибирует ДНК-полимеразу. Это приводит к блокиро-
3. АЗАЦИТИДИН
Азацитидин (5-азацитвдин) вызывает множественные эффекты, связанные с его цитотоксическим действием. Он фосфорилируется до мононуклеотида посредством уридин-цитвдинкиназы. Азацитидин 5'-фосфат далее ингибирует оротидилат-декарбоксилазу, что уменьшает продукцию пиримидиновых нуклеотидов. Дальнейший метаболизм
приводит к встраиванию азацитидина в ДНК и РНК и подавляет синтез ДНК, РНК и белка.
5-Азацитидин (Азацитидин)
Азацитидин вводится внутривенно (табл. 56-3), его надо беречь от света и хранить при слегка кислой pH. Препарат нестабилен из-за возможности разрыва кольца. При приеме отмечают тошноту и лихорадку. Период полувыведения составляет 3-6 часов, большая часть выводится или в неизмененном виде, или в дезаминированной форме.
В США азацитидин в настоящее время изучается, и он известен как “средство второго ряда” для лечения острого лейкоза. Оптимальная схема дозировки еще не разработана. Препарат может вызвать выраженную длительную миелосупрессию.
Растительные алкалоиды
Винбластин
Винбластин — растительный алкалоид, полученный из Vinca rosea, или барвинка. Механизм его действия включает деполимеризацию микротрубочек, которые являются важной частью цитоскелета и митотического веретена деления. Препарат специфически связывается с белком микротрубочек тубулином, образуя димер. Комплекс препарата с тубулином присоединяется к формирующемуся концу микротрубочек, завершая их сборку, и далее происходит деполимеризация микротрубочек. В результате митоз останавливается в метафазе, митотическое веретено деления растворяется и нарушается сегрегация хромосом. Препарат вызывает тошноту и рвоту, облысение и подавляет функцию костного мозга. Используется при лечении системной болезни Ходжкина и других лим
фом (табл. 56-4). Некоторые родственные средства, включая деацетилвинбластин (виндезин) и винзо-лидин, в настоящее время проходят клинические испытания.
Винкристин
Винкристин также алкалоид V. rosea и структурно близок с винбластином. Считают, что механизм его действия идентичен таковому у винбластина; он является “ядом для веретена деления” и вызывает остановку митотического цикла. Несмотря на сходство с винбластином, винкристин обладает удивительно отличающимся спектром клинического действия и качественно отличными токсическими эффектами.
Винкристин успешно применялся в комбинации с преднизоном для достижения ремиссии при остром лейкозе у детей. Он также используется для лечения некоторых других быстро пролиферирующих новообразований. Препарат часто вызывает нейротоксические эффекты (табл. 56-4), что ограничивает его применение только короткими курсами. Он иногда подавляет функцию костного мозга.
Подофиллотоксины
Два соединения — VP-16 (этопозид) и родственный препарат VM-26 (тенипозид) являются полу-синтетическими производными подофиллотоксина, который выделяют из корня мандрагоры (Podophyllum peltatupi). Этопозид разрешен к клиническому применению в США; форма для энтерального приема все еще проходит испытания.
ТАБЛИЦА 56-4. Химиотерапия противоопухолевыми препаратами природного происхождения: схема дозировки и токсические эффекты
Препарат Схема дозировки при монотерапии Острая токсичность Поздняя токсичность
Блеомицин До 15 мг/м2 два раза Аллергические реак- Отек кистей рук, фиброз лег-
(Бленоксан) в неделю до общей дозы 200 мг/м2 ции, лихорадка, гипотензия ких, стоматиты, облысение
Дактиномицин (актиномицин D, Космеген) 0.04 мг/кг в/в еженедельно Тошнота и рвота Стоматиты, расстройство желудочно-кишечного тракта, облысение, подавление функции костного мозга
Даунорубицин 30-60 мг/м2 ежедневно в/в в Тошнота, лихорадка, Кардиотоксичность, подавле-
(дауномицин, течение 3 дней или 30- покраснение мочи ние функции костного мозга,
Керубидин) 60 мг/м2 в/в еженедельно (не гематурия) облысение
Доксорубицин 60 мг/м2 в/в каждые 3 неде- Тошнота, покраснение Кардиотоксичность, облысе-
(Адриамицин) ли до максимальной общей дозы 550 мг/м2 мочи (не гематурия) ние, подавление функции костного мозга, стоматиты
Этопозид 50-100 мг/м 'ежедневно в Тошнота, рвота, гипо- Облысение, подавление функ-
(ВеПезид, VP-16) течение 5 дней тензия ции костного мозга
Идарубицин (Идамицин) 12 мг/м2 в/в ежедневно в течение 3 дней (с цитарабином) Тошнота, рвота Подавление функции костного мозга, воспаление слизистых оболочек, кардиотоксичность
Паклитаксел 130-170 мг/м2 в/в за 3 или Тошнота, рвота, гипо- Подавление функции костного
(Таксол) 24 часа каждые 3-4 недели тензия, аритмии мозга
Пликамицин (митра-мицин, Миграции) 25-50 мкг/кг в/в через день до приема 8 доз Тошнота, рвота Тромбоцитопения, гепатотоксичность
Митомицин (Мутамицин) 20 мг/м2 каждые 6 недель Тошнота Тромбоцитопения, лейкопения
Винбластин (Велбан) 0.1-0.2 мг/кг в/в еженедельно Тошнота, рвота Облысение, утрата рефлексов, подавление функции костного мозга
Винкристин (Онковин) 1.5 мг/м2 в/в (максимум: 2 мг еженедельно) Нет Отсутствие рефлексов, мышечная слабость, периферические невриты, паралитическая непроходимость кишечника, умеренное подавление функции костного мозга, облысение
Этопозид и тенипозид довольно сходны по химической структуре, по блокирующему действию на клетки в поздней фазе S-G2 клеточного цикла и по клиническим проявлениям, наблюдаемым при приеме. Механизм действия включает подавление топоизомеразы II, что приводит к повреждению ДНК вследствие разрыва цепочки при формировании тройного комплекса препарата, ДНК и фермента. Препараты нерастворимы в воде и требуют ра
створимого носителя для приготовления формы для клинического применения. После внутривенного введения (табл. 56-4) они связываются с белками и распределяются по всему организму, за исключением мозга. Выводятся преимущественно с мочой, и в меньшем количестве — с желчью. Кроме тошноты, рвоты и облысения, наблюдаются значительные токсические эффекты в отношении гематопоэтической и лимфоидной систем. До настояще
го времени этопозид рассматривается как средство лечения моноцитарного лейкоза, тестикулярного рака и овсяно-клеточной карциномы легких; тени-позид активен в отношении разных лимфом.
Паклитаксел
Паклитаксел — эфир алкалоида, получаемого из Тиса западного (Taxus brevifolia) и Тиса европейского (Taxus baccata). Препарат действует как яд для митотического веретена деления посредством увеличения полимеризации тубулина. Эта стимуляция паклитакселом сбора микротрубочек происходит при отсутствии микротрубочко-ассоциированного протеина (MAPs) и гуанозинтрифосфата.
Паклитаксел обладает значительной активностью при лечении рака яичников и поздней стадии рака молочной железы. Основными дозозависимыми токсическими эффектами являются: нейтропения, тромбоцитопения и периферические нейропатии. Родственный препарат таксотер в настоящее время проходит клинические испытания.
Антибиотики
Скрининг продуктов жизнедеятельности микробов привел к открытию нескольких ингибиторов роста, которые оказались эффективными для химиотерапии рака. Многие из этих антибиотиков связываются с ДНК посредством встраивания между специфическими основаниями и блокируют синтез новых ДНК или РНК (или обеих), вызывая разделение цепочек ДНК и таким образом влияя на репликацию клетки. Все эти клинически эффективные антибиотики являются продуктом разных видов почвенных грибов Streptomyces. К ним относятся антрациклины, актиномицин, блеомицин, митомицин и пликамицин.
Антрациклины
Антрациклиновые антибиотики, выделенные из Streptomyces peucetius или caesius, относятся к наиболее эффективным цитотоксическим противоопухолевым средствам. Два родственных соединения, доксорубицин и даунорубицин, разрешены FDA к применению и используются чаще других.
Другие антрациклины в настоящее время разра-. батываются, включая полусинтетические средства.
nh2
О
II
R: — С — СН3
Даунорубицин
О
II
R: —С —СН2ОН
Доксорубицин
Даунорубицин (первое средство из этого класса, которое было выделено) применяется для лечения острого лейкоза. Доксорубицин обладает широким спектром потенциальной активности в отношении многих разных типов рака.
Механизм действия
У антрациклинов выявлены три основных механизма токсического действия на органы и опухоли: 1) высокоаффинное связывание с ДНК (посредством встраивания в структуру с последующей блокадой синтеза ДНК и РНК) и разделение цепочки ДНК за счет действия на топоизомеразу II; 2) связывание с мембранами клеток с изменением подвижности их транспорта и ионов и 3) генерация семихиноновых свободных радикалов и радикалов кислорода с помощью ферментрегулируемых восстановительных процессов. Последнее действие, возможно, обусловливает кардиотоксический эффект вследствие опосредуемого радикалами кислорода повреждения мембран.
Фармакокинетика
При клиническом использовании антрациклины вводятся внутривенно (табл. 56-4). Максимальная концентрация в крови уменьшается на 50 % в первые 30 минут после инъекции, но значимый уровень сохраняется до 20 часов. Антрациклины метаболизируются в печени с восстановлением и гидролизом заместителей кольца. Спиртовая форма является активным метаболитом, а агликон — неактивным. Большая часть препарата и его метабо
литы выводятся с желчью, и приблизительно */6 выводится с мочой. Некоторые метаболиты сохраняют противоопухолевую активность. Экскреция с желчью включает внутрипеченочную циркуляцию цитотоксических продуктов. У пациентов со значительным увеличением билирубина в сыворотке (> 2.5 мг/100 мл) начальная доза антрациклинов должна быть уменьшена до 75 % от обычной.
Клиническое применение
Доксорубицин является одним из наиболее важных противоопухолевых средств. Он применяется главным образом в лечении карцином молочной железы, эндометрия, яичников, яичек, щитовидной железы и легких, а также для лечения многих сарком, включая нейробластому, саркому Эвинга, остеосаркому и рабдомиосаркому. Препарат эффективен при гематологических видах рака, включая острый лейкоз, множественную миелому, болезнь Ходжкина и диффузную неходжкинскую лимфому; используется для вспомогательной терапии остеогенной саркомы и рака молочной железы. Доксорубицин, в основном, применяют в комбинации с другими средствами (например, циклофосфамидом, цисплатином и с производными нитрозомочевины), с которыми он действует как синергист, вызывая более продолжительную ремиссию, чем при монотерапии. При таком методе использования уменьшаются некоторые токсические эффекты, которые проявились бы при назначении больших доз доксорубицина.
Основное назначение даунорубицина — лечение острого лейкоза. В данном случае препарат обладает несколько большей активностью, чем доксорубицин. Однако даунорубицин имеет более узкий спектр применения; эффективность его действия в случае плотных опухолей, по-видимому, ограничена.
Новый аналог антрациклина — идарубицин прошел полное клиническое испытание и сейчас одобрен для применения в лечении острого миелоидного лейкоза (ОМЛ). В комбинации с цитарабином идарубицин, по-видимому, более активен, чем даунорубицин, вызывая полную ремиссию у пациентов с ОМЛ. Наблюдается некоторое увеличение продолжительности жизни при применении комбинации идарубицина и цитарабина по сравнению с комбинацией даунорубицина и цитарабина.
Побочные реакции
Как и многие другие цитотоксические средства, антрациклины подавляют функции костного мозга, но кратковременно и с быстрым восстановлением. Токсические эффекты более выражены у антрациклинов (доксорубицина и даунорубицина), чем у других средств, включая потенциально необратимую, кумулятивную дозозависимую кардиотоксичность. Механизм кардиотоксического действия до сих пор изучается и, видимо, включает чрезмерную внутриклеточную опосредованную доксорубицином продукцию свободных радикалов в миокарде. Это явление редко отмечается при приеме доксорубицина в дозе меньше 500 мг/м2. Применение более низких еженедельных доз или продолжительных инфузий доксорубицина, при которых не достигаются максимальные концентрации в плазме, уменьшает частоту возникновения кардиотоксичес-ких эффектов по сравнению с прерывистой (каждые 3-4 недели) схемой применения более высоких доз.
Второй токсический эффект доксорубицина и даунорубицина — сильное или полное облысение при применении в стандартных дозах практически у всех больных.
Дактиномицин
Дактиномицин — противоопухолевый антибиотик, выделенный из Streptomyces.
Механизм действия и фармакокинетика
Дактиномицин прочно связывается с двухцепочечной ДНК посредством встраивания между смежной парой оснований гуанин-цитозин. Дактиномицин блокирует все формы ДНК-зависимого синтеза РНК, причем образование рибосомальной РНК наиболее чувствительно к действию препарата. Репликация ДНК снижается намного меньше, но белковый синтез у клеток, на которые воздействовал препарат, блокируется. Степень восприимчивости к дактиномицину, по-видимому, зависит от способности клеток накапливать и удерживать антибиотик
Приблизительно половина внутривенной дозы дактиномицина (табл. 56-4) остается в неизмененном виде и выводится с желчью; небольшое количество экскретируется с мочой. У препарата небольшое время полусуществования в плазме. Дактиио-
мицин раздражает ткани, поэтому его вводят осторожно, избегая попадания в околососудистые ткани. После введения вены промывают изотоническим раствором натрия хлорида.
Клиническое применение
Дактиномицин используют в комбинации с хирургическим вмешательством и с винкристином (с или без лучевой терапии) для вспомогательного лечения опухоли Вильмса. Его также применяют вместе с метотрексатом для проведения потенциально излечивающей терапии пациентов с локализованной или рассеянной хориокарциномой беременных.
Побочные реакции
Подавление функции костного мозга (основной дозозависимый токсический эффект препарата) обычно выявляется в течение 7-10 дней. Все форменные элементы крови чувствительны, но особенно тромбоциты и лимфоциты, следствием чего является в ряде случаев тяжелая тромбоцитопения. Также отмечают тошноту и рвоту, диарею, язвы полости рта и кожные высыпания. Препарат оказывает иммуносупрессорное действие, поэтому пациентам, принимающим дактиномицин, не следует назначать вакцины живых вирусов. Иногда наблюдаются облысение и различные кожные нарушения. Дактиномицин, как и антрациклины, при проведении повторной лучевой терапии способствует рецидивированию поражений кожи, наблюдавшихся в местах предыдущего облучения (radiation recall).
Пликамицин
Пликамицин (генерик — митрамицин) является одним из хромомициновых антибиотиков, выделенных из Streptomycesplicatus. Механизм действия пликамицина, по-видимому, включает связывание с ДНК, возможно, через комплекс антибиотик-Mg2+; это взаимодействие прерывает ДНК-зависи-мый синтез РНК. Кроме того, препарат снижает концентрацию кальция в плазме, очевидно посредством воздействия на остеокласты, которое не зависит от эффекта на опухолевые клетки (используется при гиперкальциемии, глава 41). Пликамицин слабоэффективен при лечении тестикулярных
раков, невосприимчивых к стандартному лечению, но он чаще используется для устранения тяжелой гиперкальциемии, обусловленной злокачественным заболеванием.
Токсические эффекты пликамицина включают тошноту и рвоту, тромбоцитопению, лейкопению, гипокальциемию, кровотечения и токсическое повреждение печени. Пликамицин в настоящее время применяется не только для лечения гиперкальциемии, но и по некоторым другим показаниям.
Митомицин
Митомицин (митомицин С) — антибиотик, выделенный из Streptomyces caespitosus. Он содержит хинон, карбамат и азиридиновые группы, каждая из которых вносит свой вклад в противоопухолевую активность. Препарат относится к “биовосстанови-тельным” алкилирующим средствам. Он подвергается метаболической (ферментативной) восстановительной активации с образованием алкилирующего средства, которое перекрестно связывается с ДНК. Испытывающие гипоксию стволовые клетки плотных (солидных) опухолей находятся в условиях, благоприятных для течения восстановительных реакций, и являются более чувствительными к цитотоксическому действию митомицина, чем нормальные и оксигенированные опухолевые клетки. Считают, что митомицин является CCNS-алкилирующим препаратом. Хотя митомицин — один из наиболее токсичных препаратов, разрешенных для клинического использования, он является лучшим средством в качестве вспомогательного препарата при лучевом воздействии на опухолевые клетки в состоянии гипоксии. Расширяется его использование в комбинированной химиотерапиии (вместе с блеомицином и винкристином) для лечения чешуйчато-клеточной карциномы шейки матки и аденокарцином желудка, поджелудочной железы и легких (вместе с доксорубицином и фторурацилом).
Препарат также применяется в качестве средства второго ряда для лечения метастатического рака ободочной кишки. Особое положение занимает митомицин в местном внутрипузырном лечении малых папиллом мочевого пузыря. Препарат вводят в мочевой пузырь в дистиллированной воде обычно на 3 часа, курс лечения составляет несколько недель. Системно всасывается очень незначительное количество препарата, и потому он достаточно эффективен в уменьшении частоты появления таких опухолей мочевого пузыря.
При внутривенном введении митомицин исчезает из сосудистого русла быстро. Вероятно, он элиминируется в основном за счет метаболизма в печени. Митомицин вызывает тяжелую миелосупрес-сию с относительно поздним токсическим действием на все три ростковых элемента костного мозга. Высоковыраженные токсические эффекты наступают после приема повторных доз. Эта поздняя форма токсических эффектов проявляется в поражении стволовых клеток гемопоэза. Тошноту, рвоту и анорексию обычно отмечают через короткий промежуток времени после инъекции, также иногда выявляют поражение почек и интерстициальную пневмонию.
Блеомицин
Блеомицины представляют ряд противоопухолевых антибиотиков, продуцируемых Streptomyces verticillus. В клинике применяется смесь (Бленок-сан) 11 различных гликопептидов с главными компонентами — блеомицином А2 и блеомицином В2. Блеомицин, по-видимому, действует посредством связывания с ДНК, что приводит к разрыву одной или обеих цепочек с последующим образованием свободных радикалов и подавлением синтеза ДНК. Полагают, что фрагментация ДНК происходит вследствие окисления комплекса ДНК-блеоми-цин-Бе(П) и приводит к хромосомным аберрациям. Блеомицин является CCS-препаратом, который вызывает скопление клеток в фазе G2. Этот эффект, по-видимому, доЗозависйм, и хроническое введение низких доз повторными инъекциями или продолжительными инфузиями считается наиболее эффективной схемой применения. Препарат действует как синергист с другими средствами — винбластином и цисплатином — в излечивающей терапии тестикулярных видов рака. Его также применяют для лечения чешуйчато-клеточных карцином голо
вы и шеи, шейки матки, кожи, полового члена и прямой кишки и для комбинированной химиотерапии лимфом. По специальному показанию блеомицин используют для внутриполостного лечения злокачественных выделений при раке яичников и молочной железы. Препарат можно вводить подкожно, внутримышечно или внутривенно, а также внутрь полостей (табл. 56-4). Максимальная концентрация блеомицина в крови после внутримышечной инъекции наблюдается в течение 30-60 минут. Внутривенные инъекции сходных доз вызывают более высокий пик концентрации, а предельное время полусуществования составляет около 2.5 часов.
Побочные эффекты включают летальные анафилактические реакции и высокую частоту возникновения лихорадки, с ознобом или без, особенно у больных с лимфомой. Лихорадка может привести к дегидратации и гипотензии у чувствительных пациентов, поэтому обычно применяют пробные малые дозы препарата для предупреждения этого потенциально тяжелого токсического эффекта. Более распространенные токсические эффекты включают анорексию, образование пузырей и гиперкератозы ладоней. Легочный фиброз, этот смертельный побочный эффект, развивается редко, как правило, у пожилых пациентов. Препарат не дает значимого миелосупрессивного эффекта поэтому он может быть включен в некоторые схемы комбинированной химиотерапии, поскольку не оказывает дополнительного токсического действия на костный мозг.
Гормональные средства
Стероидные гормоны и антистероидные препараты
Взаимодействие между гормонами и гормонза-висимыми опухолями было впервые выявлено в 1896 г., когда Битсон (Beatson) продемонстрировал, что овариэктомия вызывает улучшение состояния у женщин с прогрессирующим раком молочной железы. Половые гормоны и гормоны надпочечников сейчас применяются для лечения некоторых типов онкологических заболеваний. Поскольку половые гормоны имеют отношение к стимуляции и контролю пролиферации и функции определенных тканей, включая молочную железу и предстательную железу, рак, возникший в этих тканях, может быть подавлен или стимулирован соответствую
щим изменением гормонального баланса. Следствием этого явилась разработка паллиативной терапии рака молочной железы и рака предстательной железы половыми гормонами или методом удаления определенных эндокринных органов.
Кортикостероиды надпочечников (особенно аналоги глюкокортикоидов) применяются для лечения острого лейкоза, лимфом, миеломы и других гематологических видов рака, а также прогрессирующего рака молочной железы и как вспомогательные средства в лечении гиперкальциемии, появляющейся при многих видах рака. Эти стероиды вызывают разрушение лимфоцитов, регресс лимфатических узлов и подавление роста определенных мезенхимальных тканей.
Большинство стероидных гормонов, применяемых для лечения рака, перечислены в табл. 56-5.
Фармакологические эффекты
Механизм действия стероидных гормонов в отношении рака лимфатической системы, рака молочной железы и предстательной железы частично изучен. Стероидные гормоны связываются с рецепторными белками в раковых клетках. Восприимчивость к эндокринной терапии предопределяет высокое содержание рецепторных белков. В опухолевых клетках выявлены высокоспецифичные рецепторные белки для эстрогенов, прогестерона, кортикостероидов и андрогенов. Как и в нормальных клетках, стероидные гормоны образуют подвижный комплекс стероид-рецептор, который непосредственно связывается с ядерным агистоновым протеином ДНК, активируя транскрипцию соответствующих кластеров генов.
Большинство стероидчувствительных видов рака имеют специфические рецепторы. Клетки преднизончувствительных лимфом и эстрогенчувствительных опухолей молочной железы и предстательной железы содержат, соответственно, специфические рецепторы для кортикостероидов, эстрогенов и андрогенов. В настоящее время доступно проведение анализа биопсийных образцов на содержание стероидных рецепторов, по результатам которого можно предсказать, кому из пациентов наиболее вероятно поможет терапия стероидами. Измерение эстрогеновых белков рецепторов (ER) и белков рецепторов прогестерона (PR) является стандартным клиническим тестом при раке молочной железы. ER- или PR-положительные результа
ты предопределяют чувствительность к гормональному подавлению опухоли или вспомогательной терапии, в то время как пациенты, опухоли которых являются ER-отрицательными, в основном, не реагируют на такое лечение.
Клиническое применение
Половые гормоны используют для лечения рака молочной железы у женщин и мужчин, рака предстательной железы и рака эндометрия матки (табл. 56-7). Изучение андрогенных, эстрогенных и прогестероновых половых гормонов выявило их важность для лечения неоперабельных опухолей молочной железы, предстательной железы и эндометрия. В заместительных дозах эстроген может стимулировать рост рака молочной железы и эндометрия. Удивительно, что высокие дозы эстрогена, которые терапевтически целесообразны в случае метастатического рака молочной железы, в значительной степени замещены антиэстрогенами. В случае рака предстательной железы андрогены стимулируют рост опухоли, а введение эстрогенов приводит к подавлению продукции андрогенов. Препараты, которые блокируют андрогенные рецепторы или восстановление тестостерона до дигидротестостерона (активный андроген предстательной железы), также применимы для лечения рака предстательной железы.
Побочные реакции
Андрогены, эстрогены и гормоны коры надпочечников вызывают задержку жидкости в организме, поскольку они уменьшают выведение Na+. Длительное применение андрогенов и эстрогенов сопровождается, соответственно маскулинизацией или феминизацией. Продолжительное применение адренокортикостероидов может привести к гипертензии, диабету, повышенной чувствительности к инфекции и развитию кушингоидной внешности (“луноподобное лицо”; глава 38, табл. 56-5).
Ингибиторы эстрогенов и андрогенов
Ингибитор эстрогенов тамоксифен имеет исключительное значение в лечении рака молочной железы. Он также эффективен в отношении проге-стеронустойчивого рака эндометрия. В настоящее
ТАБЛИЦА 56-5. Гормональноактивные средства: схема дозировки и токсичность
Гормональные средства Обычная дозировка для взрослых Острая токсичность Поздняя токсичность
Андрогены
Тестостерона пропионат 100 мг в/м 3 раза в неделю Нет Задержка жидкости, маскулинизация
Флюоксиместерон (Галотестин) 10-20 мг/день энтерально Нет Холестатическая желтуха у некоторых пациентов, принимающих флуоксиместерон
Антиандрогены
Флутамид (Эулексин) 500 мг/день энтерально Нет Нет
Эстрогены
Диэтилстильбэстрол Этинил эстрадиол 1-5 мг энтерально 3 раза вдень 3 мг/день энтерально Иногда тошнота и рвота Задержка жидкости, феминизация, маточные кровотечения
(Эстинил) Антиэстрогены
Тамоксифен (Нолвадекс) 20 мг/день энтерально Нет Нет
Прогестины
Гидроксипрогестерона 1 г в/м два раза в неделю Нет Нет
капроат
Медроксипрогестерон (Провера) 100-200 мг/день энтерально; 200-600 мг энтерально два раза в неделю Нет Нет
Мегестрола ацетат (Мегейс) 40 мг энтерально 4 раза вдень Нет Задержка жидкости
Адренокортикостероиды
Гидрокортизон 40-200 мг/день энтерально Нет Задержка жидкости, ги-
Преднизон 20-100 мг/день энтерально Агонисты гонадотропинрилиэинг-гормона Нет пертензия, диабет по-вышенная чувствительность к инфекции, “луноподобное"лицо
Госерелина ацетат (Золадекс) 3.6 мг п/к один раз в месяц Преходящее появление симптомов Нет
Леупролид (Лупрон) 7.5 мг п/к раз в месяц “Приливы" жара (приступообразные ощущения жара) Нет
Ароматические ингибитор
Аминоглютетимид 250 мг энтерально два раза (Цитадрен) в день, с гидрокортизо- ном, 20 мг два раза вдень Ингибитор пептидного гормона Головокружения, сыпь Нет
Октреотид (Сандостатин) 100-600 мкг/день п/к в 2-4 дробных дозах Тошнота и рвота Нет
время тамоксифен проходит клинические испытания в качестве химиопрофилактического средства у женщин с высоким риском возникновения рака молочной железы. Тамоксифен действует как конкурентный парциальный агонист-ингибитор эстрогенов и связывается с рецепторами эстрогена эстрогенчувствительных тканей и опухолей. Однако тамоксифен обладает константой аффинитета к ER в 10 раз меньшей, чем эстрадиол, что диктует необходимость удаления эндогенного эстрогена для достижения оптимального эффекта антиэстрогена.
Необходимая концентрация тамоксифена в плазме достигается после энтерального приема. Препарат обладает гораздо большим периодом полувыведения, чем эстрадиол. Обычная дозировка составляет 10 мг два раза в день (табл. 56-5), хотя дозы до 100 мг/м2 вводили без появления признаков токсичности. Для достижения постоянной концентрации активного метаболита (моногидрокситамоксифена) в плазме при схеме приема по 20 мг/день может потребоваться несколько недель, поэтому рекомендуют начинать в первый день с “нагрузочного курса” 80 мг.
Побочные реакции в обычном диапазоне доз умеренные. Наиболее часто наблюдаются “приливы” жара. Иногда отмечают тошноту, а также задержку жидкости. В ряде случаев происходит “внезапное обострение” рака груди, которое, как правило, исчезает при продолжении терапии.
Тамоксифен
При прогрессирующем раке молочной железы клиническое улучшение отмечают у 40-50 % пациентов, принимающих тамоксифен. Для этих больных характерно: 1) отсутствие эндогенных эстрогенов (овариэктомия или состояние постменопаузы) и 2) наличие рака молочной железы, при котором выявляются ER- или PR-белки. При применении в качестве вспомогательной терапии при хирургическом вмешательстве у женщин в состоянии постменопаузы с ER-положительным раком молочной железы тамоксифен достоверно увеличивал срок жизни. Кроме прямого антиэстрогенного
эффекта на опухолевые клетки, тамоксифен также подавляет уровень инсулинподобного фактора роста I и регулирует локальную продукцию трансформирующего фактора роста Р (TGFp). Эти эндокринные эффекты тамоксифена можно считать основой определенного противоопухолевого действия в отношении других типов опухолей — рака яичников и меланомы.
Антиандроген флутамид одобрен FDA для лечения рака предстательной железы. Его используют для устранения остаточных андрогенных эффектов после орхиэктомии или в сочетании с леупро-лидом. Финастерид, нестероидный ингибитор 5а-тестостеронредуктазы (глава 39), фермента, который превращает тестостерон в дигидротестостерон, находится в стадии изучения как средство лечения рака. Он считается многообещающим препаратом, поскольку способен предотвращать эффекты андрогенов на опухолевую ткань предстательной железы без подавления продукции андрогенов или действия на другие ткани.
Агонисты гонадотропин-рилизинг-гормона
Леупролид (ацетат) и госерелин являются синтетическими пептидными аналогами естественного гонадотропинрилизинг-гормона (GnRH, LHRH) (главы 36 и 39). Эти аналоги более сильны, чем естественный гормон, и действуют как агонисты GnRH, с парадоксальным результатом действия на гипофиз при продолжительном приеме (или как депо-препараты) — сначала стимуляция, за которой следует подавление высвобождения фолликулостимулирующего гормона и лютеинизирующего гормона, что приводит к снижению тестикулярного синтеза андрогенов. Именно это явление обусловливает эффективность данных средств при лечении метастатической карциномы предстательной железы.
Леупролид сравнивали с диэтилстильбэстролом (ДЭС) при стандартной гормональной терапии последним рака предстатательной железы. Подавление синтеза андрогена и уменьшение в сыворотке простатической кислой фосфатазы (маркера метастатического распространения рака) у обоих препаратов примерно одинаково. Однако болезненная гинекомастия, тошнота, рвота, отек и тромбоэмболии встречаются при применении леупролида со значительно меньшей частотой. Леупролид и госерелин
дороже, но разница в затратах исчезает при оценке общей стоимости лечения осложнений, вызванных применением ДЭС, или стоимости операции и госпитализации по поводу орхиэктомии. При приеме леупролина и госерелина один раз в месяц формируется продолжительно действующее депо. Эндокринные эффекты этих средств могут успешно использоваться для лечения гормонзависимого рецеп-торположительного рака молочной железы, но это показание к применению еще требует изучения.
Ингибиторы ароматазы
Аминоглютетимид является ингибитором синтеза стероидов надпочечниками на первом этапе (превращение холестерола в прегненолон; глава 38). Аминоглютетимид также ингибирует вненад-почечниковый синтез эстрона и эстрадиола. Кроме прямого действия на стероидогенез в надпочечниках, аминоглютетимид ингибирует фермент ароматазу, который превращает андроген надпочечников андростендион в эстрон. Такая ароматизация андрогенного предшественника в эстроген может происходить в жировой клетчатке тела. Поскольку эстрогены усиливают рост рака молочной железы, синтез эстрогена в жировой ткани за пределами половых желез может быть важным для роста рака молочной железы у женщин в постклимактерическом периоде.
Аминоглютетимид эффективен для лечения метастатического рака молочной железы у женщин, опухоль которых содержит значительное количество рецепторов к эстрогену и прогестерону. Аминоглютетимид обычно назначают совместно с гидрокортизоном (в замещающих дозах) для того, чтобы избежать симптомов надпочечниковой недостаточности. Гидрокортизон предпочтительнее дексаметазона, поскольку последний усиливает скорость катаболизма аминоглютетимида. Побочные эффекты аминоглютетимида включают редкие головокружения, заторможенность, нарушения зрения и сыпь.
Аминоглютетимид совместно с гидрокортизоном обычно применяется для вспомогательной терапии второго ряда у женщин, которые лечились тамоксифеном, что обусловлено большим количеством побочных эффектов у аминоглютетимида, чем у тамоксифена. Тем не менее аминоглютетимид можно применять и для начальной гормонотерапии. Исследуются другие более сильные и селективные ингибиторы ароматазы.
Противоопухолевые средства разных групп (табл. 56-6)
Амсакрин
Амсакрин — это производное 9-анилиноакриди-на, которое вызывает разрыв хромосом. Этот препарат встраивается между парами оснований ДНК, нарушает форму двойной спирали и вызывает разрыв одной или двух цепочек ДНК и перекрестное связывание ДНК-белок. Считается, что разрыв цепочки ДНК происходит посредством образования комплекса топоизомераза П-ДНК при участии амсакрина.
Амсакрин большей частью метаболизируется печенью и имеет период полувыведения 8-9 часов. При нарушении функции печени происходит значительное увеличение времени его пребывания в плазме. Амсакрин обладает значительной активностью в отношении антрациклин- и цитарабинустой-чивого острого миелобластного лейкоза, прогрессирующих карцином яичников и лимфом. Гематологический токсический эффект определяется дозой. Сообщалось о случае остановки сердца во время инфузии амсакрина.
Аспарагиназа
Аспарагиназа (L-аспарагинамидогидролаза) является ферментом, который выделяется из бактерий. Препарат используется для лечения детского острого лейкоза. Аспарагиназа действует опосредованно через катаболический распад аспарагина в сыворотке до аспарагиновой кислоты и аммония. Концентрация глютамина в крови также уменьшается. Это приводит к подавлению синтеза белка опухолевыми клетками, для которых требуется внешний источник аспарагина. В результате низкого или дефицитного уровня синтеза аспарагина блокируется пролиферация клеток. Большинство неопухолевых клеток могут синтезировать аспарагин и поэтому являются менее чувствительными к действию аспарагиназы.
Гидроксимочевина
Гидроксимочевина (H2NCONHOH) является аналогом мочевины. Механизм действия заключается в подавлении синтеза ДНК в S-фазе. Препа-
ТАБЛИЦА 56-6. Противоопухолевые средства разных групп: схема дозировки и токсичность
Препарат Обычная дозировка Острая токсичность Отсроченная токсичность
Амсакрин 90 мг/м2 в/в в течение 5 дней (лейкоз) Тошнота Подавление функции костного мозга
Аспарагиназа 20000 МЕ/м2 ежедневно Тошнота и лихорадка, аллер- Гепатотоксичность, депрессия,
(Элспар) в/в в течение 5-10 дней гические реакции панкреатиты
Гидроксимочевина (Гидреа) 300 мг/м2 энтерально в течение 5 дней Тошнота и рвота Подавление функции костного мозга
Митотан (Лизодрен) 6-15 г/день энтерально Тошнота и рвота Дерматиты, диарея, депрессия
Митоксантрон (Новантрон) 10-12 мг/м2 в/в каждые 3-4 недели Тошнота Подавление функции костного мозга, иногда кардиотоксичность, умеренное облысение
Хинакрин 100-300 мг/день внут-риполостные инъекции в течение 5 дней Локальная боль и лихорадка Нет
рат ингибирует фермент нуклеотидредуктазу, вызывая истощение пула дезоксинуклеозидтрифосфата. Гидроксимочевину назначают внутрь. Основное применение — лечение меланомы и хронического миелолейкоза. Однако препарат играет второстепенную роль в обоих случаях. Главный побочный эффект — подавление функции костного мозга. В больших дозах (> 40 мг/кг в сутки) может возникнуть мегалобластоз, толерантный к витамину В|2 и фолиевой кислоте. Желудочно-кишечные симптомы, включая тошноту, рвоту и диарею, обычно наблюдаются у пациентов, принимающих гидроксимочевину в больших дозах.
Митоксантрон
Митоксантрон (дигидроксиантрацендион) является соединением антроцена, чья структура сходна с антрациклиновым кольцом. Препарат связывается с ДНК, вызывает разрыв цепочки и ингибирует синтез и ДНК, и РНК. Недавно он был одобрен для лечения резистентного острого лейкоза. Время полувыведения митоксантрона из плазмы составляет приблизительно 32 часа; большей частью он выводится с фекалиями. Митоксантрон активен при лечении и взрослого, и детского острого миелобластного лейкоза, неходжкинской лимфомы и рака молочной железы. Лейкопения является дозозависимым токсическим эффектом, также наблюдаются умеренная тошнота и рвота, стоматиты и
облысение. Препарат оказывает незначительное кардиотоксическое действие, обычно проявляющееся аритмиями.
Митотан
Этот препарат (рис. 38-4) является предшественником ДДТ. Первоначально были обнаружены его адренолитические свойства при действии на собак. Впоследствии установлено, что его можно применять для лечения карциномы надпочечников. Препарат вызывает регрессию опухоли и уменьшение чрезмерной секреции стероидов надпочечниками, что часто наблюдается при этом злокачественном заболевании. Токсические эффекты включают кожные высыпания, диарею и депрессию, анорексию, тошноту, сонливость и дерматиты.
Считают, что использование митотана должно быть ограничено только лечением карциномы надпочечников.
Производные ретиноевой кислоты
Все траис-ретиноевые кислоты (этретинаты) вызывают ремиссию у пациентов с острым проми-елоцитарным лейкозом (ОПЛ) посредством индукции окончательной дифференциации, при которой лейкемические промиелоциты теряют способность
к пролиферации. ОПЛ связана с t( 15; 17) хромосомной транслокацией, которая разрывает ген для ядерного «-рецептора ретиноевой кислоты и вносит его в ген, называемый PML. Этот химерный ген, который экспрессирует аберрантные формы рецептора «-ретиноевой кислоты, присутствует фактически у всех пациентов с геном PML и, по-видимо-му, отвечает за чувствительность ко всем транс-ре-тиноевым кислотам.
13-Цис-ретиноевая кислота (изотретиноин) дает значительный эффект как химиопрофилактическое вспомогательное средство, используемое для предотвращения рецидивов первичных опухолей у пациентов с чешуйчато-клеточной карциномой головы и шеи.
Наиболее частые токсические эффекты ретиноидов включают влияния на кожу, слизистые оболочки, скелет, печень и тератогенные эффекты.
Факторы роста костного мозга
Применение стимулирующих факторов костного мозга при химиотерапии может уменьшить частоту возникновения и тяжесть нейтропенического сепсиса и других осложнений. С недавнего времени применяют два фактора роста костного мозга, которые стимулируют рост нейтрофилов: фактор, стимулирующий колонии гранулоцитов (G-CSF), и фактор, стимулирующий гранулоциты-макрофаги (глава 32). Специфические показания к их применению еще уточняются, но ясно, что они могут сократить период госпитализации после трансплантации костного мозга и уменьшить частоту появления инфекций, обусловленных тяжелой нейтропенией.
Исследуемые средства
Некоторые препараты, упомянутые в тексте, в США находятся в статусе исследуемых до тех пор, пока их эффективность и безопасность не будут установлены. В особых случаях, когда лечение одним из этих средств является оправданным, препарат может быть взят на испытание в клинику университета или Центр рака или использован после контакта с Отделом по лечению рака Национального института проблем рака (The Division of Cancer Treatment of the National Cancer Institute), который может предоставить дальнейшую информацию и
дать список специалистов, которые уполномочены применять эти средства.
Такой статус имеют генцитабин, амонафид, азацитидин и амсакрин — средства, применяемые при остром лейкозе. К другим соединениям, все еще находящимся в стадии изучения, относятся сурамин, таксотер, тенизоламид и 9-амино-20(з)-камп-тотецин. Все эти препараты дают значительные токсические эффекты. До тех пор, пока фармакология этих средств не будет полностью изучена и не подтвердится польза их основных эффектов, применение будет ограничиваться клиническими исследованиями.
II. Клиническая фармакология противоопухолевых химиотерапевтических средств (табл. 56-7)
Знание кинетики пролиферации опухолевых клеток, а также информация о фармакологии и механизме действия противоопухолевых химиотерапевтических средств приобретают важное значение в создании оптимальной схемы химиотерапевтического лечения пациентов с раковыми заболеваниями. Стратегия выработки схемы лечения требует знания особых характеристик специфических опухолей: например, имеется ли быстро растущая фракция? существует ли высокая скорость спонтанной смерти клеток? находится ли большая часть клеток в фазе Go? имеется ли значительная фракция гипоксических стволовых клеток, образующих опухоль? находятся ли аналогичные им здоровые клетки под гормональным контролем? Знание фармакологии специфических средств необходимо в такой же степени: например, обладает ли препарат особым аффинитетом, чтобы быть захваченным опухолевой клеткой (стрептозоцин)? являются ли опухолевые клетки чувствительными к препарату? действует ли препарат специфически на клеточный цикл?
Средства, которые действуют на клеточный цикл, часто могут быть использованы более эффективно после лечения циклонеспецифическими препаратами (например, алкилирующими средствами);
ТАБЛИЦА 56-7. Злокачественные опухоли, чувствительные кхимиотерапии
Диагноз Современные препараты выбора Другие используемые средства для лечения
Острый лимфоцитарный Индукция: винкристин + преднизон, под- Аспарагиназа, даунорубицин, кармус-
лейкоз держание ремиссии: меркаптопурин, тин, доксорубицин, цитарабин, алло-метотрексат и циклофосфамид в раз- пуринол1, краниоспинальная лучевая личных комбинациях терапия
Острый миелоцитарный Комбинированная химиотерапия: цитара- Метотрексат, тиогуанин, меркаптолу-
и миеломоноцитар- бин и митоксантрон или даунорубицин, рин, аллопуринол1, митоксантрон,
ный лейкоз или идарубицин азацитидин2, амсакрин2, этопозид
Хронический лейкоци- Хлорамбуцил и преднизон (если показан) Винкристин, андрогены1, аллопури-
тарный лейкоз нол1, доксорубицин, флударабин2
Хронический миелобла- Бусульфан или интерферон Винкристин, меркаптопурин, гидрокси-
стный лейкоз мочевина, мелфалан, интерферон, аллопуринол1
Болезнь Ходжкина (ста- Комбинированная химиотерапия: ме- Винбластин, доксорубицин, ломустин,
дии III и IV) хлорэтамин, винкристин, прокарбазин, дакарбазин, этопозид, ифосфамид, преднизон (МОРР) блеомицин, интерферон
Неходжкинская Комбинированная химиотерапия: цикло- Блеомицин, ломустин, кармустин, это-
лимфома фосфамид, доксорубицин, винкристин, позид, интерферон, митоксантрон, преднизон ифосфамид
Множественная миелома Мелфалан плюс преднизон или мульти- Циклофосфамид, винкристин, кармус-препаратная комбинированная химио- тин, интерферон, доксорубицин, ан-терапия дрогены1
Макроглобулинемия Хлорамбуцил Флударабин2, преднизон
Истинная полицитемия Бусульфан, хлорамбуцил или циклофосф- Радиоактивный 32Р амид
Карцинома легких Этопозид + цисплатин Метотрексат, винкристин, винбластин, доксорубицин, митомицин С
Карцинома головы и шеи Фторурацил + цисплатин Метотрексат, блеомицин, гидроксимо- чевина, доксорубицин,винкристин
Карцинома эндометрия Прогестины или тамоксифен Доксорубицин, цисплатин, карбоплатин
Карцинома яичника Циклофосфамид и цисплатин или карбо- Доксорубицин, мелфалан, фторурацил, платин винкристин, алтретамин (гексаме- тилмеламин), блеомицин, таксол
Карцинома шейки матки Цисплатин, карбоплатин Ломустин, циклофосфамид, доксору- бицин, метотрексат, митомицин, блеомицин, винкристин, интерферон, 13-цис-ретиноевая кислота
Карцинома молочной же- 1. Вспомогательная химиотерапия или та- Циклофосфамид, доксорубицин, винк-
лезы моксифен после первичной операции ристин, метотрексат, фторурацил, на молочной железе таксол, митоксантрон, преднизон1, 2. Комбинированная химиотерапия или мегестрол, андрогены1, аминоглюте-гормональные манипуляции при позд- тимид них рецидивах
Хориокарцинома (тро- Один метотрексат или этопозид и цис- Винбластин, меркаптопурин, хлорам-
фобластические новообразования) платин буцил, доксорубицин
ТАБЛИЦА 56-7. (Продолжение)
Диагноз Современные препараты выбора для лечения Другие используемые средства
Карцинома яичек Комбинированная химиотерапия: цисплатин, блеомицин и этопозид Метотрексат, дактиномицин, пликамицин, винбластин, доксорубицин,циклофосфамид, этопозид, ифосфамид + месна'
Карцинома предстательной железы Эстрогены или GnRH-агонист+флутамид Аминоглютетимид, доксорубицин, цисплатин, преднизон', эстрамустин, фторурацил, прогестины, сурамин
Опухоль Вильмса Винкристин плюс дактиномицин после операции и лучевой терапии Метотрексат, циклофосфамид, доксорубицин
Нейробластома Циклофосфамид + доксорубицин и винкристин Дактиномицин, даунорубицин, цисплатин
Карцинома щитовидной железы Радиойодин (1311), доксорубицин, цисплатин Блеомицин, фторурацил, мелфалан
Карцинома надпочечников Митотан Сурамин2
Карцинома желудка или поджелудочной железы Фторурацил+доксорубицин и митомицин Гидроксимочевина, ломустин, цисплатин
Карцинома ободочной Фторурацил + лейковорин или интерфе- Циклофосфамид, митомицин, произ-
КИШКИ рон (или оба) водные нитрозомочевины
Карциноид Доксорубицин + циклофосфамид Интерферон, дактиномицин, метисер-гид', стрептозоцин, октреотид
Инсулинома Стрептозоцин, интерферон Доксорубицин, фторурацил, митомицин, стрептозоцин
Остеогенная саркома Доксорубицин или метотрексат Циклофосфамид, дакарбазин, интерферон
Разнообразные саркомы Доксорубицин + дакарбазин Метотрексат, дактиномицин, ифосфамид + месна', винкристин, винбластин
Меланома Дакарбазин, цисплатин Ломустин, гидроксимочевина, митомицин, дактиномицин, интерферон, тамоксифен
' Поддерживающее средство, не онколитик.
2 Исследуемое средство. Лечение возможно при помощи квалифицированных специалистов и через центры, уполномоченные National Cancer Institute и Cooperative Oncology Groups.
этот принцип проверялся на немногих опухолях человека, но с возрастающим успехом. В создании комбинированных химиотерапевтических программ важно определение истинного синергизма (опухолевые клетки поражаются в большей степени при использовании комбинации препаратов, чем это можно объяснить простой суммацией эффектов индивидуальных средств) или антагонизма препаратов. Использование комбинации цитарабина с ан-трациклином для лечения острого миелобластного
лейкоза и применение винбластина или этопозида вместе с цисплатином и блеомицином для лечения тестикулярных опухолей являются хорошим примером истинного синергизма препаратов в отношении раковых клеток, но не в отношении нормальных тканей.
Предпочтительнее использовать цитотоксические химиотерапевтические средства интенсивными “пульсирующими” курсами каждые 3-4 недели, а не применять схему непрерывного ежедневного
лечения. Это позволяет максимально воздействовать на популяцию неопластических клеток с полным гематологическим и иммунологическим восстановлением между курсами, а не держать пациента в состоянии постоянной супрессии при цитотоксической терапии. При таком методе уменьшается частота возникновения побочных эффектов, но не снижается терапевтическая эффективность.
Применение этих принципов хорошо иллюстрируется современным подходом к лечению острого лейкоза, лимфом, опухоли Вильмса и тестикулярных новообразований.
Вспомогательная химиотерапия микрометастазов: комплексная терапия
Несомненно, что наиболее важную роль химиотерапия рака играет в качестве начальной вспомогательной терапии, или терапии “исходного поля", перед проведением лечения другими методами, такими как хирургическое вмешательство или лучевая терапия. Неудачи первичной терапии происходят, главным образом, вследствие скрытых микрометастазов, находящихся за пределами исходной области воздействия. Считают, что наряду с доступными в настоящее время методами лечения эта форма комплексной терапии дает наибольший шанс излечения пациентам с плотными (солидными) опухолями.
Отдаленные микрометастазы обычно имеются у пациентов с одним или более положительными (пораженными) лимфатическими узлами к моменту операции (например, рак молочной железы) и у пациентов с опухолями, имеющими известную предрасположенность к раннему гематогенному распространению (например, остеогенная саркома, опухоль Вильмса). Риск рецидива или метастатического заболевания у таких пациентов чрезвычайно высок (80 %). Только системная терапия может адекватно воздействовать на микрометастазы. Химиотерапевтическая схема лечения, которая, по крайней мере, умеренно эффективна в отношении прогрессирующего рака, может обладать излечивающим потенциалом (при правильной дозировке и схеме лечения) в комбинации с хирургическим вмешательством. Показано, что вспомогательная химиотерапия увеличивает как продолжительность жизни после излечения, так и общую выживаемость у больных с остеогенной саркомой, рабдомиосаркомой или раком молочной железы. Это касается и
использования 3 циклов комбинированной химиотерапии (например, “МОРР”) перед полным облучением лимфатических узлов при болезни Ходжкина в стадии ПВ.
При раке молочной железы у женщин в предкли-мактерическом периоде с метастазами в лимфатические узлы к моменту мастэктомии наблюдается улучшение состояния после комбинированной химиотерапии. Выявлено, что при некоторых схемах проведения цитотоксической химиотерапии достигается увеличение общей продолжительности жизни и продолжительности жизни после излечения. Химиотерапия увеличивает степень излечения в случае высокоопасного первичного рака молочной железы. Активные схемы лечения включают следующие средства, применяемые в различных комбинациях: циклофосфамид, метотрексат, фторурацил, доксорубицин и винкристин. В основном лечение, по крайней мере тремя активными препаратами, было эффективным. Результаты, которые дает комбинированная химиотерапия, превосходят результаты использования только одного препарата, потому что комбинированная химиотерапия лучше справляется с гетерогенностью клеток опухоли и дает больший логарифм подавления опухолевых клеток. Для увеличения ожидаемой эффективности требуются полные дозировки цитотоксических средств. Клинические испытания подтвердили эффективность тамоксифена как вспомогательного средства для лечения женщин в постклимактерическом состоянии с позитивным тестом на рецепторы к эстрогену у первичной опухоли. Вспомогательную терапию тамоксифеном необходимо, вероятно, продолжать в течение многих лет, так как он оказывает цитостатическое, а не цитоцидное действие. Вспомогательная химиотерапия тамоксифеном сейчас является стандартом для лечения женщин в постклимактерическом состоянии с положительными лимфатическими узлами и с положительными ER- и PR-тестами опухолей. Считают, что тамоксифен также воздействует на ER-отрицатель-ные опухоли посредством иных механизмов, чем действие на рецепторы к эстрогену. Например, препарат уменьшает в сыворотке концентрацию инсу-линподобного фактора роста I и увеличивает концентрацию подавляющего рост фактора TGFp в клетках стромы в пределах опухоли.
Другими показаниями к применению вспомогательной химиотерапии являются колоректальные (фторурацил плюс левамизол или лейковорин), те
стикулярные (винбластин, блеомицин и цисплатин), гинекологические новообразования, опухоли головы и шеи (различные препараты). Таким образом, вспомогательную химиотерапию (имеющую цель излечения пациента) следует проводить больным, которые подверглись первичному хирургическому вмешательству и лучевой терапии и имеют стадию заболевания и гистологический тип опухоли с высоким риском образования микрометастазов. Эти рекомендации относятся к типам опухолей, для которых уже разработана паллиативная химиотерапия и при которых наблюдалась полная ремиссия в далеко зашедших стадиях заболевания. Для каждого случая должно быть тщательно изучено соотношение пользы и риска.
Начальная химиотерапия (до локального хирургического вмешательства) сейчас широко применяется у пациентов с остеогенной саркомой и облегчает проведение сберегающих конечность операций. В настоящее время оценивается необходимость применения начальной химиотерапии для лечения запущенных форм рака молочной железы до проведения операции.
Лейкозы
1. ОСТРЫЙ ЛЕЙКОЗ
Детский лейкоз
Острый лимфобластный лейкоз (ОЛЛ) является преобладающей формой лейкоза у детей и наиболее распространенной формой рака у детей. Дети с этим заболеванием в настоящее время имеют относительно хороший прогноз. Некоторые пациенты с неопластическими лимфоцитами, экспрессирующими поверхностные антигенные черты Т-лимфоцитов, имеют плохой прогноз (глава 57). Цитоплазматический фермент, экспрессируемый нормальными тимоцитами — конечная дезоксицити-дилтрансфераза (конечная трансфераза) — экспрессируется во многих случаях ОЛЛ. Т-клетки при этой болезни также экспрессируют высокий уровень фермента аденозиндезаминазы (АДА). (В этом случае интересно применить ингибитор АДА пен-тостатин [дезоксикоформицин] для лечения таких видов заболевания Т-клеток.) До 1948 г. средняя продолжительность жизни при остром лимфобластном лейкозе составляла 3 месяца. С внедрением антагонистов фолиевой кислоты продолжитель
ность жизни значительно увеличилась. Далее было обнаружено, что кортикостероиды, меркаптопурин, винкристин, даунорубицин и аспарагиназа эффективны при лечении этого заболевания. Комбинация винкристина и преднизона плюс другие средства сейчас применяется, чтобы вызвать начальную ремиссию. У более 90 % детей после такой терапии наступает полная ремиссия с минимальными токсическими эффектами. Однако циркулирующие стволовые клетки опухоли часто проникают в головной мозг, и их нельзя уничтожить с помощью данных препаратов, потому что они не проникают через гематоэнцефалический барьер. Была показана эффективность “профилактической” интрате-кальной терапии метотрексатом для предотвращения лейкоза центральной нервной системы (основной механизм рецидива). Поэтому интратекальную терапию метотрексатом необходимо рассматривать как стандартный компонент начальной схемы лечения детей с ОЛЛ. К альтернативным методам предотвращения лейкоза центральной нервной системы, которые также считаются действенными, относятся интратекальное введение цитарабина и краниоспинальное облучение. Однако лучевая терапия осевой части ЦНС может привести к задержке роста скелета. При единожды достигнутой полной ремиссии (> трех логарифмов убитых клеток) всегда показана “поддерживающая", или “консолидирующая”, терапия. Она обычно состоит из комбинации энтерального приема метотрексата, меркаптопурина и циклофосфамида, вводимых или ударными дозами время от времени, или в различных последовательностях. Этот метод “полной терапии” следует считать стандартом лечения, так как он существенно увеличивает показатель излечиваемости детей с острым лейкозом. Считается, что такая терапия дает большую надежду на полное излечение. Средняя продолжительность жизни детей с острым лейкозом сейчас приближается к 4 годам. Во многих медицинских центрах прекращают интенсивную химиотерапию у пациентов, у которых не отмечается признаков рецидива после 3 лет проведения интенсивной химиотерапии. Дети, которые выжили в течение 5 лет при полной ремиссии, обладают более чем 60 % вероятностью постоянной ремиссии или излечения (Rivera, 1993).
Если лейкоз рецидивирует, применяют те же препараты, чтобы вновь вызвать ремиссию. При отсутствии эффекта реиндукцию пытаются вызвать другими средствами (даунорубицин, винкристин,
аспарагиназа, метотрексат и др.) в различных комбинациях. Возможность излечения этой смертельной детской болезни стимулировала современные исследования по разработке метода интенсивной комбинированной химиотерапии с использованием уже известных средств плюс аспарагиназа, даунорубицин и другие экспериментальные препараты и повысила интерес к применению комбинированной химиотерапии при других видах онкологических заболеваний.
Лейкоз у взрослых
У взрослых наблюдается преимущественно ми-елоцитарный острый лейкоз, хотя были выявлены несколько случаев лимфобластного лейкоза. В отличие от ОЛЛ, начальная терапия острого миело-бластного лейкоза (ОМ Л) требует применения препаратов, токсичных в отношении клеток нормального костного мозга. Наиболее активное средство для лечения ОМ Л — цитарабин; однако его лучше использовать в комбинации. Комбинация антрацик-линов с цитарабином вызывает полную ремиссию у 70 % пациентов.
Больному часто требуется интенсивная поддерживающая терапия во время токсического периода начальной химиотерапии, пока не наступит ремиссия. Такая терапия включает: переливание тромбоцитов для профилактики кровотечения, G-CSF для укорочения периода нейтропении и назначение бактерицидных антибиотиков и переливание гранулоцитов для подавления инфекций. Более молодые пациенты (< 55 лет), у которых наступила полная ремиссия и у которых есть HLA-совместимые доноры, являются кандидатами для аллогенной трансплантации костного мозга. Химиотерапия высокими дозами и тотальное облучение тела, за которым следует иммунодепрессия, предшествуют процедуре трансплантации. Эта процедура позволяет излечить 40 % соответствующих пациентов с острым лейкозом. Пациенты в возрасте старше 60 лет менее восприимчивы к химиотерапии, главным образом вследствие их меньшей резистентности к инфекции. Обычно ремиссия поддерживается курсами тиогуанина и цитарабина. Митоксантрон, азацитидин и амсакрин применяются в качестве средств второго ряда у пациентов с развившейся резистентностью к стандартной терапии. Ожидаемая средняя продолжительность жизни пациентов с ОМЛ, у которых наступила полная ремиссия, сей
час возросла до 1 года, а некоторые пациенты находятся в состоянии ремиссии более трех лет. Считается, что примерно 20 % взрослых пациентов, достигших полной ремиссии после проведения современной стандартной химиотерапии, избавлены от рецидивов лейкоза и, вероятно, излечились.
2. ХРОНИЧЕСКИЙ МИЕЛОБЛАСТНЫЙ ЛЕЙКОЗ
Хронический миелобластный лейкоз (ХМЛ) связан с ростом стволовых клеток крови, имеющих хромосомные нарушения. Нарушения в 22-й хромосоме с потерей короткого плеча или его транслокацией в длинное плечо хромосомы 9 определяются в 90 % случаев. Это так называемая Филадельфийская хромосома (Ph1). Клинические симптомы и течение болезни определяются количеством лейкоцитов и скоростью его возрастания. Большинство пациентов с числом лейкоцитов более 50 000/мкл нуждаются в лечении. Цель лечения — уменьшение количества гранулоцитов до нормального уровня, увеличение концентрации гемоглобина до нормальной и облегчение симптомов, связанных с метаболическими нарушениями. Наиболее эффективный метод лечения, вызывающий ремиссию,— прием интерферона-а или бусульфана с другими алкилирующими средствами (для энтерального приема) или с гидроксимочевиной. Иногда проводят локальное рентгеновское облучение селезенки. На ранней стадии заболевания лечение приводит к быстрому уменьшению размера селезенки, снижению числа лейкоцитов и субъективному улучшению состояния. Интерферон-а может уменьшить или подавить экспрессию Ph* хромосомы в миелоидных предшественниках в костном мозге, но этот эффект редко отмечается при применении цитотоксических средств. Длительная химиотерапия облегчает симптомы и проявления хронического миелобластного лейкоза, но не увеличивает продолжительность жизни. Основное преимущество, которое имеют молодые пациенты с ОМЛ, состоит в возможности аллогенной трансплантации костного мозга, проводимой, когда пациент находится в состоянии ремиссии, предпочтительно в течение первого года после постановки диагноза. Трансплантация костного мозга может излечить до 50 % таких больных.
У пациентов, которым пересадка костного мозга невозможна (например, старше 55 лет и не име
ющие HLA-совместимого донора), и у тех, кто не излечился в течение 3-5 лет после постановки диагноза, развивается ускоренная или острая фаза лейкоза. В этом случае назначение гидроксимочевины или меркаптопурина может привести к частичному временному улучшению. Комбинированная химиотерапия, включающая цитарабин, аспарагиназу и винкристин или гидроксимочевину в сочетании с преднизоном или без него, может дать преходящее облегчение, но прогноз в отношении пациентов с ХМЛ в случае бластной трансформации остается неблагоприятным.
3. ХРОНИЧЕСКИЙ ЛИМФОЦИТАРНЫЙ ЛЕЙКОЗ
Лечение хронического лимфоцитарного лейкоза (ХЛЛ) в значительной степени отличается от такового при хроническом миелобластном лейкозе. Считают, что ХЛЛ является результатом постепенного накопления моноклональных В-лимфоцитов, а не результатом быстрой пролиферации неопластических клеток, в то время как ХМЛ является пролиферативным новообразованием, требующим системного лечения. Диагноз обычно ставится случайно, задолго до развития симптомов. Хотя средняя продолжительность жизни после постановки диагноза составляет всего 3 года, заболевание чаще наблюдается у пожилых пациентов, более высокая смертность которых искажает данные по выживаемости. Многие пациенты, не имеющие симптомов, могут жить в течение длительного времени (например, 5-15 лет) без лечения. Имеет смысл воздерживаться от лечения пациентов, у которых заболевание ограничено лимфоцитозом периферической крови, до тех пор, пока число лимфоцитов не превысит 150 000/мкл. Лечение показано, если развиваются анемия или тромбоцитопения, иммунодефицит, уменьшение массы тела, лихорадка или генерализованное поражение органов.
Терапевтические методы, используемые для лечения ХЛЛ, включают применение кортикостероидов, химиотерапию алкилирующими средствами или флударабином. Часто довольно эффективен преднизон. После начального курса лечения преднизоном по 80 мг/день в течение нескольких недель дозу препарата можно постепенно уменьшить или же перейти на чередующуюся схему дозировки (через день), при которой, фактически, не возникает побочных эффектов. Гемолитическая ане
мия может быть серьезной реакцией на прием преднизона, хотя тромбоцитопения часто более устойчива к коррекции.
Хлорамбуцил, вероятно, является самым удобным для энтерального приема алкилирующим препаратом и дает наименьшие побочные эффекты. Обычно доза составляет 0.1 мг/кг/день, но необходимо еженедельное определение числа форменных элементов крови. Циклофосфамид, в качестве альтернативы, можно принимать “ударными курсами” по 1 г/м2 энтерально примерно 4 дня каждые 4-6 недель. Флударабин в настоящее время становится препаратом выбора в лечении ХЛЛ. Цель терапии состоит в ликвидации системных проявлений заболевания; полная нормализация числа лимфоцитов не является необходимой. Лечение можно прекратить сразу же после стабилизации состояния пациента, но поддерживающую терапию следует проводить, если симптомы быстро появятся снова. Локальная терапия рентгеновским облучением способствует уменьшению увеличенных лимфатических узлов, но назначается редко. Важно не перелечить этих, как правило, пожилых пациентов, так как их устойчивость к воздействию понижена.
4. ВОЛОСАТО-КЛЕТОЧНЫЙ ЛЕЙКОЗ
Эта редкая форма лейкоза происходит из специфической субпопуляции В-клеток и имеет симптомы и признаки, сходные с ХЛЛ; однако она поддается традиционной химиотерапии. Применение а-интерферона, который сейчас предпочитают для лечения волосато-клеточного лейкоза (ВКЛ), одобрено FDA. Почти у 90 % больных достигается гематологическое улучшение при применении а-интерферона. Ингибиторы аминазиндезаминазы, кладри-бин и пентостатин, являются очень активными в отношении ВКЛ и могут вызвать полную ремиссию (подтвержденную результатами биопсии) даже у пациентов с рецидивами после лечения интерфероном.
Лимфомы
1. БОЛЕЗНЬ ХОДЖКИНА
О причине возникновения болезни Ходжкина известно мало, но ее терапия претерпела революционное улучшение. Болезнь Ходжкина представляет собой лимфому с определенными уникальны
ми характеристиками ее естественного происхождения: 1) у нее явная тенденция распространяться из одного вовлеченного лимфатического узла в анатомически смежные узлы каким-то “методичным” способом и 2) она скрыто ограничена только лим-фоидой системой в течение длительного промежутка времени. Может происходить также и внеузло-вое поражение, например печени, костного мозга, легких и других органов, что является доказательством более “злокачественного” поведения опухоли. Для эффективного лечения этого заболевания и разработки рационального плана лечения необходимо сначала установить степень (стадию) заболевания. Широко распространенное поражение проявляется в таких симптомах, как потливость, анорексия, лихорадка и уменьшение массы тела, а также инфильтрацией других органов, включая легкие, печень и костный мозг.
Интенсивная рентгенотерапия аппаратами высокого напряжения является излечивающей в большинстве случаев ранней стадии болезни Ходжкина, ограниченной областью одного лимфатического узла или нескольких соседних областей выше диафрагмы (стадии I и II). Лучевая терапия также иногда применяется у пациентов без симптомов с III стадией болезни Ходжкина. Как видно из табл. 56-7, в лечении болезни Ходжкина применяются разные химиотерапевтические средства; однако комбинированная химиотерапия дает лучшие результаты.
Комбинированная химиотерапия показана пациентам с III или IV стадиями болезни Ходжкина. Результаты лечения ША стадии болезни Ходжкина тремя циклами химиотерапии с последующей полной лучевой терапией узлов превосходят результаты, достигаемые с помощью одной радиотерапии. В стандартной химиотерапии используют комбинацию из 4 препаратов, известную как МОРР (МОПП), содержащую мехлорэтамин, онковин (винкристин), прокарбазин и преднизон. Это лечение проводится повторно в течение по крайней мере 6 месяцев, а иногда в течение 1 года. У более 80 % ранее не лечившихся пациентов с прогрессирующей болезнью Ходжкина (стадии III и IV) наступает полная ремиссия, включая исчезновение всех симптомов и объективных признаков опухоли.
“Не перекрестно-устойчивая” схема лечения, альтернативная МОРР, предложенная Bonadonna, включает доксорубицин (адриамицин), блеомицин, винбластин и дакарбазин (ABVD). Считают, что ABVD-схема по эффективности близка к МОРР и,
что более важно, имеет значение при неудачном лечении МОРР-методом. Лечение по данным схемам должно проводиться врачом-онкологом, который знаком с индивидуальными и синергичными токсическими эффектами и противопоказаниями для используемых средств. После развития ремиссии при применении по крайней мере 6 курсов МОРР или ABVD приблизительно у 50 % пациентов исчезают все признаки болезни Ходжкина более чем на 2 года. Комбинация ABVD не сопровождается поздним развитием острого лейкоза, возможно из-за отсутствия в ней алкилирующих средств и прокарбазина.
Примерно половина пациентов, достигших полной ремиссии при применении МОРР или ABVD, излечиваются от болезни Ходжкина.
Производные нитрозомочевины, такие как ломустин, также являются эффективными в отношении болезни Ходжкина и применяются с другими средствами для того, чтобы вновь вызвать ремиссию у пациентов с рецидивами после лечения по стандартной схеме. Предложены новые средства, эффективные в лечении болезни Ходжкина, в том числе митоксантрон и меченные изотопом антитела к ферритину.
2. ЛИМФОМЫ “НЕ ХОДЖКИНА”
Клинические характеристики лимфом не Ходжкина (НХЛ) зависят от главных гистопатологических черт и иммунологического происхождения неопластических клеток. В основе простейшей применяемой классификации лежит определение типа клеток, а также присутствие или отсутствие узловатости в лимфоматозных тканях. Как правило, при узловатых лимфомах гораздо лучший прогноз (средняя продолжительность жизни больных до 7 лет) по сравнению с прогнозом при диффузной форме лимфомы (средняя продолжительность жизни 1-2 года). Наблюдаемые поражения печени и костного мозга, желудочно-кишечного тракта и локализованные экстралимфатические поражения более обычны для НХЛ, чем для болезни Ходжкина. При этом большая часть пациентов (примерно */3) имеет IV стадию заболевания к моменту обращения к врачу (15 % пациентов — при болезни Ходжкина).
Комбинированная терапия, несомненно, предпочтительней монотерапии в случае диффузной, но не узловатой лимфомы. Узловатые лимфомы являются медленно развивающимися опухолями и на
много лучше реагируют на паллиативное лечение одним препаратом, чем диффузные лимфомы. Некоторые диффузные лимфомы излечиваются с помощью доступных средств, в то время как узловатые лимфомы — нет. Действительно, нет доказательств, что комбинированная химиотерапия медленно растущей узловатой лимфомы лучше, чем монотерапия хлорамбуцилом.
Выявлено, что доксорубицин чрезвычайно активен в лечении лимфом не Ходжкина. Несмотря на изучение ряда комбинаций агрессивных препаратов, включая доксорубицин, винкристин, циклофосфамид, преднизон, цитарабин, блеомицин, метотрексат и этопозид, ни одна из них, по-видимо-му, не дала более высоких результатов, чем комбинация из 4 препаратов: циклофосфамида, доксорубицина, винкристина и преднизона (“CHOP”). Современные данные свидетельствуют, что от */3 до */2 пациентов с диффузной крупноклеточной лимфомой излечиваются при проведении интенсивной комбинированной химиотерапии. Новые препараты — митоксантрон и паклитаксел — также активны в лечении лимфом не Хождкина. Показано, что а-интерферон вызывает уменьшение (регрессию) опухоли при некоторых узловатых лимфомах. а-Интерферон также применяется в случае периферической Т-клеточной лимфомы. Недавно испытывались моноклональные антитела против антигенов Т- или В-клеток у немногих пациентов с лейкозом или лимфомой, и были выявлены некоторые противоопухолевые эффекты.
Множественная миелома
Эта опухоль плазматических клеток сейчас является одной из “моделей” онкологического заболевания, потому что опухоль возникает из естественных стволовых клеток и опухолевые клетки продуцируют белок-маркер (миеломный иммуноглобулин), который позволяет количественно определить общее содержание в организме опухолевых клеток. Опухоль растет, главным образом, в костном мозге и окружающей кости, вызывая анемию, боль в костях, литические повреждения, переломы костей, а также повышение чувствительности к инфекции. Лечение алкилирующими средствами для энтерального приема, такими как мелфалан или циклофосфамид, и перемежающимися высокими дозами преднизона эффективно у большей части пациентов с миеломой. Был разработан относитель
но простой метод комбинированной химиотерапии с использованием мелфалана и преднизона. В случае прогрессирующего заболевания несколько лучшие результаты получены при применении более интенсивной схемы лечения, включающей алкилирующие средства, доксорубицин, нитрозомочевину и алкалоид Vinca. После такого лечения у 75 % пациентов улучшилось состояние, что выражалось в уменьшении симптоматики н увеличении продолжительности жизни. Но в большинстве случаев через 2-3 года лечения развивается устойчивость к химиотерапии. Использование аллогенных трансплантатов костного мозга возможно у пациентов в возрасте до 55 лет.
Альтернативная стратегия была разработана, чтобы по возможности продлить период ремиссии. Для этого пациенты, которые достигли ремиссии после 6-12 месяцев начальной химиотерапии, были переведены на поддерживающую продолжительную терапию а-интерфероном. Поддерживающее лечение интерфероном может удлинить ремиссию, но не увеличивает продолжительность жизни. Учитывая стоимость интерферона и его токсичность, необходимость применения данного метода лечения миеломы остается проблематичной. У пациентов с рецидивом после начальной положительной реакции на химиотерапию применение комбинации винкристина и доксорубицина в 4-дневной инфузии с высокой дозой дексаметазона вызывает вторую ремиссию в 70 % случаев. При вновь возникшем рецидиве больных можно “сенситизировать” добавлением к схеме лечения верапамила или циклоспорина. У некоторых пациентов также применяется монотерапия высокими дозами глюкокортикоидов.
Рак молочной железы
1.1 И II СТАДИИ НОВООБРАЗОВАНИЯ
Лечение первичной карциномы молочной железы значительно изменилось в результате улучшения ранней диагностики (в том числе самодиагностики, а также при помощи специалистов центров по определению рака) и выполнения мультимодальных клинических исследований, включающих системную химиотерапию в качестве дополнения к операции. Женщины с I стадией латерального поражения к моменту операции на молочной железе (иссечение маленьких первичных опухолей и отрицательного (непораженного) подмышечного лим
фатического узла) сейчас излечиваются хирургическим вмешательством и имеют 80 % вероятность полного излечения. Современный подход предусматривает проведение более консервативной операции. В то время как стандартная хирургическая процедура является по сути модифицированной радикальной мастэктомией, сегментарная мастэктомия со взятием на анализ образца подмышечного лимфатического узла является в равной степени эффективной в лечении первичных опухолей с диаметром менее 4 см.
Женщины с одним или более положительными лимфатическими узлами имеют очень высокий риск системного рецидива и смерти от рака молочной железы. Таким образом, состояние лимфатического узла прямо указывает на риск скрытых отдаленных микрометастазов. В этой ситуации постоперативное применение системной цитотоксической химиотерапии 6-месячными курсами цикло-фосфамид-метотрексат-фторурацил (CMF) уменьшает частоту рецидивов и увеличивает продолжительность жизни. Другие комбинации лекарств, такие как фторурацил-доксорубицин(адри-амицин)-циклофосфамид (FAC) также эффективны. Все эти схемы химиотерапии оказывались наиболее эффективными у женщин со II стадией рака молочной железы и с поражением от 1 до 3 лимфатических узлов. До сих пор у женщин с 4 пораженными узлами и более успех вспомогательной химиотерапии был ограничен. Химиотерапия высокими дозами препаратов с защитой аутогенных стволовых клеток и при поддержке фактора роста сейчас изучается для лечения женщин с 10 пораженными узлами и более. Анализ выявил повышение выживаемости женщин в доклимактерическом периоде с положительными узлами, которых интенсивно лечили многокомпонентной лекарственной комбинированной химиотерапией. Тамоксифен эффективен у женщин в постклимактерическом периоде в качестве монотерапии или совместно с цитотоксической химиотерапией. В рандомизированных исследованиях результатов химиотерапии рака молочной железы выявлено, что вспомогательная химиотерапия женщин в доклимактерическом периоде и вспомогательная монотерапия тамоксифеном женщин в постклимактерическом периоде дают положительные результаты при I стадии (с отрицательными узлами) рака молочной железы. Несмотря на то, что у этих групп пациентов самый низкий общий риск возникновения рецидивов после одного
только хирургического вмешательства (около 35-50 % за 15 лет), он может быть еще больше снижен с помощью вспомогательной терапии. Основная польза от лучевой терапии, по-видимому, состоит в том, что она замещает радикальную операцию и, таким образом, позволяет получить лучшие косметические результаты при ограниченной операции на молочной железе.
2. Ill И IV СТАДИИ НОВООБРАЗОВАНИЯ
Мультимодальные программы, которые обсуждались выше, являются вполне эффективными для пациенток группы риска, но лечение женщин с прогрессирующим раком молочной железы остается главной проблемой. В самом деле, некоторые женщины обращаются к врачу уже с неоперабельными “локальными” поражениями с подозрением на метастазы (стадия III) или с очевидными отдаленными метастазами (стадия IV). В настоящее время большинству женщин с локальными или отдаленными рецидивами проводят операцию по удалению опухоли молочной железы или операцию вместе с лучевой терапией.
Современное лечение прогрессирующего рака молочной железы является только паллиативным. Комбинированная химиотерапия или гормональная терапия (или обе) продлевают жизнь большинства пациенток, а также облегчают течение болезни. Биохимически разные виды рака молочной железы (на основании определения присутствия рецепторов к эстрогену или прогестерону) сохраняют свойственную нормальной молочной железе чувствительность ко многим гормонам, включая реакцию стимулированного роста на действие гормонов яичников, надпочечников и гипофиза. Ова-риэктомия без или в сочетании с применением тамоксифена является необходимой у женщин в пре-климактерическом периоде с ER- или PR- положительными опухолями, имеющими метастазы в коже, лимфатических узлах, плевре или в костях. Пациентки, у которых наблюдается улучшение, обусловленное иссечением опухоли, также реагируют на терапию тамоксифеном. При умеренном и тяжелом поражении легких, печени, мозга и других висцеральных органов редко наблюдается улучшение состояния от “гормональных манипуляций”. В таких случаях показана начальная системная химиотерапия. Независимо от мест поражения, если отсутствует рецептор к эстрогену, вероятность появле
ния реакции на гормонотерапию составляет менее чем 5 %. У мужчин с раком молочной железы наблюдаются сходные терапевтические реакции на кастрацию практически в любом возрасте.
Применение антиэстрогенов
Андрогены и эстрогены успешно применяются у некоторых пациентов с рецепторположительным раком молочной железы, но применение тамоксифена подтвердило, что он является нетоксичным альтернативным средством для традиционной гормональной терапии. Он уже вытеснил другие средства по многим показаниям и может считаться препаратом выбора для лечения гормонзависимого ре-цепторположительного рака молочной железы. “Вспышка” заболевания иногда отмечается при применении тамоксифена и может предвещать последующее достижение исключительно хорошей ремиссии, но требуется хорошее поддерживающее лечение (например, от болей в костях или гиперкальциемии). Тамоксифен эффективен у женщин как в преклимактерическом, так и в постклимактерическом периоде с ER- и PR-положительными опухолями. Тамоксифен незначительно увеличивает риск развития рака матки с частотой, сходной с таковой при применении эстрогенов.
Применение ингибиторов ароматазы
Аминоглютетимид совместно с гидрокортизоном эффективен в лечении гормонзависимого ре-цепторположительного рака молочной железы. Он часто применяется у женщин, которые ранее лечились тамоксифеном, или у женщин с ER- или PR-положительными типами рака груди.
Системная химиотерапия
Применение цитотоксических средств и гормонов становится высокоспециализированным и все более эффективным средством в лечении рака. Комбинированная химиотерапия в значительной степени улучшила состояние пациентов с висцеральным поражением при прогрессирующем раке молочной железы. Доксорубицин — наиболее активный препарат для монотерапии со средним уровнем чувствительности 40 %. Выявлено, что комбинированная химиотерапия приводит к гораздо более продолжительным ремиссиям у 50-80 % пациентов.
В схеме комбинированного лечения, не базирующейся на применении доксорубицина, используют в основном, циклофосфамид плюс метотрексат и фторурацил (CMF) или плюс винкристин и преднизон (CMFVP). Комбинации, основывающиеся на применении доксорубицина, включают циклофосфамид с винкристином или фторурацилом. При большинстве комбинированных схем химиотерапии частичные ремиссии имеют среднюю продолжительность примерно 10 месяцев, а продолжительность полных ремиссий — примерно 15 месяцев. К сожалению, только 10-20 % пациентов достигают полной ремиссии при использовании любой из этих схем лечения, а в случае метастатического рака молочной железы полные ремиссии обычно непродолжительны. Включение в программу лечения тамоксифена приводит только к умеренному дополнительному улучшению. При использовании доксорубицина в таких комбинациях его прием прекращают до появления у пациента кардиотоксических реакций. В этом случае обычно назначают другие препараты. Показано, что паклитаксел активен для предварительного лечения женщин с метастатическим раком молочной железы, при этом до 50 % больных чувствительны к действию препарата.
Хориокарцинома матки
Эта редкая опухоль, которая возникает из эмбриональной трофобластической ткани, была первым метастатическим раком, излеченным с помощью химиотерапии. Массивные дозы метотрексата — 25 мг/день в течение 4 или 5 дней — дают большое количество случаев излечения с полным подавлением метастатических поражений и исчезновением хорионических гонадотропных гормонов в моче. Терапию следует повторять на протяжении нескольких месяцев после того, как исчезнут все признаки заболевания. Альтернативная схема лечения с высоким уровнем излечения (включая лечение случаев, устойчивых к метотрексату) состоит в использовании комбинации этопозида с цисплатином.
Карцинома яичников
Данное новообразование часто остается скрытым до тех пор, пока не метастазирует в брюшную полость и не проявится злокачественным асцитом. Важно установить стадию развития новообразова
ния, используя лапароскопию, ультразвуковое или компьютерное томографическое сканирование. У пациентов с I стадией опухолей, по-видимому, улучшается состояние после лучевой терапии тазовой области и может наступить дополнительное улучшение после проведения комбинированной химиотерапии. Комбинированная химиотерапия сейчас является стандартным методом лечения III и IV стадий заболевания. Наиболее ударная комбинация включает циклофосфамид и цисплатин или карбоплатин, которые вызывают ремиссию у 70-80 % больных и полную ремиссию приблизительно у 40 %. Паклитаксел недавно одобрен FDА для применения у женщин с резистентным раком яичников. Он дает ремиссию у ’/3 таких пациенток. Сейчас изучается его комбинация с цисплатином. Радиотерапия (включая полное облучение брюшной полости) не повышает уровень выживаемости при высокой стадии поражения и, в основном, не показана. В современных клинических исследованиях выявлены многообещающие признаки эффективности комплексного лечения, использующего хирургическое вмешательство, радиотерапию и вспомогательную комбинированную химиотерапию при I и II стадиях новообразований. Определение вида стволовых клеток опухоли все чаще проводится для индивидуализации схемы лечения пациенток с раком яичников.
Тестикулярные новообразования
Монохимиотерапия вызывает впечатляющее уменьшение опухоли в некоторых случаях прогрессирующих тестикулярных новообразований, не се-мином, но мало полных ремиссий длительностью более чем 1 год. Внедрение комбинированной химиотерапии цисплатином, винбластином и блеомицином (PVB) произвело значительные изменения в этой статистике. Чувствительны к химиотерапии 95 % пациентов, и приблизительно у 90 % наступает полная ремиссия. Вероятно, более половины пациентов, достигших полной ремиссии, излечиваются с помощью химиотерапии. Замена винбластина на этопозид не уменьшает частоту ремиссий и уровень излечения, однако гематологические токсические эффекты наблюдаются реже. При прогрессирующем заболевании (пациенты с метастазами в лимфатические узлы) проведение такого дополнительного лече
ния не показано, потому что более чем у половины пациентов не развивается рецидивов после начальной операции, которая включает ретроперитониаль-ное иссечение лимфатических узлов, и потому что уровень излечения с использованием химиотерапии при рецидиве заболевания довольно высокий.
Карцинома предстательной железы
Карцинома предстательной железы — одна из первых форм рака, у которого обнаружена чувствительность к изменению гормонального статуса. Орхиэктомия или терапия низкими дозами эстрогена (или и то и другое) вызвали продолжительное улучшение состояния пациентов с повреждением костей. Сходные результаты были получены также при применении агониста гонадотропинрилизинг-гор-мона. Эти препараты менее токсичны, чем эстрогены, но гораздо болеедорогие. Применение антиандрогена флютамида после орхиэктомии или вместе с леупролидом также имеет второстепенное значение. Гормональное лечение облегчает течение болезни у 70-80 % пациентов и вызывает значительное уменьшение количества выявленных метастазов. Критериями реакции на терапию являются уменьшение болей в костях, объективные признаки нормализации структуры пораженных костей и уменьшение уровня простатспецифического антигена и щелочной фосфатазы предстательной железы. Противогрибковый препарат кетоконазол подавляет синтез андрогенных стероидов и может в будущем найти применение в лечении рака предстательной железы. Недавно установлено, что антагонист фактора роста (и противопаразитарное средство) сурамин обладает противоопухолевой активностью у пациентов с метастатическим раком предстательной железы. Полагают, что он также действует через эндокринные механизмы. Но в целом химиотерапия не является определяющей для излечения от этого заболевания.
Карцинома щитовидной железы
До недавнего времени только радиоактивный йод (,3|1) обладал терапевтической активностью в отношении метаболического рака щитовидной железы. При этом его эффекты были ограничены дей-
станем на хорошо дифференцированные опухоли, которые могли концентрировать йод. Сейчас установлено, что доксорубицин и цисплатин обладают значительной активностью в отношении рака щитовидной железы различных гистологических типов (особенно при анапластических поражениях). Эти препараты вызывают весьма выраженное уменьшение опухоли и увеличивают продолжительность жизни. Применение комбинированной химиотерапии совместно с ,3,1 при раке щитовидной железы является многообещающим у пациентов группы высокого риска, у которых выявлены анапластические клетки при гистологическом исследовании или прорастание сосудов в щитовидную железу..
Желудочно-кишечные карциномы
Данная группа новообразований ограниченно чувствительна к существующим химиотерапевтическим препаратам. Эти опухоли продуцируют канцероэмбриональный антиген (СЕА), поэтому для определения рецидива после операции, а также чувствительности к системной химиотерапии (или рецидива после нее) могут быть применены радиоиммунные пробы. Колоректальная аденокарцинома является наиболее распространенным типом рака и только в 43 % случаев излечивается хирургическим методом. Пациенты с микрометастазами в регионарных лимфатических узлах являются кандидатами для проведения вспомогательной химиотерапии фторурацилом совместно с левамизолом. Установлено, что такая комбинация препаратов, по сравнению с одним только хирургическим вмешательством, уменьшает частоту рецидивов после операции на 35 % и повышает выживаемость. Фторурацил — наиболее активное средство для монотерапии пациентов с метастазами, но он обеспечивает ремиссию только в 21 % случаев и не вызывает полных ремиссий. Эффекты фторурацила можно усилить у больных с метастатическим колоректальным раком с помощью сопутствующего применения лейковорина или интерферона (или обоих). Ло-мустин, митомицин и циклофосфамид — менее активные средства. Митомицин или кармустин также действуют на эти карциномы при применении с фторурацилом. При всех схемах лечения наблюдаются существенные гематологические токсические эффекты. Поскольку эти комбинации не вызывают
полных ремиссий, не удлиняют продолжительность жизни и являются довольно токсичными, их следует применять только у пациентов, имеющих метастазы. Установлено, что катетеризация печеночной артерии и повторные артериальные инфузии фторурацила или FUDR дают положительный эффект при лечении пациентов с колоректальным раком, который метастазировал только в печень. Монотерапия фторурацилом широко изучалась как дополнение к хирургическому вмешательству, но она незначительно снижала частоту возникновения рецидивов, наблюдаемую после операции.
Рак желудка и рак поджелудочной железы являются менее частыми, но гораздо более агрессивными заболеваниями, и обычно их невозможно полностью удалить хирургически, поскольку они, как правило, широко метастазируют к моменту операции. Совместное применение фторурацила, доксорубицина и митомицина облегчает течение болезни у некоторых пациентов. Считают, что “неадъювантная" химиотерапия с активным применением 5-ФУ до операции дает некоторую надежду на излечение.
Установлено, что карцинома островковых клеток поджелудочной железы, образующаяся из р-клеток и секретирующая инсулин, исключительно чувствительна к антибиотику стрептозоцину. Получены хорошие результаты в лечении этой редкой опухоли стрептозоцином. Терапия данным препаратом для некоторых пациентов может быть излечивающей. Стрептозоцин часто применяют с другими препаратами, например фторурацилом, доксорубицином и митомицином.
Бронхогенная карцинома
Лечение эпидермоидных, крупноклеточных типов рака и аденокарцином легких дает неудовлетворительные результаты. Предотвращение заболевания (в первую очередь посредством отказа от курения) остается наиболее важным способом контроля. Средняя прогнозируемая продолжительность жизни после постановки диагноза составляет 8 месяцев. В редких случаях опухоль может быть удалена при операции, кроме того, используется рентгеновское облучение для паллиативного облегчения боли, уменьшения обструкции или кровотечений. Однако в большинстве случаев рака легких к моменту постановки диагноза уже имеются отдаленные метастазы, и поэтому химиотерапия является наиболее важным методом лечения.
Рак легких обладает печально известной устойчивостью ко всем традиционным формам химиотерапии, но некоторые новые методы дают многообещающие результаты. Установлено, что гистологическое исследование опухолевой ткани важно для определения подгрупп пациентов, чувствительных к химиотерапии. Пациенты с мелкоклеточным (овсяновидные клетки) раком легких (наиболее быстро растущий тип) наиболее чувствительны к комбинированной химиотерапии такими препаратами, как цисплатин, этопозид, доксорубицин, циклофосфамид, метотрексат и нитрозомочевина. Пациенты с ограниченными мелкоклеточными карциномами лучше всего реагируют на такую схему лечения. Им также может быть показано полное облучение головного мозга для стерилизации часто присутствующих скрытых метастазов в центральной нервной системе. Однако профилактическая роль облучения головного мозга остается неопределенной вследствие значительного поражения функции мозга, которое развивается у таких пациентов. При немелкоклеточном раке легких комбинация этопозида и цисплатина дает ограниченный положительный эффект.
Злокачественная меланома и разнообразные саркомы
Метастатическая меланома является одним из наиболее трудных для лечения новообразованием. Выявлено, что большинство химиотерапевтических средств вызывают ее уменьшение по крайней мере у 10 % пациентов. Может происходить и спонтанная регрессия опухоли, особенно метастазов в коже, поэтому уменьшение кожных поражений не обязательно свидетельствует о чувствительности к химиотерапии. Иммунологическая реактивность лимфоцитов хозяина к опухоли частично объясняет причину исчезновения кожных поражений, но “спонтанная регрессия” висцерального заболевания случается редко и метастазы наблюдаются практически в каждом органе тела. Дакарбазин и цисплатин — наиболее активные цитотоксические препараты при этом заболевании. Биологические средства, включая лейкоцитарный интерферон человека (естественный или рекомбинантный), могут иметь сходную активность. Целесообразно назначение интерлейкина-2. Тамоксифен потенцирует эффекты многих лекарственных комбинаций, включающих цисплатин.
Остеогенная саркома и саркома Эвинга реагируют на доксорубицин, а комбинация доксорубицина и дакарбазина способна вызвать существенную регрессию в 40 % случаев рабдомиосаркомы, фибросаркомы, остеогенной саркомы и родственных опухолей. Применение вспомогательной химиотерапии, которая включает доксорубицин после начальной операции, при остеосаркоме увеличивает среднюю продолжительность жизни при этом практически всегда смертельном новообразовании. Сходные результаты были получены у пациентов с саркомой мягких тканей конечностей, у которых дополнительная химиотерапия увеличивала продолжительность жизни после излечения. Когда этот метод был применен вместе с сохраняющей конечность операцией, уменьшилась частота проведения ампутации как части первичного хирургического вмешательства. При сильно метастазирующей саркоме мягких тканей проводят терапию первого ряда с использованием комбинаций на основе доксорубицина. У пациентов с рецидивами после лечения по данной схеме иногда наступает улучшение состояния после использования ифосфамида.
Опухоли головного мозга
Астроцитомы III и IV стадий (преимущественно полиморфные глиобластомы) являются наиболее частыми первичными опухолями головного мозга, чрезвычайно устойчивыми к хирургическому лечению. Несмотря на'успехи использования компьютерного томографического (КТ) сканирования, которое точнее визуализирует место начального поражения для последующего хирургического лечения, средняя продолжительность жизни в случае применения только хирургического вмешательства до настоящего времени составляет примерно 20 недель. Дополнительная радиотерапия всего мозга (приблизительно 5 500 сГр) или монотерапия кар-мустином (220 мг/м2 каждые 6-8 недель) увеличивают среднюю продолжительность жизни до 36 недель, в то время как мультимодальная терапия (операция + лучевая терапия + кармустин) увеличивает ее до 50 недель, а 25 % пациентов живут приблизительно 18 месяцев. Этот мультимодальный метод, хотя все еще ограниченный по эффективности, может быть рекомендован в качестве паллиативного для пациентов с такими опухолями до тех пор, пока не будут разработаны более эффективные схемы ле
чения. Экспериментальный препарат тенизоламид, по-видимому, эффективен для лечения опухоли головного мозга и в настоящее время проходит начальные клинические испытания.
Подавление злокачественных выпотов и асцитов
Прямые инъекции мехлорэтамина или других противоопухолевых средств в пораженную полость ликвидируют или уменьшают асциты и выпоты, вызываемые карциномой, у приблизительно 2/3 пациентов. Метод эффективен независимо от типа первичной опухоли.
Процедура включает удаление большей части плевральной или асцитической жидкости и последующую инъекцию лекарства в полость. Доза мехлорэтамина, применяемого интраплеврально, составляет 0.4 мг/кг, или общую дозу 20-30 мг в среднем на пациента. Раствор приготавливают непосредственно перед введением для того, чтобы избежать потери активности препарата вследствие гидролиза. Необходимо установить катетер, чтобы ток жидкости из полости был свободный. Это позволяет избежать инъекции препарата в ткани. Плевральные или перитонеальные выпоты, вызываемые карциномой яичников или молочной железы, часто чувствительны к внутриполостному введению блеомицина в дозе 60 мг/м2. После инъекции препарата пациент должен менять положение тела, чтобы препарат распределился по всей плевральной полости. На следующий день оставшуюся жидкость откачивают.
После инъекции мехлорэтамина в плевральную полость иногда отмечаются боль, тошнота и рвота. Тошноту и рвоту можно снять внутримышечным введением фенотиазина непосредственно перед или в ходе процедуры. Функция костного мозга подавляется умеренно при таком способе введения мехлорэтамина, за исключением пациентов, которым проводилась экстенсивная лучевая терапия. Блеомицин или тиотепа предпочтительнее мехлорэтамина для интраперитонеального применения, поскольку значительно меньше раздражают брюшину и не вызывают боль.
Тетрациклин применяется интраплеврально со сходным терапевтическим успехом. Обычно отмечают боль в месте введения и появление лихорадки, однако системного подавления гематопоэза не наблюдается.
Оценка чувствительности опухоли
Химиотерапия рака может привести к клиническому улучшению или появлению значительных токсических эффектов, или и к тому, и к другому. Поэтому чрезвычайно важно критически анализировать эффекты лечения для того, чтобы получить в итоге улучшение состояния больного (или излечение). Предварительные данные о результатах применения анализа стволовых клеток опухоли для определения необходимой формы химиотерапии являются довольно обнадеживающими, особенно когда речь идет об отказе от препаратов, которые, возможно, вызовут токсические эффекты без компенсирующего клинического улучшения. Этот анализ достаточно точен (70 %) при определении средств, которые окажутся полезными для пациентов. В следующих параграфах обсуждаются наиболее важные признаки благоприятного воздействия химиотерапии.
Сокращение размера опухоли может быть выявлено с помощью физикального обследования, рентгенологического обследования или с помощью специальных методов сканирования (рак молочной железы и предстательной железы), компьютерной томографии, ЯМР-исследования или ультразвуковой эхографии.
Другим признаком чувствительности опухоли к терапии является значительное снижение скорости роста опухоли или уменьшение вещества-маркера, которое отражает массу опухоли в организме. Такими маркерами являются парапротеины сыворотки или мочи и макроглобулинемия в случае множественной миеломы; хорионический гонадотропин в случае хориокарциномы и тестикулярных новообразований; стероиды мочи при карциноме надпочечников и паранеопластическом синдроме Кушинга; 5-гидроксииндолуксусная кислота при карциноидном синдроме; и простатспецифический антиген при раке предстательной железы. Секретируемые опухолевые антигены, такие как а-фетопротеин, могут быть обнаружены при гепатоме, тератоэмбрио-нальной карциноме и, в редких случаях, при раке желудка; канцероэмбриональный антиген можно обнаружить при карциномах толстой кишки, легких и молочной железы. Опухолевый антиген СА 125 очень полезен для исследования чувствительности к лечению у женщин с раком яичников.
Нормализация функции органов, которая ранее была нарушена присутствием опухоли, является полезным индикатором эффективности действия лекарств. Примером такого улучшения служит нормализация функции печени (например, повышение концентрации альбумина плазмы) у пациентов с выявленными метастазами в печени, улучшение неврологических данных у пациентов с церебральными метастазами. Исчезновение признаков и симптомов паранеопластических синдромов часто попадает в эту основную категорию и может быть принято за показатель чувствительности опухоли к лечению.
Ценным признаком является общее улучшение состояния пациента. Хотя эта характеристика является комбинацией субъективных и объективных факторов и может быть отнесена к плацебо-эффектам. Тем не менее очевидные признаки клинического улучшения могут послужить поводом для повторного анализа некоторых объективных показателей, перечисленных выше. Факторы, которые учитываются в определении общего состояния пациента, включают повышение аппетита, увеличение массы тела и активизацию режима (например, амбулаторный вместо постельного). Оценка статуса активности обладает преимуществом в подведении итогов по полезным и токсическим эффектам от химиотерапии и позволяет врачу судить, является ли конечный эффект химиотерапии реальным паллиативом. Применяются стандартизированные шкалы (шкала Карновского, Eastern Cooperative Oncology Group Scale).
Вторичные злокачественные образования
и химиотерапия рака
Вторичные злокачественные образования являются поздними осложнениями некоторых видов химиотерапии рака. Наиболее частым вторичным злокачественным образованием является острый миелогенный лейкоз (ОМЛ). Другие вторичные злокачественные образования редки. ОМЛ отмечают у 15 % пациентов с болезнью Ходжкина, которые подверглись лучевой терапии и МОРР; у пациентов с множественной миеломой, карциномой яичников или молочной железы, которых лечили мел-
фаланом. Несколько алкилирующих средств (так же, как и ионизирующее облучение) рассматриваются в качестве лейкозогенных. Известно, что прокарбазин (компонент комбинации МОРР) является мутагенным для бактерий и канцерогенным для животных. Механизм канцерогенного действия этих и других препаратов остается малопонятным. В то время как риск ОМЛ является относительно малым, улучшение от полной ремиссии или излечения болезни Ходжкина или ремиссия при других новообразованиях — выраженные. С дальнейшим развитием метода химического подавления и излечения рака проблема вторичных злокачественных опухолей будет приобретать все большее значение. Уже имеются сведения, что определенные алкилирующие средства (например, циклофосфамид) менее канцерогенны, чем другие. Систематическое тестирование канцерогенности противоопухолевых средств на нескольких видах животных позволяет выявить менее токсичные средства и заменить ими более канцерогенные препараты. В этом случае риск возникновения вторичных опухолей должен уменьшиться без принесения в жертву эффекта.
Используемые препараты
Новейшую информацию читатель может найти в источниках, помещенных в списке литературы.
Избранная литература
Canallos G. Р. et al. Chemotherapy of advanced Hodgkin’s disease with MOPP, ABVD, or MOPP alternating with ABVD. N. Engl. J. Med. 1992; 327: 1478.
Chabner B. A., Collins J. M. (eds). Cancer Chemotherapy: Principles and Practice of Oncology, 4th ed. Lippincott, 1993.
Curtis R. E. et al. Risk of leukemia after chemotherapy and radiation treatment for breast cancer. N. Engl. J. Med. 1992; 326: 1745.
Dianzani F., Antonelly G„ Capobianchi M. R. The Interferon System. Serono Symposium Publications. Raven Press, 1989.
DeVita V. T. Jr., Hellman S., Rosenberg S. A. (eds). Cancer: Principles and Practice of Oncology, 4th ed. Lippincott, 1993.
Fisher R. I. et al. Comparison of standard regimen (CHOP) with three intensive chemotherapy
Иммунофармакология
57
Хосе А. М. Барбуто, Эван М. Херш, Сидни И. Салмон
Механизмы иммунитета
Средства, которые подавляют иммунный ответ, играют важную роль в трансплантологии и при заболеваниях, связанных с его нарушением. Хотя некоторые детали механизма иммунитета все еще не ясны, можно вычленить основные этапы развития специфической иммунной реакции (рис. 57-1 и 57-2) для предположительной оценки соразмерности фармакологического эффекта и токсического действия иммуносупрессоров.
Считается, что специфический иммунитет является результатом взаимодействия антигенов (веществ, которые организмом хозяина обычно принимаются за чужеродные) с мононуклеарными клетками, циркулирующими в крови, лимфе и тканях. Природа самоузнавания, или “толерантности”, сложна, но, видимо, биологические основы этой нечувствительности закладываются еще в утробе матери во время развития лимфоидной ткани. Механизмы, которые обеспечивают толерантность, включают уничтожение клонов, блокаду рецептора антигена комплексом антиген-антитело, появление антител к поверхностному клеточному иммуноглобулину и активное подавление Т-лимфоцитов. Несмотря на то, что лимфоидные клетки имеют эмбриональное происхождение из тимуса, а костный мозг играет главную роль в развитии специфического иммунитета, решающий первоначальный шаг “процессинга антигена” происходит в антигенпрезентирующих клетках (АПК), к которым относятся дендритные клетки (считается, что они происходят из моноцитов крови или тканевых макрофагов), клетки Лангерганса, макрофаги и В-лимфоциты. Макрофаги или супернатанты из культуры макрофагов также могут стимулировать или подавлять пролиферативные реакции среди иммунных клеток. Эти реакции регулируются фактором роста пептидов. Что касается интерлейкинов, то установлено, что они ускоряют или подавляют пролиферацию В-клеток,
Сокращения, используемые в этой главе
АЛГ Антилимфоцитарный глобулин
АПК Антигенпрезентирующая клетка
АТГ Антитимоцитарный глобулин
ИФН Интерферон
ИЛ Интерлейкин
ФАТ Фактор активации тромбоцитов
CD Кластер дифференциации
CSF Колониестимулирующий фактор
CTLC Цитотоксический Т-лимфоцит
FKBP FK-связывающий белок
HAMA Антимышиные антитела человека
HLA Антиген лейкоцитов человека
IgE, IgG, Иммуноглобулины Е, G, М и др.
IgM и др.
МНС Главный комплекс гистосовмес-
тимости
NK Натуральный киллер
TNF Фактор некроза опухоли
Т-клеток или обоих видов клеток. Моноциты и макрофаги секретируют также простагландин Е2, который угнетает пролиферацию предшественников В- и Т-клеток. Способность лимфоидных клеток взаимодействовать со специфическими антигенами генетически детерминирована; различные лимфоидные клоны имеют индивидуальную специфичность к разным антигенным детерминантам. Частично генетическая регуляция пролиферации клеток иммунной системы, как считают, принадлежит антигенпрезентирующим клеткам, экспрессирующим основные антигены гистосовместимости, которые предъявляют чужеродные антигены Т-лимфоцитам.
Индивидуальные типы клеток, вовлеченных в иммунный ответ, можно распознать с помощью моноклональных антител к специфическим составля-
Ранний предшественник В-ряда СД9, СД10+
Лимфоидная стволовая клетка костного мозга СД19, СД20+
Эквивалент фабрициевой сумки
Т-лимфоцит СД5+
Тимур СДг
Антиген
Т-супрессор СД8+
В-клетка
Большая ,,
пре-В-клетка Малая
СЛ22+ пре-В-клетка СД23+
Д СД23+
Т-хелпер СД4+
Моноцит СД14+
Антиген
Т-эффектор
Лимфокины
Антиген Плазматическая клетка
Антиген
В-клетка памяти
Антитела иммуноглобулины IgG IgA lgM igD igE
Рис. 57-1. Происхождение и взаимодействие клеток иммунной системы. Сплошные стрелки означают стимуляцию или развитие, прерывистые — подавление. Антигенные маркеры клеточной поверхности (CD) показаны на самой ранней стадии их появления. Обычно они появляются на более поздних стадиях дифференциации в данном ряду клеток
ющим клеточной поверхности, обозначаемых как кластеры дифференциации (CD) и пронумерованных определенным образом. В то время как некоторые CD идентифицируются только как мембранные антигены, обладающие неизвестными функциями, другие распознаются как специфические рецепторы или ферменты. Важной группой молекул на поверхности антигенпрезентирующих клеток являются антигены II класса главного комплекса гистосовместимости (major histocompatibility complex — МНС) (известные также как 1а-антиге-ны). Антигены МНС II класса связывают фрагменты чужеродных антигенов в комплекс, который рас
познается Т-хелперами. Взаимодействие Т-клеток с результирующим антигенным комплексом в значительной степени потенцирует иммунные реакции, в том числе активацию В-клеток и образование антител.
В основе функционирования лимфоидной системы лежит принцип дуализма. Два различных типа лимфоидных клеток — Т- и В-лимфоциты — опосредуют, соответственно, клеточный и гуморальный иммунитет (рис. 57-3). Оба типа клеток обнаружены в крови и различных тканях тела, а также в периферических лимфоидных тканях (включая лимфатические узлы, селезенку и костный мозг). Дли-
Узнавание антигена
Клональная пролиферация
Дифференциация
Иммунные эффекты
Т -лимфоциты
Нативный антиген
из тимуса
Эффекты Т-хелпера
Эффекты к супрессора
Поверхностный антиген
Предшест-
Митоз
венник антителообразующей клетки
Малый лимфоцит
Накопление иммунных клеток в месте ответа
1. Узнавание антигена и взаимодействие с В-клетками
2. Гиперчувствительность замедленного типа (продукция цитокинов, клетки-киллеры)
3. Иммунологическая память
4. Супрессия или стимуляция (регуляция) В- и Т-клеток
, Антитело- „ образующая Плазматическая клетка клетка
Связывание с антигеном
Секреция специфических антител
^Иммуноглобулины «9)
В-лимфоциты
Образование сывороточных антител
Клетка памяти
Рис. 57-2. Упрощенная схема клеточного и гуморального иммунитета
тельно живущие клоны малых лимфоидных клеток, происходящие из тимуса (Т-клетки), видимо, узнают антиген в иммуногенной форме. Считают, что Т-клетка CD3a+7+ образуется из клеток-предшественников костного мозга под влиянием гормонов тимуса, которые продуцируются его эпителиоидным компонентом. Самыми молодыми развивающимися Т-клетками иммунной системы являются тимоциты CD1+. Пролиферация клонов антиген-специфических Т-клеток, которая происходит после контакта с фрагментами антигена, отвечает за развитие “клеточного иммунитета”, который проявляется в реакциях гиперчувствительности замедленного типа и важен при отторжении пересаженных тканей, а также для устойчивости к вирусным, грибковым и микобактериальным инфекциям.
Специфичные к антигену рецепторы на поверхности Т-клеток отвечают за иммунологическую специфику. Определенные субпопуляции Т-клеток влияют также на синтез антител В-клетками или модулируют его. Различают Т-клетки СГЭ4+-“хел-перы” и Т-клетки СО8+-“супрессоры”. Субпопуляции Т-клеток можно различить функционально или с помощью моноклональных антител, направ
ленных против специфических поверхностных клеточных антигенов, которыми различаются Т-хелперы и Т-супрессоры. Они взаимодействуют с различными классами молекул МНС. Так, Т-супрессоры взаимодействуют с антигенами, связанными с МНС класса I, а Т-хелперы — с антигенами МНС класса II (1а). Другим важным подтипом Т-клеток является цитотоксический Т-лимфоцит (CTLC) — обычно клетка CD8+, вовлеченная в отторжение трансплантата. Т-клетки, по-видимому, оказывают прямое цитотоксическое действие (например, на опухолевые клетки или трансплантаты) и с помощью высвобождения эффекторных веществ, называемых цитокинами (табл. 57-1). Цитокины продуцируются и другими клетками лимфоретикулярной системы.
Специфические антитела (иммуноглобулины) продуцируются потомками второго типа лимфоидных клеток — В-лимфоцитами, имеющими костномозговое происхождение. Первая идентифицируемая клетка этого ряда — пре-В-лимфоцит, которая обладает неперераспределяемыми генами иммуноглобулинов и экспрессирует антигены HLA класса II: CD19, CD37, CD38, CD40. В-лимфоциты
Структурные характеристики
Секретируемые продукты
Т-лимфоциты
(не адгезирующиеся на стекле, спонтанно образующие “розетки" с эритроцитами барана)
Рецептор антигена (подобный легким цепям) ---------___
Н2-гистаминовый рецептор
В-лимфоциты (адгезирующиеся на стекле, образующие “розетки” с эритроцитами барана, покрытыми антителами и комплементом)
Рецептор комплемента (связывает комплексы антиген-антитело-комплемент)
Антигены гистосовместимости
Плазматическая клетка (дифференцирующаяся из В-лимфоцита)
Тета-антиген
la-подобные антигены
Антигены гистосовместимости
Антигенсвязывающий рецептор (иммуноглобулиноподобный)
Антигенсвязывающий рецептор (иммуноглобулиноподобный)
Рецептор комплемента
Антигены гисто-_____
совместимости
? Интерферон
Интерферон
Интерлейкин-4 (в Т-хелперах)
у-Интерферон (в Т-супрессорах)
Специфические антитела классов IgG, IgA, IgM, IgD или IgE
Специфические антитела класса М (IgM)
Прототип антитела-иммуноглобулина класса G (IgG)
NH2-|S
Область шарнира
s-s s-s s s-s s-s s
Fab-фрагмент (участок, связывающий антиген, co- держит активные участки антитела)
Fc-фрагмент (содержит структурные сайты для связывания комплемента, определяет принадлежность к классу иммуноглобулинов, отвечает за вторичные биологические функции
S-SS-
l-SS-
— NH2
1-s s-
1-s s-
U'-S S
Тяжелая цепь
s S-S s-s s s-s s-s
NHZ
Активный сайт для связывания антигена
Легкая цепь
СООН СООН
Рис. 57-3. Эффекторы иммунного ответа. Специфические типы клеток, включая Т-лимфоциты, В-лимфоциты и плазматические клетки, так же как и секретируемые иммуноглобулины-антитела, имеют места связывания со специфическим антигеном, а также обладают различными генетическими и функциональными характеристиками. В развитии иммунного ответа важную роль играют не только выделяемые продукты, но и характерные особенности мембран
можно идентифицировать по присутствию интактных моноклональных иммуноглобулинов на их поверхности, которые служат в качестве рецепторов
к антигену. В-лимфоциты обладают также рецепторами к компонентам системы комплемента и к иммунным комплексам и презентируют поверхно-
ТАБЛИЦА 57-1. Цитокины
Цитокины Свойства
Интерферон-а (ИФН-а) Интерферон-0 (ИФН-0) Интерферон-у (ИФН-у) Оказывает антивирусное и антипролиферативное действие Оказывает антивирусное и антипролиферативное действие Оказывает иммуномодулирующее действие; повышает продукцию цитокинов и антимикробную активность лейкоцитов
Интерлейкин 1 (ИЛ-1) Интерлейкин 2 (ИЛ-2) Интерлейкин З(ИЛ-З) Интерлейкин 4 (ИЛ-4) Интерлейкин 5 (ИЛ-5) Интерлейкин 6 (ИЛ-6) Интерлейкин 7 (ИЛ-7) Стимулирует эндогенный пироген и рост костного мозга; медиатор воспаления Стимулирует пролиферацию Т-клеток и их активацию в “киллерные клетки” Стимулирует ранние предшественники в костном мозге; “мульти CSF” Стимулирует пролиферацию антиген-активированных В- и Т-клеток Стимулирует пролиферацию эозинофилов Стимулирует плазматические клетки и ранние предшественники костного мозга Стимулирует пролиферацию и дифференциацию ранних клеточных предшественников
Интерлейкин 8 (ИЛ-8) Интерлейкин 9 (ИЛ-9) Интерлейкин 10 (ИЛ-10) Фактор-0 некроза опухоли (TNF0) Фактор хемотаксиса нейтрофилов Фактор роста тучных клеток Подавление иммунного ответа Оказываетпротивопаразитарное действие (малярия, трипаносомоз); опосредует воспалительные реакции при эндотоксцческом шоке и противоопухолевое действие; стимулирует пролиферацию В-лимфоцитов
Фактор некроза опухоли (TNF) Колониестимулирующий фактор гранулоцитов-макрофагов (GM-CSF) Колониестимулирующий фактор гранулоцитов (G-CSF) Колониестимулирующий фактор моноцитов-макрофагов (M-CSF) Мобилизует кальций из костей; дает другие эффекты, сходные с таковыми TNF0 Стимулирует гранулоциты, нейтрофильные моноциты-макрофаги и пролиферацию и дифференциацию эозинофилов Стимулирует пролиферацию и дифференциацию гранулоцитов Стимулирует пролиферацию моноцитов-макрофагов
стный МНС (1а) антиген. До контакта с антигеном на поверхности лимфоцита преобладают иммуноглобулины классов IgD и IgM.
К моменту рождения у человека в структуре лимфатического узла и селезенки обнаруживаются парафолликулярные скопления тимусзависимых лимфоцитов и фолликулярные гнезда иммуногло-булинсинтезирующих клеток, которые образуют зародышевые центры. Считают, что тесное взаимодействие между антигенпрезентирующими клетками, несущими антиген в иммуногенной форме на клеточной поверхности, и комплементарными клонами Т-лимфоцитов необходимо для того, чтобы клональная пролиферация Т-клеток привела к развитию клеточного иммунитета. Специфически активированные антигеном Т-клетки взаимодейству
ют с В-клетками и вызывают их дифференциацию в антителообразующие клетки (рис. 57-1 и 57-2). Первичный иммунопролиферативный ответ усиливается или подавляется Т-клетками с функцией Т-хелперов или Т-супрессоров.
Естественные киллеры (CD16, 56, 57+) могут играть важную роль в отторжении опухоли и противовирусном иммунитете. NK-клетки являются крупными гранулярными лимфоцитами (с азуро-фильными цитоплазматическими гранулами) с иммуноглобулин-отрицательной и Fc-рецептор-положительной поверхностью и с низким аффинитетом к эритроцитам баранов. Исследования с применением моноклональных иммунных сывороток подтверждают, что NK-клетки могут происходить от Т-клеток или моноцитов, но могут представлять
и совершенно отдельный ряд лимфоидных клеток. NK-клетки обладают реактивностью в отношении опухолевых и нормальных клеток и могут играть важную роль в защите организма хозяина. Однако их место в системе иммунитета in vivo остается неопределенным.
Антителообразующие клетки могут увеличить свои способности к синтезу путем дальнейшей дифференциации в плазматические клетки, клоны которых синтезируют большие количества антител одного из классов иммуноглобулинов — IgG, IgA, IgM, IgD, IgE. Во время дифференциации индивидуальные клоны могут “переключить” свой иммунологический тип с IgD на IgA, IgM, IgG, IgE, даже если активный участок секреции антител останется идентичным по структуре после этого “переключения”. В результате специфические антитела связываются с чужеродными антигенами, вызывая их преципитацию, инактивацию (например, вирусов), лизис (например, эритроцитов) или опсонизацию с последующим фагоцитозом (например, бактерий). При некоторых обстоятельствах комплемент связывается с комплексом антиген-антитело и облегчает разрушение или фагоцитоз антигена. Повторное появление антигена вызывает немедленное химическое соединение антигена и антитела, а также служит в качестве “ускорителя”, запускающего быструю вторичную волну клеточной пролиферации и синтеза антител.
Двойственная природа иммунитета подтверждается такими “экспериментами природы”, как генетические болезни. Например, синдром ДиГеорге (DiGeorge), развивающийся вследствие отсутствия третьей жаберной щели, связан с недоразвитием тимуса и нарушением гиперчувствительности замедленного типа при нормальном образовании антител. Напротив, гиперчувствительность замедленного типа обычно не нарушена при другом врожденном иммунодефицитном заболевании — Х-наследу-емой агаммаглобулинемии, которая проявляется дефицитом антител. У младенцев с синдромом ДиГеорге или с тяжелым смешанным иммунодефицитом (с недостатком и клеточного, и гуморального иммунитета) отсутствует активность циркулирующего гормона тимуса. Некоторые дети с комбинированным иммунодефицитом, по-видимому, обладают специфическим дефицитом аденозиндез-аминазы, которая играет решающую роль в метаболизме нормальных лимфоцитов и предотвращает внутриклеточное накопление токсических про
дуктов дезокси-АТФ. Для лечения таких детей применяются препараты стабилизированной аденозин-дезаминазы. Недавно начали использовать генную трансфекцию, чтобы обеспечить устойчивое восстановление активности фермента (“генная терапия”). Изучение состава циркулирующих в крови лимфоцитов выявило, что у пациентов с синдромом ДиГеорге не хватает Т-клеток, а у пациентов с врожденной агаммаглобулинемией — В-лимфоцитов.
СПИД также характеризуется значительным снижением иммунитета организма по отношению к инфекциям и раку вследствие истощения пула клеток CD4+ Т-хелперов. Так как в ходе заболевания этот процесс усиливается, прогрессивно увеличивается и частота развития инфекционных осложнений и злокачественных новообразований.
Считают, что сложность иммунной системы обеспечивает достаточное количество точек контроля для ответа на появление “запретных клонов”, которые обладают активностью против собственных белков организма (относительно редкое явление). Обычно большая часть компонентов лимфоидной системы сохраняется в состоянии сильного “подавления” до тех пор, пока они избирательно не активируются для специфического иммунного ответа. Процесс состоит из большого количества этапов и можно полагать, что действие иммуносупрессивных средств может быть направлено на различные участки этого пути (рис. 57-4), включая индукцию специфической толерантности. Иммунная система является основным барьером в отношении вторгающихся микроорганизмов, в том числе онкогенных вирусов, а также в отношении токсинов и чужеродных клеток, поэтому состояние генерализованной иммуносупрессии может быть потенциально очень опасным для организма-хозяина.
Практически все клинически эффективные и доступные сегодня иммуносупрессивные средства обладают общими иммуноподавляющими свойствами и должны применяться с осторожностью. Исключение составляет КЬ()(О)-иммуноглобулин. Генерализованная иммуносупрессия увеличивает риск заражения инфекцией и развития лимфоретикулярных и других злокачественных опухолей. С помощью иммунодепрессивных препаратов, как правило, легче предотвратить или ослабить первичный иммунный ответ, чем подавить уже развившуюся иммунную реакцию. Даже принимая во внимание эти ограничения и предосторожности, иммуносупрессия необходима для лечения ряда приобре-
Дифференциация и синтез /
Пролиферация
Средство
Узнавание антигена
Преднизон Циклоспорин Азатиоприн Метотрексат Дактиномицин Циклофосфамид Антилимфоцитарный глобулин и моноклональные анти-Т-клеточные внтитела Rh0(D) иммуноглобулин
Т- клетки или антитела
Взаимодействие
Антиген
о
Комплемент
Отторжение ткани
Место действия
2.6
2,3 2 2
2,3 2
1,2,3
1
Рис. 57-4. Места действия иммуносупрессивных средств на иммунный ответ
тенных иммунных расстройств, а также при трансплантации органов. Простого определения понятия аутоиммунитета не существует, но известно, что он связан с активацией и пролиферацией Т-клеток и продукцией антител против тканевых антигенов организма хозяина. Даже если такие аутоиммунные реакции вызваны латентной инфекцией (например, ретровирусами), симптомы и признаки заболевания часто можно уменьшить с помощью иммунодепрессивной терапии.
Тесты
на иммунокомпетентность
Для тестирования иммунологической компетентности и ее изменений, вызванных лекарствами, используют разнообразные методы. Перечислим самые простые из них, которые можно применить для определения эффектов иммуноподавляющих и иммуностимулирующих лекарств.
1. Гиперчувствительность замедленного типа, тестируемая с помощью кожного теста, определяет способность отвечать на воздействие антигенов или “вспоминать” антигены. С вводимыми антигенами (обычно микробными) пациент уже до этого встречался. Примерами являются антигены эпидемичес
кого паротита, стрептокиназы-стрептодорназы, Candida albicans, столбняка, дифтерии и Pseudomonas, а также туберкулин. К другой группе антигенов относятся сенситизирующие химические вещества, например динитрохлорбензол.
2. Измерение содержания иммуноглобулинов сыворотки, сывороточного комплемента и специфических антител к различным естественным и приобретенным антигенам.
3. Серийное измерение иммунного ответа после первичной иммунизации или повторной реиммунизации (рис. 57-4).
4. Подсчет абсолютного числа циркулирующих лимфоцитов.
5. Измерение процентного содержания В-кле-ток, Т-клеток и их субпопуляций (например, используя моноклональные антитела), включающее как этап подсчет числа циркулирующих лимфоцитов крови.
6. Оценка in vitro выраженности пролиферативных ответов лимфоцитов на такие митогены, как фитогемагглютинин, конканавалин А и митоген фитолакки.
7. Смешанные лимфоцитарные реакции, в которых лимфоциты одного индивидуума пролиферируют в ответ на аллогенные лимфоциты другого индивидуума.
8. Оценка цитотоксичности NK-клеток к опухолевым клеткам-мишеням.
Взаимоотношения между иммуносупрессивной терапией и химиотерапией рака
Хотя некоторые препараты, используемые для иммуносупрессии (рис. 57-4), входят и в арсенал средств химиотерапии рака (глава 56), лечение этих двух категорий больных основано на различных принципах. Характер и кинетика пролиферации опухолевой клетки не идентичны пролиферации иммунной клетки, что позволяет использовать эти различия при иммуносупрессии. Например, в то время как пролиферация опухолевой клетки является “нестимулируемой”, пролиферация иммунной клетки происходит в ответ на присутствие специфического антигена. Деление индивидуальных злокачественных клеток в пределах большой клеточной популяции происходит беспорядочно и, види
мо, асинхронно. Напротив, пролиферация иммунных клеток частично “синхронизируется” при взрыве митотического деления после контакта с антигеном в большой популяции реагирующих клеток, проходящих генеративный цикл в период формирования специфического иммунитета, Таким образом, при применении цитотоксических препаратов в момент начального контакта с чужеродным антигеном (например, после трансплантации почки) уничтожается очень большое количество изначально малого числа клеток-предшественников, так как антиген стимулирует пролиферацию селективных клонов, а не всех клонов иммунных клеток. Это обеспечивает большую избирательность токсического действия лекарства в отношении нежелательного иммунного клона при аутоиммунных заболеваниях, чем при химиотерапии рака. Чтобы постоянно блокировать иммунопролиферацию при аутоиммунной патологии цитотоксические препараты принимают ежедневно в низких дозах. Те же самые средства (например, циклофосфамид) в химиотерапии рака назначают прерывисто в больших дозах “ударными” курсами каждые 3-6 недель. Такая тактика лечения способствует быстрому восстановлению иммунитета между курсами, что желательно для усиления противоопухолевых реакций, но не при иммуносупрессивной терапии.
Иммуносупрессивные средства
Кортикостероиды
Кортикостероиды были первым классом гормональных средств, обладающих антилимфоцитарны-ми свойствами. Введение глюкокортикоида (например, преднизона, дексаметазона) уменьшает размеры и содержание лимфоцитов в лимфатических узлах и селезенке. В то же время не наблюдается существенного цитотоксического действия на пролиферирующие миелоидные или эритроидные стволовые клетки костного мозга. Полагают, что глюкокортикоиды влияют на клеточный цикл активированных лимфоидных клеток. Механизм их действия описан в главах 38 и 56. Эти средства довольно цитотоксичны в отношении определенных субпопуляций Т-клеток, но их иммунологические эффекты, возможно, связаны с их способностью модифицировать клеточные функции, а не с прямым
цитотоксическим действием. Глюкокортикоиды ингибируют продукцию медиаторов воспаления: тромбоцитактивирующего фактора, лейкотриенов, простагландинов, гистамина и брадикинина. Эти гормональные средства подавляют хемотаксис и нарушают бактерицидную и фунгицидную активность моноцитов и нейтрофилов, но не изменяют их способности к фагоцитозу. Под действием кортикостероидов изменяется и лейкоцитарная формула. Они могут вызвать лимфопению (вероятно, из-за секвестрации лимфоидной ткани) и нейтрофилию (из-за нарушения краевого стояния нейтрофилов и выхода из сосудистого русла). Наряду с подавлением продукции ИЛ-1 моноцитами глюкокортикоиды вызывают уменьшение продукции ИЛ-2 и у-интерферона. Хотя клеточный иммунитет поражается больше, чем гуморальный, первичное антителообразование может уменьшиться: при продолжительном применении препаратов ослабляется уже развившаяся иммунная реакция. Более того, продолжительное введение преднизона активирует распад IgG — основного класса иммуноглобулинов-антител, тем самым снижая эффективную концентрацию специфических антител. С помощью кортикостероидной терапии обычно нейтрализуется кожная гиперчувствительность замедленного типа.
Глюкокортикоиды широко применяются по разным клиническим показаниям, где их иммуносупрессивные и противовоспалительные свойства рассматриваются как терапевтические эффекты. Сюда относятся такие аутоиммунные расстройства, как аутоиммунная гемолитическая анемия, идиопатическая тромбоцитопеническая пурпура, воспалительное заболевание кишечника, системная красная волчанка и некоторые случаи тиреоидитов Хашимото. Кортикостероиды модулируют также аллергические реакции и используются при бронхиальной астме, что будет обсуждаться далее в этой главе. Их часто назначают реципиентам пересаженных органов, особенно в период кризиса отторжения, потому что дозу можно увеличить без опасения токсического воздействия на костный мозг. Обычный диапазон доз преднизона как иммунодепрессивного средства составляет 10-100 мг энтерально ежедневно. Потенциальные побочные эффекты кортикостероидов, включая подавление функции надпочечников и серьезные вирусные, бактериальные и грибковые инфекции, возможны, когда эти средства применяют для длительной иммуносупрессии.
Циклоспорин
Циклоспорин (рис. 57-5) используется как высокоэффективное иммуноподавляющее средство в случае трансплантации органов человека, для угнетения реакции “трансплантат против хозяина” после операции по пересадке костного мозга и при лечении отдельных аутоиммунных расстройств. Монотерапия циклоспорином столь же результативна, как и его применение в сочетании с преднизоном, эффект от приема циклоспорина превосходит таковой от приема комбинаций из азатиоприна, преднизона и антилимфоцитарных антител по показателям частоты отторжений и инфекционных осложнений. В предварительных исследованиях на животных также получены обнадеживающие результаты. Препарат представляет собой жирорастворимый пептидный антибиотик, который, по-видимому, нарушает на ранней стадии дифференциацию Т-клеток и блокирует их активацию. В недавних работах показано, что циклоспорин подавляет in vitro транскрипцию генов, кодирующих ИЛ-2, ИЛ-3, ИФН-у и другие факторы, продуцируемые антигенстимулируемыми Т-клетками, но не блокирует влияние лимфокинов на Т-клетки и взаимодействие с антигеном.
Циклоспорин принимают энтерально ежедневно в дозе 7.5-25 мг/кг. Токсические эффекты включают нефротоксическое действие, гипергликемию и гиперлипидемию, некоторое увеличение роста волос и временную дисфункцию печени. Регулярное наблюдение за концентрацией препарата в крови помогает избежать этих осложнений. Препарат обладает низкой токсичностью в отношении костного мозга. Частота развития лимфом у реципиентов трансплантата, принимающих циклоспорин, несколько выше средней, но не отличается от показателя у больных, получающих другие иммуносупрессивные средства.
Циклоспорин обладает достаточной силой и эффективностью, чтобы избежать необходимости одновременного применения кортикостероидов,
СНОНСНСН3СН2СН = СНСН3
I
СНСО — Abu — MeGly — MeLeu — Vai — MeLeu I I
CH3---N----MeVal---MeLeu----D-Ala---Ala
Рис. 57-5. Циклоспорин. (Abu, L-2-аминобутирил)
азатиоприна, циклофосфамида или других иммунодепрессивных препаратов у некоторых пациентов, в то же время иногда необходимо комбинировать его с другими иммунодепрессивными средствами. Препарат использовали с успехом как единственный иммунодепрессант при пересадке трупной почки, поджелудочной железы и печени. Он также подтвердил свою высокую эффективность при трансплантации сердца. При приеме в дозе 7.5 мг/кг/день или менее циклоспорин дает выраженный терапевтический эффект при различных аутоиммунных расстройствах, включая увеиты, ревматоидные артриты (в случае раннего лечения), диабет I типа. Почти у % детей с начальными симптомами диабета можно прервать или уменьшить инсулинотерапию в пределах 6 недель после начала лечения циклоспорином. Таким образом, циклоспорин в нетоксических дозах подавляет аутоиммунный процесс против островковых клеток поджелудочной железы, отвечающий за возникновение диабета I типа.
После энтерального приема циклоспорин медленно и неполностью всасывается (20-50 %). Время его полувыведения составляет 24 часа. Принятая доза почти полностью метаболизируется и выводится с желчью.
Считают, что внедрение циклоспорина является важным шагом в направлении создания более специфичных и избирательных средств, эффективных в отношении действия на субпопуляции лимфоцитов, но его побочные эффекты все еще значительны, хотя, по-видимому, меньше, чем у кортикостероидов и других цитотоксических средств, применяемых для иммунодепрессии.
Такролимус (FK 506)
FK 506 является иммуносупрессивным макролидным антибиотиком, продуцируемым Streptomyces tsukubaensis. По химической структуре он отличается от циклоспорина, но похож на него по механизму действия. Оба препарата связываются с цитоплазматической пептидилпролилизомеразой, которая находится во' всех тканях. Циклоспорин связывается с циклофилином, a FK 506 — с FK-связывающим белком (FKBP). Оба комплекса подавляют одну и ту же цитоплазматическую фосфатазу — кальциневрин, по-видимому, участвующую в активации специфического для Т-клеток фактора транскрипции. Этот фактор транскрипции (так на
зываемый NF-АТ) вовлечен в синтез интерлейкинов активированными Т-лимфоцитами.
В эквивалентных по массе количествах FK 506 в 10—100 раз сильнее, чем циклоспорин, ингибирует иммунные реакции. Сейчас FK 506 проходит клинические испытания при трансплантации печени, сердца, почки и поджелудочной железы. При трансплантации почки препарат так же эффективен, как циклоспорин. В случае пересадки печени FK 506, видимо, более эффективен, судя по показателям приживаемости трансплантата и продолжительности жизни пациента. Более того, препарат подтвердил свою эффективность в случае применения после неудачи использования стандартной терапии, направленной на снижение риска отторжения (в том числе с введением анти-Т-лимфоци-тарных антител).
Препарат можно применять энтерально или внутривенно. После приема внутрь максимальная концентрация достигается через 1-4 часа. Период полувыведения внутривенной формы препарата составляет приблизительно 9-12 часов. Метаболизируется FK 506 главным образом с участием цитохрома Р-450 в печени. Токсические эффекты сходны с эффектами циклоспорина. Это нефротоксическое и нейротоксическое действие, гипергликемия (требующая терапии инсулином) и желудочно-кишечные дисфункции.
Новые иммуносупрессивные средства
Продолжаются исследования в области разработки новых менее токсичных и более специфичных иммуносупрессивных средств. Микофенолата мо-фетил (RS-61433) представляет собой полусинте-тическое производное микофеноловой кислоты, выделенной из плесени Penicillium glaucum. In vitro препарат подавляет ряд лимфоцитарных реакций, включая митогенной и смешанный лимфоцитарный ответ. Механизм действия Зависит от его способности ингибировать синТеЗ йу^инов de novo. Недавнее использование препарата у пациентов с трансплантацией почки и пёЧени дала многообещающие результаты при терапии рефрактерного отторжения и непереносимости циклоспорина или FK 506. В последнем случае микофенолата мофетил назначали в комбинации с преднизоном. Известно, что родственный препарат, мизорибин, ингибирующий
тот же путь синтеза нуклеотидов, эффективен при трансплантации почки. В Японии его применяют как средство, альтернативное более токсичному аза-тиоприну. Другой препарат этой группы — брекви-нар натрия. Он ингибирует путь синтеза пиримидина de novo. Препарат применяют для лечения рака, а с 1992 г. начаты его клинические испытания при трансплантации. В эксперименте выявлен сильный иммуносупрессивный эффект бреквинара и синергизм с циклоспорином.
15-Дезоксиспергуалин был выделен из Bacillus laterosporus. Он оказывает выраженное антимоноци-тарное действие, включая подавление экспрессии антигена МНС и образования свободных радикалов. Препарат дает также антилимфоцитарный эффект: он ингибирует продукцию антител после иммунизации и образование цитотоксических клеток во время смешанных лимфоцитарных реакций. Очевидно, он действует на поздних этапах активации Т- и В-лимфоцитов и способен даже подавить вторичные реакции антителообразования. Препарат успешно применяется для лечения острого отторжения при трансплантации почек. Сейчас проводят эксперименты для того, чтобы проверить, может ли этот препарат предотвратить образование антимышиных антител человека (НАМА) после терапии моноклональными мышиными антителами.
Рапамицин* — это макролидный антибиотик, выделенный из Streptomyces hygroscopicus, сходный по структуре с FK 506. Как и FK 506, он связывает FKBP. Однако препарат не ингибирует продукцию интерлейкина активированными Т-клетками, хотя блокирует реакцию Т-лимфоцитов на цитокины. В условиях in vitro препарат подавляет Т-клсточный ответ на FK 506, но, видимо, является синергистом циклоспорина. В опытах на животных препарат сам по себе или в комбинации с другими иммунодепрессантами эффективно предотвращает отторжение аллотрансплантатов почки и сердца.
Цитотоксические средства
Азатиоприн
Азатиоприн представляет собой имидазольное производное меркаптопурина (6-меркаптопурин, 6-МР) и функционирует как структурный аналог или антиметаболит (глава 56). Хотя действие пред-
* Новое название — сиролимус.
Азатиоприн
положительно определяется наличием меркаптопурина в его составе, азатиоприн применяется более широко, чем меркаптопурин, в иммуносупрессивной терапии. Эти препараты являются прототипами структурных аналогов нормальных метаболитов клетки или цитотоксическими разновидностями иммуносупрессивных средств. Многие другие лекарства, которые убивают пролиферативные клетки, по-видимому, действуют подобным образом при иммунном ответе.
Азатиоприн хорошо всасывается из желудочно-кишечного тракта и метаболизируется сначала до меркаптопурина (на рисунке эта часть находится под пунктирной линией). Далее основная часть активного вещества окисляется ксантиноксидазой до 6-тиомочевой кислоты и выводится с мочой. Небольшое количество препарата в неизмененном виде выводится почками, поэтому у пациентов с анурией или удаленной почкой может отмечаться значительное усиление токсических эффектов. Поскольку инактивация препарата во многом зависит от ксантиноксидазы, больным, которые одновременно принимают аллопуринол (глава 56), являющийся ее ингибитором, следует уменьшить дозу аза-тиоприна до ’/4-’/з от обычной дозы для предотвращения развития токсических эффектов.
Иммуносупрессия при терапии азатиоприном или меркаптопурином, скорее всего, является результатом вмешательства в метаболизм нуклеиновых кислот на этапе активации клеточной пролиферации, которая происходит после антигенной стимуляции. Цитотоксический эффект аналогов пурина основан на разрушении стимулированных лимфоидных клеток. Хотя для поддержания синтеза антител плазматическими клетками тоже необходим продолжительный синтез иРНК, азатиоприн и меркаптопурин тормозят этот процесс в
меньшей степени, чем синтез нуклеиновых кислот в пролиферирующих клетках. Эти цитотоксические препараты блокируют также клеточный иммунитет и первичную и вторичную выработку сывороточных антител.
Считают, что азатиоприн и меркаптопурин способствуют сохранению прежде всего почечных, а также других аллотрансплантатов. Имеются положительные результаты лечения с их помощью острых гломерулонефритов и почечной формы системной красной волчанки.
Как и для меркаптопурина, главный токсический эффект азатиоприна—подавление функции костного мозга, обычно проявляющееся в виде лейкопении, хотя могут наблюдаться анемия, тромбоцитопения и кровотечения. При применении препарата в высоких дозах отмечаются кожная сыпь, лекарственная лихорадка, тошнота и рвота, иногда диарея. Может наблюдаться дисфункция печени, которая проявляется очень высоким уровнем активности щелочной фосфатазы в сыворотке и умеренно выраженной желтухой.
Хотя эти препараты потенциально токсичны для кроветворения в костном мозге (угнетение предшественников мегакариоцитов и эритроцитов), их терапевтический эффект превалирует над токсическим. Их иногда применяют в терапии преднизон-устойчивой идиопатической тромбоцитопенической пурпуры и аутоиммунных гемолитических анемий.
Циклофосфамид
Алкилирующий агент циклофосфамид недавно оказался в центре внимания как иммуносупрессивное средство. Он, вероятно, является наиболее сильным из синтезированных на сегодняшний день иммунодепрессантов. Циклофосфамид разрушает пролиферирующие лимфоидные клетки, а также, вероятно, алкилирует некоторые из покоящихся клеток. Прием очень высоких доз (>120 мг/кг внутривенно в течение нескольких дней) может вызвать явную специфическую толерантность к новому антигену, если препарат вводят одновременно с ним или через незначительный промежуток времени. В меньших дозах препарат очень эффективен в терапии системной красной волчанки, у пациентов с антителами к фактору XIII и синдромами кровоточивости, при аутоиммунной гемолитической анемии и истинной эритроцитарной аплазии при гранулематозе Вегенера.
Несмотря на то, что лечение циклофосфамидом в больших дозах значительно увеличивает риск возникновения панцитопении и геморрагических циститов, препарат помогает “прижиться” трансплантатам костного мозга и может проявить эффективность при других типах трансплантации. Хотя циклофосфамид вызывает толерантность к костномозговым или иммуноклеточным трансплантатам, его применение не предотвращает в последующем развития синдрома “трансплантат против хозяина”, который может привести к смертельному исходу, если донор плохо подходит по гистосовместимости. Для выживания пациентов в период интенсивной терапии необходимы специализированный медицинский уход и поддерживающие средства.
Другие цитотоксические средства
Другие цитотоксические средства, в том числе винкристин, метотрексат и цитарабин (глава 56), также обладают иммуносупрессивными свойствами. Метотрексат недавно широко применялся в терапии ревматоидного артрита (глава 35). Хотя многие препараты можно использовать для подавления иммунных реакций, они не получили такого широкого распространения, как пуриновые антагонисты, и показания к их применению с этой целью определены недостаточно четко. Пациентам с идиосинкразическими реакциями на пуриновые антагонисты, по-видимому, уместно назначать метотрексат (который можно принимать энтерально). В период угрозы отторжения почечного трансплантата с некоторым успехом применялся также антибиотик дактиномицин. Считается, что винкристин довольно эффективен при идиопатической тромбоцитопенической пурпуре, устойчивой к преднизону. Родственный ему алкалоид винбластин, также содержащийся в барвинке розовом, in vitro предотвращает дегрануляцию тучных клеток и высвобождение из них гистамина и других вазоактивных соединений посредством связывания с элементами микротрубочек в клетке.
Антитела как иммуносупрессивные средства
До недавнего времени для выделения специфических антител требовались иммунизация животных и получение антисыворотки с последующей
очисткой фракции у-глобулина. “Гибридомная” технология Мильштейна и Келера совершила революцию в этой области и радикально увеличила чистоту и специфичность антител, применяемых для иммунодепрессии и по другим показаниям. Гибри-домы образуются при слиянии антителообразующих и плазмацитомных клеток. Стабильную гибридную клетку, продуцирующую требуемые антитела, можно клонировать, и получить культуру для синтеза антител в значительных количествах. В фармацевтической промышленности с этой целью начали применять ферментеры.
Антилимфоцитарные и антитимоцитарные антитела
Начиная со времени первых наблюдений Мечникова на рубеже нашего века, в единичных случаях приготавливали иммунные сыворотки, действие которых направлено против лимфоцитов. С наступлением эры пересадки человеческих органов внезапно приобрел новое значение гетерогенный анти-лимфоцитарный глобулин (АЛГ). В настоящее время АЛГ, антитимоцитарный глобулин (АТГ) и моноклональные анти-Т-антитела применяются в клиниках многих медицинских центров, которые занимаются трансплантацией органов. Антисыворотку обычно получают с помощью иммунизации крупных животных лимфоидными клетками человека или методом гибридомы для образования моноклональных антител.
Антилимфоцитарные антитела изначально действуют на малые долгоживущие периферические лимфоциты, которые циркулируют между кровью и лимфой. При продолжительном введении антител истощается также пул “тимусзависимых” лимфоцитов из околососудистых скоплений лимфоидных фолликулов, так как они обычно участвуют в рециркуляции. Антилимфоцитарные антитела связываются с поверхностью этих Т-клеток (рис. 57-2) и вызывают иммуносупрессию с помощью различных механизмов. В печени и селезенке происходят опсонизация и фагоцитоз антителсвязанных клеток. При применении некоторых препаратов поликлональных антител может происходить цитотоксическое разрушение клеток, опосредуемое комплементом сыворотки. Этот эффект не наблюдается в случае использования мышиных моноклональных антител, так как они не активируют систему комплемента человека. Другим возможным механизмом действия
является антителозависимая клеточная цитотоксическая реакция. Препараты антител могут блокировать иммунную функцию, не только лизируя клетки, но и модулируя поверхностную экспрессию молекул, вовлеченных в функционирование лимфоцитов. Это легко демонстрируется с помощью моноклональных антител, главным образом тех, действие которых направлено против комплекса CD3-TCR. Как результат деструкции или инактивации Т-клеток происходит довольно специфическое нарушение гиперчувствительности замедленного типа и клеточного иммунитета, в то время как образование гуморальных антител остается относительно незатронутым. Более того, поликлональные и моноклональные антитела являются самым избирательным средством воздействия на иммунную систему и поэтому играют важную роль в проведении трансплантации органов. Применение моноклональных антител, направленных против специфических популяций иммунных клеток, существенно повышает селективность терапии после пересадки органа и открывает возможности применения этого метода в лечении аутоиммунных расстройств.
АЛГ и моноклональные антитела можно использовать при трансплантациях для индукции иммуносупрессии, лечения первичных отторжений или отторжений, устойчивых к терапии стероидами. Поскольку такие антитела не были адекватно стандартизированы, можно дать только общие рекомендации по схеме дозировки и лечения. После трансплантации почки АЛГ обычно вводят (внутримышечно) сначала ежедневно, затем реже. АЛГ обычно назначают вместе с азатиоприном и преднизоном, поэтому “вычислить” только его действие на трансплантаты почки человека невозможно. Из-за нефротоксичности циклоспорина в схеме лечения больных после пересадки почки часто используют АЛГ и моноклональные антитела с тем, чтобы избежать применения циклоспорина в начальный период. Исследователи, которые лечили реципиентов с пересаженной почкой с помощью АЛГ, считают, что он снижает потребность в других иммуносупрессивных средствах и улучшает выживаемость у пациентов, получивших почки от неродственных доноров или умерших людей. Описаны успешные случаи применения АЛГ для подготовки больных к пересадке костного мозга. С этой целью препарат назначали в больших дозах в течение 7-10 дней перед трансплантацией клеток костного мозга донора. Остаточный АЛГ, видимо, разрушает Т-клет-
ки в донорском костномозговом трансплантате, уменьшая вероятность возникновения тяжелого синдрома “трансплантат против хозяина”.
К побочным эффектам АЛГ относятся прежде всего типичные проявления, наблюдаемые после инъекции чужеродного белка, полученного из гетерологичной сыворотки. В месте инъекции часто ощущается боль и развивается эритема. Поскольку сохраняются гуморальные механизмы антителооб-разования в ответ на введение чужеродных IgG, могут вырабатываться реагиновые и преципитиру-ющие антитела. Сходные реакции провоцируют моноклональные антитела мышиного происхождения, но они вызываются высвобождением цитокинов Т-клетками и моноцитами, как это было описано. Другим осложнением применения моноклональных антител является синтез у больного анти-мышиных антител, инактивирующих препарат и препятствующих их продолжительному использованию. По этой причине очень перспективно применение гибрида “от человека к человеку” для исключения большинства реакций на гетерогенные белки. Развитие молекулярной биологии позволило внедрить еще один метод — “гуманизацию” мышиных антител, который позволяет антигенсвязан-ные мышиные моноклональные антитела помещать в каркас из иммуноглобулинов человека. Эти химерные (гибридные) антитела менее иммуногенны, чем мышиные моноклональные.
При введении АЛГ или моноклональных антител наблюдались анафилактические реакции и сывороточная болезнь, что обычно требовало прекращения терапии. Кроме того, комплексы антител хозяина с АЛГ лошади могут преципитировать и оседать в клубочках пересаженной почки. Но более опасно образование гистиоцитарной лимфомы ягодиц в месте инъекции АЛГ. У пациентов с трансплантацией почки частота этого осложнения, а также других видов рака повышена и может составлять 2 % у больных с длительным периодом выживания после операции. Вероятно, отчасти это обусловлено подавлением защитных реакций организма против онкогенных вирусов и трансформированных клеток. Полагают, что преобладание лимфом в этих случаях объясняется сочетанием длительной иммунной супрессии с хронически низким уровнем пролиферации лимфоцитов.
Весьма перспективна стандартизация антилим-фоцитарных антител с антитимоцитарным глобулином моноклонального происхождения, потому
что некоторые из этих антисывороточных средств селективны в отношении субпопуляций Т-лимфоцитов и могут направленно использоваться в неограниченных количествах. В настоящее время применяются или находятся в стадии изучения моноклональные антитела мышей и крыс, направленные против комплекса CD3-TCR Т-клеток, рецепторов ИЛ-2 (экспрессируемых только активированными Т-клетками), молекул CD4 и лимфокинов.
Клинические исследования показали, что мышиные моноклональные антитела (муромонаб-CD3; ОКТЗ), направленные против молекул CD3 на поверхности тимоцитов человека и зрелых Т-клеток, также можно использовать для предотвращения отторжения трансплантата почки. In vitro ОКТЗ блокирует как киллерные функции цитотоксических Т-клеток, так и проявление других функций Т-лимфоцитов человека. Во многих центрах по пересадке трупных трансплантатов почки подтвердилась большая эффективность ОКТЗ (в комбинации с низкими дозами стероидов или другими иммунодепрессивными средствами) при лечении острых отторжений по сравнению с традиционной терапией стероидами. При этом регистрировались лучшие показатели выживаемости в течение 1 года: ОКТЗ — 62 %, стероидная терапия — 45 %, что позволяет рекомендовать назначение ОКТЗ (муромо-наб-СОЗ) при кризисах отторжения аллотрансплантатов почки.
Сейчас проходят клинические испытания ри-цинконъюгированные мышиные моноклональные антитела (ксомен Н-65), существенно подавляющие реакцию “трансплантат против хозяина” после аллогенной трансплантации костного мозга.
ВЬ0(О)-иммуноглобулин
Одним из главных достижений иммунофармакологии является разработка метода предупреждения Rh-гемолитической болезни новорожденных. Он основывается на феномене блокирования первичной иммунной реакции на чужеродный антиген, если специфические к нему антитела пассивно ввести в момент контакта с антигеном. Rh0(D)-HMMy-ноглобулин представляет собой концентрированный (15 %) раствор IgG человека, содержащий высокий титр антител против Rh0(D)-aHTHreHa эритроцитов.
Сенсибилизация Rh-отрицательных матерей к D-антигену обычно происходит при рождении
Кйо(В)-положительного или Би-положительного младенца, когда эритроциты плода могут проникнуть в кровяное русло матери. Это может наблюдаться при выкидыше или внематочной беременности. При последующих беременностях материнские антитела против Ph-положительных клеток передаются плоду во время третьего триместра, приводя к развитию эритробластоза плода или гемолитической болезни новорожденного.
Если матери сделать инъекцию ВЬ0(В)-антител в пределах 72 часов после рождения Rh-положи-тельного младенца, у нее подавляется выработка антител на чужеродные ВЬ0(В)-положительные клетки. Это предотвращает Rh-гемолитическую болезнь новорожденных при последующих беременностях. Для успешной профилактики мать должна быть Rho(D)-oтpицaтeльнoй и Ви-отрицатель-ной и не иммунизированной ранее к РЬ0(Б)-фак-тору. Лечение часто рекомендуют Rh-отрицатель-ным женщинам, у которых были выкидыши, внематочные беременности или аборты с неустановленным типом крови плода.
Примечание: Rh0(D)-HMMyHorno6ynHH вводят матери, но его нельзя вводить младенцу.
Обычная доза препарата составляет 2 мл внутримышечно. Побочные эффекты случаются редко и ограничиваются дискомфортом в месте введения. Иногда отмечают незначительное повышение температуры.
Подавление иммунного ответа при пассивном введении специфических антител может заключаться в быстром уничтожении чужеродного антигена после связывания с антителом или осуществляться посредством иммуносупрессии по типу обратной связи, при которой структура антигена после образования его комплекса с антителом изменяется настолько, что он больше не распознается как чужеродный. Если антитела вызывают иммуносупрессию по типу обратной связи, они, возможно, действуют на макрофаги, Т- или В-лимфо-циты (рис. 57-1—57-3).
Клиническое применение иммуносупрессивных средств
В настоящее время иммуносупрессивные средства применяют в трех клинических ситуациях: 1) трансплантация органов; 2) аутоиммунные расстройства; 3) изоиммунные расстройства (Rh-гемо
литическая болезнь новорожденных). Спектр используемых препаратов и схемы дозирования зависят от специфики расстройства (табл. 57-2). Во многих случаях их еще предстоит оптимизировать.
Трансплантация органов
При трансплантации органов для обеспечения гистосовместимости большое значение имеет типи-рование тканей, базирующееся на определении гаплотипов донора и реципиента, HLA, и оценка результатов смешивания in vitro их лимфоцитарных культур (MCL). Хорошая гистосовместимость уменьшает вероятность отторжения трансплантата и потребность в интенсивной иммуносупрессивной терапии. В случае пересадки почки реакция на трансплантацию и иммуносупрессивные средства зависит от природы исходных почечных нарушений у пациента.
Часто в основе первичного заболевания почек у реципиента лежит иммунопатология. Два главных типа гломерулярных повреждений — почечный компонент при системной красной волчанке и ост
рый гломерулонефрит — регулируются иммунными механизмами. Хотя иммуносупрессивная терапия может оказать благоприятное действие в случае этих двух заболеваний, полных данных по этому вопросу еще нет. Поскольку пациенты с тяжелыми гломерулонефритами часто являются кандидатами на пересадку почки, большое значение имеют патологические факторы, которые могут сохраняться и повредить пересаженной почке. Установлено, что у пациентов с антителами против базальных мембран может произойти острое отторжение трансплантата при пересадке почки. Эти больные, вероятно, нуждаются в иммуносупрессивной терапии в течение 6-8 недель после билатеральной нефроэк-томии во время осуществления программы диализа до тех пор, пока не будет найден донор почки. Сходным образом, пересаживать почку пациентам с системной красной волчанкой можно только после установления контроля над причиной системного повреждения почки.
При всех этих иммунологических препятствиях реакция на пересадку почек становится все более удовлетворительной, даже в случаях трансплан
ТАБЛИЦА 57-2. Клиническое применение иммуносупрессивных средств
Заболевание Используемый иммуносупрессивный препарат Реакция
Аутоиммунные Идиопатическая тромбоцитопеническая пурпура Аутоиммунная гемолитическая анемия Острый гломерулонефрит Аутоантитела к фактору XIII Различные “аутореактивные” расстройства2 Изоиммунные Гемолитическая анемия новорожденных Трансплантация органов Почек Сердца Печени Костного мозга (HLA-совместимые) Преднизон’, винкристин, иногда меркаптопурин или аза- Обычно хорошая тиоприн, высокие дозы у-глобулина Преднизон’, циклофосфамид, хлорамбуцил, меркаптолу- Обычно хорошая рин,азатиоприн Преднизон’, меркаптопурин, циклофосфамид Обычно хорошая Циклофосфамид + фактор XIII Обычно хорошая Преднизон, циклофосфамид, азатиоприн, циклоспорин Часто хорошая ИГ1о(0)-иммуноглобулин’ Отличная Циклоспорин, азатиоприн, преднизон, АЛГ, ОКТЗ Очень хорошая Моноклональные антитела, дактиномицин, циклофосфамид Хорошая Циклоспорин, преднизон Удовлетворительная Циклоспорин, циклофосфамид, преднизон, метотрексат, Очень хорошая АЛГ, общее облучение, костный мозг донора, “очищенный” моноклональными анти-Т-клеточными антителами, иммунотоксины
' Препарат выбора.
2 Системная красная волчанка, ревматоидные артриты, гранулематоз Вегенера, хронически активный гепатит, липоидные нефрозы, воспалительное заболевание кишечника.
тации с неподобранными по совместимости трупными почками. Наиболее успешно трансплантация проходит у пациентов, подвергшихся до операции переливанию крови. Применение циклоспорина при ведении пациентов с трансплантацией улучшило приживаемость трансплантатов и, что более важно, уменьшило уровень заболеваемости и увеличило общую продолжительность жизни пациентов. В настоящее время более 80 % пациентов с тщательно подобранными, но не родственными пересаженными почками живут после трансплантации до двух лет и удлинение продолжительности жизни до пяти лет не является такой уж безнадежной мечтой. Как уже обсуждалось, введение моноклональных анти-Т-клеточных антител (муромонаба-СВЗ) значительно уменьшает вероятность острого отторжения трансплантатов.
Все большие успехи достигаются при пересадке костного мозга пациентам с апластической анемией, устойчивым острым лейкозом или тяжелым врожденным комбинированным иммунодефицитным заболеванием, которым подобрали подходящих по HLA и MLC доноров. Больным с апластической анемией или лейкозом перед трансплантацией необходима интенсивная иммуносупрессия. С целью создания аутогенного запаса костного мозга для реинфузии после высокодозной химиотерапии применяют “очистку” костного мозга пациента моноклональными антителами к маркерным антигенам лейкоза, лимфомы и нейробластомы. В этом отношении, видимо, особенно многообещающим является использование конъюгатов моноклональных антител с иммунотоксинами, что может в значительной мере расширить распространение аутогенной трансплантации костного мозга. Пациентам, которым пересадили не аутогенный костный мозг или не трансплантат от идентичного близнеца, необходима посттрансплантационная иммуносупрессивная терапия для того, чтобы ослабить синдром “трансплантат против хозяина”, который приписывают действию иммуноцитов донора костномозгового трансплантата. Последние исследования указывают на то, что введение анти-Т-клеточной иммунной сыворотки или циклоспорина в значительной части случаев может модифицировать или обратить развившийся синдром “трансплантат против хозяина”.
Циклоспорин подтвердил свою эффективность как иммуносупрессивное средство для применения при трансплантациях почки, сердца, печени и кост
ного мозга. Вместе с более новыми лекарствами его до сих пор оценивают в качестве альтернативного средства по отношению к другим более сложным иммуносупрессивным схемам лечения.
Аутоиммунные расстройства
Эффективность иммуносупрессантов при аутоиммунных расстройствах широко варьирует. Тем не менее такой способ лечения обеспечивает ремиссию во многих случаях аутоиммунной гемолитической анемии, идиопатической тромбоцитопенической пурпуры, сахарного диабета I типа, тиреоидитов Хашимото и височных артериитов. Очевидное улучшение часто наблюдается и у пациентов с системной красной волчанкой, острыми гломерулонефритами, приобретенными ингибиторами (антителами) фактора XIII и при других аутоиммунных состояниях. Некоторые случаи идиопатической апластической анемии также, по-видимому, являются аутоиммунными заболеваниями. Если в их основе лежит повышение активности Т-супрессоров CD8+, гуморальным медиатором подавления гематопоэза может быть у-интерферон, продуцируемый этими клетками. Недавно у ряда пациентов с апластической анемией наблюдалось значительное клиническое улучшение и удлинение продолжительности жизни после монотерапии АТГ. Несколько ранее было установлено, что лечение пациентов после трансплантации костного мозга циклофосфамидом, циклоспорином или АЛГ увеличивает на длительное время число форменных элементов крови даже при очевидном отторжении трансплантата и восстанавливает функции костного мозга реципиента, снова поддерживающего аутоиммунную основу апластической анемии. Установлено, что применение больших доз нормального у-иммуноглобулина (при внутривенном введении) оказывает благоприятное действие при устойчивой идиопатической тромбоцитопенической пурпуре. Более того, оказалось, что внутривенное введение больших доз иммуноглобулина (2 г/кг) безопасно и эффективно при синдроме Кавасаки, так как уменьшает системное воспаление и предотвращает аневризмы коронарных артерий. Возможный механизм действия иммуноглобулина при внутривенном введении включает уменьшение числа Т-хелперов, увеличение числа Т-супрессоров, ограничение спонтанной продукции иммуноглобулина и идио
типические-антиидиотипические взаимодействия с “патологическими антителами”.
Другим новым методом контроля этих состояний является иммуноабсорбция плазмы с использованием белка А. Этим методом предположительно удаляются иммунореактивные антитела, особенно в форме иммунных комплексов. В настоящее время он одобрен FDA для лечения идиопатической тромбоцитарной пурпуры у больных СПИДом.
Часто можно только предполагать, что именно иммуносупрессивные свойства таких препаратов, как преднизон, циклоспорин, циклофосфамид, меркаптопурин или АЛГ, вызывают эти улучшения. Для обеспечения эффективности действия некоторых из этих лекарств может также иметь значение их противовоспалительное действие.
Иммуномодулирующие средства
Новая область фармакологии, находящаяся пока в стадии изучения и обсуждения,— это разработка средств, которые модулируют, а не подавляют иммунные реакции. Целью всех научных исследований, ведущихся в этой области, является создание препаратов, усиливающих иммунный ответ у пациентов с избирательным или генерализованным иммунодефицитом. Основные показания к применению таких средств — это лечение иммунодефицитных расстройств, хронических инфекционных заболеваний и рака. В настоящее время все иммуностимулирующие (или иммуномодулирующие) препараты, кроме БЦЖ и левамизола, можно рассматривать как находящиеся в стадии изучения. Эпидемия СПИДа в значительной степени увеличила интерес к развитию более эффективных иммуномодулирующих средств. Возбудитель ВИЧ находится в клетках-хелперах CD4+ и разрушает их, приводя к прогрессирующему иммунологическому параличу.
Тимозин и другие пептиды тимуса
Тимозин состоит из группы пептидных гормонов, синтезируемых эпителиоидным компонентом тимуса. Они были выделены и очищены из вилочковой железы человека и быка. Тимозин с мол. м. приблизительно 10 ООО, по-видимому, передает специфичность Т-клеток недифференцированным
лимфоидным стволовым клеткам. Низкомолекулярные фракции также могут обладать активностью, подобной гормонам тимуса. Концентрация тимозина в сыворотке, высокая в детстве и в подростковом возрасте, начинает падать к 30-40 годам и снижена у пожилых людей. Она снижена также при синдроме ДиГеорге с дефицитом Т-клеток. Обработка лимфоцитов тимозином in vitro увеличивает число клеток, что обнаруживается по маркерам поверхности Т-клеток и их функции. С механистической точки зрения, тимозин стимулирует созревание пре-Т-лимфоцитов. Эффективность эмбриональных трансплантатов тимуса в случае синдрома ДиГеорге, вероятно, обеспечивается действием тимозина. Поэтому перспективно применение очищенного гормона для лечения этого заболевания и других состояний с дефицитом Т-клеток. Рекомбинантный пептид тимозин ос-1 вызывает увеличение продукции ИЛ-2 и увеличивает экспрессию рецепторов ИЛ-2 на Т-лимфоцитах. Он проходит клинические испытания при лечении рака и хронического активного гепатита. Предварительные результаты обнадеживают.
Два других связанных с тимусом пептида, тимо-пентин и гуморальный фактор тимуса, также стимулируют Т-клетки и изучаются как средства для терапии СПИДа, а также рака и гепатита.
Цитокины
Цитокины представляют собой большую гетерогенную группу белков с различными функциями. Синтезируемые лимфоретикулярными клетками, они участвуют во многих видах взаимодействий, обеспечивающих функционирование иммунной системы и контроль гемопоэза. Цитокины, которые были идентифицированы, представлены в табл. 57-1. В большинстве случаев они осуществляют свой эффект через рецепторы на поверхности соответствующих клеток-мишеней и, видимо, действуют подобно гормонам. В других случаях цитокины проявляют антипролиферативные или антимикробные эффекты.
Первая открытая группа цитокинов была представлена интерферонами (обсуждаются в главе 49), за которыми последовало открытие колониестимулирующих факторов (CSF, глава 32). Последние регулируют пролиферацию и дифференциацию клеток-предшественников в костном мозге. Большая часть недавно открытых цитокинов была классифи-
цирована как интерлейкины и пронумерована в порядке их обнаружения. Развитие методов клонирования генов в значительной мере облегчило идентификацию большинства интерлейкинов и продукцию высокоочищенных цитокинов всех типов.
Благодаря этим достижениям цитокины играют все более важную роль в иммунофармакологии и, возможно, найдут разнообразное применение в лечении инфекций и воспалительных, аутоиммунных и неопластических расстройств. В настоящее время для клинического применения при разнообразных новообразованиях, включая волосато-клеточный лейкоз и саркому Капоши, FDA одобрен ИФН-а. Он активен также в качестве противоопухолевого средства при злокачественной меланоме, раке почек, карциноидном синдроме и Т-клеточном лейкозе. Интерферон Р~ 1Ь одобрен FDA для лечения рецидивирующего типа множественного склероза. Считают, что этот цитокин уменьшает число умеренных и тяжелых обострений заболевания в течение 2-летнего периода, хотя он не снижает общий уровень нетрудоспособности пациентов. ИФН-у разрешен для лечения хронических гранулематозных заболеваний, а ИЛ-2 — для лечения метастатического рака почки. ИФН-а применяется и при гепатитах. В настоящее время развивается большое количество клинических исследований других цитокинов, включая ИЛ-1, ИЛ-3, ИЛ-4, ИЛ-6. Широкое использование фактора некроза опухоли (TNF) в терапии различных злокачественных новообразований дала разочаровывающие результаты. Даже в высокотоксичных дозах TNF почти не давал положительных результатов, за исключением случаев внутриартериального применения высоких доз TNF для лечения злокачественной меланомы конечностей.
Недавно цитокины проходили клинические исследования в качестве вспомогательных средств при вакцинациях. Выявлены некоторые положительные эффекты интерферона и ИЛ-2 при вакцинации против гепатита В. Однако рекомбинантные цитокины пока слишком дорогостоящие препараты для того, чтобы широко применять их в качестве вспомогательных средств при вакцинации. .
Одна из самых многообещающих новых областей исследования заключается в попытках обратить лейкопению и неадекватный резерв гранулоцитов, возникшие в результате болезни или терапии рака с помощью колониестимулирующего фактора гранулоцитов-макрофагов (GM-CSF) и колониестимули
рующего фактора гранулоцитов (G-CSF). GM-CSF (сарграмостим) и G-CSF (филграстим) одобрены для клинического применения при нейтропении, обусловленной последствиями применения химиотерапии. Лечение начинают через день после окончания химиотерапии с ежедневными инъекциями цитокина, что значительно укорачивает продолжительность и уменьшает тяжесть нейтропении. Подтверждена эффективность CSF в поддерживающей терапии больных с ожогами и пациентов с различными инфекционными заболеваниями. Их, видимо, целесообразно вводить вместе с антибиотиками пациентам со слабой лейкоцитарной реакцией на инфекцию. Важно подчеркнуть, что в случае нормальной иммунофизиологии эффект экзогенных цитокинов в отношении клеток-мишеней часто опосредуется каскадом различных цитокинов, осуществляющих свое действие последовательно или одновременно. Например, первоначальный контакт с ИФН-уувеличивает число рецепторов для TNF на поверхности клеток-мишеней.
Самый новый метод иммуномодуляции включает применение ингибиторов цитокинов для лечения воспалений и септического шока, т. е. заболеваний, где цитокины (ИЛ-1 и TNF) вовлечены в патогенетические механизмы. Сейчас изучаются антицито-киновые моноклональные антитела, находящиеся в цитозоле цитокиновые рецепторы (связывающие ИЛ-1 и TNF, характерные для человека) и ИЛ-1 Ra — антагонист рецептора ИЛ-1 (также естественно встречающиеся молекулы, которые связываются с рецепторами ИЛ-1, но не вызывают биологического ответа). На различных моделях показано, что эти вещества эффективны в лечении ряда заболеваний, включая септический шок, экспериментальные артриты, колиты, опосредованные образованием иммунных комплексов, и диабет. В I фазе клинических испытаний установлена безопасность применения анти-TNF и ИЛ-lRa моноклональных антител на добровольцах. Предварительные данные III фазы исследований моноклональных анти-TNF-антител подтверждают, что они могут быть эффективны в лечении септического шока при наличии бактериемии. Результаты III фазы испытаний ИЛ-lRa, проведенных на 893 пациентах, указывают на то, что среди пациентов группы высокого риска (595 пациентов с риском смерти > 24 %) лечение с применением ИЛ-lRa достоверно улучшило выживаемость (р < 0.03). В других клинических испытаниях ИЛ-lRa изучали их действие при язвен
ных колитах, ревматоидных артритах и миелогенном лейкозе.
Синтетические средства
Иммуномодулирующие свойства были выявлены у нескольких синтетических химических средств. Оказалось, что левамизол, используемый в первую очередь для лечения паразитарных инфекций, активизирует у человека гиперчувствительность замедленного типа, раулируемую Т-клетками. Установлено, что левамизол увеличивает число Т-лимфоцитов in vitro и усиливает реактивность кожных тестов in vivo при иммунодефиците, связанном с болезнью Ходжкина. Широко изучалась возможность применения левамизола при ревматоидных артритах. Однако вызываемый им тяжелый агранулоцитоз (главным образом у НБА-В27-позитивных пациентов) не сопоставим с пользой от приема препарата, что послужило причиной исключения ревматоидного артрита из показаний к применению левамизола. Препарат потенцирует действие фторурацила при вспомогательной терапии колоректального рака, и потому комбинация левамизола и фторурацила одобрена FDA для клинического использования по этому показанию после операции. Применение левамизола в данном случае заметно уменьшает вероятность рецидива. Механизм его действия скорее всего связан с активацией макрофагов и уничтожением с их помощью остаточных опухолевых клеток.
Препарат инозиплекс (изопринозин) также обладает иммуномодулирующей активностью. В различных доклинических и клинических исследованиях выявлено, что он увеличивает цитотоксичность естественных клеток-киллеров, а также функциональную активность Т-клеток и моноцитов. При использовании препарата у больных СПИДом отмечены некоторые благоприятные изменения иммунного статуса. Сейчас изучаются другие синтетические препараты, в том числе цианоазиридиновые соединения (азимексон, циамексон и имексон) и метилинозинмонофосфат, с целью возможного включения в терапию СПИДа и неоплазий.
БЦЖ (бацилла Кальметта-Герена) и другие вспомогательные средства
БЦЖ является жизнеспособным штаммом Mycobacterium bovis, который применяют для иммунизации против туберкулеза. Его также исполь
зуют как неспецифическое вспомогательное средство или иммуностимулятор в противораковой терапии, но это дает результаты только в случае внутрипузырной терапии поверхностного рака мочевого пузыря. Считается, что БЦЖ прежде всего активирует макрофаги, делая их более эффективными киллерами вместе с лимфоидными клетками в эфферентной части иммунного ответа. Сходными неспецифическими иммуностимулирующими свойствами, возможно, обладают липидные экстракты из БЦЖ (например, метанолэкст-рагируемый осадок), а также нежизнеспособные препараты Corynebacterium parvuin. Химически идентифицированное производное клеточной стенки БЦЖ — [Бу518]мурамоилдипептид — разрешен в Японии в качестве средства для стимуляции восстановления костного мозга после химиотерапии рака. Эти препараты стимулируют высвобождение макрофагами различных цитокинов, включая ИЛ-1, колониестимулирующие факторы и TNF. Показано, что TNF высвобождается в кровь животных, получавших БЦЖ, после провокации эндотоксином. TNF рассматривают как важный медиатор гипотензивной реакции, наблюдаемой у пациентов с эндотоксическим шоком, обусловленным грамотрицательной бактериемией.
Иммунологические реакции на препараты
и лекарственная аллергия
В этой части главы обсуждаются основные иммунные механизмы и способы их подавления или стимуляции с помощью лекарственных средств. Препараты могут активировать иммунную систему в нежелательном направлении, что расценивается как побочные реакции организма на лекарственные средства. Эти реакции, как правило, классифицируются как “лекарственная аллергия”. В самом деле, многие из нежелательных эффектов на прием таких препаратов, как пенициллин, йодиды, фенитоин и сульфаниламиды,— аллергические по своей природе. Они проявляются в виде кожных высыпаний, отека, анафилактических реакций, лихорадки и эозинофилии. Механизм, лежащий в основе аллергической сенсибилизации к препаратам, прояснился после открытия иммуноглобулинов класса Е и понимания сущности процессасенсити-
зации и активации базофилов прови и тканевых тучных клеток.
Реакции на лекарственные препараты, опосредуемые иммунными процессами, могут иметь различные механизмы. Выделяют 4 основные типа гиперчувствительности, которые могут вызывать аллергию на лекарства.
1тип. IgE-опосредуемые острые аллергические реакции на укусы, пыльцу и препараты: анафилаксия, крапивница и сосудистый отек. IgE фиксирован на тканевых тучных клетках и базофилах крови.
II тип. Комплементзависимые аллергические реакции, опосредуемые IgG или IgM. Антитела фиксируются на циркулирующих кровяных клетках, подлежащих комплементзависимому лизису.
III тип. Реакции на препараты, примером которых может служить сывороточная болезнь. В ее развитии участвуют иммунные комплексы, содержащие IgG. Она является по существу мультисистем -ным комплементзависимым васкулитом.
IV тип. Опосредуемая иммунными клетками аллергия, которая служит механизмом развития аллергического контактного дерматита при местном применении препарата.
Иногда различные типы гиперчувствительности могут присутствовать одновременно. Некоторые
побочные реакции на препараты могут быть ошибочно классифицированы как аллергические или иммунные, тогда как в действительности они являются генетическими нарушениями или идиосинкразией и не регулируются иммунными механизмами (например, гемолиз при применении примахина в случае дефицита глюкозо-6-фосфатдегидроге-назы или апластическая анемия при применении хлорамфеникола).
Лекарственная аллергия немедленного типа (тип I)
Механизмы иммунной активации, которые действуют при лекарственной аллергии, сходны с нормальным гуморальным ответом человека на чужеродные макромолекулы. Эти механизмы можно рассматривать в рамках теоретической схемы, которая описывает афферентную дугу иммунного ответа (рис. 57-6) и эфферентную дугу, включающую фармакологические медиаторы аллергии (рис. 57-7). Ландштейнер и его сотрудники впервые продемонстрировали, что животных можно сенситизировать к таким простым химическим соединениям, как пикриновая кислота (гаптен), если вещество связывается с белком-переносчиком.
Свободный препарат
8 Переносчик (например, альбумин)
Комплекс препарат-переносчик
Предшественник атопических (IgE) антителообразующих клеток ।
Макрофаг
Т-хелпер (СД4+)
Фиксация 1дЕ-антител
на тучных клетках и базофилах крови
ип . Блокирующее действие активация " ни30на
Митоз
Атопические
Клетки, продуцирующие |дЕ-антитела 1дЕ-антитела
Рис. 57-6. Индукция IgE-зависимой аллергической чувствительности к препаратам и другим аллергенам
Связывание аллергене со специфическим lgE-антителом на поверхности тучной клетки вызыввет высвобождение медиаторов
Дегрануляция и высвобождение медиаторов
Гистамин, кинины, лейкотриены (SRS), простагландины, серотонин,тромбоцит-акгивирующий фактор • • *
Частично блокирующее действие антигистаминных средств
Гладкая мышца и другие органы-мишени
Чвстично блокирующее действие изопротеренола, теофиллине, адреналина и кромолина
Рис. 57-7. Реакция IgE-чувствительной клетки на последующий контакт с аллергеном
В таком связывании могут принимать участие белки-переносчики нормальных тканей или крови. Последующий иммунный ответ будет специфическим для гаптена, хотя для иммунного узнавания и необходима связь с белком. Удивительно, что узнавание белка-переносчика генетически детерминировано, даже если организм продуцирует антитело против него. Когда гаптеном является лекарственный препарат, на него часто реагируют антителообразующие клетки, относящиеся к предшественникам клеток-продуцентов антител класса IgE. IgE-специфический иммунный ответ очень зависим от Т-хелперов, которые секретируют ИЛ-4 и ускоряют дифференциацию В-клеток в IgE-образующие клетки. Т-супрессоры секретируют ИФН-у, который может блокировать этот процесс и подавлять иммунный ответ. В норме уровень IgE является самым низким из всех иммуноглобулинов (< 1 мкг/мл), но в случае аллергии он может возрасти в 10 раз и более. Антитела IgE обладают интересным свойством фиксироваться на базофилах крови и тучных клетках тканей и являются кожносенситизирующими (или атопическими) антителами.
Фиксация IgE на высокоаффинных Fc-рецепто-рах (Fc£R) базофилов крови или их тканевом эквиваленте (тучных клетках) определяет стадию ост
рой аллергической реакции. Среди мест распределения тучных клеток и IgE-сенсибилизации наиболее важными являются кожа, легкие и желудочно-кишечный тракт. Когда провоцирующий препарат снова вводится в организм, комплексы IgE-FceR на поверхности сенситизированных базофильных лейкоцитов и тучных клеток связываются с антигенной формой препарата (рис. 57-7). В результате, когда молекулы IgE на двух соседних FceR образуют мост при связывании специфического антигена, происходит стимуляция и высвобождение медиаторов (например, гистамина, лейкотриенов; см. главы 16 и 18) из гранул. Высвобождение медиаторов опосредуется падением содержания цАМФ в тучной клетке. Считают, что многие препараты, которые блокируют дегрануляцию тучных клеток (например, катехоламины, кортикостероиды, теофиллин), воздействуют на различные этапы синтеза или распада цАМФ. Высвобождение гистамина может сопровождаться выявлением других вазоактивных вешеств, в частности цитокинов. Эти медиаторы вызывают немедленные реакции со стороны кожи и гладких мышц, что приводит к повреждению ткани и развитию воспаления. В случае возникновения ларингоспазма, бронхоспазма или гипотензии пациентам может грозить смертельная опасность.
Фармакотерапия немедленной аллергии
Возможную индивидуальную чувствительность к лекарственным средствам можно проверить при помощи простой скарификационной пробы, то есть нанести очень разбавленный раствор препарата на кожу и сделать царапину кончиком иглы. Если имеется аллергия, часто немедленно образуется волдырь и воспалительная гиперемия. Однако во многих случаях кожный тест может быть отрицательным, несмотря на высокую гиперчувствительность к гаптену или продуктам метаболизма препарата. Отрицательный результат будет получен и в случаях, когда антитела относятся к другому классу (не IgE).
Препараты, модифицирующие аллергические реакции, действуют на различные звенья цепи событий. Преднизон, который часто применяется при тяжелых аллергических реакциях, является иммунодепрессантом и, возможно, подавляет пролиферацию клонов, продуцирующих IgE, и ингибирует продукцию ИЛ-4 Т-хелперами во время иммунного ответа. В эфферентной дуге аллергической реакции изопротеренол, адреналин и теофиллин уменьшают высвобождение медиаторов из тучных клеток и базофилов и вызывают бронходилатацию, в то время как антигистаминные препараты полностью ингибируют гистамин, который в противном случае мог бы вызвать бронхоспазм и увеличить проницаемость капилляров в органах-мишенях. Кортикостероиды могут также уменьшать повреждения и отек в воспаленной ткани, “разблокируя” P-заблокированные клетки и облегчая действие катехоламинов в клетках, которые могли стать рефрактерными к адреналину и изопротеренолу. Некоторые препараты, эффекты которых направлены на подавление синтеза лейкотриенов, сейчас проходят клинические испытания на предмет эффективности в лечении острой аллергии и воспалительных заболеваний. Считают, что применяемый в терапии аллергической астмы кромолин-натрий подавляет высвобождение медиаторов анафилаксии после взаимодействия антигена и антитела (глава 19, том 1). Однако механизм его действия все еще не понятен до конца. Антигистаминный препарат кетотифен, используемый для профилактики различных аллергических заболеваний, по-видимому, обладает и другими механизмами, не зависимыми от его антигистаминных свойств, связанными с влиянием на эозинофилы.
Десенсибилизация при гиперчувствительности к лекарственным средствам
В случае угрожающего жизни заболевания при отсутствии альтернативных средств должны применяться определенные препараты (например, пенициллин), даже при наличии известной аллергической чувствительности. В таких случаях иногда можно добиться десенсибилизации, начиная лечение с небольших доз препарата и градуально увеличивая их в течение часов или дней до достижения полного терапевтического уровня. Это рискованное лечение, и нужно быть всегда готовым к купированию острого анафилактического шока. Этот вид десенсибилизации отличается от иммуносупрессии тем, что иммунный механизм часто бывает стимулирован и его реактивность только предположительно уменьшается, в то время как лечение продолжается. С внедрением цефалоспоринов и других антибиотиков необходимость проведения такой десенсибилизации к пенициллину существенно уменьшилась.
Механизм десенсибилизации при гиперчувствительности к лекарственным средствам сложен и не совсем понятен. Она может происходить благодаря постепенному истощению тучных клеток и базофилов или вследствие избытка антигенов, которые при определенных обстоятельствах блокируют высвобождение медиатора. В некоторых случаях аллергическая десенсибилизация достигается с помощью стимуляции конкурирующих клонов клеток, которые продуцируют “блокирующие” антитела, часто относящиеся к классам IgG или IgA. Кроме того, может происходить активация синтеза специфических Т-супрессоров.
Аутоиммунные реакции (тип II) на лекарственные препараты
Лекарственные препараты могут вызвать определенные аутоиммунные синдромы. Примерами этого феномена являются развитие системной красной волчанки после введения гидралазина или терапии прокаинамидом; “волчаночного гепатита” вследствие чувствительности к слабительным средствам; аутоиммунной гемолитической анемии в результате введения метилдопы; тромбоцитопенической пурпуры как побочного эффекта терапии хини
дином и агранулоцитозовпод действием различных препаратов. При этих аутоиммунных состояниях, вызванных лекарствами, выявляются антитела к тканевым компонентам или препаратам. Считается, что во многих случаях иммунные механизмы вовлечены в патогенез так называемой идиопатической тромбоцитопенической пурпуры, хотя выявить специфические антитела очень сложно. Иногда случайными участниками иммунологической реакции на препараты становятся тромбоциты или гранулоциты, что приводит к их гибели или активации с помощью комплекса антиген-антитело или к их разрушению ретикулоэндотелиальной системой, провоцируя развитие “идиопатической” тромбоцитопенической пурпуры или агранулоцитоза.
К счастью, аутоиммунные реакции на лекарства обычно затихают в пределах нескольких месяцев после отмены вызвавшего их препарата. Иммуносупрессивная терапия применяется только в случае очень тяжелой аутоиммунной реакции.
Сывороточная болезнь и васкулиты (тип III)
Сывороточная болезнь является более вероятной реакцией на введение препарата, чем немедленный анафилактический ответ. Клинические проявления сывороточной болезни включают кожные высыпания по типу крапивницы, артралгии или артриты, лимфоаденопатию и лихорадку. Их продолжительность обычно составляет 6-12 дней и, как правило, после прекращения приема препарата они сразу исчезают. Хотя IgE могут играть некоторую роль в развитии заболевания, но в основном в реакцию вовлечены комплементсвязываюЩие антитела классов IgM или IgG. Для лечения тяжелых реакций на препараты в виде сывороточной болезни применяют кортикостероиды.
Лекарственные средства также могут вызвать иммунные васкулиты. Сульфаниламиды, пенициллин, тиоурацил, противосудорожные средства и йодиды провоцируют гиперчувствительные ангииты. При гиперчувствительности к препаратам вторично может возникать полиморфная эритема, представляющая собой умеренный кожный васкулит. Синдром Стивенса-Джонсона (полиморфная эритема, артрит, нефрит, нарушения центральной нервной системы и миокардит), вероятно, относится к наиболее тяжелым формам этого типа гипер
чувствительности. Появление синдрома часто связано с терапией сульфаниламидами.
Клиническое определение иммунологических реакций на лекарственные средства
Ввиду многочисленности лекарств, вводимых госпитализированным больным, не всегда легко определить, какое из них вызывает аллергический или иммунный синдром лекарственной чувствительности. При записи истории болезни необходим тщательный опрос каждого пациента о возможной чувствительности к лекарствам в анамнезе, так как ошибки и упущения могут быть опасны. Почти во всех случаях, когда быстро определяется “виновный” препарат, его прием прекращают. Если требуется применение альтернативного средства (например, антибиотика), во избежание реакций перекрестной чувствительности выбирают лекарство из другого класса препаратов. Так как некоторые широкораспространенные лекарства типа пенициллина являются наиболее обычными аллергенами, при сборе анамнеза следует всегда задавать вопрос о чувствительности к пенициллину. В сомнительных случаях для подтверждения лекарственной аллергии может быть очень полезен кожный тест. Он значительно менее опасен, чем терапевтическое испытание, и обычно показан, когда имеется неясный аллергический анамнез и веские клинические показания для лечения данным препаратом. Альтернативой широко применяющемуся кожному тесту является один из видов радиоиммунного исследования — радиоаллергосорбентный тест.
Предупреждения об известной гиперчувствительности пациента должны быть четко отражены в записях истории болезни пациента или в клинической карте. При подозрении на непереносимость препарата должна быть проведена оценка анафилактического потенциала пациента, поскольку поздние высыпания несут иной прогноз, чем крапивница или сосудистый отек. При однажды выявленной лекарственной аллергии соответствующая информация должна быть передана пациенту в ясной форме для предотвращения повторных осложнений в будущем, когда реакции на этот препарат могут быть более серьезными. В случае установленной тяжелой формы лекарственной чувствительности к распространенным препаратам пациенту не
обходимо посоветовать иметь при себе сообщающую об этом справку, для того чтобы уменьшить шанс применения этого препарата в неотложных ситуациях, например после несчастного случая.
Препараты*
Азатиоприн (Имуран)
Перорально: таблетки по 50 мг Парентерально: 100 мг/мл для инъекций (флаконы по 20 мл)
Циклофосфамид (Цитоксан, Неосар) Перорально: таблетки по 25,50 мг Парентерально: порошок для растворения (флаконы по 100, 200, 500 мг и 1,2 г) для инъекций
Циклоспорин (Сандиммун) Перорально: капсулы по 25,50 мг; раствор 100 мг/мл
Парентерально: 50 мг/мл для в/в введения
Интерферон £-1Ь (Бетасерон)
Парентерально: флаконы по 0.3 мг для п/к инъекций
Лимфоцитарный иммуноглобулин (Атгам) Парентерально: 50 мг/мл для инъекций (в ампулах по 5 мл)
Муромонаб-СИЗ [ОКТЗ] (Ортоклон ОКТЗ) Парентерально: ампулы по 5 мг/ 5 мл для инъекций
КЬ0(П)-иммуноглобулин микродоза (HypRho-DMini-Dose, MIC Rh0GAM, Мини Гамулин Rh) Парентерально: флаконы с разовой дозой и микродозой
Такролим [FK 506] (Програф)
Перорально: капсулы по 1.5 мг Парентерально: 5 мг/мл для инъекций
Избранная литература
Banchereau J., Rousset F. Human В lymphocytes: Phenotype, proliferation and differentiation. Adv. Immunol. 1992; 52:125.
Blaese R. M. Development of gene therapy for immunodeficiency: Adenosine deaminase deficiency. Pediatr. Res. 1993; 33 (Suppl.): S49.
Ferrara J. L. M., Deeg H. J. Graft-versus-host disease. N. Engl. J. Med. 1991; 324:667.
Foon K. A. Biological response modifiers: The new immunotherapy. Cancer Res. 1989; 319:146.
Gresser I. (ed.). Interferon. Academic Press, 1981.
Rieder M. J. Immunopharmacology and adverse drug reactions. J. Clin. Pharmacol. 1993; 33:316.
Samuelsson B. et al. Leukotrienes and slow reacting substance of anaphylaxis (SRS-A). Allergy, 1980; 35: 375.
Schindler R. (ed.). Cyclosporin in Autoimmune Diseases. Springer Verlag, 1985.
Schreiber S. L., Crabtree G. R. The mechanism of action of cyclosporin A and FK 506. Immunol. Today, 1992; 13:136.
Sigal N. H., Dumont F. J. Cyclosporin A, FK-506, and rapamycin: Pharmacologic probes of lymphocyte signal transduction. Annu. Rev. Immunol. 1992; 10:519.
Starzl T. E., Makowka L., Todo S. (eds). FK 506: A potential breakthrough in immunosupression. Transplant. Proc. 1987; 19 (Suppl. 6): 3.
Stites D. P., Terr A. I. (eds). Basic & Clinical Immunology, 7th ed. Appleton & Lange, 1991.
Vietta E. S., Thorpe P. E., Uhr J. W. Immunotoxins: Magic bullets or misguided missiles? Immunol. Today, 1993; 14:252.
• Несколько препаратов интерлейкина и других моноклональных антител являются “препаратами-сиротами”. Лекарственные средства, обсуждаемые в этой главе и не приведенные здесь, можно найти в других главах (см. Указатель).
Раздел IX.
Токсикология________________________
Введение в токсикологию: профессиональная токсикология 58 и токсикология окружающей среды
.. ... .. ..— ........• .... - . . . -
Габриель Л. Плаа
Человечество живет в окружении химических веществ. Подсчитано, что более чем 60 000 химических соединений находится в постоянном употреблении и примерно 500 новых веществ ежегодно поступают на коммерческий рынок. Технический прогресс сопровождается загрязнением окружающей среды. Индустриализация и образование крупных урбанистических центров приводят к загрязнению воздуха, воды и почвы. Основные причины этого связаны с производством и потреблением энергии, изготовлением и использованием промышленных химикатов и с интенсификацией сельскохозяйственной деятельности.
Токсикология и ее подразделы
Токсикология изучает вредные воздействия химических и физических агентов на все живые системы. В биомедицинской области токсикология изначально занимается исследованием нежелательных эффектов лекарств или других веществ у человека, а также оценкой безопасности или риска, связанных с их применением.
Профессиональная токсикология
Профессиональная токсикология имеет дело с химическими веществами, встречающимися в промышленности. Работники могут подвергаться
действию этих средств во время синтеза, производства или упаковки этих веществ или при их использовании в процессе работы. Сельскохозяйственные рабочие могут подвергнуться вредному воздействию пестицидов во время обработки полей. Основная задача профессиональной токсикологии состоит в идентификации потенциально опасных химических соединений, определении условий для безопасного их применения и предупреждении их поступления в организм в угрожающих здоровью количествах. Разработаны инструкции, устанавливающие безопасные концентрации для многих химических веществ в окружающем рабочее место воздухе. The American Conference of Govermental Industrial Hygienists периодически подготавливает списки рекомендуемых предельно допустимых концентраций (ПДК) почти для 600 таких веществ (Lu, 1991). Три различных категории концентраций в воздухе (выраженные в частях на миллион [ч/млн] или в миллиграммах на метр кубический [ мг/м3 ]) были разработаны, чтобы охватить различные условия вредных воздействий: 1) среднесменная величина ПДК в воздухе рабочей зоны (threshold limit value-time-weighted average, TLV-TWA) — концентрация, рассчитанная для 8-часового рабочего дня или 40-часовой рабочей недели, во время которых работник может подвергаться воздействию без вредных для него последствий; 2) ПДК для коротких
интервалов времени (threshold limit value-shortterm exposure limit, TLV-STEL), то есть максимальная концентрация (значение более высокое, чем TLV-TWA), которая не должна превышаться в любое время в течение не более чем 15-минутной экспозиции; 3) максимальная ПДК (threshold limit value-ceiling, TLV-C) — концентрация, которая никогда не должна превышаться. Эти инструкции пересматриваются при поступлении новой информации о химических веществах.
Токсикология окружающей среды
Токсикология окружающей среды имеет дело с потенциально вредными влияниями химических веществ, присутствующих в качестве загрязнителей внешней среды, на биологические объекты. Термин “внешняя среда” включает все окружение индивидуального организма, но особенно воздух, почву и воду. “Загрязнители” — это вещества, которые находятся в окружающей среде, по крайней мере частично как результат деятельности человека, и которые оказывают вредное воздействие на организмы. Хотя человек считается особо важным видом-мишенью, другие наземные и водные виды животных также важны как потенциальные биологические мишени.
Загрязнение воздуха является результатом индустриализации, технологического развития и урбанизации. Люди также могут подвергаться воздействию химикатов, применяемых в сельском хозяйстве в качестве пестицидов или используемых в производстве продуктов питания, в которых они присутствуют в следовых количествах или в виде ингредиентов. The Food and Agriculture Organization и the Word Health Organization (FAO/WHO) Joint Expert Commission on Food Additives внедрили термин допустимое суточное поглощение (acceptable daily intake - ADI) для обозначения “суточного объема поглощения химического вещества, который на основании всех известных на данный момент фактов считают не представляющим ощутимого риска в течение всей жизни” (Lu, 1991). После оценки имеющихся научных данных FAO/WHO периодически публикуют значения ADI (выраженные в миллиграммах на килограмм массы тела на 1 сутки) для многих пестицидов и пищевых добавок, которые могут входить в пищевую цепь человека. Эти инструкции пересматриваются при поступлении новой информации.
Экологическая токсикология
Экотоксикология как научная дисциплина сформировалась относительно недавно и является частью токсикологии окружающей среды. Она занимается токсическими эффектами химических и физических агентов на организмы, особенно на популяции и сообщества в пределах определенной экосистемы. Экотоксикология изучаеттрансформацию химических соединений и их взаимодействия с окружающей средой. Традиционная токсикология изучает токсические эффекты на индивидуальные организмы; экотоксикология имеет дело с влияниями на популяции живых организмов или на экосистемы (Truhaut, 1977). Возможно, что внешнее событие, оказавшее тяжелое воздействие на одиночные организмы, не окажет существенного воздействия на популяции или экосистему. Таким образом, термины “токсикология окружающей среды” и “экотоксикология” не являются взаимозаменяемыми.
Токсикологические термины и определения
Токсичность, опасность и риск
Токсичность — это способность химического средства вызывать повреждение. Это качественный термин. Разовьются или нет эти повреждения зависит от количества абсорбированного химического вещества (тяжести воздействия дозы). С другой стороны, опасность — это вероятность того, что повреждение произойдет в данной ситуации или условиях-, в первую очередь рассматриваются условия применения и попадания под воздействие. Для оценки опасности необходимо знать как присущую веществу токсичность (качественный аспект), так и количество вещества, воздействию которого может подвергнуться биологический объект (количественный аспект). Люди могут безопасно использовать потенциально токсичные вещества при соблюдении условий, необходимых для минимизации непосредственного контакта с ними. Присутствие потенциально токсичных веществ на рабочем месте или в окружающей среде необязательно означает, что существует опасная ситуация.
Риск определяется как ожидаемая частота встречаемости нежелательных эффектов, возникающих после действия химического или физического агента. Оценка риска осуществляется с помо
щью данных доза-эффект и экстраполяции наблюдаемой зависимости на ожидаемые реакции от реально воздействовавших доз. Качество и стабильность биологических данных, используемых для такой оценки, являются основным лимитирующим фактором. Был разработан ряд математических моделей, и они часто применяются для расчета риска, например, канцерогенности (Ecobichon, 1992); они также могут применяться для оценки риска, связанного с другими видами токсического действия.
Пути вредного воздействия
Способ поступления химических веществ в организм различен при неодинаковых ситуациях воздействия. В промышленных условиях основной путь попадания химического вещества в организм — ингаляционный. Трансдермальный путь также является важным, а вероятность энтерального пути минимальна. Следовательно, меры предупреждения интоксикаций, в основном, направлены на уменьшение поглощения веществ при дыхании или при местном контакте. Атмосферные загрязнители попадают в организм при дыхании, в то время как воздействие соединений, находящихся в воде и почве, происходит энтеральным путем.
Продолжительность вредного воздействия
Токсические реакции могут различаться качественно в зависимости от продолжительности вредного воздействия. Разовое воздействие или многократное токсическое воздействие в течение 1 или 2 дней представляет собой острое токсическое воздействие. Многократные воздействия в течение продолжительного времени являются хроническим токсическим воздействием. В профессиональных условиях труда человек может подвергаться как острому (например, случайный выброс), так и хроническому (постоянная работа с химическими веществами) вредному воздействию, хотя с большей вероятностью люди могут подвергаться хроническим вредным воздействиям химических веществ из окружающей среды (например, загрязнения грунтовых вод). Принимаются во внимание возможные последствия контакта с малыми концентрациями химикатов в течение длительного
периода времени; этот тип хронического воздействия называется низкоуровневое продолжительное воздействие. Токсический эффект после острого воздействия может наступить сразу, а может выявляться через различные промежутки времени; последний феномен называется поздняя (отсроченная) токсичность. При хроническом воздействии токсический эффект может не проявляться в течение нескольких месяцев (и даже лет). Вредный эффект, являющийся результатом острого или хронического воздействия химического вещества, может быть обратимым и необратимым. Относительная обратимость токсического эффекта зависит в том числе и от способности пораженного органа к восстановлению.
Присутствие смесей
Обычно люди контактируют одновременно или последовательно с несколькими (или многими) химическими веществами. Это осложняет оценку потенциально опасных ситуаций, встречающихся на рабочем месте или в окружающей среде. Результирующий биологический эффект комбинированного воздействия нескольких средств может быть охарактеризован, как добавочный (аддитивный), сверхдобавочный (синергитический) или субдобавочный (антагонистический). Существует и другой тип взаимодействия — потенциация (особая форма синергизма). В случае потенциации одно из двух веществ не дает токсического эффекта само по себе (или эффект минимален), но при одновременном воздействии двух средств эффект активного вещества усиливается. Все эти типы воздействия наблюдаются и у человека. При отсутствии противоположных данных обычно считается, что токсические эффекты химических веществ в смеси являются аддитивными.
Данные о влиянии внешней среды
Известны определенные химические и физические характеристики, важные для оценки потенциальной опасности токсических веществ, присутствующих в окружающей среде. Кроме информации относительно воздействия на различные организмы, для предвидения эффекта загрязнения внешней среды необходимы первичные знания о
следующих свойствах веществ: способность к распаду; их распространяемость (распределение) в воздухе, воде и почве; происходит или нет биоаккумуляция; и их перемещение и бионакопление в процессе перемещения по пищевым цепям. Химические вещества, которые плохо распадаются (абиотическим или биометаболическим путем), сохраняются в окружающей среде и, таким образом, могут накапливаться. Липофильные вещества имеют тенденцию биоаккумулировать в жировой ткани организма. Когда токсичное вещество внедряется в пищевую цепь, может происходить его биоконцентрация, когда один биологический вид питается другим и концентрирует в себе химическое вещество. Загрязнители, которые наиболее широко распространены в окружающей среде, плохо распадаются, относительно подвижны в воздухе, воде и почве, биоаккумулируют, а также обладают способностью к биоконцентрации. Были сделаны попытки оценить у человека потенциал биоаккумуляции органических химикатов, обнаруживаемых в окружающей среде (Geyer, 1986).
В экотоксикологии имеется 3 взаимодействующих компонента: токсичное вещество, окружающая среда и организмы (сообщества, популяции и экосистемы). Экотоксикологические исследования имеют целью определение распространения и способов попадания токсичных веществ в неживую окружающую среду, включая распределение и превращения; поступления и превращения токсичных веществ в биосфере; качественных и количественных токсических последствий для экосистемы.
Специфические химические вещества
Загрязнители воздуха
Насчитывают 5 основных веществ, на которые приходится 98 % всех загрязнителей воздуха (Amdur, 1991): монооксид углерода (примерно 52 %), оксиды серы (примерно 18 %), углеводороды (примерно 12 %), твердые частицы (примерно 10 %) и оксиды азота (примерно 6 %). Источниками этих химических веществ являются: транспорт, промышленность, производство электроэнергии, отопление и свалки отходов. Значительного про
гресса достигло наше понимание химии загрязнения воздуха вследствие урбанизации (Seinfeld, 1989). “Восстановительный тип” загрязнения (сернистым диоксидом и дымом вследствие неполного сгорания угля) вызывает острые токсические эффекты, особенно у пожилых людей и у лиц, предрасположенных к сердечным и респираторным заболеваниям. Группа эффектов, отличающихся от тяжелого раздражения глаз, является менее выраженной в случае “окислительного или фотохимического типа” загрязнения (углеводороды, оксиды азота и фотохимические окислители). Загрязнение окружающего воздуха относится к факторам, вносящим свой вклад в развитие бронхитов, бронхообструктивных заболеваний, эмфиземы легких, бронхиальной астмы и рака легких (Sarnet, 1991).
1. ОКСИД УГЛЕРОДА
(МОНООКСИД УГЛЕРОДА)
Оксид углерода (СО) — это газ без цвета, вкуса и запаха, не вызывающий раздражения, являющийся продуктом неполного сгорания. Средняя концентрация СО в атмосфере составляет 0.1 ppm (ч/млн); при интенсивных транспортных потоках она может превысить 100 ч/млн. Значения предельно допустимых концентраций (TLV-TWA и TLV-STEL) представлены в табл. 58-1.
ТАБЛИЦА 58-1. Значения предельно допустимых концентраций (TLV) некоторых обычных загрязнителей воздуха и растворителей.
(Н.О. — не определено)
Вещество TLV (ppm) ч/млн
TWA1 STEL’
Бензол 10 Н.О.
Оксид углерода 25 Н.О.
Тетрахлорид углерода 5 Н.О.
Хлороформ 10 Н.О.
Диоксид азота 3 5
Озон 0.1 Н.О.
Диоксид серы 2 5
Тетрахлорэтилен 50 200
Толуол 50 Н.О.
1,1,1-Трихлорэтан 350 450
Трихлорэтилен 50 200
'Пояснения в тексте.
Механизм действия
СО обратимо соединяется с кислородсвязыва-ющими участками гемоглобина и обладает аффинитетом к гемоглобину в 220 раз большим, чем кислород. Образовавшийся продукт, карбоксигемоглобин, не может переносить кислород. Более того, присутствие карбоксигемоглобина уменьшает диссоциацию кислорода от оставшегося оксигемоглобина, что уменьшает транспорт кислорода в ткани. Сильнее всех при этом страдают головной мозг и сердце. У здоровых некурящих взрослых уровень карбоксигемоглобина в крови составляет менее 1 %; этот уровень соответствует эндогенному образованию СО при катаболизме гема. У курящих лиц содержание карбоксигемоглобина достигает 5-10 % в зависимости от характера курения. У лиц, находящихся в атмосфере, содержащей 0.1 % СО (1000 ч/млн), уровень карбоксигемоглобина может достигнуть 50 %.
Клинические проявления интоксикации
Основными признаками интоксикации СО являются гипоксия и развитие симптомов в такой последовательности: 1) психомоторные нарушения; 2) головная боль и чувство сдавления в височной области; 3) спутанность сознания и снижение остроты зрения; 4) тахикардия, тахипноэ, обморок и кома; 5) глубокая кома, судороги, шок и остановка дыхания. Индивидуальная вариабельность реакций при конкретной концентрации карбоксигемоглобина довольно высока. При уровне карбоксигемоглобина ниже 15 % редко возникают симптомы отравления; коллаптоидное состояние и обмороки могут наблюдаться при концентрации примерно 40 %; а при концентрации карбоксигемоглобина выше 60 % может быть смертельный исход. Продолжительная гипоксия и бессознательное постгипоксическое состояние сопровождаются развитием остаточных необратимых поражений головного мозга и миокарда. Клинические проявления усиливаются при тяжелой работе, значительном подъеме над уровнем моря и при высокой температуре окружающей среды. Считают, что наличие сердечно-сосудистого заболевания увеличивает риск, связанный с действием СО (Folinsbee, 1992).
Хотя интоксикацию СО обычно рассматривают как проявление острой токсичности, существуют
свидетельства того, что хроническое воздействие низких концентраций СО может привести к нежелательным эффектам, включая развитие атеросклероза коронарных артерий у курящих. Однако убедительные экспериментальные доказательства отсутствуют (Реппу, 1991). Плод человека может оказаться высокочувствительным к воздействию СО.
Лечение
При острой интоксикации в первую очередь нужно вынести больного из зараженной атмосферы и поддерживать функцию дыхания, сопровождая эти мероприятия введением кислорода — специфического антагониста СО. При давлении воздуха 1 атм время полувыведения СО составляет приблизительно 320 мин; при вдыхании 100 % кислорода время полувыведения — приблизительно 80 мин; при проведении оксигенобаротерапии (2-3 атм) время полувыведения СО уменьшается до 20 мин.
2. ДИОКСИД СЕРЫ
Диоксид серы (SO2) — это бесцветный, вызывающий раздражение слизистых оболочек газ, образующийся, главным образом, при горении серосодержащего ископаемого топлива (угля, нефти). Значения TLV-TWA и TLV-STEL представлены в табл. 58-1.
Механизм действия
При контакте с водой SO2 образует сернистую кислоту, которая вызывает сильное раздражение глаз, слизистых оболочек и кожи. Подсчитано, что приблизительно 90 % вдыхаемого SO2 всасывается в верхних дыхательных путях, основном месте действия. S О2 вызывает спазм бронхов; изменяет тонус гладких мышц и, по-видимому, в эти реакции вовлечены парасимпатические рефлексы (глава 19). Воздействие SO2 в концентрации 5 ч/млн в течение 10 минут приводит к затруднению дыхания у боль-шинствалюдей. Показано, что воздействие в концентрации 5-10 ч/млн вызываеттяжелый бронхоспазм; 10-20 % здорового молодого взрослого населения реагируют даже на меньшие концентрации. Известен феномен адаптации к раздражающим концентрациям SO2. Астматики особенно чувствительны к действию SO2 (Amdur, 1991; Folinsbee, 1992).
Клинические проявления интоксикации и лечение
Признаки и симптомы интоксикации включают раздражение слизистых оболочек глаз, носа, гортани и рефлекторный бронхоспазм. В случае тяжелого воздействия наблюдается отсроченное развитие отека легких. Кумулятивные эффекты хронического воздействия низких концентраций SO2 слабо выражены. Однако хроническое воздействие ухудшает течение хронических сердечно-легочных заболеваний (Ellenhorn, 1988). Специфического лечения отравлений SO2 не существует, оно проводится средствами, применяемыми для лечения воспаления дыхательных путей.
3. ОКСИДЫ АЗОТА
Диоксид азота (NO2) — это коричневатый, вызывающий раздражение слизистых оболочек газ, иногда являющийся продуктом горения. Он также выделяется из свежего силоса; воздействие на фермеров NO2 при заготовке силоса может привести к развитию так называемого синдрома “легкого фермера”. Значения TLV-TWA и TLV-STEL на 1993 г. представлены в табл. 58-1.
Механизм действия
NO2 — это раздражающее вещество, проникающее глубоко в легкие, способное вызвать отек легких. Считают, что альвеолярные клетки I типа являются основными клетками-мишенями, подвергающимися острому воздействию. Концентрация NO2 25 ч/ млн является раздражающей для некоторых людей; умеренное раздражение слизистых оболочек глаз и носа возникает при 50 ч/млн. Воздействие NO2b концентрации 50 ч/млн в течение! часаможет вызвать отек легких и, возможно, подострое или хроническое поражение легких; воздействие в концентрации 100 ч/млн вызывает отек легких и смерть.
Клинические проявления интоксикации и лечение
Признаки и симптомы острого воздействия NO2 включают раздражение слизистых оболочек глаз и носа, кашель, продукцию слизистой или пенистой мокроты, одышку и боль в груди. Отек легких может появиться в течение 1-2 часов. У некоторых
лиц клинические признаки интоксикации длятся до двух недель. В дальнейшем может развиться вторая стадия заболевания. Для нее характерно утяжеление состояния, включая рецидив отека легких и фиброзную деструкцию терминальных бронхиол (облитерирующий бронхиолит). Хроническое воздействие NO2 на лабораторных животных в концентрации 10-25 ч/млн приводит к эмфизематозным изменениям. Таким образом, хроническое действие NO2 на человека опасно. Не существует специфического лечения в случае острой интоксикации NO2; применяются терапевтические средства для лечения глубоко проникающего поражения легких и некардиогенного отека легких. Необходимо поддержание нормального газообмена с помощью адекватной оксигенации и альвеолярной вентиляции. Лекарственная терапия включает бронходилататоры, седативные средства и антибиотики; применение кортикостероидов, по некоторым данным, является спорным (Ellenhorn, 1988).
4. ОЗОН
Озон (О3) — голубоватый, раздражающий слизистые оболочки газ, который содержится в обычном атмосферном воздухе, где он является основным поглотителем ультрафиолетовых лучей. В производственных условиях он может встречаться вокруг высоковольтного электрического оборудования и озонпроизводящих приборов, применяемых для очистки воздуха и воды. Озон является сильным оксидантом, обнаруженным в загрязненном городском воздухе. Показатели TLV-TWA и TLV-STEL представлены в табл. 58-1.
Клинические проявления интоксикации и лечение
О3 раздражает слизистые оболочки. Умеренное воздействие вызывает раздражение верхних дыхательных путей. Тяжелое воздействие может вызвать глубокое поражение легких, сопровождающееся отеком легких. Некоторые эффекты О3 сходны с действием радиации, это подтверждает предположение о том, что токсичность Оз может быть результатом образования реактивных свободных радикалов. Газ вызывает поверхностное, частое дыхание и уменьшает эластичность легких. Наблюдается также повышенная чувствительность легких к бронхо-констрикторным влияниям. Воздействие концент
рации 0.1 ч/млн в течение 10-30 минут вызывает раздражение и сухость гортани; при более высоких концентрациях изменяется острота зрения, появляются загрудинные боли и одышка. Функции легких поражаются при воздействии в концентрациях, превышающих 0.8 ч/млн. У людей наблюдаются гиперчувствительность и воспалениедыхательных путей (Folinsbee, 1992). Морфологические и биохимические изменения в легких являются как результатом прямого поражения, так и вторичной реакцией на исходное поражение (Wright, 1990). Продолжительное воздействие на животных приводит к морфологическим и функциональным легочным изменениям. Хронические бронхиты, бронхиолиты, фиброзы и эмфизематозные изменения наблюдаются у различных видов животных при воздействии концентраций О3 свыше 1 ч/млн. Не существует специфического лечения острой интоксикации О3. Лечение проводят средствами, применяемыми при глубоко проникающем поражении легких и некардиогенном отеке легких.
Растворители
1. ГАЛОГЕНСОДЕРЖАЩИЕ
АЛИФАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
Эти вещества широко применяются в качестве растворителей, обезжиривающих и чистящих средств. К ним относятся четыреххлористый углерод, хлороформ, трихлорэтилен, тетрахлорэтилен (перхлорэтилен) и 1,1,1-трихлорэтан (метилхлоро-форм). Значения предельно допустимых концентраций представлены в табл. 58-1.
Механизм действия
и клинические эффекты
У лабораторных животных галогенированные углеводороды вызывают угнетение центральной нервной системы, поражение печени и почек. Они также оказывают кардиотоксическое действие. Эти вещества являются депрессантами центральной нервной системы человека, хотя выраженность действия варьирует в значительной степени; хлороформ является наиболее мощным депрессантом и широко применялся в качестве средства для общей анестезии. Хроническое воздействие тетрахлорэтилена может вызвать нарушение памяти и периферические нейропатии. Гепатотоксичность —
обычный токсический эффект, который может развиться у человека после острого или хронического воздействия, а его тяжесть зависит от количества поглощенного вещества. Тетрахлорид углерода — наиболее сильный гепатотропный яд. Нефротоксические эффекты могут наблюдаться у человека после воздействия тетрахлорида углерода, хлороформа и трихлорэтилена. При изучении последствий воздействия хлороформа, тетрахлорида углерода, трихлорэтилена и тетрахлорэтилена в течение всей жизни у мышей и крыс была обнаружена канцерогенная активность. Последствия продолжительного воздействия на человека низких концентраций указанных веществ изучены еще не полностью.
Лечение
Не существует специфического лечения острой интоксикации галогенированными углеводородами. Способы лечения зависят от поражения тех или иных систем организма (Arena, 1979).
2. АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
Бензол широко применяется как растворитель и как промежуточное звено в синтезе других химикатов. Значения TLV-TWA и TLV-STEL на 1993 г. представлены в табл. 58-1. Острым токсическим эффектом бензола является угнетение центральной нервной системы. Воздействие в концентрации 7500 ч/млн в течение 30 мин может быть смертельным. Воздействие в концентрациях более 3000 ч/млн сопровождается эйфорией, тошнотой, нарушением координации движений и комой. При более низких концентрациях (250-500 ч/млн) признаками отравления являются сонливость, головная боль и тошнота. Не существует специфического лечения острой интоксикации бензолом.
Хроническое воздействие бензолом может вызвать очень тяжелые токсические поражения. Наиболее значительным действием является коварное и непредсказуемое повреждение костного мозга, следствием которого являются апластическая анемия, лейкопения, панцитопения или тромбоцитопения. Клетки костного мозга на ранней стадии развития наиболее чувствительны к действию бензола. Начальные проявления хронической интоксикации бензолом могут быть неопределенными (головная боль, усталость и потеря аппетита). Эпиде
миологические исследования предполагают наличие связи между хроническим воздействием бензола и увеличением случаев лейкоза у рабочих. Эти эффекты еще необходимо воспроизвести на лабораторных животных (Yardley-Jones, 1991).
Толуол (метилбензол) не обладает миелотокси-ческими свойствами бензола и не вызывает лейкоза. Однако он является депрессантом центральной нервной системы. Значения TLV-TWA и TLV-STEL представлены в табл. 58-1. Воздействие толуолом в концентрации 800 ч/млн вызывает выраженную слабость и атаксию, а при концентрации 10 000 ч/млн быстро развивается потеря сознания. Хронические эффекты продолжительного воздействия толуола неясны. Выявленные изменения в поведении человека обычно связаны с воздействием нескольких растворителей, а не одного толуола (Ellenhorn, 1988).
Инсектициды
1. ХЛОРИРОВАННЫЕ УГЛЕВОДОРОДНЫЕ ИНСЕКТИЦИДЫ
Эти средства включают 4 группы веществ: ДДТ (хлорофенотан) и его аналоги, гексахлориды бензола, циклодиены и токсафены (табл. 58-2). Они являются арильными, карбоциклическими или гетероциклическими соединениями, содержащими в качестве заместителей хлор. Соединения широко различаются по характеру биотрансформации и способности к накоплению; токсические свойства и величина накопления в организме не всегда коррелируют. Вещества могут всасываться через кожу, а также попадать в организм при дыхании и энтерально. Однако существуют выраженные количественные отличия между различными производными: раствор ДДТ плохо проникает через кожу, в то время как диелдрин абсорбируется кожей очень эффективно.
Токсическое действие на человека
Острые токсические эффекты действия хлорированных углеводородных инсектицидов на человека качественно сходные. Эти средства инактивируют натриевый насос в возбудимых мембранах и вызывают быстрые повторные разряды в большинстве нейронов. Ингибируется также транспорт ионов кальция. В результате нарушается реполяри-
ТАБЛИЦА 58-2. Хлорированные углеводородные инсектициды _____
Химический класс Соединения Класс токсичности’ ADI2 (МДД)
ДДТ и аналоги Дихлордифе-нилтрихлор-этан (ДДТ) 4 0.005
Метоксихлор 3 0.1
Тетрахлорди-фенилэтан (ТДЭ) 3 —
Бензола гексахлориды Бензола гексахлорид (БГХ; гексахлорцикло-гексан) 4
Линдан 4 0.01
Циклодиены Алдрин 5 0.0001
Хлордан 4 0.001
Диелдрин 5 0.0001
Гептахлор 4 0.0005
Токсафены Токсафен (камфехлор) 4 —
1 Класс токсичности: вероятная энтеральная летальная доза для человека у веществ 3 класса = 500-5000 мг/кг; 4 класса = 50-500 мг/кг; 5 класса = 5-50 мг/кг (Gosselin, 1984).
2 ADI = допустимое суточное потребление (мг/кг массы тела/ /сутки)(или МДДсут— максимально допустимая доза в сутки).
зация и увеличивается возбудимость нейронов. Главный эффект — стимуляция центральной нервной системы. Первым проявлением отравления ДДТ может быть тремор, переходящий в судороги. Для других соединений судороги часто являются первым признаком интоксикации. Не существует специфического лечения острой интоксикации, лечение обычно симптоматическое. Хроническое введение некоторых из этих средств лабораторным животным вызывало увеличение частоты опухолевого роста; но единая точка зрения относительно потенциальных канцерогенных свойств этих веществ отсутствует (Ames, 1987,1992). Однозначных свидетельств наличия канцерогенных эффектов у человека не получено.
Токсикология окружающей среды
Хлорированные углеводородные инсектициды относятся к “постоянно присутствующим” химикатам. Их распад происходит довольно медленно по
сравнению с другими инсектицидами, а факт их бионакопления, особенно в водных экосистемах, хорошо доказан. Миграция инсектицидов в почве зависит от ее состава; присутствие органической материи способствует проникновению этих химикатов в почву, в то время как в песчаных почвах абсорбция происходит плохо. Десорбция из почвы медленная.
Вследствие загрязнения хлорорганическими инсектицидами окружающей среды их применение в Северной Америке и Европе было повсеместно сокращено. Некоторые из них до сих пор применяются в тропических странах.
2. ФОСФОРОРГАНИЧЕСКИЕ ИНСЕКТИЦИДЫ (ФОИ)
Некоторые из этих средств, перечисленные в табл. 58-3, применяются для борьбы с разнообразными паразитами. Эти пестициды действуют при непосредственном контакте с насекомыми или через растения. В последнем случае вещества проникают в растения и действуют на насекомых, питающихся ими. Некоторые из этих соединений используются в ветеринарии в качестве местных или системных ан-типаразитарных средств или в случаях, где необходимо продолжительное угнетение холинэстеразы (глава 7). ФОИ всасываются через кожу, а также проникают через дыхательные пути и желудочно-кишечный тракт. Биотрансформация быстрая, осо-
ТАБЛИЦА 58-3. Фосфорорганические инсектициды
Соединение Класс токсичности’ АО12(МДД)
Азинфос-метил 5 0.0025
Хлорфенвинфос — 0.002
Диазинон 4 0.002
Дихлофос — 0.004
Диметоат 4 0.02
Фенитротион — 0.005
Лептофос — —
Малатион 4 0.02
Паратион 6 0.005
Паратион-метил 5 —
Трихлорфон 4 0.01
' Класс токсичности: вероятная энтеральная летальная доза для человека: у веществ 4-го класса 50-500 мг/кг, для 5-го класса = 5-50 мг/кг и 6-го класса=< 5 мг/кг (Gosselin, 1984). 2 ADI—допустимое суточное потребление (мг/кг массы тела в сутки).
бенно по сравнению с биотрансформацией хлорированных углеводородных инсектицидов.
Токсическое действие на человека
У млекопитающих, так же как и у насекомых, основным эффектом этих средств является угнетение ацетилхолинэстеразы в результате фосфорилирования эстеразного участка. Признаки и симптомы, характеризующие острую интоксикацию, являются следствием ингибирования этого фермента, что приводит к накоплению ацетилхолина. Некоторые вещества обладают также прямой холинергической активностью. Эти эффекты и методы лечения отравлений описаны в главе 7.
Помимо угнетения ацетилхолинэстеразы, некоторые из этих средств способны фосфорилировать другой фермент, присутствующий в нервной ткани. Это так называемая нейротоксическая эстераза (Johnson, 1990; Lotti, 1992). Ингибирование нейротоксической эстеразы приводит к развитию поздних эффектов, характеризующихся полинейропатией, сопровождаемой параличом и дегенерацией аксонов (organophosphorus ester-induced delayed polyneuropathy, OPIDP). Куры оказались наиболее чувствительными к этому эффекту ФОИ. Данный вид используется для изучения патогенеза поражений и идентификации потенциально нейротоксичных фосфорорганических соединений. На человека нейротоксическое действие оказывает триортокрезилфосфат (ТОКФ), неинсектицидное фосфорорганическое соединение, а из инсектицидов — дихлофос, трихлорфон, лептофос, метамидофос, мипафокс и трихлоронат (Lotti, 1992). Полинейропатия обычно начинается с чувства жжения и покалывания, особенно в стопах, через несколько дней развивается мышечная слабость. Сенсорные и моторные нарушения могут затрагивать руки и ноги. Нарушается походка и может появиться атаксия. Специфического лечения поздней (отсроченной) нейротоксичности не существует.
Токсикология окружающей среды
Фосфорорганические инсектициды не относятся к "постоянно присутствующим” пестицидам. Считают, что они незначительно загрязняют окружающую среду, несмотря на сильное острое токсическое воздействие на организмы.
3. КАРБАМАТНЫЕ ИНСЕКТИЦИДЫ
Эти соединения (табл. 58-4) угнетают ацетил-холинэстеразу за счет карбамолирования эстеразного участка фермента, т. е. они обладают токсическими свойствами, аналогичными фосфорорганическим инсектицидам. Клинические проявления и лечение интоксикации представлены в главе 7. Клинические эффекты карбаматов более короткие по продолжительности, чем эффекты фосфорорганических соединений. Диапазон между дозами, вызывающими минимальную интоксикацию, и летальными дозами больше у карбаматных, чем у фосфорорганических средств. Спонтанная реактивация холинэстеразы происходит быстрее после ее угнетения карбаматами.
Карбаматные инсектициды относятся к “непостоянно существующим” пестицидам окружающей среды и, как полагают, вызывают незначительное ее загрязнение.
4. РАСТИТЕЛЬНЫЕ ИНСЕКТИЦИДЫ
Инсектициды, получаемые из естественных источников, включают никотин, ротенон и пиретрум. Никотин получают из высушенных листьев Nico-tiana tabacum и Nicotiana rustica. Он быстро всасывается со слизистых оболочек; свободный алкалоид, но не его соль, быстро абсорбируется кожей. Никотин реагирует с рецептором ацетилхолина на
ТАБЛИЦА 58-4. Карбаматные инсектициды
Соединение Класс токсичности’ АО12(МДД)
Алдикарб 6 0.005
Аминокарб 5 —
Карбарил 4 0.01
Карбофуран 5 0.01
Диметан 4 —
Диметилан 4 —
Изолан 5 —
Метомил 5 —
Пропоксур 4 0.02
Пирамат 4 —
Пиролан 5 —
Зектран 5 —
1 Класс токсичности: вероятная энтеральная летальная доза для человека: для 4-го класса 50-500 мг/кг, 5-го класса = 5-50 мг/кг и 6-го класса = < 5 мг/кг (Gosselin, 1984).
2 ADI—допустимое суточное потребление (мг/кг массы тела в сутки).
постсинаптической мембране (симпатических и парасимпатических ганглиев, нервно-мышечных соединений), вызывая деполяризацию мембраны. Токсические дозы вызывают стимуляцию, за которой быстро следует блокада нервной передачи. Эти эффекты описаны в главе 7. Лечение направлено на поддержание жизненных функций и купирование судорог.
Ротенон (рис. 58-1) получают из Derris elliptica, Derris mallaccensis, Lonchocarpus utilis и Lonchocarpus urucu. Ротенон при приеме внутрь вызывает раздражение желудочно-кишечного тракта. Наблюдаются также конъюнктивиты, дерматиты, фарингиты и риниты при местной аппликации. Лечение симптоматическое.
Пиретрум состоит из 6 эфиров, обладающих инсектицидными свойствами: пиретрин I (рис. 58-1), пиретрин II, цинерин I, цинерин II, ясмолин I и яс-молин II. Синтетические пиретроиды составляют примерно 30 % от всех применяемых в мире инсектицидов (Ecobichon, 1991). Пиретрум действует при ингаляционном поступлении или при приеме внутрь; всасывание через кожу незначительное. Эфиры хорошо биотрансформируются. Пиретроидные инсектициды не являются высокотоксичными для млекопитающих. После всасывания в достаточном количестве основным местом их токсического действия является центральная нервная система. Возбуждение, судороги и тетанический паралич могут развиться вследствие блокирования натриевых каналов, аналогичным с механизмом действия ДДТ. Лечение включает назначение противосудорожных средств. Наиболее частые поражения, наблюдаемые у человека, развиваются вследствие аллергических свойств этих веществ — контактные дерматиты. Отмечались кожные парестезии у рабочих, распылявших синтетические пиретроиды. При тяжелом производственном отравлении людей синтетическими пиретроидами в Китае наблюдались значительные поражения центральной нервной системы, в том числе судороги (Ecobichon, 1991).
Гербициды
1. ХЛОРФЕНОКСИЛЬНЫЕ ГЕРБИЦИДЫ
2,4-Дихлорфеноксиуксусная кислота (2,4-D), 2,4,5-трихлорфеноксиуксусная кислота (2,4,5-Т), их соли и сложные эфиры являются основными соединениями, представляющими интерес как гер-
Дихлордифенилтрихлорэтан (ДДТ)
2,3,7,8 - Тетрахлордибензодиоксин (ТХДД) О- СН2- СООН
CI
2,4 - Дихлорфеноксиуксусная кислота (2,4-Д)
2,4,5 - Трихлорфеноксиуксусная кислота (2,4,5-Т)
Рис. 58-1. Химические структуры некоторых инсектицидов и гербицидов
бициды, применяемые для уничтожения сорняков (рис. 58-1). Эти вещества относятся к 4-му или 3-му классу токсичности, с вероятной летальной дозой для человека в диапазоне 50-500 или 500-5000 мг/кг соответственно (Gosselin, 1984).
У человека 2,4-D в больших дозах может вызвать кому и генерализованную мышечную гипотонию. В редких случаях мышечная слабость и выраженная миотония могут длиться в течение нескольких недель. При отравлении 2,4,5-Т кома тоже может наблюдаться, но нарушение мышечных функций маловероятно. У лабораторных животных была выявлена дисфункция печени и почек. Существуют ограниченные данные, что производственное воздействие феноксильными гербицидами сопровождается увеличением риска появления неходжкинской
лимфомы; данные о развитии саркомы мягких тканей считаются сомнительными (Morrison, 1992).
Токсикологический профиль этих средств, особенно 2,4,5-Т, был неясным вследствие присутствия химических примесей (диоксинов), образующихся во время процесса производства. Считают, что присутствие 2,3,7,8-тетрахлордибензо-р-диоксина (TCDD) является причиной тератогенного действия, выявленного у некоторых видов животных, а также контактных дерматитов и хлоракне, наблюдаемых у рабочих, участвующих в производстве 2,4,5-Т. Несмотря на обширные исследования, было очень трудно выявить отдаленные токсические эффекты TCDD у человека (Bertai, 1989).
TCDD, как примесь в гербицидах, вызывает интерес из-за своего возможного канцерогенного дей
ствия на человека и, в частности, развития саркомы мягких тканей и злокачественных лимфом. Однако этиологическая роль TCDD в появлении злокачественной меланомы маловероятна, а доказательства развития саркомы мягких тканей считаются неубедительными. Роль TCDD в этиологии других раковых заболеваний еще предстоит изучить (Johnson, 1992,1993).
2. БИПИРИДИЛОВЫЕ ГЕРБИЦИДЫ
Паракват является наиболее важным средством этого класса (рис. 58-1). Его относят к веществам 4-го класса токсичности при вероятном диапазоне летальной дозы для человека 50-500 мг/кг. Был описан ряд летальных интоксикаций у человека (несчастные или суицидные случаи).
У человека первые симптомы после поступления внутрь связаны с раздражением желудочно-кишечного тракта (кровавая рвота и кровавый стул). Затем в течение нескольких дней могут появиться респираторные нарушения (поздняя токсичность) с развитием застойного геморрагического отека легких, сопровождающегося широко распространенной клеточной пролиферацией. Также выявляются признаки поражения печени, почек или миокарда. Интервал между поступлением вещества внутрь и смертью может достигать нескольких недель. Из-за отсроченного токсического действия на легкие важно быстро удалить паракват из пищеварительного тракта. Рекомендуются промывание желудка, применение слабительных средств и адсорбентов для предотвращения дальнейшего всасывания. Если же вещество всосалось, лечение успешно в менее чем 50 % случаев. Кислород при отравлении паракватом необходимо использовать с осторожностью (несмотря на необходимость борьбы с одышкой или цианозом), так как он может усилить поражение легких (Arena, 1979). За пациентами требуется продолжительное наблюдение, потому что пролиферативная фаза, приводящая к массивному фиброзу легких, начинается через 1-2 недели после отравления (Ellenhorn, 1988).
Загрязнение окружающей среды
Полихлорированные бифенильные соединения (ПХБ) широко применяются в качестве диэлектриков и теплообменных жидкостей, пластификато
ров и в огнетушителях. В США их промышленное производство и использование было прекращено в 1977 г. К сожалению, эти вещества долго сохраняются в окружающей среде. Продукты для коммерческого использования были смесями изомеров и гомологов ПХБ, содержащими 12-68 % хлора. Эти соединения высокостабильны и липофильны, слабо метаболизируются и очень устойчивы во внешней среде. Они накапливаются в пищевых цепях. Пища является главным источником поступления ПХБ для человека.
Тяжелое отравление ПХБ произошло в 1968 г. в Японии в результате загрязнения пищевого растительного масла ПХБ-содержащими примесями (болезнь Юшо). При отравлениях у женщин не исключалось действие химикатов на плод и на процесс развития новорожденного (Yen, 1989). Сейчас установлено, что загрязненное пищевое растительное масло содержало не только ПХБ, но также полихлорированные дибензофураны и полихлорированные тетрафенилы. Следовательно, эффекты, которые изначально приписывали действию только ПХБ, как считают, в большей степени могли быть вызваны другими веществами-примесями. У рабочих, профессионально контактирующих с ПХБ, отмечают следующие клинические явления: поражение кожи (хлоракне, фолликулиты, эритема, сухость кожи, сыпь, гиперкератозы, гиперпигментация), нарушения функции печени и повышенный уровень триглицеридов в плазме. У человека изолированные эффекты ПХБ на репродуктивную функцию и развитие, а также возможное канцерогенное действие еще предстоит изучить. Существует большое количество данных, полученных при обследованиях людей, указывающих, что ПХБ представляют небольшую опасность для здоровья человека, за исключением ситуаций, где пища была заражена высокими концентрациями этих соединений.
Избранная литература
Amdur М. О. Air pollutants. In: Casarett and Doull’s Toxicology, 4th ed. Amdur M. O., Doull J., Klaassen C. D. (eds). Pergamon, 1991.
Ames B. N. Pollution, Pesticides, and Cancer. J. AOAC Int. 1992; 75:1.
Ecobichon D. J. The Basis of Toxicity Testing. CRC Press, 1992.
Хелатные соединения и отравления тяжелыми металлами
59
Мария Альмира Коррейя, Чарльз Е. Беккер
Некоторые металлы, например железо, являются необходимыми для жизни, другие же, например свинец, присутствуют во всех организмах, но не выполняют биологических функций. Более того, тяжелые металлы, находящиеся в окружающей среде, несут опасность для большинства живых организмов. Возможно, наиболее древние болезни человека отчасти были обусловлены отравлениями тяжелыми металлами при добыче, переработке и использовании их. Даже при современном уровне знаний об этой опасности частота интоксикаций тяжелыми металлами и необходимость эффективной терапии в случае отравления ими остается высокой.
Фармакология хелатных соединений
Хелатирующие агенты (комплексоны) — наиболее гибкие и эффективные антидоты при отравлении металлами. Эти соединения обычно представляют собой высокореактивные молекулы с двумя или более электроотрицательными группами, которые образуют стойкие координационно-ковалентные связи с катионами металлов. Формирующиеся таким образом комплексы выводятся затем из организма. Действие этих средств является прекрасной демонстрацией использования принципа химического антагонизма. Классический пример — эдетат (этилендиаминтетраацетат — ЭДТА; рис. 59-1).
Эффективность хелатного соединения частично определяется числом лигандов в его составе, способных связываться с металлом. Чем их больше, тем
более стабилен металл-хелатный комплекс. В зависимости от числа связей комплекс металл-лиганд может быть отнесен к моно-, би- или полидентатам. Хелатные соединения содержат в своем составе такие функциональные группы, как —ОН, —SH и —NH, которые могут отдавать электроны для связи с металлами. Такое связывание эффективно предотвращает взаимодействие металлов с подобными группами ферментов, коферментов, клеточных нуклеофилов и мембран. К сожалению, комплексоны действуют неизбирательно и могут связывать такие ионы, как Са2+ и Zn2+, которые необходимы организму. Результат взаимодействия определяется относительным аффинитетом токсичных и эссенциальных металлов к хелатам. Таким образом, токсические эффекты при назначении некоторых комплексонов могут быть вызваны связыванием необходимых организму металлов. Проблему можно решить разумным назначением препаратов эссенциальных металлов одновременно с хелатными соединениями.
Относительная эффективность различных хелатных соединений по облегчению выведения металлов из организма частично определяется и фармакокинетикой хелатов. Чтобы произошло сколько-нибудь значимое снижение уровня металлов, их аффинитет к комплексонам должен быть выше, чем аффинитет к эндогенным лигандам, а относительная скорость обмена металла между эндогенными лигандами и хелатными соединениями должна быть выше, чем скорость элиминации комплексонов. Если комплексон элиминируется быстрее, чем диссоциирует комплекс металл—эндогенный лиганд, он может не достигнуть концентрации, необходимой для эффективной конкуренции с эн-
НО—С С-ОН
^СН2 СН2
''n N^
сн2 сн2—сн2 сн2 I I
Na —О —С С —О—Na
II II
О О
Н2С о
Na —О —С —СН2 С—С С —С —О —Na
н2 н2 н2
Рис. 59-1. Солевая и хелатная формы этилендиаминтет-раацетата (ЭДТА). А. В растворе динатриевой соли ЭДТА ионы натрия и водорода химически и биологически активны. Б. В растворе кальций-двунатрий эдетата кальций связан координационно-ковалентными связями с атомами азота так же, как и обычными ионными связями. Ионы кальция эффективно выводятся из раствора. В. В хелатном комплексе свинец-ЭДТА металл включен в пять гетероциклических колец (По: Meyers F.H., Jawetz Е., Goldfien A. Review of Medical Pharmacology, 7th ed. Lange, 1980.)
догенными местами связывания. Этот фактор может стать особенно значимым, если выведение осуществляется через образование тройного комплекса (эндогенный лиганд-металл-экзогенный комп-
лексон). Приведенные соображения также подсказывают, что эффективная мобилизация может совершиться только тогда, когда физиологическое распределение хелатных соединений включает компартменты организма, содержащие металл. Например, свинец может накапливаться в костной ткани и быть недоступным для связывания комплексонами. Нужно помнить, что в процессе абсорбции тканевой профиль распределения металла со временем может заметно изменяться. Тот же свинец вначале распределяется в мягкие ткани, такие как костный мозг, головной мозг, почки и яички. Накопление в костной ткани происходит позднее. Следовательно, при выборе комплексона нужно учитывать характер первичного и вторичного распределения металла в тканях. Может оказаться полезной комбинированная терапия двумя или более хелатными агентами, каждый из которых способен проникать в различные ткани-мишени. Далее будут представлены отдельные препараты данной группы.
Бидентаты
1. ДИМЕРКАПРОЛ
(2,3-димеркаптопропанол)
Димеркапрол (БАЛ — британский антилюизит) (рис. 59-2) представляет собой бесцветную маслянистую жидкость с неприятным запахом тухлых яиц. Он растворим в воде, но водные растворы нестабильны и быстро окисляются. Поэтому димеркапрол выпускают в виде 10 % раствора в арахисовом масле. Его вводят внутримышечно (инъекции болезненны).Препарат прямо взаимодействует с металлами в крови и тканевой жидкости и реактивирует сульфгидрилсодержащие ферменты клетки. Однако он наиболее эффективен при назначении немедленно вслед за воздействием металлов. Это означает, что лечебные эффекты БАЛ обусловлены скорее предотвращением связывания металлов с компонентами клетки, чемудалением уже связанного металла.
Показания и побочные эффекты
Димеркапрол считается эффективным антидотом при отравлениях мышьяком, ртутью и, возможно, при отравлениях свинцом у детей. Он также используется в случаях отравления кадмием. При
внутримышечном введении БАЛ быстро всасывается, метаболизируется и выводится почками в течение 4 часов. Препарат имеет разнообразные побочные эффекты, наиболее значительными из которых являются сердечно-сосудистые (гипертензия и тахикардия). Он также вызывает головную боль, тошноту, рвоту, слезо- и слюнотечение, парестезии и боль в месте инъекции.
Из-за большого числа побочных эффектов ди-меркапрола ведется интенсивный поиск менее токсичных средств среди его производных. Наиболее многообещающими оказались сукцимер (2,3-ди-меркаптоянтарная кислота, DMSA, димеркапрола сукцинат) и 2,3-димеркаптопропан-1-сульфонат (DMPS). Эти более полярные, чем димеркапрол, агенты распределяются преимущественно во внеклеточной жидкости и поэтому обладают меньшей клеточной токсичностью. В сравнительном исследовании у мышей оба вещества обнаружили большую эффективность и меньшую токсичность, чем димеркапрол (Aposhian, 1990). Предварительные клинические данные подтверждают, что они эффективны при отравлениях ртутью и мышьяком так же, как и при свинцовой интоксикации (Graziano, 1988). Сукцимер в настоящее время одобрен к применению при отравлениях свинцом у детей с уровнем свинца в крови > 45 мг/100 мл и с успехом проходит испытания при некоторых других типах интоксикации тяжелыми металлами (мышьяком и ртутью). Изучается также возможность использования препарата в профилактике нефролитиаза у пациентов с гомозиготной цистинурией, склонных к образованию камней. Сукцимер может вызвать небольшие изменения функции печени и количества лейкоцитов.
2. ПЕНИЦИЛЛАМИН (О-р,р-диметилцистеин)
Пеницилламин (рис. 59-2) представляет собой белые кристаллы водорастворимого продукта метаболизма пенициллина. D-изомер по сравнению с L-изомером относительно нетоксичен и, следовательно, является предпочтительной формой антидота. Пеницилламин быстро всасывается из кишечника и устойчив к метаболическому разрушению. Подобная высокая резистентность к метаболической деградации достигается N-ацетилирова-нием (например, образование N-ацетилпеницилл-амина).
H2N
(СН2)5
CONH
(СН2)2 (СН2)5
CONH
(СН2)2 (СН2)5
Ферроксамин
H2C-S4
I м
НС—sz
I Н2С-ОН
соон
I
CH —SH I CH-SH I соон
Димеркапрол (2,3-димеркапто-пропанол)
Сукцимер (DMSA)
СНз о
I II
Н3С — с-сн — с — он
I I
s nh2
Пеницилламин (D-(3, р - диметилцистеин)
Рис. 59-2. Химическая структура некоторых комплексонов. Ферроксамив вне связи с железом называется деферроксамином. Ферроксамин представлен здесь для демонстрации функциональных групп: видно, что железо активно удерживается в замкнутой системе. Димеркапрол захватывает металл в стабильное гетероциклическое кольцо ковалентным связыванием. Сукцимер близок по строению к димеркапролу. Две молекулы пеницилламина могут связать одну молекулу меди или другого металла (М — молекула металла) (Из: Meyers F.H., Jawetz Е., Goldfien A. Review of Medical Pharmacology, 7th ed. Lange, 1980.)
Показания и побочные эффекты
Пеницилламин используется главным образом при отравлениях медью или для предупреждения кумуляции меди, как в случае болезни Вильсона. Иногда его применяют в качестве вспомогательного средства при лечении отравлений свинцом, ртутью и мышьяком и в терапии тяжелого ревматоидного артрита (глава 35). Частым токсическим эффектом L-изомера является дефицит пиридоксина, но он редко наблюдается при назначении D-формы препарата. Продолжению использования препарата могут препятствовать острые аллергические реакции, особенно у пациентов с аллергией на пенициллины. Описаны также нефротоксические реакции с протеинурией; продолжительное применение препарата может привести к развитию почечной недостаточности. Токсическое влияние на костный
мозг при длительном приеме пеницилламина иногда выражается в апластической анемии. Имеют место и аутоиммунные заболевания, включая системную красную волчанку и гемолитическую анемию.
Полидентаты
1. КАЛЫДИЙ-ДВУНАТРИЙ ЭДЕТАТ
Этилендиаминтетрауксусная кислота (этилендиаминтетраацетат — ЭДТА) (рис. 59-1) in vitro является эффективным комплексоном для многих двух- и трехвалентных металлов. Однако связывание эссенциального кальция in vivo, обусловленное высоким сродством, ограничивает клиническое использование препарата. Это ограничение частично снимается назначением кальций-двунатриевой соли ЭДТА.
ЭДТА относительно плохо проникает через клеточные мембраны и поэтому более эффективно хелатирует внеклеточные ионы металла, чем внутриклеточные. Высокополярные ионные свойства ЭДТА исключают его сколько-нибудь значимое энтеральное всасывание и, следовательно, комплексон (кальций-двунатриевая соль) назначается или путем медленного внутривенного введения, или внутримышечно. Препарат выводится посредством клубочковой фильтрации за 24 часа при нормальной функции почек. Его эффекты, включая нефротоксический, могут пролонгироваться у пациентов с почечной недостаточностью.
Показания и побочные эффекты
Такие тяжелые металлы, как свинец и некоторые другие, способны связываться с ЭДТА и, вытесняя Са2+, эффективно захватываться им. Использование ЭДТА для мобилизации ртути, напротив, неэффективно, вероятно, из-за незначительного rto-ступления препарата в те ткани, где концентрируется ртуть, а также вследствие менее успешной конкуренции ртути со связанным кальцием. ЭДТА не пригоден для лечения атеросклеротических заболеваний сердечно-сосудистой системы.
В высоких дозах ЭДТА нефротоксичен: почечные канальцы относительно чувствительны к его токсическим эффектам, в том числе гидропической дегенерации, затрагивающей проксимальные канальцы и прогрессирующей до их полной деструкции. Слабо выраженные эффекты исчезают с пре
кращением терапии. К другим (редким) осложнениям относятся озноб, лихорадка, тошнота, рвота, миалгии, аллергические реакции и глюкозурия.
2. ТРИЕНТИН
Триентин (триэтилентетрамин НС1) является полвдентатным хелатирующим агентом, обладающим сродством к меди и эффективным при болезни Вильсона (лентикулярной дегенерации печени). Триентин одобрен в США для применения по этому показанию. Первые сообщения подтвердили, что в этом качестве препарат, возможно, менее токсичен, чем пеницилламин. Он имеет также некоторый эффект при отравлении никелем. Между тем в хронических экспериментах, выполненных на крысах, была обнаружена тератогенность триентина. Сейчас исследуется еще один комплексон для меди, тетратиомолибдат, достаточно эффективный и, вероятно, менее токсичный (продемонстрировано на овцах). В будущем он может заменить триентин.
сн2—сн2 сн2—сн2 сн2—сн2
H2N NH NH ИНг
Триентин
3. ДЕФЕРОКСАМИН
Дефероксамина мезилат выделяют из Streptomyces pilosus. Он активно связывает железо и незначительно — металлы, необходимые организму в следовых количествах. Более того, конкурируя за слабо связанное в железосодержащих белках (гемосидерин и ферритин) железо, он не в состоянии конкурировать за железо, включенное в биологические хелатные комплексы, такие как микросомальные и митохондриальные цитохромы и гемопротеины. Следовательно, этот препарат является средством выбора при отравлениях железом. Он может быть полезен и в терапии интоксикаций алюминием при почечной недостаточности (Jones, 1991).
Дефероксамин слабо всасывается при энтеральном приеме. Для получения эффекта он должен назначаться внутримышечно или внутривенно. Предполагают, что он метаболизируется, но пути метаболизма неизвестны. Продукты почти полностью выделяются с мочой, придавая ей темно-красный цвет, если количество свободного железа превосходит объем связанного. Внутривенное введение
может привести к гипотоническому шоку вследствие выброса гистамина, особенно при быстром введении. Описано нейротоксическое действие препарата при длительной терапии передозировки железа.
Иногда наблюдаются нежелательные идиосинкразические реакции: покраснение, узловатая эритема, раздражение кишечника и крапивница. Кроме того, осложнения при терапии дефероксамином включают тяжелую коагулопатию, печеночную и почечную недостаточность и инфаркт кишечника.
Использование дефероксамина при отравлении железом описано в главе 32.
Токсикология тяжелых металлов
Свинец
Токсические эффекты свинца составляют, вероятно, старейшее профессиональное заболевание в мире. Свинец в настоящее время широко распространен в воздухе, пище и воде, так что полного освобождения окружающей среды от свинца добиться практически невозможно. Благодаря хорошему знанию кинетики и токсикологии свинца и программам скрининга свинца у детей, частота острых свинцовых отравлений сейчас, к счастью, намного ниже, чем в прошлом. Условия труда улучшаются, уменьшается опасное воздействие на детей свинецсодержащих красок, взрослые реже сталкиваются с некачественными виски и корпусами батарей (Schneitzer, 1990). Однако по-прежнему актуальны такие вопросы охраны здоровья, как загрязнение окружающей среды и угроза для почечной, репродуктивной, гемопоэтической и неврологической функций, которую несет хроническое воздействие свинца в малых дозах (Landrigan, 1989). Выявлено отсутствие безопасного порога для действия свинца на эти системы й органы. Свинец не выполняет полезных функЦйй в организме человека.
Фармакокин0Ика
Металлический свинец медленно, но постоянно всасывается ингаляционнО й из желудочно-кишечного тракта. Неорганический свинец слабо всасывается через кожу, а его органические соединения хорошо проникают Этим путем. Наиболее общей при
чиной промышленных отравлений служит абсорбция свинцовой пыли в респираторном тракте. Основным путем проникновения при бытовых отравлениях является желудочно-кишечный тракт (табл. 59-1). Всасывание в нем колеблется в зависимости от природы соединений свинца, в среднем всасывается примерно 10 % поступившего в желудок неорганического свинца. Кальций, железо и фосфор пищи изменяют степень всасывания свинца в кишечнике. Исследования на лабораторных животных показали, что диета с низким содержанием кальция и железа увеличивает захват свинца, что сопровождается биохимическими и морфологическими признаками нарастания токсичности.
Всосавшись из респираторного или желудочно-кишечного тракта, свинец связывается с эритроцитами и сначала широко распространяется в мягких тканях, таких как костный мозг, головной мозг, почки и яички. Период его полувыведения из этих тканей составляет приблизительно 30 дней. Свинец проникает через плаценту и несет потенциальную угрозу для плода. Наибольшее количество поступившего в организм свинца окончательно накапливается в скелете; период полувыведения из костной ткани составляет более 20 лет. Костное депо может служить источником свинца в случае разрушения кости (например, при почечной недостаточности). Содержание свинца в кости определяется с использованием рентген-флюоресцентного метода (Kosnett, 1994). Свинец накапливается также в ногтях и волосах, которые теоретически могли бы быть полезным материалом для оценки его содержания в организме. Однако наружное загрязнение создает проблемы в интерпретации этих данных. Поступивший через кишечник свинец выводится с фекалиями (свыше 90 %) и мочой. Большая часть всосавшегося свинца выводится путем почечной элиминации. Незначительные его количества экскретируются с потом и материнским молоком.
Фармакодинамика
Свинец способен образовывать комплексные связи со многими соединениями. Он нарушает функцию ферментов и поражает различные органы и системы.
А. Кровь. Обычно развивается микроцитарная гипохромная анемия, но не все пациенты со свинцовым отравлением страдают анемией. Свинец вызывает серьезные расстройства в биосинтезе гема,
Вещество Форма поступления в организм Путь всасывания Распределение Органы-мишени для токсинов Метаболизм Пути выведения
Мышьяк Неорганические Желудочно-ки- Эритроциты (95- Повышение проница- Активно связывается с Преимуще-
соли мышьяка шечный, кожный, респираторный (через все слизистые поверхности) 99% связывается емости капилляров, с глобином) (24 ч); приводящее к вазо-затем поступаете дилатации и сосудис-печень, легкие, тому коллапсу. Разоб-почки, стенку ки- щениеокислительно-шечника, селезен- го фосфорилирова-ку,мышцы,нервную ния, приводящее к ткань (2 недели); нарушению клеточ-далее — в кожу, во- ного метаболизма лосы и кости (годы) сульфгидрильными группами различных ключевых ферментов клетки с образованием стабильных циклических тиоарсинов. Замещает неорганический фосфор в синтезе макроэр-гических фосфатов ственно почками. Второстепенный путь - с потом и фекалиями
Свинец Неорганические Желудочно-ки- Кости (90%), зубы, Кроветворные ткани и Диссоциация и связыва- С мочой и фека-
оксиды свинца шечный, респи- волосы, кровь(эри- печень, ЦНС, почки, ние свинца сульфгид- ЛИЯМИ(основ-
и его соли раторный, кожный (второстепенный) троциты), печень, нервно-мышечная почки передача рильными группами в чувствительных тканях ной); с потом (второстепенный)
Органический (тетраэтилсвинец) Кожный (основной), желудочно-кишечный Печень ЦНС Деалкилизация в печени (быстро)-»триалкиль-ные метаболиты; (мед-ленно)-»диссоциация до свинца С мочой и фекалиями (основной); с потом (второстепенный)
Ртуть Элементарная Респираторный ЦНС (где она захва- ЦНС (нейропсихичес- Элементарная Нд пре- С мочой
ртуть тракт тывается какНд2*), кие нарушения, выз-почки (сопровож- ванные элементар-даясь превраще- ной Нд и его Нд2* ме-нием элементар- таболитом), почки ной Нд в Нд2*) (тесно связанный с превращением элементарной Нд в Нд2*) вращается в Нд2* (основной); с фекалиями (второстепен- • ный)
Неорганическая: Нд* (малотоксичная); Нд2* (более токсичная) Желудочно-кишечный, кожный (второстепенный) Почки (преобладаю- Почки, желудочно-щее), кровь, мозг кишечный тракт (второстепенно) Нд2* + R-SH превращается в Hg*-S-R, Hg(S-R)2 С мочой
Органическая: алкилы, арилы, алкоксиды Желудочно-кишечный, кожный (существенный) Почки, головной ЦНС мозг, кровь R-Hg* превращается в Нд2* + R (медленно) С мочой
Глава 59. Хелатные соединения и отравления тяжелыми металлами______________________________ 505
приводящие к выведению порфиринов и их предшественников с мочой. Наиболее чувствительны к ингибирующему влиянию свинца дегидратаза Д-аминолевулиновой кислоты и феррохелатаза. Ингибирование первого фермента блокирует превращение Д-аминолевулиновой кислоты в порфобилиноген. В результате Д-аминолевулиновая кислота экскретируется с мочой, и ее концентрация в моче может использоваться как диагностический тест. Ингибирование феррохелатазы приводит к снижению продукции гема и накоплению его предшественника, протопорфирина IX. Вдобавок снижение продолжительности жизни эритроцитов содействует развитию свинециндуцированной анемии.
Б. Нервная система. Свинец поражает как периферическую, так и центральную нервную систему. Связь неврологических нарушений с минимальными концентрациями свинца остается сомнительной (Needleman, 1990). Даже при очень высоком уровне металла в крови и заметных нарушениях кроветворной функции некоторые индивидуумы могут не иметь очевидной неврологической патологии. Наиболее общим признаком периферической невропатии является легкая слабость разгибательных мышц рук. Нижняя часть тела реже вовлекается в патологический процесс. Чувствительность обычно не нарушается. Как правило, свинцовая невропатия развивается после нескольких месяцев хронического воздействия, но может развиться подостро в течение двух-трех недель.
Свинцовая энцефалопатия — серьезное острое расстройство, наблюдаемое прежде всего у детей, съевших свинецсодержащие краски. Она редко встречается у взрослых. Энцефалопатия чаще всего начинается с судорог, что связано с повышением внутричерепного давления и отеком мозга. Смертность от этого осложнения высока, поэтому требуется экстренная терапия хелатными соединениями. У работающих со свинцом при сильных хронических воздействиях засвидетельствованы нарушения высшей нервной деятельности (Stollery, 1989).
В. Почки. Свинец может вызывать интерстициальное повреждение почек и гипертензию. При острой интоксикации он может нарушать метаболизм мочевой кислоты и вызывать как острую подагру, так и подагрическую нефропатию. Собственно свинцовая нефропатия развивается только после длящегося годами воздействия свинца. Недавние исследования подтвердили, что повреждение почек, гипертензия или оба осложнения у взрослых могут
развиваться из-за свинцовых отравлений в детстве. К гипертензии у взрослых, особенно у чернокожих мужчин, может приводить воздействие свинца внешней среды, например из бензина и сигарет (Osterloh, 1989).
Г. Репродуктивные органы. Свинец поражает и репродуктивную систему. Давно известно, что отравления свинцом сопровождаются снижением фертильности у женщин и повышением случаев мертворождения. О действии свинца на репродуктивную функцию мужчин известно мало, хотя в тяжелых случаях отмечали стерильность и тестикулярную атрофию, а при бессимптомном воздействии свинца — дозозависимые изменения спермы.
Д. Желудочно-кишечный тракт. Отравления свинцом могут вызывать снижение аппетита, боли в эпигастрии, спастические боли в животе и запор. Механизм свинцовых колик неясен, но включает сокращение гладкой мускулатуры кишечной стенки. Желудочно-кишечная симптоматика обратима при проведении хелатной терапии.
Основные формы свинцовой интоксикации
А. Отравления неорганическим свинцом
1. Острое отравление неорганическим свинцом сегодня встречается редко. Обычно оно происходит на производстве в результате ингаляции больших количеств оксида свинца или у маленьких детей из-за попадания в желудок больших доз свинца через рот со свинецсодержащими красками. Острая интоксикация сопровождается тяжелыми желудочно-кишечными расстройствами, которые прогрессируют до заметных нарушений со стороны центральной нервной системы. Если всасывание свинца происходит более медленно, абдоминальные колики и энцефалопатия могут развиваться в течение нескольких дней. Диагностика острых отравлений неорганическим свинцом может быть затруднена Похожая симптоматика наблюдается при аппендиците, пептической язве и панкреатите.
2. Хроническое отравление свинцом вызывает слабость, отсутствие аппетита, нервозность, тремор, уменьшение массы тела, головную боль и желудочно-кишечную симптоматику. Сочетание повторных приступов абдоминальных болей и слабости разгибательных мышц без нарушений чувствительности указывает на возможное свинцовое отравление. Наиболее характерным для хронического свинцо
вого отравления неврологическим признаком является слабость мышц запястья.
Диагноз подтверждается определением уровня свинца в крови и выявлением нарушений порфиринового обмена. Если исключена железодефицитная анемия, для диагностики хронического свинцового отравления может быть полезна цинк-эрнтро-цит-протопорфириновая проба. В мазках периферической крови нередко обнаруживается базофильная зернистость. Отложения свинца в длинных костях не так характерны для отравления, как свинцовая кайма на деснах. В сложных случаях для подтверждения сомнительного диагноза свинцового отравления используется проба связывания с ЭДТА или К-рентгено-флюоресцентный тест костей.
Б. Отравления органическим свинцом. Эти отравления обычно вызываются тетраэтил- или тет-раметилсвинцом, которые входят в состав бензина как антидетонирующие агенты. Органический свинец высоколетуч и жирорастворим, поэтому он быстро всасывается через кожу и респираторный тракт. Тяжелые отравления происходят из-за намеренного “нюхания” бензина. В итоге развиваются острые расстройства центральной нервной системы. Они могут быстро прогрессировать, вызывая галлюцинации, нарушения сна, головную боль и раздражительность (как при тяжелой алкогольной абстиненции). Гематологические нарушения при отравлении органическим свинцом незначительны. Тетраэтил- и тетраметилсвинец метаболизируются в печени до триалкилсвинца и неорганического свинца. Триалкилсвинец играет ведущую роль в развитии острого отравления. Хроническое отравление органическим свинцом, к счастью, является редкой патологией. Большей частью его вредное действие наблюдается при очистке бензиновых цистерн или из-за нюхания этилированного бензина. При массированном воздействии органического свинца судорожные припадки могут окончиться комой и смертью. По уровню свинца в крови и моче (иногда он повышен) трудно судить о тяжести отравления органическим свинцом.
Лечение
А. Отравления неорганическим свинцом. Их лечат, немедленно прекращая вредное воздействие и используя хелатирующую терапию. При тяжелых интоксикациях внутривенно вводят кальций-двунатриевую соль ЭДТА в дозе приблизительно
8 мг/кг. Некоторые врачи рекомендуют детям, отравившимся свинцом, внутримышечно ввести димеркапрол в дозе 2.5 мг/кг. Особенно показан детям со свинцовым отравлением прием внутрь сук-цимера. Как руководство для терапии необходим мониторинг уровня свинца в крови и моче. Доступность сукцимера делает ненужным использование пеницилламина. Не рекомендуется лечение пациентов, не имеющих симптомов, хелатирующими соединениями. Противопоказано и профилактическое назначение хелатирующих агентов рабочим, подвергающимся воздействию свинца, так как оно может повысить всасывание металла из желудочно-кишечного тракта. После прекращения терапии хелатами необходимо периодически оценивать уровень свинца в крови и состояние порфиринового обмена для выявления возможного рикошетного повышения содержания металла, если он начинает высвобождаться из костной ткани.
Б. Отравления органическим свинцом. Первая помощь в этом случае состоит в обеззараживании кожи и предупреждении дальнейшего воздействия органического свинца. Лечение судорожных припадков требует разумного использования антиконвульсантов.
Мышьяк
Элементарный мышьяк и его соединения широко распространены в природе. Мышьяк — это распространенный загрязнитель каменного угля и руд многих металлов, особенно меди, свинца и цинка. В промышленности источниками мышьяка являются преимущественно угольные электростанции и плавильные печи. В США приблизительно 1.5 миллиона работающих потенциально подвергаются воздействию соединений мышьяка.
Токсикологическое значение имеют такие химические формы мышьяка, как элементарный мышьяк, неорганический мышьяк, органические соединения мышьяка и газ арсин (AsH3). Наиболее токсичными являются трехвалентный мышьяк и арсин.
Мышьяк использовали в античной Греции и в Древнем Риме как терапевтическое средство и как яд. Не так давно (вплоть до появления пенициллина) мышьяк применяли в терапии сифилиса и как тонизирующее средство в растворе Фоулера. Сегодня его терапевтическое применение ограничивается лечением трипаносомоза, поражающего центральную нервную систему. Наиболее часто с неме
дицинскими целями соединения мышьяка используются как инсектициды, гербициды, фунгициды, алгициды (уничтожение водорослей) и консерванты для дерева, а также в полупроводниковых микросхемах, в сплавах и при выплавке стекла.
Фармакокинетика
Мышьяк и его соединения содержатся во внешней среде и в пищевых продуктах, поскольку они присутствуют в океанической воде, особенно в устьях морских лагун вблизи промышленных районов. Большие количества мышьяка могут обнаруживаться в алкогольных напитках при неправильном их изготовлении. Многие виды морепродуктов содержат нетоксичные формы мышьяка. Эти загрязнения из внешней среды могут способствовать повышению уровня мышьяка в моче, поскольку при обычном анализе различные его формы не дифференцируются. Среднесуточное поглощение мышьяка из источников окружающей среды составляет менее 1 мг. Общее содержание мышьяка в организме у взрослых примерно 20 мг, в основном в костях и в меньшей степени в волосах и коже. Неорганический мышьяк может абсорбироваться из легких, кишечника и редко — через неповрежденную кожу (табл. 59-1).
Всасывание соединений мышьяка в желудочно-кишечном тракте зависит от их водорастворимос-ти. Трехвалентные арсенаты слаборастворимы, а пятивалентные — более растворимы. Органические соединения мышьяка обычно плохо всасываются из желудочно-кишечного тракта. Мышьяк способен проникать через плаценту и может нанести вред плоду. Трехвалентная форма мышьяка экскретируется медленно, главным образом с фекалиями, тогда как пятивалентная более быстро экскретируется с мочой в метилированном виде. Всасывание мышьяка через кожу зависит от его жирорастворимости: у трехвалентной формы жирорастворимость больше, чем у пятивалентной. Неорганические соединения трехвалентного мышьяка частично окисляются в организме до пятивалентной формы, а некоторые — метилируются.
Фармакодинамика
Все основные токсические эффекты неорганических соединений мышьяка можно отнести за счет его трехвалентной формы. Трехвалентный мышьяк
ингибирует тиоловые ферменты и разрушающе действует на эпителиальную выстилку респираторного и желудочно-кишечного трактов, на кожу и другие ткани. В первую очередь трехвалентным мышьяком поражаются нервная система, костный мозг, печень, кожа и дыхательные пути. Мышьяк признан канцерогеном для человека (Bates, 1992).
Основные формы интоксикации мышьяком
А. Острые и подострые формы отравления неорганическим мышьяком. Эти отравления могут вызвать сильную тошноту, рвоту, абдоминальные боли, раздражение кожи, ларингит и бронхит. Гастроэнтерит бывает очень тяжелым, вплоть до геморрагического. Выдыхаемый воздух и фекалии приобретают сладкий металлический чесночный запах. Характерен стул типа “рисового отвара”. Трехвалентные формы мышьяка поражают также капилляры, вызывая повышение проницаемости, дегидратацию, шок и смерть. Если пациент пережил острый период, могут последовать угнетение костного мозга, энцефалопатия и невропатия с нарушением чувствительности.
Лечение острого отравления мышьяком включает стимуляцию рвоты или промывание желудка, коррекцию дегидратации и электролитного дисбаланса, поддерживающую терапию для печени и других пораженных органов и тканей. В тяжелых случаях немедленно назначают хелатную терапию ди-меркапролом: 3-5 мг/кг внутримышечно каждые четыре часа в течение 48 часов. Димеркапрол продолжают вводить в течение последующих 10 дней с интервалом в 12 часов, пока выявляется экскреция мышьяка с мочой. По некоторым данным, сукцимер более эффективен, чем димеркапрол (Jones, 1991).
Б. Хроническое отравление неорганическим мышьяком. В этом случае могут наблюдаться прободение носовой перегородки, раздражение кожи, сенсорная невропатия, выпадение волос, угнетение костного мозга, жировая инфильтрация печени или поражение почек. Кожные проявления включают расширение сосудов кожи и бледность (вследствие анемии), выливающиеся в характерный комплекс “молока и роз”. Длительное воздействие мышьяка может привести к гиперкератозу ладоней и стоп, усилению пигментации кожи, выпадению волос и белой исчерченности ногтей. Иногда из-за хрони
ческой тошноты и желудочно-кишечных расстройств возникает кахексия. Обычными являются конъюнктивит и раздражение слизистых оболочек гортани и дыхательных путей.
Лабораторная диагностика отравления неорганическим мышьяком может быть затруднена. Уровни мышьяка в моче, волосах и ногтях — это показатели предшествующего воздействия, но не интоксикации. Содержание мышьяка в моче изменяется при потреблении морепродуктов. При минимальной вероятности воздействия и употреблении в пищу среднего количества морепродуктов экскреция мышьяка с мочой не превышает 100 мкг за 24 часа. Для диагностики значимы лабораторные свидетельства подавления костного мозга, изменения в функциональных пробах печени, протеинурия и гематурия.
В. Отравления органическим мышьяком. Эти отравления относятся к редким. Органические соединения мышьяка абсорбируются в разной степени в зависимости от их валентности и обычно быстро экскретируются. Органические соединения мышьяка, находящиеся в бензине, в большинстве случаев не превращаются в неорганический мышьяк. Механизм токсичности органического мышьяка включает ингибирование тиоловых ферментов, особеннно в центральной нервной системе. Иногда наблюдаются повреждения серого и белого вещества мозга.
Г. Отравления арсином. Арсин (AsH3) известен как один из самых мощных гемолитических агентов. Он первично абсорбируется ингаляционным путем. Арсин соединяется с гемоглобином и окисляется до соединения, вызывающего гемолиз. Разрушение эритроцитов ведет к гемоглобинурии, приводящей к острой почечной недостаточности. Обнаруживаются распространенные повреждения почечных канальцев наряду с утолщением клубочковых базальных мембран. Начальные симптомы отравления — темная моча, желтуха и сильные абдоминальные боли. При тяжелом отравлении повышается уровень мышьяка в моче. К лабораторным находкам относятся гемолиз и тяжелая анемия. Для предупреждения разрушения эритроцитов хелатирующая терапия бесполезна. Исход острого отравления арсином определяют поддерживающие меры, прежде всего обменная трансфузия и гемодиализ при почечной недостаточности.
Д. Другие проявления отравлений мышьяком. Обнаружено, что у пациентов, подвергшихся дли
тельной терапии неорганическими соединениями мышьяка, особенно раствором Фоулера, при псориазе и других кожных заболеваниях, повышена вероятность возникновения рака кожи. Исследование здоровья рабочих плавильных производств в США подтверждает возрастание риска заболевания раком дыхательной системы, которое, вероятно, зависит от дозы мышьяка. Поскольку работники плавильных цехов соприкасаются со множеством вредных и сопутствующих факторов, повышающих риск респираторного канцерогенеза, для определения степени опасности необходимы дальнейшие исследования. Попытки продемонстрировать канцерогенный потенциал соединений мышьяка на животных не удались. В тестировании на мутагенность, особенно в тесте Эймса, не выявлен однозначный мутагенный эффект мышьяка, хотя хромосомные нарушения были описаны. Вопреки неопределенности результатов экспериментальных исследований мышьяк сегодня причислен к канцерогенам в отношении кожи и легких человека. Возможно его участие в развитии рака печени, органов желудочно-кишечного тракта, кроветворной системы, почек и мочевого пузыря (Bates, 1992).
Ртуть
Металлическая ртуть (“подвижное серебро”), единственный металл, который является жидкостью в обычных условиях, всегда привлекал интерес людей. Давно известно, что добыча ртути вредит здоровью. С тех пор, как промышленное использование ртути стало обычным (последние 200 лет), выявлены новые формы токсичности, для которых доказана связь с неорганическими соединениями этого элемента или с собственно металлом. В 1953 г. в японском рыбачьем поселке Минамата случилась таинственная эпидемия. Поселок располагался около стоков большого предприятия, на котором производится виниловый пластик. Эпидемия отравлений была следствием потребления рыбы, выловленной в водах, загрязненных стоками этой фабрики. Виновником оказалась метилртуть, образующаяся в океанской воде при действии бактерий на неорганическую ртуть из стоков.
К главным источникам неорганической ртути, представляющим токсическую опасность, относятся материалы, используемые в стоматологических лабораториях, консерванты для дерева, гербициды, инсектициды, спермицидные гели, средства для
фейерверков, электробатарейки, термометры, барометры, измерительные приборы, а также производство хлора и гидрооксида натрия. Органические соединения ртути применяют как фунгициды для обработки зерна и для предупреждения развития плесени.
Фармакокинетика
Всасывание ртути значительно варьирует в зависимости от химической формы металла. Элементарная ртуть умеренно летуча и способна абсорбироваться из легких (табл. 59-1). Она слабо всасывается из желудочно-кишечного тракта. Основным источником развивающегося отравления является вдыхаемая ртуть. Потенциально угрожают здоровью и летучие короткоцепочечные органические алкилртутные соединения. После всасывания ртуть распределяется в тканях за несколько часов с образованием наибольших концентраций в проксимальных почечных канальцах. Она быстро связывается с сульфгидрильными группами. Выводится ртуть в основном с мочой, хотя некоторое количество удаляется через желудочно-кишечный тракт и потовые железы. Большая часть попавшей в организм неорганической ртути выводится в течение одной недели, но головной мозг и почки удерживают ртуть на более длительный период.
Синдромы острого и хронического отравления ртутью зависят от формы соединения. Принятая внутрь металлическая ртуть дает незначительный токсический эффект. Очень токсичен хлорид ртути, вызывающий острые почечные нарушения. Органические меркуриаты, особенно метилртуть, более полно всасываются из желудочно-кишечного тракта. Короткоцепочечные органические соединения ртути обычно концентрируются в центральной нервной системе и поэтому не обладают нефротоксичностью. Не существует неоспоримых свидетельств того, что ртутная амальгама в стоматологических наполнителях опасна для пациента.
Основные формы ртутной интоксикации
А. Острая. Острые отравления ртутью наиболее часто происходят из-за вдыхания высоких концентраций ее паров. Симптомы включают боль в груди, поверхностное дыхание, металлический привкус во рту, тошноту и рвоту. Позднее развивается острое поражение почек. Если пациент выживает, на
третий или четвертый день появляются тяжелый гингивит и гастроэнтерит. В наиболее тяжелых случаях возникают сильный мышечный тремор и нарушения психики.
Б. Хроническая. Хроническое отравление ртутью иногда сложно диагностировать. Часто предъявляются жалобы на заболевания полости рта и желудочно-кишечные расстройства, могут наблюдаться признаки почечной недостаточности. При отравлении обычны гингивит, обесцвечивание десен и расшатанность зубов. Могут быть увеличены слюнные железы. Нередко возникает тремор, охватывающий пальцы, руки и ноги. Хроническое отравление ртутью может напоминать лекарственную интоксикацию, дисфункцию мозжечка или болезнь Вильсона. Часто наблюдается изменение почерка. Описаны офтальмологические симптомы, в том числе отложение ртути в хрусталике. Указывают на изменения личности с необычайно сильными страхами, невозможностью сконцентрироваться и раздражительностью. Это психологическое расстройство известно как эретизм.
Для постановки диагноза хронического ртутного отравления в первую очередь должен быть установлен источник воздействия, так как концентрации ртути в организме широко варьируют, очевидно благодаря фармакокинетическим факторам. Для диагностики может быть полезен анализ волос.
Лечение
А. Острое. Лечение острого ртутного отравления состоит в устранении источника загрязнения и применении хелатирующей терапии. В течение первых 48 часов внутримышечно каждые 4 часа вводят димеркапрол в дозе 3-5 мг/кг. В последующие 10 дней интервал между инъекциями увеличивают до 12 часов. Есть сведения, что сукци-мер более эффективен и менее токсичен, чем димеркапрол (Jones, 1991). Если развивается почечная патология, потребуется гемодиализ. Активированный уголь не связывает ртуть в желудочно-кишечном тракте.
Б. Хроническое. В этом случае полезным может оказаться сукцимер. Для наблюдения за эффективностью повышающегося выведения нужно мониторировать уровень ртути в моче. Лечение отравлений органической ртутью разработано недостаточно. Назначение хелатирующих соединений требует дальнейшего изучения.
Препараты
Дефероксамин (Десферала мезилат)
Парентерально: порошок для приготовления раствора для инъекций (500 мг во флаконе)
Димеркапрол, БАЛ (в масле)
Парентерально: 100 мг/мл для инъекций (в ампулах по 3 мл)
Эдетат кальция [кальция ЭДТА] (Кальций Двунатрий Версенат) Парентерально: 200 мг/мл для инъекций
Пеницилламин (Купримин, Депен)
Перорально: капсулы по 125,250 мг;
таблетки по 250 мг
Сукцимер (Хемет)
Перорально: капсулы по 100 мг
Триентин (Сиприн)
Перорально: капсулы по 250 мг
Избранная литература
Baghurst Р. A. et al. Environmental exposure to lead and children’s intelligence at the age of seven years. The Port Pirie cohort study. N. Engl. J. Med. 1992; 327: 1279.
Bates M. N., Smith A. H., Hopenhayn-Rich C. Arcenic ingestion and internal cancers: A review. Am. J. Epidemiol. 1992; 135:462.
Craswell P. W. et al. Chronic renal failure with gout: A marker of cronic lead poisoning. Kidney Int. 1984; 26: 319.
Greenhouse A. H., Glaeske C. S. Heavy metal intoxication. In: Textbook of Clinical Neurotoxicology and therapeutics, 2nd ed. Klawans H. L. et al. (eds). Raven Press, 1992.
Jones M. M. New developments in therapeutic chelating agents as antidotes for metal poisoning. Crit. Rev. Toxicol. 1991; 21: 209.
Kosnett M. J. et al. Factors influencing bone lead concentration in a suburban community assessed by noninvasive К x-ray fluorescence. JAMA, 1994; 271:197.
Лечение больных с отравлением 60
Чарльз Е. Беккер, Кент R Олсон
Каждый год в США происходит более миллиона случаев острых отравлений. Большинство смертей является следствием намеренной суицидной передозировки лекарственных средств или токсичных соединений. В последние 20 лет в результате разработки безопасной упаковки и эффективного обучения предупреждению отравления детская смертность из-за случайного потребления токсичных продуктов значительно снизилась.
Несмотря на относительно высокую частоту отравлений, они редко оканчиваются смертью, если жертва быстро получает медицинскую помощь и хорошую поддерживающую терапию. Тщательное лечение обструкции дыхательных путей, дыхательной недостаточности, гипотонии, судорожных припадков и терморегуляторных расстройств способствует росту выживаемости больных с передозировкой, достигших госпитального этапа.
В этой главе дается обзор механизмов развития отравлений, первой помощи при передозировке, диагностики токсических синдромов и специализированного лечения отравлений, включая методы ускорения элиминации препаратов и токсинов.
Токсикокинетика
и токсикодинамика
Токсикологические проблемы лучше всего видны на классической фармакологической модели. Эта модель основывается на фармакологических свойствах химических агентов и эффектах “нормальных” доз у “нормального” человека. Токсикология расширяет эту информацию применительно к чрезмерным дозам.
Термин “токсикокинетика” подразумевает абсорбцию, распределение, экскрецию и метаболизм токсинов, терапевтических средств, принятых в токсических дозах, и их метаболитов. Термин “токсикодинамика” используется для обозначения вред
ного действия этих веществ на жизненные функции. Хотя между фармакокинетикой и токсикокинети-кой большинства веществ имеется много общего, существуют и важные различия.
Специальные аспекты токсикокинетики
Объем распределения
Объем распределения (V(l) определяется как действительный объем, в котором распределяется вещество в организме. Он рассчитывается исходя из введенной дозы и конечной концентрации в плазме: Vd = доза/концентрация (глава 3). Если вещество легко связывается тканями или иным способом удаляется из плазмы, то его концентрация в плазме будет низкой, a V(, очень большим. При большом Vd препарат труднодоступен для мероприятий, нацеленных на очищение крови, в частности для гемодиализа. К препаратам с большим объемом распределения (> 5-10 л/кг) относятся антидепрессанты, фенотиазины, линдан и фенциклидин (РСР), с относительно малым объемом распределения (< 1 л/кг) — теофиллин, салицилаты, фенобарбитал, литий и фенитоин (табл. 3-1).
Клиренс
Клиренс — это величина объема плазмы, который очищается от вещества за единицу времени. Для большинства лекарств общее количество препарата, удаляемого за единицу времени, так же как и клиренс, зависит от его концентрации в плазме. Организм имеет внутренние механизмы очищения от препарата, и общий клиренс является суммой клиренсов, определяемых экскрецией почками, метаболизмом в печени и удалением с потом, фекалиями и выдыхаемым воздухом (глава 3). При планировании стратегии детоксикации важно знать долю
каждого органа в общем клиренсе. Например, если 95 % препарата метаболизируется в печени и только 5 % выводится путем почечной экскреции (например, фенциклидин), то даже существенное повышение мочеотделения будет иметь слабое влияние на общую элиминацию.
Передозировка может изменять обычные фармакокинетические процессы, и это необходимо учитывать при прогностической оценке кинетики препарата у отравленного пациента. Например, растворение таблетки или время эвакуации из желудка может изменяться так, что максимальное проявление эффектов токсина задерживается. Препараты могут повреждать желудочно-кишечный тракт и вследствие этого нарушать всасывание. Если превышена способность печени метаболизировать лекарство, то его избыток будет попадать в кровоток. При существенном увеличении концентрации лекарственного вещества в крови происходит насыщение связывающей способности тканей и белков, что приводит к возрастанию фракции свободного препарата и более выраженному токсическому действию. В обычных дозах большинство препаратов элиминируется со скоростью, пропорциональной концентрации в плазме (кинетика первого порядка). Если концентрация в крови очень высока и возможности нормального метаболизма превзойдены, скорость элиминации может стать фиксированной (кинетика нулевого порядка). Это изменение кинетики может значительно продлить период полувыведения вещества в плазме и тем самым повысить его токсичность.
Специальные аспекты токсикодинамики
Знание общей фармакологии помогает врачу предупредить серьезные токсикодинамические проблемы в диагностике отравления и ведении пациента с интоксикацией. Общие принципы дозозави-симости, описанные в главе 2, имеют решающее значение в определении серьезности положения. При рассмотрении квантовых зависимостей доза-эффект должны приниматься во внимание как терапевтический индекс, так и перекрывание кривых терапевтического и токсического эффектов. Граница безопасности учитывает последний фактор. К примеру, как показано на рис. 60-1, препараты А и Б имеют одинаковый терапевтический индекс.
Рис. 60-1. Сравнение квантовых кривых доза—эффект двух препаратов с различными границами безопасности. Оба препарата имеют одинаковый терапевтический индекс (TD50/ED50). Тем не менее в дозе, требуемой для проявления терапевтического эффекта у 90 % больных, признаки токсичности наблюдаются менее чем у 1 % пациентов, принимающих препарат А, и у 20 % пациентов, принимающих препарат Б
Однако вероятность вызвать непреднамеренную интоксикацию намного больше у препарата Б, поскольку его кривая токсического ответа в значительно большей степени перекрывает диапазон терапевтических доз, чем в случае препарата А. Для некоторых лекарств, например гипно-седативных, основной токсический эффект является прямым продолжением терапевтического действия, как показывает их градуальная кривая доза—эффект (рис. 60-2). В случае препарата с пологой кривой (препарат А) для проявления летального эффекта может потребоваться 100-кратное превышение терапевтической дозы. В противоположность этому препарат с более крутой кривой (Б) может вызвать смертельный исход при 10-кратной передозировке.
У многих препаратов может происходить наложение различных по механизму действия терапевтических и токсических эффектов. Так, интоксикация препаратами, которые обладают атропиноподобными эффектами (например, трициклическими антидепрессантами), снижает потоотделение, затрудняя рассеивание тепла. С другой стороны, при этом возможны также повышение мышечной активности или судороги; продукция тепла в организме тем самым еще более повышается, что может привести к летальному перегреву. Передозировка средств, которые угнетают сердечно-сосудистую
Рис. 60-2. Сравнение градуальных кривых доза—эффект двух гипно-седативных средств. Чтобы вызвать остановку дыхания необходимо многократное превышение предписанной дозы препарата А, т. е. он безопаснее, чем препарат Б
систему, в частности блокирующих 0-адренорецеп-торы или барбитуратов, может глубоко нарушать не только функции органов-мишеней, но и все функции, зависящие от кровотока. Они включают почечную и печеночную элиминацию токсина и любых других средств, которые могут быть назначены. Напротив, недостаток тканевой перфузии при падении кровяного давления может привести к временному снижению уровня препарата в органе-мишени. Когда же давление восстанавливается до адекватного уровня, увеличившаяся доставка токсина может существенно усилить интоксикацию. В результате бывает трудно понять колебания выраженности признаков отравления. Таким образом, должное внимание к токсикодинамике яда способствует лучшему пониманию изменений в состоянии больных с интоксикацией.
Принципы лечения больных с отравлениями
Как умирают больные с отравлением?
В большинстве случаев отравлений основой лечения является поддерживающая терапия. Понимание общих механизмов смерти, вызванной отравлением, может помочь подготовке врача к эффективному лечению больных.
Многие токсины угнетают центральную нервную систему, приводя к ступору или коме. У коматозных больных часто нарушается проходимость дыхательных путей и сам акт дыхания, что может закончиться смертью в результате обструкции дыхательных путей при западении языка, аспирации желудочного содержимого в трахеобронхиальное дерево или остановки дыхания. Это наиболее частые причины смерти при передозировке наркотиков, барбитуратов, алкоголя и других гипно-седативных средств.
При отравлении часто встречаются также сердечно-сосудистые токсические реакции. Гипотензия может быть следствием прямого угнетения сократимости миокарда, гиповолемия — перераспределения жидкости или потери жидкости или крови; периферический сосудистый коллапс вызывается блокадой опосредуемого ос-адренорецептора-ми сосудистого тонуса, бради- или тахиаритмии — прямыми кардиальными влияниями. Гипотензия обычно развивается при передозировке трициклических антидепрессантов, фенотиазинов, 0-адре-ноблокаторов, блокаторов кальциевых каналов, теофиллина, фенобарбитала и других гипно-седативных средств. Гипотензия может быть и результатом гипотермии, вызванной отравлением с нарушениями температурной регуляции. Гипотермия часто усугубляется быстрым внутривенным введением жидкости комнатной температуры (24 *'С). При передозировке многих кардиоактивных средств, таких как амфетамин, кокаин, трициклические антидепрессанты, дигиталис и теофиллин, случаются летальные аритмии, в частности желудочковая тахикардия и фибрилляция.
Если отравление вызвано цианидами, сероводородом, оксидом углерода и другими ядами, которые вмешиваются в транспорт и утилизацию кислорода, несмотря на адекватную вентиляцию и назначение кислорода, может развиться клеточная гипоксия. Она проявляется тахикардией, гипотонией, тяжелым лактоацидозом и признаками ишемии на ЭКГ.
К смерти могут привести судороги, мышечная гиперактивность и ригидность. Судороги опасны провокацией легочной аспирации, гипоксии и лактоацидоза. Вследствие поддерживающейся мышечной гиперактивности развивается гипертермия, способствующая разрушению мышц и миоглобинурии, почечной недостаточности, лактоацидозу, гиперкалиемии и повреждению головно
го мозга, т. е. картине типичного теплового удара. Препараты и токсины, которые могут вызвать судороги, — это трициклические антидепрессанты, теофиллин, изониазид, фенотиазины, кокаин, литий, стрихнин и хлорированные углеводороды (камфора и линдан).
Поражение других органов и систем после отравления нередко отсрочено. Так, паракват специфически атакует легочную ткань, приводя к пневмофиброзу через несколько дней после потребления. Массивный некроз печени после отравления ацетаминофеном или некоторыми грибами вызы: вает печеночную энцефалопатию и смерть через 24-48 часов после приема.
Наконец, некоторые пациенты умирают до госпитализации в результате травматических повреждений, обусловленных поведенческими эффектами принятых препаратов. Интоксикация алкоголем и другими гипно-седативными средствами является фактором, часто содействующим дорожно-транспортным инцидентам. Находясь под действием галлюциногенов (например, фенциклидина), человек может погибнуть из-за неадекватных поступков или от падения с высоты.
Первая помощь больным с отравлением
Первая помощь больным с комой, судорожными припадками и другими нарушениями нервного статуса имеет общие черты, независимо от принятого яда. Попытки поставить точный токсикологический диагноз только отсрочивают проведение поддерживающих мероприятий, составляющих основу (азбуку — “ABCD”) лечения отравлений. Каковы же эти основы?
Во-первых, воздушные пути (А — airway) должны быть очищены от рвотных масс и всего, что затрудняет дыхание; при необходимости вводится ротовой воздуховод или эндотрахеальная трубка. Многим пациентам для выведения запавшего языка из воздушных путей достаточно простого перемещения в положение лежа на боку. Адекватность дыхания (В — breathing) должна оцениваться путем наблюдения и измерения газов в артериальной крови. Больных с дыхательной недостаточностью нужно интубировать и проводить искусственную вентиляцию. Адекватность циркуляции (С — circu
lation) должна определяться измерением частоты пульса, кровяного давления, объема мочи и оценкой периферической перфузии. Необходимо поставить внутривенный катетер для забора крови и определения уровня глюкозы в плазме и других обычно определяемых показателей.
С этого момента каждый больной с нарушением психического статуса должен получать помощь в виде концентрированной декстрозы (глюкозы) (D — dextrose). Взрослым назначают 25 г (50 мл 50 % раствора глюкозы) внутривенно. Это необходимое рутинное мероприятие, так как пациенты с гипогликемической комой стремительно и необратимо теряют нейроны головного мозга. Пока нет быстрых и достоверных способов отличить больных с гипогликемией от больных с отравлением. В этих случаях назначение глюкозы до получения результатов анализа содержания сахара в крови в общем безопасно. Алкоголики и истощенные больные должны также получить 100 мг тиамина внутримышечно для предупреждения синдрома Вернике.
Антагонист наркотических аналгетиков налоксон назначают внутривенно в дозе 0.4-2 мг. Он устраняет угнетение дыхания и центральной нервной системы, вызванное любыми наркотическими средствами. Полезно помнить, что наркотики вызывают смерть в первую очередь за счет угнетения дыхания, следовательно, если проходимость дыхательных путей и поддержка дыхания уже обеспечены, налоксон может и не понадобиться. Пациентам с подозрением на передозировку бензодиазепинов полезен антагонист бензодиазепинов флумазенил (глава 21), но его нельзя использовать при наличии в анамнезе судорожных припадков или передозировки антидепрессантов и в качестве замены полноценной поддержки проходимости дыхательных путей.
Помощь при отравлении требует основательного знания методов лечения гиповентиляции, комы, шока, судорог и психозов. Умозрительные токсико-кинетические рассуждения принесут мало пользы, если не поддерживаются жизненно важные функции. Особое внимание к обеспечению проходимости дыхательных путей требуется при гиповентиляции и коме. Необходимо часто проверять содержание газов в артериальной крови и предупреждать аспирацию содержимого желудка. Контроль жидкости и электролитов иногда сложен. Для обеспечения адекватного, но не чрезмерного поступления жидкости необходим мониторинг массы тела, цент
рального венозного давления, давления заклинивания в легочных капиллярах и газов артериальной крови. При соответствующей поддерживающей терапии большинство больных с комой, шоком, судорогами и ажитацией поправятся после отравления.
Анамнез и физикальное обследование
Когда необходимые первичные вмешательства выполнены, можно начать более детальную оценку для постановки уточненного диагноза. Она включает сбор анамнеза и проведение токсикологически ориентированного краткого физикального обследования. Необходимо отслеживать и лечить другие возможные причины комы или судорог, такие как травма головы, менингит или обменные нарушения.
А. Анамнез. В токсикологической практике устные сообщения о количестве и даже типе принятых средств могут быть недостоверны. Для выяснения обстоятельств, в которых произошел инцидент, нужно опросить членов семьи, полицию, пожарных и младший медицинский персонал. В комнату неотложной помощи необходимо доставить все шприцы, пустые бутылки, домашние продукты или медикаменты безрецептурного отпуска, находившиеся в непосредственной близости от пациента с подозрением на отравление.
Б. Физикальное обследование. Краткое обследование должно выполняться с упором на те области, которые с наибольшей вероятностью дадут ключ к токсикологическому диагнозу. Они включают показатели обеспечения жизненных функций, состояния глаз и ротовой полости, кожи, живота и нервной системы.
1. Жизненно важные функции. Во всех токсикологических случаях необходима тщательная оценка кровяного давления, пульса, дыхания и температуры. Гипертензия и тахикардия типичны для передозировки амфетамина, кокаина, фенциклидина, никотина и антимускариновых средств. Гипотензия и брадикардия — характерные черты передозировки наркотиков, клонидина, гипно-седативных средств и p-блокаторов. Гипотензия и тахикардия обычны при отравлении трициклическими антидепрессантами, фенотиазинами и теофиллином. Частое дыхание типично для амфетамина и других симпатомиметиков, салицилатов, оксида углерода и других токсинов, вызывающих метаболический ацидоз. Гипертермию вызывают симпатомиметики,
антимускариновые средства, салицилаты и средства, вызывающие судороги или мышечную ригидность. Гипотермия может быть связана с тяжелой передозировкой наркотиков, фенотиазинов и седативных средств, особенно при сочетании отравления с пребыванием на холоде или внутривенными инфузиями растворов комнатной температуры.
2. Глаза. Глаза являются ценным источником токсикологической информации. Сужение зрачков (миоз) типично для приема высоких доз наркотиков, клонидина, фенотиазинов, фосфорорганических инсектицидов и других ингибиторов холинэстеразы, а также глубокой комы, вызванной седативными средствами. Расширение зрачков (мидриаз) обычно для действия амфетамина, кокаина, ЛСД, атропина и других м-холинолитических средств. Горизонтальный нистагм характерен для интоксикации фенитоином, алкоголем, барбитуратами и другими седативными средствами. Присутствие как горизонтального, так и вертикального нистагмов весьма подозрительно на отравление фенциклидином. Птоз и офтальмоплегия являются характерными чертами ботулизма.
3. Рот. При обследовании рта можно выявить признаки ожогов едкими веществами или обнаружить сажу от вдыхания дыма, отметить типичный запах алкоголя, углеводородных растворителей, паральдегида или аммиака. Некоторые врачи могут распознать отравление цианидами по запаху горького миндаля. Известно, что при интоксикациях мышьяком и фосфорорганическими соединениями ощущается запах чеснока.
4. Кожа. При отравлениях атропином и другими антимускариновыми средствами кожа часто красная, горячая и сухая. Повышенная потливость наблюдается при действии фосфорорганических соединений, никотина и симпатомиметиков. Цианоз может быть вызван гипоксемией или метгемоглобинемией. При иктеричности можно заподозрить некроз печени, вызванный отравлением ацетаминофеном или грибами Amanita phalloides.
5. Живот. Обнаруживаемый при обследовании живота илеус типичен для отравления антимускариновыми, наркотическими и седативными средствами. Гиперактивные кишечные звуки, абдоминальные спазмы и диарея обычны при отравлениях фосфорорганическими соединениями, железом, мышьяком, теофиллином и A. phalloides.
6. Нервная система. Необходимо тщательное неврологическое обследование. Локальные судоро
ги и двигательная заторможенность указывают скорее на органические повреждения (такие, как травматическое внутричерепное кровотечение), чем на токсическую или обменную энцефалопатию. Нистагм, дизартрия и атаксия типичны для отравлений фенитоином, алкоголем, барбитуратами и другими седативными средствами. Ригидность и гиперактивность мышц обычны для действия метаквалона, галоперидола, фенциклидина и симпатомиметических средств. Судороги часто вызываются передозировкой трициклических антидепрессантов, теофиллина, изониазида и фенотиазинов. При глубокой коме, вызванной наркотиками и гипно-седативными препаратами, могут наблюдаться вялая кома с отсутствием рефлексов и даже изоэлектрическая ЭЭГ, имитирующая смерть мозга.
Токсические синдромы
Основываясь на первичном физикальном обследовании, возможно поставить предварительный диагноз типа отравления. В табл. 60-1 перечислены характеристики некоторых важных токсических синдромов.
Лабораторные и рентгеновские методы обследования
В токсикологической диагностике полезны следующие лабораторные исследования.
А. Определение газов артериальной крови. Гиповентиляция может привести к повышению Рсо2 (гиперкапния). При аспирационной пневмонии или отеке легких, вызванном препаратами, Ро2 может быть низким. Бедная оксигенация тканей вследствие гипоксии, гипотензии или отравления цианидами приводит к метаболическому ацидозу. Так как показатель Ро2 отражает только кислород, растворенный в плазме, а не общее содержание кислорода в крови, при отравлении оксидом углерода вопреки выраженному дефициту оксигемоглобина он может оставаться нормальным.
Б. Измерение концентрации электролитов. Должно измеряться содержание натрия, калия, хлора и бикарбонатов. Дефицит анионов рассчитывается вычитанием концентрации анионов из концентрации катионов:
Дефицит анионов = (Na+ + К*) - (НСОз + СГ).
В норме этот показатель не превышает 12-16 мЭкв/л. Он увеличивается в присутствии неиз-меряемых анионов, появление которых сопровождает развитие метаболического ацидоза. Это происходит, например, при диабетическом кетоацидозе, почечной недостаточности или шок-индуциро-ванном лактоацидозе. Повышенный дефицит анионов с метаболическим ацидозом мотут вызвать аспирин, метанол, этиленгликоль, изониазид и железо (табл. 60-2).
Опасны нарушения физиологического уровня калия в плазме, поскольку они могут привести к сердечным аритмиям. К препаратам, вызывающим гиперкалиемию при нормальной функции почек, относятся собственно калий, блокаторы 0-адрено-рецепторов, гликозиды наперстянки, фториды и литий. К препаратам, ассоциирующимся с гипокалиемией, относятся барий, агонисты 0-адреноре-цепторов, кофеин, теофиллин, диуретики и толуол.
В. Оценка почечной функции. Некоторые токсины оказывают прямое нефротоксическое действие; в других случаях почечная недостаточность развивается вследствие шока, диссеминированного внутрисосудистого свертывания (ДВС) или миоглобинурии. При отравлении должен быть измерен азот мочевины, уровень креатинина в крови и выполнен анализ мочи. Повышение активности креатинфосфокиназы (КФК) в плазме и обнаружение миоглобина в моче свидетельствуют о мышечном некрозе вследствие развития судорог или ригидности мышц. Кристаллы оксалатов в моче говорят о возможном отравлении этиленгликолем.
Г. Определение осмоляльности плазмы. Рассчитываемая осмоляльность плазмы зависит главным образом от содержания в ней натрия и глюкозы и уровня азота мочевины крови (АМК). Она определяется по следующей формуле:
2 х Na+ (мЭкв/л) + Глюкоза (мг/100 мл)/18 + + АМК(мг/100 мл)/3.
Этот расчетный показатель в норме находится в пределах 280-290 мОсм/кг. Этанол и другие спирты при попадании в организм могут значительно увеличивать измеряемую осмоляльность плазмы, но, поскольку эти вещества не включены в расчет, они вызывают осмолярную разницу:
Осмолярная разница =
Измеренная осмоляльность -- Рассчитанная осмоляльность.
ТАБЛИЦА 60-1. Важнейшие токсические синдромы, вызываемые основными группами препаратов
Группа препаратов Клинические признаки отравления Ключевые моменты детоксикации
Антидепрессанты (например, амитрип-тиллин, доксепин, мапротилин и др.) Обычны антихолинергические проявления: расширенные зрачки, тахикардия, горячая сухая кожа, снижение звуков кишечной перистальтики при аускультации живота. “Три К” — кома, конвульсии и кардиальные проблемы — являются наиболее общими причинами смерти. Главный диагностический признак — расширение на ЭКГ комплекса QRS более 0.1 с (нехарактерно для амоксапина). Обычны гипотония и желудочковые аритмии Контроль судорог, коррекция ацидоза и кардиотоксичности вентиляцией и НСО3. Не использовать физостигмин или флумазенил. Следить за гипертермией
Антимускариновые средства (например, атропин, скополамин, антигистаминные средства, трициклические антидепрессанты, трава дурмана, грибы Amanita muscaria) Галлюцинации, делирий, кома. При отравлении трициклическими антидепрессантами и антигистаминными средствами возможны судороги. Тахикардия, гипертензия. Гипертермия с сухой, горячей кожей. Мидриаз. Снижение звуков кишечной перистальтики при аускультации кишечника, задержка мочи. Предполагается замедленное опорожнение желудка Контроль гипертермии. Физостигмин является потенциально полезным, но не должен назначаться при отравлении трициклическими антидепрессантами
Холиномиметические средства (например, фосфорорганические и карбаматные инсектициды) Тревожность, ажитация, судороги, кома. Можно наблюдать брадикардию (мускариновый эффект) или тахикардию (никотиновый эффект). Зрачки с булавочную головку. Избыточное слюноотделение, потливость. Кишечные звуки повышенно активны при абдоминальных спазмах, диарее. Мышечные сокращения и подергивания, сопровождаемые вялым параличом. Смерть в результате паралича дыхательных мышц Поддержка дыхания; атропин, пралидоксим (2-РАМ). Снять одежду, промыть кожу
Опиоидные средства (например, морфин, героин, меперидин, кодеин, метадон) В зависимости от дозы сонливость, заторможенность или кома. Кровяное давление и сердечный ритм обычно понижены. Гиповентиляция или апноэ. Зрачки с булавочную головку. Кожа холодная; могут проявляться признаки внутривенного злоупотребления препаратами с сопутствующими инфекционными осложнениями. Кишечные звуки понижены. Мышечный тонус ослаблен; изредка наблюдаются подергивания, ригидность. Идентичным синдромом может характеризоваться передозировка клонидина Поддержка проходимости дыхательных путей. Могут быть необходимы частые повторные введения налоксона из-за короткого периода полувыведения препарата
Салицилаты Спутанность, летаргия, кома, судороги. Гипервентиляция, гипертермия. Метаболический ацидоз с дефицитом анионов. Дегидратация, потеря калия. Острая передозировка: очень серьезен прогноз при уровне свыше 100 мг/100 мл (1000 мг/л) более 6 часов. Хроническая или случайная передозировка: уровень в крови не коррелирует с тяжестью отравления; более тяжелые проявления токсичности; часто ошибочно диагностируется как инфекция верхних дыхательных путей или гастроэнтерит Коррекция ацидоза и водно-электролитных нарушений; подщелачивание мочи; гемодиализ, если pH или симптомы со стороны ЦНС не удается контролировать
ТАБЛИЦА 60-1. (Продолжение)
Группа препаратов Клинические признаки отравления Ключевые моменты детоксикации
Гипно-седативные средства (например,бензодиазепины, барбитураты, этанол) Возбуждающие средства (например, амфетамин, кокаин, фенциклидин) Разнообразны в зависимости от стадии интоксикации: вначале растормаживание и буйство, позднее летаргия, ступор, кома. При глубокой коме: гипотония, узкие зрачки. При умеренной интоксикации обычен нистагм. При глубокой коме кишечные звуки ослаблены. Тонус мышц обычно понижен. Может сопровождаться гипотермией Ажитация, психоз, судороги. Гипертензия, тахикардия, аритмия. Мидриаз (часто). При отравлении феницикли-дином обычен вертикальный и горизонтальный нистагм. Кожа теплая и потная. Тонус мышц повышен; возможен некроз мышц. Гипертермия может быть главным осложнением Поддержка дыхания и проходимости дыхательных путей. Избегать перегрузки жидкостью. Флумазенил может снять кому, вызванную бензодиазепинами Контроль судорог, кровяного давления и гипертермии
ТАБЛИЦА 60-2. Вызванный лекарственными средствами ацидоз с дефицитом анионов
Тип ацидоза Средства
Метаболический ацидоз Метанол, этиленгликоль, салицилаты
Лактатный ацидоз Любые судороги, вызванные препаратами; железо, фенформин, гипоксия
Кетоацидоз Этанол
Примечание. Нормальный дефицит анионов, рассчитываемый по формуле (Na* + К*) - (НСО3“ + СГ), составляет 12-16 мЭкв/л, а по формуле (Na*) - (НСО3~+СГ) — 8-12 мЭкв/л.
ТАБЛИЦА 60-3. Вещества, вызывающие
осмолярную разницу
Вещество Потенциально летальный уровень (мг/100 мл) Соответствующая осмолярная разница (мОсм/кг)
Этанол 350 75
Метанол 80 25
Этиленгликоль 200 35
Изопропанол 350 60
При отсутствии значимого уровня осмотически активных молекул токсина осмолярная разница равна нулю. Табл. 60-3 отражает ожидаемую прибавку осмоляльности при отравлениях этанолом, метанолом, этиленгликолем и изопропанолом.
Д. Электрокардиограмма. Увеличение длительности комплекса QRS до значений, превышающих 0.1 с, является типичным для передозировки трициклических антидепрессантов и хинидина (рис. 60-3). Интервал QT может удлиняться при отравлениях хинидином, фенотиазином и трициклическими антидепрессантами. Разнообразные атриовентрикулярные блоки и множественные же
Примечание. Большинство лабораторий для определения осмолярности использует метод точки замерзания. Если же используется метод точки испарения, спирты могут испаряться и их добавка к осмоляльности будет потеряна.
лудочковые аритмии обычны при отравлении наперстянкой. ЭКГ может выявить типичные нарушения, когда передозировку сопровождают гипотермия и дисбаланс электролитов. Гипоксемия при отравлении оксидом углерода может вылиться в ишемические изменения на ЭКГ.
Е. Рентгенологическое исследование. Простой снимок полости живота может оказаться полезным, поскольку некоторые таблетки, особенно железа и калия, могут быть рентгеноконтрастными. Рентген грудной клетки может выявить аспирационную пневмонию или отек легких. При подозрении на черепно-мозговую травму рекомендуется компьютерное томографическое сканирование.
Рис. 60-3. Изменения на ЭКГ при передозировке трициклических антидепрессантов. А. Замедленная внутрижелудочковая проводимость отражается в удлинении интервала QRS (0.18 с, по сравнению с нормой 0.08 с). Б и В. Суправентрикулярная тахикардия с прогрессивным расширением комплекса QRS имитирует желудочковую тахикардию. (По: Benowitz N. L., Goldschlager N. Cardiac disturbances in the toxicologic patient. In: Clinical Management of Poisoning and Drug Overdose. Haddad L. M., Winchester J. F. [eds]. Saunders, 1983.)
Скрининговые тесты
Распространено ошибочное представление о том, что “срочное” токсикологическое “просеивание” является лучшим путем к диагнозу и лечению острого отравления. Скрининг занимает много времени, является дорогим и зачастую ненадежным: некоторые препараты не обнаруживаются. Клинического обследования больного и обычных лабораторных исследований обычно достаточно, чтобы выработать предварительный диагноз и соответствующий план лечения. Когда рассматривается вопрос о назначении специфической антидотной или инвазивной терапии, например гемодиализа, может быть назначено углубленное лабораторное исследование. Так, для назначения антидотной терапии N-ацетилцистеином полезно количественное определение ацетаминофена. По уровню теофиллина, лития, салицилатов и других препаратов в плазме можно судить о необходимости гемодиализа и гемоперфузии (табл. 60-4).
Время приема яда
Для определения тяжести отравления важно учесть время от момента приема яда и сравнить его, если возможно, с уровнем токсина в плазме. Важ
ность фактора времени в оценке уровня токсина в плазме особенно хорошо показана для отравлений аспирином. Концентрация аспирина 50 мг/100 мл через 4-6 часов после поступления в желудок соответствует слабой степени интоксикации. Тот же уровень через 36 часов после потребления свидетельствует уже об очень тяжелом отравлении. В основе этого явления лежит тот факт, что клинические проявления токсического действия на некоторые органы-мишени, такие как мозг, могут значительно задерживаться по сравнению с возникновением пиковой концентрации препарата в крови.
Концентрация токсинов в крови
Запомните, поддерживающая терапия не должна откладываться до получения результатов лабораторных анализов.
Существует относительно немного случаев острых отравлений, при которых необходимо измерение уровня токсина в крови для оценки опасности и выбора терапии. Примерами таких случаев являются отравления ацетаминофеном, аспирином, литием, оксидом углерода, дигоксином, карбамазепином и теофиллином. Диагноз отравления этанолом, метанолом и этиленгликолем обычно можно поста-
ТАБЛИЦА 60-4. Показания для гемодиализа (ГД) и гемоперфузии (ГП)
Показания Токсин Процедура
Показаны немед- Этиленгликоль ГД
ленно в случае Метанол ГД
серьезной ин- Салицилаты ГД
токсикации Теофиллин ГП или ГД
Прокаинамид ГД или ГП
Показаны при не- Мепробамат ГП
достаточности Этхлорвинол ГП
поддерживаю- Фенобарбитал ГП
щих мер или Литий ГД
при опасности длительной комы Карбамазепин ГП
Не показаны Амфетамины, РСР, кокаин Бензодиазепины Хлорпромазин, другие антипсихотики Дигоксин Глютетимид Наркотики Хинидин Трициклические антидепрессанты
вить на основании клинической симптоматики, но он должен быть подтвержден токсикологической лабораторией. Количественный анализ содержания в крови и моче гипно-седативных средств выполняют, когда рутинные поддерживающие процедуры оказываются неадекватными и, особенно, когда рассматривается вопрос о диализе, например при отравлении фенобарбиталом. Обширный количественный скрининг необходим также в случаях предполагаемой смерти мозга. В табл. 60-5 перечислены гипно-седативные средства, их кинетические параметры и методы лечения.
Обеззараживание
После первичной диагностической оценки и лабораторного исследования Должны предприниматься процедуры обеззараживания. Они включают в себя удаление токсинов с кожи или из желудочно-кишечного тракта.
А. Кожа. Загрязненная одежда должна быть полностью снята и сохранена для анализа. Проник
новение токсинов через кожу исследовано мало, но такую возможность необходимо предупредить. Для отмывания пользуются обильным количеством воды с мылом.
Б. Желудочно-кишечный тракт. Существуют противоположные мнения относительно эффективности очищения кишечника, особенно когда лечение.начато более чем через 1 час после приема яда. Некоторые авторитетные специалисты рекомендуют простое назначение активированного угля без предварительного освобождения кишечника.
Предостережение. Необходимо защитить дыхательные пути. Все нужное для неотложных мероприятий оборудование (отсос и т. п.) должно быть готово для немедленного использования. Судороги, отсутствие рвотного рефлекса и изъязвление слизистых оболочек полости рта служат противопоказанием для стимуляции рвоты. Промывание желудка противопоказано, если дыхательные пути находятся под угрозой (например, пациенту без сознания с отсутствием рвотного рефлекса). Едкие кислоты и щелочи нужно разбавлять, но не нейтра-лизовывать. Врачи не должны вводить свои пальцы в глотку пациента. Нельзя использовать в качестве рвотного средства соленую воду или горчицу.
1. Рвота. Рвоту вызывают назначением внутрь сиропа ипекакуаны, 30 мл взрослым и 10-15 мл детям, при необходимости повторяют процедуру однократно через 15 мин. (Следует избегать жидкого экстракта ипекакуаны из-за высокой концентрации в нем рвотных и кардиотоксичных алкалоидов.) Доказано, что домашнее использование ипекакуаны безопасно и эффективно и должно быть частью домашнего лечения детей в случаях отравлений. Ипекакуана помогает даже тогда, когда были приняты высокие дозы противорвотных медикаментов. Ипекакуану we используют, если предполагаемый интоксикант является конвульсантом (как, например, трициклические антидепрессанты), так как судорожные припадки могут случиться внезапно и в случае рвоты во время припадка весьма вероятна аспирация. Апоморфин намного более токсичен, чем ипекакуана, особенно для детей, поскольку он вызывает упорный рвотный рефлекс и угнетает центральную нервную систему. Апоморфин не следует использовать.
2. Промывание желудка. Если пациент в сознании или его воздушные пути защищены эндотра-хеальной трубкой, может быть выполнено промывание желудка (рис. 60-4). По возможности долж-
ТАБЛИЦА 60-5. Токсикологические характеристики передозировки некоторых снотворно-седативных средств
Препарат Vd (л/кг) ^1/2 нормальных ДОЗ (часы) ^1/2 чрезмерных ДОЗ (часы) Макси- Терапия мальный терапевтический уровень Комментарии
Фенобарбитал 0.75 60-100 70-120 20 Поддерживающая. Повторные дозы активированного угля через желудочный зонд и подщелачивание мочи могут увеличить элиминацию Избегать перегрузки жидкостью. Может потребоваться гемоперфузия, если уровень в плазме > 250 мг/л или если развивается упорная гипотензия
Пентобарбитал 1-2 20-30 50 50 Поддерживающая Короткого действия
Хлоралгидрат 0.6 4-8 19-20 15 Поддерживающая Гастриты, аритмии. Рентгеноконтрастные таблетки
Глютетимид (Дориден) 20-25 8-12 34-40 0.5 Поддерживающая Циклические изменения в течение комы; мидриаз
Этхлорвинол (Плацидил) 3-4 10-20 20-100 100 Поддерживающая Розовый или зеленый аспирате острым запахом. При передозировке —длительная кома
Диазепам (Валиум) 1-2 30-70 50-140 5 Поддерживающая Тяжелые передозировки редки, если нет комбинации с другими препаратами. Флу-мазеНил является антагонистом бензодиазепинов
на быть использована трубка наибольшего диаметра. Раствор для промывания (обычно 0.9 % солевой раствор) нужно нагреть до температуры тела для предупреждения гипотермии.
3. Послабление. Предполагается, что назначение слабительных средств ускоряет удаление токсинов из желудочно-кишечного тракта, хотя изучение этого вопроса в контролируемых клинических исследованиях не проводилось. Педиатрами описаны случаи обнаружения целых таблеток (особенно в кишечнорастворимых оболочках) в стуле после введения слабительных средств. Если назначается также активированный уголь, при этой процедуре отмечается стул с активированным углем, что помогает оценить общее время прохождения через желудочно-кишечный тракт. Предпочтительным слабительным средством является сорбитол (70 %). Если не нарушена функция почек, можно использовать и магния сульфат. Слабительные средства на масляной основе не имеют преимуществ и по
тенциально опасны. В табл. 60-6 перечислены некоторые обычно употребляемые слабительные.
4. Активированный уголь. Назначение активированного угля в достаточном количестве является полезной детоксицирующей процедурой, поскольку он связывает многие токсины. Лучше всего давать его в соотношении по крайней мере 10:1 активированного угля к предполагаемой дозе токсина. Активированный уголь не связывает железо, литий, калий и лишь слабо связывает алкоголь и цианиды. Он бесполезен при отравлениях, вызванных едкими щелочами или кислотами, борной кислотой, этанолом или другим спиртом, железом, литием, метилкарбаматом или толбутамидом.
Обычно активированный уголь назначают в недостаточных для детоксикации дозах. В большинстве клинических исследований активированный уголь давали после приема нормальных терапевтических доз лекарств, в то время как контролируемые испытания использования активированного
Рис. 60-4. Положение промывающей трубки и пациента во время очищения желудка (“прокачивания желудка"). На верхнем рисунке показано взаимное расположение эн-дотрахеальной трубки с манжетой в трахее (не закрашена) и промывающей трубки (точечная штриховка). На нижнем рисунке представлена левая боковая позиция, которая является оптимальной для удаления содержимого желудка. (По: Olson К. R. [ed.]. Poisoning & Drug Overdose, Appleton & Lange, 1990.)
ТАБЛИЦА 60-6. Обычные дозы слабительных при обеззараживании'
Магния цитрат (10%)
(магний =1.6 мЭкв/мл) Магния сульфат (10%)
(магний = 0.8 мЭкв/мл)
Натрия сульфат (10%)
(натрий =1.4 мЭкв/мл)
Сорбитол(70 %) (не содержит натрия или магния)
Взрослые: 100-150 мл
Дети: 1 мл/кг
Взрослые:150-250 мл
Дети: 1-2 мл/кг
Взрослые:150-250 мл
Дети: 1-2 мл/кг
Взрослые: 50-100 мл
Дети: 1 мл/кг
’ По: Reigel J. М., Becker С. Е. Use of cathartics in toxic ingestions. Ann. Emerg. Med. 1981; 10: 254.
Примечания.
1. Избегать магнийсодержащих слабительных при болезнях почек и в случаях потребления нефротоксинов.
2. Избегать натрийсодержащих слабительных при нарастающей сердечной недостаточности и гипертензии.
3. Никогда не использовать слабительные на масляной основе.
угля после передозировки немногочисленны. Тем не менее недавние исследования подтвердили, что активированный уголь, назначаемый без предварительного опорожнения желудка, может быть также эффективен, как традиционное опорожнение с последующим введением активированного угля. В других исследованиях было продемонстрировано, что повторные дозы активированного угля каждые 4 часа помогают при отравлениях, вызванных карбамазепином, хлордеконом, дапсоном, дигитоксином, надололом, фенобарбиталом и теофиллином.
Специфические антидоты
Популярное мнение, что существуют противоядия для каждого яда, ошибочно. Истина заключается в обратном — лишь для немногих классов токсинов имеются в распоряжении относительно селективные антидоты. Основные антидоты и их характеристики перечислены в табл. 60-7. Эти препа-
ТАБЛИЦА 60-7. Специфические антидоты
Антидот Токсин(ы) Комментарии
Ацетилцистеин (Мукомист) Ацетаминофен Лучшие результаты, если назначается в пределах 8-10 часов после отравления. Следить за функциональными пробами печени и уровнем ацетаминофена в крови. Слабо распознаваемая токсичность. Дозы: 140 мг/кг внутрь как ударная доза, затем 70 мг/кг внутрь каждые 4 часа до 17 доз или до того, как уровень ацетаминофена в плазме станет нулевым. Внутривенный ацетилцистеин успешно используется в Европе и находится на испытании в США
Атропин Антихолинэстеразные: фосфорорганические соединения, карбаматы Пробная доза 1-2 мг (для детей 0.05 мг/кг) вводится внутривенно пока не появятся симптомы атропинизма (тахикардия, расширенный зрачок, илеус). Дозу можно повторять каждые 10-15 минут до снижения потоотделения, слюнотечения как конечной цели терапии
Натрия Мембраностабилизирую- 1-2 мЭкв/кг внутривенно болюсно обычно снимает кардио-
бикарбонат щие кардиотоксичные средства (трициклические антидепрессанты, хинидин и пр.) токсические эффекты (широкий QRS, гипотензию). Давать осторожно при сердечной недостаточности (избегать перегрузки натрием)
Дефероксамин (Десферал) Соли железа Если отравление тяжелое, вводят 15 мг/кг/ч внутривенно. Моча может стать розовой. 100 мг дефероксамина связы- вает 8.5 мг железа
Дигоксин- Дигоксин и родственные Содержимое 1 флакона связывает 0.6 мг дигоксина; показа-
специфичные сердечные гликозиды ния включают серьезные аритмии, гиперкалиемию
FAB-антитела
Эсмолол Теофиллин, кофеин, мета-протеренол Короткодействующий p-блокатор обращает р1 -индуцированную тахикардию и р2-индуцированную вазодилатацию. Внутривенно вводить 25-50 мкг/кг/мин
Этанол Метанол, этиленгликоль Терапию этанолом можно начинать до подтверждения лабораторной диагностики. Ударная доза рассчитывается так, чтобы достичь уровня в крови не менее 100 мг/100 мл (42 г/70 кг для взрослых)
Флумазенил Бензодиазепины Доза для взрослого составляет 0.2 мг внутривенно, повторяется при необходимости до максимума в 3 мг. Не вводить пациентам с судорогами, бензодиазепиновой зависимостью или передозировкой трициклических антидепрессантов
Глюкагон Блокаторы ^-адренорецепторов 5-10 мг внутривенно болюсно могут устранить гипотензию и брадикардию, которые были резистентны к р-агонистам. Может вызвать рвоту
Хелатирующие соединения
Кальций-двунатрий этилендиаминтетраацетат (СаЭДТА) Свинец В случаях свинцовой энцефалопатии вводить 50-75 мг/кг/сут внутримышечно или внутривенно за 3-6 приемов в течение нескольких дней (до 5). Пересматривать дозу при почечной недостаточности. Токсичность: Снижение содержания цинка и дефицит витамина В6. Избегать назначения внутрь
ТАБЛИЦА 60-7. (Продолжение)
Антидот Токсин(ы) Комментарии
Димеркапрол (БАЛ) Мышьяк, свинец, ртуть Вводить 3-5 мг/кг каждые 4 часа внутримышечно в течение двух дней, затем 2.5-3 мг/кг каждые 6 часов в течение семи дней. Не эффективен при отравлении арсином. Пытаться ощелачивать мочу. Следить за давлением крови. Не дает эффекта, если начало лечения задерживается до 24 часов
Пеницилламин Свинец, золото, мышьяк Вводить 1 г в сутки, разделив на 4 дозы, внутрь перед едой
Налоксон Наркотические средства, Специфический антагонист опиоидов; начальная доза 1-2 мг
(Наркан) другие опиоидные производные внутривенно, внутримышечно или подкожно. Могут понадобиться большие дозы для обращения эффектов передозировки пропоксифена, кодеина или производных фентанила. Длительность действия (2-3 ч) может быть значительно короче, чем у антагонизируемых опиоидов
Кислород Оксид углерода Чистый кислород вводится через маску с сильным потоком; использование гипербарической камеры спорно
Физостигмина "Рекомендован" для Дозы для взрослых составляют 0.5-1 мг внутривенно медлен-
салицилат м-холинолитических средств, но не для трициклических антидепрессантов но. Эффекты преходящи (30-60 минут); минимальные эффективные дозы можно повторить, если симптомы возвращаются. Может вызвать брадикардию, повышение бронхиальной секреции, судороги. Иметь наготове атропин для устранения чрезмерных эффектов. Не использовать при передозировке трициклических антидепрессантов
Пралидоксим Антихолинэстеразные Доза для взрослого составляет 1 г внутривенно. Можно по-
(2-РАМ) фосфорорганические соединения вторять каждые 3-4 часа, если необходимо, или лучше путем постоянной инфузии 250-400 мг/ч. Педиатрическая доза составляет приблизительно 250 мг. Не доказана польза при отравлении карбаматами
Гидроксокоба-ламин Цианиды Препарат-"сирота". Доступен только в некоторых центрах помощи при отравлениях
раты дополняются иммунотропными средствами, такими как змеиный антивенин и антитела к дигоксину.
Методы усиления элиминации токсинов
После соответствующей диагностики и процедур обеззараживания и назначения антидотов очень важно рассмотреть меры усиления элиминации: форсированный диурез, диализ или обменные процедуры. Если организм пациента способен быстро выводить токсин, сокращается период комы, удаляются метаболиты и уменьшается степень поражения органов. Вот почему важно обладать знаниями о токсикокинетике яда.
В случаях массивных передозировок пути элиминации с ограниченной емкостью часто насыщаются. Препаратами, демонстрирующими концентрационно-зависимую токсикокинетику при передозировке, являются этанол, салицилаты, фенитоин, хлоралгидрат, этхлорвинол, некоторые барбитураты, теофиллин и ацетаминофен. В случае отравления этими средствами методы усиления элиминации, содействующие общему очищению организма, могут значительно улучшить клинический исход.
А. Методы, имеющиеся в распоряжении
1. Теоретически использование процедуры диализа, включая перитонеальный диализ, гемодиализ и гемоперфузию, необходимо для удаления токси
нов, выводимых метаболическими механизмами, которые нельзя усилить.
2. Почечную элиминацию немногих токсинов можно усилить изменением pH мочи. Подщелачивание мочи полезно в случаях передозировки салицилатов или фенобарбитала. Форсированный диурез с введением чрезмерных объемов жидкости повышает риск водно-электролитного дисбаланса и ухудшения функции легких.
Б. Диализ (табл. 60-4)
1. Перитонеальный диализ. Это относительно простой и доступный метод. Однако он неэффективен для удаления большинства препаратов.
2. Гемодиализ. Гемодиализ более эффективен, чем перитонеальный диализ, и хорошо изучен. Он содействует коррекции водно-электролитного дисбаланса, а также может усиливать удаление токсических метаболитов, например формиатов в случае отравления метанолом. Эффективность перитонеального и гемодиализа зависит от молекулярной массы, водорастворимости, степени связывания с белками, эндогенного клиренса и распределения в организме выводимого токсина. Удаление препаратов этими методами может быть активировано путем увеличения времени диализа или изменения диализирующего средства для связывания токсина. Однако при увеличении продолжительности времени диализа повышается также риск осложнений от этих процедур. Гемодиализ особенно полезен в случаях передозировок с водным и электролитным дисбалансом или когда токсические побочные продукты удалимы.
В. Гемоперфузия. В последние 5 лет для лечения лекарственной передозировки все шире используется гемоперфузия. Кровь откачивается от пациента по венозному катетеру через колонку адсорбирующего материала и затем возвращается к больному. Для предотвращения свертывания крови в картридже необходима системная антикоагуляция гепарином. Гемоперфузия не восстанавливает водно-электролитный баланс и не удаляет всех токсичных продуктов. Тем не менее она может удалить многие высокомолекулярные токсины, слаборастворимые в воде, поскольку перфузионный картридж имеет большую площадь адсорбирующей поверхности, которая прямо перфузируется кровью и не задерживается мембранами. Факторами, лимитирующими скорость удаления токсина при гемоперфузии, являются аффинитет адсорбирующей смолы к препарату, скорость тока крови через кар
тридж и скорость выравнивания содержания препарата в периферических тканях и крови. В настоящее время изучаются возможности использования различных картриджей при отравлениях.
Хотя в этом отношении исследовано относительно немного токсинов, показано, что гемоперфузия может обеспечить полное очищение организма от салицилатов, фенитоина, этхлорвинола, фенобарбитала, теофиллина и карбамазепина. Такие осложнения, как эмболизация адсорбентом, убывание клеток крови, удаление белков, растворов и стероидов, постепенно минимизируются по мере приобретения клинического опыта.
Г. Выбор используемого метода. Препараты или токсины с чрезмерно высоким объемом распределения, в частности трициклические антидепрессанты и дигоксин, слабо удаляются гемодиализом или гемоперфузией. Поэтому до проведения диализных процедур требуется критический анализ кинетических параметров и возможностей диализа. В табл. 60-4 перечислены случаи, требующие немедленного диализа, те, при которых он используется лишь тогда, когда поддерживающие мероприятия недостаточны, и те, для которых диализ не показан. В токсикологической лаборатории должны измеряться уровни метанола, этиленгликоля, салицилатов, теофиллина, фенобарбитала, параквата и лития в крови в ходе диализа.
Проблемы усиления элиминации хорошо иллюстрируются при интоксикации фенциклидином. Исследования на лабораторных животных подтвердили ограниченность почечного клиренса и малый эффект от изменения pH крови для распределения этого препарата. Тем не менее было показано, что закисление мочи увеличивает его почечный клиренс. Отсасывание из желудка повышает диффузию из плазмы фенциклидина в содержимое желудка. На основании этих предварительных данных большое число пациентов получило лечение закислением мочи и отсасыванием из желудка, но с малыми доказательствами эффективности этого метода. Так как интоксикация фенциклидином имеет волнообразную клиническую картину, трудно оценить улучшение состояния больного. Поскольку отравление фенциклидином сопровождается мышечной деструкцией и экскрецией миоглобина с мочой, несоответствующее закисление мочи может увеличить вероятность преципитации миоглобина в почечных канальцах, повышая тем самым вероятность развития почечной недостаточности.
Лечение укусов змей, пауков и скорпионов
Яды некоторых змей и скорпионов, а для очень маленьких детей и яд паука “черная вдова” представляют собой серьезную токсикологическую опасность. Для США весьма актуальны укусы гремучей змеи из-за значительного количества поступающего яда, его высокой токсичности и того факта, что жертва в момент укуса может находиться далеко от медицинского учреждения.
А. Укус гремучей змеи. Признаки укуса гремучей змеи включают локальное кровотечение, сильную боль, быстро начинающийся и прогрессирующий поверхностный отек, формирование гематомы, лимфаденит и явные следы зубов. Многие исследования показали, что обычно применяемые на месте экстренные средства (надрез и отсасывание, пережатие и прикладывание льда) являются скорее вредными, чем полезными. С другой стороны, избегание ненужных движений помогает ограничить распространение яда. Действенная терапия включает введение противоядия и должна начинаться как можно скорее.
Перед назначением противоядия должна быть определена группа крови и ее перекрестная совместимость. Необходимо следить за временем свертывания и кровотечения. Дозу противоядия устанавливают в соответствии с наличием и скоростью прогрессирования признаков системной интоксикации: тошноты, рвоты, парестезии, геморрагических расстройств, шока, аритмии, почечной недостаточности и отека легких. При тяжелом состоянии после укуса гремучей змеи необходимо назначить по крайней мере пять флаконов противоядия; могут потребоваться и 10—20 флаконов. Через 10-12 дней после лечения с использованием больших доз противоядия часто развиваются признаки сывороточной болезни. Для определения чувствительности к лошадиной сыворотке обычно делается кожная проба, но негативный тест не гарантирует от анафилаксии. При тяжелой сывороточной болезни эффективны только стероиды.
Общие ошибки в лечении отравлений
Представления об “универсальном антидоте” (жженый хлеб, оксид магния, таниновая кислота) бесполезны и могут быть опасны. Если используется сироп ипекакуаны, он должен даваться сразу,
еще до прибытия в госпиталь или во время диагностических процедур в кабинете неотложной помощи. Клинический опыт, особенно в педиатрии, подтверждает, что ипекакуану может назначать лицо без медицинского образования, особенно если его инструктирует по телефону врач.
В прошлом принятые внутрь кислоты или щелочи нейтрализовывали, однако это приводит к выделению тепла и увеличивает разрушение тканей. Поэтому предпочтительной является процедура разбавления. Для этой цели можно использовать обильные количества молока или воды (до 15 мл/кг). Стимуляция рвоты раздражением пальцами глотки, солями меди или гипертоническим раствором соли может повредить рот и пищевод. Использование слабительных средств на масляной основе может вызвать липидную пневмонию. Жидкости для промывания желудка, содержащие большие количества натрия и фосфата, способны спровоцировать тяжелый дисбаланс электролитов. Чрезмерная гидратация ухудшает функцию легких. Большие количества глюкозы могут понижать уровень фосфатов и калия. Стимуляторы дыхания и аналептические средства бесполезны и даже опасны при отравлениях.
Необходим мониторинг функций почек и печени. Мышечная деструкция (рабдомиолиз) может привести к острой почечной недостаточности. Необдуманное подкисление мочи повышает вероятность почечной недостаточности, вызванной деструкцией мышц и экскрецией миоглобина. Катетеры в вене, артерии или мочевом пузыре могут стать источником инфекции. Большие количества жидкости комнатной температуры или процедура диализа могут понизить температуру тела и ухудшить сердечно-сосудистую функцию. Соответствующая поддерживающая терапия иногда приводит к физиологическому выживанию больного с неврологическими нарушениями. В любом случае, особенно при передозировке гипно-седативных средств, необходима крайняя осторожность в диагностике смерти мозга: такие пациенты могут пробудиться после многих дней отсутствия ЭЭГ-активности.
Избранная литература
Ellenchorn M.J., Barcelou D. G. Medical Toxicology.
Diagnosis and Human Poisoning. Elsevier, 1988.
Goldfrank L. R. et al. (eds). Toxicologic Emergencies, 5th ed. Appleton & Lange, 1993.
Раздел X.
Специальные темы
Специальные аспекты перинатальной 6"|
и педиатрической фармакологии
Гидеон Корен, Мартин С. Коэн
Действие препаратов на плод и новорожденного младенца основывается на общих принципах, приведенных в главах 1-4. Тем не менее физиологические условия, в которых реализуются эти фармакологические законы, отличаются у беременных женщин и быстро развивающихся детей раннего возраста. В настоящее время начинают осознаваться особенности фармакокинетики у этих пациентов, в то время как информация относительно фармакодинамических отличий (например, характеристики и реакции рецепторов) пока еще очень предварительна. В этой главе сформулированы основные фармакологические принципы в специальном контексте перинатальной и педиатрической фармакологии.
Лекарственная терапия при беременности
Фармакокинетика
Большинство лекарств, принимаемых беременными, способно проникать через плаценту и оказывать на развивающийся эмбрион и плод фармакологическое и тератогенное действие. На плацентарный перенос и действие препаратов на плод влияют следующие критические факторы: 1) физико-химические свойства препарата; 2) скорость, с которой препарат проходит через плаценту, и количе
ство препарата, поступающего к плоду; 3) длительность воздействия препарата; 4) характеристики его распределения в различные ткани плода; 5) стадия плацентарного и плодного развития ко времени воздействия лекарства; 6) эффекты комбинированного использования препаратов.
А. Жирорастворимость. Как и в случае с другими биологическими мембранами, прохождение лекарства через плаценту зависит от жирорастворимости и степени ионизации препарата. Липофильные средства быстро диффундируют через плаценту и поступают в кровообращение плода. Так, тиопентал — препарат, широко применяемый при кесаревом сечении, пересекает плаценту почти немедленно и может вызвать седацию или апноэ у новорожденного. Высокоионизированные препараты, такие как сукцинилхолин (дитилин) и тубоку-рарин, также используемые при кесаревом сечении, медленно проникают через плаценту и попадают в плод в очень низких концентрациях. Непроницаемость плаценты для полярных соединений скорее относительна, чем абсолютна. Если градиент концентраций мать-плод достаточно высок, полярные соединения пересекают плаценту в измеримых количествах. Салицилаты, почти полностью ионизированные при физиологических значениях pH, быстро пересекают плаценту. Это происходит потому, что небольшие количества неионизированных салицилатов являются высоко жирорастворимыми.
Б. Размер молекул. Молекулярная масса также влияет на скорость переноса и количество препарата, проходящего через плаценту. Средства с мол. м. 250-500 могут легко пересекать плаценту в зависимости от их жирорастворимости и степени ионизации. Препараты с мол. м. 500-1000 пересекают плаценту с большим трудом, а лекарства с мол. м. более 1000 — очень плохо. Важным клиническим приложением этих свойств является выбор гепарина как антикоагулянта у беременных. Поскольку он представляет собой очень большую (и полярную) молекулу, гепарин не способен пересекать плаценту. В отличие от варфарина, который тератогенен и не должен назначаться в течение первого триместра, гепарин можно без опасения вводить беременным, нуждающимся в снижении свертываемости крови. Очевидными исключениями из “правила размера” являются материнские глобулины-анти-тела и определенные полипептиды, которые проникают через плаценту каким-то пока не идентифицированным селективным механизмом.
В. Связывание с белками. Степень связывания лекарства с белками плазмы (особенно с альбуминами) может также влиять на скорость переноса и количество перенесенного вещества. Однако, если соединение является высоко жирорастворимым (например, некоторые газообразные анестетики), эти показатели не будут сильно зависеть от связывания с белками. Перенос таких более жирорастворимых средств и скорость выравнивания концентраций больше зависят от плацентарного кровотока (и пропорциональны ему). Это обусловлено тем, что жирорастворимые препараты диффундируют через плацентарный барьер так быстро, что скорость выравнивания концентраций не зависит от уровней свободного препарата, ставших равными по обе стороны. Если препарат слабо растворим в жирах и ионизирован, его перенос идет медленно и, очевидно, будет задерживаться связыванием препарата с белками плазмы матери. Имеет значение также различная степень связывания с протеинами, поскольку некоторые препараты связываются с белками плазмы матери сильнее, чем в плазме плода, из-за пониженной связывающей активности фетальных протеинов. Это характерно для сульфаниламидов, барбитуратов, фенитоина и местноанестезирующих средств.
Г. Плацентарный и плодный метаболизм препаратов. Защитить плод от лекарств, принимаемых матерью, помогают два механизма. Во-первых, соб
ственно плацента играет роль не только полупроницаемого барьера, но и места метаболизма некоторых средств, проходящих через нее. Установлено, что в ткани плаценты происходят отдельные реакции различных видов ароматического окисления (например, гидроксилирования, N-деалкилирова-ния, деметилирования). Этим путем окисляются этанол и пентобарбитал. Возможно, метаболическая активность плаценты приводит к образованию токсичных метаболитов, и следовательно, плацента может увеличивать токсичность (например, этанола, бензпиренов). Во-вторых, препараты, которые проникли через плаценту, поступают в систему кровообращения плода через пупочную вену. Примерно 40-60 % кровотока пупочной вены поступает в печень плода; остаток минует печень и поступает в системное кровообращение. Препарат, который поступает в печень, может частично метаболизироваться здесь до его поступления в кровообращение плода. Кроме того, большое количество препарата, присутствующего в пупочной артерии (возвращающегося в плаценту), может переводиться через плаценту обратно в пупочную вену и снова в печень. Еще раз отметим, что метаболиты некоторых препаратов могут быть более активны, чем исходное соединение, и негативно воздействовать на плод.
Фармакодинамика
А. Действие препаратов на организм матери. Эффекты препаратов в отношении репродуктивных органов (молочная железа, матка и др.) иногда изменяются эндокринными условиями, соответствующими стадии беременности. Эффекты лекарств в отношении других тканей матери (сердце, легкие, почки, центральная нервная система и пр.) при беременности значительно не изменяются, хотя изменившиеся физиологические условия (сердечный выброс, почечный кровоток) могут потребовать применения препаратов, в которых та же женщина не нуждается вне беременности. Например, при застойной сердечной недостаточности, вызванной повышением нагрузки на сердце при беременности, могут быть необходимы сердечные гликозиды и диуретики, а при диабете беременных для контроля концентрации глюкозы в крови может понадобиться инсулин.
Б. Терапевтическое действие средств на плод. Терапия плода является развивающейся областью перинатальной фармакологии. Она состоит в на
значении препарата беременной, когда плод является лекарственной мишенью. В настоящее время, если ожидаются преждевременные роды, для стимуляции созревания легких плода применяются кортикостероиды. Фенобарбитал при назначении беременным перед родами может индуцировать ферменты печени плода, ответственные за глюку-ронизацию билирубина, что снижает вероятность желтухи у новорожденных. Недавно было выявлено, что применение фенобарбитала матерью понижает риск внутричерепного кровотечения плода у недоношенных детей. Для лечения сердечных аритмий у плода матерям назначают противоарит-мические средства.
В. Предсказуемое токсическое влияние препаратов на плод. Хроническое использование матерью опиоидов может вызвать зависимость у плода и новорожденного. Эта зависимость обычно проявляется после родов как неонатальный абстинентный синдром. Менее изучена лекарственная токсичность для плода, вызванная использованием ингибиторов ангиотензинпревращающего фермента в течение беременности. Эти препараты могут привести к значительному и необратимому повреждению почек у плода и поэтому противопоказаны беременным. Побочные эффекты могут быть и отсроченными, как в случае воздействия диэтилстильбэ-строла (ДЭС) на плод-девочку, у которой повышается риск возникновения аденокарциномы влагалища после полового созревания.
Г. Тератогенное действие препаратов. Однократное внутриматочное воздействие препарата способно затронуть структуры плода, претерпевающие в это время быстрое развитие. Талидомид является примером препарата, который может сильно поражать развитие конечностей после кратковременного воздействия, если оно происходит на решающей стадии развития конечностей. Риск та-лидомидной фокомелии приходится на период с четвертой по седьмую недели беременности, поскольку в течение этого времени развиваются руки и ноги (рис. 61-1).
Механизмы, посредством которых различные препараты вызывают тератогенные эффекты, мало понятны и, по-видимому, являются многофакторными. Например, препараты могут оказывать прямое действие на материнские ткани с развитием вторичного (непрямого) действия на ткани плода. Лекарства могут нарушать проникновение кислорода или питательных веществ через плаценту и поэто
му влиять на наиболее быстро метаболизирующие ткани плода. Наконец, препараты могут оказывать выраженное прямое действие на процессы дифференциации в развивающихся тканях. Например, установлено, что витамин А (ретинол) имеет значительное направленное на дифференциацию в нормальных тканях действие. Некоторые аналоги витамина А (изотретиноин, этретинат) являются мощными тератогенами, что подтверждает их способность изменять процессы дифференцировки. Наконец, при некоторых видах нарушений играет роль, вероятно, дефицит ключевого вещества. Так, добавление фолиевой кислоты во время беременности способствует снижению риска появления дефектов нервной трубки, например spina bifida.
Продолжительное воздействие тератогена может привести к кумуляции эффекта или поражению многих органов, проходящих через различные стадии развития. Хроническое потребление высоких доз этанола в течение беременности, особенно в течение первого и второго триместров, может вызвать алкогольный синдром плода (глава 22). При этом синдроме поражаются центральная нервная система, рост и развитие лица.
Для заключения о тератогенности предполагаемого вещества или процесса необходимо, чтобы оно: 1) приводило к характерному набору уродств, указывающему на селективность для определенных органов-мишеней; 2) давало свои эффекты на определенной стадии развития плода, то есть в течение ограниченного временного периода органогенеза органов-мишеней (рис. 61-1); 3) имело дозо-зависимость. В табл. 61-1 перечислены некоторые препараты, известные как тератогены или имеющие другие побочные эффекты в период беременности.
Лекарственная терапия у младенцев и детей
Физиологические процессы, которые влияют на фармакокинетические переменные младенцев, значительно изменяются в первый год жизни, особенно в первые несколько месяцев. Поэтому особое внимание должно быть оказано фармакокинетике данной возрастной группы. Фармакодинамические различия между педиатрическими и другими пациентами детально не исследованы и, вероятно, незначительны, исключая касающихся специфических тканей-мишеней, которые созревают к рождению
Рис. 61-1. Схематическая диаграмма критических периодов развития человека (По: Мооге К. L. The Developing Human, Clinically Oriented Embriology, 4th ed. Saunders, 1988.)
532 _____Раздел X. Специальные темы
Глаза
1 Ноги
ТАБЛИЦА 61-1. Лекарства со значительным негативным влиянием на плод
Лекарство Триместр Эффект
Ингибиторы АПФ Все,особенно второй и третий Поражение почек
Аминоптерин Первый Множественные тяжелые аномалии
Аминогликозиды Все Токсичность в отношении восьмой пары черепных нервов
Амфетамины Все Кистозные поражения коры головного мозга, нарушенный ход развития, пониженная успеваемость в школе
Андрогены Второй и третий Маскулинизация женского плода
Трициклические антидепрессанты Первый Третий Отдельные сообщения о врожденных аномалиях, обусловленных использованием имипрамина, амитриптилина и нортриптилина Неонатальные симптомы отмены описаны для кломипрамина, дезип-рамина и имипрамина
Барбитураты Все Первый Хроническое применение может привести к неонатальной зависимости Некоторые свидетельства повышения случаев врожденных уродств
Бусульфан Все Различные врожденные уродства; низкая масса тела при рождении
Хлорамбуцил Все Аномалии мочеполового тракта
Хлорамфеникол Третий Повышенный риск синдрома серого младенца
Хлорпропамид Все Пролонгированная симптоматическая неонатальная гипогликемия
Кломипрамин Третий Неонатальная летаргия, гипотония, цианоз, гипотермия
Кокаин Все Повышенный риск спонтанного аборта, отслоения плаценты и преждевременных схваток; неонатальный инфаркт мозга, кистозные поражения коры, нарушенное развитие и пониженная успеваемость в школе
Кортизон Первый Повышенный риск расщепленного нёба
Циклофосфамид Первый Различные врожденные уродства
Цитарабин Первый, второй Различные врожденные аномалии
Диазепам Все Хроническое применение ведет к неонатальной зависимости
Диэтилстильбэстрол Все Аденоз влагалища, очевидная клеточная аденокарцинома влагалища
Дисульфирам Первый Уродства нижних конечностей, “VACTERL” синдром'
Этанол Все Высокий риск фетального алкогольного синдрома
Этретинат Все Чрезвычайно высокий риск множественных врожденных уродств
Героин Все Хроническое применение ведет к неонатальной зависимости
Гидрофлуметиазид Первый Некоторые свидетельства повышенного риска врожденных уродств
Йодиды Все Врожденный зоб, гипотиреоидизм
Изотретиноин Все Чрезвычайно высокий риск врожденных аномалий
Литий Первый Сердечно-сосудистые дефекты
Метадон Все Хроническое применение ведет к неонатальной зависимости
Метотрексат Первый Множественные врожденные уродства
Метилтиоурацил Все Гипотиреоидизм
Метронидазол Первый Возможно, мутаген (по исследованиям на животных; нет свидетельств мутагенных или тератогенных эффектов у человека)
Пеницилламин Первый Cutis laxa, другие врожденные уродства
Фенциклидин Все Изменения при неврологическом обследовании, слабо выраженный сосательный рефлекс и плохой аппетит
ТАБЛИЦА 61 -1. (Продолжение)
Лекарство Триместр Эффект
Фенитоин Все Расщепленные губа и нёбо
Прогестины Все Нарушения развития половых органов, дефекты сердца и сосудов
Пропилтиоурацил Все Врожденный зоб
Тамоксифен Все Высокий риск спонтанного аборта или поражения плода
Тетрациклин Все Обесцвечивание и дефекты зубов и нарушенный рост костей
Талидомид Первый Фокомелия (укорочение или отсутствие длинных костей конечностей)
Триметадион Все Множественные врожденные аномалии
Вакцины, живые вирусы Все Риск инфицирования плода ослабленным вирусом
Вальпроевая кислота Все Различные врожденные аномалии, особенно spina bifida
Варфарин Первый Гипоплазия седла носа, хондродисплазия
Третий Риск кровотечения. Прекратить использование за месяц до родов
1 VACTERL — Vertebral anomalies, Anal atresia, Cardiovascular anomalies, Tracheo-Esophageal fistula, Renal anomalies, Limb defects (аномалии позвоночника, атрезия ануса, сердечно-сосудистые аномалии, трахеально-пищеводная фистула, аномалии почек, дефекты конечностей).
или вскоре после него (например, закрытие артериального протока).
Всасывание лекарств
Всасывание препаратов у младенцев происхо-доит по тем же общим принципам, что и у взрослых. К основным факторам, влияющим на всасывание препарата, относятся кровоток в месте введения, который определяется физиологическим статусом младенца или ребенка, а для назначаемых внутрь препаратов — желудочно-кишечная функция, которая быстро изменяется в течение первых нескольких дней после рождения. Возраст от момента рождения тоже влияет на регуляцию всасывания препаратов.
А. Кровоток в месте введения. Всасывание после внутримышечной или подкожной инъекции у новорожденных, как и у взрослых, зависит в основном от скорости кровотока в мышце или в подкожной области введения. Физиологические состояния, которые могут снизить кровоток в данных областях,— это сердечно-сосудистый шок, сужение сосудов, вызванное симпатомиметическими средствами, и сердечная недостаточность. Обычно больные недоношенные дети, нуждающиеся во внутримышечных инъекциях, имеют очень малую мышечную массу. Это еще более осложняется уменьшением периферической перфузии в данных областях. В таких случаях всасывание становится труднопредсказуемым, поскольку препарат может оставаться в
мышце и всасываться более медленно, чем ожидалось. Если вдруг перфузия улучшается, возможно быстрое и неожиданное повышение количества препарата, поступающего в циркуляцию, приводящее к высоким и потенциально токсическим концентрациям лекарства. Примерами препаратов, особенно опасных в таких ситуациях, являются сердечные гликозиды, аминогликозидные антибиотики и антиконвульсанты.
Б. Желудочно-кишечная функция. В короткий период после рождения в желудочно-кишечном тракте новорожденного происходят значительные биохимические и физиологические изменения. У доношенных детей вскоре после рождения в течение нескольких часов увеличивается кислотная секреция в желудке. У недоношенных младенцев секреция кислоты в желудке происходит более медленно, достигая наиболее высоких концентраций на четвертый день жизни. Поэтому препараты, которые частично или полностью инактивируются при низком pH желудочного содержимого, не должны назначаться внутрь.
Время освобождения желудка в первый день или первые несколько дней жизни увеличено до 6-8 часов. Поэтому препараты, которые абсорбируются преимущественно в желудке, всасываются более полно, чем предполагается. В случае, если препараты абсорбируются в тонком кишечнике, терапевтический эффект может запаздывать. Перистальтика у новорожденных нерегулярная и может быть ослаблена. Количество препарата, всасывающегося в
тонком кишечнике, поэтому непредсказуемо. При ослабленной перистальтике тике может абсорбироваться большее, чем обычно, количество препарата, в результате чего стандартная доза становится потенциально токсичной. В табл. 61-2 представлены данные по энтеральной биодоступности различных препаратов у новорожденных в сравнении с более старшими детьми и взрослыми. Повышение перистальтики, например при диарее, ведет к понижению объемов всасывания, так как уменьшается время контакта с абсорбирующей поверхностью кишечника.
У новорожденных имеется тенденция к более низкой, чем у взрослых, активности ферментов желудка и кишечника. Активность а-амилазы и других панкреатических ферментов у новорожденных и детей до 4-месячного возраста снижена. Новорожденные имеют также низкую концентрацию желчных кислот и активность липазы, что понижает всасывание жирорастворимых препаратов.
Распределение лекарств
Поскольку в процессе развития организм изменяется, объемы распределения препаратов также меняются. Новорожденные имеют более высокий процент содержания воды от массы тела (70-75 %), чем взрослые (50-60 %). Могут наблюдаться также различия между доношенными (70 % массы тела составляет вода) и недоношенными младенцами (85 % воды от массы тела). Подобным же образом внеклеточная жидкость составляет у младенцев
ТАБЛИЦА 61 -2. Абсорбция (биодоступность) различных препаратов, назначаемых внутрь, у новорожденных в сравнении с более старшими детьми и взрослыми
Препарат Абсорбция при приеме внутрь
Ацетаминофен Понижена
Ампициллин Повышена
Диазепам Нормальная
Дигоксин Нормальная
Пенициллин G Повышена
Фенобарбитал Понижена
Фенитоин Понижена
Сульфаниламиды Нормальная
40 % массы тела по сравнению с 20 % у взрослых. У большинства новорожденных диурез появляется в первые 24-48 часов жизни. Многие препараты распределяются через внеклеточную жидкость, поэтому ее объем важен для определения концентрации препарата в области рецепторов. Это особенно существенно для водорастворимых лекарств (таких как аминогликозиды) и в меньшей степени — для жирорастворимых средств.
Недоношенные младенцы имеют значительно меньше жиров, чем доношенные. В сумме жиры тела у недоношенных младенцев составляют приблизительно 1 % общей массы тела по сравнению с 15 % у доношенных новорожденных. В связи с этим у недоношенных младенцев жирорастворимые средства накапливаются в меньших количествах, чем у старших детей и взрослых.
Другим важным фактором, влияющим на распределение препаратов, является их связывание белками плазмы. Наибольшей связывающей способностью обладает альбумин. Как правило, связывание препаратов белками у новорожденных снижено. Это наблюдается при применении местноанестезирующих препаратов, диазепама, фенитоина, ампициллина и фенобарбитала. Поэтому концентрация свободного (несвязанного) лекарства в плазме повышается. Поскольку именно свободный препарат дает фармакологический эффект, это может привести к усилению действия препарата или даже к проявлениям токсичности, несмотря на нормальную или даже низкую общую концентрацию в плазме (связанного плюс несвязанного лекарства). Рассмотрим это положение на примере диазепама. Его терапевтическая концентрация в плазме составляет 300 мкг/л. Если у старших детей и взрослых диазепам на 98 % связан с протеинами, то концентрация свободного препарата составляет 6 мкг/л. Предположим, что эта концентрация свободного препарата производит у пациентов желаемый эффект, не вызывая токсичности. Однако, если он дается недоношенному младенцу в дозе, подобранной по массе тела, и она обеспечивает создание суммарной концентрации препарата 300 мкг/л, а связывание с белками составляет только 90 %, тогда концентрация свободного препарата будет 30 мкг/л, что в пять раз больше, чем у взрослых! Хотя при более высокой свободной концентрации происходит более быстрая элиминация (глава 3), эта концентрация изначально может быть очень токсичной.
Некоторые препараты конкурируют с билирубином плазмы за связывание с альбумином. Лекарства, назначаемые новорожденным с желтухой, способны вытеснять билирубин из связи с альбуминами. Из-за более высокой проницаемости гематоэнцефалического барьера у новорожденных существенные количества билирубина могут проникать в головной мозг и вызывать билирубиновую энцефалопатию. Фактически это наблюдалось, когда недоношенным младенцам назначались сульфаниламидные антибактериальные препараты в качестве профилактики против сепсиса. Напротив, если содержание плазменного билирубина возрастает по физиологическим причинам или из-за несовместимости группы крови, билирубин может вытеснять препарат из связи с альбумином и существенно повышать его свободную концентрацию. Это может произойти без изменения общей концентрации препарата и усилить его терапевтический эффект или привести к токсичности. Такие случаи известны для фенитоина.
Метаболизм лекарственных средств
Метаболизм большинства препаратов происходит в печени (глава 4). Метаболическая активность цитохром Р-450-зависимой оксидазы смешанной функции и сопрягающих ферментов в раннем неонатальном периоде жизни существенно снижена (50-70 % от значений у взрослых). Период развития, когда ферментативная активность максимально зависит от специфических ферментативных систем, не определен. Образование глюкуронидов (на килограмм массы тела) достигает уровня взрослых между третьим и четвертым годами жизни. По причине низкой скорости метаболизма препаратов у новорожденных многие из лекарств медленно элиминируются и имеют длительный период полувыведения. Если не учитывать незрелость новорожденных, при приеме препаратов, метаболизирующихся в печени, возможно развитие токсических эффектов. В табл. 61-3 продемонстрировано^ как могут различаться периоды полувыведенйя лекарств у новорожденных и взрослых и Как понижается этот показатель для фенобарбитала и фенитоина, когда новорожденные подрастают. При назначении препаратов детям этой возрастной групйы (особенно на длительный период) должен учитываться процесс созревания.
ТАБЛИЦА 61-3. Периоды полувыаедения различных лекарств у новорожденных и взрослых
Лекарство Неонатальный возраст tl/2 у новорожденных (часы) tl/2 у взрослых (часы)
Ацетаминофен 2.2-5 1.9-2.2
Диазепам 25-100 40-50
Дигоксин 60-70 30-60
Фенобарбитал 0-5 дней 200 64-140
5-15 дней 100
1-30 месяцев 50
Фенитоин 0-2 дня 80 12-18
3-14 дней 18
14-50 дней 6
Салицилаты 4.5-11 10-15
Теофиллин Новорожденный 13-26 5-10
Ребенок 3-4
Для новорожденного важно, принимала или нет его мать препараты, способные индуцировать раннее созревание ферментов печени у плода (такие как фенобарбитал). В таком случае способность новорожденных метаболизировать определенные препараты будет больше, чем ожидается. При этом терапевтический эффект менее выражен, а концентрация препаратов в плазме более низкая, чем обычно характерно для неонатального периода.
Выделение лекарственных средств
Скорость гломерулярной фильтрации у новорожденных намного ниже, чем у младенцев, детей или взрослых, и это ограничение сохраняется в течение нескольких первых дней жизни. Фильтрация клубочков, рассчитанная по площади поверхности, составляет у новорожденных только 30-40 % от значений для взрослых. Еще ниже скорость гломерулярной фильтрации у младенцев, рожденных до 34 недель беременности. Функция значительно усиливается в течение первой недели жизни. В это время скорость гломерулярной фильтрации и почечного плазмотока повышается на 50 % по сравнению с первым днем. В конце третьей недели гломерулярная фильтрация составляет уже 50-60 % от взрослого уровня; через 6-12 месяцев она достигает значений, характерных для взрослых (на единицу пло
щади поверхности). Поэтому препараты, элиминация которых зависит от функции почек, выводятся из организма в первые недели жизни очень медленно.
Пенициллины, например, выводятся недоношенными младенцами на уровне 17 % от значений у взрослых, если учитывать площади поверхности, и на уровне 34 % при сравнении по массетела. Дозы ампициллина для новорожденных в возрасте до 7 дней составляют 50-100 мг/кг/сут в два приема с 12-часовыми интервалами. Дозы для младенцев старше 7 дней составляет 100-200мг/кг/сутвтриприемас 8-часовыми интервалами. Пониженная скорость почечной элиминации у новорожденных наблюдается также при назначении аминогликозидных антибиотиков (канамицина, гентамицина, неомицина, стрептомицина). Дозировка гентамицина для младенцев в возрасте до 7 дней составляет 5 мг/кг/сут в два приема с 12-часовыми интервалами, для младенцев старше 7 дней — 7.5 мг/кг/сут в три приема с 8-часовыми интервалами. Общий клиренс для дигоксина прямо зависит от адекватности почечной функции; при снижении почечной фильтрации возможна кумуляция препарата. У больных младенцев почечная функция может не повышаться до предсказанной величины в течение первых недель и месяцев жизни, поэтому соответствующая коррекциядозы и схемы назначения бывает затруднительной. В этой ситуации коррекцию следует производить на осно-везамеров концентрации препарата в плазме, проводимых в ходе терапии.
Особенности фармакодинамики у новорожденных
Адекватное применение препаратов позволяет выживать новорожденным с тяжелыми нарушениями, которые в противном случае умерли бы в пределах нескольких дней или недель после рождения. Например, назначение индометацина (глава 35) вызывает быстрое закрытие просвета артериального протока у младенцев с нормальным сердцем, для чего в противном случае потребовалось бы хирургическое вмешательство. Напротив, инфузия простагландина Ei оставляет открытым проток, что может сохранить жизнь младенцам с транспозицией главных сосудов или тетрадой Фалло (глава 18). Недавно описан неожиданный эффект такой инфузии ПГЕ|. Препарат вызвал антральную гиперплазию с нарушением эвакуации содержимого желуд
ка у 6 из 74 младенцев, получавших его (Peled et al„ 1992). Этот феномен, по-видимому, дозозависим.
Лекарственные формы и соблюдение режима приема в педиатрии
Лекарственные формы, в которых выпускаются препараты, и способ, которым родители дают препарат детям, определяют действительно вводимую дозу. Многие препараты готовят для детей в форме эликсиров или суспензий. Эликсиры представляют собой спиртовые растворы, в которых растворены и равномерно распределены молекулы препарата. Встряхивания перед употреблением не требуется и, если часть средства не испаряется, первая и последняя дозы из бутылки должны содержать равные количества препарата.
Суспензии содержат нерастворимые частицы препарата, которые распределяются равномерно по всему объему после взбалтывания. Если встряхивание производится не строго каждый раз при приеме лекарства, первая доза из бутылки может содержать меньше препарата, чем последние дозы, в результате чего в начале курса терапии достигается меньшая, чем предполагалось, концентрация в плазме и наблюдается меньший эффект лекарства. Напротив, в конце курса терапии, когда это не ожидается, может развиться токсичность. Такое неравное распределение является возможной причиной неэффективности или токсичности суспензии фенитоина у детей. По этой причине врач, выписывающий лекарство, должен знать форму, в которой отпускается препарат, и дать соответствующую инструкцию фармацевту и пациенту или родителям.
Соблюдения дозировки, возможно, более трудно достигнуть в педиатрической практике, чем в какой-либо другой, поскольку оно зависит не только от добросовестных усилий родителей следовать предписаниям, но и от ошибок измерений, проливания и выплевывания. Например, измеренный объем “чайной ложки” колеблется от 2.5 до 7.8 мл. Родители должны получить калиброванную медицинскую ложку или шприц из аптеки. Это улучшает точность измерения дозы и упрощает назначение препаратов детям.
При оценке соблюдения дозирования часто полезно спросить, делалась ли попытка дать другую дозу после того, как ребенок пролил половину от
того, что было предложено. Родители не всегда способны сказать с уверенностью, какую дозу ребенок получил в действительности. Необходимо рассказать родителям, будить или нет ребенка днем или ночью для получения очередной 6-часовой дозы. Эти вопросы нужно обсудить и прояснить, не должно остаться сомнений в том, что родители могут или не могут делать. Несоблюдение предписаний часто случается, когда для лечения среднего отита или инфекций мочевого тракта выписывают антибиотики и дети начинают чувствовать себя хорошо после четырех или пяти дней терапии. Родители могут не понимать необходимости продолжения приема лекарства, даже если был назначен курс на 10 или 14 дней. Это недопустимо, родителям необходимо рассказать, почему важно продолжить лечение на предписанный период, даже если ребенок кажется излеченным.
В пределах возможного должны выбираться практичные и удобные формы дозирования и схемы введения. Чем легче давать ребенку лекарство и следовать схеме приема, тем аккуратнее будут соблюдаться предписания.
Детям (с учетом их возможностей к пониманию и сотрудничеству) при приеме лекарств необходимо внушать мысль об ответственности за их собственное здоровье. Это должно обсуждаться в доступных терминах как с детьми, так и с родителями. Необходимо также объяснить возможные побочные эффекты и взаимодействие препаратов с лекарствами безрецептурного отпуска или с пищей. Когда терапия не обес-печивает необходимого эффекта, должна приниматься во внимание возможность несоблюдения дозировки. Имеются многочисленныесвидетельстватого, что в таких случаях сообщения родителей или детей могут быть весьма неточными. Незапланированное измерение концентрации в плазме и числатаблетокмо-жет помочь раскрыть несоблюдение предписаний. Очень эффективным для оценки адекватности дозирования оказалось использование компьютеризированных контейнеров таблеток, которые регистрируют каждое открытие крышки.
Использование лекарств в период лактации (табл. 61-4)
Во время лактации лекарства необходимо использовать с осторожностью. Врач должен знать, какие препараты потенциально опасны для вскарм
ливаемого младенца (табл. 61-4). Большинство лекарств, назначаемых лактирующим женщинам, обнаруживается в грудном молоке. К счастью, концентрация препаратов в грудном молоке обычно низка. В связи с этим общее количество, которое может получить младенец в день, значительно ниже, чем то, которое можно принять за “терапевтическую дозу”. Если кормящей матери назначен относительно безопасный препарат, оптимально следует принимать его через 30-60 минут после кормления и за 3-4 часа до следующего кормления. Это дает время для выведения многих препаратов из материнской крови; их концентрация в материнском молоке будет относительно низкой. Необходимо избегать лекарств, о которых неизвестно, безопасны ли они при лактации. В противном случае на время приема препарата прекращают грудное вскармливание.
В грудном молоке обнаруживается большинство антибиотиков, принимаемых кормящими матерями. Концентрация тетрациклина составляет приблизительно 70 % от концентрации в плазме матери, что представляет опасность устойчивого окрашивания зубов у младенцев. Концентрации хлорамфеникола в грудном молоке недостаточны, чтобы вызвать синдром серого младенца, но в дальнейшем имеется вероятность угнетения костного мозга. Поэтому во время лактации следует избегать приема хлорамфеникола. Концентрации изониазида в грудном молоке и в крови матери быстро уравниваются. Его уровень в материнском молоке достаточно высок, чтобы у младенца развился дефицит пиридоксина, если мать не получает пиридоксин дополнительно.
Обычно концентрации седативных и снотворных средств в грудном молоке достаточны, чтобы вызвать фармакологические эффекты у некоторых младенцев. Барбитураты, принятые матерью в снотворных дозах, способны вызвать летаргию, седацию и ослабление сосательного рефлекса у младенца. Хлоралгидрат может привести к седации, если ребенка кормить во время пика концентрации в молоке. Диазепам также имеет седативный эффект у вскармливаемого младенца, но, что еще важнее, вследствие длительного периода его полувыведения возможна значительная кумуляция препарата.
Опиоиды, такие как героин, метадон и морфин, поступают в грудное молоко в количествах, потенциально достаточных для продления состояния неонатальной наркотической зависимости, если
ТАБЛИЦА 61 -4. Часто используемые ао время лактации лекарства и их возможное влияние на вскармливаемого младенца
Лекарство Влияние на младенца Комментарии
Ампициллин Минимальное Незначительные побочные эффекты; возможны случаи диареи или ал-
Аспирин Минимальное лергической сенситизации Случайный прием, вероятно, безопасен; в высоких дозах создает зна-
Вврфарин Минимальное чительную концентрацию в грудном молоке В грудном молоке находятся очень малые количества
Героин Значительное Поступает в грудное молоко и способен продлевать неонатальную нар-
Диазепам Значительное котическую зависимость Вызывает седацию у вскармливаемых грудью младенцев; у новорож-
Дигоксин Минимальное денных может произойти кумуляция В грудное молоко поступают незначительные количества
Дикумарол Минимальное Побочные эффекты не описаны; полезно следить за протромбиновым
Изониазид Минимальное временем младенца Концентрация в молоке равна концентрации в плазме матери. Возмож-
Йод (радиоактивный)Значительное но развитие дефицита пиридоксина у младенца Поступает в грудное молоко в количествах, вызывающих тиреоидную
Канамицин Минимальное супрессию у ребенка Побочные эффекты не описаны
Кодеин Минимальное Побочные эффекты не описвны
Кофеин Минимальное Умеренный прием кофеина безопасен; концентрация в грудном мо-
Литий Значительное локе составляет примерно 1 % от общей дозы, принятой матерью Избегать кормления грудью
Метадон Значительное (См. героин.) Под постоянным врачебным наблюдением грудное вскар-
Оральные Минимальное мливание может быть продолжено. У младенца могут развиться признаки опиатной абстиненции, если мать внезапно прекратит прием метадона или грудное вскармливание В высоких дозах могут подавить лактацию
контрацептивы Пенициллин Минимальное Очень низкие концентрации в грудном молоке
Преднизон Умеренное Низкие дозы, принимаемые матерью (5 мг/сут), вероятно, безопасны.
Пропилтиоурацил Значительное Доз, в 2 раза или более превышающих физиологические количества (> 15 мг/сут), необходимо по возможности избегать Может подавить тиреоидную функцию у младенца
Пропранолол Минимальное В грудное молоко поступают очень малые количества
Спиронолактон Минимальное В грудное молоко поступают очень малые количества
Теофиллин Умеренное Может поступать в грудное молоко в умеренных количествах, но раз-
Тетрациклин Умеренное витие значительных эффектов маловероятно Возможность стойкого окрашивания развивающихся зубов у младен-
Тироксин Минимальное ца. Необходимо избегать в период лактации В терапевтических дозах побочных эффектов не дает
Толбутамид Минимальное Низкие концентрации в грудном молоке
Фенитоин Умеренное Количества, поступающие в грудное молоко, могут быть достаточны-
Фенобарбитал Умеренное ми, чтобы вызвать побочные эффекты у младенца Снотворные дозы могут вызвать седацию у младенца
ТАБЛИЦА 61 -4. (Продолжение)
Лекарство Влияние на младенца Комментарии
Хлоралгидрат Значительное Может вызвать сонливость, если кормление происходит при максимальной концентрации в молоке
Хлорамфеникол Значительное Концентрации слишком малы, чтобы вызвать синдром серого младенца; существует опасность угнетения костного мозга; рекомендуется не принимать хлорамфеникол при грудном вскармливании
Хлоротиазид Минимальное Хлорпромазин Минимальное Этанол Умеренное Побочные эффекты не описаны По-видимому, незначительные Умеренное потребление матерью редко оказывает влияние на младенца; большие количества, принятые матерью, способны вызвать алкоголизацию младенца
мать постоянно принимала препарат в период беременности. В условиях достаточного контроля и хороших взаимоотношений между матерью и врачом ребенка можно вскармливать грудью, пока мать принимает метадон. Она, однако, не должна резко прекращать прием препарата; ребенок может быть отучен от метадона, если мать будет снижать дозы. Необходимо следить за признаками наркотической абстиненции у ребенка.
Сообщений о том, что минимальное употребление алкоголя матерью вредит вскармливаемому младенцу, нет. Чрезмерные же количества алкоголя способны вызвать алкогольные эффекты у ребенка. Уровень никотина в грудном молоке курящих матерей низок и не вредит младенцу. У пьющих кофе матерей в грудное молоко экскретируются очень небольшие количества кофеина.
Литий поступает в молоко в концентрациях, равных концентрациям в плазме матери. Клиренс этого препарата почти полностью зависит от почечной элиминации, и женщины, получающие литий, могут подвергнуть малыша воздействию относительно больших количеств препарата.
Такие препараты, как пропилтиоурацил и толбутамид, поступают в грудное молоко в количествах, достаточных, чтобы повлиять на эндокринную функцию младенца. Их необходимо по возможности избегать или прекращать грудное вскармливание.
Радиоактивные вещества (иодированный 1251-альбумин и радиойодин) способны подавлять тиреоидную функцию у младенцев и могут десятикратно повысить риск последующего развития рака щитовидной железы. Грудное вскармливание в этих случаях противопоказано после больших доз, а пос
ле малых доз от него необходимо воздержаться в течение нескольких дней или недель. Подобным же образом грудного вскармливания следует избегать матерям, получающим противоопухолевую химиотерапию или лечащимся цитостатиками при коллагеновых заболеваниях (например, при красной волчанке) или после трансплантации органов.
Дозирование лекарств в педиатрии
Из-за различий в фармакокинетике у младенцев и детей, простое пропорциональное уменьшение взрослой дозы лекарства может быть недостаточным для расчета безопасной и эффективной педиатрической дозы. Наиболее надежна обычно та информация о педиатрических дозах, которая размещена производителем на вкладыше в упаковке. Если такой информации для назначаемого лекарства нет в наличии, перерасчет может быть сделан с помощью любого из нескольких методов, принимающих во внимание возраст, массу или площадь поверхности тела. Эти правила не точны и не должны использоваться, если производитель предусмотрел педиатрическую дозу. Большинство лекарств, разрешенных к применению у детей, имеют рекомендуемые педиатрические дозы, установленные в основном в миллиграммах на килограмм или на фунт массы тела. При любом способе расчета (по одному из четырех методов, приведенных далее, или в соответствии с рекомендациями производителя) педиатрическая доза никогда не должна превышать взрослую дозу.
Площадь поверхноститела
Расчеты дозы, базирующиеся на возрасте или массе тела, традиционны и имеют тенденцию к преуменьшению требующейся дозы.
Возраст (правило Янга):
„ _ Возраст (годы)
Доза = Взрослая дозах —— ----
н Возраст+12
Масса (правило Кларка, несколько более точное):
Доза = Взрослая доза х
Масса (кг)
70
или
ТАБЛИЦА 61 -5. Определение дозы препарата по площади поверхности тела'Л
Масса тела (кг) (фунт) Приблизительный возраст Площадь поверхности тела (м2) Процент отдозы взрослого
3 6.6 Новорожденный 0.2 12
6 13.2 3 месяца 0.3 18
10 22 1 год 0.45 28
20 44 5.5 года 0.8 48
30 66 9 лет 1 60
40 88 12 лет 1.3 78
50 110 14 лет 1.5 90
60 132 Взрослый 1.7 102
70 154 Взрослый 1.76 103
' По: Silver Н. К., Kempe С. Н., Bruyn Н. В. Handbook of Pediatrics, 14th ed. Lange, 1983.
2 Например, если взрослая доза составляет 1 мг/кг, доза для трехмесячного ребенка должна быть 2 мг/кг (18 % от 70 мг/6 кг).
Доза = Взрослая дозах
Масса (фунты)
150
Более адекватны расчеты, учитывающие площадь поверхности тела (табл. 61-5).
Избранная литература
American Academy of Pediatrics, Committee on Drugs: Emergency drug doses for infants and children. Pediatrics, 1988; 81:462.
Benitz W. E., Tatro D. S. The Pediatric Drug Handbook, 2nd ed. Year Book, 1988.
Briggs G. G., Freeman R. К., Yaffe S. J. Drugs in Pregnancy and Lactation, Williams & Wilkins, 1990.
Morselli P. L. Clinical pharmacology of the perinatal period and early infancy. Clin. Pharmacokinet. 1989; 17 (Suppl): 13.
Roberts R. J. Drug Therapy in Infants: Pharmacologic Principlesand Clinical Experience, Saunders, 1984.
Специальные аспекты гериатрической фармакологии
62
Бертрам Г. Катцунг
Общество часто относит каждого, кто старше 65 лет, к “пожилым”, но большинство авторов полагает, что область гериатрии охватывает лиц старше 75 лет, хотя и это определение слишком произвольно. Кроме того, хронологический возраст является только одной детерминантой специфических эффектов лекарственной терапии, которые наблюдаются у пожилых. У большинства индивидуумов по мере старения происходят важные изменения в реакции на некоторые препараты. С возрастом изменяется также характер использования лекарств как в результате повышения заболеваемости, так и вследствие тенденции к назначению многих лекарственных средств. Общие изменения в жизни пожилого человека значительно влияют на действие используемых препаратов. Среди этих перемен — увеличение частоты сочетанных заболеваний, проблемы с питанием, ограничение финансовых возможностей, а у некоторых пациентов — и несоблюдение режима приема лекарств.
Таким образом, практикующий врач должен быть осведомлен о модификациях фармакологических реакций, которые могут произойти у пожилого человека, и о том, как поступать в этих случаях.
Возрастные фармакологические изменения
Функциональные способности большинства основных систем и органов постепенно снижаются, начиная с наступления зрелости, в течение всей жизни. Как показано на рис. 62-1, имеется не “средневозрастное плато”, а скорее — линейное снижение функций, начинающееся не позднее 45 лет. Однако это лишь усредненные данные, не приложимые к каждому лицу выше определенного воз
раста. Приблизительно одна треть здоровых людей не имеет возрастного снижения, например, в клиренсе креатинина. Таким образом, пожилые люди не теряют с повышенной скоростью специфических функций по сравнению с молодыми, а, видимо, накапливают с течением времени больше дефектов. Некоторые из них приводят в результате к нарушению фармакокинетики. Для фармакологов и клиницистов наиболее важным является снижение функции почек. Другие изменения и сопутствующие заболевания могут нарушать фармакодинамические характеристики больного.
80-
70-
60-
50-
40-
30-
20-
100
HI—।----1--1----1-----1---1--1
30 40 50 60 70 80 90
Возраст (годы)
Рис. 62-1. Влияние возраста на некоторые физиологические функции. (По: Kohn R. R. Principles of Mammalian Aging, Prentice-Hall, 1978.)
Фармакокинетические изменения
А. Всасывание. Имеется мало свидетельств того, что в старости происходят какие-либо значительные нарушения абсорбции веществ. Тем не менее связанные с возрастом заболевания могут изменять скорость, с которой всасываются некоторые лекарства. Это те болезни, которые нарушают привычное питание, ведут к большему потреблению безрецептурных средств (например, антацидов, слабительных) и понижению эвакуаторной способности желудка.
Б. Распределение. Как отмечено в главах 1 и 3, распределение вещества является производным от химических характеристик молекулы лекарства, а также размера и состава компартментов организма. Пожилые люди имеют пониженную мышечную массу тела, уменьшенное общее и процентное содержание воды в организме и повышенный процент жиров. Некоторые из этих изменений представлены в табл. 62-1. Обычно наблюдается снижение концентрации альбуминов плазмы, связывающих многие препараты, особенно слабые кислоты. Возможно сопутствующее понижение уровня орозомукои-да — белка, связывающего многие щелочные вещества (ос-кислый гликопротеин). Следовательно, отношение связанного препарата к свободному может
ТАБЛИЦА 62-1. Некоторые возрастные изменения, влияющие на фармакокинетику лекарственных средств'
Переменные Молодой возраст (20-30 лет) Старческий возраст (60-80 лет)
Вода в организме (% от массы тела) 61 53
Мышечная масса тела (% от массы тела) 19 12
Жиры в организме 26-33 (женщины) 38-45
(% от массы тела) 18-20 (мужчины) 36-38
Альбумин плазмы (г/100мл) 4.7 3.8
Масса почек (% от показателя в молодом возрасте) 100 80
Кровоток печени (% от показателя в молодом возрасте) 100 55-60
' Составлено по различным источникам.
значительно изменяться. Как объясняется в главе 3, это соответственно влияет на величину насыщающей дозы препарата. Вместе с тем, поскольку и клиренс, и эффекты препаратов связаны со свободной концентрацией, стационарные эффекты режима поддерживающей дозировки не должны изменяться под влиянием одних этих факторов. Например, насыщающая доза дигоксина у пожилого больного с застойной сердечной недостаточностью должна быть уменьшена в связи со снижением действительного объема распределения. Поддерживающую дозу нужно уменьшить вследствие пониженного клиренса препарата.
В. Метаболизм. Способность печени метаболизировать препараты не снижается с возрастом одинаково для всех препаратов. Исследования на животных и некоторые клинические испытания подтвердили, что определенные лекарства метаболизируются более медленно; некоторые из них перечислены в табл. 62-2. Можно видеть, что наибольшие
ТАБЛИЦА 62-2. Влияние возраста на печеночный клиренс некоторых лекарств.
(1) — фаза I метаболизма в системе оксидаз смешанной функции печени; (2) — фаза II метаболизма (конъюгация) или фаза / метаболизма в немикросомальных системах
Имеется возрастное снижение печеночного клиренса Возрастных различий не обнаруживается
Алпразолам (1) Этанол (2)
Барбитураты (1) Изониазид (2)
Карбеноксолон(1) Лидокаин(1)
Хлордиазепоксид (1) Лоразепам (2)
Хлорметиазол(1) Нитразепам (2)
Клобазам (1) Оксазепам (2)
Деметилдиазепам (1) Празозин(1)
Диазепам (1) Салицилаты(2)
Флуразепам (1) Имипрамин (1) Меперидин (1) Нортриптилин (1) Фенилбутазон (1) Пропранолол(1) Хинидин,хинин(1) Теофиллин (1) Толбутамид (1) Варфарин (1)
изменения происходят в фазе I реакций, осуществляемых микросомальной системой оксидаз смешанной функции. Значительно меньше изменяется способность печени осуществлять реакции конъюгации (фаза II; глава 4). Некоторые из этих изменений могут быть обусловлены снижением кровотока в печени (табл. 62-1) — важной переменной в клиренсе препаратов, имеющих высокий коэффициент экстракции печенью. К тому же в старости снижается способность печени восстанавливаться после повреждений, вызванных, в частности, алкоголем или вирусным гепатитом. Поэтому наличие в анамнезе недавнего заболевания печени в пожилом возрасте должно вести к осторожности в дозировании препаратов, которые выводятся в основном печенью, даже после очевидного полного восстановления организма. Наконец, у пожилых чаще встречаются болезни, влияющие на функции печени, например застойная сердечная недостаточность. Это может серьезно нарушать способность печени метаболизировать препараты, а также уменьшать печеночный кровоток. Функции печени может нарушить и серьезный дефицит питания, часто встречающийся в старости.
Г. Элиминация. Поскольку почки — это главные органы, очищающие организм от лекарств, очень важным является уже упомянутое “естественное” снижение их функциональных возможностей. Как показано в табл. 62-3, имеется возрастное снижение клиренса креатинина, наблюдаемое примерно у двух третей населения. Важно отметить, что это понижение не отражается в эквивалентном увели-
ТАБЛИЦА 62-3. Влияние возраста на клиренс
креатинина, концентрацию в плазме и общую продукцию креатинина в организме'
Возраст (лет) Клиренс креатинина (мл/мин)2 Концентрация креатинина в плазме (мг/100 мл) Продукция креатинина (мг/24ч)
17-24 140 0.81 1790
25-34 140 0.81 1862
35-44 133 0.81 1746
45-54 127 0.83 1689
55-64 120 0.84 1580
65-74 110 0.83 1409
75-84 97 0.84 1259
’По: Rowe J. W. et al. J. Gerontol. 1976; 311:155.
2 Приведен к 1.73 м2 площади поверхности тела.
чении концентрации креатинина в плазме, потому что продукция креатинина тоже уменьшается из-за снижения по мере старения мышечной массы. Практическим результатом этого изменения является значительное удлинение периода полувыведения многих средств (рис. 62-2) и возможность их кумуляции до токсического уровня, если не уменьшить дозу или частоту приема. Рекомендации по дозированию у пожилых часто учитывают снижение почечного клиренса. Если для препарата, выводящегося почками, известна только доза для взрослых людей молодого возраста, ориентировочная коррекция может быть сделана с использованием формулы Кокрофта-Гаульта (Cockcroft, 1976), применимой к пациентам в возрасте от 40 до 80 лет:
Клиренс креатинина (мл/мин) =
_ (140 - возраст) х (масса тела в кг)
”72 х уровень креатинина плазмы в мг/100 мл
Для женщин результат нужно умножить на 0.85. Если больной обладает нормальной почечной функцией (до одной трети пациентов), доза, скорректированная таким образом, будет слишком низкой. Если состояние почечной функции пациента неизвестно, желательно первоначально назначать малую дозу. При необходимости точного измерения определяют стандартный 12- или 24-часовой клиренс креатинина. Как уже указывалось, фармакокинетические параметры изменяются при нарушении питания. Пациенты с тяжелой дегидратацией (часто у парализованных больных или при других двигательных нарушениях) могут иметь дополнительное значительное снижение почечного клиренса препаратов, которое полностью обратимо при регидратации.
Для экскреции летучих препаратов важно состояние легких. В связи с понижением респираторных возможностей (рис. 62-1) и учащением случаев активных легочных заболеваний у пожилых в этой возрастной группе не показана ингаляционная анестезия и более приемлемым является использование парентеральных средств (глава 24).
Фармакодинамические изменения
Издавна предполагали, что гериатрические пациенты намного более “чувствительны” кдействиюмно-гих препаратов, подразумевая изменения в фармакодинамическом взаимодействии лекарств с их рецепторами. В настоящее время признано, что многие (воз-
А
3 а
Б
20
10г
Г вГ 8
R
д5
S’
3
0)
80
В
25
Имипрамин
Амитриптилин
Циклофосфамид
Тиоридазин Прокаин у пенициллин - Доксициклин - Антипирин
0> 5 03 ! е
40 60
Возраст (годы)
Ф -т 57 со
Iе
Хлорталидон
5
-Гентамицин
-Тетрациклин
-Канамицин
Метопролол Пропранолол Метотрексат Цефазолин Сульфаметизо л
-Практолол
Аминопирин
Дигидрострептомицин
Метотримепразин
•Литий
40 60
Возраст (годы)
40 60
Возраст (годы)
-100
о
20
Рис. 62-2. Возрастное увеличение периода полувыведения некоторых препаратов. Препараты сгруппированы на основе периода полувыведения. А: 0.5—3 часа; Б: 1—10 часов; В: 5—25 часов; Г: 20—370 часов. Линии соединяют крайние точки возрастного ряда; они не подразумевают линейного взаимоотношения между возрастом и периодом полувыведения. (По: Ritschel W. A. Pharmacokinetics in the aged. In: Pharmacologic Aspects of Aging. Pagliaro L. A, Pagliaro A. M. [eds], Mosby, 1983.)
О ф
2
з
2.
18. Заказ 3252
40 60
Возраст (годы)
ф 5
3
!
50
25
•-Протриптилин - Фенилбутазон
-Фенобарбитал
-Диазепам
Спиронолактон
• Амобарбитал
-Дезипрамин
'Дигоксин
можно, большинство) из этих явных изменений происходят вследствие нарушения фармакокинетики или замедления гомеостатических реакций. Клини-ческиеисследования подтвердили,что пожилыелюди более чувствительны кнекошррьш гипно-седативным средствамианалгетикам.Крометого.имеютсяэкспе-риментальные данные, которые подтверждают нал и-чие существенных изменений с возрастом в характеристиках или числе определенных типов рецепторов. Наиболее четко показано снижение выраженности реакции на стимуляторы и блокаторы Р-адренорецеп-торов. Другие примеры еще будут рассмотрены.
У пожилых, по-видимому, притупляются некоторые механизмы гомеостатического контроля. Гомеостатические реакции часто являются важными компонентами общей реакции на лекарство, эти физиологические нарушения могут менять характер или интенсивность ответа на введение препарата. В сердечно-сосудистой системе приращение сердечного выброса, необходимое при слабой или умеренной физической нагрузке, успешно достигается, по меньшей мере, до 75-летнего возраста (у лиц без явных сердечных заболеваний), но это повышение у пожилых является результатом, в первую очередь, увеличения ударного объема, а не тахикардии, как в молодом возрасте. В старости повышается среднее кровяное давление (у большинства населения стран Запада), но значительно учащаются случаи симптоматической ортостатической гипотензии. Подобно этому средний 2-часовой послеобеденный уровень сахара в крови увеличивается примерно на 1 мг/100 мл с каждым годом после 50 лет. Нарушена также температурная регуляция, поэтому пожилые люди плохо переносят гипотермию.
Основные группы лекарственных препаратов
Средства, влияющие на центральную нервную систему
Гипно-седативные средства
В возрасте между 30 и 70 годами период полувыведения многих бензодиазепинов и барбитуратов увеличивается на 50-150 %. Наиболее значительные изменения происходят за десятилетие от 60 до 70 лет. У многих бензодиазепинов фармакологичес
ки активны как исходные молекулы, так и их метаболиты, образующиеся в печени (глава 21). Возрастное снижение почечной функции и болезни печени, если они есть, способствуют замедлению элиминации этих соединений. Кроме того, для некоторых из этих препаратов описано увеличение объема распределения. Лоразепам й оксазепам, возможно, меньше, чем другие бензодиазепины, подвержены подобным изменениям. Сложилось общее мнение, что изменение чувствительности пожилых к гипно-седативным препаратам зависит не только от фармакокинетических, но и от фармакодинамических факторов. Чтобы избежать осложнений, необходимо прежде всего отслеживать такие токсические эффекты этих средств, как атаксия и другие виды двигательных нарушений (Ray, 1987,1992).
Аналгетики
С увеличением возраста изменяется фармакокинетика опиоидов (наркотических аналгетиков). Пожилые часто значительно более чувствительны к действию этих средств на дыхание из-за возрастных изменений респираторной функции. Поэтому данную группу препаратов нужно использовать с осторожностью, учитывая чувствительность конкретного больного, при назначении дозы лекарства, необходимой для получения полного эффекта. Исследования показывают, что опиоиды часто недодают больным, которые нуждаются в сильных аналгетиках при хронических болевых синдромах в онкологии (Portenoy, 1992). Нет оправданий для недостаточного применения этих препаратов, особенно в лечении пожилых больных, тем более что хорошие схемы терапии боли легкодоступны (Ashburn, 1993; Schug, 1992).
Антипсихотические средства и антидепрессанты
При лечении различных психических заболеваний у пожилых широко используются (и, вероятно, слишком активно) антипсихотические средства (фенотиазины и галоперидол). Нет сомнений, что они полезны при шизофрении в старческом возрасте и, вероятно, при лечении симптомов, связанных с делирием или деменцией, ажитацией, агрессивностью и параноидным синдромом, которые проявляются у некоторых гериатрических больных. Тем не менее они недостаточно эффективны при этих за
болеваниях пожилых людей, и их дозы не следует повышать, исходя из иллюзии о возможности полного контроля состояния пациента. Нет свидетельств того, что эти препараты дают какие-либо благоприятные эффекты при деменции Альцгеймера. Теоретически можно ожидать, что антимуска-риновые эффекты фенотиазинов усугубят нарушения памяти и интеллектуальную дисфункцию у пожилых. Улучшение состояния у ажитированных и агрессивных больных может просто отражать седативные эффекты препаратов. Когда желательны седативные антипсихотики, приемлемы фенотиазины, например тиоридазин. Если седации необходимо избежать, наиболее подходящим является галоперидол. Последний препарат обладает повышенной экстрапирамидной токсичностью, и его назначения необходимо избегать у больных с экстрапи-рамидными расстройствами в анамнезе. Фенотиазины, особенно старые препараты (хлорпромазин), и у людей в молодом возрасте часто вызывают ортостатическую гипотензию вследствие их блокирующего действия на ос-адренорецепторы. Они тем более склонны к проявлению такого действия у пожилых (глава 28).
Из-за большей чувствительности пожилых пациентов к этим препаратам их начальная доза обычно меньше той, которая применяется в молодом возрасте. Период полувыведения некоторых фенотиазинов в гериатрической популяции повышен (рис. 62-2): для тиоридазина, например, он увеличивается более чем в 2 раза. Связывание флуфеназина с белками плазмы уменьшается, что приводит к повышению соотношения свободной и общей фракций препарата.
Для лечения мании у пожилых часто применяется литий. Поскольку он выводится почками, дозы должны быть соответственно скорректированы. Сопутствующее применение тиазидных диуретиков снижает клиренс лития и должно сопровождаться дополнительным уменьшением дозы и более частым измерением уровня лития в крови.
Полагают, что у пожилых недостаточно диагностируют и лечат психическую депрессию. Это мнение подтверждает высокий уровень суицидов в возрастной группе старше 65 лет (вдвое выше среднего уровня в США). К сожалению, апатия, вялый аффект и асоциабельность при большой депрессии могут быть ошибочно приняты за сенильную деменцию. Судя по ограниченным свидетельствам, пожилые люди реагируют на антидепрессанты (как три
циклические, так и ингибиторы МАО) так же, как и более молодые пациенты, но более чувствительны к их токсическим эффектам (Preskorn, 1993). Этот фактор, наряду со сниженным клиренсом некоторых из этих препаратов, подчеркивает важность осторожного дозирования и повышенного внимания к проявлениям токсических эффектов. Если используются трициклические антидепрессанты, необходимо выбирать препараты со сниженным антимускариновым действием, т. е. нортриптилин или дезипрамин (табл. 29-2).
Препараты, используемые при болезни Альцгеймера
Болезнь Альцгеймера характеризуется прогрессирующим нарушением памяти и когнитивных реакций и может привести к сведению жизненных функций человека до исключительно вегетативных. Биохимические дефекты, ответственные за эти изменения, не идентифицированы, но имеется много свидетельств заметного снижения активности аце-тилхолинтрансферазы и других признаков подавления холинергической нейрональной активности и уменьшения активности дофамина, норадреналина, серотонина и соматостатина в головном мозге. Холинергические и, возможно, другие нейроны погибают или разрушаются. Пациенты с болезнью Альцгеймера часто более чувствительны к токсическому действию на центральную нервную систему препаратов с антимускариновыми эффектами. Существует много методов лечения болезни Альцгеймера (Gottlieb, 1993). Наибольшее внимание сосредоточено на применении холиномиметических препаратов из-за свидетельств в пользу потери холинергических нейронов. Полагают, что ингибирование МАО типа В селегилином (L-депренил) дает некоторый полезный эффект (Tariot, 1987). Так называемые церебральные вазодилататоры неэффективны (Thompson, 1990).
Такрин (тетрагидроаминоакридин) — широко исследованный длительнодействующий ингибитор холинэстеразы и мускариновый модулятор (Freeman, 1991; Schneider, 1993), представляющий собой активный при приеме внутрь амин. Он быстро поступает в центральную нервную систему и имеет длительность действия 6-8 часов. (В противоположность этому физостигмин действует 1-2 часа.) Такрин блокирует как ацетилхолинэстеразу, так и бутирилхолинэстеразу и обладает сложным инги
бирующим действием на мг и м2-холинорецепто-ры. Он является также слабым никотиновым блокатором. Кроме того, препарат, очевидно, повышает выделение ацетилхолина из холинергических нервных окончаний. Наконец, такрин может ингибировать МАО, понижать высвобождение ГАМК и увеличивает выделение норадреналина, дофамина и серотонина из нервных окончаний. В высоких концентрациях такрин может затрагивать и другие рецепторы (NMDA, аденозиновые), а также калиевые каналы. Несмотря на его крайне широкий спектр действия, внимание фармакологов сосредоточено на холинергических эффектах такрина. В настоящее время исследуются его холиномиметические аналоги (например, велнакрин). Такрин вызывает побочные холиномиметические эффекты (тошнота и рвота) и оказывает значительное токсическое действие на печень. Последнее проявляется обратимым повышением плазменного уровня АЛТ или ACT, настолько существенным, что требуется уменьшение дозы или отмена препарата у 40-50 % пациентов. Описан случай гепатоцеллюлярного некроза с желтухой (Schneider, 1993).
Хотя в первых клинических испытаниях с двойным слепым контролем (очень небольших по объему) такрин проявил эффективность, в последующих более крупных исследованиях она не превышала таковую плацебо. Самые большие современные испытания с двойным слепым контролем демонстрируют скромный позитивный эффект этого средства (Davis, 1992). Тем не менее такрин разрешен к применению в США, поскольку пока нет более эффективных препаратов.
Сердечно-сосудистые средства
Антигипертензивные средства
Как уже отмечалось, кровяное давление, особенно систолическое, с возрастом повышается у жителей стран Запада и в большинстве стран, где потребляется много соли. У величение заметно прежде всего у женщин после 50 лет. Большая частота и иногда мягкое течение этой формы поздно начинающейся систолической гипертензии оправдывает консервативный подход к ее лечению. С другой стороны, диастолическую гипертензию и значительное повышение систолического давления выше возрастных норм нужно лечить энергично, так как они сопровождаются увеличением частоты инсультов, застой
ной сердечной недостаточности и почечной недостаточности (Gifford, 1987). При эффективном лечении эти осложнения возникают значительно реже.
Основные принципы терапии в группе гериатрического возраста не отличаются от описанных в главе 11, но применяются обычные меры предосторожности, учитывающие измененную фармакокинетику и чувствительность. Необходимо поощрять нелекарственную терапию (снижение массы тела у тучных и ограничение соли) по причине ее безопасности. Разумно на первом этапе лекарственной терапии использовать тиазиды. Проявления токсичности этих средств в виде гипокалиемии, гипергликемии и ги-перурикемии более присущи пожилым из-за более высокой частоты аритмий, инсулиннезависимого диабета и подагры у этих пациентов. Таким образом, более целесообразно применение низких антигипертензивных доз, чем максимальных диуретических. Эффективны и безопасны блокаторы кальциевых каналов, если их назначать в соответствии с реакцией организма. Они особенно полезны, если у больного имеется атеросклеротическая ишемия (глава 12). Р~ Блокаторы потенциально опасны для пациентов с обструктивными заболеваниями дыхательных путей и считаются менее полезными для пожилых, чем блокаторы кальциевых каналов. При более тяжелых формах гипертензии эффективны и безопасны метилдопа и гидралазин. Редко возникает необходимость применять такие мощные препараты, как гуанетидин или миноксидил.
Средства с положительным инотропным эффектом
Застойная сердечная недостаточность является распространенным и особенно опасным для пожилых заболеванием. Страх перед ним может быть одной из причин чрезмерного назначения сердечных гликозидов в данной возрастной группе. В одном исследовании у 90 % пациентов, которым отменили терапию дигоксином, не наблюдалось возврата симптомов или признаков недостаточности, т. е. препарат использовался без необходимости. Токсические эффекты этой группы препаратов особенно опасны в гериатрической популяции, так как пожилые люди более склонны к аритмиям. В старшей возрастной группе понижен клиренс дигоксина, и хотя объем распределения также часто уменьшен, период полувыведения этого препарата может
повышаться на 50 % и более. Поскольку препарат выводится почками, при определении режима дозирования должна учитываться почечная функция. Свидетельств того, что имеется какое-либо повышение фармакодинамической чувствительности к терапевтическим эффектам сердечных гликозидов, нет. В экспериментальных исследованиях было продемонстрировано даже возможное понижение чувствительности. С другой стороны, не исключено повышение чувствительности к токсическому аритмогенному действию гликозидов. Гипокалиемия, гипомагниемия, гипоксия (из-за легочных заболеваний) и коронарный атеросклероз способствуют высокой частоте вызванных наперстянкой аритмий у гериатрических больных. Более редкие токсические реакции, такие как делирий, изменения зрения и эндокринные нарушения (глава 13), также более часто встречаются у пожилых, чем у молодых пациентов.
Противоаритмические средства
Лечение аритмий у пожилых является особенно сложным и ответственным из-за отсутствия у них хорошего гемодинамического резерва, высокой частоты электролитных нарушений и большого числа случаев тяжелых коронарных заболеваний. С возрастом клиренс хинидина и прокаинамида снижается, а период их полувыведения повышается. В гериатрической практике следует избегать назначения ди-зопирамида, потому что его основные токсические эффекты — антимускариновое действие, вызывающее проблемы с мочеиспусканием, и отрицательное инотропное действие на сердце, ведущее к застойной сердечной недостаточности,— особенно нежелательны у этих пациентов. У пожилых клиренс лидокаина, по-видимому, изменяется мало, но период его полувыведения повышается. Хотя это наблюдение подразумевает повышение объема распределения, гериатрическим больным рекомендуют снизить насыщающую дозу этого препарата из-за возрастания чувствительности к его токсическим эффектам.
Противомикробные средства
Некоторые возрастные изменения способствуют увеличению частоты инфекций у гериатрических пациентов. По-видимому, у пожилых происходит снижение защитных сил (прежде всего нарушение функции Т-лимфоцитов). Это проявляется в
повышении вероятности развития серьезных инфекций и рака. Что касается легких, то повышение чувствительности к инфекции определяется снижением мукоцилиарного клиренса, зависящим от курения и возраста. В связи с задержкой мочи и катетеризацией у мужчин значительно учащаются случаи серьезных инфекций мочевого тракта. Начиная с 1940 г., антимикробные препараты в большей степени, чем любые другие средства, способствуют продлению жизни, поскольку они возмещают в некоторой мере повреждение естественной защиты организма.
Основные принципы антимикробной терапии пожилых не отличаются от применяемых у более молодых пациентов (глава 52). Главные фармакокинетические изменения связаны с пониженной функцией почек; так как большинство р-лактамных, аминогликозидных и фторхинолоновых антибиотиков экскретируются этим путем, можно ожидать серьезных изменений периода их полувыведения. Это особенно важно в случае аминогликозидов, потому что они оказывают концентрационнозависимое токсическое действие на почки и другие органы. Для гентамицина, канамицина и нетилмицина период полувыведения более чем удваивается. Согласно одному исследованию, для тобрамицина это повышение не столь значимо.
Противовоспалительные средства
Очень частым заболеванием у пожилых является остеоартрит, в то время как ревматоидный артрит не относится исключительно к гериатрическим проблемам. Основные принципы противовоспалительной терапии и свойства соответствующих средств (глава 35) полностью применимы в гериатрии.
Нестероидные противовоспалительные средства должны использоваться у гериатрических больных с особым вниманием, потому что они дают токсические эффекты, к которым пожилые люди очень чувствительны. В случае аспирина наиболее серьезными из них являются раздражение желудочно-кишечного тракта и кровотечение. Для более новых НПВС характерна вероятность серьезного повреждения почек, которое может быть необратимым. Поскольку эти препараты в первую очередь выводятся почками, они будут быстрее накапливаться у гериатрических пациентов и особенно у тех, нару
шение почечной функции которых уже превышает средний для их возраста уровень. Легко замыкается порочный круг, в котором кумуляция НПВС усиливает повреждение почек, что вызывает еще большую кумуляцию и так далее. Беноксапрофен, очень активное НПВС, был запрещен вскоре после его выпуска, потому что несколько пожилых пациентов умерло от почечной недостаточности в результате ошибочной дозировки. За изменениями почечной функции пожилых, получающих высокие дозы НПВС, необходимо внимательно наблюдать.
В старческом возрасте при непереносимости полных доз НПВС чрезвычайно полезны кортикостероиды. Однако они последовательно вызывают дозо- и времязависимый остеопороз — особенно опасный для пожилых токсический эффект. Нет уверенности, что этот эффект, вызываемый препаратами, может быть предотвращен повышением потребления кальция и витамина D, но, по-видимому, благоразумно применять эти средства и поощрять регулярную гимнастику у любого пациента, принимающего кортикостероиды.
Побочные эффекты препаратов у пожилых
Связь между количеством принимаемых препаратов и частотой побочных реакций на них хорошо документирована. В специализированных лечебных учреждениях для пожилых среднее число лекарственных назначений на одного пациента колеблется между 6.6 и 7.7. Исследования показали, что количество больных с побочными реакциями повышается от 10 %, когда принимается один препарат, примерно до 100 %, когда принимаются 10 препаратов. Таким образом, можно ожидать, что приблизительно половина пациентов при длительном лечении будут иметь распознанные или нераспознанные осложнения. Побочные реакции на препараты у гериатрических пациентов случаются по крайней мере вдвое чаще, чем у лиц более молодого возраста. Причины такого высокого числа инцидентов, несомненно, связаны с ошибками в назначениях врачей и ошибками в применении препаратов больными.
Врачебные ошибки иногда случаются потому, что врач не оценивает серьезность старческих изменений в фармакокинетике и роль врзрастных болезней. Некоторые ошибки связаны с неосведом
ленностью врача о несовместимости препаратов, назначенных другими врачами тому же пациенту. Например, циметидин, нередко выписываемый пожилым, чаще вызывает нежелательные эффекты (спутанность сознания, затрудненная речь) в гериатрической популяции, чем у более молодых пациентов. Он также ингибирует печеночный метаболизм многих препаратов, включая фенитоин, вар-фарин, 0-блокаторы и другие средства. У больного, который принимал одно из названных средств без побочных эффектов, может заметно повыситься его уровень в крови и могут развиться тяжелые токсические реакции, если циметидин добавляется в схему лечения без коррекции дозирования других препаратов. Дополнительный перечень препаратов, которые ингибируют микросомальные ферменты печени и приводят к возникновению побочных эффектов, описаны в приложении II.
Ошибки пациентов могут происходить из-за несоблюдения предписания по причинам, описанным в следующем разделе. Кроме того, они часто случаются из-за применения препаратов без ведома врача. Как отмечено в главе 65, многие препараты безрецептурного отпуска содержат “скрытые ингредиенты” с сильными фармакологическими эффектами. Например, многие антигистаминные средства оказывают значительное седативное действие и существенно более опасны для пациентов с нарушением когнитивных функций. Кроме того, их анти-мускариновое действие может вызывать задержку мочи у пожилых мужчин или глаукому у пациентов с сужением передней камеры глаза. Если пациент принимает также ингибитор метаболизма (например, циметидин), вероятность побочных реакций значительно возрастает.
Практические аспекты гериатрической фармакологии
Разумное использование лекарственных средств может значительно продлить жизнь пожилых пациентов и улучшить ее качество. Тем не менее существуют определенные практические препятствия выполнению предписаний, которые врач должен распознавать.
Стоимость препаратов может быть важным препятствием при лечении пациентов с низким доходом,
который не покрывается страховкой. Врач должен быть осведомлен о стоимости выписываемого препарата и наличии более дешевой альтернативной терапии. Например, месячная стоимость лечения артрита новыми НПВС превышает 75 долл., тогда как для генерика аспирина она составляет примерно 2 долл., адля старого НПВС ибупрофена— примерно 15долл.
Несоблюдение предписаний может происходить из-за забывчивости или спутанности сознания, особенно если пациент имеет несколько назначений с разными интервалами между приемами препаратов. Показано, что в 1986 г. в США на популяцию в возрасте свыше 65 лет приходилось до 25 % всех визитов к врачам и 32 % выписываемых лекарств, хотя она составляет только 11-12 % всего населения (Food and drug administration, 1989). Так как рецепты часто выписываются несколькими врачами, обычно нет попыток сформировать “интегрированный” режим, при котором применяются препараты с близкими интервалами между приемами. Больные могут забыть инструкции о необходимости соблюдения установленного времени лечения, например при инфекциях. Исчезновение симптомов часто становится причиной прекращения приема препарата, особенно если он дорогой.
Несоблюдение предписаний может быть и намеренным. Решение не принимать препарат может основываться на предыдущем опыте лечения им. Врач должен попытаться выявить причины для такого "разумного” несоблюдения предписаний. Назначение альтернативных средств, как правило, улучшает соблюдение предписаний, потому что привлеченный как участник в лечебный процесс пациент больше стремится выполнять назначения.
Некоторые ошибки в приеме препаратов вызываются физической неспособностью. Артрит, тремор и проблемы зрения способствуют этому. Жидкие медикаменты, которые отмеряются “чайной ложкой”, особенно неподходящи для пациентов с любым видом тремора или двигательных нарушений. "Недоступные детям” упаковки часто “недоступны пациенту”, если у него артрит. Многие пациенты старше 70 лет страдают катарактой и макулярной дегенерацией, поэтому надписи на этикетках должны быть достаточно крупными для прочтения больными с пониженным зрением или иметь цветовую кодировку, если пациент видит, но не способен читать.
Лекарственная терапия имеет значительный потенциал как полезного, так и вредного действия
на гериатрических пациентов. Баланс может смещаться в правильном направлении при следовании перечисленным ниже принципам.
1. Владеть полной информацией о препарате. Болезнь может быть вызвана препаратом. Уже принимаемые препараты могут взаимодействовать с выписываемыми средствами.
2. Выписывать лекарства только по специфическим и рациональным показаниям. Не выписывать циметидин при “диспепсии”.
3. Определить цель лекарственнойтерапии. Затем начать с малых доз и увеличивать до получения желательного эффекта. Ждать по крайней мере три характерных для возраста периода полувыведения препарата перед повышением дозы. Если при нормальных для взрослых дозах ожидаемого действия не происходит, проверить уровень препарата в крови. Если эффект не наблюдается при соответствующем уровне в крови, следует перейти на другой препарат.
4. Поддерживать высокий уровень бдительности в отношении реакций на препараты и их взаимодействия. Знать, какие другие препараты принимает больной.
5. Насколько возможно, упростить режим дозирования. При выписывании нескольких средств стараться применять лекарства, которые можно принимать в одно время суток. Когда это возможно, снизить число принимаемых препаратов.
Избранная литература
Abrams W. В. Cardiovascular drugs in the elderly.
Chest, 1990; 98:980.
Ashburn M. A., Lipman A. G. Management of pain in the cancer patient. Anesth. Analg. 1993; 76:402.
AvornJ. et al. A randomized trial of a program to reduce the use of psychoactive drugs in nursing homes. N. Engl. J. Med. 1992; 31:101.
Blazer D. Depression in the eldery. N. Engl. J. Med. 1989; 320: 164.
Chatellier G., Lacomblez L., Groupe Franqais d’Etude de la Tetrahydroaminoacridine: Tacrine (tetrahydroaminoacridine; TH A) and lecithin in senile dementia of the Alzheimer type: A multicentre trial. Br. Med. J. 1990; 300:495.
Cody R. J. Physiologic changes due to age: Implications for drug therapy of congestive heart failure. Drugs Aging, 1993; 3:320.
Дерматологическая фармакология*
Дирк Б. Робертсон, Говард И. Майбах
63
Кожа является источником ряда специальных проблем и возможностей для терапевта. При болезнях кожи особенно показана местная терапия, хотя некоторые дерматологические заболевания в той же степени или даже лучше реагируют на препараты, назначаемые системно.
Основные фармакокинетические принципы, регулирующие применение препаратов, наносимых на кожу, те же, что и при других путях введения препаратов (главы 1 и 3). Тем не менее кожа человека, хотя она часто изображается как простая трехслойная структура, представляет собой сложный ряд диффузионных барьеров. Количественный учет движения препарата и несущей его основы через эти барьеры составляет базис фармакокинетического анализа дерматологической терапии; число методов для таких измерений быстро растет, увеличивается их чувствительность.
Остановимся на главных переменных, которые определяют фармакологический ответ на препараты, наносимые на кожу:
1. Региональные различия проницаемости для препаратов. Например, мошонка, лицо, подмышки и скальп проницаемы гораздо больше, чем предплечье, и требуют меньше препарата для развития эффекта.
2. Концентрационный градиент. Повышение концентрационного градиента повышает массу переносимого за единицу времени препарата так же, как в случае диффузии через другие барьеры (глава 1). Так, резистентность к местным кортикостероидам иногда можно преодолеть, используя более высокие концентрации препарата.
* Из-за большого числа и разнообразия дерматологических препаратов, наиболее важные лекарственные формы описываются на протяжении этой главы, а не в разделах, посвященных конкретным препаратам.
3. Режим дозирования. Вследствие своих физических свойств кожа действует как резервуар для многих лекарственных средств. В результате “локальный период полувыведения” может быть достаточно большим, что позволяет апплицировать препараты с коротким системным периодом полувыведения один раз в день. Например, при многих заболеваниях аппликация кортикостероидов один раз в сутки, по-видимому, столь же эффективна, как и многократное нанесение.
4. Основа препарата и прижатие повязкой. Соответствующая основа препарата максимизирует способность препаратов проникать через внешние слои кожи. Кроме того, благодаря своим физическим свойствам (увлажняющим или подсушивающим), основы препаратов могут сами давать значительный терапевтический эффект. Для увеличения абсорбции многих средств высокоэффективно прижатие (наложение пластичного бинта для удержания препарата и его основы в тесном контакте с кожей).
Основы дерматологических препаратов
Лекарственные препараты для местного применения обычно состоят из активных ингредиентов, добавленных к основе, которая упрощает кожную аппликацию. При выборе лекарственной основы важно учитывать растворимость в ней действующего начала, скорость его освобождения, способность основы гидратировать роговой слой, увеличивая таким образом проницаемость, стабильность терапевтического агента в основе, а также физические и химические взаимодействия основы, рогового слоя и действующего средства. Основы традицион
но считаются фармакологически инертными, однако благодаря оригинальным физическим свойствам многие из них сами проявляют терапевтическую активность,
В зависимости от основы дерматологические лекарственные формы могут быть классифицированы как растворы, влажные повязки, лосьоны, гели, аэрозоли, порошки, пасты, кремы и мази. В этом ряду повышается способность основы задерживать испарение с поверхности кожи, будучи наименьшей у растворов и примочек и наибольшей у мазей. Как правило, острое воспаление с намоканием поверхности, везикуляцией и образованием корок лучше лечится высыхающими препаратами, такими как растворы, влажные повязки, лосьоны, тогда как хроническое воспаление с ксерозом, шелушением и ли-хенификацией лучше поддается лечению препаратами со смазывающими свойствами, то есть кремами и мазями. Растворы, лосьоны, гели и аэрозоли пригодны для нанесения на скальп и волосистые области. Эмульгированные тающие типы кремов, не вызывающие мацерации, могут использоваться в областях опрелости.
Для приготовления гомогенных, стабильных препаратов, когда составляются смеси несмешива-ющихся жидкостей, такие как жиро-водные кремы, применяют эмульгаторы. У некоторых пациентов от этих средств развивается раздражение. Решить проблему может замена их на препарат, который не содержит эмульгаторов, или содержит их в более низких концентрациях.
Антибактериальные средства
Местные антибактериальные препараты
Местные антибактериальные средства используются для предупреждения инфекции в чистых ранах, при раннем лечении инфицированных дерматозов и ран, для снижения колонизации стафилококком полости носа, дезодорации подмышек и для лечения обыкновенных (юношеских) угрей. Эффективность антибиотиков в этих местцых аппликациях неодинакова. Общая фармакология антибактериальных средств описывается в главах 42-52.
Ряд антиинфекционных препаратов наряду с антибиотиками содержит кортикостероиды. Нет убедительных доказательств того, что местные кортикостероиды подавляют противомикробный эффект антибиотиков, когда они оба входят в один препарат. В лечении вторично инфицированных дерматозов, которые обычно колонизированы стрептококками, стафилококками или ими обоими, комбинированная терапия может оказаться лучшей по сравнению с монотерапией кортикостероидами. Комбинации антибиотик-кортикостероид эффективны при лечении пестрого дерматита, наружного отита и гнойничковой экземы.
Выбор определенного антибиотика зависит, конечно, от диагноза и от результатов исследования культуры, если оно проведено, и чувствительности клинических образцов in vitro. Возбудителями, выделенными при большинстве инфицированных дерматозов, являются гемолитический стрептококк группы A, Staphylococcus aureus или оба одновременно. В хирургических ранах присутствуют те возбудители, которые пребывают в окружающей среде. Поэтому при выборе терапевтического средства важно иметь информацию о региональных эпидемиологических данных и преобладающих формах устойчивости к препаратам. Готовые местные антибактериальные препараты могут содержать множество антибиотиков в дозах, значительно превышающих терапевтический порог. Эти лекарственные формы имеют преимущества при смешанных инфекциях. Для них характерны более широкий охват инфекций, вызванных неизвестными возбудителями, и более медленное развитие устойчивости микробов к любому отдельному антибактериальному компоненту.
1. БАЦИТРАЦИН И ГРАМИЦИДИН
Бацитрацин и грамицидин относятся к полипеп-тидным антибиотикам, активным в отношении грамположительных бактерий: стрептококков, пневмококков и стафилококков. Кроме того, к ним чувствительно большинство анаэробных кокков, нейссерий, возбудителей столбняка и дифтерии. Бацитрацин смешивается с мазевой основой один или в комбинации с неомицином, полимиксином В или и с тем и с другим. Смазывание бацитрицином передней полости носа временно понижает колонизацию патогенным стафилококком. При длительном применении может развиваться микробная ре
зистентность. Бацитрацин редко вызывает контактный уртикарный синдром. Более часто развивается аллергический контактный дерматит. Бацитрацин слабо абсорбируется через кожу, так что системная токсичность практически не проявляется.
Грамицидин эффективен только при местном применении в комбинации с другими антибиотиками: неомицином, полимиксином, бацитрацином и нистатином. Системная токсичность препарата ограничивает его использование только местным применением. При местном нанесении в терапевтических концентрациях случаи сенситизации чрезвычайно редки.
2. Мупироцин
Мупироцин (псевдомониевая кислота А) по структуре отличается от других доступных в настоящее время местных антибактериальных средств. К мупироцину чувствительно большинство грамположительных аэробных бактерий, включая метициллиноустойчивые штаммы S. aureus. Продемонстрирована его эффективность в терапии импетиго, вызванного S. aureus и р-гемолитическим стрептококком группы А. Интраназальное применение для снижения содержания в носу S. aureus может сопровождаться раздражением слизистых оболочек, вызванным полиэтиленгликолевой основой. После местного нанесения на интактную кожу не наблюдается абсорбции мупироцина.
3. Полимиксин в сульфат
Полимиксин В является полипептидным антибиотиком, эффективным против грамотрицательных организмов, в том числе Pseudomonas aeruginosa, Escherichia coli, Enterobacter и Klebsiella. Большинство штаммов Proteus и Serratia устойчивы, как и все грамположительные микроорганизмы. Местные препараты представляют собой растворы или мази. В распоряжении имеется ряд готовых комбинаций антибиотиков, содержащих полимиксин В. При местном применении трудно достичь определяемых в плазме концентраций, но общая суточная доза, наносимая на поврежденную кожу или открытую рану, для снижения вероятности нейротоксичности и нефротоксичности не должна превышать 200 мг. Гиперчувствительности к полимиксину В при местном использовании обычно не бывает.
4. НЕОМИЦИН И ГЕНТАМИЦИН
Неомицин и гентамицин являются аминоглико-зидными антибиотиками, эффективными против грамотрицательной флоры, прежде всего Е. coli, Proteus, Klebsiella и Enterobacter. Гентамицин обычно проявляет большую активность, чем неомицин, в отношении Р. aeruginosa. Он также более активен против стафилококков и гемолитических стрептококков группы А. Широкого местного применения гентамицина, особенно в госпитальных условиях, необходимо избегать, чтобы замедлить появление гентамицинустойчивых организмов.
Имеется ряд местных форм неомицина. Существуют и его комбинации с полимиксином, бацитрацином и другими антибиотиками. Неомицин используют также в виде стерильного порошка для местного применения. Гентамицин доступен в виде мази или крема.
При местном нанесении неомицина редко можно определить его концентрацию в плазме. Что касается гентамицина, то в случае его применения в водно-смешиваемых формах на больших площадях поврежденной кожи (пациенты с ожогами) возможно обнаружение в плазме 1-18 мкг/100 мл. Оба препарата водорастворимы и выделяются в первую очередь с мочой. Почечная недостаточность может свидетельствовать о кумуляции этих антибиотиков с развитием возможной нефротоксичности, нейротоксичности и ототоксичности.
Неомицин часто вызывает сенситизацию, особенно если его применяют при экзематозном дерматозе или смешивают с мазевой основой. Если это произошло, возможна перекрестная чувствительность к стрептомицину, канамицину, паромомицину и гентамицину.
5. Местные антибиотики при угрях
Некоторые парентеральные антибиотики, которые традиционно используются для лечения обыкновенных угрей, оказались эффективными и при местном применении. В настоящее время с этой целью назначают четыре антибиотика: клиндамицина фосфат, эритромицин-основание, метронидазол и тетрациклина гидрохлорид. Местная терапия менее эффективна, чем системное назначение тех же антибиотиков. Поэтому она показана по большей части в случаях слабого или умеренного угревого воспаления.
Клиндамицин
Клиндамицин обладает in vitro активностью против Propionibacterium (Corinebacterium) acnes. Предполагается, что это действие лежит в основе благоприятного эффекта препарата при лечении угрей. Приблизительно 10 % применяемой дозы абсорбируется, в связи с чем описаны редкие случаи кровавого поноса и псевдомембранозного колита после местного применения. Водно-спиртовые основы могут вызвать сухость и раздражение кожи, жалобы на жжение и покалывание. Водно-гелевые основы достаточно устойчивы и реже вызывают дегидратацию и раздражение. Аллергических контактных дерматитов обычно не бывает.
Эритромицин
В препаратах для местного применения, чтобы облегчить пенетрацию, обычно используется эритромицин в виде основания, а не соли. Хотя механизм действия местной лекарственной формы эритромицина при угревом воспалении неизвестен, предполагается, что оно вызвано угнетением Р. acnes. Одним из возможных осложнений местной терапии является развитие устойчивых к антибиотику штаммов организмов, включая стафилококки. Если это происходит в сочетании с клинической инфекцией, местный эритромицин необходимо отменить и начать соответствующую системную ан-тибиотикотерапию. Местные побочные реакции могут включать ощущение жжения во время аппликации, сухость и раздражение кожи. Аллергическая гиперчувствительность, по-видимому, проявляется редко. Эритромицин входит также в стандартную комбинацию с бензоилпероксидом (препарат Бензамицин) для местного лечения обыкновенных угрей.
Метронидазол
При лечении розовых угрей эффективен гель метронидазола для местного применения. Механизм его действия неизвестен, но может быть связан с ингибирующим влиянием метронидазола на Demodex brevis. Установлено, что при приеме внутрь этот препарат является канцерогеном для чувствительных видов грызунов, поэтому местное применение во время беременности, кормящими матерями и детьми не рекомендуется. Местные побочные
эффекты проявляются в виде сухости, жжения и покалывания.
Тетрациклин
Для местного лечения обыкновенных угрей используются два местнодействующих тетрациклиновых антибиотика: 1) тетрациклина гидрохлорид на водно-спиртовой основе, содержащий п-децилме-тилсульфоксид и 2) меклоциклина сульфосалицилат на кремовой основе. Уровень тетрациклина в плазме, который достигается при длительном местном применении водно-спиртовой формы (два раза в день), составляет 0.1 мкг/мл или менее. Заметной абсорбции после обширных местных аппликаций меклоциклина сульфосалицилата два раза в день в течение 4 недель и более не описано.
Терапевтический эффект этих препаратов при обыкновенных угрях относят к их ингибирующему влиянию наР. acnes. Их применение сопровождается временным желтым окрашиванием кожи, которое более заметно у светлокожих лиц. Хотя фоточувствительность не является проблемой, но тем не менее ее опасность должна приниматься во внимание при применении этих потенциально фо-тотоксичных антибиотиков. Как все производные тетрациклина, эти средства не должны использоваться у беременных и пациентов, которые имеют в анамнезе значительную дисфункцию почек или печени.
Противогрибковые средства
Терапия поверхностных инфекций, вызванных грибами группы дерматофитов, может проводиться местными противогрибковыми средствами, например клотримазолом, миконазолом, эконазолом, кетоконазолом, нафтифином, толнафтатом и галопроги-ном, илиназначаемымивнутрьсредствами, например гризеофульвином и кетоконазолом. Поверхностные инфекции, вызванные грибами рода Candida, можно лечить местным применением клотримазола, мцко-назола, эконазола, кетоконазола, нистатина или амфотерицина В. Хронический генерализованный кандидоз кожи и слизистых оболочек чувствителен к длительной терапии кетоконазолом, назначаемым внутрь.
Противогрибковые препараты для местного применения
1. АЗОЛОВЫЕ ПРОИЗВОДНЫЕ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ
Производные имидазола, которые в настоящее время включают клотримазол, эконазол, кетоконазол, миконазол, оксиконазол и сульконазол, имеют широкий спектр активности в отношении дерматофитов (Epidermophyton, Microsporum и Trichophyton) и дрожжей, в том числе Candida albicans и Pityro-sporum orbiculare, вызывающих разноцветный лишай.
Миконазол (монистат, микатин) местно применяют в виде крема и лосьона, а также в виде вагинального крема или свечей при вульвовагинальном кандидозе. Клотримазол (лотримин, мицелекс) используется местно как крем, лосьон, вагинальный крем и вагинальные таблетки. Эконазол (спектазол) выпускают для местного применения в виде крема, оксиконазол (оксистат) — в виде крема и лосьона. Для местного лечения дерматофитии и кандидоза назначают кетоконазол (низорал) в виде крема, а для лечения себорейного дерматита — в виде шампуня. Сульконазол (экзельдерм) используется в виде раствора. Недавно на основании данных о более быстром симптоматическом улучшении, по сравнению с результатами монотерапии противогрибковым средством, в практику были введены стандартные противогрибково-кортикостероидные комбинации для местного применения. Одним из примеров таких комбинаций является крем, содержащий клотримазол и бетаметазона дипропионат (лотризон).
Аппликация один или два раза в день на пораженную область обычно приводит к очищению от поверхностной дерматофитной инфекции за 2-3 недели, хотя применение препаратов должно продолжаться до подтверждения искоренения микроорганизмов. Паронихиальный иинтертригинозный кандидозы можно эффективно лечить любым из этих средств при применении три или четыре раза в день. При себорейном дерматите используют аппликации кетоконазола два раза в день до получения клинического эффекта.
Местные побочные реакции на имидазолины могут включать покалывание, кожный зуд, эритему и локальное раздражение. Аллергический контактный дерматит проявляется редко.
2. ЦИКЛОПИРОКС ОЛАМИН
Циклопирокс оламин является синтетическим противогрибковым средством широкого спектра с угнетающим действием против дерматофитов, грибов рода Candida и Р. orbiculare. Это средство, по-видимому, ингибирует захват прекурсоров синтеза макромолекул; местом действия, вероятно, является клеточная мембрана.
Фармакокинетические исследования показывают, что при применении средства в виде раствора на спину под тугую повязку абсорбируется 1-2 % дозы. Циклопирокс оламин имеется в продаже в виде 1 % крема (лопрокс) для местного лечения дерматомикоза, кандидоза и разноцветного лишая. Случаи побочных реакций редки. Описаны кожный зуд и ухудшение клинического течения заболевания. Возможность замедленной контактной аллергической гиперчувствительности представляется незначительной.
3. НАФТИФИН
Нафтифина гидрохлорид представляет собой аллиламин, высокоактивный против дерматофитов и в меньшей степени — против дрожжей. Его противогрибковое действие обусловлено селективным ингибированием скваленэпоксидазы — ключевого фермента для синтеза эргостерола.
Нафтифин (нафтин) выпускают в виде 1 % крема для местного лечения дерматофитии, применяемого два раза в день. Побочные реакции включают местное раздражение, ощущение жжения и эритему. Необходимо избегать контакта со слизистыми оболочками.
4. ТЕРБИНАФИН
Тербинафин (ласмисил) является п-аллилами-ном, сходным с нафтифина гидрохлоридом по механизму действия. Он используется в виде 1 % крема для местной терапии инфекций, вызванных дерматофитами. Сообщалось о побочных реакциях на тербинафин, которые заключаются в локальном раздражении с эритемой, сухостью и покалыванием. Следует избегать попадания в глаза и на слизистые оболочки.
5. ТОЛНАФТАТ
Толнафтат относится к синтетическим противогрибковым соединениям, которые при местном при
менении активны против инфекций, вызванных дерматофитами Epidermophyton, Microsporum и Trichophyton. Он действует также на Р. orbiculare, но не на Candida.
Толнафтат (афтат, тинактин) продается в виде крема, раствора, порошка или порошкового аэрозоля для нанесения два раза в день на инфицированные области. Часто вслед за прекращением терапии развиваются рецидивы, а инфекции ладоней, подошв и ногтей обычно не реагируют на монотерапию толнафтатом. Порошок или порошковый аэрозоль можно длительно использовать после начальной терапии у пациентов, восприимчивых к инфекционному лишаю. Толнафтат обычно хорошо переносится и редко вызывает раздражение или контактную аллергическую сенситизацию.
6. ГАЛОПРОДЖИН
Галопроджин является синтетическим галогенированным феноловым эфиром, активным в отношении Epidermophyton, Microsporum и Trichophyton, а также Р. orbiculare. Хотя данное соединение активно in vitro в отношении Candida, его применение ограничено лечением инфекций, вызванных дерматофитами, и разноцветного лишая.
Галопроджин (галотекс) используется в виде крема или раствора. Через интактную кожу проникает незначительно, поэтому системной токсичности вследствие местной аппликации не наблюдается. Малые количества абсорбируемого препарата превращаются в трихлорофенол, который экскретируется преимущественно с мочой. Аппликации два раза в день на пораженную область обычно приводят к очищению за 2-3 недели. Инфекции ладоней, стоп и ногтей часто резистентны к местной терапии. Побочные реакции выражаются в локальном раздражении, ощущении жжения, везикуляции, повышенной мацерации и усилении предшествующих повреждений. Необходимо избегать контакта с глазами. Аллергическая контактная гиперчувствительность проявляется редко.
7. НИСТАТИН И АМФОТЕРИЦИН В
Нистатин и амфотерицин В полезны в местной терапии инфекций, вызванных С. albicans, но неэффективны против дерматофитов. Из-за узкого спек-традействияинезначительноговсасыванияиз желудочно-кишечного тракта после назначения внутрь
применение нистатина ограничено местным лечением Сапг/гТ/а-инфекций кожи и слизистой оболочки. Амфотерицин В имеет широкий противогрибковый спектр и используется внутривенно для лечения многих системных микозов (глава 48) и менее широко — для лечения кожных инфекций, вызываемых Candida.
Местнодействующие препараты нистатина при лечении паронихиального и интертригипозного кандидозов рекомендуют назначать в виде аппликации два или три раза в день. Кандидоз полости рта (молочница) лечат, помещая 5 мл (2 мл для детей) оральной суспензии нистатина в рот на несколько минут перед проглатыванием четыре раза в день. Альтернативной терапией для молочницы является рассасывание во рту до полного растворения вагинальной таблетки четыре раза в день. Возвратный или устойчивый кандидозы перианальной, вульвовагинальной и “пеленочной” (diaper) областей могут реагировать на назначение нистатина внутрь в дозе 0.5-1 млн ЕД у взрослых (100 000 ЕД у детей) четыре раза в день в дополнение к местной терапии. Вульвовагинальный кандидоз можно лечить введением 1 вагинальной таблетки два раза в день в течение 14 дней и затем на ночь в течение еще 14-21 дня.
Амфотерицин В (фунгизон) для местного применения имеется в форме крема, мази и лосьона. Для лечения паронихиального и интертригинозно-го кандидоза рекомендованы аппликации от 2 до 4 раз в день на пораженную область.
Побочные эффекты, связанные с применением нистатина внутрь, включают слабую тошноту, диарею и иногда — рвоту. Местные аппликации не вызывают раздражения, аллергическая контактная гиперчувствительность является чрезвычайно редкой. Назначаемый местно амфотерицин В хорошо переносится и только иногда вызывает локальное раздражение. Гиперчувствительность проявляется исключительно редко. Препараты могут вызвать временное желтое окрашивание кожи, особенно когда используются в форме крема.
Противогрибковые средства для приема внутрь
1. ГРИЗЕОФУЛЬВИН
Гризеофульвин эффективен при введении внутрь против дерматофитной инфекции, вызванной Epidermophyton, Microsporum и Trichophyton. Он неэффективен против Candida и Р. orbiculare.
Противогрибковое действие гризеофульвина приписывают ингибированию синтеза клеточной стенки, влиянию на синтез нуклеиновых кислот и угнетению митоза. Гризеофульвин вступает во взаимодействие с микротрубочками митотического веретена и с цитоплазматическими микротрубочка-ми. Разрушение цитоплазматических микротрубочек может привести к нарушению образования вновь синтезируемых составных частей клеточной стенки. Гризеофульвин активен только против растущих клеток.
После приема внутрь 1 г измельченного (мик-ронизированного) гризеофульвина пик концентрации в плазме в 1.5-2 мкг/мл достигается за 4-8 часов. Препарат может определяться в роговом слое спустя 4-8 часов после приема внутрь, с наиболее высокой концентрацией в наружных слоях и наиболее низкой в базальном слое. Уменьшение размера частиц лекарственного средства значительно повышает абсорбцию препарата. Препараты, которые содержат частицы наименьших размеров, обозначаются как “ультрамикронизированные”. Ульт-рамикронизированный гризеофульвин достигает биоэквивалентного уровня в плазме в половинной от измельченного препарата дозе. Кроме того, растворение гризеофульвина в полиэтиленгликоле в еще большей степени увеличивает абсорбцию. Мик-ронизированный гризеофульвин выпускают в таблетках по 250 мг и 500 мг, а ультрамикронизиро-ванный препарат — в виде таблеток по 125 мг, 165 мг и 330 мг и капсул по 250 мг.
Обычная взрослая доза микронизированной (“микроразмерной”) формы препарата составляет 500 мг в сутки в один или два приема во время еды; иногда при лечении резистентныхинфекций назначается 1 г/сут. Педиатрическая доза составляет 10 мг/кг массы тела в сутки в один или два приема во время еды. Для применения у детей используют оральную суспензию.
Гризеофульвин наиболее эффективен при лечении инфекционного лишая скальпа и гладкой (неволосистой) кожи. В целом, инфекции в области скальпа реагируют на лечение через 4-6 недель, а инфекции гладкой кожи — через 3-4 недели. Дерматофитные инфекции ногтей поддаются лечению только при длительном назначении гризеофульвина. Ногти рук могут отреагировать на 6 месяцев терапии, тогда как пальцы ног очень устойчивы к лечению и может потребоваться 8-18 месяцев терапии; при этом почти всегда происходит рецидив.
Побочные эффекты, наблюдаемые при терапии гризеофульвином, включают головную боль, тошноту, рвоту, диарею, фоточувствительность, периферические невриты и иногда—спутанность сознания. Гризеофульвин получают из плесени Penicillium, поэтому у пациента может развиться перекрестная чувствительность к пенициллину. Препарат противопоказан больным с порфирией и недостаточностью печени или тем, кто имел аллергические реакции на него в прошлом. Его безопасность при беременности не установлена. Имеются отдельные сообщения о лейкопениии и протеинурии. Поэтому у пациентов, подвергающихся длительной терапии, благоразумно провести стандартное исследование печени, почек и кроветворной системы. Гризеофульвин может изменять активность кумариновых антикоагулянтов, поэтому может потребоваться коррекция дозирования антикоагулянтов.
2. АЗОЛОВЫЕ ПРОИЗВОДНЫЕ ДЛЯ ПРИЕМА ВНУТРЬ
Производные азола, доступные в настоящее время для пероральной терапии системного микоза, включают флуконазол (дифлукан), итраконазол (споронакс) и кетоконазол (низорал). Как указывалось в главе 48, имидазольные производные действуют, изменяя проницаемость клеточных мембран чувствительных клеток путем нарушения синтеза липидов, особенно стеролов, в грибковых клетках.
Кетаконазол был первым производным имидазола, использованным для пероральной терапии системного микоза. Больные с хроническим кандидозом кожи и слизистой оболочки хорошо реагируют на прием один раз в день 200 мг кетоконазола со средним временем очищения 16 недель. Большинству пациентов требуется длительная поддерживающая терапия. При лечении хромомикоза сообщалось о различных результатах.
Установлена высокая эффективность кетоконазола при терапии кожных инфекций, вызванных видами Epidermophyton, Microsporum и Trichophyton. Инфекции гладкой кожи часто реагируют в течение 2-3 недель на однократную суточную дозу в 200 мг внутрь. Ладонно-подошвенная кожа реагирует слабее, часто для лечения требуется 4-6 недель при дозе 200 мг два раза в день. Инфекции волос и ногтей могут потребовать даже более длительного лечения; особенно низкий уровень излечения отмечен при лишае головы. Разноцветный лишай очень чув
ствителен к коротким курсам с дозой 200 мг один раз в день.
Тошнота или кожный зуд отмечаются приблизительно у 3 % пациентов, принимающих кетоконазол. Более значительные побочные эффекты — это гинекомастия, повышение активности ферментов печени и гепатит. Рекомендуют осторожно использовать кетоконазол у больных с гепатитом в анамнезе. При длительной терапии целесообразно проводить стандартное исследование функций печени пациентов.
Кболее новым производным азола для пероральной терапии относятся флуконазол и итраконазол. Флуконазол хорошо абсорбируется после приема внутрь и имеет 30-часовой период полувыведения из плазмы. Всвете этого, суточнойдозы в 100 мгдоста-точно для лечения кандидоза кожи и слизистых оболочек; при дерматофитных инфекциях достаточно приема через день. Период полувыведения итраконазола близок к показателю для флуконазола. До 28 дней после окончания терапии в роговом слое сохраняется терапевтическая концентрация. Рекомендуемая доза итраконазола составляет 200 мг в сутки. Для обеспечения максимальной абсорбции лекарства принимают во время еды.
Одновременное назначение внутрь производных азола и терфенадина или астемизола может повысить концентрацию последних в плазме из-за ингибирования их метаболизма. Это может привести к серьезным нарушениям сердечного ритма, в том числе к желудочковой тахикардии и смерти. Поэтому совместное назначение внутрь производных азола стерфенадином или астемизолом абсолютно противопоказано!
Противовирусные средства
Ацикловир
Ацикловир является синтетическим аналогом гуанина с ингибирующей активностью в отношении членов семейства вирусов герпеса, включая типы I и II простого герпеса. Как объясняется в главе 49, ацикловир фосфорилируется преимущественно тимидинкиназой вируса простого герпеса и метаболит, образующийся в процессе фосфорилирования,— ацикловира трифосфат, вмешивается в действие ДНК-полимеразы вируса герпеса и в репликацию вирусной ДНК. Показания к применению и
энтеральное и парентеральное использование ацикловира при лечении кожных инфекций рассматриваются в главе 49.
Местная форма ацикловира (зовиракс) представляет собой мазь для аппликаций при преимущественно кожных инфекциях простого герпеса и для ограничения кожных и слизистых герпетических инфекций у пациентов с пониженным иммунитетом. При первичных инфекциях местное применение ацикловира сокращает длительность вирусных высыпаний и может сократить время излечения. При локализованной, ограниченной инфекции кожи и слизистых оболочек у иммунодефицитных больных его использование может сопровождаться снижением длительности вирусных высыпаний. Нет свидетельств того, что местное применение ацикловира приносит какую-либо пользу при лечении рекуррентной болезни у пациентов без иммунодефицита. Неразборчивое применение ацикловира может привести к селекции резистентных штаммов вируса простого герпеса, у которых имеется дефицит тимидинкиназы. Это необходимо принять во внимание при рассмотрении возможности местного использования ацикловира у больных с первичной инфекцией простого герпеса, но без иммунодефицита.
Местные побочные реакции на ацикловир могут включать кожный зуд и слабую боль с преходящим покалыванием или жжением.
Антиэкзопаразитарные (антидерматозоонозные) средства
Линдан
(гексахлороциклогексан)
у-Изомер гексахлороциклогексана обычно назывался у-бензолгексахлорид, что ошибочно, поскольку в данном соединении отсутствует бензольное кольцо. Линдан является эффективным педикуло-цидным и скабицидным средством.
Исследование чрескожной абсорбции раствора линдана в ацетоне показало, что всасывается почти 10 % дозы, нанесенной на предплечье, которые впоследствии экскретируются с мочой за период свыше 5 дней. Уровень в плазме после аппликации ком
мерческого лосьона линдана достигает максимума через 6 часов и после этого снижается с периодом полувыведения 24 часа. После абсорбции линдан концентрируется в тканях, богатых жирами, включая головной мозг.
Линдан (квелл, скабене) имеется в продаже в виде шампуня, лосьона или крема. При педикулезе головы или лобка порция в 30 мл шампуня взбивается в мыльную пену и оставляется на области скальпа или половых органов на 5 минут и затем смывается. Дополнительная аппликация не показана, разве только если живые вши присутствуют через 1 неделю после лечения. Тогда может потребоваться повторное применение. Недавнее беспокойство по поводу токсичности линдана изменило режим его использования при чесотке: сейчас предлагают однократное нанесение препарата на 8-12 часов на все тело от шеи и ниже с последующим обмыванием. Повторная обработка необходима, только если будут обнаружены активные клещи, но не ранее, чем через 1 неделю после первичной обработки.
Существует много противоречий в вопросе о возможной системной токсичности линдана, применяемого местно в медицинских целях. Беспокойство о нейротоксичности и гематотоксичности привело к ограничению применения линдана у младенцев, детей и беременных. Современные упаковки препарата в США содержат предостережение о невозможности его использования как скабицида у недоношенных младенцев и больных с судорожными расстройствами. Опасность системных побочных реакций на линдан у взрослых пациентов при использовании согласно предписаниям минимальна. Тем не менее может развиться локальное раздражение, и потому необходимо избегать контакта с глазами и слизистыми оболочками.
Кротам итон
Кротамитон, N-этил-о-кротонотолуидид, является скабицидным средством с некоторыми проти-возудными свойствами. Механизм его действия неизвестен, исследования особенностей всасывания через кожу не проводились.
Кротамитон (эуракс) выпускается в виде крема или лосьона. Для лечения чесотки рекомендуют две обработки всего тела от подбородка и ниже с 24-часовым интервалом и очищающей ванной через 48 часов после последней обработки. Кротамитон до
статочно эффективен, чтобы быть альтернативой линдану. Могут развиться аллергическая контактная гиперчувствительность и изначальное раздражение, вынуждающие прекратить терапию. Необходимо избегать попадания на остро воспаленную кожу, в глаза или на слизистые оболочки.
Бензилбензоат
Бензилбензоат эффективен как педикулоцид и скабицид, но в основном вытеснен линданом. Механизм действия бензилбензоата неизвестен. Хотя он, по-видимому, относительно нетоксичен при местном применении, его токсический потенциал при лечении чесотки не исследован.
Сера
Сера имеет длительную историю использования в качестве скабицидного средства. Хотя она не раздражает кожу, но обладает неприятным запахом, является пачкающей и неприятной для использования. В последние годы сера вытеснена более эстетичными и эффективными скабицидами, но остается потенциальным альтернативным средством для применения у младенцев и беременных. Обычной формой является 5 % осажденная сера в керосине.
Малатион
Малатион — это фосфорорганический ингибитор холинэстеразы (глава 7), который эффективен как педикулоцидное средство и показан для лечения головного педикулеза. В исследованиях in vitro выявлено, что малатион оказывает подавляющее действие в отношении как вшей, так и гнид в концентрации 0.5 %.
Малатион (приодерм) выпускается в виде 0.5 % лосьона на спиртовой основе. При педикулезе головы одна аппликация (30 мл) наносится на сухие волосы и скальп и оставляется на 8-12 часов перед мытьем головы. Пациент должен быть повторно обработан, только если активные вши обнаруживаются через 7-10 дней после начальной обработки. Примерно 8 % применяемого средства на ацетоновой основе абсорбируется через кожу. Хотя экспериментальные исследования не выявили канцерогенности у малатиона, его мутагенность не опреде
ляли, поэтому рекомендуется осторожность при использовании у беременных, кормящих матерей и младенцев. Эта форма является слабым раздражителем и не способна вызывать контактную аллергическую гиперчувствительность.
Перметрин
Перметрин нейротоксичен для Pediculus humanus, Pthirus pubis и Sarcoptes scabiei. Менее чем 2 % применяемой дозы абсорбируется через кожу. Остающийся препарат устойчив до 10 дней после нанесения.
Рекомендуется аппликация неразбавленного 1 % крема-ополаскивателя перметрина (нике) на область, пораженную педикулезом, на 10 минут. Затем препарат смывают теплой водой. Для лечения чесотки на тело от шеи и ниже наносится единственная аппликация 5 % крема (элимит), оставляется на 8-12 часов и затем смывается. Побочные реакции на перметрин выражаются в преходящем жжении, покалывании и кожном зуде. Может развиться перекрестная чувствительность к растениям рода хризантем.
Средства, влияющие на пигментацию
Гидрохинон и монобензон
Гидрохинон и монобензон (монобензильный эфир гидрохинона) используются для уменьшения гиперпигментации кожи. Местное применение гидрохинона обычно приводит к временному осветлению, тогда как монобензон вызывает необратимую депигментацию.
Механизм действия этих соединений, по-види-мому, включает ингибирование фермента тирозиназы, вмешиваясь таким образом в биосинтез меланина. Кроме того, монобензон может быть токсичен для меланоцитов, приводя к устойчивой депигментации. Имеет место некоторая абсорбция этих компонентов через кожу, поэтому монобензон может вызвать гипопигментацию в местах, удаленных от области нанесения. Как гидрохинон, так и монобензон могут вызвать локальное раздражение. Описаны случаи аллергической сенситизации к данным соединениям, перед применением на лице
благоразумно выполнить аппликационный тест на небольшом участке кожи тела.
Триоксален и метоксален
Триоксален и метоксален являются псораленами, используемыми для репигментации депигмен-тированных пятен витилиго. Недавнее создание высокомощных длинноволновых ультрафиолетовых флюоресцентных ламп подтолкнуло интенсивные исследования возможностей фотохимиотерапии в комбинации с пероральным назначением ме-токсалена при псориазе и с пероральным назначением триоксалена при витилиго.
Псоралены для проявления благоприятного эффекта должны быть фотоактивированы длинноволновым ультрафиолетовым светом в диапазоне — 320-400 нм. Они встраиваются в ДНК и при последующем облучении образуют циклобутановые соединения с пиримидиновыми основаниями. Могут образовываться как монофункциональные, так и бифункциональные соединения. Последние образуют промежуточные поперечные связи. Эти фотопродукты ДНК могут ингибировать ее синтез. Основной долговременной опасностью псораленовой фотохимиотерапии являются катаракта и рак кожи.
Солнцезащитные средства
Лекарственные средства местного применения, эффективные в защите от солнечного света, содержат или какие-либо химические соединения, которые поглощают ультрафиолетовый свет, названные солнцепротекторами, или непрозрачные материалы (такие как диоксид титана, который отражает свет), названные зонтиками.
В качестве солнцепротекторов наиболее широко используются р-аминобензойная кислота (ПАБК) и ее эфиры, бензофеноны и дибензоилме-таны. Большинство солнцезащитных препаратов предназначены для поглощения ультрафиолетового света в диапазоне В с длиной волны от 280 до 320 нм. Этот коротковолновый свет вызывает эритему и дубление, обусловленные солнечным воздействием, Хроническое действие света стимулирует старение кожи и фотокарциногенез. Парааминобен-зойная кислота и ее эфиры являются наиболее эффективными и доступными поглотителями света в В-диапазоне.
К бензофенонам относятся оксибензон, диоксибензон и сулисобензон. Эти соединения имеют широкий спектр поглощения: от 250 до 360 нм, но их эффективность при ультрафиолетовом облучении в эритемогенном диапазоне ниже, чем у р-амино-бензойной кислоты. Дибензоилметаны (парасол и эусолекс) поглощают волны с длиной в более длинном ультрафиолетовом A-диапазоне, от 320 нм до 400 нм, с максимумом поглощения в области 360 нм. К пациентам, особенно чувствительным к ультрафиолетовым волнам A-диапазона, относятся индивидуумы с полиморфной светлой сыпью, кожной красной волчанкой и вызванной препаратами фоточувствительностью. Этим пациентам самую высокую фотозащиту может обеспечить бутилметок-сидибензоилметан-содержащий солнцепротектор (UVA Guard).
Фактор защиты (protection factor, PF) — это мера эффективности в поглощении эритемогенного ультрафиолетового света. Он определяется путем измерения минимальной эритемной дозы (minimal erythema dose — MED) с солнцезащитой и без нее в группе здоровых людей. Отношение MED при солнцезащите к MED без солнцезащиты и определяется как фактор защиты. Светлокожим индивидуумам, у которых легко возникает солнечный ожог, советуют применять продукты с высоким фактором защиты (15 и выше). Те, у кого более темная кожа, могут использовать солнцепротекторы с более низким фактором защиты (10-15).
Противоугревые средства
Ретиноевая кислота
Ретиноевая кислота, известная также как третиноин или транс-ретиноевая кислота, является кислой формой витамина А. Это эффективное местное средство лечения обыкновенных угрей. Выявлено, что некоторые аналоги витамина А, например 13-г^с-ретиноевая кислота (изотретиноин), эффективны при разнообразных кожных заболеваниях при назначении внутрь. Спиртовая форма витамина А является природной. Ретиноевая кислота (местное терапевтическое средство) образуется при окислении спиртовой группы. Все четыре двойные связи боковой цепи находятся в транс-конфигурации.
Ретиноевая кислота не растворима в воде, но растворима во многих органических растворителях.
Ретиноевая кислота
Она чувствительна к окислению и образованию эфира, особенно при экспозиции на свету. Местно применяемая ретиноевая кислота остается преимущественно в эпидермисе, с меньшей чем 10 % абсорбцией в кровь. Небольшие количества ретиноевой кислоты, абсорбируемые после местной аппликации, метаболизируются печенью и экскретируются с желчью и мочой.
Ретиноевая кислота дает несколько эффектов в отношении эпителиальных тканей. Она стабилизирует лизосомы, повышает активность полимеразы рибонуклеиновых кислот, повышает уровень простагландина Е2, цАМФ и цГМФ и увеличивает включение тимидина в ДНК. Ее действие при угрях связано с ослаблением соединения между эпидермальными клетками и усилением их сменяемости. Считается, что это приводит к изгнанию содержимого из открытых протоков сальных желез (ка-медонов) и трансформации закрытых протоков в открытые.
Местный препарат ретиноевой кислоты (ретин-А) наносится вначале в концентрации, достаточной чтобы вызвать легкую эритему со слабым шелушением. Концентрацию или частоту аппликаций можно уменьшить, если произошло слишком сильное раздражение. Местный препарат ретиноевой кислоты должен наноситься только на сухую кожу, необходима осторожность во избежание контакта с углами носа, глаз, рта и слизистыми оболочками. В течение первых 4-6 недель терапии камедоны вначале могут ясно не проявляться и создавать впечатление, что угри усиливаются ретиноевой кислотой. Тем не менее при продолжении терапии пораженные участки становятся чище и через 8-12 недель обычно наблюдается клиническое улучшение.
К наиболее частым побочным эффектам местных препаратов ретиноевой кислоты относятся эритема и сухость, которые проявляются в первые несколько недель применения, но можно ожидать, что они исчезнут при продолжении терапии. Экспериментальные исследования свидетельствуют, что трети
ноин повышает онкогенный потенциал ультрафиолетового излучения. В свете этого пациентам, использующим ретиноевую кислоту, нужно посоветовать избегать или Минимизировать пребывание на солнце и использовать солнцезащитные средства. Аллергическйй контактный дерматит на местные препараты ретиноевой кислоты развивается редко.
Изотретиноин
Изотретиноин (аккутан) является синтетическим ретиноидом, применение которого в настоящее время ограничено лечением тяжелых пустулезных угрей, резистентных к стандартной терапии. Точный механизм действия изотретиноина при пустулезных угрях неизвестен, хотя он, очевидно, уменьшает размеры и снижает функцию сальных желез. Препарат хорошо абсорбируется, в значительной степени связывается с альбуминами плазмы и имеет период полуэлиминации 10-20 часов.
Изотретиноин
Большинство пациентов с пустулезными угрями положительно реагирует на дозу 1-2 мг/кг, разделенную на два приема, вводимую ежедневно в течение 4-5 месяцев. Если тяжелые пустулезные угри не пропадают в течение этой начальной терапии, после 2-месячного перерыва можно провести второй курс терапии. Обычные побочные эффекты сходны с гипервитаминозом А: сухость и зуд кожи и слизистых оболочек. Реже появляются головная боль, потемнение роговицы, псевдоопухоль мозга, воспалительные заболевания кишечника, анорексия, алопеция, мышечные и суставные боли. Все эти эффекты обратимы при прекращении терапии. У пациентов, получавших изотретиноин, наблюдался гиперостоз скелета, у детей — преждевременное закрытие эпифизов. Часто нарушается жировой обмен (триглицеридов); клиническое значение этого феномена в настоящее время неизвестно.
Для пациенток, принимающих изотретиноин, значительную опасность представляет тератоген
ность изотретиноина, поэтому женщины в детородном периоде должны использовать эффективные формы контрацепции минимум за 1 месяц до, в течение всего курса лечения и в течение одного менструального цикла или более после окончания терапии. Плазменный тест на беременность должен быть выполнен в течение двух недель до начала терапии у этих пациенток, и лечение можно начать только на второй или третий день следующего нормального менструального периода.
Этретинат
Этретинат (тигазон) является ароматическим ретиноидом, который высокоэффективен в лечении псориаза, особенно пустулезных форм. Он назначается внутрь в дозе 1-5 мг/кг/сут, начиная с 0.5 мг/кг/сут у пациентов с псориатической эритродер-мией. При хроническом приеме препарата выявлена медленная терминальная фаза его элиминации длительностью в несколько месяцев. Побочные эффекты, характерные для терапии этретинатом, подобны осложнениям при приеме изотретиноина и напоминают гипервитаминоз А. Нарушения обмена липидов наблюдаются не часто, тем не менее сообщалось о преходящем повышении активности печеночных ферментов. У животных этретинат более тератогенен, чем изотретиноин, что вызывает особое беспокойство в виду его пролонгированного периода элиминации после хронического назначения. Препарат нельзя принимать женщинам детородного возраста.
Бензоилпероксид
Бензоилпероксид является эффективным местным средством лечения обыкновенных угрей. Он проникает через роговой слой или неизмененные фолликулярные отверстия и метаболическим путем превращается в бензойную кислоту в пределах эпидермиса и дермы. Менее чем 5 % применяемой дозы абсорбируется из кожи за 8-часовой период.
Считается, что механизм действия бензоилпероксида при угрях связан с его антимикробной активностью в отношении Р. acnes и его очищающим и комедолитическим действием.
Чтобы снизить вероятность раздражения, для аппликаций должны применяться низкие кончен-
трации (2.5 %) препарата 1 раз в день на первой неделе терапии с повышением частоты применения и концентрации препарата в дальнейшем, если он хорошо переносится. Недавно появилась лекарственная форма со стандартной комбинацией бензоилпероксида (5 %) и эритромицина-основания (3 %) (бензамицин).
Бензоилпероксид в экспериментальных исследованиях оказывает сильное контактное сенситизиру-ющее действие, этот побочный эффект может развиваться в среднем у 1 % пациентов с угрями. Необходимо соблюдать осторожность во избежание контакта с глазами и слизистыми оболочками. Бензоилпероксид является оксидантом и иногда может вызывать отбеливание волос или цветных тканей.
Противовоспалительные средства
Местные кортикостероиды
Замечательная эффективность местных кортикостероидов при лечении воспалительных дерматозов была отмечена много позже введения в практику в 1952 г. гидрокортизона. Впоследствии был разработан целый ряд аналогов, различающихся по активности, концентрации и основам, используемым для приготовления лекарственных форм. Терапевтическая эффективность местных кортикостероидов базируется в первую очередь на их противовоспалительной активности. Окончательное объяснение действия этих лекарств на эндогенные медиаторы воспаления, такие как гистамин, кинины, лизосомальные ферменты, простагландины и лейкотриены, требует дальнейшего экспериментального обоснования. Антимитотический эффект кортикостероидов в отношении эпидермиса человека можно считать дополнительным механизмом действия при псориазе и других дерматологических заболеваниях, связанных с ускорением жизненного цикла клеток. Общая фармакология этих гормональных средств рассматривается в главе 38.
Первым местным глюкокортикостероидом был гидрокортизон, являющийся естественным стероидным гормоном коры надпочечников. Преднизолон и метилпреднизолон также активны при местном применении, как и гидрокортизон. 9ос-Фтор-производные гидрокортизона были активны мест
но, но солезадерживающие свойства делают нежелательным даже их местное применение. 9а-Фто-рированные стероиды дексаметазон и бетаметазон, разработанные впоследствии, не имеют каких-либо преимуществ перед гидрокортизоном. Однако ацетонидные производные фторированных стероидов триамцинолон и флюоцинолон имеют отчетливые преимущества при местной терапии. Подобно этому бетаметазон не очень активен местно, но присоединение пятиуглеродной валератной цепочки к гидроксилу в 17-м положении превращает его в соединение, которое более чем в 300 раз активнее гидрокортизона при местном применении. Флюоцино-нид является 21-ацетатным производным фторхи-нолона ацетонида; добавление 21 -ацетата увеличило местную активность почти в пять раз. Фторирование стероидов не требуется для высокой активности: гидрокортизона валерат и бутират обладают активностью, близкой к таковой у триамцинолона ацетонида.
При аппликации на здоровую кожу кортикостероиды абсорбируются очень незначительно. Так, всасывается приблизительно 1 % дозы раствора гидрокортизона, наносимого на переднюю поверхность предплечья. Наложение на обработанную поверхность непроницаемой пленки (пластичного бинта) является эффективным методом увеличения проницаемости, десятикратно повышающим абсорбцию. В проницаемости для кортикостероидов имеются заметные региональные анатомические отличия. По сравнению с абсорбцией в районе предплечья всасывание гидрокортизона через кожу подошвы равно 0.14, ладоней — 0.83, скальпа — 3.5, лба — 6, вульвы — 9 и мошонки — 42. Проницаемость воспаленной кожи при атопическом дерматите повышается в несколько раз; и при таких тяжелых эксфолиативных заболеваниях, как псориатическая эритродермия, барьер для пенетрации, очевидно, незначителен.
Экспериментальные исследования чрескожной абсорбции гидрокортизона не выявили значительного повышения абсорбции при повторном применении в сравнении с однократной дозой; в большинстве случаев одна аппликация в день достаточно эффективна. Кортикостероиды в виде мази несколько менее активны, чем крем или лосьон. Повышение концентрации кортикостероидов увеличивает проницаемость, но не в прямой зависимости. Например, приблизительно 1 % гидрокортизона от 0.25 % раствора абсорбируется с кожи пред
плечья. Десятикратное увеличение концентрации лекарства вызывает только четырехкратное повышение всасывания. Растворимость кортикостероидов в основе является важным фактором, определяющим их чрескожную абсорбцию. Заметное повышение эффективности отмечается при использо
вании оптимальной основы, что видно на примере более новых форм бетаметазона дипропионата и дифлорасона диацетата.
В табл. 63-1 сгруппированы местные формы кортикостероидов в соответствии с их относительной активностью. В табл. 63-2 перечислены основные
ТАБЛИЦА 63-1. Относительная активность некоторых местных кортикостероидов в различных формах
Наиболее низкая активность
0.25-2.5 % Гидрокортизон
0.25 % Метилпреднизолона ацетат (Медрол)
0.04 % Дексаметазон' (Гексадрол)
0.1 % Дексаметазон' (Декадерм)
1.0% Метилпреднизолона ацетат (Медрол)
0.5 % Преднизолон (Мети-Дерм)
0.2 % Бетаметазон' (Целестон)
Низкая активность
0.01 % Флюоцинолона ацетонид' (Флюонид, Синалар)
0.01 % Бетаметазона валерат' (Вализон)
0.025 % Флюорометолон1 (Оксилон)
0.05 % Аклометазона дипропионат (Акловат)
0.025 % Триамцинолона ацетонид' (Аристокорт, Кеналог, Триацет)
0.1 % Клокортолона пивалат' (Клодерм)
0.03 % Флуметазона пивалат' (Локортен)
Средняя активность
0.2 % Гидрокортизона валерат (Весткорт)
0.1 % Мометазона фуроат (Элокон)
0.1 % 0.025 % Гидрокортизона бутират (Локоид) Бетаметазона бензоат' (Бенизон, Флуробат, Утикорт)
0.025 % 0.1 % Флурандренолид' (Кордран) Бетаметазона валерат' (Вализон)
0.05 % Флутиказона пропионат (Кутиват)
0.05 % Десонид (Тридесилон, Десоувен)
0.025 % Хальцинонид' (Халог)
0.05 % Дезоксиметазон' (ТопикортЬ.Р.)
0.05 % Флурандренолид' (Кордран)
0.1 % Триамцинолона ацетонид'
0.025 % Флюоцинолона ацетонид'
Высокая активность
0.05 % Бетаметазона дипропионат' (Дипрозон)
0.1 % Амцинонид' (Циклокорт)
0.25 % Дезоксиметазон' (Топикорт)
0.5 % Триамцинолона ацетонид'
0.2 % Флюоцинолона ацетонид* (Синалар HP)
0.05 % Дифлорасона диацетат' (Флорон, Максифлор)
0.1 % Хальцинонид' (Халог)
Наиболее высокая активность
0.05 % Бетаметазона дипропионат' на оптимизированной основе (Дипролен)
0.05 % Дифлорасона диацетат' на оптимизированной основе (Псоркон)
0.05 % Галобетазола пропионат' (Ультрават)
0.05 % Клобетазола пропионат’ (Темоват)
1 Фторированные стероиды.
ТАБЛИЦА 63-2. Дерматологические заболевания и их реакция на лечение кортикостероидами местного действия (расположены в порядке убывания чувствительности)
Очень чувствительные
Атопический дерматит
Себорейный дерматит
Лишай простой хронический
Анальный зуд
Поздняя стадия аллергического контактного дерматита
Поздняя стадия ирритантного дерматита Нуммулярный экзематозный дерматит Дерматит при стазе
Псориаз, особенно лица и половых органов
Менее чувствительные
Дискоидная красная волчанка
Псориаз ладоней и подошв
Липоидный диабетический некробиоз
Саркоидоз
Линейный красный лишай
Пузырчатка
Наследственный доброкачественный буллезный эпидермолиз
Витилиго
Кольцевидная гранулема
Наименее чувствительные: требуются инъекции в область поражения
Келоиды
Гипертрофические рубцы
Гипертрофический плоский лишай
Гнездная плешивость
Угревые цисты
Узловатая почесуха
Узловой хондродерматит
дерматологические заболевания согласно их чувствительности к данным препаратам. К первой группе относятся заболевания, заканчивающиеся клиническим выздоровлением при использовании кортикостероидов с активностью от низкой до умеренной. При заболеваниях второй группы часто необходимо использовать высокоактивные препараты, наложение повязок или и то и другое. Когда достигается ремиссия, все усилия должны быть направлены на поддерживающее лечение пациентов низкоактивными кортикостероидами.
В определенных клинических ситуациях ограничение проницаемости для местных кортикостероидов можно преодолеть инъекцией в область поражения относительно нерастворимых кортикостероидов, например триамцинолона ацетонида, триамцинолона диацетата, триамцинолона гексацетонида и бетаметазона ацетат-фосфата. Когда эти средства вводят в область поражения, на месте инъекции остаются заметные количества, которые постепенно освобождаются в течение 3-4 недель. Этот вид терапии часто эффективен при поражениях, которые, согласно табл. 63-2, в основном нечувствительны к местным кортикостероидам. Для лечения местной атрофии доза солей триамцинолона должна быть ограничена 1 мг на один участок лечения, т. е. 0.1 мл суспензии, содержащей 10 мг/мл.
Побочные эффекты
Все адсорбируемые местные кортикостероиды обладают способностью подавлять гипофизарноадреналовую систему (глава 38). Хотя у большинства пациентов при этом выявляют лишь изменения в лабораторных анализах, могут наблюдаться случаи серьезного нарушения стресс-реактивности. В результате длительного применения местных кортикостероидов в больших количествах может развиться ятрогенный синдром Кушинга. Нанесение сильнодействующих кортикостероидов на обширные площади тела на длительное время, с прижиманием или без, повышает вероятность системных побочных эффектов. У детей они возникают легче, что приводит к особенно опасному в этом возрасте замедлению роста.
Локальные побочные эффекты местных кортикостероидов включают: 1) атрофию, которая проявляется как втянутая, светлая, часто сморщенная, похожая на "сигаретную бумагу”, кожа с возвышающимися телеангиэктазиями и тенденцией к развитию пурпуры и экхимозов; 2) стероидную розеолу с упорной эритемой, сосудистой телеангиэктазией, пустулами и папулами, расположенными центрально на лице; 3) периоральный дерматит, стероидные угри, поражения кожными инфекциями, гипопигментацию, гипертрихоз и повышенное внутриглазное давление; 4) аллергический контактный дерматит, который подтверждается тестом нанесения на ограниченный участок кожи кортикостероидов в высоких концентрациях, например 1 % в вазелине, поскольку местные кортикостероиды не
являются ирритантами. Местные кортикостероиды противопоказаны гиперчувствительным к ним лицам.
Смолистые соединения
Каменноугольная смола (деготь) является основным побочным продуктом разделительной возгонки битумной смолы и представляет собой чрезвычайно сложную смесь, содержащую около 10 000 соединений. Это нафталин, фенантрен, фторантрен, бензол, ксилол, толуол, фенол, крезолы, другие ароматические соединения, пиридиновые основания, аммиак и перекиси. Деготь входит во многие препараты безрецептурного отпуска в форме добавок для ванн, шампуней и водно-спиртовых гелей. В соответствии с Фармакопеей США, Национальным Формуляром и другими прописями деготь в концентрациях от 2 до 10 % может быть также составной частью лекарств.
Жидкий углеродный детергент (liquor carbonis detergents, LCD) является раствором каменноугольной смолы, приготовленным путем экстракции со спиртом и эмульгирующим агентом, например полисорбатом 80. Этот раствор содержит 20 г каменноугольной смолы на 100 мл и может быть добавлен в концентрации 2-10 % в кремы, мази или шампуни.
Смолистые препараты используются в основном при лечении псориаза, дерматита и хронического простого лишая. Фенольные составляющие наделя-ютэти соединения противозудными свойствами, делая их особенно ценными в терапии хронических л и-шайныхдерматитов. Течение острого дерматитасве-зикуляцией и намоканием может ухудшаться даже слабыми смолистыми препаратами, которые необходимо отменить. Тем не менее при подострых и хронических стадиях дерматита и псориаза эти препараты весьма полезны и представляют собой альтернативу применению местных кортикостероидов.
Обычной побочной реакцией на соединения древесной смолы является ирритантный фолликулит, требующий прекращения терапии пораженных областей на период 3-5 дней. Могут развиться также фототоксичность и аллергический контактный дерматит. Смолистых препаратов следует избегать пациентам, у которых ранее наблюдалась повышенная чувствительность к ним. Осторожность должна соблюдаться при использовании смолистых соединений у больных с эритродермальным или ге
нерализованным пустулезным псориазом из-за опасности тотальной эксфолиации.
Кератолитические и деструктивные средства
Салициловая кислота
Салициловая кислота была химически синтезирована в 1860 г. и широко используется с тех пор в дерматологической терапии как кератолитическое средство. Она представляет собой белый порошок, хорошо растворимый в спирте, но мало растворимый в воде.
Салициловая кислота
Салициловая кислота всасывается через кожу и распределяется во внеклеточном пространстве, достигая максимального уровня в плазме через 6-12 часов после аппликации. Поскольку 50-80 % салицилата связывается с альбуминами, у пациентов с гипоальбуминемией обнаруживается временное повышение уровня свободных салицилатов в плазме. Мочевые метаболиты применяемой местно салициловой кислоты — это салицилуровая кислота и ацильные и фенольные глюкурониды салициловой кислоты; только 6 % от общего количества выводимого препарата является неизмененной салициловой кислотой. Приблизительно 95 % единичной дозы салицилата экскретируется с мочой в течение 24 часов после его всасывания.
Механизм кератолитического и других терапевтических эффектов салициловой кислоты малопонятен. Препарат может растворять поверхностные клеточные белки, которые поддерживают целостность рогового слоя, тем самым приводя к десква-мации роговых частиц. Салициловая кислота является кератолитической в концентрациях 3-6 %. В концентрациях более 6 % она разрушает ткани.
При местном применении могут развиваться салицилизм и смерть. У взрослых 1 г наносимого местно препарата салициловой кислоты повышает
уровень салицилатов в плазме не более чем до 0.5 мг/100 мл плазмы; порог токсичности составляет 30-50 мг/100 мл. У детей возможен более высокий уровень, поэтому они подвергаются большей опасности развития салицилизма. В случаях тяжелых интоксикаций средством выбора в лечении является гемодиализ (глава 60). Благоразумно ограничивать как общее количество наносимой салициловой кислоты, так и частоту аппликаций. У пациентов с аллергией на салицилаты могут развиться крапивница, анафилактическая и мультиформная эритематозная реакции. Местное применение при использовании высоких концентраций салициловой кислоты иногда сопровождается локальным раздражением, острым воспалением и даже изъязвлением. Особая осторожность должна соблюдаться при применении препарата на конечностях у больных диабетом или у пациентов с периферическими сосудистыми заболеваниями.
Пропиленгликоль
Пропиленгликоль широко используется в местных препаратах, потому что является превосходной основой для органических соединений. Недавно его стали употреблять как самостоятельное кератоли-тическое средство в концентрации 40-70 % при использовании пластичной повязки или в геле в сочетании с 6 % салициловой кислотой.
Лишь минимальные количества наносимой местно дозы всасываются через нормальный роговой слой. Абсорбируемый через кожу пропиленгликоль окисляется печенью до молочной и пировиноградной кислот с последующей их утилизацией в общем обмене организма. Приблизительно 12-45 % абсорбированного средства экскретируется неизмененным с мочой.
Пропиленгликоль — эффективное кератолити-ческое средство для удаления гиперкератических фрагментов. Он является также эффективным увлажнителем, повышающим содержание воды в роговом слое. Гигроскопические свойства средства могут помочь появлению Осмотического градиента в роговом слое, тем самыМ повышая гидратацию смывающей водой самых внешних слоев кожи, не затрагивая внутренние.
Пропиленгликоль применяется под полиэтиленовой повязкой или вместе С 6 % салициловой кислотой для лечения ихтиоза, кератодерматозов ладоней и подошв, псориаза, красного остроконечно
го лишая, остроконечного кератоза и гипертрофического плоского лишая.
В концентрациях более 10 % пропиленгликоль может действовать на некоторых пациентов как ир-ритант; больные с экзематозным дерматитом могут быть более чувствительны. При применении пропи-ленгликоля встречается аллергический контактный дерматит, поэтому в настоящее время проводят кожную пробу. С этой целью рекомендуется использовать 4 % водный раствор пропиленгликоля.
Мочевина
Мочевина на соответствующем кремовом носителе или мазевой основе смягчает и увлажняет роговой слой кожи. Она обладает способностью снижать неприятное маслянистое ощущение мази или лосьона. Это свойство используется при приготовлении дерматологических препаратов. Мочевина представляет собой белый кристаллический порошок со слабым запахом аммиака при смачивании.
Мочевина абсорбируется через кожу, хотя степень всасывания точно не установлена. Она распределяется преимущественно во внеклеточном пространстве и экскретируется с мочой. Мочевина относится к естественным продуктам метаболизма, поэтому и системных токсических реакций при местном применении не происходит.
' Считают, что мочевина повышает содержание воды в роговом слое в результате гигроскопических свойств этой молекулы. Мочевина является также кератолитическим веществом. Механизм действия, по-видимому, заключается в модификации прекератина и кератина, ведущей к повышению растворимости. Вдобавок, мочевина может разрывать водородные связи, которые поддерживают целостность рогового слоя.
В кремах и лосьонах мочевина в концентрациях 2-20 % используется как увлажнитель. В 20 % концентрации ее применяют как кератолитическое средство при таких заболеваниях, как обычный ихтиоз, гиперкератоз ладоней и подошв, ксероз. Мочевина в концентрации 30-50 % на мазевой основе, накладываемая на ногтевые пластинки под прижимающей повязкой, полезна для смягчения ногтей перед удалением. Нанесение в концентрации 10-20 % на “пеленочную” (diaper), паховую области или область экзематозного дерматита может сопровождаться неприятным ощущением жжения, что вынуждает прекратить использование препарата.
Смола подофилла и подофилокс
Смола подофилла — спиртовой экстракт Podophyllum peltatum (корень мандрагоры, или майское яблоко) используется в лечении остроконечных кондилом и других бородавок. Она представляет собой смесь подофиллотоксина, а- и Р-пелтатина, дезоксиподофиллотоксина,дегидроподофиллоток-сина и других соединений. Она растворима в спирте, эфире, хлороформе и сложной бензойной настойке.
Смола подофилла может всасываться через кожу, особенно в межскладочных областях и при аппликациях на большие влажные кондиломы. Она растворима в жирах и поэтому широко распределяется по всему телу, включая центральную нервную систему.
Основным показанием к применению смолы подофилла служат остроконечные кондиломы. По-дофиллотоксин и его производные являются активными цитотоксическими агентами со специфическим аффинитетом к микротубулярному белку митотического веретена. В результате их действия предупреждается образование веретена деления и эпидермальный митоз останавливается в метафазе. Для лечения остроконечных кондилом рекомендуется сложная бензойная настойка с 25 % концентрацией смолы подофилла. Аппликация должна ограничиваться только областью нароста, чтобы уменьшить общее количество используемого лекарства и предупредить тяжелые эрозивные изменения в прилежащих тканях. В случаях лечения больших обширных кондилом для минимизации системной абсорбции благоразумно ограничиваться аппликациями на части пораженной области. Пациенту рекомендуют смыть препарат через 2-3 часа после первичной аппликации, поскольку возможно развитие реакции раздражения. В зависимости от индивидуальной реакции больного этот период может быть расширен до 6-8 часов для последующих аппликаций. Если три или пять аппликаций не привели к значительному результату, необходимо рассмотреть возможность применения других методов лечения.
Токсические симптомы, сопровождающие чрезвычайно большие аппликации, включают тошноту, рвоту, нарушения чувствительности, мышечную слабость, нейропатию со сниженными сухожильны
ми рефлексами, кому и даже смерть. Обычным является локальное раздражение, а случайное попадание в глаз может вызвать тяжелый конъюнктивит. Противопоказано использование при беременности ввиду возможных цитотоксических влияний на плод.
Недавние клинические испытания чистого подофиллотоксина (подофилокс) позволили одобрить применение этого препарата в 5 % концентрации (кондилокс) для аппликации пациентам при лечении генитальных кондилом. Низкая концентрация подофилокса значительно снижает возможность системной токсичности. Большинство мужчин с разрастаниями на пенисе можно лечить, используя менее чем 70 мкл на аппликацию. В этой дозе подофилокс обычно не определяется в плазме. Лечение проводится самостоятельно циклами из двукратных аппликаций в сутки в течение трех дней подряд с 4-дневным перерывом. Местные побочные эффекты включают воспаление, эрозии, жгучую боль и зуд.
Кантаридин
Кантаридин является активным ирритантом, выделенным из кантарид или высушенных волдыр-ных жуков (Lytta [Cantharis]vesicatoria, известных также как Русская или Испанская мушка). Способность насекомых вида Cantharis вызывать пузыри и буллы на коже человека привела к исследованию возможного терапевтического использования кантаридина в дерматологии. Основным клиническим применением этого средства является лечение больных с контагиозным моллюском и обычными бородавками, особенно околоногтевыми.
Количество кантаридина, абсорбируемое после кожной аппликации, неизвестно. Он экскретируется почками, и в случае попадания внутрь значительных количеств развивается заметное раздражение всего мочевого тракта с болью и приапизмом.
Кантаридин действует на митохондриальные окислительные ферменты, приводя к снижению уровня АТФ. Это ведет к изменениям мембран эпидермальных клеток, акантолизу и образованию пузырей. Этот эффект является полностью внутриэпидермальным и не приводит к шрамам.
Главное применение кантаридина — лечение вульгарных бородавок. Околоногтевые бородавки лечатся путем нанесения кантаридина на поверхность бородавки, куда после подсыхания наклады
вается непористая повязка. Образуется пузырь, разрешающийся через 7-14 дней, за которые участок очищается. Оставшиеся бородавки обрабатываются вновь. Для излечения может понадобиться несколько аппликаций. Подошвенные бородавки обрабатывают путем срезания и наложения на это место нескольких слоев кантаридина. Затем накладывается прижимающая пластичная повязка. Образующийся пузырь удаляется через 10-14 дней. Оставшиеся бородавки обрабатываются повторно. Контагиозный моллюск часто реагирует на единичную аппликацию без прижимающей повязки. Безболезненная аппликация и отсутствие остаточного рубцевания делают кантаридин идеально подходящим для лечения детей.
По периферии обработанной кантаридином бородавки может образоваться кольцо бородавок как результат внутриэпидермальной инвазии. Их можно повторно обработать кантаридином или применить альтернативный метод. Системные токсические эффекты при местной терапии не наблюдаются, хотя употребление внутрь такого небольшого количества, как 10 мг, приводит к болям в животе, тошноте, рвоте и шоку.
Фторурацил
Фторурацил является фторированным пиримидиновым антиметаболитом, который представляет собой урацил с атомом фтора, замещающим 5-метильную группу. Фармакология этого средства при системном применении описывается в главе 56. Местно фторурацил используется для лечения множественного лучевого кератоза. При кератоакантозе назначают также инъекции в место поражения.
Фармакокинетика препарата при местной инъекционной терапии не определена. Абсорбируется приблизительно 6 % наносимой местно дозы — количество, недостаточное для провоцирования системных побочных эффектов. Большая часть абсорбируемого препарата метаболизируется и экскретируется в виде двуокиси углерода, мочевины и а-фтор-р-аланина. Небольшое количество элиминируется с мочой неизмененным. Фторурацил ингибирует активность тимидилатсинтетазы, вмешиваясь в синтез дезоксирибонуклеиновой кислоты, и в меньшей степени — рибонуклеиновой кислоты. Эти эффекты наиболее заметны в атипичных, быстро пролиферирующих клетках.
Реакция калечение начинается с эритемы и прогрессирует через везикуляцию, эрозию, поверхностное изъязвление и, наконец, реэпителизацию. Лечение фторурацилом должно продолжаться до тех пор, пока воспалительная реакция не достигнет стадии изъязвления и некроза (обычно в течение 3-4 недель); к этому времени лечение должно быть закончено. Процессы заживления продолжаются в течение 1-2 месяцев после прекращения терапии. Местные побочные реакции могут включать боль, зуд, ощущение жжения, чувствительность и остаточную поствоспалительную гиперпигментацию. Чрезмерное пребывание на солнце во время лечения может повышать интенсивность реакции, поэтому его необходимо избегать. Сообщалось о контактном аллергическом дерматите при лечении фторурацилом, следовательно его применение противопоказано больным с соответствующей гиперчувствительностью. Недавно доказана эффективность инъекций 5 % водного раствора фторурацила в место поражения кератоакантозом. Еженедельные инъекции по 25-50 мг делают до тех пор, пока не отмечается инволюция патологии на 70-80 %. Если поражение не регрессирует после пяти инъекций, выполняется иссекающая операция. К местным реакциям относят эритему, воспаление и последующий некроз опухоли. Системные побочные эффекты не наблюдались и не предвидятся ввиду сравнительно малых количеств фторурацила, назначаемого еженедельно. Недавние испытания показали подобную эффективность у 10 % крема мазопроко-ла (актинекс).
Миноксидил
Применяемый местно миноксидил эффективен в обращении прогрессивного уменьшения волос на темени, связанного с андрогенной алопецией. Облысение макушки более чувствительно к терапии, чем облысение лобной области. Механизм действия миноксидила на волосяные фолликулы неизвестен. Исследования влияния длительного назначения препарата продемонстрировали, что эффект у миноксидила недолговременный и прекращение терапии может привести к потере волос за 4-6 месяцев. Абсорбция через нормальную кожу скальпа минимальна, но возможные системные влияния на кровяное давление (глава 11) должны отслеживаться у больных с сердечными заболеваниями.
Антисеборейные средства
В табл. 63-3 перечислены местные препараты для лечения себорейных дерматитов. Они различаются по активности. В тяжелых случаях может быть необходима сопутствующая терапия местными кортикостероидами.
ТАБЛИЦА 63-3. Антисеборейные средства
Шампунь хлороксина (Капитрол)
Шампунь каменноугольной смолы (Ионил-Т, Пентракс, Тераплекс-Т, Т-Гель)
Шампунь кетоконазола (Низорал)
Шампунь сульфида селениума (Сельсан, Экссел) Шампунь цинка пиритиона (DHS-Цинк, Тераплекс-Z)
Различные пероральные медикаменты
Ряд препаратов, используемых в первую очередь при других заболеваниях, находит также применив в качестве пероральных средств для терапии дерматологических болезней. Несколько таких препаратов перечислено в табл. 63-4.
ТАБЛИЦА 63-4. Пероральные медикаменты различных групп
и дерматологические заболевания, при которых они используются
Препарат или группа Заболевания
Антигистаминные Противомалярийные Антиметаболиты Дапсон Кожный зуд (любого происхождения) Глава 16 Красная волчанка, фотосенсибилизация Глава 35 Псориаз, пузырчатка, пемфигоид Глава 56 Герпетиформный дерматит, возвышающаяся эритема, пузырчатка, пемфи- Глава 46 гоид, буллезная красная волчанка
Кортикостероиды Пузырчатка, пемфигоид, красная волчанка, аллергические контактные дер- Глава 38 матозы и некоторые другие дерматозы
Избранная литература
Allen J. G., Bloxham D. Р. The pharmacology and pharmacokinetics of the retinoids. Pharmacol. Ther. 1989; 40: 1.
Bronaugh R., Maibach H. I. Percutaneous Penetration: Principles and Practices, 2nd ed. Dekker, 1991.
Corey L. et al. A trial of topical acyclovir in genital herpes simplex virus infection. N. Engl. J. Med. 1982; 306: 1313.
Guy R. H. et al. Kinetics of drug absorbtion across human skin in vivo. Developments in methodology. Pharmacol. Skin, 1987; 1:70.
Jones H. E. Ketoconazole. Arch. Dermathol. 1982; 118: 217.
Jones H. E., Simpson J. E., Artis W. W. Oral ketoko-nazole: An effective and safe treatment for dermatophytosis. Arch. Dermatol. 1981; 117:129.
Orkin M. et al. (eds). Scabies and Pediculosis, CRC Press, 1990.
Phillips T. J., Dover J. S. Recent advances in dermatology. N. Engl. J. Med. 1992; 326:167.
Rasmussen J. E. Topical antibiotics. J. Dermatol. Surg. 1976; 2:69.
Thompson S. C. et al. Reduction of solar keratoses by regular sunscreen use. N. Engl. J. Med. 1993; 329: 1147.
Препараты, используемые при желудочно-кишечных заболеваниях
64
Дэвид Ф. Альтман
Многие препараты, рассматриваемые в других разделах этой книги, находят применение для лечения желудочно-кишечных заболеваний. Антимус-кариновые средства ингибируют стимулированную поступлением пищи секрецию кислоты в желудке, а также влияют на гладкую мускулатуру кишечника; эти препараты полезны при некоторых формах функциональных кишечных заболеваний. Мускариновые агонисты стимулируют гладкую мускулатуру и используются для возбуждения двигательной активности кишечника. Никотин табачного дыма является одним из сильнейших факторов риска рецидива язвы; наоборот, никотин из никотиновой жевательной резинки или пластыря может иметь благоприятный эффект при язвенном колите. Некоторые фенотиазины обладают превосходными проти-ворвотными свойствами, а наркотические аналгети-ки и некоторые из их производных являются эффективными противодиарейными средствами благодаря способности угнетать двигательную активность кишечника. Некоторые другие группы лекарственных средств используются почти исключительно при желудочно-кишечных заболеваниях; они группируются и описываются в этой главе в соответствии с их терапевтическим применением.
Препараты, используемые при кислотно-пептических заболеваниях
К кислотно-пептическим заболеваниям относят пептическую язву (желудка и дуоденальную), гастроэзофагеальный рефлюкс и патологические ги
персекреторные состояния, такие как синдром Зол-лингера-Эллисона. Патогенез пептической язвы не до конца понятен. Ясно, что для ее развития необходима желудочная секреция кислоты и пепсина. Однако столь же важными могут быть факторы, касающиеся устойчивости слизистой оболочки к кислоте, особенно продукция желудочно-кишечной слизи и секреция бикарбонатов эпителиальными клетками. Широко признается роль бактерий Helicobacter pylori в патогенезе язвы. Салицилаты и другие нестероидные противовоспалительные средства могут не только вызывать диспепсию, но способны также провоцировать или обострять пептическую язву и ее осложнения. Имеющиеся в настоящее время препараты могут нейтрализовывать желудочную кислоту, уменьшать желудочную секрецию кислоты или повышать защитные силы слизистой оболочки за счет “цитопротекторной” или возможной антимикробной активности. Большинство клиницистов лечат пациентов с рецидивирующими язвами антимикробными препаратами для искоренения колонизации Н. pylori.
Антациды
Антациды являются слабыми основаниями, которые реагируют с желудочной соляной кислотой с образованием соли и воды. Их польза при пептической язвенной болезни, очевидно, основана на способности уменьшать кислотность в желудке и, поскольку пепсин неактивен в растворах с pH выше 4.0, снижать пептическую активность. Однако недавние испытания, показавшие заживление язвы при назначении относительно низких суточных доз антацидов, подтверждают, что эти факторы могут
быть не единственной причиной их эффективности. Исследования на животных подтвердили защиту слизистой оболочки антацидами или через стимуляцию продукции простагландинов, или за счет связывания неидентифицированной повреждающей субстанции. Роль, которую играют эти разнонаправленные механизмы, еще предстоит определить.
Большинство применяемых в настоящее время антацидов в качестве основного компонента содержат гидроксид магния или алюминия (поодиночке или в комбинации), иногда в сочетании с натрия бикарбонатом или солями кальция. В табл. 64-1 представлены данные по химической активности, нейтрализующей способности, растворимости и побочным эффектам некоторых из этих ингредиентов. Истинная буферная емкость любого соединения определяется его способностью нейтрализовывать кислоту и длительностью его пребывания в желудке. Учитывая это, доступные для назначения комбинации (табл. 64-2) разработаны с целью максимизировать их эффективность и минимизировать неудобства. Антациды значительно различаются по вкусу и цене.
Клиническое применение антацидов
После еды кислота в желудке вырабатывается со скоростью 45 мЭкв/ч. Однократная доза антацида в 156 мЭкв, принимаемая через час после еды, эффективно нейтрализует кислоту желудка в течение двух часов. Вторая доза, принимаемая через 3 часа после еды, поддерживает эффект еще в течение одного часа. Соотношение дозы и эффекта антацидов колеблется в зависимости от секреторной способности желудка (некоторые индивидуумы являются “гиперсекреторами", некоторые — “гипосек-
реторами”) и скорости, с которой антациды выводятся из желудка. Кроме того, антациды сильно различаются по активности. По этикетке препарата нельзя выяснить относительные количества различных компонентов и их реактивность. Однако имеющиеся в продаже антациды отличаются в семь раз по их кислотонейтрализующей способности in vitro. Антациды могут эффективно ускорять заживление дуоденальных язв. При язвах желудка их польза менее очевидна. В лучших контролируемых испытаниях эффективности терапии дуоденальной язвы было выявлено, что 140 мЭкв антацида, даваемые через 1 час и 3 часа после каждого приема пищи и перед сном, ускоряли заживление дуоденальных язв, хотя не приносили существенного облегчения боли по сравнению с плацебо. Для получения этой степени нейтрализующей активности требуются разные дозы антацидов (табл. 64-2). Таблетированные антациды в основном являются слабыми по нейтрализующей способности, поэтому для соблюдения режима высоких доз потребуется большое количество таблеток. Они не рекомендуются для терапии активной пептической язвы. В этом случае единственный оптимальный способ максимально нейтрализовать кислоту желудка в течение суток — это прием 140 мЭкв жидкого антацида через 1час и 3 часа после еды и перед сном. Объем конкретного антацида должен быть подобран так, чтобы его кислото-нейтрализующий эффект соответствовал 140 мЭкв. Как уже отмечалось, весьма важен вкус антацида. Больные часто предпочитают один препарат другому.
Уже упоминалось о том, что ускоренное заживление может произойти при приеме таблетированных или жидких антацидов в дозах, значительно меньших, чем те, которые необходимы для нейтра-
ТАБЛИЦА 64-1. Основные компоненты антацидов
Компонент Нейтрализующая способность Соль, образующаяся в желудке Растворимость соли Побочные эффекты
NaHCO3 Высокая NaCI Высокая Системный алкалоз, задержка жидкости
СаСО3 Умеренная caQg Умеренная Гиперкальциемия, нефролитиаз, молочно-щелочной синдром
А1(ОН)3 Высокая AICI3 Низкая Обстипация, гипофосфатемия; абсорбция препаратов снижает их биодоступность
Мд(ОН)г Высокая MgCI2 Низкая Диарея, гипермагниемия (упаци-
ентов с почечной недостаточностью)
ТАБЛИЦА 64-2. Жидкие антациды
Препарат Ингредиенты Кислотонейтра- Объем, необ- Содержание натрия (мг/доза) Стоимость курса высоких Доз’
лизующая способность (мЭкв/мл) ходимый для нейтрализации 140 мЭкв (мл)
Альтернагель Алюминия гидроксид 3.2 44 17 148 долл.
Амфожель Алюминия гидроксид 1.3 107 150 301 долл.
Гелусил Алюминия гидроксид, магния гидроксид, симетикон 4.8 29 7.5 98 долл.
Маалокс Алюминия гидроксид, магния гидроксид 2.7 52 14 132 долл.
Маалокс HRF Алюминия гидроксид, магния гидроксид 5.7 25 4.0 107 долл.
Миланта-DS Алюминия гидроксид, магния гидроксид, симетикон 5.1 27 6.2 90 долл.
1 Стоимость лекарства на 1 месяц лечения в режиме высоких доз (пояснения в тексте), основывающаяся на прейскурантах производителей в Drug Topics Red Book, 1994.
лизации кислоты в желудке. Возможно, что благоприятные эффекты антацидов отражают нечто иное, нежели простую нейтрализацию кислоты в желудке. Соединения алюминия, например, могут действовать посредством прямого цитопротектив-ного эффекта или путем связывания повреждающих субстанций.
Побочные реакции на антациды часто касаются изменений в состоянии кишечника. Как указывается в табл. 64-1, соли магния часто имеют послабляющий эффект, а гидроксид алюминия — запирающий. Эти проблемы могут быть отрегулированы сочетанием или чередованием приема соединений с противоположными эффектами. Другие потенциальные проблемы при применении антацидов связаны с абсорбцией катионов (натрия, магния, алюминия, кальция) и системным алкалозом. К счастью, это становится клинической проблемой только у пациентов с почечной патологией. К серьезным осложнениям у больных с застойной сердечной недостаточностью может привести прием антацидов с высоким содержанием натрия. Антациды давно являются главным средством терапии гастроэзофагеального рефлюкса. Однако они, по-видимому, обладают слабым влиянием на течение болезни. Антациды в комбинации с алгиновой кислотой (га-вискон) приводят к уменьшению кислотного рефлюкса и симптоматическому улучшению. Антациды используются для облегчения боли при эзофагитах, язве желудка и дуоденальной язве, хотя пла-цебо-контролируемые испытания показали отсут
ствие обезболивающего эффекта у однократной “эффективной” дозы антацида при любом из этих состояний.
Антисекреторные желудочные средства
Секреция кислоты в желудке находится под контролем трех основных агонистов: гистамина, ацетилхолина и гастрина (рис. 64 -1). Общим конечным направлением действия является действие через протонную помпу, Н+,К+-АТФазу. Разработаны ингибиторы активности двух первых стимуляторов секреции и протонной помпы.
Антагонисты Н2-гистаминорецепторов
Со времени внедрения антагонистов Н2-гиста-минорецепторов в середине 1970-х гг. они приобрели широкое признание. В США применяют четыре препарата: циметидин, ранитидин, фамотидин и низатидин (глава 16). Эти средства способны на 90 % угнетать базальную, стимулированную пищей и ночную секрецию желудочной кислоты после однократной дозы. Многие испытания продемонстрировали их эффективность в ускорении заживления дуоденальных и желудочных язв и предупреждении их рецидива. Очевидно также, что все они равноэффективны при этих заболеваниях. Кроме того, эти препараты помогают при синдроме Золлинге-
Рис. 64-1. Схематическая диаграмма гормонального и фармакологического контроля секреции ионов водорода париетальными клетками желудка. (Анти-м — антимус-кариновые средства; анти-Н2 — Н2-гистаминблокирую-шне средства.) Внутриклеточные процессы понятны не до конца (помечены вопросами). Имеются некоторые новые свидетельства того, что гистаминовые рецепторы и, возможно, холинорецепторы расположены, скорее, на клетках близлежащих тканей, а не на собственно париетальных клетках
ра-Эллисона и гиперсекреторных состояниях желудка, наблюдаемых при системном мастоцитозе.
А. Дозирование. Наиболее важной детерминантой скорости заживления дуоденальных язв является подавление ночной секреции кислоты. Ранее рекомендовали назначать эти средства по меньшей мере дважды в день, но оказалось, что прием однократной дозы на ночь может быть столь же эффективен и способствует лучшему соблюдению режима приема. При активной язве циметидин дают в дозах в 400-600 мг дважды в день или 800 мг на ночь; ранитидин и низатидин — 150 мг дважды в день или 300 мг на ночь; фамотидин — 20 мг дважды в день или 40 мг на ночь. Для предупреждения рецидива назначают ежедневно на ночь половину высших вечерних доз.
Б. Токсичность. Все антагонисты Н2-рецепто-ров обычно хорошо переносятся, побочных эффектов описано немного. Наиболее длительный опыт клинического применения имеет циметидин. Сообщалось о состоянии спутанности сознания, особенно у пожилых пациентов, при приеме этого препа
рата. Терапия циметидином, прежде всего длительная и в высоких дозах, может вызвать обратимую гинекомастию. Она очень редко наблюдается при приеме ранитидина и фамотидина. Известно, что циметидин вызывает дозозависимое повышение содержания пролактина в плазме и может изменять метаболизм эстрогенов у мужчин. У 34 % людей, принимающих фамотидин или ранитидин, наблюдается головная боль. Для всех препаратов этого класса описаны редкие случаи обратимых гематологических нарушений. Циметидин замедляет также микросомальный метаболизм в печени некоторых лекарств, таких как варфарин, теофиллин, диазепам и фенитоин. Ранитидин, по-видимому, дает меньший эффект, а фамотидин и низатидин не влияют на лекарственный метаболизм в печени.
В. Комбинированная терапия. Несмотря на то, что широко назначают комбинации антагонистов Н2-рецепторов и антацидов, эта дорогая практика имеет мало рациональных объяснений. Хотя у пациентов, получающих препараты в таком сочетании, наиболее высок уровень pH желудка, доказательств их полезного действия в отношении ускорения заживления и облегчения боли нет.
Г. Рефрактерные формы заболевания. Резистентность (отсутствие реакции на Н2-блокаторы или антациды) пептическихязв остается проблемой, особенно среди пожилых людей и курильщиков, и примерно 20 % язв не заживает в течениечетырех недель традиционной терапии. Фармакологические подходы, альтернативные неэффективному курсу Н2-бло-каторов, включают использование более высоких доз или пролонгированного курса первоначального средства, замену данного антагониста Н2-рецепторов на другой или переход на “цитопротекторное” средство. Всеэти способы продемонстрировали эффективность в небольших испытаниях Больным, у которых выявлен//. pylori, при рефрактерных формах заболевания показанакомбинация антибиотиков и висмута. Пациентам с синдромом Золлингера-Эллисона часто необходимо повысить дозу Н2-блокатора, например до 2400 мг/сут циметидина.
Антимускариновые средства
Антагонисты холинорецепторов (более подробно описываются в главе 8) наиболее эффективны в качестве дополнения к антагонистам Н2-рецепторов, особенно для тех пациентов, которые рефрактерны к лечению последними, или для больных с ночной
болью. Пирензепин — антимускариновое средство с относительно селективной активностью в отношении Mf-мускариновых рецепторов желудка, как показывают исследования, может быть весьма полезным в терапии язвы. Трициклические антидепрессанты (глава 29) также могут ускорять заживление пептических язв, но точный механизм их действия (блокада Н2-рецепторов, антимускариновый или оба одновременно) неясен, а тщательных клинических испытаний не проводилось (Ries, 1984).
Ингибиторы протонной помпы
Омепразол является замещенным бензимидазолом, который необратимо ингибирует протонную помпу (Н+,К+-АТФазу, рис. 64-1) париетальных клеток желудка. Препарат активируется в кислой среде секреторных канальцев париетальных клеток (по сути дела это пролекарство) и, вероятно, действует с наружной стороны мембраны. Однократная суточная доза способна ингибировать кислотную секрецию желудка по существу на 100 %. В настоящее время омепразол одобрен для терапии тяжелых форм гастроэзофагеального рефлюкса, которые не реагируют на другое лечение, и для лечения короткими курсами активных дуоденальных язв. Он также используется при патологических гиперсекреторных синдромах, таких как синдром Золлингера-Эллисона, множественные эндокринные неоплазии и системный мастоцитоз. Начальная доза составляет 60 мг один раз в день. У становлено, что омепразол, назначаемый 3 дня в неделю, предупреждает рецидив дуоденальных язв. Тем не менее профилактика дуоденальных язв и рефлюкса пока не является утвержденным показанием для этого препарата. Опасения, связанные с приемом омепразола, касаются последствий длительного полного подавления кислотной секреции для бактериальной колонизации желудка и развития гипергастринемии. У крысдли-тельное назначение больших доз препарата вызывает развитие карциноидных опухолей желудка. Этот феномен не описан для человека, и омепразол на сегодняшний день считается безопасным средством. Второй препарат этого класса, лансопразол, находится на испытаниях.
Октреотид
Октреотид — это длительно действующий синтетический аналог соматостатина. Выявлено значи
тельное ингибирование этим препаратом секреции некоторых циркулирующих пептидных гормонов и ингибирование желудочной и панкреатической секреции. Хотя не сообщалось о контролируемых испытаниях октреодина у пациентов с синдромом Золлингера-Эллисона, иногда в подобных случаях наблюдалось некоторое симптоматическое улучшение. Описано снижение размеров метастазов и замедление опухолевого роста. Имеются также свидетельства того, что у пациентов с портальной гипертензией вследствие хронических заболеваний печени октреотид может понижать портальное давление и уменьшать риск варикозного кровотечения, хотя у некоторых больных нарушается почечная функция. Поскольку препарат вводят парентерально, его применение по этим показаниям имеет ограничения. Тем не менее очевидная эффективность октреотида стимулирует дальнейший поиск активных при приеме внутрь аналогов соматостатина.
Мукопротективные средства
Сукральфат
Сукральфат, или алюминия сахарозосульфат, является сульфатированным дисахаридом, разработанным для использования при пептической язвенной болезни. Механизм его действия обусловлен избирательным связыванием с некротизированными тканями язвы, где он действует как барьер для кислоты, пепсина и желчи. Кроме того, сукральфат прямо абсорбирует соли желчи. Наконец, препарат стимулирует эндогенный синтез простагландинов. С помощью того или иного механизма сукральфат, как было выявлено, способствует заживлению дуоденальных язв. Он плохо абсорбируется системно (хотя у пациентов с почечной недостаточностью в крови обнаружен повышенный уровень), и побочных эффектов описано немного. Дозировка составляет 1 г 4 раза в день на пустой желудок (самое меньшее за 1 час до еды). Для активации необходимо кислое значение pH, поэтому его не назначают одновременно с антацидами или антагонистом Н2-рецепторов.
Коллоидные соединения висмута
Как и сукральфат, соединения висмута, по-видимому, селективно связываются с язвой, покрывая ее и защищая от кислоты и пепсина. Другие
предполагаемые механизмы действия включают угнетение активности пепсина, стимуляцию образования слизи и повышение синтеза простагландинов. Они могут также обладать некоторой проти-вомикробной активностью в отношении Н. pylori, хотя такая возможность дискутируется. При комбинировании с антибиотиками, например метронидазолом и тетрациклином, наблюдался уровень заживления язв до 98 %. Высокая стоимость и потенциальная токсичность этой схемы ограничивают ее использование только серьезными язвами или у больных с частыми рецидивами. В этих случаях в США используют висмута субсалицилат (Пепто-Бисмолк). В Европе широко применяется трикалий дицитрато бисмутат, превосходящий эффект плацебо в заживлении как дуоденальной, так и желудочной язв. Его побочные эффекты минимальны, энцефалопатия, описанная при длительном использовании других соединений висмута, не развивается.
Карбеноксолон
Карбеноксолон является синтетическим производным глицирризиновой кислоты (извлекаемой из корня солодки), эффективным, как установлено, при желудочной и дуоденальной язвах. Механизм действия карбеноксолона неясен, но предполагается, что препарат усиливает образование, секрецию и вязкость кишечной слизи. Хотя его язвозаживляющая активность очевидна, препарат дает значительный альдостероноподобный побочный эффект, так что его клиническое применение ограничивают гипертензия, задержка жидкости и гипокалиемия. Сопутствующее назначение спиронолактона уменьшает задержку жидкости, но устраняет и язвозаживляющий эффект; тиазиды предупреждают задержку натрия без подавления основного действия лекарства. Карбеноксолон, хотя и широко используется в Европе, в США пока еще только исследуется.
Простагландины
Эти производные арахидоновой кислоты подробно описываются в главе 18. Метилированный аналог простагландина Е| мизопростол разрешен для предупреждения язв, вызванных приемом НПВС. Хотя простагландины синтезируются в слизистой оболочке желудка и, предположительно,
дают цитопротекторный эффект в дозах, достаточных для предупреждения или заживления язв у экспериментальных животных, основным механизмом действия простагландинов, по-видимому, является угнетение желудочной секреции. Этот эффект может быть опосредован ингибированием ги-стаминстимулированного образования цАМФ (вероятно, главного вторичного посредника гистамин-стимулированной кислотной секреции). Мизопростол вызывает дозозависимую диарею. Вследствие стимулирующего влияния на матку он противопоказан женщинам детородного возраста. Трудно определить роль мизопростола в лечении язвы. Повседневная клиническая профилактика НПВС-вызванных язв не оправдана. Исключение составляют пациенты с недавними или незарубцевавши-мися язвами, у которых невозможно прекратить применение НПВС.
Препараты, усиливающие двигательную активность желудочно-кишечного тракта
Заизменение двигательной функции кишечника ответственны холинергическиемеханизмы, поэтому холиномиметические препараты, например бетане-хол, эффективны как средства усиления двигательной активности желудочно-кишечного тракта.
Более селективными стимуляторами перистальтики (прокинетическими средствами) являются метоклопрамид и цизаприд. Метоклопрамид относится также к сильным антагонистам дофамина. Оба препарата, очевидно, высвобождают ацетилхолин из холинергических нейронов в мезентериальных сплетениях нервной системы кишечника. Кроме того, они могут сенситизировать гладкую мускулатуру кишечника к действию ацетилхолина. Они не повышают желудочной или панкреатической секреции. Эти препараты ускоряют пищеводный клиренс, повышают давление нижнего сфинктера пищевода, ускоряют освобождение желудка и укорачивают время перемещения по тонкому кишечнику. Центральный антидофаминовый эффект метоклопрамида предположительно отвечает за его выраженные противорвотные свойства. Цизаприд этого действия не оказывает.
Метоклопрамид
H2N
ОСНз
Цизаприд
Клиническое применение этих препаратов соответствует их фармакологическим эффектам. Метоклопрамид облегчает интубацию тонкого кишечника. Кроме того, метоклопрамид и цизаприд способны вызвать значительное симптоматическое облегчение у пациентов с двигательной недостаточностью желудка, особенно с диабетическим гастропарезом, но, возможно, и после ваготомии и других расстройств освобождения желудка (Drenth, 1992). У больных с хроническим гастроэзофагеальным рефлюксом оба средства эффективно снижают изжогу, хотя их долговременное действие не изучено. Наконец, метоклопрамид является эффективным противорвотным средством, особенно полезным в сочетании с противораковой химиотерапией, в неотложной хирургии ил и во время родов для предупреждения аспирации желудочного содержимого. Оба препарата быстро абсорбируются, пик концентрации наблюдается через 40-120 минут после приема однократной дозы. Период их полувыведения из плазмы составляет 2-4 часа.
Обычная доза метоклопрамида составляет 10 мг 4 раза в день во время приема пищи и на ночь. В сочетании с противоопухолевой химиотерапией используются большие дозы (до 1-2 мг/кг). При интубации тонкого кишечника 20 мг препарата медленно вводят внутривенно. Основные побочные эффекты метоклопрамида — сонливость, нервозность и дистонические реакции. Сообщалось также о паркинсонизме и поздней дискинезии. Препарат может вызывать повышенное выделение пролактина гипофизом, описаны менструальные расстройства и галакторея. Цизаприд в настоящее время утвержден только для использования при гастроэзофаге
альном рефлюксе (“изжоге”), рекомендуемая доза составляет 10 мг 4 раза в день. В клинических испытаниях у пациентов с диабетическим гастропарезом прием 5-10 мг цизаприда значительно облегчал освобождение желудка.
Макролидный антибиотик эритромицин как агонист мотилина обладает прокинетической активностью. Он проявляет клиническую эффективность при диабетическом гастропарезе и псевдонепроходимости кишечника.
Противорвотные средства
Тошнота и рвота могут появляться в различных условиях, в том числе при беременности, укачивании, желудочно-кишечной непроходимости, пептической язве, лекарственной токсичности, инфаркте миокарда, почечной недостаточности и гепатите. При противоопухолевой химиотерапии вызванные препаратами тошнота и рвота часто возникают столь регулярно, что при повторном курсе лечения может развиться условнорефлекторная рвота “ожидания” — до приема химиотерапевтического средства. Если ее не подавить, больной может отказаться от дальнейшей химиотерапии.
Физиологические механизмы, ответственные за тошноту и рвоту, до конца не понятны. Координация комплекса двигательной активности желудка и абдоминальной мускулатуры происходит в “рвотном центре”, который локализуется в ретикулярной формации среднего мозга. Рвотный центр получает вход от хемочувствительной триггерной зоны, расположенной в дне четвертого желудочка, веста-
булярного аппарата и других областей. Триггерная зона реагирует на химические стимулы, в частности противоопухолевые химиотерапевтические средства, очевидно, через активацию дофаминовых или серотониновых рецепторов.
Основными противорвотными средствами являются Нгантигистаминные препараты, фенотиазины, метоклопрамид и ондансетрон.
Антигистаминные средства с хорошим противо-рвотным действием (например, дифенгидрамин, гидроксизин) дают значительные антимускарино-вые и седативные эффекты (глава 16). Вероятно, что оба они наряду с Неблокирующим эффектом содействуют противорвотной активности. Они особенно эффективны при тошноте и рвоте, связанной с укачиванием, возможно, из-за специфического подавления передачи по вестибулярно-мозжечковому пути. Для предупреждения укачивания используются также антихолинергические средства, прежде всего скополамин (глава 8).
Фенотиазины блокируют дофаминовые рецепторы в хемочувствительной триггерной зоне так же, как и в других областях головного мозга (глава 28). Как противорвотные средства часто используются прохлорперазин и прометазин. Хотя почти все фенотиазины обладают некоторой противорвотной активностью, их применение ограничено степенью седации, сопровождающей противорвотное действие. При использовании больших доз для борьбы с тошнотой и рвотой, сопровождающих химиотерапию, могут возникать тяжелые экстрапирамидные расстройства, особенно нарушение тонуса. Нарушение тонуса обычно устраняется внутривенным введением 50 мг дифенгидрамина.
Метоклопрамид также действует как дофаминовый антагонист и используется для предупреждения и лечения тошноты и рвоты. Для предотвращения индуцированной химиотерапией и послеоперационной тошноты и рвоты разрешен ингибитор 5-НТ3 рецепторов ондансетрон (глава 16). Производные марихуаны, включая собственно тетрагидроканнабинол (дронабинол), являются эффективными противорвотными средствами для некоторых пациентов, в том числе для тех, кому не помогают другие препараты. Дронабинол разрешен для применения по этому показанию. Механизм его действия неизвестен, но, по-видимому, опосредован рецепторами хемочувствительной триггерной зоны. Противорвотные свойства присущи кортикостероидам, но механизм их действия неизвестен. Нако
нец, такие гипно-седативные средства, как бензодиазепины, часто используют для подавления условно-рефлекторной тошноты и рвоты.
Препараты панкреатических ферментов, используемые для замести тельной терапии
При недостаточности поджелудочной железы, когда выработка липазы падает ниже 10 % от нормальной, возникает стеаторея. Известно, что после приема пищи в просвет кишечника освобождается приблизительно 100 000 ЕД липазы в час. Таким образом, призаместительнойтерапии панкреатическими ферментами должно освобождаться по меньшей мере 10000 ЕД за час. Однако из-за инактивации ферментов при pH ниже 4.0 только примерно 8 % активной липазы достигает дистальных отделов двенадцатиперстной кишки. Различные препараты панкреатических ферментов значительно отличаются по ферментативной активности. Указание производителей о содержании ферментов может не всегда соответствовать хорошо стандартизированным in vitro лабораторным исследованиям. Два основных вида используемых препаратов — это панкреатин (спиртовой экстракт из поджелудочной железы свиней) и панкрелипаза (обогащенный липазой препарат свиной поджелудочной железы). Содержание ферментов в различных препаратах панкреатических ферментов по результатам исследований in vitro представлено в табл. 64-3. Как указано в таблице, колебания в содержании ферментов можно частично компенсировать увеличением дозы. Реакцию на терапию определяют по снижению количества жиров и азота в кале. Для заместительной терапии панкреатическими ферментами рекомендуют различные схемы применения препаратов, но, по-видимому, имеется мало различий между назначением медикамента с едой и назначением его каждые 2 часа в течение всего дня. Так как потребность в дозе индивидуальна, необходимо следить за результатом терапии—суточной экскрецией жиров в стуле — и повышать количество капсул или таблеток до тех пор, пока не будет наблюдаться терапевтический эффект. Добавление
ТАБЛИЦА 64-3. Ферментативная активность некоторых заместительных препаратов панкреатических ферментов (нд - нет данных)
Препарат Активность (ЕД в таблетке или капсуле) Число таблеток Снижение (%) в кале
Липаза Трипсин Амилаза или капсул на прием жиров азота
Илозим' 3600 3444 329 600 3 48 НД
Котазим' 2014 1797 499 200 5 нд 35
Панкреаза' 2005 нд нд 3 73 40
Виоказа' 1636 1828 277 333 6 49 40
' Генерик — панкрелипаза.
в схему циметидина увеличивает эффективность ферментов, ограничивая, вероятно, их кислотную инактивацию. Поскольку препараты ферментов имеют высокое содержание пуринов, может наблюдаться образование мочекислых почечных камней. В таблетках также может быть достаточно лактозы, чтобы вызвать неприятные симптомы у лактозо-чувствительных пациентов. Наконец, заместительная терапия панкреатическими ферментами является дорогой, стоимость ее может достигать 1500 долл, в год. Имеются сообщения о неэффективности ферментативных препаратов-генериков, так как для этих лекарств исследованиебиоэквивалентностинеявляет-ся обязательным (Hendeles, 1990).
Слабительные
Слабительные различных типов широко назначаются и еще чаще приобретаются без рецепта, что указывает на сложившееся предубеждение о “регулярности” стула. Эти препараты в целом классифицируются по упрощенному механизму действия на раздражающие (или стимуляторы); средства, увеличивающие объем; и средства, размягчающие стул. Однако слабительные оказывают более сложные влияния, включающие взаимодействие осмотических эффектов с эпителиальным транспортом, изменения в нервной системе кишечника и выделение внеклеточных регуляторов, таких как простагландины.
Раздражающие, или стимулирующие, слабительные
Касторовое масло гидролизуется в верхних отделах тонкого кишечника до рицинолевой кислоты — местного ирританта, повышающего кишечную
перистальтику. Начало его действия быстрое и продолжается, пока соединение не выводится через толстый кишечник. Крушина, сенна и алоэ содержат эмодиновые алкалоиды, которые освобождаются после всасывания из кишечника и экскретируются в толстый кишечник, где стимулируют перистальтику. Таким образом, начало их действия задерживается на 6-8 часов. Считается, что хроническая стимуляция толстого кишечника ведет к его хроническому растяжению и закрепляет необходимость в слабительных. Близкие по структуре фенолфталеин и бисакодил также являются мощными стимуляторами толстого кишечника. Их действие может быть пролонгировано из-за энтеропе-ченочной циркуляции.
Слабительные, увеличивающие объем стула
Гидрофильные коллоиды, приготовленные из неперевариваемых частей фруктов, овощей и семян, образуют в пределах толстого кишечника гели, ра-стягивающиё его и тем самым стимулирующие перистальтическую активность. Агар, семя psyllium (метамуцил) и метилцеллюлоза действуют таким же образом. Сходный эффект имеют отруби и другие виды растительных волокон. Солевые слабительные, такие как магния цитрат и магния гидроксид, тоже растягивают кишечник и стимулируют его сокращения. Эти невсасываемые соли за счет осмотического действия удерживают в кишечнике воду и вызывают его растяжение. Изоосмотические электролитные растворы, содержащие полиэтиленгликоль, применяют для промывания толстого кишечника, прежде всего при подготовке к радиологическим или эндоскопическим процедурам, и для удаления принятых внутрь токсинов. Лактулоза
является синтетическим дисахаридом (галактозо-фруктоза), который не всасывается, действуя как осмотическое слабительное при назначении в дозах в 10-20 г до 4 раз в день.
Средства, размягчающие стул
Средства, эмульгирующие стул, служат для его смягчения и облегчают продвижение каловых масс. К ним относятся минеральное масло, глицериновые свечи и детергенты, например диоктил натрия сульфосукцинат (докузат).
Антидиарейные средства
Наиболее широко используемые при диарее рецептурные препараты — это слабый аналог меперидина дифеноксилат (с атропином) и химически родственный галоперидолу лоперамид. Лоперамид доступен также без рецепта. Активным метаболитом дифеноксилата является дифеноксин, продающийся в качестве рецептурного лекарства. Механизм их действия в кишечнике подобен действию опиоидов (глава 30) и включает угнетение освобождения ацетилхолина через пресинаптичес-кие опиоидные рецепторы в нервной системе кишечника. Лоперамид не проникает через гематоэнцефалический барьер и таким образом вызывает меньшую седацию и меньшую зависимость, чем дифеноксилат. Ни один из этих препаратов нельзя применять пациентам с тяжелым язвенным колитом, поскольку может быть спровоцирован токсический мегаколон. Подтверждено, что эти средства пролонгируют диарею у больных с инфекциями, вызванными Shigella или Salmonella. С другой стороны, у пациентов при синдроме раздражения кишечника с преобладанием диареи прием лоперамида в дозах 2-4 мг 4 раза в день может привести к существенному клиническому улучшению, особенно если сочетается с диетой, содержащей большое количество клетчатки, использованием анти-холинергических средств в качестве антиспастических. Широко используются такие адсорбенты, как каолин и пектин. Их действие связано со способностью адсорбировать соединения из раствора, предположительно связывая потенциальные кишечные токсины. В целом, однако, они намного менее эффективны, чем уже упомянутые препараты, а также могут нарушать всасывание других ле
карственных средств. Экспериментальные и клинические наблюдения показали, что агонисты «^адренорецепторов, например клонидин, могут уменьшать секрецию электролитов кишечником при состояниях, подобных диабетической диарее (Fedorak, 1985). Подобные ос2-селективные средства, в меньшей степени проникающие в центральную нервную систему, начали исследоваться с целью применения по этому показанию.
Препараты, используемые для растворения желчных камней
Нерастворимый в воде холестерин растворяется в желчи лишь при участии желчных кислот и лецитина, которые вместе с холестерином образуют смешанные мицеллы. Когда холестерин секретируется в желчь в чрезмерных по отношению к лецитину и желчным кислотам количествах, его кристаллы осаждаются и могут образовывать холестериновые желчные камни. У пациентов с такими камнями, возможно, нарушена секреция желчных солей или усилена секреция холестерина, или оба этих нарушения сочетаются.
Пероральная терапия
У некоторых пациентов холестериновые камни эффективно растворяют хенодиол, представляющий собой исходную желчную кислоту человека, и урсодиол — 70-эпимер хенодиола. Оба препарата увеличивают общий пул желчных солей, но основной их эффект, по-видимому, более сложен. Хенодиол ингибирует фермент, лимитирующий скорость образования холестерина, ГМГ-КоА-ре-дуктазу, вызывая таким образом снижение секреции холестерина. Урсодиол переводит холестерин в форму жидких кристаллов, а также, вероятно, стабилизирует канальцевые мембраны гепатоцитов. Так как 70-эпимер, очевидно, не ингибирует 7а-гидроксилазу — фермент, лимитирующий скорость синтеза желчных кислот, добавление урсодиола в пул желчных кислот не влияет на их синтез. Эти физико-химические различия между двумя соединениями, вероятно, являются причиной некоторых особенностей в их токсических эффектах.
Применение хенодиола ограничено его побочными эффектами. Примерно у 30 % пациентов наблюдается дозозависимая диарея, приблизительно столько же больных имеет повышенный уровень трансаминаз или холестерина в плазме. Урсодиол обладает существенно меньшими побочными эффектами, но он очень дорогой. В настоящее время исследуют вопрос, поможет ли сочетание урсодиола с хенодиолом снизить стоимость и токсичность терапии.
Эти средства наиболее эффективны при растворении небольших (< 5 мм) плавающих камней в функционирующем желчном пузыре. Они не могут растворить камни, в которых более 4 % по массе составляет кальций (к несчастью, камни с низкой концентрацией кальция часто радионеконтрастны и не могут быть обнаружены). Таким образом, для многих пациентов такое лечение неэффективно, у них не будет полного растворения камней даже после двухлетней терапии. Кроме того, уровень рецидивов достаточно высок, так что для больных, которые хорошо реагируют на начальный курс терапии, это лечение может рассматриваться как пожизненное. Сопутствующее назначение хенодиола или урсодиола может усилить эффективность раздробления камней ударной волной. Эта комбинация исследуется.
Другие состояния, при которых испытаны эти средства, включают холестатические расстройства печени и билиарного дерева. Недавние исследования показали, что урсодиол эффективен при первичном билиарном циррозе и склерозирующем холангите. Точный механизм неизвестен, но предполагается, что, изменяя эндогенный пул желчных кислот, урсодиол устраняет внутриклеточную кумуляцию токсичных желчных кислот. Терапевтические испытания выявляют улучшение как на биохимическом (активность печеночных ферментов), так и на гистологическом уровнях.
Другие средства
Метил-/ег£-бутиловый эфир может растворять холестериновые камни в желчном пузыре и желчных протоках при инфузии через катетер непосредственно в желчный пузырь или просвет желчных протоков. Эфир имеет точку кипения в 52.2 "С и, таким образом, остается жидким при температуре тела. Эфиры являются прекрасными растворителями для липидов, и камни могут раствориться в те
чение нескольких часов. Точная терапевтическая роль метил-£ег£-бутилового эфира пока не определена, и похоже, что он будет зарезервирован для отдельных больных, которым противопоказано хирургическое лечение. Моноктаноин (глицерил-1-монооктаноат) — еще одно средство, которое инфу-зируют в общий желчный проток через катетер или Т-образную трубку для растворения закупоривающих желчные протоки камней. С его помощью камни полностью растворяются или существенно уменьшаются в размерах для ускорения их последующего удаления.
Препараты, используемые при лечении хронических воспалительных заболеваний кишечника
Основными препаратами, используемыми при лечении хронических воспалительных заболеваний кишечника (язвенный колит, болезнь Крона ), являются кортикостероиды и другие иммунодепрессивные средства, а также производные салицилатов.
Салицилаты
Установлено, что неабсорбируемая 5-аминоса-лициловая кислота (5-ASA) является активным противовоспалительным средством при воспалительных заболеваниях кишечника. 5-ASA (мезала-мин) может влиять на многие этапы метаболизма арахидоновой кислоты, решающие для патогенеза воспаления. В недавних исследованиях показано, что наряду с подавлением циклооксигеназного пути, снижающим продукцию простагландинов, препарат ингибирует образование лейкотриенов, что может быть более важным. 5-ASA может также действовать как акцептор свободных радикалов. Для расшифровки механизмов его действия необходимы дальнейшие исследования.
К несчастью, 5-AS А нельзя принять перорально в достаточной дозе для получения полезного эффекта в толстом кишечнике без чрезмерного раздражения верхних отделов желудочно-кишечного тракта и развития системного токсического действия. Сульфасалазин представляет собой сульфапиридин и 5-аминосалициловую кислоту, соединенные
азо-связью. Препарат слабо всасывается из кишечника, и азо-связь разрывается при участии бактериальной флоры в дистальной части тонкого кишечника и толстом кишечнике с освобождением 5-ASA. Сульфасалазин был сначала внедрен для лечения ревматоидного артрита в 1940-х гг. Впоследствии было показано, что он эффективен при слабо или умеренно активном язвенном колите и колите Крона, но менее эффективен при болезни Крона тонкого кишечника. При язвенном колите он более эффективен как поддерживающее средство, чем для достижения клинической ремиссии.
Обычные терапевтические дозы сульфасалазина составляют 3-4 г/сут, разделенных на несколько приемов. Для поддержания ремиссии при язвенном колите требуются меньшие дозы, обычно 2 г/сут. Примерно у 20 % пациентов, получающих 4 г/сут, встречаются дозозависимые побочные эффекты: недомогание, тошнота, абдоминальный дискомфорт или головная боль. Некоторых из них можно избежать, начиная терапию с низких доз и медленно повышая их до желаемого уровня, а также используя кишечнорастворимые препараты или жидкие суспензии. Сообщалось об угнетении сульфасалазином всасывания фолиевой кислоты, поэтому целесообразно дополнительное назначение фолата. Наконец, как и при приеме других сульфаниламидов, иногда наблюдаются реакции, подобные сывороточной болезни, и тяжелое угнетение костного мозга.
Разработаны и другие пероральные формы 5-аминосалицилата, которые освобождают активный компонент лекарства в дистальном отделе кишечника, что позволяет избежать токсичности сульфапиридина и чрезмерного системного всасывания 5-ASA. В олсалазине две молекулы 5-ASA соединены диазо-связью, которая разрушается бактериями в толстой кишке, освобождая действующее вещество. В балсалазиде (находится на стадии исследования) 5-AS А соединена посредством диазо-связи с инертным переносчиком. Этот комплекс также разрушается в толстой кишке. Собственно 5-ASA имеется в наличии (как мезаламин) в двух формах: в виде клизмы и в медленноосвобождаю-щих микросферах для перорального назначения. Контролируемые исследования этих средств дали обнадеживающие результаты при легком и умеренном язвенном колите и болезни Крона. В настоящее время мезаламин разрешен только для лечения активного колита, а олсалазин разрешен только для
поддержания ремиссии. Все эти препараты хорошо переносятся. Наиболее частым нежелательным эффектом является водянистый стул, который наблюдается у 15-35 % пациентов, получающих олсалазин, и предположительно вызван секретогонными свойствами препарата. Возможно, 5-ASA провоцирует наблюдаемое изредка усиление язвенного колита при приеме сульфасалазина. Все новые препараты являются более дорогими, чем сульфасалазин, а их клиническая эффективность еще не вполне доказана. 5-AS А для местного применения в виде клизмы или ректальных свечей эффективна при лечении активного дистального колита и разрешена к применению по этому показанию. Однако для излечения могут потребоваться месяцы, кроме того, препарат из клизмы достигает в лучшем случае селезеночного изгиба. К счастью, местная терапия оказалась достаточно эффективной в качестве средства профилактики рецидивов у пациентов, достигших ремиссии.
Иммунодепрессивные средства
К иммунодепрессивным средствам, применяемым при воспалительных заболеваниях кишечника, относятся кортикостероиды, которые много лет используются для подавления острых эпизодов, и цитотоксические средства. Как АКТГ, так и стандартные кортикостероиды, такие как гидрокортизон и преднизон, сравнимы по клинической эффективности. Местные кортикостероиды, вводимые в виде клизмы, эффективны у пациентов с дистальным колитом, но при длительном их применении возникают побочные эффекты, подобные тем, что наблюдаются при системном введении кортикостероидов. Обнадеживают исследования более новых местных препаратов с тем же противовоспалительным эффектом, но без системного действия, например тик-сокортола пивалат. Однако ни одно из этих соединений еще не применяют в США. При лечении воспалительных кишечных заболеваний стали чаще использоваться цитотоксические средства, особенно азатиоприн и меркаптопурин. Их свойство снижать потребность в стероидах благоприятно для пациентов с болезнью Крона и язвенным колитом. Особенно полезными они могут быть в терапии свищевых осложнений болезни Крона. Оба препарата, по-видимому, более эффективны, чем кортикостероиды, в качестве профилактических у пациентов с болезнью Крона. Используемые дозы являются от-
иосительно низкими, начиная с 50 мг/сут и не превышая 1.5 мг/кг в сутки. При этом уровне доз гематологические осложнения минимальны, хотя необходимо тщательное наблюдение. Кроме того, опасность вызываемой препаратом малигнизации при длительном применении в этих дозах минимальна. При воспалительных заболеваниях кишечника можно использовать циклоспорин, но его токсичность ограничивает длительное применение.
Препараты, используемые в терапии портальносистемной энцефалопатии
Для лечения портально-системной энцефалопатии сочетают прием неабсорбируемого антибиотика широкого спектра действия неомицина (глава 45) с ограничением белков в диете. При этом состоянии эффективна также лактулоза. Механизм действия лактулозы неясен. Она, очевидно, разрушается кишечными бактериями до молочной кислоты, уксусной кислоты и других органических кислот. Предполагается, что это может облегчать “вылавливание” кишечным трактом ионов аммиака или других токсичных для центральной нервной Системы веществ. Изменение нормальной кишечной флоры лактулозой рассматривается как другой механизм действия, но он точно не доказан. Лактулозу в виде сиропа дают в дозах 15-30 мл 4 раза в день или до тех пор, пока у пациента не будет мягкий стул четыре или пять раз ежедневно. Препарат хорошо переносится, его можно давать в сочетании с неомицином, хотя эта комбинация не имеет явных преимуществ перед монотерапией лактулозой. Лактулозу можно назначать и в виде клизмы.
Препараты (Антацидные препараты в табл. 64-2)
Блокаторы Н2-гистаминовых рецепторов
Циметидин (Тагамет)
Перорально: таблетки по 200, 300,400, 800 мг; жидкость 300 мг/5 мл Парентерально: водный раствор 300 мг/2 мл для инъекций; 300 мг/50 мл (0.9 % раствор натрия хлорида)
Фамотидин (Пепсид)
Перорально: таблетки по 20,40 мг; порошок 400 мг для приготовления суспензии 40 мг/5 мл
Парентерально: 10 мг/мл для инъекций
Низатидин (Аксид)
Перорально: капсулы по 150,300 мг
Ранитидин (Зантак)
Перорально: таблетки по 150,300 мг;
сироп 15 мг/мл
Парентерально: 0.5, 25 мг/мл для инъекций
Антихолинергические средства
Анизотропии (генерик, Вальпин)
Перорально: таблетки по 50 мг
Атропин (генерик)
Перорально: таблетки по 0.4,0.6 мг Парентерально: 0.05, 0.1, 0.3, 0.4, 0.5, 0.8, 1 мг/мл для инъекций
Клидиний (Кварзан)
Перорально: капсулы по 2.5,5 мг
Дицикломин (генерик, Бентил, др.)
Перорально: капсулы по 10, 20 мг;
сироп 10 мг/5 мл
Парентерально: 10 мг/мл для инъекций
Гликопирролат (генерик, Робинал)
Перорально: таблетки по 1,2 мг
Парентерально: 0.2 мг/мл для инъекций
Изопропамид (Дарбид)
Перорально: таблетки по 5 мг
Мепезолат (Кантил)
Перорально: таблетки по 25 мг
Метантелин (Бантин)
Перорально: таблетки по 50 мг
Метскополамин (Памин)
Перорально: таблетки по 2.5 мг
Оксифенциклимин (Дарикон)
Перорально: таблетки по 10 мг
Пропантелин (генерик, Про-Бантин, др.)
Перорально: таблетки по 7.5,15 мг
Тридигексетил (Патилон)
Перорально: таблетки по 25 мг
Ингибитор протонной помпы
Омепразол (Прилосек)
Перорально (медленного высвобождения): капсулы по 20 мг
Мукопротекторные средства
Мизопростол (Цитотек)
Перорально: таблетки по 100,200 мкг
Сукральфат (Карафат)
Перорально: таблетки по 1 г
Средства при нарушениях перистальтики и отдельные противорвотные
Цизаприд (Пропульсид)
Перорально: таблетки по 10 мг
Дронабинол (Маринол)
Перорально: таблетки по 2.5,5,10 мг
Метоклопрамид (генерик, Реглан, др.) Перорально: таблетки по 5,10 мг; сироп по 5 мг/5 мл Парентерально: 5 мг/мл для инъекций
Ондансетрон (Зофран)
Перорально: таблетки по 4,8 мг Парентерально: 2 мг/мл для внутривенных инъекций
Прохлорперазин (Компазин)
Перорально: таблетки по 5,10,25 мг; капсулы по 10,15,30 мг; раствор 1 мг/мл Ректально: свечи по 2.5,5, 25 мг Парентерально: 5 мг/мл для инъекций
Отдельные противовоспалительные препараты, используемые при желудочно-кишечных заболеваниях
Гидрокортизон (Кортенема, Кортифоам)
Ректально: 100 мг/60 мл на одну удерживаемую сохраняемую клизму;
90 мг аппликационной интраректальной пены
Мезаламин (Азакол, Роуваза)
Перорально: таблетки по 400 мг
Ректально: суспензия 4 г/60 мл; свечи по 500 мг
Метилпреднизолон (Медрол Энпак)
Ректально: 40 мг/флакон удерживаемой клизмы
Олсалазин (Дипентум)
Перорально: капсулы по 250 мг
Сульфасалазин (генерик, Азульфидин, др.)
Перорально:таблетки и кишечнорастворимые таблетки по 500 мг; суспензия 250 мг/5 мл
Отдельные антидиарейные средства
Висмута субсалицилат (Пепто-Бисмол, др.) Перорально: жевательные таблетки и суспензии по 262 мг; суспензия 524 мг/15 мл
Дифеноксин (Мотофен)
Перорально: таблетки по 1 мг (с 0.025 мг атропина сульфата)
Дифеноксилат (генерик, Ломотил, др.)
Перорально: таблетки и жидкость по 2.5 мг (с 0.025 мг атропина сульфата)
Каолин/пектин (генерик, Каопектат, др.) Перорально: 5.85 г каолина и 130 мг пектина на 30 мл суспензии
Лоперамид (Имодиум)
Перорально: капсулы по 2 мг;
жидкость 1 мг/5 мл
Парегорик (генерик)
Перорально: 2 мг морфина (эквивалента) на 5 мл жидкости
Отдельные слабительные средства
Бисакодил (генерик, Дулколакс, др.)
Перорально: таблетки по 5 мг
Ректально: свечи по 5, 10 мг
Cascara sagrada (генерик)
Перорально: таблетки по 325 мг; жидкий экстракт по 5 мл на дозу (приблизительно 18 % спирта)
Касторовое масло (генерик, др.)
Перорально: жидкость или жидкая эмульсия
Докузат (генерик, Колэйс, др.)
Перорально: капсулы по 50, 100, 240, 250 мг;
таблетки по 100 мг; сиропы 50, 60, 150 мг/15 мл; раствор 50 мг/мл
Глицериновые свечи (генерик, Сани-Супп, Флит Бэбилакс)
Лактулоза (Хронулак, Цефулак) Перорально: сироп 10 г/15 мл
Магния гидроксид [магнезиальное молочко, Английская соль] (генерик) Перорально: 7-8.5 % водная суспензия
Метилцеллюлоза
Перорально: жидкость 450 мг/5 мл
Минеральное масло (генерик, др.)
Перорально: жидкость, гель или эмульсия
Фенолфталеин (генерик, Экс-Лакс, др.) Перорально: таблетки по 60,90 мг
Поликарбофил (Эквалактин, Митролан, ФайберКон, Файбер-Лакс) Перорально: таблетки по 500,625 мг; таблетки и жевательные таблетки по 500, 1250 мг
Полиэтиленгликоля электролитный раствор (КоЛайт, GoLYTELY, др.)
Перорально: порошок для перорального раствора, готовится один галлон (приблизительно 4 л)
Силлиум (генерик, Серутан, Метамуцил, др.) Перорально; 3.4,3.5,4.94 г порошка силлиума на пакет; доступен также 50 %, 100 % исиллиум
Сенна (Сенокот, др.)
Перорально: таблетки по 187, 217 мг; таблетки по 600 мг сенны (экв.); гранулы по 326,326.1 мг; 1.65 г сенны экв. у2 чайной ложки гранул; сироп 218 мг/5 мл; 6.5,7 % жидкость
Ректально: свечи по 652 мг
Препараты, растворяющие желчные камни
Хенодиол(Хенике)
Перорально: таблетки по 250 мг
Моноктаноин (Моктанин)
Парентерально: инфузионный флакон на 120 мл
Урсодиол (Актигалл)
Перорально: капсулы по 300 мг
Избранная литература
Binder Н. J., Donowitz М. A new look at laxative action. Gastroenterology, 1975; 69:1001.
Burgess E., Muruve D. Aluminium absorbtion and excretion following sucralfate therapy in chronic renal insufficiency. Am. J. Med. 1992; 92:471.
Chamberlain С. E., Peura D. A. Campylobacter (Helicobacter) pylori: Is peptic disease a bacterial infection? Arch. Intern. Med. 1990; 150:951.
Drossman D. A., Thompson W. G. The irritable bowel syndrome: Review and a graduated multicomponent treatment approach. Ann. Intern. Med. 1992; 116:1009.
Hentschel E. et al. Effect of ranitidine and amoxicillin plus metronidazole on the eradication of Helico-bacterpylori and the recurrence of duodental ulcer. N. Engl. J. Med. 1993; 328:308.
Hixson L. J. et al. Current trends in the pharmacotherapy for gastroesophageal reflux disease. Arch. Intern. Med. 1992; 152: 717.
Hoffman A. F. Nonsurgical treatment of gallstone disease. Annu. Rev. Med. 1990; 41:401.
Johnston D. E., Kaplan M. M. Pathogenesis and treatment of gallstones. N. Engl. J. Med. 1993; 328:412.
Lauritsen K., Laursen L. S., Rask-Madsen J. Clinical pharmacokinetics of drugs used in the treatment of gastrointestinal diseases. (Two parts.) Clin. Pharmacokinet. 1990; 19:11,94.
Lynn R. B., Friedman L. S. Irritable bowel syndrome. N. Engl. J. Med. 1993; 329:1940.
McCarthy D. M. Sucralfate. N. Engl. J. Med. 1991; 325: 1017.
Ramirez B., Richter J. E. Review article: promotility drugs in the treatment of gastro-esophageal reflux disease. Aliment. Pharmacol. Ther. 1993; 7: 5.
Soil A. H. Pathogenesis of peptic ulcer and implications for therapy. N. Engl. J. Med. 1990; 322:909.
Walt R. P., Langman M. S. J. Antacids and ulcer healing. Drugs, 1991; 42:205.
Wolfe M. M., Soli A. H. The physiology of gastric acid secretion. N. Engl. J. Med. 1988; 319:1707.
Терапевтический и токсический потенциал препаратов 05
безрецептурного отпуска
Мари-Энн Кода-Кимбл
В США препараты по закону разделены на два класса: те, которые отпускаются только по рецептам, и те, для которых указания по безопасному применению могут быть даны в письменной форме. Последнюю категорию составляют невыписываемые препараты, или препараты безрецептурного отпуска (over-the-counter — ОТС, с прилавка). В 1992 г. американское общество израсходовало около 12 млн долл, примерно на 300 000 ОТС-препаратов для самостоятельного лечения самодиагностированных заболеваний, от прыща до бородавок. Эти 300 000 препаратов включают примерно 700 активных ингредиентов в различных формах и сочетаниях. Таким образом, очевидно, что многие из них являются не более чем аналогами, рекламируемыми для публики так, чтобы убедить, что между ними имеются значительные различия. Например, имеется более 100 различных системных болеутоляющих средств и почти все они содержат в качестве основных ингредиентов аспирин, ацетаминофен, салициламид, фенацетин, ибупрофен или сочетание этих средств. Отличия одного от другого достигаются добавлением спорных ингредиентов, таких как кофеин или антигистаминные препараты; фирменным названием, выбранным с целью оттенить особенность применения или силу действия (“женские боли", “артрит”, “максимум”, “экстра”); особой лекарственной формой (кишечнорастворимые таблетки, жидкости, медленно высвобождаемые препараты, порошки, шипучие формы). За счет всех этих ухищрений возрастает цена и в большинстве случаев менее дорогой препарат-генерик может быть равноэффективным. Можно с уверенностью сделать вывод, что население в целом перегружено и запутано изобилием лекарств и, вероятно, будет применять те из них, которые наиболее упорно рекламируются.
С 1972 г. Управление по пищевым продуктам и лекарствам (Food and Drug Administration, FDA) участвует в анализе безопасности и эффективности ингредиентов ОТС. Два основных последствия этого анализа таковы: 1) ингредиенты, отмеченные как неэффективные или небезопасные для терапевтического использования, на которое они претендуют, исключаются из рецептур ОТС (например, антимускариновые средства были убраны из снотворных ОТС); 2) средства, доступные ранее только по рецептам, переводятся в разряд ОТС, потому что они были оценены экспертами как в целом безопасные и эффективные для использования потребителем без медицинского контроля (например, местный гидрокортизон 0.5 % и 1 %, дифенгидрамин, ибупрофен, клотримазол). Некоторые ингредиенты ОТС, применявшиеся ранее только в низких дозах, теперь доступны в более высоких концентрациях. В табл. 65-1 перечислены некоторые рецептурные средства, которые рекомендованы для безрецептурного отпуска. Хотя по этим рекомендациям издано несколько последних регулирующих указаний, позиция FDA состоит в разрешении производителям включать эти ингредиенты в препараты ОТС на основании публикации экспертных обзоров до тех пор, пока FDA не выявит причины, заставляющей отменить это разрешение. К другим рецептурным препаратам, находящимся в настоящее время на рассмотрении для ОТС-продажи, относятся Н2-антагонисты, сукральфат, антигистаминные средства без седативного эффекта, некоторые нестероидные противовоспалительные средства, никотиновая жевательная резинка, альбутерол и кромолин.
Имеются три причины, по которым для клинициста важно хорошо знать этот класс препаратов. Во-первых, многие из ингредиентов, содержащих
ся в них, эффективны при лечении обычных заболеваний, и важно суметь помочь больному выбрать безопасный и эффективный препарат (табл. 65-2). Во-вторых, многие из активных ингредиентов, содержащихся в ОТС-препаратах, могут усугублять существующие заболевания или взаимодействовать с прописываемыми лекарственными средствами (приложение II “Взаимодействие препаратов”). Наконец, неправильное употребление или злоупотребление препаратами ОТС может вызвать значительные медицинские осложнения. Например, подростки злоупотребляют симпатомимети-ком фенилпропаноламином, включенным во многие противопростудные, противоаллергические и понижающие массу тела препараты и часто продающимся на черном рынке как заменитель кокаина или амфетамина. Даже в двух- или трехкратных терапевтических дозах это средство может вызвать тяжелую гипертензию, судороги и внутричерепное кровотечение. Общая осведомленность о безрецептурных препаратах и их составе дает возможность клиницистам более полно оценивать вероятность возникновения проблем, связанных с их применением.
В табл. 65-2 перечислены препараты ОТС, которые могут быть эффективно использованы для решения медицинских проблем, обычно встречающихся у амбулаторных больных. Выбор одного, а не другого средства важен для больных с определенными медицинскими проблемами или принимающих некоторые рецептурные препараты. Это подробно описывается в других главах. Рекомендации, перечисленные в табл. 65-2, основаны на эффективности ингредиентов и на следующих принципах.
1. Выбирать препарат, который является простейшим по рецептуре в отношении ингредиентов и формы дозировки. В целом предпочтительны мо-ноингредиентные препараты. Некоторые комбинированные средства содержат эффективные дозы всех ингредиентов, другие же — терапевтические дозы некоторых ингредиентов и субтерапевтические дозы других. Более того, вероятны различия в длительности действия между ингредиентами и всегда существует возможность, что врач или пациент будет неосведомлен о присутствии определенного активного ингредиента в препарате. Аспирин, например, представлен во многих противопро-студных препаратах; пациент, не знающий об этом, может принимать отдельные дозы аналгетиков в
дополнение к тому, что содержится в противопро-студных препаратах.
2. Выбирать препарат, который содержит терапевтически эффективную дозу.
3. Выбирать препарат, на упаковке которого перечислены его ингредиенты и их количества. Сигнатуру препарата необходимо всегда внимательно читать, поскольку ингредиенты могут быть изменены без публичного извещения или изменения фирменного названия.
4. Рекомендовать генерик (родоначальный продукт), если он доступен.
5. Быть осторожным в отношении рекламных заявлений относительно особого превосходства над аналогичными препаратами.
6. Для детей в первую очередь должны учитываться доза, лекарственная форма и вкус препарата.
Приема некоторых ингредиентов безрецептурных препаратов необходимо избегать или использовать их с осторожностью у отдельных пациентов по причине того, что они могут ухудшать существующие медицинские проблемы или взаимодействовать с уже принимаемыми лекарствами. Многие из наиболее сильных ингредиентов “скрыты” в препаратах, где их присутствие не ожидается (табл. 65-3). Такая неосведомленность о составе безрецептурных средств и убеждение многих врачей в том, что они “неэффективны и безвредны”, могут вызвать диагностические ошибки и, возможно, искажать результаты терапии.
Например, неисчислимое количество ОТС-пре-паратов, включая противокашлевые и противопростудные средства, лекарства от насморка и препараты, понижающие аппетит, содержат симпатоми-метики. Их применения нужно избегать или использовать с осторожностью при инсулинзависимом диабете и у больных с гипертензией, ангиной или гипертиреоидизмом. Лицам с активной пептической язвенной болезнью, некоторыми нарушениями в системе тромбоцитов или пациентам, принимающим пероральные антикоагулянты, не следует употреблять аспирин.
Наконец, избыточ ное ил и неправильное использование безрецептурных препаратов может вызвать значительные медицинские проблемы. Примером является рикошетная гиперемия вследствие регулярного применения назальных спреев в течение 3-4 дней ил и более. Неправильное и длительное использование некоторых антацидов (например, алюминия гидроксида) можетвызвать запор у пожилых
ТАБЛИЦА 65-1. Ингредиенты, которые рекомендованы экспертным обзором для перевода из рецептурного в безрецептурный отпуск
Ингредиенты и дозировка Эффект Примеры моноингредиентных препаратов
Системные Бромфенирамин 4 мг каждые 4-6 часов Антигистаминный Диметан Экстентабс
Хлорфенирамин 4 мг каждые 4-6 часов Антигистаминный Хлор-Триметон, Телдрин
Дифенгидрамина гидрохлорид 25-50 мг Антигистаминный Бенадрил
каждые 4-6 часов Противокашлевый Бенилин сироп
Снотворный Соминекс 2, Слип-Изи 3
Доксиламин 7.5-12.5 мг каждые 4-6 ча- Антигистаминный Нет
сов Диклонина гидрохлорид 0.05-0.10 % Пероральный местный внес- Сакрет-спрей максимальной
тетик, аналгетик силы
Фтор (различные соли) Профилактический антика- Нет
Нвтриевые 0.05 % полоскания риесный
Оловянные 0.1 % полоскания Фосфорно-кислые 0.02 % полоскания Метоксифенамина гидрохлорид 100 мг Бронходилататор' Нет
каждые 4-6 часов Прометазина гидрохлорид 6.25-12.5 мг Антигистаминный1 Нет
каждые 8-12 часов Псевдоэфедрина гидрохлорид и суль- Устранение заложенности D-Феда, Судафед
фат 60 мг каждые 4-6 часов носа
Пирантела памоат 11 мг/кг в однократ- Противогельминтный (круг- Лекарство Риза от нематод
ной дозе лые черви)
Местные Эфедрина сульфат 2-25 % Сосудосуживающий при кро- Нет
Эфедрина гидрохлорид 100-200 мкг в вотечениях Сосудосуживающий при кро- Нет
водном растворе 4 раза в день вотечениях
Галопрожин 1 % Противогрибковый (противокандидозный1) Противовоспалительный Нет
Гидрокортизон (основание и различные Нет
соли) 0.5-1 % (противогрибковый1)
При перхоти (себорейный Азросеб-НС
дерматит) Противозудный, противо- Калде-Корт, Кортэйд, Ланакорт
Миконазола нитрат 2 % воспалительный Противогрибковый Микатин крем, спрей, порошок,
Противокандидозный жидкость Монистат вагинальный крем, свечи
Нистатин 100 000 ЕД/г Противокандидозный’ Нет
Оксиметазолина гидрохлорид 0.1 % Устранение заложенности Африн, Дюрэйшн, Нео-Синефрин
Фенилэфрина гидрохлорид 0.5 мг в вод- носа 12-часовой
Сосудосуживающий при кро- Нет
ном растворе 4 раза в день вотечениях
ТАБЛИЦА 65-1. (Продолжение)
Ингредиенты и дозировка Эффект Примеры моноингредиентных препаратов
Ксилометазолин0.1 % Устранение заложенности Длительнодействующий носовой носа ороситель Дристан, Нео-Синеф- рин II длительно действующий, Синекс долго действующий восстанавливающий дыхание носовой спрей
' Несмотря на рекомендации экспертов, в FDA в настоящее время имеются разногласия по безрецептурному использованию препарата по этим показаниям.
ТАБЛИЦА 65-2. Эффективные ингредиенты отдельных классов ОТС-препаратов
Категория ОТС Ингредиент и дозировка Примеры препаратов Комментарии
Противоугревые Бензоилпероксид, Генерик, Беноксил, Кле- Один из наиболее эффективных противо-
препвраты 2.5, 5,10% расил, Окси-5, Окси-10 угревых препаратов. Применять в щадящем режиме один или два раза в день. Снижать дозу, если обнаруживается чрезмерное кожное раздражение
Противоаллер- Хлорфенирамин, Генерик, Хлор-Триметон Антигистаминные препараты сами по себе
гические 4 мг каждые 4-6 (4 мг/таб или сироп улучшают многие симптомы, связанные с
препараты часов; 12 мг 10 мл), Длительно дей- аллергическим ринитом или сенной ли-
каждые 12 часов ствующий Хлор-Триметон1 (8 мг/таб), Телдрин в капсулах с длительным высвобождением1 (8 мги 12мг/капс) хорадкой. Хлорфенирамин, бромфенирв-мин и клемастин вызывают меньшую сонливость, чем дифенгидрамин, метапири-лин, пириламин, доксиламин и фентолок-самин. Иногда симптомы, не облегчав-
Бромфенирамин, Симптом 3 (4 мг/10 мл), мые антигистаминными средствами, рв-
4 мг каждые 4-6 Диметан Экстентаб1 агируют на добавление симпатомимети-
часов; 12 мг каждые 12 часов Клемастина фумарат, 1.34 мг каждые 12 часов Дифенгидрамин1, 25-50 мг каждые 4-6 часов Хлорфенирамин (4 мг) с псевдоэфедрином (60 мг) Клемастина фумарат (1,34 мг) с фенил-пропаноламином (75 мг) каждые 12 часов Трипролидина гидрохлорид (2.5 мг) с псевдоэфедрином (60 мг) (12 мг) Тавист-1 (1.34 мг/таб) Бенадрил (25 мг/капс; 12.5 мг/5 мл эликсира) Новагистин, эликсир и таблетки (по 10 мл или 2 таблетки); Триамини-цин противоаллергический (в таблетках) Тавист-D Актифед ков
ТАБЛИЦА 65-2. (Продолжение)
Категория ОТС Ингредиент и дозировка Примеры препаратов Комментарии
Аналгетики и Аспирин, 300- Генерик, Байер Аспирин Имеются многочисленные модификации
антипиретики 600 мг каждые 4-6 часов Ацетаминофен, 300-600 мг каждые 4-6 часов Ибупрофен,1 200-400 мг каждые 4-6 часов Напроксен, 200 мг каждые 8-10 часов (325 мг/таб) Генерик, Датрил, Тайленол (325 мг/таб различной силы действия) Генерик, Адвил, Нуприн, Медиприн (200 мг/таб) Элив (200 мг/таб) препаратов, включающие добавки антацидов, кофеина и метапирилина; кишечнорастворимые таблетки и шипучие формы; длительнодействующие или сверхактивные препараты; различные смеси аналгетиков. Ни одна не имеет каких-либо существенных преимуществ перед моноингредиентными препаратами. Ацетаминофен лишен противовоспалительной активности, но имеется в жидком виде; эта лекарственная форма используется в первую очередь у младенцев и детей, которые не могут жевать или глотать таблетки. Аспирин необходимо осторожно применять у некоторых индивидуумов (пояснения в тексте). Избегать препаратов, содержащих фенацетин, например соединение A.S.A., Бромо-Зельцер, капсулы А.Р.С. Сверхсильные препараты содержат 400-600 мг активного ингредиента
Антациды Сочетания гидроксида магния и гидроксида алюминия Гелюсил, Гелюсил II, Маалокс № 1, Маалокс № 2, Миланта, Миланта II, Вингел, др. Комбинации магния и алюминия гидроксид с меньшей вероятностью вызовут запор или диарею и имеют высокую нейтрализующую емкость. Формы “II” являются приблизительно вдвое более сильными по нейтрализующей способности. Перечисленные препараты являются жидкими и отличаются низким содержанием натрия
Противодиарей- Висмута салицилат, Пепто-Бисмол Способен изменить цвет языка и кала на
ные средства 600 мг 4 раза в день для предупреждения диареи путешественников Лоперамид, вначале 4 мг, затем 2 мг после каждого неоформленного стула, не превышать 16 мг/сут Опий, порошок, 15-го мг 1-4 раза в день, не более (262 мг/таб или 524 мг/30 мл суспензии) Имодиум (2 мг/капс или 1 мг/5 мл жидкости) Диабисмал суспензия (0.47 мг/мл), Донна-гель-PG (0.8 мг/мл), черный. Салицилаты абсорбируются и могут вызвать звон в ушах Синтетический опиоид, который не проникает в ЦНС. Не отнесен к контролируемым веществам. Избегатьулихорадящих больных Вещество списка V при сочетании с другими противодиарейными веществами. В некоторых странах недоступен как ОТС.
ТАБЛИЦА 65-2. (Продолжение)
Категория ОТС Ингредиент и дозировка Примеры препаратов Комментарии
Местные проти- 2 дней (<= 1.5-2 мг морфина) Настойка опия (па-регорик), 4-5 мл 1-4 раза вдень, не более 2 дней (1 мл парегорика содержит 4 мг опия) Толнафтат, 1 % Инфантол Пинк (0.5 мг/мл) Каоден с Парегориком (0.125 мг/мл), Парепек-толин (0.12 мг/мл) Генерик, Афтат, Тинактин Избегать применения у лихорадящих больных и предрасположенных к токсическому мегаколону. Возможно угнетение ЦНС См. предыдущий комментарий Фунгицидный. Эффективен для лечения
вогрибковые средства Местные проти- раствор,крем или порошок Клотримазол, 1 % крем или вагинальные формы по 100 мг’ Миконазола нитрат, 2% крем или 100 мг вагинальные таблетки' Гидрокортизон, Фем-Кэйр, Джин- Лотри-мин, Мицелекс 7 Монистат-7 Генерик, Кортэйд (крем, дерматомикозов стоп, ног Клотримазол и миконазол эффективны также при вагинитах, вызванных Candida albicans. Вводится одна таблетка (вкладыш) на ночь в течение 7 дней Применяются для временного облегчения
вовоспали- 0.5 % лосьон, мазь), Дермо- зуда и воспаления, связанных с малыми
тельные препараты Гидрокортизон, 1 % лэйт, Ланакорт Генерик, Калдекорт, Кор- высыпаниями вследствие контактного или аллергического дерматита, укусов
Антисеборей- крем или спрей1 Селена сульфид тизон 10, Ланакорт 10, Кортэйд максимальной силы Селсун Блу насекомых и геморроя. Наносятся малые количества и сильно втираются в кожу 3-4 раза в день Оба являются цитостатическими сред-
ные средства Противокашле- 1-2% Цинк пиритион, 1-2% Кодеин, 10-20 мг Много препаратов. Брек Ван, Хед энд Шоулдерс Керакол, Робитуссин А-С ствами, которые уменьшают скорость смены эпидермиса. Употребляется на чистый скальп на 5-10 минут 2 или 3 раза в неделю. Селена сульфид может раздражать глаза и кожу В дозах, необходимых для подавления
вые каждые 4-6 часов (оба содержат 2 мг/мл) кашля, аддиктивный потенциал, связан-
препараты (с гуайфенезином) Декстрометорфан, 10-20 мг каждые 4 часа или 30 мг каждые 6 часов (с гуайфенезином) Керакол D (2 мг/мл), 2/G-DM (3 мг/мл), Новагис-тина противокашлевая формула (5 мг/мл), Пертуссин 8-часовая противокашлевая формула (1.5 мг/мл), Робитуссин DM (3 мг/мл) ный с кодеином, низкий. Кодеин является наркотиком списка V, и в некоторых странах его ОТС-продажа ограничена. Эффективность отхаркивающих средств, которые включаются почти во все проти-вокашлевые препараты, сомнительна. Гу-айфенезин обладает меньшим потенциалом токсичности. Необходимо обращать внимание на скрытые ингредиенты в этих препаратах
ТАБЛИЦА 65-2. (Продолжение)
Категория ОТС Ингредиент и дозировка Примеры препаратов Комментарии
Средства от насморка Местные Оксиметазолин Африн Местные симпатомиметики эффективны
Отхаркивающие Ксилометазолин Фенилэфрин Пероральные Псевдоэфедрин, 60 мг каждые 4 часа или 120 мг каждые 12 часов Фенилпропанол-амин, 25 мг каждые 4 часа Гуайфенезин Длительнодействующий носовой ороситель Дристан, Нео-Синеф-рин II, Сайнекс-LA., назальный спрей Синутаб Аллерест, назальный спрей Корицидин, Нео-Синефрин, NTZ Новафед (30 мг/5 мл), Судафед (30 мг/таб или 5 мл) Судафед SA (120 мг/капс). Не имеется моноингреди-ентного препарата 1/G, Нортуссин, Робитус- как скорая помощь при насморке, связанном с обычными простудами и аллергиями. В целом предпочтительны длительно действующие средства (оксиметазолин и ксилометазолин), хотя фенилэфрин столь же эффективен. Пероральные средства, восстанавливающие носовое дыхание, обладают пролонгированным действием, но могут вызвать больше системных эффектов. Псевдоэфедрин в меньшей степени стимулирует ЦНС. Фе-нилпропаноламин также эффективен. Всасывание перорального фенилэфрина непредсказуемо Единственный отхаркивающий ингреди-
средства (120 мг/мл): в воз- син сироп ент, выбранный FDA, как имеющий науч-
Слабительные расте > 12 лет 200-400 мг каждые 4 часа; в возрасте 6-12 лет 100-200 мг каждые 4 часа; в возрасте 2-6 лет, 50-100 мг каждые 4 часа Увеличивающие Метамуцил, Серутан ные доказательства безопасности и эффективности Наиболее безопасные слабительные для
средства Педикулоцидные объем Размягчающие стул —докузат натрий Солевые слабительные Перметрин 1% Генерик, Колэйс, Колок-тил, Доксинат Магниевое молочко Филипса NIX, крем-ополаскива- хронического применения включают увеличивающие объем и размягчающие стул средства. Солевые слабительные и стимуляторы могут использоваться однократно, но не хронически (пояснения в тексте) Эффективны. Нанести на сухую кожу и
средства Пиретрум в комплексе с пиперо-нилбуторидом тель А-200 — педикулоцид-ный шампунь и гель; RID — педикулоцидный шампунь скальп, полностью смачивая поверхность. Оставить на 10 минут. Далее смыть водой и ополоснуть. Избегать контакта с глазами. Повторить однократно, если произошло повторное заражение. Вычесать гнид
ТАБЛИЦА 65-2. (Продолжение)
Категория ОТС Ингредиент и дозировка Примеры препаратов Комментарии
Снотворные средства Дифенгидрамин,1 25-50 мг на ночь Соминекс 2, Слип-Изи 3 (25 мг/таб или капе); Слипинал (50 мг) Дифенгидрамин—антигистаминное средство с хорошо известным угнетающим влиянием на ЦНС; в настоящее время доступен без рецепта для применения в качестве седативного
' Ранее были доступны только по рецептам. В настоящее время продаются свободно.
ТАБЛИЦА 65-3. Скрытые ингредиенты в препаратах безрецептурного отпуска
Скрытый препарат или класс препаратов Класс безрецептурных Примеры препаратов средств
Спирт(процент Противокашлевые сиропы и Бреакол (10 %), Котуссис (20 %), Формула 44D (20 %),
этанола) противопростудные сред- Холле (22 %), Новагистин DMX (10 %), НиКвил ночное ства противопростудное средство (25 %), Пертуссин 8-часо- вая противокашлевая формула (9.5 %), Пруникодеин (25 %), Ромилар III (20 %), Туссар SF (12 %) Полоскания для рта Астринг-О-Сол (65 %), ополаскиватель для рта цепакол (14 %), антисептик листерии (75 %), Скоуп (19 %)
Антигистаминные Аналгетики Таблетки от сильной головной боли Аллерест, Эксцедрин РМ, Перкогезик, таблетки Синарест Антиастматическиесредст- Бронитин, Приматин М ва Противопростудные и про- Много препаратов: Алка-Зельцер Плюс, Аллерест, Проти-тивоаллергические пре- вокашлевый сироп Бенилин, Хлор-Триметон, Контак, Ко-параты рицидин, Ко-Тайленол, Дристан, Новагистин, Ни-Квил, Синарест, Сайн-Офф, Синутаб, Супер Анагист, Триминик, Триаминицин, 4-компонентные таблетки от простуды Дерматологические препа- Пирибензамин крем или мазь раты Средства помощи при мен- Кардуй, Памприн, Санрил струациях Средства для улучшения пе- Бонин, Драмамин, Марезин ристальтики, противорвотные препараты Снотворные средства Композ таблетки, Нервайн, Ньютол, Слип-Изи, Соминекс Местные препараты против Дристан, Синекс насморка
Антимускариновые Противодиарейные Доннагель, Доннагель-PG
средства средства Противокашлевые, проти- Синулин таблетки вопростудные и противо- аллергические средства Антигеморроидальные пре- Противогеморроидальные свечи Вайанойдс параты
ТАБЛИЦА 65-3. (Продолжение)
Скрытый препарат или класс препаратов Класс безрецептурных Примеры препаратов средств
Аспирин и другие Аналгетики Много препаратов: Алка-Зельцер, Анацин, Аспергум, Коуп,
салицилаты Экотрин, Эксцедрин, Физрин порошок, Миазурин, Пер-систин, Стенбек таблетки и порошок, Ванквиш Противодиарейные сред- Пепто-Бисмол (висмута субсалицилат) ства Противопростудные и про- Алка-Зельцер Плюс, Конгеспирин, Корицидин, Дристан тивоаллергические сред- таблетки, Сайн-Офф, Триаминицин, 4-компонентные ства таблетки от простуды Средства помощи при мен- Диурекс (калия салицилат), Мидол струациях Снотворные средства Квайт Волд таблетки, Транквил капсулы (натрия салици- лат)
Кофеин Аналгетики Анацин, Бромо-Зельцер, Коуп, Эксцедрин, Стенбек таб- летки и порошок, Ванквиш Противопростудные и про- Корибан D, Дристан, Супер Анагист, Триаминицин тивоаллергические средства Менструальные и диурети- Аква-Бан, Мидол, Три-Аква ческие средства Стимуляторы Эвейк, НоДоз, Виварин Препараты для снижения Анорексии капсулы, Дексатрим массы тела
Эстрогены Кремы для волос Ле Кэйр
Местные анестети- Противокашлевые Формула 44 противокашлевой диск, Силексин противокаш-
ки(обычно левые таблетки, Виккс подавляющие кашель таблетки
бензокаин) Дерматологические прела- Америкаин — спрей или мазь первой помощи, Дермопласт, раты Нуперкаинал — крем и мазь, Меди-Квик, Соларкаин, Унгуентин спрей, Унгуентин Плюс Антигеморроидальные пре- Америкаин, Анузол мазь, Ланакан медицинский крем, Ну-параты перкаинал — крем или мазь, Тронолан анестезирующий антигеморроидальный крем Пастилки Цепакол Троше, Холд, Спек-Т средство при воспалении горла, Трокеттес, Викс пастилки при воспалении горла Средства, применяемые Беби Орайел, Бензодент, Нумзидент, Орабейз В с бензо-при зубной боли, холодо- каином, Орайел лосьон при прорезывании зубов, зубные вой чувствительности и капли прорезывании зубов Препараты для снижения Диет Трим таблетки, Слим Лайн—леденцы и жевательная массы тела резинка, Спантрол
Натрий (мг/таблет- Аналгетики Алка-Зельцер шипучее обезболивающёе и антацид (567),
ку или мг/5 мл Бромо-Зельцер (761), Физрин порошок (673), натрия
или как указано) салицилат (50 мг, 300 мг) Антациды Алка-Зельцер шипучий антацид (276), Амфожель жидкий (7), А.М.Т (7), БисоДол (157), Ролайдс(53), СодаМинт(89)
ТАБЛИЦА 65-3. (Продолжение)
Скрытый препарат или класс препаратов Класс безрецептурных средств Примеры препаратов
Натрий (мг/таблет-ку или мг/5 мл или как указано) Сиропы от кашля Корибан D (31), Цероуз (38), Дристан (59), Пертуссин 8-часовая противокашлевая формула (24), Формула 44 (68), Викс сироп от кашля (54)
(продолжение) Слабительные Безотлагательная смесь Метамуцил (250 мг/пакет), Флитс Энема (500 мг, из которых 250-300 мг абсорбируется), Фосфо-Сода (55), Сал Гепатика (1000)
Симпатомиметики Аналгетики Антиастматические средства Противопростудные и противоаллергические препараты Таблетки от сильной головной боли Аллерест, Синарест, Сайн-Эйд Синус Бронкаид, Бронкотабс, Приматен, Тедрал Алка-Зельцер Плюс, Аллерест, Хлор-триметон против насморка, Контак, Корицидин ‘D’ таблетки от насморка, Ко-Тайленол, Дристан, Новафед, Новагистин Синус таблетки, НиКвил, Синарест, Сайн-Эйд, Сайн-Офф, Синутаб, Судафед, Супер Анагист, Триаминицин, 4-компонентные противопростудные таблетки
Сиропы от кашля Антигеморроидальные препараты Пастилки Препараты помощи при менструациях Местные препараты от насморка Препараты для снижения массы тела Цероуз DM, Формула 44D, Робитуссин-РЕ, Триаминик экспекторант, Триаминикол и многие другие A-Каин, ректальная мазь Эпинефрикаин, антигеморроидальные мази НТО Стейнлесс Манзан, Пазо, Вайанойдс Спек-Т средство от фарингита и насморка, Сакретс Формула при простуде и насморке Фемкапс, Флюидекс-Плюс с Диадаксом Множество. Африн, Бензедрекс, Нео-Синефрина гидрохлорид, NTZ, Привин Синекс, Викс Инхалер Аппедрин таблетки, Дексатрим капсулы, Проламин капсулы
людей, а также гипофосфатемию. Злоупотребление слабительными (преимущественно пожилыми людьми) может привести к абдоминальным спазмам и водно-электролитным расстройствам. Нарушения сна, нервозность и тревожность могут развиться из-за применения симпатомиметиков или кофеина, скрытых во многих препаратах ОТС (табл. 65-3). Хроническое системное применение некоторых аналгетиков, содержащих большое количество кофеина, может вызвать рикошетные головные боли. Длительный прием аналгетиков, особенно содержащих фенацетин, провоцирует развитие интерстициального нефрита. Аспирин и ацетаминофен в больших количествах вызывает серьезную интоксикацию у взрослых и детей. Антигистаминные сред
ства могут приводить к седации или сонливости, особенно когда принимаются одновременно с гипно-се-дативными препаратами, транквилизаторами, алкоголем или другими средствами, угнетающими центральную нервную систему. Наконец, антигистаминные средства, местныеанестетики, антибиотики, антибактериальные средства, средства против раздражения кожи.р-аминобензойная кислота, консерванты и дезодоранты, содержащиеся во множестве местных и вагинальных безрецептурных препаратов, могут вызывать аллергические реакции.
Существует три главных информационных источника об ОТС-препаратах. Наиболее содержательным является Handbook of Nonprescription Drugs', там дана оценка ингредиентов, содержащих
ся в основных классах препаратов ОТС и перечислены основные из них. Physicians’Desk Reference for Nonprescription Drugs — перечень информации производителей, относящейся к ОТС-препаратам, является в некоторой степени неполным по числу включенных препаратов и составу представленных сведений. The New Medicine Show — руководство для потребителя по применению ОТС-препаратов — критически оценивает эти средства и обсуждает их рациональное использование. Оно хорошо написано и фактологически корректно. Любой врач, который ищет более специальную информацию в отношении безрецептурных препаратов, найдет здесь полезные рекомендации.
Избранная литература
Editors of Consumers Reports. The New Medicine Show: Consumer’s Union Practical Guide to Some Everyday Health Problems. Consumer’s Union of The United States, Inc, 1989.
Fredd S. B. The OTC drug approval process. Am. J. Gastroenterol. 1990; 85:12-14.
Handbook of Nonprescription Drugs, 10th ed. American Pharmaceutical Association, 1993.
Palmer H. H. New OTCs: A selected review. Am. Pharm. 1992; NS 32:26-38.
Smith M. H. B., Feldman W. Over-the-counter cold medications. A critical review of clinical trials between 1950 and 1991. JAMA, 1993; 269: 2258-2263.
Рациональное назначение лекарств и выписывание рецептов
66
Пол В. ЛофхОлм, Бертрам Г. Катцунг
Решение врачом вопроса о лечении больного предполагает, что пациент обследован и ему поставлен диагноз. Вслед за этим врач может сделать выбор из ряда возможных направлений лечения. Лекарственная терапия, хирургия, психиатрическая помощь, лучевая терапия, физиотерапия, обучение здоровому образу жизни, советы, дальнейшие консультации или отказ от терапии предоставляют широкие возможности выбора. Из них чаще всего выбирают лекарственную терапию. В большинстве случаев она требует выписывания рецепта. Рецепт является предписанием врача по приготовлению или отпуску специфического лечения (обычно лекарственного) для конкретного больного. Когда пациент приходит с визитом в лечебное учреждение, врач или другой специалист в сфере здравоохранения в 67 % случаев выписывает лекарства, в среднем один рецепт за визит (может быть выписано более одного рецепта за одно посещение).
В этой главе представлен план назначения лекарств, обсуждаются врачебная форма рецепта, обычные ошибки в рецептах и официальные требования, которые регламентируют процесс выписывания лекарств. Наконец, рассматриваются некоторые социальные и экономические факторы, влияющие на выписывание и использование препаратов.
Рациональное назначение лекарственных препаратов
Подобно другим процедурам в медицине, выписывание рецептов должно основываться на ряде рациональных шагов. Эти операции могут быть описаны следующим образом.
1. Поставьте точный диагноз. Назначения, основанные только на желании удовлетворить психологическую потребность больного в лечении, часто являются неудовлетворительными и могут привести к побочным эффектам. Для совершения следующего шага необходим точный диагноз, даже если он является “предположительным”. Тридцатипятилетней женщине с симметричной скованностью, болью и воспалением суставов, которые усиливаются утром и не связаны в анамнезе с инфекцией, может быть поставлен диагноз ревматоидного артрита. Этим диагнозом и его обоснованием необходимо поделиться с больным.
2. Обдумайте патофизиологические основы установленного диагноза. Если патология ясна, врач находится в гораздо лучшей позиции для выбора эффективной терапии. Например, новые знания о медиаторах воспаления делают возможным более эффективное использование НПВС и других средств, используемых при ревматоидном артрите. Пациент должен быть обеспечен информацией о патофизиологии на доступном уровне и в соответствующем количестве. Многие общественные и частные агентства по изучению болезней (например, American Heart Association, American Cancer Society, Arthritis Foundation) подготавливают информационные брошюры, адаптированные для больных.
3. Выберите точную цель терапии. Необходимо выбрать цель лечения для каждого из патофизиологических процессов, определенных на предыдущем этапе. У пациента с ревматоидным артритом облегчение боли путем подавления воспалительного процесса является одной из главных терапевтических целей, которая определяет рассматриваемые группы лекарственных средств. Замедление хода патологического процесса при ревматоидном арт
рите — другая терапевтическая цель, которая может дать повод для рассмотрения иных групп препаратов и предписаний.
4. Определите препарат выбора. Одна или более групп препаратов определяются терапевтическими целями, поставленными на предыдущем этапе. Назначение препарата выбора из общего числа этих групп следует из анализа особенностей пациента и клинической картины. В некоторых случаях такие характеристики, как возраст, раса, сопутствующие заболевания и прием других лекарств, чрезвычайно важны для определения наиболее подходящего препарата для терапии данного заболевания. В случае с вероятным ревматоидным артритом важно знать, имеет ли больная в анамнезе непереносимость аспирина или язвенную болезнь, является ли стоимость лекарств существенным фактором и есть ли необходимость в приеме лекарств один раз в день. Основываясь на этой информации, будет выбран, вероятно, препарат из группы нестероидных противовоспалительных средств. Если больная не переносит аспирин и не страдает язвенной болезнью, но нуждается в недорогом лечении, рациональным выбором был бы ибупрофен.
5. Определите соответствующий режим приема. Режим дозирования определяется в первую очередь фармакокинетикой препарата у данного пациента. Если известно, что у него имеется заболевание основных органов, необходимых для элиминации выбранного препарата, потребуется коррекция “усредненного” режима. Для такого препарата, как ибупрофен, который элиминируется в основном почками, должна быть оценена почечная функция. Если почки функционируют нормально, период полувыведения ибупрофена (примерно 2 часа) требует назначения его 3 или 4 раза в день. Доза, рекомендуемая лекарственными справочниками и литературой производителей, составляет 400-800 мг 4 раза в день.
6. Продумайте план наблюдения за действием препарата и определите конечную цель терапии. Врач должен описать пациенту виды эффектов препарата, за которыми следует наблюдать, и каким образом это нужно делать, включая лабораторные исследования (если необходимо) и признаки и симптомы, о которых пациент должен сообщать. Для состояний, которые требуют ограниченного курса терапии (например, большинство инфекций), длительность лечения необходимо обосновать так, что
бы больной не прекратил прием препарата преждевременно и понял, почему рецепт, возможно, не требуется возобновлять. Больному с ревматоидным артритом нужно объяснить необходимость длительной (возможно, неопределенно долгой) терапии. Врач должен уметь точно определить любые изменения в состоянии пациента, которые потребуют коррекции терапии. Например, при желудочно-кишечном кровотечении больному с ревматоидным артритом необходимо немедленно изменить лекарственную терапию и быстро выяснить причины кровотечения. Основные токсические реакции, при которых требуется немедленное вмешательство, нужно четко описать пациенту.
7. Планируйте программу обучения пациента. Предписывающий лекарственное лечение и другие участники лечебного процесса должны быть готовы к повторению, расширению и закреплению передаваемой пациенту информации так часто, как это необходимо. Чем более токсичен выписываемый препарат, тем важнее эта программа обучения. Как показал опыт с тератогенными средствами (Shulman, 1989), должна быть осознана важность информирования и вовлечения пациента в каждый из приведенных здесь этапов.
Рецепт
Хотя рецепт может быть выписан на любом листе бумаги (если там будут все необходимые его составляющие), он обычно имеет специальную форму. Типичная печатная форма рецепта для амбулаторного больного показана на рис. 66-1.
В условиях стационара препараты выписываются на особой странице больничной истории болезни пациента, называемой врачебным листом назначений, или картой назначений. Содержание этого предписания подробно описано в правилах для медицинского персонала госпитального Комитета по фармации и терапии (Pharmacy and Therapeutics Committee). На форме печатается или пишется имя пациента, ниже следуют назначения, состоящие из названия и концентрации лекарственного средства, дозы, пути введения и частоты применения, даты, другой необходимой информации и подписи выписывающего. Часто длительность терапии или количество доз не обозначены, следовательно, прием лекарств продолжается до тех пор, пока врач не прекратит назначение или пока не окончится действие страхового полиса.
Рис. 66-1. Обычная форма рецепта для амбулаторного больного. Очерченные цифры объясняются в тексте
Типичная карта назначений может выглядеть следующим образом:
6/14/94
(1) Ampicillin 500 мг в/в каждые 6 ч х 5 дней (2) ASA 0.6 г в прямую кишку каждые 6 ч
[Подпись] Дж. Б. Доу, Д.М.
Таким образом, элементы госпитальной карты назначений эквивалентны центральным элементам (8-11) рецепта длй амбулаторных больных.
В клинической или амбулаторной практике каждый из элементов реЦеНта должен быть понятным.
Элементы рецепта
Первые четыре элемента рецепта для амбулаторного больного — это данные о личности выписывающего: имя, лицензионная классификация (т. е. профессиональная категория), адрес и номер
телефона амбулатории. Перед отпуском рецепта фармацевт должен убедиться в добросовестности выписавшего рецепт лица и иметь возможность связаться с автором рецепта по телефону при возникновении каких-либо вопросов. Элемент 5 является датой выписки рецепта. Она должна располагаться у верхней границы рецептурной формы или в начале (левый край) предписаний. Поскольку бланк имеет юридическое значение и существует определенная временная связь между датой беседы больного и врача и датой посещения аптеки, фармацевт должен отказаться выполнять предписание без проверки по телефону, если с тех пор, как выписан рецепт, прошло очень много времени.
Элементы 6 и 7 обозначают имя и адрес пациента. Они должны быть написаны четко.
Основная часть рецепта содержит элементы с 8 по 11, которые указывают лекарственное средство, отпускаемое количество, дозу и полные рекоменда
ции по применению. При выписывании названия препарата (элемент 8) может использоваться или фирменное название (патентованное, коммерческое наименование), или родовое (генерическое) название препарата (некоммерческое наименование). Доводы в пользу применения того или другого еще будут обсуждаться. Концентрация препарата (элемент 9) должна быть представлена в метрических единицах. Тем не менее врач должен быть хорошо знаком с обеими используемыми в настоящее время системами: аптекарской и метрической. Для практических целей может быть полезен следующий приблизительный перевод:
1 гран = 0.065 г, часто округляется до 60 мг 15 гран = 1 г
1 унция - 30 мл
1 чайная ложка = 5 мл
1 столовая ложка = 15 мл
1 кварта = 1000 мл
20 капель = 1 мл
2.2 фунта = 1 кг 1 minim = 1 капля
Концентрация раствора обычно выражается как количество вещества, растворенного в 100 мл раствора: например, в 20 % растворе калия хлорида содержится 20 г вещества на 1 дл (г/100 мл). Необходимо отчетливо выписывать как концентрацию, так и объем.
Количество выписываемого лекарства должно отражать предположительную длительность лечения, стоимость, необходимость продолжительного контакта с клиникой, или врачом, возможность злоупотребления и вероятность токсических реакций или передозировки. Необходимо также принимать во внимание стандартные дозы, в которых препарат доступен, и является ли рецепт на препарат первичным, повторным или возобновляемым. Если для эффективного лечения стрептококковой инфекции необходимо 10 дней терапии, должно быть выписано соответствующее количество препарата на полный курс. Контрацептивные средства часто выписываются на год или до проведения следующего обследования. Однако некоторые пациентки не способны приобрести годовой запас за один раз, поэтому может быть назначено количество лекарства, необходимое на 3 месяца, с указаниями по повторному выполнению или возобновлению три раза или втечение 1 года (элемент 12). Наконец, при первом выписывании лекарства, используемого для лече
ния хронического заболевания, назначают небольшое начальное количество препарата с повторным выполнением предписания в больших количествах. Целью начального предписания небольшого количества препарата является снижение затрат пациента, если окажется, что он не переносит данное средство. Как только проблема непереносимости решена, больной может закупать большее количество лекарства не столь часто, что обычно обходится дешевле.
Указания по применению (элемент 11) должны отражать специфику препарата и особенности пациента. Чем проще указания и чем меньше число приемов (и препаратов) в день, тем лучше. Главной причиной неэффективности лечения является несоблюдение пациентом предписаний (неаккуратное выполнение режима приема средств). Чтобы пациент помнил о приеме лекарства, часто рекомендуют принимать препарат во время приема пищи или близко к нему, а также на ночь. Однако важно справиться об образе питания больного и других характеристиках образа жизни, поскольку многие не едят три раза в день с равными промежутками между приемами пищи, особенно если чувствуют тошноту или соблюдают диету.
Врач и фармацевт должны объяснить каждому пациенту, как и когда принимать лекарства, какова длительность терапии и цель медикаментозного лечения. (Нельзя предполагать, что это сделает кто-то другой.) Более того, название препарата, цель его назначения и длительность терапии должны быть написаны на каждой этикетке так, чтобы препарат мог быть легко идентифицирован в случае передозировки. Инструкция “принимать как указано” может сэкономить время, которое занимает выписывание назначений, но часто ведет к нарушению режима приема, запутыванию пациента и ошибкам в лекарственной терапии. Чтобы избежать токсических реакций и получить максимально полезный эффект от терапии, указания по применению должны быть ясными и краткими.
Забота FDA и различных профессиональных медицинских групп об образовании населения в области фармации отразилась в создании ряда программ. Фармакопейное Собрание Соединенных Штатов (United States Pharmacopeia! Convention, USP) ежегодно публикует трехтомник, озаглавленный “Информация о лекарственных средствах” ("Drug Information” - USP DI). Первый том содержит информацию для профессионалов (выписыва
ющих рецепты), а второй состоит из коротких информационных памяток, подготовленных для пользования пациентами при знакомстве с препаратами, которые они принимают. Издание 1994 г. охватывает свыше 1000 лекарственных средств. Для пациентов столь же полезна программа, спонсируемая Американской Медицинской Ассоциацией (American Medical Association). Примерно для 100 лекарственных средств подготовлены листы инструкций для пациентов по лекарственной терапии (Patient Medication Instruction, PMI) на доступном языке, которые содержат информацию об индивидуальных препаратах и классах лекарств. Содержание листов PMI сходно с тем, что изложено в памятках USP DI для тех же препаратов. Информация о USP DI и листах PMI может быть получена в специальном ведомстве (USP Drug Information Division, 12601 Twinbrook Parkway, Rockville, MD 20852-1790).
Хотя указания по применению лекарств более не пишутся на латыни, многие латинские аббревиатуры (и некоторые другие, приведенные ниже) еще используются. Их знание необходимо для отпускающего препараты фармацевта и часто полезно для врача. Расшифровка некоторых из еще применяемых аббревиатур приведена в табл. 66-1.
Элементы с 12 по 14 включают информацию о повторном выполнении, отказе от необходимости защищенного от детей контейнера и дополнительные указания (например, название препарата на этикетке, “может вызывать сонливость”, “не принимать алкогольных напитков” и т. д.). В настоящее время большинство фармацевтов вносят название лекарственного средства в сигнатуру, если только выписывающий не указывает иного или препарат не имеет напечатанное или оттиснутое название на таблетке или капсуле. Здесь же указывается дата истечения срока годности для данного препарата. Если пациент или врач не отказываются от защищенного от детей контейнера, фармацевт обязан поместить в него препарат. Фармацевт не имеет права выполнить рецепт повторно без подтверждения от выписавшего. Врач может дать подтверждение о возобновлении рецепта при его выписывании или по телефону. Наконец, выписывающий может просить, чтобы фармацевт поместил на сигнатуре особые предупреждающие замечания. Элементы с 15 по 17 представляют собой подпись выписавшего рецепт и другие опознавательные данные.
Ошибки при выписывании
Все рецептурные назначения должны быть разборчивыми, недвусмысленными, датированными (с указанием времени выписывания в случае карты назначений) и четко подписаны, чтобы облегчить связь между лицом, выписавшим рецепт, фармацевтом и медицинской сестрой. Более того, хороший рецепт или карта назначений содержат достаточно информации для того, чтобы позволить фармацевту или медсестре обнаружить возможные ошибки до того, как препарат будет отпущен или введен.
Некоторые виды ошибок особенно часто встречаются при выписывании назначений. Это пропуск необходимой информации; неразборчивое написание, ведущее к ошибкам в дозах или времени приема препарата; выписывание препаратов, не подходящих для конкретной ситуации.
Пропуск информации
Ошибки с пропуском являются обычными в госпитальных картах и могут включать указания “возобновить предоперационное назначение лекарств”, что предполагает, что имеется полный и аккуратный список “предоперационных лекарств”; “продолжать в/в введение растворов”, из чего неясно, какие жидкости следует вводить, в каком объеме и на какой период времени; “продолжать применение глазных капель”, которое опускает упоминание о том, какой глаз необходимо лечить, так же как и сведения о препарате, концентрации и частоте введения. В карте назначений может отсутствовать указание о прекращении предыдущей лекарственной терапии при начале новой; может не быть уточнений по поводу применения обычной или длительнодействующей лекарственной формы; может быть не указана концентрация или количество препарата в пролонгированной форме; может разрешаться применение лекарства “по необходимости” без пояснения, какие состояния будут оправдывать эту необходимость.
Плохое написание рецепта
В качестве примера плохого написания рецепта традиционно приводится рецепт, написанный неразборчивым почерком. Тем не менее известны и другие, часто более опасные, виды плохого написания рецептов. Одним из наиболее важных являет-
ТАБЛИЦА 66-1. Аббревиатуры, используемые в рецептах и картах назначений. (Отметим, что некоторые
аббревиатуры имеют более одного значения. Всегда безопаснее выписывать назначения без сокращений) ' ________
Аббревиатура Расшифровка Аббревиатура Расшифровка
а перед Р после
ас перед едой рс после еды
AD правое ухо РО через рот
AS левое ухо PR через прямую кишку
AU обауха prn при необходимости
agit встряхивать, взбалтывать q каждый
Aq вода qam, от каждое утро
Aq dest дистиллированная вода qd ежедневно
bid дважды в день qh, q1h каждый час
c вместе с q2h, q3h, etc каждые 2 часа, каждые 3 часа и т. д.
cap капсула qhs каждый вечер перед сном
D5W, D5W 5 % водный раствор глюкозы qid четыре раза в день
dil растворить, разбавить qod через день
disp, dis отпустить qs достаточное количество
dL децилитр rept, repet может быть повторен
elix эликсир Rx возьми
ext экстракт s без
g грамм SC, SQ подкожно
gr гран Sig.S обозначить
gtt капли SOS если необходимо
h час ss,ss половина
hs на ночь stat сразу, сейчас же
IA внутриартериально sup, supp свеча
IM внутримышечно susp суспензия
IV внутривенно tab таблетка
IVPB внутривенно совместно (в одной tbsp, T столовая ложка (всегда выписывать
капельнице) “15 мл”)
kg килограмм tid три раза в день
L, I литр tr, tinct настойка
mEq, meq миллизквивалент tsp чайная ложка (всегда выписывать
mg миллиграмм “5 мл”)
mL миллилитр U единицы (всегда выписывать “еди-
mcg, pg микрограмм (всегда выписывать (не использо- ницы”)
“микрограмм”) ватьэту
no номер аббревиатуру)
non rep не повторять vag вагинальный
OD правый глаз i, ii, iii, iv, etc один, два, три, четыре и т. д.
OS, OL левый глаз dr жидкая драхма
OTC безрецептурный отпуск (объем жидкости — 3.7 мл)
OU оба глаза
ся неоднозначно поставленная десятичная точка. Так, “.1” легко принимается за “1.”, если десятичная точка не поставлена определенно, что означает десятикратное превышение дозы. Этой опасности легко избежать, предваряя всегда десятичную точ- ку нулем. С другой стороны, добавление ненужного нуля после десятичной точки также повышает опасность десятикратного превышения дозы, поскольку “1.0 мг” легко принять за “10 мг”, тогда как “1 мг” так не воспринимается. Разделительная ко-
сая линия (“/”) традиционно использовалась как заменитель десятичной точки. От нее следует отказаться, поскольку она похожа на цифру “1”. Подобно этому никогда не должно использоваться сокращение “U” для единиц (units), потому что “ 10U” легко принимаются за “100”; необходимо всегда писать слово “units”. При дозировании в микрограммах необходимо всегда полностью писать эти единицы, потому что сокращенная форма (“pg”) очень легко принимается за “mg”, а это 1000-кратное превышение дозы! Если существует несколько типов дозирования препарата, нельзя выполнять назначения, указывающие только число единиц дозировочных форм без общей требуемой дозы. Например, назначение “одна ампула фуросемида” неприемлемо, потому что фуросемид имеется в ампулах, содержащих 20, 40 или 100 мг препарата. Неясный почерк может таить смертельную опасность, когда имеются препараты со сходным названием, но очень разными эффектами, например ацетазоламид и ацетогексамид, метотрексат и метолазон (Huseby, 1991). В этой ситуации ошибки легче всего избежать путем обозначения показания к применению препарата в основной части рецепта, например “ацетазоламид, при глаукоме”.
Выписывание препаратов, не подходящих больному
Выписывание несоответствующего препарата конкретному больному происходит из-за незнания противопоказаний, налагаемых другими заболеваниями, которые могут быть у пациента, недостаточной информации о других средствах, принимаемых им (включая препараты безрецептурного отпуска), или недостаточных знаний о физико-химической несовместимости между препаратами, которые могут взаимодействовать один с другим. Противопоказания для препаратов при наличии сопутствующих заболеваний и их фармакокинетические характеристики перечисляются в комментариях к препаратам, описанным в данной книге. Вкладыш производителя, находящийся в упаковке, обычно содержит сходную информацию. Некоторые из наиболее важных лекарственных взаимодействий перечислены в приложении II и в соответствующих упаковочных вкладышах.
Вероятность физико-химического взаимодействия особенно опасна при парентеральном введении. Например, когда концентрация ионов кальция
и фосфатов в растворах для общего парентерального питания чрезмерно высока, может произойти выпадение осадка. Подобно этому одновременное назначение антацидов или продуктов с высоким содержанием металлов может нарушить всасывание в кишечнике многих препаратов, в частности тетрациклинов. Хорошим источником такой информации является упаковочный вкладыш и руководство по инъекционным средствам {Handbook of Injectable Drugs).
Соблюдение предписаний
Соблюдение предписаний — это те пределы, в которых пациент следует инструкциям. Существует четыре вида несоблюдения назначений, ведущих к ошибкам в лекарственной терапии:
1. Пациент не получает медикаментов. Ряд исследований подтверждает, что одна треть пациентов не получает прописанные лекарства. Некоторые больные покидают стационар без назначенных лекарств, тогда как другие выписываются из клиники без возобновления их догоспитального медикаментозного лечения. Часть пациентов не может позволить себе приобрести выписанные препараты.
2. Пациент не принимает лекарства так, как предписано. Примерами являются неправильная дозировка, частота назначения, ошибочное время или последовательность приема, неправильный способ введения или цель приема препарата.
3. Пациент преждевременно прекращает прием препаратов. Это может случиться, например, если больной ошибочно предполагает, что лекарственная терапия более не нужна, поскольку флакон опустел или произошло симптоматическое улучшение.
4. Пациент (или другое лицо) принимает медикаменты несоответствующим образом. Например, больной по какой-либо причине может делиться лекарством с другими.
Несоблюдению предписаний способствуют ряд факторов. Некоторые заболевания протекают бессимптомно (например, гипертензия), и у пациентов нет неприятных ощущений, которые напоминали бы им о приеме препаратов. Пациенты с очень сильными болями, например при артритах, могут беспрерывно менять препараты в надежде найти какой-то лучший. Степень соблюдения назначений зависит от схемы приема: пациентам, принимающим препараты один раз в день, легче следовать предписаниям, чем принимающим препарат четы
ре раза в день. Играют также роль особенности больного. Мужчина, живущий один, с меньшей вероятностью будет соблюдать назначения предписания, чем женатый мужчина того же возраста. Иногда выполнению предписаний мешает упаковка. Так, пожилым больным артритом часто бывает трудно открыть контейнер с лекарством. Различные общественные или личные предубеждения к применению препаратов тоже являются барьером для успешного лечения.
Стратегия улучшения следования предписаниям врача включает расширение связей между пациентом и службой здравоохранения; оценку личных, общественных и экономических условий, отражающихся на образе жизни больного; формирование привычки приема препаратов (например, во время еды, если пациент питается регулярно); обеспечение системами, облегчающими прием медикаментов (т. е. устройствами, которые разделяют дозы препаратов по дням недели, или часами с сигналом для оповещения о времени приема лекарств); рассылку фармацевтом по почте напоминаний по выполнению предписаний пациентам, хронически принимающим препараты. Больному, для которого существует вероятность прекращения приема лекарства из-за возможной непереносимости или неэффективности, необходимо дать разъяснение, как отслеживать и оценивать эффекты лекарственной терапии. Соблюдение предписаний часто улучшается путем активного вовлечения пациента в лечебный процесс.
Законодательные факторы (США)
Правительство США различает два класса препаратов: препараты безрецептурного отпуска (ОТС) и те, которые требуют рецепта от лицензированного выписывающего лица (прописываемые препараты). Препаратами ОТС являются те, которые могут безопасно самостоятельно приниматься человеком без медицинского образования при им самим диагностированных состояниях, и для которых соответствующие сигнатуры могут быть написаны языком, понятным для населения. Половину всего количества потребляемых американцами препаратов составляют препараты ОТС.
Выписывать опасные препараты (которые имеют этикетку “Федеральный закон запрещает отпуск
без рецепта”) имеют право врачи, дантисты, педиатры и ветеринары (в ряде штатов некоторые фармацевты, медсестры, фельдшеры и оптометристы), обученные диагностике и лечению. Фармацевты уполномочены отпускать предписанные средства соответственно инструкции выписывающего лица, при условии, что указание по фармакотерапии является уместным и рациональным для пациента. Медсестры уполномочены вводить препараты пациентам в соответствии с назначением выписывающего лица.
Выписываемые препараты контролируются Управлением по пищевым продуктам и лекарственным средствам Соединенных Штатов (FDA). Этикетка о рецептурном статусе и вкладыш в упаковку являются частью требований к упаковке для всех выписываемых препаратов. Вкладыш в упаковке — это официальная брошюра, сообщающая о показаниях, противопоказаниях, предостережениях и дозировании препарата.
Выписывающее лицо определяет на рецепте, кто может получать предписанные препараты. Фармацевт может приобретать эти препараты, но отпущены они могут быть только по рецепту уполномоченного законом лица. Таким образом, понятие “рецепт” означает в действительности три вещи: инструкцию врача в карте больного, выписанное требование, к которому адресуется фармацевт при отпуске препарата, и сигнатура, прикрепленная к флакону с лекарством для пациента.
Тогда как федеральное правительство контролирует препараты и их маркировку и распространение, законодательные власти штатов через их лицензионные комиссии, например Комиссию медицинских экспертов (Board of Medical Examiners), определяют, кто может выписывать препараты. Выписывающие рецепты лица должны пройти экзамен, уплатить сбор, а в ряде штатов представители некоторых профессий должны соответствовать и другим требованиям для возобновления лицензии, таким как продолженное образование. Если эти требования удовлетворены, выписывающему разрешается назначать отпуск препаратов.
Федеральное правительство и штаты налагают особые ограничения на препараты с потенциалом зависимости: опиоиды, галлюциногены, психостимуляторы и депрессанты (глава 31). При выписывании этих средств должны соблюдаться особые требования. Закон о контролируемых лекарствах (Controlled Drug Act) требует от выписывающих и
отпускающих препараты зарегистрироваться в Агентстве по контролю лекарств (Drug Enforcement Agency, DEA), оплатить сбор, получить личный регистрационный номер и вести записи о всех выписанных или отпущенных контролируемых препаратах. Каждый раз, когда выписывается контролируемое средство, на рецептурном бланке нужно ставить регистрационный номер DEA. Контролируемые препараты классифицируются в соответствии с их потенциалом зависимости, как показано в табл. 66-2.
Рецепты на препараты с высоким потенциалом зависимости (класс II) не выполняют повторно. Рецепты на препараты классов III, IV и V могут выполняться повторно, но существует 5-разовый максимум повторного выполнения и ограничение времени отпуска шестью месяцами после даты выписки. Рецепт на препараты класса II не может передаваться по телефону, некоторые штаты требуют особого, изданного в штате, рецептурного бланка для его выписки. Эти законы направлены на кон-
ТАБЛИЦА 66-2. Классификация контролируемых веществ
Потенциал зависимости Комментарии
Класс 1 Высокий Не разрешены для медицинского применения; недостаточная безопасность приема в качестве лекарственных средств
Класс II Высокий Применяются в медицинской практике. Злоупотребление может вести к психологической или физической зависимости
Класс III Меньше, чем у 1 или II классов Применяются в медицинской практике. Умеренный или низкий потенциал физической зависимости и высокий потенциал психологической зависимости
Класс IV Меньше, чем у III класса Применяются в медицинской практике. Ограниченный потенциал зависимости
КлассV Меньше, чем у IV класса Применяются в медицинской практике. Возможна ограниченная зависимость
троль количества препаратов, вызывающих зависимость, которые получает население.
Применение препаратов по утвержденным и неутвержденным показаниям
В США FDA допускает применение препарата только по конкретным показаниям, предложенным и документированным производителем в его Заявлении на регистрацию нового лекарственного средства (New Drug Application, NDA, глава 5). Эти одобренные (утвержденные) показания приводятся на упаковочном вкладыше к препарату. По различным причинам они могут не включать всех состояний, при которых препарат может быть полезен. Врач же иногда считает нужным выписать средство для лечения некоторых других, не утвержденных (не обозначенных) клинических состояний, часто на основании последних научных достижений. Федеральные законы, регулирующие правила FDA и применение препаратов, не налагают ограничений на такое не утвержденное применение*. Даже если у пациента возникают побочные эффекты от приема препарата, его применение по необо-значенным показаниям само по себе не составляет “врачебной ошибки”. Однако суды считают обозначения на упаковочном вкладыше полным списком показаний, для которых препарат считается безопасным, если клиницист не сможет подтвердить (основываясь на данных литературы и пр.), что применение препарата было обоснованным.
Социально-экономические факторы
Выписывание препаратов-генериков
Выписывание по родовому (генерическому) наименованию предоставляет фармацевту возможность гибкости в выборе конкретного лекарствен-
*“Когда препарат разрешен для продажи, врач может выписывать его для применения по иной схеме терапии или для групп пациентов, которые не включены в одобренные показания. Такое “неутвержденноё” (точнее “необозначенное") применение при некоторых обстоятельствах может быть уместным и рациональным и, как правило, отражает достижения в лекарственной терапии, которые широко описаны в медицинской литературе". — FDA Drug Buil. 1982; 12:4.
ного средства для выполнения назначений и возможной экономии для пациента, если имеется ценовая конкуренция. Например, фирменное название популярного седативного средства компании “Рош” звучит как Валиум. Родовым названием того же химического вещества, принятым списком USAN (United States Adopted Names) и одобренным FDA, является диазепам. Все лекарственные препараты диазепама в США соответствуют фармацевтическим стандартам, изложенным в Фармакопее Соединенных Штатов, но различаются производителями и ценами многократно. Для других препаратов разница в цене между продуктом с фирменным наименованием и генериком варьирует от двукратной или менее до стократной и даже более.
В некоторых штатах и многих клиниках страны фармацевты имеют право на замену генерически эквивалентного лекарственного препарата, даже если в назначении указано патентованное наименование. В этом случае, если врач хочет использовать конкретный фирменный препарат, требуется письменное указание “отпустить как написано”. Некоторые субсидируемые правительством программы по охране здоровья требуют, чтобы фармацевт отпускал самый дешевый в реестре генерически эквивалентный продукт. Однако правила выбора фармацевтом лекарственного препарата не разрешают замену одного терапевтического средства на другое, т. е. не разрешен отпуск трихлорметиазида вместо гидрохлортиазида без санкции врача, даже если эти два диуретика считаются фармакодинамически эквивалентными.
Нельзя считать, что все генерики сравнимы по качеству с фирменными лекарствами, хотя для большинства средств это справедливо. Препараты разных производителей, а иногда и различные партии препарата, выпущенного одним производителем, могут отличаться по биодоступности. Для очень немногих препаратов, имеющих обычно низкий терапевтический индекс, низкую растворимость или высокую долю инертных ингредиентов по отношению к содержанию активного препарата, фирменный препарат может быть более эффективным. При угрожающих жизни заболеваниях выгоды генерической замены перевешиваются клинической необходимостью, так что рецепт должен быть выполнен как написано.
Чтобы кодифицировать информацию о биоэквивалентности, FDA публикует Списокутвержденных лекарственных продуктов с оценкой терапевтичес
кой эквивалентности (Approved Drug Products With Therapeutic Equivalence Evaluations) с ежемесячными приложениями, так называемую “Оранжевую Кни1у”. Она содержит перечни продуктов из многих источников, относя препараты к одной из двух категорий. Препараты, обозначенные шифром "А”, считаются биоэквивалентными всем разновидностям этого препарата с подобным шифром “А”. Продукты, не считающиеся биоэквивалентными, обозначены шифром “В.” Из приблизительно 8000 перечисленных лекарственных препаратов 90 % кодированы шифром “А”. Эта информация публикуется также в 3-м томе USP DI.
Выбор предписанного лекарства на основании цены стал широко практиковаться в США, так как третья сторона плательщиков (страховые компании и пр.) усиливают регулирование, экономящее деньги. Врач может преодолеть эти влияния путем записи “отпустить как написано” на рецепте с обозначением фирменного наименования продукта. Однако в таких случаях пациент обязан оплатить разницу в цене между отпускаемым препаратом и более дешевым средством.
Другие ценовые факторы
Частный фармацевт обосновывает свои издержки стоимостью препарата и своих профессиональных услуг. Плата осуществляется каждый раз, когда отпускается предписанный препарат. Предписывающее лицо регулирует частоту выполнения рецептов путем подтверждения повторного выполнения и определения отпускаемого количества. Таким образом, выписывающий может сэкономить деньги пациента, выписывая стандартные количества (так что препараты не нужно будет переупаковывать), и, когда осуществляется длительное лечение, назначением наибольших количеств, сообразных с безопасностью и расходами. Таким образом, оптимальное выписывание препарата часто включает консультации между выписывающим лицом и фармацевтом.
Избранная литература
California Business and Professions Code, Chapter 9, Division 2, Pharmacy Law. Department of Consumer Affairs, Sacramento, Calif., 1985.
Do we pay too much for prescriptions? Consumer Reports, 1993; 58:668.
Приложение I.
Вакцины, иммуноглобулины и другие сложные биологические продукты
Стивен Л. Барриер
Вакцины и родственные им биологические продукты составляют важную группу средств, на создание которых направлены совместные усилия микробиологов, инфекционистов, иммунологов и иммунофармакологов. Всестороннее обсуждение этих средств выходит за рамки данной книги, здесь приводится лишь перечень наиболее важных препаратов. Читатель, которому требуется более полная информация, может найти ее в источниках, перечисленных в конце приложения.
Активная иммунизация
Активная иммунизация означает введение антигенов реципиенту с целью вызвать формирование антител и клеточного иммунитета. Иммунизацию проводят для стимуляции защиты против многих инфекционных болезней. С этой целью используют инактивированный (убитый) или живой, но ослабленный биологический материал (табл. 1-1). Идеальный иммуноген должен полностью предупреждать болезнь и носительство, способствовать выработке длительного иммунитета при минимуме иммунизаций, не вызывать токсических реакций и быть пригодным для массовой иммунизации (т. е. дешевым и удобным для введения). Активная иммунизация в целом предпочтительнее, чем пассивная, так как у реципиента вырабатывается лучшая устойчивость (во время сенсибилизации появляются более высокие титры антител, что сопровождается в некоторых случаях реакциями клеточного иммунитета) при более редком повторении проце
дуры. Однако активная иммунизация сопровождается осложнениями, не встречающимися при пассивной иммунизации и связанными главным образом с введением чужеродных белков (например, аллергия, неспецифические токсические реакции).
Современные рекомендации для стандартной активной иммунизации даются в табл. 1-2.
Пассивная иммунизация
Пассивная иммунизация означает передачу иммунитета реципиенту, используя предварительно образованные иммунологические эффекторы. С практической точки зрения, для пассивной иммунизации должны быть использованы только иммуноглобулины, так как пассивное введение иммунных эффекторных клеток технически сложно и сопровождается реакцией “трансплантат против хозяина”. Отметим, однако, что можно с успехом назначать человеку неиммунные эффекторные клетки (например, гранулоциты), а клеточный иммунитет передавать или усиливать другими средствами (интерферон, фактор переноса).
Для пассивной иммунизация антителами используют иммуноглобулины человека или животных различной степени очистки. Они могут содержать относительно высокие титры антител, направленных против специфических антигенов, или антитела, обнаруживаемые у большинства населения.
Пассивная иммунизация полезна в следующих случаях: 1) для лиц, неспособных вырабатывать антитела (например, при врожденной агаммаглобу-
ТАБЛИЦА I-1. Материалы, обычно используемые для активной иммунизации (АКДС — коклюшно-дифтерийно-столбнячный
анатоксин; АДС—дифтерийно-столбнячный анатоксин; Сд — столбнячно-дифтерийный анатоксин для взрослых; С — столбнячный анатоксин.)'
Возбудитель или заболевание Препарат(источник) Вид агента Путь введения Первичная иммунизация Длительность эффекта Комментарии
Холера Противохолерная вакцина Убитые бактерии Подкожно, внутримышечно Две дозы с промежутком от 1 недели до 1 месяца 6 месяцев2 50 %-ная защита. Ревакцинацию необходимо проводить каждые 6 месяцев
Дифтерия АКДС, АДС (адсорбированная) для детей младше 6 лет; Сд (адсорбированная) для всех остальных. Отдельно имеется также дифтерийный анатоксин. Анатоксин Внутримышечно Три дозы с 4-недельным или большим перерывом, с дополнительной дозой год спустя для детей младше 6 лет. (Может вводиться в то же время, что и вакцина против полиомиелита, с интервалом между дозами не менее 8 недель.) 10 лет3 Если применение АКДС сопровождается судорогами, используют АДС. Школьникам и взрослым вводят третью дозу через 6-12 месяцев после второй
Инфекция, Очищенный полисаха- Полисаха- Внутримы- Однократное введение Неопреде- Наиболее эффективен при
вызванная Haemophilus influenza ридтипа b (полирибо-зилрибитолфосфат) и полисахаридно-белковый конъюгат (дифтерийный анатоксин) рид ± белок шечно детям в возрасте 18-24 месяцев ленная введении в возрасте старше двух лет, но детям из группы высокого риска рекомендуется в возрасте 18 месяцев. Предпочтительнее конъюгированная вакцина
Гепатит В Вирус гепатита В и по- Очищенный Внутримы- Три дозы: одна началь- Несколько Защита более чем на 90 %.
верхностный антиген, инактивированные (плазма человека-носителя; рекомбинантный протеин) и инактивированный белок вирусной оболочки шечно ная, одна через месяц и одна через 6 месяцев. Больным с иммунодефицитом рекомендуется двойная доза. При внутрикожном введении может быть равноэффективна 1 /10 от стандартной дозы (0.1 мл) лет Проводят предиммуниза-цию лицам, не обладающим иммунитетом (т. е. без австралийского (HBs) антигена в крови) и имеющим высокий риск заболевания (медицинскому персоналу, супругам носителей и пр.)
Приложение I.
Возбуди- Препарат (источник) Вид агента Путь Первичная Длитель- Комментарии
тельили введения иммунизация ность
заболева- эффекта
ние
Грипп Вакцина против вируса гриппа, моновалентная, бивалентная и трехвалентная (куриный эмбрион). Состав вакцины изменяется в зависимости от типов вируса, вызывающих заболевание Полностью убитый или разрушенный вирус; типы А и В Внутримышечно
Корь Вакцина против вируса кори, живая ослабленная (куриный эмбрион) Живой вирус Подкожно
Менингококковый менингит Менингококковая полисахаридная вакцина (полисахарид группы А, группы С, или обеих). Имеется также тетравалентный препарат, содержащий серотипы А, С, W-135 иУ Полисахарид Подкожно
Однократная доза. (Ког- 1-3 года Иммунизация проводится в
да в вакцину впервые вводится новый важный антигенный компонент, предпочтительнее давать две дозы с 4-недельным или большим перерывом. Детям младше 13 лет для уменьшения частоты побочных реакций вводят две дозы препарата разрушенного вируса.) ноябре. Рекомендуется ежегодно пациентам с кардиореспираторными заболеваниями, диабетом, другими хроническими заболеваниями и пожилым. Пациенты, получающие химиотерапию при онкологическом заболевании, вероятно, отреагируют лучше, если будут иммунизированы до ее проведения или в промежутке между курсами
Однократная доза в воз- Стойкий Реиммунизируют, если
расте 15 месяцев. иммуни- вакцина вводилась до 15-
Если риск заболевания корью высок (например, при эпидемии), вводится раньше тет месячного возраста; может предупредить развитие инфекции, если вводится менее чем через 48 часов после заражения
Однократная доза. По- ? Стойкий Рекомендуется в эпидеми-
скольку для первично- иммуни- ческих ситуациях, для
го антитела требуется по меньшей мере 5 дней, находящимся в домашнем контакте необходимо провести профиликтическую ан-тибиотикотерапию рифампином (600 мг, или 10 мг/кг, 12 часов четырехкратно) тет применения в армии с целью предупреждения вспышек инфекции среди новобранцев и, возможно, как вспомогательная мера при профилактической антибиотикотерапии для предупреждения вторичных случаев при семейных контактах. Не дает надеж-
ного эффекта у детей до двухлетнего возраста
Вакцины, иммуноглобулины и другие сложные биологические продукты_______________________________________________611
Возбудитель или заболевание Препарат(источник) Вид агента Путь введения Первичная иммунизация Длительность эффекта Комментарии
Эпидемический паротит Вакцина против вируса эпидемического паротита, живая, штамм Jeryl Lynn (куриный эмбрион). Живой вирус Подкожно Однократная доза Стойкий иммунитет Реиммунизация проводится в возрасте около одного года
Коклюш АКДС, а также отдельная противококлюшная вакцина. Убитая бактерия Внутримышечно Как для АКДС Примечание3 Как правило, не рекомендуется в возрасте старше шести лет
Пневмо- Пневмококковая поли- Полисаха- Подкожно, 0.5 мл Неопреде- Рекомендуется лицам с вы-
кокки сахаридная вакцина, поливалентная (23 наиболее часто встречающихся серотипа) рид внутримышечно ленная; вероятно, не менее 5 лет соким риском серьезной пневмококковой инфекции: аспленией, серповидноклеточной гемоглобинопатией, хроническими кардиореспираторны-ми заболеваниями и пр. Эффективность у детей различная; не рекомендуется детям до двух лет
Полиомие- Вакцина полиомиелит- Живые Перораль- Две дозы с 6-8-недель- Устойчи- Взрослым рекомендуется
лит ная, живая, пероральная, трехвалентная (почки обезьян, культура диплоидных клеток человека). Имеется также моновалентная вакцина вирусы типов I, II и III но ным и более перерывом, третье введение через 12 месяцев. (Может даваться в то же время, что и первая иммунизация АКДС.) Четвертая доза перед поступлением в школу рекомендуется детям, иммунизированным в первые 1 -2 года жизни вый иммунитет только при повышенном риске, связанном с поездкой в эпидемические или опасные эндемические районы, или с профессиональным контактом. (В этих обстоятельствах предпочтительна инактивированная вакцина.) Лица, которые получили первичную вакцинацию, при опасности заражения могут принять единичную ревакцинирующую дозу
Приложение I.
ТАБЛИЦА 1- 1. (Продолжение) 03 03
Возбуди- Препарат (источник) Вид агента Путь Первичная Длитель- Комментарии 2 т
тель или введения иммунизация ность г
заболева- эффекта S 2
ние 2
Полиомие- Вакцина против поли- Убитые ви- Внутримы- Три дозы с перерывом в 2-5 лет, Вакцина убитых вирусов о 3
лит омиелита (по возмож- русы типа шечно 1 -2 месяца, четвертая возможно одобрена к применению, О\ <
(продол- ности используйте I, II и III доза через 6-12 меся- дольше но малодоступна и более S
жение) вакцину более высо- цев и пятая — перед не рекомендуется, за ис- г
кой активности) поступлением в шко- ключением использова- X tl
л у3 ния у пациентов с имму- и
нодефицитом или, воз- ф
можно, у неиммунизиро- 8
ванных взрослых, риску- * I
ющих заразиться полио- г ф
миелитом во время путе- о\ X
шествия, или для имму- g
низации их детей “1 X
Бешенство Антирабическая вакци- Убитый ви- Внутримы- До инфицирования: Неизвест- Профилактическая имму- X ф
на (из диплоидных РУС шечно две дозы с перерывом на; веро- низация только при про- X X
клетокчеловека). Вне в одну неделю, третья ятно, бо- фессиональном риске ф
США еще используют доза через 2-3 неде- лее двух или присутствии в опас- и g
вакцины, приготов- ли. После инфициро- лет ном эндемическом райо-
ленные из утиных эм- вания: пять дней по не. Для обеспечения эф- Е
брионов или мозга дням: 0, 3, 7, 14 и 28. фективной иммунизации
мышей, но они более Вводят антирабичес- через 3-4 недели после
токсичны ким иммуноглобули- последней инъекции не-
ном (табл. П-3) обходимо определить
титр антител и при отсутствии реакции повторить инъекцию
Рану обильно промывают тампоном и ополаскивают водой с мылом. (Применение гипериммунной сыворотки и иммуноглобулина описано в табл. 11-3.)
При укусах животных проводят также противостолбнячные мероприятия
Возбудитель или заболевание Препарат(источник) Вид агента Путь введения Первичная иммунизация Длительность эффекта Комментарии
Краснуха Вакцина вируса краснухи, живая (культура диплоидных клеток человека) Живой вирус Подкожно Однократная доза Стойкий иммунитет Вводить в возрасте более 15 месяцев. Не вводить во время беременности? Женщины должны предохраняться от беременности 3 месяца после иммунизации. Предупреждает заболевание, но не инфицирование
Оспа Противооспенная вакцина (лимфа из области икроножной мышцы, куриный эмбрион) Живой вирус коровьей оспы Внутрикожно Однократная доза Згода Единственные группы риска, которым в настоящее время показана противооспенная вакцина, — это военный и лабораторный персонал, работающий с вирусом оспы. Более не требуется для совершен-ния международных поездок, так как оспа искоренена. Производство для применения у гражданских лиц прекращено в мае 1983 г.
Столбняк АКДС, АДС (адсорбированная) для детей до шести лет; Сд, С (адсорбированная) — для остальных Анатоксин Внутримышечно Две дозы с перерывом в четыре недели или более; третья доза через 6-12 месяцев после второй дозы 10 лет3,4 Школьникам и взрослым ввести четвертую дозу через 6-12 месяцев после первой серии инъекций
Туберкулез Вакцина БЦЖ. В США Живая Внутри- Однократная доза (0.1 ? Постоян- Не рекомендована к при-
имеется только датский подтип ослабленная Micobacterium bovis кожно или подкожно (по рекомендации производителя) мл внутрикожно). ный иммунитет5 менению в США. Имеет разную степень эффективности
Приложение I.
Возбудитель или заболевание Препарат(источник) Вид агента Путь введения Первичная иммунизация Длительность эффекта Комментарии
Брюшной Брюшнотифозная вак- Убитая Подкожно Две дозы с перерывом в 3 года3 Защита на 70 %. Рекомен-
тиф цина бактерия или внутрикожно четыре недели или более или три дозы с перерывами в одну неделю (менее желательно) дуется только для предупреждения инфицирования при путешествии, эпидемии или контакта с домашним носителем, не, рекомендуется при маточном кровотечении
Желтая лихорадка Вакцина против желтой лихорадки (куриный эмбрион, штамм 17-D) Живой вирус Подкожно Однократная доза 10 лет2 Рекомендуется при проживании в эндемических районах Африки и Южной Америки или путешествиях в эти регионы
1 Дозировки для конкретных препаратов, включая возрастные различия, лучше всего брать из упаковочных вкладышей производителя. Иммунизация должна производится путем, предложенным для данного препарата.
2 Интервал ревакцинации, требуемый по международным правилам.
3 Для реактивации иммунитета достаточно единичной дозы через любое время после окончания срока эффективной первичной иммунизации.
4 При загрязненных или тяжелых ранениях вводить реиммунизирующую дозу, если прошло более 5 лет после полной иммунизации или последней реиммунизации.
5 Проба на вираж реакции на PPD (очищенный дериват белка) через 2 месяца и реиммунизация в случае отрицательной реакции.
Вакцины, иммуноглобулины и другие сложные биологические продукты__________________________________________615
ТАБЛИЦА I-2. Рекомендуемый порядок активной иммунизации и кожных проб у детей'
Возраст Назначаемый препарат Рекомендуемая проба
С рождения до 4 дней 2 месяца 4 месяца 6 месяцев 15-19 месяцев (предпочтительно в 15 месяцев) 18-24 месяца 4-6 лвт HBV2 АКДС3, HBV, пероральная трехвалентная вакцина против полиомиелита4 АКДС, пероральная трехвалентная вакцина против полиомиелита АКДС, HBV, пероральная трехвалентная вакцина против полиомиелита (по усмотрению) АКДС, противокоревая вакцина5, вакцина против эпидемического паротита6, вакцина против краснухи8, пероральная трехвалентная вакцина против полиомиелита Вакцина против Haemophilus influenzae5 АКДС, пероральная трехвалентная вакцина Туберкулиновая проба7
14-16 лет против полиомиелита Вакцина против краснухи8 — Сд*° Туберкулиновая проба7
' Переработано из MMWR 1986; 35: 577.
2 HBV — вакцина против гепатита В.
3 Анатоксины дифтерии и столбняка, осажденные на квасцы или абсорбированные гидроокисью алюминия, комбинированные с бактериальным антигеном коклюша. Подходит для детей младшего возраста. Три дозы по 0.5 мл внутримышечно с интервалами 4-8 недель. Четвертая инъекция 0.5 мл внутримышечно вводится примерно год спустя.
4 Пероральная вакцина живого вируса полиомиелита. Трехвалентная (сочетание типов 1,2 и 3) вводится 3 раза с интервалами 6-8 недель и затем в качестве реиммунизации через 1 год. Моновалентная вакцина в настоящее время используется редко; ее вводят с 6-недельными интервалами, с последующей ревакцинирующей дозой трехвалентной вакцины через 1 год. Инактивированная (типа Salk) трехвалентная вакцина доступна, но не рекомендуется. Примечание, одна из последовательностей моновалентных вакцин (тип 2, затем 1, затем 3) соответствует рекомендациям Совещательного Комитета по иммунизации Службы здравоохранения США (US Public Health Service Advisory Committee on Immunization Practices). Американская Академия Педиатрии рекомендует последовательность 1,3, 2.
5 Вакцина живого вируса кори, 0.5 мл внутримышечно. При использовании ослабленного штамма (Edmonston) одновременно вводится 0.01 мл/фунт человеческого у-глобулина в противоположную руку для уменьшения реакции на вакцину. Такая процедура не предусматривается для вакцины “более ослабленного" штамма (Schwarz). Не должна использоваться инактивированная лротивокоревая вакцина.
6 Вакцина живого вируса эпидемического паротита (ослабленная), 0.5 мл внутримышечно.
7 Частота назначения туберкулиновых проб зависит от опасности инфицирования, т. е. от распространенности туберкулеза в популяционной группе. Указанные интервалы являются рекомендуемым минимумом.
6 Вакцина живого вируса краснухи (ослабленная) может вводится в возрасте от одного года до пубертатного периода. Некоторые врачи рекомендуют вакцину против краснухи только для девочек лрепубертатного возраста. Все содержимое флакона с разовой дозой вакцины, восстановленной из лиофилизированной формы, вводится подкожно. Вакцина не должна вводиться беременным женщинам или планирующим беременность в течение трех месяцев после вакцинации. Женщина должна быть предупреждена о возможности развития артралгий или артритов после вакцинации. Вакцина вируса краснухи, выращенного в клеточной культуре RA 27/3, одобрена в США в 1979 г. Живую вакцина не используют у пациентов с иммунодефицитом, кроме детей с ВИЧ-инфекцией.
9 Вакцина полисахарида Н. influenzae или полисахарид-белкового конъюгата (последняя предпочтительнее).
10 Анатоксин столбняка и анатоксин дифтерии, очищенные, адаптированные для взрослых, вводятся каждые 7-10 лет.
Показание Препарат Дозирование Комментарии
Укус паука “Черная вдова” Лошадиная антитоксическая иммунная сыворотка (противоядие) против яда паука “Черная вдова" Один флакон (6000 ЕД) внутримышечно или внутривенно Применение ограничено у детей массой тела менее 15 кг (только в группе с высокой заболеваемостью или смертностью). Выпускается фирмой Merck Sharp & Dohme
Ботулизм Поливалентный лошадиный антитоксин АВЕ (имеются также шестивалентный ABCDEF, двухвалентный АВ и моновалентный Е антитоксины) Один флакон внутривенно и один флакон внутримышечно; повторить через 2-4 часа, если симптомы усиливаются, и через 12-24 часа Для лечения ботулизма. Имеется в CDC.’ В 20 % случаев развиваются сывороточные реакции. Только для антитоксина типа Е показано кардинальное изменение исхода заболевания. Профилактика обычно не рекомендуется, может вводиться лицам без признаков болезни при определенном инфицировании
Дифтерия Дифтерийный лошадиный антитоксин 20 000 (1 флакон) — 120 000 ЕД внутримышечно в зависимости от тяжести и длительности заболевания. Одинаковая доза для детей и взрослых Для лечения дифтерии. При контактах неиммунизированныхс заболевшими должно отдаваться предпочтение активной иммунизации и, возможно, профилактике эритромицином, а не профилактике антитоксином. Контактные лица должны быть обследованы на наличие признаков заболевания; при необходимости вводят антитоксин. Имеется в CDC.1
Гепатит А (инфекционный) Иммуноглобулин (ISG) Для постинвазивной профилактики 0.02 мл/кг внутримышечно как можно раньше после заражения (до двух недель) При хронической инфекции доза 0.06 мл/кг рекомендуется каждые 6 месяцев. (0.02 мл/кг эффективны в течение 2-3 месяцев.) Смягчает, но не предупреждает инфекцию. Рекомендуется при домашних контактах и других контактах такой же интенсивности, а также перед поездкой в эндемические районы. Не рекомендуется при служебных и школьных контактах, если нет признаков развития эпидемии В постоянном риске заражения гепатитом А находится персонал психиатрических учреждений, учреждений для умственно отсталых детей и тюрем, а также те, кто работает с низшими приматами
Вакцины, иммуноглобулины и другие сложные биологические продукты
Показание Препарат Дозирование Комментарии
Гепатит В (сывороточный) Иммуноглобулин гепатита В (HBIG). Может быть эффективен обычный иммуноглобулин 0.06 мл/кг внутримышечно как можно раньше после инфицирования, предпочтительно в течение семи дней. Если с первой дозой HBIG не вводилась вакцина против гепатита В, через 25-30 дней после ин-фицирования необходимо сделать вторую инъекцию Назначается неиммунизированным лицам в качестве постинвазивной профилактики, которая сопровождает или парентеральное заражение, или прямой контакт слизистой оболочки с HBsAg-позитивными материалами. Не вводят лицам, уже имеющим анти-HBsAg антитела. Однократная доза 0,13 мл/кг вводится новорожденным от матерей, у которых в третьем триместре развился гепатит Вив крови ко времени родов имелся HBs антиген
Гепатит ни А, ни В Иммуноглобулин (ISG) 0.06 мл/кг внутримышечно как можно раньше после инфицирования Вводится лицам с парентеральным заражением через сыворотку больных гепатитом или при других тесных контактах. Неопределенная эффективность
Гипогаммаглобулинемия Иммуноглобулин (ISG) 0.6 мл/кг внутримышечно каждые 3-4 недели или 2-4 мл/кг внутривенно каждые 4 недели (специальный глобулин, пригодный для внутривенного введения) В начале терапии вводится двойная доза. Для предупреждения частых инфекций при отсутствии очевидной гипогаммаглобулинемии иммуноглобулин бесполезен
Корь Иммуноглобулин (ISG). Про-тивокоревой иммуноглобулин сейчас не выпускают 0.25 мл/кг внутримышечно как можно раньше после инфицирования. Эта доза может быть неэффективной у больных с иммунодефицитом, которые должны получать 20-30 мл Живая противокоревая вакцина обычно предупреждает инфекцию при введении в течение 48 часов после заражения. Если назначается иммуноглобулин, иммунизация живым вирусом откладывается на 3 месяца
Пересадка органа Антилимфоцитарная или ан-титимоцитарная иммунная лошадиная сыворотка или глобулин Различные схемы. Необходимо следовать рекомендациям производителя Используется в качестве вспомогательного иммунодепрессивного средства у больных, подвергшихся трансплантации органов
Коклюш Противококлюшный иммуноглобулин 1.25 мл внутримышечно (детям) Сомнительная эффективность как при лечении, так и при профилактике. Имеется в Cutter Laboratories
Приложение I.
-•• :?*.vy^W?W1W’ «'•'’.-aw.... л
Показание Препарат Дозирование Комментарии
Полиомиелит Иммуноглобулин (ISG) 0.15 мл/кг внутримышечно Показан только инфицированным иммунизированным лицам. Иммунизировать живой или инактивированной вакциной через 2-3 месяца с последующей реиммунизацией
Бешенство Антирабический иммуноглобулин (лошадиную антирабическую сыворотку вводить нежелательно, тем более что требуются высокие дозы — около 500 ЕД/ 20 кг массы тела) 20 МЕ/кг, до половины которых инфильтрируется местно в область ранения, а остальное вводится внутримышечно Вводится как можно раньше после заражения. Рекомендуется во всех случаях укусов или царапин, нанесенных плотоядными, особенно летучими мышами, хорьками, лисами, волками или енотами, несмотря на видимое здоровье животных, если их мозг не может быть немедленно исследован и не обнаружено отсутствие бешенства. Не рекомендуется лицам, выработавшим антитела в ответ на доинвазивную профилактику. Необходимо сочетать с антирабической иммунизацией. Доступна через CDC1
Резус-фактор-изоимму-низация(вследствие трансфузии плод-мать) Rh0 (D) иммуноглобулин Женщинам с резус-отрицатель-ной кровью одна доза внутримышечно в течение 72 часов после выкидыша, амниоцентеза, акушерского родоразре-шения Rh-положительным ребенком или переливания Rh-положительной крови Только для неиммунизированных женщин. Может проявлять эффект и при значительно более позднем введении, поэтому вводится даже по истечении 72 часов после инцидента. Один флакон содержит 300 мкг антител и способен надежно подавлять иммунную реакцию, как установлено методом мазков по Betke-Kleihauer, при гемотрансфузии плод-мать до 30 мл
Краснуха Иммуноглобулин (ISG) 20-40 мл при инфицировании Предупреждает заболевание у реципиента, но не у плода зараженной матери, поэтому не рекомендуется беременным
Вакцины, иммуноглобулины и другие сложные биологические продукты
Показание Препарат Дозирование Комментарии
Укус змеи Лошадиная антитоксическая иммунная сыворотка против коралловой змеи, лошадиная поливалентная антитоксическая иммунная сыворотка против ямкоголовых змей Минимум 3-5 флаконов внутривенно (предпочтительно) или внутримышечно Доза должна быть достаточной для подавления симптомов интоксикации. Предпринимаются также меры против столбняка. Имеется в Wyeth Laboratories ([215] 688-4400) или CDC'
Столбняк Противостолбнячный иммуноглобулин. (Бычий и лошадиный антитоксины не рекомендуются. Они применяются в 10-кратной по отношению к противостолбнячному иммуноглобулину дозе.) Профилактика: 250-500 ЕД внутримышечно Лечение: 3000-6000 ЕД внутримышечно Вводится в отдельном шприце и в другое место, чем одновременно вводимый анатоксин. Рекомендуется только при значительных или загрязненных ранениях лицам, которые получили менее двух доз анатоксина в любое время в прошлом (менее трех доз, если с момента ранения прошло более 24 часов или при иной высокой вероятности заражения столбняком)
Вакцинальная болезнь Противовакцинальный иммуноглобулин Профилактика: 0.3 мл/кг внутримышечно. Лечение: 0.6 мл/кг внутримышечно. По необходимости можно повторить при лечении и с интервалом в 1 неделю для профилактики Может помочь в лечении вакцинальной болезни глаз, вакцинальной экземы, генерализованной вакцинальной болезни, при вакцинальном некрозе и для предупреждения этих осложнений у подверженных вакцинации пациентов с кожными болезнями. Имеется в CDC.'
Ветряная оспа Иммуноглобулин против ветрянки и опоясывающего лишая или противозостер-ный иммуноглобулин (если его нет, может быть эффективен обычный иммуноглобулин) Вводится от 125 ед. /10 кг (пациентам с массой тела < 50 кг), до 625 ед. (пациентам с весом > 50 кг) внутримышечно в пределах 96 часов после инфицирования Показан детям до 15 лет с иммунодепрессией или иммунодефицитом, для которых известно, что они не иммунизированы (по лабораторным тестам, если возможно) или имеют домашний, больничный (2-или 4-местная палата или смежные постели в большой палате) контакт или контакт с заболевшим товарищем по играм (> 1 часа комнатных игр). Назначают новорожденным, у матерей которых развилась ветря-
Приложение I.
линемии); 2) для предупреждения заболевания, когда время не позволяет провести активную иммунизацию (например, после инфицирования); 3) для лечения некоторых болезней, обычно предупреждаемых иммунизацией (например, столбняк); 4) для лечения состояний, при которых активная иммунизация невозможна или не практикуется (например, укус змеи).
Введение иммуноглобулинов человека иногда вызывает осложнения. Инъекции могут быть умеренно болезненными, изредка развивается стерильный абсцесс. У лиц в состоянии определенного дефицита иммуноглобулинов (дефицита IgA и пр.) могут развиваться аллергические реакции на иммуноглобулины, что ограничивает терапию. Традиционные иммуноглобулины содержат агрегаты IgG, которые при внутривенном введении могут вызвать тяжелые реакции.
Если же пассивно вводимые антитела получены из плазмы животных, могут развиться аллергические реакции, от анафилаксии до сывороточной болезни. Высоко очищенные иммуноглобулины, особенно полученные от грызунов, менее аллергичны. Во избежание анафилактических реакций предварительно ставят пробы на чувствительность к сыворотке животных. Если проба свидетельствует о гиперчувствительности, лучше отказаться от этого специфического вида чужеродного белка (например, лошадиной сыворотки) и выбрать антитела, полученные от других животных (например, козы, кролика) или человека. Если альтернативный препарат недоступен, а введение специфических антител необходимо, может быть выполнена десенсибилизация. Пробы на гиперчувствительность и протоколы десенсибилизации описаны Stites (1994).
Антитела, полученные из сыворотки человека, не только снимают опасность аллергических реакций, но также имеют намного более длительный период полувыведения у человека (около 23 дней для IgG антител), чем полученные из животных источников (5-7 дней или менее). Следовательно, для обеспечения терапевтической концентрации на несколько недель можно ввести значительно меньшие дозы антител человека. Поэтому для формирования пассивной защиты желательно применять человеческие антитела. Имеющиеся средства для пассивной иммунизации представлены в табл. 1-3.
Юридическая ответственность за побочные реакции
Врач обязан информировать пациента об опасности иммунизации и использовать вакцины и антисыворотки надлежащим образом. Для оценки риска побочной реакции может потребоваться кожная проба. Некоторые из опасностей, описанных в Приложении, в настоящее время являются неизбежными, поэтому пациент и общество должны осознавать риск, связанный с обычно назначаемыми иммуногенами (например, вакцины против полиомиелита или противостолбнячной вакцины).
Чтобы производители придерживались существующих стандартов производства биопрепаратов, они должны нести ответственность по закону за их недостатки. Однако принятая в современной американской судебной системе поддержка громадных исков от статистически неизбежных жертв практики здравоохранения вынуждает производителей ослаблять усилия по развитию и производству маловыгодных, но медицински ценных терапевтических средств, например вакцин. Поскольку применение и продажа этих продуктов являются предметом тщательного надзора и одобряются государственными структурами, такими как Главный медицинский совешательный Комитет по иммунизации и Управление по пищевым и лекарственным продуктам, “строгую ответственность за продукцию” (ответственность без отступлений) нельзя считать подходящим законодательным стандартом для применения, когда дело касается редких реакций на биопродукты, которые произведены и назначены в соответствии с руководящими правительственными инструкциями.
Рекомендуемая иммунизация для взрослых перед путешествием
Каждый взрослый, путешествующий или нет, должен быть иммунизирован противостолбнячным анатоксином, а также полностью иммунизирован против полиомиелита и дифтерии. В дополнение к
этому каждый путешественник обязан выполнить требования по иммунизации государственных органов здравоохранения посещаемых стран. Они перечислены в Health Information for International Travel и имеются в Superintendent of Documents, US Goverment Printing Office, Washington, DC 20402. Издание The Medical Letter on Drugs and Therapeutics также периодически предлагает современные рекомендации для путешественников (например, выпуск от 6 апреля 1990 г). Иммунизация, полученная при подготовке к путешествию, должна быть записана в Международный сертификат иммуни-зациии. Примечание: иммунизация против оспы не требуется для путешествия в любую страну.
Избранная литература
Brooks G. F„ Butel J. S., Ornston L. N. Jawetz, Melnick & Adelberg’s Medical Microbiology, 19th ed. Appleton & Lange, 1991.
Centers for Disease Control: General recommendations on immunization. MMWR, 1994; 43:1.
Conte J. E., Barriere S. Manual of Antibiotics and Infectious Diseases, Lea & Febiger, 1992.
Grossman M., Cohen S. N. Immunization. In: Basic & Clinical Immunology, 7th ed. Stites D. P., Terr A. E. (eds). Appleton & Lange, 1991.
Stites D. P., Terr A. E. Parslow T. G. (eds). Basic & Clinical Immunology, 8th ed. Appleton & Lange, 1994.
Приложение II.
Важнейшие взаимодействия лекарственных средств
Ф. Д. Ханстен
Механизмы взаимодействия лекарственных средств
Одним из факторов, способных изменять реакцию организма на лекарственные средства, является сопутствующее назначение других препаратов. Существуют различные механизмы, посредством которых взаимодействуют лекарства, но большинство из них можно отнести к фармакокинетическим (абсорбция, распределение, метаболизм, экскреция), фармакодинамическим или к их сочетанию. Знание механизма взаимодействия вводимых препаратов часто является клинически полезным, так как может предсказать время действия лекарства и помочь предотвратить его нежелательные взаимодействия. Некоторые важные лекарственные взаимодействия развиваются при участии двух или более механизмов.
Фармакокинетические механизмы
Всасывание в желудочно-кишечном тракте может быть нарушено сопутствующим назначением других средств, которые, во-первых, адсорбируют лекарство на своей поверхности, во-вторых, связываются с препаратом или образуют с ним хелатные соединения, в-третьих, изменяют pH желудка или, в-четвертых, изменяют моторику желудочно-кишечного тракта. Необходимо понимать различие между влиянием на скорость всасывания и влиянием на величину всасывания. Угнетение только скорости абсорбции препарата не столь клиничес
ки важно, как уменьшение ее величины, которое приводит к достижению лишь субтерапевтического уровня препарата в плазме.
Механизмы, посредством которых взаимодействие лекарственных средств изменяет распределение препаратов, включают конкуренцию за связывание с белками плазмы и вытеснение из участков связывания в тканях. Хотя конкуренция за связывание с плазменными белками повышает свободную концентрацию вытесненного препарата в крови (а значит, и его эффект), это увеличение, как правило, временное вследствие компенсаторного повышения распределения препарата. Клиническая значимость вытеснения препарата из связи с белками, вероятно, преувеличена; современные данные указывают на малую вероятность того, что такие взаимодействия приводят к побочным эффектам. Вытеснение из тканевых участков связывания может способствовать повышению концентрации лекарства в крови. Такой механизм объясняет, например, возрастание концентрации дигоксина при сопутствующем лечении хинидином.
Сопутствующая терапия может стимулировать или ингибировать метаболизм лекарственных веществ. Барбитураты, карбамазепин, глютетимид, фенитоин, примидон, рифампин, рифабутин вызывают индукцию (стимуляцию) микросомальной ферментативной системы печени, метаболизирующей лекарственные средства. Индукция ферментов не происходит быстро: максимальный эффект развивается обычно через 7-10 дней. Такое же или более длительное время требуется и для ее исчезновения после прекращения приема индуктора ферментов. Угнетение метаболизма в целом происходит быстрее, чем индукция ферментов, и может на
чаться, как только будет достигнута достаточная концентрация ингибитора в печени. Однако, если у препарата длительный период полувыведения, может пройти неделя или более до достижения нового постоянного уровня в плазме. В список лекарств, которые могут ингибировать микросомальный метаболизм в печени других средств, включены аллопуринол, хлорамфеникол, циметидин, ципрофлоксацин, кларитромицин, дилтиазем, дисульфирам, эноксацин, эритромицин, флуконазол, изониазид, итраконазол, кетоконазол, метронидазол, миконазол, омепразол, фенилбутазон, пропоксифен, сульфаниламиды и верапамил.
Сопутствующая лекарственная терапия также может нарушать почечную экскрецию активного препарата. На почечную экскрецию лекарств, являющихся слабыми кислотами или слабыми основаниями, могут повлиять другие средства, которые изменяют pH мочи. Это происходит вследствие изменения ионизации препарата, приводящего к нарушению его жирорастворимости и, следовательно, его способности реабсорбироваться обратно в кровь из почечных канальцев. Для некоторых препаратов важным путем элиминации является активная секреция в просвет почечных канальцев. Нарушение этого процесса при сопутствующей лекарственной терапии изменяет уровень препарата в плазме и фармакологический ответ на его введение.
Фармакодинамические механизмы
При одновременном введении двух препаратов со сходными фармакологическими эффектами обычно наблюдается аддитивный или синергичный ответ. При этом препараты могут действовать на один и тот же рецептор или на разные рецепторы. Напротив, одновременно принимаемые средства с противоположными фармакологическими эффектами могут снизить ответ на один из них или на оба этих препарата. Фармакодинамические взаимодей
ствия лекарственных средств относительно часто встречаются в клинической практике, но их побочные эффекты можно минимизировать, если предвидеть такое взаимодействие и принять соответствующие контрмеры.
Сочетанная токсичность
Сочетанное применение двух или более средств, каждое из которых оказывает токсическое действие на один и тот же орган, может значительно повысить вероятность его повреждения. Например, одновременное назначение двух нефротоксичных препаратов может вызвать повреждение почек, даже если доза каждого из них в отдельности недостаточна для развития токсического эффекта. Более того, органотоксичность препарата может быть усилена другим средством, не оказывающим собственное токсическое действие на этот орган.
Предсказуемость лекарственного взаимодействия
Сведения, приведенные в табл. II-1, использованы здесь для оценки предсказуемости лекарственного взаимодействия. Эти оценки помогут определить, произойдет или нет взаимодействие, но не всегда означают, что это взаимодействие вызовет побочный эффект. Вызовет ли вероятное взаимодействие побочный эффект, зависит, во-первых, от наличия факторов, которые предрасполагают к нежелательным проявлениям лекарственного взаимодействия (заболевания, особенности функционирования органов, доза препаратов и пр.), и, во-вторых, понимания со стороны врача необходимости проведения соответствующих наблюдений или принятия предупредительных мер.
ТАБЛИЦА 11-1. Важнейшие взаимодействия лекарственных средств ВП = Высоко предсказуемое. Взаимодействие происходит практически у всех пациентов, получающих комбинацию. П = Предсказуемое. Взаимодействие происходит у большинства пациентов, получающих комбинацию. НП = Непредсказуемое. Взаимодействие происходит только у некоторых пациентов, получающих комбинацию.
НУ = Не установлено. Данных, на которых основывается оценка предсказуемости, недостаточно._____
Препарат Свойства, способствующие Клинически документированные взаимодействия
или группа лекарственному взаимодействию
препаратов
Спирт Хронический алкоголизм приводит к индукции ферментов. Острая алкогольная интоксикация имеет тенденцию ингибировать лекарственный метаболизм (независимо от того, является ли данное лицо алкоголиком или нет). Тяжелая алкогольная дисфункция может подавлять способность печени метаболизировать лекарственные препараты. Ди-сульфирамподобная реакция в присутствии определенных препаратов. Дополнительное угнетение центральной нервной системы при сочетании с другими угнетающими ее средствами Ацетаминофен [НУ]: повышенное образование ге-патотоксичных метаболитов ацетаминофена (ухро-нических алкоголиков) Пероральные антикоагулянты [НУ]: повышенное гипопротромбинемическое действие при остром алкогольном отравлении Средства, угнетающие центральную нервную систему [ВП]: аддитивное или синергичное угнетение центральной нервной системы Инсулин [НУ]: острый прием алкоголя может повысить гипогликемический эффект инсулина (особенно у голодающих больных) Средства, которые могут вызвать дисульфирам-подобную реакцию: Цефалоспорины [НП]: дисульфирамподобные реакции отмечены при назначении цефамандола, цефоперазона, цефотетана и моксалактама Хлоралгидрат [НП]: механизм не установлен Дисульфирам [ВП]: ингибирует альдегиддегидрогеназу Метронидазол [НП]: механизм не установлен Производные сульфонилмочевины [НУ]: хлор-пропамид с наибольшей вероятностью будет вызывать дисульфирамподобную реакцию; острый прием алкоголя может повысить гипогликемический эффект (особенно у. голодающих пациентов)
Аллопуринол Ингибирует ферменты печени, метаболизирующие лекарства Пероральные антикоагулянты [НП]: повышенный гипопротромбинемический эффект Азатиоприн [П]: пониженный уровень обезвреживания азатиоприна, ведущий к повышению его токсичности Меркаптопурин [П]: пониженный уровень метаболизма меркаптопурина, приводящий к повышению его токсичности
Антациды Антациды могут адсорбировать препараты в желудочно-кишечном тракте, уменьшая таким образом их всасывание. Антациды ускоряют эвакуацию из желудка, более быстро пере- Дигоксин [НП]: пониженное всасывание дигоксина в желудочно-кишечном тракте Железо [П]: пониженное всасывание железа в желудочно-кишечном тракте при сочетании с некоторыми антацидами
ТАБЛИЦА 11-1. (Продолжение)__________________________________________________________________________
ВП = Высоко предсказуемое. Взаимодействие происходит практически у всех пациентов, получающих комбинацию.
П = Предсказуемое. Взаимодействие происходит у большинства пациентов, получающих комбинацию.
НП = Непредсказуемое. Взаимодействие происходит только у некоторых пациентов, получающих комбинацию.
НУ = Не установлено. Данных, на которых основывается оценка предсказуемости, недостаточно.___________
Препарат или группа препаратов Свойства, способствующие лекарственному взаимодействию Клинически документированные взаимодействия
Антациды мещая препараты к участкам всасы- Кетоконазол [П]: пониженное всасывание кетокона-
(продолже- вания в кишечнике. Некоторые анта- зола в желудочно-кишечном тракте вследствие уве-
ние) циды (например, магния гидрооксид + алюминия гидрооксцц) несколько подщелачивают мочу, изменяя тем самым экскрецию препаратов, чувствительных к pH мочи личения pH (для всасывания кетоконазола требуется кислая среда) Хинолоны [ВП]: пониженное всасывание в желудочно-кишечном тракте ципрофлоксацина, норфлоксацина, зноксацина(и,вероятно, других хинолонов) Салицилаты [П]: повышенный почечный клиренс салицилатов вследствие увеличения pH мочи (только при приеме больших доз салицилатов) Натрия полистерен сульфонат [НУ]: связывает катионы антацидов в кишечнике, приводя к метаболическому алкалозу Тетрациклины [ВП]: пониженное всасывание тетрациклинов в желудочно-кишечном тракте
Антихолинер-гические средства См. Антимускариновые средства См. Антимускариновые средства
Пероральные Лабильный метаболизм изменяется Средства, повышающие антикоагулянтный эф-
антикоагу- под влиянием препаратов. В высо- фект:
лянты кой степени связаны с белками плазмы. Антикоагуляционный ответ изменяется средствами, которые нарушают синтез или катаболизм факторов свертывания Амиодарон [П]: снижает уровень метаболизма антикоагулянтов Анаболические стероиды [П]: нарушают распределение факторов свертывания? Хлорамфеникол [НУ]: пониженный уровень метаболизма дикумарола (и, вероятно, варфарина) Циметидин [ВП]: пониженный уровень метаболизма антикоагулянтов Ципрофлоксацин [НУ]: вероятно, ингибирует метаболизм антикоагулянтов Клофибрат [П]: механизм не установлен Даназол [НУ]: нарушает синтез факторов свертывания? Декстротироксин [П]: повышает катаболизм факторов свертывания? Дисульфирам [П]: пониженный уровень метаболизма антикоагулянтов Эритромицин [НУ]: вероятно, ингибирует метаболизм антикоагулянтов Флуконазол [НУ]: пониженный уровень метаболизма варфарина
ТАБЛИЦА 11-1. (Продолжение)
ВП = Высоко предсказуемое. Взаимодействие происходит практически у всех пациентов, получающих комбинацию.
П = Предсказуемое. Взаимодействие происходит у большинства пациентов, получающих комбинацию.
НП = Непредсказуемое. Взаимодействие происходит только у некоторых пациентов, получающих комбинацию.
НУ = Не установлено. Данных, на которых основывается оценка предсказуемости, недостаточно.
Препарат Свойства, способствующие или группа лекарственному взаимодействию препаратов Клинически документированные взаимодействия
Пероральные (См. выше) антикоагулянты (продолжение) Метронидазол [П]: пониженный уровень метаболизма антикоагулянтов Миконазол [НУ]: механизм не установлен Нестероидные противовоспалительные средства [П]: ингибирование функции тромбоцитов, изъязвление желудка; некоторые средства повышают гипопротромбинемический ответ (маловероятно при применении ибупрофена или напроксена) Фенилбутазон [ВП]: ингибирует метаболизм антикоагулянтов Хинидин [НП]: дополнительная гипопротромбине-мия Салицилаты [ВП]: подавление функций тромбоцитов аспирином, но не другими салицилатами; [П] в больших дозах оказывает гипопротромбинеми-ческое действие Сульфинпиразон [НУ]: механизм не установлен Сульфаниламиды [НУ]: ингибируют метаболизм антикоагулянтов; вытесняют из связи с белками Тиреоидные гормоны [П]: повышают катаболизм факторов свертывания Триметоприм-сульфаметоксазол [П]: ингибирует метаболизм антикоагулянтов; вытесняет из связи с белками См. также Спирт, Аллопуринол Средства, которые могут понижать антикоагулянтный эффект: Аминоглютетимид [П]: индукция ферментов Барбитураты [П]: индукция ферментов Карбамазепин [П]: индукция ферментов Холестирамин [П]: уменьшает всасывание антикоагулянтов Глютетимид [П]: индукция ферментов Нафциллин [НУ]: механизм не установлен Примидон [П]: индукция ферментов Рифампин [ri]: индукция ферментов Влияния антикоагулянтов на другие лекарства: Пероральные гипогликемические средства [П]: дикумарол ингибирует метаболизм толбутамида и хлорпропамида в печени Фенитоин [П]: дикумарол ингибирует метаболизм фенитоина
ТАБЛИЦА 11-1. (Продолжение)
ВП = Высоко предсказуемое. Взаимодействие происходит практически у всех пациентов, получающих комбинацию. П = Предсказуемое. Взаимодействие происходит у большинства пациентов, получающих комбинацию. НП = Непредсказуемое. Взаимодействие происходит только у некоторых пациентов, получающих комбинацию. НУ = Не установлено. Данных, на которых основывается оценка предсказуемости, недостаточно.
Препарат Свойства, способствующие или группа лекарственному взаимодействию препаратов Клинически документированные взаимодействия
Трицикличес- Ингибирование захвата катехолами-кие антидеп- нов постгантионарными адренер-рессанты и гическими нейронами. Антимуска-антидепрес- риновые эффекты могут бытьусиле-санты второ- ны другими антимускариновыми го поколения средствами. Метаболизм изменяется под влиянием препаратов Барбитураты [П]: повышенный уровень метаболизма антидепрессантов Карбамазепин [НУ]: повышенный уровень метаболизма антидепрессантов Циметидин [П]: пониженный уровень метаболизма антидепрессантов Клонидин [П]: пониженный уровень антигипертензивного действия клонидина Флуоксетин [НУ]: ингибирует метаболизм антидепрессантов Гуанадрел [П]: пониженный захват гуанадрела в участках действия Гуанетидин [П]: пониженный захват гуанетидина в участках действия Ингибиторы моноаминоксидазы [НП]: иногда возбуждение, гипертермия, мания и конвульсии, но многие пациенты переносят данную комбинацию без побочных эффектов Хинидин [НУ]: ингибирует метаболизм антидепрессантов Симпатомиметики [П]: повышенный прессорный ответ на норадреналин, адреналин и фенилэфрин (мезатон)
Антигистамин- Чувствительны к ингибированию мета-ные средст- болизма в печени ва, не обладающие седативным эффектом (терфен один, астемизол) Эритромицин [НП]: пониженный уровень метаболизма антигистаминных средств; возможны сердечные аритмии. Сходные эффекты может вызвать кларитромицин Кетоконазол [П]: пониженный уровень метаболизма антигистаминных средств, повышенный уровень в плазме, возможна сердечная аритмия
Антимускари- Понижают уровень моторики желудочковые но-кишечного тракта. Это может посредства высить биодоступность малораство- римых средств и снизить биодоступность препаратов, разрушаемых в кишечнике. Сочетанное применение более чем одного антимускариново-го средства или сочетание антимус- Комбинированные антимускариновые средства [П]: антимускариновые побочные эффекты (например, паралитический илеус, задержка мочи, затуманенное зрение) Леводопа [П]: повышенное разрушение леводопы в кишечнике; пониженный уровень леводопы в плазме
ТАБЛИЦА 11-1. . (Продолжение)
ВП = Высоко предсказуемое. Взаимодействие происходит практически у всех пациентов, получающих комбинацию. П = Предсказуемое. Взаимодействие происходит у большинства пациентов, получающих комбинацию. НП = Непредсказуемое. Взаимодействие происходит только у некоторых пациентов, получающих комбинацию. НУ = Не установлено. Данных, на которых основывается оценка предсказуемости, недостаточно.
Препарат или группа препаратов Свойства, способствующие лекарственному взаимодействию Клинически документированные взаимодействия
Антимускариновые средства (продолжение) каринового средства с другим препаратом со “скрытым" антимускари-новым действием (особенно антигистаминными препаратами ОТС) повышает вероятность антимускари-новых побочных эффектов (См. выше)
Барбитураты Индукция микросомальных ферментов печени, метаболизирующих лекарства. Дополнительное угнетение центральной нервной системы при сочетании с другими центральными депрессантами Р-Адреноблокаторы [П]: повышенный уровень метаболизма р-адреноблокаторов Блокаторы кальциевых каналов [П]: повышенный уровень метаболизма блокаторов кальциевых каналов Средства, угнетающие центральную нервную систему [ВП]: дополнительное угнетение центральной нервной системы Кортикостероиды [П]: повышенный уровень метаболизма кортикостероидов Циклоспорин [НУ]: повышенный уровень метаболизма циклоспорина Доксициклин [П]: повышенный уровень метаболизма доксициклина Эстрогены [П]: повышенный уровень метаболизма эстрогенов Фенотиазины [П]: повышенный уровень метаболизма фенотиазина Хинидин [П]: повышенный уровень метаболизма хинидина Теофиллин [НУ]: повышенный уровень метаболизма теофиллина; снижение эффекта теофиллина Вальпроевая кислота [П]: пониженный уровень метаболизма фенобарбитала См. также Пероральные антикоагулянты; трициклические антидепрессанты
Блокаторы Р-адреноре-цепторов Блокада p-адренорецепторов (особенно неселективными средствами, такими как пропранолол) изменяет ответ на симпатомиметические средства с Р-агонистической активностью (например, адреналин). Р-Адреноблокаторы, которые в боль- Препараты, повышающие эффект fl-блокаторов: Хлорпромазин [П]: пониженный уровень метаболизма пропранолола Циметидин [П]: пониженный уровень метаболизма тех p-адреноблокаторов, которые выводятся преимущественно печенью, например пропранолола. Меньшее влияние (если оно есть) на те, ко-
ТАБЛИЦА 11-1. (Продолжение)
ВП = Высоко предсказуемое. Взаимодействие происходит практически у всех пациентов, получающих комбинацию. П = Предсказуемое. Взаимодействие происходит у большинства пациентов, получающих комбинацию. НП = Непредсказуемое. Взаимодействие происходит только у некоторых пациентов, получающих комбинацию. НУ = Не установлено. Данных, на которых основывается оценка предсказуемости, недостаточно.
Препарат или группа препаратов Свойства, способствующие лекарственному взаимодействию Клинически документированные взаимодействия
Блокаторы шой степени метаболизируются при торые выводятся почками, например атенолол,
р-адреноре- первом прохождении через печень, надолол
цепторов могут испытывать влияния препара- Фуросемид [П]: пониженный уровень метаболиз-
(продолже- тов, способных изменять этот про- ма пропранолола
ние) цесс. p-Блокаторы могут снижать печеночный кровоток Гидралазин [П]: пониженный уровень метаболизма пропранолола Препараты, снижающие эффект 0-блокаторов: Индукторы ферментов [П]: барбитураты, фенитоин и рифампин могут усиливать метаболизм p-блокаторов; другие индукторы ферментов могут оказывать сходное действие Нестероидные противовоспалительные средства [П]: индометацин снижает антигипертензивный ответ; другие ингибиторы простагландинов, вероятно, также вступают во взаимодействие Влияния 0-блокаторов на другие средства: Клонидин [НУ]: гипертензивная реакция при отмене клонидина у пациента, принимающего пропранолол Инсулин [П]: ингибирование восстановления уровня глюкозы при гипогликемии; подавление симптомов гипогликемии (кроме потливости); повышенное кровяное давление во время гипогликемии Лидокаин [НУ]: пониженный клиренс введенного внутривенно лидокаина; повышенный уровеньли-докаина в плазме Празозин [П]: усиление гипотензивной реакции на первый прием празозина Симпатомиметики [П]: повышенная прессорная реакция на адреналин (и, возможно, на другие симпатомиметики); этот эффект более вероятен при применении неселективных р-блокаторов
Смолы, Смолы связывают в желудочно-ки- Ацетаминофен [НУ]: пониженное всасывание аце-
связываю- щечном тракте принятые перораль- таминофена в желудочно-кишечном тракте
щие желч- но препараты. Смолы могут связы- Гликозиды наперстянки [НУ]: пониженное всасыва-
ные кислоты вать и лекарства, которые подвергаются циркуляции в энтеропеченоч-ном круге, даже если последние вводятся парентерально ние дигитоксина (а также, возможно, дигоксина) в желудочно-кишечном тракте Метотрексат [НУ]: пониженное всасывание метотрексата в желудочно-кишечном тракте
ТАБЛИЦА 11-1. (Продолжение)
ВП = Высоко предсказуемое. Взаимодействие происходит практически у всех пациентов, получающих комбинацию. П = Предсказуемое. Взаимодействие происходит у большинства пациентов, получающих комбинацию. НП = Непредсказуемое. Взаимодействие происходит только у некоторых пациентов, получающих комбинацию. НУ = Не установлено. Данных, на которых основывается оценка предсказуемости, недостаточно.
Препарат Свойства, способствующие или группа лекарственному взаимодействию препаратов Клинически документированные взаимодействия
Смолы, связы- (См. выше) вающие желчные кислоты (продолжение) Тиазидные диуретики [П]: пониженное всасывание тиазидов в желудочно-кишечном тракте Тиреоидные гормоны [П]: пониженное всасывание тиреоидных гормонов См. также Пероральные антикоагулянты
Блокаторы Верапамил, дилтиазем и, возможно, кальциевых никардипин (но не нифедипин) инги- каналов бируют ферменты печени, метабо- лизирующие лекарства. Метаболизм дилтиазема, нифедипина, верапамила и, возможно, других блокаторов кальциевых каналов может быть стимулирован Карбамазепин [П]: пониженный уровень метаболизма карбамазепина при действии дилтиазема или верапамила; возможное повышение уровня метаболизма блокаторов кальциевых каналов Циметидин [П]: пониженный уровень метаболизма блокаторов кальциевых каналов Циклоспорин [П]: пониженный уровень метаболизма циклоспорина при действии дилтиазема, никар-дипина, верапамила Рифампин [П]: повышенный уровень метаболизма блокаторов кальциевых каналов См. также Барбитураты, теофиллин
Карбамазепин Индукция микросомальных ферментов печени, метаболизирующих лекарства. Чувствителен к ингибированию метаболизма Циметидин [П]: пониженный уровень метаболизма карбамазепина Кортикостероиды [П]: повышенный уровень метаболизма кортикостероидов Даназол [П]: пониженный уровень метаболизма карбамазепина Дилтиазем [П]: пониженный уровень метаболизма карбамазепина Доксициклин [П]: повышенный уровень метаболизма доксициклина Эритромицин [НУ]: пониженный уровень метаболизма карбамазепина Эстрогены [П]: повышенный уровень метаболизма эстрогенов Флуоксетин [НУ]: пониженный уровень метаболизма карбамазепина Галоперидол [П]: повышенный уровень метаболизма галоперидола Изониазид [П]: пониженный уровень метаболизма карбамазепина Пропоксифен [ВП]: пониженный уровень метаболизма карбамазепина
ТАБЛИЦА 11-1. (Продолжение)
ВП = Высоко предсказуемое. Взаимодействие происходит практически у всех пациентов, получающих комбинацию. П = Предсказуемое. Взаимодействие происходит у большинства пациентов, получающих комбинацию. НП = Непредсказуемое. Взаимодействие происходит только у некоторых пациентов, получающих комбинацию. НУ = Не установлено. Данных, на которых основывается оценка предсказуемости, недостаточно.
Препарат или группа препаратов Свойства, способствующие лекарственному взаимодействию Клинически документированные взаимодействия
Карбамазепин (продолжение) (См. выше) Теофиллин [НУ]: повышенный уровень метаболизма теофиллина Тролеандомицин [П]: пониженный уровень метаболизма карбамазепина Верапамил [П]: пониженный уровень метаболизма карбамазепина См. также Пероральные антикоагулянты, трициклические антидепрессанты, блокаторы кальциевых каналов
Хлорамфеникол Ингибирует ферменты печени, метаболизирующие лекарства Фенитоин: [П] пониженный метаболизм фенитоина Гипогликемические средства — производные сульфанилмочевины [П]: пониженный уровень метаболизма производных сульфанилмочевины См. также Пероральные антикоагулянты
Циметидин Ингибирует микросомальные ферменты печени, метаболизирующие лекарства (ранитидин и новые Нг-ги-стаминоблокаторы, по-видимому, так не действуют). Может ингибировать почечную канальцевую секрецию слабых оснований. Уменьшает кровоток в печени, тем самым снижая метаболический эффект первого прохождения препаратов с высоким коэффициентом экстракции. (Тем не менее способность циметидина нарушать печеночный кровоток дискутируется) Бензодиазепины: [П] пониженный уровень метаболизма алпразолама, хлордиазепоксида, диазепама, галазепама, празепама и хлоразепата, но не оксазепама, лоразепама или темазепама Кармустин [НУ]: усиление угнетения костного мозга Кетоконазол [НУ]: пониженное всасывание кетоконазола в желудочно-кишечном тракте вследствие увеличения pH кишечника; можно ожидать, что и другие Н2-гистаминоблокаторы дают подобный эффект Лидокаин [П]: пониженный уровень метаболизма лидокаина; увеличение уровня лидокаина в плазме Фенитоин [НУ]: пониженный уровень метаболизма фенитоина; увеличение уровня фенитоина в плазме Прокаинамид [П]: пониженная почечная экскреция прокаинамида; увеличение уровня прокаинамида в плазме. Для ранитидина характерен подобный, но менее выраженный эффект Хинидин [П]: пониженный уровень метаболизма хинидина; увеличение уровня хинидина в плазме Теофиллин [П]: пониженный уровень метаболизма теофиллина; увеличение уровня теофиллина в плазме См. также Пероральные антикоагулянты, трициклические антидепрессанты, p-адреноблокаторы, блокаторы кальциевых каналов, карбамазепин
ТАБЛИЦА 11-1. (Продолжение)
ВП = Высоко предсказуемое. Взаимодействие происходит практически у всех пациентов, получающих комбинацию.
П = Предсказуемое. Взаимодействие происходит у большинства пациентов, получающих комбинацию.
НП = Непредсказуемое. Взаимодействие происходит только у некоторых пациентов, получающих комбинацию.
НУ = Не установлено. Данных, на которых основывается оценка предсказуемости, недостаточно._____
Препарат Свойства, способствующие Клинически документированные взаимодействия
или группа лекарственному взаимодействию
препаратов
Циклоспорин Метаболизм может стимулироваться Аминогликозиды [НУ]: возможно усиление нефро-под влиянием препаратов. Чувстви- токсичности телен к ингибированию метаболиз- Амфотерицин В [НУ]: возможно усиление нефроток-ма сичности
Андрогены [НУ]: повышенный уровень циклоспорина в плазме
Дилтиазем [НУ]: пониженный уровень метаболизма циклоспорина; усиление эффекта циклоспорина
Эритромицин [НУ]: пониженный уровень метаболизма циклоспорина; усиление эффекта циклоспорина
Флуконазол [НУ]: пониженный уровень метаболизма циклоспорина; усиление эффекта циклоспорина
Кетоконазол [НУ]: повышенный уровень циклоспорина в плазме с развитием нефротоксичности вследствие ингибирования метаболизма циклоспорина
Ловастатин [НУ]: у пациентов, принимающих оба препарата, отмечены миопатия и рабдомиолиз
Фенитоин [НУ]: повышенный уровень метаболизма циклоспорина; ослабление эффекта циклоспорина
Рифампин [П]: повышенный уровень метаболизма циклоспорина; ослабление эффекта циклоспорина
Верапамил [НУ]: пониженный уровень метаболизма циклоспорина; усиление эффекта циклоспорина
См. также Барбитураты, блокаторы кальциевых каналов
Гликозиды наперстянки
Дигоксин чувствителен к угнетению всасывания в желудочно-кишечном тракте. Токсичность дигиталиса может повышаться при электролитном дисбалансе, вызванном лекарственными средствами (например, при гипокалиемии). Дигитоксин обладает лабильным метаболизмом. Почечная экскреция дигитоксина чувствительна к ингибированию
Средства, повышающие эффект наперстянки:
Амиодарон [П]: пониженная экскреция дигоксина почками ведет к повышению концентрации дигоксина в плазме
Дилтиазем [П]: повышенный уровень дигоксина в плазме (обычно на 20-30 %) из-за пониженного почечного и внепочечного клиренса
Эритромицин [НП]: повышенное у некоторых пациентов всасывание дигоксина в желудочно-кишечном тракте, вероятно, связано с ослаблением инактивации дигоксина кишечной флорой
Средства, вызывающие дефицит калия [П]: повышенная вероятность дигиталисной интоксикации
ТАБЛИЦА 11-1. (Продолжение)
ВП = Высоко предсказуемое. Взаимодействие происходит практически у всех пациентов, получающих комбинацию. П = Предсказуемое. Взаимодействие происходит у большинства пациентов, получающих комбинацию. НП = Непредсказуемое. Взаимодействие происходит только у некоторых пациентов, получающих комбинацию. НУ = Не установлено. Данных, на которых основывается оценка предсказуемости, недостаточно.
Препарат или группа препаратов Свойства, способствующие лекарственному взаимодействию Клинически документированные взаимодействия
Гликозиды наперстянки (продолжение) (См. выше) Хинидин [ВП]: пониженная экскреция дигоксина; вытеснение дигоксина из участков связывания в тканях; может затрагивать и дигитоксин Спиронолактон [НУ]: пониженная почечная экскреция дигоксина и искажение результатов некоторых сывороточных проб дигоксина Верапамил [П]: повышенный уровень дигоксина в плазме Средства, снижающие действие наперстянки: Каолин-пектин [П]: пониженное всасывание дигоксина в желудочно-кишечном тракте Пеницилламин [НУ]: пониженный уровень дигоксина в плазме Рифампин [НУ]: повышенный уровень метаболизма дигитоксина и, возможно, дигоксина Сульфасалазин [НУ]: пониженное всасывание дигоксина в желудочно-кишечном тракте См. также Антациды; смолы, связывающие желчные кислоты
Дисульфирам Ингибирует микросомальные ферменты печени, метаболизирующие лекарства. Ингибирует альдегиддегидрогеназу Бензодиазепины [П]: пониженный уровень метаболизма хлордиазепоксида и диазепама, но не лоразепама и оксазепама Метронидазол [НУ]: у пациентов, получавших такую комбинацию, описаны спутанность сознания и психозы; механизм неизвестен Фенитоин [П]: пониженный уровень метаболизма фенитоина См. также Спирт, пероральные антикоагулянты
Эстрогены Метаболизм может стимулироваться под влиянием препаратов. Энтеро-печеночная циркуляция эстрогенов может быть прервана в результате нарушения кишечной флоры (например, вызванного антибиотиками) Ампициллин [НП]: прерывание энтеропеченочной циркуляции эстрогенов; возможно снижение эффективности пероральных контрацептивов Кортикостероиды [П]: пониженный уровень метаболизма кортикостероидов, что ведет к усилению их эффекта Диазепам [НУ]: пониженный уровень метаболизма диазепама Гризеофульвин [НУ]: возможно снижение эффективности пероральных контрацептивов
ТАБЛИЦА 11-1. (Продолжение)
ВП = Высоко предсказуемое. Взаимодействие происходит практически у всех пациентов, получающих комбинацию.
П = Предсказуемое. Взаимодействие происходит у большинства пациентов, получающих комбинацию.
НП = Непредсказуемое. Взаимодействие происходит только у некоторых пациентов, получающих комбинацию.
НУ = Не установлено. Данных, на которых основывается оценка предсказуемости, недостаточно.__________
Препарат или группа препаратов Свойства, способствующие лекарственному взаимодействию Клинически документированные взаимодействия
Эстрогены (продолжение) (См. выше) Рифампин [НП]: повышенный уровень метаболизма эстрогенов; возможно снижение эффективности пероральных контрацептивов См. также Барбитураты, карбамазепин
Железо Связывается с препаратами в желудочно-кишечном тракте, снижая их всасывание Метилдопа [НУ]: пониженное всасывание метил-допы Хинолоны [П]: пониженное всасывание ципрофлоксацина, норфлоксацина и, возможно, других хинолонов Тетрациклины [П]: пониженное всасывание тетрациклинов; пониженная эффективность железа См. также Антациды
Леводопа Леводопа разрушается в кишечнике до момента достижения мест всасывания. Средства, которые нарушают моторику желудочно-кишечного тракта, могут изменять степень разрушения в просвете кишечника. Ан-типаркинсоническое действие леводопы чувствительно к ингибированию другими препаратами Клонидин [НУ]: снижает антипаркинсонический эффект Ингибиторы моноаминоксидазы [П]: гипертоническая реакция (карбидопа предупреждает взаимодействие) Папаверин [НУ]: снижает антипаркинсонический эффект Фенотиазины [П]: снижают антипаркинсонический эффект Фенитоин [НУ]: снижаетантипаркинсонический эффект Пиридоксин [П]: снижает антипаркинсонический эффект (карбидопа предупреждает взаимодействие) См. также Антимускариновые средства
Литий Почечная экскреция лития чувствительна к изменениям натриевого баланса (снижение содержания натрия может вызывать задержку лития). Чувствителен к препаратам, повышающим токсическое действие лития на центральную нервную систему Ингибиторы АПФ [НУ]: возможно снижение почечного клиренса лития; усиление эффекта лития Диуретики (особенно тиазиды) [П]: пониженная экскреция лития; фуросемид вызывает этот эффект с меньшей вероятностью, чем тиазидные диуретики Галоперидол [НП]: описаны редкие случаи нейротоксичности у маниакальных больных, особенно получающих большие дозы одного или обоих препаратов Метилдопа [НУ]: повышенная вероятность токсического действия лития на центральную нервную систему
ТАБЛИЦА 11-1. (Продолжение)
ВП = Высоко предсказуемое. Взаимодействие происходит практически у всех пациентов, получающих комбинацию. П = Предсказуемое. Взаимодействие происходит у большинства пациентов, получающих комбинацию. НП = Непредсказуемое. Взаимодействие происходит только у некоторых пациентов, получающих комбинацию. НУ = Не установлено. Данных, на которых основывается оценка предсказуемости, недостаточно.
Препарат или группе препаратов Свойства, способствующие лекарственному взаимодействию Клинически документированные взаимодействия
Литий (продолжение) (См. выше) Нестероидные противовоспалительные средства [НУ]: сниженная почечная экскреция лития (исключая сулиндак) Теофиллин [П]: повышенная почечная экскреция лития; ослабление эффекта лития
Ингибиторы моноамин-оксидазы Увеличенное депонирование норадреналина в адренергических окончаниях. Вытеснение этих запасов другими средствами может вызвать острую гипертензивную реакцию. Ингибиторы МАО обладают собственной гипогликемической активностью Антиадренергические средства [П]: дополнительный гипогликемический эффект Декстрометорфан [НУ]: описаны тяжелые реакции (гипертермия, кома, смерть) Флуоксетин [НУ]: сообщалось о смертельных случаях у пациентов, принимающих это сочетание; необходимо дальнейшее изучение Гуанетидин [П]: подавление гипотензивного действия гуанетидина Наркотические аналгетики [НП]: у некоторых пациентов развиваются гипертензия, ригидность, возбуждение; меперидин взаимодействует с большей вероятностью, чем морфин Фенилэфрин [П]: описаны случаи гипертензии, поскольку фенилэфрин метаболизируется моноамин-оксидазой Симпатомиметики (непрямого действия) [ВП]: известны случаи гипертензии, вызванные высвобождением депонированного норадреналина См. также Леводопа
Нестероидные противовоспалительные средства Угнетение синтеза простагландинов может привести к снижению почечной экскреции натрия, нарушению устойчивости к гипертензивным стимулам и снижению почечной экскреции лития. Большинство НПВС угнетают функцию тромбоцитов, могут повышать вероятность кровотечения в результате действия других препаратов, нарушающих гемостаз. Большинство НПВС в высокой степени связываются с белками плазмы. Фенилбутазон может снижать уровень микросомального метаболизма препаратов в печени (в ряде Ингибиторы АПФ [П]: пониженный антигипертензивный ответ Фуросемид [П]: пониженный диуретический, натрийуретический и антигипертензивный ответ на фуросемид Гидралазин [НУ]: пониженный антигипертензивный ответ на гидралазин Метотрексат [НУ]: возможно повышение токсического действия метотрексата (особенно при противоопухолевой терапии) Фенитоин [П]: пониженный уровень метаболизма фенитоина в печени Триамтерен [НУ]: понижение почечной функции отмечено при сочетании триамтерена с индометацином как у здоровых субъектов, так и у больных
ТАБЛИЦА 11-1. (Продолжение)
ВП = Высоко предсказуемое. Взаимодействие происходит практически у всех пациентов, получающих комбинацию. П = Предсказуемое. Взаимодействие происходит у большинства пациентов, получающих комбинацию. НП = Непредсказуемое. Взаимодействие происходит только у некоторых пациентов, получающих комбинацию. НУ = Не установлено. Данных, на которых основывается оценка предсказуемости, недостаточно.
Препарат или группа препаратоа Саойства, способствующие лекарственному взаимодействию Клинически документированные взаимодействия
Нестероидные противовоспалительные средства (продолжение) случвев действует как индуктор ферментов). Фенилбутазон может нарушать почечную экскрецию некоторых препаратов См. также Пероральные антикоагулянты, р-адрено-блокаторы, литий
Фенитоин Стимулирует микросомальный метаболизм препаратов в печени. Чувствителен к ингибированию метаболизма Средства, метаболизм которых стимулируется фенитоином: Кортикостероиды [П]: пониженный уровень кортикостероидов в плазме Доксициклин [П]: пониженный уровень доксициклина в плазме Метадон [П]: пониженный уровень метадона в плазме; симптомы абстиненции Мексилетин [НУ]: пониженный уровень мексиле-тина в плазме Хинидин [П]: пониженный уровень хинидина в плазме Теофиллин [НУ]: пониженный уровень теофиллина в плазме Верапамил [НУ]: пониженный уровень верапамила в плазме См. также Циклоспорин, эстрогены Средства, угнетающие метаболизм фенитоина: Амиодврон [П]: повышенный уровень фенитоина в плазме; возможно снижение уровня амиодарона в плазме Хлорамфеникол [П]: повышенный уровень фенитоина в плазме Фелбамат [П]: повышенный уровень фенитоина в плазме Флуконазол [П]: повышенный уровень фенитоина в плазме Флуоксетин [П]: повышенный уровень фенитоина в плазме Изониазид [НП]: повышенный уровень фенитоина в плазме; проблема в первую очередь возникает у медленных ацетиляторов изониазида См. также Циметидин, дисульфирам, фенилбутазон
ТАБЛИЦА 11-1. (Продолжение)
ВП = Высоко предсказуемое. Взаимодействие происходит практически у всех пациентов, получающих комбинацию. П = Предсказуемое. Взаимодействие происходит у большинства пациентов, получающих комбинацию. НП = Непредсказуемое. Взаимодействие происходит только у некоторых пациентов, получающих комбинацию. НУ = Не установлено. Данных, на которых основывается оценка предсказуемости, недостаточно.
Препарат или группа препаратов Свойства, способствующие лекарственному взаимодействию Клинически документированные взаимодействия
Фенитоин (продолжение) (См. выше) Средства, усиливающие метаболизм фенитоина: Рифампин [П]: пониженный уровень фенитоина в плазме
Калийсберега-ющие диуретики (амилорид, спиронолактон, три-амтерен) Аддитивный эффект при сочетании с другими средствами, повышающими концентрацию калия в плазме. Могут нарушать почечную экскрецию не только калия, но и других веществ (например, дигоксина, ионов водорода) Ингибиторы АПФ [НУ]: дополнительный гиперкалиемический эффект Препараты калия [П]: дополнительный гиперкалиемический эффект; проблема возникает прежде всего при нарушениях функции почек См. также Гликозиды наперстянки, нестероидные противовоспалительные средства
Пробенецид Нарушает почечную экскрецию препаратов, которые активно секретируются в канальцах, особенно слабых кислот. Подавляет конъюгацию других средств с глюкуроновой кислотой Клофибрат [П]: угнетение образования глюкуронидов клофибриновой кислоты Метотрексат [ГТ]: пониженная почечная экскреция метотрексата; возможна токсическая реакция на метотрексат Пенициллин [П]: пониженная почечная экскреция пенициллина Салицилаты [П]: пониженный урикозурический эффект пробенецида (взаимодействие маловероятно при дозах менее 1.5 г салицилатов в сутки)
Хинидин Метаболизм может стимулироваться под влиянием препаратов. Подавляет активность цитохрома Р-450 2D6. Почечная экскреция чувствительна к изменению pH мочи Ацетазоламид [П]: пониженная почечная экскреция хинидина, вызванная повышением pH мочи; повышенный уровень хинидина в плазме Амиодарон [НУ]: повышенный уровень хинидина в плазме; механизм не установлен Каолин-пектин [НУ]: пониженное всасывание хинидина в желудочно-кишечном тракте Рифампин [П]: повышенный уровень метаболизма хинидина в печени См. также Пероральные антикоагулянты, трициклические антидепрессанты, барбитураты, циметидин, гликозиды наперстянки, фенитоин
Хинолоновые антибиотики Чувствительны к угнетению всасывания в желудочно-кишечном тракте. Некоторые хинолоны ингибируют микросомальные ферменты печени Кофеин [П]: ципрофлоксацин, эноксацин, пипедеми-новая кислота и в меньшей степени норфлоксацин ингибируют метаболизм кофеина Сукральфат [ВП]: пониженное всасывание ципрофлоксацина, норфлоксацина и, вероятно, других хинолонов в желудочно-кишечном тракте
ТАБЛИЦА 11-1. (Продолжение)
ВП = Высоко предсказуемое. Взаимодействие происходит практически у всех пациентов, получающих комбинацию. П = Предсказуемое. Взаимодействие происходит у большинства пациентов, получающих комбинацию. НП = Непредсказуемое. Взаимодействие происходит только у некоторых пациентов, получающих комбинацию. НУ = Не установлено. Данных, на которых основывается оценка предсказуемости, недостаточно.
Препарат или группа препаратов Свойства, способствующие лекарственному взаимодействию Клинически документированные взаимодействия
Хинолоновые антибиотики (продолжение) (См. выше) Теофиллин [П]: ципрофлоксацин, эноксацин и в меньшей степени норфлоксацин снижают уровень метаболизма теофиллина; ломефлоксацин и офлоксацин, по-видимому, оказывают незначительное действие См. также Антациды, пероральные антикоагулянты
Рифампин Индукция микросомальных ферментов печени, метаболизирующих лекарства Кортикостероиды [П]: повышенный уровень метаболизма кортикостероидов в печени; ослабление эффекта кортикостероидов Кетоконазол [НУ]: повышенный уровень метаболизма кетоконазола; ослабление эффекта кетоконазола Мексилетин [НУ]: повышенный уровень метаболизма мексилетина; ослабление эффекта мексилетина Гипогликемические средства — производные сульфанилмочевины [П]: повышенный уровень метаболизма толбутамида в печени и, вероятно, других производных сульфанилмочевины, метаболизирующихся в печени (включая хлорпропамид) Теофиллин [П]: повышенный уровень метаболизма теофиллина; ослабление эффекта теофиллина См. также Пероральные антикоагулянты, блокаторы Р-адренорецепторов, блокаторы кальциевых каналов, циклоспорин, гликозиды наперстянки, эстрогены
Салицилаты Нарушают почечную экскрецию препаратов, которые активно секретируются в канальцах. При использовании больших доз салицилатов почечная экскреция зависит от pH мочи. Аспирин (но не другие салицилаты) нарушает функцию тромбоцитов. Большие дозы салицилатов обладают собственной гипогликемической активностью. Салицилаты могут вытеснять препараты из мест связывания с белками плазмы Ингибиторы карбоангидразы [НУ]: повышенная концентрация ацетазоламида в плазме; повышенная токсичность салицилатов из-за снижения pH крови Кортикостероиды [П]: повышенная элиминация салицилатов; возможно дополнительное токсическое воздействие на слизистую оболочку желудка Гепарин [НУ]: повышенная склонность к кровотечению при действии аспирина, но, вероятно, не других салицилатов Метотрексат [П]: пониженный почечный клиренс метотрексата; повышенная токсичность метотрексата Сульфинпиразон [ВП]: пониженный урикозуричес-кий эффект сульфинпиразона (взаимодействие
ТАБЛИЦА 11-1. (Продолжение) _________________________________________________________________________
ВП = Высоко предсказуемое. Взаимодействие происходит практически у всех пациентов, получающих комбинацию.
П = Предсказуемое. Взаимодействие происходит у большинства пациентов, получающих комбинацию.
НП = Непредсказуемое. Взаимодействие происходит только у некоторых пациентов, получающих комбинацию.
НУ = Не установлено. Данных, на которых основывается оценка предсказуемости, недостаточно.___________
Препарат или группа препаратов Свойства, способствующие лекарственному взаимодействию Клинически документированные взаимодействия
Салицилаты (продолжение) (См. выше) маловероятно при дозах салицилатов менее чем 1.5 г в сутки) См. также Антациды, пероральные антикоагулянты, пробенецид
Теофиллин Чувствителен к снижению уровня метаболизма в печени. Лабильный метаболизм Бензодиазепины [НУ]: снижение седативного эффекта бензодиазепинов Дилтиазем [П]: пониженный уровень метаболизма
теофиллина; усиление эффекта теофиллина
Кларитромицин [НУ]: пониженный уровень метаболизма теофиллина; усиление эффекта теофиллина
Эритромицин [П]: пониженный уровень метаболизма теофиллина; усиление эффекта теофиллина
Курение [ВП]: повышенный уровень метаболизма теофиллина,'’ослабление эффекта теофиллина
Такрин [П]: пониженный уровень метаболизма теофиллина; усиление эффекта теофиллина
Тролеандомицин [П]: пониженный уровень метаболизма теофиллина; усиление эффекта теофиллина Верапамил [П]: пониженный уровень метаболизма теофиллина; усиление эффекта теофиллина
См. также Барбитураты, карбамазепин, циметидин, литий, фенитоин, хинолоны, рифампин
Избранная литература
Cluff L. Е., Petrie J. S. Clinical Effects of Interaction Between Drugs. Exerpta Medica, 1974.
Hansten P. D., Horn J. R. Drug Interactions. Applied Therapeutics, Lea & Febiger. [Quarterly]
Jankel C. A., Speedie S. M. Detecting drug interactions. A review of the literature. Ann. Pharmacother. 1990; 24: 982.
Rizack M. A. (ed.). The Medical Letter Handbook of Adverse Interactions. The Medical Letter, 1993.
Tatro D. S. (ed.). Drug Interaction Facts. Lippincott. [Quarterly]
Указатель
Большинство препаратов указано под их родовыми названиями. Если указано торговое название лекарства, ссылка на страницу относится к имеющимся препаратам. Для более детального ознакомления следует смотреть ссылку на родовое название.
А
Аббокиназа II: 27,42.
См. также Урокиназа
Абсанс 1:462
Абстинентный синдром 1:572 Абсцесс II: 300,333,380
Авентил 1:458.
См. также Нортриптилин
Авермектины II: 364
Авлоклор II: 392.
См. также Хлорохин Автономная нервная система
(АНС) 1:101-120
Агонисты 1:15-16; 22
а-Агонисты и глаукома 1:190
Адамантанамины II: 299
Адвил И: 86. См. также Ибупрофен
Аддикция (пристрастие) 1:579 Аддисона болезнь II: 134-135 Аденилат циклаза 1:159
Аденина арабинозид II: 306,338
См. также Видарабин
Аденозин 1:277,278,288,293
Аденозинтрифосфат (АТФ) 1:107
Адреналин 1:166,173-174,389,395
Адренергическая передача, рецепторы 1:106-109,154-160
Адренергические нейроны 1:106-107,203
Адренергических нейронов блокаторы 1:202
Адреноблокаторы 1:175-192
Адренокортикотропин (АКТГ) II: 98-99
а-Адренолнтики селективные 1:219
Адренорецептор блокирующие средства II: 120-121
Р-Адренорецептор(ы) 1:40,155-156, 158-159,242,253,386-391
Адриамицин II: 437-438.
См. также Доксорубицин Адруцил II: 300,434,570.
См. также Фторурацил Азактам II: 251.
См. также Азтреонам Азалии 11:87,289,585.
См. также Сульфасалазин Азатадин, препараты 1:343 Азатиоприн II: 76-77,472-473 Азацитидин II: 434,445 Азидотимидин II: 306.
См. также Зидовудин Азинфос-метил II: 496 Азитромицин II: 278,310-311 Азлин II: 250.
См. также Азлоциллин Азлоциллин II: 241-243,250 Азмакорт 1:396.
См. также Триамцинолон Азо-восстановление 1:79 Азокрасители II: 419-420 Азол(ы) II: 293
Азола производные, местные II: 556 Азолид И: 86.
См. также Фенилбутазон Азота оксид 1:226,394 Азота диоксид И: 492 Азтреонам II: 251,332,339-341 AZTII: 306. См. также Зидовудин Азулфидин II: 87,585.
См. также Сульфасалазин Акатизия 1:534
АкваМефитон II: 42.
См. также Фитонадион Аквахлорал суппретте 1:347.
См. также Хлоралгидрат Акинетон I: 430.
См. также Бипериден Аккомодационная эзотропия 1:133 Аккуприл 1:168
Аккутан II: 445,562-564
Акловат II: 565
Аклометазона дипропионат II: 565 Акне II: 554,573-574
Аконитин 1:486
Акромицин VII: 388-389.
См. также Тетрациклин
Аксид 1:344. См. также Низатидин Актар И: 108.
См. также Адренокортикотропин Активаза И: 42
Активин II: 160
Активированный уголь II: 523-525 Активная иммунизация II: 608 Актигалл II: 586.
См. также Урсодиол
Актидил 1:344
Актиномицин D II: 436 Албамицин II: 319.
См. также Новобиоцин Албендазол II: 395-399,416 Алгиновая кислота II: 575 Алев II: 86. См. также Напроксен Алзапам 1:347.
См. также Лоразепам Алифатические углеводороды, галогенизированные II: 493 Алкалоз метаболический 1:302-305 Алкалоиды 1:152,336-345
Алкалоиды спорыньи 1:336-345 Алкеран II: 423-426.
См. также Мелфалан
Алкилирующие средства II: 423-430,472
Алкогольдегидрогеназный путь 1:431 Аллерген(ы) 1:381-383 Аллергический контактный дерматит и местные кортикостероиды 11:567
Аллопуринол 1:19,84
Аллопуринол II: 85-86,221,430,626
Аллопуринола рибозид II: 356
Алоэ И: 580
Alopecia areata, местные кортикостероиды II: 567
Алпренолол Г. 85,176
Алтае 1:168.
См. также Рамиприл
Алтретамин II: 428
Алупент 1:318.
См. также Метапротеренол
Алурат 1:429
Алфента 1:475.
См. также Алфентанил
Алфентанил 1:462,577
Алферов N И: 306
Альбумин и измерение концентраций лекарств I: 70
Альбутерол 1:389,396
Альдактон 1:247-248.
См. также Спиронолактон Альдегид (ы), антимикробные
эффекты II: 320-321
Альдомет 1:168.
См. также Метилдопа Альдостерон 1:213,308 Альдостерон II: 140—141 Альдрин II: 494
Альпразолам 1:412,425,428;
11:542-543
Альпростадил, препараты 1:377
Альтеплаза II: 42
Альтернагель II: 573
Альцгеймера болезнь И: 547
Алюминия гидроксид И: 573
Алюминия сахарозы сульфат II: 576 Амантадин 1:516-517; II: 298-299 Amanita phalloides 1:149; II: 516 Amanita virosa 1:149
Амбеноний 1:131,137
Амбиен 1:348.
См. также Золпидем
Амебиаз II: 371-374,383-388
Амебициды 383-384
Амебная дизентерия II: 384-385
Аменорея II: 101
Аменорея-галакторея, бромокриптин II: 105-106
Аметоптерин II: 87.
См. также Метотрексат
Амидат 1:393.
См. также Этомидат
Амиды 1:79,484
Амикар II: 420
Амикацин 1:56
Амикацин II: 222-223,266,332
Амикин II: 269.
См. также Амикацин
Амилнитрит!: 225,231,240,594-595
Амилин II: 181,202-203
Амилорид 1:308-309,316
Амин(ы) 1:80,141,546
Аминные алкалоиды, структура I: 337
а-Аминобензилпенициллин II: 238
Аминогликозиды II: 261-268
Аминоглютетимид II: 142,444-445
Аминокапроновая кислота И: 27,41 9-Амино-20(5)-камптотецин II:
445-446
Аминокарб И: 496
Аминокислоты 1:407-408
Аминооксидазы 1:79
6-Аминопенициллановая кислота II: 236
Аминоптерин, влияние на плод II: 533
Аминосалицилат натрия II: 281
Аминосалициловая кислота (PAS)
II: 277
5-Аминосалициловая кислота (5-
ASA)II:582
Аминофиллин I: 385
4-Аминохинолин II: 367
8-Аминохинолин II: 367
7-Аминоцефалоспорановая кислота II: 244
Амиодарон 1:280-282
Амптал 1:429
Амитиозон II: 714
Амитриптилин 1:342,552,555
Амлодипин 1:213,220,240
Аммонийная ртутная мазь USP И: 323
Амобарбитал 1:429
Амодиахин II: 367
Амоксапин 1:545-557
Амоксил II: 250.
См. также Амоксициллин Амоксициллин II: 241 Амоксициллин/калия клавуланат
II: 250
Амонафид II: 445-446
Ампициллин II: 241,535,634-635
Ампициллин/сульбактам натрия II: 250
Ампролиум II: 361-362
Амринон 1:252-257
Амсакрин II: 444-445
Амфенон В И: 142
Амфетамин 1:161,173,584-587
Амфоджел II: 573
Амфотерицин ВII: 290-291,389 Амциноннд II: 565
Анаболические стероиды II: 172-175 Анавар II: 180.
См. также Оксандролон Аналгезируюшие средства 1:558;
11:65-67,80-82
Аналгезия 1:558,566,567,540 Анапрокс И: 86-87.
См. также Напроксен, Напроксен натрия
Анафранил 1:458.
См. также Кломипрамин Ангиотензин 1:197,213-214,346-351
Ангиотензиноген 1:347
Ангиотензинпревращающий фермент (АПФ), ингибиторы I: 214-215
Angiostrongylus cantonensis II: 396-397,405
Андрогены надпочечников II: 141 Андрол-50 II: 180.
См. также Оксиметолон Андростендиол II: 158 Андростендион II: 158,172 Андростерон II: 160 Анектин 1:417.
См. также Сукцинилхолнп Анемия II: 9-24
Анестезия 1:420,468-470,480-482, 483-492
Анестезия аналгетиками, опиоиды I: 391
Анестетики общие 1:381-393 Анизотропии 1:147; II: 584
Анионная передозировка и петлевые диуретики 1:303-305
Анионные ингибиторы II: 118-119
Анистреплаза II: 36,42
Анкобон II: 297.
См. также Флуцитозин
Ансаид И: 88
Ансамицин II: 278
Анспор II: 251
Антабус 1:359.
См. также Дисульфирам
Антагонист(ы) 1:16,22
Антагонисты Н(-рецепторов 1:324-328
Антагонисты Н2-рецепторов 1:88-90,328-332
Антазолин 1:326
Антациды И: 573-575
Антиамебные средства II: 363
Антиандрогены II: 177-178
Антиаритмические средства 1:273-293,504
Антибактериальные средства И: 553-555
Аитиверт 1:272.
См. также Меклизин 1:344
Антивирусная химиотерапия II: 303-306
Антивирусные средства II: 298-306, 558-560
Антигемофилический фактор, препараты II: 42
Антигенпрезентирующие клетки (APCs)II:463
Антигипертензивные средства I: 193-221
Антигистаминные средства 1:323-332
Антидепрессанты 1:544-557; 11:546-547
Антидиабетические средства II: 634-635
Антидиарейные средства II: 581
Антидоты II: 524-526
Антиингибиторный коагулянтный комплекс, препараты II: 42
Антикоагулянты II: 27-35
Антилейшманиозные средства, механизмы действия И: 364
Антилимфоцитарные антитела II: 474
Антилимфоцитарный глобулин (ALG) 11:474
Антималярийные средства И: 76-77,366
Антиметаболиты II: 430-434
Антимускариновые средства 1:139-150
Аитипаразитарная химиотерапия II: 353-364
Антипиретические средства II: 61, 335
Антипротозойные средства II: 366-393
Антипсихотические средства 1:524-543
Антиревматические средства II: 61 Антисеборейные средства II: 571 Антисептики II: 320-326 Антистероидные средства И: 439-433
Антитимоцитарные антитела II: 474 Антитимоцитарный глобулин
(ATG)II:474
Антитиреоидные средства II: 117-127 Антитрипаносомные средства II:
363-343
Антитромбин III II: 27, 42 Антитромботические средства И: 38 Антифасциолярные средства, механизм действия II: 364
Антифиляриозные средства, механизм действия II: 364
Антихолинергические средства I: 139-153
Антихолинэстеразные средства II: 524
Антицестодные средства II: 363 Антиэметические средства II: 578 Антиэстрогены II: 168 Антрациклины II: 437 Антуран II: 87.
См. также Сульфинпиразон Анцеф II: 251.
См. также Цефазолин Ancylostoma duodenale И: 413-415 Апазон II: 3,63,73 Аполипопротеин (Аро) В-100II: 44 Апраклонидин 1:190 Апресолин 1:168 Апробарбитал 1:429.
См. также Алурат
Апротинин и калликреин-кинино-вая система 1:354
Арабинофуранозиладенин II: 306.
См. также Видарабин
Арабинофуранозилцитозина гидрохлорид II: 301,433-434, 472-473.
См. также Цитарабин
Арален II: 392. См. также Хлорохин
Арамин 1:130
Арахидоновая кислота 1:362-368, 377
Ara-A II: 306. См. также Видарабин
Ara-C II: 301,433-434,472-473.
См. также Цитарабин
Аргинин вазопрессин II: 41
Аргирол S.S. 10 % II: 325
Ардуан 1:417.
См. также Пипекуроний
Аредиа II: 669.
См. также Памидронат
Аристокорт И: 145. См. также Триамцинолон
Аристофан II: 145
Аритмии. См. Сердечные аритмии
Ароматазы ингибиторы II: 442,445, 455
Ароматические углеводороды II: 493-494
Ароматическое гидроксилирование 1:79
Арсин (газ), отравление II: 508
Артан 1:430
Артемизин II: 382-383
Артериальной крови газы II: 517
Артериовенозный концентрационный градиент и ингаляционная анестезия 1:472
Артрит II: 61-62,140
Артропан II: 86
Арфонад I: ИЗ, 168.
См. также Триметафан
Асакол II: 585.
См. также Мезаламин
Асендин 1:458.
См. также Амоксапин
Аскаридоз II: 395,398,404,405, 409-410
Ascaris lumbricoides II: 364,396,404, 413
Аспарагиназа II: 444
Аспартат 1:406
Аспергиллез, эмпирическая проти-вомикробная терапия II: 331
Аспирин II: 37,63-69
Астемизол 1:326,343; II: 628
Астма 1:379-398
Астокорт 1:3.
См. также Триамцинолон Атабрин НС1II: 392.
См. также Хинакрин Атаракс 1:272,348.
См. также Гидроксизин Атгам II: 486
Атенолол 1:183-185,207
Атетоз 1:509,521 Ативан 1:347,379,393.
См. также Лоразепам Атовахон II: 390 Атолон II: 145.
См. также Триамцинолон Атонические судороги 1:462-463 Атракуриум 1:498,503 Атровент 1:113,319.
См. также Ипратропиум Атромид-S II: 60.
См. также Клофибрат Атропин 1:139-146 Атропина сульфат и моторика бронхов I: 391-392
АТФ. См. Аденозинтрифосфат Аугестин II: 179.
См. также Норэтиндрон Аугментин II: 250 Ауранофин II: 76-78 Ауротиоглюкоза II: 76-77 Ауротиомалат И: 76-78 Аутоплекс II: 41-42 Ауторецепторы 1:117 Афлатоксины II: 419 Африканский трипаносомоз II:
414-415
Африн 1:174.
См. также Оксиметазолин Афтат II: 295-296,556-557 Ацебутолол 1:186,207 Ацеои 1:220
Ацетазолампд 1:19,190,301,316, 461; 11:636-637
Ацетальдегида метаболизм 1:432 Ацетаминофен 1:19,56,80;
11:80-82,88,524,535-536 Ацетил-р-метилхолин 1:124 Ацетилирование 1:80,81 Ацетилсалициловая кислота II: 64, 86
Ацетилхолин (АЦХ) 1:36,104-105, 124,408-409,493
Ацетилхолина хлорид 1:124 Ацетилхолинэстераза 1:104,129
Ацетилцистеин II: 534
Ацетогексамид II: 198
Ацетофеназин 1:542
Ацефен, 88.
См. также Ацетаминофен Ацидифицируклцие вещества II: 317 Ацидоз 1:303,309-310; II: 521,573-
574
Ацикловир II: 301-302,306,339-
341,559-560
Ациклогуанозин II: 306.
См. также Ацикловир AcinetobacterW-. 244,265 АэроБид 1:396 Аэроспорин И: 269
Б
Babesia II: 388
Бакампициллин II: 241,250
Баклофен 1:506-507
Бактерицидность II: 224
Бактерицидные титры, сыворотка 11:334
Бактоцилл II: 250.
См. также Оксациллин
Бактрим И: 289,393.
См. также Триметоприм-сульфаметоксазол
Балантидиаз II: 391
Баллизм 1:520
Балсалазид II: 585
Банкрофта филяриоз II: 404 Бантин I: ИЗ.
См. также Метантелин
Барбитураты 1:415-421,582-584
Барорефлекс, постуральный 1:194-195
Батрахотоксин и натриевые каналы 1:486
Бацилла Кальметта-Герена (BCG) 11:841
Бацитрацин II: 310,553
Беамин 1:359.
См. также Тиамин
Безафибрат И: 55
Беклометазон дипропионат II: 140
Беклометазон при астме 1:396
Белладонны алкалоиды 1:152 G-белок 1:37-39
Бенадрил 1:272.
См. также Дифенгидрамин
Беназеприл 1:214,220 Бендрофторметиазид 1:307,316 Бенемид II: 87.
См. также Пробенецид Бензалконий II: 324-325 Бензэстрол II: 150 Бензилбензоат II: 560 Бензилпенициллин II: 238 Бензо[а]пирен и метаболизм лекарств 1:84
Бензодиазепины 1:413-422,582-584
Бензокаин 1:485,491 Бензол II: 420,493,567 Бензоморфаны 1:576 Бензофеноны II: 561 Бензтиазид 1:307,316 Бензтропин 1:141,518,522 Бенилин DM 1:476.
См. также Декстрометорфан Бенилин Сироп II: 589
Бентил 1:112.
См. также Дицикломин Бентил II: 584.
См. также Дицикломин Бепридил 1:288
Бетадин И: 325.
См. также Повидон-иодин Бетазол 1:323
Бетаксолол 1:207
Бета-лактам(ы) II: 225-230,249-250
Бета-лактамаза II: 249-250,335 Беталин S1:359.
См. также Тиамин Бетаметазон II: 564 Бетанехол II: 577-578 Бетанидин 1:202 Бетапейс 1:145.
См. также Соталол Бетасерон II: 486 Бетоптик 1:191.
См. также Бетаксолол Бефениум II: 364 Бигуаниды II: 199,299 Бизинолат II: 362 Бикарбонат 1:296; II: 524 БиларцилП:416.
См. также Метрифонат Биливист II: 127 Биодоступность 1:60-62 Биотрансформация 1:73-86 Бипериден 1:518,522
Бипиридины 1:252-253
Биполярные аффективные расстройства 1:536-537
Бисакодил II: 580
Бисопролол 1:184,191,219
Бнтин И: 416. См. также Битионол
Битионол II: 399
Битолтерол 1:389-390
Бифосфонаты II: 210
Бициллин II: 250
Бленоксан II: 440.
См. также Блеомицин
Блеомицин И: 440
Блокадрен 1:192,219.
См. также Тимолол p-Блокаторы 1:182-191,207,285 Блокаторы кальциевых каналов I: 212-213,231-237,287-288,393
Болезни движения (укачивание, кинетозы) 1:146,327
Борная кислота II: 322
Ботулизм, иммунизация И: 617-618
Ботулизма токсин 1:118
Брадикинин и воспаление II: 61-62 Бревиблок 1:145,227.
См. также Эсмолол
Бревитал натрия 1:482
Бреквинар натрия И: 472 Бретилиум 1:279,280,292
Бретилол 1:227.
См. также Бретилиум
Бретин 1:319.
См. также Тербуталин
Бриканил 1:319.
См. также Тербуталин
Брокефрин 1:395
Бромид и эпилепсия 1:461 Бромокриптин 1:515-516;
11:424-425,572-573
Бромокриптина мезилат и гиперпролактинемия 1:342
5-Бромурацил II: 300
Бромфен 1:272.
См. также Бромфенирамин Бромфенирамин 1:326,343; II: 257, 272
Бронхиолярная гладкая мускулатура и гистамин 1:322
Бронходилататоры 1:379-398 Букладин-S Софттабс 1:343
Буклизин, препараты 1:343 Бумекс 1:247.
См. также Буметанид
Буметанид 1:304,316 Бупивакаин 1:491 Бупренекс 1:475.
См. также Бупренорфин Бупренорфин 1:560,562,577 Бупропион 1:547-548,552 Буримамид!: 88 Бусерелин И: 99-100,176 БуСпар 1:347.
См. также Буспирон Буспирон 1:335,422-423 Бусульфан II: 424-426 Бутабарбитал, препараты 1:429 Бутазолидин И: 88.
См. также Фенилбутазон Бутамбен, препараты 1:491 Бутезин Пикрат 1:491 Бутнзол 1:429 Бутирилхолинэстераза и ингибиторы холинэстеразы 1:130-131 Бутирофенона производные 1:525-526
Бутоконазол II: 295 Бутоксамин 1:176,186 Буторфанол 1:562,562,577 Буфадиенолиды 1:246-247 Буформин И: 199-200 BCNU 11:423,426-427.
См. также Кармустин
В
Вазоактивные пептиды 1:346-360
Вазоактивный интестинальный
пептид (VIP) 1:107,358 Вазодилататоры 1:197,208-213, 222-241,255
Вазоксил 1:174.
См. также Метоксамин Вазопрессин 1:354-355;
II: 102,107-109
Вазотек 1:220,262.
См. также Эналаприл
Вакцины II: 298,534-535,619-620
Вализон II: 145.
См. также Бетаметазон
Валиум 1:428,442,466,508,417.
См. также Диазепам
Вальпин II: 584.
См. также Анизотропии Ванкомицин II: 224-228,308 Вантин II: 251
Вапорол 1:240.
См. также Амилнитрит Варфарин II: 32-35,42,534-535, 539-540,543
Васкор 1:240,292.
См. также Бепридил Векуроний 1:497,498,503,508 Велбан II: 435.
См. также Винбластин Веллбутрин 1:556.
См. также Бупропион Венлафаксин 1:556 Вентолин 1:396.
См. также Альбутерол Верапамил 1:213,220,232-287,240, 287-288,292
Верапамил II: 631-639 Вератридин 1:484 Вератрума алкалоиды 1:198-199 Версед 1:428,482.
См. также Мидазолам Веснаринон 1:254 Весприн 1:542 Вибрамицин II: 260,393.
См. также Доксициклин Вивактил 1:556.
См. также Протриптилин Вигабатрин 1:453-454 Видарабин II: 299-301,306,338 Видекс II: 306 Винбластин II: 435 Винкристин II: 435,472-473 Винстрол И: 180.
См. также Станозолол Биомицин II: 277-278 Виразол И: 306.
См. также Рибавирин Вискен 1:192,219.
См. также Пиндолол Висмута соединения II: 578,585 Вистарил 1:344,429.
См. также Гидроксизин Витамин DII: 206-207,215-220 Витамин B|2 II: 14-21 Витамин КII: 34,39 Витензин 1:219.
См. также Гуанабенз Внутренний фактор И: 18 Внутривенные анестетики 1:479-482 Вольтарен И: 87.
См. также Диклофенак Воспалительные заболевания II: 582-584
646
Габапентин 1:454-457,466
Гавискон И: 575
Галазон USP II: 321-322
Галанин 1:107
Галдол 1:446. См. также Галоперидол Галдол деканоат 1:542 Галламин 1:494,508 Галлия нитрат II: 213 Галлюциногены 1:587-591 Галог11:565
Галогены, антимикробные эффекты 11:321
Галоперидол 1:526,532-533,542 Галоперидол II: 630,634-635 Галопрогин II: 297,557 Галотан 1:482
Галотестин II: 179 Галофантрин II: 366-368 Гаметоциды II: 366 Гамимун Н II: 306
ГАМК. См. Гамма-аминомасляная кислота
Гамма-аминомасляная кислота (ГАМК) 1:407-410
Гаммаглобулин II: 298 Ганглиоблокирующие средства I: 150-153,202
Ганглионарный никотиновый ацетилхолиновый рецептор 1:493 Ганит II: 222-223..
См. также Галлия нитрат Гантанол II: 289.
См. также Сульфаметоксазол Гантризин II: 289.
См. также Сульфизоксазол Ганцикловир II: 302 Гарамицин II: 269.
См. также Гентамицин Гастринрилизинг-гормон 1:107 Гастрокром 1:319.
См. также Кромолин-натрий Гексаметилентетрамин II: 429 Гексаметоний 1:151 Гексахлорфен USP II: 324-325 Гексахлорфен, препараты II: 325 Гексахлорциклогексан II: 560 Гексилрезорцинол II: 324 Гексэстрол II: 150 Гелонтин Капселе 1:379.
См. также Метсуксимид
Гельминты II: 353-354,364
Гемихолиний и автономная передача 1:118
Гемодиализ (ГД) II: 520-521,525-526
Гемолитическая анемия II: 478-479, 484
Гемонил 1:429,466
Гемостаз II: 26-27
Гемофил М II: 42
Гемфиброзил II: 54
Генерализованные судороги 1:444, 463-464
Генетические заболевания II: 462 Гентамицин И: 260,265-266,554 Генцитабин II: 445-446 Геоциллин II: 250.
См. также Карбенициллин
Гепарин II: 27-31
Гепарин кальций, препараты II: 42
Гепарин натрий, препараты II: 42
Гепатит В И: 298,306,610-611,617-618
Гепатит А, иммунизация II: 617-618 Гепатит ни А, ни В, иммунизация II: 617-618
Гептахлор II: 494
Гербициды II: 496-498
Гереф II: 108-109
Гериатрическая фармакология II: 542-551
Героин 1:574,581
Герпес II: 301-303,559
Гетероциклические антидепрессанты 1:545,547,550
Гетразан 11:416.
См. также Диэтилкарбамазин Гибикленс II: 324-325.
См. также Хлоргексидина глюконат
Гибистат II: 324-325.
См. также Хлоргексидина глюконат
Гивид II: 306
Гигротон 1:247.
См. также Хлорталидон
Гидрокодон 1:575
Гидрокодон/ацетаминофен, препараты Г. 578
Гидрокортизон II: 128-136,564-565,584
Гидроксибензилбензимидазол и РНК-энтеровирусы II: 299-300
15-Гидроксидегидрогеназный путь 1:368
6-Гидроксидофамин и автономная передача 1:118-119
Гидроксизин II: 578
10-Гидроксикарбазепин, структура 1:450
Гидроксикобаламин II: 14 Гидроксимочевина II: 444-445
Гидроксипрогестерона капроат II: 156-157,179,442
Гидроксистильбамидин II: 294 Гидроксихинолины II: 361-363,384 Гидроксихлорохин II: 76-77,368 Гидроксиэстрон, структура II: 158 Гидролиз 1:79
Гидромокс 1:247
Гидроморфон 1:574
Гидропероксиэйкозатетраеновые кислоты 1:361
Гидрофильные коллоиды II: 580
Гидрохинон II: 561
Гидрохлортиазид 1:306-307,316;
11:220-221
Гилорел 1:168.
См. также Гуанадрел Гиосциамин 1:112,958.
См. также Атропин
Гиосцин 1:113.
См. также Скополамин Гипергликемия II: 181-182 Гиперкалиемия 1:304,309 Гиперкальциемия II: 212-214 Гиперкальциурия идиопатическая
11:220-222
Гиперлипидемия II: 44-60 Гиперлипопротеинемия II: 44 Гипернатриемия и осмотические диуретики 1:311
Гиперпаратиреоидизм первичный 11:216
Гиперпигментация II: 561
и терапия эстрогенами II: 154—
155
Гиперреактивность 1:48 Гиперстат IV1:168.
См. также Диазоксид
Гипертензия 1:193-221
Гипертермия, злокачественная I:
478,507-508
Гипертиреоидизм II: 96,122-126 Гипертонический криз 1:181 Гипертриглицеридемия II: 47-50
Гиперурикемия 1:305,307
Гиперфосфатемия И: 215
Гиперхлоремический метаболический ацидоз 1:302,309
Гиперхолестеринемия II: 49-51 Гиперчувствительность 1:48 Гиперчувствительность немедленного типа 1:380
Гипогаммаглобулинемия, иммунизация II: 617-618
Гипогликемические средства И: 194-201,631,639
Гипогликемия II: 193,201,381
Гипогонадизм II: 102,152
Гипокалиемический метаболический алкалоз 1:304-305
Гипокальциемия II: 218
Гипоксантин И: 434
Гипомагниемия и петлевые диуретики 1:305
Гипонатриемия и диуретики 1:307 Гипопаратиреоидизм II: 214-216
Гипореактивность 1:48
Гипоталамические гормоны II: 90-106
Гипоталамус II: 89
Гипотензия и симпатомиметические средства 1:169-170
Гипотиреоидизм II: 97,120-122
Гипофиза гормоны II: 90-109 Гипофосфатемия II: 214-216
Гнпрекс И: 317-318.
См. также Метенамина гиппурат
Гирудин II: 31
Гисманал 1:272.
См. также Астемизол
Гистамин 1:318-323
Гнстрелин II: 99-100
Гнтакерол II: 222-223.
См. также Дигидротахистерол
Гитрин 1:145,168.
См. также Теразозин 1:219 Глаукома!: 133-134,171-172,189, 190
Глибурид И: 199
Гликолитические пути II: 360
Гликолитические ферменты II: 360
Гликопирролат 1:141,147,152,958;
11:584
Глиназа ПресТаб II: 202-203.
См. также Глибурид
Глипизид И: 199
Глицентин II: 202-203
Глицерил-1-монооктаноат II: 582
Глицериновые свечи II: 581
Глицин 1:407-408,416
Глутамат 1:407-408
Глюкагон II: 181-182,202-203
Глюкагон кишечника II: 201-202
Глюкоза и отравление II: 514-515 Глюкокортикоиды II: 61-62,80-81, 128-132,136,213-214,470
Глюкотрол II: 202.
См. также Глипизид Глюкуронидация 1:80 Глютаральдегид, антимикробное действие И: 321
Глютетимид 1:429; II: 521-522,628
Гозерелин II: 100,176,441
Гоматропин 1:146,152 Гонадорелнн II: 99-101 Гонадотропин(ы) II: 101-102 Гонадотропннрилизинг-гормон II:
99-101
Гормон роста II: 93-94
Гормона роста рилизинг-гормон II: 91-92
Гормональная контрацепция II: 160-162
Госерелин II: 99-100,176,442
Госсипол II: 178
Грамицидин II: 553
Грамотрицательные бактерии, эмпирическая антимикробная терапия II: 329-330
Грамположительные бактерии, эмпирическая антимикробная терапия II: 331
Гранизетрон, препараты 1:272
Грибами отравление II: 516 Гризеофульвин II: 293-294,557-558
Грипп А II: 298-299,348
Грипп В и рибавирин II: 299-300
Грипп, иммунизация II: 610-611
Гуанабенц 1:200
Гуанадрел 1:202
Гуанетидин 1:202-204
Гуанидин и РНК-энтеровирусы II: 299-300
Гуанозин и тимидинфосфотрансфераза II: 356
Гуанфацин 1:200
Гуматин И: 269,392-393
Гуматроп II: 108-109
Гуморальный иммунитет II: 465
Гуморсол 1:100
д
Дакарбазин II: 428
Дактиномицин II: 438
Далган 1:475.
См. также Дезоцин
Далман 1:347.
См. также Флуразепам
Даназол II: 41,168-169
Данокрин II: 188.
См. также Даназол
Дантриум 1:417.
См. также Дантролен
Дантролен 1:508
Дапсон II: 279
Дараннд 1:247.
См. также Дихлорфенамид
Дараприм II: 393.
См. также Пириметамин Дарбид 1:112,959.
См. также Изопропамид Дарикон 1:113; II: 585.
См. также Оксифенцнклимин Даунорубицин II: 437-439 Двухосновной дигидрат фосфата кальция, препараты II: 222-223
Деалкилирование, окислительное I: 78
N-деалкилирование 1:78
О-деалкнлирование 1:78
S-деалкилирование 1:78 Дебризохин 1:202
Дегидроподофиллотоксин II: 569 Дегидроэметин II: 383-384 Дегидроэпиандростерон сульфат
(DHEAS) II: 172
Дегидроэрнандростерон (DHEA) II: 128,141,160,172
Дезаминирование 1:78
Дезинфицирующие средства II: 320-326
Дезипрамин 1:85,546,556
Дезирел 1:458.
См. также Тразодон
Дезовен II: 565
Дезоксикортикостерон II: 141
Дезоксикортикостеронаацетат II: 136
Дезоцин 1:576
Декадерм II: 565.
См. также Дексаметазон
Декадрон фосфат II: 145
Декадрон-LA II: 165
Дека-Дураболин II: 179-180.
См. также Нандролона деканоат Декарис II: 417.
См. также Левамизол Декломицин 1:316; II: 258 Декохинат II: 362 Дексаметазон II: 145,564 Декседрин 1:130.
См. также Декстроамфетамин Дексозин 1:130.
См. также Метамфетамин Декстроамфетамин 1:583 Декстрометорфан 1:576 Декстротироксин, лекарственные взаимодействия II: 625 Делалутин II: 178-179.
См. также Гидроксипрогестерона капроат
Делзим 1:476.
См. также Декстрометорфан Дельта-D II: 222-223.
См. также Холекальциферол Демадекс 1:248.
См. также Торсемид Демерол 1:475.
См. также Меперидин Демсер 1:145.
См. также Метирозин Депакен 1:379,446 Депакот 1:379,446 Депен 1:430; 11:87,511.
См. также Пеницилламин Деполяризующие блокирующие средства 1:499-501 Деполяризующие средства 1:493 Депо-Медрол II: 145.
См. также Метилпреднизолон Депо-Эстрадиол ципионат II: 178-179
Депренил 1:430.
См. также Селегилин Дерматологические средства II: 552-571
Дерматофитоз II: 294-296,556 ДесенсИтизация 1:16,39-41 Десланозид, препараты 1:262 Десмопрессин ацетат II: 41 Десмопрессин, препараты II: 108-109 Десферал II: 24,511
Десфлуран, структура 1:469
Дети и лекарственная терапия II: 533-538
Диабет сахарный II: 181-182,191-193
Диабинез II: 203
Диазепам 1:428,460-461,505
Диазоксид 1:212
Диамокс 1:247.
См. также Ацетазоламид ДиапидП: 108-109 Диацетилмоноксим (ДАМ) Диацетилхолин 1:417.
См. также Сукцииилхолин Диацинон II: 496-497 Дибензилин 1:145.
См. также Феноксибензамин Дибензодиазепин 1:526-527,532 Дибензоилметаны II: 561 Дибукаин, препараты 1:491 Дигибайнд 1:262 Дигидроиндолон 1:532 Дигидрокодеин 1:575 Дигидроксифенилаланин, структура 1:511
Дигидропиридины 1:213 Дигидроптероат II: 354 Дигидрострептомицин II: 263-264 Дигидротахистерол II: 207-208 Дигидротестостерон II: 172 Дигидрофолат, генерация II: 18-19 Дигидрофолатредуктаза II: 15 Дигидроэрготамйн 1:341,345 Дигиталис 1:246-252 Дигитоксин 1:247
Дигоксин 1:247
Дигоксиновая иммунная сыворотка, препараты 1:262
Дигоксиновые специфические антитела и отравления II: 524
Дидронел II: 222-223.
См. также Этидронат Диелдрин II: 494 Диенэстрол II: 150,179 Дизипал 1:430.
См. также Орфенадрин Дизопирамид 1:278-279 Диклоксациллин II: 238,250 Диклон 1:491
Диклонин, препараты 1:491 Диклофенак II: 71,87
Дикумарол II: 35 Дилантин 1:379.
См. также Фенитоин Дилоксанида йодохинол II: 374 Дилоксанида фуроат II: 364,385, 392
Дилтиазем 1:213,220
Димелор II: 203.
См. также Ацетогексамид Димеигидринат 1:326,344 Диметилан II: 496 Диметилтубокурарин 1:417.
См. также Метокурин Диметилцистеин II: 87,511.
См. также Пеницилламин
Диметоат II: 496
Динапен II: 256.
См. также Диклоксациллин ДинаСерк 1:168,185.
См. также Исрадипин Динопростон 1:377 Диоксибензол II: 561 Диоктил натрия сульфосукцинат II:
581
Дипентум II: 585.
См. также Олсалазин Дипивефрин 1:172 Дипиридамол, препараты II: 42 Диприван 1:393.
См. также Пропофол
Дипрозон II:
Дипролен II: 565 Дирений 1:248.
См. также Триамтерен Дисалцид II: 87 Дисменорея и эйкозаноиды 1:373 Диссоциативная анестезия 1:481 Дистония 1:509,521 Дисульфирам 1:440-442 Дитропан 1:113.
См. также Оксибутинин Диукардин 1:247 Диуретики 1:197-198,253-254, 294-317
Диурил 1:247.
См. также Хлортиазид Дифенгидрамин 1:325-326 Дифеноксилат 1:575; II: 581 Дифеноксин 1:575 Дифиллин, препараты 1:397 Дифлукан II: 297.
См. также Флуконазол Дифлунизал II: 66 Дихлорацетамиды II: 384 Дихлордифенилтрихлорэтан (ДДТ)
11:494
Дихлорфенамид 1:316 Дицикломин 1:147,152 Диэтиламид лизергиновой кислоты (ЛСД) 1:337,587-591
Диэтилкарбамазин II: 364,417
Диэтилкарбамазин цитрат II: 400-
402
Диэтилстильбэстрол (ДЭС) II: ISO-152, 178-179,442
ДНК-вирусы II: 299-301,419-420
Добутамин 1:167,173,253
Доза
нагрузочная 1:66-67
неэффективная 1:93 поддерживающая 1:65-66 срединная летальная 1:93
Доза-эффект — кривая зависимости 1:45,47
Дозировка и токсичность II: 435
Доксазозин 1:176
Доксакурий 1:508
Доксепин 1:522,556
Доксиламин 1:326
Доксициклин II: 259,368,381,393,
628-630
Доксорубицин II: 437-438
Доксорубицин-блеомицин-винблас-тии-дакарбазин (ABVD) II: 452
Докузат II: 581
Долобид II: 87.
См. также Дифлунизал
Долофин 1:475.
См. также Метадон
Допар 1:430. См. также Леводопа
Допастат!: 202.
См. также Дофамин
Дорал 1:428
Дориден 1:348.
См. также Глютетимид
Дофамин 1:166,510,514,525,527
Дофаминергическая система
и антипсихотические средства 1:527-529
Драмамин 1:272.
См. также Дименгидринат
Древесный уголь, активированный 11:223-225
Дрисдол II: 222.
См. также Эргокальциферол
Дромостанолона пропионат II: 173
Дронабинол II: 578,623
Дулколакс II: 585-586
Дураболин II: 180.
См. также Нандролона феипро-
пионат
Дураквин 1:227,801.
См. также Хинидин
Дуранест 1:402.
См. также Этидокаин Дурисеф II: 251.
См. также Цефадроксил
Е
Е-Мицин II: 317-318.
См. также Эритромицин ЕнамицинП: 269.
См. также Гентамицин
Желудочно-пищеводный рефлюкс 11:572,576
Желудочные антисекреторные средства II: 574-576
Желчные кислоты II: 416
Желчные кислоты, связывающие смолы II: 54-56
3
Загрязнители воздуха II: 490-493 Зантак 1:344; 11:584.
См. также Ранитидин Зароксолин 1:316.
См. также Метолазон Заронтин 1:455-456,466.
См. также Этосуксимид Застойная сердечная недостаточность 1:242-263
Зебета!: 191,219.
См. также Бисопролол
Зектран И: 496
Земурон 1:508.
См. также Рокуроний
Зестрил 1:220,262.
См. также Лизиноприл Зидовудин II: 299,303,306 Зилоприм II: 87-88.
См. также Аллопуринол Злоупотребление ингалянтами I:
594-595
Зоб II: 121-126
Зовиракс II: 306.
См. также Ацикловир
Зокор II: 60.
См. также Симвастатин
Золадекс II: 108-109,180.
См. также Госерелин
Золота натрий тиомалат, препараты 11:88
Золофт 1:556.
См. также Сертралин
Золпидем 1:423,429
Зоман 1:131
Зосин II: 250.
См. также Пиперациллин
Зофраи 1:342.
См. также Ондансетрон
Зофран II: 585.
См. также Ондансетрон
И
Ибопамин 1:166
Ибупрофен II: 70,87
Ивермектин II: 364,402
IgA II: 465
IgD II: 465
IgE II: 465
IgE-вызываемая лекарственная аллергия II: 482
IgE-чувствительные клетки, ответ на аллергены II: 482
IgG II: 465
IgMH:465
Идамицин И: 435-437.
См. также Идарубицин
Идарубицин II: 437
Идиосинкразия лекарственная 1:48
Идроциламид 1:507
Измо 1:240.
См. также Изосорбида мононитрат
Изо-Бид 1:240.
См. также Изосорбида динитрат
Изокарбоксазид 1:552,556
Изолан II: 496
Изониазид II: 271-274,629,631,
636-637
Изоникотиновая кислота II: 481
Изопринозин II: 481
Изопропамид 1:147,153
Изопропанол II: 321
Изопротеренол 1:160,174,396
Изоптин 1:220,240,292.
См. также Верапамил
Изопто Гоматропин 1:152.
См. также Гоматропин
Изопто Карбахол 1:137.'
См. также Карбахол
Изопто Карпин 1:137.
См. также Пилокарпин Изордил 1:240.
См. также Изосорбида динитрат Изосорбида динитрат 1:240 Изосорбида мононитрат 1:240 Изофлуран 1:469,482 Изофлурофат 1:137 Изоэтарин 1:389,396 Изупрел 1:174,396.
См. также Изопротеренол Илозим II: 508
Илозон II: 317-318.
См. также Эритромицин Илотицин II: 317-318.
См. также Эритромицин Имидазолиновый рецептор 1:200 Имипенем II: 249-250,332,339 Имипенем/циластатин, препараты
II: 251-252
Имипрамин 1:278,280,546,548-552 Имитрекс 1:345.
См. также Суматриптан Иммунная инсулиновая резистентность II: 193-195
Иммуноглобулин внутривенный, препараты II: 306
Иммуноглобулины II: 465 Иммунодепрессивные средства II: 75-77,469-479,584
Иммунодепрессия и глюкокортикоиды II: 130-131
Иммунокомпетентность, тесты II: 469 Иммунологические реакции II:
481-485
Иммуномодулирующие средства II: 479-481
Иммунофармакология И: 463-486 Имодиум II: 585.
См. также Лоперамид Импромидин 1:323 Имуран II: 486.
См. также Азатиоприн Инверсии 1:153,219.
См. также Мекамиламин Ингаляционные анестетики 1:470-479 Ингибин II: 160
Ингибиторы синтеза ДНК II: 313 Ингибиторы фибринолиза II: 41 Ингибиторы холинэстеразы 1:133-135
Индапамид 1:306,307,316 Индерал 1:192,219,240,292.
См. также Пропранолол
Индола производные, структура II: 70
Индометацин II: 64,73,87 Индорамин 1:179 ИндоцинП: 87.
См. также Индометацин Инозиплекс II: 471 Инозитол-1,4,5-трифосфат (ИТФ) 1:42-43,122,156,369
Инокор 1:262.
См. также Амринон Инотропные средства и старение II:
548
Инсектициды II: 494-497
Инсулин II: 181-195
Инсулин ленте II: 187-189 Инсулинома, химиотерапия II: 448 Интал 1:396.
См. также Кромолин-натрий Интерлейкины II: 21-22,479-481 Интерферон II: 303-305 Интерферон-а, препараты II: 306 Интерферон-P-lb, препараты II: 486 Интрон-А II: 306 Интропин 1:262.
См. также Дофамин Инфантильные спазмы 1:444 Инфаркт миокарда 1:222-223,259-
261
Ионизация, константы 1:18-19 Иопидин 1:173.
См. также Апраклонидин Йохимбин 1:176,179 Ипекакуаны сироп II: 521 Иподат II: 119
Иподат натрия, препараты II: 127 Ипратропиум 1:141,153,396 Исмалин сульфат 1:219.
См. также Гуанетидин Исрадипин 1:220,240 Итраконазол II: 292,297,558 Ифосфамид II: 424
Ишемическая болезнь сердца I:
141-142
й
Йодид II: 110,119,126-127,534
Йодная настойка, препараты II: 325
Йодоксин II: 393.
См. также Йодохинол Йодо-Ниацин II: 126-127 Йодохинол II: 386
Йопановая кислота II: 119,126-127
К
Кабикиназа II: 42.
См. также Стрептокиназа Калан 1:168,185,227-228.
См. также Верапамил Калиевые каналы 1:292,394 Калийсберегающие диуретики I:
307-310
Калликреин(ы) 1:351-352
Калликреин-кининовая система I: 351-354
Кал-Суп II: 222-223
КальдеКорт II: 145,585.
См. также Гидрокортизон Кальдерол II: 222-223.
См. также Кальцифедиол Кальциджекс II: 222-223.
См. также Кальцитриол Кальций динатрия версенат II: 511 Кальцимар II: 222-223.
См. также Кальцитонин лосося Кальципарин II: 42
Кальцитонин II: 209-210,218-221
Кальцитонин лосося II: 223 Кальцитонин человека, препараты 11:222-223
Кальцитониновый ген-связанный пептид (CGRP, ко-кальцигенин) 1:107,359
Кальцитриол II: 207-208,222-223 Кальцифедиол II: 217,222-223 Кальциферол II: 222-223.
См. также Эргокальциферол Кальция ацетат, препараты И: 222-223
Кальция глюконат II: 222-223 Кальция глюцептат II: 222-223 Кальция карбонат, препараты II:
222-223
Кальция лактат II: 222-223 Кальция цитрат II: 222-223 Камфехлор II: 494
Канамицин II: 261-262,267 Каннабидиол 1:592
Каннабиноиды 1:591-594
Каннабинол 1:592
Кантаридин II: 569 Кантил 1:113; II: 585.
См. также Мепензолат КантрексИ: 269.
См. также Канамицин Канцероген(ы) II: 419-420 Candida albicans II: 419-424,469, 556-557
Каолин II: 581
Каолин/пектин И: 585,632-633, 636-637
КаопектатП: 583.
См. также Каолин/пектин Капастата сульфат II: 281.
См. также Капреомицин Капитрол11:571 Капотен 1:168,203.
См. также Каптоприл 1:220 Капреомицин И: 277-278,281 Каптоприл 1:214-216,220,356 Карафат II: 585.
См. также Сукральфат Карбамазепин 1:449-451,463,466, 540
Карбамазепин II: 628-629 Карбамат, инсектициды II: 496-497 Карбаминовая кислота 1:124 Карбамоил-Р-метилхолин, структура 1:124
Карбамоилхолин, структура 1:124 Карбанилиды И: 324-325 Карбапенемы II: 249-250 Карбарил II: 496
Карбахол 1:124,157,190
Карбахола хлорид, свойства 1:125 Карбенициллин II: 241-243,250 Карбеноксолон II: 543,577 Карбидопа 1:511,522 Карбидопа/леводопа 1:511,522 Карбимазол II: 117-118 Карбиноксамин 1:326,343 Карбоангидразы ингибиторы I: 299-303
Карбоангидразы ингибиторы II: 554 Карбомицин II: 311
Карбонильное восстановление 1:79 Карбоплатин,дозировка и токсичность II: 430
Карбопрост, препараты I: 377
Карделмицин II: 310 Карден 1:168,185.
См. также Никардипин
Кардизем 1:168,185,228.
См. также Дилтиазем
Кардилат 1:184
Кардиогенный шок 1:170,261
Кардиоквин 1:227.
См. также Хинидин Кардионатрин 1:355 Кардиотоксичный агент, отравление, антидоты II: 524
Кардура 1:145,168.
См. также Доксазозин
Кармустин (BCNU) II: 424,426-427
Карпрофен II: 73
Картеолол 1:190-191,207
Картрол 1:145,167.
См. также Картеолол
Карцинома надпочечников II: 447-
448
Каскара II: 580
Касторовое масло II: 566,580
Катапрес 1:168.
См. также Клонидин
Катартикс II: 523
Катехол, структура 1:160 Катехоламины 1:160,166-167
Катехол- О-метилтрансфераза (КОМТ) 1:516
Катинон 1:585
Катионные поверхностно-активные средства, антимикробные эффекты II: 325
Кафергот 1:272-273.
См. также Эрготамин
Квазепам 1:428
Квантовая кривая “Доза-эффект” I: 47
Кварзан 1:152
Квелл II: 494,560
Квестран II: 59-60.
См. также Холестирамин Квинестерол II: 152,179 Кемадрин 1:523.
См. также Проциклидин КенакортП: 145.
См. также Триамцинолон Кератолитические средства И: 567-
571
Керлон 1:191,217.
См. также Бетаксолол
Кеталар 1:481-482.
См. также Кетамин
Кетамин 1:481,588
Кетансерин 1:336
Кетоконазол II: 144,176-178,292-294
Кетопрофен II: 64,71,87
Кеторолак II: 64,71,87
Кетотифен II: 483
Кетракс II: 417.
См. также Левамизол
Кефзол II: 251.
См. также Цефазолин
Кефлекс II: 251.
См. также Цефалексин
Кефлин II: 251.
См. также Цефалотин КефуроксП: 251.
См. также Цефуроксим Кининогены 1:351-352 Кинины 1:351-353; II: 61 Кислотно-пептическая болезнь II:
573-574
Кислоты II: 322
Китрил 1:345.
См. также Гранизетрон Кишечника заболевания, воспалительные, применяемые лекарства 11:582-583
Клавулановая кислота II: 239,249
Кладрибин II: 431-433
Кларитин 1:272.
См. также Лоратидин Кларитромицин И: 278,310-312 Кларка правило II: 398
Клебцил II: 269.
См. также Канамицин Клемастин, препараты 1:344 Клеоцин И: 317-318.
См. также Клиндамицин Клеточной стенки — ингибиторы II: 308-310
Клиндамицин II: 312,317-318,555
Клинорил II: 87.
См. также Сулиндак
Клиренс 1:54-59
Клистин 1:272.
См. также Карбиноксамин
Клобазам 1:460-461
Клодерм II: 565
Клозапин 1:526,527,532,542
Клозарил 1:446.
См. также Клозапин Клоксациллин II: 250 КломидП: 180.
См. также Кломифена цитрат Кломипрамин 1:552,556
Кломифена цитрат II: 168 Клоназепам 1:460,542 Клоиидин 1:199,201-202,219;
11:628-634
Клонопин 1:428,466,542.
См. также Клоназепам Клоразепат 1:428,460 Клоразепат, фармакокинетика 1:416 Клорпактин И: 326
Клотримазол II: 294-296,556 Клотримазол-бетаметазона дипро-
пионата — мазь И: 556
Клофазимии II: 280 Клофибрат II: 55,636-637
Коат II: 42
Когентин 1:430.
См. также Бензтропин Кодеин 1:576-577
Кодеин/аспирин, препараты 1:578 Кодеин/ацетаминофен, препараты 1:578
Кокаин 1:168,585-587
Кокрофта-Гафта формула И: 544 Колаце II: 585-586.
См. также Докузат Колестид II: 59-60.
См. также Колестипол Колестипол II: 55-56 Коли-Мицин М II: 269 Коли-Мицин СII: 269 Колистиметат, препараты II: 270 Колистин, препараты II: 270 Коллоидные соединения висмута II:
576
Колхицин II: 83 Компазин 1:446.
См. также Прохлорперазин Конвертирующий фермент 1:348 Конин-НТИ: 42
Конкурентные антагонисты 1:28-30 Конотоксин и автономная передача 1:118-119
Контрацептивы II: 160-168,178 Концентрация в крови-время, кривая 1:62
Конъюгация 1:77-80
Конъюгированные эстрогены И: 178-179
Коргард 1:145,168,185.
См. также Надолол
Кордарон 1:227.
См. также Амиодарон 292 Кордран II: 565
Кортайд II: 145,585.
См. также Гидрокортизон Кортенема II: 585.
См. также Гидрокортизон Кортеф II: 145,585.
См. также Гидрокортизон Кортизол II: 128-135 Кортикостероиды 1:392-393,396 Кортикостероиды, препараты аэрозольные 1:396
Кортикотропин II: 108-109.
См. также Адренокортикотропин Корти котропинрелизинг-гормон
(CRH)II:97
Кортон ацетат II: 165
Кортросин II: 108-109.
См. также Косинтропин
Коры надпочечников антагонисты И: 142-145
Коры надпочечников гормоны II: 129 Косинтропин II: 98-99
Космеген II: 438.
См. также Дактиномицин Кости минеральный гомеостаз II:
212,221
Котазим II: 580
Котрансмиттеры 1:103,107 Ко-тримоксазол II: 289,392-393.
См. также Триметоприм-сульфа-метоксазол
Коумадин II: 42.
См. также Варфарин
Кофеин 1:385,584; II: 524,539-540 Крезолы II: 567
Криопреципитат II: 40-41 Кристодигин 1:202.
См. также Дигитоксин Кровяные шизонтициды II: 366 Кровяные шизонты II: 336 Кромакалин 1:382-385,396 Кромолин 1:382-385,396 Кромолин-натрий II: 482 Кросс-толерантность 1:572 Кротамитон II: 560
Ксанакс 1:428
Ксенобиотики 1:13,73
Ксилен И: 556
Ксилокаин 1:292,492.
См. также Лидокаин
Ксилометазолин 1:167,174; II: 125, 130,963
Кумариновые антикоагулянты II: 30-32
Куприд 1:430,523; 11:511.
См. также Триентин Купримин 1:430; II: 87-88,511.
См. также Пеницилламин
Кураре 1:493
Кутиват II: 565
Л
Лабеталол 1:176,179,191,207,219 Лазикс 1:316.
См. также Фуросемид ЛазмизилП: 556 Лактулоза II: 580-581,584 Ламотридджин 1:454 Ланакорт II: 145,585.
См. также Гидрокортизон Ланзопразол II: 576 Ланоксикапс 1:262.
См. также Дигоксин Ланоксин 1:262.
См. также Дигоксин Лариам II: 393.
См. также Мефлохин Лародопа 1:522.
См. также Леводопа Леваллорфан, структура 1:561 Левамизол II: 79-81,363-364,404, 417
Леватол!: 192,219.
См. также Пенбутолол Левобунолол 1:192 Леводопа 1:510-514 Лево-Дроморан 1:577.
См. также Леворфанол Левоксин II: 127.
См. также Левотироксин Левометадил ацетат, препараты I: 577
Левонантрадол 1:593 Левопропоксифен 1:576 Леворфанол 1:575,577 Левотироксин II: 115-116,123-124 ЛевотроидП: 127.
См. также Левотироксин Левофед 1:174.
См. также Норадреналин Левсинекс 1:153
Лейкеран II: 76-77,424-426.
См. также Хлорамбуцил Лейкин II: 24.
См. также Сарграмостим
Лейкотриены (ЛТ) 1:366-367,393-394
Л ейцин-эн кефалин 1:563 Лейшманиоз II: 288,387-389
Лекарства-основания 1:18-19 Лекарства-кислоты 1:18-19,328-
330
Лекарственные рецепторы 1:22-25, 27-32
Лептоспироз II: 59-60
Лептофос II: 496
ЛесколИ: 534
Леупролид II: 99-100,176,443
Леустатин II: 433.
См. также Кладрибин
Лецитин II: 381
Либрий I; 428.
См. также Хлордиазепоксид
Лиганд(ы) 1:36-37
Лидокаин 1:282-289,292,485,492
Лизинвазопрессин, дозировка II: 107
Лизиноприл 1:214
Лизодрен II: 145.
См. также Митотан
ЛикваеминП: 42
Лимфоцитарный иммуноглобулин, препараты II: 486
Линдан II: 495,559-560
Линестренол, активность II: 157
Линкозамины II: 312
Линкомицин II: 232,312
Линкоции II: 317-318.
См. также Линкомицин
Лиорезал 1:508.
См. также Баклофен
Лиотиронин II: 115-117
Лиотрикс II: 115-117
Липемия II: 49-50
Липидил II: 59-60.
См. также Фенофибрат
Липоксины 1:361-362
Липооксигеназы 1:366,393-394
Липопротеиды высокой плотности (ЛПВП) 11:44
Липрессин, препараты II: 108
Литий 1:311,536-542; II: 534,539-540,634-635
Лишай II: 567
Лобелии 1:91
Ловастатин II: 56-60
Ловенокс II: 42.
См. также Эноксапарин
Лодин II: 87. См. также Этодолак Лодозин 1:430.
См. также Карбидопа Лозартан 1:280
Лозол 1:247. См. также Индапамид ЛокортенП: 565 Локсапин 1:434,438,446 Локситан 1:446.
См. также Локсапин Ломефлоксацин II: 309-310,313, 317-318,341
ЛомотилП: 585.
См. также Дифеноксилат Ломустин II: 426-429 Лонил-ТП: 572 Лонитен 1:168.
См. также Миноксидил Лоперамид 1:474; II: 581 ЛопидП: 59-60.
См. также Гемфиброзил Лопрессор 1:145,168,185.
См. также Метопролол ЛопроксП: 556 ЛорабидП: 252.
См. также Лоракарбеф Лоразепам 1:337,347,374,379,393 Лоракарбеф II: 247-248 Лоратидин 1:257,272 Лортаб 1:476 Лотензин 1:168.
См. также Беназеприл
Лотризон II: 556
Лотримин II: 292-297,556.
См. также Клотримазол Лотузат 1:347 Лудиомил 1:458.
См. также Мапротилин Лупрон II: 108-109,179.
См. также Леупролид Люголя раствор П: 127,325 Люминал натрия 1:347,379.
См. также Фенобарбитал Лютеинизирующий гормон (ЛГ) II:
101,147
ЛютрепалсП: 108
м
Маалокс II: 573-574
Маалокс ТС II: 573-574
Маган II: 87
Магний 1:195,224-225
Магния гидроксид II: 573-574, 585-586
Магния салицилат, препараты II: 87
Магния сульфат II: 523
Магния хлорид, препараты 1:288, 292
Магния цитрат II: 523
Макроглобулинемия, химиотерапия
II: 447-448
Макролиды II: 231-233,310-312 Максаир 1:396
Максаквин II: 318.
См. также Ломефлоксацин Максимальная эффективность 1:46 Максифлор II: 565 Малаоксон 1:131 Малатион II; 496,560-561 МалбпримП: 393.
См. также Пириметамин/дапсон Малярия II: 348,354,370-371 Манделамин II: 317-318.
См. также Метенамина манделат Мандол II: 251.
См. также Цефамандол Маннитол 1:310-311,316 МАО ингибиторы 1:516,548,555-
556
Мапротилин 1:547-548,552,556 Марезин 1:344.
См. также Циклизин МаринолП: 585.
См. также Дронабинол Марихуана 1:591-594 Маркаин 1:492.
См. также Бупивакаин Марплан 1:556.
См. также Изокарбоксазид МатуланП: 428.
См. также Прокарбазин Мафенид, препараты II: 289 Мафенида ацетат II: 284-285 Мебарал 1:429,442 Мебеквин II: 393.
См. также Йодохинол Мебендазол II: 361-363,404 Мевакор II: 50-60.
См. также Ловастатин
Мегестрол, препараты II: 25 Мегестрола ацетат II: 156-157,442 Медицинская фармакология, определение!: 12
Медроксипрогестерона ацетат II: 156-157,178-179
Мезантоин 1:466, См. также Мефенитоин Мезаламин II: 583 Мезлин И: 250.
См. также Мезлоциллин Мезлоциллин II: 241-243,250,339-341
Мезоридазин 1:533,542 Мекамиламин 1:151 Меклизин 1:326,344 МекломенП: 77 Меклофенамат II: 72 Меклофенамат натрия, препараты
II: 87
Меклофенамовая кислота И: 70 Мексилетин 1:278-279,284,292 Мекситил 1:292.
См. также Мексилетин МектизанП: 417.
См. также Ивермектин Меларсена оксид, механизм действия II: 364
Меларсопрол II: 389 Мелларил 1:542.
См. также Тиоридазин МелфаланИ: 423-426 Менотропины II: 101 Мепакрин, препараты II: 393 Мепензолат 1:153; II: 585 Меперидин 1:562,574-575,577 Мепивакаин 1:492 Мепробамат 1:413,429 Мербромин II: 323-324,326 Мерзол II: 326 Меркаптопурин II: 433-434,472 Мертиолат II: 326 Местинон 1:137.
См. также Пиридостигмин Местные анестетики 1:84,395-402, 414,966
Местранол, структура II: 151 Метадон 1:562,574,577; II: 539-540, 637
Металленэстрил II: 151 Метамуцил II: 585-586 Метамфетамин 1:174,585 Метандрен II: 178.
См. также Метапротеренол Метанол 1:431,440-441 Метантелин 1:147,153 Метапролол, аффинитет к рецептору 1:176,192
Метапротеренол 1:389-390,396;
11:524-525
Метараминол 1:174
Метарбитал, препараты 1:429,466
Метахолин, структура 1:124 Метациклин II: 257
Метдилазин, препараты 1:344
Метенамин II: 321
Метенамина гиппурат II: 317 Метенамина манделат II: 317 Метпамид 1:88
Мети-Дерм II: 145.
См. также Преднизолон Метиклотиазид 1:307,316 Метикортен II: 145.
См. также Преднизолон Метплбензокват II: 361-362 Метилбензол II: 494 Метилдопа 1:200-201, 219 Метиленгликоль 1:431-441 3,4-Метилендиоксиметамфетамин
(MDMA) 1:589
Метилксантины 1:385-388,396-397 4-Метилпиразол 1:431
Метилпреднизолон II: 133,140,145, 565,585
Метилприлон 1:429 Метилтестостерон II: 172-173,179 Метилтиоурацил II: 534
Метилфенидат 1:167,174 Метилхлороформ II: 493 Метилцеллюлоза II: 585-586
Метилэргоновин 1:345 Метилэтилкетон 1:594 а-Метилтирозин 1:118
1 -Метил-4-фенил-1,2,5,6-тетрагид-ропиридин (МРТР) 1:519
Метимазол II: 117-118,120-122 Метипранолол 1:191
Метирапон II: 142-145 Метирозин 1:118,179-182,192
Метисазон II: 305
Метисергид 1:342,345
Метициллин, препараты II: 250 Метогекситал, препараты 1:482 Метоклопрамид II: 577-579,585
Метоксален II: 561
Метоксамин 1:167,174 Метоксиклор II: 494-495 Метоксифенамина гидрохлорид II: 589
Метоксифлюран 1:469,471,482 Метоксиэстрон II: 158
Метокурин 1:498,503,508
Метолазон 1:306,316
Метомил II: 496
Метопирон II: 145.
См. также Метирапон Метопролол 1:183,186,192,207,219 Метотрексат II: 75-77,431,472-473 Метрифонат II: 364,406,417 Метродин II: 108-109.
См. также Урофоллитропин Метронидазол II: 339-341,371-374, 534,555,625,635
Метскополамин 1:153 Метсуксимид 1:456,466 Метубина йодид 1:507.
См. также Метокурин Метформин II: 199 Метэргин 1:345 Метэстрол II: 150 Мефенамовая кислота II: 72,87 Мефенитоин 1:448-449 Мефентермин, препараты 1:174 Мефитон II: 42.
См. также Фитонадион Мефлохин II: 374-377 Мефобарбитал 1:429,466 Мефоксин, 691.
См. также Цефокситин Мехлорэтамин II: 76-77,424-426 Миакальцин II: 222-223.
См. также Кальцитонин лосося Мивакрон 1:508.
См. также Мивакурий Мивакурий 1:496,498,503,508 Мигрень 1:340-342 Мидазолам 1:428,469,482 Мидамор 1:316.
См. также Амилорид Мидриаз 1:143 Мидриацил 1:153.
См. также Тропикамид Мизолин 1:467.
См. также Примидон Мизопростол 1:377; II: 577,585 Мизоридин 11:471-472 Миидил 1:344
Миконазол II: 292-293,297,556,625 Миконазола нитрат II: 582
Микатин II: 297.
См. также Миканазол, Миканазо-ла нитрат
Микобутин II: 281.
См. также Рифабутин Микофенолат (RS-61443) 11:472
Микрокс 1:316.
См. также Метолазон Микроназа И: 203.
См. также Глибурид
Микронор II: 179.
См. также Норэтинодрон Миланта-И II: 573 Милбемицины II: 363-364 Милонтин 1:466.
См. также Фенсукцимид Милринон 1:252,262 Милтаут 1:429.
См. также Мепробамат Минералокортикоиды II: 133-134, 140-145
Минеральное масло II: 581,585-586 Мини-Гамулин Rh И: 486.
См. также Иммуноглобулин Минипресс 1:191, 219.
См. также Празозин
Минитран 1:240.
См. также Нитроглицерин Миноксидил 1:210-211,220 Миноциклин II: 257,259,338 Миноцин II: 259.
См. также Миноциклин Миоклонические судороги 1:462 Миокризин II: 87
Миостат 1:137. См. также Карбахол Миохол 1:137.
См. также Ацетилхолин Мипироцин И: 554 Мипроевая кислота 1:467,541-542 Мителаза 1:137.
См. также Амбеноний Митоксантрон II: 444-445 Митомицин II: 436,438-439 Митотан II: 142,145,444-445 Митрамицин II: 210,213,222-223 Миграции II: 222-223.
См. также Пликамицин Митролан II: 585-586 Мицелекс II: 292-297.
См. также Клотримазол Мобан 1:542. См. также Молиндон Мобидин II: 87 Модрастан II: 145 Моклобемид 1:548 Моксалактам II: 244,247 Моктанин И: 586.
См. также Моноктаноин Молиндон 1:526,532-533,542 Мометазона флюорат II: 565
Монистат II: 269-277.
См. также Миконазол Монобензон И: 561 Моноклат II: 42 Моноктаноин II: 582,586 Моноприл 1:220.
См. также Фозиноприл Моноцид II: 251.
См. также Цефоницид Мороицизин 1:278-279,285,292 Морфин 1:559-577 Морфинаны 1:561,575 Мотофен II: 585.
См. также Дифеноксин
Мотрин II: 87.
См. также Ибупрофен Мофлохин II: 374-377 Мукомист II: 524 Мулеран II: 573.
См. также Бусульфан Мурамила дипептид II: 481 Муромонаб-СИЗ II: 476 Мускарин Г. 121
Мускариновых рецепторов блокаторы 1:139-152,391-392
Мустарген II: 76-77,423-426.
См. также Мехлорэтамин Мусцимол 1:521 Мыла II: 323
Мышьяк И: 508-509
н
Набуметон II: 64,70,72
Наван 1:542. См. также Тиотиксен Нагрузочная доза 1:43-44 Надолол 1:183-184,186,192,207, 219,241
Назалкром 1:396.
См. также Кромолин-натрий Налбуфин 1:560,562,575,578 Налидиксовая кислота II: 313-314, 316-318
Наллпен II: 250.
См. также Нафциллин Налоксон 1:560,562 Налорфин 1:560,575 Налтрексон 1:560,575,582 Нандролона деканоат II: 174,180 Нандролона фенпропионат II: 174, 180
Напроксен II: 71,87
Напроксен натрия II: 87
Напросин II: 87.
См. также Напроксен
Нардил 1:556. См. также Фенелзин Наркотиками отравление II: 524-525
Наркотические аналгетики II: 636-637
Натамицин II: 297
Натрий-кальций обменник 1:243-244
Натрия бикарбонат II: 524-525 Натрия вальпроат 1:446,456-459, 463
Натрия нитропруссид 1:211-212
Натрия ораграфин II: 127
Натрия перборат II: 321
Натрия салицилат II: 86-87
Натрия стибоглюконат II: 388
Натрия сульфат II: 523
Натрия тиосалицилат И: 86-87 Натрия фторид II: 222-223 Натрия хлорид II: 321 Натуретин 1:316.
См. также Бендрофторметиазид Нафазолин 1:174 Нафарелин И: 99-100,109,176-177 Нафлон II: 87.
См. также Фенопрофен Нафтален II: 566 Нафтилуксусная кислота II: 70 Нафтин II: 296,556 Нафтифин II: 296,556 Нафцил II: 250.
См. также Нафциллин Нафциллин II: 250,332,339-341, 348-349
Неадренергические, нехолинергические нейроны 1:112
Небнин II: 269.
См. также Тобрамицин Неграм II: 317-318.
См. также Налидиксовая кислота Недеполяризующие блокаторы I: 494-499,500-502
Недокромил 1:382-385,394-395,396 Незакаин 1:491
Нейролептики 1:524
Нейролептический злокачественный синдром 1:535
Нейролептаналгезия 1:480 Нейронтин 1:466.
См. также Габапентин
Нейропептид Y1:359-360 Нейротензин 1:359 Нейтра-Фос II: 222-223.
См. также Фосфат Нембутал 1:429,466.
См. также Пентобарбитал Необратимые антагонисты 1:28-30 Нео-Глюкагон II: 222-223 Неомицин II: 56,59-60,267-269, 554
Неосар II: 486.
См. также Циклофосфамид Нео-Синефрин 1:174.
См. также Оксиметазолин,
Фенилэфрин, Ксилометазолин Неостигмин 1:119,130-131,137 Нервно-мышечная блокада 1:493-505
Нернста уравнение 1:266
Нестероидные противовоспалительные средства (НПВС) II: 61-69, 83-88,625-637
Нетилмицин II: 261-262,269,341 Нетромицин II: 269.
См. также Нетилмицин Неупоген II: 24.
См. также Филграстим Нефролитиаз 1:315 Ниацин II: 52-53,60 Низатидин 1:329,344 Низолдипин 1:233-236 НизораП: 145,297.
См. также Кетоконазол Никардипин 1:213,220,233,236, 240
Никлозамид II: 364,407 Никотин 1:136,584-585 Никотиновый рецептор 1:36,498-499
Нимодипин 1:233-236,240 Ниморазол 1:387 Нимотоп 1:240.
См. также Нимодипин Ниридазол 1:364 Нистатин II: 295,557,589 Нитразепам 1:412,416,460 Нитраты 1:224-231,240 Нитрендипин 1:233-236 Нитриты 1:224-231 Нитро-Бид IY1:240.
См. также Нитроглицерин Нитрогард 1:240.
См. также Нитроглицерин
Нитроглицерин 1:224-231,240 Нитро-Дур 1:240.
См. также Нитроглицерин Нитрозомочевина II: 427 Нитроимидазолы II: 384,387 Нитрол 1:240.
См. также Нитроглицерин Нитронг 1:240.
См. также Нитроглицерин Нитропруссид 1:220 Нитрофуразон II: 325 Нитрофурантоин II: 315-318 Нитрофураны II: 325 Нифедипин 1:213,220,233-236,240 Нифуртимокс II: 355,389-390 Новобиоцин II: 310,319 Новокаин 1:492.
См. также Прокаин Ноктек 1:429.
См. также Хлоралгидрат Нолахист 1:344.
См. также Фениндамин Нолвадекс II: 180.
См. также Тамоксифен Нолудар 1:429 Норадреналин 1:106-107,118,160, 166,174,177,407,409
Норваск 1:213,220
См. также Амлодипин Норгестрел II: 156-157,178-179 Норлутат II: 179.
См. также Норэтиндрон Норлутин II: 179.
См. также Норэтиндрон Нормодин 1:191,219.
См. также Лабеталол Нороксин II: 319.
См. также Норфлоксацин Норпейс 1:292.
См. также Дизопирамид Норплйнт II: 179 Норпрамин 1:556.
См. также Дезипрамин Нортриптилин 1:546,548,556 Норфлоксацин II: 309,313-314,319 Норэтиндрон II: 156-157,178-179 Норэтинодрел II: 156-157 Нубаин 1:578. См. также Налбуфин Нуморфан 1:578.
См. также Оксиморфон Нуперкаинал 1:491 Нуромакс 1:508.
См. также Доксакурий
О
Объем распределения 1:54 Оврет II: 178-179.
См. также Норгестрел Ограниченное связывание с белками и концентрация лекарства 1:69 Озон II: 492 Окисление 1:78 Оксазолидиндионы 1:459-460 Оксазепам 1:412,416,428 Оксамнихин II: 364,408 Оксандролон II: 173,180 Оксантел памоат II: 364,408 Оксапрозин II: 34,71-72 Оксациллин II: 238,250,339-341 Оксибутинин 1:153 Оксикодон 1:560,562,579,581 Оксиконазол II: 295-296,556 Оксилон II: 565 Оксиметазолин 1:174; II: 589 Оксиметолон II: 173,180 Оксиморфон 1:560,562,579 Оксимы 1:149 Оксистат II: 295-296,556 Окситетрациклин II: 255-256 Окситоцин II: 102-109 Оксифенциклимин 1:153 Окскарбазепин 1:450 Оксотреморин 1:125 Окстрифиллин 1:397 Октреотид II: 92-93,109,442 Окупресс 1:191,219.
См. также Картеолол Окуфен II: 88.
См. также Флубипрофен Олеандомицин II: 310 Олсалазин II: 583,585 Омепразол II: 583,585 Омнипен II: 250.
См. также Ампициллин Ондансетрон 1:336,345; И: 578,585 Онковин II: 435,472-473 Опиаты 1:558 Опиоиды 1:558-578 Оптимин 1:343 Оптипранолол 1:191.
См. также Метипранолол Оральные гипогликемические средства II: 194-202
Оральные контрацептивы II: 160-162,178
Орал 1:542.
См. также Пимозид Органические нитриты 1:595 Ориназе II: 203.
См. также Толбутамид
Орлаам 1:577
Орнидазол И: 387
Орто-Динэстрол II: 178-179.
См. также Дненэстрол
Орудие II: 87.
См. также Кетопрофен Орфенадрин 1:518,522 Осмитрол 1:316
См. также Маннитол Осмотические диуретики 1:310-311 Острый лейкоз II: 450-451 Острый лимфобластный лейкоз
(ALL) II: 450
Отравление золотом, антидот II: 524-525
Отравление холинергическими средствами 1:148-149
Отравления II: 203,492-498,524-525
Отравления цианидами II: 524-525
Отравления, лечение II: 527 Отривин 1:174.
См. также Ксилометазолин ОТС-препараты (безрецептурные) 11:587-596
Оубаин 1:247-249
Офлоксацин II: 309,313-314,319
п
Павулон 1:508.
См. также Панкуроний Паклитаксел II: 437 Паксил 1:556.
См. также Пароксетин Паксипам 1:428 Палудрин II: 393.
См. также Прогуанил Памелор 1:556.
См. также Нортриптилин Памидронат II: 209-210,213,221— 223
Памин 1:153.
См. также Метскополамин Панадол II: 88.
См. также Ацетаминофен Панкреаза II: 580 Панкреатин II: 580
Панкуроний 1:495,498,508
Папаверин II: 634-635
Парадион 1:466
Паракват II: 497-498
Паральдегид 1:429
Параметадион 1:466
Параметазон II: 133
Параоксон 1:131
Параплатин II: 429-430
Паратион 1:131
Паратиреоидный гормон II: 204-208
Паргилин 1:205
Парлодел 1:522.
См. также Бромокриптин
Парнат 1:556.
См. также Транилципромин Пароксетин 1:547,548,552,556 Парциальные агонисты 1:30-32 Патилон II: 585
Пеганон 1:379. См. также Этотоин
Педиатрические дозировки II: 537-
538
Педикулициды II: 592-594
Пектин II: 581
Пеламин 1:344
Пелтатин II: 569-570
Пемолин 1:167
Пенбутолол 1:184,186,192,219
Пенетрекс II: 317-318.
См. также Эноксацин
Пеницилламин 1:522-523; II: 78-79, 87,134-135,502,632-633
Пенициллины II: 224-231,236-243, 250-251,484-485,539-540,636-637
Пентазоцин 1:576,578
Пентаэритрола тетранитрат 1:231,
240
Пентобарбитал 1:413,429,466
Пентоксифиллин 1:397
Пентостам II: 393
Пентотал 1:482.
См. также Тиопентал
Пентракс II: 571
Пентран 1:482.
См. также Метоксифлюран Пептидогликан II: 224-231 Пепто-Бисмол II: 585.
См. также Висмута соединения Перголид 1:516,523
Пергонал II: 108-109.
См. также Менотропины * Переносчики глюкозы II: 185-186
Периактин 1:344.
См. также Ципрогептадин Периндоприл 1:220 Период полувыведения 1:59-60 Перитрат 1:240.
См. также Пентаэритрола тетранитрат
Перкодан 1:578
Перкоцент 1:578
Пермакс 1:516,523
См. также Перголид
Пермапен II: 250
Перметил 1:542.
См. также Флуфеназин Перметрин II: 561 Пертофран 1:556.
См. также Дезипрамин Перфеназин 1:526,533,542 Перхлорат II: 117-119 Перхлорэтилен II: 493 Петлевые диуретики 1:237-239,244 Петля Генле 1:232-233 Пефлоксацин II: 313-314 Пикамицин II: 210,213,221-223, 437,439
Пикротоксин II: 364 Пилокарпин 1:131,190 Пимозид 1:526,542 Пиндолол 1:176,183,192 Пипекуроний 1:497,498,503,508 Пиперазин II: 364,409 Пиперацетазин 1:533 Пиперациллин II: 241-243,250, 339-341
Пипрацил II: 250.
См. также Пиперациллин Пиразинамид II: 275,281 Пирамат II: 496 Пирантела памоат II: 364,413,589 Пирбутерол 1:396 Пирензепин 1:141-142 Пиретрум II: 496-497
Пиридоксин II: 272-273,636-637 Пиридостигмин 1:131,137 Пириламин 1:326,344 Пириметамин II: 232-233,286-287, 367,377,393
Пироксикам II: 64,70,72,88 Пиролан II: 496
Питоцин II: 108-109.
См. также Окситоцин Питрессин II: 108-109.
См. также Вазопрессин
Плазма. Связывание лекарств 1:69 Плазмин II: 36
Плаквенил II: 88.
См. также Гидроксихлорохин Платинол 11:429.
См. также Цисплатин Плацебо-реакция 1:95 Плацентарный метаболизм лекарств II: 530-531
Плацидил 1:429.
См. также Этхлорвинол Плендил 1:220,240.
См. также Фелодипин Пликамицин II: 210-213,221-223 Повидон-иодин II: 321-322,326 Поддерживающая доза 1:65-66 Подофиксол II: 569 Подофиллотоксин II: 431-432,569 Поламин 1:344 Полиены II: 228 Поликарбофил II: 580-585 Полимиксины II: 228-230,268-270, 554
Политиазид 1:307,316 Полициллин II: 250.
См. также Ампициллин Полиэтиленгликоль II: 585-586 Понстел II: 87.
См. также Мефенамовая кислота Понтокаин 1:492.
См. также Тетракаин Постнагрузка 1:245 Постуральный барорефлекс 1:194-195
Потенциалы действия 1:268-270, 285-286
Правастатин II: 56,59-60 Правахол II: 59-60.
См. также Правастатин Празепам 1:425,428 Празиквантел II: 363-364,410-413 Празозин 1:175-176,179,191,219 Праке 1:492
Пралидоксим (РАМ) 1:148-149,153 Прамоксин 1:492
Прегнандиол II: 158-159 Прегнил II: 88.
См. также Хорионический гонадотропин человека Преднизолон II: 133,144,566 Преднизон II: 539-540,584 Предсердные аритмии и дигиталис 1:255-258
пароксизмальная тахикардия и симпатомиметические средства 1:169-173 Предсердный натрийуретический
пептид (ANP) 1:355-357
Предсердный натрийуретический фактор (ANF) и трансмембранные ферменты 1:35-37
Прелон II: 144.
См. также Преднизолон Прелудин 1:174.
См. также Фенметразин Премарин II: 178-179 Пренальтерол 1:168 Прецеф II: 251.
См. также Цефоранид
Привин 1:174
Прилокаин 1:485,492
Прилосек II: 585.
См. также Омепразол Примаксин II: 252
Примахин II: 367-369,374-377,393 Примидон 1:452-453,467
Принивил 1:262.
См. также Лизиноприл Приобретенного иммунодефицита синдром (СПИД) II: 289,302-303,468
Приобретенного фактора VIII ингибиторы II: 478-479
Приодерм. См. Малатион Присколин 1:191.
См. также Толазолин Про-Бантин 1:153.
См. также Пропантелин Пробантин II: 585.
См. также Пропантелин Пробенецид II: 88,636-637 Пробукол II: 83 Провентил 1:396.
См. также Альбутерол Провера II: 178-179.
См. также Медроксипрогестерона ацетат
Прогабид 1:507
Прогестерон II: 156-160,167-170, 178-179
Прогестины II: 156-160,167-170, 178-179,442
Прогуанил II: 367,369,377-378 Прозак 1:556.
См. также Флюоксетин Проинсулин II: 182,190-191
Проказа II: 271,279-281
Прокаин 1:485,492
Прокаинамид 1:277-279,292
Прокарбазин II: 428-429 Прокардиа 1:240.
См. также Нифедипин Проликсин 1:542.
См. также Флуфеназин Пролоприм II: 298.
См. также Триметоприм
Промазин 1:542
Прометазин 1:325,344
Промышленные растворители 1:594
Пронестил 1:292.
См. также Прокаинамид
Пронтозил II: 282
Пропантелин 1:141,147,153
Пропафенон 1:277-279,292 Пропиленгликоль II: 321,568 Пропилтиоурацил II: 117-118,121-
124,127,534-535
Проплекс II: 42
Пропоксифен 1:560,562,575,578
Пропоксур II: 496
Пропофол 1:469,480-482
Пропранолол 1:118,176,183-186, 192,206-207,219,240,278-279, 292,342
Пропранолол II: 119-121,123-124
Пропульсид П: 585.
См. также Цизаприд
Проскар II: 180.
См. также Финастерид
ПроСом 1:428
Простагландины 1:361-378
Простафлин II: 250.
См. также Оксациллин Простациклин 1:364-367 Простигмин 1:137.
См. также Неостигмин
Простин 1:377
Противогрибковые средства II: 290-297,556-588
Противокашлевые средства 1:576
Противоспалительные средства II: 549,564-567
Противоэпилептические средства I: 443-467
Протирелин II: 108-109.
См. также Тиреотропинрилизинг-гормон
Протонам 1:153.
См. также Пралидоксим
Протопин II: 108-109.
См. также Соматрем Протриптилин 1:546,548,556 Прохлорперазин 1:542; II: 578,585 Проциклидин 1:523 Псевдоэфедрин 1:174 Псилоцибин 1:588-589 Психическая зависимость 1:421, 531,572-571
Псоралены II: 561
Пуринетол II: 433-434,472-473.
См. также Меркаптопурин Пуромицин II: 305
Р
Радиоактивный йод И: 119,123-
124,163
Развитие человека, критические периоды II: 532
Раздражающие слабительные II:
580
Рак эндометрия II:, 613-614,845 р-Амииобензойная кислота
(ПАБК) II: 282-283,561
Рамиприл 1:214,220
Ранитидин 1:344
Рапамицин II: 472
Растворители II: 490,492-495
Растительные инсектициды II: 496
Раувольсцин 1:176
Рафоксанид II: 364
Реактиваторы холинэстеразы I:
148-149
Ребенок и лекарственная терапия II: 533-538
Регитии!: 191.Си.тпосеФентоламин
Реглан II: 585.
См. также Метоклопрамид Резерпин 1:204-205,219,519 Резорцинол II: 323
Резохин II: 392. См. также Хлорохин
Релаксин II: 160
Ремантадин II: 298-299,306
Ремоксиприд 1:526
Ренез 1:316. См. также Политиазид
Ренин 1:213,346-351
Ренин-ангиотензиновая система I:
346-351
Реноквид II: 289.
См. также Сульфацитии
Ресторил 1:428. См. такжеУеллазеагм
Ретин-А II: 562.
См. также Ретиноевая кислота Ретиноевая кислота II: 445,562 Ретровир II: 303,306.
См. также Зидовудин Рецепторы 1:22-23.
См. также Лекарственные рецепторы
а-Рецептор(ы) 1:154-156 Рибавирин II: 300,306 Ридаура II: 87-88.
См. также Ауранофин Римактан II: 280.
См. также Рифампин
Риопан II: 573
Риспердал 1:542
Риталин-SR 1:174.
См. также Метилфенидат Ритансерин 1:336 Ритмол 1:292.
См. также Пропафенон Ритодрин 1:167,172 Рифабутин II: 280 Рифадин И: 280.
См. также Рифампин Рифампин II: 232-233,274,280, 299-306,628-639
Рициноловая кислота II: 580 Робинул 1:152.
См. также Гликопирролат Роваза II: 585.
См. также Мезаламин Рокалтрол II: 222-223.
См. также Кальцитриол Рокуроний 1:497-498,503,508 Ромазикон 1:428.
См. также Флумазенил Рондомицин II: 259.
См. также Метациклин Ротенон II: 496-497 Роферон-А II: 306 Роцефин II: 251-252.
См. также Цефтриаксон Ртути дихлорид NF II: 323 Ртуть II: 509-511
С
Сальбутамол (альбутерол) 1:389
Салициазосульфапиридин II: 284-
285
Салициланилиды II: 324-325
Салицилаты II: 61-69,86-88,535-536,543-583,636-639
Салицилизм II: 67-68,568 Салициловая кислота II: 64,321 Салицин II: 84
Салурон 1:316
Сальметерол 1:396
Сальсалат II: 87
Сандостатин II: 108-109.
См. также Октреотид Сансерт 1:345.
См. также Метисергид Саралазин 1:213-214 Сарграмостим II: 25 Свинец II: 504-507
Связывание, лекарство-рецептор 1:14 Севофлуран 1:469 Седативно-снотворные средства I:
411-430,582-584
Секальцифедиол II: 207 Секобарбитал 1:413,429
Секонал 1:429.
См. также Секобарбитал Секондизол II: 387
Сектрал 1:197,219,292.
См. также Ацебутолол Селдан 1:344.
См. также Терфенадин Селегилин 1:511,516,523 Селективные ингибиторы обратного захвата серотонина 1:544-556
Селсан II: 571
Семустин II: 294,296-299 Сенильная церебральная недостаточность и алкалоиды спорыньи I: 343
Сенна II: 580,586
Сенокот II: 586. См. также Сенна Сенсоркаин 1:492.
См. также Бупивакаин Септизол II: 326
Септра II: 289.
См. также Триметоприм-сульфа-метоксазол
Сера II: 560
Сераке 1:428. См. также Оксазепам Сердечная мышца и блокаторы кальциевых каналов 1:232
Сердечно-сосудистые заболевания и оральные контрацептивы II: 166
Сердечно-сосудистые средства и старение И: 548
Сердечные аритмии 1:188,264
Сердечные гликозиды 1:242-263 Сердца остановка и симпатомиметические средства 1:128
Сердце
блокада и симпатомиметические средства 1:128
замена клапана
и антипсихотические средства I: 440
и гистамин 1:253
и литий 1:445
и метопролол 1:183
и острое потребление алкоголя 1:352
и сердечные гликозиды 1:192-195 и симпатомиметики 1:122
и холиномиметики 1:99
недостаточность.
См. также Застойная сердечная недостаточность однонаправленный блок и re-entry 1:212
острая, лечение 1:200-202 хроническая, лечение 1:199-200 частота 1:191
Серебро II: 284-285,289,323-326 Серентил 1:542.
См. также Мезоридазин Серотонин 1:332-336,406,409-410 Серофен II: 180.
См. также Кломифена цитрат Серпазил 1:219, См. также Резерпин Сертралин 1:547-548,552,556 Серутан II: 585-586 Серы диоксид II: 491 Сильваден II: 289.
См. также Сульфадиазин Симвастатин II: 56,60 Симетикон II: 573 Симметрел 1:522.
См. также Амантадин Симпатомиметики 1:154-174,388-391 Симпатомиметические средства, анафилаксия 1:171
Синарел II: 108-109.
См. также Нафарелин
Синдром отмены, вызванный антагонистом опиатов 1:572
Синекван 1:556.
См. также Доксепин Синемет 1:430.
См. также Карбидопа/леводопа I: 522
Синтопинон II: 108-109.
См. также Окситоцин Синтроид II: 126-127.
См. также Левотироксин Сисомицин II: 261 Ситналар II: 565 Скабен II: 559-560.
См. также Линдан Скополамин 1:140-146,153 Слабительные при обеззараживании II: 523
Слабительные средства II: 580-581, 585-586
Слабительные, увеличивающие объем стула II: 580-581
Сложные парциальные судороги I: 461-462
Сло-Фнллин 1:397.
См. также Теофиллин Смола, связанная с гемфиброзил/ желчной кислотой II: 58 Снотворные 1:333.
См. также Седативно-снотворные средства 1:411 -430 Сократимость сердца, контроль I:
242-244
Соли золота II: 76-78 Соматостатин II: 92-93 Соматрем II: 93,96 Сорбитол II: 523 Сорбитрат 1:240.
См. также Изосорбида динитрат Соталол 1:192,278-279,292 Спазмолитики 1:493,505-508 Спарин 1:542. См. также Промазин Спектазол II: 295-296,556 Спектиномицин II: 268-269 Спирамицин II: 310-311 Спиронолактон 1:307-308,316 Спирты 1:350-359.
См. также Этанол 1:431-442 Споронакс II: 297.
См. также Итраконазол Споронтиццдные средства II: 368 Средняя летальная доза 1:93 Средняя токсическая доза 1:46 Средняя эффективная доза 1:46 Ставудин II: 304 Стадол 1:577.
См. также Буторфанол Станозолол И: 173-174,180 Стелазин 1:542.
См. также Трифлуоперазин
Стенокардия (грудная жаба) 1:222 Стенокардия напряжения 1:237-240
Стереоизомеризм 1:14 Стероидные нервно-мышечные блокаторы 1:497,498,503
Стибоглюконат И: 393
Стрептаза II: 42.
См. также Стрептокиназа Стрептокиназа И: 24-25,36,42 Стрептомицин II: 261-270 CNP, структура 1:356 Сублимаз 1:577.
См. также Фентанил Субстанция Р1:107,358-359 Судафед II: 589 Судороги 1:420,444-466,505 Сукральфат II: 576,585,639 Сукцинилхолин 1:495,498,503,508 Сулиндак II: 64,72,87-88 Сулисобензон II: 561 Сульбактам II: 249 Сульконазол II: 295-296,556 Сульфадиазин II: 283-285,288-289 Сульфадоксин II: 284-285,288-289 Сульфаметоксазол II: 248-285,288-289,332,338-341
Сульфаметиозол И: 284-285,288-289
Сульфамилон II: 288-289.
См. также Мафенид Сульфаниламид 1:301; II: 282-285 Сульфапиридин II: 288-289 Сульфасалазин II: 79,87-88,288-289,585,632-633
Сульфацитин II: 283-285,288-289 Сульфизоксазол II: 282-284,289 Сульфинпиразон II: 87-88,625,639 Сульфонилмочевина II: 195-199 Сульфоны II: 280,354,379 Суматриптан 1:335,345 Супразин 1:542.
См. также Трифлуоперазин Сурамин II: 389-390,414,445-446 Суритал 1:482 Сурмонтил 1:556.
См. также Тримипрамин Сурьмы соединения II: 399 Суфента 1:578.
См. также Суфентанил Суфентанил 1:562,578
т
Тагамет 1:344; II: 584.
См. также Циметидин Тазидим II: 250.
См. также Цефтазидим
Такарил 1:344
Такрин II: 547 Таксол II: 424.
См. также Паклитаксел Талбутал 1:429 Талвин 1:578.
См. также Пентазоцин Талидомид П: 530-531,534-535 Тамбокор 1:292.
См. также Флекаинид Тамоксифен II: 167-168,441 Тарактан 1:542 Тегопен II: 250.
См. также Клоксациллин Тегретол 1:466,542.
См. также Карбамазепин Телдрин 1:344.
См. также Хлорфенирамин Телепак II: 125-127 Темазепам 1:416,429 Темарил 1:344 Темоват II: 565
Тенекс 1:219. См. также Гуанфацин Тензилон 1:137
Тенормин 1:191,219,240.
См. также Атенолол Теобромин 1:385,397 Тео-Дур 1:319.
См. также Теофиллин Теофиллин 1:385,397; II: 483,535-
536,539-540,543,628-640 Теразозин 1:176,179,191 Терапевтический индекс 1:47 Тербуталин 1:172,389,396 Терконазол II: 295-297 Террамицин II: 260.
См. также Окситетрациклин Терфенадин II: 558 Теслак II: 180
Тестекс II: 180.
См. также Тестостерон Тестолактон II: 180
Тестостерон II: 160-162,172-175 Тетрагидрозолин 1:174 Тетрагидроканнабинол 1:592 Тетракаин 1:485,492
Тетрациклин II: 229,255-257,555 Тетраэтиламмоний 1:151 Тетраэтилтиурам 1:442.
См. также Дисульфирам Тетродотоксин 1:118,486 Тиабендазол II: 415
Тиазидные диуретики 1:305-307 Тиамилал 1:482
Тиамин Г. 442
Тигазон II: 445,463
Тизин 1:174
Тикар II: 250.
См. также Тикарциллин Тикарциллин II: 238,241-243,250 Тиклид II: 42.
См. также Тиклопидин Тиклопидин II: 42
Тиленол II: 87-88.
См. также Ацетаминофен Тиментин II: 250-251
Тимозин И: 479
Тимол II: 323
Тимолол 1:183-184,186,190,192
Тимопентин II: 479
Тинактин II: 195-236,556-557
Тиндал 1:542
Тинидазол II: 387
Тиоамиды II: 117
Тиоконазол II: 297
Тиопентал 1:479,482
Тиоридазин 1:526,528,539,542
Тиосемикарбазоны II: 305 Тиотиксен 1:526,528,539,542
Тиоцианат II: 117-119
Тирамин 1:118,168-169
Тирар II: 126-127
Тиреоидные гормоны II: 110-117, 120-127
Тиреотропинрилизинг-гормон И: 95-96
Тирозинкиназы 1:35-36
Тироксин II: 127 Тиролар II: 127.
См. также Лиотрикс
Тканевые шизоитициды II: 366 Тобрамицин II: 261-262,265,269, 334,338-341
Токаинид 1:278-279,284,292
Токсафены II: 494-495
Толазамид II: 197-198
Толазолин 1:175-176,191 Толбутамид II: 196-198,203,539-540
Толектин II: 87-88.
См. также Толметин Толерантность 1:48,579 Толиназа II: 203.
См. также Толазамид
Толметик II: 72
Толметин II: 64,70,87-88 Толнафтат II: 296,556-557 Толуол II: 494-495,567 Тонокард 1:292. См. также Токаинид Торадол II: 87. См. также Кеторолак Торазин 1:541.
См. также Хлорпромазин Торналат 1:396.
См. также Битолтерол Торсемид 1:304,317 Тофранил 1:556.
См. также Имипрамин Тразодон 1:547-548,552,556 Тракриум 1:507.
См. также Атракуриум Трал 1:152
Трандат 1:191,219.
См. также Лабеталол Транилципромин 1:548,552,556 Транксен 1:428,466.
См. также Клоразепат Тремор интенционный 1:520 Триазолам 1:412,416 Триамтерен 1:308-309,317 Триамцинолон II: 133-134,140,145,
156
Тридесилон II: 565
Тридил 1:240.
См. также Нитроглицерин Тридион 1:467.
См. также Триметадион Триентин 1:523; II: 503,511 Трийодтиронин II: 112-117 Трикальция фосфат II: 223 Трилафон 1:542.
См. также Перфеназин Тримепразин 1:344 Триметадион 1:459,467 Триметафан 1:151,202 Триметоприм II: 232-233,282-284, 367-368
Триметоприм-сульфаметоксазол
II: 287-289,392-393,627-629 Тримипрамин 1:552,556 Тримплекс II: 289.
См. также Триметоприм Триостат II: 127
Трифлуоперазин 1:526,542 Трифлупромазин 1:542 Трифторидин II: 299-301 Трихлорметиазид 1:317 Трихлорэтанол 1:413 Трихлорэтилен II: 493 Трициклические антидепрессанты I:
545-547,549-550,552 Тробицин II: 269.
См. также Спектиномицин Тролеандомицин II: 631,639 Тромбоксан АII: 26 Тромбоксаны 1:361-362 Тропикамид!: 141,146,153 Тубокурарин 1:493,496,498,503,508 Тяжелые металлы II: 323,504-511
У
Углеводная толерантность и тиазиды 1:307
Углерод четыреххлористый II: 490-491
Углерода монооксид II: 490-491, 524
Уксусная кислота II: 321
Ультраленте инсулин II: 187-189
Ультрацеф II: 251.
См. также Цефадроксил
Унипен II: 250.
См. также Нафциллин
Унисертс II: 88.
См. также Ацетаминофен
Унифил 1:397.
См. также Теофиллин
Урапидил 1:179
Урацел II: 87
Урекс II: 317-318.
См. также Метенамина гиппурат
Урехолин 1:137.
См. также Бетанехол
Урокиназа II: 27,36,42
Урофоллитропин II: 101-102,108—
109
Урсодиол II: 581-582,586
Ф
Фактор IX 11:41
Фактор IX сложный, препараты II:
42
Фактор VIII 11:40-41
Фактор кумуляции 1:60 Фактрел II: 108-109.
См. также Гонадорелин Фамотидин II: 570,584 Фанзидар II: 379 Фармакодинамика 1:22-52 Фармакокинетика 1:53-72 Фелбамат 1:454-455 Фелден II: 87.
См. также Пироксикам Фелодипин 1:213,220 Феминон II: 178-179.
См. также Этинил эстрадиол Фенаматы, структура II: 70 Фенантрены 1:560,575 Фенацемид 1:448-449,466 Фенбендазол II: 364 Фенелзин 1:552,556 Фенерган 1:344.
См. также Прометазин Фенилбутазон II: 64,70,73,84,88, 626
Фенилпропаноламин 1:167,174 Фенилэтиламин 1:156 Фенилэфрин 1:156-161,174 Фениндамин 1:344
Фенитоин 1:278-279,284,467;
II: 534-536,539-540,631,636-637
Фенитротион II: 496 Фенметразин 1:167,174,585 Фенобарбитал 1:413-415,425,429;
11:522,535-536,539-540 Феноксибензамин 1:176-182,191 Фенолфталеин II: 580,585-586 Фенолы II: 324-325,566 Фенопрофен II: 71,87 Фенотерол 1:389 Фенотиазины 1:325-326,525,527, 532
Фенотиазины II: 578,628,635 Фенофибрат II: 55
Фенпрокумон II: 35 Фенсукцимид 1:456,466 Фентанил 1:562,577 Фентоламин 1:176-182,191,208 Фенурон 1:466.
См. также Фенацемид Фенциклидин 1:588-589 Ферроксамин, структура II: 490 ФиберКон II: 585-586 Фибер-Лакс II: 585-586 Фибриноген II: 41
Фибринолиз II: 27
Фибринолитическая система II: 30-31
Фибринолитические средства II: 36 Физическая зависимость 1:421,432, 564-565,579
Физиологический антагонизм 1:32
Физостигмин 1:130-131,137,190;
11:524-525
Филграстим II: 479
Финастерид II: 178,180 Фитонадион II: 33,42 Флавин монооксигеназа 1:79 Флавоксат, препараты 1:152 Флакседил 1:417.
См. также Галламин
Флекаинид 1:284-289,292
Флексерил 1:508
Флит Фосфо-Сода II: 223.
См. также Фосфат
Флозехинан 1:254
Флоксин II: 319.
См. также Офлоксацин
Флоксуридин II: 306
Флолан 1:377
Флоринеф ацетат II: 142
Флорон II: 565
Флороприл 1:101.
См. также Изофлурофат 1:137
Флувастатин, препараты II: 60
Флударабина фосфат II: 433 Флудрокортизон II: 134-136,141 Флуклоксациллин, структура II: 238 Флуконазол II: 292-294,558 Флумадин II: 306.
См. также Ремантадин Флумазенил 1:418-419,429 Флуметазона пивалат II: 565 Флунаризин 1:342 Флунитразепам, фармакокинетика 1:416
Флуонид II: 565
Флуорантрен II: 566-567
Флуотан 1:393.
См. также Галотан 1:482
Флуоцинолон II: 564
Флуразепам 1:412,416,428,924
Флурбипрофен II: 71-72 Флутемид II: 178,441-442 Флутиказона пропионат II: 565 Флуфеназин 1:526,532-533,542 Флуцитозин II: 292,297 Флюоксетин 1:548,556
Фозиноприл 1:214
Фолиевая кислота II: 14-21
Фолликулит II: 567
Фолликулостимулирующий гормон
II: 101-102,147
Фомепизол 1:432
Форан 1:393.
См. также Изофлуран 1:482 Формицин В И: 355-356 Формотерол 1:390 Фортаз II: 251.
См. также Цефтазидим Фоскавир II: 306.
См. также Фоскарнет Фоскарнет II: 304 Фосфат II: 204,212-216,222-223 Фосфодиэстеразы ингибиторы I: 242,252
Фосфолин 1:136-137 Фосфонацетат II: 304 Фосфономицин II: 230-231 Фосфорорганические ингибиторы холинэстеразы 1:129-133,148
Фосфорорганические ингибиторы холинэстеразы II: 495-497,524-525 Фробен II: 86-87.
См. также Флурбипрофен 5-Фтор-2'-деоксиуридин II: 305 Фторурацил II: 300,434,570 Фторфенилалании II: 305 Фторхинолоны II: 232,278-279 5-Фторцитозин II: 297.
См. также Флуцитозин Фунгизон II: 297. См. также
Амфотерицин В Фунгизон внутривенный II: 297.
См. также Амфотерицин В Функциональная толерантность I:
579
Фурадантин II: 318.
См. также Нитрофурантоин Фуразолидон II: 316 Фурамид II: 385.
См. также Дилоксанида фуроат Фурацин II: 326 Фуросемид 1:303-304,316
X
Халцион 1:347.
См. также Триазолам 1:429 Хелатирующие агенты II: 500-504
Хенике II: 586.
См. также Хенодиол
Хенодиол II: 586
Химиотерапия рака II: 419-462 Химическая контрацепция II: 178 Химические канцерогены II: 419 Хинакрин II: 364,367,382,393,445-446
Хинаприл 1:214,220 Хинестрол II: 159,178-179 Хинетазон 1:307,316
Хинидин 1:275-277,292; II: 378, 380,393,484-485,524-525,543, 627-628
Хинин II: 61-66,364,367,378,484-485,543
Хинолоны II; 232-233,313-314,627, 634-635,639
Хлор, антимикробные эффекты II: 322
Хлоралгидрат 1:413,429; II: 522, 539-540,625-626
Хлорамбуцил II: 76-77,423-426 Хлорамфеникол II: 253-255 Хлоргексидин II: 324 Хлоргексидина глюконат II: 324-325
Хлоргуанид II: 377-378 Хлордан II: 494
Хлордиазепоксид 1:84,412,416,425, 428
Хлорметиазол II: 542-544 Хлоромицетин II: 258-259.
См. также Хлорамфеникол Хлоропрокаин 1:491 Хлоротрианисен II: 150-152,178-
179
Хлороформ 1:594; II: 493 Хлорохин II: 76-77,371-374 Хлорохин фосфат с примахина
фосфатом II: 391-393 Хлорпромазин 1:526-527,532,541 Хлорпротиксен 1:542 Хлорталидон 1:306,316 Хлортетрациклин II: 255-256 Хлортиазид 1:301,307,316 Хлор-Триметон 1:272.
См. также Хлорфенирамин 1:344 Хлорфенвинфос II: 496 Хлорфенирамин 1:326,344; II: 589 Хлорцнклизин и лекарственный метаболизм 1:84
Холедил 1:397
Холекальциферол II: 207-208,222-223
Холера II: 257
Холестирамин II: 54-56,60 Холецистокинин 1:107
Холибар II: 59-60.
См. также Холестирамин Холина салицилат, препараты II: Холина эфиры 1:124; II: 86 Холинергическая передача 1:74-75 Холинолитики 1:517 Холиномиметические средства I:
123-138
Хорея 1:419,428
Хорея Гентингтона 1:509,520 Хорионический гонадотропин
человека II: 104
Хромомикоз II: 558
Хроническое воспалительное заболевание кишечника, используемые средства II: 582-584
Хронулак II: 585-586.
См. также Лактулоза
ц
Цедиланид-D 1:262
Цеклор, 691.
См. также Цефаклор
Целестон II: 145.
См. также Бетаметазон
Целестон фосфат II: 145 Целипролол 1:176,184,186
Центал II: 416.
См. также Албендазол Центракс II: 425,428.
См. также Празепам
Цепрозил II: 251
Цереброспинальная жидкость
(ЦСЖ), проникновение антимикробных средств II: 332
Церубидин II: 437.
См. также Даунорубицин Цетилпиридпниума хлорид USP II: 324-325
Цетиризин, препараты 1:344 Цефадил II: 251.
См. также Цефапирин Цефадроксил II: 244,251 Цефазолин II: 244,251 Цефаклор II: 246,251 Цефалексин II: 245, 252
Цефалоспорины II: 244-249 Цефалотин II: 245,251 Цефамандол II: 244,251 Цефамицины II: 245 Цефапирин II: 245 ЦефзилП: 251.
См. также Цефпрозил Цефизокс II: 252.
См. также Цефтизоксим Цефиксим II: 244,251 Цефпран II: 325 Цефметазол II: 246,251 Цефобнд II: 252.
См. также Цефоперазон Цефокситин II: 246,251 Цефоницид II: 246,251 Цефоперазон II: 252 Цефоранид II: 246,251 Цефотаксим II: 246,252 Цефотан 11:252.
См. также Цефотетан Цефотетан II: 252 Цефподоксим II: 251 Цефпрозил II: 247-248,252 Цефтазидим II:
Цефтриаксон II: 247-248,251-252 Цефтизоксим II: 247-248,252 Цефулак II: 585-586.
См. также Лактулоза Цефуроксим II: 248,252 Цианокобаламин II: 14 Цибакальцин II: 223 Цизаприд II: 578 Циклизин 1:325,326,344 Циклобензаприн 1:508 Циклогил 1:112.
См. также Циклопентолат Циклодиены II: 494 Циклокапрон II: 42.
См. также Транексамовая кислота
Циклокорт II: 565 Циклопентолат 1:146,152 Цнклопирокс оламин II: 556 Цнклоплегия 1:143 Циклопростин 1:377 Циклосерин II: 277,317-318 Циклоспорин II: 471,628-633 Циклофосфамид II: 76-77,424-427, 472-473
Ци клофосфам нд-доксорубнцин-винкристин-преднизолон (CHOP) II: 453-454
Циклофосфамид-метотрексат-фторурацил (CMF) II: 455
Циклофосфамид-метотрексат-фторурацил-винкристин-предни-зон (CMFVP) 11:455
Циметидин II: 574-576
Цинерин I и II, II: 496-497 Цинобак 11:318.
См. также Циноксацин Циноксацин II: 313-314 Цинхонизм и хинин II: 380-381 Ципро 11:319.
См. также Ципрофлоксацин Ципрогептадин 1:326,344 Ципротерон II: 178-179 Ципрофлоксацин II: 309,313-315, 332,339
Цисплатин II: 429
Цисплатин-винбластин-блеомицин
(PVB) II: 456-457 Цистоспаз-М 1:153 Цнтадрен II: 145.
См. также Аминоглютетимид Цитанест 1:402.
См. также Прилокаин Цитарабин II: 301,434 Цитозар-Ц II: 301,336,472-473.
См. также Цитарабин
Цитозина арабинозид II: 301,334, 472-473. См. также Цитарабин
Цитокины II: 465,479-481 Цитомегаловирусный иммуноглобулин внутривенный, препараты 11:306
Цитомел II: 126.
См. также Лиотиронин Цитотек 1:303; II: 585.
См. также Мизопростол Цитотоксическиесредства 11:472-473 Цитохром Р4501:75-86
метаболизм простагландинов
1:364-368
CMF (Циклофосфамид-метотрек-сат-фторурацил) II: 455
CMFVP (Циклофосфамид-мето-трексат-фторурацил-винкристин-преднизон) И: 455
CCNUII: 424,427-429.
См. также Ломустин
ч
Человеческий лейкоцитарный антиген II: 477
Человеческий менопаузный гонадотропин II: 101-102
Четвертичные амины 1:141,147
Эдекрин 1:247.
См. также Этакриновая кислота Эдетат II: 500
Эдетат кальция бинатриевый II: 503 Эдетат кальция, препараты II: 511 Эдрофоний 1:134,137
ЭДТА. См. Этилендиаминтетраацетат
Эзидрикс 1:247.
См. также Гидрохлортиазид Эйкозаноиды 1:361-378 Эймса тест II: 419-420 Эквалактин II: 585-586
Экванил 1:348.
См. также Мепробамат Эквиленин II: 150 Эквилин II: 150 Эконазол II: 296,556 Экселдерм II: 296,556 Экс-Лакс II: 585-586.
См. также Фенолфталеин Эксна 1:247.
См. также Бензтиазид 17-Эстрадиол, структура II: 150 Элавил 1:458.
См. также Амитриптилин 1:556 Элдеприл 1:430.
См. также Селегилин 1:523 Электрический потенциал и секреция калия 1:300 Эликсофиллин 1:319.
См. также Теофиллин Элиминация, ограниченная по объему 1:58-59
Эметин II: 383-384,402
Эминаза II: 42.
См. также Анистреплаза Эмпирии 1:578 Эналаприл 1:214,220,350 Эндогенная депрессия 1:538-539 Эндометрий и эстрогены II: 150-152
Эндорфины 1:563
Эндотелии 1:357-358
Эндурон 1:247.
См. также Метиклотиазид
Энкефалины 1:563
Эноксапарин II: 28,422
Эноксацин II: 309,317-318
Энфлуран 1:482
Эпиандростерон, структура II: 158
Эпидермальный ростовой фактор I: 35
Эпилепсия 1:443-467
Эпинин 1:166
Эпоген II: 24
Эпоксидация 1:78
Эпоксиэйкозатетраеновая кислота 1:361
Эпопростенол, препараты 1:377 Эпоэтин альфа, препараты II: 24 Эргокальциферол II: 208,223 Эргомар 1:273. См. также Эрготамин Эргостат 1:273. См. также Эрготамин Эрготамин 1:345
Эрготрата малеат 1:272
Эритромицин II: 231-233,310-311, 555
Эритропоэтин II: 22-24 Эритроцин II: 317-318.
См. также Эритромицин
Эскалит 1:542
Эсмолол 1:184, 186
Эссенциальная гипертензия 1:194
Эссенциальный тремор 1:519 Эстазолам, препараты 1:428
Эстинил II: 177-178.
См. также Этинилэстрадиол
Эстрадерм II: 178-179
Эстрадиол II: 149-150
Эстрадиол валерат, средняя И: 151-152
Эстрадиол трансдермальный II: 177-178
Эстрадиол ципионат в масле II:
177-178
Эстровиз II: 177-178.
См. также Квинестрол
Эстрогены II: 149-155
Эстрон II: 149
Эстропипат II: 149,177-178
Этакриновая кислота 1:190,304,316
Этамбутол II: 275
Этанол 1:350-357,747.
См. также Алкоголь 1:431-442
Этидокаин 1:485,491
Этидронат II: 209-210,213,220
Этиленгликоль 1:441 -442
Этилендиаминтетраацетат II: 550-503
Этнлнорадреналин, препараты 1:396
Этилэстренол И: 173
Этинамат, препараты 1:429
Этинилэстрадиол II: 151-152,177-
178,442
Этинодиолдиацетат, активность II: 156-157
Этионамид II: 277
Этмозин 1:227.
См. также Морицизин
Этнор II: 416. См. также Левамизол
Этодолак II: 72
Этоксинафтамидопенициллин II:
238
Этомидат 1:482
Этопозид II: 436
Этосуксимид 1:455-456,466
Этотоин 1:448-449
Этран 1:392-393,
См. также Энфлуран Этретинат II: 445-446,564 Этхлорвинол 1:429 Эулексин II: 180.
См. также Флутамид
Эуракс II: 560
Эутроид И: 126.
См. также Лиотрикс Эфедрин 1:161,167,389,396 Эфедрин сульфат, рекомендованный для безрецептурного использования И: 589
Эфедрон интраназальный 1:130, 318.
См. также Эфедрин
Эфир 1:594
Эфиры, метаболизм 1:79 Эфлорнитин II: 389-390 Эффексор 1:556
Эффект первого прохождения 1:75 Эхотиофат 1:133,137
Я
Яичники II: 147-149,160-162
Яичников гормоны II: 160-162
Ясмолин I и II, II: 496-497
Том 2
Авторы.................................................................................5
Раздел VI. Препараты для лечения заболеваний крови, воспаления и подагры.............9
Глава 32. Препараты, используемые для лечения анемий; гемопоэтические факторы роста.9
Глава 33. Препараты, используемые для коррекции системы коагуляции.................27
Глава 34. Препараты, используемые при гиперлипидемиях..............................45
Глава 35. Нестероидные противовоспалительные средства; неопиоидные аналгетики; средства, используемые для лечения подагры....................................60
Раздел VII. Гормональные средства.................................................. 89
Глава 36. Гормоны гипоталамуса и гипофиза..........................................89
Глава 37. Тиреоидные и антитиреоидные средства....................................110
Глава 38. Адренокортикостероиды и их антагонисты..................................128
Глава 39. Половые гормоны и их ингибиторы.........................................147
Глава 40. Гормоны поджелудочной железы и антидиабетические препараты..............181
Глава 41. Средства, влияющие на минеральный гомеостаз костной ткани...............204
Раздел VIII. Химиотерапевтические средства..........................................225
Глава 42. Принципы действия противомикробных средств..............................225
Глава 43. Пенициллины и цефалоспорины.............................................237
Глава 44. Хлорамфеникол и тетрациклины............................................252
Глава 45. Аминогликозиды и полимиксины............................................260
Глава 46. Антимикобактериальные препараты.........................................270
Глава 47. Сульфаниламиды и триметоприм............................................283
Глава 48. Противогрибковые средства...............................................291
Глава 49. Противовирусные средства и профилактика.................................299
Глава 50. Препараты для использования по специальным показаниям и антисептики мочевыводящих путей.............................................309
Глава 51. Средства для дезинфекции и антисептики..................................321
Глава 52. Клиническое использование противомикробных средств......................326
Глава 53. Основные принципы химиотерапии паразитарных заболеваний.................352
Глава 54. Антипротозойные средства................................................367
Глава 55. Клиническая фармакология противоглистных средств........................394
Глава 56. Химиотерапия рака.......................................................418
Глава 57. Иммунофармакология......................................................462
Раздел IX. Токсикология............................................................487
Глава 58. Введение в токсикологию: профессиональная токсикология и токсикология окружающей среды..............................................487
Глава 59. Хелатные соединения и отравления тяжелыми металлами................500
Глава 60. Лечение больных с отравлением......................................512
Раздел X. Специальные темы...................................................529
Глава 61. Специальные аспекты перинатальной и педиатрической фармакологии....529
Глава 62. Специальные аспекты гериатрической фармакологии....................542
Глава 63. Дерматологическая фармакология.....................................552
Глава 64. Препараты, используемые при желудочно-кишечных заболеваниях........572
Глава 65. Терапевтический и токсический потенциал препаратов безрецептурного отпуска.586
Глава 66. Рациональное назначение лекарств и выписывание рецепта.............599
Приложение I. Вакцины, иммуноглобулины и другие сложные биологические продукты..........................................609
Приложение П. Важнейшие взаимодействия лекарственных средств...................623
Указатель........................................................................641