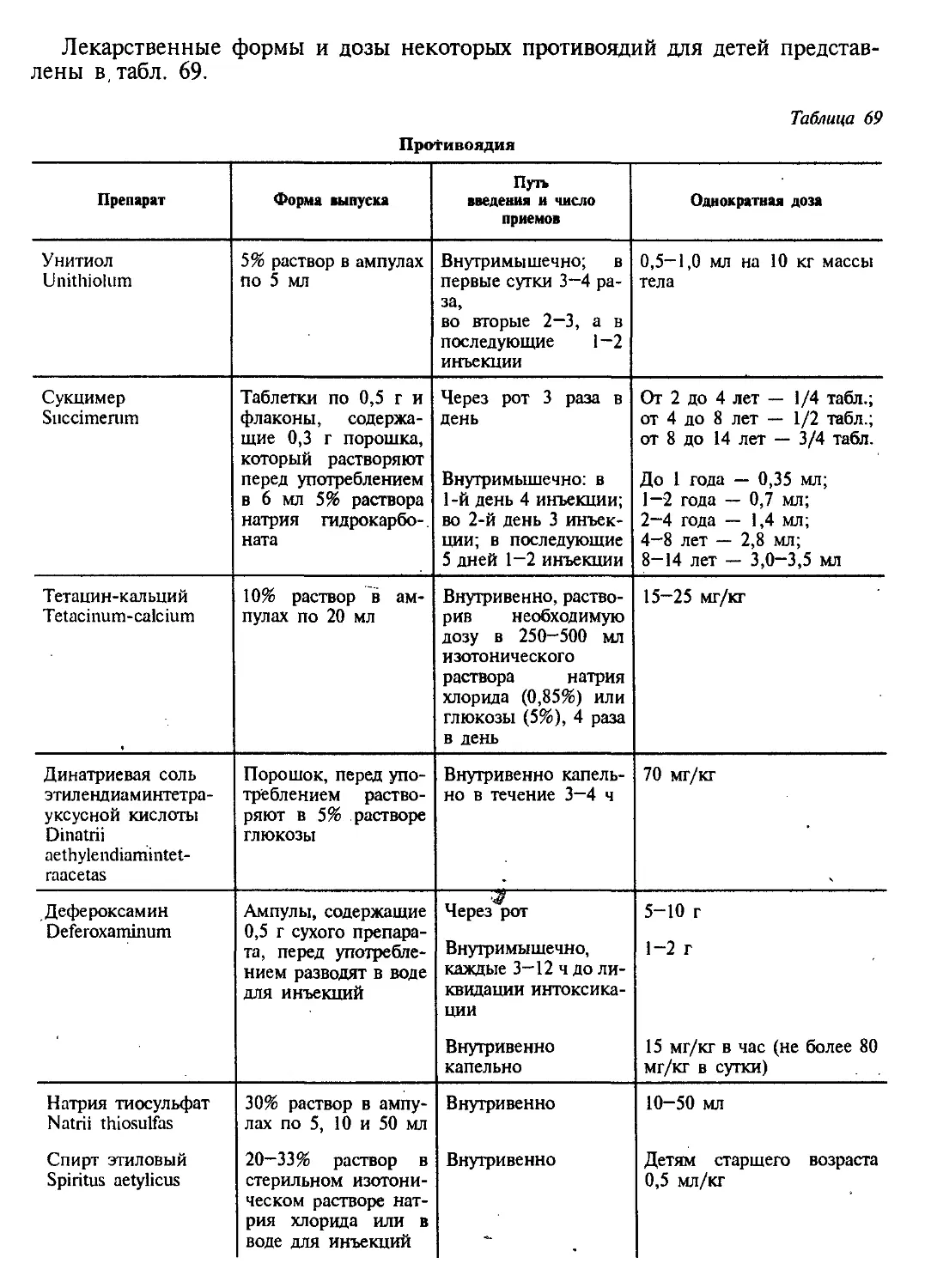
Текст
И. В. Маркова, И. Б. Михайлов, М. В. Неженцев
ФАРМАКОЛОГИЯ
Издание второе, переработанное и дополненное Рекомендовано Министерством здравоохранения РФ в качестве учебника для студентов педиатрических факультетов высших медицинских учебных заведений
Санкт-Петербург Фолиант 2001
ПРЕДИСЛОВИЕ К ПЕРВОМУ ИЗДАНИЮ
Учебник соответствует программе по фармакологии для медицинских, в том числе педиатрических факультетов. Однако эта программа утверждена еще Министерством Здравоохранения СССР в 1983 г. Новой программы пока нет. За эти годы в фармакологии появились и новые группы лекарственных средств, и новые препараты существующих групп, появились новые сведения о механизме их действия, показания к применению, в частности у детей; сведения о нежелательных эффектах препаратов.
В данный учебник включены новые группы лекарственных средств: антиоксиданты, антигипоксанты, объединены в отдельную группу лекарственные средства, влияющие на пуринергические системы. Почти во все группы лекарственных средств включены новые препараты, вошедшие в медицинскую практику.
При обсуждении фармакодинамики лекарственных средств в обшей части учебника рассмотрено значение биологически активных веществ, их агонистов и антагонистов на системы аденилатциклазы и фосфатидилинозитолов. Даны краткие сведения о хронофармакологии.
Учебник имеет педиатрическую направленность; в нем есть сведения об особенностях фармакокинетики и фармакодинамики, показания к применению и нежелательные эффекты у детей, особенно младшего возраста. Даны дозы основных лекарственных средств, применяемых в педиатрии. Однако в учебнике есть сведения о применении лекарственных средств и в другие возрастные периоды жизни человека.
Учебник предназначен для студентов третьего курса педиатрических и лечебных факультетов медицинских институтов.
ПРЕДИСЛОВИЕ КО ВТОРОМУ ИЗДАНИЮ
Прошло семь лет после первого издания учебника. За это время появились новые препараты, новые группы лекарств, новые сведения о фармакодинамике и фармакокинетике лекарственных средств. К сожалению, о возрастных особенностях использования лекарств у детей новых сведений очень мало.
Во второе издание включены современные сведения о фармакологии вообще, об отдельных группах и новых препаратах, о применении лекарств у детей.
Поскольку речь идет об учебнике для студентов третьего курса педиатрических факультетов медицинских высших учебных заведений, а не о руководстве для врачей, мы не стремились слишком расширить объем книги, сохранив возможность прочтения главы при подготовке к занятию. Поэтому материал учебника изложен кратко.
Авторы учли замечания и предложения читателей, сделанные по поводу первого издания и будут признательны за предложения и замечания по поводу второго издания.
з
ВВЕДЕНИЕ
Фармакология — наука о лекарствах. Лекарства — вещества, применяемые для предотвращения заболеваний у человека (и у животных) или для их устранения.
Первые лекарства появились в доисторические времена, когда человек начал использовать части растений, минералы, жидкости и ткани животных для нанесения на раны, приема внутрь с целью восстановить здоровье. Нередко это сопровождалось молитвами, ритуальными танцами и пр.
На протяжении тысячелетий менялось представление о том, что такое здоровье, болезнь, лекарство. Эти представления соответствовали знаниям людей разных эпох. Например, длительное время считали, что здоровье — результат равновесия в организме горячего и холодного, сухого и влажного, а болезнь — следствие недостатка йди избытка одного из этих свойств. Соответственно и лекарства делили на горячие (перец, мышьяк), холодные (опий), сухие (девясил) и влажные (ртуть) и назначали их больным с целью устранить нарушенное равновесие.
На протяжении веков колдуны, жрецы испробовали в качестве лекарств почти все растения, минералы, ткани и жидкости животных, изготовляя из них порошки, экстракты, настои, отвары и пр. Особенное внимание уделялось цветам, корням, плодам, семенам растений, напоминающим части тела или органы человека. Считали, что приготовленные из них порошки и прочие лекарственные формы должны «помогать» при болезнях этих частей тела или органов (не имея естественно никаких доказательств). Некоторые из таких лекарств вызывали какие-нибудь эффекты, например, масло из семян клещевины (касторовое масло) вызывало диарею. Эти семена записаны в папирусах египетских жрецов. Но далеко не все применявшиеся в те далекие времена «лекарства» способствовали выздоровлению.
Прошло время, врачи и фармацевты поняли, что необходима проверка лекарств. Иногда это делали сами изготовители. В историю медицины вошел Ф. Сертюрнер, который в 1806 г. попробовал выделенный им из опия морфин и погиб из-за передозировки.
Годом рождения экспериментальной фармакологии считают 1867 г., когда Рудольф Бухгейм — профессор университета в Дерпте (ныне Тарту) приступил к систематическим испытаниям существовавших тогда лекарств на животных. Первоначально методы исследований были очень просты, но и они исключили из списка лекарств большое число неэффективных или токсичных (ядовитых) веществ.
Сейчас фармакологи для своих исследований используют почти все методы, применяемые физиологами, патологами, биохимиками, гистологами и представителями других медико-биологических наук для выяснения влияния лекарственных веществ на конкретные функции, биохимические процессы, активность отдельных органов, систем и всего организма.
Большинство современных лекарств — высокоактивные вещества, извлеченные из растений, тканей животных, продуктов жизнедеятельности микроорга-
4
низмов и очищенные от балластных веществ. Синтезировано огромное число химических веществ, похожих по структуре на природные вещества; но есть лекарства, совершенно не похожие на них.
Некоторые химические соединения очень ядовиты, и их не применяют в медицинской практике. Их изучают представители другой науки, ответвившейся от фармакологии, — токсикологии (от греч. toxicon — яд). Деление веществ на лекарства и яды условно, так как одно и то же вещество в зависимости от дозы может быть и лекарством (в меньшей дозе), и ядом (в большей дозе). К применению в качестве лекарств допускают лишь вещества с большой широтой терапевтического действия, то есть отношением токсической дозы к терапевтической дозе.
По современному законодательству вновь создаваемое лекарственное вещество'должно прежде всего пройти тщательное испытание на экспериментальных животных, для изучения не только вызываемого им терапевтического эффекта (противовоспалительного, противоаллергического, обезболивающего и пр.), но и его воздействия на различные функции организма (деятельность почек, печени, сердца, кроветворение и многое другое). Лишь после этого можно производить клинические испытания нового препарата, сопоставляя результаты его применения у больных с результатами приема аналогичными больными плацебо (от лат. placere — нравиться) — препарата, не содержащего лекарства, но имеющего такую же лекарственную форму (понравившуюся исследователю), что и лекарственное вещество (таблетки, капсулы и пр.). Это делается во избежание психологического воздействия на больного (внушения), чтобы результат от приема препарата был связан с объективным воздействием на организм, а не с верой в эффективность лекарства.
Вера в спасительные свойства лекарств — основа положительных результатов при лечении некоторых больных различными знахарями, колдунами. Это подтверждают и результаты приема плацебо. В зависимости от вида патологии (запоры, кашель, коронарная болезнь, язвенная болезнь желудка или двенадцатиперстной кишки) прием такой «пустышки» может вызвать временный лечебный эффект у 20—60% больных. Мало того, прием плацебо может вызвать даже нежелательные эффекты (головную боль, тошноту, рвоту, даже судороги, нарушения зрения), похожие на те, что возникают у больных, принимающих изучаемое лекарство. Как видим, значение ййушения очень велико. Но эффект от плацебо короткий, так как не подкреплен воздействием лекарства на патологический процесс. Тем не менее в медицинскую практику разрешено вводить только такие препараты, результат от применения которых статистически достоверно отличается от результатов приема плацебо (испытания естественно проводятся на фоне общепринятого лечения конкретной патологии).
Не всегда клинические испытания проводятся с участием плацебо. При ряде заболеваний, особенно тяжелых, испытания нового препарата проводят путем сопоставления его эффективности с эффективностью наиболее часто применяемого при данной патологии уже существующего лекарственного средства. При этом оценивают и терапевтический результат, и отсутствие или меньшую выраженность нежелательных эффектов, стоимость препарата и пр.
Терапевтический эффект у больных зависит от многих факторов, прежде всего от возраста пациента. В Санкт-Петербургской педиатрической медицинской академии (ранее Петербургском педиатрическом медицинском институте) уже давно (с 1930 г.) проводятся исследования по возрастной фармакологии.
5
Создатель кафедры института — действительный член АМН СССР, профессор В. М. Карасик — основатель этой отрасли фармакологии в нашей стране.
Помимо возраста эффективность лекарств зависит от этиологии и патогенеза болезни у данного пациента, имеющейся у него сопутствующей патологии, приема других лекарств, диеты и пр. Одно и то же лекарство у разных больных с внешне похожим заболеванием (гипертоническая болезнь, сердечная недостаточность и пр.) может привести к неодинаковым результатам: вызвать или нет как терапевтический, так и нежелательные эффекты.
Правила выбора лекарств для больных, определение режима их приема (доз, частоты приема, длительность курса лечения и пр.), допустимость или недопустимость сочетания с другими лекарствами изучает сравнительно молодая отрасль фармакологии — клиническая фармакология. Эту науку студенты медицинских институтов изучают на пятом—шестом курсах после и во время прохождения основных клинических дисциплин.
Часть I ОБЩАЯ ФАРМАКОЛОГИЯ
ВИДЫ ДЕЙСТВИЯ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ
Лекарственное вещество может оказывать местное, резорбтивное и рефлекторное действие. Местное действие возникает на месте нанесения лекарственного вещества на кожу, слизистые оболочки до его всасывания в кровь. Резорбтивное действие возникает после всасывания лекарственного вещества в кровь и распределения его вместе с ней по периферическим тканям (периферическое действие) или в центральной нервной системе (центральное действие). Рефлекторное действие — результат активации лекарственным средством чувствительных рецепторов, локализованных как на поверхности тела (кожа, слизистые оболочки), так и во внутренних структурах организма (хеморецепторы каротидных клубочков, эндотелия сосудов и др.).
ПОНЯТИЕ О ДОЗЕ
Доза — количество вещества, вцодимого в организм. Обычно лекарственный препарат назначают в терапевтической дозе, вызывающей лечебный эффект. Величина терапевтической дозы может меняться в зависимости от возраста ребенка, путей введения лекарственного вещества, желаемого терапевтического эффекта. Различают дозы, назначаемые на один прием — разовые, в течение суток — суточные, на курс лечения — курсовые. Лекарственное средство можно назначать из расчета на 1 кг массы тела или на 1 м2 поверхности тела, на 1 год жизни ребенка.
Величину дозы для детей определяют в процессе клинических испытаний препарата, учитывая особенности его фармакокинетики (всасывание, распределение, элиминация) и реакции на него организма ребенка. В педиатрии предпочитают использовать лекарственные средства, которые имеют большую терапевтическую широту (отношение токсической дозы к терапевтической).
Токсическая доза — количество вещества, вызывающее отравление ребенка. Летальная доза вызывает смерть.
7
РАСПРОСТРАНЕНИЕ
ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ В ОРГАНИЗМЕ
В организме лекарственное вещество проникает через различные барьеры: через стенки кишки, сосуда, клеточную мембрану, мембраны субклеточных структур и др. Вещество может проникать пассивно — без затраты энергии в сторону меньшей концентрации (по градиенту концентрации), путем растворения в липидном слое мембраны, и активно — с затратой энергии, часто против градиента концентрации.
Пассивно проникают неэлектролиты (например, спирты), неионизированные молекулы слабых кислот — барбитуратов, салицилатов и др., а также оснований — алкалоидов, амидопирина и др. Большинство лекарственных веществ являются солями, преимущественно натриевыми, реже калиевыми, кальциевыми, слабых кислот или оснований. В жидкостях и тканях организма они могут быть в виде целых молекул, растворимых в липидах и легко проникающих во все ткани, и в виде ионов, в основном утративших способность растворяться в липидах и плохо проникающих в ткани, pH среды определяет степень ионизации этих веществ. Междургем pH разных жидкостей — желудочного сока, кишечного содержимого, молока, слюны, мочи и т. д. — неодинаков. Кислоты диссоциируют в более щелочной среде, основания — в более кислой.
Пассивная диффузия может происходить и через межклеточные поры, существующие в эндотелии капилляров почти во всех тканях, кроме центральной нервной системы. Эти поры достаточно велики и прохождение через них зависит от интенсивности кровотока (особенно в клубочках почек), а не от растворимости в липидах или от градиента pH.
Активный транспорт (водорастворимых витаминов, аминокислот, многих метаболитов, нейромедиаторов и веществ, похожих на них) осуществляется через мембраны нейронов, сосудистые сплетения, канальцы почек. Он характеризуется избирательностью, насыщаемостью и осуществляется с затратой энергии, обычно против электрохимического градиента.
Облегченный транспорт (например глюкозы) тоже избирателен, осуществляется с помощью специальных носителей без затраты энергии, по градиенту концентрации.
Проникновение лекарств может быть и путем пиноцитоза (полимеры, полипептиды) с образованием и прохождением везикул через клеточные мембраны.
ПУТИ ВВЕДЕНИЯ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ
Пути введения лекарственных веществ принято делить на энтеральные и парентеральные. Энтеральные пути введения — через рот, в прямую кишку, а парентеральные — все остальные пути. Академик В. М. Карасик предложил иное деление путей введения: без нарушения целости покровов и с их нарушением.
Введение без нарушения целости покровов — введение во все естественные отверстия тела: через рот, прямую кишку, ингаляционно, под язык, в полость носа, конъюктивальный мешок, уретру, мочевой пузырь, влагалище, в отверстия сальных желез и др. Часть этих путей введения — через рот, прямую кишку, посредством ингаляции, под язык — используют для получения в основном
8
резорбтивного эффекта, а остальные — для получения местного действия. Но лекарственное вещество может всосаться с любой слизистой оболочки и кожи. Поэтому даже местно лекарственное вещество можно применять у детей только в терапевтической дозе, рекомендуемой для приема через рот.
Для получения резорбтивного эффекта путь введения должен быть оптимальным, чтобы обеспечить максимальную биодоступность лекарственного средства, т. е. попадание его к месту первичного действия.
Прием внутрь наиболее удобен, но биодоступность многих веществ при таком способе введения минимальна. Уже в полости рта, а особенно в желудке и кишечнике, лекарственное средство подвергается воздействию различных ферментов желудочно-кишечного тракта, а в толстой кишке — ферментов микроорганизмов. Лекарственное вещество может сорбироваться различными компонентами пищи, образовывать с ними невсасывающиеся комплексы. На поверхности слизистой оболочки кишечника расположен слой связанной воды (его толщина находится в обратной зависимости от возраста ребенка), препятствующий всасыванию жирорастворимых веществ. В слизистой оболочке кишечника функционируют транспортные механизмы, активно переносящие в кровь различные вещества (аминокислоты, водорастворимые витамины, сахара и другие ионизированные и полярные молекулы). Эти транспортные механизмы у детей первого года жизни еще плохо развиты, в связи с этим до полутора лет у детей медленно всасываются липидо- и водорастворимые лекарственные средства.
В стенке кишечника функционируют ферменты, подвергающие первому и второму этапам биотрансформации многие лекарственные вещества, после чего они утрачивают способность растворяться в липидах и способность к всасыванию. У детей первых месяцев жизни активность этих ферментов невелика, поэтому лекарственные вещества остаются в неизмененном виде и легче всасываются. Из тонкой кишки вещество по портальной вене попадает в печень и уже при первом прохождении через нее может подвергнуться биотрансформации. Из печени по полой вене вещество попадает в правое предсердие и далее — в легкие, в. которых некоторые вещества также подвергаются химическим превращениям. Лишь потом лекарственное вещество попадает в левое предсердие и далее — в систему кровообращения.
Таким образом, еще до попадания вУсистему кровообращения принятое внутрь лекарственное средство может исчезнуть, т. е. подвергнуться пресистемной элиминации. Интенсивность пресистемной элиминации разных веществ'неодинакова, она может колебаться от 0 до 100%.
У детей до 1,5 лет биодоступность принятых внутрь лекарственных веществ лишь немногим отличается от таковой у взрослых. Однако всасывание их (и активное, и пассивное) происходит очень медленно, в результате чего в плазме крови создаются небольшие концентрации, иногда недостаточные для получения терапевтического эффекта.
Новорожденным опасно вводить внутрь гиперосмолярные растворы, так как это может спровоцировать возникновение у них некротизирующего энтероколита.
Некоторые вещества назначают под язык (нитроглицерин) или прилепляют к слизистой оболочке внутренней поверхности щеки (трансбуккальное введение: препараты простагландинов, окситоцина, нифедипина и др.). При таком способе введения вещество быстро всасывается в кровь, почти не подвергаясь пресистемной элиминации.
9
На введенное через прямую кишку лекарственное вещество меньше воздей-ствуют разрушающие или биотрансформирующие факторы. Всасывание происходит через геморроидальные вены, кровь по которым, минуя печень, попадает в нижнюю полую вену, то есть значительно меньше подвергается пресистемной элиминации. Это может способствовать хорошей биодоступности принятого вещества. Вместе с тем усвоение вещества ограничивается относительно малой поверхностью и длительностью его контакта со слизистой оболочкой по сравнению с приемом внутрь. Слизистая оболочка прямой кишки у детей младшего возраста очень нежная, легкораздражаемая; возникающие рефлексы ведут к быстрому опорожнению кишечника и к уменьшению биодоступности лекарственного вещества. Раздражение может стать причиной проктитов. Большое значение при этом имеет качество основы, на которой приготовлены ректальные свечи. Растворы лекарств, введенные в виде клизмы (после очистительной клизмы), могут всосаться очень быстро, создав высокую концентрацию в плазме крови, почти равную таковой после внутривенного введения.
Иными словами, всасывание лекарственного вещества из Прямой кишки непостоянно, оно может быть и о<ень хорошим, и совершенно недостаточным. Этим способом введения лекарств пользуются при невозможности приема лекарств внутрь (из-за рвоты, бессознательного состояния) или при назначении лекарственных средств, легко инактивирующихся в желудочно-кишечном тракте, например, назначение противорвотных средств, препаратов интерферона. - Ингаляции газов и парообразных веществ, особенно растворимых в липидах, быстро приводят к всасыванию вещества и развитию резорбтивного эффекта, так как площадь поверхности альвеол очень велика, а тонкий слой их клеток и клеток эндотелия сосудов, окружающих их, не препятствует проникновению таких веществ. Пресистемная элиминация при этом способе введения невелика. При ингаляции аэрозолей кинетика вещества во многом зависит от величины его частичек. Частицы размером 60 мкм и больше оседают на поверхности глотки и заглатываются в желудок; частицы размером 20 мкм проникают в терминальные бронхиолы; размером 6 мкм — в респираторные бронхиолы, размером 2 мкм — в предальвеолярный проход (жом) и 1 мкм — в альвеолы. Всасывание происходит в основном из глубоких отделов легких, а попавшее на поверхность слизистых оболочек бронхов вещество вызывает преимущественно местное действие (расслабление спазмированных бронхов, разжижение мокроты и др.).
При назначении лекарственных средств путем ингаляции следует учитывать, что у детей, особенно младшего возраста, слизистая оболочка дыхательных путей легко подвергается раздражению, реагирует на него обильным отделением секрета и набуханием, что может нарушить проходимость дыхательных путей. Особенно большую осторожность нужно соблюдать при вдыханий кислорода, который вызывает не только раздражение, но и повреждение слизистых оболочек, а у недоношенных угнетает синтез сурфактанта (вещество, поддерживающее альвеолы в расправленном состоянии).
Вливание небольших количеств водных (!) растворов в трахею или бронхи приводит к быстрому их всасыванию. При этом эффект получается почти такой же, как от внутривенного введения препарата. Этот способ используют при реанимации больных с тяжелыми расстройствами сердечной деятельности, включая остановку сердца (на фоне закрытого его массажа и искусственной вентиляции легких), когда из-за спадения вен невозможно произвести в них 10
введение препарата. Так, назначают адреналин, атропин, лидокаин в дозах, равных дозам для внутривенного введения.
Аэрозоли полярных веществ (например, аминогликозидных антибиотиков), плохо всасывающихся из просвета бронхов, применяют для получения местного эффекта (в данном случае противомикробного).
Липидорастворимые (!) вещества хорошо всасываются со слизистой оболочки носа, быстро попадая в ЦСЖ и мозг, так как существует прямой контакт подслизистой оболочки носа с субарахноидальным пространством обонятельной доли мозга. Таким способом вводят растворимые в липидах фентанил (наркотический анальгетик), кетамин (средство общей анастезии) — для обезболивания, мидазолам (транквилизатор) — для премедикации перед накроти-зированием..
Нанесение лекарств на кожу в основном вызывает местный эффект, но она не представляет собой непреодолимый для них барьер; некоторые легко всасываются и в то же время способны создать в подкожной клетчатке депо, поддерживающее определенную концентрацию вещества в крови. Втиранием в кожу препаратов нитроглицерина, теофиллина получают их резобтивные эффекты, сохраняющиеся 2—3 дня. Мази этих препаратов приготовляют на особых основах и втирают их в переднюю поверхность груди.
При нанесении других лекарств на кожу детей, следует учесть, что-чем младше ребенок, тем нежнее кожа, тоньше ее роговой слой и через нее легче происходит всасывание любого вещества. Поэтому при нанесении лекарств на кожу ребенка их следует назначать в дозах, не превышающих доз для приема через рот. Иначе могут возникнуть тяжелые нежелательные эффекты (препараты йода, глюкокортикоидов и пр.). С особой осторожностью следует наносить лекарства на поврежденную кожу (ожог, рана, мацерация в области опрелостей), так как в этой области всасывание происходит особенно легко, и лекарство может вызвать тяжелую интоксикацию даже со смертельным исходом (например, от нанесения присыпки с борной кислотой).
Другие способы применения лекарственных веществ без нарушения целости покровов используют для получения местного действия (не исключающего всасывания вещества). Необходима осторожность при закапывании растворов в полость носа ребенку, так как раздражающее вещество (например, протаргол) может вызвать рефлекторную (с поверхности глотки и верхних дыхательных путей) остановку дыхания.
Ввведение с нарушением целости покровов (инъекции). Внутривенные, внутримышечные, эндолимфатические и подкожные инъекции используют для получения резорбтивного действия, а остальные — в полость плевры, сустава, брюшины, в желудочки мозга, абсцессы и пр. — для получения местного действия. Однако любая инъекция может вызвать резорбтивный эффект.
Внутривенно введенное вещество немедленно оказывается в плазме крови, биодоступность его при этом максимальна. Поэтому вводить лекарственное вещество надо медленно, так как быстрая инъекция может создать его токсические концентрации в небольшой порции крови, попадание которой в сердце, центральную нервную систему способно нарушить их деятельность. Детям следует по возможности избегать внутривенного вливания гипертонических растворов, поскольку они повреждают эндотелиальные клетки и способствуют образованию тромбов в мелких сосудах, нарушают гематоэнцефалический барьер, увеличивая поступление воды и лекарств в мозг, а у новорожденных
и
(особенно недоношенных) повышают опасность внутримозговых геморрагий и некротизирующего энтероколита.
Новорожденным нередко вводят лекарственные вещества в вену пуповины. При этом в первые несколько часов после рождения примерно половина дозы вещества попадает через венозный проток в нижнюю полую вену, а остальная — в кровоток печени. Уже в первые сутки начинается сужение просвета венозного протока, и к концу двух—трех суток жизни кровоток по нему может прекратиться, тогда все введенное вещество сразу попадает в кровоток печени. Это, с одной стороны, ограничивает его биодоступность, а с другой, — способствует его повреждающему действию на печень. Поэтому введение в вену пуповины новорожденных должно быть завершено к концу первых суток жизни ребенка. Иначе лекарственное вещество, преимущественно поступая в печень, уже при первом прохождении через нее будет подвергаться биотрансформации и к тому же может накопиться в печени и нарушить ее функцию. Длительные инфузии лекарственных растворов в вену пуповины могут сопровождаться осложнениями, нередко опасными: инфицированием, тромбозом воротной вены, даже некротическими изменениями в печени.
При проведении длительных |нутривенных инфузий следует учесть, что стенки трубок, по которым раствор поступает в кровь, могут впитывать лекарственные средства. Если трубка длинная, а раствор мало концентрирован, то попадание лекарства в кровь может быть совершенно недостаточным.
При внутримышечном и особенно подкожном введении всасывание происходит медленнее. В подкожной клетчат.ке и мышце может возникнуть депо вещества, из которого оно медленно всасывается. У детей очень лабильная гемодинамика, она легко нарушается при шоке, коллапсе, обезвоживании, что ухудшает всасывание лекарственных веществ из этих тканей. Некоторые вещества, введенные в мышцу, могут вызвать ее повреждение (дигоксин, сибазон, лидокаин). В подкожной клетчатке много чувствительных рецепторов, и введение кислых, гипертонических растворов и раздражающих веществ может вызвать сильную боль.
Эндолимфатически (в лимфатический проток или в лимфатические сосуды на конечностях) введенные вещества вместе с лимфой проникают во все ткани, могут сорбироваться на поверхности и проникать в лимфатические узлы и их клетки, воздействуя на находящиеся там микроорганизмы, метастазирующие опухолевые клетки. При использовании этого способа введения противомик-робных средств достигают лучшего результата, чем при введении другими путями, при лечении больных с тяжелыми септическими состояниями, перитонитом и пр.
РАСПРЕДЕЛЕНИЕ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ
Попавшее в кровь лекарственное вещество может раствориться в плазме крови, связаться с ее белками (преимущественно с альбуминами и отчасти с кислым гликопротеином) и сорбироваться на поверхности клеток крови.
Разные вещества связываются с белками плазмы в неодинаковой степени — от долей процента до 99%; соответственно величина свободной фракции вещества, способной проникать в ткани, может варьировать в больших пределах. Содержание альбуминов и кислого гликопротеина в плазме крови новорожденных и грудных детей значительно меньше, чем у более старших детей и 12
взрослых. В результате свободная фракция лекарственных веществ у них больше, а связанная — меньше. Это и облегчает попадание вещества в ткани и органы-мишени, и ускоряет его элиминацию. У детей любого возраста связывание лекарственных веществ с белками плазмы снижается при гипотрофии, забо-, леваниях печени (уменьшение синтеза белка), почек (потеря его с мочой). Лекарства могут связываться с мембранами форменных элементов крови и проникать в них. Окисляющие вещества при этом способны вызвать гемолиз, а попав в эритроцит, — привести к образованию метгемоглобина, что нарушит транспорт кислорода тканям. Особое значение это имеет для новорожденных, у которых в эритроцитах есть фетальный гемоглобин, железо которого легко окисляется до трехвалентного, а восстанавливающих ферментов недостаточно. Гемолиз и метгемоглобинемию могут вызвать фенацетин, парацетамол, викасол, метиленовый синий, нитриты, а у недоношенных даже аскорбиновая кислота (вернее, ее метаболит — монодегидроаскорбиновая кислота, для восстановления которой обратно в аскорбиновую кислоту у них не хватает глутатиона).
Лекарственные вещества, циркулирующие в крови, могут обладать разной степенью растворимости в воде и липидах. Чем более оно ионизировано или полярно, тем больше растворяется в воде. У детей раннего возраста воды в организме (особенно внеклеточной) значительно больше, чем у детей старшего возраста и у взрослых. Поэтому вещества, хорошо растворимые в воде (например строфантин), оказавшись в большем ее объеме, создают у детей меньшую концентрацию в плазме крови. Вещества, хорошо растворимые в липидах, способны накапливаться в жировой (околопочечной, подкожной) ткани, а также в мышцах, где связываются с белками тканей. У новорожденных и грудных детей с меньшим слоем подкожной жировой клетчатки и с меньшей мышечной массой, чем у более старших детей и взрослых, растворимые в липидах и хорошо связывающиеся с белками тканей вещества (например, дигоксин) могут оказаться в плазме крови в большей концентрации, чем у взрослых. '
У новорожденных и грудных детей гистогематические барьеры недостаточно зрелые. Наибольшее значение имеет незрелый гематоэнцефалический барьер (ГЭБ), через который, по сравнению со взрослыми, лекарственные вещества поступают в большем количестве в мозг, создавая в нем большие концентрации. Это необходимо учитывать при назначений центрально действующих средств (особенно средств, угнетающих центральную нервную систему) и средств периферического действия. Например, осмотически активные соединения у новорожденных и грудных детей легко проникают в мозг и препятствуют созданию градиента осмотического давления между плазмой крови и цереброспинальной жидкостью, что затрудняет выведение воды из мозговой ткани, при отеке мозга. К тому же назначение осмотических растворов повреждает ГЭБ (происходит его «раскрытие»), что облегчает попадание в мозг других экзогенных и эндогенных (например, билирубина) веществ.
Но ГЭБ — не индифферентная липидосодержащая мембрана, а активная структура, регулируемая мозгом при помощи специальных трофических факторов, определяющих особые свойства эндотелия капилляров мозга (составляющих морфологическую структуру ГЭБ). ГЭБ может осуществлять активный транспорт ряда эндогенных веществ (нейтральных и основных аминокислот) и лекарств, похожих на них по структуре, при помощи специальных носителей, синтезируемых клетками эндотелия кадилляров мозга. Избыток одной аминокислоты (например, фенилаланина) может нарушить этим нормальный обмен
13
мозга и его развитие. В клетках эндотелия капилляров мозга есть специальные рецепторы, способные связывать молекулы пептидов (инсулина, трансферина), вместе с ним проникать внутрь нее, затем пептид путем экзоцитоза выталкивается в интерстициальное пространство мозга. С трансферином в мозг попадает не только железо, но и алюминий. Белки плазмы крови, связывающие липидорастворимые вещества, являются их транспортерами; вступая в контакт с эндотелием капилляров мозга, они подвергаются конформационным изменениям, в результате чего лекарственное вещество отщепляется от них и легко проникает в мозг.
В условиях гипоксии и ацидоза возрастает кровоснабжение мозга, уменьшается ионизация слабых кислот, что способствует их попаданию в мозг.
ЭЛИМИНАЦИЯ
Элиминация — удаление лекарственного вещества из организма путем как биотранформации, так и экскреции.
Различают пресистемную и системную элиминацию. Пресистемная элиминация осуществляется при первом“прохождении вещества через стенку кишечника, печень, легкие до его попадания в систему кровообращения. Системная элиминация — удаление вещества из системы кровообращения.
Биотранформация. Биотрансформация введенных извне химических веществ (в том числе и лекарственных) происходит преимущественно в печени, но может быть и в почках, стенке киШечника, легких, мышцах и в других тканях и органах. В цитозоле гепатоцитов существуют специальные белки — лиган-дины, извлекающие из плазмы крови и связывающие в названных клетках химические вещества, которые уже затем подвергаются биотрансформации. Обнаружены лигандины для нейтральных веществ, анионов, желчных кислот и органических катионов.
Бйотрансформация в основном происходит в два этапа, но химические превращения некоторых веществ могут совершаться и в один этап.
Первый этап заключается в окислении или восстановлении отдельных активных групп в структуре молекулы. Это происходит при участии монооксигеназных систем, основными компонентами.которых являются цитохромы Р-450 (цит. Р-450) и НАДФ-Н цитохрома Р-450 редуктаза. Вещество, подвергшееся воздействию ферментов этой системы, из неполярного или малополярного соединения превращается в более полярное соединение, подготовленное для второго этапа химических превращений, лучше растворимое в воде, экскретируемое почками и хуже проникающее в ткани. В большинстве случаев фармакологическая активность таких метаболитов становится меньше активности исходного вещества. Однако в результате биотрансформации могут образоваться вещества, обладающие такой же и даже большей активностью, чем первоначальное соединение (например, метаболиты новокаинамида).
Цитохромы Р-450 — гемосодержащие ферменты, локализованные в гладком эндоплазматическом ретикулуме клеток печени (и ряда других тканей). Они тесно взаимодействуют с другим ферментом НАДФ-Н-цитохрома Р-450 редуктазой — флавопротеиновым ферментом, тоже локализованном в гладком эндоплазматическом ретикулуме клеток. Десять молекул цитохрома Р-450 взаимодействуют с одной молекулой названной редуктазы.
14
Эта монооксигеназная система подвергает окислительной биотрансформации вещества с ароматическими и алифатическими боковыми цепями: Н-деалки-лированию (имипрамин, сибазон, теофиллин, эритромицин), О-деалкилирова-нию (кодеин, индометацин), ароматическому гидроксилированию (дифенин, фенобарбитал, анаприлин), N-окислению (дапсон), S-окислению (циметидин, тиоридазин), дезаминированию (сибазон, фенамин), алифатическому гидроксилированию (бутамид, ибупрофенн, циклоспорин).
Обнаружено по крайней мере 12 генов, кодирующих образование разных цитохромов Р-450, отличающихся друг от друга аминокислотным составом белковой части фермента и способностью взаимодействовать с разными веществами, участвуя в их биотрансформации. На первом этапе биотрансформации участвуют и другие ферменты, в частности неспецифические эстеразы, амидазы, эпоксид гидролазы. Они локализованы тоже в эндоплазматическом ретикулуме клеток печени, а также в клетках кишечника и некоторых других тканей.
Во многих тканях содержатся протеазы и пептидазы, биотранформирующие полипептидные лекарственные средства.
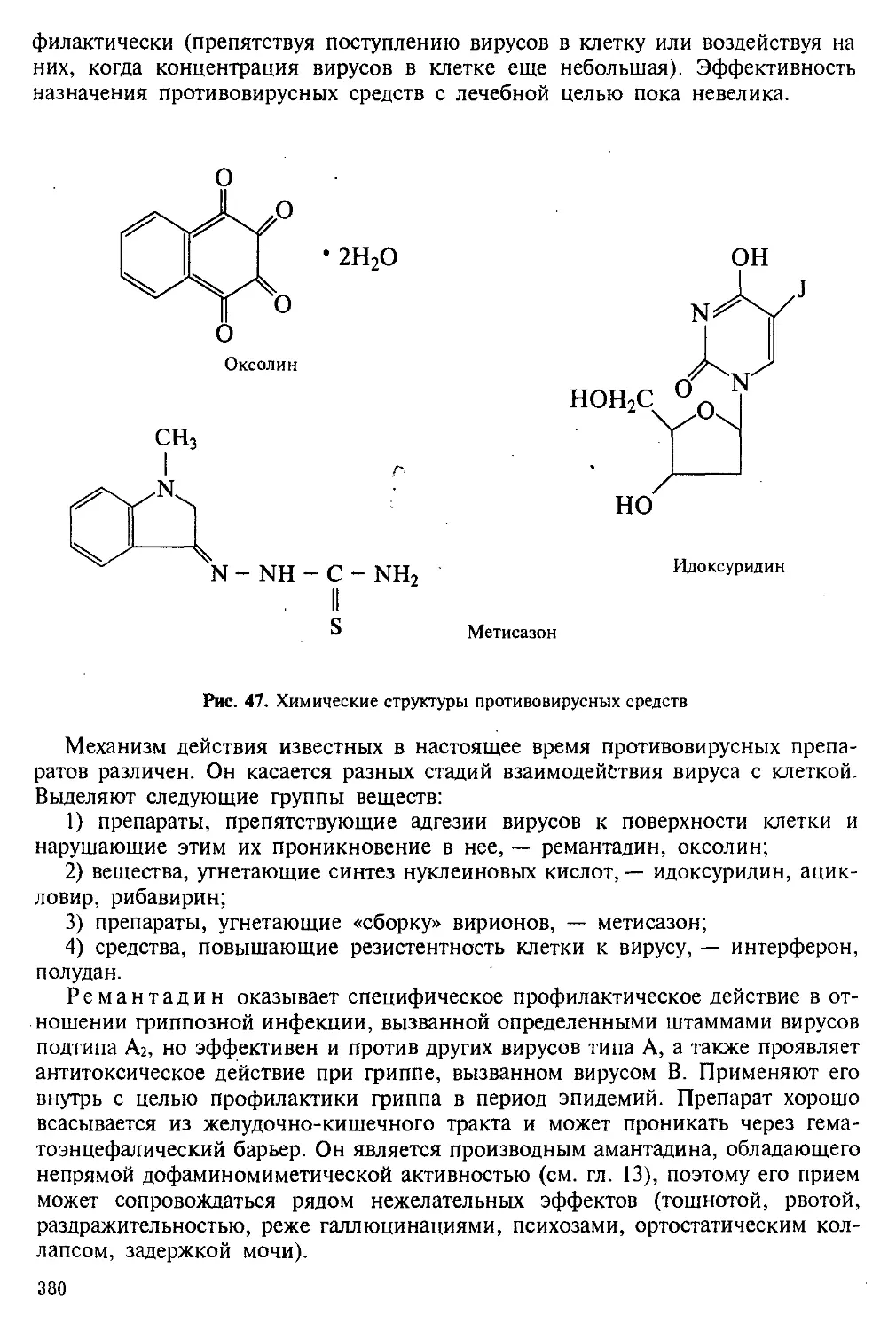
В процессе первого этапа биотрансформации небольшая часть некоторых соединений может превратиться в метаболиты, утратившие первоначальную активность, характеризующиеся способностью очень быстро вступать во взаимодействие с биологически активными группами эндогенных веществ и образовывать с ними прочные соединения. Такие метаболиты называют реактивными. Они надолго задерживаются в тканях и при повторных введениях могут в них накапливаться (кумулироваться). Итогом взаимодействия таких метаболитов с нуклеиновыми кислотами является канцерогенность, мутагенность, тератогенность введенного вещества. Взаимодействие таких метаболитов с ферментами клеток приводит к нарушению их функции и даже к гибели — некрозу. Взаимодействие с белками тканей может привести к образованию сложных антигенов и затем к аллергическим реакциям. Наиболее реактивными метаболитами являются эпоксиды и N-оксиды. В эпоксиды превращаются фенобарбитал (и некоторые другие барбитураты), диэтилстильбэстрол, карбамазепин и некоторые другие бензодиазепины, дифенин, а также содержащийся в дыме табака бензпирен. В N-оксиды превращаются димедрол, фенамин, октадин, триметоприм, некоторые фенотиазины и дд.
Второй этап биотрансформации заключается в образовании парных эфиров с глюкуроновой, серной, уксусной кислотами, а также с глицином, глутатионом. При этом образуются высокополярные соединения, хорошо растворимые в воде, мало растворимые в липидах, плохо проникающие в ткани и в большинстве случаев фармакологически неактивные.
Наибольшее значение имеет процесс глюкуронидации. Основные ферменты, участвующие в этом процессе, — локализованные в микросомах клеток печени, почек, кишечника, мозга, кожи уридиндифосфат глюкуронилтрансферазы, переносящие активированный остаток глюкуроновой кислоты на ароматические и алифатические спирты, карбоксильные кислоты, амины и свободные сульфгидрильные группы эндогенных и экзогенных веществ, образуя S- и N-гдю-куронидные конъюгаты, хорошо растворимые в воде ,и быстро выводимые с мочой.
В цитозоле клеток содержатся сульфотрансферазы, переносящие неорганическую серу от активированного З-фосфоаденозина-5-фосфосульфата на гидроксильные группы фенолов и алифатических спиртов. Группа ацетилтранс-
15
фераз катализирует ацетилирование аминов, гидразинов, сульфаниламидов. Существуют люди с разной активностью этих ацетилирующих ферментов. В связи с этим различают «быстрых ацетилаторов» и «медленных ацетилаторов». У них с разной скоростью происходит ацетилирование соответствующих лекарств. При этом ацетилированные метаболиты нередко хуже растворяются в воде, медленнее выводятся с мочой, чем исходные вещества.
Конъюгация с трипептидом (глутатионом) происходит практически во всех тканях. Глутатионовые конъюгаты затем расщепляются до производных цистеина, которые (в основном в почках) подвергаются ацетилированию, превращаясь в конъюгаты ацетилцистеина, называемые производными меркаптуровой кислоты — меркаптидами, по содержанию которых в моче судят о наличии и активности глутамата в организме.
У новорожденных и детей первых месяцев жизни печень относительно больше (в 2 раза), чем у взрослых. Монооксигеназные системы в ней начинают функционировать еще в гестационный период (с 6—8 нед). В этом состоит существенное отличие человеческого плода от плодов многих других млекопитающих, у которых эти ферментные системы начинают функционировать лишь к концу гестационного пе^рода. Активность монооксигеназных систем в печени новорожденных, конечно, невелика, но они уже способны подвергать биотрансформации ряд лекарственных веществ. Однако в печени новорожденного недостаточно функционируют лигандины, в результате чего захватывание циркулирующих в плазме крови веществ и последующее их удерживание в печени невелики. Это ограничивает их биотрансформацию и превращение как в неактивные, так и в активные (в том числе реактивные) метаболиты.
В печени новорожденных и грудных детей недостаточно зрелы и ферменты второго этапа биотрансформации, участвующие в ацетилировании и особенно в глюкуронидации веществ.
Из-за незрелости ферментных систем печени в плазме крови новорожденных и грудных детей дольше остаются не подвергшиеся биотрансформации исходные жирорастворимые вещества, способные проникать в ткани и давать фармакологические эффекты. Вместе с тем в печени детей этого возраста могут образоваться иные метаболиты, не обнаруживаемые у взрослых. Например, теофиллин (диметилксантин) у взрослых подвергается диметилированию и превращению в неактивное монометильное производное, а у плодов и новорожденных — метилированию и превращению в триметилксантин-кофеин, фармакологическая активность которого высока и качественно отличается от таковой теофиллина. Скорость биотранформации лекарственных веществ после периода новорожденное™ возрастает, достигая взрослого уровня в разные сроки в зависимости от качества второго этапа, которому подвергается данное вещество: образование эфиров с глюкуроновой кислотой к концу второго месяца, соединение с глутамином в три месяца, с глицином в шесть месяцев. В последующие возрастные периоды в связи с интенсификацией биосинтетических процессов в растущем организме ребенка биотрансформация некоторых веществ у детей в возрасте 3—5 лет может происходить даже быстрее, чем у взрослых.
При заболеваниях печени биотрансформация лекарств замедляется, что может способствовать их кумуляции и возникновению нежелательных и даже токсических эффектов. Поэтому таким больным дозу лекарств, подвергающихся биотрансформации в печени, надо уменьшать. Ряд лекарств угнетает функцию 16
печени (левомицетин, тетрациклин, эритромицин, бутамид, кетоконазол, циметидин, оксолиновая кислота), нарушает биотрансформацию других лекарств, принятых на их фоне, и повышает риск возникновения их нежелательных эффектов. Примером может служить интоксикация теофиллином, развивающаяся от обычных его доз на фоне приема эритромицина. Но есть вещества, повышающие активность печени, индуцируя в ней синтез ферментов, участвующих в первом и втором этапах биотрансформации как эндогенных, так и экзогенных (в том числе лекарственных) веществ. К таким лекарствам относятся: фенобарбитал, зиксорин, дифенин, гексамидин, карбамазепин, рифампицин, димедрол, супрастин. Они ускоряют метаболизм и эндогенных (витаминов, гормонов), и экзогенных веществ, снижая их эффективность. Например, рифампицин снижает эффективность пероральных противозачаточных средств. Фенобарбитал и зиксорин специально назначают для ускорения метаболизма билирубина у новорожденных с гипербилирубинемией.
Экскреция. Лекарственное вещество может быть экскретировано печенью, почками, кишечником, легкими, молочными железами и некоторыми другими железами внешней секреции.
Печень экскретирует с желчью в кишечник как неизмененные (преимущественно полярные соединения), так и образовавшиеся в ней метаболиты, в том числе эфиры глюкуроновой и других кислот. Ионизированные и высокополярные молекулы обратно не всасываются и выводятся вместе с фекалиями. Малополярные соединения, растворимые в липидах, реабсорбируются из кишечника в кровь, поддерживая в ней и тканях свою концентрацию, а затем вновь экскретируются с желчью. Так осуществляется кишечно-печеночная (эн-терогепатическая) циркуляция веществ, продолжающаяся до тех пор, пока оно не подвергнется биотрансформации и не превратится в водорастворимый метаболит, экскретируемый почками. У новорожденных в стенке кишечника активно функционирует fl-глюкуронидаза, расщепляющая эфиры глюкуроновой кислоты с освобождением из них неполярного, легко реабсорбирующегося исходного вещества. Таким образом, у новорожденного процесс энтерогепати-ческой циркуляции может осуществляться в большей степени, чем у взрослых.
Основной экскретирующий орган — почки. Выведение ими лекарственных веществ может происходить пассивно —аДтутем клубочковой фильтрации и активно — путем канальцевой секреции. Интенсивность выведения вещества почками может быть ограничена процессами активной и пассивной реабсорбции.
В клубочках почек фильтруются вещества с молекулярной массой до 5000— 10 000, не связанные с белками плазмы крови. Интенсивность фильтрации зависит от кровоснабжения почек, артериального давления и др. У новорожденных висцеральный листок капсулы почечного клубочка (капсула Шумлян-ского-Боумена) выстлан высоким цилиндрическим, а не низким плоским, как у взрослых, эпителием. Это создает большее препятствие для фильтрации. У новорожденных проницаемость пор базальной мембраны и фильтрующая поверхность на единицу поверхности тела в 2 раза меньше, чем у взрослых. Кроме того, у новорожденных всего 5—8% (вместо 15-25% у взрослых) минутного объема крови попадает в почки. Наконец, в этом возрасте сосуды почек характеризуются высокой резистентностью, а фильтрационное давление невелико. В результате процесс фильтраций у новорожденных осуществляется
17
медленнее, чем в более старшем возрасте. Уровень фильтрации взрослого достигается примерно к 6—12 месяцам, но в это время названная функция еще очень лабильна и меняется в зависимости от состояния функции почек и всего организма.
Активная секреция ионизированных и полярных веществ происходит в проксимальных канальцах почек при участии специальных транспортных систем (отдельно для кислот и для оснований), нуждающихся в хорошем снабжении энергией. Эти транспортные системы насыщаемы и малоизбирательны. В результате одни органические кислоты (или основания) могут нарушить выведение других органических кислот (или оснований). Любое нарушение гемодинамики или дыхания, приводящее к гипоксии и к уменьшению образования энергии, угнетает процесс активной секреции канальцев. Связывание лекарственных веществ с белками плазмы крови не только не препятствует их канальцевой секреции, но может даже ей способствовать, так как белки выполняют в данном случае транспортную роль, доставляя вещества к канальцам.
У новорожденных и грудных детей меньше масса тубулярных клеток, длина и кровоснабжение канальцев, в них еще мало функционируют транспортные системы. Поэтому вещества, удаляемые путем активной секреции, исчезают из организма детей медленнее, чем у взрослых. Постепенно скорость канальцевой секреции возрастает и к одному году достигает постоянного уровня. Однако для разных веществ это происходит в разные сроки; для пенициллина, например, уже к концу первого месяца.
Процесс реабсорбции катионов, анионов, глюкозы, аминокислот происходит активно, а жирорастворимых, неполярных молекул после повышения их концентрации в моче — пассивно. В кислой моче кислоты (барбитураты, салицилаты и пр.), а в щелочной — основания (алкалоиды, местные анестетики, амидопирин и пр.) находятся преимущественно в виде неполярных, хорошо растворяющихся в липидах молекул и быстро реабсорбирующихся.
У новорожденных и грудных детей моча преимущественно кислая (это же отмечают у детей любого возраста при циститах), поэтому у них органические кислоты легче реабсорбируются и задерживаются в организме, а основания выводятся быстрее.
Выведение лекарственных веществ с молоком матери. В педиатрии это имеет большое значение, так как может быть причиной возникновения у грудных детей нежелательных эффектов. Поэтому кормящим женщинам противопоказаны: мидантан (амантадин — противогриппозное средство), левомицитин, тетрациклины (антибиотики), налидиксовая кислота, триметоприм (противо-инфекционные средства), резерпин (антигипертензивное средство), антитиреоидные средства типа тиоурацила, радиоактивные препараты йода, алкалоиды спорыньи (прекращающие маточные кровотечения), морфин (анальгетик), противоопухолевые средства и некоторые другие.
МЕХАНИЗМ ДЕЙСТВИЯ (ФАРМАКОДИНАМИКА) ЛЕКАРСТВЕННЫХ СРЕДСТВ
Механизм действия лекарств связан с их воздействием на физиологические, патофизиологические и биохимические процессы, происходящие в организме человека.
18
Фармакодинамика подавляющего большинства лекарственных средств является следствием их влияния на функцию биологически активных веществ (БАВ), участвующих либо в передаче нервного импульса, либо являющихся гормонами, витаминами, аминокислотами, метаболитами и пр.
Многие лекарственные вещества могут изменять активность рецепторов (компонентов цитоплазматической мембраны, внутриклеточных структур, в том Числе ферментов, структурных белков и пр.), существующих в организме для взаимодействия с БАВ. Для каждого эндогенного БАВ существуют специфические рецепторы. Лекарства же могут быть в разной степени похожими (по структуре, пространственному расположению частей молекулы) на эти эндогенные вещества. Их структурные аналоги или вещества очень похожего строения могут взаимодействовать с соответствующим рецептором, вызывать его возбуждение и имитировать эффект эндогенного вещества. Лекарственные средства, менее похожие по структуре на БАВ, тоже могут взаимодействовать с рецептором, слегка его возбуждать, но блокировать реакцию на эндогенное БАВ и его агонисты (неполный антагонист, антагонист с внутренней миметической активностью). Наконец, лекарственное вещество может взаимодействовать с рецептором и полностью блокировать его реакцию и на соответствующее БАВ, и на его агонисты.
Лекарства могут вступать в связь не с самим рецептором, находящимся, например, на поверхности клеточной мембраны, а с другими ее компонентами, окружающими рецептор. При этом могут произойти изменения в пространственном расположении компонентов мембраны так, что рецептор станет более или менее доступным для БАВ. В результате может возникнуть либо сенсибилизация (повышение чувствительности), либо десенситизация (снижение чувствительности) рецептора по отношению к БАВ. Поскольку в этом случае лекарство влияло не на рецепторы, а на другие участки мембраны, то этот эффект называют аллостерическим (от греч. alios — другой).
Рецепторы для БАВ могут находиться не только на поверхности клеточной мембраны, но и внутри клетки, в частности в цитоплазме.
Взаимодействие лекарственных средств — аналогов БАВ — с рецепторами, расположенными на поверхности клеточных мембран или внутри клетки, приводит (как и при контакте с БАВ) к возникновению сигнала для начала активности клетки. Как уже сказано, д$я каждого БАВ существуют свои рецепторы, нередко разные (по 2—5 и более). Но реакции клеток на возникший сигнал обычно развиваются с помощью внутриклеточных посредников (мессенджеров) и могут оказаться одинаковыми независимо от качества БАВ или похожего на него вещества.
Рецептор, локализованный на поверхности клеточной мембраны, может быть компонентом (доменом) системы, в которую помимо самого рецептора входит каталитическая (ферментная, энзиматическая) субъединица (домен), находящаяся внутри клетки. Оба компонента (домены) связаны друг с другом короткой цепью из гидрофобных остатков аминокислот внутри самой клеточной мембраны (см. схему 1).
Такими рецепторами являются, например, рецепторы для полипептидных гормонов, регулирующих рост, дифференцировку, развитие й иногда быстрые метаболические реакции. Эти рецепторы представляют собой протеинкиназы, катализирующие фосфорилирование протеинов-мишеней. Мишенями могут быть энзимы (в том числе другие киназы), регуляторные или структурные протеины. Фосфорилирование изменяет активность этих протеинов. В них
19
А. Рецепторы, связанные с энзимами
Наружная поверхность клеточной мембраны
Цитоплазма
Энзимы: тирозин киназы, тирозинфосфатазы, серинкиназа, треонинкиназа, гуанилатциклаза
Б. Лигандзависимые ионные каналы
Наружная поверхность клеточной мембраны
Ионный канал
Рецепторы: для ацетилхолина (Н), гамма-аминомасляной кислоты (А), глицина, серотонина (3)
В. Рецепторы, связанные с G-протеииами (ос-, ₽-, у-субъединицы) (на внутренней поверхности клеточной мембраны)
Рецептор
Лиганд + рецептор
ГДФ + а, Р, у а + ГТФ >
Сигнал
а + ГТФ + эффектор
' t
ГТФаза
ГДФ + а, Р, У
Эффектор
Г. Рецепторы в цитоплазме
Схема 1. Варианты рецепторов
чаще фосфорилируются остатки тирозина с помощью тирозинкиназ (см. схему 1), например в рецепторах для инсулина, эпидермального ростового фактора, некоторых лимфокинов. Фосфорилироваться могут остатки серина или треонина в протеинах, например при взаимодействии рецептора с трансформирующим ростовым Р-фактором.
Рецепторы могут быть связаны не с протеинкиназами, а с внутриклеточной гуанилатциклазой, образующей вторичный мессенджер—гуанозинмонофосфат (ГМФ), например, рецептор, взаимодействующий с предсердным натриурети-ческим пептидом.
20
Рецепторы для различных нейромедиаторов могут быть у медиаторозависимых (лигандозависимых) ионных каналов в плазматических мембранах клеток, по которым происходит передвижение ионов как внутрь, так и из клетки. Например, рецепторы для ацетилхолина (Н), гамма-аминомасляной кислоты: ГАМК-А, рецепторы для глутамата, аспартата, глицина, серотонина (3). Эти каналы являются частью сложной структуры, состоящей из нескольких компонентов, способных реагировать на различные агонисты и антагонисты названных БАВ.
Рецепторы могут быть связаны с G-протеинами. Эти рецепторы для биологических аминов, эйкозаноидов (простагландинов, лейкотриенов и пр.), многих пептидных гормонов. Взаимодействие названных БАВ с соответствующими рецепторами облегчает связывание гуанозинтрифосфата (ГТФ) со специфическими G-белками, которые в свою очередь регулируют активность специфических эффекторов. Этими эффекторами (исполнителями) могут быть энзимы: аденилатциклаза (АЦ), фосфолипазы (ФЛазы), А2, С, Д; каналы для кальция, калия, натрия; некоторые транспортные протеины. В каждой клетке может быть много G-протеиноВ; каждый из них регулирует активность различных эффекторов, изменяя при этом функцию клетки. G-протеины связаны с внутренней поверхностью мембраны клетки, они состоят из трех субъединиц — а, Р, у, отличаясь друг от друга качеством а-субъединицы (см. ниже). В неактивном состоянии G-протеин связан с гуанозиндифосфатом (ГДФ). После взаимодействия БАВ (или его агониста) с рецептором происходит связывание а-субъединицы с ГТФ, отщепление ГДФ, диссоциация G-протеина с освобождением комплекса р-, у-субъединиц. Комплекс а-субъединицы с ГТФ взаимодействует с эффектором. В этом и заключается сигнал.
Прекращение сигнала связано с активностью ГТФазы, отщепляющей фосфат от ГТФ, превращая его в ГДФ. При этом а-субъединица снова образует комплекс с р-, у-субъединицами и с ГДФ. Образовавшийся комплекс снова готов к передаче сигнала (см. схему 1, В).
Как уже сказано, от качества а-субъединицы зависит активность G-протеина и его влияние на эффектор, так:
as — субъединица активирует аденилатциклазу;
ai — тормозит аденилатциклазу;
ао — тормозит ток Са++ внутрь клетки; ы
aq — активирует фосфолипазу С;
аи — активирует Na+/H+ обмен;
at — активирует фосфодиэстеразу для ГМФ в органе зрения;
а? — активирует аденилатциклазу в системе обоняния.
Комплекс Ру-субъединиц регулирует:
— лигандзависимый ток К+;
— аденилатциклазу;
— фосфолипазу С.
Комплекс Ру-субъединиц может регулировать названные энзимы самостоятельно или вместе с а-субъединицей.
Рецепторы, локализованные в цитоплазме, взаимодействуют с липидорастворимыми гормонами (стероидами, тиреоидными гормонами), витаминами (D, ретиноидами). Образовавшийся комплекс рецептора с лигандом проникает в ядро, где и происходит транскрипция соответствующих генов.
Вторичные внутриклеточные мессенджеры (посредники): аденилатциклаза, фосфолипаза С, Са++ и др.
21
Аденилатциклазы — группа по крайней мере 10 изоэнзимов (специфичных для разных тканей), переводящих АТФ в циклический аденозинмонофосфат (цАМФ), который регулирует целый ряд внутриклеточных метаболических процессов.
В зависимости от качества рецептора, вещества, воздействующего на него и а-субъединицы G-протеина может произойти активация или торможение АЦ (см. схему 2). \
Существует много различных БАВ и лекарств, способных активировать Gs или G, протеины (содержащие соответственно о^- или агсубъединины) и в результате стимулировать или тормозить активность АЦ (см. табл. 1). При этом одно и то же вещество, влияя на разные рецепторы, может вызвать противоположные эффекты.
Таблица 1
Биологически активные вещества, влияющие на аденилатциклазу после взаимодействия со своими рецепторами (названы в скобках)
БАВ, активирующие АЦ БАВ, тормозящие АЦ
Адреналин ((3-адренорецепторы) Адреналин (а2-адренорецепторы)
Изадрин (то же) Норадреналин (то же)
Дофамин (дофаминовыеррецепторы) Ацетилхолин (М2 и (УЦ-холинорецепторы)
Серотонин (cepoTOHHHOBbieiv, vj. virPe4enT0Pb|) Дофамин (дофаминовыец-рецепторы)
Гистамин (гистаминовы'ец-рецепторы) Аденозин (дденозиновыеррецепторы)
Аденозин (аденозиновыец-рецепторы) Эндорфины и энкефалины (опиатные рецепторы)
Вазопрессин (вазопрессиновые|-рецепторы) Ангиотензинц
Тиреотропин Тромбин
Фитогемаглютинин Серотонин (серотониновыеррецепторы)
Активация АЦ повышает образование цАМФ и вызывает в связи с этим ряд эффектов. Среди них большое значение имеют следующие.
Облегчение поступления Са++ в клетку (через медиатор-зависимые каналы), где он инициирует многочисленные процессы.
Повышение активности протеинкиназ, фосфорилирующих различные белки, в которых акцепторами фосфата являются серин, треонин и реже тирозин — компоненты либо ферментов (что и приводит их-в состояние активности), либо структурных белков (что приводит к изменению конформации белков мембран, хроматина, регуляторных субъединиц киназ, выполняющих роль активатора или репрессора соответствующего гена в ядре клетки).
Активирование процесса трансметилирования, в котором донатором метильных групп является S-аденозилметионин (превращающийся после отдачи метильной группы в S-аденозил гомоцистеин), а акцепторами — ДНК, РНК, белки хроматина, мембран, кальмодулин (внутриклеточный белок, связывающий Са++ и мбдулирующий его эффекты), фосфолипиды мембран, гормоны и пр. Метилирование названных веществ меняет их активность, в том числе ферментов, свойства ионных каналов, транспортных белков и пр. Метилирование фосфолипидов меняет текучесть мембран, их эластичность (ийеет значение для эритроцитов).
22
Наружная поверхность мембраны
АТФ
цАМФ
Внутренняя поверхность мембраны
Схема 2. Стимуляция1 и ингибирование аденилатциклазы (объяснение смотри в тексте)
Иными словами, изменяя активность АЦ и БАВ, и лекарственные вещества могут повлиять на многие функции клеток, органов, тканей: повысить или затормозить освобождение нейромедиаторов, гормонов, сокращение кардиомиоцитов или гладких мышц, активность ферментов печени и в других тканях, агрегацию тромбоцитов и многое другое.
Прекращается активность цАМФ под влиянием фосфодиэстараз, переводящих цАМФ в нециклический АМФ. Различают несколько этих ферментов, специфичных для разных тканей.
Активируя Gq-протеин (содержащий ац-б^бъединицу), многие БАВ и лекарства стимулируют систему фосфатидилинозитолов. Перечислим их:
1) активаторы системы:
ацетилхолин (М,-, М3- и М5-холинорецепторы);
норадреналин (ai-адренорецепторы);
адреналин (агадренорецепторы);
гистамин (гистаминовыегрецепторы);
серотонин (серотониновыеп-рецепторы);
глутаминовая кислота;
ангиотензин (ангиотензиновыец-рецепторы);
брадикинин;
холецистокинин;
глюкагон (глюкагоновыегрецепторы);
вещество Р;
фактор, активирующий пластинки;
тромбин;
аденозинтрифосфат (пуриновыеи-рецепторы);
23
люлиберин;
тиреолиберин;
инсулин; глюкоза;
2) ингибиторы системы:
норадреналин (аг-адренорецепторы);
дофамин (Дгрецепторы).
Фосфатидилинозитол (ФИ) представляет собой эфир инозитола (шестиатомного спирта) с диацилглицеролом (диацилглицерином), в котором водород двух гидроксильных групп замешен на жирные кислоты, одна из них — арахидоновая кислота (см. схему 3). ФИ может иметь дополнительно одну или две фосфатные группы, такие метаболиты называют фосфатидилмонофосфат (ФИФ) и фосфатидилдифосфат (ФИФ2). После взаимодействия нейромедиаторов, аминокислот, гормонов и других веществ со своими рецепторами последние вступают в контакт с Gq-протеинами, после чего происходит активация фосфолипазы С, расщепляющей ФИФ2 на инозитолтрифосфат (ИФ3) и диа-цилглицерол (ДАГ)- ИФ3 взаимодействует с внутриклеточными рецепторами, раскрывая канал, по которому Са++ из депо (кальцисом эндоплазматического ретикулума) поступает в цитоплазму клетки (1 молекула ИФ3 освобождает 20 ионов Са). ИФ3 после взаимодействия со своим рецептором и освобождения Сат+ немедленно прекращает активность, так как подвергается либо дефосфорилированию (до инозитола, утилизируемого для ресинтеза ФИ), либо фосфорилированию (до ИФ6-фитина, являющегося источником фосфатных групп). ДАГ взаимодействует со своим внутриклеточным рецептором — протеинкиназой С (ПК С), образует с ней комплекс, который может немедленно инициировать деятельность клетки, зависящую от ее функциональной роли (освобождение медиаторов из аксонов нейронов, секрецию эндокринных и экзокринных желез и пр.), а также активировать процессы роста и деления клеток, экспрессию генов и др. ДАГ затем отщепляется от ПК С, подвергаясь либо фосфорилированию и превращению в фосфатидиевую кислоту (утилизируемую для ресинтеза ФИ), либо под влиянием фосфолипазы А2 расщепляется с освобождением арахидоновой кислоты, метаболиты которой (простагландины, лейкотриены) могут стать посредниками уже следующего этапа биохимических процессов в клетке. Освободившаяся от ДАГ протеинканаза С возвращается в цитозоль клетки, где взаимодействует со следующими молекулами ДАГ, образующимися из ФИФ2 под влиянием очередного сигнала.
Биохимические процессы, инициированные цАМФ, ИФ3 или ДАГ, приводят к накоплению в клетке Са++, свободных радикалов кислорода, особенно гидроксильного иона ‘ОН, гидроперекисей жирных кислот, эндоперекисей простагландинов (ПГ,С и Н) и пр., которые активируют находящуюся в цитозоле клеток гуанилатциклазу (ГЦ), переводящую ГТФ в цГМФ, который инициирует различные процессы в клетках. Назовем лишь некоторые из них. Наиболее важно ограничение активности цАМФ, например, путем его инактивации ФДЭой-1 и удаления Са++ из клетки. Полагают, что увеличение образования цГМФ — реакция на образование цАМФ по принципу отрицательной обратной связи. Так, цГМФ уменьшает силу сердечных сокращений, увеличенную цАМФ, и расширяет коронарные сосуды, защищая сердце от чрезмерного расходования энергетических ресурсов. цГМФ оценивают как неспецифический стресс-сигнал 24
ФИФ2
ДАТ
Медиаторы
R r Гормоны
1,11 , I,
О = С С = О ФЛ С + Пр G $ Рец $
II J 5
О о I I н2с - сн -сн2
Клеточная мембрана
Ri R2
I I
О = С с = о
I • I
о о
I I
н2с - сн -сн3
ДАТ ИФ,
Протеинкиназа С 'I'
ДАТ + ПКС
Освобождение нейромедиаторов
Секреция гормонов
Рост клеток
Деление клеток и пр.
ОБОЗНАЧЕНИЯ:
Кальцисомы ЭПР
I
Освобождение Са++
Рец — рецептор
ФИФ2 —Фосфатидилинозитолдифосфат
ИФз — Инозитолтрифосфат
ДАГ — диацилглицерол
Фл С — фосфолипаза С
Пр G — протеин G
ПК С — протеинканаза С
Ri R.2 — жирные кислоты (R.2 — арахидоновая кислота)
Влияние
Гидролиз Результат
Схема 3. Система фосфатидилинозитолов
25
приближения к необратимым изменениям в окислительно-восстановительных процессах и ионном гомеостазе клетки. /
Ионы кальция — внутриклеточные посредники 3-го порядка в активности многих БАВ и их аналогов, стимулирующих образование цАМФ или гидролиз ФИФ2 и либо увеличивающих поступление его в клетку, либо освобождающих его из внутриклеточных депо (эндо- или саркоплазматического ретикулума, митохондрий). Повышение внутриклеточной концентрации кальция активирует процессы освобождения нейромедиаторов, .сокращения миокарда, скелетных и гладких мышц, секрецию эндо- и экзокринных желез, агрегацию тромбоцитов; Са++ повышает активность многих ферментов, участвующих в белковом, жировом и углеводном обмене, способствующих освобождению арахидоновой кислоты из фосфолипидов и пр. Посредником в активности Са++ является кальмодулин — белок, состоящий из 148 остатков аминокислот. Комплекс кальмодулина с Са++ стимулирует функцию многих ферментов: фосфодиэстераз циклических нуклеотидов (цАМФ и цГМФ), протеинканаз, зависящих от этих нуклеотидов, Са++-, Mg++-ATФaзы цитоплазматической мембраны, фосфорилазы, киназы гликогенсинтетазы, фосфолипазы А2, сукциндегидрогеназы, N-метилтрансферазы и многих других. Под влиянием этого комплекса (кальмодулина с Са*+) мбгут одновременно увеличиваться процессы образования цАМФ и распада цГМФ. Кальмодулин участвует в регуляции деления клеток (стимулируя синтез ДНК, вступление клетки в фазу митоза), в сократительной функции миокарда, склелетных мышц, миометрия.
Кроме кальциевых каналов, открывающихся под влиянием различных медиаторов и гормонов (стимулирующих образование цАМФ), существует по крайней мере три типа «медленных» кальциевых каналов, открывающихся под влиянием деполяризации клеточной мембраны (потенциал- или вольтажзави-симые каналы). В настоящее время существует большая группа лекарственных веществ (блокаторы кальциевых каналов), блокирующих эти потенциалзависимые каналы, препятствующих поступлению Са++ внутрь клетки и этим ограничивающих его чрезмерную активность. Некоторые лекарства могут тормозить кальмодулин.
В фармакодинамике ряда лекарственных средств имеет значение их способность взаимодействовать (вместо БАВ) с ферментами (холинэстеразами, моно-аминоксидазами, редуктазой фолиевой кислоты, кининазами, ангиотензин-кон-вертирующим ферментом, плазмином, калликреином, синтетазой оксида азота и др.), тормозить их активность и этим изменять зависимые от них биохимические процессы.
В фармакодинамике лекарств могут иметь значение и другие способы воздействия на биологические процессы. Они рассмотрены в частных главах учебника.
ПОНЯТИЕ О ХРОНОФАРМАКОЛОГИИ
Хронофармакология — составная часть хрономедицины. Она изучает зависимость терапевтического эффекта лекарств от биоритма физиологических, патологических процессов в организме человека, а также влияние лекарственных средств на эти биоритмы.
Известно, что многие функции в организме человека осуществляются с определенным ритмом. Различают околосуточные (циркадианные) колебания
26
физиологических процессов, месячные и сезонные периодизмы. От них зависят изменения в чувствительности (хронэстезии) ко многим лекарствам и .в их фармакокинетике (хронокинетике). Изменения в чувствительности связаны с ритмическими изменениями в секреции гормонов, освобождения нейромедиаторов, активности внутриклеточных посредников (цАМФ, фосфатидилинозитолов). Изменения в кинетике связаны с различной скоростью секреции желудочного сока (и его количества), поджелудочной железы, печени, колебаниями в интенсивности метаболических процессов в печени и других органах, выделительной функции почек и пр.
В развитии патологических процессов тоже существует околосуточные и другие колебания. Например, повышение артериального давления у многих больных, страдающих гипертонической болезнью, происходит в 18-20 ч. У лиц, страдающих бронхиальной астмой, могут быть индивидуальные варианты подъема тонуса гладкой мускулатуры бронхов. Поэтому антигипертензивные средства более рационально назначать перед подъемом артериального давления (в 13-17 ч), а не равномерно на протяжении всего дня. Это и повышает результативность лечения, и уменьшает риск возникновения нежелательных эффектов. Определив ритм повышения тонуса бронхиальной мускулатуры у больного бронхиальной астмой, тоже можно назначать соответствующие препараты перед его подъемом, а не весь день.
Уже давно суточную дозу глюкокортикоидов делят на два приема в сутки: утром 2/3 дозы, а днем — остальную 1/3, чтобы имитировать физиологические колебания уровня гормона в крови. Стимулирующее же влияние АКТГ на кору надпочечников наиболее выражено после полуночи, поэтому его более рационально вводить в поздние вечерние часы.
Лекарственные вещества могут нарушить биологические ритмы человеческого организма, особенно если одновременно применять несколько лекарств (полипрагмазия). Возникающая дизритмия вначале проявляется понижением умственной и физической работоспособности, вегетативными нарушениями, а потом и в более тяжелой патологии. Появились сведения, что одна из новых групп лекарственных веществ — адаптогенов (препараты элеутерококка, левзеи, лимонника, дибазол, физиологические дозы витаминов) способствуют восстановлению нормальных биоритмов и улучшению функций организма.
Исследования в области хронофармакологии в самом начале, но они имеют очень большое значение, так как позволяют более рационально применять лекарственные средства, добиваясь большего успеха от меньших доз и с меньшим числом нежелательных эффектов.
НЕЖЕЛАТЕЛЬНЫЕ
ЭФФЕКТЫ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ
Нежелательные эффекты лекарственных веществ — объединяющее понятие для побочных (ненужных), токсических (опасных) и неспецифических (аллергических) эффектов лекарственных препаратов.
Нежелательные эффекты могут быть следствием разных причин.
I. Результат механизма действия (фармакодинамики) лекарств. Так, атропин назначают для устранения брадикардии, но он одновременно может вызвать у больного сухость слизистых оболочек полости рта, голосовых связок. Все
27
эти эффекты — результат блокирования атропином холинорецепторов. Индометацин тормози? образование простагландинов, поэтому вызывает противовоспалительный эффект, но одновременно увеличивает секрецию кислого желудочного сока, что у значительного процента больных, особенно у детей до 7 лет, может способствовать ульцерации слизистой оболочки желудка.
II. Результат передозировки или кумуляции (накопления) вещества при повторном его введении. Передозировка может быть из-за ошибки в приеме или назначении лекарства. Накопление же чаще возникает у больных с нарушенной выделительной функцией почек при приеме таких лекарственных средств, как дигоксин, гентамицин, стрептомицин, фурадонин, полимиксин Б и пр., выводимые с мочой в неизмененном виде. Например, при лечении кумулировать могут не только принятые лекарства, но и их метаболиты. Так, метаболиты лидокаина выводятся из организма медленнее, чем он сам: они могут накопиться и нарушить функцию центральной нервной системы, так как обладают судорожным действием.
III. Результат образования реактивных метаболитов, особенно эпоксидов и N-оксидов (см. стр. 15), вызывающих цитотоксические, мутагенные, канцерогенные, тератогенные эффекты, Аллергические реакции.
IV. Результат генетических особенностей организма, проявляющихся в недостаточной продукции или функции ферментов, инактивирующих лекарственные вещества. Например, в организме может синтезироваться особая бутирилхолин-эстераза, что никак не сказывается на его функционировании, но нарушает гидролиз миорелаксанта дитилина и новокаина. В результате введение этих препаратов может вызвать более длительную миорелаксацию (не 1—3 мин, как обычно, а 30—40 мин и больше) и падение артериального давления соответственно.
Недостаточность глюкозо-6-фосфатдегидрогеназы в эритроцитах нарушает в них функцию восстанавливающих ферментов (метгемоглобинредуктазу, глута-тионредуктазу), и при приеме окисляющих лекарственных средств у больных появляются метгемоглобинемия и гемолиз эритроцитов. Это может быть при приеме хингамина, ацетилсалициловой кислоты, фенацетина, парацетамола, амидопирина, сульфаниламидных препаратов, нитрофуранов, викасола, левомицетина и пр.
У больных с недостаточностью уридиндифосфоглюкуроновой кислоты прием лекарств, подвергающихся глюкуронидации в печени, приводит к увеличению уровня непрямого билирубина в крови (без признаков гемолиза эритроцитов). Такое явление может быть при приеме викасола, никотиновой кислоты, эстрогенов, андрогенов, глюкокортикоидов, трийодтиронина, левомицетина, сульфаниламидов, барбитуратов, парацетамола и пр.
V. Аллергические реакции, возникающие от приема лекарственных средств, обладающих антигенными свойствами, от образования их метаболитов с такими же свойствами, от образования комплексов самих лекарственных средств или их метаболитов с белками крови, компонентами клеточных мембран и пр. Эти реакции обычно возникают через 7—9 дней после первого приема препарата. Аллергические реакции могут быть немедленного и замедленного типа.
VI. Ложные аллергические реакции, возникающие из-за активации системы комплемента или освобождения медиаторов гиперчувствительности немедленного типа без участия JgE. Это наблюдают, например, при введении йодосо-28
держащих рентгеноконтрастных веществ, ампицилина. От последнего у больных (особенно у детей, страдающих инфекционным мононуклеозом или цитомегалией) может появиться на внутренней поверхности конечностей макулярная, реже — папулярная сыпь. Она обычно исчезает самостоятельно в течение 6 дней, несмотря на продолжающийся прием препарата.
ДЛИТЕЛЬНОЕ ПРИМЕНЕНИЕ ЛЕКАРСТВ
При длительном применении лекарств может произойти изменение реакции на них.
1. Может снизиться эффективность лекарств — произойти привыкание к нему, например, при длительном применении нитроглицерина (улучшающего коронарный кровоток), салбутамола и других p-адреномиметиков (при бронхиальной астме), противоопухолевых средств и пр. Это является следствием либо истощения эндогенных метаболитов, участвующих в их фармакодинамике (как в случае с нитроглицерином), либо десенситизации рецепторов, реагирующих на лекарственное вещество (как в случае с p-адреномиметиками), либо увеличения содержания в мембране клеток особого Р-гликопротеина, активно удаляющего из них многие противоопухолевые вещества. Снижение реакции на некоторые вещества можно преодолеть. Если привыкание происходит быстро, в течение нескольких часов или дней, то это явление называют тахифи-лаксией.
2. Происходит повышение толерантности (переносимости) к лекарственному веществу. Это может быть, например, следствием индуцирования в печени ферментов, инактивирующих данное лекарство и этим снижающих его активность. Такое явление наблюдается при приеме барбитуратов, дифенина; для получения эффекта больному приходится принимать большие дозы препарата, чем в начале лечения.
3. Наблюдается развитие психической и физической зависимости от лекарства — наркомании. Это явление возникает от приема лекарственных средств, вызывающих хорошее самочувствие (эйфорию), улучшающих настроение, иногда появление каких-то галлюцинаций, необычных психических реакций (особенно легко эта зависимость возникает у подростков). Сначала из любопытства человек хочет еще раз испытать пережитые им ощущения. Однако они не всегда повторяются, а если возникают, то уже от ббльших доз. После нескольких приемов человек уже не может отказаться от употребления этого вещества, так как оно стало необходимым для поддержания деятельности мозга (см. гл. 6), и исчезновение его из организма вызывает тяжелые явления лишения — абстиненцию, то есть человек становится зависимым от данного вещества — наркоманом.
Вещества, вызывающие явления психической и физической зависимости, называют наркотическими — наркотиками (не путать со средствами общей анестезии, вызывающими состояние наркоза). К ним относят: опий и его алкалоиды (морфин, кодеин, героин), промедол и другие синтетические наркотические анальгетики (см. гл. 6), некоторые барбитураты, кокаин, фенамин (амфетамин), этанол (этиловый спирт), а также вещества типа марихуаны (гашиш, план, анаша), не применяемые в медицине.
Длительное употребление наркотиков вызывает тяжелые психические и физические расстройства организма человека, что может стать причиной его
29
гибели. Наркоманы опасны для общества, так как они готовы на любое преступление ради получения ставшего необходимым для них наркотика. В связи с этим к применению названных веществ, особенно у подростков и психически неуравновешенных людей, следует относиться с крайней осторожностью и по возможности избегать их назначения. Эти препараты хранятся в шкафу А, отпускаются по рецептам, выписанным на специальных бланках.
ОТРИЦАТЕЛЬНОЕ ВЛИЯНИЕ
ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ НА ЭМБРИОН И ПЛОД
Лекарственные вещества способны вызвать нежелательные действия: эмбри-отоксическое, тератогенное и фетотоксическое, которые могут быть следствием прямого токсического влияния на плод, а также результатом нарушений гемодинамики в фетопланцентарной системе, гормонального, витаминного, минерального баланса в организме беременной женщины и ее плода.
Эмбриотоксический эффект — повреждение неимплантированной бластоцисты, приводящее в большинстве случаев к ее гибейи. Этот эффект могут вызвать барбитураты, салицилаты, антиметаболиты, сульфаниламиды, никотин и некоторые другие вещества.
Тератогенный эффект возникает преимущественно в результате приема лекарственных средств с 3-й по 10-ю неделю беременности. Он заключается в нарушении дифференцировки тканей плода, из-за чего может родиться ребенок с пороками развития конечностей, головы, внутренних органов: сердца, желудочно-кишечного тракта, мочеполовой системы, центральной нервной системы и др. В зависимости от особенностей порока ребенок может оказаться нежизнеспособным и погибнуть вскоре после рождения, а может остаться инвалидом на всю жизнь. Некоторые пороки (половой системы, органов зрения, слуха, а также нарушения интеллекта, поведения) обнаруживают не сразу, а по мере становления соответствующих функций.
Возникновению тератогенного эффекта способствуют длительный прием лекарственных веществ, особенно в высоких дозах, наличие у беременной женщины патологии элиминирующих органов (почек, печени), особой генетической предрасположенности. Имеет значение и возраст женщины: тератогенный эффект чаще возникает у юных, еще недостаточно сформированных женщин в возрасте 12-14 лет, и у женщин с завершающейся функцией репродуктивной системы — в возрасте старше 40 лет.
По степени опасности для’ человеческого плода различают три группы лекарственных средств.
Первая группа — наиболее опасные препараты: талидомид (легкое снотворное, применявшееся за рубежом), андрогены, метотрексат и другие антифоли-евые препараты, диэтилстильбэстрол.
Вторая группа — препараты средней степени опасности: дифенин, фенобарбитал и некоторые другие противоэпилептические средства, цитостатики.
Третья группа — менее опасные (но широко применяемые) препараты: салицилаты, левомицетин, тетрациклины, изониазид, фторотан (опасен для работающих в анестезиологическом отделении), сибазон и другие бензодиазепины, мепротан, аминазин, резерпин, дикумарин и другие антагонисты витамина К.
30
Дифферецирующаяся ткань особенно чувствительна к повреждающим воздействиям. Поэтому качественно похожие пороки вызывают разные вещества, принятые беременной женщиной в соответствующий критический период для развития того или иного органа эмбриона. Но особенность порока может зависеть и от самого вещества. Например, эпоксиды диэтил стильбэстрол а накапливаются в репродуктивном тракте как женского, так и мужского эмбриона и плода, нарушая его развитие. Выявляется это в период полового развития и в начале половой жизни Человека. Нарушения репродуктивной системы являются причиной бесплодия (как женщин, так и мужчин), выкидышей, мертворождаемости, канцерогенеза в органах половой сферы. Дифенин (производное гидантоина) вызывает гидантоиновый синдром, очень похожий на алкогольный, с типичным внешним обликом ребенка (гипертелоризм — широкое расстояние между глазами, ушами, сосками; узкий лоб, низко расположенные уши, короткая шея, вдавленная широкая переносица и пр.), нередко с нарушением интеллекта.
Фетотоксический эффект — это результат реакции созревающего или уже зрелого плода на лекарственные средства. Индометацин и некоторые другие ингибиторы синтеза простагландинов вызывают закрытие или сужение артериального протока, p-адреномиметики нарушают углеводный обмен, р-адрено-литики — ритм сердца. Аминогликозидные антибиотики вызывают ототоксичность, бензодиазепины, барбитураты, магния сульфат, этанол и др. — угнетение центральной нервной системы, ацетилсалициловая кислота и другие антагонисты витамина К — геморрагии. Перечисленные токсичные реакции могут быть причиной тяжелой патологии плода и новорожденного и повышения перинатальной смертности детей.
Часть II ЧАСТНАЯ ФАРМАКОЛОГИЯ
Раздел I НЕЙРОТРОПНЫЕ СРЕДСТВА
&
Существует огромное число нейротропных средств, влияющих как на центральную, так и на периферическую нервную систему. Эти вещества по своей структуре в большей или меньшей степени напоминают структуру различных нейромедиаторов: различных моноаминов (норадреналина, дофамина, серотонина, гистамина), ацетилхолина, аминокислот (гамма-аминомасляной кислоты, глутаминовой, аспарагиновой кислот и пр.). В связи с этим нейротропные средства могут либо имитировать эффекты медиаторов, быть их миметиками (от греч. mimeticos — подражающий), либо способствовать эффектам медиаторов, сенсибилизировать к ним, либо блокировать их эффект, быть их блокаторами, литиками (от греч. lyticos — прекращать, разрушать, растворять).
Активность синапса и влияние на него фармакологических средств достаточно сложны. Образование классических нейромедиаторов осуществляется в цитоплазме сомы и аксонов нейронов при участии энзимов: холинацетилтран-сферазы, тирозингидроксилазы, триптофангидроксилазы, синтезирующих соответственно ацетилхолин, норадреналин (а также дофамин, адреналин) и серотонин. Образовавшиеся в соме медиаторы транспортируются по аксону к его терминалям, где и содержатся в мелких везикулах. Но помимо этих классических нейромедиаторов в соме многих нейронов, как в центральной, так и в периферической нервной системе, на рибосомах, связанных с эндоплазматическим ретикулумом, синтезируются различные нейропептиды: вазоактивный интестинальный пептид (ВИП), нейропептид Y (НПУ), вещество Р, холецистокинин, энкефалины, динорфин и многие другие нейропептиды. Некоторые из них обильно синтезируются в структурах гипоталамуса, выполняя функцию соматостатина, тиреотропин релизинг гормона, люлиберина и пр. Все эти нейропептиды тоже опускаются в пресинаптическое окончание, где накапливаются в крупных везикулах, иногда вместе с классическим нейромедиатором.
Под влиянием нервного импульса из пресинаптических окончаний центральных или периферических нервных волокон может освободиться один классический нейромедиатор, либо одновременно (из одной или разных везикул) с нейропептидом. Последний может функционировать самостоятельно, но чаще 32
модулирует функцию основного медиатора, активирующего соответствующие рецепторы на постсинаптической мембране и этим изменяющего деятельность органа или ткани, зависимых от данного нейрона.
На пресинаптических окончаниях аксонов существуют рецепторы, реагирующие на освобождаемый данным окончанием медиатор (классический и нейропептид), активация этих рецепторов тормозит дальнейшее освобождение медиатора. Так осуществляется ауторегуляция процесса. Кроме того, на пресинаптических окончаниях существуют механизмы активного транспорта, осуществляющие возврат освободившегося из окончаний классического медиатора (норадреналина, дофамина, адреналина, гистамина, серотонина, ГАМК и пр.) или его метаболита (холина). Механизмов возврата нейропептидов в преси-наптическое окончание пока не обнаружено. Поэтому их запасы истощаются скорее, чем запасы классических нейромедиаторов.
Существующие в настоящее время нейротропные средства преимущественно влияют на активность классических нейромедиаторов. Во всяком случае их влияние на активность нейропептидов пока неизвестно.
Нейротропные средства могут воздействовать на рецепторы (активируя или блокируя), локализованные как на постсинаптической, так и на пресинапти-ческой мембранах; нарушить возврат медиатора в пресинаптическое окончание, повышая этим его концентрацию в синапсе и воздействие на постсинаптические рецепторы; могут быть сами транспортированы в пресинаптическое окончание, накапливаться там в везикулах и освобождаться из них во время нервного импульса. Активность нейропептидов остается без изменений. Между тем они способны влиять на процессы освобождения, захвата классических нейромедиаторов, реакцию на них постсинаптических рецепторов. Таким образом, изменение функции, в частности центральной нервной системы, под влиянием нейротропных средств является следствием сложных межнейрональных отношений, не всегда еще ясных, особенно при длительном применении препаратов.
Глава 1
ЛЕКАРСТВЕННЫЕ ^СРЕДСТВА, ВЛИЯЮЩИЕ НА ПЕРЕДАЧУ ВОЗБУЖДЕНИЯ В ХОЛИНЕРГИЧЕСКИХ СИНАПСАХ
Холинотропные средства влияют на передачу нервных импульсов, осуществляемых при участии ацитилхолина (см. схему 4). Он синтезируется из холина и уксусной кислоты под влиянием цитоплазматической холинацетилазы (хо-линацетилтрансферазы) как в теле нейрона (из которого затем спускается в окончание аксона), так и в окончаниях нервных волокон. Ацетилхолин депонируется в везикулах в комплексе с АТФ или с нейропептидами. Под влиянием нервного импульса везикулы прилипают к внутренней поверхности пресинап-тического окончания и освобождают находящуюся в них порцию (квант) ацетилхолина в синаптическую щель. Происходит взаимодействие медиатора со своими рецепторами, находящимися на поверхности постсинаптической мембраны, вызывая соответствующие изменения в функции эффекторного органа. Сразу же ацетилхолин подвергается гидролизу под влиянием ацетилхолинэс-
2 Зак. 3856 33
теразы (АХЭ) на холин и ацетат. Холин активно захватывается пресинапти-ческим окончанием и транспортируется внутрь его (избыток ацетилхолина или холина в синаптической щели тормозит этот процесс), где при участии аце-тил-КоА митохондрий и холинацетилазы снова превращается в ацетилхолин. Ацетат поступает в лимфу, а затем в кровеносное русло.
На пресинаптических окончаниях существуют рецепторы, реагирующие на ацетилхолин; возбуждение одних из них способствует дальнейшему освобождению ацетилхолина, а возбуждение других — тормозит этот процесс. Избыток ацетилхолина, попавший в кровеносное русло, подвергается гидролизу бути-рилхолинэстеразой, инактивирующей не только ацетилхолин, но и другие эфиры холина и некоторые другие эфиры (например, новокаин).
Холинотропные средства действуют на передачу нервного импульса в холинергических синапсах. По структуре или пространственному расположению частей молекулы эти вещества в разной степени похожи на молекулу ацетилхолина (см. рис. 1, 2). Поэтому они могут взаимодействовать либо с холино-рецепторами, либо с окружающими их частями клеточной мембраны, либо с инактивирующими ферментами (ацетилхолинэстераза и бутирилхолинэстераза).
О
II
Нз С — С — О -СН2 - СН2 - N+
Рис. 1. Ацетилхолин
Н2 N - С - О —СН2 - СН2 - N+
СНз
— СНз
Рис. 2. Карбахолин
Препараты этой группы взаимодействуют преимущественно с холинорецеп-торами. Различают М- и Н-холинорецепторы, названные так потому, что они обладают соответственно высокой чувствительностью к яду мухомора — мускарину или к алкалоиду — никотину, содержащемуся в листьях табака. М- и Н-холинорецепторы в основном расположены постсинаптически.
М-холинорецепторы локализуются на мембранах гладкомышечных клеток, автоматически функционирующих Р клеток миокарда, AV узла, желез внешней секреции, иннервируемых постганглионарными парасимпатическими нервами, а также на мембранах клеток гладкой мускулатуры желудка, матки, потовых желез, иннервируемых некоторыми постганглионарными симпатическими не-рЁамй'.""'*‘‘~“”" ...... ......................... ........
Различают пять вариантов М-холинорецепторов, отличающихся друг от друга способностью активировать разные сигнальные механизмы. Так, М,-холиноре-цепторы локализованы в автономных ганглиях и в центральной нервной системе. Их стимуляция активирует Gq протеин и фосфолипазу С, приводя к
34
(+)Н
(М, Н)
ОБОЗНАЧЕНИЯ:
АХ — ацетилхолин; ХР — холинорецептор; М-М-холинорецептор; Н-Н-холинорецептор; АХЭ — ацетилхолиноэстераза; Дц-КоА — ацетилкоэнзим А (митохондрий);
КоА -> коэнзим А (митохондрий); ТМ — транспортный -механизм;
ХА — холинацетилаза (холинацетилтрансфераза); (+) — активация; (-) — торможение
Схема 4. Холинергический синапс
образованию ИФ3 и ДАГ, что сопровождается повышением внутриклеточной концентрации Са++ и активацией соответствующих нейронов.
М2-холинорецепторБГ~7ю1<алйзоБанБГ-~к~'с?'рдцег в синоаурикулярном узле, преДс^дайГ~атриовёнтрикулярном узле и“н®много в желудочках. Стимуляция этих рецепторов приводит к активации калиевых каналов через (3-, у-субъеди-ницы G, протеина и к угнетению АЦ тоже через G; протеин. В результате возникает замедление спонтанной деполяризации и гиперполяризация в синоаурикулярном узле, укорочение длительности ПД и снижение силы сокращений предсердий, замедление проведения в атриовентрикулярном"~узлёПГ" небольшоё~снижёйие с'йлЫ сдКращений^жёлудочков7~ ' ' ~ ’
"М^хблйнорецёпторь! локализованы в гладкой мускулатуре и в железах внешней секреции. Их стимуляция приводит к сокращению гладкцх мышц и к усилению секреции тем же механизмом, чтй' н^К1'ИИЯПЙ)ГмГ-рецепторов. ”
Лдкализаийя и эффекты, возникающие при стимуляции М4- и'М5-рецепторов пока не определены. Однако известно, что стимуляция М4-рецепторов активирует калиевые каналы и угнетает АЦ через стимуляцию G, протеина, а стимуляция М5-рецепторов приводит к стимуляции фосфолипазы С (подобно активации Мгрецепторов) и к повышению внутриклеточной концентрации Са++.
35
М-холинорецепторы могут быть локализованы и внесинаптически, например на поверхности эндотелиальных клеток сосудов (М3) и на поверхности эритроцитов. При активации М3 эндотелиальных рецепторов происходит освобож-дение ре юГ^бЙрующат. Фактора — оксида~азота (NO), который диффундирует через эндотелиальные клетки к гладкой мускулатуре сосудов и вызывает ее расслабление. Поэтому при наличии в плазме крови ацетилхолина или М-хо-линомиметиков происходит снижение артериального давления. Если же эндотелий поврежден, и ацетилхолин (или М-холиномиметики) воздействует прямо на гладкую мускулатуру сосудов, происходит ее сокращение и повышение артериального давления.
Различают и разные Н-холинорецепторы. Одни из них расположены на постсинаптической мембране нейронов (Нн-рецепторы) вегетативных ганглиев, ганглиоподобных образований (мозгового вещества надпочечников, каротидных клубочков, нейрогипофиза), а другие — на постсинаптической мембране скелетных мышц (Нм-рецепторы).
М-холинорецепторы являются лигандозависимыми ионными каналами (см. стр. 21), и их активация вызывает очень быстрое, за миллисекунды, повышение проницаемости ионов натрия и кальция через эти каналы, вызывая деполяризацию клеточных мембран, ПД и возбуждение эффекторного органа (нейрона ганглия, скелетной мышцы).
В центральной нервной системе есть и Н- и М-холинорецепторы, но последних больше.
Помимо расположения в постсинаптических структурах, холинорецепторы локализуются и пресинаптически. Стимуляция Н-холинорецепторов способствует освобождению ацетилхолина, а стимуляция М-холйнорецепторов тормозит его.
Холйнотропные средства делят на холинопозитивные (прямые и непрямые холиномиметики) и холинонегативные (блокирующие холинорецепторы, холи-нолитики).
ХОЛИНОМИМЕТИЧЕСКИЕ СРЕДСТВА
Холиномиметические средства делят на прямые и непрямые (см. табл. 2). Каждую из этих групп делят на подгруппы в зависимости от их влияния на М- или Н-холинорецепторы. В каждой подгруппе различают вещества, содержащие пятивалентный и трехвалентный азот. У веществ, содержащих пятивалентный азот, 4 валентности заняты углеродными атомами, а к пятой присоединен остаток какой-либо кислоты. Такие вещества (их называют четвертичными соединениями) при pH жидких сред организма подвергаются диссоциации. Они мало растворяются в липидах, а поэтому плохо всасываются из желудочно-кишечного тракта и трудно проникают через гематоэнцефалический барьер. Вещества, содержащие трехвалентный азот (их называют третичными соединениями), в организме не диссоциируют, и их целые молекулы, растворяющиеся в липидах, значительно легче проникают в кровь из желудочно-кишечного тракта, а из крови через гистогематические барьеры — в ткани. Поэтому для получения центральных эффектов предпочитают назначать третичные соединения, а для получения периферических — четвертичные.
36
Таблица 2
Холиномиметические средства
Прямые холииомиметики Непрямые холииомиметики
Ингибиторы холинэстеразы
М-холмиомиметики Н-холииомиметики Обратимые Необратимые
Пилокарпин Ацеклцдин Карбахолин Бетанехол Мехолин Третичные Лобелии Цитизин Анабазин Четвертичные Карбахолин Физостигмин Аминостигмин Галантамин Прозерин Оксазил Фосфакол Армин Пирофос
Прямые холиномиметические средства. Это вещества, имитирующие эффекты ацетилхолина и, так же • как он, активирующие холинорецепторы. Для их действия не нужен ни нервный импульс, ни ацетилхолин.
Как уже сказано, стимуляция. Mi-, М3- и М5-холинорецепторов ведет к активации протеина Gq и к увеличению гидролиза фосфатидилинозитола; стимуляция же М2- и М4-холинорецепторов сопровождается активацией Gj-npo-теина и угнетением АЦ. В SA и AV узлах и в миокарде предсердий, а также в нейронах ствола.головного мозга возбуждение М2-рецепторов приводит к активации ру-субъединиц Gj-протеина, которые стимулируют фосфолипазу А2, освобождающую арахидоновую кислоту. Она под влиянием липоксигеназы превращается в метаболит, открывающий калиевые каналы: калий интенсивно покидает клетку, приводя к гиперполяризации клеточной мембраны. Другие калиевые каналы (М-ток) при активаций М-холинорецепторов (при участии Сч-протеина и фосфолипазы С) закрываются, препятствуя выходу калия. Это происходит, например, в нейронах коры головного мозга и в гиппокампе.
Иными слбвами, активация разных М-холинорецепторов сопровождается неодинаковыми внутриклеточными и мембранными процессами, приводящими к изменению функции эффекторных органов. При этом в одном и том же органе могут быть несколько вариантов М-холинорецепторов.
М-холиномиметические средства вызывают: а) сокращение гладкой мускулатуры желудка, кишечника, бронхов, матки, цюПИрной ~мыцпШ7~'сфин1?тера** рЗДужкиГб) повышение секреции рлюнных, б{^ю1алы^^7^^з1^СД^д1ыХ1-. жглуЛЖЙ^Г^елез7*в) замедление проведения возбуждения "в атриовентрикулярном узле, понижение возбудимости и автоматизма Р клеток SA узла сердца.
М-холиномиметики у детей применяют относительно редко. Основным показанием к их назначению является глаукома. У таких больных офтальмологи предпочитают применять третичные пилокарпин или ацеклидин, хорошо проникающие в ткани глаза, для снижения внутриглазного давления при глаукоме. Этот эффект — следствие сокращения сфинктера радужки, ее истончения, в результате чего освобождается внутренний угол передней камеры глаза и облегчается отток внутриглазной жидкости через пространства радужно-роговичного угла и венозный синус склеры.
37
Бетанехол рекомендуют использовать для повышения тонуса нижнего сфинктера пищевода, чтобы предотвратить или устранить желудочно-пищеводный рефлюкс, особенно опасный у детей раннего возраста: попадание кислого содержимого в пищевод может привести к рефлекторному угнетению дыхания и даже к его прекращению. Иногда карбахолин назначают при атонии желудка, кишечника или мочевого пузыря. Очень редко четвертичные М-хо-линомиметики назначают при предсердных тахиаритмиях.
При передозировке М-холиномиметиков или отравлении мухоморами назначают блокатор М-холинорецепторов — атропин.
Н-холиномиметические средства. Лобелии и цитизин — алкалоиды, получаемые из растений лобелии одутлой (Lobelia inglata) и рикитника (Cytisus'laburnum) или мышатника (Thermosidis lanceolata) соответственно.
Основные их эффекты связаны со стимуляцией Н-холинорецеторов мозгового слоя надпочечников, вегетативных ганглиев и каротидных клубочков. Для активации названных структур растворы солей этих алкалоидов надо вводить внутривенно. При других путях введения в плазме крови, омывающей указанные рецепторы, не создаются необходимые концентрации вещества. Стимуляция ганглиев приводит к увеличению освобождения медиаторов из окончаний постганглионарных волокон вегетативных, преимущественно симпатических ганглиев, повышая этим периферическое сопротивление сосудов, артериальное и венозное давление. Этому способствуют и катехоламины, более интенсивно освобождаемые из мозгового слоя надпочечников. Стимуляция каротидных клубочков приводит к интенсификации активирующих импульсов, поступающих к нейронам продолговатого мозга, регулирующим дыхание. В результате возрастают частота и глубина дыхания. Это поддерживает прямая стимуляция названных нейронов Н-холиномиметиками, проникшими в мозг. Однако подобно никотину они могут вызвать вслед за возбуждением торможение функции нейронов, что приведет к исчезновению возбуждения и даже к остановке дыхания. Опасность такого осложнения тем больше, чем младше ребенок, у которого из-за высокой проницаемости гематоэнцефалического барьера могут возникнуть токсические концентрации миметика в ткани мозга. В связи с этим педиатры крайне редко применяют Н-холиномиметики, в основном при отравлении угарным газом. Наибольшую опасность представляет введение Н-хо-линомиметиков в вену пуповины новорожденным. В настоящее время от такого их применения педиатры отказались.
Препараты, содержащие лобелии (лобесил) и цитизин (табеке), используют для устранения явлений абстиненции, возникающих при прекращении курения. Для этой же цели применяют анабазин — алкалоид из ежовника безлистного (Anabasis aphylla).
Никотин — алкалоид, содержащийся в листьях табака (Nicotiana tabacum), поступает в организм в процессе курения. Он приводит к активации симпатических и парасимпатических ганглиев, мозгового слоя надпочечников, а также к нарушению функций центральной нервной системы. Стимуляция мозгового слоя надпочечников и симпатических ганглиев приводит к сужению периферических сосудов, что нарушает кровоснабжение многих органов й тканей, к гликогенолизу и т. д. Курение, начатое в подростковом возрасте, относится к факторам риска, способствующим раннему развитию атеросклероза, артериальный гипертензии, ишемической болезни сердца. Активация парасимпатических ганглиев приводит к повышению тонуса гладкой мускулатуры бронхов, повышению секреции бронхиальных желез и развитию патологии органов
38
дыхания (бронхиты, пневмонии, астма). Активация парасимпатических ганглиев повышает секрецию кислого желудочного сока, что в сочетании с подавлением аппетита вследствие гликогенолиза и повышения уровня глюкозы в крови, усиливает факторы, агрессивно влияющие на слизистую оболочку желудка и двенадцатиперстной кишки и способствующие развитию язвенной болезнй.
В центральной нервной системе никотин неодинаково влияет на освобождение и содержание ацетилхолина, норадреналина, серотонина и других медиаторов в окончаниях соответствующих нейронов. Это сказывается на функции центральной нервной системы (в частности, ухудшает память), а также на активности-эндокринной системы, регулируемой гипоталамическими структурами мозга. В результате этого может уменьшиться секреция соматотропного гормона, гонадотропинов, что отрицательно сказывается на росте, физическом и половом созревании подростка. Под влиянием никотина возрастает освобождение эндорфинов (см. гл. 6), что и является причиной развития физической зависимости от никотина, то есть наркомании. С вдыхаемым дымом табака в организм попадает канцерогенное вещество — бензпирен, приводящий к развитию бронхогенного рака.
Курение во время беременности нарушает развитие и функцию плаценты, а в итоге приводит к более частому (чем у некурящих женщин) преждевременному прерыванию беременности (аборты, выкидыши, рождение недоношенных детей), мертворождению, появлению пороков развития у детей, большей перинатальной смертности.
Никотин выводится с молоком матери, создавая в .нем нередко высокие концентрации, достаточные для возникновения интокси^ции и даже для внезапной остановки дыхания, то есть смерти ребенка.
Непрямые холиномиметики (антихолинэстеразные, холиносенсибилизирующие). Их делят на третичные и четвертичные (см. табл. 3), а также на алкалоиды и синтетические вещества. К алкалоидам относятся: физостигмин (из африканского растения Physostigmavenenosum) и галантамин (из клубней подснежника Воронова (Galantus Woronowi).
Эти препараты обратимо ингибируют (на 1—8 ч) как ацетилхолинэстеразу (преимущественно в области синапса), инактивирующую только ацетилхолин, так и бутирилхолинэстеразу, инактивирующую не только ацетилхолин, но и другие сложные эфиры холина (например дитилин), а также эфиры других оснований (например, новокаин), циркулирующие в крови.
Рис. 3. Галантамин
Рис. 4. Прозерин
39
Таблица 3
Классификация холинолитических средств
М-холииолитики М- и Н-холинолитики Гаиглиолитики Миорелаксанты
Третичные Третичные Третичные Антидеполяризующие
Атропин Апрофен Пахикарпин Д-тубокурарин
Скополамин Арпенал Пирилен Ардуан
Платифилин Гоматропин Четвертичные Метацин Гастрозепин Спазмолитик Четвертичные Бензогексон ий Пентамин Панкуроний * Атракурий Векуроний Деполяризующие Дитилин Декаметон ий
Атровент Гигроний Кватерон Камфоний
В результате ингибирования холинэстераз освобождающийся во время нервного импульса ацетилхолин инактивируется медленнее. В синапсе возникает большая его концентрация, вызывающая более интенсивный эффект. Кроме того, названные препараты способны повышать чувствительность (сенсибилизировать) холинорецепторы к ацетилхолину. Поскольку они вызывают эффект только при наличии нервного импульса, то их и называют непрямыми холи-номиметиками.
Четвертичные соединения применяют у детей для устранения острого пареза желудка, кишечника, мочевого пузыря, для улучшения проведения нервных импульсов к скелетным мышцам при наличии остаточных явлений детского паралича, при миастении, сохранении эффекта недеполяризуюших миорелаксантов, иногда — для устранения тахиаритмий. Третичные соединения используют в офтальмологической практике для понижения высокого внутриглазного давления. Кроме того, их все шире применяют для восстановления функции центральной нервной системы у детей с интоксикацией атропином, психотропными средствами, снотворными, этанолом и другими веществами, угнетающими центральную нервную.систему.
В младшем возрасте организм более вынослив к антихолинэстеразным средствам, так как для раннего онтогенеза характерны низкое содержание ацетилхолина в пресинаптических окончаниях и более высокая активность, холинэстераз. Однако при передозировке этих средств у детей (как и у взрослых) могут возникнуть спазм бронхов, повышение секреции бронхиальных, слезных, слюнных желез, брадикардия, усиление сокращений желудка (рвота), кишечника (понос). В тяжелых случаях развиваются тремор, судороги и смерть. Для ликвидации развившихся симптомов необходимо ввести атропин и противосудорожные средства (гексенал, сибазон; см. гл. 11).
Существуют соединения, необратимо ингибирующие холинэстеразу. К ним относится большая группа фосфорорганических соединений (ФОС): армии, фосфакол, пирофос, в том числе инсектициды (хлорофос, карбофос). Под влиянием ФОС происходит прочное фосфорилирование активного участка 40
холинэстеразы, прекращается ее функция. Инактивация ацетилхолина восстанавливается лишь после синтеза новых молекул холинэстеразы.
ФОС применяют в офтальмологии при лечении глаукомы. После закапывания раствора необходимо на 2—3 мин надавить на область слезного мешка, чтобы воспрепятствовать попаданию препарата в слезный канал и последующему его всасыванию.
При передозировке ФОС может возникнуть тяжелая интоксикация, похожая на картину отравления непрямыми холиномиметиками, но более длительная и резче выраженная. Помимо атропина и средств, угнетающих центральную нервную систему, в таких случаях необходимо назначать реактиваторы холинэстеразы. К ним относится ряд оксимов (содержащих группу (=N~OH), которые связываются с ФОС и отрывают их от холинэстеразы, восстанавливая ее активность. Однако это может произойти только в самом начале действия ФОС (в течение 5—20 мин), пока не произошло необратимых изменений фермента, после этого «оторвать» ФОС от него уже невозможно. В качестве реактиваторов используют дипироксим, пальдом (четвертичные соединения) и изонитрозин (третичный препарат). Первые два преимущественно влияют на периферические ткани, а изонитрозин влияет и на центральную нервную систему, но он. более слабый препарат.
Показана эффективность антикальциевых препаратов (например форидона), особенно на фоне предварительной атропинизации.
М-холинолитические средства блокируют или ослабляют реакции М-холинорецепторов на ацетилхолин и холиномиметические средства.
Их делят на третичные и четвертичные соединения (см. табл. 3), а также на естественные алкалоиды и синтетические вещества. К алкалоидам относятся: атропин (см. рис. 5), получаемый из красавки, белены, дурмана, скополамин — из тех же растений, платифиллин — из крестовника плосколистного.
Рис. 5. Атропин (
Неоднородность М-холинорецепторов (см. выше) проявляется в их неодинаковой чувствительности к различным М-холинолитикам. Получены даже вещества, преимущественно блокирующие разные М-холинорецепторы.
Так, гастрозепин (пирензепин) и телензепин преимущественно блокируют Mi-холинорецепторы, химбацин — М4-холинорецепторы, гек-сагидрозилдифендиол — М3-холинорецепторы. Однако в качестве лекарств из этих блокаторов пока применяют лишь гастрозепин. Атропин, скополамин блокируют любые М-холинорецепторы, но в неодинаковой степени. Так, в небольших дозах и концентрациях атропин подавляет только секрецию слюнных и бронхиальных желез, в больших дозах — расслабляет круговую мышцу радужки, цилиарную мышцу, вызывает учащение сокращений сердца,
41
еще в больших дозах снижает тонус гладких мышц мочевого пузыря, кишечника, бронхов; для выраженного угнетения секреторной и моторной функции желудка нужны дозы, близкие к токсическим. Гастрозепин (пирензепин) преимущественно влияет на железы желудка и в значительно меньшей степени влияет на частоту сердечных сокращений, гладкие мышцы глаза; Атровент (ипрат-ропия бромид) преимущественно снижает тонус гладкой мускулатуры бронхов, тоже в меньшей мере влияя на деятельность сердца, круговую мышцу радужки.
Атропин и скополамин (как третичные соединения) хорошо проникают во все ткани организма, в том числе и в центральную нервную систему. Их широко используют в анестезиологии в качестве преМедикационных средств, так как они предотвращают рефлекторную остановку сердца, секрецию слюны и ее заглатывание (вместе с ингалируемым веществом) или аспирирование. Применяют их и для снижения секреции желудочного сока, ослабления спазмов гладкой мускулатуры кишечника, желчных протоков (здесь особенно эффективен платифиллин), для ликвидации брадиаритмии, связанной с чрезмерной активностью блуждающего нёрва. В офтальмологии атропин применяют (местно) для осмотра глазного днй, гда обездвиживания гладких мышц глаза после операций. Но педиатры предпочитают назначать четвертичные М-холинолити-ки, мало проникающие в центральную нервную систему. Метацин применяют для устранения болезненных спазмов кишечника, желчевыводяших путей, мочеточников, мочевого пузыря; гастрозепин — при язвенной болезни желудка и двенадцатиперстной кишки, а также при гиперацидном гастрите; атровент в виде аэрозоля — для устранения бронхоспазма. Его бронхолитический эффект отмечают даже у детей до 1,5 Лет, у которых другие бронхолитики часто оказываются неэффективными.
Атропин и содержащие его препараты (экстракт из красавки и др.) противопоказаны детям с гипертермией, так как подавление потоотделения может вызвать еще большее повышение температуры тела и ухудшить состояние ребенка. Их нельзя назначать детям с глаукомой и с болезнью Дауна (у последних очень легко развивается тяжелая интоксикация).
Дети' младшего возраста, особенно до 3-6 мес, высокочувствительны к атропину и к алкалоидам его группы. У них интоксикация названными веществами приводит сразу к угнетению центральной нервной системы (без предварительного возбуждения, как у более старших детей и взрослых).
Одновременно возникают тахикардия, сухость слизистых оболочек, расширение зрачка, не реагирующего на свет. Смерть может наступить от остановки дыхания. Для оказания помощи помимо общих мероприятий, направленных на удаление яда из организма, назначают непрямые холиномиметики, предпочитая третичные (аминостигмин, галантамин, физостигмин).
Н-холинолитические средства делят на ганглиоблокаторы и миорелаксанты.
Ганглиоблокаторы (ганглиолшпики). Различают третичные ганглиоблокаторы: пахикарпин (алкалоид из растения софора толстоплодная (Sophora pachycarpa)), пирилен, и четвертичные — бензогексоний (см. рис. 6), пентамин, гигроний, кватерон, камфоний и др.
Препараты этой группы нарушают проведение импульсов через вегетативные ганглии, при этом кватерон, камфоний и пирилен с некоторым преимуществом влияют на парасимпатические ганглии. Гигроний, арфонад отличаются кратковременностью действия.
42
Н3С^ СН3
Н3С N+ - (СН2)6 - N+ СН3
Н3С ' ' СНз
Рис. 6. Бензогексоний
Нарушая проведение возбуждения через симпатические ганглии, ганглио-блокаторы снижают тонус гладкой мускулатуры прекапиллярных сфинктеров артериол и венул. В результате они улучшают микроциркуляцию в тканях, что используют при терапии больных с разными формами шока, инфекционными токсикозами, ожоговой болезнью, пневмонией и пр. Они увеличивают депонирование крови в емкостных сосудах (венах), что уменьшает возврат крови к сердцу (т. е. преднагрузку), и улучшают условия его работы, особенно при острой сердечной недостаточности. Они понижают и артериальное давление, что облегчает выбрасывание крови из сердца в артериальное русло (уменьшают постнагрузку). Ганглиоблокаторы назначают детям при гипертонических кризах, отеке мозга, левожелудочковой недостаточности, приводящей к отеку легких, для проведения управляемой гипотонии во время операций на тканях с обильным кровоснабжением.
У детей до 3 лет ганглиоблокаторы меньше понижают артериальное давление, чем в более старшем возрасте. Это связано с сохраняющимся автономным функционированием нейронов соответствующих ганглиев, меньше зависящих от центральных симпатических нейронов. Микроциркуляцию в этом возрасте ганглиоблокаторы улучшают так же, как и в другие возрастные периоды.
Блокирование ганглиев парасимпатической системы приводит к уменьшению секреции желудочного сока, сокращений кишечника и желудка. Это используют при лечении гиперацидных гастритов и язвенных болезней у детей. Ганглиоблокаторы снижают влияние блуждающего нерва на тонус гладкой мускулатуры бронхов и секрецию бронхиальных желез. Это используют при лечении хронического бронхита, эмфиземы, для профилактики приступов бронхиальной астмы. t
Применение ганглиоблокаторов вызывает ряд осложнений. Наиболее опасным из них является ортостатический коллапс, то есть падение артериального давления при переходе человека из горизонтального в вертикальное положение. Это осложнение — результат торможения импульсации в симпатических путях к венам. Оно обычно возникает у детей старше 3 лет, особенно у подростков. Камфоний, пирилен и кватерон реже вызывают названное осложнение. Кроме ортостатических явлений, ганглиоблокаторы снижают кислотность желудочного сока, вызывают атонические запоры, задержку мочи (последнее способствует развитию циститов). Для предотвращения этих осложнений рекомендуют одновременно назначать мягкие слабительные или непрямые холиномиметики (прозерин).
43
Кроме того, ганглиоблокаторы могут вызвать сухость слизистых оболочек рта, гортани, расширение зрачков, нарушение аккомодации, повысить внутриглазное давление. Поэтому они противопоказаны больным глаукомой. Третичные ганглиоблокаторы, проникая в центральную нервную систему, могут нарушить мышление, восприятие окружающего, иногда тремор; при передозировке — судороги.
Поскольку ганглиоблокаторы преимущественно выводятся из организма почками в неизмененном виде, они могут кумулироваться при нарушении их выделительной функции. Поэтому соответствующим больным названные препараты либо противопоказаны, либо их назначают в значительно меньшей дозе.
Миорелаксанты. Различают антидеполяризующие (d-тубокурарин, ардуан) и деполяризующие (дитилин^декаметоний) миорелаксанты.
ч <
Рис. 7. Тубокурарин
Антидеполяризующие (конкурентные) миорелаксанты блокируют Н-холинорецепторы скелетных мышц и конкурируют с ацетилхолином за взаимодействие с ними. Увеличение концентрации ацетилхолина в синапсе (например, после назначения антихолинэстеразных средств) может устранить эффект препаратов данной группы. Однако у непрямых холиномиметиков длительность действия может оказаться короче, чем у миорелаксантов, тогда произойдет рекураризация с угнетением функции дыхательной мускулатуры. Поэтому больные требуют длительного наблюдения и нередко повторного введения прозерина. Спровоцировать рекураризацию могут и аминогликозидные антибиотики (канамицин, гентамицин и пр.), линкозамиды (линкомицин, клиндамицин), также способные нарушать нервно-мышечную передачу импульсов.
Т-убокурарин (см. рис. 7) способен активировать освобождение гистамина из тучных клеток. Это представляет опасность для детей, страдающих аллергическими заболеваниями, и перед его введением необходимо сделать инъекцию антигистаминных средств (димедрол, дипразин).
Относительно новые антидеполяризуюшие миорелаксанты — ардуан и особенно атракурий и векуроний, характеризуются достаточно быстрым при одномоментном введении началом действия, способностью поддерживать миорелаксацию при внутривенном капельном вливании (без кумуляции препарата и его эффекта), а также быстрым исчезновением миорелаксации после
44
прекращения его инфузии. В связи с этим, только что названные препараты, особенно атракурий, используют и для длительной кураризации во время проведения операций, и для кратковременной релаксации во время проведения интубации трахеи у больного.
Антидеполяризующие миорелаксанты абсолютно противопоказаны больным с миастенией.
Дети первых месяцев и лет жизни высокочувствительны к антидеполяризующим миорелаксантам, так как у них невелики запасы ацетилхолина в пре-синаптических окончаниях, и при поступлении возбуждения его меньше освобождается в синаптическую щель, создавая в ней меньшую (чем у взрослых) концентрацию. Вместе с тем эффект от применения этих релаксантов (по неизвестной пока причине) у детей исчезает скорее, чем у взрослых.
Деполяризующие миорелаксанты сначала кратковременно активируют Н-хо-линорецепторы скелетных мышц, открывая ионные каналы для Na+ и Са++. В результате возникает деполяризация концевой пластинки (с находящимися в ней Н-холинорецепторами), распространяющаяся на окружающую его сарколемму мышечного волокна. В результате возникает кратковременный спазм или фибрилляция скелетных мышц, сопровождающиеся выходом из них ионов калия, гиперкалиемией (способной затем привести к болезненным спазмам скелетных мышц). Эту фазу действия дитилина можно рассматривать как холиномиметическую, длящуюся несколько секунд. Деполяризация сменяется затем потерей чувствительности рецептора к ацетилхолину, продолжающейся несколько минут. Эту фазу и оценивают как холинонегативную (аналогичный эффект вызывает избыток ацетилхолина в синапсе в присутствии ингибитора холинэстеразы). Ее рассматривают как результат потери способности деполяризованной концевой пластинки и окружающей ее сарколеммы инициировать распространение мышечного ПД при наличии продолжающейся деполяризации концевой пластинки. Длительная деполяризация клеточных мембран вызывает интенсивный выход ионов калия из внутриклеточных депо и гиперкалиемию.
Дитилин инактивируется бутирилхолинэстеразой; обычно вызываемая им миорелаксация длится 2—4 мин. Блокирование фермента непрямыми холино-миметиками удлиняет его эффект (см. рис. 8).
&
(CH3)3N+ - СН2 - СН2 - О - С ~(СН2)2 - С -о -СН2 - СН2 —N+(CH3)3
О О
Рис. 8. Дитилин
Высокая активность названного фермента у детей раннего возраста — основная причина введения более высоких (на 1 кг массы тела) доз препарата для получения миорелаксации. Встречаются люди с особой атипичной холинэстеразой, которая медленно- или совсем не инактивирует дитилин. У таких людей вызываемый им эффект длится не минуты, а часы. Для его устранения необходимо вливание крови или плазмы крови здорового человека, в которых содержится названный фермент.
45
Деполяризующие миорелаксанты способны вызвать двойной эффект особенно при длительном действии и на фоне фторированных углеводородов (фторотан, энфлуран и пр. средства общей анастезии). Вначале возникает, как уже сказано, деполяризация концевой пластинки, но потом постепенно развивается ее реполяризацйя, напоминающая десенситизацию рецептора. Происходит переход I фазы во II тип блока — антидеполяризацию, устраняемую ингибиторами ХЭ. II фаза может длиться у разных людей неодинаковое время. Для ее устранения используют непрямые холиномиметики типа прозерина, но их антагонистический эффект оказывается слабее, чем по отношению к препаратам типа тубокурарина.
При введении дитилина могут возникнуть нежелательные эффекты, являющиеся следствием:
а) стимуляции Н-холинорецепторов вегетативных ганглиев (брадикардия), наружных мышц глаза (приводящих к сдавлению глазного яблока и к повышению внутриглазного давления);
б) болезненных сокращений скелетных мышц, связанных с гиперкалиемией; поэтому деполяризующие миорелаксанты противопоказаны больным с травмами мягких тканей, ожогами, с нетра^матическим рабдомиолизом, повреждениями спинного мозга, с пара- и тетраплегиями, с мышечной дистрофией из-за опасения возникновения чрезмерной гиперкалиемии и нарушения калиевого обмена в организме;
в) аллергических реакций (эритематозная сыпь, отеки губ, век, миндалин, надгортанника, снижение артериального давления, бронхоспазм и пр.);
г) особенно опасна злокачественная гипертермия, которую могут спровоцировать фторированные углеводороды (фторотан и пр.) у больных с аутосомными доминантными заболеваниями скелетных мышц, с врожденной патологией миофибрилл, проявляющейся у младенцев мышечной гипотонией, слабостью проксимальных мышц и последующей задержкой развития двигательной активности тела; у таких больных обнаруживают мутацию в каналах, по которым происходит освобождение Са++, их называют рионодиновыми (рионодин — химическое вещество) рецепторами. Под влиянием деполяризующих миорелаксантов, особенно в присутствии фторотана, происходит интенсивное освобождение Са++ из саркоплазматического ретикулума; клинически это проявляется гипертермией (быстрым повышением температуры тела до 41~42° С), метаболическим ацидозом, тахикардией, ригидностью скелетных мышц. Эти осложнения нередко кончаются летальным исходом. Для борьбы со злокачественной гипертермией необходимо производить физическое охлаждение тела, вдыхание 100% кислорода, борьбу с метаболическим ацидозом и внутривенное введение дантролена — блокатора освобождения Са++ из саркоплазматического ретикулума.
Применяют миорелаксанты у детей преимущественно в анестезиологии для расслабления скелетных мышц во время операции, при вправлении вывихов, репозиции отломков костей, перед интубированием трахеи для последующей ингаляции средств общей анестезии или проведения искусственной вентиляции легких. Кроме того, миорелаксанты, в основном ардуан, начали применять в период выхаживания новорожденных для предупреждения напряжения скелетных мышц в период различных болезненных процедур, особенно при проведении механической вентиляции легких. Напряжение мышц приводит к нера-46
циональному расходованию кислорода в организме ребенка, к подскокам внутричерепного давления, что увеличивает опасность разрыва мозговых сосудов и внутримозговых геморрагий.
Мелликтин — производное алкалоида метилликаконитина, извлекаемого из растений живокость сетчатоплодная, живокость полубородатая и некоторых других. По механизму действия он похож на d-тубокурарин, так как нарушает проведение импульсов в нервно-мышечных синапсах. Его антагонистами также являются прозерин и другие антихолинэстеразные средства. Но он хорошо всасывается из желудочно-кишечного тракта (так как в нем нет четвертичного азота). Применяют его при спастичности скелетной мускулатуры, нарушающей двигательную активность человека, например, при болезни Паркинсона, постэнцефалическом паркинсонизме (см. гл. 13) и других заболеваниях, связанных с патологией структур мозга, регулирующих двигательную функцию скелетных мышц. ,
Центральные холинолитики: амизил, циклодол, тропацин, н о раки н, амедин, динезин — преимущественно блокируют холинорецепторы в центральной нервной системе. Их применяют в качестве транквилизаторов (амизил) или антипаркинсонических средств (см. гл. 4 и 13).
Лекарственные формы и дозы средств для детей, влияющих на передачу возбуждения в холинергических синапсах, представлены в табл. 4.
Таблица 4
Лекарственные средства, влияющие на передачу возбуждения в холинергических синапсах
Препарат Лекарственная форма Путь введения Однократная доза
Ацеклидин Aceclidinum Глазная мазь 3% и 5% В конъюнктивальную полость
Пилокарпина гидрохлорид Pilocarpini hydrochloridum Глазные капли \% раствор В конъюнктивальную полость 2 капли
Лобесил Lobesilum Табекс Tabex Официналвные таблетки Внутрь ii Подросткам по 1/3-1/2—1 таблетке 1-2-3 раза в день в течение 7—10 дней, затем по 1/3—1/2 таблетки 1 раз в день в течение 2-4 нед
Аминостигмин Aminostigminum 0,1% раствор в ампулах по 1 мл Внутримышечно Внутривенно 0,025-0,054 мг/кг
Физостигмина салицилат Physostigmini salicylas Глазные капли 0,25%—5% раствор 0;1% раствор в ампулах по 1 мл В конъюнктивальную полость Внутримышечно Подкожно 2 капли До Г года — 0,1 мг; 2-4 года — 0,2 мг; 5—7 лет — 0,5 мг; 8—10 лет — 1 мг; 10 лет и старше — 2 мг
Прозерин Proserinum 0,05% раствор в ампулах по 1 мл Подкожно До 1 года — 0,009 мг/кг; 1—5 лет — 0,008 мг/кг; 6-10 лет — 0,007 мг/кг; 11—14 лет — 0,006 мг/кг
47
Окончание табл. 4
Препарат Лекарственная форма Путь введения Однократная доза
Галантамина гидробромид Galanthamini hydrobromidum 1 % раствор в ампулах по 1 мл Подкожно До 1 года — 0,18 мг/кг; 1—5 лет — 0,16 мг/кг; 6—10 лет — 0,14 мг/кг; 11-14 лет — 0,12 мг/кг
Атропина сульфат Atropini sulfas 0,1% раствор в ампулах по 1 мл То же До 1 года — 0,018 мг/кг; 1—5 лет — 0,016 мг/кг; 6—10 лет — 0,014 мг/кг; 11-14 лет — 0,012 мг/кг
Метацин Metacinum 0,1% раствор в ампулах по 1 мл До 1 года — 0,018 мг/кг; 1-5 лет — 0,016 мг/кг; 6—10 — 0,014 мг/кг; 11-14 — 0,012 мг/кг
Вензогексоний Benzohexonium 2,5% раствор в ампулах по 1 мл Р" Внутривенно До 1 года — 1-2 мг/кг; 2-4 года — 0,5-2 мг/кг; 5-7 лет — 0,05-2 мг/кг; 8 лет — 0,5 мг/кг
Пентамин Pentaminum 5% раствор в ампулах по 1 мл Внутримышечно До 1 года — 2-4 мг/кг; 2-4 года — 1,5-2 мг/кг; 5-7 лет — 1-1,5 мг/кг; 8 лет — 0,5-1 мг/кг
Ардуан Arduanum 4 мг порошка ,в ампуле. Растворитель: 4 мл изотонического раствора натрия хлорида Внутривенно До 1 года — 0,1 мг/кг; старше 1 года — 0,13 мг/кг
Глава 2 ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ВЛИЯЮЩИЕ НА ПЕРЕДАЧУ ВОЗБУЖДЕНИЯ В АДРЕНЕРГИЧЕСКИХ СИНАПСАХ
Адренотропные средства влияют на передачу импульсов в адренергических синапсах, локализованных как в центральной нервной системе, так и в периферических тканях, иннервированных постганглионарными симпатическими волокнами и некоторыми постганглионарными парасимпатическими волокнами (потовые железы, матка, желудок). Адренорецепторы находятся и в тканях, не имеющих адренергическую иннервацию, обычно они реагируют на гормоны мозгового вещества надпочечников (адреналин, норадреналин и дофамин), циркулирующие в крови.
В отличие от холинергических структур, где медиатором является одно вещество — ацетилхолин, в адренергических синапсах функционируют три медиатора — норадреналин, дофамин и адреналин. Основным из них является норадреналин, освобождающийся как в центральной нервной системе, так и в периферических синапсах. Дофамин — в основном медиатор в центральной 48
но
ch2-ch-nh2->ho-Z у- ch2-ch-nh2-> I \=/ I
COOH / COOH
OH Диоксифенилаланин (дофа)
ch-ch2-nh2-> I
OH
Норадреналин
-> HO
CH - CH2 - NH - CH3
ОН Адреналин
Схема 5. Синтез катехоламинов
нервной системе, в ней же обнаружены и нейроны, освобождающие при своем возбуждении адреналин.
Все три медиатора и гормона (как и другие вещества, содержащие гидроксильные группы в 3 и 4 положениях ароматического ядра) называют катехоламинами (от названия катехол или катехин, которым обозначают ортодиоксобензол). Все они образуются из одного предшественника — тирозина (см. схему 5).
Эти три катехоламина взаимодействуют с разными рецепторами; ai, a2, Pi, р2, Д| и Д2 (Д — дофаминовые). После воздействия на рецептор значительная часть (60—80%) попавшего в синапс медиатора с помощью специального активного транспортного механизма, локализованного в пресинаптическом окончании, возвращается обратно и депонируется в везикулах. Оказавшийся вне везикул катехоламин подвергается окислительному дезаминированию с помощью моноаминоксидазы (МАО). Остальные 20—40% медиатора либо подвергаются метилированию в ортоположении при.участии катехоламин-ортоме-тилтрансферазы (КОМТ), либо удаляются из синаптической щели в лимфатическое пространство, а затем в кровь, либо (в очень небольшом количестве) связываются с белками постсинаптической мембраны — протеидизируются (см. схему 6). В стенке кишечника, печени, ГЭБ, плаценте содержатся либо оба, либо один из инактивирующих ферментов (МАО и КОМТ). В результате принятые через рот катехоламины не всасываются, а из крови не проникают в мозг и через плаценту к плоду.
У детей младшего возраста и механизмы возврата катехоламинов в преси-наптическое окончание, и инактивирующие ферменты функционируют еще недостаточно, поэтому, несмотря на небольшое содержание катехоламинов в пресинаптических окончаниях адренергических волокон, их концентрация в плазме крови может быть выше, чем у более старших детей и взрослых.
49
ОБОЗНАЧЕНИЯ:
МАО — моноаминоксидаза; КОМТ — катехолортометилтрансфераза; КА — катехоламин; АР — адренорецептор; ТМ — транспортный механизм возврата катехоламинов; знак (—) — угнетение освобождения медиатора; знак (+) — увеличение освобождения медиатора; аз, Pi — адренорецепторы; Дз — дофаминорецептор; М, Н — холинорецепторы
Схема 6. Адренергический синапс.
Освобождение, возврат и инактивация катехоламинов
Как уже сказано, различают разные адрено- и дофаминорецепторы. Их возбуждение активирует G-протеины. Возбуждение pi и Р2 адренорецепторов активирует Gs-протеин, что приводит к стимуляции АЦ. Возбуждение аг-ад-ренорецептора активирует Gi-протеин и тормозит АЦ (см. табл 1). Возбуждение си-адренорецептора активирует Gq-протеин, чем стимулирует фосфатидилинозитоловую систему, а возбуждение Д1 -рецептора и аз-адренорецептора тормозит эту систему (см. табл. 2).
Адренорецепторы обнаружены и на пресинаптических окончаниях адренергических волокон, активация (Зз-рецепторов способствует, а активация аз- и Дгрецепторов тормозит освобождение катехоламинов. На этот процесс влияет и ацетилхолин через Н (облегчение) и М (торможение) холинорецепторы (см. схему 6).
АДРЕНОПОЗИТИВНЫЕ СРЕДСТВА
Это вещества либо непосредственно активирующие адренорецепторы — прямые адреномиметики, либо способствующие освобождению медиатора — непрямые адреномиметики.
Прямые адреномиметики. К ним относят: адреналин, норадреналин и вещества, похожие на них по структуре (см. табл. 5).
50
Таблица 5
Структура прямых и непрямых адреномиметиков
Препараты R1 R2 R3 R4 R5
Норадреналин -ОН -он —н —н —н
Мезатон -ОН —н —н —н -СНз
Фетанол -он —н —н -н -С2Н5
Изадрин -он -он -н —н /СН3 -•СН СНз
Орципреналин -Он —н -он —н /СНз - СН СНз
Фенотерол -он —н -он - н /СНз - сн( й— хсн2у у он
Салбутамол -СН2-ОН -он -н -н /СНз - СН - СНз ^СНз
Добугамин -он -он —н -н - СН - СН2 - СН2 -/ у он СНз
Эфедрин -н —н -н -СНз -СНз
51
Адреналин способен возбуждать все адренорецепторы: а,, аг, |3i, (32. Его влияние на разные органы и ткани зависит от преобладания в них тех или иных адренорецепторов и от его концентрации.
Наиболее значимо влияние адреналина на сердечно-сосудистую систему. В сердце он укорачивает систолу и диастолическое расслабление желудочков, повышает возбудимость клеток синусового узла (водителей ритма — пейс-мекеров), активируя в нем латентные пейсмекерные клетки. В результате учащаются сокращения сердца. Одновременно происходит и увеличение силы сердечных сокращений, и потребление миокардом кислорода. Адреналин повышает мембранный потенциал волокон Пуркинье, чем может исправить нарушения проведения возбуждения по ним. Он укорачивает рефрактерный период в AV узле, уменьшая этим выраженность AV блока и даже устраняя его. Систолическое артериальное давление под влиянием адреналина повышается в связи с учащением и увеличением силы сокращений миокарда, но диастолическое артериальное, давление от обычных терапевтических доз снижается, что является следствием его воздействия на более чувствительные к нему Рг-адренорецепторы скелетных мышц, резистентность которых снижается. Более высокие дозы адреналина влияют уже на ai-адренорецепторы скелетных мышц и других тканей, что приводит к повышению артериального давления. Интенсивное повышение последнего воздействует на барорецепторы дуги аорты и каротидного синуса, рефлекторно активируя центр блуждающего нерва, что приводит к брадикардии и к некоторому снижению артериального давления.
Не менее важно влияние адреналина на систему дыхания. У бронхиальной мускулатуры нет симпатической иннервации, но на ней и на секреторных железах есть внесинаптические адренорецепторы. Циркулирующий в крови адреналин (или р2-адреномиметики) вызывает расслабление гладкой мускулатуры бронхов, наиболее отчетливое при наличии их предшествовавшего спазма или повышенного тонуса. Слабо, но все же адреналин может уменьшить секрецию бронхиальных желез. У лиц с бронхиальной астмой он к тому же тормозит освобождение медиаторов аллергических реакций немедленного типа и медиаторов воспаления.
На гладкую мускулатуру других органов и тканей адреналин влияет по-разному: он расслабляет желудок, кишечник, матку в последние месяцы беременности, детрузор мочевого пузыря, но вызывает сокращение пилорического и илеоцекального сфинктера, а также сфинктера мочевого пузыря.
Адреналин интенсивно влияет на обмен веществ. Влияя на аг-адренорецепторы, он тормозит секрецию инсулина и одновременно снижает захват глюкозы тканями, приводя к гипергликемии, но, воздействуя на р2-адренорецепторы, он стимулирует секрецию инсулина.
Адреналин стимулирует триглицеридлипазу и этим увеличивает концентрацию свободных жирных кислот в плазме крови. Он повышает секрецию ренина в юкстагломерулярной ткани почек, что способствует повышению артериального давления. Адреналин увеличивает захват ионов калия мышечной тканью, приводя к гипокалиемии. Однако при длительном введении адреналина возрастает захват калия клетками печени, тогда постепенно запас калия в мышцах истощается.
52
Из-за столь многогранного действия адреналина его использование ограничено. В педиатрии его преимущественно применяют в качестве средства, устраняющего обструкцию дыхательных путей, так как он может и снять спазм гладкой мускулатуры бронхов, и уменьшить набухание их слизистой оболочки вследствие сужения ее сосудов. Но этот терапевтический эффект сопровождается большим числом нежелательных эффектов: тахикардией, нарушением кровоснабжения миокарда, повышением артериального давления, гипергликемией, тремором, нередко тошнотой, рвотой и т. д.
К адреналину быстро развивается привыкание (тахифилаксия), и на повторные введения препарата реакция становится слабее. К тому же он, возбуждая ai-адренорецепторы в легочных сосудах, вызывает их сужение, нарушая легочный кровоток и газообмен между альвеолярным воздухом и капиллярной кровью. Активация агадренорецепторов может стать причиной спазма пред-альвеолярного жома и нарушить попадание воздуха в альвеолы, то есть он может устранить бронхоспазм (у астматика), но не гипоксемию.
Иногда адреналин применяют для восстановления деятельности остановившегося сердца. В этом случае его вводят непосредственно в мышцу сердца (вместе с атропином во избежание вагусного эффекта).
При передозировке адреналина у ребенка развиваются тахикардия, экстрасистолы и даже фибрилляция желудочков, резко повышаются системное артериальное давление, давление в сосудах малого круга, увеличивается пред- и постнагрузка на сердце, возникают его недостаточность, отек легких, кровоизлияние в мозг; или под его оболочки (преимущественно субарахноидально). Для ликвидации этих явлений необходимо одновременно ввести а- и Р-адре-ноблокирующие средства.
Адреномиметики — норадреналин, мезатон, фетанол, галазолин, нафтизин (см. табл. 6).
Норадреналин способен влиять на а2- и (3|-адренорецепторы, но основное значение имеет его воздействие на а,-адренорецепторы. Возбуждение рецепторов постсинаптических структур и внесинаптических рецепторов сосудистой стенки вызывает сокращение гладких мышц артериол и венул (см. табл. 7), что повышает их резистентность, артериальное и венозное давление, возврат крови к сердцу, ударный объем крови, а вЧгвязи с этим пост- и преднагрузку на сердце. Выталкиваемая с большей силой из сердца кровь стимулирует барорецепторы дуги аорты и каротидного синуса, что рефлекторно повышает активность блуждающего нерва и Ведет к .брадикардии.
Сужение сосудов отмечают в большинстве органов и тканей, в том числе в почках, печени, кишечнике, скелетных мышцах. Снижается фильтрация в клубочках почек, уменьшается образование мочи. В связи с повышением давления в аорте коронарные сосуды пассивно расширяются, но у больных со стенокардией Принцметала имеет место гиперчувствительность а-рецепторов, в результате чего может произойти их сужение, нарушение коронарного кровотока со всеми последствиями. Введение норадреналина сопровождается снижением объема циркулирующей крови из-за сокращения посткапиллярных венул и повышения давления в них, что приводит к повышенной транссудации жидкой части плазмы крови в,ткани. Метаболические эффекты от введения норадреналина такие же, как от адреналина, но значительно менее выражены и возникают от больших доз.
53
Таблица 6
Сравнительная характеристика ct-адреиомиметиков
Препарат Инактивирование Активируемые адренорецепторы Адренорецепторы
МАО комт ai а2 Р2
Норадреналин +4-4- ++++ +++ +++ + -
Адреналин +++ ++++ +++ +++ +++ +++
Мезатон ++ + + + + - - -
Фетанол + - + - - • - ,
Клофелин - - + +++ - -
Галазолин - - ++ - -
Нафтизин - г + + - - -
Примечание. Количество (+) означает интенсивность эффекта или степень инактивации ферментами. Знак (-) означает отсутствие эффекта.
Таблица 7
Локализация «-адренорецепторов и результаты их активации
Тип рецептора Локализация Результат активации
«1 Гладкая мускулатура кровеносных сосудов; предальвеолярный жом Миокард Селезенка Радиальная мышца радужки Печень Центральная нервная система Констрикция Увеличение силы сокращений1 Констрикция Сокращение (расширение зрачка) Увеличение гликогенолиза Повышение локомоции
«2 1 'а г» Окончание адренергических аксонов Кровеносные сосуды Адренергические нейроны Центральная нервная система Жировая ткань Островковая ткащ. поджелудочной железы Снижение освобождения катехоламинов Констрикция Снижение активности Успокоение, анальгезия, угнетение структур, активирующих сердечно-сосудистую систему Угнетение липолиза Снижение освобождения инсулина 4.»/
Примечание. 1. Слабее, чем стимуляция pi-рецепторов. (.
Активирование норадреналином пресинаптических аг-адренорецепторов приводит к торможению освобождения медиатора из окончаний симпатических волокон. Норадреналин в основном применяют для получения сосудосужива-54
юшего эффекта при лечении детей с острой гипотензией, возникающей при сепсисе, гипертермии, нарушении деятельности центральной нервной системы и т. д.
Адренорецепторы хорошо развиты к моменту рождения ребенка, поэтому сосудистая реакция легко возникает в любом возрасте. Вместе с тем в период новорожденное™ еще недостаточно зрелы механизмы инактивации норадре-' налина (обратный захват мембранами пресинаптических окончаний, окислительно^ дезаминирование МАО и метилирование КОМТ. Поэтому в грудном возрасте введенный извне норадреналин дольше циркулирует в крови и оказывает более длительное действие. В связи с этим вводить его детям нужно очень осторожно.
При передозировке норадреналина у ребенка могут развиться: спазм прекапиллярных сфинктеров, нарушающий микроциркуляцию и вызывающий гипоксию тканей, сужение сосудов почек и их ишемия, способная привести затем к почечной недостаточности; спазм предальвеолярных жомов (преимущественно у детей, страдающих бронхиальной астмой), нарушающий поступление воздуха в альвеолы. При попадании под кожу норадреналин может вызвать ее некроз.
Мезатон также широко применяют в педиатрии как сосудосуживающее средство. Он реже вызывает спазмы сосудов почек и некротические изменения в коже при попадании в нее. Иногда растворы мезатона используют (сначала интраназально, а затем путем вдыхания с помощью ультразвуковых ингаляторов) для лечения детей с острым вирусным (но не бактериальным) крупом; вызывая сужение сосудов слизистой оболочки трахеи и бронхов, он ограничивает ее набухание и улучшает проходимость дыхательных путей. Эффект длится около 30 мин.
Норадреналин и мезатон могут быть опасными для больных с сердечной недостаточностью, так как повышают нагрузку на сердце (оно должно выталкивать больший объем крови в сосуды с повышенной резистентностью) и одновременно суживают коронарные сосуды, т. е. уменьшают доставку кислорода миокарду и энергообразование в нем.
Фетанол мало инактивируется МАО и КОМТ, поэтому он может всосаться из желудочно-кишечного тракта, и его назначают через рот при хронической гипотонии у подростков, при подострых коллаптоидных состояниях у детей (и взрослых) любого возраста.
Галазолин и нафтизин применяют в виде растворов местно, преимущественно для ограничения набухания и секреции слизистых оболочек носа, вызванных как вирусной инфекцией, так и аллергической реакцией на попавший антиген. При неосторожном применении у детей эти препараты могут всосаться и вызвать гипертензию. При длительном нанесении на слизистую оболочку носа они могут вызвать в ней и даже в перегородке носа некротические изменения.
(ii-Адреномиметики — клофелин (клонидин, гемитон, катапре-сан), гуанфацин, гуанобенз (см. рис. 9).
Клофелин активирует а2-адреНорецепторы, расположенные пресинапти-чески как в центральной нервной системе, так и на периферических адренергических нервных волокнах, а также аг-адренорецепторы, локализованные в стенке сосудов (преимущественно артериальных).
55
Клофелин
r>
Рис. 9. аг-Адреномиметики
В результате активации центральных аг-адренорецепторов затормаживается освобождение различных нейромедиаторов, в частности ацетилхолина, норадреналина, дофамина, возбуждающих аминокислот (глутаминовой, аспарагиновой). Это приводит к возникновению седативного эффекта (успокоению), подавлению боли (анальгетический эффект), к снижению температуры тела, уменьшению поступления к периферическим органам и тканЛм импульсации от центральных нейронов симпатической нервной системы. В частности, возникает торможение тонически активных норадренергических вазопрессорных нейронов латерального ретикулярного ядра продолговатого, мозга и голубого пятна. В итоге снижаются освобождение катехоламинов из мозгового слоя надпочечников и окончаний симпатических волокон, артериальное внутриглазное давление, урежаются сокращения сердца, затормаживается освобождение ренина в почках (что ограничивает активность ренин-ангиотензин-альдос-тероновой системы и уменьшает задержку воды и натрия в организме), сокращение матки.
Обнаружено, что в организме существует эндогенное клофелинподобное вещество (вещества), условно названное эндозолином, которое тоже активирует аг-адренорецепторы и участвует в регуляции артериального давления.
Клофелин — липидорастворимое вещество, поэтому он очень легко всасывается из желудочно-кишечного тракта, проникает через все барьеры, включая гематоэнцефалический, кожу и пр. Поэтому его применяют любыми способами, принимая внутрь, под язык, трансдермально, внутримышечно, подкожно, внутривенно (очень редко) и эпидурально.
При приеме внутрь он появляется в крови в среднем минут через 20, максимальная его концентрация в ней через 2,5 ч, период полувыведения из организма — 9—16 ч. Примерно 60% введенной дозы выводится почками в неизмененном виде.
Применяют клофелин очень широко. Прежде всего в качестве антигипертензивного средства при артериальной гипертензии разного происхождения.
56
Снижение им периферического сопротивления артериальных сосудов облегчает условия работы сердца, предотвращая или устраняя возникновение сердечной недостаточности. Имеет значение и увеличение им диуреза, что является след* ствием снижения активности ренин-ангиотензин-альдостероновой системы, повышения освобождения гипоталамического натрийуретического фактора (из-за стимуляции а2-адренорецепторов и функционально связанных с ними опиатных рецепторов). У больного увеличивается выведение воды и натрия с мочой, экскреция же калия не меняется. Этот диуретический эффект не зависит от активности простагландинов и не меняется при ингибировании их образования (индометацином и другими нестероидными противовоспалительными средствами; см. гл. 39).
В качестве антигипертензивного средства его применяют длительно; после снижения-артериального давления отменять препарат следует постепенно, иначе внезапное прекращение торможения пресинаптических эффектов может привести к резкому повышению активности симпатических нейронов (феномен отдачи), увеличить импульсацию от них к периферическим тканям и привести к гипертоническому кризу, коронарной недостаточности, кровоизлиянию в мозг.
Все шире используют клофелин в анестезиологии для подготовки больного к операции (для премедикации), во время и после нее. Имеет значение его успокаивающее влияние на центральную нервную систему, потенцирующее эффективность средств общей анестезии (см. гл. 8), анальгетиков (см. гл. 6), снижение освобождения катехоламинов, стабилизация артериального давления и пр.
Клофелин вызывает анальгетический эффект. Особенно интенсивно он выражен при эпидуральном введении, применяемом для обезболивания родов, во время ортопедических операций, у больных со злокачественными опухолями, в том числе в терминальной стадии, при повреждении спинного мозга и пр. Полагают, что его анальгетический эффект связан с угнетением ноцицептивных ответов нейронов заднего рога спинного мозга и с воздействием на антино-цицептивные механизмы, осуществляемые при участии голубого пятна, нисходящий путь которого модулирует передачу болевого импульса на уровне спинного мозга. Анальгетический эффект клофйлина не сопровождается эйфорией (хорошим самочувствием), возникновением физической и психической зависимости (наркомании), но может быть ослаблен антагонистами морфина, то есть в возникновении анальгетического эффекта участвуют эндогенные опиа-тергические системы (см. гл. 6).
Эпидуральное его введение усиливает эффект местных анестетиков. В акушерстве он используется для прекращения преждевременных родов. При этом удачно сочетаются его способность подавлять сокращения матки (результат центральной активации аг-адренорецепторов), боль, повышенное освобождение катехоламинов и предотвращать подъем артериального давления во время схваток, успокоение женщин.
Клофелин с успехом применяют для устранения явлений лишения (абстиненции) у наркоманов, алкоголиков и курильщиков табака. Надо только помнить, что вместе с веществами, угнетающими центральную нервную систему (морфином и его группой, алкоголем, барбитуратами и другими снотворными), клофелин применять нельзя, иначе произойдет сильнейшее угнетение цент
57
ральной нервной системы, включая угнетение дыхания, что может привести к гибели человека.
Влияя на центральную нервную систему, клофелин способствует освобождению СТГ, что используют с диагностической целью (для выявления причин медленного роста ребенка).
При одномоментном или кратковременном (1—3 дня) приеме препарата обычно осложнений не отмечают, лишь при быстром внутривенном введении активация аг-адренорецепторов гладких мышц сосудов приведет к повышению их резистентности и подъему артериального давления раньше, чем клофелин проникнет в центральную нервную систему и вызовет центральный антигипертензивный эффект. Поэтому внутривенное введение клофелйна должно быть медленным. При длительном применении могут возникнуть сухость слизистых оболочек полости рта, дыхательных путей, запоры.
Гуанфацин вызывает практически те же эффекты, что и клофелин, но отличается от него более длительным пребыванием в организме, менее выраженным явлением отмены и других нежелательных эффектов.
Гуанобенз отличается сравиительно быстрым исчезновением из организма (его период полувыведения — 4—6 ч) и интенсивной биотрансформацией в печени (поэтому при ее патологии дозу надо снижать). Сухость слизистых оболочек рта, запоры, угнетение центральной нервной системы также выражены, как и при приеме клофелйна.
Метилдофа — синтетический препарат, удовлетворительно всасывающийся из желудочно-кишечного тракта и проникающий во все ткани, включая центральную нервную систему. В организме он подвергается биотрансформации, превращаясь сначала в метилдофамин, а затем в метилнорадреналин — ложный медиатор. Образовавшийся метилнорадреналин захватывается в пре-синаптические окончания адренергических волокон и депонируется в везикулах. Во время нервного импульса он освобождается вместе с естественным медиатором. В периферических структурах он вызывает эффект, аналогичный норадреналину, но в центральной нервной системе активирует аг-адренорецепторы, подобно клофелину. Поэтому он тоже снижает повышенное артериальное давление, преимущественно за счет понижения периферического сопротивления сосудов; он улучшает кровоснабжение почек и может увеличить диурез. Иногда снижает уровень ренина в плазме крови. 2/з всосавшегося препарата выводятся почками, при недостаточности их функции может произойти его кумуляция. Прием метилдофа может сопровождаться возникновением нежелательных эффектов: нарушением функции желудочно-кишечного тракта (тошнота, рвота), лейкопенией, головной болью, повышением температуры тела. Может быть аутоимунная гемолитическая анемия, нарушение функции печени. Отмену препарата, также как и клофелйна, надо проводить постепенно.
^-Адреномиметические средства. К ним относят: адреналин, изадрин, добутамин, орципреналин (метапротеренол, алупент, аст-мопент), фенотерол (беротек, партусистен, тербутал и н), с ал-бутамол (албутелор, вентолин). Они отличаются друг от друга по способности воздействовать на различные адренорецепторы, подвергаться инактивации под влиянием ферментов (см. табл. 8).
58
Таблица 8
Сравнительная характеристика р-адреномиметиков
Препарат Инактивация Активируемые адренорецепторы
МАО комт 31 ₽2 «1
Адреналин +++ 4-4-4-4- +++ + + + +++
Изадрин +++ 4-4-4- +++ 4-4-4- -
Добутамин ++ - ++ + 4-
Оршшреналин + - + 4-4-4- -
Салбутамол + +++ + +++ —
Бриканил - - + -+++ -
Примечание. Количество (+) отражает интенсивность эффекта или степень инактивации ферментами, (—) — отсутствие эффекта.
В таблице 9 представлены результаты активации fj|- и [Зг-адренорецепторов.
Таблица 9
Локализация p-адренорецепторов и результаты их активации
р Тип ецепторов Локализация Результат стимуляции
31 Синусовый узел Миокард Атриовентрикулярный узел Пучок и ножки Гиса Печень, скелетные мышцы Повышение возбудимости, учащение сокращений сердца Увеличение силы сокращений Увеличение проводимости Увеличение автоматизма Увеличение гликогенолиза
02 • Артериолы, особенно скелетных мышц^ Релаксация
л ? Гладкая мускулатура бронхов То же
Беременная матка Ослабление и прекращение сокращений
Островковая ткань поджелудочной железы Окончания симпатических нервов Окончания холинергических нервных волокон Увеличение секреции инсулина 'г - UtiQ,!-,. J Увеличение освобождения медиатора Увеличение освобождения ацетилхолина /
И 02 Жировая ткань Юкстагломерулярная ткань в почках Увеличение липолиза Увеличение освобождения ренина
Изадрин редко применяют в педиатрии: в основном в качестве бронхо-расширящего средства. Для устранения бронхоспазма его вводят внутривенно капельно. Ингаляции эффективны только в том случае, если величина частичек
59
меньше 3 мкм, тогда они проникают вглубь легких и достигают мельчайших бронхов и предал ьвеолярного жома.
Адреномиметические средствах преимущественным воздействием на ренорецепторы (орци прен ал и н, салбутамол, фенотерол) имеют большее значение для педиатрии. Их применяют и для профилактики, и для купирования бронхоспазма у детей, при этом нарушений в деятельности сердца они взывают значительно меньше, чем адреналин или изадрин. Терапевтический эффект от их введения преимущественно наблюдают у детей старше 1,5 лет. Причина этого явления пока недостаточно ясна. Допускают, что в младшем возрасте обструкция дыхательных путей связана не столько со спазмом слабо развитой гладкой мускулатуры, сколько с набуханием слизистой оболочки бронхов, которое эти вещества не устраняют. Важна способность салбутамола устранять угнетающее влияние коклюшного токсина на p-адренорецепторы бронхов и ускорять этим ликвидацию приступов кашля.
Р2-Адреномиметики способны устранить или ослабить сокращения беременной матки. Это используют для подавления преждевременных родов, сохранения беременности или ее продления.о и у матери, и у плода все же возникает тахикардия, а у новорожденного, родившегося вскоре после введения препарата, — гипогликемия, являющаяся следствием длительно сохраняющейся у него функции инсулина, интенсивно выделяемого в ответ на гипергликемию (возникшую из-за попадания глюкозы через плаценту к плоду и из-за гликогенолиза в его тканях).
Добутамин преимущественно влияет на Рг, отчасти на р2- и а|-адрено-рецецторы (на последние в основном в миокарде). Он не увеличивает освобождение норадреналина и не влияет на Д-рецепторы. Вводят его внутривенно капельно. Уже через 2 мин отмечают увеличение силы сердечных сокращений с максимальным эффектом через 10-20 мин. Этот эффект связан с активацией Pi- и at-рецепторов, поэтому соответствующие адренолиТики (например, анап-рилин и празозин) устраняют его. Увеличение силы сокращений сердца приводит к увеличению сердечного выброса, не сопровождаемого учащением сокращений сердца, изменениями артериального давления, кровоснабжения почек, кишечника. На фоне острой гипоксемической гипоксии снижает давление в легочных капиллярах, а в связи с этим и опасность развития отека легких.
Добутамин быстро инактивируется МАО, и период его полувыведения всего 2-3 мин. При длительной внутривенной инфузии к нему быстро развивается привыкание (тахифилаксия), и эффект снижается на 30-40%, поэтому дольше 2-3 суток производить инфузию нецелесообразно. Однако достигнутое улучшение деятельности сердца может сохраняться несколько недель, а у отдельных больных и несколько месяцев. Поэтому его начали применять и при хронической сердечной недостаточности путем прерывистого внутривенного введения по несколько часов или дней (не больше 2) в неделю.
Применяют добутамин в основном при острой сердечной недостаточности, сочетающейся с дыхательной недостаточностью у больных с кардиогенным и септическим шоком.
Дофамин и прямые дофаминомиметики: апоморфин, бромокриптин (парлодел). Их эффект связан с активацией дофаминовых рецепторов (см. табл. 10).
60
Таблица 10
Локализация дофамивовых (Д) рецепторов и результаты их активации
Тин Д-рецепторов Локализация Результат их активации
Д1 Гладкая мускулатура сосудов: почек, брыжейки, кишечника, сердца, мозга Гладкая мускулатура нижнего сфинктера пищевода, желудка, кишечника Подчелюстная железа Экзокринная часть поджелудочной железы Центральная нервная система Гипоталамус Триггерная зона продолговатого мозга Релаксация Релаксация, ослабление сокращений Снижение секреции Повышение секреции Повышение двигательной активности Снижение секреции пролактина Тошнота, рвота
Д2 Окончания симпатических волокон Преганглионарные вегетативные волокна Снижение освобождения катехоламинов Снижение освобождения ацетилхолина, угнетение передачи импульсов в вегетативных ганглиях
Дофамин и дофаминомиметики активируют Д-рецепторы в разных тканях неодинаково. Апоморфин преимущественно влияет на триггерную зону продолговатого мозга, и его используют в качестве рвотного средства (см. гл. 26). Наибольшее значение бромокриптина (парлодела) состоит в подавлении секреции пролактина и лактации, в восстановлении функции яичников и ритма менструаций, если эти нарушения связаны с гиперпролактинемией. Известно, что избыток пролактина тормозит секрецию фолликулостимулирующего и лютеинизирующего гормонов. Кроме того, бромокриптин (парлодел) способен тормозить секрецию соматотропного гормона из опухоли аденогипофиза. Поэтому его применяют при лечении акромегалии.
Дофамин инактивируется МАО, поэтому его вводят внутривенно капельно, так как период его полувыведения очень короткий (не больше 9 мин). В минимальной дозе 0,5—2 мкг/(кг-мин) он активирует Д|-рецепторы, вызывая расширение почечных, мезентериальных, мозговых и коронарных сосудов, снижает общую периферическую резистентность сосудов. В результате очень быстро увеличивается диурез, клиренс креатинина, натриурез. В дозе 2-3 мкг/(кг • мин) вызывает активацию (^-адренорецепторов, что приводит к увеличению силы сердечных сокращений, сердечного выброса и к ликвидации сердечной недостаточности. В дозе 7-10 мкг/(кг мин) активирует р2-адренорецепторы (это может сопровождаться увеличением освобождения катехоламинов из симпатических окончаний), что вызывает учащение сокращений сердца, даже возникновением тахиаритмий. От этих и более высоких доз дофамина могут активироваться и а,-рецепторы сосудов, что приводит к повышению их резистентности, подъему артериального давления и к снижению кровоснабжения почек.
У новорожденных дофамин способен проникать через гематоэнцефалический барьер, что увеличивает его (и норадреналина) концентрацию в ЦСЖ, тормозит секрецию пролактина и тиреотропинрелизинг гормона гипофизом и гипоталамусом соответственно. На сердечно-сосудистую, систему новорожденных и грудных детей дофамин влияет в меньших дозах. Для увеличения диуреза, улучшения
61
сердечной деятельности и периферического кровообращения дофамин им начинают вводить в дозе 0,5 мкг/(кг • мин), постепенно увеличивая дозу и индивидуально подбирая ее.
Когда при кардиогенном или септическом шоке вынуждены вводить высокие дозы дофамина с целью улучшить деятельность сердца, повысить артериальное давление, для предотвращения спазма почечных сосудов одновременно надо вводить препараты, улучшающие почечный кровоток, например, натрия нитропруссид (см. гл. 23).
Длительность внутривенных инфузий дофамина индивидуальна, но не должна быть больше 2-3 дней, так как к этому времени к нему развивается тахифилаксия, и эффект намного снижается.
При введении дофамина может повыситься давление в легочных капиллярах, поэтому он опасен при острой гипоксемической дыхательной недостаточности (во время которой отмечают повышение давления в этих капиллярах). Дофамин вызывает ряд нежелательных эффектов: тахикардию, аритмии, легочную гипертензию, подавление рефлексов с химиорецепторов каротидных клубочков на СО2, увеличение экскреции фосфатов с мочой, что приводит к гипофосфатемии, нарушающей метаболические процессы и ухудшающей сокращения диафрагмы. Высокие дозы дофамина могут ухудшить кровоснабжение конечностей, вызвать гангрену пальцев.
Леводопа — предшественник дофамина, норадреналина и адреналина, не инактивируется МАО и КОМТ, хорошо всасывается из желудочно-кишечного тракта и проникает во все ткани, включая центральную нервную систему. Нормализуя содержание дофамина в подкорковых структурах (хвостатое -.ядро и т. д.), леводопа восстанавливает нормальные сокращения скелетных мышц у больных, страдающих торсионной дистонией, паркинсонизмом и другими гиперкинезами (см. гл. 13).
У детей с недостаточным ростом леводопу применяют для стимуляции секреции соматотропного гормона (результат воздействия дофамина, образовавшегося в центральной нервной системе, на гипоталамические структуры, регулирующие синтез и освобождение этого гормона).
При назначении препарата у ребенка могут возникнуть тошнота, рвота, снижение артериального давления, тахикардия, нарушение сна.
Непрямые адреномиметические средства. Эфедрин и фенамин похожи по структуре на катехоламин, поэтому их активно транспортируют специальные механизмы из синаптической щели в пресинаптическое окончание, где они депонируются в везикулах. Названные вещества вытесняют из везикул обычно содержащиеся в них катехоламины, увеличивая их освобождение как во время нервного импульса, так и спонтанно. Кроме того, эти вещества блокируют возврат катехоламинов из синаптической щели в пресинаптическое окончание (обычно возвращается 60—80% выделившегося медиатора), увеличивая этим их концентрацию в области адренорорецептора, и приводят к его возбуждению. Наконец, они сенсибилизируют адренорецепторы к катехоламинам. Эфедрин преимущественно повышает активность норадреналина, а фенамин — дофамина, особенно в центральной нервной системе. Поэтому фенамин используют в качестве психотропного средства (см. гл. 4).
У детей первых месяцев и лет жизни содержание катехоламинов в преси-наптических окончаниях и активность транспортных механизмов, переносящих медиаторы из синаптической щели в окончание нервного волокна, еще невелики. Поэтому применение непрямых адреномиметиков у детей младшего 62
возраста менее эффективно, чем у старших детей и у взрослых. Для достижения одинакового эффекта (например, для повышения артериального давления на равную величину) детям нужна значительно большая доза эфедрина на единицу массы тела, чем у взрослых. Повышение активности а-адренорецепторов накопившимся медиатором приводит к сужению сосудов, что используется при местном применении для подавления секреции, например, слизистой оболочкой носа. Резорбтивный эффект используется для повышения артериального давления у детей с хронической гипотонией. Повышение возбудимости адренорецепторов приводит к расслаблению гладкой мускулатуры бронхов или к предупреждению возникновения ее спазма. Поэтому эфедрин используют для профилактики, реже — для устранения приступов бронхиальной астмы. Имеет значение и уменьшение набухания слизистой оболочки бронхов. Однако эфедрин, вызывая сужение легочных сосудов, ухудшает газообмен. При повторных введениях эффективность эфедрина падает, особенно быстро у детей младшего возраста.
При передозировке эфедрина у детей старше 5 лет отмечают беспокойство, сердцебиение, тошноту. У детей до 5 лет этих осложнений обычно не бывает, напротив, у них возможно угнетение центральной нервной системы (даже сонливость).
Непрямые дофаминомиметики: мидантан, глудантан, 1-депренил. Они способствуют освобождению дофамина из пресинаптических окончаний, сенсибилизируют к нему Д-рецепторы. В основном их применяют при лечении паркинсонизма (см. гл. 13).
АДРЕНО- И ДОФАМИНОНЕГАТИВНЫЕ СРЕДСТВА
Адренонегативные средства — это вещества, нарушающие передачу возбуждения в адренергических синапсах. Различают а- и p-адрёноблокаторы (их называют также а- и p-адренолитиками или а- и p-адренолитическими средствами) и симпатолитики. Последние нарушают передачу возбуждения на уровне пресинаптических окончаний, то есть действуют пресинаптически. Здесь же рассматриваются блокаторы дофаминовых рецепторов. В табл. 11 приведены адренолитические средства, блокирующие афенорецепторы.
а-Адреноблокаторы. Эти средства могут быть селективными, то есть блокировать только ссгрецепторы, и неселективными.
а,-Адреноблокатор празозин снижает периферическое сопротивление сосудов, и его применяют у подростков в качестве антигипертензивного средства (см. гл. 23).
Неселективный а-адреноблокатор фентоламин, блокируя аг-адренорецепторы, устраняет повышенный тонус артериол и венул, спазм прекапиллярных сфинктеров, сокращение предальвеолярного жома. Блокируя аг-адренорецепторы, он устраняег-тормозящее влияние катехоламинов на пресинаптические окончания симпатических волокон, что приводит к увеличению освобождения медиаторов, вызывающих активацию p-адренорецепторов (а-адренорецепторы блокированы). Это также способствует уменьшению резистентности периферических сосудов, артериального давления, улучшает микроциркуляцию, расслабляет гладкую мусклатуру бронхов, но увеличивает частоту и силу сокращений сердца.
63
Таблица 11
Средства, блокирующие адренорецепторы
Препараты Адренорецепторы
ai 0.2 ₽1 Р2
Празозин + - - -
Фентоламин - + + - -
Д игидроэрготокс ин + + - -
Пирроксан + + - -
Анаприлин - • - + +
Окспренолол (тразикор) - - 4- +
Пиндолол (вискен) - - + +
Алпренолол - - 4- +
Атенолол р - 4- -
Талииолол (корданум) - - 4- -
Фентоламин назначают для улучшения микроциркуляции у детей с болезнью Рейно, акроцианозом, а также при шоке, ожоговой болезни, обезвоживании и пр. Появились сообщения об эффективности применения и фентоламина, и пирроксана при некоторых формах бронхиальной астмы (устранение спазма пррдальвеолярного жома), об успешном использовании фентоламина при сердечной недостаточности у детей (снижение- пре- и постнагрузки на сердце, улучшение его деятельности). При длительном назначении больших доз фентоламина может развиться тяжелая гипогликемия, по-видимому, в* результате активации действия Р-адренорецепторов и секреции инсулина.
Пирроксан влияет на функцию структур центральной нервной системы, регулирующих артериальное давление, и его применяют в основном в качестве антигипертензивного средства (см. гл. 23).
fi-Адреноблокаторы. Средства этой группы отличаются не только способностью блокировать Pi- или Рз-адренорецепторы, но наличием или отсутствием мембраностабилизирующей и внутренней симпатомиметической активности.
Мембраностабилизирующей активностью обладают анаприлин, окс-пренолол, пиндолол, алпренолол. Это действие, заключающееся в уменьшении проницаемости мембраны для ионов натрия и калия, не связано с блокированием p-адренорецепторов (аналогичным действием обладают местные анестетики, антигистаминные средства, ионы кальция и пр.), но отчасти способствует возникновению терапевтических эффектов перечисленных препаратов.
Внутренней симпатомиметической активностью обладают пиндолол, окс-пренолол, алпренолол. Это свойство заключается в способности названных веществ, взаимодействуя с адренорецепторами, активировать их, вызывать небольшой миметический эффект, но одновременно предотвращать реакцию этих 64
же. рецепторов на медиатор нервного импульса или адреномиметические средства.
Внутренняя симпатомиметическая активность предотвращает развитие полного блока p-адренорецепторов и связанных с ним осложнений.
Блокирование р,-адренорецепторов уменьшает реакцию сердца на симпатическую импульсацию. Это преимущественно проявляется в период физической или эмоциональной нагрузки предотвращением или устранением тахикардии, эктопических очагов возбуждения, снижением силы и частоты сердечных сокращений, минутного объема крови, потребности миокарда в кислороде. Блокирование р2-адренорецепторов уменьшает секрецию ренина и освобождение катехоламинов из пресинаптических окончаний и этим косвенно ограничивает их активирующее влияние на а-адренорецепторы; устраняет расслабляющее влияние катехоламинов на гладкую мускулатуру бронхов. Блокирование pi- и р2-адренорецепторов ограничивает липолиз, освобождение свободных жирных кислот.
p-Блокаторы широко применяют у детей для профилактикти или устранения тахиаритмий, преимущественно суправентрикулярных, в том числе связанных с тиреотоксикозом; для понижения артериального давления, как при эссенциальной гипертонической болезни, так и при симптоматических гипертензиях,; для устранения симпатического влияния на сердце и спазмированное устье легочной артерии у детей с тетрадой Фалло; для снижения напряжения мускулатуры желудочков и особенно межжелудочковой перегородки у детей с гипертрофической кардиомиопатией (улучшение диастолического расслабления сердца ведет у них к увеличению ударного и минутного объема крови и к улучшению гемодинамики); для подавления чрезмерной возбудимости центральной нервной системы у детей с эссенциальным тремором, страхами, сочетающимися с тахиаритмией и пр.
Существуют фармакокинетические особенности p-блокаторов. Так, анапри-лин и окспренолол при приеме внутрь усваиваются только на 50-20%, все остальное инактивируется при первом прохождении через стенку кишечника и в печени. Циркулирующие в крови сначала интенсивно, а затем во все меньшей степени эти препараты захватываются печенью и инактивируются ею. Поэтому в начале лечения период полужизнй препаратов небольшой (40-60 мин), а затем увеличивается до 3,5-6 ч. Поэтому при длительном назначении их дозу надо уменьшать. Пиндолол мало подвергается пресистемной элиминации и биологическое усвоение его примерно равно 90%, доза и скорость его системной элиминации при длительном назначении не меняются.
При использовании p-блокаторов могут возникнуть нежелательные эффекты: резкое ослабление возбудимости и сократимости миокарда, приводящее к развитию сердечной недостаточности; появление атриовентрикулярного блока; повышение тонуса и спазм бронхов, особенно у детей с бронхиальной астмой: гипогликемия из-за угнетения гликогенолиза. Эти осложнения возникают реже при назначении препаратов, обладающих внутренней симпатомиметической активностью. Бронхоспазм реже возникает и при использовании pi-адреноли-тиков (кардиоселективных): атенолола, талинолола. Наибольшее количество осложнений возникает от применения анаприлина. Поэтому он противопоказан детям с бронхиальной астмой, синусовой брадикардией, атриовен-
3 Зак. 3856
65
трикулярным блоком, сердечной недостаточностью, нарушениями периферического кровообращения.
Средства, блокирующие дофаминовые рецепторы. Способностью блокировать Д-рецепторы обладают аминазин (и другие производные фенотиазина), галоперидол, дроперидол (и другие производные бутирофенонов), метоклопрамид (церукал) и пр. Все они характеризуются широким спектром нейротропного действия и рассматриваются в других разделах учебника (см. гл. 4, 26).
Симпатолитики — вещества, нарушающие освобождение медиатора из окончаний симпатических волокон.
К этой группе относятся резерпин, октадин (изобарин) и орнид.
Резерпин — алкалоид из индийского растения Rauwoljla serpentina — нарушает связывание и депонирование катехоламинов в везикулах пресинап-тического окончания; из них они попадают в цитоплазму и инактивируются МАО. Истощение запасов катехоламинов приводит к ослаблению симпатической импульсации к артериолам, сердцу и другим тканям и органам; снижаются периферическая резистентность сосудов и артериальное давление, понижаются возбудимость сердца и частота его сокращений, а следовательно, и минутный объем крови. Поэтому резерпин7 применяют в качестве антигипертензивного средства (см. гл. 23), преимущественно у детей с гиперкинетической формой артериальной гипертонии.
Проникая в центральную нервную систему, резерпин истощает запасы в ней и катехоламинов, и серотонина, что нередко приводит к угнетению функции мозга и даже к психической депрессии. Дети раннего возраста очень чувствительны к резерпину. Он может проникнуть к плоду через плаценту, а к ребенку с молоком матери, вызывая при этом_угнетение дыхания, рефлексов сосания, сонливость, набухание слизистой оболочки носа, затрудняющее носовое дыхание (ртом новорожденные не умеют дышать). Все это создает опасность для ребенка. Поэтому резерпин Противопоказан беременным и кормящим.
Октадин активно транспортируется в аксоплазму пресинаптического окончания, создавая в нем концентрации в 1000—3000 раз выше, чем во внеклеточной жидкости. Препарат вытесняет медиатор из везикул в цитоплазму,^ где его инактивирует МАО. В синаптическую щель медиатор проникает с трудом, так как высокие концентрации препарата стабилизируют мембрану окончания и делают ее малопроницаемой для катехоламинов. В результате происходит истощение их запасов, ослабляется симпатическая импульсация к артериолам, венулам и к сердцу. Это уменьшает периферическое сопротивление сосудов, частоту сокращений сердца, освобождение ренина, в результате чего понижается артериальное давление. В основном октадин применяют в качестве антигипертензивного средства. В центральную нервную систему этот препарат не проникает и не вызывает ее угнетения, но он ограничивает импульсацию к венулам, способствуя возникновению ортостатических явлений (гипотензии) и даже ортостатического коллапса при переходе ребенка из положения лежа в положения стоя. Это осложнение отмечают у детей преимущественно школьного возраста.
Орнид также накапливается в пресинаптических окончаниях и нарушает освобождение катехоламинов. В педиатрии его применяют мало, так как он плохо всасывается из желудочно-кишечного тракта.
Лекарственные формы и дозы адренотропных средств для детей представлены в табл. 12.
66
Таблица 12
Адренотропные средства
Препарат Лекарственная форма Путь введения Число введений Однократная доза
Адреналина гидрохлорид Adrenalinum hyd-rochloridum 0,1% раствор в ампулах по 1 мл Внутримышечно 2 До 1 года — 0,1-0,15 мл; 2-4 года — 0,2 мл; 5—10 лет — 0,3-0,4 мл
Норадреналина гидротартрат1 Noradrenalinum hydro tart га ricum 0,2% раствор в ампулах по 1 мл Внутривенно капельно 1 20-30 мкг/кг в 1 мин
Мезатон1 Mesatonum 1 % раствор в ампулах по 1 мл То же 1-2 20—30 мкг/кг в 1 мин
Галазолин Halazolinum 0,05% раствор во флаконах по Ю мл В полость носа 1 По 1 капле в каждую половину носа
Клофелин Clophelinum Таблетки по 0,075 мг и 0,15 мг •Внутрь 3 0,01—0,02 мг/кг
0,01% раствор в ампулах по 1 мл Внутримышечно, подкожно 3 0,01-0,02 мг/кг
Добутамин1 Dobutaminum 1,25% раствор в ампулах по 20 мл Внутривенно капельно 1 7,5—10 мкг/кг в 1 мин
Эфедрина гидрохлорид Ephedrini hydroc-hloridum Порошок Внутрь 1-2 . До 1 года - 0,002-0,003 г; 2-5 лет — 0,003-0,01 г; 6-12 лет — 0,02 г
Орципреналина сульфат Orciprenalini sulfas Таблетки по 0,02 г Внутрь 2-4 До 1 года — 0,005 г; 2-4 года — 0,007 г; 5-7 лет — 0,01 г; 8-10 лет - 0,011-0,015 г
0,05% раствор в ампулах по 1 мл Внутривенно, внутримышечно 1 До 1 года — 0,2-0,4 мл; 2—4 года — 0,6 мл; 5-7 лет — 0,8 мл; 8—10 лет — 1,0 мл
Фенотерол Fenoterolum Аэрозольный баллон по 15 мл (содержит 300 доз) Ингаляционно 2-3 7,5 мг
Солбутамол2 Salbutamolum Таблетки по 0,02 г Внутрь 2-3 До 4 лет — 0,15 мг/кг; 5-7 лет — 0,002 г; 8—10 лет — 0,004 г
Дофамин1 Dophaminum 0,05% или 4% раствор в ампулах по 1 мл Внутривенно капельно 1 От 2—6 до 5-10 мкг/кг в 1 мин
Фентоламина гидрохлорид Phentolamini hyd-rochloridum Таблетки по 0,025 г Внутрь 3 2-3 мг/кг в сутки
Пирроксан Pyrroxanum Таблетки по 0,015 г То же 3 2—4 года — 2-10 мг; 5-7 лет — 10-15 мг; 8-10 лет — 15-20 мг
67
Окончание табл. 12
Препарат Лекарственная форма Путь введения Число введений Однократная доза
Анаприлин Anaprilinum Таблетки по 0,01 г и 0.04 г Внутрь 3 1-4 мг/кг в сутки
0,1% раствор в ампулах по 1 и 5 мл Внутривенно (в течение 10 мин) 1 0,02 мг/кг в сутки
Окспренолол Oxprenololum Таблетки по 0,02 г Внутрь 3 2—3,5 мг/кг в сутки
Пиндолол Pindolokim Таблетки по 0,005 г То же 3 6 мг/кг в сутки
0,02% раствор в ампулах по 5 мл Внутривенно (в течение 5 мин) 1 2 мг/кг
Октади н Octadinum Таблетки по 0,025 г Внутрь 1 0,2-3 мг/кг в сутки
Резерпин Reserpinum Таблетки по 0,0001 г То же 2-3 3-4 6-12 лет - 0,0001 г Старше 12 лет — 0,0001 г
500 мл изотонического раствора натрия
Примечание. 1. Содержимое ампулы разводят в хлорида или 5% раствора глюкозы. 2. Суточная доза.
3 ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ВЛИЯЮЩИЕ НА АКТИВНОСТЬ ПУРИНЕРГИЧЕСКИХ СИСТЕМ
В центральной и периферической нервной системе обнаружены пуринер-гические нейроны, при активации которых из окончаний аксонов происходит освобождение либо аденозина (нуклеозида, состоящего из аденина и рибозы), либо аденозинтрифосфата (АТФ), которые взаимодействуют со специфическими рецепторами, локализованными на постсинаптической мембране эффекторных органов. Пуринергические волокна иннервируют сердце, кровеносные сосуды, почки, желудок, кишечник, жировую клетчатку. Обилие пуринергических аксонов обнаружено в центральной нервной системе. Кроме того, АТФ содержится в окончаниях холинергических и адренергических волокон и освобождается ’ вместе с ацетилхолином или норадреналином и затем функционирует либо как АТФ, либо после дефосфорилирования в виде аденозина.
От других нейромедиаторов аденозин и АТФ отличаются еще и тем, что они синтезируются не только в нервных окончаниях пуринергических нейронов, но и вне синапсов, непосредственно в тканях, особенно интенсивно в эндотелиальных клетках сосудов. В тканях образование аденозина может происходить двумя способами: а) при нормальном содержании кислорода в крови и тканях (при нормоксии) из S-аденозилгомоцистеина, под влиянием специальной гидролазы; б) при гипоксии — из аденозинмонофосфата под влиянием нуклеотидаз (локализованных в клеточных мембранах, в мембранах лизосом и митохондрий). При гипоксии образование аденозина резко (в 100 и более раз) возрастает. В клетках аденозин может быть в связанном с белками виде, может подвергаться воздействию аденозиндезаминазы и превращаться в инозин, может 68
(при накоплении больших его количеств) обратно превращаться в АМФ или в S-аденозилгомоцистеин.
В мембране этих клеток есть специальный нуклеозидный носитель (транспортер), который осуществляет транспорт аденозина (или инозина) как из клетки, так и обратно, особенно из эндотелиальных клеток в кровь и из крови обратно. Из крови аденозин быстро исчезает (период его полувыведения из нее всего несколько секунд) так как: а) захватывается эритроцитами, где под влиянием аденозинкиназы подвергается фосфорилированию в аденозинмонофосфат; б) захватывается при участии нуклеозидного носителя обратно в эндотелий; в) под влиянием аденозиндеаминазы крови превращается в инозин.
С помощью фармакологических средств выделили несколько пуриновых рецепторов. -
Пуриновые / (П-1) рецепторы — реагируют на аденозин, поэтому их называют еще аденозиновыми (А) рецепторами; их блокируют ксантины. П-1 рецепторы делят на аденозиновые-1 (AJ и аденозиновые-2 (А2) рецепторы. Стимуляция А| рецепторов сопровождается ингибированием аденилатциклазы и снижением содержания цАМФ в эффекторном органе, стимуляция же А2 рецепторов приводит к активаций аденилатциклазы и к увеличению содержания цАМФ в органе. В центральной нервной системе, преимущественно на пресинаптических окончаниях различных аксонов, обнаружены аденозиновые рецепторы, функция которых не связана с аденилатциклазой.
Пуриновые II (П-П) рецепторы — реагируют на АТФ и в меньшей степени на АДФ и АМФ, ксантины на них не влияют. Функциональная роль этих рецепторов еще недостаточно изучена.
При стимуляции Ai-рецепторов происходит замедление сокращений сердца из-за: а) гиперполяризации клеток синусового узла (следствие повышения проницаемости для К+ и его выхода из клетки); б) замедления проведения в .AV узле; в) устранения активности стимулированной катехоламинами аденилатциклазы (на базисную активность фермента аденозин не влияет); г) снижения освобождения катехоламинов из пресинаптических окончаний адренергических волокон (это наблюдается и в других органах и тканях), от «высоких концентраций аденозина — уменьшение силы сокращений сердца. Стимуляция Аг рецепторов вызывает, кроме того, сужение ’ афферентных сосудов клубочков почек и снижение в связи с этим клуб^ковой фильтрации; торможение освобождения ренина и эритропоэтина в почках; в жировой ткани — торможение липолиза, увеличение захвата глюкозы и триглицеридов дипоцитами. В центральной нервной системе стимуляция А,-рецепторов приводит к торможению освобождения многих нейромедиаторов: ацетилхолина, норадреналина, дофамина, серотонина, гамма-аминомасляной кислоты, а также возбуждающих аминокислот: (аспарагината и глутамата). В результате активация А,-рецепторов вызывает угнетение центральной нервной системы: снижение спонтанной активности нейронов, спонтанной двигательной активности, подавление судорог, эпилептических припадков, угнетение структур, регулирующих дыхание; возникновение антианксиогенного эффекта (это напоминает эффект бензодиазепинов (см. гл. 4), центральная миорелаксация.
Стимуляция А2-рецепторов вызывает расширение артериальных сосудов в организме, кроме афферентных сосудов в клубочках почек (в, них, так же как и при стимуляции А|-рецепторов, происходит сужение просвета), повышает продукцию эритропоэтина, очень высокие концентрации аденозина могут вызвать повышение секреции ренина. Стимуляция А2-рецепторов на поверхности
69
тромбоцитов приводит к повышению содержания в них цАМФ и торможению их агрегации (см. гл. 28).
Аденозиновые рецепторы содержатся и в других органах и тканях, но тип этих рецепторов пока неясен, к тому же при патологии может меняться соотношение А,- и А2-рецепторов. Например, у больных бронхиальной астмой аденозин в сравнительно небольших концентрациях способен вызвать бронхоспазм (прямо или путем освобождения гистамина из тучных клеток, как у морских свинок), у здоровых же людей такой реакции не наблюдают. Обнаружено, что при бронхиальной астме снижается сродство аденозиновых, особенно А2-рецепторов к аденозину, и его воздействие на них сопровождается меньшим подъемом уровня цАМФ, чем у здоровых лиц.
Аденозин расширяет сосуды кишечника, способствуя всасыванию, тормозит перистальтику кишечника, модулирует секрецию желудочного 'сока и поджелудочной железы. Он интенсивно влияет на процессы иммуногенеза: тормозит активность ДНК и РНК, деление и дифференцировку клеток, угнетает стимулирующее влияние митогенов на лимфоциты, их цитолитическую активность. При дефиците аденозиндеаминазы в крови (при болезни Ходжкина), сопровождающемся^ увеличением концентрации аденозина в крови, отмечают угнетение иммунитета и высокую чувствительность к различным инфекциям.
Существуют три группы лекарственных средств, влияющих на активность аденозина.
I. Прямые аденозиномиметики (агонисты), активирующие аденозиновые рецепторы.
II. Непрямые аденозиномиметики, нарушающие активность нуклеозидного носителя и возврат аденозина в клетки, в том числе в эндотелиальные клетки и этим повышающие его активность.
III. Аденозинолитики — блокаторы аденозиновых рецепторов.
К аденозиномиметикам относят сам аденозин, способный влиять на оба типа рецепторов, синтетические вещества, преимущественно влияющие на Ai-рецепторы (циклопентиладенозин, циклогексиладенозин, фенилизоПропила-денозин и пр.) или А2-рецепторы (N-этилкарбоксамидоаденозин-НЭКА, его этиловый аналог — МЭКА, 2-хлороаденозин, 2-фениламиноаденозин и пр.). Своеобразным аденозиномиметиком является метаболит аденозина — инозин.
К пуриновым II миметикам относят АТФ, АДФ, АМФ.
Прямые аденозиномиметики. Аденозин. Очень быстро элиминирует из кровеносного русла, поэтому его применяют в виде капельной внутривенной инфузии для вызывания управляемой гипотензии во время операции на сосудах (например при аневризме аорты), для подавления суправентрикулярной тахикардии.
Инозин (рибоксин, инозие-F) — сравнительно стойкий препарат, его можно принимать внутрь, а также вводить внутривенно (предпочтительно — капельно). Его эффекты немного отличаются от эффектов аденозина, возможно он взаимодействует с любыми пуриновыми рецепторами. Инозин расширяет коронарные сосуды, особенно под эндокардом, повышает их реакцию на аденозин, улучшает кровоток в зоне миокарда, окружающей участок инфаркта, отчасти и в зоне ишемии, улучшая этим доставку кислорода. Освобождающаяся из него рибоза утилизируется в процессе гликолиза и является источником энергии. Инозин обладает кардиотоническим действием, связанным с влиянием на особые инозиновые рецепторы (отличающиеся от аденозиновых). Оно про
70
является в увеличении силы сердечных сокращений даже на фоне угнетения p-адренорецепторов, Na+, К+-АТФазы, блокады кальциевых каналов. При этом возрастают сокращения не только в нормальном, но и в инфицированном миокарде без повышения потребления кислорода, без учащения сердечных сокращений, без риска возникновения сердечных аритмий и без нарушений AV проводимости.
Инозин применяют при слабости сердечных сокращений, при нарушении деятельности сердца из-за отравлений: p-блокаторами, сердечными гликозидами, антикальциевыми препаратами, толуеном, ксиленом, содержащимися в различных красителях, клеях, употребляемых подростками для вызывания оглушения центральной нервной системы.
Он вызывает лечебный эффект при циркуляторных шоках, возникающих при ожогах, травмах, инфекционных эндотоксикозах и пр.
Названные выше синтетические аналоги аденозина, активирующие Аг и Аг-рецепторы пока проходят экспериментальные и клинические испытания.
К П-П миметикам относят АТФ, АМ Ф.
АТФ (фосфобион) вводят внутривенно, но из крови в ткани он не проникает (как и другие нуклеотиды), однако воздействуя на эндотелий сосудов, способствует освобождению из него простациклина и эндотелиального происхождения релаксирующего фактора NO (см. гл. 21). Кроме того, АТФ быстро расщепляется АТФазами с освобождением аденозина.
Применяют АТФ у больных со спазмами периферических сосудов (болезнь Рейно, перемежающаяся хромота), мышечной дистрофии. У взрослых е!го назначают при хронической коронарной недостаточности, миокардиодистрофии.
АМФ-аденозинмонофосфат (фосфаден) проникает из кровеносного русла в клетки тканей. Помимо активации П-П рецепторов, он является предшественником АТФ и аденозина, воздействующих на П-П и П-1 рецепторы соответственно.
Применяют фосфаден при сердечно-сосудистой патологии. После его введения возрастает сила сердечных сокращений, что является следствием улучшения трофики миокарда, накопления в нем энергии. Частота сокращений сердца снижается. Препарат тормозит агрегацию тромбоцитов, улучшает микроциркуляцию. Это способствует заживлению трофических язв, ожогов. Иногда фосфаден применяют при заболеваниях печени, улучшение ее метаболических процессов сопровождается снижением отложения жира в ней.
Непрямой аденозиномиметик — дипиридамол (курантил, персантин) ингибирует нуклеозидный носитель и этим препятствует выходу, но в большей степени возврату аденозина в клетки, в том числе в клетки эндотелия. В результате в крови возрастает концентрация аденозина, а следовательно, и его эффекты. Обнаружена способность дипиридамола увеличивать освобождение простациклина из эндотелиальных клеток. В центральной нервной системе дипиридамол взаимодействует с Ai- и бензодиазепиновыми рецепторами, вызывая транквилизирующий эффект, похожий на эффекты бензодиазепинов.
Применяют дипиридамол в качестве средства, улучшающего коронарный и мозговой кровоток (см. гл. 21, 22), а также в качестве антиагреганта (см. гл. 28).
71
Таблица 13
Ксантины
СН3
Препарат R1 R2 Добавление
1 Теобромин —Н -СНз -
Нигексин - СНз-(СН2)5 с -СНз Никотиновая кислота
О
II
- СНз - С - (СН2)4
-СНз
Н
—н
Пентоксифиллин
Теофиллин
Эуфиллин
-СНз
-СНз
Этилендиамин
Дипрофиллин
-СНз
- СН2 - СН -СН2 -он
ОН
Ксантинола никотинат
-СНз
Никотиновая кислота
- СН2 - СН — СН2 — N
ОН
/СНз
\ сн2 - сн2 - он
. Блокаторы аденозиновых рецепторов — аденозинолитики. Эта группа средств (см. табл. 13) представлена производными ксантина (диоксипурина). К ним относят: кофеин, теофиллин, теобромин, давно применяемые в медицинской практике, и их производные. К производным теофиллина относят: эуфиллин (эквимолярная смесь теофиллина с этилендамином), дипрофиллин, ксантинола никотинат (теоникол, компламин), к производным теобромина — темисал (диуретин), нигексин, рентоксифиллин (трентал).
Длительное время основным в механизме действия ксантинов считали угнетение ими фосфодиэстераз, инактивирующих цАМФ или цГМФ. Однако этот эффект возникает (in vitro) от концентраций ксантинов, намного превы-72
шающих их концентрации в организме человека, наблюдаемые от приема терапевтических доз препаратов. Следует однако учесть, что фосфодиэстеразы в разных тканях неодинаковы, и, возможно, в некоторых из них небольшое блокирование фермента и может возникнуть от терапевтических доз. Но по современным данным основное в их действии — угнетение аденозиновых рецепторов, преимущественно Аь
Блокирование Aj-рецепторов устраняет или ослабляет влияние на них аденозина и способствует большему воздействию аденозина на А2-рецепторы. В результате под влиянием ксантинов, особенно под влиянием теофиллина, эуфиллина, пентоксифиллина, дипрофиллина, происходит расслабление гладкой мускулатуры сосудов, улучшение кровотока по коронарным, мозговым, почечным сосудам. Эти же препараты расслабляют гладкую мускулатуру бронхов (особенно теофиллин), кишечника, мочеточников, желчных протоков и пр. Известно, что увеличение уровня цАМФ в гладкомышечной ткани (в данном случае из-за активации А2-рецепторов) препятствует соединению миозина с актином, снижает сократимость гладкой мускулатуры и устраняет ее спазмы. Особенно большое значение имеет бронхолитический эффект теофиллина (и эуфиллина) при лечении больных с бронхиальной астмой. Он и преобладает и устраняет бронхоспазм. К тому же он ослабляет угнетающее влияние аденозина на иммунитет, увеличивает число Т-супрессоров в крови таких больных почти до нормы, снижая этим образование иммуноглобулина В лимфоцитами-. Теофиллин, повышая содержание цАМФ в тучных клетках и базофилах, тормозит освобождение из них гистамина (см. гл. 40).
Ксантины тормозят агрегацию тромбоцитов, так как повышают в них содержание цАМФ (см. гл. 28). Однако «старые» препараты (теофиллин, теобромин) вызывают этот эффект в токсических дозах и концентрациях. Сравнительно новый препарат — пентоксифиллин тормозит агрегацию кровяных пластинок в терапевтических дозах. Поэтому его с успехом и применяют как антиагрегант для улучшения реологических свойств крови (см. гл. 28), к тому же он препятствует агрегации и других форменных элементов крови, в том числе эритроцитов. Это связано и с его способностью повышать освобождение простациклина из эндотелиальных клеток и увеличивать эластичность и деформируемость эритроцитов во время их прохождения по капиллярам. Кроме того, пентоксифиллин повышает фибринолитическую активность крови, увеличивая уровень активатора плазминогена и снижая уровень фибриногена в крови. Недавно обнаружено блокирование пентоксифиллином освобождения из активированных макрофагов и так называемого фактора, некротизирующего опухоли, и реакцию на него. Этот фактор образуется в тканях при тяжелой гипоксии и под влиянием ряда микробных токсинов, ядов змей и пр. Ограничивая активность названного фактора пентоксифиллин может сохранить целостность тканей при тяжелых патологических состояниях, например, легких при септическом шоке и пр.
Пентоксифиллин широко применяют для лечения микроциркуляторных нарушений различного происхождения: сосудистых заболеваний глаз, нарушений периферического кровообращения, цереброваскулярной патологии, диабетической нефроангиопатии и пр. Наиболее хороший эффект получается при его сочетании с дипиридамолом, простациклином, малыми дозами ацетилсалициловой и никотиновой кислотой.
Ксантины, особенно кофеин, и в несколько меньшей степени теофиллин, повышают возбудимость центральной нервной системы тоже за счет устранения
73
или ослабления тормозящего влияния на нее аденозйна. Кофеин повышает функционирование высших отделов головного мозга, устраняя утомленйе, сонливость, повышая умственную работоспособность, а также функцию отделов ствола головного мозга, регулирующих дыхание и артериальное давление. Поэтому его с успехом применяют при нарушениях дыхания и падении артериального давления, при многих патологических состояниях, включая инфекционные токсикозы, посленаркозное угнетение центральной нервной системы и пр. (см. гл. 5).
Теофиллин не влияет на высшие отделы центральной нервной системы, но отчетливо повышает возбудимость структур головного мозга, регулирующих дыхание. Поэтому его очень широко применяют в педиатрии для оказания помощи новорожденным, особенно недоношенным детям с периодическим дыханием, апноэ, с риском внезапной смерти.
Периодическое дыхание (кратковременные остановки дыхания на 5-10 с, чередующиеся с периодами регулярного дыхания) наблюдается у 30—50% недоношенных детей с первых дней жизни. Оно может продолжаться до 6 нед, не вызывая особых изменений в состоянии ребенка и не требуя лечения, однако за этим нарушением необходим постоянный контроль, так как он может перейти в идиопатическое апноэ.'
Идиопатическое апноэ — остановки дыхания на 20—30 с, сочетающиеся с брадикардией (до 100 сокращений сердца в 1 мин и меньше) и с цианозом. Эти остановки дыхания появляются преимущественно у детей с низкой массой тела при рождении (менее 1750 г) обычно со 2—3 дня жизни: их может быть до 40—80 в сутки. В итоге может наступить внезапная смерть ребенка. Эта патология является следствием незрелости структур головного мозга и периферических компонентов рефлекторной дуги, участвующих в регуляции дыхания. Возникновение апноэ могут спровоцировать внутричерепные геморрагии, септицемия, гипогликемия.
Теофиллин в дозах, меньше спазмолитических, устраняет приступы апноэ у недоношенных новорожденных или делает их короче, без одновременной брадикардии, то есть неопасными для жизни детей. Эффект возникает не сразу после введения препарата (то есть он не является простым аналептиком), а после повторных введений, к концу 1-2 суток лечения. Начинают с внутривенного введения насыщающей дозы эуфиллина, а затем переходят на поддерживающую дозу либо теофиллина внутрь, либо эуфиллина внутривенно.
Теофиллин применяют также для облегчения перевода недоношенного ребенка с искусственной вентиляции легких, часто применяемой для лечения детей с синдромом дыхательных расстройств, на спонтанное дыхание. Искусственная вентиляция у недоношенных детей с очень низкой массой тела может нарушить функционирование структур, регулирующих дыхание, и после его отмены у больных нередко возникают приступы апноэ. Применение теофиллина в течение нескольких дней предотвращает эту патологию и способствует быстрому восстановлению самостоятельного дыхания.
Теофиллин назначают также грудным (недоношенным и доношенным) детям, для профилактики внезапной смерти. У таких детей также могут наблюдаться периодические остановки дыхания во время сна, вплоть до летального исхода (в таких семьях нередко отмечали случаи внезапной смерти детей на фоне казалось бы полного благополучия). Теофиллин устраняет эти нарушения.
По тем же показаниям у новорожденных применяют и кофеин.
74
Все ксантины хорошо всасываются из желудочно-кишечного тракта, легко проникают во все ткани, в печени подвергаются деметилированию и выводятся почками. У новорожденных, однако, теофиллин практически не деметилируется, и 90% введенной дозы выводится с мочой в неизмененном виде, несколько его процентов (2—3%) подвергается метилированию, то есть превращению в кофеин. Последний очень медленно выводится из организма новорожденных, и при повторных введениях теофиллина происходит накопление кофеина в организме ребенка.
В табл. 14 приведены сведения о скорости элиминации теофилина у новорожденных и детей других возрастных групп, в том числе больных бронхиальной астмой. Как следует из таблицы, элиминация теофиллина у детей первого года жизни происходит медленнее, а после года быстрее, чем у взрослых, приближаясь к их параметрам в пубертатном возрасте.
Таблица 14
Возрастная вариабельность элиминации теофиллина
Возраст больного Период полувыведения, ч
Недоношенные дети с апноэ (7,5±4,4 дней) 30±6,5 1
Доношенные дети 1-го полугодия (3,6±0,85 мес) Доношенные дети после 6 мес (1,1+0,5 лет) Здоровые 6,0±2,3 3,6±1,8
Дети 2,5±0,9 лет Дети 10,7±2,6 лет Больные бронхиальной астмой 3,4±1,1 3,7±1,1
Взрослые (не курящие) здоровые 8,7±2,2
Элиминация теофиллина может меняться не только с возрастом. Она замедляется при сердечной недостаточности, гипоксии, гипертермии, нарушении функции печени и почек, во время ночногсхрна, на фоне углеводистой диеты, приема эритромицина. В этих ситуациях возникает опасность интоксикации препаратом. Курение ускоряет метаболизм теофиллина в печени и снижает его терапевтический эффект.
У теофиллина очень небольшая терапевтическая широта действия, к тому же существуют индивидуальные различия в чувствительности к нему. Поэтому полагается индивидуально подбирать дозу препарата, определяя его уровень в крови или внимательно контролируя появление нежелательных эффектов, возникающих при передозировке.
Теофиллин повышает секрецию кислого желудочного сока, что на фоне расслабления им нижнего сфинктера пищевода представляет опасность для грудных детей, у которых в положении лежа может произойти пассивное затекание (регургитация) кислого желудочного сока в пищевод и вызывать рефлекторную остановку дыхания.
При повышении концентрации теофиллина в крови может произойти учащение сокращений сердца, что является следствием устранения им тормозящего влияния аденозина на Р клетки синусового узла, AV узел и на пресинаптические
75
окончания адренергических волокон, следствием чего является увеличение освобождения катехоламинов. Появление тахикардии свидетельствует о необходимости снизить дозу теофиллина и/или увеличить промежутки времени между его приемами. При более выраженной интоксикации появляется тошнота, рвота (результат освобождения дофамина в триггерной зоне продолговатого мозга), геморрагии (результат угнетения агрегации тромбоцитов), в рвотных массах может быть кровь, диарея (результат устранения тормозящего влияния аденозина на перистальтику), нередко с кровью. В тяжелых случаях могут развиться судороги (результат устранения тормозящего влияния, аденозина на мозг) и смерть.
К производным ксантинов можно отнести и этимизрл (см. рис. 10).
Он преимущественно влияет на центральную нервную систему, повышает ее возбудимость, но может вызвать и успокоение, улучшает процессы мышления (поэтому его относят к ноотропам), памяти, настроение; при угнетении дыхания может активировать структуры, регулирующие эту функцию. В гипоталамусе увеличивает секрецию кортиколиберина, а следовательно, секрецию АКТГ аденогипофизом, глюкокортикоидов корой надпочечников и синтез сурфактанта в легких. Этимизол оказывает активирующее влияние на иммунные процессы, повышает сопротивляемость организма к. инфекции. Повышая содержание цАМФ в клетках слизистой оболочки желудка, способствует ее регенерации при наличии язвенных изменений в ней.
Этимизол применяют для профилактики синдрома дыхательных расстройств у недоношенных новорожденных, назначая его женщинам с преждевременно начавшимися родами (при выявлении незрелости легких у их плодов по недостаточному содержанию лецитина в околоплодной жидкости). Применяют и для поддерживающей терапии детей, матери которых перед родами получали (для стимуляции синтеза сурфактанта в легких плода) глюкокортикоиды. Применяют его в качестве ноотропного средства для улучшения памяти, мышления. Иногда назначают для улучшения дыхания при его нарушениях у больных с инфекционными токсикозами, при посленаркозном угнетении центральной нервной системы и пр. Назначают его и при нарушениях иммунитета.
Из нежелательных эффектов этимизола следует назвать возбуждение центральной нервной системы, проявляющееся в виде нарушений сна, раздражительности. Поэтому его не следует назначать вечером, особенно перед сном.
Лекарственные формы и дозы лекарственных средств, влияющих на активность пуринергических систем, даны в табл. 15.
Таблица 15
Лекарственные средства, влияющие на пуринергические системы
Препарат Лекарственная форма Путь введения Число приемов в сутки Доза (на прием)
Кофеин бензоат натрия Coffeinum natrio-benzoicum Порошок Таблетки по 0,1 г, 0,2 г и 0,075 г 10% раствор в ампулах по 1 мл Внутрь Подкожно 2-3 1 0,025-0,1 г То же
Теофиллин1 Theophyllinum Порошок Внутрь 2—4 6-9 лет — 24 мг/кг; 9-12 лет — 20 мг/кг; 12-16 лет —. 18 мг/кг
76
Окончание табл. 15
Препарат Лекарственная форма Путь введения Число приемов в сутки Доза (на прием)
Этимизол Aethimizolum Таблетки по 0,1 г « 1-2 Подростку по 0,1 г
Рибоксин Riboxinum Таблетки по 0,2 г « 3-4 Подростку по 0,1-0,2 г
Фосфаден Phosphadenum Таблетки по 0,025 г и 0,05 г « 2-3 Подростку по 0,025 г
Примечание. 1. Суточные дозы.
Глава 4 ПСИХОТРОПНЫЕ СРЕДСТВА
Психотропные средства — препараты, преимущественно действующие на психические функции человека, корригирующие его эмоции, мотивации поведения и психомоторную активность. Они нашли широкое применение для лечения нарушений психоневрологической деятельности: психозов, неврозов, психического недоразвития и др., а также у психически здоровых людей для снятия тревоги, эмоционального напряжения, судорог. •
Основным объектом воздействия психотропных средств является лимбическая система, гиппокамп, гипоталамус и ретикулярная формация. Эти отделы головного мозга играют важную роль в формировании и регуляции эмоциональных реакций, поведенческих актов, вегетативных проявлений эмоций и пр. Механизм действия большинства психотропных средств связан с вмешательством в обмен и эффекты нейромедиаторов, участвующих в осуществлении психической деятельности.
К психотропным препаратам относятся: нейролептики, транквилизаторы и седативные препараты, которые преимущественно угнетают психическую деятельность человека; препараты лития, обладающие модулирующим влиянием, то есть их эффект зависит от исходного состояния больного; антидепрессанты и психостимуляторы, преимущественно повышающие уровень эмоциональных реакций и ноотропные средства, улучшающие процессы памяти, обучения и т. д.
НЕЙРОЛЕПТИКИ
Эти препараты оказывают антипсихотическое, седативное и вегетотропное действие. В основу классификации нейролептиков положена их химическая структура. Согласно этой классификации выделяют следующие группы нейролептиков:
1. Производные фенотиазина: аминазин, левомепромазин (тизерцин), эта-перазин, френолон, трифтазин, тиопроперезин, (мажентил), перициазин (ну-лептил), тиоридазин (сонапакс, меллерил).
2. Производные тиоксантена: хлорпротиксен, зуклопентиксол (клопиксол).
3. Производные бутирофенона: галоперидол, трифлуперидол (триседил), дро-перидол.
4. Разные: клозапин (лепонекс), сульпирид (эглонил).
77
Антипсихотический эффект нейролептиков заключается в подавлении таких симптомов, как бред, галлюцинации, страх, агрессивность. Этот эффект у них связывают с блокированием дофаминовых рецепторов в лимбической системе. Наиболее выраженным антипсихотическим эффектом обладают: аминазин, трифтазин, этаперазин, левомепром:азин, галоперидол, трифлуперидол, хлорпротиксен, зуклопентиксол. Эти препараты назначают при шизофрении, маниакальном возбуждении у больных с маниакально-депрессивным психозом, острых алкогольных психозах, психотических расстройствах у больных эпилепсией и других психических заболеваниях, сопровождающихся возбуждением, напряжением, страхом.
Седативное действие препаратов проявляется в замедлении психических процессов, движении, речи, снижении реакции на внешние стимулы, в усилении действия других средств, угнетающих центральную нервную систему (средств общей анестезии, наркотических анальгетиков, этанола). Этот эффект препаратов связывают с блокадой а-адренорецепторов в ретикулярной формации, торможением освобождения катехоламинов из пресинапса, а также угнетением Н,-гистаминовых рецепторов. Сильным седативным действием обладают аминазин, левомепромазин, галоДеридол, трифлуперидол, дроперидол. Препараты, обладающие сильным седативным действием, психиатры используют у больных с выраженным психомоторным возбуждением, анестезиологи — для премедикации, создания двигательного покоя после операции или при травме головного мозгй. Дроперидол, отличающийся коротким действием, применяют в сочетании с наркотическими анальгетиками для нейролептанальгезии.
Некоторые нейролептики — тио ридазин, перициазин, сульпирид, френолон обладают слабым седативным действием, и, напротив, могут оказывать активирующий эффект. После их приема у больных уменьшаются симптомы тревоги, страха, улучшается настроение, контакт с другими людьми. Используют нейролептики с растормаживающим, стимулирующим действием у больных с вялотекущей шизофренией, апато-абулическим синдромом (в клинической картине больных преобладают вялость, заторможенность психических и двигательных реакций, понижение настроения) при кататонических состояниях.
Вегетотропное действие нейролептиков проявляется в угнетении разнообразных вегетативных реакций. Нейролептики, блокируя дофаминовые рецепторы триггерной зоны, оказывают противорвотное действие. Этаперазин, галоперидол, аминазин применяют при остро возникших тошноте, рвоте, икоте. В результате угнетения адрено- и серотонинорецепторов в гипоталамусе, расширения периферических сосудов и увеличения теплоотдачи, а также вследствие понижения активности дыхательных ферментов тканей и уменьшения образования тепла нейролептики вызывают гипотермический эффект. Он особенно характерен для аминазина, который назначают при выполнении нейрохирургических операций и операций на сердце в условиях искусственного кровообращения, при ликвидации гипертермии, не поддающейся лечению жаропонижающими средствами. В этих ситуациях аминазин используют в сочетании с другими нейротропными препаратами (новокаин, димедрол) в виде литической смеси.
У новорожденных аминазин используют для устранения пилороспазма, так как тонус пилорического сфинктора в этом возрасте регулируется адренергической иннервацией.
78
Длительное использование нейролептиков, особенно в больших дозах, приводит к возникновению нежелательных эффектов. Наиболее распространенными из них являются Ъкстрапирамидные расстройства, связанные с блокадой дофаминовых рецепторов черной субстанции и растормаживанием в связи с этим стриопаллидарной системы. Экстрапирамидные расстройства проявляются в виде тремора рук, нарушения мимики, скованности и других двигательных расстройств. Возникновение экстрапирамидных расстройств характерно для таких препаратов, как трифлуперидол, галоперидол, трифтазин, аминазин. Этот нежелательный эффект редко возникает при приеме хлорпротиксена, перици-азина, клозапина, сульпирида. Кроме того, при использовании нейролептиков могут возникать: нарушения функции сердечно-сосудистой системы (снижение артериального давления вплоть до ортостатического коллапса, тахикардия) — от аминазина, левомепромазина, хлорпротиксена; нарушения функции печени и почек; изменение секреции тропных гормонов аденогипофизом (СТГ, ТТГ). Блокада дофаминовых рецепторов в гипоталамусе нейролептиками приводит к повышению синтеза и секреции пролактина, что проявляется у больных увеличением молочных желез, расстройствами менструального цикла, нарушением сексуальной функции.
Нейролептики нельзя назначать беременным женщинам, особенно в ранние сроки беременности, так как они обладают тератогенным действием.
При назначении нейролептиков детям нужно учитывать возрастные особенности их действия — возможность парадоксальных реакций из-за неодновременного созревания различных нейромедиаторных структур в центральной нервной системе; большую выраженность у них антипсихотического действия. Поэтому детям необходимо назначать менее сильные препараты. При длительном использовании нейролептиков велика опасность нарушения психического развития детей.
ТРАНКВИЛИЗАТОРЫ
Эта группа веществ действует успокаивающе на центральную нервную систему. Основным их эффектом является транквилизирующий, то есть уменьшающий эмоциональную напряженность, тревогу, страх невротического происхождения. Если же эти симптомы возникают при психотических расстройствах и сопровождают острые бредовые, галлюцинаторные, аффективные состояния, то транквилизаторы оказываются мало эффективными. Транквилизирующее действие препаратов этой группы сопровождается седативным, центральным миорелаксирующим и противосудорожным эффектами.
КЛАССИФИКАЦИЯ ТРАНКВИЛИЗАТОРОВ
1. Производные бензодиазепина — хлозепид (элениум), сибазон (диазепам, седуксен, реланиум), феназепам, нозепам (тазепам, оксазепам), мезапам (рудотель), алпразолам (ксанакс).
2. Производные пропандиола — мепротан (мепробамат).
3. Производные дифенилметана — амизил.
4. Разные — мебикар, триоксазин, оксилидин.
79
В настоящее время наиболее изучен механизм действия производных бензодиазепинов. Они активируют специфические бензодиазепиновые рецепторы, расположенные на клеточной мембране нейронов лимбических структур мозга, гипоталамуса, ядер таламуса. Возбуждение этих рецепторов приводит к сенсибилизации функционально и морфологически связанных с ними рецепторов ГАМК по отношению к этому универсальному тормозному медиатору центральной нервной системы. Усиление действия ГАМК приводит к торможению эмоциональных реакций, снижению уровня возбудимости центральной нервной системы, повышению порога судорожных реакций и уменьшению потока нервных импульсов, поддерживающих мышечный тонус.
В психиатрической практике транквилизаторы используют при невротических, неврозо- и психопатоподобных нарушениях с преобладанием в клинической картине раздражительности, страха, вспыльчивости, напряженности, тревоги, навязчивости. Использование препаратов у таких больных ведет к повышению настроения, работоспособности, облегчают контакт с окружающими. Наиболее сильным транквилизирующим эффектом обладают феназепам и сибазон. ' \ '
Седативное действие транквилизаторов выражается в устранении чрезмерного возбуждения и двигательной активности, в улучшении процесса засыпания и в увеличении продолжительности сна без существенного изменения его структуры, в усилении действия на центральную нервную систему общих анестетиков, наркотических анальгетиков, этанола. Этот эффект используют у людей с расстройствами сна, а также для премедикации, атаралгезии (в сочетании с наркотическими анальгетиками). Седативное действие слабо выражено у мезапама, мебикара и триоксазина, поэтому их называют дневными транквилизаторами.
Транквилизаторы снижают активность симпатико-адреналовой системы, ослабляя вегетативные компоненты эмоциональных реакций, что используют при лечении психосоматических заболеваний — гипертонической болезни, аритмий и др.
Миорелаксирующий и противосудорожный эффекты наиболее выражены у сибазона и хлозепида. Их применяют у больных со спастическими состояниями скелетных мышц, а также для устранения судорог любого происхождения. Сибазон является наиболее ценным противосудорожным средством для детей, так как не угнетает дыхание и оказывает антигипоксическое действие (см. гл. 11).
Длительное применение транквилизаторов приводит к нарушениям внимания и памяти, особенно кратковременной; к сонливости, мышечной слабости, иногда к возникновению зависимости. Все транквилизаторы обладают тератогенным действием и поэтому противопоказаны беременным женщинам.
СЕДАТИВНЫЕ СРЕДСТВА
К седативным средствам относятся препараты брома — натрия и калия бромиды, бромкамфора; препараты лекарственных растений — валерианы, пустырника, пассифлоры, п и о н а; комбинированные препараты — валокормид, корвалол. Седативные средства усиливают процесс торможения или понижают процесс возбуждения, облегчают наступление сна
80
и углубляют его. Применяют седативные средства при лечении неврозов, повышенной раздражительности, бессоннице, психосоматических заболеваниях. Большинство препаратов этой группы малотоксичны, почти не имеют нежелательных эффектов и поэтому широко используются у детей. Исключением являются бромиды, при длительном приеме которых возможна их кумуляция, приводящая к бромизму (насморку, конъюктивитам, ослаблению памяти, кожному зуду). Для ликвидации бромизма назначают натрия хлорид в сочетании с большим количеством воды (от 0,5 до 3 л в сутки) в зависимости от возраста. Хлорид вытесняет бромид из тканевой жидкости и способствует выведению его с мочой.
ПСИХОРЕГУЛИРУКЛЦИЕ СРЕДСТВА
Препараты лития. Из солей лития в качестве психотропных средств используют лития карбонат, микалит (пролонгированная лекарственная форма лития карбоната), лития оксибутират. Соли лития способны стабилизировать настроение при профилактическом назначении больным с маниакальными и депрессивными проявлениями, а также снижают аффективные нарушения у больных с психозами, олигофренией, хроническим алкоголизмом. Механизм действия солей лития связывают с его конкурентными отношениями на мембранах клеток с другими ионами (натрия, калия, магния, кальция). Обнаружено также, что литий тормозит некоторые этапы метаболизма инозитолфосфатов и в результате меняется активность медиаторов, участвующих в психической деятельности — норадреналина, дофамина, серотонина и ГАМК.
Нежелательные явления при приеме препаратов лития наблюдаются в начале лечения или при повышении его концентрации в сыворотке ^крови. Их возникновению способствуют нарушения баланса электролитов, нарушения выделительной функции почек, уменьшение потребления жидкости. У больного появляются тремор пальцев, атаксия, чувство усталости, сонливость, диспеп-тические явления, нарушения ритма сердца. Соли лития противопоказаны при нарушении выделительной функции почек-и беременным женщинам.
АНТИДЕПРЕССАНТЫ
Основной эффект антидепрессантов — тимолептическое действие, то есть улучшение настроения, подавленного в результате заболевания. Этот эффект связывают с их способностью увеличивать содержание нейромедиаторов — норадреналина, серотина, дофамина — в структурах мозга, отвечающих за эмоциональные реакции. Различают следующие группы антидепрессантов:
— ингибиторы МАО — необратимый — ниаламид (нуредал); обратимый — моклобемид (аурорикс);
— трициклические антидепрессанты — и м и з и н (м ел и п ра м и н), амитриптилин (триптизол), азафен, доксепин;
— четырехциклические антидепрессанты — пиразидол, миансерин, мапротилин.
— ингибиторы обратного захвата серотонина — флуоксетин.
81
Механизм тимолептического действия антидепрессантов 1-й и 3-й групп осуществляется за счет блокады МАО и уменьшения инактивации катехоламинов. Антидепрессанты 2-й и 4-й групп блокируют обратный захват катехоламинов и серотонина пресинаптическими нервными окончаниями, увеличивая этим их концентрацию в синаптической щели. Длительная блокада обратного захвата нейромедиаторов приводит к компенсаторному снижению чувствительности постсинаптических рецепторов, что усиливает тимоле птический эффект. Тимолептическое действие препаратов развивается довольно медленно — через 5—10 дней от начала лечения.
Кроме тимолептического, разные антидепрессанты обладают еще седативным и психоэнергизирующим действием. Так, у имизинаи ниаламида преобладает стимулирующее влияние на центральную нервную систему, поэтому их предпочитают назначать при депрессивных состояниях, сочетающихся с вялостью, заторможенностью, безынициативностью. Амитриптилин и азафен, у которых выражен седативный эффект, наоборот, назначают больным с тревожно-депрессивными состояниями, сопровождающимися возбуждением, двигательной расторможенностью. Пиразидол обладает модулирующим влиянием на центральную неявную систему, то есть стимулирующим при заторможенных депрессиях и седативным при тревожных.
Кроме истинных депрессий, антидепрессанты назначают при депрессивных состояниях, сопровождающих психосоматические заболевания — ишемической болезни сердца, хронических болевых синдромах, дискенизиях органов брюшной полости. Детям старше 7 лет имизин назначают при лечении функционального ночного энуреза. Эффект их при этом заболевании связан с тем, что под влиянием имизина увеличивается емкость мочевого пузыря и снижается его сократимость. Названный эффект связывают с уникальной комбинацией эффектов, вызываемых имизином, — антихоли-нергическим влиянием на фоне отмеченного выше потенцирования адренергического воздействия на мочевой пузырь. Терапевтический эффект развивается в течение надели, но окончательный результат можно оценить лишь на втором месяце от начала лечения. Длительность курса у разных больных неодинакова, но в среднем 3—6 месяцев, дозы и частоту приема снижают постепенно, на протяжении 3-4 недель.
Побочные эффекты антидепрессантов в большинстве случаев связаны с их способностью блокировать рецепторы по отношению к другим нейромедиаторам. Блокада Н,-гистаминовых рецепторов проявляется в развитии сонливости, понижении аппетита и увеличении массы тела; блокада мускариновых холинорецепторов ответственна за нарушение зрения, обострение глаукомы, сухость слизистых оболочек дыхательных путей, наклонность к запорам, задержку мочи, тахикардию, нарушения памяти. Антидепрессанты могут снижать антигипертензивный эффект симпатолитиков, клофелйна, за счет блокады обратного захвата норадреналина. Антидепрессанты, относящиеся к ингибиторам МАО, могут инактивировать неспецифические ферменты печени, участвующие в обезвреживании токсических веществ эндогенной и экзогенной природы. Поэтому их нельзя сочетать с многими лекарственными препаратами, в том числе с антидепрессантами других групп, фуразолидоном, их не используют в детской практике. Пиразидол снижает токсичность кислорода и его назначают перед сеансами гипербарической оксигенации (см. гл. 37).
82
ПСИХОСТИМУЛЯТОРЫ
Препараты этой группы ускоряют процессы мышления, устраняют усталость, сонливость. Их действие проявляется как у больных с пограничными астеническими состояниями, сопровождающимися вялостью и заторможенностью, так и у здоровых людей.
К психостимуляторам относят:
— производное пурина — кофеин;
— фенилалкиамины и их аналоги — фенамин (амфетамин), мери-дил (центедр.ин, риталин);
— фенилалкилсиднонимины — сиднокарб, сиднофен.
Механизм психостимулирующего действия кофеина связан с конкурентной блокадой аденбзиновых рецепторов нейронов головного мозга (см. гл. 3). Большие дозы кофеина могут привести к истощению нервных клеток, длительное его применение ведет к уменьшению эффекта, так как в клетках мозга компенсаторно образуются новые аденозиновые рецепторы. Курс лечения кофеином не должен превышать один месяц.
Механизм действия на центральную нервную систему производных фенил-алкиламинов и производных фенилалкилсиднониминов связан с их непрямым катехоламиносенсибилизирующим действием, то есть они способствуют освобождению норадреналина и дофамина из гранул пресинаптических окончаний, тормозят обратный нейрональный захват этих медиаторов и незначительно стимулируют адренергические рецепторы. Показано, что фенамин и меридил в большей степени влияют на дофаминергические структуры, а сиднофен и сиднокарб — на норадренергические.
Используют психостимуляторы при лечении нарколепсии (приступы сна), энцефалита и других заболеваний, сопровождающихся сонливостью, вялостью, апатией, астенией; повышенной утомляемости; для снижения эффекта снотворных и наркотических средств. В детской практике обычно используют сиднокраб или сиднофен как препараты менее токсичные. Психостимулирующий эффект у них не сопровождается эйфорией, двигательным возбуждением и тахикардией.’ Они не вызывают привыкания. Детям их назначают при малых дисфункциях мозга, задержке развития с целью повышения процесса запоминания, концентрации внимания; иногда при ночном недержании мочи.
Нежелательными эффектами при использовании психостимуляторов группы фенамина являются бессонница, повышение артериального давления, тахикардия, нарушение аппетита. Но самое главное — возникновение физической и психической зависимости, то есть наркомании.
НООТРОПНЫЕ СРЕДСТВА
Ноотропные средства — лекарственные вещества метаболического типа действия, способные активировать пластические процессы в центральной нервной системе, улучшать энергетический статус нервных клеток, повышать их устойчивость к воздействию неблагоприятных факторов различного генеза, оказывать положительное влияние на высшие психические функции головного мозга — обучение, память, умственную деятельность.
83
По своей химической структуре ноотропные средства преимущественно являются производными ГАМК — пирацетам, аминалон, натрия оксибутират, фенибут, пантогам, пикамилон. Но есть вещества и другой структуры — пиридитол (энцефабол), представляющий две молекулы витамина Вб, соединенные дисульфидным мостиком, кавинтон и винкапан — производные алкалоидов барвинка, церебролизин — гидролизат мозга животных.
Механизм действия ноотропных средств не связывают с влиянием на какие-либо рецепторы. Ноотропные препараты улучшают кровоснабжение мозга за счет прямого релаксирующего действия на сосуды, особенно в ишемизированных участках, а также расширения резервных капилляров. Важным свойством ноотропных препаратов является их способность улучшать энергетический ста-, тус клеток мозга — стимуляция ими аденилатциклазы и угнетение нуклеотидфосфатазы приводит к ускорению оборота АТФ; они повышают поступление глюкозы через мембраны нейронов и ее утилизацию, активируют ферменты дыхательной цепи, цикла трикарбоновых кислот, что приводит к увеличению даже в условиях гипоксии выработки АТФ. Следующим важным эффектом ноотропов является активизациями ми биосинтеза РНК, белков и липидов, регенерации нейронов; при этом активируются процессы запоминания, обучения; снижается старение клеток головного мозга.
Препараты используют при сосудистых заболеваниях головного мозга, сопровождающихся нарушениями памяти, внимания, речи; после травм головного мозга, включая родовые травмы; в период реабилитации после перенесенных нейроинфекций, коматозных состояний. В педиатрической практике ноотропы назначают детям с задержкой умственного развития, детским церебральным параличом. В последние годы ноотропы (пирацетам) стали успешно использовать в акушерской практике, назначая его беременным женщинам с поздним токсикозом для предотвращения внутриутробной гипоксии и ее влияния на функцию и последующее развитие головного мозга. Новорожденные, родившиеся после пренатального воздействия пирацетамом, не отличаются по многим показателям от детей, рожденных женщинами, у которых беременность протекала без патологии. Некоторые из ноотропов — пантогам и фенибут — способны проявлять транквилизирующие свойства. Поэтому их. назначают при неврозах и неврозоподобных состояниях; пантогам, кроме того, эффективен при гиперкинезах, треморе, некоторых разновидностях эпилептических припадков. Используют ноотропы также при лечении острых отравлений (этанолом, морфином, барбитуратами) для купирования абстинентных состояний при алкоголизме и наркоманиях.
Побочных эффектов при использовании названных ноотропов практически не отмечается. Однако эти препараты противопоказаны в первые три месяца беременности, при наличии психомоторного возбуждения, острой почечной недостаточности. Пирацетам не рекомендуют назначать девочкам в период полового созревания, так как он может спровоцировать у них функциональные маточные кровотечения.
Относительно новыми ноотропными средствами являются вещества, влияющие на глутаматергические структуры: мемантин и глицин.
Мемантин — блокатор ионного канала одного из рецепторов (NMDA) глутаматергических структур. После его введения происходит повышенное вы
84
деление биогенных аминов и ингибирование их обратного поглощения нейронами. Это способствует передаче импульсов в центральной и периферической нервной системе.
Мемантин назначают детям с ослаблением памяти и концентрирования внимания, при синдроме деменции; при церебральных и спинальных спастических синдромах, возникших из-за повреждения мозга в раннем возрасте, черепно-мозговой травмы; при синдроме паркинсонизма.
Прием препарата может вызвать головокружение, чувство усталости, беспокойства, повышенной возбудимости, повышение внутричерепного давления.
На фоне мемантина усиливается действие барбитуратов, нейролептиков, антихолинергических средств.
Глицин — агонист глицинового участка NMDA рецептора глутаматерги-ческих структур. Он повышает эффективность глутамата, освобождение ацетилхолина, норадреналина, дофамина и их участие в передаче нервного импульса. Глицин улучшает метаболические процессы в тканях мозга, вызывает седативное, антидепрессорное действие.
Применяют глицин в период ремиссии при тревожно-депрессивных состояниях, повышенной раздражительности (в составе комбинированной терапии). У подростков (и взрослых) с успехом его применяют для лечения хронического алкоголизма, прерывания запоя, острого абстинентного синдрома.
Назначают глицин в таблетках под язык по 100 мг 2—4 раза в день в зависимости от возраста и показания к применению.
Дозы основных психотропных средств даны в табл. 16.
Психотропные средства
Таблица 16
Препарат Лекарственная форма Путь введения Число введений в сутки Однократная доза
Аминазин Aminazinum Таблетки 0,01; драже 0,025, 0,05, 0,1 г Внутрь'^ 3 До 1 года — 2,5 мг; 2—4 года — 6 мг; 5-7 лет — 9 мг; 8-10 лет — 12-20 мг
2,5% раствор в ампулах по 1, 2, 5 и 10 мл Внутримышечно 1-2 От 0,5-1 мг/кг до 1,5 мг/кг (для детей до 12 лет)
Дроперидол Droperidolum 0,25% раствор в ампулах по 5 и 10 мл Внутривенно, внутримышечно 1 0,25-0,5 мг/кг, но не более 25 мг (для детей всех возрастов)
Сибазон (диазепам) Sibazonum Таблетки по 0,001, 0,002 и 0,005 г Внутрь 3-4 0,3-0,5 мг/кг
0,5% раствор в ампулах по 2 мл Внутривенно, внутримышечно 1-2 0,3-0,5 мг/кг
85
Окончание табл. 16
Препарат Лекарственная форма Путь введения Число введений в сутки Однократная доза
Пирацетам Pyracetamum Таблетки по 0,2 г Внутрь 3 0,2-0,4 г
Фенибут Phenibutum Порошок, таблетки 0,25 г То же 3 До 4 лет — 0,05-0,1 г; 5 лет и старше — 0,2-0,3 г
Натрия оксибутират Natrii oxybutiras 20% раствор в ампулах по 10 мл Внутривенно, внутримышечно 1 100 мг/кг
5% сироп во флаконах по 400 мл Внутрь 3-4 150 мг/кг
Амитриптилин Amitriptylinum Таблетки 0,025 г То же 1-2 От 3~7 лет — 12,5 мг; 7—10 лет — 25 мг; 10—14 лет — 25-50 мг
Глава 5 АНАЛЕПТИКИ
Аналептики — это группа лекарственных веществ, оказывающих возбуждающее действие на центральную нервную систему, в частности на структуры, регулирующие дыхание и тонус сосудов. Наиболее выражен эффект аналептиков при угнетении названных структур. Главной целью их назначения является стимуляция дыхания.
Аналептики отличаются друг от друга не только химическим строением, но и способностью влиять на отдельные структуры продолговатого мозга и ствола мозга, а также по способности провоцировать судороги или повышать готовность к ним.
В настоящее время аналептики в педиатрии применяют все реже. Это связано с тем, что они, повышая возбудимость центральной нервной системы, увеличивают тонус скелетных мышц и в связи с этим — расходование кислорода, что. приводит к гипоксии мозга и угнетению его функций. Кроме того, они повышают риск возникновения судорог. В детской практике в качестве аналептиков применяют: этимизол, бемегрид, кордиамин, камфору, кофеин, углекислый газ, коразол.
Этимизол (см. рис. 10) выгодно отличается от других препаратов этой группы, поскольку малотоксичен, не вызывает судорог и может даже понижать возбудимость центральной нервной системы (см. гл. 3).
Механизм его действия: подобно ксантинам этимизол вмешивается в пурин-ергические процессы, устраняя или ослабляя активацию пуриновых рецепторов аденозином. Под влиянием этимизола в клетках накапливается цАМФ (в 86
результате повышения активности аденилатциклазы), что и сопровождается усилением его эффектов. В частности, увеличение внутриклеточного содержания цАМФ тормозит освобождение ферментов из лизосом, что предупреждает повреждение клеток и их мембран. Это действие препарата имеет значение для активации репаративных процессов. Возбуждение этимизолом гипоталамических центров ведет к повышению секреции АКТГ гипофизом, в результате увеличивается секреция глюкокортикоидов, стимулирующих синтез сурфактанта, тормозящих процессы'воспаления и аллергии.
^NH - СН3
С
NH - СНз
Рис. 10. Этимизол
Этимизол показан: при угнетении дыхания, вызванном нетяжелым отравлением снотворными препаратами, наркотическими анальгетиками, средствами для наркоза; иногда новорожденным в состоянии небольшой гипоксии (оценка по шкале Апгар 6-8 баллов). В случаях тяжелой гипоксии этимизол (как и другие аналептики) не назначают, он может ухудшить состояние ребенка.
Этимизол применяют для пренатальной профилактики синдрома дыхательных расстройств у недоношенных детей. Для этой цели его назначают матери перед родами, а затем ребенку для поддерживающей терапии. Кроме того, его назначают для лечения аллергических заболеваний, в частности бронхиальной астмы, а также ревматизма и др. Противоаллергическое и противовоспалительное действие обеспечивается увеличением урЬвня глюкокортикоидов. При бронхиальной астме имеет значение и прямое спазмолитическое действие этимизола. Иногда его применяют для улучшения мозгового кровообращения, повышения умственной работоспособности, улучшения кратковременной памяти, для повышения устойчивости тканей к гипоксии (см. гл. 36).
Коразол — в настоящее время применяется редко. Он оказывает возбуждающее действие на структуры, регулирующие дыхание и тонус сосудов. В механизме действия коразола наиболее важное значение имеет его антагонизм с эндогенными лигандами бензодиазепиновых рецепторов и ГАМК. В больших дозах вызывает возбуждение головного й спинного мозга, может оказать пробуждающее действие при отравлениях снотворными средствами, наркотическими анальгетиками и этанолом. Но применяют его лишь при отравлениях средней тяжести. Коразол часто провоцирует судороги, особенно в состоянии гипоксии.
Более специфическим средством при отравлении барбитуратами является бемегрид — структурный и функциональный антагонист производных бар-
87
битуровой кислоты (см. рис. 11). Он снимает угнетение дыхания, мало влияя на тонус сосудов и величину артериального давления. Его применяют при интоксикации барбитуратами средней тяжести, при нарушении функций мозга у больных инфекционными заболеваниями.
Н3С С2Н5
Рис. 11. Бемегрид
Кордиамин (пикетамид) — диэтиламид никотиновой кислоты (см. рис. 12). Повышает возбудимость центральной нервной системы, а также влияет на хеморецепторы каротидного клубочка, в результате чего стимулирует дыхание, увеличивает артериальное давление. Для получения терапевтического эффекта кордиамин нужно вводить внутривенно. При подкожном и внутримышечном введении наблюдается резкая болезненность в месте инъекции, что тоже, уже рефлекторно, стимулирует центральную нервную систему. Кроме того, обнаружена его способность индуцировать обезвреживающие ферменты в печени. Кордиамин применяют при коллапсе, возникающем в состоянии наркоза и в послеоперационном периоде; для лечения гипербилирубинемии у новорожденных. В педиатрии кордиамин применяют все же редко, так как он повышает судорожную готовность.
Рис. 12. Кордиамин
Камфора (см. рис. 13) — препарат, получаемый из камфорного дерева, растущего в Восточной Азии, камфорного базилика, растущего в Сибири, и синтетически. Для парентерального применения используют правовращающую натуральную камфору в виде масляных растворов. При подкожном введении происходит раздражение чувствительных рецепторов подкожной клетчатки, что приводит к рефлекторному возбуждению центральной нервной системы. После всасывания присоединяется прямое действие на структуры продолговатого мозга. Камфора способствует стабилизации клеточных мембран, ограничивая 88
их повреждение токсическими веществами, это нормализует обменные процессы в тканях, в частности в миокарде. Кроме того, она повышает реакцию адренорецепторов на катехоламины, а также снижает реакцию на ацетилхолин, ингибирует агрегацию тромбоцитов и улучшает микроциркуляцию. В результате улучшается вентиляция легких, гемодинамика в сосудах брюшной полости, увеличивается коронарный кровоток, кровоснабжение мозга, слегка повышается артериальное давление. Все эти эффекты выражены умеренно.
Применяют камфору в случаях острой и хронической сердечной недостаточности, при коллапсе, инфекционных заболеваниях.
В сравнении с другими аналептиками камфора действует более длительно. Основная часть введенной дозы окисляется, образовавшиеся метаболиты конъюгируют с глюкуроновой кислотой и выводятся почками. Часть камфоры выделяется в неизмененном виде легкими, способствуя отделению мокроты и проявляя антисептические свойства.
Рис. 13. Камфора
При наружном применении камфора вызывает небольшое раздражение чувствительных рецепторов, способствует расширению сосудов, а также проявляет противовоспалительное и противомикробное действие. Ее применяют в виде спиртовых и масляных растворов наружно для лечения заболеваний суставов, мышц, для профилактики пролежней. °
Сульфокамфокаин — водорастворимый аналог камфоры (комплексное соединение сульфокамфорной кислоты и новокаина). По сравнению с камфорой обладает более быстрым действием. Его можно вводить подкожно, внутримышечно и внутривенно.
Углекислота — является естественным специфическим возбудителем хеморецепторов каротидного клубочка и центральных структур, регулирующих дыхание. Для получения названного эффекта ее вдыхают в небольших концентрациях (3-7%), а большие концентрации вызывают одышку, ацидоз, судороги, паралич дыхательного центра. Применяют ее в смеси с кислородом при отравлении угарным газом, сероводородом, а также для стимуляции дыхания у больных после наркоза, вызванного ингаляционными средствами общей анестезии.
Стрихнин — алкалоид из семян чилибухи, произрастающей в Африке. В медицинской практике применяют соль стрихнина — нитрат. Стрихнин является антагонистом глицина — тормозного медиатора вставочных нейронов
89
(клеток Реншоу) спинного мозга, повышает рефлекторную возбудимость центральной нервной системы, а в больших дозах вызывает болезненные тетанические судороги. В терапевтических дозах стрихнин оказывает стимулирующее действие на органы чувств (зрение, вкус, слух, тактильные ощущения, обоняние), возбуждает сосудодвигательный и дыхательный центры, тонизирует скелетную мускулатуру, кровообращение. Применяют стрихнин при общем понижении обменных процессов, при утомляемости, гипотонической болезни и общей слабости, при некоторых функциональных расстройствах зрения, парезах. При передозировке возможны напряжение мышц лица, затылка, затруднение дыхания, в тяжелых случаях — тонические судороги.
Кофеин — алкалоид, получаемый из листьев чая, зерен кофе. В медицинской практике его используют в виде комплексной соли — кофеин бензоат натрия. По химическому строению (см. рис. 14) он относится к группе ксантинов (см. гл. 3) и по фармакологическим свойствам близок к теофиллину и теобромину. По механизму действия все ксантины являются антагонистами аденозина, однако наиболее сильным возбуждающим действием на центральную нервную систему обладает кофеин?’ В связи с этим кофеин чаще используют как психостимулирующий препарат. Он усиливает и регулирует процессы возбуждения в коре головного мозга, в результате чего повышается умственная и физическая работоспособность.
Аналептические свойства кофеина проявляются в ослаблении действия наркотических анальгетиков и снотворных средств, в повышении рефлекторной возбудимости спинного мозга, в возбуждающем действии на структуры мозга, регулирующие дыхание, тонус сосудов. Под влиянием высоких доз кофеина усиливается работа сердца, увеличивается частота и сила сердечных сокращений. При коллапсе артериальное давление повышается, при нормальном артериальном давлении существенных изменений не наблюдается, так как одновременно с возбуждением центральных структур, регулирующих сосудистый тонус, происходит периферическое воздействие на гладкую мускулатуру сосудов (головного мозга, сердца, почек, скелетных мышц).
•н2о
Рис. 14. Кофеин
Применяют кофеин при заболеваниях, сопровождающихся угнетением функций центральной нервной системы и снижением АД, при нетяжелых отравлениях наркотическими анальгетиками и другими ядами, при спазмах сосудов мозга. При коллапсе кофеин бензоат натрия вводится в виде 20% раствора 90
внутривенно. Препарат не следует применять при повышенной судорожной активности.
Дозы и режим применения аналептиков дань! в табл. 17.
Таблица 17
Аналептики
Препарат Форма выпуска - Путь введения Однократная доза
Этимизол Aethimizolum 1% раствор в ампулах по 3 или 5 мл Новорожденным в вену пуповины В виде 0,3% раствора в дозе 1 мг/кг (развести в изотоническом растворе натрия хлорида)
Бемегрид Bemegridum 0,5% раствор в ампулах по 10 мл Внутривенно До 1 года — 2 мл; 2-4 года — 3 мл; 5-7 лет — 4 мл; 8 лет — 5 мл
Коразол Corazohim 10% раствор в ампулах по 1 мл Внутривенно медленно в 10-20 мл 5% раствора глюкозы До 1 года — 0,2 мл; 2—4 года — 0,3-0,5 мл; 5—7 лет — 0,6 мл; 8 лет — 0,75—0,8 мл
Кофеин-бензоат натрия Coffeinum-natrii benzoas 10% раствор в ампулах по 1 и 2 мл Подкожно До 1 года — 0,4 мл; 2-4 года — 0,5 мл; 5—10 лет — 0,6—0,75 мл; старше 10 лет — 1 мл
Камфора Camphora 20% раствор в масле в ампулах по 1 мл Подкожно До 1 года — 0,5-1,0 мл; до 2 лет — 1,0 мЛ; 3—6 лет — 1,5 мл; старше 10 лет — до 5 мл
Глава би АНАЛЬГЕТИКИ
Анальгетики делят на две группы препаратов: наркотические и ненаркотические.
Наркотические анальгетики — лекарственные средства, оказывающие центральное, обратимое, дозозависимое и избирательное болеутоляющее действие. Наркотическими их называют потому, что при повторных введениях к ним развивается психическое и физическое пристрастие (зависимость) — наркомания.
В группе наркотических анальгетиков выделяют:
1. Галеновые препараты — настойка и экстракт опия. Опий — высушенный млечный сок из надрезов на недозревших коробочках сонного мака (Papaver somniferum).
2. Новогаленовый препарат — омнопон, содержит все 25 алколоидов опия и очищен от балластных веществ (сапонинов).
91
3. Алкалоиды опия: а) производные пиперидинфенантрена (морфин, кодеин и др.); б) производные изохинолина (папаверин и др). Последние не обладают анальгетической активностью, а вызывают спазмолитический эффект.
4. Полусинтетические аналоги морфина (этилморфин, гидрокодон и др.). Эти препараты созданы на основе химической структуры морфина (см. рис. 15), в которой фенольный гидроксил замещен другим радикалом.
Рис. 15. Химическая структура морфина
5. Синтетические заменители морфина (промедол, фентанил, пентазоцин, пиритрамид, эстоцин, буторфанол, бупренорфин, трамадол, метадон, суфентанил, алфентанил, оксиморфон, гидроморфон, леворфанол, пропоксифен, тилидин, налбуфин).
Наркотические анальгетики имитируют эффекты эндогенных опиатных пептидов (энкефалинов и эндорфинов), которые функционируют в различных отделах центральной нервной системы и в периферических тканях. Наиболее изучено их значение для функции ноцицептивной и антиноцицептивной систем.
Ноцицептивная система — воспринимает, проводит болевой импульс и формирует реакции на боль. Боль могут воспринимать специальные болевые рецепторы (ноцицепторы) и рецепторы дальней модальности (баро-, термо-, хеморецепторы) при достаточной силе раздражения. Ноцицептивная система представлена специфическим и неспецифическим путями проведения болевого ощущения. Специфический путь (неоспиноталамический) — быстрый, малонейронный, воспринимающий эпикритическую боль (пороговую, светлую, эмоционально неокрашенную, точно локализованную, отвечающую на вопрос — где болит?). Неспецифический путь (палеоспиноталамический) — медленный, многонейронный, с многочисленными переключениями, воспринимающий протопатическую боль (надпороговую, темную, эмоционально окрашенную, плохо локализованную, отвечающую на вопрос — как болит?) (см. схему 7). Этот вариант боли может возникнуть от небольших по силе, но длительно повторяющихся раздражений, суммирующихся в ядрах таламуса.
Кандидатами на роль медиаторов боли прежде всего являются вещество Р, холецистокинин, соматостатин, а также 1-глютамат.
Проведение болевого импульса сопровождается формированием различных реакций. Так, эпикритическая боль сопровождается в основном двигательной реакцией. При увеличении силы и продолжительности воздействия болевого
92
Ноцицепторы (или баро-, термо-, хеморецепторы)
Афференты (Ад, Ay, С)
Задние корешки спинного мозга
Нейроны задних рогов спинного мозга1
СПЕЦИФИЧЕСКИЙ ПУТЬ
НЕСПЕЦИФИЧЕСКИЙ ПУТЬ
Ядра продолговатого мозга
Желатинозное вещество спинного мозга1
Вентральные ядра таламуса
I
Задняя центральная извилина коры головного мозга (поля Si, S2)1
Гигантоклеточное ядро бульбарного отдела
Ретикулярная формация среднего мозга1
Гипоталамус1
I
Неспецифические ядра таламуса1
Лимбическая система1
I
Верхняя лобная, теменная извилина коры головного мозга1
Примечание. 1. Места действия наркотических анальгетиков.
Схема 7. Ноцицептивная система
раздражителя возникает протопатическая боль, которая сопровождается эмоциональными (страдание, паника, страх), вегетативными (расширяются зрачки, усиливается потоотделение, увеличивается частота сердечных сокращений, и дыхания, появляются диспепсические явления и т. п.) и звуковой реакциями. У каждого человека существует свой определенный интервал переносимости боли, после чего возникает генерализованная реакция на боль (максимальная выраженность всех реакций).
93
Антиноцицептивная система — нарушает восприятие боли, проведение болевого импульса и формирование реакций. Центром этой системы является скопление короткоаксонных энкефалинергических нейронов вокруг Сильвиевою водопровода — центральное серое околоводопроводное вещество (ЦСОВ). Болевой импульс активирует названный центр, что приводит к усилению энкефалинергической импульсации по нисходящим путям к нейронам заднего рога спинного мозга (повышается порог болевой чувствительности) и по восходящим путям к нейронам ретикулярной формации, таламуса, гипоталамуса и лимбической системы (подавляются вегетативные и эмоциональные реакции, то есть повышается порог болевой выносливости). Энкефалины (пентапептиды) активируют опиатные (точнее энкефалиновые) рецепторы. Различают 4 вида этих рецепторов: мю, каппа, дельта и эпсилон. Они локализованы преимущественно на пресинаптических окончаниях аксонов других нейронов, тормозя освобождение их медиаторов (в том числе ацетилхолина, норадреналина, серотонина, гамма-аминомалсяной кислоты и др.), а также медиаторов, участвующих в проведении болевых импульсов. В состав антиноцицептивной системы входят и эндорфины (полипептиды), которые вырабатываются в гипофизе и гипоталамусе, выделяются в спинномозговую жидкость, попадают в кровь и тоже могут влиять на энкефалинергические рецепторы. Выделение эндорфинов в кровь увеличивается при стрессе, акупунктуре, беременности, родах, под влиянием закиси азота, фторотана и зависит от состояния высшей нервной деятельности' (положительные эмоции).
Как уже было сказано, наркотические анальгетики имитируют эффекты энкефалинов и эндорфинов. Главным образом эти препараты влияют на неспецифический, многонейронный путь ноцицептивной системы. Они нарушают поступление болевых импульсов к ядрам таламуса, гипоталамуса, миндалевидному комплексу, увеличивают интервал переносимости боли, то есть повышают порог болевой выносливости и немного влияют на нейроны задних рогов спинного мозга. В итоге повышается порог болевой чувствительности. Наркотические анальгетики предупреждают нарушение функции сердечно-сосудистой системы, возникновение страха, страдания, ужаса, связанных с болью. Сильные анальгетики (фентанил и др.) способны подавить проведение возбуждения и по специфическому ноцицептивному пути.
Кроме того, наркотические анальгетики повышают активность и антиноцицептивной системы, энкефалинергических нейронов, на телах которых тоже есть так называемые опиатные рецепторы.
По анальгетической силе основные наркотические анальгетики располагаются в следующем порядке: фентанил, бупренорфин, буторфанол, морфин, омнопон, трамадол, промедол, пентазоцин, кодеин. Следует отметить, что у детей дозы (на кг массы тела) этих препаратов меньше, чем у взрослых. Продолжительность действия фентанила 30—40 мин, бутафанола 8 ч, у всех же остальных препаратов около 4 часов. При подкожном введении начинается эффект от большинства препаратов через 10—15 мин, а при пероральном приеме — через 20-30 мин (при внутривенном введении фентанила через 5 мин).
Следует отметить, что препараты данной группы не очень хорошо всасываются из желудочно-кишечного тракта и частично обезвреживаются при первом прохождении через стенку кишечйика, то есть подвергаются пресистемной элиминации. Поэтому их предпочитают назначать парентерально.
Фентанил (как наиболее хорошо растворимый в липидах препарат) начали применять интраназально. При таком способе введения он быстро проникает 94
в центральную нервную систему, подавляя боль, например, после родов. В акушерстве фентанил вводят эпидурально, воздействуя на желатинозную субстанцию спинного мозга, он сам вызывает выраженный анальгетический эффект и усиливает местную анестезию, вызываемую лидокаином. Анальгетики у детей лучше проникают через гематоэнцефалический барьер в мозг, чем у взрослых, создавая там более высокие концентрации. Исключение составляет фентанил, хорошо растворимый в липидах и легко проникающий через все барьеры в любом возрасте. Все препараты этой группы быстро проникают через плаценту и накапливаются в мозговой ткани плода. Основной путь элиминации наркотических анальгетиков — биотрансформация (преимущественно в печени), заканчивающаяся образованием глюкуронидов, выводимых с мочой. У детей процесс биотрансформации происходит медленнее, особенно в самом раннем возрасте. Поэтому у детей первых недель и месяцев жизни велика опасность кумуляции препаратов и интоксикации ими. Интересен в связи с этим фентанил, который, начиная с 3 месяцев жизни, выводится из организма скорее, чем у взрослых.
Кроме болеутоляющего эффекта, наркотические анальгетики вызывают и другие центральные эффекты. Эти препараты угнетают структуры продолговатого мозга, регулирующие дыхание. У детей это угнетение возникает особенно легко, при этом урежение дыхания, в отличие от взрослых, у них не сопровождается его углублением, что связано с особенностями функции как центральных структур, так и дыхательного аппарата (расположение ребер, слабость дыхательных мышц и пр.). В результате у детей, особенно до 2-3 лет, введение морфина нередко сопровождается возникновением гипоксии и дыхательного ацидоза. Поэтому без особого к тому показания детям этого возраста препараты морфина и его группы лучше не назначать. Алкалоиды группы морфина влияют и на другие структуры головного мозга. Они угнетают экспираторный центр и активируют центр блуждающего и глазодвигательного нервов и, примерно у 20% людей, триггерную зону на дне IV желудочка. В результате после введения морфина и других препаратов этой группы отмечают угнетение кашлевого рефлекса, брадикардию, слезоточение, сужение зрачка, у некоторых больных тошноту и даже рвоту. У детей любого возраста, страдающих дыхательными аллергозами, морфин и кодеин могут вызвать освобождение гистамина из тучных клеток, приводя к бронхоспазму и набуханию слизистой оболочки бронхов.
Наркотические анальгетики группы морфина влияют также на функцию желудочно-кишечного тракта, вызывая антидиарейный эффект. Он связан с возникновением спастических сокращений сфинктеров (илеоцекального, внутреннего сфинктера прямой кишки), ограничением перистальтики, снижением в криптах секреции кишечного сока и ускорением реабсорбции в ворсинках жидкости и солей из просвета кишечника. Эти вещества уменьшают диурез в основном из-за увеличения секреции вазопрессина (антидиуретического гормона).
Анальгетики этой группы прямо взаимодействуют с опиатными рецепторами, локализованными в коре головного мозга, гипоталамусе, гипокампе, миндалевидном комплексе и других отделах головного мозга. В результате возникают психотропные эффекты, заключающиеся в появлении эйфории (хорошего самочувствия). Эйфория, вызываемая морфином, характеризуется исчезновением или притуплением неприятных эмоций, чувства страха, тревоги; внимание переключается на приятные ощущения или размышления, возникает состояние
95
безразличия к окружающему. Желание испытать это состояние еще раз и является причиной возникновения психической зависимости человека от, препарата. Этот вариант зависимости очень легко возникает у подростков^ Одновременно развивается и физическая зависимость. Допускают, что наркотические анальгетики, активируя опиатные рецепторы, тормозят освобождение по принципу обратной связи (как в эндокринной системе), а может быть и синтез эндогенных опиатных пептидов, постепенно заменяя их активность. В результате отмены анальгетиков возникает недостаточность и вводимого ранее анальгетика, и эндогенного пептида. Развиваются явления лишения (абстиненции), проявляющиеся в виде вегетативных (слезотечение, усиление потоотделения, расширение зрачков, тошнота, рвота, понос), сердечно-сосудистых (резкие колебания артериального давления, тахикардия), психические (расстройства сна, галлюцинации) и прочих нарушений, продолжающихся в течение 2-3 сут. Для предупреждения или ликвидации этих явлений наркоман готов на преступление, чтобы только достать препарат. Постоянный прием препарата приводит к психической и физической деградации человека. Опасность развития наркомании и является главным ограничением применения данных препаратов в медицине. Из аптек их отпус^дют только по специальным рецептам. Они хранятся в шкафу А.
Признаки абстиненции могут возникнуть даже у новорожденного, если мать во время беременности получала наркотические анальгетики. У ребенка учащается дыхание (до 60 и более раз в минуту), из-за выдыхания углекислоты развивается алкалоз, нарушающий состояние организма (укорачивается сон, усиливается рефлекс Моро, появляется тремор, судороги, регургитация, рвота, обильное потоотделение, чихание). Если ребенку не оказать помощь (назначением раствора простой настойки опия или фенобарбитала), он может погибнуть. .
Назначают эти препараты для устранения болей при наличии травм, ожогов, после операций, при проведении болезненных манипуляций, при возникновении болей из-за спазмов мочеточников, желчных путей и пр. Применяют их у больных с неоперабельными злокачественными новообразованиями. Возникающая эйфория (особенно после введения морфина) облегчает психическое состояние больного.
Препараты этой группы нельзя применять дольше 3—4 дней, иначе может развиться наркомания. При острых болях в животе их можно назначить только после (!) постановки диагноза. Эти препараты противопоказаны при черепномозговой травме, так как из-за угнетения дыхания и накопления углекислоты в крови происходит расширение сосудов мозга, что увеличивает опасность возникновения его отека.
У детей разного возраста преимущественно применяют промедол, реже фентанил, омнопон, пентазоцин. Промедол предпочтителен потому, что он меньше угнетает дыхание и к нему медленнее развивается пристрастие. Его рассматривают как детский анальгетик. Для акушерской практики имеет значение его способность расслаблять гладкую мускулатуру шейки матки. При очень тяжелом болевом синдроме детям вводят и фентанил — пока самый сильный анальгетик, но он выражение нарушает дыхание, так как угнетает и регулирующие его центральные структуры, и вызывает спастическое сокращение межреберных мышц.
При передозировке наркотических анальгетиков у ребенка развивается угнетение центральной нервной системы, характеризующееся потерей сознания, 96
угнетением дыхания (вплоть до его остановки), падением артериального давления, снижением температуры тела, сужением зрачков, не реагирующих на изменение освещенности, но на фоне этого угнетения у детей (в отличие от взрослых) возникают тонико-клонические судороги.
Для ликвидации интоксикации морфином (и препаратами его группы) лучше всего ввести антагонисты наркотических анальгетиков — налоксон или налорфин1. Они устраняют влияние этих веществ на опиатные рецепторы и восстанавливают нормальную функцию центральной нервной системы. Налорфин — частичный антагонист опиатов, он сам может активировать опиатные рецепторы, но устраняет эффекты введенных извне наркотических анальгетиков. Налоксон же полный антагонист опиатов. Его введение может вызывать нежелательные эффекты: повышение артериального давления, тахипноэ, тремор, потливость. При отсутствии налоксона (или налтрексона) можно использовать этимизол — аналептик, не вызывающий судорог, или кофеин. При глубоком угнетении дыхания производят искусственную вентиляцию легких.
Налоксон назначают внутривенно или внутримышечно. Всасывание препарата и его эффект развивается в течение нескольких минут, действие продолжается 4—5 ч. Через рот его применять нельзя, так как он почти полностью инактивируется при первом же прохождении через стенку кишечника и печень (то есть подвергается пресистемной элиминации). В печени происходит его биотрансформация — превращение в глюкуронийы, выводимые затем с мочой.
Кроме лечения отравлений морфином и препаратами его группы, налоксон применяют для профилактики и устранения нарушений дыхания у новорожденного, если мать получала наркотические анальгетики перед родами. С профилактической целью его вводят матери за 10-15 мин до завершения родов, а с лечебной целью — новорожденному в пупочную вену.
Налоксон начали применять у больных и без передозировки наркотических анальгетиков в случаях, когда повышена активность эндопиоидов: угнетение дыхания у новорожденных детей, перенесших гипоксию в родах; острая гипотензия при геморрагическом, эндотоксическом, травматическом шоке, когда избыточное количество освободившихся эндорфинов нарушает секрецию катехоламинов мозговым веществом надпочечников. Этот препарат назначают при ожирении, для понижения аппетита и гфи проведении дифференциальной диагностики наркоманий.
Для усиления анальгетического эффекта препаратов группы морфина и большего ограничения вегетативного и эмоционального компонентов в реакции на боль их нередко сочетают с транквилизаторами или нейролептиками. Этот вариант обезболивания дополняет, а иногда даже заменяет общее обезболивание у детей. У них чаще используют атаранальгезию — сочетание транквилизаторов бензодиазепинового ряда (преимущественно диазепама-сибазона) с фентанилом или промедолом. Нейролептанальгезия — сочетание нейролептика дроперидола (производного бутирофенона) и анальгетика фентанила — очень хорошая форма обезболивания. Ребенок практически не реагирует на болевое раздражение и с полным безразличием относится ко всему происходящему. Все же для подавления сознания дополнительно дают вдыхать закись азота с кислородом (1:1), а детям с повышенной чувствительностью к боли вводят оксибутират
1 Налорфин обладает галлюциногенным действием, поэтому его используют редко.
4 Зак. 3856
97
натрия. Надо только помнить, что у детей бутирофеноны часто вызывают гиперкинетический синдром.
Лекарственные формы и дозы наркотических анальгетиков для детей представлены в табл. 18.
Таблица 18
Наркотические анальгетики
Препарат Лекарственная форма г Путь введения Однократная доза
до 1 года 2-4 года 5-7 лет 8-10 лет больше 10 лет
Промедол Promedolum 1% раствор в ампулах по 1 мл Подкожно 0,1 мл 0,2-0,4 мл 0,5-0,7 мл 0,75 мл 1 мл
Морфина гидрохлорид1 Morphim hyd-rochloridum Порошок, таблетки по 0,01 г Через рот 1 мг 3 мг 5 мг
1% раствор в ампулах по 1 мл Подкожно 0,1 мл 0,3 мл 0,5 мл
Фентанила2 цитрат Phentanyli citras 0,005% раствор в ампулах по 2 и 10 мл Внутривенно при проведении нейролеп-танальгезии 0,0025 мг/кг
Налоксон NaJoxonum 0,05% раствор в ампулах по 0,5 мл Новорожденному в пупочную вену 5 мкг/кг в 2 мл изотонического раствора хлорида натрия
1% раствор в ампулах по 1 мл Внутривенно или внутримышечно (матери) за 10-15 мин до завершения родов 5-10 мг
Детям 1-12 лет внутривенно или внутримышечно 200 мкг/кг »
Примечания. 1. Детям до 4-х лет не назначать. 2. Детям любого' возраста.
НЕНАРКОТИЧЕСКИЕ АНАЛЬГЕТИКИ
Ненаркотические анальгетики не вызывают эйфории, пристрастия, привыкания, то есть наркомании; не угнетают дыхания и кашля, не влияют на процессы суммации подпороговых раздражений.
Анальгетический эффект, вызываемый препаратами этой группы, рассматривают как следствие устранения гиперальгезии в очаге воспаления. Образующиеся при воспалении ПГЕ2 и ППг потенцируют влияние брадикинина, серотонина и гистамина (то же образующихся в патологическом очаге) на чувствительные рецепторы. Ненаркотические анальгетики, блокируя циклооксигеназы, снижают образование ПГЕ2 и ПП2. При этом они уменьшают их потенцирующее действие на болевые рецепторы и поступление болевых им-98
пульсов в центральную нервную систему. Кроме того, препараты этой группы» ограничивают накопление ПГ в структурах головного мозга, участвующих в восприятии боли. Это приводит к уменьшению болевого синдрома, особенно связанного с воспалительной реакцией. Только подавлением воспалительного процесса нельзя объяснить анальгетический эффект этих препаратов. Например, парацетамол вызывает анальгетический эффект, не подавляя воспаления, а бутадион — сильное противоспалительное средство — не обладает анальгетическим действием. Обнаружено их активирующее влияние на тормозные импульсы, исходящие из околоводопроводного серого вещества; угнетение проведения импульсов по восходящим волокнам спинного мозга; угнетающее влияние на таламические центры болевой чувствительности. Наконец, обнаружена их способность усиливать освобождение эндорфинов.
В качестве ненаркотических анальгетиков используют:
Производные пиразолона — анальгин, амидопирин.
Анальгин обладает более сильным обезболивающим эффектом, чем амидопирин, и поэтому его чаще используют в клинике. Назначают его при головной и зубной боли, невралгиях, артритах, миозитах, после операций; при почечных и печеночных коликах, спастической дисменорее, спазмах коронарных сосудов анальгин используют в комбинации со спазмолитиками. Наиболее эффективной такой комбинацией является препарат баралгин.
При длительном применении анальгина и амидопирина наблюдаются нежелательные эффекты, типичные для пиразолоновых производных (см. гл. 39). При однократном приеме препаратов возможны аллергические реакции, даже анафилактический шок при внутривенном введении:
Производные парааминофенола — Парацетамол.
Этот препарат оказывает отчетливый жаропонижающий и анальгетический эффекты. Он малотоксичен и выгодно отличается, например, от ацетилсалициловой кислоты тем, что не приводит к появлению геморрагии и брохоспазма даже у больных бронхиальной астмой. Иногда парацетамол вызывает явление метгемоглобинемии, особенно опасной для детей периода новорожденное™, так как у них очень низка активность метгемоглобинредуктазы и других восстанавливающих ферментов в эритроцитах. У детей старшего возраста (после 14 лет) из парацетамола могут образоваться реактивные метаболиты, способные повреждать печень и почки. Одновременное назначение индукторов энзимов печени (фенобарбитала, дефинина) увеличйЬают и образование этих метаболитов и повреждение названных органов.
Глава 7 МЕСТНОАНЕСТЕЗИРУЮЩИЕ СРЕДСТВА
Местноанестезирующими средствами называют вещества, которые временно угнетают возбудимость нервных окончаний и проводимость по чувствительным нервным волокнам, что приводит к потере чувствительности.
Молекулы большинства анестетиков содержат три основных фрагмента: ароматическую структуру, промежуточную цепочку и аминогруппу (см. рис. 16). Ароматическая структура определяет степень липофильности, а аминогруппа — специфичность действия. Средняя часть молекулы обычно представляет собой алифатическую цепочку, построенную по типу сложных эфиров или амидов; от нее зависит стойкость и длительность эффекта. Анестетики, имеющие в
99
молекуле амидную связь, в отличие от сложных эфиров, не разрушаются эстеразами крови, печени и тканевых жидкостей. Биотрансформация амидов происходит с помощью монооксигеназной системы.
По химическому строению местноанестезирующие средства делят на две группы: I) сложные эфиры ароматических кислот (новокаин, дикаин, анестезин, кокаин); 2) замещенные амиды кислот (лидокаин, триме-каин, пиромекаин, бупивакаин, бензофурокаин, мепивакаин, этидокаин, прилокаин).
Анестетики применяют в виде солянокислых солей, растворимых в воде. Для того чтобы препарат проявил свое местноанестезирующее действие, должен произойти гидролиз соли и освобождение основания, растворимого в липидах. Этот процесс протекает лишь в щелочной среде (pH тканей в обычных условиях составляет 7,35-7,4). Поэтому в воспаленных тканях местные анестетики не проявляют активности, так как в кислой среде (в очаге воспаления pH 5-6) гидролиза солей не происходит и основание, необходимое для специфического эффекта, не освобождается.
Липидорастворимые основания местных анестетиков накапливаются в мембранах нервных волокон и их окончаний, где они и переходят в катионную ионизированную форму. После 'этого они связываются с чувствительным рецептором, локализованным на внутренней поверхности оболочки нервного волокна. Рецептор находится в натриевом вольтажзависимом канале. После взаимодействия с ним местного анестетика проницаемость мембраны для ионов натрия снижается, что препятствует возникновению потенциала действия и, следовательно, проведению импульсов..
nh2
О = С - О - СН2 - СН2 - N • НС1 ХС2Н5
HN — С — CH2 — N • НС1
Ксикаин
Рис. 16. Химические структуры местных анестетиков
100
Имеются данные о том, что анестетики снижают проницаемость и для ионов калия и кальция, участвующих в регуляции проницаемости мембраны нервных волокон для ионов натрия. Существует также предположение, что уменьшение ионной проницаемости аксональных мембран может быть связано с влиянием4 анестетиков на поверхностное натяжение фосфолипидов, входящих в их состав.
Описанные выше процессы происходят не только на мембранах нервных волокон и их окончаний, но и в скелетных мышцах, миокарде, водителях ритма в сердце и пр.
Местные анестетики способны блокировать проведение возбуждения по всем нервным волокнам (чувствительным, двигательным, вегетативным), однако в различных концентрациях и с неодинаковой скоростью, что зависит от отсутствия, наличия или толщины миелиновой оболочки, препятствующей проникновению местного анестетика к нервному волокну. Наиболее чувствительны к анестетикам тонкие безмякотные волокна. При инфильтрационной анестезии (см. ниже) в первую очередь нарушается проведение возбуждения именно по ним. В результате исчезает болевая и температурная чувствительность, наступает местное расширение сосудов вследствие блокады симпатических волокон. Другие виды чувствительности (тактильная, ощущение давления) угнетаются медленнее, и в последнюю очередь блокируется проведение по двигательным нервам. (Местные анестетики не проникают через шванновскую оболочку, поэтому проведение блокируется только в перехватах Ранвье.) Для прекращения проведения нервного импульса необходимо, чтобы блокада распространялась на 3 последовательных перехвата Ранвье. Чем толще нерв, тем больше расстояние между перехватами, и это частично объясняет большую резистентность толстых волокон к препаратам.
Другая причина предпочтительной блокады чувствительных волокон связана с зависимостью действия местных анестетиков от характеристик деполяризации. Вызванная ими блокада более выражена при большей частоте и длительности деполяризации. Сенсорные, особенно болевые волокна имеют высокую частоту импульсации и сравнительно длительный потенциал действия (более 5 мс). Двигательные волокна посылают импульсы с меньшей частотой и более коротким потенциалом действия (меньше 5 мс).
Однако названные правила дифферецированной блокады нервов иногда могут быть изменены, что связано с пол^кением волокна в пучке. Так, в некоторых крупных нервных стволах двигательные волокна расположены по наружной поверхности и поэтому первыми контактируют с препаратом, который введен в окружающие ткани. Следовательно, в этих случаях блокада двигательных волокон может наступить раньше, чем чувствительных. Следует также отметить анатомическую особенность расположения нервных волокон в некоторых нервных стволах конечностей. В конечностях проксимальные чувствительные волокна часто расположены на наружной поверхности нерва, а дистальные — в его центре. Поэтому во время инфильтрационной блокады крупного нерва анестезия сначала развивается проксимально, а затем распространяется дистально, когда анестетик начинает проникать в центр нерва.
Восстановление проводимости по нервам происходит в обратном порядке: обычно позже всего восстанавливается функция безмякотных волокон.
Как самостоятельный метод местное обезболивание в педиатрии используют сравнительно редко. Только 6—8% оперативных вмешательств у детей (обычно кратковременных й не очень болезненных) проводят под местной анестезией. Чаще эти вещества применяют в сочетании со средствами общей анестезии.
101
Различают несколько видов местной анестезии.
Терминальная (концевая, поверхностная) анестезия развивается при воздействии препаратов на чувствительные нервные окончания, находящиеся в слизистых оболочках или на раневых поверхностях. В педиатрической практике этот метод используют для анестезии роговицы глаза, носовых ходов — при интраназальной интубации, пищевода — при зондировании желудка, уретры — при цистоскопии, поверхности ожогов при их лечении и пр.
Для данного вида обезболивания применяют дикаин, пиромекаин и бупйвакаин, которые легко проникают в поверхностные слои слизистых оболочек и достигают чувствительных нервных окончаний. Продолжительность действия бупивакаина составляет 3-6 часов, тогда как у дикаина, пиромекаина и лидокаина — 1,5-3 часа.
Для терминальной анестезии применяют и анестезин, однако он плохо проникает через неповрежденные слизистые оболочки и кожу. Поэтому он эффективен лишь при повреждении поверхностных слоев названных тканей, и его применяют для обезболивания раневых и язвенных поверхностей. В форме свечей его назначают при заболеваниях прямой кишки (геморрой, трещины, зуд). Иногда его назначают внутрь при рвоте, связанной с раздражением слизистой оболочки желудка, а также при язвенной болезни желудка.
Кокаин применяют редко из-за его высокой токсичности и возникновения к нему болезненного пристрастия — наркомании (кокаинизма). Этот препарат представляет интерес с исторической точки зрения, так как является родоначальником местных анестетиков.
Проводниковая (регионарная) анестезия наступает в результате блокады анестетиком нервного ствола. При этом нарушается проведение нервных импульсов от рецепторов к центральной нервной системе, и утрачивается в результате этого чувствительность в той области, которая иннервируется нервным проводником. Для данного вида обезболивания применяют новокаин, три-мекаин, лидокаин и др.
Спинномозговая (корешковая) анестезия — один из вариантов проводниковой анестезии. Осуществляется путем введения растворов анестезирующих веществ в субарахноидальное пространство между остистыми отростками поясничных позвонков для воздействия на задние (чувствительные) корешки спинного мозга. В хирургической практике применяют и другие разновидности проводниковой анестезии: перидуральную, паравертебральную, сакральную и другие.
Спинномозговую анестезию в детском возрасте используют крайне редко. Значительно шире применяют перидуральную анестезию, которую назначают не только во время оперативных вмешательств, но и после них для устранения боли (вместо анальгетиков), а также для ликвидации тормозных симпатических влияний на перистальтику кишечника (например, при перитоните) и ее восстановления. С этими целями у детей наиболее широко используют тримекаин, несколько реже — лидокаин.
Инфильтрационная анестезия достигается послойным пропитыванием тканей раствором анестетика, начиная с кожи. При этом препарат воздействует и на нервные волоконца, и на их окончания. Для данного вида обезболивания используют новокаин, тримекаин, лидокаин и др. Их применяют при проведении операций у новорожденных и детей грудного возраста, а также при небольших хирургических вмешательствах у детей старшего возраста (пилоро-томия, удаление ангиом и т. п.). Чтобы замедлить всасывание анестетиков из мест введения и удлинить эффект, к их растворам (особенно к новокаину)
102
добавляют раствор адреналина гидрохлорида (0,1%) — 1 каплю на 2-10 мл раствора анестетика.
Местные анестетики, особенно новокаин, лидокаин и тримекаин, используют и для резорбтивных целей. Новокаин применяют для блокирования вегетативных ганглиев (результат стабилизации мембран пресинаптических окончаний); лидокаин и тримекаин — в качестве антиаритмических средств (см. гл. 20), лидокаин оказывает противосудорожный эффект (см. гл. 11). Все эти препараты можно использовать вместе со средствами обшей анестезии, вводя в ткань богатую чувствительными рецепторами (надкостница, брюшина и пр.) и этим ограничивая поступление болевых импульсов в центральной нервной системе и необходимость увеличения дозы наркотизирующего вещества в соответствующий период операции.
Нежелательные эффекты местноанестезирующих средств связаны с их резорбтивным действием. Они оказывают легкое угнетающее влияние на центральную нервную систему (сонливость, двигательная заторможенность, головокружение), чувствительность которой к,ним значительно выше, чем периферического отдела нервной системы. Местные анестетики обладают Н-холи-нолитическим действием и тормозят передачу нервных импульсов в синапсах вегетативных ганглиев. Поэтому они могут понижать тонус гладкой мускулатуры внутренних органов и снижать артериальное давление. У некоторых людей с генетически обусловленной недостаточностью или качественными особенностями бутирилхолинэстеразы нарушается метаболизм новокаина. У таких больных может быть тяжелый коллапс от введения обычной дозы препарата. Аллергические реакции возникают, как правило, при применении сложных эфиров ароматических кислот. Следует также отметить уменьшение антибактериальной активности сульфаниламидных препаратов, назначаемых на фоне новокаина, что связано с превращением последнего в парааминобензойную кислоту, которую используют микробы для синтеза фолиевой кислоты, необходимой для синтеза нуклеиновых кислот, то есть деления клеток.
При передозировке местных анестетиков нарушается деятельность центральной нервной системы: повышается ее возбудимость (беспокойство, вздрагивания, рвота, судороги), сменяющаяся затем выраженным угнетением (паралич структур, регулирующих дыхание, коллапс). Для ликвидации интоксикации применяют барбитураты (подавление судорог), вдыхание кислорода, введение сердечных гликозидов и сосудосуживающих средств (эфедрин) для ликвидации коллапса. При угнетении дыхания проводят искусственную вентиляцию легких. Применять аналептики нельзя, опасно провоцирование судорог.
Лекарственные формы и дозы местных анестетиков для детей представлены в табл. 19.
Таблица 19
Местные анестетики
Препарат Лекарственная форма Варианты анестезии Однократные дозы1
Новокаин Novocainum 0,25% и 0,5% растворы в ампулах по 1, 2, 5, 10, 20 мл и во флаконах по 200 и 400 мл Инфильтрационная Не больше 20 мг/кг для детей всех возрастов
1 % и 2% растворы в ампулах по 1, 2, 5, 10 мл Проводниковая
103
Окончание табл. 19
Препарат Лекарственная форма Варианты анестезии Однократные дозы1
Лидокаин Lidocainum Ампулы по 10 и 20 мл 1% раствора; по 2 мл и 10 мл 2% раствора Проводниковая, перидуральная 15 мг/кг для детей всех возрастов
3—5% раствор Терминальная
0,25—0,5% раствор Инфильтрационная
Тримекаин Trimecainum Ампулы по 10 мл 1% раствора Проводниковая То же
Ампулы по 1—2 мл 5% раствора Терминальная
Ампулы по 10 мл 0,25%' раствора И нфильтрационная
Анестезин Anaesthesinum Порошок, 5% мазь, таблетки по 0,3 г Терминальная До 1 года — 0,02—0,04 г; 2—5 лет — 0,05—0,1 г; 6-12 лет - 0,12-0,25 г
Ди каин Dicainum 1% раствор во флаконах по 5-10 мл То же По 1 капле в конъюнктивальный мешок глаза или на слизистую носа (не больше 2 раз в день)
Примечание. 1. Приведены дозы сухого вещества.
Глава 8
СРЕДСТВА, ПРИМЕНЯЕМЫЕ ДЛЯ ОБЩЕЙ АНЕСТЕЗИИ
Средства общей анестезии (СОА) вызывают состояние наркоза (от греч. narcosis — оцепенение, усыпление), то есть обратимого угнетения центральной нервной системы.
Различают ингаляционные и неингаляционные СОА, вводимые в организм путем вдыхания или инъекций (преимущественно внутривенных). Вызываемое ими угнетение центральной нервной системы развивается постепенно, поэтому различают несколько стадий наркоза, наиболее отчетливо выраженных при вдыхании диэтилового эфира (см. схему 8).
I стадия — стадия анальгезии — от момента введения препарата до потери сознания. Она характеризуется снижением болевой, но сохранением других видов чувствительности, тонуса скелетной мускулатуры и рефлексов.
II стадия — стадия возбуждения — характеризуется утратой сознания, возникновением речевого и двигательного возбуждения, повышением артериального давления и усилением всех рефлексов.
104
Показатели I стадия II стадия Ш стадия IV стадия
1-й период 2-й период 3-й период 4-й период
Сознание
Движения глазных яблок —*
Величина зрачков (•) (•) (’) (•) (•) (•) J9L
Веки Закрыты Крепко сжаты Закрыты Полуоткрыты Открыты Широко открыты Широко открыты
Роговичный рефлекс
Реакция зрачка на свет ВНИИ
Дыхание брюшное
грудное
Пульс
Кровяное давление
Тонус мускулатуры скелетной HBHHBI
абдомиальной
Рвотный рефлекс
Схема 8. Клиническая характеристика стадий эфирного наркоза
Ill стадия — стадия хирургического наркоза — характеризуется постепенным угнетанием рефлексов, тонуса скелетных мышц с сохранением дыхания и сердечной деятельности.
Различают несколько уровней III стадии:
первый уровень: у больного сужены зрачки, реагирующие на свет, сохранены роговичный рефлекс и движение глазных яблок, угнетены поверхностные рефлексы, дыхание глубокое и ритмичное;
второй уровень: глазные яблоки больного фиксированы, зрачок на свет не реагирует, исчезает роговичный рефлекс, скелетные мышцы расслаблены, исчезают рефлексы с глотки и гортани, дыхание ритмично, но слегка угнетено;
третий уровень: у больного незначительно расширены зрачки, появляется десинхронизация грудного и брюшного дыхания, снижается артериальное давление, учащается пульс, полностью расслабляются скелетные мышцы;
четвертый уровень: зрачки резко расширены, дыхание поверхностное, диафрагмальное, учащенное, артериальное давление значительно снижено, пульс резко учащен.
IV стадия (недопустимая) — г^редозировка СОА — прекращение дыхания, катастрофическое падение артериального давления, зрачки максимально расширены, глаза раскрыты.
СОА могут быть применены: самостоятельно, для получения мононаркоза (в современной медицине крайне редко); в комбинации с другими СОА — комбинированный наркоз; для введения больного в состояние наркоза — вводный наркоз, быстро достигаемый, но кратковременный; для длительного, но не очень глубокого угнетения центральной нервной системы — базисный наркоз, длящийся на протяжении всей операции (часа 2—3), на его фоне требуются очень небольшие дозы другого СОА, чтобы получить спокойное глубдкое угнетение центральной нервной системы.
ИНГАЛЯЦИОННЫЕ СРЕДСТВА ОБЩЕЙ АНЕСТЕЗИИ
Ингаляционные СОА используют на фоне вводного или базисного наркоза, вызываемого неингаляционными средствами, для поддержания необходимого уровня угнетения центральной нервной системы.
Диэтиловый эфир (см. рис. 17) — бесцветная летучая жидкость с резким запахом, е точкой кипения 35° С, горит и взрывоопасен. Его пары раздражают слизистые оболочки полости рта и дыхательных путей.
н5с2 - о - С2Н5
Рис. 17. Диэтиловый эфир
• Для вызывания общей анестезии необходимо вдыхание газовой смеси, содержащей 10-15 об % эфира, а для поддержания наркоза — 4-5 об%.
Эфир хорошо растворяется в воде и всего в несколько раз лучше растворим в жирах и липидах. Поэтому при самостоятельном его использовании наркоз 106
развивается медленно. Ill стадия возникает лишь через 15—20 мин, и ей предшествует длительная стадия возбуждения, во время которой у больного могут развиться тяжелые осложнения. К ним относятся: обильная секреция слюнных и бронхиальных желез, рвота (результат раздражения слизистой оболочки желудка проглоченной слюной, содержащей эфир), аспирирование рвотных масс, нарушающих проходимость дыхательных путей, а в последующем вызывающие аспирационную пневмонию; брадикардия и даже остановка сердца из-за рефлекторного возбуждения блуждающего нерва. Поэтому эфир никогда не применяют для мононаркоза и вводят на фоне премедикации атропином (предотвращающим секрецию и вагальные рефлексы) и вводного или базисного наркоза.
Эфир способствует освобождению катехоламинов из мозгового вещества надпочечников, поэтому во время наркоза артериальное давление поддерживается на нормальном уровне, сила сердечных сокращений обычно достаточна даже у больных с ослабленным миокардом. Вместе с тем освобождение катехоламинов может привести к гликогенолизу, снижению уровня гликогена в печени и к нарушению ее функции; к увеличению уровня глюкозы в крови, что опасно для больного сахарным диабетом; иногда к возникновению аритмии сердечных сокращений.
После прекращения вдыхания эфира наркоз исчезает медленно, что связано с его хорошей растворимостью в воде плазмы крови. Эфир преимущественно (85-90%) выдыхается из организма в неизмененном виде, при этом происходит его испарение на поверхности дыхательных путей и их охлаждение, что способствует возникновению пневмоний. Все же часть попавшего в организм эфира подвергается окислению до ацетальдегида и этанола.
Эфир применяют до сих пор потому, что у него большая широта наркотического действия: в концентрации 0,1-0,25 г/л крови он вызывает I стадию наркоза, в концентрации 1,3-1,4 г/л — третий уровень III стадии; остановка дыхания — от концентрации 1,6—1,8 г/л. Однако у детей, преимущественно находящихся в состоянии гипертермии или обезвоживания, эфир в начале наркотизирования, во время наркоза или после него может вызвать судороги.
Проводимая перед вдйканием эфира премедикация позволяет уменьшить его концентрацию во вдыхаемом воздухе и предупредить возникновение многих осложнений. Одновременное введение миорелаксантов позволяет выполнить операцию на втором уровне III стадии.
Фторотан — тяжелая, бесцветная жидкость с характерным сладковатым запахом, с точкой кипения 50° С, не горит, не взрывается, при добавлении к эфиру предотвращает его горение (см. рис. 18). Смесь фторотана с эфиром — азеотропная смесь. Наркоз возникает при вдыхании газовой смеси, содержащей 2-3 об% фторотана. Угнетение центральной нервной системы развивается очень быстро, так как он плохо растворяется в воде, быстро насыщает плазму крови и прекрасно растворяется в жирах и липидах, поэтому легко проникает через гематоцефалический барьер в мозг. Через 3—5 мин после начала вдыхания может возникнуть третий уровень III стадии наркоза. Стадии возбуждения обычно нет, слизистые оболочки он не раздражает, поэтому рефлекторных осложнений, вызываемых эфиром, нет. В связи с быстрым проникновением в центральную нервную систему необходимо контролировать и регулировать концентрацию фторотана во вдыхаемом воздухе, чтобы не допустить чрезмерно
107
глубокого угнетения центральной нервной системы. У фторотана очень маленькая широта наркотического действия: в концентрации 0,09—0,12 г/л крови он вызывает I стадию наркоза, а уже в концентрации 0,18-0,22 г/л — третий уровень III стадии, в концентрации же 0,28—0,35 г/л крови возникает остановка дыхания. В связи с этим применять фторотан, пользуясь специальными испарителями, может только опытный анестезиолог.
Фторотан обладает Н-холинолитическим действием, блокируя Н-холиноре-цепторы скелетных мышц и вегетативных ганглиев. В результате он вызывает выраженное расслабление скелетных мышц (и повышает их чувствительность к антидеполяризующим миорелаксантам). Это проявляется в ослаблении сокращений дыхательных мышц и в снижении объема вдыхаемого воздуха, нередко до величин, недостаточных для поддержания адекватной вентиляции легких^ К тому же фторотан снижает реакцию центральных структур, регулирующих дыхание, на углекислоту, а в легких ухудшает газообмен, о чем свидетельствует увеличение разницы между парциальным давлением кислорода в альвеолах й в артериальной крови. Поэтому во время фторотанового наркоза необходимо контролировать вентиляцию легких и проводить вспомогательное дыхание после интубирования тр&еи.
Блокирование вегетативных ганглиев приводит к расширению сосудов во многих органах и тканях, чему способствует и активация образования оксида азота в эндотелиальных клетках. В результате снижается артериальное давление. При этом расширенные сосуды в коже, почках, внутренних органах брюшной полости, мозге утрачивают способность к ауторегуляции, и снижение артериального давления ухудшает перфузию названных тканей и органов. Происходит расширение сосудов в плохо вентилируемых участках легких, так как угнетается вазоконстрикция в них, обычно наблюдаемая при гипоксии. В мозге увеличивается кровоток, возрастает образование ЦСЖ и ее давление. Поэтому фторо-тановый наркоз не годится для проведения нейрохирургических операций.
Фторотан снижает силу сердечных сокращений, так как препятствует поступлению Са++ в клетки миокарда, поэтому он может быть опасным для больных с сердечной недостаточностью. Вместе с тем он повышает чувствительность В-адренорецепторов к адреналину, и повышенное его освобождение из надпочечников и особенно его введение может привести к тяжелой аритмии
F С1 •
F- С - С- Н
F Вт
F Н F F F F
II I II ।
F—С —С —О —С —Н Н-С-С-О-С-Н
II I II ।
F Cl F Cl F F
Фторотан
Изофлуран
Энфлуран
Рис. 18. Фторированные углеводороды
108
сердечных сокращений, иногда фатальных. Поэтому на фоне фторотанового наркоза недопустимо введение адреналина, а перед наркотизированием больной должен находиться в состоянии физического и эмоционального покоя, предотвращающего освобождение катехоламинов в кровь. Для этой цели производят премедикацию (см. ниже).
Фторотан расслабляет гладкую мускулатуру бронхов, может даже устранить бронхоспазм у больных с астматическим состоянием. Происходит расслабление гладкой мускулатуры и матки. Это облегчает проведение акушерских внутри-маточных манипуляций, но одновременно фторотан угнетает как естественные, так и вызванные сокращения матки во время родов, удлиняя их и увеличивая послеродовые кровотечения и кровопотерю.
Во время фторотанового наркоза на 40—50% снижается клубочковая фильтрация в почках и уменьшается образование мочи, но по прекращении наркоза функция почек восстанавливается. Фторотан снижает и кровоток в печени. Описаны случаи гепатотоксичности примерно 1:10 000 его применения. В этих случаях через 2-3 дня после наркоза у больного возникает лихорадка, сопровождаемая анорексией, тошнотой, рвотой. Иногда появляется сыпь, эозинофилия, биохимические проявления токсического гепатита.
Элиминация фторотана осуществляется в основном дыхательными путями. Происходит это достаточно быстро, минут через 5—15 наркоз прекращается, но полное восстановление мышления происходит лишь через несколько часов (имеет значение медленное освобождение фторотана из жировых депо).
1-25% фторотана подвергается биотрансформации в печени (чем меньше его попадает в организм, тем больший процент подвергается биотрансформации), превращаясь во фторацетальдегид и фторэтанол. Последний обладает свойствами реактивных метаболитов, прочно соединяясь с компонентами клеточных мембран, белками клеток и с нуклеиновыми кислотами, вызывая гепатотоксичность, нефротоксичность, мутагенный, канцерогенный и тератогенный эффекты. Тератогенный эффект преимущественно опасен для служащих анестезиологических отделений, постоянно вдыхающих небольшие концентрации фторотана, выдыхаемого больным.
У больных с врожденными пороками ко<дно-мышечной системы фторотан может спровоцировать злокачественную гипертермию с быстрым повышением температуры тела до 41—42°С и часто с летальным исходом. Возникновению этого осложнения способствуют деполяризующие миорелаксанты (см. гл. 1). Поэтому таким больным фторотан противопоказан.
Энфлуран и изофлуран очень похожи по своим фармакологическим эффектам на фторотан. Для вызывания III стадии наркоза одним энфлураном необходимо 4 об% его в газовой смеси, а изофлурана для этой же цели 2—3 об%. Для поддержания наркоза во вдыхаемой газовой смеси необходимо 1,5-3 об% энфлурана и 1,5-2 об% изофлурана. Оба ослабляют сокращения миокарда, снижают артериальное давление, угнетают дыхание, расслабляют скелетную мускулатуру и гладкую мускулатуру бронхов, матки. Энфлуран, как и фторотан, увеличивает мозговой кровоток и внутричерепное давление, поэтому тоже противопоказан для нейрохирургических операций.
Как и фторотан, оба препарата могут спровоцировать злокачественную гипертермию у больных с врожденными пороками костно-мышечной системы.
109
Отличие от фторотана заключается в том, что энфлуран очень мало, а изофлуран совсем не повышает чувствительность миокарда к адреналину. Поэтому на их фоне (при необходимости) можно вводить небольшие количества адреналина.
Во время глубокого энфлуранового наркоза могут быть подергивания мышц рта, лица, шеи, конечностей, особенно при высоком (35% и выше) содержании кислорода во вдыхаемой газовой смеси. Он противопоказан больным эпилепсией. Изофлуран может активизировать рефлексы дыхательных путей, вызывая усиленную секрецию слизи, кашель, ларингоспазм. Для их предотвращения необходимо проведение премедикации (см. ниже), в частности введение атропина.
Изофлуран не влияет на мозговой кровоток и внутричерепное давление, поэтому его можно применять во время нейрохирургических операций.
Энфлуран и особенно изофлуран подвергаются в печени значительно меньшей биотрансформации, чем фторотан и из них не образуются реактивные метаболиты, поэтому они не вызывают тератогенный канцерогенный и прочие нежелательные эффекты.
Циклопропан — бесцветный газ со сладким запахом и вкусом. Взрывоопасен (см. рис. 19).
сн2
Рис. 19. Циклопропан
Вдыхание его в концентрации 1—2 об% вызывает анальгезию без утраты сознания, в концентрации 6-8 об% приводит к утрате сознания, а в концентрации 20-25 об% — к III стадии наркоза, дыхание угнетает в концентрации 35-50 об%. Наркоз возникает быстро и быстро исчезает после прекращения вдыхания циклопропана. Элиминация его осуществляется путем выдыхания, биотрансформации в организме не подвергается.
Циклопропан — опасный анестетик. Он стимулирует и М-холинорецепторы и адренорецепторы (а и 0). В результате он вызывает обильную секрецию бронхиальных желез и сокращение гладкой мускулатуры бронхов, нарушая этим их проходимость, что может стать причиной гипоксии и даже ацидоза. Кроме того, он повышает артериальное давление, вызывает брадикардию и в то же время резко повышает аритмогенное действие катехоламинов. Именно при его вдыхании наибольшая опасность возникновения тяжелых аритмий сердечных сокращений. Поэтому его редко применяют, особенно в детской анестезиологии.
Закись азота — бесцветный газ со сладковатым вкусом, не раздражающий слизистые оболочки. Вдыхают его в смеси с кислородом и для получения наркоза его в газовой смеси должно быть 80%, для анальгезии — 30-50%.
ПО
Закись азота быстро проникает в центральную нервную систему, вызывая хорошую анальгезию, сопоставимую по интенсивности с анальгезией, вызываемой морфином. Поэтому ее используют для обезболивания больных с тяжелыми травмами, инфарктом миокарда, в родах и т. п. Анальгетический эффект можно получить даже путем подкожного введения газа, например, при лечении больных с ожогами.
Наркоз от вдыхания одной закиси азота — поверхностный, с сохранением мышечного тонуса, некоторых рефлексов. Поэтому ее обычно используют на фоне базисного наркоза или нейролептанальгезии, а также одновременно с вдыханием фторированных углеводородов. Поскольку закись азота слегка увеличивает освобождение катехоламинов из мозгового вещества надпочечников, то при совместном ее применении с фторотаном (или другими фторированными' углеводородами) происходит небольшое, но все же повышение уровня катехоламинов в крови, что сопровождается некоторым расширением зрачков, повышением периферического сопротивления сосудов, артериального давления, силы сокращений сердца (по сравнению с применением одних фторированных углеводородов). При совместном их применении увеличивается глубина наркоза. Это позволяет уменьшить количество вдыхаемых фторированных углеводородов, что снижает их отрицательное влияние на дыхание и опасность возникновения других нежелательных эффектов.
Закись азота слегка повышает освобождение катехоламинов из мозгового вещества надпочечников, но это мало влияет на артериальное давление и деятельность сердца, хотя иногда может вызвать аритмию сердечных сокращений. На функцию печени практически не влияет, однако в эксперименте обнаружено, что она угнетает процессы окислительного фосфорилирования в митохондриях и печени, и миокарда.
Закись азота лучше азота растворяется в плазме крови (а во вдыхаемой газовой смеси они могут содержаться в равных количествах), и одну молекулу азота в ней заменяют 35 молекул закиси азота. В итоге ничтожный пузырек воздуха, попавший в вену может резко увеличиться и привести к возникновению эмболии. В полостях человеческого тела, содержащих воздух (внутреннее ухо, пазухи лобной кости, верхней челюсти) замена азота на больший объем закиси азота повышает давление, может вызвать боль, повредить барабанную перепонку, особенно при тимпанопластике. При надичии пневмоторакса объем газа в плевральной полости возрастает в 2—5 раз, сдавливает легкие, нарушает вентиляцию и гемодинамику; при илеусе резко возрастает объем воспаленной кишки,-затрудняя выполнение операции.
При длительном вдыхании закиси азота происходит угнетение метионин-синтетазы, зависимой от витамина В12, что нарушает синтез ДНК, продукцию лейкоцитов и эритроцитов в костном мозге. Окисление атома кобальта в витамине В12 закисью азота приводит к возникновению мегалобластических изменений в костном мозге. Это ограничивает ее применение в качестве анальгетического вещества.
Таким образом, несмотря на малую токсичность закиси азота, ее применение требует осторожности. Особое внимание должно быть обращено на необходимость поддержания 20% содержания кислорода в газовой смеси, чтобы во время наркоза не возникло гипоксии с последующей декортикацией больного.
. - 111
НЕИНГАЛЯЦИОННЫЕ СРЕДСТВА ОБЩЕЙ АНЕСТЕЗИИ
Барбитураты. В качестве СОА используют гексеналитиопентал — барбитураты ультракороткого действия (см. рис. 20).
При медленном внутривенном введении наркоз может возникнуть во время или сразу после заврешения инъекции препаратов — на конце иглы. Это связано с хорошей липидорастворимостью неионизированных молекул названных веществ и их быстрым проникновением в мозг. Одновременно они проникают и в другие органы с богатым кровоснабжением (сердце, почки, печень), Все они составляют примерно 6% от массы тела; кровообращение затем перераспределяет барбитураты в ткани с менее интенсивным кровообращением (скелетные мышцы, жировая ткань), это снижает их концентрацию в мозговой ткани, и наркоз прекращается. Биотрансформация же препаратов происходит медленно. Так, тиопентал инактивируется со скоростью примерно 15% введенной дозы в час. Содержащийся в жировой ткани и мышцах барбитурат постепенно поступает в кровь, поддерживает в ней концентрацию, способную вызвать неглубокое угнетение центральной нервной системы, сонливость, длящуюся несколько часов.
ONa
Рис. 20. Гексенал
Боль барбитураты подавляют очень плохо. Они недостаточно угнетают вегетативные рефлексы, особенно у детей младшего возраста, поэтому болезненные манипуляции во время операции могут вызвать тахикардию, слезотечение, потливость, учащение дыхания, колебания артериального давления, нарушения ритма сердца, даже шок, у детей младшего возраста — его эквивалент — дыхательную недостаточность, повышение внутричерепного давления. На фоне даже глубокого барбитуратного наркоза сохраняются рефлексы с глотки и гортани, поэтому перед интубацией трахеи больного обязательно введение миорелаксантов и желательно наркотических анальгетиков (например, фентанила).
Барбитураты блокируют вегетативные ганглии, снижая поэтому артериальное давление, венозное давление и возврат крови к сердцу, ударный и минутный объем крови, особенно у больных со слабостью сердечных сокращений. При гиповолемии, возникшей из-за геморрагии, обезвоживания и по другим причинам, а также при сосудистой нестабильности, сепсисе, токсемии или шоке обычная доза тиопентала может привести к резкому снижению артериального давления, циркуляторному коллапсу и даже к остановке сердца.
Мозговой кровоток и интенсивность обмена мозговой ткани барбитураты снижают, поэтому их можно использовать для нейрохирургических операций. 112
Они усиливают секрецию бронхиальных желез, не зависящую от активности холинергических структур, поэтому не устраняемую атропином.
В основном барбитураты используют для введения больного в наркоз, после чего либо (на фоне введения, миорелаксантов) интубируют трахею больного и переводят его на вдыхание ингаляционных СОА, либо приступают к капельному внутривенному вливанию других неингаляционных СОА, например, кетамина.
При попадании раствора тиопентала в подкожную клетчатку возникает сильная боль и некроз ткани. При ошибочном внутриартериальном введении происходит немедленное повреждение эндотелия и глубоких слоев сосудистой стенки, возникает эндоартериит с последующим тромбозом. При обнаружении ошибки следует немедленно через ту же иглу ввести 5—10 мл \% раствора новокаина для устранения боли и спазма сосудов, гепарин — для предотвращения тромбоза.
Пропанидид (эпонтол, сомбревин) — маслянистая жидкость, нерастворимая в воде, и в качестве растворителя используют кремофор (см. рис. 21).
осн3 п
О Й С2Н5
ч // \ II /
с-н2с-/ Vo-ch2-c-n
С3Н7С) хс2н5
Рис. 21. Пропанидид
Внутривенное введение пропанидида через 15-30 с вызывает угнетение центральной нервной системы, особенно коры головного мозга, подавляя сознание, рефлексы и психическую активность. Однако анальгетический эффект препарата невелик. У больного может быть сохранена и даже повышена функция структур, регулирующих двигательную активность скелетных мышц. Поэтому во время наркоза отмечают напряжение мускулатуры (что может мешать вправлению вывихов, репозиции отломков костей), вздрагивания, усиление спинальных рефлексов. о
Используют пропанидид для коротковременных манипуляций, болезненных процедур, диагностических исследований и пр.
Вскоре после введения препарата возникает гипервентиляция из-за стимуляции дыхательного центра; интенсивное удаление углекислоты приводит затем к урежению дыхания и даже к его остановке на 20—40 с. Препарат блокирует Р-адренорецепторы, особенно в миокарде и может уменьшить силу и частоту сердечных сокращений, ударный и минутный объем крови. Поэтому у больных с сердечной недостаточностью может нарушить гемодинамику, но предотвратить аритмию сердечных сокращений, вызванную другими.СОА. Пропанидид увеличивает освобождение гистамина из базофилов и тучных клеток, особенно у детей с аллергическими заболеваниями. Наиболее опасным осложнением может быть анафилактический шок и бронхоспазм.
Эффект пропанидида очень кратковременный, он длится всего 3—5 мин. Это связано (как и в случае применения барбитуратов) с его перераспределением в организме, а также с гидролизом эстеразами плазмы крови. У больного
из
быстро восстанавливается сознанйе, мышечный тонус, и вскоре он может уйти из амбулатории.
Кетамин (кеталар, калипсол) все шире применяется в анестезиологии, в том числе детской (см. рис. 22). При внутреннем введении наркоз возникает мгновенно (через 15—20 с) и продолжается. минут 20; при внутримышечном введении (большей дозы) эффект возникает через 3-5 мин и продолжается до 30 мин.
Ри<^22. Кетамин
Кетамин применяют для введения в наркоз, а также для его поддержания, для последней цели его вводят в виде капельной инфузии.
Кетамин вызывает диссоциативный наркоз, так как он преимущественно блокирует таламо-кортикальные Связи и дезорганизует афферентную чувствительность мозга. На функцию коры и ствола мозга влияет меньше, возможно — косвенно. В отличие от других СОА кетамин активирует опиатные и серотониновые рецепторы мозга.
Во время кетаминового наркоза сохраняется и может быть даже повышен мышечный тонус (что увеличивает выход К+ из мышц в плазму крови), сохраняются рефлексы с глотки и гортани, поэтому перед интубированием трахеи обязательно введение миорелаксантов. Но нужны только антидеполяризующие миорелаксанты; деполяризующие увеличивают выход К+ из скелетных мышц, что в сочетании с аналогичным эффектом кетамина может привести к опасной гиперкалиемии.
Кетамин нарушает обратный захват катехоламинов, повышая их концентрацию в синапсах и в плазме крови. В связи с этим у больных возрастает артериальное давление, сила и частота сердечных сокращений, ударный и минутный объем крови. Во время наркоза увеличивается мозговой кровоток, обмен веществ мозга: потребление кислорода, глюкозы, образование макроэргов. На функцию печени и почек обычно не влияет.
Кратковременность эффекта кетамина связана с его быстрой инактивацией в печени. Один из его метаболитов — норкетамин — вызывает анальгетический эффект. Анальгезия после кетаминового наркоза может продолжаться несколько (3-4) часов, что имеет большое значение для больных с ожогами и другими болезненными травмами. Снотворным и успокаивающим действием он не обладает. Напротив, после наркоза у больных возникает повышение возбудимости центральной нервной системы, могут быть бред, галлюцинации, нарушения сознания. Для профилактики этих явлений используют премедикаци-онные средства: дроперидол или сибазон. Последний предотвращает и сильные мышечные боли, связанные с напряжением мышц во время наркоза, и повы
114
шением уровня калия в плазме крови. Нарушения сознания устраняют физостигмином.
Пред и он (виадрил) — стероидное вещество, лишенное гормональных свойств и хорошо растворимое в воде. После внутривенного введения наркоз возникает через 3-5 мин и продолжается 1—3 ч (см. рис. 23). Применяют его в основном для базисного наркоза, так как он усиливает эффекты других СОА. Сам он вызывает неглубокое угнетение центральной нервной системы и недостаточную анальгезию, поэтому его сочетают с ингаляцией закиси азота или с наркотическими анальгетиками, которые усиливают вызываемое им угнетение центральной нервной системы.
С - СН2 - О - С - СН2 - СН2 - С - ONa
II II II
0 0 о
Рис. 23. Предион
Препарат вызывает расслабление скелетной мускулатуры, мышц глотки и гортани, предотвращает возникновение глоточных и гортанных рефлексов, расслабляет гладкую мускулатуру бронхов, желчевыводящих путей, мочеточников и’может быть использован для устранения их спазмов. Предион понижает возбудимость Р-адренорецепторов, может слегка ослабить сокращения сердца и предотвратить или устранить аритмию сердечных сокращений, вызванную другими СОА.
Недостатком предиона является его раздражающее влияние на эндотелий вен и опасность возникновения флебитов, образования тромбов. Для предотвращения этого осложнения после введения препарата через ту же иглу вводят либо изотонический раствор натрия хлорида, либо 0,25% раствор новокаина (промывают сосуд). Создан новый препарат предион Г с добавлением глицина, защищающего эндотелий вен от раздражения.
Предион может подавить психомоторное возбуждение и галлюцинации, поэтому иногда его используют для устранения этих явлений (например, при белой горячке).
.Альтезин — стероидный анестетик, представляющий собой смесь двух веществ (альфаксолона и альфадолона), нерастворимый в воде, выпускается в ампулах в виде эмульсии на кремафоре. После внутривенного введения наркоз наступает быстро и продолжается 20—30 мин. Широта его терапевтического действия больше, чем у любого другого СОА, включая ГОМК.
Применяют альтезин для вводного наркоза, переходя затем на другие СОА, но используют и в виде капельной инфузии, для поддержания наркоза. Его
115
рассматривают как один из лучших препаратов при травмах, ожогах, нейрохирургических и офтальмологических операциях, в акушерстве, у лиц с высоким хирургическим риском.
Га м ма-оксимасля ная кислота (ГОМК)'производное ГАМК (см. гл. 4, 11, 36). При внутривенном введении ГОМК вызывает наркоз через 7-10 мин, который продолжается 1—2 ч. Угнетение центральной нервной системы связано со специфическим воздействием на рецепторы ГАМК. Наибольшее их количество содержится в коре головного мозга, мозжечке, хвостатом ядре и паллидуме, значительно меньше — в стволе головного мозга, гипоталамусе и еше меньше в спинном мозге. Поэтому ГОМК преимущественно угнетает кору головного мозга. В небольших дозах она вызывает снотворный и успокаивающий эффекты. Препарат не нарушает дыхания, функцию сердечно-сосудистой системы, обменные процессы и обладает отчетливым антигипоксантным действием (см. гл. 36). Детям еще в палате его нередко вводят ректально, а в грудном возрасте и внутрь для успокоения ребенка, которого затем перевозят в операционный блок.
Пропофол (диприван) — маслянистая жидкость. Вводят его внутривенно в виде 1% эмульсий. Наркоз возникает быстро, на конце иглы. Для получения длительного эффекта его вводят внутривенно капельно. Во время наркоза происходит снижение артериального давления из-за ослабления периферического сопротивления сосудов. Сердечный выброс не меняется, аритмии обычно не возникает, не бывает и ишемии миокарда. У больного может быть угнетение и даже кратковременная остановка дыхания на 30 с; снижается минутный объем дыхания, реакция на углекислоту и гипоксию. Премедикация опиатами усиливает эти эффекты. Во время наркоза не нарушается кровоснабжение печени, почек, но церебральный кровоток уменьшается. Выход из состояния наркоза происходит быстрее, чем после тиопентала, скорее восстанавливается и мышление.
На месте введения может возникнуть боль, но без последующего развития флебита и тромбоза сосуда. В начале наркоза и при выходе из него у больного могут возникнуть судороги или непроизвольные движения.
Итак, в качестве СОА применяют разнообразные химические вещества, вызывающие внешне похожее угнетение центральной нервной системы, характеризующееся обратимой потерей сознания, чувствительности, рефлексов. Все это связано с нарушением проведения нервных импульсов в синапсах. Однако при характеристике эффектов отдельных препаратов было отмечено, что разные вещества угнетают центральную нервную систему неодинаково. Одни вызывают большой анальгетический эффект (закись азота, кетамин), другие — слабый (фторотан, циклопропан, тиопентал, ГОМК), одни вызывают интенсивное расслабление скелетных мышц (фторотан), а другие даже повышают их тонус (предион), одни достаточно равномерно угнетают разные отделы головного мозга (эфир, фторотан), другие преимущественно воздействуют на кору головного мозга (ГОМК), а третьи вызывают диссоциацию в активности таламокортикальных структур мозга (кетамин) и пр.
В связи с этим сейчас нет унитарной теории наркоза, единообразно объясняющей угнетение центральной нервной системы, вызываемое любым СОА.
Более или менее однотипно влияют на центральную нервную систему ингаляционные СОА, которые мо/ут функционировать как инертные, липидо-116
растворимые вещества, способные сорбироваться мембранами нейронов и их аксонов и накапливаться в них. Этим они изменяют физико-химические свойства фосфолипидов мембраны и нарушают проходимость ионных каналов, особенно натриевых, поскольку ион натрия интенсивно гидратирован. Калий, как менее гидратированный ион, легче проходит через ионные каналы из клетки, вызывая гиперполяризацию ее мембраны. В результате нарушается возникновение возбуждающего постсинаптического потенциала и потенциала действия, что и препятствует распространению возбуждения как по афферентным путям, например, в ретикулярной формации ствола мозга, так и по эфферентным путям из центральной нервной системы к скелетным мышцам и другим исполнительным органам и тканям.
Ингаляционные средства общей анестезии отчетливо нарушают и освобождение медиаторов из пресинаптических окончаний. Это связывают не только с их накоплением в фосфолипидном слое мембран аксонов, но и со способностью нарушать поступление в нервное окончание Са+* из внеклеточной среды. Известно, что СОА блокируют Н-холинорецепторы пресинаптических окончаний, возбуждение же этих рецепторов ассоциируется с открытием потенциалзависимых кальциевых каналов N-типа и возникновением тока Са++ внутрь аксона, что и приводит к освобождению из него нейромедиаторов. На изолированных PC-12 клетках (похожих на хромаффинные клетки мозгового вещества надпочечников и на клетки симпатических ганглиев) показано, что фторотан, изофлуран, энфлуран, метоксифлуран понижают взаимодействие Н-холинорецепторов с кальциевыми каналами N-типа в пресинаптических окончаниях4 и этим препятствуют поступлению в них Са++ и освобождению нейромедиатора, в данном случае норадреналина. На другие кальциевые каналы (а-и Т-типов), а также на М-холинорецепторы эти СОА не влияют.
Однако даже среди ингаляционных средств одной группы существуют различия. Так, в опытах in vitro на пирамидных нейронах гиппокампа крыс показано, что в 1 МАК (в минимальной анестизирующей концентрации), фторотан вызывают гиперполяризацию мембраны, сочетающуюся с повышенной проницаемостью ее для К+, энфлуран- вызывает гиперполяризацию, но сочетающуюся со снижением проницаемое!^ мембраны для К+, а изофлуран вызывает вариабельные эффекты.
Иными словами, полного понимания тонких механизмов действия даже ингаляционных СОА до сих пор еще нет.
Механизм действия неингаляционных средств общей анестезии еще сложнее. Липидорастворимость этих веществ объясняет лишь их фармакокинетику, легкое проникновение в мозг. Они не являются индифферентными веществами и активно влияют на проведение нервных импульсов.
Выявлено, что большинство СОА в терапевтических концентрациях усиливает эффект ГАМК, увеличивая возбуждение ГАМК-А — постсинаптических рецепторов и в связи с этим ток ионов хлора внутрь клетки и гиперполяризацию клеточных мембран нейронов. Исключением является кетамин, который относят к отчетливым антагонистам возбуждающей глутаминовой аминокислоты в центральной нервной системе: он блокирует один из рецепторов глутамата (НМДА) и этим угнетает центральную нервную систему.
117
ПРЕМЕДИКАЦИЯ
Учитывая возникновение разнообразных осложнений во время наркоза, перед наркотизированием больных вводят ряд лекарственных веществ для предотвращения этих осложнений.
Сибазон (седуксен, диазепам) назначают накануне операции на ночь (преимущественно старшим детям) и перед операцией. Вызываемое им успокоение сопровождается снижением уровня катехоламинов и кортикостероидов в плазме крови, что предотвращает нарушения деятельности сердца, углеводного обмена, повышение артериального давления и пр. Этот же препарат (или другие бензодиазепины) предотвращают психические расстройства и мышечные боли, возникающие при применении кетамина.
Мидазолам — бензодиазепин короткого действия, очень удобен в детской анестезиологии. Его можно ввести интраназально ребенку, сидящему на руках у родителя, внутрь или ректально, но тогда эффект возникнет позднее (от дозы 0,2 мг/кг при интраназальном, пероральном и ректальном введении успокоение возникает через 10, 53 и 30 мин соответственно). У ребенка возникает сонливость, вялость, безразличие, подавление эмоций, длящиеся около 30 мин. В таком состоянии ребенка транспортируют в предоперационную и готовят к операции.
Барбитураты — старшим детям иногда накануне операции на ночь назначают фенабарбитал или этаминал.
Атропин — обязательно вводят всем больным перед операцией для предотвращения вагальных рефлексов, секреции.
Димедрол, дипразин назначают для предотвращения эффектов гистамина, особенно у больных, страдающих аллергическими заболеваниями, а также при введении ребенку пропанидида, тубокурарина, морфина, повышающих освобождение гистамина из базофилов и тучных клеток. К тому же эти препараты предотвращают эффекты гистамина, освобождающегося из поврежденных тканей (например, у обожженных больных), а сами угнетают центральную нервную систему, способствуя угнетающему влиянию СОА на нее.
Клофелин все шире используют до, во время и после операции. Имеет значение его успокаивающее влияние на центральную нервную систему. Ребенок, особенно старшего возраста, подросток спокойнее направляется в операционную, без повышения уровня катехоламинов в крови и без подъема артериального давления. На фоне клофелина нужны меньшие концентрации или дозы СОА, что снижает опасность для больного. Препарат обладает выраженным анальгетическим действием, что тоже способствует анестезии, а после операции уменьшает болевые ощущения. Он понижает секрецию слюны, предотвращает повышение внутриглазного давления во время интубации трахеи, поддерживает артериальное давление на постоянном уровне (без подскоков во время болезненных манипуляций), поддерживает нормальный ритм сокращений сердца, предотвращая возникновение эпизодов и тахи- и брадикардии. Он повышает почечный кровоток, снижает освобождение антидиуретического гормона и реакцию на него, в результате увеличивается диурез, выведение различных шлаков и . введенных лекарственных средств. Наконец, снижая освобождение катехоламинов из надпочечников и их уровень в крови, клофелин предотвращает или устраняет озноб и дрожь в послеоперационном периоде, возникающие у значительного процента больных после операции. Это ослож
118
нение представляет опасность для больных с выполненной операцией на сердце, крупных сосудах, к тому же во время озноба и дрожи у больного интенсивно расходуется кислород, глюкоза, гликоген, нарушая этим метаболизм.
Клофелин увеличивает длительность действия наркотических анальгетиков (вероятно из-за угнетения цитохрома Р-450) и может повысить их концентрацию в крови ребенка. С одной стороны, это уменьшает расходование названных препаратов, но с другой (при невнимательности анестезиолога) — может привести к интоксикации больного. У гипертоников после введения клофелйна иногда отмечают явление отдачи — повышение артериального давления (см. гл. 2, 23).
Нейролептанальгезия (см. гл. 6), то есть совместное применение нейролептика (в основном дроперидола) и наркотического анальгетика (фентанила) очень часто используют для обезболивания больных, особенно с высоким хирургическим риском. Она создает своеобразное базовое угнетение центральной нервной системы, потенцирует эффективность СОА. Обычно на фоне нейролептанальгезии больному вводят миорелаксанты, интубируют трахею и приступают к вспомогательной или искусственной вентиляции легких с ингаляцией средств общей анестезии. Во время операции можно производить дополнительное вливание и фентанила, и дроперидола, лучше по отдельности, по мере необходимости для поддержания угнетения центральной нервной системы и анальгезии.
Во время нейролептанальзегии могут быть различные осложнения. Наиболее опасны резкая брадикардия и даже остановка сердца, что связывают либо с блокадой адренорецепторов миокарда (дроперидолом), либо с активацией блуждающего нерва (фентанилом). Для профилактики этого осложнения дроперидол надо вводить медленно, и перед проведением нейролептанальгезии вводить атропин. Фентанил может вызвать ригидность дыхательной мускулатуры, нарушающую нормальную вентиляцию легких. Для предотвращения этого явления больному вводят миорелаксанты, интубируют трахею и переводят его на вспомогательное или искусственное дыхание. Дроперидол может спровоцировать экстрапирамидные расстройства; введение аминазина предотвращает это явление. После операции могут быть озноб с доожью, их устраняют клофелином или комбинацией дипразина с промедолом.
Дозы средств общей анестезии даны в табл. 20.
Таблица 20
Средства для наркоза
Препарат Лекарственная форма Путь введения Однократная доза
Тиопентал-натрий Thiopentalum-natrium Порошок во флаконах по 0,5 и 1 г Внутривенно (приготовляют 2% или 10% раствор на изотоническом растворе натрия хлорида или дважды дистиллированной воде) Для вводного наркоза 7—10 мг/кг в виде 2% раствора Для наркоза 30—35 мг/кг в виде 10% раствора
Гексенал Hexenalum Порошок во флаконах по 1 г Внутривенно (приготовляют 2% или 10% раствор на изотоническом растворе хлорида натрия) То же
119
Окончание табл. 20
Препарат Лекарственная форма Путь введения Однократная доза
Пропанидид Propanididum 5% раствор в ампулах по 10 мл Внутривенно, содержимое ампулы разводят вдвое до 2,5% раствора изотоническим раствором натрия хлорида 6-10 мг/кг; для истощенных больных 3-4 мг/кг
Пред ион для инъекции Predionum pro injectionibus Порошок во флаконах по 0,5 г Внутривенно (приготовляют 5% раствор, растворив содержимое в 10 мл 5% раствора глюкозы или изотонического раствора натрия хлорида) Для вводного наркоза 10—12 мг/кг; для моно- и базисного наркоза 15—20 мг/кг
Кетамин Ketaminum 1% раствор во флаконах по 20 мл и 5% раствор во флаконах по 10 мл Внутривенно Внутримышечно 2 мг/кг 6 мг/кг
Натрия окси-бурат Natrii oxybutiras 20% раствор в ампулах по 10 мл ВнутривейИо Для вводного наркоза 100-120 мг/кг
Пропофол Propofolum 1 % эмульсия в ампулах по 20 мл Внутривенно По 0,6 мг/кг каждые 10 с до возникновения наркоза; суммарная доза 2—2,5 мг/кг. Для поддержания наркоза 4—12 мг/кг/час
Глава 9 СПИРТ ЭТИЛОВЫЙ
Этиловый спирт (этанол, этиловый алкоголь) является веществом, угнетающим центральную нервную систему. Это бесцветная летучая жидкость с резким запахом и жгучим вкусом.
Этанол — хороший растворитель и консервант, поэтому его используют для приготовления настоек и экстрактов.
В организме содержатся небольшие количества эндогенного алкоголя; в крови его концентрация колеблется от 0,004 до 0,01%.
В медицинской практике его используют для получения местного, резорбтивного и, отчасти, рефлекторйого эффектов.
При местном применении этанол обладает антисептическими, свойствами, вызывая денатурацию белков цитоплазмы микробных клеток. Поэтому его используют для обработки рук хирурга перед операцией, обеззараживания кожи операционного поля, стерилизации инструментов.
При местном же применении проявляется раздражающее действие алкоголя, что используют для обтираний и компрессов. О назначении этанола при отеке легких см. гл. 18. При приеме внутрь происходит раздражение слизистых оболочек желудка, что может рефлекторно вызвать рвоту. У детей, не привыкших к этанолу, прием крепких спиртных напитков легко вызывает спазм пилорического сфинктера.
120
Некоторые спиртные напитки (аперитивы, столовые и десертные вина) стимулируют вкусовые рецепторы языка и их назначают больным для повышения аппетита.
При приеме внутрь реализуется резорбтивное действие этанола. Он хорошо всасывается из ЖКТ. Начинается его всасывание в полости рта и пищеводе, около 20% всасывается в желудке и 80% в двенадцатиперстной кишке.
Быстрота всасывания зависит от крепости напитка: быстрее всасываются слабые (10%) растворы, более крепкие (около 40%) всасываются медленнее из-за дубящего действия спирта на слизистую, местного сужения сосудов и нарушения эвакуации. Если желудок до приема спирта был наполнен пищей (особенно обволакивающей слизистую: картофель, масло, сметана, каши) всасывание значительно замедляется.
Из крови этанол очень быстро путем пассивной диффузии проникает во все ткани и жидкие среды организма. При уменьшении концентрации в крови он диффундирует из тканей обратно в кровь. Из сосудов легких этанол проникает в альвеолы и выдыхаемый воздух. Соотношение концентрации алкоголя в крови и альвеолярном воздухе является постоянным и составляет около 2100:1.
Этанол обладает выраженной органотропностью: в мозгу его концентрация превосходит содержание в крови (мозг насыщен алкоголем даже в фазе его элиминации), этанол концентрируется также в секрете простаты, в яичках и сперме, оказывая токсическое влияние на половые клетки. Он прекрасно проникает через плаценту, выводится с молоком.
Резорбтивное действие этанола проявляется в угнетении центральной нервной системы, выраженность которого зависит от концентрации, дозы этанола. При использовании небольших доз возникает стадия возбуждения, являющаяся следствием ослабления процессов торможения. Она длится долго и характеризуется нарушением психомоторных реакций, развитием эйфории, снижением самоконтроля и работоспособности. Уже после приема небольших доз алкоголя происходит угнетение сосудодвигательного центра, приводящее к расширению сосудов кожи.
Этанол обладает умеренной анальгезирующей способностью, уменьшает остроту восприятия стрессорных факторов, снижает чувство страха. Он обладает высокой калорийностью: при сгорании в <^>ганизме 100 г этанола выделяется 710 Ккал. В критических случаях больным, находящимся на парентеральном питании, его вливают внутривенно (50-70 г в сутки). Это, вместе с отмеченными резорбтивными эффектами, служит причиной включения его в некоторые противошоковые жидкости.
Прием этанола с целью повышения устойчивости к холоду не может быть оправдан: под влиянием алкоголя возрастает теплопродукция, но одновременно возрастает теплоотдача. Расширение кожных сосудов создает ложное ощущение тепла, но растет его потеря за счет радиации и потоотделения. Опьяневшие дети погибают от переохлаждения даже при температуре воздуха +2 —5°С.
Этанол угнетает секрецию антидиуретического гормона и окситоцина, вызывая увеличение диуреза и снижение сокращений беременной матки. Последнее иногда используют для прекращения преждевременных родов. Терапевтический эффект — прекращение родовой деятельности — возникает у 80% женщин. При отсутствии этого эффекта этанол, проникший через плаценту, у родившегося недоношенного ребенка может вызвать угнетение центральной нервной системы.
121
Элиминация этанола осуществляется путем экскреции в неизмененном виде и путем биотрансформации. В неизмененном виде он удаляется легкими, почками и молочной железой (в небольшом количестве) и потовыми железами. Биотрансформация в основном протекает в печени и отчасти в других тканях.
Обнаружено три основных варианта начального этапа биотрансформации этанола.
1. Окисление в цитозоле гепатоцитов с помощью специфического фермента алкогольдегидрогеназы (АДГ) в присутствии НАД до ацетальдегида:
АДГ
С2Н5ОН + 2НАД -> С2Н4О + 2НАДН.
Этот путь играет решающую роль у здоровых людей, так как он метаболизирует 70-80% принятого этанола.
2. Окисление с помощью неспецифической окисляющей системы микросом печени с участием цитохрома Р-450.
3. Окисление с помощью катат^зы, оксидаз и пероксидаз тканей. По этому пути обычно биотрансформируется до 15% алкоголя, но у больных алкоголизмом людей его роль возрастает.
Завершающим этапом биотрансформации ацетальдегида является его превращение под влиянием ацетальдегиддегидрогеназы (ААД) в ацетат, который при участии ацетил-КоА окисляется до углекислоты и воды:
ААД ацетил-КоА
С2Н4О —> ацетат -> СО2 + Н2О + энергия.
Этанол подвергается метаболизму с постоянной скоростью, не зависящей от его концентрации в крови, но пропорционально массе тела и, вероятно, массе печени.
В течение часа у человека со средней массой тела метаболизируется около 10 г абсолютного алкоголя.
При острой интоксикации этанолом изменение функций центральной нервной системы и других органов человека является следствием воздействия на организм не столько самого алкоголя, столько его основного метаболита — ацетальдегида. Ацетальдегид увеличивает освобождение из адренергических окончаний катехоламинов, которые повышают тонус резистивных сосудов (артерий мышечного типа, артериол), вызывают тахикардию, повышают потребность миокарда и других тканей в кислороде. Показано, что ацетальдегид способен конденсироваться с некоторыми катехоламинами, в частности с дофамином, с образованием тетрагидроизохинолинов (ТГИХ). Один из ТГИХ — сальсолинол, вызывает галлюцинации, приводит к абстиненции. Конденсация ацетальдегида с серотонином приводит к образованию гармалина — ингибитора МАО, тоже являющегося сильным галлюциногеном. Интенсивное окисление этанола ведет к накоплению НАДН, НАДФН, которые могут изменить обмен катехоламинов с образованием ТГИХ, накапливающихся в нейронах мозга и действующих по типу ложных медиаторов, заменяющих катехоламины. ТГИХ способствуют высвобождению эндорфинов и сами могут активировать опиатные рецепторы, оказывая влияние на психику. Ацетальдегид нарушает функции 122
печени, тормозя элиминацию продуктов метаболизма. Ацетальдегид тормозит окислительно-восстановительные реакции, угнетая этим окисление других веществ. В плазме крови накапливаются жирные кислоты, глицерин, пировиноградная кислота. Все это способствует накоплению кислых метаболитов, развитию метаболического ацитоза, отека легких. Часто отмечают гипокальциемию и гипогликемию, которые могут стать причиной судорог. Этанол оказывает капилляротоксический эффект, повышает агрегацию тромбоцитов. Ацетальдегид угнетает сократительную функцию миокарда.
Лечение острого отравления начинают с удаления этанола из желудка. При сохранении сознания назначают рвотные (сироп рвотного корня, раствор поваренной соли, у детей старше 5 лет — апоморфин). При отсутствии сознания, а также у детей раннего возраста промывают желудок с последующим назначением активированного угля и солевого слабительного. Слабительное не только ускоряет выведение этанола, но и препятствует его' всасыванию. Для купирования ацидоза вводят натрия гидрокарбонат; для устранения гипогликемии — растворы глюкозы или фруктозы. При нарушении дыхания назначают ИВЛ с дополнением кислорода. Назначение аналептиков не считается оправданным из-за большого числа осложнений. Для поддержания функции сердечно-сосудистой системы назначают сердечные гликозиды, плазмозаменители. Если функция почек сохранена и нет признаков сердечной недостаточности и отека легких, может быть применен форсированный диурез. Применение фуросемида и маннита полезно также с целью уменьшения гидратации мозга. Проводят активную витаминизацию препаратами витаминов группы В (Вь В5, В6, В12), С и Е. Обязательно назначают обильное питье или вливание жидкостей.
При повторных приемах этанола может развиться физическая и психическая зависимость — алкоголизм, вариант наркомании. ч ;
Возникновение алкоголизма связано с изменением активности нейромедиаторных систем, особенно серотонинергической (в гипоталамусе снижается содержание серотонина). Адренергическая система принимает активное участие в формировании влечения к алкоголю на всех его стадиях. С помощью этой системы возникает эйфория, а также потребность к употреблению больших доз этанола. Снижается активность фермента холинэстеразы, осуществляющей разрушение ацетилхолина. При употреблении алкоголя происходит быстрая перестройка дофаминергической системы более высокий уровень функционирования. При прекращении приема алкоголя повышение активности дофаминергической системы проявляется вегетативными расстройствами, участвуя в формировании абстинентного синдрома.
При алкоголизме возникает диспропорция нейропептидов в таламусе и стриатуме. Дефицит метэнкефалина приводит к появлению симптомов дискомфорта. Прием этанола устраняет диспропорцию нейропептидов за счет увеличения содержания метэнкефалина, но при хроническом употреблении этанола он теряет коррегирующие свойства.
Как и в генезе острого алкогольного отравления, в возникновении алкоголизма большую роль играет ацетальдегид. Он вступает в реакции конденсации с биогенными аминами — катехоламинами и серотонином^ образуя тетрагидроизохинолины (ТГИХ) и тетрагидробетакарболины (ТБК) соответственно.
ТГИХ и ТБК способны вступать во взаимодействие с опиатными рецепторами, вызывая эйфорию и галлюцинации, являясь одной из причин возникновения зависимости к этанолу. Происходит ингибирование ортометилтран-сферазы и моноаминоксидазы мозга, блокада захвата дофамина и норадрена
123
лина нервной тканью. Отмечается также снижение числа p-адренорецепторов. В результате изменения активности моноаминов в мозговой ткани может возникнуть дисфункция центральной нервной системы, наиболее тяжелой формой которой является белая горячка (спутанность сознания, бред, галлюцинации, бессонница), деградация личности.
В формировании абстинентного состояния на фоне отмены приема алкоголя большое значение имеет сочетание функциональной слабости ГАМК-ергичес-кой системы, что подтверждается снятием симптомов абстиненции ГАМК-по-зитивными препаратами: фенибутом, пирацетамом, с повышенной активностью глутаматергической системы.
Постоянное употребление алкоголя приводит к нарушению функции многих внутренних органов и тканей. Вследствие влияния на фосфолипиды клеточных мембран возрастает процент насыщенных жирных кислот при одновременном уменьшении ненасыщенных, особенно фосфатидиевой и арахидоновой кислот (источники простагландинов). Из-за снижения числа протекторных простагландинов, отвечающих за синтез муцина слизистой оболочкой, и прямого раздражающего действия этанола на слизистую желудка развивается гастрит. Кроме того, 15-20% растворы канола резко стимулируют секрецию НО, повышают высвобождение гистамина и гастрина. Нарушение активности многих ферментных систем желудка и кишечника приводит к ухудшению пищеварения, усвоению витаминов (особенно фолиевой кислоты, тиамина, цианокобаламина, токоферола). Под влиянием алкоголя страдает функция поджелудочной железы, вначале эндокринная (скрытый диабет), в дальнейшем часто развивается каль-кулезный панкреатит. У алкоголиков нередко встречается хронический панкреатит. Неблагоприятное действие этанол оказывает на печень. Нарушаются процессы окисления, в том числе и восстановленного никотинамидаденинди-нуклеотида, в результате чего происходит его накопление. Это направляет утилизацию ацетил-КоА на синтез жирных кислот, а не холестерина (являющегося предшественником глюкокортикоидов и половых гормонов) и не в цикл трикарбоновых кислот. Жирные кислоты накапливаются в гепатоцитах и стеатоз обнаруживают у 60—80% алкоголиков. Со стеатоза гепатоцитов начинается повреждение печени, затем развивается алкогольный гепатит (у 30-50% алкоголиков), приводящий, часто в сочетании с вирусной инфекцией (вирусы гепатита), у многих больных к циррозу печени. Острый алкогольный гепатит плохо поддается лечению и летальность от него составляет 5—20%. Из-за ограничения синтеза холестерина уменьшается синтез половых гормонов и глюкокортикоидов, что отрицательно сказывается на жизнедеятельности организма.
Особенно страдает головной мозг. Уже через 10 дней приема этанола у экспериментальных животных отмечают массовую гибель нейронов. Для алко-. голиков характерно нарушение структуры сна: удлинение периода засыпания, уменьшение фазы медленноволнового сна, уменьшение общей продолжительности сна. Длительный прием этанола снижает остроту зрения и нарушает координацию движения. Удлиняется время реакции на зрительные и слуховые раздражители. У больных с повышенной судорожной готовностью этанол может спровоцировать судороги. Нередко развивается алкогольный амнестический синдром (корсаковский синдром) — необратимые нарушения краткосрочной памяти при отсутствии поражения сенсорной сферы или алкогольная энцефа
124
лопатия (синдром Вернике) — неврологическое заболевание, сопровождающееся атаксией, офтальмоплегией, нистагмом и спутанностью сознания. Оба заболевания иногда объединяются под названием «синдром Вернике-Корсакова». На ранней стадии этого заболевания быстрый эффект оказывают большие дозы парентерально вводимого тиамина, который способствует предупреждению прогрессирования болезни.
При алкоголизме поражаются сосуды, нарушается кровоснабжение органов, особенно сердца. Капилляротоксический эффект сопровождается повышением агрегации тромбоцитов и эритроцитов, нарушением микроциркуляции, особенно в тех органах, где создаются наибольшие концентрации алкоголя (мозг, миокард). Этанол оказывает и прямое токсическое действие на сердце, снижая активность дегидрогеназ, цитохромоксидазы, количество АТФ, КФ, гликогена; вызывая торможение реакций гликолитической цепи до блока, что напоминает авитаминоз В1; активности АТФазы, способности саркоплазматического ретикулума и митохондрий связывать кальций.
Этанол поражает почки, эндокринные железы, особенно половые. Он нарушает и функцию гипоталамо-гипофизарно-гонадной системы. В результате уменьшается синтез тестостерона, увеличивается секреция пролактина; происходит ускоренное превращение тестостерона в эстерон. Пролактин тормозит секрецию гонадотропинов. Все это приводит к гипогонадизму, фиминизации мужского организма, импотенции, бесплодию. Этанол может провоцировать застойные явления в предстательной железе.
Употребление этанола до, во время зачатия или в период беременности может нарушить нормальное развитие плода, привести к рождению психически и физически неполноценного ребенка с врожденными пороками развития. Тератогенное действие отмечают даже при использовании небольших количеств алкоголя (от 1 до 3 г в день).
У детей алкоголиков отмечают худшие способности к обучению и запоминанию, нарушенное поведение: гиперактивность, снижение концентрации внимания, раздражительность, драчливость. Пренатальное действие этанола резко увеличивает гибель потомства, уменьшает массу плода, мозга. Отмечаются множественные пороки развития: микрофтальмия, косоглазие, аномалии грудной клетки, пороки развития сердца, генитально-анальные нарушения и пр.
При приеме алкоголя не следует применять лекарственные средства, угнетающие центральную нервную систему (барбитураты, нейролептики и др.), они усиливают действие друг друга, что может привести к развитию тяжелых осложнений.
Лечение алкоголизма проводится в специализированных лечебных заведениях врачами-наркологами. Обязательно используются методы дието-, психо-и фармакотерапии.
При абстинентном синдроме — большие дозы витаминопрепаратов С и В (особенно тиамина). Для детоксикации и снятия явлений абстиненции применяют хлордиазепоксид (хлозепид) или диазепам (сибазон) — при угрозе развития белой горячки. Лоразепам — для больных с тяжелым заболеванием печени. Анаприлин (пропранолол}, атенолол — при синусовой тахикардии. Клонидйн (клофелин) для устранения симптомов вегетативной дисфункции (тремора, тахикардии, гипертензии).
125
Для лечения алкоголизма используют дисульфирам (тетурам), который угнетает АДГ и вызывает повышение концентрации ацетальдегида в крови с последующей интоксикацией. Прием алкогольного напитка в течение 12 ч после дисульфирама вызывает тяжелую реакцию, продолжающуюся 1—3 ч: чувство прилива к голове, расширение сосудов кожи лица и шеи, головную боль, тахикардию, затруднение дыхания, потоотделение, тошноту, рвоту, может развиться коллапс. Назначив алкоголь на фоне действия тетурама, вырабатывают отрицательный условный рефлекс на вкус и запах алкоголя.
Кроме того, препарат ингибирует дофамин-бета-оксидазу и таким образом нарушает синтез норадреналина, что в свою очередь вызывает дефицит катехоламинов. Испытав такое состояние, человек боится употреблять этанол на фоне тетурама.
Тетурам из ЖКТ всасывается медленно и не полностью. Отмечается его кумуляция, так как он разрушается медленно. Назначать его можно только взрослым и людям не старше 60 лет, не имеющим серьезной сердечно-сосудистой патологии, заболеваний печени, почек, эндокринных желез и других органов, он противопоказан при беременности и психических заболеваниях.
Из побочных эффектов тетурама выделяют: слабость, тошноту, судороги, утомляемость, металлический вкус во рту. Иногда отмечают потерю сознания.
Широкое применение нашел препарат эспераль, представляющий собой стерильные таблетки тетурама для имплантации. С его помощью в организме создается депо тетурама, обеспечивающее ровную постоянную сенсибилизацию к этанолу, исключаются пропуски в приеме препарата. Общая доза тетурама оказывается минимальной, а сенсибилизирующий эффект — стойким (до года). Прием этанола на фоне лечения эспералем может иногда привести к смерти. Тетурам усиливает эффект антикоагулянтов и препаратов, угнетающих нервную систему. При одновременном приеме тетурама и изониазида повышается вероятность развития центральных эффектов, например, головокружения, нарушения координации движения, бессонницы. Прием метронидазола на фоне лечения тетурамом или в течение двух недель после него может привести к развитию психотических реакций.
Более мягким действием, чем тетурам, обладает кальция карбамид, способный обратимо блокировать ацетальдегиддегидрогеназу.
Для уменьшения потребности в алкоголе и устранения его тонизирующего действия применяют антагонисты наркотических анальгетиков (налтрексон и др.).
Лекарственная терапия алкоголизма не всегда достаточно эффективна, так как в основном построена на страхе и не затрагивает главного — подавления влечения к этанолу и развития абстинентного синдрома. Препараты, используемые для лечения алкоголизма приведены в табл. 21.
Таблица 21
Средства для лечения алкоголизма
Препарат Форма выпуска Доза
Тетурам Teturamum Таблетки по 0,1 г и 0,15 г 0,26-0,5 г/сут
Циамид Cyamidum Таблетки по 0,1 г 0,05 г/сут
126
Глава 10 СНОТВОРНЫЕ СРЕДСТВА
Снотворные средства — вещества, способствующие зйсыпанию, нормализующие длительность и глубину сна при его нарушении, не связанном с соматической патологией.
Сон необходим для человека. Существует много факторов, регулирующих естественный сон, но наиболее важным из них являются биологические часы — суточный ритм.
Выделяют в структуре сна две фазы — медленноволнового (переднемозгового) и б'ыстроволнового (заднемозгового, парадоксального) сна, которые характеризуются соответственно медленными и быстрыми волнами на ЭЭГ. Они сменяют друг друга несколько раз во время ночного сна. Всего фаза медленноволнового сна составляет 75—80%, а быстроволнового 20—25% от обшей продолжительности сна. У детей первых месяцев жизни фаза быстроволнового сна несколько больше. Во время медленноволнового сна глазные яблоки неподвижны, мышечный тонус сохранен, мышцы подчелюстной области напряжены, наблюдается повышение секреции гормона роста. Вероятными медиаторами, отвечающими за возникновение медленноволнового сна, являются ГАМК, серотонин и пептид «дельта сна». Во время парадоксального сна отмечают быстрое движение глазных яблок, расслабление мышц, артериальное давление повышено или нестабильно, может быть тахикардия. Полагают, что парадоксальный сон необходим для ассоциативных процессов и консолидации памяти. В возникновении быстроволнового сна существенную роль играют катехоламины (преимущественно норадреналин) и ацетилхолин.
Дефицит медленноволнового сна вызывает чувство хронической усталости, тревоги, снижение умственной работоспособности, двигательную неуравновешенность. Недостаточность парадоксального сна может стать причиной повышенной возбудимости у детей, неврозов.
Согласно статистике от 20 до 40% всего населения промышленноразвитых стран страдает теми или иными формами нарушения сна.
Различают несколько причин нарушений сна: физиологические — из-за нарушений нормального биоритма (ночные дежурства, перелет в другой часовой пояс); психологические — из-за повышенного беспокойства, положительных или отрицательных эмоций, напряженной умственной деятельности в течении дня, особенно вечером; патологические — из-за страха, депрессии, бреда, галлюцинаций; фармакологические — из-за употребления лекарственных средств, повышающих возбудимость центральной нервной системы (кофеина, теофилина, этимизола); специальных синдромов — ночные апноэ, насильственные движения конечностей и пр.; идиопатические — без видимых причин.
Виды нарушений сна тоже могут быть различными: пресомНические, когда нарушен только процесс засыпания; интрасомнические, когда у человека поверхностный сон, частые пробуждения, чувство непрекращаюшейся умственной деятельности; постсомнические — раннее пробуждение, возможная последующая сонливость.
При назначении снотворных средств надо учитывать эти причины и виды нарушений сна и в соответствии с ними подбирать методы профилактики й при необходимости выбирать соответствующий препарат.
Хорошее снотворное должно действовать быстро, вызывать достаточно глубокий и продолжительный сон (6—8 ч), не нарушая его структуру; у препарата должна быть достаточная широта терапевтического действия, чтобы при пере
127
дозировке и при намеренном приеме высоких доз препарата (при суицидной попытке) не развилось тяжелое отравление. При применении препарата не должно быть тяжелых нежелательных эффектов, кумуляции, привыкания, психической и физической зависимости (наркомании).
Различают три поколения снотворных средств.
К первому поколению относят большую группу средств различного химического строения.
Из препаратов первого поколения в основном используются барбитураты, практически первые высокоактивные снотворные средства.
Барбитуровая кислота — продукт конденсации мочевины и малоновой кислоты, представляет собой шестичленное кольцо (см. табл. 22). Снотворными свойствами обладают ее производные, полученные путем замены атомов водорода у углерода в пятом положении на различные радикалы: арильные (кольцевой структуры), алкильные (линейной структуры). Натриевые соли этих препаратов хорошо растворимы в воде, растворимость же в липидах различная в зависимости от степени полярности включенных в молекулу радикалов, она определяет скорость возникновения и длительность эффекта барбитуратов.
Таблица 22
Барбитуровая кислота
Название препарата R1 R2 R3
Барбитал -С2Н5 -С2Н5 • -
Фенобарбитал -С2Н5 -
Барбамил -С2Н5 - СН2 - СН2 - СН < СНз Na
Этаминал Na -С2Н5 - СН —СН2 - СН2 - СНз СНз Na
Циклобарбитал -С2Н5 -
Барбитураты делят на три группы в зависимости от скорости наступления эффекта и его длительности: барбитураты длительного действия (фенобар
128
битал, барбитал), средней продолжительности (барбамил, этаминал, циклобарбитал), ультракороткого действия (гексе^ал, тиопентал). В качестве снотворных применяются первые две группы барбитуратов.
Барбитураты в зависимости от дозы могут вызвать угнетение центральной нервной системы разной глубины: от легкого седативного, снотворного эффекта до состояния наркоза. Терапевтическая широта их действия невелика — прием 3-4 таблеток может вызвать тяжелое угнетение центральной нервной системы.
Вызываемое барбитуратами угнетение центральной нервной системы является следствием нарушения синаптической передачи импульса, отчасти из-за активирования системы тормозного медиатора — ГАМК, а также из-за угнетения освобождения ацетилхолина из пресинаптических окончаний. Раньше других структур головного мозга барбитураты угнетают ретикулярную формацию ствола головного мозга, в которой импульсы передаются по полисимпатическим путям, подавляют ее активирующее влияние на кору головного мозга, что и вызывает гипноседативный эффект.
Барбитураты нарушают нормальную структуру сна, подавляя быстроволновую его фазу. Поэтому при длительном применении могут появиться признаки ее недостаточности: неврозы, раздражительность и даже психозы. Вместе с тем укорочение парадоксальной фазы иногда используют у больных с заболеваниями сердечно-сосудистой системы для предотвращения возникновения аритмий, спазма коронарных сосудов, подъема артериального давления во время сна.
При приеме барбитуратов длительного действия снотворный эффект возникает через 30—60 мин и длится 8 ч и более; при приеме препаратов средней продолжительности действия эффект развивается через 10-20 мин и длится 4-6 ч. После пробуждения у человека может сохраняться сонливость, нарушающая физическую и умственную работоспособность в течении дня.
При длительном применении барбитуратов у некоторых больных могут возникнуть привыкание (для получения снотворного эффекта придется назначать не одну, а 2-3 таблетки), а также психическая и физическая зависимость (наркомания). Поэтому барбитураты используются все реже, особенно у детей и подростков с лабильной психикой.
Барбитураты применяют в качестве противоэпилептических и противосудорожных средств, для понижения возбудимости центральной нервной системы при неврозах, вегетососудистой дистонии, а также для премедикации перед хирургическими операциями.
Барбитураты, в основном фенобарбитал, назначают для профилактики и лечения гипербилирубинемии у новорожденных, так как они стимулируют образование ферментов печени (цитрохромов Р-450, глюкуронилтрансферазы), участвующих в обезвреживании эндогенных и экзогенных веществ. Отмечено, что по этой же причине фенобарбитал, назначенный в конце беременности матери или вскоре после рождения ребенку, снижает уровень андрогенов в плазме крови мужских плодов и новорожденных мальчиков, нарушая этим последующее развитие гипоталамо-гипофизарно-гонадной системы, что может сказаться отрицательно на половом созревании,и половой активности у юноши и мужчины.
При применении барбитуратов могут быть многочисленные нежелательные эффекты: вялость, сонливость, головная боль, быстрая утомляемость, у некоторых больных, напротив, психомоторное возбуждение. У отдельных больных могут быть тошнота, рвота, диарея, аллергические реакции в виде крапивницы, генерализованной эритемы, макулезной сыпи и эксфолиативного дерматита. Следует заметить, что в связи с ускоренным метаболизмом в печени фолиевой
5 Зак. 3856
129
кислоты, витаминов D и К длительный прием барбитуратов может привести к возникновению мегалобластической анемии, нейтропении, тромбоцитопении, рахитоподобной остеопатии и геморрагиям. Они могут спровоцировать почечную порфирию.
Отравление барбитуратами возникает при случайной или- преднамеренной (при попытке к самоубийству) передозировке. Клиническая картина характеризуется угнетением функций центральной нервной системы: сначала вялость, сонливость, быстро переходящие в коматозное состояние по типу наркоза. Часто отравление барбитуратами сопровождается патологией органов дыхания (ателектазы, отек легкого) или почек (острое «закрытие» почки). Смерть чаще всего наступает от паралича структур головного мозга, регулирующих дыхание и сосудодвигательную функцию. Лечение начинают с промывания желудка у больного без сознания после интубирования трахеи, введения активированного угля, форсирования диуреза. При коматозном состоянии больного переводят на И ВЛ, так как кислородное голодание усиливает депрессивное действие барбитуратов.
Глютатемид. Быстро всасывается из ЖКТ и полностью биотрансформи-руется в печени. Снотворный эффект проявляется через 30 мин после приема и может продолжаться до 10 ч. Механизм действия подобен таковому у барбитуратов.
Хлоралгидрат в настоящее время применяется крайне редко. В организме он в значительной степени превращается в трихлорэтанол, обладающий гипноседативным действием. Хлоралгидрат вводят в клизмах в разбавленном виде с обволакивающими веществами для предотвращения раздражения слизистой оболочки кишечника. Препарат быстро всасывается. Он ускоряет наступление сна (через 10 мин), но существенно не влияет на его продолжительность и структуру. Трихлорэтанол конъюгирует с глюкуроновой кислотой и выводится с мочой в форме урохлораловой кислоты, однако частично он превращается в трихлоруксусную кислоту, которая способна накапливаться в печени и миокарде, вызывая нарушение их структуры и функции.
В качестве активатора ГАМ К-рецепторов используется натрия-оксибу-тират. Препарат хорошо всасывается при любом способе введения. Длительность действия от 3 до 8 ч. Особенностью действия препарата является удлинение медленноволнового сна при неизмененном быстроволновом. К этой же группе относится и фенибут. Он увеличивает скорость засыпания, продолжительность фазы глубокого сна, сокращает число и длительность пробуждений во время сна и не меняет общей структуры сна.
Метаквалон — производное хинозолинона. Его принимают внутрь, поскольку он хорошо всасывается. Сон наступает через 15—30 мин и продолжается 6-8 ч. Препарат обладает также противокашлевым, противосудорожным, небольшим местноанастезирующим и спазмолитическим действиями. Усиливает эффекты барбитуратов и анальгетиков. Подвергается биотрансформации в печени. Применяют метаквалон при нарушении сна различной этиологии, в том числе при бессоннице, связанной с острыми и хроническими заболеваниями. При передозировке возможно развитие коматозного состояния, угнетение дыхания, судороги.
Бромизовал оказывает седативное и умеренное снотворное действие. Хорошо переносится. Детям его назначают при бессоннице, хорее и коклюше. Снотворное действие усиливается при одновременном назначении амидопирина.
Детям наиболее часто применяют бензодиазепины — снотворные 2-го поколения, так как они в наименьшей степени нарушают структуру сна, не 130
укорачивая его быстроволновую фазу (ем. табл. 23). Бензодиазепины облегчают засыпание, в частности, за счет своего противотревожного действия. Их фармакодинамика связана с тем, что они активируют бензодиазепиновые рецепторы, являющиеся модулирующим фрагментом рецептора ГАМК, сопряженного с ионофором хлора. Активация бензодиазепиновых рецепторов облегчает связывание ГАМК с ее рецептором, раскрытие хлорных каналов, торможение нейронов, участвующих в формировании эмоций человека.
В качестве снотворных используют бензодиазепины средней продолжительности действия: нитразепам, феназепам, сибазон, флуразепам; бензодиазепины короткого действия: тр и азолам, мидазолам.
Наиболее часто применяемым Препаратом является нитразепам (эунок-тин, радедорм, могадон), эффект которого проявляется через 20-40 мин и длится 6-8 ч. Пробуждение после приема данного препарата легкое, но больные нередко жалуются на вялость, мышечную слабость, головную боль, головокружение. К нитразепаму может возникнуть толерантность, но физическая и психическая зависимость бывает редко. Отмена длительно применявшегося препарата может вызвать симптомы лишения: раздражительность, потливость, страх, нервозность, нарушение засыпания. Поэтому отмену нужно проводить постепенно.
В России очень перспективны, правда пока редко применяемые, бензодиазепины короткого действия; триазолам, мидазолам, эффект которых развивается через 10—20 мин и длится 2—3 ч. В основном их назначают при нарушении засыпания. Прием этих препаратов практически не сопровождается возникновением нежелательных эффектов.
В настоящее время часто используют комбинацию сибазона и циклобарбитала — реладорм, действие которого начинается через 5-10 мин и длится 6-8 ч. При приеме данного препарата к, нему может возникнуть физическая и психическая зависимость (табл. 23).
Таблица 23
Сравнительная характеристика барбитуратов и бензодиазепинов
Барбитураты Бензодиазепины
Трудное пробуждение Нарушают физиологическую структуру сна (укорачивают быстроволновой сон) Выраженное влияние на обмен веществ (образование энзимов в печени) Высокий риск возникновения физической зависимости Высокая опасность передозировки Легйбе пробуждение Очень небольшое влияние на структуру сна Очень небольшое влияние на обмен веществ Небольшой риск Меньшая опасность передозировки
К снотворным 3-го поколения относят производные циклопирролондв й 1-триптофана. Производными ццклопирролонов являются зо пи клон (имо-ван) и золпидем (и в а д а л). Их относят к группе бензодиазепиноподобных препаратов, действующих атипично или избирательно на. бензодиазепиновые рецепторы. Оба препарата действуют быстро (в течении 10 мин), но кратковременно (2—3 ч), у них не отмечают седативных последствий в дневное время;
131
риск развития синдрома отмены и лекарственной зависимости минимален. Но их назначают детям старше 15 лет.
1-Триптофан — предшественник серотонина. Он способствует засыпанию, возникновению сна нормальной глубины и продолжительности без нарушений его структуры. У препарата большая терапевтическая широта действия, нежелательных эффектов не обнаружено. Однако он пока не нашел широкого применения, и о его эффективности и безопасности для детей практически ничего не известно.
Дозы снотворных даны в табл. 24.
Таблица 24
Форма выпуска и дозы снотворных средств
Препарат Форма выпуска Доза
Барбитал Barbitalum Таблетки по 0,25 г 0,025-0,25 г
Фенобарбитал Phenobarbitelum Таблетки по 0,05 г 1,7-2,5 мг/кг
Барбамил Barbamilum Таблетку, по 0,1 г 5-8 мг/кг
Нитразепам Nitrazepamum Таблетки по 0,005 г 0,005 г
Глава 11 ПРОТИВОСУДОРОЖНЫЕ СРЕДСТВА
Противосудорожные средства используют для устранения судорог любого происхождения. Причиной возникновения судорог могут быть: заболевания центральной нервной системы (менингит, энцефалит, эпилепсия, билирубиновая энцефалопатия, травма головы), нарушения обменных процессов в организме {гипокальциемия, гипогликемия, гипертермия, гипоксия и др.), прием лекарств в чрезмерной дозе (амидопирина, анальгетиков, морфина и т. д.).
У детей, особенно в первые годы жизни, судороги часто генерализованные, возникают в 5—6 раз чаще, чем у взрослых. Это обусловлено морфологическими и функциональными особенностями их мозга: повышенной проницаемостью гематоэнцефалического барьера, неустойчивостью обменных процессов, склонностью мозга к отеку, недостаточным синтезом ГАМК и пр. Судороги должны быть немедленно устранены, так как они опасны для жизни человека. Во время судорог истощаются и не восполняются энергетические ресурсы в организме, особенно в мозге, что может привести к его необратимым повреждениям, к гибели пациента или последующей инвалидности.
Лечение судорог — этиопатогенетическое. Если есть возможность быстро определить причину, вызвавшую судороги, то ее надо немедленно устранить. Например, назначить препараты кальция при гипокальциемии, глюкозу при гипогликемии, жаропонижающие при гипертермии, противоинфекционные и противовоспалительные средства при менингите, энцефалите и пр. Одновременно назначают противосудорожные препараты. Если этиология судорог не известна, то начинают терапию с противосудорожных средств, а средства, устраняющие причину судорог, присоединяют в более поздний период, когда причина судорог будет установлена.
132
Фармакодинамика противосудорожных средств заключается в угнетении повышенной активности нейронов, участвующих в формировании судорожной реакции, и в подавлении иррадиации возбуждения путем нарушения синаптической передачи. К сожалению, препараты могут угнетать и нормально функционирующие нейроны, в частности нейроны структур, регулирующих дыхание. Это очень опасно, особенно для детей первых лет жизни. Следует учесть, что во время судорог повышается проницаемость гематоэнцефалического барьера; противосудорожные средства в больших количествах поступают в мозг. К тому же истощение энергетических ресурсов нервной ткани тоже приводит к ее угнетению.
Противосудорожные средства делят на две группы: а) средства, мало угне-тающие,дыхание (натрия оксибутират, бензодиазепины, лидокаин, фентанил с дроперидолом); б) средства, существенно угнетающие дыхание (барбитураты, магния сульфат, хлоралгидрат). Как правило, начинают с препаратов первой группы, если же они не устраняют судороги, используют препараты второй группы. Иногда одновременно назначают препараты обеих групп.
В крайних случаях, когда устранить судороги перечисленными выше препаратами не удается, вызывают наркоз гексеналом или миорелаксацию недеполяризующими миорелаксантами (анатруксоний, циклобутоний, имбретил), при этом переводят больного на искусственное дыхание.
Натриевая соль гаммаоксимасляной кислоты (ГОМК) — натрия оксибутират — производное гаммааминомасляной кислоты (ГАМК) — медиатора торможения в центральной нервной системе. ГОМК, в отличие от ГАМК, легко проникает через гематоэнцефалический барьер в мозг, но подобно ей она подавляет высвобождение возбуждающих, медиаторов из пресинапти-ческих окончаний (влияя на ГАМК-Б рецепторы) И вызывает постсинаптическое торможение (влияя на ГАМК-А рецепторы). В зависимости от дозы препарат может оказывать снотворное, противосудорожное действие или вызывать наркоз.
Большое значение имеет способность ГОМК поддерживать функцию центральной нервной системы и других тканей и органов, в условиях гипоксии (см. гл. 36) и улучшать мозговое кровообращение, влияя на ГАМК-Б преси-наптические рецепторы.
ГОМК вводят внутривенно медленно; при быстрой инъекции возможно кратковременное апное, двигательное возбуждение, рвота. После внутривенного введения ГОМК, противосудорожный эффект развивается через 10—15 мин и продолжается в среднем 2 ч. Для усиления,и удлинения этого действия ГОМК (в уменьшенной на 50% дозе) сочетают с дроперидолом, ГОМК повышает чувствительность адренорецепторов к катехоламинам, поэтому ее нельзя вводить при артериальной гипертензии.,
Бензодиазепины (сибазон, хлозепид, феназепам) угнетают активность нейронов и распространение нервного импульса в головном и спинном мозге за счет аллостерической активации тормозных эффектов ГАМК. Очень важно их антигипоксическое действие, способствующее выживанию в условиях пониженного содержания кислорода в тканях (см. гл. 36).
В основном из данной группы препаратов используют сибазон (диазепам, седуксен). Внутривенная инъекция сибазона .может прекратить судороги сразу («на конце иглы») или в течении 5^-10 мин'. Продолжительность эффекта 2 ч. Иногда необходимо повторное введение препарата. В особых случаях названный препарат можно ввести внутримышечно или ректально.
133
Лидокаин (ксикаин) при внутривенном введении очень быстро (в течение нескольких минут) подавляет у детей судороги любого происхождения. Начинают обычно с насыщающей дозы, а затем переходят на капельное вливание (так как эффект препарата короткий), продолжающееся иногда 1-1,5 сут. Механизм ликвидации судорог, видимо, аналогичен противоаритмическому действию препарата: нормализация ионной проходимости через клеточную мембрану.
У детей широко применяют препараты, используемые для нейролептанальгезии — фентанил с дроперидолом, которые воздействуют на гиппокамп — пусковую зону судорог различной локализации. Из-за наличия в этой комбинации синтетического заменителя морфина — фентанила, у детей до года может возникнуть угнетение дыхания (устраняемое налорфином и искусственной вентиляцией легких).
Фенобарбитал (люминал) — барбитурат длительного действия. В педиатрии его часто применяют для купирования и профилактики судорог любой этиологии. Для подавления судорог его в виде натриевой соли вводят внутривенно или внутримышечно, а для профилактики — через рот (если готовой растворимой формы препарата нет, ее готовят, добавляя гидрокарбонат натрия). Применяют фенобарбитал при не очень сильных судорогах, так как терапевтический эффект развивается медленно. До полутора лет, особенно у новорожденных, назначение препарата через рот нерационально, так как терапевтическая концентрация в плазме крови возникает только через 4-6 ч, то есть слишком поздно. После полутора лет скорость всасывания фенобарбитала из желудочно-кишечного тракта примерно такая же, как из мышцы. Ценность фенобарбитала состоит в длительности действия, которая у новорожденных может сохраняться до двух суток. Кроме того, этот препарат защищает мозг от ишемической гипоксии. Имеет значение его способность вызывать сужение сосудов в неишемизированных участках мозга и этим улучшать гемоперфузию ишемизированных зон; подавлять функцию центральной нервной системы и этим снижать ее потребность в кислороде; ограничивать образование и активность свободных радикалов кислорода в ишемизированных участках. Этим он предотвращает повреждение клеточных мембран, Na, К -насоса, развитие внутриклеточного отека и повышение внутричерепного давления. Сказанное имеет особое значение для выхаживания новорожденных, родившихся в условиях тяжелой гипоксии. Существенную роль в его механизме играет способность повышать чувствительность ГАМК-рецепторов к соответствующему медиатору.
Хороший Противосудорожный эффект возникает от сочетания фенобарбитала с сибазоном. Обычно начинают терапию с последнего, тогда судороги устраняются быстро, и дозы фенобарбитала могут быть уменьшены в 2 раза, что снижает опасность угнетения дыхания.
Вместо фенобарбитала могут быть взяты и другие производные барбитуровой кислоты; барбамил, этаминал-натрия (если готовой формы нет, ее готовят на воде).
Магния сульфат чаще вводят внутримышечно, очень редко внутривенно, так как у препарата небольшая широта терапевтического действия (см. гл. 35). Ионы магния подавляют освобождение медиаторов, преимущественно ацетилхолина, из пресинаптических окончаний как в центральной нервной системе, так и в нервно-мышечных синапсах. Это приводит к центральному и периферическому противосудорожному эффекту (миорелаксации), который может сопровождаться угнетением структур, регулирующих дыхание, и релак-134
сацией межреберных мышц. В результате уменьшается вентиляция легких, развивается гипотензия с угнетением сократительной деятельности миокарда.
Как противосудорожное средство магния сульфат применяют в настоящее время в детской практике редко, преимущественно при судорогах, связанных с гипомагниемией, отеком мозга или артериальной гипертензией.
Хлоралгидрат применяют очень редко. Вводят его ректально, обязательно с обволакивающим веществом (со слизью из крахмала), так как он обладает резким местнораздражающим действием. К тому же он может нарушать функции миокарда, печени и почек (токсическое влияние трихлоруксусной кислоты — одного из метаболитов хлоралгидрата), что особенно опасно у детей до 5 лет. Противосудорожный эффект возникает через 10—30 мин.
Лекарственные формы и дозы противосудорожных средств для детей представлены в табл. 25.
Таблица 25
Противосудорожные средства
Препарат Лекарственная форма Путь введения Однократные дозы для детей любого возраста
Сибазон Sibazonum 0,5% раствор в ампулах по 2 мл Внутривенно (медленно) 0,3—0,5 мг/кг (до 1 мг/кг) (не больше 10 мг на введение)
Ректально 0,5 мг/кг
Натрия оксибутират Natrii oxybutyras 20% раствор в ампулах по 10 мл Внутривенно (медленно) 100-150 мг/кг; при сочетании с другими противосудорожными средствами SO-75 мг/кг
Лидокаин Lidocain 10% раствор в ампулах по 10 и,20 мл Внутривенно Насыщающая доза 2 мг/кг, поддерживающая доза 4—6 мг/кг в час
Гексенал . Hexenalum Порошок 1 г в ампуле. Перед употреблением раст-ворить в изотоническом растворе NaCl 10% раствор ректально 0,5 мг/кг (50 мг/кг)
5% раствор внутримышечно 0,5 мг/кг (25 мг/кг) /
1% раствор внутривенно (медленно) Не более 15 мг/кг
Фенобарбитал Phenobarbitalum Порошок . Внутрь 15 мг/кг — насыщающая доза; поддерживающая доза (через 12 ч): детям до 1 года — 5 мг/кг, старше года — 3 мг/кг. Затем 10 дней по 10 мг/кг 1 раз в день (в любом возрасте)
/Фенобарбитала натриевая соль Natrii phenobarbitali 50-100 мг фенобарбитала поместить в 1 мл дистиллированной воды и добавить гидрокарбонат Na до растворения Внутривенно Насыщающая доза 10-15 мг/кг; Поддерживающая доза 1 мг/кг (новорожденным)
Магния сульфат Magnii sulfas 25% раствор в ампулах по 10 и 20 мл Внутривенно 0,2 мл/кг
Хлоралгидрат Chloralhydras Порошок. Приготовить микстуру: 20 мл. 2% раст-’ вора хлоралгидрата + 80 мл слизистого отвара Ректально до 1 года — 10—15 мл, 1-6 лет — 20 мл, старше 6 лет — 50 мл
135
Глава 12 ПРОТИВОЭПИЛЕПТИЧЕСКИЕ СРЕДСТВА
Противоэпилептические средства — лекарственные препараты, предупреждающие припадки у больных, страдающих эпилепсией. Эпилепсия (от греческого слова — припадок) встречается у 1—2% детей. Характер припадков зависит от локализации патологического очага в головном мозге. Различают несколько форм эпилепсии: 1) большие припадки (grand mat — большая болезнь) — генерализованные тонико-клонические судороги с потерей сознания, сменяющиеся через несколько минут общим угнетением центральной нервной системы; 2) малые припадки (petit mal — малая болезнь) — характеризуются очень кратковременной утратой сознания, клинически протекают либо в виде абсанса, либо в виде миоклонических кратковременных судорог (кивки, клевки и т. п.); 3) психомоторные автоматизмы — немотивированные действия с выключенным сознанием.
Для лечения каждой из форм эпилепсии применяют определенные противоэпилептические. средства. Различают: 1) средства, применяемые при больших и психомоторных припадках (фенобарбитал, гексамидин, дифенин, хлоракон); ’2) средства, применяемые при малых припадках (этосуксимид, пуфемид); 3) средства, эффективные при разных формах припадков (вальпроат натрия, вальпроат кальция, клоназепам, клобазам, карбамазепин, окскарбамазепин, ламотриджин, габапентин, вигабатрин,.фелбамат, тиагабин). Последняя группа имеет очень важное значение, так как болезнь часто протекает полиморфно.
Противоэпилептические средства либо подавляют патологическую активность нейронов в эпилептогенном очаге (дифенин, этосуксимид и др.), либо нарушают распространение из него возбуждения, вовлечение других нейронов и этим предотвращают возникновение припадков (фенобарбитал, гексамидин и др.).
К противоэпилептическим средствам предъявляют определенные требования. Они должны: 1) обладать высокой активностью и большой продолжительностью действия; 2) хорошо всасываться из желудочно-кишечного тракта; 3) обладать минимальной токсичностью и большой широтой действия; 4) не накапливаться в организме и к ним не должны развиваться привыкание и лекарственная зависимость; 5) их длительный (годами) прием не должен сопровождаться возникновением тяжелых нежелательных эффектов. К сожалению, современные противоэпилептические средства отвечают лишь некоторым из этих требований.
Принципы применения противоэпилептических средств: 1) по возможности использовать один препарат (монотерапия) или индивидуально для каждого больного подбирать необходимую комбинацию препаратов (комплексная терапия); 2) при необходимости дозу увеличивать постепенно; 3) оценивать эффективность только через несколько недель постоянного приема (препарат должен уменьшать количество припадков не менее чем на 50%); 4) при необходимости осуществлять плавную замену одного препарата другим; 5) проводить непрерывную терапию (при отсутствий припадков — отмена препарата, допустима не ранее, чём через 4—5 лет, при отсутствии патологических изменений на электроэнцефалограмме).
136
СРЕДСТВА, ПРИМЕНЯЕМЫЕ ПРИ БОЛЬШИХ И ПСИХОМОТОРНЫХ ПРИПАДКАХ
Фенобарбитал (люминал) (см. гл. 11) применяют для лечения больных с психомоторными и большими припадками в субгипнотических дозах. Назначение этого препарата обычно сопровождается возникновением нежелательных эффектов. В первые дни терапии отмечают сонливость, нистагм, у детей нередко возникает раздражительность и гиперактивность. Все это постепенно проходит. При длительном применении фенобарбитала увеличивается образование и активность обезвреживающих ферментов в печени (ряда изоформ цитохрома — Р-450, ферментов глюкуронидазной системы и пр.). В результате ускоряется образование неактивных метаболитов ряда эндогенных веществ, в том числе витаминов D, К, Вс. Это приводит к возникновению остеопатии (отчасти напоминающей рахит), мегалобластической анемии, гипопротеинемии, геморрагий. Последние особенно часто встречаются у новорожденных от матерей с эпилепсией, принимающих фенобарбитал. Для профилактики и лечения названных осложнений дети, длительно получающие фенобарбитал, должны дополнительно принимать препараты витаминов D, К и Вс, а также соли кальция.
Гексамидин (примидон) Но химической структуре близок фенобарбиталу, однако он менее активен (в 3 раза) и не вызывает выраженного снотворного эффекта. Гексамидин хорошо всасывается из кишечника; около 20% препарата превращается в организме в фенобарбитал, что играет важную роль в механизме его действия. Выводится гексамидин печенью и Почками. Больным с нарушением функции этих органов назначать данный препарат не рекомендуется.
Нежелательные эффекты: в начале лечения возможны головокружение, сонливость, атаксия, нистагм, тошнота, рвота; все эти явления проходят без лечения; при длительном применении препарата может развиться мегалобластическая анемия, а также дефицит витаминов D и К.
Дифенин (фенитоин) ограничивает иррадиацию нервных импульсов из эпилептогенного очага, что рассматривают как следствие ограничения поступления ионов натрия внутрь преимущественно вставочных нейронов поли-синаптических путей. В результате чего уменьшается ритмическая активность этих нейронов, что и тормозит распространение возбуждения.
Из желудочно-кишечного тракта дифеййн всасывается хорошо, но максимальная концентрация в плазме крови возникает медленно — от 4-6 до 24 ч после приема. В крови он на 90% связан с альбуминами. Его биотрансформация происходит в печени. Вместе с тем дифенин как и фенобарбитал вызывает индукцию микросомальных ферментов печени, что снижает активность многих эндогенных веществ и одновременно назначаемых лекарств. Продукты Превращения дифенина и небольшие его количества в неизменном виде выделяются из организма почками. Уменьшение содержания препаратов в плазме на 50% происходит в течении 20-30 ч. Дифенин. может кумулироваться, но в значительно меньшей степени, чем фенобарбитал.
В отличие от последнего, в терапевтических дозах общего угнетающего действия на центральную нервную систему дифенин не оказывает. Угнетение ее может быть только при передозировке. Рднако при применении дифенина могут наблюдаться нежелательны^ явления, особенно в начале его применения: нарушения функции желудочно-кишечного тракта (тошнота, рвота), исчезающие через 2-3 нед головокружения, возбуждение, повышение температуры тела. Кроме того, у отдельных больных отмечают атаксию, сыпь, гиперплазию
137
десен. Гиперплазия десен — результат местного действия препарата на митотическую активность слизистой оболочки. Это осложнение требует постоянной санации полости рта.
Кроме противоэпилептической активности, дифенин обладает антиаритми-ческим (при отравлении сердечными гликозидами — см. гл. 19) и анальгетическим (при невралгии тройничного нерва) действием.
Хлоракон (бе кл амид) применяют обычно не самостоятельно, а вместе с фенобарбиталом или дифенином. Препарат угнетает передачу импульсов с пирамидных и сегментарных спинальных путей на мотонейроны спинного мозга. В основном его назначают детям с явлениями аффективного напряжения, злобности и с необычным поведением. Переносится больными хорошо, но иногда может вызывать слабость, головокружение, диспепсические расстройства.
СРЕДСТВА, ПРИМЕНЯЕМЫЕ ПРИ МАЛЫХ ПРИПАДКАХ
Этосуксимид (суксилеп,д1икнолепсин) — наиболее активен при малых припадках, менее токсичен, Йем ранее применявшийся триметин. Иногда его применяют при невралгии тройничного нерва. Препарат хорошо всасывается из желудочно-кишечного тракта, максимальная концентрация в крови — через 4 ч. С белками практически не связывается, подвергается биотрансформации, превращаясь в глюкурониды, а 10—20% выделяются с мочой в неизменном виде. Период полужизни у взрослых — 60 ч, у детей в 2 раза меньше.
Нежелательные эффекты: желудочно-кишечные расстройства (потеря аппетита, тошнота, рвота), изредка наблюдают сонливость, головную боль, эйфорию, самостоятельно исчезающие при продолжающемся применении препарата, возможно беспокойство, неспособность концентрировать мысль. Наиболее опасны изменения со стороны крови: лейкопения, тромбоцитопения, апластическая анемия. У больных необходимо производить анализы крови и мочи (возможна альбуминурия).
Пуфемид очень близок к этосуксимиду по своей клинико-фармакологической характеристике.
Вальпроат натрия (депакин, конвул?кс)и вальпроат кальция (конвульсофин) — соли вальпроевой кислоты. Механизм действия вальпроевой кислоты связывают с активацией глютаматдекарбоксилазы, осуществляющей превращение глутаминовой кислоты в ГАМК, и с торможением ГАМК — аминотрансферазы, разрушающей названный медиатор. Поскольку ГАМК является эндогенным тормозным медиатором, угнетающим пре- и постсинаптические разряды, «считают, что препараты вальпроевой кислоты понижают этим путем возбудимость моторных зон головного мозга. Вальпроевая кислота не только предупреждает эпилептические припадки, но и улучшает психический статус больного, его настроение.
Препарат хорошо всасывается из желудочно-кишечного тракта, максимальная концентрация в крови достигается через 2 ч. В печени он подвергается биотрансформации, превращаясь в неактивные соединения, выделяемые с мочой. Период полужизни 8—15 ч:
При приеме препарата возможна тошнота, рвота, тяжесть в животе, угнетение, чувство усталости, а также уменьшение агрегации тромбоцитов и снижение свертываемости крови. Вальпроевая кислота противопоказана при нарушениях функции печени (опасность кумуляции, интоксикации со смертель
138
ным исходом), почек, геморрагическом диатезе. Кроме того, известно, что она ухудшает утилизацию карнитина и поэтому может нарушить функцию печени, вызвать мышечную дистрофию и кардиомиопатию у детей. Препарат противопоказан беременным, так как обладает тератогенным действием.
Клоназепам (антэлепсин) и клобазам — производные бензодиазепина. Подобно другим препаратам этой группы они повышают активность ГАМК. Препараты быстро и полностью всасываются из желудочно-кишечного тракта, подвергаются биотрансформации в печени, превращаясь в неактивные метаболиты. Период полужизни у взрослых 20-60 ч, у детей короче.
При приеме данных препаратов возможны расстройства координации движений, раздражительность, депрессивные явления, повышенная утомляемость.
Карбамазепин (тегретол, финлепсин) химически близок к трициклическому антидепрессанту имизину, что объясняет близость его механизма действия и фармакологических эффектов (улучшается настроение, но может возникнуть возбуждение и бессонница).
Карбамазепин кроме противоэпилептического действия обладает способностью снимать боли при невралгии тройничного нерва.
Из желудочно-кишечного тракта всасывается 20—30% дозы. Максимальная концентрация в крови — через 4—10 ч. В печени из него образуется до 8 метаболитов, один из них активный (эпоксид карбамазепина). Препарат индуцирует ферменты печени, ускоряя свою биотрансформацию (и других эндо-и экзогенных веществ), поэтому при длительном введении его период полувыведения укорачивается с 12-30 до 10-20 ч, что требует увеличения дозы. Препарат обычно хорошо переносится, однако при длительном применении возникают нежелательные эффекты: психические нарушения, бессонница и сонливость, атаксия, головокружение, нарушения аккомодации, потеря аппетита, тошнота, рвота, лейкопения, агранулоцитоз и тромбоцитопения. При назначении препарата необходимо контролировать кровь.
Окскарбамазепин относят к аналогам карбамазепина. Однако окскар-бамазепин в отличие от карбамазепина не повышает активность печеночных ферментов и в процессе его метаболизма не образуется эпоксид (с последним преимущественно связывают нейротоксичность).
Ламотриджин (ламиктал) обладает антифолатными и антиглютамат-ными свойствами (тормозит высвобождение возбуждающих аминокислот из пресинапса), то есть блокирует механизм Повышенного возбуждения в центральной нервной системе, слабо угнетая нормальную функцию нейронов. Кроме того, препарат, блокируя вольтаж-зависимые каналы, обладает способностью стабилизировать клеточные мембраны нейронов для ионов натрия и кальция.
Препарат вводят внутривенно или назначают внутрь до еды. Он полностью и быстро всасывается из желудочно-кишечного тракта, пик концентрации в плазме крови возникает через 2—3 ч. Биодоступность составляет 98%. Препарат связывается с белками плазмы крови на 55%.
Биотрансформация ламотриджина происходит в печени медленно путем глюкуронидации. Основной мeтaбoлит-2N — глюкуроновая кислота, вещество с высоким почечным клиренсом, поэтому в плазме крови его обнаружить очень трудно. Около 7% препарата от поступившей дозы выделяется с мочой в неизмененном виде, только 2% — с фекалиями.
Ламотриджин не стимулирует и не угнетает ферментные системы печени.
Период полуэлиминации из крови составляет 29 ч. Постоянный уровень в крови достигается через 4-5 дней. При монотерапии ламотриджин назначают 1 раз в сутки. При комплексной терапии с препаратами (карбамазепином^
139
дифен ином, фенобарбиталом), ускоряющими превращение ламотриджина в печени, последний назначают 2 раза в день.
При использовании ламотриджина возможны головная боль, головокружение, сонливость или бессонница, агрессивность, спутанность сознания, тошнота, кожная сыпь (обычно макулопапулезная), ангионевротический отек, синдром Стивенса-Джонсона, токсический некроз кожи, лимфаденопатия, лейкопения, тромбоцитопения, нарушения функции печени.
Габапентин (неуронтин) блокирует вольтаж-зависимые кальциевые каналы, усиливает действие ГАМК.
Препарат назначают внутрь, он хорошо всасывается из желудочно-кишечного тракта, максимальная концентрация в крови возникает уже через 2-3 ч. Габапентин практически не связывается с белками плазмы крови. Препарат выводится с мочой в неизмененной виде. Период полуэлиминации составляет 5-7 ч. Кратность назначения 3 раза в день.
Нежелательные эффекты: наиболее часто отмечают сонливость, головокружение, слабость, головную боль, атаксию, тремор, диплопию, нистагм, а также ринит, тошноту, рвоту, реже возникают повышенная раздражительность, амнезия, дизартрия, судороги, увеличение массы тела, фарингит, кашель, диспепсические явления.
Вигабатрин (сабрил) необратимо угнетает ГАМК — трансаминазы, повышая таким образом содержание ГАМК в мозге.
Препарат хорошо и достаточно быстро абсорбируется из желудочно-кишечного тракта, пиковая концентрация в крови возникает через 1-2 ч. Он практически не связывается с белками плазмы крови. Препарат выводится с мочой в неизменном виде. Период полуэлиминации составляет 6-8 ч. Кратность назначения 2 раза в день. Постоянная концентрация в сыворотке крови устанавливается через 1—2 дня.
Нежелательные эффекты: беспокойство, раздражительность, депрессия, повышенная агрессивность, психотические нарушения; редко — головные боли, нистаГм, тремор, парастезии; очень редко — неврит или атрофия зрительного нерва.
Фелбамат (фелбатол) блокирует рецепторы для возбуждающих аминокислот (аспартата и глутамата).
Пик концентрации препарата в.крови после приема внутрь возникает через 1-6 ч, связывание с белками пдазмы, крови составляет около 25%. Препарат подвергается биотрансформации в печени путем гидроксилирования и глюкуронидации. Он обладает свойством незначительно повышать активность ферментов печени. Часть препарата выводится из организма в неизмененном виде с помощью почек. Период полуэлиминации из крови составляет около 20 ч. Кратность назначения 3-4 раза в день. Время возникновения постоянной концентрации препарата в крови через 5-8 дней.
Нежелательные эффекты: головная боль, беспокойство, раздражительность, тремор, психотические нарушения, ;
Тиагабин — увеличивает внеклеточный уровень ГАМК за счет нарушения ее обратного захвата глиальными клетками.
Он хорошо и быстро всасывается из желудочно-кишечного тракта, максимальная концентрация в крови возникает через 0,5-2 ч. Препарат подвергается биотрансформации в печени под влиянием монооксигеназной системы. Период полуэлиминации составляет в среднем 7 ч. Кратность назначения 2—3 раза в день.
140
Нежелательные эффекты: вялость, сонливость, головная боль, нарушение памяти и, познавательных функций, психические расстройства, гепатотоксичность, диспепсические расстройства.
Противоэпилептическими свойствами обладают также некоторые препараты из других фармакологических групп, например, мочегонное средство диакарб, сердечный гликозид дигоксин, антиподагрическое средство аллопуринол и некоторые др.
Лекарственные формы и дозы противоэпилептических средств для детей представлены в табл. 26.
Таблица 26
Противоэпилептические средства
Препарат Форма выпуска, г Число приемов в сутки Суточная доза, мг/кг
Фенобарбитал Phenobarbitalum Таблетки 0,05—0,1 1-2 5—10 мг
Дифенин Dipheninum Таблетки 0,01 1-3 До 5 лет — 0,5 таблетки, 5—8 лет — 1 таблетка, старше 8 лет — 1-2 таблетки
Гексамидин Hexamidimim Таблетки 0,125—0,25 2 0,125-0,5 г
Карбамазепин Carbamazepinum Таблетки 0,2 2-4 20 мг/кг
Этосуксимид Ethosuximidum Капсулы 0,25 3-4 0,25 г
Вальпроат натрия Natrium valproicum Таблетки, капсулы 0,15; 0,2 и 0,3 3 15-40 мг/кг
Клоназепам Clonazepanum Таблетки 0,001 3-4 До 1 года — 0,1-1,0 мг, 1-5 лет — 1,5—3,0 мг, 6-16 лет — 3,0-6,0 мг
Примечание. Число приемов препарата в сутки назначается врачом индивидуально.
Глава 13 ПРОТИВОПАРКИНСОНИЧЕСКИЕ СРЕДСТВА
Противопаркинсонические средства используют для устранения синдрома паркинсонизма, характеризующегося следующими проявлениями: ригидностью (резко повышенным тонусом) скелетных мышц, тремором (постоянное непроизвольное дрожание пальцев и кистей рук, нижней челюсти, языка, головы) и акинезией (скованностью движений), а также повышенной саливацией, потливостью, сальностью лица, раздражительностью и плаксивостью. Различают первичный паркинсонизм (болезнь Паркинсона), являющийся самостоятельным наследственно-дегенеративным хроническим заболеванием; вторичный паркинсонизм, являющийся следствием инфекционного поражения центральной нервной системы, атеросклероза сосудов головного мозга, отравления марганцем, угарным газом, травмы головы и т. п. и лекарственный паркинсонизм, возникающий из-за применения нейролептиков и некоторых других препаратов.
Патогенез паркинсонизма неизвестен. Обнаружено, однако, что при этом заболевании в подкорковых структурах (черной субстанции, бледном шаре,
141
красном ядре) снижается содержание дофамина, в связи с этим ослабевает или исчезает его тормозящее влияние на холинергические структуры стриарной системы (хвостатое ядро, скорлупа), участвующих в регуляции функций других отделов центральной нервной системы, в частности, спинного мозга. При недостатке дофамина усиливается активность холинергических структур в стриатуме. Для устранения создавшегося дисбаланса между дофаминергическими и холинергическими влияниями необходимо либо устранить дефицит эндогенного дофамина, либо ввести дофаминомиметики (прямые, непрямые), либо назначить центральные холинолитики, защищающие холинорецепторы от чрезмерного их возбуждения ацетилхолином.
Различают следующие группы противопаркинсонических средств:
1. Средства, восстанавливающие дефицит дофамина в нейронах паллидарной системы (леводопа, наком, мадопар).
2. Средства, стимулирующие дофаминовые рецепторы на нейронах стриарной системы:
а) прямые дофаминомиметики — бромокриптин, каберголин, лизурид, пер-голид;
б) непрямые дофаминомиметики — мидантан, глудантан.
3. Ингибиторы ферментов, разрушающих эндогенный дофамин и дофаминомиметики (1-депренил, энтакапон, толкапон).
4. Средства, блокирующие холинорецепторы на нейронах стриарной системы (циклодол, нопакин, динезин, тррпацин, когентин, акинетон).
Все противопаркинсонические средства устраняют или ослабляют синдром паркинсонизма лишь во время их применения.
На рис. 24 представлены химические структуры некоторых противопаркинсонических средств.
Леводопа
Рис. 24. Химические структуры противопаркинсонических средств
142
СРВДСТВА, УСТРАНЯЮЩИЕ ДЕФИЦИТ ДОФАМИНА В НЕЙРОНАХ ПАЛЛИДАРНОЙ СИСТЕМЫ
Леводопа (1-допа, левопа) является предшественником дофамина (см. гл. 2). Препарат легко проникает через гематоэнцефалический барьер в головной мозг, где превращается в дофамин. Накапливаясь в нейронах паллидарной системы, дофамин восстанавливает их активность и устраняет или ослабляет проявления паркинсонизма. Леводопа преимущественно устраняет акинезию, несколько меньше — ригидность. Тремор, а также слюнотечение, повышенная потливость и сальность кожи устойчивы к препарату. Поэтому леводопу нужно назначать одновременно с холинолитическими препаратами.
Назначают леводопу внутрь сразу после еды. Она хорошо всасывается из желудочно-кишечного тракта. Максимальная концентрация в плазме крови наблюдается через 1-2 ч после приема. Выделяется в значительной степени (свыше 75% за сутки) почками, частично через кишечник.
Леводопа относится к наиболее эффективным средствам, применяемым при лечении болезни Паркинсона и вторичном паркинсонизме. В качестве корректора при лекарственном паркинсонизме данный препарат не назначают. Лечебный эффект развивается постепенно, улучшение состояния наблюдается обычно через 1-4 нед. Препарат принимают длительно (3-5 лет), делая кратковременные (на 5—7 дней) перерывы во время лечения, иначе довольно быстро к нему развивается толерантность.
Назначение леводопы может сопровождаться различными побочными эффектами: тошнотой, рвотой, анорексией, ортостатичёской гипотонией, аритмиями, психическими расстройствами. Все эти осложнения обратимы и могут быть нивелированы снижением дозы препарата. Многие побочные эффекты связаны с превращением леводопы путем декарбоксилирования в периферических тканях (печени, почках, кишечнике) в дофамин, который не проникает через гематоэнцефалический барьер. Для уменьшения периферического декарбоксилирования применяют леводопу со специальными ингибиторами дофадекарбоксилазы, не проникающими через гематоэнцефалический барьер. В качестве таких ингибиторов применяют карбидопу и бенсеразид. Они препятствуют биотрансформации леводопы в периферических ткцнях и этим повышают ее Поступление в центральную нервную систему, а следовательно, и лечебный эффект. Препаратами, содержащими ингибиторы декарбоксилирования, являются наком и мадопар.
Леводопу нельзя одновременно назначать с ингибиторами моноаминокси-дазы (МАО) во избежание возникновения резкой гипертензии.
СРВДСТВА, СТИМУЛИРУЮЩИЕ ДОФАМИНОВЫЕ РЕЦЕПТОРЫ НА НЕЙРОНАХ СТРИАРНОЙ СИСТЕМЫ
Прямые дофаминомиметики
Бромокриптин (парлодел) — полусинтетическое производное алко-лоида спорыньи (эргокриптина); является специфическим агонистом дофаминовых рецепторов (главным образом типа Дц). Он вызывает те же фармакологические эффекты, что и леводопа (см. выше).
Назначают бромокриптин сразу после еды, он хорошо всасывается из желудочно-кишечного тракта (через 1-2 ч концентрация препарата в крови достигает максимума) и быстро проникает в мозг.
143
Антипаркинсонический эффект данного препарата наблюдается при применении больших доз, вызывающих нежелательные эффекты: тошноту, рвоту, запор, артериальную гипотонию, набухание слизистых оболочек и др. Поэтому бромокриптин используют обычно в качестве дополнения к леводопе.
По своей клинико-фармакологической характеристике каберголин, ли-зурид и перголид близки бромокриптину.
Непрямые дофаминомиметики
Мидантан (амантадина гидрохлорид) оказывает непрямой дофаминомиметический эффект, который опосредован через блокаду NMDA-pe-цепторов, получивших свое название по имени селективного агониста этих рецепторов: Ь}-метил-<1-аспарагиновой кислоты. Мидантан усиливает освобождение дофамина из пресинаптических окончаний.
Назначают мидантан внутрь после еды. Применяют его для лечения болезни Паркинсона или вторичного паркинсонизма, особенно в тех случаях, когда леводопа противопоказана или неэффективна.
Препарат преимущественно подавляет акинеторигидный синдром, значительно меньше влияя на гиперкинетический синдром (тремор).
Мидантан является быстродействующим препаратом: его эффект наступает в первые дни лечения. ;
Препарат обычно хорошо переносится. Однако иногда появляются нежелательные эффекты (головная боль, бессонница, общая слабость, диспепсические явления), при возникновении которых дозу уменьшают. В связи с возможным возбуждением центральной нервной системы его следует с осторожностью применять у больных с психическими заболеваниями, при тиреотоксикозе и при эпилепсии, и не назначать вечером.
Глудантан — глюкуронид мидантана. Препарат характеризуется меньшей токсичностью и лучшим прохождением через гематоэнцефалический барьер.
Ингибиторы ферментов, разрушающих эндогенный дофамин и дофаминомиметики
L-депренил, избирательно ингибируя моноаминоксидазу-Б (МАО-Б), приводит к повышению концентрации медиаторных моноаминов, в том числе содержания дофамина в паллидуме. 1-Депренил оказывает антиоксидантное действие на дофаминергические клетки, за счет чего может замедлять неуклонное прогрессирование заболевания.
Энтакапон и толкапон являются обратимыми ингибиторами кате-холортометилтрансферазы (КОМТ) и на периферии, и в центральной нервной системе. Таким образом, они тормозят катаболизм дофамина и дофаминомиметиков.
Фармакологические эффекты аналогичны леводопе, хотя их выраженность значительно меньше. Они позволяют усилить эффекты леводопы, не повышая ее суммарную дозу или даже снижая таковую.
Препараты данной группы дополняют эффекты друг друга, а также карби-допы и бенсеразида, тормозящих другой путь распада дофамина, поэтому их можно сочетать.
Препараты назначают через рот. Они быстро и относительно полно всасываются из кишечника. Максимальная концентрация в плазме крови наблюдается в промежутке от 0,5 до 2 ч после приема внутрь. Связывание с белками плазмы крови — более 90%. Ингибиторы ферментов хорошо проникают через гематоэнцефалический барьер. Большая часть (80—85%) принятой дозы препаратов выводится с мочой. Кратность назначения 1-депренила 1 раз утром перед 144
завтраком или 2 раза в сутки — перед завтраком и перед сном. Толкапон или энтакапон назначают 3 раза в сутки во время еды или в промежутках между приемами пищи.
Нежелательные эффекты: 1-депренил может вызвать сухость во рту, нарушение сна, тошноту и рвоту.
Толкапон и энтакапон часто вызывают диарею вследствие усиления перистальтики кишечника, которая возникает обычно через 2—4 мес от начала применения. Кроме того, эти препараты могут повысить активность трансаминаз печени, вызывать бессонницу, дискинезию, тошноту и анорексию.
СРЕДСТВА, БЛОКИРУЮЩИЕ ХОЛИНОРЕЦЕПТОРЫ НА НЕЙРОНАХ СТРИАРНОЙ СИСТЕМЫ
Цикло-дол (пар ко пан) — центральный и периферический холинолитический препарат. Он подавляет стимулирующие холинерические влияния на нейроны стриарной системы.
Препарат назначают внутрь, он хорошо всасывается из желудочно-кишечного тракта и быстро (через 8—12 ч) выводится из организма (кумуляции не наблюдается). При длительном применении к нему развивается привыкание.
Циклодол заметно уменьшает тремор, слюнотечение, потоотделение, сальность кожи и относительно мало влияет на мышечную ригидность и акинезию. Поэтому его обычно сочетают с недеполяризующими третичными миорелаксантами (кондельфин, мелликтин), назначаемыми внутрь.
При применении циклодола могут возникнуть нежелательные явления, связанные с его периферическими М-холинолитическими свойствами: сухость во рту, нарушение аккомодации, повышение внутриглазного давления, тахикардия, запор и др. при уменьшении дозы или при отмене препарата побочные явления проходят. При передозировке — появляются нарушения и со стороны центральной нервной системы (возбуждение, галлюцинации и т. п.).
При лечении паркинсонизма могут быть использованы центральные холи-нолитики: нопакин, динезин, тропацин, когентин, акинетон и др.
Лекарственные формы и дозы противопаркинсонических средств для детей представлены в табл. 27.
!j Таблица 21
Противопаркинсонические средства
Препарат Лекарственная форма Путь введения Число приемов в сутки Суточная доза для детей любого возраста
Леводопа Levodopum Капсулы и таблетки 0,25 г; 0,5 г Внутрь 3-4 0,25 г (через каждые 2—3 дня дозу увеличивают на 0,25 г до суточной дозы 3,0 г; подбор дозы осуществляют индивидуально; в особых случаях доза может быть увеличена)
Мидантан Midantanum Таблетки 0,1 г То же 3-4 0,2-0,4 г
Циклодол Cyclodolum Таблетки 0,001 г; 0,002 г; 0,005 г « 1-2-3 0,001 г (каждый день прибавляют по 0,001 г до суточной дозы 0,01 г; подбор дозы осуществляют индивидуально)
145
Раздел II ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ВЛИЯЮЩИЕ НА ФУНКЦИИ ИСПОЛНИТЕЛЬНЫХ ОРГАНОВ
Глава 14 ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ПРИМЕНЯЕМЫЕ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ НАРУШЕНИЙ ДЫХАНИЯ У НОВОРОЖДЕННЫХ И ГРУДНЫХ ДЕТЕЙ
В период новорожденное™ возникают специфические патологические состояния: синдром дыхательных расстройств, периодическое дыхание и идиопатическое апноэ, синдром внезапной смерти.
Синдром дыхательных расстройств (СДР) может быть следствием внелегоч-ных и легочных нарушений. К. причинам нелегочного СДР . относят острую кровопотерю, врожденные пороки сердца, грудной клетки, гипотермию, метаболический ацидоз, гипоксию, внутречерепную родовую травму и др., к легочным — пневмонии, пневмопатии, пороки развития легких. Из пневмопатий преимущественное значение имеет болезнь гиалиновых мембран. У недоношенных детей с гестационным возрастом до 28 нед она встречается в 60% случаев, с гестационным возрастом 32—36 нед — в 15—20%, а после 37 нед — в 5% случаев. Наиболее известной причиной болезни гиалиновых мембран является дефицит сурфактанта.
Сурфактант — поверхностно-активное вещество, состоящее преимущественно из фосфолипидов. Основную массу в нем составляет фосфатидилхолин (60—70%), но очень важную роль играет фосфатидилглицерин, хотя его содержание в сурфактанте и невелико (всего 5—10%). Именно эти компоненты фосфолипидов и ответственны за снижение поверхостного натяжения в альвеолах. Напомним, что во время гипоксии в тканях возрастает образование аденозина, увеличивающего ресинтез S-аденозилгомоцистеина, который тормозит процесс трансметилирования и, в частности, образование фосфатидил-холина (из фосфалтидилэтаноламина). Кроме липидов, в сурфактанте содержатся специальные сурфактантные протеины, из них протеин А имеет особенно большое значение для поддержания и потенцирования эффекта фосфолипидов.
Сурфактант синтезируют альвеолоциты II типа, начиная с 20-24 нед внутриутробной жизни, в начале естественно в очень небольших количествах. До 30-32 нед образование основного его компонента проходит путем трансметил-лирования фосфатидилэтана — ламина и превращения его в фосфатидилхолин. Этот процесс очень чувствителен к гипоксии, ацидозу и гипотермии, так как любое из этих состояний увеличивает образование аденозина (см. выше). После 30-32 нед синтез фосфатидилхолина происходит другим путем, менее чувствительным к гипоксии и к другим патологическим состояниям.
146
Недостаточный синтез сурфактанта и его легкая повреждаемость приводят к СДР, часто возникающему у недоношенных детей. При этом происходит спадение альвеол во время выдоха и нарушение вентиляции. О недостаточности сурфактанта можно судить, определяя качество фосфолипидов в околоплодной жидкости. Если в ней отношение лецитина к сфингомиелину меньше единицы, в легких плода мало сурфактанта и он нуждается в профилактическом назначении средств, стимулирующих его синтез. Если это отношение больше двух, то сурфактанта в легких достаточно.
Роль сурфактанта состоит не только в поддерживании альвеол в расправленном состоянии. В просвете бронхов он способствует отлипанию мокроты, ее мукоцилиарному клиренсу; он обладает свойствами неимунной опсонизации, способствуя подавлению стафилококковой и стрептококковой инфекции; увеличивает миграцию в легкие моноцитов и их превращение в макрофаги, а также увеличивает освобождение из последних фактора, стимулирующего мо-ноцитопоэз.
Стимуляторы синтеза сурфактанта. Для стимуляции сурфактанта применяют средства разной структуры.
Глюкокортикоиды (см. гл. 31) взаимодействуют со специальными рецепторами альвеолоцитов II типа и стимулируют в них синтез сурфактанта. В развитии этого эффекта есть латентный период, длящийся 1—2 сут. Поэтому глюкокортикоиды (предпочтительно дексаметазон или бетаметазон) вводят матери, останавливая на 1—2 сут преждевременно начавшиеся роды вливанием р2-адреномиметиков (салбутамол, партусистен и др.), которые и сами способствуют синтезу сурфактанта. Назначением этих средств удается снизить частоту и тяжесть СДР у недоношенных с незрелыми легкими.
Этимизол и эуфиллин— антагонисты аденозина (см. гл. 3) устраняют или уменьшают активированный им ресинтез S-аденозилгомоцистеина и этим способствуют восстановлению процесса трансметилирования фосфатидилэта-ноламина в фосфатидилхолин (основной компонент сурфектанта). Этимизол к тому же увеличивает синтез АКТГ и через него синтез глюкокортикоидов.
Этимизол можно назначать матери с профилактической целью в течение 6-7 дней (внутрь или внутривенно), но иногда бывает достаточно и одной внутривенной инфузии уже в период начавшихся родов. С лечебной целью его вводят для поддерживающей терапии новорожденному, получавшему глюкокортикоиды пренатально (через материнский организм).
Эуфиллин (см. гл. 3), введенный за 24 ч до родов, стимулирует синтез сурфактанта. Помимо устранения эффекта аденозина возможно имеет значение его способность увеличивать синтез или освобождение тироксина, улучшать фетоПлацентарный кровоток, предупреждая этим гипоксию плода, то есть одну из причин СДР. Очень важно, что он не угнетает имунные свойства организма (как глюкортикоиды) и вызывает меньше осложнений.
Тироксин и трийодтиронин (см. гл. 31) назначают на основании наблюдений, свидетельствующих о- нередко обнаруживаемой недостаточности этих гормонов у недоношенных детей с СДР и о их способности активировать синтез сурфактанта. С профилактической целью их вводят интраамниотически матери перед родами, с лечебной целью -*• сразу после рождения внутримышечно ребенку (с риском развития названной патологии).
Инозитол — шестиатомный спирт, входящий в состав фосфолипидов сурфактанта в виде фосфатидилинозитола. Он интенсивно синтезируется в тканях плода, и у новорожденного его концентрация в плазме крови в 2-100
147
раз выше, чем у взрослых. Отчасти это следствие его медленного метаболизма и экскреции почками, результат заглатывания его с амниотической жидкостью, а после рождения — поступлением с молоком матери.
При СДР в плазме крови детей обнаружен низкий уровень инозитола, что совпадает с низким содержанием в околоплодной жидкости лецитина и отсутствием в ней фосфатидилглицерина. Назначение таким детям инозитола уменьшает опасность развития СДР. Особенно важно его введение детям с развившейся из-за СДР бронхолегочной дисплазии, так как перевод их на искусственную вентиляцию легких лишает возможности кормления грудным молоком матери.
Бензиламины — амброксол и бромгексин в основном используют в качестве отхаркивающих и противокашлевых средств (см. гл. 16), но у них значительно больший спектр действия. Они увеличивают секрецию сурфактанта, активируют мукоцилиарный клиренс, повышают образование мокроты,' снижают ее вязкость, что способствует ее удалению из просвета бронхов.
В-основном их назначают при угрозе преждевременных родов женщинам, которым противопоказаны глюкокортикоиды (при сахарном диабете, повышенном артериальном давлении и п{У).
Дозы стимуляторов синтеза сурфактанта даны в табл. 28.
Таблица 28
Стимуляторы синтеза сурфактанта
Препарат Форма выпуска Путь введения Число введений в сутки Суточная доза
Дексаметазон Dexamethasonum Таблетки по 0,0005 г Матери внутрь за 1 день до родов 3 5 мг
0,4% раствор в ампулах по 1 мл Внутримышечно матери в течение 2—3 дней перед родами 1 12 мг
Этимизол1 Aethimisolum Таблетки по 0,1 г Матери внутрь .2 По 1/4 таблетки
1% раствор в ампулах по 3 и 5 мл Внутривенно капельно матери (содержимое ампулы развести в 200 мл изотонического раствора натрия хлорида) 1 30-50 мг
Внутримышечно ребенку 1-3 0,2-1,0 мг/кг
Эуфиллин Euphyllinum 24% раствор в ампулах по 1 мл Внутримышечно матери в течение 3 дней перед родами 2 250 мг
Сурфактант, HL (BL) Флаконы с лифофилизи-рованным порошком. Перед употреблением получают взвесь из 50 мг в 2,5—5 мл изотонического раствора натрия хлорида Интратрахеальная инстилляция в течение 20-25 мин или ингаляция аэрозоля в течение 120 мин (с помощью альвеолярного небулайзера) 1 400 мг/м2
Примечание. 1. Желательно в течение 6—7 дней перед родами.
148
ПРЕПАРАТЫ СУРФАКТАНТА
Препараты сурфактанта получены из легких крупного рогатого скота, телят, свиней, из стерильной человеческой амниотической жидкости (взятой во время операции кесарева сечения). Препараты из амниотической жидкости особенно ценны, так как они содержат сурфактантный протеин А и поэтому характеризуются высокой эффективностью.
Препараты сурфактанта начинают инстиллировать в дыхательные пути недоношенного ребенка с низкой массой тела немедленно после рождения, иногда еще до завершения родов, до первого вдоха ребенка (то есть после прорезывания головки). Введение сурфактанта уменьшает частоту и тяжесть СДР у таких детей, снижает опасность развития осложнений этой патологии (пневмоторакса, интерстициальной эмфиземы, внутрижелудочковых геморрагий), предотвращает развитие бронхолегочной дисплазии. Одной инстилляции бывает достаточно для поддержания дыхания в течение 3-5 дней, иногда вводят препарат и вторично (после вдыхания кислорода, чтобы инстилляция жидкости не привела к временной гипоксии).
Препараты сурфактанта начали применять не только при СДР у недоношенных новорожденных, но и при синдроме острого повреждения легкого (СОПЛ), развивающегося у детей любого возраста, а также у взрослых. СОПЛ — результат вторичного дефицита сурфактанта. в легких, возникающего из-за активации компонентов противоспалительного каскада, выброса эндотелинов, адгезии полиморфноядерных нейтрофилов к эндотелию капилляров легких, ингибирования компонентов сурфактанта токсичными продуктами и белками плазмы крови.
Препараты сурфактанта назначают при СОПЛ, явившемся результатом острой двусторонней крупноочаговой пневмонии, бронхолегочной дисплазии, мигрирующего долевого ателектаза легких, асфиктических состояний из-за утопления, инфекционно-токсического шока и пр. Применение сурфактанта в названных ситуациях способствует улучшению газообмена в легких, что проявляется в нормализации газового состава крови (рОг, рСО2), в увеличении легочной растяжимости, улучшении рентгенологической картины легких, в более раннем прекращении вдыхания' высоких концентраций кислорода и в укорочении общей длительности искусственной вентиляции легких. Все это приводит к ускорению выздоровления детей, к снижению летальности от тяжелейших расстройств дыхания.
В России с успехом применяют отечественные препараты сурфактанта HL (из амниотической жидкости рожениц) и BL (из легких крупного рогатого скота). Назначают их в виде суспензии, приготовленной непосредственно перед употреблением. Вводят ее либо путем инстилляции, длящейся около 20 мин на фоне продолжающегося вдыхания 100% кислорода (то есть без разгерметизации дыхательного контура), либо ингаляцией через альвеолярный небулайзер в течение 120 мин. Второй способ предпочтительнее.
Препараты не вызывают аллергических и иных нежелательных эффектов.
СРЕДСТВА, УСТРАНЯЮЩИЕ ПЕРИОДИЧЕСКОЕ ДЫХАНИЕ И АПНОЭ У НЕДОНОШЕННЫХ ДЕТЕЙ
Для этих целей применяют кофеин и эуфиллин (см. гл. 3).
Лекарственные формы и дозы для детей средств, устраняющих нарушения дыхания в период новорожденности, представлены в табл. 29.
149
Таблица 29
Препараты для устравения апноэ недоношенных
Препарат Форма выпуска Путь введения Число введений в сутки Суточная доза
Эуфиллин Euphyllinum 24% раствор в ампулах по 1 мл Внутривенно Внутрь 1 2-3 Насыщающая доза: 7 мг/кг — одномоментно, 10 мг/кг в течение 30 мин Поддерживающая доза1: 2 мг/кг/сут
Кофеин Coffeinum Порошок То же » 1 1 Насыщающая доза2: 10 мг/кг Поддерживающая доза1: 2,5 мг/кг
Примечание. 1. Первый раз поддерживающую дозу назначают через 24-48 ч после насыщающей. 2. Доза кофеина-основания (=18 мг/кг кофеина-салинилата натрия).
г>
Глава 15 ПРОТИВОКАШЛЕВЫЕ СРЕДСТВА
Препараты этой группы подавляют кашель — защитный механизм удаления содержимого из бронхов. Частый и упорный кашель, особенно в виде длительных приступов, сопровождается повышением внутригрудного давления и может способствовать постепенному развитию гипертензии в малом круге кровообращения, эмфиземы легких, формированию легочного сердца.
Применение противокашлевых средств целесообразно в тех случаях, когда кашель неэффективен или даже способствует ретроградному движению секрета в глубь легких (при хроническом бронхите, эмфиземе, муковисцидозе), а также при рефлекторном кашле, возникшем из-за раздражения слизистой оболочки воспалительным процессом.
К препаратам, обладающим прямым противокашлевым действием, относят:
1. Лекарственные средства, действующие на кашлевый центр:
а) Ненаркотические противокашлевые препараты (глауцина гидрохлорид и глаувент), вызывающие противокашлевое, гипотензивное и спазмолитическое действие, не угнетающие дыхание, не тормозящие моторику кишечника, не вызывающие привыкания и лекарственной зависимости.
б) Наркотические противокашлевые препараты (кодеин, эстоцин, дионин, морфин), подавляющие кашлевой рефлекс, угнетая кашлевой и дыхательный центры в продолговатом мозге. К ним развивается привыкание и пристрастие.
2. Лекарственные препараты, подавляющие чувствительные рецепторы в бронхах или действующие на афферентные пути регуляции дыхания.
Местные анестетики (лидокаин), фалиминт, препараты смешанного действия (л и бе кс ин, тусупрекс).
Глауцин — алкалоид из растения мачек желтый (Glaueium flavum). Он угнетает кашлевой центр, успокаивающе действует на центральную нервную систему, ослабляет спазм гладкой мускулатуры бронхов при бронхитах. Глауцин назначают для подавления кашля при трахеитах, фарингитах, острых бронхитах, коклюше. После его введения не отмечают угнетения дыхания, задержки от-150
деления секрета из бронхов и отхаркивания мокроты, нарушений функции кишечника. Дети хорошо переносят препараты: лишь иногда у них может немного понизиться артериальное давление, что связано с блокадой «-адренорецепторов, возникнуть головокружение, тошнота.
Либексин — синтетический препарат, действующий и центрально, и периферически. Он подавляет активность кашлевого центра, устраняет спазм бронхов, блокирует рецепторы напряжения в бронхах и легких. По противо-кашлевой активности либексин соответствует кодеину, но не вызывает пристрастия и не угнетает дыхание.
Либексин хорошо подавляет кашель у детей с трахеитами, бронхитами, бронхиальной астмой, эмфиземой и др. После его приема облегчается отделение мокроты. Либексин широко применяют у детей и у взрослых, так как он не нарушает функцию печени, почек, центральной нервной системы. Но его не рекомендуют назначать больным с гипотензией, а также детям с обильным отделением мокроты.
Тусупрекс (окселадин) преимущественно влияет на кашлевой центр, не угнетая дыхательный и сосудодвигательный центры. Применяют его для успокоения кашля при заболеваниях легких и верхних дыхательных путей.
Фалиминт оказывает местноанестезирующее и дезинфицирующее действие на слизистую оболочку полости рта и носоглотки, уменьшая при воспалении возникновение с них рефлексов и кашель.
Наркотические противокашлевые средства содержат алкалоиды опия или синтетические аналоги морфина. Они легко угнетают дыхание, понижая чувствительность дыхательного центра к углекислоте, одновременно они повышают возбудимость других отделов центральной нервной системы и при передозировке могут вызвать и резкое нарушение дыхания, и тоникоклонические судороги. Эти препараты противопоказаны детям до 2 лет.-
Детям старше 2 лет наркотические противокашлевые средств (Кодеин, этил-морфин, эстоцин) назначают только в случае очень тяжелого сухого кашля, не устраняемого другими препаратами. Угнетая дыхательный центр, они ограничивают объем дыхания, способствуют задержке углекислоты и возникновению ацидоза. Это нежелательно при эмфиземе, пневмонии, бронхиальной астме и других заболеваниях, сопровождающихся нарушением вентиляции легких. Под влиянием наркотических противокашлевых средств повышается тонус гладкой мускулатуры бронхов, снижается активность волосков мерцательного эпителия и ухудшается удаление мокроты из бронхов. При длительном применении (более недели) кодеин и другие препараты этой группы могут вызвать пристрастие. В связи с этим особую осторожность следует соблюдать при их назначении подросткам. Лекарственные формы и дозы противокашлевых средств для детей представлены в табл. 30.
Таблица 30
Противокашлевые препараты
Препарат Форма выпуска Путь введения Число приемов в сутки Однократная доза
Глауиина гидрохлорид Glaucini hydroch-loridum Таблетки по 0,05 г Внутрь 3 До 2 лет не назначать, после 2 лет — 1 мг на 1 год жизни
151
Окончание табл. 30
Препарат Форма выпуска Путь введения Число приемов в сутки Однократная доза
Либексин Libexinum Таблетки по 0,1 г То же 3 До 2 лет — 0.025 г; после 2 лет — 0,05 г
Тусупрекс Tusuprex Таблетки по 0,01 и 0,02 г; сироп по 0,01 гв 1 мл 3—4 До 2 лет — 0,005 г; после 2 лет — 0,01 г
Фалиминт Falimint Драже по 0,025 г 4-8 0,025 г
Эстоцин Aestocinum Порошок, таблетки по 0,005 г « 2-3 До 2 лет не назначать, от 2 до 4 лет — 0,005 г, старше 4 лет — 0,01 г
Глава 16 ОТХАРКИВАЮЩИЕ СРЕДСТВА
Лекарственные средства этой группы могут облегчить отхаркивание мокроты, способствуя либо отделению жидкой мокроты, либо разжижая ее (т. е. вызывая муколитический эффект).
К веществам, увеличивающим отделение жидкой мокроты, относят препараты растительного происхождения и синтетические средства. Механизм их действия может быть различным.
Ряд препаратов этой группы, полученных из рвотного корня, из корней алтея, солодки, из травы термопсиса, а также синтетический препарат — терпингидрат, вызывают небольшое раздражение слизистой оболочки желудка, что рефлекторно повышает возбудимость рвотного центра. Рвоты при этом не возникает, но повышается секреция жидкой слизи в дыхательных путях, активность мерцательного эпителия, удаляющего содержимое из мелких бронхиол в более крупные и в трахею (мукоцилиарный клиренс), усиливаются перистальтические движения гладкой мускулатуры бронхов. В результате и облегчается отхаркивание мокроты, удаление ее из бронхов.
Однако к применению настоев из рвотного корня и травы термопсиса надо относиться внимательно. При их передозировке у ребенка может возникнуть рвота. Кроме того, в связи с содержанием в термопсисе цитизина (Н-холино-миметического алкалоида) высокие его дозы могут вызвать у ребенка кратковременную стимуляцию дыхания, сменяющуюся затем его угнетением.
Увеличивают секрецию жидкой мокроты йодиды калия и натрия, гидрокарбонат натрия, секретирующиеся слизистой оболочкой бронхов. Аналогичный эффект вызывают эфирные масла плодов аниса, трав багульника, душицы и пр. После всасывания в желудочно-кишечном тракте они экскретируются слизистой оболочкой бронхов, вызывая ее раздражение, что и увеличивает секрецию жидкой мокроты и повышает мукоцилиарный клиренс содержимого бронхов.
Препараты, содержащие йод, нельзя назначать беременным женщинам и матерям, кормящим грудным молоком своих детей. Попадая через плаценту 152
или с молоком к ребенку, йодиды угнетают функцию щитовидной железы, вызывая гипотиреоз, нарушающий последующее развитие ребенка, и увеличение размеров щитовидной железы (что затрудняет роды и может сдавить трахею ребенка).
Муколитические средства разжижают густую мокроту, облегчая этим ее удаление из просвета бронхов и устраняя в них питательную среду для микроорганизмов.
Наиболее часто из этих средств применяют бромгексин (бисольвон) (см. гл. 14), фрагментирующий мукопротеины и кислые мукополисахариды бронхиального секрета, снижая этим его вязкость. К тому же он активирует мерцательный эпителий бронхов, может повыситься содержание в мокроте JgG, лизоцима, секреторного JgA, сурфактанта. Все это не только облегчает удаление (отхаркивание) мокроты, но и способствует выздоровлению детей с бронхолегочными заболеваниями, например с затяжной и хронической пневмонией, рецидивирующим и астматическим бронхитом, легочной и смешанной формой муковисцидоза и пр.
Осложнений бромгексин обычно не вызывает.
Бромгексин может содержаться в различных официальных препаратах, например в бронхосане, содержащем кроме него препараты нескольких растений. Назначают его детям любого возраста каплями.
М е с н а (мистаброн) содержит сульфгидрильные группы, приводя к разрыву дисульфидных связей в слизистом секрете дыхательных путей, вызывает муколитический эффект, облегчая отхаркивание. Используют его в виде ингаляций при муковисцидозе, бронхиальной астме, астматическом бронхите, бронхоэктазах и пр. ;
Прием препарата иногда вызывает тошноту, рвоту, диарею, чувство жжения за грудиной, могут быть аллергические реакции.
Колдрекс бронхо (гуаифенезин) — отхаркивающее средство, уменьшающее поверхностное натяжение и адгезивные свойства мокроты, чем снижает ее вязкость и облегчает удаление из дыхательных путей. Хорошо всасывается из желудочно-кишечного тракта, подвергается биотрансформации в печени, метаболиты выводятся почками. При приеме иногда наблюдают тошноту, рвоту, диарею.
Ацетилцистеин (мукомист, ацетеин,^флуимуцин) — дезинтегрирует дисульфидные группы мукополисахаридов, уменьшая этим вязкость мокроты, ее прилипаемость к поверхности бронхов, особенно он показан детям с муковисцидозом, в бронхиальном секрете которых чрезмерно высоко содержание гликопротеинов с ненормальным соотношением гидрофильных и гидрофобных компонентов. Кроме того, назначение ацетилцистеина таким детям вызывает разжижение желчи, исчезновение холестаза, уменьшение размеров печени, улучшение пищеварения. Но препарат назначают и при другой патологии, например, при пневмонии, бронхиальной астме и пр.
Применяют ацетилцистеин в виде аэрозоля или внутримышечно 1-2 раза в день; курс лечения от 8-14 ингаляций (при пневмонии) до 20-30 ингаляций (при муковисцидозе).-
У ацетилцистеина неприятный запах, и у некоторых больных он может вызвать тошноту. Иногда он провоцирует бронхоспазм, легочные геморрагии.
Карбоцистеин (бронкатар) активирует сиаловую трансферазу бокаловидных клеток слизистой оболочки бронхов, нормализуя этим соотношение кислых и нейтральных сиаломукоидов в бронхиальном секрете, вязкость и
153
эластичность слизи. После его приема уменьшается число бокаловидных клеток, восстанавливается секреция JgA, содержание сульфгидрильных групп в слизи. В результате облегчается отхаркивание содержимого из бронхов.
Его применяют при бронхитах, трахеобронхитах, ринитах, отитах. Он повышает эффективность противомикробных средств, ускоряет заживление патологических изменений в слизистых оболочках дыхательных путей.
Назначают его детям любого возраста в виде сиропа. Он хорошо всасывается из желудочно-кишечного тракта, 80% выводится почками в неизмененном виде, остальное в виде метаболита. Длительность лечения от 8 дней до 3 нед в зависимости от характера заболевания. При приеме препарата могут быть боли в животе, тошнота, рвота; снижение дозы ликвидирует эти осложнения. Препарат нельзя назначать больным язвенной болезнью желудка и двенадцатиперстной кишки. В первые дни приема препарата может быть увеличение отделения мокроты.
Назначая детям с сахарным диабетом, следует учесть содержание в препарате сахарозы.
Ферментные препараты', трипсин, рибонуклеазы.
Трипсин — протеолитический фермент, получаемый из поджелудочной железы крупного рогатого скота; -расщепляет молекулы белков, полипептидов, фибринные сгустки, находящиеся на поверхности поврежденных (некротизированных) тканей; на нормальные ткани не влияет.
В качестве лекарства обычно применяют трипсин кристаллический в виде аэрозоля или раствора для внутримышечных инъекций.
Применяют его при наличии гнойной мокроты, нарушающей проходимость дыхательных путей. Помимо разжижения мокроты, он вызывает противовоспалительный эффект. Для улучшения последующего удаления разжиженной мокроты хорошо одновременно применять бронхолитические средства. После ингаляции необходимо тщательно прополоскать рот и промыть нос.
Рибонуклеаза аморфная — ферментный препарат из поджелудочной железы крупного рогатого скота. Она деполимеризует РНК до кислоторастворимых моно- и олигонуклеотидов, разжижает гной, слизь, густую мокроту. Тоже способна подавлять воспаление.
При патологии дыхательных путей ее применяют в виде аэрозоля 1 раз в день: курс лечения 1-10 ингаляций.
Лекарственные формы и дозы отхаркивающих средств см. в табл. 31.
Таблица 31
Отхаркивающие средства
Препарат Форма выпуска Путь введения Число приемов в сутки Однократная доза
Корень алтея Radix Althaeae Отвар (из 3,0 г на 100 мл) Внутрь 4-5 По 1 чайной, десертной, столовой ложке
Мукалтин Mucaltinum Таблетки по 0,05 г с добавлением 0,087 г натрия гидрокарбоната и 0,16 г винной кислоты То же 4-5 По 1-2 таблетки на прием. Таблетку можно растворять в 1/3 стакана теплой воды, добавляя сахарный сироп. Выпить перед едой
.154
Пролоджение табл. 31
Препарат Форма выпуска Путь введения Число приемов в сутки Однократная доза
Трава термопсиса Herba Thermopsidis Настой (из 0,1 г на 100 мл) Настой (из 0,2 г на 100 мл) Внутрь 3 До 2 лет — по 1/2—1 чайной ложке; после 2 лет — по 1/2—1 чайной, столовой, десертной ложке
Пертуссин Pertiissinum Флаконы по 100 мл То же 3 По 1/2 чайной, десертной ложке
Капли нашатырно-анисовые Liquor ammonii anisatis Жидкость « 2-3 1 капля на год жизни, но не более 15 капель
Эликсир грудной Elixir pectoralis Флаконы по 25 мл « 3-4 1 капля на год жизни
Терпингидрат Terpinum hydratum Порошок и таблетки по 0,25 и 0,5 г (с содой) « ' 3 25 мг на год жизни
Калия йодид Kalii jodidum 1—3% водный раствор « 2-3 По 1 чайной, десертной, столовой ложке
Натрия бензоат Natrii benzoas В микстуре (с термопсисом или алтеем) « 3 0,02 г на 1 год жизни (не более 0,2—0,3 г подросткам)
Ацетил цистеин Acetylcysteinum 20% раствор в ампулах по 5 и 10 мл Ингаляционно 5% или 10% раствор, полученный разведением офици-нального раствора изотоническим раствором натрия хлорида 1-2 2,5-3 мл (5% или 10% раствора)
10% раствор в ампулах по 1 мл Внутримышеч-но О 2 Детям до 1 года — 10-15 мг/кг; детям старше 1 года — по 0,5-1,0 мл
Бромгексин Bromhexinum Таблетки по 0,004 г Внутрь 3 Детям в возрасте от 2 до 5 лет — по 0,002 г; от 6 до 14 лет — по 0,004 г. Детям в возрасте до 2 лет не назначают
Трипсин Trypsinum Флаконы по 5 или 10 мг сухого вещества, перед употреблением 10 мг растворяют в 2-3 мл изотонического раствора натрия хлорида Ингаляционно 1 По окончании ингаляции удалить остатки вещества (отхаркиванием и откашливанием)
155
Окончание табл. 31
Препарат Форма выпуска Путь введения Число приемов в сутки Однократная доза
Бронкатар Bronkotar Сироп во флаконах по 125 мл, в 5 мл — 100 мг Внутрь 3 До 5 лет — 1—2 чайные ложки в сутки); старше 5 лет — 3 чайные ложки в сутки
Бронхосан Bronchasan Жидкость во флаконах по 25 мл Внутрь 4 До 2 лет — по 5 капель; 2—6 лет — по 10 капель; старше 10 лет — по 20 капель
Месна Mesna Раствор для ингаляций в ампулах по 2 мл Ингаляции Индивидуально То же
Колдрекс-бронхо Coldrex-broncho Сироп во флаконах по 100 и 160 мл, в 5 мл (чайной ложке) — 100 мг Внутрь Каждые 2-3 ч Детям 3—12 лет по 5 мл; детям старше 12 лет — по 10 мл
Глава 17 БРОНХОЛИТИЧЕСКИЕ СРЕДСТВА
Бронхолитические средства — это средства, устраняющие спазм гладкой мускулатуры бронхов. Они рассмотрены в других главах: теофиллин и его препарат эуфиллин в главе 3, p-адреномиметики — в главе 2, атровент — в главе 1, блокаторы кальциевых каналов — в главах 22, 23.
Одновременно с ними при тяжелом астматическом состоянии применяют глюкокортикоиды (см. гл. 31). Для профилактики приступа бронхиальной астмы применяют кромолин натрия и кетотифен (см. гл. 40).
Применяют и комбинации этих препаратов: фенотерол с кромогликатом натрия — дитэк, фенотерол с ипратропия бромидом — беродуал, салбу-тамол с кромогликатом натрия — интал плюс> салбутамол с ипратропия бромидом — комбивент. Все эти препараты применяют в форме аэрозоля.
Глава 18 ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ, ПРИМЕНЯЕМЫЕ ПРИ ОТЕКЕ ЛЕГКИХ <
Основными причинами отека легких являются острая левожелудочковая недостаточность и токсическое действие на легочную ткань. После проведения мероприятий по устранению этих причин больным назначают пеногасители. К ним относят антифомсилан (кремнеорганический полимер) и этанол (табл. 32). Оба препарата наливают в банку Боброва, содержащую теплую (24-25° С) воду (высота ее столба не должна быть менее 15 см), через которую пропускают газовую смесь с дополнительным содержанием кислорода (для его 156
увлажнения). Оба препарата понижают поверхностное натяжение жидкостей, прекращая образование пены. Это имеет очень большое значение, так как отечной жидкости в легких может быть и немного, но образовавшаяся пена заполняет все дыхательные пути, нарушая прохождение воздуха и газообмен. Эффект антифомсилана возникает через 3—4 мин, а этанола — через 20—30 мин.
Кроме того, при отеке легких, возникшем из-за сердечной недостаточности, вводят внутривенно: фуросемид (см. гл. 25), строфантин струйно медленно (см. гл. 19), ганглиоблокаторы (см. гл. 1) и (или) нитроглицерин (см. гл. 21).
При токсическом отеке легких с нормально функционирующим сердцем вместо фуросемида назначают маннит — струйно (см. гл. 25).
Пеногасители
Таблица 32
Препарат Лекарственная форма Путь введения Число введений в сутки
Антифомсилан Antifomcilanum 10% раствор наливают в банку Боброва Ингаляции в течение 15 мин До 3 раз
Этанол Aethanolum 30—40% раствор наливают в банку Боброва То же То же
Глава 19 СЕРДЕЧНЫЕ ГЛИКОЗИДЫ
Сердечные гликозиды — безазотистые соединения растительного происхождения, характеризующиеся кардиотоническим действием. Данные препараты играют исключительно важную роль в терапии больных с острой и хронической сердечной недостаточностью любого генеза. Названная патология занимает одно из первых мест в общей структуре заболеваемости у детей, подростков и взрослых, а также среди причин смертности и инвалидности людей.
Сердечные гликозиды содержатся в неш^льких видах наперстянки (шерстистая, пурпуровая, ржавая и пр.), ландыше майском, горицвете весеннем, строфанте, обвойнике греческом, морском луке, олеандре, желтушнике раскидистом и других растениях. Из них основное значение имеет наперстянка. Из ее листьев получают химически чистые гликозиды-, дигитоксин (из наперстянки пурпуровой), дигоксин, целанид (изоланид) и аце-тилдигитоксин(адацин)(из наперстянки шерстистой). К числу химически чистых препаратов относится и строфантин, получаемый из семян тропических многолетних лиан — строфанта гладкого и строфанта Комбе. Выпускают их в виде таблеток и ампулированных растворов, содержащих точно известные количества активного вещества без каких-либо примесей. Но наряду с ними выпускают и новогаленовые препараты: кор гл икон из листьев майского ландыша, содержащий сумму его гликозидов, основным из которых является конваллятоксин; адонизид из травы горицвета весеннего, содержащий гликозиды цимарин и адонитоксин. Они тоже очищены от примесей, но не строго дозированы. Очень редко-, но все же принимают и галеновый препарат — порошок из высушенных листьев наперстянки
157
(пурпуровой), содержащей не только ее гликозиды, но и балластные вещества (сапонины и др.), способные раздражать слизистую оболочку желудбйно-ки-шечного тракта и нарушать всасывание гликозидов. Основной недостаток новогаленовых препаратов заключается в их непостоянной активности; Начинают входить в практику полусинтетические сердечные гликозиды, получаемые путем включения активных радикалов в естественные гликозиды. К числу таких препаратов относятся: бета-метилдигоксин, строфантидина ацетат и др.
У всех сердечных гликозидов принципиально одинаковое химическое строение: Молекула состоит из двух частей: сахаристой (гликона) и несахаристой (агликона) (см. рис. 25). Носителем биологической активности гликозидов является агликон, в котором различают два циклических компонента: стероидный (циклопентанпергидрофенантрен) и лактоновый. Если в молекуле лактоновое кольцо пятичленное, то гликозид называют карденолидом; если оно шестичленное, то его называют буфадиенолидом, так как они обнаружены в секрете из кожных желез жаб (Bufo). Молекулы агликона могут быть полярными и неполярными в зависимости от количества в них полярных (кетоновых и спиртовых) групп. Полярные гликозиды (строфантин, конваллятоксин) содержат по 4—5 таких групп, относительно полярные (дигоксин, целанид) -г по 2—3 группы, а неполярные (дигитоксин) — не более одной. Чем более полярна молекула, тем больше ее растворимость в воде и меньше — в липидах. Это имеет существенное значение для фармакокинетики препаратов и даваемых ими эффектов. По степени растворимости в липидах сердечные гликозиды можно расположить в следующем порядке: дигитоксин > ацедоксин > бета-метилдигоксин > дигоксин > целанид > строфантин >конваллятоксин.
Гликон у большинства гликозидов представлен либо специфическими (Д-Дигитоксоза, Д-цимароза, Д-олеандроза и др.), либо неспецифическйми (Д-глюкоза, Д-рамноза, Д-ксилоза, Д-фруктоза) широко распространенными в природе сахарами. От гликона также в определенной степени зависят фармакокинетические свойства сердечных гликозидов и их активность.
Рис. 25. Химическая структура сердечных гликозидов
Карденолиды
Буфадиенолиды
158
Фармакокинетика. Путь введения сердечных гликозидов. Внутрь вводят только неполярные хорошо всасывающиеся гликозиды: дигитоксин, дигоксин, ацедок-син, бета-метилдигоксин; полярные же, плохо всасывающиеся, — строфантин, конваллятоксин, назначают только парентерально, в основном внутривенно.
Поскольку сердечные гликозиды, с одной стороны, оказывают раздражающее действие на слизистую оболочку желудочно-кишечного тракта, а с другой, — могут образовать невсасывающиеся комплексы с компонентами пищи, рекомендуется их назначать внутрь через 1—1,5 ч после еды.
Всасывание галеновых препаратов происходит хуже химически чистых гликозидов, так как балластные вещества, содержащиеся в них, задерживают усвоение сердечных гликозидов. При застое в системе воротной вены всасывание названных веществ происходит очень медленно, особенно если они применяются в виде порошка листьев наперстянки.
Ректально сердечные гликозиды в настоящее время практически не применяют, так как имеется большой выбор препаратов для инъекций. К тому же всасывание сердечных гликозидов из прямой кишки происходит медленно, а раздражение слизистой оболочки может быть интенсивным.
Растворимые в воде сердечные гликозиды (строфантин, дигоксин, изоланид) при острой сердечной недостаточности вводят внутривенно. Перед введением ампулированный раствор препарата разводят в 10—20 мл изотонического раствора натрия хлорида (0,85%) или глюкозы (5%).
Более высокая концентрация гликозида в крови после введения в вену и быстрое ее достижение, с одной стороны, способствует скорейшему появлению терапевтического эффекта, а с другой, — усиливают опасность передозировки и появления интоксикации. Поэтому необходимо вводить препарат медленно; даже в самых экстренных случаях введение должно продолжаться 2—5 мин, чтобы успело произойти разведение препарата во всей массе циркулирующей крови. При резком снижении артериального давления и спадении вен раствор сердечных гликозидов детям иногда вводят в уздечку языка (объем раствора не должен превышать 1-2 мл). Эта область имеет хорошее кровоснабжение, и всасывание произойдет быстро. Иногда строфантин И дигоксин вводят внутримышечно. Но этот способ введения малорационален, так как всасывание гликозидов происходит медленно, а в мышце возникают деструктивные изменения, и сама инъекция очень болезненна. •
В крови сердечные гликозиды могут найдиться в свободной и связанной с белками (преимущественно с альбуминами) форме. При этом следует отметить строгую закономерность: чем менее полярен гликозид, тем больше он связан с белками плазмы.
В связи с этим строфантин и конваллятоксин (содержащийся в коргликоне) очень быстро попадают в ткани из кровеносного русла, с чем и связано быстрое начало их действия.
Низкое содержание белков в плазме крови детей, особенно альбуминов, а также у больных при патологии печени и почек (нефротический синдром, гепатит) уменьшает связанную фракцию сердечных гликозидов, что сказывается на их дальнейшей кинетике и эффективности.
Неодинаковая способность разных гликозидов связываться с белками плазмы определяет и разную скорость поступления их в ткани, так как проникает только свободная фракция названных веществ.
Сердечные гликозиды поступают практически во все ткани организма, хотя и в разной степени, что связано с неодинаковым кровоснабжением тканей,
159
разным содержанием в них липоидов и белков, качеством этих Компонентов в тканях, наличием в них специальных рецепторов, а также с физико-химическими свойствами самих препаратов.
Скорость распределения и связывания сердечных гликозидов в тканях может меняться при патологических состояниях. Например, при тиреотоксикозе она повышена, а при гипотиреозе — снижена. Соответственно и концентрация дигоксина в плазме таких больных ниже или выще, чем у людей с нормально функционирующей щитовидной железой.
Сердечные гликозиды накапливаются в скелетных мышцах, связываясь с их белками. В них возникает своеобразное депо названных веществ. У истощенных больных с плохо развитой мускулатурой или у детей с меньшим содержанием мышечной ткани в организме <25% у новорожденных и 43% у взрослых) уровень сердечных гликозидов, в том числе и величина свободной фракции в плазме крови, оказываются выше, чем у людей с хорошо развитой мускулатурой.
Элиминация сердечных гликозидов осуществляется путем биотрансформации и экскреции препарата печенью, почками и кишечником.
В табл. 33 представлены основные показатели кинетики четырех наиболее применяемых сердечных гликозвдов.
Таблица 33
Степень нсасывания, нремя наступления максимального эффекта и продолжительность пребывания различных препаратов сердечных гликозидов в организме человека
Препарат Всасывание из ЖКТ, % Начало эффекта Связывание с белками плазмы крови, % Коэффициент элиминации1
прием внутрь внутривенное введение, мин
Дигитоксин 100 1-1,5 ч 60-90 95-97 7
Дигоксин 80-100 1,5-2 ч 30-40 20-30 20
Строфантин 5-8 Эффекта нет 5-10 Практически не связывается 40
Коргликон 3-5 То же 3-5 То же 100
Примечание. 1. Количество препарата, выводимого за сутки, в процентах от его величины, находящейся в организме.
Фармакодинамика. К числу основных лечебных эффектов названных препаратов следует отнести: положительный инотропный (увеличение силы сердечных сокращений) и отрицательный хронотропный (урежение частоты сердечных сокращений).
Сердечные гликозиды взаимодействуют с сарколёммной Na+, К+-АТФазой, являющейся рецептором для эндогенных дигиталисоподобных веществ — кар-диодигинов. Кардиодигины — олигопептиды, вырабатывающиеся в гипоталамусе, их структура и функция сейчас интенсивно изучается. Положительный инотропный эффект гликозидов обусловлен угнетением Na+, К+-АТФазы примерно на 35%. Следует подчеркнуть, что у детей сродство рецепторов к сердечным гликозидам меньше, чем у взрослых.
Существует ряд представлений о возможном механизме ингибирования Na', К+-АТФазы сердечными гликозидами:
160
1) прямое влияние, например, за счет нарушения связывания АТФ с молекулой фермента; 2) аллостерическое влияние, например, гликозид может связаться с. фосфолипидами мембраны непосредственно вблизи от активных центров фермента и этим изменить его конформацию и подвижность.
Торможение Na+, К+-насоса приводит к увеличению внутриклеточного Na+ и в связи с этим Са2+, за счет активности Na+, Са2+ обменного механизма. В концентрации более 10-6 М в цитоплазме Са2+ устраняет тропомиозиновую депрессию актомиозина, активирует АТФазу миозина, следствием чего и является увеличение силы сокращений миофибрилл. При уменьшении тормозящего влияния сердечных гликозидов — эффект исчезает, а при угнетении активности фермента более чем на 60% появляется токсический эффект.
Сердечные гликозиды увеличивают поступление Са2+ в кардиомиоциты также за счет других механизмов:
1. Гликозиды вызывают конформационные изменения компонентов клеточной . мембраны, нарушая этим удержание Са2+ в мембранных пулах и делая мембрану более проницаемой для неро.
2. Проникая внутрь клетки, сердечные гликозиды увеличивают мобилизацию внутриклеточного Са2+ из саркоплазматического ретикула и митохондриальных мембран.
3. Сердечные гликозиды обеспечивают транспорт Са2+ в клетку за счет образования с ним во внеклеточной среде хелатных комплексов.
Сердечные гликозиды влияют и на уровень внутриклеточного К+, играющего важную роль в синтезе макроэргов, сократительных белков, в поляризации клеточных мембран, ликвидации внутриклеточного ацидоза и внеклеточного алкалоза.
Угнетая Na+, К+-АТФазу в миокарде и других тканях (в частности, в скелетных мышцах), они нарушают этим возврат К+ в клетку, что может привести к гипокалигистии, наблюдаемой от приема токсических доз. Снижая поступление К+ в клетку, сердечные гликозиды увеличивают его внеклеточный уровень, приводя к гиперкалиемии.
Между тем терапевтические дозы сердечных гликозидов увеличивают содержание этого иона в клетке. Сказывается ликвидация сердечными гликозидами гиперадьдостеронемии, имеющей место при сердечной недостаточности.
Улучшение гемодинамики способствует ь^таболизму альдостерона в печени, снижению секреции ренина, активирующего ангиотензин — альдостероновую систему, а также за счет снижения реакции почек на минералокортикоиды (проявление антагонизма с этими гормонами). Нормализация уровня минералокортикоида в организме устраняет чрезмерную экскрецию К+, что сопровождается возрастанием содержания данного иона в плазме крови и в тканях.
Существенное значение в фармакодинамике сердечных гликозидов имеет и их способность нарушать обратный захват катехоламинов пресинаптическими окончаниями адренергических нервных волокон и увеличивать их высвобождение из лабильного депо. Обнаружено, что гликозиды повышают активность и других медиаторов (см. ниже). Это нейротропное действие сказывается на деятельности сердечно-сосудистой и нервной систем.
Только что рассмотренные механизмы воздействия сердечных гликозидов на обмен Са2+, Na+, К+, энергетический баланс клеток и др. являются основой их кардиотонического действия.
Увеличивая силу сердечных сокращений, другими словами, ликвидируя ги-посистолию у больных с сердечной недостаточностью, сердечные гликозиды
6 Зак. 3856
161
одновременно вызывают брадикардию, то есть отрицательный хронотропный эффект.
Урежение сокращений в основном связано со стимулирующим влиянием более сильной ударной волны крови, выбрасываемой из сердца, на барорецепторы дуги аорты и каротидного синуса, с которых импульсы поступают к центру блуждающего нерва. Рефлексы с барорецепторов потенцируются нейротропными эффектами сердечных гликозидов. Они сенситизируют барорецепторный механизм в каротидном синусе и в афферентных волокнах, идущих от названных рецепторов, регистрируется учащение спонтанной импульсации. В результате активируется центр блуждающего нерва, возрастает импульсация по его эфферентным холинергическим волокнам, иннервирующим сердце. Параллельно сердечные гликозиды увеличивают освобождение ацетилхолина из окончаний и возникает вагомиметичёский эффект. В результате замедляется синусовый ритм и атриовентрикулярное проведение, подавляется автоматизм в эктопических очагах предсердий, укорачивается период рефрактерное™ мышечных клеток предсердий. Кроме того, сенситизация барорецепторов усиливает тормозящее влияние идущей от них импульсации на гипоталамические отделы, что уменьшает поток симпатических импульсов к сердцу. Это также способствует замедлению ритма, проводимости и понижению возбудимости.
По выраженности положительного инотропного и отрицательного хронотропного действия сердечные гликозиды отличаются друг от друга (см. табл. 34).
Допускают, что эти различия отчасти связаны с неодинаковым вмешательством сердечных гликозидов в функцию медиаторных систем. Например, у части больных с сердечно-сосудистой патологией нарушена функция блуждающего нерва; у них брадикардия выражена в меньшей степени или полностью отсутствует.
Таблица 34
Распределение сердечных гликозидов в порядке убывание степени выраженности положительного инотропного и отрицательного хронотропного эффектов
Положительный инотропный эффект Отрицательный хронотропный эффект
Строфантин Дигитоксин
Изолан ид Ацедоксин
Дигоксин Дигоксин
Ацед оксин Изоланид
Дигитоксин Строфантин
Огромная значимость сердечных гликозидов заключается в том, что, увеличивая силу и уменьшая частоту сердечных сокращений больного сердца, эти препараты одновременно снижают его потребность в кислороде и расходование энергии. Как было сказано выше, с одной стороны, под влиянием сердечных гликозидов происходит нормализация энергетического обмена за счет прямого и опосредованного (через калий) влияния на последний. Этому способствует и увеличение диастолы, во время которой происходит доставка к сердечной мышце кислорода и необходимых ей питательных веществ. С другой стороны, компенсированный недостаток энергии нормализует работу ионных насосов, обеспечивающих удаление Са2+ из цитоплазмы клетки во внеклеточное прост-162
обеспечивающих удаление Са2+ из цитоплазмы клетки во внеклеточное пространство (экструзию), а также в саркоплазматический ретикулум и митохондрии (секвестрацию). Этим гликозиды ликвидируют неполное расслабление во время диастолы (гиподиастолию), а следовательно, неоправданный расход энергии. Кроме того, устраняется вызываемая кальцием активация протеолитических ферментов, приводящая к возникновению микронекрозов.
Более сильные сокращения сердца полнее выталкивают кровь из его полостей, уменьшается остаточный объем крови, растяжение миокарда, а в связи с этим и затраты энергии на его сокращение.
Итак, сердечные гликозиды в терапевтических дозах вызывают положительный инотропный и отрицательный хронотропный эффекты. При этом увеличивается минутный объем сердца, что может повысить общее артериальное давление, особенно если оно было низким у больного с сердечной недостаточностью. Одновременно происходит разгрузка венозной части большого круга кровообращения и снижается венозное давление в нем. Это уменьшает приток крови к сердцу (то есть преднагрузку), его растяжение во время диастолы, а следовательно, и напряжение, которое необходимо производить мышце сердца для выталкивания крови из его полостей. В результате уменьшается остаточный объем крови, снижается ее давление на стенку желудочков во время диастолы, устраняется сдавление сосудов под эндокардом, улучшается кровообращение сердца, устраняется его ишемия. Это в свою очередь улучшает обмен миокарда, сдвигая его в аэробную сторону и увеличивая образования АТФ.
Улучшение кровотока в большом круге кровообращения способствует разгрузке малого круга, снижению давления в его сосудах; при этом уменьшается опасность усиленной эксудации жидкости в просвет альвеол (то есть отека легких) и улучшается газообмен. В результате в артериальной крови содержание кислорода возрастает, а углекислоты — снижается; исчезает цианоз, снижается возбудимость дыхательного и сосудодвигательного центров. Это устраняет одышку у больных с тяжелой степенью сердечной недостаточности и высокое периферическое сопротивление сосудов (jo есть постнагрузку). Дыхание у больного становится реже и глубже, нормализуется скорость кровотока. Это улучшает доставку кислорода тканям, ликвидирует в них гипоксию и метаболический ацидоз.
Улучшение гемодинамики, в частности, уменьшение застоя в венах большого круга кровообращения не только уменьшает образование отеков, но и в связи со снижением гидростатического давления способствует их рассасыванию. В почках усиливается процесс фильтрации и образования первичной мочи. Как указывалось выше, снижается активность альдостерона, то есть его способность задерживать натрий и воду в организме, выводить калий, в результате чего увеличивается диурез, натрийурез и уменьшается потеря калия.
Показания к применению сердечных гликозидов. Сердечные гликозиды назначают: с лечебной целью при хронической систолической форме сердечной недостаточности; при острой сердечной недостаточности; профилактически для предотвращения развития сердечной недостаточности при пневмониях, токсикозах, некоторых отравлениях и т. п.; при суправентрикулярной (но не вентрикулярной!) тахикардии.
163
Синергисты сердечных гликозидов. Назначение вместе с сердечными гликозидами их синергистов имеет смысл только в том случае, если получен эффект от назначения самих гликозидов. Нужно помнить, что синергисты гликозидов потенцируют их действие только тогда, когда либо нарушены процессы жизнедеятельности миокарда, на которые синергист способен оказать влияние, либо тогда, когда его содержание в организме снижено. Из приведенного ниже перечня синергистов одновременно с гликозидами назначают, как правило, не более 1-2. К этим препаратам относят витамины: Bf (кокарбоксилаза), В3, В6, B12, Вс и Е, стероидные анаболизанты (неробол и др.), а также калия оротат, метилурацил, панангин/аспаркам, поляризующие смеси (калия хлорид, инсулин, глюкоза).
Противопоказания к назначению сердечных гликозидов. Относительные: резкая брадикардия, групповые экстрасистолы, значительная гипокалиемия и гиперкальциемия, выраженное нарушение атриовентрикулярной проводимости. Абсолютные: интоксикация указанными препаратами. Гипертрофическая миокар-диопатия, в том числе у новорожденных от матерей, страдающих сахарным диабетом.
Интоксикация сердечными гликозидами. При применении сердечных гликозидов примерно в 20—25% больных возникают нежелательные эффекты.
Симптомы, возникающие при интоксикации сердечными гликозидами, условно делят на кардиальные й внекардиальные.
К кардинальным проявлениям интоксикации (51—90%) относят: нарушение ритма (начальные признаки: брадикардия, на ЭКГ — снижение S-Т; синусовая аритмия с удлинением интервала P-Q, отрицательные Т; вслед за ним возникают узловые и предсердные экстрасистолы, предсердная тахикардия, AV-блок), возобновление сердечной и проявление признаков коронарной недостаточности.
К внекардиальным симптомам интоксикации относят: 1) диспепсические (75-90%): потеря аппетита, тошнота, рвота, диарея, боли в животе; 2) неврологические (30~90%): утомление, головная боль, мышечная слабость, расстройство зрения, страх, бред, галлюцинации, судороги; 3) смешанные (37%); 4) крайне редко встречающиеся: тромбоцитопения, аллергический васкулит, гинекомастия, бронхоспазм и др.
Механизм интоксикации сердечными гликозидами связан с сильным (примерно на 60% и более) угнетением функции мембранной Na+, К+-АТФазы в сердце, центральной нервной системе и других органах.
Тормозя активность Na+, К+-насоса в сарколемме кардиомиоцитов токсические дозы сердечных гликозидов нарушают этим удаление из клетки Na+, попавшего в нее в процессе возбуждения, и возврат К+, вышедшего из нее в момент реполяризации мембраны.
Развивается гипокалигистия, и без того имеющая место при сердечной недостаточности (60—80 мг на 100 г ткани миокарда при норме 200-250 мг), как следствие возникновения гиперальдостеронизма. Гипокалигистия приводит к снижению поляризации клеточной мембраны (этому способствует и задержка Na+ внутри клетки). Так как потенциал покоя оказывается ниже нормы, то во время возбуждения и величина потенциала действия снижена, поэтому 164
нарушается процесс сопряжения изменений потенциала мембраны с сокращением миофибрилл. Гипокалигистия отрицательно сказывается на синтетических процессах в миокарде: снижается образование гликогена, АТФ, белка. Наконец, часть отсутствующих ионов калия замещается ионами водорода, в результате развивается внутриклеточный ацидоз, сопровождаемый внеклеточным алкалозом. Все эти явления ведут к постепенно нарастающей слабости сократительной деятельности сердца — гипосистолии.
Мембранная Na+, К+-АТФаза различных клеток в сердце имеет неодинаковое сродство к гликозидам. Причем АТФаза клеточных мембран проводящей системы сердца в 2,5 раза чувствительнее, чем соответствующий энзим миоцитов миокарда. Это обстоятельство является причиной того, что первыми симптомами интоксикации сердечными гликозидами являются нарушения проводимости (отрицательное дромотропное действие), то есть возникновение разных форм блоков. Особенно интенсивно при интоксикации гликозидами нарушено проведение в атриовентрикулярном узле, что является следствием повышения активности блуждающего нерва. Этому способствует облегчение освобождения ацетилхолина большими концентрациями сердечных гликозидов. Кроме того, сердечные гликозиды, изменяя подвижность липидов биомембран, увеличивают проницаемость последних, что на фоне ингибиции Na+, К+-АТФазы элементов проводящей системы и увеличения в них соотношения Na+/K+ способствует поступлению Са2+ в клетки в обмен на Na+. В результате в некоторых клетках, в частности, в волокнах Пуркинье появляется спонтанная деполяризация (характерная для автоматически функционирующих Р-клеток-синусового узла) (см. гл. 20). Это и объясняет появление эктопических очагов возбуждения в желудочках, экстрасистолии (батмотропное действие). Их развитию способствует брадикардия, снижение потенциала действия в клетках синусового узла; распространение его с декрементом позволяет медленно развивающейся спонтанной деполяризации в волокнах Пуркинье достичь порогового уровня, приводящего к возникновению потенциала действия (то есть к появлению автоматически функционирующих клеток), распространяющегося на соседние мышечные волокна.
Токсические дозы сердечных гликозидов снижают энергетические ресурсы миокарда (отчасти, как говорилось выше, из-за дефицита К+ в клетке), что нарушает удаление из кардиомиоцитов Са2+ в период диастолы (после завершения систолы) как путем экструзии через кальциевые каналы в клеточной мембране, так и путем депонирования в клетке. В результате уменьшается расслабление миофибрилл — возникает гиподиастолия. Кроме того, избыточная концентрация свободного Са2+ внутри клетки приводит к освобождению различных протеолитических ферментов из лизосом, что и приводит к структурным повреждениям клеток и к возникновению очагов некроза; это является еще одной из причин гипосистолии. Гиподиастолия и гипосистолия нарушают процесс изгнания крови из полостей желудочков, возрастает конечное диастолическое давление. В результате нарушается кровоток под эндокардом, что усугубляет ишемию миокарда. Частота сокращений не возрастает, так как повышена активность блуждающего нерва, и не компенсирует снижение сердечного выброса, как при сердечной недоста
165
точности. При тяжелой интоксикации вновь развивается недостаточность кровообращения и рее ее следствия: гипоксия, одышка, цианоз и пр.
В токсических дозах сердечные гликозиды оказывают вазоконстрикторное действие на любые сосуды в связи с их способностью освобождать катехоламины, что безусловно также неблагоприятно сказывается на работе сердца: повышение тонуса вен увеличивает преднагрузку, а повышение тонуса артерий увеличивает постнагрузку на сердце.
В работах последних лет показано, что важную роль в реализации токсических эффектов сердечных гликозидов играет их влияние на центральную и периферическую нервную систему.
Проникая в мозг, сердечные гликозиды взаимодействуют с Na+, К+-АТФазой на поверхности нейронов и окончаний их аксонов и тем самым изменяют активность нейромедиаторов и условия функционирования нейронов.
Влияние сердечных гликозидов на центральную нервную систему обусловливает возникновение не только нервно-психических нарушений при интоксикации ими, но и глазных (микро- и макропсия, нарушение цветоощущений, появление пятен в поле зрения и «у. п.); диспепсических (освобождение дофамина в триггерной зоне приводит.‘к тошноте, рвоте; освобождение норадреналина в пищевом центре — к потере аппетита и т. д.) и кардиальных симптомов, например, аритмий.
И наконец, важное значение имеет способность токсических доз сердечных гликозидов выраженно угнетать Na+, К+-АТФазу и в скелетных мышцах. При этом нарушается возврат калия в клетку и поэтому увеличивается уровень внеклеточного калия, что может привести к опасной гиперкалиемии, вызывающей нарушение сердечной деятельности.
Лечение интоксикации сердечными гликозидами. Все лекарства, устраняющие токсический эффект сердечных гликозидов, можно объединить в несколько групп: 1) препараты, уменьшающие всасывание гликозидов из желудочно-кишечного тракта — танин, вазелиновое масло, английская или карловарская соль, холестирамин (если речь идет о /приеме через рот или гликозид участвует в гепатоэнтеральной циркуляции); 2) препараты, связывающие гликозиды, циркулирующие в крови, — унитиол, специфические антитела к этим гликозидам: 3) препараты, снижающие в крови и миокарде концентрацию кальция, угнетающего активность мембранной Na+, К+-АТ-Фазы — трилон Б, натрия цитрат; 4) препараты, устраняющие гиперкалиемию — инсулин с . глюкозой, соли магния; 5) препараты, устраняющие симптомы интоксикации, в первую очередь аритмии — дифенин, лидокаин, атропин (последний при тяжелых формах брадикардиальных нарушений ритма) и другие симптомы, гипоксию — оксигенотерапия: судороги, бред, галлюцинации — аминазин, фенобарбитал и т. п.
Лекарственные формы и дозы сердечных гликозидов для детей даны в табл. 35
166
Таблица 35
Сердечные гликозиды
Препарат Лекарственная форма Путь введения Число приемов в сутки Суточная доза
Дигоксин Digoxinum 0,025% раствор в ампулах по I мл Внутривенно медленно, разведя 5% раствором глюкозы или 0,85% раствором натрия хлорида На три инъекции с перерывом в 8 часов Новорожденные Дети Под-ростки
Недоношенные Доношенные Насыща 1—12 мес ющая доза, 1-12 лет мкг/кг
16 24 30 32 12-16
Таблетки по 0,00025 г Через рот На три приема с перерывом в 8 часов 20-30 30 35 ’ 40 15-20
1 Поддерживающая доза, мкг/кг
5-10 10 15-20 10 3,6-4,5
Строфантин Strophanthinum 0,05% раствор в ампулах по 1 мл Внутривенно • -медленно, разведя 5% раствором глюкозы или 0,85% раствором натрия хлорида На 1—2 инъекции До 2-х лет 2-7 лет 7-14
20 мкг/кг 8 мкг/кг 6 мкг/кг
Коргликон Corglyconum 0,06% раствор в ампулах по 1 мл Внутривенно медленно 1—2 (с интервалом 8—10 часов) до 1 года 2—4 года 5—7 лет 8-10 лет больше 10 лет
0,1—0,15 мл 0,15-0,2 мл 0,3—0,4 мл 0,5 мл 0,7—0,8. мл
Дигитоксин Digitoxinum Таблетки по 0,0001 г Через рот В три приема в течение 3-х дней Дети 2-12 месяцев Дети 1-16 лет
Насыщающая доза (мкг/кг)
35 25
1 Поддерживающая доза (мкг/кг)
3,5 2,5
Глава 20 ПРОТИВОАРИТМИЧЕСКИЕ СРЕДСТВА
Противоаритмические средства применяют для ликвидации или предупреждения нарушений ритма сердечных сокращений.
Причины нарушений ритма сокращений сердца могут быть самыми разными: в 90% случаях это результат поражения сердца (ишемическая болезнь, инфаркт, миокардит, кардиосклероз, пороки), в остальных случаях имеют значение инфекционно-токсические факторы (ревматизм, вирусные инфекции), интоксикация (сердечными гликозидами, фторотаном, циклопропаном, ксантинами, противоаритмическими препаратами), электролитные (гипокалиемия, гипомагниемия) и гормональные нарушения, врожденная патология (сохранение эмбриональных структур проводящей системы сердца — синдром Вольфа-Пар-кинсона-Уайта) и др. У новорожденных детей органических поражений сердца, как правило, не обнаруживают, и аритмии в основном являются следствием нарушения гомеостаза. У детей первых двух лет жизни преобладают суправентрикулярные тахиаритмии, часто увязанные с сохранением эмбриональных, аномальных путей проведения импульса.
Противоаритмические препараты делят на две группы: этиотропные средства (устраняют причины, приведшие к нарушению ритма сокращений) и истинные противоаритмические средства, влияющие на автоматизм и проводимость сердца.
К этиотропным средствам относят: стероидные и нестероидные противовоспалительные препараты; препараты, нормализующие электролитный и энергетический обмены в миокарде (панангин/аспаркам, кокарбоксилаза, пантотеновая кислота, пиридоксин, токоферол, поляризующие смеси, сердечные гликозиды и др.); седативные средства (бромиды, валериана, сибазон); препараты, нормализующие уровень кальция в крови (кальцитонин, цитрат натрия), и др. Эти препараты описаны в соответствующих главах.
Истинные противоаритмические средства делят на препараты, ликвидирующие А) тахиаритмии или Б) брадиаритмии.
А. Средства, устраняющие тахиаритмии:
— препараты, стабилизирующие мембраны; группа хинидина (хинидин, но-вокаинамид и др.) или препараты IA класса;
— препараты, стабилизирующие мембраны; группа лидокаина (лидокаин, тримекаин, пиромекаин, дифенин и др.) или препараты IB класса;
— препараты, стабилизирующие мембраны; группа аймалина (аймалин, эт-мозин, этазицин и др.) или препараты IC класса;
— бета-адренолитики (анаприлин, талинолол и др.) или препараты II класса;
— средства, удлиняющие процесс реполяризации (орнид, амиодарон) или препараты III класса;
— блокаторы медленных кальциевых каналов (верапамил и др.) или препараты IV класса.
Б. Средства, устраняющие брадиаритмии:
— М-холинолитики (атропин и др.);
— адреномиметические средства (адреналин и др.);
— гормонопрепарат — глюкагон.
В практической медицине обычно назначают одновременно этиотропные средства и истинные противоаритмические препараты.
168
Известно, что автоматические клетки синусового и дистальной части атро-вентрикулярного узлов являются (см. схему 9) «медленными», тогда как все остальные — «быстрыми» (см. схему 9). Ритм сердечных сокращений определяется активностью «медленных», автоматических Р-клеток (расе maker). В них в период покоя возникает спонтанная деполяризация кальциевого типа (фаза 4 потенциала действия), являющаяся следствием преимущественного вхождения ионов кальция (и в меньшей степени натрия) через «медленные» каналы в клетку. После достижения пороговой величины деполяризации проницаемость клеточной мембраны для ионов натрия и кальция резко возрастает, они проникают через «быстрые» каналы, и развивается быстрая деполяризация (фаза О потенциала действия) мембраны и даже возникает так называемый овершут, то есть состояние, когда наружная поверхность мембраны приобретает более положительный заряд, чем ее внутренняя поверхность. Вслед за этим развивается фаза реполяризации клеточной мембраны.
Схема 9. Фазы потенциала действия «быстрых».(А) и «медленных» (Б) клеток
Различают три этапа этого процесса: быстрый (фаза 1), связанный с вхождением ионов хлора; медленный (фаза 2), связанный с выходом ионов калия и медленным входом кальция; и поздний (фаза 3), связанный с активностью Na+, К+-АТФазы, удаляющей из клетки проникший в нее ион натрия и возвращающей ион калия. Параллельно функционирует кальциевый насос, удаляющий избыток кальция из клетки, и механизмы депонирования его в митохондриях или в саркоплазматическом ретикулуме.
Скорость спонтанной деполяризации в Р-клетках зависит от функции вегетативной нервной системы: активация симпатических влияний повышает
169
вхождение ионов кальция (и натрия), ускоряет спонтанную деполяризацию; активация парасимпатических влияний увеличивает выход калия, приводит к гиперполяризации клеточной мембраны, что замедляет ее деполяризацию и частоту сокращений сердца.
В «быстрых» клетках нет спонтанной деполяризации. Для возникновения в них потенциала действия необходим электрический импульс, который откроет «медленные», главным образом натриевые и в меньшей степени кальциевые каналы. Однако под влиянием особых условий (см. вышеназванные причины аритмий) мембрана этих клеток может приобрести способность к спонтанной деполяризации натриевого типа, то есть к самопроизвольному возбуждению. Если такое происходит с клетками проводящей системы сердца (расположенными ниже дистальной части атриовентрикулярного узла), то возникают гете-ротропные очаги; если с клетками рабочего миокарда — то начинают функционировать эктопические очаги. В этом случае появляются дополнительные более медленные водители ритма и экстрасистолы. Нарушения распространения возбуждения по проводящей системе сердца или возникновения дополнительных очагов возбуждения изменяют длительность рефрактерного периода, что может служить причиной ретроградного возврата возбуждения и рециркуляции импульсов, что также может стать-причиной как отдельных экстрасистол, так и постоянной тахикардии. Напомним, что пришедшее из проводящей системы сердца к рабочему миокарду возбуждение может вызывать его сокращение, если у него закончился эффективный рефрактерный период (ЭРП). ЭРП охватывает абсолютный рефрактерный период (АРП), когда сердце не способно ни к возбуждению, ни к сокращению, и тот период, когда сердце способно к слабому возбуждению, не приводящему к сокращению миокарда. На ЭКГ ЭРП соответствует комплексу QRS и всему сегменту S-T.
А. Средства, устраняющие тахиаритмии
1. Препараты, стабилизирующие мембраны. Группа хинидина. Препараты этой группы понижают проницаемость клеточной мембраны для ионов натрия цо «медленным» каналам автоматических клеток эктопических очагов, а следовательно, замедляют в них скорость спонтанной деполяризации натриевого типа (фаза 4). Кроме того, препараты данной группы тормозят в названных клетках проникновение ионов натрия и кальция по «быстрым» каналам (фаза 0) и выход иона калия из клетки во время ре поляризации (фаза 2), то есть увеличивают ЭРП. Происходит выравнивание длительности рефрактерного периода в эктопическом очаге с длительностью названного периода в нормальных участках рабочего миокарда, что препятствует возврату возбуждения.
Несмотря на принципиальное сходство в механизме действия препаратов группы, между ними есть некоторые различия.
Хинидин (алкалоид из коры хинного дерева) в педиатрической практике применяют сравнительно редко. В основном его используют при предсердных формах аритмий.
Назначают хинидин внутрь, поскольку он хорошо всасывается из кишечника, но эффект развивается после его накопления в миокарде через 1-1,5 ч, иногда позже. В тканях он распределяется неравномерно. Наибольшее его количество обнаруживают в миокарде: в желудочках в 20 раз, а в предсердиях в 10 раз больше, чем в плазме крови. Хинидин подвергается биотрансформации в печени, лишь 10-30% введенной его дозы в неизмененном виде выводятся почками, и все же при нарушении их выделительной функции может произойти кумуляция препарата. У детей до 12 лет элиминация хинидина происходит 170
скорее, чем у взрослых. Для того чтобы избежать резких колебаний в их плазме крови концентраций препарата, суточную дозу хинидина детям делят на 5—6 приемов, а не на 4, как взрослым.
При передозировке или кумуляции хинидина (на ЭКГ отмечают расширение комплекса QRS более чем на 25%) резко нарушается процесс спонтанной деполяризации в «медленных» клетках синусового узла, деполяризация мышечных клеток. Это приводит к брадикардии, блокам, ослаблению сокращений сердца, к нарушениям гемодинамики и к падению артериального давления. Особенно существенно хинидин ослабляет сократительную функцию миокарда при наличии у больного сердечной недостаточности. Поэтому возникает необходимость одновременного назначения сердечных гликозидов. Однако хинидин способен вытеснять разные лекарства из их связи с белками плазмы крови и тканей, в частности и сердечные гликозиды,- Концентрация например дигоксина в плазме крови возрастает в 2 раза. Увеличивается и их концентрация в мозговой ткани, что имеет крайне важное значение для возникновения нейрогенных симптомов интоксикации гликозидами. Кроме того, хинидин, как и гликозиды, тормозит Na+, К+-АТФазу в миокарде, то есть он является синергистом их токсического действия. Поэтому при назначении хинидина дозу гликозидов снижают в 2 раза.
Применение хинидина требует большой осторожности еще и потому, что он обладает ваголитическим действием, то есть ограничивает (вероятно на пресинаптическом уровне) влияние блуждающего нерва на сердце. Это сопровождается повышением атриовентрикулярной проводимости, что при наличии частых возбуждений в предсердиях (мерцание, трепетание) может привести к опасной тахикардии и даже к фибрилляции желудочков. Холинолитическим действием хинидина очевидно можно объяснить возникновение нарушений зрения, слуха и диспепсических расстройств (последние являются результатом и тормозного влияния препарата на Na+, К+-АТФазу в кишечнике). Длительное применение хинидина может привести к возникновению аллергических осложнений, в частности тромбоцитопенической пурпуры.
Хинидин противопоказан детям с сердечной и почечной недостаточностью, заболеваниями печени, идиосинкразией.
Новокаинамид (производное.местного анестетика — новокаина) преимущественно подавляет желудочковые эк<драсистолы и проведение возбуждения по дополнительным (аномальным) путям. Поэтому его в основном применяют при желудочковых тахикардиях и экстрасистолах.
Для ликвидации аритмий его вводят внутривенно (медленно) или внутримышечно, максимальная концентрация в крови возникает через 1—2 или 5—30 мин соответственно. <
Около 50% попавшего в организм новокаинамида выводится почками в неизмененном виде, а остальное количество подвергается биотрансформации в печени. Основным метаболитом является N-ацетилновокаинамид (N-AHA), также обладающий антиаритмическим действием, но значительно медленнее, чем сам новокаинамид, выводимый почками. Период полувыведения новокаинамида у детей 7-12 лет 1,7 ±0,1 ч (у взрослых 2-7 ч), a N-AHA — 6 ч., При повторных введениях новокаинамида этот метаболит накапливается. При почечной недостаточности (или при нарушении функции почек у больных с сердечной недостаточностью) экскреция новокаинамида и особенно N-AHA замедляется (до 11—16 и 78—124 ч соответственно), поэтому таким больным препарат надо назначать реже и в меньшей дозе. В начале лечения новокаи-
171
намид принимают каждые 3—4 ч, а затем переходят на более редкие приемы — каждые 5—6 ч (из-за накопления N-AHA).
Новокаинамид обладает ганглиоблокирующим действием, поэтому он снижает артериальное и венозное давление, а у больных в положении стоя может вызвать коллапс. Подобно хинидину новокаинамид способен ухудшить сократительную активность миокарда, поэтому его рекомендуют применять вместе с небольшими дозами сердечных гликозидов. При интоксикации или кумуляции новокаинамид и его метаболит могут вызвать возбуждение центральной нервной системы и даже судороги. При длительном применении возможны диспепсические явления, сыпи, лейкопении и синдром, напоминающий красную волчанку с поражением суставов и легких.
Новокаинамид противопоказан детям с атриовентрикулярным блоком, сердечной и почечной недостаточностью
Прием хинидина и новокаинамида у каждого третьего больного сопровождается различными нежелательными эффектами, поэтому их не применяют у больных с хроническим формами аритмий.
2. Препараты, стабилизирующие мембраны. Группа лидокаина. Механизм действия препаратов этой группы ^отличается от предыдущей только тем, что они увеличивают мембранную проницаемость для ионов калия, облегчая их выход из клетки, чем ускоряют фазу 2 реполяризации мембраны. В результате уменьшается длительность ЭРП, что способствует ликвидации рециркуляции возбуждения. Препараты этой группы не ослабляют сокращения миокарда и не нарушают проведение возбуждения, в том числе в атриовентрикулярном узле.
Лидокаин (местный анестетик) применяют для немедленной ликвидации тахикардии и фибрилляции желудочков. Он плохо всасывается (биодоступность 30%) из желудочно-кишечного тракта, поэтому внутрь его редко назначают. При внутривенном введении максимальная концентрация в крови достигается через несколько минут, но она быстро снижается, а следующие 100 мин падает постепенно. Препарат подвергается биотрансформации в печени (при патологии этот процесс замедляется), только 10% введенной дозы выводится почками в неизмененном виде. Из лидокаина образуются два основных метаболита: мо-ноэтилглицинксиламид (обладающий антиаритмическим действием, но способный вызвать рвоту и судороги), и глицинксиламид (усиливающий судорожное действие и лидокаина, и первого метаболита).
Для ликвидации приступа аритмии лидокаин вводят внутривенно одномоментно, а затем переходят на длительное его внутривенное вливание или на введение других препаратов (например, анаприлина).
При введении лидокаина возможна головная боль, сонливость, дезориентация, изменение зрения. При передозировке или кумуляции (особенно метаболитов) могут быть психозы, судороги, сопровождаемые нарушениями дыхания, снижение артериального давления и кома.
Лидокаин противопоказан детям с сердечной, печеночной и почечной недостаточностью, а также детям с аллергическими реакциями на него. В последнем случае лидокаин можно заменить близкими ему препаратами: триме-каином или пиромекаином.
Ди фенин (применяют также в качестве противоэпилептического средства — см. гл. 12) действует подобно лидокаину, но отличается от него облегчением поступления ионов натрия в 0 фазу деполяризации клеток миокарда. Этим он ускоряет развитие потенциала действия, сокращение миокарда. Воз-172
действуя на центральную нервную систему, дифенин снижает ее влияние (особенно симпатическое) на деятельность сердца, что особенно важно при интоксикации сердечными гликозидами. Поэтому дифенин главным образом и применяют для устранения суправентрикулярных и желудочковых аритмий, обусловленных интоксикацией сердечными гликозидами. Эффективность его в таких случаях очень велика — 50-90%. Важной особенностью дифенина является и то, что он (в отличие от лидокаина и препаратов 1 группы) оказывает антиаритмическое действие и при гипокалиемии (при гиперкалиемии он ухудшает проведение возбуждения). При аритмиях, не связанных с интоксикацией сердечными гликозидами, дифенин мало эффективен.
В экстренных случаях его вводят внутривенно (в виде натриевой соли). Эффективная концентрация однако сохраняется всего несколько минут, так как препарат уходит в ткани, и аритмия может снова восстановиться. Устойчивый терапевтический эффект возникает лишь через 6-12 ч. Для поддерживающей терапии его назначают через рот 2—4 раза в день. Детям первых лет жизни доза (на единицу массы тела) должна быть больше, чем в более старшем возрасте.
При передозировке или кумуляции препарата появляются атаксия, нистагм, нарушения психики, боли в суставах, брадикардия, трепетание предсердий и гипотония. При длительном применении препарата возможны диспепсия, сыпи, гиперплазия десен, мегалобластическая анемия и остеопатия. Последние два осложнения являются следствием быстрой инактивации в печени фолиевой кислоты, витаминов D и К соответственно. Поэтому детям, длительно получающим этот препарат, необходимо дополнительное назначение названных витаминов.
3. Препараты, стабилизирующие мембраны. Группа аймалина. Механизм действия препаратов этой группы похож на механизм противоаритмических средств группы хинидина и отличается только тем, что они не влияют на мембранную проницаемость для ионов калия (фаза 2). Необходимо отметить, что аймалин дополнительно обладает симпатомиметической активностью, а этмозин и этацизин — М-холинолитической активностью.
Аймалин (гилуритмал.; тахималин) — алкалоид раувольфии. Препарат обладает коронарорасширяющим действием, поэтому может быть рекомендован при аритмиях, возникших на фоне ишемической болезни сердца.
Для оказания экстренной помощи его вводят внутривенно или внутримышечно, для поддерживающей терапии — через рот. После парентерального введения эффект развивается через несколько минут. Из желудочно-кишечного тракта усваивается неполностью, так как подвергается пресистемной элиминации в основном при первом прохождении через печень. Циркулирующий в крови аймалин частично выводится с желчью в кишечник и участвует в энтерогепатической циркуляции.
Препарат менее токсичен, чем хинидин или новокаинамид, но все же он может вызывать тошноту, головную боль, диплопию. На месте внутримышечного введения иногда появляются инфильтраты. При передозировке могут быть блоки в различных отделах проводящей системы сердца, уменьшение силы сокращений миокарда и снижение артериального давления. При длительном применении у детей возможны диспепсии, внутрипеченочный холестаз и агранулоцитоз.
173
Аймалин противопоказан детям со слабостью сердечных сокращений, нарушениями проводимости, недостаточностью кровообращения III степени, резкой гипотонией.
В последние годы созданы новые менее токсичные противоаритмические средства, также относящиеся к группе аймалина: этм оз ин и этацизин — производные фенотиазина. Эти препараты наиболее эффективны при желудочковых аритмиях.
Этмозин и этацизин назначают внутрь (с профилактической целью), внутримышечно и внутривенно (для купирования приступов пароксизмальной тахикардии). После парентального введения эффект развивается через несколько минут. Нельзя вводить препарат под кожу из-за раздражающего действия.
Названные выше препараты не влияют на сократимость миокарда, слабо снижают артериальное давление (даже при внутривенном введении), оказывают умеренный коронарорасширяющий, спазмолитический и М-холинолитический эффект.
При приеме этмозина или этацизина возможно головокружение, онемение языка, кожный зуд. Препараты противопоказаны при выраженной гипотонии, нарушении функции печени и почек.
4. Бета-адреноблокаторы (анаприлин, талинолол — см. гл. 2). Они нарушают поступление кальция и натрия в период спонтанной деполяризации (фаза 4) как в синусовом, так и в гетеротопных и эктопических водителях ритма. Кроме того, они ускоряют выход ионов калия из клетки, укорачивая этим фазу 2 реполяризации, а следовательно, и ЭРП. Существенное значение имеет их седативное влияние на центральную нервную систему и благоприятное воздействие на обмен миокарда. Но они нарушают поступление ионов натрия и кальция в фазу 0 потенциала действия рабочего миокарда и проводящей системы, ослабляя этим сокращения сердца и нарушая проведение возбуждения, особенно в артриовентрикулярном узле.
Препараты этой группы применяют у детей с разнообразными формами аритмий для ликвидации суправентрикулярной и желудочковой тахикардии, фибрилляции предсердий. Для получения экстренного эффекта бета-адрено-блокаторы вводят внутривенно. Эффект, в зависимости от формы аритмии, развивается либо немедленно (суправентрикулярная тахикардия), либо через 20—60 мин. Для поддерживающей терапии препараты назначают внутрь. Стойкий терапевтический эффект возникает через 3—6 дней. Курс лечения обычно 10-40 дней.
Наиболее важные осложнения анаприлина: сердечная недостаточность, гипотония, бронхиальная астма, выраженная брадикардия (блоки), психическая депрессия. Талинолол в отличие от анаприлина является кардиоселективным препаратом, поэтому он не вызывает бронхоспазма, и, обладая внутренней симпатомиметической активностью, менее опасен у больных с сердечной недостаточностью.
5. Средства, удлиняющие процесс реполяризации. Орнид, (см. гл. 2) угнетает проницаемость клеточной мембраны для ионов кальция (вход в клетку) в фазу 2, амиодарон — для ионов калия (выход из клетки) в фазу 2. Этим они задерживают развитие реполяризацйи клеточной мембраны и удлиняют ЭРП.
Амиодарон (кордарон), кроме того, угнетает спонтанную деполяризацию автоматических медленных клеток (фаза 4), проведение возбуждения по 174
проводящей системе миокарда, в том числе в атриовентрикулярном узле и по дополнительным (эмбриональным) путям. Сократимость рабочего миокарда не нарушает. Большое значение имеет его способность улучшать коронарный кровоток (результат альфа-адренолитического действия) и снабжение миокарда кислородом, то есть устранять ишемию миокарда, нередко являющуюся причиной аритмий. Он может вызвать и брадикардию (результат блокирования бета-адренорецепторов).
Амиодарон устраняет фибрилляцию и трепетание предсердий, синдром Во-льфа-Паркинсон-Уайта, желудочковую тахикардию.
Он медленно и неполностью всасывается из желудочно-кишечного тракта, 50% принятой дозы подвергается пресистемной элиминации. В организме распределяется неравномерно: в миокарде его концентрация в 100 раз, в мышцах в 30 раз, а в жировой ткани в 10 раз больше, чем в плазме крови. Антиарит-мический эффект возникает лишь после его накопления в миокарде (до определенных величин), у детей — в среднем через 4 дня (может быть уже через 7-24 ч), а у взрослых — через 6-8 дней. Для достижения более быстрого эффекта его начинают принимать с насыщающей дозы, принимаемой через рот на протяжении 7 дней (взрослым внутривенно капельно в течение 24 ч), а затем переходят на поддерживающие дозы (составляющие половину от насыщающей).
Элиминация амиодорона происходит медленно, период полувыведения из крови около 28 дней, и после отмены антиаритмическое действие препарата сохраняется несколько дней-недель (в зависимости от длительности курса лечения, который может продолжаться до нескольких лет).
При кратковременном применении амиодарон нетоксичен, но при длительном употреблении отмечают возникновение брадикардии, гипотензивного эффекта, тошноту, тяжесть в подложечной области, парестезии, тремор, атаксию, фотодерматит (при этом у 5% больных появляется серо-голубое окрашивание кожи), иногда нарушения зрения (появляется радужный нимб по периферии зрительного поля, реже катаракта) или функции щитовидной железы, очень редко фиброз легких или цирроз печени.
Орнид (бретилий) преимущественна влияет на желудочки и применяется для устранения и профилактики желудочковых экстрасистол, тахикардии и фибрилляции. В экстренных случаях его вводят внутривенно, в менее срочных ситуациях — внутримышечно. Из желудочно-кишечного тракта он всасывается плохо и через рот его не назначают. Орнид неравномерно распределяется в организме, накапливаясь в окончаниях симпатических волокон и в сердце (в нем концентрация препарата в 30 раз больше, чем в плазме крови).
Орнид — малотоксичный препарат, но иногда отмечают тошноту, рвоту, очень редко — чувство жара, набухание слизистой носа, временное ухудшение зрения, ощущение напряжения и болезненности в икроножных мышцах, гипотензивный эффект.
6. Блокаторы медленных кальциевых каналов (верапамил и др., см. гл. 21, 22, 23). Блокаторы угнетают перенос ионов кальция по «медленным» 1-каналам через клеточные мембраны внутрь клетки и этим замедляют спонтанную деполяризацию автоматических медленных клеток.
Препараты наиболее эффективны при тахиаритмиях предсердного происхождения, хотя могут вызвать небольшой эффект и при желудочковых тахи
175
аритмиях. Синусовый ритм может восстановиться уже во время или немедленно после внутривенного вливания препаратов. У детей с суправентрикулярной тахикардией (наиболее частая форма аритмий) верапамил вызывает эффект в 100% случаев. Для экстренной ликвидации приступа верапамил вводят внутривенно струйно (за 30—40 с), капельное вливание неэффективно. После прекращения приступа переходят на прием поддерживающих доз через рот. Длительность курса 3-4 нед.
Основной побочный эффект верапамила — ослабление сердечных сокращений, а в тяжелых случаях — падение артериального давления, что является следствием блокирования кальциевых каналов в миокарде и гладкой мускулатуре сосудов.
Верапамил нельзя назначать одновременно с бета-адреноблокаторами или вводить новорожденным, матери которых получали перед родами эти средства, так как у ребенка может произойти резкое угнетение деятельности сердца и даже его остановка.
Б. Средства, устраняющие брадиаритмии
В эту группу входят средства, повышающие процессы возбудимости и проводимости в сердце, а также устраняющие тормозящее влияние на них блуждающего нерва.
1. М-холинолитические средства (атропин и др. — см. гл. 1) устраняют влияние блуждающего нерва на сердце и эффективны при резкой брадикардии, обусловленной его повышенной активностью. Следует быстро создать полную терапевтическую дозу этих препаратов, иначе может произойти даже усиление брадикардии из-за блокады пресинаптических М-холинорецепторов в сердце и усиление освобождения ацетилхолина из окончаний блуждающего нерва.
Назначают их детям при синусовой брадикардии, синоатриальной или атриовентрикулярной блокадах, при интоксикации сердечными гликозидами.
2. Адреномиметические средства (адреналин и др.; см. гл. 2) возбуждают бета-адренорецепторы Р-клеток, увеличивают в них образование цАМФ и поступление кальция. В результате эти препараты повышают возбудимость автоматических клеток и улучшают атриовентрикулярную проводимость.
Применяют эти препараты в крайних случаях (атриовентрикулярная блокада, приступ Морганьи-Адам-Стокса), так как они значительно повышают потребность миокарда в кислороде, нарушают в нем обменные процессы.
3. Гормонопрепарат — глюкагон влияет на свои рецепторы, что приводит к повышению уровня свободного кальция в клетках сердца. В результате возрастает автоматическая активность клеток синусового узла, улучшается проведение возбуждения в атриовентрикулярном узле, исчезают различные блоки. Глюкагон имеет преимущества перед адреномиметическими средствами, так как он не повышает автоматизм желудочков и не вызывает их тахикардии и фибрилляции.
Глюкагон вводят внутривенно капельно. Эффект препарата короткий (10—15 мин) и поэтому требуется его вводить длительно (до 2-х сут).
Назначают его при брадиаритмиях, развившихся в результате передозировки бета-адреноблокаторов, сердечных гликозидов и при блоках различного происхождения. Он может устранить слабость сокращений сердца (и развивающийся из-за этого сердечно-сосудистый коллапс), возникающую при отравлении бета-блокаторами и сохранить этим жизнь ребенка.
176
Глюкагон нельзя применять вместе с препаратами кальция, так как он увеличивает освобождение данного иона из внутриклеточных депо, повышает его концентрацию в клетке, что приводит к аритмии и даже к. остановке сердца. Вливание глюкагона может сопровождаться возникновением тошноты и рвоты, гипергликемии. Последняя сохраняется и после отмены препарата, а затем сменяется гипогликемией; гипокалиемией (поэтому вместе с глюкагоном необходимо вводить калия хлорид).
Лекарственные формы и дозы антиаритмических средств для детей представлены в табл. 36.
Таблица 36
Противоаритмические средства
Препарат Лекарственная форма Путь введения Число приемов в сутки Доза (мг/кг) для детей любого возраста
Хинидина сульфат Chinidini sulfas Таблетки по 0,1 и 0,2 г Через рот 5-6 15-20 (до 30) в сут
Новокаинамид Novocainamidum 10% раствор в ампулах по 10 мл Внутривенно 1 Однократно 3—6 (в течение 5 мин)
Внутривенно капельно Длительное вливание 20-80 мкг/кг в минуту
Таблетки по 0,25 г Через рот 6 15-50 (в сут)
Аймалин Ajmalinum 2,5% раствор в ампулах по 2 мл Внутривенно 3 1 (на 1 введение)
Таблетки по 0,05 г Через рот 3 1—1,5 (на прием)
Лидокаин Lidocainum 1 % раствор в ампулах по 2 и 10 мл Внутривенно 1 2,5—3 (однократно в течение 5 мин)
Внутривенно капельно Длительное вливание 10—50 мкг/кг в минуту
Дифенин Dipheninum Официнальные , таблетки (по 0,117 г) Через рот 2-3 6-10 (в сут)
Амиодарон Amiodaronum Таблетки по 0,2 г Через рот 1-2 5 (в сутки)
Орнид Omidum 5% раствор в ампулах по 1 мл Внтуривенно 1 4-10
Внутримышечно 3-4 5 (на 1 введение)
Верапамил Verapamilum 0,25% раствор в ампулах по 1 мл Внутривенно 1 0,1—0,2 (в течение 30-40 с)
Таблетки по 0,04 г Через рог 3-4 2—5 (на прием)
177
Глава 21 КОРОНАРНЫЕ СРЕДСТВА
Коронарные или антиангинальные средства — это препараты, используемые у больных ишемической болезнью сердца (ИБС) для купирования или предупреждения приступов, а также для профилактики инфаркта миокарда и повышения толерантности к физической нагрузке.
При ИБС у больных отмечается несоответствие между потребностью миокарда в. кислороде и возможностями его кровоснабжения.
Коронарные средства либо улучшают кровоснабжение миокарда, либо, воздействуя на его метаболизм, снижают энергозатраты, либо влияют одновременно на то и на другое, приводя к относительному соответствию кровоснабжение и потребность миокарда в кислороде.
Наибольшее значение в современной терапии имеют следующие группы коронарных средств:
нитраты (нитроглицерин, нитросорбид, нитролонг, сустак, эринит);
блокаторы кальциевых каналов г(веpanамил, нифедипин, дилтиа-зем);
fi-адреноблокаторы (анаприлин, окспренолол, алпреналол, пиндолол, атенолол);
коронарорасширяющие средства (дипиридамол, карбохромен, мол -сидомин);
препараты рефлекторного действия (валидол, валокордин, корвалол).
НИТРАТЫ
Нитраты — органические соединения, содержащие группы -O-NO2 (см. рис. 26). В препарате их может быть несколько. Поэтому различают: а) изосорбида мононитраты — моно-мак, моночинкве (для приема внутрь), к а р д и к с моно, моно-мак 50 Д (препараты продленного действия);'б) изосорбида динитраты — нитросорбид (для приема внутрь), изо-мак (для приема под язык), кардикс — препарат длительного действия; в) препараты с тремя нитрогруппами: нитроглицерин (для приема под язык), его препараты продленного действия (тринитролонг — в полимерной пленке, наносимой на десны: сустак, нитронг — назначаемые внутрь); препарат с четырьмя нитрогруппами — эринит (нитропентон), назначаемый внутрь.
Фармакодинамика нитратов складывается из их прямого периферического действия на гладкую мускулатуру сосудов и центрального влияния на симпатические отделы центральной нервной системы, снижающего адренергическую импульсацию к сердцу и сосудам. Прямое действие нитратов на стенку сосудов, по-видимому, является следствием их взаимодействия с сульфгидрильными группами эндогенных «нитратных рецепторов». При этом от молекулы нитрата отщепляется группа NO2, превращающаяся затем в NO (оксид азота), активирующий цитозольную гуанилатциклазу. Под влиянием этого фермента образующийся из гуанозинтрифосфата (ГТФ) циклический гуанозинмонофбсфат (цГМФ), снижает концентрацию свободного кальция в цитоплазме мышечных клеток и этим вызывает их расслабление. Кроме того, нитраты могут способ-178
сн2 - о - no2 ch - о - no2 сн2 - о - no2
Нитроглицерин
Нитросорбид
н2с--------
нс - о - no2 I О
—СН
НС---------
о I
нс - о - no2
—сн2
o2n - о - н2с сн2 - о - no2
cz
o2n-o-h2cz xch2-o-no2
Эринит
Рис. 26. Химическая структура нитратов
ствовать освобождению простациклина из эндотелия сосудистой стенки и угнетать продукцию тромбоксана А2. Этот эффект также приводит к сосудорасширяющему действию. Снижение адренергической импульсации к сердцу и сосудам (результат центрального действия) ограничивает освобождение катехоламинов из симпатических окончаний, что также способствует расширению пораженных сосудов, снижению работы сердца и потребности его в кислороде. Расширение периферических сосудов, преимущественно вен, ведет к уменьшению венозного возврата крови к сердцу (снйжая преднагрузку). Это уменьшает конечно-диастолическое давление в левом желудочке, улучшает кровоснабжение субэндокардиальной области миокарда; уменьшает напряжение менее растянутой стенки левого желудочка и потребность миокарда в энергии и кислороде. Нитраты увеличивают кровоснабжение ишемических участков миокарда, способствуют перераспределению коронарного кровотока и этим ограничивают размеры инфаркта миокарда.
Используют нитраты для купирования приступов ИБС (нитроглицерин) или для их предупреждения (пролонгированные формы нитроглицерина, мононитратов и динитратов изосорбида). Снижение преднагрузки на сердце улучшает условия его работы, что используется при лечении больных застойной сердечной недостаточностью.
Нежелательными эффектами нитратов являются головная боль, головокружение, шум в ушах, прилив крови к лицу. Это связано с расширением сосудов кожи лица и головы и уменьшением кровоснабжения мозга. При этом происходит «кислородное обкрадывание мозга», так как легче расширяется наружная ветвь сонной артерии. Растирание кожи головы растворами ментола ведет
179
к сужению сосудов кожи, улучшению кровоснабжения мозга и ликвидирует головную боль. Кроме того, нитраты повышают проницаемость сосудистой стенки, что может повысить образование цереброспинальной жидкости и внутричерепное давление, а также образование внутриглазной жидкости и ухудшить течение глаукомы. После приема нитратов больным необходимо лежать в течение 1-2 ч во избежание ортостатической гипотензии. Длительный прием нитратов может привести к метгемоглобинемии. Большинство нежелательных эффектов нитратов исчезают при уменьшении дозы препарата. К нитратам может наступить привыкание, являющееся следствием истощения SH групп в мембранах эндотелия сосудов. Введение тиосульфата Na или унитиола может возместить недостаток этих групп и восстановить реакцию на нитраты.
БЛОКАТОРЫ КАЛЬЦИЕВЫХ КАНАЛОВ
Кальциевые каналы расположены в мембранах клеток, имеют макромолекулярную структуру. По ним ионы Са проникают внутрь клетки. Каждый канал может пропустить около 30 000 йбнов кальция в секунду. Через эти каналы поступают также ионы Na, Ba, Н. Кальциевые каналы обнаружены во всех тканях организма, в том числе в проводящей системе сердца, миофибриллах миокарда, гладкомышечных клетках сосудов. Различают потенциал-зависимые и медиатор-зависимые кальциевые каналы. Блокаторы кальциевых каналов влияют только на потенциал-зависимые каналы, которые также могут быть разного типа, в зависимости от вида ткани, где они находятся. Поэтому блокаторы кальциевых каналов неодинаково влияют на функцию разных тканей и органов. Препараты этой группы взаимодействуют со специфическими местами связывания на мембранах клеток вокруг входа в канал или внутри него, уменьшая их функцию и ток ионов Са в клетку. В результате возникает вазодилатация и кардиодепрессия. В зависимости от химической структуры препаратов и их влияния на различные потенциал-зависимые каналы блокаторы кальциевых каналов подразделяют на две группы:
1) производные дигидропиридина — нифедипин (коринфар, кордафен), ни-кардипин; эти препараты оказывают выраженное расслабляющее действие на периферические и коронарные артерии и слабо выраженное кардиодепрессив-ное действие;
2) недигидрсщиридиновые производные — верапамил (изоптин, финоптин) и дилтиазем (кардизем); эти препараты оказывают умеренное расслабляющее действие на периферические сосуды, коронарорасширяющее действие, но выраженное кардиодепрессивное действие (снижают силу и частоту сердечных сокращений, замедляют проводимость).
Блокаторы кальциевых каналов имеют короткий период полувыведения, в связи с чем их назначают обычно 3-4 раза в день. В последнее время созданы лекарственные формы с медленно высвобождающимися нифедипином, верапамилом и дилтиаземом. Эти препараты назначают 1-2 раза в день.
Используют блокаторы кальциевых каналов прежде всего как коронарные средства при ИБС со стабильной стенокардией напряжения. У таких больных они снижают частоту приступов, потребность в нитроглицерине, улучшают переносимость физических нагрузок.
180
Эффективность их превышает действие p-блокаторов и равна нитратам. У больных с вазоспастической стенокардией блокаторы кальциевых каналов являются препаратами выбора. Кроме ИБС, блокаторы кальциевых каналов назначают больным с артериальной гипертензией (см. гл. 23), болезнью Рейно, мигренях. Преимущество препаратов этой группы состоит в том, что их можно назначать больным, у которых сердечно-сосудистая патология сочетается с такими сопутствующими заболеваниями, как бронхиальная астма, брадикардия, сахарный диабет, р-Адреноблокаторы в подобных случаях назначать нельзя, так как они могут усугубить течение сопутствующего заболевания. Необходимо подходить с осторожностью к сочетанию блокаторов кальциевых каналов и Р-адренорецепторов; особенно опасно их сочетание с верапамилом, так как это может привести к резкой брадикардии. Нифедипин оказывает расслабляющее действие не только на сосуды, но и другие гладкомышечные органы. Его используют при спазмах Пищевода, в акушерской практике для прекращения преждевременных родов.
Никардипин обладает выраженными липофильными свойствами, свободно проникает в центральную нервную систему и может оказывать лечебный эффект при церебральной ишемии.
Нежелательные эффекты блокаторов кальциевых каналов проявляются в виде головной боли, головокружения, покраснения кожных покровов, отеков на ногах. Кроме того, верапамил может способствовать брадикардии и блокадам проводящей системы, а нифедипин — гиперплазии десен, психозам.
Отмену препаратов этой группы рекомендуют проводить постепенно, в течение 3-х дней, так как иногда наблюдается «синдром отмены», проявляющийся в возникновении тахикардии, подъеме АД.
Бета-адреноблокаторы (см. гл. 2). К этой группе препаратов, используемых при ИБС, относят анаприлин (индерал), окспренолол (трази-кор), п и н до л ол (вискен), талинолол (корданум), ал пренолол. Общим свойством всей этой группы является их способность блокировать Р-адренорецептор1?1 по отношению к. эндогенным катехоламинам и устранять влияние симпатической нервной системы на органы, имеющие эти рецепторы. Связь их с p-рецептором обратима и может быть устранена путем увеличения концентрации агониста. У некоторых преваратов этой группы есть и дополнительные эффекты: так, пиндолол, окспренолол и алпренолол оказывают одновременно с блокадой некоторое стимулирующее действие на рецепторы (внутренняя симпатомиметическая активность). Поэтому эти препараты существенно не влияют на частоту сердечных сокращений в покое, что является их определенным преимуществом, особенно у пожилых больных.
При ИБС p-блокаторы оказывают лечебный эффект за счет уменьшения силы и частоты сердечных сокращений, то есть работы сердца и соответственно потребности миокарда в кислороде. Кроме того, благодаря уменьшению частоты сердечных сокращений увеличивается время диастолического наполнения и коронарной перфузии. На фоне действия p-блокаторов увеличивается толерантность к физической нагрузке. При инфаркте миокарда p-блокаторы, уменьшая систолическое напряжение стенок сердца, снижают вероятность их разрыва в зоне инфаркта. Используют p-блокаторы у больных ИБС чаще при стенокардии напряжения, кроме того их назначают при аритмиях и гипертонической болезни (см. гл. 20 и 23).
181
Нежелательными эффектами Р-адреноблокаторов являются: общая слабость, провокация перемежающейся хромоты, спазм бронхов, резкая брадикардия, гипергликемия. При резком прекращении лечения возможен «синдром отмены» с фибрилляцией желудочков и развитием инфаркта миокарда. Отменять р-ад-реноблокаторы нужно на протяжении 10 дней при ограничении физической активности.
КОРОНАРОРАСШИРЯЮЩИЕ СРЕДСТВА
Мол сидомин (корватон) — относится к новому классу кардиотропных соединений сидноиминам. Он прямо активирует цитозольную гуанилатциклазу, чем увеличивает образование цГМФ. Последний снижает внутриклеточную концентрацию ионов свободного Са, что ведет к расслаблению сосудов, преимущественно вен. В результате, как и под влиянием нитратов, уменьшается венозный приток крови к сердцу, преднагрузка на него, снижается давление в левом желудочке и напряжение стенки менее растянутого миокарда. Таким образом, облегчается коронарный; кровоток и уменьшается потребность миокарда в кислороде. Назначают препарат больным с ИБС для предупреждения приступа; препарат назначают внутрь, его действие наступает через 20-30 мин, продолжительность эффекта до 6 ч.
Нежелательными эффектами молсидомина являются головная боль, снижение артериального давления. Так же, как нитраты, препарат противопоказан при тяжелой гипотонии, кардиогенном шоке. Не рекомендуется его назначение в первые 3 месяца беременности.
Дипиридамол (кур а нт и л) относится к производным пиримидина (см. гл. 3, 28). Его механизм коронарорасширяющего действия связан с увеличением концентрации аденозина в миокарде. Дипиридамол понижает сопротивление мелких коронарных артерий, способствует образованию коллатералей сосудов миокарда, тормозит агрегацию тромбоцитов. Назначают дипиридамол обычно внутрь в течение нескольких недель и даже месяцев. Кроме ИБС, дипиридамол в качестве антиагреганта назначают при склонности к тромбообразованию. При внутривенном введении больших доз дипиридамола может возникнуть синдром «обкрадывания», то есть неблагоприятного перераспределения крови через коронарные коллатерали, не пораженные атеросклерозом, от ишемизированных участков в другие отделы миокарда. Ишемия миокарда при этом может усугубиться в пораженных участках. Поэтому дипиридамол не рекомендуют назначать больным с распространенным стенозирующим атеросклерозом коронарных артерий. Из нежелательных эффектов дипиридамола отмечены тошнота, головная боль, кожный зуд.
Карбохромен (интенсаин, интенкордин). Механизм коронарорасширяющего действия карбохромена связывают с ингибированием фосфодиэстеразы и накоплением вследствие этого цАМФ, а также с повышением активности 5-нуклеотидазы и увеличением образования аденозина. Карбохромен увеличивает коронарный кровоток, при длительном применении способствует развитию коллатералей, отмечается также небольшое увеличение минутного объема сердца за счет положительного инотропного действия. На величину артериального давления и частоту сердечных сокращений карбохромен не
182
влияет. Применяют его внутрь 3 раза в день после еды в течение нескольких месяцев при ИБС с локальным стенозом одной-двух коронарных ветвей и стабильном течении заболевания. Карбохромен не рекомендуют назначать больным с распространенным стенозирующим атеросклерозом коронарных артерий, а также при язвенной болезни желудка, заболеваниях печени и почечной недостаточности.
ПРЕПАРАТЫ РЕФЛЕКТОРНОГО ДЕЙСТВИЯ
Валидол — 25% раствор ментола в ментоловом эфире изовалериановой кислоты. По действию близок к ментолу. Оказывает успокаивающее влияние на центральную нервную систему и обладает умеренным рефлекторным сосудорасширяющим действием. Назначают валидол в виде раствора для применения в виде капель на сахар или в виде таблеток и капсул, которые следует держать под языком до полного растворения. Валидол используют при легких приступах ИБС, неврозах, морской и воздушной болезни.
Корвалол (валокардин) — комбинированный препарат, содержащий этилового эфира бромизовалериановой кислоты около 2%, фенобарбитала 1,82%, едкого натрия (для перевода фенобарбитала в растворимый фенобар-битал-натрий) около'3%, масло мяты перечной 0,14%, смеси спирта этилового 96 и воды дистиллированной до 100%. Входящие в состав корвалола компоненты оказывают седативное и спазмолитическое действие. Применяют корвалол при нерезко выраженных спазмах коронарных сосудов, тахикардии, неврозах с повышенной раздражительностью, бессоннице. Назначают его внутрь до еды по 15-30 капель 2-3 раза в день. Корвалол обычно хорошо переносится;.даже при длительном применении препарата нежелательных явлений не наблюдается.
Дозы коронарных средств даны в табл. 37.
Таблица 37
Коронарные средства
Препарат Лекарственная форма Путь введения Число приемов в сутки Однократная доза
Нитроглицерин Nitroglycerinum 1% раствор в спирте во флаконах по 5 мл Таблетки по 0,0005 г 1 % раствор в масле в капсулах по 0,0005 и 0,001 г Под язык (на сахар) Под язык То же Во время приступа То же « 2-3 капли (1-1/2 таблетки) 1—2 таблетки 1 капсула
Верапамил Verapamilum Таблетки по 0,04 г 0,25% раствор в ампулах по 1 мл Внутрь Внутривенно 3-4 1 1-4 мг/кг 0,1-0,2 мг/кг
Молсидомин Molsidominum Таблетки по 0,002 г Внутрь Под язык 2-3 1/2-1 таблетка
183
Глава 22 СРЕДСТВА, УЛУЧШАЮЩИЕ МОЗГОВОЙ КРОВОТОК
При нарушениях мозгового кровообращения как острых, так и хронических, используют препараты, улучшающие кровоток, и в связи с этим метаболические процессы в мозговой ткани. Улучшить кровоток могут вещества, устраняющие спазм сосудов мозга; особенно ценятся препараты с преимущественным воздействием на них. Лекарственные вещества, равномерно расширяющие сосуды в организме, либо вызывают небольшой эффект, либо приводят к «обкрадыванию» мозга. Мозговой кровоток может улучшиться и после введения веществ, которые повышают АД, увеличивая при этом поступление крови в сосуды мозга.
К препаратам, улучшающим мозговой кровоток, относят:
производные ксантина — эуфиллин, кофеин, пентоксифиллин (трентал);
блокаторы кальциевых каналов гг нифедипин, циннаризин;
препараты никотиновой кислоты — никошпан, ксантинола никотинат, нигексин;
дегидрированные производные алкалоидов спорыньи — дегидроэрготамин, дегидроэрготоксин;
а.-адреноблокаторы — сермион (ницерголин);
производные алкалоидов барвинка — девинкан, кавинтон (винпоцетин);
ноотропы — пирацетам, пикамилон.
Производные ксантина. Эуфиллин (см. гл. 3) применяют для купирования церебральных сосудистых кризов, уменьшения внутричерепного давления и отека мозга при инсультах. Вводят его при этой патологии внутривенно медленно, разводя в 10-20 мл 20% раствора глюкозы. Кофеин (см. гл. 3, 4) применяют при спазмах сосудов головного мозга (мигрени) часто в сочетании с другими сосудистыми средствами и анальгетиками. Пентоксифиллин применяют при ишемической энцефалопатии. Также он тормозит агрегацию эритроцитов.
Из блокаторов кальциевых каналов (см. гл. 20) применяют нифедипин для профилактики мигрени.
Циннаризин (стугерон) (обладающий преимущественным действием на мозговые сосуды) применяют при хронических нарушениях мозгового кровообращения, связанных с гипертонической болезнью и ранними формами атеросклероза мозговых сосудов. Назначают циннаризин длительно, в течение 3-18 мес. Однако он вызывает побочные явления: сонливость, тошноту; сухость во рту отмечают очень редко.
Препараты никотиновой кислоты (см. гл. 32). Это, как правило, комбинированные препараты, содержащие одновременно и другие спазмолитические средства.
Нигексин и ксантинола никотинат (те он и кол) сочетают свойства веществ группы теофиллина и никотиновой кислоты. Используют их для увеличения мозгового кровообращения у больных после травматических повреждений мозга, при ранних формах атеросклероза. Никошпан — комби
184
нированный препарат, в состав которого входят но-шпа и никотиновая кислота. Он обладает хорошим сосудорасширяющим эффектом, и его применяют при спазмах мозговых сосудов. Нежелательные эффекты при использовании этих препаратов обусловлены наличием в них никотиновой кислоты (см. гл. 32).
а-Адреноблокаторы. Дигидроэрготамин и дигидроэрготоксин за счет а-адреноблокирующего действия вызывают расширение сосудов и улучшение мозгового кровотока, что позволяет использовать их при мигрени.
Сермион (ницерголин) — а-адреноблокатор с преимущественным влиянием на сосуды головного мозга Он существенно улучшает мозговой кровоток. Кроме того, он обладает способностью понижать агрегацию тромбоцитов, уменьшать опасность образования тромбоцитарных тромбов в артериальной системе. Одновременно с воздействием на сосудистый'тонус отмечено влияние сермиона на метаболизм нервных клеток — препарат улучшает функции клеточных мембран, .регулирует обмен воды и электролитов, усиливает процессы метилирования и синтез РНК, что приводит к улучшению процесса обучения и памяти. Эти свойства препарата позволяют говорить о ноотропоподобном действии сермиона. Назначают сермион внутрь в таблетках по 5 мг или (как ницерголин) внутривенно капельно, когда 1 ампулу, содержащую 4 мг препарата, разводят в 200-400 мл изотонического раствора натрия хлорида. Курс лечения 2—4 недели. Сермион хорошо переносят. Нежелательные эффекты — анорексия, тошнота, боли в желудке, возникающие в основном при парентеральном пути введения. Возможна непродолжительная гипотензия. Иногда возникают головные боли во время инфузии препарата, прекращающиеся после ее окончания. При введении сермиона в комбинации с другими антигипертензивными средствами возможен потенцирующий эффект, поэтому рекомендуется контролировать артериальное давление. Следует избегать назначения сермиона во время беременности.
Производные алкалоидов барвинка. Кавинтон (винпоцетин) повышает мозговой кровоток и снижает цереброваскулярное сопротивление; при этом отмечается, что усиление кровотока наступает прежде всего в тех участках мозга, где сосуды сужены. Препарат вызывает улучшение микроциркуляции и метаболизма мозга: повышается усвоение-’кислорода, усиливается аэробный гликолиз и образование АТФ. Кроме того, кавинтон улучшает реологическое состояние крови, ингибирует агрегацию тромбоцитов,
Сосудорасширяющее действие кавинтона связано с его тормозящим влиянием на поступление кальция внутрь клетки, а также с угнетением мобилизации кальция из внутриклеточных деПо при деполяризации мембран гладкомышечных клеток сосудов. В больших дозах кавинтон оказывает расслабляющее действие на скелетные мышцы.
Препарат назначают внутрь, курс лечения должен быть не менее 2 мес. В острых случаях кавинтон вводят внутривенно капельно, при этом нельзя совмещать с гепарином. Нельзя вводить раствор кавинтона подкожно и внутримышечно.
Выраженных нежелательных эффектов кавинтон не вызывает; Возможны случаи проходящего снижения артериального давления и тахикардии. Противопоказанием для его приема являются беременность, тяжелая форма ИБС и аритмии.
185
Девинка нпо своему механизму действия и эффектам подобен кавинтону, но в отличие от него проявляет слабое седативное действие.
Ноотропы (см. гл. 4).
Дозы и режим применения средств, улучшающих мозговое кровообращение, даны в табл. 38.
Таблица 38
Препараты, применяемые при нарушениях мозгового кровообращения
Препарат Лекарственная форма Путь введения Число введений в сутки Однократная доза
Циннаризин Cinnarizinum Таблетки по 0,025 г Внутрь 2-3 0,025-0,05 г
Ксантинола никотинат Xantinoli nicotines Таблетки по 0,15 г 15% раствор в ампулах по 2 мл Внутрь Внутримышечно, внутривенно медленно 3 1-2 0,15 г 0,3 г
Сермион Sermionum Таблетки по 0,01 г Внутрь 3 0,005-0,01 г
Кавинтон Cavinton Таблетки по 0,005 г 0,5% раствор в ампулах по 2 мл Внутрь Внутривенно капельно в 500-1000 мл изотонического раствора натрия хлорида 3 3 0,005 г 0,01 г
Девинкан Devincan Таблетки по 0,005 и 0,01 г 0,5% раствор в ампулах по 1 мл Внутрь Внутримышечно 2-3 1 0,005-0,01 г 0,005 г
Глава 23 АНТИГИПЕРТЕНЗИВНЫЕ СРЕДСТВА
Высокое артериальное давление может быть проявлением эссенциальной гипертонической болезни (одного из наиболее распространенных сердечнососудистых заболеваний), а также следствием многих патологических процессов (эндокринных расстройств, заболеваний почек, центральной нервной системы и др.). Артериальную гипертензию регистрируют не только у взрослых и подростков, но и у детей школьного и даже дошкольного возраста. Артериальная гипертензия — ведущий фактор риска инсультов и ишемической болезни сердца. Она нарушает деятельность сердца, способствует возникновению его недостаточности, ухудшает кровоснабжение мозга, печени
186
и других органов. Поэтому так важны антигипертензивные средства (АГТС) — вещества, снижающие повышенное артериальное давление. Классифицируют АГТС, учитывая их действие на разные звенья системы регуляции артериального давления.
КЛАССИФИКАЦИЯ АНТИГИПЕРТЕЗИВНЫХ СРЕДСТВ
I. Средства, уменьшающие стимулирующее влияние адренергической иннервации на сердечно-сосудистую систему
1. Препараты, преимущественно действующие на центральные структуры симпатической нервной системы: клофелин, гуанфацин, метилдофа, моксони-дин.
2. Ганглиоблокаторы: бензогексоний, пентамин, камфоний, гигроний.
3. Симпатолитики: резерпин, раунатин, октадин.
4. Альфа-адреноблокаторы: пирроксан, празозин, доксазозин.
5. Бета-адреноблокаторы: анаприлин, окспренолол, пиндолол, алпренолол.
6. Альфа- и бета-адреноблокаторы: лабеталол, карведилол.
II. Вазодилататоры
1. Блокаторы кальциевых каналов: нифедипин, верапамил, дилтиазем.
2. Артериолярные вазодилататоры: апрессин, миноксидил.
3. Артериолярные и венозные вазодилататоры: натрия нитропруссид.
4. Миотропные: дибазол, магния сульфат.
III. Средства, влияющие на ренин-ангиотензиновую систему
1. Ингибиторы ангиотензин-конвертирующего фермента: каптоприл, лизиноприл, эналаприл, периндоприл.
2. Антагонисты ангиотензина II: лозартан (козаар), ирбезартан, валзартан.
IV. Средства, влияющие на водно-солевой обмен (диуретики)
Гипотиазид, клопамид, спиронолактон (верошпирон).
СРЕДСТВА, УМЕНЬШАЮЩИЕ СТИМУЛИРУЮЩЕЕ ВЛИЯНИЕ АДРЕНЕРГИЧЕСКОЙ ИННЕРВАЦИИ НА СЕРДЕЧНО-СОСУДИСТУЮ СИСТЕМУ
Препараты, преимущественно действующие на центральные структуры симпатической нервной системы.
Клофелин (клонидин), метилдофа (д о п е г и т) и другие препараты группы являются центральными аг-адреномиметиками (см. гл. 2). Механизм их антигипертензивного действия преимущественно связан со стимуляцией пресинаптических аг-рецепторов в ядрах солитарного тракта варолиевого моста и голубого пятна, что приводит к торможению тонически активных вазопрессорных их нейронов. В результате снижается тонус периферических сосудов, образование ренина в почках и его поступление в плазму крови, урежается частота сердечных сокращений. Препараты этой группы стимулируют и периферические пресинаптические аг-рецепторы на окончаниях адренергических аксонов, что тоже понижает освобождение из них норадреналина и его концентрацию в плазме крови.
187
Клофелин и метилдофа отчетливо снижают артериальное давление у больных гипертонической болезнью; на нормальное артериальное давление влияют незначительно. Обычно эти препараты применяют длительно, но иногда клофелин используют и для купирования гипертонического криза. Для этой цели его вводят внутривенно медленно в течение 3-5 мин, предварительно разведя в изотоническом растворе натрия хлорида (чтобы избежать подъема артериального давления, вызванного активацией а2-рецепторов в периферических сосудах (см. гл. 2). После внутривенного введения клофелйна больной должен лежать 1-2 ч для профилактики ортостатической гипотензии. При умеренном гипертоническом кризе клофелин можно ввести внутримышечно или принять таблетку под язык. О других терапевтических и нежелательных эффектах клофелйна и метилдофы (см. гл. 2).
Моксонидин — стимулятор имидазолиновых рецепторов в центральной нервной системе и слабый активатор а2-адренорецепторов. Препарат вызывает продолжительное антигипертензивное действие, снижая уровень норадреналина, адреналина, ренина, ангиотензина II и альдостерона в плазме крови. Прием моксонидина сопровождается не^рльшим числом нежелательных эффектов: сухостью во рту, утомляемостью, головными болями.
Ганглиоблокаторы (бензогексоний, пентамин, камфоний, гиг-роний). Эти препараты снижают артериальное давление за счет блокады симпатических ганглиев (см. гл. 1). При этом отмечается снижение тонуса артериол и венул, уменьшение общего периферического сопротивления сосудов, давления в легочной артерии и правом желудочке. Уменьшение венозного возврата приводит к снижению преднагрузки на сердце. Эти препараты вводят парентерально для лечения больных с гипертоническим кризом, отеком мозга или легких, а также в хирургии для управляемой гипотонии во время операции. Желательно подбирать дозы, ганглиоблокаторов для каждого больного индивидуально. После инъекции пациент должен лежать около 2 ч во избежание ортостатической гипотензии.
Нежелательные эффекты ганглиоблокаторов связаны с их способностью блокировать также парасимпатические ганглии. У больных отмечают нарушение аккомодации, повышение внутриглазного давления, сухость во рту, запоры, атонию кишечника и мочевого пузыря.
Симпатолитики (вещества пресинаптического действия, нарушающие передачу возбуждения на уровне окончаний адренергических волокон) (см. гл. 2).
Резерпин (рауседил) снижает повышенное артериальное давление в результате уменьшения запасов катехоламинов в нервных окончаниях как в центральной, так и в периферической нервной системе, в надпочечниках. Препарат нарушает связь катехоламинов с резервирующими белками в гранулах и способствует выходу норадреналина, дофамина и серотонина в цитоплазму. Здесь они подвергаются инактивации митохондриальной моноаминооксидазой (МАО).
Снижение содержания- катехоламинов в почках приводит к уменьшению освобождения из них ренина.
Используют резерпин для длительного лечения гипертонической болезни, обычно в сочетании с диуретиками и препаратами миотропного действия.
Максимальный терапевтический эффект развивается спустя несколько недель. После отмены препарата полное прекращение его действия также отме
188
чается через несколько недель. Кроме гипертонической болезни, резерпин назначают больным с тиреотоксикозом, так как он уменьшает у них явления, связанные с повышенной активностью симпатической нервной системы, в частности тахикардию, потливость и пр.
Нежелательные явления при лечении резерпином преимущественно заключаются в угнетении центральной нервной системы. У больных отмечают сонливость, депрессию, которая после отмены резерпина проходит очень медленно и плохо поддается лечению антидепрессантами. Как следствие преобладания парасимпатических влияний у больных отмечают брадикардию, образование или обострение пептических язв желудка, повышение секреции соляной кислоты, моторики желудочно-кишечного тракта. Имеет значение и повышение резерпином освобождения гистамина. Из-за расширения сосудов слизистой и ее отека развивается заложенность носа. Отмечают также повышение аппетита и увеличение массы тела, задержку натрия и воды. При сочетании резерпина с диуретиками снижается риск возникновения отеков, усиливается гипотензивный эффект.
Большие дозы резерпина могут способствовать эндокринным нарушениям, проявляющимся в импотенции у мужчин, гинекомастии, снижении фертильности (плодовитости) у женщин. Этот эффект препарата связывают с его способностью повышать секрецию пролактина гипофизом.
Раунатин (раувазан) является растительным препаратом, содержащим помимо резерпина и другие алкалоиды раувольфии (серпентин, аймалин и др.). По антигипертензивному действию он подобен резерпину, но эффект наступает медленнее и выражен слабее. Присутствие других алкалоидов снижает его влияние на центральную нервную систему, придает препарату антиаритмичес-кую активность.
Нежелательные эффекты от раунатина отмечают редко. Проявляются они в виде общей слабости, заложенности носа, нарушения функции желудочно-кишечного тракта. Осложнения, как правило, проходят при уменьшении дозы или после кратковременного периода (1-3 дня).
Октадин (изобарин) (см. гл. 2) проявляет антигипертензивный эффект за счет опустошения запасов катехоламинов в депо. Он поступает в нервные окончания, накапливается в гранулах и выталкивает из них норадреналин. Кроме того, понижая проницаемость мембран пресинаптических окончаний октадин мешает возврату в них медиатора. В отличие от резерпина он не проникает через гематоэнцефалический барьер и не оказывает центрального действия. При приеме октадина через рот антигипертензивный эффект развивается медленно и не сопровождается подъемом артериального давления. При внутривенном же введении препарата, особенно у больных феохромоцитомой, гипотензивному действию может предшествовать повышение артериального давления. Эту фазу действия октадина связывают с быстрым выбросом норадреналина в кровь, но повышение кровяного давления бывает нестойким и длится от 30 мин до 2 ч. Снижая влияние симпатических органов, октадин способствует преобладанию парасимпатического воздействия на них, в частности вагуса на сердце, что приводит к брадикардии. В условиях брадикардии улучшается кровоснабжение миокарда, нормализуются метаболические процессы в нем и снижается минутный
189
объем. Этот эффект также способствует антигипертензивному действию окта-дина.
. Основным показанием для назначения октадина является гипертоническая болезнь. Его желательно сочетать с тиазидовыми диуретиками, так как он задерживает натрий и воду в организме.
Нежелательные эффекты см. в гл. 2. Противопоказан октадин при артериальной гипертензии, обусловленной феохромоцитомой, так как на фоне лечения им усиливается выход катехоламинов из опухоли, а также при острых нарушениях мозгового кровообращения и выраженной почечной недостаточности.
Альфа-адреноблокаторы (см. гл. 2). Пирроксан блокирует периферические СС1_ и а2-адренорецепторы, нарушая передачу сосудосуживающих импульсов и вызывая расширение главным образом мелких кровеносных сосудов. Кроме того, пирроксан снижает симпатическую импульсацию из центральной нервной системы к сосудам, так как обладает центральным а-адренолитическим эффектом. Гипотензивный эффект пирроксана непродолжителен. Используют его при гипертонических и диэнцефдльных кризах, вводя подкожно или внутримышечно.
Во время инъекции и после нее в течение 1,5—2 ч больной должен лежать, чтобы избежать ортостатической гипотензии. Для профилактики названных кризов его применяют внутрь.
Кроме гипертонической болезни, пирроксан назначают при нарушениях вестибулярного аппарата (синдрома Меньера), для профилактики морской и воздушной болезни, а также для ослабления морфинной и алкогольной абстиненции.
Из нежелательных эффектов надо отметить брадикардию и усиление болей в области сердца у больных ИБС.
Празозин (минипресс) и доксазозин (кардура) — блокаторы а,-адренорецепторов (см. гл. 2). Кроме того, он оказывает прямое действие на гладкую мускулатуру вен и артериол. В результате они снижают венозный приток и преднагрузку на сердце, а снижая артериальное давление, уменьшают и постнагрузку. Поэтому названные препараты используют и для лечения сердечной недостаточности.
а-Адреноблокаторы благоприятно влияют на липиды плазмы. Они понижают уровень общего холестерина, триглицеридов и атерогенных фракций липопротеидов, что уменьшает развитие атеросклероза сосудов. В отличие от других а-блокаторов'празозин не вызывает тахикардию.
Празозин и доксазозин назначают чаще в виде монотерапии при легкой и умеренной артериальной гипертензии. В более тяжелых случаях их можно комбинировать с диуретиками и р-блокаторами.
В начале лечения препараты необходимо принимать в небольшой дозе (1 нт/сут), так как от их высоких доз возможен «феномен первой дозы». Он проявляется ортостатической гипотензией, сопровождаемой обмороками, головокружением и сердцебиением. Особенно выражена эта реакция у больных со сниженной концентрацией натрия в крови, возникшей, например, вследствие бессолевой диеты или приема диуретиков. Назначение празозина иногда сопровождается развитием толерантности к нему. Ранняя толерантность проявляется на 3—4 день лечения, а поздняя — через несколько недель.
190
Другие нежелательные эффекты при использовании празозина — сухость во рту, расстройства желудочно-кишечного тракта — наблюдаются редко.
Бета-адреноблокаторы (см. гл. 2). p-Адреноблокаторы находят широкое применение при гипертонической болезни, особенно на ее ранних стадиях, когда у больных обнаруживают гиперкинетический тип кровообращения с резко повышенным сердечным выбросом и тахикардией. Из p-блокаторов при гипертонической болезни чаще используют пропранолол (анаприлин, индерал), окспренолол (тразикор), пиндолол (вискен) и алпренолол (оптин), талинолол (корданум). Антигипертензивное действие p-блокаторов в большой степени обусловлено снижением сердечного выброса в результате блокады р-рецепторов миокарда.
Кроме того, уменьшение артериального давления под влиянием препаратов этой группы является следствием снижения выброса ренина в плазму, угнетения симпатической импульсации на центральной нервной системы.
P-Блокаторы оказывают антигипертензивный эффект спустя 1-3 недели после начала лечения. В ранние сроки p-блокаторы могут повысить периферическое сопротивление сосудов, так как блокируют в них p-рецепторы в гладкой мускулатуре. Повышение тонуса периферических сосудов может быть и следствием компенсаторной реакции в ответ на снижение сердечного выброса. В дальнейшем через 6—8 нед развивается стойкий лечебный эффект, который поддерживается, по-видимому, высвобождением простагландина 12 из стенок сосудов; снижением образования ангиотензина II (следствие понижения уровня ренина); дальнейшим снижением активности симпатической нервной системы и реабсорбции натрия и воды.
P-Блокаторы отличаются друг от друга по кардиоселективности, наличию симпатомиметической активности и мембраностабилизирующему действию (см. гл. 2).
Кардиоселективные препараты (талинолол) следует предпочитать у больных с сопутствующими обструктивными заболеваниями дыхательных путей, поражениями периферических артерий.
P-Блокаторы, обладающие внутренней симпатомиметической активностью (окспренолол, алпренолол, пиндолол), в меньшей степени урежают частоту сердечных сокращений в покое, что имеет значение у больных с наклонностью к брадикардии.
При гипертонической болезни p-блокаторы используют для длительного лечения; принимают их внутрь.
Нежелательные эффекты p-блокаторов обусловлены их специфическим фармакологическим действием на p-адренорецепторы. У больных с тяжелым заболеванием миокарда и нарушением его сократительных свойств их назначение может вызвать симптомы застойной сердечной недостаточности.
Вследствие угнетения функции синусового узла и проводимости р-бло-каторы вызывают брадикардию и блоки проводящей системы преимущественно атрио-вентрикулярного узла. Это осложнение менее свойственно препаратам с внутренней симпатомиметической активностью. Некардйоселек-тивные препараты, блокируя рз-рецепторы в бронхах, могут ухудшать состояние больных бронхиальной астмой. Частыми нежелательными эффектами Р-блокаторов являются чувство похолодания конечностей, обострение синдрома Рейно и перемежающейся хромоты. Препараты, легко растворимые в
191
жирах и проникающие через гематоэнцефалический барьер (анаприлин, алпре-нолол), при длительном лечении могут привести к депрессии, бессоннице. Со стороны желудочно-кишечного тракта при лечении p-блокаторами могут наблюдаться такие побочные явления, как понос, боль в животе, запоры; на коже иногда появляется сыпь.
Альфа- и бета-адреноблокаторы. Л а бе тал о л и кардивелол — препараты, обладающие свойством блокировать и а- и Р-адренорецепторы. Они снижают повышенное артериальное давление у больных артериальной гипертензией как в покое, так и при стрессовых ситуациях; снижают периферическое сосудистое сопротивление, уровень ренина и альдостерона в плазме крови, но только при высоком исходном их содержании. Гипотензивный эффект препаратов усиливается при комбинации с диуретиками. При длительном лечении гипертонической болезни препарат назначают внутрь, постепенно увеличивая дозу. Для купирования гипертонического криза и «синдрома отмены» после клофелина препарат вводят внутривенно струйно или капельно. Для капельной инфузии его предварительно разводят в 200 мл 5% раствора глюкозы или изотонического раствора натрия хлорида.
Нежелательные реакции при Назначении лабеталола и кардивелола возникают редко. При приеме больших доз или быстром внутривенном введении у больного может быть ортостатическая гипотензия. Реже развиваются слабость, нарушение зрения, сухость слизистой оболочки носа, рвота, бронхоспазм. Препараты могут вызвать обратимое повышение в плазме крови активности ферментов печени, холестаз и желтуху, гипергликемию.
ВАЗОДИЛАТАТОРЫ
Блокаторы кальциевых каналов (см. гл. 21) — нифедипин, верапамил и дилтиазем — тормозят поступление ионов’ кальция в клетки мышечной стенки артериол, что приводит к снижению общего периферического сопротивления сосудов. Поэтому препараты используют в качестве АГТС.
Нифедипин (коринфар, кордафен) — наиболее эффективное средство для лечения гипертонической болезни, так как оказывает более сильное расширяющее действие на сосуды, чем верапамил. Он отчетливо снижает диастолическое артериальное давление. Используют нифедипин и для купирования резкого повышения давления, назначая его под язык, и при хронической гипертонической болезни, особенно сочетающейся с ИБС, брадиаритмией. Однако снижая систолическое и диастолическое артериальное давление, нифедипин может спровоцировать возникновение рефлекторной тахикардии, повышающей потребность миокарда в кислороде. Поэтому для получения более выраженного и продолжительного гипотензивного эффекта лучше использовать нифедипин ретард или сочетать его с р-адреноблока-торами.
Нежелательные эффекты нифедипина связаны с чрезмерной вазодилатацией, что проявляется у больных головокружением, покраснением кожных покровов, головной болью, отеками на ногах. Иногда наблюдаются тошнота, гиперплазия десен, психозы или угнетение центральной нервной системы. Побочные эффекты, как правило, уменьшаются при снижении дозы лекарства. Отмену
192
препарата необходимо проводить постепенно, в течение 3-х дней, так как может наблюдаться «синдром отмены».
Верапамил (изоптин) снижает артериальное давление за счет расширения периферических сосудов, а также уменьшения сердечного выброса и частоты сердечных сокращений. Назначают верапамил как для длительного лечения гипертонической болезни (внутрь), так и для купирования гипертонического криза (внутривенно).
Из специфических нежелательных эффектов верапамила следует отметить брадикардию, атриовентрикулярный блок и запоры. При одновременном, приеме верапамила и дигоксина уровень последнего в плазме крови повышается, что может служить причиной дигиталисовой интоксикации.
Дилтиазем вызывает очень редко нежелательные эффекты — отек голеней и стоп, аритмии.
Артериолярные вазодилататоры — апрессин и минаксидил.
Апрессин (гидралазин) — тормозит дофамингидроксилазу, уменьшав превращения дофамина в норадреналин и влияние последнего на «-адренорецепторы сосудов. Кроме того, он обладает миотропным действием, препятствуя поступлению кальция в цитоплазму клеток из внутриклеточных депо и из внеклеточного пространства.
Миноксидил (ми нон а) — агонист (открыватель) калиевых каналов в гладкомышечных клетках сосудов (преимущественно артериол).
В результате уменьшения сопротивления сосудов компенсаторно повышается активность симпатической нервной системы, что проявляется в учащении сокращений сердца, увеличении сердечного выброса и повышении потребности миокарда в кислороде. Поэтому вазодилататоры не применяют для монотерапии, а комбинируют с [3-блокаторами. Актив_ация симпатической нервной системы приводит также к повышению уровня ренина и альдостерона в плазме крови и, следовательно, к задержке натрия и воды в организме. Для увеличения антигипертензивного эффекта апрессин и миноксидил рекомендуют сочетать с диуретиками. Назначают эти препараты обычно больным с артериальной гипертензией, резистентной к другим препаратам.
Нежелательными эффектами, наблюдаемыми при назначении апрессина и '.миноксидила, являются сердцебиение, головная боль, отеки. Кроме того, апрессин может вызвать синдром, очень похожий на красную волчанку, а миноксидил — гипертрихоз. .
Отмена препаратов спустя 1-2 мес приводит к исчезновению побочных эффектов.
Артериолярный и венозный вазодилататор — натрия нитропруссид. Это. мощный периферический вазодилататор короткого действия. На активность симпатической нервной системы действует подобно нитратам (см. гл. 21). Препарат назначают для купирования гипертонических кризов или для управляемой гипотензии во время хирургических операций. Вводят его внутривенно капельно, разводя в 5% растворе глюкозы.
При длительном введении натрия нитропруссида (более 48-72 ч) может произойти накопление его метаболитов, образующихся в печени, — тиоцианата и цианида. Признаки отравления тиацианатом: смазанная речь, судороги, психозы и кома. В этом случае больному нужно назначить (после отмены препарата)
7 Зак. 3856
193
витамин Bn, тиосульфат натрия, натрия гидрокарбонат и провести ингаляцию кислородом.
Быстрое введение препарата может привести к ортостатической гипотензии. Противопоказаниями к применению натрия нитропруссида являются гипертиреоидизм, тяжелое нарушение функции почек и печени.
Миотропные средства — дибазол и магния сульфат. Дибазол оказывает сосудорасширяющее и спазмолитическое действие, устраняет местные расстройства кровообращения, главным образом в головном мозге, сердце и почках. Однако он может уменьшить сердечный выброс. Назначают дибазол внутривенно или внутримышечно при гипертонических кризах, внутрь — при церебральных проявлениях гипертонической болезни. Одновременно с дибазолом можно применять резерпин или гипотиазид. Дибазол обычно хорошо йерено-сится. Лицам пожилого возраста его следует назначать (особенно внутривенно) на фоне сердечных гликозидов из-за опасности резкого уменьшения сердечного выброса.
Магния сульфат (см. гл. 35) понижает артериальное давление в связи с общим успокаивающим действием на центральную нервную систему, а также уменьшением сопротивления сосудов за счет угнетения входа Са++ в клетку и уменьшения его выхода из саркоплазматического ретикулума. Используют сульфат магния для купирования гипертонических кризов, вводя его внутримышечно или внутривенно медленно, так как при быстром введении возможно угнетение дыхания.
СРЕДСТВА, ВЛИЯЮЩИЕ НА РЕНИН-АНГИОТЕНЗИНОВУЮ СИСТЕМУ
Ренин — фермент, синтезирующийся в почках, после попадания в кровоток воздействует на ангиотензиноген, содержащийся в плазме крови, превращая его в неактивный ангиотензин I. Последний под влиянием специального ангиотензин-конвертирующего фермента (АКФ) превращается в ангиотензин II, являющийся одним из наиболее мощных эндогенных сосудосуживающих веществ. Кроме того, ангиотензин II стимулирует выделение альдостерона, в результате чего происходит задержка Na и воды в организме и увеличение объема циркулирующей крови; стимулирует центральные адренергические структуры и освобождение катехоламинов из пресинаптических окончаний. АКФ к тому же является киназой II, инактивирующей кинины в крови. Препараты, блокирующие АКФ, снижают образование ангиотензина II, альдостерона и повышает эффекты кининов. К препаратам этой группы относятся каптоприл, эналаприл и лизиноприл. Введение их больным гипертонической болезнью приводит к снижению периферического сопротивления сосудов и объема циркулирующей крови, следовательно, к снижению артериального давления. Названные препараты назначают внутрь, начиная с небольшой дозы, и постепенно увеличи
194
вают ее до поддерживающей. Применяют их как для монотерапии, так и в комбинации с диуретиками (обычно тиазидами).
Калийсберегающие диуретики (спиронолактон) на фоне каптоприла применять не следует, так как они могут спровоцировать гиперкалиемию. Эти препараты способны улучшать легочный и почечный кровоток, увеличивать мочеотделение (см. гл. 25), поэтому, кроме артериальной гипертензии, каптоприл, эналаприл и лизиноприл назначают при застойной сердечной недостаточности и гломерулонефрите.
Нежелательные эффекты при назначении ингибиторов АКФ развиваются редко. Примерно у 1% больных наблюдается протеинурия. Она возникает между 3 и 5 месяцем лечения чаще у больных с предшествующими заболеваниями почек и при назначении им высоких доз каптоприла. При развитии протеинурии следует снизить дозу препарата или отменить его. При лечении ингибиторов АКФ наблюдаются осложнения аллергического характера — набухание слизистых, сыпи, кашель, спазм бронхов, лихорадка — следствие избыточной активности кининов. Лизиноприл больные лучше переносят, но иногда он может вызвать нарушения функции печени.
Лозартан — конкурентный блокатор ангиотензиновых рецепторов в гладкой мускулатуре сосудов, в надпочечниках и нервной ткани.
Эффект лозартана зависит от исходного уровня ренина и ангиотензина II у больного. Артериальное давление снижается только при артериальной гипертензии, связанной с избыточной активностью ангиотензина.
Средства, влияющие на водно-солевой обмен — диуретики (см. гл. 25).
Для лечения гипертонической болезни диуретики назначают в качестве монотерапии в начале заболевания; обычно у лиц среднего и пожилого возраста.
На следующих стадиях гипертонической болезни диуретики используют в комбинации с другими антигипертензивными средствами.
Терапевтический эффект диуретиков связан с их способностью выводить натрий и воду из организма и таким образом уменьшать объем циркулирующей крови. В результате снижается сердечный выброс и соответственно уровень артериального давления. При длительном применении диуретиков уменьшается общее периферическое сопротивление, так как снижается содержание натрия в гладкомышечных клетках кровеносных сосудов и их реакция на эндогенные спазмогены (катехоламин, ангиотензин II).
Из диуретиков при гипертонической болезни чаще используют тиазидовые производные — дихлотиазид (ги потиазид), клопамид (бриналь-дикс), а также калийсберегающие мочегонные — спиронолактон (ве-рошпирон) и триамтерен (подробнее механизм их действия и нежелательные эффекты см. гл. 25).
Дозы и режим применения антигипертензивных средств даны в табл. 39.
195
Таблица 39
Антигипертензивные средства
Препарат Лекарственная форма Путь введения Количество введений в сутки Однократная доза
Клофелин Clophelinum Таблетки 0,000075 Внутрь 2—4 0,000075— 0,00015 г
0,01% раствор в ампулах по 1 мл Внутривенно медленно, разводя 10—20 мл изотонического раствора натрия хлорида 1
Празозин Prazosinum Таблетки по 0,001 г Внутрь 3-4 0,0005-0,001 г
Коринфар Corinfar Драже 0,01 г ( . То же 2-3 0,01 г
Апрессин Apressinum Таблетки и драже по 0,01 г или 0,025 г « 3 1-3 мг/кг
Дибазол Dibasolum Таблетки по 0,02 г и 0,002 г « 3-4 0,02 г
1% раствор в ампулах по 1, 2 и 5 мл Внутривенно медленно 1 0,5-2,0 мл
Магния сульфат Magnesii sulfas 25% раствор в ампулах по 5, 10 и 20 мл Внутримышечно 1-3 0,2 мл/кг
Внутривенно медленно
Каптоприл Captopril Официнальные капсулы Внутрь 2-3 25—50 мг
Капотен Capotenum Таблетки по 25 и 50 мг
Главя 24
АНТИГИПОТЕНЗИВНЫЕ СРЕДСТВА
Антигипотензивные средства — это группа препаратов, применяемых для восстановления до нормы сниженного артериального давления. Острое падение артериального давления (коллапс, шок) может быть следствием кровопотери, травмы, отравления, инфекционных заболеваний, сердечной недостаточности, обезвоживания и др. Кроме того, может встречаться хроническая артериальная гипотензия как самостоятельное заболевание. Для ликвидации артериальной гипотензии применяют препараты:
196
1) увеличивающие объем циркулирующей крови — плазмозаменители;
2) сосудосуживающие средства центрального (кофеин, кордиамин) и периферического действия (а-ад р е н о м и ме т и к и, глюкокортикоиды, минералокортикоиды, ангиотензинамид);
3) улучшающие микроциркуляцию тканей и устраняющие их гипоксию — ганглиоблокаторы, а-адреноблокаторы;
4) улучшающие работу сердца и повышающие минутный объем — сердечные гликозиды (см. гл. 19), добутамин и дофамин (см. гл. 2);
5) средства, оказывающие тонизирующее действие на центральную нервную систему — настойки лимонника, женьшеня, заманихи, аралии; экстракты элеутерококка и родиолы розовой.
ПЛАЗМОЗАМЕНИТЕЛИ
Плазмозамещающие растворы делят на крупномолекулярные и низкомолекулярные. Крупномолекулярные соединения (полиглюкин, реополиглюкин и желатиноль) обладают гемодинамическими и дезинтоксикационными свойствами. Низкомолекулярные соединения (гемодез, полидез) используются для дезинтоксикации и в меньшей степени для гемодинамических целей.
Крупномолекулярные препараты имеют большую массу, близкую к таковой альбумина крови. Они не проникают через сосудистую стенку в ткани, не фильтруются в клубочках почек и поэтому длительно циркулируют в кровеносном русле. Эти высокомолекулярные соединения поддерживают онкотическое давление плазмы крови и способствуют сохранению ОЦК, чем повышают артериальное давление.
Полиглюкин — 6% раствор декстрана (полимера глюкозы) в изотоническом растворе натрия хлорида. Средняя относительная молекулярная, масса 60 000±10 ООО, относительная вязкость 2,8-4,0; pH 4,5—6,5. Его вливание больному с острой кровопотерей может быстро повысить артериальное давление и длительно удерживать его на достигнутом уровне. Препарат нетоксичен, постепенно подвергается деполимеризации и выделяется почками (в первые сутки около 50%).
Полиглюкин вводят внутривенно или внутриартериально. С целью профилактики пока во время операции полиглюкин вводят внутривенно капельно.
Противопоказано введение полиглюкина при травмах черепа с повышенным внутричерепным давлением, кровоизлиянием в мозг, больным с сердечной и почечной недостаточностью.
Реополиглюкин — 10% раствор декстрана с относительной молекулярной массой 30 000—40 000 в изотоническом растворе натрия хлорида. Препарат способствует извлечению жидкости из тканей, особенно отечных, в кровяное русло, восстанавливает кровоток в мелких сосудах и оказывает дезинтоксикационное действие (связывает циркулирующие в крови микробные токсины и яды). Применяют реополиглюкин при нарушении микроциркуляции для профилактики и лечения травматического, хирургического и ожогового шока; для дезинтоксикации при перитоните, острых отравлениях, панкреатите.
Желатиноль — коллоидный 8% раствор частично расщепленного желатина в изотоническом растворе натрия хлорида. Относительная молекулярная
197
масса 20 000 ± 5000, pH 6,8—7,6. Применяют его в качестве плазмозамещающего средства при кровопотерях, хирургическом и травматическом шоке; для дезинтоксикации организма в тех же случаях, что и реополиглюкин. Желатиноль обычно не вызывает осложнений. После его введения в течение 1—2 дней в моче может быть белок, так как препарат выделяется частично почками в неизмененном виде.
Низкомолекулярные соединения — гемодез, полидез используются в качестве средств для дезинтоксикации и возмещения потери жидкости.
Гемодез — водно-солевой раствор, содержащий 6% низкомолекулярного поливинилпирролидона и ионы натрия, калия, кальция, магния, хлора. Его относительная молекулярная масса 12 600 ±2700, pH 5,2-7.
Пол и дез — 3% раствор поливинилового низкомолекулярного спирта в изотоническом растворе натрия хлорида. Относительная молекулярная масса 10 000 ±2 000, pH 5,1-6,1.
Оба препарата назначают внутривенно капельно для дезинтоксикации организма при острых отравлениях, инфекционных токсикозах и других патологических состояниях, сопровожда^уцихся интоксикацией. Механизм действия препаратов обусловлен способностью низкомолекулярных соединений связывать токсины и яды, циркулирующие в крови, и быстро выводиться вместе с ними почками. Они усиливают почечный кровоток, повышают клубочковую фильтрацию и увеличивают диурез.
При медленном введении препараты обычно осложнений не вызывают, если же их вводить струйно быстро, то возможны тахикардия, понижение артериального давления и затруднение дыхания, тошнота.
При острых кишечных инфекциях, когда дегидратация не вызывает еще резких нарушений функции дыхания и сердечно-сосудистой системы, используют низкомолекулярные соединения и водно-солевые растворы через рот. К таким препаратам относятся энтеродез, глюкосолан и регидрон.
Энтеродез — низкомолекулярный поливинлпирролидон. Относительная молекулярная масса 12'600 ±2700. Выпускается в виде порошка белого или желтого цвета. Перед употреблением растворяют 5 г порошка (1 чайную ложку) в 100 мл кипяченой воды с добавлением сахара. Механизм лечебного действия энтеродеза заключается в его способности активно связывать токсины в желудочно-кишечном тракте и выводиться с ними кишечником. Энтеродез обладает высокой лечебной эффективностью также у больных с острой гнойной инфекцией, ожоговой болезнью, сепсисом. Он включается в комплексную терапию токсикозов разного происхождения.
Энтеродез хорошо переносится больными, возможны быстро проходящие тошнота и рвота, которые не являются основанием для отмены препарата.
Глюкосолан и регидрон — это сложные солевые растворы (состав см. в табл. 40), назначаемые детям для оральной регидратации при гастрите и энтерите, особенно с синдромом «водянистой диареи», сопровождаемой эксикозом 1—2 степени.
Противопоказаниями для оральной регидратации являются неукротимая рвота, обезвоживание степени, наличие гиповолемического шока или инфекционно-токсического шока в сочетании с тяжелой интоксикацией, анурией, почечной недостаточностью.
198
Таблица 40
Состав глюкосолана и регидрона
Показатель Глюкосолан Регидрон
Натрия хлорид, г 3,5 3,5
Натрия бикарбонат, г 2,5 -
Натрия цитрат, г - 2,9
Калия хлорид, г 1,5 2,5
Глюкоза, г 20 10
Питьевая вода, л 1 1
Осмолярность, мосм/л 331 260
Натрий, ммоль/л 90 93,9
Калий, ммоль/л 20,1 33,5
Хлор, ммоль/л 62,85 93,5
Бикарбонат, ммоль/л 11,9 -
Циатрат, ммоль/л - 11,7
СОСУДОСУЖИВАЮЩИЕ СРЕДСТВА ЦЕНТРАЛЬНОГО ДЕЙСТВИЯ
Сосудосуживающие средства центрального действия — кофеин и кордиамин (см. гл. 5) возбуждают угнетенные структуры головного мозга, регулирующие тонус сосудов. Назначают их при коллаптоидных и шоковых состояниях под кожу; кордиамин внутривенно медленно; при хронической гипотонии — внутрь.
СОСУДОСУЖИВАЮЩИЕ СРЕДСТВА ПЕРИФЕРИЧЕСКОГО^ДЕЙСТВИЯ
а-Адреномиметики (норадреналин, мезатон) непосредственно активируют а-адренорецепторы сосудов, повышая периферическое сопротивление и артериальное давление (см. гл'. 2). Эти препараты применяют в основном при остром падении артериального давления. Для лечения хронической гипотензии предпочтительнее а-адреномиметик периферического действия м и -додрин (г у трон). Он стимулирует адренорецепторы в периферических сосудах, что увеличивает тонус гладкой мускулатуры артериол, мобилизует депонированную в венах кровь, увеличивая ее возврат к сердцу и повышая артериальное давление. Мидодрин медленно биотрансформируется, что обеспечивает длительность антигипотензивного эффекта. Препарат не оказывает существенного влияния на сердце и центральную нервную систему. Нежелательные эффекты — брадикардия и нарушения мочеиспускания.
Минералокортикоиды — ДОКСА (см. гл. 31) вызывают задержку натрия и увеличивают объем плазмы крови, что приводит к повышению артериального давления. Таблетки ДОКСА принимают под язык один раз в день.
199
Глюкокортикоиды (см. гл. 31) увеличивают реакцию адренорецепторов на катехоламины и блокируют их обратный нейрональный захват, повышая этим содержание катехоламинов в плазме. Кроме того, повышая содержание глюкозы в крови и соответственно осмотическое давление, они способствуют поддержанию объема циркулирующей крови.
Ангиотензинамид (гипертензин) по химической структуре близок к эндогенному ангиотензину II. Он оказывает сильное и быстрое прессорное действие, обусловленное повышением периферического сопротивления кровеносных сосудов, особенно артериол малого калибра. На тонус вен влияет незначительно. Прямого действия на сердце препарат не оказывает.
Ангиотензинамид обладает также способностью вызывать сокращение гладкой мускулатуры матки, кишечника, мочевого и желчного пузыря. Он стимулирует выброс адреналина из надпочечников и продукцию альдостерона. Ангиотензинамид быстро инактивируется содержащимся в крови ферментом ан-гиотензиназой, в связи с чем при однократном введении оказывает кратковременный (2—3 мин) прессорный эффект. Поэтому его вводят внутривенно капельно. г
Применяют ангиотензинамид при шоковых состояниях; особенно при изо-волемическом шоке, связанном с вазомоторным коллапсом (после травм операции) при интоксикациях, комах и тяжелых инфекционных заболеваниях. При кардиогенном шоке препарат нужно применять с большой осторожностью.
Вводят ангиотензинамид внутривенно капельно в 5% растворе глюкозы или в 0,9% растворе хлорида натрия.
При применении ангиотензинамида может наблюдаться брадикардия. _
СРЕДСТВА, УЛУЧШАЮЩИЕ МИКРОЦИРКУЛЯЦИЮ
а-Адреноблокаторы (тропафен) (см. гл. 2) вызывают расширение пери-' ферических сосудов, особенно артериол и прекапилляров. Это приводит к улучшению микроциркуляции в мышцах, внутренних органах (почках) и к ликвидации явлений гипоксии в них. Используют тропафен чаще для предупреждения гипертензивных реакций, обусловленных повышением содержания в крови катехоламинов во время анестезии и хирургических вмешательств.
Ганглиоблокаторы (пентамин) за счет блокады симпатических ганглиев ликвидируют спазм прекапиллярных сфинктеров, нормализуют микроциркуляцию в тканях и ликвидируют в них гипоксию. Используют ганглиоблокаторы в комплексной терапии септического, геморрагического и иных форм шока.
Растительные средства, оказывающие тонизирующее влияния на центральную нервную систему и стимулирующие функцию сердечно-сосудистой системы, назначают при хронической гипотонии, астении. В качестве таких препаратов используют н асто й ки плодов лимонника, корня женьшеня, корней аралии и заманихи; экстракты элеутерококка и родиолы розовой. Все препараты назначают внутрь по 20-30 капель, детям доза рассчитывается по 1 капле на год жизни. Курс лечения такими препаратами обычно составляет 15—30 дней. Препараты не рекомендуют принимать во второй половине дня, так как можно нарушить сон.
Дозы и лекарственные формы препаратов даны в табл. 41.
200
Таблица 41
Антигипотензивные средства
Препарат Лекарственная форма Путь введения Количество введений в сутки Однократная доза
Реополиглюкин Rhcopoiyglucinum Флаконы по 200 мл и 400 мл Внутривенно капельно 1 10-20 мл/кг
Желатиноль Gelatinoeum Флаконы по 450 мл То же 1 15-30 мл/кг
Гемодез Haemodesum Флаконы по 100, 200 и 400 мл 1 10-15 мл/кг
Энтеродез Enterodesum Порошок в пакетах по 5 и 50 г Внутрь. Перед употреблением 5 г порошка (1 чайная ложка) растворяют в 100 мл кипяченой воды 1-3 5 г
Ангиотензинамид Angiotensinamidum Порошок по 0,001 г во флаконе. Перед употреблением развести в 100 мл 5% раствора глюкозы или 0,85% раствора натрия хлорида Внутривенно капельно • 1 1—10 мкг/мин (скорость вливания подбирается индивидуально)
Глава 25 МОЧЕГОННЫЕ СРЕДСТВА
Мочегонные средства увеличивают выведение воды (диуретический эффект) и солей (салуретический эффект) почками.
Эти препараты по скорости и длительности действия делят на: 1) мочегонные экстренного действия (фуросемид, этакриновая кислота, маннит и др.), начало их эффекта от нескольких ми'Йут до 1 часа, продолжительность — 2-8 ч; 2) мочегонные средней скорости и длительности действия (дихлотиазид, диакарб, триамтерен, амилорид и др.), начало эффекта через 1-4 ч, продолжительность — 9~24 ч; 3) мочегонные медленного и длительного действия (спиронолактон и др.); начало эффекта через 2-5 дней, продолжительность 5-7 дней.
МОЧЕГОННЫЕ ЭКСТРЕННОГО ДЕЙСТВИЯ
Фуросемид (лазикс, фунартрил) угнетает процессы энергообразования (окислительное фосфорилирование и гликолиз) в эпителиальных клетках восходящей части петли Генле, что приводит к угнетению активной реабсорбции ионов хлора (а вместе с ними и пассивной реабсорбции ионов натрия и частично калия). Это сопровождается усиленным выведением из организма солей и воды. В этом же отделе нефрона фуросемид тормозит процесс активной реабсорбции магния, увеличивая его выведение с мочой.
201
Помимо прямого мочегонного эффекта фуросемид увеличивает диурез и косвенно. Он способствует освобождению простагландина а2 и простациклина из мебран эндотелиальных клеток, что сопровождается расширением просвета сосудов, увеличением почечного кровотока в перитубулярном пространстве и снижением осмотического давления в интерстиции. Последнее нарушает работу противоточно-поворотной системы петли Генле.
. Кроме того, фуросемид (тоже из-за повышения активности простациклина) существенно увеличивает емкость вен большого круга кровообращения, замедляя возврат крови к сердцу, снижая этим преднагрузку и облегчая выброс крови из его полостей. Расширение вен мозга способствует отсасыванию из него избыточных количеств внеклеточной воды, предупреждая или устраняя поэтому развитие его отека.
Применяют фуросемид при острой и хронической сердечной недостаточности, отеке легких, мозга, для форсирования диуреза, при острых отравлениях водорастворимыми ядами, гиперкальциемиях1, гипертонической болезни (так как снижает объем циркулирующей крови) и у родильниц для подавления лактации.
Механизм действия этакринсУВой кислоты (урегита) похож на таковой фуросемида, но она, кроме того,"способна снизить активность антидиурети-ческого гормона в собирательных трубочках. Применяют ее по тем же показаниям, что и фуросемид.
Диуретический эффект фуросемида и этакриновой кислоты развивается лишь после их попадания в первичную мочу путем активной секреции в проксимальных канальцах. Поскольку секреторная активность нефронов в младшем возрасте развита недостаточно, то у новорожденных и детей первых месяцев жизни мочегонный эффект фуросемида и этакриновой кислоты возникает медленнее, чем у более старших детей и взрослых. Существенные возрастные различия в скорости элиминации фуросемида из организма: период полувыведения фуросемида у недоношенных новорожденных — 22 ч, у доношенных новорожденных — 12 ч, у грудных детей — 2 ч, у взрослых — 0,5—1 ч. В связи с этим при повторных введениях фуросемида у новорожденных, особенно у недоношенных, он накапливается, что способствует возникновению у них его токсических эффектов. Аналогичная ситуация возникает и при применении этакриновой кислоты.
При назначении этих препаратов могут развиться осложнения, особенно в случаях их накопления при повторных введениях в организме новорожденных и у больных с нарушенной выделительной функцией почек. У новорождённых детей, особенно недоношенных, может быть обезвоживание; в любом возрасте фуросемид и этакриновая кислота могут снизить содержание в плазме крови натрия, кальция, калия, магния. Изменение ионного баланса в лимфе внутреннего уха является причиной нарушения функции, а затем и структуры волосковых клеток, что приводит к необратимому нарушению слуха — ототоксичности. Особенно опасна в этом отношении этакриновая кислота. Недопустимо их сочетание с другими ототоксическими веществами (например, с аминогликозидными антибиотиками: канамицином, тобрамицином, гентамицином и пр.).
Увеличение выделения магния из организма снижает активность околощитовидной железы, продукцию паратгормона, а следовательно, освобождение кальция из костей и образование активных метаболитов витамина D в почках, участвующих в реабсорбции кальция из мочи.
202
В связи с повышенным содержанием кальция в моче у детей могут образоваться оксалатные или фосфатные камни в мочевыводящих путях (для профилактики этого явления одновременно назначают дихлотиазид, ограничивающий выведение кальция с мочой). Гипокалиемия и гипомагниемия нарушают многие функции в организме, особенно сердечно-сосудистой системы (см. гл. 35). В связи с интенсивным выведением хлоридов может развиться алкалоз. Нужна осторожность при их применении у больных сахарным диабетом, так как они слегка угнетают секрецию инсулина, что может привести к гипергликемии. Кроме того, препараты могут вызвать холестаз, облегчающий образование камней в желчном пузыре.
Маннит — многоатомный спирт, основной препарат в группе осмотических диуретиков. Его вводят внутривенно струйно-медленно (но не капельно!). При этом повышается осмотическое давление в плазме крови, что приводит к извлечению излишней воды из отечных тканей, к увеличению объема циркулирующей крови (ОЦК) и тока плазмы в сосудах почек. В нефроне, в связи с плохой реабсорбцией, его концентрация и осмотическое давление мочи возрастает по мере продвижения в дистальном направлении, что нарушает концентрационную функцию нефрона, задерживает реабсорбцию воды и ионов натрия. В результате увеличивается их выведение. Прием маннита сопровождается повышенным выведением калия, натрия, кальция и магния, но в меньшей степени, чем от приема фуросемида или этакриноврй кислоты. Иногда отмечают нарушение кислотно-основного состояния (у одних больных может быть алкалоз, у других — ацидоз).
Кроме того, увеличение ОЦК приводит к усилению выработки специальными клетками правого предсердия натрийуретического фактора, нарушающего реабсорбцию натрия в проксимальных канальцах и уменьшающего секрецию альдостерона, что тормозит реабсорбцию натрия в дистальном отделе нефрона.
В основном маннит применяют для поддержания высокого диуреза у больных с гемолитическими реакциями, для форсирования диуреза при острых отравлениях веществами, хорошо выводящимися' почками, при пре-ренальной азотемии. Его применяют для дегидратирующей терапии при отеке гортани, токсическом (при отравлении керосином, бензином) отеке легких, но не при отеке легких, связанном с сердечной недостаточностью (так как увеличение ОЦК ухудшит условия работы сердца и состояние больного), для предоперационной подготовки больных глаукомой. Маннит применяют при отеке мозга, если у больного не нарушена функция гематоэнцефалического барьера (ГЭБ), и существует разница между осмотическим давлением в плазме крови и в цереброспинальной жидкости. При нарушении функции ГЭБ (гипоксия, травма черепа) или его недостаточности (у новорожденных) осмотические мочегонные мало эффективны и даже опасны, так как проникая в ЦСЖ, повышают в ней осмотическое давление и привлекают в мозг жидкость, что ухудшает условия его деятельности. Положение усугубляется еще увеличением ОЦК и кровоснабжения мозга, а следовательно, и образования ЦСЖ. Поэтому применение осмотических мочегонных при гипоксическом отеке мозга у новорожденных весьма сомнительно. Фуросемид значительно более эффективен.
Осмотические мочегонные противопоказаны при нарушении выделительной функции почек.
203
МОЧЕГОННЫЕ СРЕДНЕЙ СКОРОСТИ И ДЛИТЕЛЬНОСТИ ДЕЙСТВИЯ
Дихлотиазид (гипотиазид) — основной представитель групп тиазидов. Его активно секретируют клетки проксимальных канальцев, после чего он тормозит активную реабсорбцию ионов натрия и пассивную реабсорбцию хлоридов преимущественно в проксимальных и в меньшей степени в дистальных канальцах почек, чему способствует небольшое ингибирование активности карбоангидразы проксимальных канальцев. Повышенное содержание натрия в конечной моче активирует механизм возврата натрия в собирательных трубочках и ответное интенсивное выведение калия с мочой. Тиазиды увеличивают реабсорбцию ионов кальция в канальцах почек, что приводит к гиперкальциемии (и гипокальциурии), которая тормозит секрецию паратгормона околощитовидной железой. Недостаток паратгормона нарушает процесс активной реабсорбции ионов магния в петле Генле, поэтому увеличивается выведение магния с мочой, особенно при длительном применении препарата.
Применяют дихлотиазид (внутрь) при отеках, связанных с сердечной недостаточностью, нарушением функции почек и печени. Важным показанием к его применению является артериадьная гипертензия любого происхождения. Ограничивая ОЦК и снижая содержание натрия в сосудистой стенке (а в связи с этим и реакцию на сосудосужийающие вещества) дихлотиазид снижает артериальное давление. По этому показанию его применяют в комбинации с другими антигипертензивными средствами (см. гл. 23). Применяют тиазиды и при лечении идиопатической кальциурии, а также для профилактики образования камней в мочевыводящих путях у детей, получающих фуросемид. Иногда его назначают при несахарном мочеизнурении, так как он ограничивает диурез у таких больных. Полагают, что это является следствием потери натрия из организма, снижения осмотического давления в плазме и интерстициальной жидкости и в результате — понижения возбудимости центра жажды.
При длительном применении тиазидов могут развиться нежелательные эффекты. Основное значение имеет гипокалиемия и гипомагниемия. В связи с этим у больных возникают нарушения сердечной деятельности, мышечная слабость, мышечные подергивания, а также диспепсические явления, сонливость. В связи с небольшой потерей хлоридов и интенсивной потерей бикар-бонатного аниона развивается гипохлоремический алкалоз. Кроме того, может быть обострение подагры (результат задержки мочевой кислоты, экскретируемой теми же транспортными механизмами, что и тиазиды), сахарного диабета (результат угнетения секреции инсулина). Для устранения или профилактики гипокалиемии и гипомагниемии назначают препарат — аспаркам (аспарагинат калия и магния). Введение одного калия хлорида менее эффективно, так как он не ликвидирует гипомагниемию.’
Диакарб (диамокс, ацетазоламид) — сравнительно слабое мочегонное средство и в качестве такового редко используется. Он является ингибитором карбоангидразы, фермента, способствующего образованию угольной кислоты из углекислого газа и воды. Блокирование этого фермента тормозит образование в эпителиальных клетках проксимального канальца угольной кислоты, что ограничивает образование из нее ионов водорода и их поступление в просвет канальцев в обмен на натрий, то есть нарушается реабсорбция натрия. Не происходит и возврата бикарбонатного аниона в кровь, что сопровождается развитием гиперхлоремического ацидоза.
Чаще диакарб используют для ингибирования карбоангидразы в других тканях. Блокирование фермента сосудистых сплетений в желудочках, мозга
204
снижает секрецию цереброспинальной жидкости и внутричерепного давления; в цилиарном теле диакарб угнетает секрецию внутриглазной жидкости, снижая этим внутриглазное давление; в нейронах мозга препарат снижает содержание натрия и воды, что приводит к угнетению их возбудимости. Учитывая эти эффекты, диакарб применяют при лечении умеренных форм гидроцефалии у детей, при обострении глаукомы, при эпилепсии (в комбинации с другими средствами). При длительном применении диакарба его предпочитают назначать один раз в день, а по возможности и через день, вместе с гидрокарбонатом натрия для восполнения потерянных с мочой бикарбонатных анионов. У больных следует контролировать и желудочную секрецию, так как препарат может снизить секрецию соляной кислоты (тоже следствие ингибирования карбоангидразы).
Триамтерен (птерофен) и амилорид — нестероидные калийсбере-гающие мочегонные средства. Они нарушают секрецию калия и реабсорбцию натрия в дистальных отделах нефрона (собирательных трубочках), поэтому их диуретический эффект слабый. Основное значение названных препаратов состоит в уменьшении выведения калия из организма, усиленное приемом других мочегонных. Поэтому их чаще применяют в комбинации с дихлотиазидом. Есть готовые комбинированные препараты: триампур (триамтерен с дихлотиазидом) и модуретик (амилорид с дихлотиазидом). Их прием вызывает хороший мочегонный эффект без возникновения гипокалиемии.
Триамтерен подвергается биотрансформации в печени, образующиеся метаболиты сохраняют свою активность и медленно выводятся из организма, особенно у больных с нарушенной выделительной функцией почек. Поэтому триамтерен и триампур опасны у больных с хронической почечной недостаточностью, у которых может возникнуть выраженная гиперкалиемия. Кроме того, они способны угнетать редуктазу, фермент, превращающий неактивную фолиевую кислоту в активную фолеиновую, и этим тормозить кроветворение и регенерацию тканей. Напомним, что и триампур, и модуретик 'содержит дихлотиазид, нежелательный для лиц, страдающих сахарным диабетом.
МОЧЕГОННЫЕ МЕДЛЕННОГО И ДЛИТЕЛЬНОГО ДЕЙСТВИЯ
Спиронолактон (верошпирон, альдактон) — стероидное калий-сберегающее мочегонное средство. Он является антагонистом альдостерона и оказывает свое действие только при первичном или вторичном гиперальдостеронизме. Спиронолактон вызывает два эффекта, не зависящих друг от друга. Вскоре после введения препарата происходит ингибирование Na+, К -АТФазы в дистальном отделе нефрона и зависимой от нее секреции ионов калия в их просвет (уменьшается число и проходимость калиевых каналов в апикальной мембране эпителиальных клеток). В результате снижается выведение калия с мочой. Второй эффект развивается медленно, он связан с ингибированием синтеза фермента пермеазы (зависящего от активности альдостерона), способствующей реабсорбции натрия в дистальных канальцах. Пермеаза, синтезированная до назначения препарата, продолжает функционировать еще 1—3 сут (в зависимости от интенсивности гиперальдостеронизма). Поэтому небольшой мочегонный эффект возникает лишь после исчезновения фермента, то есть через 1—3 сут. Одновременно спиронолактон ограничивает поступления натрия в сосудистую стенку, понижая чувствительность к сосудосуживающим веществам и артериальное давление. Этим спиронолактон понижает постнагрузку на сердце, облегчая его деятельность.
205
Применяют спиронолактон при хронической сердечной недостаточности. При почечной недостаточности его назначать нельзя, так как у таких больных он вызывает гиперкалиемию. Поскольку при хронической сердечной недостаточности обычно назначают сердечные гликозиды, следует учесть, что спиронолактон увеличивает процессы их биотрансформации (в печени) и снижает поглощение миокардом. Иными словами, спиронолактон снижает и терапевтический, и токсический эффекты гликозидов.
При применении спиронолактона у больных может появиться головная боль, сыпь на коже, нарушение функции желудочно-кишечного тракта (результат устранения благоприятного влияния альдостерона на репаративные процессы в слизистой оболочке), андрогенные эффекты у женщин, проявляющиеся в виде нарушений менструального цикла, у мужчин отмечают гинекомастию. У отдельных больных может быть тромбоцитопения.
Лекарственные формы и дозы мочегонных средств для детей представлены в табл. 42.
Таблица 42
Моче^рнные средства
Препарат Форма выпуска Путь введения Число введений в сутки Однократная доза для детей разного возраста
Фуросемид Furosemidum Таблетки по 0,04 г 1% раствор в ампулах по 2 мл Через рот Внутривенно, внутримышечно 1-4 1 1—2 мг/кг То же
Этакриновдя кислота Acidum etacrynicum Таблетки по 0,05 г Через рот 1 1,5-2 мг/кг
Маннит Mannituni 15% раствор в ампулах по 200, 400 и 500 мл Внутривенно 1 0,5-2,0 г/кг
Диакарб Diacarbum Таблетки по 0,25 г Через рот 1 (угром) 5 мг/кг
Дихлотиазид Dichothiazidum Таблетки по 0,025 г То же 1-2 1—2 мг/кг
Спиронолактон Spironolactonum Таблетки по 0,025 г « 1 1-2 мг/кг
Глава 26 ЛЕКАРСТВЕННЫЕ СРЕДСТВА,
ВЛИЯЮЩИЕ НА ФУНКЦИИ ОРГАНОВ ПИЩЕВАРЕНИЯ
У детей патология желудочно-кишечного тракта встречается очень часто. Это могут быть нарушения пищеварения, трофики слизистой оболочки и моторики. Поэтому препараты для лечения этих заболеваний условно делят на следующие группы:
206
I. Средства, влияющие на пищеварение (регуляторы аппетита, ферментные и желчегонные препараты).
П. Средства, влияющие на секреторную функцию слизистой желудка и ее трофику.
III. Средства, влияющие на моторику желудочно-кишечного тракта (рвотные и противорвотные, слабительные и обстипационные).
СРЕДСТВА, ВЛИЯЮЩИЕ НА ПИЩЕВАРЕНИЕ
I. Регуляторы аппетита. Их делят на две группы: 1 — стимуляторы аппетита и 2 — анорексигенные вещества.
1. Лекарственные средства, повышающие аппетит, делят на препараты, стимулирующие центральные структуры, регулирующие аппетит, и на вещества, улучшающие аппетит в связи с активацией обменных процессов и вторично увеличивающие отделение желудочного сока. Из препаратов первой группы следует отметить горечи и ципрогептадин.
Горечи (настойка полыни, сок подорожника) возбуждают рецепторы языка и слизистой оболочки полости рта, вызывая рефлекторную активацию пищевых центров и и^ реакцию (увеличение секреции желудочного сока) на прием пищи. В результате повышается аппетит и улучшается переваривание пищи.
Назначают эти препараты детям старше 2-х лет за 15 мин до еды.
Ципрогептадин (перитол) — обладает антисеротониновой, антигис-таминовой и антихолинергической активностью. Он непосредственно активирует структуры гипоталамуса, регулирующие аппетит, устраняя угнетающее влияние на них серотонина (его антигистаминовый эффект используется педиатрами при лечении ряда аллергических заболеваний). При длительном назначении могут быть нарушения психики, головокружения, сонливость; может возникать зависимость. За счет антихолинергической активности препарат вызывает сухость во рту, повышение внутриглазного давления и задержку мочи.
Циптогептадин назначают за час до еды. Чаще его используют как толчковый препарат, коротким курсом.
Ко второй группе стимуляторов аппетитаютносятся лекарственные вещества, увеличивающие синтез белков, утилизацию различных метаболитов: анаболические стероиды, витамины, препараты железа, инсулин (малые дозы), карнитин (см. соответствующие главы) и апилак.
Апилак — сухое вещество нативного пчелиного маточного молочка, назначают в виде сублингвальных таблеток за час до еды.
Препараты обеих групп применяют при лечении детей с гипотрофиями, анорексией, после инфекционных заболеваний, тяжелых операций, при онкологических, неврологических заболеваниях и при гипоацидных гастритах с нерезко выраженной атрофией слизистой оболочки.
2. Анорексигенные вещества находят применение при лечении ожирения, которое отягощает течение многих заболеваний, нарушает обмен веществ, функцию сердечно-сосудистой системы и пр. Наиболее целесообразный путь лечения ожирения заключается в ограничении количества и калорийности принимаемой пищи. Однако такое лечение вызывает тягостное ощущение голода. Для его устранения иногда и применяют средства, понижающие аппетит.
207
Дезопимон, фепранон, мефолин — непрямые адреномиметики — подавляют активность пищевого центра. Их применяют у детей для лечения преимущественно алиментарного ожирения. При их использовании могут возникать нежелательные эффекты: повышение возбудимости центральной нервной системы, нарушение поведения и сна ребенка. У некоторых детей может развиться тахикардия, подняться артериальное давление. Их нельзя назначать на ночь и детям с артериальной гипертензией, аритмиями сердечной деятельности. Препараты могут вызвать зависимость.
Реже в качестве анорексигенных средств используют серотониномиметик — фенфлюрамин или антагонист эндогенных энкефалинов — налоксон. Они прямо угнетают центр аппетита. Однако их широкое применение ограничено, так как прием первого может сопровождаться бронхоспазмом, болями в животе, психическими расстройствами, а второго — артериальной гипертонией, возникновением эйфории, приводящей к психической, а затем и физической зависимости.
П. Ферментные препараты применяют как средства возмещающей терапии при недостаточной секреции желудочных и кишечных желез, а также поджелудочной железы. г.
Пепсин — ферментный препарат, получаемый из слизистой оболочки желудка свиней. Он расщепляет белки на пептиды. Данный фермент активен только при pH в пределах от 1,5 до 4,0. Поэтому при гипоацидных состояниях его необходимо назначать вместе с соляной кислотой.
Соляная кислота активизирует пепсин, стимулирует секрецию желудочных желез, подготавливает железо к всасыванию в кишечнике, обладает противомикробным действием, устраняя процессы брожения в желудке, вызывает сокращение пилорического отдела (пища длительнее обрабатывается в желудке) и, рефлекторно стимулируя поджелудочную железу, создает лучшие условия для кишечного пищеварения.
Натуральный желудочный сок содержит выделяемые железами желудка ферменты, его pH колеблется от 0,8 до 1,2. Препарат получают от здоровых собак (при мнимом кормлении) или лошадей, он имеет кислый вкус, специфический запах и плохо хранится. Принимают препарат во время еды. Наиболее удобен в употреблении абомин (содержит сумму протеолитических проферментов из слизистой оболочки желудка ягнят и телят молочного возраста), который выпускают в виде таблеток.
Панкреатин получают из высушенной поджелудочной железы крупного рогатого скота и свиней. Он содержит набор ферментов: трипсин, химотрипсин, липазу и амилазу. Выпускают его в форме таблеток. В желудке часть этих ферментов (белков) инактивируется под влиянием пепсина, поэтому целесообразно их запивать щелочной водой (боржоми и т. п.).
В настоящее время появились препараты панкреатина с очень высокой ферментативной активностью. Это — креон, ликреаза и панцитрат.
Панзинорм (энзинорм) — препарат из слизистой оболочки желудка, желчи, панкреатина и аминокислот. Выпускают его в виде двухслойной таблетки. В желудке из верхнего слоя освобождаются аминокислоты, пепсин и катепсин, а в кишечнике — панкреатин и желчные кислоты.
Фе стал — препарат поджелудочной железы и желчи, которые освобождаются из драже в кишечнике.
Мексаза — трехслойная таблетка. Первый слой содержит протеолитический фермент из ананаса — бромелаин. В кишечнике из второго слоя осво
208
бождаются панкреатин и желчные кислоты, а сердцевиной таблетки является противомикробное средство — энтеросептол.
.Все препараты данной группы назначают перед или во время еды.
Их применяют у больных атрофическим гастритом или энтеритом, у перенесших резекцию части кишечника, а также при врожденных и приобретенных энзимопатиях, недостаточности поджелудочной железы, хронических запорах, неспецифических поносах, бродильной и гнилостной диспепсии и т. п.
III. Желчегонные препараты. Желчь содержит желчные кислоты, которые эмульгируют в кишечнике жиры и способствуют всасыванию и жиров, и жирорастворимых веществ, в том числе витаминов. Недостаток желчи может быть связан с нарушением образования в клетках печени или с затруднением ее поступления в двенадцатиперстную кишку из желчного протока. В связи с этим желчегонные средства делят на вещества, увеличивающие секрецию желчи — холеретики, и вещества, облегчающие поступление желчи в кишечник — холекинетики. Это деление условно, потому что представители и той и другой подгрупп влияют на оба процесса, только в разной, степени.
Холеретики. К ним относят преимущественно препараты натуральных желчных кислот, которые стимулируют секрецию как жидкой, так и плотной фракции желчи и в кишечнике способствуют эмульгированию жира и всасыванию жирорастворимых веществ.
Ал л о хол — препарат, содержащий желчь животных, вызывает холерети-ческое действие, подавляет к тому же процессы брожения и гниения в кишечнике.
Дегидрохолевая кислота (хол о го н) — продукт окисления холевой основной желчной кислоты, преимущественно стимулирует отделение жидкой фракции желчи и значительно увеличивает кровоток по печеночным артериям. Всасывание жира и жирорастворимых веществ после ее приема практически не меняется.
Холосас-сироп из сгущенного водного экстракта плодов шиповника. Он стимулирует образование и отделение желчи, снижает ее вязкость и плотность.
Оксафенамид — синтетический холеретик; подобно холосасу стимулирует образование и отделение желчи, а также снижает ее вязкость. Оксафенамид к тому же спазмолитик, устраняет спазм сфинктера Одди и обладает гипохо-лестеринемическим действием.
Все эти препараты применяют при хронических холециститах, холангитах, холецисто-гепатитах. Дети обычно их хорошо переносят.
Все холеретики противопоказаны при закупорке желчных путей.
Холекинетики. Магния сульфат, сорбит, ксилит. Даже в небольших количествах ион магния активирует секрецию холецистокинина слизистой оболочкой кишечника; этому способствует и повышение осмотического давления в просвете кишечника. Холецистокинин вызывает расслабление сжимателя общего желчного протока (сфинктера Одди) и сокращение желчного пузыря, т. е. он облегчает поступление желчи в кишечник. Магния сульфат может оказать послабляющее действие. Сорбит, ксилит — многоатомные спирты — повышают осмотическое давление в просвете кишечника и вызывают аналогичный эффект.
Устранить спазм желчных путей и сфинктера Одди могут и другие спазмолитики, в том числе атропин (М-холинолитик), папаверин, но-шпа (миотропные препараты). Они способствуют оттоку желчи, ликвидируют ее застой при холециститах, предотвращают развитие инфекций в желчном пузыре и образование в нем камней.
209
СРЕДСТВА, ВЛИЯЮЩИЕ НА СЕКРЕТОРНУЮ ФУНКЦИЮ СЛИЗИСТОЙ ЖЕЛУДКА И ЕЕ ТРОФИКУ
В патогенезе язвенной болезни помимо генетической предрасположенности большое значение имеют дисбаланс между факторами агрессии (пепсин, соляная кислота и др.) и факторами зашиты (слизь, степень кровоснабжения слизистой, скорость деления эпителиальных клеток и др.), а также наличие специального возбудителя Helicobacter pylory, повреждающего слизистую оболочку желудка. Поэтому данную группу средств условно делят на: 1) средства, ингибирующие систему факторов агрессии; 2) средства, активизирующие систему факторов зашиты; 3) противоинфекционные средства, подавляющие названный микроорганизм.
I. Средства, ингибирующие систему факторов агрессии
Ингибиторы секреции желудочного сока
На главных и обкладочных клетках слизистой желудка есть М2-холино-, Н2-гистамино- и гастринорецепторы, стимуляция которых приводит к выделению из них пепсиногена и соляной кислоты, которая превращает неактивный фермент в активный — пепсин.
Для снижения секреторной функции названных клеток применяют: М-хо-линолитики, Н2-гистаминолитики и антигастриновый препарат — омепразол.
Из М-холинолитиков в основном применяют атропин, метацин, а также гастрозепин (пирензепин), структурный аналог трициклических антидепресантов. Атропин и метацин в основном уменьшают секрецию пепсиногена и мало влияют на выделение соляной кислоты и гастрина. Они не обладают узкой селективностью (см. гл. 1), поэтому их прием сопровождается сухостью во рту, тахикардией, повышением внутриглазного давления, нарушением -аккомодации и самое главное — расслаблением гладкой мускулатуры кишечника, что приводит к нарушению эвакуации содержимого желудка, а следовательно, к его растяжению. При этом происходит активация желудочной фазы секреции. Поэтому эффективность этих препаратов низка. Значительно селективнее оказался М-холинолитик — гастрозепин, эффективно ослабляющий влияние блуждающего нерва на выделение желудочного сока. Он подавляет секрецию гастрина, тормозит базальную и стимулированную пентагастрином и инсулином желудочную секрецию. Продукцию пепсина снижает больше, чем продукцию соляной кислоты. Прием гастрозепина не сопровождается перечисленными выше нежелательными явлениями, и он значительно медленнее выводится из организма, поэтому его назначают только два раза в сутки (метицин 4 раза). ’
Другая группа ингибиторов секреции желудочного сока — Н2-гистаминоли-тики (ци м ети д и н, ранитидин и фа моти д и н), подавляющие выделение соляной кислоты, активированное гистамином, пентагастрином и М-хо-линомиметиками. При этом уменьшается секреция пепсина, объем желудочного сока, содержание в нем иона водорода. Особенно важно подавление ими базальной и ночной секреции желудочного сока. Однако эти препараты не снижают секрецию гастрина, его уровень в плазме крови натощак и не предупреждают его повышение после еды. При внезапной отмене препарата возможен рецидив болезни. Н2-гистаминолитики наиболее эффективны при язвенной болезни двенадцатиперстной кишки.
210
При назначении циметидина могут возникнуть нежелательные эффекты: головная боль, слабость, головокружение, запоры, диарея, редко — нарушение сознания, зрительные галлюцинации, клонические судороги. Повышение им секреции пролактина и снижение секреции фолликулостимулирующего и лютеинизирующего гормонов может нарушить половое созревание подростков, увеличить молочные железы и даже стимулировать секрецию молока. Кроме того, препарат блокирует андрогеновые рецепторы, что может стать причиной возникновения у мужчин импотенции. Известна способность циметидина ингибировать монооксигеназную систему печени, в связи с этим он тормозит биотрансформацию многих лекарственных средств.
Ранитидин и фамотидин превосходят по своей активности циметидин в 6 и 24 раза соответственно. При назначении этих препаратов описанные выше осложнения не обнаружены.
Омепразол — ингибирует работу К+, Н+-АТФазы эпителиальных клеток желудка, поэтому понижается кислотность его сока и активность пепсина. Курс лечения продолжается 4—6 недель. При назначении препарата существует опасность возникновения гиперплазии энтерохромаффинеподобных клеток с образованием микроузелков в подслизистом слое.
Необходимо отметить, что омепразол, нарушая работу К+, Н+-АТФазы у Helicobacter pylori, оказывает бактериостатическое действие на названный микроб.
2. Антацидные средства нейтрализуют соляную кислоту желудочного сока, уменьшая пищеварительную активность пепсина и его неблагоприятное действие на поверхность слизистой оболочки желудка; некоторые препараты этой группы стимулируют продукцию муцина. Различают системные (натрия гидрокарбонат) и несистемные (алюминия гидроокись, магния окись, кальция карбонат) антациды.
Натрия гидрокарбонат, связывая ионы водорода, быстро снижает кислотность желудочного сока (что может усилить секрецию гастрина), но эффект его короткий (15-20 мин). Хорошо всасываясь и поступая в систему кровообращения, натрия гидрокарбонат может привести к возникновению метаболического алкалоза. В педиатрической практике натрия гидрокарбонат как антацид не используют.
У детей обычно применяют несистемные антациды, т. е. вещества, не изменяющие кислотно-основное состояние крови.
Алюминия гидроокись достаточно быстро нейтрализует соляную кислоту, связывая ионы хлора, к тому же она сорбирует пепсин, снижает его активность, подавляет образование пепсиногена и в то же время увеличивает отделение слизи. Препарат способен образовывать гель, обладающий обволакивающим и адсорбирующим эффектами. При длительном приеме препаратов алюминия: а) нарушается всасывание фосфатов из кишечника, что увеличивает их выведение с фекалиями, приводит к гипофосфатемии и к последующей резорбции костей и кальциурии и б) может произойти всасывание алюминия, его отложение в костях (нарушающее кроветворение) и в мозговой ткани (вызывая иногда энцефалопатию).
Альмагель — комплексный препарат (гидроокись алюминия, окись магния, сорбитол), применяемый не только в качестве антацида и адсорбента, но и желчегонного средства. Этот препарат дети обычно переносят хорошо, но при длительном назначении нарушается функция кишечного барьера для алюминия, в результате чего в плазме крови возрастает его концентрация, что
211
может сопровождаться развитием энцефалопатии и остеомаляции с отложением металла в костях.
Магния окись — сильный антацид с длительным действием, вызывающий слабительный эффект; его часто комбинируют с карбонатом кальция, при применении которого наблюдаются запоры. У детей его используют редко, так как он может вызвать слабость, тошноту, рвоту, головную боль, гиперкальциемию и даже привести к алкалозу.
II. Средства, активирующие систему факторов защиты
Данная группа лекарственных средств способствует заживлению слизистой оболочки желудка и- кишечника, увеличивает синтез муцина (нейтральных мукополисахаридов), нейтрализующего ион водорода. Эту группу препаратов называют репарантами или цитопротекторами. Их назначают не только при язвенной болезни желудка и двенадцатиперстной кишки. Некоторые из них применяют и по другим показаниям: трофические язвы разной локализации, труднозаживающие раны и ожоги, тяжелые инфекционные заболевания, а также для стимуляции лейко- и эритропоэза.
Метил урацил — производное пиримидина. Препарат увеличивает синтез нуклеиновых кислот и деление клеток слизистой оболочки желудочно-кишечного тракта, в частности мукоцитов.
Сукралфат (ульцермин) — алюминиевая соль сульфированных дисахаридов. Препарат взаимодействует с белком эрозированной поверхности, образовавшаяся пленка из альбуминатов облегчает процесс эпитализации. Кроме того, он улучшает кровоснабжение слизистой.
Дезоксикортикостерона ацетат (ДОКСА) — синтетический препарат, обладающий свойствами естественного минералокортикоида альдостерона. Он задерживает в организме ионы натрия, способствует поляризации клеточных мембран, поэтому удлиняет жизнь эпителиальных клеток и уменьшает скорость их слущивания (эксфолиации). ДОКСА, как правило, назначают внутримышечно в масляном растворе. У препарата небольшая широта терапевтического действия, его применение часто сопровождается возникновением нежелательных эффектов (отеки, гипертония, мышечная слабость, анорексия и др.), поэтому его трудно дозировать.
Ликвиритон — препарат из солодкового корня (Radix Liquiritiae). Он содержит вещества, обладающие минералокортикоидной и противовоспалительной активностью. Его прием улучшает кровоснабжение слизистой оболочки и уменьшает освобождение лизосомальных ферментов (гидролаз). Близкими по механизму и эффекту к ликвиритону являются: карбеноксолон (химически чистая глицирритиновая кислота, выделенная из солодкового корня) и гефарнат (получен из белокочанной капусты).
Метилметионинсульфония хлорид (витамин U) — активная форма метионина. Препарат является донатором метильных групп, необходимых для синтеза нуклеиновых кислот, белков, активности фосфолипидов мембран клеток. Метилируя гистамин, он превращает его в неактивную форму, что уменьшает секрецию желудочного сока. У отдельных больных прием препарата может вызвать тошноту и рвоту.
III. Препараты, подавляющие возбудителя — Helicobacter pylori
Д е - н о л — коллоидный раствор висмута, оказывает бактериостатическое действие на Helicobacter pylori, микроб, обнаруженный в слизистой желудка
212
людей, страдающих язвенной болезнью. Подобным действием обладают метронидазол, амоксициллин, кларитромицин, фуразолидон и некоторые другие противомикробные средства (см. гл. 42, 44).
СРЕДСТВА, ВЛИЯЮЩИЕ НА МОТОРИКУ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
1. Рвотные средства. Рвота — сложнорефлекторный акт, в осуществлении которого принимают участие мышцы желудка, брюшной стенки, диафрагмы и др. Она возникает при активации центра рвоты самыми разнообразными стимулами (например, раздражение рецепторов желудка, вестибулярного аппарата), но преимущественно поступлением импульсации. от специальной хеморецеп-торной, так называемой триггерной зоны, возбуждаемой дофамином.
Рвотные средства применяют у детей для удаления из желудка ядов или вызвавших отравление пищевых продуктов.
Апоморфин (полусинтетический алколоид, получаемый из морфина) — дофаминомиметик (см. гл. 2) вызывает рвоту, стимулируя дофаминовые рецепторы триггерной зоны продолговатого мозга. Импульсация, поступающая из рвотного центра, тормозит активность автоматически функционирующих клеток — водителя ритма желудка, в результате чего возникает его угнетение, следствием чего является ретроградное поступление возбуждения к желудку от автоматических клеток водителя ритма двенадцатиперстной кишки, приводя к дуоденально-желудочному рефлексу и к рвоте. Допускают и прямое угнетающее влияние апоморфина на водитель ритма желудка. Сам рвотный центр апоморфин угнетает, поэтому при отсутствии эффекта от первой дозы вводить препарат второй раз бессмысленно. Он тормозит и другие структуры головного мозга, вызывая у детей сонливость, угнетение дыхания и даже снижение артериального давления. Особенно выражено это угнетение центральной нервной системы у детей до 5 лет, поэтому им этот препарат противопоказан.
Концентрированный раствор поваренной солив теплой воде (2-4 чайных ложки на стакан воды) и сироп рвотного корня (1 чайная ложка), содержащий алкалоид эмитин, вызывают рвоту рефлекторно, так как раздражают слизистую оболочку желудка. Раздражение слизистой желудка сопровождается спазмом пилорического сфинктера, что задерживает поступление яда в кишечник. Эффект от этих препаратов’возникает позднее, чем от апоморфина, но не сопровождается угнетением центральной нервной системы.
Сироп рвотного корня содержит алкалоид эметин, раздражающий чувствительные рецепторы слизистой оболочки желудка, приводя к рефлекторной рвоте. Препарат чаще применяют у де!ей в возрасте до 4—5 лет, так как у них нежная слизистая оболочка желудка легко поддается воздействию разных раздражителей.
Рвотные средства противопоказаны детям при отравлениях, вызванных веществами, раздражающими слизистые оболочки (кислотами, щелочами, керосином, бензином, калия перманганатом и т. п.), так как во время рвоты их частички или капельки попадают в дыхательные пути, приводя к повреждению ткани легких, их отеку. Рвотные противопоказаны также детям, находящимся в бессознательном состоянии и при отравлении кардиотоническими («хроно-негативными») ядами, так как усиливается тонус блуждающего нерва и брадикардия.
213
2. Противорвотные средства. Выбор того или иного препарата зависит от причины, приведшей к рвоте.
Метоклопрамид (церукал, реглан) относится к дофаминолити-кам, поэтому он угнетает триггерную зону продолговатого мозга. Кроме того, он непрямой холиномиметик, поэтому повышает тонус нижнего сфинктера пищевода, устраняя желудочно-пищеводный рефлекс, усиливает сокращения желудка и кишечника, восстанавливает активность водителя ритма желудка, устраняя тошноту и рвоту. Назначают его при рвоте, связанной с активацией триггерной зоны при накоплении в плазме крови токсических метаболитов у больных с токсикозом беременных (гестозом), при передозировке сердечных гликозидов, цитостатиков и др. Кроме того, препарат применяют у грудных детей для ликвидации срыгиваний, а также у новорожденных с низкой массой тела для стимуляции обычно вялой двигательной активности желудка и кишечника.
У детей старшего возраста при приеме препарата могут возникнуть гипер-кинето-дистонические явления в мышцах шеи, головы, верхних конечностей.
М-холинолитики (аэрон), содержащие скополамин, используют при перевозбуждении лабиринтного аппарата в качестве противорвотных средств. При их назначении могут возникнуть нарушения аккомодации, сердцебиение, сухость во рту и другие осложнения. При морской болезни эффективны также противогистаминные средства (например, димедрол).
У новорожденных и грудных детей (1—2 мес жизни) для устранения рвоты из-за пилороспазма используют аминазин (нейролептик — см. гл. 4), так как в этом возрасте тонус названного сфинктера зависит от адренергической активности.
Анестезин (местный анестетик — см. гл. 7) оказывает противорвотный эффект, так как подавляет чувствительные рецепторы корня языка (раздражаемые во время бронхоскопии, фиброгастроскопии и пр.) и слизистой желудка (раздражаемые, например, диэтиловым эфиром, проглоченным вместе со слюной во время наркотизирования больного).
3. Слабительные средства. Это средства, ускоряющие опорожнение кишечника, увеличивая выведение воды с фекалиями, либо нарушая ее всасывание, либо увеличивая ее секрецию.
Солевые слабительные (м а г н и я сульфат, натрия с ул ьф ат) повышают осмотическое давление в просвете кишечника, что задерживает всасывание воды (принятой с лекарством и содержащейся в кишечном секрете), увеличивает объем кишечного содержимого, который вызывает растяжение кишки и рефлекторно стимулирует перистальтику. К тому же при повышении осмотического давления в просвете тонкой кишки увеличивается секреция ее слизистой оболочкой холецистокинина, который не только усиливает перистальтику кишечника, но и увеличивает кровоток в желудочно-кишечном тракте, повышает секрецию пищеварительных соков, расслабляет сфинктер Одди, усиливает сокращение желчного пузыря и повышает ток желчи в кишечник. Особенно хороший эффект возможен от магния сульфата.
Эти соли принимают для получения однократного слабительного эффекта. Назначают их при лечении детей с острыми отравлениями (в этом случае предпочитают натрия сульфат), а также вместе с некоторыми противоглистными препаратами для ограничения их всасывания или для ускорения удаления глистов.
214
Грудным детям солевые слабительные противопоказаны, так как они могут вызвать значительную внеклеточную дегидратацию.
При назначении магния сульфата нужна осторожность, так как всосавшийся ион магния может угнетать сократительную деятельность сердца и нарушать нервно-мыщечную передачу.
Касторовое масло получают из семян клещевины. Под влиянием панкреатической липазы оно расщепляется на глицерин и рициноловую кислоту. Рициноловая кислота нарушает процесс активного всасывания воды и электролитов в тонкой кишке и стимулирует секрецию жидкости, увеличивая объем содержимого в кишечнике. Глицерин же «смазывает» поверхность слизистой оболочки, облегчая продвижение содержимого. Назначают касторовое масло детям при эпизодических запорах и перед рентгенологическим исследованием. Оно противопоказано при отравлениях жирорастворимыми веществами.
Фенолфталеин (пурген) ингибирует Na\ К+-АТФазу слизистой оболочки толстой кишки, тем самым нарушая всасывание из нее Na+ и воды, а также способствует активности кальция в ее гладких мышцах.
У детей раннего возраста фенолфталеин иногда вызывает кишечные колики, сердцебиение, нарушение дыхания и даже коллапс. Поэтому до 1 года его не следует назначать. Иногда на фенолфталеин могут появиться аллергические реакции.
Препараты ревеня (порошок, таблетки, сухой экстракт и настойка), коры крушины (отвар, экстракт, таблетки), листьев сенны (настой, таблетки) содержат антрагликозиды, несахарной частью которых является эмодин, хризофановая кислота и другие производные антрахинона.
Целые молекулы гликозидов всасываются в тонком отделе кишечника, экскретируются в толстой кишке, где под влиянием ферментов ми'крофлоры расщепляются с освобождением агликонов, вызывающих сокращение гладкой мускулатуры. Прием готового 'агликона эффекта не вызывает, так как он подвергается инактивации в тонкой кишке путем превращения в антрахинон. Эти препараты не нарушают пищеварение и всасывание в кишечнике. Поэтому их применяют при хронических атонических запорах и дйя облегчения дефекации при геморрое и трещинах прямой кишки.
Обычно препараты хорошо переносятся, но при длительном применении (годами) иногда возникают хронические зац^ры (из-за атрофии гладких мышц) и тяжелые нарушения функции печени. Не следует их назначать кормящим женщинам, так как, выделяясь с молоком, они могут вызвать диарею у ребенка.
Масло вазелиновое — очищенная фракция нефти, получаемая после отгонки керосина. Препарат при приеме внутрь не всасывается и размягчает каловые массы. Назначают при хронических запорах и отравлениях жирорастворимыми ядами. Длительное применение может вызвать нарушения пищеварения.
Слабительные средства (любого механизма действия) не следует назначать для длительного использования, так как с фекалиями происходит интенсивная потеря катионов, особенно калия. В результате развивается гипокалиемия и гипокалигистия, нарушающие синтез ацетилхолина вообще и в кишечнике в частности, что сопровождается запорами, анорексией, является причиной нефропатий, нервно-мышечной слабости, угнетения рефлексов, пареза мочевого пузыря и т. п.
4. Противодиарейные (обстипационные) средства. Их применение уменьшает выведение воды с фекалиями, преимущественно угнетая процессы секреции в
215
тонком кишечнике, вызванные термолабильным токсином кишечной палочки, токсинами шигелл, клостридий, некоторыми вирусами (повышающими активность аденилатциклазы в клетках крипт). Кроме того, антидиарейный эффект может быть следствием удаления из просвета кишечника осмотически активных веществ (сорбита, лактозы, крахмала), недостаточно всасывающихся из кишечника у данного больного.
Холестирамин — анионообменная смола, образующая в кишечнике невсасываемые комплексы с желчными кислотами и микробными эндотоксинами. Препарат может сорбировать и некоторые вирусы. В результате он устраняет вызываемые ими чрезмерную секрецию в криптах тонкого кишечника и зависящие от этого нарушения всасывания. Холестирамин, удаляя желчные кислоты из просвета кишечника, может нарушить всасывание жиров и жирорастворимых витаминов A, D, Е, К. Поэтому длительно препарат назначать нельзя.
Уголь активированный — животного и растительного происхождения, специально обработанный и обладающий в связи с этим большой поверхностью, способной адсорбировать токсины, газы и др.
И модиум — содержит лопераЙид, аналог промедола (см. гл. 6). Препарат, стимулируя в слизистой оболочке кишечника опиатные рецепторы, приводит к торможению секреции в криптах и к стимуляции процессов всасывания в ворсинках тонкого кишечника. В результате снижается объем содержимого в кишке, ее растяжение и устраняются рефлексы, усиливающие перистальтику. Может иметь значение и вызываемое лоперамидом сокращение внутреннего анального сфинктера. Назначают детям старше 3 лет. У детей младшего возраста препарат может вызвать сонливость и угнетение дыхания.
Лекарственные формы и дозы для детей препаратов, влияющих на функции желудочно-кишечного тракта, даны в табл. 43.
Таблица 43
Средства, влияющие на функции желудочно-кишечного тракта
Препарат Лекарственная форма Путь введения Число введений в сутки Доза
Карнитина хлорид Camitini chloridum 20% раствор во флаконах по 100 мл Внутрь 2-3 До 1 года — по 10 капель, 1-6 лет — по 14 капель, 6-12 лет — по 1/4 чайной ложки на прием
Настойка полыни Tincture Absinthii' Флакон по 25 мл То же 3 До 2-х лет не давать; после 2-х лет — по 1 капле на год жизни за 15 мин до еды (на прием)
Ципрогептадин Cyproheptadinum Таблетки 0,04 г, сироп во флаконе по 100 мл 4 3 От 6 мес до 2 лет — 0,4 мг/кг/сут; 2-6 лет — 6 мг/сут; 6-14 лет — 12 мг/сут
Циметидин Cimetidinum Таблетки по 0,2 г 4 3 До 7 лет не давать; после 7 лет — 10 мг/кг/сутки
Альмагель Almagel Флаконы по 170 мл 4 4 До 10 лет — по 1/2 дозированной ложки; 10—15 лет — по 1 ложке на прием
216
Окончание табл. 43
Препарат Лекарственная форма Путь введения Число введений в сутки Доза
Аллохол Tab. Allocholum Таблетки детские, таблетки взрослые Внутрь 3-4 До 7 лет — по 1 таблетке; старше 7 лет — по 1-2 таблетки на прием
Метоклопрамид Metoclopramidum Таблетки по 0,01 г То же 3 До 6 лет — 1 мг/кг в сут; старше 6 лет — 0,005-0,01 г (разовая доза)
0,5% раствор в ампулах по 2 мл Внутримышечно 2-3 В той же дозе
Натрия сульфат Natrii sulfas Порошок Внутрь 1 1 г на год жизни
Фенолфталеин Phenolphtaleinum Таблетки по 0,1 г и 0,05 г То же 1 До 3-х лет не назначать, 3—4 года — 0,05 г; 5-6 лет — 0,1 г; 7-9 лет — 0,15 г; 9-14 лет — 0,15-0,2 г
Корень ревеня Radix Phei Порошок « 1 До 1 года не назначать; 2 года — 0,1 г; 3-4 года — 0,15 г; 5-6 лет — 0,2 г; 7-9 лет — 0,25-0,5 г; 10-14 лет —0,5—1,0 г
Холестирамин Cholestyraminum Порошок « 3 Новорожденным 0,9—1,5 г; детям другого возраста — 4—8 г в день
Глава 27 ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ВЛИЯЮЩИЕ НА СОКРАТИТЕЛЬНУЮ ДЕЯТЕЛЬНОСТЬ МАТКИ
Матка — гладкомышечный орган, способный к тоническим и ритмическим (фазовым) сокращениям. Их возникновение регулируется нервной и эндокринной системами. На поверхности мембраны гладкомышечных клеток находятся рецепторы для различных биологически активных веществ (ацетилхолина, норадреналина, серотонина, гистамина, брадикинина, окситоцина, вазопрессина, простагландинов и пр.), под влиянием' которых происходит возбуждение соответствующих рецепторов и зависимых от них кальциевых каналов, по которым кальций устремляется внутрь клетки. Там он соединяется с кальмо-дуллином; образовавшийся комплекс активирует киназу легких цепей миозина. Происходит фосфорилирование миозина, соединение его с актином; образовавшийся актомиозин и вызывает сокращения, длящиеся недолго, так как под влиянием фосфатазы происходит дефосфорилирование миозина и как следствие — распад актомиозина. На поверхности мембраны гладких мышц содержатся и потенциалзависимые кальциевые каналы; они раскрываются при де
217
поляризации клеточной мембраны, возникающей из-за распространения потенциала действия или под влиянием повышенной концентрации калия.
Женские половые гормоны по-разному влияют на чувствительность матки к различным гормонам и медиаторам нервного импульса, вызывающим ее сокращения.
Эстрогены способствуют возникновению межмышечных связей, по которым распространяется волна возбуждения, приводящая к сокращению органа; рецепторов для окситоцина и их способность связывать его; а-адренорецепторов, возбуждение которых вызывает сокращение матки и подавляет образование (или активность) Р-адренорецепторов, возбуждение которых тормозит деятельность матки; увеличивают синтез простагландинов.
Прогестерон и его заменители, напротив, уменьшают образование межмышечных связей в миометрии, число рецепторов для эстрадиола, окситоцина, подавляют реакцию а-адренорецепторов и способствуют реакции 0-адреноре-цепторов, тормозят синтез простагландинов.
К концу беременности снижается активность прогестерона (иногда это может произойти в середине беременности, когда секреция прогестерона желтым телом яичников уже прекратилась^ синтез его в плаценте еще недостаточен, тогда происходит спонтанное прерывание беременности), и возрастает активность эстрогенов. При недостаточности последних задерживается не только развитие полноценных сокращений матки, но и растяжение («созревание») шейки матки, осуществляемое под влиянием простагландинов. Они активируют коллагеназы, деполимеризующие коллаген в шейке матки, что способствует ее растяжению под влиянием сокращений тела.
Лекарственные вещества, влияющие на сократительную деятельность матки, подразделяют на токостимуляторы (от греч. токос — роды) или утеротонические средства, усиливающие сокращения матки, и токолитические (утеролитические) средства, ослабляющие деятельность матки. Токостимуляторы в свою очередь делят на препараты, вызывающие фазовые (ритмические) и тонические сокращения. Фазовые сокращения матки вызывают в процессе изгнания плода, а тонические — после рождения ребенка, для прекращения послеродовых кровотечений (сокращающаяся матка сдавливает поврежденные сосуды), отделения последа, ускорения инволюции матки и пр. К. первой подгруппе относят: окситоцин, препараты задней доли гипофиза, простагландины, ганглиоблокаторы; ко второй подгруппе — алкалоиды спорыньи, котарнин, ряд препаратов растительного происхождения. К токолитикам относят: Р-адреномиметики, блокаторы кальциевых каналов, клофелин, индометацин.
ТОКОСТИМУЛЯТОРЫ
Окситоцин и препараты, его содержащие (питуитрин, гифотоцин, маммофизин), синтетические аналоги окситоцина — дезаминоокси-тбцин (сандопарт) и синтоцинон. Препараты гипофиза содержат не только окситоцин, но и вазопрессин.
Окситоцин — полипептидный гормон задней доли гипофиза (см. гл. 31). Его основным фармакологическим свойством является способность вызывать фазовые сокращения матки. Однако введение его высокой дозы может вызвать и тонические ее сокращения. Поскольку к нему имеет место индивидуальная
218
чувствительность женщины, то для избежания тонических сокращений в период изгнания плода его вводят внутривенно капельно, индивидуально подбирая дозу препарата.
Применяют окситоцин для вызывания родов (например, при переношенной беременности) на фоне предварительных введений эстрогенов; для стимуляции ослабленной родовой деятельности. В случае тяжелых послеродовых кравоте-чений окситоцин вводят непосредственно в матку, в менее тяжелых случаях — под кожу. Подкожно вводят и другие препараты, содержащие окситоцин, для профилактики или устранения послеродовых кровотечений (после рождения ребенка!). Применяют его и для увеличения отделения молока в связи с сокращением миоэпителиальных элементов молочной железы.
Противопоказаны окситоцин и его аналоги при несоответствии размеров таза и плода, при поперечном и. косом его положении, при угрожающем разрыве матки. Окситоцин вызывает нежелательные эффекты у матери (флебиты, задержку жидкости, что способствует повышению артериального давления; гипонатриемию) и у ребенка: повышение уровня билирубина в плазме крови, возможны геморрагии в сетчатку глаза.
Простагландины. Препараты простагландина Рга- динопрост, (энзап-рост F) и простагладина Ег:динопростон (простин Е) сравнительно недавно вошли в акушерскую практику. Они обладают выраженным стимулирующим влиянием на миометрий, вызывая и усиливая ритмические его сокращения, а также вызывая «созревание» шейки матки (см. выше). Простагландины снижают число р- адренорецепторов в гладкой мускулатуре тела мйтки и снижают их чувствительность к p-адреномиметикам. Эти препараты оказывают свое действие как на беременную, так и на небеременную матку.
Применяют простагландины преимущественно в условиях стационара. Назначают их для родовозбуждёния, стимуляции ослабленной родовой деятельности, раскрытия зева матки, а также для прерывания беременности как в самом ее начале, так и затем на первом и втором триместрах.
Существуют разные лекарственные формы простагландинов, которые вводят внутривенно (капельно), экстра-t и интраамниотически, интравагинально, транс-буккально (таблетки). При локальном введении (интравагинально, интраамниотически) простагландины более эффективна и меньше вызывают нежелательных эффектов. Внутривенное же их введение может вызвать (особенно при переношенной беременности) гиперреактивность матки, проявляющуюся в возникновении не только фазовых, но и тонических сокращений, а также в появлении тошноты, рвоты, поноса, головной боли, тахикардии, повышения температуры тела, флебитов. Препараты простагландина Ега противопоказаны при бронхиальной астме, в активной фазе язвенного колита, гипертонии, при преэклампсии.
Препараты простагландинов не используют при несоответствии размеров таза и плода, при поперечном и косом его положении, при наличии послеоперационных рубцов на теле матки и пороков ее развития.
На плод и новорожденного простагландины мало влияют, но все же в первые 48 ч примерно у 40% детей обнаруживают кровоизлияния в сетчатку глаза.
Препараты алкалоидов спорыньи (эрготал, эргометрин, метилэрго-метрин, эрготамин) повышают тонус миометрия, гладких мышц внутрен-
219
них органов и сосудов. Особенно выражено тонизирующее действие на миометрий у эргометрина и эрготамина. После введения этих препаратов наступает длительное тоническое сокращение мышцы матки. Алкалоиды спорыньи используют для остановки послеродовых маточных кровотечений (сдавление сосудов сократившимися мышечными волокнами матки), для ускорения инволюции матки, при маточных кровотечениях, не связанных с родами (метрор-рагии, меноррагии, кровотечения после абортов и пр.).
Скорость наступления эффекта зависит от способа введения препаратов. Эргометрин хорошо всасывается в желудочно-кишечном тракте и достаточно быстро вызывает эффект (через 10—15 мин). При парентеральном введении все препараты действуют почти сразу. Поэтому при тяжелых послеродовых кровотечениях эрготамин или эргометрин вводят подкожно или внутримышечно. В менее тяжелых случаях препараты спорыньи назначают внутрь.
Алкалоиды спорыньи нельзя использовать для ускорения родовой деятельности матки, так как они резко повышают ее тонус и могут вызвать сдавление пуповины, нарушить фетоплацентарный кровоток, что приведет к внутриутробной гипоксии плода и его гибели.
Применение препаратов спорыньи может сопровождаться нежелательными эффектами — тошнотой, рвотой, поносом. При остром отравлении возникают двигательное возбуждение, судороги, боли в эпигастральной области, тахикардия. При длительном приеме этих препаратов возможны явления эрготизма, связанные со спазмом сосудов и нарушением питания тканей (особенно конечностей), также могут быть психические расстройства. Алкалоиды спорыньи выводятся молочными железами, с молоком матери могут попасть к ребенку и вызвать у него сужение сосудов, повышение артериального давления, нарушения микроциркуляции в тканях и пр. Поэтому женщина, получающая препараты спорыньи, не должна кормить ребенка грудью.
Производное дигидроизохинолина. Котарнина хлорид — синтетический препарат. Оказывает тонизирующее действие на мускулатуру матки. Используют при недостаточно быстро развивающейся инволюции матки после родов и абортов, при маточных кровотечениях различного генеза. Применяют его внутрь.
Препараты растительного происхождения — настойка листьев барбариса, э кстракт травы пастушьей сумки, экстракт чистеца буквицецветного. Эти препараты усиливают сокращения матки. Применяют их при атонии, атонических маточных кровотечениях, при субинволюции матки после родов и абортов, при маточных кровотечениях, связанных с воспалительными процессами.
Назначают внутрь по 20-30 капель.
токолитики
Р-Адреномиметики (ритодрин, тербуталин) (см. гл. 2). Показаны Р-адреномиметики при преждевременных (начавшихся при сроке до 37 нед беременности) родах. Назначают их прежде всего с целью прекратить преждевременно начавшуюся родовую деятельность и продлить беременность (оптимально до 37-39 нед), а также для улучшения фетоплацентарного кровотока у беременных женщин с токсикозом, то есть для устранения внутриутробной 220
гипоксии плода; для снижения у таких женщин диастолического артериального давления.
В зависимости от показаний |3-адреномиметики применяют внутрь или парентерально. В экстренных случаях их вводят внутривенно капельно, переходя затем на прием внутрь. Введение |3-адреномиметиков сопровождается возникновением нежелательных эффектов у матери (тахикардия, аритмия сокращений сердца, снижение артериального давления, гипергликемия, гипокалиемия, кетоацидоз, снижение pH крови). Преимущественно эти осложнения возникают у женщин с патологией сердечно-сосудистой системы. Если не удается прекратить родовую деятельность, то у родившегося недоношенного ребенка могут быть: гипергликемия, сменяющаяся длительной гипогликемией, гипокальциемия, увеличение уровня свободного билирубина в плазме крови, атоническая непроходимость кишечника, повышение секреции желудочного сока.
[З-Адреномиметики неэффективны при раскрытии шейки матки больше чем на 2 см и при сильных (продолжительность более 30 с) и частых (более 1 раза за 10 мин) сокращениях матки.
Противопоказаны p-адреномиметики роженицам с артериальной гипертонией, пороками сердца, гиперфункцией щитовидной железы, сахарным диабетом, при отслойке плаценты и маточных кровотечениях, патологии плода (аномалии развития, мертвый плод), при раскрытии шейки матки более чем на 5 см.
Индометацин — ингибитор синтеза простагландинов (см. гл. 39), поэтому он может прекратить или ослабить сокращения матки. Однако его применение требует осторожности, так как при неправильном выборе дозы и режима введения препарат может вызвать тяжелые осложнения у плода и новорожденного. К ним относятся: сужение сосудов пуповины, приводящие к нарушению циркуляции крови у плода и к его гипоксии, сужение артериального протока, приводящее к нарушению нормальной гемодинамики плода (вместо 7% выброса крови из правого предсердия в сосуды легких могут поступать значительно большие ее количества, что приводит к растяжению сосудов легких, гипертрофии их гладких мышц и к развитию легочной гипертензии, нарушающей деятельность сердца плода и новорожденного), снижение мочеобразова-ния у плода (что уменьшает количество околоплодной жидкости), возникновение отеков, асцита, плевральных выпотов у новорожденных.
Прием индометацина в дозе 100—300 мг в сутки на протяжении 7-21 дня обычно не вызывает перечисленных осложнений.
В последнее время в акушерскую практику в качестве токолитиков входят такие препараты, как нифедипин (блокатор Са каналов, см. гл. 21) и клофелин (а-адреномиметик, см. гл. 12). Большого опыта применения этих препаратов еще не накоплено, однако первые наблюдения дали хорошие результаты. Нифедипин эффективен в 70% случаев преждевременных родов. Его применяют в тех случаях, когда противопоказаны |3-адреномиметики (гипертония, сахарный диабет). Клофелин эффективен приблизительно в 80%. Его хорошо использовать у беременных женщин с поздним токсикозом, так как препарат способствует снижению артериального давления, подавляет боль и пр. (см. гл. 2).
Дозы маточных средств даны в таблице 44.
221
Таблица 44
Лекарственные средства, влияющие на сократительную активность миометрия
Препарат Форма выпуска Путь введения Число приемов в сутки Однократная доза
Простенон Prostenon 0,1% и 0,5% спиртовой раствор в ампулах по 1 мл. Содержимое ампулы развести в 500 мл изотонического раствора натрия хлорида Внутривенно капельно Однократно Индивидуально от 0,75 до 5 мг
Энзапрост Ensaprost То же Внутривенно капельно Экстраамниально То же При внутривенном введении — 1-2 мкг/мин При экстраамниальном введении — от 5 до 30 мг
Эргометрина малеат Ergometrini maleas Таблетки по 0,0002 г Внутрь 2-3 0,2-0,4 мг
0,02% раствор в ампулах по 1 мл Внутримышечно Внутривенно 0,1-0,2 мг
Эрготамина гидротартрат Ergotamini hydrotartras Драже по 0,001 г Внутрь 1-3 2 мг
0,05% раствор в ампулах по 1 мл Внутримышечно 0,5-1,0 мл
0,1% раствор во флаконах по 10 мл Внутрь 10 капель
Котарнина хлорид Cotarnini chloridum Таблетки по 0,05 г Внутрь 2-3 0,05 г
Раздел III ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ВЛИЯЮЩИЕ НА СИСТЕМУ КРОВИ
Глава 28 ЛЕКАРСТВЕННЫЕ СРЕДСТВА ВЛИЯЮЩИЕ НА СВЕРТЫВАНИЕ КРОВИ
В организме в динамическое равновесии находятся свертывающая и антисвертывающая системы. Система свертывания крови состоит из тромбоцитов и пластиночных факторов, содержащихся в них, а также из белков, синтезирующихся в клетках печени. Антисвертывающая система представлена плазмином (фибринолизином) — протеолитическим ферментом, находящимся в крови в неактивном состоянии (плазминоген), белками плазмы крови (протеинами С, S), тормозящими процесс образования фибрина, а также веществами, продуцируемыми (простациклин, тромбомодулин и др.) или фиксированными на эндотелиальных клетках (гепарин) и. пр. При нарушенном равновесии между этими двумя системами может возникать либо повышенная кровоточивость, либо тромбообразование. Оба состояния требуют коррекции путем назначения лекарственных препаратов.
Лекарства, влияющие на свертывание крови делят на 2 основные группы: гемостатические и антитромботические средства.
ГЕМОСТАТИЧЕСКИЕ СРЕДСТВА
Их условно делят на: 1) агреганты; 2) коагулянты (прямые и непрямые); 3) ингибиторы фибринолиза.
1. Агреганты — препараты, способствующие агрегации и адгезии тромбоцитов.
В регуляции активности тромбоцитов участвует ряд биологически активных веществ. Одни из них способствуют агрегации, другие препятствуют ей. Различают «сильные» (тромбин, коллаген, простагландины — эндопероксиды, тромбоксан А2, фактор, активирующий тромбоциты, — ФАТ) и «слабые» (аденозиндифосфат — АДФ, адреналйн, вазопрессин, серотонин) агреганты. Антиагрегантной активностью обладают ПГ 12 (простациклин), ПГ Д2, эндотелиального происхождения миорелаксирующий фактор (ЭПМФ).
Почти все агреганты взаимодействуют со своими рецепторами на поверхности тромбоцитов, затем благодаря специальному протеину G активируют фосфолипазу С (ФЛ С). Различают множество ФЛ С в мембране и цитозоле тромбоцитов, отличающихся друг от друга субстратами и скоростью катализа дифосфата фосфатидилинозитола (ФИФ2) (см. раздел «Общая фармакология»). Образовавшиеся из ФИФ2 под влиянием ФЛ С инозитолтрифосфат (ИФ3) и диацилглицерол (ДАГ) увеличивают концентрацию свободного кальция и активность протеинкиназы С (ПК С) в тромбоците. ИФ3 освобождает кальций
223
из быстро обмениваемого пула клеточной мембраны и из медленно обмениваемого пула эндоплазматического ретикула тромбоцитов. Освободившийся кальций поступает внутрь тромбоцита, где и активирует ряд процессов, способствующих активности пластинок:
— кальций образует с кальмодулином комплекс, который активирует фосфокиназу, фосфорилирующую легкие цепи миозина, после чего тот соединяется с актином; образовавшийся актомиозин активирует сократительный аппарат клетки и освобождает из нее агрегирующие факторы;
— кальций активирует протеазу, освобождающую актин из связанной, неактивной формы; протеазу, освобождающую из ПК С ее активную фракцию ПК М; фосфолипазу А2 (ФЛ А2), освобождающую арахидоновую кислоту; фактор, активирующий тромбоциты (ФАТ) из фосфолипидов мембраны тромбоцитов.
ПК С (стимулированная ДАГ) модифицирует гликопротеиновые рецепторы на поверхности тромбоцитов, превращая их в активную форму, способную связать фибриноген, агрегирующий тромбоциты; активирует секрецию тромбоцитами агрегирующих факторов ^фосфорилирует специальный протеин (протеин 47), превращая его в активную форму, способную полимеризовать актин; фосфорилирует липокортин, устраняя этим его тормозящее влияние на активность ФЛ А2; облегчает освобождение арахидоновой кислоты и ФАТ из фосфолипидов мембран тромбоцитов.
Арахидоновая кислота под влиянием циклооксигеназ (ЦОГ) превращается в эндопероксиды (ПГ G2 и ПГ Н2), тромбоксан А2 — мощные агреганты, и отчасти в простагландины Д2, F2a и Е2 — антиагреганты. Под влиянием липоксигеназы (ЛОГ) арахидоновая кислота превращается в 12-моногидроперок-си- и 12-моногидроксиэйкозотетраеновые кислоты (12-ГПЭТЕК и 12-ГЭТЕК), которые подавляют реакцию тромбоцитов на арахидоновую кислоту и на ее метаболиты (образовавшиеся при участии ЦОГ).
Из активированных тромбоцитов происходит освобождение (секреция): серотонина, АДФ (из плотных гранул), фактора Виллебранда (ФВ), фибронектина и тромбоспондина (из а гранул). Серотонин и АДФ в небольших концентрациях вызывают обратимую агрегацию тромбоцитов, но способствуют вовлечению дополнительных их количеств в процесс агрегации. ФВ необходим для адгезии тромбоцита к .субэндотелиальной ткани сосуда; фибриноген и тромбоспондин приводят к необратимой агрегации тромбоцитов. Фибриноген к тому же поддерживает активность ФЛ А2, освобождающей арахидоновую кислоту и ФАТ, что способствует агрегации.
Ингибирование агрегации тромбоцитов осуществляется при участии цАМФ и цГМФ.
цАМФ: тормозит связывание тромбина с поверхностью тромбоцитов и этим предотвращает развитие внутриклеточных процессов, ведущих к их активации; тормозит зависимое от ФЛ С образование ИФ3 и ДАГ; снижает активность ПК С; тормозит функцию внутриклеточного кальция (снижает его освобождение из внутриклеточных депо, проникновение из внеклеточной среды, активизирует процесс реквестрации); тормозит зависимое от ФЛ А2 освобождение арахидоновой кислоты и ФАТ; тормозит фосфолирирование легких цепей миозина и этим предотвращает активность сократительного аппарата тромбоцитов.
224
цГМФ. Его функция пока мало изучена, но известно, что он препятствует образованию ИФ3 и ДАГ из ФИФ2, тормозя этим последующие процессы в пластинках.
Из всех биологически активных веществ, обладающих агрегантными свойствами, применяют «слабые» агреганты — серотонин и метаболит адреналина — адроксон, а также препараты кальция.
О механизме их влияния на тромбоциты сказано выше. Но необходимо отметить, что в антигеморрагическом действии серотонина существенное значение имеет и его влияние на клетки эндотелия и гладкой мускулатуры сосудов. Он вызывает сокращение эндотелиальных клеток, увеличивая межклеточные пространства,, через которые в субэндотелиальную ткань устремляется жидкая фракция плазмы крови, вызывая ее набухание и уменьшая просвет сосудов, чему-способствует сокращение гладкой их мускулатуры, вызываемое серотонином.
Серотонин в виде адипината вводят внутривенно или внутримышечно при тромбоцитопениях и тромбоцитопатиях (болезни Верльгофа, Виллебранда, геморрагическом синдроме после приема цитостатиков и т. п.). Однако он вызывает большое число опасных осложнений: спазм гладкой мускулатуры бронхов, сосудов, кишечника, вызывает фазные изменения артериального давления и др. Поэтому у детей его применяют редко.
Адроксон — практически не влияет на тонус сосудов и деятельность сердца. Преимущественно его применяют местно (например, при удалении миндалин), реже подкожно при паренхиматозных-и капиллярных кровотечениях (при травмах или операциях).
Кальций, как сказано выше, непосредственно участвует в агрегации и адгезии тромбоцитов, но кроме того он активирует тромбин и фибрин. Таким образом, он стимулирует образование и тромбоцитарных, и фибринных тромбов. В основном препараты кальция применяют при кровотечениях, связанных со снижением его уровня в плазме крови ребенка (после переливания больших количеств цитратной крови и плазмозаменителей с низким содержанием кальция или без него).
В качестве препаратов используют кальция хлорид (внутривенно или внутрь) и глюконат (внутривенно, внутримышечно или внутрь). Быстрое внутривенное введение кальция хлорида ребенку может привести к остановке сердца и снижению артериального давления. К агрегантам надо отнести и этамзилат (дицинон), ингибирующий синтез простациклина и этим снижающий его влияние на агрегацию тромбоцитов. К тому же он способствует уплотнению базальной мембраны капилляров, увеличивая полимеризацию гиалуроновой кислоты в ней и нормализации мозгового кровотока. При внутривенном введении гемостатический эффект развивается через 5—15 мин. Его с успехом применяют у новорожденных детей, в том числе недоношенных, для профилактики внутримозговых геморрагий. Он снижает частоту и тяжесть этой патологии, а следовательно, улучшает прогноз у детей, родившихся в состоянии тяжелой гипоксии.
2. Коагулянты — вещества, увеличивающие образование фибринных тромбов, делят на прямые и непрямые.
А. Прямые коагулянты — тромбин и фибриноген, белки, получаемые из донорской крови. Они вызывают Эффект и in vivo, и in vitro. Биологическая роль тромбина сложна, так как он одновременно и способствует, и препятствует образованию тромбов. Способствует коагуляции крови потому, что яв-
8 Зак. 3856
225
ляется протеолитическим ферментом, разрывающим две специфические аргинил-гликолевые связи в молекуле фибриногена, и отщепляет от ядра молекулы отрицательно заряженные фибринопептиды А и Б. Этим тромбин уменьшает силы электростатического отталкивания и в присутствии ионов кальция способствует образованию полимера фибрина (но происходит это только на поврежденной поверхности сосуда). К тому же тромбин активирует XIII фактор, катализирующий процесс «сшивания» полимера фибрина, т. е. упрочняющий тромб.
Вместе с тем, влияя на нормальные эндотелиальные клетки, тромбин увеличивает освобождение из них простациклина — активного антиагреганта, препятствуя распространению тромба. Кроме того, тромбин, вступая во взаимодействие с тромбомодулином (белком, находящимся на поверхности нормального эндотелия), образует с ним комплекс и утрачивает при этом свою активность. Образовавшийся комплекс активирует протеин С (гликопротеин, синтезируемый в печени), который после взаимодействия с протеином S (также синтезируемым в печени) устраняет активирующее влияние V и VIII факторов на превращение протромбина в тромбин и способствует освобождению из эндотелиальных клеток тканево/в активатора плазминогена, под влиянием которого плазминоген превращаемся в плазмин, разрушающий фибрин.
Помимо взаимодействия с тромбомодулином элиминация тромбина осуществляется антитромбином-Ш, активируемым гепарином (образующимся в эндотелиальных клетках). Антитромбин-III эстерифицирует и необратимо инактивирует не только тромбин, но и другие сериновые протеазы (X, XI, XII факторы), гепарин при этом отщепляется. В отсутствии гепарина антитромбин III проявляет очень слабую активность; при его дефиците возрастает опасность возникновения венозных тромбов. Это может быть при наследственной недостаточности его синтеза, при патологии почек и печени, когда он теряется с мочой либо недостаточно синтезируется, а также при приеме некоторых лекарств, в частности, оральных контрацептивов, L-аспарагиновой кислоты.
В качестве лекарства тромбин назначают детям с кровотечениями,, местно в виде специальной пленки, ваты, иногда в форме аэрозоля (при кровотечениях из дыхательных путей) или раствора, применяемого через рот (при желудочных кровотечениях).
Фибриноген — превращается под влиянием тромбина в фибрин. Применяют его как местно, в виде фибринных пленок, так и внутривенно при преждевременной отслойке плаценты, диссеминированном внутрисосудистом свертывании крови (ДВСК-синдром) (вместе с гепарином) и других состояниях, характеризующихся гипо- и афибриногенемией. Кроме того, есть препарат фибриногена, содержащий антигемофильный глобулин А (VIII фактор), его назначают при гемофилии (форма А).
Б. Непрямые коагулянты — витамины К — производные нафтохинона. Различают витамин Кь поступающий в организм с растительной пищей, витамин К2, содержащийся' в продуктах животного происхождения и образующийся кишечными бактериями, и К3 — синтетический витамин, бисульфитное производное которого викасол давно используется в медицине.
Висакол не сам вызывает эффект, а образующиеся из него в печени витамины К] и К2, и повышение коагуляции после его введения развивается медленно. Препарат витамина К] — фитоменадион лучше всасывается из кишечника, и сам вызывает эффект, поэтому прекращение геморрагий возникает быстро. 226
Витамин К в организме существует в виде гидрохинона, эпоксида и хинона, постоянно превращающихся в названной последовательности из одной формы в другую. В момент превращения гидрохиноновой формы в эпоксидную витамин активирует специальную карбоксилазу, которая карбоксилирует остатки глутаминовой кислоты, содержащиеся в разных белках. После этого белки становятся активными, в частности, приобретают способность связывать ион кальция. Так, происходит активация протромбина, а также VII, IX и X факторов свертывающей системы крови, протеинов С и S, обладающих антикоагулянтными свойствами, а также белков, связывающих кальций в плазме крови, в стенке кишечника, канальцах почек, в костях (остеокальцин) и пр. В отсутствии витамина К названные белки синтезируются, но остаются неактивными, это так называемые акарбокси И, VII, IX, X факторы. Акарбокси II обладает даже антагонистическими свойствами по отношению к протромбину (он получил название protein induced vitamin К absence или PIVKA II). Активированные протеины С и S, взаимодействуя с фосфолипидами на поверхности тромбоцитов и эндотелиальных клеток, быстро инактивируют Va и Villa факторы, тормозя этим коагуляцию крови. В то же время они блокируют инактиватор тканевого активатора плазминогена, в результате освобождение последнего из эндотелия возрастает, что способствует фибринолизу.
Биологическая роль витамина К не ограничивается активацией названной карбоксилазы. Он обладает антигипоксантной активностью, способствуя транспорту водорода от НАДН к KoQ, минуя флавопротеин I (НАДН-дегидрогеназу). Этим витамин К облегчает синтез АТФ в митохондриях. Известно также, что под влиянием витамина К возрастает синтез альбуминов, миофибриллярных белков, фактора эластичности сосудов, но механизмы этих процессов пока неясны.
Витамин К преимущественно применяют в качестве коагулянта, вызывающего эффект только в организме, но не in vitro. Антикоагулирующие его свойства обычно не проявляются. Назначают его при дефиците витамина, который может быть следствием: а) недостаточного образования микрофлорой кишечника у новорожденных (в связи со стерильностью его содержимого), у детей с дисбиоценозом кишечника, вызванного приемом антибиотиков, когда исчезают микроорганизмы, его синтезирующие; б) при нарушениях всасывания из-за недостаточного поступления желчи (обтурация желчного протока, гепатит) и жира в кишечник; в) при приеме антагонистов витамина К (см. ниже). Кроме того, витамин К назначают при рахите, мышечной слабости и атонии кишечника у детей.
Викасол обладает окисляющими свойствами и у новорожденных; при введении в повышенных дозах может вызвать гемолиз эритроцитов и метгемоглобинемию. Эти осложнения могут быть и у больных с недостаточностью восстанавливающих ферментов в эритроцитах (глюкоза-6-фосфатдегидрогеназы, глутатионредуктазы). Фитоменадион таких осложнений не вызывает даже при недостаточности названных ферментов.
3. Ингибиторы фибринолиза. Аминокапроновая кислота — производное лизина. В молекулах фибриногена и фибрина содержится лизин, именно с ним взаимодействуют активные центры плазминогена плазмина, подвергая затем эти белки гидролизу. Аминокапроновая кислота взаимодействует с этими участками плазминогена и плазмина, устраняет их активность, сохраняя молекулу фибрина и состоящий из него тромб.
227
Контрикал — антиферментный препарат, получаемый из легких крупного рогатого скота. Он образует с плазминогеном неактивные комплексы.
Назначают аминокапроновую кислоту и контрикал при кровотечениях, связанных с повышенной активностью фибринолитической системы и недостаточностью фибриногена. Например, при циррозе печени, портальной гипертензии, при кровотечениях после операций на органах, богатых тканевым активатором плазминогена, при использовании аппаратов искусственного кровообращения, при передозировке фибринолитических средств, при массивных переливаниях консервированной крови (возможность развития вторичной гипофибриногенемии) и пр.
Кроме того, эти препараты, ингибируя протеолитические ферменты, прямо (контрикал) или опосредованно, через систему фибринолиза (аминокапроновая кислота), тормозят активность кининов. Поэтому их применяют у детей при травматическом шоке, панкреатите, ожогах, сотрясении мозга, менингитах, то есть при патологических состояниях, характеризующихся повышением активности кининов.
Вводят аминокапроновую кислоту через рот, внутримышечно и внутривенно; контрикал — только внутривенно. ^Лри резкой активации фибринолиза их назначают одновременно с фибриногеном.
АНТИТРОМБОТИЧЕСКИЕ СРЕДСТВА
Их условно делят на: 1) антиагреганты; 2) антикоагулянты (прямые и непрямые); 3) фибринолитики (прямые и непрямые).
1. Антиагреганты
Ацетилсалициловая кислота ингибирует агрегацию тромбоцитов, так как необратимо угнетает их циклооксигеназу, ацетилируя ее, и этим нарушает образование агрегирующих простагландинов и тромбоксана А2 (см. выше). Кроме того, она является антагонистом витамина К и этим препятствует активности II, VII, IX и X факторов свертывающей системы крови.
Ацетилсалициловая кислота предотвращает развитие тромбоцитарных тромбов, преимущественно артериальных. У детей ее в основном применяют для лечения диссеминированного внутрисосудистого свертывания крови (ДВСК), нередко в сочетании с гепарином, тоже эффективным антиагрегантом (см. ниже). Для лечения и профилактики гиперкоагуляции крови у взрослых ее назначают в небольших дозах (0,08—0,2 г/сут) при инфаркте миокарда, лицам, перенесшим его, при стенокардии, гипертонической болезни, атеросклерозе и пр. В дозе 80 мг/сут ацетилсалициловую кислоту применяют для профилактики позднего токсикоза у беременных женщин с риском развития названной патологии. Для выявления риска возникновения этого токсикоза используют пробу с ангиотензиногеном, реакция на который у соответствующих больных резко повышена. При данной патологии имеет место чрезмерное образование в мелких сосудах плаценты тромбоксана А2, который вызывает их спазм, образование тромбоцитарных тромбов, нарушение плацентарного кровотока, приводит к внутриутробной гипоксии плода.
Дипиридамол (курантил, п е р с а н т и н) предотвращает агрегацию тромбоцитов, так как ограничивает их активность в связи с: а) ингибированием фосфодиэстеразы и увеличением в них уровня цАМФ (см. раздел «Общая фармакология»); б) ингибированием аденозиндезаминазы, что приводит к по-228
вышению концентрации в плазме крови аденозина (см. гл. 3), являющегося антагонистом аденозиндифосфата (эндогенного агреганта); в) увеличением образования простациклина эндотелиальными клетками.
Дипиридамол тоже используют для лечения или профилактики ДВСК-син-дрома у детей (в комбинации с гепарином), например, во время шока, обезвоживания, токсикоинфекциях. У взрослых его применяют при коронарной недостаточности, для профилактики приступов стенокардии и инфаркта миокарда.
Натрия цитрат связывает ионы кальция и этим ограничивает их активность. Применяют препарат в основном для консервирования крови, но иногда и для приема через рот (или внутривенно) для ликвидации гиперкальциемий и лечения отравлений у детей сердечными гликозидами.
Кроме того, способностью подавлять агрегацию тромбоцитов обладают препараты, относящиеся к другим группам лекарственных средств:
— глюкокортикоиды, ингибирующие фосфолипазу А2;
— другие (помимо ацетилсалициловой кислоты) нестероидные противовоспалительные средства, обратимо ингибирующие циклооксигеназу тромбоцитов;
— никотиновая кислота, ингибирующая тромбоксансинтетазу;
— теофиллин, папаверин и ксантинола-никотинат, ингибирующие фосфодиэстеразу тромбоцитов и повышающие в них содержание цАМФ;
— адренолитические средства, устраняющие активирующее влияние катехоламинов на тромбоциты;
— нитроглицерин и натрия нитропруссид, увеличивающие образование в тромбоцитах цГМФ, препятствующего агрегации тромбоцитов (см. выше);
— пентоксифиллин (трентал), повышающий синтез и освобождение простациклина эндотелиальными клетками, снижающий уровень фибриногена в плазме крови; кроме того, он способствует изгибаемости эритроцитов, облегчая этим их прохождение по капиллярам и препятствуя образованию эритроцитарных тромбов.
2. Антикоагулянты
Их делят на прямые и непрямые.
А. Прямые антикоагулянты вызывают эффект in vitro и in vivo.
Гепарины — лекарственные препараты, получаемые из легких и печени крупного рогатого скота и свиней. Анионные группы придают их молекулам отрицательный заряд. Специфический участок гепарина соединяется с положительно заряженными аминогруппами в молекуле антитромбина III, что повышает реактивность его специфических аргиниловых групп, которые, взаимодействуя с активными центрами сериновых протеаз (тромбина, 1Ха, Ха, Х1а и ХПа факторов), подавляют их активность и образование фибринных тромбов. Гепарин повышает активность фибринолитической системы за счет образования комплекса с антиплазмином. И, наконец, гепарин накапливается на поверхности эндотелиальных клеток и клеток крови, создавая в них концентрацию в 100 раз больше, чем в плазме крови. Этим он придает отрицательный заряд поверхности эндотелия и тромбоцитов, препятствуя их адгезии и агрегации, а также освобождению из них агрегирующих факторов.
Таким образом, гепарин является и антикоагулянтом, и стимулятором фибринолитической системы, и антиагрегантом. Последнему качеству гепарина придают особенно важное значение.
К числу других эффектов гепарина нужно отнести: его способность нарушать кооперацию Т- и В-лимфоцитов (а следовательно, образование иммуноглобу
229
линов), ингибировать систему комплемента; активировать липопротеиновую липазу и снижать чрезмерный синтез альдостерона; связывать гистамин и активизировать гистаминазу.
В педиатрии гепарин преимущественно используют при ДВСК-синдроме, встречающемся при гипоксии, обезвоживании, некоторых инфекциях, тканевой травме и пр. Вводят его отдельно или в комбинации с другими препаратами, нарушающими агрегацию тромбоцитов, при необходимости и с фибриногеном. Кроме того, гепарин назначают детям при повышенном риске тромбообразо-вания в сердце (эндокардиты, мерцательная аритмия, пороки и пр.), при гемодиализе и искусственном кровообращении.
Появились первые сообщения о высокой эффективности эндолюмбального введения гепарина при гнойных менингитах у новорожденных детей. При этой патологии в спинномозговой жидкости уменьшается содержание гепарина и повышается уровень белков (в том числе, фибриногена), серотонина, различных ферментов, ведущих к некротическим изменениям в оболочках и к образованию тромбов в сосудах мозга. Введение гепарина связывает и инактивирует названные ферменты, резко повышая выживаемость таких детей и снижает частоту неврологических осложнений. -
Гепарин также используют для лечения ревматизма, гиперальдостеронизма, бронхиальной астмы, для улучшения почечного кровотока и увеличения диуреза при острых нефритах, а также при парентериальном питании недоношенных (для улучшения усвоения жиров).
Введение гепарина может вызвать нежелательные эффекты: головокружение, анорексию, тошноту, рвоту, понос. Примерно у 20% больных наблюдается временное облысение, у 30% — тромбоцитопения. При назначении гепарина может быть крапивница, при длительном применении — остеопороз, так как гепарин является «кофактором» паратгормона.
При передозировке или повышенной чувствительности к гепарину развивается геморрагический синдром. Для устранения чрезмерного эффекта гепарина используют его антагонист — основной белок — протамина сульфат, вводимый внутривенно. На введение этого белка могут развиться неспецифические аллергические реакции (гиперемия лица, крапивница, боли по ходу вен, за грудиной, в животе, озноб и т. п.), но более опасны осложнения, связанные с освобождением тромбоксана А2, вызванным комплексом гепарина с протамином. Освобождение тромбоксана А2 происходит в первые же минуты после внутривенного введения протамина, вызывая повышение артериального давления в сосудах легких, правожелудочковую недостаточность и системную гипотензию. У некоторых больных эти реакции очень резко выражены.
В настоящее время в медицинской практике также используют препараты низкомолекулярного или фракционного гепарина. К ним относят: л о г и п а -рин, фраксипарин, далтепарин, кливарин и др. Их получают методом ферментативной деполимеризации высокомолекулярного гепарина с помощью бактериальной гепариназы.
Низкомолекулярные гепарины не влияют на коагуляцию (не связывают 11 фактор), то есть они не изменяют время свертывания крови, но их терапевтический эффект больше, чем у высокомолекулярных форм.
Важно отметить, что низкомолекулярные гепарины имеют большую биодоступность после подкожного и внутримышечного введения, чем стандартный гепарин, приближаясь к 100% по сравнению с 30%.
230
Длительное применение низкомолекулярных' гепаринов связано с меньшим риском возникновения нежелательных эффектов, присущих высокомолекулярному гепарину, среди которых превалируют тромбоцитопения, геморрагия и остеопороз.
Низкомолекулярные гепарины подходят как для кратковременного применения (несколько дней), так и для долговременной антитромботической терапии, необходимость в которой может продолжаться от 6 нед до 6 мес. Долговременная терапия низкомолекулярным гепарином может быть альтернативой операциям реваскуляризации у больных с хорошей переносимостью данного препарата.
Б. Непрямые антикоагулянты вызывают эффект только in vivo.
Антагонисты витамина К: 1) производные кумарина — неодику-марин (пелентан); 2) производные индандиона — фенилин. Эти препараты, похожие по химической структуре на витамин К, блокируют эпоксидредуктазу, переводящую эпоксидную форму витамина К в хиноновую, нарушая этим циклическое превращение витамина и его активность (аналогичный эффект вызывает ацетилсалициловая кислота). В результате нарушается активация протромбина (II) и проконвертина (VII), антигемофильного глобулина В (IX) и тромботропина (X), необходимых для образования фибринных тромбов. Но одновременно антагонисты витамина К препятствуют активации протеинов С и S (см. выше), обладающих антикоагулирующей активностью.
Основное значение эти препараты имеют для профилактики образования фибринных тромбов (митральный стеноз с постоянной или пароксизмальной мерцательной аритмией, наличие клапанных протезов) и лечения тромбофлебитов.
Названные препараты назначают через рот.
При применении непрямых антикоагулянтов могут появиться геморрагии, являющиеся следствием не только угнетения образования фибринных тромбов, но и повышения проницаемости сосудистой стенки. У детей они нарушают синтез альбуминов, миоальбуминов и использование креатинфосфата в скелетных мышцах. Все это крайне нежелательно для развивающегося организма. Следует обратить особое внимание на опасность гиперкоагуляции крови в первые трое суток после введения названных препаратов (особенно неодику-марина). Это связано с более быстрым снижением уровня протеинов С и S (у которых период полужизни более 24 часов), чем II, VII, IX и X факторов (у которых период полужизни более 6—7 часов). Поэтому при острых ситуациях (инфаркт миокарда и т. п.) в первые три дня одновременно назначают и антагонисты витамина К, и гепарин.
Снижение уровня протеинов С и S может стать причиной развития так называемых «кумариновых» некрозов в мягких тканях (ягодицы, грудные железы, щеки, половой член), являющихся результатом тромбоза капилляров и мелких венул. Появляются эти некрозы на 4—10 день от начала приема препаратов, чаше у женщин. Для ликвидации начинающегося осложнения производят инфузию замороженной плазмы крови, богатой протеином С.
3. Фибринолитические средства (прямые и непрямые)
А. Фибринолизин (плазмин) — прямой фибринолитик, который получают путем активации (с помощью трипсина) профибринолизина (плазминогена). Как протеолитический фермент он расщепляет фибрин, действуя однако лишь на поверхности тромба. Он может ликвидировать фибринные (преимущественно венозные) тромбы и приводить к реканализации затромби-
231
рованных сосудов. Продукты деградации фибрина обладают антикоагулянтным действием, так как ингибируют полимеризацию мономеров фибрина и образование тромбопластина.
Фибринолизин — препарат экстренной помощи, его назначают при тромбоэмболических состояниях: периферическая окклюзия сосудов, тромбоз сосудов. мозга и глаз, ишемическая болезнь миокарда, устранение тромбов, возникших внутри шунта (сосудистые протезы).
При введении фибринолиза у больного могут быть геморрагии в связи со снижением уровня в крови фибриногена и протромбина, а также аллергические реакции (повышение температуры тела, озноб, боли в животе, крапивница), которые можно устранить антигистаминными препаратами.
Б. Стрептолиаза (стрептокиназа) — непрямой фибринолитик, продукт жизнедеятельности стрептококков. Она стимулирует перевод циркулирующего в крови проактиватора в активатор, трансформирующий плазминоген в плазмин. Кроме того, стрептокиназа образует комплекс с плазминогеном (1:1), который активирует остальные молекулы плазминогена крови. Препарат способен проникать внутрь тромбами там активировать процесс фибринолиза. Особенно хороший эффект возникает при воздействии стрептокиназы на тромб, образовавшийся не более 7 дней тому назад. Применяют стрептолиазу при поверхностных и глубоких тромбофлебитах, тромбоэмболиях легочных сосудов, септических тромбозах и пр. /
При введении стрептолиазы (даже первом) нередко возникает аллергическая реакция (повышение температуры, сыпи, крапивницы, гиперемия, снижение артериального давления), так как в организме многих детей могут быть антитела к стрептококкам и продукты их жизнедеятельности. Для профилактики этого явления назначают глюкокортикоиды. При назначении стрептолиазы могут возникнуть геморрагии, иногда очень тяжелые; у некоторых больных отмечают гемолиз, снижения уровня гемоглобина; последнее является следствием прямого токсического действия препарата на эритроциты. Длительное применение стрептолиазы может стать причиной возникновения нефрита, являющегося следствием образования иммунных комплексов.
Лекарственные формы и дозы средств, влияющих на свертывание крови, для детей представлены в табл. 45.
Таблица 45
Средства, влияющие на свертывание крови
Препарат Лекарственная форма Путь введения Число приемов в сутки Суточная доза
Викасол Vikasolum Таблетки по 0,015 г 1% раствор в ампулах по 1 мл Внутрь Внутримышечно 2-3 1 Новорожденному — не более 0,004 г; до 1 года — 0,002—0,05 г; до 2 лет — 0,006 г; 3~4 года — 0,008 г; 5—9 лет — 0,01 г; 10—14 лет — 0,015 г
Кислота аминокапроновая Acidum aminocap-ronicum Порошок 5% раствор во флаконах по 100 мл Внутрь Внутривенно 3-4 1 До 1 года — 0,05 г/кг; после года — 0,1 г/кг (в сутки не более 10,0— 15,0 г)
232
Окончание табл. 45
Препарат Лекарственная форма Путь введения Число приемов а сутки Суточная доза
Конткрикал Contrykal Ампулы по 10000 (50000) ЕД в сухом виде Внутривенно 2-3 До 3 лет — 1000 ЕДДкгхсут); 3-12 лет — 20000-30000 ЕД; старше 12 лет — 40 000 ЕД на одно введение
Кальция хлорид Calcii chloridum 5-10% раствор во флаконах по 100 мл 10% раствор в ампулах по 5 и 10 мл Внутрь Внутривенно (медленно) 2-3 1 До 1 года — 1,0-1,5 мл; 2—4 года — 2,0—3,0 мл; 5-6 лет — 3,0-4,5 мл; 7-9 лет — 3,0-6,0 мл; 10-14 лет — 4,0—9,0 мл
Кальция глюконат Calcii ghiconas Таблетки по 0,5 г 10% раствор в ампулах по 10 мл Внутрь Внутримышечно' Внутривенно 2-3 1 В той же дозе
Гепарин Heparinum Флаконы по 5 мл (с активностью 5, 10 и 20 тыс. ЕД в 1 мл) Внутривенно 4-6 300 ЕД/кг
Мазь в тубах по 25 г (2500 ЕД) Наружно 2-3 0,5—1,0 мг на участок кожи диаметром 3-5 см
Дипиридамол Dipiridamohim Таблетки по 0,025 и 0,075 г Внутрь за 1 час до еды 2-3 5 мг/(кгхсут)
0,5% раствор в ампулах по 2 мл Внутримышечно Внутривенно (очень медленно) 1 1 1,5-5,0 мг/кг 1,0-3,0 мг/кг
Глава 29 СРЕДСТВА, СТИМУЛИРУЮЩИЕ КРОВЕТВОРЕНИЕ
1. Антианемические средства
Анемия — часто встречающаяся патология в детском возрасте. Особенно легко она возникают у детей, родившихся недоношенными или рожденными женщинами с анемиями, поздним токсикозом и некоторой другой патологией; у детей, находящихся на искусственном вскармливании. Способствуют возникновению анемий острые и хронические инфекционные заболевания, плохое питание (пищей, содержащей недостаточное количество белка, витаминов).
Различают гипохромные и гиперхромные анемии. Первые могут быть следствием недостаточности железа в организме (железодефицитные анемии) или недостаточности других факторов (витаминов Е, С, Вс, В6 и пр.), необходимых для нормального кроветворения. Гиперхромные анемии — следствие недостатка в организме фолиевой кислоты или цианокобаламина (витаминов Во и Вп соответственно).
233
Различают и лекарственные вещества, применяемые для профилактики и лечения либо гипохромных, либо гиперхромных анемий.
К лекарственным веществам, назначаемым для профилактики и лечения гипохромных анемий, относят препараты железа, а также витамины Е, С, В2, Вб, препараты меди, магния (о них смотри в соответствующих главах).
Препараты железа показаны прежде всего при железодефицитных анемиях. Они могут быть следствием недостаточного поступления железа в организм плода (при соответствующей анемии у матери), ребенка при нарушениях всасывания из кишечника (из-за мальабсорбции, воспалительных процессов, приеме тетрациклинов). При искусственном вскармливании ребенок получает коровье молоко, в котором содержится мало железа (0,2-0,5 мг/л) и усваивается его всего лишь 5-9%. При кормлении же материнским молоком ребенок получает больше железа (0,5-1,5 мл/л, в среднем 0,7-0,8 мг/л) и усваивается оно лучше — 10—48%. Железодефицитные анемии могут быть также следствием потерь железа во время различных геморрагий: носовых, маточных, травматических, кишечных (во время гастроэнтерита грудной ребенок может в сутки потерять до 2 мл крови, в 1 мл которой содержится до 0,5 мг элементарного железа), почечных (различные гематурии) и пр.; следствием интенсивного расходования железа во время инфекционного процесса (резко возрастает активность НАДН — дегидрогеназы в фагоцитах й пр.). Препараты железа кроме того применяют при различных гипотрофиях, так как в организме больного при этом обнаруживают недостаточную активность тканевых геминовых и негеминовых ферментов и в связи с этим нарушения синтеза белков, деления клеток и пр.
Препараты железа делят на две группы: препараты для приема внутрь и для инъекций. При применении пероральных препаратов железа необходимо соблюдать условия, способствующие его усвоению. Внутрь назначают только препараты двухвалентного железа, так как трехвалентное вызывает раздражение и повреждение слизистой оболочки желудочно-кишечного тракта и плохо усваивается. Двухвалентное железо в желудке образует низкомолекулярные комплексы с пептидами, аминокислотами, гемом, фруктозой, аскорбиновой, янтарной кислотами. Эти комплексы не выпадают в осадок в щелочной среде кишечника, и содержащееся в них железо всасывается. Поэтому одновременно с препаратами железа ребенок должен получать полноценное питание, содержащее мясные продукты (включая печень, сердце, яичный желток), фрукты. Если у ребенка обнаруживают недостаточную продукцию соляной кислоты и пепсина в желудке, то их необходимо назначать в качестве лекарства, чтобы обеспечить освобождение из белков олигопептидов, аминокислот, гема, необходимых для всасывания железа в кишечнике. Вместе с тем одновременно с железом нельзя принимать вещества, образующие с ним комплексы, выпадающие в щелочной среде кишечника в осадок и не всасывающиеся в нем: препараты кальция, фосфаты, молоко и молочные продукты, содержащие Са и Р, тетрациклины, пищевые продукты, содержащие фитиновую кислоту (хлебные злаки, бобовые), поэтому нельзя одновременно есть каши из пшенички, пшена, гороха, чечевицы.
Всасывается железо преимущественно в двенадцатиперстной кишке, а при анемиях — и в других отделах тонкого кишечника. Сначала происходит активный захват его водорастворимых комплексов щеточной каемкой слизистой 234
оболочки кишечника (для ее нормальной активности необходима фолиевая кислота). Затем в клетке железо освобождается из комплекса и транспортируется по направлению к серозной поверхности либо путем простой диффузии (по градиенту концентрации), либо в комплексе со специальным белком-носителем, синтез которого повышается во время анемии. Активность этого белка-носителя зависит от энергии, поставляемой гемсодержащими ферментами и белком, содержащим медь. Этот белок переносит железо через клетку только один раз; для переноса следующей его порции необходимо синтезировать новые молекулы белка, но на это требуется 4—6 ч. Поэтому препараты железа и следует принимать через 6 ч. Иначе в кишечнике останется невсосавшееся железо; несмотря на то, что оно двухвалентное, это железо может вызвать раздражение слизистой оболочки кишечника. Если в клетке слизистой оболочки оказалось избыточное количество двухвалентного железа, оно может окислиться до трехвалентного и соединиться с апоферритином, превратив его в ферритин, который затем вместе со слущивающейся клеткой попадает в просвет кишечника и выбрасывается вон из организма. Нормально всасывающееся железо из клетки кишечника попадает в кровеносное русло, где окисляется до трехвалентного состояния и соединяется с p-гликопротеином, сидерофилином (трансферрином), транспортирующий его в органы кроветворения (костный мозг) или в органы депонирования (печень, селезенка). При анемиях в крови больше свободного сидерофилина, и он может больше связать железа, поэтому оно и больше всасывается.
Сидерофилин переносит трехвалентное железо к специфическим рецепторам, локализованным в плазматической мембране клеток, преимущественно в костном мозге, печени и ретикулоэндотелиальной системе. Комплекс Fe+++ и сидерофилина связывается с этим рецептором, подвергается эндоцитозу. Внутри клетки железо отщепляется, поступая в специальные эндосомы, а рецептор вместе с сидерофилином возвращается на поверхность клетки, происходит отщепление сидерофилина и возвращение его в плазму крови. В клетках обнаружен специальный ген, который регулирует продукцию рецепторов для сидерофилина и апоферритина. При малом содержании железа в организме этот ген способствует продукции повышенного количества рецепторов для сидерофилина и образованию небольших йбличеств апоферритина. При высоком содержании железа происходит противоположное явление: повышенное образование апоферритина и небольшое количество рецепторов для сидерофилина. (Напомним, что ферритин — основная форма депонирования железа в клетках организма.)
В организме железо расходуется на синтез геминовых и негеминовых ферментов. К геминовым относятся: гемоглобин, миоглобин, цитохромы, в том числе цитохром Р-450, пероксидазы, каталазы, участвующие в транспорте кислорода, водорода, ликвидации перекисей и пр. К негеминовым ферментам относятся сукциндегидрогеназа, ацетил-КоА-дегидрогеназа, НАДН-дегидроге-наза и пр., участвующие в транспорте водорода в дыхательной цепи митохондрий различных тканей и в образовании АТФ, необходимого для обеспечения энергией биохимических процессов, происходящих в них. Небольшие количества свободного трехвалентного железа, находящиеся в жидкостях организма, также участвуют в каталитических процессах, например, активируя свободнорадикальные процессы, образование перекисей липидов в клеточных мембранах,
235
в частности, в мембранах эритроцитов, клетках эндотелия, слизистой оболочки кишечника и пр. Поэтому избыток свободного иона железа — опасен.
Принимаемые внутрь препараты железа делят на органические и неорганические. К последним относят лишь железа закисного сульфат и восстановленное железо, все остальные препараты — органические. Все они содержат разные количества железа, чаще около 20% (лишь в восстановленном железе его 95—97%), способность которого к усвоению тоже неодинакова, 12—16% у железа закисного сульфата, 7—9% у железа лактата и 0,5% у восстановленного железа. Поэтому из принятого 0,5 г железа закисного сульфата в оптимальных условиях будет усвоено организмом не более 12 мг элементарного железа.
Для профилактики железодефицитных анемий у доношенного ребенка достаточно 1 мг/кг элементарного железа, которое рекомендуют назначать с двух месяцев жизни на 2-3 мес ежедневно. Недоношенным новорожденным для этой же цели назначают по 2 мг/кг элементарного железа в сутки в период с 2 нед по 2 мес жизни, увеличивая затем дозу до 4 мг/кг в период с 4 до 12 мес, когда запасы железа в организме будут уже израсходованы. Поскольку железо увеличивает расходование йитаминов Е, Вб, то их следует назначать вместе.
Принятое натощак железо усваивается лучше, но и чаще вызывает нежелательные эффекты. Поэтому при возникновении диспепсических расстройств следует перейти на прием его препаратов после еды, хотя усвоение железа и ухудшается.
Об эффективности препаратов железа судят по увеличению в крови числа ретикулоцитов, содержания гемоглобина, цветного показателя. Обычно терапевтический эффект развивается через 2—4 нед. Устранение же дефицита железа в тканях осуществляется медленнее, через 2—3 мес постоянного приема. О достижении эффекта судят, определяя содержание цитохромов в соскобах слизистой оболочки полости рта.
Для повышения эффективности препаратов железа их следует применять вместе с аскорбиновой кислотой и пищей, содержащей'мясные продукты, так как они увеличивают биодоступность железа.
При пероральном приеме препаратов железа могут возникнуть дис'пепти-ческие расстройства (тошнота, рвота, понос), связанные с раздражением слизистой оболочки невсосавшимся железом, активированием свободнорадикальных реакций и перекисного окисления липидов, особенно интенсивно это осложнение наблюдают от приема восстановленного железа, гемостимулина. (Препараты витамина Е препятствуют перекисному окислению липидов.) Опасность диспептических расстройств наиболее высока у новорожденных, преимущественно недоношенных, особенно перенесших гипоксию, нарушения кровообращения, дыхания, функции желудочно-кишечного тракта. У таких детей нарушен процесс активного всасывания из кишечника вообще и железа в частности.
При неэффективности и непереносимости пероральных препаратов железа применяют инъекционные его препараты: фербитол, феррум лек, же к -тофер и пр. Они содержат трехвалентное железо в комбинации с органическими компонентами. Вводят эти препараты внутримышечно, реже внутривенно. 236 '
При их применении абсолютно противопоказан одновременный прием пероральных препаратов железа.
Перед введением инъекционного препарата необходимо определить потребность ребенка в железе и его общую курсовую дозу. Для этого высчитывают дефицит железа в организме, исходя из содержания гемоглобина в крови.
Курсовая доза железа (мг) = Рх(78—0,35 НЪ), где Р — масса тела ребенка в кг, НЬ — фактическое содержание НЬ у ребенка (в г/л).
Ежедневный прирост гемоглобина у детей раннего возраста, получающих феррум лек, после латентного периода в 7-10 дней составляет 4 г/л; при приеме фербитола — 2,6 г/л и при оральном приеме гемостимулина, лактата или аскорбината железа — 0,9 г/л. Однако парентеральное введение препаратов железа — более ответственная процедура, которую можно производить только в условиях стационара. Эти препараты не следует вводить на высоте инфекционного заболевания. Ввведение их новорожденным допустимо только в случае тяжелой анемии с лечебной целью. Профилактическое же назначение препаратов железа для инъекций новорожденным и грудным детям недопустимо, так как после их введения у таких детей обнаруживают угнетение хемотаксиса нормальных нейтрофилов и возрастание частоты сепсиса, вызываемого грамот-рицательными бактериями.
Внутривенно препараты железа вводят медленно, в течение 5 мин. И в течение часа наблюдают, не возникнут ли нежелательные эффекты: чувство онемения вокруг рта, пульсация, боли в груди и в спине. Повторное введение препаратов железа больным с такими явлениями недопустимо. Внутривенные введения могут вызвать головные боли, лихорадку, генерализованную лимфаденопатию, артралгию, уртикарию, у некоторых больных с ревматоидным артритом может быть обострение болезни.
После введения инъекционных препаратов железо быстро поступает в кровь и связывается с сидерофилином. При его врожденном дефиците или дефиците, связанном с недостаточным синтезом (при заболеваниях печени) или потерей из организма (при заболеваниях почек), значительная часть введенного железа оказывается в свободной форме. Это очень опасно, так как несвязанное железо повреждает эндотелий сосудов, вызывает гемолиз эритроцитов, расширяет артериолы и венулы, повышает их проницаемость. У ребенка краснеет лицо, шея. При появлении этих признаков дальнейшее введение препаратов железа следует прекратить, иначе из-за снижения периферического сопротивления сосудов, снижения объема циркулирующей крови (в связи с повышенной проницаемостью сосудов) может произойти резкое падение артериального давления. Нарушение кровоснабжения кишечника и других тканей приводит к освобождению из них ферритина, подавляющего реакцию сосудов на катехоламины и ангиотензин II. В результате возникает шок, гипоксия и ацидоз, последний усугубляется еще и тем, что железо ингибирует цикл трикарбоновых кислот. Из-за резкого повышения проницаемости сосудов происходит диапедез эритроцитов в желудок (кровяная рвота), кишечник (кровавый понос), в мозг, легкие, миокард. Все вместе взятое может привести ребенка к гибели. Для оказания ему помощи вводят внутрь (5—10 г), внутримышечно или внутривенно (по 60-80 мг/(кгхсут)) дефероксамина (десфер ал а). При отсутствии дефероксамина можно назначить тетацин-кальций внутривенно капельно (по 30-75 мг/(кгхсут)), разделив дозу на две инфузии, проводимые через 4—8 ч.
237
К лекарственным средствам, применяемым для профилактики и лечения гиперхромных анемий, относятся фолиевая кислота и цианокобаламин (см. гл. 32).
При лечении гипохромных анемий назначают ряд витаминов и тяжелых металлов.
Аскорбиновая кислота (ее включают в ряд препаратов железа) образует комплексы с железом, хорошо усваивающиеся в кишечнике. Она восстанавливает трехвалентное железо в двухвалентное, чем тоже способствует его усвоению и препятствует раздражению слизистой оболочки кишечника.
Витамин Е — активирует синтез гема, тормозит перекисное окисление липидов клеточных мембран, эритроцитов, предотвращая их гемолиз и продляя жизнь.
Пиридоксин может нормализовать кроветворение у больных с сидеробластной анемией (врожденной' и приобретенной). У таких больных Нарушен синтез гемоглобина и обнаруживают накопление железа в перинуклеарных митохондриях эритроидных клеток.
Рибофлавин косвенно способствует синтезу глобина, чем тоже увеличивает образование гемоглобина. г'
Меди сульфат назначают при ее дефиците, наблюдаемом у плохо питающихся детей раннего вдзраста. Медь способствует всасыванию железа в кишечнике и включению железа в гемоглобин. Она — составная часть гемо-стимулина.
Кобальт способствует усвоению железа, стимулирует синтез гемоглобина, нормализует эритропоэз. Применяют в виде коамида при лечении гипохромных, гипопластических, сидеробластных анемий.
Препараты эритропоэтина
Эритропоэтин — гликопротеин, синтезируемый специальными клетками в почках. Он влияет на эритроидную колониеформирующую единицу (ЭКФЕ) костного мозга. В норме он вместе с интерлейкинами 1, 3, 4 и гранулоцитарно-макрофагальным колониестимулирующим фактором (см. ниже) стимулирует дифференцировку прогениторных клеток для ЭКФЕ. Высокие концентрации эритропоэтина могут прямо влиять на нормобласты и способствовать раннему выходу ретикулоцитов в кровь.
В качестве лекарственных средств применяют препараты рекомбинантного человеческого эритропоэтина: эпрекс (эпоэтин альфа) и рекормон.
Эти препараты назначают в основном при анемиях, связанных с хроническими заболеваниями почек, когда в организме отмечают дефицит эритропоэтина, и к тому же уремические токсины (полиамины) тормозят костный мозг и его реакцию на эритропоэтин.
Оба препарата вводят внутривенно или предпочтительнее под кожу 3 раза в неделю.
После начала введения у больного вскоре увеличивается содержание гемоглобина в крови и гематокрит. Когда гематокрит достигает 30%, дозу препарата надо снизить. Вместе с препаратами эритропоэтина надо назначать препараты железа, иначе возникает его недостаток из-за быстрого расходования на синтез гемоглобина вновь образующихся эритроцитов, и эффективность эритропоэтина резко снизится.. Для увеличения терапевтического эффекта эритропоэтин рекомендуют назначать одновременно не только с препаратами железа, но и с фолиевой кислотой, пиридоксином и цианокобаламином.
238
Эффект эритропоэтина после отмены препарата недели через три исчезает, если не ликвидирована хроническая почечная недостаточность.
II. Средства, стимулирующие лейкопоэз
Можно различать стимуляторы лейкопоэза, применяемые при легких и тяжелых формах лейкопоэза.
При легких формах лейкопений применяют производные пиримидина — метилурацил (метацин) и пентоксид. Оба препарата стимулируют синтез нуклеиновых кислот, белков, деление клеток, лейкопоэз, регенерацию тканей (у больных с ожогами, переломами костей, длительно не заживающими ранами, язвами желудка и двенадцатиперстной кишки), повышают неспецифическую и специфическую резистентность организма к инфекции (но во время инфекции их нельзя применять, так как они могут быть утилизированы микроорганизмами, что будет способствовать их делению и дальнейшему развитию инфекционного заболевания).
Прием этих препаратов может сопровождаться возникновением аллергических реакций в виде сыпей, головными болями, головокружением.
При более тяжелых формах лейкопений, возникающих, например, при лечении больных цитостатиками и лучевой терапией, применяют синтетический препарат лейкоген и рекомбинантные или очищенные человеческие колониестимулирующие факторы.
Лейкоген — производное тиазолидин-декарбоновой кислоты. Он стимулирует лейкопоэз при тяжелых его нарушениях, при агранулоцитозе, возникшем по разным причинам.
Препарат противопоказан при лимфогранулематозе и лейкозах.
Колониестимулирующие факторы
Граноцит (ленограстим) — рекомбинантный человеческий гранулоцитарный колониестимулирующий фактор, участвующий в продукции гранулоцитов, макрофагов, мегакариоцитов. Он индуцирует освобождение гранулоцитов из костного мозга, повышая их число в периферической крови, активирует фагоцитоз и цитотоксичность зрелых гранулоцитов.
Граноцит устраняет миелосупрессию у больных, получающих цитостатики, укорачивает длительность лейкопении. В результате у больного повышается неспецифическая резистентность, реже возникают (или не возникают совсем) вторичные инфекции.
Начинают его вводить на следующий день после окончания курса химиотерапии, до нее и во время этой терапии граноцит назначать нельзя. Вводят его подкожно или внутривенно 1 раз в сутки, продолжительность терапии до 28 дней. Необходим контроль числа лейкоцитов в крови.
Нежелательные эффекты: лейкоцитоз, тромбоцитопения, иногда боли в мышцах и костях, боли на месте инфекции.
Лейпоген (филграстим) гранулоцитарный колониестимулирующий фактор человека. Высокоочищенный препарат. По механизму действия, показаниям к применению и нежелательным эффектам очень похож на граноцит. Его не рекомендуют при тяжелых заболеваниях почек и печени.
Лейкомакс (молграмостим) — рекомбинантный человеческий гранулоцитарно-макрофагальный колониестимулирующий фактор. Он увеличивает образование колоний и пролиферацию гранулоцитов, моноцитов, макрофагов. Он
239
стимулирует фагоцитарную и цитотоксическую функцию зрелых гранулоцитов в отношении бактерий и клеток злокачественных опухолей.
Применяют его при различных нейтропениях, апластической анемии, пересадке костного мозга, лейкопениях, связанных с инфекцией (в частности со СПИДом).
Вводят лейкомакс под кожу или внутривенно, начиная через 24 ч после окончания курса химиотерапии. Дозы и режим применения зависят от характера заболевания.
Препарат вызывает большое число различных нежелательных эффектов: нарушения функции желудочно-кишечного тракта (тошнота, рвота, анорексия, диарея, боли в животе), судороги, миалгия, головные боли, головокружения, парезы, спутанность сознания из-за повышения внутричерепного давления, нарушений мозгового кровообращения. Могут быть осложнения в функции сердечно-сосудистой системы: артериальная гипотензия, сердечная аритмия, сердечная недостаточность, отек легких, повышение капиллярной проницаемости, отеки, экссудативный перикардит. Могут быть аллергические реакции в виде сыпей, зуда. г
Дозы и режим применения стимуляторов кроветворения даны в табл. 46.
Стимуляторы кроветворения
Таблица 46
Препарат Форма выпуска Содержание элементарного железа Путь введения Число введений в сутки Дозы
Железа закисного сульфат Ferrosi sulfas Порошок в желатиновых капсулах по 0,5 г в 1 г препарата 100 мг Внутрь 3 Детям до 3 лет 5—8 мг/кг в сутки; старше 3 лет 5 мг/кг в сутки
Железа лактат Ferri lactas Порошок в желатиновых капсулах по 0,1-1,0 г в 1 г. препарата 190 мг То же 3 То же
Гемостимулин Haemostimulinum Таблетки, содержащие 0,123 г крови сухой пищевой, 0,246 г железа лактата, 0,005 г меди сульфата в 1 таблетке 25 мг « 3 «
Ферроплекс Ferroplex Драже, содержащие 0,05 г железа сульфата, 0,03 г кислоты аскорбиновой в 1 драже 10 мг « 3 «
Феррокаль Ferrocalum Таблетки, содержащие 0,2 г железа сульфата, 0,1 г кальция фруктозодифосфата, 0,02 г церебролецитина в 1 таблетке 40 мг « 3 По 2-4 таблетки на прием
240
Окончание табл. 46
Препарат Форма выпуска Содержание элементарного железа Путь введения Число введений в сутки Дозы
Сироп алоэ с железом Sirupus Aloes cum ferro Флаконы по 100 мл. Состав: 135 г 20% раствора хлорида закислого железа; 15 г кислоты хлористоводородной разведенной, 4 г лимонной кислоты и до 1000 г сока алоэ древовидного В 1 чайной ложке — 2 мг Внутрь 3 По 0,5—1 чайной ложке в 1/4 стакана воды
Фербитол Feitiitolum Флаконы по 2 мл В 1 мл 50 мг Внутримышечно 1 До 2 лет — по 25-50 мг; старше 2 лет — по 50-100 мг ежедневно. На курс 7-15 инъекций
Лейкоген Leucogenum Порошок, таблетки по 0,02 г Внутрь 3-4 До 6 мес — 0,01 г/сут; 6 мес — 1 год - 0,02 г/сут; 1-7 лет — 0,04 г/сут; 7 лёт — 0,06 г/сут
Граноцит Granocyte Сухое вещество во флаконах по 13,4 млн ЕД Растворитель — 1 мл в ампуле Подкожно Внутривенно 1 19,2 млн ЕД/м2 в сутки
Лейпоген Leupogen Раствор для инъекций — 300 мкг (30 млн ЕД) в 1 мл Подкожно 1 5-10 мкг/кг в сутки
Эпрекс Eprex Раствор, содержащий 10 000 ЕД в 1 мл Подкожно Внутривенно 3 раза в неделю 50 ЁД/кг (начальная доза)
Раздел IV ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ПРИМЕНЯЕМЫЕ ПРИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЯХ
Глава 30 ПРОТИВОЛЕЙКОЗНЫЕ И ПРОТИВООПУХОЛЕВЫЕ ПРЕПАРАТЫ
В терапии злокачественных новообразований используют вещества синтетического и природного происхождения, преимущественно действующие на опухолевый процесс и сравнительно мало влияющие на нормальные ткани организма.
К числу наиболее часто встеча^щихся новообразований у детей относятся лейкозы (они составляют 27—33% -всех онкологических заболеваний), опухоли центральной нервной системы (18%), лимфогранулематоз (7%), опухоли почек (нефробластома, опухоль Вильмса), опухоли мягких тканей, нейрогенные опухоли (нейробластомы), опухоли глаз (ретинобластома), тератобластомы, гистиоцитоз X.
Классификация противоопухолевых препаратов
1. Алкилирующие средства:
а) производные хлорэтиламина: эмбихин, новэмбихин, хлорбутил (лейкеран), циклофосфан, допан, сарколизин, мелфалан, ифосфамид, миелобромол, дег-ранол, лофенал;
б) производные этиленимина: тиофосфамид, фторбензотэф, имифос, фотрин;
в) производные дисульфоновых кислот: миелосан, миелобромол;
г) производные нитрозомочевины: нитрозометилмочевина, стрептозотоцин, ломустин, кармустин;
д) препараты разного химического строения: прокарбазин, декарбазин, про-спидин.
2. Антиметаболиты:
а) антагонисты фолиевой кислоты: метотрексат (аметоптерин);
б) антагонисты пуринов: меркаптопурин, тиогуанин;
в) производные пиримидинов: цитарабин (цитозар), фторафур, фторурацил, 5-азацитидин.
3. Комплексные соединения платины: цисплатин, карбоплатин.
4. Антибиотики: рубомицин (дауномицин), карминомицин, доксорубицин, оливомицин, брунеомицин, блеомицин.
5. Препараты растительного происхождения: розевин (винбластин), винк-ристин (онковин), колхамин, подофиллин, этопозид.
6. Ферментные препараты: L-аспарагиназа (краснитин, лейкеназа).
7. Гормональные препараты и ингибиторы образования гормонов: преднизолон, тамоксифен, медростерон, ципротерон, аминоглютетимид, хлодитан.
8. Разные синтетические препараты: дибунол, гексаметилмеламин, гидроксимочевина, цитембена, спиробромин.
242
Различают циклоспецифические препараты (антагонисты фолиевой кислоты, пурина, блеомицин, этопазид, винкристин, винбластин), влияющие на клетки, проходящие клеточный цикл (G1 -> S -> G2 -> М), и циклонеспецифические, нарушающие структуру клеток, находящихся в любом периоде цикла деления (алкилирующие соединения, комплексные препараты платины, большинство противоопухолевых антибиотиков, 1-аспарагиназа).
Цитотоксическая терапия основывается на принципе синхронизации накопления основной массы опухолевых клеток в одной из митотических фаз. Это происходит под влиянием противоопухолевых циклоспецифических средств — синхронизаторов. Вслед за этим применяют другие циклоспецифические или1 циклонеспецифические препараты — экзекуторы, уничтожающие большинство этих клеток.
Существуют разные схемы комбинированного применения противоопухолевых средств. Например, АБВС — адриамицин, блеомицин, винбластин, дакар-базин, схема ЦМФ — циклофосфан, метотрексат, фторурацил, ВАМП — винкристин, аметоптерин, меркаптопурин, преднизолон и др. Таких схем очень много, более 80.
Комбинация средств с разным механизмом действия усиливает их терапевтический эффект.
Идеальное терапевтическое средство должно уничтожать злокачественные клетки, не повреждая нормальные ткани. Пока таких средств не существует. Все противоопухолевые средства вызывают* нежелательные эффекты, преимущественно связанные с нарушением деления или функции клеток нормальных тканей. Наиболее частыми осложнениями являются нарушения функции желудочно-кишечного тракта, угнетение кроветворения, поражения печени, почек, сердца, нейротоксические явления, алопеция, повышение температуры тела, инфекция, аллергические реакции. Эти нежелательные эффекты могут быть разной степени, иногда очень тяжелые, требующие прекращения введения противоопухолевого препарата.
Дети раннего возраста хуже старших детей и взрослых переносят химиотерапию. У них нередко ухудшается общее состояние, нарастает интоксикация, появляются срыгивания, рвота, быстро развивается лейкопения. Поэтому им назначают не больше двух цитостатиков в д^нь, короткими курсами (3-4 дня). В этом возрасте предпочитают применять циклофосфан, адриамицин, винкристин и их различные комбинации.
АЛКИЛИРУЮЩИЕ СРЕДСТВА
Препараты этой группы присоединяются ко многим эндогенным веществам путем алкилирования, то есть замены атома водорода на алкильную группу СН2, чаще всего с гуаниновым остатком цепи ДНК, тормозя этим ее синтез или удвоение. Кроме того, они химически реагируют с различными функциональными группами (гидроксильными, карбоксильными, сульфгидрильными и пр.) нуклеиновых кислот, аминокислот, пептидов и др. Нарушается активность ферментов, участвующих в окислительном фосфорилировании, снижаются энергообеспеденность синтетических процессов, митотическое деление и жизнедеятельность клеток. Высокой чувствительностью к алкилирующим соединениям обладаю,т быстропролиферирующие клетки опухолевых и некоторых
243
нормальных тканей (кроветворные элементы, слизистая оболочка кишечника, семенники).
Эмбихин, новэмбихин используют (внутривенно) у детей в комплексном лечении лимфогранулематоза, опухолей глаз. Хлорбутин (лейкеран) назначают внутрь при лимфогранулематозе, опухолях яичников. Эти препараты токсичны. В дозах близких к лечебным, они могут вызывать угнетение кроветворения в костном мозге, нарушать функцию желудочно-кишечного тракта.
СН2 - СН2С1
Н3С- СНС1 - СН2 - N Z
Х СН2 - СН2С1
Рис. 27. Новэмбихин
О
II
но- с - сн2 - сн2 - сн2
СН2 - СН2С1
N\
СН2 - СН2С1
Рис. 28. Хлорбутин
Эмбихин, новэмбихин при попадании на кожу и слизистые оболочки оказывают раздражающее и нарывное действие; при попадании под кожу вызывают некроз тканей (рис. 27, 28). Эмбихин очень токсичен, поэтому у детей его применяют крайне редко.
Циклофосфан высокоэффективен у детей раннего возраста, он обладает широким противоопухолевым спектром действия и применяется при остром лимфобластозном лейкозе, хроническом лейколейкозе, опухолях почек, костей, нейробластоме, ретинобластоме, тератобластоме и др. При остром лейкозе у старших детей и взрослых циклофосфан часто назначают в сочетании с метотрексатом (аметоптерин), меркаптопурином, преднизолоном (комбинация ЦАМП). Сам циклофосфан неактивен, но при проникновении в клетки быстро разлагается под влиянием фосфатаз с освобождением активного метаболита. Препарат может быть назначен внутрь, внутримышечно, внутривенно и в полости. В отличие от других производных хлорэтиламина он не оказывает местнораздражающего действия, слабее угнетает тромбоцитопоэз. Все же при его назначении могут отмечаться лейкопения, анемия, рвота, выпадение волос,
головокружение, ухудшение зрения, гематурия, повышение температуры тела.
Циклофосфан обладает кумулятивными свойствами, поэтому уменьшение ко-
личества лейкоцитов может продолжаться в течение 2-3 недель после отмены
препарата (рис. 29).
/СН2 - СН2С1
Рис. 29. Циклофосфан
CH2z- СН2С1
• Н2О
244
Циклофосфан и хлорбутин используют при лечении системных заболеваний соединительной ткани (красная волчанка и пр.), а также для профилактики отторжения пересаженных тканей (в комбинации с другими иммунодепрессантами).
Производные нитрозомочевины. Ломустин и кармустин легко проникают через гематоэнцефалический барьер в мозг и являются одними из основных средств лечения первичных опухолей центральной нервной системы и метастазов в мозг некоторых солидных опухолей (рака молочной железы, легкого, меланомы). Их обычно сочетают с другими препаратами, проникающими в мозг.
Прием внутрь этих препаратов может вызвать диспепсические расстройства, миелосупрессию, нередко возникающую через 4-6 нед. После начала приема препаратов иногда отмечают токсический гепатит и пр. Оба препарата могут вызвать боль по ходу вены, флебиты; при его попадании в окружающие вену ткани возникает их некроз.
Прокарбазин. Прокарбазин назначают внутрь или ректально. В печени и почках из него образуются метаболиты, некоторые из них являются ингибиторами МАО, поэтому на фоне препарата могут усиливаться эффекты симпа-томиметиков, антидепрессантов. В основном его применяют при лимфогранулематозе, назначают при гистиоцитозе X, некоторых опухолях головного мозга и легких.
Помимо типичных для противоопухолевых препаратов нежелательных эффектов он иногда вызывает неврологические нарушения (головную боль, сонливость, периферическую нейропатию).
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ ПЛАТИНЫ
Цисплатин и карбоплатин действуют подобно алкилирующим средствам, ингибируя синтез ДНК путем образования межцепочечных и внутри-цепочечных связей. Эти комплексные соединения образуют ковалентные связи с гуанином, аденозином и цитозином.
Оба препарата вводят внутривенно, цисплатин при раке мочевого пузыря еще и внутрипузырно, его же можно вводив и внутриартериально. Цисплатин назначают при лечении злокачественных опухолей яичка и яичников, рака мочевого пузыря, предстательной железы, матки, мелкоочагового рака легких, меланомы кожи и пр.
Введение цисплатина сопровождается нефротоксичностью, нарушением функции дистальных канальцев и собирательных трубочек. В 100% случаев он вызывает тошноту и рвоту; угнетает все ростки кроветворения; ототоксический эффект — результат необратимого поражения VIII пары черепно-мозговых нервов. У детей особенно высока возможность ототоксического эффекта, приводящего к глухоте, а в возрасте до 2 лет — к глухонемоте.
Карбоплатин назначают по тем же показаниям. Он отличается от цисто-платина меньшей нефротоксичностью и значительно меньшей ототоксичностью, но он может вызвать нейротоксичность (периферическую нейропатию, снижение сухожильных рефлексов).
245
АНТИМЕТАБОЛИТЫ
Соединения этой группы представлены структурными аналогами естественных метаболитов: фолиевой кислоты, пуриновых и пиримидиновых оснований.
Метотрексат — структурный аналог и антагонист фолиевой кислоты. Он тормозит активность дигидрофолатредуктазы и этим нарушает превращение фолиевой кислоты в тетрагидрофолиевую (рис. 30), необходимую для транспорта одноуглеродных остатков, утилизируемых для синтеза тимидилата и пуриновых нуклеотидов, а также аминокислот (серина, метионина). Метотрексат подавляет митоз и рост быстро делящихся клеток. У детей метотрексат применяют для лечения острых лейкозов и (интратекально) опухолей центральной нервной системы; у женщин — при хорионэпителиоме матки, интратекально.
Меркаптопурин по строению близок к аденину (6-аминопурину) и гипоксантину (6-оксипурину). Он «вмешивается» в пуриновый обмен и нарушает синтез нуклеиновых кислот (рис. 31).
Рис. 30. Метотрексат
nh - сн - с;
он о
сн2
сн2-с
он
Рис. 31. Меркаптопурин
Препарат эффективен у детей, страдающих острым лейкозом. Кроме того, его используют при хорионэпителиоме матки и ретикулезах. Препарат назначают внутрь, обычно вместе с аллопуринолом (ингибитором ксантиноксидазы), чтобы уменьшить превращение его в неактивный метаболит — 6-сульфомочевую кислоту и затем в мочевую кислоту и этим предотвратить образование конкрементов в мочевыводящих путях и возникновение острой подагры.
Метотрексат и меркаптопурин, помимо противоопухолевого действия, обладают иммунодепрессивным эффектом.
Цитарабин — антагонист пиримидина. В организме он превращается в цитидин трифосфат, ингибирующий ДНК-полимеразу и этим угнетающий синтез ДНК. Цитарабин наиболее эффективен при лечении острых лейкозов,
246
обострении хронических лейкозов, лимфогранулематоза. Вводят его внутривенно. Цитарабин нередко применяют в комбинации с винкристином, цикло-фосфаном и адримицином.
Антиметаболиты обладают высокой токсичностью. При их применении возможны длительные диспептические расстройства (тошнота, рвота, понос, анорексия), стоматиты, поражение печени, лейкопения, тромбоцитопения. Чаше эти осложнения наблюдаются при использовании метотрексата. Этот препарат также может вызывать язвенные стоматиты с кровотечением, поражение почек, выпадение волос, кровоточивость. Метотрексат опасно сочетать с НПВС, вытесняющими его из связи с белками плазмы крови и повышающими его токсичность, а также с антикоагулянтами и препаратами, нарушающими кроветворение (сульфаниламидами и др.). При повторных курсах к антиметаболитам развивается устойчивость.
АНТИБИОТИКИ
Противоопухолевые антибиотки состоят из циклических групп, соединенных с пептидами (дактиномицин) или с углеводами (адриамицин). Циклические группы этих антибиотиков встраиваются между соседними парами специфических оснований ДНК или РНК (или обеих), вызывая разделение цепочек нуклеиновых кислот и этим блокируя синтез новых ДНК; в результате нарушается репликация клетки.
Из этих средств наиболее часто используют дактиномицин, адриамицин, карминомицин и рубомицин.
Дактиномицин наиболее эффективен при лечении опухоли почек (опухоль Вильмса). Но его с успехом применяют и при лечении сарокомы Юинга, опухолей яичек и яичников, рабдомиосаркомы. Вводят его внутривенно, не допуская попадания в окружающие ткани, так как возникает их некроз. Дактиномицин нередко комбинируют с другими цитостатиками или лучевой терапией, что увеличивает терапевтический и, к сожалению, токсические его эффекты. Лечение дактиномицином должна проводиться под контролем функции печени, почек, содержания лейкоцитов и тромбоцитов в крови. Осложнения после введения препарата обычно"7 обратимы и исчезают после его отмены.
Адриамицин — одно из наиболее часто используемых противоопухолевых средств, назначаемых в различных схемах лечения опухолей у детей и взрослых. Адриамицин применяют при лечении опухоли Вильмса, нейробластомы, саркомы мягких тканей, остеосаркомы, острых лейкозов, тератобластомы и др. Вводят его внутривенно, внутриартериально, внутрипузырно. Его назначение может привести к угнетению кроветворения (лейкопении, тромбоцитопении, анемии). Он обладает кардиотоксичностью, вызывая острую, подострую и хроническую кардиопатии. Последняя начинается с болей в сердце, аритмии, затем развивается сердечная недостаточность, может быть инфаркт миокарда, фиброз мышцы сердца. Поэтому его надо назначать вместе с кардиопротектором — кардиоксаном (см. ниже).
Карминомицин эффективен у детей при лечении нефробластомы, рабдомиосаркомы, симпатобластомы и др. Вводят его внутривенно. Карминомицин может вызвать тошйоту, рвоту, лейко- и тромбоцитопению, при попадании
247
под кожу возможен некроз тканей. Кардиотоксический эффект выявляется редко.
Блеомицин — циклоспецифический цитостатик (способный накопить опухолевые клетки в периоде S? клеточного цикла). Применяют его при плоскоклеточном раке кожи, раке полового члена, тератоидных опухолях яичек и яичников, саркоме Юинга. Используют в полихимиотерапии неходжкинских лимфом и рецидивах лимфогранулематоза.
Из его нежелательных эффектов следует отметить: повышение температуры тела, длящееся иногда несколько часов, алопецию, гиперпигментацию кожи, гиперкератоз ладоней, деформацию ногтей. Наиболее опасны, встречающиеся у 1-5% больных, пульмониты и фиброз легких, преимущественно при получении высоких доз препарата (выше 200 мг/м2) или облучении в области легких.
ПРЕПАРАТЫ РАСТИТЕЛЬНОГО ПРОИСХОЖДЕНИЯ
Розевин (винбластин) и винкристин — циклоспецифические цитостатики — содержащиеся в барвинке розовом {Vinca rosea), блокируют митоз клеток на стадии метафазы. Несмотря на весьма незначительные отличия в химической структуре этих веществ, спектр их противоопухолевого действия и токсические эффекты существенно различаются.
Розевин в основном применяют при лимфогранулематозе, ретикулосаркоме, ретинобластоме, гистоциозе X, а также при хорионэпителеоме.
Винкристин эффективно применяют при острых лейкозах, опухоли Вильмса, опухолях мягких тканей, нейробластоме и тератобластомах у детей. Оба препарата используют в качестве синхронизаторов (см. ниже) в различных схемах полихимиотерапии. Препараты вводят внутривенно. При попадании раствора под кожу возникает раздражение тканей.
Нежелательные эффекты препаратов обратимы. Розевин вызывает лейкопению, тромбоцитопению. Его токсическое действие выражено значительно меньше, чем у других препаратов, что позволяет применять препарат длительно и использовать в комбинации с другими противоопухолевыми средствами. Розевин может вызвать тошноту, рвоту, боли в животе, выпадение волос. При введении винкристина наибольшую опасность представляют нервномышечные расстройства (снижение сухожильных эффектов, невриты, мышечная атрофия). Кроме того, препарат может вызвать запоры, лихорадку, выпадение волос. Тромбоцитопения и лейкопения бывают реже, чем при использовании препаратов других групп.
ФЕРМЕНТНЫЕ ПРЕПАРАТЫ
Аспарагиназа — препарат, полученный из кишечной палочки {E.colt), инактивирует аспарагиновую кислоту, которая необходима для деления неопластических клеток, получающих ее из крови, но не способных ее синтезировать. L-аспарагиназа, создавая дефицит аспарагина, нарушает функцию клеточных мембран опухолевых клеток, их метаболизм и деление. У детей L-ac-парагиназу используют главным образом при остром лимфобластном лейкозе, а также при лимфо- и ретикулосаркоме.
248
L-аспарагиназа может быть эффективной при резистентности к другим цитостатикам.
Вводят ее внутривенно (медленно). Применение препарата может сопровождаться повышением температуры тела, тошнотой, рвотой, потерей аппетита, аллергическими реакциями, нарушением функции печени, почек, поджелудочной железы, неврологическими расстройствами, уменьшением содержания в крови фибриногена и склонностью к геморрагиям.
При лечении L-аспарагиназой рекомендуется еженедельно контролировать содержание в крови холестерина, общего белка, белковых фракций, трансми-назы, показатели свертывающей системы крови и др. Неблагоприятные реакции при лечении L-аспарагиназой непостоянны и в основном обратимы.
ГОРМОНАЛЬНЫЕ И АНТИГОРМОНАЛЬНЫЕ ПРЕПАРАТЫ
В химиотерапий злокачественных заболеваний крови и кроветворных органов в комплексе с цитостатическими препаратами применяют кортикостероиды (преднизолон, преднизон и др.). Препараты, близкие к андрогенам (медротестерон, пролотестонХ и конкурентные антагонисты эстрогенов (тамоксифен) используют главным образом при раке молочной железы; препараты с эстрогенной активностью (фосфэстрол, хлортриани-з е н) — при раке предстательной железы. В механизме действия этих средств наибольшее значение имеют принцип обратной связи, подавление секреции собственных половых гормонов, активирующих гормонозависимые ткани и опухоли. Ингибитор функции коры надпочечников — хлодитан — используют при гормонально-активных опухолях коры надпочечников.
ДРУГИЕ ПРОТИВОЛЕЙКОЗНЫЕ И ПРОТИВООПУХОЛЕВЫЕ СРЕДСТВА
Проспидин эффективен у детей при опухолях половых органов, глаз, папилломатозе верхних дыхательных путей,, раке кожи и др. (рис. 32).
Рис. 32. Проспидин
Его используют внутривенно, внутримышечно или местно в виде мази. Проспидин хорошо переносится, не угнетает кроветворения. Все же при его назначении могут быть парестезии (онемение кожи лица, языка, пальцев рук), понижение артериального давления, нарушение функции почек.
249
Прокарбазин назначают при лечении лимфогранулематоза и меланомы в случаях, когда другие химиотерапевтические средства оказались неэффективны. В организме из прокарбазина образуется метилуглеродистый ион-диазоме-тан, обладающий алкилирующими свойствами, и активный метаболит (амино-имидазол-карбоксамид). Оба вызывают противоопухолевый эффект.
Используют его самостоятельно или в комбинации с винкристином, преднизолоном. Прокарбазин вводят только внутривенно. Он может вызвать тошноту, рвоту, стоматиты, угнетение гемопоэза, тромбоцитопоэза. Реже отмечают неврологические расстройства: миалгии, артралгии и другие нежелательные эффекты.
Помимо перечисленных препаратов, в детской онкологической практике применяют другие противоопухолевые средства: допан, хлорбутин, сарколизин, дегранол, оливомицин и др. У большинства больных, получающих противоопухолевые препараты, трудно предсказать эффективность лечения тем или иным средством. Главная задача — подобрать комбинацию препаратов, наиболее эффективных у данного больного. Критерием излеченное™ у детей может служить двухлетний период без рецидивов и метастазов.
ЛЕКАРСТВЕННЫЕ СРЕДСТВА, СПОСОБСТВУЮЩИЕ ПЕРЕНОСИМОСТИ ПРОТИВООПУХОЛЕВЫХ СРЕДСТВ
Эти препараты назначают вместе с цитостатиками или после курса лечения ими.
1. Противорвотные средства.
Наиболее эффективны — трописетрон (новобан), ондансетрон (зоф.ран), гранисетрон (китрил) — блокаторы периферических (в пищеварительном тракте) и центральных (в стволе мозга) серотониновых рецепторов (см. гл. 26). Трописетрон вводят внутривенно или принимают внутрь за 1 ч до завтрака 1 раз в сут. Китрил и зофран назначают либо один раз в сутки внутривенно, либо 2 раза в день внутрь (тоже за 1 ч до еды).
Метоклопрамид (церукал, реглан) (см. гл. 26) — угнетает триггерную зону продолговатого мозга. Назначают его внутрь после еды, в тяжелых случаях внутримышечно или внутривенно.
2. Гастропротекторы (см. гл. 26).
Карбеноксолон (биогастрон) — глицирритиновая кислота из солодкового корня, обладающая минералокортикоидной и противовоспалительной активностью. Препарат улучшает кровоснабжение слизистой оболочки, уменьшает освобождение лизосомальных ферментов (протеаз, скорость эксфолиации эпителиальных клеток, сохраняя образование муцина и бикарбонатов, блокирующих ион водорода. Назначают его за 30 мин до еды.
Дуогастрон — специальная форма карбеноксолона — в виде капсул, растворяющихся в двенадцатиперстной кишке. Этот препарат используют для профилактики или устранения эрозий и язв в этой кишке.
Сукральфат — алюминиевая соль сульфированных полисахаридов. Формирует защитный барьер из полимеризующегося в кислой среде препа-250
рата. Этот барьер защищает слизистую оболочку от соляной кислоты и пепсина.
3. Стимуляторы аппетита.
Ци пр'оге птадин (перитол) — (см. гл. 26) — активирует структуры гипоталамуса, регулирующие аппетит. Назначают его за 1 час до еды.
4. Гепатопротекторы.
Силимарин (легален) — смесь флавоноидов, обладающих антиоксидантными свойствами, связывающих свободные радикалы, прекращая этим перекисное окисление липидов, т. е. сохраняя целостность клеточных мембран и функцию гепатоцитов. К тому же он стимулирует биосинтез структурных и функциональных белков, фосфолипидов, ускоряет регенерацию тканей. Назначают его внутрь 2—3 раза в сутки.
Л и в - 5 2 — комплексный препарат из отваров тысячелистника, цикория, кассеи восточной, черного паслена и других растений. Он защищает печень, повышает аппетит, улучшает пищеварение.
5. Гемостимуляторы.
Эпоэтин-альфа — рекомбинантный эритропоэтин человека (см. гл. 29).
Фолиниевая кислота (кальция фолинат, лейковорин) — активный метаболит фолиевой кислоты, переносчик одноуглеродных остатков (см. гл. 29). Назначают ее для профилактики осложнений от приема метотрексата в виде инъекций через 6—18 ч после его инфузии.
6. Стимуляторы лейкопоэза.
Граноцит (ленограстим), нейпоген (филграстим), лейкомакс (молграмостим) — рекомбинантные колониестимулирующие факторы человека. Они усиливают образование колоний и пролиферизацию гранулоцитов, моноцитов и макрофагов (см. гл. 29). Их назначают подкожно или внутривенно через сутки после окончания курса химиотерапии. Препараты могут вызвать нежелательные эффекты, особенно их много у лейко-макса.
7. Уропротекторы.
Месна (урометитексан) — связывает акролеин-метаболит хлорэтила-мидов (циклофосфана, изофосфамида), раздражающий слизистую оболочку мочевого пузыря. Месна взаимодействует § акролеином, образуя стабильный тиоэфир. Вводят препарат внутривенно струйно медленно или капельно, иногда внутрь, если нет тошноты и рвоты. Можно вводить в одном шприце с цик-лофосфаном или изофосфамидом. Разовая доза месны должна составлять 20% или больше от разовой дозы цитостатика.
8. Кардиопротектор.
Кардиоксан (дексразоксан) похож на этилендиаминтетраацетат (ЭДТА). В миокарде из него образуется метаболит, связывающий железо и препятствующий образованию радикалов кислорода. Кроме того, этот метаболит образует комплексы с антрациклиновыми антибиотиками (адриамицином, ру-бомицином и др.), защищая этим кардиомиоциты от их токсического воздействия. Назначают кардиоксан внутривенно капельно за 45—60 мин до первой дозы антрациклинового антибиотика. Доза препарата должна в 10-20 раз превышать дозу цитостатика. ।
Дозы и режим применения противоопухолевых и противолейкозных средств даны в табл. 47.
251
Таблица 47
Противоопухолевые и противолейкозвые средства
Препарат Лекарствеаная форма Путь введения Растворитель Число введений Продолжительность курса Суточная доза
Циклофосфан Cyclophosphanum Ампулы по 0,2 г Таблетки по 0,05 г Внутривенно Внутрь после еды Стерильная вода 10 мл 1 раз в 7 дней Ежедневно 3 нед 15 мг/кг 2,5-3 мг/кг
Карминомицин Carminomycinum Флаконы по 0,005 г Внутривенно Стерильный изотонический раствор натрия хлорида 10 мл Ежедневно 3 дня 0,15-0,2 мг/кг
Дактиномицин Dactinomycinum 0,05% раствор в ампулах по 1 мл То же Ежедневно 3 дня 0,015 мг/кг
Адриамицин Adriamycinum Флаконы по 0,01 г « Стерильная вода 5 мл 2 раза в 7 дней 2 нед 0,4-0,8 мг/кг
Винкристин Vincristinum Флаконы по 0,0005 г « Прилагаемый растворитель 10 мл 1 раз в 7 дней 3-4 • нед 0,05-0,15 мг/кг
Раздел V ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ВЛИЯЮЩИЕ НА ОБМЕН ВЕЩЕСТВ
Глава 31 ГОРМОНАЛЬНЫЕ ПРЕПАРАТЫ
Эндокринная и нервная системы регулируют все функции организма, поддерживая его гомеостаз. Кроме того, они ответственны за процессы дифференциации клеток и тканей, роста и созревания организма, а также за процессы сохранения вида (воспроизводство) и старения. Взаимосвязь нервной и эндокринной систем осуществляется преимущественно на уровне гипоталамуса. Нейросекреторные клетки гипоталамуса имеют на своей поверхности рецепторы, чувствительные к нейромедиаторам (ацетилхолину, катехоламинам, ГАМК, гистамину и пр.). Нейромедиаторы, возбуждая свои рецепторы, приводят к освобождению гипоталамических нейропептидов (либеринов и статинов), регулирующих освобождение тропных гормонов из передней доли гипофиза. В свою очередь, тропные гормоны регулируют секрецию гормонов периферическими эндокринными железами. Увеличение или уменьшение концентрации гормонов эндокринных желез в крови по принципу обратной связи влияют на секрецию тропных гормонов. Функция желез, секретирующих гормоны, поддерживающих постоянство водно-солевого и углеводного обмена — минералокортикоиды, кальцитонин и паратгормон, инсулин, глюкагон — регулируется изменением водно-электролитного состава и уровнем глюкозы крови, а не тропными гормонами.
Гормоны и соответствующие им гормонопрепараты делят на 4 группы в зависимости от химической структуры.
1. Пептидные гормонопрепараты:
а) олигопептиды — вазопрессин, окситоцин, тиреолиберин, гонадолиберин, соматостатин, кортикотропинлиберин;
б) белки — инсулин, глюкагон, соматотропин, пролактин, паратгормон, кальцитонин, адренокортикотропин;
в) гликопротеины — фолликулостимулирующий гонадотропин, лютеинези-рующий гонадотропин, тиреотропный гормон.
2. Производные аминокислоты: адреналин, тироксин, трийодтиронин.
3. Стероиды: эстрогены, прогестерон, тестостерон, глюкокортикоиды, альдостерон.
4. Производные циклических полиненасыщенных жирных кислот — простагландины.
Взаимодействие гормона с клетками тканей и органов-мишеней осуществляется с помощью специфических рецепторов. Пептидные гормоны, простагландины и адреналин связываются с рецепторами, локализованными на поверхности клеточных мембран. Количество и сродство этих рецепторов к гормону значительно варьируют при многих состояниях, в частности, уменьшаются при повышении концентрации соответствующего гормона (защитный механизм против чрезмерной стимуляции клеток-мишеней). После связывания пептидного гормона с мембранным рецептором происходит изменение активности аденилатциклазы или системы фосфатидилинозитолов (см. стр. 19). В результате
253
возникает каскад внутриклеточных реакций — активирование или ингибирование ферментов, изменение проницаемости мембран, экспрессия генов, а также синтез РНК, ДНК, белков. Стероидные гормоны свободно проходят через клеточную мембрану, образуют комплекс с растворимыми цитоплазматическими рецепторами и проходят в ядро клетки, где взаимодействуют с ядерным акцептором. В результате происходит экспрессия генов и синтез соответствующих (гормону) белков. Стероидные гормоны могут проявлять свое действие и посредством взаимодействия с рецепторами на. поверхности клетки, изменяя активность аденилатциклазы (быстрые эффекты). Для гормонов щитовидной железы специфические рецепторы расположены непосредственно в ядре клетки, затем идет процесс аналогично стероидным гормонам.
Гормональные препараты получают из желез животных и человека, а также синтетическим путем. Используют гормонопрепараты преимущественно для возмещения недостатка гормона в организме, но кроме того для получения фармакодинамических эффектов, направленных на лечение неэндокринных заболеваний (как правило, в больших дозах) и для подавления гиперфункции соответствующих желез.
ПРЕПАРАТЫ ПЕРЕДНЕЙ ДОЛИ ГИПОФИЗА
Кортикотропин (КТ) получают из гипофиза свиней. Добавлением хлорида цинка к нему создают препарат пролонгированного действия — суспензия цинк-кортикотропин. В терапевтической практике используют также синтетические человеческие препараты кортикотропина, содержащие разное количество аминокислот: косинтропин, гумактид, тетрако-зактид (синактен); есть среди них препараты длительного действия, например синактен-депо.
Кортикотропин стимулирует синтез и выделение в кровь глюкокортикоидов и в меньшей степени альдостерона и андрогенов из коры надпочечников, для предупреждения развития «синдрома отмены» после длительного лечения глюкокортикоидами, а также для определения функциональной' активности гипо-таламо-гипофизарно-надпочечниковой системы. Длительное применение кортикотропина нецелесообразно, так как оно может привести к истощению коры надпочечников, задержке натрия и воды, отекам и повышению артериального давления. Но КТ способен вызвать и собственные эффекты, не связанные с секрецией кортикостероидов — он улучшает мозговой кровоток.
Соматотропин (соматотропный гормон — СТГ) — видоспецифический гормон. Получают рекомбинантным способом — нордитропин. Этим же способом получают очень похожее по структуре на СТГ вещество — с о м а т -рем. Соматотропин и его препараты не сами вызывают эффекты, а образующиеся под их влиянием в печени и скелетных мышцах — посредники — соматомедины — инсулиноподобные факторы роста (ИПФ-I и ИПФ-П). Основной эффект соматомединов — стимуляция роста хряща. Он связан с их способностью увеличивать поглощение сульфата и включение его в хондроин-тинсульфат, аминокислоты и включение их в синтез белка. Кроме того, он участвует в процессе синтеза белков, деления клеток и регенерации других тканей. Основным показателем для назначения соматотропина является низкорослость, зависимая от нарушения функции гипоталамо-гипофизарной системы — гипофизарный нанизм. Лечение следует начинать сразу же после 254
установления диагноза, по возможности с 1—2 лет жизни. Терапия соматотропином продолжается до закрытия эпифизарных зон роста. Среди нежелательных эффектов соматотропина отмечают раздражительность, головную боль, возможность провокации диабета у больных с его скрытой формой или с предиабетом; аллергические реакции.
Тиротропин — гликопротеид, который стимулирует захват йода, синтез тиреоглобулина и гормонов щитовидной железы. Применяют его только с целью дифференциальной диагностики нарушений функции щитовидной железы.
Гонадотропин хорионический (хориогонин) близок по эффектам к лютеинезирующему гонадотропину. Его основной эффект заключается в стимуляции процессов овуляции, синтеза прогестерона и тестостерона. Применяют гонадотропин хорионический прежде всего для лечения функционального бесплодия женщин. Кроме того, его назначают мужчинам при бесплодии, связанном с нарушением функции гипоталамуса и гипофиза, половом инфантилизме, при двустороннем крипторхизме, для диагностики первичного и вторичного гипогонадизма. При применении препарата возможны аллергические реакции, чрезмерное увеличение яичек и яичников. Препарат противопоказан при воспалительных заболеваниях и опухолях половых органов.
Гонадотропин менопаузальный близок по эффектам к фолликулостимулирующему гормону, усиливает процесс деления яйцеклеток и сперматозоидов. Используют его, комбинируя с хорионическим гонадотропином, для лечения бесплодия.
Даназол (данов^ал) — синтетический препарат, подавляющий секрецию гонадотропинов у мужчин и женщин. Он обратимо угнетает овуляцию и вызывает атрофию эндометрия. Применяют его при эндометриозе с сопутствующим бесплодием, первичных меноррагиях, гинекомастии, преждевременном половом созревании. Он может вызвать нежелательные эффекты: вирилизацию (из-за наличия у препарата небольшой андрогенной активности), головную боль, головокружение, эмоциональную лабильность, аллергические реакции, алопецию.
ПРЕПАРАТЫ ЗАДНЕЙ ДОЛИ ГИПОФИЗА
Окситоцин — октапептид, получаемый синтетически. Основным свойством окситоцина является его способность вызывать сокращения гладкой мускулатуры беременной матки. Причем в последние 4 нед беременности чувствительность матки к окситоцину многократно возрастает. Второй эффект окситоцина — это усиление сокращений протоков молочной железы и облег-чение выделения молока. Применяют окситоцин для вызывания родов при переношенной беременности, преждевременном отхождении вод, для стимуляции родовой деятельности при слабой сократительной функции матки; в послеродовый период при задержке отделения плаценты, атонических кровотечениях, замедлении инволюции матки; для стимуляции отделения молока. Противопоказаниями для назначения окситоцина являются несоответствие размеров таза и плода, а также наличие повреждений стенки матки. Осложнения — задержка жидкости в организме (опасно для женщин с артериальной гипертензией), увеличение уровня билирубина в плазме крови новорожденного.
255
Питуитрин — экстракт из задней доли гипофиза крупного рогатого скота и свиней — содержит окситоцин, вазопрессин. Он вызывает соответствующие эффекты: сокращение мускулатуры матки, сужение артериол и повышение артериального давления, а также увеличение реабсорбции воды в канальцах почек. Назначают питуитрин при гипотонических маточных кровотечениях, для нормализации инволюции матки в послеродовый период; вводят его при этом под кожу или внутримышечно. Во время родов введение питуитрина со стимулирующей целью не рекомендуется, так как он может способствовать спазму коронарных сосудов и нарушению гемодинамики плода. Особенно опасно введение питуитрина роженицам с гестозом (поздним токсикозом. беременных), так как у них снижена активность вазопрессиназы, поэтому возможно накопление вазопрессина и усиление его эффектов.
Питуитрин противопоказан при выраженном атеросклерозе, артериальной гипертензии, ИБС.
Адиурекрин — сухой питуитрин, основным эффектом которого является регулирование реабсорбции воды. Порошок адиурекрина применяют путем втягивания в полость носа при несахарном мочеизнурении. Антидиуретический эффект вазопрессина, содержащееся в питуитрине или в адиурекрине, сравнительно небольшой и короткий-(1—2 ч). Он сочетается с повышением артериального давления, возникновением головной боли.
Синтетический аналог вазопрессина — десмопрессин. Он отличается от естественного гормона преобладанием антидиуретического эффекта над сосудосуживающим и значительно более длительным действием (8—12 ч). Его можно принимать внутрь, интраназалъно, вводить внутривенно и внутримышечно. Применяют десмопрессин для лечения не только несахарного мочеизнурения, но и ночного недержания мочи (энуреза). При энурезе повышение уровня вазопрессина в крови во время сна обычно отсутствует. Прием десмопрессина перед сном создает достаточную концентрацию препарата в крови на 8-10 ч. Осложнений почти не бывает. Похожие эффекты вызывают и другие синтетические аналоги лизинвазопрессин (липрессин), дисидипин.
Получен и совершенно иной синтетический аналог вазопрессина — тер-липрессин (ремистип), оказывающий выраженное сосудосужающее действие практически без антидиуретического. За счет повышения тонуса гладких мышц сосудистой стенки он вызывает сужение артерий, вен и венул, особенно в брюшной полости. Это приводит к уменьшению кровотока в гладкомышечных органах, а также в печени, и к снижению давления в портальной системе.
Используют терлипрессин при кровотечениях из варикозно расширенных вен пищевода, язв желудка или двенадцатиперстной кишки, при маточных кровотечениях, кровотечениях во время операций на органах брюшной польсти и малого таза. Вводят его внутривенно струйно. Нежелательные эффекты терлипрессина — повышение артериального давления, уменьшение частоты сердечных сокращений, усиление перистальтики кишечника.
ПРЕПАРАТЫ ЙОДОСОДЕРЖАЩИХ ГОРМОНОВ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И АНТИТИРЕОИДНЫЕ СРЕДСТВА
Нарушения функции щитовидной железы встречаются часто как у детей, так и у взрослых. Для растущего организма особенно велико значение гормонов щитовидной железы, так как они способствуют дифференцировке- тканей,
256
энхондральному росту костей, формированию скелета и развитию нервной ткани. Недостаток гормонов в раннем возрасте ведет к задержке роста, соматическим нарушениям и олигофрении (кретинизму), в более старшем возрасте — к замедлению обмена веществ (микседеме). Для синтеза гормонов щитовидной железы необходимо достаточное количество йода. При его дефиците образуются неактивные их предшественники. Гормонопрепаратами, способными заменить естественные гормоны, являются тиреоидин, получаемый из высушенных щитовидных желез скота. Он содержит два гормона — тироксин (тетрайодтиронин) и трийодтиронин. Трийодтиронин получен и синтетически. Он эффективнее естественного препарата в 3—5 раз. Механизм действия этих гормонов щитовидной железы связан с их способностью повышать синтез или активность дегидрогеназ, участвующих в транспорте водорода в дыхательной цепи митохондрий и в синтезе АТФ, а также повышать проницаемость мембран и стимулировать синтез РНК и белка. Они также повышают реакцию тканей на катехоламины и этим оказывают положительное ино- и хронотропное действие на сердце, ускоряют метаболизм холестерина, синтез гемоглобина, мобилизацию кальция, выработку тепла и т. д. Используют тиреоидин и трийодтиронин в качестве возмещающей терапии при врожденном или приобретенном гипотиреозе, ожирении, протекающем с гипотиреозом, эндемическом зобе (из-за недостатка йода в воде). При передозировке тиреоидина или трийодтиронина могут наблюдаться явления, характерные для гипертиреоза (учащение пульса, аритмии, повышенная возбудимость центральной нервной системы, потливость). В отдельных случаях на тиреоидин возможны аллергические реакции. При длительном назначении тиреоидных гормонопре-паратов, особенно пожилым больным, может произойти обострение ишемической болезни сердца, которое необходимо корректировать уменьшением дозы гормонов и включением в терапию антиангинальных средств.
Гипертиреоз или тиреотоксикоз может'быть следствием аденомы щитовидной железы, диффузного токсического зоба или аутоимунного процесса. Антитиреоидные средства показаны в начале лечения заболевания, особенно у молодых больных, для подготовки к резекции зоба. Используют в качестве антитиреоидных препаратов мерказолил и дийодтирозин, реже карбонат лития и перхлорат калия. Мерказолил — наиболее эффективный препарат этой группы. Механизм ’ его действия связан с торможением синтеза тиреоидных гормонов путем блокады йодизации тирозина и последующей конденсации монойодтирозина. Во время лечения им необходимо проводить контрольные исследования крови, так как препарат может вызвать лейко- и тромбоцитопению. Кроме того, возможны тошнота, рвота, кожная сыпь, увеличение лимфатических узлов, нарушение функции печени. Дийодтирозин тормозит выработку тиреотропного гормона, что снижает функцию щитовидной железы.
Лития карбонат нарушает освобождение тиреоидных гормонов из тиреоглобулина и превращает тироксин в активный трийодтиронин. Назначают его при тяжелых формах тиреотоксикоза, часто комбинируют с мерказолилом. Лития карбонат дает быстрый (в течение 1—2 дней) эффект, но имеет узкий диапазон терапевтических доз, поэтому курс лечения им обычно не превышает 1—3 нед. Осложнения от препаратов лития (см. гл. 4). Калия перхлорат, тормозящий захват йода железой, применяют только при возникновении аллергических реакций у больных на мерказолил, так как он блокирует на длительное время щитовидную железу, что мешает дальнейшей диагностике и терапии.
9 Зак. 3856
257
ПРЕПАРАТЫ ЩИТОВИДНОЙ И ОКОЛОЩИТОВИДНОЙ ЖЕЛЕЗ, ВЛИЯЮЩИЕ НА ФОСФОРНО-КАЛЬЦИЕВЫЙ ОБМЕН
Кальцитрин — препарат, получаемый из щитовидных желез свиней и лосося. Он содержит кальцитонин, основной эффект которого заключается в уменьшении резорбции костей и стимуляции отложения фосфорно-кальциевых солей в костной ткани. Под его влиянием снижается уровень щелочной фосфатазы в крови; обнаружена обратная зависимость между уровнем кальцитонина в крови и снижением активности названного фермента. Кроме того, кальцитонин может тормозить секрецию гастрина, активность циклооксигеназы и в связи с этим образование простагландинов и тромбоксана. Он может вызывать анальгетический эффект. Кальцитрин применяют при системной патологии костной ткани: болезни Педжета, гипервитаминозе D, климактерическом, стероидном и других видах остеопороза, фантомных болях после ампутации конечностей. Его включают также в комплексное лечение язвенной болезни и хронического обструктивного бронхита. Кальцитрин вводят внутримышечно, подкожно; при лечении фантомных болей — внутривенно. При назначении кальцитрина возможны аллергические реакции в месте инъекции, покраснение кожи лица, тошнота. В этих случаях делают перерыв в лечении на 2—3 дня, иногда отменяют препарат.
Паратиреоидин — препарат, получаемый из околощитовидных желез крупного рогатого скота. Действующим началом этого препарата является паратгормон. Основные эффекты его: усиление всасывания Са++ в кишечнике, повышение реабсорбции Са++ в почках, а также активация гидроксилазы в почках, переводящей кальцидиол в кальцитриол — основной гормоноподобный метаболит витамина D, мобилизация Са из костей. Используют паратиреоидин вместе с препаратами кальция, вводимыми внутривенно или через рот, при гипопаратиреоидизме. Лечение паратиреоидином следует проводить под контролем концентрации кальция в крови. При его передозировке в связи с возникновением гиперкальциемии наблюдается общая слабость, вялость, рвота, в более тяжелых случаях — мышечная атония, летаргия, вплоть до комы.
ПРЕПАРАТЫ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ И СИНТЕТИЧЕСКИЕ САХАРОПОНИЖАЮЩИЕ СРЕДСТВА
Инсулин — белок, синтезируемый Р-клетками островков Лангерганса поджелудочной железы. В качестве его препаратов прйменяют свиной и говяжий инсулин, выделяемый из поджелудочной железы животных, и человеческий инсулин, полученный методом генной инженерии или из свиного инсулина путем замены в нем аланина на треонин.
По длительности действия препараты инсулина делят на:
•1. Препараты короткого действия, эффект которых начинается через 15—30 мин с пиком действия через 1,5—2 ч, длительность действия 4—6 ч: актрапид (свиной и человеческий инсулин); инсулрап (говяжий инсулин); хуму-лин-регулятор и хоморап-пенфил (человеческий инсулин), хума-лог (человеческий инсулин).
Хумалог — препарат, характеризующийся очень быстрым началом действия — через 10—12 мин, с пиком — через 30 мин—2 ч и с длительностью 258
действия 4—6 ч. После его введения можно фазу принимать пищу. По фармакокинетике он соответствует длительности гиперинсулинемии, возникающей после еды у здорового человека.
2. Препараты средней продолжительности действия с началом через 1,5—2 ч, с пиком — через 3-12 ч и длительностью эффекта — 8-12 ч; протафан (свиной и человеческий); инсулин-семиленте (свиной); инсулин — ленте (свиной и говяжий); монотард (свиной); хумулин и хомо-фан-пенфил (человеческий).
3. Препараты продолжительного действия с началом через 4—8 ч, пиком через 8—18 ч и обшей длительностью действия — 20—30 ч: инсулин-уль-траленте (говяжий); ху м ул и н - ул ьтрал онг и ультра-тард (человеческий).
Инсулин взаимодействует с рецепторами, расположенными преимущественно в печени, скелетных мышцах и в жировой ткани. Рецептор состоит из а-субъединицы, расположенной на внешней поверхности клеточной мембраны,’ с ней и взаимодействует молекула инсулина, и Р-субъединицы, прошивающей мембрану насквозь и содержащей тирозинкиназу. После взаимодействия инсулина с а-субъединицей происходит активация тирозинкиназы, что приводит к фосфорилированию ряда белков внутри клетки, например, белка, транспортирующего глюкозу (Glut-4) и белков, транспортирующих калий и фосфаты в клетку. Это происходит в течение нескольких секунд. Фосфорилирование других белков-ферментов приводит либо к их активации (гексокиназы, пируваткиназы, фосфофруктокиназы, гликогенсинтетазы; ферментов, образующих НАДФ-Н кофактор) или к торможению (например, ферментов, участвующих в катаболических процессах, что уменьшает распад гликогена, липидов, пируваткарбок-силазы, фосфоенолпируваткарбоксилазы, фруктозобифосфатазы и гдюкозо-6-фосфатазы, тормозящих глюконеогенез. Эти эффекты возникают в течение нескольких минут. Затем инсулин в комплексе с рецептором погружается в клетку (интернализируется), освобождается от него. Свободный инсулин, способствует поглощению аминокислот, процессу трансляции и удлинению поли-пептидных цепей, активируя функции рибосомного белка. Одновременно он препятствует действию протеолитических систем. Затем инсулин переваривается лизосомами. Рецептор, отсоединенный от иясулина, возвращается обратно на поверхность клеточной мембраны и взаимодействует с новыми молекулами гормона. Эти внутриклеточные эффекты инсулина осуществляются в течение нескольких часов.
Самые медленные эффекты — митогенез, деление клеток — осуществляются в течение нескольких дней.
Инсулин и его препараты назначают больным юношеским инсулинзависимым диабетом. Дозы препаратов подбирают индивидуально по следующим параметрам: уровень глюкозы в крови, глюкозурия, ацетонурия (показатель инсулиновой недостаточности), уровень триглицеридов. Инъекции препарата проводят 1—3 раза в сутки под кожу или внутримышечно. Препараты короткого действия вводят за 30 мин до еды. Внутривенно инсулин для инъекций вводят только при диабетической коме вместе с раствором глюкозы во избежание перевода больного в гипогликемическое состояние. В небольших дозах (4-8 ЕД в день) инсулин используют как анаболизант при гипотрофиях, анорексии. При передозировке инсулина может наступить гипогликемический шок с по
259
терей сознания, судорогами и падением сердечной деятельности. При начальных симптомах гипогликемии (потливость, чувство голода, бледность, дрожь) больному нужно дать сахар через рот, а при более тяжких ее проявлениях — глюкозу внутривенно. На месте инъекций инсулина могут возникнуть липодистрофические изменения, более характерные для детей и женщин. Наиболее эффективный метод этого осложнения — замена инсулина на суинсулин, так как в развитии липодистрофии основную роль играют иммунные механизмы.
Синтетические сахароснижающие средства. Важным преимуществом этих препаратов является возможность их приема внутрь. Различают 4 группы сахароснижающих средств.
/. Производные сульфонилмочевины.
Первое поколение: толбутамид (бутамид), карбутамид (б у к ар -бан), хлорпропамид (диабенез).
Второе поколение: глибенкламид (манинил), гликлазид (диа-•м и крон), гл и пиз ид (минидиаб), глимепирид (а мари л).
И. Бигуаниды: фенформин (диботин), буформин (глибутид), метформин (глюкофаг).
III. Ингибиторы альфа-гликозид&зы: акарбоза (глюкобай).
IV. Производные тиазолидиндиона: циглитазон, пиоглитазон, эн-глитазон, троглитазон.
Механизм действия производных сульфонилмочевины связан с повышением чувствительности [3-клеток к глюкозе, в результате чего возрастает секреция инсулина. Они также повышают чувствительность клеток-мишеней к инсулину, подавляют секрецию глюкагона. При наличии у больных сахарным диабетом выраженного дефицита инсулина эти препараты теряют свой эффект. Препараты группы сульфонилмочевины назначают в сочетании с диетой больным диабетом после 25 лет, без кетоацидоза. При длительном лечении этими препаратами может возникнуть резистентность, диспепсические явления, аллергические реакции, лейкопения, задержка жидкости — антидиуретический эффект.
Бигуаниды уменьшают уровень глюкозы в крови даже при отсутствии активности Р-клеток поджелудочной железы. Они не снижают уровень глюкозы в крови здоровых людей и у больных диабетом. II типа после ночного голодания, но существенно снижают его после приема пищи, не вызывая при этом гипогликемии. Поэтому их называют эугликемическими средствами.
Бигуаниды обычно хорошо переносятся, иногда наблюдают диспепсические расстройства. У некоторых людей эти препараты могут вызвать молочно-кислый ацидоз, в случае развития последнего препараты отменяют.
Акарбоза — обратимо угнетает альфа-глюкозидазу — фермент энтероцитов тонкой кишки; в результате нарушается расщепление сложных сахаров (крахмала, сахарозы и пр.) до простых сахаров, способных всасываться из кишечника. В результате предупреждается подъем уровня глюкозы в крови после еды.
Акарбоза — псевдоолигосахарид, получаемый из растений семейства Acti-noplanceae.
Производные тиазолидиндиона пока мало изучены. Они повышают чувствительность тканей-мишеней к инсулину, понижают синтез липидов в мышечных и жировых клетках. Их назначают внутрь за 30 мин до еды больным со II типом диабета.
260
ПРЕПАРАТЫ ГОРМОНОВ КОРЫ НАДПОЧЕЧНИКОВ
В коре надпочечников вырабатываются стероидные гормоны или кортикостероидные. По влиянию на обмен веществ кортикостероиды делят на минералокортикоиды и глюкокортикоиды. Кроме того, там же синтезируются андрогены и эстрогены.
Минералокортикоиды. Альдостерон — основной минералокортикоид, продуцируемый корой надпочечников (100—200 мкг/сут). В качестве лекарства применяют его синтетические заменители — дезоксикортикостерона ацетат или триметилацетат (перкортен). В дистальных канальцах почек минералокортикоиды стимулируют синтез фермента — пермеазы, участвующей в реабсорбции натрия. Кроме того, они усиливают секрецию кадия, водорода, магния и аммония в этих же канальцах (вне зависимости от пермеазы). Они увеличивают реабсорбцию натрия в потовых, слюнных железах, в слизистой оболочке желудочно-кишечного тракта и повышают содержание Na+ во внеклеточной жидкости, способствуют поляризации мембраны в клетках гладкой мускулатуры сосудов, чем повышают их реакцию на сосудосуживающие вещества. Основное показание для применения минералокортикоидов — возмещающая терапия при первичной надпочечниковой недостаточности (болезни Аддисона). Еще одним показанием для применения дезоксикортикостерона является первичная гипотония с ортостатическими нарушениями. Назначают препараты внутримышечно или под язык. Передозировка может привести к отекам и повышению артериального давления из-за гипернатриемии и анорексии, запору, нарушению сердечной деятельности из-за гипокалиемии сможет быть даже гипокалиемический алкалоз.
Глюкокортикоиды. Препараты этой группы делят на естественные — гидрокортизон, кортизон и синтетические — преднизолон, метилпреднизолон, дексаметазон, триамцинолон, беклометазон. Синтетические препараты отличаются от естественных по структуре, в частности, введением в их молекулу дополнительной двойной связи в кольцо, •атома фтора или хлора, и в связи с этим -особенностями фармакокинетики и эффектов. Большинство глюкокортикоидов хорошо всасывается из желудочно-кишечного тракта, проникает через слизистые оболочки и кожу. Исключение представляют специальные препараты, синтезированные для местного применения в виде мази (триамцинолона ацетонид) или аэрозоля (беклометазон). Однако и они при длительном применении или использовании больших доз также могут всасываться и оказывать резорбтивные эффекты.
Для проявления биологической активности глюкокортикоидов большое значение имеет их связывание со специальным транспортным белком плазмы крови — транскортином и альбуминами. В отличие от гидрокортизона, который на 90% связывается с этими белками плазмы (80% с транскортином и 10% с альбумином), синтетические препараты всего на 60—70% связаны с ними, поэтому они на 40% оказываются в виде свободной фракции, скорее и больше проникают в ткани. При дефиците белков крови у больного (что может быть при нарушении функции печени, почек, наличии воспалительного процесса в организме) еще более высокий процент синтетических глюкокортикоидов может быть в свободной фракции и вызвать нежелательные эффекты. Синтетические
261
препараты медленнее инактивируются в печени и обладают поэтому более продолжительным действием. Кроме того, изменения структуры препаратов уменьшили минералокортикоидное действие и повысили их противовоспалительную активность. Биологические эффекты глюкокортикоидов связаны с их влиянием на функцию многих ферментов (рис. 33). Так, они в печени и почках стимулируют глюконеогенез из белков, подавляют утилизацию глюкозы в тканях, в результате в плазме крови возрастает уровень глюкозы. Избыток этих гормонов приводит к катаболизму белка с отрицательным азотистым балансом. Прямо на липолиз глюкокортикоиды не влияют, но увеличивают воздействие на него катехоламинов, особенно в подкожной жировой клетчатке конечностей. В верхней части туловища и на лице, наоборот, увеличивается отложение жира. Результатом вмешательства глюкокортикоидов в процессы обмена веществ будет атрофия мышц, остеопорозы, изменение внешности больного («лунообразное» лицо). В то же время под влиянием глюкокортикоидов увеличивается синтез и активность некоторых белков. Например, ферментов печени, участвующих в метаболизме эндогенных и биотрансформации экзогенных веществ. В легких плода и новорожденного они стимулируют синтез сурфактанта, обеспечивающего расправление альвеол после рождения ребенка. Глюкокортикоиды индуцируют синтез и секрецию клетками белка липомодулина, ингибирующего фосфолипазу Аг (см. гл. 39). Влияние на лимфатическую систему см. в гл. 40.
Кроме влияния на процессы обмена, глюкокортикоиды необходимы для поддержания нормальной структуры сосудистой стенки, клеточных и лизосомальных мембран. Стабилизация мембран глюкокортикоидами приводит к улучшению микроциркуляции, уменьшению отечности тканей. К тому же глюкокортикоиды ослабляют процессы захвата катехоламинов клетками тканей, этим повышают их концентрацию в крови. Кроме того, глюкокортикоиды восстанавливают чувствительность адренорецепторов к катехоламинам, то есть могут устранить тахифилаксию к ним.
Естественные глюкокортикоиды применяются в качестве средств возмещающей терапии при надпочечниковой недостаточности (болезнь Аддисона, кровоизлиянии в надпочечники), адреногенитальном синдроме. Введение глюкокортикоидов должно соответствовать физиологическому ритму их секреции, то есть 2/3 суточной, дозы утром (в 7-8 ч), а остальное в обеденное время (13-14 ч). Для фармакодинамической терапии используют как естественные, так и синтетические препараты, в первую очередь, при ургентных состояниях — шоке, сепсисе, гипоксии, отеке мозга, травмах мозга и внутричерепных кровоизлияниях, отравлениях, последствиях укусов змей и насекомых. Кроме того, глюкокортикоиды назначают при синдроме дыхательных расстройств у новорожденных, связанного с недостаточным синтезом сурфактанта у недоношенных детей. Во всех перечисленных выше случаях глюкокортикоиды назначают кратковременно. Длительные курсы глюкокортикоидов показаны при тяжелых воспалительных и аллергических заболеваниях (см. гл. 40).
Большинство осложнений, возникающих при использовании глюкокортикоидов, развивается при длительном назначении препаратов. В течение короткого времени можно наблюдать только нарушение водно-солевого обмена от препаратов, сохраняющих минералокортикоидную активность — задержка в организме натрия и воды, отеки, потеря калия и гипокалиемия, гипокалигистия. Для профилактики и коррекции этого осложнения рекомендуется назначать 262
больным аспаркам, панангин, тиазиды. Длительный прием глюкокортикоидов приводит к возникновению экзогенного синдрома Кушинга, торможению секреции АКТГ, снижению иммунитета, обострению хронических инфекций (туберкулеза) и возникновению острых заболеваний, нарушению заживления ран, повышению возбудимости центральной нервной системы, стероидный диабет, пептические язвы, угнетение роста детей, миодистрофии. В возникновении ряда перечисленных осложнений большое значение имеет способность глюкокортикоидов тормозить образование соматомединов, нарушая этим их влияние на синтез белков, нуклеиновых кислот и пр. Задержка роста детей может быть обратима, если глюкокортикоиды назначают не более 1,5 лет.
Метилпреднизолон
Рис. 33. Структурные формулы основных препаратов глюкортикоидов
Возникновение пептических язв, как следствие назначения глюкокортикоидов, также связано с нарушением деления клеток слизистой оболочки желудка
263
и кишечника, увеличением секреции кислого желудочного сока и торможением синтеза мукополисахаридов. Последние защищают слизистую оболочку желудка от повреждающего действия. Глюкокортикоиды способствуют инактивации витамина D, ослабляют его влияние на всасывание Са из кишечника, сами тормозят этот процесс. В результате повышения экскреции Са в плазме крови возникает гипокальциемия, усиливающая секрецию паратгормона. Последний способствует рассасыванию костей, то есть остеопорозу, переломам.
В связи с большим количеством нежелательных эффектов, наблюдаемых при терапии глюкокортикоидами, необходимо с осторожностью подходить к их назначению, особенно у детей.
ПОЛОВЫЕ ГОРМОНЫ
Андрогены. Препаратами мужских половых гормонов, получаемых синтетическим путем, являются тестостерона пропионат и метилтестос-терон. Андрогены способствуют развитию гениталий, вторичных половых признаков, сперматогенезу, формируют мужскую психику и сексуальность; поддерживают половую потенцию,- Кроме того, андрогены активируют синтез белка, особенно в мышечной й костной тканях. Препараты андрогенов используют главным образом в качестве возмещающей терапии при половом недоразвитии у мальчиков (инфантилизм), функциональных нарушениях половой системы у мужчин.
Анаболические стероиды получены на основе тестостерона. Они преимущественно стимулируют синтез белка и обладают сравнительно небольшими андрогенными свойствами. Их прием сопровождается положительным азотистым баллансом, уменьшением выведения калия, фосфатов и серы, необходимых для синтеза белка. Анаболические стероиды отличаются друг от друга по силе и продолжительности действия: метандростенолон (неробол) — короткого действия; нандролона фенилпропионат, феноболин (ду-раболин), нандролона деканаат (ретаб ол ил) — длительного действия. Метандростенолон назначают через рот, ежедневно, в течение 4—6 нед; феноболин вводят внутримышечно 1 раз в 7-10 дней; ретаболил — внутримышечно 1 раз в 2-3 нед.
Препараты анаболических стероидов применяют при кахексии и дистрофии различного происхождения, у реконвалесцентов после тяжелых операций, травм, ожогов, при хронической коронарной недостаточности и кардиосклерозе, язвенной болезни желудка и двенадцатиперстной кишки, остеопорозах, миопатиях и мышечной дистрофии, гипопластической анемии.
При приеме препаратов возможны нежелательные эффекты, связанные с их андрогенными свойствами: вирилизация у женщин (гирсутизм, менструальные нарушения, низкий голос); ускорение созревания скелета и прекращение роста у детей. Поэтому детям можно их назначать только короткими курсами, не больше 2-4 нед.
Эстрогены — женские половые гормоны, вырабатываемые в фолликулах яичников. В качестве препаратов используют естественные — эстрон (фолликулин), эстрадиола пропионат, премарин (смесь конъюгированных эстрогенов) и синтетические препараты — этинилэстрадиол (м и крофол л и н), эти н ил эстрад иол а сульфат (депосистен), синэстрол, диэтилстильбэстрол, сигетин. Их используют в ОСНОВ-264
ном для возмещающей терапии при эстрогенной недостаточности — при нарушенном менструальном цикле, аменорее, эндометриозе, функциональных маточных кровотечениях в климактерический период, функциональном бесплодии, слабости родовой деятельности (перед введением родостимулирующих средств). Эстрогенные препараты противопоказаны при злокачественых новообразованиях женских половых органов, эндометрите, патологии молочных желез. Их назначают, когда при опухолях предстательной железы у мужчин имеет значение подавление секреции гонатропинов и антагонизм между эстрогенами и андрогенами во влиянии на предстательную железу.
Гестагены — гормоны желтого тела. В качестве препаратов используют синтетический прогестерон и его производные: гидроксипрогестерона капронат (депоста т), гидроксипрогестерона ацетат (провера), мегэстрола ацетат, а также синтетические производные тестостерона: этистерон (прегнин), аллилэстринол (туринал), норэтинодрел и др. Основной эффект прогестерона — это трансформация эндометрия, подготовка его слизистой к имплантации и последующему развитию оплодотворенного яйца. Другой важный эффект прогестерона — обеспечение «покоя» миометрия путем понижения его чувствительности к окситоцину, то есть сохранение беременности. Препараты гормонов желтого тела используют в качестве возмещающей терапии при кровотечениях, связанных с дисфункцией яичников, бесплодии, недонашивании беременности.
Гормональные противозачаточные средства могут быть или комбинацией эстрогенов и гестагенов, или прогестинами. Основным механизмом контрацептивного эффекта этих препаратов является торможение секреции гонатропинов гипофизом по принципу обратной связи и тем самым предотвращение развития яйцеклетки в фолликулах и овуляции. Кроме того, гормональные контрацептивы могут непосредственно влиять на яичники, замедлять скорость прохождения яйцеклетки по фаллопиевым трубам, изменять процессы обмена в эндометрии, нарушать имплантацию бластоцисты. Из комбинированных средств с целью контрацепции рекомендуют препараты, содержащие минимальные количества гормонов — марвелон, нон-овлон, нордетт (овидон, ригевидон), бревикон, демулен и пр. Таблетки этих препаратов следует принимать с 5 по 26 день менструального цикла с последующим семидневным перерывом. Одним из вариантов контрацепции является разовое назначение препарата после полового сношения. К таким препаратам относится постинор, содержащий повышенное количество гестагена-левоноргестрона. Одну таблетку постинора принимают в течение 1 ч после полового акта. Препарат нельзя принимать более 4 раз в месяц, так как более частый прием может нарушить менструальный цикл.
Прогестины делят на ежедневно принимаемые таблетки «мини-пили».
Микронор, экслютон, фемулен и пр. и имплантируемый препарат — норплант (левоноргестрон) — система из 6 капсул, вводимых под кожу плеча или предплечья на 5 лет.
Гормональные контрацептивы необходимо индивидуально подбирать для каждой женщины, учитывая ее собственный гормональный фон.
Нежелательные эффекты контрацептивов зависят от дозы гормонов в комбинации, особенно эстрогенов. Они проявляются тошнотой, рвотой, раздражительностью, нагрубанием молочных желез, повышением свертывания крови.
265
ПРОСТАГЛАНДИНЫ
В медицинской практике применяют синтетические простагландины: динопрост (энзапрост, простин F а), динопростон (простин Е), эпопростенол (простациклин, флолан), мизопростол (цитотек), карбопрост, алпростадил.
Динопрост и динопростон применяют для прерывания беременности в любые ее сроки (по медицинским показаниям); для остановки послеродовых кровотечений. Эти препараты размягчают шейку матки (повышая содержание в ней протеогликанов и активность коллагеназы) и стимулируют сокращение матки.
Для стимуляции родов предпочитают динопростон (простин Е), не вызывающий, в отличие от простатина Fa, бронхоспазма; он обладает натриурети-ческим действием, не вызывает сужения сосудов, что очень важно для женщин с преэклампсией.
Алпростадил (препарат из группы простагландинов Ei) и эпопростенол применяют при хронических облитерирующих заболеваниях артерий нижних конечностей и кистей рук. Эпопростенол может заменить гепарин при проведении гемодиализа. Мизопростол означают для предупреждения ульцероген-ного действия НПВС и глюкокортикоидов.
Дозы лекарственных средств и способы их назначения см. табл. 48.
Таблица 48
Гормональные препараты
Препарат Форма Путь введения Число приемов в сутки Суточная доза
Адиурекрин Adiurecrinum Порошок В полость носа 2-3 Взрослым 0,1—0,15 г; детям от 3 до 7 лет — 0,03— 0,04 г; от 7 до 12 лет — 0,06-0,1 г
Тиреоидин Thyreoidinum Таблетки по 0,05, 0,1 и 0,2 г Через рот 2-3 Взрослым — 0,6—1 г; Детям до 6 мес — 0,03 г; 6 мес — 1 г — 0,06 г; 2 года — 0,09 г; 3-4 года — 0,15 г; 5-6 лет — 0,25 г; 7-9 лет — 0,3 г; 10г 14 лет — 0,45 г
Инсулин Insulinum Флаконы по 5, 10 мл (40 ЕД или 80 ЕД в 1 мл) Подкожно Внутримышеч но 1-2 Индивидуально от 1-40 ЕД/день
Преднизалон Prednisolonum Таблетки по 0,001 и 0,005 г Внутрь 1-2 1-5 мг/кг
Ампулы с порошком по 0,025 г Внутривенно, предварительно разводя в 5 мл воды для инъекций
Метандро-стенолон Methandrosteno-lonum Таблетки по 0,001 и 0,005 г Внутрь 1-2 До 2 лет — 0,05—0,1 мг/кг; 2-5 лет - 0,001-0,002 г; 6-13 лет — 0,003-0,005 г
266
Глава 32 ВИТАМИННЫЕ ПРЕПАРАТЫ
Витамины — органические вещества разнообразной химической структуры, несинтезируемые в организме, но необходимые для регуляции обмена веществ. Их источники — пища и микрофлора кишечника (преимущественно бифидобактерии). Большинство витаминов входит в состав коферментов, после сочетания которых с апоферментами образуются энзимы, участвующие в различных видах обмена. Витамины особенно необходимы во время развития и роста организма, когда наиболее интенсивны процессы синтеза белков и деления клеток.
Препараты витаминов назначают преимущественно для профилактики и устранения гиповитаминозов, очень часто встречающихся у детей первых месяцев жизни, особенно у недоношенных новорожденных, у которых отсутствуют или очень малы запасы витаминов A, D, E в печени, так как лишь в последние месяцы внутриутробной жизни в ней происходит их депонирование.
Гиповитаминозы могут быть следствием:
1) недостаточного поступления витаминов к плоду, например, из-за нерационального питания его матери;
2) недостаточного содержания некоторых витаминов в молоке матери (D, Е), в коровьем молоке (D, Е, С, А), особенно после термической обработки его (С, Вь, Вс, Вп) и при хранении на свету;
3) отсутствия в кишечнике достаточного количества нормальной микрофлоры, являющейся источником ряда витаминов (К, Вс, Bi, В?, Be, Вп), при дисбиоцинозе, когда исчезают бифидобактерии или резко снижено их количество в содержимом кишечника; это наблюдается у недоношенных новорожденных, у новорожденных от матерей с токсикозом беременных, у детей, получающих антибактериальные препараты;
4) недостаточного поступления желчи в кишечник — отсюда нарушается всасывание жирорастворимых витаминов (А, К, Е, D);
5) замедленного всасывания ряда витаминов при затяжных дисфункциях желудочно-кишечного тракта;
6) недостаточного образования активный метаболитов некоторых витаминов (например, метаболитов холе- и эргокальциферола) у недоношенных детей и при тяжелых заболеваниях печени и почек;
7) повышенной потребности в витаминах (инфекционные заболевания, занятия спортом, период интенсивного роста, беременность, лактация и пр.).
Особое значение приобретает дополнительное назначение витаминов детям и взрослым, находящимся на парентеральном питании, а также при заменном переливании крови, гемосорбции.
В качестве витаминных препаратов используют: натуральные экстракты из растительного сырья (черной смородины, лимона, черноплодной рябины, облепихи), синтетические препараты, полностью имитирующие структуру естественных витаминов, или их изомеры (витамеры). Применяют й готовые коферменты, например, кокарбоксилазу, рибофлавина мононуклетид, пиридо-сальфосфат, кобамамид и др.
Следует, однако, подчеркнуть, что витамины необходимы организму в нормальных количествах. Их избыток не менее опасен, чем недостаток.
267
Кроме возмещающей терапии, витаминопрепараты (ВП) широко применяют и как средства регулирующей терапии; в этих случаях у детей, как и у взрослых, дозы ВП значительно превышают их суточную потребность (например, препарат никотиновой кислоты — для улучшения регионарного кровотока, аскорбиновая кислота — в качестве антигипотензивного средства).
ЖИРОРАСТВОРИМЫЕ ВИТАМИНЫ1
Витамин А — объединенное название группы ретиноидов. Различают три основных ретиноида: ретинол (спирт), ретиналь (альдегид) и ретиноевая кислота. В организм витамин А поступает с пищей, либо в виде провитамина — каротина, содержащегося в растительных продуктах (морковь, петрушка, черная смородина, черника, облепиха, персики, абрикосы), либо в виде эфиров (пальмитат, стеарат) ретинола, источником которых являются сливочное масло, яичный желток, печень. В организме используется ретинол, освобожденный из эфира гидролазами поджелудочной железы и слизистой оболочки кишечника. У детей до 6 мес эти ферменты в «поджелудочной железе почти не продуцируются, их активность после полугода постепенно увеличивается и к одному году достигает уровня взрослых. В связи с этим до 6 мес витамин А усваивается мало.
Каротин превращается в витамин под влиянием каротиназы (в слизистой оболочке желудочно-кишечного тракта, печени, коже), ее активность у детей раннего возраста тоже низка, поэтому у них провитамин мало превращается в витамин и, откладываясь в коже, может привести к псевдожелтухе (без желтизны глаз).
* В грудном молоке содержится достаточное количество ретинола, но при искусственном вскармливании дети нуждаются в дополнительном приеме витамина А. При парентеральном питании детей и взрослых ретинол необходимо добавлять в инфузионный раствор, и лучше в виде пальмитата, который не поглощается трубками инфузионной системы.
Свободный от эфира ретинол активно захватывается клетками слизистой оболочки тонкого кишечника, в ней он снова превращается в эфир с жирной кислотой и в таком виде поступает в кровь, связывается с липопротеидами, активно захватывается печенью и депонируется в ней. По мере необходимости под влиянием специальной гидролазы в печени витамин освобождается из эфира, образует комплекс с синтезируемым в ней особым полипептидом — ретинол-связывающим белком (РСБ) и поступает в кровь в комплексе с ним, где соединяется еще с одним белком — транстиретином (ТТ). При нормальном содержании ретинола в организме он циркулирует в крови почти целиком в связанном с РСБ и ТТ виде. Не связанный с ними ретинол — токсичен. РСБ транспортирует ретинол в органы-мишени. В клетках этих органов ретиноиды соединяются с цитоплазматическим рецептором (при этом РСБ и ТТ отщепляются и возвращаются в кровь по отдельности) и образуют комплекс, проникающий в ядро, где дерепрессирует гены, что приводит к синтезу специфических белков и к возникновению соответствующих биологических эффектов. Метаболизм ретинола происходит медленно, образовавшиеся метаболиты выводятся с мочой.
1 О витамине К — см. гл. 28.
268
Ретинол может окисляться в организме в альдегид (его реакция обратима), который в свою очередь окисляется в ретиноевую кислоту (необратимо).
Ретиноевая кислота проникает в цитоплазму клеток-мишеней, где соединяется со специальными рецепторами (подобно тироксину, кортикостероидам, кальцитриолу), образовавшийся их комплекс проникает в ядро, приводя к транскрипции генов, следствием чего является синтез ферментных и структурных белков, рецепторов для некоторых гормонов, факторов роста. Этим она влияет на рост, дифференцировку и функцию клеток-мишеней. Для ретинола таких рецепторов в ядрах клеток пока не обнаружено; допускают, что он в клетках подвергается окислению, превращаясь в ретиноевую кислоту, которая и вызывает многие эффекты, характерные для витамина А.
Витамин А стимулирует синтез ферментов, необходимых для образования сульфатов, входящих в состав кислых мукополисахаридов, сульфоцереброзидов, гепарина, таурина и т. д.
Кроме того, ретинол участвует в регуляции синтеза антител, факторов неспецифической защиты организма от инфекции — интерферона, лизоцима, секреторного иммуноглобулина А и др. Витамин стимулирует процесс фагоцитоза, повышая проницаемость мембран лизосом лимфоцитов. Поэтому витамин А назначают часто болеющим детям, страдающим хроническими инфекционными заболеваниями, как для лечения, так и для профилактики.
Ретинол необходим для нормального функционирования бокаловидных клеток, продуцирующих слизь в слизистых оболочках. При его недостатке бокаловидные клетки слизистых оболочек заменяются базальными клетками, которые начинают пролиферировать. Происходит замена оригинального эпителия на кератинизирующие клетки, подавляется нормальная секреция, пррисходит слущивание ороговевших клеток, развивается сухость эпителия, его инфицирование. Прием ретинола приводит к восстановлению бокаловидных клеток, постепенной регенерации и дифференцировке клеток слизистых оболочек и кожи, предупреждает ороговение и последующее слущивание клеток, что способствует устранению хронических воспалительных процессов в дыхательных путях; уменьшает сухость роговицы (предупреждает закупоривание протоков слезных желез); камнеобразование в желчных и мочевых путях; ороговение эндометрия, что способствует имплантированию оплодотворенной яйцеклетки.
Витамин А применяют у детей с рахитом, с задержкой развития зубов, скелета. Имеет значение его синергизм с соматомедином (посредником в активности СТГ).
Ретинол применяют для лечения больных с гемералопией (нарушением зрения в темноте), так как он необходим для образования родопсина — зрительного пигмента в клетках сетчатки глаз. В них цисретинол под влиянием пиридиновых нуклеотидов, превращается в цисретиналь, соединяющийся с белком опсином. Под влиянием света цисретеналь превращается в трансформу и опсин отщепляется. Активированный трансретиналь быстро взаимодействует с другим белком — трансдуцином (протеином Gt), который стимулирует фосфодиэстеразу для цГМФ. При этом происходит снижение содержания последнего в сетчатке, из-за этого снижается проходимость Na+ каналов в мембранах клеток, возникает увеличение трансмембранного, потенциала, ПД, распрост-растранйющийся по зрительному нерву в головной мозг.
Трансретиналь может прямо превратиться в цисретиналь, который опять соединяется с опсином, -образуя родопсин, способный снова реагировать на поступление света к сетчатке.
269
Применяют препараты витамина А при врожденных нарушениях обмена ретинола: гиперкаротинемии (недостаточность каротиназы), фоликулярном кератозе Дарье (генетический дефект, характеризующийся нарушением использования витамина эпителиальной тканью).
Прием избыточных доз ретинола приводит к гипервитаминозу А, проявляющемуся в увеличении секреции спинномозговой жидкости, повышении внутричерепного давления, головными болями, тошнотой и рвотой, явлениями менингизма.
При гипервитаминозе А нарушается нормальная структура и функция клеточных и субклеточных (митохондрий, лизосом) мембран, активируются свободнорадикальные реакции, перекисное окисление липидов, в результате повреждаются различные органы и ткани. В печени нарушается синтез факторов свертывающей системы крови, детоксицирующая функция, развивается ее жировая дистрофия. Увеличение синтеза гепарина способствует геморрагиям. У детей острый гипервитаминоз развивается редко (при приеме нескольких миллионов ЕД). Хронический гипервитаминоз может развиться при длительном применении повышенных доз витамина А, особенно его витамеров. Назначение больших доз витамина А беременном женщинам может привести к нарушению развития плода.
Для ликвидации гипервитаминоза необходимо назначить маннит (для снижения внутричерепного давления), глюкокортикоиды, ускоряющие биотрансформацию ретинола в печени и стабилизирующие клеточные мембраны; витамин Е как антиоксидант, а также гормоны щитовидной железы, тормозящие свободнорадикальные реакции.
Витамин D (эргокальциферол — витамин D2, холекальциферол — D3). Эргокальциферол синтезируется в наземных растениях, морских водорослях, содержится в рыбе. Холекальциферол образуется в коже человека под влиянием ультрафиолетовых лучей (УФ), проникающих в эпидермис. Образовавшийся в коже витамин D3 связывается со специальным белком, в комплексе с ним попадает в лимфу, а затем в кровь, из которой захватывается печенью.
Для поддержания нормального уровня витамина D в сыворотке крови достаточно облучение солнечным светом только кожи лица и кистей рук ребенка по 2 ч в неделю, а УФ облучения матери (1,5 минимальные эритемные дозы на все тело в течение 90 с), увеличивает содержание витамина D в ее молоке в 10 раз.
В качестве лекарства применяют препараты эргокальциферола (витамина Д2), синтетические аналоги метаболитов витамина D— кальцидиол (25-OH-D3) и кальцитриол (1,25 (OH)2D3), а также синтетическое вещество — оксидевит (Ia-OH-холекальциферол). Эти препараты вводят через рот. Для усвоения витамина D2 из кишечника необходимо поступление в него желчи, для всасывания кальцидиола желчь не столь необходима, а для всасывания кальцитриола и оксидевита она не нужна.
Всасывание принятого внутрь эргокальциферола происходит в верхнем отделе тонкой кишки в присутствии желчных кислот. В крови витамин D и его метаболиты связываются со специальным транспортным глобулином — витамин D связывающий белок — или с альбуминами. Сам витамин D мало активен. Из него сначала в печени образуется 25-оксикальциферол — кальцидол, а затем уже из кальцидола в проксимальных канальцах почек (под влиянием ai-гидроксилазы) образуется 1,25-диоксикальциферол (1,25(ОН)2Вз — кальцитриол). Этот процесс активируют паратгормон, аскорбиновая кислота, рибофлавин. После взаимодействия кальцитриола со своими рецепторами в почках
270
происходит активация 24-гидроксилазы, под влиянием которой образуется 24, 25 диоксикальциферол (24, 25 (OH)2D3), этот процесс может стимулировать и синтетический препарат — оксидевит. Кальцитриол и 24, 25 (ОН)2Г)2 основные гормоноподобные метаболиты витамина D и оказывают влияние на организм человека и животных.
Элиминация эргокальциферола и холекальциферола происходит медленно (в течение 30 дней и дольше), но его активные метаболиты (кальцидиол, кальцитриол и 24, 25 (ОН)2Пз), а также оксидевит исчезают значительно скорее (в течение 7-10 дней). В основном они подвергаются биотрансформации в печени, а образовавшиеся метаболиты выводятся с мочой.
Образовавшиеся из витамина D его активные метаболиты — кальцитриол и 24, 25 (ОН)гВз проникают в клетки органов-мишеней (прежде всего в кишечник, кости, почки), где взаимодействуют со своими рецепторами, образуют с ними комплекс, проникающий в ядро и дерепрессирующий специальные гены. В результате активируется процесс синтеза специфических белков, связывающих кальций, и коллагена. Оба метаболита, особенно кальцитриол, влияют на состав и функцию фосфолипидов клеточных мембран слизистой оболочки кишечника и эпителия канальцев почек, чем способствует всасыванию и реабсорбции кальция. Оба метаболита активируют дифференцировку и пролиферацию хондроцитов и остеобластов, увеличивают в них синтез «незрелого» коллагена, в который и происходит отложение фосфорнокальциевых солей; стимулируют синтез остеокальцина — главного неколлагенового белка костной ткани, необходимого для костеобразования и отложения кальция в костях (по уровню остеокальцина в плазме крови судят об интенсивности развития костей и об эффективности терапии рахита препаратами витамина D).
Для нормального развития костей необходимо воздействие на их метаболизм и кальцитриола и 24, 25 (OH)2D3. При увеличении концентрации кальцитриола в крови происходит активация остеокластов и резорбция костей. Его рассматривают как «аварийный» гормон, поддерживающий необходимый уровень кальция в крови. 24, 25 (OH)2D3 увеличивает отложение фосфорнокальциевых солей в костях и в физиологических, и в повышенных концентрациях, не вызывая резорбции костей. Он в условиях нормокальциемии обеспечивает нормальный остеогенез и минерализацию костей, и именно его уровень в плазме крови у больных рахитом снижен.
В почках метаболиты витамина D регулируют реабсорбцию кальция, фосфатов, аминокислот, цитрата, карнитина.
Кальцитриол способен тормозить синтез паратгормона. Помимо кишечника, костей и почек рецепторы для метаболитов витамина D содержатся в клетках, тканях, не участвующих в регуляции фосфорнокальциевого обмена: в желудке, гонадах, мозге, скелетных мышцах, миокарде, поджелудочной железе, Т- и В-лимфоцитах, моноцитах, фибробластах дермы, кератиноцитах и пр. У кальцитриола широкий спектр действия. Он стимулирует секрецию тиреотропного гормона, участвует в регуляции иммунных процессов, тормозя продукцию интерлейкина-П активированными Т-лимфоцитами, и синтез иммуноглобулинов активированными В-лимфоцитами. Под его влиянием возрастает образование интерлейки на-1 моноцитами, фегоцитарная активность макрофагов и пр.
Применяют витамин D и его метаболиты преимущественно для профилактики и лечения разных форм рахита.
Прежде всего при классическом рахите, возникающем из-за недостаточной? поступления витамина D с пищей или из-за недостаточности его депо в организме. Недоношенным детям его назначают (с профилактической целью)
271
со второй недели жизни, доношенным новорожденным, находящимся на искусственном вскармливании, через 2-3 нед после рождения, а доношенным детям, находящимся на естественном вскармливании, со 2—3 мес жизни, когда уже израсходованы запасы витамина в печени.
Витамин D назначают при рахите, возникшем из-за нарушения его всасывания из-за малого поступления желчи (при холестазе) или жира (при парентеральном питании) в кишечник. В этом случае назначают либо эргокальциферол внутримышечно, либо кальцидиол или оксидевит внутрь. Рахит и рахитоподобные состояния у старших детей и взрослых могут быть следствием ускоренной элиминации витамина D печенью, активированной фенобарбиталом, дифенином, зиксорином и рядом других лекарственных вещеётв. Поэтому с профилактической целью вместе с этими препаратами и назначают витамин D.
При D-резистентном рахите I типа, являющемся следствием наследственной патологии, когда в канальцах почек не происходит превращение кальцидиола в кальцитриол, ребенку надо назначать кальцитриол или оксидевит.
D-резистентный рахит II типа, тоже возникает как следствие наследственной патологии, заключающейся в отсутствии или недостаточности тканевых рецепторов для кальцитриола. В этих ояучаях введение даже высоких его доз не вызывает терапевтитческого эффекта. Таким детям приходится вводить (постоянно) парентерально препараты кальция. Появились сведения о положительном влиянии на кальциевый обмен оксидевита.
Кроме лечения рахита, витамин D применяют при переломах костей для ускорения заживления; женщинам в последние 2—3 мес беременности для профилактики у них остеомаляции и повреждения зубов.
При назначении витамина D нельзя допускать возникновения гипервита-миноза. Для этой цели необходимо контролировать выведение кальция с мочой (проба Сулковича), активность щелочной фосфатазы в крови. Лучше назначать масляные растворы витамина D, так как спиртовые могут стать более концентрированными (после неоднократного открывания сосуда и испарения спирта). Недопустимо сочетать назначение витамина D и УФО кожи.
Прием высоких доз витамина D может вызвать гипервитаминоз. Он может развиться у детей с повышенной чувствительностью к этому витамину (у детей с идиопатической гиперкальциемией), а также при превышении профилактических и лечебных доз или при одновременном назначении витамина D и УФр ребенку или беременной женщине.
При гипервитаминозе в результате усиленного всасывания кальция из кишечника и рассасывания костей развивается гиперкальциемия, приводящая к кальцификации стенок сосудов и клапанов сердца. Увеличивается освобождение лизосомальных ферментов и активируются свободнорадикальные реакции, что способствует повреждению клеток паренхиматозных органов. Повреждение клеточных и субклеточных мембран приводит к нарушению транспорта ионов К и Mg в клетки, в которых снижается содержание названных катионов. Это ухудшает деятельность многих органов и тканей, особенно страдает функция сердца, ослабляются его сокращения, могут возникнуть аритмии, ухудшается гемодинамику.
Для ликвидации гипервитаминоза помимо немедленной отмены препаратов витамина, необходимо назначить: вазелиновое масло в качестве слабительного, дльмагель, фенобарбитал, ускоряющий элиминацию витамина, а также фуросемид, увеличивающий выведение кальция и снижающий его уровень в плазме крови. Введение фуросемида необходимо повторять ежедневно до достижения 272
стойкой нормализации уровня кальция в плазме крови. Одновременно назначают инфузионную терапию с добавлением препаратов К и Mg.
Для профилактики кальцификации тканей назначают верапамил (изопТин), для нормализации развития костей — витамины А и Е, последний к тому же защищает мембраны клеток печени, почек и других тканей от свободных радикалов кислорода и продуктов перекисного окисления липидов, образующихся под влиянием высоких доз витамина D; Глюкокортикоиды тоже обладают антиоксидантным действием, тормозят всасывание кальция из кишечника, отложение его в мягкие ткани и ускоряют элиминацию витамина D, стимулируя функцию печени. Кальцитонин препятствует рассасыванию костей.
Интенсивность терапии зависит от выраженности симптомов гипервитами-ноза.
Витамин Е (а-токоферол). Препаратом витамина Е является раствор токоферола ацетата в масле. Витамин Е всасывается в верхних отделах тонкого кишечника. Профилактически а-токоферол назначают недоношенным дет^м, так как в крови и печени у них его содержание очень низкое. Вначале эГим детям витамин лучше вводить парентерально, так как его всасывание из кишечника происходит медленно и не всегда полностью. Витамин Е необходим детям, получающим искусственное вскармливание, так как в коровьем молоке этого витамина в 5—10 раз меньше, чем в женском, а полиненасыщенных жирных кислот (повышающих потребность в нем) значительно больше; новорожденным, перенесшим родовую травму, а также гипоксию в родах, у которых повышено расходование витамина. В женском молоке витамин Е находится в виде спирта (легко всасывающегося из кишечника). Его содержание в молоке, особенно молозиве, вполне достаточно как для доношенного, так и для недо-ношеннного ребенка.
Для усвоения витамина Е и его эфиров из кишечника необходимо поступление в него жира и желчи. Транспортируется токоферол липопротеидами плазмы крови, из нее он поступает во все ткани и внедряется в клеточные мембраны. Наибольшие его количества обнаруживают в жировой ткани, мышцах и печени. Эфиры витамина Е в крови и в тканях подвергается гидролизу, свободный а-токоферол и вызывает биологические эффекты. Элиминация а-токоферола в основном осуществляется путем его экскреции с желчью в просвет кишечника, но часть его реабсорбируется,.участвуя в энтерогепатической циркуляции. В печени а-токоферол образует парные соединения с глюкуроновой кислотой, которые могут выводиться из организма с мочой. Витамин Е элиминирует из организма медленно, особенно у новорожденных, у которых возможна его кумуляция.
Витамин Е увеличивает синтез белков в различных тканях: коллагена — в подкожной клетчатке и костях, сократительных белков — в скелетных, гладких мышцах и миокарде. Витамин Е активирует синтез белков слизистых оболочек, плаценты, повышает синтез ферментов, гормонов. Токоферол стимулирует образование гема (входящего в состав гемоглобина, миоглобина, каталаз, пероксидаз, цитохромов), в результате чего активируется эритропоэз, улучшается дыхание тканей.
Витамин Е необходим для нормальной репродуктивной функции человека, так как он стимулирует синтез гонадотропинов в гипофизе, развитие плаценты, образование в ней хорионического гонадотропина. В акушерской практике витамин Е назначают женщинам с угрожающим выкидышем, поздним токсикозом беременности.
273
Витамин Е обладает антиоксидантными свойствами (см. гл. 37), тормозит свободнорадикальные реакции, предотвращая образование в клеточных и субклеточных мембранах перекисное окисление, продукты которых повреждают мембраны и вызывают гибель клетки. В связи с этим токоферол используют при лечении новорожденных с гипербилирубинемией, связанной с деструкцией мембран и гемолизом эритроцитов, для профилактики ретинопатий, нередко развивающихся при интенсивной оксигенотерапии недоношенных детей.
Токоферол, стабилизируя липидные клеточные мембраны, уменьшает образование простагландинов в тромбоцитах и процесс их агрегации; в легких он защищает от повреждения ткань альвеол, способствуя синтезу сурфактанта. Поддерживая целостность мембран, витамин Е косвенно способствует активности локализованных в них энзимов, в частности, Na+, К+-АТФазы, необходимой для сохранения нормального соотношения ионов натрия и калия внутри и вне клеток, без чего невозможна их функция. Поэтому он является синергистом терапевтического эффекта сердечных гликозидов и в то же время предотвращает их токсическое действие на сердце.
Витамин Е назначают при склереме и склередеме у грудных детей, при коллагенозах у старших детей, при лечении гипервитаминоза D, при различных воспалительных заболеваниях, особенно при пневмонии, при гипохромных анемиях.
Высокие (терапевтические) дозы витамина Е можно назначать не более пяти дней, так как в избыточных количествах он вызывает нарушение функции печени, почек и других органов и тканей.
ВОДОРАСТВОРИМЫЕ ВИТАМИНЫ
Аскорбиновая кислота (витамин С). Аскорбиновая кислота содержится во многих ягодах, фруктах и овощах. Ее препаратами являются: аскорбиновая кислота, галаскорбин, аскорутин, сироп из плодов шиповника. При выраженном дефиците аскорбиновой кислоты в организме взрослых и детей наблюдается бледность кожи и слизистых, петехиальные высыпания на них, гематурия, мелена, гипохромная анемия, гиперестезия, раздражительность и другие признаки цинги.
Витамин С активно всасывается в тонком кишечнике, в небольшом количестве депонируется в лейкоцитах и почти во всех тканях организма. Элиминация аскорбиновой кислоты происходит как путем ее экскреции в неизмененном виде с мочой, так и путем биотрансформации (преимущественно в печени) в дезоксиаскорбиновую и дикетогулоновые кислоты (последняя превращается в щавелевую кислоту), выводимые с мочой.
Для профилактики гиповитаминоза аскорбиновую кислоту назначают грудным детям, так как в молоке матери его содержание невелико, особенно зимой и весной; детям, находящимся на искусственном вскармливании, так как витамин С инактивируется при нагревании молока; детям, страдающим дисфункцией желудочно-кишечного тракта, при которой нарушено его всасывание.
С лечебной целью витамин С применяют при гипоксии и метаболическом ацидозе, часто развивающихся у детей во время шока, лихорадки, инфекционных заболеваний, при обезвоживании, поскольку он участвует в окислительно-восстановительных реакциях, чем поддерживает большое число разнообразных биохимических процессов.
Аскорбиновая кислота функционирует как кофактор в процессах гидроксилирования и амидации. Она необходима для превращения остатков пролина 274
и лизина в проколлаген, в гидроксипролин и в гидроксилизин коллагена; для окисления лизиновой боковой цепи белков в процессе образования карнитина; для превращения фолиевой кислоты в фолиниевую, для окисления эндогенных и экзогенных веществ в монооксигеназной системе (с участием цитохромов Р-450), в гидроксилировании допамина и превращении его в норадреналин.
Она необходима для функционирования амидаз, участвующих в активности ряда гормонов и пептидов: окситоцина, вазопрессина, холецистокинина и пр. Она способна восстанавливать негеминовое трехвалентное железо в двухвалентное, чем облегчает его усвоение в кишечнике.
В тканях аскорбиновая кислота участвует в синтезе коллагена, протеогликана и других компонентов межклеточного матрикса в ряде тканей, в том числе в зубах, костях, эндотелии капилляров и пр. Она необходима для нормального развития и функции зубов, скелета. При ее недостаточности (цинге) нарушается их строение и функция, появляются петехии.
Витамин С назначают детям с рахитом, гипотрофией и язвенными процессами, так как он необходим для синтеза различных белков. Используют аскорбиновую кислоту при гипо- и гиперхромных анемиях и других железодефицитных состояниях (так как она способствует всасыванию железа в кишечнике, включению его в гем, а также переводу фолиевой кислоты в тетрагид-рофолиевую).
Витамин С необходимо назначать при лечении детей с инфекционными заболеваниями, так как он активирует синтез антител, интерферона, функцию фагоцитов, слизистых оболочек бронхов, представляющих барьер для инфекции.
Аскорбиновая кислота уплотняет сосудистую стенку (за счет увеличения образования межклеточного вещества и снижения активности гиалуронидазы), поэтому ее используют у детей при геморрагических васкулитах: скарлатине, кори, токсическом гриппе, болезни Шенлейна-Геноха. Она препятствует освобождению гистамина, стимулирует синтез глюкокортикоидов, что уменьшает экссудацию, поэтому ее используют при лечении аллергических реакций немедленного типа. Витамин С эффективно поддерживает артериальное давление, стимулируя синтез и сохранение от окисления катехоламинов и участвуя в образовании эндогенных стероидов.
При использовании высоких доз витамина развивается гипервитаминоз: у ребенка может повыситься возбудимость центральной нервной системы, нарушиться сон, углеводный обмен, так как образующаяся в больших количествах дегидроаскорбиновая кислота, конкурируя глюкозой за транспортный механизм, препятствует поступлению последней в ткани, при этом в плазме крови содержание сахара повышается. При приеме больших доз аскорбиновой кислоты увеличивается ее выведение почками, что снижает pH мочи, одновременно повышается образование щавелевой кислоты. В результате облегчается образование конкрементов в мочевыводящих путях. В высоких дозах аскорбиновая кислота может способствовать процессам окисления: ее метаболит — монодегидроаскорбиновая кислота — обладает прооксидантными свойствами. Для ее обратного превращения в аскорбиновую кислоту необходимо достаточное содержание восстанавливающих агентов (глютатиона, витамина Е). Содержание последних в организме недоношенного новорожденного недостаточно, и введение им даже 30—50 мг аскорбиновой кислоты может вызвать гемолиз эритроцитов и образование в них метгемоглобина. Большие дозы витамин С могут привести к прерыванию беременности, вероятно, из-за повышения эстрогенного фона.
Аскорбиновую кислоту нельзя вводить в одном шприце или инфузионной среде с мононуклеотидом рибофлавина, цианокобалламином, анальгином и многими другими лекарствами.
275
Витамин Р. В качестве лекарственных препаратов/ используют рутин, кверцетин, аскорутин, новые витамеры — венорутон и троксе-вазин. В качестве источника витамина Р назначают плоды шиповника, цитрусовые, черную смородину, черноплодную рябину и др.
Основное зн'ачение витамина Р — увеличение депонирования аскорбиновой кислоты в тканях. Собственный эффект витамина Р — нормализация структуры сосудистой стенки. Его используют преимущественно вместе с аскорбиновой кислотой для уменьшения проницаемости сосудов при скарлатине, кори, гриппе, экссудативных явлениях и т. д. Кверцетин — активный антиоксидант (см. гл. 37).
Тиамин (витамин Bi). Препаратами тиамина являются тиамина бромид и хлорид, бенфотиамин, кокарбоксилаза (коферментная форма). Тиамин содержится в растительной и животной пище, хлебе (особенно крупного помола), молоке. В грудном молоке здоровых женщин тиамина для детей доношенных и недоношенных достаточно, но при кормлении на первом году жизни молочными смесями, приготовленными на коровьем молоке, витамин Bi нужно добавлять.
Витамин Bi активно всасывается в тонком кишечнике, в печени подвергается фосфорилированию, превращаясь # моно-, ди- или трифосфат. Профилактически тиамин назначают беременным и кормящим женщинам при повышенном его расходовании, особенно женщинам с гиполактией, когда для увеличения отделения молока они употребляют много жидкости, повышая этим диурез и выведение витамина Bi из организма с мочой; больным с заболеваниями желудочно-кишечного тракта, когда нарушено его усвоение, а также при применении антибиотиков, угнетающих образование тиамина микрофлорой кишечника.
Дифосфат тиамина — кокарбоксилаза — входит в состав дегидрогеназы пировиноградной и а-кетоглютаровой кислот, а также в состав транскеталазы. Названные ферменты участвуют в регуляции углеводного обмена, понижают содержание сахара в крови, способствуют ликвидации метаболического ацидоза, активации инсулина, увеличивают синтез АТФ и восстановленного никотинамидадениннуклеотидфосфата (НАДФ • Н). Кокарбоксилазу в комплексе с другими препаратами назначают при острых гипоксических состояниях (пневмония, диабетическая кома, обезвоживание, шок, ишемия миокарда, мозга), а также при аритмиях сердца, новорожденным, перенесшим асфиксию. Витамин Bi применяют у детей с хронической сердечной недостаточностью (вместе с сердечными гликозидами), поскольку он при участии транскеталазы увеличивает синтез белков, липидов, ацетилхолина; у детей с нарушениями эвакуаторной функции кишечника (запоры, парез кишечника), с полиневритами.
Тиамин показан также при ряде заболеваний, связанных с врожденными нарушениями его обмена: при подострой некротизирующей энцефалопатии, перемежающейся атаксии, тиаминзависимой мегалобластической анемии и др. В этих случаях используют «мегавитаминные дозы» (до 1500 мг в день).
При гипервитаминозе Bi могут наблюдаться аллергические явления: зуд, крапивница, ангионевротический отек. Быстрое внутривенное введение тиамина может вызывать синаптОплегию и связанное с этим угнетение центральной нервной системы, дыхания, мышечную слабость и артериальную гипотонию.
Кокарбоксилазу и тиамин нельзя растворять вместе с лазиксом (фуросемидом), бензилпенициллином, пиридоксином, цианобаламином, АТФ, аскорбиновой кислотой.
Рибофлавин (витамин Вг). Помимо самого рибофлавина, применяют его коферментные формы — рибофлавина мононуклеотид и флави-276
нат(динатриевая соль рибофлавин-аденозин дифосфата). Рибофлавин содержится во многих пищевых продуктах, в том числе и в молоке, но обычно в связанном с белками виде. В стенке проксимального отдела тонкой кишки освобожденный от белка рибофлавин подвергается фосфорилированию и после этого быстро всасывается (путем активного транспорта).
У детей грудного возраста активное всасывание рибофлавина из кишечника происходит значительно медленнее, чем у детей старшего возраста.
Рибофлавин входит в состав флавинмононуклеотида (ФМН) и флавинаде-ниндинуклеотида (ФАД), необходимых для активности большого числа флавиновых ферментов, участвующих в транспорте водорода (т. е. в тканевом дыхании), образовании АТФ в митохондриях.
Профилактически рибофлавин назначают беременным и кормящим женщинам в связи с повышенной потребностью в нем, детям с заболеваниями желудочно-кишечного тракта. Его применяют также у детей, длительно получающих антибиотики и сульфаниламиды, подавляющие микрофлору кишечника, синтезирующую витамин.
В лечебных дозах витамин В2 применяют при гипо- и авитаминозе, особенностью которых является задержка физического развития, а в младшем возрасте — судороги, так как центральная нервная система детей этого возраста особенно чуствительна к тканевой гипоксии, развивающейся из-за недостатка флавиновых ферментов.
Следствием гиповитаминоза Вг являются ухудшение переваривающей способности кишечника, появление поноса со зловонным запахом, хейлоз, ангу-лярный стоматит, глоссит, кератит, себоррейный дерматит. Введение рибофлавина предотвращает возникновение названных явлений.
При гипоксии, связанной с нарушениями внешнего или тканевого дыхания, сердечной недостаточности, используют мононуклеотид рибофлавина. Раствор этого препарата на свету инактивируется, поэтому при необходимости вводить капельно, флакон надо обернуть черной бумагой.
Рибофлавин показан при лечении детей с гипохромными анемиями, так как благодаря ему увеличивается образование в почках эритропоэтина, усиливается синтез глобина, сохраняется восстановленная форма фолиевой кислоты. Его применяют также у детей с инфекционными заболеваниями, так как он повышает неспецифическую резистентность организма.
Рибофлавин назначают новорожденным^: гипербилирубинемией, подвергающимся светолечению, так как длительное освещение (синим светом) кожи ускоряет элиминацию витамина из организма ребенка. Токсических эффектов от введения витамина Вг и его коэнзимов не наблюдали.
Пантотеновая кислота (витамин В5). В качестве витаминного препарата используют кальция пантотенат. Недостаточность этого витамина может возникнуть при подавлении микрофлоры кишечнйка, при повышенном расходовании его в организме во время физической нагрузки и при инфекционных заболеваниях. Низкое содержание пантотеновой кислоты отмечается у детей при рахите. Из желудочно-кишечного тракта витамин В5 хорошо всасывается.
Пантотеновая кислота, входя в состав кофермента А, обусловливает процессы ацетилирования, а также синтеза нуклеиновых кислот и белков; нормализует цикл Кребса, образование ацетилхолина, АТФ, фосфолипидов и других биологически активных веществ. В связи с этим ее применяют при лечении рахита, атонии гладкой мускулатуры кишечника, мочевого пузыря (после операции), для предупреждения осложнений от некоторых антибиотиков, например, нарушения нервно-мышечной передачи и пр.
277
Пантотеновая кислота необходима для синтеза фосфолипидов, для поддержания нормальной структуры клеточных мембран всех тканей (в том числе слизистой оболочки кишечника, тканей миокарда, печени, почек и пр.).
Пантотеновая кислота способствует ликвидации метаболического ацидоза, активирует синтез коллагена и способствует профилактическому и лечебному действию витамина D.
Пиридоксин (витамин Вб). Три вещества: пиридоксин, пиридоксаль, пиридоксамини фосфаты двух последних являются препаратами витамина Вб- Пиридоксальфосфат — основная форма витамина в крови.
Витамин Вб хорошо всасывается из желудочно-кишечного тракта, в печени превращается в пиридоксальфосфат, являющийся кофактором многих ферментов. Элиминация пиридоксина происходит путем биотрансформации в пири-доксовую кислоту, экскретируемую с мочой.
В женском и коровьем молоке витамина Вб достаточно, но при нагревании молока или стоянии его на свету пиридоксаль и пиридоксамин превращается в неактивное вещество — дисульфид пиридоксаля. К. молочным смесям, приготовленным из коровьего молока, добавляют теплоустойчивый пиридоксин.
Образовавшийся в организме пиридоксальфосфат участвует прежде всего в регуляции белкового обмена. Он Необходим для активного всасывания аминокислот из кишечника, транспорта их из кровяного русла в ткани, переами-нирования, дезаминирования, декарбоксилирования аминокислот, активности аспартатаминотрансферазы, рукциндегидрогеназы, синтеза бедков; под его влиянием происходит синтез пуриновых и пиримидиновых оснований (входящих в состав нуклеиновых кислот), гема, простагландинов, коэнзима А.
Назначают витамин Вб беременным и кормящим женщинам, так как пиридоксин интенсивно транспортируется к плоду через плаценту и выводится с молоком; детям с повышенной потребностью в нем: недоношенным детям с низкой массой тела при рождении, подросткам в период полового созревания, а также детям, получающим с пищей повышенное содержание белка; при охлаждении, тяжелой физической нагрузке.
В связи с выраженным анаболическим действием пиридоксин используют для лечения гипотрофий, рахита, дистрофических изменений в миокарде, печени. Высокоэффективен витамин Вб при гипохромных анемиях, в том числе анемиях, вознйкающих во второй половине беременности, а также при симптомах раннего токсикоза беременных (неукротимой рвоте).
Дефицит пиридоксина может привести к судорожным состояниям, так как нарушает образование у-аминомасляной кислоты из глутаминовой, серотонина из триптофана, поэтому его применяют при комплексной терапии эпилепсии; для устранения судорог, связанных с интоксикацией противотуберкулезными средствами, производными изониазида, нарушающими использование пиридоксина в организме, а также его используют при терапии судорог неясной этиологии, при недостаточной функции печени, гипоксических состояниях, слабости сердечных сокращений.
Применяют витамин Вб для подавления лактации (по 600 мг 1 раз в сутки внутримышечно в течение 5-7 дней), для лечения заболеваний, возникающих из-за наличия генетических дефектов пиридоксальзависимых ферментов, например, гомоцистинурии. При неполном дефекте таких ферментов назначение больших доз (в 10—100 раз больше физиологических) может хотя бы частично устранить эти нарушения.
Фолиевая кислота (витамин Вс) — объединенное название группы фолатов, молекула которых состоит из трех компонентов: птерина, парааминобензойной кислоты и глутаминовой кислоты. Число ее остатков в разных фолатах может 278
быть различным, всасывается же из кишечника только моноглутамат. Поступают фолаты в организм с пищей (зеленые листья растений, злаки, овощи, бобы, сыр, печень) и синтезируются микрофлорой кишечника. Тепловая обработка пиши снижает содержание в них фолатов на 50-90%.
Недостаточность фолатов наиболее часто обнаруживают у беременных женщин (от 40 до 80% в разных областях страны), что является одной из причин различной патологии (недонашиваемости, пороков развития у детей, мертворождений и пр.), и у детей раннего возраста. Фолиевая кислота активно транспортируется через плаценту к плоду, и в его плазме крови и эритроцитах ее концентрация в 5 и 2 раза выше, чем в плазме крови и эритроцитах матери соответственно.
С молоком нормально питающейся матери ребенок обычно получает достаточное ее количество (50—60 мкг/л). Дополнительное назначение фолиевой кислоты не увеличивает ее содержание в молоке, поэтому в случае необходимости витамин надо назначать непосредственно ребенку.
В материнском молоке содержится фолиевая кислота в виде моноглутамата и поэтому хорошо всасывается, микрофлора же синтезирует ее в виде полиглутамата, из которого под влиянием кишечной конъюгазы должно произойти освобождение моноглутамата, который затем и всасывается. При спру, воспалительных заболеваниях слизистой оболочки (а у взрослых и при алкоголизме) отсутствует или недостаточна активность названной конъюгазы, что нарушает усвоение синтезированной микрофлорой фолиевой кислоты. Прием антибиотиков, угнетающих нормальную микрофлору кишечника, резко снижает синтез фолиевой кислоты. Дифенин и некоторые другие противоэпилептические средства образуют невсасывающиеся комплексы с ней, к тому же они и фенобарбитал стимулируют биотрансформацию фолатов в печени. Молочные смеси, приготовленные из выпаренного молока, содержат очень мало фолатов (меньше 20 мкг/л), и дети, находящиеся на искусственном вскармливании, получают совершенно недостаточные их количества. Очень мало фолатов в козьем молоке (6 мкг/л).
Ребенок в первом полугодии жизни должен получать не менее 40 мкг фолатов в сутки, во втором полугодии первого года жизни — 120 мкг/сут, с 2 до 12 лет — 200 мкг/сут. Новорожденные с очень низкой массой тела нуждаются в больших количествах фолиевой кислоты, по крайней мере 100 мкг/сут на протяжении 2—3 мес. Дети, находящиеся на искусственном ^скармливании, тоже нуждаются в повышенных количествах фолиевой кислоть!, им с конца второго месяца жизни рекомендуют назначать по 1 мг фолатов в сутки. Беременные женщины должны получать ежедневно по 800 мкг (обычные взрослые — 400 мкг), а лактируюшие женщины — 600 мкг фолиевой кислоты в сутки.
Названные количества фолиевой кислоты обеспечивают нормальное кроветворение и рост ребенка.
Фолиевая кислота под влиянием редуктаз (активируемых цианокобаламином, аскорбиновой кислотой и биотином) превращается сначала в дигидро-, а затем в тетрагидрофолиевую кислоту, которая после присоединения формильного остатка превращается в активную фолиевую кислоту. Последняя необходима для синтеза пуриновых, пиримидиновых оснований, нуклеиновых кислот и белков, т. е. для эритро- и лейкопоэза, роста ребенка, трофических и регенераторных процессов.
При недостаточности фолиевой кислоты развивается макроцитарная анемия, нарушается рост ребенка, возникает гипотрофия, затормаживается функция костного мозга, нарушается развитие центральной нервной системы, возникают гистологические и функциональные изменения в слизистой оболочке кишеч-
279
ника, нарушается всасывание железа, цианокобаламина и ряда других факторов, появляется предрасположение к возникновению энтеритов. У детей замедление роста может быть и при отсутствии анемии.
Фолиевую кислоту назначают при макроцитарной анемии, а также при других формах анемий, учитывая ее влияние на усвоение железа и цианокобаламина из кишечника. Ее применяют также у недоношенных новорожденных с первых дней жизни (по 100 мкг/сут) для профилактики гиповитаминоза; у детей с гипотрофиями, дефектами слизистых оболочек (губ, полости рта), кожи (опрелости); у детей с острой диареей для ускорения регенерации слизистой оболочки и более быстрого прекращения названной патологии.
Синтетическая фолиевая кислота — моноглутамат хорошо всасывается из желудочно-кишечного тракта при любой патологии.
При приеме фолиевой кислоты могут возникнуть нежелательные явления, чаще в виде диспепсии, но при приеме высоких доз может произойти повышение возбудимости ЦНС, возникнуть бессонница и даже судороги. Это является следствием активирующего влияния на ЦНС тетрагидрофолиевой кислоты.
Цианокобаламин (витамин В12). Основным источником цианокобаламина является микрофлора кишечника. После всасывания он попадает в различные ткани и жидкости организма человека и животных. Поэтому он содержится в молоке, мясе, печени. ’
Для его всасывания; из кишечника необходим специальный мукопротеин слизистой оболочки желудка — «внутренний фактор»; образующийся с ним комплекс поступает в тонкий кишечник, присоединяется к его поверхности, после чего с помощью еще одного специального белкового рецептора и происходит всасывание витамина. В крови он связывается с транскобаламинами 1 и II, транспортирующими его в ткани. Накапливается цианокобаламин в печени. С желчью он может выводиться в кишечник и снова из него всасываться, т. е. он участвует в энтерогепатической циркуляции. Цианокобаламин легко проникает через плаценту и накапливается в печени плода, его запасов у здорового доношенного ребенка хватает на год жизни. Меньшие его количества обнаруживают у недоношенных новорожденных и у детей женщин с его дефицитом, особенно у вегетарианок.
С молоком матери новорожденный ребенок получает около 0,3 мкг цианокобаламина в сутки, этого количества обычно достаточно для его нормального развития, при искусственном же вскармливании молочными смесями, приготовленными из кипяченого или выпаренного молока, ребенок может вообще не получить витамина, так как нагревание снижает его содержание практически до 0.
Дефицит В12 может развиться при нарушении структуры и функции слизистой оболочки кишечника (целиакии, спру, дефиците фолиевой кислоты), когда нарушается его всасывание и энтерогепатическая циркуляция; при некоторых глистных инвазиях (широкий лентец), при длительных кишечных инфекциях, когда нарушена функция рецепторного белка, связывающего витамин перед его всасыванием; после резекции части желудка, когда снижается или исчезает секреция «внутреннего фактора».
Внутри клеток цианокобаламин функционирует в виде двух коэнзимов: метилкобаламина (МКА) и дезоксиаденозилкобаламина (ДАКА). ДАКА катализирует изомеризацию 1-метилмалрнил-КоА, необходимого для образования сукцинил-КоА, участвующего в утилизации янтарной кислоты, в липидном и белковом обмене, в синтезе миелина. ДАКА необходим для активности восстанавливающих ферментов, в частности, дигидрофолатредуктазы, переводящей дигидрофолиевую кислоту в тетрагидрофолиевую; для сохранения активности сульфгидрильных групп в различных ферментах и белках, например, в глута-280
тионе, предупреждающем образование метгемоглобина и гемолиз эритроцитов (наблюдаемый при мегалобластической анемии).
МКА — ключевой фактор в поддержании активности синтетазы метионина, участвующего например в метилировании тетрагидрофолиевой кислоты, которая становится донатором метильных групп, используемых для многих биологических процессов, в том числе и для образования МКА, а метильная группа МКА метилирует гомоцистеин, превращающийся в метионин, необходимый для нормального синтеза ДНК, и являющийся донатором метильных групп для синтеза ацетилхолина, адреналина, гистамина и других биологически активных веществ.
Недостаточность витамина В12 проявляется в виде мегалобластической анемии, гипотрофии, нарушения развития функций центральной и периферической нервной системы (сказывается недостаточность миелина и ацетилхолина), ахилии.
Применяют витамин В12 прежде всего при мегалобластической анемии Адисон-Бирмера. Его прием восстанавливает нормобластическое кроветворение, нормализует продолжительность «жизни» эритроцитов, ликвидирует неврологические расстройства, нарушения секреции желудочного сока. Применяют его и при других анемиях — гипохромных (вместе с препаратами железа, фолиевой кислоты) и гипопластических, сопровождающихся геморрагиями. Кроме того, его применяют при гипотрофиях, некоторых формах кетоацидоза, в частности, при нарушении усвоения пропионовой кислоты; при заболеваниях печени, так как образующийся при его участии холин предотвращает ее ожирение; при гипоацидном состоянии, так как он способствует секреции желудочного сока; при различных радикулитах, так как он нормализует структуру нервных проводников (их миелиновых оболочек).
Никотиновая кислота (Витамин РР). Препаратами витамина являются кислота никотиновая и никотинамид.
Никотиновая кислота поступает в организм не только с пищей, но и образуется в нем из триптофана (поэтому ее относят к витаминам условно), при участии ферментов, содержащих пиридоксин и рибофлавин. Тепловая обработка молока не изменяет содержание в нем витамина РР.
Элиминация никотиновой кислоты и ее амида происходит в основном путем выведения их почками в неизмененном виде, а также путем биотрансформации в печени.
Гиповитаминоз РР может возникнуть и$-за стерильности кишечника у новорожденного, при назначении антибиотиков, из-за нарушения всасывания никотиновой кислоты, превращения ее в кофакторы. Следствием гиповитаминоза могут быть ухудшение функции желудочно-кишечного тракта, нарушение психики, дерматиты, то есть симптомы пеллагры.
Кофакторы никотинамида (НАД и НАДФ) входят в состав различных дегидрогеназ, без которых невозможны многие виды обмена, поэтому недостаточность витамина РР приводит к нарушению дыхания тканей и синтетических процессов в них, образования АТФ. В связи с этим витамин РР используют при состояниях, характеризующихся гипоксией и метаболическим ацидозом (шок, коллапс, обезвоживание и т. п.).
В связи с тем, что никотиновая кислота (но не никотинамид) увеличивает освобождение из тканей гистамина и брадикинина, улучшает микроциркуляцию, ее применяют для усиления кровотока по сосудам почек, сердца, грловного мозга, нижних конечностей, часто в комбинации с другими сосудорасширяющими лекарственными средствами (никоверин, никошпан-, ксантинола никотинат).
281
Витамин РР применяют также при заболеваниях, сопровождающихся более интенсивным образованием фибринных тромбов, так как он стимулирует фибринолитическую систему крови и препятствует агрегации тромбоцитов, нарушая образование тромбоксана А2.
Из-за освобождения гистамина никотиновая кислота может вызывать нежелательные эффекты: покраснение кожи, кожные сыпи, кожный зуд, головокружение, снижение артериального давления, повышение секреции желудочного сока.
Никотинамид подобных явлений не вызывает, но и на кровоток он не влияет.
При передозировке могут быть анорексия, рвота, гипергликемия, нарушения функции печени, ульцерация слизистой оболочки желудка. Длительное применение высоких доз неблагоприятно влияет на функцию печени.
Витамин Bis (пангамовая кислота). В качестве препарата применяют кальция пангамат. Витамин Ви, являющийся донатором метильных групп, необходим для синтеза холина, метионина, креатина, адреналина, стероидных гормонов и других соединений. Его применяют у детей с патологией печени в качестве липотропного препарату, назначают при- заболеваниях сердца, так как он способствует синтезу креатина, креатинфосфата и активирует дыхательные ферменты тканей. Витамин Bis участвует в синтезе фосфолипидов, липидов мозговой ткани, тем самым способствует восстановлению и сохранению функций мозговой ткани.
Есть сведения, что витамин В15 предупреждает возникновение аллергических реакций на пенициллин. Его также применяют для лучшей переносимости сульфаниламидов, кортикостероидов и других препаратов. Кальция пангамат обычно хорошо переносится, но необходима осторожность при его использовании у больных со значительно повышенным артериальным давлением.
Метилметионинсульфония хлорид (витамин U). Препарат является активированной формой метионина; он способен отдавать метильные группы, необходимые для синтетических процессов в организме. Метилируя гистамин, витамин U превращает его неактивную форму, что способствует снижению секреции кислого желудочного сока и уменьшению болей. Применяют его при язве желудка и двенадцатиперстной кишки, хроническом гастрите (при нормальной, пониженной и повышенной секреции), гастралгии. Препарат обычно хорошо переносится.
Биотин (витамин Н). Биотином богаты практически все продукты животного происхождения, в том числе молоко. Кроме того, биотин синтезируется бактериальной флорой кишечника. Симптомы его изолированной недостаточности: депрессия центральной нервной системы, мышечные боли, гиперэстезия, анорексия, сухой чешуйчатый дерматит с поразительно серым цветом кожи. У детей раннего возраста дефицит биотина возникает в случае длительного парентерального питания без добавления биотина.
Биотин является кофактором четырех карбоксилаз, функция которых заключается в фиксации СО2. Дефицит биотина нарушает синтез жирных кислот; катаболизм многих важнейших аминокислот, что приводит к кетолактацидозу, тромбоцитопении, неврологической патологии, задержке интеллектуального развития.
Лекарственные формы и дозы для детей витаминных препаратов даны в табл. 49.
282
Таблица 49
Витаминные препараты
Препарат Лекарственная форма Путь введения Число введении в сутки Суточная доза
Ретинол Retinolum 3,44% масляный раствор во флаконах по 10 мл Внутрь 1 До 1 года — 1 капля через день; 1—7 лет — 1 капля в день; старше 7 лет — 2 капли в лень
Эргокальциферол Ergocalciferolum 0,0625% масляный раствор во флаконах по 10 мл; в 1 мл — 25 000 ME, в 1 капле — 625 ME То же 1 Для профилактики рахита 1 капля в день
Токоферола ацетат Tocopheroli acetas 50% масляный раствор в капсулах по 0,1 и 0,2 мл 5% и 10% масляные растворы во флаконах по 10, 20, 25 мл (в 1 капле соответственно 1 и 2 мг токосЬеоола) 4 3 2-3 По 1 капсуле (беременной женщине) До 1 года — 0,005-0,01 г; старше 1 года — 0,01-0,015 г
Кислота аскорбиновая Acidium ascorbinicum 5% и 10% растворы в ампулах по 1, 2, 5 мл Таблетки по 0.025 г Внутримышечно Внутоь 1-2 3 До 1 года — 0,025—0,05 г; 1 —2 года — 0,05 г; 3-4 года — 0,1 г; 5-10 лет — 0.15 г
Тиамина бромид Thiamini bromidum 3% и 6% раствор в ампулах по 1 мл Таблетки или драже по 0,002 г Внутримышечно, подкожно Внутрь 1 2-3 0,005-0,01 г Столько мг, сколько лет ребенку, но не более 0.01 г
Кокарбоксилаза Cocarboxilasum 0,05 г в ампулах Внутримышечно, внугоивено 1-2 0,025—0,05 г
Рибофлавин Riboflavinum Таблетки по 0,002 Внутрь 3 До 1 года — 0,002 г; 2-15 лет - 0.003-0.01 г
Рибофлавина мононуклеотид Riboflavinum mononucleotidum 1% раствор в ампулах по 1 мл Внутримышечно 1 0,5—1,0 мл
Пиридоксин Pyridoxinum Таблетки по 0,002, 0,005 и 0,01 г 1% и 5% растворы в ампулах по 1 мл Внутрг/ Внутримышечно, подкожно 2-3 1-2 До 1 года — 0,001-0,002 г; 1—2 года — 0,0025 г; 3—6 лет —0,005 г; 7-9 лет — 0,01 г; 10-15 лет - 0,02-0,05 г
Никотинамид Nicotinamidum Таблетки по 0,005, 0,025 г Драже по 0,015 г 1%, 2,5%, 5% растворы в ампулах по 1 и 2 мл Внутрь Внутримышечно, подкожно 1-2 1-2-3 Детям — 0,005-0,01 г При пеллагре — 0,01-0,05 г
Кислота фолиевая Acidum folicum Таблетки по 0,001 Внутрь 2-3 До 1 года — 0,0006 г; 1-3 года — 0,001 г; 4-10 лет — 0.002 г
Цианокобаламин Cyanocobalaminum Витамин Bn Vitaminum В12 0,003%, 0,01%, 0,02%, 0,05% растворы в ампулах по 1 мл Внутримышечно, подкожно 1 До 1 года — 0,5 мкг; 1-3 года — 1 мкг; 4—7 лет — 1,5 мкг; 7—10 лет — 2 мкг
283
Глава 33 НЕВИТАМИННЫЕ КОФАКТОРЫ
К препаратам этой группы относят: карнитин, оротовую кислоту, липоевую кислоту. Все они — эндогенные метаболиты, но отчасти поступают и извне с пищей.
Карнитин — окситриметиламиномасляная кислота — образуется в печени и почках из у-бутиробетаина под влиянием специальной гидроксилазы (для образования у~бутиробетаина необходим метионин как источник метильных групп). Активность гидроксилазы у новорожденных всего 12% от уровня взрослых, последний достигается лишь к 15 годам. Таким образом, у детей первых лет и особенно месяцев жизни основным источником карнитина является пища — молоко и мясные продукты.
Недостаточность карнитина может быть у недоношенных детей, особенно находящихся на полном парентальном питании (нарушающем утилизацию метильных групп метионина); у больных на гемодиализе (происходит удаление свободного карнитина, обычно реабсорбируемого в почках); у больных с резко повышенным расходованием карййтина: гипоксия (особенно миокарда, скелетных мышц), дифтерия; при интенсивной потере из организма (прием вальпроевой кислоты, цирроз печени).
Карнитин способствует утилизации длинноцепочечных (пальмитиновой, сте-риновой и пр.) и среднецепочечных (октановая) жирных кислот. Они легко проникают из плазмы крови в цитозоль клетки, но только при участии карнитина проникают в митохондрии: он соединяется с ними, превращаясь в ацилированную форму, от нее в митохондриях жирные кислоты расщепляются, соединяются с КоА, а карнитин возвращается в цитозоль клетки и может транспортировать следующую молекулу жирной кислоты. Оказавшись в митохондриях, жирные кислоты подвергаются бета-окислению, освобождая энергию, накапливающуюся в виде АТФ, и превращаясь в кетоновые тела (Р-оксимас-ляную, ацетоуксусную кислоты) и ацетат, легко проникающие из клетки в плазму крови, а затем используются в различных метаболических процессах. Утилизация жирных кислот происходит в миокарде и скелетных мышцах, поэтому именно эти ткани особенно нуждаются в карнитине. При гипоксии происходит интенсивное его расходование, и в мышечной ткани может возникнуть его дефицит. Это не только нарушит утилизацию жирных кислот, но и снизит образование КоА в тканях, что в свою очередь нарушает многие биохимические процессы, в частности, активность пируваткарбоксилазы — ключевого фермента неоглюкогенеза. В итоге снизится образование глюкозы в печени и почках, уровень ее в плазме крови, что отрицательно скажется на функционировании всех тканей.
Карнитин способствует утилизации а-аминокислот, аммония, возникновению положительного азотистого баланса, синтезу белков, делению клеток, росту, прибавке массы тела ребенка, потреблению пищи, аппетиту.
Карнитин назначают недоношенным новорожденным, особенно находящимся на полном парентеральном питании, детям с внутриутробной гипотрофией, детям, перенесшим родовую травму и гипоксию, детям с плохим аппетитом, задержкой роста, плохими прибавками массы тела. Его применяют у больных с сердечной недостаточностью, спровоцированной или сопровождающейся ишемией миокарда. Его введение у таких больных улучшает энергообразование в 284
миокарде, силу его сокращений. Особенно большое значение он имеет у больных дифтерией, при которой уровень карнитина в миокарде падает почти до 0.
Нежелательных эффектов при приеме карнитина не отмечено.
н3сх
Н3С - N+- СН2 - СН - СН2 — С
Н3СZ он
Карнитин
/7°
СН2 - СН2 - СН - (СН2)4 - с
I I 4 ОН
S-----------s
Липоевая кислота
Оротовая кислота
Рис. 34. Структурные формулы группы невитаминных кофакторов
Липоевая (дитиооктановая) кислота в организме превращается в дигидролипоевую кислоту, образуя с ней окислительно-восстановительную систему, участвующую в транспорте водорода. Это имеет значение для поддержания процессов транспорта водорода в митохондриях, образованию в них АТФ, особенно в условиях гипоксии. Поэтому липоевую кислоту назначают больным с острой (внутривенно) и хронической (внутрь) гипоксией. Она обладает и антиоксидантными свойствами, тормозя перекисное окисление липидов, превращение НЬО в MetHb. Последнее важно для больных с сердечнососудистой патологией, получающих нитраты.
285
Липоевая кислота в качестве кофермента входит в состав ряда энзимов, регулирующих углеводный и жировой обмены. Под ее влиянием активизируются ферменты цикла трикарбоновых кислот, скорее исчезает молочная кислота и внутриклеточный ацидоз. Она стимулирует образование КоА, необходимого для утилизации жирных кислот, и ее введение ограничивает отложение жира в печени. Кроме того, она обладает гепатозащитным действием, предупреждая повреждение печени различными токсическими веществами.
Липоевую кислоту и ее амид используют при лечении детей с сахарным диабетом, так как она усиливает эффекты инсулина. При легких формах диабета она и без инсулина (но с обязательным соблюдением диеты) может поддержать углеводный обмен на нормальном уровне. Назначают ее и при различных гепатитах, так как при этой патологии отмечают резкое снижение ее содержания в печени. Введение лицоевой кислоты значительно улучшает функцию печени, активность различных ее ферментов.
Для детей большое значение имеет способность липоевой кислоты активизировать процессы синтеза белков, увеличивать прибавку массы тела растущего ребенка.
В качестве лекарства в основном применяют липамид, так как сама липоевая кислота обладает неприятным запахом и вкусом.
Оротовая кислота — эндогенный метаболит, утилизируемый для синтеза пиримидиновых оснований, входящих в состав нуклеиновых кислот. Поэтому оротовая кислота способствует синтезу белков, делению клеток, росту ребенка, прибавке массы тела, регенерации тканей, кроветворению.
Применяют ее для лечения детей с различными гипотрофиями, больных со слабостью сердечных сокращений, с нарушенной функцией печени, при различных анемиях, лейкопениях (в комплексном лечении). Прием препарата сопровождается улучшением сократительной деятельности сердца, метаболической функции печени, увеличением числа эритроцитов и лейкоцитов в крови, ускорением заживления различных язв и пр.
Лекарственные формы и дозы невитаминных коферментов даны в табл. 50.
Таблица 50
Невитаминные кофакторы
Препарат Лекарственная форма Путь введения Число приемов в сутки Однократная доза
Карнитина хлорид Camitini chloridum 20% раствор во флаконах по 100 мл Внутрь за 30 мин до еды Внутрь перед едой 2—3 в течение 2-6 нед 2-3 в течение месяца Новорожденным 0,3% раствор (разводят 3 мл 20% раствора в 200 мл 5% раствора глюкозы) по 1 fl-20 мл До 1 года по 10 капель; 1-6 лет — по 14 капель; 6-12 лет — по 1/4 ч. ложки
Липамид Lipamidum Таблетки по 0,025 г Внутрь 1-2 По 1/2-1 таблетки
Калия оротат Kalii orotas Таблетки по 0,1 г и 0,5 г Внутрь: за 1 ч до еды или через 4 ч после нее 2-3 в течение 3—5 недель 10-20 мг(кг х сут)
286
Гляви 34 ПРЕПАРАТЫ ЦИНКА И МЕДИ
Препараты цинка. В организме обнаружено около 90 металлоэнзимов, функционирующих при участии цинка. Среди них ферменты, осуществляющие синтез ДНК, ДНК-зависимой РНК-полимеразы; многие альдолазы, пептидазы, фосфатазы, супероксиддисмутаза, ангиотензинконвертируюший фермент (переводящий неактивный антиотезин-I в активный антиотензин-П), алкогольдегидрогеназа в печени и в сетчатке (в последней этот фермент участвует в использовании ретиналя) и пр. Цинк взаимодействует с компонентами клеточных мембран, поддерживая их стабильность, ограничивая, например, освобождение гистамина из тучных клеток, серотонина из тромбоцитов и т. д. Он конкурирует с некоторыми тяжелыми металлами за взаимодействие с белками. Этим он ограничивает активирующую способность железа в образовании свободных радикалов (особенно гидроксильного иона) и их повреждающее действие на клеточные мембраны. Цинк активирует лимфоидную ткань. При гипоцин-кемии обнаруживают гипоплазию вилочковой железы, лимфатических узлов, лимфопению, уменьшение числа Т-лимфоцитов, угнетение клеточного иммунитета.
У беременной женщины резко возрастает потребность в цинке, так как он активно транспортируется через плаценту к плоду, в ее крови концентрация цинка может упасть до 40% от нормы. Гипоцинкемия у матери приводит к уменьшению содержания цинка в организме ее плода и ребенка. В результате возникают внутриутробная гипотрофия и задержка нарастания массы тела ребенка после рождения.
Злоупотребление алкоголем во время беременности нарушает трансплацентарное поступление цинка, приводя к снижению его содержания в тканях плода и новорожденного. Это рассматривают как одну из причин фетального алкогольного синдрома. Недостаточность цинка в организме беременной из-за относительного или резкого ограничения белковой пищи может стать причиной врожденных пороков развития плода, недостаточной массы его головного мозга, в постнатальном периоде — причиной задержки роста, развития иммунной системы.
Потребность в цинке очень велика у новорожденных, особенно у недоношенных новорожденных, так как у них происходит интенсивный синтез белка и деление клеток, что повышает расходование цинка, а всасывание его в этом возрасте из желудочно-кишечного тракта осуществляется медленно. Поэтому они нуждаются в дополнительном назначении цинка. Их суточная потребность в нем примерно 3 мг. При парентеральном питании новорожденных детям нужны еще большие количества цинка (до 40 мг/сут). Парентеральное питание детей, особенно недоношенных, без включения цинка (и меди) в Цитательные смеси приводит к соответствующей недостаточности (в сутки таким детям надо вводить 150 мкг/кг сульфата цинка и 16 мкг/кг сульфата меди для возмещения потерь и предупреждения их дефицита). У некоторых женщин молочные железы не секретируют цинк, несмотря на его нормальное содержание в плазме крови. Кормление ребенка таким молоком приводит к гипоцинкемии. У некоторых детей цинк плохо усваивается из желудочно-кишечного тракта, что связано с генетическими особенностями организма.
Гипоцинкемия, кроме того, возникает при заболеваниях печени (увеличивается потеря с мочой), при стеаторее (цинк образует невсасывающийся комплекс с жирами и фосфатами в кишечнике), при заболеваниях почек (теряется
287
вместе с альбуминами, нарушается его реасорбция в канальцах), при гиповитаминозе D (нарушается реабсорбция в почках и отложение в костях), при ожогах (потеря с тканевой жидкостью); при назначении лекарственных средств с катаболическим действием, например глюкокортикоидов (распад белков способствует потере цинка, к тому же нарушается его всасывание из кишечника).
При гипоцинкемии у детей отмечают замедление роста и прибавки массы тела, ослабление сопротивляемости организма инфекций, медленное заживление ран, язв, ухудшение аппетита, вплоть до полной анорексии. При длительной или тяжелой гипоцинкемии появляется акродерматит (буллезно-пустулезные изменения кожи, иногда на больших поверхностях тела, не поддающееся лечению противоинфекционными средствами). Гипоцинкемия у мальчиков может в дальнейшем привести к гипогонадизму.
В качестве препаратов цинка применяют цинка сульфат или глюконат окиси цинка. Назначают их обычно внутрь, предварительно разводя в молоке. В молоке есть специальный лигандин — пиколевая кислота, которая связывает цинк и способствует его всасыванию. Особенно хорошо всасываются растворы солей цинка, разведенные в женском молоке) Лучше других препаратов дети переносят окись цинка. Для профилактической цели грудным детям можно давать молочную смесь «Детолакт», в 1 л которой содержится 5 мг цинка. С лечебной целью новорожденным назначают 5-10 мг препарата цинка в сутки. Для ликвидации акродерматита лечение начинают с 200—400 мг/сут, постепенно понижая дозу до 50 мг в сутки (меньшая доза не предупреждает рецидивд болезни).
Препараты цинка с успехом применяют для профилактики и лечения острых респираторных заболеваний у детей. Они предупреждают или уменьшают тяжесть этих инфекций.
Препараты цинка могут ослабить ряд осложнений, вызываемых глюкокортикоидами (особенно образование эрозий и язв в желудке), ускоряют заживление язв, ожогов, например, химических ожогов пищевода у детей (случайно проглотивших щелочи или кислоты).
Появились сведения о положительных результатах применения препаратов цинка при гепатолентикулярной дегенерации (болезни Вильсона) у детей. Его прием делает баланс меди отрицательным или нейтральным, предупреждая задержку меди и ее отложение в клетках печени и чечевицеобразных ядрах головного мозга.
Местно препараты давно используют в качестве антисептических, противовоспалительных и вяжущих средств.
Препараты меди. Медьсодержащие ферменты участвуют в транспорте железа через клетку слизистой оболочки кишечника, во внедрении железа в гем; они катализируют биосинтез порфиринов, созревание ретикулоцитов. Медь необходима для активности супероксиддисмутазы, очищающей ткани от избытка супероксидного аниона и этим защищающей клеточные мембраны от повреждения.
Дефицит меди у беременных животных приводит к внутриутробной гибели значительного процента плодов, высокому проценту врожденных аномалий, нарушений роста, гемопоэза.
Недостаточность содержания меди обнаруживают у значительной части недоношенных детей (ее запасы в их печени и селезенке ничтожны), у них на первом-втором месяце жизни отмечают ее отрицательный баланс. Особенно часто недостаточность меди возникает при парентеральном питании недоношенных детей, не получавших дополнительных количеств меди.
288
Дефицит меди может быть у новорожденных детей, длительно получавших парентеральное питание без ее добавления, у детей с заболеваниями желудочно-кишечного тракта, особенно при диарее, у^детей с гипотрофиями, рахитом, у быстро растущих детей, грудных детей, получающих пищу с низким содержанием меди: цельное коровье молоко, пастеризованное женское молоко. Ги-покупремия у новорожденных и грудных детей проявляется бледностью, задержкой психомоторного развития, общей гипотонией, гипопигментацией волос и кожи, изменениями костей (остеопороз, преимущественно ребер), гепато-спленомегалией, себоррейным дерматитом, расширением поверхностных вен, вакуолизацией эритроцидных и миэлоидных клеток костного мозга, сидеробластной гипохромной анемией и нейтропенией.
При гипокупремии снижается активность медьзависимых ферментов, особенно супероксиддисмутазы.
Недоношенным детям рекомендуют назначать сульфат меди в течение нескольких месяцев для профилактики анемий и других признаков ее недостаточности.
Дозы препаратов цинка и меди для детей даны в табл. 50.
Таблица 50
Препараты цинка и меди
Препарат Форма выпуска Путь введения Число введений в сутки Доза
Цинка окись Zinci oxydum Порошок Внутрь, размешав в молоке 1-3 Новорожденным — 5—10 мг в сутки; грудным — 10—15 мг в сутки; детям старше 1 года — 20-50 мг на прием
Цинка сульфат . Zinci sulfas 0,25-0,5% растворы во флаконах по 5 мл В конъюнктивальную полость 2 По 1—2 капли на прием
Меди сульфат Cupri sulfas 1 % раствор во флаконах Внутрь в молоке во время еды 2-3 По 5—15 капель на прием
Глава 35 ПРЕПАРАТЫ НАТРИЯ, КАЛИЯ, МАГНИЯ Й КАЛЬЦИЯ
Каждый из перечисленных металлов играет важную роль в регуляции многих биологических процессов. Их недостаток или избыток в организме нарушает нормальный обмен и функцию как отдельных органов, так и всего организма.
Препараты натрия. Ион натрия содержится преимущественно в плазме крови и во внеклеточной жидкости, поддерживая в них осмотическое давление и поляризацию клеточных мембран (потенциал покоя). Его проникновение через мембрану обусловливает возникновение как возбуждающего постсинаптического потенциала, так и потенциала действия, без которых невозможна ни
10 Зак. 3856
289
передача нервных импульсов, ни функция практически всех органов и тканей организма.
В качестве препарата натрия применяют преимущественно натрия хлорид. Его используют в виде изотонического, гипотонического и гипертонического растворов.
Изотонический (0,85%) раствор натрия хлорида применяют для разведения различных веществ, назначаемых в форме инъекций. Используют его и для возмещения потерь воды и натрия при различных формах обезвоживания у детей. Обычно для этой цели его вливают вместе с 5% (изотоническим) раствором глюкозы (который рассматривают как источник воды, так как глюкоза быстро сгорает) в разных соотношениях (в зависимости от формы обезвоживания). При вододефицитном обезвоживании, когда воды теряется больше, чем натрия (при одышке, лихорадке, рвоте и других состояниях), 1 объем изотонического раствора натрия хлорида смешивают с 1-2 объемами 5% раствора глюкозы. При соледефицитном обезвоживании, то есть при гипонатриемии, когда натрия теряется больше, чем воды, например при поносах, почечной и надпочечниковой недостаточности, при обильном потоотделении, сочетающемся с бесконтрольным потреблением воды, при бессолевой диете, сочетающейся с применением мочегонных, с удалением асцитической жидкости и пр., напротив, смешивают 3-4 объема изотонического раствора натрия хлорида с 1 объемом 5% раствора глюкозы. При этой форме обезвоживания нередко вливают и гипертонические растворы (2-5%) натрия хлорида для более быстрого восстановления осмотического давления плазмы крови и внеклеточной жидкости. Иначе осмотическое давление в клетке оказывается выше, чем в плазме крови, и вода, устремляясь в клетки, вызывает внутриклеточный отек с нарушением клеточного обмена, потерей калия, развитием внутриклеточного ацидоза.
Гипонатриемия проявляется беспокойством, общим возбуждением, тошнотой, головокружением, резкой гипотонией мышц и в то же время мышечными подергиваниями, тонико-клоническими судорогами, коллапсом. Все это связано с нарушением функции как периферических органов и тканей, так и центральной нервной системы.
Вливание растворов натрия хлорида, особенно гипертонического, должно производиться под постоянным контролем, так как у больного могут развиться острая сердечная недостаточность, отек легких.
Недопустима быстрая коррекция гипонатриемии! Она может вызвать миелинолиз Варолиевого моста, проявляющийся в спутанности сознания, коме, бульбарных расстройствах, пара- и тетраплегии (или парезах) и развитии отека мозга, заканчивающегося гибелью больного.
Гипертонический (10%) раствор натрия хлорида используют местно, накладывая смоченные им тампоны на гнойные раны, для отсасывания раневой жидкости, ее содержимого (ее ток идет в сторону более высокого осмотического давления), гноя, т. е. для очищения ран.
В качестве препаратов натрия можно рассматривать также натрия сульфат, используемый в качестве слабительного (см. гл. 26), натрия гидрокарбонат, применяемый как щелочное вещество (см. гл. 38), раствор Рингера-Локка, в 1 л которого (приготовленного на воде для инъекций) содержится 9 г натрия хлорида, натрия гидрокарбоната, кальция хлорида и калия хлорида по 0,2 г, глюкозы 1 г, а также глюкозо-солевые растворы для оральной дегидратации.
290
Препараты калия. Ионы калия содержатся преимущественно внутри клетки, поддерживая поляризацию клетбчных мембран, стимулируя активность многих ферментных систем, в частности, систем, участвующих в синтезе АТФ, гликогена, белков, ацетилхолина и пр.
Недостаточное содержание калия в организме может быть следствием усиленного выведения его из желудочно-кишечного тракта во время рвоты или поноса. Он может выводиться также почками при назначении некоторых мочегонных, особенно тиазидов или диакарба, гормональных препаратов (гидрокортизона и пр.), при интоксикации сердечными гликозидами и т. д. Гипокалиемия может развиться после введения препаратов инсулина, увеличивающего Проникновение иона калия в клетки. Гипокалигистия (уменьшение содержания калия в тканях) может развиваться при генерализованной или локальной гипоксии даже при нормальной концентрации калия в плазме крови: сокращение образования АТФ нарушает возврат калия в клетку.
Потеря калия клеткой сопровождается замещением его другими катионами: натрием (на 2/3) и водородом (на 1/3), что приводит к развитию внутриклеточного ацидоза и отека и к внеклеточному алкалозу в результате исчезновения иона водорода из плазмы крови. Гипокалиемия (менее 4 ммоль/л, критический уровень — 1,5 ммоль/л) и гипокалигистия проявляются тяжелыми нарушениями функций практически всех органов и тканей. Наиболее ранними признаками гипокалигистии обычно бывают нарушения деятельности сердца: слабость сокращений (результат недостаточного энергообразования и синтеза сократительных белков), аритмии — экстрасистолы, преимущественно желудочковые, блоки (результат нарушения реполяризации мембран Р-клеток и клеток проводящей системы). На ЭКГ при этом отмечают снижение и уплощение зубца Т, уменьшение и расширение комплекса QRS. Помимо нарушений деятельности сердца, у ребенка отмечают атонию кишечника (метеоризм, запоры, парезы), ослабление сокращений скелетных мышц, дыхательной мускулатуры, что особенно опасно.
В качестве препарата наиболее часто используют калия хлорид. Его назначают внутрь для профилактики гипокалиемии у детей, получающих ди-акарб или тиазиды, гормональные препараты, сердечные гликозиды, после хирургических операций совместно с анаболическими препаратами для более эффективного синтеза белка.
Внутривенно его вливают в виде 7,5% Детвора (в 1 мл содержится 1 мэкв К+) при тяжелой гипокалиемии, аритмиях сердца, при начальных формах интоксикации сердечными гликозидами (когда еще не произошло резкого увеличения содержания калия в плазме крови), при упорных рвотах, поносах, парезах кишечника. Большое значение имеет вливание раствора калия при внутриклеточном ацидозе, обычно сочетающемся с внеклеточным алкалозом, при пароксизмальных семейных параличах, связанных с внезапным выведением калия из организма.
Существует ряд препаратов, которые облегчают поступление калия в клетку и этим ускоряют ликвидацию гипокалигистии. Прежде всего этим свойством обладают инсулин с глюкозой. Поэтому специально приготовляют так называемые поляризирующие смеси, например 250 мл 5% раствора глюкозы, 30 мл 2% раствора калия хлорида и 8-10 ЕД инсулина. Особенно эта смесь показана при нарушениях деятельности сердца, внутриклеточном ацидозе. При, гиперволемии и гипергидратации применяют смесь, состоящую из 100 мл 10% раствора глюкозы, 2 ЕД инсулина, 4 мл 7,5% раствора калия хлорида и 1 мл 10% раствора кальция глюконата.
291
К препаратам калия относятся также панангин и аспаркам, представляющие собой комбинацию аспарагинатов калия и магния (с несколько разными соотношениями). И аспарагинат, и ионы магния также облегчают проникновение ионов калия в клетку. В основном их применяют внутрь при нарушениях ритма и слабости сердечных сокращений, например при язвенной болезни желудка и двенадцатиперстной кишки. В экстренных случаях (острый приступ аритмии сердца) панангин вводят и внутривенно.
К веществам, облегчающим попадание калия в клетку, относят и оксибутират натрия (см. гл. 4, 36).
При неосторожном вливании растворов калия хлорида, особенно детям с почечной недостаточностью, может развиться гиперкалиемия (содержание калия в плазме крови выше 6 ммоль/л, критическая концентрация — 9,5-10 ммоль/л), проявляющаяся в повышении нервной и мышечной возбудимости, а также в нарушении ритма сердечных сокращений (блоки).
Для устранения гиперкалиемии назначают вливание раствора инсулина с глюкозой, увеличивающих поступление калия в ткани, где он задерживается вместе с вновь синтезированным гликогеном (на 1 г последнего расходуется 13 мг калия). Одновременно можно вводить препараты кальция, являющегося антагонистом калия. f
Препараты магния. Магний — преимущественно внутриклеточный катион (99%), содержится в костях (60%), мышцах, эритроцитах и пр. В плазме крови содержится всего 1% от его общего количества, поэтому изменение в ней концентрации магния мало сказывается на его содержании в организме. Для определения дефицита магния используют нагрузочную пробу. В норме за 24 ч выводится 80% введенной дозы; меньшее выведение свидетельствует о задержке магния в тканях и о его недостаточном содержании. У новорожденных для этой цели вливают 0,12 мл/кг 25% раствора сульфата магния. При этом у большинства недоношенных и у .50% доношенных новорожденных обнаруживают его дефицит.
Гипомагниемия может возникнуть из-за нарушения всасывания магния в дистальном отделе тонкой кишки при энтеритах, спру, кишечном лимфостазе, а также при стеаторее, то есть при образовании невсасывающихся солей магния с жирными кислотами; при интенсивной потере кишечной жидкости, содержащей достаточно высокие количества магния, при длительных поносах, язвенном колите, избыточном назначении слабительных и пр.; повышенной экскреции почками. В почках он фильтруется в клубочках, а затем реабсорбируется в толстом отделе восходящего колена петли нефрона. Реабсорбция магния связана с кинетикой кальция и натрия: при интенсификации натрий-уреза и кальцийуреза увеличивается выведение и магния. Поэтому любое вливание растворов, содержащих названные катионы, увеличивает выведение с мочой и магния. Любая гиперкальциемия (в том числе даже вследствие временной гиперфункции околощитовидных желез) приводит к потере магния. Мочегонные, влияющие на петлю нефрона (фуросемид, этакриновая кислота, ртутные препараты), увеличивают выведение магния из организма. Аналогичный эффект вызывают сердечные гликозиды, гентамицин и другие аминогли-козидные антибиотики, осмотические мочегонные и алкоголь. Реабсорбция магния нарушается также при состоянии ацидоза, гипофосфатемии. Многие заболевания почек, в том числе гломерулонефрит, пиелонефрит, характеризуются нарушением реабсорбции и повышенной потерей магния. Недостаточное белково-энергетическое питание детей сопровождается дефицитом магния (у них резко снижается его содержание в мышцах).
202
Магний активирует мембранную №+К+-АТФазу, удаляя натрий из клетки и возвращая в нее калий. Этим он способствует сохранению нормального внутри- и внеклеточного содержания названных ионов, поляризацию клеточных мембран. Снижая содержание натрия в гладкой мускулатуре сосудов, он косвенно препятствует обмену натрия на кальций с помощью специального механизма и этим снижает содержание в ней кальция, а следовательно, и резистентность сосудов. Это предотвращает или снижает развитие и артериальной гипертензии, и спазма коронарных сосудов. Увеличивая поступление калия в клетки миокарда, магний способствует его влиянию на синтез гликогена, АТФ, сократительных белков, а следовательно, и нормализации силы сердечных сокращений. Миокард содержит достаточные количества магния и быстро его расходует, за три часа его обменивается 50%.
Магний активирует освобождение паратгормона и повышает реакцию костной ткани на него, повышает активность гидроксилазы в почках, переводящей кальцидиол в кальцитриол — гормоноподобный метаболит витамина D; магний участвует в регуляции освобождения многих нейромедиаторов (тормозя этот процесс), в том числе освобождение ацетилхолина, норадреналина, возбуждающих аминокислот (глутаминовой и аспарагиновой аминокислот), то есть участвует в регуляции возбудимости центральной и периферической нервной системы. Наконец, магний поддерживает эластичность мембран эритроцитов, способствует освобождению простациклина из эндотелия сосудов, улучшая этим микроциркуляцию в тканях. Последнее имеет особенно большое значение при позднем токсикозе беременных, при котором отмечают ухудшение микроциркуляции в плаценте.
При недостаточности магния в организме нарушается активность околощитовидных желез и освобождение их гормона, что приводит к уменьшению содержания кальция в плазме крови. К тому же при гипомагниемии угнетена реакция тканей на паратгормон (из-за недостаточной активности соответствующей аденилатциклазы). Гипокальциемия у таких детей не устраняется витамином D.
Гипомагниемия часто сочетается с гипокалиемией, так как нарушается реабсорбция калия в клетки тканей, особенно в миокард и скелетные мышцы. В результате развивающейся гипокалигистии возникают аритмии сердечной деятельности, повышается чувствительность миокарда к токсическому действию сердечных гликозидов, развивается мышечная слабость, сопровождающаяся (из-за гипокальциемии) фасцикуляцией, подергиванием мышц, даже локальными или генерализованными судорогами. При недостаточности магния нарушается эластичность клеточных мембран, в частности, мембран эритроцитов, что укорачивает их «жизнь» и приводит к анемии. Эта анемия характеризуется ретикуло-, сферо- и микроцитозом, гиперплазией костного мозга.
Основным препаратом магния является магния сульфат. Для получения резорбтивного эффекта его вводят парентерально (внутривенно, внутримышечно). Применяют его для восстановления нормального содержания магния в организме, а также для угнетения центральной нервной системы (см. гл. 8) и понижения артериального давления (см. гл. 23). Возмещение потерь магния устраняет все перечисленные признаки гипомагниемии.
Магния сульфат назначают детям младшего возраста для устранения гипокальциемии, не поддающейся лечению паратгормоном и витамином D; новорожденным — для профилактики вторичной асфиксии, более быстрого восстановления функций, нарушенных при гипоксии, увеличения выживаемости (при неблагоприятном течении беременности у матери); детям любого возраста
293
для борьбы с аритмиями сердца неясной этиологии, для лечения анемий, особенно связанных с рахитом.
Гипермагниемия возникает при введении избыточных количеств магния сульфата. У новорожденных она может быть после введения названного препарата матери во время родов. В период новорожденное™ выведение магния почками происходит очень медленно. Гипермагниемия характеризуется угнетением центральной нервной системы, дыхания, рефлекса, сосания, мышечной слабостью, снижением артериального давления. Для- устранения этих нежелательных явлений, особенно у новорожденных, назначают препараты кальция.
Препараты кальция. Физиологическая роль кальция в организме огромна. От него зависит активность каждой клетки; освобождение медиаторов и гормонов, участвующих в интеграции функций организма, его систем; активность автономных клеток — водителей ритма и в сердце, и в других органах (в частности, в желудочно-кишечном тракте). С кальцием связана активность огромного количества различных ферментов, факторов свертывающей системы крови, тучных клеток и т. д. Кроме того, кальций в виде фосфорнокислых солей представляет собой основу скелета.
Существует ряд факторов, регулирующих кальциевый обмен в организме. Из них наиболее важное значение $меют паратгормон, кальцитонин, витамин D (вернее его активные метаболиты).
Кальций активно транспортируется плацентой к плоду. В третьем триместре беремености прирост кальция в организме плода особенно велик (119-151 мг/(кг • сут)), одновременно высок и прирост фосфатов (до 60-85 мг/(кг сут))-, к концу беременности их прирост снижается (до 89 и 48 мг(кг • сут) соответственно). При преждевременном рождении столь интенсивного прироста Са и Р в организме ребенка не происходит, так как в молоке матери их содержится мало (30-35 мг/дл Са и 10—15 мг/дл Р). Это и является одной из причин последующего развития остеопении или рахита недоношенных. Поэтому в молоко и молочные смеси, назначаемые недоношенным, необходимо добавлять и Са и Р. В 1 дл молока их должно быть 85 и 33 мг соответственно.
Гипокальциемия — это концентрация Са в сыворотке крови меньше 1,75 ммоль/л, а ионизированного Са меньше — 0,87—0,75 ммоль/л. Ее отмечают у большого процента новорожденных детей от женщин с инсулинозависимым диабетом, у недоношенных новорожденных, у детей, перенесших в родах гипоксию (сопровождаемую повышением уровня кальцитонина в плазме крови, который препятствует мобилизации кальция и фосфатов из костей под влиянием паратгормона). При гипоксии новорожденных, наряду со снижением уровня кальция в плазме крови, падает его уровень и в эритроцитах, что сопровождается уменьшением содержания в них 2,3-дифосфоглицерата, а это нарушает отдачу кислорода тканям, усугубляя гипоксию. Введение гидрокарбоната натрия для ликвидации метаболического ацидоза снижает уровень ионизированного кальция в плазме крови.
Гипокальциемия может развиться при переливании растворов, не содержащих кальций (изотонический раствор натрия хлорида, глюкозы и др.), «цитратной» крови (то есть донорской крови, к которой добавили натрия цитрат для связывания кальция и предотвращения ее свертывания). Она может быть следствием гиповитаминоза D, гипопаратиреоидизма. Снижается активность кальция и при алкалозе, при котором увеличивается связывание этого катиона с белками плазмы, а свободная (активная) его фракция уменьшается. У новорожденных гипокальциемия может быть следствием гипомагниемии и функционального гипопаратиреоидизма. Последний связывают с гиперпаратиреои-294
дизмом матери, возникшим из-за недостаточности у нее во время беременности витамина D, чему способствует патология печени, желчных путей.
Гипокальциемия проявляется типичными судорогами, ларингоспазмом, симптомами Хвостека, Труссо, резким усилением перистальтики кишечника, угнетением миокарда (на ЭКГ удлинение интервала ST) вплоть до остановки сердца. У новорожденных ларингоспазм и симптомы Хвостека и Труссо обычно не отмечают, но у них возникают поверхностное дыхание, эпизоды апноэ, бледность или цианоз кожи, тахикардия, повышенная возбудимость, подергивание и тремор конечностей, вздутие живота, судороги.
К препаратам кальция относят кальция хлорид и кальция глюконат. Кальция хлорид — соль сильной кислоты, быстро диссоциирует. Его вводят внутрь или внутривенно. Кальция глюконат — соль слабой кислоты, медленно диссоциирует, его можно вводить еще и внутримышечно, и даже под кожу, что очень удобно в младшем детском возрасте.
Названные препараты применяют для ликвидации гипокальциемии, устранения токсических эффектов гиперкалиемии и гипермагниемии, так как кальций является антагонистом этих катионов. Препараты кальция применяют (вместе с витамином D) для лечения рахита, остеомаляции, при незарашении костных переломов, для повышения свертываемости крови (особенно, если она была нарушена переливанием жидкостей без кальция). Препараты кальция широко используют при экссудативных состояниях, связанных с воспалением (плевриты, синуситы и др.), аллергическими реакциями немедленного типа, так как кальций понижает проницаемость сосудистой стенки, входя в состав межклеточного вещества. Кроме того, фиксируясь в избыточном количестве на поверхности мембраны тучной клетки, он, вероятно, меняет ее конформационные свойства, чем мешает проникновению кальция внутрь нее и развитию последующего каскада явлений (см. гл. 40).
Назначают препараты кальция также для восстановления нервно-мышечной проводимости импульсов, нарушенных у детей аминогликозидными антибиотиками. Вместе с раствором адреналина (после предварительного введения атропина) его вводят в сердце во время внезапной его остановки, например при наркозе.
Прием раствора кальция хлорида внутрь может вызвать у ребенка рвоту в результате резкого раздражения слизистой^оболочки желудка, а внутривенное введение нередко сопровождается расширением сосудов вследствие освобождения сосудорасширяющего фактора из эндотелия артериол (оксида азота), снижения артериального давления, зуда. Быстрое внутривенное введение кальция хлорида может вызвать нарушение сердечной деятельности и даже остановку сердца (результат блокады №+К+-АТФазы в клетках миокарда). При попадании под кожу раствор кальция хлорида вызывает ее некроз. Из сказанного следует, что детям предпочтительнее назначать кальция глюконат.
Гиперкальциемия (уровень Са в плазме крови выше 2,74 ммоль/л) наблюдается при длительном приеме тиазидных мочегонных, высоких доз витаминов D, А. Ее признаками могут быть сонливость, полиурия, анорексия, рвота, запор, обезвоживание, гипертония, аритмии сердца, нефрокальциноз, поражения глаз из-за отложения Са. Для снижения уровня Са в плазме крови назначают фуросемид (увеличивающий выведение Са с мочой), преднизолон (нарушающий всасывание кальция в кишечнике), в более тяжелых случаях — натриевую соль этилендиаминтетрауксусной кислоты (увеличивающей выведение Са с мочой), кальцитонин (препятствующий рассасыванию костей).
295
Ксидофон — комплексон, связывающий Са, имеет особое отношение к его кинетике в организме. Подобно эндогенному пирофосфату он увеличивает усвоение Са, его отложение в костях, но предупреждает его отложение в мягких тканях. Пока его применяют у детей для лечения дерматомиозитов. Назначают его внутрь в виде 3% раствора, по 10—15 мг/кг. Длительный прием препарата может ликвидировать кальцинаты в мягких тканях.
Лекарственные формы и дозы для детей препаратов натрия, калия, кальция и магния представлены в табл. 52.
Таблица 52
Препараты натрия, калия, кальция и магния
Препарат Лекарственная форма Путь введения Число введений Доза
Натрия хлорид Natrium chloridum Раствор изотонический для инъекций во флаконах по 400 мл Внутривенно капельно 1 5-10 мл/кг вместе с 5% раствором глюкозы
Калия хлорид Kalii chloridum 7,5% раствор во флаконах Внутривенно капельно после раст-воре^ня в 10% растворе глюкозы 1 1,5-2 мл/кг (на 100 мл раствора глюкозы не больше 5 мл 7,5% раствора калия хлорида)
Панангин Pananginum Официнальный раствор в ампулах по 10 мл Внутривенно медленно, разведя в 20-30 мл изотонического раствора натрия хлорида или глюкозы 1 1 мл на 1 год жизни
Магния сульфат1 Magnesii sulfas 25% раствор в ампулах по 10 мл Внутримышечно 4 1-й день — новорожденному с гипомагниемией по 0,4 мл/кг в сутки. Остальные дни — в той же дозе по показаниям. Новорожденным, родившимся в состоянии асфиксии, — по 0,5—0,8 мг/кг в сутки, при тяжелой гипоксии начинают с 0,2 мл/кг, увеличивая к 3-4-му дню дозу до 0,8 мл/кг
Кальция глюконат Calcii gluconas 10 % раствор в ампулах по 10 мл Внутримышечно, подкожно 1 До 1 года — 1-2 мл; 1-4 года — 2 мл; 4—7 лет — 2,5 мл; 7-10 лет — 3 мл; старше 10 лет — 4-5 мл
Примечание. 1. Для ликвидации гипомагниемии.
Глава 36 АНТИГИПОКСАНТЫ
Антигипоксанты (АГ) — вещества, повышающие резистентность организма или отдельных органов к кислородной недостаточности.
Различают АГ специфического и неспецифического действия. К АГ специфического действия относят вещества, которые в условиях гипоксии способны сохранить или повысить активность энергосинтезирующих процессов, элект-296
ронтранспортной дыхательной системы митохондрий, активизировать ферменты биологического окисления, а также вещества, являющиеся субстратами компенсаторных метаболических путей, и препараты, улучшающие транспортную функцию крови по доставке кислорода к тканям. Некоторые АГ способны вызывать несколько из перечисленных эффектов.
ПРОИЗВОДНЫЕ ГАМК
у-Оксимасляная кислота (ГОМК) и ее натриевая соль — натрия оксибутират легко проникают в центральную нервную систему и вызывают не только угнетение ее (анальгезию, подавление судорог и наркоз (см. гл. 18, 11), но и отчетливый АГ эффект. ГОМК в нейронах превращается в янтарный полуальдегид, образующий с ним систему, участвующую в транспорте Н+ от НАДН к флавиновым ферментам в дыхательной цепи митохондрий, устраняя этим дефицит окисленной формы НАД, являющийся акцептором водорода на 1 этапе названной цепи от ее субстратов (пирувата, малата, глутамата, жирных кислот и пр.). В связи с улучшенной утилизацией пировиноградной и молочной кислот исчезает внутриклеточный ацидоз. ГОМК (подобно ГАМК) способна через янтарный полуальдегид превращаться в янтарную кислоту, увеличивая этим ее пул (известно, что в условиях гипоксии средней тяжести происходит переключение дыхательных процессов в митохондриях на II этап — утилизацию янтарной кислоты, минуя I этап, связанный с активностью НАД). Этим ГОМК поддерживает процессы окислительного фосфорилирования в митохондриях, образование АТФ, необходимого для сохранения функции нейронов в условиях гипоксии. ГОМК облегчает проникновение К+ в клетки, способствуя ликвидации гипокалигистии и внутриклеточного ацидоза (входящий К+ вытесняет из клетки Н+), но одновременно мбжет развиться гипокалиемия. Для ее профилактики или устранения одновременно с ГОМК назначают калия хлорид (в дозе, составляющей 1/10 от дозы ГОМК). Выходящий из клетки Н+ может ликвидировать внеклеточный алкалоз.
В качестве АГ ГОМК применяют в экстренных случаях при генерализованной гипоксии разного происхождения, гипоксии мозга, например, при черепно-мозговой травме; при внутриутробной гипоксии плода у женщин с поздним токсикозом беременных; при оказании помощи новорожденным, находящимся в состоянии гипоксии.
Вводят препарат внутривенно медленно, иначе могут возникнуть судороги. Поскольку ГОМК способствует эффекту сосудосуживающих средств, его нельзя назначать вместе с ними или больным с гипертоническим кризом.
Фенибут и пантогам (производные ГАМК, см. гл. 4) по механизму действия похожи на ГОМК. Они хорошо всасываются из желудочно-кишечного тракта и проникают в мозг, поэтому их назначают внутрь. Используют эти препараты для поддерживающей терапии больных, перенесших острую гипоксию, для лечения больных с черепно-мозговой травмой, у пожилых больных при атеросклеротических нарушениях кровоснабжения мозга. Их тоже надо назначать вместе с препаратами калия (аспаркамом) или пищей, содержащей повышенное количество калия (картофель, овощные или фруктовые соки, изюм, урюк и пр.).
Пирацетам (ноотропил, пирамем — см. гл. 4) — производное пирролидона — очень активный АГ. Он способствует утилизации глюкозы, активности гексозомонофосфатного шунта, являющегося поставщиком фруктозомонофосфата и фруктозодифосфата — метаболитов гликолиза, усваиваемых и в самом
297
этом шунте и в цикле Эмбдена-Мейергофа. В результате образуется АТФ и окисленный НАД, способный воспринимать Н+ от окисляемых субстратов (пирувата, малата и пр.). Возрастает пул АТФ, необходимый для поддержания активности нейронов. Этому способствует улучшение мозгового кровотока, вызываемого пирацетамом, улучшение им реологических свойств крови (так как он является дезагрегантом), и эластичности мембран эритроцитов, что облегчает их проходимость по капиллярам.
В качестве АГ пирацетам применяют при внутриутробной и перинатальной гипоксии плода и новорожденного, улучшая последующее постнатальное развитие ребенка, снижая риск нарушений в развитии мозга и гибели ребенка. Применяют его и для поддерживающей терапии больных, перенесших острую гипоксию разной этиологии.
ПРОИЗВОДНЫЕ ГУАНИЛТИОМОЧЕВИНЫ, МЕРКАПТОБЕНЗИМИДАЗОЛА И ПР.
Гутимин — производное гуанилтиомочевины. Он способствует поступлению глюкозы в клетки различных? органов и тканей, ее утилизации в них (повышая активность гексокиназьг и малатдегидрогеназы), устраняя избыток Н+ в цитозоле клеток. Он активирует процесс окислительного фосфорилирования в митохондриях даже при гипоксии средней тяжести, увеличивает синтез АТФ. К тому же он тормозит гидролазы АТФ. Возросший пул этого макроэрга обеспечивает функционирование нейронов и клеток других тканей в условиях гипоксии. Кроме того, гутимин тормозит процессы липолиза, поддерживая нормальную структуру клеточных и субклеточных мембран. Наконец гутимин способствует диссоциации оксигемоглобина, обеспечивая этим лучшую доставку кислорода тканям.
Применяют гутимин при разных формах гипоксии, в том числе при внутриутробной гипоксии плода.
Амт и зол — производное диамино-тиодиазола — по фармакодинамике похож на гутимин. Его также применяют при различных формах гипоксии, включая внутриутробную гипоксию плода женщин с поздним токсикозом беременных.
Бемитил — производное меркаптобензимидезола — активный АГ и ак-топротектор. Он активирует синтез и активность ферментов глюкогенеза, увеличивая этим образование (в печени и почках) глюкозы и потребление ее мозгом, миокардом, мышцами. В процессе неоглюкогенеза происходит «очищение» организма от молочной кислоты и аммиака, утилизируемых в глюко-золактатном и глюкозоаланиновом циклах. Бемитил снижает потребление кислорода тканями, теплопродукцию, расходование энергетических ресурсов на единицу выполненной работы. Он стимулирует синтез РНК, белков, в том числе митохондриальных, процессы окислительного фосфорилирования и образования АТФ; повышает активность антиоксидантных ферментов (суперок-сиддисмутазы, каталазы).
Бемитил применяют преимущественно при хронической гипоксии. При острой гипоксии мозга он менее эффективен. Его с успехом применяют при психической астении различного генеза, при реабилитации больных, перенесших острый гепатит (скорее восстанавливается масса печени, уменьшается выраженность и длительность нарушений ее функции), лучевую болезнь; он способствует ликвидации патологических явлений при нервно-мышечных заболеваниях (прогрессирующая миодистрофия, вторичные миопатии и пр.), вестибулярных расстройствах, иммунопатологических процессах, так как акти
298
вирует гуморальный и особенно клеточный иммунитет, например, у больных с рецидивирующим рожистым воспалением.
Прием бемитила у некоторых больных сопровождается неприятными ощущениями в области желудка, печени, тошноты, особенно при приеме натощак; может возникнуть избыточное психоактивирующее действие: эффективная лабильность, раздражительность, уменьшение глубины и продолжительности ночного сна. Снижение дозы, временная отмена препарата или назначение короткими курсами (по 3—5 дней с перерывами на 2-3 сут) уменьшает выраженность нежелательных эффектов.
Этомерзол — тоже производное бензимидазола. Он как и бемитил является антигипоксантрм, актопротектором (веществом, повышающим физическую работоспособность и КПД физической работы без увеличения потребления кислорода и теплопродукции) и антиоксидантом (см. ниже). Он увеличивает синтез РНК и белков-ферментов, энергопродукцию, утилизацию метаболитов, в частности, лактата, пирувата и аммиака.
Применяют этомерзол при хронической гипоксии, психической астении, для лечения больных лучевой болезнью и перенесших гепатит и пр.
ПРЕПАРАТЫ,
СПОСОБСТВУЮЩИЕ ОБРАЗОВАНИЮ И УТИЛИЗАЦИИ ЯНТАРНОЙ КИСЛОТЫ
В условиях гипоксии янтарная кислота образуется не только в цикле трикарбоновых кислот, но и ускоренным способом путем активации аспартатаминотрансферазы (Ас-АТ) и в несколько меньшей степени аланин-амино-трансферазы (Ал-АТ). При их участии глутамат превращается в ГАМК, а она через янтарный полуальдегид в янтарную кислоту. Введение глутаминовой и аспарагиновой (в виде аспаркама) кислот способствует образованию янтарной кислоты. Следует предостеречь только от применения глутаминовой кислоты при генерализованной гипоксии или гипоксии мозга, особенно у детей раннего возраста. В. этих условиях глутаминовая кислота интенсивно освобождается в головном мозге из глутаматергических нейронов и не может быть возвращена в них специальным транспортным механизмом в связи с недостаточностью энергии. Высокое содержание глутамата в межнейронных структурах вызывает гибель глутаматергических нейронов с последующими нарушениями структуры и функции мозга. У детей раннего возраста глутамат легко проникает в мозг и может усугубить названные патологические явления.
Кофактором трансаминаз является пиридоксальфосфат, поэтому его введение или введение пиридоксина (витамина Вб, см. гл. 32) ускоряет образование янтарной кислоты. Повышает активность трансаминаз липоевая кислота и некоторые барбитураты (например, фенобарбитал). Кокарбок-с и л а з а, входящая в состав кетоглутарат-дегидрогеназы, и тиамин способствуют образованию янтарной кислоты в цикле трикарбоновых кислот. Утилизируется янтарная кислота при участии сукциндегидрогеназы, а она является флавиновым ферментом. Поэтому введение рибофлавина, рибофлавина мононуклеотида и флавината (натриевой соли рибофлавин-аде-нин-динуклеотида) способствует активности фермента и усвоению янтарной кислоты.
Хорошие результаты при лечении больных с гипоксией получены от применения следующих комбинаций: пиридоксина с тиамином, пиридоксина с рибофлавином, рибофлавина с липоевой кислотой, пиридоксальфосфата с ри
299
бофлавином. В острых ситуациях их вводят путем инъекций, а при хронической гипоксии — внутрь.
Проксипин — сукцинатсодержащее производное оксипиридина — активный АГ, максимально эффективный в острый период гипоксии с ишемией тканей (миокарда, мозга). Он способствует компенсации дефицита энергии за счет активации сукцинатоксидазного пути окисления; модулирует активность ферментов субстратного участка дыхательной цепи митохондрий; уменьшает потери АТФ, тормозит деградацию адениннуклеотидов, восстанавливает энергетический заряд. Помимо антигипоксантного препарат вызывает также антис-трессорный, анксиолитический, антидепрессорный и противосудорожный эффекты. Он не вызывает существенных нежелательных эффектов.
СУБСТРАТЫ
ДЛЯ УТИЛИЗАЦИИ ПО АЛЬТЕРНАТИВНЫМ МЕТАБОЛИЧЕСКИМ ПУТЯМ
Фруктозо-монофосфат и фруктозо-дифосфат. Это — метаболиты, образующиеся и утилизируемые в пентозофосфатном цикле (гексозо-монофосфатном шунте) и в цикле Эмбдена-Мейергофа. Основное значение имеют при ишемии миокарда. Внутривенное их введение сопровождается уменьшением образования лактата, исчезновением внутриклеточного ацидоза, снижением потребления глюкозы миокардом (в связи с интенсивным потреблением названных метаболитов), кислорода митохондриями при окислении глутаминовой, альфа-кетоглутаровой и янтарной кислот; активацией окислительного фосфорилирования и образования АТФ. В результате улучшается коронарный кровоток, работа сердца в условиях ишемии и ацидоза, уменьшаются размеры инфаркта миокарда. Имеет значение и способность названных метаболитов снижать сродство гемоглобина к кислороду, то есть лучше отдавать его тканям.
Адениловая кислота (МАП) тоже содержит фруктозо-дифосфат, и ее давно используют при лечении миокардиодистрофии, спазмах периферических сосудов. Назначают внутрь.
ВЕЩЕСТВА, ПОВЫШАЮЩИЕ ДОСТАВКУ КИСЛОРОДА ТКАНЯМ
Помймо названных гутимина, пирацетама, фруктозо-фосфатов, этим свойством обладают пентоксифиллин (трентал), препараты магния и милдронат.
Пентоксифиллин (см. гл. 3) снижает сродство гемоглобина к кислороду и повышает эластичность мембран эритроцитов, облегчая их прохождение по капиллярам. Последнему способствуют и препараты магния (магния сульфат, асп аркам).
Милдронат — синтетический аналог у-бутилобетаина (предшественника карнитина, см. гл. 33) — увеличивает содержание в эритроцитах 2,3-дифос-фоглицерата, взаимодействующего с цепями дизоксигемоглобина, стабилизирующего его конформацию и увеличивающего отдачу кислорода тканям. Кроме того, милдронат способствует синтезу метгемоглобинредуктазы и этим снижает содержание метгемоглобина в эритроцитах, обычно повышенного при гипоксиях различного происхождения, в частности, у. больных с хронической сердечной недостаточностью, особенно при приеме нитритов. Милдронат обладает и антиоксидантным действием.
300
Триметазидин (предуктал) обладает и антигипоксантным и антиоксидантным действием. Во время гипоксии он способствует нормализации энергетического метаболизма тканей (миокарда, мозга), предотвращает снижение внутриклеточного содержания АТФ, креатинфосфата, гликогена, восстановленного глутатиона, активности супероксиддисмутазы, каталазы, предотвращает накопление лактата, тормозит ПОЛ, сохраняет нормальное функционирование ионных каналов.
Препарат полифенолов — олифен — жадно связывает электроны, повышая этим активность ферментов дыхательной цепи митохондрий. К тому же, он способствует сохранению восстановленного глутатиона — активного эндогенного антиоксиданта, препятствуя ПОЛ клеточных и субклеточных мембран.
Кофермент Q (убихинон) — компонент дыхательной цепи митохондрий, участвующий в переносе ионов водорода. К тому же он способен тормозить ПОЛ, то есть снижать антиоксидантное действие.
Применяют его при хронической гипоксии, лучевой болезни, после перенесения гепатита (для восстановления функции печени) и пр.
К антигипоксантам неспецифического действия относят различные сосудорасширяющие вещества, особенно те, что улучшают мозговое кровообращение (кавинтон, девинкан), антикальциевые препараты (циннаризин, нифедипин), 0-адреноблокаторы (анаприлин), ингибиторы каскада арахидоновой кислоты (индометацин) и пр. Большинство из этих препаратов обладает и антиоксидантным эффектом.
Глава 37 АНТИОКСИДАНТЫ
Антиоксиданты — вещества, устраняющие или тормозящие чрезмерно активированные свободнорадикальные реакции и перекисное окисление липидов.
Основными источниками активных форм кислорода (АФОг) являются: нейтрофилы и другие фагоциты в процессе активации их функции; гипоксантин, накапливающийся при гипоксии и утилизируемый при реоксигенации под влиянием ксантиноксидазы; процесс образования метаболитов арахидоновой кислоты; аутоокисление гемоглобина. К АФО2 относятся: супероксидный анион (Ог), перекись водорода (Н2О2), гидроксильный ион ('ОН) и синглетный кислород (’О2). АФО2 повреждают многие компоненты клеток, но особенно быстро происходит изменение в структуре полиненасыщенных жирных кислот, входящих в клеточные и субклеточные мембраны. Происходит перекисное окисление липидов (ПОЛ) мембран, что повышает их проницаемость, увеличивает поступление Са++ внутрь клетки, в ее цитоплазме возрастает концентрация свободного Са++, активирующего многие протеолитические и липолитические ферменты, усугубляя нарушения функции клетки и вызывая даже ее гибель.
Активация ПОЛ отмечена при огромном числе разнообразных заболеваний воспалительного, аутоаллергического характера, ишемических повреждений мозга, сердца, при проведении некоторых лечебных процедур (кислородотера-пия, гипербарическая оксигенация, ультрафиолетовое облучение), приема лекарств, обладающих прооксидантными свойствами (тетрациклины, изониазид, парацетамол, примахин, адриамицин, рубомицин, аминазин, препараты железа, меди, ртути, свинца и пр.).
301
Антиоксиданты могут непосредственно взаимодействовать с АФОг, устранять ионы железа, меди, активирующие свободнорадикальные реакции, изменять структуру мембран, ограничивая доступность полиненасыщенных жирных кислот (ПНЖК) для окислителей, повышать активность антиоксидантных эндогенных ферментов (супероксиддисмутазы, каталазы, глутатионпероксидазы и пр.).
а-Токоферол (витамин Е, см. гл. 32) — наиболее активный и широко применяемый антиоксидант. Он связывает пероксидные радикалы ПНЖК, прерывая этим цепь свободнорадикальных реакций, предотвращает ПОЛ. Кроме, того, он предупреждает или тормозит окисление селенидов в мембранах митохондрий, поддерживает активность глутатионпероксидазы (в молекуле которой содержится 4 атома селена). Витамин Е активирует синтез гема, гемоглобина и гемсодержащих ферментов (каталазы, пероксидазы), т. е. косвенно он способствует и транспорту кислорода тканям, и инактивации перекисей.
Карнитин (см. гл. 33) — ацетил-карнитин и синтетический аналог их предшественника (у-бутиробетаина) — милдронат — нормализуют жировой обмен, ограничивают окисление липидов, тормозят образование гидроперекисей и этим сохраняют целостность клеточных мембран.
У больных с сердечно-легочной^недостаточностью милдронат увеличивает альвеолярную вентиляцию, устраняет гипоксемию, нормализует иммунологические показатели, центральную и периферическую гемодинамику. У новорожденных, перенесших хроническую внутриутробную гипоксию, карнитин способствует быстрому обратному развитию патологических симптомов, восстановлению первоначальной массы тела, снижению интенсивности физиологической желтухи, улучшению прогноза.
Аскорбиновая кислота (см. гл. 32) является донатором Н+ и способствует восстановлению свободных радикалов кислорода, преимущественно вне клетки, но отчасти и внутри нее. Как антиоксидант наибольшее значение имеет при воспалительных заболеваниях легких. Этот эффект особенно отчетлив у больных с достаточным содержанием в организме витамина Е и глутатиона. При их дефиците аскорбиновая кислота преимущественно может быть в форме моногидроаскорбиновой кислоты, являющейся свободным радикалом и обладающей прооксидантными свойствами.
Эссенциале — сложный препарат, содержащий фосфолипиды и комплекс витаминов, обладающих антигипоксантными (тиамин, рибофлавин, пиридоксин, никотинамид) и антиоксидантными свойствами (цианокобаламид, а-то-коферол). Фосфолипиды способны внедряться в структуру мембран и препятствовать чрезмерному ПОЛ, этому содействуют и содержащиеся в препарате витамины.
Эссенциале с успехом применяют при гестозе и нефропатии беременных. Его введение улучшает состояние женщин и новорожденных. Дети рождаются с большей массой тела, лучшей оценкой по шкале Апгар, они скорее адаптируются к условиям внеутробной жизни.
Эстрогены — стабилизируют клеточные мембраны и предотвращают ПОЛ.
Флавоноиды — кверцетин, силибор, фламин, флакумин — инактивируют ОН и Ог, ограничивая этим их повреждающее воздействие на клеточные мембраны. Кверцетин к тому же блокирует липоксигеназу, тормозя синтез лейкотриенов, в частности лейкотриена Вд. Этим он ограничивает приток гранулоцитов в ишемизированный миокард, стенки коронарных сосудов, способствуя сохранению эндотелиального и гладкомышечного их слоя. В итоге кварцетин улучшает сокращения инфарцированного миокарда, ограничивает 302
размер очага инфаркта. Кверцетин и его производное рутин (витамин Р) нерастворимы в воде, и их назначают в порошках внутрь. Водно-растворимый венорутон вводят и внутривенно.
Силибор, фламин и флакумин преимущественно защищают мембраны гепатоцитов.
Карнозин — эндогенный дипептид, в большом количестве содержащийся в скелетных мышцах, подавляет аскорбат — зависимое ПОЛ мембран, взаимодействует с продуктами превращения липидов, тушит синглентнвш кислород, взаимодействует с ОН и О2, образует комплексный, длительно живущий метаболит, постепенно элиминирующий из организма. В комплексе с медью и цинком проявляет супероксиддисмутазную активность.
Его применяют для профилактики и лечения заболеваний с чрезмерно активированными процессами ПОЛ.
Аллопуринол — ингибитор ксантиноксидазы — предупреждает образование О2 в период реперфузии из гипоксантина, накапливающегося при гипоксии в миокарде, легких, стекловидном теле, кишечнике, крови, и предотвращает (по той же причине) избыточное превращение в стенке кишечника восстановленного глутатиона в окисленную форму.
Аллопуринол активно используют при лечении больных с ИБС, ишемическим поражением кишечника и других органов и тканей (кроме центральной нервной системы, в которой активность ксантиноксидазы невелика).
Нестероидные противовоспалительные средства (см. гл. 31), тормозя синтез простагландинов, нарушают и образование АФОг. Основное значение это имеет для мозговой ткани и для подавления воспаления любой локализации. Введением индометацина (наиболее сильного ингибитора синтеза простагландинов) можно существенно уменьшить ПОЛ клеточных и субклеточных мембран.
Ионол (дибунол) — противоопухолевый препарат, обладающий антиоксидантной активностью, по интенсивности иногда превышающий эффективность витамина Е. Его с успехом применяют при заболеваниях, связанных с'повышенным образованием АФОг и ПОЛ, например, при ИБС, лучевых и трофических поражениях кожи, слизистых оболочек, стрессах, язвенной болезни желудка и двенадцатиперстной кишки.
Димефосфон (см. стр. 307) увеличивает функцию окислительно-восстановительной системы глутатиона, предохраняя от окисления сульфгидрильную группу. Этим он повышает антиоксидантную активность крови и предотвращает ПОЛ.
d-Пеницилламин — (см. гл. 40) связывает железо и этим уменьшает его стимулирующее влияние на образование "ОН. Комплекс d-пеницилламина с медью обладает активностью супероксиддисмутазы и ликвидирует OL
Унитиол — обычно используют в качестве противоядия (см. стр. 398), но он отвлекает на свои сульфгидрильные группы окисляющие радикалы, сохраняя этим активность тиоловых групп различных биологически активных веществ, в частности глутатиона. Его используют перед сеансами гипербарической оксигенации, при хронической гипоксии плода у женщин с гестозом, для предотвращения интенсификации свободнорадикальных реакций и ПОЛ.
Пиразидол — обратимый ингибитор МАО А типа. Обычно его применяют в качестве антидепрессанта при психических депрессиях (см. гл. 4). Он подавляет измененную при гипоксии активность названного фермента, который в этих условиях приобретает способность инактивировать не только МАО, но и глюкозамин, чем увеличивает микровязкость и ПОЛ мембран эритроцитов,
зоз
а также концентрацию внеэритроцитарного гемоглобина в плазме крови. Похожие изменения в активности МАО происходили при отравлении кислородом. Пиразидол угнетает активность МАО и предотвращает перечисленные изменения. Назначают его за 30 мин до проведения гипербарической оксигенации.
Тауфон (таурин) — серосодержащая аминокислота, способствующая энергетическим процессам, участвующая в обмене жиров и пр. Обнаружено, что он обладает антиоксидантными свойствами, улучшая функцию печени у людей, подвергшихся ионизирующему облучению. Его прием приводит к сохранению активности супероксиддисмутазы, глутатионпероксидазы в эритроцитах.
Резорцин — стабилизирует мембраны, предотвращает ПОЛ и структурные изменения в клетках. Применяют его местно при заболеваниях кожи.
Дозы и режим приема антигипоксантов и антиоксидантов см. в табл. 53.
Таблица 53
Антигипоксанты и антиоксиданты
Препарат Лекарственная форма Путь введения Г:- Число введений в сутки Однократная доза
Гутимин Gutiminum Порошок растворяют в 200—400 мл 10% раствора глюкозы Внутривенно 1 Роженице 4—6 мг/кг
АмтиЗол Amtizolum Порошок растворяют в 200—400 мл 10% раствора глюкозы Внутривенно 1 Роженице 4-6 мг/кг
Эссенциале Essentiale Ампулы по 5 или 10 мл препарата, содержащих 250 или 1000 мг эссенциальных липидов В вену пуповины. Внутривенно капельно в 5% растворе глюкозы 1 Новорожденному 1—2 мл Курс — 7 дней /
Унитиол Unithiolum 5% раствор в ампулах по 5 мл Внутримышечно 1 1 мл/10 кг массы тела (в любом возрасте)
Пиразидол Pyrazidolum Таблетки по 0,025 г и 0,05 г Внутрь 1 За 30 мин до гипербарической оксигенации (подростку и взрослому)
Глава 38 СРЕДСТВА, ИСПОЛЬЗУЕМЫЕ ДЛЯ НОРМАЛИЗАЦИИ КИСЛОТНО-ОСНОВНОГО СОСТОЯНИЯ
Поддержание постоянства кислотно-основного состояния (КОС) является одним из необходимых условий гомеостаза. Отклонение pH крови от нормальных величин (7,35—7,42), то есть явления ацидоза или алкалоза, могут наблюдаться при патологии сердечно-сосудистой, дыхательной, пищеварительной систем, отравлениях лекарственными препаратами и ядами, и ряде других состояний. Для ликвидации ацидоза (или алкалоза) необходимо устранить его при
304
чины, но в процессе их устранения в невыясненных или тяжелых ситуациях включаются средства, прямо нормализующие КОС.
СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ МЕТАБОЛИЧЕСКОГО АЦИДОЗА: КИСЛОРОД, НАТРИЯ ГИДРОКАРБОНАТ, ТРИСАМИН
Кислород устраняет артериальную гипоксемию, активизирует в крови и тканях аэробные процессы, способствует утилизации недоокисленных метаболитов разных видов обмена (молочной, пировиноградной, жирных кислот и пр.), то есть ликвидирует явления и гипоксии, и ацидоза. Вместе с тем следует помнить, что гипероксия не менее опасна, чем гипоксия. При избыточном поступлении кислорода в организм наблюдается ряд нежелательных эффектов и прежде всего у новорожденных и недоношенных детей. Гипероксия активирует образование свободных радикалов кислорода (супероксидного аниона 05, гидроксила ‘ОН; перекиси водорода Н2О2, атомарного кислорода), которые вызывают окисление липидов клеточных мембран, образование из них перекисей липидов, что повреждает мембраны клеток. Гипероксия нарушает функцию мембран легочной ткани, головного мозга, сетчатки глаза (последнее приводит к развитию ретролентальной фиброплазии и слепоте). В связи с этим рекомендуется назначать новорожденным, особенно недоношенным детям, длительное вдыхание газовой смеси, содержащей не более 30% кислорода. Смесь, содержащую 60% кислорода, можно давать вдыхать ребенку не больше 6-10 ч, 80% — не больше 2—3 ч. Газовая смесь должна быть увлажнена и нагрета. Для профилактики повреждений легких, глаз назначают витамин Е (см. гл. 32).
Натрия гидрокарбонат при взаимодействии с кислыми продуктами образует натриевые соли органических кислот и угольную кислоту, которая элеминируется легкими и почками:
NaHCOs + Н+А (анион кислоты) -» Н2СО3 + NaA
Н2О СО2
В результате исчезает избыток ионов водорода, то есть ацидоз, и возрастает щелочной резерв. Препарат оказывает эффект быстро, но ликвидирует только внеклеточный ацидоз, так как внутрь клеток бикарбонатный анион не проникает. У новорожденных натрия гидрокарбонат следует использовать только в тяжелых случаях метаболического ацидоза, при снижении pH крови ниже 7,2-7,25.
Нежелательные эффекты натрия гидрокарбоната обусловлены возрастанием парциального давления углекислоты и концентрации натрия в плазме крови. Они возникают у больных с тяжелой (III и IV степенью) сердечной недостаточности. Увеличение углекислоты в плазме крови может привести к гиперкапнии и остановке дыхания, чаще наблюдаемой у недоношенных детей. Про-' никая в клетки (при недостаточной вентиляции легких), углекислота способствует возникновению внутриклеточного ацидоза, сопровождающегося нарушением аэробных и возрастанием анаэробных процессов, увеличивается образование лактата, усугубляющего нарушения КОС. Это проявляется в ухудшении сократительной деятельности сердца, торможении процессов неоглюкогенеза в печени и почках, уменьшении уровня глюкозы в крови. Следовательно, введению натрия гидрокарбоната должны предшествовать мероприятия по нала
305
живанию адекватной вентиляции легких — оксигенотерапия. Вливание натрия гидрокарбоната приводит к торможению диссоциации оксигемоглобина и этим снижает доставку кислорода тканям, усугубляя их гипоксию. Поэтому к назначению препарата больным с сердечной недостаточностью надо относиться осторожно. Задержка натрия в организме, особенно при его недостаточной экскреции (в младшем возрасте или заболевании почек), приводит к повышению осмотического давления плазмы крови, гиперволемии, опять же к увеличении нагрузки на сердце и к отекам. Поэтому гипернатриемия может быть причиной внутричерепных кровоизлияний у новорожденных, особенно недоношенных детей, у которых в связи с недостаточным развитием базальной мембраны клеток эндотелия капилляров мозга, выполняющих функцию гемато-энцефалического барьера, гиперволемия и гиперосмолярность плазмы приводит к «открытию» гематоэнцефалического барьера и развитию внутримозговых геморрагий. Проникновение натрия в цереброспинальную жидкость и повышение ее осмотического давления способствует внутриклеточному обезвоживанию мозга и нарушению его функции. Вводить растворы натрия гидрокарбоната целесообразно внутривенно медленно, капельно в 4% или 2% концентрации. После его введение следует назначить фуросемид, чтобы ускорить выведение излишнего для организма натрия.
Трисамин (ТНАМ, трисаминол, трисбуфер) — слабое основание, являющееся акцептором ионов водорода. В растворе взаимодействует с кислотами, в частности с угольной, убирая ион водорода и оставляя бикарбонатный анион:
(СН2ОН)з = C-N+H2 + Н+А (СН2ОН)3 = CNH3 + А", (Н2СОз)~ (НСО?)
где А — анион.
Оставшиеся от кислот анионы, преимущественно органические, подвергаются метаболизму, а бикарбонатный анион увеличивает щелочные резервы. 30% трисамина в виде целых недиссоциированных молекул проникает через мембраны клеток и через гематоэнцефалический барьер в мозге. Поэтому трисамин может устранить не только внеклеточный, но и внутриклеточный ацидоз, в том числе и в нейронах мозга. Эффект трисамина в отличие от натрия гидрокарбоната развивается сравнительно медленно. Примерно 80% его выводится в течение 3 суток в неизмененном виде почками, и повторные введения допустимы лишь через 2-3 суток.
Трисамин назначают при метаболическом ацидозе любого происхождения (шок, коллапс, ожоги, диабетическая кома, отравления барбитуратами, салицилатами и т. д.). Помимо буферных свойств трисамин обладает действием осмотического диуретика, подщелачивает мочу, увеличивает выведение с мочой натрия, калия и глюкозы. Поэтому к раствору трисамина обычно добавляют натрия и калия хлориды, глюкозу. Для новорожденных раствор трисамина сочетают только с раствором глюкозы из-за опасности возникновения гиперосмолярности плазмы.
При передозировке трисамина могут развиваться алкалоз, остановка дыхания (из-за связывания ионов водорода в регулирующих дыхание нейронах), гипогликемия, гипотония, тошнота, рвота. Трисамин вводят внутривенно медленно, новорожденным — в пупочную вену; введение в пупочную артерию недопустимо, так как наблюдаются тяжелые осложнения в форме некрозов, порезов и т. д.
306
СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ МЕТАБОЛИЧЕСКОГО АЛКАЛОЗА
Метаболический алкалоз возникает при большой потере хлоридов (например, при рвоте, диарее, назначении мочегонных средств — фуросемида, этакриновой кислоты), при накоплении в организме натрия в большем количестве, чем хлоридов (при гиперальдостеронизме, вливаниях натрия гидрокарбоната, натриевых солей, карбенициллина и пр.), при избыточном назначении органических кислот (лактата, ацетата), которые в организме подвергаются метаболизму, а фиксированные основания остаются, а также при недостатке протеинов в сыворотке, нейтрализующих избыток сильных катионов (натрия, калия, кальция, магния). Метаболический алкалоз обычно сочетается с внутриклеточным ацидозом, гипокалигистией и гипокальциемией.
Для устранения метаболического алкалоза используют калия хлорид, аскорбиновую кислоту, диакарб, аргинина гидрохлорид, кислоту хлористоводородную.
Калия хлорид возмещает недостаток не только хлоридов, но и калия. Его лучше вводить вместе с глюкозой и инсулином, чтобы облегчить попадание калия в клетку и этим способствовать ликвидации внутриклеточного ацидоза. К тому же, поступая в клетку, калий может вытеснить из нее связанный с внутриклеточными белками ион водорода, поступающий в плазму крови, что способствует ликвидации алкалоза (см. гл. 35).
Аскорбиновая кислота (см. гл. 32) используется в больших дозах — 1000-1500 мг.
Диакарб (см. гл. 25) — ингибитор карбоангидразы, способствует выведению из организма натрия и бикарбонатов, используют у детей в дозе 25-50 мг/кг в сутки.
Иногда применяют раствор 21,07% аргинина гидрохлорида, вводимый внутривенно капельно, длительно, но он противопоказан детям с нарушенной выделительной функцией почек, так как у них может возрасти уровень мочевины в крови и развиться гиперкалиемия.
0,1 N раствор кислоты хлористоводородной назначают внутривенно капельно, разводя в. 5% растворе глюкозы.
Респираторный алкалоз чаше является следствием гипервентиляции, развивающейся при лихорадке, энцефалите, черепно-мозговой травме, неправильной НВЛ. J
Для устранения респираторного алкалоза необходимо ликвидировать его причину. В помощь можно назначить средства, успокаивающие чрезмерно возбужденный дыхательный центр (фенобарбитал, сибазон и пр., см. гл. 4, 10).
Димефосфон — отечественный препарат — может быть отнесен к лекарственным средствам, нормализующим КОС. Механизм его действия еще недостаточно ясен, хотя известно, что он обладает антиоксидантным действием (см. гл. 37).
Его назначают внутрь детям любого возраста, начиная с периода новорожденное™. После его приема больными, например, с тяжелой пневмонией, через 2—3 суток нормализуется КОС, повышается рН; концентрация стандартного бикарбоната, снижается дефицит оснований (в контрольной группе аналогичных детей названные изменения возникают лишь на 4-6 сут). Нормализация КОС способствует улучшению деятельности сердца, кровоснабжения тканей, реологии крови, снижает агрегацию тромбоцитов и эритроцитов, улучшает антимикробную функцию нейтрофилов (очень чувствительную к гипоксии), увеличивает содержание в крови 1g М и А. Прием димефосфона улучшает
307
состояние больных и при другой патологии, например при бронхиальной астме; у них постепенно снижается число и тяжесть приступов удушья. Осложнений от приема димефосфона обычно не отмечают.
Дозы препаратов, нормализующие КОС, даны в табл. 54.
Таблица 54
Средства, нормализирующие кислотно-основное состояние
Препарат Лекарственная форма Путь введения и однократная доза
Натрия гидрокарбонат Natrii hydrocarbonas Ампулы 20 мл — 4% раствор Внутривенно капельно или струйно. Новорожденным — 5-7 мл на кг массы тела
Трисамин Trisaminum Флаконы по 250 мл, 3,66% раствор Внутривенно капельно или медленно струйно. Новорожденным — 2—3 мл. Детям других возрастов — 5 мл/кг в течение часа
Димефосфон Dimefosfonum Флаконы по 200 мл, 15% раствор Г- Внутрь. Новорожденным 50 мг/кг/сут по 1 чайной ложке 3 раза в день. Детям 6—14 лет по 10—15 мл 3 раза в день
Раздел VI ПРОТИВОВОСПАЛИТЕЛЬНЫЕ
И ПРОТИВОАЛЛЕРГИЧЕСКИЕ СРЕДСТВА
ПРОТИВОВОСПАЛИТЕЛЬНЫЕ СРЕДСТВА
Противовоспалительными препаратами называют лекарственные средства, подавляющие развитие воспалительного процесса. Их делят на три группы: нестероидные противовоспалительные средства, стероидные противовоспалительные средства — глюкокортикоиды и противовоспалительные средства медленного действия или средства «базисной» терапии.
НЕСТЕРОИДНЫЕ ПРОТИВОВОСПАЛИТЕЛЬНЫЕ СРЕДСТВА
Нестероидные противовоспалительные средства (НПВС) — это группа препаратов, являющихся производными органических кислот. К ним относятся:
— производные салициловой кислоты — ацетилсалициловая кислота (аспирин) и натрия салицат; неацетилированные салицилаты — салицилсалицитат (дисалицид) и дифлунисал (долобид);
— производные пиразолона — бутадион (фенилбутазон), амидопирин, анальгин; пирролизина — кеторолак;
— производные индолуксусной кислоты — индометацин (метиндол), сулин-дак (клинорил);
— производные фенилпропионовой кислоты — ибупрофен (бруфен), напроксен (напросин), кетопрофен;
— производные фенилуксусной кислоты — натрия диклофенак (вольтарен, ортофен);
— производные антраниловой кислоты — флуфенамовая кислота, мефена-мовая кислота; </
— оксикамы — пироксикам (фелден), мелоксикам, теноксикам.
Все названные препараты являются средствами симптоматической терапии, так как тормозят любой воспалительный процесс независимо от вызвавшей его причины.
Нестероидные противовоспалительные средства в основном подавляют экссудативную и пролиферативную фазы воспаления. Ограничение ими экссудативного процесса приводит к уменьшению выхода в ткани форменных элементов крови и плазменных белков, что сказывается и на течении пролиферативного процесса. В механизме антиэкссудативного эффекта этих препаратов ведущее место занимает их способность угнетать циклооксигеназы (ЦОГ) I и 2, участвующие в образовании простагландинов из арахидоновой кислоты. ЦОГ-1 — фермент, постоянно функционирующий в клетках различных органов и тканей и регулирующий продукцию простагландинов, обеспечивающих нормальную активность клеток, например, синтез тромбоксана А2 тромбоцитами, простациклинов эндотелиальными клетками и клетками слизистой оболочки желудка, простагландина Ei и простациклинов клетками почек и пр.
309
ЦОГ-2 в нормальных тканях находится в очень низких концентрациях, но во время воспаления ее уровень резко возрастает. Есть основание полагать, что именно ЦОГ-2 принимает участие в продукции Провоспалительных простагландинов, потенцирующих активность медиаторов воспаления (гистамина, брадикинина, серотонина), раздражающих болевые рецепторы в очаге воспаления, способствующих клеточной пролиферации и деструкции тканей.
Блокируя обе ЦОГ (1 и 2), НПВС вызывают и противовоспалительный эффект, и нежелательные эффекты (см. ниже), нарушая образование простагландинов и в очаге воспаления, и в нормальных тканях.
Недавно появилось новое противовоспалительное средство — месулид — избирательно блокирующее только ЦОГ-2. Поэтому он вызывает значительно меньше нежелательных эффектов.
Угнетая в очаге воспаления ЦОГ-2, НПВС подавляют образование из арахидоновой кислоты прежде всего эндоперекисей (ПГ Нг и G2) и связанные с ними свободнорадикальные реакции, чем предотвращают перекисное окисление липидов и ограничивают повреждение клеточных мембран, распространение и прогрессирование воспаления.
Угнетая образование простагландина Е2 из эндоперекисей, НПВС могут уменьшить многие его эффекты, -в частности тормозить влияние на разные функции макрофагов и нейтрофилов (хемотаксис, фагоцитоз), продукцию ин-терлейкина-2 (ИЛ-2) и пролиферацию клеток, чувствительных к ИЛ-2. НПВС могут ослаблять и угнетать влияние ПГ Е2 на клеточный иммунитет — они снижают угнетающее влияние ПГ Ег на пролиферацию Т-лимфоцитов, активность естественных киллеров, экспрессию е-рецепторов на Т-лимфоцитах и пр. Тем самым НПВС способствует тем эндогенным механизмам, которые повышают борьбу организма с инфекцией или другими факторами, вызывающими воспаление.
Характер взаимодействуя НПВС с циклооксигеназами разных тканей неодинакова. Ацетилсалициловая кислота необратимо ингибирует ее путем ацетилирования, но этот процесс происходит только под влиянием целой молекулы. После деацетилирования и превращения препарата в салициловую кислоту ингибирование циклооксигеназ осуществляется значительно слабее и обратимо. Все остальные НПВС ингибируют циклооксигеназы обратимо. Ибупрофен, напроксен, бутадион и анальгин делают это быстро, а индометацин и натрия диклофенак — медленно. Кроме того, НПВС ингибируют циклооксигеназы в разной степени. Наиболее сильными ингибиторами этих ферментов являются индометацин, натрия диклофенак и мефенамовая кислота; слабыми ингибиторами — ацетилсалициловая кислота, амидопирин. Показано также, что НПВС разных химических групп неодинаково ингибируют эти ферменты в различных органах и тканях. Особенности взаимодействия препаратов этой группы с циклооксигеназами в клинических условиях проявляются в разной выраженности противовоспалительного и нежелательных эффектов у больных.
Антипролиферативное действие препаратов названной группы заключается в снижении образования гранулем. Оно отчасти является следствием ограничения активности в очаге воспаления серотонина и брадикинина, стимулирующих деление фибробластов. В результате уменьшается образование мукополисахаридов и предотвращается дезорганизация соединительной ткани.
В качестве противовоспалительных средств эту группу препаратов применяют у больных с ревматизмом (обычно в острую фазу); в комплексе с другими препаратами их применяют при ревматоидном артрите, красной волчанке, склеродермии, а также при артритах не ревматической природы — псориати-310
ческом, подагрическом; поражениях позвоночника (анкилозирующем спондилите), сосудов (тромбофлебитах), почек и т. д. Эффективность НПВС (чаше других препаратов таким больным назначают индометацин) при гломеруло-нефритах связан с их способностью снижать образование ТХ А2 и улучшать вследствие этого кровообращение почек, а также уменьшить формирование тромбоцитарных тромбов.
Жаропонижающий эффект нестероидных противовоспалительных средств заключается в снижении лихорадочной, но не нормальной температуры тела. Лихорадка — одно из проявлений защитной реакции организма на инфекцию. Она является следствием повышенного образования ПГ Ез, вызванного эндогенными или экзогенными пирогенами* в цереброспинальной жидкости, в ‘частности интерлейкином-1. В результате повышения концентрации ПГ Ез в переднем отделе гипоталамуса нарушается нормальное соотношение между Na и Са. Это изменяет активность нейронов теплорегулируюших структур головного мозга. В результате возрастает теплопродукция и снижается теплоотдача. НПВС, тормозя образование ПГ Ез, восстанавливают нормальную активность нейронов теплорегулирующих структур и повышают теплоотдачу путем излучения тепла с поверхности кожи и испарения обильных количеств пота. Жаропонижающие препараты показаны детям при температуре 38,5-39° С, нарушающей общее состояние ребенка. Детям с сердечно-сосудистой патологией и склонным к судорожным состояниям они должны назначаться уже при температуре 37,5-38° С. Наибольшее значение в качестве жаропонижающих средств в педиатрической практике имеют анальгин, парацетамол , ибупрофен. В последнее время в качестве жаропонижающего средства у детей стали использовать и напроксен.
ХАРАКТЕРИСТИКА ОТДЕЛЬНЫХ ГРУПП НЕСТЕРОИДНЫХ ПРОТИВОВОСПАЛИТЕЛЬНЫХ СРЕДСТВ
Салицилаты: ацетилсалициловая кислота, натрия салицилат, ласпал (лизина ацетилсалицилат), саход (холин салицилат). Применяют салицилаты у детей для лечения ревматического поражения суставов, воспаления легких и верхних дыхательных путей. Из желудочно-кишечного тракта салицилаты хорошо всасываются при кислых величинах pH. Попадание их из крови в ткани, в том чи^ле в головной мозг, возрастает при ацидозе, когда процент неионизйрованных молекул увеличивается. Поэтому использование ацетилсалициловой кислоты у детей, находящихся в состоянии ацидоза (гипертермия, обезвоживание) опасно из-за возможности интоксикации от терапевтических доз. Осложнения, связанные с приемом ацетилсалициловой кислоты, проявляются прежде всего геморрагическим синдромом. Необратимо блокируя циклооксигеназу 1 в тромбоцитах, она угнетает образование тромбоксана и агрегацию тромбоцитов. К тому же ацетилсалициловая кислота — антагонист витамина К. У новорожденных, матери которых перед родами получали ацетилсалициловую кислоту, отмечали более выраженную мелену, кровотечения йз пуповины, кровоизлияния в мозг. У более старших детей и взрослых больных могут быть носовые, маточные, желудочно-кишечные кро-
1 Парацетамол (панадол=эффералган=тайленол) и анальгин — слабые ингибиторы циклооксигеназ. Они оказывают действие только при небольших концентрациях эндоперекисей, например в гипоталамусе, приводя к жаропонижающему и анальгетическому эффектам, но не при повышенных концентрациях эндоперекисей, генерируемых лейкоцитами в очаге воспаления. Поэтому противовоспалительного эффекта они не вызывают.
311
вотечения. Снять геморрагический синдром можно назначением витамина К и средств, повышающих агрегацию тромбоцитов, в частности этамзилата. Другим опасным осложнением этой группы препаратов является провокация спазма .бронхов — «аспириновая астма». Этот эффект связывают с возникновением дисбаланса ПГ и лейкотриенов в бронхах. Угнетение салицилатами циклооксигеназы приводит к преобладающему образованию лейкотриенов из арахидоновой кислоты — спазмогенных факторов.
Чаще всего астматический обструктивный синдром бывает обусловлен приемом именно ацетилсалициловой кислоты, но его развитие возможно и от приема других НПВС и некоторых химических средств иной структуры. Так, в 100% случаев у больных с «аспириновой астмой» отмечают перекрестную реакцию бронхов на прием индометацина и ибупрофена, в 60% — при назначении мефенамовой кислоты, в 30% — при использовании пищевых продуктов, содержащих желтый краситель — тартрозин или консервант — натрия бензоат.
Салицилаты подавляют образование ПГ Е2 и ПГ 12 в слизистой оболочке желудка, что повышает кислотность и переваривающую активность желудочного сока, ускоряет слущивание эпителия, нарушает кровоснабжение слизистой оболочки. Больным, имеющим патологию со стороны желудочно-кишечного тракта (гастриты, энтероколиты) назначение ацетилсалициловой кислоты нежелательно. Большое значение имеет измельченность ацетилсалициловой кислоты: чем более измельчен препарат, тем меньше его повреждающее влияние на слизистую оболочку желудка. Поэтому препараты разных фирм и фармза-водов могут с неодинаковой частотой вызывать патологические изменения в желудке. Для уменьшения повреждающего действия ацетилсалициловой кислоты на желудочно-кишечный тракт клиницисты рекомендуют назначать одновременно с ней блокаторы гистаминовых-2 рецепторов (ранитидин, фамо-тидин) или блокаторы М-холинорецепторов (гастрозепин).
В последние годы установлена связь между приемом ацетилсалициловой кислоты детьми с вирусными инфекциями и возникновением у них синдрома Рейе. Этот синдром характеризуется сочетанием энцефалопатии и нарушением функции печени, часто (до 80%) приводящим к смерти больного. Поэтому следует избегать назначения салицилатов детям в качестве жаропонижающих средств на фоне вирусных инфекций (ОРВИ, ветряной оспы, гриппа).
Неацетилированные салицилаты (сахол) меньше угнетают образование ПГ Е2 в слизистой желудка и меньше повреждают ее. Эти же препараты значительно меньше влияют на агрегацию тромбоцитов и реже вызывают геморрагии; они меньше повреждают печень и их прием не провоцирует возникновение синдрома Рейе.
Производные пиразолона (бутадион = фенилбутазон). Бутадион хорошо всасывается из желудочно-кишечного тракта и прямой кишки. Дозы при пероральном и ректальном введении должны быть равны. В плазме крови 98—99% его связано с белками. Обладая более высоким сродством к белкам, бутадион может вытеснять из комплекса с ними антикоагулянты кумаринового ряда, сульфаниламиды, пенициллин и некоторые другие вещества, повышая фармакологический эффект последних.
Используют бутадион при ревматизме, но особенно он эффективен при воспалительных поражениях внесуставных тканей — бурситах, тендинитах, лигаментитах, фасциитах. Поскольку бутадион медленно элиминирует из организма, его можно назначать детям 1 раз в сутки. Как и многие НПВС, производные пиразолона при длительном применении вызывает осложнения со стороны желудочно-кишечного тракта. Бутадион особенно тяжело повреж
312
дает слизистую оболочку желудка, так как прямо тормозит в ней синтез белка и деление клеток. Поэтому его и препараты, содержащие бутадион (реопирин, пирабутол) нельзя назначать дольше 1-2 нед. Он противопоказан при язвенной болезни желудка и двенадцатиперстной кишки. В экспериментах бутадион используют как ульцерогенное вещество. Поражения системы кроветворения от пиразолоновых препаратов проявляются лейкопенией, анемией, тромбоцитопенией — в тяжелых случаях агранулоцитозом. Агранулоцитоз возникает, как правило, в молодом возрасте у больных ревматоидным полиартритом. Появление этого осложнения связывают с иммунным конфликтом между лекарством, выполняющим роль гаптена, и антителом плазмы. Кроме того, описаны случаи повреждения почечной паренхимы и нарушений функции почек, особенно от больших доз.
Производные индола (индометацин=метиндол, сулиндак). Индометацин — один из самых сильных препаратов этой группы. Он оказывает хороший лечебный эффект при воспалительном процессе, сопровождаемом дегенеративными изменениями в суставах, особенно позвоночника. Он является препаратом выбора при ревматоидном артрите.
Недоношенным детям индометацин назначают при открытом артериальном протоке, так как он наиболее интенсивно, чем другие НПВС, подавляет образование простагландинов в его гладкой мускулатуре и способствует закрытию протока. Индометацин в данном случае вводят внутривенно или через рот всего 1—2 раза (вторую дозу через 24 ч). Для профилактики задержки диуреза новорожденным до индометацина вводят внутривенно фуросемид.
У детей до 7 лет этот препарат вызывает много осложнений преимущественно из-за ингибиции синтеза простагландинов. Так, снижая синтез ПГ Ег и ПГ h в почках, индометацин уменьшает диурез и экскрецию натрия и калия. Отмечают даже возникновение гиперкалиемии при сочетании индометацина с калийсберегающими диуретиками, сердечными гликрзидами, (3-блокаторами. Но при аллергических гломерулонефритах, ограничивая образование ТХ Аг, индометацин может улучшить кровоснабжение почек и образование мочи. Этому способствует и его тормозящее влияние на активность системы комплемента.
При лечении индометацином у больных отмечают боли в эпигастрии, рвоту, понос, кишечные кровотечения, могут появиться эрозии и даже язвы. Этот препарат нередко нарушает функцию центральной нервной системы, что проявляется в головокружении, сонливости, ухудшении слуха и зрения. У некоторых больных возникает раздражимость, гиперактивность. Многие осложнения, вызываемые индометацином, проходят после его отмены, тем не менее некоторые педиатры не рекомендуют его детям до 14 лет.
Производные фенилпропионовой кислоты (ибупрофе н=б руфен, кетопрофен, напроксен). Ибупрофен по противовоспалительной активности, анальгетическому и жаропонижающему эффектам близок к салицилатам. Препарат хорошо всасывается из желудочно-кишечного тракта, относительно быстро и полно выводится из организма. Его назначают детям при ревматоидном артрите, ревматизме и лихорадке. Препарат характеризуется малой токсичностью и дети обычно хорошо его переносят. Иногда при использовании ибупрофена отмечают расстройства желудочно-кишечного тракта — изжогу, тошноту, рвоту, метеоризм. После уменьшения дозы побочные явления, как правило, проходят. Более тяжелые осложнения ибупрофена — гемолитическая анемия, снижение остроты зрения, анафилактический шок — описаны у больных с выраженной аллергией, особенно при наличии системной красной волчанки.
313
Напроксен по многим свойствам близок бруфену, но более выражение тормозит воспалительный процесс. Он хорошо и быстро всасывается из кишечника. Напроксен подвергается биотрансформации в печени, превращаясь в глюкурониды, выводимые с мочой, но отчасти выводится почками в неизмененном виде. Учитывая медленное выведение из организма, напроксен назначают 2 раза в день. Его назначают больным с нетяжелым течением ревматоидного артрита и остеоартроза, а также как жаропонижающее средство.
Нежелательные эффекты обычно нетяжелые: боли в эпигастрии, тошнота, кишечные расстройства, сыпи — вызывает редко.
Кетопрофен по эффективности и переносимости также близок к бруфену, однако с преобладанием анальгетического эффекта над противовоспалительным. Используют его при ревматических заболеваниях с выраженным болевым синдромом, радикулитах. Несомненным достоинством кетопрофена является возможность его внутримышечного введения, что во многих случаях позволяет быстро уменьшить боль. Кетопрофен относится к хорошо переносимым препаратам. Из нежелательных эффектов отмечают тошноту, гастралгии; реже — головные боли, головокружения, кожные сыпи и бронхоспазм.
Производные фенилуксусной кисеты (диклофенак натрия = вольта-рен = ортофен). Это наиболее• эффективный из современных НПВС. Он сочетает выраженный противовоспалительный эффект с хорошей переносимостью, что делает возможным длительный прием препарата. Препарат хорошо всасывается из кишечника, довольно быстро проникает в синовиальную жидкость, концентрируясь в ней; выводится почками в виде окисленных метаболитов, образующихся в печени. Назначают натрия диклофенак преимущественно при ревматизме, ревматоидном артрите, различных артрозах, поражении позвоночника (болезнь Бехтерева), воспалении мягких тканей (бурситах, тендинитах), радикулитах, в послеоперационном периоде.
Нежелательные эффекты — в виде диспепсических явлений, головной боли наблюдаются очень редко.
Производные антраниловой кислоты (флуфенамовая кислота, мефе-намовая кислота). У препаратов этой группы больше выражен анальге-тическийэффект, чем противовоспалительный, они хорошо снимают острую и хроническую боль. Используют их при ревматизме, полиартритах, невралгиях, лихорадке. Побочные явления наблюдаются при применении больших доз (понижение аппетита, боль в животе, кожная сыпь, головная боль).
Оксикамы — пироксикам. Этот препарат существенно отличается по структуре от ранее применявшихся средств. Он достаточно хорошо всасывается из кишечника и проникает в синовиальную жидкость, где его концентрация составляет 36—45 ч, поэтому препарат обычно назначают 1 раз в сутки. Как анальгетик пироксикам является более сильным препаратом, чем ибупрофен, напроксен и бутадион. Назначают его при ревматизме, остеохондрозах и других ревматических болезнях.
Больные переносят пироксикам очень хорошо: для уменьшения диспепсических явлений его рекомендуют принимать через полчаса после еды.
СТЕРОИДНЫЕ ПРОТИВОВОСПАЛИТЕЛЬНЫЕ ПРЕПАРАТЫ (СПВП)
По химическому строению они относятся к 11,17-оксикортйкостероидам. Первыми препаратами этой группы были естественные глюкокортикоиды, выделенные из надпочечников — гидрокортизон и кортизон (см. гл. 31). В
314
настоящее время осуществлен синтез этих веществ, а также ряда их аналогов и производных. Общая формула противовоспалительных стероидов выглядит следующим образом (рис. 35).
СН2 - СНз
Рис. 35. Стероидное кольцо
Из синтетических аналогов СПВП наиболее часто в клинической практике используют преднизолон (дегидрированный аналог гидрокортизона), метилпреднизолон, а также фторированные производные — дексаметазон, триамцинолон, флуметазон, бетамезон. При введении в молекулу одного или нескольких атомов фтора происходит существенное повышение противовоспалительной активности препаратов.
Противовоспалительный эффект СПВП, в первую очередь, связан с их способностью ингибировать через белок — липокортин, активность фермента фосфолипазы Аг. Этот фермент участвует в гидролизе мембранных фосфолипидов, освобождая из них арахидоновую кислоту, являющуюся субстратом для синтеза провоспалительных медиаторов — простагландинов и лейкотриенов.
К тому же СПВП угнетают ген, кодирующий образование ЦОГ-2, функционирующий в очаге воспаления, не влияя на ЦОГ-1 в Нормальных тканях. Таким образом, глюкокортикоиды существенно подавляют образование простагландинов в очаге воспаления. Кроме того, они обладают антиоксидантным свойством, тормозя перекисное окисление липидов и сохраняя целостность клеточных мембран тканей. Этим они препятствуют распространению воспаления.
Антипролиферативный эффект СПВП связан с ограничением миграции моноцитов в очаге воспаления и тормояйнием деления фибробластов. Они также подавляют синтез мукополисахаридов и этим ограничивают связывание тканями воды и белков плазмы, попавших вместе с экссудатом в очаг ревматического воспаления. В результате уменьшается развитие фибриноидной фазы ревматического воспаления, а затем и гиалиноза. СПВП угнетают активность коллагеназы, протеолитического фермента, разрушающего интерстициальный коллаген и вызывающего деструкцию костей при ревматоидном артрите.
Используют стероидные противовоспалительные препараты при всех формах активного ревматизма и прежде всего при первичном ревмокардите, красной волчанке, ревматоидном артрите. Для получения лучшего эффекта их рекомендуют вводить локально, то есть делать внутрисуставные, интрасиновиальные и другие инъекции. Курс лечения обычно длится 1—2 мес и отмена препаратов должна проводиться медленно. Часто глюкокортикоиды в острую стадию ревматического процесса или при ревматоидном артрите сочетают с НПВС. Под влиянием комплексной терапии в более короткие сроки и у большего числа больных отмечается уменьшение признаков поражения сердца, суставов, формирования пороков. Побочные эффекты и дозы СПВП см. в гл. 31.
Дозы противовоспалительных средств даны в табл. 55.
315
Таблица 55
Противовоспалительные средства
Препарат Лекарственная форма Путь введения Число приемов в сутки Суточная доза
Ацетилсалициловая кислота Acidum acetylsalicylicum Таблетки по 0,1; 0,25 и 0,5 г Л Через рот после еды 4 0,15-0,2 г (на год жизни)
Анальгин Analginum Таблетки по 0,05; 0,1 и 0,15 г Через рот 3-4 0,025—0,05 г (на год жизни)
50% раствор в ампулах по 1 и 2 мл Внутримышечно, внутривенно 1-2 0,1 мл на год жизни
Фенацетин Phenacetinum Таблетки Через рот 2 0,08-0,1 (на год жизни)
Парацетамол Paracetamolum Порошок То же 2 10 мг/кг (однократно)
Бутадион Butadionum Таблетки по 0,03; 0,05 и 0,15 г р Через рот после еды 3-4 Первые 2-3 дня по 10—15 мг/кг, затем 5-8 мг/кг
Ибупрофен Ibuprofenum Таблетки по 0,2 г Через рот 3-4 Первые 2-3 дня по 10—15 мг/кг, затем 5-10 мг/кг
Индометацин IndometaCi num f Капсулы и драже по 0,025. г Через рот, после еды 3-4 1-2 мг/кг
Свечи по 0,05 г Ректально 2 1-2 мг/кг
Напроксен Naproxen Таблетки по 0,25 г Через рот 2 Первые 2—3 дня по 20—30 мг/кг, затем 5-10 мг/кг
Диклофенак-натрий Diclofenac-Natrium Таблетки по 0,025 г Через рот во время или после еды 2-3 Первые 2-3 дня по 1 мг/кг, затем 0,3-0,8 мг/кг
Глава 40 ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ПРИМЕНЯЕМЫЕ ПРИ ПАТОЛОГИИ ИММУННЫХ ПРОЦЕССОВ
У детей, как и у взрослых, может быть дисфункция иммунной системы, проявляющаяся в виде чрезмерных или недостаточных реакций на антиген.
Различают лекарственные средства, ослабляющие чрезмерные реакции на антигены, — противоаллергические, и средства, стимулирующие реакции на них, иммуностимуляторы.
ПРОТИВОАЛЛЕРГИЧЕСКИЕ СРЕДСТВА
Противоаллергические средства делят на две подгруппы: а) средства, применяемые для подавления гиперчувствительности немедленного типа (ГНТ); б) средства, применяемые при лечении заболеваний, в патогенезе которых присутствуют элементы гиперчувствительности замедленного типа (ГЗТ).
316
СРЕДСТВА, ПРИМЕНЯЕМЫЕ ДЛЯ ЛИКВИДАЦИИ И ПРОФИЛАКТИКИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ НЕМЕДЛЕННОГО ТИПА
Медицина располагает в основном средствами, воздействующими на анафилактический вариант ГНТ, для воздействия же на цитолитический ее вариант или образование иммунных комплексов лекарственных средств очень мало.
Анафилактическая реакция на антиген возникает после его взаимодействия с двумя IgE, которые фиксированы Fc-фрагментами на Fc-IgEi рецепторах, локализованных на поверхности тучных клеток или базофилов, либо на Fc-IgE2 рецепторах, локализованных на поверхности «клеток воспаления» (тромбоцитах, нейтрофилах, макрофагах, эозинофилах. В первом случае возникает ранняя (сразу после попадания антигена в организм и завершающаяся через 2 ч), а во втором задержанная или поздняя (начинающаяся через 2 ч и завершающаяся через 24 ч) анафилактическая форма ГНТ. При раннем варианте анафилактической реакции происходит немедленное раскрытие кальциевых каналов и поступление через них Са++ из внеклеточной жидкости внутрь клетки; одновременно может произойти освобождение Са++ й из внутриклеточных депо, так как поступивший сигнал (результат взаимодействия иммуноглобулина с антигеном) активирует систему фосфатидилинозитолов (см. раздел «Общая фармакология»). В результате в клетке увеличивается концентрация несвязанного Са++, что приводит: а) к активному выбросу содержимого гранул этих клеток (гистамин, гепарин и др.) во внеклеточную среду; б) к активации протеолитических ферментов, повышающих функцию фактора Хагемана, а следовательно, и образование кининов; в) к активации фосфолипазы А2 (ФЛ Аз) в мембране клеток, освобождающей из фосфолипидов арахидоновую кислоту, из которой под влиянием липоксигеназы образуются лейкотриены (ЛТ): ЛТ В4, являющийся хемоаттрактантом, привлекающим клетки воспаления, и ЛТ С4, D4, Е4 (объединенные под названием МРС-А), вызывающие спазмы гладкой мускулатуры сосудов, бронхов, нарушающих деятельность сердца и пр. Под влиянием циклооксигеназы из арахидоновой кислоты образуются простагландины (ПГ), особенно ПГ D2 и ПГ F2a, являющиеся мощными спазмогенами, а также тромбоксан (ТХ А2), способствующий агрегации тромбоцитов. После взаимодействия антигена с IgE, фиксированным на Fc-IgE2 рецепторах, происходит активация клеток воспаления, которые продуцируют свои биологически активные вещества. Среди них наибольшее значение имеют: фактор, активирующий тромбоциты (ФАТ), и фактор, некротизирующий опухоли (ФИО). ФАТ освобождается почти из всех клеток воспаления. Он способствует агрегации тромбоцитов, расширяет сосуды, повышает их проницаемость, вызывает спазм гладкой мускулатуры бронхов, повышая их реакцию на другие спазмогены и приводя к гиперреактивности бронхов, хемотаксису клеток воспаления. Из попавших в ткани нейтрофилов освобождаются протеолитические ферменты, супероксидный ион (его источником являются и активированные макрофаги) и ФИО. ФИО и катионные белки эозинофилов способны вызвать деструкцию эпителия на поверхности бронхов (обнажая субэпителиальную ткань с локализованными в ней гладкомышечными клетками, рецепторами, реагирующими на различные биологически активные вещества — гистамин, брадикинин, ЛТ и пр., безмякотными С-нервными волоконцами и пр.) или эндотелия на поверхности сосудов (увеличивая выход жидкой части плазмы и форменных элементов крови в субэндотелиальную ткань, вызывая ее отек, инфильтрацию нейтрофилами и другими клетками крови, и способствуя образованию тромбов).
317
Средства, используемые для лечения заболеваний, при которых реакция гиперчувствительности немедленного типа занимает ведущее значение, подразделяют на две группы: а) средства, препятствующие освобождению медиаторов анафилактической реакции (гистамина, брадикинина, ЛТ, ФАТ и пр.); б) средства, подавляющие реакцию исполнительных органов на гистамин и другие вещества, освобождающиеся во время анафилактической реакции.. К первой группе относят 02-адреномиметики, ксантины, кромолин-натрий, кетотифен, глюкокортикоиды; ко второй группе относят гистаминолитики, антагонисты ФАТ, ЛТ и пр.
СРЕДСТВА, ПРЕПЯТСТВУЮЩИЕ ОСВОБОЖДЕНИЮ МЕДИАТОРОВ АНАФИЛАКТИЧЕСКОЙ РЕАКЦИИ
1
^2-Адреномиметики (сал.бутамол, фенотерол и др. (см. гл. 2)) активируют аденилатциклазу, увеличивая этим в тучных клетках и базофилах содержание цАМФ, который препятствует раскрытию кальциевых каналов и освобождению Са++ из внутриклеточных депо. Этим они ограничивают повышение концентрации свободного Са++ в цитоплазме клеток и развитие последующих явлений. При бронхиальной астме имеет значение их способность устранять уже возникший спазм гладких мышц бронхов, тоже в связи с повышением содержания в них цАМФ.
К сожалению, к р2-адреномиметикам развивается тахифилаксия, и снижается их эффективность. Приходится увеличивать дозу и частоту применения препаратов, что может вызвать тяжелые нежелательные эффекты; особенно опасны нарушения деятельности сердца.
Ксантины (теофиллин и его препарат эуфиллин) тоже предупреждают освобождение медиаторов ГНТ и устраняют спазм гладких мышц. Механизм их терапевтического действия до сих пор недостаточно ясен (см. гл. 3).
Обнаружено, что ксантины являются антагонистами аденозина медиатора пуринергических систем. Теофиллин способен ингибировать пуринергические (П-1) рецепторы, участвующие во многих биохимических процессах. В частности, ингибирование А,-рецепторов, локализованных на пресинаптических окончаниях, устраняет тормозящее влияние аденозина на освобождение катехоламинов и в плазме крови возрастает их концентрация. Блокада Ai-рецепторов на поверхности тучных клеток ограничивает способность их Fc-IgE-рецепторов связывать IgE, снижает освобождение ФАТ из легочных макрофагов у астматиков, устраняет у них бронхоспазм, вызываемый аденозином. Кроме того, теофиллин устраняет тормозящее влияние аденозина на лимфоциты, увеличивает пролиферацию Т-супрессоров (подавляющих образование иммуноглобулинов), количество которых у детей с аллергическими заболеваниями снижено.
Бронхолитический, эффект теофиллина возникает при его концентрации в плазме крови от 10 до 20 мкг/мл. Для достижения этой концентрации сначала вводят его насыщающую дозу (зависящую от возраста), в экстренных случаях — внутривенно, в менее срочных — внутрь, а затем переходят на поддерживающие дозы.
Интенсивность всасывания теофиллина из желудочно-кишечного тракта и биотрансформация в печени очень вариабельны. Эти процессы зависят не только от возраста ребенка, но и от индивидуальных особенностей функции желудочно-кишечного тракта, печени, почек. Элиминация теофиллина замедлена при ухудшении гемодинамики (особенно при тяжелой сердечной недостаточности), гипоксии, нарушении функции печени (в том числе при ее
318
угнетении эритромицином), при лихорадке, диете с преобладанием углеводов, ослаблении выделительной функции почек. Во всех этих случаях дозу теофиллина (и его препарата эуфиллина) надо уменьшать или назначать препарат реже, так как у теофиллина небольшая широта терапевтического действия. При накоплении препарата в организме или при введении чрезмерной дозы может возникнуть интоксикация. У ребенка появляются тахикардия, сердцебиение, повышается возбудимость, затем возникает рвота с примесью крови (рвота «кофейной гущей» — результат увеличения проницаемости сосудистых стенок), в тяжелых случаях неукротимая, понос тоже с примесью крови, повышение температуры тела, обезвоживание (результат увеличения диуреза и удаления влаги легкими в связи с учащением дыхания). В очень тяжелых случаях появляются непроизвольные движения и судороги (в результате устранения тормозящего влияния аденозина на центральную нервную систему). Может наступить смерть. Для устранения интоксикации назначают, наряду с активированным углем и промыванием желудка, солевые слабительные, 'противосудорожные средства (фенобарбитал, сибазон-диазепам), форсирование диуреза, а в очень тяжелых случаях — гемодиализ или гемосорбцию.
СТАБИЛИЗАТОРЫ КЛЕТОЧНЫХ МЕМБРАН
Кетотифен (задитен) (см. рис. 36) препятствует поступлению Са++ в тучные клетки и этим ограничивает освобождение гистамина, ЛТ, ФАТ, катионных белков из эозинофилов, повышает число Т-супрессоров в крови, активность [3-адренорецепторов, устраняя тахифилаксию по отношению к катехоламинам. Кроме того, он подавляет реакцию на уже освободившийся гистамин и, что особенно важно, на ФАТ. ФАТ освобождается не только во время замедленной анафилактической реакции, но и при других патологических состояниях, особенно при тяжелых инфекционных заболеваниях, септическом и эндотоксическом шоках, во время реакции отторжения пересаженных органов и пр. Поэтому так важны антагонисты ФАТ. Кетотифен был первым препаратом, способным устранить его эффекты, особенно отчетливо проявляющиеся во время аллергических реакций (не только в бронхах, но и в других тканях). К настоящему времени становится ясно, что существуют разные рецепторы для ФАТ, поэтому один антагонист не может ликвидировать все его эффекты. Уже созданы и постепенно входят в медийнскую практику в качестве антагонистов ФАТ (кадсуренон алкалоид китайского лука; бензодиазепины короткого действия — триазолам, апафант; антикальциевый препарат дилтиазем и некоторые другие), применяемые при септическом и,эндотоксическом шоках, для профилактики и устранения реакции отторжения пересаженных тканей (вместе с иммунодепрессантами).
Кетотифен хорошо растворяется в воде и в липидах, поэтому его можно назначать в водных растворах. Он хорошо всасывается из желудочно-кишечного тракта и проникает во все ткани; в печени подвергается биотрансформации, в результате которой из него образуются метаболиты с сохраненной фармакологической активностью.
Применяют кетотифен не только при бронхиальной астме, но и у детей, страдающих сезонными ринитами, конъюнктивитами, экземой, пищевой аллергией. У детей препарат более активен, чем у взрослых, но при бронхиальной астме стойкий терапевтический эффект наступает лишь через 10-12 нед ежедневного приема. Дети его хорошо переносят, иногда лишь отмечают небольшую сонливость, повышение аппетита и увеличение массы тела.
319
о
Кромолин-натрий (интал, хромогликат) (см. рис. 37) предупреждает попадание Са++ в тучную клетку, так как препятствует раскрытию кальциевых каналов. В результате он ограничивает освобождение медиаторов ГНТ, но не устраняет спазм гладкой мускулатуры.
Рис. 37. Кромолин-натрий
Как и кетотифен, кромолин-натрий устраняет та^ифилаксию по отношению к Р-адреномиметикам и эндогенным катехоламинам, тоже тормозит освобождение ФАТ и снижает на него реакцию, постепенно ликвидируя гиперреактивность бронхов по отношению к антигенам, гистамину и пр. Кроме того, он стабилизирует окончания С-волокон в обнаженной субэпителиальной ткани в бронхах больных с бронхиальной астмой. В результате прекращается освобождение из их окончаний (при антидромном распространении импульса во время сегментарного аксон-рефлекса) вещества Р и возникновение его эффектов (освобождение гистамина, хемотаксис моноцитов, превращение их в макрофаги, освобождение из них ТХ Аг, ЛТ, супероксидного иона, протеолитических ферментов и пр.), в частности, бронхоспазма. Из желудочно-кишечного тракта он не всасывается. В воде он не растворяется и его применяют в виде мельчайшего порошка путем ингаляции для лечения атопических форм бронхиальной астмы. У детей кромолин-натрий более эффективен, чем у взрослых. Полная ликвидация (Или значительное ограничение) приступов астмы наблюдают через 4—5 нед постоянного лечения, но улучшение наступает раньше. При использовании этого препарата удается снизить дозы кортикостероидов или даже прекратить их назначение.
Применяют кромолин-натрий и для профилактики бронхоспазма, провоцируемого у детей физическими упражнениями, когда из-за учащенного и углубленного дыхания более холодный воздух поступает в глубину дыхательных
320
путей, охлаждает эпителий и способствует освобождению гистамина из тучных клеток (и при отсутствии каких-либо антигенов). Иногда его назначают для лечения аллергического ринита, реакций желудочно-кишечного тракта (рвота, понос) на пищевые антигены, содержащиеся в рыбе, фруктах и других продуктах.
Дети обычно переносят препарат хорошо, иногда, в первые дни лечения, у больных с гиперреактивностью он раздражает дыхательные пути, вызывая спазм бронхов. Для профилактики такого осложнения назначают эфедрин.
Недокромил очень похож на кромолин-натрий по структуре и механизму действия. Отличается от него большей эффективностью и неприятным вкусом. Назначают также для ингаляций.
Глюкокортикоиды (преднизолон, триамцинолон, дексаметазон и др.) препятствуют взаимодействию IgE с Ес-рецептором на поверхности тучных клеток и базофилов, но не способны вытеснять их после фиксации. Они тормозят фосфолипазу Аг преимущественно за счет индуцирования синтеза липомодулина (ингибитора ФЛ Аз), в результате они предотвращают освобождение арахидоновой кислоты и образование ее метаболитов (ПГ, ЛТ, ТХ Аз, ФАТ). Синтез липомодулина осуществляется после латентного периода (4-24 ч), поэтому глюкокортикоиды не могут предупредить раннюю реакцию на антиген, но они предотвращают инфильтрирование поврежденных аллергическим процессом тканей (в частности, дыхательных путей) клетками воспаления (тромбоцитами, эозинофилами, нейтрофилами, а также моноцитами, превращающимися в тканях в макрофаги) и этим предупреждают возникновение задержанной анафилактической реакции на антиген.
Кроме того, глюкокортикоиды тормозят процессы экссудации (см. гл. 39) и этим устраняют (или ограничивают) набухание слизистых оболочек, нередко являющееся главной причиной обструкции дыхательных путей, особенно у детей раннего возраста. Глюкокортикоиды способствуют восстановлению реакции Р-адренорецепторов на катехоламины, обычно ослабленной у детей с аллергическими заболеваниями. Эти гормонопрепараты уменьшают и цитотоксические реакции, так как они способны блокировать Fc-рецепторы на поверхности макрофагов для других иммуноглобулинов (G, М), а также для Сз компонента системы комплемента на поверхности и макрофагов, и клеток, подвергающихся цитолизу. В итоге они пре^этврашают дальнейшую активацию системы комплемента, приводящую к цитолизу (эритроцитов, тромбоцитов и других клеток). В высоких дозах глюкокортикоиды тормозят синтез С4-С8 компонентов системы комплемента и активируют катаболизм С3 (ключевого) компонента этой системы. Поэтому их применяют и при лечении заболеваний, связанных с образованием иммунных комплексов. В этих случаях могут быть применены и другие ингибиторы системы комплемента (гепарин, индометацин).
Как средства, подавляющие ГНТ, глюкокортикоиды применяют у детей только при лечении тяжелых форм соответствующих заболеваний, так как при их использовании возникает много различных осложнений (см. гл. 39) и отмена этих препаратов может приводить к восстановлению патологии.
Также при лечении детей с ГНТ применяют этимизол, пиридоксин, пантотеновую кислоту, способствующие секреции эндогенных глюкокортикоидов.
Препараты, снижающие реакцию исполнительных органов на медиаторы анафилактической реакции
Противогистаминные препараты — вещества, ослабляющие реакцию на гистамин путем блокирования его рецепторов. Структурные формулы см. рис. 38.
11 Зак. 3856
321
Гистамин, освобождающийся из тучных клеток (а в центральной нервной системе из окончаний гистаминергических нейронов), воздействует на гистаминовые! и гистаминовые? (Hi и Н? соответственно) рецепторы.
Воздействуя на Hi-рецепторы, гистамин через Gq-протеин активирует в клеточной мембране фосфолипазу С, расщепляющую фосфатидилинозитол с освобождением инозитол-3-фосфата и диацилглицерола (см. часть I «Общая фармакология»), способствующих освобождению Са*+ из эндоплазматического ретикулума клеток и этим вызывает их активность, в частности сокращение гладкой мускулатуры кишечника, матки, а также сократительных элементов в клетках эндотелия капилляров.
Различают блокаторы гистаминовых, (НО и гистаминовых? (Н?) рецепторов. Для подавления аллергических реакций имеют значение только Н, блокаторы; Н? блокаторы рассмотрены среди средств, влияющих на функцию желудочно-кишечного тракта, так как они снижают секрецию соляной кислоты в желудке.
Блокаторы Hi рецепторов делят на препараты I и II поколений. К I поколению относят: димедрол (дифенгидрамин), дипразин (пипольфен), супрастин (хлорпирамин), диазолин (мебгидролин), т а в е г и л (клемас-тин) и ф е н к а р о л. Ко II поколению относят: терфенадин (телден), лоратидин (кларитин), астомизол (гисманал), цетиризин (зир-тек) и др.
Влияя на Hi рецепторы эндотелиальных клеток мелких сосудов, гистамин вызывает освобождение из них сосудорасширяющих веществ оксида азота и простациклина, что приводит к расширению мелких сосудов, преимущественно посткапиллярных венул, скоплению крови в них, снижению объема циркулирующей крови, чему способствует и выход плазмы крови, белков и клеток крови через расширенные промежутки между сократившимися эндотелиальными клетками. В результате происходит падение артериального давления, сгущение крови, вовлечение клеток крови в патологический процесс. Влияя на чувствительные рецепторы в эпидермисе и дерме, гистамин вызывает жжение, чувство зуда и боли.
Блокаторы Hi рецепторов препятствуют или устраняют перечисленные эффекты гистамина. Их применяют при лечении крапивницы, сенной лихорадки, сывороточной болезни, вазомоторного насморка, ангионевротического отека, зудящих дерматозов, аллергических реакциях на лекарственные вещества, в том числе при анафилактическом шоке.
На бронхоспазм у астматиков они мало влияют, иногда лишь отмечают небольшой профилактический, но не лечебный эффект, так как бронхоспазм у них возникает под влиянием не гистамина, а лейкотриенов и фактора, активирующего пластинки.
Многие Н, блокаторы обладают М-холинолитическим действием, проявляющимся, например, в снижении секреции бронхиальных желез, что приводит к сгущению слизи, слипанию поверхности бронхов, что препятствует их проходимости и устранению бронхоспазма под влиянием других лекарственных средств. М-холинолитическое действие проявляется и в повышении внутрй-глазного давления, поэтому препараты противопоказаны при глаукоме.
Hi гистаминолитики I поколения легко проникают через гематоэнцефалический барьер в головной мозг, вызывая угнетение его функций, особенно димедрол и дипразин (пипольфен), которые поэтому нередко применяют в качестве снотворных средств. Hi гистаминоблокаторы II поколения очень мало проникают в центральную нервную систему и мало вызывают М-холинолити-322
ческий эффект, поэтому в терапевтических дозах они не угнетают центральную нервную систему и не уменьшают секрецию экзокринных желез.
Нежелательные эффекты обычно возникают при передозировке препаратов, их можно наблюдать даже от обычных доз у особо чувствительных детей. Проявляются эти эффекты в сонливости, головокружении, головной боли, сухости во рту, тошноты, обшей слабости, иногда в повышении внутриглазного давления. Преимущественно эти явления возникают при приеме препаратов I поколения (на их фоне нельзя принимать средства, угнетающие центральную нервную систему, этанол), хотя иногда их в значительно меньшей степени наблюдают при приеме и препаратов II поколения. Длительный прием гнетами ноблокаторов, особенно димедрола и астемизола, может привести к возникновению аллергических реакций на них (результат образования сложных антигенов с белками плазмы крови и тканей).
Средства, применяемые при лечении системных заболеваний соединительной ткани
В патогенезе этих заболеваний существенную роль играет гиперчувствительность замедленного типа. В ее осуществлении участвуют цитотоксические Т-лимфоциты, разрушающие клетки, имеющие на своей поверхности антигены; сенсибилизированные Т-лимфоциты, которые посредством своих лимфокинов рекрутируют моноциты, превращая их в макрофаги, активируют секрецию и функции последних, заключающиеся в цитотоксичности, фагоцитозе поврежденных клеток и прочее. Но в патологически измененной синовиальной оболочке суставов (при ревматоидном артрите) или соединительной ткани при другой ее патологии обнаружены и иммунные комплексы (то есть 1g и компоненты системы комплемента), и макрофаги, которые освобождают протеолитические ферменты, свободные радикалы кислорода и различные цитокины и т. д. .
В развертывании патологического процесса одну из ключевых функций выполняет монокин — интерлейкин-1 (ИЛ-1), продуцируемый макрофагами, инфильтрующими поврежденные ткани, и синовиоцитами, приобретающими такую способность. Из-за повышенного его образования активируется синтез ПГ Е? и функция нейтрофилов; и то, и другое стимулирует латентные протеазы, разрушающие синовиальную оболочку хряща. При этом образуются метаболиты коллагена, обладающие свойствами эндогенных антигенов, активируются лимфоциты, освобождающие различные лимфокины, из которых следует Ътметить ИЛ-2, активирующий пролиферацию Т-лимфоцитов-киллеров, а также лимфокины, передающие сенсибилизацию другим клеткам, образуя их клоны.
При лечении системных заболеваний соединительной ткани применяются так называемые противоревматические средства медленного действия (хингамин, пеницилламин, препараты золота), а также глюкокортикоиды и цитостатики.
Хингамин (делагил, хлорохин) введен в медицину в качестве прсг-тивомалярийного средства, но он способен подавлять воспалительные реакции, в которых участвует ГЗТ.
Хингамин стабилизирует клеточные и субклеточные мембраны, в частности мембраны лизосом, ограничивая выход из них гидролаз и тормозя этим фазу альтерации обычного воспаления. Кроме того, хингамин подавляет активность нуклеиновых кислот (внедряясь между парами их оснований) и тем самым нарушает деление клеток, в частности лимфоцитов, тормозит продукцию ими лимфокинов, в том числе ИЛ-2, в результате снижается активность и деление Т-лимфоцитов, стимулирующее влияние Т-хелперов на деление моноцитов,
323
продукция ими ИЛ-1. В результате постепенно затухает воспалительный процесс, возникающий из-за попадания антигена в соединительную ткань сустава,
кожи и пр.
Рис. 38. Структурные формулы противогистаминных препаратов
Применяют его у детей с непрерывно рецидивирующим, затяжным и вялотекущим ревматизмом, при среднетяжелой форме ревматоидного артрита, системной красной волчанке и некоторых других заболеваниях подобного рода.
324
Терапевтический эффект развивается медленно (через 10—12 недель) при ежедневном приеме препарата. Лечение должно быть длительным минимум 6 месяцев, обычно 1—2 года.
Столь долгое назначение препарата может сопровождать возникновение нежелательных эффектов (связанных с накоплением препарата в тканях): угнетением секреции желудочного сока, миопатией. Наиболее опасна ретинопатия, способная привести к слепоте. Поэтому при применении препарата надо регулярно контролировать остроту и величину поля зрения, назначать соляную кислоту с пепсином, нестероидные анаболизанты (оротовую кислоту, карнитин и др.).
Пеницилламин (купренил) — продукт метаболизма пенициллина, содержит сульфгидрильную группу, способную связывать многие вещества, в том числе тяжелые металлы.
В педиатрии его давно применяют для лечения гепатолентикулярной дегенерации, так как, связывая ионы меди, он препятствует ее отложению в печени и в чечевицеобразных ядрах головного мозга, предупреждая их повреждение и нарушение функции. Применяют его и при цистинурии: связывая цистин, пеницилламин предупреждает его выпадение в осадок и образование конкрементов в мочевыводящих путях.
Механизм терапевтического действия при ревматизме и ревматоидном артрите не совсем понятен. Считают, что он образует комплексные соединения с медью, облегчая этим ее доставку в очаги воспаления, в которых обычно снижены и ее содержание, и активность супероксиддисмутазы (фермент, содержащий медь), устраняющей избыток свободных радикалов кислорода, освобождающихся в очаге воспаления и повреждающих мембраны соседних клеток. Образуя комплексные соединения с железом, пеницилламин ограничивает его катализирующую роль в образовании чрезвычайно активного радикала кислорода (’ОН). Кроме того, он тормозит образование антигенов коллагеновой структуры. Применяют пеницилламин преимущественно при лечении активного прогрессирующего ревматоидного артрита. Терапевтический эффект появляется через 12 недель, отчетливое улучшение — через 5—6 месяцев. При длительном назначении у детей могут возникнуть нежелательные эффекты: сыпи, нарушения функции желудочно-кишечного тракта, временная потеря вкуса, тромбоцитопения (иногда тяжелая с геморрагиями^, протеинурия (иногда заканчивающаяся развитием нефротического синдрома).
В ряде стран пеницилламин используют для профилактики и лечения гипербилирубинемий у новорожденных и ретинопатии недоношенных детей, подвергшихся интенсивной кислородотерапии. Это прйменение также основано на способности пеницилламина удалять свободные радикалы кислорода, предупреждая этим повреждение мембран эритроцитов, тканей сетчатки, альвеол. Известно, что в тканях новорожденных мала активность супероксиддисмутазы и восстанавливающих ферментов. Новорожденным пеницилламин назначают всего 1~2 дня, у некоторых детей при этом отмечают диспепсию, исчезающую после отмены препарата.
Препараты золота — кризанол, солганал, ауротиоглюкоза, ауронофин. Препараты золота нарушают захват антигена макрофагами, препятствуют освобождению интерлейкина-1 моноцитами и интерлейкина-2 лимфоцитами, подавляют пролиферацию Т-лимфоцитов, снижают активность Т-хеллеров, образование 1g В-лимфоцитами, ревматоидного фактора, иммунных комплексов, тормозят активацию системы комплемента.
325
Препараты золота используют для лечения ревматоидного артрита, системной красной волчанки, псориатического артрита и других коллагенозов. Растворы (кризанол, солганал — масляные, ауротиоглюкоза — водный) предназначены для парентерального введения (внутримышечного или непосредственно в область пораженного сустава), ауронофин — препарат для перорального приема.
Инъекции указанных препаратов производят 1 раз в неделю (ауронофин принимают ежедневно) длительное время. Первые признаки улучшения состояния больного могут появиться через 6—7 недель, отчетливый терапевтический эффект возникает через 10—12 недель. Для получения более выраженного эффекта препараты золота назначают одновременно с нестероидными противовоспалительными средствами (см. гл. 39) или с глюкокортикоидами. Надо отметить, что. приблизительно у 25—30% больных препараты золота оказываются неэффективными, но об этом можно судить после 6 месяцев применения этих средств.
При применении препаратов золота могут возникнуть различные осложнения: сыпь, язвы на слизистой оболочке рта, протеинурия, тромбоцитопения, и изредка панцитопения, отмечают функциональные нарушения в печени; при парентеральном применении иногД может возникнуть нитритоидный криз. Пероральный препарат менее опасен, так как выводится стенкой толстой кишки, меньше накапливается в почках и печени.
Глюкокортикоиды (преднизолон и др.) подавляют реакцию клеток на лимфокины (фактор, активирующий макрофаги, фактор переноса и пр.), ограничивая этим клон сенсибилизированных клеток. Они нарушают инфильтрирование тканей клетками крови, в том числе моноцитами, тоже предупреждая этим превращение их в макрофаги тканей. Имеет значение их способность стабилизировать мембраны лизосом, снижать в крови число циркулирующих Т-лимфоцитов, особенно Т-хелперов, препятствуя этим их активности, кооперации с В-лимфоцитами и образованию иммуноглобулинов, угнетать активность макрофагов, в частности продукцию ими ИЛ-1, увеличивать синтез белков, тормозящих латентные протеазы и фосфолипазу Аг. Применяют их при лечении детей с диффузными заболеваниями соединительной ткани (ревматоидный артрит и др.) обычно в сочетании с другими препаратами.
Цитостатики. При лечении диффузных заболеваний соединительной ткани у детей преимущественно используют циклофосфан, хлорбутин, аза-тиоприн, реже меркапто пурин (см. гл. 30), циклоспорин А.
Угнетая деление клеток, в том числе лимфоидной ткани, они ограничивают образование иммунокомпетентных клеток и развитие иммунопатологических механизмов при ревматоидном артрите, системной волчанке и пр. Названные препараты рассматривают как резервные. Обычно их применяют при неэффективности других противоревматических средств медленного действия. Назначают их иногда и при тяжелых формах заболеваний с ГНТ, так как ингибируя деление Т-лимфоцитов, они нарушают их кооперацию с В-лимфоцитами, а следовательно, и образование иммуноглобулинов.
При назначении цитостатиков возможны серьезные осложнения (см. гл. 30).
Циклоспорин А — это антибиотик, являющийся циклическим пептидом, состоящим из 11 аминокислот.
Циклоспорин А внедряется в лимфоциты, связывается с цитоплазматическими и ядерными белками, тормозя кодирование синтеза в активированных Т-лимфоцитах лимфокинов, в частности интерлейкина-2, у-интерферона, фактора, ингибирующего миграцию макрофагов, фактора их хемотаксиса. Кроме
326
того, он снижает функцию моноцитов (так как подавляет их активирование лимфокинами), в том числе продукцию интерлейкина-1; подавляет генерацию клонов цитотоксических клеток-киллеров по отношению к пересаженным тканям. Очень важно его свойство сохранять и даже повышать активность Т-суп-рессоров, т. е. циклоспорин А способствует проявлению естественной иммунодепрессии, подавляет отторжение пересаженных тканей и органов. Он меньше других цитостатиков угнетает деление клеток в различных тканях, и при его применении возникает меньше гематологических и инфекционных осложнений.
Применяют циклоспорин А обычно в комбинации с преднизолоном. Основным показанием к его назначению является профилактика отторжения пересаженных тканей. Кроме того, его используют при ревматоидном артрите, в комбинации с преднизолоном, при лечении больных с гломерулонефритом. Введение циклоспорина позволяет снизить дозу преднизолона (а стало быть, уменьшить и риск возникновения его нежелательных эффектов) и уменьшить количество обострений данного заболевания.
При назначении циклоспорина А необходимо поддерживать его уровень в плазме крови не выше 200-400 нг/мл, чтобы не допустить развития тяжелых осложнений. При более высоких концентрациях циклоспорина А в крови у больного может нарушиться кровоснабжение почек, уменьшиться диурез, фильтрация в клубочках (снизиться клиренс креатинина), повыситься уровень калия в плазме крови и артериальное давление, развиться гиперхлоремический ацидоз, появиться гипомагниемия, проявляющаяся в возникновении тремора, судорог. Кроме того, при приеме циклоспорина А могут быть: гиперплазия десен; торможение образования простациклина эндотелиальными клетками, что способствует тромбообразованию; угнетение функции печени.
ИММУНОСТИМУЛЯТОРЫ
Препараты этой группы применяют для активации иммунных процессов у детей со сниженной сопротивляемостью к инфекции.
К иммуностимуляторам относят производные пиримидинов, имидазолинов, препараты из липополисахаридов грамотринательных бактерий, полипептиды (гормонопрепараты тимуса), препараты нукдеиновых кислот, некоторых растений, витамины, эубиотики. v
Производные пиримидинов — метилурацил (метацил) и пентоксид стимулируют синтез нуклеиновых кислот и белков. Под их влиянием повышаются поглотительная активность макрофагов, в том числе легочных, фагоцитарная активность лейкоцитов, переваривание захваченного микроорганизма, активность системы комплемента, в том числе компонентов его альтернативного пути, больше образуется лизоцима, интерферона. При воздействии пиримидинов увеличивается эффективность иммунизации и содержание нормальных антител. Под влиянием препаратов ускоряется регенерация тканей (заживление язв, ран и др.). Они повышают специфическую и неспецифическую резистентность организма к инфекции, способствуют более быстрой ликвидации инфекционного процесса.
Назначают пиримидины часто болеющим детям со сниженной резистентностью к инфекции. Нередко их применяют вместе с химиотерапевтическими препаратами. Это приводит к более быстрому выздоровлению детей и предупреждает повторные заболевания. Кроме того, их применяют при лечении детей, страдающих ревматизмом (в сочетании с нестероидными противовоспалитель-
327
ними средствами), детям с сердечной недостаточностью (вместе с сердечными гликозидами), с язвенной болезнью желудка и двенадцатиперстной кишки (вместе с другими противоязвенными средствами — см. соответствующие главы). Во всех этих случаях они ускоряют развитие терапевтического эффекта и способствуют выздоровлению больных.
При использовании пентоксида у детей могут быть диспепсические расстройства. Метилурацил дети переносят хорошо.
Производные имидазолина — левамизол (декарис), дибазол. Левамизол используют в качестве противоглистного средства (см. гл. 49), однако основное значение для медицины имеет его способность активировать неспецифическую резистентность организма к инфекции. На организм влияет и сам левамизол, и образующийся из него метаболит (последний намного активнее). Оба активируют Т-лимфоциты, моноциты, макрофаги и нейтрофилы.
Левамизол стимулирует клеточно-опосредованные иммунные реакции. Он потенцирует деление и дифференцировку Т-лимфоцитов, их реакцию на антигены, но только при наличии в организме пока неидентифицированного «сывороточного» фактора, иммунологически похожего на тимопоэтин — гормон вилочковой железы (хотя и не образуется в ней). У детей с отсутствием этого фактора левамизол неэффективен.-
Обнаружена способность левамизола имитировать активность тимопоэтина (то есть он является тимопоэтиномиметиком), приводя к увеличению числа Т-лимфоцитов, их бластогенезу, повышению активности Т-лимфоцитов (преимущественно супрессоров, но отчасти и хелперов), способствуя продукции ими лимфокинов. Левамизол повышает активность фагоцитов (миграцию, хемотаксис, активность рецепторов на их поверхности по отношению к иммуноглобулину и к комплементу), активирует продукцию интерферона.
В итоге левамизол повышает неспецифическую резистентность организма к инфекции. Его применяют у больных с иммунодефицитом (например, с агаммаглобулинемией), с хроническими инфекциями (проказа, бруцеллез, микозы, кандидоз), с рецидивирующими инфекциями (верхних дыхательных путей и др.). Применяют его и при генерализованной герпетической инфекции даже у новорожденных детей.
Кроме того, левамизол обладает противовоспалительными свойствами и способностью тормозить образование и активность свободных радикалов кислорода. Сочетание этих свойств со способностью восстанавливать активность иммунной системы объясняет его эффективность при лечении больных с диффузными заболеваниями соединительной ткани, в частности с ревматоидным артритом, системной красной волчанкой, болезнью Крона и др. Применение его в течение 6 мес нередко приводит к субъективному и объективному улучшению в состоянии таких больных, однако более длительный прием нежелателен, так как эффективность препарата может исчезнуть (причина пока неизвестна).
Назначают его внутрь. Половина принятой дозы препарата выводится из организма за 4 ч, а полностью за 48 ч, но стимулирующее его влияние на иммунную систему сохраняется дольше, иногда на протяжении недели. Поэтому его назначают 1 раз в неделю или два дня подряд в неделю по одной дозе. В первые недели лечения системных заболеваний соединительной ткани нередко наблюдают обострение болезни (вероятно, это результат увеличения активности Т-хелперов, лимфокинов), но затем постепенно ее признаки исчезают. У некоторых больных состояние только ухудшается.
328
При назначении левамизола могут быть нежелательные эффекты: лейкопения и даже агранулоцитоз (в результате увеличения активности лейкоагглютининов) при ненарушенном кроветворении; сыпи, синдром, напоминающий грипп, сопровождающийся тошнотой, рвотой, ознобами, болями в суставах и мышцах. Иногда отмечают протеинурию, связанную с отложением иммунных комплексов, нарушение функции желудочно-кишечного тракта, передачи нервно-мышечных импульсов, повышение артериального давления.
Левамизол противопоказан беременным женщинам.
Дибазол в основном используют в качестве спазмолитического и антигипертензивного средства (см. гл. 23), однако у него обнаружено и иммуностимулирующее действие. Усиливая синтез нуклеиновых кислот и белков, он способствует образованию антител, повышая тем самым поствакцинальный иммунитет. Дибазол также активирует неспецифическую резистентность организма, повышая фагоцитарную активность макрофагов и лейкоцитов, увеличивая синтез интерферона. Но все эти эффекты развиваются медленно, поэтому дибазол используют для профилактики (но не для лечения) инфекционных заболеваний. Как иммуностимулятор дибазол в основном применяют для профилактики гриппа и других ОРВИ во время эпидемий или в весенние и осенние месяцы, когда вероятность этих заболеваний повышается.
ПРЕПАРАТЫ МИКРОБНОГО ПРОИСХОЖДЕНИЯ
Липополисахариды бактерий — продигиозан, пирогенал. В педиатрии чаще применяют продигиозан, получаемый из Bact. prodigiosum.
Оба препарата активируют функцию В-лимфоцитов, увеличивая продукцию ими антител. Это увеличивает специфическую и неспецифическую резистентность организма к инфекции. Продигиозан приводит к мобилизации лейкоцитов, возрастает их число в периферической крови. Одновременно увеличивается их фагоцитарная активность, которая сохраняется дольше, чем лейкоцитоз. Возрастает опсонизирующая активность сыворотки. Очень важно активирующее влияние продигиозана на фагоцитарную активность макрофагов, в которых он интенсифицирует функцию многих ферментов и образование различных монокинов.
Используют продигиозан для ускорений^ликвидации инфекции и удаления продуктов некротического распада, рассасывания воспалительного экссудата и заживления ран. Его часто назначают вместе с антибиотиками, при этом инфекционный процесс ликвидируется1 быстрее. Использование его в форме аэрозоля повышает образование интерферона, лизоцима, лактоферрина, секреторного IgA в слизистой оболочке дыхательных путей, то есть факторов местной защиты тканей.
Применяют продигиозан при лечении острых и хронических инфекционных заболеваний у детей, в том числе при пневмониях, пиелонефритах, туберкулезе, дизентерии (Зонне и Флекснера) и пр.
Назначают препарат внутримышечно. При его использовании может на несколько часов повыситься температура тела до 37,2—38°С, реже до более высоких цифр. Могут быть боли в животе, сердце, головная боль. Нельзя назначать этот препарат детям с поражениями ЦНС, острой сердечно-сосудистой недостаточностью.
Бронхомунал — лизат из 7 бактерий (пневмококков, гемофильной палочки, бранхамелл, золотистого стафилококка, зеленеющего и пиогенного
329
стрептококков, клебсиелл). Влияет на Пейеровы бляшки в кишечнике, стимулируя гуморальный иммунитет, увеличивает количество циркулирующих в крови Т-лимфоцитов, повышает содержание 1g А в слизистой оболочке дыхательных путей.
Применяют его для профилактики и терапии (вместе с противомикробными средствами) заболеваний верхних дыхательных путей (бронхита, тонзиллита, фарингита, ларингита, ринита, синусита, отита).
Нежелательные эффекты редко: рвота, диарея.
Бронхо-ваксом — лиофилизированный лизат, тоже из 7 бактерий несколько иного состава. Применяется по тем же показаниям.
Рибомунил содержит рибосомы клебсиелл, пневмококков, пиогенных стрептококков, гемофильной палочки и протеогликаны клебсиелл. Он стимулирует клеточный и гуморальный иммунитет, повышает фагоцитарную активность макрофагов и нейтрофилов, функцию Т-лимфоцитов, продукцию иммуноглобулинов, факторов неспецифической защиты организма.
Применяют рибомунил для профилактики и лечения рецидивирующих инфекционных заболеваний верхних дыхательных путей.
Биостим — экстракт пГикоп^теинов из клебсиелл (С/, pneumoniae). Активирует гуморальный и клеточный- иммунитет, фагоцитоз, Т- и В-лимфоциты, продукцию колониестимулирующего фактора, интерлейкина!.
Применяют биостим для профилактики вторичной инфекции при хронических заболеваниях бронхов и при других заболеваниях дыхательных путей.
Гормонопрепараты тимуса — тактивин, тималин, тимоген. Эти препараты представляют собой комплексы полипептидных фракций, выделенных из вилочковой железы крупного рогатого скота и имитирующих эффекты тимопоэтинов (гормонов тимуса). Препараты обладают способностью корригировать нарушенную иммунологическую реактивность организма, так как активируют систему Т-лимфоцитов, нормализуют соотношение Т- и В-лимфо-цитбв, их субпопуляций, реакции клеточного иммунитета, усиливают фагоцитоз, стимулируют продукцию лимфокинов.
Применяют препараты в качестве иммуностимуляторов и биостимуляторов при острых и хронических гнойных и вирусных заболеваниях, при воспалительных реакциях, при нарушении процессов регенерации (трофические язвы, язвенная болезнь желудка и двенадцатиперстной кишки, ожоговая болезнь и пр.), при угнетении иммунитета и кроветворения после лучевой и химиотерапии у онкологических больных. У детей чаше используют тималин и тимоген, у взрослых — тактивин.
Вводят тималин глубоко в мышцы (избегая попадания в кровеносные сосуды), тактивин вводят под кожу. Тимоген выпускается в виде капель, назначаемых интраназально.
Препарат нуклеиновых кислот — натрия нуклеинат. Этот препарат обладает широким спектром биологической активности. Он стимулирует лей-копоэз, способствует ускорению процессов регенерации, усиливает миграцию и кооперацию Т- и В-лимфоцитов, повышает фагоцитоз, активирует факторы неспецифической резистентности организма.
Применяют натрия нуклеинат в комплексной терапии лейкопении, агранулоцитоза, хронических воспалительных реакций.
’ Назначают натрия нуклеинат внутрь или внутримышечно курсом 10 и более дней.
Препараты растительного происхождения — настойка элеутерококка, настойка женьшеня, экстракт родиолы розовой. Эти препараты ззо
оказывают общетонизирующий (адаптогенный) эффект. В экспериментах на животных было показано, что они способны несколько усиливать лизоцимную активность сыворотки крови, стимулировать систему комплемента, способствовать выработке антител.
В настоящее время названные препараты нашли применение в качестве средств профилактики гриппозной и другой вирусной инфекции во время эпидемий, а также для адаптации к суровым условиям жизни (на севере, в пустынях). Они способствуют нормализации биологических ритмов в организме.
Нежелательные реакции на эти препараты могут проявляться бессонницей, тахикардией, повышением артериального давления.
Назначают их внутрь по 10—20 капель до еды. Курс лечения 10—20 дней.
Циклоферон синтетический аналог алкалоида из растения Citrus gran-dis — индуктор синтеза интерферонов лейкоцитами, макрофагами, фибробластами, эпителиальными клетками, лимфоидными элементами селезенки, печени и легких, тканями мозга.
Применяют циклоферон для профилактики и лечения герпетической и цитомегаловирусной инфекции, для комплексной терапии вирусных гепатитов, нейровирусных заболеваний (например, серозного менингита).
Тонзилгон — смесь экстрактов из корня алтея, цветов ромашки, травы хвоща, листьев ореха, травы тысячелистника, коры дуба, травы одуванчика. Он повышает фагоцитарную активность макрофагов, гранулоцитов, неспецифическую защиту организма от инфекции; вызывает противовоспалительный эффект, снижая отечность слизистых оболочек верхних дыхательных путей.
Применают тонзилгон при острых и хронических заболеваниях верхних дыхательных путей.
Витамины — аскорбиновая кислота, ретинол, а-токоферол, пиридоксин, рибофлавин, тиамин и др. (см. гл. 32).
Назначение витаминов при острых и хронических инфекционных и воспалительных процессах преследует несколько целей. Во-первых, во время этих заболеваний витамины интенсивно расходуются. Во-вторых, назначаемые таким больным противоинфекционные средства нередко угнетают микрофлору кишечника и продукцию ею витаминов. Оба этих фактора могут вызвать состояние гиповитаминоза. В-третьих, такие витамины, как аскорбиновая кислота и ретинол оказывают непосредственное иммуностимулирующее действие, усиливая образование антител и активируя неспецифическую резистентность организма (фагоцитоз, лизосомальные ферменты и пр.). Во время инфекционных заболеваний аскорбиновую кислоту можно назначать в дозах, несколько превышающих суточную потребность. Однако следует с осторожностью относиться к рекомендациям некоторых авторов использовать для профилактики вирусных инфекций аскорбиновую кислоту в дозах, превышающих 1 грамм в сутки.
Эубиотики — лиофильно высушенные живые бактерии, которые после приема внутрь оживают и заселяют кишечник.
К препаратам этой группы относят: бифидумбактерин, бификол, лактобактерии и пр.
Ожившие в кишечнике бифидо- и лактобактерии продуцируют уксусную и молочную кислоты, создавая в нем кислую среду, угнетающую гнилостные и газообразующие микроорганизмы (клостридии, протей, бактероиды и пр.); продуцируют и другие антибактериальные вещества, тормозящие деление различных условно-патогенных (гемолизирующей кишечной палочки, кишечной палочки с измененными ферментативными свойствами, лактозонегативных энтеробактерий) бактерий и возбудителей кишечных инфекций (клебсиелл, саль
331
монелл, шигелл и пр.). Подавление процессов гниения и брожения эубиотиками устраняет метеоризм, способствует нормализации процессов пищеварения, всасывания в кишечнике. Восстановление нормальной микрофлоры в кишечнике способствует иммунизации организма, повышает его сопротивляемость к инфекции.
Применяют эубиотики для профилактики и устранения дисбактериоза (дис-биоценоза) в кишечнике, то есть для восстановления «нормальных» микроорганизмов в фекалиях (бифидо- и лактобактерий).
Дисбактериоз может возникнуть: у новорожденных, родившихся от матерей с поздним токсикозом беременных или с заболеваниями сердечно-сосудистой системы; у недоношенных новорожденных, особенно с внутриутробной инфекцией, леченных антибиотиками с первых дней жизни; у детей, находящихся на искусственном вскармливании, получающих стерильное донорское молоко или при позднем начале грудного вскармливания; у недоношенных новорожденных, перенесших внутриутробную гипоксию; в любом возрасте при приеме ряда антибиотиков: ампициллина, тетрациклинов, левомицетина, бисептола и др.; у больных с язвенной болезныОР'Двенадцатиперстной кишки, особенно при лечении их препаратами, снижающими кислотность желудочного сока; у больных с хроническими гастродуоденитами; у детей с пищевой аллергией, хроническим пиелонефритом, рахитом, гипотрофией, сепсисом, гнойно-инфекционными заболеваниями.
Во всех этих случаях и назначают эубиотики. Их прием способствует улучшению стула, уменьшает метеоризм, повышает аппетит и прибавку массы тела детей.
СРЕДСТВА НЕСПЕЦИФИЧЕСКОЙ ТЕРАПИИ
К этой группе относят разнообразные вещества, нередко неизвестного пока механизма действия, которые тем не менее способны активировать иммунные свойства организма, вызывать противовоспалительный эффект и стимулировать регенерацию тканей.
Кожно-раздражающие вещества. К ним относят горчичники, скипидарную мазь, 5%-ную настойку йода, смесь равных объемов водки (40% раствора этанола) с уксусом (6% раствором уксусной кислоты).
Нанесение этих препаратов на кожу приводит к раздражению чувствительных нервных окончаний и с помощью аксон-рефлексов вызывает расширение сосудов не только на месте нанесения, но и внутри тканей и органов в соответствии с зонами Геда. В коже освобождаются биологически активные вещества (гистамин, кинины и пр.). Улучшение кровоснабжения способствует доставке в очаг воспаления эндогенных противовоспалительных биологически активных веществ и лекарственных средств, оттоку токсинов из поврежденных тканей. Все это помогает более быстрому прекращению воспаления и регенерации тканей.
Горчичники смачивают теплой (!) водой для активации фермента ми-розина, освобождающегося из горчицы. Применяют их у детей старше 3-5 лет. Для ослабления раздражающего действия их накладывают через лист бумаги (газеты). Держат минут 5—15.
332
Скипидарную мазь применяют у детей старше 3-5 лет с нормальной функцией почек и печени дня растирания кожи при невралгиях, миозите, ревматизме, воспалительных процессах в дыхательных путях.
5% настойку йода применяют по этим же показаниям.
Смесь водки с уксусом используют для растирания кожи спины и конечностей у лихорадящих детей любого возраста.
Раздражающие вещества нельзя наносить на поврежденные участки кожи.
Препараты растительного происхождения. Экстракт алоэ жидкий применяют при язвенной болезни двенадцатиперстной кишки и желудка, при ряде глазных заболеваний: прогрессирующей близорукости, блефарите, конъюнктивите, кератите.
Сок алоэ применяют местно для лечения гнойных ран, ожогов, воспалительных заболеваний.
Сок каланхоэ применяют местно для очищения ран от некротических тканей; стимулирует их заживление.
Эхинабене — жидкий экстракт эхинацеи, назначаемый внутрь. Он повышает неспецифическую резистентность организма к инфекции, стимулирует лейкопоэз, фагоцитарную активность гранулоцитов, макрофагов. Применяют его для профилактики и лечения гриппа и ОРВИ, инфекционно-воспалительных процессов в носоглотке и полости рта.
Препараты животного происхождения. Хонсурид — препарат из гиалиновых хрящей крупного рогатого скота. Применяют местно для ускорения заживления и эпителизации длительно не заживающих ран. Но его нельзя применять при острых воспалительных процессах в ране, обширном некрозе тканей, избыточной грануляции.
Актовегин и солкосерил — депротеинизированные препараты из телячьей крови, содержат натуральные низкомолекулярные вещества (нуклеозиды, нуклеотиды, аминокислоты и пр.). Оба улучшают обмен тканей, энергетические ресурсы клеток, анаболизм, улучшают кровоснабжение тканей.
Назначают их внутрь, путем инъекций и местно в виде мазей и гелей. Применяют при нарушениях периферического кровообращения, язвах, пролежнях, ожогах, обморожениях, воспалительных заболеваниях слизистой оболочки полости рта, десен, губ. При парентеральном введении препаратов возможны аллергические реакции в вид© крапивницы, зуда, анафилаксии. Иногда возникают локальная отечность, изменения вкуса и окраски зубов. При нанесении на рану может возникнуть быстро проходящее чувство жжения.
Продукты пчеловодства. Прополис — пчелиный клей выпускают в разнообразных лекарственных формах и применяют наружно, внутрь и в виде аэрозоля. Назначают для лечения ран и ожогов, экземы, дерматозов, нейродермитов, полосканий полости рта и горла, внутрь в качестве гепатопротектора; в виде аэрозоли применяют при гингивитах, стоматитах, глосситах.
Апилак — препарат пчелиного молочка, секрета желез рабочих пчел. Он активирует анаболические процессы и применяется при гипотрофиях у детей раннего возраста, при потере аппетита, нарушениях питания после перенесения инфекционных заболеваний, при себорее кожи лица, опрелостях, кожном зуде и пр.
На прополис и апилак могут быть аллергические реакции у лиц с повышенной чувствительностью к продуктам жизнедеятельности пчел.
Дозы и режим приема лекарственных средств, влияющих на иммунные процессы, см. в табл. 56.
333
Таблица 56
Лекарственные средства, влияющие на иммунные процессы
Препарат Лекарственная форма Путь введения Число введении в сутки Однократная доза
Астемизол Astemizolum Таблетки по 0,01 г Суспензия по 50 мл (в 5 мл 0,005 г) Внутрь 1 2-6 лет — 0,2 мг/кг; 0,2 мл суспензии/кг; 6-12 лет — по 1/2 таблетки (максимально 1,5 таблетки)
Терфенадин Terfenadinum Таблетки по 0,06 г Внутрь 2 2-6 лет — 2 мг/кг; 6-12 лет — 30 мг; 12 лет — 60 мг
Лоратидин Loratidinum Таблетки по 0,01 г Внутрь 1 2-12 лет (до 30 кг) — 0,005 г; 12 лет — (больше 30 кг) 0,01 г
Зиртек Zyrtek Таблетки по 10 мг Раствор во флаконе 10 мл (в 1 мл 20 каплях 10 мг) Внутрь 1 2—6 лет — 10 капель; 6 лет — 1 таблетка или 20 капель (10 мг)
Бронхомунал Bronchomunal Капсулы по 3,5 мг внутрь 1 Курс 10-30 дней
Бронхо-ваксом Broncho-vaxom Капсулы по 3,5 мг Внутрь 1 6 мес — 12 лет по 1 капсуле; 12 лет — по 2 капсулы
Рибомунил Ribomunyl Официнальные таблетки Внутрь 1 1-3 таблетки
Биостим Biostim Таблетки и капсулы по 0,001 г Внутрь 1-2 Детям старше 1 года — 3 курса по 8 дней с перерывом в три нед 1 раз в год
Циклоферон Cycloferonum Ампулы по 2 мл, в 1 мл 125 мг Внутримышечно Внутривенно 1 Два дня подряд, затем через день, всего 5-10 инъекций
Тонзилгон Tonsilgon Драже или жидкий экстракт по 10Q мл Внутрь 5-6 До 5 лет по 1 капле на год жизни; в 5-10 лет по 15 капель; 10—15 лет по 1 драже или по 20 капель; курс 4-6 нед
Мазь скипидарная Ung. Terebinthi-пае В банках по 50,0 г Растирание кожи 1 Детям старше 3-5 лет
Экстракт алоэ жидкий для инъекций Extr. Aloes flui-dum proinjectio-nibus Ампулы по 1 мл Подкожно 1 До 5 лет — 0,2-0,3 мл; 5 лет — 0,5 мл; 14 лет — 1 мл; курс 30-50 инъекций
Сок алоэ Succus Aloes Флаконы по 100 мл Орошение ран, примочки 1
Сок каланхоэ Succus Kalancho-es Ампулы по 10 мл Флаконы по 100 мл Смачивают повязку и накладывают на рану 1 1—3 мл. Курс 15—20 дней
334
Продолжение табл. 56
Препарат Лекарственная форма Путь введения Число введений в сутки Однократная доза
Хонсурид Chonsuridum Порошок во флаконе по 0,06 и 0,1 г. Растворить в 5 или 10 мл 0,5% раствора новокаина Местно с марлевой повязкой на рану 1 раз в 3 дня
Актовегин Actovegin Драже Раствор в ампулах по 2,5 и 10 мл Внутрь, внутривенно, внутримышечно 3 1 Подросткам: 1-я доза — 10—20 мл, затем по 2-5 мм ежедневно
20% гель или 5% мазь в тубах по 20,0 г Местно 1 раз в неделю
Солкосерил Solcoseryl Таблетки по 0,2 г Раствор в ампулах по 2, 5 и 10 мл Внутрь Внутривенно 3 1 Подросткам — 5-20 мл Курс — 2-6 нед
Прополис Propolis Таблетки Настойка Внутрь Местно, лечение ран 3-4 1 Курс 3-6 мес
Мазь То же 1
Апилак Apilacum Таблетки по 0,01 г Свечи по 0,005 и 0,01 г Свечи по 0,0025 г Внутрь Ректально 3 3 3 Детям разного возраста Недоношенным, новорожденным. Курс 7—15 дней
Димедрол Dimedrolum Порошок Таблетки по 0,02 г Внутрь во время еды 2-3 До 1 года — 0,002-0,005 г; 2-5 лет - 0,005-0,015 г; 6-12 лет — 0,015-0,030 г
Свечи по 0,01 г Ректально
1% раствор в ампулах по 1 мл Внутримышечно Внутривен-. но J
Диазолин Diazolinum Порошок, драже по 0,05 г Внутрь 1-2-3 0,02-0,05 г
Дипразин Diprazinum Таблетки по 0,005 и 0,01 г Внутрь 1-3 1—2 года — 0,0025 г; 3-4 года — 0,005 г; 5-6 лет — 0,0075-0,01 г; 7~9 лет — 0,01 г; 10-14 лет — 0,015 г
2,5% раствор в ампулах по 2 мл Внутримышечно Внутривенно
Фен карол Phencarolum Порошок, таблетки по 0,025 г Внутрь 2-3 До 3 лет — 0,005 г; 3—7 лет — 0,01 г; 7-12 лет - 0,01-0,015 г; старше 12 лет — 0,025 г
335
Окончание табл. 56
Препарат Лекарственная форма Путь введения Число введений в сутки Однократная доза
Супрастин Suprastinum Таблетки по 0,025 г Внутрь 2-3 До 1 года — 0,002—0,005 г; 1-5 лет - 0,005-0,015 г; 6-12 лет — 0,015-0,03 г
1% раствор в ампулах по 1 мл Внутримышечно Внутривенно
Тавегил Tavegil Таблетки по 0,001 г Внутрь 2 6-12 лет — 0,5-1 таблетка
Кетотифе н Ketotifenum Капсулы и таблетки по 0,001 г Сироп (в 1 мл 0,2 мг) Внутрь 2 0,025 мг/кг
Кромолин-натрий Cromolin-Sodium Порошок в капсулах для ингаляций по 0,02 г Ингаляци-онно 3-4 (до 6) После 5 лет — 1 капсула
Теофиллин Theopyllinum Порошок Внутрь 2-3 2—4 года — 0,01—0,04 г; 5-6 лет — 0,04—0,06 г; 7-9 лет - 0,05-0,075 г; 10—14 лет — 0,05-0,1 г
Свечи Ректально
Хингамин Chingaminum Таблетки по 0,25 г Внутрь 1 0,125-0,25 г
Пеницилламин Penicillaminum Капсулы и таблетки по 0,15 и 0,25 г Внутрь 2-3 В начале лечения детям до 20 кг — 0,025 г, детям более 20 кг — „0,05 г. Через 10—14 нед лечения детям до 20 кг — 0,15 г; детям более 20 кг — 0,2 г
Левамизол Levamisolum Таблетки по 0,05 и 0,015 г Внутрь 1 раз в неделю 1 мг/кг
Продигиозан Prodigiosanum 0,005% раствор в ампулах по 1 мл Внутримышечно 1-2 раза в неделю В начале лечения — 25 мкг (0,5 мл), постепенно дозу увеличивают до 100 мкг (2 мл)
Метил урацил Methyluracilum Порошок Таблетки по 0,5 г Внутрь 3 До 1 года — 0,05 г; 1—3 года — 0,08 г; 3-8 лет — 0,1- 0,2 г; 8-12 лет — 0,5-0,7 г
Раздел VII ПРОТИВОМИКРОБНЫЕ И П РОТИ ВО ПАРАЗИТАРНЫЕ СРЕДСТВА
Р’лзва 41 ДЕЗИНФИЦИРУЮЩИЕ И АНТИСЕПТИЧЕСКИЕ СРЕДСТВА
Противомикробные препараты, губительно действующие на микроорганизмы вне сред человеческого организма, делят на две группы: средства для дезинфекции и антисептики.
Дезинфицирующие вещества применяют для уничтожения микроорганизмов во-внешней среде (мебель, посуда, одежда, предметы ухода за больными). К ним относят лекарственные препараты, в основном, денатурирующие белки, действующие неизбирательно на клетки макро- и микроорганизмов. Они, как правило, высокотоксичные для человека.
Антисептики — лекарственные вещества, подавляющие микроорганизмы на поверхности тела; на коже и слизистых оболочках. Их применяют наружно: для обработки кожи, слизистых, либо для промывания полостей. Для детей применяют вещества, плохо проникающие в глубь тканей и плохо всасывающиеся в кровь, учитывая менее совершенные тканевые барьеры, особенно в раннем возрасте. Применяемые в педиатрии препараты не должны вызывать раздражения и повреждения кожи и слизистых оболочек. Антисептики — большая группа лекарственных препаратов с различными механизмами проти-вомикробного действия, преимущественно они вызывают бактерицидный эффект. Многие из них денатурируют белок и не обладают избирательностью действия по отношению к микроорганизмам. В качестве антисептиков могут быть использованы и препараты из других групп, обладающие противомик-робными свойствами: антибиотики, сульфаниламиды, оксихинолины, нитрофураны, некоторые органические кислоты й т. д.
К дезинфицирующим и антисептически^ средствам относят:
1. Галогены: препараты хлора (хлорамин Б, хлорная известь, пантоцид, гексахлорафен, хлоргексидин); препараты йода (раствор йода спиртовый, йоди-нол, йодоформ, йодонат). Механизм их противомикробного действия заключается в том, что освобождающийся галоген денатурирует белки.
Препараты хлора. Раствор хлорамина Б применяют преимущественно для дезинфекции посуды, мебели, неметаллического инструментария, для обеззараживания предметов ухода за больными, хлорную известь — для дезинфекции помоек, выгребных ям и пр. Пантоцид применяют в основном для обеззараживания воды, для чего одну таблетку разводят в определенном объеме воды. Он может быть использован и для дезинфекции рук.
Гексахлорафен применяют для обработки ран, операционного поля, для купания новорожденных (3% раствор). Он малоактивен против грамотри-цательных бактерий. При длительном применении может вызвать спонгиозную энцефалопатию.
Хлоргексидин (гебитан, гибикленс) уничтожает грамположительные и грамотрицательные бактерии, а также грибки (рода Candida). Применяют для обработки операционного поля у детей, для купания новорожденных. Препарат
337
более эффективен, чем гексахлорафен, и не вызывает существенных осложнений.
Препараты йода. Их у детей применяют с осторожностью, поскольку молекулярный йод вызывает раздражение кожи и слизистых, может привести к их ожогу, а при смазывании поверхностей, всасываясь, создает в крови концентрации, угнетающие секрецию щитовидной железы.
Й од и н ол применяют наружно при тонзиллитах, гнойных отитах, ринитах, гнойных хирургических заболеваниях, трофических язвах, термических и химических ожогах. Препарат содержит активный молекулярный йод в поливиниловом спирте, который задерживает освобождение йода и удлиняет его взаимодействие с тканями.
Йодонат — водный комплекс раствора йода с поверхностно активным веществом. Применяют для обработки операционного поля в качестве заменителя спиртового раствора йода. Бактерицидный эффект оказывают оба компонента препарата, подавляя стафило- и стрептококки, синегнойную палочку, грибки.
Спиртовые растворы йода (3—5%) преимущественно применяют у детей старше года для обработки операционного поля, для лечения фурункулов и других инфекционных поражений кожи. Для обработки остатка пуповины у новорожденных применение этих растворов нежелательно, во-первых, спиртовой раствор может повредить кожу ребенка; во-вторых, под образовавшейся корочкой из свернувшегося белка могут сохраниться микроорганизмы.
2. Окислители: раствор перекиси водорода, калия перманганат.
Раствор перекиси водорода 3% применяют для промывания ран и для остановки мелких кровотечений. При соприкосновении с раневой поверхностью происходит распад Н2О2 и освобождение атомарного кислорода. Он повреждает клеточные мембраны микроорганизмов, а образующаяся пена механически очищает рану. Выпускается в виде концентрированного раствора под название «Пергидроль».
Калия перманганат применяют в виде водных растворов для промывания ран (0,1—0,5%) и для прижиганий язвенных и ожоговых поверхностей (2-5%), для обработки пупочной ранки. Применяют его с профилактической целью во время купания новорожденных (0,01-0,05%). Во всех случаях недопустима сохранность кристаллов в растворах, так как они могут вызвать химические ожоги слизистых оболочек и кожи, повредить ее роговой слой. Если ожог все-таки произошел, кожу необходимо промыть 1% раствором аскорбиновой кислоты, которая способна предупредить и устранить повреждающее действие препарата на кожу (см. гл. 50).
3. Кислоты и щелочи: кислота салициловая, кислота бензойная, кислота борная, натрия тетраборат и др.
Кислоту салициловую применяют наружно как антисептическое, раздражающее и кератолитическое средство в мазях, присыпках, в виде спиртовых растворов. Входит в состав официнальных лекарственных форм: линимент «Камфоцин», присыпка «Гальманин», жидкость мозольная и др.
Кислоту бензойную используют наружно как бактерицидное и фунгицидное средство. При приеме внутрь усиливает секрецию слизистой оболочки бронхов, поэтому ее применяют внутрь в виде натриевой соли при бронхитах как отхаркивающее средство.
Кислоту борную применяют как антисептическое средство в присыпках, мазях, в виде водных и спиртовых растворов. Абсолютно противопоказана новорожденным и детям младшего возраста, поскольку с поврежденной кожи, а также со слизистых оболочек она легко всасывается в кровь и может вызвать 338
тяжелую интоксикацию с летальным исходом. Борная кислота кумулируется в тканях, куда она быстро проникает из плазмы крови, снижая периферическое сопротивление сосудов (вызывая падение артериального давления) с ослаблением их реакции на сосудосуживающие вещества. Кроме того, борная кислота вызывает нефротоксический эффект.
Натрия тетраборат (бура, боракс) обладает фунгицидным действием; применяют наружно для промываний, спринцеваний, полосканий.
4. Альдегиды: раствор формальдегида, гексаметилентетрамин и др.
Раствор формальдегида (формалин) применяется как дезинфицирующее и дезодорирующее средство для мытья рук, кожи, для дезинфекции инструментов. Входит в состав лизоформа (мыльный раствор формалина).
Гексаметилентетрамин (уротропин) применяется как антисептик мочевыводящих путей, поскольку в кислой среде способен разрушаться с образованием формальдегида. Выпускается в форме порошка, таблеток, 40% раствора в ампулах по 5 и 10 мл. Входит в состав сложных таблеток «Уросал», «Кальцекс».
5. Спирты: спирт этиловый различных концентраций (96—40%) (см. гл. 9). !
Применяют наружно как антисептическое и раздражающее средство в форме компрессов, обтираний, для стерилизации шовного материала, хирургических инструментов и т. д.
6. Соли тяжелых металлов: препараты ртути (ртути амидохлорид), препараты серебра (нитрат серебра, протаргол, колларгол), препараты цинка (цинка окись, цинка сульфат), препараты висмута (дерматол, висмута основной нитрат).
Препараты ртути — высокоактивные противомикробные средства, но обладают высокой токсичностью, поэтому в настоящее время их используют крайне редко. Соли ртути входят в состав различных мазей и применяются в дерматологии для лечения паразитарных заболеваний, сифилиса (серая ртутная мазь), пиодермии (белая ртутная мазь), блефаритов, кератитов, себореи (желтая ртутная мазь).
Препараты серебра. Серебра нитрат применяют для прижиганий при эрозиях, язвах, трещинах, грануляциях (ляпис). В форме растворов небольших концентраций оказывает вяжущее и противовоспалительное действие.
Протаргол в виде растворов применяют как вяжущее, противовоспалительное и антисептическое средство. Выпускается в форме глазных капель.
Колларгол применяют для промывания гнойных ран, при рожистом воспалении, гнойном конъюнктивите. Иногда раствор'колларгола используют интраназально при воспалении слизистой оболочки. Следует учесть, что в один носовой ход можно закапать ребенку не более 2 капель 2% раствора. Большее количество раствора может попасть на заднюю стенку глотки и вызвать рефлекторную остановку дыхания. Опасность этого осложнения тем выше, чем младше ребенок.
Препараты цинка — цинка сульфат применяют в форме растворов глазных капель. Цинка окись входит в состав сложных официнальных мазей и присыпок, обладает противовоспалительным и подсушивающим действием.
Препараты висмута — висмута нитрат основной, ксероформ и дерматол обладают противомикробными и вяжущими свойствами. Висмут способен связывать сульфгидрильные группы ферментов микроорганизмов, либо, в зависимости от концентрации препарата, денатурировать их белки. Дерматол и ксероформ входят в состав многих присыпок, мазей и паст и применяют их только наружно. О с н о в н о й нитрат висмута применяют для лечения
339
энтеритов и колитов, он входит в состав сложных лекарственных форм: викалин, викайр.
7. Красители: метиленовый синий, бриллиантовый зеленый, этакридина лактат. Применяют их для обработки кожи и слизистых оболочек с профилактической и лечебной целями. Можно применять у новорожденных. Катионы этих веществ вытесняют водород из соединений, необходимых для жизнедеятельности бактерий. В итоге возникает бактериостатический или бактерицидный эффект, но преимущественно в отношении грамположительных бактерий и грибков, на грамотрицательные бактерии влияют минимально.
Метиленовый синий — преимущественно бактериостатический препарат выпускают его в виде водных и спиртовых растворов. Для новорожденных предпочтительней водные растворы, так как спирт может нарушить нормальную структуру и функцию кожи. 1—2% растворы применяют для лечения пиодермии, отдельных фурункулов, молочницы, у взрослых и детей для обработки полости рта при стоматите.
Бриллиантовый зеленый используют в виде 1—2% спиртового или водного растворов. У новорожденных предпочитают 1% водный раствор для лечения пиодермии, конъюнктивитов, для обработки пуповины.
Этакридина лактат (риванол) преимущественно влияет на грам-положительные кокки. Применяют его в виде 0,1—0,2% растворов, пропитывая им тампоны, салфетки, наносимые на инфицированные участки кожи. При конъюнктивите применяют 0,1% раствор для промывания глаз.
8. Производные фенола: резорцин, ихтиол и альбихтол.
Растворы самого фенола применяются только для дезинфекции белья, предметов ухода, инструментов, мебели, для консервирования лекарственных веществ, сывороток и т. д.
Резорцин применяют наружно для лечения кожных заболеваний в виде мазей, водных и спиртовых растворов.
Фенилсалицилат (салол) применяют внутрь при воспалительных заболеваниях кишечника. В щелочной среде кишечника фенилсалицилат распадается на салициловую кислоту и фенол, которые угнетающе действуют на кишечную микрофлору. Использовать для детей раннего возраста не рекомендуется из-за опасности повреждения слизистой оболочки кишечника.
Бензонафтол применяют при заболеваниях желудочно-кишечного тракта как антисептическое средство.
В а гот и л — водный раствор крезолсульфоновой кислоты. Применяют в гинекологии для лечения воспалительных процессов шейки матки, влагалища. Оказывает трихомонадоцидное действие, ускоряет регенерацию, оказывает местное сосудосуживающее действие.
Препараты антисептиков даны в табл. 57.
Таблица 57
Антисептики
Препарат Форма выпуска Способ применения
Метиленовый синий Methylenum coeruleum Калия перманганат Kaiii permanganas Йод Jodum 1%, 2% спиртовые и водные растворы 1% водный раствор, 0,01%, 0,1%, 0,5% водные растворы 1% и 3% спиртовые растворы Смазывание Смазывание Промывания, ванны, примочки Обработка операционного поля
340
Окончание табл. 57
Препарат Форма выпуска Способ применения
Йодинол Jodinolum 1% водный раствор Повязки, полоскания *
Колларгол Collargolum 0,2%, 1%, 2%, 3% водные растворы Промывания, закапывания
Перекись водорода Hydrogenii peroxydum 3% водный раствор Обработка ран
Глава 42 АНТИБИОТИКИ
Антибиотики — продукты обмена микроорганизмов, подавляющие активность других микробов. В качестве лекарственных препаратов используют естественные антибиотики, а также их пблусинтетические производные и синтетические аналоги, обладающие способностью подавлять возбудителей различных заболеваний в организме человека.
По химическому строению антибиотики делят на несколько групп:
А. Бета-лактамные антибиотики.
1. Пенициллины.
а) Природные пенициллины: бензилпенициллин и его соли, феноксиметил-пенициллин.
б) Полусинтетические пенициллины:
— пенициллиназоустойчивые с преимущественной активностью в отношении стафилококков: оксациллин, клоксациллин, флуклоксациллин;
— с преимущественной активностью в отношении грамотрицательных бактерий (амидинопенициллины): амдиноцилЛин (мециллинам), ацидоциллин;
— широкого спектра действия (аминопенициллины): ампициллин, амоксициллин, пивампициллин;
— широкого спектра действия, особенно высокоактивные в отношении синегнойной палочки и других грамотрицательных бактерий (карбокси- и уреи-допенициллины): карбенициллин, тикарцшйин, азлоциллин, мезлоциллин, пиперациллин.
2. Цефалоспорины:
а) первое поколение: цефалоридин, цефазолин и др.;
б) второе поколение: цефамандол, цефуроксим и др.;
в) третье поколение: цефотаксим, цефтазидим и др.;
г) четвертое поколение: цефпиром, цефепим и др.
3. Монобактамы: азтреонам.
4. Карбапенемы: имипенем, меронем, тиенам, примаксин.
Б. Фосфомицин.
В. Макролиды:
а) первое поколение: эритромицин, олеандомицин;
б) второе поколение: спирами'цин (ровамицин), рокситромицин (рулид), кларитромицин (клацид) и др.;
в) третье поколение: азитромицин (сумамед).
Г. Линкозамиды: линкомицин, клиндамицин.
Д. Фузидин.
34.1
Е. Аминогликозиды:
а) первое поколение: стрептомицин, мономицин, канамицин;
б) второе поколение: гентамицин;
в) третье поколение: тобрамицин, сизомицин, амикацин, нетильмицин;
г) четвертое поколение: изепамицин.
Ж. Левомицетин.
3. Тетрациклины:
. а) естественные: тетрациклин, окситетрациклин, хлортетрациклин;
б) полусинтетические: метациклин, доксициклин, миноциклин, морфоцик-лин.
И. Рифамицины: рифоцин, рифамид, рифампицин.
К. Гликопептидные антибиотики: ванкомицин, тейкопланин.
Л. Ристомицин.
М. Полимиксины: полимиксин В, полимиксин Е, полимиксин М.
Н. Грамицидин.
О. Полиеновые антибиотики: нистатин, леворин, амфотерицин В (см. гл. 47).
По характеру антимикробного действия антибиотики делят на бактерицидные и бактериостатические. К бактерицидным, вызывающим гибель микроорганизмов, относят пенициллины, цефалоспорины, аминогликозиды, полимиксины и др. Такие препараты могут дать быстрый терапевтический эффект при тяжелых инфекциях, что особенно важно у детей младшего возраста. Их применение реже сопровождается рецидивами заболеваний и случаями носительства. К бактериостатическим антибиотикам относят тетрациклины, левомицетин, макролиды и др. Эти препараты, нарушая синтез белков, угнетают деление микроорганизмов. Они обычно достаточно эффективны при заболеваниях средней степени тяжести.
Антибиотики способны ингибировать биохимические процессы, происходящие в микроорганизмах. По механизму действия они делятся на следующие группы:
1. Ингибиторы синтеза микробной стенки или ее компонентов во время митоза: пенициллины, цефалоспорины, карбапенемы, монобактамы, гликопептидные антибиотики, ристомицин, фосфомицин, циклосерин.
2. Антибиотики, нарушающие структуру и функцию цитоплазматических мембран: полимиксины, аминогликозиды, полиеновце антибиотики, грамицидин, гликопептидные антибиотики.
3. Ингибиторы синтеза РНК на уровне РНК-полимеразы: рифамицины.
4. Ингибиторы синтеза РНК на уровне рибосом: левомицетин, макролиды (эритромицин, олеандомицин и др.), линкомицин, клиндамицин, фузидин, тетрациклины, аминогликозиды (канамицин, гентамицин и др.), гликопептидные антибиотики.
Кроме того, важное значение в механизме действия отдельных антибиотиков, особенно пенициллинов, имеет их ингибирующее влияние на адгезию микроорганизмов к клеточным мембранам.
Механизм действия антибиотиков во многом определяет тип вызываемых ими эффектов. Так, антибиотики, нарушающие синтез микробной стенки или функцию цитоплазматических мембран, являются бактерицидными препаратами; антибиотики же, угнетающие синтез нуклеиновых кислот и белка, обычно действуют бактериостатически. Знание механизма действия антибиотиков необходимо для правильного их выбора, определения продолжительности курса лечения, подбора эффективных комбинаций препаратов и пр.
342
Для обеспечения этиотропной терапии необходимо учитывать чувствительность возбудителей к антибиотикам. Природная чувствительность к ним обусловлена биологическими свойствами микроорганизмов, механизмом действия антибиотиков и другими факторами. Различают антибиотики узкого и широкого спектра действия. К антибиотикам узкого спектра действия относят препараты, подавляющие преимущественно грамположительные или грамотрицательные бактерии: некоторые пенициллины (бензилпенициллин, оксациллин, ацйдо-циллин, азтреонам, ристомицин, фузидин, новобиоцин, бацитрацин, ванкомицин, монобактамы (азтреонам). Узким спектром обладают и полимиксины В, Е, М, угнетающие грамотрицательные бактерии, а также противогрибковые антибиотики нистатин, леворин, амфотерицин В, амфоглюкамин, микогептин, гризеофульвин.
К антибиотикам широкого спектра действия относят препараты, влияющие как на грамположительные, так и на грамотрицательные бактерии: ряд полу-синтетических пенициллинов (ампициллин, амоксициллин, карбенициллин); цефалоспорины, особенно третьего и четвертого поколений; карбапенемы (ими-пенем, меронем, тиенам); левомицетин; тетрациклины; аминогликозиды; ри-фамицины. Некоторые из названных антибиотиков действуют, кроме того, на риккетсии, хламидии, микобактерии и др.
При выявлении возбудителя инфекционного заболевания и его чувствительности к антибиотикам предпочтительно применение препаратов узкого спектра действия. Антибиотики же широкого спектра назначают при тяжелом течении заболевания и при смешанной инфекции.
Среди антибиотиков выделяют препараты, накапливающиеся внутри клеток (соотношение внутри- и внеклеточных концентраций более 10). К ним относят макролиды, особенно новые (азитромицин, рокситромицин, спирамицин), карбапенемы, клиндамицин. Хорошо проникают внутрь клеток (соотношение внутри- и внеклеточных концентраций от 1 до 10) рифампицин, левомицетин, тетрациклины, линкомицин, ванкомицин, тейкопланин, фосфомицин. Пенициллины, цефалоспорины, аминогликозиды внутрь клеток проникают плохо (соотношение внутри- и внеклеточных концентраций меньше 1). Не проникают внутрь клеток и полимиксины.
В процессе применения антибиотиков к ним может развиться устойчивость микроорганизмов. К пенициллинам, цефад)оспоринам, монобактамам, карба-пенемам, левомицетину, тетрациклинам, гликопептидам, ристомицину, фосфо-мицину, линкозамидам устойчивость развивается медленно и параллельно понижается терапевтический эффект препаратов. К аминогликозидам, макролидам, рифамицинам, полимиксинам, фузидину устойчивость развивается очень быстро, иногда в процессе лечения одного больного.
ХАРАКТЕРИСТИКА ОТДЕЛЬНЫХ ГРУПП АНТИБИОТИКОВ
Пенициллины. По химическому строению эти антибиотики являются производными 6-аминопенициллановой кислоты (6-АПК), содержащими различные заместители (R) в аминогруппе (см. рис. 39).
Механизм противомикробного действия пенициллинов заключается в нарушении образования клеточной стенки из предварительно синтезированных фрагментов муреина. Различают естественные пенициллины: бензилпенициллин (в виде натриевой, калиевой, новокаиновой солей), бициллины, феноксиме-тилпенициллин; полусинтетические пенициллины: оксациллин, клоксациллин,
343
ампициллин (пентрексил), амоксициллин, карбенициллин, карфециллин, пиперациллин, мезлоциллин, азлоциллин и др.
Бензилпенициллин дает четкий терапевтический эффект при лечении заболеваний, вызванных пневмококками, стафилококками, гемолитическими стрептококками группы А, менингококками, гонококками, бледной спирохетой, коринобактериями, палочкой сибирской язвы и некоторыми другими микроорганизмами. Многие штаммы микробов, особенно стафилококки, резистентны к бензилпенициллину, так как продуцируют фермент fj-лактамазу, инактиви-руюший антибиотик.
Бензилпенициллин обычно вводят внутримышечно, в критических ситуациях внутривенно (только натриевую соль). Дозы варьируют в больших пределах от 30000—50000 Ед/(кгхсут) до 1000000 ЕД/(кгхсут) в зависимости от возбудителя, тяжести и локализации инфекционного процесса.
Терапевтическая концентрация в плазме крови возникает уже через 15 минут после внутримышечного введения и сохраняется в ней 3-4 ч. Бензилпенициллин хорошо проникает в слизистые оболочки и легкие. Он мало поступает в цереброспинальную жидкость, миокард, кости, плевральную, синовиальную жидкости, в просвет бронхов и в^иокроту. При менингитах возможно эндо-люмбальное введение натриевой соли бензилпенициллина. Препарат можно вводить в полости, эндобронхиально, эндолимфатически. В высоких концентрациях его обнаруживают в желчи и в моче. У детей до месячного возраста элиминация бензилпенициллина происходит медленнее, чем у взрослых. Это определяет частоту введения препарата: на первой неделе жизни 2 раза в сутки, затем 3-4 раза, а после месяца, как у взрослых, 5-6 раз в сутки.
При лечении инфекций, требующих длительной антибиотикотерапии и не имеющих острого течения (очаговая стрептококковая инфекция, сифилис), для профилактики обострений ревматизма применяют пролонгированные препараты бензилпенициллина: новокаиновую сол ь, • б и ц и лл и н ы 1, 3, 5. Эти препараты по спектру антимикробного действия не отличаются от натриевой и калиевой солей бензилпенициллина, их можно использовать у детей старше 1 года. Все пролонгированные пенициллины вводят только внутримышечно в виде суспензии. После однократной инъекции новокаиновой соли терапевтическая концентрация бензилпенициллина в крови сохраняется до 12 ч. Бициллин-5 вводят 1 раз в 2 недели. Инъекции бициллина-1 и бициллина-3 производят 1 раз в неделю. В основном бициллины применяют для профилактики рецидивов ревматизма.
Феноксиметилпенициллин — кислотоустойчивая форма пенициллина, применяется внутрь натощак 4-6 раз в сутки для лечения нетяжелых инфекционных заболеваний. Спектр его действия практически такой же, как у бензилпенициллина.
Оспен (бимепен) бензатин феноксиметилпенициллин медленно всасывается из желудочно-кишечного тракта и длительно поддерживает терапевтическую концентрацию в крови. Назначают в виде сиропа 3 раза в день.
Оксациллин, кл оке аци лл и н, флуклоксациллин — полусин-тетические пенициллины, применяемые в основном при лечении заболеваний, вызванных стафилококками, в том числе резистентными к бензилпенициллину. Оксациллин способен ингибировать |3-лактамазу стафилококков и усиливать эффект других пенициллинов, например ампициллина (комбинированный препарат оксациллина с ампициллином — ампиокс). При заболеваниях, вызванных другими микроорганизмами, чувствительными к бензилпенициллину (менингококки, гонококки, пневмококки, стрептококки, спирохеты и др.), 344
названные антибиотики практически применяют редко из-за отсутствия положительного эффекта.
R
— HN
СООН
Оксациллин, клоксациллин, флуклоксациллин хорошо всасываются из желудочно-кишечного тракта. В плазме крови эти препараты связаны с белками и плохо проникают в ткани. Названные антибиотики можно вводить внутримышечно (каждые 4—6 ч) и внутривенно струйно или капельно.
Амидинопенициллины — амдиноциллин (мециллинам) антибиотик уз-"' кого спектра действия, неактивен в отношении грамположительных бактерий, но эффективно подавляет грамотрицательные бактерии (кишечную палочку, шигеллы, сальмонеллы, клебсиеллы). Синегнойная палочка, протей и неферментирующие грамотрицательные бактерии обычно устойчивы к действию ам-
345
диноциллина. Особенностью данного антибиотика является то, что он активно взаимодействует с ПСБ-2 (пенициллинсвязывающим белком), в то время как большинство других р-лактамных антибиотиков взаимодействует с ПСБ-1 и ПСБ-3. Поэтому он может быть синергистом других пенициллинов, а также цефалоспоринов. Препарат вводят парентерально, при этом он во много раз лучше проникает внутрь клеток, чем ампициллин и карбенициллин. Особенно высока эффективность антибиотика при инфекции мочевыводящих путей. Для энтерального применения синтезировано эфирное произврдное препарата пива мд и но ци л л и н.
Полусинтетические пенициллины широкого спектра действия — ампициллин, амоксициллин имеют наибольшее значение при лечении заболеваний, вызванных гемофильными палочками, гонококками, менингококками, некоторыми видами протея, сальмонеллами, и, кроме того, возбудителями листериоза и энтерококками. Эти антибиотики эффективны и для лечения инфекционных процессов, вызываемых смешанной (грамположительной и гра-мотрицательной) микрофлорой. Ампициллин и амоксициллин можно вводить внутрь, например при лечении инфекций желудочно-кишечного тракта, мочевыводящих путей, отита. Нейсосавшийся из желудочно-кишечного тракта ампициллин вызывает раздражение слизистых оболочек, приводя у значительного процента детей к рвоте, поносу, раздражению кожи вокруг анального отверстия. Амоксициллин отличается от ампициллина лучшим всасыванием, поэтому его можно назначать через рот не только при легких, но и при среднетяжелых инфекциях. Амоксициллин меньше раздражает слизистые оболочки желудочно-кишечного тракта, реже вызывает рвоту, понос. При тяжелых заболеваниях, требующих создания в крови высокой концентрации антибиотика, названные препараты вводят парентерально.
Карбоксипенициллины — к а р б е н и ц и л л и н, тикарциллин обладают еще большим спектром антимикробного действия, чем ампициллин, и отличаются от него дополнительной способностью подавлять синегнойную палочку, индол-положительные штаммы протея и бактероиды. Основное их применение — заболевания, вызванные названными возбудителями. Из желудочно-кишечного тракта карбенициллин и тикарциллин всасываются очень плохо, поэтому их применяют только парентерально (карбенициллин внутримышечно и внутривенно, тикарциллин внутривенно). Карфециллин — фениловый эфир карбенициллина. Он хорошо всасывается из желудочно-кишечного тракта, после чего из него освобождается карбенициллин. Карбокси пенициллины по сравнению с ампициллином хуже проникают в ткани, серозные полости, цереброспинальную жидкость. Карбенициллин в активной форме и высоких концентрациях содержится в желчи и в моче. Его выпускают в виде динатриевой соли, поэтому при нарушении функции почек возможна задержка в организме воды и возникновение отеков.
Применение препаратов может сопровождаться появлением аллергических реакций, симптомов нейротоксичности, острого интерстициального нефрита, лейкопении, гипокалиемией, гипернатриемией и т. д.
Уреидопенициллины (ациламинопенициллины) — пиперациллин, мез-лоциллин, азлоциллин — антибиотики широкого спектра действия, подавляющие грамполоЖительные и грамотрицательные микроорганизмы. Названные антибиотики в основном используют при тяжелых грамотрицательных инфекциях, особенно при заболеваниях, вызванных синегнойной палочкой (обязательно в сочетании с аминогликозидами), клебсиеллами. Уреидопенициллины хорошо проникают внутрь клеток. В организме они мало метаболи-346
зируются и выделяются почками путем фильтрации и секреции. Препараты мало устойчивы к р-лактамазе, поэтому их рекомендуют назначать с ингибиторами этого фермента. Пиперациллин назначают при хронических воспалительных заболеваниях бронхов, в том числе при муковисцидозе и хронических бронхитах. Препараты могут вызвать лейкопению, тромбоцитопению, нейтропению, эозинофилию, аллергические реакции, нарушения функции желудочно-кишечного тракта, интерстициальный нефрит и др.
При назначении полусинтетических пенициллинов широкого спектра действия: аминопенициллинов (ампициллин, амоксициллин), карбоксипенициллинов (карбенициллин, тикарциллин), уреидопенициллинов (пиперациллин, мезлоциллин, азлоциллин) необходимо помнить, что все названные антибиотики разрушаются стафилококковыми р-лактамазами, и поэтому к их действию резистентны продуцирующие пенициллиназу штаммы этих микробов.
Комбинированные препараты с ингибиторами р-лактамаз — клавулановой кислотой и сульбактамом. Клавулановаякислотаисульбактам (сульфон пенициллановой кислоты) относят к р-лактаминам, обладающим очень слабым противомикробным действием, но, вместе с тем, они подавляют активность р-лактамаз стафилококков и др. микроорганизмов: гемофильной палочки, кишечной палочки, клебсиелл, некоторых бактероидов, гонококков, ле-гионелл; не подавляют или подавляют очень слабо р-лактамазы синегнойной палочки, энтеробактерий, цитробактера. Препараты, содержащие клавулановую кислоту и сульбактам, предназначены для парентерального применения — ауг-ментин (амоксициллин + калия клавуланат), тиментин (тикарциллин + калия клавуланат), уназин (ампициллин + сульбактам). Их используют при лечении отитов, синуситов, инфекций нижних дыхательных путей, кожи, мягких тканей, мочевыводящих путей и др. заболеваний. Уназин высокоэффективен для лечения перитонитов и менингитов, вызванных микроорганизмами, интенсивно продуцирующими р-лактамазу. Аналоги препарата уназин, предназначенные для приема внутрь, — сультамициллин и сулациллин.
Естественные и полусинтетические пенициллины (кроме карбокси- и уреидопенициллинов) — малотоксичные антибиотики. Однако бензилпенициллин и в меньшей степени полусинтетические пенициллины могут вызвать аллергические реакции, в связи с чем их применение у детей с диатезами и аллергическими заболеваниями ограничено. Введение высоких доз бензилпенициллина, ампициллина, амоксициллина ,уожет привести к повышению возбудимости центральной нервной системы, судорогам, что связано с антагонизмом антибиотиков по отношению к ГАМК тормозному медиатору в центральной нервной системе.
Пролонгированные препараты пенициллинов следует вводить очень осторожно под небольшим давлением через иглу с большим диаметром. Попадание суспензии в сосуд может вызвать тромбообразование. Полусинтетические пенициллины, применяемые внутрь, вызывают раздражение слизистой оболочки желудка, ощущение тяжести в животе, жжения, тошноту, особенно при назначении натощак. Антибиотики широкого спектра действия могут приводить к дисбиоценозу в кишечнике и спровоцировать появление вторичной инфекции, вызванной синегнойной палочкой, клебсиеллами, дрожжевыми грибками и др. О других осложнениях, вызываемых пенициллинами, см. выше.
Цефалоспорины — группа природных и полусинтетических антибиотиков, имеющих в своей основе 7-аминоцефалоспорановую кислоту (см. рис. 40).
В настоящее время наиболее распространено деление цефалоспоринов по поколениям (см. табл. 58).
347
Таблица 58
Классификация цефалоспоринов
I поколение II поколение III поколение IV поколение
Цефалоридин (цепорин) Цефамандол (мандол) Цефотаксим (клафоран) Цефпиром (кейтен)
Цефалотин (кефлин) Цефуроксим (кетоцеф) Цефтизоксим (эпоцелин) Цефепим (максипим)
Цефазолин (кефзол) Цефоницид (моноцид) Цефтриаксон (лонгацеф)
Цефрадин (велоцеф) Цефоранид (трецеф) Моксалактам (латамоксеф)
Цефадроксил (ультрацеф) Цефокситин Цефтазидим (фортум)
Примечание. В скобках приведены наиболее часто используемые синонимы препаратов.
Некоторые препараты этой группы могут быть использованы для приема внутрь: из цефалоспоринов I поколения — цефадроксил, цефалексин, цефрадин; II поколения — цефуроксим (зиннат), III поколения — цефспан (цефоксим), цефподоксим (орелакс), цефтибутен (цедекс). Цефалоспорины для приема внутрь обычно применяют при заболеваниях средней тяжести, так как они менее активны по сравнению с препаратами для парентерального введения.
Цефалоспорины обладают широким спектром действия.
Цефалоспорины I поколения угнетают активность кокков, особенно стафилококков и стрептококков (исключение составляют энтерококки и резистентные к метициллину штаммы стафилококков), а также дифтерийной палочки, бацилл сибирской язвы, спирохет, эшерихий, шигелл, сальмонелл, моракселл, клебсиелл, иерсиний, бордетелл, протея и гемофильных палочек. Цефалоспорины II поколения обладают таким же спектром действия, но они создают более высокие концентрации в крови и лучше проникают в ткани, чем препараты первого поколения. Они более активно влияют на некоторые штаммы грамотрицатель-ных бактерий, резистентные к I поколению цефалоспоринов, включая большинство штаммов кишечной палочки, клебсиелл, протея, гемофильной палочки, моракселл, возбудителей коклюша, гонококков. Вместе с тем цефалоспорины II поколения не влияют на синегнойную палочку, «больничные штаммы» грамотрицательных бактерий и отличаются несколько меньшим угнетающим влиянием по сравнению с цефалоспоринами I поколения на стафилококки и стрептококки. Цефалоспорины III поколения характеризуются еще большей широтой противомикробного спектра, хорошей проникающей способностью, высокой активностью против грамотрицательных бактерий, в том числе внутрибольничных штаммов, резистентных к другим антибиотикам. Они влияют, кроме вышеназванных микробов, на псевдомонады, морганеллы, серрации, клостридии (кроме Cl. difficile) и бактероиды. Вместе с тем они характеризуются сравнительно невысокой активностью по отношению к стафилококкам, пневмококкам, менингококкам, гонококкам и стрептококкам. Цефалоспорины IV поколения активнее препаратов III поколения подавляют большинство грамотрицательных и грамположительных бактерий. Цефалоспорины IV поколения влияют на некоторые мультирезистентные микроорганизмы, устойчивые к большинству антибиотиков: цитобактер, энтеробактер, ацинетобактер.
348
Цефалоспорины IV поколения резистентны к р-лактамазам и не индуцируют их образование. Но они не влияют на Cl. difficile, бактероиды, энтерококки, листерии, легионеллы и некоторые другие микроорганизмы.
Применяют их для лечения тяжелых заболеваний, а также у больных с нейтропенией и подавленным иммунитетом.
Наибольшие концентрации цефалоспоринов обнаруживают в почках и мышечной ткани, меньшие — в легких, печени, плевральной, перитонеальной жидкостях. Все цефалоспорины легко проходят через плаценту. В цереброспинальную жидкость проникают цефалоридин (цепорин), цефотаксим (клафоран), моксалактам (латамоксеф), цефтриаксон (лонгацеф), цефтизоксим (эпоцелин) и др. .Большинство цефалоспоринов выводится почками в неизмененном виде путем активной секреции клетками канальцев и отчасти клубочковой фильтрации.
соон
349
Цефалоспорины применяют при лечении заболеваний, вызванных резистентными к пенициллинам микроорганизмами, иногда при наличии аллергических реакций на пенициллины. Назначают их при сепсисе, заболеваниях органов дыхания, мочевыводяших путей, желудочно-кишечного тракта, мягких тканей, костей. При менингите у недоношенных новорожденных обнаружена высокая активность цефотаксима, моксалактама, цефтизоксима, цефтриаксона.
Применение цефалоспоринов может сопровождаться болезненностью на месте внутримышечного введения; флебитами после внутривенного применения; тошнотой, рвотой, поносом при приеме препаратов внутрь. При повторном применении у детей с высокой чувствительностью к препарату могут быть кожная сыпь, лихорадка, эозинофилия. Цефалоспорины не рекомендуется назначать детям с анафилактической реакцией на пенициллины, но допустимо их применение при наличии других проявлений аллергии — лихорадки, сыпи и др. Перекрестные аллергические реакции между цефалоспоринами и пенициллинами наблюдают в 5-10% случаев. Некоторые цефалоспорины, особенно цефалоридин и цефалотин, обладают нефротоксическим действием. Этот эффект связывают с медленным их выведением почками и с накоплением в них продуктов перекисного окислен^ липидов. Нефротоксичность антибиотика возрастает при дефиците витамина Е и селена. Препараты могут угнетать микрофлору желудочно-кишечного тракта и приводить к дисбиоценозу, перекрестной инфекции, вызванной госпитальными штаммами микробов, кандидозам и дефициту витамина Е в организме.
Азтреонам — синтетический высокоэффективный fj-лактамный антибиотик из группы монобактамов. Применяется для лечения инфекций дыхательных путей, менингитов, септических заболеваний, вызванных грамотрицательными, в том числе полирезистентными микроорганизмами (псевдомонадами, морак-селлами, клебсиеллами, гемофильной палочкой, кишечной палочкой, иерси-ниями, серрациями, энтеробактером, менингококками, гонококками, сальмонеллами, морганеллами). На грамположительные аэробные и на анаэробные бактерии азтреонам не влияет.
Имипенем — р-лактамный антибиотик из группы карбапенемов с ульт-рашироким спектром действия, включающим большинство аэробных и анаэробных грамположительных и грамотрицательных бактерий, в том числе микроорганизмы, резистентные к пенициллинам, цефалоспоринам, аминоглико-зидным и другим антибиотикам. Высокая бактерицидность имипенема обусловлена легким проникновением через стенки бактерий, высокой степенью сродства к ферментам, участвующим в синтезе бактериальной стенки микроорганизмов. В настоящее время из упомянутой группы антибиотиков в клинике используют имипенем в комбинации с циластатином (эту комбинацию называют тиенам). Циластатин ингибирует почечную пептидазу, тормозя этим образование нефротоксичных метаболитов имипенема. Тиенам обладает сильной противомикробной активностью, широким спектром действия. Натриевую соль имипенем-циластатина выпускают под названием при максин. Ймипе-нем стабилен к р-лактамазе, но слабо действует на микроорганизмы, расположенные внутри клеток. При назначении имипенема могут быть тромбофлебиты, диарея, в редких случаях судороги (особенно при нарушенной функции почек и заболеваниях центральной нервной системы).
Меронем (меропенем)не подвергается биотрансформации в почках и из него не образуются нефротоксичные метаболиты. Поэтому его применяют без циластатина. Он меньше тиенама влияет на стафилококки, но более эф
350
фективен по отношению к грамотрицательным энтеробактериям и псевдомонадам.
Меронем создает в цереброспинальной жидкости (ЦСЖ) активную бактерицидную концентрацию и его с успехом применяют при менингитах, не опасаясь нежелательных эффектов. Этим он выгодно отличается от тиенама, который вызывает нейротоксические эффекты, а потому противопоказан при менингитах.
Азтреонам и карбапенем практически не всасываются в желудочно-кишечный тракт, и их вводят парентерально. Они хорошо проникают в большинство жидкостей и тканей организма, выделяются преимущественно с мочой в активной форме. Отмечена высокая эффективность препаратов при лечении больных с инфекциями мочевыводящих путей, костно-суставногр аппарата, кожи, мягких тканей, с гинекологическими инфекциями, гонореей. Особенно показано применение азтреонама в педиатрической практике в качестве альтернативы аминогликозидным антибиотикам.
Фосфомицин (фосфономицин) — бактерицидный антибиотик широкого спектра действия, нарушающий образование микробной стенки за счет подавления синтеза УДФ-1Ч-ацетилмурамовой кислоты, то есть его механизм действия отличается от такового пенициллинов и цефалоспоринов. У него широкий спектр действия. Он способен подавлять грамотрицательные и грамположи-тельные бактерии, но не влияет на клебсиеллы, индолположительный протей.
Фосфомицин хорошо проникает в ткани, включая костную, а также цереброспинальную жидкость; в достаточном количестве содержится в желчи. Выводится названный антибиотик в основном почками. Назначают его преимущественно при тяжелых инфекциях, вызванных резистентными к другим антибиотикам микроорганизмами. Он хорошо сочетается с пенициллинами, цефалоспоринами, а при совместном применении с аминогликозидными антибиотиками наблюдается не только усиление противомикробного действия, но и снижение нефротоксичности последних. Фосфомицин эффективен при лечении менингита, сепсиса, остеомиелита, инфекций мочевыводящих и желчевыводящих путей. При инфекциях полости рта и кишечных инфекциях его назначают энтерально. Фосфомицин относится к малотоксичным препаратам. При его применении у некоторых больных могут наблюдаться тошнота и диарея, других нежелательных эффектов д<У настоящего времени не выявлено.
Гликопептидные антибиотики. Ванкооцин, тейкопланин — антибиотики, действующие на грамположитедьные кокки (включая метициллинорезистентные стафилококки, штаммы стафилококков, образующих |3-лактамазу, стрептококки, пенициллинрезистентные пневмококки, энтерококки) и бактерии (коринебактерии и др.). Очень важно их влияние на клостридии, особенно на С/, difficile. Ванкомицин влияет и на актиномицеты.
Ванкомицин хорошо проникает во все ткани и жидкости организма, кроме цереброспинальной. Его применяют при тяжелых стафилококковых инфекциях, вызванных штаммами, резистентными к другим антибиотикам. Основными показаниями для ванкомицина являются: сепсис, инфекции мягких тканей, остеомиелит, эндокардит, пневмонии, некротизирующий энтероколит (вызванный токсигенными клостридиями). Вводят ванкомицин внутривенно капельно 3-4 раза в сутки, новорожденным 2 раза в сутки. При лечении очень тяжелых стафилококковых менингитов, учитывая относительно слабое проникновение ванкомицина в цереброспинальную жидкость, целесообразно^его интратекаль-ное введение. Тейкопланин отличается от ванкомицина медленной элимина-
351
цией, вводят его внутривенно капельно 1 раз в сутки. При псевдомембранозном колите и стафилококковом энтероколите ванкомицин назначают внутрь.
Наиболее частое осложнение применения ванкомицина массивное — освобождение из тучных клеток гистамина, приводящее к артериальной гипотензии, появлению красной сыпи на шее (синдром «красной шеи»), голове, конечностях. Этого осложнения обычно удается избежать, если необходимую дозу ванкомицина вводить в течение не менее часа и предварительно ввести противо-гистаминные препараты. Возможны тромбофлебиты и уплотнение вен по ходу инфузии препарата. Ванкомицин — нефротоксичный антибиотик, следует избегать его совместного применения с аминогликозидами и другими нефротоксичными препаратами. При интратекальном введении ванкомицин может вызвать судороги.
Ристомицин (ристоцетин) — антибиотик, подавляющий грамположи-тельные микроорганизмы. К нему чувствительны стафилококки, стрептококки, энтерококки, пневмококки, споровые грамположительные палочки, а также коринебактерии, листерии, кислотоустойчивые бактерии и некоторые анаэробы. На грамотрицательные бактерии и кокки не влияет. Вводят ристомицин только внутривенно, из желудочно-кишечного тракта он не всасывается. Антибиотик хорошо проникает в ткани, особенно высокие его концентрации обнаруживают в легких, почках и селезенке. Применяют ристомицин главным образом при тяжелых септических заболеваниях, вызванных стафилококками и энтерококками в случаях, когда предшествующее лечение другими антибиотиками оказалось неэффективным.
При применении ристомицина иногда наблюдают тромбоцитопению, лейкопению, нейтропению (вплоть до агранулоцитоза), иногда отмечают эозинофилию. В первые дни лечения возможны реакции обострения (озноб, сыпь), довольно часто наблюдают аллергические реакции. Длительное внутривенное введение ристомицина сопровождается уплотнением стенок вен и тромбофлебитами. Описаны ото- и нефротоксические реакции.
Полимиксины — группа полипептидных бактерицидных антибиотиков, подавляющих активность преимущественно грамотрицательных микроорганизмов, включая шигеллы, сальмонеллы, энтеропатогенные штаммы кишечной палочки, иерсинии, холерный вибрион, энтеробактер, клебсиеллы. Важное значение для педиатрии имеет способность полимиксинов подавлять активность гемофильной палочки и большинства штаммов синегнойной палочки. Полимиксины действуют как на делящиеся, так и на находящиеся в стадии покоя микроорганизмы. Недостатком полимиксинов является их малое проникновение внутрь клеток и поэтому малая эффективность при заболеваниях, вызванных внутриклеточно расположенными возбудителями (бруцеллез, брюшной тиф). Полимиксины характеризуются плохим проникновением через тканевые барьеры. При приеме внутрь они практически не всасываются. Полимиксины В и Е применяют внутримышечно, внутривенно, при менингитах их вводят эндолюмбально, при инфекциях ЖКТ назначают через рот. П ол им и кс и н М применяют только внутрь и местно. Внутрь полимиксины назначают при дизентерии, холере, колиэнтеритах, энтероколитах, гастроэнтероколитах, сальмонеллезах и других кишечных инфекциях.
При назначении полимиксинов внутрь, а также при местном их применении нежелательные реакции наблюдаются редко. При парентеральном введении они могут вызвать нефро- и нейротоксические эффекты (периферические нейропатии, нарушение .зрения и речи, мышечную слабость). Эти осложнения наиболее часто встречаются у людей с нарушением выделительной функции почек. Иногда при применении полимиксинов наблюдается лихорадка, эози-352
нофилия, крапивница. У детей парентеральное введение полимиксинов допустимо только по жизненным показаниям, в случае инфекционных процессов, вызванных грамотрицательной микрофлорой, устойчивой к действию других, менее токсичных противомикробных препаратов.
Грамицидин (грамицидин С) активен главным образом в отношении грамположительной микрофлоры, включая стрептококки, стафилококки, пневмококки и некоторые другие микроорганизмы. Применяют грамицидин только местно в виде пасты, растворов и защечных таблеток. Растворы грамицидина используют для обработки кожных покровов и слизистых оболочек, для промываний, орошения повязок при лечении пролежней, гнойных ран, фурункулов и т. п. Таблетки грамицидина предназначены для рассасывания при инфекционных процессах в полости рта и глотки (ангина, фарингит, стоматит и пр.). Проглатывать таблетки грамицидина нельзя: при попадании в кровь он может вызвать гемолиз эритромицитов.
Макролиды. Различают три поколения макролидов. I поколение — эритромицин, олеандомицин. II поколение — спирамицин (ровами-цин), рокситром ици н (рулид), джозамицин (вил ьпрафен), кларитромицин (кладид), мидекамицин (макропен). III поколение — азитромицин (сумамед).
Макролиды — антибиотики широкого спектра действия. На очень чувствительные к 'ним микроорганизмы они оказывают бактерицидный эффект: стафилококки, стрептркокки, пневмококки, коринебактерии, бордетеллы, морак-селлы, хламидии и микоплазмы. На другие микроорганизмы — нейссерии, легионеллы, гемофильные палочки, бруцеллы, трепонемы, клостридии и риккетсии — они влияют бактериостатически. У макролидов II и III поколений более широкий спектр действия. Так, джозамицин и кларитромицин подавляют геликобактер пилори (и их применяют при лечении язвенной болезни желудка), спирамицин влияет на токсоплазмы. Препараты II и III поколений угнетают и грамотрицательные бактерии: кампилобактер, листерии, гарднереллы и некоторые микобактерии.
Все макролиды можно назначать внутрь, некоторые препараты (эритромицин фосфат, спирамицин) можно вводить внутривенно.
Макролиды хорошо проникают в аденоиды, миндалины, ткани и жидкости среднего и внутреннего уха, легочную ткань, бронхи, бронхиальный секрет и мокроту, кожу, плевральную, перитонеальную и синовиальную жидкости, в высоких концентрациях содержатся в нейтрофилах и альвеолярных макрофагах. В цереброспинальную жидкость и центральную нервную систему макролиды проникают плохо. Большое значение имеет их способность проникать в клетки, накапливаться в них и подавлять внутриклеточную инфекцию.
Препараты выводятся преимущественно печенью и создают высокие концентрации в желчи.
Новые макролиды отличаются от старых большей устойчивостью в кислой среде и лучшим биоусвоением из желудочно-кишечного тракта вне зависимости от приема пищи, пролонгированным действием.
Макролиды преимущественно назначают при нетяжелых формах острых заболеваний, вызванных чувствительными к ним микроорганизмами. Основными показаниями к применению макролидов являются тонзиллиты, пневмонии (в том числе вызванные легионеллами), бронхиты, дифтерия, коклюш, гнойные отиты, заболевания печени и желчевыводящих путей, пневмопатии и конъюнктивиты, вызванные хламидиями. Они очень эффективны при хламидийной пневмонии у новорожденных. Применяют макролиды также при заболеваниях мочевыводящих путей, но для получения хорошего терапевтического
12 Зак. 3856
353
эффекта, особенно при использовании «старых» макролидов, мочу необходимо подщелачивать, так как в кислой среде они неактивны. Назначают их при первичном сифилисе и гонорее.
Синергизм наблюдается при совместном применении макролидов с сульфаниламидными препаратами и антибиотиками группы тетрациклина. Комбинированные препараты, содержащие олеандромицин и тетрациклины, выпускают под названием олететр ин, тетраолеан, с и г м а м и ц и н. Макролиды нельзя сочетать с левомицетином, пенициллинами или цефалоспоринами.
Макролиды — малотоксичные антибиотики, однако они раздражают слизистую оболочку желудочно-кишечного тракта, могут вызвать тошноту, рвоту, понос. Внутримышечные инъекции болезненны, при внутривенном введении может развиться флебит. Иногда при их применении развивается холестаз. Эритромицин и некоторые другие макролиды ингибируют монооксигеназную систему в печени, в результате нарушается биотрансформация ряда лекарственных веществ, в частности теофиллина, чем повышается его концентрация в крови и токсичность. Они тормозят также биотрансформацию бромокриптина, дигидроэрготамина (входящего в ряд антигепертензивных средств), карбамазепина, циметидина и др.
Микролиды нельзя назначать Огесте с новыми антигистаминными препаратами — терфенадином и астемизолом из-за опасности гепатоксического их действия и опасности аритмии сердечных сокращений.
Линкозамиды: л и н к о м и ц и н и клиндамицин. Эти антибиотики подавляют преимущественно грамположительные микроорганизмы, включая стафилококки, стрептококки, пневмококки, а также микоплазмы, различные бактероиды, фузобактерии, анаэробные кокки, некоторые штаммы гемофильной палочки. Клиндамицин, кроме того, действует, хотя и слабо, на токсоплазмы, возбудителей малярии, газовой гангрены. Большинство грамотрицательных бактерий к линкозамидам устойчивы.
Линкозамиды хорошо всасываются в ЖКТ независимо от приема пищи, проникают почти во все жидкости и ткани, включая костную, но плохо проникают в центральную нервную систему и цереброспинальную жидкость. Новорожденным препараты вводят 2 раза в сутки, более старшим детям — 3—4 раза в сутки.
Клиндамицин отличается от линкомицина большей активностью по отношению к некоторым видам микроорганизмов, лучшим всасыванием из желудочно-кишечного тракта, но в то же время он чаще вызывает нежелательные эффекты.
Линкозамиды применяют при лечении инфекций, вызванных устойчивыми к действию других антибиотиков грамположительными микроорганизмами, особенно при аллергии к препаратам группы пенициллина и цефалоспоринам. Их назначают при инфекционных гинекологических заболеваниях и инфекциях ЖКТ. В связи с хорошим проникновением в костную ткань, линкозамиды являются препаратами выбора при лечении остеомиелита. Без специальных показаний их не следует назначать детям при эффективности других, менее токсичных антибиотиков.
При применении линкозамидов у детей могут возникнуть тошнота, понос. Иногда развивается псевдомембранозный колит — тяжелое осложнение, вызванное дисбиоценозом и размножением в Кишечнике Cl. difficile, выделяющих токсин. Названные антибиотики могут вызывать нарушение функции печени, желтуху, лейконейтропению и тромбоцитопению. Аллергические реакции, в основном в виде кожной сыпи, встречаются довольно редко. При быстром
354
внутривенном введении линкозамиды могут вызвать нервно-мышечный блок с угнетением дыхания, коллапс.
Фузидин. Наибольшее значение имеет активность фузидина в отношении стафилококков, в том числе устойчивых- к действию других антибиотиков. Он действует и на другие грамположительные и грамотрицательные кокки (гонококки, менингококки). Несколько менее активен фузидин по отношению к коринебактериям, листериям, клостридиям. Антибиотик не активен в отношении всех грамотрицательных бактерий и простейших.
Фузидин хорошо всасывается из желудочно-кишечного тракта и проникает во все ткани и жидкости, кроме цереброспинальной. Особенно хорошо проникает антибиотик в очаг воспаления, печень, почки, кожу, хрящи, кости, бронхиальный секрет. Препараты фузидина назначают внутрь, внутривенно,, а также местно в виде мази.
Фузидин особенно показан при заболеваниях, вызванных устойчивыми к пенициллину штаммами стафилококков. Препарат высокоэффективен при остеомиелите, заболеваниях органов дыхания, печени, желчевыводящих путей, кожи. В последние годы его используют при лечении больных с нокардиозом и колитом, вызванным клостридиями (кроме Cl. difficile). Выводится фузидин преимущественно с желчью и может быть использован у больных с нарушением выделительной функции почек.
Выраженное усиление противомикробной активности наблюдается при сочетании фузидина с другими антибиотиками, особенно эффективна комбинация с тетрациклинами, рифампицином и аминогликозидами.
Фузидин — малотоксичный антибиотик, но может вызывать диспепсические расстройства, исчезающие после отмены препарата. При внутримышечном введении антибиотика наблюдается некроз тканей (!), при внутривенном — может быть тромбофлебит.
Аминогликозидные антибиотики. Выделяют четыре поколения аминогликозидов. К антибиотикам I поколения относят стрептомицин, мон ом и ц И н, неомицин, канамицин; II поколения — гентамицин (гарамицин); III поколения — тобрамицин, сизомицин, амикацин, нетилмицин; IV поколения — изепамицин.
Аминогликозидные антибиотики бактерицидны, обладают широким спектром действия, угнетают грамположительные и особенно грамотрицательные микроорганизмы. Аминогликозиды II, III и .IV поколений способны подавлять синегнойную палочку. Основное практическое значение имеет способность препаратов угнетать активность патогенных кишечных палочек, гемофильной палочки, клебсиелл, гонококков, сальмонелл, шигелл, стафилококков. Помимо этого, стрептомицин и канамицин используют в качестве противотуберкулезных препаратов, мономицин для воздействия на дизентерийную амебу, лейшмании, трихомонады, гентамицин — на возбудителя туляремии.
Все аминогликозидные антибиотики плохо всасываются из желудочно-кишечного тракта и из просвета бронхов. Для получения резорбтивного эффекта их вводят внутримышечно или внутривенно. После однократного внутримышечного введения эффективная концентрация препарата в плазме крови сохраняется у новорожденных и детей младшего возраста 12 ч и более, у детей старшего возраста и взрослых 8 ч. Препараты удовлетворительно проникают в ткани и жидкости организма, за исключением цереброспинальной жидкости, плохо проникают внутрь клеток. При лечении менингитов, вызванных грамот-рицательными бактериями, аминогликозидные антибиотики предпочтительно вводить эндолюмбально. При наличии тяжелого воспалительного процесса в легких, органах брюшной полости, малого таза, при остеомиелите и сепсисе
355
показано эндолимфатическое введение препаратов, что обеспечивает достаточную концентрацию антибиотика в органах, не вызывая кумуляции его в почках. При гнойном бронхите их вводят в виде аэрозоля или путем инстилляции раствора непосредственно в просвет бронхов. Антибиотики этой группы хорошо проходят через плаценту, выводятся с молоком (у грудного ребенка аминогликозиды практически не всасываются из ЖКТ), но велика опасность появления дисбактериоза.
При повторном введении отмечается накопление аминогликозидов втючках, во внутреннем ухе и некоторых. других органах.
Препараты не .подвергаются биотрансформации и выводятся почками в активной форме. Элиминация аминогликозидных антибиотиков замедлена у новорожденных, особейно недоношенных детей, а также у больных с нарушением выделительной функции почек.
Аминогликозидные антибиотики применяют при осложненных инфекционных заболеваниях дыхательных и мочевыводящих путей, при септицемии,, эндокардите, реже при инфекциях желудочно-кишечного тракта, для профилактики и лечения инфекционных осложнений у хирургических больных.
В ряде случаев рекомендуют сочетание препаратов этой группы с пенициллинами, но растворы этих антибиотиков нельзя смешивать в одном шприце.
Аминогликозидные антибиотики, введенные парентерально, токсичны. Они могут вызвать ототоксический, нефротоксический эффекты, нарушить нервно-мышечную передачу импульсов и процессы активного всасывания из желудочно-кишечного тракта.
Ототоксический эффект антибиотиков является следствием необратимых дегенеративных изменений волосковых клеток кортиева органа (внутреннее ухо). Опасность возникновения этого эффекта наиболее велика у новорожденных, особенно у недоношенных, а также при родовой травме, гипоксии в родах, менингите, нарушении выделительной функции почек. Ототоксический эффект может развиться при попадании антибиотиков к плоду через плаценту; при сочетанном назначении с другими ототоксическими средствами (фуросемидом, этакриновой кислотой, ристомицином, гликопептидными антибиотиками).
Нефротоксический эффект аминогликозидных антибиотиков связан с нарушением функции многих ферментов в эпителиальных клетках канальцев почек, разрушением лизосом. Клинически это проявляется увеличением объема мочи, снижением ее концентрации и протеинурией, то есть возникновением неолигурической почечной недостаточности.
Антибиотики этой группы нельзя сочетать с другими ото- и нефротоксичными препаратами. У детей раннего возраста, особенно истощенных и ослабленных, аминогликозидные антибиотики могут угнетать нервно-мышечную передачу вследствие уменьшения чувствительности Н-холинорецепторов скелетных мышц к ацетилхолину и подавлением освобождения медиатора; в результате этого может быть нарушение функции дыхательных мышц. Для устранения этого осложнения назначают препараты кальция вместе с прозерином после предварительного введения атропина. Накапливаясь в стенке кишечника, аминогликозиды нарушают в ней процесс активного всасывания аминокислот, витаминов, сахаров. Это может привести к мальабсорбции, ухудшающей состояние ребенка. При назначении аминогликозидных антибиотиков в плазме крови снижается концентрация магния и кальция.
В связи с высокой токсичностью аминогликозидные антибиотики следует назначать только при тяжелых инфекциях, короткими курсами (не более 5-7 дней).
356
ЛЕВОМИЦЕТИН (ХЛОРАМФЕНИКОЛ)
Левомицетин — бактериостатический антибиотик (см. рис. 41), но на гемофильную палочку типа «Ь», некоторые штаммы менингококков, пневмококков влияет бактерицидно. Он подавляет деление многих грамотрицательных бактерий: сальмонелл, шигелл, кишечной палочки, бруцелл, возбудителя коклюша; грамположительных аэробных кокков: пиогенных стрептококков и стрептококков группы В; большинство анаэробных микроорганизмов (клостридии, бактероиды); холерный вибрион, риккетсии, хламидии, микоплазмы.
О
II
ОН NH - С - СНС12
o2n сн - сн - СН2ОН
Рис. 41. Химическая структура левомицетина
К левомицетину устойчивы микобактерии, Cl. difficile, цитобактер, энтеро-бактер, ацинетобактер, протей, синегнойная палочка, стафилококки, энтерококки, коринебактерии, серрации, простейшие и грибки.
, Левомицетин-основание хорошо всасывается из желудочно-кишечного тракта, быстро создавая активные концентрации в плазме крови. Антибиотик хорошо проникает из плазмы крови во все ткани и жидкости, в том числе и в цереброспинальную.
К сожалению, сам левомицетин обладает горьким вкусом и у детей может вызвать рвоту, поэтому в младшем возрасте предпочитают назначать эфиры левомицетина — стеарат или пальмитат. У детей первых месяцев жизни всасывание левомицетина, назначенного в виде эфиров, происходит медленно вследствие низкой активности липаз, гидролизующих эфирные связи и освобождающих левомицетин-основание, способное к всасыванию. Внутривенно введенный сукцинат левомицетина тоже подвергается гидролизу (в печени или почках) с освобождением активного левомицетина-основания. Негидролизованный эфир выводится почками, у новорожденных около 80% введенной дозы, у взрослых 30%. Активность гидролаз у детей низка и имеет индивидуальные различия, поэтому от одной и той же дозы левомицетина могут возникать неодинаковые его концентрации в плазме крови и в цереброспинальной жидкости, особенно в раннем возрасте. Необходимо контролировать концентрацию левомицетина в крови ребенка, так как без этого можно либо не получить терапевтического эффекта, либо вызвать интоксикацию. Содержание свободного (активного) левомицетина в плазме крови и в цереброспинальной жидкости после внутривенного введения обычно ниже, чем после его приема внутрь.
Левомицетин имеет особенно важное значение при лечении менингитов, вызванных гемофильной палочкой, менингококками и пневмококками, на которые он действует бактерицидно. .Для лечения этих менингитов левомицетин нередко сочетают с р-лактамными антибиотиками (особенно с ампициллином или амоксициллином). При менингитах, вызванных другими возбудителями, совместное применение левомицетина с пенициллинами нецелесообразно, так как в таких случаях они являются антагонистами. Левомицетин с успехом
357
применяют при лечении брюшного тифа, паратифов, дизентерии,' бруцеллеза, туляремии, коклюша, инфекции глаз (в том числе трахомы), среднего уха, кожных покровов и многих других заболеваний.
Левомицетин обезвреживается в печени и выводится почками. При заболеваниях печени вследствие нарушения нормальной биотрансформации левомицетина может возникнуть интоксикация им. У детей первых месяцев жизни обезвреживание этого антибиотика происходит медленно, и поэтому велика опасность накопления в организме свободного левомицетина, что приводит к появлению ряда нежелательных эффектов. Левомицетин, кроме того, угнетает функцию печени и тормозит биотрансформацию теофиллина, фенобарбитала, дифенина, бензодиазепинов и ряда других лекарственных веществ, увеличивая их концентрацию в плазме крови. Одновременное назначение фенобарбитала стимулирует обезвреживание левомицетина в печени и снижает его эффективность.
Левомицетин — токсичный антибиотик. При передозировке левомицетина у новорожденных, особенно недоношенных, и детей первых 2~3-х месяцев жизни может возникнуть «серый коллапс»: рвота, понос, нарушение дыхания, цианоз, сердечно-сосудистый коллапс, остановка сердца и дыхания. Коллапс — следствие нарушения сердечной деятельности из-за угнетения окислительного фосфорилирования в митохондрия^ При отсутствии помощи летальность новорожденных от «серого коллапса», очень высока (40% и больше).
Наиболее распространенное осложнение при назначении левомицетина — нарушение гемопоэза. Могут быть дозозависимые обратимые нарушения в виде гипохромной анемии (из-за нарушения использования железа и синтеза гема), тромбоцитопении и лейкопении. После отмены левомицетина картина крови восстанавливается, но медленно. Необратимые дозонезависимые изменения кроветворения в виде апластической анемии встречаются с частотой 1 на 20000—1 на 40 000 лиц, принимающих левомицетин, и развиваются обычно через 2-3 недели (но могут быть и через 2—4 месяца) после применения антибиотика. Они не зависят от дозы антибиотика и длительности лечения, а связаны с генетическими особенностями биотрансформации левомицетина. Кроме того, левомицетин угнетает функцию печени, коры надпочечников, поджелудочной железы, может вызвать невриты, гипотрофию. Аллергические реакции при использовании левомицетина бывают редко. Биологические осложнения могут проявляться в виде суперинфекций, вызванных устойчивыми к антибиотику микроорганизмами, дис-биоценоза и др. Детям до 3-х лет левомицетин назначают только по особым показаниям и лишь в очень тяжелых случаях.
ТЕТРАЦИКЛИНЫ (см. рис 42.)
Различают:
1. Естественные антибиотики: тетрациклин, окситетрациклин, хлортетрациклин и их соли.
2. Полусинтетические препараты: метациклина гидрохлорид (ро-ндомицин), доксициклина гидрохлорид (вибрамицин), миноциклин (миноцин).
Тетрациклины являются антибиотиками широкого спектра действия. Они действуют бактериостатически, подавляют активность многих грамположитель-ных и грамотрицательных бактерий, микоплазм, спирохет, лептоспир, риккетсий, хламидий, возбудителей сибирской язвы, столбняка, газовой гангрены, чумы, холеры. Неактивны в отношении микобактерий туберкулеза и лепры, стафилококков, энтерококков, коринебактерий, синегнойной палочки, цито-, энтеро- и ацинетобактера, протея, серраций, CL difficile, бактероидов, гемофильной палочки типа «Ь», простейших и грибков.
358
Препарат R1 R2
Тетрациклин СНз ОН - н
Мётациклин - СНз - он
Доксициклин = сн2 - он
Рис. 42. Химическая структура тетрациклинов
Тетрациклины используют главным образом при инфекциях, вызванных кишечной палочкой, энтеробактериями, клебсиеллами, сальмонеллами, шигел-лами, микоплазмами, хламидиями, гонококками. К сожалению, многие штаммы только что названных микроорганизмов стали в последнее время резистентными к ним.
Тетрациклины, предназначенные для приема через рот, принимают до еды, так как они образуют невсасывающиеся комплексы с содержащимися в пище металлами: железом, медью, кальцием и магнием. Для парентерального введения используют тетрациклина гидрохлорид (внутримышечно) и доксициклин (внутривенно).
Тетрациклины хорошо проникают в жфгчь, легкие, костную ткань, в том числе в зубы. В цереброспинальную жидкость они поступают удовлетворительно при внутривенном введении (доксициклин), создавая там концентрацию до 25% от уровня в плазме крови. Лучше других тетрациклинов в ликвор проникает миноциклин, он же концентрируется в слезах, слюне, поэтому его назначают носителям менингококков.
Тетрациклины в основном экскретируются почками в неизмененном виде, и при нарушении их функции накапливаются в организме. Исключением являются доксициклин и миноциклин, преимущественно элиминирующиеся путем биотрансформации в печени. Их можно назначать больным с нарушенной выделительной функцией почек. Отчасти тетрациклины в неизмененном виде выводятся с желчью, создавая в ней высокие концентрации.
' Тетрациклины показаны при инфекциях нижних отделов мочевыводящих путей, пиелонефритах (они особенно эффективны в кислой моче), воспалениях органов дыхания, кожи, мягких тканей, остеомиелите, венерических заболеваниях. Отмечена высокая эффективность доксициклина при инфекциях мочеполовой системы, в том числе вызванных хламидиями. Наиболее важно при
359
менение тетрациклинов при особо опасных инфекциях: холере, чуме, сибирской язве, бруцеллезе, туляремии, борелиозе.
Детям тетрациклины назначают крайне редко. Их применение допускается лишь после 8 лет (в некоторых странах даже после 14 лет) в суточной дозе не более 25 мг/кг, разделенной на 2~4 приема.
Тетрациклины — токсичные антибиотики. Концентрируясь (в«виде комплексов с кальцием) в костях, зубах, зачатках зубов, они нарушают их развитие. Тетрациклины нарушают функцию печени, уменьшая синтез белков (в том числе альбуминов, акарбоксипротромбина, проконвертина), метаболизм билирубина и азотистых шлаков. Они нарушают синтез белков и в других тканях, что может приводить к снижению массы тела, уменьшению резистентности к инфекциям, отрицательному азотистому балансу. Тетрациклины могут повысить продукцию цереброспинальной жидкости, вызывая явления менингизма, повышают чувствительность кожи к ультрафиолетовым лучам.* Тетрациклины накапливаются в слизистой оболочке желудочно-кишечного тракта, нарушая в ней процессы активного транспорта, а также деление клеток, что приводит к диспепсическим расстройствам, изъязвлению слизистых оболочек. Продукты распада тетрациклинов, содержащиеся в препаратах с прошедшим сроком годности, повреждают канальцы пояек. Миноциклин вызывает нарушение функции вестибулярного аппарата. Нельзя назначать тетрациклины беременным, так как они могут вызывать диссеминированное внутрисосудистое свертывание крови, нарушить функцию почек, а также оказать тератогенное действие на плод. Тетрациклины вызывают дисбиоценоз в кишечнике.
Рифамицины. Основными препаратами этой группы являются природный антибиотик р и ф о ц и н (рифамицин SV) и его полусинтетическое производное рифампицин (бенемицин). Рифамицины способны угнетать полирезистен-тные штаммы стафилококков, стрептококки, клостридии, протей, некоторые бактероиды, палочку сибирской язвы, бруцеллы, гемофильную палочку, хламидии, менингококки, гонококки, франциселлы (возбудители туляремии). В больших концентрациях действуют на возбудителей кишечных инфекций (кишечную палочку, шигеллы, сальмонеллы). Рифамицины — один из наиболее эффективных противотуберкулезных и противолепрозных препаратов.
Основными отличиями рифампицина от рифоцина (рифамицина SV) являются эффективность первого при приеме через рот, а также более широкий антибактериальный спектр действия.
К рифамицинам очень быстро возникает устойчивость микроорганизмов, поэтому их следует назначать только вместе с другими противомикробными препаратами. Наиболее часто их сочетают' с аминогликозидными антибиотиками, бактримом или фузидином.
Рифамицины хорошо проникают во все ткани и жидкости организма, включая цереброспинальную. Высокие концентрации создаются в мокроте, плевральной жидкости, в костях. Рифамицины подвергаются биотрансформации в печени. При ее патологии может быть кумуляция этих антибиотиков. При патологии почек они в организме не накапливаются.
Рифамицины используют при туберкулезной инфекции, а также при воспалительных заболеваниях дыхательных путей и легких, вызванных полирезис-тентными стафилококками, при инфицировании моче- и желчевыводящих путей, при остеомиелите, менингите.
Рифамицины — низкотоксичные антибиотики. Нежелательные эффекты после их применения наблюдают обычно у больных с патологией печени или при использовании чрезмерно высоких доз. Возможны аллергические реакции, протекающие обычно в виде сыпи, хотя наблюдаются они относительно редко.
360
Могут быть диспепсические явления, дисфункция печени и поджелудочной железы. При длительном применении может развиться миопатия, связанная с атрофией мышечных волокон. Рифамицины активируют процессы биотрансформации в печени, поэтому они способны снизить содержание в плазме крови витамина D, уменьшить активность непрямых антикоагулянтов, дигитоксина, синтетических противодиабетических препаратов, противозачаточных средств. Вместе с тем биотрансформацию теофиллина они замедляют, что может привести к его кумуляции и появлению токсических эффектов. Рифамицины противопоказаны беременным женщинам, больным с нарушениями функции печени и поджелудочной железы. Особая осторожность требуется при назначении названных антибиотиков у новорожденных детей. Рифамицин имеет яркий коричнево-красный цвет и может окрашивать мочу, мокроту, слезную жидкость и кожные покровы.
Дозы антибиотиков даны в табл. 59.
Таблица 59
Антибиотики
Препарат Лекарственная форма Путь введения Число введении в сутки Суточная доза (для детей старше 1 мес)
Бензилпенициллина натриевая соль Benzylpenicillinum-natrium Флаконы по 250000, 500 000, 1 000 000 ЕД Внутримышечно, внутривенно 4-6 50 000-200 000— 300 000 ЕД/кг
Оксациллина натриевая соль Oxacillinum-natrinum Флаконы по 0,25 и 0,5 г Таблетки по 0,25 и 0,5 г Капсулы по 0,25 г Внутримышечно, внутривенно Внутрь 4-6 50—200 мг/кг
Амоксициллин Amoxicillinum Капсулы по 0,25 и 0,5 г Внутрь
Ампициллин Ampicillinum Флаконы по 0,25 и 0,5 г Таблетки, капсулы по 0,25 г Внутримышечно, внутривенно Внутрь
Карбенниллина динатриевая соль Carbenicillinum dinatricum Флаконы по 1 г Внутримышечно, внутривенно 4-6 50—400 мг/кг
Цефазолин (кефзол) Cephazolin Флаконы по 0,25; 0,5; 1; 2; 4 г Внутримышечно, внутривенно 2-3 25—50 мг/кг
Клафоран (цефотаксим) Clafbran Флаконы по 0,5 и 1,0 г Внутримышечно, внутривенно 2-4 75-150 мг/кг
Эритромицина фосфат Erythromycin) phosfas Флаконы по 0,05; 0,1 и 0,2 г Таблетки по 0,1 и 0,25 г Капсулы по 0,1 и 0,2 г Внутримышечно, внутривенно Внутрь 4-6 30—50 мг/кг
361
Окончание табл. 59
Препарат Лекарственная форма Путь введения Число введений в сутки Суточная доза (для детей старше 1 мес)
Азитромицин (Сумамед) Azythromycin Капсулы по 0,25 г; таблетки по 0,5 г Внутрь 1 1-й день: 8—10 мг/кг; со 2-го дня: 4—5 мг/кг
Линкомицина гидрохлорид Lincomycini hydrochloridum 30% раствор в ампулах по 1 и 2 мл (300 мг в мл) Капсулы по 0,25 г, Внутримышечно Внутрь 3-4 10-20 мг/кг
Клиндамицина фосфат Clindamycini phosfas Капсулы по 0,125 г Внутрь 3-4 30—60 мг/кг
Клиндамицина гидрохлорид Clindomycini . hydrochloridum 15% раствор в ампулах по 2 мл (300 мг в 2 ^л) Внутримышечно, внутривенно 3-4 30—40 мг/кг
Рифампицин Rifampicinum Капсулы по 0,05 и 0,15 г Внутрь 2-3 8-10 мг/кг
Фузидин-натрий1 Fusidinum-natrium Таблетки по 0,125 и 0,25 г Внутрь 2-3 40-60 мг/кг
Канамицина моносульфат Kanamycini monosulfas Таблетки по 0,125 и 0,25 г Внутрь 3-4 50-100 мг/кг
Гентамицина сульфат Gentamycini sulfas Флаконы по 0,08 г; 4% раствор в ампулах по 1 и 2 мл Внутримышечно 2-3 3-5 мг/кг
Тобрамицин Tobramycinum Флаконы по 0,04; 0,05; 0,075; 0,08 г Внутримышечно, внутривенно 2-3 3—5 мг/кг
Левомицетина сукцинат растворимый Laevomycetin! succinas solubile Флаконы по 0,5 и 1 г Внутривенно 4 75-100 мг/кг
Левомицетина стеарат2 Laevomycetin! stearas Таблетки по 0,25 и 0,5 г Внутрь 3-4 75—ЮО'мг/кг
Полимиксина М сульфат3 Polymyxin! М sulfas Таблетки по 500 000 ЕД Внутрь 3-4
Примечания.
1. Для детей старшего возраста доза фузидин-натрия 20-30 мг/кг.
2. Доза левомицетина-основания. 1 г левомицетина стеарата содержит 0,55 г левомицетина.
3. Суточная доза полимиксина М сульфата для детей до 3-4 лет — 100 тыс. ЕД; детям 5-7 лет — 1400 тыс. ЕД; детям 8-10 лет — 1600 тыс. ЕД; детям 11-14 лет — 2000 тыс. ЕД.
362
Глава 43
СУЛЬФАНИЛАМИДНЫЕ ПРЕПАРАТЫ
Препараты этой группы являются синтетическими противомикробными средствами, производными сульфаниловой кислоты. Все они имеют общую формулу (см. рис. 43).
_2 so2-nh-R
Препарат R1 R2
Стрептоцид —н —н
Сульфадимезин —н СНз СН3
Норсульфазол —н N—П
Этазол —н N N АД С2Н5
Сульфацил-натрий О II H2N V SO2 - N - С - СНз Na
Сульфаметоксазол -н nU СНз
Сул ьфади метокс и н -Н ОСНз N—< —N чосн,
Сульфален —н Н3СО
363
Рис. 43. Химическая структура сульфаниламидных средств
Сульфаниламидные препараты подавляют жизнедеятельность как различных кокков (стрептококки, кроме зеленящего, стафилококки, пневмококки, гонококки, менингококки), так и палруек (энтеропатогенная кишечная палочка, шигеллы, сальмонеллы, клебсиеллы, иерсинии и др.). Сульфамонометоксин и сульфапиридазин, кроме того, влияют на токсоплазмы, хламидии, протей, плазмодии малярии, нокардии. Сульфаниламидные препараты часто оказывают лечебный эффект, при терапии заболеваний, вызванных устойчивыми к антибиотикам штаммами этих возбудителей.
Сульфаниламиды — бактериостатические препараты. По химической структуре они похожи на парааминобензойную кислоту (ПАБК) и могут захватываться микробами вместо нее. При этом нарушается образование фолиевой кислоты, обеспечивающей жизнедеятельность клеток (синтез нуклеиновых кислот и белков). Сульфаниламиды не действуют на микроорганизмы, которые сами синтезируют ПАБК, а также на покоящиеся формы микробов. В тканях человека фолиевая кислота не синтезируется, поэтому в его обмен веществ сульфаниламиды не вмешиваются.
Сродство микроорганизмов к парааминобензойной кислоте выше, чем к сульфаниламидам, поэтому концентрация названных препаратов в крови должна превышать таковую ПАБК в десятки и сотни раз. Применение недостаточных доз сульфаниламидов может привести к селекции устойчивых к ним штаммов микробов.
В практических целях можно использовать следующую классификацию сульфаниламидов.
1. Сульфаниламиды, используемые при системных инфекциях:
— короткого действия: стрептоцид, этазол, норсульфазол, сульфадимезин, сульфацил (альбуцид);
— средней продолжительности действия: сульфазин, сульфаметоксазол;
— длительного действия: сульфапиридазин, сульфамонометоксин, сульфади-метоксин;
— сверхдлительного действия: сульфален (келфизин);
— комбинированные прёпараты с триметопримом: бактрим (бисептол), гро-септол, потесептил и др.
2. Используемые при инфекциях ЖКТ: сульгин, фталазол, фтазин, салазо-сульфапиридазин, салазосульфапиридин, салазосульфадиметоксин.
3. Используемые при инфекциях мочевыводящих путей: уросульфан, суль-фадиметоксин, сульфален.
364
4. Используемые в глазной практике: сульфацил натрия, сульфапиридазин натрия.
Для парентерального введения можно использовать сульфаниламиды, хорошо растворяющиеся в воде. Для этой цели применяют препараты короткого действия: этазол натрия, сульфацил натрия, стрептоцид растворимый и препарат сверхдлительного действия — сульфален-меглюмин.
Большинство сульфаниламидов хорошо всасывается из кишечника (исключение составляют специально утяжеленные препараты, применяемые для лечения инфекций ЖКТ). В плазме крови они связаны с белками, но сравнительно легко проникают в различные ткани.
Выведение сульфаниламидов осуществляется преимущественно путем клубочковой фильтрации, поэтому чем больше препарат связан с белками плазмы, тем медленнее происходит его элиминация. Некоторые сульфаниламиды, особенно сульфален, могут реабсорбироваться из мочи. Названные особенности определяют скорость выведения препаратов из организма.
Выбор препарата зависит от его фармакокинетических особенностей, а также от возбудителя, локализации и течения инфекционного процесса.
Для лечения системных инфекций применяют сульфаниламиды, хорошо всасывающиеся из кишечника. Они легко проникают из плазмы крови в ткани, создавая в них эффективные концентрации, в том числе в легких, в плевральной, синовиальной, асцитической жидкостях. В цереброспинальную жидкость лучше остальных препаратов проникает сульфапиридазин, практически не проникает сульфадиметоксин. Остальные сульфаниламиды в ликвор проникают умеренно. Сульфаниламиды хорошо проникают через плаценту, создавая в околоплодной жидкости, крови и тканях плода и новорожденного концентрации, достаточные для проявления противомикробного действия. В молоке матери концентрация препаратов равна таковой в ее плазме крови, и грудной ребенок может получить сульфаниламид в количестве, достаточном для появления у него нежелательных эффектов.
В печени сульфаниламиды подвергаются биотрансформации путем ацетилирования и (или) глюкуронидации. Ацетилированные метаболиты плохо растворяются в воде, поэтому в моче могут выпасть в осадок, нарушив проходимость канальцев почек. Для профилактики этого осложнения необходимо запивать каждую порцию сульфаниламида стаканом щелочной воды (раствор соды, боржом) для подщелачивания мочи й повышения растворимости ацетилированных метаболитов. Это правило необходимо соблюдать при назначении стрептоцида, норсульфазола, сульфадимезина, этазола, сульфацила, сульфазина. При назначении препаратов длительного и сверхдлительного действия крис-таллурия наблюдается редко, что связано с приемом этих препаратов в меньших дозах, а также с тем, что названные сульфаниламиды частично образуют эфиры с глюкуроновой кислотой, хорошо растворимые в воде. Сульфадиметоксин подвергается глюкуронидации и выводится с мочой в неизмененном виде, поэтому опасности образования его кристаллов в моче нет. В неизмененном виде выделяется почками уросульфан, создавая в моче высокие концентрации, поэтому его применяют для лечения инфекций мочевыводящих путей. Для лечения инфекций желчевыводящих путей используют сульфадиметоксин, сульфапиридазин и сульфален, которые содержатся в желчи в активном виде и высокой концентрации.
Сульфаниламиды, хорошо всасывающиеся из кишечника, применяют для лечения заболеваний дыхательных путей, тонзиллита, фарингита, отита, менингита, инфекционных поражений кожных покровов.
365
В настоящее время широко используют комбинированные препараты сульфаниламидов, содержащие три метоп ри м: бактрим (бисептол, ко-тримок-сазол, бактериал), гросептол, потесептил, сульфатон и др. Триметоприм — ингибитор дигидрофолатредуктазы, переводящей дигидрофолиевую кислоту в активную тетрагидрофолиевую (фолиниевую) кислоту, транспортирующую одноуглеродные фрагменты-, необходимые для синтеза пуриновых и пиримидиновых оснований, некоторых аминокислот и белков. (В тканях человека дигидрофолатредуктаза менее чувствительна к триметоприму, чем фермент в микроорганизме.) Триметоприм обладает выраженным противомикровным действием и является активным синергистом сульфаниламидов. Все комбинированные препараты, в состав которых он входит вместе с сульфаниламидами, характеризуются широким спектром действия. Они подавляют активность грамположительных и грамотрицательных микроорганизмов: различных кокков, палочек (включая гемофильную палочку и легионеллы), хламидий, пневмоцист, актиномицетов и некоторых анаэробов. К ним устойчивы микобактерии туберкулеза, бледная трепонема, синегнойная палочка, микоплазмы.
Плохо всасывающиеся из кишечника сульфаниламиды (сульгин, фталазол, фтазин) применяют для лечения кэддечных инфекций: сальмонеллезов, брюшного тифа, дизентерии, гастроэнтеритов и др. Названные препараты задерживаются в кишечнике, где подвергаются гидролизу с отщеплением активной сульфаниламидной части молекулы, оказывающей противомикробное действие. Салазосульфаниламиды — препараты, применяемые в основном при неспецифическом язвенном колите и болезни Крона. Они накапливаются в соединительной ткани кишечника, где постепенно расщепляются, образуя активный сульфаниламид и аминосалициловую кислоту, обладающую противовоспалительным действием.
Применение сульфаниламидов в обычных дозах редко сопровождается осложнениями. Нежелательное действие препаратов чаще возникает у людей с нарушенной выделительной функцией почек, у детей первых месяцев жизни, а также при назначении чрезмерно высоких доз и (или) при длительном их применении.
Сульфаниламиды могут вытеснять из связи с белками плазмы крови дифенин, синтетические противодиабетические средства (производные сульфонил-мочевины), непрямые антикоагулянты (неодикумарин и др.), что приводит к повышению свободной фракции препаратов. В результате обычные дозы названных лекарственных веществ могут вызвать нежелательные эффекты.
Не следует назначать сульфаниламиды новорожденным детям с гипербилирубинемией, так как они могут препятствовать связыванию билирубина с белками плазмы крови, чем повышают опасность билирубиновой энцефалопатии. Иногда у новорожденных и грудных детей сульфаниламиды приводят к окислению иона железа фетального гемоглобина, что вызывает появление метгемоглобина, нарушение транспорта кислорода, гипоксию и ацидоз. Для профилактики этого осложнения одновременно необходимо назначать препараты, обладающие антиоксидантными свойствами, например, аскорбиновую кислоту с глюкозой.
Помимо этих осложнений, сульфаниламиды могут вызвать аллергические реакции, протекающие обычно в виде сыпей, дерматитов, лейкопении. Иногда отмечают появления полиневритов и нарушение функции центральной нервной системы.
Комбинированные препараты, содержащие триметоприм, у детей с дефицитом фолиевой кислоты могут нарушить превращение фолиевой кислоты в 366
ее активный метаболит — тетрагидрофолиевую кислоту, что ведет к недостатку названного витамина и сопровождается нейтро- и (или) тромбоцитопенией, нарушениями функции желудочно-кишечного тракта (тошнотой, рвотой, диареей), иногда наблюдают глоссит, стоматит, псевдомембранозный коЛит. Для устранения и профилактики осложнений можно принимать препарат фолини-евой кислоты — кальция фолинат.
Дозы сульфаниламидных препаратов даны в табл. 60.
Таблица 60
Характеристика сульфаниламидных препаратов
Сульфаниламид Связывание с белками плазмы, % Ацетилирование, % Период полуэлимн-иацни, ч Кол-во приемов в сутки Первая суточная доза, . мг/кг Поддерживающая суточная доза, мг/кг
Стрептоцид1 Streptocidum 12-24 25-50 9-10 4-6 100-150 *
Норсульфазол1 Norsulfazolum 55 20-25 4-6 4-6 100-150
Сульфадимезин1 Sulfadimezinum 80-85 40-80 7 4-6 100-150
Этазол1 Aethazolum 95 5-15 5-10 4-6 100-150
Сульфазин1 Sulfazinum 17-56 15-45 17 2-3 100-150
Сульфапиридазин Sulfapiridazinum 73-90 20-75 35 1 25 12,5
Сульфамонометоксин Sulfamonomethoxinum 65-92 40-50 30 1 25 12,5
Сульфадиметоксин Sulfadimethoxinum 90-99 10-30 40 1 25 . 12,5
Сульфален Sulfalenum 33-47 40-75 65 1 25 12,5
и средней длительности действия
Примечание. 1. поддерживающие дозы
Для препаратов короткого действия соответствуют первой суточной дозе.
Глава 44
ДРУГИЕ СИНТЕТИЧЕСКИЕ ПРОТИВОМИКРОБНЫЕ СРЕДСТВА
НИТРОФУРАНЫ
Нитрофураны — синтетические противомикробные препараты, содержащие нитрогруппу в 5-м положении и различные заместители во 2-м положении фуранового ядра (см. рис. 44).
367
Нитрофураны эффективны в отношении грамположительных и грамотри-цательных микроорганизмов (стафилококков, стрептококков, пневмококков, менингококков, шигелл, сальмонелл, анаэробов и др.), а также трихомонад, лямблий, спирохет, некоторых хламидий. Механизм противомикробного действия различных нитрофуранов принципиально одинаков. Они подавляют микроорганизмы, которые обладают редуктазами, восстанавливающими нитрогруппу. Образующиеся в процессе такого метаболизма (летальный синтез) токсичные вещества повреждают клеточную стенку, необратимо блокируют НАДН, цикл трикарбоновых кислот (цикл Кребса) и ряд других биохимических процессов. В результате названных процессов нарушается функция цитоплазматической мембраны и возникает бактерицидный эффект. Кроме того, как сами нитрофураны, так и их восстановленные метаболиты могут образовывать комплексы с нуклеиновыми кислотами, что приводит к ингибированию синтеза ряда белков, то есть имеет место бактериостатическое действие.
Отличительной чертой нитрофуранов является то, что они не нарушают иммунную защиту, а напротив, несколько повышают сопротивляемость организма к инфекции (отмечено увеличение фагоцитарного индекса лейкоцитов и титра комплемента). Нитрофура^! подавляют продукцию микроорганизмами токсинов, поэтому могут быстро устранить явления токсикоза при сохранении возбудителя инфекции в организме. Под влиянием названных препаратов микробы теряют способность вырабатывать антифаги и теряют устойчивость к фагоцитозу.
В зависимости от химического строения, несмотря на принципиально однотипный механизм действия, отдельные нитрофураны имеют некоторые различия в спектре действия, отличаются кинетикой и в связи с этим имеют различные показания к применению. Тип действия-(бактерицидный или бактериостатический) зависит от концентрации препарата (при высоких концентрациях преобладает бактерицидный эффект) и вида микроорганизмов. Привыкания микроорганизмов к нитрофуранам в процессе лечения либо не происходит, либо оно происходит очень медленно.
Выводятся нитрофураны преимущественно в неизмененном виде путем секреции в проксимальных канальцах почек. Названные вещества — слабые кислоты. Они диссоциируют в щелочной моче, что препятствует их реабсорбции и ускоряет экскрецию. Одновременное назначение веществ, подкисляющих мочу (аскорбиновая кислота, салицилаты, кальция хлорид), способствует превращению нитрофуранов в целые (липидорастворймые) молекулы, подвергающиеся реабсорбции. Это может привести к задержке препаратов в организме и при повторных приемах к их накоплению и возникновению нежелательных эффектов.
В плазме крови нитрофураны находятся недолго, поэтому в ткани они проникают мало, в ликвор не попадают совсем.
Фурацилин действует на грамположительные и грамотрицательные микроорганизмы. Применяют его местно для лечения и профилактики гнойновоспалительных процессов, а также для промывания полостей.
Фуразолин отличается преимущественной активностью в отношении грамположительных микроорганизмов. Применяют его внутрь при лечении инфекций почек и мочевыводящих путей, стафилококковых энтеритов, раневой инфекции, рожистого воспаления, эмпиемы и др.
Фурадонин активен в отношении грамположительных и грамотрицатель-ных микроорганизмов. Назначают внутрь. Быстро всасывается и очень быстро выводится почками в неизмененном виде, поэтому в плазме крови возникает 368
очень небольшая, а в моче высокая концентрация. Его применяют для лечения инфекционных заболеваний мочевыводящих путей (пиелиты, пиелонефриты, циститы, уретриты).
Препарат R
Фурацилин ч - СН = N — NH- С nh2
Фуразолидон — СН = N — N О
Фурагин _ с = СН - СН = N - N 1 0^ NHC
Фурадонин ! Г° — СН = N — N NH О
Фуразолин — СН = N — N 1 у у Л„ЛСН! - N О О 0 \'
Рис. 44. Химическая структура нитрофуранов
Фурагин эффективен в отношении грамположительных и грамотрица-тельных микроорганизмов. Применяют внутрь (преимущественно при заболеваниях мочевых путей) и местно для промывания свищей, гнойных ран, ожогов и др. При тяжелых формах инфекционный заболеваний (сепсис, раневая и гнойная инфекция, пневмонии и др.), вызванных стафилококками, стрептококками, кишечной палочкой и другими чувствительными к препарату возбудителями, внутривенно вводят калиевую соль фурагина (фурагин растворимый, солафур).
369
Фуразолидон, по сравнению с остальными нитрофуранами, характеризуется более выраженным влиянием на грамотрицательные микроорганизмы. Кроме того, он эффективен для лечения лямблиоза и обладает противотрихо-монадной активностью. Слабо влияет на возбудителей гнойной и газовой инфекции. Назначают внутрь. Он хорошо всасывается, проникает во многие ткани и жидкости (кроме ЦСЖ и мозга). Применяют фуразолидон при дизентерии, паратифе, пищевых сальмонеллезных токсикоинфекциях, лямблиозе, а также для лечения трихомонадных кольпитов и уретритов.
Для лечения стафилококковых инфекций синергистами нитрофуранов являются пенициллины, аминогликозиды, макролиды; при заболеваниях, вызванных грамотрицательными микроорганизмами, — левомицетин и .тетрациклины.
Нитрофураны малотоксичны, но являясь окислителями, у новорожденных и грудных детей могут вызвать гемолитическую анемию и метгемоглобинемию. Для профилактики этого осложнения одновременно с названными препаратами необходимо принимать глюкозу, витамин Е и другие восстанавливающие вещества. При длительном применении высоких доз нитрофуранов или у больных с нарушенной выделительной функцией почек могут наблюдаться нейротоксические реакции, проявляющиеся^ виде симметричных парестезий, парезов, мышечных дистрофий, нарушении зрения, слуха. Иногда нитрофураны вызывают нарушение функции органов дыхания (одышка, сухой кашель, озноб, внезапное повышение температуры), легочный фиброз. Фуразолидон ингибирует моноаминоксидазу (МАО), поэтому его нельзя назначать одновременно с веществами, инактивируемыми этим ферментом (адреналин, норадреналин, дофамин, мезатон и др.), а также с другими препаратами, ингибирующими МАО (нуредал), и трициклическими антидепрессантами; из пищи необходимо исключить продукты, содержащие тирамин (сыр, сливки, творог). В противном случае может возникнуть резкое сужение сосудов, гипертонический криз, вызванные эндогенными катехоламинами и их всосавшимися из ЖКТ предшественниками.
ПРОИЗВОДНЫЕ 8-ОКСИХИНОЛИНА, НАФТИРИДИНА И 4-ОКСИХИНОЛИНА
В эту группу объединены синтетические противомикробные средства, имеющие сходное химическое строение. Различают три поколения названных препаратов:
1-е поколение 2-е поколение 3-е поколение
Энтеросептол Кислота оксолиниевая Норфлоксацин
Хиниофон Кислота налидиксовая Ципрофлоксацин
Интестопан Кислота пипемидиновая Офлоксацин
Нитроксолин Кислота пиромидиновая Пефлоксацин
Хлррхинальдол Эноксацин
8-оксихинолины — препараты первого поколения. Они подавляют активность грамотрицательных бактерий, амеб и некоторых грибков, образуя комплексы с ионами металлов, необходимых для активации ферментных си.стем микроорганизмов. Оксихинолины, содержащие галогены (хлор, бром, йод) — энте-370
росептол, хиниофон и некоторые комбинированные препараты (мексаформ, мексаза и др.) при приеме через рот всасываются плохо, и их применяют для лечения инфекций желудочно-кишечного тракта. Оксихинолины, содержащие нитрогруппу (нитроксолин), при приеме через рот хорошо всасываются и выделяются с мочой в неизмененном виде, поэтому оказываются эффективными для лечения инфекций почек и мочевыводящих путей.
Энтеросептол — производное 8-оксихинолина, содержащее йод и хлор. При приеме внутрь практически не всасывается, поэтому его применяют в качестве антибактериального препарата при энтероколитах, амебной и бактериальной дизентерии, протозойных колитах, гнилостной диспепсии и других инфекционных заболеваниях желудочно-кишечного тракта.
Мексаформ — комплексный препарат, содержащий, помимо энтеросеп-тола, фанхинон, — соединение, обладающее противомикробным и амебоцид-ным действием, а также М-холинолитик и спазмолитик оксифенония бромид. Мексаформ назначают при расстройствах пищеварения, сопровождающихся явлениями брожения, метеоризмом, а также при неспецифических поносах и гнилостной диспепсии.
Мексаза, помимо энтеросептола и фанхинона, содержит ферментные препараты бромелина (бромелаин) и панкреатина, а также дигидрохолевую кислоту. Мексазу применяют при инфекционных заболеваниях желудочно-кишечного тракта, сопровождающихся расстройствами пищеварения, в том числе при недостаточной функции поджелудочной железы, расстройствах секреции желудочного и кишечного сока, бродильной и гнилостной диспепсии и т. п.
Энтеросептол также входит в состав некоторых лекарственных форм для наружного применения, например, мази «Дермозолон», содержащей, кроме того, глюкокортикоид — преднизолон. «Дермозолон» применяют при инфицированных экземах, поверхностных язвах, грибковых поражениях кожи и пр.
Хиниофон (ятрен) — производное 8-оксихинолина, содержащее йод. Он подавляет активность грамотрицательных микроорганизмов и амеб. Назначают его внутрь и парентерально при амебной дизентерии и язвенных колитах, а также местно в виде мазей, присыпок и растворов-для лечения гнойных ран, ожогов, язв.
Интестопан — препарат, близкий по действию и показаниям к энтеро-септолу, но, в отличие от первого, не содержащий йода.
Хлорхинальдол содержит в молекуле 2 атома хлора. Он подавляет грамположительные и грамотрицательные бактерии. Применяют его при заболеваниях желудочно-кишечного тракта, вызванных стафилококками, протеем и другими энтеробактериями, при дисбактериозе, а также при лямблиозе и амебиазе.
Нитроксолин (5-НОК) противомикробный препарат широкого спектра. Действует на грамположительные и грамотрицательные микроорганизмы, а также на некоторые грибки (рода Candida и др.). Он, в отличие от вышеназванных производных 8-оксихинолина, при приеме внутрь быстро всасывается из желудочно-кишечного тракта и выводится в неизмененном виде почками, создавая в моче высокую концентрацию. Назначают нитроксолин при инфицировании мочевыводящих путей (пиелонефрит, цистит, уретрит и пр.), а также для профилактики инфекционных осложнений после операций на органах урогенитального тракта. Препарат обычно хорошо переносится. Иногда отмечают диспепсические расстройства, аллергические сыпи. Более тяжелые нежелательные эффекты (нарушения функции центральной нервной системы) могут возникнуть у больных с нарушенной выделительной функцией почек.
371
Налидиксовая кислота (Производное нафтиридина)
Оксолиниевая кислота (производное 4-оксихинолина)
От других препаратов этой группы осложнения возникают очень редко. Все же при повреждении слизистой оболочки кишечника, например при амебной дизентерии, энтеросептол может всосаться и оказать токсическое действие на нервную систему, проявляющееся обычно в виде невритов, в том числе зрительного нерва. Их нельзя применять при тяжелых заболеваниях печени, почек,
372
зрительного нерва. Энтеросептол, содержащий йод, может вызвать явления йодизма, а интестопан, в состав которого входит бром, некоторое угнетение центральной нервной системы.
ПРОИЗВОДНЫЕ НАФТИРИДИНА И 4-ОКСИХИНОЛИНА
Кислота налидиксовая (неграм, невиграмон) — препарат второго поколения, производное нафтиридина. Она оказывает бактериостатический или бактерицидный эффект в зависимости от концентрации в среде. В основе ее противомикробного действия лежит способность связывать ионы двухвалентйого железа, необходимые для активации ферментных систем микроорганизмов. Налидиксовая кислота подавляет активность грамотрицательных микроорганизмов: кишечной палочки, шигелл, сальмонелл, протея и др. Она неэффективна в отношении грамположительных микробов и анаэробов. Из желудочно-кишечного тракта хорошо всасывается, проникает во все ткани и жидкости организма (исключение составляют центральная нервная система й ликвор) и быстро выводится почками в неизмененном виде. Применяют ее главным образом при острых инфекционных процессах мочевых путей (пиелонефриты, циститы и пр.), вызванных чувствительными к препарату микроорганизмами. Менее эффективен препарат при хронических заболеваниях. Иногда налидиксовую кислоту применяют для лечения энтероколитов, холециститов, отитов и других заболеваний, но ее эффективность при названных патологических процессах может оказаться недостаточной вследствие быстрого выведения препарата почками.
При применении налидиксовой кислоты в отдельных случаях отмечают возникновение тошноты, рвоты, церебральных нарушений в виде головной боли, головокружения, а также кожные аллергические и фотоаллергические реакции. Иногда она оказывает гепатотоксическое действие. Налидиксовая кислота противопоказана при нарушении функции печени, угнетении дыхательного центра, беременным женщинам и новорожденным детям.
Кислота оксолиниевая (грамурин) — противомикробное средство широкого спектра действия из группы хинолонов (4-оксихинолинов), особенно эффективное для лечения инфекций, вызванных грамотрицательными микроорганизмами. Наиболее чувствительны к ней кишечная палочка, протей и клебси-еллы. Оксолиниевая кислота часто оказывайся эффективной при лечении заболеваний, вызванных штаммами возбудителей, устойчивыми к действию антибиотиков. Механизм ее противомикробного действия сходен с таковым налидиксовой кислоты (угнетение активности клеточных ферментов микроорганизмов), но оксолиниевая кислота, по сравнению с последней, отличается большей активностью, широтой и длительностью действия. При приеме через рот она хорошо всасывается и очень быстро выводится почками в неизмененном виде, поэтому применяют ее преимущественно при инфекциях мочевых путей (циститы, пиелонефриты, цистопиелиты и др.). Наиболее активен препарат при острых процессах. При применении оксолиниевой кислоты у детей могут наблюдаться диспепсические расстройства, аллергические реакции, повышенная возбудимость центральной нервной системы (нарушение сна, беспокойство, увеличение судорожной готовности), головная боль, тахикардия, слабость. Она может нарушать инактивацию в печени некоторых лекарственных препаратов (непрямых антикоагулянтов, синтетических антидиабетических и противоэпилептических средств). Оксолиниевая кислота противопоказана при эпилепсии, новорожденным и детям с патологией печени, беременным и кормящим женщинам.
373
Пипемидиновая (палин, пипрам) и пиромидиновая кислоты — уроантисептики из группы хинолонов (4-оксихинолинов). По химическому строению, механизму действия, антибактериальному спектру, осложнениям и противопоказаниям названные препараты .сходны с оксолиниевой кислотой. Отличаются от последней несколько большей активностью. Назначают пипемидиновую и пиромидиновую кислоты при острых и хронических инфекциях мочевых путей, преимущественно у взрослых, поскольку опыта применения данных противомикробных средств у детей до 14 лет еще недостаточно.
Фторхинолоны (фторсодержащие 4-хинолоны, 4-оксихинолины третьего поколения) — офлоксацин (таривид), ципрофлоксацин (ципро-бай), пефлоксацин, эноксацин, норфлоксацин.
Препараты этой группы отличаются исключительно широким спектром действия, более 97% возбудителей инфекционных заболеваний чувствительны к действию фторхинолонов. Они влияют на грамположительные и грамотрицательные бактерии, включая:, нейсерии, кишечную палочку, шигеллы, сальмонеллы, клебсиеллы, энтеробактеры, протей, морганеллы, иерсинии, гемофильную палочку, кампилобактер, синеЙдойную палочку, легионеллы, моракселлы, бруцеллы, стафилококки, листерии, коринебактерии, хламидии и др. Названные препараты легко проникают внутрь микроорганизмов, где необратимо блокируют А-субъединицу ДНК-гиразы, фермента, необходимого для репликации бактериальной ДНК. В результате происходит сверхскручивание ДНК, гидролиз АТФ, нарушение проницаемости мембран и, как следствие этого, лизис микроорганизмов. Фторхинолоны хорошо всасываются из ЖКТ, легко проникают во все ткани и жидкости организма (исключение составляют ЦСЖ и центральная нервная систему), в высоких концентрациях они содержатся в слюне, мокроте, желчи, коже, экссудатах, секрете предстательной железы. Важной особенностью этих препаратов является то, что они могут накапливаться внутри клеток (коэффициент распределения цитоплазма/плазма крови больше 10) и поэтому эффективны при лечении инфекционных процессов, для которых характерно внутриклеточное расположение микроорганизмов (брюшной тиф, гонорея и др.). В организме фторхинолоны частично подвергаются биотрансформации, причем некоторые метаболиты обладают выраженной противомик-робной активностью. Выводятся названные вещества с мочой и желчью. Элиминация эноксацина и офлоксацина осуществляется преимущественно путем клубочковой фильтрации, и при нарушении выделительной функции почек они могут накапливаться в организме, что сопровождается появлением нежелательных эффектов. Пефлоксацин выводится преимущественно с желчью, поэтому при заболеваниях почек его кумуляции в организме не происходит.
Применяют фторхинолоны при инфекциях верхних и нижних дыхательных путей, кожи,'мягких тканей, брюшной полости (включая органы малого таза), заболеваниях почек, урогенитального тракта и др.
При применении фторхинолонов иногда отмечают расстройства функции ЖКТ (тошнота, рвота, анорексия, запоры или поносы, боли в животе), аллергические реакции. Противопоказаны они беременным и кормящим женщинам, новорожденным, а также больным с повышенной чувствительностью к упомянутым препаратам. В экспериментах на развивающихся животных установлено, что фторхинолоны нарушают формирование хрящевой ткани, поэтому применение названных препаратов в настоящее время у детей допускается только в особых случаях, при неэффективности других противомикробных средств.
374
Уменьшение противомикробного действия фторхинолонов отмечают при их совместном применении с противоинфекционными препаратами, нарушающими синтез нуклеиновых кислот (рифампицин, нитрофураны) или белка (левомицетин), а также с веществами, снижающими всасывание первых (антациды-, ранитидин, гастрозепин).
НИТРОИМИДАЗОЛЫ
Производные нитроимидазола (см. рис. 46): метронидазол (трихопол, клион, флагил, метрогил и др.) и тинидазол (фисижин) — преператы, обладающие антипротозойным действием; к ним чувствительны трихомонады, лямблии, кишечные амебы, некоторые лейшмании. Кроме того, они являются одними из наиболее эффективных средств для лечения инфекций, вызванных анаэробными бактериями. Нитроимидазолы легко проникают внутрь микроорганизмов, где их нитрогруппа под влиянием нитроредуктаз восстанавливается. В результате такой биотрансформации образуются высокотоксичные метаболиты, повреждающие бактериальную ДНК. Аэробные микроорганизмы не имеют нитроредуктаз, восстанавливающих нитроимидазолы, и в условиях in vitro к ним не чувствительны. В организме же при наличии смешанной (аэробной и анаэробной) инфекции некоторые анаэробы (Вас. fragilis и. др.) превращают нитроимидазолы в активные метаболиты, способные подавлять аэробную микрофлору (кишечную палочку и др.).
После приема внутрь нитроимидазолы хорошо всасываются, легко проникают во все ткани и жидкости организма, включая мозг, ликвор, кости, желчь, очаги воспаления и некроза.
Метронидазол
R = - С2Н4ОН
Тинидазол
л?
R = — СН2 - СН2 - SO2 - С2Н5
Рис. 46. Химическая структура нитроимидазолов
Метронидазол и тинидазол применяют для лечения трахомонадоза, лямблиоза, амебиаза, кожного лейшманиоза, заболеваний, вызванных анаэробными микроорганизмами (некротизирующий энтероколит, эндокардит, болезнь Крона, менингит и др.), а также инфекционных процессов, обусловленных смешанной микрофлорой.
Нитроимидазолы — низкотоксичные препараты, но иногда при их применении отмечают потерю аппетита, тошноту, рвоту, диарею, кожные сыпи, полиурию, дизурию, нарушения функции печени и центральной нервной системы (возбуждение, тремор и даже судороги), лейко- нейтропению, отеки, изменения на ЭКГ.
Нитроимидазолы противопоказаны больным с нарушением кроветворения и прогрессирующими заболеваниями центральной нервной системы.
375
Дозы и режим приема синтетических противомикробных средств для детей даны в табл. 61.
Таблица 61
Синтетические противомикробные средства
Препарат Лекарственная форма Путь введения Число приемов в сутки Суточная доза, мг/кг
Фуразолидон Fyrazolidonum Таблетки по 0,05 и 0,1 г Внутрь после еды 3-4 4-5
Фурадонин Furadoninum Таблетки по 0,03 и 0,05 г То же 3-4 4-5
Фурагин Furaginum Таблетки по 0,05 г « 3-4 4-5
Кислота оксолиниевая Acidum oxolinicum Таблетки по 0,25 г Внутрь 2-3 20-30
Кислота налидиксовая Acidum nalidixicum ' Р' Капсулы, : таблетки по 0,5 г То же 3-4 50-60
Офлоксацин Ofloxacin Таблетки по 0,2 г « 2-3 10-20
Нитроксолин1 Nitropxolinum Таблетки по 0,05 г « 4
Энтеросептол Enteroseptol Таблетки по 0,25 г « 3 по 1/2 таблетки
Интестопан2 Intestopanum Официнальные таблетки « 2-4
Метронидазол Metronidazolum Таблетки по 0,25 и 0,5 г « 3 15-20
0,5% раствор в ампулах по 20 мл Внутривенно медленно 3 15-20
0,5% раствор во флаконах по 100 мл Внутривенно капельно 3 15-20
Тинидазол Tinidazol Таблетки по 0,5 г Внутрь • 3 50-60
Примечания. 1. Нитроксолин назначают детям до 5 лет в суточной дозе 200 мг, более старшим детям 300—400 мг. 2. Интестопан назначают детям до 2 лет в суточной дозе 1/4 таблетки на кг массы тела, после 2 лет — по 1—2 таблетки 2—4 раза в день.
Глава 45
ПРОТИВОТУБЕРКУЛЕЗНЫЕ СРЕДСТВА
В современном комплексном лечении туберкулеза решающую роль играет специфическая антибактериальная терапия. В отечественной фтизиатрии принята следующая классификация противотуберкулезных средств:
376
I группа — наиболее эффективные препараты: гидразиды изоникотиновой кислоты (изониазид, фтивазид и др.), рифампицин;
II группа — препараты средней эффективности: этамбутол, стрептомицин, протионамид, пиразинамид, канамицин, циклосерин;
III группа — препараты умеренной эффективности: ПАСК, тибон.
Гидразиды изоникотиновой кислоты (ГИНК). В эту группу препаратов относят изониазид, фтивазид, метазид, салюзид. Самым эффективным представителем этой группы является изониазид (тубазид). Он обладает высокой бактериостатической активностью в отношении микобактерий. Применяют его внутрь в виде аэрозоля, внутримышечно и внутривенно. Механизм действия состоит в нарушении обмена веществ микобактерий, так как ГИНК блокирует многие их ферменты: каталазу, дегидрогеназы, дезоксирибонуклеазу и др. Производные ГИНК подвергаются ацетилированию, утрачивая при этом свою активность. Процесс этот у разных больных происходит с разной скоростью. Больным с быстрым ацетилированием нужно назначать препараты ГИНК в несколько больших дозах. Применяют изониазид для лечения всех форм активного туберкулеза у взрослых и детей. Часто его комбинируют с другими противотуберкулезными средствами (ПАСК, этамбутолом, стрептомицином). При длительном лечении ГИНК могут наблюдаться головные боли, периферические невриты, дерматиты, особенно у больных с медленным ацетилированием этих препаратов. Многие из этих нежелательных эффектов возникают из-за дефицита витаминов группы В, особенно пиридоксина, так как ГИНК нарушает их обмен. Для устранения нежелательных эффектов ГИНК больным необходимо назначать Bi и Вб внутримышечно. Препараты группы ГИНК противопоказаны при эпилепсии, заболеваниях периферической нервной системы, нарушениях функции печени и почек.
Фтивазид, салюзид и метазид отличаются от изониазида меньшей активностью, но и меньшей токсичностью. Назначают их обычно внутрь.
Рифампицин — полусинтетический антибиотик широкого спектра действия (см. гл. 42). На микобактерию туберкулеза действует бактериостатически, в больших дозах оказывает бактерицидный эффект. Основным механизмом туберкулостатического действия рифампицина является подавление синтеза белков и ингибиция РНК, локализованной в рибосомах микобактерий. Назначают его внутрь натощак преимущественно при лечении туберкулеза легких.
Нежелательными эффектами рифампицина являются диспепсические явления, дисфункция печени и поджелудочной железы, лейкопения, геморрагический синдром. Препарат окрашивает мочу, мокроту, слезную жидкость в красноватый цвет.
При монотерапии быстро развивается устойчивость к рифампицину, поэтому его обычно комбинируют с изониазидом, этамбутолом и др.
При развитии устойчивости микобактерий к рифампицину применяют его новое производное — рифабутин (микобутин), более высокая эффективность которого обусловлена хорошим его проникновением в клетки и воздействием на биосинтез ДНК микобактерий в концентрациях в 8 раз ниже концентраций рифампицина.
Рифабутин быстро всасывается из желудочно-кишечного тракта, максимальная его концентрация в плазме крови возникает через 2—4 ч после приема внутрь. Высокий его уровень в плазме крови поддерживается в течение 30 ч.
377
В легочной ткани концентрация рифабутина в 5—10 раз более высокая, чем в плазме крови, и она сохраняется в течение 24 ч.
Преимуществом рифабутина является также его способность воздействовать на атипичные микобактерии и неспецифическую патогенную флору, а также хорошая переносимость больными.
Стрептомицин и канамицин (см. гл. 42).
Этамбутол подавляет только размножающиеся микобактерии; используют его для лечения разных форм туберкулеза при устойчивости бактерий к другим противотуберкулезным средствам.
Действие этамбутола на микобактерии связано с торможением синтеза РНК и белков, а также с его способностью взаимодействовать с ионами двухвалентных металлов (Cu++, Mg++) и нарушением структуры рибосом.
Препарат назначают внутрь однократно не более 1 г в сутки. В процессе лечения этамбутолом необходим систематический контроль офтальмолога, так как препарат может ухудшить остроту зрения, нарушить цветоощущение, уменьшить поле зрения.
Протионамид и пиразинамид так же, как этамбутол, назначают при устойчивости микобактерий к основным препаратам. Особенностью пи-разинамида является его способность проникать в зоны казеоза, поэтому он рекомендован для лечения туберкулем, казеозно-пневмонических процессов. Оба препарата могут вызвать диспепсические расстройства.
Циклосерин — антибиотик широкого спектра, блокирующий образование клеточной стенки микобактерий и снижающий ее кислотоустойчивость. Циклосерин обладает токсическим действием на нервную систему, что может проявляться головокружением, бессонницей, повышенной раздражительностью. Иногда наблюдаются и более тяжелые осложнения: эпилептиформные припадки, галлюцинации, острые психозы. Нежелательные эффекты обычно приходят после уменьшения дозы или при отмене препарата. Тем не менее его нельзя использовать у детей младшего возраста, а также у взрослых при наличии сопутствующих заболеваний нервной системы.
ПАСК — натриевая соль парааминосалициловой кислоты. Механизм действия обусловлен ее конкуренцией с парааминобензойной кислотой, необходимой для роста микобактерий. По силе действия ПАСК уступает многим противотуберкулезным средствам, поэтому применяется только в комбинации с препаратами ГИНК, стрептомицином. Из нежелательных явлений отмечают диспепсии, дерматиты, увеличение щитовидной железы.
Т и б о н (тиоацетазон) проявляет бактериостатическое действие в отношении возбудителей туберкулеза и лепры. Назначают его при туберкулезе слизистых и серозных оболочек, лимфаденитах, туберкулезных свищах. Препарат токсичен, противопоказан при нарушении функции печени, почек, кроветворных органов. Используют его редко, в комбинации с препаратами ГИНК, ПАСК, стрептомицином.
В последние годы в качестве противотуберкулезных средств стали применять фторхинолоны (ломефлоксацин, офлоксацин, ципрофлоксацин), обладающие не только противотуберкулезной активностью, но и широким спектром действия на сопутствующую неспецифическую патогенную микрофлору. Эти средства в комбинации с изониазидом, пиразинамидом или со стрептомицином положительно зарекомендовали себя при лечении больных с тяжелыми казеозно-некротическими формами туберкулеза легких, особенно при одновременном наличии неспецифических воспалительных заболеваний органов дыхания (пневмонии, бронхитов).
378 i
ПРИНЦИПЫ И МЕТОДЫ ХИМИОТЕРАПИИ ТУБЕРКУЛЕЗА
Химиотерапия туберкулеза должна быть длительной, непрерывной и комбинированной с назначением двух и более препаратов. Лечение туберкулеза обычно продолжается 12—18 мес, иногда и более. Необходимость непрерывной многомесячной химиотерапии обусловлена локализацией туберкулезных палочек в глубине очагов с недостаточным кровообращением, препятствующим поступлению в них лекарств. Кратковременные или длительные, но с перерывами, курсы не обеспечивают излечения процесса. Комбинированное применение нескольких препаратов связано с тем, что монотерапия способствует развитию вторичной лекарственной устойчивости микобактерий уже через 2— 3 мес лечения. Кроме того, рациональная комбинация отдельных препаратов приводит к потенцированию их туберкулостатического действия.
Дозы и режим применения противотуберкулезных средств даны в табл. 62.
Таблица 62
г Противотуберкулезные средства
Препарат Лекарственная форма Путь введения Число введений в сутки Суточная доза
Изониазид Isoniazidum Порошок, таблетки по 0,1 и 0,3 г Внутрь 1-2 Взрослым 10 мг/кг Детям 5-8 — 10 мг/кг
Фтивазид Phthivazidum Порошок, таблетки по 0,1; 0,3 и 0,5 г То же 2-3 Взрослым 1—1,5 г Детям 20-40 мг/кг
Рифампицин Rifampicinium Капсулы по 0,05 и 0,15 г « ,1 Взрослым 0,45 мг/кг Детям 8-10 мг/кг
Этамбутол Ethambutolum Таблетки по 0,1; 0,2 и 0,4 г « 1 В любом возрасте 20—25 мг/кг (не более 1 г)
Натрия парааминосалицилат Natrii paraaminosali-cylas Порошок, таблетки по 0,5 г Гранулы в упаковке по 100 г Внутрь после 3-4 Взрослым 8—10 г Детям 0,2 г/кг
Глявя 46
ПРОТИВОВИРУСНЫЕ СРЕДСТВА
Противовирусные препараты применяют для профилактики и лечения заболеваний, вызванных вирусами (см. рис. 47).
Вирусы живут и размножаются только в клетках организма хозяина. Они используют биосинтетические процессы в клетках макроорганизма, модифицируя их. В связи с этим избирательно уничтожить вирус медикаментами, не повредив при этом клетку хозяина, практически невозможно. Другими словами, у этих препаратов мал химико-терапевтический индекс. Противовирусные средства чаше используют местно (можно создать высокую концентрацию) и про-
379
филактически (препятствуя поступлению вирусов в клетку или воздействуя на них, когда концентрация вирусов в клетке еще небольшая). Эффективность назначения противовирусных средств с лечебной целью пока невелика.
Идоксуридин
Метисазон
Рис. 47. Химические структуры противовирусных средств
Механизм действия известных в настоящее время противовирусных препаратов различен. Он касается разных стадий взаимодействия вируса с клеткой. Выделяют следующие группы веществ:
1) препараты, препятствующие адгезии вирусов к поверхности клетки и нарушающие этим их проникновение в нее, — ремантадин, оксолин;
2) вещества, угнетающие синтез нуклеиновых кислот, — идоксуридин, ацикловир, рибавирин;
3) препараты, угнетающие «сборку» вирионов, — метисазон;
4) средства, повышающие резистентность клетки к вирусу, — интерферон, полудан.
Ремантадин оказывает специфическое профилактическое действие в отношении гриппозной инфекции, вызванной определенными штаммами вирусов подтипа Аг, но эффективен и против других вирусов типа А, а также проявляет антитоксическое действие при гриппе, вызванном вирусом В. Применяют его внутрь с целью профилактики гриппа в период эпидемий. Препарат хорошо всасывается из желудочно-кишечного тракта и может проникать через гематоэнцефалический барьер. Он является производным амантадина, обладающего непрямой дофаминомиметической активностью (см. гл. 13), поэтому его прием может сопровождаться рядом нежелательных эффектов (тошнотой, рвотой, раздражительностью, реже галлюцинациями, психозами, ортостатическим коллапсом, задержкой мочи).
380
Препарат противопоказан при острых заболеваниях печени и почек, усилении функции щитовидной железы. Ремантадин не рекомендуют назначать детям до 1 года.
Оксолин эффективен при вирусных заболеваниях глаз, кожи, при вирусных ринитах. Используют препарат для индивидуальной профилактики гриппа. В период эпидемии гриппа, особенно при контакте с больными, применяют его мазь для смазывания слизистой оболочки носа утром и вечером. При этом иногда наблюдается проходящее жжение слизистой оболочки.
Идоксуридин (керецид, ИДУР) оказывает ингибирующее влияние' на ДНК-полимеразу. В связи с этим он подавляет развитие ДНК-содержащих вирусов. Препарат применяют местно при герпетической инфекции глаз. Помимо этого его иногда применяют и для резорбтивного действия при генерализованном герпесе, вводя внутривенно капельно. Однако он не снижает количество вирусов в мозговой ткани больных с герпетическим энцефалитом и к тому же слишком токсичен при системном введении. Учитывая сильное иммунодепрессивное действие идоксуридина, одновременно с ним целесообразно назначить ребенку 4-10 мл иммуноглобулина или гамма-глобулина. При внутривенном введении препарат может вызвать боль по ходу вены.
Ацикловир (зовиракс, вирулекс) — ациклический аналог гуанозина, подвергается превращению в монофосфат под влиянием индуцируемой вирусом Герпеса тимидинкиназы, а затем фосфорилируется до трифосфата под влиянием энзимов клеток хозяина. Трифосфат ацикловира и ингибирует вирусную ДНК-полимеразу, и является ее ложным субстратом (при его утилизации не образуется нормальная ДНК). В неинфицированной клетке тимидинкиназа не синтезируется и фосфорилирование ацикловира происходит очень медленно, не создавая концентраций, способных подавить синтез ДНК клетки хозяина. Поэтому препарат влияет только на клетку, инфицированную вирусом герпеса, но не на нормальные клетки организма человека.
Ацикловир применяют местно, внутрь, внутримышечно и внутривенно при системной герпетической инфекции и ветряной оспе у новорожденных. Данный препарат существенно снижает летальность от герпетической инфекции и ее неврологические осложнения. Цитомегаловирус не индуцирует тимидинкиназу, но его ДНК-полимераза очень чувствительна-даже к небольшим концентрациям трифосфата ацикловира. Небольшие количества последнего, образовавшиеся в клетках, могут быть достаточными для предупреждения инициации репликации вируса, но, к сожалению, совершенно недостаточными для прекращения начавшегося процесса. С целью профилактики цитомегаловирусной инфекции era назначают больным за 5 дней до пересадки костного мозга, почек, а затем на протяжении 36 дней после операции.
Новорожденные хорошо переносят ацикловир, но у более старших детей и взрослых могут возникать нежелательные эффекты: тремор, летаргия, галлюцинации, судороги, головная боль, артериальная гипотензия, диспепсические явления, нарушения иммунитета и кроветворения.
Валацикловир и фамацикловир по своей клинико-фармакологической характеристике близки к ацикловиру. Но их нельзя вводить внутримышечно.
Ганцикловир высокоэффективен в отношении цитомегаловирусов. Препарат назначают внутрь во время еды. Биоусвоение из желудочно-кишечного тракта составляет 15—20%, тем не менее этого достаточно для оказания эффекта.
381
Связывание с белками плазмы крови всего 9-30%, поэтому препарат хорошо проникает в различные ткани и жидкости (включая ликвор). Большая часть препарата в неизмененном виде выводится почками.
К нежелательным эффектам ганцикловира относят: гематотоксичность, эн-цефалопатические реакции, иммунодепрессию, повреждение репродуктивной функции, а также мутагенный, тератогенный и канцерогенный эффекты.
Рибавирин (виразол) — аналог пуриновых нуклеозидов, тормозит репликацию многих РНК-вирусов (миксо-, арено-, ретровирусов и др.). В основном его используют для лечения ослабленных и недоношенных новорожденных с заболеваниями дыхательных путей (пневмония и т. п.), вызванных респираторно-синцитиальным вирусом. Вводят препарат с помощью специального ингалятора в виде аэрозоля, длительность процедуры 12—20 ч, курс 5-7 дней. Его применение может сопровождаться рвотой, анемией, ретикулоцито-зом, появлением сыпи, конъюнктивитом, повышенной возбудимостью. С воздухом препарат может попасть в организм медицинского персонала и вызвать тератогенный эффект. ,
Метисазон (марборан) эффективен в отношении вируса оспы. Назначают препарат внутрь. Применяют для профилактики натуральной оспы и уменьшения осложнений при противооспенной вакцинации. Из побочных эффектов чаше всего возникают диспепсические явления (тошнота, рвота). Противопоказаниями к применению метисазона являются тяжелые заболевания печени, почек, желудочно-кишечного тракта.
Особо следует остановиться на противовирусном препарате азидотимидин (зидовудин), применяемом при синдроме приобретенного иммунодефицита (СПИД) — ВИЧ-инфекции человека. После проникновения лимфотропного РНК-содержащего вируса иммунодефицита человека (ВИЧ) в лимфоцит происходит синтез вирусной ДНК на матрице (вирусной РНК) под влиянием обратной транскриптазы, что и приводит к повреждению лимфоцитов. Механизм действия азидотимидина заключается в блокаде названного фермента. В основном он эффективен у носителей вируса до появления признаков заболевания.
Азидотимидин назначают внутрь или вводят внутривенно. Биоусвояемость из желудочно-кишечного тракта составляет около 60%. Связь с белками плазмы крови 35%. Препарат легко проникает в различные ткани и жидкости, включая ликвор. Он подвергается биотрансформации в печени, его главный метаболит 5'-0-глюкуронид. Экскреция с помощью почек в неизмененном виде (90%) и в виде метаболитов. Период полуэлиминации из крови 1 ч.
У каждого 4-го больного, получающего азидотимидин, возникает анемия (чаще микроцитарного характера), нейтропения, лейкопения, гепатомегалия. Реже прием препарата сопровождается головной болью, извращением вкуса, тошнотой, диареей, миалгиями, гипертермией, ознобом, кардиалгией и депрессией.
На вирус иммунодефицита человека (ВИЧ-инфекция), хотя и слабее, чем азидотимидин, влияет и фосфоноформат.
Фосфоноформат (фоскарнет) вводят внутривенно. Экскреция препарата осуществляется в неизмененном виде почками.
При использовании фосфоноформата возможны костно-мозговые депрессии, иммунодепрессия, нарушения функции печени и почек, а также тератогенный, мутагенный и канцерогенный эффекты.
382
Интерферон получают из питательной жидкости, в которой культивируют лейкоциты или фибробласты человека, в ответ на воздействие вируса — интерфероногена. Интерферон видоспецифичный низкомолекулярный гликопротеин. Препарат имеет широкий противовирусный спектр.
Интерферон не сам обладает противовирусным действием. Он взаимодействует со специальными местами связывания на поверхности клеток, что приводит к активации протеинкиназы и образованию низкомолекулярного ингибитора синтеза белков, стимулирующего эндонуклеазы, разрушающие РНК вирусов и клеток хозяина.
Существует несколько основных типов интерферонов: а- и p-интерфероны (отвечают в первую очередь за антивирусную защиту) и у-интерферон (последний в основном является регулятором иммунитета). В случаях бактериальных, грибковых и протозойных инфркций система интерферона включается в процессы иммунологической элиминации патогена. В некоторых случаях интерфероны реализуют свои эффекты по аналогии с вирусными инфекциями (например, при инфицировании микроорганизмами, имеющими внутриклеточные стадии развития: хламидии, микоплазмы, боррелии и др.).
Интерферон помимо противовирусного и противомикробного действий способен активировать сниженный иммунитет (повышает фагоцитарную активность макрофагов и спонтанную токсичность натуральных киллеров), вызывать противоопухолевый эффект, влиять на многие функции организма, в том числе на функции центральной нервной системы.
В клинике используют следующие препараты:
— а-2А-интерфероны: реаферон, роферон;
— а-2В-интерфероны: нитрон-А, инрек, виферон;
— а-2С-интерфероны: берофор, эгиферон, велферон;
— p-интерфероны: бетасерон, фрон;
— у-интерфероны: гаммаферон, иммуноферон.
Интерферон (в 1 мг 1000 ЕД) применяют для профилактики и лечения гриппа, а также других вирусных респираторных заболеваний. Раствор препарата закапывают в носовые ходы или используют путем распыления. Эффект возникает только местно, так как интерферон не всасывается. Свежеприготовленный раствор (в ампулу с порошком вливают-до метки кипяченую воду) вводят интраназально по 2—3 капли 1-2 раза в^ень с целью профилактики, а с лечебной целью — 4—6 раз в день. Интерферон может предотвратить заболевание гриппом, а также уменьшить тяжесть инфекции. Применяют его местно и при лечении опоясывающего лишая.
В условиях невесомости (на космических кораблях) получают высокоочи-щенный интерферон (в 1 мг 5 000 000 ЕД) для парентерального введения (внутривенно, внутримышечно, внутрикостно, эндолюмбально, эндолимфатически). Но препарат плохо проникает в ткани и быстро инактивируется, поэтому его приходится назначать 4—6 раз в сутки. Этот препарат применяют для лечения системных вирусных заболеваний и злокачественных опухолей.
Нежелательных явлений при местном применении интерферона не выявлено. При парентеральном же введении могут возникнуть: лихорадка, головная боль, миалгия, снижение артериального давления, аритмия, тахикардия, желудочковая экстрасистолия, нарушения кроветворения и функции центральной нервной системы в виде вялости, утомляемости, ухудшения аппетита, рвоты. Препарат выводится почками, поэтому при их поражении его назначать нельзя.
383
Парентеральное введение высоких доз очищенного интерферона новорожденным может быть опасным. В экспериментах показано, что интерферон может вызвать некротические изменения в печени и гибель новорожденных животных, а у выживших развивается тяжелый гломерулонефрит.
Интерфероногены — вещества, способные вызывать образование интерферона. К ним, помимо вирусов, многих бактерий, риккетсий, экстрактов грибков, относят различные химические вещества. Последние обычно представляют собой полимеры, двойные нуклеозиды. Интерфероногены стимулируют образование собственного интерферона в соответствующих тканях организма, что очень важно, так как' он обладает строгой видо- и тканеспецифичностью, не обладают антигенностью. К числу таких препаратов можно отнести пол уд ан (полиаденил-уридиловая кислота). Его используют при вирусных заболеваниях глаз. Вводят под конъюнктиву или назначают в виде глазных капель.
Кроме полудана, применяют и другие синтетические интерфероногены: н е -овир, циклоферон, амиксин. Их спектр действия значительно шире. Эти препараты применяют с целью профилактики и лечения тяжелых форм гриппа и ОРВИ, вирусных гепатитов, энцефалитов герпетической и арбови-русной этиологии.
Существуют неспецифические методы лечения респираторных вирусных инфекций у детей раннего возраста. Среди них РНК-аза и ДНК-аза в виде аэрозолей, ингибиторы протеаз (Е-аминокапроновая кислота, контрикал, гордокс, трасилол), вводимые разными способами. Например, Е-аминокапро-новую кислоту применяют внутрь, разведя предварительно в молоке, или закапывают в носовые ходы. Названный препарат не используют при склонности ребенка к тромбозам.
Лекарственные формы и дозы основных препаратов для детей представлены в табл. 63.
Таблица 63
. Противовирусные средства
Препарат Форма выпуска Путь введения Число введении в сутки Суточная доза
Ремантадин Remantadiniun Таблетки по 0,05 г Внутрь после еды 1 (для профилактики) 0,015 г на 1 год жизни
Оксолин Oxolinum 6,25% и 0,5% мази и порошок (для приготовления раствора) Смазывание слизистой оболочки носа 2
Идоксуридин Idoxuridinum 0,1% раствор во флаконах, глазные капли В конъюнктивальную полость Каждый час днем и через каждые 2 ч ночью 2 капли (однократная доза)
Внутривенно 1 50 мг/кг
Метисазон Methisazonum Таблетки по 0,2 г Внутрь (спустя 1— 1,5 ч после еды) 2 10 мг/кг
Интерферон biterferonum В ампулах по 0,2 мг; перед употреблением растворяют в 2 мл кипяченой воды Интраназально Профилактически — 3, с лечебной целью — 5 6 капель 10 капель
384
Глава 47 ПРОТИВОГРИБКОВЫЕ СРЕДСТВА
Для подавления роста и размножения патогенных грибков используют препараты различной химической структуры.
Различают препараты, используемые для воздействия на поверхностные и системные (глубокие) микозы.
ПРЕПАРАТЫ, ПРИМЕНЯЕМЫЕ ПРИ ПОВЕРХНОСТНЫХ МИКОЗАХ (поражениях кожи, слизистых оболочек полости рта, желудочно-кишечного тракта, влагалища)
Гризеофульвин — антибиотик, продуцируемый плесневым грибком Penicillium nigricans (griseofulvum). Он оказывает фунгистатическое действие на разные виды дерматофитов (трихофиты, микроспориумы, ахорионы, эпидер-мофитоны). Неэффективен при кандидозах. Важным свойством гризеофульвина является его эффективность при приеме внутрь. Активность гризеофульвина зависит от степени дисперсности порошка: мелкокристаллическая форма примерно в два раза менее активна, чем специально подготовленная высокодисперсная форма, которая называется «Гризеофульвин-форте».
Гризеофульвин нарушает синтез клеточной стенки грибков, подавляет репликацию ДНК и, образуя комплексы с растворимой РНК, угнетает синтез их белка.
Антибиотик хорошо всасывается из желудочно-кишечного тракта, максимальная концентрация в крови наблюдается через 4—5 ч. Он избирательно откладывается в роговом слое эпидермиса, матрице ногтей, прикорневой зоне волос, защищая вновь образуемый кератин от поражения грибками. В нижних частях рогового слоя гризеофульвин обнаруживается в достаточной концентрации уже после трех дней лечения, в среднем слое — через 10—15 дней, а в верхнем — через 33-56 дней, это и определяет продолжительность курса лечения. Антибиотик концентрируется также в печени, жировой ткани, в скелетной мускулатуре. В печени он подвергается биотрансформации и выделяется с мочой и калом.
Гризеофульвин применяют для Лечения фавуса, трихофитии, микроспории волосистой части головы и гладкой кожи, а также при поражении ногтей (онихомикоз), вызванного патогенными грибками (ахорионом, трихофитоном, красным эпидермрфитоном).
Во время применения гризеофульвина возможна тошнота, рвота, боли в животе, головная боль, головокружение, дезориентация. У детей часто развиваются аллергические реакции, изменения со стороны крови (лейкопения или лейкоцитоз, эозинофилия, лимфопения), торможение неспецифического иммуногенеза, нарушение порфиринового .обмена, обмена витаминов группы В.
Для большей эффективности лечения одновременно с гризеофульвином местно назначают другие противогрибковые средства: амиказол, препараты ундециленовой кислоты, йода, салициловой кислоты и др.
Изготовлены мазь и линимент гризеофульвина для нанесения на пораженные участки кожи, ногти. Эти препараты вызывают четкий терапевтический эффект без нежелательного действия.
13 Зак. 3856
385
Пимафуцин (натамицин) — антибиотик с таким же как у гризео-фульвина действием. Отличается от него тем, что не всасывается из желудочно-кишечного тракта, с поверхности кожи и слизистых оболочек. Применяют его при заболеваниях, вызванных дрожжевыми грибками, преимущественно при кандидомикозе полости рта, кишечника, влагалища, отомикозах, кандидозе кожи и ногтей в виде таблеток, свечей, крема, суспензии для местного применения. От приема таблеток иногда может быть тошнота, рвота; от крема, свечей — раздражение, чувство жжения.
Ламизил (тербинафин) — производное аллиламинов, подавляет ранний этап синтеза стеринов в клетке грибка. По спектру действия похож на гризеофульвин, но оказывает фунгицидное действие на Candida albicans, поэтому он эффективен при инфекционном процессе, устраняет опасность рецидива.
Применяют его в виде таблеток для приема внутрь и в виде мази для наружного применения. Нежелательные эффекты возникают реже, чем от гризеофульвина, но все же его не следует назначать беременным и кормящим женщинам.
Полиеновые антибиотики: н и ст^ати н, л е вор и н, амфотерицин В — основные препараты для лечения* всех форм кандидоза. Они обладают фун-гистатическими, а в высоких дозах фунгицидными свойствами. Нистатин и леворин очень плохо всасываются из желудочно-кишечного тракта, поэтому их применяют для лечения поверхностных микозов.
Механизм действия полиеновых антибиотиков заключается в образовании комплексов со стеринами клеточной мембраны грибков, что ведет к повышению проницаемости цитоплазматической мембраны и потере клеткой низкомолекулярных водорастворимых соединений (катионы К+, NHJ, фосфаты, аминокислоты и др.) и подавлению жизнедеятельности микроорганизмов.
Нистатин и леворин применяют для лечения молочницы и кандидоза желудочно-кишечного тракта. Препараты эффективны при наружном применении: в виде свечей и мазей их используют для лечения кандидозов кожи и слизистых оболочек. При кандидозе кишечника нистатин и леворин назначают внутрь в виде таблеток. Поскольку препараты плохо всасываются из желудочно-кишечного тракта, при кандидозе дыхательных путей их целесообразно применять ингаляционно р виде растворов натриевых солей.
Токсичность нистатина и леворина незначительна, поэтому осложнения возникают редко, но иногда возможны тошнота, рвота, диарея.
Нистатин и леворин применяют для профилактики кандидозов при длительном лечении антибиотиками широкого спектра действия.
При кандидозе кожи и слизистых оболочек применяют также водные и спиртовые растворы красителей, обладающие антисептическими свойствами: генциановый фиолетовый, метиленовый синий, фуксин, бриллиантовый зеленый и др.
Синтетические препараты. Амиказол эффективен в отношении дерматофитов (трихофитон, микроспориум) и дрожжеподобных грибков рода Candida. Применяют только наружно в форме мази и присыпки.
Клотримазол — противогрибковый препарат широкого спектра действия. Эффективен при дерматофитиях, кандидозах, оказывает антибактериальное и противопротозойное действие. Назначают при микозах кожи и урогенитальном кандидозе. Выпускают в форме мази и вагинальных таблеток.
386
Препараты ундециленовой кислоты: мазь «Ц и н к у н д а н», мазь «У н д е -цин», присыпка «Дустундан», мазь «М и ко сел тин*; Применяют прй эпидермофитии, дрожжевом дерматозе в виде мазей или присыпок. Содержащаяся в названных лекарственных формах ундециленовая кислота и ее натри-евая соль оказывают при местном применении фунгистатическое и фунгицидное действие, поскольку они нарушают обменные процессы в клеточных мембранах грибков.
Препараты «Декамин», «Октат и он», «Микозол он», «Э с ул ан», «Хлорацетофос» имеют различную химическую структуру, выпускается в виде мазей или спиртовых растворов, применяются только наружно для лечения эпидермофитии, руброфитии, микроспории, трихофитии.
Растворы йода: 1-2% спиртовые растворы йода, раствор Люголя, йодид калия, йодид натрия, дийодолеин. Оказывают противогрибковое и антимикробное действие. При поверхностных микозах применяют местно, при глубоких внутрь.
ПРЕПАРАТЫ, ПРИМЕНЯЕМЫЕ ДЛЯ ЛЕЧЕНИЯ СИСТЕМНЫХ МИКОЗОВ
Амфотерицин В — полиеновый антибиотик, обладающий широким спектром действия. Его применяют для лечения системного кандидоза и других глубоких микозов, что выгодно отличает его от других противогрибковых средств. Амфотерицин В активен и при тех микозах, возбудители которых устойчивы к другим препаратам, например при североамериканском бластомикозе, различных формах гистоплазмоза, криптококкоза, кокцидиомикоза, споротрихоза и др. Эффективность амфотерицина В усиливается при его сочетании с другими антибиотиками (например, с тетрациклином и рифампицином). В связи с плохим всасыванием из желудочно-кишечного тракта его назначают парентерально (внутривенно, эндолюмбально). Возможно также местное и ингаляционное применение антибиотика. Однако, препарат характеризуется высокой токсичностью: довольно часто возникают тошнота, рвота, диарея, лихорадка, головная боль, нарушения деятельности сердца, нефротоксичность, нарушения электролитного баланса, угнетение гемопо^а. Поэтому в педиатрии чаще применяют препарат а мф о глюка мин, представляющий собой смесь амфотерицина В с N-метилглюкаминовой солью.
Амфоглюкамин сопоставим по эффективности с амфотерицином В, но значительно менее токсичен. Он всасывается из желудочно-кишечного тракта, поэтому его можно назначать через рот для получения резорбтивных эффектов. По структуре и свойствам близок к амфоглюкамину препарат ми ко гептин. В связи с широким внедрением в практику синтетических противогрибковых препаратов амфотерицин В и его аналоги в педиатрической практике в настоящее время используются редко.
Синтетические противогрибковые препараты. Флу цитозин (ан кот и л) назначают при системных кандидозах, особенно мочевых путей. Флуцитозин хорошо всасывается из желудочно-кишечного тракта, легко проникает в ЦСЖ. Возможна комбинация флуцитозина с амфотерицином при кандидозном сепсисе или в случае развития резистентности к одному из препаратов. Побочными эффектами могут быть: тошнота, рвота, диарея, потеря аппетита, кожные сыпи,
\
387
головокружение, галлюцинации, лейкопения, анемия, повышение активности печеночных ферментов.
Кетоконазол (низорал) — показания аналогичны таковым для флу-цитозина.
Побочные эффекты: тошнота, рвота, боли в животе, гепатотоксичность, головная боль, лихорадка, гинекомастия, подавление функции надпочечников.
Миконазол (дактарин) показания аналогичны таковым для флуцито-зина и кетоконазола, однако миконазол плохо всасывается из желудочно-кишечного тракта, поэтому его вводят внутривенно. Миконазол подвергается биотрансформации в печени, поэтому его не назначают при ее патологии. Нельзя назначать с амфотерицином из-за возможного антагонизма.
Побочные эффекты: зуд, сыпь, лихорадка, озноб, тошнота, рвота, диарея, флебиты, гипонатриемия, почечная недостаточность, психоз, сердечные аритмии, тромбоцитопения, анемия.
Флуконазол (дифлюкан) спектр действия препарата подобен кетоконазолу, однако препарат менее токсичен, хорошо всасывается из желудочно-кишечного тракта, поэтому его назначают и через рот, и внутривенно. Хорошо проникает в ЦСЖ и мозг, медленно выводится из организма, поэтому его можно принимать 1 раз в день. ’
Дозы противогрибковых средств даны в табл. 64.
Таблица 64
Противогрибковые средства
Препарат Лекарственная форма Путь введения Число введении в сутки Однократная доза
Нистатин Nystatinum Таблетки и свечи по 250000 и 500000 ЕД Мазь, содержащая в 1 г 10 000 ЕД нистатина Внутрь Ректально Наружно 3-4 (курс 10-14 дней) До 1 года - 100000-125000 ЕД, от 1 года до 3 лет — 250000 ЕД, старше 13 лет — 1000000— 1500000 ЕД
Леворин Levorinium Таблетки и порошки по 500000 ЕД Мазь, содержащая в 1 г 500000 ЕД леворина Внутрь Защечно Наружно 3-4 (курс 7-12 дней) До 2 лет — 25000 ЕД/кг; 2-4 года — 20000 ЕД/кг; после 6 лет — 200000—250000 ЕД
Амфотерицин В Amphotericinum В Порошок для инъекций по 50000 ЕД во флаконах Перед применением содержимое флакона растворить в 10 мл воды для инъекций Полученный раствор развести в 450 мл 5% раствора глюкозы Внутривенно капельно в течение 4— 6 ч 1 Постепенное повышение дозы антибиотика от 1-й до 20-й инъекций детям 1—3 лет - 75-400 ЕД/кг, 4-7 лет — 100-500 ЕД/кг, 8-12 лет — 125-600 ЕД/кг, 13-18 лет - 150-700 ЕД/кг
Амфоглюкамин Amphoglucami-num Таблетки по 100000 ЕД Внутрь после еды 2 До 2 лет — 25000 ЕД, 2-6 лет - 100000 ЕД, 6-9 лет - 150000 ЕД, 9-14 лет — 200000 ЕД
388
Глава 48 ПРОТИВОПРОТОЗОЙНЫЕ СРЕДСТВА
Антиамебные препараты, используемые при кишечном амебиазе, обычно назначают внутрь; они способны проникать в стенку кишки и накапливаться в ней. При внекишечном амебиазе с поражением печени, легких и других органов медикаменты, как правило, вводят парентерально, что обеспечивает создание их высоких концентраций в пораженном органе.
Классификация антиамебных средств:
1. Препараты, применяемые при амебиазе любой локализации: производные имидазола (метронидазол, тинидазол) и нитротиазола (ниридазол).
2. Средства, применяемые при кишечной форме амебиаза: производные оксихинолина (хиниофон, энтеросептол, мексаформ, дийдохин, интестопан), органические соединения мышьяка (аминарсон, осарсол, бемарсал, амебикон, амебал), препараты разной химической структуры (дилоксанид, хлорбетамид, хлорфеноксамид, глаукорубин).
3. Средства, применяемые при локализации амеб в печени: хингамин.
4. Препараты, применяемые при тканевых формах амебиаза с локализацией паразита в стенке кишки и в печени: производные эметина (эметина гидрохлорид, дегидроэметин), висмут-йодид.
В педиатрии наибольшее значение имеют метронидазол, хиниофон, эметина гидрохлорид.
Метронидазол (см. гл. 44) легко проникает в клетки простейших, где его нитрогруппа под влиянием нитроредуктаз подвергается восстановлению. Образовавшийся метаболит вызывает деградацию ДНК паразитов. Препарат хорошо всасывается из желудочно-кишечного тракта и проникает во все ткани и жидкости (включая вагинальный секрет, семенную жидкость, молоко кормящих матерей, слюну), выводится почками. Метронидазол давно применяют для подавления амеб, лямблий, трихомонад. Нежелательные эффекты проявляются в виде металлического привкуса во рту, тошноты, рвоты, головной боли. При назначении больших доз метаболиты могут окрашивать мочу в темный цвет. Противопоказан препарат при беременности, в период лактации, а также при нарушениях кроветворения.
Хиниофон нарушает систему окислительного фосфорилирования в митохондриях амеб за счет галогенизации ферментов и образования комплексов с ними. Препарат угнетает дыхательный цикл амеб, так как блокирует железосодержащие центры ферментов. Основным показанием к назначению хини-офона является амебная дизентерия. Из желудочно-кишечного тракта препарат всасывается в незначительных количествах. Большая часть лекарственного вещества остается в содержимом кишки и выделяется с фекалиями. Нежелательные эффекты в виде боли в животе, диареи возникают у детей реже, чем у взрослых. Хиниофон противопоказан при гиперфункции щитовидной железы, повышенной чувствительности к йоду, заболеваниях печени и почек.
Эметина гидрохлорид оказывает прямое действие на амеб, вызывая дегенерацию ядер и повреждение цитоплазмы. Препарат нарушает биосинтез протеинов, ингибируя процесс переноса аминокислот от транспортной РНК к рибосомам. Под его влиянием погибают вегетативные формы амеб, которые подвергаются дегенеративным изменениям. На цистные формы эметин оказывает слабое действие. Наиболее рационально использование препарата при внекишечном и остром кишечном амебиазе у больных, не переносящих метронидазол, или при его неэффективности. Вводят эметин подкожно или внут
389
римышечно. Он является действующим началом рвотного корня и при приеме внутрь вызывает рвоту. Отсюда его название: от греч. emesis — рвота. Более всего эметин накапливается в печени. Особенностью его фармакокинетики является способность секретироваться в просвет кишки. Нежелательные эффекты: боли в мышцах, сердечная слабость, полиневриты, тошнота, рвота, головные боли. В период лечения больной должен соблюдать постельный режим. Детям до 6 мес препарат не назначают. Эметин противопоказан больным с сердечной недостаточностью, аритмиями, заболеваниями почек, беременным женщинам.
Антилямблиозные средства используют при обнаружении цист и трофозоитов лямблий в содержимом двенадцатиперстной кишки или кале. В настоящее время имеется большое число лекарств для лечения лямблиоза. Однако средствами выбора при данном паразитозе у детей следует считать аминохинол, фуразолидон и метронидазол.
Аминохинол, относящийся к группе производных аминохинолина, применяют при лечении лямблиоза, кожного лейшманиоза и токсоплазмоза. Препарат обычно хорошо переносится. У отдельных детей могут возникнуть тошнота, рвота, головная боль. При передозировке возможны шум в ушах, общая слабость и бессонница. В этих случаях, а также при аллергических кожных реакциях, следует прекратить прием аминохинола. В процессе лечения необходимо контролировать картину крови, функции печени и почек.
Фуразолидон (см. гл. 44) подавляет жизнедеятельности лямблий и три-хомонад. При использовании высоких доз, а также у пациентов с нарушенной выделительной функцией почек, препарат может вызвать нейротоксические явления (парестезии, парезы, поражение зрительного нерва). Наиболее распространенным нежелательным эффектом являются диспепсические расстройства (тошнота, рвота, боль в животе). С осторожностью следует назначать фуразолидон при нарушении функции почек.
Метронидазол (см. гл. 44) полностью подавляет трофозоиты лямблий. Для получения терапевтического эффекта препарат назначают 2-3 мес, после чего следует провести контрольное исследование на полноту излечения.
Дозы противопротозойных препаратов даны в табл. 65.
Противопротозойные средства
Таблица 65
Препарат Лекарственная форма Путь введения Число приемов в сутки Суточная доза
Метронидазол Metronidazohim Таблетки по 0,25 и 0,5 г Внуть 3 При амебиазе — 35— 50 мг/кг; при лямблиозе от 2 до 5 лет — 0,25 г; 5-10 лет - 0,375 г; старше 10 лет — 0,5 г
Хиниофон Chiniofonum Таблетки и капсулы по 0,5 г Внутрь 3 От 1 до 2 лет — 0,1 г; 2_3 года — 0,15 г; 3-4 года — 0,2 г; 4-5 лет — 0,25 г; 5-6 лет — 0,3 г; 6—8 лет — 0,45 г; 8-12 лет — 0,6 г; 12—13 лет — 0,7 г; 13-15 лет — 1,0 г; старше 16 лет — 1,5 г
390
Окончание табл. 65
Препарат Лекарственная форма Путь введения Число приемов в сутки Суточная дйза
Эметина гидрохлорид Emetini hydrochloridum Ампулы по 1 мл 1% раствора Внутримышечно, подкожно 2 От 6 мес до 1 года — 0,005 г, 1-2 года — 0,01 г; 2—5 лет — 0,02 г; 5-9 лет — 0,03 г; 9-15 лет — 0,04 г
Аминохинол Aminochinolum Порошок и таблетки по 0,025 и 0,05 г Внутрь 3 До 1 года — 0,025 г; 1-2 года — 0,05 г; 2—4 года — 0,075 г; 4—6 лет — 0,1 г; 6-8 лет — 0,15 г; 8-12 лет — 0,2 г; 12-16 лет - 0,25-0,3 г
Фуразолидон Furazolidonum Таблетки по 0,05 г Внутрь 4 10 мг/кг
Глава 49 ПРОТИВОГЛИСТНЫЕ СРЕДСТВА
Антигельминтные средства применяют для борьбы с паразитическими червями и их личинками, вызывающими заболевания человека (см. табл. 66). Медикаменты могут действовать паразитоцидно, вызывая гибель гельминтов, или же паразитостатически, нарушая их функции. Выбор препарата для лечения зависит от вида паразита и стадии его развития. Противоглистные средства можно разделить на препараты широкого спектра действия (мебендазол, пра-зиквантель) и антигельминтики специфического действия: для борьбы с круглыми червями (левамизол, пирантел, пиперазина адипинат, нафтамон, дифезил, дитиазанин, пирвиния памоат, тиабендазол), ленточными (фенасал, экстракт мужского папоротника, аминоакрихин, семя тыквы) и сосальщиками (хлоксил).
Таблица 66
Классификация гельминГозов человека
Гельмннтозы Глисты
1. Нематодозы: 1. Круглые черви:
аскаридоз аскарида
трихоцефалез власоглав
энтеробиоз острица
анкил остомидозы:
— анкилостомоз анкилостома
— некатороз некатор
стронгилоидоз стронгилоида
трихинеллез трихинелла *
2. Цестодозы: 2. Ленточные черви:
дифиллоботриоз широкий лентец
тениаринхоз бычий цепень
391
Окончание табл. 66
Гельминтозы Глисты
тениоз свиной цепень
гименолепидоз карликовый цепень
3. Трематодозы: 3. Сосальщики:
описторхоз описторхис
клонорхоз клонорхис
фасциолез фасциола
СРЕДСТВА ШИРОКОГО СПЕКТРА ДЕЙСТВИЯ
Мебендазол (вермокс) угнетает углеводный обмен глистов, что приводит к истощению запасов гликогена в их тканях и к уменьшению образования АТФ. Из желудочно-кишечного тракта человека он не всасывается. Препарат обладает активностью при энтеробйозе, аскаридозе, анкилостомидозе, трихо-цефалезе, трихинеллезе, цестодозах кишечника и трематодозах печени. Нежелательных эффектов от приема мебендазола не описано, однако его не рекомендуют использовать при беременности.
Празиквантель влияет на клеточные мембраны в теле гельминтов, нарушая нормальный ток ионов как внутрь клеток, так и из них. В результате ослабевает функция мышечных клеток. Очень велика эффективность препарата в отношении трематодозов печени, гименолепидоза, тениаринхоза и дифилло-ботриоза. В редких случаях у больных прием празиквантеля вызывает тошноту, боли в эпигастрии, горечь во рту, головную боль. Препарат противопоказан при нарушении функции печени и при беременности.
АНТИНЕМАТОДОЗНЫЕ СРЕДСТВА, применяемые при изгнании аскариды, власоглава, острицы, некатора, анкилостомы, стронгилоиды, трихинеллы
Левамизол (декарис) препятствует утилизации сукцината, так как ингибирует фермент сукцинатдегидрогеназу. Это уменьшает образование АТФ и вызывает паралич мускулатуры нематод. Левамизол используют для массовой дегельминтизации в связи с высокой его эффективностью при аскаридозе. Реже препарат назначают при анкилостомидозе и стронгилоидозе. Левамизол удобен в применении, так как не требует изменений в диете и назначения слабительных. Нежелательные эффекты возникают редко и проявляются в виде боли в животе, тошноты, головокружения, головной боли.
Пирантел (комбантрин) вызывает у глистов паралич мускулатуры, вследствие чего паразиты не могут удержаться на поверхности кишки. Очень высока эффективность препарата при аскаридозе, энтеробиозе и анкилостомидозе. Таблетки принимают после измельчения (без слабительного и изменений в диете). Переносится пирантел хорошо, хотя возможны диспепсия, головная боль и головокружение. Противопоказан при беременности.
Пиперазина адипинат (пиперазина адипат) оказывает антихолинер-гическое действие на мионевральные связи нематод, вызывая паралич мышц. Препарат наиболее эффективен в отношении аскарид и остриц. Пиперазина 392
адипинат хорошо переносится детьми, не требует изменений в диете. Нежелательные эффекты в виде диспепсии, мышечной слабости и сонливости возникают редко. Препарат противопоказан при эпилепсии, а также при нарушении функции печени и почек.
Нафтамон (бефениум) оказывает влияние на нервно-мышечную систему гельминтов, вызывая сначала контрактуру мышц, сменяющуюся затем их параличом. При аскаридозе, анкилостомидозе, энтеробиозе и стронгилоидозе применяют таблетки нафтамона «К», покрытые оболочкой. При трихоцефалезе используют таблетки нафтамона, растворимые в кишечнике. При назначении препарата рекомендуется воздерживаться от употребления молочных, жирных, острых и соленых продуктов. Нежелательные эффекты: диспепсия, слабость, головокружение и головная боль. Препарат противопоказан при заболеваниях печени. Производное нафтамона дифезил применяют при трихоцефалезе.
Дитиазанин (тельмид) угнетает тканевое дыхание нематод. Препарат относится к группе цианиновых красителей, из желудочно-кишечного тракта почти не всасывается. Дитиазанин используют при трихоцефалезе, стронгилоидозе, реже при аскаридозе и энтеробиозе. При его приеме кал окрашивается в синий цвет. При появлении такой же окраски мочи, свидетельствующей о всасывании препарата (из-за имеющихся изъязвлений и воспаления слизистой оболочки), его следует отменить. Нежелательные эффекты: тошнота, рвота, диспепсия. Дитиазанин противопоказан при заболеваниях желудка, кишечника, печени и почек.
Пирвиния памоат (ванкин) нарушает аэробное дыхание гельминтов. Тоже относится к цианиновым красителям. Из желудочно-кишечного тракта препарат не всасывается, выделяется с фекалиями, окрашивая их в красный цвет. Пирвиния памоат эффективен только в отношении остриц. Детьми переносится хорошо. Из нежелательных эффектов изредка наблюдают диспепсию, головокружение, головную боль. Противопоказан при патологии кишечника, печени и почек.
Тиабендазол (минтезол) вызывает гибель нематод. Препарат быстро всасывается из желудочно-кишечного тракта. Эффективен при всех нематодо-зах, но особенно при стронгилоидозе и трихинеллезе. У детей раннего возраста тиабендазол используют относительно редко в связи с довольно частыми побочными явлениями. Особая осторожность нужна при наличии у ребенка патологии печени и почек. Нежелательные эффекты: брадикардия, артериальная гипотензия, головокружение, диспепсия, шум в ушах, боль в глазах. Тиабендазол противопоказан при беременности.
АНТИЦЕСТОДОЗНЫЕ СРЕДСТВА, применяемые для удаления бычьего, свиного, карликового цепня, широкого лентеца
Фенасал (никлозамид) снижает устойчивость покровных тканей ленточных червей к воздействию ферментов пищеварительной системы и вызывает паралич мышц глистов. Рекомендуется назначать препарат при тениаринхозе, дифиллоботриозе и тениозе. Использовать при тениозе следует осторожно из-за опасности развития цистицеркоза, так как фенасал, обладая теницидным действием, не проявляет овоцидного эффекта. Это приводит к тому, что при
393
нарушении личной гигиены онкосферы могут попадать в желудок и из него через кровеносную систему в ткани глаза и мозга, вызывая их тяжелое поражение (цистицеркоз). Препарат хорошо переносится. У части детей может развиться диспепсия. Противопоказаний нет.
Экстракт мужского папоротника вызывает расслабление присосок головки цестод, и они на некоторое время теряют способность прикрепляться к стенке кишки. Для удаления глистов обязательно нужно слабительное (солевое), иначе они снова могут присосаться к поверхности кишечника. Действующие вещества препарата — производные флороглюцина и фильмарон. Препарат эффективен в отношении тениоза, тениаринхоза, гименолепидоза и дифиллоботриоза. Лечение проводится в условиях стационара по определенной схеме, включающей безжировую диету, которая обеспечивает контакт экстракта с гельминтами и уменьшает опасность всасывания и возникновения нежелательных эффектов в виде нарушения функции сердечно-сосудистой системы, судорог, тошноты, рвоты, болей в животе. Обязательно назначение солевого слабительного. Экстракт противопоказан детям до 2 лет, беременным женщинам, а также при заболеваниях сердаа, печени, почек, желудочно-кишечного тракта и при лихорадке. ’ ,
Аминоакрихин нарушает функцию нервно-мышечной системы цестод, и они отпадают от стенки кишки. Препарат применяют при непереносимости экстракта мужского папоротника или при терапии гименолепидоза, резистентного к другим средствам. Накануне и в день лечения после аминоакрихина назначают слабительное. Нежелательные эффекты: тошнота, рвота, диспепсия. Противопоказания: гастриты, язвенная болезнь.
Семя тыквы содержит вещество, расслабляющее присоски головки глистов. Препарат по активности уступает экстракту мужского папоротника. Используют для изгнания всех четырех видов ленточных червей. Применяют очищенное семя или отвар из него. Нежелательных эффектов и противопоказаний нет. Эффективно сочетанное назначение препарата с экстрактом мужского папоротника и последующим приемом слабительного.
АНТИТРЕМАТОДОЗНЫЕ СРЕДСТВА, применяемые для изгнания описторхисов, фасциол, клонорхисов
Хлоксил угнетает углеводный обмен трематод, а также оказывает деструктивное влияние на нуклеопротеиды кишечного эпителия и паренхимы гельминтов. Препарат вначале возбуждает мышцы глистов (присоски после нескольких сокращений открываются и паразиты теряют способность прикрепляться к ткани), затем полностью обездвиживает сосальщиков. Хлоксил используют для борьбы с трематодозами печени (описторхозом, фасциолезом, клонорхозом). Дети обычно переносят его хорошо, но все же возможны нарушения функции печени, сердца и аллергические реакции в виде кожных сыпей. Препарат противопоказан при беременности, патологии печени' (не связанной с гельминтозом) и миокарда.
Дозы противоглистных средств даны в табл. 67. Путь введения всех препаратов через рот, прием 1 раз в сутки.
394
Таблица 67
Антигельминтные средства
Препарат Форма выпуска Курс лечения (дни) Суточная доза
Мебендазол Mebendazohim Таблетки по 0,1 г 1-7 До 3 лет — 0,05 г, старше 4 лет — 0,1 г
Празйквантель Prasiquantelum Суспензия, в 1 мл 0,1 г 1 10-20 мг/кг
Левамизол Levamisohim Таблетки по 0,05 и 0,15 г 1 2,5 мг/кг
Пирантел Pyrantelum Таблетки по 0,25 г; суспензия, в 1 мл — 0,05 г 1-3 10 мг/кг
Пиперазина адипинат Piperazini adipinas Таблетки по 0,2 и 0,5 г. 5% раствор во флаконах по 100 мл ’ 2-5 Детям до 1 года — 0,2 г; старше 2 лет — 0,1 г на год жизни, но не более 1,0 г
Нафтамон Naphthamonum Таблетки нафтамона «К» по 0,5 г, покрытые оболочкой. Таблетки по 0,5 г 3-5 3-5 лет — 2,0-2,5 г; 6-8 лет — 3,0 г; 9-10 лет — 4 г; старше 10 лет — 5,0 г
Дифезил Diphezylum Порошок 5 2-5 лет — 2,0-3,0 г; 6-10 лет — 3,5-4,0 г; 11-15 лет — 4,5-5,0 г
Дитиазанин Dithiazaninum Порошок 5-10 2,5—5,0 мг/кг
Пирвиния памоат Pyrvinii pamoas Драже по 0,05 г Суспензия (100 мл), в 1 мл — 0,01 г 1 5 мг/кг
Тиабендазол Thiabendazolum Суспензия (5 мл), в 1 мл — 0,1 г 2-7 25 мг/кг
Фенасал Phenasalum Таблетки по 0,5 г Порошок 4-7 До 4 лет — 0,5 г; 5-6 лет — 1,0 г; 6-9 лет — 1,5 г; старше 9 лет — 2,0 г
Экстракт мужского папоротника Extractum Filicis mans spis-sum Капсулы по 0,5 г 1 0,5 г на год жизни, но не более 4 г
Аминоакрихин Aminoacrichinum Таблетки по 0,1 г Порошок 5 До 6 лет — 0,15 г; 7-12 лет — 0,2 г; 13-15 лет — 0,3 г
Семя тыквы Semen Cucurbitae В пачках по 130 г 1 Отвар: до 5 лет — из 100—150 г; . 5—7 лет — из 200 г; 8-10 лет — из 300 г неочищенного семени. Очищенное семя: до 4 лет — 75 г; 5—7 лет — 100 г; 8-10 лет — 150 г; 10-15 лет - 200-250 г
Хлоксил ' Chloxylum Порошок 3-5 20 мг/кг
395
Раздел VIII ПРОТИВОЯДИЯ
Глава 50 ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ПРИМЕНЯЕМЫЕ ПРИ ЛЕЧЕНИИ ОСТРЫХ ОТРАВЛЕНИЙ У ДЕТЕЙ
Отравления у детей чаще происходят в возрасте до 5 лет, то есть в период их знакомства с окружающим миром. В основном интоксикация происходит из-за случайного проглатывания ребенком какого-либо вещества. Преимущественно (50% случаев) отравления у детей возникают из-за приема внутрь лекарственных веществ. Нередко встречаются случаи отравления средствами бытовой химии (20% — инсектицидами, растворителями, лаками, красками, пятновыводителями и пр.), а также ядовитыми растениями (цикута, красавка) и грибами (мухомор, бледная погана).
При оказании экстренной помощи отравившемуся ребенку следует различать 3 группы мероприятий: 1) удаление невсосавшегося яда; 2) удаление всосавшегося яда; 3) поддержание основных функций организма.
1. Удаление невсосавшегося яда проводят при первом же контакте врача (фельдшера) с больным.
При попадании ядовитых веществ на кожу и слизистые оболочки необходимо немедленно их обмыть теплой водой с мылом. Есть и специфические противоядия, нейтрализующие или прекращающие воздействие яда на кожу и всасывание через нее (см. табл. 68).
Таблица 68
Противоядия, применяемые для удаления яда с поверхности тела
Яд Противоядие для удаления с поверхности тела Примечание
Карбофос, хлорофос (и др. ФОС) Фенол, крезол Скипидар, бензин, четыреххлористый углерод Белый фосфор Калия перманганат 10—15% раствор нашатырного спирта или 5-6% раствор натрия гидрокарбоната Растительное масло, полиэтиленгликоль Теплая мыльная вода 2-3%. раствор сульфата меди 0,5-1,0% раствор аскорбиновой кислоты или равные объемы 3% раствора перекиси водорода и 3% раствора уксусной кислоты Происходит гидролиз яда. Спасающий должен надеть резиновые перчатки Вазелиновое масло нельзя Нельзя этиловый спирт Образуется безопасный С11Р2 Предотвращение образования атомарного кислорода, едкого калия, двуокиси марганца, повреждающих ткани
При попадании яда на конъюнктиву и роговицу их необходимо промыть теплым физиологическим раствором, молоком (при их осутствии просто водой). Процедуру необходимо проводить в течение 10-20 мин, неоднократно сменяя жидкость. После ее окончания в конъюнктивальный мешок можно закапать 0,5-1% раствор местного анестетика (дикаина, новокаина и т. п.). Если в глаза попали карбофос, хлорофос или другие фосфорорганические соединения, про-396
мывание производят 3% раствором натрия гидрокарбоната. В случае попадания в глаза кислот или щелочей промывать их растворами щелочей или кислот соответственно нельзя (можно еще больше повредить ткани).
Удаление яда из желудка производят путем вызывания рвоты и (или) его промыванием.
Рвоту можно вызвать с помощью теплого 5—10% раствора натрия хлорида, сиропа рвотного корня или апоморфина. Последний применяют только у детей старше 5 лет (см. гл. 26).
Промывание желудка следует проводить у всех отравившихся детей даже после рвоты, так как в складках слизистой оболочки желудка яд может остаться. Лучше промывание производить теплым физиологическим раствором или раствором Рингера-Локка, чтобы не переохладить ребенка и не нарушить у него водно-солевой баланс. Для этой цели можно использовать реополиглюкин, сорбирующий яд.
Даже самое тщательное промывание желудка не гарантирует полного удаления яда, поэтому необходимо после него обязательно назначить активированный уголь, способный сорбировать яд и вывести его из организма вместе с фекалиями. Если принят быстро всасывающийся яд (морфин, этаминал-на-трий, амидопирин и пр.), то активированный уголь должен быть введен еще до промывания желудка (и после него).
При отравлении веществами, участвующими в энтерогепатической циркуляции (дигитоксин, индометацин, рифампицин и др.), надо дать активированный уголь повторно, чтобы связать вновь поступающие в кишечник порции яда.
Для завершения мероприятий по удалению невсосавшегося яда необходимо назначить слабительное и поставить клизму.
В качестве слабительного обычно назначают 15—20% раствор натрия сульфата. В случае отравления жирорастворимыми ядами применяют вазелиновое масло (3 мл на 1 кг массы тела), которое растворяет яды (керосин, бензин, скипидар, четыреххлористый углерод), но не способствует их всасыванию (в отличие от касторового масла!). Подробно о слабительных средствах см. гл. 26.
2. Удаление всосавшегося яда. При отравлении летучими веществами необходимо вынести ребенка на свежий воздух и ввести аналептические средства (кофеин, этимизол) или назначить вдыхание карбогена для стимуляции дыхания, чтобы увеличить вентиляцию легких^ ускорить выведение яда.
При отравлении веществами, раздражающими дыхательные пути (даже принятыми внутрь) (формалином, нашатырным спиртом, сероводородом, бензином и пр.), для профилактики отека легких больному надо создать полный покой и назначить вдыхание кислорода (при появлении признаков отека вместе с пеногасителями — этанолом или антифомсиланом см. гл. 18). Кислород надо увлажнять, пропуская через воду в банке Боброва. При отравлении парами нашатырного спирта (или аммиака) кислород следует пропускать через 5-7% раствор уксусной кислоты; при отравлении парами формалина — через слабый, раствор нашатырного спирта.
Для ускорения элиминации водорастворимых диализабельных ядов и их метаболитов применяют форсированный диурез.
Метод форсирования диуреза зависит от степени тяжести отравления. При легком отравлении следует назначать обильное питье и фуросемид через рот; при средней тяжести отравления — внутривенное вливание среднемолекулярных плазмозаменителей (гемодез, полидез), так как содержащиеся в них полимеры способны связывать яд и затем вместе с ним выводиться с мочой;
397
при тяжелой степени отравления и жидкости, и мочегонные (маннит, сорбит, фуросемид, см. гл. 25) вливают внутривенно.
Форсирование диуреза не проводят, если отравление произошло веществами, хорошо связывающимися с белками плазмы и тканей. К числу таких веществ относятся: аминазин, амитриптилин, атропин, барбамил, сибазон, дигитоксин, дигоксин, имизин, кодеин, метаквалон, морфин, ниаламид, ноксирон, прозерин, тиопентал-натрий, фосфорорганические соединения, хлозепид.
При отравлении слабыми кислотами (барбитуратами, салицилатами и пр.) больному следует вводить натрия гидрокарбонат для ощелачивания мочи, это ускоряет их выведение с мочой. При отравлении же основными веществами (фенотиазинами, мепротаном, бензодиазепинами и пр.) подщелачивать мочу нельзя, это замедлит выведение ядов с мочой.
Форсирование диуреза проводить нельзя, если у больного возникли почечная недостаточность или недостаточность кровообращения.
При острой почечной недостаточности вместо форсированного диуреза в случае отравления диализабельными ядами может быть применен гемодиализ.
Для удаления диализабельных и недиализабельных ядов иногда применяют заменное переливание крови или гемосорбцию (пропускание крови через колонки со специальными сортами активированного угля или ионообменных смол).
Связыванию ядов и их удалению из организма способствуют следующие противоядия: унитиол, сукцимер, мекаптид, тетацин-кальций, пентацин, три-лон Б, дефероксамин, пеницилламин, метиленовый синий, амилнитрит. Все названные антидоты можно назначать при условии нормальной функции почек.
УнитиоЛ содержит две сульфгидрильные группы, способные связывать тяжелые металлы (ртуть, висмут, медь, цинк, золото, никель, хром), металлоиды (мышьяк), сердечные гликозиды. Образовавшиеся комплексы с названными веществами хорошо растворяются в воде и выводятся почками. Унитиол хорошо всасывается из желудочно-кишечного тракта и из мышц, поэтому его назначают внутрь, внутримыщечно, а при необходимости (при отравлении парами ртути) ингаляционно. Препарат хорошо проникает во все ткани и жидкости, выводится почками в неизмененном виде. При введении унитиола необходимо назначить натрия гидрокарбонат для подщелачивания мочи, иначе может произойти диссоциация комплекса, освобождение металла и повреждение им почечной ткани. Прием унитиола может сопровождаться возникновением ряда нежелательных эффектов: тошнота, иногда рвота, головная боль, ощущение жжения слизистых оболочек губ, рта, слезотечение, ринорея. При передозировке могут быть судороги. Все перечисленные явления исчезают самостоятельно.
Сукцимер, как и унитиол, содержит две сульфгидрильные группы и тоже связывает тяжелые металлы, мышьяк и сердечные гликозиды. В отличие от унитиола, он способен связывать также свинец и кадмий, поэтому его и применяют при названных отравлениях.
Мекаптид — дитиоловое соединение, которое проникает в эритроциты, превращается там в дисульфидное соединение, окисляющее попавший и повреждающий их мышьяковистый водород (унитиол при этом отравлении противопоказан!), переводя его в малотоксичное вещество, выводимое с мочой. Вводят препарат внутримышечно.
Тетацин-кальций — комплексон, образующий плохо диссоциирующие растворимые в воде соединения со свинцом, железом, цинком, медью, марганцем, ванадием, хромом, а также с ураном, иттрием, цезием й пр.
398
Вводят его внутрь при попадании яда в желудок, внутривенно капельно; иногда применяют местно.
В основном его используют при лечении хронических отравлений свинцом. Для этих целей его вводят внутривенно.
При острых отравлениях перечисленными металлами его применяют редко, только после тщательного удаления яда из желудка: образовавшиеся комплексы легко всасываются из желудочно-кишечного тракта и не препятствуют развитию интоксикации.
Иногда его применяют местно при лечении ожогов кожи, возникающих от соприкосновения с хромом.
При длительном применении тетацин-кальция могут развиться дефицит железа и гипохромная анемия, поэтому в процессе лечения необходимо одновременно (но не в одном растворе) назначать препараты железа, цианокобаламин.
Пентацин — комплексон, предназначенный для удаления из организма радиоактивного свинца, иттрия, цезия, цинка, смеси продуктов деления урана. Выделение урана, плутония, радия, стронция не ускоряет.
Вводят препарат внутривенно медленно. Он может вызвать тошноту, рвоту, головокружение, головные боли, боли в конечностях и в груди (может возникнуть нарушение коронарного кровотока).
Динатриевая соль этилендиаминтетрауксус ной кислоты (трилон Б) образует комплексные соединения с кальцием и другими катионами, снижая их содержание в плазме крови и в тканях. Применяют его при острых отравлениях сердечными гликозидами. Следует подчеркнуть, что при этом снижается не только токсический, но и терапевтический эффект этих средств. Выпускают его в порошке. Перед употреблением приготовляют раствор на 5% растворе глюкозы, который вводят внутривенно капельно. Быстро вводить нельзя, так как из-за интенсивного связывания кальция могут развиться острая гипокальциемия и тетания. Иногда вливание препарата сопровождается чувством жжения во всем теле; оно сохраняется 1~2 ч после окончания вливания, затем проходит.
Дефероксамин применяют при отравлениях железом и алюминием, так как он связывает эти металлы; назначают его также при гемосидерозе, так как он извлекает железо из ферритина и гемосидерина (но не из геминовых соединений). Выпускают препарат в порошге, перед употреблением его разводят в воде для инъекций. При остром отравлении железом его назначают внутрь и парентерально (внутримышечно или внутривенно).
При быстром внутривенном введении может развиться коллапс. Прием препарата может сопровождаться аллергическими осложнениями типа крапивницы, сыпей. Длительное применение может привести к помутнению хрусталика.
Пеницилламин (см. гл. 40) образует комплексные соединения с медью и свинцом, и его применяют при хронических отравлениях этими металлами. Назначают препарат внутрь, давая запивать кислым раствором (с pH около 3).
Метиленовый синий в жидкостях организма частично превращается в лейкометиленовую синь, образуя с ней окислительно-восстановительную систему, переводящую примерно 10% гемоглобина в метгемоглобин. Если метгемоглобина в крови больше 10% (при отравлениях метгемоглобинообра-зователями), то названная окислительно-восстановительная система переведет часть метгемоглобина обратно в гемоглобин, сохранив в крови опять-таки 10% метгемоглобина.
399
Применяют метиленовый синий при отравлениях цианидами, сероводородом и метгемоглобинообразователями (нитритами, анилином, нафталином, сульфаниламидами, резорцином). Метгемоглобин, содержащий трехвалентное железо, связывает цианиды (или сероводород), извлекая их из тканей и освобождая этим тканевые дыхательные ферменты. В результате восстанавливается тканевое дыхание. Постепенно освобождающиеся из связи с метгемоглобином Цианиды обезвреживаются в печени, превращаясь в безопасные роданиды.
В экстренных случаях препарат вводят внутривенно, в менее опасных случаях (например, отравление лавровишней) внутрь, до исчезновения интоксикации.
Амилнитрит тоже образует метгемоглобин, поэтому его применяют при отравлениях цианидами и сероводородом, но только у детей старше 5 лет. Препарат (1—2 капли) наносят на ватку и дают вдыхать. Больной должен при этом лежать, так как препарат вызывает расширение сосудов, артериальное и венозное давление могут упасть. В положении стоя вдыхание амилнитрита может привести к ортостатическому коллапсу.
По отношению к некоторым ядам можно применить их фармакологический антидот. Например, при отравлении адреналином — фентоламин + анаприлин; атропином — физостигмин; морфином — налоксон; ФОС — атропин; |3-адре-нолитиками — глюкагон, дофамин^рибоксин и т. д.
При отравлении некоторыми веществами можно применять антидоты, ускоряющие биотрансформацию яда в нетоксические метаболиты. Так, натрия тиосульфат применяют при отравлениях цианидами. Он способствует их превращению в относительно безопасные роданиды, выводимые с мочой. Поскольку этот процесс происходит медленно, то для сохранения жизни человека сначала вводят метгемоглобинообразователи, извлекающие цианиды из тканей (см. выше). Вводят препарат внутривенно. Другой препарат спирт этиловый используют при отравлении метанолом. Этанол реагирует с алкогольдегидрогеназой и препятствует ее действию на метиловый спирт, предотвращая образование из него формальдегида, ответственного за развитие у отравившегося ацидоза и необратимой утраты зрения.
Для ускорения биотрансформации ядов в печени назначают преднизолон или другие глюкокортикоиды. При отравлениях ядами, не угнетающими центральную нервную систему (например, витамином D), можно ввести фенобарбитал или зиксорин. Улучшают обезвреживающую функцию печени также хол и на хлорид, пиридоксин, фолиевая кислота, цианокобаламин, кокарбоксилаза, калия оротат, кислота лйпоевая. Способствует метаболической функции печени и инсулин, но его нельзя рекомендовать при отравлениях центрально действующими ядами, так как он облегчает попадание нейротропных средств в мозг.
3. Поддержание основных функций организма. При отравлениях возникают нарушения в работе разных систем. Поэтому необходимо проводить соответствующую симптоматическую терапию. Например, при неглубоком угнетении дыхания назначают дыхательные аналептики (бемегрид, этимизол и др.); при нарушении функции сердечно-сосудистой системы вводят сердечные гликозиды (строфантин и др.), противоаритмические (лидокаин и др.) и сосудосуживающие средства (норадреналин, мезатон и др.); в случае возникновения судорог — противосудорожные средства (сибазон, ГОМК и др.), при гипертермии — жаропонижающие (анальгин, парацетамол и др.) или гипотермические (дроперидол) препараты и пр.
Лекарственные средства симптоматической терапии подробно описаны в соответствующих главах учебника.
400
Лекарственные формы и дозы некоторых противоядий для детей представлены в, табл. 69.
Таблица 69
Противоядия
Препарат Форма выпуска Путь введения и число приемов Однократная доза
Унитиол Unithioium 5% раствор в ампулах по 5 мл Внутримышечно; в первые сутки 3—4 раза, во вторые 2—3, а в последующие 1-2 инъекции 0,5—1,0 мл на 10 кг массы тела
Сукцимер Succimerum Таблетки по 0,5 г и флаконы, содержащие 0,3 г порошка, который растворяют перед употреблением в 6 мл 5% раствора натрия гидрокарбо-. ната Через рот 3 раза в день Внутримышечно: в 1-й день 4 инъекции; во 2-й день 3 инъекции; в последующие 5 дней 1-2 инъекции От 2 до 4 лет — 1/4 табл.; от 4 до 8 лет — 1/2 табл.; от 8 до 14 лет — 3/4 табл. До 1 года — 0,35 мл; 1-2 года — 0,7 мл; 2-4 года — 1,4 мл; 4-8 лет — 2,8 мл; 8-14 лет — 3,0-3,5 мл
Тетацин-кальций Tetacinum-calcium 10% раствор в ампулах по 20 мл Внутривенно, растворив необходимую дозу в 250—500 мл изотонического раствора натрия хлорида (0,85%) или глюкозы (5%), 4 раза в день 15-25 мг/кг
Динатриевая соль этилендиаминтетра-уксусной кислоты Dinatrii aethylendiamintet-raacetas Порошок, перед употреблением растворяют в 5% растворе глюкозы Внутривенно капельно в течение 3—4 ч 70 мг/кг
Дефероксамин Deferoxaminum Ампулы, содержащие 0,5 г сухого препарата, перед употреблением разводят в воде для инъекций 3 Через рот Внутримышечно, каждые 3—12 ч до ликвидации интоксикации Внутривенно капельно 5-10 г 1-2 г 15 мг/кг в час (не более 80 мг/кг в сутки)
Натрия тиосульфат Natrii thiosulfas Спирт этиловый Spiritus aetylicus 30% раствор в ампулах по 5, 10 и 50 мл 20—33% раствор в стерильном изотоническом растворе натрия хлорида или в воде для инъекций Внутривенно Внутривенно 10-50 мл Детям старшего возраста 0,5 мл/кг
АЛФАВИТНЫЙ УКАЗАТЕЛЬ
А Амикин 355 Аминостигмин 37
Адацин 157 Аденозин 70 Аденозина дифосфат 70, 223 Аденозин монофосфат 71 Аденозин трифосфат 71 Адиурекрин 256 Адонизид 157 Адреналин 52, 176 Адриамицин 247 Адроксон 225 Азатиоприн 326 Азафен 81 5-Аза цитидин 242 Азидотимидин 382 Азитромицин 353 Азлоциллин 346 Азтреонам 350 Аймалин 173 Акарбоза 260 ; ’ Акинетон 145 Актовегин 333 Актрапид 258 Албутерол 58 Аллилэстринол 265 Аллопуринол 303 Аллохол 209 Длоэ (сок, экстракт) 333 Алпразолам 79 Алпренолол 64, 174, 181, 191 Алпростадил 266 АлупенТ 60 Алфентанил 92 Альбуцид 364 Альдактон 205 Альмагель 211 Альтезин 115 Алюминия гидроокись 211 Амантадин 144 Амарил 260 Амброксол 148 Амдиноциллин 345 Амебикон 389 Амебал 389 Аметоптерин 242 Амидопирин 99, 309 Амизил 79 Амйказол 385 Амикацин 355 АмиКсин 384 Амилорид 205 Амилнитрит 400 Айииазин 30, 66, 78, 214 Аминалон 84 Аминарсон 389 Аминоакрихин 394 Аминоглютетимид 242 Аминохинол 390 Амиодарон 174 Аминофиллин 72 Амитриптилин 81 Амиодарон 174 Амоксициллин 213, 346 Ампиокс 344 Ампициллин 346 Амтизол 298 Амфетамин 83 Амфоглюкамин 387 Амфотерицин В 386 Анабазин 37, 38 Анальгин 99, 311,.400 Анаприлин 64, 174, 178, 191 Ангиотензинамид 200 Анестезин 100 Анкотил 387 Антабус 126 Антифомсилан 156 Антэлепсин 139 Апилак 207, 333 Апоморфин 60, 213, 397 Апрессин 193 Апрофен 40 Аргинина гидрохлорид 307 Ардуан 44 Армин 37, 40 Арпенал 40 Аскорутин 274 L-Аспарагиназа 248 Аспаркам 292 Астемизол 322 Астмопент 58 Атенолол 65, 174 Атракурий 44 Атровент 42 Атропин 41, 118, 176, 209 АТФ 71 Аугментин 347 Ауронофин 325 Ауротиоглюкоза 325 Ацедоксин 162 Ацеклидин 37 Ацетазоламид 204 Ацетеин 153 Ацетилдигитоксин 157 Ацетилцистеин 153 Ацидоциллин 341 Ацикловир 381 Аэрон 214 Б Бактериал 366 Бактрим 366 Баралгин 99 Барбамил 128 Барбитал 128 Бекламид 138 Беклометазон 261
402
Бемарсал 389 •
Бемегрид 87, 400
Бемитил 298
Бенемицин 360
Бензилпенициллина калиевая соль 344
Бензилпенициллина натриевая соль 344
Бензилпенициллина новокаиновая соль 344
Бензогексоний 42, 188
Бензонафтол 340
Бензофурокаин 100
Бенсеразид
Бенфотпамин 276
Беродуал 156
Беротек 58
Берофор 383
Бета-метилдигоксин 158
Бетаметазон 147
Бетанехол 38
Бетасерон 383
Бефениум 393
Бимелен 344
Биогастрон 250
Бисекурин 265
Бисептол 360
Бисольвон 153
Биостим 330
Биотин 282
Бифидумбактерин 331
Бификол 331
Блеомицин 248
Бораке 339
Бревикон 265
Бретилий 175
Бриканил 59
Бриллиантовый зеленый 340
Бринальдикс 195
Бромгексин 148, 153
Бромизовал 130
Бромкамфора 80
Бромокриптин 60, 143
Бронкатар 153
БронхЬ-ваксом 330
Бронхомунал 329
Бронхосан 156
Брунеомицин 242
Бруфен 313
Букарбан 260
Бупивакаин 100
Бупренорфин 92
Бура 339
Бутадион 312
Бутамид 260
Буторфанол 92
Буформин 260
В
Ваготил 340
Валацикловир 381
Валидол 178
Валокордин 178
Валокормид 80
Вальпроат кальция 138
'Вальпроат-натрия 138
Ванкин 393
Ванкомицин 351
Векуроний 44
Велоцеф 348
Велферон 383
Венорутон 276
Вентолин 58
Верапамил 175, 178, 193
Вермокс 392
Верошпирон 195, 205
Виадрил 115
Вибрамицин 358
Вигабатрин 140
Викасол 226
Вильпрафен 343
Винбластин 248
Винкапан 84
Винкристин 248
Винпоцетин 185
Виразол 382
Вирулекс 381
Вискен 181, 191
Висмута нитрат основной 339
Витамин А 268
- Bi 276
- В2 276
- В5 277
- Вб 278
- Bn 280
- В15 282
- Вс 278
- С 274
- D 270
- Е 238, 273, 302
- U 282
- Н 282
- Р 276
- РР 281
Виферон 383
Водорода перекись 341
Вольтарен 314
* Г
•Габапентин 140
Галазолин 55
Галантамин 39
Галаскорбин 234
Галоперидол 66, 78
Гаммаферон 383
Ганцикловир 381
Гастрозепин 41, 210
Гарамицин 355
Гебитан 337
Гексаметилентетрамин 339
Гексаметилмеламин 242
Гексамидин 137
Гексахлорафен 337
Гексенал 112, 128
Гемитон 55
Гемодез 198
Гемостимул ин 240
403
Гентамицин 355
Гепарин 229
Гибикленс 337
Гигроний 42, 188
Гидралазин 193
Гидрокодон 92
Гидрокортизон 261
Гидроксимочевина 242
Гидроксипрогестерона ацетат 265
Гидроксипрогестерона капронат 265
Гидроморфон 92
Гилуритмал 173
Гипертензин 200
Гипотиазид 195, 204
Гисманал 322
Гифотоцин 218
Глаувент 150
Глаукарбин 389
Глауцин 150
Глибенкламид 260
Глибутид 260
Гликлазид 260
Глимепирид 260
Глипизид 260
Глицин 85
Глудантан 63
Глюкагон 176
Глюкобай 260
Глкжосолан 198
Глюкофаг 260
Глютетимид 130
ГОМК 116, 133, 297, 400
Гонадотропин менопаузальный 255
Гонадотропин хорионический 255
Горчичники 332
Грамицидин 353
Грамурин 373
Гранисетрон 250
Граноцит 239, 251
Гризеофульвин 385
Гросептол 366
Гуадантан 144
Гуанфацин 58
Гуанобенз 58
Гумактид 254
Гутимин 298
Гутрон 199
д
Дактарин 388
Дактиномицин 247
Далтепарин 230
Даназол 255
Дановал 255
Дауномицин 242
Девинкан 186
Дегранол 242
Дезаминоокситоцин 218
Дезоксикортикостерона ацетат 212, 261
Дезопимон 208
Декаметоний 40
Декамин 387
Декарбазин 242
Декарис 328, 392
Дексаметазон 261, 321
Дексразоксан 251
Делагил 323
Демулен 265
Де-нол 212
Депакин 138
Депосистен 264
Депостат 265
L-Депренил 63, 144
Дерматол 339
Десмопрессин 256
Десферал 237
Дефероксамин 237, 399
Джозамицин 353
Диабенез 260
Диазепам 79, 118
Диазолин 322
Диакарб 204
Диамикрон 260
Диамокс 204
Дибазол 194, 328
Диботин 260
Дибунол 303
Дигидроэрготамин 185
Дигидроэрготоксин 185
Дигитоксин 157
Дигоксин 157
Дийодохин 389
Дийодтирозин 257
Дикаин 100
Диклофенак-натрий 314
Дикумарин 30
Дилоксанид 389
Дилтиазем 178, 193, 319
Димедрол 15, 118, 322
Димефосфон 303, 307
Динезин 145
Динопрост 219, 266
Динопростон 219, 266
Дионин 150
Дипиридамол 71, 178, 228
Дипироксим 41
Дипразин 118, 322
Диприван 116
Дипрофиллин 72
Дисалицид 309
Дисидипин 256
Дисульфирам 125
Дитэк 156
Дитиазанин 393
Дитилин 45
Диуретин 72
Дифезил 395
Дифенгидрамин 322
Дифенин 15, 30, 137, 172
Дифлунисал 309
Дифлюкан 388
Дихлотиазид 195, 204
Диэтилстильбэстрол 15, 30, 2(
Добутамин 60
ДОКСА 199, 212
404
Доксазозйн 190
Доксепин 81
Доксициклина гидрохлорид 358 •
Доксорубицин 242
Долобид 300
Долан 242
Допегит 187
Дофамин 61
Дроперидол 66, 78, 119, 400
Дустундан 387
Дуогастрон 250
Дураболин 264
Ж
Жектофер 236
Желатиноль 197
Железа закисного сульфат 236
— лактат 236
Железо восстановленное 236
3
Задитен 319
Закись азота НО
Зидовудин 382
Зиксорин 17
Зиннат 348
Зиртек 322
Зовиракс 381
Золпидем 131
Зопиклон 131
Зофран 250
Зуклопентиксол 78
И
Ибупрофен 311, 313
Ивадал 131
Идоксуридин 380
Изадрин 59
Изепамицин 355
Изобарин 189
Изоланид 157
Изо-мак 178
Изониазид 30 377
Изонитрозин 41
Изоптин 180, 193
Изофлуран 108
Имизин 81
Имипенем 350
Имифос 242
Иммуноферон 383
Имован 131
Имодиум 216
Индерал 181, 191
Индометацин 221, 313
Инозин 70
Инозие F 70
Инозитол 147
Инрек 383
Инсулин 258
Инсулин-ленте 259
Инсулин-семиленте 259
Инсулин-ультраленте 259
Инсулрап 258
Интал 320
Интал плюс 156
Интенкордин 182
Интенсаин 182
Интерферон 383
Интестопан 370, 389
Ионол 303
Ифосфамид 242
й
Йод (настойка) 338, 385
Йодинол 338
Йодонат 338
К
Каберголин 144
Кавинтон 84, 185
Каланхоэ сок 333
Калипсол 114
Калия бромид 80
— йодид 152
— оротат 286, 400
— перманганат 338
— перхлорат 257
— хлорид 291, 307
Кальцитрин 258
Кальцитриол 270
Кальция глюконат 225, 295
— карбонат 225, 295
— фолинат 251
— хлорид 225, 295
Камфоний 42, 188
Камфора 88
Канамицин 355, 378
Капли нашатырно-анисовые 155
Капотен 196
Каптоприл 194
Карбамазепин 15, 139
Карбахолин 38
Карбенициллин 346
Карбеноксолон 250
Карбоплатин 245
Карбопрост 266
Карбохромен 178
Карбоцистеин 153
Карбутамид 260
Карведилол 187
Кардивелол 192
Кардизем 180
Кардикс 178
Кардикс моно 178
Кардура 190
Кардиоксан 251
Карминомицин 247
Кармустин 242
Карнитин 216, 284, 302
Карнозин 303
Карфецйллин 346
405
Катапресан 55
Кватерон 42
Кверцетин 302
Кейтен 348
Келфизин 364
Керецид 381
Кеталар 114
Кетамин 114
Кетоконазол 388
Кетопрофен 314
Кеторолак 309
Кетотифен 319
Кетоцеф 348
Кефзол 348
Кефлин 348
Кислород 305
Кислота аскорбиновая 238, 274, 302, 307, 331
— адениловая 300
— 5-аминокапроновая 227
— ацетилсалициловая 228, 311
— бензойная 338
— борная 338
— гамма-оксимасляная 116 Л
— дегидрохолевая (хологон) 209
— клавулановая 347
— липоевая 285, 299, 400
— мефенамовая 314
— налидиксовая 370
— никотиновая 229, 281
— у-оксимасляная 297
— оксолиниевая 370
— оротовая 286
— пангамовая 282
— пантотеновая 277
— пипемидиновая 370
— пиромидиновая 370
— салициловая 338, 385
— соляная 208
— фолиевая 238, 278, 400
— фолиниевая 251
г- флуфенамовая 314
— хлористоводородная 307
— ундециленовая 385
— этакриновая 202
Китрил 250
Кларитин 322
Кларитромицин 353, 213
Кдафоран 348
Клацид 353
Клемастин 322
Кливарин 230
Клиндамицин 354
КлИнориЛ 309
Клион 375
Клобазам 139
Клозапин 77
Клоксациллин 344
Клоназепам 139
Клонидин 55, 187
Клопамид 195
Клопиксол 77
Клотримазол 386
Клофелин 55, 118, 187, 221
Коамид 238
Когентин 145
Кодеин 92, 150
Козаар 194
Кокаин 100
Кокарбоксилаза 276, 298, 400
Колдрекс бронхо 156
Колларгол 339
Колхамин 242
Комбантрин 392
Комбивент 156
Компламин 72
Конвулекс 138
Конвульсофин 138
Кондельфин 145
Контри кал 228
Кора крушины 215
Коразол 87
Корвалол 80, 178
Корватон 182
Коргликон 157
Корданум 181, 191
Кордарон 174
Кордафен 180, 192
Кордиамин 88, 199
Коринфар 180, 192
Корень алтея 152
т- солодки 152
— ревеня 215
— рвотный 152
Кортизон 261
Кортикотропин 254
Косинтропин 254
Котарнин 220
Ко-тримоксазол 366
Кофеин 72, 83, 90 149, 184, 199
Кофермент Q 301
Краснитин 242
Креон 208
Кризанол 325
Кромолин натрия 320
Ксанакс 79
Ксантинола никотинат 72, 184, 22$
Ксероформ 339
Ксикаин 100, 133
Ксилит 209
Курантил 71, 182, 228
Купренил 325
Л
Лабеталол 192
Лазикс 201 »
Лактобактерии 331
Ламизил 386
Ламиктал 139
Ламотриджин 139
Ласпал 311
Латамоксеф 348
Левамизол 328, 392
Леводопа 62, 142
Левомепромазин 78
Левомицетин 30, 357
406
Левоноргестрон 265
Леворин 386
Леворфанол 92
Легален 251
Лейкеран 242
Лейковорин 251
Лейкеназа 242
Лейкоген 239
Лейкомакс 239, 251
Ленограстим 239, 251
Лепонекс 77
Либексин 150
Лив-52 251
Лидокаин 100, 133, 150, 172, 400
Лизина ацетилсалицилат 31
Лизинвазопрессин 256
Лизиноприл 194
Лизурид 144
Ликвиритон 212
Ликреаза 208
Линкомииин 354
Липамид 286
Липрессин 256
Листья наперстянки 157
Листья сенны 215
Лития карбонат 81, 257
— оксибутират 81
Лобелии 38
Лобесил 38
Логипарин 230
Лозартан 195
Ломефлоксацин 378
Ломустин 242
Лонгацеф 348
Лоратадин 322
Лофенал 242
Люминал 134, 137
м
Магния окись 211
— сульфат 134, 194, 209/214, 293
Мадопар 143
Мажентил 77
Макропен 353
Максипим 348
Маммофизин 218
Мандол. 348
Манинил 260
Маннит 203
МАП 300
Мапротилин 81
Марборан 382
Марвелон 265
Масло вазелиновое 215
, — касторовое 215
Мебгидролин 322
Мебендазол 392
Мебикар 79
Мегэстрола ацетат 265
Меди сульфат 238, 289
Медротестрон 242
Мезапам 79
Мезатон 55, 199, 400
Мезлоциллин 346
Мекаптид 398
Мексаза 208, 371
Мексаформ 371, 389
Мелипрамин 81
Меллерил 77
Мелликтан 145
Мелоксакам 300
Мелфалан 242
Мемантин 85
Мепивакаин 100
Мепробамат 79
Мепротан 30, 79
Меридил 83
Мерказолил 257
Меркаптопурин 246, 326
Меронем 350
Меропенем 350
Месна 156, 251
Метадон 92
Метазид 377
Метаквалон 130
Метандростенолон 264
Метациклина гидрохлорид 358
Метацил 327
Метацин 42, 210
Метилдофа 58, 187
Метиленовый синий 340, 399
Метилметионинсульфония хлорид (витамин U) 2Г2 282
Метилпреднизолон 261
Метилтестостерон 264
Метилурацил 212, 239, 327
Метилэргометрин 219
Метиндол 313
Метисазон 380, 382
Метоклопрамид 66 214, 250
Метотрексат 30, 246
Метрогил 375
Метронидазол 375, 389, 213
М^формин 260
Мёфолин 208
Мециллинам 345
Миансерин 81
Мидазолам 118, 130
Мидантан 63, 144
Мидекамицин 353
Мидодрин 199
Миелобромол 242
Миелосан 242
Мизопростол 266
Микалит 81
Микобутин 377
Микогептин 387
Микозолон 387
Микосептин 387
Миконазол 388
Микронор 265
407
Микрофоллин 264 — хлорид 290
Милдронат 300, 302 — цитрат 229
Минижаб 260 Натуральный желудочный сок 208 Нафтамон 393
Минипресс 190 Нафтизин 55
Миноксидил 193 Невиграмон 373
Минона 193 Неграм 373
Миноциклин 358 Недокромил 321
Миноцин 358 Нейпоген 251 Неовир 384
Минтезол 393 Неодикумарин 231
Могадон 130 Неомицин 355
Модуретик 205 Неробол 264
Моклобемид 81 Нетилмицин 355
Моксалактам 348 Неулептил 78
Моксонидин 188 Неуронтин 140
Молграмостим 239, 251 Ниаламид 81
Молсидомин 178 Нигексин 72, 184
Моно-мак 178 Низорал 388
Моно-мак 50D 178 Никардипин 181
Мономицин 355 Никетамид 88
Монотард 259 Никоверин 281
Моноцид 348 А Никотин 38
Моночинкве 178 » Никлозамид 393
Морфин 92, 150 Никотинамид 281
Мукалтин 154 Мукомист 153 Мускарин 34 Никошпан 184, 281 Нистатин 386 Нитразепам 130 Нитроглицерин 178, 229
н Нитрозометилмочевина 242 Нитроксолин 370
Наком 143 Налбуфин 92 Налоксон 97, 208 Налорфин 97 Налтрексон 97 Нандролона деканаат 264 Нандролона фенилпропионат 264 Напроксен 311, 314 Напросин 309 Настойка аралии 200 — валерианы 80 — жень-шеня 200, 330 — заманихи 197, 200 — лимонника 200 Нитролонг 178 Никтронг 178 Нитрон А 383 Нитропентон 178 Нитросорбид 178 Нитротиазол 389 Нифедипин 178, 184, 192, 221 Ницерголин 185 Новобан 250 Новокаин 100 Новокаинамид 171 Новэмбихин 242 Нозепам 79 5-НОК 371 Нон-овлон 265 Ноотропил 297
— опия 91 — пиона 80
— полыни 207 — пустырника 80 — элеутерококка 33 Натамицин 386 Нопакин 145 Норадреналин 53, 199, 400 Нордетт 265 Нордитропин 254
Натрия бромид 80 — бензоат 155 Норплант 265 Норсульфазол 364
— гидрокарбонат 152, 211, 290, 305 — йодид 152 Норфлоксацин 370 Норэтинодрел 265
— нитропруссид 193, 229 — нуклеинат 330 Но-шпа 209 Нуредал 8 Г
— оксибутират 84, 130, 133, 297 — парааминосалицилат 379 О
— салицилат 311 — сульфат 214, 290, 397 Обрацин 355
— тиосульфат 400 Овидон 265
— тетраборат 339 Оксазепам 79
408
Оксазил 37 Оксафенамид 209 Оксациллин 344 Окселадин 151 Оксидевит 270 Оксилидин 79 Оксиморфон 92 Окситетрациклин 358 Окситоцин 218, 255 Оксолин 380 Окспренолол 64, 178, 191 Октадин 15, 66, 189 Олеандомицин 353 Олететрин 354 Оливомицин 242 Омепразол 211 Омнопон 91 Ондансетрон 250 Онковин 242 Опий 91 Оптин 191 Орелакс 348 Орнид 66, 175 Ортофен 314 Орципреналин 60 Осарсол 389 Оспен 344 Офлоксацин 370, 378 Пивамдиноциллин 346 Пикамилон 84, 184 Пикнолепсин 138 Пилокарпин 37 Пимафуцин 386 Пиндолол 64, 174, 191 Пиоглитазон 260 Пиперазина адипинат 392 Пиперациллин 346 Пипольфен 322 Пипрам 374 Пирабутол 313 Пиразидол 81, 303 Пиразинамид 388 Пирамем 297 Пирантел 392 Пирацетам 84, 184, 297 Пирвиниум 393 Пирвиния эмбонат 393 Пирензепин 210 Пиридитол 84 Пиридоксин 238, 278, 331, 400 Пиридоксальфосфат 299 Пирилен 40 Пиритрамид 92 Пирогенал 329 Пироксикам 314 Пиромекаин 100 Пирофос 40
п Пирроксан 64, 190 Питуитрин 218, 256
Палин 374 Пальдом 41 Панангин 292 Панзинорм 208 Панкреатин 208 Панкуроний 40 Пантогам 84, 297 Пантоцид 337 Панцитрат 208 Папаверин 92, 209, 229 Паратиреоидин 258 Парацетамол 99, 311, 400 Паркопан 145 Парлодел 60, 143 Партусистен 60 ПАСК 378 Пахикарпин 40 Пеницилламин 303, 325, 399 Пентамин 42, 188, 200 Пентазоцин 92 Пентацин 398 Пентоксид 239, 327 Пентоксифиллин 72, 184, 229, 300 Пепсин 208 Перголид 144 Периндоприл 194 Перитол 207, 251 Перициазин 78 Перкортен 261 Персантин 71, 228 Пертуссин 155 Пефлоксацин 370 Плазмин 231 Платифиллин 41 Плоды аниса 152 Подофиллин 242 Полиглюкин 197 Полидез 198 Полимиксин В 352 Полимиксин Е 352 Полимиксин М 352 Полудан 384 Поляризующая смесь 291 Црстинор 265 Потесептил 366 Празиквантель 392 Празозин 63, 190 Прегнин 265 Предион 115 Преднизолон 261, 321, 326, 400 Предуктал 301 Премарин 264 Прилокаин 100 Примаксин 350 Примидон 137 Провера 265 Прогестерон 265 Продигиозан 329 Прозерин 39 Прокарбазин 249 Проксипин 300 Промедол 92 Пропанидид 113 Прополис 333
Пропоксифен 92
Пропофол 116
Пропранолол 191
Проспидин 249
Простациклин 266
Простин Е 219, 266
Простин F 266
Протамина сульфат 230
Протаргол 339
Протафан 259
Протионамид 378
Птерофен 205
Пурген 215
Пуфемид 138
Р
Радедорм 130
Ранитидин 210
Раствор перекиси водорода 338
— Рингер-Локка 290
— формальдегида 339
Раувазан 189 #'
Раунатин 189
Рауседил 188
Реаферон 383
Реглан 214, 250 '
Регидрон 198
Резерпин 30, 66, 188
Резорцин 304, 340
Рекормон 238
Реланиум 79
Ремантадин 380
Ремистип 256
Реопирин 313 '
Реополиглюкин 197
Ретаболил 264 1
Ретинол 331
Рибавирин 381
Рибоксин 77
Рибомунил 330
Рибонуклеаза 154
Рибофлавин 238, 276, 299, 331
Рибофлавина мононуклеотид 276, 299
Риванол 340
Ригевидон 265
Ристомицин 352
Ристоцетин 352
Риталин 83
Ритодрин 220
Рифабутин 377
Рифамицин SV 360
Рифампицин 360, 377
Рифоцин 360 ’
Ровамицин 353
Розевин 242
Рокситромицин 353
Рондомицин 358 .
Роферон 383
Ртутные мази 339
Рубомицин 242
Рулид 353
Рутодель 79
Рутин 276
С
Сабрил 140
Салазопиридазин 364
Салазосульфадиметоксин 364
Салазосульфапиридазин 364
Салазосульфапиридин 364
Салбутамол 60, 318
Салицилат натрия 309. 311
Салицилсалицилат 609
Салол 340
Салюзид 377
Сандопарт 218
Сарколизин 242
Саход 311
Седуксен 79, 118
Семя тыквы 394
Серебра нитрат 339
Сермион 185
Серотонин 225
Серотонина адипинат 225
Сибазон 30, 79, 118, 130, 133, 400
Сигетин 264
Сигмамицин 354
Сиднокарб 83
Сиднофарм 83
Сиднофен 83
Сизомицин 355
Силибор 302
Силимарин 251
Синактен 254
Синактен-депо 254
Синтоцинон 218
Синэстрол 264
Сироп алоэ с железом 241
— из плодов шиповника 274
— рвотного корня 213, 397
Скипидарная мазь 333
Скополамин 41
Сок подорожника 207
Солганал 325
Солкосерил 333
Соматотропин 254
Соматрем 254
Сомбревин ИЗ
Сонапакс 77
Сорбит 209
Спирамицин 353
Спиронолактон 195, 205
Спирт нашатырный 91
— этиловый 120, 339, 400
Стрептозотоцин 242
Стрептокиназа 232
Стрептолиаза 232
Стрептомицин 355, 378
Стрептоцид 363
Стрихнин 89
Строфантин 157, 400
Сгутерон 184
Сукралфат 212, 250
Суксилеп 138
410
Сукцимер 398
Сулациллин 347
Сулиндак 313
Сульбактам 347
Сульгин 364
Сульпирид 78
Сультамициллин 347
Сульфадимезин 363
Сульфадиметоксин 363
Сульфазин 364
Сульфален 363
Сульфаметоксазол 363
Сульфамонометоксин 364
Сульфапиридазин 364
Сульфатон 366
Сульфацил 364
Сульфацил-натрий 363
Сульфокамфокаин 88
Сумамед 343
Супрастин 322
Сурфактант 146
Сустак 178
Суфентанил 92
т
Табекс 38
Тавегил 322
Тазепам 79
Тактивин 330
Талинолол 65, 174, 191
Тамоксифен 249
Таривид 374
Таурин 304
Тауфон 304
Тахималин 173
Тегретол 139
Тейкопланин 351
Телден 322
Тельмид 393
Темисал 72
Теноксикам 309
Теобромин 72
Теоникол 72, 184
Теофиллин 72, 229, 318
Тербинафин 386
Тербуталин 220
Терлипрессин 256
Терпингидрат 152
Тарфенадин 329
Тестостерона пропионат 264
Тетацин-кальций 237, 398
Тетракозактид 254
Тетраолеан 354
Тетрациклин 30, 358
Тетурам 125
Тиабендазол 393
Тиагабин 140
Тиамин 276, 299, 331
Тибон 378
Тиенам 350
Тизерцин 77
Тикарциллин 346
Тилидин 92
Тймалин 330
Тиментин 347
Тимогеи 330 . .
Тинидазол 375, 389
Тиопентал 112, 128
Тиоридазин 78
Тиофосфамид 242
Тиреоидин 257
Тироксин 147
Тиротропин 255
Тобрамицин 355
Токоферол 273, 302, 331
Толбутамид 260
Толкапон 144
Тонзилгон 331
Трава багульника 152
Трава душицы 152
Трава термопсиса 152
Тразикор 181, 191
Трамадол 92
Трентал 72, 229, 300
Трецеф 348
Триазолам 130, 318
Триампур 205
Триамтерен 195, 205
Триамцинолон 261, 321
Трийодтиронин 147, 257
Тримекаин 100
Триметазидин 301
Триметилацетат 261
Триметоприм 15, 366
Тринитролонг 178
Триоксазин 79
Трипсин 154
Триптизол 81
Трисамин 305
Трисаминол 305
Трисбуфер 305
Трифлуперидол 78
Трифтазин 78
Трихопол 375
Тд^глитазон 260
Троксевазин 276
Тромбин 225
Тропафен 200
Тропацин 145
Трописетрон 250
Тубазид 377
Тубокурарин 44
Туринал 265
Тусупрекс 150
У
Убихинон 301
Углекислый газ 89
Уголь активированный 216, 397
Ультра-тард 259
Ультрацеф 348
Ульцермин 212
Уназин 347
Ундецин 387
411
Унитиол 303, 398
Урегит 202
Урометитексан 251
Уросульфан 364
Уротропин 339
Ф
Фалиминт 150
Фамацикловир 381
Фамотидин 210
Фелбамат 140
Фелдек 309
Фелбатол 140
Фемулен 265
Феназепам 79, 130, 133
Фенамин 15, 62, 83
Фенасал 393
Фенибут 84, 130, 297
Фенилбутазон 312
Фенилин 231
Фенилсалицилат 340
Фенитоин 137
Фенкарол 322
Фенобарбитал 15, 30, 128, 134, 137
Феноболин 264
Феноксиметилпенициллин 344
Фенолфталеин 215
Фенотерол 60, 318
Фентанил 92, 119
Фентоламин 63
Фенфлюрамин 208
Фенформин 260
Фепранон 208
Фербитол 236
Феррокаль 240
Ферроплекс 240
Феррум лек 236
Фестал 208
Фетанол 55
Фибриноген 225
Фибринолизин 231
Физижин 375
Физостигмин 39
Филграстим 239, 251
Финоптин 180
Финлепсин 139
Фитоменадион 226
Флавинат 277, 299
Флагил 375
Флакумин 302
Фламин 302
Флолан 266
Флуимуцйн 153
Флуклоксациллин 344
Флуконазол 388
Флуметазон 261
Флуоксетин 81
• Флуразепам 130
Флуцитозин 387
Фосфаден 71
Фолликулин 264
Формалин 339
Фортум 348
412
Фоскарнет 382
Фосфемид 242
Фосфэстрол 249
Фосфобион 71
Фосфомицин 351
Фосфономишгн 351
Фосфоноформат 382
Фотрин 242
Фраксипарин 230
Френолон 78
Фрон 383
Фруктоза-дифосфат 300
Фруктоза-монофосфат 300
Фтазин 364
Фталазол 364
Фтивазид 377
Фторафур 246
Фторбензотэф 242
Фторотан 30, 107
Фторурацил 242
Фузиднн 355
Фурагин 369
Фурадонин 368
Фуразолидон 370, 390, 213
Фуразолин 368
Фурантрил 201
Фурацилин 368
Фуросемид 210, 397
X
Хингамин 323, 389 Хинидин 170 Хиниофон 370, 389 Хлодитан 249 Хлозепид 79, 133 Хлоксил 395
Хлоракон 138 Хлоралгидрат 130, 135 Хлорамин Б 337 Хлорамфеникол 357 Хлорбетамид 389 Хлорбутин 242, 326 Хлоргексидин 337 Хлорная известь 337 Хлорохин 323 Хлорпирамин 322 Хлорпропамид 260 Хлорпротиксен 78 Хлортетрациклин 358 Хлортрианизен 249 Хлорфеноксамид 389 Хлорхинальдол 370 Холестирамин 216 Холин салицилат 311 Холина хлорид 400 Хологон 209 Холосас 209 Хоморап-пенфил 258 Хомофан-пенфил 259 Хонсурид 333 Хориогонин 255 Хромогликат натрия 320 Хумалог 258
Хумулин 259
Хумулин-регулятор 258
Хумулин-ультралонг 259
ц
Цедекс 348.
Целанид 157
Центедрин 83
Цепорин 348
Церебролизин 84
Церукал 214, 250
Цетиризин 322
Цефадроксил 348
Цефазолин 348
Цефалексин 349
Цефалоридин 349
Цефалотин 348
Цефамандол 348
Цефепим 348
Цефлодоксим 348
Цефоксим 348
Цефоницид 348
Цефоранид 348
Цефотаксим 349
Цефпиром 348
Цефрадин 348
Цефспан 348
Цефтазидим 348
Цефтизоксим 348
Цефтриаксон 348
Цефуроксим 348
Циамид 126
Цианокобаламин 238, 280, 400
Циглитазон 260
Циклобарбитал 128
Циклодол 142, 145
Циклопропан 110
Циклосерин 378
Циклоспорин А 326
Циклоферон 331
Циклофосфан 242, 326
Циластатин 350
Циметидин 210
Цинка окись 289, 339
— сульфат 288, 339
Цинкундан 387
Циннаризин 184
Ципробай 374
Ципрогептадин 207, 251
Ципротерон 242
Ципрофлоксацин 370, 378
Цисплатин 245
Цитарабин 246
Цитембена 242
Цитизин 38
Цитозар 246
Цитотек 266
э
Эгиферон 383
Эглонил 77
Экслютон 265
Экстракт мужского папоротника 394
— опия 91
— пассифлоры 80
— родиолы розовой 200, 330
— элеутерококка 200
Элениум 79
Эликсир грудной 155
Эмбихин 242
Эметин 389
Эметина гидрохлорид 389
Эналаприл 194
Энглитазон 260
Энзинорм 208
Энзапрост 219, 266
Эноксацин 370
Энтакапон 144
Энтеродез 198
Энтеросептол 370, 389
Энфлуран 108
Энцефабол 84
Эпонтол 113
Эпопростенол 266
Эпоцелин 348
Эпоэтин-альфа 251
Эпрекс 238
Эргокальциферол 270
Эргометрин 219
Эрготал 219
Эрготамин 219
Эринит 178
Эритромицин 353
Эспераль 126
Эссенциале 302
Эстоцин 92, 150
Эстрадиола пропионат 264
Эстрон 264
Этазол 363
Этакридина лактат 340
Этамбутол 377
Этаминал 128
Этанол 120, 156
Этацизин 174
Этйдокаин 100
Этилморфин 92, 151
Этимизол 76, 86, 147, 400
Этинилэстрадиол 264
Этистерон 265
Этиферон 383
Этмозин 174
Этомерзол 299
Этопозид 242
Этосуксимид 138
Этмозин 168
Эуноктин 130
Эуфиллин 72, 147, 184, 3.18
Эфедрин 62
Эфир диэтиловый 106
Эхинабене 333
Я
Ятрен 371
ОГЛАВЛЕНИЕ
Предисловие к первому изданию...........,.................................. 3
Предисловие ко второму изданию............................................ 3
Введение.................................................................. 4
ЧАСТЬ I. ОБЩАЯ ФАРМАКОЛОГИЯ. И. В. Маркова................................. 7
ЧАСТЬ II. ЧАСТНАЯ ФАРМАКОЛОГИЯ............................................ 32
Раздел L Нейротропные средства ..... 32
Глава" I. Лекарственные средства, влияющие на передачу возбуждения в холинергических синапсах. fH, В. Маркова....................,.... 33
Глава 2. Лекарственные средства. Влияющие на передачу возбуждения в адренергических синапсах. И. В. Маркова................................ 48
Глава 3. Лекарственные средства, влияющие на активность пуринергических систем. И. В. Маркова ............................................... 68
Глава 4. Психотропные средства. Л. А. Воронкова, М. В. Неженцев........ 77
Глава 5. Аналептики. М. А. Иванова..................................... 86
Глава 6. Анальгетики. И. Б. Михайлов................................. 91
Глава 7. Местноансетсзирующие средства. Я. Б. Михайлов................. 99
Глава 8. Средства общей анестезии. О. Л. Виноградов, И. В. Маркова.... 104
Глава 9. Спирт этиловый. О. Л. Виноградов, М. В. Неженцев............. 120
Глава 10. Снотворные средства. О. Л. Виноградов, А. М. Ротледер....... 127
Глава II. Противосудорожные средства. И. Б. Михайлов.................. 132
. Глава 12. Противоэпилептические средства. И. Б. Михайлов............. 136
Глава 13. Противопаркинсоничсские средства. И. Б. Михайлов.......... 141
Раздел Н. Лекарственные средства, влияющие на функцию исполнительных органов . . 146
Глава 14. Лекарственные средства, применяемые для профилактики и лечения
нарушений дыхания у новорожденных и грудных детей. И. В. Маркова . . 146
Глава 15. Противокашлсвысюрсдства. Н. В. Ускова, А. М. Ротледер....... 150
Глава 16. Отхаркивающие средства. И. В. Маркова....................... 152
Глава 17. Бронхолитические средства. И. В. Маркова.................... 156
Глава 18. Лекарственные средства, применяемые при отеке легких. И. В. Маркова 156
Глава 19. Сердечные гликозиды. И. Б. Михайлов......................... 157
Глава 20. Противоаритмическис средства. И. Б. Михайлов................ 168
Глава 21. Коронарные средства. Л. А. Воронкова, М. В. Неженцев........ 178
Глава 22. Средства, улучшающие мозговой кровоток. Л. А. Воронкова..... 184
Глава 23. Антигипертензивные средства. Л. А. Воронкова ............... 186
Глава 24. Антигипотепзивные средства. Л. А. Воронкова................. 196
Глава 25. Мочегонные средства. И. Б. Михайлов..........................201
Глава 26. Лекарственные средства, влияющие на функции органов пищеварения. И. Б. Михайлов.........................................................206
Глава 27. Лекарственные средства, влияющие на сократительную деятельность матки. А. Р. Данилов.................................................. 217
Раздел III. Лекарственные средства, влияющие на систему крови.............223
Глава 28. Лекарственные средства,1 влияющие на свертывание крови. И. В. Маркова, И. Б. Михайлов..........................................223
Глава 29. Средства, стимулирующие кроветворение. И. В. Маркова.........233
414
Раздел IV. Лекарственные средства, применяемые при злокачественных новообразованиях ....................................................................... 242
Глава 30. Противолейкозные и противоопухолевые препараты. И. В. Маркова, А. Р. Данилов .......................................................... 242
Раздел V. Лекарственные средства, преимущественно влияющие на обмен веществ .... 253
Глава 31. Гормональные препараты. Л. А. Воронкова, И. В. Маркова.............. 253
Глава 32. Витаминные препараты. О. Н. Григорьева, И. В. Маркова ...............267
Глава 33. Невитаминные кофакторы. И. В. Маркова .....................(.........284
Глава 34. Препараты пинка и меди. И. В. Маркова .............................. 287
Глава 35. Препараты натрия, калия, магния и каления. И. В. Маркова ........... 289
Глава 36. Антигипоксанты. И. В. Маркова ...................................... 296
Глава 37. Антиоксиданты. И. В. Маркова........................................ 301
Глава 38. Средства, используемые для нормализации кислотно-основного состояния. Г. А. Пташник ........................................................... 304
Раздел VI. Противовоспалительные и противоаллергические средства................. 309
Глава 39. Противовоспалительные средства. Л. А. Воронкова ....................... 309
Глава 40. Лекарственные средства, применяемые при патологии иммунных процессов. А. Р. Данилов, И. В. Маркова .......................................... 316
Раздел VII. Противомикробные и противопаразитарные средства ..................... 337
Глава 41. Дезинфицирующие и антисептические средства. М. А. Иванова .......... 337
Глава 42. Антибиотики. А. Л. Титов, И. Б. Михайлов, М. В. Неженцев............ 341
Глава 43. Сульфаниламидные препараты. А. Л. Титов ............................ 363
Глава 44. Другие синтетические противомикробные средства. А, Л. Титов......... 367
Глава 45. Противотуберкулезные средства. Л. А. Воронкова...................... 376
Глава 46. Противовирусные средства. И. Б. Михайлов ........................... 379
Глава 47. Противогрибковые средства. М. А. Иванова, А. М. Ротледер............ 385
Глава 48. Противопротозойные средства. С. И. Александров ..................... 389
Глава 49. Противоглистные средства. С. И. Александров ........................ 391
Раздел VIII. Противоядия ........................................................ 396
Глава 50. Лекарственные средства, применяемые при лечении острых отравлений у детей. И. Б. Михайлов....................................................... 396
л/
Алфавитный указатель ............................................................ 402