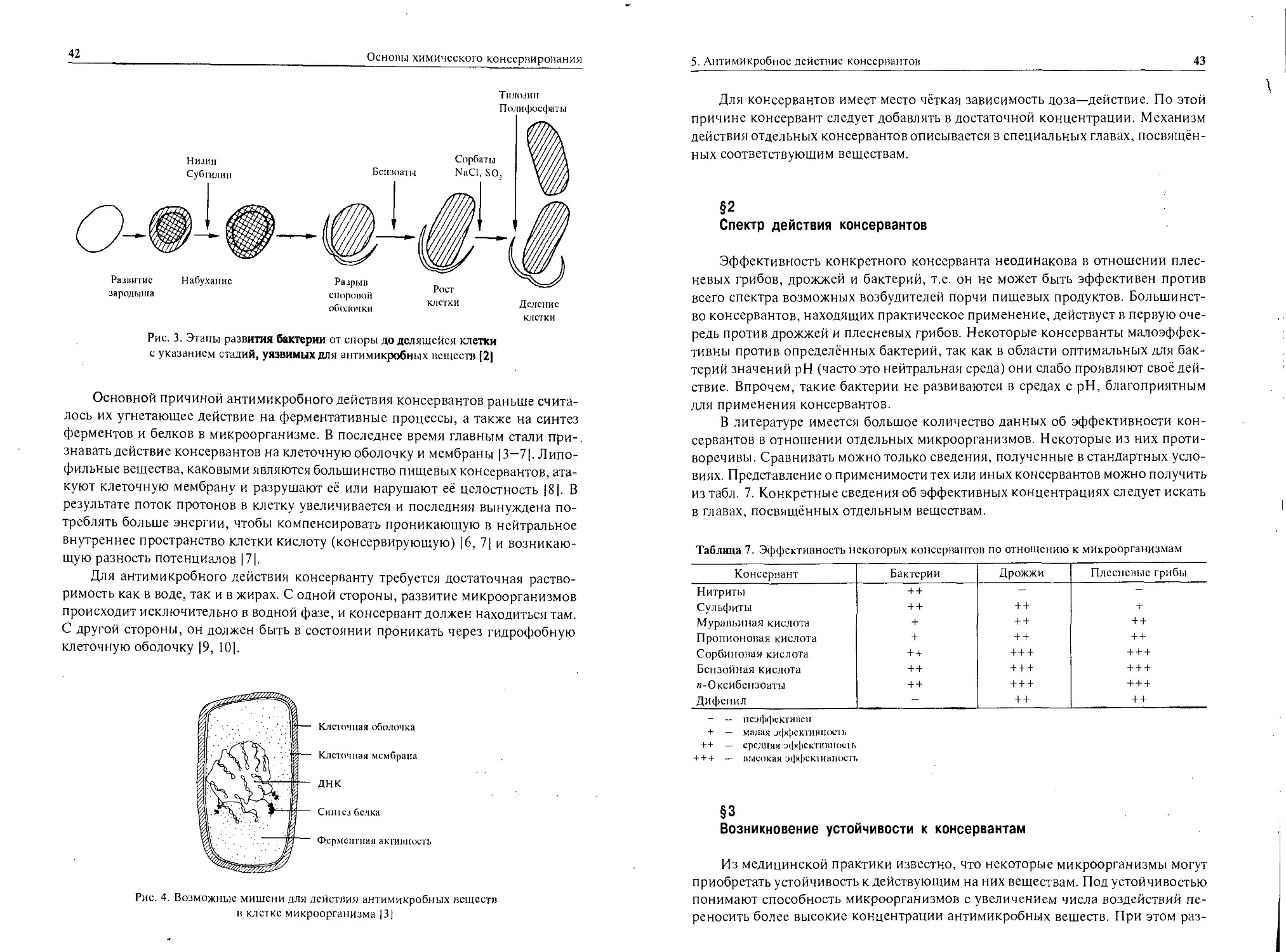
Теги: пищевая промышленность в целом производство и консервирование пищевых продуктов государство и право юридические науки пищевая промышленность пищевые добавки
ISBN: 5-901065-03-4
Год: 1998
Текст
Erich Luck • Martin Jager
Chemische
Lebensmittelkonservierung
Stoffe - Wirkungen - Methoden
Dritte vollig iiberarbeitete und aktualisierte Auflage
Эрих Люк '- Мартин Ягер
Консерванты в
пищевой промышленности
Свойства и применение
Перевод с немецкого канд. хим. наук Сарафановой Л. А,
Научный редактор канд. хим. наук Пульцин М. Н.
Санкт-Петербург ГИОРД 1998
SSL.
УДК 664.8
ББК 675.22
Л 94
Люк Э., Ягер М.
Л 94 Консерванты в пищевой промышленности. — 3-е изд. Пер. с нем. —
СПб: ГИОРД, 1998. - 256 с.
ISBN 5-901065-03-4 (в пер.)
Издание состоит из двух частей. В первой дамы общие сведения о консервантах,
вторая посвящена свойствам и применению отдельных консервантов.
Книга предназначена для технологов, микробиологов и других специалистов пище-
вых производств. Она может быть полезна студентам и всем интересующимся пищевыми
добавками.
УД К 664.8
ББК 675.22
ISBN 5-901065-03-4
© Springer-Verlag Berlin Heidelberg, 1995
© ГИОРД, 1998
Предисловие
Концепция государственной политики в области здорового питания насе-
ления России, совместно разработанная и представленная на рассмотрение пра-
вительства Российской Федерации Министерством Науки России, Минздравом
России, Минсельхозпродом России, Российской академией медицинских наук и
Российской академией сельскохозяйственных наук, в качестве основных приори-
тетов предусматривает значительное расширение отечественного производства
пищевых продуктов и обеспечение их безопасности.
В этой связи первостепенное значение приобретает проблема максимально-
го сохранения уже произведённых продовольственного сырья и пищевых продук-
тов на всех этапах их производства, хранения, транспортировки и реализации,
включая домашние условия. По некоторым оценкам, 25% произведённого в мире
продовольствия подвержено повреждающему действию только микроскопичес-
ких (плесневых) грибов. А другие микроорганизмы, например, повсеместно рас-
пространённые стрептококки и стафилококки, быстро размножающиеся и при-
водящие к порче многие виды продуктов, прежде всего животного происхожде-
ния! Итак, задача № 1 — сохранение пищевого продукта, предотвращение его
порчи, и в итоге — предотвращение или снижение экономических потерь.
Употребление в пищу продуктов, атакованных микроорганизмами, опасно
для здоровья, а в ряде случаев и жизни человека. Во-первых, многие микроорга-
низмы в процессе своего развития продуцируют токсины, которые накапливают-
ся в продуктах и, поступая в организм человека, могут вызывать отравления, иногда
с летальным исходом. Во-вторых, сами живые микроорганизмы, поступая с пи-
щей в достаточно больших количествах, могут инициировать инфекционный про-
цесс. Пищевые токсикоинфекции и микотоксикозы представляют собой очень
серьёзную проблему, постоянно находящуюся в центре внимания как органов
здравоохранения всех стран, так и многих международных организаций. Итак,
задача № 2 — обеспечение безопасности пищевых продуктов путём недопущения
или предотвращения развития на них микроорганизмов.
Обе задачи могут быть достаточно надёжно и эффективно решены с помощью
рационального и грамотного применения пищевых добавок — консервантов.
Термином пищевые добавки называют природные, идентичные природным
или синтетические химические соединения, которые не являются собственно пи-
щевыми веществами (они не несут пластических функций и не являются источ-
ником энергии), а специально добавляются в пищевой продукт по ходу техноло-
гического процесса для достижения определённого эффекта, в данном случае —
консервирующего.
6
При выборе пищевых добавок вообще и консервантов в частности, основ-
ным критерием наряду с эффективностью является их безопасность. Безопасность
не только для конкретного человека, употребляющего пищу, содержащую данные
пищевые добавки (консерванты), но и для последующих поколений. Следует иметь
в виду, что включению в список разрешённых той или иной пищевой добавки
(консерванта), предшествует долгий и трудный путь токсикологической оценки,
исключающий возможность наличия у неё мутагенного, канцерогенного, терато-
генного, гонадотоксического или любого другого неблагоприятного действия. Этот
путь завершается подробнейшим обсуждением всех результатов специальным
высококомпетентным международным органом — Объединённым комитетом эк-
спертов ФАО/ВОЗ по пищевым добавкам (JECFA), который даёт путевку в жизнь,
в пищевую промышленность любой пищевой добавке, в том числе и консерванту,
и определяет параметры их качества и допустимую суточную дозу. Важно также,
что JECFA постоянно и строго следит за своим детищем, регулярно пересматри-
вая всю накопленную мировую информацию о нём и принимая соответствующие
решения (расширение сферы использования, запрещение применения, увеличе-
ние или уменьшение принятой допустимой суточной дозы). Это очень компетен-
тные и ответственные решения. Поэтому не стоит бояться консервантов. Без них
современная пищевая промышленность эффективно работать не может, да и нам —
современному обществу — без них никак не обойтись. На одной чаше весов —
опасности, связанные с недоеданием, дефицитом пищи, пищевыми инфекциями
и интоксикациями, на другой — мифические «опасности» самих консервантов.
Рациональное применение только одобренных и разрешённых современной ме-
дициной пищевых добавок — консервантов — это магистральный путь развития
пищевой индустрии. Конечно, это ни в коем случае не исключает поиск и широ-
кое применение альтернативных приёмов сохранения пищевых продуктов.
XXI век, на пороге которого стоит человечество, требует новых подходов от
пищевой промышленности — конструирования пищевых продуктов заданного
качества модифицированного химического состава, удовлетворяющих физиоло-
гические потребности человека в полном объёме, повышающих пищевую плот-
ность его рациона в целом. Без пищевых добавок, без консервантов эту проблему
решить невозможно!
Настоящая монография Эрика Люка и Мартина Ягера «Консерванты в пи-
щевой промышленности» в сжатой, но достаточно информативной форме на
современном уровне обобщает эту проблему, систематизирует и характеризует
основные и второстепенные консерванты. Книга, безусловно, полезна для спе-
циалистов различных отраслей пищевой промышленности.
В.А.ТУТЕЛЬЯН
Академик Российской академии
медицинских наук, профессор,
заместитель директора НИИ питания РАМН.
7
Оглавление
Основы химического консервирования.............................9
Глава 1. Консервирование пищевых продуктов:
история вопроса, цели и задачи................................11
Глава 2. Определение консервантов в продуктах питания..........17
Глава 3. Токсиколого-гигиенические аспекты ................... 19
Глава 4. Пищевое законодательство..............................37
Глава 5. Антимикробное действие консервантов...................40
Консервирующие вещества........................................57
Глава 6. Поваренная соль.......................................60
Глава 7. Диоксид углерода......................................67
Глава 8. Азот .................................................74
Глава 9. Нитраты...............................................76
Глава 10. Нитриты..............................................80
Глава 11. Озон.................................................86
Глава 12. Диоксид серы.........................................89
Глава 13. Хлор.................................................99
Глава 14. Этанол............................................. 103
Глава 15. Сахароза........................................... 107
Глава 16. Муравьиная кислота..................................112
Глава 17. Уксусная кислота..................................... 116
Глава 18. Пропионовая кислота................................ 122
Глава 19. Сорбиновая кислота................................. 127
Глава 20. Эфиры пироугольной кислоты..........................137
Глава 21. Бензойная кислота...................................141
Глава 22. Эфиры лара-оксибензойной кислоты................... 147
Глава 23. о/адю-Фенилфнол.................................... 153
Глава 24. Дифенил............................................ 156
Глава 25. Дым (коптильный)....................................159
Глава 26. Тиабендазол........................................ 163
Глава 27. Низин.............................................. 166
Глава 28. Натамицин.......................................... 170
Глава 29. Лизоцим............................................ 174
Глава 30. Серебро............................................ 177
Глава 31. Борная кислота .................................... 179
Глава 32. Азид натрия........................................ 181
Глава 33. Фосфаты ........................................... 182
Глава 34. Перекись водорода.................................. 183
8
Глава 35. Фториды ..........................................185
Глава 36. Броматы.......................................... 186
Глава 37. Окись этилена.....................................187
Глава 38. Пропиленгликоль...................................190
Глава 39. Гексаметилентетрамин..............................191
Глава 40. Хлоруксусная кислота............................. 194
Глава 41. Бромуксусная кислота............................. 195
Глава 42. Молочная кислота..................................196
Глава 43. Эфиры глицерина и жирных кислот со средней длиной цепи .. 198
Глава 44. Этилендиаминтетрауксусная кислота................ 199
Глава 45. Аллилгорчичное масло..............................200
Глава 46. Тиомочевина.......................................201
Глава 47. Дегидрацетовая кислота............................202
Глава 48. Салициловая кислота...............................204
Глава 49. /wpa-Хлорбензойная кислота........................206
Глава 50. Фурилфурамид......................................207
Глава 51. Антибиотики.......................................209
Глава 52. Пряности и содержащиеся в них вещества............210
Глава 53. Ферменты..........................................211
Глава 54. Бактериоцины......................................212
Глава 55. Защитные культуры микроорганизмов.................213
Глава 56. Упаковки и покрытия ..............................214
Примечания......................................... 217
Литература..........................................222
Предметный указатель................................251
Основы
химического
консервирования
Глава 1
Консервирование пищевых продуктов:
история вопроса, цели и задачи
Пищевые продукты, как правило, быстро портятся. Поэтому приходится ис-
пользовать их немедленно или, если это невозможно, принимать меры для их
сохранения, т.е. консервировать.
§1
Защита пищевых продуктов: определения
В пищевом продукте могут происходить физические, химические, биохими-
ческие и микробиологические процессы, отрицательно влияющие на его качест-
во. В данной книге рассматриваются только микробиологическая порча пище-
вых продуктов и вещества, которые такую порчу замедляют или предотвращают.
Микробиологическая порча пищевых продуктов происходит при наличии
определённых условий, необходимых для протекания биологических процессов:
1. Наличие возбудителей порчи. Микробиологическая порча пищевого про-
дукта невозможна, если на его поверхности или внутри него отсутствуют микро-
организмы.
2. Наличие доступных для микроорганизмов питательных веществ. Если та-
ковые отсутствуют, то микроорганизмы не могут развиваться.
3. Наличие благоприятных для жизнедеятельности микроорганизмов тем-
пературы, активности воды, концентрации кислорода, окислительно-восстано-
вительного потенциала, концентрации ионов водорода (pH). Если эти условия
неблагоприятны, микроорганизмы или не будут развиваться вовсе, или их раз-
витие будет замедленным.
4. Достаточно длительное время хранения пищевого продукта. Если пище-
вой продукт будет использован до того, как начнётся нежелательный рост мик-
роорганизмов, мероприятия против микробиологической порчи излишни.
О микробиологической порче можно говорить лишь тогда, когда в результа-
те деятельности микроорганизмов качество пищевого продукта ухудшается.
Под порчей пищевого продукта понимают лишь нежелательное изменение
его качества. Отсюда следует, что не всякое микробиологическое изменение —
порча. Например, сбраживание виноградного сока дрожжами не является пор-
чей, если целью служит получение вина, и является, если требуется сохранить
виноградный сок неизменным. Уксус может образовываться при нежелательном
прокисании вина, а может целенаправленно получаться из вина с помощью тех
же уксуснокислых бактерий; в первом случае налицо порча, а во втором её нет.
Напомним также, что микроорганизмы необходимы для получения таких извест-
12
Основы химического консервирования
ных продуктов питания, как хлеб, йогурт и т.д. Иногда ответ на вопрос о том,
оценивать ли микробиологическое изменение пищевого продукта как ухудше-
ние его качества или нет, зависит от глубины и направления этого изменения.
Например, процесс созревания сыра может плавно перейти в его порчу, причём
точно определить переходный момент зачастую невозможно. Такая неопреде-
лённость может иметь юридические последствия, так как во многих странах су-
ществуют запреты на поставку в торговлю испорченных продуктов.
§2
Способы консервирования
Под консервированием продуктов питания понимается совокупность мер,
направленных против различных видов порчи. В более узком смысле под кон-
сервированием понимают действия, направленные против микробиологической
порчи. Для этого издавна пользуются двумя принципиально отличающимися ме-
тодами: физическим и химическим. В последнее время активно обсуждаются ме-
тоды биологического консервирования пищевых продуктов (см. гл. 54 и 55).
При консервировании необязательно уничтожать имеющиеся микроорганиз-
мы. Важнее создать условия, в которых они не могли бы испортить пищевой
продукт.
Физические методы консервирования (которые в этой книге не обсуждают-
ся) заключаются в том, что пищевой продукт подвергают физическому воздейст-
вию, которое препятствует росту микробов. Самые известные из них — стерили-
зация и пастеризация (воздействие нагреванием), охлаждение и замораживание
(воздействие холодом), сушка (удаление воды) и облучение.
Химические методы консервирования заключаются в добавлении более или
менее хорошо известного химического соединения, которое подавляет развитие
микроорганизмов или уничтожает их. Такие вещества называют консервантами.
Различают консерванты в широком и в узком смысле этого слова1. К первым
относят, например, соль и уксус, ко вторым — сорбиновую и сернистую кисло-
ты. Существенное отличие между этими группами заключается в используемых
концентрациях. Первые применяются в концентрациях выше 0,5—I %, а для вто-
рых из-за их более сильного антимикробного действия достаточно 0,5% и менее.
При биологических способах консервирования к продуктам питания добав-
ляют очищенные культуры определённых микроорганизмов, которые оказыва-
ют тормозящее действие на возбудителей порчи. Такие культуры называют за-
щитными.
§3
Почему необходимо консервировать пищевые продукты
Зерно, фрукты и другие растительные продукты питания можно употреб-
лять в свежем виде лишь в течение короткого времени после сбора урожая. По-
этому с давних пор, особенно в наших широтах, люди вынуждены были делать
долговременные запасы. Периоды дождей и засухи, которые были и есть повею-
। Консервирование пищевых продуктов: история вопроса, цели и задачи
13
ду в мире, также заставляли сохранять продукты питания. Упоминание об этом
встречается в Библии: «И сказал Иосиф фараону: <...> Да повелитфараон поста-
вить над землёю надзирателей и собирать в семь лет изобилия пятую часть с зем-
ли Египетской. Пусть они берут всякий хлеб этих наступающих хороших годов ...
И будет сия пища в запас для земли на семь лет голода...» |Быт. 41: 25, 34—36].
В этом отрывке говорится (если излагать в современных терминах) о сохранении
продуктов питания в атмосфере защитного газа, так как зерно защищалось от
порчи углекислым газом, образующимся при дыхании2.
Необходимость консервировать пищевые продукты возникла в результате
развития цивилизации. Сегодня человечество живёт преимущественно в горо-
дах, где производить продукты питания практически невозможно. В промыш-
ленно развитых странах всё меньшее число людей производит пищу для всё боль-
шего их числа. Это возможно, только если пищевые продукты имеют достаточ-
ный срок хранения.
С развитием цивилизации изменились жизненные привычки и потребности
людей, у них появилось желание наслаждаться деликатесами и экзотическими
продуктами из дальних стран. Выпускается множество «фирменных» продуктов
питания, к сохранности которых предъявляются особенно высокие требования.
Во всех этих случаях не обойтись без использования соответствующих приёмов
сохранения, т.е. без консервирования.
Хотя консервирование (по крайней мере в развитых странах) достигло вы-
сокого уровня, всё ещё поразительно много пищевых продуктов теряется в ре-
зультате порчи. По некоторым оценкам, более 20% произведённых продуктов не
достигают стола потребителя, а достаются грызунам, насекомым и микроорга-
низмам. В менее развитых странах эти потери намного больше.
Если раньше продукты питания консервировали исключительно по эконо-
мическим причинам, то в последнее время добавился и токсикологический ас-
пект1. Например, в 60-х годах обнаружилось, что многие плесневые грибы обра-
зуют токсины, которые могут попадать в продукты питания. Если ограничить
рост плесневых грибов, например применяя консерванты, то уменьшается и об-
разование токсинов 111. Поэтому с точки зрения профилактики заболеваний ис-
пользование безусловно нетоксичных консервантов менее рискованно, чем от-
каз от них.
§4
История химического консервирования пищевых продуктов
Когда человек был ещё собирателем и охотником и буквально «едва сводил
концы с концами», он не нуждался в консервировании продуктов питания. Дли-
тельное их хранение не требовалось, так как природа предоставляла ему посто-
янные источники пищи. С началом неолитической революции (примерно 10 тыс.
лет назад), когда человек стал переходить к оседлому образу жизни, на смену
собирательству и охоте пришли обработка земли и приручение диких животных.
Человек стал делать запасы продовольствия, наподобие белки или хомяка защи-
щая их от сородичей и непогоды. Переход к питанию припасами приводил и к
14
Основы химического консервирования
изменению его структуры, нарушению традиционных (физиологичных) норм.
Значительно изменялись при этом и органолептические свойства продуктов.
Первыми способами консервирования были сушка и засолка. Пища, сохра-
нённая таким образом, имела соответствующие недостатки. Так, один париж-
ский торговец XIV века советовал своим покупателям для приготовления сушё-
ной трески, хранившейся 12 лет, вымочить её в течение ночи в воде, а затем от-
бить кувалдой до размягчения. Читая исторические документы о питании насе-
ления умеренных климатических зон зимой или о рационе моряков, мы видим,
что эта пища полностью или в основном состояла из консервированных продук-
тов. В питании преобладали зерно и мука, сушёное, вяленое и солёное мясо или
рыба. Во многих странах хлеб пекли только два или три раза в году. Потом его
высушивали и месяцами употребляли размоченным, в виде кашицы. Однообра-
зие такой пищи очевидно. О влиянии методов консервирования на составляю-
щие продуктов питания почти ничего не знали. Нередки были болезни.
С течением времени список применяемых консервантов пополнился спир-
том, коптильным дымом, сернистой кислотой, уксусной, молочной и некоторы-
ми другими органическими кислотами. Эти вещества использовали в течение двух
тысячелетий.
Сдвиги в консервировании продовольствия появляются с началом индуст-
риализации. Потребитель становится требовательнее, его больше не удовлетво-
ряет качество пищи, сохраняемой с помощью известных ктому времени консер-
вирующих средств, — они слишком сильно изменяют структуру и свойства про-
дуктов питания.
Достижения химии начали применять и в консервировании. Стали возникать
теории, обосновывающие технологию этого процесса. Исследуя дым, Райхенбах
обнаружил в продуктах сухой перегонки древесины маслянистое вещество, кото-
рое назвал креозотом4 из-за его способности сохранять мясо. О своём открытии он
сообщил в восторженных тонах, хотя тогда же установил, что это вещество пред-
ставляет опасность для здоровья |2|. Применение креозота ограничивалось его
неприятным запахом. Однако в одной книге по химии пищевых продуктов, из-
данной в 1848 году, креозот подробно описывался как ещё одно консервирую-
щее средство наряду с солью (применение которой правильно называли косвен-
ной сушкой), сушкой, нагреванием, молочнокислым брожением, сахаром, спир-
том, уксусом и коптильным дымом 131.
Лишь сто лет назад стали предприниматься усилия с целью не только «как-
нибудь» сохранить продукты питания, но и защитить имеющиеся в них нестой-
кие составные части от разрушения, а также сохранить их питательные и вкусо-
вые свойства. На первых порах в список пищевых консервантов попали такие
вещества, как плавиковая кислота, фториды, хлораты и т.п. Предложения добав-
лять такие «химикалии» к продуктам питания не были связаны с аморальными
побуждениями (корыстью или желанием ввести в заблуждение). Скорее всего
они были вызваны незнанием возможных вредных последствий их применения,
ведь токсикологические исследования ещё не проводились. Существовало мне-
ние, что добавление тех малых количеств веществ, какие необходимы для кон-
сервирования, едва ли может нанести ущерб здоровью. Поэтому вначале в выбо-
ре консервантов не особенно церемонились. Сделанное около ста лет назад пред-
ложение о внесении салициловой и борной кислот в перечень пищевых консер-
1. Консервирование пищевых продуктов: история вопроса, цели и задачи
15
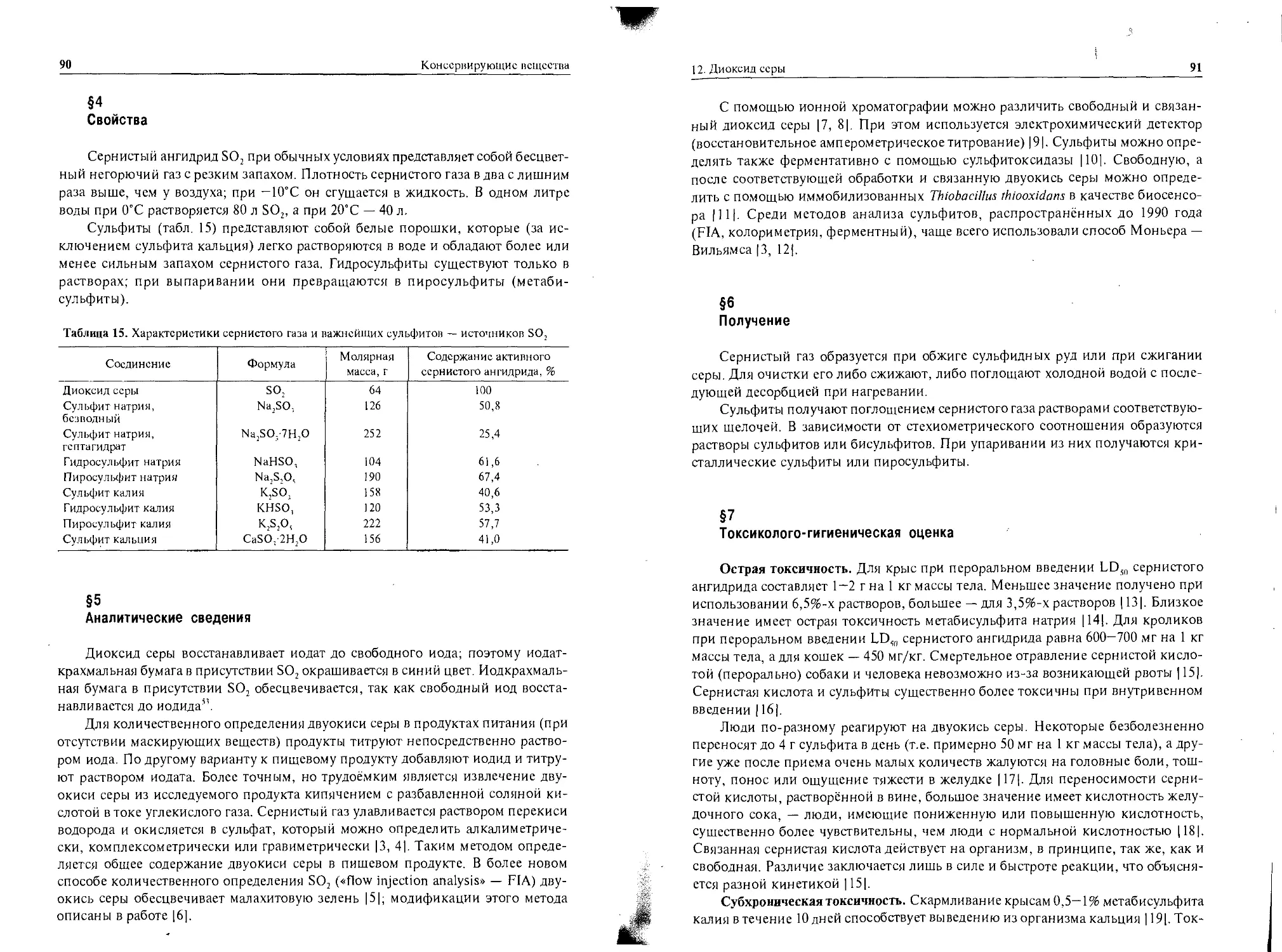
Таблица 1. История развития химического консервирования продуктов питания |2|
Доисторические времена Древний Египет Древний Рим До 1400 года 1775 1810 Использование поваренной соли, коптильного дыма Использование уксуса, масла, мёда Использование сернистой кислоты для стабилизации вин Бойксль изобретает соления Хофер предлагает в качестве консерванта буру Предложено использовать сернистую кислоту для консервирования мяса
1833 1858 1859 1865 1874 Райхснбах предлагает креозот для консервирования мяса Яквсс открывает антимикробное действие борной кислоты Гофман выделяет из масла рябины сорбиновую кислоту Йодин открывает антимикробное действие муравьиной кислоты Кольбе и Тирш открывают антимикробное действие салициловой кислоты
1875 1907 Флек открывает антимикробное действие бензойной кислоты Беринг предлагает формальдегид и перекись водорода для консервирования молока
1908 В США разрешено применять в продуктах питания бензойную кислоту
1913 Марголиус открывает антимикробное действие л-хлорбензойной кислоты
1923 Сабаличка открывает антимикробное действие сложных эфиров и-оксибснзойной кислоты
1938 Гофман, Дэлби и Швайцср предлагают пропионовую кислоту для консервирования хлебобулочных изделий
1939 Мюллер (и независимо от него в 1940 году Гудинг) открывает антимикробное действие сорбиновой кислоты
1947 Колеман и Вольф открывают антимикробное действие дегидрацстовой кислоты
С 1950 1954 1956 Систематическая проверка вновь предлагаемых консервантов Начало промышленного производства сорбиновой кислоты Бернхард, Тома и Гент открывают антимикробное действие сложных эфиров пироугольной кислоты
С 1980 Широкое применение защитной атмосферы
вантов было прогрессивным, хотя сегодня оба эти консерванта уже не удовле-
творяют требованиям безопасности.
В конце XIX столетия в качестве консерванта стали применять муравьиную
кислоту, а в начале XX века — бензойную кислоту, которая и сегодня использу-
ется в больших масштабах. Поскольку вначале к бензойной кислоте (и к салици-
ловой) относились острожно, причисляя их к соединениям ароматического ря-
да, и считая канцерогенными, велись поиски её заменителей. Ими оказались
в-хлорбензойная кислота и сложные эфиры я-оксибензойной кислоты'. В конце
30-х годов в качестве консервантов стали применять соли пропионовой кисло-
ты, а после Второй мировой войны — сорбиновую кислоту и её соли. Широкое
распространение сорбиновой кислоты является в значительной мере следствием
возникшего в 50-х годах нового подхода к токсикологической оценке пищевых
добавок вообще и консервантов в частности. Это — ненасыщенная жирная ки-
слота, исследована она лучше всех других широко применяемых консервантов, и
безопасность её использования не вызывает ни малейшего сомнения.
16 Основы химического консервирования
В последние 15—20 лет наблюдается сильное стремление к потреблению све-
жих продуктов питания. В связи с этим промышленность старается сократить
путь от производителя к потребителю. В развитых странах для сохранения све-
жих продуктов широко используют охлаждение (даже во время транспортировки).
Современные тенденции развития способов сохранения продуктов питания
дают основания полагать, что в недалеком будущем станут применяться «щадя-
щие» способы химического консервирования. Под этим следует понимать при-
менение веществ, которые могут быть получены из растений или микроорганиз-
мов, проявляющих антимикробные свойства. Такие вещества неспециалисты
a priori считают менее подозрительными, потому что это природные соединения.
Примечательно, что в публикациях, направленных против пищевых доба-
вок, консерванты критикуются меньше всего, так как критикам известно, что в
определённых случаях применение консервантов защищает здоровье потребите-
лей. Таким образом, несомненно, что химическое консервирование продуктов
питания сохранит свое значение и в будущем.
Глава 2
Определение консервантов
2
в продуктах питания
Как технологам, так и юристам необходимы возможность обнаружить кон-
сервант В пищевом продукте и определить его количество.
§1
Качественный анализ
Поскольку пищевые консерванты не составляют единого класса химических
соединений, для них нельзя подобрать общий способ подготовки проб и общий
метод анализа. Чтобы обнаружить наличие консерванта, можно использовать не-
специфический микробиологический тест. Для этого в исследуемый продукт (ино-
гда после соответствующего разбавления) вносят известные штаммы микроорга-
низмов, против которых активен предполагаемый консервант, и в течение опре-
делённого времени наблюдают, происходит ли размножение микроорганизмов.
Многие из них (особенно дрожжи) выделяют углекислый газ, количество кото-
рого может быть измерено. Этот способ, под названием «тест на брожение», рань-
ше имел определённое значение, однако сегодня применяется редко из-за не-
достаточной специфичности.
Штаммы микроорганизмов, необходимые для микробиологического теста,
могут быть получены, например, из «Deutschen Sammlung fur Mikroorganismen
(DSM)» в Брауншвейге или из «American Type Culture Collection» (ATCC, 12301
Parklawn Drive, Rockville, MD 20852, USA)6.
В литературе описаны химические и инструментальные способы определе-
ния практически всех пищевых консервантов. Основные из них кратко изложе-
ны во второй части монографии. Чтобы облегчить аналитикам выбор конкрет-
ного метода, для упомянутых способов определения консервантов указаны их
достоинства и недостатки. С детальным описанием методов анализа можно озна-
комиться по оригинальным работам, ссылки на которые приведены в тексте.
§2
Количественный анализ
Большинство продуктов питания имеет чрезвычайно сложный состав, и от-
дельные их компоненты могут мешать определению консервантов. По этой при-
чине, а иногда и для концентрирования, сначала выделяют консерванты из ана-
лизируемого продукта. Для этого используются экстракция, отгонка с водяным
18
Основы химического консервирования
паром или специальные методы. Выделенную субстанцию после предваритель-
ной очистки подвергают собственно анализу. Эта последовательность действий
называется подготовкой проб.
Для количественного анализа консервантов используются газовая, тонко-
слойная или жидкостная хроматография, химические, колориметрические, фо-
тометрические и другие методы. Всё большее распространение получает высоко-
эффективная жидкостная хроматография (ВЭЖХ); поэтому в аналитической части
каждой главы, посвящённой конкретному консерванту, упоминается этот метод
и возможность его применения.
§3
Требования к чистоте
Как и все пищевые добавки, консерванты должны удовлетворять опреде-
лённым стандартам качества. Поэтому большинство современных постановле-
ний о разрешении к применению того или иного консерванта включают и требо-
вания к его чистоте. В основном требования ограничивают содержание тяжёлых
металлов и специфических примесей, которые могут появиться при синтезе кон-
серванта.
Глава 3
Токсиколого-гигиенические аспекты
3
§1
Основные положения
Во все времена пища человека содержала вещества, которые в определённых
условиях и при достаточной концентрации представляли опасность для жизни
или здоровья. Это могли быть естественные составляющие продуктов питания,
например ядовитые вещества из рапса7 и других кормовых культур, вызываю-
щие увеличение щитовидной железы, или цианогенные гликозиды из маниоки.
Кроме того, опасные и вредные вещества могут образовываться как реакция рас-
тений на внешние патогенные факторы (так называемые фитоалексины; напри-
мер, соланин или хаконин в картофеле) или в результате микробиологического
поражения продуктов питания (микотоксины и др.). Из-за высокой ядовитости
большинства микотоксинов этот вид заражения представляет собой серьёзную
проблему |1, 2|. Поскольку целенаправленное и квалифицированное примене-
ние консервирующих веществ может препятствовать образованию микотокси-
нов, консерванты вносят существенный вклад в безопасность нашего питания.
Ранее вспомогательные вещества и пищевые добавки (в том числе консер-
ванты) применяли в продуктах питания без особой проверки. Достаточным до-
казательством их безвредности считалось отсутствие непосредственных негатив-
ных последствий для здоровья при употреблении пищевых продуктов с этими
добавками. Таким способом человечество «тестировало» вещества, добавляемые
в пищу (как, впрочем, и самоё пищу).
Со времён бесконтрольного использования «химикалий» в консервирова-
нии пищевых продуктов берёт своё начало заметная ещё и сегодня (хотя уже
уменьшающаяся) неприязнь многих людей к пищевым консервантам вообще. В
XX веке (особенно с 50-х годов), в связи с развитием такой науки, как токсико-
логия, положение принципиально изменилось. Вспомогательные вещества и пи-
щевые добавки разрешаются к использованию в продуктах питания только в том
случае, если их токсикологические испытания (проведённые в соответствии с
современными научными требованиями) не дают оснований предполагать нали-
чие какого-либо вреда от них. Законодательство о пищевых добавках исходит из
принципа «запрета с разрешающей оговоркой». Изначально все пищевые добав-
ки запрещены; применяться могут только те из них, для которых чётко оговари-
ваются предельное количество и область применения. Сегодня токсичность вспо-
могательных веществ и пищевых добавок изучена лучше, чем токсичность мно-
гих продуктов питания и их компонентов. Это связано с тем, что к природным
20
Основы химического консервирования
ядовитым составляющим пищевых продуктов общественность всегда проявляла
несравнимо меньший интерес, чем к пищевым добавкам.
При токсикологической оценке вспомогательных веществ и пищевых доба-
вок исходят из того, что между дозировкой и продолжительностью действия, с
одной стороны, и наблюдаемыми последствиями, с другой, имеется причинно-
следственная связь, которая может быть выражена математически (зависимость
доза-действие), и что существует некоторая доза, ниже которой вещество не ока-
зывает влияния на организм (допустимая доза, пороговое значение). Эта доза
должна быть определена. Причём следует констатировать не факт проявления
действия, как обычно делается в фармакологии, а факт его отсутствия — непри-
вычная для научной теории и практики задача. Сказанное о допустимой дозе не
относится к канцерогенным и генотоксичным веществам, так как для такого ро-
да веществ пороговое значение не может быть определено по причине их особенно
широкого биологического действия* (ковалентные модификации ДНК) |3|.
Еще Парацельс в 1538 году в третьем из семи своих основополагающих
определений (Epistola dedicorata St. Veit) следующим образом сформулировал тот
принцип, что нужно принимать малые дозы веществ, чтобы они не оказывали
острого ядовитого действия: «Всё содержит яд, / и всё есть яд, / и ничего нет без
яда, / только доза делает / вещь чистым ядом. / Например, любая еда / и любое
питьё, / принимаемые не в своей дозе, / становятся ядом, / что приводит к выводу:
/ это я сам позволяю / яду быть ядом».
Парацельс хотел этим сказать не только то, что любое вещество становится
ядом начиная с определённой дозы, но и что существуют дозы, ниже которых
отсутствует токсическое действие яда.
Требуемый объём исследований и методы их проведения определяются имею-
щейся или предполагаемой потребностью в проверяемом веществе. В экспери-
ментах с животными сегодня существует целый ряд экспресс-методов in vitro, в
которых могут быть исследованы такие параметры, как генная токсичность и му-
тагенность (см. §4 и 5 гл. 3). «Раздражающее действие» и «проникновение через
кожу» также изучаются в тестах in vitro (например, «хорионаллантоидный» тест).
Подобным образом изучается и острая генная токсичность (например, Neutral
Red uptake inhibition test). Однако все известные тесты in vitro, даже в совокупно-
сти, не могут полностью заменить испытания на животных. Тестирование in vitro
позволяет лишь уменьшить число таких испытаний |4|. Кроме того, в каждом
отдельном случае необходимо решать вопрос правомерности переноса результа-
тов, полученных in vitro, сначала на животных, а потом и на человека.
Основные сведения для токсикологической оценки получают в эксперимен-
тах in vivo. Предпочтительно использование мелких животных с коротким вре-
менем жизни — мышей, крыс и других грызунов, собак, обезьян; в отдельных
случаях используют иные виды животных. Всех их специально разводят и содер-
жат в определённых условиях. Для решения некоторых фармакологических за-
дач подопытных животных разводят методами генной инженерии, которые дают
отличные модели для экспериментов.
На следующем этапе биохимическое поведение вещества и его обмен у че-
ловека исследуются под врачебным контролем на добровольцах (как и при изу-
чении лекарств). Вследствие этого риск перенесения на человека результатов,
которые получены в экспериментах с животными, сильно уменьшается.
3. Токсиколого-гигиенические аспекты
21
В настоящее время для оценки безопасности вспомогательных веществ и пи-
щевых добавок в качестве главных рассматриваются следующие критерии:
— острая токсичность;
— метаболизм и токсикокинетика;
— генотоксичность/мутагенность;
— репродуктивная токсичность, включая тератогенность и влияние на
способность к воспроизведению потомства;
— субхроническая токсичность;
— хроническая токсичность;
— канцерогенность.
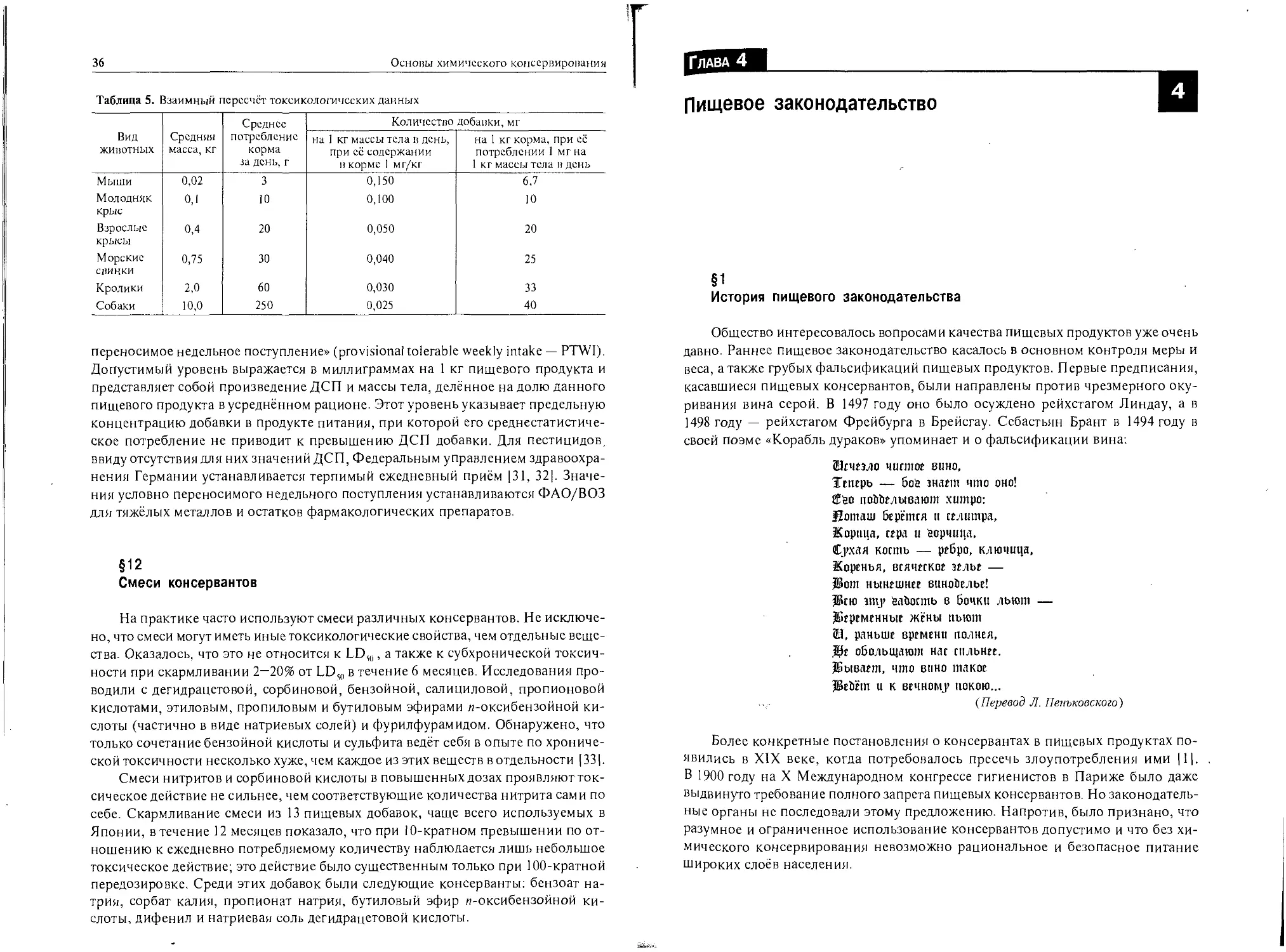
Последовательность оценки токсикологической безопасности вспомогатель-
ных веществ и пищевых добавок представлена схемой на рис. 1. Отдельные ис-
следования часто проводят одновременно; например, опыты по хронической ток-
сичности сочетают с проверкой на канцерогенность. В исследованиях по обмену
веществ определяют, происходит ли накопление проверяемого вещества в орга-
низме. Проверяют также, происходят ли биопревращения испытуемого вещест-
ва (всасывание, распространение, метаболизм и удаление).
Ост рая 1 оксичност ь -----------------—-----1
। Отказ от применения
Гспоюксичпость ------------------------—-----1
Отказ от применения
Снижение плодовитости -----------------------1
-| *
Т Отказ от применения
Тера гот ci нюсть ---------------------—-----
। Отказе! применения
Субхроническая токсичность ------------—-----1
। Отказ от применения
Хроническая токсичность,
в !.ч. каипсро1сппос(ь ______________________
-|
’ Отказ от применения
Всщсст во с точки зрения
токсикологии может быть допущено
в качестве вспомогательного
или пищевой добавки
Рис. 1. Принципиальная схема оценки токсикологической
безопасности вспомогательных веществ и пищевых добавок:
- — отсутствие риска;
+ — сеть отрицательные результаты, которые могут иметь значение
при использовании проверяемого вещества в продуктах питания
22
Основы химического консервирования
Применение современных методов токсиколого-гигиенических исследова-
ний в институтах, специализирующихся в соответствующей области, даёт уве-
ренность, что используются подходящие виды животных при надлежащем их со-
держании и кормлении, а также правильно выбираются способ введения прове-
ряемых веществ и их дозы. Соответствующие рекомендации имеются, например,
в документах Организации экономического сотрудничества и развития — ОЭСР
(Organization for Economic Co-operation and Development — OECD). И наконец,
решающим является правильная интерпретация результатов.
Перед началом токсикологических исследований вещества требуется устано-
вить его идентичность, т.е. проверяемое вещество должно быть химически и физи-
чески идентично тому, которое в дальнейшем будет использоваться на практике.
Поэтому сначала устанавливают точные характеристики проверяемого вещества.
Наряду с обычными химическими показателями они должны включать содержа-
ние основного вещества и допустимое содержание примесей. Для синтетического
соединения или однокомпонентного природного вещества установление характе-
ристик, как правило, проще, чем для многокомпонентных природных веществ.
Для первых известен путь синтеза, есть указания на возможность наличия побоч-
ных продуктов, которые обычно удаляют из испытуемого вещества с помощью очи-
стки (перекристаллизации, перегонки и пр.). Поскольку сами вспомогательные
вещества и добавки применяются в пищевых продуктах в малых количествах, то
примеси к ним (содержание которых составляет миллиграммы или даже микро-
граммы на 1 кг) попадают в пищевой продукт ещё более разбавленными.
Желательно, чтобы пищевые добавки не проявляли фармакологического дей-
ствия. Это требование предъявляется и к консервантам. Казалось бы, для них
оно особенно актуально, так как, обладая антимикробной активностью, консер-
ванты, в принципе, могут применяться против возбудителей болезней (напри-
мер, дерматомикозов). Реально фармакологическая эффективность веществ, ис-
пользуемых в качестве пищевых консервантов, мала и её можно не учитывать.
Вещества, находящие практическое применение в медицине (например, некото-
рые антибиотики), не используются в качестве пищевых добавок из-за опасно-
сти привыкания к ним.
§2
Острая токсичность
Показатель острой токсичности — средняя летальная доза’ (LD50) даёт гру-
бую оценку токсикологических свойств вещества при одноразовом приёме |5|.
Она представляет собой дозу, при которой погибает (предположительно) 50%
подопытных животных, и зависит от многих факторов — вида животных, их воз-
раста, массы, пола и условий содержания. Для того чтобы можно было сравни-
вать показатели острой токсичности различных веществ, все эти факторы долж-
ны быть стандартными.
Показатель острой токсичности указывают в миллиграммах проверяемого
вещества на 1 кг массы тела подопытного животного. Чем выше значение LDS(),
тем меньше острая токсичность вещества.
3 Токсиколого-гигиенические аспекты
23
Для газообразных веществ показателем острой токсичности служит средняя
летальная концентрация (LCW), измеряемая в миллиграммах на 1 л воздуха. От
показателей LDS(I и LCW следует отличать среднюю эффективную дозу (EDSJ) —
дозу, которая оказывает определённое действие на 50% животных.
Для определения LDW испытуемое вещество в различных дозах дают груп-
пам животных, состоящим из 5 мужских и 5 женских особей. Вспомогательные
вещества и пищевые добавки вводят только перорально. Исследуемая доза вво-
дится единовременно с помощью зонда; если она слишком велика (например,
при очень малой токсичности), её можно давать частями, но в течение одного
дня. Животные наблюдаются не менее 1—2 недель.
Показатель острой токсичности прежде всего даёт информацию, необходи-
мую для определения места испытуемого вещества в ряду известных соедине-
ний. Кроме того, в испытаниях на острую токсичность получают сведения о ха-
рактере токсикологического действия — при вскрытии трупов животных в от-
дельных случаях можно установить, какие органы особенно подвержены дейст-
вию тестируемого вещества. Эти наблюдения служат отправной точкой для даль-
нейших токсикологических исследований, в частности LDW даёт ориентиры для
определения диапазонов дозировок в тестах на субхроническую и хроническую
токсичность. И наконец, определение острой токсичности позволяет получить
информацию об ожидаемом риске для человека в случае аварии, злоупотребле-
ния или профессиональной работы с данным веществом.
В зависимости от значения средней летальной дозы вещество можно отнести
к одному из следующих классов:
LDW, мг/кг
Менее 5
5-49
50-499
500-4999
Болес 5000
Класе токсичности
1 -й
2-й
3-й
4-й
5-й
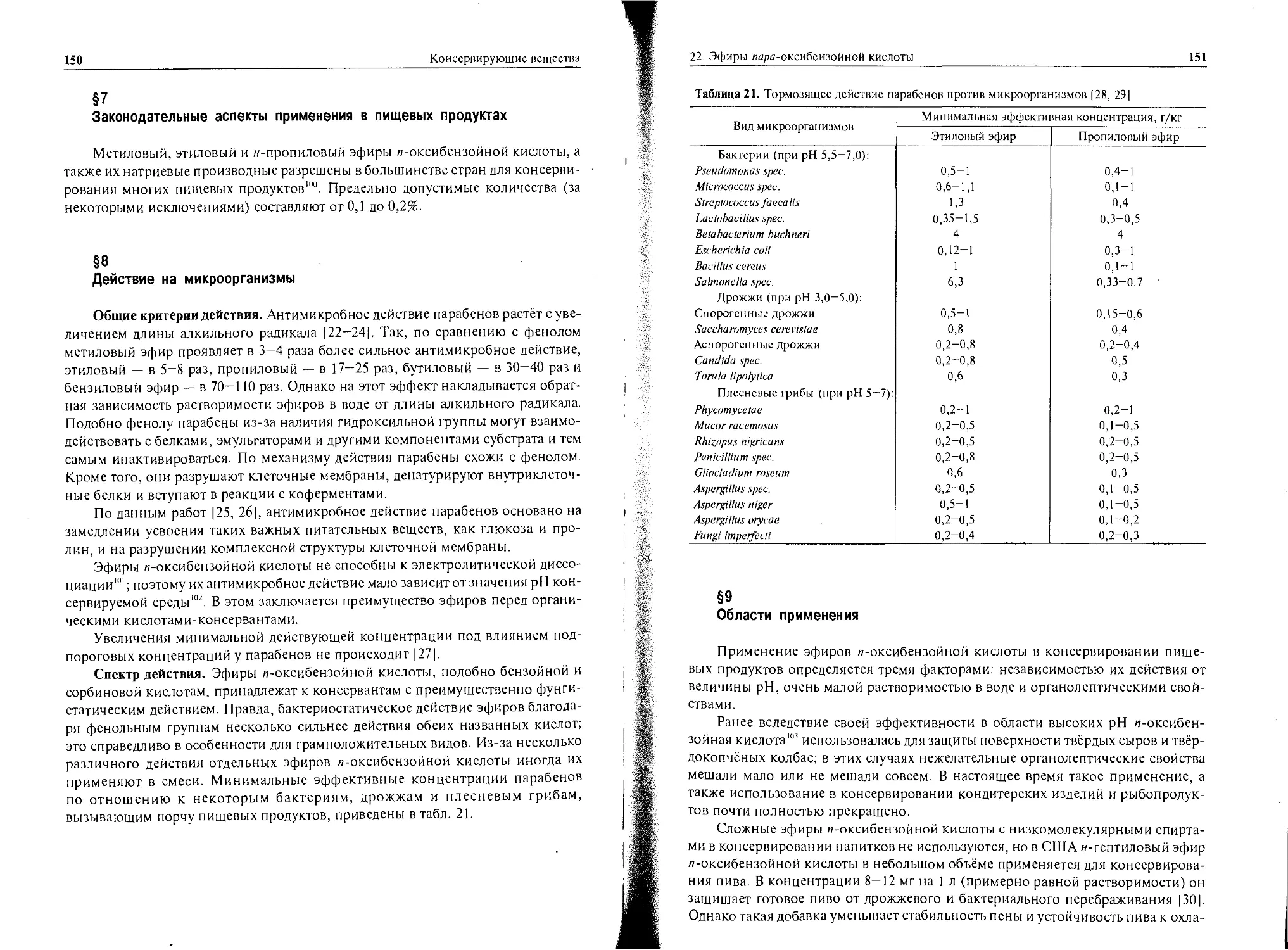
Данные, приведённые в табл. 2, показывают, что вещества, применяемые в
качестве консервантов, относятся к 4-му и 5-му классам токсичности. Исключе-
ние составляют нитриты (3-й класс токсичности).
В соответствии с постановлением ОЭСР №401 (проверка острой токсично-
сти) описанные выше опыты для определения острой токсичности с 1991 года по
научным и этическим соображениям заменены значительно более прогрессив-
ной (сточки зрения защиты животных) процедурой «Fixed-dose-procedure» [6].
§3
Исследование метаболизма и токсикокинетики
Сведения о всасывании и возможных превращениях испытываемого веще-
ства в организме имеют для его общей токсикологической оценки такое же зна-
чение, как и данные об органах, подверженных его воздействию. Опыты сначала
тоже проводятся на животных.
24
Основы химического консервирования
Таблица 2. Средняя летальная доза некоторых веществ, проявляющих
консервирующее действие
Консервант LD,0, мг/кг Вид животных
Муравьиная кислота 1 200 Мыши
Бензойная кислота 3 000 Крысы
Дегидрацстовая кислота 1 000 То же
Дифенил 3 300
Этанол 9 500 Мыши
Эфиры и-оксибснзойной кислоты 6 000-8 000 То же
Хлорид натрия 3 750 Крысы
Нитраты 6 000 То же
Нитриты 100-200
о-Фенилфснол 3 000
Пимарицин 1 500
Пропионовая кислота 4 000
Сахароза 30 000
Салициловая кислота 1 100 Кролики
Диоксид серы 1 000-2 000 Крысы
Сорбиновая кислота 10 000 То же
Особо важны исследования на животных, которые метаболизируют тести-
руемое вещество подобно человеку, так как на следующем этапе к опытам при-
влекают добровольцев (под врачебным контролем).
В предварительных опытах на животных формируются общие представле-
ния о вероятном поведении тестируемого вещества в организме, in vitro проверя-
ется его устойчивость к кислотному, щелочному и ферментативному гидролизу,
действие на изолированные органы, клетки и одноклеточные организмы.
Чтобы проследить путь вещества в организме, его вводят в нормальной и
повышенной концентрациях и изучают превращение и выделение самого веще-
ства и метаболитов в биологических жидкостях, органах и тканях. С помощью
повышенных доз выясняют зависимость метаболизма от дозировки (появление
иных метаболитов при «перегрузке» обычных путей превращения). Устанавли-
вают, в каком органе или ткани происходят биохимические превращения иссле-
дуемого вещества и как они зависят от дозы и времени. Иногда подопытным
животным вводят исследуемое вещество, «меченное» радиоактивным изотопом
углерода |4С.
Если наблюдается распад молекулы на несколько частей, то можно исполь-
зовать соединения, «меченные» двумя изотопами (например, ’Н и 14С), и обна-
руживать их в органах и биологических жидкостях животного по отдельности.
Общее распределение радиоактивности в организме подопытного животного ис-
следуется с помощью авторадиографии. Для этого животное (мышь или крысу)
после введения исследуемого вещества умерщвляют и подвергают глубокому за-
мораживанию в жидком азоте. Гистологические срезы радиофотографируют. По-
лученные изображения позволяют визуально наблюдать распределение общей
радиоактивности в организме животного.
При авторадиографии нельзя различить исходное вещество и метаболиты.
Это можно сделать для каждого отдельного органа, подвергнув его ткани экс-
тракции и разделив экстракт методом ВЭЖХ с детектором по радиоактивности.
3. Токсиколого-гигиенические аспекты
25
Для выяснения структуры метаболитов используются УФ- и ИК-спектроскопия,
ЯМР-спектроскопия на ядрах 'Н и ”С и масс-спектрометрия. Исследования ме-
таболизма составляют основу для дальнейших опытов по изучению субхрониче-
ской и хронической токсичности.
Существует несколько вариантов участия консерванта в обмене веществ. Не-
растворимые вещества, как правило, проходят неизменёнными через кишечник,
и в этом случае на биологическое воздействие вне желудочно-кишечного тракта
или появление метаболитов рассчитывать не приходится. Предварительно долж-
но быть точно установлено, что исследуемое вещество не подвергается измене-
ниям под действием кишечных бактерий и не всасывается в виде продуктов рас-
пада. Иногда у весьма мелкодисперсных веществ появляется возможность пря-
мого перехода из кишечника в кровеносную систему в результате пиноцитоза
или фагоцитоза. Соединений, относящихся к первой группе, среди консерван-
тов нет.
Вторая группа веществ хотя и всасывается из желудочно-кишечного тракта,
но химическому превращению не подвергается. Они не дают токсичных метабо-
литов и могут неизменёнными выводиться с мочой. При испытании таких ве-
ществ необходимо проверять, не происходит ли их превращение под действием
кишечной микрофлоры. Среди этой группы консерванты также отсутствуют.
Вещества третьей группы всасываются из желудочно-кишечного тракта, но
после биохимического разложения или превращения (биотрансформации) вы-
водятся из организма. На первом этапе они, например, окисляются, а затем, на
втором этапе, приобретают гидрофильность (связываясь с глюкуроновой, сер-
ной, фосфорной кислотами или иным путём), а вместе с нею и способность к
выведению из организма. Для веществ, метаболизирующихся подобным обра-
зом, характерны достаточно быстрые биохимические превращения и отсутствие
накопления метаболитов в организме. Примером может служить бензойная ки-
слота, которая в организме человека образует с глицином гиппуровую кислоту и
в таком виде выводится с мочой1".
Четвёртую группу образуют соединения, которые всасываются и метаболи-
зируются подобно веществам третьей группы, но их выведение или выведение
их метаболитов происходит относительно медленно. Такие вещества могут нака-
пливаться в организме, что нежелательно. Примеры консервантов этого вида —
борная и салициловая кислоты.
Последнюю группу составляют соединения, которые организм после всасы-
вания использует так же, как обычные питательные вещества. Они подвергаются
биохимическому разложению, подобно компонентам пищи — жирам, белкам,
углеводам и пр. Примерами веществ такого рода являются пропионовая и сорби-
новая кислоты.
§4
Генотоксичность
Под генетической токсичностью (генотоксичностью, мутагенностью) веще-
ства понимают его способность оказывать вредное воздействие на наследствен-
ность, т.е. вызывать нежелательные мутации. Спонтанно мутации происходят у
26
Основы химического консервирования
любого живого организма, но они быстро исправляются определённой «ремонт-
ной» системой. Мутации, вызываемые генотоксикантами, возникают в результа-
те связывания последних с ДНК, торможения репарационной системы и т.д. В
соответствии с характером изменения генетического аппарата различают мута-
ции генные, хромосомные и геномные.
Генные, или точечные, мутации заключаются в изменении химической струк-
туры генов. К ним относятся:
транзиция — обмен пуринового основания на пуриновое или пирими-
динового на пиримидиновое;
трансверсия — обмен пуринового основания на пиримидиновое или
наоборот;
инсерция — вставка одной или нескольких пар оснований;
делеция — выпадение одной или нескольких пар оснований.
Инсерцию и делению называют также мутациями со сдвигом рамки.
Хромосомные мутации (в отличие от генных) отражаются на внешнем виде
хромосом, наблюдаемом в световой микроскоп. Вещества, которые вызывают хро-
мосомные мутации, называются мутагенами. Важнейшими типами хромосомных
мутаций являются:
делеция — утрата части хромосомы;
дупликация — удвоение участка хромосомы;
инверсия — поворот фрагмента хромосомы;
транслокация — обмен участками хромосом.
Кольцевые хромосомы тоже подвержены мутациям.
Геномные мутации подразделяют на анеуплоидии и полиплои-
дии11. Анеуплоидией называют изменение количества отдельных хромосом —
уменьшение (нулли- и моносомия) или увеличение (три-, тетра- и полисомия)
их числа, т.е. несбалансированный хромосомный набор. Полиплоидия — это уве-
личение числа хромосомных наборов соматических клеток по сравнению с обыч-
ным диплоидным.
Для проверки на мутагенность используются как тесты in vitro — с микроор-
ганизмами (бактериями, дрожжами, грибами и др.) и клеточными культурами (в
том числе культурами лимфоцитов человека), так и тесты in vivo — с растениями,
насекомыми (особенно вида Drosophila те! a nogaster), мелкими грызунами (осо-
бенно мышами). Так как различные способы испытаний обнаруживают разные,
уязвимые для тестируемых веществ места генетического субстрата, необходимо
применять несколько методов проверки мутагенности (так называемая «тест-
батарея»).
Условия проведения таких испытаний (мутационного теста по Эймсу, теста
на трансформацию клетки, теста на хромосомные мутации, микроядерного теста
и др.) опубликованы в официальных изданиях. Получаемые результаты требуют
исключительно осторожной интерпретации, поскольку ошибки могут быть как в
сторону завышения, так и в сторону занижения.
Самый известный, бесспорно, тест Эймса. Он основан на том, что опреде-
лённые штаммы Salmonella typhimurium, которые вследствие мутации потеряли
свою способность к синтезу гистидина, под влиянием мутагенов могут мутиро-
вать в первоначальную форму (ревертанты) и вследствие этого расти на сво-
бодных от гистидина питательных средах. Разные штаммы S. typhimurium (ТА 98,
3. Токсиколого-гигиенические аспекты
27
ТА ЮО, ТА 1535) имеют склонность к различным типам мутации; следователь-
но, выбором штамма можно получить некоторое представление о типе возни-
кающей мутации. При тестировании по Эймсу могут возникнуть трудности —
иногда консерванты оказывают тормозящее действие на S. typhimurium.
Наряду со многими другими весьма популярен также микроядерный тест
(см. общую литературу).
Испытания на мутагенность имеют особое значение для токсикологической
оценки вспомогательных веществ и пищевых добавок, поскольку мутагенность и
канцерогенность (по меньшей мере для генотоксичных веществ) почти всегда
встречаются одновременно.
§5
Репродуктивная токсичность
Исследования по репродуктивной токсичности включают проверку влияния
данного вещества на мужскую и женскую плодовитость и общую способность к
продолжению рода, на внутри- и послеутробное развитие, а также выяснение
наличия у него тератогенных свойств.
Под тератогенностью вещества понимают его способность вызывать появле-
ние уродств у эмбрионов. Тератогены принципиально недопустимы в качестве
вспомогательных веществ в пищевых технологиях и добавок в продуктах пита-
ния. В то же время некоторые природные составляющие пищевых продуктов (на-
пример, спирт) обладают значительной тератогенностью, а вызываемая спиртом
алкогольэмбриопатия считается серьёзной токсикологической проблемой.
Для проверки на тератогенность беременным животным дают тестируемое
вещество в критических фазах эмбрионального развития. Определяют, в частно-
сти, число имплантаций эмбрионов, число их ранних и поздних рассасываний,
число живых и мёртвых зародышей, положение и распределение зародышей в
маточных трубах, массу приплода, уродства скелета и органов.
В процессе эмбрионального развития различные органы в разное время и в
разной степени восприимчивы к тератогенным факторам. Поэтому при изуче-
нии тератогенеза важную роль играет время экспозиции.
К настоящему времени очень хорошо описано тератогенное действие тали-
домида («контерган-катастрофа»12), спирта и диэтилстильбэстрола, который за-
нимает особое место в трансплацентарном индуцировании опухолей. Имеются
указания на тератогенность антагонистов фолиевой кислоты (аминоптерин) и
синтетических прогестинов |7|.
§6
Подострая токсичность13
Испытания на подострую токсичность имеют обычно продолжительность
28 дней и представляют собой промежуточное звено между исследованиями ост-
рой (однократное, введение вещества и наблюдение в течение 1—2 недель) и суб-
хронической токсичности (ежедневное введение вещества в течение 90 дней и
28
Основы химического консервирования
более, см. §7 гл.З). Путём многократного (обычно 3-кратного) введения вещест-
ва за сравнительно короткое время в этих испытаниях пытаются обнаружить воз-
можное кумулятивное токсическое действие тестируемого вещества или его ме-
таболитов. В рамках этих же исследований выясняют, происходит ли адаптация
организма к испытуемому веществу и не проявляют ли какие-либо конкретные
органы особой чувствительности к нему. Это можно определить, например, из-
мерением активности различных ферментов печени.
§7
Субхроническая токсичность
При исследовании субхронической токсичности испытуемое вещество скарм-
ливают в течение 3—6 месяцев (т.е. в течение срока, составляющего приблизи-
тельно 10% продолжительности жизни подопытных животных). Для опытов ис-
пользуют обычно грызунов (крыс, мышей или хомяков) и другие виды животных
(собак или свиней). Чтобы иметь возможность обнаружить различия действия в
зависимости от пола, включают в опыт равное число мужских и женских особей.
Необходимо использовать достаточно большое число животных, чтобы можно
было сделать статистическую оценку. В опытах участвует и некоторое количест-
во контрольных животных, которых содержат в тех же условиях, что и подопыт-
ных, но им не скармливают исследуемое вещество. Проверяемое вещество при-
меняют в нескольких дозах (не менее трёх). Наивысшая из них должна находить-
ся в области, в которой несомненно можно ожидать токсического действия. Та-
ким образом узнают, какие органы подвержены воздействию испытуемого веще-
ства. В дальнейших опытах уделяют им особое внимание.
Опыты по субхронической токсичности включают исследования живых
животных и их трупов (по окончании опыта).
У живых животных наблюдают и изучают внешние параметры, такие, как
поведение, изменение массы тела, потребление пищи и воды. Проверяют внеш-
ний вид и состав мочи и фекалий, наличие в них нефизиологических веществ и
других отклонений от нормы. Проводят клинико-биохимические исследования
крови и её сыворотки, которые дают информацию о выполнении органами важ-
нейших функций. По окончании опыта животных забивают. Определяют массу
главных внутренних органов и затем подвергают их макроскопическому и гисто-
логическому исследованию. Особое внимание обращают на печень и почки, по-
скольку именно их функции связаны в первую очередь с обменом веществ и сек-
рецией. Часто они реагируют на скармливание повышенных доз определённых
веществ небольшим и обратимым увеличением, не сопровождающимся гистоло-
гическими изменениями. Это увеличение может быть объяснено биологической
реакцией на стрессовую ситуацию.
Для исследования субхронической токсичности доза тестируемого вещества
должна быть выбрана так, чтобы, с одной стороны, токсическое действие было
явно заметно, с другой — подопытные животные остались живы. Испытания на
субхроническую токсичность, наряду с уже упомянутыми целями (выяснение воз-
можности адаптации к исследуемому веществу, накопления его в организме жи-
вотного, «обратимости» причиняемого им вреда; определение «целевых органов»),
3. Токсиколого-гигиенические аспекгы
29
служат и для оценки диапазона доз и способа введения вещества в организм при
изучении хронической токсичности (см. §8 гл 3).
§8 '
Хроническая токсичность
Под хронической токсичностью понимают итоговое действие, которое может
быть обнаружено после скармливания вещества в течение 2 лет и более. Скарм-
ливание вещества в течение длительного времени позволяет обнаружить такие
явления, как канцерогенез или возрастная зависимость восприимчивости опреде-
лённой ткани. Поэтому опыты по определению хронической токсичности рассмат-
риваются как важный элемент оценки потенциального риска пищевой добавки.
В опытах по хронической токсичности особенно важно использовать доста-
точно большое количество животных. Это позволяет дать статистическую оцен-
ку14 результатам наблюдений, сокращая доверительный интервал вероятности
биологического события, и обнаружить редко встречающиеся явления. В осталь-
ном используют те же принципы, что и в опытах по суб хронической токсичности
(см. §7 гл. 3).
Проверяемое вещество даётся животным в более высоких дозах14. При выбо-
ре доз опираются на результаты предшествующих опытов по субхронической ток-
сичности. Следует учитывать, что определённое количество испытуемого веще-
ства может находиться в пище естественным образом.
В испытаниях на хроническую токсичность следует соблюдать следующие
правила:
— в качестве наибольшей использовать такую дозу, которая в опытах по суб-
хронической токсичности ещё не оказывала никакого действия;
— не применять корм с содержанием испытуемого вещества выше 5%;
— иметь в виду, что результаты, полученные в условиях стресса или в других
специфических условиях, могут быть не связаны с исследуемым веществом;
— использовать диету, сбалансированную по калорийности (при этом сле-
дует учитывать, что некоторые вещества в высоких дозах влияют на усвоение
пищи);
— учитывать, что исследуемое вещество в повышенных концентрациях мо-
жет изменять органолептические свойства корма; иногда это становится причи-
ной частичного отказа подопытных животных от приёма корма и, как следствие,
может отрицательно сказаться на их развитии.
В исследованиях по хронической токсичности наблюдают прежде всего раз-
витие животных, их поведение, функции отдельных органов (имеющие внешние
проявления) и ферментативные реакции. Подопытных животных или забивают
по окончании опыта, или содержат до наступления естественной смерти. Все жи-
вотные подвергаются вскрытию. Гистологические исследования в первую оче-
редь проводятся на животных, принимавших высокие дозы испытываемого ве-
щества и имеющих макроскопические поражения, опухоли. Изучаются следую-
щие органы и ткани: лимфатические узлы, молочные и слюнные железы, бед-
ренные кости или позвонки (включая костный мозг), гипофиз, трахеи, лёгкие,
сердце, щитовидная железа, пищевод, желудок, тонкий кишечник, ободочная
30
Основы химического консервирования
кишка, печень, жёлчный пузырь, поджелудочная железа, селезёнка, почки, над-
почечники, мочевой пузырь, простата, яички, яичники, матка, головной мозг,
глаза, спинной мозг. Особенности распределения испытываемого вещества в ор-
ганизме могут потребовать исследований и других органов и тканей.
Результаты исследования должны быть правильно интерпретированы. Крайне
важно оценить возможность их переноса на человека и предполагаемый риск.
К пищевым добавкам сегодня предъявляют требования по безопасности более
высокие, чем к лекарствам. Побочное действие лекарства обычно несоизмеримо
меньше той опасности для здоровья, которую оно предотвращает. Поэтому с ним
смириться легче, чем с побочным действием пищевой добавки.
Перечисленные оценки позволяют определить уровень (дозу) потребления
добавки, при котором не обнаруживается никакого отрицательного действия. Он
называется «уровень, не вызывающий наблюдаемого действия» (no-observed-
effect-level — NOEL), представляет собой наивысшую дозу, не оказывающую ток-
сического действия, и служит основой для установления «допустимого суточно-
го поступления» — ДСП (см. §11 гл.З). Отношение дозы, безопасной в долго-
срочных токсикологических опытах, к концентрации в продукте питания назы-
вается степенью реальной безопасности.
В табл. 3 приведены значения степени реальной безопасности некоторых ве-
ществ, проявляющих консервирующее действие (чем выше значение степени ре-
альной безопасности, тем менее рискованно применение данного вещества).
Таблица 3. Степени реальной безопасности некоторых веществ
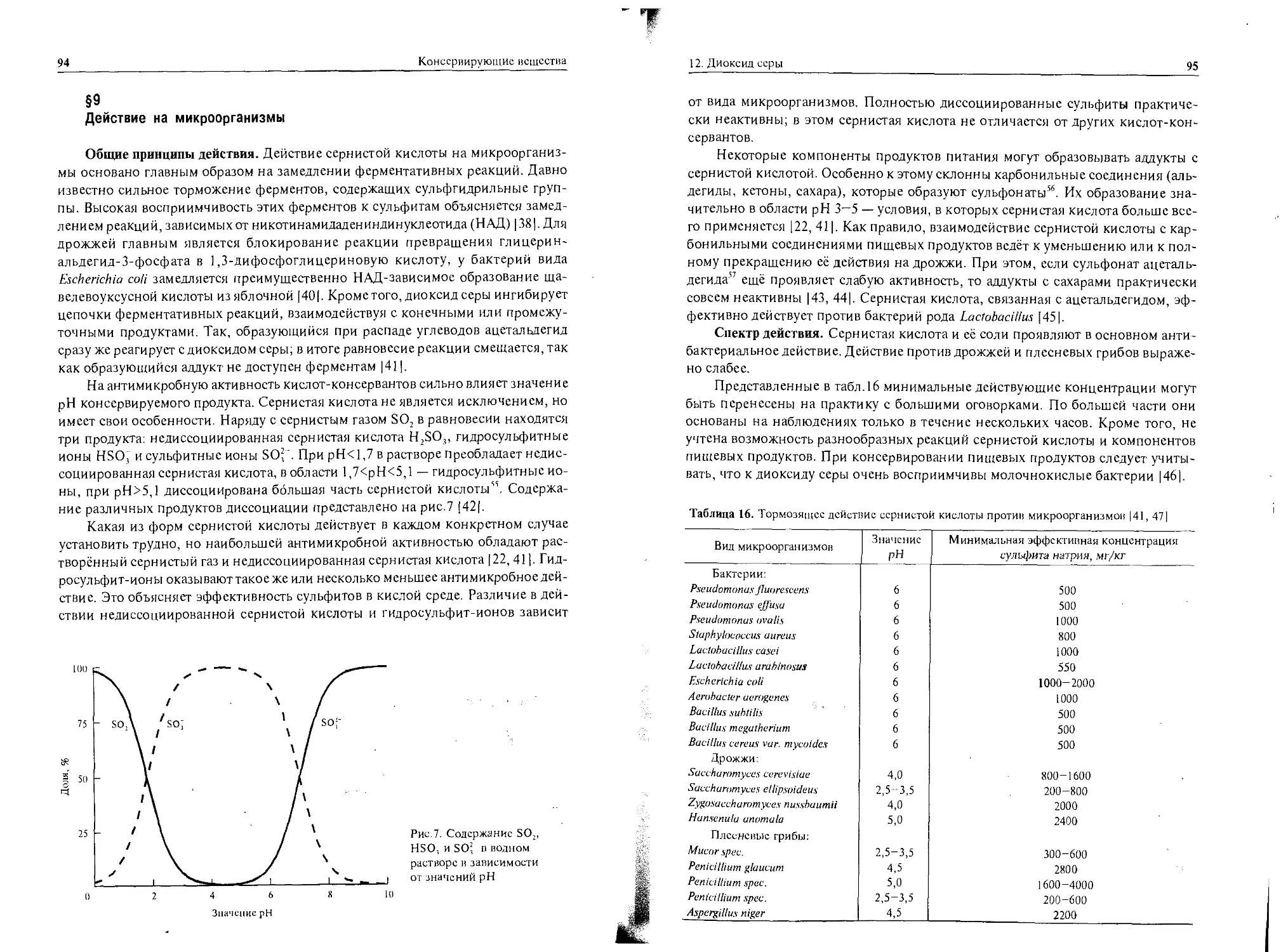
Вещество Хроническая переносимость, % в корме Концентрация в пищевых продуктах прямого потребления, % Степень рсалыюй безопасности
Муравьиная кислота 0,2 о,3 0,7
Бензойная кислота 1 0,1 10
Дифенил 0,1 0,005 20
Уксусная кислота 10 1 10
Этанол 4 До 3016 Около 0,13
Поваренная соль 1 2 0,5
Нитриты 0,02 0,01 2
Парабены 1 0,05 20
Пропионовая кислота 3 0,3 10
Диоксид серы 0,2 0,02 10
Сорбиновая кислота 5 0,1 50
Сахар Около 60 До 60 Около 1
Обратим внимание на то, что давно известные вещества, которые много-
кратно рекомендовались международными организациями в качестве консерван-
тов, имеют наименьшие степени реальной безопасности. Уточним, что добавки,
разрешённые в качестве консервантов, могут применяться только в довольно ма-
лом числе продуктов питания и в определённых законом количествах. В то же
время поваренная соль и сахар содержатся во многих продуктах питания не как
консерванты, к тому же в концентрациях гораздо больших, чем специализиро-
ванные консервирующие добавки.
3. Токсиколого-гигиенические аспекты
31
§9
Канцерогенность
Вспомогательные вещества и пищевые добавки могут приниматься вместе с
пищей длительное время, в том числе детьми и подростками, поэтому возмож-
ность их участия на различных стадиях канцерогенеза должна быть исследована
в высшей степени детально. Как известно, развитие опухолей — процесс дли-
тельный и поэтапный. В соответствии с концепцией многоступенчатости он мо-
жет быть подразделён на следующие фазы: экспозиция, инициация, промотиро-
вание, конверсия и прогрессирование |8, 9].
Согласно этой концепции вещества, с одной стороны, могут действовать как
инициаторы рака (например, генотоксичные агенты), а с другой стороны, в ка-
честве промоторов могут способствовать образованию опухолей (например, фор-
боловый эфир или этанол). Только совместное действие инициаторов и промо-
торов ведёт последовательно через конверсию (превращение предканцероген-
ных поражений в злокачественную опухоль) и прогрессирование (развитие и рас-
пространение метастазов) к формированию общей картины ракового заболевания.
Инициаторами возникновения рака в большинстве случаев являются гено-
токсичные вещества, т.е. вещества, способные ковалентно модифицировать ДНК.
Наряду с генотоксичными канцерогенами существуют негенотоксичные (эпиге-
нетические) канцерогены |10, 111, например сахарин, лимонен или бутилокси-
анизол, чьё действие обнаружено до сих пор только для некоторых видов живот-
ных. В случае генотоксичных агентов важно, является зависимость доза—дейст-
вие линейной или нет. Например, для формальдегида эта зависимость нелинейна,
так что может быть сомнительным наличие порогового значения индуцирован-
ного формальдегидом канцерогенеза17. Поскольку наибольшее значение для об-
разования опухолей имеют генотоксичные агенты, обнаружение ковалентного
связывания испытуемого вещества (или его метаболитов) с ДНК (ДНК-аддукта)
играет особую роль в выявлении его канцерогенного действия. У человека обра-
зование аддуктов ДНК с афлатоксином В, может быть обнаружено иммунологи-
чески или с помощью ВЭЖХ. Такие способы оценки риска получили название
«молекулярная дозиметрия» |3, 12, 13[.
Так как появлению опухоли может предшествовать значительный инкуба-
ционный период, канцерогенное действие вещества проверяют методом корм-
ления животного в течение всей жизни, начиная с возможно более раннего воз-
раста. Наиболее подходящие подопытные животные — мыши и крысы, посколь-
ку у них невелика продолжительность жизни. Как подопытная, так и контроль-
ная группы животных должны быть достаточно велики. Обычно канцерогенность
исследуют на двух видах животных.
Исследования по канцерогенности продолжительны и дороги; поэтому, а так-
же из соображений зашиты животных (нс в последнюю очередь) ведутся интен-
сивные поиски более быстрых методов испытаний. К сожалению, разработан-
ные до сих пор способы недостаточно надёжны и не могут полностью заменить
опыты на животных. Такого рода методом может служить тест на мутагенность
(см. §4 гл.З). Однако отсутствие мутагенности не гарантирует отсутствия канце-
рогенности. Некоторые вещества (преканцерогены), будучи сами по себе в этом
отношении безопасными, в организме превращаются в канцерогенные метабо-
32
Основы химического консервирования
литы (вторичные канцерогены), которые, например, соединяются с ДНК. В ре-
зультате они действуют как инициаторы канцерогенеза. Для проверки возмож-
ности такого взаимодействия тестируемое вещество, меченное радиоактивным
изотопом, вводится крысам; через несколько часов или дней из органов под-
опытных животных (предпочтительно печени) выделяют ДНК и определяют её
радиоактивность. Последняя служит мерой количества связанного исследуемого
вещества (индекс ковалентного связывания). Канцерогены и неканцерогенные
вещества отличаются по величине этого индекса в 1 — 100 тысяч раз 1141. Сущест-
вуют и другие способы определения наличия ковалентной модификации ДНК 13].
При проверке консервантов на канцерогенность их вводят перорально
(скармливают). При парентеральном введении появление опухоли в месте инъ-
екции не рассматривается как доказательство канцерогенности, если она остаёт-
ся локализованной в месте ввода и если нет иных доказательств канцерогенного
действия. Это связано с тем, что при инъекции (особенно многократной) пора-
жения тканей могут появляться из-за хронического раздражения и воспаления.
Такой процесс может не иметь ничего общего с действием исследуемого вещества.
Некоторый интерес представляют эпидемиологические исследования кан-
церогенности веществ, известных и уже длительное время применяемых в пище-
вой химии. Однако выводы таких исследований спорны из-за трудностей интер-
претации результатов. Для разрешённых к применению веществ эпидемиологи-
ческое изучение невозможно в любом случае1'1.
Важной проблемой при исследовании канцерогенного действия пищевых до-
бавок является оценка порогового значения, т.е. дозы, которая ещё не вызывает
нежелательного действия. Аргументы в пользу постулируемой некоторыми авто-
рами необратимости канцерогенных явлений базируются на исследованиях доза-
действие, на экспериментах, которые охватывали несколько поколений подо-
пытных животных, а также на концепции мутаций соматических клеток, как пер-
вом шаге канцерогенеза, и переноса возникших дефектов при делении клеток.
Проблема экстраполяции результатов опытов с высокими дозами с животных на
человека решена ещё не полностью.
Из опытов на животных известно, что многие вещества, которые в высоких
дозах проявляют канцерогенное действие, в малых дозах опухолей не дают (на-
пример, формальдегид).
Кроме того, известно множество веществ, которые в высоких концентраци-
ях проявляют канцерогенное действие и в то же время содержатся естественным
образом в продуктах питания (в малых количествах). Некоторые вещества, по-
требляемые в больших количествах с пищей и напитками (например, спирт), на
основании опытов с животными находятся под подозрением, как инициаторы
или, в меньшей мере, промоторы опухолей (пищевода, прямой кишки, молоч-
ной железы) 115, 16|. Особенно острая ситуация с проблемой канцерогенности
добавок существует в США. Там имеет силу закона так называемая поправка Де-
лани («Delaney anticancer clause»). Она гласит, что вещество не может быть разре-
шено к применению в продуктах питания, даже в ограниченном количестве, ес-
ли оно проявляет канцерогенное действие у человека или животного в любой,
даже самой высокой концентрации. Правда, поправка Делани имеет силу только
для добавок, но не для самих пищевых продуктов.
3. Токсиколого-гигиенические аспекты
33
§10
Аллергенное действие
Симптоматика, обозначаемая в обычном словоупотреблении как «пищевая
аллергия», в научном смысле делится на истинную пищевую аллергию (как им-
мунная реакция выработки комплексов антиген-антитело) и реакции неперено-
симости пищи (не связанные с иммунной системой).
Вопреки широко распространённому мнению, ответственными затакого рода
реакции чаще всего являются не консерванты и вообще не добавки, а естествен-
ные составляющие продуктов питания (белки орехов, коровьего молока, хлеб-
ных злаков) 117, 18].
Истинные пищевые аллергии (ИПА) — это так называемые аллергии немед-
ленного типа (реакция типа I), например сенной насморк. Они обусловлены уско-
ренным образованием специфических антител (иммуноглобулин Е) против аллер-
гена и сопровождаются выделением медиаторов, таких, как гистамин или бради-
кинин. Эти медиаторы, в конечном счёте, ответственны за симптомы ИПА. На-
следственная предрасположенность к такого вида реакциям называется атопией.
От ИПА следует отличать так называемую реакцию позднего типа (реакция ти-
па IV), которая протекает с участием не только антител, но и Т-лимфоцитов, мак-
рофагов и т. д. Пример такого рода реакции — аллергия на никелевые украшения.
От истинных аллергических явлений следует отличать непереносимость про-
дуктов питания (НПП), а также псевдоаллергические реакции (ПАР). НПП мо-
жет быть вызвана как врождёнными, так и приобретёнными ферментными де-
фектами (примеры: непереносимость лактозы, непереносимость алкоголя мно-
гими жителями Азии) и по своим симптомам (как и ПАР) трудноотличима от
истинной аллергии 119, 20].
Известно, что некоторые красители, антиоксиданты, ферментные препара-
ты и консерванты вызывают аллергию и реакции непереносимости. Для людей,
чувствительных к веществам такого рода, на потребительской упаковке продук-
товых товаров указываются содержащиеся в них добавки, чтобы эти люди могли
воздержаться от их употребления. Что касается консервантов, то здесь положе-
ние осложняется тем, что некоторые из них могут оказаться в составе пищи не
только искусственным, но и естественным путём, так как встречаются в нату-
ральных продуктах. Например, салициловая кислота уже давно не применяется
в качестве добавки, но люди, чувствительные к ней, могут страдать от аллергии,
так как это вещество встречается в природном продовольственном сырье. Бен-
зойная кислота, а также л-оксибензойная кислота и её эфиры и встречаются в
природе, и применяются в качестве искусственных добавок. Следовательно, оба
источника этих веществ могут быть причиной соответствующих реакций.
Из применяемых сегодня консервантов аллергенами считаются прежде все-
го сульфиты (особенно для астматиков) |21, 22], бензойная кислота |23, 24| и
парабены [23]. Пропионовая и сорбиновая кислоты аллергенами не являются [251.
34 Основы химического консервирования
§11
Допустимое суточное поступление
Самым надёжным способом проверки опасности консерванта были бы не-
посредственные испытания на человеке. Но по известным соображениям они
возможны только в конце успешного исследования и только в ограниченном объ-
ёме. Поэтому заключения о влиянии на человека приходится делать по результа-
там опытов на животных.
Объединённый комитет экспертов ФАО/ВОЗ” (JECFA) и Научная комис-
сия по пищевым добавкам Европейского Сообщества (SCF) устанавливают на
основе результатов токсикологических исследований величину допустимого су-
точного поступления — ДСП (acceptable daily intake — ADI). ДСП определяет
количество вспомогательного вещества или пищевой добавки (в миллиграммах
на 1 кг массы тела в день), которое может потребляться человеком в течение всей
жизни. ДСП указывает границу, незначительные нарушения которой допустимы
|26, 27|.
ДСП равно дозе вспомогательного вещества или пищевой добавки, которая
ещё не оказывает токсического действия в опытах по хронической токсичности
(NOEL, см. §8 гл.З), делённой на коэффициент безопасности. Этот коэффици-
ент обычно принимается равным 100. Он может быть больше, если для этого есть
особые причины, либо меньше, если речь идёт о веществе, которое является обыч-
ной составляющей пиши человека, или если путь распада данного вещества по-
добен пути распада обычных компонентов пищи 128, 291.
Коэффициент безопасности учитывает следующие обстоятельства:
— токсикологические исследования пищевых добавок проводят в основном
на животных; перенесение на человека результатов опытов с животными сопря-
жено с некоторым, пусть даже небольшим, риском;
— многие животные в расчёте на 1 кг массы тела потребляют пищи больше,
чем человек (крыса, например, в 7—8 раз);
— часто в пище содержится несколько добавок одновременно; хотя синер-
гизм в токсикологии редок, его возможность тоже должна быть учтена;
— продукты, содержащие пищевые добавки, потребляются в числе прочих
и людьми, имеющими особенности метаболизма, — детьми, больными, пожилы-
ми людьми, беременными и кормящими грудью; это вносит дополнительный фак-
тор риска, который учитывается при установлении ДСП;
— значение ДСП устанавливается в расчёте на потребление продукта с пи-
щевой добавкой в течение всей жизни, а также учитывает вариации индивиду-
ального потребления.
В тех случаях, когда JECFA считает, что токсикологическая безопасность
вещества выяснена ещё недостаточно, устанавливается временное ДСП. Суще-
ственные составляющие продуктов питания, нормальные продукты обмена ве-
ществ человеческого организма или вещества очень малотоксичные имеют не-
ограниченное ДСП.
Если в токсикологической безопасности уже разрешённого вещества появ-
ляются сомнения, то статус его ДСП «понижается» с постоянного до временного
и предлагается провести дополнительные исследования. Так, SCF в феврале
1994 года перевела значения ДСП для бензойной кислоты и парабенов (соответ-
3 Токсиколого-гигиенические аспекты
35
ственно 0—5 и 0—10 мг на 1 кг массы тела) из постоянных во временные и пред-
полагала по окончании дополнительных исследований в 1996 году заново их об-
судить. JECFA пока не присоединилась к этому решению, т.е. эти две организа-
ции предлагают одинаковые по значению, но разные по статусу величины ДСП.
В значениях ДСП, установленных JECFA и SCF, могут существовать и количе-
ственные различия. В настоящее время для консервантов действуют значения
ДСП, приведённые в табл. 4.
Доза исследуемого вещества, лежащая в основе ДСП (т.е. не оказывающая
токсического действия, NOEL), указывается на 1 кг массы тела. В то же время,
если в опытах на животных исследуемое вещество добавляется в корм, то и при-
водят его содержание в корме. Для пересчёта доз из одной системы в другую
достаточно знать массу животного и количество потребляемого им корма. При-
меры приведены в табл. 5.
Непосредственный переход от ДСП к концентрациям, разрешённым в про-
дуктах питания, затруднителен. Тем не менее установленное значение ДСП
необходимо для законодателя, как опорная точка при разрешении добавки и ус-
тановлении максимальных её концентраций в пищевом продукте. Можно отме-
тить (принимая во внимание коэффициент безопасности), что кратковременные
превышения ДСП не несут никакого риска.
Фактическое потребление пищевых добавок обычно значительно ниже ДСП.
Расчёты показывают, что потребление консервантов в Германии составляет 1—
10% от ДСП 130]; однако есть и исключения, например диоксид серы.
От ДСП следует отличать «допустимый уровень» (permissible level — PL),
«терпимый ежедневный приём» (duldbare tagliche Aufnahme— DTA) и «условно
Таблица 4. Допустимое суточное поступление некоторых консервантов (по JECFA)
Вещество ДСП, мг/кг, не более
Муравьиная кислота и ос соли 3*
Бензойная кислота и се соли 5*
Бифенил (дифенил) 0,05
Уксусная кислота и се соли Не ограничено
Гексаметилентетрамин 0,15
Метиловый эфир л-оксибснзойной кислоты 10*
Этиловый эфир и-оксибензойной кислоты 10’
Пропиловый эфир и-оксибензойной кислоты 10*
Лизоцим Применение допустимо
Нитраты натрия и калия 5
Нитриты натрия и калия 0,2**
Молочная кислота и её соли Нс ограничено
Натамицин (пимарицин) 0,3
Низин 33 000 (ME)
Диацстат натрия 15
о-Фенилфенол 0,2
Пропионовая кислота и её соли Нс ограничено
Сернистая кислота и сё соли 0,7*
Сорбиновая кислота и сс соли 25*
Перекись водорода Не установлено
* Групповое ДСП (в пересчете на кислоту).
** Кроме продуктов для детского питания, в которые добавление нитриюв запрещено.
36
Основы химического консервирования
Таблица 5. Взаимный пересчет токсикологических данных
Вид животных Средняя масса, кг Среднее потребление корма за день, г Количество добавки, мг
на 1 кг массы тела в день, при её содержании в корме 1 мг/кг на 1 кг корма, при её потреблении 1 мг на 1 кг массы тела в день
Мыши 0,02 3 0,150 6,7
Молодняк крыс 0,1 10 0,100 10
Взрослые крысы 0,4 20 0,050 20
Морские свинки 0,75 30 0,040 25
Кролики 2,0 60 0,030 33
Собаки 10,0 250 0,025 40
переносимое недельное поступление» (provisional tolerable weekly intake — PTWI).
Допустимый уровень выражается в миллиграммах на 1 кг пищевого продукта и
представляет собой произведение ДСП и массы тела, делённое на долю данного
пищевого продукта в усреднённом рационе. Этот уровень указывает предельную
концентрацию добавки в продукте питания, при которой его среднестатистиче-
ское потребление не приводит к превышению ДСП добавки. Для пестицидов,
ввиду отсутствия для них значений ДСП, Федеральным управлением здравоохра-
нения Германии устанавливается терпимый ежедневный приём |31, 32|. Значе-
ния условно переносимого недельного поступления устанавливаются ФАО/ВОЗ
для тяжёлых металлов и остатков фармакологических препаратов.
§12
Смеси консервантов
На практике часто используют смеси различных консервантов. Не исключе-
но, что смеси могут иметь иные токсикологические свойства, чем отдельные веще-
ства. Оказалось, что это не относится к LD,(I, а также к субхронической токсич-
ности при скармливании 2—20% от LD5() в течение 6 месяцев. Исследования про-
водили с дегидрацетовой, сорбиновой, бензойной, салициловой, пропионовой
кислотами, этиловым, пропиловым и бутиловым эфирами л-оксибензойной ки-
слоты (частично в виде натриевых солей) и фурилфурамидом. Обнаружено, что
только сочетание бензойной кислоты и сульфита ведёт себя в опыте по хрониче-
ской токсичности несколько хуже, чем каждое из этих веществ в отдельности 1331.
Смеси нитритов и сорбиновой кислоты в повышенных дозах проявляют ток-
сическое действие не сильнее, чем соответствующие количества нитрита сами по
себе. Скармливание смеси из 13 пищевых добавок, чаще всего используемых в
Японии, в течение 12 месяцев показало, что при 10-кратном превышении по от-
ношению к ежедневно потребляемому количеству наблюдается лишь небольшое
токсическое действие; это действие было существенным только при 100-кратной
передозировке. Среди этих добавок были следующие консерванты; бензоат на-
трия, сорбат калия, пропионат натрия, бутиловый эфир л-оксибензойной ки-
слоты, дифенил и натриевая соль дегидрацетовой кислоты.
Глава 4
Пищевое законодательство
§1
История пищевого законодательства
Общество интересовалось вопросами качества пищевых продуктов уже очень
давно. Раннее пищевое законодательство касалось в основном контроля меры и
веса, а также грубых фальсификаций пищевых продуктов. Первые предписания,
касавшиеся пищевых консервантов, были направлены против чрезмерного оку-
ривания вина серой. В 1497 году оно было осуждено рейхстагом Линдау, а в
1498 году — рейхстагом Фрейбурга в Брейсгау. Себастьян Брант в 1494 году в
своей поэме «Корабль дураков» упоминает и о фальсификации вина:
Исчезло чистое вино,
Теперь — Бой знает что оно!
£Ейо поЬЬелывают хитро:
3?оташ Берётся и селитра,
Корица, сера и йорчица,
«Сухая кость — реБро, ключица,
Коренья, всяческое зелье —
бот нынешнее винойелье!
бею зту йайость в Бочки льют —
беременные жёны пьют
®, раньше времени полнея,
бе оБольщают нас сильнее.
бывает, что вино такое
беЬёт и к вечному покою...
(Перевод Л. Пеньковского)
Более конкретные постановления о консервантах в пищевых продуктах по-
явились в XIX веке, когда потребовалось пресечь злоупотребления ими |1|.
В 1900 году на X Международном конгрессе гигиенистов в Париже было даже
выдвинуто требование полного запрета пищевых консервантов. Но законодатель-
ные органы не последовали этому предложению. Напротив, было признано, что
разумное и ограниченное использование консервантов допустимо и что без хи-
мического консервирования невозможно рациональное и безопасное питание
широких слоёв населения.
38 Основы химического консервирования
§2
Современные мировые тенденции
С 50-х годов нашего века ощутимо усилилось стремление согласовать пище-
вое законодательство в международных масштабах. Одной из причин этого стал
всё возрастающий поток товаров через государственные границы. Основы на-
ционального и международного регулирования в этой области заложены на засе-
даниях JECFA (проходящих с 1954 года) и комиссии Codex alimentarius™.
Вплоть до начала XX века пищевое законодательство многих стран ограни-
чивалось запретом на использование вредных для здоровья веществ с указанием
названий некоторых из них. Такой подход недостаточен для надёжной защиты
потребителя — необходима всеобщая система так называемых положительных
списков. Последнее означает, что запрещается применение всех веществ, кроме
тех, которые разрешены особым предписанием. Кроме того, для разрешённых
веществ дополнительно предписывается, какие из них, в каких пищевых про-
дуктах и в каких максимальных количествах могут применяться. В частности,
консерванты могут использоваться только в тех пищевых продуктах, для кото-
рых это действительно имеет смысл. При определении максимально допустимых
количеств ориентируются на технологическую необходимость с учётом разумно-
го уровня безопасности.
Использование консервантов часто регулируется особыми предписаниями,
например в Великобритании. В некоторых странах, например во Франции, кон-
серванты рассматриваются в постановлениях для конкретных пищевых продук-
тов. С недавних пор наметилась тенденция регулировать использование консер-
вантов совместно с другими пищевыми добавками, как это давно принято в Скан-
динавии, Швейцарии и Германии. ЕЭС в рамках общего подхода к пищевым
добавкам в очень подробных положительных списках определило, какие кон-
серванты, для каких пищевых продуктов, в каких максимально допустимых ко-
личествах и при каких условиях могут применяться.
§3
Критерии допуска к использованию
Международное мнение уже давно едино в том, что пищевые добавки (а зна-
чит и консерванты) могут быть разрешены только в том случае, если они техно-
логически необходимы, не представляют риска для здоровья и используются в
интересах потребителя.
В приложении II к директиве Совета по согласованию правовых норм госу-
дарств-участников по добавкам в пищевых продуктах (89/107/EWG от 21.12.88)
сказано, что пищевую добавку можно применять только при соблюдении следу-
ющих условий:
— убедительно доказана технологическая необходимость, и поставленная
цель не может быть достигнута другими экономическими и технологическими
методами;
— добавка в предлагаемой дозе безвредна для здоровья потребителя, насколь-
ко об этом позволяют судить имеющиеся научные данные;
4. Пищевое законодательство
39
— потребитель не вводится в заблуждение.
При установлении предельно допустимых количеств учитывают как ДСП
(см. §10 гл.З), так и требование разрешать соответствующий консервант только в
той дозе, которая необходима для достижения желаемого эффекта. Все консер-
ванты находятся под постоянным наблюдением. При изменении условий при-
менения и появлении новой научной информации их статус может быть изме-
нён (см. §11 гл.З).
Пищевые консерванты должны удовлетворять требованиям к чистоте
(см. §3 гл.2).
Таблица 6. Список консервантов, разрешённых в Европейском Союзе
для применения в пищевых продуктах21
Индекс Наименование Индекс Наименование
Е200 Сорбиновая кислота Е231 о-Фенилфснол
Е202 Сорбат калия Е232 о-Фснилфенолят натрия
Е2ОЗ Сорбат кальция Е233 Тиабсндазол
Е210 Бензойная кислота Е234 Низин
Е211 Бензоат натрия Е235 Натамицин (пимарицин)
Е212 Бензоат калия Е239 Гексаметилентетрамин
Е213 Бензоат кальция Е242 Димстилдикарбонат
E2I4 Этил-и-гидроксибснзоат Е249 Нитрит калия
E2i5 Натриевая соль Е250 Нитрит натрия
этил-л-гидроксибензоата Е251 Нитрат натрия
Е216 Пропил-и~гидроксибснзоат Е252 Нитрат калия
Е217 Натриевая соль Е260 Уксусная кислота
пропил-л-гидрокеибензоата E26I Ацетат калия
E2I8 Мстил-и-гидроксибензоат Е262 Ацетат натрия
Е219 Натриевая соль Е263 Ацетат кальция
мстил-л-гидроксибензоата Е270 Молочная кислота
Е220 Диоксид серы Е280 Пропионовая кислота
Е221 Сульфит натрия Е281 Пропионат натрия
Е222 Гидросульфит натрия Е282 Пропионат кальция
Е223 Пиросульфит натрия Е283 Пропионат калия
Е224 Пиросульфит калия Е284 Борная кислота
Е226 Сульфит кальция Е285 Тетраборат натрия (бура)
Е227 Гидросульфит кальция Е290 Диоксид углерода
Е228 Бисульфит калия E94I Азот
Е230 Дифенил (бифенил) Е| 105 Лизоцим
Глава 5
Антимикробное действие консервантов
5
§1
Общие механизмы действия
Консерванты в пищевых продуктах замедляют рост и развитие бактерий, плес-
невых грибов и дрожжей, а также обмен веществ в них.
Угнетающее н убивающее действие. На практике часто различают фунгиста-
тическое (угнетающее грибы) или бактериостатическое (угнетающее бактерии)
действие, с одной стороны, и фунгицидное (убивающее грибы) или бактерицидное
(убивающее бактерии) действие — с другой. При более точном рассмотрении та-
кое разделение оказывается необоснованным. Фунги- и бактериостатики отли-
чаются от фунги- и бактерицидов только скоростью антимикробиотического дей-
ствия. При добавлении консерванта в пищевой продукт микроорганизмы могут
погибнуть или продолжать расти — результат зависит от концентрации консер-
ванта (рис. 2) 111.
Гибель всех микроорганизмов при использовании обычных концентраций
консерванта происходит в течение нескольких дней или недель. В этом заключа-
ется существенное различие между консервантами и средствами дезинфекции.
Последние применяются только тогда, когда микроорганизмы должны бытьунич-
Рис. 2. Изменение числа бактерий в зависимости от концентрации вещества,
проявляющего антимикробное действие
5. Антимикробное действие консервантов
41
тожены очень быстро. Зависимость скорости отмирания микроорганизмов под
действием консервантов от времени описывается уравнением для мономолеку-
лярного процесса:
К = ln(Z„/Z)/t или Z, = Z(, е-к',
где К — константа скорости отмирания;
t — время;
Z„ — число живых клеток в начальный момент (с = 0);
Z, — число живых клеток в момент времени t.
Эта закономерность строго соблюдается только при относительно высокой
концентрации консерванта и моноклональной популяции микроорганизмов. Кро-
ме того, она справедлива только для закрытой системы, в которой не могут про-
исходить ни разбавление консерванта, например путём его улетучивания, ни из-
менение pH22, ни добавление других микроорганизмов (новое инфицирование).
Но даже если указанные условия соблюдаются не полностью (как часто и бывает
в практике консервирования), описанная выше «кинетика отмирания» может рас-
сматриваться как основа для оценки действия консервантов в пищевых продуктах.
Добавление консервантов в пищевые продукты имеет смысл только в том
случае, если они применяются в достаточной концентрации. Развитие микроор-
ганизмов следует остановить на начальной (линейной) стадии их размножения,
а не тогда, когда их рост стал экспоненциальным. Во-первых, в экспоненциаль-
ной стадии необходимы слишком высокие дозы консервантов, во-вторых, кон-
серванты не предназначены для уничтожения микроорганизмов в сильно обсе-
менённых субстратах, т.е. для возвращения уже испорченных пищевых продук-
тов в мнимосвежее состояние. С помощью обычных концентраций большинства
консервантов это и невозможно. Поэтому консерванты непригодны для компен-
сации нарушений производственной гигиены.
Действие на микроорганизмы. Механизм действия консервантов на возбу-
дителей порчи многообразен. Здесь играют роль и физические, и физико-хими-
ческие, и биохимические факторы. Чаще отдельные факторы действуют совме-
стно, но иногда блокируется одна-единственная стадия метаболизма клетки мик-
роорганизма. Бактерии, как известно, образуют споры — консерванты угнетают
определённые фазы прорастания спор (рис. 3) |2|.
Антимикробное действие консерванта (рис. 4) можно объяснить его воздей-
ствием:
- на ДНК,
— на синтез белка,
— на активность ферментов,
— на клеточную мембрану,
— на клеточную оболочку,
— на механизмы транспорта питательных веществ.
Иной механизм действия у веществ, которые снижают активность воды в
субстрате, угнетая тем самым рост и развитие микроорганизмов. Упаковка, по-
крытия, масла и защитная атмосфера затрудняют развитие аэробов, препятствуя
доступу кислорода к пищевым продуктам. Все эти вещества, как правило, не уби-
вают микробов, а лишь угнетают развитие. Когда их действие прекращается, вновь
начинается рост вредных микроорганизмов и происходит порча продукта.
42
Основы химического консервирования
Развитие
зародыша
Набухание
Рис. 3. Этапы развития бактерии от споры до делящейся клетки
с указанием стадий, уязвимых для антимикробных веществ [2]
Основной причиной антимикробного действия консервантов раньше счита-
лось их угнетающее действие на ферментативные процессы, а также на синтез
ферментов и белков в микроорганизме. В последнее время главным стали при-
знавать действие консервантов на клеточную оболочку и мембраны |3—7|. Липо-
фильные вещества, каковыми являются большинство пищевых консервантов, ата-
куют клеточную мембрану и разрушают её или нарушают её целостность |81. В
результате поток протонов в клетку увеличивается и последняя вынуждена по-
треблять больше энергии, чтобы компенсировать проникающую в нейтральное
внутреннее пространство клетки кислоту (консервирующую) [6, 7| и возникаю-
щую разность потенциалов |7|.
Для антимикробного действия консерванту требуется достаточная раство-
римость как в воде, так и в жирах. С одной стороны, развитие микроорганизмов
происходит исключительно в водной фазе, и консервант должен находиться там.
С другой стороны, он должен быть в состоянии проникать через гидрофобную
клеточную оболочку (9, 10].
Рис. 4. Возможные мишени для действия антимикробных веществ
н клетке микроорганизма |3|
5. Антимикробное действие консервантов
43
Для консервантов имеет место чёткая зависимость доза—действие. По этой
причине консервант следует добавлять в достаточной концентрации. Механизм
действия отдельных консервантов описывается в специальных главах, посвящён-
ных соответствующим веществам.
§2
Спектр действия консервантов
Эффективность конкретного консерванта неодинакова в отношении плес-
невых грибов, дрожжей и бактерий, т.е. он не может быть эффективен против
всего спектра возможных возбудителей порчи пищевых продуктов. Большинст-
во консервантов, находящих практическое применение, действует в первую оче-
редь против дрожжей и плесневых грибов. Некоторые консерванты малоэффек-
тивны против определённых бактерий, так как в области оптимальных для бак-
терий значений pH (часто это нейтральная среда) они слабо проявляют своё дей-
ствие. Впрочем, такие бактерии не развиваются в средах с pH, благоприятным
для применения консервантов.
В литературе имеется большое количество данных об эффективности кон-
сервантов в отношении отдельных микроорганизмов. Некоторые из них проти-
воречивы. Сравнивать можно только сведения, полученные в стандартных усло-
виях. Представление о применимости тех или иных консервантов можно получить
из табл. 7. Конкретные сведения об эффективных концентрациях следует искать
в главах, посвящённых отдельным веществам.
Таблица 7. Эффективность некоторых консервантов по отношению к микроорганизмам
Консервант Бактерии Дрожжи Плесневые грибы
Нитриты ++ - -
Сульфиты ++ + + +
Муравьиная кислота + + + + +
Пропионовая кислота + + + + +
Сорбиновая кислота ++ ++ + +++
Бензойная кислота + + +++ +++
л-Оксибснзоаты ++ +++ +++
Дифенил - ++ + +
— — неэффективен
+ — малая э(|х|)сктивиос'1ь
++ — средняя эффективность
+ + + — высокая эффективность
§3
Возникновение устойчивости к консервантам
Из медицинской практики известно, что некоторые микроорганизмы могут
приобретать устойчивость к действующим на них веществам. Под устойчивостью
понимают способность микроорганизмов с увеличением числа воздействий пе-
реносить более высокие концентрации антимикробных веществ. При этом раз-
44
Основы химического консервирования
личают не передающуюся по наследству (адаптационную) и наследуемую (мута-
ционную) устойчивость. Первая исчезает, если прекращается действие антимик-
робного вещества. Во втором случае устойчивость остаётся и после прекращения
воздействия. Устойчивость приобретают прежде всего бактерии и особенно к ан-
тибиотикам. В медицине и в области защиты растений ведутся поиски веществ,
которые могут делать устойчивость микроорганизмов обратимой 1111.
Отметим, что не следует смешивать понятие устойчивости микроорганизма
с отсутствием (или наличием лишь слабого) угнетающего действия вещества или
со способностью микроорганизма к разрушению антимикробного вещества.
Следствием истинной устойчивости микроорганизмов к пищевым консерван-
там является существенный экономический ущерб в пищевой промышленности и,
опосредованно, ущерб здоровью. Хорошо изучено формирование устойчивости бак-
терий и грибов к пищевым консервантам [12]. Его наблюдали, например, при ис-
пользовании тиабендазола для сохранения цитрусовых 113|. Описана устойчивость
конкретных штаммов микроорганизмов (Listeria monocytogenes Scott А) к определён-
ным консервантам (низин). В данном конкретном случае причинами возникнове-
ния устойчивости оказались существенные структурные и функциональные изме-
нения мембран и появление способности к разрушению низина 114|.
Для антибиотиков, не применяемых в консервировании пищевых продук-
тов (пенициллин, тетрациклин, окситетрациклин, хлортетрациклин), коэффи-
циенты увеличения устойчивости составляют от 15 до 150, а для стрептомици-
на — даже 1670 115]. Устойчивость Escherichia coli к антибиотикам можно возоб-
новить действием сублетальной дозы сорбиновой кислоты 116|. Возможность фор-
мирования устойчивости к антибиотикам — основная причина отказа от их при-
менения в качестве пищевых консервантов. Если иногда антибиотики всё-таки
применяются в консервировании, то только те из них, которые не используются
в терапевтических целях.
§4
Применение смесей консервантов
В медицине различные субстанции иногда используют в сочетании друг с
другом, чтобы достичь усиления или изменения действия отдельных компонен-
тов. В консервировании тоже применяют эмпирически подобранные комбина-
ции консервантов. При использовании таких смесей в пищевой технологии можно
ожидать следующих результатов 117}:
— расширение спектра действия;
— усиление антимикробного эффекта;
— уменьшение концентрации отдельных консервантов.
Расширение спектра действия. Любой консервант эффективен только про-
тив части возбудителей порчи, встречающихся в продуктах питания. Это ограни-
чение можно обойти, используя смеси консервантов. Теоретически такие смеси
могут иметь спектр действия, отличающийся от суммы спектров обоих компо-
нентов (в том числе и более широкий). В таком случае смесь может оказаться
эффективной против микроорганизмов, против которых отдельные её компо-
5. Антимикробное действие консервантов
45
ненты неэффективны (181. Например, многие бактерии в большей степени угне-
таются смесью сорбиновой и бензойной кислот, чем каждой в отдельности 119, 20|.
Основной практический интерес представляет сочетание бензойной и сор-
биновой кислот (действующих преимущественно против дрожжей и плесеней) с
антибактериальными консервантами. В качестве последнего наибольшее значе-
ние имеет сернистая кислота (особенно для продуктов растительного происхож-
дения). В этом случае одновременно используются её противоферментные и ан-
тиокислительные свойства.
Изменение антимикробного действия. При совместном использовании двух
и более консервантов возможны три варианта:
— простое сложение;
— синергизм;
— антагонизм.
При простом сложении смесь действует как сумма её составляющих; в слу-
чае синергизма она проявляет угнетающее действие в меньшей концентрации,
чем каждый из компонентов по отдельности; при антагонизме эффект противо-
положен — для смеси необходима более высокая концентрация, чем для индиви-
дуальных консервантов.
Применение синергически действующей смеси позволяет достигнуть сни-
жения общего содержания консервантов в продукте питания и уменьшения воз-
можных побочных эффектов (в частности — органолептических) 1181. К сожале-
нию, до сих пор нет надёжных данных о влиянии одних консервантов на дейст-
вие других [19—23]. Синергический эффект, который удавалось наблюдать в ла-
бораторных условиях, настолько мал, что не имеет практического значения. Ве-
роятно, большинству комбинированных препаратов (которые раньше продава-
лись во множестве) оказывали предпочтение в сравнении с чистыми консерван-
тами скорее по коммерческим причинам.
Одной из разновидностей синергизма можно считать сочетание консерван-
та длительного действия (например, сорбиновой кислоты) с быстро, но недолго
действующим (например, диэтилпирокарбонатом) 124|. Последний быстро унич-
тожает имеющиеся бактерии, а сорбиновая кислота защищает от вторичного ин-
фицирования.
Положительный эффект может давать применение консервантов совместно
с теми веществами, которые уменьшают диссоциацию кислот или вызывают ос-
мос и снижают равновесную влажность продуктов (поваренная соль или сахар).
§5
Сочетание консервантов с физическими способами консервирования
Зачастую имеет смысл не только совместное применение нескольких кон-
сервантов, но и сочетание консервантов с физическими приёмами консервиро-
вания — нагреванием, охлаждением, облучением, сушкой, обработкой высоким
давлением, токами высокой частоты или импульсными электрическими полями.
Такое сочетание может снижать нежелательное побочное действие отдельных спо-
собов. Следует отметить, что добавление консервантов требует меньших энерге-
тических затрат, чем использование физических способов консервирования.
46
Основы химического консервирования
Совместное использование нескольких способов консервирования имеет дос-
таточно древнюю историю. Мумифицирование тел в Древнем Египте (хотя му-
мии безусловно нельзя отнести к продуктам питания) по существу представляло
собой консервирование с помощью целого набора приёмов — снижение актив-
ности воды, сдвиг pH в неблагоприятную для роста бактерий область, примене-
ние антибактериальных веществ |25|. Квашение и маринование тоже сочетают
разные методы — понижение pH вследствие образования или добавления кисло-
ты и снижение активности воды под действием поваренной соли2’. При копче-
нии сочетаются химические и физические факторы — воздействие антимикроб-
ных составляющих дыма дополняется подсушиванием. Для сохранения рыбных
пресервов уже десятки лет используют сочетание холода и добавления бензой-
ной кислоты.
Комбинирование различных факторов в последние годы систематически изу-
чал Лейстнер, который ввёл понятие «технологии барьеров» 126-291. Он пришёл
к выводу, что несколько тормозящих факторов (барьеров) замедляют развитие
микроорганизмов, если эти барьеры установлены в продукте в достаточном числе
и на нужной «высоте» (даже если каждый барьер в отдельности недостаточен для
угнетения микробов). На рис. 5 представлена упрощённая схема этой концепции.
Важнейшими барьерами для микроорганизмов служат:
— низкая начальная обсеменён ность;
— низкая температура хранения;
— низкое значение pH;
— низкая активность воды;
Рис. 5. Технология барьеров (4 примера) 127]
Примеры / и 2 — решающим для торможения является консервант, пример .? — значение pH, пример 4 —
отсутствуют барьеры, достаточные для консервирования; обозначения: и, — активность воды; pH — водо-
родный показатель; Е — окислитсльно-восс1анови1'сльный потенциал; t — температура (нагрев, охлажде-
ние); коне. — консервант
5. Антимикробное действие консервантов
47
— минимальное воздействие кислорода;
— высокая температура тепловой обработки;
— достаточная концентрация консервантов.
Консерванты и нагрев. Пониженные и повышенные температуры быстрее
приводят к гибели микроорганизмов в присутствии консервантов, чем в их от-
сутствие. Другими словами, при одной и той же температуре микробы скорее
погибают при наличии консервантов, чем без них. Это подтверждено в лабора-
торных опытах со многими видами бактерий и большинством обычных консер-
вантов, например: с дрожжами и бензойной или салициловой кислотами |30—
331, дрожжами и пимарицином |34|, дрожжами и сорбиновой кислотой |31—33,
35, 36], плесневыми грибами и бензойной кислотой 137], плесневыми грибами и
сорбиновой кислотой |371, атакже бактериями рода Salmonella и сорбиновой ки-
слотой 138 [. Снижение активности воды (поваренной солью или сахаром) усили-
вает устойчивость дрожжевых клеток к воздействию нагрева 139, 401. Добавление
сорбиновой или бензойной кислоты делает дрожжи восприимчивыми даже при
пониженной активности воды 140, 41].
Синергизм температуры и консервантов не столь велик, чтобы иметь большое
практическое значение.
Консерванты и холод. Совместное действие консервантов и низких темпе-
ратур подчиняется тем же закономерностям, которые описаны для высоких тем-
ператур. Концентрации консервантов, которые при комнатной температуре не
могут предотвратить порчу, при хранении пищевого продукта на холоде стано-
вятся достаточными 11, 421.
Консерванты и облучение. Добавление консервантов позволяет уменьшить
дозу облучения при обработке продуктов питания с помощью ионизирующей ра-
диации. Как in vitro, так и на практике был установлен синергизм между консер-
вантами и ионизирующим излучением, например для рыбопродуктов |43|. Кро-
ме того, консерванты (например, сорбиновая кислота) могут уменьшать такие
явления, вызванные облучением, как посторонний привкус или изменение окрас-
ки, т.е. выступать в роли радиопротекторов |44|. Использование консервантов
совместно с ионизирующим излучением предполагает их достаточную радиаци-
онную стабильность |45|. Установлено, что антимикробное действие УФ-лучей
усиливается в присутствии консервантов, например сорбиновой кислоты |4б|.
§6
Консервирование как защита от токсинобразующих микроорганизмов
Если раньше консерванты применяли в продуктах питания исключительно
из экономических соображений, то сегодня их всё чаще используют с целью за-
щиты от токсинобразующих микроорганизмов24. Фактически применение кон-
сервантов имеет профилактический характер. Предотвращая порчу продуктов пи-
тания, они уменьшают опасность образования токсинов. Такая профилактика тем
более важна, что образовавшееся ядовитое вещество не может быть удалено из
пищи или корма.
Против токсинобразующих бактерий консерванты использовались давно, хотя
и неосознанно. Так, нитриты и нитраты применяют в производстве солений не
48
Основы химического консервирования
только для придания продуктам привычной окраски. Нитриты препятствуют раз-
витию бактерий рода Clostridium и, следовательно, образованию ботулотоксина.
Поскольку нитриты сравнительно токсичны, в начале 80-х годов была проведена
большая работа по исследованию действия на токсинобразующие бактерии, осо-
бенно рода Clostridium, иных консервантов (совместно с пониженными количе-
ствами нитрита или в его отсутствие). Хорошие результаты были достигнуты с
сорбиновой кислотой. Однако она не может заменить нитрит в части окрашива-
ния мяса в красный цвет и придания ему характерного аромата соления.
Использование консервантов против токсинобразующих грибов позволяет
снизить опасность загрязнения пищи микотоксинами |47, 481. Такого рода опас-
ности в большой степени подвержены твёрдые сыры, твёрдокопчёные колбасы,
фруктовые продукты и выпечка (примерно треть спонтанно растущих на амери-
канском эмментальском сыре плесневых грибов образуют микотоксины |49|).
Наиболее технологичный способ борьбы с загрязнением этих продуктов мико-
токсинами — применение консервантов.
Особенно хорошо изучено действие на токсинобразующие грибы сорбино-
вой кислоты 150—58[. Другие консерванты (например, пропионовая и бензойная
кислоты или натамицин) тоже препятствуют образованию токсинов 154, 59, 601.
Сорбиновая кислота сильнее подавляет образование микотоксинов, чем разви-
тие соответствующих плесневых грибов |50, 55, 56]. В культурах Aspergillusparaci-
ticus, находящихся в состоянии покоя (но не роста), сорбиновая кислота подав-
ляет синтез афлатоксина 1611. Также действуют и пропионаты 1621. При высокой
обсеменённости в благоприятной среде грибы продолжают развиваться в при-
сутствии 3 г сорбата калия на 1 кг продукта, однако образование микотоксинов
при этом подавляется |60|. В подпороговой концентрации пропионовая |63| и
сорбиновая 163, 641 кислоты могут способствовать образованию афлатоксина.
Сульфиты в определённых условиях разрушают афлатоксины |65|. Теорети-
чески они могли бы использоваться для «деконтаминации» поражённых продук-
тов, но такой способ рекомендовать нельзя. Следует предотвращать рост плесне-
вых грибов и связанное с ними образование афлатоксинов добавлением консер-
вантов.
§7
Влияние свойств субстрата на действие консервантов
Эффективность консервантов зависит от состава и физико-химических
свойств консервируемого пищевого продукта. На неё могут влиять вещества, ко-
торые изменяют pH или активность воды либо селективно адсорбируют консер-
ванты, а также природные составляющие продукта, которые сами проявляют ан-
тимикробное действие. Некоторые из этих факторов усиливают действие кон-
сервантов, а другие ослабляют. По этим причинам используемая концентрация
консерванта в пищевом продукте часто отличается от минимальной действую-
щей концентрации, определённой in vitro.
Влияние водородного показателя. Консерванты, способные к электролити-
ческой диссоциации, могут проявлять антимикробное действие либо за счёт об-
разующихся ионов водорода, либо в виде недиссоциированных молекул25.
5. Антимикробное действие консервантов
49
Примером консерванта, который действует посредством ионов водорода, мо-
жет служить уксусная кислота. Здесь на первом плане стоит кислотное действие,
т.е. снижение величины pH. При пониженном pH некоторые микроорганизмы,
прежде всего бактерии, теряют жизнеспособность. Консерванты этого типа при-
меняются в относительно высокой концентрации, так как для существенного сни-
жения pH забуференного субстрата (а таковым оказывается большинство пище-
вых продуктов) необходимо не менее 1% кислоты.
Типичный представитель второй группы — сорбиновая кислота. В этом слу-
чае антимикробное действие проявляют почти исключительно недиссоцииро-
ванные молекулы. Только молекулы (но не гидрофильные анионы) из-за своей
липофильности могут проникать через клеточные мембраны микроорганизмов
и угнетать внутриклеточные ферменты. Такие консерванты действуют в концен-
трации много ниже 1%.
Доля недиссоциированной кислоты уменьшается с повышением pH. Таким
образом, консерванты, способные диссоциировать, тем эффективнее, чем выше
кислотность субстрата26. Долю недиссоциированных молекул можно вычислить
из константы диссоциации кислоты по формуле |66|:
а = [Н ]/([Н ] + D) ,
где а — доля недиссоциированной кислоты;
IН+1 — концентрация ионов водорода;
D — константа диссоциации.
В табл. 8 приведены доли недиссоциированных молекул для важнейших
консервантов в области pH 3—7.
Из данных следует, что в нейтральной среде эти консерванты проявляют сла-
бую активность или не проявляют её вообще27. В такой среде применимы только
недиссоциирующие или малодиссоциирующие соединения, например эфиры
Таблица 8. Доля недиссоциированных молекул для консервантов-кислот
при различных значениях pH
Консервант (кислота) Константа диссоциации рК Доля недиссоциированной кислоты, %, при pH
3,0 3,5 4,0 4,5 5,0 5,5 6,0 6,5 7,0
Сернистая 1,54-10 2 1,81 6 2 0,6 0,2 0,06 0,02 0,01 0 0
Салициловая 1,07 10 ’ 2,97 48 23 9 3 1 0,3 0,1 0,03 0,01
Муравьиная 1,77-10 ‘ 3,75 85 64 36 15 5 1,8 0,6 0,2 0,06
л-Хлор- бензойная 9,3-10 ’ 4,03 92 77 52 25 10 3,3 1,1 0,3 0,1
Бензойная 6,46-10 ’ 4,18 94 83 61 33 13 5 1,5 0,5 0,15
л-Гидрокси- бензойная 3,3-10 ’ 4,48 97 91 75 49 23 9 2,9 1,0 0,3
Уксусная 1,76-10 ’ 4,75 98 95 85 64 36 15 5,4 1,8 0,6
Сорбиновая 1,73-10 5 4,76 98 95 85 65 37 15 5,5 1,8 0,6
Пропионовая 1,32-10 ' 4,88 99 96 88 71 43 19 7,0 2,3 0,8
Дсгидраце- 5,30-10 6 5,27 100 98 95 86 65 37 16 5,6 1,9
товая
Гидросуль- фитный ион 1,02-10 7 6,99 100 100 100 100 99 97 91 76 50
Борная 7,3-10 1,1 9,14 100 100 100 100 100 100 100 100 99
50
Основы химического консервирования
л-оксибензойной кислоты или борная кислота. Существенное различие между
отдельными консервантами обнаруживается при pH 5—6, который имеют многие
пищевые продукты. Например, сорбиновая и пропионовая кислоты в этих усло-
виях ещё достаточно эффективны, а бензойная и муравьиная почти непригодны.
Теоретически можно было бы компенсировать малую долю недиссоцииро-
ванных молекул высоким общим содержанием консерванта. Однако такой спо-
соб может привести к выходу за рамки законодательных нормативов на количе-
ство применяемых добавок и(или) к недопустимому изменению вкуса пищевого
продукта.
Особое место среди консервантов занимает сернистая кислота. Она может
присутствовать в продукте в четырёх формах: в виде растворённого газа (SO2),
сернистой кислоты (H2SO3), гидросульфит-иона (HSO3) и сульфит-иона (SO:).
Антимикробное действие отдельных форм весьма различается. Благодаря нали-
чию гидросульфит-ионов сернистая кислота ещё проявляет некоторое антимик-
робное действие в области средних значений pH |67|.
По описанным причинам смещение pH пищевого продукта в область кис-
лой реакции в принципе увеличивает эффективность консервантов. Повышение
кислотности благоприятно для сохранения пищевых продуктов ещё и потому,
что некоторые бактерии в достаточно кислой среде теряют способность разви-
ваться. На практике рост кислотности пищевого продукта имеет ограничения по
вкусу.
Есть основания утверждать, что кислоты-консерванты проявляют антими-
кробное действие не только в недиссоциированной форме, но и в виде ионов.
Однако действие последних всегда существенно слабее, чем недиссоциированных
кислот (в случае сорбиновой кислоты примерно в 100 раз) 168, 691.
Влияние коэффициента межфазного распределения. Коэффициентом распре-
деления растворённого вещества между фазами называется отношение его кон-
центраций в этих средах. Оценить коэффициент распределения можно по отно-
шению растворимостей вещества в обеих фазах. В практике консервирования
пищевых продуктов важную роль играет коэффициент распределения консер-
ванта между жировой и водной средами в эмульсиях (маргарин, майонез и т.п.).
Рост микроорганизмов в таких системах происходит исключительно в водной
фазе, и та часть консерванта, которая находится в жировой среде, оказывается
бесполезной28. Следовательно, лучшим (при прочих равных условиях) будет кон-
сервант, имеющий наименьший коэффициент распределения.
Консерванты имеют различную растворимость в разных жирах, и коэффи-
циент распределения зависит от вида жира. Поваренная соль, сахар и другие рас-
творённые в воде вещества снижают растворимость в ней консервантов и увели-
чивают коэффициенты распределения (так называемое высаливание). С повыше-
нием pH коэффициент распределения уменьшается, потому что в жировую фазу
переходят только недиссоциированные молекулы консерванта29. В табл. 9 пред-
ставлены коэффициенты распределения некоторых консервантов между расти-
тельным маслом |70, 711 или октанолом |72| и водой.
Влияние активности воды. Для нормальной жизнедеятельности микроорга-
низмов нужно, чтобы активность воды (aw) в субстрате, на котором они развива-
ются, была не ниже определённой величины. Добавление веществ, снижающих
активность воды в пищевом продукте, положительно сказывается на эффектов-
5. Антимикробное действие консервантов
51
Таблица 9. Коэффициенты распределения консервантов
Консервант Растительное масло Октанол
Пропионовая кислота 0,17 —
Сорбиновая кислота 3,0 21
Мстил-л-окси бензоат 5,8 91
Бензойная кислота 6,1 51
Этил-л-оксибснзоат 26,0 —
Пропил-л-оксибснзоат 87,5 1010
ности консервантов31'. Важнейшими из таких веществ являются поваренная соль,
сахар, глицерин и гликоли. В табл. 10 приведены сведения о пороговых значени-
ях активности воды для некоторых микроорганизмов, встречающихся в пище-
вых продуктах |27, 731. Из неё следует, что большинство бактерий нуждаются в
высокой активности воды, в то время как многие плесневые грибы и дрожжи
хорошо развиваются даже при активности воды ниже 0,85.
Активность воды (если она не единственный лимитирующий фактор) влия-
ет и на образование микроорганизмами токсинов. Например, образование пени-
циллиновой кислоты грибами Aspergillus ochraceus возможно даже при активно-
сти воды ниже 0,76 |27, 331. Бактерии Clostridium botulinum типа В не образуют
токсинов при aw < 0,94 1271. Выработка энтеротоксина А бактериями Staphylococcus
aureus прекращается при активности воды ниже 0,87 |27|.
Влияние других физико-химических свойств субстрата. На жизнедеятельность
микроорганизмов влияют и другие свойства субстрата, например окислительно-
восстановительный потенциал и парциальное давление кислорода |74|. Поэтому
все добавки и составляющие пищевых продуктов, способные изменять эти фак-
торы, влияют на необходимую концентрацию консерванта. Типичным приме-
ром может служить сернистая кислота, которая изменяет окислительно-восста-
новительный потенциал. На парциальное давление кислорода в системе влияют
поваренная соль, диоксид углерода и азот31 174|.
Влияние веществ, содержащихся в пищевом продукте. Из веществ, входящих
в состав пищевых продуктов или добавляемых в них, на эффективность консер-
вантов больше всего влияют поваренная соль, углеводы и этанол.
Поваренная соль в некоторых пищевых продуктах усиливает действие кон-
сервантов, главным образом из-за осмотического удаления воды и как следствие
снижения её активности. Кроме того, соль непосредственно влияет на ферменты
и таким образом содействует консервантам. С другой стороны, в эмульсиях соль
увеличивает коэффициенты распределения консервантов, что неблагоприятно
сказывается на их эффективности.
Среди углеводов самое большое влияние на действие консервантов оказы-
вают сахара. В низких концентрациях эти легко усвояемые питательные вещест-
ва способствуют развитию микроорганизмов, и в некоторых пищевых продуктах
только лишь их присутствие делает необходимым добавление консервантов. При
высоких концентрациях сахара, наоборот, подавляют развитие микроорганиз-
мов, так как, подобно поваренной соли, снижают активность воды. По влиянию
на коэффициенты распределения они также схожи с солью, но действуют не-
сколько слабее.
52
Основы химического консервирования
Таблица 10. Пороговые значения активности воды для некоторых микроорганизмов,
встречающихся в пищевых продуктах |27|
аи Бактерии Дрожжи Плесневые грибы
0,98 Clostridium', Pseudomonas* —
0,97 Clostridium1, Pseudomonas* — —
0,96 Flavobacterium, Klebsiella, Lactobacillus*, Proteus*, Pseudomonas*, Shigella — —
0,95 Alcaligenes, Bacillus, Citrobacter, Clostridium3, Enterobacter, Escherichia, Propionibacterium, Proteus. Pseudomonas, Salmonella, Serratia, Vibrio 1 -
0,94 Bacillus*, Clostridium*. Lactobacillus, Microbacterium, Pediococcus, Streptococcus*, Vibrio — Siachybotrys
0,93 Bacillus5, Micrococcus*, Lactobacillus*. Streptococcus — Botrytis, Mucor, Rhizopus
0,92 — Ptchia, Rhodotorula, Saccharomyces* —
0,91 Corynebacterium, Streptococcus — —
0,90 Bacillus6, Lactobacillus*, Micrococcus, Pediococcus, Staphylococcus1. Vibrio* Hansenula, Saccharomyces —
0,88 — Candida, Debaryomyces, Hanseniaspora, Torulopsis Cladosporium
0,87 — Debaryomyces* —
0,86 Micrococcus*, Staphylococcus*, Vibrio* — —
0,84 — — Alternaria, Aspergillus*, Paecilomyces
0,83 Staphylococcus* Debaryomyces* Penicillium*
0,81 — Saccharomyces* Penicillium '
0,79 — — Penicillium*
0,78 — — Aspergillus, Emericella
0,75 Haiobacterium, Halococcus — Aspergillus*, Waiiemia
0,70 — — Aspergillus*. Chrysosporium
0,62 — Saccharomyces* Eurotium*
0,61 — — Monascus (Xeromyces)
Примечание. Звездочкой и цифрами помечены: * отдельные штаммы; 1 Clostridium botulinum тип С; 2 Clostridium
botulinum тип Е и отдельные штаммы С. perfringens; 5 Clostridium botulinum тин А и В, а также С. perfringens;
4 отдельные штаммы С. botulinum тип В; 5 отдельные штаммы Bacillus stearolhermophilus; А Bacillus subtifis в
определенных условиях; ' Staphylococcus aureus При анаэробном развитии; 11 Staphylococcus aureus при аэробном
развитии; 4 отдельные штаммы Vibrio costico/us.
5. Антимикробное действие консервантов
53
Этанол обычно усиливает действие консервантов.
Некоторые консерванты могут взаимодействовать с компонентами пищевых
продуктов. При этом они частично или полностью теряют свою активность. Ес-
ли предполагаются реакции такого рода, то для компенсации, как правило, ис-
пользуют более высокие дозы консерванта. Примером может служить диоксид
серы, который реагирует с альдегидами и глюкозой'2 |22|. В вине эта реакция
нежелательна, потому что ведёт к связыванию важного побочного продукта бро-
жения — ацетальдегида”. Нитриты тоже могут реагировать с составляющими пи-
щевых продуктов. В частности, из нитритов и аминов могут образовываться кан-
церогенные нитрозамины. Более подробные сведения о возможных взаимодей-
ствиях с компонентами пищевых продуктов приводятся в главах, посвящённых
отдельным консервантам.
§8
Разложение консервантов
Как правило, пищевые консерванты химически стабильны. Поэтому можно
не опасаться их разложения в пищевых продуктах в течение допустимых для по-
следних сроков хранения. Среди неорганических консервантов исключения со-
ставляют нитриты, сульфиты, перекись водорода и озон, среди органических —
пирокарбонаты и антибиотики |75|.
Для некоторых из этих веществ разложение необходимо, так как на нём ос-
новано их действие. Например, перекись водорода уничтожает микробов посред-
ством выделяемого кислорода. Для других консервантов, например для диме-
тилпирокарбоната, разложение нежелательно, так как приводит, в конце кон-
цов, к их исчезновению из продукта.
Некоторые консерванты могут разлагаться микроорганизмами. Это относится
прежде всего к органическим соединениям, которые служат некоторым микро-
организмам источником углерода. Например, метилпарабен разлагается
бактериями вида Pseudomonas aeruginosa |7б|, а сорбиновая кислота — грибами
рода Penicillium 177] и другими 1781. Разложение наблюдается не только в тех слу-
чаях, когда консервант не действует против данного микроба, но и если имеется
значительное несоответствие между концентрацией эффективного консерванта
и обсеменённостью субстрата (например, в случае сильно загрязнённого пище-
вого продукта или при уже начавшейся микробиологической порче). Поэтому
нельзя сохранить пищевые продукты с помощью консервантов и возвратить им
«свежесть», если порча уже началась. Потребитель пищевых продуктов, которые
законсервированы веществами, способными к микробиологическому разложе-
нию, имеет тем самым гарантию, что для выработки этих продуктов было ис-
пользовано микробиологически чистое сырьё.
54 Основы ХИМИ,,ССКОГО консервирования
§9
Методы проверки консервантов
Для проверки эффективности консервантов в пищевых продуктах имеется
два метода, которые, как правило, используются последовательно: тест на пита-
тельных средах и практические испытания.
Тест на питательных средах. При испытаниях на питательных средах, кото-
рые проводятся в первую очередь для соединений с неизвестными свойствами, в
пробы субстрата добавляют различные количества исследуемого вещества и вы-
севают чистую культуру тестируемого микроорганизма. После нескольких дней
инкубации на основе различий в развитии культур на отдельных пробах можно
получить представление о концентрации действующего вещества, тормозящей
развитие данного микроба. Полученный результат можеТ зависеть от вида ис-
пользованного субстрата. Важны и условия инкубации — с точки зрения их оп-
тимальности какдля развития выбранного вида микроорганизмов, так и для дей-
ствия тестируемого консерванта. Количественные результаты получают на жид-
ких питательных средах, измеряя их помутнение на спектрофотометре'4 или опре-
деляя прирост массы мицелия (для грибов).
Известная в бактериологии проба с диффузией в агар-агаР веществ, вводи-
мых через отверстия, имеет ограниченное значение дЛя проверки пищевых
консервантов. Использование этой пробы предполагает, что действующее
вещество должно угнетать как можно больше микроорганизмов- Однако при кон-
сервировании пищевых продуктов такая задача не ставится- Добавляя консер-
ванты в пищевые продукты, стремятся подавить только те микроорганизмы, ко-
торые вызывают порчу. Описанные в медицинских изданйях тесты для космети-
ческих средств и фармацевтических препаратов в пишеП°й сфере тоже имеют
ограниченное применение 1791. Предъявляемые в косметйке и фармации требо-
вания по срокам хранения и условия первичного и вторичного инфицирования
не совпадают с таковыми в области пищевых продуктов.
Тест на питательных средах in vitro достаточно точен с микробиологической
точки зрения, но для практики представляет интерес лигПЬ как ориентир. С его
помощью невозможно смоделировать некоторые воздействия пищевого продук-
та на консервант. Кроме того, на практике имеют дело не с одним видом микро-
организмов, а с множеством. Поэтому в реальных условиях никогда не бывает
такого «идеального» заражения, как в опытах in vitro.
Практические испытания. После тестов in vitro обязательно должны быть про-
ведены практические испытания. Для них в качестве питательной среды исполь-
зуют тестируемый пищевой продукт. Исследуемый консервант в различных кон-
центрациях добавляется к разным партиям пищевого np<WKTa, находящегося в
обычной торговой упаковке. Пробы инфицируют микроорГанизмами, обычно вы-
ступающими в роли возбудителей порчи данного продукт3- Часть проб хранится
в обычных условиях (прежде всего, при нормальной теМпеРатУРс), а часть — в
ухудшенных (при повышенной температуре). В течение определённого времени,
которое должно соответствовать обычному или желательномУ сроку хранения,
продукт проверяют на годность. Установления органолептических свойств при
этом недостаточно. Помимо них проверяют изменение химических и физиче-
5. Антимикробное действие консервантов
55
ских параметров (каких именно — зависит от вида пищевого продукта). Особое
значение имеет определение числа микроорганизмов.
Здесь возникают проблемы с «правильным» инфицированием продукта. Речь
идёт не только о том, чтобы при вить те виды микроорганизмов, которые на прак-
тике играют роль возбудителей порчи; необходимо также создать обсеменённость,
приближенную к реальной, что не всегда просто. Консерванты не предназначе-
ны для того, чтобы уничтожить как можно больше микроорганизмов; они долж-
ны подавить относительно небольшую популяцию микробов, которая может ока-
заться в пищевом продукте, изготовленном с соблюдением требований гигиены.
(Существуют консерванты, которые могут разлагаться микроорганизмами, если
последние присутствуют в необычно большом количестве. Если при проверке
действия такого консерванта применяют слишком сильно обсеменённый субстрат,
то может показаться, что консервант не работает, хотя на практике (в нормально
инфицированном пищевом продукте) его эффективность достаточна.
§10
Принципы выбора подходящего консерванта
Пищевые продукты нельзя защищать от порчи любыми веществами, прояв-
ляющими консервирующее действие. При выборе консерванта для конкретного
случая необходимо соблюдать определённые требования.
Консервант не должен:
— вызывать опасений сточки зрения физиологии;
— порождать токсикологические и экологические проблемы в процессе про-
изводства, переработки и использования;
— вызывать привыкания;
— реагировать с компонентами пищевого продукта или реагировать только
тогда, когда антимикробное действие больше не требуется;
— взаимодействовать с материалом упаковки и адсорбироваться им.
Консервант должен:
— иметь возможно более широкий спектр действия;
— быть достаточно эффективным против микроорганизмов, обычно при-
сутствующих или ожидаемых в (или на) данном пищевом продукте в условиях,
имеющихся в данном пищевом продукте (pH, активность воды и т.д. — см. §7 гл.5);
— воздействовать на токсинобразующие микроорганизмы и, по возможно-
сти, замедлять образование токсинов в большей степени, чем развитие микроор-
ганизмов;
— как можно меньше влиять на микробиологические процессы, протекаю-
щие в некоторых пищевых продуктах (дрожжевое брожение теста, молочнокис-
лое брожение квашений, созревание сыра);
— по возможности оставаться в пищевом продукте в течение всего срока
хранения;
— как можно меньше влиять на органолептические свойства пищевого про-
дукта (запах, вкус, цвет и текстуру);
— по возможности быть простым в применении;
56
Основы химического консервирования
— достаточно хорошо растворяться в воде (при использовании в пищевых
продуктах, содержащих воду);
— быть недорогим, чтобы не увеличивать существенно цену пищевого про-
дукта (впрочем, использование консервантов, даже дорогостоящих, обычно де-
шевле применения физических способов консервирования, например термооб-
работки или облучения);
— иметь разрешение на применение в пищевых продуктах или перспективы
на получение такого разрешения;
— иметь качество и чистоту, соответствующие национальным и междуна-
родным нормам и требованиям.
Консервирующие
вещества
59
В гл. 6—29 рассмотрены консерванты, используемые в настоящее время на
практике; в гл. 30—55 обсуждаются вещества либо утратившие полностью своё
значение, либо находящие незначительное применение; в гл. 56 кратко изложены
сведения об упаковках и покрытиях.
В табл. 11 приведены отдельные консерванты, используемые в наиболее
важных группах продуктов.
Таблица 11. Консерванты, обычно применяемые для наиболее важных групп продуктов
Группа
продуктов
Жировые эмульсии
Сыры
Мясопродукты
Рыбопродукты
Овощная продукция
Фруктовая продукция
Безалкогольные напитки
Вино
Хлебобулочные изделия
Кондитерские изделия
Примечание. Коиссрваиг применяется: + + — часто; + — реже; ( + ) — в исключительных случаях;
— — нс применяется.
Глава 6
Поваренная соль
§1
Синонимы
ШРАС. хлорид натрия.
Русский: хлористый натрий, «соль»*.
Немецкий: Kochsalz, Natriumchlorid, Speisesalz, «Saiz».
Английский: sodium chloride, table salt, «salt».
Французский: chlorure de sodium, sei de cuisine, «sei».
Итальянский: chloruro di sodio, sale de cucina, «sale».
Испанский: chloruro sodico, sal comun, sal de cocina, «sal».
§2
Историческая справка
Соль как пищевая добавка (культового характера) упоминается уже в Вет-
хом завете. В качестве консерванта для продуктов питания она была хорошо из-
вестна в Древнем Египте 111, на Ближнем Востоке и в Древнем Риме |2—4|. Пова-
ренная соль была приправой и необходимым компонентом для приготовления
продуктов питания 15]. В средние века соль была важным предметом торговли в
Центральной и Северной Европе. Об этом напоминают названия городов (Гал-
ле) и улиц (Гелльвеге). В течение столетий соль была важнейшим (если не един-
ственным) консервантом, особенно для мяса, рыбы и овощей, хотя ещё 200 лет
тому назад она стоила вдвое дороже говядины.
Соль и в наши дни используется для сохранения продуктов питания, но ред-
ко в одиночку — чаще в сочетании с другими консервантами.
§3
Товарные формы
В продажу поступает поваренная соль различной степени измельчения, так
как в зависимости от целей применения предпочтение отдаётся товару грубого
или тонкого помола. По происхождению различают соль морскую, каменную и
выварочную. Разные виды соли содержат различные количества примесей.
Здесь и далее кавычками выделены бытовые названия.
6. Поваренная соль
61
§4
Свойства
Поваренная соль NaCl представляет собой бесцветные кубические кристал-
лы солёного вкуса и без запаха. Температура её плавления равна 80ГС. В 100 г
воды при комнатной температуре растворяется около 36 г соли. В 100 г такого
раствора содержится 26,5 г NaCl, в 100 мл — 31,8 г, а его плотность равна 1,20 г/мл.
Водородный показатель (pH) раствора поваренной соли составляет 6,7—7,335.
§5
Аналитические сведения
Для определения содержания поваренной соли её извлекают из исследуемо-
го продукта или его золы тёплой водой и известными способами анализируют
вытяжку на натрий (например, фотометрией пламени) или на хлор (например,
титрованием по Мору или Фольгарду).
§6
Получение
Поваренную соль получают из каменной соли или из морской воды36. Ка-
менная соль обычно недостаточно чиста для пищевых целей. Для получения про-
дукта пищевого качества каменную соль растворяют в воде и выпаривают очищен-
ный рассол на больших противнях (выварочная соль). В тёплых странах для по-
лучения соли морскую воду выпаривают на солнце в садочных бассейнах, при-
чём разные соли17 кристаллизуются из морской воды по очереди |6|.
§7
Токсиколого-гигиеническая оценка
Острая токсичность. При пероральном введении концентрированного вод-
ного раствора поваренной соли голодным крысам LD50 составляет 3,75 г на 1 кг
массы тела 17, 81. Доза в 35—40 г соли вызывает острое отравление у человека |9|.
Такие отравления неоднократно случались, когда соль ошибочно принимали за
сахар 110|.
Субхроиическая токсичность. При скармливании концентрированного вод-
ного раствора поваренной соли голодным крысам в течение 100 дней (примерно
'/к, продолжительности жизни) LDS0 составляла 2,7 г на 1 кг массы тела. У него-
лодных крыс эта величина возрастает до 6,14 г, что может объясняться разбавле-
нием соли (кормом) и замедлением её всасывания 18, 111. При добавлении соли в
корм животные переносили существенно более высокие концентрации 112, 13|.
Соль не тератогенна |14| и не оказывает мутагенного влияния на дрожжи вида
Saccharomyces cerevisiae или бактерии вида Salmonella typhimurium 115].
ta
Консервирующие вещества
Хроническая токсичность. Добавление к корму 2,8—5,6% поваренной соли
замедляет развитие и сокращает продолжительность жизни подопытных живот-
ных 1161.
Биохимическое поведение. Поваренная соль влияет на осмотическое давле-
ние биологических жидкостей и жизненно необходима как источник натрия. При
повышенной концентрации она может оказывать токсическое действие: в пер-
вую очередь — на пищеварительный тракт, а во вторую — почти на все органы
|8, 171. Вследствие хорошей растворимости в воде соль относительно быстро вы-
водится из организма. Поваренная соль противопоказана человеку при некото-
рых заболеваниях сердца, системы кровообращения и почек. В таких случаях ис-
пользуют солезаменители”, которые консервантами не являются.
§8
Законодательные аспекты применения в пищевых продуктах
Поваренная соль, как жизненно необходимая составляющая пищи и веще-
ство, столетиями применяющееся в пищевой технологии, вряд ли подлежит за-
конодательным ограничениям, в том числе и в части предельно допустимого со-
держания в пищевом продукте. Исключение составляют диетические продукты
(бессолевые или с пониженным содержанием соли). В Германии законодатель-
ство не относит поваренную соль к пищевым добавкам”.
§9
Действие на микроорганизмы
Общие критерии. Поваренная соль снижает активность воды (табл. 12), ухуд-
шая тем самым условия существования микроорганизмов. Её действие сравнимо
с обезвоживанием; поэтому использование соли называют «химическим высу-
шиванием». Одной только солью невозможно надёжно защитить пищевой про-
дукт от всех микробных поражений, даже превысив все мыслимые вкусовые ог-
раничения 118/. Активность воды даже в насыщенном растворе поваренной соли
ещё достаточно велика (а„=0,75), и некоторые микроорганизмы в таких услови-
ях могут развиваться.
Таблица 12. Активность воды /< растворах поваренной соли /19/
Концентрация соли, г на 100 г воды Активность воды Концентрация соли, г на 100 г воды Активность воды
0,88 1,75 3,57 7,01 8,82 10,34 13,50 16,54 19,40 0,995 0,99 0,98 0,96 0,95 0,94 0,92 0,90 0,88 22,21 23,55 24,19 27,29 30,10 32,55 35,06 36,06 0,86 0,85 0,84 0,82 0,80 0,78 0,76 0,75
6. Поваренная соль
63
Для консервирования пищевые продукты помещают в более или менее на-
сыщенный соляной раствор (рассол) или добавляют к ним сухую соль. При этом
происходит осмотическое обезвоживание продукта и снижение активности воды
в нём; степень снижения зависит от количества добавленной соли.
По устойчивости к действию соли различают слабогалофильные (толерант-
ные), среднегалофильные и сильногалофильные микроорганизмы. Первые луч-
ше всего растут в среде с содержанием поваренной соли 1—5%, вторые переносят
5—20% соли, а третьи — до 30%.
Антимикробное действие поваренной соли нельзя объяснить только сниже-
нием активности воды. Так, например, некоторые бактерии рода Clostridium в
присутствии поваренной соли растут при активности воды не менее 0,96, а в при-
сутствии глицерина — до 0,93 120|. При пониженной активности воды бактерии
усиленно накапливают некоторые аминокислоты, вследствие чего замедляется
их рост 1211. Поваренная соль снижает растворимость кислорода в воде, поэтому
в сильносолёных продуктах микроорганизмам (аэробам) доступно меньше ки-
слорода, чем в слабосолёных |22|.
Начиная с концентрации 2% поваренная соль усиливает действие других кон-
сервантов |23|. Минимальная концентрация, при которой сорбиновая кислота
оказывает действие на дрожжи и плесени, в присутствии 4—6% поваренной соли
в 2-3 раза ниже, чем при её отсутствии (в присутствии 8% — примерно в 4 раза)
|24]. Это влияние особенно чётко проявляется в кислых средах (при низких зна-
чениях pH) в отношении дрожжей |25| и бактерий рода Clostridium 1201.
Большое практическое значение имеет использование поваренной соли в
сочетании с физическими способами консервирования, прежде всего с хранени-
ем на холоде и высушиванием 126—281. Благодаря осмосу поваренная соль повы-
шает устойчивость к нагреванию плесневых грибов 129| и бактерий |30|. Проти-
воположный эффект описан для бактерий рода Clostridium 1311.
При засолке некоторых пищевых продуктов происходит их естественное сква-
шивание. В этом случае соль подавляет часть дикой микрофлоры, что благопри-
ятствует развитию молочнокислых бактерий.
Антимикробное действие поваренной соли вряд ли можно объяснить её не-
посредственным тормозящим влиянием на ферменты. Существуют ферменты,
активность которых при небольших концентрациях поваренной соли даже по-
вышается.
Спектр действия. Так как влияние поваренной соли связано главным обра-
зом с уменьшением активности воды, спектр её действия определяется чувстви-
тельностью различных микроорганизмов к этому фактору (32|. Пороговые зна-
чения активности воды для некоторых микроорганизмов, встречающихся в про-
дуктах питания, представлены в табл. 10 (§7 гл.5).
Среди микроорганизмов, переносящих повышенную концентрацию соли,
следует назвать дрожжи рода Torulopsis и рода Тоги 1а, род Oospora, отдельные ви-
ды стафилококков и молочнокислых бактерий.
Некоторые микроорганизмы галофильны в буквальном смысле — они не
только переносят высокие концентрации поваренной соли, но и лучше растут в
её присутствии. Однако такие бактерии не имеют большого значения как возбу-
дители порчи пищевых продуктов.
64 Консервирующие вещества
§10
Области применения
Жировые продукты. Микробиологической порче подвержены только жиро-
вые эмульсии (масло и маргарин). Поваренная соль используется как консер-
вант для обоих продуктов.
Соль (в сухом или растворённом виде) добавляют после промывки масля-
ных зёрен до начала формования в количестве 0,3—2% массы, что составляет 1—
13% поваренной соли в водной фазе (подверженной микробиологической порче).
При изготовлении маргарина соль добавляют непосредственно в водную фазу
(до 19% или до 3% в пересчёте на всю массу маргарина).
Молочные продукты. Поваренная соль играет важную роль как консервант
для сыра. В зависимости от сорта сыра соль добавляют в сухом виде к сырной
массе и(или) на его поверхность (сухое соление) либо чаще в виде растворов (со-
ляных ванн). Последние — это почти насыщенные растворы соли, имеющие pH
около 5,2. В них легко поселяются дрожжи и толерантные к соли бактерии, кото-
рые могут стать причиной инфицирования сыра. В зависимости от сорта и раз-
меров сыр выдерживают в соляных ваннах от 1 часа (камамбер) до 5 дней (эм-
ментальский). В зрелом сыре содержится от 1 до 3% соли; концентрация выше
или ниже бывает только в исключительных случаях. Считается, что соли в сыре
должно быть не менее 5% от количества содержащейся в нём воды. К сырной
массе обычно добавляют мелкую соль (до 1 мм), а при сухом солении — более
крупную (1,8—2 мм).
В процессе созревания сыры периодически поливают рассолом для предот-
вращения заплесневения поверхности. Однако такая обработка недостаточна для
полной защиты от микробиологической порчи, в особенности от плесени. Жела-
тельно кроме соли (которая для сыра всё-таки служит скорее вкусовой добавкой,
чем консервантом) применять настоящее противоплесневое средство, например
сорбиновую кислоту.
Яйцепродукты. Поваренная соль в концентрации 5—8% иногда применяется
для консервирования меланжа и жидких желтков. Яйца, консервированные в
солёной воде, — это яйца, сваренные вкрутую и помещённые в крепкий соляной
раствор.
Мясопродукты. Солёное мясо на протяжении веков было важным продук-
том питания. Сегодня большие количества поваренной соли используются как
составная часть посолочных смесей или индивидуально в сочетании с другими
способами консервирования — охлаждением, сушкой, копчением. Уже в кон-
центрации 1—3% поваренная соль демонстрирует хорошее антимикробное дей-
ствие. Эта сравнительно небольшая добавка приводит к понижению активности
воды, достаточному для угнетения многих вызывающих порчу бактерий в кол-
басных изделиях, ветчине, копчёностях.
Рыбопродукты. Посол — очень старый способ консервирования рыбы, со-
хранивший своё значение и в наше время. С помощью соли консервируют анчо-
усы, шпроты, треску, лосося, рыбную икру, но главным образом сельдь. С XIV века
(Willem Beukelzoon из Бирфлита, Голландия) сельдь перед посолом освобождают
от внутренностей (кроме молок и икры). Соль добавляют на борту рыбопромыс-
лового судна (посол в море) или после его разгрузки (посол на берегу) в твёрдом
6. Попаренная соль
65
виде (сухой посол) или в виде рассола (мокрый посол). При сухом посоле имеет
значение крупность помола. Мелкая соль излишне быстро проникает в рыбу.
При использовании слишком крупной соли возникает опасность её неравномер-
ного распределения. Различают несколько видов посола.
Транспортный посол. Соль добавляют к рыбе ещё в море в количестве 0,5—2%
по массе (0,7—3% от массы содержащейся в рыбе воды). В такой концентрации
поваренная соль — недостаточная защита от микробиологической порчи; поэтому
рыбу ещё и охлаждают. Срок хранения ограничен.
Слабый (лёгкий, малый) посол. Соли (сухой или в виде рассола) добавляют
около 10% от массы рыбы (до 20% от массы содержащейся в рыбе воды). В такой
концентрации соль действует против микробиологической порчи ограниченное
время. Типичный продукт, получаемый в результате слабого посола, — мало-
сольная сельдь.
Средний посол. Количество добавляемой соли больше, чем при слабом (но
меньше 20% от массы содержащейся в рыбе воды). Концентрация рассола 15—
18%.
Крепкий посол. Соль добавляют в количестве более 14% от массы рыбного
мяса (20—24% от массы содержащейся в рыбе воды). Рыба крепкого посола ис-
пользуется в качестве сырья для дальнейшей переработки. Она может долго со-
храняться без микробиологической порчи, но и в ней не исключён рост гало-
фильных микроорганизмов. Для ещё большего увеличения срока хранения рыбу
можно дополнительно высушить (пример — вяленая треска).
Поваренная соль применяется в качестве консерванта для икры (содержа-
ние соли 3—10%), анчоусов, рыбных паст (до 20%) и пресервов (2-5%). Обычно в
этих продуктах соль применяется не индивидуально, а в сочетании с копчением
и такими консервантами, как борная кислота (икра), селитра (анчоусы), уксус-
ная кислота, гексаметилентетрамин, бензойная и сорбиновая кислоты (марина-
ды), а также в сочетании с маслом (сайда).
Овощные продукты. Поваренная соль — единственный консервант при со-
лении натуральных овощей, которые применяются как сырьё для дальнейшей
промышленной переработки. Этим способом консервируют главным образом
спаржу, бобовые, капусту, морковь, свёклу, лук, грибы и маслины, используя
15—25%-й (в зависимости от вида продукта) рассол. Из-за высокой концентра-
ции соли молочнокислое брожение практически отсутствует, но не исключено
появление плёнчатых дрожжей.
От солёных овощей следует отличать овощи, заквашенные в слабых раство-
рах соли, где они подвергаются молочнокислому брожению (квашеная капуста,
солёные огурцы, маслины). В этом случае основной консервант не поваренная
соль, а образующиеся в результате брожения (или добавляемые) органические
кислоты.
Фрукты. Из-за своего вкуса поваренная соль обычно не используется в ка-
честве консерванта для фруктов. Стоит упомянуть только цитрусовые для произ-
водства цукатов. Здесь поваренная соль (в виде морской воды или 6-8%-го рас-
сола) служит промежуточным консервантом, до того как продукты окончательно
законсервируют с помощью сахара.
66 Консервирующие вещества
§11
Прочие действия
Поваренная соль обладает наряду с консервирующим и другими свойствами,
большей частью полезными. В первую очередь это — вкусовая добавка. Более
того, в большинстве пищевых продуктов соль скорее вкусовая добавка, чем кон-
сервант. Нужные для вкуса концентрации соли обычно существенно ниже кон-
центраций, необходимых для консервирования. Поэтому продукты питания, кон-
сервируемые одной солью, редко пригодны для непосредственного употребле-
ния. Они используются как сырьё для дальнейшей промышленной переработки
или должны обессоливаться, например вымачиванием.
Поваренная соль оказывает разнообразное влияние на белки. Она вызывает
набухание мяса, повышая его водосвязывающую способность40, и ускоряет кули-
нарную обработку рыбы.
Консервируемые поваренной солью пищевые продукты часто имеют повы-
шенную склонность к окислению (прогоркание жира). Причиной этому являет-
ся сама поваренная соль; содержащиеся в ней следы тяжёлых металлов могут
каталитически ускорять окисление. Это свойство соли имеет практическое зна-
чение прежде всего для мясных и рыбных продуктов.
Наконец, поваренная соль обезвоживает продукт за счёт осмоса. Вместе с во-
дой теряется и часть водорастворимых составляющих —- минеральных веществ,
витаминов, белков. Вследствие этого биологическая ценность пищевых продук-
тов, консервируемых солью, в целом ниже, чем у свежих.
Глава 7
Диоксид углерода
§1
Синонимы
IUPAC: оксид углерода (IV).
Русский: двуокись углерода, угольный ангидрид, углекислота, «углекислый газ».
Немецкий: Kohlendioxid, Kohlensaureanhydrid, «Kohlensaure».
Английский: carbon dioxide.
Французский: bioxyde de carbone, gaz carbonique, «acid carbonique».
Итальянский: biossido di carbonio, anidride carbonica, «acido carbonico».
Испанский: dioxido de carbono, anhidrido carbonico, «acido carbonico».
§2
Историческая справка
Углекислота (остающаяся в напитках после спиртового брожения или выде-
ляющаяся при дыхании хранящегося зерна) с древних времён неосознанно ис-
пользовалась для сохранения продуктов питания. Намеренное добавление дву-
окиси углерода — достижение нового времени.
§3
Товарные формы
Двуокись углерода поставляется в жидком и твёрдом (сухой лёд) виде. Жид-
кая углекислота удобна в обращении — её легко дозировать. Сухой лёд как кон-
сервант большого значения не имеет. Он широко используется как хладагент, но
в этом качестве не является предметом нашего изучения.
§4
Свойства
Двуокись углерода СОг при обычных условиях представляет собой бесцвет-
ный негорючий газ с кисловатым запахом и вкусом. Плотность углекислого газа
приблизительно в 1,5 раза выше, чем у воздуха. При 0°С двуокись углерода кон-
денсируется в бесцветную жидкость под давлением 3,49 МПа, а при 20°С — под
Давлением 5,54 МПа. В 1 л воды при комнатной температуре растворяется около
1 л углекислоты, что значительно выше растворимости многих других газов.
68
Консервирующие вещества
Поэтому при использовании газозащитных смесей, содержащих двуокись угле-
рода, последняя избирательно поглощается пищевым продуктом и её концен-
трация в газовой фазе меняется [1].
§5
Аналитические сведения
Количество диоксида углерода можно определить весовым или объёмным
методами. Углекислый газ, выделенный из исследуемого продукта, поглощают
раствором гидроксида бария либо гидроксида натрия. В первом случае количест-
во двуокиси углерода определяют по массе образовавшегося карбоната бария. Во
втором случае образовавшийся карбонат натрия разлагают серной кислотой и
количество диоксида углерода измеряют по его объёму или кулонометрически 11].
Углекислый газ можно определить и с помощью специальных тестовых трубок |2|.
§6
Получение
Диоксид углерода можно добывать из природных источников. Его также по-
лучают из газовых смесей, образующихся при сжигании кокса. Смесь пропуска-
ют через абсорбционные колонны, в которых углекислый газ связывается в виде
бикарбоната4'.
§7
Токсиколого-гигиеническая оценка
Для животных смертельная концентрация углекислого газа в воздухе (при
кратковременной экспозиции), по разным данным, составляет от 30 до 60% об.
(в присутствии 20% об. кислорода). При длительном вдыхании опасны концен-
трации свыше 3% об. Для двуокиси углерода ПДК. составляет 5000 мг/м’.
§8
Законодательные аспекты применения в пищевых продуктах
В большинстве государств отсутствуют законодательные ограничения на при-
менение диоксида углерода (Е290) в пищевых продуктах42. В некоторых странах
существует требование, по которому минеральная вода, разлитая в бутылки, и
полученные из неё лимонады должны содержать то же количество углекислого
газа, что и природное сырьё. В ряде стран установлено ограничение на содержа-
ние двуокиси углерода в винах, не относящихся к игристым.
7. Диоксид углерода
69
§9
Действие на микроорганизмы
Общие принципы действия. Действие двуокиси углерода обусловлено не-
сколькими факторами. Во-первых, замена ею части воздуха приводит к сниже-
нию концентрации кислорода, который необходим многим микроорганизмам.
Во-вторых, углекислый газ обладает антимикробным действием, так как участ-
вует в дыхательном обмене микроорганизмов. В-третьих, если углекислый газ
присутствует в больших количествах, он может существенно изменять значение
pH на поверхности пищевого продукта41, в результате чего некоторые микроор-
ганизмы на ней погибают 13, 4].
Технология хранения продуктов питания в атмосфере инертного газа вме-
сто воздуха называется «упаковкой с модифицированной атмосферой» (modified-
atmosphere packing — МАР). Если воздух заменяется (частично или полностью)
углекислым газом, то концентрация кислорода снижается (в пределе — до нуля),
т.е. действие двуокиси углерода здесь косвенное. В пищевых продуктах, обрабо-
танных по MAP-технологии, угнетаются только аэробные микроорганизмы. На
развитие патогенных анаэробов, вызывающих инфекции и интоксикации, диок-
сид углерода практически не влияет, и безопасность таких продуктов оказывает-
ся под вопросом |5|. Для Campylobacter jejuni описана даже стимуляция роста в
МАР |6|. То же имеет место для Clostridium sporogenes (3, 7|. Бактерии вида
Clostridium botulinum при малых концентрациях углекислого газа образуют токси-
ны, а высокие его концентрации (45—70%) действуют на них угнетающе |8].
Недостатки МАР — необходимость постоянного контроля температуры
(охлаждения) и выбора для каждого пищевого продукта определённого, экспе-
риментально устанавливаемого состава защитной атмосферы. Это дорогостоя-
щее мероприятие, которое может проводиться только квалифицированным пер-
соналом. Достоинство МАР в том, что срок хранения продуктов увеличивается в
несколько раз по сравнению с обычным способом.
На рис. 6 представлены сравнительные данные по росту вредных бактерий
на свином мясе в атмосфере воздуха и углекислого газа при различных темпера-
турах |9|. Использование атмосферы с высоким содержанием углекислого газа
представляет интерес прежде всего для пищевых продуктов с низкой активно-
стью воды.
Углекислый газ не убивает микроорганизмы (во всяком случае за короткое
время), а только замедляет их развитие. Он удерживает микроорганизмы в ла-
тентной фазе; в этом состоянии они не размножаются, но ферментативные про-
цессы в них отчасти протекают. Быстрая гибель микроорганизмов наблюдается
лишь при высоком давлении двуокиси углерода, обычно в сочетании с низкими
температурами. Эти технологии применяют в пищевой промышленности при бун-
керном хранении муки, чая, пряностей. Создают давление 10—30 атм в течение
30-240 минут; при нормальном давлении (и концентрации углекислого газа свыше
60%) для уничтожения микроорганизмов требуется 10—20 дней 110|. Очень высо-
кое давление (несколько тысяч атмосфер) пригодно также для дезинсекции (унич-
тожения насекомых) в рисе или другом сырье; недавно описаны способы дезин-
секции с использованием меньшего давления и требующие меньших затрат 1111.
70
Консервирующие вещества
Температура храпения. °C
Рис. 6. Рост бактерий на свином мясе
(зависимость времени достижения обссменсппости Ю6КОЕ/см2 от температуры
в воздушной атмосфере и в углекислом газе)
Очень высокое давление применяется и для инактивации пектинэстераз во Фрук-
товом соке 1121.
При использовании МАР с углекислым газом необходимо применять газо-
непроницаемые упаковочные материалы, например комбинированные полиэфир-
полиэтиленовые или полиэфир-алюминий-полиэтиленовые плёнки 1131. Но не-
зависимо оттого, используется ли упаковка с защитным газом или конкурирую-
щая с ней вакуумная упаковка, существует множество факторов, влияющих на
срок хранения. В числе прочих — вид и форма товара, а также пластичность и
прочность упаковки.
Спектр действия. Диоксид углерода действует преимущественно на облигат-
ные аэробы. Плесневые грибы к нему вполне устойчивы. Полностью подавить
их рост с помощью углекислого газа при обычном давлении невозможно 114].
Особенно это справедливо для температур около 20°С 115|. Консервирующее дей-
ствие углекислого газа усиливается при содержании кислорода ниже 0,2% 114].
В интервале концентраций углекислого газа 10—90% афлатоксинобразующие мик-
роорганизмы продуцируют тем меньше токсинов, чем выше содержание угле-
кислоты 1161-
Дрожжи тоже малочувствительны к углекислому газу. В его присутствии они,
при определённых условиях, способны к реакциям обмена веществ, вызываю-
щим порчу пищевых продуктов. Например, некоторые дрожжи в присутствии
углекислого газа могут (не размножаясь) сбраживать сахар в спирт. Развитие плес-
невых дрожжей углекислый газ более или менее сдерживает. Действие диоксида
углерода на дрожжи усиливается с увеличением его концентрации.
Отношение различных видов бактерий к диоксиду углерода весьма разнооб-
разно. Особенно к нему чувствительны психрофильные виды Pseudomonas 115| и
Achromobacter, а также Escherichia coll |17|. Угнетающее действие диоксида углеро-
да на род Salmonella особенно ярко выражено в присутствии сорбата калия. Воз-
можно использование антимикробной активности углекислого газа при высо-
ком давлении на бактерии рода Salmonella и рода Listeria |18|. Напротив, многие
7. Диоксид углерода
71
молочнокислые бактерии 115, 17] и бактерии рода Clostridium 13, 5| довольно ус-
тойчивы к действию двуокиси углерода. Некоторые бактерии рода Salmonella, мо-
лочнокислые бактерии и штаммы Campylobacter под действием углекислого газа
могут даже ускорять развитие |5, 19].
§10
Области применения
Молочная продукция. Для сыра в потребительской упаковке атмосфера дву-
окиси углерода применяется как защита от окисления и микробиологической
порчи. Она замедляет развитие дрожжей, плесневых грибов и психрофильных
бактерий в мягких и твёрдых сырах |20|. Концентрация углекислого газа в за-
щитной атмосфере должна быть близка к 100%. Хорошо действуют и смеси угле-
кислого газа с азотом.
Мясопродукты. Хранение охлаждённого свежего мяса в атмосфере с 15—40%
углекислого газа значительно увеличивает срок его годности; консервирующий
эффект возрастает с увеличением концентрации углекислоты (211. Действие ди-
оксида углерода направлено главным образом против плесневых грибов и бакте-
рий рода Pseudomonas и рода Achromobacter', менее чувствительны к нему дрожжи,
род Lactobacillus и вид Microbacterium thermosphactum. Очень эффективны смеси
углекислоты с другими защитными газами ]22|.
Повышенное содержание углекислого газа в атмосфере хранилища может
приводить к изменению цвета и вкуса мяса, особенно если нарушаются опреде-
лённые границы содержания кислорода; например, в работе ]23] это описано для
говядины. Литературные данные об оптимальных концентрациях двуокиси уг-
лерода и кислорода противоречивы (см. табл. 13).
Для сарделек найдено |24|, что оптимальное по антимикробной активности
против вида Listeria monocytogenes содержание углекислого газа в инертной атмо-
сфере составляет 50-80%.
Морепродукты. Срок годности рыбы, например кефали, можно продлить при
хранении её в инертной атмосфере (25(. Углекислый газ в сочетании с нагрева-
нием замедляет действие и олиф енол оксидаз (ответственных за ферментативные
реакции, вызывающие появление бурой окраски) в омарах 1261.
Фрукты и овощи. Использование инертной атмосферы является щадящим
способом замедления как микробиологических, так и ферментативных измене-
ний при хранении фруктов и овощей, например картофеля |27|, инжира (28],
груш 1291, шампиньонов и вешенки |30].
Напитки. Хранение фруктовых соков под давлением углекислого газа на хо-
лоде часто используют в качестве способа консервирования. Метод был открыт
швейцарцем Бёхи и известен в производстве фруктовых соков как способ Бёхи.
Для сохранения соков необходима концентрация углекислого газа 1,5%, что
соответствует давлению примерно 7 атм при 15’С. Углекислота даже под давле-
нием не убивает микроорганизмы, прежде всего дрожжи, а только замедляет их
развитие. Микроорганизмы вполне сохраняют способность к некоторым фер-
ментативным реакциям; например, дрожжи могут до известных пределов проду-
цировать спирт. Углекислый газ малоэффективен против молочнокислых бакте-
72
Консервирующие вещества
Таблица 13. Примеры газовых смесей, применяемых для некоторых
продуктов, обработанных по МАР-тсхнологии |5|
Продукт %СОг %О2 %N,
Свежее мясо 30 30 40
15-40 60-85 0
Солонина 20-50 0 50-80
Жареное мясо 75 10 15
Яйца 20 0 80
0 0 100
Птица 25-30 0 70-75
60-75 5-10 20
100 0 0
20-40 0 60-80
Свинина 20 80 0
0 0 100
Рыба 40 30 30
40 0 60
60 0 40
Твердый сыр 0-70 0 30-100
30 0 70
Сандвичи 20-100 0-10 0-100
0 0 100
Макаронные изделия 70-80 0 20-30
Хлебобулочные изделия 20-70 0 80-20
0 0 100
100 0 0
рий, и при хранении соков в его атмосфере опасность молочнокислого броже-
ния сохраняется. В этом случае требуется сочетание с небольшими количествами
диоксида серы, если это допустимо.
Углекислый газ широко используется в качестве консерванта для прохлади-
тельных напитков. Давление составляет 2—4 атм, т.е. гораздо ниже, чем в спосо-
бе Бёхи. При этом можно достичь небольших, но достаточных для практического
использования сроков годности. Давно экспериментально установлено, что га-
зированные напитки более стабильны в отношении микробиологической порчи,
чем негазированные. Содержание бактерий в таких напитках уменьшается с уве-
личением срока хранения и концентрации диоксида углерода.
Антимикробное действие углекислоты используется и в производстве вин.
При сбраживании виноградного сока под давлением углекислого газа можно
управлять брожением и прервать его при определённом содержании спирта и
сахара, причём получается вино с известным остаточным сахаром |311. Вино мож-
но специально насыщать углекислым газом (в концентрации 0,6—1,2 г на 1 л) для
защиты от такого вида микробиологической порчи, как перебраживание. При-
годны для этого и смеси двуокиси углерода с азотом.
Хлебобулочные изделия. Упаковка и хранение полуфабрикатов из теста, вы-
печки или нарезанного хлеба в атмосфере инертного газа — сегодня общеприня-
тый технологический приём. Его применение затрудняется высоким содержани-
ем в выпечных изделиях воздуха и кислорода. На практике упаковку и хлеб пе-
ред вакуумированием следует «промыть» углекислым газом. Концентрация ди-
7. Диоксид углерода
73
оксида углерода в таких системах колеблется в зависимости от условий (актив-
ность воды, температура хранения, вид и количество микроорганизмов) от 62 до
99% |32|. Срок годности хлебобулочных изделий может быть увеличен при ис-
пользовании углекислого газа в сочетании с такими антимикробными агентами,
как этанол |33| или сорбиновая кислота |34|.
§11
Прочие действия
Поскольку углекислый газ замещает воздух и таким образом «оберегает» про-
дукты от контакта с кислородом, он обладает, в некотором смысле, антиокисли-
тельным действием и используется при упаковке жировых и молочных продук-
тов, сухих завтраков, арахиса и других склонных к окислению сухих съестных
припасов. «Антиокислительное» действие углекислоты часто имеет существенно
большее значение, чем её антимикробные свойства. Однако такое действие, как
и влияние углекислого газа на дыхание заложенных на хранение фруктов и ово-
щей |35|, не является предметом рассмотрения в этой главе.
Двуокись углерода в большинстве случаев положительно влияет на органо-
лептические свойства напитков, она повышает освежающее действие многих из
них. Наконец, следует упомянуть гиперемическое действие диоксида углерода,
которое вызывает ускоренное всасывание других веществ через слизистую обо-
лочку желудка. Оно проявляется, например, в виде ускоренного всасывания спир-
та из игристых вин.
Г ЛАВА 8
Азот
§1
Синонимы
Немецкий: Stickstoff.
Английский: nitrogen.
Французский: nitrogene.
Итальянский: azoto.
Испанский: azoe, nitrdgeno.
§2
Товарные формы
Азот поставляется в сжиженном виде или в виде газа в баллонах под давле-
нием 150—200 атм.
§3
Свойства
Азот N2 представляет собой бесцветный газ без запаха. При атмосферном
давлении и температуре —196°С он превращается в жидкость. Азот, в отличие от
углекислого газа, почти нерастворим в воде.
Получение
В промышленности азот получают ректификацией жидкого воздуха.
§5
Токсиколого-гигиеническая оценка
Азот инертен и поэтому нетоксичен. Однако вдыхание чистого азота вызы-
вает удушье из-за отсутствия кислорода.
8. Азот
75
§6
Законодательные аспекты применения в пищевых продуктах
В большинстве стран применение азота в пищевых продуктах законодатель-
но не ограничивается. В Германии он имеет статус пищевой добавки44.
§7
Действие на микроорганизмы
В отличие от углекислого газа азот не обладает антимикробным действием.
Эффект от его применения основан исключительно на вытеснении кислорода,
жизненно необходимого для облигатных аэробов 11, 21. Род Clostridium азотом не
угнетается 131. Азот мешает образованию афлатоксинов плесневыми грибами, од-
нако не в такой мере, как двуокись углерода |4|. Азот, так же как и углекислота,
применяется в качестве защитного газа; при этом к упаковочным материалам
предъявляются те же требования (см. §9 гл.7).
§8
Области применения
Азот используется (часто в смеси с двуокисью углерода) как защитный газ
для упакованных хлебобулочных изделий, мяса и птицы, рыбы, твёрдого сыра,
яиц (см. табл. 13) 15, 61.
§9
Прочие действия
Поскольку азот замещает воздух и таким образом «оберегает» продукты от
контакта с кислородом, он обладает, в некотором смысле, антиокислительным
действием и используется при упаковке жировых и молочных продуктов, сухих
завтраков, арахиса и других склонных к окислению сухих съестных припасов, а
также напитков. Антиокислительное действие азота имеет существенно большее
значение, чем антимикробное, однако оно не является предметом рассмотрения
в этой книге.
Глава 9
Нитраты
9
§1
Синонимы
Русский: селитры.
Немецкий: Nitrate, Salpeter.
Английский: nitrates.
Французский: nitrates, salpitre, nitre.
Итальянский: nitrati, salnitro.
Испанский: nitratos, azoatos, salitre, nitro.
§2
Историческая справка
Селитра веками использовалась при посоле мяса и как добавка к рыбе и сы-
ру. Кто первым начал использовать селитру для консервирования пищевых про-
дуктов достоверно неизвестно. Сведения о том, что голландец Гилис Бойкель
(Gillis Beukel), умерший в 1397 году, первым применил её для консервирования
рыбы и что немецкое слово «Рбке1» (рассол) образовано от его имени, сомни-
тельны. Возможно, Бойкель имел дело только с поваренной солью, а с селитрой
не был знаком, как и те, кто занимался посолом до него 111. Но к 1500 году селит-
ра уже известна — Себастьян Брант упоминает её в своей сатирической поэме
«Корабль дураков» (см. §1 гл.4).
Хотя в настоящее время и выяснилось, что главную роль в приготовлении
мясопродуктов играет не селитра, а образующийся из неё нитрит, она до настоя-
щего времени не потеряла своего значения (прежде всего, при обработке круп-
ных кусков мяса). Однако от её применения для консервирования пищевых про-
дуктов отказываются всё чаще.
§3
Товарные формы
Нитраты натрия или калия поставляются в чистом виде (натриевая или ка-
лиевая селитра) или в смеси с поваренной солью и другими веществами.
9. Нитраты
77
§4
Свойства
Селитра (и натриевая и калиевая) представляет собой белый кристалличе-
ский порошок; натриевая селитра гигроскопична. Нитрат натрия NaNO, имеет
температуру плавления 31 ГС, нитрат калия KNO, — 337°С. В 100 г воды при
комнатной температуре растворяется около 90 г NaNO, и 37 г KNO,. В спирте
оба нитрата растворимы очень мало.
§5
Аналитические сведения
При качественном и количественном анализе следует учитывать, что в боль-
шинстве случаев нитриты мешают определению нитратов. Нитриты удаляют, дей-
ствуя подкисленным раствором мочевины или амидосульфокислотой. Класси-
ческие цветные реакции обычно основаны на восстановлении нитрата до нитри-
та и взаимодействии последнего с сульфаниловой кислотой или а-нафтилами-
ном. Нитраты и нитриты можно быстро идентифицировать и количественно опре-
делить с помощью ионной хроматографии |2|.
§6
Получение
Нитрат натрия приготовляют пропусканием нитрозного газа (получаемого
окислением аммиака) через раствор едкого натра или соды. Нитрат калия обра-
зуется при взаимодействии карбоната или гидроксида калия с азотной кислотой
либо из хлорида калия и азотной кислоты в присутствии кислорода45.
§7
Токсиколого-гигиеническая оценка
Острая токсичность. Для крыс LDW нитрата натрия составляет 3—7 г на 1 кг
массы тела. Для более крупных животных нитраты более токсичны. Для челове-
ка считается смертельной доза в 30-35 г на 1 кг массы тела46 |3|. Нитрат калия
токсичнее нитрата натрия; вследствие локального раздражения кишечника и обез-
воживания организма он вызывает понос |4|.
Субхроническая токсичность. Систематических опытов на животных по ис-
пользованию нитратов в качестве пищевых добавок проведено недостаточно. Су-
ществующие данные касаются главным образом попадания нитратов в организм
сельскохозяйственных животных через питьевую воду или растительный корм.
Установлено, что потребление домашними животными в течение 5 недель воды,
содержащей 100 мг нитрата калия на 1 литр, вызывает у них увеличение образо-
вания метгемоглобина. По другим данным, 2% нитрата в траве для кормления
овец не оказывают отрицательного действия на животных |41.
78
Консервирующие вещества
Нитраты не проявляют тератогенного действия в концентрации до 400 мг на
1 кг массы тела |4].
Хроническая токсичность. В литературе отсутствуют сведения о системати-
ческих исследованиях хронической токсичности нитратов на животных |4|.
При изучении канцерогенности нитрата натрия для крыс установлено, что
доза, при которой эффект отсутствует (NOEL), составляет 2,5 г на 1 кг массы
тела в день. При переносе этих результатов на человека, конечно, следует учиты-
вать различия в метаболизме нитратов 15,6|. Исходя из указанного значения NOEL
и обычного фактора безопасности (от 100 до 500), SCF и JECFA установили ДСП
0—5 мг на 1 кг массы тела |7|. Младенцы и маленькие дети особенно чувствитель-
ны к нитратам и образующимся из них в организме нитритам (опасность метге-
моглобинемии); поэтому для продуктов детского питания установлены особен-
но низкие значения допустимого содержания нитратов.
Эпидемиологическая связь между добавлением нитратов и появлением ра-
ковых заболеваний, по современным данным, отсутствует. Опровергающие этот
факт работы авторов из Китая, Чили, Японии и Колумбии не учитывают некото-
рые существенные для здоровья факторы, например нехватку витамина С 17).
Биохимическое поведение. Нитраты могут превращаться в нитриты в ходе
ферментативных процессов или под действием микроорганизмов. Это восста-
новление протекает в значительной степени бесконтрольно. Оно может идти са-
мопроизвольно в продуктах питания и в пищеварительном тракте человека. У
взрослых превращение нитратов в нитриты происходит в кишечнике, у грудных
детей — уже в желудке или двенадцатиперстной кишке; там нитриты очень легко
всасываются, поэтому для грудных детей нитраты особенно токсичны. Таким об-
разом, сами нитраты относительно безопасны, но в организме они могут превра-
щаться в нитриты, которые значительно опаснее, поскольку могут вступать в ре-
акцию нитрозирования с образованием нитрозаминов.
§8
Законодательные аспекты применения в пищевых продуктах
Нитрат натрия (а иногда и калия) разрешён во многих странах в качестве
пищевой добавки к определённым сортам сыра, а также мясо- и рыбопродуктов.
В некоторых государствах от применения нитратов в мясопродуктах отказыва-
ются из-за их неконтролируемого превращения в нитриты и предпочитают раз-
47
решать исключительно нитриты .
§9
Действие на микроорганизмы
Антимикробное действие нитратов направлено исключительно против ана-
эробных бактерий; развитию аэробных они, скорее, способствуют. Некоторые
микроорганизмы могут использовать нитраты как источник азота. От нитратов в
тех концентрациях, в которых они обычно добавляются в пищевые продукты,
вряд ли можно ожидать тормозящего действия на бактерии. Как антимикробное
9. Нитраты
79
средство нитраты действуют в основном в виде нитритов, образующихся из них в
пищевом продукте.
§10
Области применения
Молочные продукты. При изготовлении мелких сыров нитраты натрия или
калия в концентрации 0,01—0,02% добавляют к молоку для замедления вспучи-
вания. Более высокие концентрации нежелательны, так как они могут вызывать
изменение окраски сыра. Нитраты при этом действует не сами — в сыре из них
более или менее быстро (в зависимости от температуры созревания) образуются
нитриты |8|. Нитриты тормозят нежелательное брожение, вызываемое бактерия-
ми рода Clostridium, рода Coli или маслянокислыми бактериями; в готовом сыре
они не обнаруживаются |8|. Для борьбы с поздним вспучиванием эмментальско-
го сыра нитраты менее пригодны, так как могут замедлять развитие полезных
пропионовокислых бактерий.
Мясопродукты, В мясопродуктах нитраты под действием бактерий превра-
щаются в нитриты. Последние проявляют антимикробную активность, а также
способствуют возникновению характерной окраски и специфического аромата.
Антимикробное действие самих нитратов незначительно |9|. Фактически (при
концентрациях нитратов, используемых на практике) консервирующим агентом
являются образовавшиеся нитриты 110]. Недостаток такого самопроизвольного
превращения заключается в том, что оно происходит неконтролируемо.
Нитраты могут использоваться в сухом виде или в виде раствора. При сухом
посоле мясо натирают смесью, состоящей из селитры, поваренной соли и сахара.
Обработанные куски мяса помещают в чан под гнёт. Поваренная соль (за счёт
осмоса) вытягивает из мяса часть тканевой жидкости. Образующийся при этом
рассол (тузлук) покрывает мясо. Сухой посол часто дополняют мокрым.
При мокром посоле мясо помещают в рассол, состоящий из селитры, пова-
ренной соли и сахара, при температуре от +6 до +8°С; более высокая температу-
ра благоприятствует размножению вредных микроорганизмов.
Рыбопродукты. Нитраты добавляют к анчоусам, но не как антимикробное
средство, а из-за их окрашивающего действия.
Глава 10
Нитриты
10
§1
Синонимы
Немецкий: Nitrite.
Английский: nitrites.
Французский: nitrites.
Итальянский: nitriti.
Испанский: nitritos.
§2
Историческая справка
В консервировании пищевых продуктов много веков использовалась селит-
ра 111, но только в 1899 году стало известно, что действующим агентом служит не
она сама, а нитрит, образующийся из неё микробиологическим путём |2|. Так
как превращение нитратов в нитриты происходит обычно неконтролируемо, то
теперь всё чаще предпочитают использовать сами нитриты. Сначала их приме-
няли в чистом виде, но в настоящее время в большинстве стран — только в смеси
с поваренной солью, часто в соотношениях, устанавливаемых законодательно.
Вследствие токсичности нитрита и образующихся из него нитрозаминов его при-
менение в консервировании пищевых продуктов подвергается критике 13].
§3
Товарные формы
Для пищевых продуктов применяется лишь нитрит натрия. Во многих стра-
нах для безопасности и упрощения дозировки он поставляется в смеси с пова-
ренной солью (так называемая нитритная соль). Сохранность и точность состава
таких смесей в целом хорошие (4(.
§4
Свойства
Нитрит натрия NaNO2 представляет собой бесцветные или слегка желтова-
тые гигроскопичные кристаллы, плавящиеся при температуре 306°C4li. Он очень
легко растворяется в воде и плохо в спирте |5].
г
10. Нитриты 81
§5
Аналитические сведения
Для качественного и количественного определения нитритов водный экстракт
из исследуемого продукта питания обрабатывают сульфаниловой кислотой; с по-
следней содержащиеся в экстракте нитриты образуют диазосоединение, которое
сочетается с а-нафтиламином в розовый азокраситель, определяемый колори-
метрически |6|. Для количественного определения можно применять также ре-
акцию с м-фенилендиамином |6|. Количественно нитриты определяют и с помо-
щью ионной хроматографии |7—9|. Содержание нитрита в нитритной соли мож-
но определить цериметрически или спектрофотометрически 1101. Основой мето-
дики, принятой в качестве стандарта в Германии, служит перманганатометрия.
Другой стандартизованный способ обнаружения нитритов в пищевых продуктах
опубликован Американской ассоциацией химиков-аналитиков (111.
§6
Получение
Нитрит натрия кристаллизуется вместе с нитратом из раствора, приготов-
ленного пропусканием нитрозного газа (получаемого окислением аммиака) че-
рез раствор едкого натра. Нитрит растворим хуже нитрата и может быть выделен
при охлаждении раствора.
§7
Токсиколого-гигиеническая оценка
Острая токсичность. Для грызунов LDW нитритов составляет 100—200 мг на 1 кг
массы тела 112—14|. Для человека нитриты более токсичны. Летальная доза при
пероральном введении составляет 32 мг на 1 кг массы тела, т.е. около 2 г на челове-
ка 114|, а по другим данным — 4-6 г 115]. Сравнительно высокая токсичность нит-
ритов может привести к отравлениям в тех случаях, когда нитриты (в чистом виде
или в смеси с нитратами) при переработке мяса применяли неправильно. В насто-
ящее время нитрит натрия используют в основном в смеси с поваренной солью.
Субхроническая токсичность. При использовании раствора нитрита натрия
(концентрация 1,4 г/л, в течение 200 дней) вместо питьевой воды у подопытных
животных были обнаружены повышенное содержание в крови метгемоглобина и
изменения в печени, селезёнке, почках и миокарде (13]. Аналогичный эффект
наблюдается и при использовании нитрита калия. По результатам исследований,
в которых крысам взамен питьевой воды в течение 13 недель давали раствор нит-
рита натрия с концентрациями до 3 г/л, было установлено, что вредный эффект
отсутствует при концентрациях не более 0,1 г/л. Это составляет менее 10 мг на
1 кг массы тела в день 116].
Нитриты оказывают мутагенное действие на микроорганизмы и клетки мле-
копитающих in vitro 131. При испытании на мутагенность in vivo часть тестов дала
положительный результат, а часть — отрицательный |17|.
82
Консервирующие вещества
Хроническая токсичность. Скармливание трём поколениям крыс по 100 мг
нитритов на 1 кг массы тела приводит к снижению концентрации гемоглобина в
крови и уменьшению продолжительности жизни (статистически недостоверно-
му). Способность к продолжению рода у крыс при этой дозе нитритов не ухуд-
шается 1181. Добавление в питьевую воду морским свинкам от 5 до 10 г нитритов
на 1 л (что соответствует 120—290 мг на 1 кг массы тела) в течение 4 месяцев не
приводит к макроскопическим изменениям (кроме состава крови); однако на-
блюдается значительное снижение репродуктивной способности |19|. В работе
1181 установлено, что нитриты не тератогенны.
При длительном использовании корма, содержащего 40% мяса с 0,02—0,5%
нитритов, канцерогенные эффекты обнаружены не были |20|. Скармливание кры-
сам втечение 115 недель корма с добавкой до 0,5% нитрита натрия показало, что
он не канцерогенен 1211. Однако не исключена возможность образования канце-
рогенных N-нитрозосоединений из нитритов и аминов. Они могут образовы-
ваться как в самих пищевых продуктах (экзогенное нитрозирование), так и в же-
лудке (эндогенное нитрозирование). При микробиологическом восстановлении
из нитрата может образовываться дополнительный нитрит. Взаимодействие нит-
рата со слюной ведёт к увеличению усвоения нитрата и нитрита из пищи. Так
как N-нитрозамины — сильные канцерогены, следует ограничивать потребле-
ние пищи, содержащей нитриты. Кроме того, рекомендуется приём веществ, за-
медляющих нитрозирование (например, витаминов С и Е). Для нитритов SCF
установлено временное значение ДСП —0—0,1 мгна 1 кг массы тела (кроме груд-
ных детей до 3 месяцев). JECFA установил ДСП 0—0,2 мг на 1 кг массы тела и
высказался против любых добавок нитритов в детское питание.
Биохимическое поведение. Нитриты легко всасываются из желудочно-ки-
шечного тракта. Они снижают тонус гладкой мускулатуры, расширяют сосуды и
снижают кровяное давление (эффект, используемый в терапии). В более высо-
ких дозах нитриты образуют метгемоглобин и поэтому ведут к цианозу.
Эти свойства нитритов никак не проявляются при концентрациях, приме-
няемых в пищевых продуктах.
§8
Законодательные аспекты применения в пищевых продуктах
Нитриты (Е249, Е250) разрешены в некоторых странах для посола рыбопро-
дуктов49. Почти во всех странах разрешено применение нитритов как вспомога-
тельных веществ при посоле мясопродуктов и в качестве консерванта для них.
Из-за токсичности нитритов зачастую разрешается применять их только в смеси
с поваренной солью.
§9
Действие на микроорганизмы
Общие принципы действия. Антимикробное действие нитритов основано на
высвобождении из них азотистой кислоты, а из неё — оксидов азота. Последние
10. Нитриты
83
связываются с аминогруппами дегидрогеназ микробных клеток, что приводит к
их угнетению 122]. Специфическое действие нитритов заключается вторможении
бактериальных ферментов, участвующих в расщеплении глюкозы [23, 241. В об-
мене веществ у бактерий есть и другие места, уязвимые для нитритов; их наличи-
ем можно объяснить угнетение роста и развития (реакции с цитохромами и с
ферментами, содержащими сульфгидрильные группы) 125, 26|.
Действие нитритов усиливается с уменьшением значения pH, т.е. с повыше-
нием кислотности среды. При pH 6,9 для угнетения бактерий вида Staphylococcus
aureus необходима концентрация нитритов 4000 мг/кг, при pH 5,8 — 400 мг/кг, а
при pH 5,05 — 80 мг/кг |25]. Добавление пищевых кислот, глюконо-6-лактона
или введение кислотообразующих бактерий (род Lactobacillus) увеличивает эф-
фективность нитритов.
Как показывают опыты на питательных средах, концентрации нитритов в
80-160 мг/кг (обычно используемые в мясной промышленности) недостаточны
для удовлетворительного торможения развития бактерий. Часто эффект достига-
ется только сочетанием нитритов с поваренной солью 1271, а также с понижени-
ем (вследствие добавления соли или из-за других факторов) активности воды,
достаточно низким значением pH, низким окислительно-восстановительным по-
тенциалом, понижением температуры хранения, тепловой обработкой и сниже-
нием бактериальной загрязнённости консервируемого продукта 128—32].
Для практического консервирования главным является угнетающее дейст-
вие нитритов на бактерии рода Clostridium и в связи с этим на образование боту-
лотоксинов. Действие усиливается примерно в 10 раз, в том числе в отношении
спор Clostridium botulinum |33|, если питательную среду с нитритом подвергали
тепловой обработке (эффект Периго) |34—37|. В этом случае минимальная эф-
фективная концентрация нитритов составляет 50—200 мг/кг (в зависимости от
значения pH) [27, 29, 38, 391. Причины эффекта Периго до сих пор ясны не пол-
ностью. Модельные опыты дают основания полагать, что продукты реакции нит-
ритов с веществами, которые при нагревании могут образовываться в мясе, обла-
дают большим антимикробным действием, чем сами нитриты. В качестве таких
веществ рассматриваются нитрозотиолы и продукты взаимодействия нитритов с
серосодержащими соединениями и двухвалентным железом (подобные солям Рус-
сена) |40, 41]. Эти соединения очень неустойчивы при нагревании [40, 42]. Воз-
можно, что действие нитрита в мясе, прошедшем тепловую обработку, могут уси-
ливать и другие продукты подобных реакций — S-нитрозоцистеин, комплексы
цистеина с двухвалентным железом и оксидами азота 1421 или продукты реакции
нитрита с сахарами, аминосахарами и другими карбонильными соединениями 1431.
Спектр действия. Нитриты не влияют на рост и развитие грибов и плесеней.
Их действие направлено исключительно против бактерий (см. табл. 14).
§10
Области применения
Добавление нитритов к мясным продуктам, особенно к колбасам и копчёно-
стям, не только способствует образованию требуемой окраски и специфического
84
Консервирующие вещества
Таблица 14. Угнетающее действие нитрита на бактерии 125]
Виды тестируемых бактерий Минимальная действующая концентрация нитрита, мг/кг, после нагрева
в анаэробных условиях в аэробных условиях
Streptococcus mitis 40 4 000
Streptococcus laclis 6 000 10 000
Streptococcus liquefaciens 800 6 000
Streptococcus faecalis 4 000 6 000
Streptococcus salivarius 80 4 000
Streptococcus pyogenes 2 20
Lactobacillus easel 4 000 8 000
Lactobacillus arabinosus 8 000 25 000
Pediococcus cerevisiae 8 000 25 000
Bacillus megatherium 80 4 000 , .
Escherichia coli 2 000 4 000
Aerobacter aerogenes 2 000 4 000
Proteus vulgaris 400 4 000
Salmonella typhosa 800 2 000
Salmonella typhimurium 2 000 4 000
Shigella flexneri 100 2 000
аромата, но и защищает от окислительной и бактериальной порчи. В рамках этой
книги интерес представляет исключительно последний эффект. Добавление нит-
ритов к мясопродуктам замедляет развитие патогенных и токсичных микроорга-
низмов и тем самым образование энтеротоксинов и других ядов, продуцируемых
бактериями, что предупреждает пищевые отравления. Их антимикробное дейст-
вие проявляется при концентрациях 50-160 мг на 1 кг продукта. Из-за токсич-
ности нитритов концентрацию желательно было бы уменьшить, используя мно-
гофункциональные заменители, но таковые до сих пор не известны.
Из множества продуктов, испытанных входе поиска таких заменителей, луч-
ше всего подходят сорбиновая кислота и сорбаты 144, 451. В производстве копчё-
ностей при обычных значениях активности воды и pH эти вещества угнетают
патогенные и токсичные микроорганизмы иногда лучше, чем нитриты (см. гл.19).
Однако их применение никогда не даёт той окраски и того аромата соления, ко-
торые возникают при использовании нитритов. По этой причине сорбаты в дан-
ной области не смогли стать заменой нитритов.
Как альтернативу нитриту можно рассматривать так называемый Вискон-
син-процесс, в котором используют защитную культуру Pediococcus acidilacticus
вместе с сахарозой 1461, а также применение безнитритных посолочных смесей
на основе динитрозилферрогемохромина или протопорфирина IX |47—49| либо
использование пигментов плесневых грибов рода Monascus''' 150—521. Некоторые
из этих методов обеспечивают привлекательное окрашивание, но большинство
нс оказывает антимикробного действия; в отдельных случаях возникают техни-
ческие проблемы, иногда продукты недостаточно проверены на токсикологиче-
скую безопасность.
Нитриты очень реакционноспособны и поэтому в мясе относительно быст-
ро претерпевают превращения 153, 541. Частично они окисляются в нитраты, или
10. Нитриты
85
превращаются в оксиды азота, или связываются с миоглобином или другими бел-
ками либо с такими аминокислотами, как триптофан и тирозин (531; частично
они реагируют с сульфгидрильными соединениями. Жиры, углеводы и другие со-
ставляющие пищевых продуктов также могут вступать в реакцию с нитритами 1551.
Для сухого и мокрого посола предпочтительнее использовать нитраты. Нит-
риты больше применяют в колбасах и других продуктах из измельчённого мяса.
При использовании нитратов нитритный посол часто удешевляется благодаря
ускорению процесса. Процесс посола можно ускорить шприцеванием рассола в
мышечную ткань или введением его через кровеносные сосуды, а также с помощью
ультразвука или вакуума.
§11
Прочие действия
Нитриты присоединяются к мышечному красителю миоглобину и образуют
с ним устойчивый при кулинарной обработке нитрозомиоглобин, в результате
чего мясо приобретает красный цвет. Наряду с этим нитриты вносят важный вклад
в создание аромата соления |44| и защищают содержащийся в мясе жир от окис-
лительной порчи. Эти «побочные» эффекты имеют для пищевого производства
по меньшей мере такую же ценность, как и консервирующее действие нитрита.
Глава 11
Озон
§1
Синонимы
Немецкий: Ozon.
Английский: ozone.
Французский: ozone.
Итальянский: ozono.
Испанский: ozono.
§2
Историческая справка
Озон был первым окислителем, применявшимся для обеззараживания питье-
вой воды. Его использование началось в 80-х годах прошлого столетия. Вода Ниц-
цы обрабатывается озоном с 1906 года 111.
В настоящее время значение озонирования возрастает, поскольку от обра-
ботки питьевой воды с помощью хлора всё чаще отказываются из токсикологи-
ческих соображений.
§3
Свойства
Озон О, представляет собой газ голубого цвета с характерным запахом, ощу-
тимым даже при очень сильном разбавлении.
§4
Аналитические сведения
Озон с о-толуидином даёт жёлтое окрашивание, которое можно измерить
фотометрически и использовать для количественного определения содержания
озона в воде. Для этой цели применяют также УФ-спектроскопию, колоримет-
рию и хемилюминесценцию. Быстрое полуколичественное определение озона
проводят с помощью специальных тестовых трубок |2|.
11. Озон
87
§5
Получение
Так как озон малоустойчив, его обычно получают на месте применения
действием тихого электрического разряда на молекулярный кислород в так на-
зываемых озонаторах. Если вместо воздуха применяется чистый кислород, то при
прочих равных условиях можно получить удвоенное количество озона.
§6
Токсиколого-гигиеническая оценка
Озон — это высокотоксичный газ. Уже при концентрации 1—2 мг на 1 м3
воздуха он раздражает слизистые оболочки [3, 4|. Острая токсичность в зависи-
мости от вида животного и экспозиции составляет от 2 до 25 мг/м1 |4, 5|. Значе-
ние ПДК51 для озона — 0,2 мг/м3. Воздействие озона приводит к образованию
перекисей из липидов и тем самым к окислительному распаду клеточных макро-
молекул |6|. Так как озон уже в бактерицидных концентрациях опасен для чело-
века, он не пригоден в качестве дезодоранта и дезинфицирующего средства для
помещений, в которых находятся люди.
§7
Законодательные аспекты применения в пищевых продуктах
Озон разрешён в некоторых странах для обработки питьевой воды (напри-
мер, в Германии; максимальная концентрация 10 мг на 1 л воды). Остаточное
количество озона в питьевой воде после обработки должно составлять не более
0,05 мг/л.
§8
Действие на микроорганизмы
Озон в соответствующей концентрации убивает бактерии относительно бы-
стро, т.е. он является скорее средством дезинфекции, чем консервантом |7, 8|.
Антимикробное действие озона основано главным образом на сильном окисли-
тельном действии, которое ведёт к необратимым изменениям жирных кислот кле-
точных мембран, белков и ДНК |7, 9, 10|. Его действие усиливается при повыше-
нии относительной влажности воздуха (по-видимому, бактерии легче уничтожа-
ются озоном в набухшем состоянии, чем в сухом). Грамположительные бактерии
более чувствительны к озону, чем грамотрицательные. Бактерицидное действие
озона значительно сильнее бактерицидного действия свободного хлора |7|. Как
сильный окислитель, озон может разрушать другие консерванты 111|.
88
Консервирующие вещества
§9
Области применения
Главная область применения озона — обеззараживание питьевой воды. Пре-
имущество его использования заключается в том, что избыточный озон после
уничтожения бактерий быстро превращается в молекулярный кислород. В воде
не остаётся (как после применения хлора) нежелательных посторонних веществ.
Подвергаемая обработке питьевая вода контактирует со смесью озона и воздуха,
получаемой непосредственно перед этим в озонаторах. Доза озона составляет
1—5 мг на 1 л воды (в зависимости от количества бактерий и других условий) 11,
12-141.
Озон находит широкое применение при дезодорировании и дезинфекции
воздуха в холодильниках и морозильниках для овощей, фруктов и рыбы, где он
используется в концентрации 2—3 мг на 1 м ’ воздуха. Озон может изменять окрас-
ку рыбы ] 15, 16|. В США птицу часто обрызгивают озонсодержащей водой для
уничтожения сальмонелл. Кроме того, озон может использоваться для стерили-
зации оборудования и бутылок в производстве вин 1171.
Глава 12
Диоксид серы
12
§1
Синонимы
IUPAC: оксид серы (IV).
Русский: двуокись серы, сернистый ангидрид, «сернистый газ», «сернистая кислота»52.
Немецкий: Schwefeldioxid, Schwefligsaureanhydrid, «schweflige Saure».
Английский: sulphur dioxide.
Французский: bioxyde de soufre, anhydride sulfureux, gaz sulfureux, «acide sulfureux».
Итальянский: biossido di zolfo, anidride solforosa, «acido sulforoso».
Испанский: dioxido de sulfuro, anhidrido sulforoso, «acido sulforoso».
§2
Историческая справка
Уже в древности (Ассирия, Китай, Греция) диоксид серы использовался при
окуривании «для изгнания злых духов» (Гомер. Одиссея. XXII, 481—2, 493—5).
Плиний упоминает, что «дух серы» является улучшителем вина (Plinius. Naturalis
historiae. XIV. 129). По мнению других авторов |1|, в какой именно форме ис-
пользовали серу не совсем ясно.
Сернистый газ стал широко использоваться, вероятно, лишь во времена позд-
него средневековья. Применение его часто порождало проблемы. В Кёльне
в XV веке обработка вина серой была полностью запрещена, так как из-за неё
«природе человека наносится вред и пьющие становятся больными» 111. В 1487 году
в Ротенбурге существовало предписание, по которому обработка бочек серой до-
пускалась, но «...следуетбрать набольшую бочку не более лота серы». Обрабаты-
вать вино серой можно было только один раз. Рейхстагом Линдау чрезмерное
окуривание вина серой было запрещено в 1497 году, а годом позже запрет был
введен и рейхстагом Фрейбурга в Брейсгау |2|.
В последующие столетия сернистый газ использовался как консервант для
целого ряда пищевых продуктов. И сегодня, несмотря на ограничения, связан-
ные с токсичностью, он незаменим в производстве многих продуктов питания.
§3
Товарные формы, производные
Диоксид серы поставляется сжиженным в баллонах, а также в виде водных
растворов. Важную роль играют и различные сульфиты.
90
Консервирующие вещества
§4
Свойства
Сернистый ангидрид SO2 при обычных условиях представляет собой бесцвет-
ный негорючий газ с резким запахом. Плотность сернистого газа в два с лишним
раза выше, чем у воздуха; при —10°С он сгущается в жидкость. В одном литре
воды при 0”С растворяется 80 л SO2, а при 20°С — 40 л.
Сульфиты (табл. 15) представляют собой белые порошки, которые (за ис-
ключением сульфита кальция) легко растворяются в воде и обладают более или
менее сильным запахом сернистого газа. Гидросульфиты существуют только в
растворах; при выпаривании они превращаются в пиросульфиты (метаби-
сульфиты).
Таблица 15. Характеристики сернистого газа и важнейших сульфитов — источников SO2
Соединение Формула Молярная масса, г Содержание активного сернистого ангидрида, %
Диоксид серы SO, 64 100
Сульфит натрия, Na3SO, 126 50,8
безводн ый
Сульфит натрия, Na2SO.-7H2O 252 25,4
гептагидрат
Гидросульфит натрия NaHSO, 104 61,6
Пиросульфит натрия Na2S,O, 190 67,4
Сульфит калия k,so. 158 40,6
Гидросульфит калия K.HSO, 120 53,3
Пиросульфит калия K2S2O5 222 57,7
Сульфит кальция CaSO. 2H2O 156 41,0
§5
Аналитические сведения
Диоксид серы восстанавливает иодат до свободного иода; поэтому иодат-
крахмальная бумага в присутствии SO2 окрашивается в синий цвет. Иодкрахмаль-
ная бумага в присутствии SO2 обесцвечивается, так как свободный иод восста-
навливается до иодида”.
Для количественного определения двуокиси серы в продуктах питания (при
отсутствии маскирующих веществ) продукты титруют непосредственно раство-
ром иода. По другому варианту к пищевому продукту добавляют иодид и титру-
ют раствором йодата. Более точным, но трудоёмким является извлечение дву-
окиси серы из исследуемого продукта кипячением с разбавленной соляной ки-
слотой в токе углекислого газа. Сернистый газ улавливается раствором перекиси
водорода и окисляется в сульфат, который можно определить алкалиметриче-
ски, комплексометрически или гравиметрически 13, 4|. Таким методом опреде-
ляется общее содержание двуокиси серы в пищевом продукте. В более новом
способе количественного определения SO2 («flow injection analysis» — FIA) дву-
окись серы обесцвечивает малахитовую зелень |5|; модификации этого метода
описаны в работе 16],
12. Диоксид серы
91
С помощью ионной хроматографии можно различить свободный и связан-
ный диоксид серы |7, 8|. При этом используется электрохимический детектор
(восстановительное амперометрическое титрование) |9|. Сульфиты можно опре-
делять также ферментативно с помощью сульфитоксидазы 110|. Свободную, а
после соответствующей обработки и связанную двуокись серы можно опреде-
лить с помощью иммобилизованных Thiobacillus thiooxidans в качестве биосенсо-
ра |11|. Среди методов анализа сульфитов, распространённых до 1990 года
(FIA, колориметрия, ферментный), чаще всего использовали способ Моньера —
Вильямса 13, 12|.
§6
Получение
Сернистый газ образуется при обжиге сульфидных руд или при сжигании
серы. Для очистки его либо сжижают, либо поглощают холодной водой с после-
дующей десорбцией при нагревании.
Сульфиты получают поглощением сернистого газа растворами соответствую-
щих щелочей. В зависимости от стехиометрического соотношения образуются
растворы сульфитов или бисульфитов. При упаривании из них получаются кри-
сталлические сульфиты или пиросульфиты.
§7
Токсиколого-гигиеническая оценка
Острая токсичность. Для крыс при пероральном введении LDsn сернистого
ангидрида составляет 1—2 г на 1 кг массы тела. Меньшее значение получено при
использовании 6,5%-х растворов, большее — для 3,5%-х растворов 1131. Близкое
значение имеет острая токсичность метабисульфита натрия |14|. Для кроликов
при пероральном введении LD,() сернистого ангидрида равна 600—700 мг на 1 кг
массы тела, а для кошек — 450 мг/кг. Смертельное отравление сернистой кисло-
той (перорально) собаки и человека невозможно из-за возникающей рвоты 115|.
Сернистая кислота и сульфиты существенно более токсичны при внутривенном
введении 1161.
Люди по-разному реагируют на двуокись серы. Некоторые безболезненно
переносят до 4 г сульфита в день (т.е. примерно 50 мг на 1 кг массы тела), а дру-
гие уже после приема очень малых количеств жалуются на головные боли, тош-
ноту, понос или ощущение тяжести в желудке |17|. Для переносимости серни-
стой кислоты, растворённой в вине, большое значение имеет кислотность желу-
дочного сока, — люди, имеющие пониженную или повышенную кислотность,
существенно более чувствительны, чем люди с нормальной кислотностью |18|.
Связанная сернистая кислота действует на организм, в принципе, так же, как и
свободная. Различие заключается лишь в силе и быстроте реакции, что объясня-
ется разной кинетикой |15|.
Субхроническая токсичность. Скармливание крысам 0,5—1% метабисульфита
калия в течение 10 дней способствует выведению из организма кальция 119|. Ток-
92
Консервирующие вещества
сичность корма с содержанием 0,6% метабисульфита натрия имеет две фазы. В
первые два месяца приёма главными являются нехватка витамина В,. В дальней-
шем (через 3—4 месяца) действие яда может быть предотвращено приёмом вита-
мина В, лишь частично. Вдобавок наступает диарея |20]. После 3 месяцев приёма
160 мг бисульфита натрия на 1 кг массы тела в день у мышей значительно увели-
чивался падёж, особенно при недостаточном питании |21|. Наличие в корме у
крыс 6—8% метабисульфита натрия в течение 10—56 дней приводило к значи-
тельному подавлению роста, уменьшению аппетита и усвоения пищи. Доза свы-
ше 2% вызывала анемию; 1 % сульфита приводил к поражениям различных орга-
нов |22|.
При кормлении свиней в течение 15 недель нежелательное влияние на раз-
витие и состояние внутренних органов наблюдалось лишь при концентрации суль-
фитов 1,7%, но уже при концентрации 0,16% снижалась концентрация тиамина
в моче и печени 123].
Хроническая токсичность. Присутствие 0,5—2% бисульфита натрия в корме
крыс в течение года ведёт к поражениям нервной системы, половых органов,
костной ткани, почек и других внутренних органов. Концентрация менее 0,25%
не приводит к патологическим явлениям (при концентрации свыше 0,1%
наблюдается понос). Добавление в корм самцов менее 0,1% бисульфита натрия
даже способствует увеличению массы |24|. Добавку 0,12% пиросульфита калия к
питьевой воде (что соответствует 30—90 мг SO2 на 1 кг массы тела) в течение
20 месяцев крысы перенесли без существенного ущерба для здоровья 1251. На-
блюдались лишь рост числа лейкоцитов у самцов, увеличение массы селезёнки у
самок и снижение числа детёнышей в помёте. Скармливание 350—700 мг/кг сер-
нистой кислоты в форме метабисульфита натрия трём поколениям крыс не ока-
зало отрицательного влияния на состояние внутренних органов, рост, способ-
ность к размножению и массу молодняка 126]. На свиней скармливание до 0,35%
метабисульфита натрия в течение 48 недель не оказало никакого действия, но
при концентрациях свыше 0,83% возникали различные органические поврежде-
ния 1231.
Опыты на четырёх поколениях крыс, получавших вино, содержащее от 100
до 450 мг SO2 на 1 л, не продемонстрировали отклонений от нормы по усвоению
белка из корма, способности к размножению, по макроскопическому и гистоло-
гическому состояниям, биохимическому поведению и массе различных внутрен-
них органов. У крыс, которые получали вино с более высоким содержанием SO2,
наблюдалось замедление развития 1271.
У крыс, получавших в длительном опыте корм, обогащённый тиамином и
содержащий 2% метабисульфита натрия, наблюдалось замедление развития, в
том числе и в последующих поколениях. При концентрации 0,5% сульфиты от-
рицательно влияют на способность к размножению. Другие поражения наблю-
даются только при более высоких дозах. При концентрациях ниже 0,25% отли-
чий от контроля нет вообще 1281.
Международное агентство по исследованию рака (International Agency for
Recearch on Cancer — IARC) зачислило сульфиты по их канцерогенному дейст-
вию на человека в разряд «inadequate evidence» (недостаточно данных); для под-
опытных животных диоксид серы отнесён в разряд «limited evidence» (ограни-
12. Диоксид серы
93
ченные данные), а сульфиты, бисульфиты и метабисульфиты — в разряд
«inadequate evidence» 1291.
Сернистая кислота может оказывать мутагенное действие на микроорга-
низмы 130, 311.
На основании этих данных и учитывая индуцируемые сульфитами реакции
непереносимости, SCF и JECFA установили для всех сульфитов значение ДСП
— 0—0,7 мг на 1 кг массы тела (в пересчёте на сернистую кислоту).
Реакции непереносимости. Сульфиты могут вызывать у людей как истинную
аллергию, так и псевдоаллергические реакции |32|. Реакции непереносимости
сульфитов выражаются большей частью в форме крапивницы или приступов аст-
мы |33|. Часто они сопровождаются непереносимостью ацетилсалициловой ки-
слоты. В зависимости от восприимчивости реакцию могут вызвать от 2 до 250 мг
диоксида серы 1341. Поэтому закон требует указывать на этикетках пищевых про-
дуктов наличие в них сульфитов 135].
Биохимическое поведение. Сера наиболее стабильна в состоянии со степе-
нью окисления +6. Поэтому сера, имеющая в двуокиси и в сульфитах степень
окисления +4, склонна к окислению до сульфата. В организме это превращение
катализируется сульфитоксидазой — ферментом, встречающимся преимущест-
венно в сердце, печени и почках 136, 371. Окислять сульфит до сульфата могут и
другие, не специфические ферменты, например ксантиноксидаза. Сульфат бы-
стро выделяется с мочой; поэтому сернистая кислота в организме не накапли-
вается.
Токсичность обусловлена также действием сернистой кислоты и сульфитов
нафункции организма, витамины и жизненно необходимые ферменты |37]. Так,
даже в очень малых концентрациях SO2 угнетает дегидрогеназы J38]. Соедине-
ния с дисульфидными мостиками, например цистин, восстанавливаются суль-
фитами до соответствующих сульфгидрильных соединений 1151. Кроме того, суль-
фиты разрушают тиамин, расщепляя связь между пиримидиновой и тиазольной
частями молекулы. Крысы, корм которых дополнительно обогащали тиамином,
переносили существенно большие количества SO2, чем контрольные животные
139|. Цитозин и 5-метил цитозин дезаминируются сульфитами in vitro.
§8
Законодательные аспекты применения в пищевых продуктах
Диоксид серы, некоторые сульфиты, бисульфиты и пиросульфиты разреше-
ны практически во всех странах для консервирования многих продуктов пита-
ния (в основном растительных)'4.
Максимально допустимые количества отличаются для разных продуктов пи-
тания. Для продуктов, непосредственно употребляемых в пищу, они не превы-
шают в большинстве случаев 100 мг/кг. Для вин максимальная концентрация, в
зависимости от страны и сорта вина, составляет 200-250 мг/л; для некоторых
сортов вина она выше.
94 Консервирующие вещества
§9
Действие на микроорганизмы
Общие принципы действия. Действие сернистой кислоты на микроорганиз-
мы основано главным образом на замедлении ферментативных реакций. Давно
известно сильное торможение ферментов, содержащих сульфгидрильные груп-
пы. Высокая восприимчивость этих ферментов к сульфитам объясняется замед-
лением реакций, зависимых от никотинамидадениндинуклеотида (НАД) 1381. Для
дрожжей главным является блокирование реакции превращения глицерин-
альдегид-3-фосфата в 1,3-дифосфоглицериновую кислоту, у бактерий вида
Escherichia coii замедляется преимущественно НАД-зависимое образование ща-
велевоуксусной кислоты из яблочной |40|. Кроме того, диоксид серы ингибирует
цепочки ферментативных реакций, взаимодействуя с конечными или промежу-
точными продуктами. Так, образующийся при распаде углеводов ацетальдегид
сразу же реагирует с диоксидом серы; в итоге равновесие реакции смещается, так
как образующийся аддукт не доступен ферментам 1411.
На антимикробную активность кислот-консервантов сильно влияет значение
pH консервируемого продукта. Сернистая кислота не является исключением, но
имеет свои особенности. Наряду с сернистым газом SO2 в равновесии находятся
три продукта: недиссоциированная сернистая кислота H2SO,, гидросульфитные
ионы HSOj и сульфитные ионы SO^. При рН< 1,7 в растворе преобладает недис-
социированная сернистая кислота, в области 1,7<рН<5,1 — гидросульфитные ио-
ны, при рН>5,1 диссоциирована большая часть сернистой кислоты". Содержа-
ние различных продуктов диссоциации представлено на рис.7 |42|.
Какая из форм сернистой кислоты действует в каждом конкретном случае
установить трудно, но наибольшей антимикробной активностью обладают рас-
творённый сернистый газ и недиссоциированная сернистая кислота 122, 41]. Гид-
росульфит-ионы оказываюттакоеже или несколько меньшее антимикробноедей-
ствие. Это объясняет эффективность сульфитов в кислой среде. Различие в дей-
ствии недиссоциированной сернистой кислоты и гидросульфит-ионов зависит
Рис.7. Содержание SO2,
HSO, и SO] п водном
растворе и зависимости
от значений pH
Значение pH
12. Диоксид серы
95
от вида микроорганизмов. Полностью диссоциированные сульфиты практиче-
ски неактивны; в этом сернистая кислота не отличается от других кислот-кон-
сервантов.
Некоторые компоненты продуктов питания могут образовывать аддукты с
сернистой кислотой. Особенно к этому склонны карбонильные соединения (аль-
дегиды, кетоны, сахара), которые образуют сульфонаты56. Их образование зна-
чительно в области pH 3—5 — условия, в которых сернистая кислота больше все-
го применяется |22, 411. Как правило, взаимодействие сернистой кислоты с кар-
бонильными соединениями пищевых продуктов ведёт к уменьшению или к пол-
ному прекращению её действия на дрожжи. При этом, если сульфонат ацеталь-
дегида57 ещё проявляет слабую активность, то аддукты с сахарами практически
совсем неактивны 143, 44|. Сернистая кислота, связанная с ацетальдегидом, эф-
фективно действует против бактерий рода Lactobacillus [45|.
Спектр действия. Сернистая кислота и её соли проявляют в основном анти-
бактериальное действие. Действие против дрожжей и плесневых грибов выраже-
но слабее.
Представленные в табл. 16 минимальные действующие концентрации могут
быть перенесены на практику с большими оговорками. По большей части они
основаны на наблюдениях только в течение нескольких часов. Кроме того, не
учтена возможность разнообразных реакций сернистой кислоты и компонентов
пищевых продуктов. При консервировании пищевых продуктов следует учиты-
вать, что к диоксиду серы очень восприимчивы молочнокислые бактерии 14б|.
Таблица 16. Тормозящее действие сернистой кислоты протии микроорганизмов [41,47]
Вид микроорганизмов Значение pH Минимальная эффективная концентрация сульфита натрия, мг/кг
Бактерии: Pseudomonas fluorescens 6 500
Pseudomonas ejjusa 6 500
Pseudomonas ovalis 6 1000
Staphylococcus aureus 6 800
Lactobacillus easel 6 1000
Lactobacillus arabinosus 6 550
Escherichia coll 6 1000- 2000
Aerobacter aerogenes 6 1000
Bacillus sublilis 6 500
Bacillus megatherium 6 500
Bacillus cercus var. mycoidcs 6 500
Дрожжи:
Saccharomyces cerevisiae 4,0 800-1600
Saccharomyces ellipsoideus 2,5-3,5 200-800
Zygosaccharomyces nussbaumii 4,0 2000
Hansenula anoma la 5,0 2400
Плесневые грибы: Mucor spec. 2,5-3,5 300-600
Penicillium glaucum 4,5 2800
PeniciIlium spec. 5,0 1600-4000
Penicillium spec. 2,5-3,5 200-600
Aspergillus niger 4,5 2200
96
Консервирующие вещества
Из табл. 16 следует, что тормозящее действие сульфита натрия в отношении
дрожжей явно слабее, чем в отношении бактерий. Кроме того, разные расы дрож-
жей по-разному реагируют на сернистую кислоту |411. Против плесневых грибов
сернистая кислота действует в тех же концентрациях, что и против дрожжей.
Для расширения спектра действия консервирующей системы сернистую ки-
слоту, обладающую в основном бактериостатическими свойствами, часто исполь-
зуют в сочетании с сорбиновой и бензойной кислотами, действующими в боль-
шей степени как фунгистатики.
Значительная устойчивость к сернистой кислоте известна только для Zygo-
saccharomyces bailii. Известно также, что штаммы дрожжей, культивируемые в от-
сутствие SO2, гораздо восприимчивее к этому консерванту, чем те, которые рос-
ли на средах, содержащих двуокись серы.
§10
Области применения
Сернистая кислота используется во многих областях пищевой промышлен-
ности, и не только из-за её антимикробного эффекта. Ниже приведены приме-
ры, иллюстрирующие только действие сернистой кислоты против микроорга-
низмов.
Мясопродукты. Сульфиты тормозят развитие бактерий в свежем мясе и мя-
сопродуктах 1481. Одновременно сернистая кислота в известной мере стабилизи-
рует окраску мяса. В результате у потребителя может сложиться обманчивое впе-
чатление о свежести мяса. Поэтому в настоящее время во многих странах приме-
нение сернистой кислоты в мясе рассматривается как фальсификация и введе-
ние в заблуждение.
Фруктовые продукты. Сернистую кислоту используют во многих продуктах
из фруктов как промежуточный консервант. Её добавляют к сырью или полу-
фабрикатам и удаляют в процессе переработки нагреванием или вакуумирова-
нием. В конечном продукте она содержится в незначительном количестве.
Как антимикробное средство сернистую кислоту применяют для сохране-
ния целых и дроблёных фруктов (используемых для дальнейшей переработки),
сухофруктов, фруктовых соков (используемых как сырьё), концентратов фрук-
товых соков, фруктовых пульп и фруктовых пюре. Кроме антимикробной роли
она почти всегда должна выполнять и другие функции защиты — от окислитель-
ных (ферментативных и неферментативных) реакций побурения, других реак-
ций окрашивания, от разрушения витаминов. Необходимая в этих случаях кон-
центрация сернистой кислоты часто выше концентрации, которая требуется для
защиты от микроорганизмов. На практике (в зависимости от вида продукта) до-
бавляют от 0,01 до 0,2% SO2, а в отдельных случаях и более. Остаточное количе-
ство сернистого газа в конечном продукте редко превышает 0,01 %, чаще оно зна-
чительно ниже. Если такие концентрации и оказывают антимикробное дейст-
вие, то незначительное, тем более что часть сернистой кислоты связана с компо-
нентами пищевого продукта, например с сахаром.
Напитки. Основной напиток, в котором применяется диоксид серы, — вино
(и полупродукты для его производства) |49|.
12. Диоксид серы
97
Сернистую кислоту применяют в производстве сока. Её добавляют к свеже-
выдавленному соку для замедления роста уксуснокислых бактерий, диких дрож-
жей и плесневых грибов. Культурные дрожжи при правильной обработке серни-
стым газом не погибают; поэтому добавление его к соку обеспечивает быстрое и
гарантированное брожение. Кроме того, обработка сернистым ангидридом за-
медляет развитие кислоторазрушающих бактерий. Для соков с низким содержа-
нием кислот, получаемых при нормальной температуре, требуется примерно 40—
50 мг двуокиси серы на 1 л; для соков, богатых кислотами, достаточно 30—40 мг/л.
Если сок получают при более высокой температуре (например, в южных стра-
нах), требуется до 200 мг/л сернистого ангидрида.
Большее количество SO2 (1500—2000 мг/л) позволяет вообще исключить бро-
жение. Из обработанного таким образом «немого» сока в специально сконструи-
рованных аппаратах нагреванием до 90—110°С при одновременном пропускании
инертного газа можно удалить двуокись серы до остаточного количества при-
мерно 25—150 мг/л 150|. После удаления сернистого газа соки можно использо-
вать для производства вин с остаточным сахаром. В настоящее время добавление
сернистого газа или сульфитов во время брожения (т.е. остановка брожения) счи-
тается нежелательным, так как приводит к слишком высокому содержанию сер-
нистой кислоты в конечном продукте.
Добавление сернистого газа во время и после приготовления вина приводит
к связыванию ацетальдегида (не обсуждаемому здесь), стабилизации окраски,
получению требуемого окислительно-восстановительного потенциала, а также к
микробиологической устойчивости. Часть сернистой кислоты связывается с раз-
личными компонентами вина и побочными продуктами брожения, прежде всего
с ацетальдегидом. Антимикробное действие сернистой кислоты определяется пре-
имущественно несвязанной частью, т.е. свободной сернистой кислотой. Связан-
ная сернистая кислота тоже оказывает действие на некоторые бактерии |45, 511.
В соответствии со своим спектром действия диоксид серы прежде всего умень-
шает бактериальные изменения вина («болезни вина») — уксусное скисание, мо-
лочнокислое и маннитное брожение, мышиный привкус и ожирение. Обычная в
виноделии концентрация сернистого ангидрида не уменьшает нежелательное раз-
витие дрожжей, т.е. перебраживание. Существуют виды дрожжей, которые ак-
тивны даже при концентрации SO2 1000 мг/л |52|. Поэтому в настоящее время
для стабилизации вин с остаточным сахаром используют сорбиновую кислоту,
чей спектр действия удачно дополняет спектр действия сернистой кислоты.
С давних пор сернистая кислота в виде 1—2%-х растворов служит для дезин-
фекции аппаратов, сосудов, бутылок, пробок и прочего оборудования и инвен-
таря, необходимого в виноделии, производстве напитков и других отраслях пи-
щевой промышленности. Ёмкость ополаскивают микробиологически чистой во-
дой и дают ей стечь, чем сводят до минимума попадание SO2 в готовый пищевой
продукт. Правда, корковые пробки от длительного воздействия сернистой ки-
слоты портятся. Известен также способ окуривания сосудов — внутри сосуда сжи-
гают серу и образующийся сернистый газ оказывает дезинфицирующее действие.
98 Консервирующие вещества
§11
Прочие действия
Наряду с консервирующим действием двуокись серы обладает целым рядом
других свойств, как полезных, так и нежелательных.
Самым серьёзным недостатком диоксида серы является его собственный ин-
тенсивный резкий запах, который можно почувствовать в обработанных им пи-
щевых продуктах5*. Поэтому диоксид серы используется преимущественно для
консервирования продуктов, подвергаемых дальнейшей переработке.
Вследствие своей высокой реакционной способности сернистая кислота мо-
жет вступать в многочисленные химические взаимодействия с составляющими
пищевых продуктов. Часть таких реакций нежелательна, а часть используется в
технологии. Важным является разрушение тиамина под действием сернистой ки-
слоты [39, 41]. Оно проявляется при высокой концентрации двуокиси серы в со-
четании с низким значением pH. Кроме того, продукты, богатые витамином В,,
вряд ли можно законсервировать сернистой кислотой, так как поглощение дву-
окиси серы тиамином снижает консервирующий эффект. В присутствии серни-
стой кислоты сильно уменьшается разрушение витамина С в пищевых продуктах.
Реакция сернистой кислоты с альдегидами полезна для виноделия. Из-за этого
свойства диоксид серы незаменим в производстве вина, так как в его отсутствие
побочный продукт брожения — ацетальдегид — придавал бы вину нежелатель-
ный запах и вкус.
Восстанавливающие и антиокислительные свойства сернистой кислоты име-
ют большое значение для многих отраслей пищевой промышленности. Добав-
лением SO2 можно замедлить реакции ферментативного побурения (он подавля-
ет активность ферментов или перехватывает ускоряющие процесс свободные ра-
дикалы). Сернистая кислота тормозит также многие неферментативные реакции
побурения, включая реакцию Майяра 1531.
Некоторые сульфиты в определённых условиях могут разрушать образую-
щиеся в пищевых продуктах афлатоксины 1541.
Из-за выдвинутых против двуокиси серы и сульфитов обвинений в токсич-
ности им давно ищут замену. В числе прочих заменителей обсуждались: 5,6-суль-
финил-Ь-аскорбиновая кислота 155], 2-фосфат аскорбиновой кислоты |56|, сама
аскорбиновая кислота, ингибиторы полифенолоксидаз и серосодержащие ами-
нокислоты [53]. Так же как и нитриты, двуокись серы — многофункциональное
вещество. По некоторым свойствам она может быть заменена другими консер-
вантами. Однако до сих пор не известно вещество, которое одновременно может
проявлять такие функции диоксида серы, как ингибирование ферментов, вос-
станавливающее и антиокислительное действие.
Глава 13 МИИИИИ^ИИИММИИИИИИИИИИ^^И
ННМНИВИНММИ^М^Н 13
§1
Синонимы
Немецкий: Chlor.
Английский: chlorine.
Французский: chlore.
Итальянский: cloro.
Испанский: cloro.
§2
Историческая справка
Хлор и отщепляющие хлор соединения, главным образом хлорная известь,
начали использоваться в медицине как дезинфицирующее средство уже в начале
XIX века. Особенно сенсационным был успех Земмельвайса, достигнутый им в
1847 году в борьбе с родильной горячкой, — он дезинфицировал руки и инстру-
59
менты хлором .
Позднее хлор стали использовать для обеззараживания оборудования при
производстве и хранении пищевых продуктов, а также питьевой и технической
воды. Обеззараживание питьевой воды с помощью хлора вытеснило более ста-
рый, но болеедорогой способ, использующий озон60.
§3
Товарные формы, производные
Хлор используется как сам по себе, так и в форме выделяющих хлор соеди-
нений, главным образом гипохлоритов натрия и калия, а иногда и дихлоризо-
Циануратов этих элементов. Хлор поступает в продажу в сжиженном виде в бал-
лонах. Диоксид хлора проявляет самостоятельное антимикробное действие.
§4
Свойства
Хлор С1г при обычных условиях представляет собой зеленовато-жёлтый газ,
который можно обнаружить в воздухе по запаху уже при концентрации 0,001 мг/л.
Плотность хлора примерно в 2,5 раза выше плотности воздуха. При 0°С под дав-
(
100
Консервирующие вещества
лением 3,76 атм он сжижается. В 1 л воды при 0°С растворяется 4,6 л, а при 20°С —
2,3 л хлора.
Гипохлорит натрия NaClO представляет собой расплывающиеся на воздухе,
легко растворимые в воде кристаллы. В продажу поступает в виде водного рас-
твора (лаббаракова вода).
Из других солей хлорноватистой кислоты применяются: гипохлорит каль-
ция Са(С1О)2, хлорная известь СаОС12 и гипохлорит магния Mg(C10)2. Все они
представляют собой белые пахнущие хлором порошки.
Диоксид хлора С1О2 представляет собой жёлтый газ, легко растворимый в
воде.
§5
Аналитические сведения
Хлор вытесняет иод из иодидов. При добавлении хлорсодержащих жидко-
стей к раствору иодида калия с крахмалом появляется синее окрашивание. Рас-
творы о-толуидина под действием хлора приобретают окраску от жёлтой до оран-
жевой. Это окрашивание можно измерить колориметрически. Быстрое полу-
количественное определение хлора можно проводить с помощью специальных
тестовых трубок 111.
§6
Получение
Хлор получают электролизом соляной кислоты или растворов хлоридов ще-
лочных металлов61. Диоксид хлора из-за трудностей обращения с ним62 получают
на месте употребления из раствора хлорита6’ натрия и соляной кислоты.
§7
Токсиколого-гигиеническая оценка
Свободный хлор обладает сильным раздражающим действием на кожу и сли-
зистые оболочки. Вдыхание воздуха, содержащего 2 г хлора на 1 м’, приводит к
быстрой смерти, так как альвеолы лёгких необратимо повреждаются образую-
щейся соляной кислотой64. Вдыхание воздуха с концентрацией хлора 60 мг/м’ в
течение четверти часа опасно для жизни. Значение ПДК для хлора65 составляет
1,5 мг/м’.
§8
Законодательные аспекты применения в пищевых продуктах
Во многих странах для обеззараживания питьевой воды и других пищевых
продуктов разрешены свободный хлор и выделяющие его соединения: гипохло-
13. Хлор
101
риты натрия, кальция и магния, хлорная известь, диоксид хлора; в случае войны
и катастрофических событий — дихлоризоцианураты натрия и калия6'’. Предель-
но допустимые концентрации для хлора и гипохлоритов в воде составляют
1,2 мг/л, а для диоксида хлора — 0,4 мг/л.
§9
Действие на микроорганизмы
Общие критерии действия. Хлор в соответствующей концентрации быстро
убивает микроорганизмы; поэтому он скорее является дезинфицирующим аген-
том, чем консервантом.
Антимикробные свойства хлора основаны на сильном окислительном дей-
ствии и быстром связывании с белками. Хлор очень легко присоединяется к двой-
ным связям биомолекул. Эти реакции ведут к прекращению обмена веществ в
микроорганизмах и их гибели |2|. Кроме того, хлор разрушает клеточные мем-
браны и вступает в реакции с ДНК |3|.
Действию хлора сильно мешает присутствие органических веществ, так как
последние с ним отчасти реагируют. Аммиак и аминосоединения тоже реагиру-
ют с хлором, ослабляя его действие. Это «пожирание хлора» следует учитывать
на практике и в случае сильно загрязнённых сред (например, для сточных вод)
рассчитывать на действующую часть — «фактический свободный хлор».
Антимикробное действие хлора значительно усиливается при повышении
температуры. Например, при одинаковой концентрации хлора споры бактерий
рода Bacillus погибают при 50°С в 10 раз быстрее, чем при 20°С |2|.
Лучше всего хлор действует в нейтральной и слабокислой среде, например
при pH 6 в 2—60 раз (в зависимости от вида микробов) быстрее, чем при
pH 10 |2|.
Спектр действия. Хлор имеет очень широкий спектр антимикробного дейст-
вия. Он эффективен как против бактерий (включая споры), дрожжей и плесне-
вых грибов, так и против водорослей, простейших и многих вирусов. Некоторые
бактерии в оптимальных условиях (низкая обсеменённость, pH 7, температура
20-25°С) погибают уже при концентрации хлора 0,05-0,1 мг/кг. Несколько бо-
лее устойчивы туберкулёзные палочки, бактерии родов Salmonella, Proteus и
Pseudomonas. Плесневые грибы примерно в 10 раз устойчивее бактерий [2, 3].
§10
Области применения
Важнейшая область применения хлора — обеззараживание питьевой воды.
Ббльшая её часть обрабатывается «непрямым хлорированием». Оно состоите том,
что газообразный хлор из баллонов в соответствующем устройстве растворяют в
воде, получая концентрат с содержанием хлора 1-5 г/л, который добавляют к
обрабатываемой воде. Применение растворов гипохлоритов и других выделяю-
щих хлор соединений пока не имеет большого значения.
102
Консервирующие вещества
При использовании хлора для обеззараживания питьевой воды возможно про-
текание галоформной реакции. При этом из свободного хлора и органических
загрязнений питьевой воды, таких, как аминокислоты и гуминовые вещества,
образуются тригалометаны, например канцерогенный хлороформ |4|. Исполь-
зуя диоксид хлора вместо самого хлора, опасность галоформной реакции можно
уменьшить.
Хлор применяют для дезинфекции ёмкостей, аппаратов и другого оборудо-
вания и инвентаря, используемого в производстве пищевых продуктов. В по-
следнее время в США водные растворы хлора и диоксида хлора используют для
уничтожения бактерий рода Salmonella в мясе птицы [5[. Описано добавление их
в промывную воду для фруктов 161 и применение в «51о\у-ге1еа5е»-форме в поли-
мерных упаковках для пищевых продуктов |7|.
§11
Прочие действия
Хлор и выделяющие хлор соединения являются сильными окислителями и
тем самым сильными корродирующими агентами.
Следует обратить внимание на высокую токсичность свободного хлора. До-
зы, используемые при обработке питьевой воды, считаются безвредными, но мо-
гут отрицательно влиять на вкус и запах.
Глава 14
Этанол
14
§1
Синонимы
IUPAC: этанол.
Русский: этиловый спирт, винный спирт, алкоголь, «спирт».
Немецкий: Ethanol, Ethylalkohol, Weingeist, «Alkohol».
Английский: ethyl alcohol, ethanol, «alcohol».
Французский: alcool ethylique, ethanol, «alcool».
Итальянский: alcool etilico, etanolo, «alcool».
Испанский: alcohol etilico, ethanol, «alcohol».
§2
Историческая справка
Спирт использовался арабами для хранения фруктов уже тысячу лет тому
назад. Ещё старше сбраживание сахаросодержащих фруктов в вино, которое в
известном смысле тоже можно считать способом консервирования. Однако хра-
нение пишевых продуктов (прежде всего фруктов) в спирте никогда не имело
большого промышленного значения и применялось главным образом в домаш-
нем хозяйстве, где этот способ сохранил своё значение до настоящего времени.
§3
Свойства
Этиловый спирт С2Н,ОН представляет собой бесцветную жидкость, сме-
шивающуюся с водой в любых отношениях и кипящую при температуре 78°С.
С водой спирт образует азеотропную смесь, содержащую 4,4% воды.
§4
Аналитические сведения
Основной метод количественного определения этилового спирта состоит в его
отгонке из исследуемого пищевого продукта и измерении плотности полученного
дистиллята. Для определения очень малых концентраций спирта пригодны фер-
ментативный анализ с алкогольдегидрогеназой 111 и окисление раствором дихро-
мата калия по Видмарку; используют также газовую и ионную хроматографию [2].
104 Консервирующие вещества
§5
Получение
Пищевой спирт получают исключительно брожением жидкостей, содержа-
щих сахара.
§6
Токсиколого-гигиеническая оценка
Острая токсичность. Для мышей LD5(I этанола при оральном введении со-
ставляет 9,5 г на 1 кг массы тела, для крыс — 13,7, для кроликов — 6,3—9,5 и для
собак — 5,5—6,5 г на 1 кг массы тела |3|. Для взрослого человека опасное для
жизни количество алкоголя (при приёме внутрь в течение короткого промежут-
ка времени) составляет 200—400 мл, что соответствует концентрации спирта в
крови 4—6%о |4|. Привычные к алкоголю люди в отдельных случаях переносят
содержание спирта в крови до 12%о.
Хроническая токсичность. При частом регулярном употреблении спирта про-
исходит привыкание, и количества, первоначально опьянявшие и оказывавшие
наркотическое действие, уже не могут парализовать центральную нервную сис-
тему. Вместо этого наступает раздражение желудочно-кишечного тракта и дру-
гие расстройства пищеварения, приводящие в дальнейшем к ожирению печени и
её циррозу. Длительно переносимая ежедневная доза этанола для мужчин со-
ставляет 30 г, а для женщин — 15 г. Хроническое употребление больших коли-
честв может вызвать ожирение печени и — впоследствии — хронический гепа-
тит. Сам этанол не канцерогенен, однако в определённых условиях способствует
химически индуцированному канцерогенезу. Повышенное потребление спирта
считается фактором риска в возникновении опухолей печени при заболевании
гепатитом В |5, 6|, а также опухолей молочной железы |7| и прямой кишки |8|.
Этанол проявляет мутагенное |9, 101 и тератогенное действие 111 ].
Значение ПДК для этилового спирта составляет 1900 мг/м1.
Биохимическое поведение. Спирт может усваиваться не только слизистой обо-
лочкой желудка, но и кожей, и через лёгкие. Небольшая часть (ок. 5%) этанола
выделяется через лёгкие и с мочой; основная же масса окисляется до ацетальде-
гида, а затем до углекислого газа и воды. Скорость удаления спирта из крови
составляет примерно 15 мг на 100 мл в час. Организм может «сжигать» около
100 мг спирта в час на 1 кг массы тела.
§7
Законодательные аспекты применения в пищевых продуктах
Так как спирт является составной частью многих пищевых продуктов, его
использование с целью консервирования законодательно не ограничивается. Ис-
ключение составляют алкогольные напитки, например вино. Законодательство
некоторых стран допускает добавление к ним спирта только в исключительных
случаях.
14. Этанол
105
§8
Действие на микроорганизмы
Концентрированный этанол вызывает денатурацию протоплазменных бел-
ков у микроорганизмов. В качестве дезинфицирующего средства чаще всего при-
меняется 60—70%-й спирт, поскольку он наиболее эффективен именно при та-
ких концентрациях. Так как действие этанола заключается в неспецифической
денатурации белка, он оказывает большее или меньшее влияние на все виды мик-
роорганизмов. Тем не менее бактерии обычно более восприимчивы к нему, чем
дрожжи. Они часто угнетаются даже при концентрации спирта ниже 10%. Толь-
ко бактерии вида Streptococcus faecatis и некоторые молочнокислые бактерии пе-
реносят более высокую концентрацию 112 [. Некоторые дрожжи переносят до 20%
спирта. При концентрации этанола 50% быстро инактивируются все вегетирую-
щие микроорганизмы, а также грибные споры; однако споры бактерий при этом
не повреждаются 1131.
Низкие (5—20%) концентрации спирта вызывают консервирующее действие
тем, что снижают активность воды в пищевом продукте. В пищевых продуктах со
средней влажностью консервирующего эффекта можно достичь уже добавлением
2—4% спирта |9|. Этанол усиливает антимикробное действие сорбиновой ки-
слоты 114, 151.
§9
Области применения
Фруктовая продукция. Довольно широко, особенно в домашнем хозяйстве,
практикуется консервирование фруктов в роме и сахаре. По этому способу фрук-
ты, а особенно ягоды и косточковые, засахаривают и затем помещают в крепкий
ром, коньяк или другие крепкие спиртные напитки. Несмотря на то что фрукты
в свежем состоянии содержат много воды, которая разбавляет алкоголь, такие
консервы не бродят, поскольку содержание спирта в них не падает существенно
ниже 20%. Для фруктов, законсервированных в роме и сахаре, наряду со спир-
том консервантом служит сахар.
Чтобы предотвратить образование плесени, домашние хозяйки иногда укла-
дывают на готовое варенье бумагу, пропитанную спиртом.
Напитки. Фруктовые соки, используемые для производства ликёров, часто
«спиртуют». При этом этанол добавляют как к свежим, так и к уже сброженным
сокам, содержащим 4—5% спирта.
Опасность микробиологической порчи вина (бактериальных болезней, дрож-
жевого перебраживания) тем меньше, чем выше в нем содержание спирта. Имею-
щийся в вине естественный алкоголь недостаточно защищает его от микробио-
логической порчи. Полная стабильность достигается лишь добавлением ректи-
фикованного спирта до общего содержания алкоголя 19-20%. В некоторых стра-
нах добавление спирта к вину запрещено в принципе. Обычно оно разрешается,
но только для специальных сортов вин, например десертных, шерри, портвейнов.
106
Консервирующие вещества
Для уменьшения дрожжевого брожения практикуется добавление спирта к
виноградному соку. Такой «немой» сок (мистель) используется главным образом
для подслащивания десертных вин.
Выпечка. В тех странах, где сорбиновая кислота не разрешена для консерви-
рования нарезанного хлеба, мелкоштучной выпечки или полуфабрикатов из тес-
та, для этой цели иногда применяется этанол — упаковочный материал перед
применением обрызгивают концентрированным спиртом. Концентрация спир-
та в выпечке получается от 0,5 до 2%. В таких количествах спирт вдобавок дейст-
вует как замедлитель черствения 116|. Этанол для этих целей может использо-
ваться и в сочетании с защитными газами (см. §10 гл.7) 117].
§10
Прочие действия
В виде алкогольных напитков спирт служит ценным возбуждающим средст-
вом. Кроме того, он — хороший растворитель, поэтому является важным экстра-
гентом и разбавителем.
Глава 15
Сахароза
15
§1
Синонимы
IUPAC: сахароза.
Русский: тростниковый сахар, свекловичный сахар, «сахар».
Немецкий: Saccharose, Rohrzucker, Rtibenzucker, «Zucker».
Английский: sucrose, cane sugar, beet sugar, «sugar».
Французский: saccharose, sucre de canne, sucre colonial, sucre de betteraves, «sucre».
Итальянский: saccarosio, zucchero di canna, zucchero di barbabietola, «zucchero».
Испанский: sacarosa, aziicar de сапа, azucar de remolacha, «azucar».
§2
Историческая справка
Сахар (тростниковый) появился в Европе из Юго-Восточной Азии около
700 года нашей эры. Отсюда он позднее попал в Америку. В XVIII веке в Герма-
нии была разработана промышленная технология производства сахара из сахар-
ной свёклы. Вначале из-за своей редкости и высокой цены сахар был предметом
роскоши и лекарством. Со временем он стал использоваться в больших количе-
ствах для подслащивания пищи, а ещё позже и для консервирования пищевых
продуктов.
§3
Товарные формы
Практическое применение находит только сахароза из сахарного тростника
(тростниковый сахар) и сахарной свёклы (свекловичный сахар). Она поступает в
продажу в твёрдом виде или в виде растворов (сиропов). По своему значению для
консервирования другие сахара сильно уступают сахарозе.
§4
Свойства
Сахароза С^Н^О,, представляет собой бесцветные, сладкие на вкус кристал-
лы, плавящиеся при температуре 185°С. В спирте сахароза растворима мало.
В 100 г воды при комнатной температуре растворяется приблизительно 204 г са-
108
Консервирующие вещества
харозы, что соответствует 67,1 г сахара на 100 г раствора. При 100°С в 100 г воды
растворяется 487 г сахарозы.
§5
Аналитические сведения
Для качественного и количественного определения сахарозы в пищевых про-
дуктах существуют ферментативный 111 и поляриметрический методы анализа, тон-
кослойная, газовая и ионная хроматография 12|, химические методы, например ме-
тод Луф-Шурла, а также высокоэффективная жидкостная хроматография |3—51.
§6
Получение
Сахарозу получают главным образом из сахарного тростника (Saccharum
officinarum) или сахарной свёклы (Beta vulgarissaccharifera). В обоих растениях са-
хароза содержится в несвязанном виде. Её извлекают водой из соответствующих
частей растений и после очистки раствора выделяют кристаллизацией.
§7
Токсиколого-гигиеническая оценка
Для крыс LD5(1 сахарозы составляет 30—35 г на 1 кг массы тела; самцы не-
сколько более восприимчивы, чем самки |5|.
Кариогеннос действие сахара бесспорно 16). Степень очистки оказывает ре-
шающее влияние на кариогенность отдельных его видов |7|. Основным факто-
ром, влияющим на возникновение кариеса, является не количество сахара, а час-
тота его употребления и время пребывания в полости рта. Для напитков это вре-
мя значительно меньше, чем для твёрдых пищевых продуктов, например конди-
терских изделий.
Сахар, как всякий высококалорийный пищевой продукт, может приводить к
избыточной массе, что, в свою очередь, может способствовать возникновению
некоторых форм диабета, хотя сам сахар и не является его причиной |7|. Соглас-
но рекомендациям ВОЗ |7|, нормальным можно считать ежедневный приём са-
харозы в количестве, не превышающем 10% дневного поступления энергии.
Мнения о болезнетворном действии сахара (например, о разрушении вита-
мина В,) не выдерживают научной критики |8—10|.
§8
Законодательные аспекты применения в пищевых продуктах
Сахар — существенная составляющая многих пищевых продуктов, и его до-
бавление в целях консервирования не имеет никаких законодательных ограни-
15. Сахароза
109
чений. Исключение составляют диетические продукты для страдающих диабе-
том или избыточной массой, а также продукты из фруктов специального качест-
ва. В России и Германии сахар не считается пищевой добавкой.
§9
Действие на микроорганизмы
Общие принципы действия. Сахароза снижает активность воды и тем самым
ухудшает условия для жизнедеятельности микроорганизмов. По этому действию
она аналогична поваренной соли (см. §9 гл.6). Так как активность воды даже в
насыщенных растворах сахара не опускается ниже 0,85, а некоторые микроорга-
низмы ещё могут развиваться в таких условиях, надёжно защитить пищевой про-
дукт от микробной порчи одним сахаром невозможно.
Для консервирования пищевые продукты помещают в концентрированный
раствор сахара (сироп) или добавляют к ним кристаллический сахар. Вследствие
осмотического удаления части воды из пищевого продукта её активность снижа-
ется. Зависимость активности воды от содержания сахарозы в растворе представ-
лена в табл. 17.
Таблица 17. Активность воды в растворах сахарозы 1131
Концентрация сахарозы, г на 100 г поды Активность воды
11 0,99
25 0,96
78 0,95
93 0,94
107 0,93
120 0,92
144 0,90
169 0,88
194 0,86
208 0,85
Большое практическое значение имеет сочетание сахара с другими консер-
вантами и с физическими способами консервации (прежде всего, сгущением, суш-
кой и нагреванием) 111]. Непосредственное антимикробное действие сахарозы
отсутствует. В малых концентрациях она даже является для многих микроорга-
низмов питательным веществом. Кроме того, сахароза вследствие осмоса повы-
шает термостойкость плесневых грибов 1121.
Спектр действия. Так как действие сахарозы определяется снижением ак-
тивности воды, спектр её действия обусловливается требованиями микроорга-
низмов к этому фактору. Из табл. 10, где представлены пороговые значения ак-
тивности воды для некоторых важных микроорганизмов, видно, что сильнее всего
угнетаются бактерии.
Среди микроорганизмов, переносящих самые высокие концентрации саха-
ра, можно упомянуть плесневые грибы вида Aspergillus glaucus и так называемые
осмотолерантные дрожжи, например вида Zygosaccharomyces rouxii, вида Z. bailii,
по
Консервирующие вещества
и различные дрожжи рода Torulopsis. Некоторые из этих дрожжей не только устой-
чивы к высокому осмотическому давлению, но и сахарофильны, т.е. они не толь-
ко переносят высокую концентрацию сахара, но и быстрее развиваются при опре-
делённых (весьма высоких) его концентрациях. Так, например, Z. rouxii лучше
растут в 30%-м растворе сахара, чем без сахара или в 60%-м растворе 114].
Сахароза, как и поваренная соль, уменьшает растворимость кислорода в во-
де. Поэтому в продуктах, содержащих много сахара, аэробные микроорганизмы
могут испытывать нехватку кислорода [15].
§10
Области применения
Фруктовые продукты. При консервировании фруктовых продуктов сахаром
различают способы, которые состоят только в добавлении сахара, и способы, в
которых дополнительно применяется сгущение. Сахар используется в твёрдом
виде или в виде сиропа.
Консервированием со сгущением получают джемы, повидла, конфитюры,
варенья. Содержание сахарозы в них составляет 55—65%, а в цитрусовых повид-
лах и вареньях даже выше.
В продуктах, консервированных сахаром (например, в джемах и вареньях),
активность воды составляет 0,75—0,82. Такие значения не всегда достаточно низ-
ки, чтобы полностью подавить рост плесеней и деятельность осмотолерантных
дрожжей. В этом случае дополнительно применяют пастеризацию или использу-
ют сахарозу вместе с другими консервантами, например сорбиновой кислотой, в
виде консервирующего или желирующего сахара (смеси сахарозы с пектинами и
сорбиновой кислотой).
Путём засахаривания без сгущения делают цукаты, а также фрукты, засаха-
ренные и обсыпанные сахаром. Фрукты или их кусочки многократно обрабаты-
вают всё более концентрированными растворами сахара. При этом (так же как
при посоле и мариновании) в результате осмоса происходит обмен между кон-
центрированным раствором сахара и клеточным соком фруктов. Готовые про-
дукты содержат сахара больше, чем джемы и варенья, и поэтому могут храниться
без дополнительного консервирования или консервантов. То же справедливо и
для фруктовых сиропов. Они готовятся путём добавления сахара к фруктовым
сокам и содержат его до 68%.
Выпечка. Сахар к выпечным изделиям добавляют для улучшения вкуса.
Одновременно он служит и важным консервантом. Типичный пример — пироги
и другие сдобные изделия. Содержание сахара в них колеблется от 20 до 50%
(в зависимости от вида продукта), что снижает активность воды до 0,83—0,9067.
Зачастую этого недостаточно для длительного хранения; поэтому по возможно-
сти добавляют и другие консерванты, например сорбиновую кислоту.
Кондитерские изделия. Среди кондитерских изделий имеются такие, в кото-
рых сахароза используется исключительно в качестве компонента, придающего
продукту вкус и увеличивающего его массу, и такие, в которых сахароза допол-
нительно выполняет функции консерванта для других составляющих. Ко второй
группе принадлежат, например, марципаны, персипаны, нуга, а также наполни-
15. Сахароза
111
тели для шоколада и пралине. Содержание сахарозы в них часто превышает 60%.
Вместе с приправами и сухими веществами остальных ингредиентов её обычно
достаточно, чтобы исключить микробную порчу. Только в редких случаях при-
ходится сочетать сахарозу с более эффективными консервантами.
§11
Прочие действия
Наряду с консервирующим действием сахароза имеет сладкий вкус, и это во
многих случаях является главной причиной применения сахара как составной
части пищевых продуктов. Концентрация сахара, заметно влияющая на вкус, су-
щественно ниже требуемой для консервирования. В области низких концентра-
ций (менее 10%) сахароза не проявляет консервирующих свойств, а является пи-
тательным веществом для многих микроорганизмов (непосредственно или после
расщепления на глюкозу и фруктозу).
Глава 16
Муравьиная кислота
16
§1
Синонимы
IUPAC: метановая кислота.
Немецкий: Ameisensaure.
Английский: formic acid.
Французский: acide formique.
Итальянский: acido formico.
Испанский: acido formico.
§2
Историческая справка
Консервирующее действие муравьиной кислоты известно уже более ста
лет |1|. Она используется в некоторых странах, преимущественно в Средней и
Восточной Европе, для консервирования пищевых продуктов, главным образом
фруктовых. В последнее время муравьиная кислота всё больше вытесняется дру-
гими консервантами или способами консервирования.
§3
Товарные формы, производные
Муравьиная кислота для консервирования пищевых продуктов поставляет-
ся в виде водных растворов самой кислоты или в виде формиатов натрия, калия
или кальция.
§4
Свойства
Муравьиная кислота НСООН представляет собой прозрачную жидкость с
резким запахом, смешивающуюся с водой во всех отношениях. В чистом виде
она кристаллизуется при 8°С и кипит при 101°С.
Формиаты натрия, калия и кальция представляют собой белые кристалли-
ческие порошки, более или менее легко растворимые в воде.
16. Муравьиная кислота
ИЗ
§5
Аналитические сведения
Для качественного и количественного определения муравьиной кислоты в
пищевых продуктах её сначала отгоняют из исследуемого продукта в виде водно-
го раствора. Затем путём нагревания с металлическим магнием в кислой среде
НСООН можно восстановить до формальдегида, который с хромотроповой ки-
слотой даёт фиолетовое окрашивание |2|. Этилформиат (образующийся при взаи-
модействии муравьиной кислоты с этанолом), реагируя с гидроксиламином, пре-
вращается в формгидроксамат6*. Это соединение реагирует с солями трёхвалент-
ного железа, давая комплекс красного цвета, количество которого измеряют фо-
тометрически |3). Кроме того, муравьиную кислоту можно определить с помо-
щью газовой хроматографии или ферментативно |4|.
§6
Получение
Муравьиная кислота образуется в качестве побочного продукта в ряде про-
мышленных процессов, например при производстве уксусной кислоты окисле-
нием углеводородов. Её можно синтезировать гидратацией окиси углерода или
омылением формамида, который, в свою очередь, получают из окиси углерода,
метанола6’ и аммиака. В некоторых из перечисленных способов образуются фор-
миаты, из которых свободную муравьиную кислоту выделяют действием мине-
ральной кислоты. Формиаты можно получить взаимодействием муравьиной ки-
слоты с соответствующими основаниями™.
§7
Токсиколого-гигиеническая оценка
Острая токсичность. Для грызунов LDW муравьиной кислоты колеблется
между 1,1 и 1,8 г на 1 кг массы тела |5, 6|. Значительно менее токсичны формиа-
ты калия и натрия — их LD51) составляет соответственно 3 и 7,4 г на 1 кг массы
тела |5|. Для человека смертельная доза муравьиной кислоты равна 50—60 г |7|.
В концентрированном виде муравьиная кислота раздражает кожу и слизи-
стые оболочки; поэтому обращаться с ней нужно осторожно.
Субхроиическая токсичность. Добавление 0,5—1% муравьиной кислоты к
питьевой воде замедляет рост крыс и наносит вред их внутренним органам |6|.
Ежедневный приём человеком 0,5 г муравьиной кислоты (что соответствует 8 мг
на 1 кг массы тела) в течение 4 недель не оказывает заметного действия |8|.
Хроническая токсичность. При включении в рацион крыс в течение 7 меся-
цев питьевой воды, содержащей 1% муравьиной кислоты, у них наблюдается из-
менение формулы крови и снижение выживаемости молодняка |6J. Двухлетнее
потребление крысами ad libitum питьевой воды с добавлением 0,2% формиата каль-
ция (150—200 мг формиата кальция на 1 кг массы тела) не приводит к нарушени-
ям функций органов. Не обнаружено отрицательного влияния на рост, развитие
114
Консервирующие вещества
и репродуктивную способность животных в последующих (до пятого) поколени-
ях. Такие же результаты были получены с удвоенной дозой формиата кальция на
двух поколениях |5|.
Муравьиная кислота оказывает мутагенное действие на насекомых, например
рода Drosophila, и некоторые микроорганизмы, но не на клетки млекопитающих 17,
8]. Муравьиная кислота и формиаты не тератогенны 15, 7—9| и не канцерогенны |7|.
Биохимическое поведение. Из-за хорошей растворимости муравьиная кислота
легко всасывается, в том числе через кожу и слизистые оболочки |9|. Она является
нормальной составной частью крови и тканей человека и играет важную роль в об-
мене веществ при переносе С.-фрагментов 15, 10|. Меньшая часть введённой в орга-
низм муравьиной кислоты выводится с мочой в неизменённом виде, а большая под-
вергается метаболизму. Период полураспада муравьиной кислоты в плазме крови
человека после орального введения формиата натрия составляет около 45 минут |9|.
§8
Законодательные аспекты применения в пищевых продуктах
Муравьиная кислота, формиаты натрия и кальция пока разрешены в неко-
торых европейских странах для консервирования отдельных видов пищевых про-
дуктов71. Проект будущего законодательства Европейского Сообщества не пред-
усматривает их использования.
§9
Действие на микроорганизмы
Общие принципы действия. Действие муравьиной кислоты, особенно про-
тив бактерий, отчасти основано на снижении ею величины pH. В отличие от выс-
ших органических кислот72 свободная муравьиная кислота, подобно уксусной и
молочной, действует лишь в сравнительно высокой концентрации, которая су-
щественно увеличивает кислотность консервируемой среды. В то же время му-
равьиная кислота оказывает и не зависящее от её кислотных свойств антимик-
робное действие. Муравьиная кислота в слабокислой среде (когда значительное
её количество находится в диссоциированной форме) подавляет действие декар-
боксилаз 1111, оксиредуктаз 1121 и, в особенности, каталазы, которую она в срав-
нении с другими кислотами-консервантами ингибирует необычайно сильно 1131.
Муравьиная кислота — самая сильная алифатическая карбоновая кислота;
из-за своей высокой константы диссоциации она годится для консервирования
только сильнокислых продуктов (pH ниже 3,5). В слабокислой и нейтральной
средах формиаты не оказывают антимикробного действия 114|. Оно проявляется
только после добавления кислоты 1111.
Муравьиная кислота в сравнении с другими алифатическими карбоновыми
кислотами в большей степени индуцирует резистентность. Например, бактерии
вида Escherichia coli после сублетальных доз способны приобретать устойчивость
к муравьиной кислоте |15|. Жизнеспособность таких устойчивых штаммов все-
гда ограничена 116|.
16. Муравьиная кислота
115
Спектр действия. Муравьиная кислота действует преимущественно против
дрожжей и некоторых бактерий (см. табл. 18). Молочнокислые бактерии и плес-
невые грибы по отношению к ней довольно устойчивы 117, 181.
Таблица 18. Тормозящее действие муравьиной кислоты против микроорганизмов (17, 18[
Вид микроорганизмом Значение pH Минимальная эффективная концентрация муравьиной кислоты, г/кг
Бактерии:
Pseudomonas spec. 6,0 2,5-7,5
Micrococcus pyogenes 6,0 14
Streptococcus lactis 5,2 4
Lactobacillus arabinosus 6,0 35-50
Escherichia coli 5,2 0,7-1
Bacillus spec. 6,0 0,5-5
Дрожжи:
Saccharomyces spec. 4,0-4,5 1,2-10
Saccharomyces spec. 5,0 0,8-36
Аспорогенные дрожжи 5,0 1-36
Trichosporon variahile 3,9 1
Hansen и la subpe lliculosa 3,0 10-12,5
Hansenula anomala 3,0 8
Candida krusei 3,0 16
Torulopsis stellata 3,0 6-16
Oospora lactis 3,0 8
Плесневые грибы:
Mucor racemesa 5,0 36
Penicillium spec. 4,5-5,0 1,64-80
Gliocladium rose и m 5,0 24
Aspergillus spec. 5,0-7,0 15-55
Fungi imperfect! 5,0 12-52
§10
Области применения
Использование формиатов при консервировании рыбных маринадов утра-
тило своё значение. То же касается и маринованных (квашеных) овощей, хотя
Для них иногда ещё используют формиат кальция (вместе с бензоатами), так как
ионы кальция укрепляют растительные ткани, в результате чего, например, огурцы
не размягчаются.
Добавление 0,3—0,4% муравьиной кислоты во фруктовые соки и пульпы сразу
после прессования защищает их от дрожжевого брожения. Муравьиная кислота
по сравнению с другими консервантами обладает тем преимуществом, что сме-
шивается с водой во всех отношениях. Это позволяет вводить её в соки простым
смешиванием. В используемых концентрациях муравьиная кислота заметно влия-
ет на вкус и запах; поэтому её добавляют только во фруктовые полуфабрикаты.
За последние годы и в этой области применение муравьиной кислоты сильно
сократилось в пользу других способов консервирования.
Глава 17
Уксусная кислота
§1
Синонимы
IUPAC: этановая кислота.
Немецкий: Essigsaure.
Английский: acetic acid.
Французский: acide acetique.
Итальянский: acido acetico.
Испанский: acido acetico.
§2
Историческая справка
Помещение пищевых продуктов в уксус или в содержащие его растворы от-
носится к старейшим способам консервирования. За 5 тысяч лет до Рождества
Христова на Востоке был известен уксус из пальмового вина. Уксус в Древнем
Риме использовали и как приправу, и для консервирования (самостоятельно ли-
бо в смеси с солью, вином или мёдом). До начала средних веков уксус изготавли-
вали исключительно в домашнем хозяйстве, сбраживая на воздухе спиртосодер-
жащие жидкости (прежде всего, вино) уксуснокислыми бактериями. Промыш-
ленное производство уксуса началось в XIV веке во Франции по орлеанскому
способу. Уксусная кислота занимает прочное место в консервировании пищевых
продуктов, причём в некоторых странах большее значение имеет не уксус, полу-
ченный брожением, а синтетическая уксусная кислота.
§3
Товарные формы, производные
Уксусная кислота для консервирования пищевых продуктов поступает в про-
дажу в виде уксуса и уксусной эссенции. Первый представляет собой 5—10%-й, а
вторая — 25—80%-й водный раствор уксусной кислоты. В зависимости от сырья
различают винный, фруктовый, пивной, солодовый, спиртовой и другие виды ук-
суса, а также синтетическую уксусную кислоту. Уксус для домашнего использова-
ния получают или брожением, или разбавлением синтетической уксусной кисло-
ты, или смешением уксусной кислоты, полученной брожением, с синтетической
уксусной кислотой. Винный уксус, поступающий в продажу в Германии, обычно
представляет собой смесь винного и спиртового уксуса в соотношении 1:4.
17. Уксусная кислота
117
Наряду с уксусной кислотой в качестве консерванта применяется и так на-
зываемый диацетат натрия. Это вещество состоит из уксусной кислоты и ацетата
натрия в мольном соотношении 1:1.
§4
Свойства
Уксусная кислота СН,СООН представляет собой бесцветную жидкость, кри-
сталлизующуюся при 17°С, кипящую при 118°С и смешивающуюся с водой во
всех отношениях.
Диацетат натрия — белый кристаллический порошок, растворимый в воде и
пахнущий уксусной кислотой.
§5
Аналитические сведения
Уксусная кислота способна улетучиваться с водой; поэтому в отсутствие дру-
гих летучих кислот её можно определить титрованием дистиллята, полученного
отгонкой с водяным паром. Кроме того, уксусную кислоту количественно мож-
но определить ионной хроматографией с УФ-детектором |1| или ферментатив-
ным методом.
§6
Получение
Уксусную кислоту получают биологическим окислением или синтетически.
Все обычные биологические методы основаны на способности бактерий ро-
да Acetobacterокислять этиловый спирт в уксусную кислоту. Ранее использовали
поверхностное брожение (орлеанский способ, метод Шютценбаха и др.), в
настоящее время применяют преимущественно глубинное брожение. Основным
сырьём служат вино и разбавленный спирт |2—4].
Синтетическую уксусную кислоту получают окислением уксусного альдеги-
да или низших углеводородов. Промышленное значение имеет также карбони-
лирование метанола.
§7
Токсиколого-гигиеническая оценка
Уксус, полученный брожением, и синтетический уксус при одинаковой кон-
центрации не отличаются по своим токсикологическим свойствам |5|.
Острая токсичность. Для крыс и мышей LDS(I уксусной кислоты (в виде раз-
бавленных, не едких растворов) при пероральном введении составляет 3—5 г на
1 кг массы тела |6, 7|. При концентрации выше 30% уксусная кислота, попадая
118
Консервирующие вещества
на кожу, вызывает ожоги. Из-за липофильности она является более сильным де-
натурирующим агентом, чем минеральные кислоты при той же концентрации
ионов водорода.
Значение ПДК уксусной кислоты” составляет 25 мг/м’.
Субхроническая токсичность. Потребление крысами в течение 2—5 месяцев
питьевой воды с добавлением 0,01—0,25% уксусной кислоты (соответствует еже-
дневному приёму 0,2 г на 1 кг массы тела) не наносило им заметного вреда 15].
По другим данным, крысы без вреда переносят в течение 2 недель ежедневный
приём 1,8 г разбавленной уксусной кислоты, но гибнут при дозе 2,4 г в день в
течение 3—5 дней. В то же время 4,2—4,8 г ацетата натрия в день крысы переносят
безразлично. Сравнивая действие уксусной кислоты и ацетатов, можно сделать
вывод, что вред наносит не ацетатный ион, а продолжительное сильное воздей-
ствие самой кислоты |6].
Хроническая токсичность. О хронической токсичности уксусной кислоты или
ацетатов при использовании их в качестве пищевых консервантов имеются лишь
отдельные сообщения. Тысячелетнее применение уксуса в качестве приправы рас-
сматривают как доказательство безвредности уксусной кислоты в низких кон-
центрациях. Исследования токсичных свойств и воздействия уксусной кислоты
касаются прежде всего производственной медицины. Непереносимость уксус-
ной кислоты встречается очень редко. Для неё исключаются первичный канце-
рогенез и генотоксичность.
Обобщённые токсикологические сведения об уксусной кислоте приведены
в работах18, 91.
Биохимическое поведение. Уксусная кислота в виде ацетил-кофермента А
играет центральную роль в обмене веществ. Она участвует как в синтезе, так и в
расщеплении органических веществ, например жирных кислот или углеводов. В
организме млекопитающих уксусная кислота может использоваться как источ-
ник энергии.
§8
Законодательные аспекты применения в пищевых продуктах
Уксусная кислота (Е260) в большинстве стран не имеет законодательных огра-
ничений как вещество аутогенное и как натуральная приправа, которая приме-
нялась в пище тысячелетиями74. В Германии уксусная кислота не считается
пищевой добавкой. В некоторых государствах закон различает бродильный ук-
сус и синтетическую уксусную кислоту. Иногда, особенно в аграрных и вино-
дельческих странах, по экономическим причинам название «уксус» использует-
ся преимущественно для уксуса, полученного брожением.
§9
Действие на микроорганизмы
Между синтетическим и бродильным уксусом нет различий по консерви-
рующему действию. Значение имеет только концентрация уксусной кислоты.
17. Уксусная кислота
119
Общие критерии. Действие уксусной кислоты (в ещё большей степени, чем
муравьиной) основано главным образом на снижении pH консервируемого про-
дукта. Для этого необходима высокая её концентрация (по сравнению с другими
кислотами-консервантами). Уксусная кислота проявляет антимикробное дейст-
вие при содержании свыше 0,5%. Она проникает через стенку клетки и денату-
рирует белки клеточной плазмы |10|.
Если добавлением кислоты снизить pH консервируемого продукта до трёх,
антимикробное действие уксусной кислоты оказывается в 10—100 раз сильнее
действия других кислот, например соляной75110 j. Это различие основано на том,
что недиссоциированная уксусная кислота вследствие своей липофильности луч-
ше проникает внутрь клетки. Уксусная кислота усиливает чувствительность бак-
терий к нагреву, но не влияет на термостойкость дрожжей и плесневых грибов.
Антимикробное действие уксусной кислоты, не связанное с её влиянием на
pH, незначительно. Константа диссоциации уксусной кислоты сравнима с кон-
стантами пропионовой и сорбиновой кислот. При высоких значениях pH её зна-
чительная часть ещё находится в недиссоциированной форме, но в этой области
она практически не действует (в отличие от сорбиновой и пропионовой кислот).
При снижении pH с 6 до 5 действие уксусной кислоты лишь удваивается [111,
в то время как доля недиссоциированной кислоты при этом возрастает пример-
но в 7 раз. Таким образом, между долей недиссоциированной кислоты и анти-
микробным действием нет положительной корреляции76.
Ацетаты антимикробным действием не обладают. Успешное использование
диацетата натрия не противоречит этому утверждению, так как действующим на-
чалом здесь служит содержащаяся в нём свободная уксусная кислота.
Спектр действия. Действие уксусной кислоты (из-за снижения ею pH) на-
правлено главным образом против бактерий. Оптимальные значения pH для раз-
вития большинства видов лежат в слабокислой и нейтральной области. Особен-
но это касается патогенных бактерий, включая род Salmonella. Однако вид Bacte-
rium xylinum в обычном пищевом уксусе ещё достаточно жизнеспособен. Бакте-
рии рода Lactobacillus обладают значительной кислотостойкостью; поэтому они
малочувствительны к уксусной кислоте 1111. Для защиты от бактериальной пор-
чи и по другим причинам бродильный уксус обрабатывают сернистым газом.
Хотя уксусная кислота и действует против плесневых дрожжей и грибов луч-
ше, чем против бактерий77, но в сравнении с другими консервантами это дейст-
вие слабое. При pH 5,0 развитие обычных дрожжей можно замедлить добавкой
уже 1% уксусной кислоты78. Полное их подавление наступает в присутствии 3,5—
4,0% уксусной кислоты |12|. Поваренная соль усиливает действие уксусной ки-
слоты главным образом потому, что снижает активность воды |13|. Этот эффект
давно используют в консервировании овощей и рыбы. Действие уксусной ки-
слоты против молочнокислых бактерий незначительно [ 131. Так как уксусная ки-
слота не обладает сильным консервирующим действием, ее часто применяют в
сочетании с физическими способами консервирования (например, пастериза-
цией) или с поваренной солью и(или) более сильными консервантами (сорбино-
вой либо бензойной кислотой).
120 Конссрнирующис вещества
§10
Области применения
Жиропродукты. В майонезы, салатные заправки и деликатесные салаты ук-
сусную кислоту добавляют не только для вкуса, но и для улучшения сохранно-
сти. Однако она обеспечивает ограниченную защиту продуктов от порчи бакте-
риями, дрожжами и плесневыми грибами. По этой причине уксусную кислоту
используют в сочетании не только с солью, но и с такими способами консерви-
рования, как пастеризация или хранение на холоде, либо с такими консерванта-
ми, как сорбиновая и(или) бензойная кислоты. Применение уксусной кислоты в
концентрации, необходимой для консервирования (свыше 1%), отрицательно ска-
зывается на вкусе 114]; слишком кислый вкус можно смягчить буферным вещест-
вом, например ацетатом натрия 115|.
Мясопродукты. Маринование или обтирание свежего мяса разбавленной ук-
сусной кислотой используется в домашнем хозяйстве как способ консервиро-
вания.
Рыбная продукция. Большое количество рыбы маринуют с помощью зали-
вок, содержащих уксус и соль. Маринование может сопровождаться тепловой
обработкой (варка, жаренье) или проводиться без нагревания. Уксусная кислота
имеет особое значение для рыбной продукции прежде всего потому, что в порче
рыбы участвуют в основном бактерии, а большинство консервантов действует
главным образом на дрожжи и плесени. Однако важные для этих продуктов бак-
терии рода Lactobacillus недостаточно подавляются уксусной кислотой в малых
концентрациях. Для надёжного сохранения маринадов необходимо сочетание ук-
сусной кислоты с другими способами консервирования (пастеризацией, охлаж-
дением) и(или) с другими консервантами. Обычная для рыбопродуктов концен-
трация уксусной кислоты (1—3%) в основном защищает от патогенных микроор-
ганизмов, прежде всего от бактерий рода Clostridium.
Овощные продукты. Маринование овощей в уксусе по действию схоже с мо-
лочнокислым брожением, только это не ферментативный процесс. Консерви-
руемое сырьё помещают в 0,5—3%-й раствор уксусной кислоты, который может
содержать пряности, соль, а иногда сахар или подсластитель. В уксусной кислоте
консервируют преимущественно огурцы, свё<лу и овощные смеси (Mixed
Pickles). Для сохранения в течение длительного срока одного уксуса недостаточ-
но. В уксусной заливке могут развиваться дрожжи и некоторые плесневые гри-
бы, особенно если она содержит сахар. Поэтому вместо сахара часто используют
кислотостойкие подсластители, например ацесульфам К. Маринованные овощи,
кроме того, желательно пастеризовать или стерилизовать. Чтобы воспрепятство-
вать микробной порче после вскрытия упаковки (прежде всего больших бочек),
в заливки добавляют сорбаты и(или) бензоаты.
Фруктовая продукция. В некоторых странах в домашнем хозяйстве марину-
ют сливы, груши, вишни, виноград и другие ягоды и фрукты. Их заливают горя-
чим 2-2,5%-м раствором уксусной кислоты с высоким содержанием сахара и сте-
рилизуют.
Выпечка. Уксусную кислоту (в основном в виде диацетата натрия) исполь-
зуют для защиты некоторых сортов хлеба от так называемой «картофельной бо-
лезни» — порчи, возникающей под действием бактерий вида Bacillus mesentericus.
17. Уксусная кислота
121
С 1906 года известно, что развитие этих бактерий можно подавить лёгким под-
кислением теста 1161. Уксусная кислота не только угнетает бактерии, но и умень-
шает их термостойкость; поэтому в тесте, подкисленном уксусной кислотой, воз-
растает скорость гибели бактерий в процессе выпечки. Концентрация диацетата
натрия составляет 0,2—0,4% от массы муки. Как средство предохранения наре-
занного хлеба от плесени диацетат натрия не используется из-за слишком слабо-
го антимикробного действия.
§11
Прочие действия
Уксусная кислота имеет большое значение и как вкусовая добавка. Во мно-
гих пищевых продуктах она используется скорее в этом качестве, чем как кон-
сервант. Воздействие уксусной кислоты на белки может приводить к изменению
вкуса — белки (особенно животные) частично гидролизуются и при этом могут
образовываться приятные на вкус продукты расщепления. Данное явление имеет
важное значение при изготовлении маринадов [17|. В то время как поваренная
соль делает рыбу жёстче, уксусная кислота её размягчает.
Глава 18
Пропионовая кислота
18
§i
Синонимы
IUPAC: пропановая кислота.
Немецкий: Propionsaure.
Английский: propionic acid.
Французский: acide propionique.
Итальянский: acido propionico.
Испанский: acido propionico.
§2
Историческая справка
Давно известно, что пропионовая кислота и её соли проявляют антимикроб-
ное действие. В 1938 году впервые было предложено использовать их для консер-
вирования хлебобулочных изделий 11], так как уже давно было известно дейст-
вие органических кислот против «картофельной болезни» хлеба |2|. С конца 30-х
годов пропионаты широко используются в США для консервирования хлеба и
ограниченно — для консервирования сыра. В других странах пропионаты также
применяются в консервировании хлебобулочных изделий, преимущественно сла-
бокислого белого хлеба.
§3
Товарные формы, производные
В пищевой промышленности используются преимущественно пропионаты
натрия и кальция. Пропионовая кислота применяется в качестве консерванта
пищевых продуктов только в некоторых странах. Основная область её использо-
вания — корма.
§4
Свойства
Пропионовая кислота СН,СН2СООН представляет собой бесцветную жид-
кость, смешивающуюся с водой во всех отношениях и имеющую стойкий непри-
ятный запах. Температура кипения составляет 14ГС. Пропионаты натрия и каль-
18. Пропионовая кислота
123
ция — это белые легко растворимые в воде порошки, пахнущие пропионовой
кислотой.
§5
Аналитические сведения
Пропионовую кислоту, также как многие другие консерванты, можно иден-
тифицировать по ИК-спектру |31.
Пропионовая кислота легко улетучивается с водяным паром; поэтому она и
её соли могут быть обнаружены в дистилляте, полученном отгонкой с водяным
паром”, с помощью бумажной или тонкослойной хроматографии. Специфиче-
ские цветные реакции для пропионовой кислоты неизвестны. Для количествен-
ного определения можно использовать газовую хроматографию |4|. После пре-
вращения в л-нитробензиловый эфир пропионовую кислоту можно определить
методом ВЭЖХ с УФ-детектированием при 265 нм |5|.
§6
Получение
Пропионовая кислота образуется в качестве побочного продукта при произ-
водстве уксусной кислоты окислением углеводородов с помощью воздуха. Син-
тезируют её взаимодействием этилена с окисью углерода и водяным паром (по
Реппе). Пропионаты получают нейтрализацией пропионовой кислоты соответ-
ствующими основаниями.
§7
Токсиколого-гигиеническая оценка
Острая токсичность. Для крыс LD,(I пропионовой кислоты перорально со-
ставляет 2,6 г на 1 кг массы тела |6|. Для пропионатов натрия и кальция эта вели-
чина имеет тот же порядок. При сочетании пропионата кальция с другими кон-
сервантами его острая токсичность не увеличивается 17]. В концентрированном
виде пропионовая кислота раздражает кожу и слизистые оболочки.
Значение ПДК для пропионовой кислоты*" составляет 30 мг/м1.
Субхроническая токсичность. При добавлении в корм молодым крысам в
течение нескольких недель 1—3% пропионата натрия или кальция они развива-
ются так же, как и контрольные животные |8|. Скармливание молодым крысам
корма с добавлением 24% пропионатов приводит к их смерти через 5 дней; взрос-
лые крысы переносят такой корм, несмотря на повреждения, примерно 20 дней
|9|. Микрофлора кишечника свиней не изменялась после четырёхнедельного
потребления корма с 0,8% пропионовой кислоты 110|. Пропионовая кислота и
пропионат кальция не мутагенны 1111.
Хроническая токсичность. После скармливания крысам корма с 4% пропио-
новой кислоты в течение 20 недель наблюдались гиперплазия и папилломы на
124 Консервирующие вещества
слизистой оболочке преджелудка 112|. Гистологическими методами были обна-
ружены разрастания основных клеток и раковые изменения гладкого эпителия
на слизистой оболочке преджелудка. В группе подопытных животных, чей корм
содержал 0,4% пропионовой кислоты, также были обнаружены гиперпластиче-
ские изменения. В исследованиях, проводившихся позднее, было показано, что
пропионовая кислота не генотоксична, и этим свойством невозможно объяснить
возникновение раковых опухолей гладкого эпителия преджелудка крыс. В суб-
хронических исследованиях с 0,3-3% пропионовой кислоты в корме, проводив-
шихся на других видах животных (например, собаках), не было обнаружено из-
менений в желудке и на слизистой оболочке пищевода. Некоторые исследова-
ния 113, 14| указывают на то, что и другие короткоцепочечные алифатические
карбоновые кислоты (например, масляная) могут индуцировать изменения пред-
желудка крыс, аналогичные описанным для пропионовой кислоты. Дальнейшие
работы показали, что на индуцирование пропионовой кислотой раковых опухо-
лей преджелудка крыс существенное влияние оказывает состав корма.
В исследованиях по репродуктивной токсичности не обнаружено отрица-
тельного влияния пропионовой кислоты на различные виды грызунов |6, 15].
По оценке SCF, при использовании пропионовой кислоты в качестве пище-
вой добавки (в тех концентрациях, которые реально применяются) не следует
ожидать её отрицательного влияния на здоровье людей. Сравнительное изуче-
ние короткоцепочечных жирных кислот и их солей продолжается 116|.
Биохимическое поведение. Пропионовая кислота и пропионаты из-за хоро-
шей растворимости в воде легко всасываются в пищеварительном тракте. Опас-
ность накопления в организме отсутствует. Пропионовая кислота, как и подоба-
ет жирной кислоте, используется организмом в качестве источника энергии 117,
18]. Часть её превращается в глюкозу, гликоген и другие продукты. Даже при
приёме высоких доз пропионовая кислота не выделяется с мочой. Распад про-
пионовой кислоты до углекислого газа и воды в тканях млекопитающих осуще-
ствляется путём связывания с коферментом А через метилмалонил-СоА, сукци-
нил-СоА и сукцинат ) 18]. Наряду с этим возможно превращение пропионовой
кислоты (через сукцинат) в Р-аланин |19|. У жвачных животных дополнительно
происходит конденсация пропионата и ацетата с образованием высших жирных
кислот с нечётным числом атомов углерода 118|. Пропионовая кислота образует-
ся при распаде некоторых аминокислот и при окислении жирных кислот с не-
чётным числом атомов углерода. Тем самым она не чужеродна организму, а яв-
ляется естественным промежуточным продуктом обмена веществ 1181.
§8
Законодательные аспекты применения в пищевых продуктах
Пропионаты натрия и кальция разрешены для консервирования хлеба и от-
части хлебобулочных изделий практически во всех странах с промышленным хле-
бопекарным производством. В некоторых государствах допускается использова-
ние и самой пропионовой кислоты*1.
18. Пропионовая кислота
125
§9
Действие на микроорганизмы
Общие принципы действия. Некоторые микроорганизмы вырабатывают про-
пионовую кислоту как продукт обмена веществ, многие другие могут её метабо-
лизировать. Если пропионовая кислота присутствует в высокой концентрации
(как при консервировании пищевых продуктов), то она, угнетая ферменты, бло-
кирует обмен веществ. К тому же пропионовая кислота снижает pH межклеточ-
ной среды, что также способствует угнетению роста и гибели клеток 120]. Анти-
микробное действие ярче выражено у недиссоциированной кислоты, чем у дис-
социированной |211.
Как и в случае других карбоновых кислот-консервантов, антимикробное дей-
ствие пропионовой кислоты сильно зависит от pH консервируемого продукта.
В этом отношении она схожа с сорбиновой кислотой, так как подобно ей имеет
сравнительно низкую константу диссоциации. Следовательно, пропионовая ки-
слота может быть использована для консервирования пищевых продуктов с вы-
соким значением pH.
Антимикробное действие пропионовой кислоты в сравнении с другими кон-
сервантами слабое, и при консервировании пищевых продуктов её приходится
использовать в относительно высоких дозах.
Спектр действия. Из-за неспецифичности действия пропионовой кислоты
её спектр чётко не определён. Практика показала, что пропионовая кислота и
пропионаты эффективны преимущественно против плесневых грибов |22|. Прав-
да, существуют грибы рода Penicillium, которые растут на питательных средах,
содержащих свыше 5% пропионовой кислоты 1231. Подавляются также дрожжи и
бактерии, главным образом грамотрицательные виды. Некоторые дрожжи, на-
пример отдельные виды рода Torula, могут использовать пропионовую кислоту в
своём обмене веществ. Практическое значение имеет действие пропионовой ки-
слоты и пропионатов на бактерии вида Bacillus mesentericus, которые вызывают
«картофельную болезнь» хлеба.
§10
Области применения
Молочная продукция. Пропионовокислые бактерии играют большую роль в
созревании некоторых сыров, например эмментальского. Такие сыры содержат
природную пропионовую кислоту, правда, в концентрации, которая не может
уменьшить образование нежелательных плесеней. В СШАдля обработки поверх-
ности твёрдых сыров против плесневения в небольшом объёме применяют 5—
10%-е растворы пропионатов натрия или кальция. Плавленый сыр можно защи-
тить от плесневения добавкой 0,2—0,3% пропионата. В молочных продуктах про-
t пионовую кислоту никогда не использовали в широких масштабах, а в настоя-
щее время практически не применяют вовсе.
Хлебобулочные изделия. В странах с промышленным хлебопечением про-
пионаты имеют большое значение в качестве консервантов хлеба и выпечки. Из-
за низкой константы диссоциации пропионовой кислоты они хорошо работают
126
Консервирующие вещества
в области высоких значений pH, характерных для большинства хлебобулочных
изделий. Пропионаты эффективны в отношении плесневых грибов и бактерий
вида Bacillus mesentericus. которые вызывают «картофельную болезнь» хлеба. Из-
за низкой эффективности пропионатов приходится использовать их в сравни-
тельно высоких концентрациях, если хлеб или другие хлебобулочные изделия
требуется хранить без плесневения дольше обычного. В этом случае пропионаты
замедляют брожение теста, что может быть компенсировано повышенной дозой
дрожжей или увеличением времени расстойки. Кроме того, пропионаты в кон-
центрации, необходимой для консервирования, влияют на запах хлеба. Такое
влияние нежелательно, прежде всего, в хлебе для тостов.
В хлебобулочных изделиях используются исключительно пропионаты: на-
триевая соль — преимущественно в сдобе, кальциевая — в хлебе. Пропионовая
кислота не применяется для консервирования хлеба в широких масштабах по
органолептическим причинам.
Пропионаты вносят в тесто при замесе. Их концентрация зависит от вида
продукта и желательного срока хранения изделия. Обычно она составляет 0,1—
0,3% от массы муки.
Пропионаты используют в хлебобулочных изделиях не только по экономи-
ческим соображениям, но также из-за их действия против микотоксинобразую-
щих микроорганизмов*2 |24|.
Ранее полагали, что при брожении теста образуются значительные количе-
ства пропионовой кислоты и пытались вывести штаммы дрожжей, которые обес-
печивали бы защиту хлеба от плесени 1251. Позднее было показано, что ни в за-
кваске, ни в хлебе, полученном опарным способом, пропионовая кислота есте-
ственного происхождения не содержится |4, 261.
§11
Прочие действия
Пропионовая кислота и её соли в концентрациях, необходимых для консер-
вирования пищевых продуктов, влияют на вкус и запах. В некоторых странах,
например в США, пропионовая кислота разрешена и используется как состав-
ная часть ароматизаторов.
Глава 19
Сорбиновая кислота
§1
Синонимы
ШРАС: гекса-2,4-диеновая кислота.
Немецкий: Sorbinsaure, trans-trans-2,4-Hexadiensfture.
Английский: sorbic acid, 2,4-hexadienoic acid.
Французский: acide sorbique.
Итальянский: acido sorbico.
Испанский: acido sorbico.
§2
Историческая справка
Сорбиновая кислота впервые получена Гофманом в 1859 году из рябинового
сока. Её антимикробное действие было обнаружено в 1939 году Мюллером (Гер-
мания) и независимо, несколькими месяцами позже, Гудингом (США). Промыш-
ленное производство сорбиновой кислоты началось в середине 50-х годов. С тех
пор она во всё возрастающих масштабах используется для консервирования пище-
вых продуктов. Вследствие физиологической безопасности и органолептической
нейтральности сорбиновую кислоту всё чаще предпочитают другим консервантам.
§3
Товарные формы, производные
Сорбиновая кислота применяется как в свободном виде, так и в виде калие-
вой и кальциевой солей и поставляется в различных формах (порошок, гранулы,
растворы). Эфиры сорбиновой кислоты и низших алифатических спиртов также
проявляют консервирующее действие, но из-за своего интенсивного запаха в ка-
честве консервантов пищевых продуктов не применяются.
§4
Свойства
Сорбиновая кислота СН,—СН=СН—СН=СН~СООН представляет собой бе-
лые, слабо пахнущие, кисловатые на вкус моноклинные кристаллы, с температу-
рой плавления 132—135°С. При комнатной температуре растворимость (на 100 г
128
Консервирующие вещества
растворителя) сорбиновой кислоты составляет: в воде — 0,16 г, в 10%-м растворе
поваренной соли — 0,07 г, в безводном этаноле и в уксусной кислоте — около
13 г, в маслах — 0,5—1 г.
Сорбат калия представляет собой белый порошок или гранулы. Это наибо-
лее растворимый из сорбатов*1. При комнатной температуре его растворимость в
воде равна 138 г, а в 10%-м растворе поваренной соли — 54 г.
Сорбат кальция — белый, без запаха и вкуса порошок, похожий на тальк.
Его растворимость в воде составляет 1,2 г.
Сорбиновая кислота, сорбат калия и особенно сорбат кальция, несмотря на
две двойные связи в молекуле, в твёрдом состоянии очень стабильны. В раство-
рах при наличии кислорода происходит окисление, которое может сопровождаться
появлением коричневой окраски 111. Однако при консервировании пищевых про-
дуктов это не существенно, потому что пищевой продукт, как правило, портится
до того, как окисление сорбиновой кислоты станет заметно; многие компоненты
пищевого продукта (жиры, ароматические составляющие) значительно более чув-
ствительны к окислению, чем сорбиновая кислота.
§5
Аналитические сведения
Сорбиновую кислоту можно количественно выделить из исследуемого пи-
щевого продукта перегонкой с водяным паром. Для качественного и количест-
венного анализа используется красное окрашивание, получаемое при окисле-
нии её дихроматом калия в присутствии 2-тиобарбитуровой кислоты |2|. Как по-
линенасыщенное соединение, сорбиновая кислота имеет отчётливый максимум
поглощения около 260 нм, который можно использовать для количественного
анализа |3|. Сорбиновую кислоту можно определять с помощью ВЭЖХ; одно-
временно с ней определяются бензойная и салициловая кислоты и парабены (не-
подвижная фаза обычно RP-18, УФ-детектирование при длине волны около
230 нм). Этот метод предложен для определения сорбиновой кислоты в любых
пищевых продуктах |4—6|, сорбатов и других консервантов в сыре |7|, йогурте
|81, фруктовых соках 191 и вине 1101.
Стандартные методы определения сорбатов (ГХ„ ТСХ и ВЭЖХ) опублико-
ваны в переработанном издании швейцарского справочника по пишевым про-
дуктам |11|. Нетрадиционные способы определения — ионная хроматография
или капиллярный изотахофорез 112| — до сих пор не смогли вытеснить обычные
методы. Описан и рентгеноструктурный*4 анализ сорбиновой кислоты 113[.
§6
Получение
В промышленности сорбиновую кислоту получают из кетена и кротонового
альдегида. В качестве промежуточного продукта образуется полимерный эфир
114|. Способ получения сорбиновой кислоты окислением 2,4-гексадиеналя утра-
тил своё значение.
19. Сорбиновая кислота
129
5
§7
Токсиколого-гигиеническая оценка
Острая токсичность. Для крыс перорально LDS() сорбиновой кислоты состав-
ляет 10,5 г на 1 кг массы тела 115J, по другим данным — 7,4 г 1161 или 8,7 г 117|.
Одновременное скармливание других консервантов не изменяет острую токсич-
ность сорбиновой кислоты |17|.
Сорбиновая кислота раздражает слизистые оболочки и неповреждённую ко-
жу только у особо чувствительных людей. Аллергенность её чрезвычайно мала,
потому что, будучи низкомолекулярным веществом, она не может вызывать об-
разования антител, а ковалентное связывание сорбиновой кислоты с белками,
которое могло бы приводить к аллергии немедленного типа, неизвестно 1181. Псев-
доаллергические реакции на сорбиновую кислоту как пищевую добавку также
крайне редки |19-21|. Острая токсичность для рыб (1250—1800 мг/л) исключи-
тельно низка; поэтому сорбиновая кислота отнесена к низшему классу опасно-
сти для водных сред 122|. В грунте и сточных водах сорбиновая кислота хорошо
разлагается 114|.
Субхроническая токсичность. Крысы переносят 10% сорбиновой кислоты в
корме в течение 42 дней без ущерба для здоровья |23|. В другом опыте такая же
добавка сорбиновой кислоты в корм крыс в течение 120 дней приводила к уско-
ренному росту и увеличению массы печени. Репродуктивная способность жи-
вотных оставалась нормальной |24|. Добавление 5% сорбиновой кислоты к кор-
му крыс и собак в опыте, продолжавшемся 90 дней, не причинило никакого вре-
да их здоровью; добавление 8% сорбиновой кислоты (что соответствует 5 г на
1 кг массы тела*') приводило только к незначительному увеличению массы пече-
ни, без гистологических изменений 1151. Дальнейшие исследования в целом под-
твердили эти данные |25~271. Наблюдаемое иногда увеличение массы печени объ-
ясняется её усиленной работой, а быстрое прибавление массы тела — калорий-
ностью сорбиновой кислоты 1281.
Хроническая токсичность. Сорбиновую кислоту начали использовать в кон-
сервировании пищевых продуктов в то время, когда для новых пищевых добавок
стали настоятельно требовать длительных исследований по хронической токсич-
ности. По этой причине она, вероятно, является консервантом, исследованным
лучше других.
Крысы получали в течение всей жизни корм с добавкой 5% сорбиновой ки-
слоты без признаков какого-либо вреда. Все исследованные функции организ-
ма, включая репродуктивную способность, остались нормальными и в следую-
щем поколении. У самцов даже обнаружено подтверждённое статистически вре-
менное ускорение роста и увеличение продолжительности жизни 1281. Скармли-
вание мышам и крысам 40—80 мг сорбиновой кислоты на 1 кг массы тела в день в
течение 17—18 месяцев не приводило к отрицательным результатам [29]. В дру-
гом опыте, длившемся свыше 2 лет, крысам давали корм с добавлением 1,5% или
10% сорбиновой кислоты. При концентрации 1,5% не было замечено отклоне-
ний в росте, кроветворении, состоянии и функциях двенадцати внутренних ор-
ганов по сравнению с контрольными животными. При концентрации 10% на-
блюдался несколько меньший прирост массы, а также увеличение щитовидной
железы, печени и почек 130]. Аналогичные результаты получены на мышах 1311.
130
Консервирующие вещества
При пероральном введении ни сорбиновая кислота |29_32|, ни сорбат калия
|28, 33| не оказывают канцерогенного действия.
С сорбатом калия было проведено большое число исследований мутагенно-
сти, и все они дали отрицательные результаты |33|; то же относится к сорбату
кальция 134|. Сорбат калия не является и тератогеном 1351.
Кратковременные тесты in vitro с сорбатом натрия, хранившимся на воздухе,
и с его растворами продемонстрировали слабую генотоксичность [36—391.
Известно, что сорбат натрия в растворе и особенно в твёрдом виде нестаби-
лен. Поэтому он не поступает в продажу. Обнаружено, что продукт окисления
сорбата натрия — 4,5-эпокси-2-гексеновая кислота — проявляет генотоксичность.
Хранившийся без доступа воздуха и потому не окислившийся раствор сорбата на-
трия, атакже сорбат калия и сорбиновая кислота, в которых вышеуказанный эпок-
сид не образуется, не обнаружили генотоксичности ни in vitro, ни in vivo |38—40|.
Биохимическое поведение. Исследования in vitro показали, что сорбиновая
кислота метаболизируется так же, как другие жирные кислоты. При этом выде-
ляется 27,6 кДж/г, из которых, по данным биологических испытаний, использу-
ются 50% [411. В организме человека и животных сорбиновая кислота подверга-
ется типичному для жирных кислот [3-окислению (см. схему) [28, 42J.
При приёме очень больших количеств сорбиновой кислоты, так же как и в
случае с обычными пищевыми жирными кислотами, можно дополнительно об-
наружить незначительное со-окисление 1431.
При скармливании крысам 1-|4С-сорбиновой кислоты в количестве от 61 до
1213 мг на 1 кг массы тела было выяснено, что 85% сорбиновой кислоты (незави-
симо от дозы) выводится в виде |4СО2'‘5. Период полупревращения сорбиновой
кислоты составляет от 40 до 110 минут (в зависимости от дозы). С мочой сорби-
новая кислота не выделяется. Часть сорбиновой кислоты через образующийся
при распаде ацетил-СоА используется для синтеза новых жирных кислот, так
Схема распада сорбиновой кислоты в организме
сн,-сн=сн-сн=сн-соон
| Гидратация снолгидратазой, +Н,0
сн ,-сн=сн-снон-сн2-соон
^Дегидрирование Р-кстогидразой, -2Н
сн -сн=сн-со-сн-соон
| Окисление 0-кстотиолазой, +2О2
СН,-СН=СН-СООН + 2СО, + Н2О
Гидратация снолгидратазой, +Н2О
сн ,-снон-сн-соон
| Дегидрирование 0-кстогидразой, —2Н
сн,-со-сн2-соон
| Окисление р-кетотиолазой, +2О2
СН,-СООН + 2СОг + Н2О
19. Сорбиновая кислота
131
как примерно 13% радиоактивного изотопа обнаруживается во внутренних
органах, мышцах и скелете животных |44|. Другими авторами эти результаты под-
тверждены на мышах 1451.
§8
Законодательные аспекты применения в пищевых продуктах
Сорбиновая кислота, сорбаты калия и кальция разрешены во всех странах
мира для консервирования многих пищевых продуктов87. Разрешённые макси-
мальные количества (за некоторым исключением) составляют от 0,1 до 0,2%.
Вследствие несомненной гигиенической безопасности повсюду в мире наблюда-
ется тенденция использования сорбиновой кислоты вместо других, менее прове-
ренных, консервантов.
§9
Действие на микроорганизмы
Общие критерии действия. Антимикробное действие сорбиновой кислоты
многосторонне. Во-первых, она угнетает в клетках микроорганизмов различные
ферменты. Из них особенно важны ферменты углеводного обмена — енолаза 146J
и лактатдегидрогеназа 147 [. Во-вторых, сорбиновая кислота сравнительно глубо-
ко, хотя и не очень специфично, вмешивается в цикл лимонной кислоты и по-
давляет, среди прочего, малатдегидрогеназу, изоцитратдегидрогеназу, а-кетоглу-
таратдегидрогеназу 1471, сукцинатдегидрогеназу 1481, фумаразу и аспартазу |49|.
В-третьих, сорбиновая кислота, имея две двойные связи, инактивирует фермен-
ты, ковалентно связывая сульфгидрильные группы |50|. В-четвёртых, в связи с
известным действием сорбиновой кислоты на каталазоположительные микроор-
ганизмы представляется возможным её влияние на каталазу и пероксидазу |51,
52|. Угнетающее действие сорбиновой кислоты на микроорганизмы, вероятно,
нельзя объяснить подавлением какого-либо одного фермента. К тому же уязви-
мые места в клетках различных типов микроорганизмов (бактерий, дрожжей, пле-
сеней) должны быть разными 1531.
Другой мишенью сорбиновой кислоты служат клеточные мембраны 154— 56].
Так, например, для подавления роста бактерий вида Escherichia coli и усвоения
ими таких аминокислот, как серин и аланин, требуются меньшие концентрации
сорбиновой кислоты, чем для подавления синтеза нуклеиновых кислот и актив-
ности лактатде гидрогеназы |551. Вследствие частичного разрушения клеточной
мембраны поток протонов в клетку усиливается; клетка должна расходовать боль-
ше энергии, чтобы компенсировать изменение разности потенциалов 1561.
Чтобы оказать воздействие внутри клетки микроорганизма, сорбиновая ки-
слота должна проникнуть через стенку. Причём в клетку проникает преимуще-
ственно недиссоциированная кислота. Так, при pH 3,15 внутрь клетки перехо-
дит около 40% имеющейся сорбиновой кислоты, а при pH около 7 в субстрате
остаётся 99% 1571. Этот факт объясняет зависимость действия сорбиновой кисло-
ты от pH. Для консервирования пищевых продуктов самой важной бесспорно
132
Консервирующие вещества
является недиссоциированная часть кислоты. Из-за малой*8 константы диссо-
циации (1,73 10 5) сорбиновая кислота, в противоположность другим кислотам-
консервантам, может использоваться также и для консервирования слабокислых
пищевых продуктов с высоким значением pH. Есть основания утверждать, что
сорбиновая кислота проявляет антимикробное действие и в диссоциированной
форме. Правда, оно примерно в 100 раз слабее, чем действие недиссоциирован-
ной кислоты 158, 59j.
Устойчивость к действию сорбиновой кислоты в узком смысле, т.е. возрас-
тание её минимальной действующей концентрации под влиянием подпороговых
концентраций, не наступает ни у бактерий вида Escherichia coli [601, ни у грибов
161, 62|. Использование сорбиновой кислоты в консервировании пищевых про-
дуктов в течение 40 лет подтверждает этот факт.
Некоторые микроорганизмы могут включать сорбиновую кислоту в свой об-
мен веществ, если она присутствует в подпороговой концентрации и имеет ме-
сто высокая обсеменённость. На практике это явление приводит к тому, что сор-
биновая кислота пригодна не для консервирования сильно обсеменённых суб-
стратов, а только для сохранения микробиологически чистых пищевых продук-
тов. Особенно хорошо изучено расщепление сорбиновой кислоты плесневыми
грибами рода Aspergillus 161 ] и рода Penicillium 163, 641.
В щелочной среде наблюдается89 образование метилкетонов [611. Плесневые
грибы вида Penicillium roqueforti могут образовывать 1,3-пентадиен 1651, который
имеет очень неприятный запах. Некоторые молочнокислые бактерии восстанав-
ливают сорбиновую кислоту до соответствующего спирта (гексадиенола) 1661, ко-
торый при взаимодействии с этанолом может превращаться в 1-этокси-2,4-гек-
садиен и 2-этокси-3,5-гексадиен [67, 68[.
Спектр действия. Действие сорбиновой кислоты направлено главным обра-
зом против дрожжей и плесневых грибов, включая афлатоксинобразующие |69|.
Из бактерий сильнее угнетаются каталазоположительные, чем каталазоотрица-
тельные 1701, строгие аэробы — более всего 1711, молочнокислые бактерии и кло-
стридии — менее всего |72|. Данные о том, что сорбиновая кислота вряд ли ока-
зывает действие на клостридии, получены в опытах на питательных средах при
оптимальном для этих микроорганизмов значении pH (около 7). В данной об-
ласти pH сорбиновая кислота из-за диссоциации и так почти не действует. До-
полнительные исследования на мясопродуктах показали, что сорбиновая кисло-
та очень хорошо подавляет клостридии (и образование ими токсинов) в сочета-
нии с нитритом и(или) поваренной солью, и(или) фосфатом, присутствующими
в малой, самостэятельно не действующей концентрации, а также если pH не-
сколько понижен |73—75].
О действии сорбиновой кислоты на различные виды микроорганизмов име-
ется ряд обзорных работ 153, 76, 77|. Минимальные эффективные концентрации
сорбиновой кислоты в отношении некоторых бактерий, дрожжей и плесневых
грибов, участвующих в порче пищевых продуктов, приведены в табл. 19 [41, 781.
Минимальные эффективные концентрации в большинстве случаев получены в
опытах на питательных средах. Из-за разнообразного влияния субстрата (см. §7
гл.5) для практического консервирования эти данные имеют только ориен-
тировочное значение.
19. Сорбиновая кислота
133
Таблица 19. Тормозящее действие сорбиновой кислоты против микроорганизмов
Вид микроорганизмов Значение pH Минимальная эффективная концентрация, г/кг
Бактерии: Pseudomonas spec. 6,0 1
Micrococcus spec. 5,5-6,4 0,5-1,5
Pediococcus cerevisiae 1
Lactobacillus spec. 4,4-6,0 2-7
Achromobacter spec. 4,3-6,4 0,1-1
Escherichia coli 5,2-5,6 0,5-1
Serratia marcescens 6,4 0,5
Bacillus spec. 5,5-6,3 0,5-10
Clostridium spec. 6,7-6,8 Болес 1
Salmonella spec. 5,0-5,3 0,5-10
Дрожжи:
Saccharomyces cerevisae 3,0 0,25
Saccharomyces ellipsoideus 3,5 0,5-2
Saccharomyces spec. 3,2-5,7 0,3-1
Hansenula anmnula 5,0 5
Brettanomyces versalilis 4,6 2
Byssochlamys fulva 3,5 0,5-2,5
Rhodotorula spec. 4,0-5,0 1-2
Torulopsis holmii 4,6 4
Torula lipolytica 5,0 1-2
Kloeckera apiculata 3,5-4,0 1-2
Candida krusei 3,4 1
Candida lipolytica 5,0 1
Плесневые грибы:
Rhizopus spec. 3,6 1,2
Mucor spec. 3,0 0,1-1
Geotrichum candidum 4,8 10
Oospora lactis 2,5-4,5 0,25-2 ‘
Trichophyton menlagrophytes 1
Penicillium spec. 3,5-5,7 0,2-1
Penicillium digitatum 4,0 2
Penicillium glaucum 3,0 1-2,5
Aspergillus spec. 3,3-5,7 0,2-1
Aspergillus Jlavus 1
Aspergillus niger 2,5-4,0 1-5
Botrytis cinerea 3,6 1,2-2,5
Fusarium spec. 3,0 I
Cladosporium spec. 5,0-7,0 1-3
§10
Области применения
Жировые продукты. Сорбиновая кислота имеет благоприятный (в сравне-
нии с другими консервантами) коэффициент распределения между маслом и во-
дой, в результате чего в водомасляных эмульсиях сравнительно высокая доля сор-
134
Консервирующие вещества
биновой кислоты (сорбатов) остаётся в водной фазе, а именно эта фаза и подвер-
жена микробиологической порче. При консервировании маргарина сорбиновая
кислота используется в концентрации 0,05—0,1% 1791. Её добавляют к жировой
фазе, а сорбат калия — к водной.
Сорбаты применяются в майонезах (которые представляют собой эмульсии
типа «масло в воде» или обратного типа*1 и склонны к микробиологической пор-
че) и деликатесных продуктах, содержащих майонез. Для предотвращения раз-
вития молочнокислых бактерий в слабокислые продукты вводят смесь сорбата
калия и бензоата натрия.
Молочные продукты. Сыры всех сортов — главная область использования
сорбиновой кислоты. Её применяют в качестве консерванта вследствие эффек-
тивности при высоких значениях pH и специфического действия на плесневые
грибы |80|. Сорбиновую кислоту и сорбаты применяют для твёрдых сыров как во
время созревания, так и при хранении в потребительской упаковке, При этом
особую роль играет действие сорбиновой кислоты против микотоксинобразую-
щих микроорганизмов |69|.
Сорбиновую кислоту применяют в основном следующими способами:
1) добавляют к сырной массе самоё кислоту или сорбат калия;
2) добавляют к рассолу сорбат калия;
3) используют для обсыпки сыра кристаллическую сорбиновую кислоту;
4) водным раствором сорбата калия обрабатывают сур путём окунания, опры-
скивания или обмывания;
5) суспензией сорбата кальция обрабатывают созревающий твёрдый сыр;
6) используют сорбиновую кислоту, сорбаты калия и кальция в фунгистати-
ческих упаковочных материалах и покрытиях.
Сорбиновую кислоту добавляют к сыру в концентрации 0,05—0,07% |81, 82|.
Для поверхностной обработки созревающего сыра требуется 10—40 г сорбиновой ки-
слоты на 1 м2, а для фунгистатических упаковочных материалов — 2—4 г/м2183, 84|.
Мясопродукты. Обработка 10—20%-м раствором сорбата калия подавляет рост
плесневых грибов на твёрдых колбасах и сардельках 185, 86|. Предпринимались
попытки защитить от возбудителей порчи и токсинобразующих микроорганиз-
мов говядину 187, 881 и мясо птицы 187, 89—911 погружением их в 5—10%-й раствор
сорбата калия. Вместе с разумным охлаждением и вакуумной упаковкой такой
способ позволяет значительно увеличить срок годности.
В работах [87, 91, 921 рассматривалась возможность использования сорбино-
вой кислоты вместо нитрита или в сочетании с уменьшенным его количеством для
ограничения роста клостридий и других токсинобразующих бактерий в солонине.
Ранее, в результате опытов на питательных средах, было сделано заключение, что
сорбиновая кислота не эффективна против этих микроорганизмов. Однако новые
исследования показали, что в мясопродуктах, при pH около 6, сочетание сорбатов
с небольшим количеством нитритов и(или) фосфатов подавляет клостридии (вклю-
чая образование ими токсинов) и другие бактерии по меньшей мере в такой же
степени, как и сами нитриты в применяемых в настоящее время концентрациях
|73—75, 89, 921. Кроме того, сорбиновая кислота /я vitro замедляет образование не-
которых нитрозаминов [931. Однако ни сорбиновая кислота, ни сорбат калия не
могут быть использованы взамен нитрита, так как не придают мясу красного окра-
шивания и не способствуют образованию аромата соления.
19. Сорбиновая кислота
135
Рыбопродукты. В сочетании с посолом, охлаждением и вакуумной упаков-
кой сорбиновая кислота оказывает антибактериальное действие на свежую рыбу
и тем самым уменьшает образование триметиламина и других нежелательных
пахучих веществ и подавляет рост патогенных микроорганизмов 194]. Из-задо-
статочно высокой активности против плесневых грибов она применяется для кон-
сервирования склонной к плесневению сушёной рыбы, например трески. Боль-
шое практическое значение имеет использование сорбиновой кислоты в восточ-
ноазиатских рыбопродуктах слабого посола.
Овощные продукты. Сорбиновая кислота в виде водорастворимых сорбатов
используется для консервирования ферментированных (квашеных) и марино-
ванных овощей. Преимущество сорбатов в этом случае — относительно слабое
действие сорбиновой кислоты против молочнокислых бактерий. Если к заложен-
ным на квашение овощам добавляют 0,05—0,15% (в зависимости от содержания в
них соли) сорбата калия, то желательное молочнокислое брожение почти не угне-
тается; напротив, сорбиновая кислота подавляет развитие вредных дрожжей и
плесневых грибов и тем самым способствует брожению [95]. Выход готовых огур-
цов при использовании сорбиновой кислоты был на 20% выше, чем без неё [96].
К содержащим уксус маринадам для огурцов и маслин добавляют 0,1—0,2% сор-
бата калия, чтобы предохранить их от дрожжей и плесневых грибов. Широко
используется сорбат калия для консервирования восточноазиатской ферменти-
рованной овощной продукции и пряных соусов [97|. При консервировании то-
матопродуктов сорбиновую кислоту часто применяют в сочетании с поваренной
солью и(или) уксусом.
Фруктовые продукты. Сорбиновая кислота в концентрации 0,05% использу-
ется для консервирования готового к употреблению чернослива, который произ-
водят замачиванием сильно высушенных плодов. Из-за активности91 воды они под-
вержены только плесневению 1981. Фруктовые пульпы можно защитить от броже-
ния и плесневения добавкой 0,1—0,13% сорбата калия. Правда, сорбиновая кисло-
та не противодействует окислению и ферментативной порче; поэтому в таких про-
дуктах её используют в сочетании с небольшим количеством двуокиси серы. В дже-
мы, варенья и желе из-за высокого содержания сахара достаточно добавить 0,05%
сорбиновой кислоты. Часто ограничиваются поверхностной обработкой расфасо-
ванной продукции. В некоторых странах сорбиновая кислота применяется в каче-
стве консерванта при домашнем изготовлении такого рода продуктов.
Напитки. Для консервирования чистых фруктовых соков справедливо всё,
что было сказано о фруктовых пульпах. Сорбат калия используют главным обра-
зом для консервирования фруктовых соков, предназначенных для дальнейшей
переработки. Обычно его применяют вместе с небольшими количествами серни-
стого газа, чтобы защитить продукт также от окисления, бактериальной (молоч-
нокислого и уксуснокислого брожения) и ферментативной порчи. Для инакти-
вации ферментов и уменьшения числа микроорганизмов продукт дополнитель-
но пастеризуют. Концентрация сорбата калия составляет 0,05—0,2% в зависимо-
сти от вида сока и требуемого срока годности. Сорбат калия в концентрации 0,02%
защищает безалкогольные освежающие напитки от порчи дрожжами.
Во всех винодельческих странах сорбиновая кислота имеет очень большое зна-
чение для стабилизации вина с остаточным сахаром. Содержащийся в вине в своей
обычной концентрации диоксид серы из-за низкой эффективности против дрож-
136
Консервирующие вещества
жей не защищает вино от перебраживания. Сочетание 200 мг сорбиновой кислоты
(или 270 мг сорбата калия) и 20—40 мг свободного SO2 в 1 л вина обеспечивает ему
надёжную защиту. В винах, которые предполагается стабилизировать сорбиновой
кислотой, следует, насколько это возможно, снизить обсеменённость микроорга-
низмами. Сорбиновая кислота не защищает вино от ферментативных изменений,
бактериального брожения и окисления; поэтому вместе с ней следует использо-
вать и двуокись серы. Сорбиновая кислота из-за иного, чем у SO2, спектра дейст-
вия не может рассматриваться как заменитель сернистой кислоты. В частности,
некоторое количество SO2 необходимо и для подавления молочнокислых бакте-
рий. Отдельные штаммы последних способны восстанавливать сорбиновую кислоту
до сорбинового спирта, который может реагировать с этанолом, давая 1-эток-
си-2,4-гексадиен и 2-этокси-3,5-гексадиен |67, 681. Последнее соединение имеет
сильный цветочный запах и является причиной так называемого «гераниевого то-
на» в неправильно обработанном вине, содержащем сорбиновую кислоту. Появле-
ние этой болезни можно предотвратить правильной обработкой вина сернистым
газом, угнетающим молочнокислые бактерии.
Хлебобулочные изделия. Сорбиновая кислота имеет общее свойство с про-
пионовой кислотой (широко используемой в консервировании хлебобулочных
изделий) — она сохраняет эффективность в области высоких значений pH. По
сравнению с пропионатами сорбиновая кислота проявляет значительно более
сильное антимикробное действие 1991, особенно в отношении меловой плесени
(Trichosporon variabile), появляющейся иногда на ржаном хлебе 11001. Сорбиновая
кислота в количестве 0,1— 0,2% к массе муки добавляется во время замеса теста.
В хлебобулочных изделиях, прежде всего в хлебе, сорбиновая кислота исполь-
зуется не только по экономическим причинам, но также из-за её действия на аф-
латоксинобразующие микроорганизмы’2 169|. Использование сорбиновой кисло-
ты в выпечных изделиях не создаёт проблем, когда в качестве разрыхлителя ис-
пользуется пекарский порошок, а не дрожжи, например в пирожных и другой слад-
кой выпечке. В этом случае в тесто вводится 0,1—0,2% сорбиновой кислоты (в за-
висимости от вида продукта и требуемого срока хранения). В хлебном тесте из-за
сильного действия сорбиновой кислоты против дрожжей могут возникнуть про-
блемы с брожением. Замедление брожения приходится компенсировать увеличе-
нием количества дрожжей и(или) времени брожения. Вместо сорбиновой кислоты
в дрожжевом тесте было предложено 11011 использовать смешанный ангидрид сор-
биновой и пальмитиновой кислот (сорбоилпальмитат). Это соединение не замед-
ляет брожение, но и не обладает антимикробным действием. В процессе выпечки
оно расщепляется, образуя свободную сорбиновую кислоту, которая и защищает
готовый хлеб от плесени. Однако для широкого применения этот препарат слиш-
ком дорог. Вместо него было предложено использовать сорбиновую кислоту с оп-
ределённым размером гранул, которая медленно растворяется во время приготов-
ления теста, не влияя на брожение, а в готовом хлебе действует в полную силу
1102|. Продукт поступает в продажу под названием Panosorb*.
Кондитерские изделия. Сорбиновая кислота вследствие нейтрального вкуса,
эффективности в области высоких pH и действенности против осмофильных дрож-
жей применяется для консервирования наполнителей шоколада и пралине. Ис-
пользуются концентрации от 0,05 до 0,2%, в зависимости от содержания в продук-
те сахара, кислот и от других влияющих на консервирующее действие факторов.
Г ЛАВА 20
Эфиры пироугольной кислоты
20
§1
Синонимы
ШРАС: эфиры диугольной кислоты.
Русский: пирокарбонаты, дикарбонаты.
Немецкий: Dikohlensaureester, Pyrokohlensaureester.
Английский: dicarbonic acid esters, pyrocarbonic acid esters.
Французский: esters d’acide dicarbonique.
Итальянский: esteri dell’acido dicarbonico.
Испанский: esters del acido dicarbonico.
§2
Историческая справка
Антимикробное действие эфиров пироугольной кислоты впервые было опи-
сано в 1956 году Бернхардом, Тома и Гентом 111. В некоторых странах диэтило-
вый эфир диугольной кислоты в середине 60-х годов использовался для консер-
вирования вин и безалкогольных напитков. В настоящее время вместо диэтил-
пирокарбоната (от которого отказались около 1973 года ввиду его токсичности)
используется диметилпирокарбонат.
§3
Товарные формы
Интерес для промышленного использования представляют низшие эфиры
пироугольной кислоты. Ранее применялся диэтиловый эфир (торговая марка
Baycovin®). Используемый в настоящее время диметиловый эфир выпускается
под торговой маркой Velcorin*.
§4
Свойства
Диметилпирокарбонат СН,О—СО—О—СО-ОСН, представляет собой бес-
цветную жидкость с фруктовым запахом, застывающую при 17°С. С этанолом и
другими спиртами он смешивается во всех отношениях; растворимость в воде
составляет 3,65%.
138
Консервирующие вещества
Диэтилпирокарбонат С2Н,О-СО-О-СО-ОС2Н, представляет собой бес-
цветную жидкость с фруктовым запахом, кипящую при 180°С с разложением.
С этанолом и другими спиртами он смешивается во всех отношениях; раствори-
мость в воде составляет 0,6%.
В присутствии воды оба эфира гидролизуются до соответствующего спирта
и углекислоты. Скорость гидролиза не зависит от давления углекислого газа, но
зависит от температуры и pH. Этиловый эфир в напитках при комнатной темпе-
ратуре полностью гидролизуется в течение 20-24 часов |2|. В тех же условиях
гидролиз метилового эфира протекает в 3-4 раза быстрее |3|. Его концентрация
в сильнокислых фруктовых соках (pH около 2,8) при температуре 10~30°С опус-
кается за 65—260 минут ниже предела обнаружения.
Пирокарбонаты реагируют не только с водой, но и с другими составляющи-
ми напитков. С этанолом они образуют диэтилкарбонат или метилэтилкарбонат
[4, 5]. В присутствии солей аммония из диэтилдикарбоната образуется в неболь-
шом количестве этилкарбамат |6, 7, 8|, а из диметилдикарбоната — метилкарба-
мат [3|. Диметилдикарбонат реагирует также с высшими спиртами, образуя сле-
довые количества (миллиардные доли) соответствующих карбонатов [9].
§5
Аналитические сведения
Для установления факта обработки винадиэтилпирокарбонатом можно про-
вести газохроматографическое исследование на присутствие диэтилкарбоната |10|.
С помощью хроматографии можно обнаружить и метилэтилкарбонат |2].
Дикарбонаты можно определить фотометрически и титрованием 1111. Газо-
хроматографический анализ сероуглеродного экстракта предложен АОАС” в ка-
честве официального метода 112|.
§6
Токсиколого-гигиеническая оценка
Острая токсичность. Для крыс LD.„ диэтилпирокарбоната при использова-
нии масляного раствора составляет 1—1,5 г на 1 кг массы тела 113|. При оральном
введении крысам более 350—500 мг диметилпирокарбоната на 1 кг массы тела
появляются локальные раздражения, и, как следствие, значение острой токсич-
ности для него определить не удаётся 114|.
Для быстро распадающихся веществ, какими и являются пирокарбонаты, их
собственная острая токсичность имеет меньшее значение, чем токсичность про-
дуктов реакции, которые могут из них образовываться.
Эфиры пироугольной кислоты раздражают кожу и слизистые оболочки; по-
этому с ними следует обращаться осторожно.
Субхроническая токсичность. При скармливании крысам в течение несколь-
ких месяцев свежеприготовленных масляных растворов диэтилпирокарбоната не
удалось обнаружить никаких вредных воздействий |13|. Напитки, содержащие
I
139
20. Эфиры пироугольной кислоты
4 г диметилпирокарбоната на 1 л, также переносились в течение 3 месяцев без
каких-либо реакций 131.
Хроническая токсичность. При оценке хронической токсичности диэтилпи-
рокарбоната оказалось, что более всего опасен один из продуктов его распада —
этилкарбамат |6|. Он проявляет канцерогенность у крыс, мышей и хомяков как
при оральном введении, так и при ингаляции.
В Германии этилкарбамат в результате опытов на животных признан явным
канцерогеном 115, 16|. Вероятно, его канцерогенное действие возникает из-за
превращения в винилкарбамат с последующим окислением до эпоксиэтилкарба-
мата, так как соответствующие оксоэтиладдукты с ДНК и белками были обнару-
жены в работе |17|. Поскольку этилкарбамат образуется при реакции ионов ам-
мония с диэтилпирокарбонатом, применение последнего в пищевых продуктах
было запрещено.
Аналогичный продукт превращения диметилпирокарбоната — метилкарба-
мат — не проявляет канцерогенного действия |3| и потому безопасен 114]. В на-
питках допускается присутствие метилкарбамата в концентрации до 0,02 мг/л.
SCF не возражает против использования диметилпирокарбоната в напитках в
концентрации 125-250 мг/л 118|. Обобщённые токсикологические данные при-
ведены в работе 119|.
§7
Законодательные аспекты применения в пищевых продуктах
В настоящее время все разрешения на применение диэтилпирокарбоната,
имевшиеся в некоторых странах, отменены. Диметилдикарбонат иногда исполь-
зуется, например в безалкогольных напитках (но не в вине), как не требующая
разрешения пищевая добавка, поскольку он отсутствует в готовом продукте.
В Европейском Союзе он под индексом Е242 разрешён для применения в неко-
торых напитках. Ограниченное разрешение существует и в других странах, на-
пример в США для вин, холодного чая и чайных экстрактов94.
§8
Действие на микроорганизмы
Общие принципы действия. Пирокарбонаты уничтожают микроорганизмы
быстрее, чем обычные консерванты; поэтому их следует считать скорее дезин-
фицирующими, чем консервирующими средствами. Эфиры пироугольной ки-
слоты так и называют — средства холодной стерилизации.
Антимикробное действие диэтилпирокарбоната основано на его взаимодей-
ствии с ферментами и мембранами микроорганизмов 1201.
Концентрация эфиров пироугольной кислоты, необходимая для уничтоже-
ния микроорганизмов, сильно зависит от уровня обсеменённости; при увеличе-
нии числа микробов в 10 раз концентрация пирокарбоната должна быть удвоена.
Ниже показано действие эфиров пироугольной кислоты против дрожжей вида
Saccharomyces cerevisiae при различной обсеменённости:
1
140
Консервирующие вещества
Число микроорганизмов в 1 мл 6000 600 60 <10
Необходимая для их уничтожения концентрация, мг/кг 200 100 60 30
Спектр действия. Диэтил- и диметилпирокарбонаты действуют преимуще-
ственно против дрожжей, много меньше против бактерий и слабее всего против
плесневых грибов. Большинство дрожжей при низком уровне обсеменённости
(400—600 мл ') погибает при концентрации пирокарбонатов порядка 100 мг/кг.
В модельных опытах с вином обнаружилось, что при обсеменённости от 50 до
200 мл”' большинство видов дрожжей погибает уже после добавления 25 мг ди-
метилпирокарбоната на 1 л вина 1211, для бактерий и плесневых грибов требу-
ются в 3-5 раз большие концентрации |3|.
Приведённые выше литературные данные о минимальной эффективной кон-
центрации пирокарбонатов по отношению к отдельным видам микроорганиз-
мов несравнимы друг с другом из-за сильной зависимости эффективности дей-
ствия от обсеменённости продукта.
§9
Области применения
Пирокарбонаты обладают уникальным для консервантов свойством: в при-
сутствии воды они за короткое время распадаются до микробиологически ней-
тральных веществ. Это определяет особенности их применения: только в про-
дуктах, которые (после уничтожения имеющихся в них микроорганизмов) будут
защищены от повторного инфицирования соответствующими технологически-
ми приёмами. Поэтому область использования пирокарбонатов ограничивается
напитками, которые сразу после обработки разливают в закрытые ёмкости. В связи
с быстрым распадом (особенно метилового эфира) пирокарбонаты следует вво-
дить непосредственно перед заполнением бутылок.
Дозирование осуществляется специально сконструированным насосом, ко-
торый позволяет непрерывно и безопасно вводить малые количества вещества.
При использовании диметилпирокарбоната, имеющего температуру кристалли-
зации 17°С, дозирующий насос в холодных помещениях приходится подогревать.
Так как эффективность обоих эфиров примерно одинакова, их концентра-
ции, рекомендуемые для использования, близки. Для газированных безалкоголь-
ных напитков они равны 50—150 мг/л, для негазированных напитков — 100—
200 мг/л. Когда диэтилпирокарбонат применялся для обеззараживания вина, его
концентрация составляла 110—170 мг/л 1111.
Диметилпирокарбонат может использоваться в виноградных соках и тома-
топродуктах как ингибитор дрожжей 122, 231. Правда, из-за быстрого гидролиза
в дополнение к нему необходимо использовать сорбат калия. Последний обеспе-
чивает длительную защиту, особенно при высоких температурах хранения. В кон-
центрации примерно 250 мг/кг диметилпирокарбонат отрицательно влияет на
окраску томатного сока и содержание в нём p-каротина и аскорбиновой кисло-
ты. Сочетание пирокарбонатов с сорбатом калия или бензоатом натрия позволя-
ет предотвратить эти явления 1231.
Глава 21
Бензойная кислота
21
§1
Синонимы
Немецкий: Benzoesaure.
Английский: benzoic acid.
Французский: acide benzoique.
Итальянский: acido benzoico.
Испанский: acido benzoico.
§2
Историческая справка
Консервирующее действие бензойной кислоты впервые было описано в
1875 году Флеком 111, который искал заменитель уже известной к тому времени
салициловой кислоте. Он проводил аналогию между действием обеих кислот и
фенола. Бензойную кислоту, в отличие от салициловой, тогда ещё не могли по-
лучать в промышленных масштабах. Она стала использоваться в консервирова-
нии пищевых продуктов лишь к началу XX столетия. С тех пор бензойная кисло-
та во всех странах широко применяется как консервант, прежде всего из-за сво-
ей низкой цены, но в последнее время её всё чаще заменяют другими, менее
токсичными консервантами.
§3
Товарные формы
Применение находит как сама бензойная кислота, так и её натриевая соль
(бензоат натрия), лучше растворимая в воде. Бензоат калия используется редко.
§4
Свойства
Бензойная кислота С6Н5СООН представляет собой белые
блестящие моноклинные листочки или иглы, которые плавятся при
122°С. В 100 г воды при комнатной температуре растворяется 0,34 г
бензойной кислоты, в 100 г жирных масел — 1—2 г. Бензойная кислота хорошо
растворима а безводном этаноле.
142
Консервирующие вещества
Бензоат натрия представляет собой белый кристаллический порошок. В 100 г
воды при комнатной температуре его растворяется 63 г.
§5
Аналитические сведения
Бензойная кислота перегоняется с водяным паром и может быть количест-
венно извлечена этим способом из исследуемого пищевого продукта. Можно вы-
делить её и твёрдофазной экстракцией |2|. В экстракте бензойную кислоту мож-
но обнаружить и количественно определить спектрофотометрически, а также с
помощью ВЭЖХ или ТСХ |3|. Для ВЭЖХ используют RP-фазу и УФ-детектиро-
вание |4, 5|.
При определении бензойной кислоты в пищевых продуктах следует учиты-
вать возможность её естественного содержания в свободном виде или в форме гли-
козидов9' в молочных продуктах и в таких ягодах, как земляника и брусника |6].
§6
Получение
В промышленности бензойную кислоту получают окислением толуола. При-
менявшиеся ранее гидролиз бензотрихлорида и декарбоксилирование фталевой
кислоты ныне утратили своё значение.
§7
Токсиколого-гигиеническая оценка
Острая токсичность. Для крыс при пероральном введении LD,0 бензойной
кислоты составляет 1,7—3,7 г на 1 кг массы тела 17, 81. Кошки часто бывают более
чувствительны к бензойной кислоте. Для них смертельная доза может составлять
0,3—0,6 г на 1 кг массы тела96191. Причиной является отсутствие в организме кошек
ферментативного превращения бензойной кислоты в гиппуровую.
Субхроническая токсичность. Скармливание мышам в течение 3 месяцев по
80 мг бензойной кислоты на 1 кг массы тела в день приводило к увеличению
смертности (особенно при одновременном потреблении сульфитов) 110). Упо-
требление в течение 4-5 дней корма, содержащего 3% бензойной кислоты, при-
водит к расстройствам центральной нервной системы, атаксии, тоническим и
клоническим судорогам; однако визуальных изменений органов не наблюдается
и патологических отклонений при гистологических исследованиях тканей серд-
ца, печени и почек не выявлено. Через 5 дней погибла половина подопытных
животных, и у них были обнаружены некротические изменения головного мозга.
Добавление к корму 1,1% бензойной кислоты снижает прирост массы, не
вызывая других нарушений 1111. В другом опыте применение корма с 4% бензоа-
та натрия в течение 90 дней не причинило вреда 17]. При использовании корма с
3% бензоата натрия в течение 10 дней у крыс и мышей обнаруживалось увеличе-
21. Бензойная кислота
143
ние массы почек и печени, изменение уровня альбумина и у-глутамилтранспеп-
тидазы, изменения клеток печени 1121.
Литературные данные о пороговой токсичной концентрации бензойной ки-
слоты в субхроническом опыте весьма различны 113, 14|.
Ежедневный приём человеком 1 г бензойной кислоты в течение 90 дней 113|,
или 12 г в течение 14 дней 115|, или 0,3-4 г в течение 60-100 дней 116] не прино-
сит вреда здоровью.
При оральном введении бензоат натрия не оказывает тератогенного дейст-
вия 117, 18|.
Хроническая токсичность. Ежедневный приём в течение 17 месяцев мыша-
ми (в течение 18 месяцев крысами) 40 мг бензойной кислоты на 1 кг массы тела
вызывает замедление развития |10|. В опыте на 40 крысах корм с добавкой 5%
бензоата натрия оказался сильно токсичным. За 2 недели все животные умерли.
Корм с 1 % бензоата натрия потреблялся без нежелательных последствий для ап-
петита, продолжительности жизни, развития, размножения, прироста массы и
гистологии шести органов 116, 19|. По результатам других исследований, разви-
тие крыс, чей корм содержал 1,5% бензойной кислоты, явно отставало от кон-
трольных животных 1201.
С 1979 года бензойная кислота используется в терапии для снижения ток-
сичности аммиака у пациентов с ферментными дефектами цикла мочевины 1211.
При этом как побочное действие наблюдалось снижение содержания N-аце-
тилглутамата внутри митохондрий |22|.
Из-за новых сведений о возможном тератогенном действии бензойной ки-
слоты SCF установила временное ДСП в 0-5 мг на 1 кг массы тела с ограниче-
ниями 1231. JECFA сохранил прежнее ДСП, составляющее 0—5 мг на 1 кг массы
тела, но требует дальнейших токсикологических исследований |24|.
Реакции непереносимости. Считается, что бензойная кислота, наряду с эфи-
рами л-оксибензойной кислоты и некоторыми азокрасителями, обладает значи-
тельным сенсибилизирующим потенциалом. Как при оральном введении, так и
при нанесении на кожу бензойная кислота может вызывать реакции неперено-
симости — крапивницу, астму, анафилактический шок |25, 261. В качестве воз-
можной причины такого действия предполагают усиленное выделение гистами-
на, индуцируемое бензоатом 1271.
Биохимическое поведение. Бензойная кислота хорошо всасывается в желу-
дочно-кишечном тракте. С белками она не соединяется. Вначале бензойная ки-
слота с АТФ образует бензоил-АТФ, а затем, подобно жирным кислотам, «акти-
вируется», давая с коферментом А бензоил-кофермент А. Последний под дейст-
вием глицин-М-ацилазы образует с глицином гиппуровую кислоту (бензоилгли-
цин), которая выделяется с мочой 116]. Меньшая часть бензойной кислоты свя-
зывается с глюкуроновой кислотой и тоже выводится с мочой 121 ].
§8
Законодательные аспекты применения в пищевых продуктах
Бензойная кислота и бензоат натрия давно разрешены в большинстве стран
для консервирования многих пищевых продуктов”.
144
Консервирующие вещества
Предельно допустимые концентрации составляют от 0,15 до 0,25%, хотя бы-
вают и исключения.
§9
Действие на микроорганизмы
Общие критерии действия. Антимикробное действие бензойной кислоты свя-
зывают с её влиянием на ферментную систему микроорганизмов. Так, напри-
мер, у некоторых бактерий и дрожжей она угнетает ферменты, управляющие ме-
таболизмом уксусной кислоты и окислительным фосфорилированием |28, 29].
Бензойная кислота, по-видимому, включается на разных этапах в цикл лимон-
ной кислоты; прежде всего, она действует на дегидрогеназы а-кетоглутаровой и
янтарной кислот J29J. Кроме того, бензойная кислота, вероятно, угнетает также
тирозиназы |30|.
Наряду с инактивацией ферментов бензойная кислота действует и на кле-
точные мембраны. Чтобы проявить действие внутри клетки микроорганизма, бен-
зойная кислота должна проникнуть в неё, преодолев стенку. Последняя прони-
цаема преимущественно для недиссоциированной кислоты. Это объясняет зави-
симость эффективности бензойной кислоты от значения pH. Антимикробное дей-
ствие проявляет только недиссоциированная кислота. Из-за сравнительно высо-
кой (6,46-10~') константы диссоциации бензойная кислота может быть использо-
вана для консервирования только сильнокислых продуктов. С другой стороны,
бензойная кислота снижает pH внутри клетки, что тоже ведёт к замедлению раз-
вития и гибели микроорганизма 1311. Этот эффект ярче выражен у диссоцииро-
ванной кислоты, чем у недиссоциированной 132|.
Приём бензойной кислоты в малых (подпороговых) концентрациях не при-
водит к появлению устойчивости к ней (увеличению минимальной действующей
концентрации) |33|.
Спектр действия. Действие бензойной кислоты направлено главным обра-
зом против дрожжей и плесневых грибов, включая афлатоксинобразующие [34,
35[. Бактерии угнетаются только частично. Против молочнокислых бактерий и
клостридий бензойная кислота малоэффективна. Минимальные эффективные
концентрации бензойной кислоты в отношении некоторых вредных для пище-
вых продуктов бактерий, дрожжей и плесневых грибов приведены в табл. 20.
§10
Области применения
Жировые продукты. Бензойная кислота несколько десятков лет использует-
ся в качестве консерванта для маргаринов, в которых её концентрация составля-
ет 0,08-0,15%. В жировую фазу маргарина добавляют кислоту, а в водную — бен-
зоат натрия, причём они могут применяться как вместе, так и по отдельности.
Бензойная кислота не идеальный консервант для маргаринов, так как относи-
тельно высокое значение pH маргарина’8 лежит на границе области, оптималь-
ной для действия бензойной кислоты. Этот факт, а также не очень благоприят-
21. Бензойная кислота
145
Таблица 20. Тормозящее действие бензойной кислоты против микроорганизмов |36, 37]
Вид микроорганизмов Значение pH Минимальная эффективная концентрация, г/кг
Бактерии:
Pseudomonas spec. 6,0 2-4,8
Micrococcus spec. 5,5-5,6 0,5-1
Streptococcus spec. 5,2-5,6 2-4
Lactobacillus spec. 4,3-6,0 3-18
Escherichia coli 5,2-5,6 0,5-1,2
Bacillus cercus 6,3 5
Дрожжи:
Спорогенные дрожжи 2,6-4,5 0,2-2
Аспорогенные дрожжи 4,0-5,0 0,7-1,5
Hansenula subpelliculosa 2-3
Pichia membranaefaciens 7
Pichia pastori 3
Candida krusei 3-7
Toru lopsis spec. 2-5
Rhodotorula spec. 1-2
Oospora lactis 3
Плесневые грибы:
Rhizopus nigricans 5,0 0,3-1,2
Mucor racemosus 5,0 0,3-1,2
Penieillium spec. 2,6-5,0 0,3-2,8
Penicillium glaucum 5,0 4-5
Aspergillus spec. 3,0-5,0 0,2-3
Cladosporium herbarum 5,1 1
ный коэффициент распределения между жировой и водной фазой” ограничива-
ют применение бензойной кислоты в предохранении маргаринов от порчи.
Бензойная кислота и бензоат натрия применяются как консерванты для май-
онезов и деликатесных продуктов, содержащих майонез. Майонез, представляю-
щий собой эмульсию типа «масло в воде», подвержен микробной порче в боль-
шей степени, чем эмульсии обратного типа. Обычно бензоат натрия использует-
ся здесь в сочетании с сорбатом калия. Эта смесь оказывает на молочнокислые
бактерии более сильное действие, чем каждый компонент в отдельности. Кроме
того, из-за уменьшения содержания бензоата такая смесь меньше влияет на ор-
ганолептические свойства продукта.
Фруктовая и овощная продукция. Ранее бензойная кислота (в виде 0,1—0,2%
бензоата натрия) широко использовалась для консервирования маринованных
овощей. Она хорошо подходит для таких продуктов вследствие их высокой ки-
слотности. По этой же причине, а также из-за высокого содержания приправ
отрицательное влияние добавки бензоата на вкус малозаметно. Сейчас бензоаты
в маринадах почти не используются; вследствие изменения запросов потребите-
лей чаще применяют пастеризацию и сорбиновую кислоту.
Бензойная кислота — хороший консервант и для кислой фруктовой продук-
ции. Благодаря своей невысокой стоимости она всё ещё используется для этой
цели, хотя с ней опасность появления нежелательного привкуса существенно вы-
146
Консервирующие вещества
ше, чем с сорбиновой кислотой. Из-за плохой растворимости в воде бензойная
кислота применяется главным образом в виде бензоата натрия. Добавив 0,1—0,13%
бензоата натрия, можно защитить фруктовые пульпы от плесневения и броже-
ния. Бензойная кислота, так же как и сорбиновая, не препятствует окислению и
ферментативной порче; поэтому во фруктовых продуктах её используют в соче-
тании с небольшими количествами диоксида серы или других антиоксидантов.
Напитки. Для консервирования чистых фруктовых соков справедливо всё,
что было сказано по поводу фруктовых пульп. Бензойную кислоту (в виде бен-
зоата натрия) используют главным образом в консервировании фруктовых со-
ков, предназначенных для дальнейшей переработки. Чтобы защитить продукты
от окисления, ферментативной и бактериальной порчи (молочно- и уксуснокис-
лого брожения), бензоат натрия обычно применяют в сочетании с небольшим
количеством SO2. Для инактивации ферментов и снижения общего числа мик-
роорганизмов продукт дополнительно пастеризуют. Концентрация бензоата на-
трия составляет 0,05—0,2% в зависимости от вида сока и желаемого срока хра-
нения.
В безалкогольных напитках бензоат натрия в концентрации 0,02% служит
недорогим дополнительным фактором защиты против дрожжей. В прохладитель-
ных напитках в присутствии аскорбиновой кислоты и ионов металлов из бензоа-
тов может образовываться незначительное количество (миллиардные доли) бен-
зола 138—40|.
§11
Прочие действия
Бензойная кислота и её соли в консервирующих концентрациях могут вы-
зывать в пищевых продуктах небольшое изменение вкуса.
Глава 22
Эфиры лара-оксибензойной кислоты
§1
Синонимы
IUPAC: сложные эфиры 4-оксибензойной кислоты.
Русский: (сложные) эфиры я-гидроксибензойной кислоты, (сложные) эфиры
л-оксибензойной кислоты, (сложные) эфиры />-оксибензойной кислоты,
я-оксибензоаты, парабены.
Немецкий: p-Hydroxybenzoesaureester, PHB-Ester, Solbro)', Nipaester, Nipagin*,
Nipasol', Nipakombin'.
Английский: esters of p-hydroxybenzoic acid, parabens.
Французский: esters de Pacide p-hydroxybenzoique.
Итальянский: esteri p-idrossibenzoici.
Испанский: esters de) acido p-hidroxibenzoico.
§2
Историческая справка
Эфиры я-оксибензойной кислоты были предложены как консерванты в
качестве заменителей салициловой и бензойной кислот, недостаток которых за-
ключается в том, что они эффективны только в сильнокислой среде. Т. Сабалич-
ка предположил, что сложные эфиры должны быть лишены этого недостатка, и
в начале 20-х годов нашего столетия синтезировал различные алкил- и арил-
я-оксибензоаты. В 1923 году он предложил их в качестве консервантов пищевых
продуктов и лекарств 111. Несмотря на определённые технические удобства и от-
носительную безвредность по сравнению с известными к тому времени консер-
вантами, эфиры я-оксибензойной кислоты из-за своих органолептических свойств
нашли очень ограниченное применение в консервировании пищевых продук-
тов. Область использования парабенов — консервирование фармацевтических и
косметических препаратов, в которых может быть использовано главное преиму-
щество этих веществ — эффективность в слабокислой и нейтральной среде.
§3
Свойства
Эфиры я-оксибензойной кислоты имеют общую формулу но-
Их свойства приведены ниже.
:оок.
148
Консервирующие вещества
Радикал, R СН. С,Н, С;Н; «-С,Н„
Расворимость при комнатной температуре,
гнаЮОгводы 0,25 0,17 0,02 0,0015
Температура плавления, "С 127 — 97 —
Парабены представляют собой белые кристаллические порошки. Их натрие-
вые производные хорошо растворимы в воде, но в нещелочных растворах не мо-
гут существовать из-за гидролиза. Растворимость парабенов в маслах возрастает
с увеличением длины алкильного радикала и составляет от 2 до 5% в зависимо-
сти от сорта масла. Из-за хорошей растворимости в маслах и плохой в воде эти
вещества в основном оказываются в масляной фазе эмульсий; в водной фазе их
концентрация невелика. Добавление парабенов к пишевым продуктам приводит
к некоторому ослаблению вкусовых ощущений 12, 3|.
§4
Аналитические сведения
Эфиры л-оксибензойной кислоты можно выделить из исследуемого пище-
вого продукта экстракцией диэтиловым эфиром, смесью диэтилового и петро-
лейного эфиров или перегонкой с водяным паром из кислых растворов. Дистил-
лят омыляют до л-оксибензойной кислоты и последнюю определяют спектрофо-
тометрически при 255 нм |4|. Для идентификации и разделения парабенов ис-
пользуются ВЭЖХ и ТСХ |5, 6, 71.
§5
Получение
Эфиры синтезируют этерификацией л-оксибензойной кислоты соответст-
вующим спиртом. Кислота получается по модифицированной реакции Кольбе
из фенолята калия и диоксида углерода под давлением при температуре 180—
250°С.
§6
Токсиколого-гигиеническая оценка
Острая токсичность. Острая токсичность эфиров л-оксибензойной кислоты
с низкомолекулярными спиртами тем ниже, чем длиннее спиртовый остаток |8|.
Для мышей LDW метилового и пропилового эфиров составляет около 8 г на 1 кг
массы тела |9, 10|, а их натриевых производных — соответственно 2 и 3,7 г на 1 кг
массы тела 110|. Для натриевых производных этилового и бутилового эфиров
LD,(I равна 2 и 0,95 г на 1 кг массы тела 110[. По другим данным, LDS() этилового
эфира равна 6 г на 1 кг массы тела, а для пропилового и бутилового эфиров —
соответственно 6,3 и 13,2 г 1111. Для кроликов LDW метилового эфира составляет
примерно 3 г на 1 кг массы тела 112|. В сочетании с другими консервантами ост-
рая токсичность эфиров л-оксибензойной кислоты не увеличивается |111.
F
22. Эфиры лиди-оксибснзойной кислоты 149
Субхроиическая токсичность. Скармливание кроликам 500 мг метил-я-ок-
сибензоата на 1 кг массы тела в день в течение 6 дней не приводило ни к каким
нарушениям; дозы в 3000 мг оказались токсичными. Кошки и собаки чувстви-
тельнее кроликов. Субхроническая токсичность пропилового эфира имеет тот
же порядок, что и метилового 1121. Приём 2 г метилового и пропилового эфиров
в день переносился человеком в течение месяца без нарушений 1131. У крыс при
субхроническом оральном применении 2,5% (самцы) и 5% (самки) изопропило-
вого эфира л-оксибензойной кислоты наблюдалось характерное уменьшение
массы тела 114].
Хроническая токсичность. При скармливании 0,9—1,2 г метилового, этило-
вого, пропилового и бутилового эфиров л-оксибензойной кислоты на 1 кг массы
тела в течение 2 лет не обнаружено никаких специфических нарушений. Гисто-
логических изменений почек, печени, лёгких и других внутренних органов не
наблюдалось. Скармливание 5,5—5,9 г на 1 кг массы тела в день приводит к за-
медлению развития молодняка крыс. Собаки переносят 1 г на 1 кг массы тела в
день в течение по крайней мере года 110].
После того как изучение пролиферации клеток преджелудка крыс привело к
положительным результатам, SCF установила временное значение ДСП 0—10 мг
на 1 кг массы тела 115|.
Метиловый эфир л-оксибензойной кислоты не проявляет канцерогенных
свойств |8|.
Реакции непереносимости. Эфиры л-оксибензойной кислоты, наряду с бен-
зойной кислотой и некоторыми азокрасителями, считают пищевой добавкой со
значительным сенсибилизирующим потенциалом. Как при оральном, так и при
локальном применении парабены могут вызывать реакции непереносимости, на-
пример крапивницу. Обычно речь идёт о псевдоаллергических реакциях, но есть
сведения и об истинных аллергиях 116|.
Биохимическое поведение. Эфиры n-оксибензойной кислоты быстро и пол-
ностью всасываются из желудочно-кишечного тракта и гидролизуются [10|; по-
этому накопления их в организме ожидать не следует. Выделение образующейся
при гидролизе л-оксибензойной кислоты происходит через мочу. У крыс в тече-
ние 24 часов около 40% выделяется в виде самой кислоты, а 23% в виде л-окси-
гиппуровой кислоты и её глюкуронового эфира. В крови обнаруживаются толь-
ко незначительные количества n-оксибензойной кислоты 117]. У кроликов выде-
ление протекает, в принципе, так же, отличается только соотношение метаболи-
тов 118—20]. Аналогично происходит выделение у кошек 112] и собак 1101. После
многодневного перорального приёма 2 г пропил-л-оксибензоата человеческая мо-
ча содержит примерно 14% введённого эфира в виде л-оксибензойной кислоты,
4% в виде л-оксигиппуровой кислоты, достаток (предположительно) в виде суль-
фопроизводного и-оксибензойной кислоты 113]. Метиловый, этиловый, пропи-
ловый и бутиловый эфиры л-оксибензойной кислоты оказывают спермицидное
действие; поэтому обсуждается их использование в контрацепции 121 ].
150 Консервирующие вещества
§7
Законодательные аспекты применения в пищевых продуктах
Метоловый, этиловый и //-пропиловый эфиры я-оксибензойной кислоты, а
также их натриевые производные разрешены в большинстве стран для консерви-
рования многих пищевых продуктов"1". Предельно допустимые количества (за
некоторыми исключениями) составляют от 0,1 до 0,2%.
§8
Действие на микроорганизмы
Общие критерии действия. Антимикробное действие парабенов растёт с уве-
личением длины алкильного радикала |22—24|. Так, по сравнению с фенолом
метиловый эфир проявляет в 3—4 раза более сильное антимикробное действие,
этиловый — в 5—8 раз, пропиловый — в 17—25 раз, бутиловый — в 30—40 раз и
бензиловый эфир — в 70—110 раз. Однако на этот эффект накладывается обрат-
ная зависимость растворимости эфиров в воде от длины алкильного радикала.
Подобно фенолу парабены из-за наличия гидроксильной группы могут взаимо-
действовать с белками, эмульгаторами и другими компонентами субстрата и тем
самым инактивироваться. По механизму действия парабены схожи с фенолом.
Кроме того, они разрушают клеточные мембраны, денатурируют внутриклеточ-
ные белки и вступают в реакции с коферментами.
По данным работ 125, 261, антимикробное действие парабенов основано на
замедлении усвоения таких важных питательных веществ, как глюкоза и про-
лин, и на разрушении комплексной структуры клеточной мембраны.
Эфиры л-оксибензойной кислоты не способны к электролитической диссо-
циации1"1 ; поэтому их антимикробное действие мало зависит от значения pH кон-
сервируемой среды1"2. В этом заключается преимущество эфиров перед органи-
ческими кислотами-консервантами.
Увеличения минимальной действующей концентрации под влиянием под-
пороговых концентраций у парабенов не происходит[27].
Спектр действия. Эфиры л-оксибензойной кислоты, подобно бензойной и
сорбиновой кислотам, принадлежат к консервантам с преимущественно фунги-
статическим действием. Правда, бактериостатическое действие эфиров благода-
ря фенольным группам несколько сильнее действия обеих названных кислот;
это справедливо в особенности для грамположительных видов. Из-за несколько
различного действия отдельных эфиров л-оксибензойной кислоты иногда их
применяют в смеси. Минимальные эффективные концентрации парабенов
по отношению к некоторым бактериям, дрожжам и плесневым грибам,
вызывающим порчу пищевых продуктов, приведены в табл. 21.
22. Эфиры иада-оксибснзойной кислоты
151
Таблица21. Тормозящее действие парабенов против микроорганизмов (28, 291
Вид микроорганизмов Минимальная эффективная концентрация, г/кг
Этиловый эфир Пропиловый эфир
Бактерии (при pH 5,5-7,0):
Pseudomonas spec. 0,5-1 0,4-1
Micrococcus spec. 0,6-1,1 0,1-1
Streptococcus faeca Us 1,3 0,4
Lactobac illus spec. 0,35-1,5 0,3-0,5
Betabacterium buchneri 4 4
Escherichia coll 0,12-1 0,3-1
Bacillus cercus 1 0,1-1
Salmonella spec. 6,3 0,33-0,7 '
Дрожжи (при pH 3,0-5,0):
Спорогенные дрожжи 0,5-1 0,15-0,6
Saccharomyces cere vista e 0,8 0,4
Аспорогенные дрожжи 0,2-0,8 0,2-0,4
Candida spec. 0,2-0,8 0,5
Torula lipolytica 0,6 0,3
Плесневые грибы (при pH 5-7):
Phycomycetae 0,2-1 0,2-1
Mucor racemosus 0,2-0,5 0,1-0,5
Rhizopus nigricans 0,2-0,5 0,2-0,5
Penicillium spec. 0,2-0,8 0,2-0,5
GUocladium roseum 0,6 0,3
Aspergillus spec. 0,2-0,5 0,1-0,5
Aspergillus niger 0,5-1 0,1-0,5
Aspergillus orycae 0,2-0,5 0,1-0,2
Fungi imperfecti 0,2-0,4 0,2-0,3
§9
Области применения
Применение эфиров л-оксибензойной кислоты в консервировании пище-
вых продуктов определяется тремя факторами: независимостью их действия от
величины pH, очень малой растворимостью в воде и органолептическими свой-
ствами.
Ранее вследствие своей эффективности в области высоких pH я-оксибен-
зойная кислота1"’ использовалась для защиты поверхности твёрдых сыров и твёр-
докопчёных колбас; в этих случаях нежелательные органолептические свойства
мешали мало или не мешали совсем. В настоящее время такое применение, а
также использование в консервировании кондитерских изделий и рыбопродук-
тов почти полностью прекращено.
Сложные эфиры я-оксибензойной кислоты с низкомолекулярными спирта-
ми в консервировании напитков не используются, но в США я-гептиловый эфир
я-оксибензойной кислоты в небольшом объёме применяется для консервирова-
ния пива. В концентрации 8—12 мг на 1 л (примерно равной растворимости) он
защищает готовое пиво от дрожжевого и бактериального перебраживания 1301.
Однако такая добавка уменьшает стабильность пены и устойчивость пива к охла-
152
Консервирующие вещества
ждению. Для внесения в пиво эфир предварительно растворяют в спирте или
пропил енгликоле.
§10
Прочие действия
Эфиры я-оксибензойной кислоты в консервирующих концентрациях могут
вызывать небольшое изменение вкуса пищевых продуктов.
В концентрации свыше 0,1% парабены оказывают локальное анестезирую-
щее и спазмолитическое действие.
Глава 23
орго-Фенилфенол
23
§1
Синонимы
IUPAC: бифенил-2-ол.
Русский: 2-фенилфенол, о-оксидифенил, о-гидроксибифенил.
Немецкий: 2-Phenylphenol, o-Oxydiphenyl, o-Hydroxybiphenyl, Orthophenyl-
phenol.
Английский: o-phenylphenol, o-hydroxybiphenyl.
Французский: o-phenylphenol.
Итальянский: o-fenilfenolo.
Испанский: o-fenilfenol.
§2
Историческая справка
Антимикробное действие производного фенола — о-фенил фенола — известно
уже давно. Впервые он был предложен в Англии в 30-х годах XX столетия в каче-
стве средства зашиты цитрусовых от плесени. В послевоенное время о-фенилфе-
нол, как и дифенил, начал применяться для защиты цитрусовых от порчи при
хранении.
§3
Свойства
о-Фенилфенол С]2Н|()О представляет собой пластинки бело- он
го или желтоватого цвета, плавящиеся при 57°С. В воде о-фенил- /^\
фенол растворим очень мало. Его натриевая соль, представляю- \О/ \<J/
шая собой белые хлопья или порошок, очень хорошо растворима
в воде. В 100 г воды при комнатной температуре растворяется около 120 г о-фе-
нилфенолята натрия.
§4
Аналитические сведения
Для качественного анализа о-фенилфенол выделяют из исследуемого пище-
вого продукта перегонкой с водяным паром. При взаимодействии с солью Проч-
154
Консервирующие вещества
ного голубого В он образует краситель, который можно обнаружить по максиму-
му поглощения в области 480 нм 111. Кроме того, о-фенилфенол можно опреде-
лить с помощью ВЭЖХ |2, 3|.
§5
Токсиколого-гигиеническая оценка
Для кошек LD,„ о-фенилфенола составляет 0,5 г, а для крыс — 3 г на 1 кг
массы тела |4, 5|. Дозы до 200 мг о-фенилфенола на 1 кг массы тела в день не
наносят заметного вреда здоровью крыс в течение 32 дней |4|.
Добавление 0,2% о-фенилфенола к корму крыс в течение 2 лет не вызывало
никаких изменений; прирост массы, внешний вид и поведение животных, их
смертность, а также гистологическое состояние различных внутренних органов
соответствовали контролю. Добавление 2% вызывало уменьшение прироста массы
и поражения почек. Собаки переносили 0,5 г о-фенилфенола на 1 кг массы тела
в день в течение одного года без специфических нарушений |5|.
В более поздней литературе обсуждается канцерогенность о-фенилфенола
16, 7|. Последующие работы |8, 9| подтверждают его канцерогенное действие на
мочевой пузырь, а также другие виды токсичного воздействия на печень, почки
и мочевой пузырь у различных видов подопытных животных. Канцерогенное дей-
ствие о-фенилфенола на человека не доказано. Тем не менее в Германии он от-
несён к веществам, для которых величину ПДК не устанавливают. Его рассмат-
ривают в качестве субстанции, изменяющей наследственность. Такое действие
имеет, по-видимому, не сам о-фенилфенол, а его метаболиты — фенилгидрохи-
нон и фенилбензохинон 110|. Соответствующие аддукты с ДНК можно обнару-
жить как in vitro, так и in vivo 1111.
Принимаемый перорально о-фенилфенол в организме крЫс частично пре-
вращается в 2,5-дигидроксибифенил, который, так же как и сам о-фенилфенол,
выводится с мочой в виде соединений с глюкуроновой или серной кислотами 112).
§6
Законодательные аспекты применения в пищевых продуктах
В большинстве стран о-фенилфенол разрешён для поверхностной обработ-
ки цитрусовых"14. Предельно допустимое остаточное количество составляет 12 мг
на 1 кг фруктов.
§7
Действие на микроорганизмы
В концентрации выше 5 мг/кг о-фенилфенол, так же как и дифенил, замед-
ляет синтез микроорганизмами каротина. Впрочем, о-фенилфенол по антимик-
робному действию аналогичен другим производным фенола. Одним из проявле-
ний его антимикробной активности является неспецифическое денатурирующее
23. opmo-Фснилфснол
155
действие на клеточные мембраны. Наряду с этим о-фенилфенол угнетает раз-
личные ферментные системы клетки, например НАД-оксидазу 112]. В связи с
наличием второго ароматического ядра о-фенилфенол обладает большей жиро-
растворимостью, чем фенол; этим и следует объяснять его большую эффектив-
ность1"5. Антимикробное действие о-фенилфенола (в противоположность кисло-
там-консервантам) возрастает с повышением pH. Диссоциированное соедине-
ние более эффективно, чем недиссоциированное""1 113].
Как большинство производных фенола, о-фенилфенол имеет широкий спектр
действия. Он проявляет и бактериостатические, и фунгистатические свойства.
Для консервирования пищевых продуктов практическое значение имеет только
его действие на плесневые грибы. Они угнетаются (в зависимости от вида) в об-
ласти pH от 6 до 8 при концентрации о-фенилфенола 10—50 мг/кг. Минимальная
действующая концентрация для бактерий вида.Escherichia coli — 115 мг/кг 1131.
Так же как и дифенил, о-фенилфенол может вызывать у плесневых грибов
резистентность (перекрёстная резистентность с дифенилом) 112].
§8
Области применения
Единственная область применения о-фенилфенола в пищевой промышлен-
ности — сохранение цитрусовых. Плоды при 30—35°С погружают на 30—60 се-
кунд в 0,5—2%-й водный раствор натриевой соли о-фенилфенола. Поскольку о-фе-
нилфенол эффективен в щелочной среде, величину pH раствора поддерживают
около 11,7. Кроме того, во избежание окрашивания кожуры в коричневый цвет к
раствору добавляют 1 % гексаметилентетрамина 112, 14|. Если вода жёсткая, в ра-
створ добавляют и небольшое количество этилендиаминтетраацетата натрия. По-
сле обработки плоды обмывают чистой водой. В результате на кожуре остаётся
небольшое количество о-фенилфенола (несколько миллиграммов на килограмм)
115|. Для обработки материала упаковки о-фенилфенол (в отличие от дифенила)
практически не используют. В последнее время увеличилось число сообщений
об устойчивости плесневых грибов, растущих на цитрусовых, к о-фенилфенолу.
Глава 24
Дифенил
24
§1
Синонимы
IUPAC: бифенил.
Русский: фенилбензол.
Немецкий: Diphenyl, Phenylbenzol.
Английский: diphenyl, biphenyl.
Французский: biphenyle, diphenyle.
Итальянский: difenile.
Испанский: difenilo.
§2
Историческая справка
Впервые дифенил был предложен в 30-е годы XX столетия для сохранения
цитрусовых, поскольку к этому времени его антимикробное действие было уже
известно. В послевоенное время он использовался для этих же целей в большом
объёме в США. Именно благодаря дифенилу стала возможной экономичная транс-
портировка цитрусовых на дальние расстояния, что позволило обеспечить этими
фруктами широкие слои населения. В настоящее время бифенил всё больше вы-
тесняется другими средствами, которые меньше влияют на органолептические
свойства цитрусовых.
§3
Свойства
Дифенил С6Н,С6Н5 представляет собой бесцветные пластин-
чатые кристаллы с запахом. Температура плавления составляет \С>/ \-У/
69~7 ГС. В воде дифенил растворим очень мало, но легко раство-
ряется в эфире и углеводородах. Давление его паров при темпе-
ратуре 20°С составляет 7,3 '10 1 мбар (0,72 Па), что соответствует концентрации
в воздухе 4,7 -10"2 мг/л (47 мг/м3) Ц|.
24. Дифенил
157
§4
Аналитические сведения
Для анализа дифенил выделяют из пищевого продукта перегонкой с водя-
ным паром. При исследовании цитрусовых для отделения дифенила от эфирных
масел, перешедших в дистиллят, последний пропускают через специальную на-
садку или дополнительно очищают на хроматографической колонке. Дифенил
можно определить по его максимуму поглощения при 250 нм или после нитрова-
ния в виде динитродифенила, который поглощает при 560 нм. Кроме того, воз-
можно использование для этой цели ИК-спектроскопии |2| и ВЭЖХ; последняя
позволяет одновременно определить и другие вещества, применяемые для по-
верхностной обработки |3|. При определении дифенила в кожуре цитрусовых
методами хроматомасс-спектрометрии или газовой хроматографии сфотоиони-
зационным детектором подготовка проб для анализа значительно упрощается |4].
§5
Получение
Дифенил содержится во фракции 230—270°С тяжёлых масел каменноуголь-
ной смолы, из которой может быть выделен в чистом виде. В промышленности
он получается термическим дегидрированием бензола.
§6
Токсиколого-гигиеническая оценка
Острая токсичность. Для крыс перорально LDW дифенила составляет 3,3 г
15], по другим данным — примерно 5 г на 1 кг массы тела 16|; для кроликов она
составляет 2,4 г |5|, для кошек — свыше 2,6 г на 1 кг массы тела |7|.
Субхроническая токсичность. Добавление 1% дифенила в корм крыс в течение
4 недель вызывает замедление развития, а также наносит вред печени и почкам |8|.
Дозы до 200 мг дифенила на 1 кг массы телав день в течение 4 недель |9| или 300 мгна
1 кг массы тела в день в течение 12 дней 1101 не наносет видимого ущерба здоровью.
В 90-дневном опыте установлено, что 0,5—1 % дифенила в корме крыс не наносит вре-
да здоровью животных 1111. В экспериментах с людьми выяснено, что приём в течение
13 недель по 35 мг дифенила в день не вызывает отрицательного воздействия 112].
Хроническая токсичность. Приём 50—100 мгдифенила вдень (0,25—0,5% от массы
корма) через 2 месяца приводил у крыс к дегенеративным изменениям печени и
почек; однако усиления этих изменений в последующем (вплоть до 13 месяцев) не
наблюдалось |6|. В опытах с четырьмя поколениями крыс, которые получали корм с
добавлением 0,01,0,1 и 1,0% дифенила, неблагоприятные эффекты (явное уменьше-
ние плодовитости и величины помёта, замедление роста) наблюдались только при
наибольшей концентрации консерванта |7|. У обезьян нарушения здоровья имели
место лишь при длительном использовании корма с 1% дифенила |7|.
Дифенил не канцерогенен |7|.
Величина ДСП для него установлена в 0-0,125 мг на 1 кг массы тела |7|.
158
Консервирующие вещества
Биохимическое поведение. В организме крыс, кроликов, собак и свиней ди-
фенил в процессе обмена веществ превращается в 4-гидроксидифенил и другие
гидроксидифенилы и(или) дифенилглюкуроновую кислоту. Большая часть ди-
фенила выделяется с мочой [7, 13—15|. Некоторые метаболиты дифенила могут
реагировать с сульфгидрильными группами белков, в частности глутатиона 116].
§7
Законодательные аспекты применения в пищевых продуктах
В большинстве стран дифенил разрешён для консервирования цитрусовых107.
Предельно допустимое остаточное количество составляет 70 мг на 1 кг плодов.
§8
Действие на микроорганизмы
Дифенил эффективен против большого числа микроорганизмов, так как он,
среди прочего, замедляет синтез каротина. Однако практическое значение имеет
только его действие против плесневых грибов. Из-за малой растворимости в во-
де определить минимальную действующую концентрацию дифенила непросто.
Известно, что уже при содержании 0,08 мг дифенила в 1 л воздуха10* угнетается
развитие Penicillium italicum и Penicillium digitatum, но на Phytophthora citrophthora,
Alternaria citri, Sclerotinia sclerotiorum и Trichoderma viride дифенил влияния не ока-
зывает 112|. Некоторые виды плесневых грибов могут приобретать устойчивость
к дифенилу, т.е. вначале в присутствии паров последнего их развитие прекраща-
ется, но через некоторое время возобновляется [12|.
§9
Области применения
Единственная область применения дифенила в пищевой промышлен-
ности — сохранение цитрусовых. В большинстве случаев им пропитывают упа-
ковочный материал (обёртку, прокладки, тарные и картонные вкладыши). Обычно
используется 1—5 г дифенила на 1 м2. Обладая высокой летучестью, дифенил в
виде паров проникает в пространство между материалом упаковки и плодами.
Часть его проникает при этом в кожуру плода 117|. Остаточные количества дифе-
нила в плодах редко превышают 50 мг/кг 1181.
§10
Прочие действия
Ранее, когда применяли более высокие дозы дифенила, кожура цитрусовых
нередко имела затхлый запах. При использовании такой кожуры в пищевом про-
изводстве приходилось некоторое время выжидать10’.
Глава 25
Дым (коптильный)
25
§1
Синонимы
Немецкий: Rauch, Raucherrauch.
Английский: smoke.
Французский: fumee.
Итальянский: fumo.
Испанский: humo.
§2
Историческая справка
Копчение с использованием дыма принадлежит к старейшим способам кон-
сервирования мяса. Оно было известно в доисторические времена и сохранило
своё значение до наших дней. В последние годы ассортимент копчёных продук-
тов особенно расширился.
§3
Способы копчения
Дым образуется при неполном сгорании любого органического материала.
Дым для копчения специально получают неполным сжиганием древесины пре-
имущественно мягких1"’ лиственных пород — бука, дуба, ольхи и клёна. Исполь-
зуется и более экзотическая древесина (гикори), а также ветки, щепки, опилки
или шишки хвойных пород (ели или сосны), часто с добавлением пряностей.
Древесина хвойных пород менее пригодна для целей копчения. В зависимости
от температуры дыма различают холодное, тёплое и горячее копчение 11,2]. Пред-
ставление о способах копчения даёт табл. 22.
Таблица 22. Способы копчения в технологии мясопродуктов
Копчение Темпера- тура, ‘С Продолжительность Продукция
Холодное Сырое (редко) Тёплое(редко) Горячее 18 (12-24) До 30 До 50 60-100 От нескольких дней до нескольких недель 2-3 дня 1—3 часа 20-60 минут Сырые колбасы, сырые копчености, сар- дельки длительной варки, варёные колбасы Быстросозрсвающис сырые колбасы Сардельки большого размера Сардельки, варёные колбасы
160
Консервирующие вещества
При холодном копчении охлаждённый до комнатной температуры дым в те-
чение недели (длительное копчение) или нескольких дней (ускоренное копче-
ние) контактирует с пищевым продуктом. Холодному копчению преимущест-
венно подвергают предварительно посоленные или подсушенные пищевые про-
дукты, например сырую колбасу. Тёплое копчение проводят при температурах
от 25 до 50°С, горячее — от 50 до 100°С; копчение, например сарделек, обычно
продолжается от 0,5 до 3 часов. В зависимости от содержания водяного пара раз-
личают сухой и сырой дым; в последнем случае говорят о сыром или парном
копчении. Чёрным называют копчение, в котором используется сильно коптя-
щий дым от хвойной древесины или смолы.
Если раньше мясо коптили дымом домашнего очага, то в настоящее время
разработаны специальные способы получения стандартизованного дыма |3—5|.
Для этого применяют дымогенераторы с электрическим или газовым нагревом
тлеющего дымообразователя, а также фрикционные генераторы, в которых дым
образуется в результате трения древесины (чаще гикори) о вращающиеся сталь-
ные диски. При сыром копчении дым образуется в результате обдува древесной
щепы воздухом, нагретым до 200—500°С, или перегретым паром. В случае элек-
тростатического копчения электрическое поле ускоряет осаждение частиц дыма
на коптящемся продукте [31.
Наряду с «классическим» копчением всё чаще используются так называемые
коптильные жидкости. Это очищенные конденсаты дыма, которые в значительной
степени освобождены от смол и нежелательных побочных продуктов (например,
ароматических углеводородов или нитрозаминов). Они служат скорее для арома-
тизации |5|, но в определённой мере оказывают и антимикробное действие |6|.
Коптильные жидкости могут использоваться в производстве копчёной рыбы |7|.
§4
Свойства
Дым для копчения представляет собой аэрозоль из капелек жидкости |3, 5|.
Он содержит также более крупные частицы (золы, смолы и копоти). В газовой
фазе имеются углеводороды, муравьиный |8| и другие альдегиды, низкомолеку-
лярные органические кислоты, фенолы, а также множество иных составляющих.
Общее число веществ, имеющихся в дыме, оценивается в 5—10 тысяч; иденти-
фицировано около 500 индивидуальных компонентов |2, 5, 9, 101. В консерви-
рующем действии дыма наибольшую роль играют фенолы 1111. В фенольной фрак-
ции дыма от твёрдой древесины преобладает сиреневый альдегид, мягкой — 4-ме-
тилгваякол и гваякол. Некоторые из этих соединений важны также для создания
аромата копчёных мясопродуктов |12|.
§5
Токсиколого-гигиеническая оценка
В настоящее время известны далеко не все составляющие коптильного ды-
ма; поэтому окончательную оценку копчению дать невозможно. Основным ток-
25. Дым (коптильный)
161
симным веществом дыма для копчения является хорошо известный канцероген
бенз(а)пирен (3,4-бензпирен). Наряду с ним в дыме встречаются и другие поли-
циклические соединения. Наивысшая допустимая концентрация составляет 1 мкг
на 1 кг съедобной части копчёного продукта. При правильном ведении процесса
этот норматив вполне реален |3, 4|. Считается, что при холодном копчении на
пищевом продукте осаждается меньше бензпирена, чем при горячем. Особенно
высокое содержание бензпирена наблюдается при чёрном копчении. Оптималь-
ными по качеству дыма и минимуму содержания полициклических углеводоро-
дов считаются температуры сжигания от 300 до 400°С |3|. Встречающиеся в дыме
альдегиды и фенолы мало сказываются на его токсичности.
При копчении солёных мясопродуктов могут образовываться небезопасные
для здоровья нитрозофенолы |13|. После одновременного скармливания крысам
коптильной жидкости, цистеина и нитритов, а также после скармливания копчё-
ных продуктов (бекона, сыра) в моче животных можно обнаружить продукт эн-
догенного нитрозирования — М-нитрозотиазолидин-4-карбоновую кислоту L 14|.
§6
Законодательные аспекты применения в пищевых продуктах
Во многих странах пищевое законодательство не ограничивает применение коп-
чения; дым, образующийся из древесины, веток, вереска и хвойных шишек, в том
числе с использованием пряностей, разрешён для копчения пищевых продуктов.
§7
Действие на микроорганизмы
Антимикробное действие коптильного дыма обусловлено имеющимися в нём
альдегидами, низкомолекулярными органическими кислотами и фенольными со-
единениями. Наряду с этим важно и высушивающее действие дыма — снижение
активности воды на поверхности копчёного продукта ограничивает рост микро-
организмов, особенно бактерий. При горячем копчении действует ещё один фак-
тор — нагрев. Антимикробное действие составляющих дыма возрастает с повыше-
нием температуры копчения 115|.
По сравнению с другими консервантами коптильный дым малоэффективен.
На копчёном продукте осаждаются сравнительно небольшие количества веществ,
имеющих антимикробные свойства. Кроме того, не все микроорганизмы угнета-
ются дымом для копчения. Так, например, плесневые грибы рода Aspergillus го-
раздо менее чувствительны, чем родов Cladosporium, Мисоги Penicillium 115, 16|.
§8
Области применения
Главная область применения копчения — мясопродукты, особенно сало, вет-
чина и колбасы всех сортов.
162
Консервирующие вещества
Копчение служит дополнительным способом консервирования определён-
ных сортов твёрдого сыра, особенно в южных странах.
Копчением увеличивают срок хранения сельди и многих других видов
рыб — скумбрии, трески, пикши, лосося, угря. Коптят рыбу и свежую, и предва-
рительно посоленную или подготовленную другим способом. Для рыбы исполь-
зуют как холодное, так и горячее копчение.
§9
Прочие действия
Коптильный дым не только увеличивает срок хранен ия пищевых продуктов,
но и придаёт им аппетитную окраску и аромат. Во многих случаях дым использу-
ется скорее по органолептическим причинам, чем с целью увеличения сохран-
ности, например в хрустящих хлебцах, отдельных сортах виски и пива. Полезное
побочное действие горячего копчения заключается также в доведении продукта
до готовности, особенно при копчении рыбы. Из-за наличия фенолов коптиль-
ный дым оказывает определённое антиокислительное действие |41. Оно может
быть обусловлено, в частности, присутствием сирингола и 4-метилсирингола 1171.
Глава 26
Тиабендазол
§1
Синонимы
IUPAC: 2-(тиазол-4-ил)-бензимидазол.
Русский: 2-(4-тиазолил)-бензимидазол.
Немецкий: Thiabendazol.
Английский: thiabendazole.
Французский: thiabendazole.
Итальянский: thiabendazolo.
Испанский: thiabendazol.
§2
Историческая справка
Тиабендазол длительное время используется в медицине как антигельминт-
ное средство. В 1964 году он был предложен в качестве фунгистатика в медици-
не, а позднее применялся для защиты растений. Оттуда тиабендазол перешёл в
пишевую промышленность, где находит некоторое применение в консервации
цитрусовых и бананов.
§3
Свойства
Тиабендазол C10H7N,S представляет собой белый кристал-
лический порошок с температурой плавления 304—ЗО5°С. Его
растворимость в воде зависит от кислотности среды; максималь-
ная составляет 3,84% при pH 2,2.
и
§4
Аналитические сведения
В бананах, цитрусовых и продуктах их переработки тиабендазол можно обна-
ружить газохроматографическим методом или ВЭЖХ с флуоресцентным детекто-
ром |1— 3|. Эти методы пригодны и для определения его в мясопродуктах |4, 5|.
Кроме того, существуют иммунологические методы обнаружения тиабендазола |6].
к
164 Консервирующие вещества
§5
Токсиколого-гигиеническая оценка
Для мышей, крыс и кроликов LD,0 тиабендазола составляет 3,1—3,8 г на 1 кг
массы тела. Крысы переносят 100—400 мг на 1 кг массы тела в течение 30 дней;
доза выше 800 мг на 1 кг массы тела вызывает замедление развития и увеличение
смертности. Добавление к корму 0,1% тиабендазола не влияет на развитие. Его
пероральное введение крысам в количестве 200 мг на 1 кг массы тела в течение
180 дней не оказывает влияния на развитие. Удвоенная доза лишь незначительно
замедляет рост животных, причём самцы несколько более восприимчивы, чем
самки. Собаки переносят 200 мг на 1 кг массы тела в течение 2 лет. Подтвержде-
ния специфических нарушений внутренних органов (кроме незначительных из-
менений процесса кроветворения) не получено |7|.
В работе |8] сообщалось о тератогенном действии тиабендазола на мышей
при скармливании экстремальных доз. Возможно, это результат влияния его ме-
таболитов — 4- и 5-гидрокситиабендазола и ацетилбензимидазола |9|. Кроме то-
го, тиабендазол оказывает на мышей нефротоксическое действие 110, 11|. Оно
особенно проявляется при недостатке глутатиона 112|. В опытах на крысах и кро-
ликах эти данные не подтвердились 1131.
Уровень приёма тиабендазола, при котором отсутствуют неблагоприятные
влияния на рост, развитие, продолжительность жизни и размножение крыс, со-
ставляет 10 мг на 1 кг массы тела в день перорально [14]. Для него установлено
ДСП 0—0,3 мг на 1 кг массы тела.
§6
Законодательные аспекты применения в пищевых продуктах
Тиабендазол (Е233) во многих странах разрешён для обработки цитрусовых
и бананов'". Допустимое остаточное содержание составляет 6 или 3 мг на 1 кг
фруктов.
§7
Действие на микроорганизмы
Тиабендазол принадлежит к консервантам, обладающим преимущественно
фунгистатическим действием (табл. 23) 115]. Особенно хорошо он подавляет плес-
невые грибы, прежде всего вида Penicillium italicum и вида Penicillium digitatum.
26. Тиабендазол
165
Таблица 23. Тормозящее действие тиабендазола против плсенсвых грибов
Название тестируемых грибов Минимальная эффективная концентрация, мг/кг
Altemaria solani <5
Aspergi llus fl a vus <5
Aspergillus fumigatus <10
Aspergillus niger 40
Aspergillus glaucus <5
Fusarium reticulatum 100
Monilia nigra 10
Mucor mucedo 100
Paecilomyces varioti 100
Penicillium oxalicum <5
Penicillium spinulosura <5
Rhigopus otyzae 100
§8
Области применения
Единственная область применения тиабендазола в пищевой технологии —
защита цитрусовых и бананов от плесени. К эмульсии или раствору, которыми
обрабатывают фрукты, его добавляют в количестве 0,1—0,45% 116, 17]. Часть ос-
таточного количества тиабендазола (5—12%) с кожуры цитрусовых переходит в
их мякоть, а часть (7—14%) попадает на руки. Остатки тиабендазола хорошо уда-
ляются как тёплой, так и холодной водой |18|.
Глава 27
27
Низин
§1
Синонимы
Немецкий: Nisin.
Английский: nisin.
Французский: nisine.
Итальянский: nisina.
Испанский: nisina.
§2
Историческая справка
В 1928 году было обнаружено, что некоторые бактерии рода Streptococcus об-
разуют вещества, которые угнетают другие молочнокислые бактерии. Уже тогда
обратили внимание на возможность использования таких пепсинустойчивых по-
липептидов в производстве сыра [1]. В 1944 году угнетающие вещества, продуци-
руемые бактериями рода Streptococcus, были описаны снова |2|, а в 50-х годах
началось промышленное производство низина. С тех пор это вещество находит
применение в консервировании пищевых продуктов, прежде всего для сохране-
ния плавленого сыра.
§3
Товарные формы
Низин используется исключительно в виде стандартизованных препаратов.
Например, английский продуктNisaplin* содержит 2,5% чистого низина и имеет
активность 1 • 106 международных единиц (м. е.) на 1 г.
§4
Свойства
Низин CI4,H2MN42O„S7 представляет собой антибиотик полипептидного ти-
па. Он состоит из четырёх схожих по строению структурных единиц, содержа-
щих от 29 до 34 аминокислот; 8 аминокислот являются редко встречающимися в
природе серосодержащими"213, 4|. Одна из них — лантионин; поэтому этот класс
веществ называют также лантибиотиками. Наряду с низином к ним принадле-
27. Низин
167
жит субтилин. Существует два подтипа низина — А и Z, которые различаются
аминокислотой в положении 27; у низина А — это аспарагиновая кислота, а у
низина Z — гистидин11’.
В 1 г воды при рН=2 растворяется 4,8 -106 м.е., а при рН=5 — 1,6 106 м.е.
чистого (40 -106 м.е./г) низина. Товарные продукты из-за наличия в них денату-
рированного молочного белка образуют в воде слегка мутные суспензии.
В сухом виде низин сохраняется годами. Стабильность растворов тем лучше,
чем ниже значение pH. При рН=2 низин, не теряя активности, выдерживает тем-
пературу 12ГС в течение 30 минут. При рН>4 в растворе он более или менее
быстро расщепляется, особенно при нагревании. Низин чувствителен к дейст-
вию протеолитических ферментов (трипсина, панкреатина), ферментов слюны
и пищеварительных ферментов, но устойчив к сычужным )5|.
§5
Аналитические сведения
Определение активности самого низина и количественное определение его
содержания в пищевых продуктах проводят с помощью диффузионного испыта-
ния на пластинке с бактериями вида Lactobacillus bulgaricus, L. helveticus var. prager,sis,
Micrococcusflavus |6| или вида Bacillusstearothermophilus |7| в качестве тестируемых
организмов [8|.
§6
Получение
Низин получают культивированием бактерий вида Streptococcus lactis [2].
В настоящее время для этого могут использоваться методы генной инжене-
рии"4 |9|.
§7
Токсиколого-гигиеническая оценка
Острая токсичность. Для крыс безопасные дозы низина составляют до
НО6 м. е. на 1 кг массы тела 110|.
Субхроническая токсичность. Крысы переносили без ущерба скармливание
сыра с содержанием до 3,33 10'’ м. е. низина на 1 кг массы тела в течение 12 не-
дель. Развитие и состояние внутренних органов соответствовало показателям в
контрольной группе |10|. Скармливание мышам 400 мг низина на 1 кг массы те-
ла в день в течение 8 недель в условиях стресса приводило к увеличению смерт-
ности 1111.
Хроническая токсичность. В течение 24 месяцев крысам давали корм с до-
бавкой 3,33 -Ю6 м. е. низина на 1 кг массы тела или соответствующее количество
гидролизованного (дезактивированного) низина, и это не вызвало никаких на-
рушений 110|. Скармливание 2 мг низина в сочетании с 40 мг сорбиновой кисло-
168
Консервирующие вещества
ты на 1 кг массы тела в день в течение двух лет не оказывало отрицательного
влияния на мышей и крыс ] 11]. SCF установила для низина ДСП 0—0,13 мг на
1 кг массы тела, в пересчёте на препарат с активностью в 40000 м.е.115 [ 121.
Биохимическое поведение. В пищеварительном тракте низин подвергается
быстрому ферментативному расщеплению. Токсическое действие на человека
крайне маловероятно, так как низин естественным образом содержится в молоке
и сыре, а низинобразующие стрептококки, как правило, встречаются в кишеч-
нике 113]. Правда, стабильность низина из-за преобладающего там значения pH
и других факторов очень мала.
§8
Законодательные аспекты применения в пищевых продуктах
Низин (Е234) разрешён главным образом для консервирования сыра (в том
числе плавленого)'16-
§9
Действие на микроорганизмы
Общие критерии действия. Действие низина направлено против цитоплазма-
тической мембраны. Она разрушается непосредственно после прорастания спор.
Поэтому действие низина против спор сильнее, чем против растущих клеток
(табл. 24) 114|, хотя низин и нельзя назвать прямым спороцидом. Две молекулы
низина, взаимодействуя с мембраной, образуют искусственный канал, через кото-
рый свободно проникают ионы 115|; в результате существенно меняется градиент
протонов. Низин, по-видимому, усиливает чувствительность бактериальных спор
к нагреву. Есть данные, указывающие, что действует лишь та часть низина, кото-
рая осталась в активной форме после нагревания; она и подавляет образование
бактериальных спор 15, 16|. Итак, низин не действует непосредственно на споры.
Его действие начинается не во время нагревания, а после него 117]. В сочетании с
хелатобразователями, например этилендиаминтетрауксусной кислотой или цит-
ратами, низин угнетает также бактерии рода Salmonella и вида Е. coli 118, 19).
Таблица 24. Тормозящее действие низина против бактерий 114]
Вид тестируемых бактерий Минимальная эффективная концентрация низина, м.е. на 1 мл агара, после прививки
спорами растущими клетками
Bacillus aterrimus 2 20
Bacillus coagulans 5 50
Bacillus suhtilis 5 100
Bacillus polymyxa 100 100
Bacillus- cercus 100 100
27. Низин
169
Активность препаратов низина выражается в международных единицах —
м. е. (International Units — IU или, ранее, Reading Units — RU). Один милли-
грамм чистого низина соответствует 40 -10’ м. е.
Антимикробное действие низина сильнее всего проявляется при pH 6,5—6,8;
правда, его стабильность в этой области pH очень мала. Низин расщепляется
ферментами слюны за время меньшее, чем время жизни одного поколения бак-
терий, т.е. микрофлора ротовой полости не может адаптироваться к низину.
Спектр действия. Низин имеет относительно узкий спектр действия. Он эф-
фективен исключительно против грамположительных бактерий (в том числе про-
тив многих молочнокислых), стрептококков, бацилл, клостридий и других ана-
эробных спорообразующих бактерий |6, 8, 20, 211. Для перечисленных бактерий
минимальная действующая концентрация (при испытании на питательной сре-
де) лежит в области 0,25—500 м. е./г (0,006—12 мг/кг) |20|. Дрожжи и плесневые
грибы низином не угнетаются; наоборот, многие из этих микроорганизмов бы-
стро разрушают низин. Listeria monocytogenes может приобретать устойчивость к
низину |22|.
§10
Области применения
Молочные продукты. Низин применяют против вспучивания твёрдого сыра,
но лишь в исключительных случаях. В плавленом сыре низин используется пре-
имущественно против анаэробных спорообразующих бактерий. В особенности
подавляются клостридии, вызывающие так называемую белую гниль или пле-
сень, а также маслянокислые бактерии. Используемая концентрация низина со-
ставляет 2—8 мг (т.е. около 100—300 10’ м. е.) на 1 кг сыра. Его вводят в процессе
плавления в виде низинсодержащей закваски или в виде порошка; допускается
также добавление низина к сырью.
Овощные продукты. Благодаря способности увеличивать чувствительность
определённых бактерий к нагреванию низин в небольших количествах исполь-
зуется как вспомогательное вещество при стерилизации. Добавление его к кон-
сервам позволяет смягчить условия стерилизации, например для томатопродук-
тов, суповых, овощных и грибных консервов )6, 20). Наиболее важна его эффек-
тивность против клостридий 12311|8.
Глава 28
28
Натамицин
§1
Синонимы
Русский: пимарицин.
Немецкий: Natamycin, Pimaricin.
Английский: pimaricin, natamycin, myprozine, A5283, tennecetin.
Французский: pimaricine.
Итальянский: pimaricina.
Испанский: pimaricina.
§2
Историческая справка
Натамицин впервые был выделен из культуральной жидкости Streptomyces
natalensis |1|. По месту происхождения пробы земли, в которой был найден дан-
ный штамм, — город Питермарицбург в провинции Натал (Южная Африка) —
антибиотик получил два названия: пимарицин и натамицин. Антибиотик, полу-
ченный в США немного позже из Streptomyces gilvosporus и Streptomyces
chattanoogensis, названный А5283, или теннецетин, и продававшийся под назва-
нием «мипроцин», оказался химически идентичен натамицину.
В основном натамицин применяется в медицине (как антибиотик) |2|. При-
мерно с 1960 года его пытаются использовать в качестве консерванта пищевых
продуктов. В настоящее время натамицин имеет некоторое значение для защиты
поверхности сыров и их оболочек.
§3
Товарные формы
Препараты натамицина выпускаются в виде порошков, мазей и вагиналь-
ных суппозиториев. В пищевой промышленности используются водные суспен-
зии и быстрорастворимые порошки под названиями Delvocid®, Delvopos®,
Delvocoat'"’ и Natamax®, а также 50%-я смесь с лактозой.
28. Натамицин
171
§4
Свойства
Натамицин C^H^NO,, представляет со-
бой белые иглы, плавящиеся с разложени-
ем при 180°С. Растворимость в воде и спир-
те составляет 0,005%. Растворы и суспензии
разлагаются под действием окислителей, тя-
жёлых металлов и света, но устойчивы к
кратковременному нагреванию |3|. При pH
от 4 до 7 натамицин стабилен. В сильноки-
слой среде происходит разрыв эфирных свя-
зей с образованием микозамина, апонатамицина и других, ещё не вполне из-
вестных веществ, которые частично димеризуются |41.
§5
Аналитические сведения
Натамицин обычно используется в малых концентрациях, и для него неиз-
вестны специфические реакции. По этим причинам следует учитывать большую
вероятность ошибки при анализе, что благоприятно для нелегального примене-
ния натамицина. Как полиен натамицин имеет максимумы поглощения при 295,
303 и 311 нм, которые могут быть использованы для его определения |5|. С этой
целью применяют и микробиологический метод, в котором используется спо-
собность натамицина подавлять колонии дрожжей вида Saccharomyces cerevisiae
на агаровых средах |3|. Натамицин можно обнаружить и с помощью тонкослой-
ного хроматографирования продуктов его расщепления 16, 7|.
§6
Получение
Натамицин получают культивированием Streptomyces natalensis.
§7
Токсиколого-гигиеническая оценка
Острая токсичность. Для мышей и крыс при пероральном введении LDSI)
натамицина равна 1,5 г, а для морских свинок — 0,45 г на 1 кг массы тела |5|.
По данным других авторов |8|, эта доза для крыс составляет 2,7—4,7 г, а для кро-
ликов — 1,4 г на 1 кг массы тела.
Субхроническая токсичность. При пероральном введении крысам до 0,05%
(45 мг на 1 кг массы тела) в течение 90 дней натамицин не причинил никакого
вреда |81. Более высокие дозы приводят к уменьшению прибавки массы, рвоте и
поносу, но не вызывают органических поражений 15, 81.
172
Консервирующие вещества
Хроническая токсичность. Крысы потребляли корм с содержанием 0,2% на-
тамицина в течение 2 лет без заметного вреда. Наблюдалась лишь меньшая, по
сравнению с контрольными животными, прибавка массы. У собак корм с 0,05%
натамицина тоже вызывал уменьшение прибавки массы; концентрация в 0,025%
токсического действия не оказывала |8|.
Поскольку натамицин относится к антибиотикам, а их применение в пище-
вых продуктах, в принципе, нежелательно, его использование должно ограничи-
ваться лишь зашитой поверхности сыров и колбас. Допустимое остаточное коли-
чество натамицина составляет 1 мг/дм2 при максимальной глубине проникнове-
ния 5 мм 19|. ДСП, установленное для него JECFA, составляет 0—0,3 мг на 1 кг
массы тела 110].
§8
Законодательные аспекты применения в пищевых продуктах
Натамицин (Е235) разрешён в ряде стран для защиты поверхности сыров
или сырных оболочек на искусственной основе119. Предельно допустимое коли-
чество его составляет 2 мг/дм2 в слое толщиной 5 мм. Некоторые страны отказа-
лись от использования натамицина в пище из-за его применения как антибиоти-
ка в медицине.
§9
Действие на микроорганизмы
Натамицин проявляет антимикробное действие против дрожжей рода Candida
как поверхностно-активное вещество, т.е. влияет на клеточные мембраны. Он
образует комплекс с эргостерином, благодаря чему увеличивается проницаемость
мембран 1111. Жизнедеятельность клетки может подавляться существенно мень-
шей концентрацией натамицина, чем её развитие12" |12|.
Натамицин действует только против дрожжей и плесневых грибов и не дей-
ствует против бактерий, вирусов и актиномицетов. Он особенно эффективен про-
тив грибков, поражающих кожу человека; этим и обусловлено его применение в
медицине. Большинство дрожжей и плесневых грибов подавляется натамици-
ном в концентрации 5-10 мг/кг 1131. Одни грибы со временем приобретают устой-
чивость к натамицину 114— 16[, другие — нет ] 17, 18f.
§10
Области применения
Молочные продукты. Натамицин сильно угнетает плесневые грибы и вслед-
ствие этого используется (в виде водной суспензии) для защиты поверхности сыра.
Подавляя рост грибов, натамицин тем самым ограничивает продуцирование ими
микотоксинов. 119, 20]. Однако речь не идёт о подавлении натамицином образо-
вания именно афлатоксинов или нейтрализации им самих афлатоксинов [19[.
28. Натамицин 173
Защищаемый сыр или окунают в 0,05—0,25%-ю суспензию натамицина, или
обмазывают ею. Эффективно добавление 0,05% натамицина к искусственным
дисперсиям, наносимым на некоторые сорта сыра [211.
Из-за малой растворимости в воде натамицин остаётся в основном на по-
верхности сыра, слабо проникая в его массу 119, 211. Интенсивность диффузии
зависит от сорта: в мягком сыре она выше, чем в твёрдом 1221. Во время созрева-
ния и хранения сыра натамицин разрушается 119, 211. Данные о степени проник-
новения в сыр и о скорости расщепления противоречивы. Это объясняется нена-
дёжностью способов качественного и количественного определения натамицина
при малых его концентрациях.
Мясопродукты. Образование плесени на сырых колбасах отчасти можно
предотвратить окунанием их в 0,1—0,25%-е растворы121 натамицина [231.
Глава 29
29
Лизоцим
§1
Синонимы
Русский: мурамидаза.
Немецкий: Lysozym.
Английский: lysozyme.
Французский: lysozyme.
Итальянский: lisozima.
Испанский: lisozima.
§2
Историческая справка
Уже десятки лет известно, что куриные яйца122, слюна и другие биологиче-
ские субстанции содержат бактериостатические вещества. Одно из таких веществ,
которое получило название лизоцим, представляет собой фермент 111. Интерес к
использованию бактериостатиков в консервировании пищевых продуктов, на-
пример для борьбы с вспучиванием твёрдых сыров, возник в 70-е годы, на волне
возрастающей неприязни к нитратам.
§3
Товарные формы
Лизоцим используется в виде стандартизованных порошкообразных пре-
паратов.
§4
Свойства
Лизоцим куриного яйца представляет собой полипептид, состоящий из 129
аминокислотных остатков и содержащий 4 дисульфидных связи. Для него опре-
делены первичная и четвертичная структуры. Молекулярная масса лизоцимов
различного происхождения — 13-23 тыс. В области pH 3-7 лизоцим стабилен и
выдерживает температуры до 50°С.
29. Лизоцим
175
§5
Аналитические сведения
Для определения количества и активности лизоцима в пищевых продуктах
используют реакцию лизиса Micrococcus luteus под его влиянием 12|.
§6
Получение
Лизоцим извлекают из белка куриного яйца. Его можно выделить также из
культуральных жидкостей некоторых бактерий [3, 4].
§7
Токсиколого-гигиеническая оценка
Лизоцим встречается во многих биологических тканях и жидкостях. Его ост-
рая токсичность не определена; крысы переносят 4 г на 1 кг массы тела. Много-
кратные внутривенные инъекции лизоцима в количестве 0,5 г на 1 кг массы тела
в течение 4 недель переносились кроликами лучше, чем инъекции яичного аль-
бумина |5|. Иммунологические исследования на морских свинках, кроликах и
человеке показали, что лизоцим имеет меньший сенсибилизирующий потенци-
ал, чем другие белки куриного яйца. Поэтому JECFA считает допустимым ис-
пользование лизоцима в пищевой технологии |61.
§8
Законодательные аспекты применения в пищевых продуктах
Лизоцим разрешён в различных странах в качестве добавки к твёрдому сы-
ру12’. В США лизоцим обладает статусом «добавки, традиционно считающейся
безопасной» (GRAS).
§9
Действие на микроорганизмы
Лизоцим (мурамидаза) гидролизует гликозидные связи муреина клеточной
мембраны между N-ацетилмураминовой кислотой и N-ацетилглюкозамином
гликополисахарида и вызываеттем самым лизис ряда грамположительных и грам-
отринательных бактерий. Возникающая у некоторых грамотрицательных бакте-
рий устойчивость по отношению к лизоциму связана, по-видимому, с присутст-
вием ионов кальция, которые стабилизируют липополисахаридный слой, так как
лишь после их удаления с помощью этилендиаминтетраацетата муреин стано-
вится доступен разрушающему действию лизоцима |7|. Перекись водорода, гли-
цин и аскорбиновая кислота усиливают действие лизоцима 18].
176
Консервирующие вещества
В концентрации 1 мкг/мл лизоцим не вызывает лизиса молочнокислых бак-
терий и микроорганизмов группы кишечной палочки. Против бактерий вида
Clostridium tyrobutyricum, которые часто ответственны за вспучивание твёрдого сыра,
лизоцим достаточно эффективен. При пониженном значении pH лизоцим эф-
фективно действует против Listeria monocytogenes |8|. При взаимодействии лизо-
цима с перилальдегидом получают соединения с высокой антибактериальной ак-
тивностью, например против бактерий вида Е. coli и вида 5. aureus [9|.
§10
Области применения
Молочные продукты. Спектр действия лизоцима позволяет использовать его
вместо нитратов для предотвращения вспучивания некоторых сортов сыра. К мо-
локу добавляют примерно 500 единиц на 1 мл |7|, что соответствует примерно
2,5 г кристаллического лизоцима на 100 л молока. Около 90% из этого количест-
ва лизоцима остаётся в сыре и считается действующим. Минимальная эффек-
тивная концентрация лизоцима в значительной степени зависит от бактериоло-
гического качества используемого молока.
Мясопродукты. По некоторым данным, добавление лизоцима к сырому фар-
шу увеличивает срок годности сарделек 110|. Правда, при концентрации пова-
ренной соли свыше 1,2% лизоцим теряет активность |8|.
Рыбопродукты. Так как лизоцим действует против бактерий рода Clostridium,
следует подумать об использовании его в копчёной рыбе для подавления роста
бактерий вида Clostridium botulinum и выработки ими токсинов.
Глава 30
30
Серебро
§1
Историческая справка
О том, что вода долго сохраняется в серебряных сосудах, упоминается ещё в
Коране 111. Повторное открытие антимикробных свойств серебра произошло во
времена Ганемана |2]. Этот факт забылся, и большинство считает автором от-
крытия швейцарского ботаника фон Негели. Он обнаружил, что вода, контакти-
ровавшая с очищенной поверхностью металла (прежде всего, серебра), губитель-
но действует на микроорганизмы, и назвал это явление «олигодинамическим эф-
фектом» |3|.
§2
Свойства, аналитические сведения
В качестве антимикробного средства используют препараты коллоидного се-
ребра и их растворы или серебро на подходящем носителе, например на диокси-
де титана.
Для обнаружения серебра раствор исследуемого напитка или его золы в сер-
ной кислоте встряхивают с раствором дитизона в четырёххлористом углероде.
Образующееся при наличии серебра жёлтое комплексное соединение можно опре-
делить фотометрически |4|.
§3
Токсиколого-гигиеническая оценка
Современные систематические исследования по токсикологии коллоидных
препаратов серебра отсутствуют. В более ранней литературе делается вывод, что
использование напитков, в которые добавлено серебро, можно считать безопас-
ным. Если даже последнее и накапливается в организме, опасность аргироза очень
мала из-за низкого содержания серебра в напитках, поступающих в продажу.
§4
Законодательные аспекты применения в пищевых продуктах
Серебро разрешено в некоторых странахдля обработки питьевой воды, дру-
гих напитков и уксуса в виде металла (Е174)124, его хлорида и сульфата, а также
178
Консервирующие вещества
хлораргентата натрия. Предельно допустимая остаточная концентрация после об-
работки составляет 0,08 мг/л.
§5
Действие на микроорганизмы
Ионы серебра влияют на процесс переноса энергии и электронов и угнетают
цитохромы b и d, а также различные флавопротеины |5|. Кроме того, описаны их
взаимодействия с клеточными мембранами, приводящие к нарушению поступ-
ления в клетку фосфатов |6|. Возможны также адсорбция ионов серебра на отри-
цательно заряженной поверхности бактерий и взаимодействие серебра с фер-
ментами.
Олигодинамическая активность серебра при pH 8,7 проявляется в 3—4 раза
сильнее, чем при pH 6,3. Бактерии вида Escherichia coli в присутствии серебра
погибают при 25°С быстрее, чем при 5°С |7|. Для более или менее надёжного
уничтожения микроорганизмов требуется выдержка в течение нескольких часов,
что едва ли возможно на практике (и совсем невозможно при фильтрации). Бел-
ки, замутнители и ионы кальция снижают эффективность обработки серебром
И, 7, 8|.
Серебро действует преимущественно против бактерий. Дрожжи и плесени
угнетаются в меньшей степени [7—9|.
§6
Области применения
Использование серебра имеет смысл исключительно для жидких продуктов.
Известно три основных способа его введения: добавление коллоидного серебра
(Katadynverfahren® — катадинирование, Micropur®), фильтрование через фильт-
рующие материалы, содержащие серебро (Sterilit®), и переведение серебра в на-
питок электролитическим путём (Elektrokatadynverfahren® — электрокатадини-
рование, Cumasina*).
Для обеззараживания питьевой воды концентрация серебра должна состав-
лять 0,025-0,1 мг/л. Для напитков, в которых имеются замутнители, требуется
более высокая концентрация. Поскольку серебро в более высоких концентраци-
ях небезопасно, применение его ограничено.
Глава 31
31
Борная кислота
§1
Товарные формы, свойства, аналитические сведения
Применение находят борная кислота Н,ВО, и бура Na2B4O7 10Н2О. Оба ве-
щества представляют собой белые блестящие пластинки или белый кристалли-
ческий порошок, умеренно растворимые в воде.
Под действием борной кислоты жёлтый цвет бумаги, пропитанной курку-
мой, меняется на оранжевый или красный (образуется розоцианин). Для коли-
чественного определения борной кислоты её экстрагируют из исследуемого пи-
щевого продукта сильно разбавленной соляной кислотой125, нейтрализуют по-
следнюю едким натром по фенолфталеину и добавляют глицерин. Борная ки-
слота с глицерином образует комплекс со свойствами сильной кислоты; его тит-
руют едким натром по фенолфталеину. Борную кислоту и её эфиры можно опре-
делить в вине с помощью ЯМР-спектроскопии на ядрах ’1В ] 11. Лучшим методом
определения борной кислоты считается анализ с использованием куркумы |2|.
§2
Токсиколого-гигиеническая оценка
Средняя летальная доза борной кислоты составляет 1—5 г на 1 кг массы тела
|3, 4|, для крыс она равна 5,14 г на 1 кг массы тела 15]. Острые отравления борной
кислотой и бурой нередки даже при наружном применении, прежде всего у детей.
Приём 0,5 г борной кислоты в течение 3—70 дней приводит к разного рода
расстройствам здоровья |4|. При исследовании репродуктивной токсичности уста-
новлено, что 0,4% борной кислоты в корме мышей и крыс оказывает токсическое
действие на почки и нервную систему самок. Заметно возросли частота уродств и
смертность новорождённых 16|. Кроме того, сообщалось об атрофии у подопыт-
ных животных яичек под действием борной кислоты |71. В качестве NOAEL126 в
отношении репродуктивной функции для крыс установлено значение 78 мг на
1 кг корма, для мышей — 248 мг на 1 кг корма |6, 81. В целом имеющиеся данные
по субхронической токсичности борной кислоты и буры явно недостаточны.
Борная кислота и бура схожи по биохимическому поведению. Оба вещества
быстро и полностью всасываются и медленно выводятся из организма |4, 9]. По-
этому при длительном поступлении, например с пищевыми продуктами, можно
ожидать накопления борной кислоты в организме. В повышенных дозах борная
кислота ухудшает усвоение пищи; вследствие этого она может использоваться в
медицине как средство для похудания.
ISO
Консервирующие вещества
SCF допускает использование борной кислоты только для консервирования
натуральной икры |7].
§3
Законодательные аспекты применения в пищевых продуктах
В настоящее время борная кислота и бура из-за своей токсичности почти не
применяются в качестве консервантов пищевых продуктов127. В некоторых стра-
нах они разрешены только для икры в концентрации не выше 4 г/кг. Из-за мало-
го потребления этого продукта опасность накопления борной кислоты в орга-
низме невелика.
§4
Действие на микроорганизмы
Борная кислота блокирует ферменты фосфатного обмена. Особенность борной
кислоты составляет очень низкая константа диссоциации (7,3 10:'), значительно
меньшая, чем у всех других кислот-консервантов |10|. Из-за этого она проявляет
антимикробное действие в нейтральной среде, так как совсем в ней не диссоцииро-
вана (карбоновые кислоты-консерванты в такой среде практически бездействуют).
Борная кислота как консервант нейтральных пищевых продуктов превосходит все
другие кислоты-консерванты. Правда, из-за сравнительно низкой эффективности
она должна использоваться в относительно высоких концентрациях.
Борная кислота эффективна главным образом против дрожжей. Плесневые
грибы угнетаются мало, бактерии — только частично (некоторые виды вообще
не угнетаются)! 10, 11].
§5
Области применения
Борная кислота долгое время широко применялась в Европе как консервант
для маргарина и масла. Её достоинство заключается в низком коэффициенте рас-
пределения (см. §7 гл.5) между жировой и водной фазами, в результате чего ос-
новная часть кислоты сосредоточивается в подверженной микробиологической
порче водной фазе. Борная кислота использовалась в концентрации 0,5—1%, что
заметно выше дозировок других консервантов.
До настоящего времени борную кислоту в концентрации не более 1% при-
меняют для консервирования жидкого сычужного фермента, так как из-за высо-
кого значения pH сохранить этот продукт с помощью других консервантов за-
труднительно. Борная кислота больше не используется как консервант для- ме-
ланжа, мясо-, рыбо- и морепродуктов. Иногда она применяется при консерви-
ровании икры в концентрации 0,3—0,5%.
Глава 32
32
Азид натрия
Азид натрия NaN, можно обнаружить после взаимодействия с динитробен-
зоилхлоридом с помощью ВЭЖХ 111,
Это сильный протоплазменный яд, и поэтому он непригоден в качестве пи-
щевого консерванта. Его острая оральная токсичность для крыс составляет 40—
60 мг на ! кг массы тела. Азид натрия снижает кровяное давление и оказывает
токсическое действие на центральную нервную систему |2|. Канцерогенное дей-
ствие его не описано, но известно мутагенное J3J. Азид натрия никогда ни в од-
ной стране не был разрешён для консервирования пищевых продуктов.
В концентрации 10—20 мг/кг азид натрия сильно угнетает дрожжи. До того
как были разрешены такие вещества, как сорбиновая кислота, его иногда неле-
гально использовали в качестве консерванта для молодого вина в концентрации
5—10 г на 1000 л и для вина с остаточным сахаром в концентрации 1—3 г на 1000 л.
Глава 33
33
Фосфаты
§1
Общие сведения
В пищевой промышленности находят применение многие свойства фосфа-
тов. Антимикробная активность некоторых из них (полифосфатов) известна уже
с 1864 года 111. Их токсикологические качества хорошо изучены |2|.
§2
Действие на микроорганизмы
Фосфаты связывают жизненно важные для микроорганизмов двухвалентные
катионы (особенно магний и кальций). Это приводит к замедлению деления клет-
ки и снижению устойчивости клеточной оболочки |3|. Их активность направле-
на преимущественно против бактерий вида Staphylococcus aureus, Streptococcus
faecalis, Bacillus subtilis и рода Clostridium |4—6|. Фосфаты снижают устойчивость
некоторых бактерий к нагреванию |7|.
§3
Области применения
Антимикробное действие фосфатов особенно важно в производстве плавле-
ного сыра. Добавляемые в количестве 2,5—3% фосфатные соли-плавители не толь-
ко эмульгируют сыр, но и улучшают его сохранность |5|.
Для снижения обсеменённости мяса птицы бактериями рода Salmonella пред-
ложено обрабатывать его водными растворами тринатрийфосфата (AvGard*) пу-
тём погружения и распыления |8, 9|.
Глава 34
Перекись водорода
§1
Товарные формы, свойства, аналитические сведения
Перекись водорода Н ,О, поступает в продажу главным образом в виде 3%-го
или 30%-го водного раствора.
Молоко, содержащее перекись водорода, даёт со свежеприготовленным
водным раствором л-фенилендиамина коричневое окрашивание (пероксидазная
реакция).
§2
Токсиколого-гигиеническая оценка
Перекись водорода и её 30%-й раствор действуют разъедающе. Однако это
не создаёт токсикологических проблем, так как в присутствии органического ма-
териала она быстро разлагается на воду и кислород.
§3
Законодательные аспекты применения в пищевых продуктах
В настоящее время в большинстве стран перекись водорода запрещена в ка-
честве пищевой добавки, так как она, будучи окислителем, может взаимодейст-
вовать с компонентами пищевых продуктов (например, витаминами) или оказы-
вать нежелательное отбеливающее действие. В Германии перекись водорода раз-
решена только для отбеливания крахмала, желатина и рыбных маринадов (роль-
мопсов)128. • :
§4
Действие на микроорганизмы
Перекись водорода следует отнести скорее к дезинфицирующим средствам,
чем к консервантам, так как она (при использовании в достаточной концентра-
ции) быстро уничтожает микроорганизмы. Она не используется для оказания дли-
тельного воздействия, поскольку самопроизвольно распадается в консервируе-
мом продукте или подвергается принудительному разложению, послетого как её
роль выполнена.
184
Консервирующие вещества
Антимикробное действие перекиси водорода объясняется главным образом
её окислительными свойствами. В клетках микроорганизмов она вызывает раз-
ного вида необратимые изменения. Ферменты, липиды и компоненты мембран
неспецифично окисляются и тем самым инактивируются.
Перекись водорода эффективна главным образом против бактерий; для уни-
чтожения дрожжей и плесневых грибов требуются более высокие дозы. В пита-
тельных растворах перекись водорода действует уже при концентрации 50—
200 мг/кг [11. Бактерии рода Clostridium и вида Staphilococcus aureus более чувстви-
тельны, чем спорообразующие аэробы и грамотрицательные бактерии |2, 3[. Уста-
новлено, что при 50°С в присутствии перекиси водорода бактерии погибают яв-
но быстрее, чем в её отсутствие |2|. Перекись водорода повышает чувствитель-
ность спор к нагреванию (4|.
§5
Области применения
В прежние времена, когда способы транспортировки и пастеризации были
развиты недостаточно, перекись водорода использовали для обеззараживания сы-
рого молока. Её добавляли к сырому молоку в количестве 0,02—0,05% и через
определённое время избыток разлагали нагреванием. В результате уничтожались
как болезнетворные микробы, так и бактерии, вызывающие порчу |5|. Этот спо-
соб был известен под названием «буддизация» (по имени автора). В настоящее
время срок хранения молока продлевают охлаждением в сочетании с добавлени-
ем сорбата калия |6|.
В сырое молоко, идущее на приготовление сыра, для уменьшения обсеме-
нённости добавляют 0,04-0,08% перекиси водорода. После выдержки в течение
30 минут при 50-53°С молоко охлаждают, а избыток перекиси разрушают 30-ми-
нутным воздействием каталазы |7|. Этот приём (под названием перекисно-ката-
лазный способ) особенно популярен в США.
В тропических странах, где гигиенические условия неблагоприятны, обра-
ботка перекисью водорода часто является единственным способом хотя бы на
некоторое время защитить молоко от порчи |8|. Здесь недостатки перекиси водо-
рода (разрушение витаминов) теряют своё значение в сравнении с достоинства-
ми. Для успеха обработки молоко должно иметь низкую обсеменённость; поэто-
му его предварительно пастеризуют |9|.
Добавление перекиси водорода в рыбные маринады предотвращает появле-
ние нежелательных бактериальных изменений и запахов. Побочное отбеливаю-
щее действие даже желательно, особенно для сельди.
Перекись водорода используют для стерилизации упаковочных материалов
под напитки типа пива и молока по технологии Тетрапак (Tetrapack-System®), в
том числе и в газовой фазе [10]. Избыточную перекись разлагают нагреванием.
Глава 35
Фториды
Фториды натрия и калия угнетают бактерии, дрожжи и плесневые грибы.
В прежние годы они иногда нелегально использовались для консервирования
маргарина, молока, масла, меланжа, мяса, пива, вина и других пищевых продук-
тов. Фториды токсичны в дозах, необходимых для консервирования продуктов
питания. Для крыс их LD,0 составляет 0,18 г на 1 кг массы тела |1]. Фториды
угнетают различные ферментные системы и нарушают обмен веществ в костях и
зубах.
Глава 36
Броматы
Бромат калия КВгО, увеличивает окислительно-восстановительный потен-
циал и тем самым оказывает антимикробное (в особенности антибактериальное)
действие. Раньше его (под названием Anti but " ) в концентрации 0,01—0,04% ис-
пользовали для предотвращения вспучивания плавленых сыров, вызываемого спо-
рообразующими анаэробными маслянокислыми бактериями. Из-за токсичности
бромат калия неприемлем как добавка в пищевые продукты 11 |1м.
Глава 37
37
Окись этилена
§1
Товарные формы, свойства, аналитические сведения
Окись этилена — химически активный газ со слабым сладковатым запахом.
Применяется в виде смесей с негорючими газами, например диоксидом углерода
(Cartox*, T-Gas* и др.) или фторуглеродами.
Для определения остатков окиси этилена в обработанных ею пищевых про-
дуктах исследуемый материал нагревают с ксилолом. Выделяющуюся окись эти-
лена можно определить газохроматографически |1|.
§2
Токсиколого-гигиеническая оценка
Для крыс и морских свинок LD50 окиси этилена при пероральном введении
составляет примерно 300 мг на 1 кг массы тела |2, 31. У человека окись этилена в
концентрации 100—200 мг на 1 л воздуха вызывает мгновенную смерть.
Морские свинки, кролики и обезьяны переносят без последствий околоОД мг
окиси этилена в 1 л воздуха по 7 часов 5 дней в неделю в течение многих месяцев.
В тех же условиях мыши и крысы переносят без заметного вреда для здоровья
вдвое меньшую концентрацию |4|. По другим данным, лабораторные животные
длительное время переносят 2 мг окиси этилена в 1 л воздуха |5|.
В литературе имеются сообщения о мутагенном действии окиси этилена
16, 7|.
В пищевых продуктах, обработанных окисью этилена, токсикологическую
опасность представляет скорее не она, а продукты её превращения. Основной из
них — этиленхлоргидрин; законченные исследования токсических свойств
последнего отсутствуют.
§3
Законодательные аспекты применения в пищевых продуктах
Окись этилена разрешена в ряде стран для окуривания некоторых безвод-
ных пищевых продуктов.
188 Консервирующие вещества
§4
Действие на микроорганизмы
Окись этилена следует считать скорее дезинфицирующим средством, чем кон-
сервантом, так как она (при достаточной концентрации) быстро уничтожает мик-
роорганизмы. Ранее полагали, что действие окиси этилена обусловлено этилен-
гликолем, образующимся при её гидролизе. Теперь ясно, что это не так, поскольку
сам этиленгликоль гораздо менее эффективен, чем окись этилена. Последняя
алкилирует белки и тем самым служит универсальным ядом для протоплазмы.
Кроме того, окись этилена реагирует с сульфгидрильными и другими активными
группами ферментных систем |4, 8|.
Эффективность окиси этилена зависит от её концентрации в газовой фазе,
времени воздействия, температуры, давления и относительной влажности возду-
ха. Удвоение концентрации окиси этилена снижает время, необходимое для унич-
тожения микроорганизмов, в два раза. Чем выше температура, тем быстрее на-
ступает действие |9, 10|. Оптимум находится при 60°С1м. Увеличение давления
ускоряет действие окиси этилена [111. В отличие от формальдегида окись этиле-
на более эффективна при низкой относительной влажности воздуха, чем при вы-
сокой. Однако некоторая минимальная влажность должна быть |2, 12|.
Вследствие универсальной реакционной способности окиси этилена по от-
ношению к белкам протоплазмы микроорганизмов спектр её действия весьма
широк. Против бактерий окись этилена действует сильнее, чем против дрожжей
и плесеней (особенно рода Alternaria) 1131. Из бактерий наименее чувствительны
Bacillussubtilis, клостридии и стафилококки |91. Против грамположительных бак-
терий окись этилена действует несколько слабее, чем против грамотрицательных.
§5
Области применения
Первоначально окись этилена использовалась в качестве средства защиты
запасов продовольствия от грызунов и насекомых. Применение её для обеззара-
живания пищевых продуктов началось в 1933 году 114|.
Из-за токсичности для человека, горючести и взрывоопасности окись эти-
лена используется только в закрытых установках. Обрабатываемые предметы или
пищевые продукты приводят в контакт с окисью этилена в особых стерилизаци-
онных камерах (под вакуумом, при нормальном или небольшом избыточном дав-
лении) 12, 15|. Процессом управляют, изменяя главным образом время экспози-
ции и температуру.
Во избежание взаимодействия окиси этилена с компонентами пищи ею об-
рабатывают только продукты с низким содержанием воды 1161, в основном пря-
ности. Последние можно обрабатывать даже в упакованном виде, так как обыч-
ные упаковочные материалы проницаемы для окиси этилена. Время экспозиции
составляет, как правило, несколько часов, концентрация около 500 мл на 1 м1
газовой фазы.
1
37. Окись этилена 189
Окись этилена применяется для стерилизации медицинских приборов и в
качестве средства борьбы с вредителями, например зерна, но такое использова-
ние не относится к теме данной книги.
§6
Прочие действия
Окись этилена может реагировать со многими компонентами продуктов пи-
тания, образуя нежелательные по органолептическим свойствам или другим при-
чинам вещества. С водой окись этилена образует этиленгликоль, со спиртами —
этиленгликолевые эфиры, с сульфгидрильными компонентами — тиоэфиры 112,
15, 17|.
Глава 38
38
Пропиленгликоль
Пропиленгликоль представляет собой жидкость, смешивающуюся с водой
во всех отношениях. Он проявляет некоторое консервирующее действие. Для
1,2-пропиленгликоля LD,,, составляет около 20-30 г на 1 кг массы тела. Канце-
рогенных свойств он не проявляет. Часть его выводится из организма в неизмен-
ном виде, другая часть окисляется в молочную кислоту 111.
Антимикробное действие 1,2-пропиленгликоля (подобно действию поварен-
ной соли или сахара) связано с понижением активности воды в его присутствии.
Поэтому он применяется в относительно высокой концентрации (выше 1%). Об-
ласть его использования — пищевые продукты со средней влажностью [2]131.
Глава 39
39
Г ексаметилентетрамин
§1
Историческая справка
Первоначально гексаметилентетрамин использовался в медицине. Позднее
его антисептические свойства стали использовать и в пищевой сфере, полагая,
что вещество, успешно применяемое в медицине, не может быть вредным в пи-
щевых продуктах. В начале XX века формальдегид (действующее начало гекса-
метилентетрамина) использовался в смеси с перекисью водорода для консерви-
рования молока. Примерно в то же время началось применение самого гексаме-
тилентетрамина для консервирования пищевых продуктов, главным образом жи-
вотного происхождения. Как консервант рыбных маринадов гексаметилентетра-
мин стал использоваться в 20-е годы. В настоящее время из-за токсичности он
запрещён в большинстве стран.
§2
Свойства, аналитические сведения
Гексаметилентетрамин представляет собой белый кристал-
лический порошок со слабым сладковатым, затем горьковатым
вкусом. В горячей воде гексаметилентетрамин растворим ху-
же, чем в холодной. Водные растворы имеют слабощелочную
реакцию.
Для обнаружения гексаметилентетрамина исследуемый пи-
щевой продукт обрабатывают кислотой. При этом образуется
формальдегид, который с хромотроповой кислотой (1,8-диоксинафталин-3,6-ди-
сульфокислотой) даёт фиолетовое окрашивание. Эта реакция может быть исполь-
зована и для количественного определения гексаметилентетрамина |11.
§3
Токсиколого-гигиеническая оценка
В малых дозах гексаметилентетрамин считается нетоксичным: человек
переносит несколько граммов ежедневно без вреда для здоровья. Летальная Доза
для него не известна 12|.
При скармливании крысам-альбиносам по 0,4 г гексаметилентетрамина в
день в течение 90 дней не наблюдалось ничего примечательного, кроме сильного
и устойчивого окрашивания шерсти в жёлтый цвет |3|. Приём беременными со-
192
Консервирующие вещества
баками 0,06—0,125% гексаметилентетрамина с кормом в течение 52 дней не по-
влиял ни на число, ни на массу, ни на состояние здоровья новорождённых щен-
ков. В опытах с более высокими дозами в первые недели наблюдали замедление
роста. Никаких других нарушений в последующие два года наблюдений не заре-
гистрировано. Отсюда делается вывод о том, что гексаметилентетрамин не тера-
тогенен |4|.
Гексаметилентетрамин (наряду с формальдегидом) оказывает мутагенное дей-
ствие на бактерии [5| и личинки дрозофилл |6|. Значение этого явления для че-
ловека оценивается по-разному |2, 7, 8|.
Добавка 1% гексаметилентетрамина к питьевой воде для мышей и крыс
в течение 60 недель также переносилась безразлично. Гексаметилентетрамин
не канцерогенен |9|. Такой же результат был получен при добавлении 0,16%
гексаметилентетрамина в корм крысам |8|.
Из-за хорошей растворимости в воде гексаметилентетрамин быстро всасы-
вается и выводится с мочой. Часть его взаимодействует с кислотой желудочного
сока, превращаясь в формальдегид 1101, который тоже быстро всасывается. В крови
формальдегид немедленно взаимодействует с эритроцитами, в которых фермен-
тативным путём быстро окисляется до муравьиной кислоты 1111.
Образующийся из гексаметилентетрамина формальдегид может взаимодей-
ствовать с аминокислотами и белками. Образующиеся формилированные белки
в той или иной степени усваиваются организмом 12, 12].
§4
Законодательные аспекты применения в пищевых продуктах
Ранее в некоторых странах (прежде всего Северной и Центральной Европы)
гексаметилентетрамин был разрешён для консервирования рыбопродуктов112.
В настоящее время он в качестве пищевого консерванта не используется из-
за токсичности формальдегида, образующегося при его разложении. В некото-
рых странах ещё разрешено применять его для консервирования отдельных сор-
тов сыра.
§5
Действие на микроорганизмы
Сам гексаметилентетрамин не проявляет антимикробную активность; дей-
ствует формальдегид, образующийся из гексаметилентетрамина в кислой среде.
Чем выше кислотность среды, тем больше степень гидролитического расщепле-
ния и тем сильнее антимикробное действие.
Действие формальдегида (и тем самым гексаметилентетрамина) основано на
реакциях с белками в клетках микроорганизмов. Подобные реакции приводят к
инактивации ферментов, например дегидрогеназ 110]. Белки, содержащиеся в пи-
щевых продуктах, могут отрицательно влиять на антимикробное действие гекса-
метилентетрамина. По этой причине на практике его приходится применять в
39. Гексаметилентетрамин
193
более высокой концентрации, чем можно было ожидать по результатам испыта-
ний на питательных средах.
Из-за неспецифического взаимодействия формальдегида с белками антимик-
робный эффект гексаметилентетрамина (при условии подходящего значения pH)
почти универсален |13]. Правда, бактерии угнетаются при более низких концен-
трациях, чем дрожжи 114|. Слабее всего гексаметилентетрамин действует против
плесневых грибов [14].
§6
Области применения
Добавление гексаметилентетрамина к молоку при производстве твёрдого сыра
в некоторых случаях снижает бактериальное вспучивание (способ пока приме-
няется только для отдельных сортов итальянских твёрдых сыров). Содержание
формальдегида в сыре составляет 2—25 мг/кг.
Гексаметилентетрамин (вследствие эффективности формальдегида против
молочнокислых и других, вызывающих порчу или патогенных, бактерий) долгое
время применялся для консервирования рыбных маринадов, анчоусов, икры, про-
дуктов из моллюсков, креветок и ракообразных. Обычно он использовался в со-
четании с бензойной и(или) сорбиновой кислотами. Такие смеси подавляют рост
дрожжей и плесневых грибов, против которых гексаметилентетрамин в отдель-
ности не действует. В рыбных маринадах он применялся в концентрации 0,02-
0,03% (в зависимости от pH).
В настоящее время гексаметилентетрамин больше не используется в консер-
вировании рыбопродуктов, как из-за токсичности формальдегида, так и по тех-
нологическим причинам. Его заменили термическая пастеризация и хранение
при низких температурах.
Глава 40
40
Хлоруксусная кислота
В длительном эксперименте на крысах с использованием корма, содержа-
щего 0,1% хлоруксусной кислоты, установлены нарушения развития, но канце-
рогенного действия не обнаружено 111. Хлоруксусная кислота не разрешена для
консервирования пищевых продуктов ни в одной стране. Её действие слабо и
направлено в большей степени против дрожжей, чем против бактерий и плесне-
вых грибов. В небольших масштабах хлоруксусная кислота и её натриевая соль
иногда использовались в некоторых странах для стабилизации вин.
Глава 41
41
Бромуксусная кислота
Бромуксусная кислота, а также её эфиры с этанолом, бензиловым спиртом и
гликолями с 40-х годов XX века предлагались под разными названиями для кон-
сервирования напитков (особенно пива, вина и соков). Однако они не были раз-
решены и не разрешены сейчас ни в одной стране. Долгое время они были ти-
пичными подпольными консервантами, так как обладают сильным антимикроб-
ным действием и из-за нестабильности трудно обнаруживаются в продукте. Уже
в концентрации 30—50 мг/л бромуксусная кислота эффективна против перебра-
живания вина. В середине 80-х годов в Баварии было зарегистрировано неле-
гальное использование хлоруксусной1” кислоты в качестве добавки в пиво.
Для мышей LD5(i бромуксусной кислоты составляет 100 мг, а для крыс — 50 мг
на 1 кг массы тела ) 1 ]. Скармливание её свиньям в количестве 10—54 мг на 1 кг
массы тела в течение 28—105 дней вызывает сильный токсический эффект. С дру-
гой стороны 2—6 мг на 1 кг массы тела в течение 350—450 дней не вызвало нару-
шений здоровья и неотразилось на росте и плодовитости; кумулятивный эффект
не наблюдался 12]. Канцерогенных свойств у бромуксусной кислоты не обнару-
жено |2|.
Антимикробное действие бромуксусной кислоты и её производных основа-
но на реакции с сульфгидрильными группами ферментов. Возможно, кроме того,
замедляются процессы клеточного окисления и восстановления. Действие на-
правлено преимущественно против дрожжей. Бактерии и плесневые грибы угне-
таются при более высоких дозах.
Глава 42
Молочная кислота
§1
Общие сведения
Молочная кислота представляет собой бесцветную или слегка желтоватую
жидкость, смешивающуюся с водой во всех отношениях. При пероральном вве-
дении её LDS(I для крыс составляет 3,7 г, а для морских свинок — 1,8 г на 1 кг
массы тела 111. Мутагенных свойств молочная кислота не проявляет [21. Поскольку
она содержится в пищевых продуктах естественного происхождения и образует-
ся при брожении, вряд ли её применение в пище следует ограничивать законода-
тельно.
§2
Действие на микроорганизмы
Антимикробное действие молочной кислоты сравнительно слабое. Консер-
вирующего эффекта можно ожидать лишь при концентрации свыше 0,5%. Дей-
ствие направлено главным образом против бактерий, особенно анаэробных. При
этом важным действующим фактором оказывается снижение pH из-за диссоциа-
ции молочной кислоты. Многие дрожжи и плесневые грибы могут включать мо-
лочную кислоту в свой обмен веществ. Поэтому для защиты пищевых продуктов
от порчи этими микроорганизмами молочную кислоту часто используют в соче-
тании с другими консервантами, например бензойной и(или) сорбиновой ки-
слотами |3], а также с натамицином.
§3
Области применения
Молочная кислота принадлежит к самым старым из известных консерван-
тов. Столетиями её использовали в производстве квашеной капусты, солёных огур-
цов, бобовых, оливок и других квашеных овощей. На Востоке с помощью молоч-
нокислого брожения сохраняют и другие пищевые продукты, в том числе и жи-
вотного происхождения. Сквашивание молока и сливок, а также некоторые ста-
дии производства сыр'а — тоже примеры использования молочной кислоты в ка-
честве консерванта. Молочная кислота образуется в результате брожения из уг-
леводов, содержащихся в этих продуктах. При этом, вследствие многочисленных
42. Молочная кислота
197
биохимических процессов, образуется совершенно новый пищевой продукт; по-
этому данный вид консервирования (как и сбраживание соков в алкогольные
напитки) можно считать химическим только условно. Недавно было предложе-
но использовать молочную кислоту и её соли как консерванты для мясных и кол-
басных изделий |4, 5|.
Глава 43
43
Эфиры глицерина и жирных кислот
со средней длиной цепи
В ЗО-е годы проводились обширные исследования антимикробных свойств
жирных кислот со средней длиной цепи |11. Возможно, эти работы послужили
толчком к открытию в 1939 году антимикробного действия сорбиновой кислоты.
Позднее обнаружилось, что глицериды таких кислот, прежде всего моноглице-
риды, наряду с высокой поверхностной активностью обладают существенно боль-
шим антимикробным действием, чем сами кислоты. Наивысшая активность по-
добного рода выявилась у лауринового эфира (монолаурата глицерина) |2|.
Подобные эфиры имеют очень широкий спектр действия (бактерии, дрож-
жи, плесневые грибы). В США их смеси с сорбиновой кислотой испытывались в
качестве консервантов пищевых продуктов |3|. Оказалось, что многие из них име-
ют органолептические и технологические недостатки, и потому они до сих пор
не получили большого распространения в консервировании. В США монолаурат
глицерина имеет статус GRAS в качестве пищевого эмульгатора, но разрешение
на применение его в качестве консерванта отсутствует (в ЕС тоже). Основной
областью использования является косметика в тех случаях, когда требуются и
эмульгирующие и консервируюшие свойства.
Глава 44
Этилендиаминтетрауксусная кислота
Этилендиаминтетрауксусная кислота в виде натриевой и кальциевой со-
лей (ЭДТА) проявляет свойства синергиста антиоксидантов и консервантов,
что объясняется её способностью к комплексообразованию. Перорально ЭДТА
малотоксичны даже в высоких дозах 111. Однако они могут связывать в ком-
плексы жизненно необходимые для организма двух- и поливалентные катио-
ны металлов и тем самым изымать их из обмена веществ.
В концентрации свыше 300 мг/кг этилендиаминтетрауксусная кислота за-
медляет спорообразование 121. Действие её чисто антибактериальное. На дрож-
жи и плесени она не оказывает никакого влияния |31. Образуя комплексы с
ионами двухвалентных металлов, этилендиаминтетрауксусная кислота уве-
личивает проницаемость клеточных мембран для консервантов, чем и объяс-
няется её синергическое действие.
В некоторых странах этилендиаминтетрауксусная кислота в небольшом
количестве используется для консервирования креветок. Охлаждённое рыб-
ное филе обрабатывают окунанием в раствор Na-ЭДТА, что предотвращает
образование триметиламина |4].
Глава 45
45
Аллилгорчичное масло
Аллилизотиоцианат СН2=СН—СН2—N=C=S представляет собой мало рас-
творимое в воде масло с неприятным запахом. Оно содержится в горчице, хрене
и других растениях.
В больших дозах отрицательно влияет на мочевой пузырь. Является мутаге-
ном |1| и канцерогеном (для крыс) |2{.
В Италии аллилгорчичное масло в виде таблеток с парафином разрешено
для стабилизации вина в больших ёмкостях114.
Глава 46
Тиомочевина
Тиомочевина действует преимущественно против плесневых грибов, в мень-
шей степени против бактерий. Одно время она (в виде 2—10%-х водных раство-
ров или 4-6%-х восковых дисперсий) применялась для сохранения цитрусовых.
В настоящее время тиомочевина из-за своей токсичности (канцерогенности) в
консервировании пищевых продуктов не используется.
Глава 47
47
Дегидрацетовая кислота
§1
Свойства, аналитические сведения
Дегидрацетовая кислота мало растворима в воде, лучше рас- 0
творима её натриевая соль. ][ сосн
Дегидрацетовую кислоту можно выделить из исследуемо- j [
го пищевого продукта экстракцией органическими раствори- н.с/хо'А
телями, например серным или петролейным эфиром. Для ка-
чественного определения используют тёмно-синее окрашивание, появляющееся
в присутствии солей меди. Дегидрацетовую кислоту, наряду с сорбиновой и бен-
зойной, можно обнаружить методом тонкослойной хроматографии |1|. Для ко-
личественного определения используют оранжево-красное окрашивание с аце-
тальдегидом в щелочной среде или максимум поглощения при 312 нм |2|.
§2
Токсиколого-гигиеническая оценка
При использовании корма, обильно политого масляным раствором
дегидрацетовой кислоты, её LD,(I для крыс составляет 1000 мг на 1 кг массы тела
|3|. Натриевая соль дегидрацетовой кислоты для крыс имеет LD50, равную 570 мг
на 1 кг массы тела, а для собак — 400 мг на 1 кг массы тела |4|.
Крысы переносят 0,1 г дегидрацетовой кислоты на 1 кг массы тела в течение
34 дней без ущерба для здоровья, но приём 0,3 г на 1 кг массы тела приводит к
большой потере массы и повреждениям различных внутренних органов 131. Корм
с 0,2% дегидрацетовой кислоты, потребляемый в течение 105 дней, снижает при-
рост массы по сравнению с контрольной группой животных |5|.
Двухлетний эксперимент на крысах, потреблявших корм с 0,1% дегидраце-
товой кислоты, не привёл к специфическим повреждениям |3|. Обезьяны пере-
носят 0,1 г дегидрацетовой кислоты на 1 кг массы тела пять раз в неделю в тече-
ние 1 года без ущерба, а потребление 0,2 г на 1 кг массы тела приводит к замедле-
нию развития и патологическим изменениям органов |3|. Длительно переноси-
мая доза для собак составляет 50 мг на 1 кг массы тела |4|. Люди переносят 9 мг
дегидрацетовой кислоты на 1 кг массы тела в течение 173 дней, при этом её кон-
центрация в плазме крови устанавливается на уровне 10—15 мг на 100 мл |6].
У человека и животных дегидрацетовая кислота быстро и полностью всасы-
вается. Она обнаруживается в плазме крови и во многих органах |2| и подавляет
различные окислительные ферменты |4|. Выделение происходите мочой, но очень
медленно |6|; поэтому при регулярном приёме следует считаться с возможно-
47. Дегидрацетовая кислота
203
стью накопления дегидрацетовой кислоты в организме. Из-за химической ак-
тивности ацетильной группы и возможности связывания с аминокислотами ис-
пользование дегидрацетовой кислоты в качестве пищевого консерванта представ-
ляется неприемлемым 17].
§3
Законодательные аспекты применения в пищевых продуктах
Дегидрацетовая кислота и её натриевая соль допущены в некоторых восточ-
ноазиатских странах для консервирования определённых пищевых продуктов. В
Европе использование дегидрацетовой кислоты в качестве консерванта не раз-
решено1’5.
§4
Действие на микроорганизмы
Дегидрацетовая кислота имеет относительно низкую константу диссоциа-
ции и потому достаточно эффективна в области высоких pH.
Действие дегидрацетовой кислоты направлено преимущественно против
дрожжей и плесневых грибов. Минимальная действующая концентрация для них
находится в диапазоне 50-500 мг/кг 18, 9|, в то время как для бактерий — 1000—
4000 мг/кг 18, 10|.
§5
Области применения
Обработка водным раствором натриевой соли дегидрацетовой кислоты по-
зволяет защитить очищенную или нарезанную тыкву от плесневения. Сама ки-
слота предложена для защиты трудносохраняемых пищевых продуктов с высо-
ким значением pH (выпечных изделий, сыров и маргаринов), а также для произ-
водства фунгистатических упаковочных материалов. Впрочем, токсичность де-
гидрацетовой кислоты препятствует её широкому применению.
48
Г ЛАВА 48
Салициловая кислота
§1
Свойства, аналитические сведения
Салициловая кислота представляет собой белый кристалличе- СООн
ский порошок, мало растворимый в воде. С хлоридом трёхвалент- fCjl
ного железа она даёт фиолетовое окрашивание, которое может быть
использовано для её количественного определения.
§2
Токсиколого-гигиеническая оценка
Острая оральная токсичность салициловой кислоты для кроликов составля-
ет 1,1—1,6 г на 1 кг массы тела. Для собакминимальная летальная дозаравна0,45—
0,5 г на 1 кг массы тела 111.
При ежедневном приёме 0,1 г салициловой кислоты на 1 кг массы тела в
течение 2 месяцев у мышей не обнаруживается каких-либо нарушений; при 0,3 г
на 1 кг массы тела возникают повреждения внутренних органов |2|. Салицилат
натрия не проявляет тератогенного действия |3|.
Открыватель антимикробного действия салициловой кислоты сообщал о том,
что он без ущерба для здоровья принимал ежедневно в течение 2 лет примерно
по 1 г салициловой кислоты |4|. Современные систематические исследования
хронической токсичности салициловой кислоты не известны.
Салициловая кислота всасывается быстро и полностью. Она не разлагается в
организме, а выводится в виде продукта взаимодействия с глицином (салицилу-
ровая, или о-оксигиппуровая, кислота) либо в другом связанном виде |2|. Выде-
ление происходит медленно; поэтому существует опасность накопления салици-
ловой кислоты в организме. При оральном приёме салициловая кислота может
вызывать сенсибилизацию.
§3
Законодательные аспекты применения в пищевых продуктах
В настоящее время салициловая кислота не применяется в качестве пищевого ,
консерванта. Она не разрешена для этой цели ни в Германии, ни в США, ни в
других развитых странах.
48 Салициловая кислота
205
§4
Действие на микроорганизмы
Салициловая кислота реагирует с белками протоплазмы микроорганизмов,
тем самым нанося им ущерб. Вероятно также её участие в ферментативных реак-
циях. Однако современные систематические исследования причин консервирую-
щего действия салициловой кислоты отсутствуют. Антимикробное действие са-
лициловой кислоты вызывается её влиянием на синтез пантотеновой кислоты,
жизненно необходимой для многих микроорганизмов, особенно бактерий |5|.
Из-за сравнительно высокой константы диссоциации (большей, чем у муравьи-
ной и бензойной) салициловая кислота может быть использована только для очень
кислых пищевых продуктов.
Салициловая кислота лучше действует против грибов и дрожжей, чем про-
тив бактерий. Однако её антибактериальная активность выше, чем у бензойной
кислоты, из-за наличия фенольной группы [6].
§5
Области применения
До середины XX века салициловая кислота была одним из самых популяр-
ных пищевых консервантов. Она применялась для консервирования меланжа,
рыбных маринадов, солёных и маринованных огурцов, оливок и фруктовых про-
дуктов. В Германии было широко распространено домашнее консервирование
компотов и варений с её помощью. Для защиты от порчи варенье и подобные
продукты иногда покрывают пергаментом, предварительно смоченным в спир-
товом растворе салициловой кислоты.
Салициловая кислота, сначала заменившая бензойную, из-за своего побоч-
ного действия и токсичности затем вновь была полностью вытеснена бензойной,
а позднее и сорбиновой кислотой. В настоящее время она не играет никакой
роли в пищевой технологии.
§6
Прочие действия
При нагревании салициловая кислота легко отщепляет углекислый газ, пре-
вращаясь в фенол. В содержащих её пищевых продуктах при нагревании могут
происходить нежелательные изменения вкуса и запаха.
При контакте с металлами (особенно с железом) пищевые продукты, содер-
жащие салициловую кислоту, могут приобретать постороннюю окраску.
Глава 49
49
пара-Хлорбензойная кислота
л-Хлорбензойную кислоту качественно и количественно можно определить
с помощью ВЭЖХ 111.
Острая и субхроническая токсичность л-хлорбензойной кислоты несколько
выше, чем бензойной. Крысы в течение 5 месяцев переносят корм с добавлением
0,2% л-хлорбензойной кислоты без нежелательных изменений в развитии, усвое-
нии корма, размножении, состоянии здоровья и гистологии печени и почек [2|.
Биохимическое поведение л-хлорбензойной кислоты в общем подобно по-
ведению бензойной. Она выводится из организма в основном в виде л-хлоргип-
пуровой кислоты.
По антимикробному действию л-хлорбензойная кислота подобна бензой-
ной. Действующим началом служит недиссоциированная форма; поэтому эф-
фективность сильно зависит от pH консервируемого продукта и проявляется
несколько слабее, чем у бензойной кислоты. л-Хлорбензойная кислота может
использоваться только для среднекислых пищевых продуктов. Эффективность
против плесневых грибов немного ниже, чем у бензойной кислоты.
Из-за плохой растворимости л-хлорбензойная кислота применялась преиму-
щественно в виде натриевой соли. Первоначально основной областью использо-
вания была фруктовая продукция: соки, плодовая мякоть и пульпы. Считалось,
что л-хлорбензойная кислота, в отличие от муравьиной, сернистой и бензойной
кислот, полностью растворяется в сильнокислой среде1’6131. Позднее натриевую
соль л-хлорбензойной кислоты в концентрации 0,05—0,1% стали использовать
для консервирования рыбных пресервов.
В настоящее время л-хлорбензойная кислота в качестве консерванта не раз-
решена и больше не применяется.
Глава 50
50
Фурилфурамид
Фурилфурамид, М-2-фурил-фуран-2-карбамид137 и ц~» &
другие производные нитрофурана находили и находят при- o2hr\j'ze=c''\)
менение в борьбе с бактериальными инфекциями у чело- н
века и животных. Вследствие высокой антибактериальной
эффективности некоторые из них в небольшом объёме использовались и в кон-
сервировании пищевых продуктов, например: фурилфурамид, нитрофуразон (се-
микарбазон 5-нитрофурфурола), фуразолидон (3-(5-нитрофурфурилиденами-
но)оксазолидин-2-он). Они применялись главным образом в восточноазиатских
странах. В настоящее время от использования производных нитрофурана в кон-
сервировании пищевых продуктов отказались в значительной степени из-за их
токсичности.
Для крыс при пероральном приёме LD,() фурилфурамида составляет 1,5 г,
а для мышей — 0,5 г на 1 кг массы тела 111. Добавка 0,2% фурилфурамида к корму
крыс в течение недели вызывала увеличение печени и гистологические измене-
ния в ней 111. Установлено также изменение ферментативной активности по срав-
нению с контрольными животными |2|. Употребление крысами в течение двух
лет корма, содержавшего 0,2% фурилфурамида, привело к увеличению смертно-
сти, в то время как 0,0125% фурилфурамида в корме никаких патологических
изменений не вызывают. Для мышей получены аналогичные результаты 111.
Фурилфурамид не проявляет тератогенного действия и не влияет на способ-
ность к воспроизведению потомства |3|, но является сильным мутагеном, как и
многие другие производные нитрофурана |4, 5|. Кроме того, он проявляет кан-
церогенное действие |6, 7|.
Производные нитрофурана замедляют перенос электронов в окислительно-
восстановительных процессах и окисление малата 181. Кроме того, не исключено
их влияние на синтез клеточной мембраны. Действие фурилфурамида не зави-
сит от pH; поэтому он может быть использован для консервирования слабокис-
лых и нейтральных пищевых продуктов.
Как большинство производных нитрофурана, фурилфурамид принадлежит
к консервантам, проявляюшим антибактериальное действие. Эффективно угне-
таются бактерии рода Bacillus, Staphyllococcus, Sarcina, Vibrio, Achromobacter,
Flavobacter и колиформные бактерии. Действующая концентрация составляет от
5 до 50 мг/кг |9|. 5-Нитрофурилакриловая кислота эффективна и против дрож-
жей 110].
Вследствие того что эффективность фурилфурамида не зависит от pH, он
применялся исключительно в тех пищевых продуктах, которые нельзя или очень
трудно сохранить иным образом. К ним относятся рыбопродукты (концентрация
15—20 мг/кг), мясо (концентрация 4—6 мг/кг), тофу (соевый творог), пасты из
бобовых и другие восточноазиатские национальные блюда (концентрация 4—
208
Консервирующие вещества
5 мг/кг) 1111. В некоторых восточноевропейских странах производные нитрофу-
рана одно время предлагались в качестве средства против перебраживания вина
110]. Однако там они не могли использоваться по токсикологическим причинам.
Глава 51
51
Антибиотики
В конце 40-х годов, с началом применения антибиотиков для лечения чело-
века и животных, возник интерес к их использованию в консервировании пище-
вых продуктов. Антибиотики оказались в числе немногих безвредных консер-
вантов с хорошей антибактериальной эффективностью. От применения некото-
рых антибиотиков ожидали уменьшения времени термообработки с целью сте-
рилизации. Однако ожидания эти не оправдались (исключение составил низин).
На первый взгляд, антибиотики должны были оказаться полезными для консер-
вирования продуктов питания ещё и потому, что они в несколько раз эффектив-
нее классических консервантов, т.е. требовались бы в весьма малых концентра-
циях, практически не влияющих на органолептические свойства продукта.
В настоящее время только два антибиотика имеют некоторое значение в кон-
сервировании пищевых продуктов — низин (см. гл. 27) и натамицин (см. гл. 28).
В целом антибиотики не применяются для этих целей, несмотря на их принци-
пиальную пригодность; имеются опасения, что их регулярное поступление в ор-
ганизм с пищей вызовет привыкание к ним”8 и тем самым сделает неэффектив-
ным применение антибиотиков в терапии, где они иногда жизненно необходимы.
Существует общее правило — не применять вещества, используемые в меди-
цине, в качестве пищевых добавок. Особенно это относится к пенициллину и
стрептомицину; поэтому они никогда не играли большой роли в консервирова-
нии пищевых продуктов. Опасность использования в этих целях антибиотиков
(в первую очередь проявляющих антибактериальное действие) заключается и в
возможности нанесения вреда микрофлоре кишечника.
Тем не менее некоторые антибиотики, например ауреомицин и тетрацик-
лин, временно использовали для консервирования свежей рыбы и других море-
продуктов. Антибиотики в количестве около 5 мг/кг добавляли ко льду, который
использовали для охлаждения рыбы в море. Водные растворы окси- и хлортетра-
циклина успешно применялись для обработки свежего мяса и птицы 111. Анти-
биотики субтилин и тилозин (проявляющие антибактериальное действие) в экс-
периментальном порядке использовали для смягчения условий стерилизации кон-
сервов; тилозин применяли также для консервирования рыбопродуктов (глав-
ным образом в странах Восточной Азии) |2—4|. Теперь эти вещества практиче-
ского значения не имеют.
Глава 52
52
Пряности и содержащиеся в них вещества
Многие пряности содержат вещества, известные своей способностью угне-
тать микроорганизмы. Интерес к использованию пряностей и содержащихся в
них веществ для консервирования пищевых продуктов основан на широко рас-
пространённом, но ошибочном мнении, что природные вещества арло/т'безопас-
нее для здоровья, чем синтетические. При этом упускают из виду, что и природ-
ные продукты могут быть небезопасны с токсикологической точки зрения |1].
Примером может служить аллилизотиоцианат (см. главу 45).
Из содержащихся в пряностях веществ в качестве проявляющих антимик-
робное действие описаны (среди прочих) альдегиды, органические кислоты, фе-
нолы, эфирные масла1”. Некоторые вещества раньше объединяли под названием
«фитонциды», часто не зная, какое именно соединение действует в конкретном
случае. Несколько подробнее исследованы томатидин томата, гумулон и лупу-
лон хмеля 12|, аллицин и аллиин чеснока, лука и хрена |3|. Наибольший интерес
представляет антибактериальная активность этих веществ 14|. В пряностях есть
также компоненты, действующие против плесеней 151.
Консервирующее действие перечисленных веществ недостаточно для прак-
тического применения; даже обычные пищевые продукты, содержащие пряно-
сти, подвержены порче. Кроме того, многие пряности (прежде всего молотые)
так сильно обсеменены, что их использование в пищевых продуктах возможно
только после стерилизации. Если бы вещества, содержащиеся в пряностях, про-
являли достаточное антимикробное действие, то не требовалась бы стерилиза-
ция самих пряностей.
Широкое использование пряностей ограничено не только недостаточным
антимикробным действием, но и их влиянием на запах и вкус продукта. Хоро-
ший консервант должен как можно меньше влиять на органолептические свой-
ства пищи.
Глава 53
53
Ферменты
Кроме лизоцима, рассмотренного в главе 29, существуют другие ферменты,
которые угнетающе или губительно действуют на микроорганизмы и могут рас-
сматриваться как потенциальные консерванты. Консервирование с использова-
нием ферментов (как и с применением бактериоцинов) называют «биоконсер-
вированием». Примерами таких ферментов могут служить кональбумин и ави-
дин куриного яйца, лактоферрин и лактопероксидаза коровьего молока |1].
Кональбумин и лактоферрин связывают железо и делают его недоступным
для микроорганизмов, угнетая тем самым развитие бактерий. Присутствие этих
ферментов в куриных яйцах, возможно, объясняет тот факт, что сырые яйца мик-
робиологически стабильнее сваренных, в которых эти ферменты инактивирова-
ны. Лактопероксидаза вместе с тиоцианатами (содержащимися в тканях живот-
ных) и перекисью водорода (образующейся из каталазоположительных микро-
организмов) формирует систему, действующую антибактериально |2|.
Смесь лактопероксидазы, глюкозооксидазы, глюкозы и тиоцианатов про-
даётся под торговой маркой Myavert C<s 131. Существует аналогичная система из
глюкооксидазы и глюкозы |4].
Ферменты (кроме лизоцима) до сих пор не приобрели практического значе-
ния в консервировании пищевых продуктов. Их действие очень ограничено, и
по эффективности они не сравнимы с обычными консервантами. Кроме того,
большинство из них слишком дорого в очищенном виде.
54
Г ЛАВА 54
Бактериоцины
Бактериоцины представляют собой белки, продуцируемые бактериями и
инактивирующие другие бактерии140. Они синтезируются на рибосомах и дейст-
вуют только против более или менее схожих бактерий 11, 2|. К бактериоцинам
относится уже обсуждавшийся нами низин141 (см. гл. 27). Это единственный бак-
териоцин, который изучен токсикологами, разрешён к применению и использу-
ется в консервировании пищевых продуктов.
Бактериоцины могут использоваться в консервировании как в виде готовых
препаратов, так и в виде микроорганизмов, которые продуцируют бактериоци-
ны непосредственно в пищевом продукте (защитные культуры; см. гл. 55). Кон-
сервирование с применением бактериоцинов (как с ферментами; см. гл. 53) на-
зывают биоконсервированием. При использовании бактериоцинов или культур
бактерий, которые их продуцируют, нужно убедиться, что упомянутые бактерии
не образуют токсинов142.
Наибольший интерес представляют бактериоцины молочнокислых бактерий
|3—61, к которым относится и низин. Так какбактериоцинами угнетаются только
бактерии, родственные тем, которые их продуцируют, бактериоцины грамполо-
жительных бактерий не эффективны против грамотрицательных бактерий, на-
пример рода Salmonella и Campylobacter. Против дрожжей и плесневых грибов бак-
териоцины вообще не действуют.
Бактериоцины являются белками; они чувствительны к нагреванию, и их
можно использовать только в пищевых продуктах, не подвергаемых термообра-
ботке. Низин составляет исключение из этого правила. Кроме того, бактериоци-
ны разрушаются протеазами других микроорганизмов или пищевых продуктов.
Разумеется, они быстро разлагаются и протеазами организма человека.
Бактериоцины (кроме низина) в настоящее время не имеют существенного
значения в консервировании пищевых продуктов. Пока возможность их приме-
нения остаётся предметом теоретического обсуждения.
Глава 55
55
Защитные культуры микроорганизмов
Защитными культурами называют культуры безвредных для здоровья чело-
века микроорганизмов, которые добавляют к пищевым продуктам с целью пред-
отвратить развитие патогенной или другой нежелательной микрофлоры [ 11. Та-
кого рода культуры (например, в виде заквасок) часто применяют для придания
продуктам аромата, вкуса или цвета.
Некоторые микробы образуют метаболиты, которые оказывают угнетающее
действие на другие микроорганизмы. Действие защитных культур аналогично
действию бактериоцинов. Наибольший практический интерес представляют мик-
роорганизмы, образующие молочную кислоту, проявляющую антимикробное дей-
ствие (см. главу 42). Естественно, что в пищевой промышленности могут исполь-
зоваться культуры только тех микроорганизмов, которые не образуют токсинов.
Защитные культуры микроорганизмов являются пищевыми добавками, но
могут применяться без особого разрешения, если на них не установлен специ-
альный запрет.
Защитные культуры применяют главным образом в молочных продуктах и
квашеных овощах. Преднамеренным добавлением молочнокислых бактерий к
бекону можно уменьшить в нём количество нитритов (см. §10 гл. 10). Этот приём
по разным причинам до сих пор не получил распространения.
Глава 56
56
Упаковки и покрытия
§1
Общие принципы
В консервировании пищевых продуктов следует различать упаковки, покры-
тия и жидкости, в которые погружают продукт, с непосредственным антимик-
робным действием или без него. Последние могут опосредованно предотвращать
или по крайней мере ограничивать микробиологическую порчу, защищая пище-
вой продукт от инфицирования (повторного) или оберегая его от необходимого
для многих возбудителей порчи кислорода воздуха. Например, старый, исполь-
зовавшийся раньше в быту способ хранения сливочного масла состоял в том, что
горшок с плотно утрамбованным маслом полностью погружали в воду и хранили
в холодном месте. Часто большое значение имеет степень доступа воздуха и сте-
пень частичного вакуумирования упаковки; некоторые микроорганизмы (ана-
эробы) развиваются в отсутствие кислорода даже лучше, чем в его присутствии.
Другие микроорганизмы, например некоторые плесневые грибы, обходятся уди-
вительно малым количеством кислорода в окружающем воздухе. Упаковка без
доступа воздуха имеет смысл только тогда, когда защищаемый пищевой продукт
предварительно был стерилизован.
Упаковки и покрытия обычно не создают больших токсикологических про-
блем, так как они, как правило, не предназначены для еды и не съедаются. Одна-
ко случайный переход компонентов упаковки в пищевой продукт не исключён.
При разработке упаковки следует ориентироваться на законодательные положе-
ния о веществах, применяемых для этих целей.
Некоторые упаковки и покрытия сами могутбыть подвержены микробиоло-
гической порче. Для них рекомендуется применять обычные пищевые консер-
ванты, так как не всегда можно исключить миграцию некоторого количества кон-
серванта из упаковки в пищевой продукт. Часто в качестве консерванта исполь-
зуется сорбиновая кислота, так как она достаточно эффективна в области высо-
ких значений pH143.
§2
Известковая вода и раствор жидкого стекла
Известковая вода (насыщенный водный раствор гидроксида кальция, содер-
жащий примерно 1,26 г Са(ОН)2 в 1 л)144 и жидкое стекло (раствор смеси гидро-
силикатов натрия) раньше использовались для сохранения куриных яиц. Непо-
средственно антимикробную активность не проявляют ни известковая вода (не-
смотря на pH 10-12)'45, ни жидкое стекло. Скорее всего, известковая вода дейст-
56. Упаковки и покрытия
215
вует вследствие того, что на скорлупе яиц гидроксид кальция превращается в
карбонат кальция. Поры яиц (стерильных внутри) закрываются, и возбудители
порчи не могут проникнуть через них. Аналогична и причина консервирующего
действия жидкого стекла — силикаты натрия на яичной скорлупе превращаются
в нерастворимую кремниевую кислоту. Яйца, обработанные известковой водой
или жидким стеклом, из-за закупоривания пор имеют повышенную склонность
к растрескиванию при варке. После обработки жидким стеклом скорлупа яйца
становится более хрупкой, чем у свежих. По вкусу лучше яйца, обработанные
известковой водой.
Кроме известковой воды известен препарат Garantol* — растворимый в воде
твёрдый продукт на основе гидроксида кальция с добавками солей железа, алю-
миния и магния.
С развитием холодильной техники оба консерванта полностью потеряли своё
значение.
§3
Минеральные и жирные растительные масла
В свободных от воды жирных растительных и минеральных маслах развитие
микроорганизмов невозможно. Когда-то минеральное масло использовали для
защиты (путём смазывания) куриных яиц. Принцип его действия тот же, что у
известковой воды и жидкого стекла, — минеральное масло закрывает поры яич-
ной скорлупы, предотвращая тем самым проникновение микробов внутрь яйца.
Жирные растительные масла используются среди прочего для изготовления
рыбных консервов, в которых предварительно посоленная рыба погружена в мас-
ло. Таким образом консервируют сайду, треску и т.п. («сайда в масле» — эрзац-
лосось)146. Из настоящего лосося иногда тоже изготовляют пресервы в масле. Кон-
сервы «сардины в масле» не являются примером консервирующего действия масла.
Здесь речь идёт о настоящих консервах, — хотя они и содержат масло, но сохран-
ность их обусловлена термической обработкой.
§4
Восковые и искусственные покрытия
В качестве материала для защитных покрытий используют натуральные вос-
ки (преимущественно карнаубский и пчелиный), некоторые синтетические вос-
ки (например, полиэтиленовый), минеральные (ископаемые) воски (например,
горный — озокерит147), а также парафин. Воски наносят в расплавленном виде, в
виде эмульсий или растворов (после высыхания растворителя образуется ровная
плёнка). Плоды цитрусовых покрывают растворами воскоподобных смол в низ-
ших углеводородах для сохранения аромата 11, 2|.
Кроме искусственных плёнок, предназначенных исключительно для упаков-
ки и не обсуждаемых здесь, некоторые синтетические вещества используются
также в качестве покрывных масс (например, водные дисперсии поливинилаце-
тата для сыра). Перед восками (служащими для аналогичной цели) они имеют то
216
Консервирующие вещества
преимущество, что через них могут проходить газы, образующиеся при созрева-
нии сыра.
Воски и искусственные покрытия (как и масла) не оказывают непосредст-
венного антимикробного действия. Их применение основано на том, что они
угнетают развитие находящихся на поверхности пищевого продукта микроорга-
низмов путём частичного предотвращения доступа кислорода и влаги (снижения
активности воды).
§5
Антимикробные упаковки и покрытия
В особую группу можно выделить упаковки и покрытия, оказывающие не-
посредственное антимикробное действие. Они содержат (в массе или на поверх-
ности) консервант, чьё назначение — полностью или частично перейти на пище-
вой продукт и создать консервирующий эффект. Так как консервант при этом
употребляется в пищу, его использование связано законодательными ограниче-
ниями на применение в пищевых продуктах. В большинстве стран не делают боль-
ших различий между непосредственной добавкой консерванта к пищевому про-
дукту и опосредованной добавкой — через упаковку.
Существует две группы консервантов для производства фунгистатических
упаковок и покрытий: с высоким и с низким давлением паров. Первые (типич-
ный пример — дифенил) переходят через паровую фазу из упаковочного мате-
риала, насыщенного ими, на поверхность пищевого продукта. При этом упако-
вочный материал оказывает одинаковое действие на всю поверхность продукта,
даже если последняя (имея сложную форму) не контактирует непосредственно с
упаковкой. Конечно, способность консерванта сравнительно быстро переходить
в упакованный пищевой продукт не всегда желательна из-за возможного влия-
ния на вкус или других причин 131.
Консерванты второй группы (с низким давлением паров) могут оказывать
фунгистатическое действие путём диффузии из упаковочного материала или по-
крытия на поверхность пищевого продукта только в том случае, когда имеется
непосредственный контакт между пищевым продуктом и упаковочным материа-
лом. Пример консервантов этого типа — сорбиновая кислота и её соли |3|.
Значение антимикробных упаковок и покрытий невелико, так как их ис-
пользование обычно дороже непосредственного добавления консервантов к пи-
щевым продуктам. Такие упаковки и покрытия имеют преимущества только в
специальных случаях.
Примечания
1 Эти дна термина нс совсем точно отра-
жают суть дела. Имеется в виду, что вещества
первой группы применяются нс только, и да-
же зачастую нс столько, как консерванты, но
и как вкусовые добавки, ароматизаторы и пр.
Вторые используются только как консерван-
ты. — Здесь и далее примечания научного редак-
тора (если не оговорено иного).
2 Пример не очень удачный. Речь несо-
мненно идет о сохранении зерна, но что в
этом участвует углекислый газ — домыслено
авторами. Поскольку обыкновенно хранили-
ще имеет вентиляцию, то углекислый газ вряд
ли может накапливаться и создавать защит-
ную атмосферу.
! См. примечание 24.
4 От грсч. кргад— мясо и ^аткод— жи-
вучий.
’ Эти вещества тоже относятся к арома-
тическим соединениям. Они предложены как
альтернатива бензойной кислоте из-за их
большей эффективности в некоторых случаях.
Подробнее об этом см. главы 22 и 49.
6 В нашей стране существует Российский
банк микроорганизмов. Он находится в Го-
сударственном научно-исследовательском
институте генетики и селекции промышлен-
ных микроорганизмов (ВНИИГЕНЕТИКА),
Москва, Дорожный I -й пр., 1. — Примеч. пере-
водчика.
7 Нс совсем удачный пример: рапс и дру-
гие кормовые культуры в пищу человеку, как
правило, нс используются.
’ Отказ законодательства в признании до-
пустимой дозы для канцерогенных и геноток-
сичных веществ вызван их особой опасно-
стью, связанной с необратимостью (по совре-
менным представлениям) вызываемых ими
негативных последствий.
’ Кроме средней летальной дозы для ха-
рактеристики острой токсичности вещества
используют также минимальную летальную до-
зу (LDH)), при которой погибает 10% подопыт-
ных животных, и абсолютно летальную дозу
(LDral) — минимальную дозу, при которой по-
гибает 100% подопытных животных.
Пример нс вполне удачный, так как в
нем отсутствует первый из упомянутых эта-
пов (окисление).
1' Существует еще один вид геномных му-
таций — гаплоидия, при которой вместо обыч-
ных для диплоидных организмов двух набо-
ров хромосом имеется лишь один.
12 Речь идет о скандале, связанном с имев-
шей место в 60-х годах вспышкой рождений
уродов у матерей, принимавших во время бе-
ременности препарат талидомид (контерган),
который рекламировался как успокаивающее
средство, в первую очередь именно для бере-
менных.
11 Здесь авторы вводят дополнительную
градацию токсичности по степени ее остроты
(эта градация нс заявлена в гл.З §1).
14 Точнее — более достоверную статисти-
ческую оценку.
15 Так в оригинале. По смыслу должно
быть «в более низких дозах».
16 Заниженное значение — крепкие спирт-
ные напитки имеют концентрацию спирта
40% и выше, соответственно завышено зна-
чение реальной безопасности.
17 Нелинейность зависимости (в матема-
тическом смысле) и отсутствие порогового
действия нс связаны. Скорее линейная зави-
симость свидетельствует об отсутствии поро-
га действия.
|! Так в оригинале.
19 Специализированные учреждения Ор-
ганизации Объединенных Наций: ФАО —
Продовольственная и сельскохозяйственная
организация ООН (FAO — Food and Agricul-
ture Organization of the Unated Nations); BO3
— Всемирная Организация Здравоохранения.
20 Codex alimentarius — Объединенная
комиссия ФАО/ВОЗ по пищевым стандартам.
21 В России в соответствии с Гигиениче-
скими требованиями к качеству и безопасно-
сти продовольственного сырья и пищевых
продуктов СанПиН 2.3.2.560-96 разрешены
для применения в пищевых продуктах все
перечисленные консерванты за исключением
Е284 и Е285. — Примеч. переводчика.
22 Снижение концентрации консерванта и
изменение pH может происходить и в изоли-
рованной среде, например под действием ми-
кроорганизмов.
21 Концентрация соли в квашениях и ма-
ринадах слишком мала для существенного
снижения активности воды.
24 Это нс совсем так. И раньше, и сейчас
добавление консервантов преследует цель
предохранения продукта от порчи. И раньше,
218
Примечания
и сейчас порча продукта приносила и прино-
сит экономические потери. Если продукт за-
грязнен токсинами (выше допустимых преде-
лов), то он несомненно должен считаться ис-
порченным. Различие между прошлым и на-
стоящим заключается в том, что за последнее
время обнаружились новые виды токсинов,
которые, конечно, существовали и ранее, но
нс были известны (поскольку их ядовитое
действие проявляется нс в острой форме, а
спустя длительное время). Иногда продукты,
загрязнённые такими токсинами, внешне со-
храняют товарный вид, поэтому ранее они
признавались годными к употреблению (хо-
тя и раньше вряд ли считались кондицион-
ными заплесневелые орехи, часто содержа-
щие, как это стало ясно теперь, афлатокси-
ны). Вновь открытые факты позволяют целе-
направленно защищать пищевые продукты и
от такого рода порчи. Однако отсюда нс сле-
дует, что цель использования консервантов
изменилась.
23 Нельзя исключить возможность суще-
ствования консервантов, которые проявляли
бы антимикробное действие в диссоциирован-
ном виде.
“ Это относится только к консервантам
второй группы.
27 Если полагать, что антимикробную ак-
тивность проявляет только нсдиссоциирован-
ная форма.
Это нс совсем так. Жировая фаза может
играть роль «депо», откуда консервант будет
переходить в водную фазу в случае снижения
его концентрации в последней (например, в
результате разрушения микроорганизмами).
Это справедливо только для консерван-
тов-кислот.
Здесь авторы допускают неточность.
Снижение активности воды ухудшает условия
существования микроорганизмов и тем самым
«помогает» консерванту подавлять их деятель-
ность. В то же время, как следует из преды-
дущего текста, растворенные в воде вещества
увеличивают коэффициент распределения
консерванта и, следовательно, снижают его
концентрацию в водной фазе и эффектив-
ность. Поэтому влияние растворённых в воде
веществ противоречиво, хотя преобладает, по-
видимому, «помощь» консерванту.
11 Здесь неточность. Поваренная соль нс
может влиять на парциальное давление кис-
лорода; она может изменять растворимость
кислорода 1! водной среде. Азотом или СО2
(или другим газом) можно заменить воздух и
тем самым уменьшить парциальное давление
кислорода (и даже свести его к нулю). Влиять
на парциальное давление кислорода могут
лишь вещества, с ним реагирующие (напри-
мер, SO,).
12 Диоксид серы реагирует с глюкозой
именно потому, что она — альдегид.
” Скорее надо говорить о связывании мно-
гих содержащихся в вине альдегидов (и кето-
нов). Их присутствие вносит вклад в «букет»
вина, а связывание приводит кого искажению.
На самом деле такая реакция маловероятна,
поскольку кислоты вина препятствуют обра-
зованию бисульфитного соединения.
34 На нефелометре.
33 Разброс в значениях pH связан с коле-
баниями в составе примесей.
36 В России основная масса соли добыва-
ется из соляных озёр, в которых она находит-
ся в виде многометровых пластов под тонким
слоем рассола (рапы); лучшая пищевая соль
добывается на озере Баскунчак (Астраханская
область).
37 Гипс, поваренная соль, сульфат магния.
31 Заменители применяют в тех случаях,
когда соль используется в качестве вкусовой
добавки,а нс консерванта.
’’ И в России. — Примеч. переводчика.
4 ,1 Соль, вследствие осмоса, вызывает
обезвоживание мяса. По этой же причине со-
лёное мясо связывает воду.
41 В промышленности двуокись углерода
получают главным образом при обжиге из-
вестняка.
42 В России диоксид углерода (Е290)
включён (в качестве газа для насыщения на-
питков) в список пищевых добавок, разрешён-
ных к применению при производстве пище-
вых продуктов.
43 Со временем углекислота распределя-
ется по всему объёму продукта и pH изменя-
ется (уменьшается) нс только на поверхности,
но и в объёме.
44 В России азот (E94I) включён (в каче-
стве хладагента и газовой среды для упаковки
и хранения) в список пищевых добавок, раз-
решённых к применению при производстве
пищевых продуктов.
43 Здесь неточность. Кислород требуется
при использовании нитрозных газов, а нс
азотной кислоты.
46 Так в оригинале, хотя это противоре-
чит сказанному выше в этом же абзаце. По-
видимому следует читать «30-35 мг на 1 кг
массы тела».
47 В России нитраты натрия (E25I) и ка-
лия (Е252) включены (в качестве консерван-
тов и фиксаторов окраски) в список пищевых
добавок, разрешённых к применению при
производстве пищевых продуктов.
4! По другим данным, температура плав-
ления нитрита натрия составляет 27 ГС (Спра-
вочник химика. Л.-М., 1963. Т.2).
49 В России нитриты калия (Е249) и нат-
рия (Е250) включены (в качестве консерван-
Примечания
219
тов и фиксаторов окраски) и список пищевых
добавок, разрешённых к применению при
производстве пищевых продуктов.
Ферментированный рис. — Примеч.
переводчика.
” В России ПДК озона в воздухе состав-
ляет 0,1 мг/м'.
'2 Так у авторов. На самом деле под сер-
нистой кислотой понимают раствор диоксида
серы в воде.
” Так в оригинале. Обычно под иодкрах-
мальной бумагой понимают бумагу, про-
питанную смесью иодида калия (или натрия)
и крахмала. Она нс может обесцвечиваться,
так как нс окрашена.
и В России диоксид серы (Е220), сульфи-
ты натрия (E22I), калия (Е225) и кальция
(Е226), гидросульфиты натрия (Е222), каль-
ция (Е227) и калия (Е228), пиросульфиты на-
трия (Е223) и калия (Е224) включены (в ка-
честве консервантов и антиокислителей,а пи-
росульфит натрия и в качестве отбеливающе-
го агента) в список пищевых добавок, разре-
шённых к применению при производстве пи-
щевых продуктов.
" Так у авторов. На самом деле, исходя
из данных по константам диссоциации,
приведённых в табл. 8 (см. гл.5 §7), более по-
ловины сернистой кислоты оказывается дис-
социировано до гидросульфитных ионов при
рН>1,8, а при рН>7,0 более половины
гидросульфитных ионов распадается с обра-
зованием сульфитных ионов. Это же следует
и из рис.7.
56 С карбонильными соединениями реаги-
рует нс сернистая кислота, а гидросульфиты.
” Правильнее — а-оксиэтилсульфонат
натрия (или калия).
” Сернистый газ нс используется для го-
товых к употреблению продуктов в первую
очередь из-за токсичности. Наличие запаха
здесь, скорее, даже полезно для потребителя,
поскольку позволяет избежать случайного
отравления.
” Хлорной известью.
В последнее время наблюдается тенден-
ция замены хлора на озон при обеззаражива-
нии воды (см. гл.11 §2).
61 В настоящее время в промышленности
хлор получают исключительно электролизом
хлоридов (обычно их водных растворов, но
иногда и расплавов).
62 Из-за трудностей в транспортировке,
поскольку СЮ2 взрывчат.
61 Хлората.
64 Повреждение происходит в первую оче-
редь из-за окислительного разрушения лёго-
чных тканей.
65 В России для хлора установлена ПДК,
рапная 1 мг/м'.
“ В России хлор (Е925) нс включён в спи-
сок пищевых добавок, разрешённых к приме-
нению при производстве пищевых продуктов.
67 Здесь важна концентрация сахара в вод-
ной фазе.
6“ Так у авторов. На самом деле образует-
ся формгидроксамовая кислота, а нс её эфир.
® Метанол для синтеза формамида не
требуется.
711 В промышленности муравьиную кисло-
ту получают главным образом в виде форми-
ата натрия из окиси углерода и NaOH.
71 В России муравьиная кислота (Е236),
формиаты натрия (Е237) и кальция (Е238)
включены (в качестве консервантов) в спи-
сок пищевых добавок, разрешённых к при-
менению при производстве пищевых про-
дуктов.
72 По-видимому, авторы имеют в виду
бегнзойную, сорбиновую и пр. кислоты.
” В России для уксусной кислоты уста-
новлена ПДК 5 мг/м’.
74 В России уксусная кислота (Е260), аце-
таты и диацстаты калия (Е261) и натрия (Е262)
(в качестве консервантов и регуляторов ки-
слотности), ацетат кальция (Е263) (в качест-
ве консерванта, регулятора кислотности и ста-
билизатора) и ацетат аммония (Е264) (в каче-
стве регулятора кислотности) включены в
список пищевых добавок, разрешённых к
применению при производстве пищевых про-
дуктов.
” Это и неудивительно, так как в растворе
с рН=3 концентрация уксусной кислоты
примерно в 60 раз больше, чем соляной.
76 Так у авторов. На самом деле приведён-
ные данные свидетельствуют именно о поло-
жительной корреляции — с ростом доли нс-
диссоциированной части растёт и антими-
кробное действие.
77 Здесь противоречие с началом преды-
дущего абзаца, где утверждается, что «дейст-
вие уксусной кислоты... направлено главным
образом против бактерий».
71 Так у авторов. Расчет показывает, что в
1%-м растворе уксусной кислоты pH равно
2,8; при pH 5,0 в растворе находятся в основ-
ном ацетаты, а нс уксусная кислота.
” Соли могут быть определены таким спо-
собом только в подкисленном растворе.
” В России для пропионовой кислоты ус-
тановлена ПДК 20 мг/м’.
" В России пропионовая кислота (Е280),
пропионаты натрия (Е281), кальция (Е282) и
калия (Е283) включены (в качестве консер-
вантов) в список пищевых добавок, разре-
шенных к применению при производстве пи-
щевых продуктов.
12 См. примечание 24.
В воде.
220
Примечания
м Так у а второ, I.
” Вдень,
16 Так у авторов. По-видимому, это недо-
разумение, так как в I - |4С-сорбиновой кисло-
те только ’/<, часть углерода представлена изо-
топом |4С. Вероятно, следует читать: «85%
сорбиновой кислоты... выводится в виде СО,».
” В России сорбиновая кислота (Е200),
сорбаты натрия (Е201), калия (Е202) и каль-
ция (Е203) включены (в качестве консерван-
тов) в список пищевых добавок, разрешенных
к применению при производстве пищевых
продуктов.
” Это нс совсем так; из упомянутых в
табл.8 двенадцати кислот-консервантов три
имеют константу диссоциации меньшую, чем
у сорбиновой, а шесть — близкую к ней.
При микробиологической деградации
сорбиновой кислоты.
'я| Майонезы представляют собой эмуль-
сии типа «масло в воде».
” Низкой.
42 См. примечание 24.
” Association of Official Analytical Chem-
ists — Ассоциация официальных химиков-
аналитиков.
44 В России диметилдикарбонат (Е242)
включён (в качестве консерванта) в список
пищевых добавок, разрешенных к примене-
нию при производстве пищевых продуктов.
” Так у авторов. На самом деле гликози-
ды по определению представляют собой про-
дукты соединения сахаров с веществами типа
спиртов или фенолов, т.е. кислот нс содер-
жат.
* Здесь неточность. Выражение «более
чувствительны» не очень уместно, так как
представленные данные нс сравнимы с пре-
дыдущими. Выражение «смертельная доза мо-
жет составлять...» ни о чем нс говорит (вспом-
ним анафилактический шок от малых доз
обычно безобидных веществ).
” В России бензойная кислота (Е210),
бензоаты натрия (Е211), калия (Е212) и каль-
ция (E2I3) включены (в качестве консерван-
тов) в списокпищсвыхдобавок, разрешенных
к применению при производстве пищевых
продуктов.
” По-видимому, авторы имеют в виду pH
водной фазы маргарина.
Это справедливо для кислоты, но не для
сё солей, — бензоаты практически полностью
сосредоточены в водной фазе.
В России метиловый (E2I8), этиловый
(Е214), пропиловый (Е216) и гептиловый
(Е209) эфиры и-гидроксибензойной кислоты
и натриевые соли метилового (E2I9), этило-
вого (Е215) и пропилового (Е217) эфиров и-
гидроксибензойной кислоты включены (в ка-
честве консервантов) в список пищевых до-
бавок, разрешённых к применению при про-
изводстве пищевых продуктов.
Здесь неточность. Эти соединения мо-
гут диссоциировать, но диссоциация проте-
кает в заметной степени лишь в щелочной
среде.
1112 Если эта среда кислая или нейтральная.
!|П Так у авторов. По-видимому, речь об
эфирах л-оксибснзойной кислоты.
1114 В России о-фенилфенол (Е231) и его на-
триевая соль (Е232) включены (в качестве
консервантов) в список пищевых добавок,
разрешенных к применению при производ-
стве пищевых продуктов.
Здесь неточность. Если речь идет об эф-
фективности защиты от микробиологической
порчи, то хорошая растворимость в жировой
фазе — минус, поскольку снижает концентра-
цию консерванта в водной среде, в которой и
развиваются микроорганизмы Например,
в §10 гл.20 справедливо указывается, что эф-
фективность бензойной кислоты ограничена
неудачным коэффициентом ее распределения
между водной и жировой фазами (в пользу
жировой).
В этом факте подтверждение предыду-
щего замечания, так как в диссоциированном
виде п-фенилфснол находится именно в вод-
ной фазе.
1117 В России дифенил (Е230) включен (в ка-
честве консерванта) в список пищевых доба-
вок, разрешенных к применению при произ-
водстве пищевых продуктов.
В гл.24 §3 указано, что максимальная
концентрация дифенила в воздухе при 20’С
составляет 0,047 мг/л.
Пока дифенил улетучится.
"" Для получения коптильного дыма ис-
пользуются дрова и опилки преимуществен-
но твёрдых пород дерева.
В России тиабендазол (Е233) включён
(в качестве консерванта) в список пищевых
добавок, разрешенных к применению при
производстве пищевых продуктов.
112 Так у авторов: говорится о 8-ми серо-
содержащих аминокислотах, в то время как в
молекуле всего 7 атомов серы.
В таком случае низину нельзя припи-
сать определённый состав, как это сделано
вначале.
114 Методами генной инженерии получают
нс низин, а (микро)организмы, его продуци-
рующие.
Так в оригинале. По-видимому надо
читать «40000 м.е./мг». — Примеч. перевод-
чики.
116 В России низин (Е234) включён (в ка-
честве консерванта) в список пищевых доба-
вок, разрешённых к применению при произ-
водстве пищевых продуктов.
Примечания
221
В России низин разрешен Госсанэпид-
надзором для консервирования овощных кон-
сервов, плавленых сыров и всех молочных
продуктов, включая пастеризованное и сте-
рилизованное молоко, — Примеч. переводчика.
ш Низин хорошо защищает от порчи плав-
леные сыры, овощные и фруктовые консер-
вы (здесь наиболее важно его действие про-
тив ботулиновых токсинов), пиво, меланж и
самые разные продукты, предупреждает тя-
гучую порчу («картофельную болезнь») хле-
ба, — Примеч. переводчика.
В России пимарицин (натамицин, Е235)
включен (в качестве консерванта) в список
пищевых добавок, разрешённых к примене-
нию при производстве пищевых продуктов.
1211 Так у авторов.
121 Так у авторов. В §4 указано, что рас-
творимость натамицина составляет 0,005%.
По-видимому имеются в виду нс растворы, а
суспензии.
122 Точнее яичный белок.
121 В России лизоцим (Е1105) включен (в
качестве консерванта) н список пищевых до-
бавок, разрешенных к применению при про-
изводстве пищевых продуктов.
124 Здесь у авторов неточность. Под индек-
сом Е174 серебро зарегистрировано как кра-
ситель (пигмент).
125 Так у авторов.
i2<’ Уровень, нс вызывающий наблюдаемо-
го неблагоприятного действия.
122 В России борная кислота (Е284) и тетра-
борат натрия (Е285) не включены в список пи-
щевых добавок, разрешенных к применению
при производстве пищевых продуктов. — При-
меч. переводчики.
|2! В России перекись водорода включена
(в качестве консерванта) в список пищевых
добавок, разрешённых к применению при
производстве пищевых продуктов.
|М В России броматы калия (Е924а) и каль-
ция (Е924Ь) включены в список пищевых до-
бавок, запрещённых к применению при про-
изводстве пищевых продуктов.
"" Противоречие с предыдущим предло-
жением.
1 ,1 В России пропиленгликоль (EI520) вклю-
чен (в качестве влагоудерживающего, смяг-
чающего и диспергирующего агента) в список
пищевых добавок, разрешённых к применению
при производстве пищевых продуктов.
1 ,2 В России гексаметилентетрамин (Е239)
включён (в качестве консерванта) в список
пищевых добавок, разрешённых к примене-
нию при производстве пищевых продуктов.
Так у авторов. Вероятно, имеется в виду
бромуксусная кислота.
В России аллилгорчичнос масло вклю-
чено (в качестве консерванта) в список пи-
щевых добавок, разрешенных к применению
при производстве пищевых продуктов.
В России дегидрацетовая кислота (Е265)
и сё натриевая соль (Е266) включены (в каче-
стве консервантов) в список пищевых доба-
вок, разрешённых к применению при произ-
водстве пищевых продуктов.
Iv’ Так в оригинале. На самом деле и му-
равьиная кислота полностью растворяется в
сильнокислой среде, а что следует понимать
под «полной растворимостью» сернистой кис-
лоты — неясно, т.к. она представляет собой
раствор сернистого гача.
1Ч-2-фурил-фуран-2-карбамид, судя по
названию, нс является производным нитро-
фурана.
Микроорганизмов.
Последняя группа выпадает из списка,
так как эфирные масла представляют собой
нс индивидуальные соединения, а смеси, в со-
став которых могут входить и вещества из упо-
мянутых перед этим классов органических со-
единений.
Тс вещества, которые и данной книге
называются бактериоцинами, по стандартной
классификации относятся к антибиотикам
бактериального происхождения. По химиче-
ской природе они представляют собой поли-
пептиды (белки).
, 41 В главе 51 низин отнесён к антибио-
тикам.
142 Это замечание излишне, так как абсо-
лютно вес вещества, вводимые в пищу, про-
ходят проверку на безвредность.
141 Так у авторов. Не совеем понятна не-
обходимость эффективности в области высо-
ких значений pH для консерванта, применяе-
мого в упаковке.
144 Растворимость гидроксида кальция в
воде при 25"С составляет 1,48 г/л.
145 Водородный показатель насыщенного
раствора гидроксида кальция составляет
около 12,5.
Неясны основания, по которым авторы
полагают, что масло в подобных продуктах
играет консервирующую роль. Скорее, оно
служит для «сдабривания» рыбы, либо масло
«механически» защищает кусочки рыбы от
контакта с воздухом, влагой и пр.
147 Озокерит для пищевых продуктов нс
используется из-за керосинового запаха. При-
меняют продукт его переработки — церезин.
Литература
К главе 1
I Luck Е. SchutzmaBnabmen gegen Lebensmittelverderb durch Schimmelpilze. In ReiB J.: Mykotoxine
in Lebensmitteln. Gustav Fischer, Stuttgart - New York, S 437-457 (1981).
2. Strahhnann B. Entdeckiuigsgeschichte antimikrobieller Konservierungsstoffe fiir Lebensmittel. Mitt. Geb.
Lebensmittelnnters. Hyg., 65, 96-130 (1974).
3. Knapp F.C. Die Nahrungsmittel in ihren chemischen mid technischen Beziehungen Vieweg Braunschweig
S 437-457 (I848).
К главе 2
Анализ
Bundesamt fur das Gesundheitswesen, Abteilnng Vollzug Lebensmittelrecht (Hrsg.). Schweizerisches
Lebensmittelbuch (5. Auflage), Ringbuch Ш, Kapitel 44 „Konservierungsstoffe fur Lebensmittel”, Bern,
Eidgendssische Drucksachen- und Materialzentrale, Loseblattsammlung seit 1992.
Horowitz E. Official methods of analysis of the Association of Official Analytical Chemists. 14th edition.
Association of Official Analytical Chemists, Washington (1984).
King R D. Developments in food analysis techniques. Applied Science Publishers, London (1978).
Kommtssion des Bundesgesundheitsamtes zur Diirchfiihrung des 35 LMBG (Hrsg), Amtliche Sammlung von
Untersuchnngsverfahren nach 35 LMBG, Beuth, Berlin, Loseblattsammlung seit 1980.
Требования к чистоте
Council of Europe (Hrsg). European Pharmacopoeia (2), European Treaty Series No 50, Sainte-Ruffine:
Maisonneuve (1989).
FAO and JECFA (Hrsg) Food an nutrition paper (FNP) Specifications for identity and purity of certain food
additives, Fortlaufende Serie, FAO/WHO, Rome, Stand: Heft Nr 49 (1990).
FAO and JECFA (Hrsg). Compendium of food additive specifications, Addendum 1 FAO/WHO Rom Stand
Heft, 52 (1992).
Glandorf K.K., Kunert P, Luck E. Handbuch Lebensmittelzusatzstoffe, Kapitel С V, Loseblattsammlung, Behr,
Hamburg (1991).
National Research Council (U.S.) Food and Nutrition Board (1981), Food Chemicals Codex: (FCC), 3.
Auflage, National Academy Press inkl. Nachtragen.
Verordnung fiber das Inverkehrbringen von Zusatzstoffen und einzehien wie Zusatzstoffe verwendeten Stoffe
(Zusatzstoff-Verkehrsverordnung) vom 10.7.1984.
К главе 3
Общая
Bakterientest: Riickmutationsversuch mit Salmonella typhiinurium.-(Gen-)mutationstest (-Amestest). Amtsbl.
Europ. Gemeinschaft, 27, 143-145 (19.09.1984, L 251).
Chromosomenaberrationstest in vivo (in vivo mammalian bone marrow cytogenetic tests chromosomal
analysis): Vorschrift veroffentlicht von der OECD (OECD-Guideline 475) vom 04.04.1984.
Chromosomenaberrationstest in vitro. Versuch zum Nachweis von Chromosomenschaden in Saugerzellen in
Kultur, Amtsbl. Europ. Gemeinschaft, 27, 131-133 (19.09.1984, L 251).
DNS-Scbadigung und -Reparatur (Unscheduled DNA synthesis = UDS) in Saugerzellen in vitro, Amtsbl Europ
Gemeinschaft, EWG Direktive 79/831 Anlage 5 Teil В (Marz 1987).
In vitro-Sauerzell-Gen-Mutationstest: Amtsbl Europ Gemeinschaft, EWG Direktive 79/831 (Marz 1987)
In vitro-Zelltransformationstest: EWG Direktive 67/548 (30.05.1988).
Mikrokerntest: Versuch zum Nachweis von Chromosomenschaden oder einer Schadigung des Mitoseapparates
in vivo. Amtsbl. Europ. Gemeinschaft, 27, 137-139 (19.09.1984, L 251).
Sanger in vivo-Dominant-Letaltest. Amtsbl. Europ. Gemeinschaft, EWG Direktive 87302, 76-78, 30.05.1988.
Classen H.-G., Elias P„ Hammes W. Toxikologisch-hygienische Beurteilung von Lebensmittelinhalts- und -
Zusatzstoffen sowie bedenklicher Verunreinigungen. Paul Parey Verlag, Berlin, S 15-60 (1987),
Eisenbrand G., Metzier M. Toxikologie fiir Chemiker, Thieme Verlag, Stuttgart (1994).
Fahrig R. Mutationsforschung und genetische Toxikologie. Wissenschaftliche Buchgesellschaft, Darmstadt (1993).
Marquardt H., Schafer S. Lehrburch der Toxikologie. Bl-Wissenschaftsverlag, Mannheim (1994).
Литература
223
Marquis J. A guide to general toxicology 2. Auflage. Karger, Basel (1989).
Muller L., Miltenberger H.G., Marquardt H., Madie S. Die Bedeutung von in vitro Zelltransformationstests
fiir die Routinepriifung. Bioforum, 16,69-76 (1993).
Parke D. Food, nutrition and chemical toxicity. Smith Gordon, London (1993).
Richardson M. Reproductive toxicology. VCH Verlagsgesellschaft, Weinheim (1993).
Schettler G., Schmahl D., Klenner T. Risk assessment in chemical carcinogenises. Springer, Berlin (1991).
Schumacher G.-H., Fanhanel J., Persaud T. Teratologie. Gustav Fischer Verlag, Stuttgart (1992).
Shtbainoto T., Bjeldanes L. Introduction to food toxicology. Academic Press, Orlando (1993).
Thiel C. Lebensmittelallergien und -intoleranzreaktionen. In: Emahrungsbericht 1992, Deutsche Gesellschaft
fiir Ernahrung e.V. Druckerei Henrich, Frankfurt (1992).
Timbrell J. Introduction to toxicology. Taylor and Francis, London (1989).
Vainio H., Magee P. Mechanisms of carcinogenises and risk identification. IARC, Lyon (1992).
Walker R., Rolls B. Nutrition and the consumer-issues in nutrition and toxicology 1. Elsevier Science
Publishers, Oxford (1992).
Walker R., Quattrucci E. Nutritional and toxicological aspects of food processing. Taylor and Francis, London (1988).
WiirglerF.E. Genetische Endpunkte. Bioforum, 14, 376-380 (1991).
Специальная
I. Goto T. Mycotoxins: Current situation. Food Rev. Intern., 6, 265-290 (1990).
2. Jelinik C., Poland A., Wood G. Worldwide occurence of mycotoxins in foods and feeds -an update.
J. Assoc Off. Anal. Chem., 72, 223-230 (1989).
3. Hemminki K. DNA Adducts, mutations and cancer. Carcinogenises, 14, 207-2 12 ( 1993).
4. Spielmann H. Die zentrale Erfassungs- und Bewertungsstelle fiir Ersatz- und Erganzungsmethoden zum
Tierversucb. Bundesgesundheitsblatt, 32, 360-363 (1989).
5. Zbinden G., Flury-Roversi M. Significants of the LD50 test for the toxocological evaluation of chemical
substances. Arch. Toxicol., 47, 77-99 (1981).
6. LD50test (Akute Toxizitatspriifung OECD Guideline 401) wird durch «fixed dose procedure» ersetzt.
Alternative Tierexp., Nr 16, Heft 3, 71 (1991).
7. Hodgson E., Levi P. A text book of modern toxicology Eilevier, New York, 159-168 und 256-260 (1992).
8 Harris C. Chemical and physical carcinogenises: advances and perspectives for the 90th. Cancer Research
(Suppl), 51, 5023s—5044s (1991).
9. Sugimura T. Multistep carcinogenises: A 1992 perspective. Science, 258, 603-607 (1992).
10. Lijinski W. Nou-genotoxic environmental carcinogens. J. Environmental Science Health, C8 (1), 45-87 (1990).
I ]. Green S. Nuclear receptors and chemical carcinogenises. Trends in pharmaceutical science (TIPS), 13,251-255 (1992).
12. Kadlubar F. Detection of human DNA-carcinogen aducts. Nature, 360, 189 (1992)
13. Marshall E. Toxicology goes molecular. Science, 259, 1394-1398 (1993).
14. Lutz W., Schlatter C. In vivo covalent binding of chemicals to DNA as a short time test for carcinogenicity.
Arch. Toxicol. Suppl., 2, 411-415 (1979).
15. Blot W. Alcohol and cancer. Cancer Re (Suppl), 52, 2119s—2123s (1992).
16 Muir C., McKinney P. Cancer of the oesophagus: A global overview. European J. Cancer Prevention,
1,259-264 (1992).
17. Aulepp H., Vieths S. Probleme mit Nahrungsmittelallergien. Dtsch. Lebensm. Rundsch., 88, 171 — 1 79 (1992).
18. Thiel C. Lebensmittelallergien und -intoleranzreaktionen. Z. Ernahrungswiss., 30, 158-173 (1991).
19. Vieths S., Schoning B., Aulepp H., Baltes W. Identifizierung kreuzreagierender Aller-gene in Pollen und
pflanzlichen Lebensmittehi. Lebensmittelchemie, 47, 49-53 (199.3).
20. Vieths S., Fischer K., Dehne L., Aulepp H., Wollenberg H., Bogel K. Versteckte Allergene in Lebensmitteln.
Bundesgesundheitsbl., 37, 51-60 (1994).
21. Belchi Hernandez J. Sulfit induced urticaria. Annuals Allergy, 71, 230-232 (1993).
22. Nagy S., Teuber S., Loscutof'S., Murphy P. Clustered outbreak of adverse reactions to a salsa containing high
levels of sulfites. J. Food Protect., 58, 95-97 (1995).
23. Jacobson D. Adverse reactions to benzoates and parabens. In: Food Allergies, Adverse Reactions to Foods and
Food Additives. Blackwell Scientific Publication, Boston (1992).
24 Michils A., Vandennoten G. Duchateau J., Yernault J.-C. Anaphylaxis with sodium benzoate. Lancet, 337,
1424-1425 (1991).
25. Rosenhall L. Evaluation of the intolerance of analgetics, preservatives and food colorants with challange tests.
Eur. J. Respir. Dis., 63, 41 (Ml9 (1982).
26. Truhaut R. The concept of the acceptable daily intake: an historic review. Food Add. Contain., 8, 151-162 (1991).
27. Kroes R., Munro I., Poulsen E. Workshop on the scientific evaluation of the safety factors for the acceptable
daily intake (ADI): Editorial summary. Food Add. Contain., 10, 269-273 (1993).
28. Renwick A. Safety factors and establishment of acceptable daily intakes. Food Add. Contain., 8, 135-150 (1991).
29 Renwick A. Data-denvate safety factors for the evaluation of food additives and environmental contaminants.
Food Add. Contain., 10, 275-305 (1993).
30. Luck E., Remmert K.H. ADI-Wert und Lebensmittelreckt. Gedanken Uber Einflilsse und Auswirkungen,
dargestellt anhand der Gesetzgebung liber Lebensmittelkonservierungsstoffe in der Bundesrepublik Deutsch-
land. Z. Ges. Lebensmittelrecht., 3, 1 15-143 (1976).
224
Литература
31. Festsetzung einer du I dbarei i taglichen Aufnahme (DTA-Wert, BGA, fiir Rtickstande von Pflanzenscliutzmittel-
Wirkstoffen im Rahmen des Zulassungsverfahrens). Bundesgesundheitsblatt, 36, 247-249 (1993).
32. ADI und DTA-Wette fiir Pflanzenschutzmittelwirkstoffe, Ausgabe 4 (Stand 05.01.1994). Bundesgesundheitsbl.
37,182-184 (1994).
33. Shtenberg A., Ignat’ev A. Toxicological evaluation of some combinations of food preservatives. Food Cosmet.
Toxicol., 8, 369-380 (1970).
К главе 4
Общая
Fortegnelse over godkendte tilsaetningsstoffer til levndesmidler (Positivlisten) fra 1. juli 1989. Stougaard Jensen,
Kobenhavn,
Dehove R.A. Regimentation des produits et services. Qualite, Consotnmation et Repression des fraudes.
Commerce Editions, Paris (1984).
Zusatzstoff-Zulassungs-Verordnung vom 22.12.1981 in der jeweils giiltigen Fassung.
Richtlinie des Rates vom 21.12.1988 zur Angleichung der Recktsvorschriften der Mitgliedsstaaten liber
Zusatzstoffe, die in Lebensmitteln verwendet werden diirfen (89/107/EWG).
Специальная
1. Strahlmann B. Bestrebungen inn eine internationale lebensmittelrechtliche Regeluug der Lebensmittelzusatze
seit Mitte des letzten Jahrhunderts. Lebensm. Wiss. Technol., 3, 1-5 (1970).
К главе 5
1. Schelhom von M. Hemmende und abtotende Wirkung von Konservierungsmitteln. Arch. Mikrobiol., 19, 30-44 (1953).
2. Gould G W. Effect of food preservatives on the growth of bacteria from spores. In; Microbial Inhibitors in
Food. Stockholm-Goteborg-Uppsala Almqvjst & Wiksell, S 17-24 (1964).
3. Eklund T. Chemical food preservations — some basic aspects and practical considerations. Vortrag Applied
food science in food preservation, London am 18.11.1981.
4. Freese E., Levin BC. Action mechanisms of preservatives and antiseptics. Dev. Ind. Microbiol. 19, 207-227
(1978).
5. Eklund T. Inhibition of growth and uptake processes in bacteria by some chemical food preservatives.
J. Appl. Bacteriol., 48,423-432 (1980).
6. Gould G.W., Brown M.H., Fletcher B.C. Mechanisms of action of food preservation procedures. Soc. Appl.
Bacteriol. Syinp. Series, 11, 67-84 (1983).
7. Eklund T. The effect of sorbic acid and esters of p-hydroxybenzoic acid on the protonmotive force in
Escherichia coli membrane vesicles. J. Gen. Microbiol., 131, 73-76 (1985).
8. Freese E., Sheu C.W., Galliers E. Function of lipophilic acids as antimicrobial food aditives.
Nature, 241, 321-325 (1973).
9. Branen A.L., Davidson P.M., KatzB. Antimicrobial properties of phenolic antioxidants and lipids. Food
Technol., 34:5, 42 (1980).
10. Robach M.C. Use of preservatives to control microorganisms in food. Food Technol., 34:10, 81 (1980).
11. Hollomon D.W. Pesticide Resistance. Chem. Ind. (London), 892-893 (1993).
12. Russell A.D. Mechanism of bacterial resistance to non-antibiotics: food additives and food and pharmaceutical
preservatives. J. Appl. Bacteriol., 71, 191-201 (1991).
13. Eckert J.W., Bretschneider B.F., Ratnayake M. Investigations on new postharvest fungicides for citrus fruits in
California. Proc Int. Soc. Citriculture, 2, 804-810 (1981).
14. Ming X., Daeschel M. Nisin resistance of foodborne bacteria and the specific resistance responses of Listeria
monocytogenes Scott A. J. Food Protect., 56, 944-948 (1993).
15. Lukas E.-M. Zur Kenntnis der antiinikrobiellen Wirkung der Sorbinsaure. 11. Mitteilung: Die Wirkung der
Sorbinsaure auf Aspergillus niger von Tieghem und andere Schimmelpilze. Zentralbl. Bakteriol. Parasitenkd.
Infektionskr. Hyg. 11. Abt 117, 485-509 (1964).
16. Athar M.A., Winner H I The development of resistance by Candida species to polyene antibiotics in vitro.
J. Med. Microbiol., 4, 505-517 (1971).
17. Rushing N.B., Senn V.J. The effect of benzoic, sorbic, and dehydroacetic acids on the growth of citrus products
spoilage organisms. Proc. Fla. State Hortic. Soc., 76, 271-276 (1963).
18. Rehm H.-J. Untersuchungen zur Wirkung von Konservierungsmittelkombinationen, II. Die Wirkung einfacher
Konservierungsinittelkombinationen auf Escherichia coll. Z. Lebensm. Unters. Forsch., 110, 356-363 (1959).
19. Rehm H.-J. Beitrag zur Wirkung von Konservierungsmittel-Kombinationen. 1. Grundlagen und Uberblick zur
Kombinationswirkung chemischer Konservierungsmittel. Z. Lebensm. Unters. Forsch., 110, 283-293 (1959).
20. Rehm H.-J., Stahl U. Untersuchungen zur Wirkung von Konservierungsmittelkombinationen. 111. Die Wirkung
einfacher Konservierungsmittelkombinationen auf Aspergilus niger und Saccharomyces cerevisiae.
Z. Lebensm. Unters. Forsch., 113, 34—47 (I960).
21. Rehm H.-J Untersuchungen zur Wirkung von Konservierungsmittelkombinationen. IV. Wirkung einfacher
Koinbinationen von Konservierungsmitteln mit einigen Antibiotica auf Escherichia coli. Z. Lebensm. Unters.
Forsch., 113, 144-152 (I960).
22. Rehm H.-J., Lukas E.-M., Senser F. Untersuchungen zur Wirkung von Konsei'vierungsmJttelkombinationen.
VIII. Die Wirkungbinflrer Koinbinationen von Konservierungsstoffen mit weiteren Antibiotica. Z. Lebensm.
Unters. Forsch., 124, 437-447 (1964).
Литература
225
23. Rehm H.-J., Sening E., Wittmann H., Walinofer P. Beitrag zur Kenntnis der antimikrobiellen Wirkung der
schwefligen Satire. III. Mitteilung. Aufliebung der antimikrobiellen Wirkung durch Bildung von Sulfonaten.
Z. Lebensm. Unters. Forsch., 123, 425—432 (1964).
24. Harrington W.O., Hills C.H. Preservative effect of diethyl pyrocarbonate and its combination with potassium
sorbate on apple cider. Food Technol., 20, 1360-1362 (1966).
25. Chirife J., Favetto G., Ballesteros S., Kitic D. Mummification in ancient Egypt: an old example of tissue
preservation byhurdle technology. Lebensmittel-Wiss. u. Technol., 24, 9-11 (1991).
26. Leistner L. Microbiology of ready-to-serve foods. Fleischwirtschaft, 58, 2008-2011 (1978).
27. Leistner L., Rodel W., Krispien K. Microbiology of meat and meat products in high- and intermediate-moisture
ranges. In. Rockland LB, Stewart GF: Water activity: Influences on food quality. Academic Press, New York-
London-Toronto-Sydney-San Francisco: S 855-916 (1981).
28. Leistner L. Food preservation by combined methods. Food Res. Int., 25, 151-158 (1992).
29. Leistner L. Principles and applications of hurdle technology. In: Gould GW: New methods of food preservation-
Blackie, London (1995).
30. Ko Swan Djien, Darwinkel-Risseeuw P.S., Pilnik W. Kombinierte Wirkung von Warmebehandlung und
Konservierungsmitteln auf Hefen in Traubensaft. I. Mitteilung. Versuche mit Natriumbenzoat. Confructa 17
356-359 (1972).
31. Beuchat L.R. Synergistic effects of potassium sorbate and sodium benzoate on thermal inactivation of yeasts.
J. Food Sci., 46, 771-777 (1981).
32. Beuchat L.R. Thermal inactivation of yeasts in fruit juices supplemented with food preservatives and sucrose.
J. Food Sci., 47, 1679-1682 (1982).
33. Beuchat L.R. Influence of water activity on growth, metabolic activities and survival of yeasts and molds.
J. Food Protect., 46, 135-141 (1983).
34. York G.K. Effect of pimaricin on the resistance of Saccharomyces cerevisiae to heat, freezing, and ultraviolet
irradiation. Appl. Microbiol., 44, 451-455 (1966).
35. Ko Swan Djien, Ypma Y.A., Pilnik W. Kombinierte Wirkung von Warmebehandlung und Konservierungsmitteln
auf Hefen in Traubensaft. H. Versuche mit Kaliumsorbat. Confructa, 18, 42-44 (1973).
36. Sankaran R., Leela R.K. Effect of preservatives on the germination and growth of thermally injured fungal
spores. Nah rung, 27, 231-235 (1983).
37. Beuchat L.R. Influence of potassium sorbate and sodium benzoate on heat inactivation of Aspergillus flavus,
Penicillium puberuhim and Geotrichum candidum. J. Food Protect., 44, 450-454 (1981).
38. Lerche M., Linke H. Versuche zur Abtotung von Salmonellen in fliissigem Eigelb mittels Sorbinsaure. Arch.
Lebensmittelhyg., 9, 121-126 (1958).
39. Doyle M.P., Marth E.H. Thermal inactivation of conidia from Aspergillus flavus and Aspergillus parasiticus. II.
Effects of pH and buffers, glucose, sucrose, and sodium chloride. J. Milk Food Technol., 38, 750-758 (1975).
40. Beuchat L.R. Combined effects of solutes and food preservatives on rates of inactivation and colony formation
by heated spores and vegetative cells of molds. Appl. Environm. Microbiol., 41, 472-477 (1981).
41. Beuchat L.R. Effects of potassium sorbate and sodium benzoate on inactivating yeasts heated in broths
containing sodium chloride and sucrose. J. Food Protect., 44, 765-769 (1981).
42. Schelhom von M. Stand der Konservierungsmittel-Forschung. Fette, Seifen. Anstrichm., 56, 221-224 (1954).
43. Maha M., Sudannan H., Chosdu R., Siagian E G., Nasran S. Combination of potassium sorbate and irradiation
treatments to extend the shelf-life of cured fish products. Comb. Processes Food Irradiat. Proc. Int. Symp.
S 305-318 (1980).
44. Thakur B., Arya S. Effect of sorbic acid on irradiation-induced sensory and chemical changes in sweetened
orangejuice and mango pulp. Int. J. Food Sci. Technol., 28, 371-376 (1993).
45. Thakur B., Trehan I., Arya S. Radiolytic degradation of sorbic acid in isolated systems.
J. Food Sci., 55, 1699-1702 (1990).
46. Harrington W.O., Hills C.H. Reduction of the microbial population of apple cider by ultraviolet irradiation.
Food Technol, 22, 1451-1454 (1968).
47. Frank H.K. Aflatoxine. Bildungsbedingungen, Eigeuschaften und Bedeutung fur die Lebensmittelwirtschaft.
Behr, Hamburg (1974).
48. Liick E. SchutzmaBnahmen gegen den Lebensmittelverderb durch Schimmelpilze. In: ReiB J: Mykotoxme in
Lebensmitteln. Gustav Fischer, Stuttgart-New York, S 437-457 (1981).
49. Bullerman L.B. Examination of Swiss cheese for incidence of mycotoxin producing molds.
J. Food Sci., 41, 26-28 (1976).
50. Groll D., Ltick E. Wirkung von Sorbinsaure und Sorboypahnitat auf die Aflatoxinbildung im Brot.
Z. Lebensm. Unters. Forsch., 144, 297-300 (1970).
51. WallhauBer K.H., Liick E. Der EinfluB der Sorbinsaure auf mycotoxinbildende Pilze in Lebensmitteln. Dtsch.
Lebensm. Rundsch., 66, 88-92 (1970).
52. ReiB J. Mycotoxine in Lebensmitteln. Vlll. Hemmung des Schimmelpilzwachstums und der Bildung von
Mycotoxinen (Aflatoxine Bl und Gl, Patulin, Sterigmatocystin) in Weizenvollkombrot durch Sorbinsaure und
Sorboylpalmitat. Dtsch. Lebensm. Rundsch., 72, 51-54 (1976).
53. Chipley J.R., Story L.D., Todd P.T., Kabara J.J. Inhibition of Aspergillus growth and extracellular aflatoxin
accumulation by sorbic acid and derivatives of fatty acids. J. Food Safety, 2, 109-120 (1981).
54. Ray L.L., Bullerman L.B. Preventing growth of potentially toxic molds using antifungal agents.
J. Food Protect., 45, 953-963 (1982).
55. Bullerman L.B. Effects of potassium sorbate on growth and aflatoxin production by Aspergillus parasiticus and
Aspergillus flavus. J. Food Protect., 46, 940-946 (1983).
226
Литература
56. Bullerman L.B, Effects of potassium sorbate growth an patulin production by Penicillium patulum and
Penicillium roqueforti. J. Food Protect., 47, 312-315 und 320 (1984).
57. Bullerman L.B. Inhibition of ochratoxin production by sorbate. J. Food Protect., 47, 820-821 (1984).
58. Tong С.-H., Draughon F.A. Inhibition by antimicrobial food additives of ochratoxin A production by
Aspergillus sulphureus and Penicillium viridicatum. Appl. Envtronm. Microbiol., 49, 1407-1411 (1985).
59. Bullerman L.B., Schroeder L.L., Park K.-Y. Formation and control of mycotoxins in food.
J. Food Protect., 47, 637-646 (1984).
60. Liewen M B., Marth E.H. Production of mycotoxins by sorbate-resistant molds
J. Food Protect., 48, 156-157 (1985).
61. Yousef A.E., Marth E.H. Incorporation of [ I4C] acetate into aflatoxin by resting cultures of Aspergillus
parasiticus in the presence of antifungal agents. Eur. J. Appl. Microbiol. Biotechnol , 18, 103-108 (1983).
62. Chourasia M. Growth, sclerotia and aflatoxin production by Aspergillus parasiticus: influence of food
preservatives. Lett. Appl. Microbiol., 17, 204-207 (1993).
63. Bauer J., Montgelas A, von Gedek B. Aflatoxin B, production in presence of preservatives antimicrobial agent.
Proc. Int. Symp. Mycotoxins, S 249-255 (1983).
64. Gareis M., Bauer J., Montgelas A., von Gedek B. Stimulation of aflatoxin B, and T-2 toxin production by
sorbic acid. Appl. Envirotim. Microbiol., 47, 416-418 (1984).
65. Tabata S., Kamimura H., Ibe A., Hashimoto H., Tamura Y. Degradation of aflatoxins by food additives.
J. Food Protect., 57, 42-47 (1994).
66. Rahn O., Conn J.E. Effect of increase in acidity on antiseptic efficiency. Ind. Eng Chem., 36, 185-187 (1944).
67. Rehm H.-J.. Wittmann H. Beitrag zur Kenntnts der antimikrobiellen Wirkung der schwefligen Saure, I.
Mitteilung. Ubersicht uber einfluBnehmende Faktoreu auf die antimikrobielle Wirkung der schwefligen Saure.
Z. Lebensm. Unters. Forsch., 118, 413-429 (1962).
68. Rehm H.-J., Lukas E.-M. Zur Kenntnis der antimikrobiellen Wirkung der Sorbiusaure. 1. Mitteilung. Die
Wirkung der undissoziierten tmd dissoziierten Anteile der Sorbiusaure auf Mikroorganismen. Zbl. Bakteriol.
Parasitenkunde, Infektionskrankh. Hyg., II. Abt 117, 306-318 (1963).
69. Eklund T. The antimicrobial effect of dissociated and undissociated sorbic acid at different pH levels.
J. Appl. Bacterio!., 54, 383-389 (1983)
70. Lubieniecki-von Schelhorn M. Untersuchungen fiber die Verteilung von Konservienmgstoffen zwischen Fett und
Wasser. I. Mitteilung Physikalisch-chemische Untersuchungen. Z. Lebensm. Unters. Forsch., 131, 329-345 (1967).
71. Lubieniecki-von Schelhorn M. Untersuchungen liber die Verteilung von Konservierungstoffen zwischen Fett und
Wasser. II. Mitteilung. Beziehungen zwischen physikalischchemischer Verteilung und anthnikrobieller Wirksam-
keit von Konservierungsstoffen in fetthaltigen Lebensmitteln. Z. Lebensm. Unters. Forsch., 133, 227-241 (1967)
72. Schmidt P.C., Franck M. Konservierung heute Chemie in unserer Zeit, 22, 39-44 (1 993).
73. Luck E. Lebensmittel von mittlerer Feuchtigkeit. Z. Lebensm. Unters. Forsch., 153, 42-52 (1973).
74. Lubieniecki-von Schelhorn M. Die Sauerstoffkonzentration als bestimmender Faktor fur mikrobielle Vorgange
in Lebensmitteln imter besonderer Beriicksichtigung einer sauerstofffreien Verpackung. Verpack-Rundsch 26,
Wiss Beilage zu Nr 1, S 1-6 (1975)
75. Sharp T.M. The breakdown of food additives. Au introductory survey. Scientific & Technical Surveys No 92.
The British Food Manufacturing Industries Research Association, Leatherhead (1976).
76. Parrof E. Stability of methylparaben. Amer. Perf. Cosmet., 83, 7-13 (1968).
77. Kinderlerer J., Hatton P. Fungal metabolites of sorbic acid. Food Add. Contam., 7, 657-669 (1990).
78. Luck E. Sorbiusaure, Band II Biochemie — Mikrobiologie. Behr, Hamburg, S 100-105 (1972).
79. Leimbeck R Die mikrobiologische Qualitat von Salben und Cremes — Methoden, Ergebnisse, Bewertung.
Parfiim. Kosmet., 72, 248-258 (1991).
К главе 6
1. Netolitzky F. Nahrungs- und Heilmittel der Uragypter. Z. Unters. Nahrungs. GenuBm., 26, 425^127 (1913).
2. Bergier J.F. Die Geschichte vom Saiz. Frankfurt - New York: Campus (1989).
3. Forbes R.J. Studies in ancient technology. Band 3, S 164-181, Leiden* Brill (1965).
4. Schleiden M.J. Das Saiz. Seine Geschichte, seine Symbolik und seine Bedeutung im Menschenleben. Leipzig:
Engelmann (1875).
5. Binkerd E.F., Kolari O.E. The history and use of nitrate and nitrite in the curing of meat.
Food Cosmet Toxicol., 13, 655-661 (1975).
6. Kaufmann D.W. Sodium chloride. The production and properties of salt and brine. New York: Reinhold (1960)
7. Boyd E.M., Shanas M.N. The acute oral toxicity of sodium chloride. Arch. Intern. Pharmacodyn. Then, 144,
86-98 (1963).
8. Boyd E.M., Boyd C.E, Toxicity of pure foods, S. Cleveland: CRC Press (1973).
9. Meneely G.R., Batterbee H.D. Sodium and Potassium. Nutr. Rev., 34, 225-235 (1976).
10. Seeger R. Giftlexikon: Natrium. Dtsch. Apotheker-Ztg., 134, 105-115 (1994).
11. Boyd E.M., Abel M.M., Knight L.M, The chronical oral toxicity of sodium chloride at the range of the LD50
(0.1 L). Can. J. Physiol. Pharmacol., 44, 157-1 72 (1966).
12. Meneely G.R., Tucker R.G., Darby W.J. Chronic sodium chloride toxicity in albino rats. J. Nutr., 48, 489-498 (1952).
13. Battarbee H.D., Meneely G.R, The toxicity of salt. Crit. Rev. Toxicol., 5, .355-376 (1978).
14 Food and Drug Research Laboratories. Teratologic evaluation of FDA 71-70 (sodium chloride) in mice, rats and
rabbits. PB-234878. Springfield: National Technical Information Service. US Department of Commerce (1974).
Литература
227
15. Litton Bionetics. Mutagenic evaluation of compound. FDA 71-70. 007647-14-5, sodium chloride reagent
ACS. PB-257870 Springfield: National Technical Information Service. US Department of Commerce (1976)
16. Meneely G.R., Tucker R.G., Darby WJ., Auerbach S.H Chronic sodium chloride toxicity Hvnertension renal
and vascular lesions. Ann Int. Med., 39. 991-998 (1953). "
I 7. Federation of American Societies for Experimental Biology. Evaluation of the health aspects of sodium chloride
and potassium chloride as food ingredients. PB-298139. Springfield: National Technical Information Service
US Department of Commerce (1979).
18. Kushner D.J. Influence of solutes and ions on microorganisms. In: Hugo WB (1976): Inhibition and destruction
of the microbial cell, S 259-282 London - New York: Academic Press (1971).
19. Robinson R. A., Stokes R.H. Electrolyte solutions. The measurement and interpretation of conductance
chemical potential and diffusion in solutions of simple electrolytes. London: Butterworths, 2. Aufl (1959).
20. Baird-Parker A C., Freame B. Combined effect of water activity, pH and temperature on the growth
of Clostridium botulinum from spore and vegetative cell inocula. J. Appl. Bacteriol., 30, 420-429 (1967).
21. SinskeyA.J. Mode of action and effective application. In: Tilbury RH: Developments in food preservatives - 1
S 113-115, London: Applied Science Publishers (1980).
22. Lubieniecki-von Schelhorn M. Die Sauerstoffkouzentration als bestimmender Faktor fiir mikrobielle Vorgange
in Lebensmitteln unter besonderer Beriicksichtigung einer sauerstofffreien Verpackung. Verpack.-Rundsch. 26
Wiss Beilage zu Nr. 1, S 1-6 (1975).
23. Schelhorn M. von. Wirksamkeit und Wirkungsbereich chemischer Konservierungsmittel fiir Lebensmittel.
Z. Lebensm. Unters. Forsch., 92, 256-266 (1951).
24. Luck E. Sorbiusaure. Chemie-Biochemie-Mikrobiologie-Technologie-Recht. Band 2, S 91 Hamburg- Behr (1972).
25. Smittie R.B. Influence of pH and NaCl on the growth of yeasts isolated from high acid food products
J. Food Sci , 42, 1552-1553 ( 1977).
26. Sofos IN. Antimicrobial effects of sodium and other ions in foods. A review. J. Food Safety, 6, 45-78 (1983).
27. Barbuti S., Ghliisi M., Companini M. Listeria in meat products. Isolation, incidence and growth characteristics.
Ind. Conserve, 64, 221-224 (1989).
28. Papageorgiou D.K., Marth E.H. Behaviour of Listeria monocytogenes at 4 and 22°C in whey and skim milk
containing 6 or 12% sodium chloride. J. Food Protect., 52, 625-630 (1989).
29. Doyle M.P., Marth E.H. Thermal inactivation of conidia from Aspergillus flavus and Aspergillus parasiticus. IL
Effects of pH and buffers, glucose, sucrose, and sodium chloride. J. Milk Food Technol., 38, 750-758 (1975).
30. Bean P.G., Roberts T.A. Effect of sodium chloride and sodium nitrite on the heat resistance of Staphylococcus
aureus NCTS 10652 in buffer and meat macerate. J. Food Technol., 10, 327-332 (1975).
31. Hutton M.T , Koskinen M.A., Hanlin J.H Interacting effects of pH and NaCl on heat resistance of bacterial
spores. J. Food Sci., 56, 821-822 (1991).
32. Ingram M., Kitchell A.G. Salt as a preservative for foods. J. Food Technol., 2, 1-15 (1967).
К главе 7
1. Lowenadler J., Ronner U. Determination of dissolved carbon dioxide by coulometric titration in modified
atmosphere systems. Lett. Appl. Microbiol., 18, 285-288 (1994).
2. Dragerwerk. Drager-Rohrchen Handbuch, Lubeck: Dragerwerk AG (1991).
3. Dixon N., Keil D. The inhibition by carbon dioxide on the growth and metabolism of microorganisms. J. Appl.
Bacteriol., 67, 109-136 (1989).
4. Haas G., Prescott H., Dudley E., Dik R., Hintlian C., Keane L. Inactivation of microorganisms by carbon
dioxide under pressure. J. Food Safety, 9, 253-265 (1989).
5. Faber .1. Microbiological aspects of modified-atmosphere packaging technology - A review. J. Food Protect.,
54, 58-70 (1991).
6. Hanninen M., Korreala H., Pakkala P. Effect of various gas atmospheres on the growth and survival
of Campylobacter jejuni on beef. J. Appl. Bacteriol., 57, 89-94 (1984).
7. Zee J., Bouchard C., Simard R., Pichard B., Holley R. Effect of N2, CO, CO2 on the growth of bacteria
from meat products under modified atmospheres. Microbiol. Aliments Nutri., 2, 351-370 (1984).
8. Lambert A., Smith J , Dodds K. Effect of head space carbon dioxide concentration on toxin production
by Clostridium botulinum in MAP, irridiated fresh pork. J. Food Project., 54, 588-592 (1991).
9. Gill C., Harrison J. The storage life of chilled pork packaged under carbon dioxide. Meat Sci., 26, 313-324 (1989).
10. Rau G. Alternative Verfahren mit inerten Gasen im Vbrratsschutz. Dtsch. Lebensm. Rundsch., 89, 216-219 (1993).
11 Locatelli D., Daolio E. Effectiveness of carbon dioxide under reduced pressure against some insects infesting
packaged rice. J. Stored Prod Research, 29, 81-87 (1993).
12. Buchheim W., Prokopek D. Die Hochdruckbehandlung. Dtsch. Milchwirtsch., 43, 1374-1378 (1992).
13. Barnett H., Conrad J., Nelson R. Use of laminated high and low density polyethylene flexible packaging
to store trout (Salmo gairdneri) in a modified atmosphere. J. Food Protect., 50, 645-651 (1987).
14. Lubieniecki-von Schelhorn M. Vermehrung und Absterben von Mikroorganismen in Abhangigkeit vom Milieu
unter besonderer Beriicksichtigung kombmierter technologischer Einfliisse. 4. Mitteilung. Chem. Mikrobiol.
Technol. Lebensm., 3, 138-147 (1974).
15. Eklund T., Jarmund T. Microculture model studies on the effect of various gas atmospheres on microbial growth
at different temperatures. J. Appl. Bacteriol., 55, 1 19 -125 (1983).
16. Shih C., Marth E. Aflatoxin produced by Aspergillus parasiticus when incubated in the presence of different
gases. J. Milk Food Technol., 36, 42 1^425 (1973).
228
Литература
17. Mohn G. The resistance of carbon dioxide of some food related bacteria.
J. Appl. Microbiol. Biotechnol., 18, 214-217 (1983).
18. Wei C, Balaban M, Fernando S, Peplow A (1991) Bacterial effects of high pressure carbon dioxide treatment
on foods spiked with Listeria or Salmonella. J Food Protect 54, 189-193
19. Church I., Parsons A. Modified atmosphere packaging technology: a review. J. Sci. Food Agric., 67, 143-152 (1995).
20. Kosikowski F., Brown D. Influence of carbon dioxide and nitrogen on microbial solutions and shelflife of
cottage cheese and sour cream. J. Dairy Sci., 56, 12-18 (1973).
21. Gill C ., Molin G. Modified atmospheres and vacuum packaging. In: Russel N., Gould G.: Food Preservatives, S
172-199, Glasgow. Blackie (1991).
22. Holley R., Delaquin P., Rodrigue N., Doyon G., Gagnon J., Garipy C. Controlled-atmosphere storage of pork
under carbon dioxide. J. Food Protect., 57, 1088-1093 (1994).
23. PenneyN., Hagyard C., Bell R. Extension of shelflife of chilled slices roast beef by carbon dioxide packaging,
hit. J. Food Sci Technol. 28, I8I-I9I (1993).
24. Kramer K., Baumgart J. Briihwiirstaufschnitt. Hemmung von Listeria monocytogenes durch modifizierte
Atmospharen. Fleischwirtschaft, 72, 666, 668, 758 (1992).
25. Gupta S_, Subrata B., Panduranga C., Chakraborti R. Preservation of mullets in carbon dioxide enriched gas-
mixture at 6-7°C. Fishery Technol., 28, 125-127 (1991).
26. Chen J., Balaban M., Cheng Wei I., Gleeson R., Marshall M. Effects of carbon dioxide on the inactivation
of Florida spiny lobster polyphenol oxidase. J. Sci. Food Agric., 61, 253-259 (1993).
27. Mazza G., Siemens A. Carbon dioxide concentration in commercial potato storages and its effect on quality
of tubers for processing. Am. Potato J., 67, 121-132 (1990).
28. Colelli G., Mitchel F., Kader A. Extension of postharvest life of mission figs by carbon dioxide enriched
atmospheres. Hort. Sci., 26, 1 193-1195 (1991).
29. Garcia J., Streif J. Qualitat und Haltbarkeit von Bimen. 1. EinfluB von CA- bzw. ULO-Lagerbedingungen.
Gartenbauwiss., 58, 36-41 (1993).
30. Kim D., Baek H., Yoon H., Kim K. Effects on carbon dioxide concentration in CA conditions of the quality of
Shiitake mushroom (Lentinus edodes) during storage. Korean J. Food Sci. Technol., 21,461-467 (1989).
31, Troost G. Technologic des Weines. S 166, Stuttgart. Ulmer (1988).
32. Avital Y., Mannheim C ., Miltz J. Effects of carbon dioxide atmosphere on staling and water relations in bread.
J. Food Sci., 35, 413-416, 461 (1990).
33. Vora H., Sidhu J. Effects of varying concentrations of ethyl alcohol and carbon dioxide on the shelf life
of bread. Chem. Mikrobiol. Technol. Lebensm., 11, 56-59 (1987).
34. Smith J., Khanizadeh S., van de Voort F., Hardin R., Ooraikul B., Jackson E. Use of response surface
methodology in shelflife extension studies of a bakery product. Food Microbiol., 5, 163-176 (1988).
35. Kubo Y, Inaba A., Nakamura R. Respiration and C2H4 production in various harvested crops held in carbon
dioxide enriched atmospheres. J. Am. Soc. Horticul. Sci., 115, 975-978 (1990)
К главе 8
1, Huffmann D.L. Effect of gas atmospheres on microbial quality of pork. J. Food Sci., 39, 723-725 (1974).
2. Eklund T., Jannund T. Microculture model studies on the effect of various gas atmospheres on microbial growth
at different temperatures. J. Appl. Bacteriol., 55, 1 19-125 (1983).
3. Parekh K.G., Solberg M. Comparative growth of Clostridum perfringens in carbon dioxide and nitrogen
atmospheres. J. Food Sci., 35, 156-159 (1970).
4. Shih C.N., Marth E.H. Aflatoxin produced by Aspergillus parasiticus when incubated in the presence
of different gases. J. Milk Food Technol., 36, 421-425 (1973).
5. Smith J. Jackson E., Ooraikul B. Microbiological studies on gas-packaged crumpets.
J. Food Protect., 46, 279-283 (1983).
6. Corinth H.-G. Haltbarkeitsverlangerung durch Anwendung von Schutzgas. Lebensmitteltechn., 12, 630-684 (1985).
К главе 9
I. Binkerd E F., Kolari O.E. The history and use of nitrate and nitrite in the curing of meat.
Food Cosmet. toxicol., 13,655-661 (1975).
2. Stein C., Classen H.-G, Schwedt G. Kinetic studies on nitrite and nitrate in rats by ion ?air chromatography.
Clinica Chiin. Acta., 175, 167-175 (1988).
3, Battelle Columbus Laboratories. GRAS (Generally Recognized as Safe) food-ingredients — nitrates and nitrites
(including nitrosamines). PI3 221220. Springfield: National Technical Information Service, US Department
of Commerce (1972).
4. Wirth W., Gloxhuber C., Krienke E.G., Wirth K.E. Toxikologie. Stuttgart: Georg. Thieme, 4. Aufl, S 93 (1985).
5. Walker R. Nitrates, nitrites and N-Nitrosocompounds: a review of the occurance in food and diet and the
toxicological implication. Food Additives Contain., 6, 717-768 (I 990).
6. Wettig K., Broschinski L., Diener W., Fischer G., Flentje B., Namaschk A., Scheibe J., Schulz K.-R. Endogen
gebildete Nitrate als Teil der gesamteii Nitratbelastung des Menschen. Bundesgesundheitsbl., 33, 235-240 (1990).
7 SCF. Bericht des Wissenschaftlichen Lebensmittelausschusses fiber Nitrate und Nitrite. Stellungnahme vom
19.10.1990, EUR 13913 (1990).
8 Schulz M E. Kay H., Mrowetz G. Untersuchungen liber das Verhalten von Nitrat im Kase. Milchwissenschaft,
15, 556-559 (I960).
Литература
229
9. Hustad GO., Cerveny J.G., Trenk H-, Deibel R.H., Kautter D.A., Fazio I., Johnston R W., Kolari O.E. Effect
of sodium nitrite and sodium nitrate on botulinal toxin production and nitrosamine formation in wieners.
Appl. Microbiol., 26, 22-26 (1973).
10. Leistner L., Hechelmann H., Uchida K. Welche Konsequenzen hatte em Verbot oder eine Reduzienmg des
Zusatzes von Nitrat und Nitrhpokelsalz zu Fleischerzeugnissen? Aus mikrobiologischer Sicht Fleischwirtschaft
53, 371-375 und 378 (1973).
К главе 10
I. Binkerd E.F., Kolari O.E. The history and use of nitrate and nitrite in the curing of meat.
Food Cosmet. Toxicol., 13, 655—661 (1975).
2. Kisskalt K. Beitrage zur Kenntnis der Ursachen des Rothwerdens des Fleisches beim Koclien, nebst einigen
Versuchen uber die Wirkung der schwefligen Satire auf die Fleischfarbe. I. Ueber das Rothwerden des Fleisches
beim Kochen. Arch. Hyg., 35, 11 —18 (1899).
3. Walker R. Nitrates, nitrites and N-Nitrosocompounds: a review of the occurence in food and diet
and the toxicological implications. Food Add. Contam., 7, 717-768 (1990).
4. Brauner-Glaesner G., Ristow R. Lagerfahiukeit von Nitritpokelsalz. Lebensmittelchem.
Gerichtl. Chem., 38, 91-94 (1984).
5. Tiedtke J., Koch H. Nitnt-Pbkelsalz-Entwicklungen, lebensmittelrechtliche und produktionsspezifische
stoffhehe Eigenscliaften und Wirkungen. Lebensmittelkontrolleur, 7: 10, 18 (1992).
6. Usher C D., Telling G.M. Analysis of nitrate and nitrite in foodstuffs. A critical review.
J. Sci. Food Agric., 26, 1793-1805 (1975).
7. Stein C., Classen H.-G., Schwedt G. Kinetic studies on nitrite and nitrate in rats by ion-pair chromatography.
Clin. Chim. Acta, 175, 167-174 (1988).
8. Kim H., Conca K. Determination of nitrite in cured meats by ion-exchange chromatography
with electrochemical detection. J. Assoc. Off. Anal. Chem., 73, 561-564 (1990).
9. Dennis M., Key P., Papworth T, Pointer M., Massey R. The determination of nitrate and nitrite in cured meat
by HPLC/UV. Food Add. Contam., 7,455—461 (1990).
10. Frommberger R. UV-spektrophotometrische Schnellbesthnmung des Natriumnitritgehaltes von Nitritpokelsalz.
Lebensmittelchem. gerichtl. Chem., 39, 99-101 (1985).
11. Helrich K. (ed). Official methods of analysis of the Association of Official Analytical Chemists. Arlington:
AOAC (1990).
12. Smyth H.F., Carpenter C.P., Weil C.S., Pozzani U.C., Striegel J.A., Nycum J.S. Range-finding toxicity data:
List VII. Am. Ind. Hyg. Assoc. J., 30, 470-476 (1969).
13. Battelle Columbus Laboratories. GRAS (Generally Recognized as Safe) food-ingredients — nitrates and nitrites
(including nitrosamites). PB 221220. Springfield: National Technical Information Service, US Department of
Commerce (1972).
14. Burden E.H W.J. The toxicology of nitrates and nitrites with particular reference to the potability of water
supplies. A review. Analyst (London), 86, 429-433 (1961).
15. Wagner H -J. Vergiftung mit Pbkelsalz. Arch. Toxikol., 16, 100-104 (1956),
16. Til H., Falke H., Ktiper C., Willems M. Evaluation of the oral toxicity of potassium nitrite in a 13-week
drinking-water study in rats. Food Chem. Toxicol., 26, 851-859 (1988).
17. SCF. Stellungnahme vom 19.10.1992 zur Unbedenklichkeit von Nitraten und Nitriten als Lebensmittelziisatz-
stoffe, 26. Bericht EUR 13913 (1990).
18. Druckrey H., Steinhoff D., Beuthner H., Schneider H., Klarner P. Priifung von Nitrit auf chronisch toxische
Wirkung an Ratten. Arzneim. Forsch., 13, 320-323 (1963).
19. Sleight S.D., Atallah O.A. Reproduction in the guinea pig as effect by chronic administration of potassium
nitrate and potassium nitrite. Toxicol Appl. Pharmacol., 12, 179-185 (1968).
20. Logten M.J. van, Tonkelaar E M. den, Kroes R., Berkvens J.M., Esch G.J. van. Longterm experiment with canned
meat treated with sodium nitrite and glucono-8-lactone in rats. Food Cosmet. Toxicol., 10, 475-488 (1972)
21. Grant D., Butler W. Chronic toxicity of sodium nitrite in the male F 344 rat. Food Chem. Toxicol., 27, 565-571 (1989).
22. Quastel J H. Woolridge W.R. The effects of chemical and physical changes in environment on resting bacteria.
Biochem. J., 21, 148 -168 (1927).
23. Woods L.F.J., Wood J.M., Gibbs P.A. The involvement of nitric oxide in the inhibition of the phosphoroclastic
system of Clostridium sporogenes by sodium nitrite. J. Gen. Microbiol., 125, 399-406 (1981).
24. Woods L.F.J., Wood J.M. A note on the effect of nitrite inhibition on the metabolism of Clostridium botulinum.
J. Appl. Bacteriol., 52, 109-110 (1982).
25. Castellani A.G., Niven C .F. Factors affecting the bacteriostatic action of sodium nitrite.
Appl. Microbiol., 3, 154-159 (1955).
26. Roberts T., Woods L, Payne M., Cammack R. Nitrite. In: Russell J., Gould G. (eds). Food Preservatives.
Glasgow: Blackie S 89-110 (1990).
27. Baird-Parker A C., Baillie M A H The inhibition of Clostridium botulinum by nitrite and sodium chloride.
Proc. Int. Symp. Nitrite Meat Prod. Zeist., S 77-90 (1973).
28. McLean R.A., Lilly H.D., Alford J. A. Effects of meat-curing salts and temperature on production
of staphylococcal enterotoxin B. J. Bacteriol., 95, 1207-1211 (1968).
29. Leistner L., Hechelmann H., Uchida K. Welche Konsequenzen hatte ein Verbot oder eine Reduzienmg des
Zusatzes von Nitrat und Nitritpbkelsalz zu Fleischerzeugnissen? Aus mikrobiologischer Sicht. Fleischwirtschaft,
53, 371-375,378 (1973).
230
Литература
30. Ala-Huikku К., Nurmi Е., Pajulahti Н., Raevuori М. Effect of nitrite, storage temperature and time
on Clostridium botulinum type A. toxin formation in liver sausage. Eur. J. Appl. Microbiol.. 4, 145-149 (1977).
31. Lee S.H., Cassens R.G., Sugiyama H Factors affecting inhibition of Clostridium botulinum in cured meat.
J Food Sci 43, 1371-1374 (1978).
32. Lechowich R.V., Brown W.L., Deibel R.H., Somers 1.1. The role of nitrite in the production of canned cured
meat products. Food Technol, 32, 45, 48, 50, 52, 56, 58 (1978).
33. Roberts T.A., Smart J.L. Inhibition of spores of Clostridium spp. by sodium nitrite.
J. Appl. Bacteriol., 37, 261-264 (1974).
34. Pen go J. A., Whiting E., Bashford T.E. Observations on the inhibition of vegetative cells of Clostridium
sporogenes by nitrite which has been autoclaved in a laboratory medium, discussed in the context
of sub-lethally processed cured meats. J. Food Technol., 2, 377-397 (1967).
35. Perigo J.A., Roberts T.A. Inhibition of Clostridia by nitrite. J. Food Technol., 3, 91-94 (1968).
36. Riha W.E., Solberg M. Clostridium perfringens inhibition by sodium nitrite as a function of pH, inoculum size
and heat. J. Food Ser, 40, 439-442 (1975).
37. Riha W.E., Solberg M. Clostridium perfringens growth in a nitrite containing defined medium sterilized by heat
or filtration. J. Food Sci., 40, 443-445 (1975).
38. Hustad G.O., Cerveny J.G., Trenk H., Deibel R.H., Kautter D.A., Fazio T., Johnston R.W., Kolari O.E. Effect
of sodium nitrite and sodium nitrate on botulinal toxin production and nitrosamine formation in wieners. Appl.
Microbiol., 26, 22-26 (1 973).
39. Grever A B.G. Minimum nitrite concentrations for inhibition of Clostridia in cooked meat products. Proc. Int.
Symp. Nitrite Meat Prod. Zeist., S 103-109 (1973).
40. Mima A., Coretti K. Ober den Verbleib von Nitrit in Fleischwaren. 11. Untersuchungen liber chemische und
bakteriostatische Eigenschaften verschiedener Reaktionsprodukte des Nitrits. Reischwirtschaft, 54, 507-510 (1974).
41. Tompkin R.B. Nitrite. In: Davidson P.M., Branen A.L.: Antimicrobials in Foods. Marcel Dekker New York 2.
Aufl, S 191-262 (1993).
42. Moran D M., Tannenbaum S.R., Archer M.C. Inhibitor of Clostridium perfringens formed by heating sodium
nitrite in a chemically defined medium. Appl. Microbiol., 30, 838-843 (1975).
43. Mima A., Coretti K. Inhibitory effect of nitrite reaction products and of degradation products of food additives.
Proc. 2nd hit. Symp. Nitrite Meat Prod. Zeist., S 39-45 (1976).
44. Toth L. Nitrite reactions during the curing of meat products. Fleischwirtschaft, 63, 208-211 (1983)
45. Liick E Sorbinsaure nnd Sorbate. Konservienmgsstoffe fiir Fleisch und Fleischwaren. Literaturiibersicht.
Fleischwirtschaft, 64, 727-733 (1984).
46. Tanaka N , Meske L., Doyle M.P., Traisman E., Thayer D.W., Johnston R W. Plant trials of bacon made
with lactic acid bacteria, sucrose and lowered sodium nitrite. J. Food Protect., 48, 679-686 (1985).
47. Smith J.S., Burge D.L. Protoporphyrin-lX as a substitute for nitrite in cured-meat color production.
J. Food Sci., 52, 1728-1729 (1987).
48. O'Boyle A.R., Rubin L.J., Diosady L.L., Aladin-Kassam N., Comer F., Brightwell W. A nitrite-free curing
system and its application to the production of wieners. Food Technol, 5, 88-104 (1990).
49. Shahidi F., Pegg R.B. Nitrite-free meat curing systems: Update and review. Food Chem., 43,185-191 (1992).
50. Fmk-Gremmels J., Dresel J., Leistner L. Einsatz von Monascus-Extrakten als Nitrit-Alternative bei Fleischer-
zeugnissen Fleischwirtsch., 71, 329-331 (1991).
51. Leistner L. Die emahrungsphysiologische Bedeutung von Angkak. Fleischwirtsch., 74, 772, 775-778 (1994).
52. Wirth F. Einschrankung und Verzicht aufNitrit bei Pbkelstoffen in Fleischerzeugnissen.
Fleischwirtsch , 71, 228-239 (1991).
53. Woolford G., Cassens R.G., Greaser ML., Sebranek J.G. The fate of nitrite: Reaction with protein.
J. Food Sci., 41,585-588 (1976).
54. Woolford G., Cassens R.G. The fate of sodium nitrite in bacon. J Food Sci,, 42, 586-589, 596 (1977).
55. Greenland S. The interaction of nitrites with food, drugs, and contaminants. J. Environ. Health, 41, 141-143 (1978).
К главе 11
Обзорная
Ozone Chemistry and Technology. Adv. Chem., Series No 21. Am. Chem. Soc. (1959).
Специальная
I. Rice R.G., Robson CM., Miller G.W., Hill A G. Uses of ozone in drinking water treatment. J. Am. Water
Works Assoc , 73, 44-57 (I98l).
2. Dragerwerk. Drager-Rohrchen Handbuch, Lubeck: Dragerwerk AG (1991).
3. Dungworth D.L., Cross C.E., Gillespie I.R., Plopper C.G. The effects of ozone on animals. In: Murphy J.S.,
Orr J R.: Ozone Chemistry and Technology. A Review of the Literature: 1961-1974, S 27-54, Philadelphia:
Franklin Institute Press (1975).
4. Gilgen A., Wanner H.U. Die toxikologische und hygienische Bedeutung des Ozons. Arch. Hygiene, 150, 62-78 (1966).
5. Mittler S., King M., Burkhardt B. Toxicity of ozone. In: Ozone Chemistry and Technology, Adv. Chem., Series
No 21, S 344-351, Washington.’ Am. Chem. Soc. (1959).
6. Sayato Y., Nakamuro K., Ueno H. Toxicological evaluation of products formed by ozonation
of aqueous organics. Japan J. Tox. Environm. Health, 39, 25 1-265 (1993)
7. Fetner R.H., IngolsR.S. Bactericidal activity of ozone and chlorine against Escherichia coli at 1°C. In: Ozone
Chemistry and Technology, Adv. Chem., Series No 21, S 370-374, Washington: Am. Chem. Soc. (1959).
Литература
231
8. Chaigneau М. Sterilisation et desinfection par les gaz, Sainte-Ruffine: Maisonnenve, S 195-207 (1977)
9. Hoffman R.K. Ozone, In: Hugo WB Inhibition and Destruction of the Microbial Cell, S 251-253, London -
New York: Academic Press (1971).
10, Naitoh S. Inhibition of food spoilage fungi by application of ozone. Japan J. Food Microbiol., 11, 11-17 (1994).
11. Brigance A., Buescher R. Effect of ozone on softening enzymes, sorbate, pigment and bacteria in recycled
pickle brine, J. Food Biochem., 16, 359-369 (1993).
12. Kurzmann G.E. Ozonanwendung in der Trinkwasseraufbereitung, Ehningen: Expert-Verlag (1993),
13, KuBmaul H., Gerz R. Ozon in der Wasseraufbereitung, Zweck und Nebenreaktionen. GetrSnke Ind,, 9, 656-658 (1993).
14. Ostruschka M, Die Abtotung von Mikroorganismen in Wasser durch Ozon unter
FlieBgleichgewichtsbedingimgen, Diss, Univ. Tubingen (1993).
15. Kaess G., Weidemann J.F. Ozone treatment of chilled beef. I. Effect of low concentrations
of ozone on microbial spoilage and surface colour of beef J. Food Technol., 3, 325-334 (1968).
16. Kaess G., Weidemann J.F. Ozone treatment of chilled beef. II. Interaction between ozone and muscle J Food
Technol., 3, 335-343 (1968).
17. Date S. Ozone sterilisation — why is it used in many European and South African wineries?
Austral. Grapegrower Winemaker, 371, 39 und 41 (1994).
К главе 12
Обзорная
Green L.F. Sulphur dioxide and food preservation — a review. Food Chem., 1, 103-124 (1976).
Heydenreich G.A. Die schweflige Saure tind ihre Salze in der Lebensmittelverarbeitung und -lagerung. Z.
Ernahrungswiss., 8, 44-65 (1967).
Ough C.S. Sulfur dioxide and Sulfites. In: Branen AL, Davidson PM: Antimicrobials in foods. New York -
Basel: Marcel Dekker, S 137-190 (1993).
Roberts A C., McWeeny D.J. The uses of sulphur dioxide in the food industry. A review. J. Food Technol 7
221-238 (1972).
Wedzicha B.L. Chemistry of sulphur dioxide in foods. London - New York: Elsevier Applied Science
Publishers (1984).
Специальная
1, Bassennann-Jordan F. von. Geschichte des Weinbaus. Frankfurt: Frankfurter Verlags-Anstalt. Band I 2. Aufl, S
460-465 (1923).
2. Strahlmann B. Entdeckungsgeschichte antimikrobieller Konservierungsstoffe fiir Lebensmittel.
Mitt. Geb. Lebensmittelunters Hyg., 65, 96-130 (1974).
3. Monier-Williams G.W. Determination of sulphur dioxide in foods. Analyst, 52, 415-416 (1927).
4. Reith J.F., Willems J.J.L. (1958) Uber die Bestimmung der Schwefligen Saure in Lebensmitteln.
Z. Lebensm. Unters. Forsch., 108, 270-280 (1958).
5. Sullivan J., Hollingworth T-, Wekell M., Meo V, Saba H-, Etemad-Moghadam A., Eklund C. Determination of
total sulfite in shrimp, potatoes, dried pineapple, and white wine by flow injection analysis: collaborative study.
J. Assoc. Off. Anal. Chem., 73, 35-41 (1990).
6. Bendtsen A., Jorgensen S. Determination of total and free sulfite in unstabilized beer by flow injection analysis.
J. AOAC Intern , 77, 948-952 (1994).
7. Warner C., Daniels D., Fitzgerald M., Joe F, Diachenko G. Determination of free and reversibly bound sulphite
in foods by reversed-phase, ion-pairing high-performance liquid chromatography.
Food Add. Contain., 7, 575-581 (1990),
8. Paino-Campa G,, Pena-Egido J., Garcia-Moreno C. Liquid Chromatographic determination of free and total
sulphites in fresh sausages. J. Sci. Food Agric., 56, 85-93 (1991).
9. Cardwell T, Cattrail R.„ Chen G., Scollary G,, Hamilton 1. Determination of sulfur dioxide in wines and
beverages by flow injection analysis with reductive amperometric detection and electrolytic cleanup. J. AOAC
Intern., 76, 1389-1393 (1993).
10. Cabre F., Cascante M., Canela E. A sensitive enzymatic method of sulfite determination. Anal, Lett., 23, 23-30 (1990),
11. Kawamtira Y, Kubo N,, Arata H. A microbial sensor for determination of sulfite in wines.
J. AOAC Intern., 77, 1052-1058 (1994).
12. Fazio T., Warner C. A review of sulphites in foods: analytical methodology and reported findings.
Food Add. Contain., 7, 433-454 (1990).
13. Jaulmes P. Etat actuel des techniques pour le remplacement de I’anhydride sulfureux,
Bull.OlV, 43, 1320 -1333 (1970).
14, Lanteainne M.-T,, Ramel P, Jaulmes P,, Manin D. Determination et comparison des DL 50 du metabisulfite de
potassium, de I’ethanal et de leur combinaison (hydroxy-ethane-sulfonate de potassium) par voie orale sur le rat
de souche Wistar. Ann. Falsif. Expert, Chim., 62, 23 1-241 (1969).
15. Lang K. Die physiologischen Wirkungeii von schwefliger Saure. Hamburg - Berlin - Dusseldorf: В Behr’s
Verlag (I960).
16. Hoppe J.O., Goble F.C. The intravenous toxicity of sodium bisulfite. J, Pharmacol, Exp. Ther., 101, 101-106 (1951).
17. Wucherpfennig K. Zur Toxizitat der schwefligen Saure. Weinberg Keller, 25, 171-184 (1978).
18. Schanderl H. Die Schweflige Saure des Weines in hygienischer Siclit.
Z. Lebensm. Unters. Forsch., 103, 379-386 (1956).
232
Литература
19, Hugot D., Causeret J.. Leclerc J. Effets de Pingest on de sulfites sur Г excretion du calcium chez le rat.
Ann. Biol. Anim. Biochim. Biophys., 5, 53-59 (1965),
20. Bhagat B., Lockett M.F. The effect of sulphite in solid diets on the growth or rats.
Food Cosmet. Toxicol., 2, 1-13 (1964).
21. Shtenberg A. J., Ignat’ev A.D. Toxicological evaluation of some combinations of food preservatives.
Food Cosmet. Toxicol., 8, 369-380 (1970).
22. Rehm H.-J., Wittmann H. Beitragzur Kenntnis der antimikrobiellen Wirkung der schwefligen Saure. II.
Mitteilung. Die Wirkung der dissoziierten und undissoziierten Saure auf verschiedene Mikroorganismen.
Z. Lebensm. Unters, Forsch., 118, 465-478 (1963).
23. Til HP., Feron V.J., Groot A.P. de. The toxicity of sulphite. I. Long-term feeding and multigeneration studies in
rats. Food Cosmet. Toxicol., 10, 463-473 (1972).
24. Fitzhugh O.G., Knudsen L.F., Nelson A. A. The chronic toxicity of sulfites. J. Pharmacol. Exp. Then, 86, 37-48 (1946).
25. Cluzan R., Causeret J., Hugot D. Le metabisulfite de potassium. Etude de toxicite a long terme sur le rat.
Ann. Biol. Anim. Biochim. Biophys., 5, 267-281 (1965).
26. Lockett M.F., Natoff l.L. A study of the toxicity of sulphite. 1. J. Pharm. Pharmacol., 12,488-496 (1960),
27. Lanteaume M.-T., Ramel P., Girard P., Jaulmes P., Gasq M., Ranau J. Effets physiologiques a long terme de
Г anhydride sulfureux ou des sulfites utilises pour le traitment des vins rouges. (Observations portant sur quatre
generations de rats). Ann. Falsif. Expert. Chim., 58, 16-31 (1965).
28. Til H.P., Feron V.J., Groot A.P. de. The toxicity of sulphite. II. Short- and long-term feeding studies in pigs.
Food Cosmet. Toxicol., 10, 291-310 (1972),
29. I ARC Monographs on the evaluation of carcinogenic risk to humans, Vol 54, S 131-186, Lyon: I ARC (1992).
30. Mukai F, Hawryluk I., Shapiro R, The mutagenic specifity of sodium bisulfite.
Biochem. Biophys. Res. Commun., 39, 983-988 (1970).
31. Hayatsu H., Miura A. The mutagenic action of sodium bisulfite. Biochim. Biophys. Acta, 39, 156-160 (1970).
32. Simon R., Stevenson D. Adverse reactions to sulfites. In: Middleton et al. (eds) Allergy, Principles and Practice,
Chapter 67, 3rd Edition (Vol. II) Mosby: St. Louis (1988).
33. Vena G., Foti C., Angelini G. Sulfite contact allergy. Contact. Derm., 31, 172-175 (1994).
34. Belchi-Hernandez J., Florido-Lopez J.. Estrada-Rodriguez J., Martinez-Alzamora F., Lopez-Serrano C., Ojeda-
Casas J. Sulfite-induced urticaria. Ann. Allergy, 71, 230-232 (1993).
35. Nagy S., Teuber S., Loscutof' S., Murphy P. Clustered outbreak of adverse reactions to a salsa containing high
levels of sulfites. J, Food Protect., 58, 95-97 (1995).
36. Bhaghat G., Lockett M.F. The absorption and eliminiatton of metabisulphite and thiosulphate by rats.
J. Pharm. Pharmacol., 12, 690-694 (I960).
37, Gunnison A.F. Sulphite toxicity A critical-review of in vitro and in vivo data.
Food Cosmet. Toxicol., 19, 667-682 (1981).
38. Pfleiderer G. Jeckel D. Wieland T. Uber die Einwirkung von Sulfit aufeinige DPN hydrierende Enzyme,
Biochem. Z., 328, 187-194 (1956).
39. Hotzel D., Muskat E., Cremer H.D. Toxizitat von schwefliger Saure in Abhangigkeit von Bindungsform und
Thiaininversorgung Z. Lebensm. Unters. Forsch., 130, 25-31 (1966).
40. Walinofer P., Rehm H.-J. Beitrag zur Kenntnis der antimikrobiellen Wirkung der schwefligen Saure. V.
Mitteilung. Die Wirkung der schwefligen Saure auf den Stoffwechsel atmender und garender Hefe- und
Colizellen, Z. Lebensm. Unters, Forsch , 127, 195-206 (1965).
41. Rehm H.-J., Wittmann H. Beitrag zur Kenntnis der antimikrobiellen Wirkung der Schwefligen Saure,
1. Mitteilung. Obersicht uber einfluBnehmende Faktoren auf die antimikrobielle Wirkung der schwefligen Saure.
Z. Lebensm. Unters. Forsch., 118,413-429 (1962).
42. King A., Ponting J., Sanschuck D., Jackson R., Mihara K. Factors affecting death of yeast by sulphur dioxide.
J. Food Protection, 44, 92-97 (1981).
43. Rehm H.-L., Sening E., Wittmann H., Walinofer P. Beitrag zur Kenntnis der antimikrobiellen Wirkung der
schwefligen Saure. III. Mitteilung. Aufliebung der antimikrobiellen Wirkung durch Bildung von Sulfonaten.
Z. Lebensm. Unters. Forsch., 123, 425-432 (1964).
44. Rehm H.-J., Walinofer P, Keskin H. Beitrag zur Kenntnis der antimikrobiellen Wirkung der schwefligen Saure.
IV. Mitteilung. Dissoziation und antimikrobielle Wirkung einiger Sulfonate.
Z. Lebensm. Unters. Forsch., 127, 72-85 (1965),
45. Fomachon J.C.M. Inhibition of certain lactic acid bacteria by free and bound sulphur dioxide.
J. Sci. Food Agric., 14, 857-862 (1963).
46. Carr J.G., Davies P.A., Sparks A.H. The toxicity of sulphur dioxide towards certain lactic acid bacteria from
fermented apple juice. J. Appl. Bacteriol., 40, 201-212 (1976).
47. Rehm H.-J., Wittmann H., Stahl U, Untersuchungen zur Wirkung von Konservierungsmittelkombinationen,
VI. Das antimikrobielle Spektrum bei Kombinationen von Konservierungsmittehi.
Z. Lebensm. Unters. Forsch., 115, 244-262 (1961)
48. Kidney A. J. The use of sulphite in meat processing. Chem. Ind. (London), S 717-718 (1974).
49. Rose A. Sulphur dioxide and other preservatives. J, Wine Res., 4, 43-47 (1993).
50. Wucherpfennig K., Frank 1., Bretthauer G. Uber die Herstellung von SiiBreserve durch Stumm-
und Eutschwefelung Allg. Dtsch. Weinztg., 109, 850-858 (1973).
51. Lafon-Lafourcade S., Peynaud E. Sur Paction antibacterienne de I’anhydride sulfureux sous forme libre et sous
forme combinee. Connaiss. Vigne Vin., 8, 187-203 (1974).
52. Schanderl H. Die Mikrobiologie des Mostes und Weines. Stuttgart: Eugen Uhner S 244 (1959).
Литература
233
53. Sapers G.M, Scientific status summary: Browning of foods: Control by sulfites, antioxidants and other means
Food Technol., 47 :10, 75-84 (1993).
54. Tabata S,, Kamimura H,, Ibe A., Hashimoto H., Tamura Y. Degradation of aflatoxins by food additives.
J. Food Protect., 57, 42-47 (1994).
55. Reutimann U., Bill R., Durr p_, Schobinger U, Ersatz von SO, durch 5,6-SulfinyI-L-Ascorbinsaure bei der
Weinbereitung. Mitt. Klosterneuburg, 41,65-70 (1991).
56. Sapers G.M., Miller R. Enzymatic browning control in potato with ascorbic-2-phosphates.
J. Food Sci., 57, 1132-1135 (1992).
К главе 13
I. Drager-Rohrchen Handbuch, Lubeck: Dragerwerk AG (1991).
2. Trueman J.R. The Halogens. In: Hugo WB: Inhibition and Destruction of the Microbial Cell London - New
York: Academic Press. S 137-183 (1971).
3. Dychdala G.R Chlorine and chlorine compounds. In: Block S.S.: Disinfection, Sterilization and Preservation.
Philadelphia: Lea and Febiger. S 319-324 (1977).
4. International Agency for Research and Treatment on Cancer, Monograph 52 Chlorinated drinking water
S 15-359, Lyon: IARC (1991).
5. Chlorine dioxide use in poultry preserving cleared by FDA. Food Chem. News vom 6.3.1995, S. 53 (1995).
6. Roberts R., Reymond S. Chlorine dioxide for reducing of postharvest pathogen inoculum during handling of
tree fruits. Appl. Envfronm. Microbiol., 60, 2864-2868 (1994).
7. Wellinghoff S. Deeping food fresh longer. Technol. Today Jimi, 1995, 20-22.
К главе 14
I. Beutler H.-О., Michal G. Nene Methode zur enzymatischen Bestiinmung von Athanol in Lebensmitteln.
Z. Anal. Chem., 284, 113-II7 (1977).
2. Barka G., Heidger V. Erfahrungen mit der neuen Bestimmungsmethode fiir Zucker und Alkohole in
der Lebensmittelanalytik. GIT Suppl. (2), 32-38 (1989).
3. Spector W.S. Handbook of Toxicology Band 1, 128-131, Philadelphia - London: WB Saunders (1956).
4. Widmark E.M.P. Die Maximalgrenzen der Alkoholkonsuinption, Biochem. Z., 259, 285-293 (1933).
5. Seitz M., Heipertz W., Osswald B., Horner M,, Simanowski IL, Egerer G., Kommerell B. Leberschaden durch
Alkohol. Bundesgesundheitsbi,, 34, 101-104 (1991).
6. Seitz M., Simanowski IL, Lieber C. Alkoholismus und alkoholische Organschaden, Heidelberg: Hiithig (1993).
7. Toniolo P., Riboli E., Protta E, Charrel M., Coppa A. Breast cancer and alcoholic consumption: A case-control
study in northern Italy. Cancer Res., 49, 5203-5206 (1989).
8. Wu A., Paganini-Hill A., Ross B., Henderson B. Alcohol, physical activity and other risk factors for colorectal
cancer. A prospective study. Brit. J. Cancer, 55, 687-694 (1987).
9. Shapero S.M., Nelson D.A , Labuza T.P. Ethanol inhibition of Staphylococcus aureus at limited water activity.
J Food Sci., 43, 1467-1469 (1978).
10. Hayes S. Ethanol-induced genotoxicity. Mutat. Res., 143, 23-27 (1985).
11. Obe G., Ristow H Mutagenic, cancerogenic and teratogenic effects of alcohol. Mutat. Res., 65, 229-259 (1979).
12. Yamamoto Y, Higashi K., Yoshi H. Inhibitory activity of ethanol on food spoilage bacteria. Part IL Studies on
growth inhibition of food spoilage microorganisms for low salt foods. Nippon Shokuhin Kogyo Gakkaishi, 31,
531-535 (1984).
13. Schmidt-Lorenz W , Hotz F. Ethanolvorbehandlung zur selektiven Koloniezahhing von Bacillussporen bei
Gewiirzen. Mitt. Gebiete Lebensm. Hyg., 76, 127-155 (1985)
14. McCarthy T., van Eeden A., Stephenson N., Newman C. Interaction between ethanol and selected antimicrobial
preservatives. S. Afric. J. Sci., 84, 128-132 (1988).
15. Parish M., Carroll D. Minimum inhibitory concentration studies of antimicrobic combinations
against Saccharomyces cerevisiae in a model broth system. J. Food Sci., 53, 237-242 (1988).
16. Seiler D.A. Flour Milling and Baking. Res. Assoc. Bull,, 2, 64 (1979).
17. Vora M., Sidhu J. Effects of varying concentrations of ethyl alcohol and carbon dioxide on the shelflife
ofbread. Chem. Mikrobiol. Technol. Lebensm., 11, 56-59 (1987).
К главе 15
I. Gromes R., MorsbergerF. Enzymatische Zuckerbestimmung. Bio. Tec., 2, 32 (1992).
2. Barka G., Heidger V. Neue Bestimmungsmethode fiir Zucker und Alkohol in Getranken. GIT Suppl. (2), 32-38 (1989).
3. Schleich W., Engelhardt H. Moglichkeiten der HPLC in der Zuckeranalytik. GIT Fachz. Lab., 33, 624, 630 (1989).
4. Solbrig-Lebuhn M. Kohlenhydratanalytik, Laborpraxis, 16, 786-789 (1992).
5. Kaufmann A. Obersicht und Anwendimg der HPLC-Analytik von Sauren und Zucker im Wein. Mitt. Geb.
Lebensmittelunters Hyg., 84, 31 1-333 (1993).
6. Boyd E.M., Godi L, Abel M. Acute oral toxicity of sucrose. Toxicol. Appl. Pharmacol., 7, 609-618 (1963).
7. DGE: Emahrungsbericht S 34 Frankfurt- Henrich (1988).
8. Schraitle S., Siebert G. Zahngesundheit und Ernahrung. Munchen: Hanser (1987).
234
Литература
9, Diet, nutrition and the prevention of chronic diseases. Report of a WHO study group. Techn. Rep. Ser. No 797.
Geneva: WHO (1990).
10, Vettorazzi G., MacDonald 1. Sucrose. Nutritional and safety aspects. Heidelberg: Springer(1988).
11. Bassler K. Zucker: Ernahrungsmedizinische Bedeutung von Zucker — Eine Bestandsaufnahme,
Z. Ernahrungswiss., 29, Suppl. I, 1-69 (1990).
12. Black P. Sucrose in health and nutrition — Facts and myths. Food Technol., 47 (1), 130-133 (1993).
13. Romming 1., Frank H. Growth response of putrefactive/anaerobe 3679 to combinations of potassium sorbate
and some common curing ingredients (sucrose, salt and nitrite), and to noninhibitory levels of sorbic acid.
J. Food Protect., 51,651-654 (1988).
14. Doyle M.P., Marth E.H. Thermal inactivation of conidia from Aspergillus flavus and Aspergillus parasiticus.
11. Effects of pH and buffers, glucose, sucrose and sodium chloride. J. Milk Food Technol., 38,750-758 (1 975).
15. Seiler DAL. Equilibrium relative humidity of baked products with particular reference to the shelflife of
cakes. In: BFM1RA: Relative humidity in the food industry. Proceedings of a symposium held in London,
16.9.1969, Symposium Proc., No 4, S 28-36 (1969).
16. Bills S., Restaino L., Lenovich L.M. Growth response of an osmotolerant sorbate-resistant yeast, Saccharo-
myces rouxii, at different sucrose and sorbate levels. J. Food Protect., 45, 1120-1124 (1982).
17 Lubieniecki-von Schellhorn M. Die Sauerstoffkonzentration als bestimmender Faktor fiir mikrobielle Vorgange
in Lebensmitteln untei besouderer Berilcksicktigung einer sauerstofffreien Verpackung. Verpack-Rundsch. 26
Wiss. Beilage zu Nr 1, S 1-6 (1975).
К главе 16
I Jodin E-V. Etudes sur quelques proprietes de I’acide formique. C. Rend., 61, 1179-118l (1865).
2. Bremanis E. Die photometrische Bestiminimg des Forinaldehyds mit ChromotropsSure. Z. Anal. Chem., 130,
44-47 (1949).
3. Tanner H. Photometrische Schnellbestimmung von Ameisensaure in Getranken. Schweiz. Z. Obst. Weinbau.,
112, 38-42 (1976).
4. Reinefeld E., Bliesner K.-M. Enzymatische Bestimmung von Ameisensaure und ihre Anwendung auf Melassen.
Zuckerind., 30, 650-652 (1977).
5. Malorny G. Die akute und chronische Toxizitat der Ameisensaure und ihrer Formiate.
Z. Ernahrungswiss., 9, 332-339 (1969).
6. Spom A., Marin V., Schobesch C. Cercefri cu privire la toxicetatea acidului formic. Igiena, 11, 507-515 (1962).
7. Tracor-Jitco, Inc. Scientific literature reviews on Generally Recognized as Safe (GRAS) food ingredients —
formic acid and derivates. PB-228558. Springfield: National Technical Information Service, US Department
of Commerce (1974).
8. Life Sciences Research Office, Federation of American Societies for Experimental Biology, Evaluation of the
health aspects of formic acid, sodium formate, and ethyl formate as food ingredients, PB-266282. Springfield:
National Technical Information Service, US Department of Commerce (1976).
9. Malorny G. Stoffwechselversuche mit Natriumformiat und Ameisensaure beim Menschen. Z. Ernahrungswiss.,
9, 340-348 (1969).
10. Palese M., Tephly T.R. Metabolism of formate in the rat. J. Toxicol. Environ. Health., 1, 13-24 (1975).
11. Scheer H (1971 a) Uber die konservierende Wirkung von Natriumformiat. Arch Fischereiwiss 22, 7 9-84
12. Lilck H. EinfluB von Konservienuigsmittehi auf Haminenzyme. 1. Mitteilung. Allgemeine Wirkung. Z. Lebensm.
Unters. Forsch., 108, 1-9 (1958).
13. Liick H, Katalasehemmung durch organische Sauren. Biochem. Z., 328, 411-419 (1957).
14. Scheer H. Uber den EinfluB von GenuB- und Mineralsauren auf die konservierende Wirkung von Natrium-
formiat. Arch. Fischereiwiss.. 22, 263-279 (1971).
15. Luck H., Rickerl E. Untersuchungen an Escherichia coli uber eine Resistenzsteigerung gegen Konservierungs-
mittel und Antibiotica. Z. Lebensm. Unters. Forsch., 109, 322-329 (1969).
16. Rehm H.-J. Untersuchungen zur Wirkung von Konservierungsmittelkombmationen. V. Zur Frage der Resistenz von
Mikroorganismen gegen Konservierungsmittel in Kombinaten. Z. Lebensm. Unters. Forsch., 115, 27-46 (1961).
17. Rehm H.-J. Grenzhemmkonzentrationen der zugelassenen Konservierungsmittel gegen Mikroorganismen.
Z. Lebensm. Unters. Forsch., 115, 293-309 (1961).
18. Balatsouras G.D., Polyinenacos N.G. Chemical preservatives as inhibitors of yeast growth.
J. Food Sci., 28,267-275 (1963).
К главе 17
I. Bouzas J., Knatt C., Bodyfeldt E, Torres A. Simultaneous determination of sugars and organic acids in cheddar
cheese by high-performance liquid chromatography. J. Food Sci., 56, 276-279 (1991).
2. Conner H.A., Allgeier R.J. Vinegar: 1st history and development. Adv. Appl. Microbiol., 20, 81-133 (1976).
3. Keszthelyi G. Der heutige Stand der biologischen Herstellung von Essigsaure unter besonderer Berticksichtigung
von submers arbeitenden Verfahren. Mitt Hoheren Bundeslehr-Versuchsanst Wein Obstbau Klosterneuburg, 24,
445-454 (1974).
4. Greenshields R.N. Acetic acid. Vinegar Econ. Microbiol., 2, 121-186 (1978).
5. Bonitnann G., Kiichle H.J., Loeser A , Meyer G., Stflrmer E. Uber die Wirkung von Essig aus Essigessenz und
Essigaus Athylalkohol aufden Organising. Z. Lebensm. Unters. Forsch., 94, 234-240 (1952),
Литература
235
6. Oettingeo W.F., von. The aliphatic acids and their esters — toxicity and potential dangers. The saturated
monobasic aliphatic acids and their esters. Acetic acid and esters: Acetic acid Amer. Med. Assoc Arch Ind
Health, 21, 28-32 (1960).
7. Spector, W.S.: Handbook of toxicology. Vol I. Philadelphia - London: WB Saunders S, 44-45 und 56-57 (1956).
8. B1BRA. Toxicity profile acetic acid and its common salts (1987).
9, Hentschler D, Toxikologisch-arbeitsmedizinische Begrihidungen von MAK-Werten. Weinheim. VCH
Loseblattsammlung (1993).
10. Reynolds A.E. The mode of action of acetic acid on bacteria. Diss, Abstr. B, 35, 4935-4936 (1975).
11. Woolford M.K. Microbiological screening of the straight chain fatty acids (Cl-C 12) as potential silage
additives. J. Sci. Food Agric., 26, 219-228 (1975).
12. Yamamoto Y., Higashi K.., Yoshii H. Inhibitory activity of acetic acid on yeasts (Studies on growth inhibition of food
spoilage microorganisms for low salt foods. Part 111). Nippon Shokuhin Kogyo Gakkaishi, 31, 772-776 (1984).
13. Yamamoto Y., Higashi K., Yoshii H. Inhibitory activity of organic acids on food spoilage bacteria (Studies
on growth inhibition of food spoilage microorganisms for low salt foods. Part 1). Nippon Shokuhin Kogyo
Gakkaishi 31, 525-530 (1984).
14. Baumgart J., Libuda H. Haltbarkeit von Mayonnaise» und Feinkostsalaten in Abhangigkeit von Konservierungs-
stoff- und Essigsaureanteil. Z. Lebensmittel-Technol. Verfahrenstechn., 28 (5), 181-182 (1977).
15. StOltzing U. EinfluB von Essigsaure und Puffersubstanzen auf die Haltbarkeit und die sensorischen Eigenschaften
unkonservierter Salatmayonnaise. Lebensmitteltechn., 19 (5), 96-99 (1987).
16. Watkins E.J. Ropiness in flour and bread and its detection and prevention.
J. Soc Chem. Ind. (London), 25, 350-357 (1906).
17. Meyer V. Probleme des Verderbens von Fischkonserven in Dosen. Vll. Untersuchungen uber die Entstehung der
Aminosauren beim Mariniereii von Heringen. VerOff. Inst. Meeresforsch. Bremerhaven, 8, 21-36 (1962).
К главе 18
I. Hoffman C., Dalby G., Schweitzer T.R. (Ward Baking Company, New York): Process for inhibition of mold.
US Patent 2J54449 (1938).
2. Watkins E.J. Ropiness in flour and bread and its detection and prevention. J. Soc. Chem. Ind. (London), 25,
350-357 (1906).
3. Losada P,. Lozano J., Gandara J. Contribucion a la identificacion de aditivos conservadores.
Alimentaria, 204, 57-83 (1989).
4, Luck E., Oeser H., Remmert K..-H., Sabel J. Uber das Nichtvorkommen von Propionsaure in Roggen-
und Mischbrot. Z. Lebensm. Unters. Forsch., 158, 27-29 (1975).
5. Badoud R., Pratz G. Improved high performance liquid Chromatographic analysis of some carboxylic acids
in food and beverages as there p-nitrobenzyl esters. J. Chromatography, 360, 119-136 (1986).
6. Toxicity profile. Propionic acid and its common salts. Carshalton, GroBbritannien, British Industrial Biological
Research Association (1987).
7. Sado 1. Synergistic toxicity of official permissible preservative food additives. Nippon Eiseigaku Zasshi, 28,
463-476 (1973).
8. Harshbarger K..E. Report of a study on the toxicity of several food-preserving agents. J. Dairy Sci., 25, 168-174 (1942).
9. McAtee J.W., Little C O., Mitchell G.E. Utilization of rumen metabolites as energy sources in rats.
Life Sci., 7 11, 769-775 (1968)
10. Cole D.J.A., Beal R.M., Luscombe J.R. The effect on performance and bacterial flora of lactic acid, propionic acid,
calcium propionate and calcium acrylate in the drinking water of weaned pigs. Vet. Rec., 83, 459-464 (1968).
11. Litton Bionetics, Inc: Mutagenic evaluation of compound FDA 75-62 Propionic acid, PB-266897. Springfield:
National Technical Information Service. US Department of Commerce 1976 u. Mutagenic evaluation of
compound FDA 75-61 Sodium propionate NF, FCC. PB-266900, Springfield: National Technical Information
Service. US Department of Commerce 1976.
|2. Griem W. Tumorogene Wirkung von Propionsaure an der Vormagenschieimhaut von Ratten im Fiitterungsversuch.
Bundesgesundheitsbl., 28, 322-327 (1985).
13. Harrison P, Grasso P., Badescu V. Early changes m the forestomach of rats, mice and hamsters exposed to
dietary propionic and butyric acid. Food Chem. Toxicol., 29, 367-371 (1991).
14. Boeld j., Netter K. Factors effecting distribution of ingested propionic acid in the rat forestomach.
Food Chem. Toxic., 31, 169-1976 (1993).
15. Harrison P. Propionic acid and a phenomenon of rodent forestomach tumorigenesis: A review. Food Chem.
Toxicol, 30, 333-340 (1992).
16. Wissenschaftlicher LebensmittelausschuB der Europaischen Gemeinschaft. Bericht des Wissenschaftlichen
Lebensmittelausschusses vom 19. Oktober 1990, Seite 11, „Propionsaure"
17. Elliot J.M., Hogue D.E., Myers G.S., Loosli J.K. Effect of acetate and propionate on the utilization of energy
by growing-fattening lambs. J. Nutr., 87, 233-238 (1965).
18. Bassler K.H. Stoffwechsel und Stoffwechselwirkungen von Propionsaure im Hinblick aufihre Verwendung
als Konservierungsmittel. Z. Lebensm. Unters. Forsch., 110, 28-42 (1959).
19. Rendina G., Coon M.J. Enzymatic hydrolysis of the coenzyme A, thiol esters of P-hydroxypropionic
and P-hydroxyisobutyric acids. J. Biol. Chem., 225, 523-534 (1957).
20. Salmond C.V., Kroll R.G., Booth I.R. The effect of food preservatives on pH homeostasis in Escherichia coli.
J. Gen. Microbiol., 130, 2845-2850 (f 984).
236
Литература
21. Eklund Т. Inhibition of microbial growth at different pH levels by benzoic and propionic acids and esters
of p-hydroxybenzoic acid. Int. J. Food Microbiol., 2, 159-167 (1985).
22. Schelhom M. von. Wirksamkeit und Wirkungsbereich chemischer Konservierungsmittel fiir Lebensmittel.
Z. Lebensm. Unters. Forsch., 92, 256-266 und Untersuchungen iiber Konservierungsmittel. V. Zur Frage
des Vergleichs der Wirksamkeit von Konservierungsmitteln. Dtsch. Lebensm. Rundsch., 47, 16-18 (1951).
23. Heseltine W.W. Sodium propionate and its derivatives as bacteriostatics and fungistatics.
J. Pharm. Pharmacol., 4, 577-581 (1952).
24. ReiB J. Mycotoxine in Lebensmitteln. VHI. Hemmimg des Schimmelpilzwachstums und der Bildung von
Mycotoxinen (Aflatoxine Bl undGl, Patulin, Sterigmatocystin) in Weizenvollkornbrot durch Sorbinsaure
und Sorboylpalmitat. Dtsch. Lebensm. Rundsch., 72, 51-54 (1976).
25. Seiler D.A.L. Factors affecting the use of mould inhibitors in bread and cake. Proc. 4th Int. Symp. Food
Microbiol. Goteborg, S 221-220 (1964).
26. Rabe E. Propionsatire in Sauerteig und Brot. Getreide, Mehl. Brot., 32, 85-89 (1978).
К главе 19
Обзорная
Keller C.L., Balaban S.M., Hickey C.S. and DiFate V.G.: Sorbic acid. In: Kirk-Othmer: Encyclopedia of chemical
technology. 3. Aufl Band 21, S 402-416. New York Chichester Brisbane Toronto Singapore: John Wiley (1983).
Liick E: Sorbinsaure. Chemie - Biochemie - Mikrobiologie - Technologie - Recht. Hamburg: В Behr’s Verlag
4 Bande 1969-1973.
Liick E. Food applications of sorbic acid and its salts. Food Add. Contain., 7, 71 1-715 (1990).
Liick E.: Sorbic Acid. In: Ullmann’s Encyclopedia of Industrial Chemistry. 5. Aufl Band A 24, S 507-513.
Weinheim. VCH Publishers 1993.
Sofos J.N.: Sorbate Food Preservatives, Boca Raton: CRC Press 1989.
Специальная
I. Thakur B.R., Sing R.K., Arya S.S. Chemistry of sorbates — A basic perspective. Food Rev. Int., 10, 71-91 (1994).
2. Schmidt H. Eine spezifische colorimetrische Methode zur Bestimmung der Sorbinsaure.
Z. Anal. Chem., 178, 173-184 (1960).
3. Luckmann F.H., Melnick D. Sorbic acid as a fungistatic agent for foods. X. Spectrophotometric determination
of sorbic acid in foods in general Food Res.. 20, 649-654 (1955).
4. Bui L., Kooper C. Reversed-phase liquid Chromatographic determination of benzoic and sorbic acids in foods.
J. Assoc. Off. Anal. Chem., 70, 892-896 (1987).
5. Hagenauer-Hener U., Frank C., Hener U , Mosandl A. Bestimmung von Aspartam, Acesulfam-K, Saccharin, Coffein,
Sorbinsaure und Benzoesatire in Lebensmitteln mittels HPLC. Dtsch. Lebensm. Rundsch., 83, 348-351 (1990).
6. Reifschneider C., Klug C , Jager M. Identifizierung und Quantifizierung von Konservierungsstoffen
in kosmetischen Mitteln. Seifen-Ole-Fette-Wachse J., 120, 650-654 (1994).
7. Kiippers S. Reversed-phase liquid Chromatographic determination of benzoic and sorbic acids in fresh cheese.
J. Assoc Off. Anal. Chem., 71, 1068-1071 (1988).
8. Olea Serrano E, Lopes 1., Revilla N. High performance liquid chromatography determination of chemical
preservatives in yogurt. J. Liq. Chromat., 14, 709-717 (1991).
9. Kantasubrata J., Imamkhasani S. Analysis of additives in fruit juice using HPLC. ASEAN Food J., 6, 155-158 (1991).
10. Flak W., Schaber R. Die Bestimmung von Konservierungsmitteln in Wein und anderen Getranken mittels
Hochdruckfliissigkeitschromatographie. Mitt. Klosterneuburg, 38, 10-16 (1988).
11. Schweizer Lebensmittelbuch, Kapitel 44: „Konservierungsmittel fiir Lebensmittel", Neuausgabe 1. Teillieferung,
Mai 1992, Bundesamt fiir das Gesundheitswesen, Beni.
12. Karovicova J., Polonski J., Simko P. Determination of preservatives in some food products by capillary
isotachophoresis. Nahning, 35, 543-544 (1991).
13. Cox P. Sorbic acid. Acta Cryst. C., 50, 1620-1622 (1994).
14. Liick E. Sorbic Acid. In: Ullmanns Encyclopedia of Industrial Chemistry. 5. Aufl Band A 24, S 507-513.
Weinheim. VCH Publishers 1993.
15. Deuel H.J., Alfin-Slater R , Weil C.S., Smyth H.F. Sorbic acid as a fungistatic agent for foods. 1. Harmlessoess
of sorbic acid as a dietary component. Food Res., 19, 1-12 (1954).
16. Smyth H.F., Carpenter C.P Further experience with the range finding test in the industrial toxicological
laboratory. J. Ind. Hyg. Toxicol., 30, 63-68 (1948).
17. Sado 1. Synergistic toxicity of official pennissible preservative food additives. Nippon Eiseigaku Zasshi, 28,
463-476 (1973).
18. Vieths S., Fischer K., Deline L.I., Bogl K.W. Allergenes Potential von verarbeiteten Lebensmitteln. Emahrungs«
Umschau, 41, 140-143, 186-190 (1994).
19. Rosenhall L. Evaluation of intolerance to analgetics, preservatives and food colorants with challange tests.
Eur. J. Respir. Dis., 63,410^119 (1982).
20. Hannuksela M., Haahtela T. Hypersensitivity reactions to food additives. Allergy, 42, 561-575 (1987).
21. Haberle M. Pseudoallergische Reaktion auf Konservierungs- und Farbstoffe. Emahrungs-Umschau, 36, 8-16 (1989).
22. Koch C.S. Okotoxikologische Daten von Kosmetik-Konservierungsstoffen. Seifen-Ole-Fette-Wachse-J., 120,
655-660 (1994).
23. Cremer H.D., Tolckmitt W., Wenderhold J. Beitrag zur Physiologie der Sorbinsaure. Klin. Wochenschr, 37, 304 (1959).
Литература
237
24. Demaree G.E., Sjogren D.W., McCashland B.W., Cosgrove F.P. Preliminary studies on the effect of feeding
sorbic acid upon the growth, reproduction, and cellular metabolism of albino rats. J. Am. Pharm. Assoc Sci
Ed., 44, 619-621 (1955)
25. Food and Drug Research Laboratories, Inc. Scientific literature reviews on Generally Recognized as Safe
(GRAS) food ingredients — sorbic acid and derivatives. PB-223864. Springfield: National Technical
Information Service. US Department of Commerce (1973).
26. BIBRA, British Industrial Biological Research Organization. Toxicity profile, Sorbic acid and its common salts
carshalton (1987).
27. Walker R. Toxicology of sorbic acid and sorbates. Food Add. Contain., 7, 671-676 (1990).
28. Lang K. Die Vertraglichkeit der Sorbinsaure. Arzneim Forsch., 10, 997-999 (1960).
29. Shtenberg A.J., Ignat’ev A.D. Toxicological evaluation of some combinations of food preservatives. Food
Cosmet. Toxicol., 8, 369—380 (1970).
30. Gaunt IF., Butterworth K.R., Hardy J., Gangolli S.D. Long-term toxicity of sorbic acid in the rat Food Cosmet
Toxicol., 13, 31-45 (1975).
31. Hendy R.J., Hardy J., Gaunt I F., Kiss I.S., Butterworth K.R. Long-term toxicity studies of sorbic acid in mice.
Food Cosmet. Toxicol., 14, 381-386 (1976).
32. Dickens F, Jones H.E.H. Waynforth H.B. Further tests on the carcinogenicity of sorbic acid in the rat. Brit J.
Cancer, 22, 762-768 (1968).
33. Litton Bionetics, Inc. Mutagenic evaluation of compound FDA 73-4, potassium sorbate. PB-245434.
Springfield: National Technical Information Service. US Department of Commerce (1974).
34. Litton Bionetics, Inc. Mutagenic evaluation of compound FDA 75-73. 00749Z-55-9. Calcium sorbate. PB-
266894. Springfield: Technical Information Service. US Department of Commerce (1977).
35. Food and Drug Research Laboratories, Inc. Teratologic evaluation of FDA 73-4, potassium sorbate; Sorbistat
in mice and rats. PB-245520. Springfield: National Technical Information Service. US Department of
Commerce (1975).
36. Mhnzener R., Guigas C., Renner H. Re-examination of potassium sorbate and sodium sorbate for possible
genotoxic potential. Food Chem. Toxicol., 28, 397-401 (1990).
37. Schiffmann D., Schlatter J. Genotoxicity and cell transformation studies with sorbates in Syrian hamster embryo
fibroblasts. Food Chem. Toxicol., 30, 669-672 (1992).
38. Schlatter J., Wurgler F, Kranzlin R., Maier P, Holliger E., Graf U. The potential genotoxicity of sorbates: effects
on cycle in vitro in V 79 cells and somatic mutations in Drosophila. Food Chem. Toxicol., 30, 843-851 (1992).
39. Wurgler F. Schlatter J., Maier P. The genotoxicity status of sorbic acid, potassium sorbate and sodium sorbate.
Mutat. Res., 283, 107-111 (1992).
40. Jung R., Cojocel C., Muller W., Bottger D., Liick E. Evaluation of the genotoxic potential of sorbic acid and
potassium sorbate. Food Chem. Toxicol., 30, 1-7 (1992).
41. Liick E. Sorbinsaure. Chemie - Biochemie - Mikrobiologie - Technologic. Band 2. Hamburg: В Behr’s Verlag,
S 15-18, 21, 42-87 (1972).
42. Deuel H.J., Calbert C.E., Anisfeld L., McKeehan H., Blunden H.D. Sorbic acid as a fungistatic agent for foods.
11 Metabolism of a,p-unsaturated fatty acids with emphasis on sorbic acid. Food Res., 19, 13-19 (1954).
43. Kuhn R., Kohler F., Kohler L. Uber die biologische Oxydation hochungesattigter Fettsauren. Ein neuer Weg zur
Darstellung von Polyendicarbonsauren. Hoppe Seyler’s Z. Physiol. Chem., 247, 197-219 (1937).
44. Fingerhut M., Schmidt B., Lang K. Uber den Stoffwechsel der ]-14C-Sorbinsaure. Biochem. Z., 336, 118-125
(1962).
45. Westoo G. On the metabolism of sorbic acid on the mouse. Acta Chem. Scand., 18, 1373-1378 (1964).
46. Azukas J.J. Sorbic acid inhibii ion of enolase from yeast and lactic acid bacteria. Thesis Michigan State Univ. (1962).
47. Rehm H.-J. Zur Kenntnis der antimikrobiellen Wirkung der Sorbinsaure. 6. Mitteilung. Die Wirkung von
Sorbinsaure auf den Kohlenhydratstoffwechsel von Escherichia coli. Zentralbl. Bakteriol. Parasitenkd.
Infektionskr. Hyg, Abt., 2, 121, 492-502 (1967).
48 Rehm H.-J. Wallnofer P. Zur Kenntnis der antimikrobiellen Wirkung der Sorbinsaure. Naturwissenschaften 51,
13-14 (1964).
49. York G.K., Vaughn R.H. Mechanisms in the inhibition of microorganisms by sorbic acid.
J. Bacteriol., 88, 41 1-417 (1964).
50. Martoadiprawito W., Whitaker J R. Potassium sorbate inhibition of yeast alcohol dehydrogenase. Biochem.
Biophys Acta, 77, 536-544 (1963).
51. Liick H. Katalasehemmung durch organische Sauren. Biochem. Z., 328, 41 1-419 (1957).
52. Liick H. EinfluB von Konservierungsmitteln auf HSininenzyme. I. Mitteilung. Allgemeine Wirkung. Z. Lebensm.
Unters. Forsch., 108, 1-9 (1958).
53 Ltewen M.B. Marth E.H. Growth and inhibition of microorganisms in the presence of sorbic acid: A review.
J. Food Protect., 48, 364-375 (1985).
54. Eklund T. Inhibition of growth and uptake processes in bacteria by some chemical food preservatives.
J. Appl. Bacteriol., 48, 423-432 (1980).
55. Eklimd T. Chemical food preservation — some basic aspects and practical considerations. Vortrag Applied food
science in food preservation London am 18.11.1981.
56. Eklund T. The effect ofsorbic acid and esters of p-hydroxybenzoic acid on the protonmotive force in Escherichia
coli membrane vesicles. J. Gen. Microbiol., 131,73-76 (1985),
57. Oka S. Studies on transfer of antiseptics to microbes and their toxic effect. Part 1. Accumulation of acid
antiseptics in yeast cells. Bull. Agric. Chem. Soc. Japan, 24, 59-65 (I960).
238
Литература
58 Rehm H.-J., Lukas E.-M. Zur Kenntnis der antimikrobiellen Wirkung der Sorbiusaure. I. Mitteilung.
Die Wirkung der undissoziierten und dissoziierten Anteile der Sorbiusaure auf Mikroorganisinen.
Zbl. Bakteriol. Parasitenkunde, Infektinskrankh., Hyg., II. Abt., 117, 306-318 (1963).
59. Eklund T. The antimicrobial effect of dissociated and undissociated sorbic acid at different pH levels
J. Appl. Bacteriol., 54,383-389 (1983).
60. Luck H., Rickerl E. Untersuchungen an Escherichia coli uber eine Resistenzsteigerung gegen Konservierungs-
inittel und Antibiotica. Z. Lebensm. Unters. Forsch., 109, 322-329 (1959).
61. Lukas E.-M. Zur Kenntnis der antimikrobiellen Wirkung der Sorbiusaure. II. Mitteilung. Die Wirkung der
Sorbiusaure auf Aspergillus niger von Tieghem und audere Schimmelpilze. Zentralbl. Bakteriol. Parasitenkd.
Infektionskr. Hyg., II. Abt., 117, 485-509 (1964).
62. Viflas I., Morlans I., Sanchis V. Potential for the development of tolerance by Aspergillus ainstelodami. A
repens and A ruber after repeated exposure to potassium sorbate. Zbl. Mikrobiol., 145, 187-193 (1 990).
63. Finol M L., Marth E.H., Lindsay R C. Depletion of sorbate from different media during growth of Penicillium
species. J. Food Protect., 45, 398-404 (1982).
64. Kinderlerer J.. Hatton P. Fungal metabolites of sorbic acid. Food Add. Contain , 7, 657-669 (1990).
65. Marth E.H., Capp C.M., Hasenzahl L., Jackson H.W., Hussong R.V. Degradation of potassium sorbate by
Penicillium species J. Dairy Sci., 49, 1197-1205 (1966).
66. Radler F. Degradation de 1’acide sorbique par les bacteries. Bull. OIV, 49, 629-635 (1976).
67. Crowell E.A., Guymon J.F. Wine constituents arising from sorbic acid addition, and identification of 2-ethoxy-
hexa-3,5-diene as source of geranium-like off-odor. Am J. Enol Vitic., 26, 97-102 (1975).
68. Rymon Lipinsky G.-W., von, Liick E., Oeser H., Lomker F. Entstehung und Ursachen des ,,Geranientons“. Mitt.
Rebe, Wein, Obstbau Frtichteverwert, 25, 387-394 (1 975).
69. WallhauBer K.H., Liick E. Der EinfluB der Sorbiusaure auf mycotoxinbildende Pilze in Lebensmitteln. Dtsch.
Lebensm. Rundsch , 66, 88-92 (1970).
70. Emard L.O., Vaughn R.H. Selectivity of sorbic acid media for the catalase negative lactic acid bacteria and
Clostridia. J. Bacteriol., 63, 487-494 (1952).
71. York G.K. Studies on the inhibition of microbes by sorbic acid Thesis Univ. California (1950).
72. York G.K., Vaughn R.H. Resistance of Clostridium parabotuiinum to sorbic acid. Food Res., 20, 60-65 (1955).
73. Ivey F.J., Robach M.C. Effect ofsorbic acid and sodium nitrite on Clostridium botulinum outgrowth and toxin
production in canned comminuted pork. J. Food Sci., 43, 1782-1785 (1978).
74. Ivey F.J., Shaver K.J., Christiansen L.N., Tompkin R.B. Effect of potassium sorbate on toxinogenesis by
Clostridium botulinum in bacon J. Food Protect., 41, 621-625 (1978)
75. Leistner L., Bern Z., Hechehnann H Potassium sorbate — an alternative to nitrite in meat products. Proc. 24th
Europ. Meat Res. Congr., 1978, III W 2:1-9.
76. Sofos J.N., Busta F.F. Antimicrobial activity of sorbate. J. Food Protect., 44, 614-622 (1981).
77. Sofos J. Sorbic acid, inode of action. In: Enzyclopedia of microbiology edited by J. Lederberg, New York:
Academic Press (1992).
78. Rehm H.-J. Grenzheininkonzentrationen der zugelassenen Konservierungsmittel gegen Mikroorganismen.
Z. Lebensm. Unters. Forsch , 115, 293-309 (1961).
79. Becker E. Roeder 1. Sorbiusaure als Konservierungsmittel fiir Margarine. Fette, Seifen, Anstrichm., 59, 321—
328 (1 957).
80. Liick E. Sorbiusaure als Konservierungsstoff fiir Kase. Dtsch. Molk. Ztg., 89, 520-521 (1968).
81. Perry G.A. Lawrence R.L. Preservative effect ofsorbic acid on creamed cottage cheese.
J. Agric. Food Chem., 8, 374-376 (1960).
82. Glandorf K., Liick E. Sorbiusaure als Konservierungsstoff fiir Sclnnelzkase. Molk. Ztg. (Hildesheim), 23,
1043-1044 (1969).
83. Smith D.P., Rollin N.J, Sorbic acid as a fungistatic agent for foods. VII. Effectiveness of sorbic acid in
protecting cheese. Food Res., 19, 59-65 (1954).
84 Liick E. Fungistatische Verpackungsinatcriahen auf Basis Sorbinsaure und Caiciumsorbat. Dtsch. Lebensm.
Rundsch., 50, 353-357 (1962).
85. Leistner L., Maing I. Y, Bergmann E. Verhinderung von unerwiinschtem Schimmelpilzwachtstum auf Rohwurst
durch Kahumsorbat. Fleischwirtschaft., 55, 559-561 (1975).
86. Holley R.A. Prevention of surface mold growth on Italian dry sausage by natamycin and potassium sorbate.
Appl. Enviromn Microbiol , 41, 422-429 (1981).
87. Liick E. Sorbiusaure und Sorbate. Konservierungsstoffe fiir Fleisch und Fleischwaren. Literaturiibersicht.
Fleischwirtschaft, 64, 727-733 (1984).
88. Kondaiah N., Zeuthen P, Jul M. Effect of chemical dips on unchilled fresh beef inoculated with E. coli,
S. aureus, S. faecalis and Cl. perfringens and stored at 30°C and 20°C. Meat Sci., 12, 17-30 (1 985).
89. Robach M.C., To E C., Meydav S., Cook C.F. Effect of sorbates on microbiological growth m cooked turkey
products. J. Food Sci., 45, 638-640 (1980).
90. To E.C., Robach M.C. Inhibition of potential food poisoning microorganisms by sorbic acid in cooked, uncured, *
vacuum packaged turkey products. J. Food Technol., 15, 543-547 (1980).
91. Robach M.C., Sofos J.N. Use of sorbates in meat products, fresh poultry and poultry products. A review.
J. Food Protect., 45, 374-383 (1982).
92 Sofos J.N. Busta F.F., Allen C.E. Botulism control by nitrite and sorbate in cured meats: A review
J. Food Protect., 42, 739-770, 1099 (1979).
93. Tanaka К Chung K.C., Hayatsu H_, Kada T. Inhibition of nitrosamine formation in vitro by sorbic acid.
Food Cosmet. Toxicol., 16, 209-215 (1978).
Литература
239
94. Thakur B.R., Patel T.R. Sorbates in fish and fish products. A review. Food Rev. Int., 10, 93-107 (1994).
95. Liick E. Sorbiusaure und Kaliumsorbat als Hilfsmittel bei der Herstellung milchsauer vergorener Gurken.
Ind. Obst- u Geintiseverwertung, 51, 410-414 (1966).
96. Courtial W. Kaliumsorbat und sein Einsatz bei der Herstellung von Salzgurken. Ind. Obst- u Gemuseverwertung,
53, 381-383 (1968).
97. Kato H., Yoshii H. Studies on the microbiology of vegetables soaked in soy-sauce. Part II Sorbic acid tolerance
of principal strains. Nippon Shokuhin Kogyo Gakkai-Shi, 13, 137-140 (1966).
98. Nury F.S., Miller M.W., Brekke J.E. Preservative effect of some antimicrobial agents on highmoisture dried
fruits. Food Technol., 14, 113-115 (1960).
99. Melnick D , Vahlteich H.W., Hackett A. Sorbic acid as a fungistatic agent for foods. XI. Effectiveness of sorbic
acid in protecting cakes. Food Res., 21, 133-146 (1956).
lOO. Lamprecht F. Zur Frage der Bekampfung des Brotschiininels insbesondere des Kreideschimmels. Brot Geback.,
9,26-30 (1955)
101. Neu H. Die Schiinmelverhiitung bei Brot durch Sorbinsaurepahnitinsaureanhydrid (Sorboylpalmitat).
Dtsch. Lebensm. Rundsch., 69, 401-404 (1973).
102. Liick E., Reininert K.-H. (Hoechst Aktiengesellschaft) Verfahren zuin Konservieren von mit Hefe und/oder
Sauerteig getriebenen Backwaren mil Sorbiusaure. Europ. Patent 75286.
К главе 20
1. Bernhard H., Thoma W. Genth H. (Farbenfabriken Bayer, Leverkusen). Konservierungsmittel. Deutsches
Patent 1011709 and US-Patent 2910400 (1956).
2. Pauli O., Genth H. Zur Kenntnis des Pyrokohlensaurediathylesters. 1. Mitteilung. Eigenschaffen, Wirkungsweise
und Analytik Z. Lebensm. Unters. Forsch., 132, 216-227 (1966).
3. Genth H. Dimethyldicarbonat — ein neuer Verschwindestoff fiir alkoholfreie, fruchtsafthaltige Erfrischungs-
getranke. Erfrischungsgetrank, 13, 262-269 (1979).
4. Ough C.S., Langbehn L. Measurement of methylcarbainate formed by the addition of dimethyl dicarbonate to
model solutions and to wines. J Agric. Food Chem., 24, 428-430 (1976)
5. Stafford P.A., Ough C.S. Formation of methanoi and ethyl methyl carbonate by dimethyl dicarbonate in wine
and model solutions. Am. J. Enol. Viticult., 27, 7-11 (1976).
6. Lofroth G., Gejvall T. Diethyl Pyrocarbonate: Formation of urethane in treated beverages. Science, 174, 1248-1250 (1971).
7. Ough C.S. Ethylcarbamate in fermented beverages and foods. II. Possible formation of ethylcarbamate from
diethyl dicarbonate addition to wine. J. Agric. Food Chem., 24, 328-331 (1976).
8. Solyinosy F, Antony F., Fedorcsak I. On the amounts of urethane formed in diethyl pyrocarbonate treated
beverages. J. Agric. Food Chem., 26, 500—503 (1 978).
9. Peterson T W., Ough C.S. Dimethyldicarboiiate reaction with higher alcohols. Am. J. Enol. Viticult., 30, 119-123 (1979).
10. Kielhofer E., Wiirdig G. Nachweis und Bestitninung von Diathylcarbonat und PyrokohlensSurediathylester im
Wein und Schauinwein. Dtsch. Lebensm. Rundsch., 59, 197-200 (1963).
11. Ough C.S. Dimethyldicarbonate and diethyldicarbonate. In: Davidson M, Branen AL: Antimicrobials in Foods.
New York: Marcel Dekker, S 343-368 (1993).
12. Horwitz W. Official Methods of Analysis of the Association of Official Analytical Chemists. 13th edition.
Washington. AOAC, S 192-193 (1980).
13. Hecht G. Zur Toxikologie des Pyrokohlensaurediathylesters. Z. Lebensm Unters. Forsch., 114, 292-297 (1961).
14. Classen H.-G., Elias P., Hammes W. Toxikologisch-hygienische Beurteilung von Lebensmittelinhalts- und -
zusatzstoffen sowie bedenklicher Verunreinigungen. Berlin: Parey, S 120-122 (1987),
15. Schinahl D., Port R., Warendorf J. A dose-response study on urethane carcinogenesis in rats and mice.
Int. J. Cancer., 19, 77-80 (1977).
] 6. Senatskominission zur Pnifung gesundheitsschadlicher Arbeitsstoffe. Maximale Arbeitsplatzkonzentrationen
und biologische Arbeitsstofffoleranzwerte. Weinheim: VCH Verlagsgesellschaft (1993).
17. Park K.-K., Liein A., Steward B., Muller J. Vinyl carbamate epoxide, a major strong electrophilic, mutagenic an
carcinogenic metabolite of vinyl carbamate and ethyl carbamate (urethane). Carcinogenesis, 14, 441-450 (1993).
18. SCF. Bericht des wissenschaftlichen Lebensmittelausschiisses der EG, S 10. EUR 139/13 DE (1990).
19. WHO Food Additives Series No 28. Toxicological evaluation of certain food additives and contaminants.
JECFA. 37th meeting, S 231-273 (1991).
20. Genth H. On the action of diethylpyrocarbonate on microorganisms. Proc 4th Int Syinp on Food Micorobiol
Goteborg, S 77-85 (1964).
21. Daudt C.E., Ough C.S. Action of dimethyldicarbonate on various yeasts. Am. J. Enol. Viticult., 31, 21-23 (1980).
22. DMDC, a good grape juice yeast inhibitor study shows Food Chem. News, 22.11.1993, S 10 (1993).
23. Bizn J., Wahem I. Citric acid and antimicrobial effect, microbiological stability and quality of tomato juice.
J. Food Sci., 39, 130-134 (1994)
К главе 21
l. Strahhnann B. Entdeckungsgeschichte antimikrobieller Konservierungsstoffe fiir Lebensmittel. Mitt. Geb.
Lebensmittelunters Hyg., 65, 96-130 (1974).
2. Moors M., Teixera C., Jimidar M., Massart D. Solid-phase extraction of the preservatives sorbic acid and
benzoic acid and the artificial sweeteners aspartame and saccharin. Anal. Chiin. Acta, 255, 177-186 (1991).
240
Литература
3. Kahn S., Murawski M,, Shenna J. Quantitative high performance thin layer chromatographic detennination of
organic preservatives in beverages. J, Liquid Cbromatogr,, 17, 855-865 (1994).
4. Hagenaner-Hener U,, Frank C,, Hener U,, Mosandl A. Bestimmung von Aspartam, Acesulfam-K, Saccharin, Coffein,
Sorbinsaure und Benzoesaure in Lebensmitteln mittels HPLC, Dtsch. Lebensm-Rundsch., 86, 348-351(1990),
5. Reifschneider C., Klug C., Jager M. Konservierungsstoffe in kosmetischen Mitteln. Identifizierung und
Quantifizierung. SOFW-Joumal, 120, 650-654 (1994).
6. Sieber R., Biitikofer U., Baumann E., Bosset J, Uber das Vbrkominen der Benzoesaure in Sauermilchprodukten
und Kase. Mitt. Geb. Lebensmittelunters Hyg., 81,484-493 (1990).
7. Deuel H.J., Alfin-Slater R., Weil C.S., Smyth H.F. Sorbic acid as a fungistatic agent for foods. 1, Harmlessness
of sorbic acid as a dietary component. Food Res., 19, 1-12 (1954),
8. Sado I. Synergistic toxicity of official permissible preservative food additives. Nippon Eiseigaku Zasshi, 28
463-476 (1973).
9. Bedford P.G.C., Clarke E.G.C. Experimental benzoic acid poisoning in the cat. Vet. Rec., 90, 53-58 (1972).
10. Shtenberg A. J., Ignat’ev A.D. Toxicological evaluation of some combinations of food preservatives.
Food Cosmet. Toxicol, 8, 369-380 (1970).
II. Kreis H,, Frese K., Wilmes G. Physiologische und morphologische Veranderungen an Ratten nach peroraler
Verabreichung von Benzoesaure. Food Cosmet. Toxicol., 5, 505-511 (1967).
12. Fujitani T. Short-term effect of sodium benzoate in F344 rats and B6C3F1 mice. Toxicol. Letters, 69,171-179 (1993).
13, Informatics, Inc. GRAS (Generally Recognized as Safe) food ingredients: Benzoic acid and sodium benzoate.
PB-221208, Springfield National Technical Information Service. US Department of Commerce (1972).
14, Federation of American Societies for Experimental Biology. Evaluation of the health aspects of benzoic acid
and sodium benzoate as food ingredients. PB-223837. Springfield: National Technical Information Service. US
Department of Commerce (1973).
15, Waldo J.F., Masson J.M., Lu W.C., Tollstrup J. The effect of benzoic acid and caronamide on blood penicillin
levels and on renal function. Am. J. Med. Sci., 217, 563-568 (1949).
16. Lang K. Vertraglichkeit der Benzoesaure. Z. Lebensm. Unters Forsch., 112, 394-403 (I960),
1 7. Minor J.L., Becker B.A. A comparison of the teratogenic properties of sodium salicylate, sodium benzoate,
and phenol. Toxicol. Appl. Pharmacol, 19, 373 (1971).
18, Food and Drug Research Laboratories, Inc. Teratologic evaluation of FDA 71-37 (sodium benzoate).
PB-221777. Springfield: National Technical Information Service. US Department of Commerce (1972).
19. Kieckebusch W., Lang K, Die Vertraglichkeit der Benzoesaure im chronischen Fiitterungsversuch. Arznetm.
Forsch., 10, 1001-1003 (i960).
20. Marquardt P, Zur Vertraglichkeit der Benzoesaure. Arzneim. Forsch., 10, 1033 (1960),
21. Tremblay G., Aureshi ]. The biochemistry and toxicology of benzoic acid metabolism and its relationship
to the elimination of waste nitrogen Pharmac. Ther., 60, 63-90 (1 993).
22. O’Connor J,, Costell M,, Grisolia S. Carbamyl-glutamate prevents of potentiation of ammonia toxicity
by sodium benzoate. Eur. J. Pediatry, 148, 340-542 (1989).
23. SCF. Report on the 92. Session. Brussels (1994).
24. JECFA. WHO Techn Rep Series 837, S 36. WHO: Geneva (1993).
25. Michils A., Vandermoten G,, Duchateau J. Yeruault J.-C. Anaphylaxis with sodium benzoate. Lancet, 337,
1414-1425 (1991).
26. Jacobsen D, Adverse reactions to benzoates and parabens. In; Food Allergy, S 276-287. Oxford Blackwell (1992).
27. Schaubschlager W., Becker W., Schade U., Zabel P., Schlaak M. Release of mediators from human gastric
mucosa and blood in adverse reactions to benzoate, hit. Arch. Allergy Appl. Immunol, 96, 97-101 (1991),
28. Bosund I. The bacteriostatic action of benzoic and salicylic acids. II. The effect on acetate metabolism. Acta
Chem. Scand., 14, 111-125 (1960).
29. Bosund I The action of benzoic and salicylic acids on the metabolism of microorganisms. Adv, Food Res., 11,
331-353 (1962).
30. Menon S,, Fleck R,, Yong G., Strothkamp K. Benzoic acid inhibition of a-, 0- and y-isoenzymes of Agaricus
bisporus tyrosinase. Arch, Biochem. Biophys., 280, 27-32 (1990).
31. Salmond C.V., Kroll R.G,, Booth l.R. The effect of food preservatives on pH homeostasis in Escherichia coli.
J Gen, Microbiol., 130, 2845-2850 (1984).
32. Eklund T. Inhibition of microbial growth at different pH levels by benzoic and propionic acids and esters of
p-hydroxybenzoic acid, hit, J. Food Microbiol, 2, 159-167 (1985),
33. Luck H., Ricker! E. Untersuchungen an Escherichia coli fiber eine Resistenzsteigerung gegen Konserviernngs-
mittel und Antibiotika. Z. Lebensm. Unters. Forsch., 109, 322-329 (1959),
34, Uraih N., Chipley J.R. Effects of various acids and salts on growth and aflatoxin production by Aspergillus
flaviis NRRL 3145. Microbios., 17: 67, 51-59 (1976).
35. Uraih N., Cassity T.R., Chipley J.R, Partial characterization of the mode of action of benzoic acid on aflatoxin
biosynthesis. Can. J. Microbiol, 23, 1580-1584 (1977).
36. Rehm H.J. Grenzhemmkonzentrationen der zugelassenen Konservierungsmittel gegen Mikroorganismen.
Z. Lebensm, Unters. Forsch., 115, 293-309 (1961).
37. Balatsouras G.D., Polymenacos N.G. Chemical preservatives as inhibitors of yeast growth. J. Food Sci,, 28,
267-275 (1963).
38. Page D., Conacher H., Weber D,, Lacroix G. A survey of benzene in fruits and retail fruit juices, fruit drinks
and soft drinks. J. Assoc. Off. Anal. Chem. Int., 75, 334-340 (1992).
Литература
241
39. McNeil Т., Nyman J., Diachenko W., Hollifield C. Survey of benzene in foods by using headspace concentration
techniques and capillary gas chromatography. J. Assoc, Off, Anal. Chem. Int., 76, 1213-1219 (1993).
40. Gardner L., Lawrence, G. Benzene production from decarboxylation of benzoic acid in the presence of ascorbic
acid and a transition-metal catalyst, J. Agric. Food Chem., 41,693-695 (1993).
К главе 22
1, Strahhnann В. Entdeckungygeschichte antimikrobieller Konservierungsstoffe fiir Lebensmittel. Mitt. Geb,
Lebensmittelunters Hyg., 65, 96-130 (1974).
2, Lubieniecki-von Schelhom M. Untersuchungen uber die Verteilung von Konservierungsstoffen zwischen Fett und
Wasser. 1. Mitteilung. Physikalisch-chemische Untersuchungen. Z. Lebensm. Unters. Forsch., 131, 329-345 (1967).
3. Lubieniecki-von Schelhom M. Untersuchungen uber die Verteilung von Konservierungsstoffen zwischen Fett und
Wasser. 11. Mitteilung. Beziehuogen zwischen physikalischchemischer Verteilung und antimikrobieller Wirksam-
keit von Konservierungsstoffen in fetthaltigen Lebensmitteln. Z. Lebensm. Unters, Forsch., 133, 227-241 (1967).
4. Lorenzen W., Sieh R. Spektrophotometrische Schnellbestimmung von Konservierungsstoffen in Lebensmitteln.
Z. Lebensm. Unters. Forsch., 118, 222-233 (1962),
5. Flak W„ Schaber R. Die Bestimmung von Konservierungsmitteln in Weinen und anderen Getranken mittels
Hochdruckfliissigkeitschromatographie, Mitt. Klosterneuburg, 38, 10-16 (1988).
6. Olea Serrano F., Sanchez I ., Riviila G. High performance liquid chromatography determination of chemical
preservatives in yogurt. J. Liquid Chromatogr., 14, 709-717 (1991),
7. Reifschneider C., Klug C., Jager M. Konservierungsstoffe in kosmetischen Mitteln-ldentifizierung und
Quantifizierimg. SOFW-J., 120, 650-654 (1994).
8, Informatics Inc. GRAS (Generally Recognized as Safe) Food Ingredients. Methyl and propyl paraben. PB-
221209. Springfield: National Technical Information Service. US Department of Commerce (1972),
9, Sokol H. Recent developments in the preservation of pharmaceuticals, Drug Stand., 20, 89-106 (1952).
10. Matthews C., Davidson J., Bauer E., Morrison J.L., Richardson A,P. p-Hydroxybenzoic acid esters as preservati-
ves. II. Acute and chronic toxicity in dogs, rats, and mice, J. Am. Pharm, Assoc. Sci, Ed., 45, 260-267 (1956).
11. Sado 1, Synergistic toxicity of official permissible preservative food additives. Nippon Eiseigaku Zasshi, 28,
463-476 (1973).
12. Schiibel K., Manger J. Ein Beitrag zur Phannakologie einiger ParaoxybenzoesSureester: das Schicksal im
Organismus und die Toxizitat, Naunyn Schmiedebergs Arch. Exp. Pathol, Pharmakoi,, 146, 208-222 (1929),
13. Sabalitschka T., Neufeld-Crzellitzer R. Zum Verhalten der p-Oxybenzoesaureester im menschlichen Korper,
Arzneim. Forsch., 4, 575-579 (1954).
14. Onadera H., Mitsumori K., Yasuhara K,, Shimo T., KurokawaN., Takahashi M. 13-Week subchronic oral toxicity
study of isopropyl-p-hydroxybenzoate in F 344 rats. Bull. Nat). Inst. Health Sci. Japan, 112, 82-88 (1994).
15. SCF. Report on the 92th session, Brussels (1994).
16. Jacobsen D. Adverse reactions to benzoates and parabens, hr. Food Allergy, Blackwell, Boston, S 276-287 (1992).
17. Derache R., Gourdon J. Metabolisme d’un conservateur alimentaire: L’acide parahydroybenzoique et ses esters.
Food Cosmet. Toxicol., J, 189-195 (1963),
18, Tsukamoto H., Terada S. Metabolism of drugs. XXIII. Metabolic fate of p-hydroxybenzoic acid and its
derivatives in rabbit. Chem, Ph arm. Bull., 8, 1066-1070 (1960).
19. Tsukamoto H., Terada S, Metabolism of drugs. XXVI. Metabolic fate of p-hydroxybenzoic acid and its
derivatives in rabbit. Chem. Pharm, Bull., 10, 86-90 (1962),
20. Tuskamoto H,, Terada S, Metabolism of drugs, XXV11. Metabolic fate of p-hydroxybenzoic acid and its
derivatives in rabbit. Chem. Pharm, Bull,, 12, 765-769 (1964).
21. Bao-Liang S., Hai-Ying L., Dun-Ren P. In vitro spermicidal activity of parabens against human spermatozoa.
Contraception, 39, 331-335 (1989).
22. Aalto T.R„ Finnan M.C., Rigler N.E. p-Hydroxybenzoic acid esters as preservatives. 1. Uses, antibactenal
and antifungal studies, properties and determination. J. Am. Pharm. Assoc. Sci. Ed,, 42, 449-457 (1953).
23. Shibasaki 1, Antimicrobial activity of alkyl esters of p-hydroxybenzoic acid, J. Ferment. Technol., 47,167-177 (1969).
24. Thompson DP. Minimum inhibitory concentration of esters of p-hydroxybenzoic acid (paraben) combinations
against toxigenic fungi. J. Food Protect., 57, 133-135 (1994).
25. Tatsuguchi K., Kuwatnoto S., Ogomori M_, Ide T., Watanabe T. Membrane disorders of Escherichia coli cells
and liposomes induced by p-hydroxybenzoic acid esters. J. Food Hyg. Soc. Japan, 32,121-127 (1991).
26. Tatsuguchi K., Kuwamoto S,, Watanabe T, Membrane degradation of heat-injured Escherichia coli stimulated
by p-hydroxybenzoate. J Food Hyg. Soc. Japan, 32, 278-283 (1991),
27. Liick H.. Rickerl E, Untersuchungen an Escherichia coli Ober eine Resistenzsteigerung gegen Konservierungs-
mittel und Antibiotica, Z. Lebensm, Unters, Forsch,, 109, 322-329 (1959).
28. Rehm H.-J, Grenzhemmkonzentrationen der zugelassenen Konservierungsmittel gegen Mikroorganismen.
Z. Lebensm. Unters. Forsch., 115, 293-309 (1961).
29. Rehm H.-J. Erfahrungen mit der Filterpapiermethode zur Schnellprufung von Konservierungsmitteln gegen
Schimmelpilze, Z. Lebensm. Unters. Forsch., 110, 375-381 (1959).
30. Kozulis J,A., Bayne P.D., Guzner J. New technique for the cold sterilization of beer. Ann. Proc. Am, Soc.
Brewing Chem., 105-115 (1971).
242
Литература
К главе 23
I. Bohme Н., Hofmann G. Uber die photometrische Bestimmung von Diphenyl und o-Hydroxy-diphenyl
in Citrusfruchtschalen. Z. Lebensm. Unters. Forsch., 114, 97-105 (1961),
2. Apelbaum A., Barkain-Golan R. Effect of altering treatment conditions during postharvest application of
sodium-o-phenylphenate on o-phenylphenol residues and rind injuries in various citrus fruits. Food Add.
Contain., 4, 317-324 (1987).
3. Luckas B. Methodik zur gemeinsainen Erfassung fungicider Pflanzenbehandlnngsmittel auf Citrusfriichten und
Obst mit Hilfe der HPLC und selektiver Detektion. Z. Lebensm. Unters. Forsch., 184, 195-197 (1987).
4. Macintosh F.C. The toxicity of diphenyl and o-phenylphenol. Analyst, 70, 334-335 (1945).
5. Hodge H.C., Maynard E.A , Blanchet H.J., Spencer H.C., Rowe V.K. Toxicological studies of orthophenyl-
phenol (Dowicide 1). J. Pharmacol. Exp. Ther., 104, 202-210 (1952).
6. Hiraga K., Fujii T. Induction of tumors of the urinary bladder in F 344 rats by dieiary administration
of o-phenylphenol. Food Chem. Toxicol., 22, 865-870 (1984).
7. Hagiwara A , Shibata M., Hirose M., Fukushima S., Ito N. Long-term toxicity and carcinogenicity study
of sodium o-phenylphenate in B6C3F1 mice. Food Chem. Toxicol., 22, 809-814 (1984).
8. Fujii T., Hikuriya M., Kamiya N., Hiraga K. Enhancing effect of thiabendazole on urinary bladder carcino-
genesis induced by sodium o-phenylphenate in F 344 rats. Food Chem. Toxicol., 24, 207-211 (1986).
9. Fujii T., Nakamura K., Hiraga K. Effect of pH on the carcinogenicity of o-phenylphenol and sodium o-phenyl-
phenate in the rat urinary bladder Food Chem. Toxicol., 25, 359-362 (1987).
10. Kolachana P, Subrahmanyan) V., Eastmond D., Smith M. Metabolism of phenylhydroquinone by prostaglandin
(H) synthese: possible implications in o-phenylphenol carcinogenesis. Carcinogenesis, 12, 145-149 (1991).
11. Ushiyama K., Nagai F., Nakagawa A., Kano 1. DNA-adduct formation by о-phenylphenol metabolite in vivo
and in vitro. Carcinogenesis, 13, 1469-473 (1992).
12. Souci S.W., Rehm H.-J., Laufer-Heydenreich S., Herbig G. Zur Kenntnis der antimikrobiellen Wirkung von
Biphenyl und Derivaten des Biphenyls. 1. Mitteilung, Antimikrobielle und stoffwechselphysiologische Wirkung.
Z. Lebensm Unters. Forsch., 134, 209-216 (1967).
13, Rehm H.-J., Laufer-Heydenreich S., WallnOfer P. Zur Kenntnis der antimikrobiellen Wirkung von Biphenyl und
Derivaten des Biphenyls. II. Mitteilung. Physikalische und chemische Grundlagen. Z. Lebensm. Unters.
Forsch., 135, 117-122 (1966).
14. Long J.K., Roberts E.A. The phytotoxic and fungicidal effects of sodium o-phenylphenate in controlling green
mould wastage in oranges. Austr. J. Agric. Res., 9, 609-628 (1958).
15. Ihloff M.L., Kalitzki M. Ueber Konserviernngs- und Schonungsmittel sowie Riickstande von Schadlings-
bekampfungsmitteln beim hnportobst. Mitt. Geb. Lebensmittehmters Hyg., 52, 327-339 (1961).
К главе 24
1. Rehm H.-J., Laufer-Heydenreich S., WalinOfer P. Zur Kenntnis der antimikrobiellen Wirkung von Biphenyl
und Derivaten des Biphenyls. II. Mitteilung. Physikalische und chemische Grundlagen. Z. Lebensm. Unters.
Forsch., 135, 117-122 (1966).
2. Paseiro Losada P., Siinal Lozano S., Simal Gandara J. Determination of biphenyl residues in citrus fruit
by derivative infrared spectrophotometry. J. Assoc. Off. Anal. Chem., 73, 632-637 (1990).
3. Luckas B. Methodik zur gemeinsainen Erfassung fungicider Pflanzenbehandlnngsmittel auf Citrusfriichten
und Obst mit Hilfe der HPLC und selektiver Detektion. Z. Lebensm. Unters. Forsch., 184, 195-197 (1987).
4. Anklam E., Miiller A. A simple method of sample preparation for analysis of biphenyl residues in citrus fruit
peels by gas chromatography. Z. Lebensm. Unters. Forsch., 198, 329-330 (1994).
5. Deichmann W.B., Kitzmiller K.V., Dierker M., Witherup S. Observations on the effects of diphenyl,
o- and p-aminodiphenyl o- and p-nitrodiphenyl und dihydroxyoctachlorodiphenyl upon experimental animals.
J. Ind. Hyg. Toxicol., 29, 1-13 (1947)
6. Pecchiai L., Saffiotti U. Studio della tossicita del difenile, dell'ossidifenile e della loro miscela (,,Dowtherm“).
Med. Lav., 48, 247-254 (1957).
7. Stratum P.G.C. van. Die Toxizitat von Diphenyl, einem fungistatischen Schutzmittel fiir Zitrusfriichte. Eine
Ubersicht und Auswertung der Literatur. Bericht Nr. R 1838 des Zentralinstituts fiir Ernahrungsforschung
T.N.O. Zeist: TN.O. (1964).
8. West H.D. Evidence for the detoxication of diphenyl through a sulfur mechanism. Proc, Soc. Exp. Biol. New
York, 43, 373-375 (1940).
9. Macintosh F.C. The toxicity of diphenyl and o-phenyl-phenol. Analyst, 70, 334-335 (1945).
10. Roghani E., Procaccini S. Assorbimento del fifenile de parte di arance e limoni avvolti in carte trattate con
difenile. Biochim. Appl., 3, 193-197 (1956).
11 Ambrose A.M. Booth A N., DeEds F., Cox A. J. Toxicological study of biphenyl, a citrus fungistat. Food Res.,
25, 328-336 (1960).
12. Souci S.W., Rehm H.-J., Laufer-Heydenreich S., Herbig G. Zur Kenntnis der antimikrobiellen Wirkung von
Biphenyl und Derivaten des Biphenyls. 1. Mitteilung. Antimikrobielle und stoffwechselphysiologische Wirkung.
Z. Lebensm. Unters. Forsch., 134, 209-216 (1967).
13. Meyer T. Scheline R.R. The metabolism of biphenyl. 11. Phenolic metabolites in the rat. Acta Pharm. Toxicol.,
39, 419-432 (1976).
14. Meyer T., Aarbakke J., Scheline R.R. The metabolism of biphenyl. I. Metabolic disposition of l4C-biphenyl in
the rat. Acta Phann. Toxicol., 39, 412-418 (1976).
Литература
243
15. Meyer Т., Larsen J.С., Hansen E.V., Scheline R.R. The metabolism of biphenyl Ill. Phenolic metabolites
in the pig. Acta Pharm. Toxicol., 39, 433 (1976).
16. Nakagawa Y, Sumiko T., Moore G., Moldeus P. Cytotoxic effects of biphenyl and hydroxybiphenyls
on isolated rat hepatocytes. Biochem. Pharmacol., 45, 1959-1965 (1993),
17. Ihloff M.L., Kalitzki M. Ueber Konserviernngs- und Schonungsmittel sowie Riickstande von Schadlings-
bekampfungsmitteln bei Importobst. Mitt. Geb. Lebensmittehinters Hyg., 52, 327-339 (1961).
18. Tomkins R.G., Isherwood F.A. The absorption of diphenyl and o-phenylphenol by oranges from treated wrans
Analyst, 70, 330-333 (1945).
К главе 25
1. Klettner P.-G. Heutige Rauchertechnologien bei Fleischerzeugnissen. Fleischwirtschaft, 59, 17, 18 und 20-24 (1979)
2. Toth L. Chemie der Raucherung. Wissenschaftliche Arbeitspapiere der Senatskommission zur Priifung von
Lebensmittelzusatzstoff- und -inhaltsstoffen. Weinheim: Verlag Chemie (1982).
3. Kersken H. Grundlagen des Raucherns. Rauchern — seit langem bekannt und vielfaltig angewandt Fleisch-
wirtschaft, 33, 921, 922, 924 und 925 (1973).
4. Kersken H. Rauchern heute. Fleischwirtschaft, 54, 1721, 1722, 1724 und 1726 (1974).
5. Toth L., Potthast K. Chemical aspects of the smoking of meat and meat products. Adv. Food Res., 29, 87-158 (1984).
6. Sofos J.N., Maga J. A., Boyle D.L. Effect of ether extracts from condensed wood smokes on the growth
of Aeromonas hydrophila and Staphylococcus aureus. J. Food Sci., 53, 1840-1843 (1988).
7. Munkner W., Meyer C. Untersuchungen zmn Einsatz von Fliissigrauch bei der Herstellung geraucherter
Fischerzeugnisse. Fleischwirtschaft, 74, 547-553 (1994).
8. Potthast K., Eigner G. Fonnaldehydgehalt in Raucherrauch und in geraucherten Fleischprodukten, Fleisch-
wirtschaft, 66, 1261-1264 (1986).
9. Maga J. A. Smoke in food processing. Boca Raton: CRC Press (1988).
10. Potthast К Herstellung und Anwendung von Rancharomen bei Fleischerzeugnissen. Int. Z. Lebensm.-Technol.
Verfahrenstech., 39, 209-213 (1988).
11. Wittkowski R. Phenole im Raucherrauch, Nachweis und Identifizierung, Weinheim: VCH Verlagsgesellschaft (1985),
12. Maga J. A. The flavor chemistry of wood smoke. Food Rev. International, 3, 139-183 (1987).
13. Hofmann G. Untersuchungen zum Vorkoinmen von Nitrosophenolen in gepokelten und geraucherten Fleischer-
zeugnissen. Fleischwirtschaft, 70, 1194-1198 (1990).
14 Ikins W.G., Gray J.L, Mandagere A.К , Booren A M., Pearson A M., Stachiw M.A., Buckley D.J. Contribution
of wood smoke to in vivo formation of >?-nitrosothiazolidine-4-carboxylic acid initial studies. Food Chem.
Toxicol., 26, 15-21 (1988).
15. Kersken H. Untersuchungen zur Wirkung von Rauch auf Schimmelpilze. Fleischwirtschaft, 54, 1341-1344 und
1346 (1974)
16. Asita AO., Campbell LA. Anti-microbial activity of smoke from different woods. Letters Appl. Microbiol., 10,
93-95 (1990).
17. Hrissafidis D., Toth L., Messer S. Gewinnung von wasserfreien Rauchkondensaten fiir die Uberpriifung ihrer
antioxidativen Wirkung. Fett Wissenschaft, Technol., 91, 207-210 (1989).
К главе 26
1. KOniger M., Walinofer P R. Untersuchungen fiber das Verhalten von Thiabendazol bei Bananen. Dtsch.
Lebensm. Rundsch., 89, 384-385 (1993).
2. Arenas R. V, Johnson N.A. Liquid Chromatographic fluorescence method for the determination of thiabend-
azole residues in green bananas and banana pulp. J. AOAC Intern., 77, 710-714 (1994).
3. Oishi M., Onishi К., Kano 1., Nakazawa H., Tanabe S. Capillary gas Chromatographic determination
of thiabendazole in citrus and apple juices. J. AOAC Intern., 77, 1293-1296 (1994).
4. Wyhowski de Bnkanski B., Degroodt J.-M., Beernaert H. Determination of thiabendazole residues in meat
by HPLC using ultraviolet and fluorometric detection. Z. Lebensm. Unters. Forsch., 193, 130-133 (1991).
5. Wyhowski de Bnkanski B., Degroodt J.-M , Beernaert H Determination of levamisole and thiabendazole
in meat by HPLC and photodiode array detection. Z. Lebensm. Unters. Forsch., 193, 545-547 (1991).
6. Bush way R.J., Young B.E.S., Paradis L.R., Perkins L.B Determination of thiabendazole in fruits
and vegetables by competitive-inhibition enzyme immunoassay. J. AOAC Intern., 77, 1243-1248 (1994).
7. Robinson H.J., Stoerk H.C., Grassle O.E. Studies on the toxicologic and pharmacologic properties
of thiabendazole. Toxicol. Appl. Pharmacol., 7, 53-63 (1965).
8. Ogata A., Ando H., Kubo Y Hiraga K. Teratogenicity of thiabendazole in ICR mice. Food Chem. Toxicol., 22,
509-520 (1984).
9. Fujitani T., Yoneyama M., Ogata A., Ueta T., Mon K., Ichikawa H. New metabolites of thiabendazole and the
metabolism of thiabendazole by mouse embryo in vivo and in vitro. Food Chem. Toxicol., 29, 265-274 (1991).
10. Toda Y, Yoneyama M., Kabashima J., Fujitani T., Nakano M. Effects of thiabendazole on the kidneys of ICR
mice. Food Chem. Toxicol., 27, 307-315 (1989).
11. Toda Y., Fujitani T., Yoneyama M. Acute renal toxicity of thiabendazole (TBZ)in ICR mice. Food Chem.
Toxicol., 20, 1021-1030 (1992).
12. Mizutoni T„ Ito K., Nomura H., Nakanishi K. Nephrotoxicity of thiabendazole in mice depleted of glutathione
by treatment with dl-buthionine sulphoximine. Food Chem. Toxicol., 28, 169-177 (1990).
244
Литература
13. Lankas G.R., Wise D.L. Developmental toxicity of orally administered thiabendazole in sprague-dawley rats
and New Zealand white rabbits. Food Chem. Toxicol., 31, 199-207 (1993).
14. Wise L.D., Cartwright M.E., Seider C.L., Sachuk L.A., Lankas G.R. Dietary two-geneiation reproduction study
of thiabendazole in sprague-dawley rats. Food Chem. Toxicol., 32, 239-246 (1994).
15. Robinson H.J., Phares H.F., Graessle O.E. Antimycotic properties of thiabendazole. J. Invest. Dermatol., 42
479-482 (1964).
16. Isshak Y.M., Rizk S.S., Khalil R.I., Fahmi B.A Long term storage of Valencia orange treated by thiabendazole.
Agric. Res. Rev., 52, 85-98 (1974).
17. Rizk S.S., Isshak Y.M. Thiabendazole as a post harvest disinfectant for citrus fruits. Agric. Res. Rev., 52, 39-46 (1974).
18. Koniger M., Walinofer P.R. Ubertragung von Thiabendazol-Riickstanden beim Schalen von Citrusfriichten
auf Hande und Fmchtfleisch. Dtsch. Lebensm. Rundsch., 86, 251-253 (1990).
К главе 27
Обзорная
Lipinska E., Gudkow A.W., Karlinkanowa S.N. Verwendung von Nisin bei der Kaseherstellung. Leipzig:
Fachbuchverlag (1976).
Hurst A. Nisin: Its preservative effect and function in the growth cycle of the producer organism. Soc. Appl.
Bacteriol. Symposium Series, No 7, 297-314 (1978).
Hurst A. Nisin. Adv. Appl. Microbiol., 27, 85-123 (1981).
Специальная
1. Rogers L.A. The inhibiting effect of Streptococcus lactis on Lactobacillus bulgaricus. J. Bacteriol., 16, 32 1-325
(1928).
2. Mattick A.T.R. Hirsch A. A powerful inhibitory substance produced by Group N Streptococci. Nature, 154,
551 (1944).
3. Gross E., Morell J.L. The structure of nisin. J. Amer. Chem. Soc., 93, 4634-4635 (1971).
4. Hansen J.N Nisin as a model food preservative. Crit. Rev. Food Sci. Nvitrit., 34, 69-93 (1994).
5. de Vuyst L., Vandamme E. Nisin, a lantibiotic produced by Lactococcus lactis subsp. Lactis: Properties,
biosynthesis, fermentation and application. In: de Vuyst L., Vandamme E. (ed): Bacteriocins of lactic acid
bacteria. Microbiology, genetics and applications. Blackie, London, S 151-221 (1994).
6. Vas K. Anwendung von Nisin in der Lebensmittelindustrie. Dtsch. Lebensm. Rdsch., 60, 63-67 (1964).
7. Fowler G.G., Jarvis B., Trainer J. The assay of nisin in foods. Techn. Series Soc. Appl. Bacteriol., 8, 91-105 (1975).
8. Hurst A., Hoover D. Nisin. In: Davidson M., Branen A.: Antimicrobials in Food. Dekker: New York, S 369-394 (1993).
9. Rauch P, Kuipers O., Siezen R., de Vos W. Genetics and protein engineering of nisin. In: Vuyst L., Vandamme E.:
Bacteriocins of lactic acid bacteria. Microbiology, genetics and applications. Blackie, London, S 223-249 (1994).
10. Frazer A.C. Sharratt M., Hickmann J. R. The biological effects of food additives. I. Nisin. J. Sci. Food Agric.,
13, 32-42 (1962).
11. Shtenberg A. J., Ignat’ev A.D. Toxicological evaluation of some combinations of food preservatives. Food
Cosmet. Toxicol., 8, 369-380 (1970).
12. SCF. Berichte des Wissenschaftlichen Lebensmittelausschusses 26. Folge, EUR 13913 DE (1990).
13. Hawley H.B. The pennissibility and acceptability of nisin as a food additive. Milchwiss., 13, 253-259 (1958).
14. Gould G.W. Effect of food preservatives on the growth of bacteria from spores. Proc. 4th Int. Symp. Food
Microbiol. Goteborg, S 17-24 (1964).
15. Winkowski K., Ludescher R., Montville T. Binding affinity of the bacteriocin nisin to lipid bilayers derived
from Listeria monocytogenes cells. 1FT Ann Meeting ’95: Book of Abstracts, 81, D-4 (1995).
16. Russell A.D. The destruction of bacterial spores. In: Hugo WB: Inhibition and destruction of the microbial cell.
Academic Press, London - New York, S 555-556 (1971).
17. Trainer J The inhibitory action of nisin on Bacillus stearothennophilus. Proc. 4th Int. Symp. Food Microbiol.,
Goteborg, S 25-33 (1964).
18. Stevens K.A., Sheldon B.W., Klapes N.A., Klaenhammer T.R. Effect of treatment conditions in nisin
inactivation on gram-negative bacteria. J. Food Protect., 55, 763-766 (1992).
19. ter Steeg P. Interactions of nisin, lysozym and citrate in biopreservation. De Ware(n)-Chemicus, 23, 183-190 (1993).
20. Hawley H.B. Nisin in food technology. Food Manuf., 32, 270-376 und 430 434 (1957).
21. Ramseier H. Die Wirkung von Nisin auf Clostridium butyricum. Arch. Mikrobiol., 37, 57-94 (1960).
22. Mazzotta A., Montville T. Listeria manocytogenes resistance to Nisin at 10°C and 30°C. 1FT Ann. Meeting ’95:
Book of Abstracts, 81, D-3 (1995).
22. Wodsak W. Nisin und seine VerwendungsmOglichkeiten. Dtsch. Lebensm. Rdsch., 58, 135-137 (1962).
К главе 28
1. Struyk A.P. Waisvisz J.M. (Gist-Brocades, Delft) Pimaricin and process of producing same.
US-Patent 3 892 850 (1955).
2. Raab W.P. Natamycin (Pimaricin). Its properties and possibilities in medicine. Stuttgart: Georg Thieme (1972).
3. Clar W.K. Shirk RJ. Kline E.F. Pimaricin, a new food fungistat. Proc 4th Int Symp Food Microbiol Goteborg,
S 167-184 (1964).
Литература
245
4. Brik Н. New high-molecular decomposition products of natamycin (pimaricin) with intact lactone rm«
J. Antibiotics, 29, 632-637 (1976).
5. Struyk A.P, Hoette I., Drost G., Waisvisz J.M., Eek T. van und Hoogerheide J.C. Pimaricin a new antifit »
antibiotic. Antibiot. Annu., 878-885 (1957-1958). ’ nurunga|
6. Millies K., Sponholz W.R. Anwendungsmoglichkeiten des Antibiotikums Natamycin (Pimaricin) zur mikro-
biologischen Stabilisierung von sauren Getranken. 2. Teil: Eigene Untersuchungsergebnisse Fliiss Obst dd
56-64 (1977). ' •’ ’
7. Davidson M., Doan C. Natamycin. In: Davidson M., Branen A.: Antimicrobials in Foods Dekker New VnrV
S 395-407 (1993). ’ ’
8. Levinskas GJ. Ribelin W.E., Shaffer C.B. Acute and chronic toxicity of pimaricin. Toxicol Add! Pharmarni
8,97-109 (1966) ' P' ’
9. SCF. Bericht des wissenschaftlichen Lebensmittelausschusses 9. Folge. Kommission der Europaischen Union
S 23-24 (1979).
10. JECFA. Natamycin, WHO Food Additive Series No. 10, Geneva WHO, S 76-85 (1976).
II. Oostendorp J.G. Natamycin. Antonie von Leeuwenhoek, 47, 170-171 (1981).
12. Bradley S.G., Farber P.J., Jones L.A. Action of polyene antibiotics on Candida. Antimicrob Agents Annu
558-569 (1960).
13. Klis J.B., Witter L.D., Ordal Z.J. The effect of several antifungal antibiotics on the growth of common food
spoilage fungi. Food Technol., 13, 124-128 (1959)
14. Hejzlar M., VyJnola F. Comparative study of pimaricin and fungicidin activity in vitro. J. Hyg. Epidemiol.
Microbiol. Immunol., 14, 211-213 (1970).
15. Athar M.A., Winner H I. The development of resistance by Candida species to polyene antibiotics in vitro.
J. Med. Microbiol., 4, 505-517 (1971).
16. Dekker J.. Gielink A.J. Acquired resistance to pimaricin in Cladosporiinn cucumerinum and Fusarium
oxysporum f. sp. narcissi associated with decreased virulence. Neth. J. Plant. Pathol., 85, 67-73 (1979).
17. Boer E. de, Stolk-Horsthuis M. Sensivity to natamycin (pimaricin) of fungi isolated in cheese warehouses.
J. Food. Protect., 40, 533-536 (1977).
18. Boer E. de, Labots H., Stolk-Horsthuis M., Visser J.N. Natamycin-Empfindlichkeit von in Rohwurst herstellenden
Betrieben gefundenen Pilzen. Fleischwirtschaft, 59, 1887-1889 (1979).
19. Kiermeier F., Zierer E. Zur Wirkung von Pimaricin auf Schimmelpilze und deren Aflatoxinbildung bei Kasen.
Z Lebensm. Unters Forsch., 157, 253-262 (1975).
20. Bullerman L.B. Incidence and control of mycotoxin producing molds in domestic and imported cheeses. Ann.
Nutrit. Aliment., 31,435-446 (1977).
21. Mol J.J. Ervaringen met een nieuw fungicide bij de schimmelbestrijding op de kaaskorst.
Ned. Melk Zuiveltijdschr., 20, 73-84 (1966).
22. Gripon J.C., Bergere J.L. Etude de la penetration et de la stabilite de la pimaricine dans les fromages a pate
molle. Lait, 52, 428^43 (1972).
23. Hechehnann H., Leistner L. Hemmung von unerwiinschtem Schimmelpilzwachstum auf Rohwursten durch
Delvocid (Pimaricin). Fleischwirtschaft, 49, 639-640 (1969).
К главе 29
I. Fleming A. On a remarcable bacteriologic element found in tissues and secretions. Proc. Royal Soc., В 93, 306 (1922).
2. Stelzner A., Klein U., Klein Y.-M., Holtz H. Zur Optimierung des Lysozym-Nachweises: Vergleichende
Untersuchungen zur Preparation des Testkeimes Micrococcus Inteus (M. lysodeikticus Fleming). Zbl. Bakt.
Hyg. 1. Abt. Orig., A 253, 253-264 (1982).
3. Hayashi K., Kasumi T, Kubo N., Tsumura N. Purification and characterization of the lytic enzyme produced by
Streptomyces rutgersensis H-46. J. Agric. Biol. Chem., 45, 2289-2300 (1981).
4. Conner D.E. Naturally occuring compounds, Lysozyme. In: Davidson M, Branen A (ed): Antimicrobials in
Foods. Marcel Dekker, New York, S 452-454 (1993).
5. Bianchi C. Antigenic properties of hen egg white lysozyme (Fleming’s lysozyme) and notes on its acute/sub-
acute toxicity. Curr. Therap. Res., 31, 494-505 (1982).
6. JECFA. WHO Food Additives Series: 30, WHO, Geneva, S 25-31 (1993).
7. Wasserfall F., Voss E., Prokopek D. Versuche liber Kasereifiing. 5. Die Verwendung von Lysozym anstelle von
Nitrat zur Verhinderung der Spatblahung im Kase. Kieler Milchwirtschaftl Forschungsber, 28, 3-16 (1976).
8. Johansen C., Gram L.. Meyer A.S. The combined inhibitory effect of lysozyme and low pH on growth of
Listeria monocytogenes. J. Food Protect., 57, 561-566 (1994).
9 Ibrahim M., Hatta H., Fujiki M., Kim M., Yamamoto T. Enhanced antimicrobial action of lysozyme against
grain-negative and gram-positive bacteria due to modification with perillaldehyde.
J. Agric. Food Chem., 42, 1813-1817 (1994).
10. Akashi A. Preservative effect of egg white lysozyme on vienna sausage. Japan J. Zootech. Sci., 42, 289-295 (1971).
К главе 30
1. Angehm M. Einsatz von Silber in der mikrobiologischen Wasseraufbereitung. Brauind, 70, 33-37 (1985).
2. Hahnemann — Entdecker der oligodynamischen Wirkung von Silber. Dtsch. Lebensm. Rundsch., 58, 73 (1962).
3. Nageli C. von. Ueber oligodynamische Erscheinungen in lebenden Zellen. Neue Denkschr. Allg. Schweiz Ges.
Gesamte Naturwissenschaften, 33,2. Folge, 1-51 (1893)
1
246 Литература
4. Miethke Н., Brosamle О. Bestimmung von Silber in alkoholfreien Getranken. Dtsch. Lebensm. Rundsch., 58,
71-73 (1962),
5. Bragg R, Ratnnie D. The effect of silver ions on the respiraiory chain of Escherichia coli. Can. J. Microbiol.
20, 833-889 (1973).
6. Schreurs W., Rosenberg H. Effect of silver ions on transport retention of phosphate by E. coli. J. Bacteriol.
152, 7-13 (1982).
8. Woodward R.L. Review of the bactericidal effectiveness of silver. J. Am. Water. Works Assoc., 55, 881-886 (1963).
7. Wuhrmann K., Zobrist F. Untersuchungen iiber die bakterizide Wirkung von Silber in Wasser. Schweiz.
Z. Hydrol., 20, 218-254 (1958).
9. Antelman M. Silver (II, 111) disinfectants Soap Cosmet. Chem. Spec., 3, 52-59(1994).
К главе 31
I. Lutz O. Nachweis von Borsaureestern in Wein durch I IB NMR. Naturwiss., 78, 67-69 (1991).
2. Siti-Mizura S., Tee E., Ooi H. Determination of boric acid in foods. Comparative study of three methods.
J. Sci. Food Agric., 55, 261-268 (1991).
3. Behre A. Technische Hilfsmittel bei der Herstellung von Lebensmitteln. I. Konservierungsmittel. Chem.-Ztg.,
54, 325-327 und 346-347 (1930).
4. Reith J.F., Genderen H. van. De toelaatbaarheid von boorzuur als conserveermiddel in levensmiddelen.
Conserva, 4, 326-331 (1956).
5. Smyth H.F., Carpenter C.P., Weil C.S., Pozzani U.C., Striegel J.A., Nycum J.S. Range-finding toxicity data.:
List VII. Am. Ind. Hyg. Assoc. J., 30, 470-476 (I969).
6. Meindel J.. Price C., Field E., Marr M., Myers C., Morrissey R., Schuetz B. Development toxicity of boric acid
in mice and rats. Fundam. Appl. Toxicol., 18, 266-277 (1992).
7. SCF. Berichte des Wissenschaftlichen Lebensmittelausschusses 26. Folge EUR 13913 DE (1990)
8. Price C., Field E., Marr M., Myers C. Final report on the developmental toxicity of boric acid in Sprague
Dawley rats. Natl. Toxicol. Program Report NTP, 90-155 (1990).
9. Pfeiffer C.C., Hallman L.F, Gersh 1. Boric acid ointment, a study of possible intoxication in the treatment
of bums. J. Amer. Med. Assoc., 128, 266-273 (1945).
10. Schelhom N. von. Untersuchungen iiber Konservierungsmittel. Vlll, Wirksamkeit der Borsaure als Konservierungs-
mittel. Dtsch. Lebensm. Rundsch., 48, 102 (1952).
11. Behre A. Grundsatzliches zur Konservierungsmittelgesetzgebung. Dtsch. Lebensm. Rundsch., 48, 10-15 (1952).
К главе 32
1. Battaglia R Mitiska J. Specific detection an determination of azide in wine. Z. Lebensm. Unters. Forsch., 182,
501-502 (1986).
2. Classen H.-G., Elias P.S., Hamines W.P. Toxikologisch-hygienische Beurteilung von Lebensmittelinhalts-
und -zusatzstoffen sowie bedenklicher Verunreinigungen. Berlin Parey, S 108 (1987).
3 Dotson S. Somers D. Differential metabolism of sodium azide in maize callus and germinating embryos.
Mutat. Res., 213, 157-163 (1989).
К главе 33
I. Morgan J. Ou a new process of preserving meat. J. Soc. Arts, 12, 347-363 (1864).
2. Ellinger R.H. Phosphates as food mdigridients. Cleveland: CRS Press, S 19-25 (1972).
3. Post F.J., Krishanmurty G.B., Flanagan M.D. Influence of sodium hexametaphosphate on selected bacteria.
Appl. Microbiol., 11, 430-435 (1963).
4. Kelch F., Biihlmann X. Der EinfluB handelsiiblicher Phosphate auf das Wachstum von Mikroorganismen.
Fleischwirtschaft, 38, 325-328 (1958),
5. Tompkin R.B Indirect antimicorbial effects in foods: Phosphates. J. Food Safety, 6, 13-27 (1983).
6. Lee R ., Hartman R., Stahr M., Olson D., Williams F. Antimicrobial mechanism of long-chained phosphates
m Staphylococcus aureus. J. Food Protect., 57, 465-469 (1994).
7. Hargreaves L.L., Wood J.M., Jarvis B. The antimicrobial effect of phosphates with particular reference to food
products. The British Food Manufacturing Industries Research Association. Scientific and Technical Surveys.
No 76. Leatherhead B.F.M.l.R.A. (1972).
8. Kim J.-W., Slavik M. Trisodium phosphate (TSP) treatment of beef surfaces to reduce Escherichia coli
О 157:H7 and Salmonella typhimurium J. Food Sci., 59, 20-24 (1994).
9. Lillard H. Effect of trisodium phosphate on salmonellae attached to chicken skin. J. Food Protect., 57, 465-469 (1994).
К главе 34
1 Kawasaki C. Nagano H., Kono K. Sterilizing effect of hvdrogen peroxide in food. Shokuhin Eiseigaku Zasshi,
11, 139-142 (1970).
2. Amin V.M., Olson N.F. Factors affecting the resistance of Staphylococcus aureus to hydrogen peroxide
treatments in milk. Appl. Microbiol., 15, 97-101 (1967).
3. Toledo R.T., Escher F E., Ayres J.C. Sporicidal properties of hydrogen peroxide against food spoilage
organisms. Appl. Microbiol., 26, 592-597 (1973).
Литература 247
4' Shin S._ Calvisi E._ Beamcin T., Paukratz H., Gerhardt P., Marquis R. Microscopic and thermal characterization
of hydrogen peroxide killing and lysin of spores and protection by transition metal ions, chelators and
antioxidants. Appl. Environm. Microbiol., 60, 3192-3197 (1994).
5. Budde C.C.L.G. Ein neues Verfahren zur Sterilisierung der Milch. Tuberculosis, 3, 94-98 (1904).
6. Ozdemir S., Kurt A. Preservation of ewe milk at room and refrigeration temperature by adding hydrogen
peroxide and potassium sorbate. Tr. J. Agric. Forestry, 18, 219-224 (1994).
7 Roundy Z.D. Treatment of milk for cheese with hydrogen peroxide. J. Dairy Sci., 41, 1460-1465 (1958).
8. Resell J.M. Die Peroxydkatalase-Behandlung der Milch. Milchwissenschaft, 12, 343-348 (1957).
9. Eapen K.C., Mattada R.R., Sharma T.R., Nath H. Keeping quality of fresh milk with hydrogen peroxide as a
preservative. J. Food Sci. Technol., 12, 87-90 (1975).
10. Coles T. Sterility with peroxide. Manufact. Chem. Marz, 1995, 27-29.
К главе 35
1. Smyth H E, Carpenter C.P Weil C.S., Pozzani U.C., Striegel J. A., Nycum J.S. Range-finding toxicity data:
List Vll. Am. Ind. Hyg. Assoc. J., 30, 470-476 (1969).
К главе 36
1. Ballmeier D., Ере B. Oxidative DNA damage induced by potassium bromate under cell-free conditions
and in mammalian cells. Carcinogenesis, 16, 335-342 (1995).
К главе 37
I. Pfeilsticker K., Fabricios G., Timme G. Simultane, gaschromatographische Bestimmung von Athylenoxid,
Athylenchlorhydrin und Athylenglykol in Getreide. Z. Lebensm. Unters. Forsch., 158, 21--25 (1975).
2. Bruhin H., Biihhnann X., Vischer W.A., Lammers T. Sterilisation mit Athylenoxid unter besonderer Beriick-
sichtigung der Anwendung bei Kunststoffeu. Schweiz. Med. Wochenschr., 91. 607-613 und 635-639 (1961).
3. Bruch C. W. Sterilization of plastics: Toxicity of ethylene oxide. In: Briggs Philipps G., Miller W.S.: Industrial
Sterilization, Durham: Duke University Press, S 49-77 (1973).
4. Bruch C.W. Gaseous sterilization. Ann. Rev. Microbiol., 15, 245-262 (1961),
5. Phillips C.R., Kaye S. The sterilizing action of gaseous ethylene oxide. Am. J. Hyg., 50, 270-279 (1949).
6. Hogstedt C., Mahnqvist N., Wadman B. Leukemia in workers exposed to ethylene oxide. J. Am med Assoc
241, 1132-1133 (1979).
7. Ethylene oxide, ethylene chlorohydrin, and ethylene glycol. Proposed maximum residue limits and maximum
levels of exposure. Federal Register, 43, 27474-27483 (1978),
8. Phillips C.R. Relative resistance of bacterial spores and vegetative bacteria to disinfectants. Bacteriol. Rev. 16
135-143 (1952).
9. Driessen F.M., Duin H. van. Steriliseren met ethyleenoxyde. Voedingsmiddelentechnol., 8, 15-19 und 32-33 (1975).
10. Toledo R.T. Chemical Sterilants for Aseptic Packaging, Food Technol., 29: 5, 102-1 12 (1975).
11. Lammers T, Gewalt R. Ein neues Sterilisationsverfahren mit gespanntem Aethylenoxyd. Z. Hyg., 144, 350-358 (1958).
12. Hoffmann R.K. Toxic gases. Ethylene oxide. In: Hugo WB. Inhibition and destruction of the microbial cell.
London - New York: Academic Press, S 226-236 (1971).
13. Steiger E., Tauchnitz H.-D., Lobe! A. Uber die Resistenz von Pilzen gegeni'iber Athylenoxid. Z. Gesamte. Hyg.
Ihre Grenzgeb., 20, 120-123 (1974).
14. Gross M.P., Dixon L.F. (Liggett & Meyers Tobacco Company New York). Method of Sterilizing, U.S. Patent
2075845 (1933).
15. Gerhardt H , Ladd Effio J.C. Athyleuoxidanwendung in der Lebensmittelindustrie. Ein Situationsbericht iiber
„Fiir und Wider“. Fleischwirtschaft, 62, 1129-1134 (1982).
16. Algnire D E. Regulation of ethylene oxide and propylene oxide in food processing and packaging applications.
Food Prod. Dev.. 10: 1, 52-53 (1976).
17. Chaigneau M. Sterilisation et desinfection par les gaz. Sainte-Ruffine: Maisonneuve, S 23-107 (1977).
К главе 38
1. lnforamtics, Inc. (1973) GRAS (Generally Recognized as Safe) food ingredients — Propylene glycol and derivatives
PB-221 233. Springfield: National Technical Information Service, US Department of Commerce (1973).
2 Davies R., Birch G.G., Parker K.J. Intennediate moisture foods. London: Applied Science Publishers, S 268-269 (1976).
К главе 39
1. Bremanis E. Die photometrische Bestimmung des Formaldehyde mit Chromotropsaure. Z. Anal. Chem. 130
44-47 (1949).
2. Schmidt-Lorenz W. Zur Verwendbarkeit von Hexamethylentetramin und Formaldehyd als Konservierungsmittel.
Z. Lebensm. Unters. Forsch., 108, 423-441 (1958).
3. Brendel R. Untersuchungen an Ratten zur Vertraglichkeit von Hexamethylentetramin.
Arzneim. Forsch., 14, 51-53 (1964).
248
Литература
4. Hunii Н., Ohder Н. Reproduction study with formaldehyde and hexamethylenetetramine in beagle dogs. Food
Cosmet. Toxicol., 11, 459-462 (1973).
5. Englesberg E. The mutagenic action of formaldehyde on bacteria. J. Bacteriol., 63, 1-11 (1952).
6. Rapoport I. A. Carbonyl compounds and chemical mechanism of mutations. Dokl Akad Nauk SSSR 54, 65-67 (1946).
7. Give a dog a bad name ... Food Cosmet. Toxicol., 2, 745-749 (1964).
8. Natvig H., Andersen J., Wulff Rasmussen E. A contribution of the toxicological evaluation of hexamethylene-
tetramine. Food Cosmet. Toxicol., 9, 491-500 (1971).
9. Della Porta G., Colnaghi M.I., Parmiani G. Non-carcinogenicity of hexamethylentetramine in mice and rats.
Food Cosmet. Toxicol., 6, 707-715 (1968).
10. Linko R.R., Nikkila O.E. Chemical preservatives in foodstuffs. 111. Hexamethylenetetramine as mold inhibitor
and the antagonistic action of amino acids. Maataloustieteellinen Aikakauskirja, 31, 162-173 (1959)
11. Malorny G., Rietbrock N., Schneider M. Die Oxydation des Fonnaldehyds zu Ameisensaure im Blut, ein Beitrag
zum Stofiwechsel des Fonnaldehyds. Naunyn-Schmiedebergs Arch. Exp. Pathol. Pharmakoi., 250, 419-436 (1965).
12. Lang K., Frimmer M., Bernert D. Stofifwechselverhalten und Vertraglichkeit formylierter und acetylierter
Proteine. Z. Gesamte Exp. Med., 117, 288-296 (1951).
13. Nikkila O.E., Linko R.R. Chemical preservatives in foodstuffs. 11. The effect on moulds. Maataloustieteellinen
Aikakauskirja, 30, 125-131 (1958).
14. Schelhom M. von. Untersuchungen uber Konservierungsmittel. IX. Hexamethylentetramin als Konservierungs-
mittel. Dtsch. Lebensm. Rundsch., 50, 90-92 (1954).
К главе 40
1. Fuhrmann F.A., Field J., Wilson R.H., DeEds F. Monochloracetate: Effects of chronic administration to rats
on growth, activity, and tissue metabolism and inhibitory effects in vitro compared with monoiodacetate and
monobromacetate. Arch. Intern. Pharmacodyn., 102, 113-125 (1955).
К главе 41
I. Fuhrmann F. A., Field J,, Wilson R.H., DeEds F. Monochloracetate: Effects of chronic administration to rats
on growth, activity, and tissue metabolism and inhibitory effects in vitro compared with monoiodacetate and
monobromacetate. Arch. Intern. Pharmacodyn., 102, 113-125 (1955).
2. Dalgaard-Mikkelsen S., Kvoming S.A., Moller K.O. Toxic effects of monobromacetic acid on pigs. Acta
Pharmacol Toxicol., 11, 13-32 (1955).
К главе 42
1. Spector W.S. Handbook of toxicology. Band 1. WB Saunders, Philadelphia - London (1956).
2. Life Science Research Office. Evaluation of the health aspects of lactic acid and calcium lactate as food ingredients.
PB-283713. Springfield National Technical Information Service. US Department of Commerce (1978).
3. Woolford M.K. Microbiological screening of the straight chain fatty acids (C.-C ) as potential silage additives.
J. Sci. Food Agric., 26, 219-228 (1975). 1
4. Shelef L. Antimicrobial effects of lactates: A review. J. Food Protect., 55, 445-450 (1994).
5. Weaver A., Shelef L. Antisterial activity of sodium, potassium and calcium lactate in pork liver sausages.
J. Food Safety, 13, 133-146 (1993).
К главе 43
1. Tetsumoto S. Sterilizing action of acids. IL Sterilizing action of saturated fatty acids. J. Agric. Chem. Soc.
Japan, 9, 388 (1933).
2. Kabara J.J. Medium-chain fatty acids and esters. In: Davidson PM, Branen AL: Antimicorbials in Foods.
Marcel Dekker, New York, S 307-342 (1993).
3. Razavi-Rohani S M., Griffiths M.W. The effect of mono- and polyglycerol laurate on spoilage and pathogenic
bacteria associated with foods. J. Food Safety, 14, 131-151 (1994).
К главе 44
1. Krum J.К., Felles C.R, Clarification of wine by a sequestering agent. Food Technol., 6,103-106 (1952).
2. Bulgarelli M. A., Shelef L.A. Effect of ethylenediaminetetraacetic acid (EDTA) on growth from spores of
Bacillus cereus. J. Food Sci., 50, 661-664 (1985).
3. Russel A.D. Ethylenediaminetetra-acetic acid, Iir Huge WB: Inhibition and destruction of the microbial cell.
London - New York: Academic Press, S 209-224 (1971).
4. Levin R.E. The effectiveness of EDTA as a fish preservative. J. Milk Food Technol., 30, 277-283 (1967).
К главе 45
1. Neudecker T. Henschler D. Allyl isothiocyanate is mutagenic in Salmonella typhimurium. Mutation Res., 156,
33-37 (1985).
Литература
249
2. Technical report on the carcinogenesis bioassay of allyl isothiocyanate (CAS No. 57-06-7) in F 344/N rats
and B6C3F1 mice (Gavage Study). NTP-81-38. NIH Publication No. 83-1790. US Department of Health
and Human Services (1982).
К главе 47
1. Khan S., Murawski M Sherman J. Quantitative HPTLC determination of organic acid preservatives
in beverages. .1. Liq, Chrom., 17, 855-865 (1994).
2. Woods L.A., Shidemann F.E., Seevers M.H., Weeks J R., Kruse W.T. Dehydroacetic Acid (DHA).
111. Estimation, absorption and distribution, j. Pharmacol. Exp. Then, 99, 84-97 (1950).
3. Spencer H.C., Rowe V.K. McCollister D.D. Dehydroacetic acid (DHA). 1. Acute and chronic toxicity.
J. Pharmacol. Exp. Tiler., 99, 57-68 (1950).
4. Seevers M.H., Shideman F.E., Woods L A , Weeks J.R., Kruse W.T. Dehydroacetic Acid (DHA).
II. General pharmacology and mechanism of action. J. Pharmacol. Exp. Tlier., 99, 69-83 (1950).
5. Ritschel W.A. Zur Vertraglichkeit der Dehydracetshure. Arzneim. Forsch., 15, 220-222 (1965).
6. Shideman F.E., Woods L.A., Seevers M.H. Dehydroacetic acid (DHA). IV. Detoxication and effects on renal
function. J. Pharmacol. Exp. Ther., 99, 98-111 (1950).
7. Barman T.E., Parke D.V., Williams R.T. The metabolisms of dehydroacetic acid (DHA). Toxicol. Appl.
Pharmacol, 5, 545-568 (1963).
8. Wolf P.A. Dehydroacetic acid a new microbiological inhibitor. Food Technol, 4, 294-297 (1950).
9. Schelhom M. von. Die Dehydracetsaure als Konservierungsmittel fiir Lebensmittel. Dtsch. Lebensm. Rundsch.
48, 16-18 (1952).
10. Brodersen R. Kjaer A. The antibacterial action and toxicity of some unsaturated lactones. Acta Pharmacol, 2,
109-120 (1946).
К главе 48
1. Spector W S. Handbook of toxicology. Band 1. WB Saunders, Philadelphia - London, S 262-263 (1956).
2. Herz A., Stampfl B. Vertraglichkeit oft wiederholter kleiner Salicylsauregaben. Z Gesamte Exp. Med. 118,
76-90 (1951).
3. Minor J.L., Becker B.A. A comparision of the teratogenic properties of sodium salicylate, sodium benzoate,
and phenol. Toxicol. Appl. Pharmacol., 19, 373 (1971).
4. Kolbe H. 1st anhaltender GenuB kleiner Mengen Salicylsaure der Gesundheit nachteilig? Z. gegen. Verfalscli.
Lebensm. u. sonst. Verbrauchsgegenstdnde, 1, 370-371 (1878).
5. Wyss O. Microbial inhibition by food preservatives. Adv. Food Res., 1, 373-393 (1948).
6. Schelhom M. von. Untersuchungen uber Konservierungsmittel. V. Zur Frage des Vergleichs der Wirksamkeit
von Konservierungsmitteln. Dtsch. Lebensm. Rundsch., 47, 16-18 (1951).
К главе 49
1. Flak W., Schaber R. Die Bestiininung von Konservierungsmitteln in Wein und anderen Getranken mittels HPLC.
Mitt. Klosterneuburg, 38, 10-16 (1988).
2. Kieckebusch W., Griein W., Lang K. Die Vertraglichkeit der p-Chlorbenzoesaure.
Arzneim. Forsch., 10, 999-1001 (1960).
3. Strahlmann B. Entdeckungsgeschichte antimikrobieller Konservierungsstoffe fiir Lebensmittel. Mitt. Geb.
Lebensmittelunters Hyg., 63, 96-130 (1974),
К главе 50
1. Miyaji T. Acute and chronic toxicity of furylftiramide in rats and mice. Tohokn J. Exp. Med., 103, 331-369 (1971).
2. Park Y.R., Lee Y, Sung N.E. A study on the acute toxicity of AF-2. Han’guk Sikp’um Kwahakhoe Chi., 8,63-60 (1976),
3. Miyaji T. Effect of furylftiramide on reproduction and malformation. Tohoku J. Exp. Med., 103, 381-388 (1971).
4. Tazima Y., Kada T., Mukarami A. Mutagenicity of nitrofuran derivatives, including furylftiramide, a food
preservative. Mutat. Res., 32, 55-80 (1975).
5. Ebringer L., Subik J., Lahitova N., Trubacjk S., Horvathova R., Siekle P., KrajcCovic^ J. Mutagenic effects
of two nitro furan food preservatives. Neoplasma, 29, 675-684 (1982).
6. Nomura T. Carcinogenicity of the food additive furylftiramide in foetal and young mice. Nature, 258, 610-611 (1975).
8. Scott Foster.I.H., Russell A.D. Antibacterial dyes and nitrofurans. II. Nitrofurans. In: Hugo WB: Inhibition
and destruction of the microbial cell. London - New York Academic Press, S 201-204 (1971).
7. Takayama S., Kuwabara N. The production of skeletal muscle atrophy and mammary tumors in rats by feeding
2-(2-furyl)-3-(5-nitro-2-furyl) acrylamide. Toxicol. Lett., 1, 11-16 (1977).
9. Matsuda T. Review on recent nitrofuran derivatives used as food preservatives. J. Fermentation Technol., 44,
495-508 (1966).
10. Farkas J. Les agents de stabilisation biologique des vins. Ann. Technol. Agric., 27, 279-288 (1978)
11. Kennard C.H L. Another food chemical, AF-2 alpha-2-furyl-5-nitro-2-furanacrylamide. Int. Flavours Food
Additives, 7: 2, 59-60 (1976).
250
Литература
К главе 51
1. Partmann W. Antibiotica in der Lebensmittelkonservierung. Z. Lebensm. Unters. Forsch., 106, 210-227 (1957).
2. Goldberg H S. Nonmedical uses of antibiotics. Adv. Appl. Microbiol., 6, 91-117 (1964).
3. Shibasaki 1. Antibacterial activity of Tylosin on Hiochi-bacteria. .1. Fermentation Technol., 48, 110-115 (1970).
4. Suzuki M., Okazaki M., Shibasaki 1. Mode of action of Tylosin (1). J. Fermentation Technol., 48, 525-532 (1970).
К главе 52
1. Hachitani N., Takisawa Y, Kawainura T, Tateno S., Sakabe H., Asanoma M., Noda M., Ishizaki M., Ishibashi T., Kuroda
K.L. Acute toxicity of natural food additives and mutagenicity screening. Tokishikoroji Foramu, 8, 91-105 (1985).
2. Haas G.J., Barsoumian R. Antimicrobial activity of hop resins. J. Food Protect., 57, 59-61 (1994).
3. Marth E.HAntibiotics in foods — naturally occuring, developed and added. Residue Rev., 12, 65-161 (1966).
4. Beuchat L.R. Sensitivity of Vibrio parahaeinolyticus to spices and organic acids. J. Food Sci., 41, 899-902 (1976).
5. Forstreuter-Kiinstler M., Ahlert B. Hemmung von Mikroorganismen durch Gewiirzinhaltsstoffe. Lebensmittel-
chem. Gerichtl. Chem., 38, 143-145 (1984).
К главе 53
1. Beuchat L.R., Golden D.A. Antimicrobials occuring naturally in foods. Food Technol., 43, 1 34-142 (1989).
2. Reiter B., Harnulv G. Lactoperoxidase antimicrobial system: natural occurence, biological functions, and
practical applications. J. Food Protect., 47, 724 (1984).
3. Ashworth D., Turton K. An approach for formulations removing preservatives from consumer products.
Cosmet. Toiletr. Manufact. Worldwide, 81-85 (1995).
4. Dobbenie D., Uyttendaele M., Delevere J. Antibacterial activity of the glucose oxidase/glucose system in liquid
whole egg. J. Food Protect., 58, 273-279 (1995).
К главе 54
1. Lucke E-К., Geis A. Bacteriocine. In: Dehne L.I., Bogl K.W.: Die biologische Konservierung von Lebens-
mitteln. Ein Statusbericht. SozEp-Heft des Bundesgesundheitsamtes, S 34-45 (1992).
2. Barnby-Smith EM, Bacteriocins: applications in food preservation. Trends in Food Sci. Technol., 3, 133-137 (1992).
3. Lewus C.B., Kaiser A., Montville T.J. Inhibition of food-borne bacterial pathogens by bacteriocins from lactic
acid bacteria isolated from meats. Appl. Enviromn. Microbiol., 57, 1683-1688 (1991).
4. Okereke A., Montville T.J. Bacteriocin inhibition of Clostridium botulinum spores by lactic acid bacteria.
J. Food Protect., 54, 349-353, 356 (1991).
5. Hoover D.G., Steenson L.R. Bacteriocins of lactic acid bacteria. San Diego Academic Press (1993).
6. Wang June Kim. Bacteriocins of lactic acid bacteria: their potentials as food biopreservative (review). Food
Rev. Int., 9, 299-313 (1993).
К главе 55
1. Li'icke F-K (1992) Schutzkulturen. In: Dehne LI, B6gl KW: Die biologische Konservierung von Lebensmitteln.
Ein Statusbericht. SozEp-Heft 4 des Bundesgesundheitsamtes, S 16-33
К главе 56
1. Charley V.L.S The prevention of microbiological spoilage in fresh fruit. J. Sci. Food Agric., 10, 349-358 (1959).
2. Long J.K., Leggo D. Waxing citrus fruits. Food Preserv. Q., 19, 32-37 (1959).
3. Liick E. Fnngistatische Verpackungsinaterialien auf Basis Sorbinsaure und Caiciumsorbat. Dtsch. Lebensm.
Rundsch., 50, 353-357 (1962).
Предметный указатель
А
А5283 170
Авидин 211
Азид натрия 181
Азот 39, 74-75
Активность воды 50
Алкоголь см. Этанол
Аллиин 210
Аллилгорчичное масло 200
Аллилизотиоцианат 210; см. также
Аллилгорчичное масло
Аллицин 210
Антибиотики 53, 209
Антимикробное действие консервантов 40
Антимикробные упаковки и покрытия 216
Ауреомицин 209
Афлатоксины 48, 98
Ацесульфам К 120
Ацетат калия 39; см. также Уксусная
кислота
Ацетат кальция 39; см. также Уксусная
кислота
Ацетат натрия 39; см. также Уксусная
кислота
Б
Бактериоцины 211,212
Бензоат калия 39; см. также Бензой-
ная кислота
Бензоат кальция 39; см. также Бензой-
ная кислота
Бензоат натрия 39; см. также Бензой-
ная кислота
Бензойная кислота 15, 25, 33, 39, 47, 48,
50, 65, 96, 119, 128, 141-146, 196
допустимое суточное поступление 35
Биоконсервирование 211,212
Бисульфит калия 39; см. также
Диоксид серы
Бисульфит натрия см. Диоксид серы
Бисульфиты см. Диоксид серы
Бифенил 39; см. также Дифенил
допустимое суточное поступление 35
Бифенил-2-ол см. «-Фенилфенол
Борная кислота 14, 25, 39, 50, 179—180
Бромат калия см. Броматы
Броматы 186
Бромуксусная кислота 195
Бура 39; см. также Борная кислота
В
Винный спирт см. Этанол
Висконсин-процесс 84
Водородный показатель 48
ВОЗ 34
Возникновение устойчивости К кон-
сервантам 43
Воски 215—216
Г
Гексаметилентетрамин 39, 191-193
допустимое суточное поступление 35
Генная токсичность 20
Генные мутации 26
Геномные мутации 26
Генотоксичность 25
Гептил-л-оксибензоат см. эфиры пара-
оксибензойной кислоты
«-Гидроксибифенил см. н-Фенилфенол
Гидроксид кальция см. Известковая
вода
Гидросульфит калия см. Диоксид серы
Гидросульфит кальция 39; см. также
Диоксид серы
Гидросульфит натрия 39; см. также
Диоксид серы
252
Предметный указатель
Гипохлорит кальция см. Хлор
Гипохлорит магния см. Хлор
Гипохлорит натрия см. Хлор
Гиппуровая кислота 25
Гликоли 51
Глицерин 51
Гумулон 210
д
Двуокись серы см. Диоксид серы
Двуокись углерода см. Диоксид угле-
рода
Дегидрацетовая кислота 36, 202-203
Диацетат натрия см. Уксусная кислота
допустимое суточное поступление 35
Дикарбонаты см. Эфиры пироугольной
кислоты
Диметилдикарбонат 39; см. также
Эфиры пироугольной кислоты
Диметилпирокарбонат 53; см. также
Эфиры пироугольной кислоты
Диоксид серы 39, 53, 89-98
Диоксид углерода 39, 67-73
Диоксид хлора см. Хлор
Дифенил 39, 154, 155, 156-158, 216
Дихлоризоцианураты см. Хлор
Диэтиловый эфир диугольной кислоты
см. Эфиры пироугольной кислоты
Диэтил пирокарбонат 45; см. также
Эфиры пироугольной кислоты
Допустимое суточное поступление 30,
34
ДСП см. Допустимое суточное поступ-
ление
Дым (коптильный) 159—162
Ж
Жидкое стекло 214—215
3
Защитные культуры микроорганизмов
213
И
Известковая вода 214—215
Искусственные покрытия 215—216
К
Канцерогенность 31
Кинетика отмирания микроорганизмов 31
Классы токсичности 23
Кональбумин 211
Консерванты
бактериостатическое действие 40
бактерицидное действие 40
аллергенное действие 33
влияние свойств субстрата на
действие 48
антагонизм 45
коэффициент безопасности 34
коэффициент распределения 50
синергизм 45
Коптильный дым 14
Копчение 46
Креозот 14
Критерии допуска к использованию 38
Л
Лактопероксидаза 211
Лактоферрин 211
Лизоцим 39, 174—176,211
допустимое суточное поступление 35
Лупулон 210
М
Метабисульфит калия см. Диоксид серы
Метабисульфит натрия см. Диоксид серы
Метабисульфиты см. Диоксид серы
Метил-и-гидроксибензоат 39; см.
также Эфиры иара-оксибензой-
ной кислоты
Метил-и-оксибензоат см. Эфиры пара-
оксибензойной кислоты
Метиловый эфир и-оксибензойной
кислоты; см. также Эфиры пара-
оксибензойной кислоты
допустимое суточное поступление 35
Методы проверки консервантов 54
Микотоксины 19,48
Минеральные масла 215
Мипроцин 170
Молекулярная дозиметрия 31
Молочная кислота 14, 39, 196—197
допустимое суточное поступление 35
Предметный указатель
253
Муравьиная кислота 15,50,112-115
допустимое суточное поступление 35
Мурамидаза см. Лизоцим
Мутагенность 10, 26, 27, 31
Н
Натамицин 39, 170-173, 196, 209
допустимое суточное поступление 35
Натриевая соль метил-л-гидрокси-
бензоата 39; см. также Эфиры
ллрл-оксибензойной кислоты
Натриевая соль пропил-п-гидрокси-
бензоата 39; см. также Эфиры
ллрл-оксибензойной кислоты
Натриевая соль этил-и-гидрокси-
бензоата 39; см. также Эфиры
ицра-оксибензойной кислоты
Натриевая соль о-фенилфенола см.
о-фенилфенол
Низин 39, 166-169, 219, 222
допустимое суточное поступление 35
Нитрат калия 39; см. также Нитраты
Нитрат натрия 39; см. также Нитраты
Нитраты 47, 81—85
допустимое суточное поступление 35
Нитрит калия 39
Нитрит натрия 39; см. также Нитриты
Нитриты 23, 36, 47, 53, 84-85
допустимое суточное поступление 35
Нитрозамины 53
О
Озон 53,91-98
л-Оксибензоаты см. Эфиры пара-
оксибензойной кислоты
и-Оксибензойная кислота 33
о-Оксидифенил см. о-Фенилфенол
Окись этилена 187—189
Оксид серы (IV) см. Диоксид серы
Оксид углерода (IV) см. Диоксид углерода
Окситетрациклин 209
Острая токсичность 22
П
Парабены 128; см. также Эфиры пара-
оксибензойной кислоты.
Пенициллин 209
Перекись водорода 53, 183—184
допустимое суточное поступление 35
Пимарицин 39, 47; см. также Ната-
мицин
Пирокарбонаты 53, 140; см. также
Эфиры пироугольной кислоты
Пиросульфит калия 39; см. также
Диоксид серы
Пиросульфит натрия 39; см. также
Диоксид серы
Пиросульфиты см. Диоксид серы
Пищевая аллергия 33
Пищевое законодательство 37
Плавиковая кислота 14
Поваренная соль 30, 45, 46, 47, 50, 51,
60-66
Подострая токсичность 27
Покрытия 214-216
Полифосфаты см. Фосфаты
Поправка Делани 32
Практические испытания 54
Применение смесей консервантов 44
Пропил-л-гидроксибензоат 39; см.
также эфиры иара-оксибензой-
ной кислоты
Пропил-л-оксибензоат см. эфиры пара-
оксибензойной кислоты
Пропиленгликоль 190
Пропиловый эфир и-оксибензойной
кислоты; см. также эфиры пара-
оксибензойной кислоты
допустимое суточное поступление 35
Пропионат калия 39; см. также
Пропионовая кислота
Пропионат кальция 39; см. также
Пропионовая кислота
Пропионат натрия 39; см. также
Пропионовая кислота
Пропионаты см. Пропионовая кислота
Пропионовая кислота 33, 36, 39, 50,
122-126, 136
допустимое суточное поступление 35
Пряности 210
Псевдоаллергические реакции 33
Р
Разложение консервантов 53
Растительные масла 215
Реакции непереносимости 33
254
Предметный указатель
Реакции непереносимости пищи 33
Репродуктивная токсичность 27
С
Салициловая кислота 14, 15, 25, 33, 36,
47, 128, 204-205
Сахар 14, 45, 47, 40, 51; см. также
Сахароза
Сахара 41
Сахароза 107-111
активность воды в растворах 109
Свекловичный сахар см. Сахароза
Селитра см. Нитраты
Сера см. Диоксид серы; см. также
Диоксид серы
Серебро 177-178
Сернистая кислота 14, 50; см. также
Диоксид серы
допустимое суточное поступление 35
Сернистый ангидрид см. Диоксид серы
Сернистый газ см. Диоксид серы
Сложные эфиры л-оксибензойной
кислоты 15; см. также Эфиры
иара-оксибензойной кислоты
Смеси консервантов 36
Соли пропионовой кислоты 15; см.
также Пропионовая кислота
Соли хлорноватистой кислоты см. Хлор
Соль 14; см. также Поваренная соль
Сорбат калия 39, 184; см. также
Сорбиновая кислота
Сорбат кальция 39, 130; см. также
Сорбиновая кислота
Сорбат натрия 130; см. также Сорби-
новая кислота
Сорбаты см. Сорбиновая кислота
Сорбиновая кислота 15, 33, 36, 39, 47,
48, 50, 96, 119, 127-136, 196, 216
допустимое суточное поступление 35
Спектры действия консервантов 43
Спирт 14; см. также Этанол
Способы консервирования 12
Средняя летальная доза 22
Средняя летальная концентрация 23
Средняя эффективная доза 23
Средства дезинфекции 40
Средства холодной стерилизации 139
Стрептомицин 209
Субтилин 209
Субхроническая токсичность 28
Сульфит калия см. Диоксид серы
Сульфит кальция 39; см. также
Диоксид серы
Сульфит натрия 39; см. также Диоксид
серы
Сульфиты 53; см. также Диоксид серы
т
Теннецетин 170
Тератогены 27
Терпимый ежедневный приём 35
Тест на питательных средах 54
Тест Эймса 26
Тетраборат натрия 39; см. также
Борная кислота
Тетрациклин 209
Технология барьеров 46
Тиабендазол 39, 163—165
2-(4-Тиазолил)-бензимидазол см.
Тиабендазол
2-(Тиазол-4-ил)-бензимидазол см.
Тиабендазол
Тилозин 209
Тиомочевина 201
Токсикокинетика 23
Токсиколого-гигиеническая оценка 19
Токсины 13
Томатидин 210
Требования к чистоте 18
Тринатрийфосфат см. Фосфаты
Тростниковый сахар см. Сахароза
У
Углекислота см. Диоксид углерода
Углекислый газ см. Диоксид углерода
Угольный ангидрид см. Диоксид
углерода
Уксус 14
Уксусная кислота 14,39, 116—121, 119, 125
допустимое суточное поступление 35
Упаковки 214-216
Уровень, не вызывающий наблюдае-
мого действия 30
Условно переносимое недельное
поступление 35
Предметный указатель
255
Ф
ФАО 34
Фенилбензол см. Дифенил
2-Фенилфенол см. о-фенилфенол
о-Фенилфенол 39, 153—155
допустимое суточное поступление 35
о-Фенилфенолят натрия 39; см. также
о-Фенилфенол
Ферменты 211
Формальдегид 31
Формиаты см. Муравьиная кислота
Формирование устойчивости к пище 44
Фосфатные соли-плавители см. Фос-
фаты
Фосфаты 182
Фториды 14, 185
Фунгистатическое 40
Фунгицидное 40
Фурилфурамид 36, 207—208
X
Хлор 99—102
Хлораты 14
и-Хлорбензойная кислота 15,206
Хлорид натрия см. Поваренная соль
Хлористый натрий см. Поваренная соль
Хлорная известь см. Хлор
Хлортетрациклин 209
Хлоруксусная кислота 194
Хромосомные мутации 26
Хроническая токсичность 29
Э
ЭДТА см. Этилендиаминтетрауксусная
кислота
Этанол 31, 51, 53, 103-106
Этил-и-гидроксибензоат 39; см. также
Эфиры иара-оксибензойной
кислоты
Этил-и-оксибензоат см. Эфиры пара-
оксибензойной кислоты
Этилендиаминтетрауксусная кислота 199
Этиловый спирт см. Этанол
Этиловый эфир и-оксибензойной
кислоты
допустимое суточное поступление 35
Эфиры глицерина и жирных кислот 198
Эфиры диугольной кислоты см. Эфиры
пироугольной кислоты
Эфиры и-оксибензойной кислоты 33,
36, 49; см. также эфиры пара-
оксибензойной кислоты
Эфиры иара-гидроксибензойной
кислоты см. Эфиры поро-окси-
бензойной кислоты
Эфиры и«/«?-оксибензойной кислоты
147-152
Эфиры пироугольной кислоты 137-140
Acceptable daily intake см. Допустимое
суточное поступление
ADI см. Допустимое суточное поступ-
ление
АО АС 138
AvGard” 182
Baycovin® 137
Delvocid® 170
Delvocoat® 170
Delvopos® 170
ED50 23
Garantol® 215
GRAS 175
International Agency for Recearch on
Cancer 92
JECFA 34
LC50 23
LD50 22
M ya vert C* 211
Natamax® 170
Nisaplin® 166
NOAEL 179
NOEL 34
Panosorb® 136; см. также Сорбиновая
кислота
SCF 34
Velcorin® 137