Автор: Кушаковский М.С.
Теги: патология сердечно-сосудистой системы сердечно-сосудистые заболевания внутренние болезни медицина практическая медицина
ISBN: 5-93929-045-0
Год: 2002
Текст
УДК 616.12—008.341
ББК 54.10
Кушаковскпй М. С. Эссенциальная гипертензия (гипертоничес-
кая болезнь). Причины, механизмы, клиника, лечение. — 5-е изд.
доп. и перераб. — СПб.: ООО «Издательство Фолиант», 2002. —
416 с., ил.
ISBN 5-93929-045-0
ISBN 5-93929-045-0
© М. С. Кушаковскпй, 2002
О Оформление. И КФ «Фолиант».
2002
Моим любимым, незабвенным
родителям посвящаю
Автор
Профессор М. С. Кушаковский,
Почетный кардиолог России,
Почетный доктор Санкт-Петербургской медицинской
академии последипломного образования
СПИСОК СОКРАЩЕНИИ
AI — ангиотензин I
АП — ангиотензин II
АВ — атриовентрикулярный
АГ — артериальная гипертензия
АД — артериальное давление
АДГ — антидиуретический гормон
АПФ — ангиотензинпревращающий фермент
ВСА — внутренняя симпатомиметическая активность
ГБ — гипертоническая болезнь
ГК — гипертензивный криз
ДБГ — допамин-Ь-гидроксилаза
ДОКА — дезоксикортикостерона ацетат
ДОФА — диоксифенилаланин
ЗСЛЖ — задняя стенка левого желудочка
МЖП — межжелудочковая перегородка
МО — минутный объем (сердца)
НЦД — нейроциркуляторная дистония
ОВЖ — объем внеклеточной жидкости
ОИЖ — объем интерстициальной жидкости
ОПС — общее периферическое сопротивление
ОЦП — объем циркулирующей плазмы
ПАГ — пограничная артериальная гипертензия
СА — синоатриальный
СИ — сердечный индекс
ТО — торакальный объем (крови)
УО — ударный объем (сердца)
ФВ — фракция выброса
ХЗСН — хроническая застойная сердечная недостаточность
ЭГ — эссенциальная гипертензия
ЮГ — юкстагломерулярные (клетки)
Pg — простагландин(ы)
ПРЕДИСЛОВИЕ
Прошедшие 7 лет с момента предыдущего издания этой кни-
ги характеризовались активным изучением эссенциальной ги-
пертензии (ЭГ) в различных ее аспектах. Особенно интенсивны-
ми были поиски новых лекарственных препаратов, эффективно
понижающих АД. При оценке этих препаратов кардиологи те-
перь ориентируются не на впечатления о них либо на скромный
диссертационный опыт, а на результаты доказательной медици-
ны (evidence-based medicine), получаемые при многоцентровых
кооперативных исследованиях, охватывающих сотни и тысячи
больных, изучаемых по единой, согласованной программе. Ил-
люстрацией полезности такого нового и несомненно прогрессив-
ного метода анализа может послужить коренной пересмотр на-
ших взглядов о роли и месте диуретиков в лечении ЭГ (см. соот-
ветствующую главу).
Существенно изменилась и общая стратегия лечения ЭГ,
чему способствовали Рекомендации Всемирной Организации
Здравоохранения и Международного общества по борьбе с ги-
пертензией. Введены новые нормативы АГ, усовершенствована
се классификация.
Возможно, менее продуктивными были исследования этиоло-
гии и патогенеза ЭГ. Мало новых идей, все еще нет ощутимых ре-
зультатов в выяснении генетических корней заболевания. Сло-
жившуюся ситуацию известный патолог проф. Ю. В. Постнов на-
звал «кризисом познания гипертензии как явления». Можно, ко-
нечно, не соглашаться со столь пессимистической оценкой,
высказанной к тому же автором, настойчиво продолжающим по-
иски истоков ЭГ. Однако очевидно, что центрогенно-нервная
теория патогенеза ЭГ, которая десятилетиями занимала в нашей
науке монопольное положение, нуждается в существенной кор-
5
рекции. К сожалению, в работах многих отечественных ученых,
клиницистов и экспериментаторов о ней часто и не вспоминают.
Между тем роль симпатической нервной системы в сложном
генезе ЭГ отрицать нельзя, но все же не этот механизм является
ведущим и определяющим. Острые (подострые) подъемы АД
действительно в основном возникают при участии нейрогенных
факторов, но хроническая, особенно устойчивая систоло-диасто-
лическая АГ, по-видимому, не может сложиться без решающего
участия почечно-гуморальных и ряда других факторов. В моно-
графии уделено этим все еще спорным вопросам много вни-
мания. В этой связи считаю своим товарищеским и профес-
сиональным долгом отметить недавно опубликованную капи-
тальную монографию профессора Б. И. Шулутко «Артериальная
гипертензия» (2001), отличающуюся оригинальностью, свобод-
ным изложением, обилием фактов. Основываясь на своих на-
блюдениях, полученных при пункционной биопсии почек
у больных ЭГ, пользуясь методом дедуктивного анализа,
Б. И. Шулутко пришел к обоснованному заключению о патоге-
нетической близости ЭГ и вторичных почечных гипертензий.
В моей книге нашли отражение работы сотрудников кафедры
кардиологии МАПО, которые накопили изрядный опыт в изуче-
нии этого заболевания.
Автор благодарен всем сотрудникам кафедры кардиологии и
Покровской больницы г. С.-Петербурга, на которой уже 70 лет
базируется кафедра. Особенно я признателен доцентам ка-
федры Н. В. Ивановой, Г. Б. Смирнову, Т. Н. Новиковой,
а также доценту кафедры терапии Медицинского университета
им. И. П. Павлова Т. В. Трешкур, способствовавшим выходу
в свет этой монографии.
Книга рассчитана на кардиологов, терапевтов, практических
врачей, преподавателей и студентов медицинских учебных заве-
дений.
Заслуженный деятель науки России,
действительный член Нью-Йоркской Академии Наук,
лауреат премий РАМН имени Г. Ф. Ланга, А. Л. Мясникова,
доктор медицинских наук
профессор кафедры кардиологии С.-Петербургской МАПО
М. С. Кушаковский
ВВЕДЕНИЕ
О НАИМЕНОВАНИИ ЗАБОЛЕВАНИЯ
Впервые хроническую форму систоло-диастолического повы-
шения АД предложили называть гипертонической болезнью, или
Hypertoniekrankheit, — Hochdruckrankheit, немецкие авторы, в
частности известный клиницист G. Bergmann, в чем легко убе-
диться, ознакомившись с его монографией «Функциональная
патология». Но еще раньше это же заболевание было названо
Е. Frank (1911) «эссенциальной гипертензией». Этот термин, чет-
ко разделивший артериальную гипертензию еще неясной этио-
логии и патогенеза и артериальную гипертензию почечной этио-
логии, т. е. Брайтовскую форму, в последующем был принят во
всем мире. Я полагаю, что настало время принять его и отечест-
венной кардиологией, которая входит во Всемирную организа-
цию здравоохранения. Такая унификация терминологии устра-
нит трудности международного общения, сделает более естест-
венным участие наших клиницистов в многоцентровых коопе-
ративных исследованиях, облегчит изучение новых противоги-
пертензивных средств, устранит различные семантические недо-
разумения.
По-прежнему актуален для нас и выбор между понятиями
«гипертония» и «гипертензия», хотя уже прошло 24 года с тех
пор, когда комиссия, созданная при Медицинской энциклопе-
дии, обоснованно отдала предпочтение термину «гипертензия» и
всем производным от него наименованиям (гипертензивные
кризы, противогипертензивные препараты и т. д.). Настало
время ввести в нашу литературу и кардиологическую практику
эти единые унифицированные наименования.
7
КРАТКАЯ ИСТОРИЧЕСКАЯ СПРАВКА
Она необходима, ибо сказано: «чтобы понять науку, надо
знать ее историю».
Открытие и разработка методов измерения АД
Термин circulatio sanguinis (циркуляция крови) впервые при-
менил итальянский медик, ботаник и философ Andreas Cisalpinus
(Цизальпин), который еще в 1569 г. высказал предположение о
существовании у человека большого круга кровообращения.
Реальное открытие системы кровообращения было осуществ-
лено великим английским ученым Вильямом Гарвеем (William
Harvey, 1578—1657). В знаменитой книге «Exercitatio Anatomica
de motu Cordis et sanguinis» (1628) он изложил результаты своих
экспериментальных наблюдений in vivo, продемонстрировавших
непрерывное движение крови по замкнутому кругу, связанное с
ритмическими сокращениями сердца — мышечной помпы. Эта
исторического значения работа логично поставила вопрос о су-
ществовании внутрисосудистого давления крови, без которого
было бы невозможно ее перемещение по сосудистому руслу.
Только через 105 лет после исследования В. Гарвея англикан-
скому клирику (священнику) Стефану Гелсу (Stefan Hales,
1667—1761) удалось измерить кровяное давление у животного.
Свои опыты Геле описал в статье «Hemastatics» (1733). Для изме-
рения АД он ввязал в левую бедренную артерию 14-летней кобы-
лы латунную трубку, которую соединил с вертикально установ-
ленной стеклянной трубкой. После снятия зажима с артерии
кровь толчкообразно поднялась в стеклянной трубке на высоту
8 футов и 3 дюйма; ее уровень колебался около среднего уровня
синхронно с сокращениями сердца вверх и вниз на 2—4 дюйма
(5—10 см). Этот же исследователь впервые наблюдал снижение
АД при искусственной дозированной кровопотере, высказал
суждение о периферическом сосудистом сопротивлении, сердеч-
ном выбросе и общем объеме крови.
В первой половине 19-го столетия запись АД у животных
производил К. Ludwig (1847), применявший для этой цели разра-
ботанный в его лаборатории J. Poisseuille (Пуазель, 1843) U-об-
разный ртутный манометр, соединенный с артерией резиновым
шлангом. Измеренное систолическое давление у лошади равня-
лось 159 мм, у собаки — 151 мм рт. ст. Воспользовавшись тем же
методом, Fevre (Февр) в 1856 г. определил систолическое АД у
8
STATICAL ESSAYS:
CONTAINING
H^MASTATICS;
Or, An Ассеежт ef feme
HYDRAULIC and HYDROSTATICAL
EXPERIMENTS
Blood and Blood-Veffcls of Animal»,
also
An Account of Ibmc Ехркжшжют on Stonis
in the KiDNiTa and Bladdxr» with an Eh-
quixy into the-NATvaa of thofe anomalous
Cokcrbtions.
To which fo added.
An APPENDIX,
CONTAINING
OBSERVATIONS and EXPERIMENTS
rdatino to foveral Suajacrs in the Firft Vdone. The
gmtcft Part of which were read at federal Meeting* before
the Royal Society.
With an INDEX to both V о ъ v м в s.
VOL. II.
МАтмг МШм JUtiMSi «wo V WNw, can MmIkmw
fZwm jwoflbor. Fra», de VcraL ХаОеае. Мфа.
By STEPHEN HALES, D. D. F. R. S.
Rector of Farriwgpon, Hamp» hi*, a, and Minifter of
Teddingtoo, МШкГех.
The Tit bro Eoitiov, Cone&ed.
L О N D О N,
Primed for WiltOO aed Nicol, ш the Strand; T. Durham.
near Charing Craft ; G» Keitw, in Gnce»drarah Street; and
Roeieioe tad Robbeti, a j, in Pater.noftcrRow. 176$.
Титульная страница работы S. Hales
9
человека, подвергшегося ампутации бедра; оно оказалось рав-
ным 120 мм рт. ст.
Неоднократно предпринимались попытки разработать некро-
вавый метод измерения АД. Одним из таких предложений был
«Sphygnomomentor» (сфигмоманометр) S. S. К. von Basch (1878),
который усовершенствовал ранее существовавший сфигмограф
К. Vierordta (1855). Суть метода состояла в том, что с помощью
резинового пелота производили давление на сосуд, оценивая
уровень АД по манометру. Однако применить этот метод у по-
стели больного не удалось. Только рекомендация итальянского
врача Scipione Riva-Rocci использовать вместо пелота соединен-
ную с манометром манжетку, в которую нагнетается воздух, дала
в руки врача пальпаторный метод (1896 г.) определения уровня
систолического АД (по ощущению пульсовой волны на лучевой
артерии при выпускании воздуха из манжеты).
Честь открытия бескровного метода измерения не только
систолического, но и диастолического АД принадлежит мо-
лодому русскому военному хирургу Николаю Сергеевичу Корот-
кову. По поручению профессора госпитальной хирургиче-
ской клиники Военно-меди-
цинской академии С. П. Фе-
дорова, Н. С. Коротков изучал
состояние кровотока у боль-
ных с артериовенозными со-
устьями, вызванными ране-
ниями, полученными ими
во время русско-японской
войны. В ноябре 1905 г.
Н. С. Коротков сделал на
межкафедральном заседании
сообщение о звуковых явлени-
ях (тоны и шумы), возникаю-
щих ниже места наложения
манжеты при пережатии ею
артерии. Присутствовавший на
заседании профессор кафедры
Портрет Н. С. Короткова
(1874-1920)
10
Др> Л 0. Во/елкмъ X» вопросу • методах»
иаом1доваи1я кровяного дше111 (вл» иваикк
проф. С. П. ведорова).
На ocaoaaala своих» иабявдаяй докладчик»
пришел» к» тому ааипчек1п, «по воин» ежа-
там артер!я При нормальных» уыолих» не дает»
никаких» авувов». Воспольлоаавишса втнм» ав-
левйм» оа» предлагает» звуковой метод» опре-
Mtaaaia кровавого дамеак ва лвдлхх Рукав»
Штеа-Roecl ааададываетса па средам» 4t плача;
даман1е в» рукав» бистро повышается дп пол-
наго прокращеяй кровоо6рацов1а вкже рукава.
ЗаЩп, предоставив» ртути манометра падать,
датским» стетоскопом» выслушивает» aprepi»
тотчас» гаже рувааа. Сперва во слышно вака-
анх» нвуков». Пра аадеи(н ртута мааометра до
млвнстиой высоты Ьолвлжвтсл первые aoporalo
топы, поавлев!» которых» укалывает» ва про-
хождеи!а часта пульсовой волны код» рукавом».
Саадов., цифры манометра, при которых» по-
явился первый тон» соотвЬтетвуют» мамсимааь-
пому даалоа1п. Пра дааавМшем» падомХи ртутм
в» мааометра слышатся смотопчоскТе компрео-
с1оввые шумы, которые переходят» скова в»
токы (вторые). Наконец», вс» авука исчтвгь.
Время ксчеаыовеа1я мукой» укалывает» ва
свободиу» проходимость пульсовом волны; дру-
гнмп словами, в» момент» всчваав1я внуком»
мииимальвое кровавое давлеж)е в» apiepla аре-
выевло даваний в» рукав». СМя, цифры мано-
метра в» «то время соотвВтспувт» манвмахь-
вому кровавому даалмио. Опыты аа жпотиых»
дали положительные релультаты. Первые мука-
товы поивлямтса (на 10—12 пт.) раньше, вежавх
ауам», для отуцек1я яотораго (г. ат. radial»)
требуется прорыв» большей часта пульсовой
волны.
Отчет о выступлении Н. С. Короткова
11
Портрет М. В. Яновского
(1854-1927)
пропедевтики внутренних
болезней М. В. Яновский
поддержал предположение
Н. С. Короткова о возмож-
ности использования этого
приема для измерения АД.
Когда спустя два года
Б. Фельнер в Германии,
независимо от Короткова,
описал тот же метод, как
новый, только благодаря
настойчивости и усилиям
М. В. Яновского приори-
тет Н. С. Короткова и рус-
ской науки был утвержден
во всем мире (цитировано по Н. Н. Савицкому). В силу своей
простоты и доступности звуковой метод Короткова—Яновского
(это будет справедливее) стал обязательным при исследовании
состояния здоровья миллионов людей. Этому методу мы обязаны
успешным развитием новой главы патологии сердечно-сосуди-
стой системы — учению об артериальной гипертензии. Жизнь
Н. С. Короткова, долгие годы находившегося в забвении,
недавно была с должной полнотой и любовью описана
проф. С. Е. Поповым в монографии «Николай Сер. Коротков:
история неизвестного доктора с бессмертным именем» (1998,
110 с.). Когда я читал эту книгу, у меня невольно возникли ассо-
циации с судьбой доктора Ю. Живаго, столь ярко созданной ге-
нием Б. Пастернака.
Между тем еще М. В. Яновский при изучении коротковских
звуковых феноменов отметил, что появление или исчезновение
звуков не всегда соответствует истинной величине переменного
давления в артерии. В частности, выявились расхождения в по-
казаниях коротковского метода в зависимости от того, повыша-
ют или понижают давление в манжете. Стал известен также факт
бесконечного звучания сосуда у совершенно здоровых людей, у
спортсменов после значительных физических нагрузок. Мини-
12
мальное (диастолическое) давление в подобных случаях опреде-
ляется близким к нулю, хотя в действительности оно нормально.
Эти и другие обстоятельства побудили моего учителя
Н. Н. Савицкого — ученика М. В. Яновского и Н. Я. Чистовича
(школа С. П. Боткина) — приступить к разработке нового графи-
ческого метода измерения АД.
Первое сообщение о новом методе было сделано Н. Н. Са-
вицким в 1922 г.; работа была завершена в середине 30-х годов.
Было бы ошибкой думать, что, разрабатывая свой метод,
Н. Н. Савицкий стремился только к преодолению некоторых
ограничений звукового метода, т. е. к более точному измерению,
в основном, диастолического давления. Николай Николаевич
поставил перед собой значительно более широкие задачи.
Известно, что несмотря на большие колебания внутрисосу-
дистого давления в аорте и артериях во время систолы И диасто-
лы, кровоток в артериолах осуществляется при устойчивом ре-
жиме давления, которое называют «давлением на входе» (в арте-
риолы), или средним гемодинамическим давлением. Впервые
И. М. Сеченовым было указано на большое физиологическое
значение среднего гемодинамического давления. И. П. Павлов в
своих классических экспериментах, выполненных в лаборатории
при кафедре С. П. Боткина, показал, что животный организм
удерживает среднее давление на постоянном уровне при весьма
значительных воздействиях.
Он сравнивал это со способ-
ностью организма сохранять
постоянство температуры тела.
С тех пор к измерению сред-
него давления неоднократно
обращались в клинике при
изучении патологических со-
стояний и реакций человече-
ского организма на различные
воздействия. Однако несовер-
шенство метода осциллогра-
фии, предложенного Мареем
Портрет Н. Н. Савицкого
(1892-1984)
13
для определения среднего давления у человека, не позволяло
широко пользоваться этим показателем в оценке функциональ-
ного состояния системы кровообращения. По данным Вакэ, ме-
тод Марея, который все еще иногда применяют, только в 25%
случаев дает верные величины. В остальных случаях ошибка из-
мерения может достигать 30 и более мм рт. ст. Итак, помимо
более точного измерени яди астол ичес ко го
давления, Николай Николаевич стремился
найти удобный и точный метод определения
среднего гемодинамического давления.
Третий стимул, если можно так выразиться, имел отношение
к исследованию бокового систолического давления. При полном
пережатии артерии манжетой регистрируется максимальное, или
конечное систолическое давление, которое представляет из себя
сумму между истинным боковым давлением крови на стенку со-
суда и ударным давлением, или так называемым гидравлическим
ударом, детально изученным Н. Е. Жуковским. Ударное давление
начинает проявлять свое действие, когда возникает препятствие
свободному передвижению крови. Запас кинетической энергии,
которым обладает движущийся столб жидкости, превращается в
давление. В условиях физиологического эксперимента определе-
ние бокового систолического давления может быть осуществле-
но введением в артерию Т-образной канюли.
Методом, который открыл возможности для одновременного
бескровного измерения у больных в клинике всех пяти величин
артериального давления: минимального, среднего, бокового, ко-
нечного и ударного, был метод тахоосциллографии, разработан-
ный и предложенный Н. Н. Савицким в 1935 г. Прибор тахоосцил-
лограф, позже названный механокардиографом, был сконструи-
рован Савицким, исходя из требований теории регистрирующих
аппаратов О. Франка. Сочетание в одном приборе тахоосцил-
лографии, позволяющей избежать искажений обычной осцилло-
графии, со сфигмографией дает возможность получать данные
не только об артериальном давлении, но и о скоростях распро-
странения пульсовой волны по артериям эластического и мышечно-
го типа, т. е. судить об их упруговязком состоянии.
В своих последующих исканиях Н. Н. Савицкий исходил из
общей направленности регуляторных механизмов аппарата кро-
вообращения на уравновешивание энергетических потребностей
организма с внешней средой. Кровь является единственным ис-
14
точником снабжения тканей кислородом теплокровных организ-
мов. И хотя организм располагает рядом приспособлений, на-
правленных к удержанию постоянства парциального давления
кислорода в тканях, первичное значение имеет количество кро-
ви, протекающее через единицу объема ткани в единицу време-
ни, т. е. МО кровообращения, или сердечный выброс. Отсюда
Н. Н. Савицкий сделал вывод, что у здорового человека в строго
стандартных условиях основного обмена величина МО сердца
должна быть пропорциональна величине основного обмена.
Исходя из этой посылки о пропорциональности минутного
объема кровообращения напряженности тканевых окислитель-
ных процессов, Н. Н. Савицкий в 1936 г. предложил ввести в
практику исследований понятие должной величины МО сердца.
Опыт работы клиники Савицкого и многих других исследова-
тельских групп Советского Союза показал, что индивидуально-
постоянная величина должного МО сердца является столь же
важной при количественной оценке состояния гемодинамики,
как и должная величина основного обмена в оценке метаболиче-
ских сдвигов у человека. В этом пункте, помимо прикладного
значения, нужно прежде всего видеть принципиальную идею.
Опытным путем была подтверждена мысль, что не только крово-
обращение в целом, как интегральная система, но и все его состав-
ляющие элементы являются функциями газового обмена. Так был
найден ключ к выведению индивидуально-должных постоянных
величин, т. е. путь, открывающий возможности количественной
оценки функции аппарата кровообращения.
Вслед за величинами должного среднего давления, должного
минутного объема сердца Н. Н. Савицкий вывел третью посто-
янную величину гемодинамики в условиях основного обмена —
удельное периферическое сопротивление: должное и рабочее, ока-
завшиеся достаточно надежными эталонами сравнения для
оценки состояния артериолярно-прекапиллярного русла. В на-
стоящее время за рубежом, да и в публикациях в наших журна-
лах, можно встретить такие понятия, как индекс R. Sannerstedt,
индекс S. Julius, т. е. периферическое сопротивление в условных
единицах, — все это запоздавшие на 30—40 лет формулы и вели-
чины удельного периферического сопротивления, предложенные
Н. Н. Савицким, подробно описанные и проанализированные в
его трех монографиях, вышедших в 1956, 1963 и 1974 годах.
15
К упомянутым должным величинам следует добавить показа-
тель эластического сосудистого сопротивления, модули упругости
артерий эластического и мышечного типа, величины, характери-
зующие утилизацию кислорода тканями, функцию красящего ве-
щества крови, т. е. гемоглобина, и его сродство к кислороду, дав-
ление кислорода в смешанной венозной крови. Это особая глава
научной деятельности школы Савицкого.
Итак, многолетние исследования школы Савицкого увенча-
лись созданием не только оригинального прибора, но и совер-
шенно нового метода количественной оценки системы кровооб-
ращения.
Поиски причин и механизмов развития АГ
Косвенное указание на возможность повышения АД у чело-
века мы впервые находим в трудах Авиценны (XI век), утверж-
давшего, что у людей, потреблявших много соли, пульс стано-
вился твердым. Р. Брайт (R. Bright, 1789—1858), изучив патоло-
гоанатомическую картину 100 погибших больных, у которых при
жизни определялась альбуминурия, отметил (1836 г.) у этих лиц
частое развитие гипертрофии левого желудочка. Р. Брайту при-
надлежит известное высказывание, смысл которого сводится к
тому, что если у больного плохо функционируют почки, то у
него больше работает сердце, т. е. повышается нагрузка на серд-
це. Развивая эти взгляды, G. Jhonson (1818—1896) впервые вы-
сказал предположение, что повышение внутрисосудистого давле-
ния крови является причиной как гипертрофии левого желудоч-
ка, так и часто возникающих при Брайтовой болезни мозговых
кровоизлияний.
На то, что повышение кровяного давления может происхо-
дить и у лиц, не страдающих почечными заболеваниями, указал,
согласно изысканиям G. Pickering (1964) и Ю. В. Постнова
(1999), доктор F. Mahomed, опубликовавший свои данные на
страницах «Известий Медико-хирургического общества» в Лон-
доне в 1874 г., что опережает работу С. Allbutt (еще до открытия
метода измерения АД). В послекоротковскую эру Е. Frank ввел
понятие «эссенциальная гипертензия» (1911 г.), что фактически
означало разграничение АГ на формы почечного и внепочечного
происхождения. Более четко это сделал Г. Ф. Ланг, разделивший
АГ на эссенциальную (ГБ) и симптоматические (вторичные)
16
TABULAR VIEW
OF THS
MORBID APPEARANCES IN 100 CASES
CONNBCTSD WITH
ALBUMINOUS URINE.
WITH OBSERVATIONS.
BY DR. BRIGHT.
The following tabular digest of one hundred cases, in which
the mottled and granular kidney has existed, and in most
of which the renal affection was a prominent feature of the dis-
ease, has been formed almost entirely from cases which have
occurred within my own observation: some of them have been
under my care during life; but in almost all, I have been pre-
sent at the examination after death; and the appearances
are either such as I have myself noted, or, where I have
neglected to do this, the ample records of our Museum manu-
scripts have furnished me with the necessary details. The
first thirty-three of the dissections which I have reduced to a
tabular form have already been published in another shape, in
my Medical Reporta: the remaining sixty-seven are unpub-
lished cases, of most of which it was my intention to* have
given an account in the present communication; but the press
of matter obliges me to defer them to a future number of this
work.
I will not assert, that every individual case recorded in the
table was ascertained, during life, to have been the subject
Титульная страница работы P. Брайта
17
Портрет Г. Ф. Ланга
(1875-1948)
формы, в статье, опублико-
ванной в 1922 г. в Трудах Ле-
нинградского института усо-
вершенствования врачей.
Все эти важные историче-
ские даты и факты характери-
зуют, на наш взгляд, преиму-
щественно умозрительный пе-
риод изучения АГ. Ему на сме-
ну пришел период научно-
экспериментального изучения
этого заболевания. За про-
шедшие годы во многих лабо-
раториях и клиниках разных
стран накопилось огромное число фактов и выдвигались новые
идеи и гипотезы. Естественно, что в своем обзоре мы можем
представить лишь краткий перечень наиболее крупных достиже-
ний в этой области кардиологии.
В 1934 г. Н. Goldblatt (1891—1977) и соавт. в эксперименте
продемонстрировали, что сужение просвета почечной артерии и
связанное с ним усиленное выделение ишемической почкой ре-
нина (предположение о его существовании высказали гораздо
раньше К. Tigerstedt и В. Bergman, 1898) вызывает повышение
АД и, следовательно, может быть причиной ЭГ. Опыты лабора-
тории Гольдблатта послужили основой для последующей разра-
ботки почечной теории происхождения ЭГ; они стимулировали
множество экспериментальных исследований, которые, в конце
концов, привели к открытию ангиотензинов I, II и ангиотензин-
превращающего фермента (Skeggs L. et al., 1954, 1956). Только
через 20 лет были синтезированы специфические ингибиторы
этого фермента, теперь широко применяемые для лечения АГ и
недостаточности кровообращения (Ondetti М., Rubin В., Cush-
man D., 1974).
К рениновой (ангиотензиновой) теории патогенеза ЭГ, практи-
чески, склонился и A. Guyton (Гайтон), когда в 1977 г. изложил
свою концепцию об обязательном участии почек в становлении
18
хронической АГ у лиц, не страдающих локальными заболевания-
ми почек. Эту теорию широко использовали J. Laragh и соавт.
(1970—1980 гг.), сделавшие попытку профилировать больных ЭГ
в зависимости от уровня активности ренина в плазме крови.
Параллельно со стремлением связать развитие ЭГ с накопле-
нием в крови больных различных прессорных веществ происхо-
дило формирование и другого направления исследований, сто-
ронники которого усматривали причины ЭГ в утрате почками
способности синтезировать и выделять в кровь депрессорные ве-
щества, обычно участвующие в регуляции АД. Здесь прежде все-
го следует упомянуть начатые еще в 30-х годах XX века работы
А. Грольмана (A. Grollman) о ренопривных механизмах АГ, а также
эксперименты W. Kolf и соавт. (1964) с удалением у животного
почечной ткани. Ренопривная гипотеза происхождения ЭГ полу-
чила значительную поддержку благодаря открытию систем по-
чечных простагландинов и кининов (McGiff J. et al., 1970; Muir-
head E. et al., 1972; Lee J. et al., 1975). В наше время, после неко-
торого периода охлаждения, вновь возрастает интерес к этой ги-
потезе. Например, Б. И. Шулутко (1991—1993 гг.) усматривает в
наследственном ослаблении медуллярно-депрессорной функции
почек причину возникновения не только ЭГ, но и симптомати-
ческих АГ. С такой точкой зрения я, в общем, согласен, хотя
в практическом отношении это отождествление разных АГ мне
представляется нецелесообразным.
Становлению еще одного направления в исследовании ЭГ
способствовали выполненные в разных странах работы по так
называемой «солевой гипертензии». В этом плане следует напом-
нить о клинических наблюдениях Е. М. Тареева (1948) и экспе-
риментах L. Dahl и соавт. (1962), создавших модель соль-чувст-
вительной АГ у животных. Тем же авторам принадлежит утверж-
дение, что у лиц с определенной наследственной предрасполо-
женностью избыток поваренной соли в пище может вести к
устойчивому повышению АД.
Эта гипотеза (в различных вариантах) и в 80—90-х годах име-
ет многих сторонников, впрочем, и не меньше оппонентов. Что
же касается принципиального вопроса о роли наследственности
в развитии ЭГ, то еще раньше R. Platt (1947) высказал предполо-
жение, что ЭГ наследуется по доминантному типу в соответст-
вии с законами Менделя, что, правда, в последующем не нашло
подтверждения.
19
Специально следует остановиться на работах отечественных
исследователей, вклад которых в исследование ЭГ трудно пере-
оценить. Прежде всего следует вновь назвать Г. Ф. Ланга, посту-
лировавшего в 1948 г. свою знаменитую центрогенно-нервную
теорию происхождения ГБ. Г. Ф. Ланг, возможно, ближе других
подошел к выяснению сущности этого заболевания. В последую-
щем углублению нейрогенной теории способствовали в 60—70-х
годах работы А. Л. Мясникова и его сотрудников (Шхваца-
бая И. К., Эрина Е. В., Арабидзе Г. Г., Некрасова А. А., Смолен-
ский В. С. и др.), в 70—90-х годах — глубокие теоретические и
клинические исследования И. И. Исакова, 3. М. Волынского,
Е. Е. Гогина, А. Н. Сененко и их соавторов; В. А. Алмазова и его
учеников и сотрудников (Цырлин В. А., Шляхто Е. М., Хирма-
нов В. Н., Маслова Н. П., Шабров А. В. и др.).
Как я уже упоминал выше, значительным достижением в вы-
яснении гемодинамических механизмов нейроциркуляторной
дистонии гипертензивного типа, пограничной артериальной ги-
пертензии (ПАГ) и ЭГ явились выполненные в 50-х годах иссле-
дования Н. Н. Савицкого и его школы (Вульфович С. О., Кузне-
цов В. И., Кушаковский М. С., Никитин В. П., Морозов К. А.,
Мошкин Е. А. и др.).
Развитием этого направления стали исследования сотрудни-
ков кафедры кардиологии Ленинградского (Санкт-Петербург-
ского) ГИДУВа по профилированию больных ЭГ и клинической
классификации гипертензивных кризов (Кушаковский М. С.,
Иванова Н. В., Смирнов Г. Б., Шутко Г. В., Легостев А. Б., Чу-
рин К. В. и др.).
В 70—80-х годах, благодаря работам ряда исследовательских
групп, в первую очередь Ю. В. Постнова и С. С. Орлова, веду-
щее положение среди теоретических основ патогенеза ЭГ заняла
«мембранная» теория. Она способствовала формированию но-
вых взглядов о характере наследственности при ЭГ, роли изме-
нений сосудистой стенки, ионной проницаемости мембраны
гладко-мышечных клеток резистивных сосудов, прежде всего
для ионов Са++. Ниже этот вопрос будет рассмотрен более
подробно.
Заканчивая этот краткий исторический очерк, я хотел бы еще
раз подчеркнуть, что мое изложение не претендует ни на полно-
ту, ни на строгое соблюдение хронологии. Развернутый анализ
современных гипотез об этиологии и патогенезе ЭГ будет пред-
20
ставлен во 2-й главе. Надо учитывать, что в подобных историче-
ских экскурсах всегда приходится искусственно отделять одни
концепции от других, хотя в реальных условиях между ними
имеются глубинные связи, несмотря на внешние различия. Пе-
речень авторов, заслуживавших хотя бы упоминания, вероятно,
следовало бы существенно расширить, однако такой возможно-
стью я не располагал, поэтому ограничился лишь упоминанием
о наиболее важных вехах и интересных идеях, выдвигавшихся на
более чем 250-летнем пути изучения АГ.
ГЛАВА 1
ОСНОВНЫЕ
ФИЗИОЛОГИЧЕСКИЕ СИСТЕМЫ
РЕГУЛЯЦИИ (КОНТРОЛЯ)
АРТЕРИАЛЬНОГО ДАВЛЕНИЯ
Среди механизмов, обеспечивающих формирование АД и
поддержание его на нормальном уровне, можно выделить: а) ге-
модинамические факторы, непосредственно определяющие вы-
соту АД; б) центральные и периферические нейрогуморальные
системы, регулирующие состояние гемодинамики, т. е. воздейст-
вующие на гемодинамические факторы в таком направлении,
чтобы удерживать АД в физиологических пределах. Это разделе-
ние, конечно, условно, поскольку те и другие механизмы посто-
янно взаимодействуют и функционируют в тесной связи.
ГЕМОДИНАМИЧЕСКИЕ ФАКТОРЫ.
ОПРЕДЕЛЯЮЩИЕ УРОВЕНЬ АД
К их числу относятся: 1) сердечный выброс, или минутный
объем (МО) сердца, т. е. количество крови, поступающей в сосу-
дистую систему в единицу времени; 2) общее периферическое
сопротивление (ОПС), или проходимость резистивных сосудов
(артериолы и прекапилляры), от которой зависит интенсивность
оттока крови из артериального русла; 3) упругое напряжение сте-
нок аорты и ее крупных ветвей, создающее общее эластическое
сопротивление (Ео); 4) вязкость крови.
Основное влияние на уровень АД оказывают изменения МО
сердца и ОПС, поскольку у здоровых людей вязкость крови яв-
ляется практически величиной постоянной (при сужении рези-
стивных сосудов вязкость крови может возрастать, дополнитель-
но повышая ОПС). Что же касается общего эластического со-
противления, то оно повышается главным образом у лиц пожи-
22
лого и старческого возраста, когда уплотняются стенки аорты и
крупных артерий эластического типа.
Согласно основной закономерности гемодинамики, между Р,
МО и ОПС существует зависимость, выражающаяся в формуле:
Р=МО х ОПС, где Р — среднее гемодинамическое давление, т. е.
результирующая величина из всех переменных величин давления
за время сердечного цикла. В физиологических условиях среднее
гемодинамическое давление поддерживается на устойчивом
уровне в пределах 80—90 (95) мм рт. ст. Это обеспечивается ре-
ципрокными соотношениями между МО и ОПС; при увеличе-
нии у здорового человека МО сердца ОПС у него понижается
адекватно, т. е. настолько, что влияние возросшего МО на уро-
вень АД вскоре нивелируется. Правда, если у такого же здорово-
го человека по какой-либо причине произошло бы значительное
повышение ОПС, то ответное снижение МО сердца оказа-
лось бы только частичным (неадекватным), ибо более резкое его
уменьшение привело бы к ухудшению кровоснабжения тканей и
их кислородному голоданию. В этой необычной ситуации орга-
низм сохраняет минимально необходимый уровень кровотока,
как бы «игнорируя» повышение АД.
Продолжая характеристику факторов гемодинамики, форми-
рующих АД, я хочу привлечь внимание к тому обстоятельству,
что и МО является производным других гемодинамических ве-
личин и прежде всего объема циркулирующей плазмы (ОЦП).
При устойчивой емкости сосудов, особенно венозных, и посто-
янном числе эритроцитов наполнение сосудистой системы,
практически, полностью зависит от ОЦП. Колебания ОЦП не-
медленно сказываются на величине МО сердца, поскольку меня-
ющееся наполнение сосудистой системы оказывает воздействие
на приток крови к сердцу. Последний зависит от величины тора-
кального объема крови (ТО), который служит непосредственным
резервуаром крови для левого отдела сердца. Соответственно,
увеличение доли этого отсека в общем объеме циркулирующей
крови, т. е. возрастание коэффициента ТО/ОЦК способствует
увеличению УО (МО) сердца.
Нельзя также не учитывать, что ОЦП находится в тесной
связи с объемом интерстициальной жидкости (ОИЖ). Соотно-
шение между этими секторами (отсеками) жидкости в здоровом
организме достаточно стабильно. Такая устойчивость в распреде-
лении объема внеклеточной жидкости (ОВЖ) между ее внутри-
23
сосудистым и интерстициальным секторами регулируется слож-
ной нервно-гуморальной системой и прежде всего симпатиче-
скими нервами, воздействующими на пре- и посткапиллярное
сопротивление и тем самым на уровень фильтрационного давле-
ния в капиллярах — «старлинговские силы» (Чернух А. М. и др.,
1975; Folkow В., Neil Е., 1973). В свою очередь, ОВЖ в теле чело-
века определяется содержанием ионов NA+ и значит тесно свя-
зан с регуляцией натриевого баланса.
Что касается ОПС, то согласно закону Пуазейля (Poisseuille),
сопротивление каждого сосуда: W = 8Ет)/л: • г4, где W — сопро-
тивление, L — длина сосуда, ц — коэффициент вязкости крови,
тс = 3,14, г — радиус сосуда. Следовательно, сосудистое сопро-
тивление току крови определяется ее вязкостью, длиной сосуда;
оно обратно пропорционально четвертой степени радиуса арте-
риол, т. е. их сужение, вазоконстрикция является наиболее важ-
ным механизмом повышения сопротивления кровотоку. Так как
артериальная система построена по принципу параллельных
шунтирующих цепей, то общее периферическое сопротивление
(ОПС) будет определяться, по аналогии с известными законами
электродинамики, следующей формулой:
—L— = -J-+ —L + + — •
Wo61uee Wj W2 + -+ Wn
В свою очередь, величина просвета резистивных сосудов
контролируется сложными нейрогуморальными и эндокринны-
ми механизмами, к рассмотрению которых мы и переходим.
НЕЙРОГУМОРАЛЬНЫЕ СИСТЕМЫ
РЕГУЛЯЦИИ АД
Тесная взаимосвязь многочисленных физиологических ком-
понентов, участвующих в формировании АД, и его достаточная
стабильность обеспечиваются многоступенчатым аппаратом ре-
гуляции, функционирующим на основе кибернетических прин-
ципов обратной связи (Анохин П. К., 1975).
Среди патофизиологов и клиницистов по-прежнему пользу-
ется признанием синтетическая концепция регуляции АД, разра-
ботанная А. Гайтоном (Guyton) в конце 70-х и в 80-х годах. Он
24
не только объединяет разнообразные, взаимодействующие между
собой механизмы, но и учитывает их относительную «силу» (эф-
фективность), быстроту включения и длительность действия.
С точки зрения А. Гайтона, регуляторные, биокибернетиче-
ские механизмы сосредоточены в двух основных системах:
1) в системе кратковременного действия, или адаптационной
(пропорциональной) контрольной системе; 2) в системе длитель-
ного действия, или интегральной контрольной системе.
Напомним, что П. К. Анохин (1975) рассматривает функцио-
нальную систему как «замкнутое физиологическое образование с
непрерывной обратной информацией об успешности данного
приспособительного действия». Такой подход несомненно имеет
преимущество перед простым перечислением отдельных меха-
низмов регулирования АД, нередко встречающемся в литературе.
Система быстрого кратковременного действия,
или адаптационная система регуляции АД
Она представлена несколькими регуляторными контурами,
или «петлями» биологической обратной связи. Главные из них:
а) барорецепторный рефлекс, включающий барорецепторы круп-
ных артерий -> центры головного мозга -> симпатические нер-
вы -> резистивные сосуды, емкостные сосуды, сердце -> АД;
б) почечный (плазменный) эндокринный контур, включающий
почки (ЮГ аппарат, ренин) АП -> резистивные сосуды АД.
Барорецепторный рефлекс. Это один из важнейших механиз-
мов регуляции сердечно-сосудистых функций (Komer Р., 1979).
Наиболее активные барорецепторы сосредоточены в дуге аорты
и в синокаротидной области. В ответ на острые изменения
внутрисосудистого давления эти рецепторы реагируют залпо-
вой афферентной импульсацией, распространяющейся через
IX—X пары черепномозговых нервов в три главных интегратив-
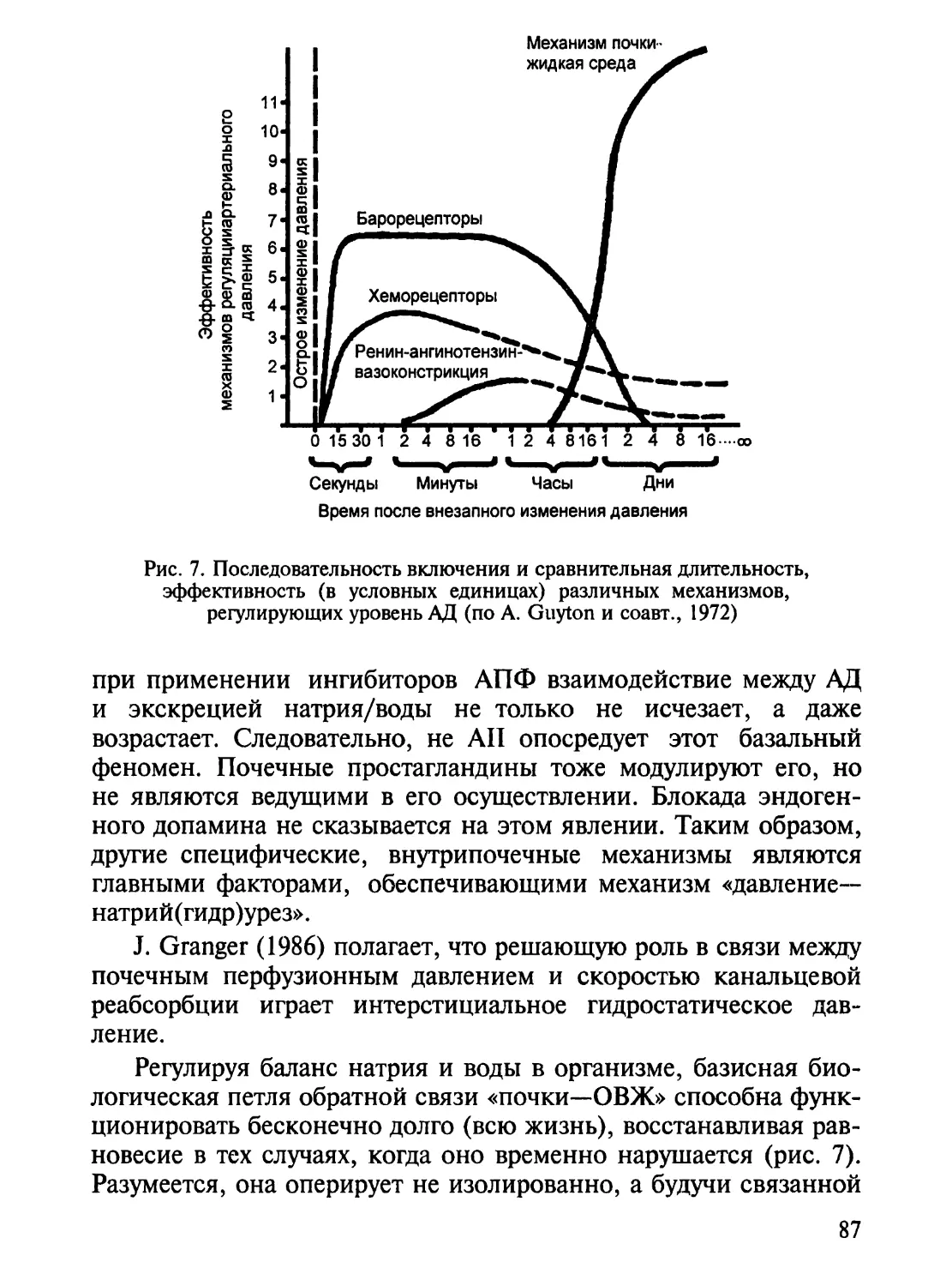
ных участка ствола мозга и сетчатого образования (рис. 1).
Первый центральный синапс барорецепторных нервов нахо-
дится в дорсомедиальной медулле, в nuclei tractus solitarii (NTS)
продолговатого мозга. Стимуляция NTS сопровождается таким
же депрессорным ответом, как и при раздражении аортального
депрессорного нерва. В зоне NTS в процессе передачи нервных
стимулов принимают участие химические передатчики, главные
из которых аминокислота — L-глутамат и пептид — субстан-
ция Р. Их выделение в зоне NTS после стимуляции аортально-
25
Рис. 1. Схема барорецепторной рефлекторной дуги.
1 — ramus sinus caroticus [n. glossopharyngeus (IX)]; 2 — афферентные волокна n. vagi (X),
выходящие из дуги аорты; 3 — nucleus tractus solitarii (NTS) продолговатого мозга; 4 — эф-
ферентные волокна n. vagi, подходящие к сердцу; 5 — центральные а-адренорецепторы
в зоне NTS; 6 — ингибиторные нейроны; 7 — бульбоспинальные пути (ингибиторные);
8 — nucl. intermediolateralis в боковых рогах спинного мозга; 9 — преганглионарные волокна;
10 — пограничный ствол; 11 — постганглионарные волокна; 12 — кровеносные сосуды
го депрессорного нерва является вторичным феноменом, появ-
ляющимся к окончанию депрессорного ответа. Микроинъекция
L-глутамата в зону NTS вызывает снижение АД и замедление ча-
стоты сердечных сокращений (Chong М. et al., 1994).
Второй основной интегративный участок ствола мозга распо-
ложен в каудальной вентролатеральной медулле; это тоже глав-
ный депрессорный центр, опосредующий барорецепторный реф-
лекс; здесь находятся группы клеток, содержащих норадреналин.
Раздражение этого центра вызывает понижение симпатической
активности на периферии, уменьшение ОПС и падение АД.
Важным открытием было описание третьего участка, распо-
ложенного в ростральной вентральной медулле, как главной
26
NTS
RVM
Baro
Affermts
Rostral Medulla
CVLM
Caudal Medulla
Spinal Cord
Sympathetic
Рис. 2. Схематическое представление о нейронах, вовлеченных в барорецепторный
симпатический рефлекс. В ответ на острое повышение АД происходит усиление
активности возбудительных (excitatory) нейронов в дуге аорты и каротидном
синусе. Эти нейроны проецируются в NTS, где деполяризуются возбудительные
нейроны второго порядка, которые, в свою очередь, проецируются в каудальной
вентролатеральной медулле (CVLM), где деполяризуются ингибиторные интер-
нейроны. Они проецируются в ростральной медулле (RVM). В результате
происходит снижение активности (частоты разрядов) в бульбоспинальных
симпатовозбудительных нейронах (---------------) и понижается АД
(по J. Chalmers et al., 1992)
симпатико-возбудимой прессорной зоны в стволе мозга (рис. 2)
(Chalmers J. et al., 1992). Укажу также, что в вентролатеральной
части рострального отдела ствола мозга расположена зона
I]-имидазолиновых рецепторов. Стимуляция этих рецепторов
способствует понижению АД (см. ниже). Ядра NTS соеди-
няются вставочными нейронами с вентролатеральными ядрами
продолговатого мозга. Каротидный барорефлекс более чувстви-
телен к снижению АД, чем к его повышению.
27
В осуществлении этих депрессорных и прессорных реакций
участвуют и более высоко расположенные центры мозга, вклю-
чая гипоталамус. В частности, имеются доказательства связи
между баро-, хеморецепторами синокаротидной зоны и секре-
цией вазопрессина и (или) пролактина. Следовательно, гипота-
ламо-гипофизарные механизмы функционируют как часть быст-
родействующей системы, поддерживающей нормальный уровень
АД (Цырлин В. С., Шляхто Е. В., 1991; Cowley A. et al., 1974;
Chalmers J. et al., 1979; Zanchetti et al., 1988).
Сложные барорефлексы достигают максимальной эффек-
тивности уже через 10—30 с после начала возбуждения сосуди-
стых рецепторов. Границы физиологических операций этих бу-
ферных механизмов соответствуют колебаниям АД от 100 до
125 мм рт. ст. (Guyton А., 1975). Непосредственная буферная
функция барорецепторных механизмов у нормотоников направ-
лена главным образом на то, чтобы сводить к минимуму колеба-
ния АД при переменах положения тела, психоэмоциональном
возбуждении, других преходящих воздействиях, т. е. эта система
служит противовесом факторам внешней среды, способным вы-
звать изменения, особенно понижение АД.
Почечный эндокринный (плазменный) контур. Этот механизм
адаптационной (контрольной) системы в основном тоже проти-
водействует острой гипотензии. Его активность проявляется в
узком диапазоне сдвигов АД: от 100 до 65 мм рт. ст. Начальное
звено почечного эндокринного контура — юкстагломерулярный
аппарат почек (ЮГ клетки), где синтезируется и выделяется ре-
нин. В норме около 80% ренина, который является протеолити-
ческим ферментом — аспартилпротеазой, находятся в плазме в
неактивной или малоактивной форме {проренин). Фермент, от-
ветственный за активацию in vivo проренина, т. е. превращение
его в ренин, пока точно неизвестен. Недавно, правда, Т. Shinaga-
wa и соавт. (1990) сообщили о таком ферменте, найденном ими в
гомогенате печени. D. Dubin и соавт. (1991) синтезировали пеп-
тид, состоящий из 11 аминокислот, обеспечивающий активацию
проренина. В свое время ряд авторов, основывающихся на ис-
следованиях in vitro, предположили, что главным активатором
проренина является плазменный калликреин. Допускается, что и
в почках проренин может под воздействием почечного калликре-
ина превращаться в ренин (Derx F. et al., 1979).
28
Поврежденная почка, в отличие от здоровой, секретирует
преимущественно активный ренин', 0-адреноблокаторы (пропра-
нолол и другие) подавляют секрецию активного ренина, но не
влияют на выделение проренина.
Регуляция секреции ренина (проренина) ЮГ клетками (со-
ставляют всего 0,01% почечной массы) осуществляется различ-
ными путями. Во-первых, через барорецепторы, находящиеся в
стенках приводящих почечных артериол и чувствительных к из-
менениям почечного перфузионного давления; секреция ренина
возрастает, если это давление понижается. Во-вторых, через хе-
морецепторы плотного пятна (macula densa) дистальных почеч-
ных канальцев, реагирующие на колебания концентрации NaCl
в жидкости, поступающей в канальцы. При этом ведущее значе-
ние придается ионам 01, транспорт которых является первичным
процессом, происходящим в толстом восходящем колене петли
Генле. Секреция ренина возрастает при снижении транспорта
ионов С1 и угнетается при избытке ионов хлора (Abboud Н. et al.,
1979). В-третьих, через почечные симпатические нервы, закан-
чивающиеся в мембране ЮГ клеток, на которой расположены
01 -адренорецепторы. Усиление 0-адренорецепторных адренерги-
ческих сигналов сопровождается увеличением секреции ренина.
По-видимому, этот последний (в нашем изложении) механизм
является ведущим, поскольку известно, что он регулирует два
других не нервных механизма (Thames М., Di Bona G., 1979).
На образование и выделение ренина оказывают влияние и
почечные простагландины (Pg); особенно стимулирует секрецию
ренина Pgh (простациклин), синтезируемый в коре почек. Эф-
фект Pgl2 опосредуется через барорецепторы ЮГ клеток (Ger-
ber J. et al., 1979). Секреция ренина зависит также от концентра-
ции различных веществ, циркулирующих в крови: катехолами-
нов, глюкагона, ионов Na+ и К+, наконец, АП. Возрастание в
плазме концентрации АП тормозит секрецию ренина по меха-
низму обратной связи («короткая петля»); образование ренина
понижается при увеличении ОВЖ и концентрации ионов Na+ в
плазме. Ограниченное поступление в организм человека ионов
Na+ с пищей (поваренная соль) способствует повышению актив-
ности ЮГ клеток и выделению ренина.
Началом в цепи сложных ферментативных реакций, приво-
дящих в конце концов к образованию АП, является взаимодей-
ствие ренина с плазменным белком аг-глобулином (тетрадека-
29
пептид), называемым также субстратом ренина, или ангиотензи-
ногеном. В результате этой реакции образуется ангиотензин I
(декапептид).
Ангиотензиноген + ренин -> Ангиотензин I (AI)
(тетрадекапептид) (декапептид)
Ген ангиотензиногена уже изолирован, и найдено его место в
хромосомах человека и крысы. В физиологических условиях
плазменная концентрация ангиотензиногена, вырабатываемого в
печени, отличается устойчивостью. Уровень ангиотензиногена
регулируется концентрацией АП по механизму обратной связи
(Eggena Р., Barrett J., 1992). При ряде состояний (беременность,
избыток эстрогенов, прием человеком глюкокортикоидов или
тиреоидина, заболевание циррозом печени) синтез этого белка
возрастает, кроме того, могут формироваться его добавочные ва-
рианты, способные влиять на образование AI. Ангиотензиноген
называют также «протеином острой фазы», поскольку синтез его
в печени повышается при некоторых формах острого и хрониче-
ского воспаления.
В исследовании W. Walker и соавт. (1979), которое проводи-
лось у 574 больных ЭГ, была найдена достоверная корреляция
между концентрацией ангиотензиногена в плазме и уровнем АД.
Ген ангиотензиногена был картирован в 1-й хромосоме (lq).
После публикации первой работы о роли гена ангиотензиногена
в развитии АГ неоднократно предпринимались попытки под-
твердить эти данные (Kotelevisev V. et al., 1991). Однако надо
признать, что большинство таких попыток оказались неудачны-
ми. Столь же безуспешными были усилия найти связь между по-
лиморфизмом гена ангиотензиногена и гипертрофией левого же-
лудочка, а также толщиной стенки сонной артерии (Beige J. et
al., 1977, 1996; Barley J. et al., 1995).
Образующийся на первом этапе ферментативной реакции AI
служит в основном материалом для дальнейших превращений,
но ему присущи и некоторые самостоятельные функции, в част-
ности: усиленное высвобождение норадреналина из окончаний
симпатических нервов, воздействие на некоторые отделы мозга с
последующей прессорной сосудистой реакцией на периферии
(Дзизинский А. А., Щепотин Ю. Е., 1980).
30
Ангиотензин II (АП) возникает в результате воздействия на
AI превращающего (конвертирующего) фермента — дипептидил
карбоксипептидазы (Erdos Е., 1975).
Ангиотензин I (AI) + превра—> Ангиотензин II (АП)
(декапептид) щающий (октапептид)
фермент
В микрососудах ангиотензин-превращающий фермент (АПФ)
расположен на мембранах клеток. Правда, этот фермент находят
и в адвентиции крупных сосудов, по-видимому, в связи с vasa va-
sorum (Rogerson F. et al., 1992). Циркулирующие молекулы АПФ
попадают в кровь, отделяясь от тканевых гликопротеидов. Важ-
нейшая роль легких в превращении AI в АП определяется преж-
де всего их богатой васкуляризацией, а также тем, что вне легких
АП не подвергается интенсивному распаду.
При таких болезнях, как саркоидоз, силикоз, бериллиоз, леп-
ра, болезнь Гоше, отмечается повышение концентрации АПФ в
плазме, однако это не приводит к возрастанию АД. Уровень
АПФ повышен и у части крыс нормотензивной линии WKY.
Следовательно, между концентрацией АПФ в плазме крови и
уровнем АД нет прямой зависимости.
В настоящее время стали известны альтернативные пути об-
разования АП без участия АПФ. В частности, в сердце человека,
по-видимому, основную роль (до 80%) в превращении AI в АП
играет фермент химаза, входящая в класс сериновых протеаз
(Nishimura Н. et al., 1996). В стенках крупных артерий человека и
некоторых млекопитающих (обезьяны, собаки) независимое от
АПФ образование АП происходит при участии химазоподобного
фермента, называемого CAGE (chymostatin-sensitive angiotensin
П-generating enzyme) (Urata H. et al., 1993).
Превращению AI в АП могут способствовать в сосудистой
стенке тканевый активатор плазминогена, в нейтрофилах — ка-
тепсин G и эластаза, а также тонин. Эти альтернативные пути
образования АП имеют наибольшее значение для активации тка-
невой системы ренин—ангиотензин II, участвующей в процессах
ремоделирования сердца и сосудов.
Следует учитывать, что в ряде тканей, в частности в голов-
ном мозге, сходной с АП эффекторной активностью обладает
ангиотензин (1—7); под действием пролиловой и нейтральной
эндопептидаз он формируется из АП и AI (Dzau N. J. et al., 1993;
Welches W. et al., 1993; Ferrario C. et al., 1990). Следовательно,
31
функции системы ренин—ангиотензин II осуществляют четыре
пептида АП, АШ, AIV и ангиотензин (1—7) (Преображен-
ский Д. В. и др., 1998). К этому следует добавить, что и образо-
вание ренина может происходить при участии фермента EDRAE
(endothelium-derived prorenin activating enzyme), т. e. вне ЮГ-сис-
темы почек.
Как видно, наши представления о строении и функции сис-
темы ренин—ангиотензин II значительно усложняются.
АПФ идентичен ферменту кининазе II, вызывающему разруше-
ние сосудорасширяющего вещества — брадикинина (Softer R., 1976).
При ингибировании (блокаде) АПФ возрастают концентрации
как AI (на фоне снижения уровня АП), так и брадикинина, т. е.
оба эффекта имеют противогипертензивную направленность.
АП присущи многообразные биологические функции. Это —
наиболее сильное прессорное вещество из известных в настоя-
щее время: его сосудосуживающая активность в 50 раз выше, чем
у норадреналина. При остром понижении АД образование рени-
на и АП усиливается; последний (вместе с норадреналином) вос-
станавливает нормальное АД, воздействуя на специфические ан-
гиотензиновые рецепторы артериол и высвобождая ионы Са++
из мембраны гладкомышечных сосудистых клеток с повышением
концентрации Са++ в миоплазме (Peart W., 1978). Требуется око-
ло 20 мин, чтобы этот механизм обратной связи достиг полной
эффективности. Ангиотензиновые рецепторы — ATi подразделя-
ются на подтипы АТ;д и ATjb, находящиеся в различных тканях.
Эти рецепторы по-разному реагируют на действие ингибиторов
АПФ (Inagami Т. et al., 1992).
Описанный путь восстановления АД при острой гипотензии
с участием АП не является единственным. Другие механизмы
имеют отношение к непосредственному взаимодействию АП с
центральными и периферическими отделами симпатической
нервной системы. Основным местом центрального нейроген-
ного прессорного эффекта АП (по-видимому, и AI) является area
postrema продолговатого мозга. Эти реакции бывают быстрыми и
замедленными. Первые связаны с достаточно острым возраста-
нием симпатической нервной активности на периферии; замед-
ленные ответы развиваются в течение часов и даже дней. Воз-
действуя на отдельные зоны ЦНС, АП не только способствует
повышению системного АД, но и усиливает чувство жажды, вы-
деление вазопрессина.
32
Периферические прессорные реакции АП (возможно, и AI)
связаны с высвобождением адреналина из мозгового слоя надпо-
чечников и норадреналина из окончаний постганглионарных
симпатических волокон. АП повышает также чувствительность
гладкомышечных сосудистых клеток к норадреналину.
Биохимические и метаболические эффекты АП не менее
многочисленны и важны. К ним относят:
активацию моноцитов;
угнетение апоптоза;
повышение захвата холестерина липопротеидов низкой плот-
ности;
стимуляцию пролиферации и миграции гладкомышечных
клеток;
повышение агрегации тромбоцитов;
ухудшение дисфункции эндотелия;
повышение тромбообразования.
Как подчеркивает Ж. Д. Кобалава (2000), большинство
эффектов, имеющих негативные последствия для сердечно-
сосудистой системы, реализуется через стимуляцию
ангиотензиновых рецепторов I типа.
Мы уже упоминали, что между уровнем АП в плазме и актив-
ностью ЮГ клеток существуют реципрокные соотношения. Раз-
рушение АП, его удаление из кровеносного русла компенсирует-
ся усилением секреции ренина и новообразованием АП. Напро-
тив, при избытке АП в плазме секреция ренина ЮГ клетками
тормозится. АП расщепляется при участии плазменных фермен-
тов-ангиотензиназ — с образованием неактивных олигопепти-
дов, а также АШ. Последний — гептапептид — продукт расщеп-
ления АП аминопептидазой. Уровень АШ в плазме достигает
лишь 20% концентрации АП. Его прессорная активность, пери-
ферическая и центральная — опосредованная, в 2 раза ниже, чем
АП. Теперь установлено, что АШ превращается в AIV. Оба они
обладают значительной биологической активностью. Вместе с
AI, АП ангиотензин III участвует в регуляции внутрипочечного
кровотока (Britton S. et al., 1980).
Необходимо хотя бы кратко рассмотреть вопрос о генети-
ческих исследованиях АПФ, в последние годы они заметно
усилились.
Установлено, что около 50% индивидуальной вариабельности
АПФ генетически детерминировано (Cambien F. et al., 1988).
2 Зак 3207
33
С 1988 г. появились сообщения о клонировании и определении
структуры гена АПФ (Hubert С. et al., 1991). Ген ангиотензин-
превращающего фермента локализован на хромосоме 17q23
(Mattei М., 1989). Был идентифицирован insertion/deletion (I/D)
полиморфизм, который заключается в наличии (insertion) или
отсутствии (deletion) фрагмента из 287 нуклеотидов в 16 интроне
гена АПФ (Regat В. et al., 1991).
На основании распределения I и D-аллелей выделяют три ге-
нетических варианта полиморфизма: гомозиготные — I/I и D/D;
гетерозиготный — I/D. Существует четкая зависимость между ге-
нотипом АПФ и концентрацией (активностью) АПФ (Regat В.
et al., 1990; Toret L. et al., 1992).
Правда, несмотря на выраженное влияние на активность
АПФ, I/D генотип не воздействует на продукцию АП, альдосте-
рона и ренина. У больных ЭГ с D/D генотипом был отмечен бо-
лее высокий уровень норадреналина в плазме крови по сравне-
нию с тем, как это бывает при I/I генотипе. По мнению
Р. М. Шахновича (1999), такое обстоятельство может оказывать
влияние на ремоделирование левого желудочка.
Основное внимание в этих исследованиях, естественно, на-
правлено на выяснение связи между полиморфизмом гена АПФ
и АД, а также гипертрофией левого желудочка. В результате
Фремингеймского исследования, охватившего 3145 больных ЭГ,
была найдена связь между наличием D-аллеля гена АПФ и более
высоким уровнем АД у мужчин, особенно диастолического дав-
ления (O’Donneli С. et al., 1997). Эти данные подтвердили X. Ren
и соавт. (1998).
Прослеживается также связь D-аллеля гена АПФ с развитием
гипертрофии мышцы левого желудочка; у лиц с генотипом D/D
АПФ выявляется большая масса миокарда левого желудочка уже
при обследовании молодых людей с ПАГ (Линчак Р. М., 2000;
Ковалев Ю. Р., 2000).
Наконец, М. Sesaki и соавт. (1996) выявили связь между ре-
грессией гипертрофии левого желудочка, наступающей при лече-
нии эналаприлом, и полиморфизмом генотипа АПФ.
Надо, однако, указать, что такого рода факты пока малочис-
ленны и не всегда подтверждаются (Минушкина Я. О. и др.,
2000; Бойцов С. А., 2000).
Заключительное звено системы ренин—АП составляют ре-
цепторы АП. В настоящее время известны 4 типа этих рецепто-
34
ров. Наиболее изучены функции 1 типа рецепторов. Воздействуя
на него, АП повышает уровень внутриклеточного Са и снижает
содержание в клетках цАМФ за счет блокирования аденилатцик-
лазы. Рецепторы I типа — АТ-1 имеют клетки различных тканей,
включая эндотелий сосудов и гладкие миоциты (Ferrari С.,
Flack J., 1996). Активация этих рецепторов приводит к росту кле-
ток, усиливает другие факторы роста, способствует выделению
эндотелина-1. АТ-П-рецепторы встречаются во всех органах и
тканях; в незрелых тканях АТ-П-рецепторов значительно боль-
ше, чем в зрелых тканях; предполагают, что эти рецепторы опо-
средуют влияние АП на овуляцию, а также рост и дифференциа-
цию клеток. Другой возможной функцией АТ2-рецепторов явля-
ется опосредование апоптоза, т. е. запрограммированной гибели
клеток. Таким образом, если АТ]-рецепторы опосредуют проли-
феративные эффекты АП, то АТг-рецепторы — его антипролифе-
ративный, или апоптотический эффекты (Dzau V. & Horiushi М.,
1996). Человеческий ген рецептора типа I ангиотензина II лока-
лизован на хромосоме 3q23 (Curnow К. et al., 1992). Известны
следующие варианты генотипов этого гена: АА, АС, СС.
Некоторые исследователи нашли, что у носителей СС-гено-
типа наблюдается достоверное повышение диастолического
давления по сравнению с обладателями генотипов АА и АС.
Ю. Б. Нефедова и соавт. (1999) не смогли найти различий в
распределении генотипов гена рецептора типа I ангиотензина II
среди больных ЭГ и здоровых людей. S. Lesage и соавт. (1997)
указывают на отсутствие взаимосвязи между каким-либо ге-
нотипом этого гена и ЭГ.
Таковы основные особенности строения и функции по-
чечной эндокринной (плазменной) системы ренин—AI—АП
(AIII) — важнейшего механизма адаптационной системы регуля-
ции АД.
Интегральная система регуляции АД
Обеспечивающая длительный контроль за уровнем АД и под-
держание его нормальных величин, интегральная система состоит
из многочисленных звеньев, среди которых ведущее значение
имеют: а) цепь почки -> кора надпочечников (альдостерон) ->
консервация ионов Na+ -> жидкая среда организма; б) депрессор-
ные механизмы, сосредоточенные главным образом в мозговом
слое (медулла) почки, а также в стенках резистивных сосудов.
35
Что касается цепи почки -> кора надпочечников, то она рас-
полагает двумя конечными эффекторными веществами: АП и аль-
достероном.
Выше были рассмотрены функции ренина и АП как плаз-
менных, гуморальных факторов, обеспечивающих быструю
(срочную) регуляцию АД. Классическое представление об этой
адаптационной системе основывается на том, что это — циркули-
рующая в крови (эндокринная) система, в которой взаимодейству-
ют печень, почки и легкие. Однако, как мы уже упоминали, все
элементы этой системы найдены и во многих других тканях и
органах, прежде всего в головном мозге. С помощью новейших
молекулярно-биологических методов свидетельства активности
генов ренина и ангиотензиногена найдены во всех органах, игра-
ющих важную роль в поддержании кардиоренального гомеостаза
(почки, надпочечники, мозг, сердце, кровеносные сосуды). Син-
тез ангиотензиногена, ренина, ангиотензинов происходит в этих
органах внутриклеточно (Lynch К. et al., 1986).
Местные системы ренин—АП оказывают аутокринные («на се-
бя») и паракринные («на соседние клетки») влияния, изменяя ло-
кальные тканевые функции (Ganten D., 1983; Dzau V., 1985;
Campbell D., 1987; Urata H., 1994). Между почечной (эндокрин-
ной), с одной стороны, и аутокринной, паракринной (местны-
ми) системами, с другой стороны, нет, по-видимому, четкой свя-
зи. Локальные механизмы способны оказывать длительное воз-
действие на резистивные сосуды, регулируя их проходимость,
соответственно — ОПС и АД. Существует мнение, что тканевые
системы ренина—АП в большей степени, чем плазменная, участ-
вуют в осуществлении противогипертензивного эффекта ингиби-
торов АПФ, тормозящих образование АП на месте и вызываю-
щих обратное развитие гипертрофии гладкомышечных сосуди-
стых клеток и сердечной мышцы (!).
Надо подчеркнуть, что локальные системы ренина—АП мало
влияют на уровень циркулирующих в плазме ренина и АП.
Воздействие АП на баланс ионов Na+ и жидкую среду орга-
низма — важнейшая функция интегральной, длительно действу-
ющей системы регуляции АД. Усиление реабсорбции Na+ обес-
печивается: а) непосредственным воздействием АП на почечные
канальцы; б) опосредованным усилением секреции альдостерона
клетками клубочкового слоя коры надпочечников.
36
Я уже упоминал, что между содержанием ионов Na+ в орга-
низме и секрецией ренина ЮГ клетками существуют реципрок-
ные соотношения. Ограничение натрия в пище стимулирует вы-
деление ренина и образование АН. У здоровых людей в такой
ситуации система ренин—АП, как плазменная, так и местная,
играет, по-видимому, ведущую роль в поддержании АД, по-
скольку при блокаде АПФ у них наблюдается резкое сниже-
ние АД. Если же натрия в пище много, секреция ренина и обра-
зование АП тормозятся. В этих случаях основным фактором,
поддерживающим АД, становится увеличение ОЦП, хотя значе-
ние системы ренин—АП полностью не исчезает (McGregor G. et
al., 1977).
Другой эффекторный гормон интегральной системы регуля-
ции АД — альдостерон — в основном обеспечивает гомеостазис
ионов Na+, К+ и воды. Подобно АП, он присутствует в плазме
здоровых людей в очень небольшой концентрации: 0,003—
0,004 нмоль/100 мл венозной крови, что составляет 1/100000 плаз-
менной концентрации кортизола. Скорость биосинтеза и выде-
ление альдостерона регулируются АП (АТП), секрецией АКТГ,
концентрацией ионов К+ и Na+ в плазме крови. Даже небольшое
повышение плазменной концентрации К+ может на длительное
время усилить секрецию альдостерона.
Существование почечно-надпочечникового гормонального
взаимодействия, или «оси» ренин—ангиотензин П—альдостерон,
подтверждается при определении у здоровых людей суточных ко-
лебаний компонентов этой системы: максимальный уровень ре-
нина и альдостерона отмечается в 4 ч утра, минимальный уро-
вень приходится на промежуток времени между 16 и 24 ч.
Альдостерон сам по себе не оказывает «обратного» влияния
на секрецию ренина; механизм обратной связи воздействует на
ЮГ клетки через натрий- и водозадерживающие эффекты альдо-
стерона. Итак, состояние натриевого баланса определяет степень
вовлеченности системы ренин—АП—альдостерон в процессы ре-
гуляции АД. Очевидно также, что оба эффекторных гормона ин-
тегральной контролирующей системы являются по своей сущно-
сти веществами с прессорной направленностью (задержка ионов
натрия и воды, сужение резистивных сосудов).
Таким образом, система ренин—АП—альдостерон играет важ-
нейшую роль в нейроэндокринном контроле различных сердеч-
но-сосудистых функций (Valloton М., 1987; Ferrario С., 1990).
37
ДЕПРЕССОРНЫЕ МЕХАНИЗМЫ
ИНТЕГРАЛЬНОЙ СИСТЕМЫ РЕГУЛЯЦИИ АД
Эти важные механизмы все еще недостаточно учитываются
при рассмотрении систем, длительно контролирующих уровень
АД, даже в концепции А. Гайтона.
Между тем еще в 30—40-х годах А. Грольман и соавт. выска-
зали предположение, что почки, помимо прессорных и задержи-
вающих натрий механизмов, располагают депрессорными и нат-
рийуретическими системами, выключение которых может спо-
собствовать формированию так называемой ренопривной АГ.
Эта гипотеза получила дальнейшее развитие после того, как
были найдены соответствующие вещества, выделяемые почками,
а также обнаружены некоторые другие гипотензивные меха-
низмы, локализующиеся как в почках, так и в периферических
сосудах.
К их числу относят: 1) систему простагландинов; 2) систему
калликреина—кининов; 3) допаминергические механизмы; 4) соб-
ственно сосудистые депрессорные механизмы; 4) натрийуретиче-
ские пептиды (рассматриваются в следующей главе).
Система простагландинов
Простагландины — ненасыщенные циклические жирные кис-
лоты, продукты метаболизма арахидоновой кислоты; они широ-
ко распространены в организме человека и животных, вызывая
многообразные физиологические эффекты (Некрасова А. А.,
1978; Dusting G., Moncada S., Vane J., 1979). Синтезируемые в
тканях, они выделяются в ответ на различные стимулы и функ-
ционируют главным образом как локальные биоактивные веще-
ства, но, как мы покажем ниже, могут попадать в кровь и, следо-
вательно, функционировать как гормоны. Имеется тканевая спе-
цифичность в выработке Pg определенного типа. Так, в коронар-
ных артериях и в сосудах скелетных мышц преобладающим
простагландином является Pgl2, или простациклин, а в мозговом
слое почек, в основном, синтезируются Pg серий Е, D, F, I, ко-
торые нередко вызывают разнонаправленные реакции.
Связь Pg с регуляцией АД демонстрирует ряд фактов:
а) внутривенное введение животным (кошки, собаки, кролики,
крысы с наследственной спонтанной АГ) арахидоновой кислоты
38
вызывает у них понижение АД; б) введение этим животным в
условиях такого острого опыта индометацина — ингибитора
циклооксигеназной реакции синтеза Pg из арахидоновой кисло-
ты сопровождается временным повышением АД, которое по сво-
им гемодинамическим характеристикам напоминает ЭГ (по-
вышение ОПС и почечно-сосудистого сопротивления при нор-
мальном МО сердца); в) при хроническом введении кроликам
индометацина отмечается прогрессирующее повышение АД од-
новременно со снижением на 80% мочевой экскреции Pg; г) ин-
дометацин понижает базальную и стимулированную активность
ренина плазмы, и это его действие связано с ингибированием
синтеза Pg; д) у больных ЭГ индометацин нейтрализует противо-
гипертензивные эффекты диуретиков и p-адреноблокаторов, по-
нижая синтез Pg.
Между тем, как недавно сообщили А. Ю. Рунихин и соавт.
(1999), пролонгированные внутривенные вливания экзогенного
Pgl2 оказывали благоприятное влияние на течение артериальной
гипертензии у крыс со спонтанной АГ. После такого курса вли-
ваний наблюдалось устойчивое снижение системного АД, проис-
ходило изменение барорефлекторной регуляции АД и биосинте-
за эндогеннных почечных простагландинов, что также способ-
ствовало улучшению кровоснабжения в органах-мишенях и при-
водило к вазодилатации в паренхиме почек, миокарде и в веще-
стве головного мозга.
Вероятно, ведущую роль в регуляции сосудистого тонуса и
АД играет простациклин, который формируется из промежуточ-
ных эндоперекисей (PgG2, PgH2) в эндотелии кровеносных сосу-
дов и, возможно, в их гладкомышечных клетках. Он является бо-
лее сильным вазодилататором, чем PgE2. Введенный внутривен-
но простациклин вызывает отчетливое понижение АД, и эта ре-
акция по гемодинамическим особенностям напоминает эффект
арахидоновой кислоты. Доминирующее положение простацик-
лина проявляется и в том, что его активность не утрачивается
полностью (только на 50%) в легочном кровотоке, тогда как PgE2
инактивируется на 90% уже за время одного прохождения крови
через легкие. Таким образом, высвобождаясь из легочного кро-
вотока, простациклин осуществляет функцию циркулирующего
гормона — вазодилататора, который модулирует сосудистый то-
нус, ОПС и АД.
39
Механизмы, с помощью которых Pg расширяет сосуды,
сложны. К их числу относятся: противодействие гормональной
(АП) и а-адренергической (норадреналин) вазоконстрикции, за-
держка выделения норадреналина из окончаний симпатических
нервов, регуляция содержания циклических нуклеотидов и, по-
видимому, прямое взаимодействие с кальциевыми механизмами
гладкомышечных сосудистых клеток.
Чувствительность сосудов к этим влияниям Pg варьирует в
различных зонах: она наиболее высока в скелетных мышцах и
низка в чревной области, сосуды которой вносят главный вклад
в формирование ОПС.
Со времен пионерских наблюдений Е. Muirchead и соавт.
(1960), а также J. Lee и соавт. (1963) почечная медулла и сосочек
рассматриваются как участки наиболее интенсивного синтеза Pg;
именно здесь выявляется наиболее богатый источник циклоок-
сигеназной активности (Anggard Е. et al., 1972). Полагали, что
кора почек не способна к синтезу Pg, хотя такая точка зрения
создавала трудности при объяснении воздействия Pg на рези-
стивные сосуды коры и выделение здесь ренина. Позже было по-
казано, что и кора почек способна синтезировать небольшое ко-
личество Pg (включая простациклин), участвующих в регуляции
почечной гемодинамики. По-видимому, сравнительно низкое
содержание Pg в коре почки связано не столько с небольшими ее
синтетическими возможностями, сколько с наличием здесь ин-
гибиторов циклооксигеназы (Terragno N. et al., 1978).
Почечный Pgl2 вместе с PgG2 и арахидоновой кислотой сти-
мулируют выделение ренина в ЮГ клетках и взаимодействуют с
АП в регуляции почечного сосудистого сопротивления, кровото-
ка и скорости клубочковой фильтрации (Weber Р. et al., 1979).
Имеется также немало фактов, показывающих, что изменение
объемов внеклеточной жидкости и плазмы, содержания в орга-
низме натрия и калия влияет на синтез медуллярных PgE2,
а они, в свою очередь, регулируют концентрационную способ-
ность почек и выделение электролитов (Epstein М. et al., 1974).
Как видно, почечные Pg, наряду с местными (сосудистыми)
Pg, осуществляют важные функции в поддержании водного и со-
левого гомеостазиса и сохранении нормальной проходимости ре-
зистивных сосудов, т. е. в процессах физиологического контроля
уровня АД.
40
Весьма показательно и то, что почечно-медуллярная микро-
сомальная активность циклооксигеназы не снижена, а усилена
у крыс со спонтанной наследственной АГ. Это указывает на то,
что снижение депрессорной функции медуллы не является началь-
ным механизмом развития такой АГ, скорее эта функция мобили-
зуется для ее предотвращения.
Калликреин-кининовая система
Еще один физиологический гуморальный депрессорный ме-
ханизм представлен системой калликреина-кинина. У человека
она подразделяется на два, по-видимому, независимых аппарата:
плазменный и почечный (железистый).
Калликреин плазмы (протеолитический фермент) — составная
часть свертывающего механизма крови — образуется из прекал-
ликреина при активации последнего фактором Хагемана. По-
мимо участия в процессах гемостаза калликреин выполняет и
другие функции, одна из которых, возможно, превращение про-
ренина в ренин. Еще одна функция калликреина состоит в от-
щеплении от кининогена (аг-глобулин) активного сосудорасши-
ряющего вещества брадикинина (нонапептид). Период полуэли-
минации введенного в кровь брадикинина не превышает 15 с.
Можно поэтому думать, что эндогенный брадикинин, высвобож-
дающийся для стимуляции свертывания крови и фибринолиза,
не оказывает заметного влияния на уровень АД. Однако вполне
реально его участие в регуляции местного кровотока путем воз-
действия на специфические сосудистые рецепторы (Дзизин-
ский А. А., Гомазков О. А., 1976; Титов М. И. и др., 1980).
Система калликреин a-к инина, найден-
ная в почках, заметно отличается от плаз-
менной системы (Lewinsky N., 1979; Von Thun A. et al.,
1994). Синтезируемый в почках калликреин исходит из каналь-
цевого эпителия кортикальных сегментов нефрона. В дисталь-
ных канальцах калликреин попадает в канальцевую жидкость и
затем в мочу. Следовательно, мочевой калликреин имеет почеч-
ное, а не плазменное происхождение. Одно только изменение
мочевой экскреции калликреина не может отражать состояние
калликреин-кининовой системы всего организма (McGiff J.,
Geller R., 1980).
41
В результате реакции между калликреином и кининогенами в
дистальных канальцах образуется лизил-брадикинин, или калли-
дин (декапептид), составляющий главную часть мочевых кини-
нов. Лизил-брадикинин, как и брадикинин плазмы, быстро раз-
рушается кининазами I и II. Я уже отмечал, что кининаза II
(дипептидил карбоксипептидаза) идентична ферменту, превра-
щающему AI в АП (Erdos Е., 1976; Softer R., 1976). Способность
кининаз регулировать содержание кининов в почках, по-види-
мому, весьма значительна. Так, подавление активности кинина-
зы II (ангиотензинпревращающего фермента) приводит к девя-
тикратному увеличению количества кининов в моче и к двух-
кратному — в почечной венозной крови. Неслучайно такие по-
бочные реакции больных на прием ингибиторов АПФ
(каптоприл, эналаприл и др.), как сухой, ирритативный кашель,
покраснение кожи, ангионевротические отеки, связывают с на-
коплением кининов («брадикининовые эффекты»). Эти реакции
не возникают, если наряду с ингибиторами АПФ применяют
специфический ингибитор брадикинина Ro 42-5892. Следова-
тельно, причина описанных реакций не в ангиотензинах, а в по-
вышении концентрации брадикинина.
Несмотря на то, что значение этой системы в регуляции вы-
деления натрия, воды и уровня АД выяснено не полностью, не-
которые важные факты на этот счет уже известны. Установлено,
что в ответ на введение в почечную артерию кининов про-
исходит усиление почечного кровотока, натрий- и гидруреза
(Distler A., Wolff Н., 1979). Такой же эффект вызывает подавле-
ние кининазы II нонапептидом ВРР9а. Между экскрецией с мо-
чой почечного калликреина и концентрацией в плазме стероид-
ных гормонов, задерживающих натрий, существует настолько
тесная положительная связь, что выделение калликреина может
служить индексом минералокортикоидной активности в орга-
низме (Margolius Н. et al., 1976; Vinchi J. et al., 1979). Ингибитор
альдостерона спиронолактон тормозит выделение калликреина.
Три гормональные системы почек — ренин-ангиотензиновая,
простагландиновая и калликреин-кининовая — соединены мно-
жественными связями. Так, выделение ренина и Pg из почек
возрастает параллельно в ответ на понижение почечного перфу-
зионного давления крови. Блокада синтеза Pg индометацином
ограничивает и образование ренина. Вместе с тем АП может
42
способствовать выделению Pg, которые ограничивают сосудосу-
живающее действие АП.
АП стимулирует образование почечного калликреина: непо-
средственно и опосредованно через альдостерон. Pg тоже усили-
вают синтез калликреина и соответственно его экскрецию с мо-
чой, а также модулируют воздействие кининов на артериальные
сосуды.
Калликреиновая система, в свою очередь, оказывает влияние
на две другие регуляторные системы. В частности, кинины, по-
видимому, способствуют формированию Pg в почках и крове-
носных сосудах, а также усиливают их действие (McGiff J. et al.,
1976; Dusting G. et al., 1979). Система почечных кининов являет-
ся антагонистом системы ренин—АП. Нельзя не учитывать и
имеющиеся данные о взаимодействии кининовых и адренергиче-
ских структур в процессе осуществления сосудистых реакций
(Гомазков О. А., Шимкович М. В., 1974).
Допаминергические депрессорные механизмы
Хотя допамин (дофамин) был синтезирован еще в 1910 г., а в
1946 г. идентифицирован как предшественник норадреналина в
цепи синтеза катехоламинов, только в 1950-х годах стало ясно,
что ему свойственна и самостоятельная физиологическая роль
нейромедиатора в ЦНС и на периферии (Rothballer А., 1959; Lac-
kovic Z., Neff N., 1983). Было найдено, что концентрация допа-
мина (Д) в различных тканях неодинакова и что существуют два
типа периферических допаминовых рецепторов: ДА] и ДА2, а
также два типа допаминовых рецепторов в ткани мозга: Д] и Д2.
ДА] — это постсинаптические допаминовые рецепторы в
гладкомышечных клетках сосудов. ДА2 — это пресинаптические
допаминовые рецепторы в окончаниях симпатических нервов.
Центральные Д]- и периферические ДА]-рецепторы имеют мно-
го общих характеристик. Центральные Д2- и периферические
ДА2-рецепторы тоже сходны, но не идентичны (Goldberg L.,
Kohli J., 1987).
Активация периферических ДА2-рецепторов вызывает тормо-
жение высвобождения норадреналина из депо симпатических
терминалей, понижает частоту сердечных сокращений и АД. Де-
прессорным эффектом сопровождается и стимуляция допамино-
вых нейронов в головном мозгу.
43
Свободный Д генерируется в почках; в процессе его синтеза
большую роль играют ионы С1‘. ДА]-рецепторы найдены в по-
чечных артериолах, клубочках и в проксимальных канальцах.
Стимуляция этих рецепторов усиливает экскрецию ионов Na+ с
мочой.
Выделение Д с мочой — сложный процесс, включающий его
конъюгацию и деконъюгацию в почках (Kuchel О. et al., 1978).
Оно возрастает при повышенном потреблении человеком пова-
ренной соли. То же происходит при внутривенном введении рас-
твора NaCI. У собак вызываемое Д усиление почечного плазмо-
тока и экскреции натрия с мочой можно предотвратить селек-
тивным воздействием на почки антагонистом ДА]-рецепторов.
Напротив, фенилдопан — бензоципиновый дериват Д, будучи
селективным стимулятором ДА]-рецепторов, усиливает нат-
рийурез.
Как видно, физиологическая роль Д со-
стоит в контроле за мочевой экскрецией
натрия и тем самым Д является важным
компонентом депрессорной системы почек.
Напомним, что главным регулятором канальцевого транс-
порта ионов Na+ в почках служит альдостерон. Снижение кон-
центрации этого гормона сопровождается усилением экскреции
натрия с мочой. Снижение содержания Д в почках тормозит вы-
деление натрия.
Другие, сосудистые, депрессорные механизмы
Эндотелиальные клетки сосудов способны секретировать как
суживающие, так и расширяющие сосуды вещества. Эндотели-
альный релаксирующий фактор теперь идентифицирован как окись
азота (NO), формирующаяся в клетках эндотелия из амино-
кислоты L-аргинина. Синтез NO в эндотелии требует присутст-
вия (участия) ионов Са++ и кальмодулина в качестве кофакто-
ров. Са — важнейший внутриклеточный медиатор синтеза NO в
эндотелии.
Как указывают в своем обстоятельном обзоре литературы
А. А. Затейщикова, Д. А. Затейщиков (1998), существуют два
уровня секреции NO: базальный и стимулированный. Тонус со-
судов в покое поддерживается постоянной базальной секрецией.
Такие вещества, как ацетилхолин (АХ), АТФ, брадикинин, а так-
44
же такие воздействия, как механическая деформация, напряже-
ние сдвига, гипоксия, вызывают стимулированную секрецию
NO, а также повышают синтез этого вещества.
Активируя цитоплазматическую (растворимую) форму гуани-
латциклазы, NO увеличивает образование циклического ГМФ
(цГМФ) в гладкомышечных клетках и тромбоцитах, что и вызы-
вает расслабление стенок сосудов, тормозит пролиферацию глад-
комышечных клеток сосудистых стенок, понижает активность
тромбоцитов и макрофагов (Vane J. et al., 1990; Busse R. et al.,
1993). Помимо расслабления гладкомышечных сосудистых
клеток окись азота тормозит агрегацию тромбоцитов, что ана-
логично эффектам нитроглицерина и нитропруссида натрия
(Ignario L., 1984).
При ЭГ, вероятно, поврежден вазодилататорный механизм,
опосредуемый NO. Острое введение ингибиторов синтеза NO
крысам, кроликам и другим животным сопровождается возраста-
нием АД (Pucci М. et al., 1994).
В поперечно-полосатых мышцах в процессе расширения со-
судов участвует и ацетилхолин (Дорохова М. И., Цырлин В. А.,
1978), воздействующий, как стало известно, через эндотелиаль-
ный релаксирующий фактор. Обогащение пищи калием усили-
вает чувствительность эндотелия сосудов к ацетилхолину. С уча-
стием NO, по-видимому, расширяет мелкие артериальные сосу-
ды и брадикинин.
Недавно описаны еще два фактора, выделяемых эндотелием
и вызывающих расслабление гладкомышечных клеток сосудов.
Первый из этих факторов — натрийуретический пептид С-типа —
еще один представитель семейства натрийуретических пептидов.
В отличие от предсердного (A-тип) и мозгового (В-тип) натрий-
уретических пептидов, этот фактор образуется в основном в эн-
дотелии и участвует в регуляции сосудистого тонуса. Натрийуре-
тический пептид С-типа ингибирует вазоконстрикторное дейст-
вие А1, но не предотвращает такой же эффект АП (Davidson N.
et al., 1996).
Другой фактор, способствующий расширению сосудов, — ад-
реномедулин (AM), вазоактивный пептид, секретируемый эпите-
лиальными клетками человека (Ishihara et al., 1997). Уровень AM
в крови при АГ и почечной недостаточности повышается
(Cheung В., Zeung R., 1997).
45
Впрочем, весьма вероятно, что функции эндотелия непосред-
ственно не связаны с патогенезом АГ, а повреждаются вторично.
Например, показано, что в результате эффективного лечения ги-
пертензии восстанавливается базальная секреция NO и реакция
сосудистого тонуса (Ltischer Т. et al., 1994).
Итак, организм человека располагает комплексом прессор-
ных и депрессорных механизмов, хорошо сбалансированных в
физиологических условиях, обеспечивающих достаточное посто-
янство АД и его пластичность, что еще в прошлом веке показал
И. П. Павлов в своей классической работе «О нормальных коле-
баниях кровяного давления у собаки». Нарушение этого
равновесия — один из механизмов форми-
рования АГ.
ГЛАВА 2
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ
ОБ ЭТИОЛОГИИ И ПАТОГЕНЕЗЕ
ЭССЕНЦИАЛЬНОЙ ГИПЕРТЕНЗИИ
(клинико-экспериментальный анализ)
НЕОДНОРОДНОСТЬ ПРИЧИН
И МЕХАНИЗМОВ РАЗВИТИЯ ЭГ
Кардиологу XXI века трудно, в отличие от его предшествен-
ников, рассматривать ЭГ как единое, однородное заболевание.
Видимо, игнорирование такого, теперь почти уже очевидного,
обстоятельства привело к неудаче многих авторов унитарных ги-
потез о происхождении этого заболевания. Вероятно, это и имел
в виду I. Page (1978) — большой знаток данной проблемы, когда
заметил, что «современные гипотезы патогенеза ЭГ недолговеч-
ны и вскоре после их провозглашения подвергаются ревизии».
Правда, еще в середине 30-х годов Г. Ф. Ланг (1936), будущий
создатель универсальной теории становления ГБ, писал, что
этиология и патогенез ГБ, «вероятно, раз-
личны в различных случаях и, следова-
тельно, мы в этом отношении имеем не
одну болезнь, а группу болезней».
За прошедшие полвека накопилось значительное количество
новых фактов, все более подкрепляющих раннюю точку зрения
Г. Ф. Ланга о том, что имеются различные формы этого заболе-
вания, пока искусственно объединяемые под общим названи-
ем ЭГ. В предыдущих изданиях этой книги (70—80-е годы) я
практически уже исходил из такой предпосылки, выделив са-
мостоятельные гиперадренергическую и гипергидратационную
формы ГБ. Мое сегодняшнее более определенное и расширенное
47
изложение этой концепции основывается на тех же предпосыл-
ках. Неоднородность ЭГ заложена в самих условиях ее возник-
новения, в сложности и множестве ее механизмов, в частности,
во взаимодействии внутренних (генетических) и внешних факто-
ров. ЭГ возникает тогда, когда стойко нару-
шается физиологическое равновесие меж-
ду прессорными и депрессорными механиз-
мами (см. главу 1).
Вслед за этой краткой и, по-видимому, необходимой посыл-
кой можно перейти к подробному анализу современных концеп-
ций патогенеза ЭГ. Надо подчеркнуть, что литература небогата
обзорами о патогенезе ЭГ; они написаны в основном экспери-
ментаторами: выделяются аналитические работы В. Folkow
(1982), А. С. Guyton (1990), A. W. Cowley (1992). Клинические же
обзоры не всегда отличаются полнотой, они нередко, к сожале-
нию, фрагментарны и часто односторонни.
В данной главе мы рассмотрим следующие основные во-
просы:
1) Состояние гемодинамики в начальной и развернутых ста-
диях ЭГ.
2) Роль симпатической нервной системы в происхождении
ЭГ; центрогенно-нервная теория ее патогенеза Г. Ф. Ланга.
3) Система имидазолиновых рецепторов продолговатого
мозга и АД.
4) Пептидергические системы мозга и ЭГ.
5) Почки, натрий, объемы жидкости и возникнове-
ние ЭГ.
6) Состояние клеточных мембран, ионы Са++ и станов-
ление ЭГ.
7) Резистентность тканей к инсулину и ЭГ.
8) Наследственность и заболевание ЭГ.
Физиологический анализ природы ЭГ и характеристику наи-
более развернутых концепций ее происхождения удобнее начать
с оценки системы циркуляции крови при этом заболевании.
Именно такую последовательность имел в виду А. А. Богомолец,
утверждавший еще в 30-х годах, что «ключ к разрешению проб-
лемы (этиологии и патогенеза ЭГ — М. К.) — в понимании ди-
намики кровообращения».
48
СОСТОЯНИЕ ГЕМОДИНАМИКИ
В НАЧАЛЬНОЙ И РАЗВЕРНУТЫХ СТАДИЯХ ЭГ
Гемодинамика в начальном периоде ЭГ
Прежде всего заслуживает подробного анализа состояние
кровообращения при юношеской форме пограничной артериаль-
ной гипертензии (ПАГ), поскольку она как бы в «чистом» виде
позволяет судить о самых ранних фазах становления ЭГ. Еще в
середине 50-х годов, обследовав свыше 200 молодых людей с
нейроциркуляторной дистонией (НЦД) гипертензивного типа
(ПАГ), я показал, что гемодинамическая структура повышенного
АД у них не всегда бывает одинаковой. В последующем к такому
же выводу пришел В. П. Никитин, осуществивший в клинике
Н. Н. Савицкого широкое исследование больных этой группы.
Я полагаю, что, несмотря на некоторые индивидуальные ко-
лебания гемодинамических показателей, можно выделить три
основных варианта юношеской ПАГ у лиц с НЦД: 1) систоличе-
ская ПАГ, связанная с увеличением ударного давления (гемоди-
намический удар); 2) систоло-диастолическая ПАГ за счет увели-
чения МО сердца при недостаточном ответном расширении ре-
зистивных сосудов (относительное повышение ОПС); 3) систо-
ло-диастолическая ПАГ с абсолютным повышением ОПС при
нормальном МО сердца.
На долю малоизвестного первого гемодинамического вариан-
та приходится около 10—15% всех случаев ПАГ при НЦД. Как
выясняется при тахоосциллографическом исследовании, изоли-
рованная систолическая гипертензия у этих лиц вызывается со-
четанием двух факторов: увеличением УО сердца и возрастанием
упругого сопротивления стенок артерий мышечного типа. По-
следний признак, не столь уж редко встречающийся у молодых
людей с НЦД и проявляющийся повышением скорости распро-
странения пульсовой волны по артериям мышечного типа, веро-
ятно, связан с усилением тонического напряжения гладкомы-
шечных клеток этих артерий (Линчак Р. М., 2000). Это обстоя-
тельство, в свою очередь, может зависеть как от повышения ак-
тивности симпатических нервов, так и от избыточной концент-
рации в плазме АП. Действие АП подтверждается, в частности,
тем, что ингибиторы ангиотензинпревращающего фермента мо-
49
гут понижать скорость распространения пульсовой волны по ар-
териям мышечного типа и систолическое АД.
При изолированной систолической ПАГ диастолическое, бо-
ковое систолическое и среднее гемодинамическое давление оста-
ется нормальным. Величина ударного давления достигает 25—
35 мм рт. ст. при норме 10—12 мм рт. ст. В зарубежной литерату-
ре пока не учитывается возможность возникновения такого ва-
рианта изолированной систолической АГ.
Второй гемодинамический вариант ПАГ, встречающийся у
50—60% молодых людей с НЦД, характеризуется увеличением
МО сердца (на ’Д—*/з по сравнению с должным), которое не
компенсируется соответствующим расширением артериол и пре-
капилляров, что приводит к повышению диастолического, сред-
него гемодинамического, бокового и конечного систолическо-
го АД. ОПС у этих лиц выше должного, хотя в абсолютных зна-
чениях оно представляется «нормальным» или даже «снижен-
ным». Если же с помощью p-адренергического блокатора
(пропранолол и др.) добиться уменьшения (нормализации) МО
сердца, то выявится абсолютное повышение ОПС.
Впервые подобные гемодинамические соотношения при ЭГ
(увеличенный МО и только относительное повышение ОПС)
были выявлены В. И. Кузнецовым (1948) в клинике Н. Н. Са-
вицкого. Позже эти данные подтвердили в той же клинике
М. С. Кушаковский (1950), В. П. Никитин (1951), К. А. Морозов
(1953), М. Н. Сывороткин (1970). Исследования школы Савиц-
кого имели принципиальную особенность, которая отличала их
от многих появившихся позже работ: никогда влияние МО
на АД не рассматривалось без того, чтобы
выяснить, насколько адекватна ответная
периферическая вазодилатация. Для этой цели
Н. Н. Савицкий предложил рассчитывать новый количествен-
ный индекс — рабочее удельное периферическое сопротивление,
т. е. величину ОПС, которая складывается у здоровых людей при
возрастании сердечного выброса. Стало очевидным, что само по
себе увеличение МО сердца не ведет к повышению АД, если од-
новременно не происходит хотя бы относительного повышения
ОПС. В настоящее время правильность этого тезиса, встречен-
ного в те годы некоторыми клиницистами со скепсисом, теперь
уже никем не оспаривается.
50
Напомню, что целью нашего гемодинамического анализа
ПАГ была попытка найти связь между изменениями гемодина-
мики и состоянием центральных и периферических нейрогумо-
ральных систем, регулирующих уровень АД. С этой точки зрения
очень важен вопрос о причинах увеличения МО, выявленного
при упомянутых двух гемодинамических вариантах ПАГ.
Среди указанных нами в предыдущей главе основных гемо-
динамических механизмов, приводящих к повышению сердечно-
го выброса, ведущую роль у лиц с НЦД и ПАГ играют гиперди-
намия сердца и увеличение индекса ТО/ОЦК, т. е. тех механиз-
мов, которые непосредственно связаны с гиперактивностью сим-
патической нервной системы.
Положительные хроно- и инотропный эффекты сердечных
симпатических нервов (через рг- и 0|-адренорецепторы (Stras-
ser R. et al., 1992)) проявляются в свойственной этим лицам
склонности к небольшому учащению и лабильности синусового
ритма, в изменениях фазовой структуры систолы левого желу-
дочка (укорочение периодов напряжения и изометрического со-
кращения, увеличение начальной скорости возрастания внутри-
желудочкового давления, повышение объемной скорости выбро-
са крови), наконец, в увеличении фракции выброса (ФВ) левого
желудочка и УО сердца. Воздействие симпатических нервов на
периферические венозные сосуды с перемещением дополнитель-
ного объема крови к центральным венам отражается у тех же лиц
с НЦД увеличением индекса ТО/ОЦК.
Однако было бы упрощением, как показали наши исследова-
ния, проведенные на кафедре кардиологии института усовер-
шенствования врачей, полностью относить все механизмы уве-
личения МО сердца при ПАГ к гиперактивности симпатической
нервной системы. При некоторых формах ПАГ, не связанных с
НЦД, например, при климактерической, алкогольной и других
ее формах, увеличение МО (УО) сердца скорее есть результат
преходящей или более устойчивой внеклеточной гипергидрата-
ции и гиперволемии, приводящих к повышению притока крови
к сердцу. Ниже этот вопрос будет рассмотрен более подробно.
Наконец, третий гемодинамический вариант ПАГ, который
мы наблюдали у 25—35% молодых людей с НЦД, характеризует-
ся более или менее устойчивым повышением ОПС при сохране-
нии нормального МО сердца. В моих материалах имеются хоро-
шо прослеженные наблюдения, показывающие, что у отдельных
51
лиц этой подгруппы гипертензия с самого начала формируется
без предшествующей фазы увеличения МО сердца (Кушаков-
ский М. С., 1958, 1977).
Как видно, повышение ОПС (относитель-
ное или абсолютное) является обязатель-
ным условием формирования систоло-диа-
столической АГ. Сужение резистивных сосудов или их
недостаточное расширение в ответ на увеличение МО сердца мо-
жет быть следствием: 1) нейрогенных воздействий в виде усиле-
ния симпатических оч-адренорецепторных стимулов — это пока-
зали исследования нашего сотрудника А. Б. Легостева (1985),
применявшего а-адреноблокатор фентоламин; 2) миогенных со-
кратительных реакций, зависящих от повышения содержания в
гладкомышечных клетках артериол ионов Са++, что продемонст-
рировал, в частности, на нашей кафедре К. В. Чурин (1993);
3) повышением активности ренина в плазме и соответственно
концентрации АП; 4) возможным влиянием других пока четко не
идентифицированных прессорных веществ либо отсутствием де-
прессорных субстанций.
Гемодинамика в развернутых стадиях ЭГ
По мере прогрессирования заболевания, т. е. перехода его в
более развернутые стадии, у большинства больных (80—85%)
происходит закономерная перестройка кровообра-
щения. Во II—III стадиях ЭГ я выделяю пять гемоди-
намических вариантов (рис. 3).
Наиболее часто (у 55—60% больных) встречается первый ва-
риант, при котором гипертензия вызывается повышением ОПС
при нормальном МО сердца. Примерно у 15—20% больных, пре-
имущественно в I стадии болезни, МО сердца все еще превыша-
ет индивидуально-должные и средние величины нормы. Реакция
системы артериолы—прекапилляры может быть в этих случаях
различной: а) ОПС остается «нормальным» — второй гемодина-
мический вариант; б) ОПС понижается, но неадекватно увеличе-
нию МО — третий вариант; в) ОПС повышается наряду с увели-
ченным МО — четвертый вариант. Последний (пятый) гемоди-
намический вариант характеризуется весьма значительным воз-
растанием ОПС и уменьшением МО (около 20% больных). Ниже
я покажу, что клинические признаки недостаточности кровооб-
52
Рис. 3. Гемодинамические варианты (I—V) ЭГ: различные соотношения между МО
сердца (светлая часть столбика) и ОПС (заштрихованная часть)
ращения не всегда имеются у таких больных; уменьшение сер-
дечного выброса носит у них приспособительный характер.
Таким образом, если у лиц с ПАГ часто выявля-
ется увеличение МО сердца (независимо
от вызвавшей его причины), то в разверну-
тых стадиях ЭГ оно встречается примерно
в 4 раза реже. Сущность гемодинамической эволюции при
прогрессировании ЭГ состоит в нормализации (или даже в сни-
жении) сердечного выброса у большинства больных вследствие
возрастания ОПС. Этот процесс происходит как при НЦД (ги-
персимпатикотония), так и у тех больных, у которых причиной
повышения МО сердца служит внеклеточная гипергидратация и
гиперволемия.
Большинство современных исследователей склонно объяс-
нять такую перестройку гемодинамики включением механизма
системной ауторегуляции. Автор этой концепции A. Guyton
(1978—1980 гг.) исходил из известных положений: а) в физиоло-
53
гических условиях между потребностью ткани (органа) в кисло-
роде и скоростью местного кровотока существует строгое соот-
ветствие; б) каждая ткань располагает комплексом механизмов,
регулирующих региональный кровоток и восстанавливающих
равновесие между ее энергетическими потребностями и крово-
обращением. Ауторегуляция — это защитное миогенное сужение
артериол в ответ на чрезмерное поступление кислорода к ткани
или органу. При увеличении МО сердца, т. е. объемной скорости
кровообращения в организме, ауторегуляция приобретает гене-
рализованный характер. Системное сужение артериол и прека-
пилляров ведет к повышению ОПС, что, в свою очередь, способ-
ствует замедлению общего кругооборота крови и уменьшению
ранее увеличенного МО сердца.
Такая общая ауторегуляция всего тела может осуществиться
только в условиях угнетения барорецепторного рефлекса, в
особенности его сосудистого компонента (Шляхто Е. В., 1991;
Cowley A. et al., 1974).
Как подчеркивает А. Гайтон, некоторые механизмы ауторегу-
ляции кровотока функционируют лишь в течение нескольких се-
кунд, другим механизмам для полного включения требуются не-
дели или даже месяцы. Хотя длительная ауторегуляция разверты-
вается медленно, она достигает значительных масштабов и эф-
фективности: в процесс ауторегуляции втягивается большее
число артериальных (резистивных) сосудов различного калибра.
Итак, анализ особенностей гемодинамики при ПАГ и ЭГ
указывает на три альтернативных пути формирования ЭГ: 1) в ре-
зультате первичного сужения (спазма) резистивных сосудов и
повышения ОПС; 2) вследствие первичного нейрогенного (ги-
персимпатикотония) увеличения МО сердца с последующей сис-
темной ауторегуляцией и повышением ОПС; 3) вследствие пер-
вичного увеличения МО сердца, вызванного задержкой ионов
Na+ и возрастанием внутрисосудистого объема жидкости, с по-
следующей системной ауторегуляцией и повышением ОПС.
Наши интересы, естественно, смещаются к поиску ответов
на вопросы: а) какие механизмы обеспечивают первичное повы-
шение ОПС у значительной группы больных? б) что способству-
ет сохраняющемуся повышению ОПС у больных с завершив-
шейся ауторегуляцией, т. е. уже после нормализации МО серд-
ца? Я перехожу, следовательно, к рассмотрению природы прес-
сорных реакций у больных ЭГ.
54
Среди прессорных субстанций ведущая роль закономерно от-
водится норадреналину, выделяемому из депо симпатических
нервов резистивных сосудов и воздействующему на сосудистые
cq -адренорецепторы. Не случайно, что одна из наиболее разра-
ботанных концепций патогенеза ЭГ связывает повышение ОПС
с усилением активности симпатической нервной системы. Здесь
настало время подробнее и шире изложить основные положения
теории Г. Ф. Ланга.
РОЛЬ СИМПАТИЧЕСКОЙ НЕРВНОЙ СИСТЕМЫ
В ПРОИСХОЖДЕНИИ ЭГ;
ЦЕНТРОГЕННО-НЕРВНАЯ ТЕОРИЯ
ПАТОГЕНЕЗА ЭГ Г. Ф. ЛАНГА
С точки зрения Г. Ф. Ланга, ЭГ есть следствие психического
перенапряжения человека, воздействия на его психическую
сферу эмоций отрицательного характера, психической травмати-
зации.
Такая ланговская форма ЭГ, возможно, существует, о чем
свидетельствуют не только клиническая практика, но и жизнен-
ные (бытовые) наблюдения. Многие люди непосредственно свя-
зывают начало их заболевания с тяжелыми и, особенно, длитель-
ными, повторяющимися душевными потрясениями: утратой род-
ственников, служебными неудачами и крушением карьеры, раз-
ладом в семье и т. д., хотя, разумеется, надо всегда помнить, что
«post hoc, non sine propter hoc».
Вспышка АГ в блокированном Ленинграде, которая приобре-
ла эпидемический характер, служит еще одним свидетельством
большого значения нервно-психологических воздействий в гене-
зе этого страдания, даже если признать, что этот «социальный
эксперимент» не был вполне «чистым». Я имею в виду влияния
водно-электролитных расстройств, алиментарной дистрофии,
желудочно-кишечных и особенно почечных заболеваний. Несо-
мненно также, что рассмотренная выше форма ПАГ при НЦД у
части молодых людей имеет характерные признаки нервно-веге-
тативной патологии (Вейн А. М. и др., 1975; Маколкин В. И.,
1985).
Обратимся к другим постулатам Г. Ф. Ланга, которые изло-
жены им вполне определенно: «...мы можем считать, что лежа-
55
щее в основе ГБ нарушение функции аппарата, регулирующего
кровяное давление, происходит прежде всего в коре больших по-
лушарий, а затем в гипоталамических центрах и заключается в
повышенной возбудимости их».
И далее: «...сокращение мускулатуры артериол осуществляет-
ся в неврогенной стадии болезни в первую очередь путем пере-
дачи симпатическими вазоконстрикторными нервами импульсов
мускулатуре артериол». Как видно, конечным звеном в цепи
нейрогенных расстройств, приводящих к становлению ЭГ,
Г. Ф. Ланг считал чрезмерную стимуляцию симпатическими им-
пульсами сц-адренорецепторов резистивных сосудов с повыше-
нием ОПС. По сути дела, это гиперсимпатикотоническая теория
происхождения ЭГ.
Между тем далеко не все исследователи, прежде и в наше
время, согласны с такой точкой зрения. По мнению известного
английского специалиста С. Dickenson (1994), «никогда не суще-
ствовало надежного доказательства того, что длительный эмо-
циональный стресс приводит к устойчивой хронической гипер-
тензии». A. Mann (1984) называл сочетание такого фактора, как
«подавление враждебности и развитие гипертензивных состоя-
ний призраком», с которым удалось покончить. Этот автор пола-
гает, что «поборники роли психических факторов в этиологии
гипертензии имеют мало доводов в свою пользу». С таким выво-
дом перекликается утверждение McCann и соавт. (1990), которые
полагают, что «поведенческие отклонения, наблюдаемые у боль-
ных с гипертензией, возникают вслед за повышением у них кро-
вяного давления», а не до него.
Здесь уместно напомнить, что во времена, когда была про-
возглашена теория Г. Ф. Ланга (1948), в нашей стране домини-
ровали взгляды некоторых ученых, догматически придерживав-
шихся так называемого «Павловского учения о нервизме». Прав-
да, сам И. П. Павлов — гениальный ученый, гордость русской и
мировой науки, никакого отношения к такой интерпретации
своего действительно передового учения не имел. Однако тео-
рию Г. Ф. Ланга, которая очень пришлась ко времени, подхвати-
ли, не заботясь о доказательствах и, главное, о ее развитии.
Вспомним, что в те годы еще отсутствовали подробные све-
дения о сосудистых адренорецепторах, не были еще открыты
пептидергические регуляторные системы, неизвестно было, что
головной мозг является местом синтеза большого числа нейро-
56
пептидов, оказывающих модулирующее влияние на функции
различных органов и систем, включая и сам мозг; не знали о
механизме «нисходящего торможения»; еще широкое хождение
имели, по сути, механистические взгляды, резко разделявшие
собственно нервные (биоэлектрические) и гуморальные (нейро-
химические) импульсы и механизмы регуляции.
Я полагаю, что теория Г. Ф. Ланга в этот еще ранний период
изучения ЭГ была, перефразируя известную фразу, «взлетом
мысли» талантливого клинициста, опередившего свое время.
Чтобы ее подтвердить, следует рассмотреть с современных
позиций, имеются ли у больных ЭГ признаки повышения актив-
ности симпатической нервной системы, а также, по возможно-
сти, проанализировать накопившийся почти за полвека огром-
ный экспериментальный материал.
Уже через три года после провозглашения Г. Ф. Лангом
своей теории R. Smithwirk (1951) подверг ряд больных ЭГ опера-
ции симпатэктомии (тораколюмбальная спланхэктомия), преры-
вавшей поступление симпатических импульсов к большинству
резистивных сосудов, обеспечивающих повышение ОПС. Вопре-
ки ожиданиям, эта операция не приводила к снижению АД.
В последующем подобные попытки повторялись, и все они за-
кончились безуспешно.
Экскреция катехоламинов с мочой у больных ЭГ
Предполагали, что судить о функциональном состоянии сим-
патической нервной системы можно будет по величине экскре-
ции с мочой катехоламинов и их метаболитов. При этом следует
учитывать, что в мочу обычно поступает не более 10% от цирку-
лирующих в крови катехоламинов. Кроме того, величина кате-
холаминурии зависит от состояния почек больного, изменяюще-
гося клиренса катехоламинов, активности ферментов, разрушаю-
щих эти нейрогормоны, и, конечно, от точности методов иссле-
дования.
Целесообразно привести современные нормативы суточного
выделения с мочой катехоламинов и их метаболитов: норадрена-
лин — 116,60 нмоль; адреналин — 43,66 нмоль; допамин (дофа-
мин) — 1918,80 нмоль, ДОФА — 119,76 нмоль; ванилилминдаль-
ная кислота — 18,62 мкмоль (Меньшиков В. В., Князев М. Д.,
Большакова Т. Д. и др., 1979).
57
Если ориентироваться на эти средние величины, то окажет-
ся, что у значительного большинства больных ЭГ суточная экс-
креция норадреналина и адреналина не отклоняется от
нормы или даже снижена. Имеется лишь указание
V. De Quattro, J. Miura (1976) о небольшой группе больных ЭГ
(около 10%), выделявших с мочой избыточное количество
норадреналина. У этих же больных был явно повышен коэффи-
циент (метнорадреналин + метадреналин)/ванилилминдальная
кислота (в норме = 0,09 + 0,05), характеризующий соотношение
между выделяемыми с мочой метоксилированными и дезамини-
рованными метаболитами катехоламинов. По мнению цитируе-
мых авторов, такое измененное соотношение может быть связа-
но с усиленным образованием у этих больных «активного норад-
реналина», поступающего к адренорецепторам из мобильного
фонда депо симпатических нервов (Strasser R. et al., 1992).
Уровень катехоламинов в плазме крови у больных ЭГ
В большей степени, по-видимому, можно приблизиться к ре-
альной оценке активности симпатической нервной системы у
больных ЭГ путем измерения концентрации в плазме циркули-
рующих катехоламинов. В наше время это делается с помощью
чувствительных и точных радиоэнзиматических методов как в
условиях покоя больного, так и после физической нагрузки.
Симпатические нервы, особенно нервы сердца, яв-
ляются основным источником плазменно-
го норадреналина. Правда, далеко не полностью нейро-
гормоны, выделяющиеся в синаптические щели, в последующем
попадают в кровоток. Конечный уровень катехоламинов в плаз-
ме зависит, по меньшей мере, от трех факторов: а) количества и
скорости поступления норадреналина в синаптическую щель из
постганглионарных адренергических волокон при каждом нер-
вном импульсе; б) количества норадреналина, возвращающегося
в депо симпатических терминалей; в) величины той его части,
которая метаболизируется в тканях.
У здоровых людей концентрация катехоламинов в плазме
мало зависит от пола, она возрастает по мере
старения человека. В исследованиях J. De Champlaine
и соавт. (1977) уровень катехоламинов в плазме оказался повы-
шенным у 43% больных ЭГ, в основном в раннем периоде забо-
левания. Вся популяция больных разделилась на две подгруппы:
58
Рис. 4. Концентрация норадреналина в плазме (в положении обследованных
лежа) и возраст больных ЭГ (ГБ), здоровых людей (по Buhler и соавт., 1980);
светлые кружки — больные; темные — здоровые нормотоники; по вертикали —
уровень норадреналина в пг/мл; по горизонтали — возраст обследованных;
видны большие колебания концентраций норадреналина; повышенные величины
преобладают у больных более молодого возраста
1) гиперадренергическую (средняя концентрация катехоламинов
плазмы равнялась 2,82 нмоль/л); 2) нормоадренергическую
(средняя концентрация = 1,22 нмоль/л). У больных с нормоадре-
нергией через 10 мин после перехода из горизонтального в вер-
тикальное положение уровень катехоламинов в среднем возрас-
тал в такой же мере, как и у здоровых людей с нормотензией.
При гиперадренергической форме ЭГ уровень катехоламинов
при тех же обстоятельствах повышался в 2 раза интенсивнее. Это
указывало на то, что примерно у 40% обследованных боль-
ных ЭГ был увеличен не только базальный тонус симпатической
нервной системы, но и ее ответы на физиологические стимулы.
Правда, и у таких больных не удалось найти корреляцию между
концентрацией катехоламинов плазмы и высотой АД (систоли-
ческого и диастолического) (рис. 4).
59
Th. Philipp и соавт. (1978) исследовали у группы больных ЭГ,
средний возраст которых был 37,9 лет, уровень плазменного
норадреналина как в покое, так и в период физической нагруз-
ки, а также прессорную реакцию у них в ответ на введение извне
норадреналина. Только у отдельных больных они обнаружили
повышенную концентрацию этого нейрогормона или избыточ-
ную чувствительность к нему. Вновь не была найдена связь меж-
ду уровнем норадреналина плазмы (в покое и при нагрузке) и
величинами АД. Не коррелировали между собой показатель ре-
активности к вводимому норадреналину и высота АД.
Н. Ibsen и соавт. (1979) измеряли концентрацию норадре-
налина в плазме у группы людей 40-летнего возраста. Неко-
торые из них страдали ЭГ, другие были нормотониками. Резуль-
таты исследований в обеих подгруппах оказались одинаковыми.
С. Beretta-Piccoli и соавт. (1980) также пришли к выводу, что
симпатическая нервная активность остается нормальной у боль-
шинства больных ЭГ, если сравнивать ее показатели с показате-
лями здоровых людей того же возраста. К еще более далеко иду-
щему заключению пришли D. Clement и соавт. (1979), утверж-
давшие, что колебания АД у больных ЭГ вообще не связаны ни с
изменениями активности симпатических нервов, ни с концент-
рацией катехоламинов в плазме крови (рис. 5).
Особый интерес, естественно, вызывают материалы, обобща-
ющие результаты исследований нескольких независимых кол-
лективов. Так, A. Distler (1979) сообщил о данных, полученных в
22 лабораториях различных стран. Только в 7 из них были най-
дены величины, превышавшие нормальные концентрации кате-
холаминов в плазме, в 11 исследованиях не выявились сколько-
нибудь значимые отклонения от нормы, в 4 — величины кате-
холаминов плазмы оказались сниженными. Наконец, D. Gold-
stein (1981) суммировал данные 32 лабораторий, занимавшихся
изучением метаболизма катехоламинов у больных ЭГ; в 40% слу-
чаев было отмечено повышение концентрации норадреналина
в плазме, в остальных 60% случаев показатели оказались нор-
мальными.
Объяснить столь существенные различия в результатах по-
пыталась группа исследователей во главе с V. De Quattro (Koba-
yashi К. et al., 1979). Они исходили из того, что «активный
норадреналин» первично метаболизируется с помощью фермента
О-метилтрансферазы в синаптической щели и затем поступает в
60
A
Рис. 5. Концентрация адреналина в плазме (в покое) у нормотоников и больных
ГБ (ЭГ) (по Buhler и соавт., 1980); слева (В) — нормотоники; справа (С) — ги-
пертоники. А — концентрация адреналина в пг/мл
плазму в виде норметадреналина. Последний был повышен
только у части молодых людей с лабильной и пограничной АГ.
У больных ЭГ в возрасте 40—60 лет концентрация норметадрена-
лина, как и норадреналина, не отклонялась от нормы. Позже,
в 1984 г., J. Kowane и соавт. тоже нашли повышение концентра-
ции норадреналина и адреналина в плазме у ряда молодых людей
с пограничной АГ.
К рассматриваемому вопросу прямое отношение имеют дан-
ные о емкости норадреналиновых депо в
окончаниях симпатических нервов у боль-
ных ЭГ. Неоднократно демонстрировалось, что у этих больных
понижена способность симпатических депо воспринимать и свя-
зывать циркулирующий в плазме и в синаптических пространст-
вах норадреналин (Mendlowitz М., 1977). Такой дефект в услови-
61
ях стресса может нарушать равномерность поступления норадре-
налина к адренорецепторам и затруднять его реабсорбцию. В ре-
зультате адренорецепторы периодически подвергаются более
длительному и интенсивному воздействию нейрогормона, хотя в
обычных условиях средний уровень катехоламинов в плазме мо-
жет оставаться нормальным.
В этой связи уместно напомнить об указании V. Euler о том,
что устойчивая концентрация ионов натрия в симпатических
терминалях является одним из важных условий нормального
функционирования норадреналиновых депо. Возможно, что в
этом звене заложена одна из связей между обменом натрия и ак-
тивностью симпатической нервной системы.
Допамин-р-гидроксилаза плазмы как показатель активности
симпатической нервной системы у больных ЭГ
Можно было надеяться, что оценить активность симпатиче-
ской нервной системы удастся путем определения в плазме уров-
ня фермента допамин-Ь-гидроксилазы (ДБГ), катализирующего
превращение допамина в норадреналин. При стимуляции симпа-
тических нервов ДБГ выделяется в синаптическую щель вместе с
норадреналином, откуда они поступают в кровь. Молекула ДБГ
крупнее молекулы норадреналина, она медленнее проникает в
кровоток и длительнее в нем циркулирует, что делает более до-
ступным измерение ее активности.
Н. К. Меркулова, С. Н. Петунии (1986) выявили у больных
ГБ I стадии наличие прямой зависимости между уровнем ДБГ в
плазме и частотой сокращений сердца, величинами МО сердца,
высотой диастолического давления. Во II—III стадиях заболева-
ния величины ДБГ не отличались от нормальных. Такая направ-
ленность изменений активности ДБГ у больных с различной тя-
жестью ГБ весьма сходна с динамикой концентрации норадрена-
лина в плазме крови.
Однако большинство других исследователей придерживаются
мнения, что базальный уровень ДБГ в большей мере определяет-
ся генетическими факторами и что при стимуляции симпатиче-
ских нервов уровни ДБГ и норадреналина в плазме не всегда из-
меняются в одном направлении. Поэтому нельзя утверждать,
что уровень ДБГ в крови является точным индексом симпатиче-
ской нервной активности.
62
Нейропептид Y плазмы как показатель активности
симпатической нервной системы у больных ЭГ
Рассматривая вопрос о роли периферических отделов симпа-
тической нервной системы в генезе ЭГ, я не могу не упомянуть
некоторые новые, пока еще слабо освещенные в литературе
данные.
В 80-х годах стало известно, что помимо классических меди-
аторов симпатические нейроны могут синтезировать и выделять
в кровь биологически активные пептиды. Среди них привлекает
внимание нейропептид Y (NPY), содержащий 36 аминокислот.
Вскоре после открытия его в мозговой ткани (Tatemoto К. et al.,
1982) он был найден и в постганглионарных симпатических нер-
вах, особенно в тех, которые иннервируют сердечно-сосудистую
систему. Чтобы в последующем изложении не повторяться, ука-
жу здесь, что центральный NPY, локализованный в норадренер-
гических нейронах NTS и в допаминергических нейронах гипо-
таламуса (Takesako Т. et al., 1994), вовлечен в процессы регуля-
ции аппетита, памяти и различных циркадных ритмов.
На периферии NPY депонируется в окончаниях симпатиче-
ских нервов вместе с норадреналином в больших и плотных пу-
зырьках. Если эти депо пополняются норадреналином благодаря
его синтезу на месте, то содержание NPY в депо восстанавлива-
ется благодаря его аксональному транспорту. Тот же нейропеп-
тид был найден в мозговом слое надпочечников крыс, где он
концентрируется в хромаффинных клетках, содержащих норад-
реналин и адреналин. При рефлекторной стимуляции симпа-
тико-адреналовой системы, например, при кровотечении, физи-
ческой нагрузке, NPY выделяется в кровь вместе с катехол-
аминами.
Периферические сердечно-сосудистые эффекты NPY вклю-
чают прямую вазоконстрикцию, усиление (модулирование) сосу-
досуживающего действия норадреналина, пресинаптическое ре-
гулирование выделения норадреналина из окончаний симпати-
ческих нервов.
Экзогенное введение NPY сопровождается прессорной реак-
цией (подъем АД), которую не удается блокировать а-адрено-
блокаторами; in vitro этот нейропептид тоже проявляет себя как
сильное прессорное вещество, вызывающее сужение артериол и
вен за счет увеличенного вхождения ионов Са++ в гладкомышеч-
ные клетки сосудов.
63
Недавно было показано, что NPY может синтезироваться и в
мегакариоцитах и депонироваться в тромбоцитах. Т. Ogawa и со-
авт. (1992) установили, что содержание NPY в тромбоцитах крыс
линии SHP и крыс, склонных к развитию инсульта, выше, чем в
тромбоцитах крыс нормотензивной линии (WKY). Этот факт все
чаще используется для определения генетической принадлежно-
сти крыс к наследственной гипертензивной линии. У последних
тромбоциты выделяют NPY почти в 2 раза интенсивнее, чем
тромбоциты нормотензивных крыс.
Приведенные факты интересны, на мой взгляд, в двух аспек-
тах: во-первых, они расширяют представление о медиаторах
симпатической нервной системы; во-вторых, показывают, что
наряду с норадреналином нейропептид Y может способствовать
повышению ОПС и АД.
Заканчивая раздел о роли периферических отделов симпа-
тической нервной системы, я считаю полезным привести резуль-
таты микронейрографических исследований, в которых непо-
средственно регистрировали потенциалы действия симпатиче-
ских нервов кожи и мышц человека. В. Wallin и соавт. (1973)
сравнивали такие симпатикограммы больных ЭГ и здоровых лю-
дей. Между этими кривыми не было существенных различий,
хотя у большинства больных АД достигало величин порядка
185/110 мм рт. ст. В покое симпатические разряды регистрирова-
ли у больных ЭГ столь же редко, как и у здоровых людей, они
зависели в основном от ритма дыхания. Транзиторные подъемы
АД сопровождались не усилением, а угнетением симпатических
нервных разрядов (!).
Подводя итоги этой части обзора, я вправе подчеркнуть, что
у значительного числа больных в стабильной стадии ЭГ отсутст-
вуют признаки гиперсимпатикотонии. Заметно чаще это явление
можно встретить у лиц с ПАГ и у больных в начальной фазе ЭГ
(не у всех), т. е. тогда, когда происходит становление заболе-
вания.
Я прихожу к принципиальному выводу: одной из при-
мечательных и загадочных особенностей
ЭГ является то обстоятельство, что ее пер-
вопричины, пускающие в ход цепную реак-
цию патогенеза, со временем у большинст-
ва больных как бы сходят со сцены. «Мавр сде-
лал свое дело, мавр может уйти» (Фридрих Шиллер). АД по-
64
прежнему поддерживается на высоком уровне, но уже за счет
других самовоспроизводящихся, саморазвивающихся механиз-
мов. Этот тезис, возможно, имеет прямое отношение к оценке
роли симпатической нервной системы в генезе ЭГ. Как подчер-
кивал В. Folkow (1989), «нейрогенные механизмы, по-видимому,
оказывают сильное патогенетическое влияние на ранних фазах
большинства видов первичной гипертензии... Однако раннее во-
влечение «структурного фактора» может более или менее быстро
маскировать это нейрогенное участие».
РОЛЬ ЦЕНТРАЛЬНЫХ ОТДЕЛОВ
СИМПАТИЧЕСКОЙ НЕРВНОЙ СИСТЕМЫ
В РАЗВИТИИ ЭГ
Еще в 60—70-х годах концепция об адренергических рецеп-
торах, участвующих в регуляции АД, была распространена на
ЦНС. Выяснилось, что различные структуры мозга, содержащие
а-адренорецепторы, могут контролировать активность симпати-
ческих нервов на периферии и, следовательно, уровень АД. Осо-
бое значение придается специфическим узлам переднемедиаль-
ного подбугорья (гипоталамус), которые считаются симпато-
ингибиторной зоной, и области nuclei tractus solitarii (NTS) про-
долговатого мозга, где расположены первичные синапсы сино-
аортальных барорецепторных нервов и имеется большая плот-
ность норадренергических нейронов с высокой концентрацией
норадреналина (Reis D., 1980).
Установлено, что норадреналин, стимулируя аг-адренергиче-
ские рецепторы гипоталамуса и (или) области NTS продолгова-
того мозга, вызывает нисходящее торможение эф-
ферентной симпатической активности и
тем самым способствует расширению рези-
стивных сосудов на периферии с пониже-
нием АД. Центральные и периферические эффекты норадре-
налина имеют, следовательно, противоположную на-
правленность: действуя в ЦНС, этот нейрогормон в конечном
счете способствует понижению АД, т. е. вызывает депрессорные
периферические эффекты; в системной циркуляции норадрена-
лин — сосудосуживающий прессорный нейрогормон.
3 Зак 3207
65
Эти и другие (см. ниже) физиологические данные послужили
основой гипотезы о том, что ЭГ может быть следствием дисба-
ланса между различными системами мозга, усиливающими и
тормозящими центральную симпатическую активность. Од-
ной из причин нарушения центрального
норадренергического равновесия может
быть дефект синтеза норадреналина в со-
ответствующих нейронах мозга. Именно такой
дефект был найден у крыс с наследственной спонтанной АГ
(SHR — линия Okamoto-Aoki).
Уже на 4-й неделе жизни этих крыс в узлах переднего подбу-
горья отмечается снижение синтеза норадреналина и активности
тесно связанного с ним фермента ДБГ. В это же время на пери-
ферии развиваются реакции противоположной направленности:
возрастание концентрации норадреналина и активности ДБГ в
плазме крови, что способствует повышению АД.
У взрослых 14-недельных крыс еще сохраняется недостаток
норадреналина в нейронах переднего подбугорья, но постепенно
снижается активность симпатической нервной системы на пери-
ферии. Очевидно, что в этой более поздней фазе заболевания
повышение АД не может быть полностью связано с усилением
а 1-адренергических сосудистых стимулов.
Такую форму АГ у крыс можно назвать центральной
(гипоталамической) норадреналин-дефи-
ц и т н о й. Возможно, что у части людей по мере их старения
или под воздействием нервно-психического напряжения (как
предполагал Г. Ф. Ланг) наступает период, когда ослабляется
синтез норадреналина в нейронах головного мозга или понижа-
ется чувствительность а2-адренергических рецепторов мозговой
ткани к симпатическим стимулам, что и отражается возрастани-
ем симпатической нервной активности на периферии и повыше-
нием АД.
В развитии учения о центрогенной АГ большую роль сыграли
фармакологические данные о механизмах гипотензивного дейст-
вия таких нейротропных средств, как клофелин (клонидин) и гу-
анабенз, у крыс со спонтанной (генетической) АГ. Напомним,
что многие исследователи склонны почти отождествлять эту мо-
дель АГ с ЭГ у человека, хотя, по-видимому, здесь допускается
некоторое упрощение. Однако нельзя не видеть, что при изуче-
66
нии АГ у крыс линии SHR были получены ценные данные, про-
ливающие свет на патогенез ЭГ у людей.
Сущность главного и неоднократно подтвержденного факта
состоит в том, что гипотензивное действие кло-
фелина и гуанабенза связано, в основном, с о
стимуляцией аг-адренорецепторов норадренер-
гических нейронов головного мозга. Эти данные явились солид-
ным подтверждением упомянутой выше гипотезы о центральных
норадреналиндефицитных механизмах формирования АГ.
Принятию этой концепции препятствуют имеющиеся у ис-
следователей разногласия по поводу места действия клофелина
или гуанабенза, а также относительно участия ряда других ней-
рохимических систем головного мозга в осуществлении гипотен-
зивного эффекта. В этом смысле большой интерес вызывают ре-
зультаты экспериментальных исследований у крыс линии SHR
состояния а2-адренорецепторов, расположенных в центральных
миндалевидных ядрах головного мозга (Koepke J., Jones J.,
Di Bona G., 1987). Эти авторы исходили из ранее установленного
факта, указывающего, что у таких крыс при воздушном стрессе
(воздействие струей воздуха) происходит повышение активности
почечных симпатических нервов, что, в свою очередь, тормозит
натрийурез (вызывает антинатрийурез). Все это нехарактерно для
нормотензивных крыс линии WKY.
Особенно показательно то, что введение в желудочек мозга
(intracerebroventricular — i. с. v.) стимулятора аг-адренорецепто-
ров гуанабенза или клофелина предотвращает и подавляет усиле-
ние активности почечных симпатических нервов (при воздуш-
ном стрессе у крыс спонтанно-гипертензивной линии). Между
тем введение тех же препаратов на периферии, внутривенно, та-
кую реакцию не вызывает.
Как видно, уменьшенная стимуляция аг-адренорецепторов
нейронов центральных миндалевидных ядер играет важную роль
в процессе включения почек в цепь реакций, ведущих к усиле-
нию реабсорбции натрия и к повышению АД. Взаимодействие
генетических факторов (состояние центральных аг-адренорецеп-
торов) и внешних стрессорных воздействий создает, по-видимо-
му, благоприятные условия для развития АГ, что, в общем, со-
гласуется с центрогенно-нервной теорией Г. Ф. Ланга.
Ряд других исследователей полагает, что действие клофелина
в основном реализуется в области nucleus tractus lateralis (NTL),
67
относящейся к вентролатеральной части продолговатого мозга.
Наконец, некоторые авторы склоняются к тому, что в гипотен-
зивный эффект клофелина вовлекаются главным образом норад-
ренергические нейроны области NTS продолговатого мозга, где,
как упоминалось, находится первый центральный синапс баро-
рецепторного рефлекса.
Правда, недавно Е. Tibiricka и соавт. (1992) представили фак-
ты, как будто опровергающие рассмотренные выше данные. Ими
было показано, что предварительное центральное введение кры-
сам линии SHR азадоксина в дозах, полностью предотвращаю-
щих гипотензивный ответ на клофелин, не оказывало влияния
на норадренергические нейроны области NTS.
Известно, что (^-адренергический механизм, на который
воздействует клофелин, чувствителен к его антагонисту —
иохимбину. В последнее время появились указания на то, что
гипотензивный эффект клофелина у крыс гипертензивной ли-
нии включает выделение b-эндорфина, воздействующего на
ствол мозга, что опосредуется иохимбинчувствительным меха-
низмом.
Получены также данные, что глутаматергические нейроны,
которые находятся в вентролатеральной части продолговатого
мозга и в которых медиаторную функцию выполняет глутамат,
тоже участвуют в регуляции АД у крыс с наследственной АГ.
Утверждают, что гиперактивность этих нейронов может иметь
отношение к патогенезу АГ и что клофелин оказывает специфи-
ческое воздействие на глутаматергическую активность нейронов.
Признание последнего факта может означать, что катехоламино-
вый метаболизм не повреждается клофелином.
Как видно, представления о нейрохимических эффектах кло-
фелина и его аналогов в головном мозгу весьма усложнились.
Возможно, были правы те исследователи, которые с самого на-
чала утверждали, что клофелин и близкие к нему нейротропные
средства оказывают влияние на целый комплекс нейрональных
систем, осуществляющих центральную регуляцию АД, включая
аппарат спинного мозга (Вальдман А. В., 1974, 1978; Цыр-
лин В. А., 1975; Kobinger W., 1966, 1972; Zwieten Р., 1973).
Уменьшение активности центральных моноаминергических
(норадренергических) нейронов, осуществляющих в норме тони-
ческое нисходящее торможение симпатической нервной системы
на периферии, можно обнаружить и на других моделях АГ у жи-
68
вотных. М. Ogawa и соавт. (1978) вызывали двухстороннюю хи-
мическую деструкцию 6-гидроксидопамином locus coeruleus, от
которого отходят восходящие аксоны к мезенцефалону, теленце-
фалону, мозжечку, а также нисходящие пути к спинному мозгу.
Степень и длительность возникавшей при этих экспериментах
АГ были более выражены у крыс, склонных к развитию спонтан-
ной АГ. Вновь между содержанием норадреналина в этих участ-
ках мозга и уровнем системного АД выявилась обратная корре-
ляционная зависимость; в месте введения 6-гидроксидопамина
отмечались дегенеративные изменения тел норадренергических
нейронов. Даже такая периферическая форма АГ, как однопо-
чечная реноваскулярная АГ, по Г. Гольдблатту (одностороннее
сужение почечной артерии при удалении второй почки), предот-
вращается, если разрушаются 6-гидроксидопамином централь-
ные норадренергические нейроны. Содержание норадреналина в
различных участках продолговатого мозга и в ядрах гипоталамуса
снижается уже через 72 ч от начала развития такой формы рено-
васкулярной АГ (Petty М., Reid J., 1978). Как видно, содержащие
катехоламины нервные клетки в ЦНС, участвующие в регуляции
АД, необходимы для развития АГ в различных ее моделях.
Возможно, что к упомянутым формам экспериментальной
гипертензии близка та, которую вызывали у кроликов путем дли-
тельной стимуляции эмоциогенных центров подбугорья (Коп-
лик Е. В., 1977), а также у крыс, подвергшихся эмоциональному
стрессу отрицательного характера (Судаков К. В. и др., 1980). По
мнению К. В. Судакова (1977), в этих моделях воспроизводится
«вся естественная история ГБ», в частности при стрессорно-обо-
ронительных реакциях «...складывается новая нейрохимическая
организация мозга, которая определяет выход нейрогуморальных
влияний на сердечно-сосудистый аппарат и развитие артериаль-
ной гипертензии...»
Итак, можно говорить о центральном норадре-
н ал ин - дефи цитном пути патогенеза ЭГ. Ста-
рая, быть может, актуальная для своего времени формула:
)Г есть следствие ослабления тормозного влияния коры голов-
ного мозга на подкорковые центры регуляции АД, по-видимому,
трансформируется в новую формулу: ЭГ — следствие г и -
и остимул яци и норадренергических нейро-
нов определенных зон головного мозга,
участвующих в регуляции АД.
69
Барорецепторный рефлекс
и «гипертензия расторможения»
При анализе клинико-экспериментальных данных, характе-
ризующих роль симпатической нервной системы в генезе ЭГ,
нельзя пройти мимо тех из них, которые имеют отношение к на-
рушениям барорецепторного рефлекса. Систему синокаротидных
и аортальных барорецепторов можно рассматривать как выне-
сенное на периферию представительство мозговых центров регу-
ляции АД. Можно было бы думать, что выключение этих рецеп-
торов, стоящих как бы на страже постоянства АД, должно при-
вести к подъему АД.
Такая «гипертензия расторможения», или «рефлексогенная»
АГ, действительно была получена в эксперименте путем перерез-
ки синокаротидных и аортальных депрессорных нервов; она от-
личалась выраженной лабильностью АД и отсутствием прогрес-
сирования в устойчивую форму (Анохин П. К., 1947; Го-
рев Н. Н., 1948; Hering G., 1932).
N. Doba и D. Reis (1974), М. Natan и D. Reis (1977) создали
модель АГ, которую можно назвать «стволовой NTS-дефицитной
гипертензией». Эти исследователи вызывали у животных двухсто-
роннее разрушение области NTS продолговатого мозга, что на-
рушало восприятие ядрами барорецепторных сигналов, т. е. про-
изводилась центральная деафферентация синоаортальных баро-
рецепторов. У крыс при таком воздействии остро развивалась АГ
злокачественного типа, характеризовавшаяся резким повышени-
ем ОПС и снижением МО сердца. Удаление почек не оказывало
влияния на течение этого процесса. Гипертензию удавалось лик-
видировать с помощью а-адреноблокатора фентоламина.
У кошек аналогичные эксперименты вызывали появление
хронической лабильной АГ: в дневное время АД было крайне
неустойчивым, среднее гемодинамическое давление на 80% пре-
вышало исходный (дооперационный) уровень. Таким образом,
NTS-дефицитная гипертензия отличается от «гипертензии рас-
торможения» отчетливым повышением среднего давления, а так-
же отсутствием рефлекторной брадикардии в ответ на введение
норадреналина (Reis D., 1980).
Исследования барорефлекса в условиях клиники обогатили
наши представления об участии нейрогенных механизмов в раз-
витии и прогрессировании ЭГ. Клинические эксперименты
предусматривают создание разрежающей шейной камеры по
70
D. Eckberg (1979) в различных модификациях, введение мезатона
или нитропруссида натрия и т. д., что позволяет судить о кар-
диохронотропном и сосудистом компонентах барорефлекса у
больных ЭГ.
Общие итоги этих исследований, проводившихся группами
В. А. Алмазова (1986), А. В. Вальдмана и соавт. (1988),
Е. В. Шляхто (1991), В. Н. Савушкина (1991), В. С. Еремеева и
соавт. (2000); A. Zanhetti и соавт. (1970), Р. Komer и соавт.
(1974), G. Mancia и соавт. (1977), Е. Gonzales и соавт. (1983),
можно изложить следующим образом:
1. В эксперименте кардиохронотропный компонент барореф-
лекса претерпевает перенастройку (resetting): он ослабевает уже
через несколько минут после подъема АД (Cardidge Н. et al.,
1981).
2. При ПАГ и начальной стадии ЭГ торможение кардиохро-
нотропного компонента барорефлекса носит функциональный
(обратимый) характер; при ЭГ II стадии снижение его чувстви-
тельности — устойчивое; такую же направленность изменений
кардиохронотропного компонента барорефлекса наблюдают при
АГ у крыс линии SHR.
3. Сосудистый компонент барорефлекса, т. е. ответные гипо-
тензивные, вазодилататорные реакции, исходящие из каротидно-
го синуса, не ослаблены у больных АГ, а, напротив, усилены вне
зависимости от ее этиологии; однако эти реакции не обеспечи-
вают должного угнетения эфферентной симпатической нервной
активности и соответственно понижения АД, а также не предот-
вращают его дальнейший рост (Савушкин В. Н., 1991; Ishizuka Y.
et al., 1987). Разумеется, такое «переключение» барорецепторного
рефлекса имеет защитное значение, так как оно способствует
усилению гипотензивных ответов и несколько демпфирует
острые подъемы систолического давления, зависящие от увели-
чения гемодинамического удара. Отсутствие такого демпфирова-
ния усиливает склонность к развитию геморрагических инсуль-
тов, чаще наблюдаемых у пожилых больных ЭГ (Кузнецов В. И.,
1950; Кушаковский М. С., 1950; Токарь А. В., 1977).
Большинство исследователей полагает, что перенастройка и
снижение чувствительности барорефлекса являются скорее след-
ствием, чем причиной повышения АД. Однако нельзя не учиты-
вать уже упоминавшегося мною факта, что системная ауторегу-
71
ляция, ведущая к повышению ОПС, не может осуществляться
без ослабления барорецепторного рефлекса.
Механизм уменьшения (перенастройки) барорефлекса не
вполне ясен. По-видимому, повреждение касается центральных
элементов рефлекторной дуги, в частности области бульбоспи-
нальных нейронов. Повреждение центрального звена нейроген-
ного контура регуляции кровообращения подтверждается изме-
нениями уровня вазопрессина и пролактина в плазме крови при
стимуляции кардиопульмональных и допаминергических рецеп-
торов (Шляхто Е. В., 1991).
Система имцдазолиновых рецепторов и АД
При написании этого раздела я, в основном, основывался на
данных, изложенных в обстоятельном обзоре В. А. Цырлина,
Н. В. Кузьменко, М. Г. Плисса (2001). Честь открытия белка из
мозга человека, идентифицированного как белок имидазолино-
вого рецептора, связывающегося с клонидином (клофелин),
принадлежит группе авторов во главе с Н. Greney (1994). В том
же году Р. Dominiak (1994) показал, что имидазолиновые рецеп-
торы представляют собой популяцию, чувствительную к клони-
дину, но не реагирующую на катехоламины. Эти рецепторы отли-
чаются от аг-адренорецепторов продолговатого мозга не только
по локализации, но и по анатомическому распределению, мо-
лекулярным свойствам и другим качествам (Цырлин В. А.
и др., 2001).
Экспериментальные, фармакологические исследования ими-
дазолиновых рецепторов, выявление их типов, способствовали
созданию двух новых лекарственных препаратов центрального
действия — агонистов Ij-имидазолиновых рецепторов: моксони-
дина и рилменидина. Первый из этих препаратов — моксонидин
(цинт) широко и достаточно успешно используется в клиниче-
ской практике (см. ниже).
В заключение я считаю полезным сделать несколько заме-
чаний:
1) вопреки утверждениям некоторых отечественных клини-
цистов, система Ij-имидазолиновых рецепторов продолговатого
мозга не является элементом симпатической нервной системы;
2) их стимуляция вызывает понижение АД, что, по словам
Р. Bousquet и соавт. (1989), рассматривается как основа новой
концепции центральной регуляции АД.
72
ПЕПТИДЕРГИЧЕСКИЕ СИСТЕМЫ МОЗГА И АД
В 1973 г. были открыты опиатные рецепторы мозговой ткани
и вскоре — два противоболевых нейропептида, названных энке-
фалинами (Хьюз Дж. и Костерлиц X., 1975). В настоящее время
в ткани мозга обнаружено уже большое число нейропептидов,
модулирующих и регулирующих различные жизненные функ-
ции, в том числе и уровень АД. Установлено, что один и тот же
нейрон может содержать несколько пептидов. Кроме ранее упо-
мянутого нейропептида У, в регуляции АД участвует мозговая
система ангиотензиногена — АП, предсердный натрийуретиче-
ский фактор и его аналоги, эндотелии, субстанция Р, оказываю-
щая депрессорное действие, и ряд других соединений. Ниже
приводятся краткие сведения о пептидах, наиболее важных в
плане их влияния на АД.
Морфиноподобные пептвды
Напомню, что самая крупная норадренергическая система
головного мозга сосредоточена в locus coeruleus, нейроны кото-
рого помимо норадреналина содержат энкефалины и другие ней-
ропептиды. Катехоламинергические нейроны сосредоточены и в
зоне NTS, их нередко называют «тоническими нейронами буль-
барного вазомоторного центра». Здесь также находят морфино-
подобные нейропептиды, как и в гипоталамусе, миндалевидных
ядрах и в средней возвышенности (Оленев С. Н., 1987; Баха-
рев В. Д., 1985; Pernow В. et al., 1978).
Выше я упоминал, что противогипертензивный эффект кло-
фелина у крыс гипертензивной линии включает выделение Ь-эн-
дорфина, воздействующего на ствол мозга (Tibirica Е. et al.,
1992). Введение в латеральные желудочки мозга крысам нормо-
тензивной линии (WKY) лейцин-энкефалина или метионин-эн-
кефалина вызывает повышение АД. Пропранолол заметно огра-
ничивает этот прессорный эффект, что указывает на вовлечение
симпатической нервной системы в сердечно-сосудистые реак-
ции, вызываемые энкефалинами, играющими, по-видимому,
роль пептидергических медиаторов. Укажем также, что опиоид-
ные нейропептиды и АКТГ исходят из общего предшественника
и выделяются в кровь при стрессорных ситуациях в эквимоляр-
ных количествах (Simon W. et al., 1978).
73
Мозговая система ренин—ангиотензин II и АД
В мозговой ткани, как уже упоминалось, найдены все эле-
менты системы ангиотензиноген—ренин—АП; более того, она
представлена здесь значительнее, чем в какой-либо другой вне-
почечной ткани (Ganten D., 1971). N. Iwai, Т. Inagami (1992) по-
казали, что содержание ренина в структурах мозга крыс линии
SHR в 2 раза больше, чем у нормотензивных крыс линии WKY.
Аллель гена ренина у крыс линии SHR является гипертензив-
ным; его экспрессия (по mRNA) отчетливо повышена. У тех же
крыс содержится заметно больше мозгового АП и более выраже-
ны ответные реакции на него, а также интенсивнее связь этого
пептида с клетками мозга, в которых повышена плотность ан-
гиотензиновых рецепторов, по сравнению с крысами линии
WKY. Показательно, что все эти особенности выявляются уже у
молодых (однонедельных) крыс гипертензивной линии.
Двухсторонняя нефрэктомия удаляет из плазмы крови весь
почечный ренин; его не находят в течение первых 24 ч после
операции, однако уже через 2—5 дней ренин вновь появляется в
плазме. Правда, его концентрация составляет лишь 50% от ис-
ходной. В это же время заметно возрастает содержание АП в го-
ловном мозгу, откуда он и поступает в кровь.
Мозговой АП вовлечен в процессы регуляции АД, баланса
электролитов и чувства жажды. Центрально введенный
АП вызывает серию прогипертензивных реакций: усиление соле-
вого аппетита и жажду, увеличенную секрецию вазопрессина и
АКТГ, наконец, — повышение АД.
Особый интерес вызывает роль АП в церебральных механиз-
мах регуляции солевого аппетита и жажды. Прямая аппликация
этого олигопептида к супраоптическим нейросекреторным клет-
кам усиливает частоту их разрядов. Введение АП в передний ги-
поталамус, септальные или преоптические области стимулирует
жажду у животных с нормальным водным балансом.
Последние исследования показали, что в осуществлении этой
функции ведущую роль играют нейроны субфорникального ор-
гана (SFO). Это, по-видимому, и есть место приложения АП в
процессе регуляции чувства жажды. Активация тех же нейронов
близкими олигопептидами (брадикинин, эледозин и др.) не дает
таких результатов. Лишь ацетилхолин вызывает сходную с ангио-
тензином II реакцию. При этом 56% нейронов реагируют только
на АП, 30% нейронов — на оба вещества, т. е. на АП и ацетилхо-
74
лин. Атропин сульфат предотвращает ацетилхолиновое раздра-
жение нейронов зоны SFO. Предполагают, что АП воздействует
на специфические хеморецепторы переднего гипоталамуса, в ча-
стности клеток SFO (Felix D., 1976).
Однако взаимодействием мозгового АП с центральными хо-
линергическими системами не ограничиваются нейрохимиче-
ские реакции этого пептида. Однократное или систематическое
введение в желудочки мозга саралазина, конкурирующего с АП
за его рецепторы, тормозит возникновение АГ у молодых крыс
линии SHR и понижает АД у взрослых крыс с уже развившейся
АГ. Аналогичное действие оказывает вводимый в ЦНС ингиби-
тор ангиотензин-превращающего фермента — каптоприл. Одно-
временно со снижением АД ослабляется жажда. На срезах ткани
гипоталамуса было найдено, что каптоприл, кроме торможения
синтеза All, способен задерживать связывание последнего с со-
ответствующими мозговыми рецепторами и ослабляет высво-
бождение норадреналина. Активно воздействует на центральную
систему ренин—АП и клофелин. Все еще не вполне ясно, через
какие механизмы мозговая система ренин—АП реализует свое
действие на периферии, т. е. как она способствует повышению
ОПС. Если между центральными и периферическими норадре-
нергическими механизмами складываются реципрокные соотно-
шения, то мозговая и почечная, а также местные сосудистые си-
стемы ренин—АП действуют, по-видимому, синергически.
Натрийуретические пептиды мозга и сердца и АД
Патофизиологическая роль предсердного натрийуретическо-
го пептида, или, по современной терминологии, предсердного
натрийуретического фактора (ПНФ), при АГ стала вызывать ин-
терес после того, как R. Quirion и соавт. (1984) сообщили, что не
только в сердце, но и в мозговой ткани широко представлены
участки, связывающие ПНФ, и что они могут рассматриваться
как специфические мозговые ПНФ-рецепторы. Далее была про-
демонстрирована возможность синтеза ПНФ в мозговой ткани.
По мнению знатока этой проблемы В. Н. Хирманова, сердце ре-
гулирует кровообращение выработкой Na-уретического пептида.
ПНФ свойственна способность тормозить активацию симпа-
тической нервной системы, образование ренина в почках, секре-
цию альдостерона и вазопрессина, вазоконстрикцию, задержку
ионов Na+ и воды. ПНФ, как уже упоминалось, ограничивает
75
процесс гипертрофии сосудов. В частности, М. Nacamura и со-
авт. (1985) нашли, что инъекция этого пептида в боковой желу-
дочек мозга задерживает потребление воды (жажду) и ограничи-
вает повышение АД, т. е. эффекты, вызываемые АП. Введение
ПНФ в зону NTS продолговатого мозга тоже сопровождается по-
нижением АД (McKitrick D., Galaresi Р., 1988).
У больных ЭГ даже небольшое возрастание концентрации
ПНФ в плазме приводит к усилению натрийуреза; при этом про-
исходит не только усиление ранее нарушенного дистального
транспорта ионов Na+, но и повышенное выделение воды в про-
ксимальных почечных канальцах (Iton Н. et al., 1987). У нормо-
тоников внутривенное введение ПНФ в физиологических дозах
также увеличивает натрий- и гидрурез и одновременно вызывает
снижение систолического и диастолического АД.
Итак, ПНФ присущи антигипертензивные
и антидипсогенные эффекты.
Теперь известно, что в мозговой ткани животных, в част-
ности крыс, находятся три субтипа рецепторов натрийурети-
ческих пептидов (А-, В- и С-рецепторы). Мозговой натрий-
уретический фактор (BNF или МНФ) по структуре и после-
довательности расположения аминокислот весьма напомина-
ет ПНФ. У здоровых людей концентрация МНФ лежит в преде-
лах 0,9+0,07 фмоль/мл плазмы и составляет 1/6 плазменной кон-
центрации ПНФ. Обычно изменения плазменной концентрации
этих двух пептидов имеют одинаковую направленность (Wan-
bach G., 1991). Интересно, что и сердце человека выделяет два
типа натрийуретических пептидов — предсердный и мозговой;
последний образуется преимущественно в стенках желудочков
сердца (Хирманов В. Н., 1993).
При введении в желудочки мозга МНФ ограничивает прес-
сорный эффект АП, секрецию катехоламинов и АКТГ в ЦНС.
Правда, К. Komatsu и соавт. (1992) не находили МНФ в мозго-
вой ткани крыс гипертензивной линии, поэтому эти авторы по-
лагают, что его физиологическое значение пока не вполне ясно.
Эндотелии мозга и АД
Одними из наиболее мощных вазоактивных веществ являют-
ся эндотелиальные пептиды — эндотелины. Самый мощный
представитель этого класса соединений — эндотелии-1 (Э) —
пептид, состоящий из 21 аминокислоты, ему придается большое
76
значение в регуляции проходимости резистивных сосудов (Пале-
ев Н. Р., Одинокова В. А., Мравян С. Р., 1993). Впервые он был
выделен в культуре эндотелиальных аортальных клеток. Это ак-
тивное сосудосуживающее вещество: внутривенное введение Э
крысам сопровождается устойчивым прессорным действием.
Хотя имеются указания, что в физиологических концентрациях
эндотелии-1, воздействуя на эндотелиальные рецепторы, вызы-
вает высвобождение факторов релаксации; в более высоких кон-
центрациях он стимулирует стойкую вазоконстрикцию (Vanhout-
te Р., 1993; Затейщикова А. А., Затейщиков Д. А., 1998). Пептид
изменяет почечную и эндокринную функции, регулируя секре-
цию ренина, альдостерона и ПНФ. У крыс линии SHR введение
антител, специфических для Э, понижает среднее АД примерно
на 10%, а почечно-сосудистое сопротивление — на 35%, при
этом скорость клубочковой фильтрации и почечный плазмоток
возрастают на 50% (Ohno A. et al., 1992).
Как и ПНФ, эндотелии обнаружен в тканях мозга, здесь он,
по-видимому, находится в магноцеллюлярных нейронах пара-
вентрикулярного и супраоптического ядер гипоталамуса, а также
в заднем гипофизе. Рецепторы Э широко распространены в моз-
говой ткани, включая гипоталамус (Makina Sh. et al., 1992). Уста-
новлено, что инсулин стимулирует секрецию эндотелина-1, ги-
перинсулинемия способствует увеличению уровня этого пептида
в плазме крови (Desideri G. et al., 1997). В настоящее время изве-
стно уже семейство эндотелинов, вызывающих интенсивную ва-
зоконстрикцию (Zimmerman R. et al., 1994).
Дигиталисоподобный натрийуретический фактор
(гормон) и АД
В 1957 г. Н. Smith указал на возможность того, что в плазме
крови может находиться еще одно (помимо ПНФ) натрийурети-
ческое вещество, участвующее в регуляции реабсорбции ионов
Na+ в почечных канальцах и влияющее на проходимость рези-
стивных сосудов. Реальное изучение этой, много лет интриговав-
шей ученых, проблемы было начато Н. de Wardener и Е. Clarcs-
son (1985) в опытах с перекрестным кровообращением у собак.
Эти исследователи пришли к выводу, что если у одного живот-
ного вызвать в ответ на увеличение ОВЖ активную выработку
натрийуретического гормона, то у другого животного, в кровь
которого этот гормон попадает, происходит не только повыше-
77
ние ОПС и АД, но и усиление натрий-гидруреза. Такая гумо-
ральная субстанция, как выяснилось, не относится к классу пеп-
тидов, а имеет стероидное строение. По последним данным она
не что иное, как эндогенный оаубаин (Hamlyn J. et al., 1991, 1992;
Pamnani M. et al., 1994). Нейроны мозга, содержащие дигоксино-
подобное вещество, находятся в паравентрикулярном и супраоп-
тическом ядрах гипоталамуса (Haber Е., Hauport G., 1987). Допу-
скается также возможность выделения некоторого количества
оаубаина в надпочечниках, что, в частности, наблюдали при над-
почечниковых опухолях. После открытия эндогенных аналогов
опия — эндорфинов и энкефалинов — стало очевидным, что
многие растительные алкалоиды и соединения имеют свои ана-
логи среди физиологических регуляторов у позвоночных живот-
ных (Хирманов В. Н., 1993).
Оаубаин, как известно, обладает способностью ингибировать
Na+-, К+-АТФазу мембраны гладкомышечных сосудистых кле-
ток, что в конечном счете через Na+—Са++-обменный механизм
приводит к накоплению ионов Са++ в миоплазме гладкомышеч-
ных клеток, к их сокращению и сужению просвета резистивных
сосудов (Haddy F., 1983).
Na+-, Ка+-АТФаза в ЦНС вовлечена в поддержание ряда
нейрональных функций, в частности таких, как передача
нервного импульса. Ингибирование здесь этого фермента усили-
вает симпатический нервный поток на периферию и тоже спо-
собствует повышению АД (Takashi Н. et al., 1989). По нашим
представлениям, активация синтеза эндогенного оаубаина зани-
мает центральное место в развитии так называемой гипергидра-
тационной формы ЭГ (Кушаковскпй М. С., Иванова Н. В.,
1985). Этот вопрос подробнее рассматривается в клиническом
разделе монографии.
Вазопрессин и АД
С теоретической точки зрения, аргинин-вазопрессин может за-
нимать особое место в генезе АГ, поскольку этому гормону (по-
липептид) присущи как сосудосуживающее действие с повыше-
нием ОПС, так и способность задерживать выделение ионов Na+
и воды с увеличением ОЦП. Оба этих эффекта носят прогипер-
тензивный характер. Действительно, известно, что аргинин-ва-
зопрессин вовлечен в развитие ДОКА-№С1-гипертензии и АГ у
спонтанных гипертензивных крыс. Несомненна роль вазопрес-
78
сина в процессах вазоконстрикции и антидиуреза (Zimmerman R.
et al., 1994).
Вазопрессин формируется в супраоптическом и паравентри-
кулярном ядрах гипоталамуса. Магноцеллюлярные нейроны ва-
зопрессина из супраоптического ядра почти полностью спроеци-
рованы на задний гипофиз; магноцеллюлярные и парвоцеллю-
лярные нейроны вазопрессина из паравентрикулярного ядра
проецируются в заднем гипофизе и в экстрагипофизарной части
соответственно.
Известны два типа вазопрессиновых рецепторов, обозначае-
мых как V] и V2; они находятся на периферии. Сосудистые ре-
цепторы относятся к V]-рецепторам, почечные — к Уг-рецепто-
рам вазопрессина.
Возвращаясь к вопросу о возможной патогенетической роли
вазопрессина в развитии АГ, следует прежде всего указать, что
были обнаружены: небольшое, но достоверное повышение его
уровня в плазме у крыс линии SHR в возрасте 5—10 нед и увели-
чение мочевой экскреции этого гормона по сравнению с крыса-
ми нормотензивной линии.
Содержание вазопрессина в гипоталамусе крыс линии SHR
снижено, а в задней доле гипофиза — повышено. В ответ на
уменьшение ОЦП крысы линии SHR (возраст 5—8 нед) усилен-
но выделяют вазопрессин по сравнению с крысами линии WKY.
Аналогичные различия выявляются и при воздействии на
гипоталамонейрогипофизарную систему ацетилхолина или АП
in vitro.
Отмечено также, что сами по себе прессорные потенции ва-
зопрессина выше у крыс SHR, чем у WKY; возможно, это зави-
сит от ослабления барорефлекса у крыс линии SHR, который
остается нормальным у крыс линии WKY. В. А. Алмазов,
Е. В. Шляхто (1993) отметили, что у лиц с ПАГ и больных ЭГ в
I стадии уровень вазопрессина в плазме крови превышал норму
на 41% и 46% соответственно.
Все эти пока еще разрозненные данные, как будто, подтвер-
ждают значение аргинин-вазопрессина в генезе АГ. Однако име-
ются факты и противоположного характера. В частности, было
показано, что блокада прессорных эффектов эндогенного вазо-
прессина не изменяет течения АГ у крыс SHR 4-недельного воз-
раста (Sladek С. et al., 1987). Правда, нельзя исключить того, что
гипертензивное действие вазопрессина осуществляется через
79
другие механизмы, которые не блокируются антагонистами
V]-рецепторов, или через Уг-рецепторы. Имеются данные о влия-
нии вазопрессина на секрецию в ЦНС ренина и ПНФ, о моду-
лировании вазопрессином барорецепторного рефлекса.
Пролактин и АД
Пролактин по своей структуре является белком. Его секреция
контролируется центральной тубероинфундибулярной допамин-
ергической системой, связанной, в свою очередь, с серотонинер-
гическим механизмом. Многие другие факторы: эндорфины,
осмоляльность плазмы, натриевый гомеостазис, эстрогены —
оказывают влияние на выделение пролактина. Последний влияет
на различные метаболические процессы в организме. Нас, есте-
ственно, интересует связь пролактина и АД.
Известны факты, указывающие на участие пролактина в ре-
гуляции функции почек, в процессах задержки ионов Na+, К+ и
воды (Алмазов В. А., Шляхто Е. В., 1993; Horrolin D. et al., 1971).
Вливание пролактина крысам, преобработанным бромокрипти-
ном, подавляющим эндогенное выделение пролактина, сопро-
вождается достоверным снижением экскреции Na+, К+ и воды.
Эксперименты, поставленные in vitro, показали, что чувстви-
тельность гладких мышц артериол к норадреналину и АП усили-
вается под воздействием пролактина.
Высокий уровень пролактина в плазме, как и повышение АД,
могут отражать усиление адренергических разрядов. R. Stumpe и
соавт. (1977) находили повышение базального уровня пролакти-
на у больных ЭГ, а К. Kollak и соавт. (1980) отмечали связь меж-
ду возрастанием концентрации пролактина в плазме и усилени-
ем симпатического тонуса. Замечено также, что повышенный
уровень пролактина и норадреналина возвращается к норме
при введении больному ЭГ стимуляторов допаминергической
системы.
Итак, снижение центральной допаминергической активности
с одновременным усилением эфферентной активности симпати-
ческой нервной системы вместе с увеличением концентрации
пролактина в плазме, обладающего самостоятельным прогипер-
тензивным действием, может быть одним из механизмов форми-
рования АГ, что, в частности, отмечается у беременных женщин.
80
Серотонин и АД
Об участии серотонина (5-гидрокситриптамин) в регуляции
АД и, возможно, в патогенезе АГ впервые сообщили в 1953 г.
I. Page и J. McCubbin.
В ткани мозга имеется большая зона серотонинергических
нейронов, особенно в бульбоспинальной области и в медиальной
raphe. Серотонинергические рецепторы мозга подразделяются на
Si- и 82-подтипы. Они, по-видимому, принимают участие в кон-
троле за такими процессами, как сон и настроение.
Периферические эффекты серотонина отличаются от цент-
ральных. Его называют «амфибарическим» веществом, посколь-
ку при снижении симпатического нервного тонуса серотонин от-
четливо повышает АД; при усилении тонуса симпатических со-
судистых нервов серотонин столь же резко понижает АД. Напри-
мер, у собак с экспериментальной нейрогенной АГ серотонин
оказывает депрессорное воздействие. Очевидно, что сосудистые
эффекты серотонина весьма сложны, они зависят от многих
факторов, в том числе от фармакологических свойств серотони-
новых рецепторов и состояния симпатического тонуса. С одной
стороны, серотониновые рецепторы 82-подтипа опосредуют су-
жение сосудов, вызываемое серотонином. С другой стороны, вы-
деляемый из энтерохромаффинных клеток серотонин расширяет
артериолы, взаимодействуя с релаксирующим фактором эндоте-
лия и усиливая пресинаптический эффект симпатических нер-
вов, а также способствуя выделению вазоактивных кишечных
полипептидов из пептидергических нервов.
Как видно, роль серотонина в регуляции АД пока не пред-
ставляется вполне ясной (Page I., 1977). Несмотря на это, можно
говорить о некоторых практических достижениях в данной обла-
сти. Я имею в виду использование кетансерина — высокоселек-
тивного блокатора Бг-серотониновых рецепторов — для лечения
больных ЭГ. Его применяют в качестве монотерапии или в ком-
бинации с 0-адреноблокатором.
Как показали R. Donnelly и соавт. (1987), в дозе 40 мг в день
кетансерин достоверно понижает систолическое и диастоличе-
ское АД у больных с легким и средним по тяжести течением ЭГ.
При этом не меняются частота сердечных сокращений, концент-
рации норадреналина и альдостерона, активность ренина в плаз-
ме. Препарат, по-видимому, улучшает эластические свойства
аорты и крупных артерий. Хотя кетансерину присущи некоторые
81
а-адреноблокирующие свойства, он, в отличие от классического
а 1-адреноблокатора празозина, не изменяет частоту сердечных
сокращений, понижает, практически в равной мере, АД в поло-
жении больного лежа и стоя, не вызывает постуральной гипотен-
зии. Надо учитывать, что кетансерин удлиняет интервал Q—Т,
что может осложняться приступами двунаправленной верете-
нообразной желудочковой тахикардии — t. d. р. (Кушаков-
ский М. С., 1992; Soffer J. et al., 1982).
Итак, я рассмотрел, если позволительно так сказать, нейро-
генные (центральные и периферические) аспекты патогенеза ЭГ.
Наступил черед для анализа других возможных путей становле-
ния этого заболевания, прежде всего, роли почек, «солевой чув-
ствительности», объемов жидкости.
ПОЧКИ, НАТРИЙ, ОБЪЕМЫ ЖИДКОСТИ
И ВОЗНИКНОВЕНИЕ ЭГ
Зависимость между потреблением NaCl и АД
Связь между избыточным потреблением поваренной соли и
повышением АД была замечена много веков тому назад, еще до
открытия методов измерения АД и появления самого понятия
«артериальная гипертензия» (см. краткий исторический очерк).
В XX веке эпидемиологические исследования, проводившиеся
во многих странах, подтвердили в принципе наличие такой свя-
зи, но они одновременно показали, что, во-первых, между коли-
чеством потребляемой соли и высотой АД имеется лишь слабая
корреляция (Campese V., 1994) и что, во-вторых, наряду с гипер-
тониками и нормотониками, реагирующими на увеличенный
прием натрия хлорида более или менее отчетливым повышением
АД, имеются люди, у которых при тех же обстоятельствах АД не
меняется (Dustan Н. et al., 1986).
Такую вариабельность реакций АД на NaCl еще в начале
60-х годов продемонстрировали в известных экспериментах
L. Dahl и соавт. (1961), которым удалось вывести две наследст-
венные линии гипертензивных крыс: «соль-чувствительных» и
«соль-устойчивых». Известна и другая генетическая (Миланская)
линия крыс с солевой АГ (Bianchi G., 1979). Наконец, следует
упомянуть четвертую форму экспериментальной АГ, вызывае-
82
мую систематическим кормлением животного поваренной со-
лью, правда, при одновременном введении дезоксикортикосте-
рона ацетата (ДОКА-ИаО-гипертензия). Эта АГ иногда приоб-
ретает злокачественный характер, но она не передается по на-
следству (Selye Н. et al., 1943).
Возникшая вследствие противоречивости эпидемиологиче-
ских данных острая дискуссия между сторонниками гипотез
«пронатризма» (Morgan Т. et al., 1979) и «антинатризма» (Simp-
son F., 1979; Swales J., 1980) не утратила своей актуальности и в
наши дни. Несомненно, что разные люди отличаются различной
чувствительностью к поваренной соли. Большинство людей в
среднем потребляют до 10—12 г соли в день, при этом только
1 человек из 8 (около 12,6%) оказывается чувствительным к та-
кому количеству соли, т. е. у него в конце концов развивается
ЭГ. У менее чувствительных людей ЭГ возникает лишь при зна-
чительном избытке соли в пище или воде. В подобных случаях
NaCl становится фактором, по-видимому, дополнительно по-
вреждающим почку, в какой-то степени уже ослабленную на-
следственным (врожденным) дефектом, не проявлявшимся ранее
при более скромном солевом режиме.
В одном из сельских районов Закарпатья среди людей, тради-
ционно потреблявших в течение жизни до 20—25 г поваренной
соли в день, АГ возникала в 3 раза чаще, чем у людей, прини-
мавших с пищей 9—12 г соли в день (Некрасова А. А., Фиту-
ла М. И., Петрушева Н. Ф. и др., 1980).
Известны также результаты 20—25 эпидемиологических ис-
следований, проведенных в географических районах, жители ко-
торых потребляли менее 2,9 г соли в день. У этих людей не реги-
стрировались подъемы АД, и оно не возрастало при их старении.
Если те же люди переезжали в другие географические зоны, где
потребление соли значительно возрастало, то у многих из них
развивалась АГ (Tobian L., 1979).
Теперь установлено, что уже среди лиц с ПАГ и у больных в
начальном периоде ЭГ имеются подгруппы людей, которые в от-
вет на внутривенное введение солевого раствора медленнее, чем
остальные больные ЭГ, выделяют избыток натрия и воды и даже
склонны задерживать их на достаточно длительное время (Не-
красова А. А. и др., 1980; Маслова Н. П. и др., 1993; Бондарен-
ко Б. Б. и др., 1993; Баранова Е. И. и др., 1994).
83
В. Wedler и соавт. (1992) сравнивали выделение натрия с мо-
чой у соль-чувствительных и соль-устойчивых лиц с нормотен-
зией и гипертензией. Все эти лица сначала получали в течение
6 дней диету, содержавшую 120 ммолей натрия (2,76 г), затем
8 дней по 10 ммолей (230 мг), наконец, еще 8 дней по 400 ммо-
лей (9,2 г) натрия. У чувствительных к соли диастолическое дав-
ление явно возрастало при переходе от 10 до 400 ммолей натрия;
у лиц, устойчивых к соли, не происходило повышения диастоли-
ческого давления.
Помимо изменений АД авторы оценивали скорость выделе-
ния натрия с мочой. Более длинный период полувыведения на-
трия выявился у пожилых больных ЭГ; чувствительность к на-
трию, т. е. повышение АД, тоже возрастала по мере старения
больных ЭГ, что еще раньше отметили М. Weinberger, N. Fine-
berg (1991).
По мнению J. Sallivan и соавт. (1982), чувствительность к
NaCl свойственна 39% лиц с ПАГ и 22% больным с ЭГ. Такую
же цифру — 39% — приводит и Л. А. Соколова (1994) из клини-
ки В. А. Алмазова, обследовавшая большую группу лиц с ПАГ.
В наблюдениях J. Sallivan и соавт. (1982) у «чувствительных»
больных ЭГ повышенное потребление поваренной соли приво-
дило к приросту среднего давления на 6,5%, СИ — на 8%; ОПС
понижалось в 2 раза слабее, чем у больных, устойчивых к соле-
вой нагрузке.
Р. Luft и соавт. (1979) наблюдали, что здоровые люди, не чув-
ствительные к NaCl, реагируют на избыток натрия в пище повы-
шением СИ на 6,9%, при снижении ОПС на 13%. Заслуживает
внимания указание тех же авторов, что соль-чувствительные и
соль-устойчивые больные ЭГ не имеют различий в уровне актив-
ности ренина, концентрации альдостерона в плазме и в степени
активности симпатической нервной системы.
Усиление солевого аппетита и АД
Возникает вопрос: что же заставляет часть людей системати-
чески потреблять пищу с повышенным содержанием натрия хло-
рида? Обычно это объясняют семейными или национальными
традициями, привычкой. Но и для возникновения или закрепле-
ния привычки должны быть предпосылки.
Углубленное изучение этого вопроса показало, что различия
в солевом аппетите у разных людей и животных имеют свое фи-
84
энологическое обоснование. В частности, известно, что резкое
усиление солевого аппетита, присущее крысам с наследственной
спонтанной АГ, может быть снижено или подавлено с помощью
центральной блокады образования АИ с помощью ингибитора
АПФ (Danicolantenic R. et al., 1982). У крыс линии SHR пред-
сердный натрийуретический фактор (ПНФ) тоже понижает соле-
вой аппетит, усиленный предварительно введенным в ЦНС АП
(Iton Н. et al., 1987).
Как видно, различия в солевом аппетите зависят, вероятно,
от интенсивности образования в головном мозгу АП и ПНФ.
Если у части людей сочетаются два, на первый взгляд, незначи-
тельных и скрытых отклонения: повышенный солевой аппетит и
чувствительность к поваренной соли, то создаются условия для
возникновения или обострения АГ.
Что же препятствует больному ЭГ или нормотонику, склон-
ному к этому заболеванию, экскретировать такое количество по-
варенной соли, которое было бы адекватно ее поступлению в ор-
ганизм?
Общепризнанно, что почки, поддерживающие водно-солевой
гомеостаз, т. е. нормальное содержание в организме натрия и
воды, являются важнейшим органом, обеспечивающим в физио-
логических условиях длительный контроль за уровнем АД. В на-
стоящее время преобладает концепция A. Guyton по поводу того,
как почки осуществляют эти функции (см. ниже).
Механизм «давление—натрийурез»
в физиологических условиях
Еще в 1843 г. К. Ludvig в эксперименте показал, что скорость
образования мочи имеет отношение к уровню АД. Этот факт по-
лучил дальнейшее развитие в классической монографии A. Cush-
пеу (1917) «The secretion of urine». В конце 70—80-х годов меха-
низм «давление—натрийурез» был тщательно изучен группой
физиологов во главе с A. Guyton. После многочисленных опытов
на изолированных почках человека и животных эти исследовате-
ли сумели представить сложные соотношения между величинами
АД и почечной экскреции натрия (воды) в виде S-образной кри-
вой почечной функции (рис. 6). Она четко демонстрирует, что
само по себе АД оказывает решающее воздействие на величину
натрий-гидруреза. При АД около 100 мм рт. ст. обеспечивается
выделение натрия и воды, адекватное его поступлению в орга-
85
Рис. 6. Кривые почечной функции у здоровых (1) и больных ЭГ (ГБ) (2)
(по A. Guyton и соавт., 1972); зависимость выделения натрия и воды
в условных единицах от уровня АД
низм. Если АД повышается, например, до 150 мм рт. ст., то нат-
рий-, гидрурез возрастают в 3 раза. Отрицательный баланс на-
трия и воды сохраняется до тех пор, пока АД не понизится до
100 мм рт. ст. Если же АД понижается до уровня <100 мм рт. ст.,
выделение почками натрия и воды начинает уменьшаться. При
АД около 50 мм рт. ст. диурез практически прекращается.
Естественно, что когда речь идет об АД, то прежде всего име-
ется в виду почечное перфузионное давление. Особенно важно
подчеркнуть, что сдвиги в экскреции натрия и воды в ответ на
изменения почечного перфузионного давления происходят без
видимых изменений почечного кровотока, скорости клубочко-
вой фильтрации и фильтрационной фракции.
Механизм «давление—натрий(гидр)урез» есть следствие из-
менений канальцевой реабсорбции в тубулярных сегментах по-
чечной медуллы (петля Генле, собирательные трубки). Неодно-
кратно демонстрировалось, что этот феномен осуществляется в
почке, полностью изолированной от воздействия симпатическо-
го нерва и циркулирующих в крови гормонов или других актив-
ных веществ.
Пока еще не вполне ясно, какие специфические внутрипо-
чечные механизмы обеспечивают механизм «давление—натрий-
урез». Хотя ангиотензин II является его сильным модулятором,
86
Время после внезапного изменения давления
Рис. 7. Последовательность включения и сравнительная длительность,
эффективность (в условных единицах) различных механизмов,
регулирующих уровень АД (по A. Guyton и соавт., 1972)
при применении ингибиторов АПФ взаимодействие между АД
и экскрецией натрия/воды не только не исчезает, а даже
возрастает. Следовательно, не АП опосредует этот базальный
феномен. Почечные простагландины тоже модулируют его, но
не являются ведущими в его осуществлении. Блокада эндоген-
ного допамина не сказывается на этом явлении. Таким образом,
другие специфические, внутрипочечные механизмы являются
главными факторами, обеспечивающими механизм «давление—
натрий(гидр)урез».
J. Granger (1986) полагает, что решающую роль в связи между
почечным перфузионным давлением и скоростью канальцевой
реабсорбции играет интерстициальное гидростатическое дав-
ление.
Регулируя баланс натрия и воды в организме, базисная био-
логическая петля обратной связи «почки—ОВЖ» способна функ-
ционировать бесконечно долго (всю жизнь), восстанавливая рав-
новесие в тех случаях, когда оно временно нарушается (рис. 7).
Разумеется, она оперирует не изолированно, а будучи связанной
87
с многочисленными центральными нейрогуморальными и мест-
ными контрольными механизмами, модулирующими ее эффек-
тивность (Guyton A., Coleman Th., 1969). Эти влияния осуществ-
ляются главным образом через изменения уровня АД и соответ-
ственно почечного перфузионного давления. Например, пони-
жение АД у человека не только ослабляет мочевую экскрецию
натрия и воды, но и стимулирует секрецию в ЮГ клетках ренина
и, следовательно, образование АП; последний, в свою очередь,
способствует повышению АД и, в конечном счете, усилению
экскреции натрия и воды.
Механизм «давление—натрийурез» при ЭГ
Нормальное функционирование этого механизма возможно
лишь в том случае, если причины, вызывающие изменения АД,
одновременно не повреждают базисные внутрипочечные меха-
низмы. При нарушении этого условия, как это и бывает при ЭГ,
кривая почечной функции смещается вправо (см. рис. 6), т. е.
для удаления с мочой равновеликого (со здоровыми людьми) ко-
личества натрия и воды требуется уже более высокое АД, следо-
вательно, происходит становление АГ (Hall J., Guyton A., Cole-
man Th., 1986). Подъем АД, как видно, играет компен-
саторную роль. «Изменения АД не прекращаются до тех
пор, пока оно не достигает точки на кривой, при которой по-
ступление и выделение (натрия и воды — М. К.) становятся рав-
ными» (Guyton А., 1979). Кроме того, форма и положение кри-
вой почечной функции показывают, что при форсированном
введении больному ЭГ большого объема солевого раствора мож-
но ожидать у части из них избыточный натрий-гидрурез, т. е. от-
ветную реакцию, явно превышающую физиологическую (Нато-
чин Ю. В., 1976; Бондаренко Б. Б. и др., 1993; Маслова Н. П.,
Баранова Е. И. и др., 1994).
Итак, среди внутрипочечных ненормальностей, ограничива-
ющих в разной степени механизм «давление—натрийурез», т. е.
уменьшение экскреции натрия и воды при повышении АД,
A. Guyton и соавт. усматривали многочисленные факторы: уси-
ленное воздействие симпатических нервов, изменения концент-
рации внутрипочечных гормонов: АП, простагландинов, а также
ПНФ, наследственные дефекты медуллы, наконец, другие, пока
не установленные влияния. Об этом же свидетельствуют работы
D. Gasselas, L. Moore (1990), L. Navar и соавт. (1991).
88
Механизмы повышения АД при задержке натрия и воды
(увеличение ОВЖ)
Теперь следует ответить на вопрос, каким образом накопле-
ние жидкости в организме приводит к повышению АД. Необхо-
димо вновь обратиться к экспериментам группы А. Гайтона. При
форсированном внутривенном введении здоровой собаке такого
количества жидкости, которое повышает ОВЖ на 25%, ОЦП не-
медленно возрастает на 25%, а МО сердца — на 200%. Одновре-
менно понижается ОПС, но только на 64%. В итоге АД повыша-
ется примерно на 8%.
Через 20 мин после вливания жидкости избыток ОЦП со-
ставляет лишь 5%, МО превышает исходный на 50%, ОПС ниже
исходного на 33%, АД приближается к нормальным величинам.
Столь быстрая коррекция уровня АД обеспечивается объемными
и барорецепторными рефлексами, способствующими нисходя-
щему торможению симпатической нервной активности и расши-
рению резистивных сосудов, а также переходу части жидкости в
интерстициальное пространство. В течение последующих 20 мин
почки удаляют лишнюю жидкость.
Если на первый, второй дни эксперимента повышение АД
обусловлено недостаточным расширением артериол при увели-
ченном МО сердца (относительное повышение ОПС), то на
2-й неделе АГ уже полностью зависит от абсолютного повыше-
ния ОПС. Устанавливающийся новый уровень АД обеспечивает
сбалансированное выделение почками натрия и воды и тем са-
мым поддержание водно-солевого гомеостазиса на фоне повы-
шенного АД.
При дальнейшем анализе этой проблемы необходимо найти
ответы по меньшей мере на два вопроса (многие авторы, к сожа-
лению, их как бы игнорируют):
1. Каковы могут быть причины недостаточного расширения
резистивных сосудов в условиях внеклеточной гипергидратации
и увеличения МО сердца?
2. В чем сущность дефекта почек, ограничивающего экскре-
цию натрия и воды?
Внеклеточная гипергидратация
и дигиталисоподобный натрийуретический фактор
В исследованиях А. Гайтона и соавт. нет четкого ответа на
первый вопрос, да и в 70-х годах еще не было эксперименталь-
89
ных данных для такого ответа. В наше время можно высказать
предположение, что относительное повышение ОПС при увели-
чении МО сердца, вместо ожидаемого адекватного понижения
ОПС, скорее всего, связано с возрастанием концентрации в кро-
ви эндогенного гликозида — оаубаина, выделяемого в условиях ги-
пергидратации нейронами гипоталамуса и ингибирующего Na+,
К+-зависимую АТФазу у мембраны гладкомышечных клеток ре-
зистивных сосудов (см. выше).
Концентрация в плазме этого вещества у больных ЭГ досто-
верно выше, чем у нормотоников (Signella G. et al., 1986). Повы-
шение его уровня коррелирует с усилением жесткости мембраны
эритроцитов, свойственной больным ЭГ (Tsudo R. et al., 1992).
Ингибирование Na+-, К+-зависимой АТФазы в мембране
гладкомышечных клеток сочетается, как упоминалось, с измене-
нием функции Na+—Са++-обменного механизма, что способст-
вует накоплению в миоплазме ионов Са++ и более интенсивному
сокращению этих мышечных клеток с сужением просвета арте-
риол и прекапилляров (Щербак Л. И., 1990; Хирманов В. Н.,
1993; Haddy F., Overbeck Н., 1976; de Wardener Н., Clarcsson Е.,
1985).
По поводу дефекта почек, ограничивающего экскрецию на-
трия и воды, можно заметить следующее. Выше, касаясь этого
вопроса, мы упомянули, что, с точки зрения А. Гайтона и соавт.,
препятствием для полноценной экскреции натрия и воды может
служить передаваемый по наследству дефект медуллярного слоя
почек, ослабляющий механизм «давление—натрийурез». Близкой
позиции придерживались М. Blaustein (1985), Н. de Wardener и
Е. Clarcsson (1985).
Можно предполагать, что у людей, имеющих этот дефект и,
следовательно, предрасположенных к развитию гипергидратаци-
онной формы ЭГ, напряженный солевой режим, еще уравнове-
шиваемый в молодости, хотя и выявляемый во время нагрузоч-
ной солевой пробы, становится чрезмерным для неполноценной
почки человека в более пожилом возрасте. Не случайно гипер-
гидратационная (объем-, Na-зависимая) форма ЭГ, клиническую
картину которой мы описываем ниже, чаще проявляется у лиц
45—50 лет. Сходная ситуация, вероятно, возникает у ряда жен-
щин в период половой инволюции.
90
Между тем имеется и другая точка зрения, активно разраба-
тываемая сторонниками центрогенно-нервной теории патогенеза
ЭГ в частности группой исследователей во главе с G. Di Bona.
Нейрогенные механизмы регуляции экскреции
натрия и воды
Сторонники этого направления исходят из того, что поддер-
жание у человека водно-солевого гомеостазиса, т. е. сохранение
ОВЖ и ОЦП в узких пределах, несмотря на дневные колебания
в приеме натрия и воды, обеспечивается нейрогенными механиз-
мами, имеющими афферентное и эфферентное звенья. Аффе-
рентное звено биокибернетической петли обратной связи пред-
ставлено главным образом механорецепторами (некапсулирован-
ные нервные элементы), расположенными в стенках левого
предсердия, а также синокаротидными и другими сосудистыми
рецепторами. Растяжение или напряжение стенок предсердия
стимулирует выход нервных импульсов, поступающих по миели-
низированным волокнам блуждающего нерва к зонам его цент-
рального представительства в продолговатом мозге и гипотала-
мусе (супраоптическое и паравентрикулярное ядра). Повышение
левопредсердного давления приводит к возрастанию концентра-
ции в плазме ПНФ, к снижению уровня АДГ, к изменениям
внутрикапиллярного давления с усилением фильтрации жидко-
сти из капилляров в интерстициальное пространство («старлин-
говские силы») и, что особенно важно (в плане рассуждений), к
снижению эфферентной активности почечных симпатических
нервов. Это ведет к уменьшению канальцевой реабсорбции на-
трия (воды) и к увеличению натрий-, гидруреза.
Надо подчеркнуть, что такая реакция симпатических нервов
специфична для почек, поскольку одновременно в других орга-
нах симпатическая нервная активность не угнетается, а повы-
шается (сердце) или не изменяется (селезенка). Стимуляция ме-
ханорецепторов левого предсердия тормозит также солевой
аппетит и жажду. Следовательно, возникает интегральный ответ,
направленный на усиленное выделение натрия и воды при огра-
ничении его поступления в организм.
У животных, склонных к АГ или уже имеющих хроническое
повышение АД, избыточное потребление поваренной соли со-
провождается в условиях стресса не усиленным выделением на-
трия, а его задержкой, т. е. антинатрийурезом. Как показали экс-
91
перименты J. Koepke и соавт. (1987), крысы наследственной ги-
пертензивной линии (SHR) реагируют именно таким парадок-
сальным образом в ответ на питье соленой воды, — в отличие от
нормотензивных крыс линии WKY. Хирургическая денервация
почек у SHR подавляет склонность к антинатрийурезу.
G. Di Bona и S. Jones (1991) продемонстрировали, что симпа-
тический нервный контроль за реабсорбцией натрия в почках
обеспечивается аг-адренорецепторными механизмами в ЦНС.
Введение в желудочки мозга (но не внутривенно) стимулятора
аг-адренорецепторов клонидина или гуанабенза предотвращает
усиление активности почечных симпатических нервов у крыс
линии SHR.
Выше мы упоминали, что эти крысы имеют большую плот-
ность аг-адренорецепторов в гипоталамусе, чем крысы WKY, и
что, возможно, центры миндалевидных ядер играют важнейшую
роль в передаче стрессорных стимулов с усилением симпатиче-
ских разрядов в почках. При этом усиленное питье соленой воды
гипертензивными крысами усиливает у них активность почечных
симпатических нервов в ответ на стресс.
Большой интерес вызывают результаты экспериментов
G. Di Bona и S. Jones (1991), поставленных на крысах линии
BHR (borderline hypertensive rats). BHR — это первая генерация
крыс, исходящая от самок линии SHR и самцов линии WKY,
т. е. это крысы с пограничной артериальной гипертензией.
Оказалось, что при повышенном потреблении NaCl (соленая
вода) и стрессорных воздействиях у крыс линии BHR развива-
лась устойчивая АГ. Повышение АД зависело от усиления актив-
ности почечных симпатических нервов, тормозивших выделение
натрия с мочой.
Эти опыты, которым я придаю большое значение, заполняют
пробел в нейрогенной теории происхождения ЭГ; ее слабым мес-
том было отсутствие объяснения генеза гипергидратационной
(солевой, объем-, Na-зависимой) формы ЭГ. Теперь мы вправе
предположить, что у определенной группы людей с наследствен-
ной повышенной чувствительностью к NaCl сочетанное воздей-
ствие стресса (психоэмоциональные факторы) и избытка пова-
ренной соли может вести к становлению ЭГ.
92
СОСТОЯНИЕ КЛЕТОЧНОЙ МЕМБРАНЫ;
ИОНЫ СА++ И ВОЗНИКНОВЕНИЕ ЭГ
Одной из таинственных особенностей ЭГ является то обстоя-
тельство, что только у части больных, страдающих этим
заболеванием, повышение АД можно связать с возрастанием кон-
центрации в крови прессорных веществ: норадреналина, АП, эндо-
генного дигиталисоподобного фактора (при гипергидратации). У
многих других больных далеко не всегда удается объяснить воз-
никновение АГ дефицитом депрессорных веществ, т. е. реноп-
ривным механизмом.
Естественно, что поиски возможных причин сужения рези-
стивных сосудов направили внимание исследователей к состоя-
нию самих гладкомышечных клеток этих сосудов. С теоретиче-
ских позиций, нарушения проницаемости мембраны гладкомы-
шечных сосудистых клеток могли бы способствовать увеличению
концентрации ионов Са++ в их миоплазме, усилению их сокра-
щения и сужению просвета резистивных сосудов.
По сообщению С. Н. Орлова (1992) — одного из создателей
мембранной теории происхождения ЭГ — впервые A. Jones
(1973) в статье «Altered ion transport in vascular smooth muscle»
указал на факт ускоренного обмена одновалентных ионов в глад-
ких мышцах артерий крыс наследственной гипертензивной ли-
нии. Эту находку затем подтвердили J. Atman и соавт. (1977),
J. Friedman (1979).
Поскольку точные количественные измерения кинетики
транспортных ионных систем в препаратах сосудистых гладких
мышц затруднены из-за ряда технических ограничений, в после-
дующем часто использовались альтернативные возможности: ис-
следование движения ионов в изолированных клетках крови
(тромбоциты, эритроциты, лимфоциты и др.) и в культуре сосу-
дистых гладкомышечных клеток (КСГК).
Повышенная проницаемость для одновалентных ионов в
клетках крови, связанная с изменениями активности ионных
переносчиков, была найдена в системах Na+—Na+-, Na+—Н+-
противотранспорта и Na+—К+, Na+—СГ-котранспорта (Пост-
нов Ю. В., Орлов С. Н., 1984; Orlow S. N. et al., 1992). В КСГК
Na+—Н+-обменная активность оказалась выше у гипертензив-
ных крыс (SHR) по сравнению с нормотензивными крысами
(WKY) (O’Donnell М., Owen N., 1991). Ка+-К+-2СГ-котранс-
93
порт изменялся, по данным ряда авторов, в меньшей степени и
не всегда однонаправленно (O’Donnell М. et al., 1988; Korigawa J.
et al., 1988). Противоречивость этих результатов могла зависеть
от особенностей культуры клеток, а также от влияния на них
ряда вазоактивных веществ. В 1992 г. S. Orlow и соавт. показали,
что и котранспорт Na+—К+—2СГ при АГ аномален как в базаль-
ных условиях, так и при воздействии АП. Эта система, обеспечи-
вающая трансмембранное перемещение ионов Na+, сцеплена с
движением одного или большого числа ионов и влияет на
Na+—Са++-обменный механизм, т. е. может способствовать на-
коплению ионов Са++ в гладкомышечных клетках.
В настоящее время имеется уже достаточно большое число
наблюдений, указывающих, что у крыс с наследственной спон-
танной АГ, а также у больных ЭГ внутриклеточная концентра-
ция ионов Са++ выше, чем у людей и животных с нормотензией.
Нарушения трансмембранных ионных токов ослабляют способ-
ность плазматической мембраны и мембран внутриклеточных
органелл удерживать ионы Са++, которые переходят в миоплаз-
му. Подобная ненормальность распространяется на кальциевый
насос (Са++—1^++-АТФазный насос), кальциевые каналы мем-
браны, уже упоминавшийся нами Na+—Са++-обменный меха-
низм, кальмодулин — белок, связывающий кальций (Ashida Т.
et al., 1991; Swales J., 1990; Dotniniczak A., Bohr D., 1990; Bing R.
et al., 1987; Meyer P., 1988).
В 1993 г. наш сотрудник К. В. Чурин изучал те же процессы в
тромбоцитах больных ЭГ. По мнению многих авторитетных ис-
следователей, тромбоциты являются активной структурой, по
своим биофизическим свойствам весьма напоминающей гладко-
мышечные клетки сосудов. С помощью флуоресцентных зондов
автор изучал распределение внутриклеточных ионов Са++ в
тромбоцитах больных ЭГ и здоровых людей как в покое, так и
при различных нагрузках. Были выведены кинетические кривые
связывания ионов Са++ с плазматической мембраной тромбоци-
тов и мембранами внутриклеточных органелл. Тромбоциты у ча-
сти больных ЭГ (не у всех!) отличались от тромбоцитов здоровых
людей более высоким содержанием ионов Са++ в мембранах, из
которых в ответ на различные стимулы в цитозоль высвобожда-
лось заметно большее количество ионов Са++, чем в контроле,
что должно существенно усиливать Са++-сигнал к активации
94
тромбоцитов — соответственно гладкомышечных клеток у боль-
ных ЭГ (Кушаковский М. С., Чурин К. В., 1993).
Как у крыс линии SHR, так и при ЭГ отмечаются ненормаль-
ности клеток структурного характера, проявляющиеся, в част-
ности, в повышении вязкости и ригидности эритроцитов, изме-
нениях ростовых регуляторных механизмов. Особенно показа-
тельно, что у крыс линии SHR выявляется увеличение размеров
и числа гладкомышечных клеток сосудов (гипертрофия и гипер-
плазия) (Owens G., Schwartz S., 1982). Эти данные подтверждают
старую концепцию В. Folkow (1980), согласно которой гипертро-
фия средней мышечной оболочки сосудов является важнейшим
элементом поддержания высокого ОПС и АД при генетической
АГ («структурная ауторегуляция»).
У крыс линии SHR плотность симпатических нервов, оказы-
вающих трофическое влияние на сосуды, хорошо коррелирует со
степенью сосудистой гипертрофии. Правда, периферическая
симпатэктомия только минимально тормозит процессы гипер-
трофии гладкомышечных сосудистых клеток. Вероятно, эти
клетки обладают врожденными особенностями, способствующи-
ми их развитию и гипертрофии, что не характерно для нормо-
тензивных крыс линии WKY. Кроме того, гладкомышечные
клетки крыс линии SHR имеют сниженную чувствительность к
ингибиторам фактора роста по сравнению с крысами WKY (Jaz-
zani R. et al., 1989; Adams A. et al., 1989; Saltis J., Bobik A., 1992).
Эти и многие другие факты легли в основу «мембранной тео-
рии» патогенеза ЭГ, разработанной преимущественно Ю. В. Пост-
новым и С. Н. Орловым в течение последних десятилетий. Ито-
говое изложение этой теории мы находим в статье Ю. В. Пост-
нова, опубликованной в № 8 «Кардиологии» за 1993 г.
Основу первичной АГ составляют, по его мнению, «распро-
страненные (т. е. не ограниченные одним типом клеток) наруше-
ния ионотранспортной функции и структуры плазматической
мембраны клеток, ведущие к изменению величины ряда кон-
стант, регулируемых плазматической мембраной» (в частности,
pH и Са++). Мембранные нарушения, вероятнее всего, по мне-
нию автора, имеют геномное происхождение и инициируются
фактором, влияние которого опосредуется через протоонкогены
клеточного генома. Сохранность специфической функции кле-
ток в этих условиях обеспечивается механизмом клеточной адап-
тации, обозначаемым Ю. В. Постновым как «клеточный ресе-
95
тинг». «Развитие клеточного ресетинга одновременно иниции-
рует изменение гормонально-нейроклеточных отношений, что
проявляется, в частности, усилением кортикоидной секреции
(гипертрофия надпочечников), активированием периферическо-
го звена симпатической нервной системы, феноменом гиперин-
сулинемии».
С точки зрения Ю. В. Постнова, «патогенетически значимым
следствием мембранных нарушений является образование в ци-
топлазме клеток повышенных (избыточных) концентраций свобод-
ного кальция (курсив мой. — М. К.) при физиологических нагруз-
ках на механизмы обеспечения кальциевого гомеостаза клеток».
С повышением концентрации свободного кальция в цитоплазме
автор связывает изменения сократительных свойств сосудистых
гладких мышц, а также возрастающее выделение нейромедиато-
ров в симпатических терминалях, снабжающих сосуды. «Увели-
чение внутриклеточной концентрации ионов Са++ и pH цито-
плазмы в совокупности является фактором, инициирующим
синтез ДНК, опосредуя ростовые влияния на клетку».
Как видно, Ю. В. Постнов в одном из последних изложений
своей гипотезы привлекает понятия молекулярной биологии,
учение о протоонкогенах, ростовых факторах, вводит новый тер-
мин «клеточный ресетинг». Это, конечно, придает его гипотезе
более современный вид, но, к сожалению, не лишает ее во мно-
гих случаях декларативности. Признавая известные достижения
автора и его коллег, их несомненный вклад в изучение патогене-
за ЭГ, я не могу не видеть, что в предлагаемой теории практи-
чески игнорируются новые факты о нарушениях центральных
механизмов регуляции АД у больных ЭГ и при эксперименталь-
ных АГ, о роли почечных симпатических нервов в регулирова-
нии реабсорбции натрия, о натрийуретическом факторе и эндо-
генном дигиталисоподобном веществе. Не делается даже попыт-
ки как-то адаптировать эти данные в новой теории, что очень ее
ослабляет. Теория, не охватывающая и не объясняющая все из-
вестные факты, не может считаться окончательно доказанной.
Кроме того, Ю. В. Постнов и его единомышленники повто-
ряют ошибки своих предшественников (вполне простительные
для последних, если учитывать уровень знаний того времени),
вновь выдвигая унитарную, монофакторную гипотезу происхож-
дения ЭГ, хотя неоднородность этого заболевания, особенно на
этапах патогенеза, теперь признается, кажется, уже почти всеми.
96
Примечательно, что С. Н. Орлов и его соавторы в статье, опуб-
ликованной в 1992 г. в J. Hypertension, значительно скромнее
формулируют свое заключение, указывая, что «изменения Са-го-
меостазиса, вероятно, играют роль в регуляции сосудистого то-
нуса и в патогенезе АГ». Нельзя не согласиться с такой точкой
зрения: накопление ионов Са++ в миоплазме гладкомышечных
сосудистых клеток рассматривается как обязательный элемент их
чрезмерного сокращения и сужения просвета сосудов. Однако
все еще не ясно, всегда ли это первичный процесс, связанный с
наследственным дефектом ионной проницаемости клеточных
мембран, либо вторичный, инициируемый избыточными симпа-
тическими нервными стимулами, воздействием АП или других
вазоактивных веществ, задержкой ионов Na+. Таким образом, с
нашей точки зрения, не может быть повышения ОПС и АД без
увеличения внутриклеточной концентрации ионов Са++, но это,
вероятно, далеко не всегда первопричина развития ЭГ. Ниже, в
клинической главе, я посвящу специальный раздел описанию
Са-зависимой (первичной) формы этого заболевания, существу-
ющей наряду с другими клинико-патогенетическими форма-
ми ЭГ.
В конце 1988 г. Ю. В. Постнов опубликовал статью, в кото-
рой он сделал попытку найти первопричины распространенных
нарушений ионотранспортной функции мембран клеток. При-
нимая внутриклеточное пространство организма как ограничен-
ную мембраной устойчивую неравновесную гемодинамическую
систему, Ю. В. Постнов полагает, что отклонения в скоростях
ионотранспортных систем могут вызываться невосполнением
термодинамического потенциала внутриклеточного пространства
в связи с хроническим дефицитом свободной энергии, которая
обеспечивает противоградиентный транспорт ионов. Как видно,
автор последовательно развивает свою концепцию, усматривая
причины нарушения транспорта ионов в глубинных процессах
изменения биоэнергетики клеток.
В этой концепции привлекают внимание три основных узла:
1) нарушения образования макроэргов в тканях, клетках; 2) из-
менения транспорта ионов через клеточную мембрану и клеточ-
ный ресетинг; 3) ослабление функции почечного баростата в
свете представлений А. Гайтона. Тем самым концепция, которую
многие годы развивал Ю. В. Постнов и его сотрудники, как бы
получает законченное изложение.
4 Зак 3207
97
Правда, более определенное мнение об этой гипотезе проис-
хождения ЭГ могли бы высказать теоретики и экспериментато-
ры, но они пока молчат. Во всяком случае, надо признать, что
это — единственная попытка выдвинуть в наше время новые идеи о
происхождении ЭГ.
РЕЗИСТЕНТНОСТЬ К ИНСУЛИНУ И ЭГ
Для ЭГ характерны различные метаболические отклонения,
вызываемые наследственными и приобретенными факторами.
Например, установлено, что особенности распределения жира у
больных ЭГ зависят от рецессивного аллеля и его гомозиготно-
сти, достоверно связанных с АГ (Santicci A., Ferri С., 1992).
Ожирение рассматривается как один из ве-
дущих факторов патогенеза ЭГ среди жителей
экономически развитых стран (Granger С., Scott D., 1994). В свя-
зи с этим гиперинсулинемия и повышенная резистентность тка-
ней к инсулину интенсивно изучаются в последние годы у боль-
ных ЭГ. Показано, в частности, что эти отклонения нередко
предшествуют появлению ЭГ в группе людей с генетиче-
ской склонностью к гипертензии (Crunfeld В. et al., 1994).
Впервые понятие «метаболического трисиндрома» появилось
в 1966 г. в работе J. Camus, объединившего у одних и тех же
больных три нарушения обмена веществ: гиперлипидемию, сахар-
ный диабет и подагру. Такое сочетание представлялось автору не
случайным, а определялось патогенетической общностью (Зи-
мин Ю. В., 1999). В последующем G. Reaven (1988) объединил
эти метаболические расстройства под названием «метаболиче-
ский синдром X», указав, что ключевую роль в его формировании
играет тканевая инсулинорезистентность с компенсаторной гипер-
инсулинемией и нарушением толерантности к глюкозе, гипер-
триглицеридемией, гипоальфахолестеринемией, ожирением по
мужскому типу и, наконец, артериальной гипертензией.
Такие обменные нарушения переплетаются в конгломерате,
который R. De Fronzo (1992) назвал «сложной метаболической
сетью или паутиной».
По данным Ю. В. Зимина (1999), ведущим компонентом сре-
ди этих нарушений является гиперсекреция инсулина, которая
98
тесно коррелирует со среднесуточным, дневным и ночным
уровнями систолического АД.
В. А. Алмазов, Я. В. Благосклонная, Е. В. Шляхто, В. И. Кра-
сильникова (1999), опубликовавшие монографию о сердечно-со-
судистом метаболическом синдроме, сделали вполне удачную
попытку объяснить патогенез АГ при этом синдроме.
Правда, особенности генетической связи между инсулином и
повышением АД пока четко не установлены, но хорошо извест-
но, что гиперинсулинемия, гипертензия и ожирение часто сочета-
ются (Ferranini D., De Fronso R., 1989). Неоднократно также де-
монстрировалось, что ЭГ сопровождается повышением уровня
инсулина в плазме даже при отсутствии ожирения и сахарного
диабета (Modan Н. et al., 1985). В общем, концентрация
инсулина, стимулирующего потребление
глюкозы всего тела, на 40% выше у боль-
ных ЭГ по сравнению с лицами, имеющими
нормальное АД.
АГ, сахарный диабет II типа, ожирение объединяет, как упо-
миналось, повышенная резистентность тканей к инсулину.
Этому «смертоносному квартету» — по выражению N. Kaplan
(1989) — в настоящее время придается все большее значение при
исследовании патогенеза ЭГ.
Напомним, что понятие «инсулиновая резистентность тка-
ней» означает такой дефект в метаболизме глюкозы, при кото-
ром биологическая реакция на инсулин ниже нормальной
(Endre Т., 1994). Ее причины и механизмы пока не ясны. Выска-
зывается предположение, что генетический дефект в клеточном
транспорте катионов может лежать в основе всех этих рас-
стройств, к чему склоняется Ю. В. Постнов (1994). Выдвигаются
и другие объяснения; например, у больных сахарным диабетом
понижена активность тканевого калликреина, что служит, по
мнению некоторых исследователей, причиной усиленной устой-
чивости тканей к инсулину.
Инсулиновая резистентность тканей ведет к гиперинсулине-
мии путем стимуляции 0-клеток поджелудочной железы. Между
тем сам по себе инсулин оказывает расширяющее воздействие на
сосуды скелетных мышц и на коронарные артерии. Длительное
внутривенное вливание инсулина не приводит к возрастанию АД
у собаки. У людей с инсулиномой и острым возрастанием уровня
99
инсулина АД не повышается. Следовательно, речь не может идти
о прямом его влиянии на резистивные сосуды.
Можно рассуждать лишь об опосредованных механизмах.
Один из них — усиление канальцевой реабсорбции натрия, сти-
мулируемое инсулином. Действительно, введение инсулина до-
стоверно понижает скорость выделения натрия с мочой как у ги-
пертензивных, так и у нормотензивных крыс. Имеются данные,
указывающие, что гиперинсулинемия, особенно у тучных людей,
играет роль в возникновении соль-чувствительной формы ЭГ;
правда, этот взгляд разделяется не всеми (Egan В. et al., 1994).
Другое объяснение: повышение под влиянием инсулина адре-
нергического тонуса (Hall L., 1990). В условиях покоя уровень
катехоламинов в плазме выше у тучных людей, чем у худощавых.
Правда, хроническое вливание инсулина не сопровождается уве-
личением плазменной концентрации катехоламинов.
Очевидно, что в этой сравнительно новой проблеме больше
вопросов, на которые пока нет ответа, но столь же ясно, что в
современных исследованиях этиологии и патогенеза ЭГ нельзя
игнорировать это направление. Надо помнить, что больные
ЭГ во многих случаях — это инсулинорези-
стентные и гиперинсулиновые люди по
сравнению с нормотониками (Endre Т. et al.,
1994).
РОЛЬ НАСЛЕДСТВЕННОСТИ В РАЗВИТИИ ЭГ
Выше мы неоднократно обращались к этой проблеме, в част-
ности в разделе о роли инсулина в генезе ЭГ. Известно, что
большинство исследователей ЭГ придерживаются известной
формулы: это заболевание — результат взаимодействия наслед-
ственных факторов, предрасполагающих к прогипертензивным
реакциям, и различных внешних воздействий, реализующих та-
кую возможность.
Клиническая литература, как и ежедневная врачебная прак-
тика, богаты указаниями на наследственный характер ЭГ. По на-
блюдениям С. Strong и J. Hunt (1980), у 81% больных ЭГ род-
ственники имели повышение АД. Наследственный фактор ка-
жется более выраженным у молодых больных, чем у пожилых. У
детей повышение АД наследственного характера проявляется
100
уже в 8—10-летнем возрасте; у них же можно обнаружить раннее
утолщение межжелудочковой перегородки в период систолы
(Stamler R., Stamler J., 1979; Mongeau J., 1987).
Описана высокая степень совпадения уровня АД среди моно-
зиготных (60%) и дизиготных (36%) близнецов (Лильин Е. Т.
и др., 1983).
Как подчеркивают А. Д. Минушкина и соавт. (2000), неуда-
чей окончились попытки связать развитие АГ с мутацией уни-
кального гена или группы генов. Исключение составляют две
редко встречающиеся формы АГ: первичный глюкокортикозави-
симый альдостеронизм, связанный с мутацией гена 11-Ь-гидро-
ксилазы (Finding J. et al., 1993), и синдром Лиддла (мутация
b-субъединицы натриевого канала эпителия почечного каналь-
ца — Chang Н., Fujita Т. (1996)).
Специальные генетические исследова-
ния пока четко не подтвердили доминант-
ную или рецессивную форму наследствен-
ной модели при ЭГ. Случаи систоло-диастолической ги-
пертензии слабо накапливаются в семьях (Lee Y. et al., 1976), и,
по-видимому, негенетические факторы сильнее воздействуют на
АД, чем генетические. Так, N. Iwai и соавт. (1994) сообщили, что
только от 20 до 40% вариаций АД в общей популяции можно
связать с генетическими факторами. Это подтвердили М. Zath-
rop, F. Subrich (1994).
С нашей точки зрения, следует различать: 1) условия (на-
следственные факторы), обеспечивающие развитие гипертензии
пограничного типа, поскольку только у 20—25% людей возника-
ет это состояние; 2) условия (наследственные факторы), способ-
ствующие переходу ПАГ в ЭГ (Волков В. С., Цикулин А. Е.,
1986). Напомним, что из числа лиц с ПАГ лишь 20—30% стано-
вятся истинными «гипертониками». При таком подходе легче от-
ветить на вопрос, почему при почти равных жизненных обстоя-
тельствах у одних людей развивается ПАГ, а у других это не слу-
чается. Появляются также более реальные возможности для вы-
яснения причин избирательной эволюции ПАГ в ЭГ либо
острого становления ЭГ без предшествующей фазы ПАГ.
Что касается наследственных факторов, предрасполагающих к
развитию ПАГ, то они могут иметь отношение к сфере цент-раль-
ной регуляции уровня АД («стрессорные гены»). Возможно, что у
людей, заболевших ПАГ, имеется чрезмерная акцентуация (!)
101
центральных нейрогуморальных разрядов даже при обычном
напряжении жизненных ситуаций. Можно также предполагать
(на это указывает вообще свойственная человеку и животным
широкая изменчивость биологических свойств), что у части лю-
дей имеется генетически предопределенное уменьшение выра-
ботки норадреналина в соответствующих нейронах головного
мозга или снижение чувствительности их аг-адренорецепторов.
В подобных условиях облегчается, под воздействием психоген-
ных факторов, возникновение норадреналин-дефицитной фор-
мы ЭГ (см. главу 2).
У других людей с самого начала выявляются наследственно
обусловленные избыточная чувствительность к поваренной соли
и повышенный солевой аппетит, что в конечном счете приводит
к формированию «солевой» (гипергидратационной) формы
ПАГ, примером которой может служить и ее климактерический
вариант.
Наконец, ПАГ может быть у некоторых людей следствием
сложных мембранных дефектов, приводящих сначала к неустой-
чивому накоплению ионов Са++ в гладкомышечных клетках ре-
зистивных сосудов с их преходящими спазмами.
Что же касается наследственных факторов, предрасполагаю-
щих к эволюции ПАГ в ЭГ, то их, по-видимому, следует искать в
отклонениях в интегральной системе регулирования АД и
прежде всего в особенностях строения и функции почки — в ее
отделах, обеспечивающих как прессорные, так и депрессорные
реакции (медулла) (Шулутко Б. И., 1994; Dahl L. et al., 1974;
de Wardener H., 1990). Имеются также данные, указывающие,
что почки с самого начала могут вовлекаться в становление АГ, в
частности у больных с солевой (гипергидратационной) фор-
мой ЭГ.
Подведем итоги: истинная сущность наследст-
венной предрасположенности к заболева-
нию эссенциальной гипертензией пока
остается неизвестной; вероятно, она носит
полигенный характер с преобладающей ак-
тивностью различных генов у отдельных
больных.
Для ЭГ характерен ряд особенностей, указывающих на ее по-
лигенный характер наследования. Во-первых, распространен-
ность заболевания в общей популяции достигает 15—20%, что
102
значительно превышает распространенность так называемых
классических генетических болезней, наследуемых по менделев-
скому типу. Во-вторых, начало ЭГ относится, в основном, к 4—
5 десятилетию жизни человека, что также скорее указывает на
неменделевский тип наследования (Постнов Ю. В., 1998).
* * *
Итак, насколько мне позволили возможности, я рассмотрел
сущность современных гипотез об этиологии и патогенезе ЭГ.
Сложность дисрегуляторных процессов, их многообразие и взаи-
мопересечение, уравновешивание противоположных эффектов и
тенденций должны быть очевидными читателю. «Прошли те вре-
мена, — подчеркивал Ф. Фольгард (1926), — когда проблема ги-
пертонии казалась простой. Напротив, чем больше вопрос этот
изучается, тем сложнее он становится». С ним перекликается
уже в наши дни Б. Фолков (1984): «Проблема не так проста, как
мы думали, но мы не знаем, сколь много мы знаем».
Создается впечатление, что ближе к истине была одна из
ранних гипотез, предложенная для объяснения происхождения
этого заболевания, — так называемая «мозаичная тео-
рия» I. Page, в которой патогенез ЭГ сравнивался со слож-
ной мозаикой, с изменяющейся, как в калейдоскопе, многоцвет-
ной картиной (рис. 8). Своей работой «Мозаичная теория арте-
риальной гипертензии» I. Page продемонстрировал тесную взаи-
мосвязь и взаимодействие различных механизмов, составляющих
интегральную систему регуляции АД. Эти исследования уже в
наше время все больше привлекают к себе внимание кардиоло-
гов-клиницистов и экспериментаторов (Арабидзе Г. Г., 1993).
Действительно, примечательной особенностью ЭГ является,
как уже упоминалось, то обстоятельство, что ее начальные, пус-
ковые механизмы по мере развития болезни как бы сходят со сцены,
становятся едва видимыми, и то, что мы находим у больных со
сложившимся заболеванием — это реликты уже отзвучавших
процессов, остатки когда-то активных механизмов, «следы ме-
теоритов на поверхности планеты».
Признавая обязательную и значительную роль симпатиче-
ской нервной системы и почек, я придерживаюсь
взгляда о полиэтиологичности и полипато-
генетичности ЭГ. Этот путь, возможно, не сулит в бли-
жайшие годы полной ясности, но он улучшает возможности ин-
103
Рис. 8. «Восьмиугольник» И. Пейджа,
характеризующий «мозаичную теорию» происхождения ЭГ (ГБ)
дивидуализированного лечения больных, что само по себе уже
немало.
ЭГ представляется мне одновременно
«болезнью регуляции» и «болезнью (фор-
мой) компенсации» (приспособления) (Куша-
ковский М. С., 1983).
Эта последняя ее особенность часто упускается из виду; меж-
ду тем она ясно прослеживается в гипотезе А. Гайтона и в «вось-
миугольнике» И. Пейджа, в центре которого поставлен уровень
перфузии тканей (рис. 8). Еще раньше, в 40-х годах, Н. Н. Са-
вицкий тоже высказывал предположение, что повышение АД
может служить некоей компенсацией тканевого кровотока, нару-
шенного в результате дисфункции кроговского механизма после-
довательного открытия и закрытия капилляров, обеспечивающих
снабжение тканей кислородом.
ГЛАВА 3
НОРМАТИВЫ
АРТЕРИАЛЬНОГО ДАВЛЕНИЯ;
ЕГО ИЗМЕНЧИВОСТЬ;
НЕКОТОРЫЕ ДРУГИЕ ОСОБЕННОСТИ
ПРИ НОРМОТЕНЗИИ И ГИПЕРТЕНЗИИ.
ПОГРАНИЧНАЯ АРТЕРИАЛЬНАЯ
ГИПЕРТЕНЗИЯ
Вопрос о том, какой уровень АД следует считать физиологи-
ческим, более сложен, чем это может показаться на первый
взгляд. Известный английский клиницист G. Pickering (1978),
например, утверждал, что АД у человека, подобно другим физи-
ческим характеристикам (масса тела, рост и др.), подвержено ин-
дивидуальным количественным отклонениям от средних вели-
чин нормы. Вот как об этом пишет Th. Pickering (1982), сын уче-
ного: «Отец предполагал, что уровень АД распределяется посте-
пенно в популяции с отклонением к высокой части кривой
распределения (логарифмическое гауссово распределение) и что
всякое разделение между нормотензией и гипертензией спорно».
Иными словами, повышенные величины АД плавно переходят
друг в друга, поэтому гипертензия — это, скорее, понятие коли-
чественное, чем качественное.
Хотя такая точка зрения имеет сторонников и в наше время,
сомнения в существовании линии раздела между нормотензией
и гипертензией утратили свое значение. В пользу того, что АГ
является качественно новым состоянием, свидетельствуют мно-
гие факты. Я упомяну только два из них. Во-первых, амбулатор-
ное суточное мониторирование АД показало, что имеются суще-
ственные различия в «поведении» АД у нормотоников и гиперто-
ников. Во-вторых, были получены доказательства полезности
и эффективности лечения лиц, имевших даже небольшие
подъемы АД, т. е. лечения заболевания.
Очевидно, что постоянство внутренней среды организма,
важной составляющей которой является АД, есть условие нор-
мальной жизнедеятельности и работоспособности здорового че-
105
ловека. В практической работе врача, в научно-эксперименталь-
ных исследованиях невозможно обойтись без согласованных
нормативов АД. Эти нормативы получены как при разовых из-
мерениях АД, так и при регистрации суточных кривых АД (мо-
ниторирование), отражающих его физиологическую изменчи-
вость, циркадные ритмы.
Существуют два подхода при определении разовой нормы АД
для людей различного возраста. Первый из них, наиболее рас-
пространенный, предусматривает массовые однократные измере-
ния так называемого обычного, или случайного, АД, т. е. давле-
ния, которое устанавливается у человека в течение дня в реаль-
ных условиях жизни. При этом допускается, что все многообраз-
ные воздействия на АД у отдельных людей сглаживаются,
уравновешиваются в популяции, т. е. используется статистиче-
ский принцип усреднения индивидуальных величин. АД измеря-
ют аускультативным методом в положении обследуемого сидя, в
спокойной обстановке, после пятиминутного отдыха.
Наиболее широкие «поиски» нормативов обычного АД были
предприняты в 50-х годах в Ленинграде (Волынский 3. М., Иса-
ков И. И., Яковлев С. И., Кейзер С. А.) и в Москве (Федоро-
ва Е. Н.). В 1974 г. массовые осмотры населения Ленинграда
с измерением АД повторили ученики 3. М. Волынского —
Е. Е. Гогин, А. Н. Сененко, Е. И. Тюрин. Нормативы обычного
АД, полученные этими исследователями, указаны в табл. 1.
Таблица 1
Нормативы обычного АД (звуковой метод)
Возраст, годы АД, мм рт. ст.
17-18 129/79
19-39 134/84
40-49 139/84
50-59 144/89
60 лет и старше 149/89 или более мягкая норма: 160-170/89
106
Как видно, у практически здорового челове-
ка средних лет и в более старшей возраст-
ной группе уровень диастолического дав-
ления не должен превышать 85—90 мм рт. ст. По
поводу «нормы» систолического давления для лиц старшего и
пожилого возраста столь определенно высказаться труднее. Этот
вопрос заслуживает более подробного рассмотрения. Основыва-
ясь на результатах массовых измерений АД, 3. М. Волынский и
его сотрудники нашли возможным характеризовать физиологи-
ческую зависимость АД от возраста человека в виде математиче-
ских формул так называемого «идеального» давления: систоличе-
ское давление - 102 + (0,6 • возраст), диастолическое давление =
= 63 + (0,4 • возраст). Это значит, что у здорового человека
70 лет АД должно равняться 144/90 мм рт. ст., что, практически,
соответствует нормативам, приведенным в табл. 1. По материа-
лам Д. Ф. Чеботарева (1977) из Киевского института геронтоло-
гии, средняя величина АД, измеренного у 24 823 лиц в возрасте
80 лет и старше, составила 153/78 мм рт. ст., у 9% обследованных
этой группы величины АД не превышали 110/70 мм рт. ст.
Между тем повседневные наблюдения показывают, что у
многих людей по мере их старения систолическое давление воз-
растает выше указанного уровня. Не столь уж редко у здоровых в
отношении сердечно-сосудистой системы лиц в возрасте 65—
70 лет обычное систолическое давление достигает величин по-
рядка 160—170 мм рт. ст. Такое повышение давления эти люди
не ощущают, они не нуждаются в гипотензивных препаратах;
это давление для них можно рассматривать как относительно
нормальное.
Надо учитывать, что практически у всех людей, начиная с
40—45 лет, происходит прирост систолического давления на 3—
6 мм рт. ст. за 1 год. У мужчин этот процесс происходит посте-
пенно и равномерно; у женщин после менопаузы отмечается бо-
лее острое возрастание систолического давления, например, от
136 до 170 мм рт. ст. (до менопаузы систолическое давление у
женщин на 1—5 мм рт. ст. ниже, чем у мужчин).
Что же касается диастолического давления, то его сравни-
тельно небольшой прирост обычно прекращается у человека, до-
стигшего 60—65-летнего возраста («плато»); после 60 лет оно на-
чинает понижаться до 70—80 мм рт. ст., что приводит к увеличе-
нию пульсового давления (амплитуда) до 90—100 мм рт. ст.
107
Таблица 2
Тахоосциллографические нормативы артериального давления
(метод Савицкого)
Возраст, годы АД, мм рт. ст.
диастоли- ческое среднее гемодина- мическое боковое систоличе- ское конечное систоличе- ское ударное
17-18 65+3 77+3 94+4 117+4 23+2
19-39 68+2 82+1 104+3 123+2 19+2
40-49. 73+2 85+1 112+2 130+2 18+2
50-59 77+1 92+1 122+1 136+2 14+1
60-69 78+1 95+1 124+1 137+2 13+3
70-79 76+1 93+1 120+2 138+2 18+1
Примечание. Данные для лиц в возрасте 17—18 лет получены моей сотрудни-
цей М. А. Шульгиной (1975); для лиц от 50 до 79 лет — К. А. Морозовым (1965).
Итак, у 65—70-летних людей, не страдающих АГ, мы нередко
находим величины АД порядка 160—170/70—85 мм рт. ст., что
отражает практически почти неизбежный процесс возрастного
уплотнения аорты и крупных артерий эластического типа. Надо
учитывать, что с возрастом происходит утолщение и уплотнение
стенки плечевой артерии. Поэтому требуется более высокий
уровень давления в манжете для достижения полной компрессии
ригидной артерии, что приводит к ложному повышению АД
(«феномен псевдогипертензии»).
Следует хотя бы кратко обсудить вопрос о нормативах АД
у детей и подростков, чему в 80—90-х годах были посвящены
солидные разработки Р. А. Калюжной (1980), В. С. Приходько
и соавт. (1980) и, особенно, В. П. Медведева и соавт. (1988).
Основываясь на этих данных, я могу указать, что у под-
ростков 14—15 лет, имеющих нормальное физическое разви-
тие, обычное систолическое давление не превышает 120—
125 мм рт. ст., диастолическое давление — 65—69 мм рт. ст.;
108
у подростков 16 лет нормальное АД обычно соответствует уров-
ню 125—129/74 мм рт. ст.
В условиях основного обмена, т. е. после ночного сна, до
приема пищи и лекарств, измеряют так называемое базальное
АД. Для этого используют как звуковой метод Н. С. Короткова,
так и тахоосциллографический метод Н. Н. Савицкого. Норма-
тивы базального АД, полученные тахоосциллографическим мето-
дом, представлены в табл. 2.
Как и следовало ожидать, величины (нормативы) базального
АД ниже обычного (случайного).
МОНИТОРНОЕ (СУТОЧНОЕ) ИЗМЕРЕНИЕ АД
Суточное мониторирование АД было предложено более
30 лет тому назад (Hinman J.,1964). Однако оно медленно входи-
ло в клиническую практику, главным образом из-за технических
проблем. В настоящее время уже создано немало вариантов
устройств, в которых используются как аускультативный, так и
осциллометрический методы измерения АД, правда, и сегодня
не все предлагаемые модели отличаются надежностью и высокой
точностью.
Обычно аппараты регистрируют величины систолического и
среднего АД, из которых рассчитывается величина диастоличе-
ского АД (Петров В. И., Недогода С. В., Тихонов В. П., 1997;
Рогоза В. И. и др., 1997; Горбунов В. М., 1977; Шулутко Б. И.,
2001). АД регистрируется с интервалами 15 мин в период бодр-
ствования и 30 мин — в период сна. АГ диагностируют при сред-
несуточном АД>135/85 мм, среднедневном — >140/90 мм, сред-
неночном — >125/75 мм рт. ст. (рис. 9).
В качестве критериев АГ используются различные показате-
ли, в частности: а) общая оценка циркадной кривой АД, ко-
торую сравнивают с кривой АД у нормотоников; б) среднее ноч-
ное и среднее дневное АД; в) «нагрузка давлением», т. е. про-
цент измерений АД, когда систолическое давление превышает
140 мм рт. ст., а диастолическое — 90 мм рт. ст.; г) вариабель-
ность АД, т. е. колебания его величин, рассчитанная как стан-
дартное отклонение от средней за определенный отрезок време-
ни; д) степень ночного снижения АД; е) величина и скорость ут-
реннего (предутреннего) подъема АД и т. д.
109
(a)
Рис. 9. Мониторирование уровня АД в амбулаторных условиях: измерения
каждые 15 мин в течение 24 ч; SBP — систолическое; DBP — диастолическое
давление в мм рт. ст. (по X. Chanudet и соавт., 1992)
В кардиологической литературе принято выделять различные
типы кривых АД и соответственно больных ЭГ, в зависимости от
изменений у них АД в течение ночи. Для количественной оцен-
ки рассчитывают степень ночного снижения АД:
_____ АДдень АД НОЧЬ
СНСАД = ---------------------х 100%,
АДдень
где АДдень и АДночь — средние величины систолического (или
диастолического) АД за дневной и ночной периоды.
ПО
Больных АГ классифицируют по величине СНСАД:
a) dippers, или дипперы — больные, у которых ночное сниже-
ние АД происходит как у нормотоников, т. е. показатель СНСАД
понижается на 10—20%; таких больных ЭГ от 52 до 82%;
б) non-dippers, или нон-дипперы — больные, у которых ночное
снижение АД недостаточное: СНСАД понижается всего на
0—10%; таких больных ЭГ от 10 до 26%;
в) over-dippers, или гипер-дипперы — больные, у которых но-
чью наблюдается чрезмерное снижение АД; СНСАД >20%; таких
больных ЭГ около 14%;
г) night-peakers, или найт-пиккеры — больные, у которых в
ночное время АД повышается; их около 3%.
Можно, конечно, дискутировать по поводу этой терминоло-
гии, но она принята во всем мире и несомненно имеет практиче-
ское значение. Так, оптимальной является величина СНСАД у
так называемых «дипперов», у них циркадный ритм АД близок к
тому, что бывает у здоровых людей, или нормотоников.
У «нон-дипперов» выше риск развития мозгового инсульта и
в среднем больше масса миокарда, чем у «дипперов» (Вол-
ков В. С., Мазур Е. С., 2000; O’Brien Е. et al., 1988; Verdochia Р.,
1990; Shimada К. et al., 1992). «Нон-дипперы» и «найт-пиккеры»
чаще встречаются среди больных с симптоматическими АГ, вы-
званными эндокринными заболеваниями, а также у больных с
реноваскулярной АГ, хронической почечной недостаточностью,
при токсикозе беременности (Горбунов Б. М., Метелица В. И.,
Дуда С. Г. и др., 1999; Mancia G. et al., 1996). Согласно
сообщению Р. Verdochia и соавт. (1991), профиль АД типа non-
dippers встречается у 8% больных с ЭГ. И. М. Воронин и соавт.
(2001) привлекают внимание к патологическим колебаниям
ночного АД, связанным с обструктивными нарушениями
дыхания во время сна.
По мнению Б. М. Горбунова и соавт. (1999), чрезмерное сни-
жение АД в ночное время, наблюдающееся у «гипер-дипперов»,
тоже не всегда и не вполне благоприятно в прогностическом от-
ношении. Авторы основываются на результатах недавно прове-
денного исследования больных 70 лет, которые относились к
группе «гипер-дипперов», страдавших ЭГ. Частота бессимптом-
ных ишемических поражений мозга у них оказалась более высо-
кой, чем в группе «нон-дипперов».
Ш
К. Karia и соавт. (1996) полагают, что недостаточная величи-
на СНСАД у «нон-дипперов», страдающих ЭГ, порождает пора-
жение органов-мишеней, тогда как слишком большая величина
СНСАД у «гипер-дипперов» чревата сосудистыми поражениями
мозга ишемической природы. Ряд авторов утверждают, что ноч-
ные величины АД лучше, чем дневные, коррелируют с частотой
возникновения осложнений ЭГ, что еще раз подчеркивает важ-
ность суточных измерений АД (Хирманов В. Н. и др. 1996; Ко-
шелева О. В., 1998).
Следует еще раз обратить внимание на то, что физиологи-
ческие циркадные колебания АД утрачиваются при распростра-
ненном атеросклерозе мозговых сосудов, а также у больных
со злокачественной АГ, при феохромоцитоме; у больных, страда-
ющих фибрилляцией предсердий, измерения не отличаются
достоверностью (Шулутко Б. И., 2001).
Особое внимание уделяется утренним (предутренним) подъ-
емам АД, которые отражают происходящую в это время суток
активацию симпатической нервной активности (Dodt С. et al.,
1997; Кобалава Ж. Д., Котовская Ю. В., Моисеев В. С., 1999).
Эти факторы рассматриваются в качестве триггера сердечно-со-
судистых осложнений (Toiler G. et al., 1992). В настоящее время
можно считать доказанным, что начало острого инфаркта мио-
карда и инсульта имеет определенную цикличность в течение су-
ток с пиком в часы пробуждения от сна (Коссо М. et al., 1987;
Willich S. et al., 1987). По данным Ж. Д. Кобалавы и соавт.
(1999), для более полной характеристики утренних подъемов АД
важен расчет скорости возрастания давления.
В заключение я считаю нужным подчеркнуть, что предлагае-
мые границы ночного снижения АД от 10 до 20% имеют ограни-
ченную воспроизводимость, на что обратили внимание ряд кли-
ницистов. Например, известно, что до 40% больных АГ при по-
вторном мониторировании АД «переходят» из группы «нон-дип-
перов» в группу «дипперов» и наоборот (Mancia G. et al., 1996).
На величину СНСАД влияют: глубина ночного сна, различия
в уровне физической активности обследуемых в разные дни,
наконец, погрешности в измерении АД (Горбунов В. Н. и др.,
1999). Между тем только воспроизводимые результаты суточ-
ного мониторирования АД имеют прогностическое значение
в отношении поражения органов-мишеней (Palantini М. et al.,
1999).
112
Суточное мониторирование АД подтвердило, что больные ЭГ
более склонны к подъемам АД при умственном напряжении,
ментальном стрессе.
Как уже упоминалось, при анализе величин АД следует учи-
тывать его суточные колебания, которые у здоровых людей и
у части больных ЭГ имеют одинаковую направленность, но
не совпадают количественно. У тех и других АД выше в после-
обеденное время, чем до полудня: примерно на 15 мм рт. ст. —
у здоровых людей и на 50 мм рт. ст. и больше — у больных ЭГ.
Пик АД в течение дня отмечается к 18 ч, наиболее низкое давле-
ние обычно регистрируется в 3 ч ночи. Даже при фиксированной
АГ в это время АД понижается иногда до 100 мм рт. ст. (систо-
лическое). В общем, разница между самыми высокими и низки-
ми величинами систолического давления в течение суток у здо-
ровых людей редко превышает 33 мм, а диастолического —
10 мм рт. ст. При ЭГ эти различия выражены заметно резче.
Очевидно, что результаты измерения АД в разные дни и в разное
время могут не совпадать не только у больных ЭГ, но и у здоро-
вых людей (Ильюткин Г. Н., Кушаковский М. С., 1980).
Прием пищи сопровождается повышением АД у нормотони-
ков на 10—15 мм, а у некоторых больных ЭГ — даже на
50 мм рт. ст. и больше. Продолжительное (ежедневное) питье
кофе тоже сопровождается подъемами АД.
Что касается половых различий, то можно указать, что до пе-
риода полового созревания АД примерно одинаково у юношей и
девушек. В последующем оно выше у мужчин, чем у женщин.
Это соотношение сохраняется до периода климактерия у жен-
щин, когда АД начинает преобладать у них. АД повышается
у здоровых женщин во время нормально протекающей беремен-
ности (примерно на 15—20 мм рт. ст.) и при переходе от фолли-
кулярной фазы менструального цикла в фазу желтого тела.
Способствуют повышению АД переполнение мочевого пузы-
ря, ощущение боли и холода. Часть больных ЭГ реагируют прес-
сорной реакцией на повышение температуры воздуха, что мало-
характерно для больных, страдающих гипертензивной формой
хронического гломерулонефрита.
Труднее поддаются учету влияния на АД климата, колебаний
атмосферного давления, солнечной активности. К сожалению, в
литературе на этот счет имеются в основном разрозненные, не-
систематизированные сообщения, иногда спекулятивного харак-
113
тера. Представления о метеочувствительности многих людей, по-
видимому, преувеличены; эта проблема скорее психоневрологиче-
ская, чем кардиологическая. Столь же неясен вопрос о влиянии
на больных ЭГ запахов цветов и деревьев. Некоторые жители
Санкт-Петербурга убеждены, что смолистые запахи сосны и ели
на Карельском перешейке вызывают у них повышение АД и дру-
гие сердечно-сосудистые расстройства. Научных доказательств
этого факта мы не встретили, хотя, разумеется, мы не исключаем
возможности индивидуальных реакций либо идиосинкразии. Все
же не следует отказываться от лечения в весьма благоприятной
климатической курортной зоне из-за обывательских предубеж-
дений.
Необходимо помнить о различных неточностях методическо-
го порядка, допускаемых при измерениях АД. У нормотоников
погрешность звукового метода составляет 6—8 мм рт. ст. Допол-
нительными источниками ошибок могут быть неправильное по-
ложение руки больного, неплотное наложение манжеты (склад-
ки, вздутия, неровности) или неподходящая для конкретного
больного манжета. Ее резиновый резервуар должен иметь такую
длину (около 30—40 см), чтобы по меньшей мере однократно
полностью плотно окружать плечо или бедро. Для измерения АД
на плече ширина резинового резервуара должна быть не меньше
12—14 см, на бедре — не менее 18—20 см.
На показатели АД оказывает влияние прессорный рефлекс
при сжатии плеча или бедра манжетой, а также волнение боль-
ного при вызове к врачу («АГ белых халатов»), У здоровых людей
такие рефлекторные или эмоциональные подъемы АД обычно не
превышают 5—7 мм рт. ст.; они явно выше у невротических
субъектов, а у больных ЭГ достигают 15—25 мм рт. ст. Чтобы не
допустить ошибки, следует в каждом случае измерять АД трижды
с короткими интервалами и считать истинными самые низкие
величины. Правда, встречаются больные, у которых цифра АД с
каждым следующим измерением не снижается, а возрастает.
Особенно тщательно надо определять момент появления и
исчезновения тонов Короткова у больных с нарушениями сер-
дечного ритма и проводимости. Например, пауза в сокращениях
сердца, вызванная дисфункцией СА узла, АВ блокадой 2-й сте-
пени или желудочковой экстрасистолой, может ошибочно вос-
приниматься как исчезновение коротковских тонов, хотя позже
они возобновляются. Следовательно, у больного уровень диасто-
114
лического давления будет ошибочно измерен как более высокий,
чем в действительности.
Здесь уместно рассмотреть вопрос о точности измерения диа-
столического давления аускультативным методом. Момент ис-
чезновения тонов (5-я фаза Короткова) в среднем на 5 мм рт. ст.
ниже величины диастолического давления, измеренного прямым
методом (артериопункция). Эта разница еще больше возрастает у
лиц, имеющих увеличенный МО сердца. Момент резкого ослаб-
ления тонов (4-я фаза Короткова) часто на 7—10 мм рт. ст. выше
величины внутриартериального диастолического давления. Поэ-
тому при значительном разрыве между 4-й и 5-й фазами корот-
ковских тонов лучше учитывать оба показателя диастолического
давления.
Надо помнить, что между величинами АД, измеренными зву-
ковым и прямым методами, отмечаются расхождения как в одну,
так и в другую сторону (Савицкий Н. Н., 1964). Так, при сопо-
ставлении результатов у 25 больных ЭГ только в 9 случаях было
получено совпадение величин систолического давления; показа-
тели диастолического давления совпали в 11 случаях, в осталь-
ных 14 случаях величины, полученные звуковым методом, были
выше, чем при артериопункции (по-видимому, чаще использо-
вался для оценки момент резкого ослабления, а не исчезновения
тонов).
При первом знакомстве с больным ЭГ целесообразно изме-
рить АД на обеих руках. Если не находят существенной асиммет-
рии АД, то в последующем можно ограничиться измерением
давления на правой (рабочей) руке у правшей и на левой руке у
левшей.
В заключение следует еще раз упомянуть о явлении, извест-
ном в литературе как «псевдогипертензия». Имеются в виду не
технические погрешности, допускаемые при измерении АД, а
ложная гипертензия, выявляемая у ряда больных, чаще пожилых
людей, имеющих резкое атеросклеротическое (кальцинирован-
ное) уплотнение стенок артерий. У этих же лиц определяется
симптом Ослера, т. е. продолжает пальпироваться лучевая арте-
рия, несмотря на ее полное пережатие. Для компрессии такой
артерии требуется давление в манжете, превышающее уровень
внутрисосудистого систолического давления.
115
ПОГРАНИЧНАЯ АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
Говоря о трудностях в распознавании ГБ, Г. Ф. Ланг подчер-
кивал, что «прежде всего они могут возникать при решении во-
проса, имеется ли уже ГБ в случаях, когда нет стойкого повыше-
ния кровяного давления и наблюдаются только кратковремен-
ные его подъемы или когда повышенное давление стойкое, но
очень небольшое...» Действительно, пациент, у которого перио-
дически отмечаются небольшие повышения АД, а в другое время
оно в пределах нормы, труден для врачебной оценки. Страдает
ли такой человек ЭГ?
В литературе при трактовке этой разновидности АГ можно
встретить различные оценки. Ряд клиницистов склонны рас-
сматривать такие преходящие и умеренные подъемы АД лишь
как проявления гиперреактивности или чрезмерной эмоциональ-
ности своих пациентов. Другие терапевты придают этому явле-
нию более серьезное значение, интерпретируя его как предги-
пертоническое состояние. Некоторые, наиболее осторожные
врачи, относят подобные случаи к начальной стадии уже сло-
жившейся ЭГ.
Все еще сохраняются различия в терминологии, хотя они
постепенно сглаживаются. Имеет смысл упомянуть некоторые
наименования, которыми пользуются врачи для обозначения
этих состояний: лабильная АГ, мягкая АГ, транзиторная АГ,
ранняя АГ, ПАГ, сосудистая вегетодистония, предгипертония,
ГБ IA стадии.
Как справедливо заметил в свое время И. К. Шхвацабая
(1972), «хотя этих больных объединяет фактор преходящей ги-
пертензии, они все же далеко не однородны по возрасту, по осо-
бенностям клинической симптоматики, а возможно, и по сущ-
ности «заболевания».
Неприемлем термин «предгипертензия» (предгипертония).
По аналогии с понятиями «предрак» и «преддиабет» его можно
воспринять как признание того, что существует очень высокая
вероятность перехода этих форм в ЭГ либо что они являются
этапом в развитии болезни.
Однако эпидемиологические разработки, осуществленные в
разных странах, не дают основания для столь категоричных вы-
водов. Хотя степень риска возникновения ЭГ у лиц с погранич-
ными формами гипертензии в 2—3 раза, а по отдельным сообще-
116
ниям, даже в 5 раз выше, чем у людей с нормальным АД, абсо-
лютный уровень такого риска, как показывают 10—20-летние и
даже более длительные наблюдения, не столь уж велик. К такому
заключению мы пришли еще в 50-х годах (Кушаковский М. С.,
1958). Под нашим наблюдением находились 200 мужчин в возра-
сте 19—29 лет; АД у них периодически выходило за пределы
135/85 мм рт. ст. Мы тщательно исключали из исследования лиц
со вторичными АГ. Уровень обычного давления контролировали
2—3 раза в неделю в течение 3—5 лет. Можно было видеть три
варианта эволюции юношеской ПАГ: 1) стойкую нормализацию
АД; 2) сохранение status quo; 3) более или менее выраженную
тенденцию к повышению и стабилизации АД, т. е. намечавший-
ся переход ПАГ в ЭГ. Последний вариант встретился у 20% мо-
лодых людей.
Такую же цифру приводят И. Видимски, И. Пржеровский
(1980), повторно, спустя 20 лет, обследовавшие группу ювениль-
ных гипертоников. Недавно Л. А. Соколова (1994) (сотрудница
В. А. Алмазова) вновь отметила, что эволюция ПАГ в ЭГ про-
исходит примерно у 30% больных. Заслуживает внимания и
одна американская статистика: в группе мужчин, которые в воз-
расте 15—29 лет имели нормальное АД, ЭГ через 15—20 лет была
выявлена в 6,1%; в группе мужчин такого же возраста, но с ис-
ходным уровнем АД 140/90—154/94 мм рт. ст. ЭГ возникла
в 10,8%.
В современной кардиологической литературе для обозначе-
ния этих небольших и неустойчивых подъемов АД используется
термин «пограничная артериальная гипертензия» (ПАГ), по-ви-
димому, впервые четко примененный S. Julius. Этот термин:
«borderline hypertension», «Grenzwerthypertonie», «1’hypertension
limite» поддерживается ВОЗ.
Выделение лиц с пограничным типом АГ было вызвано как
эпидемиологическими, так и клиническими соображениями. Во-
первых, изменились наши представления о нормативах АД. Во-
вторых, стало ясно, что лиц с ПАГ нельзя безоговорочно отожде-
ствлять с больными ЭГ — это «группа относительного риска»
развития в последующем ЭГ: только около 20—30% лиц с ПАГ
имеют вероятность в будущем стать «гипертониками». Наконец,
в-третьих, лечение лиц с ПАГ, в отличие от больных ЭГ, должно
носить ограниченный характер с преимущественным примене-
нием нефармакологических методов. Недавно этой проблеме
117
была посвящена специальная монография, написанная В. А. Ал-
мазовым, Е. В. Шляхто, Л. А. Соколовой (1993).
Необходимо дать четкое определение понятия ПАГ. Погранич-
ной артериальной гипертензией называют такую разновидность
первичной, по своей сути, АГ, при которой систолическое и
(или) диастолическое давление спонтанно колеблется в разное
время от нормальных величин до уровня «пограничной зоны».
Согласно старым рекомендациям комитета экспертов ВОЗ, зо-
ной пограничной гипертензии для взрослых людей считаются
колебания АД от 140/90 до 159/94 мм рт. ст. Следовательно, раз-
личают два родственных, но не идентичных состояния: ПАГ и
ЭГ. При таком подходе ведущее значение приобретают принци-
пы распознавания ПАГ. В свое время я рекомендовал соответст-
вующую методику и придерживаюсь ее и сейчас: у лиц со склон-
ностью к небольшим и преходящим подъемам АД производят
его измерения в спокойной обстановке, в положении сидя,
3 раза с интервалами в неделю. Заключение о ПАГ становится
реальным, если в одном из трех амбулаторных измерений диа-
столическое давление ниже 90 мм рт. ст., а в двух других оно ко-
леблется в пределах 90—94 мм рт. ст., либо если систолическое
давление спорадически превышает возрастную норму, но не вы-
ходит за границу 159 мм рт. ст. При закрепившейся ЭГ все три
отсчета диастолического давления будут выше 94 мм, а систоли-
ческого давления — выше 159 мм рт. ст. Если же больной с ана-
мнестическими указаниями на повышение АД «пограничного
типа» осматривается врачом в период нормотензии, то такого че-
ловека от истинного «нормотоника» часто отличает подъем диа-
столического давления до 90—94 мм рт. ст. при проведении кли-
ноортостатической пробы или пробы с дозированной физиче-
ской нагрузкой.
Чтобы не впасть в ошибку, врачу следует ознакомиться со
всеми имеющимися у пациента данными об уровне АД: если оно
прежде неоднократно выходило за пределы «пограничной зоны»,
то не может быть и речи о ПАГ.
Полезно посоветовать своему пациенту проследить за коле-
баниями АД на дому в разное время дня. Измерения могут про-
изводить сами больные или их родственники, обученные мето-
дике. Нетрудно убедиться, что «домашние» цифры давления час-
то ниже, чем регистрируемые в поликлинике или в другом ле-
чебном учреждении («АГ белых халатов»). Однако у 30% лиц
118
с ПАГ уровень АД и в домашних условиях превышает на две
сигмы средние величины давления у здоровых лиц того же воз-
раста.
В 1977 г., предложив ввести в нашу кардиологическую прак-
тику представление о ПАГ, я указал, что заключение об этой
разновидности АГ можно считать обоснованным, если: 1) изме-
ренное звуковым методом обычное АД колеблется в пределах
от 140/90 мм рт. ст. до 159/94 мм рт. ст.; 2) нормализация АД
происходит спонтанно, без воздействия гипотензивных средств,
после отдыха и т. д.; 3) исключена возможность симптомати-
ческой (вторичной) АГ; 4) отсутствуют признаки гипертрофии
левого желудочка (электрокардиографические, эхокардиогра-
фические, рентгенологические) и другие характерные для ЭГ
изменения органов-мишеней (глазное дно, сосуды мозга и
почек).
По поводу гипертрофии левого желудочка следует сделать до-
полнительные замечания. В последние годы, благодаря широко-
му применению эхокардиографии, выяснилось, что примерно у
1/3 лиц с уровнем АД, соответствующим ПАГ, увеличена масса
миокарда левого желудочка. Кроме того, у здоровых людей с
отягощенной по ЭГ наследственностью в 60% случаев отмечает-
ся утолщение задней стенки левого желудочка и (или) межжелу-
дочковой перегородки по сравнению со здоровыми людьми с
нормальной наследственностью. Поэтому мы полагаем, что в пе-
речень признаков, обязательных для ПАГ, следует добавить еще
один — пятый: сохранение физиологических суточных колеба-
ний АД при его мониторировании, отсутствие ночных подъемов
АД, которые могут быть причиной увеличения мышечной массы
левого желудочка.
Представляют большой интерес результаты недавно закон-
ченных генетических исследований у группы молодых мужчин с
ПАГ, которые провел Р. М. Линчак (2000). Автор нашел, что у
этих лиц, проживающих в Северо-Западном регионе России,
превалирующим является генотип ДД (46%) гена ангиотен-зинп-
ревращающего фермента и генотип АС (54%) гена рецепторов 1-
го типа ангиотензина II (ATSi). При этом значимого влияния ни
одного из генотипов этих генов не обнаружено на показатели
центральной кардиогемодинамики и степень микроальбумину-
рии, которая выявлялась у части лиц с ПАГ.
119
Вместе с тем, Р. М. Линчак отметил, что у лиц, в геноме ко-
торых одновременно присутствует генотип ДД гена АПФ и гено-
тип СС гена ATR, обнаруживаются наиболее выраженные изме-
нения со стороны органов-мишеней.
Необходимо обсудить еще три вопроса, выдвинутые самой
клинической практикой. Первый из них: является ли ПАГ «при-
вилегией» молодых людей и можно ли относить к ПАГ такие же
умеренные, преходящие подъемы АД у лиц среднего или пожи-
лого возраста? Напомним, что многие терапевты отождествляют
понятие ПАГ с юношеской (ювенильной) АГ. Повышение АД
этого типа действительно чаще встречается у молодых людей
(солдат, студентов, подростков). Однако если исходить из хоро-
шо известного факта, что ЭГ в основном заболевают люди
45—55 лет, то следует признать, что и ПАГ, предшествующая в
части случаев становлению этого заболевания, может возникать
не только у лиц молодого возраста, но и в более старших возра-
стных группах. Статистические выкладки подтверждают это за-
ключение.
По данным американских исследователей, среди взрослых
людей ПАГ встречается в среднем в 10%. В Германии общее чис-
ло лиц с ПАГ достигает 4,5 млн. Естественно, представляют ин-
терес данные о распространении ПАГ по территории бывшего
Советского Союза (Чазов Е. И., Елисеев О. М., 1976). В группе
детей школьного возраста АД в так называемой «переходной
зоне» отмечалось в 3—6% случаев; среди мужчин 25—29 лет —
в 5,9-7,5%; 30-34 лет - в 9%; 35-39 лет - в 10,4%; 40-
44 лет — в 12,7%; 45—49 лет — в 16,2%; 50—54 лет — в 18,6%;
55—59 лет — в 18,5% случаев.
Ежегодно число вновь регистрируемых лиц с ПАГ достигает
1%. В США это составляет 2 млн человек в возрасте 25—34 лет и
столько же — в возрасте 15—24 лет, в Германии — около
500 000 человек в каждой возрастной группе.
Что касается половых различий, то ПАГ в группе людей мо-
ложе 50 лет чаще наблюдается у мужчин, после 50 лет она преоб-
ладает у женщин. Во всех возрастных группах больше лиц с сис-
толической ПАГ, что, в частности, отметили Е. Е. Гогин,
А. Н. Сененко и Е. И. Тюрин (1978).
Суть второго вопроса, который часто ставят практические
врачи, состоит в следующем: является ли ПАГ диагнозом и соот-
ветственно нозологической единицей? Ответ на этот вопрос я
120
даю отрицательный. ПАГ — это не заболевание и не может,
естественно, рассматриваться как самостоя-
тельная нозологическая единица. Эволю-
ция этого ди срегул яторного состояния не-
определенна и различна у разных лиц. Только
у части из них ПАГ трансформируется в ЭГ — четко очерченное
заболевание.
В интересах практики, чтобы связать понятие о ПАГ с кли-
никой, я в свое время предложил различать ряд клинических вари-
антов ПАГ: 1) пограничную АГ молодых людей («юношеский»
вариант — обычно следствие нейроциркуляторной дистонии,
тщательно изученной Н. Н. Савицким и соавт., В. И. Маколки-
ным и его сотрудниками (1985); этот вариант ПАГ нельзя отож-
дествлять с синдромом И. Пейджа — диэнцефальной формой
ювенильной АГ); 2) пограничную АГ у лиц, страдающих пси-
хоневрозами, вегетодистонией («психоневротический» вариант,
близкий к предыдущему); 3) пограничную АГ у женщин в пе-
риод возрастной инволюции гонад и нарушения овариальной
функции («климактерический» вариант ПАГ), на связь этого ва-
рианта ПАГ с чувствительностью к поваренной соли указывают
данные И. Ш. Штеренталя и соавт. (1993), Л. А. Соколовой
(1994); 4) пограничную АГ, связанную с чрезмерным и хрониче-
ским потреблением алкогольных напитков, а также при абсти-
ненции («алкогольные» варианты ПАГ); 5) пограничную АГ у
спортсменов («спортивный» вариант ПАГ); 6) пограничную АГ
вследствие длительного воздействия ряда профессиональных
вредностей (шум, вибрация, интоксикации) — «профессиональ-
ный» вариант ПАГ, по-видимому, близкий к нейрогенному, что
продемонстрировала сотрудница нашей кафедры кардиологии
С. В. Кныш (1980).
Выделение этих (возможно, и других) вариантов ПАГ должно
помочь врачу связать преходящие и небольшие подъемы АД с
известными патофизиологическими расстройствами и тем са-
мым подойти к формулировке диагноза в случаях, когда диагно-
стика ЭГ еще не представляется надежной. В то же время упомя-
нутые выше варианты ПАГ, в том числе климактерический,
не должны рассматриваться как разновидности вторичных АГ.
Это — первичная дисрегуляторная, пока еще не фиксирован-
ная АГ, имеющая свои клинические особенности (Калашнико-
121
ва М. Н., Шурыгина В. Д., 1988), — ее дальнейшая трансформа-
ция выясняется с течением времени.
Наконец, третий вопрос, часто вызывающий дискуссию,
можно изложить так: каковы соотношения между ПАГ и нейро-
циркуляторной дистонией (НЦД) гипертензивного типа? Выше я
практически уже дал ответ на этот вопрос. Еще раз подчеркнем,
что первична НЦД, а вторична ПАГ. Правильный диагноз дол-
жен звучать примерно в такой форме: НЦД гипертензивного
типа (ПАГ) или НЦД с пограничным типом АГ. Пограничная
артериальная гипертензия у лиц с НЦД — это преимущественно
нейрогенная, гиперсимпатикотоническая форма повышения АД,
возникающая вследствие нарушения функции нейрогумораль-
ных систем, регулирующих уровень АД. ПАГ возникает тогда,
когда эти гомеостатические системы контроля АД не обеспечи-
вают равновесия между периферическими р-адренергическими
сосудорасширяющими и а-адренергическими сосудосуживаю-
щими реакциями. Такое состояние еще может подвергаться об-
ратному развитию или стабилизироваться на неопределенно
долгое время. Третий — нежелательный — путь ведет к станов-
лению ЭГ.
Не могу не отметить, что в последние годы наблюдается тен-
денция к исключению ПАГ из кардиологической практики. Это
проявилось, во-первых, в некоторых изменениях границ АД, ко-
торые теперь относят к ПАГ, во-вторых, в попытках вообще
устранить понятие ПАГ из классификаций АГ. Сторонники та-
ких перемен основываются на изменениях представлений о нор-
мативах АД. Мне кажется, что не следует столь поспешно отка-
зываться от принятого, прочно вошедшего в практику понятия,
к тому же весьма распространенного. ПАГ — не диагноз, а сосу-
дистый синдром, заслуживающий не исключения, а дальнейшего
более глубокого изучения. Это не ЭГ 1 степени, при которой у
больного уже выявляется повышение ОПС, а неустойчивое уве-
личение МО сердца при непостоянном сужении резистивных со-
судов.
В заключение я считаю полезным указать на перемены,
которые произошли в последние годы в определении уровня
ПАГ. По рекомендации ВОЗ-МОГ (1999), подгруппа погра-
ничной АГ включает лиц с систолическим АД в пределах
140—149 мм рт. ст.; диастолическим — 90—94 мм рт. ст. Уро-
122
вень «высоко нормального АД» определен как 130—139/85—
90 мм рт. ст.
Между тем результаты Фремингеймского исследования пока-
зали, что относительный риск развития сердечно-сосудистых
осложнений значительно выше при высоком нормальном давле-
нии, чем при уровне АД, соответствующем категории «нормаль-
ного» АД. Так, при уровне систолического АД, равном 130—
139 мм рт. ст., по сравнению с уровнем систолического АД ниже
120 мм рт. ст. относительный риск развития инфаркта миокарда
возрастает на 70%, инсульта — на 90% (O’Donneli С., Ridker Р.,
Glynn R. et al., 1997). Правда, эти относительные величины тре-
буют еще подтверждения.
ГЛАВА IV
КЛИНИЧЕСКАЯ КАРТИНА ПРИ ЭГ:
СОСТОЯНИЕ ОРГАНОВ-МИШЕНЕЙ;
СТЕПЕНИ (СТАДИИ), ФОРМЫ,
ТЕЧЕНИЕ И ИСХОДЫ ЭГ
РАСПРОСТРАНЕННОСТЬ ЭГ,
ВОЗРАСТНЫЕ И ПОЛОВЫЕ ОСОБЕННОСТИ БОЛЬНЫХ
К числу больных ЭГ теперь относят лиц, у которых повторно
(неоднократно) или постоянно диастолическое давление дости-
гает уровня >90 мм рт. ст., систолическое давление обычно пре-
вышает 170 мм рт. ст. Это — хроническая систоло-диастоличе-
ская АГ; изолированное повышение систолического давления я
не включаю в понятие ЭГ; напротив, изолированное повышение
диастолического давления, встречающееся сравнительно редко,
следует рассматривать как разновидность ЭГ.
Как видно, при определении понятия ЭГ приоритет отдается
уровню диастолического давления, однако, как я покажу ниже,
прогностическое значение повышения систолического давления
ничуть не меньше (если не больше) возрастания диастолическо-
го давления.
О распространенности ЭГ среди населения экономически
развитых стран можно судить по последним данным, приводи-
мым С. Vallbona и V. Paulik (1992), объединившим результаты
ряда эпидемиологических исследований в США (табл. 3).
Очевидно, что за анализируемые два десятилетия число
больных ЭГ среди мужчин несколько возросло, среди жен-
щин не изменилось или даже снизилось. Правда, в некоторых
других исследованиях, законченных в 90-х годах, приводятся
более высокие показатели распространения ЭГ, прибли-
жающиеся к 25%. Если же учитывать верхний предел нормы
АД = 135/85 мм рт. ст., который еще в 1984 г. рекомендовал
Комитет по АГ США, то общее число гипертоников возрастет
124
Таблица 3
Распространенность ЭГ среди населения США в 1960—1980 гг.
(в % к общему числу взрослых людей)
Уровень АД, мм рт. ст. 1960-1962 гг. 1971-1974 гг. 1976-1980 гг.
м ж м ж м ж
СД > 140 или ДД > 90 40,8 34,0 42,7 34,3 43,6 32,6
СД > 160 или ДД > 95 18,8 18,6 20,7 18,0 20,9 15,4
Примечание. СД — систолическое, ДД — диастолическое давление;
М — мужчины, Ж — женщины.
более чем вдвое. Простой расчет показывает, что в 70—80-х гг.
число людей, имевших повышение АД пограничного типа,
составило среди мужчин почти 23%, среди женщин — 17%.
Распространенность ЭГ (>140/90) в России составляла в
1993 г. среди мужчин 39,2%, среди женщин — 41,1% (из доклада
экспертов научного общества по изучению АГ). Женщины лучше
мужчин информированы о наличии у них заболевания (58,9%
против 37,1 %) и чаще лечатся (46,7% против 21,6%), в том числе
эффективно (17,5% против 5,7%). До 40 лет АГ чаще встречается
у мужчин, после 50 лет — чаще у женщин. По данным рабочей
группы ВОЗ (1997), Россия по смертности от ИБС и инсульта за-
нимает одно из первых мест в Европе. Среди мужчин в возрасте
45—74 лет 87,5% случаев смерти от сердечно-сосудистых заболе-
ваний приходятся на ИБС и инсульт. У женщин того же возраста
доля ИБС и инсульта в структуре смертности от сердечно-сосу-
дистых заболеваний равна 85% (Константинов В. В., Жуков-
ский Г. С., Очаков Р. Г. и др., — 1993, 1994).
Распределение больных ЭГ по возрасту иллюстрируют данные
И. С. Глазунова и соавт. (1990). В группе мужчин 20—39 лет —
жителей Москвы — они обнаружили диастолическое давление
£95 мм рт. ст. в 8,2% случаев, среди мужчин 40—54 лет —
в 23—27% случаев, т. е. в 3 раза чаще.
Эпидемиологическое обследование населения Ленинграда
показало, что среди мужчин 20—29 лет АГ встретилась в
9,4% случаев, в возрасте 30— 39 лет — в 18,1%, в группе 40—
49 лет — в 35,1%, в группе 50— 59 лет — в 45,1% и в группе 60—
69 лет — в 50,9%. Среди женщин АГ регистрировалась в разных
125
возрастных группах со следующей частотой: 20—29 лет — 3%,
30-39 лет - 7,5%, 40-49 лет - 20,4%, 50-59 лет - 45,4%,
60—69 лет — 57,5% (Климов А. Н., 1989). Во всех возрастных
группах распространенность АГ в Ленинграде была выше, чем
в Москве. При анализе этих данных следует учитывать, что
в число больных АГ, по-видимому, попало немало лиц с атеро-
склеротической систолической гипертензией. В общем следует
считать правильным утверждение, что ЭГ относительно редко
возникает у лиц моложе 30 лет. Это — зона симптоматических
(вторичных) АГ, хотя мне, вероятно, как и другим клиницистам,
приходилось наблюдать молодых людей в возрасте 20—30 лет,
несомненно страдавших ЭГ. У этих людей обычно происходило
накопление наследственных признаков ЭГ в двух или, скорее,
в нескольких поколениях как по материнской, так и по отцов-
ской линии. В США каждый четвертый взрослый человек имеет
повышенный уровень АД, к 70 годам АГ встречается уже
у каждого второго человека (Alder-Graschinsky Е., 2000).
Что касается верхнего возрастного предела, при котором воз-
можно становление ЭГ, то его, практически, не существует. На-
пример, по данным Д. Ф. Чеботарева (1978), среди людей >80 лет
ЭГ встречается в 18% случаев. Все же будет правильным подчер-
кнуть, что становление ЭГ у лиц старше 60 лет происходит не
столь уж часто. Это — зона атеросклеротической систолической
АГ либо атеросклеротической реноваскулярной систоло-диасто-
лической АГ.
Правда, в последних рекомендациях ВОЗ/МОГ изолирован-
ная систолическая АГ рассматривается как подвид ЭГ (с этим за-
ключением согласиться не могу, поскольку как по происхожде-
нию, так и по особенностям гемодинамики эти формы АГ совер-
шенно разные).
У больных сахарным диабетом курение табака способствует
подъему АД, увеличению частоты сердечных сокращений и на-
рушениям функции вегетативной нервной системы. Эти измене-
ния могут рассматриваться в отношении связи курения с разви-
тием диабетической нефропатии (Poulsen Р. et al., 1998).
Прекращение употребления алкоголя ведет к снижению вы-
сокого АД (Aguilera М. et al., 1999). Укажу также, что сниженная
вариабельность синусового ритма — показатель вегетативной
дисфункции — обнаруживается у больных с ЭГ и указывает на
126
риск ее развития у мужчин с нормальным АД (Singhl J. et al..
1998).
Следует сделать дополнительные замечания по поводу забо-
леваемости ЭГ мужчин и женщин. Если ориентироваться на
табл. 3 и другие приведенные выше данные, то создается впечат-
ление о преобладании ЭГ среди мужчин. Однако это правило
скорее относится к возрастным группам до 40—55 лет. Число
женщин, страдающих ЭГ, заметно увеличивается при достиже-
нии ими возраста старше 50 лет. Согласно одной из статистик, у
женщин 40—49 лет частота заболевания ЭГ составила 15%, среди
женщин 50—59 лет этот показатель достиг уже 27%. В итоге, по
мнению ряда исследователей, отношение женщин к мужчинам,
болеющим ЭГ, в общем составляет в США 1,3 : 1, в Польше 2:1.
По поводу влияния различных профессиональных факторов
на распространенность ЭГ среди населения пока нет полной яс-
ности. В прежние годы многие исследователи склонялись к
тому, что ЭГ — это преимущественно заболевание людей, зани-
мающихся интенсивным умственным трудом, поскольку психи-
ческое перенапряжение рассматривалось как наиболее вероятная
причина ЭГ. В наше время соотношение между больными ЭГ
умственного и физического труда как будто изменяется в пользу
последних. Возможно, что такая эволюция связана с широко
распространяющимся среди населения злоупотреблением алко-
гольных напитков. Разумеется, этот вопрос заслуживает дальней-
шего изучения.
О заболеваемости ЭГ жителей различных климатических зон
нашей страны тоже известно не столь уж много. По материалам
отдела профилактической кардиологии Сибирского филиала
КНЦ, в зоне Норильска в начале 80-х годов ЭГ выявлялась поч-
ти у каждого третьего мужчины в возрасте 30—59 лет (Турчин-
ский В. И., 1980). Между тем у рабочих и служащих предприя-
тий Новосибирска (мужчины 30—59 лет) ЭГ была обнаружена
в 21% случаев, т. е. достоверно реже (Никитин Ю. П., 1982).
Кооперативная программа по борьбе с АГ среди промышленных
рабочих, осуществлявшаяся в 27 городах Советского Союза сре-
ди мужчин 30—54 лет, выявила значительный разброс заболевае-
мости ЭГ: от 18% в Чебоксарах до 40% в Алма-Ате; у 2/з больных
повышение АД носило стабильный характер (Оганов Р. Т., Гла-
зунов И. С., 1985). Конечно, такие существенные различия не
могут быть объяснены одними влияниями климатических факто-
127
ров. Заслуживает дополнительного упоминания так называемая
артериальная гипертензия «белого халата». Недавно было
показано, что изолированное повышение АД в кабинете врача не
является столь безобидным феноменом, как это предполагали
прежде (Zakopoulos N. et al., 1999).
Становление заболевания и его течение
Начало доброкачественно протекающей ЭГ во многих случа-
ях остается незамеченным больными, так как первые, обычно
нерезкие и преходящие подъемы АД не всегда сопровождаются
характерной симптоматикой. Здесь, правда, возможны два вари-
анта: 1) развитие ЭГ из ПАГ, при этом период ПАГ может быть
весьма продолжительным; 2) становление ЭГ без предшествую-
щего периода ПАГ.
У многих людей повышение АД бывает случайной находкой
при диспансеризации, профессиональном отборе, определении
показаний к санаторно-курортному лечению, годности людей к
военной службе, например, летчиков к летной работе и т. д. По-
степенный переход ПАГ в ЭГ (I стадия) также плохо распознает-
ся из-за клинического сходства этих двух родственных гипертен-
зивных состояний.
Свойственное ЭГ хроническое течение характеризуется вол-
нообразным чередованием периодов ухудшения и улучшения, т. е. по-
вышений и понижений АД с тенденцией к его стабилизации на
более или менее высоком уровне. Хотя физиологические реак-
ции отдельных больных на повышение АД индивидуальны, хро-
ническая АГ со временем, раньше или позже, дает о себе знать
нарастающим повреждением различных органов, среди которых
особой ранимостью отличаются сердце, головной мозг, сетчатка
глаза, почки. Их называют органами-мишенями; этот термин
впервые применил в 1955 г. С. Реггега, наблюдавший прогресси-
рование ЭГ у 500 нелеченных больных.
Свое описание клиники ЭГ я начинаю с характеристики ор-
ганов-мишеней, повреждение которых составляет сущность это-
го заболевания, занимает центральное место в его клинической
картине, предопределяет прогноз и исходы ЭГ.
Сердце и артериальные сосуды при ЭГ
Сердце вовлекается в гипертензивный процесс первично и
вторично. Под первичным я понимаю увеличение МО сердца,
128
отмечаемое у части больных, особенно у молодых людей с ПАГ.
Повышение сердечного выброса — механизм, стимулирующий у
предрасположенных к АГ людей цепную реакцию, ведущую к
устойчивому повышению АД (функциональная, или анатомиче-
ская, сосудистая ауторегуляция — см. главу 2).
Вторичное вовлечение сердца связано с его функционирова-
нием в условиях повышенных ОПС и АД. Артериальная гипер-
тензия — наиболее часто встречающееся в клинике внутренних
болезней состояние, при котором левый желудочек хронически
испытывает нагрузку давлением (постнагрузка), выполняя чрез-
мерную работу в течение всей систолы. Сердце реагирует на та-
кие условия усилением сократительности, структурной адапта-
цией и мобилизацией нейрогуморальных приспособительных
механизмов.
Гипертрофия левого желудочка
Упомянутые выше механизмы приспособления сердца к хро-
ническому повышению нагрузки реализуются в конечном счете
в форме гипертрофии левого желудочка, т. е. в увеличении его
мышечной массы (утолщение стенок).
Как подчеркивал Ф. 3. Меерсон (1969, 1975), «процесс гипер-
трофии (левого желудочка — М. К.) у человека обычно развива-
ется в том же темпе, что и вызвавшая его болезнь — он медленно
прогрессирует при нарастающей гипертонии». Сформулирован-
ная в те годы этим автором «триада»: гиперфункция—гипертро-
фия—декомпенсация (ослабление сердечной мышцы) полностью
сохраняет свое значение и для нашего времени. Правда, ее суще-
ственно пополнили новые данные о молекулярных механизмах
развития и прогрессирования гипертрофии.
Диастолическая дисфункция левого желудочка
Нарушение активного расслабления левого желудочка в пе-
риод диастолы является ранним признаком изменения миокарда
у больных ЭГ; по времени оно опережает становление гипертро-
фии (Topol Е. et al., 1985). Наша сотрудница И. И. Якубович
(1993, 1996) судила, как принято, о диастолической функции ле-
вого желудочка по результатам Допплерэхокардиографического
исследования: по скорости быстрого наполнения левого желу-
дочка (волна Е при сканировании отверстия митрального клапа-
S3.IK 3207
129
Рис. 10. Скорости трансмитрального кровотока у больного С., 52 лет,
с нормальным АД
на), скорости движения крови через митральное отверстие во
время систолы левого предсердия (волна А), а также по величине
коэффициента Е/А (рис. 10).
У нормотоников волна Е не ниже 63,4 см/с; волна А колеб-
лется в пределах 39,1—65,1 см/с; коэффициент Е/А обычно не
меньше 1,3 (рис. 10).
В настоящее время выделяют 3 формы (степени) нарушения
диастолической функции левого желудочка, если основываться
на величинах трансмитрального кровотока, исследованных доп-
плеровским эхокардиографическим методом:
1) анормальное расслабление стенок левого желудочка:
Е/А<1 — у больных до 50 лет; Е/А<0,5 — у больных старше
50 лет;
2) рестриктивная форма расслабления, когда отмечается по-
вышение давления в левом предсердии и удлиняется период
изоволюмического расслабления левого желудочка (ПИВР у
больных 30— 50 лет)>100 мс; показатель Е/А>2,0;
3) псевдонормализация, когда показатель Е/А = 1—2,0.
130
В наших наблюдениях диастолическая функция левого желу-
дочка оказалась нарушенной, если судить по волне Е, у 20 из
64 больных ЭГ II стадии (31,3%); в среднем понижение волны Е
составило 28,9%. Коэффициент Е/А был ниже нормы у 41 боль-
ного (64,1%), в среднем его уменьшение равнялось 41,2%.
Расширение левого предсердия, о котором мы судили по ве-
личине его объема (в норме = 22,3±6,2 см3), выявилось у
57 больных ЭГ, т. е. в 89,1% случаев; объем в среднем составил
137,2% от нормы; у многих из этих больных выслушивался или
регистрировался IV тон сердца либо предсердный ритм галопа.
Итак, прямые или косвенные признаки ухудшения диастоли-
ческой функции левого желудочка мы выявили у 2/3—4/5 боль-
ных ЭГ. Нарушение способности стенок левого желудочка к рас-
слаблению сопровождалось уменьшением его наполнения и УО
сердца (рис. 11).
Анатомические изменения и биохимические расстройства
в миокарде при левожелудочковой гипертрофии
На первых этапах развития гипертрофии происходит увели-
чение диаметра кардиомиоцитов, числа миофибрилл, митохонд-
рий и размера ядер. Если же гипертрофия прогрессирует и под-
держивается длительное время, то клеточная организация и фор-
ма кардиомиоцитов отчетливо нарушаются, явно удлиняются
ядра, возрастает объем миофибрилл. Последняя фаза гипертро-
фии характеризуется утратой сократительных элементов, грубы-
ми разрывами Z-полос, утратой параллельности в расположении
саркомеров, образованием участков соединительной ткани, за-
меняющих мышечную ткань, расширением и извилистостью
Т-трубок саркоплазматического ретикулума (Verrans Y., 1983).
Все упомянутые выше структурные изменения и поврежде-
ния, происходящие в гипертрофированной мышце, постоянно
сочетаются с биохимическими изменениями в миокарде. Посте-
пенно понижается способность клеток синтезировать белки, не-
обходимые для обновления миофибрилл, митохондрий, фермен-
тов, в том числе и тех, которые участвуют в процессах мышеч-
ного возбуждения, сокращения и расслабления. Появляется из-
быток кальция в клетках и связанный с ним комплекс функцио-
нальных нарушений — «кальциевая триада» (Меерсон Ф. 3.,
131
1980). Уменьшается содержание норадреналина и 01-адреноре-
цепторов в миокарде, понижается реакция мышечных клеток на
симпатические нервные стимулы. Тормозится стимулирующий
эффект простагландинов, участвующих в регуляции клеточного
уровня циклических нуклеотидов. Соответственно этой биохи-
мической и морфологической эволюции ограничиваются сокра-
тительные возможности «гипертонического сердца».
Мы уже упоминали, что развитие молекулярной биологии
способствовало более глубокому проникновению в сущность ин-
тимных процессов развития гипертрофии миокарда. На наших
глазах произошел переход от анатомо-физиоло-
гического уровня исследований, результаты ко-
торых в общих чертах были представлены выше, к молеку-
лярному уровню.
Эти исследования показали, что механизмы сердечной ги-
пертрофии включают не только процесс ремоделирования (струк-
турная приспособительная перестройка) всех составляющих сер-
дечной ткани (кардиомиоциты, матрикс, кровоснабжение), но и
активацию нейроэндокринных систем организма больного ЭГ, в
первую очередь недавно открытых местных механизмов.
Локально продуцируемые сердечные медиаторы (модуляторы)
функционируют, как упоминалось (глава 2), в аутокринной
(«воздействие на собственные клетки») и паракринной манере
(«воздействие на соседние клетки»). Аутокринная и паракрин-
ная системы выделяют в миокарде различные пептиды и другие
активные вещества, среди которых следует назвать ангиотен-
зин II, эндотелии, пептидные факторы роста, эндотелиальный
релаксирующий фактор, предсердный натрийуретический пеп-
тид и простациклин (Re R., 1987; Dzau V., 1992). Представлен-
ные в сердце пептидные факторы роста вовлечены в молекуляр-
ные механизмы его ремоделирования и развития гипертрофии.
Среди них: трансформирующий фактор роста — В, кислые и
основные факторы роста фибробластов, ангиотензин II и эндо-
телии, способствующие увеличению кардиомиоцитов и проли-
ферации фибробластов. Антагонистами этим «ростовым» веще-
ствам выступают фактор релаксации, высвобождаемый эндоте-
лием, и ряд других веществ, которые тормозят клеточный рост.
Между действием «ростовых» и «антиростовых» факторов в фи-
зиологических условиях устанавливается равновесие, от наруше-
ния которого уже в патологических условиях зависит, подверг-
132
нется ли сердечная мышца гипертрофии и ремоделированию
либо претерпит дилатацию.
Многие из синтезируемых в сердце модуляторов оказывают
разнонаправленное воздействие на систему коронарных сосудов:
некоторые из них могут ухудшать перфузию гипертрофирован-
ного миокарда, понижать поглощение им кислорода. Те же ло-
кальные агенты способны нарушать существующий в норме ба-
ланс между положительными и отрицательными инотропными
воздействиями на миокард. В частности, положительный ино-
тропный эффект вызывают ангиотензин II, генерируемый непо-
средственно в сердце; эндотелин-пептид, сосредоточенный в
микрососудах сердца и в эпикардиальных артериях; катехолами-
ны, а также ангиотензин II, доставляемый в миокард из общего
кровотока. Отрицательный инотропный эффект присущ эндоте-
лиальному релаксирующему фактору и предсердному натрийуре-
тическому пептиду. Сдвиги равновесия между этими разнона-
правленными влияниями могут в каждый момент изменять со-
кратительность миокарда и скорость развития его гипертрофии.
Необходимо напомнить, что норадреналин, подобно АП, облада-
ет митогенетическими свойствами, стимулируя развитие гипер-
трофии сердечной мышцы (Simpson Р., 1983).
Итак, в отличие от старых взглядов, связывающих гипертро-
фию левого желудочка исключительно с повышением АД, т. е.
с механическими факторами — увеличением нагрузки на сердце,
современная точка зрения учитывает помимо АД значение мно-
гих других механизмов, особенно внутрисердечных, определяю-
щих интенсивность процесса гипертрофии. Наряду с гемодина-
мическими, биохимическими, нейрогуморальными факторами,
большое значение придается генетическим, молекулярно-биоло-
гическим особенностям миокарда. Степень гипертрофии варьи-
рует и в зависимости от пола больного: она преобладает у муж-
чин; масса левого желудочка тесно связана и с размерами тела
человека.
Становятся понятными два обстоятельства, постоянно сму-
щавшие наблюдательных кардиологов: 1) слабая корреляция
между уровнем АД и массой левого желудочка (лучше коррели-
руют с массой левого желудочка показатели среднего и систоли-
ческого давления, измеренного при суточном мониторировании)
(Drayer J. et al., 1983); 2) отсутствие корреляции между длитель-
ностью гипертензивного анамнеза и выраженностью левожелу-
133
дочковой гипертрофии. Например, у больного со сравнительно
кратковременным периодом повышения АД может определяться
отчетливая гипертрофия левого желудочка, тогда как у другого
больного с АГ средней тяжести, сохраняющейся в течение мно-
гих лет, гипертрофии левого желудочка может не быть либо она
минимальна (Frohlich Е., Tarazi R.,1979, 1983; Hammond I. et al.,
1986; Messerli F. et al., 1984).
Показательно и то, что регрессия (обратное развитие) гипер-
трофии тоже не коррелирует со степенью снижения АД (Sen S.,
1983). В практическом отношении важен вопрос: не сказывается
ли обратное развитие гипертрофии на сократительной функции
левого желудочка, иначе говоря, следует ли добиваться регрессии
гипертрофии, не вызовет ли это ослабление миокарда? В экспе-
рименте на животных уменьшение левожелудочковой гипертро-
фии приводило к улучшению насосной функции сердца. В кли-
нических условиях снижение массы миокарда левого желудочка
тоже не сопровождалось уменьшением его ФВ.
Кровоснабжение гипертрофированного миокарда
Очень важен и вопрос об адекватности кровоснабжения ги-
пертрофированного миокарда. В экспериментальных условиях у
животных при возрастании диаметра кардиомиоцитов не отмеча-
лась пролиферация капилляров, в результате чего увеличивалось
межкапиллярное расстояние, а плотность капилляров понижа-
лась. Этот процесс более выражен в субэндокардиальном мы-
шечном слое и в папиллярных мышцах, отличающихся поэтому
повышенной чувствительностью к ишемии (Bache R., 1988).
Между тем клинико-физиологические исследования больных
ЭГ показывают, что при устойчивой гипертрофии
левого желудочка общее поглощение кис-
лорода миокардом возрастает пропорцио-
нально увеличению мышечной массы. В покое
коронарная артериовенозная разница по Ог не отличается от
нормальной, указывая на то, что коронарный кровоток соответ-
ствует потребностям миокарда в кислороде. Однако его величи-
на, отнесенная к единице мышечной массы, не повышается при
воздействии вазодилататоров, что отражает снижение вазодила-
таторного резерва гипертрофированного миокарда.
Кровоснабжение гипертрофированного миокарда постепенно
ухудшается, благодаря нарастающим со временем атеросклероти-
134
ческим изменениям венечных артерий. Формирование и про-
грессирование коронарного по происхождению кардиосклероза
осуществляется в гипертрофированном миокарде разными путя-
ми: образованием мелких рубчиков на месте гибнущих ишемизи-
рованных и дистрофических клеток, бесклеточным развитием
соединительной ткани в местах атрофии мышечных волокон, за-
мещением рубцовой тканью участков инфаркта миокарда. Круп-
ные рубцовые очаги могут быть и результатом слияния соседних
фокусов склероза сердечной мышцы.
Как показали К. Weber, Ch. Brilla (1992), накопление в мио-
карде коллагена за счет его синтеза фибробластами происходит
интенсивнее, чем деградация коллагена. Развитие соединитель-
ной ткани в миокарде больного ЭГ прежде всего связано, как
упоминалось, с постоянной его перегрузкой и гибелью мышеч-
ных элементов. Большую роль в этих процессах играет и воздей-
ствие таких факторов, как избыток АП, дефицит ионов К+,
Mg++, чрезмерное влияние альдостерона и повышенное потреб-
ление больным поваренной соли.
Известно, что рецепторы для пептидных гормонов, таких как
АП, локализуются на мембране клеток, рецепторы для альдосте-
рона — в клеточном цитозоле. Избыток АП способствует некро-
зу кардиомиоцитов; некротические участки замещаются фиброз-
ной тканью — это репаративная форма кардиосклероза. Избыток
альдостерона по отношению к потребляемой поваренной соли
вызывает некрозы миокарда, заканчивающиеся формированием
периваскулярно-интерстициального фиброза.
Как видно, фиброз миокарда (кардиосклероз) представлен
при ЭГ различными вариантами, нарушающими тканевую одно-
родность, свойственную, например, адаптивной гипертрофии ле-
вого желудочка у спортсменов. Гетерогенность структуры гипер-
трофированного миокарда у больных ЭГ нарушает в нем элект-
рические и механические процессы.
В заключение следует еще раз подчеркнуть, что гипертрофия
миокарда левого желудочка, характеризующаяся нарастанием его
мышечной массы и утолщением стенок и (или) перегородки,
происходит без увеличения числа клеток (кардиомиоцитов),
т. е. без гиперплазии. У больных ЭГ с отчетливо выраженной ги-
пертрофией левого желудочка (без недостаточности кровообра-
щения) его мышечная масса может возрастать почти на 100%
(>200 г).
135
Гипертрофия левого желудочка — важнейший элемент так
называемого «гипертензивного (гипертонического) сердца», или,
хотя это звучит длиннее, но правильнее, «сердца больного ЭГ».
Это обстоятельство позволяет нам перейти к описанию клиниче-
ских признаков и симптомов, характерных для больного ЭГ.
Клинические данные
Боли в области сердца. Некоторые больные ЭГ не испытыва-
ют болей в области сердца или в левой половине грудной клетки,
хотя у них АД длительное время поддерживается на высоком
уровне. Значительно большее число лиц, страдающих ЭГ, перио-
дически ощущает боли у соска, за грудиной и в прекардиальной
области. Эти симптомы нередко бывают связаны с коронаро-
склерозом, развитие которого ускоряется под воздействием вы-
сокого АД. Однако было бы упрощением утверждать, что ише-
мия миокарда является единственной причиной болевых ощуще-
ний, испытываемых больными ЭГ. Механизмы сердечного боле-
вого синдрома при этом заболевании многообразны, и его диф-
ференцированная оценка необходима для выбора правильного,
адекватного метода устранения болей. Варианты этих болей мы
классифицируем следующим образом:
1. Стенокардия во всех ее разновидностях [по данным
А. А. Азизова и соавт. (1993), частота синдрома стенокардии у
больных АГ в сочетании с ИБС составляет 62,2%, у больных АГ
без ИБС - 41,7%].
2. Боли, тесно связанные с подъемами АД. Они, разумеется,
тоже могут иметь ангинозную природу, поскольку в этих услови-
ях возрастает нагрузка на левый желудочек и его потребность в
кислороде (увеличивается «двойное произведение»). Однако (не-
редко) эти боли по своей окраске не всегда могут рассматривать-
ся как стенокардические. Я имею в виду длительные ноющие
боли или чувство тяжести в области сердца, медленно ослабева-
ющие по мере снижения АД. У некоторых больных можно даже
отметить довольно устойчивый «болевой порог», т. е. возобнов-
ление болей в тот момент, когда АД достигает определенного
уровня. Причины описываемого явления сложны и не вполне
исследованы. По-видимому, имеет значение ряд факторов: чрез-
мерное напряжение стенок аорты (аорталгия), стимуляция меха-
норецепторов миокарда левого желудочка, передающих сигналы
в ЦНС через эфферентные симпатические нервы сердца (Косиц-
136
кий Г. И., 1975), и, возможно, ишемия субэндокардиального мы-
шечного слоя, испытывающего наибольшее напряжение при си-
столе левого желудочка. Последний механизм, вероятно, не иг-
рает ведущей роли, на что, помимо прочего, указывает отсутст-
вие эффекта от приема нитроглицерина. Это подтверждается
также коронарографическими и эхокардиографическими иссле-
дованиями. В частности, A. Sacrez и соавт. (1978) провели такие
исследования у группы больных ЭГ, страдавших приступами сте-
нокардии. Коронарограммы у части из них оказались нормаль-
ными, но отмечалась значительная гипертрофия стенок левого
желудочка и межжелудочковой перегородки.
3. «Постдиуретические» боли; они нередко возникают (вместе
с аритмиями сердца или без них) спустя 12—24 ч после обильно-
го диуреза, чаще у женщин. Ноющие, иногда жгучие боли в об-
ласти сердца длительностью от одного до двух-трех дней ощу-
щаются больными на фоне общей мышечной слабости, вялости,
апатии. В основе такого синдрома лежит вызванный диуретиком
клеточный дефицит калия (гипокалигистия), снижение концент-
рации ионов К+ в плазме (гипокалиемия), гипохлоремия с вне-
клеточным алкалозом. Нитраты в подобных случаях неэффек-
тивны; боли постепенно исчезают спонтанно либо быстрее —
после внутривенного капельного вливания раствора калия хло-
рида или панангина (аспаркам).
4. Боли, связанные с плохой переносимостью сердечных гликози-
дов, которые назначают больным ЭГ при фибрилляции предсер-
дий или при выраженной гипертрофии левого желудочка для
улучшения его сократительной функции. Эти болевые ощущения
появляются через 20—60 мин после внутривенного введения
0,05% раствора строфантина, особенно если его доза превышает
0,25 мл. Надо прежде всего подчеркнуть, что сердечные гликози-
ды не показаны тем больным ЭГ, которые сохраняют синусовый
ритм и состояние компенсации. Появление «дигиталисных» бо-
лей иногда бывает первым указанием на начинающуюся инток-
сикацию.
5. Распространен вариант «фармакологических» болей, свя-
занный с продолжительным применением симпатолитических
средств. Резерпин, гуанетидин и близкие к ним препараты при
назначении их на длительные сроки в больших дозах могут вы-
зывать истощение норадреналиновых депо в окончаниях симпа-
тических нервов сердца. Наша сотрудница Н. Ф. Капралова
137
показала, что даже однократное внутримышечное введение
1,25 мг рауседила больным ЭГ с выраженной гипертрофией ле-
вого желудочка приводит к временному прекращению экскреции
с мочой норадреналина. Между тем значительная часть выделяе-
мого норадреналина имеет источником сердечную фракцию это-
го нейрогормона. Больные (чаще это люди пожилого возраста)
ощущают «резерпиновые» боли как жжение или тяжесть в облас-
ти сердца; они сохраняются в течение многих часов независимо
от уровня АД и постепенно исчезают после прекращения при-
емов симпатолитических средств. Эти боли можно рассматривать
как одно из проявлений гипоадренергической формы дистрофии
миокарда (Аничков С. В. и др., 1975; Кушаковский М. С., 1975,
1977).
6. Боли невротического характера (кардиалгии) — отнюдь не
всегда «привилегия» лиц с ПАГ и НЦД; они ощущаются и боль-
ными ЭГ. Это длительные ноющие и щемящие боли с распро-
странением под левую лопатку, в левую руку с онемением паль-
цев либо кратковременные острые «проколы» у соска. Связь по-
добных ощущений с эмоциями, невротическими реакциями
сравнительно легко устанавливается при беседе с больным.
Нельзя только забывать, что те же эмоциональные воздействия
могут провоцировать у больных ЭГ приступы стенокардии.
7. Нарушения сердечного ритма, особенно тахиаритмии, неред-
ко сопровождаются появлением у больных ЭГ болевых ощуще-
ний. Иногда — это типичная стенокардия напряжения. В других
случаях боли могут, по-видимому, вызываться чрезмерной сти-
муляцией миокардиальных рецепторов. При дифференциальной
диагностике следует учитывать особенности клиники, анамнез и,
конечно, данные ЭКГ. Если, например, боли появляются вслед
за приступом аритмии и прекращаются в момент его окончания,
если не происходит смещения сегмента ST, горизонтального или
косо-нисходящего типа, если больной достаточно хорошо пере-
носит физические нагрузки, то «аритмические» боли у него, ско-
рее, не связаны с ухудшением коронарного кровообращения.
Границы (размеры) сердца, верхушечный толчок
Увеличение сердца у больных ЭГ происходит с разной скоро-
стью, но обычно в определенной последовательности. Сначала в
процесс вовлекаются «пути оттока» левого желудочка: развивает-
ся его концентрическая гипертрофия, типичная для длительных
138
изометрических нагрузок. Не случайно у многих больных ЭГ
верхушечный толчок не прощупывается даже в положении боль-
ного на левом боку, что обычно облегчает пальпацию левожелу-
дочкового толчка. При медленном прогрессировании заболева-
ния и сравнительно умеренном повышении АД такая ситуация,
т. е. концентрический характер гипертрофии левого желудочка,
может сохраняться многие годы. Вообще не существует прямой
зависимости между длительностью АГ и размерами сердца (объ-
яснение этому явлению было дано выше). Следовательно, отсут-
ствие у больного сильного верхушечного толчка не может слу-
жить основанием для заключения о кратковременности заболе-
вания.
Рентгенологические признаки
левожелудочковой гипертрофии при ЭГ
В период начальной, концентрической, гипертрофии может
выявляться лишь закругление верхушки левого желудочка. При
более выраженном, но все еще умеренном утолщении свободных
стенок левого желудочка его верхушка опускается слегка книзу.
При нарастании гипертрофии верхушка левого желудочка ото-
двигается влево, уменьшая просвет нижней части легочного
поля, и еще больше вниз, где она может проецироваться ниже
купола диафрагмы.
У больных во II—III стадии ЭГ в прямой рентгенологической
позиции можно видеть отчетливое увеличение нижней левой
дуги с длиной сегмента левого желудочка около 10 см и большо-
го диаметра до 16 см, а также удлинение поперечника сердца
(кардиоторакальный индекс около 51%). Сердце приобретает вид
удлиненного овала (Матвеева Л. Г. и др., 1979). В этом далеко
зашедшем периоде у части больных ЭГ может пальпироваться
верхушечный толчок, который воспринимается как высокий и
приподнимающий.
При гипертрофии и дилатации «путей притока» левый желу-
дочек увеличивается кзади, суживая ретрокардиальное простран-
ство (второе косое рентгенологическое положение). У многих
больных одновременно можно наблюдать отчетливое увеличение
левого предсердия (начинает увеличиваться очень рано) и арте-
риального конуса правого желудочка, а также некоторое сглажи-
вание талии сердца. В более поздних стадиях ЭГ или при быст-
ром ее прогрессировании происходит увеличение всех отделов
139
сердца: правый желудочек расширяется вправо, оттесняя вверх и
кзади расширенное правое предсердие. Во втором косом поло-
жении видно, что правый желудочек увеличивается и кпереди,
суживая ретростернальное пространство. Длинник сердца возра-
стает из-за высокого стояния правого атриовазального угла и
смещения книзу верхушки левого желудочка. Поперечник серд-
ца может увеличиваться за счет расширения обоих желудочков.
Сердце приобретает треугольную форму с преимущественным
выступанием левой границы.
Некоторые клиницисты и рентгенологии, основываясь на
факте смещения правых границ сердца и увеличения правого
желудочка, высказывают предположение о развитии у больных
сочетанной гипертензии большого и малого круга кровообраще-
ния, вызванной общими нейрогенными механизмами. Подобная
гипотеза пока не получила клинического или экспериментально-
го подтверждения. Недоказанным остается существование и осо-
бой хронической пульмоногенной системной АГ (Мухарля-
мов Н. М., 1980; Жданов В. Ф., 1993).
По мнению многих других исследователей, гипертрофия пра-
вого желудочка у больных ЭГ вызывается изменениями миокар-
да, связанными с нарушениями условий кровообращения. В час-
ти случаев имеют значение сопутствующие хронические забо-
левания бронхолегочной системы (эмфизема легких, легочное
сердце).
Эхокардиографические признаки
левожелудочковой гипертрофии
Эхокардиографическому методу присущи наибольшая специ-
фичность (90%) и чувствительность (90%) при определении ги-
пертрофии левого желудочка. Для сравнения укажем, что специ-
фичность ЭКГ-метода тоже высока (95%), а чувствительность за-
метно ниже (60%) (Юренев А. П., 1983; Филатова Н. П. и др.,
1993; Panidis I. et al., 1984; Wallerson D., Devereux R., 1987).
С помощью эхокардиографического метода гипертрофию ле-
вого желудочка находят у 17—42% больных ЭГ (Hammond I.
et al., 1986; Devereux et al., 1987). Такие относительно низкие по-
казатели не должны вызывать удивление, поскольку в наше
время преобладающая часть больных ЭГ находится в 1 стадии за-
болевания, при которой гипертрофия миокарда еще отсутствует
140
Рис. 11. Скорости трансмитрального кровотока у больной С., 64 лет;
АД 210/120 мм рт. ст,—140/90 мм рт. ст. VE/VA = 0,52; Тзам. = 294 м/с.
Диагноз: ЭГ, нарушение активного расслабления миокарда левого желудочка
Рис. 12. Б-ная М-ва, 52 лет. Диагноз: ЭГ, АД = 180/105—130/90 мм рт. ст.
Масса миокарда левого желудочка — 210 г; индекс массы — 105 г/л2;
толщина ЗС и МЖП = 12 мм
либо выражена столь незначительно, что не поддается опреде-
лению.
При М-эхокардиографическом сканировании признаками
гипертрофии служат утолщение задней стенки левого желудочка
(ЗСЛЖ) и (или) межжелудочковой перегородки (МЖП) до вели-
чины, превышающей 10—11 мм. Используя соответствующие
формулы расчета, измеряют индекс массы мышцы левого же-
лудочка, который в норме у мужчин не превышает 134 г/м2,
у женщин — ПО г/м2 (Savage D., 1985; Casale Р. et al., 1986;
Devereux R., 1989) (рис. 12).
2О-эхокардиографическое сканирование тоже используется
для измерения массы левого желудочка (Reichek N., 1987). Полу-
чаемые данные, как и при М-сканировании, хорошо коррелиру-
ют с результатами измерения массы левого желудочка у умерших
больных ЭГ. Нормальная масса левого желудочка не превышает
215 г (рис. 12).
142
D. Savage (1987) выделяет четыре типа левожелудочковой ги-
пертрофии у больных ЭГ. Такое разделение основывается на
использовании трех характеристик: 1) отношение: толщина
ЗСЛЖ/поперечный диаметр левого желудочка в диастоле; 2) от-
ношение: толщина МЖП/толщина ЗСЛЖ; 3) увеличение диа-
метра левого желудочка в конце диастолы (верхняя граница нор-
мы у мужчин 3,1 см/м2, у женщин 3,2 см/м2).
Четыре типа (формы) гипертрофии левого желудочка у боль-
ных ЭГ обозначают следующим образом: 1) концентрическая ле-
вожелудочковая гипертрофия (утолщение стенок на >45% без
расширения полости левого желудочка); 2) диспропорциональ-
ная септальная гипертрофия (отношение толщина МЖП/толщи-
на ЗСЛЖ>1,3); 3) эксцентрическая недилатационная гипер-
трофия (утолщение ЗСЛЖ<45% без расширения полости левого
желудочка); 4) эксцентрическая дилатационная гипертрофия
(утолщение ЗСЛЖ<45% вместе с расширением полости левого
желудочка (рис. 12).
Распределение этих форм у больных ЭГ показано в табл. 4.
Таблица 4
Распределение форм левожелудочковой гипертрофии
у лиц с хроническим повышением АД (по D. Savage, 1987)
Форма левожелудочковой гипертрофии Мужчины, % Женщины, %
1. Концентрическая 45 48
2. Диспропорциональная септаиьная 4 6
3. Эксцентрическая недилатационная 31 33,5
4. Эксцентрическая дилатационная 20 13,5
Если объединить показатели концентрической и эксцентри-
ческой недилатационной гипертрофии, то общее число случаев
гипертрофии левого желудочка без расширения его полости со-
ставит 76% — у мужчин и более 81% — у женщин.
Комментируя эти данные, я прежде всего замечу, что цифры,
приведенные в табл. 4, заметно выше тех, которые были указаны
в начале данного параграфа. Причину различий следует искать в
том, что в наблюдениях D. Savage преобладали больные во
143
II—III стадии ЭГ, тогда как в общей статистике доминировала
группа больных в I стадии заболевания.
Можно также с определенностью утверждать, что у большин-
ства больных в этих развернутых стадиях ЭГ левожелудочковая
гипертрофия протекает без расширения полости левого желудоч-
ка. Его дилатация, свидетельствующая об ослаблении миокарда,
выявилась лишь у 13—20% больных с далеко зашедшей ЭГ.
К этому важному вопросу я возвращусь при обсуждении пробле-
мы «Недостаточность кровообращения у больных ЭГ».
Необходимо сделать добавление, поскольку среди клиници-
стов большое распространение получил эхокардиографический
метод оценки гипертрофии и геометрии левого желудочка у
больных ЭГ, предложенный R. Devereux и соавт. (1992). Эти ис-
следователи основывались на представлениях о ремоделировании
левого желудочка, т. е. о процессе его структурной и функцио-
нальной перестройки, изменениях его геометрии, происходящих
при ЭГ. С этой точки зрения гипертрофия левого желудочка рас-
сматривается как частный случай ремоделирования миокарда.
Классификация ремоделирования левого желудочка у боль-
ных ЭГ была разработана A. Canau, R. Devereux, М. Romon и др.
(1992); они выделили 3 типа изменений левого желудочка: 1) кон-
центрическую; 2) эксцентрическую формы гипертрофии; 3) кон-
центрическое ремоделирование. Кроме того, по предложению
Р. Verdecchia, J. Schillaei (1994) выделяется особая форма ремоде-
лирования, связанная с изолированной (или преобладающей)
гипертрофией межжелудочковой перегородки (асимметрическое
левожелудочковое ремоделирование).
Тип ремоделирования определяют путем измерения индекса
массы миокарда левого желудочка (ИММЛЖ) и относительной
толщины его стенок (ОТС). Последний показатель вычисляют
путем деления суммы толщины межжелудочковой перегородки и
толщины задней стенки левого желудочка на величину конечно-
го диастолического размера (диаметра) левого желудочка. В нор-
ме показатель ОТС<48.
Больные с концентрической гипертрофией левого желудочка
имеют ИММЛЖ выше нормы, а ОТС больше 0,45.
Больные с эксцентрической гипертрофией левого желудочка
имеют ИММЛЖ выше нормы, а ОТС меньше 0,45.
Больные с концентрическим ремоделированием левого желу-
дочка не имеют увеличения ИММЛЖ, а ОТС больше 0,45.
144
Больные с асимметрическим ремоделированием левого желу-
дочка имеют превышение толщины МЖП над толщиной ЗСЛЖ
более чем в 1,5 раза.
Иллюстрацией могут послужить данные, полученные
Е. В. Шляхто, А. О. Конради и др. (1999). Эта группа авторов ис-
следовала структуру левого желудочка у 100 больных ЭГ. У 63
из них АГ оценивалась как мягкая, у 37 — умеренная. Возраст
44 женщин и 56 мужчин колебался от 18 до 59 лет (в среднем
46,2±1 год); длительность АГ от 1 года до 20 лет (в среднем
6,8±0,7 года). К моменту обследования систолическое АД
у больных в среднем равнялось 174±69 мм рт. ст., диастоличе-
ское — 104,1±0,7 мм рт. ст.
По ЭКГ гипертрофия левого желудочка выявлялась у 18 боль-
ных (18%), по результатам эхокардиографии — в 65%, что сопо-
ставимо с данными R. Devereux и соавт. (1986); D. Savage и со-
авт. (1979).
Показатель ИММЛЖ составил у больных с мягкой ста-
дией ЭГ 117±6,0 г/м2; у больных с умеренной стадией заболева-
ния 153,6+6,8 г/м2 (Р<0,01); ОТС соответственно равнялась:
0,38±0,02 и 0,45±0,04 (Р<0,01).
По типам ремоделирования больные распределились следую-
щим образом: нормальная геометрия левого желудочка сохраня-
лась у 24 больных (давность гипертензии 5,2±1,5 года; уро-
вень АД — 142/83 мм рт. ст.), концентрическая гипертрофия —
у 25 больных (давность гипертензии — 6,7+1,3 года, АД —
в среднем 164/98 мм рт. ст.); эксцентрическая гипертрофия —
у 38 больных (давность заболевания 6,9+1,4 года, АД в среднем
173/104 мм рт. ст.); концентрическое ремоделирование —
у 11 больных (давность гипертензии 6,3±1,2 года; АД —
177/105 мм рт. ст.); асимметричная гипертрофия у 2 больных.
Авторы пришли к выводу, что концентрические варианты ре-
моделирования сопровождаются более существенными измене-
ниями диастолической функции левого желудочка. Среднесуточ-
ный уровень АД был связан коррелятивной связью с коэффици-
ентом Е/А и показателем изоволемического расслабления левого
желудочка, что соответствует данным М. Galderisi и соавт. (1996).
Значение среднесуточного АД для прогнозирования тяжести
гипертрофии левого желудочка было также показано в исследо-
ваниях V. Smith и соавт. (1996), Н. Mancia (1990). Ряд авторов,
следуя указанию R. Devereux, утверждают, что концентрическая
145
гипертрофия левого желудочка является наиболее неблагоприят-
ной. Обычно этот тезис декларируется без доказательств. Я пола-
гаю, что эксцентрическая гипертрофия левого желудочка, когда
к гипертрофии присоединяется дилатация левого желудочка, в
большей степени угрожает больному ЭГ развитием сердечной
недостаточности, чем концентрическая гипертрофия, которая,
правда, имеет большую склонность осложняться сердечными
аритмиями. Y. Shigematsu и соавт. (1998) полагают, что тип
гипертрофии левого желудочка обладает предсказующим
значением в отношении развития поражений сетчатки глаза и
почек у больных с АГ.
Что же касается непропорционально большого утолщения
МЖП, то обычно оно не сопровождается обструкцией выходно-
го тракта из левого желудочка, в отличие от идиопатической ги-
пертрофической кардиомиопатии. У больных ЭГ лишь в очень
редких случаях наблюдается переднесистолическое движение
створки митрального клапана, что, в частности, приходилось ви-
деть нашим сотрудникам Т. Н. Новиковой и В. И. Новикову
(1994). При очень тяжелом течении ЭГ диспропорциональная
форма гипертрофии МЖП встречается чаще (Шхвацабая И. К.,
1976; Tochima Н. et al., 1975; Новикова Т. Н., 1995).
Аускультация сердца (фонокардиография)
По мере нарастания гипертрофии левого желудочка у боль-
ных ЭГ уменьшается громкость I тона у верхушки сердца; здесь
же у части из них слышится систолический шум митральной ре-
гургитации, связанный с кальцинозом кольца митрального кла-
пана и основания его створок. Как показали наблюдения нашего
сотрудника А. А. Балябина (1989), этот шум имеет локальный ха-
рактер, он редко распространяется в левую подмышечную об-
ласть и в другие участки; иногда этот шум приобретает музы-
кальный характер. Шум митрального кальциноза слышится пре-
имущественно у пожилых больных ЭГ, чаще у женщин (Куша-
ковский М. С., Балябин А. А., 1990).
Частой находкой, как упоминалось, бывает IV (предсердный)
тон, который регистрируется почти у каждого второго больного
во II—III стадии ЭГ. Появление IV тона связано с усилением
предсердной систолы, что является следствием уменьшения ак-
тивного диастолического расслабления левого желудочка и его
гипертрофии.
146
Ill (желудочковый) тон встречается примерно у 30% боль-
ных ЭГ; у части из них глухой III тон слышится в течение пер-
вых нескольких систол, а затем исчезает. У других больных
III тон становится постоянным и более высоким по тембру, что,
по-видимому, отражает факт повышения конечного диастоличе-
ского давления в левом желудочке.
Хорошо известный признак повышения АД — акцент II тона
на аорте. Если он приобретает музыкальный (тимпанический)
оттенок, то это служит свидетельством тяжести и длительности
гипертензии, а также уплотнения стенок аорты. Кроме того, во
2-м межреберье, справа у грудины, чаще у пожилых больных,
особенно женщин, выслушивается систолический шум выброса,
связанный с фиброзом или кальцинозом кольца аортального
клапана и основания его полулуний (Балябин А. А., 1989).
Электрокардиограмма у больных ЭГ
Электрокардиограмма больного ЭГ отражает сложный комп-
лекс изменений, происходящих в миокарде. Среди них основное
значение имеет увеличение мышечной массы (гипертрофия), не-
достаточность венечного кровообращения (кардиосклероз). Кро-
ме того, на электрические процессы в сердце оказывают влияние
колебания АД, нейрогенные стимулы, гипокалиемия, гипотен-
зивные средства и т. д.
В практической работе очень важно уметь разграничивать бо-
лее устойчивые элементы «гипертензивной кривой» от преходя-
щих ее изменений, которые в определенные периоды болезни
приобретают решающее значение. Быстрое нарастание электро-
кардиографических признаков гипертрофии левого желудочка
или нагрузки на него, усиливающие смещение электрической
оси влево, появление признаков блокады передневерхнего раз-
ветвления левой ножки, исчезновение зубца q нужно рассматри-
вать как доказательства недостаточной эффективности лекарст-
венного лечения ЭГ.
По мере прогрессирования ЭГ и стабилизации высокого АД
изменения ЭКГ углубляются, и эта эволюция имеет характерную
направленность. Следовательно, можно говорить о существова-
нии некоторого параллелизма между выраженностью электро-
кардиографических нарушений и тяжестью заболевания. Опре-
147
деленную зависимость удается также установить между характе-
ром изменений ЭКГ и показателями гемодинамики.
Исходя из этих предпосылок, я предложил (1979, 1982) раз-
личать 5 основных типов ЭКГ при ЭГ. К этому следует добавить,
что у 10—15% больных, преимущественно в начале заболевания,
ЭКГ остается нормальной (Сумароков А. В., Михайлов А. А.,
1975).
К / типу «гипертензивной кривой» я отношу ЭКГ с высоко-
амплитудными, симметричными зубцами Т в левых грудных от-
ведениях, в отведениях I, aVL. Я называю такую ЭКГ «гипер-
норадренергической». У больных в это время выявляются гемо-
динамические признаки изотонической гиперфункции левого
желудочка, т. е. увеличение МО сердца на фоне только относи-
тельного повышения ОПС.
II тип ЭКГ можно наблюдать у больных с устанавливающей-
ся изометрической гиперфункцией левого желудочка. МО сердца
у многих из них уже нормален, ОПС умеренно повышено. При
таком гемодинамическом режиме на ЭКГ в большей или мень-
шей степени находят отражение: а) гипертрофия «путей оттока»
левого желудочка и начинающееся увеличение его общей мы-
шечной массы; б) ухудшение диастолической функции левого
желудочка; в) усиливающееся участие левого предсердия в
функции левого желудочка. Не следует, однако, ожидать у каж-
дого больного всех этих электрокардиографических признаков
(рис. 13).
Гипертрофия «путей оттока» может проявиться, во-первых,
увеличением амплитуды зубца Q в левых грудных отведениях
(Журавлева Н. Б., 1972); во-вторых, уплощением, двухфазностью
(—Ь) или неглубокой неравносторонней инверсией зубца Т в от-
ведении aVL (при вертикальной позиции сердца — в отведении
aVF). Последний признак иногда бывает единственным и наибо-
лее ранним указанием на начинающуюся гипертрофию функ-
ционально напряженных участков миокарда левого желудочка.
Аналогичное значение имеют такие признаки, как уменьшение
амплитуды зубца Г в отведении Vg и синдром ZVpTVg.
Изменения зубца Р могут быть первыми симптомами пере-
стройки миокарда, подвергающегося хроническому повышению
АД. Как показала наша сотрудница И. И. Якубович, увеличение
объема левого предсердия в пределах от 33,2 до 83,2 см3 (норма
22,3±6,2 см3) отмечается у 89,1% больных ЭГ. Оно в существен-
148
Рис. 13. ЭКГ при ЭГ: а — тип I; б — тип II; в — тип III
(объяснение в тексте)
ной мере зависит от ослабления активной диастолы левого желу-
дочка, развивающегося еще до гипертрофии его стенок; это час-
то сочетается, как упоминалось, с появлением IV (предсердного)
тона сердца у верхушки.
149
Ill тип электрокардиографических изменений при ЭГ возни-
кает у больных с отчетливым увеличением мышечной массы ле-
вого желудочка, хотя его гипертрофия все еще носит преимуще-
ственно концентрический характер. Важнейшим признаком ле-
вожелудочковой гипертрофии становится возрастание амплиту-
ды комплекса QRS с отклонением его суммарного вектора кзади
и влево. Часто для оценки этого показателя используются раз-
личные количественные индексы, которые в неясных случаях
облегчают распознавание гипертрофии, хотя, конечно, не сле-
дует переоценивать их чувствительность и специфичность
(рис. 13).
Наряду с изменениями периода деполяризации у больных на
ЭКГ видны более отчетливые нарушения конечной части желу-
дочкового комплекса: уплощение или двухфазность (-+) зуб-
цов Т в отведениях I, aVL, V5.6, иногда сочетающиеся с неболь-
шим смещением сегмента ST книзу. В отведениях III, aVR, Vi-з
деформации имеют дискордантную направленность. Изменения
ЭКГ при этом типе не всегда бывают стабильными, они сглажи-
ваются в результате систематического и активного лечения забо-
левания. По некоторым данным, понижение систолического
давления более тесно коррелирует с уменьшением вольтажа зуб-
ца А в отведении aVL и угла QRS—T во фронтальной и горизон-
тальной плоскостях. Понижение диастолического давления в бо-
льшей мере проявляется уменьшением величины Svi + RV5.6 и
угла QRS—Тъо фронтальной плоскости.
IV тип «гипертонической ЭКГ» характерен для больных с
развернутой клиникой и более тяжелым течением ЭГ (рис. 14).
МО сердца нередко у них понижен по сравнению с индивиду-
ально-должной величиной, ОПС очень высокое, отчетливо сни-
жена функция аортальной компрессионной камеры. Под воздей-
ствием хронической нагрузки сопротивлением гипертрофия ле-
вого желудочка становится явно эксцентрической, т. е. расширя-
ется и полость желудочка.
Электрокардиографическая картина пополняется рядом при-
знаков. Помимо высокоамплитудных комплексов QRS в левых
отведениях можно наблюдать увеличение их продолжительности
более 0,10—0,11 с, а также времени внутреннего отклонения в
отведениях (больше 0,05 с), более резкое отклонение элект-
рической оси QRS влево. Переходная зона смещается к правым
грудным отведениям. В некоторых случаях исчезает начальный
150
зубец г в отведении Vj.2 (реже в V3) с образованием глубоких комп-
лексов QS. По аналогии с тем, что иногда бывает у больных с не-
достаточностью клапанов аорты, этот признак можно связать
не только со значительным преобладанием потенциалов левого
желудочка, но и с фиброзом межжелудочковой перегородки.
Особенно большие изменения претерпевает конечная часть
желудочкового комплекса. Заметно возрастает расхождение век-
торов ST и QRS. В отведениях I, aVL, V5.6 сегменты ST смещены
книзу от изоэлектрической линии с дугообразной выпуклостью,
обращенной вверх. В отведениях III, aVR, V1.3 эти сегменты сме-
щаются кверху от изоэлектрической линии с вогнутостью, обра-
щенной вниз. Степень депрессии сегментов ST варьирует у раз-
ных больных, в ряде случаев она достигает 2—3 мм. Выраженное
отклонение вектора зубца Т вправо и вперед сопровождается ин-
версией этих зубцов в отведениях I, aVL, V5.6 и увеличением их
амплитуды в «дискордантных» отведениях. Зубцы Т неравносто-
ронние, часто двухфазные (-+). Разнонаправленность векторов
QRS и Т проявляется значительным расхождением электриче-
ских осей QRS и Т, угол между которыми превышает 120—150°.
Не следует забывать, что эти изменения реполяризации возника-
ют вторично по отношению к уширенному и увеличенному ком-
плексу QRS (правило желудочкового градиента).
V тип ЭКГ занимает особое место, поскольку на его форми-
рование большое влияние оказывают прогрессирующий корона-
рокардиосклероз и другие осложнения ИБС. Вместо увеличения
можно видеть уменьшение амплитуды комплексов 0R5, а также
следы коронарных эпизодов (инфаркт миокарда и т. д.) и раз-
личные нарушения внутрижелудочковой проводимости. У ряда
больных, как и при предыдущих типах ЭКГ, отклонение элект-
рической оси QRS левее -30° связано с блокадой передневерхне-
го разветвления левой ножки как в его перегородочной, так и в
дистальной области. Правда, присоединение коронарокардио-
склероза не всегда приводит к искажению «гипертензивной»
ЭКГ (рис. 14).
Специального обсуждения заслуживает вопрос о терминах
«перегрузка», «перенапряжение» левого желудочка, широко ис-
пользуемых в практической работе. К такому заключению обыч-
но склоняются, если на ЭКГ: а) усиливается смещение книзу
сегмента ST и (или) его изгиб приобретает вогнутый вид; б) ин-
вертированные зубцы Т становятся заостренными и симметрич-
151
I
Рис. 14. ЭКГ при ЭГ: а — тип IV; б — тип V; рубцовые изменения после
инфарктов миокарда (отведение II, III, aVF, V3_4); объяснение в тексте
ними; в) переходная зона в грудных отведениях смещается еще
заметнее вправо. В общем, изменения ST—T комплекса пред-
ставляются более значительными, чем следовало бы ожидать по
правилу желудочкового градиента. Допускают, что при этих об-
стоятельствах левый желудочек «перегружен», его мышца «пере-
152
напряжена», «истощена», она работает на пределе своих возмож-
ностей.
Еще F. Wilson обратил внимание на неточность и условность
этих терминов, поскольку электрокардиографические признаки
так называемого перенапряжения левого желудочка могут сохра-
няться у больных ЭГ многие годы без развития у них сократи-
тельной недостаточности миокарда. При сравнении показателей
гемодинамики в покое и при физической нагрузке у больных ЭГ
с нормальным периодом реполяризации на ЭКГ и с типичными
электрокардиографическими признаками «перегрузки» левого
желудочка выявляется, что в обеих группах больных УО и МО
сердца возрастают практически в одинаковой степени в ответ на
физическую нагрузку, если больные не страдают хронической
ИБС.
Причины дополнительных изменений ST—T комплекса у
ряда больных при возрастании АД следует искать прежде всего в
биохимическом звене регуляции электрических процессов в клеточ-
ных мембранах (распределение ионов Са++, К+ между субэндо-суб-
эпикардиальными мышечными слоями, содержание норадре-
налина, АП, других активных пептидов и т. д.) (Кушаков-
ский М. С., 1975, 1992, 2001; Surawicz В. et al., 1975).
По нашему мнению, терминам «перегрузка», «перенапряже-
ние» левого желудочка следует предпочесть хотя и близкие, но
более точные названия: «увеличившаяся нагрузка», «гиперфунк-
ция», «уменьшившаяся нагрузка» и т. д. Например, гипертрофия
левого желудочка IV типа с признаками увеличившейся на него
нагрузки.
Столь же осторожно следует подходить к трактовке некото-
рых изменений реполяризации у больных ЭГ как проявлению
ишемии переднебоковой стенки левого желудочка. Это заключе-
ние часто обосновывают тем, что отрицательные зубцы Г фор-
мируются не только в отведениях V5.6 (где им предшествуют вы-
сокие зубцы R), но и в отведениях V4 и даже в отведении V3, где
им может предшествовать комплекс RS или rS. Как справедливо
замечает наша сотрудница Н. Б. Журавлева, такая «очаговость»,
или ишемия, нередко зависит от значительного отклонения век-
тора Т вправо и вверх в результате вторичных, а не первичных
изменений реполяризации в мышце левого желудочка. Многие
из таких больных не испытывают болей в сердце ни в покое, ни
по время привычных для них физических усилий. При велоэрго-
153
метрических пробах они способны выполнять значительную ра-
боту без развития ангинозного приступа (Хейфец 3. Н., 1976;
Смирнов Г. Б., 1994). Более того, у части больных физическая
работа приводит к восстановлению нормальной полярности зуб-
цов Т и переходу нисходящего сегмента ST в изоэлектрический
или восходящий (Хоменко В. Л., 1974; Смирнов Г. Б., 1994). Ра-
зумеется, речь не идет о больных ЭГ с устойчивым и очень высо-
ким АД, часто имеющих сужения венечных артерий сердца, что
проявляется «скрытой» ишемией (при мониторировании ЭКГ)
либо ангинозным синдромом.
Итак, дифференциация «нагрузочных», «дистрофических»
изменений конечной части желудочкового комплекса от их ис-
тинных ишемических «двойников» должна основываться на ком-
плексном учете прежде всего клинических данных (стенокар-
дия!) и, разумеется, результатов велоэргометрической пробы
либо коронарографии.
К рассматриваемой проблеме имеет отношение и вопрос об
изменениях ST—T комплекса у больных ЭГ, принимающих сер-
дечные гликозиды. Эти препараты тоже могут имитировать «пе-
регрузку» и «ишемию» миокарда. В практической работе вновь
следует учитывать клинические данные, а также то немаловаж-
ное обстоятельство, что при дигитализации интервал Q—T
постепенно укорачивается по сравнению с должным, при гипер-
трофии левого желудочка этот интервал, скорее, удлиняется.
В оценке состояния миокарда у больных ЭГ важное место от-
водится характеристике зубца С/.
а) Конкордантное увеличение амплитуды зубцов Т и U в
грудных отведениях обычно вызывается избыточными р-адре-
нергическими воздействиями на миокард; б) конкордантная ин-
версия зубцов Ти U или T—Uсоединения в левых грудных отве-
дениях нередко носит вторичный характер по отношению к уве-
личенному комплексу QRS. Однако более глубокая, или изоли-
рованная, инверсия зубца U и (или) T—U соединения может
быть связана с ишемией субэндокардиального мышечного слоя.
Для тяжелой ишемии субэндокарда особенно типично сочетание
инверсии TU—U комплекса с поздними систолическим кликом
и систолическим шумом. Это должно служить указанием на
ишемическую дисфункцию папиллярной мышцы и регургита-
цию крови в левое предсердие («папиллярный клик-синдром»);
в) возрастание амплитуды зубцов U с одновременным уплощени-
154
ем или инверсией зубцов Т наблюдается у больных ЭГ при гипо-
калиемии, вызванной длительным приемом салуретиков. Отно-
шение U/T начинает превышать 0,35 (в одном и том же отведе-
нии), высота зубца U в каком-либо из отведений >1 мм, форми-
руются сливные зубцы Т+U; в левых грудных отведениях
выпуклая «гипертрофическая» форма смещенного книзу сегмен-
та ST приобретает вогнутый вид; в правых грудных отведениях
сегменты ST располагаются ниже изоэлектрической линии, тог-
да как при гипертрофии левого желудочка без гипокалиемии они
подняты над этой линией.
В заключение следует кратко описать изменения ЭКГ при
острых нарушениях мозгового кровообращения, осложняю-
щих ЭГ. В 1954 г. Е. Burch и соавт. описали картину «элект-
рокардиографического синдрома мозгового инсульта». В 70-х го-
дах эта проблема была предметом клинического исследования
Б. В. Ильинского и С. П. Астраханцевой (1971). Изменения ЭКГ
были обнаружены у 65,5% больных. Они появлялись с первых
часов развития инсульта и достигали максимальной степени к
концу первых-началу вторых суток.
Авторы нашли возможным выделить при этих состояниях
6 типичных вариантов деформации конечной части желудоч-
кового комплекса. Первый вариант (в 23,7% случаев) — увеличе-
ние амплитуды зубцов Т и U, их частичное слияние; второй ва-
риант — уменьшение амплитуды зубцов Т при одновременном
повышении зубцов U; третий вариант — инверсия зубцов Г вме-
сте с возрастанием высоты зубцов U; четвертый вариант — пол-
ное слияние зубцов Т и U с образованием гигантских положи-
тельных и отрицательных зубцов; пятый вариант — изолирован-
ное увеличение амплитуды зубцов U; шестой вариант, или «тер-
минальный», — тахикардия, увеличение и заострение зубцов Р
в отведениях II, III, aVF, отчетливое снижение сегментов ST,
инверсия или двухфазность (-+) зубцов Т во всех отведениях.
В отличие от инфаркта миокарда, у больных с мозговым ин-
сультом отсутствуют изменения комплексов QRS и куполооб-
разный подъем сегмента ST. Деформация комплексов ST—T—U
очень лабильна, при благоприятном течении инсульта к 3—5—
7-му дню происходит восстановление нормальной формы и по-
лярности зубцов.
Авторы пришли к обоснованному выводу, что причиной на-
рушения реполяризации при мозговых инсультах являются из-
155
быточные адренергические воздействия на сердце и гипокалие-
мия. Это — крайнее выражение острой нейрогенной дистрофии
миокарда (кардиомиопатии).
Эссенциальная гипертензия и ИБС
Выше этот вопрос частично рассматривался; его ведущее
клиническое значение побуждает нас сделать дополнительные
замечания. Несомненно, что сама по себе гипертрофия миокарда
создает основу для появления, при неблагоприятных обстоятель-
ствах, его ишемии, и в этом смысле она рассматривается как
«фактор риска» ИБМ. Скрытую («немую») ишемию неоднократ-
но документировали у больных ЭГ при мониторной регистрации
ЭКГ (Феофанов Т. Ф., Юренев А. П., 1992).
Вместе с тем, ЭГ сопровождается прогрессирующим атеро-
склерозом венечных артерий сердца. Некоторые исследователи
склонны видеть в таком сочетании близость (даже идентичность)
этиопатогенетических факторов ЭГ и ИБС, что, по-видимому,
не соответствует истине, хотя бы потому, что ИБС неред-
ко развивается у больных, не имеющих по-
вышения дд. Известно также, что понижение АД отнюдь
не всегда приводит к регрессу атеросклероза, к улучшению
коронарного кровообращения и уменьшению смертности от
ИБС. Последовательное увеличение смертности от сердечно-
сосудистых заболеваний наблюдается с повышением АД на
каждые 10 мм рт. ст. от уровня 110/70 мм рт. ст. (Chin D.,
Richardson Р., 2000).
Отрицательное же влияние ЭГ на разви-
тие и течение коронаро атеро с клероза не
вызывает сомнения (Азизов А. А. и др., 1993). Соглас-
но многолетним наблюдениям в г. Фремингейме (США), у лиц
обоего пола в возрасте от 39 до 59 лет с уровнем систолическо-
го давления выше 160 мм рт. ст. риск заболеть ИБС увеличива-
ется в 3—4 раза по сравнению с нормотониками того же воз-
раста. В группе мужчин, имевших систолическое давление
160 мм рт. ст. и выше, случаи внезапной (коронарной) смерти
регистрировалась в 3 раза чаще, чем среди мужчин с систоличе-
ским давлением ниже 140 мм рт. ст. По данным А. М. Вихерта и
Е. Е. Матовой (1972), у мужчин, страдавших ЭГ и умерших от
разных причин на пятом десятилетии жизни, стенозы венечных
156
артерий встречались в 2 раза чаще, чем у людей той же возраст-
ной группы с нормальным АД.
ЭГ оказывает существенное влияние на течение и исходы ин-
фаркта миокарда. Из 609 больных острым инфарктом миокарда,
наблюдавшихся A. Beck и L. Hochrein (1974), ЭГ страдали
285 человек (47%). У больных ЭГ течение острой стадии инфарк-
та миокарда чаще осложнялось недостаточностью кровообраще-
ния, отеком легких. Больничная летальность оказалась у них
выше, особенно у мужчин, а также, независимо от пола, — у лиц
старше 60 лет. И. Е. Ганелина (1974) отмечала развитие отека
легких при остром инфаркте миокарда в 3,1 раза чаще в группе
больных ЭГ. А. С. Сметнев (1971) тоже пришел к выводу, что
отягчающая роль ЭГ у больных острым инфарктом миокарда,
осложнившимся кардиогенным шоком, проявляется в более час-
том сочетании шока с острой сердечной недостаточностью, про-
текающей с выраженным застоем в малом круге кровообра-
щения.
Сохранение высокого АД после развития острого инфаркта
миокарда, по-видимому, способствует учащению разрывов мио-
карда. Женщинам при наличии у них ЭГ сравнительно чаще гро-
зит смерть от внезапно начинающейся фибрилляции желудочков
(Ганелина И. Е., 1970).
Нарушения сердечного ритма и проводимости у больных ЭГ;
угроза внезапной смерти
В свое время Г. Ф. Ланг (1950) обратил внимание на относи-
тельную редкость сердечных аритмий при ЭГ. Е. М. Тареев
(1972), солидаризуясь с такой точкой зрения, подчеркивал, что
даже при злокачественном течении ЭГ экстрасистолия и мерца-
тельная аритмия — не столь частые находки.
Однако современная клиническая практика не дает основа-
ний для столь оптимистических заключений. Об этом, в частно-
сти, свидетельствуют наблюдения наших сотрудников, сделан-
ные в противоаритмическом центре Ленинграда (Иванова Н. В.,
Реброва Г. А., 1990). За период с 1984 по 1989 г. в центре наблю-
дались 3165 больных ЭГ с различными формами нарушения сер-
дечного ритма и проводимости, что составило 35,6% от всех кар-
диологических больных, страдавших аритмиями и блокадами.
Варианты аритмий (блокад), встретившиеся у больных ЭГ, при-
ведены в табл. 5.
157
Таблица 5
Варианты сердечных аритмий у больных ЭГ
Вид аритмий (блокады) Число наблюдений % от общего числа аритмий
Пароксизмы фибрилляции и трепетания предсердий 1107 35,0
Хроническая форма фибрилляции предсердий 179 5,7
Предсердная экстрасистолия 691 21,7
Желудочковая экстрасистолия 659 20,6
Наджелудочковые тахикардии 176 5,5
АВ блокады 1—2 степени 353 Н,4
Как видно, в наблюдениях нашей клиники у больных ЭГ
явно преобладали предсердные аритмии, особенно пароксизмы
фибрилляции и трепетания предсердий. Нам неоднократно при-
ходилось видеть, как даже после однократного приема диуретика
(включая триампур) у больных ЭГ обильный диурез заканчивал-
ся развитием пароксизма мерцательной аритмии.
Подавляющее большинство больных, указанных в табл. 5,
страдали III стадией ЭГ (65,1%), реже аритмии встречались во
II стадии заболевания (28,9%), и особенно редко в I стадии (6%).
Случаи хронической фибрилляции предсердий в основном на-
блюдались у лиц пожилого возраста (в среднем 78 лет). Больные
ЭГ с зарегистрированной экстрасистолией и АВ блокадами (уз-
ловыми) относились к средней возрастной подгруппе (60—
62 года).
Итак, в отличие от 50—60-х годов, в 80—90-х годах больные
ЭГ совсем нередко переносят аритмические эпизоды. Вероятно,
такие неблагоприятные перемены связаны с более широким рас-
пространением ИБС и, вообще, с возрастанием частоты аритмий
в популяции. Несомненно также, что отрицательную роль сыгра-
ло и неограниченное применение диуретиков (комбинированные
препараты) при лечении этих больных: диуретические средства в
больших дозах способствуют потере ионов К+ и Mg++, развитию
метаболического алкалоза, т. е. повышают аритмогенный потен-
циал сердца. Бесконтрольный прием «старых» симпатолитиков
158
(резерпин, допегит, клофелин и др.), сердечных гликозидов по-
жилыми больными ЭГ приводит к брадикардии, паузам, за кото-
рыми нередко следуют пароксизмы тахисистолии (Кушаков-
ский М. С., 1992).
Что же касается анатомической основы для аритмий, то она,
практически, всегда имеется у больных II—III стадии заболева-
ния. Здесь на первый план выдвигаются гипертрофия миокарда
и коронаросклероз, затем рано возникающие расширение левого
предсердия, внутрисердечные дегенеративные кальцинозы, ла-
тентные дисфункции СА узла.
Может вызвать удивление редкость тяжелых желудочковых
тахиаритмий в наших наблюдениях. Известно, что левожелудоч-
ковая гипертрофия является достоверным независимым факто-
ром риска смертности больных ЭГ (наряду с ИБС) (Bornani N.,
1987). Все погибшие в нашей клинике от злокачественных желу-
дочковых аритмий больные имели выраженное сужение венеч-
ных артерий сердца, что и расценивалось как ведущая причина
их смерти.
Недостаточность кровообращения у больных ЭГ
Сравнительно недавно было показано, что отдельные кар-
диомиоциты, выделенные из гипертрофированного сердца моло-
дых крыс наследственной гипертензивной линии, обладают спо-
собностью к усиленному сокращению. Эти данные согласуются
с результатами ранее проведенных измерений сократительной
силы папиллярных мышц у крыс той же линии SHR (Норе Н.,
1987).
Конечно, перенос представлений от одной клетки на весь
миокард проблематичен, но в принципе он допустим. Следова-
тельно, можно утверждать, что гипертрофия миокарда, особенно
в ее начальных стадиях, служит защитным адаптивным механиз-
мом в условиях хронической избыточной нагрузки на сердце,
вызываемой повышением АД (Brookly Р. et al., 1992).
В то же время известно, что левожелудочковая гипертрофия
является одним из ведущих «факторов риска» развития недоста-
точности миокарда как у больных ЭГ, так и при других заболева-
ниях сердца. Результаты фремингеймского исследования, прово-
дившегося на устойчивой группе людей с 1949 по 1986 г., показа-
ли, что повышение АД может способствовать формированию
хронической застойной сердечной недостаточности (Kannel W.,
159
Belanger A., 1991). Правда, позже те же исследователи отметили
существенное понижение роли АГ в развитии недостаточности
сердца, что они связывали с прогрессом, достигнутым в лече-
нии ЭГ.
J. Tecrlink и соавт. (1991) обобщили данные о 1861 больном с
хронической застойной сердечной недостаточностью, о которых
имелись соответствующие сведения в 31 статье, опубликованной
в ведущих кардиологических журналах в 80—90-х годах. Средний
возраст этих больных составил 54,2 года. Среди причин недоста-
точности кровообращения на долю АГ пришлось только 3,8%.
Еще в 1982 г. я склонялся к тому, что общая формула, со-
гласно которой ЭГ ведет к застойной сердечной недостаточно-
сти, не характеризует ни частоты, ни темпов развития этого
осложнения. Значительная часть больных ЭГ даже при устойчи-
вом повышении АД многие годы сохраняет физическую актив-
ность и способность выполнять свои служебные обязанности.
Эти люди в обычных условиях жизни мало страдают от одышки
и слабости.
Застойная недостаточность кровообращения нетипична для
медленно прогрессирующих и неосложненных форм ЭГ. Лишь
присоединение к АГ инфаркта миокарда,
стенозирующего к о р о н а р о с к л е р о з а , сахар-
ного диабета, тяжелой инфекции, и особен-
но пароксизмов фибрилляции предсердий,
приводит к развитию застойного синдрома
с приступами удушья, увеличением печени
и отеками. Резкое ослабление гипертрофированного мио-
карда наблюдается также у больных ЭГ при развитии злокачест-
венного гипертензивного синдрома, и особенно у стариков, у ко-
торых имеется резкое нарушение диастолической функции лево-
го желудочка при сохраненной (или даже супернормальной) его
систолической функции (Topol Е. et al., 1985); у этих больных
нередко развивается состояние, получившее название гипертен-
зивной гипертрофической кардиомиопатии. В таких случаях кар-
диогемодинамика ухудшается при приеме диуретиков и прямых
вазодилататоров (гидралазин и др.). Напротив, на р-адренобло-
каторы и антагонисты Са больные реагируют лучше, поскольку
эти препараты улучшают диастолическую функцию левого желу-
дочка. Здесь уместно напомнить указание С. Friedberg (1966) о
том, что сердечная недостаточность «при гипертонической болезни
160
сердца почти всегда связана с тяжелым коронарным атероскле-
розом».
Оценивая механическую деятельность сердца у больных ЭГ,
Г. Ф. Ланг различал три периода: 1) период компенсации; 2) пе-
риод изолированной недостаточности левого желудочка; 3) пери-
од недостаточности всего сердца. Эта периодизация была нами
несколько расширена (Кушаковский М. С., 1982).
Руководствуясь практическими соображениями, мы выдели-
ли пять периодов, характеризующих процесс постепенного и
прогрессирующего ослабления сократительной функции миокар-
да у больного ЭГ.
Первый из этих периодов — период компенсации; второй —
период пониженной переносимости физических нагрузок; тре-
тий — период хронической, еще умеренной левожелудочковой
недостаточности; четвертый — период ночной пароксизмальной
одышки и приступов отека легких; пятый — период двусторон-
ней застойной сердечной недостаточности. Разумеется, при
оценке состояния миокарда у больных ЭГ можно пользоваться
н ь ю-й оркской классификацией сердечной
недостаточности.
Итак, у больных ЭГ сердечная недостаточ-
ность возникает прежде всего в результате
нарушения диастолической функции лево-
го желудочка, что особенно характерно для
стариков. Снижение систолической функции левого желу-
дочка следует за его диастолической дисфункцией либо есть
следствие указанных выше осложнений (инфаркт миокарда,
фибрилляция предсердий и т. д.) или присоединения других за-
болеваний (сахарный диабет и др.).
Состояние крупных артерий;
разрывы аорты, ее расслаивающая аневризма при ЭГ
Артериальная система — сложная сеть эластических трубок,
переходящих в сосуды преимущественно мышечного типа, за-
канчивающиеся резистивными сосудами и капиллярами. Арте-
рии эластического типа функционируют как «трубопроводы» и
амортизаторы, продвигая кровь с минимальной потерей давле-
ния по направлению к резистивным сосудам и демпфируя (сгла-
живая) значительные колебания АД, вызываемые интермиттиру-
ющими сокращениями сердца. Выброс крови левым желудочком
6 Зак 3207
161
генерирует пульсовую волну, т. е. распространяющуюся волну
давления. Такая сложная система может быть описана законо-
мерностями работы растяжимой эластической камеры (Windkes-
sel) — концепцией, выдвинутой О. Frank (1926), а затем глубоко
исследованной Н. Н. Савицким (1949—1962).
Под влиянием хронического повышения АД эластические
артерии становятся жестче, ригиднее; податливость их стенок
(compliance) понижается. Кроме структурных изменений (потеря
эластичности) уплотнению сосудов способствует повышение мы-
шечного тонуса, свойственное больным АГ. Каротидные артерии
у крыс гипертензивной линии SHR заметно ригиднее, чем у
крыс нормотензивной линии WKY (Kaputo L. et al., 1992). При
ЭГ и старении человека, благодаря аналогичным процессам, воз-
растает уровень систолического давления, снижается диастоли-
ческое давление и изменяется форма пульсовой кривой (Савиц-
кий Н. Н., 1948; Мошкин Е. А., 1958; Levy В., Million J., 1992).
Достоверное снижение податливости артерий, определяемое
по величине модуля эластичности Юнга и коэффициенту
УО/пульсовое давление, выявляется у больных АГ сравнительно
рано (Хаютин В. М., 1964; Гуревич М. И. и др., 1988). Надо также
учитывать, что между АД и объемом артерий нет линейной зави-
симости (Safar М., 1990). Именно поэтому внимание исследовате-
лей привлекает не только стандартный контроль за уровнем АД,
но и состояние сосудистых стенок, в частности податливость ар-
териальных сосудов. В нашей стране это направление развивали
А. Г. Полотебнов (1869) в клинике С. П. Боткина, М. И. Хвили-
вицкая (1929), а затем Н. Н. Савицкий и его ученики.
Дифференцированное воздействие противогипертензивных
средств на ригидность стенок артерий и системное АД должно
учитываться в клинике, что может сыграть важную роль в пред-
отвращении или уменьшении степени повреждения сосудов и,
значит, органов-мишеней. Здесь уместно напомнить, что немно-
гие противогипертензивые препараты, такие как Са-блокаторы,
ингибиторы АПФ и кетансерин, способны улучшать растяжи-
мость аорты и ее ветвей.
ЭГ является причиной 94% случаев расслаивающей аневризмы
(гематомы) аорты; у женщин разрывы аорты случаются в 2 раза
реже, чем у мужчин. Если учесть, что нормальная стенка вос-
ходящей аорты способна выдержать давление разрыва до
2500 мм рт. ст., то станет очевидным, что у больных ЭГ наруше-
162
ние целостности сосуда происходит на фоне выраженных струк-
турных изменений его стенки (атеросклероз, повреждение vasa
vasorum, возрастание ригидности). Возможно, что во время ги-
пертензивных кризов, осложняющихся разрывами аорты, ее
стенки подвергаются добавочным повреждениям от избытка ка-
техоламинов и других прессорных веществ (Смоленский В. С.,
1964). Надрыв аорты обычно локализуется над клапанами аорты.
В сложной и быстро изменяющейся клинике расслаивающей
аневризмы аорты выделяют три основные фазы (Лапинер М. Я.,
1969; Levy В., Mallin J., 1992). Первая, или начальная, фаза прояв-
ляется остро нарастающими и исключительно интенсивными
(раздирающими) болями в грудной клетке, преимущественно за
грудиной с последующим их распространением в руки, шею,
спину вдоль позвоночника, живот — по мере перехода рас-
слаивания с восходящей части аорты на другие ее отделы. Хотя
общая картина болезни в это время напоминает коллапс (блед-
ность, тахикардия, одышка), уровень АД остается довольно
высоким. На ЭКГ обычно отсутствуют признаки,
типичные для острого инфаркта миокарда. За
счет сдавления окружающих тканей и сужения сосудов, отходя-
щих от аорты, возникает многообразная симптоматика: различ-
ные неврологические нарушения, вплоть до параплегии, колико-
образные боли с гематурией, а иногда с развитием анурии, рез-
кие боли в животе, сопровождающиеся кровавой рвотой, меле-
ной, кишечной непроходимостью. При стенозировании крупных
артерий может появиться систолический шум; неполное закры-
тие аортального отверстия приводит к возникновению диастоли-
ческой регургитации (шум).
Вторая фаза в течение процесса расслаивания стенки аорты
характеризуется относительной ремиссией: уменьшаются боли,
несколько сглаживаются компрессионные симптомы. Однако
вскоре заболевание переходит в третью фазу, которая также
бывает весьма многообразной, в зависимости от того, в каком
участке аорты происходит разрыв адвентиции. Например, при
кровоизлиянии в сердечную сорочку развивается острая тампо-
нада сердца. Общим же признаком этой фазы является падение
объема крови за счет массивного кровотечения. Половина боль-
ных умирает в течение первых 24 ч. Только 9% больных живут
около полугода. С помощью современных лекарственных
средств, быстро понижающих АД, иногда удается продлить
163
жизнь больным (до 1 года) или подготовить их к эффективной
хирургической операции. В последние годы, благодаря успешной
гипотензивной терапии, число случаев разрыва аорты понизи-
лось.
ПОВРЕЖДЕНИЯ ЦНС ПРИ ЭГ
Некоторые сведения по патофизиологии
Функциональные и органические изменения сосудов голов-
ного мозга и связанная с ними симптоматика занимают ведущее
место в клинической картине ЭГ. Именно отсюда ис-
ходит главная угроза жизни или тяжелой
инвалидизации больных ЭГ. Поэтому поддержание
церебрального кровотока является важнейшим условием нор-
мальной деятельности головного мозга. Один из важнейших ме-
ханизмов, поддерживающий на артериоллярном уровне его по-
стоянство, несмотря на колебания АД, получил название ауторе-
гуляции мозгового кровообращения.
Сущность этого процесса состоит в том, что в период, когда
системное АД резко возрастает, резистивные сосуды мозга под-
вергаются сужению (спазму), защищая тем самым капиллярную
сеть от прямого воздействия высокого АД. В период же, когда
системное АД заметно понижается, резистивные сосуды мозга
расширяются, способствуя усилению капиллярного кровотока.
У нормотоников нижний предел ауторегуляции составляет
60—70 мм рт.ст. (для системного среднего гемодинамического
давления) (Olsen J., 1972). Дальнейшее понижение среднего ге-
модинамического давления означает переход через нижнюю гра-
ницу ауторегуляции, т. е. расширение мозговых резистивных со-
судов уже не сможет компенсировать понижение давления. Это
ведет к ишемии мозга. Правда, ткани мозга сначала компенсиру-
ют его недостаточное кровоснабжение усилением экстракции
кислорода из крови, т. е. повышением утилизации кислоро-
да. При снижении среднего системного давления до 35—
40 мм рт. ст. последний механизм тоже оказывается недостаточ-
ным. В результате появляются такие симптомы гипоксии мозга
(при низком АД), как головокружение, рвота, сонливость,
ухудшение зрения, наконец, потеря сознания.
164
У больных ЭГ плато кривой ауторегуляции смещается вправо
(вверх). Нижний предел ауторегуляции у них соответствует уров-
ню среднего системного давления около 120 мм рт. ст. Если этот
порог преодолевается, например, при быстром снижении АД
с помощью фармакологических средств (нифедипин, a i-адрено-
блокатор и др.), то мозговой кровоток не восполняет потребно-
сти тканей в кислороде; он составляет лишь 73% от должного;
в результате развивается гипоксия мозга. Не случайно, при тя-
желых гипертензивных кризах мы не реко-
мендуем у лиц с хронической АГ стремиться к
ускоренному снижению АД до нормальных ве-
личин.
Разумеется, не меньшее значение имеет характеристика
верхнего предела ауторегуляции. В норме верхний предел ауто-
регуляции мозгового кровотока равен 150 мм рт. ст. (Strandga-
ard S., Olsen J. et al., 1973). у больных ЭГ верхний предел ауто-
регуляции тоже смещен вправо (кверху), при этом смещение
кривой давление—кровоток выражено резче при более высоком
давлении, чем при низком (Harper S., Bohlen Н., 1984). Меха-
низм ауторегуляции при подъеме АД включается на 5—10 мин,
он достигает максимальной эффективности в течение 7 мин.
Устойчивое повышение АД с прорывом верхнего предела ауторе-
гуляции и гипоперфузией Мозга сопровождается пропотеванием
плазмы через стенку артериол и капилляров, что, в свою оче-
редь, вызывает возникновение очагового мозгового отека, сдав-
ливание капилляров, дальнейшее понижение мозгового кровото-
ка. Все это составляет клиническую картину острой мозговой ги-
пертензивной энцефалопатии или в более тяжелых случаях ведет
к апоплексии (кровоизлияние) в вещество мозга. Подчеркну, что
плазморрагия при острой гипертензивной энцефалопатии на-
блюдается только в дилатированных артериях, но никогда не
встречается в спазмированных сосудах (Furrur S. et al., 1976). Это
значит, что при угрозе инсульта не следует злоупотреблять быст-
родействующими кальциевыми блокаторами (адалат).
В меньшей степени такой же феномен может быть связан с
гиперкапнией во время сна, проявляющейся хорошо известными
утренними головными болями у больных ЭГ.
Смещение порога ауторег ул яторно го
механизма — результат функциональной и
структурной перестройки мозговых с о с у -
д о в, которая происходит в течение хронической АГ. Среди этих
165
процессов одно из ведущих мест занимает гипертрофия сосуди-
стой стенки. В серии своих классических работ В. Folkow (1990)
показал, что гипертрофия стенки сосудов (ее утолщение) ведет к
сужению просвета сосудов, т. е. к увеличению соотношения тол-
щина/просвет. Это обстоятельство, в свою очередь, понижает
способность резистивных сосудов к расширению и усиливает их
склонность к вазоконстрикции.
Исходя из этих данных, можно считать, что гипертрофия
гладкомышечных клеток стенок сосудов является важнейшим
фактором, ответственным за смещение ауторегуляторного плато
вправо (вверх) при хронической АГ. G. Baumbach и D. Heistad
(1991) полагают, что пульсовое (а не среднее) давление может
быть фактором, определяющим развитие гипертрофии стенок
мозговых сосудов и последующих осложнений. Напомним, что
еще в 50-х годах мы обратили внимание (в клинике Н. Н. Са-
вицкого) на значение гемодинамического удара (ударное давле-
ние) для развития мозговых сосудистых эпизодов. Между тем
именно увеличение гемодинамического удара часто ведет к рас-
ширению пульсовой амплитуды давления.
Основываясь на свежих данных о состоянии сосудов мозга у
крыс, склонных к развитию инсультов (SHR—SP), G. Baumbach
и D. Heistad (1991) предлагают альтернативное гипотезе В. Fol-
kow объяснение, согласно которому не утолщение стенки по на-
правлению к просвету, а уменьшение наружного диаметра сосу-
дов, или их «ремоделирование», имеет основное значение для уве-
личения индекса стенка/просвет сосуда.
Понижение (нормализация) АД у боль-
ных ЭГ, особенно достаточно длительное,
сопровождается обратным развитием сосу-
дистой гипертрофии и ремоделирования.
Этот положительный эффект наблюдали в стенках аорты, мозго-
вых, почечных, мезентериальных и мышечных сосудов. Напри-
мер, у крыс линии SHR—SP искусственно вызванное сужение
сонных артерий предотвращает развитие гипертрофии стенок ар-
териол мозга.
Итак, структурные патологические изменения мозговых со-
судов, возникающие под влиянием высокого АД и угрожающие
мозговыми катастрофами, играют одновременно важную защит-
ную роль, изменяя границы ауторегуляции.
166
В литературе все чаще появляются сведения по поводу регу-
ляторного значения эндотелиальных факторов. Важнейшая роль
нормального эндотелия в мозге состоит в сохранении барьера
между кровью и клетками мозга. При ЭГ дисфункция эндотелия
проявляется в различных формах. Во-первых, в нарушении гема-
тоэнцефалического барьера. Во-вторых, в ослаблении синтеза и
выделения эндотелиального релаксирующего фактора. В-треть-
их, в образовании сократительного фактора, который в нормаль-
ном эндотелии не формируется.
При остром и значительном подъеме АД прорыв или дис-
функция гематоэнцефалического барьера происходит сначала в
мозговых венулах, затем в артериолах и капиллярах. Сосуды
cerebrum более чувствительны к такому прорыву, чем сосуды
ствола мозга. При хронической АГ тоже возникают условия для
нарушения гематоэнцефалического барьера, что может приво-
дить к очаговому отеку мозга, очаговому снижению кровотока и
к некрозу мозговой ткани.
Итак, если прежде спазму мозговых сосудов отводилась цент-
ральная роль в развитии мозговой симптоматики у больных с тя-
жело протекающей ЭГ, то, с современной точки зрения, эта кон-
цепция признается ошибочной.
Сужение артериол является ауторегуля-
торной защитной реакцией (разумеется, до извест-
ного предела). Напротив, дилатированные сегменты артериол, не
способные к ауторегуляторному сужению, служат тем местом,
где чаще происходит прорыв гематоэнцефалического барьера в
условиях высокой АГ.
Необходимо коснуться и некоторых новых данных по поводу
транзиторных ишемических мозговых атак. Эти реакции, имею-
щие важное клиническое значение, обычно связывают с микро-
эмболиями сосудов мозга и сетчатки, и прежде всего с наруше-
ниями функции тромбоцитов. В норме активация тромбоцитов
вызывает вазодилатацию, так как они выделяют АДФ, который,
в свою очередь, способствует выделению эндотелиального релак-
сирующего фактора и тем самым расширению сосудов. При ЭГ в
результате эндотелиальной дисфункции нарушается реакция на
АДФ: вместо вазодилатации наступает вазоконстрикция. Воз-
можно, что эндотелиальные дисфункции могут вызывать по-
вреждения и за счет измененного выделения эндотелиального
167
фактора роста, имеющего отношение к стимулированию склеро-
за мозговых сосудов.
Клинические данные
По данным Г. Г. Арабидзе и Гр. Г. Арабидзе (1999), Россия и
страны СНГ занимают 2-е место в мире по частоте нарушения
мозгового кровообращения, тогда как США — 27-е место, хотя
распространенность артериальной гипертензии в этих странах
примерно одинакова: 23—25% (Chalmers J. et al., 1996). Известно
также, что инсульты в России возникают в 4 раза чаще, чем в
странах Западной Европы, несмотря на то, что среднее АД в этих
регионах отличается незначительно (1993).
Число сосудистых мозговых нарушений увеличивается с возрас-
том больных ЭГ. В группе лиц с диастолическим давлением
95—104 мм рт. ст. частота таких осложнений каждое десятилетие
возрастает приблизительно в 2 раза. При диастолическом дав-
лении 105 мм рт. ст. и выше этот процесс резко ускоряется. По-
вышение диастолического давления пограничного типа (85—
94 мм рт. ст.) мало влияет на частоту сосудистых осложнений у
людей в возрасте от 30 до 59 лет.
У больных ЭГ начальные признаки сосудистой патологии
мозга (головная боль, головокружение, шум в голове и ушах,
расстройства памяти, снижение умственной работоспособности)
встречаются в 2 раза чаще, чем у людей с нормальным АД, и в
1,5 раза чаще, чем у лиц того же возраста с пограничной арте-
риальной гипертензией. По наблюдениям нашего сотрудника
А. А. Комиссаренко (1995), в этой начальной фазе сосудистых
мозговых расстройств повышение у больных АД пограничного
типа может даже несколько улучшать кровоснабжение мозга,
если их сравнивать с больными, имеющими начальные проявле-
ния атеросклероза мозговых сосудов и нормотензию. Это более
заметно при сравнении показателей кровотока в левом полуша-
рии мозга.
Число мозговых инсультов при ЭГ в 9 раз превышает тот же
показатель людей с нормальным АД. Риск геморрагического ин-
сульта повышается у лиц, имеющих систолическое давление от
160 до 200 мм рт. ст., — в 8—9 раз и при давлении больше
200 мм рт. ст. — в 13 раз, по сравнению с теми людьми, у кото-
рых уровень систолического давления ниже 140 мм рт. ст.
(Смирнов Е. В., 1976). В общем, в экономически развитых стра-
168
нах в структуре смертности взрослого населения цереброваску-
лярные заболевания (ЭГ и атеросклероз) стоят на 3-м месте,
уступая лишь ИБС и злокачественным опухолям.
Как уже упоминалось, больным ЭГ свойственны различ-
ные формы сосудистой патологии головного мозга. В 1971 г.
Е. В. Шмидт и Г. А. Максудов предложили классификацию сосу-
дистых поражений головного и спинного мозга, принятую и в
настоящее время. Приводим выдержки из этой обширной клас-
сификации, имеющие прямое отношение к ЭГ и необходимые
для практической работы терапевтов и кардиологов.
Классификация сосудистых поражений
головного и спинного мозга
I. Заболевания и патологические состояния, приводящие к на-
рушениям кровоснабжения мозга: 1) атеросклероз; 2) гипертони-
ческая болезнь (эссенциальная гипертензия); 3) сочетание атеро-
склероза с артериальной гипертензией; 4) болезни с симптомати-
ческой артериальной гипертензией; 5) вазомоторные дистонии
(ангиоспазмы, извращенная реактивность сосудов и др.).
II. Характер нарушений мозгового кровообращения. А. На-
чальные проявления неполноценности кровоснабжения мозга.
Б. Острые нарушения мозгового кровообращения. 1. Преходя-
щие нарушения мозгового кровообращения: а) транзиторные
ишемические приступы; б) гипертензивные кризы. 2. Кровоиз-
лияние оболочечное: а) субарахноидальное; б) эпи- и субдураль-
ное. 3. Кровоизлияние в мозг: а) паренхиматозное; б) паренхи-
матозно-субарахноидальное; в) прорыв крови в желудочки мозга.
4. Инфаркт мозга: а) при патологии магистральных артерий го-
ловы; б) при патологии внутримозговых сосудов; в) другого ге-
неза. 5. Инфаркт мозга эмболический: а) кардиогенный; б) дру-
гого генеза. 6. Острая гипертензивная энцефалопатия и др.
Наиболее ранними и постоянными симптомами сосудистого
мозгового синдрома при ЭГ бывают головные боли. Как извест-
но, Г. Ф. Ланг выделял у этих больных три разновидности голов-
ных болей. Первая из них — так называемые «нетипичные» голов-
ные боли невротического характера, весьма напоминающие ощу-
щения, испытываемые лицами с ПАГ. Вторая разновидность —
«типичные» головные боли. Их окраска, длительность, локализа-
ция варьируют у разных больных. Это давящие, тупые утренние
боли в затылке, обычно ослабевающие к середине дня, пульси-
169
рующие жгучие боли в темени, тяжесть в лобной и височных от-
делах головы по вечерам, «неясная», затуманенная, «тупая» голо-
ва. Боли усиливаются при умственном напряжении и физиче-
ской нагрузке.
По мнению ряда авторов, в патогенезе типичных болей
основную роль играет относительно меньшее сужение внутриче-
репных сосудов по сравнению с периферическим спазмом арте-
риол, т. е. недостаточность ауторегуляторного механизма, в ре-
зультате чего возрастает давление в мозговых капиллярах и уско-
ряется чрезкапиллярная фильтрация жидкости. Большое значе-
ние в появлении типичных головных болей придается изменени-
ям венозного кровотока в сосудах мозга (Кедров А. А., 1993;
Кедров А. А. и др., 2000).
Между уровнем АД и интенсивностью головных болей не
всегда существует параллелизм, возможно потому, что восприя-
тие болей очень субъективно. Нам нередко приходилось наблю-
дать больных, плохо переносивших даже незначительные повы-
шения АД (140/90—160/90 мм рт. ст.). Вместе с тем, некоторые
больные, особенно в пожилом возрасте, не всегда реагируют
на выраженные подъемы АД (180—200/100—110 мм рт. ст.). Есть
больные, у которых головные боли появляются при сниже-
нии привычного для них АД, что, вероятно, зависит от частич-
ного преодоления нижней границы ауторегуляции мозгового
кровотока.
Третья разновидность головных болей встречается у больных
с самыми тяжелыми и быстро прогрессирующими формами за-
болевания, а также во время гипертензивных кризов. Боли чаще
локализуются в затылке, но могут быть и диффузными, они от-
личаются особой интенсивностью и обычно связаны с отеком
мозга и повышением внутричерепного давления.
Переходя к характеристике острых нарушений мозгового
кровообращения, в частности транзиторных ишемических при-
ступов (атак), я должен подчеркнуть, что они возникают при-
близительно у 40—50% больных ЭГ, не получающих необходи-
мою лечения.
Эти преходящие ишемии нередко провоцируются внешними
причинами (кашель, чихание, поперхивание, обильная еда, нату-
живание при дефекации) или рефлекторными влияниями со сто-
роны внутренних органов (вздутие живота, задержка мочи при
аденоме предстательной железы, желчно- и мочекаменная болез-
170
ни и т. д.). У ряда больных, особенно пожилого возраста, через
вагокардиальные рефлексы вызывается урежение или нарушение
регулярной деятельности сердца (синусовая брадикардия, си-
ноаурикулярная блокада, аритмии) и вторично ухудшается моз-
говое кровообращение с преходящей ишемией мозга.
Клиническая картина преходящих нарушений мозгового кро-
вообращения складывается из общемозговых и (или) очаговых
симптомов (Боголепов Н. К., 1971; Канарейкин Е. Ф., 1975; Лоб-
зин В. С., 1989). Первые проявляются головной болью, ощуще-
нием тяжести, пульсацией и чувством распирания в голове,
шумом и звоном в голове и ушах, заложенностью ушей, несис-
темным головокружением, обостренным восприятием зритель-
ных и слуховых раздражений. Более интенсивные приступы
ишемии мозга могут приводить к временным нарушениям памя-
ти на ближайшие события, к дезориентации в пространстве и
времени.
Характер очаговых признаков в основном зависит от локали-
зации сосудистого процесса, т. е. от того, возникает ли преходя-
щая недостаточность кровообращения в каротидном, вертебраль-
но-базилярном или в других сосудистых бассейнах.
Очаговые изменения проявляются у больных двигательными
нарушениями (гемипарезы, расстройства координации и равно-
весия, атаксия конечностей, экстрапирамидные симптомы), из-
менением чувствительности, снижением зрения и другими зри-
тельными расстройствами (диплопия, гемианопсия и т. д.), афа-
зией (обычно моторной), реже дисфагией, дизартрией, систем-
ным головокружением с рвотой, нистагмом, эпилептиформными
припадками джексоновского типа.
Продолжительность этих ишемических атак колеблется от
нескольких минут до 24 ч; если же симптоматика сохраняется до
48 ч, то это состояние обозначают как пролонгированная (затяну-
тая) ишемическая атака. Более длительное сохранение очаговой
симптоматики означает развитие мозгового инсульта.
По материалам ВОЗ (1971), у 16—28% больных ЭГ транзи-
торная ишемия мозга регистрировалась однократно за 3—4 года
наблюдения; у 50% больных приступы возникали один раз в год;
свыше 30% больных имели в течение 3—4 лет более 5 ишемиче-
ских атак.
Обычно не удается выявить зависимости между частотой
ишемических мозговых атак и последующим развитием инфарк-
171
та мозга. Высказывается даже предположение, что повторные
преходящие ишемии мозга могут даже способствовать мобилиза-
ции защитных механизмов, в какой-то мере предотвращающих
более грозные сосудистые осложнения (Канарейкин К. Ф.,
1975).
Ишемический инсульт
Стойкие клинические проявления ишемического приступа
свыше 48 ч практически означают формирование инфаркта моз-
га. Инфаркт мозга (ишемический инсульт) — наиболее частая
форма мозгового инсульта вообще и у больных ЭГ в частности.
Согласно наблюдениям сотрудников НИИ неврологии АМН
СССР, этиологические факторы при инфаркте мозга распреде-
ляются следующим образом: тромбоз сосудов атеросклероти-
ческой природы — 57,6% случаев (в 18,6% вместе с ЭГ), только
ЭГ — 28,4%. Ангиографические и секционные исследования по-
казывают, что в значительном числе случаев инфаркт мозга мо-
жет развиваться и при отсутствии полной закупорки мозговых
артерий (47,5% случаев). В группе мозговых ишемий стали выде-
лять также эмболические инфаркты мозга — около 5% всех на-
рушений мозгового кровообращения (Лобзин В. С., 1989).
Наиболее часто инфаркты мозга поражают людей в возрасте
50—59 лет (31,2% всех инфарктов мозга) и 60—69 лет (28,1%). У
мужчин инфаркты мозга встречаются несколько чаще, чем у
женщин (3 : 2).
Большинство ишемических инсультов имеет отношение к
области кровоснабжения внутренней сонной артерии, бассейну
средней мозговой артерии, обычно ее корково-подкорковым вет-
вям (около 80% инфарктов мозга). На долю инфарктов, связан-
ных с нарушением циркуляции крови в передней и задней моз-
говых артериях, приходится по 10% этих осложнений.
Хотя ишемический инсульт может развиться в любое время
суток, чаще это случается во время сна или сразу после пробужде-
ния. Симптоматика нарастает обычно постепенно, на протяже-
нии часов или даже нескольких дней. Ее выраженность может то
ослабевать, то вновь усиливаться. Однако более чем в 30% случа-
ев процесс протекает по типу апоплексии, что затрудняет диф-
ференциальный диагноз с кровоизлиянием в мозг (Лунев Д. К.,
1975).
172
Характерной чертой ишемического инсульта является превали-
рование очаговых симптомов над общими. При инфаркте в области
больших полушарий ведущими очаговыми симптомами бывают
парезы и параличи конечностей на стороне, противоположной
очагу, в сочетании с парезами лицевого и подъязычного нервов;
гемианестезия, гемианопсия, расстройства речи (афазия — при
очагах в левом полушарии мозга); парез взора: глаза больного
обращены в сторону пораженного полушария. При локализации
инфаркта в области мозгового ствола кроме парезов конечностей
и глазодвигательных расстройств отмечаются нистагм, голово-
кружение, дисфагия, нарушение статики и координации.
Для ишемических инсультов не типичны головные боли, ред-
ко наблюдается рвота, обычно отсутствуют менингеальные сим-
птомы; у многих больных не бывает потери сознания, хотя мо-
жет отмечаться легкое оглушение, повышенная сонливость, дез-
ориентированность. Лишь при обширных полушарных инфарк-
тах с отеком мозга возникают более выраженные расстройства
сознания с переходом в сопорозное или коматозное состояние.
В первый день заболевания температура тела у больного норма-
льная. Повышение АД чаще бывает умеренным или даже отно-
сительно пониженным по сравнению с обычными для больного
цифрами. Только в отдельных случаях ишемический инсульт
развивается на фоне очень высокого АД. Спинномозговая жид-
кость при инфарктах мозга, как правило, не изменена, давление
ее обычно не повышено. В периферической крови в первый день
ишемического инсульта не отмечается существенных сдвигов.
У большинства больных наиболее тяжелое состояние отмеча-
ется в первые 2—3 дня, затем наступает период улучшения; темп
восстановления нарушенных функций варьирует от случая к слу-
чаю. Летальность достигает 20%. По наблюдениям А. Н. Колто-
вер и соавт. (1975), наиболее частой причиной летального исхода
бывает ущемление и смещение ствола за счет отека мозга; реже
больные погибают от разрушения вещества мозга в области ин-
фаркта или от соматических осложнений. Многие остальные
больные, перенесшие ишемический инфаркт, становятся тяже-
лыми инвалидами.
Геморрагический инсульт
Кровоизлияния в вещество мозга составляют при ЭГ около
20% всех острых нарушений мозгового кровообращения. Боль-
173
шинство этих осложнений приходится на группы больных в воз-
расте 50—59 и 60—69 лет (около 60%); среди больных 40—49 лет
и моложе 39 лет внутримозговые кровоизлияния встречаются со-
ответственно в 22,3% и 3,5% всех геморрагий (по материалам
А. Н. Колтовер и др., 1975). Заболеваемость среди мужчин и
женщин одинакова; после 60 лет — геморрагические инсульты
чаще встречаются у женщин. Локализация гематом различна:
в 85% наблюдений кровоизлияние локализуется в полушариях
мозга, в 10% — в мозжечке, в 5% — в стволе мозга, чаще в обла-
сти Варолиева моста (Лобзин В. С., 1989).
Как я упоминал выше, в патогенезе внутримозговых крово-
излияний ведущую роль играют анатомические изменения арте-
риол и мелких артерий в связи с пропитыванием их стенок плаз-
мой. Следствием некробиотических изменений бывают разрывы
сосудов или их надрывы с образованием милиарных аневризм.
Напомню, что еще в 1934 г. К. Г. Волкова утверждала, что одни
атеросклеротические изменения артерий без АГ не могут быть
причиной кровоизлияний, что, по-видимому, правильно (Колто-
вер А. Н., 1975; Cile A., Jates J., 1969). Кровоизлияние в вещество
мозга возможно и вследствие разрыва врожденных аневризм
мозговых сосудов, в частности у лиц молодого возраста. Массив-
ное паренхиматозное кровоизлияние может осложниться проры-
вом крови в подоболочечное пространство или в желудочки моз-
га, а также сопровождается выраженным отеком со сдавлением
и ущемлением ствола мозга в вырезке мозжечкового намета и
в большом затылочном отверстии (Колтовер А. Н., 1975; Лоб-
зин В. С., 1991).
Геморрагический инсульт — «удар», вне зависимости от ло-
кализации и вида начинается внезапно, обычно днем, в период
активной деятельности больных, после физического или психо-
эмоционального напряжения. Первые признаки кровоизлия-
ния — тяжелая головная боль и рвота. Быстро, через несколько
минут, больной теряет сознание с развитием глубокой комы.
Лицо у него принимает багрово-синюшный цвет, дыхание стано-
вится хриплым, шумным (стерозным). АД заметно повышено
(около 200 мм рт. ст.), пульс трудно сжимаемый, иногда редкий,
быстро, в течение нескольких часов заметно повышается темпе-
ратура тела (при прорыве крови в желудочки мозга — до
40—4ГС); в крови определяется нейтрофильный лейкоцитоз со
сдвигом формулы влево.
174
При полушарных гематомах — зрачки широкие и неравно-
мерные, при кровоизлияниях в ствол — зрачки резко сужены, не
реагируют на свет. Обычно уже через несколько минут после на-
чала кровоизлияния в полушария развивается гемиплегия, соче-
тающаяся с центральным парезом лицевой мускулатуры и языка,
отмечаются плавающие движения глазных яблок; гематома в об-
ласти Варолиева моста вызывает тетраплегию, полное отсутствие
рефлексов, децеребрационную ригидность, центральную нейро-
генную гипервентиляцию.
Значительное место в клинике острого периода геморрагиче-
ского инсульта занимают нарушения мышечного тонуса (Лебеде-
ва Н., 1975). Диагностическое значение имеют менингеальные
симптомы — ригидность затылочных мышц, симптомы Брудзин-
ского, Кернига и другие признаки раздражения мозговых оболо-
чек. В ликворе определяется кровь.
В острой фазе геморрагического инсульта развивается гипо-
калиемия с соответствующими изменениями конечной части же-
лудочкового комплекса на ЭКГ; это является прогностически
неблагоприятным признаком. При исследовании глазного дна
определяются выраженное сужение сосудов, свежие кровоизлия-
ния, у 25% больных — отек сетчатки и застойные соски. Прогноз
при кровоизлиянии в мозг почти всегда неблагоприятный.
Смертность колеблется от 80 до 90%. Кровоизлияния в мозговой
ствол и мозжечок обычно всегда заканчиваются смертью больно-
го. Большинство больных погибает в первые несколько суток,
хотя после хирургического удаления гематомы и мер реанимации
период комы может затягиваться на 2—3 недели.
Субарахновдальные кровоизлияния
Они составляют примерно 15—20% всех внутричерепных не-
травматических кровоизлияний в мозг. По данным П. П. Соко-
рянского, Д. И. Хачатурова (1974), 40% случаев субарахноидаль-
ных геморрагий связаны с ЭГ. Во многих других случаях причи-
ной этих кровоизлияний являются разрывы врожденной или
приобретенной аневризмы внутричерепной артерии. Рецидивы
таких разрывов аневризмы протекают очень тяжело и нередко
заканчиваются гибелью больных (Боголепов Н. К., 1967, 1971).
Для клиники этого варианта геморрагического инсульта харак-
терно сочетание общемозговых, оболочечных и очаговых симпто-
мов. Столь же остро и внезапно возникают головные боли и рво-
175
та, психомоторное возбуждение, судороги; больные стонут и
вскрикивают, хватаются руками за голову и т. д. Усиливающиеся
головные боли часто локализуются в шейно-затылочной области
с иррадиацией в глаза; нарушается сознание чаще в форме сопо-
розного состояния. В менее тяжелых случаях периоды наруше-
ния сознания бывают относительно короткими, а очаговые при-
знаки — слабо выраженными. Температура тела достигает феб-
рильных цифр, нередко возникает синусовая брадикардия.
Менингеальные симптомы появляются уже на 1—2 день за-
болевания: ригидность затылочных мышц, симптомы Кернига и
Брудзинского, светобоязнь, общая гиперестезия. В ликворе
определяют кровь. Быстро развиваются застойные явления на
глазном дне. В большинстве случаев обнаруживаются резкий
вторичный подъем АД и изменения ЭКГ.
Глазное дно у больных ЭГ;
гипертензивная ангиоретинопатия
В свое время Lund (1974) поставил вопрос: являются ли сосу-
ды сетчатки «зеркалом» почек или мозга? Оказалось, что уровень
корреляционных связей между изменениями глазного дна и со-
судов различных органов (клинико-анатомические сопоставле-
ния) наиболее высок для сосудов мозга и сетчатки. По данным
того же автора, мозговые кровоизлияния в 100%, а инфаркты
мозга в 94% случаев сочетаются с повреждениями сосудов сетча-
той оболочки глаз. При обычном, «доброкачественном» течении
ЭГ по картине глазного дня можно делать достаточно достовер-
ное суждение о состоянии мозговых сосудов. Дело в том, что
мелкие сосуды сетчатки лишены симпатической иннервации; их
изменения в основном определяются уровнем АД в art. ophthal-
mica, к которой подходят окончания симпатического нерва. Со-
суды сетчатки чувствительны также к локальным факторам, в
особенности к величине РОг.
У здоровых людей в ответ на случайное повышение АД рети-
нальные сосуды спазмируются. При ЭГ затяжной ауторегулятор-
ный спазм приводит к повреждениям стенки сосудов, но это еще
не ретинопатия. Появление более глубоких изменений: кровоиз-
лияний, экссудатов, очагов «взбитой ваты» (cotton wool) означает
прорыв ауторегуляторного механизма в сосудистой системе сет-
чатки.
176
По классификации Кейса, Вегенера, Баркера (1939), все еще
принятой во всех странах мира, выделяют четыре стадии ангио-
ретинопатии.
I стадия — минимальное сегментарное или диффузное суже-
ние артерий и артериол; II стадия — более отчетливое сужение
просвета этих сосудов, умеренное утолщение их стенок; сдавле-
ние вен уплотненными артериолами (феномен перекреста —
симптомы Салюса—Гунна), извилистость и расширение вен;
III стадия — выраженный склероз и сужение артериол, их не-
равномерность; крупные и мелкие кровоизлияния в виде ярко-
красных очагов, полос, кругов; экссудаты типа «взбитой ваты»;
IV стадия — признаки предыдущей стадии, а также двусторон-
ний отек сосков зрительных нервов (!) с подъемом оптического
диска и смазанностью его краев; отек сетчатки (!), иногда ее от-
слойка; яркие очажки, группирующиеся вокруг соска и в области
желтого пятна (фигура звезды); прогрессирующее понижение
зрения или внезапная потеря зрения на один или оба глаза.
Как видно, отек соска является характерным признаком только
4-го типа (стадии), он обычно ассоциируется с особой, злокаче-
ственной, формой ЭГ и со злокачественным финалом этого за-
болевания. В этих случаях fundus hypertonicus больше коррелиру-
ет с изменениями сосудов почек, и в картине глазного дня пре-
обладают паренхиматозные повреждения, связанные с фибрино-
идным некрозом артериол и деструкцией капилляров.
Представляет практический интерес вопрос об уровне оф-
тальмотонуса у больных ЭГ. В общем, средний уровень внутри-
глазного давления находится у них в пределах нормы. Цветовая
чувствительность у части больных ЭГ понижена, особенно к
красному, зеленому и синему цветам, что следует учитывать при
профессиональном отборе лиц соответствующих профессий.
ПОВРЕЖДЕНИЯ ПОЧЕК ПРИ ЭГ
Выше было показано, что почки участвуют в становле-
нии ЭГ. В данном разделе рассматривается состояние почек —
органа-мишени, особенно сильно повреждаемых высоким АД.
В 1955 г. С. Perera, изучавший естественное течение ЭГ у 500 боль-
ных, не получавших специфического лечения, обнаружил, что у
7% из них возникла злокачественная АГ (отек соска зрительного
177
нерва, уремия), у 42% выявлялась протеинурия без азотемии, на-
конец, у 18% больных постепенно прогрессировала хроническая
почечная недостаточность. Этот, разумеется, нежелательный и в
наше время недопустимый клинический эксперимент ясно про-
демонстрировал, что по меньшей мере у 2/з больных ЭГ при от-
сутствии лечения возникают тяжелые повреждения почек.
При анализе механизмов поражения почек под воздействием
повышенного АД следует исходить из того факта, что изменения
кровотока можно наблюдать уже в прегипертензивной фазе забо-
левания (ПАГ и т. д.). J. Van Hoff и соавт. (1991), в частности,
показали, что почечный кровоток понижается, а почечно-сосу-
дистое сопротивление возрастает и повышается фильтрационная
фракция даже у лиц лишь с риском развития ЭГ. Обратимость
вазоконстрикции в этих случаях подтверждается при воздейст-
вии таких препаратов, как антагонисты кальция и ингибито-
ры АПФ. Возможно, что врожденный дефект в системах, конт-
ролирующих кровоснабжение почек, и объясняет повышенную
чувствительность у этих людей почечных сосудов к АП и к сим-
патической нервной стимуляции; последняя, в свою очередь,
усиливается при избыточном потреблении поваренной соли.
У многих лиц с уже сложившейся ЭГ в еще большей степени
и чаще находят повышение почечного сосудистого сопротивле-
ния, следующее за ним снижение почечного кровотока при со-
хранении нормальной скорости клубочковой фильтрации и уве-
личении фильтрационной фракции. При этом долго сохраняет
свое значение функциональный компонент вазоконстрикции,
что отчетливо продемонстрировали N. Hollenberg и соавт. (1987),
наблюдавшие усиленное расширение почечных сосудов в ответ
на введение ацетилхолина, допамина и фентоламина у 2/з боль-
ных, правда, со сравнительно легким течением ЭГ.
Со временем функциональная вазоконстрикция усиливается
и дополняется явными морфологическими изменениями почеч-
ных сосудов и нефронов с развитием, в конечном счете, почеч-
ной недостаточности.
Морфогенез почечной недостаточности представлен несколь-
кими основными вариантами, и процесс «гипертензивного по-
вреждения» почечных артериол проходит ряд периодов (Шулут-
ко Б. И., Перов Ю. Л., 1993). Сначала в сосудах появляются че-
редующиеся сужения и расширения (Giese J., 1973). За этим
следует фокальное нарушение проницаемости в расширенных
178
участках артериол, наконец, их плазматическое пропитывание с
отложением белковых макромолекул (плазморрагия). Крайним
проявлением такого, по терминологии Н. Goldblatt, плазматиче-
ского васкулеза, наблюдаемого при злокачественной форме ЭГ,
является фибриноидный некроз прегломерулярных артериол и мел-
ких артерий, повреждение капилляров клубочков (гломерулит) с
гибелью нефронов, большими изменениями в моче и быстрым
развитием почечной недостаточности («фаровская почка»).
Другой путь развития почечной недостаточности иногда на-
зывают полузлокачественным. Процесс гипертензивного по-
вреждения начинается в межлобулярных артериях и в отходящих
от них афферентных артериолах. При этом мало страдает сред-
няя мышечная оболочка, а преимущественно утолщается инти-
ма, в которую в большом числе мигрируют гладкомышечные
клетки из медии. Эти клетки, находящиеся в различной стадии
дегенерации, выделяют материал базальной мембраны и кислые
гликозаминогликаны. Кроме того, мышечные клетки связывают
фактор роста, выделяемый поврежденным эндотелием. Так фор-
мируется значительное количество артериол с очень толстой
стенкой и весьма узким просветом. L. Tobian (1987) сравнивает
эту ситуацию с наличием в почках многих тысяч гольдблаттов-
ских зажимов, вызывающих ишемию и почечную недостаточ-
ность полузлокачественного типа (иногда с начинающимся оте-
ком соска зрительного нерва). По мнению ряда исследователей,
этот тип развития почечной недостаточности может быть связан
с некоторыми этническими особенностями больных (черноко-
жие американцы), а также с хроническим дефицитом калия.
Диета, обогащенная калием, может предотвращать у таких боль-
ных ЭГ, а также в эксперименте утолщение интимы междолевых
артерий и артериол и, следовательно, прогрессирование почеч-
ной недостаточности.
Третий путь, который при хронической ЭГ может вести к
развитию почечной недостаточности, связан с отложением гиа-
лина в стенках афферентных артериол и развитием артериоло-
склероза. Гиалин сначала откладывается под эндотелием, затем
распространяется к эластике. Гиалиновая субстанция нередко
окружает мышечные клетки медии и в части случаев претерпева-
ет дегенарцию; она распространяется и на клубочки, которые,
как и афферентные артериолы, не подвергаются некрозу. Клу-
бочки постепенно отмирают, часть клубочков утрачивается, как
179
и вообще почечная ткань. Отмечаются и выраженные интерсти-
циальные повреждения; гибель нефронов ведет к формированию
«первично сморщенной почки», или «доброкачественного» нефроан-
гиосклероза — характерного анатомического субстрата медленно
текущей ЭГ.
По данным R. Smithwick и В. Gastieman (1951), такие изме-
нения находят у 55% больных с установившимся высоким АД и
только у 25% больных с преходящими повышениями АД. Прав-
да, аналогичный процесс может развертываться и у лиц без АГ,
особенно у пожилых и старых людей. Например, на 8-м десяти-
летии жизни артериолосклероз почечных сосудов находят у
29% людей, не имевших повышения АД.
В настоящее время благодаря эффективным методам лечения
(Са-блокаторы, ингибиторы АПФ и др.) такой финал ЭГ
(развитие артериолосклероза) наблюдается значительно реже.
Уже в начале 60-х годов, по данным Института кардиологии
им. А. Л. Мясникова, летальные исходы у больных ЭГ от почеч-
ной недостаточности составляли всего 1,2% среди всех причин
смерти этих больных. В 80—90-х годах эта цифра стала еще
ниже. Более того, патологоанатомы теперь не всегда находят
признаки гиалиноза и плазматического пропитывания стенок
почечных артериол у больных ЭГ (чаще у женщин), погибших от
ее мозговых и сердечных осложнений (Журавлева Н. Б., 1974;
Хмельницкий О. К., 1974).
Мы рассмотрели общепринятые представления о путях по-
вреждения почек у больных ЭГ, когда высокое АД вызывает клу-
бочковую ишемию за счет повреждения прегломерулярных арте-
рий и артериол, способствуя прогрессирующему сужению их
просвета и клубочкового кровотока.
Однако в последние годы выдвинуто альтернативное объясне-
ние, согласно которому развитие почечной недостаточности свя-
зывается с клубочковой капиллярной гиперфильтрацией. Этот меха-
низм был продемонстрирован не только на различных моделях
АГ у животных, но и при ЭГ у людей. Повышение скорости клу-
бочковой фильтрации коррелирует со степенью повреждения по-
чек. Усиление скорости клубочковой фильтрации в одном неф-
роне впервые выявили при ЭГ в 1976 г. W. Birkenhager и
М. Schalekamp (1976). Они предполагали, что благодаря этому
механизму АГ сопровождается уже на ранних стадиях ускорен-
ной деструкцией почечных артериол и клубочков. Вследствие
180
повышения АД афферентные артериолы могут временно меха-
нически расширяться, передавая высокое АД непосредственно к
капиллярам клубочков, ускоряя скорость клубочковой фильтра-
ции, что заканчивается повреждением капиллярной сети клубоч-
ков, а затем и гибелью нефронов (Петров В, И. и др., 1997; Rui-
lope L. et al., 1992; Neuringer J., Brenner B., 1992).
Клинические данные
Клинические проявления доброкачественного нефросклероза
могут отсутствовать многие годы. Даже в поздних стадиях ЭГ не-
часто встречаются изменения в моче, главным образом в виде
очень умеренной протеинурии (менее 1 г/л за 24 ч), небольшой
микрогематурии и цилиндрурии. Более выраженный мочевой
синдром можно видеть при присоединении интеркуррентного
заболевания, лихорадки, при гипертензивных кризах, в периоде
застойной недостаточности кровообращения. Стойкие измене-
ния в моче, особенно если они определяются у больных со сред-
ней или умеренной АГ, скорее, имеют местное происхождение и
служат показанием к тщательному обследованию у больного со-
стояния почек и мочевыводящих путей для выявления таких за-
болеваний, как нефрит, пиелонефрит, мочекаменная болезнь,
диабетический гломерулосклероз и т. д. Злокачественное течение
ЭГ, напротив, может сопровождаться значительной протеин-
урией в сочетании с гематурией и цилиндрурией. Протеинурия —
универсальное патологическое изменение, указывающее на про-
грессирование нарушений функции почек. Эффективный конт-
роль АД сопровождается уменьшением протеинурии (статисти-
чески значимым) (Ruilope L., 2000).
У большинства больных ЭГ, как правило, сохраняются нор-
мальная относительная плотность мочи и достаточный диапазон
ее колебаний в течение суток (проба Зимницкого); концентра-
ция в плазме креатинина, мочевины остается в физиологических
пределах. Лоханочно-чашечная система почек обычно почти не
изменяется. По наблюдениям многих клиницистов, при изуче-
нии функции почек методом изотопной ренографии у большин-
ства больных ЭГ II—III стадии отмечаются симметричные изме-
нения: более медленный пологий подъем кривых, растянутые
секреторные и экскреторные сегменты, увеличение времени
максимального накопления и времени полувыведения изотопа,
снижение секреторного индекса.
181
Мы уже упоминали о почечном плазмотоке (кровотоке). У
молодых людей с легкой гипертензией он понижается при физи-
ческой нагрузке и заметно возрастает под воздействием вазоди-
лататоров (см. выше). У больных II—III стадии ЭГ почечный
плазмоток достоверно уменьшен как в покое, так и в период на-
грузки.
Особенно тяжелое поражение кровеносных сосудов, в част-
ности почечных, наблюдается у больных АГ при ее сочетании с
сахарным диабетом (Шестакова Л. В. и др., 1995; Ворон-
цова. В., Шестакова Л. В., 1996; Gall М. et al., 1991). Поданным
Фремингеймского исследования, тяжелые сердечно-сосудистые
осложнения наблюдаются у этой категории больных в 5 раз
чаще, чем в сопоставимых возрастных группах общей популяции
(Wilson Р. et al., 1991). Внедрение в клиническую практику
допплерэхокардиографических методов исследования почечного
кровотока значительно расширило клинические возможности
диагностики (Карпов Р. С. и др., 1999). В. И. Петров и соавт.
(1997) подчеркивают, что при длительной АГ почечные сосуды
изменяют свою геометрию и структуру, т. е. подвергаются про-
цессу ремоделирования. При ультразвуковом исследовании визуа-
лизация почечных артерий на всем их протяжении возможна ме-
нее чем у половины обследуемых (Зубарев А. Р., Григорьян Р. А.,
1991). Устья почечных артерий визуализируются значительно
чаще: более чем в 90% случаев. Надо признать, что несмотря на
значительные успехи ультразвуковой ангиографии, методом вы-
бора в диагностике многообразных форм реноваскулярной АГ
остается рентгеноконтрастная ангиография.
Существует согласие по поводу того, что изменения почек
при ЭГ весьма различны у разных больных. Согласно наблюде-
ниям Б. И. Шулутко (1995), при аутопсии умерших от ЭГ в
15% случаев выявляется первично сморщенная почка, в 56% слу-
чаев почки макроскопически сохраняют нормальный вид. Ряд
американских ученых утверждают, что ЭГв20% случаев
приводит к почечной недостаточности. Все
же надо признать, не оспаривая принципиально это положение,
что в клинике мы реже, чем в прежние годы, встречаемся с
явными нарушениями функции почек у больных ЭГ.
В последние годы найдены новые, более ранние и точные
индикаторы повреждения почек при ЭГ (табл. 6) (Ruilope L.
et al., 1992).
182
Таблица 6
Индикаторы раннего повреждения почек при ЭГ
Гиперурикемия
Увеличение экскреции с мочой N-ацетил-р-глюкозаминидазы
Увеличение экскреции с мочой альбумина
Увеличение экскреции с мочой р2-микроглобулина
Гиперурикемию определяют у 25% нелеченных больных с
легкой АГ. F. Messerli и соавт. (1980) сообщили, что больные ЭГ
с гиперурикемией имеют ниже величину почечного кровотока и
более высокое почечное и системное периферическое сопротив-
ление, чем больные без гиперурикемии. Недавно интересные
данные о связи уратной нефропатии с АГ привел Н. А. Мухин
(2000).
Увеличенное выделение с мочой канальцевого фермента
N-ацетил-р-глюкозаминидазы без других признаков почечного
повреждения тоже наблюдали у больных ЭГ (Alderman М. et al.,
1983). Н. Parving и соавт. (1974) сообщили, что плохо леченные
больные ЭГ выделяют с мочой избыточное количество альбуми-
на. Этот факт был подтвержден в последующем у другой группы
больных, имевших повышенную мочевую экскрецию альбумина
(>30 мг/24 ч), стойко исчезнувшую после успешного трехлетнего
лечения заболевания p-адреноблокаторами и диуретиками. В об-
щем, микроальбуминурию находят у 35—40% больных ЭГ, в том
числе и у лиц с ПАГ (Линчак Р. М., 2000). Это — маркер по-
вреждения клубочков, предшествующий развитию явной проте-
инурии, что особенно характерно для больных с инсулин-неза-
висимым сахарным диабетом.
Повышенное выделение с мочой Р2-микроглобулина, как
и альбумина, — следствие трансгломерулярного пассажа этих
белков (Christensen С., 1983). В. И. Петров и соавт. (1997) пола-
гают, что большую диагностическую ценность имеет определе-
ние в моче органоспецифических почечных изоферментов, чем
Рг-микроглобулинов. По мнению этих авторов, это не только
высокодостоверное, но и простое, дешевое исследование (диск
электрода в полиакриламидном геле).
183
СТАДИИ ЭГ
(СТАРАЯ КЛАССИФИКАЦИЯ)
По предложению Г. Ф. Ланга, в отечественной кардиологи-
ческой литературе и в практической работе уже многие годы
принято деление ЭГ на три стадии, отражающие глубину по-
вреждения органов-мишеней, прогрессирование заболевания во
времени, его тяжесть. Всемирная организация здравоохранения
придерживалась, практически, той же позиции. Надо признать,
что эта классификация ЭГ удовлетворяла в течение нескольких
десятков лет как исследователей, так и особенно практических
врачей.
I (легкая) стадия ЭГ
Согласно упомянутой классификации ВОЗ, предложенной
еще в 1962 г., I стадия ЭГ характеризуется повышением
АД> 160/95 мм рт. ст., т. е. выше уровня давления при ПАГ.
В I стадии у больных еще отсутствуют органические изменения
в сердечно-сосудистой системе, в частности гипертрофия левого
желудочка. Последнее обстоятельство создает некоторые диагно-
стические трудности, поскольку в практической работе утолще-
ние задней стенки левого желудочка и (или) межжелудочковой
перегородки можно наблюдать при эхокардиографическом ис-
следовании не только у больных, у которых повышение АД соот-
ветствует I стадии ЭГ, но изредка даже у лиц с ПАГ.
Мне неоднократно приходилось встречаться с подобными
противоречиями, в частности при рецензировании диссертаци-
онных работ, т. е. в подобных случаях неясно, нужно ли при
определении стадии ЭГ ориентироваться на уровень АД либо на
факт небольшой гипертрофии левого желудочка у больного. К
сожалению, комитет экспертов ВОЗ пока не дал рекомендации
по этому вопросу.
Что касается моей точки зрения, то, при всех возможных
оговорках и памятуя об отсутствии строгой корреляции между
уровнем АД и выраженностью гипертрофии левого желудочка,
я все же придерживаюсь мнения, что при наличии гипертрофии
миокарда врачу следует определять более высокую стадию ЭГ,
т. е. не I, а II. Кроме того, полезно (по возможности) провести
суточную мониторную регистрацию АД, показатели которого в
184
этом случае лучше коррелируют с толщиной стенок левого желу-
дочка.
Необходимо коснуться еще одного вопроса терминологиче-
ского характера. Все чаще I стадию ЭГ, иногда объединяя с ПАГ,
называют «мягкой». По нашему мнению, этот термин имеет ско-
рее бытовую окраску, а не медицинскую, и, по-видимому, мало
соответствует реальному положению, поскольку прогноз боль-
ных в I стадии заболевания значительно хуже, чем у лиц с нор-
мотензией. Многолетние эпидемиологические наблюдения в
г. Фремингейме показали, что у людей с весьма умеренными по-
вышениями АД возможность развития в последующем мозгового
инсульта возрастает в 3—5 раз, смертельных случаев инфаркта
миокарда — в 2—3 раза по сравнению со здоровыми людьми.
В группе мужчин в возрасте от 35 до 45 лет с АД около
160/100 мм рт. ст. летальность на протяжении 20 лет оказалась
в 5 раз выше, чем у мужчин с исходным давлением
<140/90 мм рт. ст. Таким образом, термин «мягкая АГ» не пред-
ставляется нам достаточно обоснованным, что, кстати, нашло
отражение в последних рекомендациях ВОЗ/МОГ, в которых
отказались от качественных характеристик ЭГ.
Продолжая характеристику I стадии ЭГ, я должен отметить,
что в этой стадии могут находиться как молодые люди, у кото-
рых сравнительно быстро произошел переход от ПАГ к ЭГ, так и
лица среднего и более пожилого возраста с начальными и прехо-
дящими подъемами АД.
Хотя такой признак, как неустойчивость уровня АД, весьма
трудно использовать для суждения о стадии ЭГ (даже если его
измеряют в стандартных условиях), повышение АД является на-
столько специфическим признаком заболевания, что его, конеч-
но, нельзя игнорировать при определении тяжести заболевания.
При распознавании I стадии руководствуются следующими по-
казателями АД: диастолическое давление в покое колеблется от
95 до 104 мм рт. ст., среднее гемодинамическое — от ПО до
124 мм, систолическое давление — в пределах от 160 до
179 мм рт. ст. (у пожилых и старых людей величины систоличе-
ского давления могут быть выше за счет уплотнения аорты).
Давление лабильно, оно спонтанно меняется в течение суток.
Нормализация АД (без приема лекарственных препаратов) на-
блюдается нередко, особенно во время отдыха больного, пребы-
вания его в отпуске, на курорте; однако это понижение АД на-
185
ступает медленнее и оно менее продолжительно, чем у лиц с
ПАГ, поскольку заболевание уже фиксировано.
Часть больных в I стадии ЭГ не испытывает никаких жизнен-
ных и физических ограничений. Других периодически беспокоят
головные боли, тяжесть и шум в голове, нарушение сна, сниже-
ние умственной работоспособности, быстро наступающее к вече-
ру, иногда несистемные головокружения, носовые кровотечения,
кардиалгии.
ЭКГ не изменена, или определяется I тип электрокардиогра-
фической кривой; вполне эффективна гемодинамика: МО серд-
ца либо нормален, либо все еще превышает должные величины;
его возрастание при физической нагрузке достаточно; изменения
глазного дна не выходят за пределы I типа по Кису—Вегенеру;
почечные функции не нарушены. Возможны гипертензивные
кризы, особенно у женщин в период климакса.
Частота сосудистых осложнений, о которых мы упоминали
выше, зависит от возраста, в котором человек заболевает ЭГ.
Среди лиц с I стадией ЭГ в возрасте 30—39 лет летальность за
последующие 20 лет была в 2,7 раза выше, чем в контроле; для
больных 50—59 лет этот показатель только в 1,7 раза превышал
контрольные цифры. Мужчины молодых и средних лет в I ста-
дии ЭГ имеют более плохой прогноз, чем женщины: показатели
летальности за последние 20 лет у первых в 1,5 раза выше.
Длительность I стадии заболевания колеблется у различных
больных в широких пределах. Ее эволюция во II стадию проте-
кает иногда настолько медленно, что создается впечатление о
стабилизации ЭГ на ее ранней стадии. В наше время такие слу-
чаи встречаются все чаще, благодаря более рациональному и си-
стематическому лечению больных. Не случайно в США в конце
80-х годов доля больных в I стадии ЭГ достигла 82% (Matorsen В.,
Preston R., 1989). Этот факт еще раз подчеркивает значение ран-
ней диагностики и оперативно начатой терапии ЭГ.
II (среднетяжелая) стадия ЭГ
Удельный вес больных, страдающих средней по тяжести ЭГ,
не превышает в США 13% от их общего числа. Эти лица состав-
ляют основную группу амбулаторных и стационарных больных.
Их беспокоят головные боли различной локализации (лоб, вис-
ки, затылок) и продолжительности (от кратковременных, лету-
чих, до длительных), головокружение, обычно несистемного
186
характера, звон и шум в ушах, периодическое ухудшение зрения,
а также приступы стенокардии, иногда одышка при физических
усилиях. Больные в подавляющем большинстве принимают про-
тивогипертензивные препараты (часто, к сожалению, нерегуляр-
но и бессистемно), прибегают к ограничениям в диете и режиме,
образ жизни этих людей уже в существенной мере определяется
течением болезни.
Правда, многие из них продолжают выполнять свои служеб-
ные обязанности, заниматься напряженной умственной и даже
физической работой. Диастолическое давление в покое колеб-
лется у них между 105 и 114 мм рт. ст.; среднее гемодинамиче-
ское — от 125 до 140 мм рт. ст.; систолическое давление достига-
ет величин 180—200 (220) мм рт. ст. Разумеется, возможны спо-
радические подъемы и выше этих цифр. Более того, для этой
стадии заболевания типичны гипертензивные кризы. Вне перио-
да лечения гипертензия достаточно стабильна, хотя во время
длительного отдыха у ряда больных происходит постепенное по-
нижение АД.
Как правило, у больных во II стадии ЭГ имеются отчетливые,
характерные (I—III, реже IV тип) изменения ЭКГ, рентгенологи-
ческие, эхокардиографические признаки гипертрофии левого
желудочка. При аускультации сердца, наряду с ослаблением
I тона у верхушки, можно уловить маятникообразный ритм, не-
постоянные III и IV тоны; на аорте слышатся громкий II тон,
приобретающий тимпатический оттенок, систолический шум
выброса (кальциноз, атеросклероз аорты и клапана).
МО сердца у большинства больных в покое несколько пони-
жен, реже нормален; при дозированной физической нагрузке он
возрастает в меньшей степени, чем у здоровых людей. Фракция
выброса левого желудочка (ФВ) нормальна либо находится на
нижней границе допустимых колебаний. ОПС заметно повыше-
но; возрастает скорость распространения пульсовой волны по
артериям эластического типа.
В неосложненных случаях клинические проявления недоста-
точности миокарда левого желудочка наблюдаются редко, хотя
его диастолическая функция уже понижена. Картина болезни
может резко измениться при ухудшении коронарного кровообра-
щения, возникновении инфаркта миокарда, фибрилляции пред-
сердий, желудочковой тахикардии.
187
Со стороны ЦНС во II стадии болезни отмечаются различ-
ные проявления сосудистой недостаточности, преходящие ише-
мии мозга, чаще без больших последствий. Однако нередки и
более тяжелые нарушения мозгового кровообращения (инфаркт
мозга, кровоизлияния); это случается у больных, которые не
контролируют уровень АД, лечатся неэффективно и несистема-
тически.
Изменения глазного дна укладываются в картину ангиорети-
нопатии 1—3 типа (стадии). Анализы мочи обычно не имеют от-
клонений от нормы; можно обнаружить уменьшение почечного
кровотока и скорости клубочковой фильтрации; на изотопных
ренограммах выявляются признаки диффузного двустороннего
снижения функции почек, хотя концентрация креатина и моче-
вины в плазме у большинства больных остается нормальной.
III (тяжелая) стадия ЭГ
Она характеризуется весьма высоким и устойчивым АД.
Величины диастолического давления обычно лежат в пределах
115—129 мм рт. ст., среднего гемодинамического — 145—170—
190 мм рт. ст., систолического — 220—230 мм рт. ст. В период
отдыха, во время пребывания на курорте АД у больных может
снизиться, но, как правило, оно не доходит до нормы. Между
тем различные и последовательные лечебные воздействия могут
оказаться эффективными и в этой стадии заболевания.
Я выделяю два варианта III стадии ЭГ. При первом из них в
клинической картине преобладают тяжелые сосудистые ослож-
нения, связанные с атеросклерозом и артериолосклерозом сосу-
дов сердца, мозга и почек: стенокардия и инфаркт миокарда,
острая или хроническая левожелудочковая недостаточность,
ишемический и геморрагический инсульты, ангиоретинопатия
2—3 типа, понижение показателей почечного кровотока и клу-
бочковой фильтрации, небольшая протеинурия, иногда эритро-
циты и цилиндры в осадке мочи.
Во втором варианте III стадия ЭГ предстает как бы в более
«чистом» виде. По невыясненным пока причинам некоторые
больные «защищены» от инфарктов миокарда и мозговых ин-
сультов, несмотря на то, что и у них ЭГ протекает длительно с
высоким уровнем АД. Интересно то обстоятельство, что у крыс
со спонтанной наследственной гипертензией тоже выведена
линия, отличающаяся повышенной склонностью к мозговым
188
инсультам, и линия с гипертензией, редко осложняющейся или
не осложняющейся такими тяжелыми нарушениями мозгового
кровообращения. У первой линии крыс отмечалось резкое акти-
вирование системы ренин—АП (Кипров Д., 1980). С точки зре-
ния J. Laragh и соавт. (1962, 1980), более или менее благоприят-
ное течение ЭГ зависит от степени активности этой системы;
в частности, гиперренинемия ведет к учащению сосудистых
осложнений, однако эта концепция пока не получила подтверж-
дения.
Характерными особенностями гемодинамики у больных с
столь значительным и хроническим повышением АД являются:
крайняя степень возрастания ОПС и снижение УО (МО) сердца.
Скорость кругооборота крови снижена, артериовенозная кисло-
родная разница увеличена. С позиций классической физиологии
такому явлению может быть дано единственное объяснение:
уменьшение сердечного выброса и замедление кровотока есть
результат сердечной слабости и недостаточности кровообраще-
ния. Между тем в период обследования эти больные физически
достаточно активны, не испытывают одышки или же указывают,
что сердцебиение и одышка появляются у них лишь при слиш-
ком быстрой ходьбе, подъемах по лестнице и т. д. Привлекает
внимание и удивляет явное несоответствие между значительны-
ми изменениями важнейших показателей гемодинамики и весь-
ма умеренными клиническими признаками нарушения сократи-
тельной функции сердца.
При обследовании таких больных мне удалось установить на-
личие обратной зависимости между величинами ОПС и МО
сердца: МО и УО оказались наиболее сниженными у тех боль-
ных, у которых ОПС было наиболее высоким. Соответственно,
замедление кругооборота крови тоже особенно четко выявилось
у больных с самым высоким ОПС. Наличие подобных соотно-
шений нам представляется особенно важным, так как оно свиде-
тельствует о сохранении существующей в физиологических усло-
виях обратной коррелятивной зависимости между ОПС, средним
гемодинамическим давлением и МО сердца. Трудно себе пред-
ставить, чтобы при недостаточности миокарда левого желудочка
столь строго соблюдались эти соотношения. Кроме того, расчет
величины работы левого желудочка показывает, что, несмотря на
уменьшение МО, она превышает должные величины на 50—75%.
Однако работа левого желудочка меньше той, которую ему при-
189
шлось бы производить при сохранении нормального МО в усло-
виях значительного и устойчивого повышения среднего гемоди-
намического давления.
Такое своеобразное состояние циркуля-
ции мы называем «гипокинетической реак-
цией аппарата кровообращения в ответ на
длительную и стабильную артериальную
гипертензию» (Кушаковский М. С., 1950; Савицкий Н. Н.,
Кушаковский М. С., 1967). Эту реакцию следует рассматривать
как компенсаторную, благоприятную для экономии сил сердечной
мышцы, способствующую уменьшению нагрузки на левый желу-
дочек, понижению среднего давления и гемодинамического уда-
ра. Говоря о приспособительном характере изменений кровооб-
ращения, мы имеем в виду компенсацию, развивающуюся на па-
тологическом фоне, облегчающую в аварийных условиях дея-
тельность сердца.
Итак, уменьшение МО сердца может быть: а) проявлением
сердечной недостаточности; б) приспособительной реакцией
сердечно-сосудистой системы в ответ на чрезмерную и хрониче-
скую постнагрузку левого желудочка.
Необходимо объяснить, каким образом в условиях этой при-
способительной гипокинетической циркуляции крови обеспечи-
вается такой уровень снабжения тканей кислородом, который
позволяет больным находиться в состоянии относительного кли-
нического благополучия без явных физических признаков лево-
желудочковой недостаточности.
Мои исследования показали, что у этих больных уменьшение
МО сердца компенсируется на периферии рядом механизмов,
контролирующих уровень кислородного снабжения тканей, в ча-
стности: повышением утилизации кислорода, сдвигом кривой
диссоциации оксигемоглобина вправо, увеличением числа от-
крытых функционирующих капилляров, что приводит к умень-
шению диаметра тканевого цилиндра, питаемого каждым капил-
ляром. Такое сочетание приспособительных реакций обеспечи-
вает не только количественную сторону тканевого дыхания, но и
его качественный уровень, т. е. относительно высокое диффузи-
онное давление кислорода в артериальном отрезке капилляра
(Кушаковский М. С., 1950, 1968).
Смещение вправо кривой диссоциации оксигемоглобина у этих
больных не всегда зависит от ацидотического сдвига pH среды,
190
поскольку у них кривая связывания углекислоты располагается
нормально и давление углекислоты в периферической венозной
крови близко к норме. Я допускаю, что в этих случаях на сродст-
во гемоглобина к кислороду могут оказывать влияние такие фак-
торы, как уровень глютатиона в крови, концентрация в эритро-
цитах 2,3-дифосфоглицерата и состояние сульфгидрильных
групп глобина (Кушаковский М. С., 1968). Среди механизмов
компенсации важное значение, по-видимому, имеет и перерас-
пределение кровоснабжения между органами в зависимости от
их устойчивости к недостатку кислорода, например, относитель-
ная централизация кровообращения. Как видно, результаты изу-
чения этой группы больных в III стадии ЭГ показывают, что
компенсация кровообращения в особых условиях может обеспе-
чиваться не только путем его интенсификации, но и за счет про-
тивоположной реакции — гипокинетической циркуляции крови.
Образно говоря, организм выбирает «наименьшее зло», сберегая
силы главного двигателя кровообращения — сердца. Недостаточ-
ность кровообращения (в клиническом смысле) начинается тог-
да, когда на фоне снижения МО сердца становятся неполноцен-
ными компенсаторные механизмы, ранее поддерживавшие кис-
лородное снабжение тканей на удовлетворительном, хотя и не на
оптимальном уровне.
Современная (последняя) классификация ЭГ
Начиная с 1993 г. мы являемся свидетелями своеобразного
классификационного «бума», проявляющегося в серии часто из-
меняющихся и нередко противоречивых, даже путанных реко-
мендаций (американских и европейских) по классификации ЭГ.
Особенно это касается различий в определениях со стороны
национальных и международных организаций, в особенности
Объединенного национального комитета США (Joint Nationale
Committee — J. N. C.) 1993, 1997 годов и Комитета по рекомен-
дациям ВОЗ—МОГ (1993). В последнее время, чтобы уменьшить
расхождения и предложить более согласованные рекомендации
для клиницистов всего мира, Комитет по рекомендациям
ВОЗ—МОГ согласился в принципе принять определение и клас-
сификацию ЭГ, предложенную J. N. С/ VI. Ниже я опускаю не-
сколько промежуточных классификаций, американских и евро-
пейских, и привожу последнюю классификацию.
191
Классификация уровней ДД
Таблица 7
Категория АД систолическое, мм рт. ст. АД диастолическое, мм рт. ст.
Оптимальное давление <120 <80
Нормальное <130 <85
Высоко нормальное 130-139 85-90
Гипертензия 1 степени («мягкая») 140-159 90-95
Подгруппа пограничная 140-149 90-94
Гипертензия 2 степени («умеренная») 160-179 100-109
Гипертензия 3 степени («тяжелая») >180 >110
Изолированная систоли- ческая гипертензия >140 <90
Подгруппа пограничная 140-149 90
Примечание. Если значение АД, или АДд попадает сразу в две соседние кате-
гории, то больного следует отнести к категории с более высокими показателями.
Легко заметить произошедшие изменения по сравнению со
старой классификацией. Во-первых, введены 3 понятия нор-
мального АД: от оптимального до высоко нормального, что
несомненно создает затруднения для практических врачей.
Во-вторых, «стадия» заменена «степенью», что мало обосно-
вано. В-третьих, изменены границы пограничной АГ: вместо
159/94 мм рт. ст. предлагаются цифры АД 140/149 для систоли-
ческого и 90/94 мм рт. ст. для диастолического АД. Это тоже не
обосновывается. Наконец, в-четвертых, в классификацию вво-
дится «изолированная систолическая гипертензия», которая по
механизмам развития и клинике не должна отождествляться с
систоло-диастолической АГ. Вполне обоснованным мне кажется
согласованный отход от «качественной» классификации АГ в
виде выделения мягкой, умеренной и тяжелой форм как не со-
ответствующих индивидуальному прогнозу. Эти термины сохра-
нены в современной редакции только в связи с частым их ис-
192
пользованием в клинической практике (Кобалава Ж. Д., 1999).
Очевидно, что классификация по уровню АД нуждается еще в
улучшениях.
В классификации ВОЗ 1996 года предлагалось второе деление
ЭГ на стадии, в зависимости от повреждения органов-мишеней.
I стадия — отсутствие объективных признаков повреждения
органов.
II стадия — выявляется по меньшей мере один из следующих
признаков поражения органов:
— гипертрофия левого желудочка (по данным рентгено-,
электро- и эхокардиографии);
— генерализованное или фокальное сужение артерий сет-
чатки;
— протеинурия и/или легкое повышение уровня креатинина
плазмы (1.6—2,0 мг/дл);
— ультразвуковые или ангиографические признаки атеро-
склеротических бляшек (в сонных, подвздошных или бедренных
артериях).
III стадия — имеются клинические и инструментальные при-
знаки поражения органов, включающие:
— со стороны сердца: стенокардию, инфаркт миокарда, сер-
дечную недостаточность;
— со стороны головного мозга: динамические расстройства
мозгового кровообращения, инсульт, гипертоническую энцефа-
лопатию;
— со стороны глазного дна: кровоизлияния и экссудацию в
сетчатку с отеком сосочка зрительного нерва или без такового;
— со стороны почек — превышение уровня креатинина
плазмы 2,0 мг/дл;
— со стороны сосудов: расслаивающуюся аневризму аорты,
симптоматическое окклюзивное поражение артерий.
Эта часть классификации вызывает еще более серьезные воз-
ражения. Вновь появились «стадии», и диагноз ЭГ у больного
мог звучать таким образом: ЭГ 1 степени и III стадии, что
трудно воспринимается. Полностью игнорировалась возмож-
ность не зависимого от легкой гипертензии атеросклеротическо-
го поражения сосудов, развития инфаркта миокарда или ишеми-
ческого инсульта, не связанного с повышением АД. Необосно-
ванно включены в классификацию такие признаки злокачест-
венной гипертензии, как отек сосочка зрительного нерва.
7 Зак 3207
193
И вообще малооправдан разрыв между АД и следствиями его по-
вышения.
По-видимому, эти и другие соображения способствовали от-
казу от деления классификации на 2 раздела; выдвинуто новое
понятие, касающееся стратификации риска. Ж. Д. Кобалава
(1999) полагает, что эти разделы «являются самыми новаторски-
ми» в рекомендациях. Я вполне согласен с такой оценкой, но не
могу не отметить громоздкость таблиц и их обилие, что отнюдь
не делает их привлекательными для врачей. Для стратификации
риска используются такие показатели, как уровень АД, неблаго-
приятные метаболические сдвиги, поражения органов-мишеней
и сопутствующие хронические состояния: инсульт, инфаркт
миокарда, гипертоническая ретинопатия и др. Как видно, ин-
фаркт миокарда, ишемический инсульт уже не входят как эле-
менты классификации ЭГ, а используются как важные прогно-
стические факторы.
Рекомендуется выделение четырех групп риска по рекоменда-
ции ВОЗ/МОГ.
Группа низкого риска (категория А). В эту группу включаются
мужчины до 55 лет и женщины до 65 лет с АГ 1 степени. У боль-
ных отсутствуют поражения органов-мишеней. Риск развития
сердечно-сосудистых осложнений в ближайшие 10 лет не дости-
гает 15% (Кобалава Ж. Д., 1999).
Группа среднего риска (категория В). В эту группу включаются
больные с широким диапазоном колебаний АД. У больных выяв-
ляются факторы риска, но отсутствуют поражения органов-ми-
шеней. Риск развития сердечно-сосудистых осложнений в бли-
жайшие 10 лет составляет 15—20%.
Группа высокого риска (категория С). У больных имеются по-
ражения органов-мишеней, сахарный диабет или более трех фак-
торов риска, независимо от стадии ЭГ. Этим больным показана
безотлагательная терапия. Риск развития сердечно-сосудистых
осложнений в ближайшие 10 лет высокий, он составляет
20-30%.
Группа очень высокого риска. К ней относят больных с III сте-
пенью повышения АД и больных с сердечно-сосудистыми забо-
леваниями, не зависящими от степени повышения АД. Риск раз-
вития сердечно-сосудистых осложнений в ближайшие 10 лет
здесь превышает 30% (Кобалава Ж. Д., 1999).
194
Как видно, такая группировка больных позволяет реально су-
дить о прогнозе заболевания индивидуального пациента, позво-
ляет сосредоточиться на методах лечения, сроках его начала и
интенсивности. Очень важно четкое разделение поражений орга-
нов-мишеней и сопутствующих клинических состояний.
При высоком риске медикаментозное ле-
чение начинают немедленно. При низком и
среднем риске лекарственному лечению
должна предшествовать немедикаментоз-
ная программа снижения АД продолжитель-
ностью от 3 до 12 мес. Если у больного имеются при-
знаки сердечной или почечной недостаточности либо сахарный
диабет с АД порядка 130—139/85—89 мм рт. ст., то естественно
проводится необходимое лекарственное лечение.
Следует признать, что несмотря на прогрессивность и многие
достоинства, свойственные новым классификационным реко-
мендациям, они сложны и не лишены недостатков. Вероятно,
поэтому в практической работе кардиологов все еще часто ис-
пользуется старая, более простая классификация ЭГ.
В рекомендациях ВОЗ/МОГ (1999) рекомендованы целевые
уровни АД.
Таблица 8
Целевые уровни АД
Группы больных Целевое АД
Общая популяция больных с АГ <140/90 мм рт. ст.
АГ + сахарный диабет без протеинурии <130/85 мм рт. ст.
АГ + сахарный диабет с протеинурией <120/75 мм рт. ст.
АГ + ХПН <120/75 мм рт. ст.
Указанные целевые уровни АД, хотя и оптимальны, но труд-
нодостижимы. Так, по данным J. Chalmers (2001), одного из ав-
торов рекомендаций ВОЗ/МОГ, только у 20—30% больных уда-
ется снизить АД до уровня <140/90 мм рт. ст.
195
Клинико-патогенетические формы ЭГ;
профилирование больных ЭГ
Наиболее наблюдательные клиницисты сравнительно давно
подметили несхожесть многих больных ЭГ, неоднородность этого
заболевания. Вероятно впервые, известный немецкий интернист
F. Folgard в 20—30-х годах предложил различать «красную» и
«бледную» формы ЭГ. Ф. Фольгард предполагал, что при крас-
ной гипертензии сужение артериол внутренностей, особенно ор-
ганов брюшной полости, способствует вытеснению крови в сосу-
ды кожных покровов, что и придает им усиленную окраску.
«Бледная» же форма гипертензии характерна, по Фольгарду и
Фару, для злокачественного почечного артериолосклероза (не-
кроза). Фактически это означало разграничение доброкачествен-
ной и злокачественной форм заболевания, что для того времени
имело огромное значение, хотя в наше время представляет глав-
ным образом исторический интерес.
Другой, получившей широкую известность попыткой профи-
лирования больных ЭГ было разделение их на три подгруппы в
зависимости от величины активности ренина плазмы крови при
обязательном учете суточной экскреции натрия с мочой, о чем
нередко забывают. J. Laragh и соавт. в 70-х годах соответственно
выделили: а) норморениновую подгруппу больных (активность
ренина = 2—4,5 нг AI/мл-ч; при стимуляции ЮГ аппарата она
возрастает в такой же мере, как и у здоровых людей; эта форма
встречается у 50—60% больных ЭГ; б) гиперрениновую под-
группу (>4,5 нг/А1/мл-ч), или ренин-стимулируемую, — 15—
20% больных; в) гипорениновую подгруппу, или нестимулируе-
мую (<2 нг А1/мл • ч) — 25—30% больных ЭГ; в данной подгруп-
пе выявляется обратная зависимость активности ренина от воз-
раста больных и особенно от тяжести и длительности ЭГ. Так, в
группе больных в возрасте 20—29 лет гипорениновая ЭГ встреча-
ется только в 6%, среди больных старше 60 лет — более чем в
50% случаев. Если группировку больных основывать на концент-
рации в плазме АП, то результаты получаются близкими к рени-
новой профилизации.
Ключевым является вопрос о связи между активностью рени-
на в плазме и повышением АД. При гиперрениновой форме ЭГ
роль АП как прессорного фактора представляется естественной,
при норморениновой — проблематичной; наконец, у больных с
196
гипорениновой ЭГ повышение АД нельзя связать с возрастанием
активности системы ренин—АП.
Разделив больных по такому принципу, авторы рениновой
профилизации сформировали далеко идущие выводы клиниче-
ского, терапевтического и прогностического характера. К сожа-
лению, эти выводы не подтвердились. Вопреки убеждению J. La-
ragh и его сотрудников, гипорениновая форма ЭГ не оказалась
самой легкой, она не менее часто осложняется, как показали ис-
следования других клиницистов, сосудистыми катастрофами. К
тому же «рениновую гипотезу» существенно поколебало откры-
тие того факта, что наряду с почечной эндокринной (плазмен-
ной) системой ренин — All существуют местные аутокринная и
паракринная системы ренин — АП, обеспечивающие, по-види-
мому, длительное, тоническое регулирование сосудистого сопро-
тивления и АД. Следовательно, производимые у больных изме-
рения активности ренина в плазме не отражают истинного, пол-
ного вовлечения ренин-ангиотензиновых механизмов в процес-
сы повышения АД. Все эти соображения позволяют, на наш
взгляд, сохранить только гиперрениновую, или ангиотензинза-
висимую, форму ЭГ в перечне клинико-патогенетических форм
этого заболевания. Гипорениновая (низкорениновая) форма —
это сборная группа, в которую входят различные по характеру и
происхождению разновидности АГ, в том числе и гипергидрата-
ционная форма ЭГ, о которой речь пойдет ниже.
Не представляется рациональным разделение ЭГ на сердеч-
ную, мозговую и почечную формы. Согласно рекомендациям
ВОЗ и решению 2-го съезда кардиологов нашей страны, при
осложнении ЭГ инфарктом миокарда, стенокардией, кардио-
склерозом основным заболеванием становится ИБС (Луком-
ский П. Е., 1974). Поскольку недостаточность кровообращения
тоже в основном зависит от прогрессирования коронаросклеро-
за, то для сердечной формы ЭГ не остается места в классифика-
ции. Развернутая почечная форма ЭГ (недостаточность), благо-
даря новым эффективным методам лечения, в наше время встре-
чается не столь уж часто. Наконец, при мозговых проявлениях
ЭГ невропатологи и кардиологи, определяя характер нарушения
кровообращения, отдают предпочтение развернутому неврологи-
ческому диагнозу поражения мозга, в котором учитываются осо-
бенности его сосудистого повреждения. Термин «церебральная
(мозговая)» форма ЭГ теперь никого не устраивает.
197
Несомненным достижением, шагом вперед, в клинико-пато-
генетическом профилировании больных ЭГ было использование
Н. Н. Савицким и его сотрудниками гемодинамического прин-
ципа, в частности складывающегося у больных соотношения
между МО и ОПС (см. выше).
Развивая это направление, мы посчитали возможным поло-
жить в основу такого профилирования имеющиеся у больных
различия биохимических и регуляторных механизмов, приводя-
щих к изменению МО и ОПС. Эта перспективная
предпосылка, как мы полагаем, оправдала
себя и позволила подойти к более диффе-
ренцированному лечению больных (Кушаков-
ский М. С., 1974, 1983).
ЭГ с признаками гиперадренергии,
или гиперадренергическая форма ЭГ
Она встречается приблизительно у 15% больных, преимуще-
ственно на ранних этапах заболевания, хотя ее можно наблюдать
и у ряда лиц, длительно страдающих ЭГ. Начальный (ранний)
вариант по своим клиническим проявлениям напоминает ПАГ
юношеского и нейровегетативного типа. Для него, как и для
ПАГ, характерно повышение концентрации в плазме норадрена-
лина и активности фермента ДБГ, умеренное увеличение экс-
креции норадреналина и метнорадреналина с мочой.
При хронической гиперадренергической форме ЭГ больных
многие годы могут беспокоить неприятные ощущения в облас-
ти сердца и сердцебиения, пульсации в голове, покраснение
лица и потливость, озноб, чувство внутреннего напряжения и
тревоги. Пульс у них учащен до 80—90 в 1 мин, он полный и
скорый. АД достигает значительных величин, отличается ла-
бильностью и большой пульсовой амплитудой, поскольку сис-
толическое давление повышается относительно больше диасто-
лического. Характерные особенности кардиогемодинамики:
«возбужденное сердце» (громкий I тон у верхушки), ускорение
кругооборота крови, увеличение УО, МО сердца, ФВ и объем-
ной скорости выброса крови, т. е. признаки гиперкинетической
циркуляции; у части больных выявляется увеличение ТО и ко-
эффициента ТО/ОЦК.
198
Свойственное здоровым людям адекват-
ное раскрытие артериол и прекапилляров в
ответ на увеличение сердечного выброса у
этих больных оказывается недостаточным.
Если учесть, что при ПАГ повышение концентрации норад-
реналина в плазме находят у 35—45% больных, то остаточную
гиперадренергию, обнаруживаемую только у 15—20% больных
со сложившейся ЭГ, следует рассматривать как реликт
центрогенно-нервного, ги персим п.а т и ч е -
ского (Л анго в с к о г о) механизма патогене-
за Э Г. Ее прототипом является спонтанная генетическая АГ у
крыс линии Okamoto—Aoki. Остается пока неясным: почему
у части больных ЭГ на всю жизнь сохраняется гиперактивность
симпатической нервной системы, тогда как у большинства дру-
гих больных она исчезает? Возможно, что у первых нарушены
механизмы возврата и депонирования норадреналина в депо
симпатических терминалей.
Выраженная лабильность АД, свойственная хроническому
гиперадренергическому варианту ЭГ, не должна рассматриваться
как проявление легкости ее течения; у больных этой подгруппы
не столь уж редко возникают цереброваскулярные нарушения и
повреждения сердца, а также гипертензивные кризы нейровеге-
тативного характера.
ЭГ с признаками задержки натрия и воды,
или гипергццратационная (объем-, натрий-зависимая) форма ЭГ
Хорошо известно, что среди больных ЭГ встречаются лица,
имеющие внешние признаки задержки воды: одутловатость
лица, периорбитальный отек, особенно по утрам после сна,
утолщение пальцев рук, снижение диуреза. У таких больных
(чаще у женщин) выявляется связь между потреблением со-
леной пищи и подъемом АД либо развитием отечных гипер-
тензивных кризов, т. е. э т о с о л ь-ч увствительные
больные ЭГ.
Помимо чувствительности к солевым и водным нагрузкам,
способствующим возрастанию АД, этих лиц отличает от осталь-
ных больных ЭГ более быстрое развитие устойчивости к симпа-
толитикам и периферическим вазодилататорам, которые способ-
ны вызвать отеки и прибавку массы тела.
199
Больные с гипергидратационной формой ЭГ сильнее других
реагируют на диуретики, что проявляется интенсивным натрий-
и гидроурезом, иногда с преходящей артериальной гипотензией
и сдвигом кислотно-основного равновесия в сторону гипохлоре-
мического алкалоза и гипокалигистии. Этот синдром характеризу-
ется рядом признаков: больной выглядит осунувшимся, он ощу-
щает резкую слабость, вплоть до обморока; у него развиваются
адинамия, апатия, которые обычно исчезают через 4—6 ч, осо-
бенно если больной принимает внутрь препараты калия (калия
хлорид, панангин и др.).
Таким больным свойственны и «рикошетные» гипертензив-
ные кризы, когда, например, у человека с высоким АД и гипер-
гидратацией после приема внутрь 100 мг гипотиазида возникает
массивный диурез с резким снижением АД. Через 10—12 ч вновь
происходит значительный подъем АД вместе с задержкой натрия
и воды. Эти вторичные (повторные), или отраженные, гипертен-
зивные кризы могут протекать тяжелее, чем начальные, первич-
ные, кризы. Для них характерны не только признаки возобно-
вившейся гипергидратации, но и гиперадренергические проявле-
ния. Система ренин—АП, как и симпатическая нервная система,
активируется в ответ на острое снижение АД и уменьшение
ОЦП (ОВЖ).
Надо подчеркнуть, что достаточно распространенное пред-
ставление о существовании объем-натрий-зависимой формы ЭГ
часто основывается не на фактических данных, а на логических
предпосылках. Наша сотрудница Н. В. Иванова (1982) измеряла
ОВЖ методом разведения изотопа брома (82Вг), т. е. определяла
«бромидное пространство», наиболее точно характеризующее ве-
личину ОВЖ, и параллельно «тиосульфатное пространство» по
разведению тиосульфата натрия.
По нашим (совместно с Н. В. Ивановой) данным, нор-
мальная величина ОВЖ {«бромидное пространство») в среднем
равняется 9,80±0,71 л/м2, «тиосульфатного пространства» —
7,30±0,81 зфл1. У 93 больных ЭГ во II стадии, находившихся на
стандартной диете (8 г NaCl; 1,5 л воды в день), средняя величи-
на ОВЖ не отклонялась от показателя средней нормы, однако
при оценке индивидуальных значений ОВЖ (отнормированные
гистограммы) у 15% больных выявилась внекле-
точная гипергидратация.
200
У здоровых женщин ОЦП, измеренный по разведению аль-
бумина — 1311, колебался в пределах от 39,1 до 45 мл/кг, от 14,9
до 16 мл/см роста и от 1,46 до 1,61 л/м2 поверхности тела. У здо-
ровых мужчин те же показатели равнялись соответственно:
39,8—48,4 мг/кг; 18,3—20,3 мл/см и 1,60—1,94 л/м2. Не выяви-
лось зависимости ОЦП от возраста здоровых людей.
При ЭГ II стадии, по наблюдениям нашей клиники, у 73,9%
больных отмечалась нормоволемия (нижняя граница нормы), у
14,2% — гиповолемия, у 11,9% больных — гиперволемия (Куша-
ковский М. С., Иванова Н. В., 1989). Таким образом, при преоб-
ладающей тенденции у больных ЭГ к уменьшению ОЦП, су-
ществует обособленная гиперволемиче-
ская подгруппа (около 12% больных). Между
тем при рассмотрении соотношения между ОПС и ОЦП выяви-
лись другие закономерности: 1) обратная нелинейная связь меж-
ду ОПС и ОЦП; 2) относительный или абсолютный избыток
внутрисосудистой жидкости по сравнению с проходимостью ар-
териолярного ложа приблизительно у 2/3 больных ЭГ.
Нарушение регуляции ОЦП при ЭГ отражается на распре-
делении внеклеточной жидкости (ОВЖ) между ее внутрисо-
судистым (ОЦП) и интерстициальным сектором (ОИЖ).
У здоровых людей ОИЖ по разведению 82Вг равняется в сред-
нем 8,0±0,72 л/м2; по разведению тиосульфата натрия —
5,7±0,88 л/м2. Коэффициент ОЦП/ОИЖ у здоровых равен соот-
ветственно по 82Вг — 0,233±0,04 (Кушаковский М. С., Ивано-
ва Н. В., 1980), или 0,223 (Tarazi R., 1976), или 0,257 (Leth А.,
Ibsen Н., 1976). По тиосульфату натрия этот коэффициент
выше — 0,330±0,08 (Кушаковский М. С., Иванова Н. В., 1980).
У больных ЭГ, протекающей с гиповолемией, коэффициент
ОЦП/ОИЖ достоверно ниже нормы (0,159 по 82Вг) как за счет
уменьшения ОЦП, так и по причине некоторого возрастания
ОИЖ. Следовательно, у 14% больных с очень высоким ОПС
имеются признаки приспособительного перераспределения час-
ти внеклеточной жидкости из внутрисосудистого в интерсти-
циальный секретер. Это согласуется с наблюдениями некоторых
авторов об ускорении транскапиллярного перехода альбумина у
ряда больных ЭГ. При гиперволемическом варианте ЭГ коэффи-
циент ОЦП/ОИЖ возрастает вследствие увеличения ОЦП.
Таким образом, у больных ЭГ имеются отклонения в системе
давление—объем по сравнению с теоретическими расчетами.
201
Чаще приходится наблюдать лишь относительное увеличение
объема жидкости на фоне уменьшенной емкости (проходимости)
резистивных сосудов, однако и такого рода соотношение есть
признак ослабления функции механизмов, регулирующих в орга-
низме содержание натрия и воды.
Увеличение ОВЖ и ОЦП (гипергидратация) у 12—15% боль-
ных ЭГ способствует возрастанию УО и МО сердца при относи-
тельном повышении ОПС. Гипергидратационную форму ЭГ
можно рассматривать как реликт Na-зависимого ме-
ханизма развития гипертензии у части лю-
дей, чрезмерно чувствительных к поварен-
ной соли. Прототипом этой формы являет-
ся АГ у соль-чувствительных крыс линии
Dahl.
Кальций-зависимая форма ЭГ
Можно было предполагать, что абсолютное или относитель-
ное повышение ОПС, свойственное больным ЭГ, зависит в ко-
нечном счете от избыточного содержания ионов Са+++ в гладко-
мышечных клетках резистивных сосудов (гиперкальцигистия),
что и ведет к их чрезмерному сокращению и тем самым к суже-
нию просвета сосудов. Такому представлению вполне соответст-
вуют как теоретические предпосылки, так и клинические данные
о понижении ОПС и АД при приеме больными ЭГ антагонистов
кальция, например, нифедипина.
Большой неожиданностью было открытие того факта, что у
части больных ЭГ уменьшения ОПС и АД можно добиться приема-
ми препарата кальция. Более 20 эпидемиологических исследова-
ний показали наличие такой обратной зависимости между коли-
чеством кальция в пище и уровнем АД (Hatton D., McCarron D.,
1984). Недавно Р. Von Zwieten (1999) подтвердил, что в экспери-
менте увеличение кальция в плазме способствует пониже-
нию АД. По нашим данным, подобная парадоксальная реакция
выявляется приблизительно у 15—25% больных ЭГ (по некото-
рым другим материалам, — еще чаще) при приеме ими внутрь
2 г кальция цитрата или другой быстро всасывающейся соли
кальция (Чурин К. В., 1993; Кушаковский М. С., Чурин К. В.,
1993). Эти больные не имеют признаков гиперадренергии; созда-
ется впечатление, что соль-чувствительные больные и больные с
202
низкорениновой формой ЭГ более часто, чем другие, склонны
понижать АД при увеличенном приеме пищевого кальция. Ос-
тальные больные ЭГ либо не реагируют на прием соли кальция,
либо АД у них возрастает (Чурин К. В., 1993).
У больных с Са-зависимой формой ЭГ наш сотрудник
К. В. Чурин (1993) нашел и другие отклонения в обмене каль-
ция, в частности: 1) у них повышено содержание ионов Са++,
связанных с мембранами внутриклеточных органелл; 2) этот свя-
занный кальций более легко, чем в норме, высвобождается и пе-
реходит во внутриклеточную жидкость; 3) прием больными соли
кальция способствует нормализации мембранного дефекта свя-
зывания ионов Са++ и снижению (!) его внутриклеточной кон-
центрации; 4) эти больные отличаются от остальных повышен-
ной экскрецией кальция с мочой; 5) у них повышен уровень па-
ратгормона в плазме крови; 6) концентрация ионов Са++ в плаз-
ме, скорее, имеет тенденцию к некоторому уменьшению, чем
характеризуется «кальциевый парадокс»: много ионов Са++ в
клетках, их меньше, чем в норме, в плазме.
В свое время D. McCarron и соавт. (1985) отметили, что каль-
цийурез у ряда больных ЭГ выше, чем у лиц с нормальным АД.
Это служит стимулом для активации паращитовидных желез, что
и ведет к повышению уровня паратгормона в плазме; последний,
в свою очередь, способствует усилению вхождения ионов Са++ в
клетки. Что же касается причины избыточного кальцийуреза, то,
по мнению тех же авторов, к этому может вести первичный де-
фект реабсорбции ионов Са++ в почках, на что указывает сниже-
ние транспорта ионов Са++ в энтероцитах (кишечник), которые
по своим биохимическим характеристикам сохраняют все осо-
бенности транспорта ионов Са++ в нефронах (McCarron D.
et al.,1985; Kwan С., 1985).
Показательно, что у части крыс наследственной гипертензив-
ной линии низкое потребление кальция с пищей и водой приво-
дит к дальнейшему усилению кальцийуреза, тогда как у крыс
нормотензивной линии при тех же условиях экскреция кальция
с мочой понижается.
Эти интересные и во многих отношениях парадоксальные
данные получили развитие в клинико-эпидемиологических ис-
следованиях С. К. Чуриной (1988), показавшей, что у ряда боль-
ных ЭГ причиной накопления внутриклеточного кальция действи-
тельно может быть его недостаток в питьевой воде, что наблю-
203
дается в Северо-Западном регионе России, в частности, в Санкт-
Петербурге, а также в некоторых районах Финляндии, где ЭГ
получила широкое распространение. Гладкомышечные клетки
сосудов накапливают кальций в условиях его недостаточного по-
ступления в организм. Суммарные результаты эпидемиологиче-
ских исследований свидетельствуют о существовании порога по-
требления кальция с пищей (около 400—500 мг в сутки), ниже
которого риск развития АГ возрастает на 25% (Чурина С. К.
и др., 1995). Большое значение имеет также нарушение содержа-
ния ионов Mg++ в плазме.
Еще один важный шаг в развитии этого нового и несомненно
перспективного направления исследований ЭГ был сделан неко-
торыми авторами, обнаружившими, что при водном и пищевом
дефиците кальция в плазме крови появляется специфический гу-
моральный фактор — пептид (PHF), способствующий усиленно-
му вхождению ионов Са++ в клетки (Pang Р., Lewanczuk R., 1989;
McCarron D., 1989). Циркулирующий в плазме прессорный пеп-
тид выделяют паращитовидные железы, но он не идентичен парат-
гормону и отличается от дигиталисоподобного фактора, как и от
вазопрессина, АП и катехоламинов.
Действие этого фактора, как подчеркивают С. К. Чурина и
соавт. (1995), отличается от действия известных прессорных ве-
ществ длительностью латентного периода (20—25 мин), большей
амплитудой (40—45% от исходного) и продолжительностью
прессорного эффекта. Паратиреоидный гипертензивный фактор
(PHF) повышает пассивный вход ионов Са и нарушает актив-
ность системы котранспорта Na+/K+ и СГ в эритроцитах, кото-
рая является молекулярным генетическим признаком, положи-
тельно сопряженным с величиной АД (Чурина С. К. и др., 1998).
Плазма крови больных с Са-зависимой формой ЭГ при ее
переливании нормотензивным крысам вызывает отчетливый и
устойчивый подъем АД, в отличие от плазмы нормотоников,
которая не оказывает влияния на уровень АД у тех же крыс
(Lewanczuk R. et al., 1990). Следовательно, речь идет об осо-
бой генетической, гуморальной форме ЭГ
(Resnik L., Laragh J., 1983).
Снижение АД под влиянием приема внутрь соли кальция —
пока основной клинический способ выявления Са-зависимого
больного ЭГ; при выявлении этого признака необходимо иссле-
204
довать величину экскреции кальция с мочой, уровень ионов
Са++, паратгормона и PHF в плазме.
Цереброишемическая форма ЭГ
Согласно экспериментальным данным В. А. Сучкова и соавт.
(1969, 1980), цереброишемическая модель экспериментальной
АГ весьма близка к ЭГ (ГБ) у человека. Подчеркивается, что
«различные патологические процессы и конституциональные
особенности, затрудняющие максимальную оксигенацию нерв-
ных центров, будут облегчать возникновение застойных очагов
возбуждения в кортикально-подкорковых участках ЦНС, ответ-
ственных за формирование вазоконстрикторной доминанты».
Клинические наблюдения подтверждают возможность разви-
тия систоло-диастолической АГ у стариков, которую можно свя-
зать с хронической умеренной ишемией некоторых участков
мозга. По своему характеру это не симптоматическая, а эссенци-
альная гипертензия. В материалах Д. Ф. Чеботарева (1978) такая
форма ЭГ встречалась у лиц старше 80 лет в 16—18% случаев.
Поздняя («старческая») форма ЭГ характеризуется, в основ-
ном, благоприятным течением, особенно у части женщин, ску-
достью симптомов, меньшей степенью левожелудочковой гипер-
трофии, сравнительно большим повышением систолического
давления, чем диастолического, например: систолическое давле-
ние >170—180; диастолическое >95 мм рт. ст. Гипертензивные
кризы у этих больных возникают нечасто; по моим наблюдени-
ям, они обычно приобретают диэнцефальную окраску с поли-
урией, гиперперистальтикой, тремором пальцев и т. д. Такие
кризы могут быть следствием ухудшения кровообращения в вер-
тебрально-базилярной области мозгового кровотока; они неред-
ко возникают после сна, горизонтального положения больных.
Предотвращение этих кризов у старых больных ЭГ — достаточно
сложная проблема.
В гемодинамическом отношении ЭГ у старых людей мало от-
личается от заболевания менее пожилых людей: УО и МО сердца
снижены, ОПС повышено. Важно подчеркнуть свойственное
больным этой группы уменьшение ОЦП, что увеличивает их
склонность к ортостатическим реакциям. Этому же способствует
ослабление барорефлекторных механизмов, что, по-видимому,
зависит от выраженных атеросклеротических изменений аорты и
сосудов мозга. Уплотнение стенок артерий может быть причиной
205
ошибочного измерения чрезмерно высокого систолического дав-
ления, поскольку требуется большее наполнение воздухом ман-
жетки, чтобы пережать ригидную артерию. Такое ложное (арти-
фициальное) повышение систолического давления называют
псевдогипертензией. Одним из ее проявлений является признак
Ослера: лучевая артерия легко пальпируется даже тогда, когда
она сжата и кровоток в ней прерван. Систолическое давление,
измеренное прямым методом (артериопункция), оказывается в
этих случаях ниже, чем по методу Короткова. Значительно воз-
растает у таких больных скорость распространения пульсовой
волны по артериям эластического типа, коэффициент См/Сэ
снижается, повышается EJW, т. е. отношение общего эласти-
ческого сопротивления к общему периферическому сопротив-
лению.
ЭГ нередко сочетается с заболеваниями других органов: са-
харным диабетом, атеросклерозом периферических сосудов, де-
генеративными артрозами, хроническими обструктивными забо-
леваниями легких, изменениями в ЦНС и психическими рас-
стройствами и, конечно, ИБС. По поводу этих многочисленных
заболеваний пожилые и старые люди принимают большое число
препаратов, которые вызывают токсические эффекты и, взаимо-
действуя с гипотензивными средствами, нередко понижают их
активность (!).
Следует подчеркнуть, что при старении усиливается вариа-
бельность АД, особенно систолического, которое в большей
мере, чем диастолическое давление, предопределяет у старых
людей развитие осложнений АГ и смертность от нее.
Активность ренина плазмы находится в обратной зависимо-
сти от возраста, среди пожилых больных преобладает низкорени-
новая форма ЭГ; активность симпатической нервной системы,
напротив, при старении больных возрастает, что может объяс-
нить свойственную им усиленную реактивность периферических
сосудов (Дзизинский А. А., Шепотин Ю. Е., 1980).
Итак, на современном уровне знаний мне
представляется возможным выделить
5 к л и н и к о - п а т о г е н е т и ч е с к и х форм Э Г:
1) гиперадренергическую;
2) гипергидратационную;
3) ангиотензин-зависимую;
4) кальций-зависимую;
5) цереброишемическую.
206
Разумеется, я не исключаю возможности дальнейшей диффе-
ренциации ЭГ, для этого требуется прежде всего вдумчивый, не-
спешный клинический анализ особенностей заболевания у каж-
дого больного.
Представленный выше вариант профилизации больных АГ
является преимущественно клиническим по своей сути. В патоге-
нетическом смысле его нельзя рассматривать как слишком жест-
кое разделение больных, поскольку при становлении и развитии
ЭГ патогенетические механизмы, как правило, взаимодействуют,
перекрещиваются и комбинируются. Я отдаю себе отчет в том,
что моя точка зрения не бесспорна и может вызвать возражения,
однако нельзя отрицать, что она создает основу для индивидуа-
лизации лечения больных ЭГ и повышения его эффективности.
Особенности ЭГ у женщин
Необходимость в таком специальном разделе, хотя бы крат-
ком, диктуется объективными причинами. У женщин ЭГ проте-
кает несколько иначе, чем у мужчин, что служит еще одним под-
тверждением общей закономерности — неоднородности
этого заболевания.
Женщинам, как показала наша сотрудница Н. В. Иванова
(1985), а затем в тщательных многолетних исследованиях —
Н. П. Маслова, Е. И. Баранова, О. Н. Жданова и их соавторы
(90-е годы), чаще свойственна гипергидратационная форма ЭГ с
характерными для нее признаками (см. выше). При легком тече-
нии заболевания — у этих женщин отмечается большая частота
сердечных сокращений, более высокий СИ (МО сердца /м2) и
сниженное ОПС по сравнению с мужчинами того же возраста
(Messerli F. et al., 1987).
При каждом данном уровне АД и в одном и том же возрасте
у женщин ЭГ протекает легче, чем у мужчин (Pickering G., 1955).
Данные Фремингеймского исследования показали, в частности,
что у женщин риск возникновения инсульта на 60%, ИБС — на
50%, случаев внезапной смерти — на 35% ниже, чем у мужчин
того же возраста (Kannel W. et al., 1984). У них обычно меньше
выражена и гипертрофия левого желудочка, а изометрическое
напряжение провоцирует повышение АД почти в 1,5 раза ниже,
чем у мужчин.
207
Правда, достоверность этих гемодинамиче-
ских различий сохраняется лишь до на-
ступления менопаузы; после нее картина
разительно меняется. Таким образом, женщины до
менопаузы имеют более ювенильные признаки ЭГ, т. е. они
(женщины) в гемодинамическом отношении оказываются моло-
же мужчин, находящихся в том же возрасте.
В доклимактерическом периоде ЭГ у женщин менее фаталь-
на; положение меняется после менопаузы, когда у постаревших
женщин ЭГ не столь уж редко осложняется мозговыми апоплек-
сиями.
ЭГ у женщин в постменопаузе
В последние годы получены принципиально новые данные
об АГ, развивающейся у женщин в период после менопаузы.
Именно в этом периоде частота случаев АГ начинает превышать
этот показатель у мужчин (Жуковский Г. С. и др., 1997; Быстро-
ва М. М., Бритов А. Н., 1999). Хотя причины повышения АД
полностью не известны (они несомненно включают генетиче-
скую предрасположенность), установлено, что с наступлением
менопаузы происходит уменьшение содержания эстрогенов до
30% от уровня, имевшегося до развития менопаузы (Быстро-
ва М. М., Бритов А. Н., 1999), что сопровождается серией мета-
болических и сосудистых реакций прогипертензивной направ-
ленности: развитием центрального ожирения, повышением кон-
центрации кортизола в плазме, ростом инсулинорезистентности
и гиперинсулинемии, понижением эндотелий-независимой вазо-
дилатации, повышением активности симпатической нервной си-
стемы.
Н. П. Маслова и Е. И. Баранова (1999, 2000) полагают, что
центральным звеном в нарушенной цепи регуляции является из-
менение соотношения между возросшей концентрацией альдо-
стерона и резко понизившейся концентрацией прогестерона в
плазме, свойственное женщинам, находящимся в периоде пост-
менопаузы.
Авторы четко показали, что ЭГ, возникающая в постменопа-
узе, является гипорениновой, что, вероятно, зависит от задержки
ионов Na в организме женщин. Е. И. Баранова установила, что
пониженное и задержанное выделение натрия с мочой связано с
повышением концентрации альдостерона в плазме, стимулирую-
208
щего реабсорбцию ионов Na в дистальных почечных канальцах.
Солевые нагрузки, поставленные Е. И. Барановой у женщин с
ЭГ в постменопаузе, позволили ей придти к выводу, что обсле-
дованные ею больные относились к группе соль-чувствительных
субъектов, по классификации Dahl. В результате этих исследова-
ний Н. П. Маслова и Е. И. Баранова сформулировали централь-
ный вывод: уровень половых гормонов и преж-
де всего прогестерона может быть важней-
шим фактором, участвующим в процессе
развития АГ у женщин в постменопаузе. За-
вершением этой большой работы явилось изучение показателей
центральной гемодинамики, непосредственно определяющих
уровень АД. Выяснилось, что АГ у женщин в постменопаузе яв-
ляется гипокинетическим состоянием с уменьшением МО серд-
ца и повышением ОПС. Очевидно, что после менопаузы проис-
ходит трансформация АГ гиперкинетического типа циркуляции,
свойственного женщинам с АГ в репродуктивном периоде, когда
чаще отмечается увеличение МО сердца и только относительное
повышение ОПС, к гипокинетическому типу с абсолютным по-
вышением ОПС. Подобная эволюция весьма напоминает ту, ко-
торую мы наблюдаем при эволюции ПАГ в устойчивую систоло-
диастолическую ЭГ. Следовательно, женщины в период
половой инволюции проделывают тот же
путь, что и все остальные больные при ста-
новлении у них ЭГ.
Важное значение имеет вопрос о повреждениях органов-ми-
шеней при ЭГ у женщин в постменопаузе. Мне импонирует со-
ображение, высказанное М. М. Быстровой, А. Н. Бритовым
(1999), о том, что гипертрофия левого желудочка рассматривает-
ся как наиболее специфическое поражение сердца при АГ.
Если до менопаузы у женщин масса миокарда левого
желудочка меньше, чем у мужчин — при любом уровне АД
(Devereux R. et al., 1989), то после менопаузы подобные различия
исчезают (Jaravaglia J. et al., 1989). Более того, есть данные, что
гипертрофия левого желудочка чаще наблюдается у женщин в
постменопаузе, чем у мужчин одного и того же возраста (Ham-
mond I. et al., 1986). По данным Н. Crumbulz и соавт. (1993),
у женщин чаще выявляется утолщение стенок левого желудочка
при неизменном размере его полости, тогда как у мужчин чаще
209
встречается увеличение конечного диастолического размера ле-
вого желудочка без утолщения его стенок.
Что же касается мозгового инсульта, этого грозного осложне-
ния ЭГ, то известно, что у женщин в постменопаузе, страдаю-
щих ЭГ, число цереброваскулярных эпизодов возрастает (Pogani-
ni-Hill A. et al., 1988; Fielach N. et al., 1989).
Предпринимаются достаточно успешные попытки применить
заместительную гормональную терапию (ЗГТ) для противодейст-
вия повреждениям мозговых сосудов (Грацианский Н. А., 1996;
Кудряшов О. Ю. и др., 1998; Garsia F. et al., 1998). Среди этих
данных особенно убедительны результаты исследования ЭГ у
женщин в постменопаузе, проведенного в Копенгагене (Pogani-
ni-Hill A. et al., 1988).
ЭГ и ожирение (клинические данные)
Увеличение массы тела обычно способствует повыше-
нию АД. Ожирение рассматривается многими специалистами
как «фактор риска» АГ (Шурыгин Д. Я., 1980; Graddock В.,
1988). В данном разделе речь пойдет не о вторичных формах та-
кого сочетания, т. е. проявлениях эндокринно-обменной патоло-
гии, а о связи между ожирением и ЭГ (ГБ).
Таблица 9 иллюстрирует тот факт, что как лабильная, так и
стабильная ЭГ развивается в среднем на 8 лет раньше у тучных
людей, чем в общей популяции.
Таблица 9
Начало ЭГ у лиц с избыточной массой тела (по J. Moeller)
Группа лиц Средний возраст, годы
Тучные люди Общая популяция людей
Нормотензия 42,7 44,7
Лабильная гипертензия 47,9 56,4
Стабильная гипертензия 54,3 62,3
Столь же точно установлено, что уменьшение мас-
сы тела у больных ЭГсопровождается у них
понижением АД. Такие сдвиги можно было наблюдать в
210
период социальных катастроф (война, голод и т. д.)*, отчетливее
эта закономерность выявляется у более пожилых больных ЭГ. С
повышением уровня жизни населения число больных ЭГ в об-
щей популяции возрастает.
Правда, не каждый тучный человек страдает ЭГ и не каждый
больной ЭГ имеет избыточную массу тела. Более часто сочетание
ЭГ и ожирения выявляется у лиц с так называемой гипертрофи-
ческой формой ожирения, развивающейся у человека в зрелом
возрасте. Лица с рано возникшим ожирением, сохраняющимся в
течение всей жизни {гиперпластическая форма), сравнительно
реже страдают ЭГ. Между тем подростки с эндокринно-обмен-
ной формой ожирения тоже относятся к числу лиц, весьма рас-
положенных к развитию вторичной АГ (Медведев В. П., Кули-
ков А. М., 1988; Бельгов А. Ю., 1994; Kolker U. et al., 1988).
Динамика кровообращения у тучных больных с ЭГ имеет
свои особенности. Избыточная масса тела повышает потреб-
ность организма в Ог и способствует усиленному его поглоще-
нию, что, в свою очередь, требует увеличения МО сердца. По-
скольку частота сердечных сокращений у этих больных изменя-
ется мало, увеличение МО, в основном, обеспечивается возрас-
танием УО сердца. Таким образом, при сочетании ЭГ и
ожирения повышение МО сердца, а также почечного кровотока
можно наблюдать даже в поздних стадиях ЭГ, когда обычно МО
сердца уже нормализуется или понижается. ОПС на фоне увели-
ченного сердечного выброса хотя и снижается, но в меньшей
степени, чем возрастает МО сердца.
Еще одной важной гемодинамической особенностью этих
больных является увеличение у них ОВЖ и ОЦП, т. е. ЭГ имеет
у них черты гипергидратационной формы. Увеличение ОЦП и,
следовательно, притока крови к сердцу повышает его «предна-
грузку». Сердце (включая левый желудочек) реагирует на это
расширением, т. е. удлинением диастолического и систолическо-
го диаметров. Расширение полости левого желудочка, в свою
очередь, повышает напряжение его стенок и тем самым «пост-
нагрузку». Миокард отвечает увеличением мышечной массы и в
конечном счете — развитием эксцентрической гипертрофии ле-
вого желудочка, что получило название «кардиомиопатии при
* Я не имею в виду «ленинградскую блокаду», при которой АГ была следст-
вием воздействия многих вредоносных факторов.
211
ожирении и гипертензии» (Messerli F., 1988). Несомненно, что
расширению сердца у этих больных способствуют дистрофи-
ческие изменения миокарда, связанные с ожирением, и дыха-
тельные нарушения (гипоксия), зависящие от гиповентиляции
нижних отделов легких, а также свойственные таким боль-
ным водно-электролитные нарушения (гипокалиемия и др.).
У тучных больных, страдающих ЭГ, возрастает склонность к на-
рушениям сердечного ритма. Ряд авторов подчеркивает, что
ожирение и ЭГ ускоренно приводят к развитию недостаточности
кровообращения.
ЭГ и сахарный диабет (клинические данные)
В главе 2 подчеркивались важность и актуальность этой
проблемы для понимания патогенеза ЭГ. Ниже будут рассмотре-
ны особенности клиники у больных, у которых ЭГ сочетается с
сахарным диабетом.
Таких больных немало; в группе больных ЭГ, наблюдавших-
ся М. Prachar и соавт. (1977), 33% страдали сахарным диабетом.
Многие другие клиницисты подчеркивают, что лица с сахарным
диабетом имеют повышенную склонность к развитию ЭГ.
В США более чем у половины больных сахарным диабетом
определяется хроническое повышение АД. По данным М. Brown
и J. Whitworth (1992), частота АГ при сахарном диабете колеблет-
ся в разных странах от 30 до 80%.
У больных сахарным диабетом помимо ЭГ встречаются ги-
пертензии другого происхождения. Среди них — нефротический
синдром Кимельстила—Уилсона (интеркапиллярный гломеруло-
склероз). АД в этих случаях повышается под влиянием двух меха-
низмов: а) увеличения количества обменноспособного натрия и
ОВЖ; б) повышенной чувствительности резистивных сосудов к
норадреналину и АП. Уровень в крови адреналина, норадрена-
лина, допамина, кортизола, ренина, альдостерона в большинст-
ве случаев остается нормальным либо понижается (Berretta-Pic-
coli С. et al., 1979; Weidmann P. et al., 1979). АГ чаще возникает
у больных, страдающих сахарным диабетом I типа, т. е. инсули-
нозависимым. Диабетическая нефропатия обычно возникает по-
сле 15-летнего заболевания сахарным диабетом: у одного из
3 больных с диабетом I типа и у одного из 5 больных с диабе-
том II типа.
212
АГ вовлечена в 4,4% случаев смерти от сахарного диабета, а
сахарный диабет имеет отношение к 10% смертей от АГ. От 35
до 75% диабетических осложнений в какой-то мере связаны с АГ
(Bild D., Touch S., 1987).
Злокачественный гипертензивный синдром возникает редко,
но интеркапиллярный гломерулосклероз
может приводить к хронической почечной
недостаточности.
Еще одна форма — гемодинамическая систо-
лическая гипертензия, связанная с атеро-
склеротическим уплотнением аорты. Третья
форма — реноваскулярная атеросклеротиче-
ская гипертензия. В одной из серий наблюдений среди
больных с реноваскулярной АГ в 20% был выявлен сахарный
диабет и еще у 37% больных допускалась возможность скрытого
сахарного диабета (Steele Т., 1977). Наконец, АГ может быть
проявлением хронического пиелонефрита, неред-
ко осложняющего сахарный диабет.
Среди клинических особенностей ЭГ (АГ) у больных сахар-
ным диабетом следует упомянуть:
1) более частое, чем обычно у больных ЭГ, возникновение
тромбозов крупных артериальных сосудов, особенно таза и бедра;
в наблюдениях Н. Janka и соавт. (1978) 80% больных сахарным
диабетом, осложнившимся проксимальным тромбозом крупных
артерий, страдали АГ, причем у многих из них АД превышало
200/110 мм рт. ст.;
2) постуральные гипотензивные реакции при переходе больно-
го из положения лежа в положение сидя (в 20% случаев);
3) «автономная (вегетативная) сердечная невропатия», харак-
теризующаяся стойким учащением синусового ритма, не реаги-
рующим на фазы дыхания, изменения положения тела и т. д. Та-
кой своеобразный ригидный синусовый ритм свойствен, в
основном, больным с длительно текущим инсулино-дефицит-
ным сахарным диабетом (Глезер М. Г., 1980; Левина Л. И., 1985,
1988). Диабетическая тотальная «денервация» СА узла может рез-
ко ограничивать физическую активность больного и даже быть
причиной его внезапной смерти (O’Brien A. et al., 1986);
4) более раннее и ускоренное развитие кардиосклероза: интер-
стициального, периваскулярного и заместительного (рубцы) с
расширением сердца и развитием застойной сердечной недоста-
213
точности даже при отсутствии коронарного атеросклероза (Узи-
левская Р. А., Кушаковский М. С., 1977);
5) склонность к возникновению электролитных расстройств,
особенно гипокалиемии и гипомагнезиемии с последующими
нарушениями сердечного ритма и проводимости (Кушаков-
ский М. С., 1992);
6) Раннее и интенсивное развитие идиопатического (дегене-
ративного) кальциноза внутрисердечных структур, что усиливает
нагрузку на миокард (Кушаковский М. С., Балябин А. А., 1990);
7) выявляется положительная корреляция между частотой ги-
пертензии и ожирением, а также уровнем триглицеридов в плаз-
ме крови;
8) напомним в заключение о «смертоносном квартете»', ги-
пертензии, сахарном диабете, ожирении и повышенной рези-
стентности тканей к инсулину.
Некоторые лабораторные данные при ЭГ
Хотя повышение АД является основным, ведущим призна-
ком ЭГ, это заболевание характеризуется и различными метабо-
лическими нарушениями. Цель лабораторных исследований —
выявление этих нарушений, а также возможной причины гипер-
тензии, степени повреждения функций различных органов, и
прежде всего органов-мишеней.
Показатель гематокрита и число эритроцитов. У многих боль-
ных отмечается склонность к увеличению содержания эритроци-
тов, гемоглобина и показателя гематокрита (47—57%) при нор-
мальном числе лейкоцитов и тромбоцитов; F. GeisbocK (1905)
еще в начале века (до открытия Короткова) обозначил этот
синдром термином «polycythemia hypertonica» (спленомегалии у
больных нет).
Теперь известно, что повышение показателя гематокрита за
счет умеренного эритроцитоза может быть связано у больных ЭГ
с двумя механизмами: 1) с истинным усилением эритропоэза
гипоталамического происхождения (Ланг Г. Ф.); 2) с уменьше-
нием ОЦП, к которому, как мы уже упоминали выше, склонны
больные во II—III стадии заболевания, при сохранении нормаль-
ной массы эритроцитов (гемоконцентрация; относительный
эритроцитоз).
Аналогичное явление можно наблюдать при воздействии на
человека стрессовых факторов, включая острое эмоциональное
214
возбуждение и состояние тревоги, а также после внутривенного
введения норадреналина и (или) АП. Не случайно для характе-
ристики такого синдрома иногда применяют наименование
«стресс-полицитемия».
«Стресс-полицитемия» не может рассматриваться как добро-
качественное явление. По некоторым наблюдениям, у 47% боль-
ных ЭГ с относительным эритроцитозом возникают тромбоэм-
болические осложнения. В далеко зашедшей стадии ЭГ или при
ее злокачественном течении показатель гематокрита может по-
нижаться за счет анемии (Кушаковский М. С., 1950).
Белки плазмы. Как и эритроцитоз, умеренная гиперпротеи-
немия зависит от уменьшения ОЦП при нормальной продукции
сывороточных белков. Протеинограмма тоже остается нормаль-
ной, лишь в глубокой старости у части больных возрастает со-
держание глобулинов в плазме.
Вязкость крови. В условиях покоя у больных ЭГ она выше,
чем у лиц с нормальным АД. Этому способствуют умеренный
эритроцитоз и небольшая гиперпротеинемия, а также другие
факторы (Зайцев В. С., Гуревич А. М., Крынский О. М., 1980).
При физической нагрузке показатели вязкости возрастают как у
больных, так и у здоровых людей с сохранением различий между
ними.
В последние годы реологические свойства крови, и прежде все-
го ее вязкость, последовательно изучали В. А. Люсов и его со-
трудники (1993). По их данным, вязкость крови повышается уже
в I стадии ЭГ; во II—III стадии заболевания эти изменения вы-
ражены более отчетливо. Только у 42% больных во II—III стадии
ЭГ сохраняются нормальные показатели вязкости крови. Среди
причин усиления вязкости крови, являющегося дополнительным
фактором для повышения ОПС (Парфенов А. С., 1980; Лапотни-
ков В. А., Хараш Л. М., 1984), можно назвать увеличение рези-
стентности мембран эритроцитов к различным воздействиям, ге-
моконцентрацию, увеличенное содержание в плазме фибриноге-
на и растворимого фибрина, а также триглицеридов и общего
холестерина (Люсов В. А., 1993), повышение агрегации тромбо-
цитов и эритроцитов (Козловский 3. И., 1993; Задионченко В. С.
и др., 1993).
Липвды крови. В начальной стадии ЭГ общая и фракционная
липидемия не отклоняются от нормы. В последующем (если ЭГ
длится больше 2 лет) нарастает гиперлипидемия. W. Holander
215
(1977) находил уровни холестерина 6,5 ммоль/л, триглицеридов
(1,65 ммоль/л) у 33% больных без явных признаков атеросклеро-
за и у 65% больных, имевших сочетание ЭГ с атеросклерозом.
По материалам наших сотрудников Б. Л. Холмянского и
М. Л. Пушкаревой, комбинация ЭГ и атеросклероза сопровож-
дается гиперлипопротеидемией II и IV типа по Фредриксену.
Надо учитывать, что у части больных возрастанию в плазме кон-
центрации холестерина и липопротеидов низкой плотности спо-
собствует длительное применение диуретиков в больших дозах и
других противогипертензивных препаратов (см. ниже).
Свертываемость крови. У больных относительно молодого
возраста в начальной стадии заболевания средние величины
основных показателей системы свертывания соответствуют нор-
ме. Тромбогенный потенциал возрастает по мере старения боль-
ных, прогрессирования ЭГ и атеросклероза (Чазов Е. И.).
А. И. Грицюк (1974), основываясь на разработанном им индексе
тромбофилии, выявил предтромботическое состояние у 40% боль-
ных в III стадии ЭГ. Нарастание тяжести заболевания сопровож-
дается усилением процесса внутрисосудистого свертывания кро-
ви (Бокарев И. Н. и др., 1993).
Показатели функции печени. При неосложненном течении
ЭГ мало изменяется активность сывороточных аланин- и аспар-
тат-аминотрансфераз. Нарушение билирубин-выделительной
функции печени встречается лишь у 5,6% больных старшего воз-
раста (Фесенко И. П., 1974). Согласно данным Н. М. Коженко
и соавт. (1976), у больных старше 50 лет во II—III стадии забо-
левания имеются признаки снижения поглотительной функции
ретикулоэндотелиальных клеток (коллоидный раствор I98AU).
У некоторых больных ЭГ более пожилого возраста отмечаются
изменения паренхиматозных печеночных клеток (1311 — бенгаль-
ский розовый).
В последние годы Т. А. Шулутко (1993) исследовала больных,
страдавших различными почечными АГ и заболеваниями пече-
ни. Она пришла к выводу, что такое сочетанное поражение пече-
ни и почек не оказывает существенного влияния на частоту АГ.
Возможное снижение синтеза ангиотензиногена (в последующем
АП) при нарушениях функции печени нивелируется, по мнению
автора, частым развитием вторичного альдостеронизма.
Сахар крови и мочевая кислота. По наблюдениям И. П. Фе-
сенко (1974), у больных ЭГ, не страдающих сахарным диабетом,
216
уровень сахара натощак повышается с возрастом: от 5,5 ммоль/л
в 45—59 лет до 7,7 ммоль/л у лиц в возрасте 75 лет и старше.
W. Hollander (1973) отметил связь между высотой гликемии
у больных ЭГ и выраженностью у них атеросклероза. Более
подробно связи между нарушениями угле-
водного обмена, резистентностью тканей
к инсулину и развитием ЭГ мы рассмотре-
ли выше.
При анализе данных о гипергликемии у больных ЭГ необхо-
димо учитывать диабетогенное действие диуретиков в больших
дозах, часто включавшихся в лечебные программы.
Содержание мочевой кислоты выше нормального уровня от-
мечается у 1/3 больных ЭГ, особенно при сочетании ее с атеро-
склерозом. Урикемия, как подчеркивалось, возрастает при нару-
шении функции почек. Влияние диуретиков на уровень мочевой
кислоты плазмы рассматривается ниже. По данным Н. А. Мухи-
на (2000), о которых я упоминал выше, у 40% больных ЭГ выяв-
ляются нарушения пуринового обмена.
Электролиты. Концентрации в плазме калия, магния, натрия,
хлора у большинства больных ЭГ вне периода приема диурети-
ков остаются нормальными, если больные находятся на свобод-
ной диете (5 г Na; 3,4 г К; 0,3 г Mg). Что касается ионов Са++,
то, как мы подчеркивали выше, у 15—25% больных с Са-зависи-
мой формой ЭГ можно наблюдать склонность к умеренной ги-
покальциемии на фоне усиленного Са-уреза. Надо также отме-
тить, что уровень Na+ в плазме может несколько понижаться у
больных с наиболее тяжелым течением ЭГ (133—134 ммоль/л).
Результатом длительного и массивного лечения диуретиком мо-
жет быть не только гипокалиемия, но и снижение общего содер-
жания калия в организме больного.
Исследования клеточного и общего содержания Na+, К+,
Са++ у больных ЭГ подтвердили, что это гетерогенная болезнь,
характеризующаяся изменениями параметров различных транс-
портных ионных систем. Особенно показательны данные о по-
вышении концентрации ионов Са++ в цитозоле тромбоцитов
при ЭГ (Чурин К. В., 1993) и о том, что противогипертензивные
препараты понижают не только АД, но и содержание Са++
в тромбоцитах, которые справедливо сравнивают с гладкомы-
шечными клетками резистивных сосудов (Erne Р. et al., 1984;
Lechi A. et al., 1987).
217
Потообразование тоже понижается при применении противо-
гипертензивных средств, что отражается на выделении с потом
калия и других электролитов (проба с усилением потоотделения
с помощью пилокарпина) (Малов Ю. С., Кучин А. Н., 1993).
Газы крови и диффузия кислорода в легких. Еще в 50—
60-х годах А. А. Трегубов, И. Ф. Лулаков, М. И. Михасев (кли-
ника Н. Н. Савицкого) показали, что у некоторых больных ЭГ
в ранней ее стадии может возникать преходящая и умеренная ар-
териальная гипоксемия, связанная с нарушениями координации
между вентиляцией и кровотоком в отдельных участках легких.
Я не обнаружил нарушений оксигенации гемоглобина и из-
менений его свойств у большой группы больных в далеко зашед-
шей стадии ЭГ без недостаточности кровообращения (Кушаков-
ский М. С., 1968).
И. П. Смирнов (1975), применив методику с вдыханием СОг,
нашел, что по мере углубления ЭГ происходит постепенное
ухудшение диффузионной способности легких. А. В. Токарь,
Л. М. Ена (1976), Л. М. Ена (1980) выявили артериальную гипок-
семию у части лиц с ЭГ в старческом возрасте.
Артериальная гипертензия у пожилых и старых людей
Согласно современным критериям, к группе пожилых отно-
сятся люди в возрасте от 68 до 76 лет; к старикам — от 77 до
86 лет; к долгожителям — от 87 до 99 лет; к категории «удачли-
вых старцев» >100 лет (Hall W., 1987).
По данным К. Ueda и соавт. (1989), за 10 лет (1973—1983 гг.)
пропорция людей в возрасте 65—74 лет заметно возросла в 28 из
32 стран Европы и Америки, о которых имелись статистические
данные. Доля этих людей достигла в Польше 30%, в Японии, Фин-
ляндии, Италии — 20% от общего числа жителей. По мере старе-
ния человеческой популяции* возрастает и число больных с АГ.
У них можно наблюдать, в основном, три варианта АГ:
1) систолодиастолическую, или «старческую» форму ЭГ;
2) систолодиастолическую реноваскулярную (атеросклероти-
ческую) АГ;
3) систолическую (атеросклеротическую) изолированную АГ.
Последняя является наиболее распространен-
ной, доминирующей, формой; я сосредоточусь на
* В последующем мы будем пользоваться единым термином — старые люди
(старики).
218
ее анализе, особенно потому, что при лечении этих больных не-
редко допускаются ошибки. Что же касается особенностей «стар-
ческой» формы ЭГ, то мы их рассмотрели выше; реноваскуляр-
ная (атеросклеротическая) АГ описана ниже (в плане дифферен-
циальной диагностики).
Возникновение изолированной систоли-
ческой АГ связано с прогрессирующим по
мере старения человека понижением элас-
тичности стенок аорты и ее крупных ветвей,
соответственно — с ослаблением амортизи-
рующей функции аортального эластическо-
го «котла» (камеры). Добавочное значение имеет по-
вреждение барорецепторных зон аортальной и синокаротидной
областей, а также атеросклеротическое изменение вне- и внутри-
черепных артерий с ишемией мозговых центров, регулирующих
упруго-вязкое состояние артериальных сосудов.
По материалам Д. Ф. Чеботарева, у стариков систолическая
АГ встречается в 2—3 раза чаще, чем ЭГ. Как сообщили A. Dayer
(1977), W. Hall (1987), изолированная систолическая гипертен-
зия регистрировалась в группе мужчин 55—64 лет в 9,5%, 65—
74 лет — в 15%, 75—79 лет — в 26,9%, 80 лет и старше — в 18% слу-
чаев. У женщин она регистрировалась несколько чаще: в воз-
расте 55—64 лет в 25,6%, 65—74 лет — в 30,7%, 75—79 лет —
32,9% случаев.
По данным Р. Г. Оганова (1997), J. Stassen и др. (1990), изо-
лированной систолической артериальной гипертензией страдают
от 10 до 20% больных старше 60 лет.
По более полным данным, приводимым J. Staessen и соавт.
(1990), распространенность изолированной систолической ги-
пертензии составляет 6% в возрасте 60 лет, 12% — в возрасте
70 лет и 24% — в возрасте 80 лет. В общем, на долю изолирован-
ной систолической гипертензии приходится до 60—70% всех слу-
чаев АГ у лиц в возрасте 60 лет и старше (Сидоренко Б. А. и др.,
1999). По классификации экспертов ВОЗ (1993) выделена погра-
ничная изолированная систолическая гипертензия, когда систо-
лическое АД повышено в пределах 140—160 мм рт. ст. при диа-
столическом давлении ниже 90 мм рт. ст. В классификации
1999 г. систолическое АД при ПАГ повышено в пределах
140—149 мм рт. ст.
219
Характерной особенностью изолированной систолической
(атеросклеротической) АГ является хроническое, отнюдь не устой-
чивое повышение систолического давления выше уровня 160—
170 мм рт. ст., при диастолическом давлении ниже 90 мм рт. ст.
У больных, находящихся в горизонтальном положении, могут
быть измерены величины АД порядка: 180/80, 195/75, 200/85,
170/70 мм рт. ст. Надо учитывать, что у этих людей измеренные
амбулаторно (дома) и в клинических условиях величины АД до-
стоверно разнятся: первые ниже вторых, эти различия в показа-
телях систолического давления составляют 15—20 мм рт. ст. При
переходе в вертикальное положение у тех же больных систоличе-
ское давление понижается на 10—25 мм рт. ст., иногда больше;
диастолическое давление изменяется мало. Возможны ортоста-
тические реакции еще до применения противогипертензивных
средств; они (реакции) отражают неспособность барорецептор-
ных механизмов и систем регуляции мозгового кровотока быстро
и адекватно приспосабливаться к изменениям положения тела.
Пульсовое давление всегда большое (до 80—100 мм рт. ст.). У по-
жилых людей отмечается более значительный подъем АД в ут-
ренние часы, по сравнению с молодыми, что угрожает развитием
ишемии мозга. В то же время, ночное снижение АД выражено в
меньшей степени у больных пожилого возраста (non-dipper). Ве-
роятность того, что человек является non-dipper, возрастает с
возрастом больного.
Многие лица сравнительно легко переносят «привычную»
для них возрастную систолическую гипертензию. У других боль-
ных даже небольшое повышение систолического давления
(>160—170 мм рт. ст.) вызывает головную боль, пошатывание,
головокружение, боли в области сердца, иногда ухудшение зре-
ния, провалы в памяти. Особенно тяжело воспринимается неко-
торыми из этих больных прирост ударного давления (гемодина-
мического удара).
Слишком резкие подъемы систолического
давления, как и внезапные его снижения, мо-
гут осложняться ишемией мозга, инсультом и
другими сосудистыми катастрофами. Эпидемио-
логические исследования показывают, что у лиц 65—74 лет, име-
ющих систолическое давление >180 мм рт. ст., при диастоличе-
ском давлении <95— 90 мм рт. ст., риск заболеть инсультом или
инфарктом миокарда значительно выше, чем у людей того же
220
возраста с более низким уровнем систолического давления.
Устойчивое возрастание систолического давления до уровня
>200 мм рт. ст. повышает в 2—4 раза вероятность сердечно-сосу-
дистых расстройств и случаев кровоизлияния в мозг (Hall W.,
1987). По данным Фремингеймского исследования, риск разви-
тия ИБС у больных 65—94 лет с систолическим АД выше
180 мм рт. ст. в 3—4 раза больше, чем у больных с систо-
лическим АД ниже 120 мм рт. ст. (Weber М. et al., 1985).
С каждым повышением систолического АД
на 20 мм рт.ст. вероятность мозгового ин-
сульта возрастает примерно вдвое (Chalmers J.
et al., 1996). Частота осложнений ЭГ увеличивается с возрастом
больных. Так, у больных с мягкой АГ в возрасте 29—34 года риск
развития осложнений в течение 10 лет составляет менее 1%,
тогда как в возрасте 65—74 лет — более 30% (Барт Б., 1994). По
данным O’Donneli С., Kannel W. (1998), изолированная систоли-
ческая гипертензия сопровождается увеличением в 2—3 раза час-
тоты мозгового инсульта, атеросклеротического поражения сосу-
дов нижних конечностей, ИБС.
Наряду с увеличением систолического и пульсового давле-
ния у этих больных часто отмечаются и другие проявления ате-
росклероза аорты и ее крупных ветвей: скорый, высокий пульс,
загрудинная пульсация, симптом Ослера (см. выше), псевдоги-
пертензия или псевдогипотензия, асимметрия давления на пле-
чевых артериях, неодинаковое наполнение пульса на сонных ар-
териях, расширение и интенсивная пульсация правой подклю-
чичной артерии, а также смещение влево перкуторной границы
сосудистого пучка, акцент II тона на аорте, приобретающий тим-
панический оттенок, систолический шум выброса (кальциноз,
атеросклероз) в месте выслушивания аорты, рентгенологические
и эхокардиографические признаки расширения, уплотнения и
обызвествления аорты; шумы на артериях живота и бедренных
артериях, сужение артерий нижних конечностей.
Типично повышение скорости распро-
странения пульсовой волны по артериям в
участке аорта —бедренная артерия до 13—
15 м/с, в единичных наблюдениях — до 25 м/с; уменьшение ко-
эффициента См/Сэ ниже единицы; повышение Сэ на отрезке
брюшная аорта—бедренная артерия, возрастание модуля упруго-
221
ста стенки аорты и уже упоминавшееся усиление гемодинамиче-
ского удара до 25—50 мм рт. ст.
Для сравнения привожу нормальные величины некоторых
из этих показателей у лиц пожилого и старческого возраста:
Сэ = 6,5 + 10 м/с; См/Сэ = 1,0 - 1,2; Еэ = 6000 ± 1500 дин/см2
(Савицкий Н. Н., 1964, 1974; Никитин В. П., 1964; Кушаков-
ский М. С., 1950; Морозов К. А., 1966; Мошкин Е. А., 1966; То-
карь А. В., 1977). Следует, наконец, указать, что, по последним
рекомендациям ВОЗ/МОГ, изолированная систолическая гипер-
тония больше не рассматривается как самостоятельное заболева-
ние. С этим последним положением я, естественно, согласиться
не могу, поскольку гемодинамические расстройства при этой
форме повышения АД имеют своеобразный характер, и заболе-
вание с самого начала имеет черты изолированной систоличе-
ской АГ. У лиц, у которых в позднем возрасте происходит уплот-
нение аорты и нарушение функции аортальной компрессионной
камеры, систолическое АД возрастает, а ДД понижается. Эта как
бы вторичная изолированная систолическая АГ действительно
является производной ЭГ, но таких больных среди больных с
изолированной систолической АГ немного.
В ряде работ исследовались генетические аспекты ЭГ у по-
жилых больных (Цфасман А. 3., 1985). Так, J. Delaneghe и соавт.
(1998) установили, что у пожилых больных с АГ наличие фено-
тина 1-1 гаптоглобина взаимосвязано с повышением систоличе-
ского АД. D. Elecwierz и соавт. (1997) сделали попытку найти
связь между полиморфизмом гена АПФ и риском развития АГ и
ИБС в разных возрастных группах. Эти исследователи устано-
вили, что ДД-генотип гена АПФ связан с развитием инфаркта
миокарда у больных моложе 50 лет и с наличием АГ у больных
ИБС старше 65 лет. J. Damiani et al. (1995) сообщили, что хотя
средние величины систолического АД за сутки у мужчин и жен-
щин достоверно не различались, максимальное значение систо-
лического АД отмечено у мужчин (158 мм рт. ст.) в 19 ч, у жен-
щин (163 мм рт. ст.) — в полдень. У мужчин это было связано с
просмотром телевизионных новостей и общением с друзьями в
клубах и барах, у женщин — с активной работой по дому. Кроме
того, у женщин средний уровень диастолического АД за сутки
был несколько выше, чем у мужчин, с максимальным подъемом
в утренние часы, после полудня и ночью. Как известно, среди
пожилых лиц широко распространена ИБС, частота которой у
222
пациентов старше 60 лет достигает 10—40% (Барб Т., 1991).
В ряде многоцентровых исследований было показано, что изоли-
рованная систолическая гипертензия повышает смертность от
сердечно-сосудистой патологии в 2—5 раз, частоту инсультов
в 2,5 раза по сравнению с людьми, имеющими нормальные по-
казатели АД при сравнимых возрасте и поле (Мартынов А. И.
и др., 1997).
По данным фремингеймского исследования, риск разви-
тия ИБС у больных 65—94 лет с систолическим АД выше
180 мм рт. ст. в 3—4 раза больше, чем у больных с систоличе-
ским АД ниже 120 мм. рт. ст. (Weber М. et al., 1989). С каждым
повышением систолического АД на 20 мм рт. ст. вероятность
мозгового инсульта возрастает вдвое (Chalmers J. et al., 1996).
Высокий уровень систолического АД является основным факто-
ром риска развития изолированного атеросклероза аорты и под-
вздошной артерии, как у мужчин, так и у женщин. На развитие
перемежающейся хромоты также больше влияет повышение сис-
толического, чем диастолического АД (Jagnon J. et al., 1994).
Атеросклеротическая реноваскулярная гипертензия
и ее сочетание с ЭГ пожилых людей
Атеросклероз почечной артерии с ее сужением обычно пора-
жает лиц старше 50 лет, 65% из них мужчины. На этот наиболее
распространенный вариант реноваскулярной гипертензии при-
ходится до 40—60% всех ее случаев (Князев М. Д., Князева Т. А.,
Арабидзе Г. Г., 1980). Большие фиброзные атероматозные бляш-
ки располагаются в начальном отрезке почечной артерии (чаще
справа), здесь же могут формироваться различной величины
тромбы. Указанием на начало реноваскулярной АГ может слу-
жить повышение АД, которое сначала, скорее, бывает лабиль-
ным (!), а позже характеризуется устойчивым возрастанием диа-
столического давления (105—110 мм рт. ст.), что вообще нехарак-
терно для стариков с присущей им изолированной систолической
гипертензией. Локализация атеросклеротических повреждений в
других сосудах отмечается более чем у 65% этих больных (По-
кровский А. В., Спиридонов А. А., 1978). К той же категории
диагностических признаков относится асимметрия АД на руках
(разница >20 мм рт. ст.), вплоть до псевдогипотензии, связанной
с атеросклеротическим сужением одной из подключичных арте-
223
рий (на стороне, где измеряется АД). В таких случаях от места
стеноза подключичной артерии выслушивается достаточно гром-
кий систолический шум. При выслушивании сердца определяет-
ся громкий II тон на аорте, приобретающий музыкальный отте-
нок; здесь же слышится систолический шум выброса (кальци-
ноз, атеросклероз аорты и полулуний аортальных клапанов).
Учащение мочеиспускания отмечается у 35—40% больных с ате-
росклеротической формой реноваскулярной АГ.
Течение реноваскулярной АГ напоминает клинику ЭГ II—
III стадии; нередко требуются годы для постановки правильного
диагноза, особенно при ее присоединении к ЭГ, которой страда-
ли больные прежде в течение многих лет. В ряде случаев сужение
почечной артерии может быть причиной возникновения злока-
чественного гипертензивного синдрома.
Наиболее точный метод диагностики стеноза почечной арте-
рии — аорторенография; известное диагностическое значение
имеет и ультразвуковое сканирование почек и брюшного отдела
аорты.
Сам по себе факт выявления атеросклеротического сужения
почечной артерии еще не означает, что гипертензия у больного
зависит от избыточного образования ренина в поврежденной
почке. Между тем успех или неудача реконструктивной сосуди-
стой операции во многом зависит от правильной оценки рени-
нового профиля АГ. Выявление ренинозависимой формы рено-
васкулярной гипертензии достигается в наше время с помощью
антагонистов АП — саралазина, или лозартана, либо ингибитора
АПФ — каптоприла. Депрессорный эффект саралазина оценива-
ется по степени снижения диастолического давления. Его сни-
жение более чем на 9% приобретает диагностическое значение.
Реакции АД на прием каптоприла описаны ниже.
Лечение реноваскулярной гипертензии обычно осуществля-
ется хирургическим путем либо с помощью лекарственных
средств и диеты. Хирургическое лечение значительно эффектив-
нее. Его методика предусматривает максимальное щажение по-
чечной ткани; наибольшее распространение получили рекон-
структивные операции на почечных артериях (аутовенозная
пластика, пластика синтетическим протезом, баллонирование
и т. д.); при стенозировании сосуда атеросклеротической бляш-
кой предпочтение отдают чрезаортальной эндартерэктомии.
224
Нефрэктомию производят лишь в ограниченном числе случаев
(Чернышев Н. Н. и др., 1980; Бояджян П. П. и др., 1980).
Отбор больных для операции при атеросклеротическом сте-
нозе почечных артерий сложен, а результаты хирургического ле-
чения не всегда удовлетворяют, поскольку на них сказывается
влияние общего сосудистого заболевания и поражение сердца.
Операция не всегда приносит успех, если у больного имеется
двустороннее атеросклеротическое сужение почечных артерий.
Понижение почечной функции (возрастание концентрации кре-
атинина в плазме крови) сопровождается возрастанием хирурги-
ческой летальности. Правда, в последние годы наблюдается тен-
денция к расширению показаний к оперативному лечению боль-
ных этой категории, в том числе и тех лиц, у которых имеется
стеноз артерии единственной почки.
Крайние клинические проявления ЭГ
(гипертензивные крайности)
Наряду с медленно прогрессирующим, обычным, течением
ЭГ («доброкачественным») известно и быстро прогрессирующее,
злокачественное, течение этого заболевания. Вместе с гипертен-
зивными кризами эту форму иногда относят к крайним проявле-
ниям ЭГ. Ниже приводятся описание особенностей этих состоя-
ний, а затем и способы их лечения (глава 5).
Злокачественная (быстро прогрессирующая) ЭГ: клиника
Злокачественной называют стремительно нарастающую и
очень тяжело протекающую АГ, в короткий срок приводящую к
повреждению сосудов почек и к развитию почечной недостаточ-
ности.
Различают: 1) злокачественную ЭГ; 2) злокачественную фазу
(финал) ЭГ; в этом случае обычно медленно текущее заболева-
ние заканчивается переходом в злокачественное течение; 3) зло-
качественный гипертензивный синдром, осложняющий симпто-
матические АГ; любая гипертензия, за исключением коарктации
аорты, может прогрессировать в злокачественный синдром; он,
правда весьма редко, развивается и при первичном альдостеро-
низме.
В наше время злокачественная ЭГ или ее фаза встречается
исключительно редко; еще 15 лет тому назад на их долю прихо-
К Зак 3207
225
дилось 0,19% от всех случаев ЭГ (Арабидзе Г. Г. и др., 1980). По-
лагают, что нелеченная ЭГ трансформируется в злокачественную
фазу приблизительно в 1% случаев.
Основную массу больных (по данным пункционной биопсии
почек) составляют лица, у которых симптоматические АГ
осложняются злокачественным гипертензивным синдромом (Ви-
херт А. М., Коздоба О. А., 1980). Эту точку зрения также хорошо
подтверждают материалы табл. 10.
Причины 83 случаев злокачественной АГ
(по М. Brown, J. Whitworth, 1992)
Таблица 10
Название заболевания Число больных %
Первичная гломерулярная болезнь почек 25 30
Вторичная гломерулярная болезнь почек 16 19
Тубулоинтерстициальный нефрит 13 16
Реноваскулярная болезнь 11 13
Синдром Конна 1 1
ЭГ 17 20
Среди больных злокачественной ЭГ преобладают мужчины.
Из 103 больных, наблюдавшихся Е. М. Тареевым, А. В. Сумаро-
ковым, А. А. Михайловым (1972), около 80% были моложе
45 лет. Заболевание начинается внезапно с интенсивной голов-
ной боли, головокружения, болей в животе, рвоты, анорексии. У
части больных первым и ведущим признаком бывает понижение
зрения, у других — удушье, кровохаркание, отек легких или
приступ стенокардии. АД достигает предельных величин:
250—300/140—160 мм рт. ст.; оно устойчиво; диастолическое дав-
ление обычно выше 130 мм рт. ст.; среднее гемодинамическое
давление превышает 170—180 мм рт. ст. Только у отдельных
больных типичный злокачественный синдром развивается при
более низком АД. Например, при остром гломерулонефрите или
эклампсии, осложняющихся таким синдромом, АД может не
превышать 160/100 мм рт. ст.
226
Быстро изменяется общий вид больного: кожа приобретает
бледный с желтизной или землистый оттенок, черты лица заост-
ряются, в глазах появляется страдальческое выражение, больные
измождены, быстро худеют. По меткому выражению Е. М. Таре-
ева, которому принадлежит наиболее полное описание клиники
злокачественной гипертензии, ее течение подобно «сближенным
гипертоническим кризам с обманчивыми ремиссиями между
ними». Неслучайно многие зарубежные клиницисты объединяют
злокачественную гипертензию и «судорожный» вариант гипер-
тензивных кризов («острая гипертензивная эцефалопатия») в
одну группу так называемых гипертензивных крайностей.
Болезнь стремительно прогрессирует, АД стабильно удержи-
вается на чрезвычайно высоком уровне, повторно возникают
кризы, связанные с отеком мозга, падает острота зрения до раз-
вития слепоты (отек соска зрительного нерва и сетчатки — 4 тип
агиорретинопатии), затемняется сознание от оглушения до со-
пора, могут присоединяться внутримозговые или субарахнои-
дальные кровоизлияния, острая сердечная недостаточность (отек
легких).
Как мы уже упоминали, особенно тяжело повреждаются
почки (фибриноидный артериолонекроз, некротический гломе-
рулит — «фаровская почка») (Вихерт А. М., Коздоба О. А., 1980);
при исследовании мочи находят изогипостенурию, протеинурию
(от 0,5 до 3 г/л белка за сутки), иногда — значительную ге-
матурию и цилиндрурию (гиалиновые и зернистые цилиндры).
В крови: нейтрофильный лейкоцитоз, повышение СОЭ, тромбо-
цитопения, гемолиз, анемия. В плазме крови возрастает концент-
рация креатинина, мочевины, остаточного азота. Снижение ско-
рости клубочковой фильтрации является наиболее важным про-
гностическим признаком. Летальность ниже среди больных с
умеренной азотемией.
В случаях остро возникшей злокачественной ЭГ почки обыч-
но сохраняют нормальные размеры; для злокачественной фазы
ЭГ типично уменьшение почек. Экскреторная урография —
сравнительно простой и малообременительный для больного ме-
тод, позволяющий судить о размерах почек; той же цели служит
ультразвуковое исследование почек.
Согласно экспериментальным данным С. Ferrario и соавт.
(1975), следует различать два клинико-физиологических типа
злокачественной гипертензии. Тип I характеризуется низким
227
МО сердца, признаками гемолиза в плазме, хорошей чувстви-
тельностью к лечению пропранололом. Типу II свойственны уве-
личение МО сердца, отсутствие гемолиза и меньшая эффектив-
ность пропранолола. Гипокалиемия, гиперренинемия, избыток
альдостерона, повышение концентрации креатинина и мочеви-
ны в плазме отмечаются в равной степени при обоих типах зло-
качественной гипертензии. Правда, у некоторых больных кон-
центрации ренина и альдостерона в плазме, по-видимому, оста-
ются нормальными (Куценко А. И. и др., 1980).
В 1930 г., по наблюдениям N. Keith и соавт., средняя продол-
жительность жизни больных с гипертензивным отеком соска
зрительного нерва составляла 4,5 мес. В 1958 г. 50% больных с
нелеченной злокачественной гипертензией погибали в течение
2 мес, а 90% — в течение первого года болезни (Kincaid-Smith Р.
et al., 1958). В 1966 г., согласно некоторым клинико-статистиче-
ским материалам, продолжительность жизни 60% больных уже
достигала 5 лет, а 38% больных — 12 лет. В 70—80-х годах пока-
затели еще более улучшились. У многих больных вместе с пони-
жением АД исчезал отек сетчатки, улучшалась деятельность сер-
дца, стабилизировался почечный процесс. Эти несомненные
достижения — результат использования в терапевтической прак-
тике новых весьма активных гипотензивных препаратов, позво-
ляющих длительное время поддерживать АД на сравнительно
низком уровне.
ГИПЕРТЕНЗИВНЫЕ КРИЗЫ: КЛИНИКА
Определение понятия. Причины и механизмы
Гипертензивные кризы (ГК) — острые и обычно значитель-
ные подъемы АД, сопровождающиеся характерной клинической
симптоматикой. Более или менее часто они осложняют течение
ЭГ, а также симптоматических АГ. Практически каждый боль-
ной ЭГ переносит в течение жизни спорадические ГК, но есть
категория больных, у которых они следуют друг за другом с ко-
роткими интервалами, что создает сложные проблемы как для
этих больных, так и для их врачей. Иногда повторяющиеся ГК
знаменуют начало быстро прогрессирующей, или злокачествен-
ной, формы ЭГ. Правда, благодаря более активному лечению ЭГ
228
во всех ее стадиях, частота ГК в последние годы несколько
уменьшилась.
Развитие ГК возможно и у лиц, не страдающих АГ, напри-
мер: при острой гипоксии, отеке легких, преэклампсии, присту-
пах бронхиальной астмы, пароксизмальной тахикардии, свинцо-
вой колике, острой порфирии, смещении «блуждающей» почки,
печеночной колике, ущемлении грыжи, кровоизлияниях в моз-
говые центры, регулирующие АД, в отдельных случаях острого
инфаркта миокарда и т. д. Особое место занимают симпатико-
адреналовые ГК у больных с диэнцефалезами, феохромоцито-
мой, при тяжелых повреждениях спинного мозга, а также у не-
которых здоровых людей в чрезвычайных обстоятельствах (синд-
ром Кеннана).
Патогенез ГК сложен и недостаточно изучен. Не возникает
сомнений в почти обязательном участии в их формировании
симпатической нервной системы. Активация симпатической
нервной системы способствует увеличению концентрации нор-
адреналина в гладкомышечных клетках резистивных сосудов, что
ведет к повышению их тонуса и своеобразному «эффекту умно-
жения» симпатико-адреналовых влияний (Голиков А. П. и др.,
1999). Другой фактор — острая или постепенно нарастающая за-
держка ионов Na+ и воды, способствующая сама по себе и через
кальциевые механизмы гладкомышечных клеток сужению рези-
стивных сосудов и повышению ОПС. Такие реакции более свой-
ственны больным с гипергидратационной формой ГБ или соль-
чувствительным больным, а также лицам, страдающим хрониче-
ским пиелонефритом и другими разновидностями паренхиматоз-
ной почечной АГ. Третий фактор, участвующий в развитии ГК и
тесно связанный со вторым, — активация системы ренин—ангио-
тензин II—альдостерон, которая регулирует водно-солевой об-
мен и уровень АД. Этот механизм тоже нередко ведет к гипер-
гидратации. Не исключается, конечно, и возможность взаимо-
действия упомянутых выше механизмов, а также участие в ста-
новлении ГК других, менее известных или еще мало изученных
факторов (№+-уретические факторы и т. д.).
С практической точки зрения, особенно важен вопрос о при-
роде импульсов, приводящих в действие всю сложную цепь проги-
пертензивных механизмов, т. е. о пусковых стимулах ГК. Иногда
они возникают как бы «беспричинно», это, разумеется чисто
внешнее впечатление (например, при овариальных расстройст-
229
вах у женщин). В большинстве других случаев можно установить
связь ГК с рядом обстоятельств: а) с отрицательными эмоциями,
психическими травмами (отнюдь не всегда острыми); б) с чрез-
мерным потреблением соленой пищи (у некоторых женщин мы
отмечали почти прямую зависимость); в) с изменениями погоды:
ГК чаще регистрируются в весенне-осенние месяцы, их значи-
тельно меньше бывает зимой и совсем мало летом; к метеороло-
гическим влияниям более чувствительны больные неврозами,
лица с астеноневротическими вегетативными реакциями, страда-
ющие остеохондрозом шейно-грудного отдела позвоночника
и др.; г) с повторяющимися ишемическими мозговыми реакция-
ми — у стариков и пожилых людей, преимущественно за счет
вертебробазилярной недостаточности кровотока (утренние ГК
при неудобном положении головы во время сна и т. д.); д) изред-
ка с воздействием инфекционных заболеваний: установлено, на-
пример, что во время эпидемий гриппа заметно возрастает число
обострений ЭГ и соответственно ГК (нервно-симпатические
стимулы, задержка ионов Na+ и воды).
В более редких случаях к возникновению ГК ведут: внезап-
ное прекращение приема клофелина после лечения достаточны-
ми дозами в течение 3 месяцев и дольше (к этому более склонны
больные с реноваскулярной АГ); повышение чувствительности
а 1-адренорецепторов резистивных сосудов («сенсибилизация») к
катехоламинам как следствие длительного лечения симпатолити-
ками (допегит, изобарин и др.); введение диуретика больному с
феохромоцитомой и т. д.
Уровень АД и его структура при ГК;
гемодинамическая характеристика
В зависимости от того, как изменяются крайние величины
АД, ГК бывают изолированными систолическими и систоло-
диастолическими (последние явно преобладают).
Изолированные систолические ГК отличаются резкими
подъемами систолического давления (>220—230 мм рт. ст.) при
сохранении нормального или даже пониженного диастолическо-
го давления (60—90 мм рт. ст.). Такое соотношение между край-
ними величинами АД можно наблюдать главным образом у лиц
пожилого и старческого возраста с выраженным атеросклерозом
аорты (потерявшая эластичность аорта в ответ на увеличение
МО сердца способствует резкому возрастанию систолического
230
давления; имеет также значение — особенно при резких коле-
баниях АД — потеря или ослабление регулирующей функции ба-
рорецепторов аорты и синокаротидной области). Систоличе-
ские ГК иногда возникают у больных ЭГ с полной АВ-блокадой
(большой МО сердца — при уплотнении аорты), коарктацией
аорты, с недостаточностью клапанов аорты.
Систоло-диастолические ГК характеризуются: а) почти рав-
номерной «прибавкой» к уровню систолического и диастоличе-
ского АД; например: при исходном АД 180/105 мм рт. ст. оно до-
стигает в момент криза величины 230/150 мм рт. ст.; б) относи-
тельно большим приростом систолического давления, например
до 270/125 мм рт. ст.; в) относительно большим возрастанием
диастолического давления, например до 210/160 мм рт. ст. В ред-
ких случаях картина ГК развертывается при сравнительно уме-
ренном повышении АД, например до 170/100 мм рт. ст. Возмож-
но, что это — результат снижения у больных «порога энцефало-
патии», т. е. ослабления механизма ауторегуляции мозгового
кровотока.
В литературе обсуждается вопрос о роли сердечного выброса
(МО сердца) и ОПС в формировании высокого АД при систоло-
диастолических ГК. По этому поводу можно высказать следую-
щие соображения. Ведущим, определяющим фактором возраста-
ния АД при любой форме систолодиастолической АГ является
повышение ОПС (абсолютное или реже относительное). МО
сердца на этом фоне может быть несколько уменьшенным (более
чем у половины больных ЭГ II—III стадии), нормальным или
увеличенным (примерно у 10—15% больных). ГК как одно из
самых ярких проявлений ЭГ не составляет в этом смысле ис-
ключения. В свою очередь, увеличение МО бывает связано с не-
сколькими причинами: с синусовой тахикардией у части боль-
ных за счет положительного хронотропного эффекта правого
симпатического нерва, более полным опорожнением левого же-
лудочка (положительный инотропный эффект левого симпатиче-
ского нерва); увеличением торакального объема крови (переме-
щение крови вследствие сужения периферических вен и венул
при воздействии симпатических нервов на оц-адренорецепторы
венозных стенок); возрастанием ОЦП и ОВЖ (при задержке
ионов Na+ и воды). Имеется в виду, что эти реакции развивают-
ся у больных с сохраненной компенсацией кровообращения.
Если же развивается сердечная недостаточность и МО сердца за-
231
метно понижается, то на фоне высокого диастолического давле-
ния систолическое давление может понизиться.
Классификация ГК; клиническая картина
ГК могут быть определены прежде всего как средние по тя-
жести и тяжелые. При таком подходе обычно оценивают уро-
вень АД и выраженность энцефалопатии. В основном так и по-
ступили Н. А. Ратнер и соавт. (1956, 1974), выделившие три
типа ГК. В том же ряду стоят классификации, в которых прини-
мается во внимание степень повреждения органов-мишеней,
наиболее страдающих от подъема АД. С этой точки зрения ГК
можно характеризовать как преимущественно «церебральный»,
«кардиальный» или «почечный» (последний встречается редко).
Со временем стала очевидной нецелесообразность разделения
ГК на кризы I типа, или адреналиновые, и кризы II типа, или
норадреналиновые. Такое деление малоперспективно. Во-пер-
вых, определение концентрации катехоламинов в плазме крови
все еще затруднительно и не отличается точностью. Во-вторых,
исследователи, которым удавалось это сделать, не смогли четко
обнаружить различия в уровне этих нейрогормонов.
Предпринимаются попытки классифицировать ГК в зависи-
мости от особенностей гемодинамики и структуры АД. Учитыва-
ют, что ГК может протекать с гипер-, эу- и гипокинетическим
типом кровообращения (Голиков А. П., 1985). Для определения
МО сердца обычно применяют интегральную или тетраполяр-
ную реографию, однако нельзя забывать, что результаты этих из-
мерений весьма приблизительны. Кроме того (я уже упоминал),
подъем АД в большей мере зависит от уменьшения проходимо-
сти резистивных сосудов. Более расширенный вариант гемоди-
намической классификации ГК предлагался сотрудниками ин-
ститута клинической кардиологии ВКНЦ (Шхвацабая И. К.,
1982). Они ориентировались на такие показатели, как: величина
конечного диастолического давления в левом желудочке, особен-
ности гемодинамики, индексы активности симпатико-адренало-
вой системы и системы ренин—ангиотензин II—альдостерон. По
сути дела, в этой классификации дается сложная характеристика
многообразных механизмов повышения АД, сведения о которых
все еще неполны и не всегда доступны анализу. Естественно, что
у практического врача или у врача скорой помощи отсутствуют
возможности для такой трактовки ГК.
232
Классификация «гипертонических крайностей», принятая
ВОЗ, предусматривает выделение: а) критической гипертензии
и б) стойкой гипертензии (Kaplan N., 1994). К первой относят:
повышение диастолического АД выше 120 мм рт. ст., гипертони-
ческую энцефалопатию, преходящие нарушения мозгового кро-
вообращения, инфаркты мозга, кровоизлияния в мозг, расслаи-
вающую аневризму аорты, острый отек легких, острую почечную
недостаточность, стенокардию, инфаркт миокарда, синдром,
связанный с выделением значительного количества катехолами-
нов, феохромоцитому, травму головы с гипертензией, ожоги,
взаимодействие лекарств. Ко второй категории относят: диасто-
лическое давление, превышающее 120 мм рт. ст., ускоренное те-
чение АГ, кровоизлияние на глазном дне (Ш тип по Keith—Wa-
gener—Barker), злокачественную гипертензию, нейроретинопа-
тию (IV тип Keith—Wagener—Barker), вторичную АГ, неконтро-
лируемую АГ в предоперационном периоде.
Как видно, в такой классификации учтены все формы тяже-
лой АГ; но не выделяются «кризы» в том понимании, которое
принято в нашей стране.
На кафедре кардиологии Санкт-Петербургского МАПО в те-
чение последних 15 лет применяют клинико-патогенетическую
классификацию ГК, в которой учитываются их проявления, до-
ступные для врачебной оценки у постели больного. Соответст-
венно, мы различаем три формы ГК: 1) нейровегетативную
(с преобладанием в клинической картине нейровегетативного
синдрома); 2) отечную (с преобладанием водно-солевого синдро-
ма); 3) судорожную (с далеко зашедшей гипертензивной энцефа-
лопатией) (Кушаковский М. С., 1977, 1983; Шутко Г. В., Ивано-
ва Н. В., 1984; Кушаковский М. С., Иванова Н. В., 1988). Преду-
сматривается также суждение о тяжести (выраженности) ГК
(в основном по уровню АД и энцефалопатии). Мы, конечно, от-
даем себе отчет в том, что у отдельных больных бывают сочета-
ния признаков, характерных для различных форм ГК.
Прежде чем перейти к описанию каждой из них, укажем об-
щие проявления ГК. ГК регистрируются у женщин примерно в
6 раз чаще, чем у мужчин. Возникают в любое время суток, боль-
ше во второй половине дня, иногда ночью. Адреналовые ГК при
феохромоцитоме нередко начинаются во время сна или вскоре
после пробуждения. Некоторые больные ощущают приближение
ГК (своеобразные продромы), у других больных можно выявить
233
определенную периодичность (регулярность) в развитии ГК,
хотя во многих остальных случаях этот процесс представляется
как бы «хаотичным». При ЭГ в момент криза АД возрастает по-
степенно, при феохромоцитоме — внезапно, стремительно, ино-
гда через несколько секунд достигая крайнего уровня
280—300/180—200 мм рт. ст. Длительность ГК тоже варьирует: от
секунд (при феохромоцитоме) до часов и даже дней (ЭГ, хрони-
ческий пиелонефрит и др.).
Ведущий синдром ГК — энцефалопатия — характеризуется
сочетанием общемозговых и очаговых симптомов. К первым от-
носятся интенсивные жгучие, распирающие, разламывающие
боли в области затылка, распространяющиеся на всю голову.
Боли сочетаются с головокружением в основном несистемного
типа, шумом и звоном в ушах, тошнотой и рвотой. Может ухуд-
шаться зрение, перед глазами появляются «сетка», «пелена»,
«черные мушки»; в сетчатке бывают кровоизлияния.
Очаговая мозговая симптоматика обычно выражена умерен-
но при нейровегетативной и более отчетливо при отечной фор-
ме ГК. Она проявляется главным образом нарушениями чувст-
вительности: онемением кожи лица и рук либо жжением, стяги-
ванием, похолоданием кожи, понижением болевой и тактильной
чувствительности в области лица, губ, языка, ощущением полза-
ния мурашек. Если и возникают двигательные очаговые наруше-
ния, то они ограничиваются легкой слабостью в дистальных от-
делах верхних конечностей (по гемитипу). В более тяжелых слу-
чаях могут развиваться преходящие гемипарезы (до одних суток)
с преобладанием слабости в руке, а также кратковременные афа-
зия, амавроз, двоение в глазах («острая ишемическая атака»).
Значительно резче выражена энцефалопатия в случаях «судорож-
ного» ГК (см. ниже).
Кардиальные осложнения ГК проявляются преимущественно у
больных, имеющих расширение полостей сердца или значитель-
ное утолщение стенок левого желудочка. Их можно сгруппиро-
вать в три синдрома: а) левосторонний застойный (одышка, уду-
шье, отек легких); б) стенокардический (тяжесть, стеснение в
груди, типичная стенокардия, инфаркт миокарда); в) аритмиче-
ский (желудочковые и предсердные экстрасистолы, фибрилля-
ция предсердий; у перенесших инфаркт миокарда — желудочко-
вые тахикардии). Для возникновения аритмии имеет значение не
234
только резкое повышение нагрузки на левую половину сердца,
но и усиление нервносимпатических стимулов, гипокалиемия.
Надо еще раз подчеркнуть, что кардиальные проявления встре-
чаются не у каждого больного, переносящего ГК. Наконец, о по-
чечных осложнениях может идти речь, если в разгар ГК или непо-
средственно после его окончания у больного появляются микро-
гематурия, протеинурия, цилиндрурия. В более тяжелых случаях
может произойти нарастание (преходящее) концентрации в кро-
ви креатинина и мочевины. Развернутая картина острой почеч-
ной недостаточности — редкое явление, если, конечно, к этому
нет предпосылок (хронический нефрит, пиелонефрит, поликис-
тоз почек и т. д.).
Нейровегетативная форма ГК. При этой разновидности ГК
больной часто возбужден, беспокоен, испуган, ощущает сухость
во рту, руки у него дрожат, лицо сначала гиперемировано, затем
бледнеет, кожа увлажняется (лоб потный), температура тела мо-
жет повыситься до субфебрильных цифр; имеется склонность к
синусовой тахикардии, пульс напряженный, иногда неправиль-
ный (экстрасистолия), систолическое давление возрастает отно-
сительно больше, чем диастолическое, учащается мочеиспуска-
ние с выделением увеличенного количества светлой мочи.
«Адреналовые» (нейровегетативные) признаки ГК достигают
максимального выражения у больных с феохромоцитомой, кото-
рую можно рассматривать как своеобразный эталон нейровегета-
тивной формы ГК. Больные напряжены, испытывают чувство
немотивированного страха, боязнь смерти; их лицо бледнеет
(спазм поверхностных сосудов кожи) и покрывается холодным
потом; заметны пиломоторные реакции («гусиная кожа») и тре-
мор рук. Одновременно появляются жгучие головные боли, тя-
жесть в затылке, пульсация в висках, головокружение, темные
круги перед глазами, ухудшается зрение. Могут быть слуховые и
зрительные галлюцинации. К этим ощущениям присоединяются
ангинозные боли за грудиной, под левой лопаткой, в левом пле-
че, сильные схваткообразные боли в подложечной области, ико-
та, тошнота, рвота, слюнотечение (живот остается мягким).
Мучительными бывают сердцебиения (у 2/3 больных с фео-
хромоцитомой); на высоте приступа синусовая тахикардия может
достигать 120—160 в 1 мин; интенсивно пульсируют шейные ар-
терии. В 20% случаев адреналовые ГК осложняются артимиями.
Изменяется ЭКГ, для которой характерны смещение сегмен-
235
тов ST книзу, увеличение зубцов U, сливающихся с зубцами Т,
иногда с образованием гигантских положительных или отрица-
тельных зубцов (при ГК у больных ЭГ тоже можно наблюдать
увеличение зубцов U). Примечательны и такие проявления, как
гипергликемия, повышение концентрации в плазме свободных
жирных кислот (липолиз), нейтрофильный лейкоцитоз, повыше-
ние температуры тела.
Итак, нейровегетативная форма ГК может
быть представлена в клинике широким
спектром признаков, отражающих различ-
ную степень активации симпатико-адрена-
ловой системы, от легкой или умеренной
при ЭГ до крайней при феохромоцитоме.
«Отечная» форма ГК у больных ГБ. Они, скорее, скованы,
подавлены, иногда сонливы, дезориентированы во времени и об-
становке; лицо у них бледное, одутловатое, веки набухшие (пе-
риорбитальный отек), кожа рук напряжена, пальцы утолщены,
отмечается почти равномерное повышение систолического и
диастолического давления либо происходит больший прирост
диастолического давления с относительным уменьшением пуль-
сового давления.
Такая своеобразная форма ГК более типична для больных
(чаще это женщины) с гипергидратационной (объем-зависимой)
формой ГБ. Кризу могут предшествовать ощущение озноба (без
повышения температуры тела), уменьшение диуреза, внешние
признаки накопления воды (ионов Na+), мышечная слабость,
нередко связанная со снижением концентрации ионов К+ в
плазме или с гипокалигистией, чувство тяжести в области серд-
ца, экстрасистолия. Надо иметь в виду, что у больных этой груп-
пы быстрее, чем у остальных больных ЭГ, происходит задержа-
ние ионов Na+ и воды при приеме (без диуретиков) нейротроп-
ных средств (резерпин, допегит, изобарин, клофелин и другие
препараты, кроме p-адреноблокаторов) или периферических ва-
зодилататоров (гидралазин, ai-адреноблокаторы). По данным
А. П. Голикова и соавт. (1999), общий объем воды в организме
при гипертензивных кризах у 26% больных превышал норму;
определялось возрастание объема воды в интерстициальном про-
странстве за счет объема циркулирующей плазмы, что согласует-
ся с результатами исследования Н. В. Ивановой (1983), прове-
денного в нашей клинике. Полезно вновь напомнить и о так на-
236
зываемых «рикошетных отечных» ГК, свойственных главным об-
разом больным, склонным к гипергидратации. Как показали
наши исследования, такие ГК возникают в результате острой ак-
тивации системы ренин—ангиотензин II—альдостерон и симпа-
тико-адреналовой системы в ответ на выделение значительного
количества воды (Na+) под воздействием диуретика. Через
10—12 ч (иногда позже) после диуреза и снижения АД у больно-
го вновь появляются одутловатость лица и подъем АД, нередко
более выраженные, чем в исходном состоянии, т. е. до приема
мочегонного средства. В заключение укажем, что эталоном
«отечного» ГК может служить «водно-солевой» криз, развиваю-
щийся при гемодиализе у больных с почечной недостаточно-
стью, если допускаются погрешности в электролитном составе
жидкостей.
«Судорожная» форма ГК. Она проявляется у больных ЭГ (или
с другим типом АГ) потерей сознания, тоническими и клониче-
скими судорогами. Этот редко встречающийся вариант ГК на-
блюдается при самом тяжелом либо злокачественном течении за-
болевания. В основе острой гипертензивной энцефалопатии ле-
жит отсутствие физиологического ауторегуляторного сужения
мозговых прекапилляров и артериол в ответ на крайне резкое
повышение системного АД. Присоединяющийся отек мозга
длится от нескольких часов до нескольких суток. По окончании
ГК больные некоторое время остаются в бессознательном состо-
янии или же бывают дезориентированы; имеется амнезия, нерез-
ко выявляются остаточные нарушения зрения или преходящий
амавроз.
Однако такое, сравнительно благополучное, окончание ГК
бывает не всегда. После наметившегося улучшения могут возоб-
новиться судороги; АД вновь нарастает, приступ осложняется
внутримозговым или субарахноидальным кровоизлиянием с па-
раличами, необратимыми изменениями мозга, переходом боль-
ных в коматозное состояние и летальным исходом. Эти больные
являются в основном пациентами отделений реанимации невро-
логических клиник; они меньше знакомы терапевтам.
Доходящее до крайней степени повышение АД может также
приводить к разрыву (расслоению) стенок аорты, к быстрому
развитию фибриноидного некроза стенок почечных сосудов,
в особенности прегломерулярных артериол с последующей де-
237
струкцией нефронов. В самых тяжелых случаях это ведет к
уремии.
При анализе клинической картины гипертензивных кризов
следует учитывать, что ряд патологических состояний имеют
сходную клинику. Я имею в виду:
1) синдром Пейджа — диэнцефальную форму повышения АД,
характеризующуюся транзиторной гипертензией, синусовой та-
хикардией, ознобами, гипергидрозом, появлением на коже крас-
ных пятен, небольшим увеличением щитовидной железы и сла-
бым повышением основного обмена;
2) синдром Паля — пароксизмальную гипертензию с голово-
кружением и сердцебиением, тоже, по-видимому, связанную с
диэнцефальными расстройствами;
3) синдром Принцметла — умеренную гипертензию, сопро-
вождающуюся болями в области сердца, слюнотечением, потли-
востью, возникающую у больных в широком возрастном проме-
жутке от 30 до 70 лет; ЭКГ не меняется;
4) синдром транзиторной артериальной гипертензии, возника-
ющий у больных с гемодинамически существенным стенозом
экстракраниальных артерий; АД повышается у них при резких
поворотах шеи, сдавлении ее шарфом, галстуком, воротником;
5) кризы симпатического генеза, вызываемые потреблением
пищевых продуктов или напитков, содержащих большое количе-
ство тирозина (сыр чеддер, красное вино и т. д.);
6) синдром Пенфилда — пароксизмальную АГ у больных с
опухолью III желудочка мозга, а также при астроцитоме (Реп-
stell J., 1929).
В заключение укажу, что в зависимости от клинико-
патогенетической формы ГК изменяются подходы к фарма-
кологическому лечению этих осложнений ЭГ (см. главу 5).
ГЛАВА 5
ЛЕЧЕНИЕ
ЭССЕНЦИАЛЬНОЙ ГИПЕРТЕНЗИИ
ОБЩИЕ ЗАМЕЧАНИЯ
О ПРИНЦИПАХ И ЦЕЛЯХ ЛЕЧЕНИЯ
Человеку, знающему по собственному опыту или рассказам
своих родственников об опасностях для здоровья, которые несет
длительное повышение АД, вопрос о целесообразности лечения
этого заболевания может показаться наивным или неуместным.
Добавлю, что хроническая артериальная гипертензия создает
серьезную угрозу благополучию и жизни многих миллионов лю-
дей в экономически развитых странах мира. Напомню, что, на-
пример, в США ЭГ — главный фактор риска ежегодно возника-
ющих 500 000 случаев мозгового инсульта и 150 000 смертей от
него (NHBPER, 1994). С другой стороны, вероятность развития
сердечно-сосудистых осложнений у больных ЭГ при снижении
АД в среднем на 10/5 мм рт. ст. уменьшается примерно на ’/з»
а снижение АД на 20/10 мм рт. ст. — на 2/з (Преображен-
ский Д. В. и др., 1999).
Р. Hebert и соавт. (1998) при анализе результатов 17 рандоми-
зированных исследований, охвативших свыше 47 тыс. больных
ЭГ, нашли, что различия в средних значениях АД между группа-
ми больных, лечившихся противогипертензивными препаратами,
и контрольными группами составили всего 13/6 мм рт. ст. Не-
смотря на столь небольшие различия в уровнях АД, число случа-
ев мозгового инсульта у лечившихся было почти на 40% меньше,
а случаев инфаркта миокарда — на 16% меньше, чем у больных,
не принимавших лекарств. Смертность от сердечно-сосудистых
причин среди леченых больных была на 21% ниже, чем среди
больных, получавших плацебо.
Как видно, лечение ЭГ современными препаратами даже при
небольшом снижении АД дает ощутимые результаты, защищая
239
больных от тяжелых, иногда роковых сердечно-сосудистых
осложнений. В 90-е годы по-новому рассматривается вопрос об
уровне АД, до которого оно должно быть снижено в результате
лечения. Как известно, в отечественной кардиологии еще недав-
но такой целью был уровень АД ниже 160/95 мм рт. ст., т. е. до-
стижение зоны пограничной артериальной гипертензии.
В рекомендациях комитета экспертов ВОЗ, опубликованных
в 1999 г., предлагаются другие показатели нормы, о которых я уже
упоминал. Основанием для таких перемен послужили результаты
многоцентровых исследований, главным образом исследования
НОТ (Hipertension Optimal Treatment), в котором участвовали
18 790 больных в возрасте от 50 до 80 лет, страдавших мягкой
или умеренной формой ЭГ. У этих больных исходное диастоли-
ческое давление колебалось в пределах 100—115 мм рт. ст. Боль-
ные были разделены на 3 группы в зависимости от уровня диа-
столического давления, который стремились достигнуть к концу
лечения {«целевое давление»).
Терапию начинали с назначения для приема внутрь фелоди-
пина-ретард (плендил) в суточной дозе 5 мг. Далее, по необходи-
мости, добавляли ингибитор АПФ или 0-адреноблокатор, еще
позже удваивали дозу фелодипина (10 мг/сут), далее удваивали
дозу ингибитора АПФ, наконец, к лечению добавляли диуретик.
Монотерапией плендилом удалось ограничиться лишь у 31% боль-
ных, что само по себе очень показательно.
Целями лечения, которое продолжалось в среднем 3,8 года,
было достижение диастолического давления до величины
90 мм рт. ст. и ниже — в 1-й группе больных, до 85 мм рт. ст. и
ниже — во 2-й группе и до 80 мм рт. ст. и ниже — в 3-й группе
больных.
Наименьшая частота сердечно-сосуди-
стых осложнений за время наблюдения была
отмечена среди больных, у которых удалось
понизить диастолическое давление до уров-
ня 82,6 мм рт. ст., а систолическое давле-
ние — до уровня 138,5 мм рт. ст.
Авторы исследования пришли к закономерному
выводу, что у больных с мягкой и умерен-
ной ЭГ I и II степени заболевания (по по-
следней классификации ЭГ) необходимо
поддерживать АД на уровне 135/85 мм рт. ст. Риск
240
мозгового инсульта у обследованных больных был наименьшим
при АД, равном 142,2/<80 мм рт. ст.
Как я уже подчеркивал, пока не вполне ясно, насколько
практичны новые предложения определять 3 уровня нормально-
го АД: «оптимальное», «нормальное» и «повышенное нормаль-
ное». Во всяком случае, обследование более 11 тысяч больных
ЭГ в ряде западно-европейских стран показало, что у 63% боль-
ных диастолическое АД было выше необходимого уровня и толь-
ко у 37% больных удалось достигнуть достаточного его сниже-
ния (Карпов Ю. А., 1999). В исследовании NHAives III, прово-
дившемся в США в 1991—1994 гг., было показано, что уро-
вень АД, не превышавший 140/90 мм рт. ст., достигался только
у 27% больных.
Что же касается приемлемости новых рекомендаций для на-
шей страны, то по-прежнему, не отрицая их полезность, я пред-
вижу некоторые трудности в их использовании: другой уровень
жизни, более тяжелые больные, иное отношение к своему здоро-
вью, другая степень медицинского обслуживания, высокие цены
лекарств — все это затрудняет применение на практике новых
рекомендаций ВОЗ/МОГ. Все же очевидно, что российские кар-
диологи должны идти в ногу с мировой кардиологией, постоян-
но учитывая все новое, что приносит прогресс нашей науки.
В этой связи весьма интересные данные об ЭГ и ее послед-
ствиях приводит Р. Г. Оганов (1999). Начиная с 70-х годов
XX века «смертность мужчин от сердечно-сосудистых заболева-
ний в России все время растет». В то же время в трех других
странах — Финляндии, Англии и Дании — тенденция была со-
вершенно иной. Правда, «начиная с 1998 г. смертность в России
пошла на снижение, и оно продолжается до сегодняшнего вре-
мени». Однако «разрыв между западными странами и нашей
страной все еще остается довольно большим». Существенным
недостатком является отсутствие единой государственной про-
граммы по лечению АГ, что препятствует последовательной
борьбе с этим тяжким заболеванием. Поэтому публикации
ВОЗ/МОГ, которые я обильно цитирую, должны несомненно
способствовать улучшению положения.
В этом кратком введении я рассмотрю еще один чрезвычайно
важный вопрос: уменьшает ли противогипертензивное лечение
вероятность развития инфаркта миокарда? Укажу, что в отличие
от 70-х—80-х годов положение в последние годы явно улучши-
241
лось. Если в прошлые годы, при уменьшении числа инсультов в
процессе лечения ЭГ, число инфарктов миокарда оставалось на
прежних высоких цифрах или даже возрастало, то в 90-х годах в
ряде многоцентровых исследований показано, что при разум-
ном снижении АД, например, с помощью
малых доз тиазидных диуретиков можно
добиться уменьшения риска развития ИБС
и ее осложнений. Надо подчеркнуть, что смертность от
сердечно-сосудистых осложнений у больных, страдавших ЭГ и
сахарным диабетом, была наименьшей при снижении диастоли-
ческого давления до уровня, не превышающего 80 мм рт. ст.
Следовательно, при сочетании ЭГ и сахарного диабета необходи-
мо снижать диастолическое АД до уровня 75—80 мм рт. ст. В то
же время в исследовании ИКРДХ, проведенном у 1148 больных,
имевших АГ и сахарный диабет, подчеркивается, что у муж-
чин пожилого возраста без сахарного диа-
бета чрезмерная противогипертензивная
терапия может предрасполагать к разви-
тию инфаркта миокарда и других сердеч-
ных осложнений. По-видимому, у больных ЭГ без сахар-
ного диабета не следует стремиться уменьшать диастолическое
давление ниже 90 мм рт. ст. (Преображенский Д. В., Сидорен-
ко Б. А., Пересыпко М. К., 1999).
Есть необходимость еще в одном принципиальном замеча-
нии. Способность современных препаратов более или менее бы-
стро понижать АД до уровня нормотензии породила надежды на
то, что в результате эффективного лечения удастся добиться вы-
здоровления больных, т. е. избежать рецидивов АГ после прекра-
щения лечения. Такие ожидания, к сожалению, не оправдались.
Задержать прогрессирование ЭГ на какой-либо ее стадии теперь,
по-видимому, можно, что само по себе является крупным дости-
жением, но полностью излечить каждого больного пока не уда-
ется.
Основные принципы лечения ЭГ
Существует ряд принципиальных положений, или правил,
соблюдение которых представляется обязательным при органи-
зации лечения больного ЭГ, даже в период радикального изме-
нения общей стратегии лечения. Они основываются, главным
образом, на последних рекомендациях ВОЗ/МОГ (1999).
242
1. При назначении больному ЭГ лекарственных средств врач
обязан разъяснить ему перспективы и цели лечения, необходи-
мость проводить его многие годы или всю жизнь. У пациента
должно сложиться ясное представление, что только дли-
тельная и устойчивая, а не временная, пре-
ходящая, нормализация АД может существенно
улучшить состояние его сердца и сосудов и тем самым снизить
риск тяжелых осложнений. Нельзя согласиться с рекомендация-
ми проводить лечение сложившейся, .стабильной ЭГ короткими
курсами, при которых необходимый уровень АД поддерживается
1—1,5 мес 1—3 раза в году. Все остальное время АД слабо конт-
ролируется: больные не получают достаточных доз лекарств либо
вообще не лечатся. Правда, прерывистая, но тоже систематиче-
ская, терапия ЭГ допустима в ранних фазах заболевания либо в
тех редких случаях, когда удается добиться его длительной ре-
миссии.
2. Во время беседы с больным важно привлечь его внимание
к правильной организации отдыха и трудового режима, к выбору
диеты, подчеркнуть вредоносное значение психоэмоциональных
факторов, особенно отрицательного характера (гнев, злобность,
агрессия, длительные обиды, внутреннее напряжение и т. д.).
Настаивая на последовательном осуществлении своей лечебной
программы, врач не должен вызывать у больного беспокойство
или страх. По своему психическому складу больные ЭГ особенно
чувствительны к психологическим воздействиям отрицательного
свойства, у них часто отмечаются склонность к пессимистиче-
ской оценке положения и высокий уровень невротизации
(Вейн А. М. и др., 1975; Губачев Ю. М. и др., 1976, 1978; Шхва-
цабая И. К., 1980; Карвасарский Б. Д., 1980; Соколов Е. И. и др.,
1980; Губачев Ю. М., Дорничев В. М., 1989; Болдуева С. А., 1993;
Маношкина Е. М., 1993; Айвазян Т. А. и др., 1995).
Хотя расстройства психоэмоциональной сферы носят у боль-
ных, скорее, вторичный характер, т. е. являются следствием хро-
нической гипертензии, многие симптомы ЭГ связаны с чувством
тревоги, вызываемой, помимо прочего, неосторожными выска-
зываниями врача. Особенно внимательным и деликатным нужно
быть при изменении схемы лекарственного лечения, которое
оказалось недостаточно успешным. В этих случаях чрезмерный
радикализм, безапелляционность или, наоборот, колебания и не-
уверенность могут стоить врачу потери контакта с больным.
243
Каждая встреча с врачом должна быть для больного источником
оптимизма и уверенности в успехе лечения. Лечение ЭГ должно
способствовать улучшению психологического состояния и каче-
ства жизни больного (Маношкина Е. М., Метелица В. И., Айва-
зян Т. А. и др., 1993; Чазова И. Е., 2001).
3. Все противогипертензивные лекарственные программы
включают в качестве основы проверенные и надежные нефарма-
кологические подходы, подробно описанные ниже. На таком
фоне фармакологическое лечение, без которого при устойчивой АГ
обойтись нельзя (!), оказывается более эффективным.
4. Больные ЭГ различаются по их реакциям на гипотензив-
ные средства: вещество, которое нормализует АД у одного боль-
ного, может быть неэффективным у другого. Даже у одного и
того же больного активность препарата колеблется в разное вре-
мя и в различных периодах заболевания. Нередко врачи назнача-
ют лекарства в определенной последовательности либо в сочета-
ниях, пока, после серии погрешностей и неудач, не находят пре-
парат или группу препаратов, обеспечивающих понижение АД.
Такой эмпирический путь подбора лекарств («метод проб и оши-
бок»), конечно, далек от совершенства, но от него еще нельзя
отказаться, поскольку остаются невыясненными в каждом от-
дельном случае патогенетические механизмы гипертензии. Для
врача не всегда очевидно, с какой клинико-патогенетической
формой заболевания он встретился. Правда, положение сущест-
венно облегчается, благодаря тому, что у большинства
больных можно добиться нормализации
или существенного понижения АД различ-
ными препаратами без предварительного
исследования механизмов повышения АД и
индивидуальной гемодинамической харак-
теристики.
5. За последнее десятилетие значительно изменились стра-
тегия лекарственной терапии ЭГ и выбор индивидуальных лечеб-
ных режимов, чему я ниже посвящаю специальный параграф.
По-прежнему справедлива формула: «в выборе лекарств нужно
руководствоваться не только стадией болезни и уровнем давле-
ния, важнее учет функциональных нарушений, которые опреде-
ляют клиническую картину болезни» (Шхвацабая И. К., Эри-
на Е. В., 1974). Определяющим критерием для назначения меди-
каментозной терапии является принадлежность больного к опре-
244
деленной группе риска, а не собственно степень повышения АД.
При высоком и очень высоком риске — ле-
карственное лечение показано безотлага-
тельно. При низком и среднем риске ему
должна предшествовать немедикаментоз-
ная программа снижения АД продолжительностью
от 3 до 12 мес. (Из инструкций ВОЗ/МОГ, 1999).
6. Изменения стратегии лечения проявились, в частности, в
отказе от ранее декларированного тезиса о том, что медикамен-
тозное лечение ЭГ не должно носить характера монотерапии.
Теперь мы располагаем препаратами, обеспечивающими эффек-
тивную монотерапию (Са-блокаторы, диуретики, а-адреноблока-
торы, ингибиторы АПФ). Правда, монотерапия ЭГ обеспечивает
необходимую эффективность лечения только у части больных с
более легким течением заболевания. Если же врач, по необходи-
мости, прибегает к сочетанию лекарств, то оно должно быть на-
учно и практически обоснованно, что требует от врача основа-
тельного знакомства с клинической фармакологией противоги-
пертензивных средств, знания их фармакокинетики и фармако-
динамики.
7. Лечение больных с менее тяжелой АГ начинают с неболь-
шой либо умеренной лекарственной дозировки, увеличивая ее,
если нужно, до полной дозы. При более тяжелом течении АГ
лечение обычно сразу же начинают с полной лекарственной
дозы.
8. Необходимо еще раз высказаться по поводу фиксированных
(патентованных) лекарственных смесей. Трудно возражать против
их применения, если они эффективны и подходят для конкрет-
ного больного. Однако эти сочетания лучше использовать после
отработки оптимальных дозировок каждого компонента и анали-
за его возможных отрицательных метаболических воздействий.
Разумеется, лечение ЭГ не должно быть статичным: нередко по
ходу применения комбинированных препаратов возникает необ-
ходимость изменить дозировку какого-либо из компонентов, что
заставляет врача отказаться от фиксированной смеси.
Это не значит, что следует избегать комбинированного лече-
ния ЭГ; клинический опыт свидетельствует, что при лечении
умеренного и особенно тяжело протекающего заболевания сни-
жения АД удается добиться назначением больному 2—3 препа-
ратов, воздействующих на различные звенья патогенеза ЭГ.
245
В многоцентровых исследованиях SHEP, МАРНУ комбинирован-
ная терапия использовалась у 45—48% больных, а в исследовании
СООРЕ — даже в 94% случаев. В исследовании НОТ лечение боль-
ных начинали, как я указывал, с фелодипина, затем при необхо-
димости добавляли ингибиторы АПФ, p-адреноблокаторы или
диуретик. Для достижения диастолического АД = 90 мм рт. ст.
комбинированная терапия применялась у 57% больных; для до-
стижения АД, равного 80 мм рт. ст. — у 72% больных. Комби-
нированная терапия несомненно ускоряет
наступление полного гипотензивного эф-
фекта (Маколкин В. И., 1999; Сидоренко Б. А., 1999).
9. Опыт длительного лечения ЭГ показывает, что почти у
каждого больного умело подобранным препаратом (или их соче-
танием) можно «расшатать» даже самую устойчивую гипертен-
зию. Вслед за этой начальной фазой лечения наступает фаза эф-
фективного контроля за уровнем АД, когда все еще требуются
достаточно большие дозы препаратов. Наконец, в третьей фазе
лечения больные многие годы могут обходиться небольшими
поддерживающими дозами лекарств. Повторю, что полная
отмена лекарственных средств более или
менее быстро приводит к рецидиву гипер-
тензии (!).
10. Врач не всегда должен стремиться к быстрому снижению
АД у больного до очень низкого уровня, особенно у лиц пожилого
возраста и у людей, страдающих атеросклерозом сосудов головно-
го мозга (см. ниже). При тяжелой АГ снижать АД нужно посте-
пенно, поскольку при быстром снижении АД ухудшается крово-
снабжение мозга и состояние сосудов глазного дна. Г. Г. Арабидзе
(1999) рекомендовал при тяжелой или злокачественной АГ пони-
жать давление поэтапно: на первом этапе — на 20—30%, на вто-
ром этапе — доводить его до нормального уровня.
При мягкой и умеренной АГ АД понижают более быстро и
«агрессивно», что обеспечивает защиту миокарда и сонных арте-
рий. Нельзя также не учитывать того, что нормализация АД при-
водит к снижению функции почек у больных сахарным диабетом
только на 1% в год, тогда как при сохранении систолического
давления на уровне больше 140 мм рт. ст. наблюдается снижение
функции почек на 6—14% (Kasiske Р. et al., 1993). К тому же сни-
жение систолического АД меньше 140 мм рт. ст. вдвое уменьша-
ет частоту возникновения диабетической ретинопатии.
246
11. Эффективность лечения ЭГ оценивается по снижению
как диастолического, так и систолического давления; последнее
рассматривается как важный фактор ограничения риска мозго-
вых сосудистых осложнений (!). В практической работе необхо-
димо придерживаться общепринятых рекомендаций о так назы-
ваемых зонах терапевтического контроля (регулирования) АД.
Должен быть обеспечен 24-часовой конт-
роль за уровнем АД. Хороший терапевтический контроль
обеспечивается такой лекарственной программой, при которой
достигается устойчивое понижение диастолического давления до
80—85 мм рт. ст.; систолического давления у лиц старше 60 лет —
до уровня 160—150 мм рт. ст. (лучше — до 140 мм рт. ст.), у более
молодых больных — до 140—145 мм рт. ст. Зона злокачественной
АГ характеризуется стабильными величинами диастолического
давления до 130—140 мм рт. ст. и выше, систолического давле-
ния >230—250 мм рт. ст.
Как я указал выше, адекватный контроль за АД должен осу-
ществляться на протяжении суток; для достижения этой цели
используются препараты с высоким коэффициентом: конечный
(остаточный) эффект/максимальный эффект. Таким образом,
медикаментозное лечение ЭГ преследует три основные цели:
адекватный контроль АД на протяжении всех суток; устранение
или уменьшение подъема АД в ранние утренние часы; отсутствие
избыточного снижения АД в ночные часы.
12. Возникновение спорадического гипертензивного криза на
фоне хорошо отрегулированного АД не обязательно должно слу-
жить поводом для отказа от избранной лекарственной програм-
мы. Часто повторяющиеся гипертензивные кризы — указание на
необходимость внесения корректив в лечение ЭГ.
13. Еще раз поставим вопрос: до какой степени следует сни-
жать АД при сочетании ЭГ и сахарного диабета?
Результаты исследования UKPDS (1998), а также данные, по-
лученные в исследовании НОТ (1998), свидетельствуют о том,
что низкие целевые уровни АД у больных сахарным диабетом ас-
социируются со значительным снижением риска сердечно-сосу-
дистых осложнений (из рекомендаций ВОЗ/МОГ, 1995). Можно
утверждать, что чем ниже уровень намечаемого целевого АД, тем
требуется одновременно больше гипотензивных средств: от 3
до 4. Это означает использование комбинации препаратов в срав-
нительно более низких дозах.
247
Два небольших рандомизированных контролируемых иссле-
дования показали, что у больных диабетом ингибиторы АПФ ока-
зывали более благоприятный эффект, особенно на проявления
ИБС, по сравнению с антагонистами кальция (Tatt Р. et al., 1998;
Estacic R. et al., 1998). Правда, в исследовании HOT, посвящен-
ном лечению ЭГ антагонистами кальция, были представлены
свидетельства того, что снижение АД до самого низкого целевого
уровня АДд < 80 мм рт. ст. обеспечило меньший риск прояв-
лений сердечно-сосудистой патологии у больных сахарным диа-
бетом.
14. АГ называют рефрактерной в том случае, когда програм-
ма лечения, включавшая комбинированную терапию в адек-
ватных дозах, а также изменения образа жизни, не приводит
к уменьшению АД ниже 140/90 мм рт. ст. у лиц с классиче-
ской ЭГ или ниже 140 мм рт. ст. — у больных с изолированной
систолической гипертензией.
Причины рефрактерности: гипертензия «белых халатов», не-
подходящая манжетка, плохое восприятие лечения больным, на-
конец, тяжелое повреждение почек. АГ «белых халатов» встреча-
ется у 20—30% больных. Эту гипертензию можно рассматривать
как реакцию «защиты», которая возникает при измерении АД
врачом. Для того, чтобы исключить такую возможность, следует
провести амбулаторное суточное мониторирование АД.
Нефармакологические подходы при лечении ЭГ
Интерес клиницистов, и особенно больных ЭГ, к нефарма-
кологическим методам лечения этого заболевания в нашей стра-
не постоянно растет, что связано с несколькими причинами:
а) широко распространившимся и часто ошибочным пред-
ставлением об абсолютном вреде «химии», т. е. синтетических
фармакологических препаратов, чему мы обязаны главным обра-
зом пропаганде лиц, весьма далеких от научной медицины: раз-
личных «целителей» и представителей так называемой «нетради-
ционной» медицины; б) трудностями в регулярном снабжении
больных лекарственными средствами и их высокой стоимостью;
в) неудобствами, которые создает для больных необходимость
принимать препараты несколько раз в день в течение многих
лет.
Под названием «нефармакологические методы лечения» объ-
единяют, как упоминалось, различные и весьма разнородные
248
приемы нелекарственного воздействия на системы, регулирую-
щие уровень АД у больного человека. Значение и полезность ча-
сти из них доказаны и не вызывают сомнения. Сведения о неко-
торых других еще слишком неполны и фрагментарны, чтобы су-
дить об их истинном месте в терапии ЭГ. Надо подчеркнуть, что
при оценке этих подходов следует руководствоваться теми же
критериями, что при проверке фармакологических средств, т. е.
иметь контрольные группы больных, учитывать частоту сердеч-
но-сосудистых осложнений, побочные эффекты и летальность.
Между тем этим приемам нередко как бы заранее дается «ин-
дульгенция», т. е. априорно, бездоказательно признаются их
полезность и эффективность.
В идеале, основной целью лечения больно-
го с АГ является достижение максималь-
ной степени снижения общего риска cep-
fl е ч н о-с осудистой заболеваемости и смерт-
ности. Это требует воздействия на все выявленные обратимые
факторы риска, такие как курение, высокий уровень холестерина
и сахарный диабет и др.
Поскольку связь между риском сердечно-сосудистой пато-
логии и величиной АД является линейной и не имеющей нижнего
порога, целью антигипертензивной терапии должно стать вос-
становление АД до уровней, определяемых как «нормальные»
или «оптимальные». Повторю, что для молодых и лиц средне-
го возраста, а также для больных сахарным диабетом, целесо-
образным представляется достижение показателей АД ниже
130/85 мм рт. ст., а для пожилых желательно добиваться по край-
ней мере высоких нормальных значений (ниже 140/90 мм рт. ст.)
(из рекомендаций ВОЗ/МОГ, 1999).
Ниже, в табл. 11 приводится перечень нефармакологических
методов лечения ЭГ и далее короткий комментарий к ней.
Таблица 11
Нефармакологические методы лечения больных ЭГ
1. Снижение массы тела.
2. Ограниченное потребление поваренной соли.
3. Индивидуально дозированные физические упражнения, проти-
водействующие гипокинезии; при этом нагрузки изометриче-
ского типа исключаются.
249
4. Организация здорового быта, отдыха и нормальной трудовой
деятельности больных с исключением факторов, травмирующих
их психическую сферу; нормализация сна.
5. Отказ от курения и употребления алкоголя (регулирование).
6. Релаксация, создание биологической обратной связи, психоте-
рапия.
7. Прекращение (по возможности) приема лекарств, о которых из-
вестно, что они могут способствовать повышению АД:
а) некоторых гормональных контрацептивных средств
(для женщин);
б) нестероидных противовоспалительных препаратов (ин-
дометацин и др.);
в) глюко- и минералокортикоидов, анаболических стеро-
идов;
г) симпатомиметиков;
д) трициклических антидепрессантов и ингибиторов МАО;
е) алкалоидов спорыньи;
ж) веществ, содержащих свинец, кадмий, талий и др.
8. Добавление в пищу:
а) калийсодержащих продуктов, препаратов калия и маг-
ния;
б) кальцийсодержащих продуктов и легко всасывающихся
препаратов кальция.
9. Физиотерапевтическое, курортное, климатическое и бальнеоло-
гическое лечение.
Избыток жира способствует повышению уровня АД с самого
детства и рассматривается как наиболее важный фактор предрас-
положенности к АГ (Stamler J., 1990).
В Фремингеймском исследовании было показано, что у 80%
мужчин и 61% женщин АГ могла быть следствием повышения
массы тела (Hubert Н. et al., 1983). Тогда же было установлено,
что увеличение массы тела на 1 кг может привести к возраста-
нию систолического давления на 1 мм рт. ст. Увеличение массы
тела, вероятно, является одним из определяющих факторов, иг-
рающим важную роль в повышении АД с увеличением возраста
человека (Staessen J. et al., 1998). Выше я кратко рассмотрел воз-
250
можные связи между синдромом инсулинорезистентности и
ожирением центрального типа, с одной стороны, и артериаль-
ной гипертензией, с другой стороны. Привожу таблицу, более
подробно характеризующую эти связи (табл. 12).
Таблица 12
Сивдром инсулинорезистентности:
— Ожирение (центрального типа)
— Артериальная гипертензия
— Гипергликемия
— Возрастание уровня в плазме липопротеидов низкой плотности
— Гиперурикемия
— Сахарный диабет II типа
— Сердечно-сосудистые заболевания
Уменьшение массы тела у больного ЭГ, как правило, сопро-
вождается снижением систолического и диастолического АД
(Frohlich Е., 1987). J. Stamler и соавт. (1980) наблюдали достаточ-
но большую группу мужчин, страдавших легкой формой ЭГ и
имевших избыточную массу тела. Под влиянием ограничений в
диете и физических нагрузок эти люди в среднем похудели на
4,8 кг. Хотя они не принимали гипотензивных препаратов, АД
понизилось у них до нормотензивного уровня. Одновременно
отмечались урежение частоты сердечных сокращений и умень-
шение концентрации холестерина в плазме. Имеется немало и
других хорошо документированных наблюдений о благоприят-
ном воздействии снижения массы тела на течение ЭГ и, разуме-
ется, сахарного диабета, часто сочетающегося с ЭГ. При сниже-
нии массы тела повышается эффективность гипотензивных
средств, если больной все еще нуждается в них. Напротив, воз-
растание массы тела может быть причиной рецидива АГ или ее
устойчивости к лекарственным препаратам.
Ограниченное потребление поваренной соли тоже рассматрива-
ется как обязательный компонент противогипертензивного лече-
ния. Бедная натрием (хлором) диета способствует понижению
АД главным образом за счет сокращения ОВЖ и ОЦП и, следо-
вательно, сердечного выброса. Эта мера понижает также чувст-
вительность стенок резистивных сосудов к сосудосуживающим
факторам и потенцирует действие гипотензивных препаратов.
251
Правда, сама по себе малонатриевая диета не всегда может обес-
печить нужный эффект и воспрепятствовать ответным прессор-
ным реакциям гомеостатических систем, регулирующих уровень
АД (повышенное выделение ренина и катехоламинов).
Более чувствительны к ограничению содержания NaCl в
пище лица с так называемой «сольчувствительной» АГ, ее объем-
зависимой (гипергидратационной) формой. Этим больным по-
требление поваренной соли лучше снизить до 3 г в день, а общее
количество жидкости — до 1,2—1,5 л. Большинству же осталь-
ных больных ЭГ можно рекомендовать среднее ограничение по-
варенной соли до 4—5 г в день (70—80 ммолль натрия). Переход
к такому солевому режиму сопровождается только умеренными
ответными сдвигами нейрогуморальной регуляции и не создает
дополнительных психологических или бытовых трудностей для
больного и его окружения. Разумеется, если ЭГ осложняется за-
стойной недостаточностью кровообращения, то этот фактор ста-
новится ведущим при определении состава диеты.
К числу диетических предписаний следует отнести увеличение
в пищевом рационе продуктов, содержащих калий и магний. По-
требление больным гипертензией сухофруктов, бананов и других
богатых калием растительных веществ либо таких препаратов,
как калия хлорид, панангин (аспаркам) и др., не только возме-
щает потери калия и магния, связанные, например, с приемом
диуретиков, но и само по себе способствует некоторому пониже-
нию АД.
Относительно новой является рекомендация обогащать дие-
ту больных ЭГ легко всасывающимися солями кальция (кальция
цитрат и карбонат). Они особенно полезны больным с так назы-
ваемой Са-зависимой формой ЭГ.
Уменьшение (регулирование) потребления алкоголя. Существует
линейная зависимость между употреблением алкоголя, уровнем
АД и распределением АГ в популяции. Помимо этого, алкоголь
ослабляет эффект противогипертензивного лечения. Больные ЭГ
могут потреблять уменьшенные дозы алкогольных напитков, до
50—60 мл водки или 200—250 мл сухого вина в день — мужчины,
и половинные количества в день — для женщин (Pudey I. et al.,
1992). Это количество должно быть сокращено при неблагопри-
ятном течении ЭГ.
Большое значение придается отказу от курения. Установле-
но, что смерть от АГ чаще наблюдается у курящих больных
(Doll R., 1976); у них более часто регистрировались случаи зло-
252
качественного течения гипертензии (Slos С. et al., 1979) и суб-
арахноидальные кровоизлияния (Bell В., Symon L., 1979). У ку-
рящих больных труднее достигается контроль за уровнем АД при
применении фармакологических средств. Отказ от курения явля-
ется, вероятно, единственной наиболее эффективной мерой,
предохраняющей больных ЭГ от сердечно-сосудистых заболева-
ний (рекомендации ВОЗ/МОГ, 1995).
Требует дальнейшего подтверждения и анализа эффектив-
ность при лечении ЭГ методов релаксации (аутогенная трениров-
ка и т. д.); биологической обратной связи и психотерапии. Ис-
следования группы клиницистов Санкт-Петербургского ГИДУВа
(Губачев Ю. М., Дорничев В. М., Баранов М. В. и др.,
1980—1993) показали, что при правильном отборе больных и
определении надежных показаний к лечению (ПАГ, начальные
фазы ЭГ) психотерапевтические воздействия могут сами по себе
или в сочетании с фармакологическими средствами обеспечи-
вать уменьшение мышечного тонуса, внутреннего напряжения и
тревоги, нередко испытываемых больными ЭГ, а также способ-
ствовать некоторому понижению АД. F. Messerli и соавт. (1979)
тоже применяли методику психологического регулирования АД у
больных с легкими и пограничными формами АГ. Начальное
снижение АД зависело от уменьшения МО сердца; ОПС, ОЦП,
активность ренина плазмы изменялись мало. Через 2—3 нед., по-
сле 7—10 лечебных сеансов, среднее гемодинамическое давление
снижалось от 116 до.101 мм рт. ст. (—13%) за счет уменьшения
ОПС. Гемодинамические сдвиги напоминали реакции системы
кровообращения на лечение p-адреноблокаторами. Правда, по
мнению Н. Black (1979), психологические методы могут способ-
ствовать только небольшому понижению АД (10/5 мм рт. ст.) в
ограниченной группе высокомотивированных лиц.
Обширное и тщательно проведенное в Санкт-Петербургском
ГИДУВе исследование Л. А. Комаровой (1979) ряда физиотера-
певтических методов продемонстрировало, что некоторые из них
могут быть альтернативными, другие — дополняющими лекар-
ственное лечение ЭГ. В качестве самостоятельных методов тера-
пии больных в I—II стадии ЭГ, вне периода ее обострения,
Л. А. Комарова предлагает синусоидальные модулированные
токи с воздействием на «воротниковую» рефлексогенную зону
(С4—Dg; ручной массаж, подводный душ-массаж (при начальной
стадии заболевания). Выбор физических методов лечения дол-
жен основываться, по мнению автора, на учете клиники заболе-
253
вания и типа гемодинамики. В литературе имеется немало дру-
гих примеров успешного применения у больных ЭГ различных
физиотерапевтических методов. Подробное их описание, а также
изложение результатов весьма эффективного и полезного ку-
рортного, климатического лечения ЭГ, можно найти в специаль-
ных монографиях и руководствах.
Весьма подходят больным ЭГ индивидуально подобранные
режимы регулярных физических упражнений, если их объем и фор-
ма контролируются специалистами по лечебной физкультуре и
кардиологами (Какорин С. В., 1993; Бутченко Л. А., 1994). В ча-
стности, рекомендуется умеренная аэробная физическая нагруз-
ка: ходьба пешком с постепенным убыстрением шага, плавание в
течение 30—45 мин 3—4 раза в неделю. Изометрические нагруз-
ки (подъем тяжестей) могут, напротив, вызывать повышение АД
(Jenniags G., 1997).
В табл. 11 приведен также перечень лекарственных препаратов
и некоторых других химических веществ, которые могут вызывать
повышение АД у больных ЭГ или быть причиной возникновения
симптоматической АГ. Ряд лекарственных соединений способен
препятствовать всасыванию противогипертензивных средств; к их
числу относятся и некоторые кишечные абсорбенты.
Классификация и характеристика
противогипертензивных препаратов
По мере углубления представлений о сущности ЭГ расширя-
лись возможности ее лекарственной терапии. В период до 50-х го-
дов XX века, т. е. в течение почти 40 лет после того, как
Е. Франк выдвинул понятие об ЭГ, еще полностью отсутствова-
ли специфические противогипертензивные средства. В этом
смысле весьма показательно замечание Г. Ф. Ланга, относящееся
к 1922 г.: «Из лекарственных средств при гипертонии главную
роль играют все средства, действующие успокаивающим образом
на центральную нервную систему: препараты брома, валерианы,
хлоралгидрат, адалид, люминал и т. д.». Позже наиболее попу-
лярным препаратом стал папаверина гидрохлорид, затем но-шпа,
эуфиллин и, наконец, дибазол, первое клиническое исследова-
ние которого было проведено в клинике Н. Н. Савицкого (Ку-
шаковский М. С., Гисматуллин Р. И., 1951). Всем этим вещест-
вам в основном присуще местное противоспастическое действие.
254
В 1953 г. на аптечном рынке появились гидралазин (апрес-
син) и производные раувольфии змеиной, а в конце 50-х го-
дов — тиазидовые диуретики. Это был значительный шаг вперед,
коренным образом изменивший терапевтическую ситуацию.
В начале 60-х годов и несколько позже в клинике стали исполь-
зовать спиронолактон (верошпирон), гуанетидин (изобарин),
а-метилдопа (допегит) и р-адреноблокаторы. Столь значитель-
ные успехи клинической фармакологии создали условия для раз-
работки единой концепции лекарственной терапии ЭГ, которая
была принята в течение двух десятилетий практически во всех
странах мира.
В 70—80-х (90-х) годах была создана серия лекарственных
препаратов нового поколения, выгодно отличавшихся от своих
предшественников. Эти препараты постепенно вытесняют ста-
рые средства, которые все реже используются в клинической
Therapeutic Antihypertensives
Рис. 15. Последовательность введения в клиническую практику
противогипертензивных препаратов в течение последних 40 лет
и их терапевтическая эффективность (по Р. van Zwieten, 1992)
255
практике. Особенности и свойства последних были подробно
нами описаны в предыдущих изданиях этой книги (1977, 1982,
1983) (рис. 15).
В настоящей монографии главное внимание уделено новым
препаратам, составляющим основу современного противогипер-
тензивного лечения. Ниже мы приводим их классификацию и
характеристику (табл. 13).
Таблица 13
Классификация современных противогипертензивных
лекарственных препаратов
I. Препараты центрального действия:
1) стимуляторы (агонисты) а2-адренорецепторов продолгова-
того мозга (клофелин, гуанабенз, гуантацин (эстулик);
2) стимуляторы (агонисты) Ii-имидазолиновых рецепторов
продолговатого мозга (моксонидин, цинт, физиотенз).
II. Блокаторы периферических ai-адренорецепторов (празозин,
доксазазин (кардура), теразазин (хайтрин).
III. Блокаторы p-адренорецепторов (пропранолол, метопролол,
атенолол, надолол, бисопролол (конкор), бетаксолол (лок-
рен), карведилол, целипролол, небиволол и др.
IV. Диуретики (тиазиды и тиазидоподобные препараты: гипотиа-
зид, политиазид, хлорталидон, индапамид (арифон), диуре-
тики петли Генле (фуросемид, этакриновая кислота, бумета-
нид); калий-задерживающие диуретики (альдактон, верошпи-
рон и др.).
V. Антагонисты кальция, или блокаторы медленных кальциевых
каналов клеточной мембраны/дигидропиридины: а) быстрого
действия: коринфар, адалат; б) медленного действия: фелоди-
пин (плендил), амлодипин (норваск), исрадипин, никарди-
пин и др.; бензотидизины: дилтиазем (кардил); фенилалкил-
амины: верапамил.
VI. Ингибиторы ангиотензинпревращающего фермента (АПФ) —
каптоприл (капотен), эналаприл (ренитек, эднит), периндоп-
рил (престариум), фозиноприл (моноприл), лизиноприл, мо-
эксиприл, трандолаприл, квинаприл и др.
VII. Блокаторы рецепторов ангиотензина II: лозартан (козоар),
валсартан (диован), ирбесартан, кандесартан, эпросортан (те-
тевен) и др.
VIII. Ингибиторы вазопептидазы: омапатрилат.
256
Стимуляторы (агонисты)
центральных постсинаптических ai-адренорецепторов
и Ij-имидазолиновых рецепторов
Приступая к характеристике этой группы гипотензивных
препаратов, я считаю необходимым вновь напомнить о физиоло-
гическом механизме нисходящего торможения периферической сим-
патической нервной активности. К сожалению, этот механизм,
раскрытию которого в нашей стране способствовала серия экс-
периментальных работ А. В. Вальдмана и В. А. Цырлина (1975),
мало учитывается приверженцами центрогенно-нервной теории
патогенеза ЭГ. Между тем теперь уже очевидно, что стимуляция
центров симпатической нервной системы, расположенных в ги-
поталамусе и продолговатом мозге, сопровождается не уси-
лением симпатической нервной активно-
сти на периферии, а ее торможением, ин-
гибированием. Соответственно, лекарственная стимуля-
ция центральных аг-адренорецепторов продолговатого мозга,
а также недавно открытых Г-имидазолиновых рецепторов про-
долговатого мозга, которые не относятся к элементам симпати-
ческой нервной системы, понижает активность ее перифериче-
ских отделов, т. е. уменьшает выделение норадреналина в терми-
налях симпатических нервов резистивных сосудов и миокарда.
Именно на таких реципрокных взаимоотношениях центра и пери-
ферии основывается применение старых центрально действую-
щих гипотензивных средств (a-метилдопа, резерпин и др.), а
также новых центрально действующих препаратов.
Клофелин (клонидин, гемитон, катапрессан, катапресс). Ме-
ханизмы гипотензивного действия препаратов этого класса были
рассмотрены в главе о патогенезе ЭГ. Напомним, что боль-
шинство экспериментальных данных указывает на центральное
аг-адреномиметическое действие этого препарата и его аналогов.
Быстро проникая через гематоэнцефалический барьер, они сти-
мулируют норадренергические нейроны ядер гипоталамуса,
а также адренорецепторы аг-подтипа продолговатого мозга; тем
самым эти препараты тормозят и ограничивают выход симпати-
ческих импульсов на периферию: к резистивным сосудам, к сер-
дцу, почкам (Вальдман А. В. и др., 1974, 1978; Цырлин В. А.,
1975; Kobinger W., 1966, 1972; van Zwieten Р., 1973; van Bogaert A.,
de Schepper J., 1979).
9 Зак 3207
257
Клофелин был синтезирован в Германии в 1962 г., его воз-
действие на АД протекает в две фазы. При быстром внутривен-
ном введении препарата в течение */2—2 мин отмечается повы-
шение АД приблизительно на 5—12% по сравнению с исходным
уровнем; МО сердца и венозное давление при этом не изменя-
ются; пульс урежается на 10—12%. Такой начальный гипертен-
зивный эффект клофелина связан с его периферическим а-адре-
номиметическим, т. е. сосудосуживающим, действием (первая
фаза).
Вторая фаза действия клофелина характеризуется постепен-
ным понижением АД, которое достигает самого низкого уровня
через 20—40 мин после инъекции клофелина; длительность ги-
потензивной реакции достигает 2—3 ч.
При приеме клофелина внутрь первая, гипертензивная, фаза
не выявляется; понижение АД начинается через 30—60 мин; его
максимальное падение приходится на 2—4 ч, а общая длитель-
ность действия достигает 10 ч. В дозе 0,15 мг препарат через 2 ч
понижает среднее гемодинамическое давление примерно на 29%
в положении больного стоя, на 22% — в положении больного
лежа. Это значит, например, что у больного ЭГ со средним гемо-
динамическим давлением около 120 мм рт. ст. клофелин пони-
жает его до 95 мм рт. ст., т. е. почти нормализует.
В гемодинамическом отношении гипотензивный эффект кло-
фелина при введении внутривенно или при однократном приеме
внутрь преимущественно связан с уменьшением МО сердца.
Это — результат снижения венозного притока крови к сердцу за
счет расширения емкостных сосудов, а также замедления сердеч-
ной деятельности (Алмазов В. А. и др., 1980). ОПС не меняется,
пока больной лежит, но при переходе его в вертикальное поло-
жение ОПС понижается вместе с МО сердца. Длительное лече-
ние клофелином больных со стабильной ЭГ приводит к умень-
шению ОПС и частоты сердечных сокращений (Алмазов В. А.
и др., 1980). У больных не изменяется нормальная гемодинами-
ческая реакция в ответ на физическую нагрузку и сохраняется
барорецепторный рефлекс (Mancia G. et al., 1980). Клофелин
способствует обратному развитию гипертрофии левого желудоч-
ка (Weinberger М., 1987).
Кровообращение в почках, скорость клубочковой фильтра-
ции и фильтрационная фракция поддерживаются у больных на
исходном уровне длительное время, по меньшей мере в течение
258
4 мес непрерывного лечения клофелином; почечно-сосудистое
сопротивление понижается (Cohen J. et al., 1979). Правда, у
больных ЭГ с почечной недостаточностью клофелин понижает
скорость клубочковой фильтрации.
Лечение клофелином сопровождается уменьшением суточной
экскреции с мочой адреналина, норадреналина и в меньшей сте-
пени ванилилминдальной кислоты. Эти эффекты зависят от
дозы препарата. Снижаются также активность ренина и концен-
трация альдостерона в плазме крови, но и в случаях гипоренино-
вой ЭГ неоднократно регистрировалось хорошее гипотензивное
действие клофелина. Очень важно, что клофелин, как и другие
центральные аг-адреностимуляторы (за исключением а-метил-
допа), понижают концентрацию в плазме общего холестерина,
холестерина липопротеидов низкой плотности и триглицеридов
(примерно на 10%). Препарат не вызывает гипергликемии и ги-
перурикемии и, следовательно, может использоваться для лече-
ния ЭГ у больных сахарным диабетом и подагрой.
К настоящему времени накопился большой клинический
опыт лечения клофелином больных в различных стадиях ЭГ.
Препарат эффективен как при легком, так и при более тяжелом
течении заболевания, хотя в качестве монотерапии он более по-
казан больным в I—II стадии. Чувствительность больных к кло-
фелину индивидуальна, что отражается на его дозировках. Изве-
стны случаи успешного лечения ЭГ предельно низкими дозами
(0,15 мг в день) и крайне большими дозами (1,5—2 мг в день).
Целесообразно начинать лечение с малых доз, 0,075 мг кло-
фелина 3 раза в сутки или по 0,15 мг 2 раза в день (во время зав-
трака и обеда), при увеличении суточной дозы большую часть
препарата назначают для приема на ночь. Индивидуальную дозу
следует тщательно подбирать, т. е. повышение или понижение
суточной дозы определяется достигнутым терапевтическим эф-
фектом. Обычно дозы клофелина приходится постепенно увели-
чивать, особенно в течение 1—2 месяцев лечения. В амбулатор-
ных условиях 0,075—0,15 мг препарата добавляют через 3—
7 дней; в условиях больницы эти промежутки могут быть сокра-
щены до 1—2 дней (если не происходит снижения высокого АД).
У большинства больных, реагирующих на
клофелин, его средняя суточная доза со-
ставляет 0,45—0,80 мг. Максимальная суточная доза —
2,4 мг — применяется редко. Необходимое гипотензивное дейст-
259
вие достигается при монотерапии клофелином у 65% стационар-
ных больных и у 56% амбулаторных больных. Понижение АД
лучше проявляется в вертикальном положении больных, но ор-
тостатическая гипотензия развивается только в 4% случаев;
обычно не происходит дальнейшего снижения АД во время и
после физической нагрузки.
Мои клинические наблюдения показывают, что следует спе-
циально привлечь внимание врачей еще к одному важному об-
стоятельству. Неоднократно в клинику поступали больные ЭГ,
длительно принимавшие клофелин в достаточных дозах, но
имевшие высокое АД — порядка 200—220/110—115 мм рт. ст.,
иногда осложнявшееся нарушениями мозгового кровообраще-
ния. При беседе с такими больными выяснялось, что повышение
АД вновь происходило у них после периода весьма эффективно-
го лечения. Рецидив АГ сочетался с появлением пастозности
(отеков) на голенях, с уменьшением диуреза и возрастанием мас-
сы тела (иногда на 3—4 кг).
Врач не всегда фиксирует этот переломный момент или мало о
нем осведомлен. Между тем причины такого явле-
ния связаны с возрастанием канальцевой
реабсорбции натрия и воды, вызываемой
при хроническом применении не только
клофелина, но и остальных нейротропных средств (кроме
p-адреноблокаторов) и вазодилататоров. Увеличение ОВЖ и
ОЦП лишает клофелин его гипотензивной активности.
Этот процесс развивается у больных с различной скоростью:
у 17—20% между 2-м и 3-м месяцем, у половины больных на
втором году лечения.
Чтобы избежать опасного рецидива гипертензии, больному
следует рекомендовать прием вместе с клофелином диуретика:
лучше через каждые 7—10 дней по 12,5—25 мг гипотиазида (или
его аналогов). До 80% больных со средним и тяжелым течением
ЭГ хорошо реагируют на такую комбинацию препаратов. При
этом удавалось на 25% уменьшить дозу клофелина. Вместе со
спорадически назначаемым диуретиком клофелин можно с успе-
хом применять 2 раза в день (Frisk-Holmberg F., 1980). При более
частых приемах диуретика могут возникнуть некоторые пробле-
мы, связанные, в частности, с тем, что не только диуретик, но и
клофелин способствует повышенному выделению калия с мочой.
260
В отличие от альдомета (а-метилдопа) клофелин не вызывает
повреждений печени и гемопоэтической системы. Однако при
его применении нередко возникают побочные реакции, завися-
щие от величины дозы. До 80% больных жалуются на появление
сухости во рту, что является следствием угнетения секреции
слюны в околоушных и подчелюстных слюнных железах. Пони-
жается также выделение желудочного сока и хлористоводород-
ной кислоты. Правда, у большинства больных после 4-й недели
лечения ощущение сухости во рту исчезает, хотя встречаются
лица, у которых оно сохраняется длительное время или даже
усиливается, особенно при повышении дозы клофелина. В по-
добных случаях благотворное действие оказывает аскорбиновая
кислота (0,3—0,5 г 2—3 раза в день). Возможно появление запо-
ров, которые можно предотвратить назначением легких слаби-
тельных веществ или фруктовых соков, одновременно восполня-
ющих потери калия.
Необходимо учитывать отрицательные влияния клофелина на
психоневрологический статус больных. У 60% из них появляются
сонливость, вялость, иногда угнетение, больше по утрам или че-
рез 2—3 ч после очередного приема внутрь препарата. При дозе
клофелина 0,15 мг такое состояние может длиться до 45—
60 мин, при увеличении дозы оно может затягиваться на не-
сколько часов. Со временем склонность к сонливости уменьша-
ется, она намного слабее на 2-м году лечения.
Случаи импотенции, понижения либидо, психической де-
прессии очень редки, но клофелин не рекомендует-
ся назначать лицам, страдающим депрес-
сивными психозами (состояниями). При лече-
нии клофелином следует с осторожностью применять трицикли-
ческие антидепрессанты (мелипрамин и др.), которые ослаб-
ляют гипотензивное действие клофелина (Gutkind J. et al., 1987);
клофелин усиливает угнетающее действие
алкоголя (!), барбитуратов и других седа-
тивных средств.
При длительном лечении клофелином больному необходимо
периодически показываться окулисту, поскольку в эксперименте
у животных наблюдали изменения сетчатки глаза. Правда, капли
клофелина используют в офтальмологической практике для
снижения внутриглазного давления.
261
Необходимо обсудить еще один важный в практическом от-
ношении вопрос: о тактике отмены клофелина. Внезапное пре-
кращение лечения опасно, поскольку у больных может развиться
своеобразный «синдром отмены» (в среднем в 1,3% случаев).
Чаще это бывает, когда суточная доза клофелина превышает
1,2 мг. Между 18 и 48 ч от момента прекращения приема препа-
рата больной начинает ощущать беспокойство, у него появляют-
ся раздражительность, тремор, синусовая тахикардия. Позже
присоединяются головные боли, усиленное слюноотделение,
боли в животе, тошнота. Резко — до предельных цифр — повы-
шается АД («феномен рикошета»).
Вся картина напоминает гипертензивный криз при феохро-
моцитоме: в плазме крови и в моче несколько возрастает содер-
жание катехоламинов. Через 2—5 дней (т. е. медленнее, чем при
адреналовом кризе у больных с феохромоцитомой) эти явления
стихают, выделение катехоламинов понижается до исходного
уровня. Реакцию отмены клофелина можно уменьшить путем
возобновления его приема либо с помощью а-адреноблокатора
(фентоламин).
Очевидно, что клофелин следует отменять не
остро, а постепенно, в течение 2—4 дней понижая
дозу. Больные должны быть предупреждены об опасности быст-
рого прекращения приема этого препарата. Если же приходится
внезапно прервать лечение вынужденно, например, в связи с хи-
рургической операцией, то к приему клофелина возвращаются в
послеоперационном периоде еще до появления первых призна-
ков «синдрома отмены». Кроме того, гиперадренергические ре-
акции в послеоперационном периоде могут быть подавлены
внутривенным введением фентоламина (от 5 до 10 мг с 5-минут-
ными интервалами, в общей дозе от 20 до 30 мг) и пропранолола
гидрохлорида (0,2 мг/кг массы тела в течение 2—4 мин, преры-
висто!).
Укажу также, что в исследовании APIS в течение 1 года
100 больных в возрасте от 30 лет до 71 года получали клонидин в
трансдермальной форме. В начале лечения больные получали в
течение 2 нед. пластырь 3,5 см2 (клонидин 100 мг/сут) — TTS-1.
При неэффективности больные использовали пластырь 7 см2
(200 мг/сут) — TTS-2 и т. д. Достоверное снижение АД отмече-
но через 12 мес после начала лечения. При этом у 56% больных
АД стабилизировалось при использовании 100—200 мг/сут,
262
у 10% больных — при дозе 300 мг/сут черезкожно. В 32% случаев
отмечены кожные реакции (цитировано по А. И. Мартынову и
соавт., 2000). На мой взгляд этот метод введения клонидина
малоперспективен.
Гуанабенз, подобно клофелину, эффективен при монотера-
пии у 60—75% больных ЭГ при легком и среднем по тяжести те-
чении заболевания. Может использоваться при сочетании ЭГ с
сахарным диабетом или подагрой, при хронической почечной
недостаточности, заболеваниях печени и ЦНС, при синуситах и
ринитах, пептической язве желудка, менопаузе. Гуанабенз пока-
зан и больным с гиперлипопротеидемией: он понижает уровень
холестерина плазмы, но не предотвращает его подъем при соче-
тании с диуретиком.
Гуантацин гидрохлорид, или эстулик, понижает АД у боль-
шинства больных при однократном приеме в сутки, начиная с
дозы 0,5—1 мг (полупериод выведения гуантацина 18 ч). При не-
обходимости дозу препарата можно повышать на 0,5—1 мг в сут-
ки с интервалами не менее недели. Оптимальная суточная доза
гуантацина — 2 мг (от 1 до 3 мг). Если с помощью одного гуан-
тацина не удается достигнуть нужного гипотензивного эффекта,
то в лечебную программу добавляют диуретик.
Существенное обстоятельство: в отличие от клофелина гуан-
тацин не вызывает задержки натрия и воды, не повышает выде-
ления калия. Препарат понижает активность ренина плазмы, не
оказывая влияния на скорость клубочковой фильтрации — даже
у больных с симптомами почечной недостаточности.
Моксонцдин (цинт, физиотенз) — агонист Ii-имидазолино-
вых рецепторов, расположенных в вентролатеральной части ро-
стрального отдела ствола мозга, тогда как а2-адренорецепторы
продолговатого мозга находятся на пресинаптических лимфанах
нейронов в ядрах одиночного тракта (nucleus tracty solitarius).
Правда, ядра одиночного тракта вставочными нейронами соеди-
няются с вентролатеральными ядрами продолговатого мозга, от
которых отходят волокна к преганглионарным нейронам, распо-
ложенным в грудном отделе спинного мозга, а также к ядрам
блуждающего нерва. Кроме того, нейроны вентролатерального
ядра соединены с гипоталамусом.
Противогипертензивное действие моксонидина и близкого к
нему рилменидина (van Zwieten R., 1977) связано с агонизмом к
Ii-имидазолиновым рецепторам нейронов, расположенных в
263
вентролатеральных ядрах продолговатого мозга (Dontonill М.
et al., 1994; Sannajust F., Haud G., 1994; Prichard B. et al., 1997;
Преображенский Д. В. и др., 1999). Сродство моксонидина к
11-имидазолиновым рецепторам в 40—70 раз выше, чем к а.2-ад-
ренорецепторам продолговатого мозга (Ernsenberger Р., 1989;
Цырлин В. А. и др., 2001).
При приеме внутрь моксонидин быстро и почти полностью
всасывается, максимальная концентрация в плазме определяется
в течение 1 часа после приема препарата; биодоступность его
высока — 84—85%; период полувыведения равен 2—3 ч; моксо-
нидин выделяется из организма человека с мочой. Снижение АД
проявляется через 30 мин, достигая максимума через 2—5 ч, ги-
потензивный эффект сохраняется до 24 ч (Schaefer Н. et al.,
1998).
Опыт отечественных клиницистов по применению моксони-
дина пока не очень большой, но он постепенно расширяется.
X. В. Небиеридзе, А. Н. Бритов, Т. В. Апарина и др. (1999) при-
менили цинт у 20 больных с мягкой и умеренной АГ, сочетав-
шейся с резистентностью к инсулину, абдоминальным ожирени-
ем и дислипопротеинемией. После 8-недельного лечения цинтом
(по 0,2—0,4 мг однократно в день) был получен хороший гипо-
тензивный эффект: систолическое АД снизилось от исходных
172,4 мм до 150,4 мм рт. ст. (р<0,01); диастолическое АД понизи-
лось от 102,7 мм до 92,5 мм рт. ст. (р<0,001); число сердечных
сокращений не изменилось. У 8 из 20 больных (40%) удалось до-
стичь целевого снижения АД (140/90 мм рт. ст. и ниже). Препа-
рат обеспечивал стабильное снижение АД в течение суток. Всего
отличный и хороший эффект был получен у 65% больных. Ко-
эффициент, отражающий отношение остаточного снижения АД,
т. е. в конце действия препарата, к его максимальному сниже-
нию, у цинта составляет 70%, что свидетельствует о стабильно-
сти его гипотензивного эффекта (Elliot Н., 1997).
Максонидин способствовал сглаживанию признаков метабо-
лического синдрома: возрастала чувствительность клеток к инсу-
лину, понижался уровень триглицеридов в плазме, т. е. проявле-
ний, которые, по современным воззрениям, связаны с усилени-
ем активности симпатической нервной системы.
Л. И. Ольбинская и соавт. (1999) изучали эффективность и
переносимость цинта у 30 больных ГБ I—II стадией (класси-
фикация ВОЗ 1962 г.). Начальная доза препарата составила
264
0,2 мг/сут; при недостаточности гипотензивного эффекта дозу
повышали до 0,4 мг/сут, а затем через 2 нед до 0,6 мг/сут (за
2 приема). Длительность лечения составила 6 мес. Эффектив-
ность терапии оценивалась как «очень хорошая» у 67% больных;
этот результат был достигнут приемами по 0,2 мг/сут у 20% боль-
ных, 0,4 мг/сут — у 36,7% и 0,6 мг/сут — у 60% больных.
Авторы ни разу не наблюдали развитие устойчивости к пре-
парату. Переносимость цинта была вполне приемлемой. В отли-
чие от клонидина, цинт значительно реже вызывал сухость
во рту, сонливость и головные боли. Авторы обратили внимание
на то, что стимуляция имидазолиновых рецепторов приводит
к уменьшению активности ренина в плазме и к умеренному ди-
уретическому эффекту, что еще в 1996 г. описали Н. Brunner,
В. Weber.
Блокаторы сц-адренорецепторов
Повышение ОПС, вызываемое, как подчеркивалось выше,
генерализованным сужением резистивных сосудов, является
фундаментальной гемодинамической ненормальностью, свойст-
венной стабильной ЭГ. Даже при ее начальных, гиперкинетиче-
ских вариантах имеется относительное повышение ОПС, кото-
рое еще больше возрастет у больного при физическом и эмоцио-
нальном напряжении.
Естественно, что рациональным и логичным представляется
метод лечения ЭГ с помощью сосудорасширяющих средств, по-
нижающих ОПС при сохранении нормального МО сердца. По-
скольку сужение резистивных сосудов в основном вызывают АП
и норадреналин, исследовательская мысль была направлена на
создание препаратов, противодействующих воздействию этих со-
судосуживающих веществ. Что касается антинорадреналиновых
препаратов, то они могли быть синтезированы только после
того, как была проведена субклассификация а-адренорецепторов
на аг и аг-субтипы (Lands A. et al., 1967).
Выяснилось, что сужение резистивных сосудов опосредуют
aj-(постсинаптические) адренорецепторы. Пресинаптические
(аг) адренорецепторы являются важнейшей частью ингибитор-
ного механизма, регулирующего выделение норадреналина из
265
окончаний симпатических нервов — как на периферии, так и
в ЦНС.
Эти факты объясняют причины неудач в лечении ЭГ таки-
ми неселективными а-адреноблокаторами (ai и аг), как фен-
толамин, феноксибензамин и др. В нашей клинике А. Б. Лего-
стев (1980) показал, что через 30—60 мин после разового приема
больными ЭГ 50 мг фентоламина гидрохлорида происходит уча-
щение пульса в среднем на 17% (синусовая тахикардия сохраня-
ется 2—3 ч); УО не меняется, МО сердца возрастает на 8,8%,
ОПС понижается на 13,3%, среднее гемодинамическое давле-
ние — только на 4,9%.
Между тем фентоламин оказался полезным в сочетании с
p-адреноблокатором. А. Б. Легостев осуществил комбинирован-
ное лечение фентоламином и вискеном (пиндолол) 31 больного
во II—III стадии ЭГ. Сначала эти лица в течение 12—16 дней
принимали внутрь от 15 до 45 мг в день вискена, затем к вискену
добавляли фентоламин в дозе 75—100 мг в день (в три приема).
У 38% больных уже на второй день комбинированного лечения
был получен дополнительный гипотензивный эффект, сохраняв-
шийся в течение всего периода сочетанной терапии. В гемодина-
мическом отношении это проявлялось понижением ОПС без та-
хикардии и возрастания сердечного выброса. Кроме того, боль-
ные избавлялись от таких неприятных ощущений, связанных
с p-адренергической блокадой, как зябкость, слабость в нижних
конечностях.
Таким образом, в качестве монотерапии фентоламин и дру-
гие неселективные a-адреноблокаторы не могут использоваться
для лечения больных ЭГ, поскольку возникающее в ответ на
снижение ОПС усиление активности симпатической нервной
системы (повышение концентрации норадреналина в плазме и
его экскреции с мочой) чрезмерно стимулирует сердечную дея-
тельность (тахикардия и т. д.). Этих отрицательных эффектов в
значительной мере лишены селективные ai-адреноблокаторы,
которые не нарушают пресинаптический (аг) механизм обратной
связи, контролирующий высвобождение норадреналина из сим-
патических терминалей и адреналина из мозгового слоя надпо-
чечников. Поэтому при применении этих препаратов уровень
катехоламинов в синаптических пространствах и в плазме возра-
стает умеренно; соответственно сравнительно слабо учащается
сердечная деятельность и мало повышается активность ренина
266
плазмы (Constantine J. et al., 1976; Hoffman B., Lepcowitz R., 1980;
Kinkaid-Smith P., 1987).
Празозин гидрохлорид (минипрес) — первое и наиболее изучен-
ное в клинике лекарственное средство этого класса (Bendy S.
et al., 1977; Cambridge D. et al., 1977). Препарат после приема
внутрь быстро и интенсивно всасывается. Его биодоступность
колеблется от 68% — у молодых людей до 48% — у пожилых
больных. Пик плазменной концентрации празозина отмечается в
течение 1—3 ч после его приема. Он активно метаболизируется в
печени; образующиеся метаболиты менее активны, чем исходное
вещество. Период полувыведения празозина короткий (от 2 до
3 ч), что делает необходимым его прием не менее 2 раз в день
(утром и вечером) (Алмазов В. А. и др., 1994).
После однократного приема больным празозина АД у него
понижается в течение 1—2-го часа; оно возвращается к исходно-
му уровню через 8—10 ч. При длительном лечении препаратом
нужный уровень АД обеспечивается двухкратным приемом пра-
зозина. Лечение начинают с дозы 1 мг два раза в день, затем
дозу, при необходимости, постепенно, в течение 2—4 нед., уве-
личивают до максимальной — 20 мг в день. Заметное понижение
или нормализация АД чаще достигается при дозах 6—10 мг
в день. Почечный кровоток и клубочковая фильтрация хорошо
поддерживаются в течение длительного периода лечения празо-
зином; МО сердца и толерантность к физической нагрузке даже
несколько возрастают. Можно встретить утверждение, что празо-
зин не вызывает учащения пульса; с этим согласиться нельзя;
при первом приеме препарата отмечается, примерно у */з боль-
ных, тахикардия вместе с чувством тревоги; по данным В. А. Ал-
мазова и соавт. (1994), у половины из них сердцебиение про-
ходит самостоятельно; остальным больным при плохой перено-
симости тахикардии приходится назначать р-адреноблокатор.
В последующем, при увеличении продолжительности лечения,
празозин заметно меньше влияет на частоту сокращений сердца.
Большим достоинством празозина и его аналогов является их
слабое влияние на ряд важных метаболических показателей: не
изменяется уровень К+ и мочевой кислоты в плазме, метаболизм
глюкозы устойчив даже при сочетании a i-адреноблокатора с ди-
уретиком. Препараты этого класса не ухудшают липидный про-
филь плазмы; в ряде исследований отмечалось понижение кон-
центрации в плазме общего холестерина при одновременном
267
увеличении содержания антиатерогенных липопротеидов высо-
кой плотности. Правда, пока отсутствуют данные о том, что пра-
зозин или другие aj-адреноблокаторы уменьшают у больных ЭГ
заболеваемость ИБС или число ее осложнений.
Лечение празозином в качестве единственного препарата
оказалось эффективным у 60—70% больных с легкой и средней
по тяжести ЭГ; при тяжелом течении заболевания, т. е. более
устойчивом повышении АД, можно добиться успеха сочетанием
празозина с p-адреноблокатором или диуретиком.
К празозину, по-видимому, не возникает привыкания (устой-
чивости), о чем свидетельствует уже накопленный 7—10-летний
опыт непрерывного лечения больных ЭГ этим препаратом.
Поскольку до 30—40% больных ЭГ слабо реагируют на пра-
зозин или другие ai-адреноблокаторы, практическое значение
приобретают пробы для выявления «чувствительных» и «нечувст-
вительных» к празозину больных ЭГ (MacCarthy Е. et al., 1981;
Kinkaid-Smith Р., 1987). По мнению G. Stokes и соавт. (1980), ре-
акция больного на инициальную дозу празозина может быть ис-
пользована для предсказания успеха или неудачи при длитель-
ном лечении. Близкой позиции придерживаются J. Reid и соавт.
(1987). В. А. Алмазов и соавт. (1994) рекомендуют для прогнози-
рования эффективности длительной монотерапии празозином
применять пробу с изометрической нагрузкой с анализом пока-
зателей гемодинамики.
В заключение следует характеризовать некоторые другие
особенности действия празозина и вызываемые им побочные
реакции.
К числу важных особенностей, о которых должен быть осве-
домлен врач, мы относим следующие.
1) Празозин и его аналоги достоверно уменьшают гипотен-
зивный эффект клофелина у больных ЭГ; это особенно четко
проявляется при внутривенном введении клофелина. Очевидно,
что сочетание а.]-адреноблокаторов и центральных о.2-адрености-
муляторов нежелательно при проведении противогипертензив-
ной терапии (Kapoesi J. et al., 1987).
2) Празозин и его аналоги при более или менее длительном
применении вызывают задержку натрия и воды за счет усиления
их канальцевой реабсорбции; пастозность голеней, уменьшение
диуреза и увеличение массы тела в период лечения a i-адрено-
блокатором служит показанием для назначения диуретика.
268
3) Как cq-адреноблокатор, празозин (и его аналоги) рас-
слабляет гладкую мускулатуру внутренних органов, снабженных
cq-адренорецепцией. Это, в частности, имеет отношение к мо-
чевому пузырю и сфинктеру мочеиспускательного канала.
У больных ЭГ, имеющих увеличение пред-
стательной железы ( а д е н о м а), oq-ад р е н о б л о -
каторы, наряду со снижением АД, сущест-
венно улучшают функцию органов мочеис-
пускания (!)
4) Противогипертензивное действие празозина отчетливо вы-
ражено у больных с хронической почечной недостаточностью
(Stokes G. et al., 1979).
В дневной дозе от 1 до 10 мг 2 раза в день празозин хорошо
переносится больными. Возникающие побочные эффекты, как
правило, легки, транзиторны и не столь уж часты; их появление
обычно не служит поводом для прекращения лечения. У боль-
ных иногда появляются: головная боль, легкое головокружение,
слабость, стертые ортостатические реакции, ослабевающие со
временем. Отчетливая ортостатическая гипотензия возникает
лишь в 1% случаев, главным образом у больных, начинающих
лечение празозином с дозы, превышающей 1 мг, либо слишком
быстро увеличивающих дозу.
Доксазозин (кардулар, кардура) — хинозолиновый дериват,
структурно близкий к празозину и обладающий аналогичным
а 1-адреноблокирующим действием. В отличие от празозина до-
ксазозину присущ сравнительно длинный период полувыведения
(от 9 до 11 ч), поэтому его можно с успехом принимать 1 раз в
день. Препарат понижает сопротивление почечных афферентных
артериол и общее почечно-сосудистое сопротивление, не изме-
няя при этом величины почечного кровотока и клиренса креати-
нина. При разовом приеме доксазозина отмечается некоторое
увеличение концентрации норадреналина и активности ренина
плазмы. Частота сокращений сердца при этом также возрастает,
например, с 75 в 1 мин до 86 в 1 мин через 6 ч; во время дли-
тельного лечения эта рефлекторная реакция исчезает (рис. 16).
При систематическом применении доксазозин понижает плаз-
менную концентрацию общего холестерина (-1,2%), триглицери-
дов (-9,1%) и, напротив, повышает уровень антиатерогенных ли-
попротеидов высокой плотности (+7,6%). Таким образом, докса-
зозин при лечении ЭГ понижает значение двух важных факторов
269
Doxazosin (n=12)
Ю-l
HR TPRI Cl
(beats/min) (dyn-s-cnrr’-m*2) (I min m2)
MAP
(mmHg)
-10-
-20 —
-30-1
Рис. 16. Изменения показателей гемодинамики и работы сердца у больных ЭГ
(ГБ) после одногодичного приема доксазозина (по Р. Leren, 1992). МАР — среднее
гемодинамическое давление; TPRI — общее периферическое сопротивление;
CI — сердечный индекс; темные столбики — показатели в покое; светлые
столбики — показатели во время работы (100 W)
риска ИБС (Pool J., 1987). По мнению ряда авторов, применение
доксазозина уменьшает риск заболевания ИБС на 15— 25% (Da-
vey М., 1989). В трех независимых исследованиях было отмечено
уменьшение степени гипертрофии левого желудочка на 7—17%
за 12—24 нед. приема больными ЭГ доксазозина (Leren Р.,
1992). Надо отметить, что в начале 2000 г. комитет по безопасно-
сти прервал применение доксазозина в исследовании ALLHAT в
связи с достоверно большей частотой развития застойной сер-
дечной недостаточности (Messerli F., 2000). Эти данные могут
стать основанием для пересмотра роли а ।-адреноблокаторов в
лечении АГ.
Лечение доксазозином сопровождается понижением показа-
теля гематокрита за счет увеличения ОЦП, возрастает и масса
тела (за 6 нед. лечения на 0,5—1 кг).
Гипотензивное действие доксазозина после его однократного
приема больным ЭГ сохраняется в течение 24 ч; к препарату, по-
видимому, не возникает устойчивости (Tonvic D., Madsbu H.-Р.,
1987). При длительном лечении доксазозином 76% больных из
числа реагировавших довольствовались дозой 3,3 мг препарата
в день (Hayduk К., 1987).
В исследовании HALT (Levy D. et al., 1996) изучалась эф-
фективность доксазозина (кардура) у 800 больных старше
270
35 лет, имевших повышенное диастолическое давление до 96—
100 мм рт. ст. Лечение начинали с 1 мг/сут. В среднем лечебная
доза доксазозина составила 7,8 мг/сут. Установлено, что такое
лечение обеспечивает достоверное снижение систолического
и диастолического АД без выраженного влияния на частоту
сердечных нарушений. Доксазозин вызывал снижение уровня
в плазме холестерина, триглицеридов, липопротеидов низкой
плотности; уровень липопротеидов высокой плотности не изме-
нялся. Авторы отметили также снижение у больных риска возник-
новения коронарогенных заболеваний (цитировано по А. И. Марты-
нову и соавт., 2000).
К числу не реагирующих на празозин больных ЭГ относятся
некоторые лица, страдающие сахарным диабетом и имеющие
признаки диабетической нейропатии с деструкцией перифериче-
ских симпатических нервов. Надо заметить, что лица с наруше-
ниями вегетативной нервной системы нередко отвечают пара-
доксальной, прессорной, реакцией и на другие гипотензивные
средства, такие, как клофелин и пропранолол (Robertson J. et al.,
1984).
Д. В. Качалков, С. И. Веселова (1998) сообщили о результа-
тах лечения ЭГ в амбулаторных условиях. 96 больных ЭГ получа-
ли доксазозин. Уровень систолического АД в среднем равнялся
188 мм, диастолического — в среднем 109 мм рт. ст. Начальная
доза доксазозина (тонокардина) составила 1 мг/сут, дозу при не-
обходимости повышали до 2 мг/сут и через каждые 2 нед — до 4,
6 и 8 мг/сут. У 19 больных была эффективной доза 1 мг/сут;
у 29 — 2 мг/сут; у 29 — 4 мг/сут; у 11 — 6 мг/сут; у 12 — 8 мг/сут.
Таким образом, у 77% больных оказались эффективными дозы
препарата от 1 до 4 мг/сут.
К концу 9-недельного курса лечения доксазазином средний
уровень систолического АД снизился от 188 до 149 мм рт. ст.
(р<0,01), диастолического АД от 109 мм рт. ст. до 86 мм рт. ст.
(р<0,01). Хорошая переносимость препарата отмечалась у 83%
больных. Ни в одном случае препарат не был отменен из-за по-
бочных эффектов.
Примерно такими же свойствами обладает a i-адреноблока-
тор третьего поколения — теразазин (хайтрин), препарат, кото-
рый умеренно понижает АД, но заметно улучшает уродинамику у
больных с аденомой предстательной железы.
271
Блокаторы кальциевых каналов клеточной мембраны
(антагонисты кальция)
Составляющие этот класс противогипертензивные препараты
тормозят (блокируют) вхождение ионов Са+ через Са-каналы
мембраны гладкомышечных клеток резистивных сосудов, задер-
живают накопление внутриклеточного кальция, понижая тем са-
мым способность сосудов к сужению. Кроме того, Са-блокаторы
уменьшают реакцию резистивных сосудов на воздействие ангио-
тензина II. Очевидно, что все эти эффекты имеют антипрессор-
ную направленность, т. е. ведут к понижению ОПС (Вгаип-
wald Е., 1982).
Класс антагонистов кальция объединяет вещества, неодно-
родные по своей структуре, биохимическим и фармакологиче-
ским свойствам. Их разделяют на три подкласса (Fleckenstein А.
et al., 1969):
1) 1,4-дигидропиридины: нифедипин, нитрендипин, никар-
дипин, нисольдипин, нимодипин, дародипин, амлодипин, фело-
дипин, исрадипин;
2) бензотидизины — дилтиазем;
3) фенилалкиламины — верапамил.
Между этими подклассами Са-блокаторов имеются различия
в их влиянии на сердце и периферические сосуды. Например,
верапамил в большей мере тормозит АВ узловое проведение, чем
дилтиазем, а нифедипин и его аналоги вызывают более значи-
тельное расширение резистивных сосудов по сравнению с вера-
памилом и дилтиаземом.
Нифедипин и другие дигццропиридины. При однократном
приеме больным ЭГ нифедипина (коринфар, кордафен, адалат)
внутрь в дозе 10—20 мг систолическое давление понижается в
среднем на 28%, диастолическое — на 27%, при ответном учаще-
нии пульса только на 15%; УО, МО сердца, коронарный кро-
воток тоже возрастают; потребление кислорода миокардом не-
сколько понижается. Степень гипотензивного эффекта у отдель-
ных больных, в общем, находится в обратной зависимости от ис-
ходного уровня АД (Ольбинская Л. И. и др., 1994).
Начало действия нифедипина (10 мг) при приеме под язык,
за щеку или раскусывании капсулы адалата, содержащей жидкий
нифедипин, отмечается через 5—10 мин; если же препарат при-
нимают внутрь или вводят в свечах per rectum, начало гипотен-
зивной реакции проявляется позже — через 15, 30, 60 мин. Са-
272
мый низкий уровень АД достигается через следующие 10—
20 мин. Гипотензивное действие сохраняется от 2 до 4 (6) часов.
Поэтому нифедипин следует принимать 3 (4) раза в день; таблет-
ки, медленно выделяющие нифедипин, принимают реже: два
раза в день.
Систематическое лечение нифедипином (монотерапия) боль-
ных в I стадии ЭГ обеспечивает нормализацию АД почти в
100% случаев; средние по тяжести больные (II стадия ЭГ) благо-
приятно реагируют на такое лечение в 80% случаев; при тяжелом
течении ЭГ (III стадия) стабильное понижение АД (нормализа-
ция) достигается труднее и далеко не всегда. В этих случаях не-
редко приходится прибегать к назначению двух препаратов; со-
четание нифедипина с клофелином дает дополнительный гипо-
тензивный эффект порядка 10%; при комбинации нифедипина с
пропранололом гипотензивная реакция возрастает более чем на
30%, но ее длительность остается той же, что и при изолирован-
ном приеме нифедипина.
В исследовании MATH более 1000 больных с диастолическим
АД 95—110 мм рт. ст. в течение 12 нед получали нифедипин (ко-
ринфар, кордарон, адалат) в дозе 30—180 мг/сут. Отмечено по-
нижение диастолической АД до нормальных величин (ниже
90 мм рт. ст.) у 76% больных, у пожилых больных (65 лет и стар-
ше) эффект был даже выше — у 85% больных (Kraoff L., 1993).
В исследование STONE было вовлечено более 1,5 тыс. боль-
ных в возрасте 60—75 лет с АД 160/96 мм рт. ст. и выше. Боль-
ные принимали нифедипин в дозе 10—60 мг/сут в течение
36 мес. Лечение значительно понижало риск возникновения тя-
желых нарушений ритма сердца и инсультов.
Имеются больные, особенно остро реагирующие на прием
нифедипина. Это, во-первых, лица, у которых ЭГ сочетается с
гиповолемией, к чему (гиповолемии) вообще склонны больные с
устойчивым и высоким АД. Во-вторых, это лица, принимающие
а 1-адреноблокаторы (празозин и т. д.). Наконец, это — старые
или пожилые люди, страдающие ЭГ. Во всех этих случаях дозу
нифедипина лучше понизить до 5 (10) мг на прием.
Са-блокаторы эффективны как у моло-
дых, так и, особенно, у пожилых больных ЭГ,
несмотря на то, что у последних чаще встречается низкоренино-
вая форма заболевания. Очень важно, что препараты этого под-
класса не вызывают дальнейшего уменьшения внутрисосудисто-
273
го объема крови (ОЦП), что особенно ухудшает состояние гемо-
динамики у старых людей.
При характеристике противогипертензивных препаратов
важное значение придается, по понятным причинам, оценке их
воздействия на функции почек. Известно, что разовый прием
нифедипина сопровождается у части больных ЭГ диуретической
реакцией, знаменующей начало понижения АД. Учащение моче-
испускания происходит через 10—20 мин после приема нифеди-
пина; такая реакция затягивается, постепенно угасая, на 1—1,5 ч.
Исследование этого явления показало, что нифедипин и его ана-
логи понижают почечно-сосудистое сопротивление, вызывают
перераспределение внутрипочечного кровотока и усиливают ско-
рость клубочковой фильтрации; в результате заметно (хотя и не
очень длительно) возрастает экскреция с мочой натрия, воды и
мочевой кислоты (Алмазов В. А., Шляхто Е. В., 1993; Opie L.,
1989).
При хроническом лечении больных ЭГ теми же Са-блокато-
рами диуретическая реакция выражена не столь отчетливо. Од-
нако, как выяснилось при изучении исрадипина (ломир), который
больные принимали в течение 3,5 мес, возрастание клиренса на-
трия и воды на 40% удавалось регистрировать неоднократно в
процессе терапии. L. Krussel и соавт. (1987), проводившие это
исследование, пришли к выводу, что натрийуретическое дейст-
вие Са-блокаторов, возможно, важнее для осуществления гипо-
тензивного эффекта, чем расширение резистивных сосудов. Уси-
ление гидроуреза происходит, по-видимому, за счет жидкости
интерстициального сектора, поскольку, повторяем, ОЦП Са-
блокаторы не понижают.
Между тем у части больных (10%), систематически прини-
мающих Са-блокатор, можно видеть появление отеков на ногах.
Теперь ясно, вопреки первым предположениям, отождествляв-
шим действие этих веществ с прямыми периферическими вазо-
дилататорами (миноксидил, гидралазин и др.), что такое явление
не связано с задержкой натрия и воды в
почках, а носит лишь местный, постураль-
ный характер (расширение вен и лимфатических сосудов).
Заканчивая этот раздел, мы хотели бы подчеркнуть, что нельзя
игнорировать и имеющиеся в литературе отдельные указания о
том, что нифедипин может вызывать преходящее (обратимое)
274
усиление почечной недостаточности у больных ЭГ, уже имевших
нарушения функции почек (Houston М., 1988).
В свете современной стратегии лечения ЭГ исключительно
важен вопрос о влиянии Са-блокаторов на липидный и углевод-
ный обмен. Нифедипин и другие дигидропиридины в основном
не изменяют концентрации глюкозы и уровень инсулина в плаз-
ме — как в покое, так и во время физической нагрузки. Лишь в
отдельных случаях ряд авторов наблюдал появление гиперглике-
мии, что, конечно, нельзя игнорировать, назначая нифедипин
больным сахарным диабетом. Через 8 нед. непрерывного лече-
ния больных нифедипином отмечается понижение на */з кон-
центрации холестерина липопротеидов низкой плотности; кон-
центрация общего холестерина, холестерина липопротеидов вы-
сокой плотности и триглицеридов к этому времени не изменяет-
ся (Schulte K.-L. et al., 1986). Наконец, следует подчеркнуть, что
антагонисты кальция относятся к числу тех средств, которые
способствуют уменьшению гипертрофии левого желудочка (Fa-
gard R., 1993). Не менее важно, что Са-блокаторы оказывают
благоприятное влияние и на уровень коронарного кровотока,
кровоснабжение мозга и механизм его ауторегуляции. Имеются
экспериментальные данные о торможении Са-блокаторами, осо-
бенно исрадипином, атерогенеза (Hollenberg N., 1987; Samuel Р.,
1990; Schmid Р., 1993; Oravcova J., 1993).
Высоко оценивая достоинства нифедипина и других дигид-
ропиридинов как препаратов, обеспечивающих благоприятный
ход лечения ЭГ, мы не можем не коснуться некоторых отрица-
тельных сторон их действия. Проведенные в 80—90-х годах меж-
дународные кооперативные исследования продемонстрировали,
что эти вещества, применявшиеся в качестве периферических
вазодилататоров для уменьшения постнагрузки на сердце у боль-
ных с хронической застойной сердечной недостаточностью
(ХЗСН), ухудшали течение заболевания, вызвали нараста-
ние застойных явлений и увеличивали число боль-
ных, погибших от ХЗСН. Эти наблюдения относятся и к легким
проявлениям ХЗСН, которые могут встретиться у части больных
ЭГ (Parker М. et al., 1985; Elkayam U. et al., 1990). По тем же со-
ображениям, не следует слишком длительно применять нифеди-
пин и некоторые родственные ему соединения у больных ЭГ,
страдающих стенокардией. Ослабление миокарда связано с отри-
цательным инотропным эффектом, оказываемым Са-блокатора-
275
ми, а также с возникающей при снижении ОПС ответной реак-
цией нейрогуморальных систем: повышением активности ренина
(АП) и уровня норадреналина в плазме, неблагоприятно влияю-
щих на миокард.
Нифедипин вызывает и некоторые другие нежелательные эф-
фекты. Среди них уже упоминавшаяся выше рефлекторная сину-
совая тахикардия (у 12% больных); правда, со временем сердце-
биения меньше ощущаются больными (Moser М., 1987). Другие
реакции связаны с периферической вазодилатацией: покраснение
лица, шеи, чувство жара (приливы), головная боль (у 6—
10% больных), миалгии, сухость во рту, набухание десен. По
словам больных, эти симптомы напоминают им ощущения, ис-
пытываемые при заболевании гриппом или при аллергических
состояниях; парестезии ощущают до 6% больных; расширение вен
и отеки стоп, голеней можно видеть у 10% больных. Ряд больных
в начале лечения нифедипином жалуются на ослабление ориен-
тировки и внимательности при вождении автомобиля и т. д.
У мужчин при длительной терапии нифедипином отмечалось
увеличение грудных желез (гинекомастия), исчезавшее после от-
мены препарата.
Препараты из подкласса дигидропири-
динов — медленно действующие — приоб-
рели за последние годы большую популяр-
ность как активные противогипертензив-
ные препараты. Правда, их широкому внедрению в лечеб-
ную практику препятствует одно серьезное обстоятельство —
дороговизна. Я имею в виду прежде всего фелодипин (плендил) и
амлодипин (норваск). Оба препарата вызывают продолжительный
гипотензивный (24-часовой) эффект при приеме их один раз в
день. Фелодипин в дозе 5—10 мг в результате такого крупномас-
штабного исследования, как НОТ, рекомендован Ев-
ропейским гипертоническим обществом в
качестве базисной терапии ЭГ; он также назван
«золотым стандартом» при лечении ЭГ. Как подчеркивает
Ж. Д. Кобалава (1999), при целевом диастолическом давлении
90 мм рт. ст. такого уровня достигают 86% больных, принимаю-
щих фелодипин; при целевом давлении 85 мм рт. ст. этого
уровня достигают 73% больных; при целевом давлении
80 мм рт. ст. — его достигают 55% больных. В большинстве случа-
ев удается поддерживать достигнутый уровень АД: в течение
276
4 лет наблюдения 77—79% больных успешно продолжали прини-
мать фелодипин (плендил). Риск развития сердечно-сосудистых
осложнений существенно понизился — на 30%. Максимальное
снижение такого риска отмечалось при достигнутом уровне диа-
столического АД 82,6 мм рт. ст. и 139 мм рт. ст. для систоличе-
ского АД.
Цитированное мной европейское исследование показало
между тем, что монотерапия ЭГ не всегда обеспечивает устой-
чивый эффект. Если в начальных фазах лечения монотера-
пию получали 53—59%, то по завершении исследования только у
32% больных сохранялась монотерапия. У большинства больных
для достижения целевого давления было достаточно применения
двух препаратов. Ингибиторы АПФ использовались в качестве
второго препарата в 41% случаев, p-адреноблокатор метопро-
лол — в 20% случаев. В результате исследования НОТ получены
доказательства того, что реальное снижение числа сердечно-со-
судистых осложнений достигается при оптимальном диастоличе-
ском давлении — приблизительно 83 мм рт. ст. Дальнейшее сни-
жение диастолического давления было безопасным до уровня
70 мм рт. ст. Особенно очевидная польза выра-
женного снижения диастолического давле-
ния была отмечена у больных, у которых
АГ сочеталась с сахарным диабетом.
В начале 90-х годов прошло многоцентровое российское ис-
следование фелодипина, в которое были вовлечены более чем
300 больных, страдавших ЭГ II стадии с диастолическим давле-
нием 95—110 мм рт. ст. Если через 2 нед. лечения фелодипином
АД не снижалось до уровня ниже 90 мм рт. ст., то к схеме лече-
ния добавляли гипотиазид.
Через 4 нед. лечения было достигнуто выраженное снижение
диастолического и систолического АД, практически без учаще-
ния сердечной деятельности. Отношение остаточного эффекта к
максимальному, которое характеризует продолжительность дей-
ствия препарата, при применении фелодипина у всех больных
имело максимальное значение — выше 50%. Кроме того, фело-
дипин вызывал нормализацию показателей суточной вариабель-
ности АД, что имеет благоприятное практическое значение (Ко-
балава Ж. Д., 1999).
Другой антагонист Са пролонгированного действия — амло-
дипин (норваск) практически не уступает по своим лечебным
277
свойствам фелодипину. Некоторые из Са-блокаторов медленно-
го действия вызывают более интенсивное расширение сосудов в
специфических сосудистых зонах: нисолдипин и нитрендипин —
в коронарных артериях сердца; нимодипин — в системе мозго-
вых сосудов. Ряду Са-блокаторов присущ менее отчетливый от-
рицательный инотропный эффект, другие отличаются более вы-
раженными диуретическими свойствами.
Нитрендипин относится к числу долго действующих Са-бло-
каторов. Даже при кратковременных курсах лечения этим препа-
ратом (20 мг/сут) отмечается обратное развитие изменений рези-
стивных сосудов.
Дародипин назначают больным по 50—100—150 мг 2 раза в
день, что приводит к устойчивому снижению систолического и
диастолического АД без заметного изменения числа сердечных
сокращений. Максимальное устойчивое гипотензивное действие
дародипина отмечается на 2-й неделе лечения; ему не свойствен
отрицательный инотропный эффект.
Итак, дародипин — сильный вазодилататор (Са-блокатор),
весьма подходящий для монотерапии ЭГ, низкие дозы дароди-
пина (50 мг 2 раза в день) предпочтительнее, чем более высокие,
поскольку при почти равном гипотензивном эффекте они вызы-
вают заметно меньше побочных реакций (Chrysany S. et al.,
1988).
Амлодипин (норваск), о котором я упоминал выше, — силь-
ный вазодилататор (антагонист Са), весьма подходящий, подоб-
но фелодипину, для монотерапии ЭГ; препарат медленно всасы-
вается, ему присуща высокая биодоступность и длительный пе-
риод полувыведения (до 43 ч). В дозах 2,5—5—10 мг/сут амлоди-
пин отчетливо снижает АД у больных ЭГ II стадии. Частота
сердечных сокращений изменяется мало, не отмечается и при-
рост массы тела или изменения ЭКГ, хотя у некоторых больных
повышается уровень в плазме креатинфосфокиназы. Побочные
реакции при лечении амлодипином нечасты (Webster J. et al.,
1987).
В исследовании ACCT терапию амплодипином (норваск)
проводили у 1000 больных в возрасте от 21 года до 80 лет.
Препарат назначался в дозах 5—10 мг/сут в течение 4 не-
дель. Систолическое и диастолическое АД понижалось на
16,5/12,5 мм рт. ст. соответственно. Снижение диастолического
давления до 90 мм рт. ст. было отмечено у 86% пациентов, чаще
278
у женщин и лиц пожилого возраста по сравнению с более моло-
дыми больными. Препарат хорошо переносится, у ряда больных
появлялась пастозность или небольшие отеки голеней (исследо-
вание ACCT — Kloner R., Sowers J., 1996).
В исследовании FISH определялись эффективность и без-
опасность применения исрадипина (ломир) у больных АГ. Лече-
ние этим препаратом не сопровождалось изменением липидного
профиля сыворотки (Luomantik К., Inkowaara J., 1992).
В исследовании LOMIR-ACT-II было показано, что исради-
пин в сочетании с каптоприлом улучшает качество жизни боль-
ных с мягкой и умеренной АГ (Yodfat Y. et al., 1994).
Следует подчеркнуть, что прием внутрь Са-блокаторов этого
подкласса оказывается более эффективным после пробуждения
больного, чем после завтрака, к чему склонны больные. Ран-
ний прием этих препаратов чаще предот-
вращает утренние сердечно-сосудистые
катастрофы (инфаркт миокарда, инсульт и
т. д.), обычно возникающие на рассвете.
Дилтиазем (кардил). В кардиологических клиниках этот пре-
парат чаще используется для лечения или предотвращения сер-
дечных тахиаритмий. В своем анализе гипотензивной активности
дилтиазема я преимущественно основываюсь на результатах не-
скольких международных кооперативных исследований. В пер-
вом из них 52 больных с легким и средним по тяжести течением
ЭГ принимали препарат в общей дозе от 100 до 360 мг в день,
разделенной на два приема. На 12-й неделе лечения препарат
вызывал достоверное снижение АД в положении больных лежа и
стоя; при этом отмечалось небольшое замедление пульса. Побоч-
ные реакции встретились в 1% случаев (головная боль, голово-
кружение, отеки ног).
Во втором кооперативном исследовании сравнивали эф-
фекты дилтиазема (120—360 мг в день, средняя доза 303 мг) и
пропранолола (160—480 мг в день, средняя доза 344 мг) у боль-
ных ЭГ в возрасте 49 лет с диастолическим давлением >95 до
<114 мм рт. ст. Через 18 нед. лечения диастолическое давление
нормализовалось или понизилось на 10 мм рт. ст. у 57% боль-
ных, принимавших дилтиазем, и у 60% больных, получавших
пропранолол.
В третьем исследовании дилтиазем сравнивали с гидрохлоро-
тиазидом (гипотиазид) тоже у больных с легкой и среднетяжелой
279
ЭГ. Дилтиазем титровали до эффективной дозы в течение 8 нед.
(240—310 мг в день), затем осуществляли постоянное лечение
4 мес. Гипотиазид (монотерапия) те же больные получали в дозе
от 50 до 100 мг в день. Хотя, в общем, снижение АД оказалось
равновеликим, гипотиазид в дозе 100 мг вызывал более значи-
тельное снижение систолического давления в положении боль-
ных лежа по сравнению с дилтиаземом (—20 мм рт. ст. против
—13 мм рт. ст.).
Нормализация диастолического давления (<90 мм рт. ст.)
либо его уменьшение на 10 мм рт. ст. отмечались у 54% больных
во время лечения гипотиазидом и у 44% больных во время лече-
ния дилтиаземом. Постуральная гипотензия возникала редко;
гипергликемия появилась у 2,3% больных, принимавших гипо-
тиазид, и у 1,5% больных — при приеме Са-блокатора; гипер-
урикемия — у 3,1% больных в период лечения гипотиазидом, у
них же происходило понижение концентрации ионов К+ в плаз-
ме в среднем на 0,54 ммоль/л. Дилтиазем не вызывал подобных
изменений, а также изменений концентрации в плазме ренина,
альдостерона и инсулина; препарат не влиял на уровень общего
холестерина и триглицеридов, но понижал концентрацию холе-
стерина липопротеидов низкой плотности — по меньшей мере
после 8 нед. непрерывного лечения.
Как дилтиазем, так и гипотиазид способствовали
более значительному снижению систоли-
ческого давления у пожилых людей, чем у мо-
лодых (Moser М., 1987).
Как видно, дилтиазем следует шире использовать для лече-
ния ЭГ I—II стадии, особенно у более пожилых больных; пре-
имущество этого препарата состоит в том, что он несколько за-
медляет (в отличие от дигидропиридинов) синусовый ритм и по-
нижает потребление кислорода в миокарде (Schulte К. et al.,
1988); при этом не следует забывать о возможном избыточном
урежении синусового ритма либо об удлинении интервала P—R
на ЭКГ, наконец, об отрицательном инотропном эффекте этого
препарата.
Верапамил (изоптин, финоптин) — Са-блокатор, расширяю-
щий резистивные сосуды и оказывающий на миокард отрица-
тельное инотропное действие. Он непосредственно воздействует
на СА узел, вызывая замедление сердечного ритма. Препарат об-
легчает выделение натрия с мочой.
280
Для лечения больных ЭГ верапамил применяют в дозах от
160 до 480 мг, в среднем 320 мг в день; эффективность верапами-
ла в основном проявляется у больных с легким течением заболе-
вания; в его более развернутых стадиях верапамил обычно ком-
бинируют с другим гипотензивным средством, в особенности с
диуретиком.
Верапамил не оказывает неблагоприятного влияния на ли-
пидный профиль больного и уровень глюкозы в плазме; не-
сколько удлиняет время АВ проведения. Естественно, что при
применении верапамила не возникает рефлекторная синусовая
тахикардия. Среди побочных эффектов этого препарата следует
упомянуть запоры, появляющиеся у 25% больных.
* * *
Надо учитывать особенности взаимодействия Са-блокаторов
с другими лекарственными средствами. Так, противоязвенный
препарат циметидин (в меньшей мере ранитидин) замедляет ме-
таболические превращения дигидропиридинов в печени, поэто-
му при одновременном назначении больному этих средств дозу
Са-блокатора уменьшают на ’/з. Гипотензивный эффект нифе-
дипина усиливают трициклические антидепрессанты. Отрица-
тельное инотропное действие некоторых Са-блокаторов усилива-
ют кордарон и хинидин. Нифедипин способствует частичному по-
нижению уровня хинидина в плазме и, напротив, может повы-
шать концентрацию дигоксина и теофилина. О способности ве-
рапамила повышать концентрацию дигоксина в плазме хорошо
известно; оба препарата могут иногда понадобиться больному ЭГ
(Кушаковский М. С., 1992; Алмазов В. А., Шляхто Е. В., 1993;
Opie L., 1989).
У больных с хроническими заболеваниями печени дозу
Са-блокаторов, в частности, медленно действующего препарата
нифедипина (ретард-таблетки), целесообразнее уменьшить.
Общим недостатком дигидропиридиновых Са-блокаторов,
особенно быстрых, следует считать довольно частое возникнове-
ние через полчаса-час после их приема внутрь своеобразного
псевдогриппозного синдрома: чувство жара, покраснение лица,
озноб, тахикардия, головная боль. Все эти симптомы постепенно
ослабевают и через 2—2,5 ч исчезают бесследно.
281
ДИУРЕТИКИ (САЛУРЕТИКИ)
Данный раздел я представляю в 2 частях: первая из них ха-
рактеризует период, когда тиазидовые диуретики и их аналоги
использовались в больших дозах для лечения ЭГ; кроме того,
она дает общее представление об этих препаратах; вторая часть
посвящена современному использованию тиазидовых и тиазидо-
подобных препаратов в малых дозах, совершенно изменивших
наши представления и открывших большие перспективы в лече-
нии ЭГ и ее осложнений.
Диуретики — часть I
С тех пор, как в 1957 г. был синтезирован первый салуретик
сульфаниламидной группы — хлоротиазид, появилось большое
число (около 40) мочегонных препаратов, часть из которых ши-
роко используется для лечения до последнего времени. Кроме
того, существует мнение, которое я разделяю, что гипотензив-
ный эффект многих препаратов различных классов в большей
или меньшей степени связан с их способностью стимулировать
диурез (Na-урез).
В эквивалентных дозах многие натрийуретики сходны по сте-
пени их гипотензивной активности. Существенные различия
имеются в длительности действия этих препаратов. С этой точки
зрения их можно разделить на: I) группу препаратов продолжи-
тельного действия — от 24 до 48—72 ч (хлорталидон, или гигро-
тон, или салуретин, или оксидолин; политиазид, или ренез, ме-
толазон); 2) группу препаратов со средним по продолжительно-
сти действием — от 6 до 18—24 ч (гипотиазид, или гидрохлоро-
тиазид; циклотиазид; бринальдикс; тиениловая кислота и др.);
3) группу препаратов кратковременного действия — от 4 до 6 ч
(фуросемид, или лазикс, этакриновая кислота, или урегит; буме-
танид); 4) особую группу составляют натрийуретики, задержива-
ющие ионы калия (спиронолактон, или альдактон, или веро-
шпирон, или осирол; триамтерен, или птерофен, или дирениум;
амилорид).
В последние годы признано целесообразным выделение двух
групп диуретиков, наиболее активных при ЭГ: 1) тиазидные -
производные бензотиадизина (гидрохлортиазид, политиазид,
бендрофлюметазид и др.); 2) тиазидоподобные (thiazide-like),
к которым относят некоторые гетероциклические соединения
282
(хлорталидон, индапамид, клопамид, метозалон, мефрузид и
др.). Хотя эти препараты по своей химической структуре отлича-
ются от бензотидизинов, они имеют одинаковое место приложе-
ния в нефронах — на уровне дистальных почечных канальцев.
Усиленное выведение почками ионов натрия и воды является
основой гипотензивного эффекта всех этих веществ; допускает-
ся, что некоторым из них, в частности тиазидовым диуретикам,
свойственны и другие, пока еще не вполне выясненные механиз-
мы понижения АД. Гипотензивное действие салуретиков проте-
кает в две фазы, которые удобно рассмотреть на примере гипо-
тиазида. К концу второго дня лечения (иногда на 1-й неделе)
давление снижается вследствие уменьшения МО сердца при от-
сутствии уравновешивающего прироста ОПС (первая фаза). В
свою очередь, падение сердечного выброса — результат потери
части обменоспособного натрия, уменьшения ОВЖ и ОЦП.
В последующем, несмотря на продолжающийся прием гипо-
тиазида, величина МО постепенно возрастает, достигая исходно-
го уровня на 4—6-й неделе, хотя АД остается пониженным или
еще больше понижается теперь уже за счет уменьшения ОПС
(вторая фаза). Относительно механизмов действия салуретиков в
этой фазе пока еще нет полной ясности. В свое время R. Tarazi и
соавт. (1970), A. Leth (1970) показали, что при длительном (до
24 мес) и непрерывном лечении тиазидовыми препаратами ОЦП
и ОВЖ остаются у больных все еще более низкими, чем в исход-
ном периоде. Эти данные согласуются со старыми наблюдения-
ми J. Wilson и Е. Freis, находивших у своих больных после 6-ме-
сячного лечения тиазидами достоверное понижение ОВЖ, а че-
рез 12 мес — понижение ОЦП. J. Hansen (1968) отмечал умень-
шение ОЦП, общего объема крови и обменоспособного натрия у
больных, получавших гидрохлоротиазид в течение 3 мес. В но-
вом исследовании Sh. Shah, J. Khetri, E. freis (1978) зарегистри-
ровали у больных, принимавших по 100 мг гипотиазида в день,
отчетливое снижение ОВЖ и уменьшение массы тела на 8-й не-
деле лечения. Р. Van Brummeln и М. Schalekamp (1980) показали,
что и через 4 мес непрерывного лечения гипотиазидом по 100 мг
в день ОВЖ поддерживается на уровне ниже нормального. Сле-
довательно, не подтверждается все еще широко распространен-
ное мнение о том, что ОЦП и ОВЖ уже на 12—14-й день лече-
ния тиазидовыми диуретиками возвращаются к нормальным ве-
личинам.
283
Однако было бы неправильным утверждать, что хроническая
гиповолемия или внеклеточная гипогидратация целиком ответ-
ственны за длительный гипотензивный эффект тиазидов. Пред-
ставлялось более логичным связывать его с изменениями ионно-
го состава стенок артериол (Na+), однако в ряде работ было по-
казано, что тиазидовые диуретики не изменяют содержания на-
трия в стенках больших и малых артерий у гипертензивных
крыс, а также в эритроцитах больных ЭГ (Goldenberg К. et al.,
1988). По мнению Sh. Shah и соавт. (1978), снижение ОПС во
второй фазе действия салуретиков обусловлено механизмом «об-
ратной ауторегуляции», что означает постепенное увеличение
проходимости резистивных сосудов в ответ на длительное умень-
шение сердечного выброса; в конечном счете это приводит к
восстановлению нормального МО сердца. Надо также подчерк-
нуть, что снижение ОПС при отсутствии заметных постуральных
реакций указывает на то, что салуретики мало влияют на постка-
пиллярные емкостные сосуды (венулы).
Гомеостатические ответы на вызываемое салуретиками
уменьшение объемов жидкости и натрия проявляются в длитель-
ном повышении секреции ренина и в усиленном выделении ка-
техоламинов. Подобные реакции напоминают то, что наблюдает-
ся у больных при резко ограниченном потреблении поваренной
соли. Эти по своей природе физиологические реакции нельзя
считать «выгодными» в плане лечения гипертензии, поскольку
они тормозят натрий- и гидрурез. Особенно неблагоприятной
бывает такая реакция на салуретики у больных с феохромоцито-
мой, когда стимулируемое диурезом выделение катехоламинов
иногда приводит к возникновению гипертензивного криза.
Уже сравнительно давно клиницисты обратили внимание на
то, что больные ЭГ при одинаковой высоте АД различным обра-
зом реагируют на лечение салуретическими средствами. Нерав-
нозначными бывают гипотензивные ответы на прием салурети-
ков в разное время даже у одних и тех же больных. Ряд исследо-
вателей связывает эти факторы с особенностями «ренинового
профиля» гипертензии, в частности, допускается, что большей
чувствительностью к диуретикам обладают больные с низкой ак-
тивностью ренина в плазме, поскольку у них имеется относи-
тельный избыток натрия и воды (Vaughan Е. et al., 1978). О. Hol-
land и соавт. (1980), ранее придерживавшиеся такой точки зре-
ния, сообщили, что они не смогли обнаружить зависимости
284
между действием диуретиков и исходным уровнем ренина в
плазме. Можно высказать предположение, что конечный гипо-
тензивный эффект диуретиков определяется тем, насколько
уменьшение ОВЖ (ОЦП) относительно преобладает над реак-
тивной вазоконстрикцией, связанной с ответным выбросом АП
и катехоламинов. Правда, это не единственные механизмы, под-
держивающие остаточную гипертензию, особенно у лиц, устой-
чивых к диуретической терапии (Van Brummelen Р. et al., 1979),
поскольку тормозящее влияние сосудосуживающих факторов на
действие диуретиков только частично удается преодолеть с по-
мощью препаратов, подавляющих секрецию ренина (0-адрено-
блокаторы и другие вещества).
Многие годы диуретики рассматривались как основа проти-
вогипертензивного лечения. В 70-х—80-х годах показания к их
применению были сужены по ряду важных причин, которые
удобно рассмотреть ниже. Все же и тогда диуретики по-прежне-
му применялись у больных, которым они могли принести поль-
зу, и особенно при комбинированной терапии с другими гипо-
тензивными препаратами. Необходимо поэтому подробнее рас-
смотреть методику назначения и принципы, на которых раньше
основывался выбор различных диуретических средств.
Е. В. Ерина (1973, 1974, 1978) провела сравнительное изуче-
ние ряда важнейших валуретиков (гипотиазид, лазикс, бриналь-
дикс, гигротон) более чем у 300 больных ЭГ. Препаратами пер-
вой линии следует считать бензотиадизины (тиазиды); к этой
группе примыкают гигротон и бринальдикс.
Тиазидовые диуретики. После приема внутрь 100 мг гипотиа-
зида АД понижается в ближайшие 3—5 ч; при дозировке 25—
50 мг это чаще происходит через 12—24 ч (Виноградов А. В.,
1969; Эрина Е. В., 1973, 1974). На 5—7-й день непрерывного ле-
чения гипотиазидом можно зарегистрировать уже отчетливое
снижение давления, хотя максимальный и устойчивый гипотен-
зивный эффект наступает позже, примерно к концу 2-й недели.
Целесообразнее начинать лечение с дозы 25—50 мг гипотиазида
в день на один прием (лучше утром); если к концу первой неде-
ли АД понижается недостаточно, то добавляют еще 25—50 мг
препарата. При стабилизации АД на нормальном уровне дозу ги-
потиазида можно уменьшить до 25—37,5 мг, принимая ее еже-
дневно или через 1—3 дня многие месяцы или годы, если этому
не препятствуют нежелательные реакции. В общем, сами по себе
285
тиазидовые диуретики обеспечивают понижение АД у 40% боль-
ных, с полной его нормализацией у 20% больных. Поэтому
нередко на 3—4-й неделе лечения приходится вводить в лечеб-
ную схему второй препарат (пропранолол, ai-адреноблокатор,
Са-блокатор и т. д.).
Под воздействием тиазидовых диурети-
ков АД понижается у больных в горизон-
тальном и вертикальном положении, как
правило, без отчетливых признаков орто-
статической гипотензии. Опасность развития по-
стуральных реакций существует у лиц пожилого возраста с выра-
женным атеросклерозом аорты и мозговых сосудов. Гипотиазид
и его аналоги понижают почечный кровоток и скорость клубоч-
ковой фильтрации; препарат неэффективен у боль-
ных с величиной клубочковой фильтрации
менее 30 — 40 мл/мин и может у них вызвать
появление азотемии. При анурии гипотиа-
зид, как и остальные диуретики (кроме осмо-
тических), противопоказан.
Если суммировать данные о гемодинамических эффектах ди-
уретиков, то можно заметить, что они имитируют расстройства
гемодинамики, встречающиеся у старых людей; снижение МО
сердца и ОЦП, уменьшение почечного кровотока. Естественно,
что подобные нефизиологические реакции в системе кровообра-
щения не могут быть отнесены к числу благоприятных.
Лечение бринальдиксом начинают с малых доз, 10—20 мг в
день утром, лучше натощак. Оптимальные гипотензивные дозы
колеблются от 20 до 60 мг в день. При ежедневном приеме пре-
парата отчетливое понижение АД можно ожидать на 3—8-й день
лечения. В наблюдениях Е. В. Ериной бринальдикс вызвал нор-
мализацию давления у всех больных со ПА стадией болезни; при
стадиях ПБ и III АД в среднем понижалось на 30/16 мм рт. ст.
Однако у 20% больных этой группы эффект был явно недоста-
точным даже при увеличении ежедневной дозы бринальдикса до
40—60 мг в день.
Гигротон — одно из средств для длительного и систематиче-
ского лечения ЭГ. Применяется в дозах 25—100 мг в день или
по 100—200 мг через 1—3 дня (в один прием утром, натощак).
У большинства больных гипотензивное действие отмечается уже
через сутки, но стойкий лечебный эффект наступает позже, к
286
концу 1—2-й недели, после чего можно уменьшить дозировку до
поддерживающей. Препарат более эффективен при умеренной и
средней по тяжести гипертензии, хотя у ряда тяжелых больных
иногда тоже можно получить отличные результаты лечения.
Ренез, подобно гигротону, является салуретиком сравни-
тельно длительного действия; препарат вызывает снижение АД
в дозах 0,5—2 мг в день либо по 1 мг через день. Максимальная
доза — 8 мг в день.
Фуросемид, этакриновая кислота, буметанид относятся к
группе наиболее сильных натрий- и гидруретиков (диуретики
петли Генле), но по своей гипотензивной актив-
ности они несколько уступают тиазидам.
Понижение АД после однократного приема внутрь фуросемида
или этакриновой кислоты начинается быстро, через 30 мин—1 ч;
эффект сохраняется в течение 3—5—8 ч. Затем АД вновь возрас-
тает, иногда до более высокого уровня за счет ответных реакций
гомеостатических систем, регулирующих АД («феномен рикоше-
та»). Поэтому при длительном лечении ЭГ дневную дозу фуросе-
мида (40—160 мг), этакриновой кислоты (50—200 мг) лучше де-
лить на 2—3 приема; буметанид принимают по 1 мг один раз в
день. Но даже и при такой лечебной тактике после 4—5 дней не-
прерывной терапии иногда развивается адаптация к этим препа-
ратам. К концу 1—2-й недели у ряда больных можно обнаружить
увеличение содержания обменоспособного натрия и ОЦП; гипо-
тензивный эффект практически исчезает. Нивелирование дейст-
вия диуретиков петли Генле, вероятно, зависит от вторичной ак-
тивации системы ренин—АП—альдостерон и рефлекторной сти-
муляции выделения АДГ.
Очевидно, что фуросемид, этакриновая кис-
лота и буметанид меньше, чем гипотиазид,
показаны для длительного лечения ЭГ. Однако
«диуретики резерва» имеют свою область применения, в которой
их преимущества очевидны. Внутривенное вливание фуросемида
(лазикса) может способствовать быстрому падению АД при ги-
пертензивных кризах. Эти препараты весьма эффективны при
острой левожелудочковой недостаточности, иногда развиваю-
щейся у больных ЭГ, при отечном синдроме, ожирении (корот-
кие курсы по 3—5 дней). Наконец, фуросемид занима-
ет особое место при лечении тех форм ЭГ,
при которых имеется почечная недостаточ-
287
н о с т ь. Переход от гипотиазида и его аналогов к фуросемиду
(120 мг 2 раза в день) или к другим «петлевым» диуретикам осу-
ществляют при возрастании уровня креатинина в плазме до
177 мкмоль/л (1,3—2,0 мг/декалитр). Напомним, что в отличие
от гипотиазида фуросемид усиливает почечный кровоток (на
30% при внутривенном введении) и в отдельных случаях повы-
шает скорость клубочковой фильтрации.
Тиениловая кислота (дифлурекс, тикринофен, селекрин) — ди-
уретик, по своей химической структуре напоминающий эта-
криновую кислоту, по салуретическому и гипотензивному дейст-
вию — гипотиазид. Основное отличие тиениловой кислоты от
остальных диуретиков состоит в ее способности увеличивать вы-
деление мочевой кислоты. Начальная доза — 250 мг однократно
утром. Эффект проявляется вскоре после приема препарата и
длится в течение 12 ч. У лиц, принимающих продолжительное
время тиениловую кислоту, отмечается заметное понижение
концентрации мочевой кислоты в плазме, тогда как все другие
диуретики способствуют ее задержке. Отчетливая урикозурия на-
блюдается уже в течение нескольких часов после первой дозы
тиениловой кислоты. Чтобы избежать острой избыточной кон-
центрации мочевой кислоты в моче (камни, острая закупорка
канальцев уратами с почечной недостаточностью!), за три дня до
назначения тиениловой кислоты отменяют другие диуретики, а
также рекомендуют больному потреблять до 1,5 л жидкости
(в течение 3 дней до приема тиениловой кислоты и 3 дней после
начала лечения). Не следует сочетать тиениловую кислоту с три-
амтереном, поскольку это иногда вызывает повышение концент-
рации креатинина в плазме. Если больной получает антикоагу-
лянты, их дозу уменьшают на 1/4 или наполовину. Противопока-
зания к назначению тиениловой кислоты: анурия, тяжелые забо-
левания почек, мочекаменная болезнь (камни из уратов);
тиениловая кислота задерживает мочевую экскрецию салицила-
тов и пенициллина.
Спиронолактон (альдактон, верошпирон, осирол) предложен и
качестве лекарственного средства в 1969 г.; по механизму дейст-
вия является конкурентным антагонистом альдостерона на уров-
не дистальных почечных канальцев. Допускается также возмож-
ность прямого тормозящего влияния спиронолактона на секре-
цию альдостерона надпочечниками. Н. Bernard и соавт. (1978)
утверждали, что существует зависимость между исходной ско
288
ростью секреции альдостерона и вызываемым спиронолактоном
снижением АД.
В клинической практике вообще, и в терапии ЭГ в частно-
сти, спиронолактон должен применяться в тех случаях, когда для
этого имеются специальные показания, а альтернативные гипо-
тензивные средства неэффективны. Такие ограничения связаны
с появившимися в последние годы сообщениями о тумороген-
ном действии спиронолактона у крыс, которым длительно вво-
дили препарат, правда, в дозах, в 25—75—250 раз превышавших
обычные дневные дозы человека.
Натрий-, гидруретический эффекты спиронолактона выраже-
ны заметно слабее, чем у тиазидовых диуретиков. Усиление ди-
уреза начинается через 2 ч после приема внутрь, диурез достига-
ет максимума к 8 ч. Однако более устойчивое нарастание суточ-
ного диуреза обычно приходится на 3—4-й день лечения; гипо-
тензивный эффект (составляет примерно 12%) проявляется еще
позже и постепенно возрастает к 5—8 нед. лечения. Дневные
дозы спиронолактона варьируют от 50 до 400 мг, разделенных на
2—4 приема (препарат лучше принимать до еды, хотя это не все-
гда удается). Оптимальной представляется доза около 100 мг в
день (Jeunemaitre X. et al., 1987).
По мнению некоторых исследователей, спиронолактон более
эффективен у больных с гипорениновой формой ЭГ, и здесь он
имеет преимущества по сравнению с гипотиазидом. Однако су-
ществует другая точка зрения. В наблюдениях Н. Bernard и соавт.
(1978) АД понижалось в равной мере при назначении 400 мг
спиронолактона как больным с гипо-, так и с норморениновой
ЭГ. По данным R. Spark и соавт. (1974), различие между дейст-
вием спиронолактона и гипотиазида можно ожидать не раньше
чем через 3 нед. непрерывного лечения (эквипотенциальные
дозы гипотиазида и спиронолактона соответственно 100 и 200 мг
в день).
Несомненным показанием для назначения спиронолактона
наряду с другими препаратами (p-адреноблокаторы) является
злокачественная гипертензия с признаками альдостеронизма.
Спиронолактон не следует применять при острой почечной недо-
статочности, анурии, гиперкалиемии, а также у больных с хро-
ническим нарушением функции почек.
Триамтерен (птерофен, дирениум) вошел в практику в 1961 г.,
относится к группе калий-задерживающих натрийуретиков,
10 Зак. 320?
289
хотя и не является антагонистом альдостерона (Комаров Ф. И.,
Касалица Ч. Я.). Препарат эффективен у лиц с низкой концент-
рацией альдостерона в крови и обладает добавочным эффектом
по отношению к спиронолактону. Натрийуретические и гипо-
тензивные свойства триамтерена выражены слабее, чем у спиро-
нолактона, поэтому триамтерен обычно применяют в комбина-
ции с более сильными натрийуретиками (Виноградов А. В., 1969,
1974). Триамтерен хорошо переносится больными; дневные дозы
от 50 до 300 мг в день делят на два приема; диурез начинается ко
2-му часу, его максимум приходится на 8 ч. Потери калия под
влиянием триамтерена уменьшаются, а уровень калия в плазме воз-
растает.
Триамтерен противопоказан больным, имеющим нарушение
функции почек, а также при анурии. Его не следует длительно
сочетать с препаратами калия. После интенсивной и продолжи-
тельной терапии триамтерен отменяют постепенно из-за угрозы
«рикошетного» калийуреза.
Амилорид — калий-задерживающий натрийуретик, который,
подобно триамтерену, применяется в сочетании с более мощны-
ми салуретиками (с гипотиазидом — модуретик и др.). Дозиров-
ки — от 5 до 20 мг в день; диуретический эффект амилорида от-
мечается в ближайшие часы после его приема внутрь.
Побочные, нежелательные эффекты диуретиков. Я уже упо-
минал, что отношение к диуретикам как к гипотензивным сред-
ствам существенно изменилось в 70-х—80-х годах, хотя по-
прежнему никто не сомневался в том, что
это — сильные противогипертензивные
препараты.
Причины снижения интереса к диуретикам или в ряде случа-
ев даже отказа от них были связаны с вызываемыми ими побоч-
ными эффектами и нежелательными влияниями на метаболизм
липидов и углеводов.
1) Выше мы отметили нефизиологические гемодинамические
эффекты диуретиков: они воздействуют не на главный патогене-
тический механизм ЭГ — повышенное ОПС, а вызывают, в об-
щем, невыгодные изменения циркуляции: уменьшение ОЦП и
МО сердца.
2) Диуретики стимулируют, как упоминалось, появление от-
рицательных метаболических сдвигов. Основное значение при-
дается их влияниям на липидный спектр крови: отчетливому повы-
290
шению плазменной концентрации общего холестерина, холесте-
рина липопротеидов низкой плотности и триглицеридов; уро-
вень холестерина антиатерогенных липопротеидов высокой
плотности диуретики понижают. Только спиронолактон слегка
изменяет (увеличивает) уровень триглицеридов, не влияя на уро-
вень других липидов (Jeunemaitre X. et al., 1987).
3) Помимо липидов диуретики повышают концентрацию
в плазме глюкозы и обладают диабетогонным действием. У ряда
больных через 2—14 нед. ежедневного приема гигротона, гипо-
тиазида или его аналогов понижается толерантность к глюкозе
(сахарная кривая), у некоторых других больных демаскируется
скрытый сахарный диабет. Особенно активно повышает уровень
глюкозы и инсулина в плазме крови гигротон (хлорталидон).
При появлении глюкозурии диуретики следует отменить. У всех
больных, особенно у пожилых людей, принимающих диуретики,
необходимо периодически проверять уровень сахара в крови и
его содержание в моче. Спиронолактон не вызывает нарушений
углеводного обмена и может использоваться прерывисто для ле-
чения ЭГ, сочетающейся с сахарным диабетом.
4) Задержка мочевой кислоты и повышение ее концентрации
в плазме — реакция, свойственная всем диуретикам, за исключе-
нием тиениловой кислоты. Длительная ежедневная терапия ги-
потиазидом вызывает гиперурикемию почти у 60% больных.
Правда, она не имеет тенденции к прогрессированию. В одной
серии наблюдений, после 6 мес лечения салуретиками гиперури-
кемия выявилась у 48% больных, после 12 мес — у 17% больных
и еще позже — только у 9% больных. Уровень мочевой кислоты
не зависит от дозы салуретика. Подагра развивается лишь в
5—10% случаев; у половины из этих больных еще до лечения ди-
уретиками отмечалась гиперурикемия. Чаще подагрой заболева-
ют женщины. Накопление мочевой кислоты может вести к отло-
жению уратов в почечной паренхиме с развитием интерстици-
ального нефрита («подагрическая почка») либо к мочекаменной
болезни. К антиподагрической терапии следует прибегать в тех
случаях, когда концентрация мочевой кислоты в плазме на-
чинает превышать 6,8 мг/100 мл у женщин и 7,5 мг/100 мл
у мужчин.
Очевидно, что все эти эффекты усиливают у
больных ЭГ вероятность развития ИБС или
ее осложнений, что и было отмечено в международных
291
кооперативных исследованиях, результаты которых изменили
«статус» диуретиков среди противогипертензивных препаратов.
5) Ежедневный прием 50—100 мг гипотиазида или через день
100 мг гигротона, а также других салуретиков сопровождается
потерей калия. В одном из исследований у 34 больных с легким
и средним течением ЭГ за 4 нед непрерывного приема 75 мг ги-
потиазида в день содержание обменоспособного калия (Ке) сни-
зилось: в группе мужчин с 1628 до 1412 мэкв/м2, в группе жен-
щин с 1387 до 1128 мэкв/м2. В другой серии наблюдений у
15 больных, получавших в течение 2 месяцев по 100 мг гипотиа-
зида в день, уровень калия в плазме в среднем понизился от ис-
ходного 4,46 до 3,84 ммоль/л. Установлено также, что даже при
очень продолжительных курсах лечения (4 года) потеря калия
редко превышает 8—14% и в последующем нарастает медленно.
Больные, потерявшие до 10% общего калия, еще не имеют кли-
нических признаков калиевого дефицита.
У лиц с задержкой натрия и воды прием 100 мг гипотиазида
сопровождается особенно обильным натрийурезом, диурезом и
калийурезом, иногда с появлением адинамии, мышечной слабо-
сти, головокружения несистемного характера, с парестезиями,
потерей аппетита, экстрасистолической аритмией, болями в об-
ласти сердца. Чаще это наблюдается у женщин. Признаки гипо-
калиемии, гипокалигистии и внеклеточного алкалоза обычно ис-
чезают через 1—2 дня, особенно если больной увеличивает по-
требление солей калия. Гипокалиемия порядка 3,5 ммоль/л и
ниже особенно способствует усилению эктопической активности
в миокарде, т. е. возникновению аритмий (фибрилляции пред-
сердий и др.).
Небольшая гипокалиемия переносится амбулаторными боль-
ными легко и требует значительно меньшей коррекции, чем по-
лагают многие врачи. Если же дефицит обменоспособного калия
достигает 20—40%, могут появиться функциональные нарушения
не только со стороны сердца, но и почек. Поэтому при длитель-
ной диуретической терапии следует рекомендовать больным уве-
личить потребление пищевого калия с тем, чтобы дополнительно
вводить около 40—60 ммоль, или 1,6—2,3 г калия в день [«калие-
вые диеты (Дорохова Е. И., Никитин В. П.): курага, изюм, суше-
ные фрукты, картофель; один банан средней величины содержит
14 моль, или 0,55 г калия]. Другой путь профилактики гипокали-
емии — прерывистое применение диуретиков. Этот способ все-
292
гда полезно испробовать (речь, конечно, идет о больных ЭГ, ко-
торым диуретики показаны).
К назначению препаратов калия прибегают, если: а) появля-
ются симптомы гипокалиемии (мышечная слабость, вялость, по-
теря аппетита, экстрасистолия и т. д.); б) уровень калия в плазме
снижается до 3,5 ммоль/л; в) если наряду с диуретиками боль-
ные получают сердечные гликозиды или стероидные гормоны;
г) при сахарном диабете, поскольку гипокалиемия ослабляет то-
лерантность к глюкозе; д) при поносах, рвоте, анорексии, уси-
ленной потливости, лихорадке; е) при хронической застойной
недостаточности кровообращения.
Доза калия 60 ммоль в день (2,3 г) эффективна для профи-
лактики и лечения гипокалиемии у 80% больных ЭГ, системати-
чески принимающих гипотиазид или его аналоги. В 20% случаев
не происходит полного восстановления плазменного уровня ка-
лия даже при его дозировке 100 ммоль в день, или 3,9 г. Лучшим
препаратом для коррекции калиевого баланса является калия
хлорид, поскольку он одновременно способствует ликвидации
гипохлоремического алкалоза.
Калия хлорид принимают внутрь в растворе либо в форме
особых таблеток, медленно выделяющих калий. Такая таблетка,
содержащая 0,312 г калия, обеспечивает его постепенное высво-
бождение в желудочно-кишечном тракте, что сводит к минимуму
риск повреждения слизистой оболочки, поскольку не создается
локальная высокая концентрация калия. Реже, чем обычно, воз-
никают и другие токсические реакции: изжога, тошнота, понос.
Вместо калия хлорида могут быть назначены: панангин по
1—2 таблетки 2—4 раза в день, оротат калия, вспенивающиеся
таблетки калия (от 1 до 4 в день). В состав «пенистого калия»
входят гидрокарбонат и цитрат калия; в одной таблетке содер-
жится 1,2 г калия.
Весьма эффективны сочетания салурети-
ков (гипотиазид) с к ал ийзадерж и в а ю щ ими
препаратами. Больные переносят их лучше, чем большие
дозы калия хлорида. Многие клиницисты используют такое со-
четание препаратов не только в начальном периоде лечения, но
и для длительной терапии ЭГ. В частности, потерю ионов калия
предотвращает добавление к гипотиазиду (50—100 мг) триамте-
рена (50—100 мг). При тяжелых дефицитах калия особенно пока-
зан амилорид: 5 мг этого препарата восполняют больше калия,
293
чем прием внутрь 3 г калия хлорида. Надо учитывать, что фуро-
семид может иногда вызвать гипокальциемию.
6) Этими реакциями не исчерпываются нежелательные эф-
фекты диуретиков. Понижая внутрисосудистый объем крови,
они активируют систему ренин—АП и симпатическую нервную
систему, что ведет к вторичной вазоконстрикции и к учащению
сокращения сердца. Тем самым возрастают нагрузка на миокард
и его потребность в кислороде. Диуретики в больших дозах могут
усиливать (!) гипертрофию левого желудочка, повышая тем са-
мым риск внезапной смерти больных ЭГ.
7) Что касается побочных эффектов спиронолактона (верош-
пирона), то главные из них следующие: гиперкалиемия (за
23 мес лечения плазменная концентрация К+ в одном из иссле-
дований возросла на 0,6 ммоль/л); повышение уровня креатини-
на в плазме (на 8,3 мкмоль/л в том же исследовании) и мочевой
кислоты (на 10,5 мкмоль/л); гинекомастия (в 13% случаев); по-
следняя реакция зависит от дозировки спиронолактона, и она
обратима; импотенция у мужчин (при больших дозах препарата);
нарушения менструального цикла у женщин, гирсутизм, а также
печеночный холестаз с диспепсией, тошнотой, рвотой, поносом;
иногда сонливость, головная боль, атаксия. Спиронолак-
тон противопоказан больным, имеющим
пептическую язву желудка и 12-перстной
кишки, поскольку он может вызвать кровотечение.
При систематическом приеме триамтерена или амилорида
возможно развитие гиперкалиемии, особенно у лиц с почечными
дисфункциями; бывают также поносы, тошнота, головные боли,
гиперурикемия.
Итак, диуретики эффективны при ЭГ; без них, по-видимому,
не обойтись, но отрицательные стороны их действия заставляли
врача подходить строго индивидуально к назначению больным
этих препаратов.
Диуретики — часть II
В 90-е годы отношение к тиазидовым диуретикам как средст-
вам лечения АГ коренным образом изменилось.
Это было связано с рядом обстоятельств. Во-первых, выясни-
лось, что хорошего противогипотензивного
эффекта можно достигнуть с помощью ма-
лых доз гипотиазида (от 6,25 мг до 25,0 мг). Так, по
294
сводным данным 31 исследования, высокие дозы тиазидных ди-
уретиков понижают уровень АД в среднем на 18/11 мм рт. ст.,
а низкие дозы (25 мг в день) — на 13/9 мм рт. ст. (Avies R., 1996).
Во-вторых, стало очевидным, что низкие дозы тиазидных диуре-
тиков лучше переносятся больными ине вызывают ме-
таболических расстройств. В длительном рандоми-
зированном исследовании, обозначенном аббревиатурой VACS,
охватившем свыше 1200 мужчин, гипотиазид (12,5—50 мг/сут)
вызывал побочные эффекты всего в 3% случаев, т. е. заметно
реже, чем каптоприл (7%), атенолол (5%), дилтиазем-ретард
(4%), празозин (12%), клонидин (14%). В-третьих, установлено,
что диуретики в низких дозах способны предот-
вращать развитие мозгового инсульта, инфарк-
та миокарда, сердечной недостаточности.
В. Psaty и соавт. (1997) опубликовали результаты мета-анали-
за 18 рандомизированных исследований. Они показали, что дли-
тельное лечение диуретиками достоверно понижает риск разви-
тия мозгового инсульта (в среднем на 34—51%), застойной сер-
дечной недостаточности (на 42—83%), а также смертности от
сердечно-сосудистых причин (на 22—24%). Только диуретики,
назначаемые больным АГ в низких дозах, способны предотвра-
щать развитие ИБС, тогда как лечение р-адреноблокаторами
не снижает повышенного риска развития и прогрессирования
ИБС. Как подчеркивают J. Chalmers и соавт. (1997), риск по-
вторных нарушений мозгового кровообращения у больных ЭГ
достоверно понижается при лечении их низкими дозами тиазид-
ных диуретиков (на 31—66%), но не изменяется при применении
селективного гидрофильного p-адреноблокатора — атенолола.
Мета-анализ результатов 10 рандомизированных исследова-
ний, в которых диуретики применялись для лечения ЭГ у боль-
ных 60 лет и старше, подтвердил, что эти препараты предотвра-
щали развитие ИБС (Messerli F. et al., 1998).
Укажу также, что тиазидовые диуретики не уступают ингиби-
торам АПФ в способности вызывать регресс гипертрофии левого
желудочка (исследование VACS). Не менее важно то обстоятель-
ство, что эти препараты понижают экскрецию ионов Са++ с мо-
чой, что делает полезным их назначение больным, страдающим ос-
теопорозом.
Наконец, подчеркну, что стоимость лечения неосложненной
ЭГ диуретиками (25 мг гипотиазида в сутки) составляет всего
295
1—3 доллара, что значительно дешевле лечения бета-адренобло-
каторами (5—24 доллара), антагонистами кальция (18—56 долла-
ров) и ингибиторами АПФ (19—46 долларов) — данные К. Pearce
и соавт. (1998), цитированные в обзоре Д. В. Преображенского,
Б. А. Сидоренко, И. М. Шатуновой, А. В. Маранич (1999). Эти
сведения чрезвычайно актуальны и для России, в которой в на-
стоящее время люди средне- и низкооплачиваемые, а также ста-
рики и пожилые люди составляют значительную часть населе-
ния.
Все эти положительные свойства тиазид-
ных и тиазидоподобных диуретиков дают
основание считать их препаратами перво-
го ряда (в малых дозах) для лечения боль-
ных ЭГ, особенно пожилых больных. Это, по-
жалуй, единственной класс противогипер-
тензивных препаратов, о которых досто-
верно установлено, что они обладают
способностью улучшать прогноз больных ЭГ.
Так эволюционировали взгляды об эффективности этих пре-
паратов за более чем 40-летнюю историю их применения.
В этой связи заслуживает специального описания оригиналь-
ный диуретик — производное хлорбензамина индапамид (ари-
фон), выпускаемый фармацевтической группой Сервье в дозах
1,25 мг—2,5 мг/сут, который больные принимают внутрь; препа-
рат не усиливает, практически, диурез, но АД понижает за счет
вазодилататорных свойств, присущих индапамиду. ОПС при
приеме препарата в дозе 2,5 мг/сут понижается на 10—18%. При
повышении дозировки до 5 мг/сут отделение мочи возрастает на
20%. Механизмы, обеспечивающие вазодилатацию, пока точно
не выяснены. Допускают, что могут играть роль: 1) блокада Са-
каналов; 2) стимуляция синтеза простагландинов (простациклин
и простагландин Е); 3) агонизм в отношении калиевых каналов
(Izuma Y. et al., 1986).
В дозе 2,5 мг/сут индапамид понижает систолическое АД на
9—35 мм, диастолическое АД — на 3—43 мм рт. ст. (Преобра-
женский Д. В. и др., 1999). По сообщению S. Massay (1989), из-
ложившего результаты многоцентрового исследования больных
ЭГ различной тяжести, показано, что индапамид снижал АД на
23/14 мм рт. ст. — у больных с мягкой ЭГ; на 39/2,5 мм рт. ст. —
у больных с умеренной ЭГ и на 39/43 мм рт. ст. — у больных с
296
тяжелой формой ЭГ. О. Leonetti и соавт. (1990) указывают, что
высокая эффективность индапамида сохраняется более чем у
60% больных ЭГ.
Для объективной оценки длительности и
равномерности гипотензивного действия
препаратов используют, как я указал
выше, отношение остаточного эффекта
(ОЭ) к максимальному эффекту (МЭ). Приня-
то считать, что отношение ОЭ/МЭ не должно быть ниже 0,50
(50%), что отражает эффективность препарата. I. Осоп (1995),
I. Mallion (1998), Р. Meridith (1988) установили, что этот показа-
тель для арифона равен 60—96% — для диастолического АД и
72—104% — для систолического АД.
Индапамид ретард в дозе 1,5 мг обладает высокой эффектив-
ностью в снижении АД, не оказывая при этом существенного
влияния на метаболические параметры.
Индапамид вызывает обратное развитие гипертрофии левого
желудочка. В исследовании LIVE показано, что после одного-
дичной терапии индапамидом ИМЛЖ (индекс массы левого же-
лудочка) достоверно понижается, тогда как в результате лечения
эналаприлом этого достичь не удается.
Индапамид хорошо переносится больными; в дозе 2,5 мг/сут
он оказывает лишь незначительное влияние на уровень глюкозы
плазмы; гипокалиемия развивается только у 1—15% больных, ги-
перурикемия ведет к отмене индапамида лишь в 1,3% случаев.
A. Bataillard и соавт. (1999) отметили отсутствие нарастания гли-
кемии даже у больных с сахарным диабетом II типа. Отмечены и
ренопротекторные свойства индапамида, а также его способ-
ность обеспечивать профилактику повторения мозговых инсуль-
тов и других нарушений мозгового кровообращения (Litop L.
et al., 1998). О. Е. Булкиной и соавт. (1990) удалось показать, что
индапамид понижает АД как в дневное, так и в ночное время.
Наблюдения нашей клиники подтверждают эффективность и
безопасность лечения больных ЭГ индапамидом (арифон) —
А. А. Балябин (1999).
Ингибиторы ангиотензинпревращающего фермента (АПФ)
(АСЕ-ингибиторы)
Создание препаратов этого класса явилось естественной ре-
акцией на доказательство того, что АП является мощным сосудо-
297
суживающим веществом, участвующим в патогенезе ЭГ и ряда
других форм АГ. Таким образом, современный врач помимо
возможности блокировать воздействие на резистивные сосуды
норадреналина способен ингибировать и прессорные эффекты
другого, гуморального фактора — АН. Показательно, что инги-
биторы АПФ могут понижать АД и у больных с двусторонним
удалением почек, что указывает на взаимодействие этих препа-
ратов и с местными, тканевыми, системами ренин—АП, дли-
тельно регулирующими проходимость резистивных сосудов, а
также с неангиотензиновыми механизмами. В общем, фармако-
логическая активность ингибиторов АПФ связана с их влиянием
на три системы: ренин—АП, каликреина-кининов, каскада ара-
хидоновой кислоты (эйкозаноидная система).
Первым препаратом из теперь уже большой серии ингибито-
ров АПФ был каптоприл (капотен), созданный в 1977 г. М. Оп-
detti и D. Cuschman. Его активность проверялась на крысах со
спонтанной АГ. Каптоприл — родоначальник подкласса ингиби-
торов АПФ, которые содержат в своей молекуле сульфгидриль-
ную группу в качестве лиганда Zn++ (ривоприл, рентиаприл и
др.). В 1980 г. были синтезированы эналаприл (Patchett A. et al.)
и близкие к нему препараты (лизиноприл, рамиприл и др.). В их
структуре лигандом Zn++ служит не SH-группа, а карбоксильная
группа. Наконец, третий подкласс ингибиторов АПФ составляют
некоторые фосфорсодержащие вещества с лигандом для Zn++
фосфинилом (фозиноприл, или моноприл и др.).
Для клинических целей особенно важно разделение этих
препаратов в зависимости от длительности их действия. С этой
точки зрения различают: а) ингибиторы АПФ короткого дейст-
вия (<24 ч), к которым относят каптоприл (период полувыведе-
ния — 2—3 ч); б) длительного действия (>24 ч); их представите-
лями является эналаприл, период полувыведения — 11,1 ч и ли-
зиноприл (период полувыведения — 12,6 ч).
Оценку эффективности рамиприла (тритапце) в условиях по-
вседневной жизни провели в исследовании CARE более чем у
11 тысяч больных в возрасте 18—75 лет, страдавших мягкой и
умеренной АГ. Дозы рамиприла колебались от 2,5 до 10 мг/сут;
больные принимали их в течение 8 нед.
Соответственно, больные принимают каптоприл 2 (3) раза в
день, эналаприл — 1 (2) раз в день и лизиноприл — 1 раз в день.
Следует учитывать, что эналаприл является провеществом, кото-
298
рое гидролизуется в плазме в активный эналаприлат, собственно
и обладающий способностью ингибировать АПФ; таким же об-
разом рамиприл превращается в рамиприлат.
Рамиприл достоверно снижал АД как у больных с систоло-
диастолической, так и при изолированной систолической АГ.
Максимальная частота случаев нормализации АД (87%) выяви-
лась у пожилых больных с систолодиастолической АГ. Наиболее
частыми побочными эффектами были кашель, головная боль,
головокружение.
В другом исследовании HIGAR изучали влияние рамиприла
на степень гипертрофии левого желудочка и уровень АД у боль-
ных с АГ. 115 больных с индексом массы левого желудочка у
мужчин более 120 г/м2 и более 98 г/м2 у женщин принимали ра-
миприл в дозах 1,25—5 мг/сут. По окончании 6-месячного лече-
ния масса миокарда уменьшилась на 13—20 г, не было корреля-
ции между уменьшением массы миокарда и снижением уровня
АД (цитировано по А. И. Мартынову и соавт., 2000).
Каптоприл быстро всасывается, его присутствие в плазме об-
наруживают уже через 15 мин после приема внутрь; пик концен-
трации препарата приходится на первый час. Биодоступность
каптоприла достаточно высока, прием пищи ее понижает. Пик
концентрации эналаприла определяется примерно к 4 ч, а лизи-
ноприла — к 6 ч после приема внутрь. Биодоступность энала-
прила тоже высока, она не зависит от приема пищи; биодоступ-
ность лизиноприла низкая (около 25%). Имеется указание, что
длительное лечение ЭГ эналаприлом улучшает метаболические по-
казатели у инсулинорезистентных больных с ЭГ(Зимин Ю. В., Ро-
доманченко Т. В., 1998).
На примере каптоприла покажем, какие гемодинамические
сдвиги вызывают ингибиторы АПФ. При первом приеме этого
препарата больными ЭГ в I—II стадии в дозе 50 мг максималь-
ный гипотензивный эффект достигается на 90-й минуте: среднее
гемодинамическое давление, например, понижается от исходно-
го уровня 141 мм до 114 мм рт. ст. (приблиз. -20%). Частота сер-
дечных сокращений и МО сердца изменяются мало, а ОПС от-
четливо понижается, в нашем примере — на 17%. Одновременно
уменьшается правопредсердное, легочно-артериальное давление
и легочно-капиллярное давление заклинивания. Заметно снижа-
ются концентрации в плазме АП и альдостерона; активность ре-
нина плазмы и уровень AI, напротив, возрастают (по механизму
299
обратной связи). Гипотензивное действие каптоприла после од-
нократного приема сохраняется несколько часов (до 6 ч).
В отличие от каптоприла гипотензивный эффект эналаприла
(начальная доза 10 мг) и лизиноприла (начальная доза 5—10 мг)
развертывается постепенно и не столь явно, но он затягивается
на 24 ч, т. е. в 4 раза дольше, чем каптоприла.
В одном из исследований при длительном применении кап-
топрила в дозе 150 мг 3 раза в день среднее гемодинамическое
давление устойчиво понижалось у реагирующих больных ЭГ уже
на первой неделе. К концу 4-й недели лечения среднее гемоди-
намическое давление оказалось ниже исходной величины при-
мерно на 20%; диастолическое давление понижалось значительнее,
чем систолическое, что вообще характерно для ингибиторов АПФ.
Число сердечных сокращений уменьшилось на 9%; МО серд-
ца — на 12%; ОПС — на 14% (достоверно); неизменным оста-
вался ОВЖ; в 7 раз возросла активность ренина плазмы (Wen-
ting G. et al., 1982).
После 9-недельного лечения ЭГ эналаприлом в дозе 20—
40 мг в день систолическое давление снижалось от исходных
180 мм рт. ст. до 150—160 мм рт. ст., диастолическое давление —
от 120 мм рт. ст. до 80—90 мм рт. ст. (Jones R. et al., 1985)
(рис. 17). По поводу дозировок эналаприла (ренитек, вазотек) у
части врачей, по-видимому, существует неясность, поэтому ука-
жу, что для больных с легким течением ЭГ начальная суточная
доза препарата должна быть 10 мг; при умеренном и более тяже-
лом течении заболевания начальную дозу повышают до 20 мг в
сутки; поддерживающие дозы эналаприла определяют в зависи-
мости от реакции больного от 10 до 20 мг (максимум) в сутки
(рис. 17).
Оценке эффективности периндоприла (престариум) посвяще-
но исследование PUTS. Около 500 больных 30—70 лет с диасто-
лическим давлением 90—104 мм рт. ст. принимали периндоприл
в дозе 4 мг/сут в течение 6 нед. Препарат понижал диастоличе-
ское давление по сравнению с плацебо. У больных с патологией
почек препарат вызвал уменьшение альбуминурии, у пациентов
с ИБС происходило достоверное уменьшение глубины депрессии
сегмента ST на ЭКГ, а также частоты приступов стенокардии.
Авторы установили, что престариум не оказывал заметного влия-
ния на липидный спектр и уровень глюкозы в плазме крови
(Stumpe К., Oterlank А., 1993).
300
12 14 16 18 20 22 24 2 4 6 8 10 12
Время суток (часы)
Систолическое и диастолическое артериальное давление у 15 больных
больные, не прошедшие лечение —р<0,001 ........р<0,05
-О- больные, прошедшие лечение—р<0,001 РЕНИТЕК 20—40 мг/сут
Рис. 17. Изменение систолического и диастолического давления у больных,
принявших от 20 до 40 мг эналаприла (ренитек) в сутки
(по R. Jones и соавт., 1985)
В общем, монотерапия ингибиторами АПФ дает хорошие ре-
зультаты у 40—50% больных, возможно, даже у 64%> больных
(Ольбинская Л. И. и др., 1993) с легкой и среднетяжелой формами
заболевания (диастолическое давление от 95 до 114 мм рт. ст.).
Этот показатель хуже, чем при лечении таких же больных
сц-адреноблокаторами, Са-блокаторами или диуретиками. Надо
иметь в виду, что меньшей чувствительностью к
ингибиторам АПФ отличаются больные с
гипорениновой формой ЭГ и пожилые люди.
Таким лицам, а также больным в III стадии заболевания с тяже-
ло протекающей ЭГ, иногда приобретающей злокачественный
характер, следует рекомендовать сочетанное лечение ингибито-
рами АПФ с диуретиком, Са-блокатором или 0-адреноблокато-
ром. Комбинация каптоприла и диуретика, назначаемого с опре-
деленной периодичностью, нередко бывает чрезвычайно эффек-
тивной, т. е. АД снижается до нормотензивного уровня и дости-
гается полный контроль за АД у очень тяжелых больных. При
комбинации АПФ-ингибиторов с диуретиком или антагонистом
301
Са++ нормализация АД достигается более чем у 80% больных в
далеко зашедшей стадии ЭГ.
Преимущество ингибиторов АПФ состоит
не столько в их особой гипотензивной ак-
тивности, а в уникальных особенностях: по-
лезном воздействии на миокард, стенки резистивных сосудов
мозга и почек и т. д. К характеристике этих эффектов мы и пере-
ходим.
Ингибиторы АПФ не вызывают ортостатических реакций,
хотя в литературе имеется указание на то, что при длительном
лечении больных ЭГ у них понижается чувствительность к сим-
патическим стимулам и расширяются вены. При назначении
этих препаратов не отмечено развитие устойчивости или вы-
скальзывание из-под лекарственного контроля. Не наблюдается
и рикошетных подъемов АД, как это бывает, например, при вне-
запном прекращении приема клофелина.
Хотя больные ЭГ с высокой активностью ренина в плазме
более резко понижают АД при длительном лечении ингибитора-
ми АПФ, корреляция между этими факторами не очень значи-
тельна. Поэтому ингибиторы АПФ применяют у больных ЭГ без
предварительного измерения активности ренина в плазме. Пре-
параты этого класса изменяют распределение МО сердца, усили-
вая региональный кровоток в жизненно важных органах (почки,
мозг, коронарное русло) по сравнению с кровотоком в скелетной
мускулатуре. В отличие от прямых вазодилататоров (гидралазин,
миноксидил и др.) ингибиторы АПФ не способствуют задержке
воды и натрия, а напротив, вызывают слабый натрийуретиче-
ский эффект. Последнюю реакцию связывают с ограничением
секреции альдостерона (Ольбинская Л. И. и др., 1993) и с усиле-
нием почечного плазмотока. Правда, могут происходить неболь-
шая задержка ионов К+ и повышение его концентрации в плаз-
ме, однако явная гиперкалиемия наблюдается только у лиц с по-
чечной недостаточностью либо при одновременном назначении
больным ЭГ ингибиторов АПФ и солей калия или калий-задер-
живающих диуретиков.
Гипертрофия левого желудочка, как неоднократно подчерки-
валось, — важнейшее следствие АГ, способствующее возникно-
вению диастолической, а затем и систолической дисфункции ле-
вого желудочка, развитию опасных аритмий, прогрессированию
коронарного атеросклероза и застойной сердечной недостаточ-
302
225
Рис. 18. Систолическое давление и мышечная масса левого желудочка у крыс
наследственной гипертензивной линии (SHR), леченных эналаприлом в течение
4 недель (по С. Johnson, 1992). Левый столбик — нелеченные крысы; средний
(темный) столбик — показатели тех же крыс после лечения; справа столбик —
показатели крыс, лечившихся эналаприлом при одновременном введении
солевого раствора NaCl
ности. При лечении ЭГ ингибиторами АПФ происходит улуч-
шение диастолической функции левого желудочка (Бастру-
ков А. И., 1993), уменьшение степени его гипертрофии и усиле-
ние коронарного кровотока. При расчете на 1 мм рт. ст. пони-
зившегося АД эти препараты в 2 раза интенсивнее
сокращают мышечную массу левого желудочка
по сравнению с другими проти вогипертензив-
ними средствами. Таким образом, ингибиторы АПФ про-
тиводействуют ростовым влияниям АП, который, как упомина-
лось, стимулирует синтез мРНК, белка, экспрессию фактора ро-
ста и клеточную гипертрофию в миокарде и в стенках резистив-
ных сосудов (Kang Р. et al., 1993) (рис. 18).
303
Ингибиторы АПФ ограничивают зону экспериментального
инфаркта миокарда, способствуя, в частности, расширению эпи-
кардиальных артерий. Препараты этого класса усиливают мозго-
вой кровоток, они расширяют крупные мозговые артерии, вклю-
чая сонные, и, следовательно, могут применяться у больных,
имеющих признаки сосудистой недостаточности мозга. Этот эф-
фект замедляет прогрессирование атеросклероза аорты и ее
крупных ветвей. Кроме того, увеличение диаметра больших арте-
рий может способствовать некоторому ослаблению барорефлек-
са, что при гипотензии ограничивает активацию симпатической
нервной системы, и возникновению рефлекторной синусовой
тахикардии. Это последнее, помимо прочего, отличает ингибито-
ры АПФ от других вазодилататоров.
Ингибиторы АПФ не вызывают нарушений углеводного и липид-
ного обмена, гиперурикемии, т. е. их можно назначать больным, у
которых ЭГ сочетается с обменными заболеваниями. Следова-
тельно, ингибиторы АПФ имеют широкий круг показаний и
применяются у больных ЭГ с измененным липидным профилем
плазмы, страдающих стенокардией, гипоксией мозга и проявле-
ниями левожелудочковой недостаточности. Имеются указания,
что длительное лечение ЭГ эналаприлом улучшает метаболиче-
ские показатели у инсулинорезистентных больных с ЭГ (Зи-
мин Ю. В., Родоманченко Г. В., 1998).
Больные ЭГ, одновременно страдающие бронхолегочными
заболеваниями, что случается нередко, хорошо переносят лече-
ние ингибиторами АПФ. Однако у части таких больных сравни-
тельно быстро появляются кашель, сухие хрипы. Причины этой
реакции мы рассмотрим ниже.
Больные с заболеванием периферических сосудов (атероскле-
роз) благополучно переносят лечение ингибиторами АПФ. В
этом смысле эти препараты имеют преимущества перед р-адре-
ноблокаторами с внутренней симпатомиметической активностью
либо селективными pi-адреноблокаторами.
В отличие от симпатолитиков ингибиторы АПФ не вызывают
умственную депрессию, не ухудшают функции мозга; напротив,
они могут усиливать мозговую активность, уменьшать депрессию
и улучшать настроение больного ЭГ (Zubenko G., Nixon R.,
1984). Эти же препараты ослабляют степень импотенции, вызы-
ваемой другими противогипертензивными средствами (р-адре-
ноблокаторы и т. д.).
304
Важнейший вопрос, от ответа на который зависит решение
врача, применять ли ингибиторы АПФ у больного ЭГ, — их вли-
яние на функцию почек. Установлено, что длительное
лечение этими препаратами улучшает по-
чечную функцию у ряда больных с признаками хрониче-
ской почечной недостаточности, если не происходит резкого по-
нижения АД (см. ниже). Изредка можно наблюдать обратимое
ухудшение почечной функции: повышение концентрации креа-
тинина в плазме, зависящее от устранения воздействия АП на
эфферентные почечные артериолы, поддерживающие высокое
фильтрационное давление. Здесь уместно указать, что при одно-
стороннем стенозе почечной артерии АПФ-ингибиторы могут
углублять нарушения на больной стороне, но это не сопровожда-
ется приростом уровня креатинина или мочевины плазмы до тех
пор, пока вторая почка функционирует нормально. При ренова-
скулярной АГ АПФ-ингибиторы в сочетании с диуретиком до-
статочно эффективны для контроля АД у большинства больных.
Правда, описаны единичные случаи развития тяжелой почечной
недостаточности у больных, имевших одну почку. Такой же эф-
фект могут вызывать и другие вазодилататоры. Замечено также,
что у больных ЭГ и сахарным диабетом ингибиторы АПФ уменьша-
ют выраженность протеинурии (снижение тонуса эфферентных
артериол).
Система ренин—АП активируется во время беременности,
что может помимо других механизмов способствовать повыше-
нию АД. Однако ингибиторы АПФ не показаны
беременным женщинам, поскольку эти препараты
воздействуют на плод (каптоприл в отличие от эналаприла про-
ходит через плаценту).
Необходимо быть ориентированным в возможностях комби-
нированной терапии ЭГ ингибиторами АПФ и другими гипотен-
зивными средствами. Мы уже упоминали, что сочетание АПФ-
ингибитора с диуретиком обеспечивает быстрое достижение нор-
мотензивного уровня АД. При этом надо учитывать, что диуре-
тики, понижая ОЦП и АД, смещают регуляцию давления от так
называемой Na-объемной зависимости к вазоконстрикторному
ренин-ангиотензиновому механизму, на который воздействуют
ингибиторы АПФ. Это иногда приводит к чрезмерному сниже-
нию системного АД и почечно-перфузионного давления с ухуд-
шением функции почек. У больных, уже имеющих такие нару-
305
шения, диуретики вместе с ингибиторами АПФ следует приме-
нять с осторожностью (!).
Отчетливый синергический эффект, сопоставимый с дейст-
вием диуретиков, дают антагонисты Са, назначаемые вместе с
ингибиторами АПФ. Антагонисты Са поэтому можно назначать
вместо диуретиков, если к последним есть противопоказания.
Как и ингибиторы АПФ, антагонисты Са усиливают растяжи-
мость крупных артерий, что особенно важно для пожилых боль-
ных ЭГ.
Надо проявлять осторожность при добавлении ингибиторов
АПФ к постсинаптическим ai-адреноблокаторам, а также к цен-
тральнодействующим аг-адреностимуляторам. Все это позволяет
избежать глубокой гипотензии. Разумеется, речь идет не о пол-
ном и обязательном отказе от этих сочетаний, а о систематиче-
ском контроле за уровнем АД, если используются упомянутые
комбинации препаратов.
Нельзя, конечно, не считаться с возможными побочными эф-
фектами ингибиторов АПФ, к характеристике которых мы, прак-
тически, уже приступили. Среди нежелательных реакций часто
упоминают сосудистый отек лица, губ, слизистых оболочек, язы-
ка, глотки, гортани, конечностей. У больного может появиться
сухой ирритативный кашель, першение в горле, понижается
аппетит. Эти осложнения связывают с накоплением брадикини-
на и субстанции Р (провоспалительные медиаторы), вызывае-
мым ингибиторами АПФ. Кашель при приеме ингибиторов
АПФ возникает в 5% случаев, хотя некоторые исследователи
приводят очень высокую цифру — 34% случаев развития этого
осложнения. В легких случаях можно ограничиться уменьшени-
ем дозы препарата. При угрозе развития обструкции верхних
дыхательных путей (!) немедленно подкожно вводят раствор ад-
реналина (1 : 1000), а прием ингибитора АПФ прекращают.
У больных с нарушенной функцией почек иногда наблюдали по-
явление нейтропении (<1000/мм3); такое случается в 3,7% случа-
ев, обычно через 3 мес от начала лечения; нейтропения исчезает
через 2 нед. после отмены каптоприла или его аналогов.
Все же среди неблагоприятных реакций, вызываемых инги-
биторами АПФ, ведущее значение имеют уже упоминавшиеся
артериальная гипотензия, нарушения фун-
кции почек и гиперкалиемия.
306
Что касается артериальной гипотензии, то прежде всего надо
упомянуть об эффекте первой дозы, который наблюдается глав-
ным образом у больных с сердечной недостаточностью. Правда,
не у всех ингибиторов АПФ он выражен, особенно слабо у пе-
риндоприла (Балябин А. А., 2000). Риск ее возникновения мини-
мальный (<3%); с такой частотой она развивается преимущест-
венно у больных с начинающейся застойной недостаточностью
кровообращения, принимающих диуретик. У больных ЭГ с более
развернутой картиной застойной сердечной недостаточности,
при такой комбинированной терапии, снижение среднего гемо-
динамического давления более чем на 20% отмечается уже в по-
ловине случаев. Почти у всех этих больных опасной гипотензии
предшествует появление гипонатриемии, вызываемой диуретика-
ми. Ряд больных с гипонатриемией и высокой ответной актив-
ностью ренина в плазме уже на первый прием ингибитора АПФ
реагируют резким понижением АД. Чаще преходящая гипотен-
зия развивается после нескольких приемов каптоприла или род-
ственных ему соединений. Максимальное снижение АД прихо-
дится на отрезок времени от получаса до 4 ч вслед за последним
приемом препарата. Примерно 30% больных в период резкого
снижения АД ощущают: головокружение, слабость, ухудшение
зрения («все расплывается»).
Более устойчивая артериальная гипотензия может вести к по-
чечной недостаточности или к задержке ионов Na+ и воды, т. е.
к парадоксальному эффекту, поскольку ингибиторы АПФ обыч-
но повышают экскрецию натрия и воды. Особенно опас-
ная гипотензия развивается у больных,
имеющих одно- либо, чаще, двустороннее
сужение почечных артерий, т. е. при рено-
васкулярной АГ или при ЭГ в сочетании с
реноваскулярной «добавкой».
Больным с высоким риском возникновения артериальной ги-
потензии следует прежде всего понизить дозу диуретика, прием
ингибитора АПФ отдалить от диуретика на 24—72 ч, а также
снизить дозу ингибитора АПФ.
Во всех этих случаях эналаприл и лизиноприл вызывают бо-
лее резкое ухудшение почечной функции, чем кратковременно
действующий каптроприл. Итак, развитие почечной недостаточ-
ности под воздействием ингибиторов АПФ зависит главным об-
разом от снижения АД и почечно-перфузионного давления.
307
При угрозе развития почечной недостаточности следует при-
держиваться трех правил:
1) начинать лечение с малых доз препаратов (2,5—5 мг эна-
лаприла или лизиноприла), титруя дозу; уровень креатинина в
плазме может возрасти в начале лечения; если прирост концент-
рации креатинина не больше 30% от его исходного уровня и он
сочетается с общим клиническим улучшением, то это рассматри-
вается как благоприятный факт. В тех же случаях, когда плаз-
менный уровень креатинина повышается значительнее, необхо-
димо: 2) снизить дозу диуретика и удлинить интервалы между
его приемами (речь, конечно, идет о лечении больных с тяжелым
течением ЭГ и (или) с ослаблением функции сердца, развитием
застойных явлений); 3) не назначать одновременно с ингибито-
ром АПФ либо отменить ранее назначенные препараты, тормо-
зящие синтез простагландинов, например: ацетилсалициловую
кислоту и другие нестероидные противовоспалительные средст-
ва, которые могут, по разным причинам, понадобиться больному
ЭГ. Эти препараты сами по себе вызывают отчетливое снижение
скорости клубочковой фильтрации; они же противодействуют
усилению почечного плазмотока, вызываемому ингибиторами
АПФ. Активность каптоприла могут уменьшать и пероральные
противодиабетические средства.
Итак, по современным воззрениям, не только сама
по себе блокада синтеза All, но в большей
мере длительность такой блокады в тече-
ние суток угрожает нарушением функции
почек.
Еще один нежелательный эффект ингибиторов АПФ — воз-
никновение гиперкалиемии (легкий гипоальдостеронизм). Эти
препараты не только повышают концентрацию ионов К+ в плаз-
ме, но и противодействуют его выведению, стимулируемому ди-
уретиками; тормозится и экскреция с мочой ионов Mg++. Не
столь отчетливо влияют ингибиторы АПФ на содержание ионов
К+ в клетках, хотя некоторую степень гипокалигистии они могут
вызывать. Вещества этого класса не всегда совместимы с верош-
пироном (альдактоном), они противопоказаны при гиперкалие-
мии и острой почечной недостаточности. Если же врач имеет
возможность систематически контролировать уровень К+ и креа-
тинина в плазме, то ингибиторы АПФ могут быть использованы
в случаях выраженной гипокалиемии временно вместе с препа-
308
ратами калия (в умеренных дозах). В последние годы для лече-
ния застойной сердечной недостаточности прибегают к сочетан-
ному назначению больному ингибитора АПФ и верошпирона
(в малых дозах — 25 мг/сут.).
Могут представить интерес данные о новых или пока мало
известных препаратах этого класса. Я имею в виду такие препа-
раты как цилазаприл, трандолаприл, квинаприл и моэксиприл.
Цилазаприл (прилазид) — ингибитор АПФ, созданный швей-
царской компанией Ф. Хоффман—Ля Рош (рис. 19—22). Это
единственный в мире ингибитор АПФ, смоделированный
компьютером. Трехмерная молекулярная структура позволяет
разместить АПФ на активные места и, тем самым, достичь высо-
кого сродства и селективности, и как следствие — применения
препаратов в очень малых дозах (Attwood М., 1989). На рис. 21
показаны сравнительные данные об относительной эффектив-
ности различных ингибиторов АПФ. Бросается в глаза значи-
тельное преимущество цилазаприлата, т. е. продукта превраще-
ния цилазаприла в плазме крови.
Прилазид обладает способностью значительно снижать ак-
тивность АПФ в различных артериальных сосудах, при спонтан-
ной гипертензии у крыс (СГК). Такая выраженная ингибиция
сосудистого АПФ, вероятно, играет главную роль в регрессии
структурных изменений артериальных сосудов.
Ингибиторы АПФ различаются по торможению тканевого
АПФ. Прилазид ингибирует тканевую АПФ активность в боль-
шей степени, чем эналаприл, каптоприл и рамиприл, что связа-
но с лучшим проникновением в ткани и клетки. Очевидно, что
свойства ингибитора АПФ определяются не только его действи-
ем на циркулирующий АПФ, но и его торможением АПФ в
стенках кровеносных сосудов.
Прилазид обладает большой эффективностью в лечении АГ.
При этом степень снижения систолического и диастолического
АД может быть такой же или даже больше, чем у других инги-
биторов АПФ или других препаратов (бета-блокаторы, диуре-
тики, антагонисты Са). Доза прилазида 2,5—5 мг однократно
в сутки обеспечивает у 55—54% больных с мягкой и умеренной
АГ нормализацию АД через 4 недели лечения. Включение в тера-
пию 12,5 мг гипотиазида понижает АД до нормы даже у 55—90%
больных ЭГ. По мнению ряда авторов, в первые два дня лечения
следует довольствоваться дозой в 1,25 мг в сутки. Прилазид регу-
309
лирует суточный ритм АД, приближая его к физиологическому
ритму, что предотвращает возможные повреждения органов-ми-
шеней (Kogler Р., 1989; Avramevic Y. et al., 1996) (см. рис. 19—22).
Трандолаприл (гоптен) применяют однократно в сутки по
1 таблетке (0,5 и 2 мг), после лечения в течение 4 недель началь-
ная доза может быть удвоена до 4 мг. Препарат применяют ут-
ром во время или после еды, запивая большим количеством
жидкости. У больных ЭГ с умеренным снижением функции пе-
чени начинают лечение с дозы 0,5 мг утром. Такую же дозу пре-
парата назначают больным ЭГ, имеющим солевой или водный
дефицит, например, лицам, подвергающимся сеансам гемодиа-
лиза, а также страдающим рвотами, поносом или принимающим
мочегонные препараты. Гоптен не следует назначать больным,
имеющим первичное повышение концентрации альдостерона в
плазме крови, при состоянии после трансплантации почек, бере-
менным женщинам, а также в период лактации. Препарат не на-
значают детям, лицам, страдающим коллагеновыми болезнями;
больным, принимающим иммунодепрессанты (цитостатики, ан-
тиметаболиты, кортикостероиды), соли лития, аллопуринол, но-
вокаинамид. В ходе лечения гоптеном не проводят гемодиализ
или гемофильтрацию, поскольку это создаст опасность развития
тяжелых анафилактических реакций и шока.
Максимальная доза гоптена, апробированная на больных, со-
ставляла 16 мг; при этом не наблюдались какие-либо токсичес-
кие реакции. Гоптен обладает самым продолжительным действи-
ем (до 2 суток), достоверно уменьшает гипертрофию левого же-
лудочка, обеспечивает снижение АД у больных с ожирением,
снижает вероятность развития рефракторной сердечной недоста-
точности в постинфарктном периоде (на 29%) — исследование
TRACE включало 1749 больных из 27 медицинских центров
Дании.
Квинаприл (Ассирго 5) — ингибитор АПФ, который принима-
ют внутрь по 5 мг однократно в сутки; доза может быть увеличе-
на, но не больше 20 мг/сут; показания к назначению квинаприла
и противопоказания идентичны препаратам этого класса. Препа-
рат не рекомендуют назначать больным с нарушенной функцией
почек (клиренс креатинина ниже 50 мг/мин), в течение гемодиа-
лиза, при нарушении функции печени; Ассирго 5 не показан
детям.
310
каптоприл
О 6 12 18 24
высвобожденный ангиотензин II (pg/30 min)
Рис. 19. Подавление высвобождения васкулярного ангиотензина II
на изолированных мезентериальных артериях кролика
после инфузии различных АПФ-ингибиторов
(материалы фирмы)
Рис. 20. Прилазид обладает 24-часовым антигипертензивным эффектом:
изменения в течение суток систолического и диастолического АД
(материалы фирмы)
311
1/IC50 (m/mol/l)x10-8 |
цилазаприлат
12,50
беназеприлат
фосеноприлат
периндоприлат
рамиприлат
лизиноприл
эналал рилат
каптоприл
Рис. 21. Относительная эффективность отдельных АПФ-ингибиторов
(материалы фирмы Берлин-Хеми)
диастолическое
систолическое
Рис. 22. Влияние прилазида на АД
(данные фирмы)
312
Моэксиприл (фирма «Schwarz Pharma»). Этот ингибитор АПФ
исследовался у женщин с мягкой и умеренной АГ в период по-
сле менопаузы (исследование MADAM). О. К. Татаренко и со-
авт. (1999) изучали влияние моэксиприла на АД и гемодинами-
ческие показатели у 20 женщин в возрасте 57 лет в период после
менопаузы, страдавших мягкой (16 человек) и умеренной АГ.
Продолжительность менопаузы к началу лечения составила в
среднем 8 лет. Моэксиприл больным назначали в начальной дозе
7,5 мг один раз в сутки. Если у больных диастолическое давле-
ние все еще превышало 90 мм рт. ст., то на 3-й неделе дозу пре-
парата повышали в 2 раза (7,5 мг два раза в день). За 9 недель
применения моэксиприла систолическое АД снижалось в сред-
нем от исходного уровня 155 мм рт. ст. до 148 мм рт. ст.; диасто-
лическое АД понизилось с 95 мм до 93 мм рт. ст. Минутный объ-
ем сердца, фракция выброса левого желудочка, как и масса мио-
карда левого желудочка, не изменились.
Авторы работы оценивают результаты лечения как вполне
удовлетворительные, хотя, на мой взгляд, это слишком оптими-
стическая оценка. М. В. Леонова, Ю. Б. Белоусов (1999) провели
сравнительное исследование ряда гипотензивных препаратов.
При монотерапии больных с мягкой АГ они не достигли желае-
мого эффекта: пониженное диастолическое давление составило
лишь 6,7%. Авторы приходят к справедливому
и объективному выводу, что ингибиторы
АПФ имеют ограниченную эффективность
при монотерапии. Наибольшую эффективность среди
препаратов этого класса, по данным тех же авторов, проявил мо-
эксиприл, который на 15% превосходил другие аналогичные
препараты.
Перивдоприл (престариум) — фирма Сервье
Я уделяю этому препарату дополнительно отдельный пара-
граф, учитывая его большое распространение в России.
Периндоприл впервые был использован для лечения ЭГ в
1988 г.; препарат является пролекарством, которое в организме
превращается в активный метаболит — периндоприлат. Препарат
быстро и полностью всасывается, биодоступность препарата со-
ставляет около 70%; максимум фармакологической активности
достигается через 4—6 ч после приема периндоприла внутрь. Пе-
риндоприл выводится почками, его элиминация замедляется у
313
пожилых больных. Период полувыведения препарата достаточно
продолжительный — 25—30 ч, что позволяет его применять один
раз в день.
Периндоприл уменьшает ОПС при небольшом изменении
частоты сердечных сокращений и сердечного выброса, т. о. по-
нижение АД не сопровождается развитием рефлекторной тахи-
кардии, что связывают с одновременно происходящей венодила-
тацией и уменьшением нреднагрузки.
При ЭГ начальная доза периндоприла составляет 2 мг один
раз в сутки с постепенным повышением дозы, при необходимо-
сти до 4 мг/сут. Максимальная доза периндоприла — 8 мг/сут.
Адекватный контроль АД достигается в большинстве случаев при
суточной дозе 4 мг.
Эффективность периндоприла при АГ изучалась в рандоми-
зированных исследованиях с применением двойного слепого ме-
тода в сравнении с каптоприлом (Lees К. et al., 1989), атеноло-
лом (Thurston М. et al., 1990), гипотиазидом + амилоридом (And-
rejak М. et al., 1991), нифедипином (Libreti A. et al., 1993). Bo
всех этих сравнительных исследованиях периндоприл не уступал
по эффективности другим препаратам. Процент больных, у кото-
рых удавалось нормализовать АД (диастолическое давление ниже
90 мм рт. ст. с помощью одного периндоприла или комбинации
его с другими препаратами (диуретики и др.), варьировал от 75
до 85%. По моим наблюдениям, монотерапия периндоприлом
обеспечивает нормализацию АД у 56—59% больных с мягкой и
умеренной формами ЭГ. Больные с изолированной систолической
АГ более устойчивы к лечению периндоприлом.
Наиболее частым побочным эффектом при лечении перин-
доприлом бывает кашель, который возникает у 7% больных, что
явно ниже цифр, отмечаемых при применении других ингибито-
ров АПФ. Не отмечалось значительных колебаний липидного
профиля по сравнению с исходными данными. В результате
3-годичного применения периндоприла у больных ЭГ и сахар-
ным диабетом, получавших инсулин, был выявлен ренопротек-
тивный эффект препарата (Hermans М. et al., 1992). Периндоп-
рил обеспечивал стойкое и достоверное понижение степени
микроальбуминурии. На фоне применения периндоприла масса
гипертрофированного миокарда уменьшается в такой же степе-
ни, как при лечении каптоприлом и нифедипином. По моему
мнению, периндоприл интенсивнее уменьшает гипертрофию ле-
314
после
после
до
Рис. 23. Уменьшение гипертрофии левого желудочка (толщины стенок)
после лечения престариумом (материалы фирмы Сервье)
Рис. 24. Уменьшение толщины стенки артерии (после лечения престариумом)
(материалы фирмы Сервье): сверху — до; внизу — после
вого желудочка по сравнению с другими ингибиторами АПФ
(рис. 23). Столь же отчетлив эффект периндоприла на утолщение
стенок резистивных сосудов у больных ЭГ (рис. 24). Также было
показано, что периндоприл обладает макроциркуляторным эф-
фектом, который проявляется в повышении растяжимости круп-
ных сонных артерий (Lones J., 1998).
Наконец, следует указать, что в многоцентровом исследова-
нии, в котором участвовали сотрудники нашей кафедры, не вы-
явился гипотензивный эффект первой дозы периндоприла у
больных, у которых фракция выброса левого желудочка была
снижена до 20% (Балябин А. А., 1999).
Можно сделать вывод, что периндоприл (престариум) являет-
ся ингибитором АПФ пролонгированного действия, обладаю-
щим достаточной противогипертензивной эффективностью и хо-
рошей переносимостью.
315
Заключая этот раздел, я все же считаю нужным подчеркнуть,
что и н г и б и т о р ы АПФ показаны главным об-
разом больным с мягкой формой ЭГ. Для иллю-
страции привожу данные О. А. Милягина и соавт. (1999), опуб-
ликованные в журнале «Кардиология». Авторы изучали влияние
препарата «эднит» (эналаприл малеат) на АД у 55 больных, стра-
давших ЭГ: у 46 больных диагностировали мягкую гипертензию,
у 9 — умеренную ее форму. Дозы препарата варьировали от 5 до
20 мг/сут; разовая доза равнялась 5—10 мг, кратность приемов
1—2 раза в сутки.
Исходная величина систолического АД в среднем равнялась
143,9 мм рт. ст.; диастолического АД — 96 мм рт. ст. Через 6 нед
лечения показатели АД были такими: 130,9 мм и 86 мм рт. ст. со-
ответственно.
Большинство опубликованных зарубежных работ также осно-
вываются на оценке гипотензивных эффектов ингибиторов АПФ
у больных с мягкой и умеренной АГ. Снижение АД про-
исходит медленно и постепенно. Значительно
худшие результаты получены при лечении больных со стабиль-
ными и тяжелыми формами ЭГ. При этом ингибиторы АПФ
как гипотензивные препараты явно уступают диуретикам или
Са-блокаторам. Ингибиторы АПФ могут исполь-
зоваться главным образом как препараты
второй линии в случаях комбинированной
терапии.
Надо учитывать, что около 30% больных ЭГ не отвечают на
монотерапию ингибиторами АПФ (Белоусов Ю. Б., 2001). Их
применение может иногда приводить к развитию острой по-
чечной недостаточности, в частности у ряда пожилых людей, у
больных, принимающих нестероидные противовоспалительные
препараты, и особенно у лиц с двухсторонним стенозом почеч-
ных артерий. Между тем ингибиторы АПФ весьма показаны
больным, у которых АГ сочетается с сахарным диабетом. Осо-
бенно эффективны эти препараты у больных с диабетической
нефропатией. Снижение протеинурии под их влиянием, вероят-
но, объясняется расширением эфферентных артериол почечных
клубочков, поскольку, как полагают, внутриклубочковая гипер-
тензия способствует фильтрации альбуминов (Lewis Е. et al.,
1983; Bank N. et al., 1987). Другие противогипертензивные препа-
раты, по-видимому, не обладают этим свойством.
316
Как видно, не следует фетишизировать ингибиторы АПФ
(в качестве абсолютных противогипертензивных средств), к чему
иногда склоняются некоторые клиницисты. Несмотря на прису-
щие этим лекарственным средствам несомненные достоинства,
проявляющиеся в большей мере при лечении хронической за-
стойной сердечной недостаточности, они могут исполь-
зоваться в качестве монотерапии у боль-
ных в более ранних и легких стадиях ЭГ. При
тяжелом течении этого заболевания их следует сочетать с други-
ми препаратами, что нередко, к сожалению, чревато серьезными
побочными реакциями. Следовательно, эти препараты, как и все
остальные, имеют свои специфические показания и противопо-
казания.
Блокаторы p-адренергических рецепторов
Произошедшие перемены в наших представлениях о значе-
нии и удельном весе различных противогипертензивных средств
коснулись частично и p-адреноблокаторов. Однако, как и в слу-
чае с диуретиками, поливалентные свойства этих препаратов
объясняют причины неизменно сохраняющегося интереса к ним
и продолжающегося успешного синтеза их новых разновидно-
стей. Поэтому я и в данной монографии считаю полезным по-
дробно характеризовать класс p-адреноблокаторов. Тем более,
что сотрудники кафедры кардиологии посвятили много усилий
изучению особенностей их действия у больных ЭГ (Кушаков-
ский М. С., 1977, 1983; Иванова Н. В., 1983; Команденко М. С.,
1983; Шутко Г. В., Иванова Н. В., 1984; Кушаковский М. С.,
Иванова Н. В., 1985; Легостев А. Б., 1985; Смирнов Г. Б., 1986;
Иванова Н. В., Смирнов Г. Б., 1988; Кушаковский М. С., Ивано-
ва Н. В., Смирнов Г. Б., 1991).
Более 30 лет назад В. Prichard и Р. Jillam (1964) впервые сооб-
щили о том, что у больных ЭГ при систематическом приеме
внутрь пропранолола происходит снижение систолического и
диастолического АД. Это известие было встречено с удивлением
и даже с некоторым скептицизмом, поскольку, с теоретических
позиций, блокада p-адренорецепторов должна демаскировать
а-адренорецепторы резистивных сосудов и тем самым способст-
вовать еще большему их сужению, т. е. возрастанию ОПС и АД.
317
Прошли годы, насыщенные дискуссиями и настойчивыми
поисками механизмов гипотензивного действия р-адреноблока-
торов. Постепенно они получили признание клиницистов и во-
шли в группу ведущих фармакологических средств в комплекс-
ном лечении ЭГ.
В настоящее время число синтезированных р-адреноблокато-
ров превысило полусотню. Их классифицируют на основе ряда
признаков (Метелица В. И., 1987). В соответствии с концепцией
A. Lands и соавт. (1967), выделивших Pi- и Рг-адренорецепторы,
различают два подкласса p-адреноблокаторов: 1) избирательно
блокирующие Pi-адренорецепторы (кардиоселективные, или се-
лективные); 2) блокирующие как рг, так и р2-адренорецепторы
(неселективные). В конце 80-х годов были синтезированы пер-
вые селективные Рг-адреноблокаторы (бопиндолол, дилевалол),
их свойства изучаются (Леонова М. В. и др., 1995; Prichard В.,
Tomlinson В., 1988).
Открытие того факта, что некоторые p-адреноблокаторы мо-
гут при определенных условиях стимулировать (возбуждать), а не
блокировать p-адренорецепторы, потребовало разделения их еще
по одному признаку: присуща им или нет внутренняя симпато-
миметическая активность (ВСА). При классификации р-адре-
ноблокаторов учитывают и такие их свойства, как гидрофиль-
ность и липофильность, т. е. определяют возможность их накоп-
ления в ткани мозга. Наконец, принимают во внимание мембра-
ностабилизирующее действие (МСД) этих препаратов, или их
способность тормозить «быстрые» натриевые каналы клеточных
мембран, участвующие в образовании потенциала действия, т. е.
в процессе возбуждения мышечных клеток резистивных сосудов.
Такие фармакокинетические свойства препаратов, как их
всасывание, биодоступность, период полувыведения и др., тоже
могут иметь большое значение при выборе р-адреноблокатора,
определении его дозы и периодичности приемов. Ниже приво-
дятся эти данные (табл. 14).
В этой таблице для каждого препарата показаны дневные до-
зировки, которые могут широко варьировать.
Легко заметить, что хорошо всасывающиеся вещества с вы-
сокой биодоступностью назначают больным в сравнительно не-
больших дозах (пиндолол, тимолол). Препараты, интенсивно
разрушающиеся в печени (первый пассаж) и соответственно с
318
низкой биодоступностью, применяют в больших дозах (алпрено-
лол, лабеталол). Продолжительность периода полувыведения в
значительной мере определяет периодичность (частоту) приемов
препарата в течение дня.
Период полувыведения надолола, соталола, атенолола позво-
ляет принимать их один раз в день, что весьма удобно для боль-
ных. Правда, некоторые p-адреноблокаторы со сравнительно ко-
ротким периодом полувыведения тоже могут назначаться на
один прием в день; это связано с фармакологической активно-
стью их метаболитов. Долю препарата, выделяющегося в неиз-
мененном виде с мочой, обязательно учитывают, в частности,
при лечении больных ЭГ, имеющих нарушения функции почек.
Следует упомянуть еще о двух препаратах, не указанных в
табл. 14, обладающих необычными свойствами: эсмололе с пе-
риодом полувыведения около 9 мин (ультракороткое действие) и
Таблица 14
Фармакокинетические параметры и средние дневные дозы
рада р -адреноблокаторов
(D. McDevitt, 1981; J. Meier, 1982; D. Harrison, 1983)
Препарат Доза, мг/день Число прие- мов в день Всасы- вание, % Эффект первого пассажа, % Био- доступ- ность, % Период полу- выве- дения, ч Выделе- ние с мочой в неизме- ненном виде, %
Алпренолол 400-800 2(3) >90 Большой 15 2-3 >1
Атенолол 100-300 1 50 100 50 6-9 40
Ацебуталол 200- 800 1 70 30 50 3-4 18
Лабеталол 300-1200 2(3) >90 «60 33 2-3 <4
Метопролол 50-100 1(2) >90 50 50 3-4 3
Надолол 80-320 1 34 0 34 10-12 34
Окспренолол 80-320 2(3) «90 40 50 1-2 3
Пиндолол 5-30 1-3 >90 13 87 3-4 35
Пропранолол 80-320 2(3) >90 60 30 2-3 <1
Соталол 80-320 1 >80 0 >80 7-15 75
Тимолол 20-60 2(3) >90 25 75 2-5 5
319
адимололе, активность которого сохраняется в течение 72 ч по-
сле однократной дозы.
Механизмы понижения АД p-адреноблокаторами. Анализ ме-
ханизмов гипотензивного действия следует проводить раздельно:
а) для p-адреноблокаторов без ВСА (или со слабой ВСА); б) для
препаратов, которым присуща выраженная ВСА (пиндолол и
ацебуталол).
Острое введение больному ЭГ (внутрь или внутривенно) про-
пранолола или другого p-адреноблокатора (кроме пиндолола и
ацебуталола) не приводит к понижению АД. Иногда несколько
понижается лишь систолическое давление, поскольку пропор-
ционально урежению пульса удлиняется период изгнания крови
из левого желудочка и уменьшается его объемная скорость вы-
броса. Отсутствие истинной гипотензивной реакции, т. е. сниже-
ния диастолического давления, связано с тем, что в ответ на вы-
зываемое p-адреноблокатором (селективным и неселективным)
уменьшение МО сердца адекватно возрастает ОПС (рефлектор-
ная ai-адренорецепторная вазоконстрикция). Это, в частности,
отметили М. Schalekamp и соавт. (1982) у 410 больных, которым
однократно вводили атенолол, метопролол, пропранолол, тимо-
лол. Аналогичные наблюдения были сделаны и другими клини-
цистами (Кушаковский М. С., 1977, 1982; Иванова Н. В., 1982;
Шляхто Е. В., 1983; Tarazi R., Dustan Н., 1972; Buhler F., 1981).
Показательно, что если после такого разового, безуспешного
введения p-адреноблокатора больному вводили а-адреноблока-
тор фентоламин, то систолическое и диастолическое давление
быстро понижалось, что отражало снятие ответного нервно-сим-
патического спазма резистивных сосудов. Очевидно, что p-а д -
реноблокаторы без выраженной ВСА сами
по себе не могут использоваться для остро-
го лечения гипертензивных кризов (!).
Стойкое понижение АД, наступающее у реагирующих боль-
ных в ответ на систематический прием p-адреноблокаторов без
ВСА, зависит от снижения ранее повысившегося ОПС до исход-
ного или более низкого уровня, несмотря на то, что МО все еще
остается уменьшенным. В свое время R. Tarazi и Н. Dustan
(1972) назвали это парадоксальное явление ауторегуляторной ва-
зодилатацией. У больных, не отреагировавших на лечение р-ад-
реноблокаторами, не происходит понижения ОПС при равнове-
ликом уменьшении МО сердца по сравнению с группой больных
320
ЭГ, отреагировавших на такое лечение. Следовательно, у послед-
них не наступает ауторегуляторная вазодилатация, но в этих слу-
чаях резистивные сосуды могут быть расширены фентоламином,
что и приводит к понижению АД.
Другой тип гипотензивной реакции прослеживается при ле-
чении больных ЭГ пиндололом или ацебуталолом. Как уже упо-
миналось, эти препараты, благодаря выраженной ВСА, действу-
ют подобно стимуляторам Рг-адренорецепторов резистивных со-
судов, расширяя их даже при однократном введении, т. е. пони-
жают ОПС, систолическое и диастолическое АД (Легостев А. Б.,
1985; Смирнов Г. Б., 1985; Clark В., 1984; Prichard В., 1987). При
систематическом лечении пиндололом или ацебуталолом закреп-
ляется тот же механизм: уменьшение ОПС при незначительном
изменении МО сердца в покое (Легостев А. Б., 1985; Метели-
ца В. И. и др., 1993).
Итак, центральное место в анализе механизмов противоги-
пертензивного действия p-адреноблокаторов (исключая пиндо-
лол и ацебуталол) занимают поиски ответа на вопрос о том, ка-
кие факторы способствуют ослаблению а-адренорецепторной
вазоконстрикции и понижению ОПС в условиях хронического
уменьшения у больных сердечного выброса.
Надо признать, что вполне удовлетворительного ответа на
этот вопрос пока нет. Выдвинуто несколько гипотез, каждая из
которых имеет свои сильные и слабые стороны. Наиболее по-
пулярна точка зрения, связывающая противогипертензивную
активность p-адреноблокаторов без ВСА с их центральным дей-
ствием, в частности с блокадой p-адренорецепторов в опреде-
ленных участках гипоталамуса и продолговатого мозга, что со-
провождается стимуляцией расположенных здесь аг-адреноре-
цепторов и, как следствие, усиленным нисходящим торможени-
ем симпатической нервной системы на периферии.
Не получила поддержки концепция об изменениях р-адре-
ноблокаторами барорецепторного рефлекса, что четко показали
В. А. Алмазов и соавт. (1984). Встречают возражение и две другие
гипотезы. Согласно одной из них, решающее значение имеет
блокада пресинаптических Рг-адренорецепторов, ограничиваю-
щая выделение норадреналина из окончаний симпатических
нервов. В другой гипотезе основную роль в процессе понижения
АД отводят блокаде постсинаптических сосудистых Pi-адреноре-
цепторов.
11 Зак. .3207
321
Противоречивое отношение вызывает и «рениновая гипотеза».
В пользу ее выдвигают следующие доводы: 1) все р-адреноблока-
торы в большей или меньшей степени подавляют активность ре-
нина в плазме в условиях, когда стимулируется ЮГ аппарат по-
чек, вырабатывающий ренин; 2) ряд авторов наблюдали положи-
тельную корреляцию между степенью гипотензивного действия
P-адреноблокаторов и исходной активностью ренина в плазме,
т. е. отмечалась большая чувствительность к этим препаратам тех
больных ЭГ, у которых заболевание протекало с гиперренине-
мией; 3) имеется сходство в реакциях АД на р-адреноблокаторы
и ингибиторы системы ренин—АП (саралазин и лазартан — ан-
тагонисты АП; каптоприл и другие аналогичные препараты —
ингибиторы АПФ); 4) компоненты системы ренин—АП обнару-
жены, как упоминалось выше, в тканях головного мозга, т. е.
«центральные» гипотензивные эффекты p-адреноблокаторов мо-
гут по своей сущности тоже быть антирениновыми.
Однако известны факты противоположного значения, не со-
гласующиеся с этой привлекательной гипотезой: 1) наблюдается
заметное расхождение во времени между подавлением активно-
сти ренина в плазме и снижением АД, последнее происходит
позже; 2) для подавления активности ренина в плазме требуются
значительно меньшие дозы p-адреноблокаторов, чем для сниже-
ния АД; 3) с помощью пропранолола и других р-адреноблокато-
ров удается нормализовать АД и у больных с гипорениновой
формой ЭГ.
Как и многие другие исследователи, я полагаю, что п р о -
тивогипертензивные эффекты р-адренобло-
каторов есть следствие сложных, многосто-
ронних реакций, в которые втянуты взаимо-
связанные системы, регулирующие АД: цент-
ральные и периферические нервно-
симпатические механизмы, почечно-надпо-
чечниковые гормональные системы, аппа-
рат кровообращения.
Постоянно сохраняет актуальность вопрос о показаниях и
противопоказаниях к назначению p-адреноблокаторов. Распро-
странено мнение, что особенно чувствительны к этим препа-
ратам те больные ЭГ, у которых повышен МО сердца и отмеча-
ется высокая активность ренина в плазме. Между тем имеется
немало фактов, указывающих на то, что упомянутые показатели
322
не должны рассматриваться как «гаранты» обязательного успеха
в лечении ЭГ р-адреноблокаторами.
Прежде всего увеличение МО может зависеть не только от
гиперактивности симпатической нервной системы, но и от дру-
гих причин, среди которых следует выделить гиперволемию,
встречающуюся у больных с гипергидратационной формой ЭГ
(Кушаковский М. С., Иванова Н. В., 1982). В случае увеличения
МО такого происхождения p-адреноблокаторы, даже в больших
дозах, менее интенсивно понижают АД, чем при равновеликом
повышении АД, протекающем с нормоволемией. Это правило,
как показали наблюдения нашей клиники, распространяется и
на p-адреноблокатор с ВСА — пиндолол (Легостев А. Б., 1985).
Главной задачей лечения у таких больных должно быть восста-
новление нормоволемии и нормогидратации с помощью мало-
натриевой диеты, диуретиков, Са-блокаторов. Но если даже ори-
ентироваться на классический гиперкинетический вариант ЭГ
(без гиперволемии), то и здесь не выявляется преимущество
p-адреноблокаторов по сравнению с их эффектом у других боль-
ных ЭГ.
Другое дело, что при выборе препарата отдают предпочтение
такому из них, который в большей мере воздействует на нару-
шенное звено кровообращения. Поскольку при гиперадренер-
гической форме ЭГ повышен МО сердца, то назначение здесь
p-адреноблокаторов представляется предпочтительным, так как
они понижают МО. Следовательно, не расчет на особую эф-
фективность, а патогенетические предпосылки заставляют вра-
ча склоняться в этих случаях к применению препаратов этого
класса.
Наши наблюдения, как и материалы ряда других клиник, не
подтверждают тезис о том, что профилизация боль-
ных по исходной активности ренина в
плазме может служить подходящим крите-
рием для предсказания успешного лечения
ЭГ р-адреноблокатором.
Вместе с тем существует ряд более определенных показаний
к применению p-адреноблокаторов у больных ЭГ: синусовая та-
хикардия, внешние признаки гиперадренергии, гипокалиемия,
сочетание ЭГ и стенокардии, тахиаритмии, перенесенный ин-
фаркт миокарда.
323
В сопоставимых дозах лечебная эффективность р-адренобло-
каторов при ЭГ примерно одинакова (см. табл. 14). Успех лече-
ния одними p-адреноблокаторами достигается, по разным сведе-
ниям, у 20—80% больных ЭГ. Такой значительный разброс в ре-
зультатах зависит, по-видимому, от различий в возрасте боль-
ных, стадии (тяжести) заболевания, его длительности и,
конечно, от использованных доз препаратов. Влияние возраста
иллюстрируют данные F. Buhler (1981). У больных ЭГ моложе
40 лет удавалось добиться снижения диастолического давления
до уровня <95 мм рт. ст. в 75% случаев; в возрасте от 40 до
59 лет — в 50%; в возрасте старше 60 лет — только в 20% слу-
чаев. В целом же по группе из 243 больных нужный эффект был
достигнут в 58% случаев. Правда, в более поздних работах эти
данные не подтвердились (см. ниже).
О значении дозы p-адреноблокаторов дают представление
материалы нашей клиники, располагающей более 700 наблю-
дений. С помощью пропранолола (обзидан, индерал, анапри-
лин) при дозировке 80—120 мг в день достигали нормотензии у
25% больных во II стадии ЭГ (Анисимова Н. А., Потапова Л. В.,
1980). При применении анаприлина в дозах 160—320—460 мг в
день хорошие результаты удалось получить уже у 80% больных с
такой же тяжестью заболевания (Иванова Н. В., 1984). Вискен
(пиндолол) в дозах 5—15 мг в день обеспечивал нормализацию
АД у 48% больных ЭГ II стадии (Легостев А. Б., 1985; Смир-
нов Г. Б., 1985).
Если сопоставить наши материалы с данными других кли-
ник, а также усреднить сведения о возрасте больных и тяжести
ЭГ, то можно прийти к следующему заключению. Пропранолол
(сам по себе) в дозах 120—160 мг в день позволяет нормализо-
вать АД у */з больных, еще у */з больных происходит существен-
ное понижение АД и наступает клиническое улучшение. Остав-
шаяся подгруппа больных неоднородна: часть из них в ответ на
повышение дозы пропранолола (>160 мг в день) реагирует аде-
кватно, т. е. наблюдается постепенное понижение АД; другая
часть — примерно 25% от общего числа больных ЭГ — отличает-
ся устойчивостью к самым высоким дозам пропранолола и дру-
гих p-адреноблокаторов (Эрина Е. В., 1980; Алмазов В. А. и др.,
1981; Шхвацабая И. К., 1982; Гогин Е. Е., Сененко А. Н., Тю-
рин Е. И., 1983; Иванова Н. В., 1984).
324
Для лечащего врача интересны не только обобщенные дан-
ные, но, в особенности, конкретные сведения о тактике и ходе
лечения различными фармакологическими средствами. Поэтому
укажем, что уже первая доза анаприлина — 40 мг внутрь — вы-
зывает урежение пульса, что отчетливо улавливается между 1 и
2 ч после приема препарата. Затем число сердечных сокращений
постепенно возрастает до исходной величины. Если больной
систематически принимает анаприлин 2 раза в день, урежение
пульса становится устойчивым: к 10-му дню лечения в дозе
>120 мг в день частота сокращений сердца оказывается на 18% в
покое и на 23% при физической нагрузке меньше исходной
(Смирнов Г. Б., 1985).
Понижение АД начинается позже, чем урежение
синусового ритма; правда, здесь особенно проявляется
зависимость от дозы препарата. Если начинать с
доз 80—120 мг в день (в два приема), то отчетливое и устойчивое
понижение систолического и диастолического давления можно
зарегистрировать только в середине или даже в конце 2-й недели
лечения. Нередко после 7-го дня терапии приходится с интерва-
лом в 3—7 дней повышать дозу анаприлина. При начальной
суточной дозе >160 мг (в два приема) гипотензивный эффект
достигается к концу первой-началу второй недели, а иногда и
раньше.
Вискен, если к нему нет хотя бы относительных противопока-
заний (стенокардия, экстрасистолия и другие аритмии), назнача-
ют для приема внутрь по 5 мг 1—2 (3) раза в день. Этот 0-адре-
ноблокатор не вызывает урежения пульса в покое, если его ис-
ходная частота лежит в пределах 70—85 в 1 мин, но уменьшает
до нормы число сокращений сердца, превышающее 90 в 1 мин;
только у 0,03% больных может возникнуть синусовая брадикар-
дия. Нагрузочную тахикардию вискен ограничивает на 22%
(Смирнов Г. Б., 1985).
Уже однократно принятая внутрь доза вискена 5 мг вызыва-
ет у реагирующих на него больных понижение через 1—1,5 ч си-
столического давления в среднем на 38 мм рт. ст., диастоличе-
ского — на 17 мм рт. ст. Систематический прием вискена (5—
10 мг в день) обеспечивает стойкую нормализацию или значи-
тельное понижение АД к середине второй недели лечения. При
суточной дозе 15 мг это происходит на первой неделе. Не реаги-
руют на вискен около 25—30% больных; в этих случаях к виске-
325
ну добавляют диуретик, поскольку у многих устойчивых к виске-
ну больных имеются гиперволемия и гипергидратация. Можно
получить, как упоминалось выше, хороший и устойчивый ре-
зультат при добавлении к вискену фентоламина (50 мг 2—3 раза
в день) (Легостев А. Б., 1986).
Надо подчеркнуть, что гипотензивное действие $-адреноблока-
торов проявляется в равной мере в горизонтальном и вертикальном
положении больного — без постуральных реакций. Эффективность
этих препаратов не утрачивается даже при длительной, много-
летней терапии. В отличие от других нейротропных гипотензив-
ных средств и периферических вазодилататоров (гидралазин, ми-
ноксидил и др.) р - ад р е н о б л о к а т о р ы не вызыва-
ют задержки натрия и воды, увеличения
массы тела (Иванова Н. В., 1982). Они уменьшают степень
гипокалиемии и способствуют возрастанию содержания калия в
организме больного ЭГ.
Проблемы, связанные с лечением ЭГ ft-адреноблокаторами, по-
бочные реакции и противопоказания. В общем, эти препараты
вполне удовлетворительно переносятся больными. Нежелатель-
ные реакции возникают у 12—16% больных. Чаще это — чувство
усталости, мышечная слабость, зябкость ног (у 2,5% больных, в
основном с атеросклерозом артерий), бессонница, депрессия
(у 0,8% больных), кошмарные сновидения (у 2,5% больных), им-
потенция (у 0,2% мужчин), тремор пальцев рук (вискен). Психо-
неврологические нарушения, по-видимому, в большей мере вы-
зывают p-адреноблокаторы, обладающие липофильностью, по-
этому лицам с изменениями психики, страдающим тяжелыми
неврозами, расстройствами сна, p-адреноблокаторы должны на-
значаться с осторожностью, лучше избегать их приема на ночь.
В последние годы много внимания уделяется возможным
атерогенным эффектам p-адреноблокаторов, в частности, их вли-
янию на содержание в плазме холестерина и липопротеидов
(Метелица В. И., Оганов Р. Г., 1988; Kaplan J. et al., 1987). Не-
смотря на противоречивость опубликованных в литературе дан-
ных, общее положение можно представить следующим образом.
Концентрацию общего холестерина и холестерина липопротеи-
дов низкой плотности p-адреноблокаторы, практически, не из-
меняют. Однако под воздействием неселективных препаратов
(пропранолол и др.) происходит понижение концентрации холе-
стерина липопротеидов высокой плотности, которым присуща ан-
326
тиатерогенная функция. Селективные препараты (метопролол,
атенолол и др.) дают такой же нежелательный эффект только в
половине исследований, тогда как p-адреноблокаторы с ВСА
(пиндолол, ацебуталол) повышают концентрацию холестерина
липопротеидов высокой плотности в каждом третьем исследова-
нии. Уровень общих триглицеридов и триглицеридов липопроте-
идов очень низкой плотности при лечении больных ЭГ повыша-
ется, и эта реакция не зависит ни от селективности, ни от ВСА
или МСД.
Основываясь на этих фактах, большинство современных кли-
ницистов рекомендует ограничить применение р-адреноблокато-
ров у больных ЭГ, сочетающейся с ИБС, или у тех, у которых
повышена концентрация липидов крови. Подчеркивается также,
что у больных, принимавших p-адреноблокаторы, не происходи-
ло уменьшение заболеваемости ИБС и ее осложнений, несмотря
на то, что достигалась нормализация АД.
Хотя все эти соображения очень серьезны, их разделяют да-
леко не все. По мнению J. Kaplan и соавт. (1987), около 80% ис-
следований «отсроченных» эффектов p-адреноблокаторов были
недостаточно продолжительными (более половины короче
6 мес). Кроме того, цифровые показатели, приведенные в этих
работах, отнюдь не отличаются однородностью; имеется также
немало наблюдений, указывающих на то, что между вызываемы-
ми фармакологическими средствами изменениями концентра-
ции липидов (липопротеидов) и клиникой атеросклероза отсут-
ствует четкая зависимость. Возможно, что недооцениваются и
результаты выполненных в последние годы шведскими учеными
экспериментальных и клинических исследований, которые про-
демонстрировали противоатерогенное действие метопролола, его
способность защищать больных ЭГ от двух тяжелых осложнений:
мозгового инсульта и инфаркта миокарда.
Понизив, подобно тиазидовым диуретикам, на 40% частоту
инсультов (за счет нормализации АД), метопролол одновременно
понизил на 24% и число коронарных (ишемических) приступов.
В тех же работах было показано, что метопролол, тимолол и про-
пранолол тормозят процессы атерогенеза: повреждение эндоте-
лия коронарных артерий, формирование атероматозной бляшки
(связывание липопротеидов низкой плотности с протеогликана-
ми стенки артерии, образование тромбов). Тем самым обеспечи-
вается кардиопротекторная функция fi-адреноблокаторов — пони-
327
жение риска возникновения фибрилляции желудочков и разры-
вов миокарда (см. рис. 19).
Проблема эта, конечно, в будущем найдет решение, пока же
приходится считаться с почти общепринятой точкой зрения:
p-адреноблокаторы у больных ЭГ следует применять таким обра-
зом, чтобы не усиливать факторы риска ИБС.
Не менее сложным является вопрос о влиянии $-адреноблока-
торов на метаболизм глюкозы. С одной стороны, при соответст-
вующих условиях они могут вызывать гипогликемию, а в период
уже развившейся гипогликемии тормозить клиренс инсулина,
что должно способствовать усилению гипогликемии. С другой
стороны (это бывает чаще), p-адреноблокаторы могут задержи-
вать выработку инсулина в ответ на нагрузку глюкозой, что ведет
к гипергликемии. Правда, p-адреноблокаторы с ВСА оказывают
более физиологическое воздействие на регуляцию углеводного
обмена. Например, пиндолол не снижает выделение инсулина в
ответ на нагрузку глюкозой у здоровых людей. Ацебуталол у здо-
ровых людей и больных сахарным диабетом, не получающих ин-
сулин, не тормозит восстановление нормального уровня глюко-
зы вслед за гипогликемией, вызванной инсулином. Между тем
пропранолол задерживает этот процесс. Кроме того, пропрано-
лол и другие вещества этого ряда изменяют ответные реакции на
гипогликемию: подавляются тахикардия и тремор, ослабляется
чувство страха, хотя сохраняется выраженная потливость. Поми-
мо диагностических трудностей создается и определенная опас-
ность недооценки ситуации.
Итак, p-адреноблокаторы не должны назна-
чаться больным ЭГ, страдающим сахарным
диабетом и получающим инсулин либо пер-
оральные сульфаниламидные гипогликеми-
ческие средства. Больным ЭГ и сахарным диабетом, ко-
торые обходятся без инсулина и других гипогликемических пре-
паратов, p-адреноблокаторы не противопоказаны, но и в этих
случаях требуется тщательный контроль за уровнем сахара кро-
ви, особенно в начале лечения р-адреноблокаторами.
По-видимому, p-адреноблокаторы не оказывают существен-
ного воздействия на уровень мочевой кислоты в плазме и могут
применяться у лиц с подагрическими расстройствами, что дает
преимущество p-адреноблокаторам по сравнению с диуретиками.
328
Функция щитовидной железы в период лечения больных ЭГ
p-адреноблокаторами (уровни в плазме Тз и Т4) не претерпевает
сколько-нибудь значительных изменений, однако замедление
синусового ритма может в некоторых случаях создавать иллюзию
устранения тиреотоксикоза. У больных с тиреотоксикозом быст-
рая отмена p-адреноблокаторов иногда сопровождается «тирео-
идным штормом», прежде всего резкой тахикардией, зависящей,
вероятно, от увеличения числа p-адренорецепторов вследствие
длительной p-адренергической блокады (пиндолол понижает
число p-адренорецепторов).
По этой же причине отмену селективных и неселективных
p-адреноблокаторов (кроме пиндолола) необходимо проводить
постепенно (в течение недели!), чтобы избежать «синдрома отме-
ны». Последний иногда развивается через 1—2 дня или позже
после внезапного прекращения лечения р-адреноблокаторами;
он проявляется чувством тревоги, синусовой тахикардией, по-
тливостью, тремором, головной болью, а также загрудинными
болями за счет обострения стенокардии. Подобное состояние
более выражено у больных, находящихся в вертикальном поло-
жении (гиперадренергический «криз»), оно постепенно исчезает
в течение нескольких дней.
Надо отметить, что при длительном лечении больных ЭГ
Р-адреноблокаторами с ВСА тоже могут появляться гиперадре-
нергические реакции и без отмены этих препаратов: потливость,
сердцебиение, тремор пальцев рук, ощущение жара в голове,
учащение мочеиспускания. Кроме того, мы наблюдали у боль-
ных, принимавших до 15 мг в день вискена, парадоксальные
подъемы АД, обычно кратковременные. Было замечено, что та-
кие же подъемы АД, связанные с острым повышением уровня
адреналина в плазме, могут развиваться во время курения табака
у больных, получающих и другие p-адреноблокаторы (Amadio Р.
et al., 1987).
Характеризуя отрицательные влияния, оказываемые р-адре-
ноблокаторами на аппарат кровообращения, я должен упомянуть
о некоторых проблемах, которые возникают при лечении этими
препаратами больных ЭГ, имеющих атеросклеротические изме-
нения (сужения) артерий нижних конечностей. Появляются чув-
ство похолодания в стопах, парестезии; понижается температура
кожи ног, она бледнеет; у ряда больных возникает или обостря-
329
ется синдром Рейно. Все это признаки ухудшения регионарного
кровообращения, что требует прекращения приемов р-адренобло-
каторов. Правда, селективные Pi-адреноблокаторы или р-адре-
ноблокаторы с ВСА, назначенные в умеренных дозах, вызывают
не столь выраженные ангиоспастические реакции.
Ряд врачей полагает, что опасным побочным эффектом р-ад-
реноблокаторов является их способность вызывать острую сер-
дечную недостаточность. Частота такого осложнения очень неве-
лика; по различным данным, она составляет 0,3—0,5%. Тщатель-
ный анализ этих случаев показывает, что все они зависели от
чрезмерного угнетения СА узла или развития АВ узловой блока-
ды. Показатели гемодинамики (УО, ФВ и др.), как правило,
у больных не ухудшались. В нашей клинике, располагающей
достаточно большим опытом, мы ни разу не наблюдали у боль-
ных ЭГ развития сердечной слабости, хотя многие из них при-
нимали значительные дозы p-адреноблокаторов длительное
время (годы). Более того, включение этих препаратов в лечебные
программы повышало способность многих больных переносить
физические нагрузки (Смирнов Г. Б., 1985). Правда, больным ЭГ
с клиническими проявлениями сердечной слабости (патологиче-
ский III тон, венозный застой в легких) при кардиомегалии, по-
вторных инфарктах миокарда, а также перенесшим операцию на
сердце, p-адреноблокаторы в малых дозах следует назначать,
если в них имеется потребность, вместе с сердечными гликози-
дами, диуретиками и нитратами.
Следовательно, опасаться сердечной недостаточности при
применении p-адреноблокаторов у больных ЭГ надо не вообще,
а только в строго очерченных случаях. В настоящее время, на-
против, доказано благоприятное действие p-адреноблокаторов,
особенно карведилола, бисопролола и др., при хронической сер-
дечной недостаточности, благодаря тому, что эти препараты ин-
гибируют отрицательное влияние на кровообращение, которое свя-
зано с чрезмерной активацией симпатической нервной системы
и системы ренин—АП (Мареев В. Ю., 1991; Francis G. et al.,
1990; Packer M., 1988; Waagstein F. et al., 1989; Кушаков-
ский M. C., 1998). Что касается синусовой брадикардии, приво-
дящей к уменьшению МО сердца, то лечение р-адреноблокато-
рами прерывают, если появляются характерные для нее симпто-
мы: слабость, головокружение и т. д. Далеко зашедшую синусо-
вую брадикардию можно устранить с помощью приема
330
изопропилнорадреналина (5 мг) или внутривенной инъекции
0,5—1,0 мл 0,1% раствора атропина сульфата.
Неселективные p-адреноблокаторы понижают бронхиальную
проходимость и вызывают затруднение дыхания у больных ЭГ,
одновременно страдающих бронхиальной астмой, астматическим
бронхитом, эмфиземой легких, ожирением. Селективные р-адре-
ноблокаторы и пиндолол могут назначаться таким больным при
крайней необходимости в умеренных дозах в три приема, обяза-
тельно в сочетании с Рг-адреностимуляторами или эуфиллином.
Я подробно рассмотрел возможности применения при ЭГ
P-адреноблокаторов, учитывая широкий спектр их фармакологи-
ческих воздействий и интерес, который эти препараты постоян-
но вызывают. По-видимому, в будущем предпочтение будет от-
даваться p-адреноблокаторам длительного действия, а также пре-
паратам с добавочной вазодилататорной активностью (целипро-
лол, карведилол, сервидилол), которые, с одной стороны,
понижают ОПС, с другой стороны, подавляют рефлекторную та-
хикардию, вызываемую вазодилатацией. Большой интерес вызы-
вают также недавно синтезированные p-адреноблокаторы с вы-
сокой степенью селективности (бисопролол и др.), которые, по
предварительным данным, нейтральны по отношению к липи-
дам крови (Вейкин А. К. и др., 1995; Леонова М. В. и др., 1995).
Перехожу к их более подробному рассмотрению.
Новые p-адреноблокаторы
Препараты с высокой степенью селективности: бисопролол,
бетаксолол
Бисопролол (конкор) и бетаксолол (локрен) относятся к под-
классу Pi-адреноблокаторов, они лишены внутренней симпато-
миметической активности и мембраностабилизирующих свойств
(Кушаковский М. С., Иванова Н. В., Смирнов Г. Б., 2000).
Сродство бисопролола к Pi-адренорецепторам в среднем в
75 раз выше, чем к Рг-адренорецепторам. Бетаксолол блокирует
Pi-адренорецепторы в 4 раза (в условных единицах) интенсив-
нее, чем такие известные Pi-адреноблокаторы, как метопролол
и атенолол.
pi-селективные блокаторы вызывают отчетливые фармаколо-
гические эффекты при состояниях, характеризующихся высокой
331
концентрацией катехоламинов в плазме, особенно норадренали-
на. К числу таких состояний можно отнести: активность хрома-
финовой опухоли надпочечников — феохромоцитому, гипогли-
кемию, вызванную инъекцией инсулина; стимуляцию симпати-
ческой нервной системы, происходящую при курении сигарет
(Тгар-Jensen J. et al., 1979).
Хотя Pi-адреноблокаторы не лишены некоторого бронхоспа-
стического действия, особенно при больших дозах, а также у аст-
матиков, их высокая селективность не препятствует (^-расширя-
ющим эффектам, которые вызывают изопропилнорадреналин и
сольбутамол у тех же больных (Dekalmer Р. et al., 1978).
Эти же препараты вызывают заметно меньше метаболических
расстройств, чем неселективные вещества того же класса. Рост
концентрации атерогенных липопротеидов низкой плотности,
триглицеридов и понижение уровня липопротеидов высокой
плотности в плазме оказывается минимальным при лечении
больных ЭГ бисопрололом и бетаксололом (Prichard В., Tomlin-
son В., 1986). Тем самым устраняется основное
возражение против применения р-адрено-
блокаторов при ЭГ. Высокоселективные р-адреноблока-
торы не удлиняют периода гипогликемии, вызываемой инъек-
цией инсулина. Это значит, что их с меньшими опасениями можно
применять у больных с сахарным диабетом, сочетающимся с АГ.
Препараты этого класса в меньшей степени воздействуют на
Na/K каналы клеток скелетных мышц, поэтому эти препараты
лучше переносятся при физических нагрузках, чем неселективные
препараты типа пропранолола (McLead A. et al., 1984).
Снижают АД селективные p-адреноблокаторы при длитель-
ном применении более интенсивно по сравнению с неселектив-
ными препаратами. В ранних клинических исследованиях R. Та-
razi и Н. Dustan (1972) подчеркивали, что снижение АД отчетли-
во проявляется у больных ЭГ лишь к концу 1—2 недели систе-
матического приема внутрь p-адреноблокаторов. Более свежие
мониторные наблюдения за изменениями АД показали, что
гипотензивный эффект пропранолола проявляется уже через
10 мин после повторного его приема внутрь. Полный же эффект
достигается в течение 1—2 дней, а прекращение приемов препа-
рата сопровождается восстановлением исходного уровня АД
примерно через 2 нед.
332
Вопреки тому, что утверждал F. Buhler (1986), указывавший,
что 0-адреноблокаторы малоэффективны у лиц старше 60 лет,
европейская группа по изучению АГ у пожилых больных отмети-
ла значительное уменьшение случаев инфаркта миокарда, моз-
гового инсульта и летальных исходов в результате лечения 0-ад-
реноблокаторами больных старше 60 лет, у которых АД было
выше 160/90 мм рт. ст. Утверждение, что 0-адреноблокаторы ме-
нее эффективны при лечении ЭГ у стариков, не подтвердил и та-
кой авторитетный исследователь, как N. Kaplan (1994).
Бисопролол (конкор) в дозе 5—10 мг однократно в день ока-
зался эффективнее при лечении ЭГ в покое и во время физиче-
ской нагрузки, чем 50—100 мг атенолола.
В многоцентровом исследовании, включавшем 249 больных
ЭГ, длившемся 6 мес, уменьшение диастолического давления до
уровня <90 мм рт. ст. было достигнуто у 57% больных, прини-
мавших 10 мг бисопролола, и у 47% больных, лечившихся 50 мг
атенолола.
В течение 6 мес сравнивалось влияние бисопролола (10 мг в
день) и ингибитора АПФ — эналаприла (20 мг в день) на степень
гипертрофии левого желудочка. Оба препарата в одинаковой
мере уменьшали признаки гипертрофии левого желудочка.
D. Braech и соавт. (1990) не смогли найти разницу в снижении
АД у 24 больных старше 65 лет, принимавших в течение 6 нед.
5—10 мг бисопролола или 25—50 мг каптоприла.
В ряде работ сопоставлялись эффекты бисопролола и Са-ан-
тагонистов. В частности, в 3 исследованиях сравнивалось дей-
ствие бисопролола и дигидропиридиновых препаратов: нифеди-
пина или нифедипина-ретард, которые больные принимали
один-два раза в день.
Два из этих исследований были предприняты у больных с
ранней ЭГ: оказалось, что между медленно выделявшимся нифе-
дипином (20—40 мг в день) и бисопрололом (10 мг в день) не
было существенных различий.
В третьем исследовании 10 мг бисопролола сравнивали с
10—20 мг нифедипина (один раз в день); оба препарата вызвали
достоверное и, практически, равное понижение АД (систоличе-
ское и диастолическое) через 4 нед. лечения больных ЭГ.
Наконец, укажем, что бисопролол (конкор) в дозе 5—40 мг в
день (в виде монотерапии) снижал АД на 17/19% в 8 других ис-
следованиях, проведенных у больных ЭГ I—II стадии с уровнем
333
диастолического давления от 90 до 120 мм рт. ст. Лечение про-
должалось от 6 до 56 нед., при этом нормализация АД достига-
лась у 79—94% больных ЭГ. Активность бисопролола сравнивали
с эффективностью лечения ЭГ диуретиками. В одном из таких ис-
следований сопоставлялось действие 10 мг бисопролола и 50 мг
гипотиазида вместе с 5 мг амилорида. Исследование проводилось
у 34 больных, разделенных на две параллельные группы. К концу
30-го дня лечения АД понизилось в подгруппе больных, прини-
мавших бисопролол. Так, диастолическое давление <90 мм рт. ст.
было достигнуто в этой подгруппе у 88,2% больных против
23,5% — в подгруппе больных, лечившихся диуретиками.
Во втором сравнительном исследовании сопоставлялись ди-
уретик хлорталидон и бисопролол. Диастолическое давление до
уровня <90 мм рт. ст. снизилось у 82% больных, принимавших
бисопролол, и у 84% больных, лечившихся хлорталидоном. Эти
результаты были получены после 4-недельного лечения. Хлорта-
лидон вызывал значительное понижение уровня К+ и возраста-
ние концентрации мочевой кислоты в плазме крови (Bueno К.
et al., 1998).
Таким образом, сравнение бисопролола с другими проти-
вогипертензивными средствами показывает, что этот высо-
коселективный p-адреноблокатор не толь-
ко не уступает, но во многом превосходит
наиболее популярные противогипертен-
зивные препараты.
Степень понижения АД бисопрололом зависит от используе-
мой дозы. Известно, что у гипертоников степень гипертрофии
левого желудочка зависит от уровня АД, устанавливающегося
при выходе из физической нагрузки (Devereux A. et al., 1989).
Физическая и эмоциональная нагрузка ведет к приросту АД у ги-
пертоников, что, в свою очередь, усиливает напряжение миокар-
да и осложняется его преходящей ишемией.
Бисопролол понижает АД не только у больных в покое, но и
обеспечивает существенное понижение АД, вызываемого физи-
ческой нагрузкой, и эта реакция, тоже зависящая от дозы препа-
рата, сохраняется в течение 24 ч после приема препарата внутрь.
Регистрация АД в течение суток подтверждает, что бисопро-
лол (конкор) сохраняет свою противоги-
пертензивную активность как днем, так и
ночью, не искажая при этом циркоидные
вариации АД. Вероятно, снижение повышенного ночного
334
АД играет важную роль в уменьшении гипертрофии левого желу-
дочка на 14—15% за период применения бисопролола в течение
6 мес.
Бисопролол эффективен у больных ЭГ различного возраста,
в том числе у пожилых людей и стариков, хотя его влияние на
изолированную систолическую гипертензию пока не исследова-
лось.
Итак, при длительном лечении, по мень-
шей мере в течение 3 лет, бисопролол обес-
печивает при монотерапии нужный эффект
у большинства больных с мягкой или уме-
ренной АГ: диастолическое давление <90 мм рт. ст. достига-
ется у 60—88% больных при дневной дозе препарата от 5 до
20 мг (однократный прием) (Gieske Н., Buchner-Hole D., 1990).
Отличные фармакологические свойства бисопролола позволяют
относить его к числу оптимальных ^-адреноблокаторов. Правда,
при тяжело протекающей ЭГ предпочтительнее представляется
комбинация бисопролола с другими гипотензивными препарата-
ми (диуретики, ингибиторы АПФ и т. д.). Окончательное сужде-
ние о месте, которое занимает противогипертензивный препарат
в системе лечения ЭГ, можно сделать, исследовав его переноси-
мость больными.
По этому поводу можно сказать следующее. Побочные эффек-
ты бисопролола (конкора), в общем, аналогичны тем, которые
встречаются при применении других 0-адреноблокаторов. В
многоцентровом исследовании, включавшем более 2000 боль-
ных, страдавших в основном мягкой и умеренной АГ, через
8 нед. непрерывного лечения 1,2% больных отказались от прие-
мов конкора из-за побочных реакций; 11,6% предъявляли жало-
бы на побочные реакции, в том числе на головокружения (3,2%),
утомляемость (2,6%), головную боль. Могут, наконец, предста-
вить интерес наблюдения сотрудников нашей кафедры и боль-
ницы №1 С.-Петербурга, применявших препарат конкор для ле-
чения ЭГ. Н. В. Иванова с группой сотрудников сравнивали дей-
ствие бисопролола у больных ЭГ и у нормотоников. Оказалось,
что препарат в течение первых четырех недель снижал систоли-
ческое АД на 25 мм, диастолическое АД — на 12 мм рт. ст., при
этом в группе «нормотоников» степень понижения АД не превы-
шала 7/5 мм рт. ст. Частота пульса в обеих группах обследован-
ных уменьшилась в равной степени на 14 в 1 мин (рис. 25).
335
Лица с нормотензией
Рис. 25. Динамика АД и ЧСС при приеме бисопролола
(по наблюдениям Н. В. Ивановой и соавт., 2000)
В ряде сравнительных исследований бисопролола с другими
бета-блокаторами было показано, что их эффект схож, если су-
дить об интенсивности понижения АД. Однако при анализе по-
казаний суточного мониторирования АД выяснилось, что бисо-
пролол сохранял свое гипотензивное действие в утренние часы
следующего дня (после однократно принятой внутрь дозы), тогда
как другие бета-адреноблокаторы утрачивали или уменьшали
свое гипотензивное действие за 2—4 ч. до приема очередной
дозы препарата. Можно, следовательно, еще раз подчеркнуть та-
кие о с о б е н н о с т и эффекта бисопролола, как
устойчивость и равномерность действия в
течение суток.
Укажу также, что в тех случаях, когда в дозе 5 мг/сут бисо-
пролол не давал ожидаемого эффекта, его с пользой комбини-
ровали с антагонистами Са, ингибиторами АПФ или с гипотиа-
зидом.
Побочные реакции, вызываемые бисопрололом, в наших на-
блюдениях были незначительными: желудочно-кишечные рас-
стройства в 0,7% случаях, похолодание нижних конечностей в
1% случаев, нарушение потенции — в 0,5% случаев, синусовая
брадикардия в 0,7%. Очевидно, что эти немногочисленные и не-
тяжелые реакции не могут создавать препятствий для широкого
использования бисопролола у больных ЭГ.
Бетаксолол (локрен) в лечении АГ.
Этот высокоселективный 0]-адреноблокатор принимают при
АГ в дозе 10—20 мг внутрь один раз в день; если возникает необ-
ходимость, то эту дозу через 1—2 нед. повышают, вплоть до
40 мг однократно в день. Низкая начальная доза показана пожи-
лым и старым людям. Дневную дозу бетаксолола следует также
понизить у больных с тяжелыми повреждениями почек.
В многоцентровом открытом исследовании в течение 6 мес
изучалась эффективность бетаксолола при ЭГ, в ее мягком и
умеренном вариантах. Из 4685 амбулаторных больных в 86% слу-
чаев и в 72% — среди пациентов в возрасте 56—85 лет было до-
стигнуто снижение систолического давления более чем на 15%
и диастолического ниже 90 мм рт. ст. Гипотензивный эффект,
полученный через 3 мес лечения, сохранялся и через 6 мес
(Dijan J., 1986).
В ряде исследований сравнивалось гипотензивное действие
бетаксолола и других противогипертензивных препаратов. В двух
337
параллельных группах, охватывающих 146 гипертоников, иссле-
довали эффективность бетаксолола (от 10 до 40 мг в день одно-
кратно) и атенолола (25—100 мг в день). Больные переносили
мягкую либо умеренную АГ.
В течение первых 12 нед. АД понижалось в большей степени
у больных, принимавших бетаксолол, в последующем гипотен-
зивный эффект обоих 0-адреноблокаторов был, практически,
одинаковым. Снижение диастолического давления до уровня
<90 мм рт. ст. было достигнуто у 72% больных, получавших бе-
таксолол, и 52% — принимавших атенолол. Р. Morselli и соавт.
(1983) сравнивали бетаксолол с рядом других 0-адреноблокато-
ров (метапролол, ацебуталол, надолол и др.) и пришли к выводу,
что гипотензивное действие всех этих препаратов примерно одина-
ково, однако бетаксололу присущ ряд преимуществ: более длитель-
ный эффект и меньшее число побочных реакций. В. Johnson и соавт.
(1990) сопоставляли бетаксолол и атенолол и сделали аналогич-
ное заключение: гипотензивный эффект бетаксолола сохранялся
дольше.
Необходимо упомянуть и о трех исследованиях этого препа-
рата, проведенных в г. Москве. В общем к этим исследованиям
были привлечены 106 больных, в основном женщины со сред-
ним возрастом 50 лет. Больных разделили на 2 подгруппы: в пер-
вой из них больные принимали бетаксолол (10—20 мг однократ-
но); в другой подгруппе больные получали лечение бетаксоло-
лом и ингибитором АПФ либо диуретиком или антагонистом
кальция.
Через одну неделю в первой группе гипотензивный эффект
был получен почти у 70% больных, причем у 60% больных ре-
зультат лечения был оценен как хороший, что означало норма-
лизацию АД или снижение его больше чем на 10%. Во второй
подгруппе больных эффект лечения был выше: он был получен
почти у 94% больных. В среднем бетаксолол в дозе 10—20 мг в
день был эффективен у 80% больных ЭГ (Белоусов Ю. Б., Ма-
лая И. П.).
Как видно, противогипертензивное действие бетаксолола
весьма сходно с действием бисопролола. Оба высокоселективных
0-адреноблокатора отличаются возможностью использования их
в форме монотерапии, длительностью эффекта, способностью
понижать степень гипертрофии левого желудочка и хорошей пе-
реносимостью больными.
338
Бета-адреноблокаторы с вазодилатирующими свойствами
Представителем этой группы веществ является карведилол
(дилатренд) — неселективный (Pi и Р2) адреноблокатор без внут-
ренней симпатомиметической активности с прямым а-адрено-
блокирующим действием, т. е. сосудорасширяющим
эффектом. Препарату присущ период полувыведения, рав-
ный 7 ч. В отличие от традиционных p-адреноблокаторов карве-
дилол оказался доза-зависимым противогипертензивным препа-
ратом уже при первом его приеме. АД снижется быстро с макси-
мумом через 2—3 ч после приема карведилола внутрь (Meyer-Sale-
bek J. et al., 1983). Быстрый эффект карведилола опосредован его
сосудорасширяющим компонентом (Mocllendorf О. et al., 1986).
Поэтому в начале лечения ЭГ ограничиваются дозой препарата
12,5 мг, которую принимают первые два дня терапии.
Стойкий максимальный противогипертензивный эффект
проявляется через 1—2 нед. от начала лечения. Не отмечено ни
тахифилаксии, ни устойчивости при длительном лечении карве-
дилолом. Препарат назначают однократно в
с у т к и, он не оказывает отрицательного влияния на циркадный
ритм АД. Карведилол хорошо переносится больными, не вы-
зывая значительных побочных реакций. Большинство
больных ЭГ довольствуются ежедневной до-
зой карведилола 25 мг в с у т к и. Лишь 5,5% больных
нуждаются в более высоких дозировках препарата. Некоторым
больным старшего возраста для снижения АД достаточно дозы
12,5 мг/сут (Smekens A. et al., 1993).
Больным, у которых монотерапия карведилолом не обеспе-
чила достаточного снижения АД, показано комбинированное ле-
чение карведилолом вместе с гипотиазидом (малые дозы) либо с
медленными антагонистами кальция. Карведилол сохраняет по-
чечную ауторегуляцию, что можно объяснить одновременно
происходящим снижением ОПС и реноваскулярного сопротив-
ления. При лечении карведилолом больных, у которых повы-
шенное АД сопровождалось повреждением почек, альбуминурия
уменьшалась в 25% случаев, а возрастала только в 2%; соответст-
вующие показатели на фоне лечения атенололом составили 13%
и 12% (March F., Giriella G., 1995). Карведилол у больных с мяг-
кой и умеренной формами ЭГ достоверно уменьшал толщину
МЖП и ЗСЛЖ, при этом ФВ левого желудочка в покое и при на-
грузке возрастала (Gibert Е. et al., 1993).
339
В. Ehmer и соавт. исследовали у больных с инсулинозависи-
мым сахарным диабетом и АГ влияние 8-недельного курса лече-
ния карведилолом на уровень гликемии и содержания гликоли-
зированного гемоглобина (НВТА) в крови. Выяснилось, что пре-
парат не изменял уровень глюкозы в крови натощак и после еды,
а также содержание гликолизированного НЬ в крови. Кроме
того, карведилол не изменял концентрацию липидов в плазме;
при лечении метопрололом, напротив, повышалась концентра-
ция в плазме триглицеридов, а уровень липопротеидов высокой
плотности понижался.
Следовательно, карведилол подходит для лечения больных, у ко-
торых ЭГ сочетается с такими неблагоприятными факторами,
как дислипидемия и инсулинорезистентность. Имеются также дан-
ные, указывающие на то, что защитный эффект карведилола при
ишемии головного мозга и инсультах связан не только с пониже-
нием АД, но и с прямыми нефропротекторными свойствами
препарата. Напомню, что карведилолу присуща и антиоксидант-
ная активность.
Особенно же значительными, почти уникальными оказались
результаты лечения карведилолом больных с хронической за-
стойной сердечной недостаточностью (программа PRECIS; Par-
ker М. et al., 1995).
III. Высокоселективный Pj-адреноблокатор III поколения с
модуляцией синтеза окиси азота (NO) и мягкой вазодилатацией —
небиволол (небилет) фирмы Берлин-Хеми/Манарини
Небивололу свойственна самая высокая кардиоселективность
(см. табл. 15).
Таблица 15
Кардиоселективность небилета:
индекс блокирования 0-рецепторов — Pi/Рг
Название препарата
Небивалол
Бисопролол
Метопролол
Атенолол
Пропранолол
Индекс Р1/02
293,0
26,0
25,0
15,0
1,9
340
Это обстоятельство находит отражение в таких свойствах не-
билета как отсутствие влияния на метаболизм углеводов и ли-
пидный обмен, сниженный риск бронхоспазма, препарат не вы-
зывает импотенцию. Небилет достоверно понижает АД и число
сердечных сокращений у больных с мягкой и умеренной ЭГ
(van Nueten L. et al., 1994). Небивололу присущ наивысший индекс:
«остаточный/пиковой эффект» (рис. 26). Препарат отлично пе-
реносится и безопасен для больных ЭГ всех возрастных групп.
Известно, что цели противогипертензивного лечения вклю-
чают как снижение АД, так и восстановление эндотелиальной
функции сосудов. Небиволол оказывает корригирующее воздей-
ствие на эндотелиальную функцию при ЭГ (Задионченко В. С.
и др., 2000).
Модулирование выработки NO в эндотелиальных клетках
приводит к расширению не только артерий, но и вен, т. е. мяг-
кому понижению постнагрузки и преднагрузки, снижению КДД
в полости левого желудочка и улучшению его диастолической
функции. В результате возрастает инотропная функция сердца,
уменьшается внутрисердечная и системная гемодинамика, в том
числе и у больных с сердечной недостаточностью (Мазур Н. А.,
1999). Таблетка небиволол содержит 5 мг препарата. Сочетание
Рис. 26. Наивысший индекс «остаточный/пиковый эффект»
(trough-to-peak ratio) (данные фирмы)
341
такой дозировки с гипотиазидом (12,5 мг) явно усиливает общий
гипотензивный эффект.
Высоко оценивая свойства этого препарата, я не могу не ска-
зать, что небиволол обеспечивает снижение АД не у всех боль-
ных. Вероятно, это объясняется широкой вариацией показателя
биодоступности небиволола у разных больных: встречаются
больные ЭГ, у которых биодоступность небиволола низкая (Ива-
нова Н. В.), что, по-видимому, препятствует осуществлению ги-
потензивного эффекта.
Блокаторы рецепторов ангиотензина II
Имелись две основные причины, которые потребовали созда-
ния нового класса противогипертензивных средств — блокаторов
рецепторов АП. Во-первых, альтернативные пути синтеза АП по-
нижают эффективность ингибиторов АПФ, поскольку образова-
ние АП в этих путях не контролируется превращающим фермен-
том. Во-вторых, накопление брадикинина, происходящее при
ингибировании АПФ, вызываемое ферментом, идентичным
кининазе, сопровождается возникновением «брадикининовых
реакций», среди которых особенно опасны иритативный кашель
и отеки верхних дыхательных путей.
Естественно было желание иметь препарат, который блоки-
ровал бы всю систему АП в ее конечном звене, т. е. блокатор ре-
цептора АП. Можно было рассчитывать, что такой препарат бу-
дет лишен «брадикининовых реакций», т. е. не будет влиять на
процесс деградации кининов и вызывать у больных кашель или
отеки.
Первым препаратом этого класса веществ был лозартан (ко-
зоар), синтезированный сотрудниками фармацевтической фирмы
«Мерк-Шарп-Доум»; далее появился валсартан (диован); число
соединений этого класса, используемых в клинике, достигло 6
(ирбесартан, кандесартан, тазосартан и др.).
В последнее время установлено (я на это уже обращал вни-
мание), что ангиотензиновые рецепторы подразделяются на
2 типа. Блокаторы воздействуют на рецепторы первого типа
(АТ[) и одновременно стимулируют рецепторы второго типа
(АТ2). Например, у валсартана сродство к ATi-рецепторам в
2000 раз превышает сродство к АТ2-рецепторам; препарат не
оказывает влияния на адренергические, гистаминовые, мускари-
новые, бензодиазепиновые и другие рецепторы, т. е. ему прису-
342
ща высокая специфичность. Нужно учитывать, что именно цир-
кулирующий в плазме АП повышает ОПС и АД, тогда как ткане-
вой АП усиливает ишемию органов, в частности вызывает гипер-
тензивную энцефалопатию, гипертрофию и фиброз миокарда,
его ремоделирование, гипертрофию стенок мышечных артерий,
артериолосклероз, гломерулосклероз, повышение уровня в плаз-
ме катехоламинов и альдостерона.
Поэтому, по мнению ряда исследователей, способность бло-
каторов АП-рецепторов стимулировать их второй тип придает
этим препаратам большую перспективность в лечении повреж-
денных органов-мишеней при ЭГ и других заболеваний сердеч-
но-сосудистой системы.
Лозартан (козоар) — препарат пептидной природы после свя-
зывания с белками плазмы циркулирует вместе с активным мета-
болитом и выводится преимущественно почками. После приема
внутрь 25—50 мг препарата (1—2 табл.) концентрация его в плаз-
ме достигает максимума через 30 мин, максимальный гипотен-
зивный эффект проявляется через 2 ч и сохраняется более 24 ч.
В исследованиях В. Петрова и соавт. (1995), Е. В. Шляхто (1995),
В. А. Алмазова и В. Н. Хирманова (1997) было показано, что ко-
зоар по своей эффективности не ниже каптоприла, атенолола,
никардипина. Согласно данным В. Петрова и соавт. (1995), ло-
зартан несколько уступает рамиприлу и эналаприлу. Кроме того,
при переводе ряда больных на лечение лозартаном у них сохра-
нялся кашель, вызванный приемом ингибитора АПФ. На по-
следнее обстоятельство обращают внимание и некоторые зару-
бежные клиницисты, что может указывать на ограниченность
известной трактовки этого явления.
Подобно ингибиторам АПФ, козоар вызывает обратное раз-
витие гипертрофии левого желудочка, тормозит гиперплазию и
гипертрофию гладкомышечных клеток резистивных сосудов.
При снижении АД козоаром не наблюдается ответной синусовой
тахикардии. Если ЭГ сочетается с сердечной недостаточностью,
то применение козоара тоже бывает полезным.
Следует обратить внимание на нефропротекторное действие
козоара, вполне сравнимое с эффектом ингибиторов АПФ и
кальциевых блокаторов. Козоар хорошо переносится больными,
он не вызывает побочных эффектов по сравнению с плацебо.
Препарат противопоказан беременным женщинам и кормящим ре-
бенка грудью.
343
Не менее тщательно изучался другой блокатор АП — валсар-
тан (диован). В 1998 г. было закончено российское многоцентро-
вое исследование эффективности и переносимости этого непеп-
тидного блокатора АП. К исследованию по единой программе
было привлечено 200 больных ЭГ. Около 70% больных снизили
диастолическое давление до уровня меньше 90 мм рт. ст., что
расценивалось как отличный результат, 29% больных не смогли
достичь такого уровня АД, хотя и снизили его на 10 мм рт. ст. и
больше. Этот результат оценивался как хороший. У 7% больных
результаты лечения были хуже, у части из них их нельзя было
признать удовлетворительными.
В исследование, о котором сообщают Л. О. Минушкина,
Б. А. Сидоренко, Д. А. Затейщиков и Д. В. Преображенский
(1999), были привлечены 200 больных с мягкой и умеренной ЭГ
(диастолическое АД колебалось в пределах 95—114 мм рт. ст.).
Начальная доза препарата составила 80 мг/сут на один прием;
при необходимости дозу валсартана повышали до 100 мг/сут на
один прием.
Достоверное снижение как систолического (в среднем на
13 мм), так и диастолического АД (в среднем на 8 мм рт. ст.) от-
мечалось уже через 2 нед. лечения. К концу 4 нед. у 131 больного
(65%) эффективность лечения расценивалась как отличная (при
снижении диастолического давления ниже 90 мм рт. ст.) и хоро-
шая (снижение диастолического АД на 10 мм рт. ст. и больше).
Остальным 69 больным дозу валсартана пришлось повысить до
160 мг/сут. К концу 8 нед. лечения валсартаном в целом по груп-
пе систолическое давление понизилось на 26 мм, диастоличе-
ское — на 16 мм рт. ст. Валсартан не нарушал естественной су-
точной дозы колебаний АД.
По данным мега-анализа 10 плацебо-контролируемых иссле-
дований, охвативших 2315 больных ЭГ, частота побочных эф-
фектов валсартана составила 15,7% (Holwerda Н. et al., 1996).
Очень показательны результаты сравнения валсартана с дру-
гими противогипертензивными препаратами. L. Corea и соавт.
(1996) сопоставляли действие валсартана (80 мг/сут) и амлодипи-
на (5 мг/сут) в течение 12-недельного сравнительного исследова-
ния у 168 больных ЭГ. Результаты были почти одинаковы: нор-
мализацию диастолического АД или его снижение на 10% отме-
чали у 67% и 60% больных соответственно; переносимость двух
препаратов была хорошей, правда, амлодипин чаще вызывал по-
344
явление отеков на нижних конечностях. Интересны результаты
сопоставления валсартана (80 мг/сут) и эналаприла (20 мг/сут).
Адекватный противогипертензивный эффект после 8-недельного
лечения был получен при лечении валсартаном в 34,5%, при
приеме эналаприла — в 20% случаев. Частота появления каш-
ля — у 1 больного, принимавшего валсартан, и 3 больных, ле-
чившихся эналаприлом.
Сравнение валсартана (80 мг/сут) и лизиноприла (10 мг/сут)
показало сходство в эффективности этих препаратов. Кашель
при лечении валсартаном случился в 1,1% против 8% — при ли-
зиноприле.
У 669 больных ЭГ сравнивались два блокатора АП: лозартан
(50 мг/сут) и валсартан (80 мг/сут). Изменения диастолического
давления в двух группах больных были сопоставимыми, частота
нежелательных эффектов была одинаковой.
По некоторым данным, ирбесартан обладает самым мощным
противогипертензивным действием среди блокаторов АП. Пере-
носимость валсартана была хорошей как у больных пожилого
возраста, так и у больных с хронической сердечной недостаточ-
ностью (исследование ELITE).
В последнее время большой интерес вызывает новый блока-
тор АП — эпросартан (теветен). В отличие от других препаратов
этого класса, работающих на уровне постсинаптических рецеп-
торов АТ], эпросартан оказывает блокирующее действие на пре-
синаптические рецепторы АТ]. Следствием этого является одно-
временная блокада ренин-ангиотензиновой и симпатико-адре-
наловой систем. Как подчеркивает Ж. Д. Кобалава (2001), одно-
временная блокада нейрогуморальных систем необходима при
таких состояниях, как стресс-индуцированная или рабочая ги-
пертензия, изолированная систолическая, алкогольная, АГ после
инсульта.
Итак, эпросартан — одно вещество с двумя механизмами
действия (Белоусов Ю. Б., 2001). Препарат назначают один раз в
сутки; его дозировка в начале лечения обычно не превышает
600 мг.
В одном из исследований сравнивался лозартан с теветеном.
У больных с мягкой АГ частота положительных ответов на теве-
тен составила 73%, а на лозартан — только 53%. В другом иссле-
довании сопоставляли эффективность теветена и эналаприла.
345
Первый препарат обеспечил снижение АД у 70% больных, вто-
рой — лишь у 54% пациентов.
Достоинством теветена является низкая частота побочных
эффектов; препарат не оказывает отрицательного влияния на ли-
пидный, углеводный обмен, уровень калия и мочевой кислоты в
плазме.
Теветен у больных с тяжелой АГ активно понижает систоли-
ческое АД, что позволяет надеяться на благоприятное влияние
препарата на частоту инсультов (Остроумова О. Д., 2001).
По мнению Ж. Д. Кобалавы, Ю. В. Котовской (2001), соот-
ношение между блокаторами АП представляется таким: эпро-
сартан -> валсартан -> лозартан -> ирбесартан.
Кооперативные, многоцентровые исследования ближайших
лет покажут, какое место займут блокаторы АП в кардиологиче-
ской практике. Я имею в виду пока не законченные исследова-
ния, известные под аббревиатурами SCOPE, LISE, VALUE,
ABCO-2D. Мне кажется, при объективном анализе уже имею-
щихся данных, что энтузиазм, высказываемый некоторыми кли-
ницистами по поводу этого класса препаратов, сменится более
спокойным и объективным отношением к ним. Во всяком слу-
чае, пока трудно говорить о преимуществах блокаторов АП перед
ингибиторами АПФ в их эффективности понижать АД при ЭГ.
Ингибиторы вазопептидазы (эндопептидазы)
Предсердный натрийуретический гормон (ПНГ) — пептид,
усиливающий натрий-гидрурез в почках и тормозящий секрецию
альдостерона надпочечниками. Оба механизма осуществляют
противогипертензивную функцию (Хирманов В. Н., 1993).
В 1992 г. был впервые создан препарат, препятствующий рас-
паду ПНГ — ингибитор метилэндопептидазы — фермента, раз-
рушающего ПНГ. Препарат, получивший название кандоксат-
рил, — провещество, гидролизующееся в организме в кандоксат-
рилат, который и ингибирует эндопептидазу. Кандоксатрилат
повышал уровень ПНГ только в 2 раза, что было недостаточно
для расширения артериол у больных ЭГ.
Новый, существенный шаг вперед в этом направлении был
сделан благодаря синтезу препарата — омапатрилата, который,
как выяснилось, одновременно ингибирует нейтральную эндо-
пептидазу и АПФ. Блокада эндопептидазы предотвращает разру-
шение ПНГ, брадикинина и адреномедулина, что обеспечивает
346
более выраженный гипотензивный эффект. Как показали ис-
следования R. Zusmann и соавт. (1999), омапатрилат в дозе
80 мг/сут. вызывал нормализацию диастолического АД у
69% больных с умеренной и у 83% больных с мягкой АГ. При
этом систолическое АД снизилось в среднем на 23,8 мм рт. ст.,
диастолическое — на 16,9 мм рт. ст. Сравнительное изучение ги-
потензивной активности омапатрилата, амлодипина и лизино-
прила показало, что прием больными внутрь 80 мг омапатрилата
обеспечил нормализацию систолического и диастолического АД
у 71% больных с мягкой АГ и у 40% больных с умеренной АГ,
тогда как амлодипин дал такой же результат у 60 и 26% больных,
а лизиноприл — у 51 и 17% больных соответственно (Waeber В.
et al., 1999). В ряде других сравнительных исследований эти дан-
ные получили подтверждение (Мартынов А. И. и др., 2000), в их
числе наблюдение сотрудников кафедры кардиологии МАПО
(г. С.-Петербург).
Укажу также, что омапатрилат хорошо переносится больны-
ми, в частности лицами пожилого и старческого возраста. Фар-
макокинетика препарата сопоставима у больных с нормальной и
нарушенной функцией почек. Активность препарата не зависит
от уровня ренина в плазме. Как видно, омапатрилат может войти
в число эффективных средств лечения ЭГ.
Современная стратегия лечения ЭГ;
выбор лекарственных препаратов для отдельного больного
Настало время сделать обобщение. Большое и все увеличи-
вающееся число противогипертензивных средств, обладающих
примерно одинаковой активностью, затрудняет выбор лечебного
препарата(ов) для конкретного больного, т. е. индивидуальный
выбор наиболее эффективного средства. Мне кажется, что эту
важную проблему можно удовлетворительно решить, если вос-
пользоваться предложенной мною профилизацией больных ЭГ,
т. е. выделением различных патогенетических форм ЭГ, требу-
ющих индивидуального лечения.
Напомню, что единая концепция лекарственного лечения ЭГ
была впервые разработана в начале 70-х годов. Она была названа
ступенчатым методом терапии ЭГ, получившим вскоре широкое
распространение и общее признание. Правда, мне неоднократно
приходилось встречать врачей, которые, подобно известному ге-
рою Мольера, не подозревавшему, что он говорит прозой, не
347
знали, что они в своей лечебной практике пользовались ступен-
чатым методом.
В основе этого метода лежало представление об ЭГ как о за-
болевании унитарной природы с единообразными механизмами
повышения АД. Естественно, что такая трактовка предопределя-
ла стереотипный подход к лечению ЭГ, главной целью которого
было снижение АД до нормальных или субнормальных величин.
Предусматривалось, в зависимости от тяжести заболевания,
уровня и устойчивости повышенного АД, назначение противоги-
пертензивных средств в определенной последовательности: от
монотерапии на 1-й ступени (диуретик или 0-адреноблокатор)
до политерапии (сочетания из 2—3-х гипотензивных средств:
симпатолитик + диуретик + периферический вазодилататор) —
на 2—3-й ступени лечения. Некоторые клиницисты сравнивают
такой достаточно «жесткий терапевтический алгоритм» с пова-
ренной книгой, в которой четко регламентированы кулинарные
предписания.
Я не разделяю такой резко отрицательной оценки ступенча-
того лечебного метода, которым достаточно успешно пользова-
лись многие годы; я полагаю, что он не так уж строго ограничи-
вал возможности маневра вдумчивого врача, привыкшего при
выборе гипотензивных препаратов ориентироваться не только на
болезнь, но главным образом на особенности клиники конкрет-
ного больного. Бесспорно также и то, что ступенчатый метод ле-
чения ЭГ сыграл значительную роль в понижении общей смерт-
ности больных ЭГ (примерно на 17—20%), а смертности от моз-
говых инсультов — даже на 40% (Moser М., 1987).
И все же были веские причины, которые нельзя не разделять,
для отхода от ступенчатого метода и замены его более современ-
ным и эффективным лечебным методом. Таких причин было не-
сколько.
Во-первых, все больше накапливалось экспериментальных и
клинических данных, свидетельствовавших о неоднородности
ЭГ: этиологической, патогенетической, биохимической и гемо-
динамической (этот вопрос подробно рассмотрен выше). Следо-
вательно, и лечение этих «многих гипертонических болезней» (тер-
мин Г. Ф. Ланга) не может быть схематическим и единообраз-
ным, как прежде.
Во-вторых, еще большее значение для отказа от привычного
и даже удобного ступенчатого метода имела все усиливавшаяся
348
неудовлетворенность клиницистов тем, что, несмотря на сниже-
ние числа инсультов, смертность среди лечившихся больных ЭГ
от ИБС (инфаркт миокарда, внезапная коронарная смерть) не
только не уменьшалась, но, скорее, возрастала. Оказалось, как
отмечалось выше, что многие из эффективных гипотензивных
средств, понижая АД, одновременно вызывают ухудшение «ли-
пидного зеркала» крови — важнейшего фактора риска ИБС. Ряд
других препаратов усиливает гипертрофию левого желудочка,
понижает толерантность к глюкозе, отрицательно влияет на
ЦНС и т. д.
Таким образом, как подчеркивал A. Zancbetti (1993), лечение
ЭГ прежде было в основном направлено на профилактику ее
осложнений, но мало воздействовало на прогрессирование сосу-
дистой патологии, в особенности коронаросклероза, т. е. недо-
статочно влияло на отдаленный прогноз заболевания.
Наконец, была третья причина, способствовавшая отходу от
ступенчатого метода лечения ЭГ. За последние годы существен-
но пополнился «фонд» фармакологических средств, а также ста-
ли известны ранее не открытые свойства старых препаратов, что
позволило в большей степени индивидуализировать лечение
больных.
Какие же основные положения новой стратегии лечения ЭГ,
принятой в 90-х годах и заменившей ступенчатый метод? Ее глав-
ные положения: выбор таких противогипертензивных средств, ко-
торые не вызывают неблагоприятных метаболических эффектов и
обеспечивают необходимый контроль за АД на протяжении суток
при однократном приеме внутрь препаратов. Я полагаю, что кон-
кретные цели такого лечения можно сформулировать следующим
образом:
1) индивидуализированная, дифференцированная терапия
больных после их предварительного профилирования, т. е. опре-
деления клинико-патогенетической формы ЭГ у каждого больного;
2) обязательная оценка возможных отрицательных воздейст-
вий гипотензивных средств на «факторы риска» ИБС (гиперли-
пидемию и т. д.), толерантность к глюкозе, гипертрофию левого
желудочка, психоэмоциональную сферу больного;
3) отказ от жестких схем лечения; возможность проведения
монотерапии не только у «легких» больных ЭГ, но и у тех, кото-
рые нуждаются в более интенсивном лечении, хотя комбиниро-
ванное лечение несомненно более предпочтительно;
349
4) смена «иерархии» противогипертензивных препаратов:
если прежде лечение начинали с диуретика или р-адреноблока-
тора и только на поздних стадиях ЭГ прибегали к cq-адренобло-
каторам, Са-блокаторам, ингибиторам АПФ, то при новом под-
ходе эти препараты могут быть стартовыми.
Вопросы профилирования больных ЭГ были подробно рас-
смотрены в главе 3 этой монографии. Больным с гиперадренер-
гической формой заболевания больше показаны р-адрено-
блокаторы без ВСА (пропранолол, метопролол, надолол и др.).
Весьма эффективны и центральные а.2-адреностимуляторы (кло-
фелин, гуанабенз, эстулик и др.). Их применение можно рас-
сматривать как заместительную терапию (см. главу 2). Широкие
показания имеют и стимуляторы ^-имидазолиновых рецепторов
продолговатого мозга. Надо иметь в виду, что больные с этой
формой ЭГ сравнительно слабо реагируют на диуретики.
При гипергидратационной (объем-натрий-зависимой) форме
ЭГ наиболее показаны: малосолевая диета (до 3—4 г поваренной
соли в день) и диуретики; а также Са-блокаторы, которым тоже
свойствен диуретический эффект. Блокаторы ^-адренергических
рецепторов малоэффективны у больных с признаками гипергидра-
тации.
При ангиотензинзависимой (гиперрениновой) форме ЭГ
можно добиться заметного понижения (нормализации ) АД с по-
мощью ингибиторов АПФ, а также p-адреноблокаторов. Эти
лица слабее реагируют на диуретики, поскольку имеют уменьшен-
ный ОЦП; у некоторых из них регистрировались даже прессор-
ные реакции в ответ на прием диуретика (Buhler F. et al., 1984).
Что касается центрального вопроса о влиянии противогипер-
тензивных препаратов на липидный профиль больного, то преж-
де всего напомним, что, согласно результатам исследовательской
липидной программы, снижение плазменной концентрации хо-
лестерина на 1% сопровождается уменьшением на 2% коронар-
ного риска (LRCP, 1984). К фактам, которые были представлены
выше, следует добавить следующие.
Тиазидовые диуретики в больших дозах усиливают 10 из 13 из-
вестных факторов риска ИБС (Houston М., 1989). Правда, неже-
лательные метаболические сдвиги, вызываемые этими препара-
тами, могут быть ограничены, если воспользоваться малыми до-
зами, например 12,5 (25) мг гипотиазида.
350
Блокаторы p-адренергических рецепторов усиливают 5 из
13 факторов риска ИБС (Houston М., 1989). Выше при обсужде-
нии этого вопроса я подчеркивал спорность этого слишком кате-
горического утверждения. Так, по мнению М. Kendall (1999),
J. Wirksrtand (1991), возрастание в плазме содержания триглице-
ридов, стимулируемое p-адреноблокаторами, нельзя автоматиче-
ски рассматривать как отрицательное явление. Столь же очевид-
но, что при некоторых вариантах течения ЭГ р-адреноблока-
торам пока нет альтернативы. По-видимому, в будущем, как
упоминалось, предпочтительным станет использование р-адре-
ноблокаторов длительного действия, а также препаратов с до-
бавочной вазодилататорной активностью (целипролол, карведи-
лол, сервидилол), которые, понижая ОПС, подавляют ответную
рефлекторную синусовую тахикардию. Вызывают также инте-
рес недавно синтезированные p-адреноблокаторы с высокой сте-
пенью селективности (бисопролол и др.), которые, по предвари-
тельным данным, нейтральны по отношению к липидам крови
(van Zwieten Р., 1992).
Блокаторы сц-адренорецепторов; их влияние на уровень ли-
пидов плазмы имеет антиатерогенную направленность. Следова-
тельно, эти препараты можно применять у больных ЭГ, имею-
щих гиперлипидемию или другие «факторы риска» ИБС. Имеет-
ся, например, указание, что применение празозина вместе с низ-
кохолестериновой диетой способствует уменьшению риска ИБС
у мужчин с ЭГ на 45% и приблизительно в 2—3 раза по сравне-
нию с тем, что обеспечивается одной низкохолестериновой дие-
той (Grimm R., Hunninghake D., 1986). Они понижают АД у
больных всех возрастных групп; новые препараты этого класса
(доксазозин и теразозин) отличаются от празозина медленным
действием и более длительным гипотензивным эффектом после
однократной дневной дозы. Эти вещества вызывают меньшую
ответную тахикардию и реже — ортостатические реакции по
сравнению с празозином. Празозин сравнительно редко использу-
ется для монотерапии ЭГ, обычно его комбинируют с р-адрено-
блокатором, тормозящим ответную синусовую тахикардию. В
подобных случаях требуется предварительная оценка потенци-
альных метаболических реакций, которую могут вызвать не
один, а уже два препарата.
351
Еще одна обсуждавшаяся выше проблема, общая для всех
периферических вазодилататоров, включая ai-адреноблокаторы
(кроме Са-блокаторов), — развивающаяся со временем задержка
натрия и воды (отеки голеней и т. д.); ее устраняют спорадиче-
скими (!) приемами диуретика на фоне хронической a i-адренер-
гической блокады. Необходимо еще раз подчеркнуть, что ai-ад-
реноблокаторы не следует сочетать с центральными а2-адрено-
стимуляторами, активность которых понижается.
Центральные аз-адреностимуляторы сами по себе (клофелин
и гуанабенз) понижают уровень общего холестерина плазмы, од-
нако они не предотвращают его возрастание при комбинации с
диуретиками (Weinberger М., 1987). Блокаторы ^-имидазолино-
вых рецепторов (миксонидин, цинт) оказывают благоприятное
влияние не только на АД, но и на многие проявления метаболи-
ческого синдрома.
Отрицательное влияние на липидный обмен Са-блокаторов в
клинике малозаметно. Экспериментальные данные, скорее, ука-
зывают на присущую им антиатерогенную активность, что более
отчетливо выражено у новых антагонистов кальция из подкласса
дигидропиридина — исрадипина и никардипина. В отличие от
остальных вазодилататоров Са-блокаторы не вызывают задержки
воды и натрия. Способность вызвать диуретическую реакцию
позволяет использовать Са-блокаторы у больных ЭГ, склонных к
задержке натрия и воды, а также в сочетании с противогипертен-
зивными препаратами, тормозящими натрий(гидр)урез. Са-бло-
каторы не рекомендуют сочетать с тиазидными или тиазидопо-
добными диуретиками (близость механизмов антигипертензив-
ного действия).
Ингибиторы АПФ не оказывают отрицательного влияния на
уровень липидов плазмы, толерантность тканей к инсулину, кон-
центрацию глюкозы и мочевой кислоты. Как и антагонисты Са,
эти препараты задерживают прогрессирование гипертрофии ле-
вого желудочка и улучшают коронарный кровоток. Регрессия ги-
пертрофии левого желудочка особенно четко проявляется при
применении периндоприла — сравнительно нового ингибитора
АПФ. Надо иметь в виду, что к ингибиторам АПФ более чувст-
вительны больные ЭГ молодого и среднего возраста.
Приводим небольшую итоговую таблицу 16, в которой указа-
ны относительные или абсолютные противопоказания к назна-
чению ряда противогипертензивных препаратов больным ЭГ,
352
Таблица 16
Противопоказания к назначению противогипертензивных средств
Сопутствующие ЭГ расстройства или заболевания Абсолютные или относительные противопоказания
1. Гиперлипопротеидемия Диуретики в больших дозах, резерпин, а-метилдопа, p-адреноблокаторы (?)
2. Сахарный диабет, нарушения угле- водного обмена Диуретики в больших дозах, p-адреноблокаторы (инсулин), гуанетидин, гуанадрел, резерпин, а-метилдопа
3. Подагра, гиперурикемия Диуретики, кроме арифона
4. Хроническая почечная недостаточ- ность Ингибиторы АПФ (при повышенной активности ренина в плазме), р-ад- реноблокаторы, гуанетидин, гуанад- рел, резерпин
5. Стенокардия Пиндолол, ацебуталол; прямые вазо- дилататоры (гидралазин, минокси- дил и др.)
6. Застойная сердечная недостаточ- ность Резерпин, гуанетидин, верапамил (?), p-адреноблокаторы (в опреде- ленных случаях), кроме карведилола и др. препаратов
7. Сердечные аритмии Пиндолол, ацебуталол, прямые вазо- дилататоры
8. Заболевания ЦНС (больные психо- зами) p-адреноблокаторы, резерпин (ино- гда), гуанетидин, а-метилдопа
9. Мигрень Вазодилататоры
10. Заболевания периферических сосу- дов (атеросклероз) p-адреноблокаторы
11. Хронические заболевания печени а-метилдопа, p-адреноблокаторы (разрушаются в печени)
12. Пептическая язва желудка и двенад- цатиперстной кишки Резерпин, гуанетидин, гуанадрел
13. Менопауза (симптомная) Прямые вазодилататоры
14. Синуситы, риниты Резерпин, p-адреноблокаторы
12 Зак 3207
353
осложненной некоторыми заболеваниями или расстройствами
метаболизма.
Упомянем также о показаниях к назначению при глаукоме
клофелина, а также p-адреноблокаторов и диуретиков (особенно
диакарба); назначение больным с аденомой предстательной же-
лезы — aj-адреноблокаторов (празозин, доксазозин, теразозин).
В заключение еще раз напомню, что центральные аг-адрено-
стимуляторы, а[-адреноблокаторы, Са-блокаторы и ингибиторы
АПФ эффективны в качестве монотерапии у 50—70% больных.
Комбинация двух или трех этих препаратов дает синергический
эффект, обеспечивая нормализацию АД у 90% больных с легкой
и средней по течению ЭГ.
Лечение АГ у женщин, находящихся в периоде постменопаузы
Патогенетические и клинические различия АГ у женщин и
мужчин, особенно у женщин в менопаузе, делают необходимым
написание специального раздела о лечении гипертензии у таких
женщин. Тем более, что АГ у женщин в постменопаузе составля-
ет около половины всех случаев гипертензии (Быстрова М. М.,
БритовА. Н., 1999). В нашей литературе этому вопросу посвяще-
ны многочисленные содержательные публикации Н. П. Масло-
вой и Е. И. Барановой.
В целом среди женщин выявляется более высокая информи-
рованность об имеющейся у них АГ и зарегистрирован более
значительный охват лечением, чем среди мужчин (Shalnova S.
et al., 1998; Margus-Vidal P. et al., 1997). Об этом, в частности,
свидетельствуют итоги 46 популяционных исследований в
22 странах, о которых сообщили О. Klugel и соавт. (1997). Про-
цент женщин, принимавших лечение по поводу АГ, был более
высоким по сравнению с мужчинами; максимальные различия
выявились в СССР; 50% женщин и 25% мужчин, страдавших АГ,
принимали противогипертензивные препараты.
Для женщин, находящихся в постменопаузе, лучшими препа-
ратами для лечения АГ, по-видимому, являются тиазидные ди-
уретики, которые активно снижают АД и уменьшают частоту
развития остеопороза (Wasnich R. et al., 1990). В отличие от тиа-
зидных диуретиков другие гипотензивные средства повышают
потерю костной ткани (Felson D. et al., 1991). Правда, имеются
пока не подтвержденные данные о том, что лозертан также ока-
354
зывает гипокальцийуретическое действие, подобно гипотиазиду
(Apandaa Р. et al., 1998).
Еще один препарат, активно изучавшийся у женщин с АГ в
постменопаузе, был ингибитор АПФ — моэксиприл. В многоцен-
тровом контролируемом исследовании, известном под аббревиа-
турой MADAM, оценивалось действие гипотиазида, атенолола,
нитрендипина наряду с моэксипролом. Выбор последнего препа-
рата был связан с его благоприятным влиянием на костные тка-
ни, особенно уязвимые у женщин в период менопаузы.
В последние годы много внимания уделяется возможности
проведения у женщин с АГ в постменопаузе заместительной гор-
мональной терапии (ЗГТ). Эстрогены оказались эффективными
не только для купирования проявлений климактерического син-
дрома, но и для лечения сердечно-сосудистых нарушений и про-
филактики остеопороза. Правда, в России принимают внутрь
гормональные препараты после менопаузы не более 1% женщин,
тогда как в Калифорнии — до 30% женщин (Sullivan J., 1996).
Имеются некоторые данные о влиянии ЗГТ на АД при АГ у жен-
щин в постменопаузе. С. Jespersen и соавт. (1983) вводили таким
больным нормальные эстрогены в течение 6 мес. и обнаружили
небольшое, но достоверное снижение АД. На фоне лечения
17ь-эстрадиолом (при трансдермальном его введении) АД пони-
жалось как в дневное, так и в ночное время; одновременно реги-
стрировались некоторое урежение пульса и понижение уровня
норадреналина в крови (Mercuro G. et al., 1997).
Все же эффекты ЗГТ нельзя признать значительными, поэтому
предпринимаются попытки применять ЗГТ совместно с гипотен-
зивными средствами. Оказалось, что сочетание 17ь-эстрадиола и
каптоприла обеспечивает более достоверное понижение АД, чем
при лечении одним каптоприлом.
В общем, я считаю правильным утверждение М. М. Быстро-
вой, А. Н. Бритова (1999), что ЗГТ не может рассматриваться как
самостоятельный вид лечения АГ у женщин в постменопаузе.
В этом разделе полезно упомянуть, что прием оральных кон-
трацептивов более молодыми женщинами приводит к подъему
АД в пределах его нормальных значений. Однако у женщин,
пользующихся оральными контрацептивами, АГ встречается в
2—3 раза чаще, чем у женщин, не применяющих эти вещества.
Подъему АД способствуют возраст >35 лет, ожирение и потреб-
ление табака (курение). Если женщина не может отказаться от
курения, ей не следует принимать оральные контрацептивы.
355
Лечение АГ, возникающей у женщин во время беременности
АГ регистрируется у 8—10% беременных, что нередко создает
серьезные угрозы здоровью, даже жизни, матери и плода.
АД> 170/110 мм рт. ст. является общепризнанным критерием ри-
ска возникновения инсульта или эклампсии. В этих случа-
ях лечение АГ становится обязательным. По-
вышение АД >150/100 мм рт. ст. служит основанием для госпи-
тализации беременной женщины (Shear R. et al., 1999). Ниже
приводится современная схема лечения АГ во время бере-
менности.
Таблица 17
Лечение АГ во время беременности
АГ 1—2 степени Препараты первой линии: Метилдопа по 500 мг 2—4 раза в день Препараты второй линии: Лабеталол 200—100 мг (2) Пиндолол 5—15 мг (2) Окспренолол 20—80 мг (2) Нифедипин SR 20—40 мг (2) Препараты третьей линии: Метилдопа + препарат второй линии или гидро- лазин 10—50 мг 2—4 раза в день Клонидин 0,05—0,2 мг (2—4)
При наличии заболеваний почек: Диуретики
АГ 3 степени Препараты первой линии'. Гидралазин 5—10 мг болюс внутривенно, при необходимости повторное введение через 20 мин до 30 мг или внутривенно введение по 3—10 мг/ч Лабеталол 10—20 мг болюс или в/в введение 1—2 мг/ч Нифедипин по 10 мг каждые 1—3 ч
При рефрактерности к пре- паратам первой линии Диазоксид в/в Нитропруссид Na в/в
Надо также заметить, что p-адреноблокаторы могут вызвать
задержку роста плода, поэтому они безопасны только в 3-м три-
местре беременности. Для купирования гипертензивных кризов
показано введение сульфата магния, гидралазина или лабетало-
356
ла. Диуретики используют ограниченно из-за опасений снизить
ОЦП, который уже снижен при беременности. Беремен-
ным противопоказаны ингибиторы АПФ и
блокаторы рецепторов АП (цитировано по докладу
экспертов научного общества изучения АГ, 1999).
Лечение АГ у пожилых и старых больных*
На первый взгляд, наиболее рациональным представляется
использование для снижения АД у старых людей нефармаколо-
гических методов лечения. Именно так я и рекомендую посту-
пать, хотя, по свидетельству ряда опытных клиницистов, такой
подход встречает затруднения у этой группы больных (Amery А.
et al., 1980; Stassen J. et al., 1985; Fagard R. et al., 1985). Как под-
черкивает Ж. Д. Кабалава (1999), обобщая международный опыт,
«сомнения в необходимости лечения пожилых пациентов (с АГ)
остались в прошлом».
При назначении старым людям с АГ лекарственных препара-
тов (а это бывает необходимым) приходится считаться с рядом
ограничений, поскольку этим людям присущ комплекс патофи-
зиологических признаков, существенно отличающих их от более
молодых больных. Еще раз подчеркнем, что имеются в виду:
а) нестабильность гемодинамики; уменьшение степени нагрузоч-
ной тахикардии в условиях, когда в ней возникает необходи-
мость; б) чрезмерная синусовая брадикардия в покое, способ-
ствующая понижению МО сердца; в) уменьшение коронарного
резерва; г) сниженная реактивность барорефлекса; д) редуциро-
ванность функций, опосредуемых p-адренорецепцией; е) пони-
женная активность ренина плазмы; ж) усиленная склонность к
сц-адреноконстрикции сосудов; з) повышенная склонность к ва-
зоконстрикции, связанная с ионами Са++; и) побочные лекарст-
венные реакции, которые возникают у лиц старше 60 лет в 2—
3 раза чаще, чем у молодых людей; эти реакции иногда могут
быть опаснее самой гипертензии.
Все эти обстоятельства заставляют проявлять осторожность
при снижении АД у старых людей фармакологическими средст-
вами. Лекарственные препараты, часто с успехом применяемые у
молодых больных, могут не подходить старым больным с АГ.
* Речь пойдет о всех разновидностях АГ у этой категории больных.
357
По уже цитированным данным К. Ueda и соавт. (1989), в те-
чение периода времени с 1973 по 1983 г. смертность от сосуди-
стых заболеваний мозга у старых людей с АГ снизилась в 28 из
32 стран мира в среднем на 20% и больше; смертность от ИБС
понизилась больше чем на 10% только в 19 из 32 стран. Несколь-
ко раньше J. Сооре и Т. Warrender (1987) пришли к выводу, что
лечение АГ у стариков не влияет на число случаев инфаркта
миокарда и смертности от него. Наконец, кооперативные иссле-
дования, известные под аббревиатурами EWPHE (European Wor-
king Party on Hypertension in the Elderly) и HEP (Hypertension El-
derly Patients), подтвердили, что лечение АГ у старых людей приво-
дит к снижению частоты инсультов. Но ни одно из этих иссле-
дований не показало такого же уменьшения случаев инфаркта
миокарда и острой коронарной недостаточности, особенно среди
женщин.
Выдвигается ряд объяснений, главные из которых: а) ИБС
прогрессирует независимо от АГ; б) лекарственные препараты,
понижая АД, могут одновременно усиливать «факторы риска»
ИБС (этот вопрос мы обсудили выше).
В 1986—1987 гг. появились сообщения о J- и U-кривых, от-
ражающих математическую (графическую) зависимость между
числом коронарных эпизодов у старых больных с АГ и уровнем
АД, достигнутым в результате лекарственной терапии. J-кривую,
или «dog-legft-феномен, впервые описал J. Anderson (1978), кото-
рый подверг повторному анализу данные, полученные в г. Фре-
мингейме (между полученными в результате лечения величи-
нами диастолического давления и числом осложнений ИБС вы-
явилось соотношение в форме J-кривой). В свою очередь,
Н. Stewart (1980) нашел, что связь между понизившимся дав-
лением и числом случаев инфаркта миокарда у стариков со
средней и тяжело протекающей АГ имеет характер U-образной
кривой.
Как четко продемонстрировали A. Cruikscank и соавт. (1988),
G. Leonetti и соавт. (1992), число умерших от ИБС среди старых
по возрасту больных АГ, у которых диастолическое давление
под влиянием фармакологических средств понижалось до 80—
90 мм рт. ст., было меньше, чем у таких же больных, имевших
более низкие (!) или более высокие величины диастолического дав-
ления. Следовательно, существуют опасения в отношении
слишком сильного снижения диастолического АД, особенно у
358
больных с коронарным атеросклерозом (гипотеза J-образной
кривой) (Kannel W., 2000).
Что касается систолического давления, то его снижение до
уровня 137—148 мм рт. ст. сопровождалось уменьшением смерт-
ности от мозгового инсульта; при дальнейшем снижении систо-
лического давления, особенно до уровня 120 мм рт. ст., число
смертей возрастало (!). Мы уже подчеркивали, что если у старого
человека регистрируется АД порядка 160—170/75—85 мм рт. ст. и
он при этом не испытывает неприятных ощущений, то врачу не
всегда следует назначать больному противогипертензивные пре-
параты, ограничившись на время контрольными осмотрами.
Правда, последние рекомендации (1994) рабочей группы Аме-
риканской ассоциации по лечению АГ у стариков более жестки:
систолическое давление следует понизить до уровня ниже
160 мм рт. ст. у тех больных, у которых оно превышало
180 мм рт. ст., и на 20 мм рт. ст. — у больных с исходным давле-
нием ниже 160 мм рт. ст. Таким образом, эта исследовательская
группа придерживается мнения, что оптимальной величиной сис-
толического давления для стариков с АГ является уровень 140—
160 мм рт. ст.
Основываясь на результатах наблюдений за 10 372 старыми
больными с АГ, J. Сооре и Т. Warrender (1987) тоже пришли к
выводу, что как слишком низкие, так и высокие величины сис-
толического давления связаны с возрастанием смертности этих
больных, что и находит отражение в U-образной кривой смерт-
ности. Таким образом, у старых людей связь между высотой АД
и смертностью более сложная, чем просто линейная зависи-
мость.
Как видно, скепсис некоторых клиницистов по поводу необ-
ходимости лечения старых людей с АГ можно понять, но согла-
ситься с такой позицией трудно.
Тактика лечения и выбор фармакологических препаратов
у стариков с АГ
Лекарственное лечение у стариков с АГ часто проводят в
форме монотерапии. Препарат выбирают, исходя из следующих
трех критериев: а) физиологическая приложимость, т. е. соответ-
ствие препарата особенностям гемодинамики больного; б) мини-
мальное число побочных реакций, вызываемых препаратом;
359
в) его благоприятное воздействие на заболевания, часто сопут-
ствующие АГ у старых людей.
Что касается физиологической приложимости, то наиболее
подходящими для этой категории больных являются тиазидовые
диуретики и Са-блокаторы из подкласса дигидропиридинов (ни-
федипин и его аналоги). Последним присущ умеренный диуре-
тический эффект, не приводящий к дальнейшему уменьшению
ОЦП, что вообще свойственно старым людям и обычно усилива-
ют диуретики. Антагонисты кальция активны при низкоренино-
вой форме АГ, поддерживают почечный и мозговой кровоток
(Gibes Т., Massie В., 1988). Имеются указания и на то, что
Са-блокаторы могут улучшать свойства аортальной эластической
камеры, способствуя тем самым понижению систолического дав-
ления, что особенно важно для этих больных.
Противогипертензивная активность фармакологических
средств изменяется в зависимости от возраста больных; это было
подтверждено в исследовании, представленном Е. Freis (1991).
В частности, удалось показать, что эффективность тиазидных
диуретиков выше у лиц 55 лет и старше, чем у более молодых
больных. Поэтому диуретики в малых дозах особенно показаны для
лечения пожилых больных с АГ.
Противогипертензивная активность p-адреноблокаторов про-
пранолола и надолола, по-видимому, мало зависит от возраста
больных, что противоречит данным J. Laragh и F. Biihler (1982),
которые отмечали более низкую активность p-адреноблокаторов
при АГ у пожилых людей. Эти авторы полагали, что у старых
больных АГ повышение АД в большей мере связано с увеличе-
нием ОВЖ, чем с вазоконстрикцией, что, по-видимому, не со-
всем верно.
По поводу полезности применения диуретиков у пожилых
больных АГ имеются данные плацебо-контролируемого исследо-
вания SHEP (Sistolic hypertension in the Elderly Program), в кото-
ром приняли участие 4376 больных 60 лет и старше с изолиро-
ванной систолической гипертензией (АД >160 мм рт. ст.). Для
начальной терапии использовался хлорталидон в дозе 12,5—
25 мг/сут; при необходимости к диуретику добавляли атенолол
или резерпин (1997).
За время наблюдения (в среднем 4,5 года) риск развития моз-
гового инсульта понизился на 36% по сравнению с контролем;
риск развития ИБС понизился на 27%.
360
В другом рандомизированном, контролируемом исследова-
нии Syst. Eur. (Systolic hypertension in Europa) принимали участие
4695 больных в возрасте 60 лет и старше, страдавшие изоли-
рованной систолической АГ. Больные получали нитрендипин
(10—40 мг/сут). Такая терапия обеспечила снижение риска разви-
тия инсульта в среднем на 42%, инфаркта миокарда — на 30%.
Наконец, сошлюсь ни исследование STOP-Hypertension, в
котором продемонстрирован благоприятный эффект терапии АГ
у больных старше 60 лет в Швеции (Dabof В. et al., 1991).
Gucyffier F. и соавт. (1999) исследовали эффективность сни-
жения АД у очень пожилых людей (старше 80 лет). Были проана-
лизированы результаты 7 рандомизированных, контролируемых
исследований, что составило группу из 1670 больных в возрасте
от 80 до 99 лет (76% женщин) со средним значением АД
180/80 мм рт. ст.; продолжительность наблюдения была 3,5 года.
Мета-анализ подтвердил, что у больных старше 80 лет необходимо
проводить антигипертензивную терапию. Частота случаев инсуль-
тов снизилась на 34% по сравнению с группой больных, не полу-
чавших лечения (р<0,05).
J. Staessen и соавт. (1998) подтвердили эффективность анта-
гонистов кальция у больных с изолированной систолической АГ.
Я уже упоминал исследование, в котором применили нитренди-
пин в качестве монотерапии или в комбинации с эналаприлом
или гипотиазидом (12,5—25 мг/сут). Это позволило отчетливо
снизить риск сердечно-сосудистых осложнений: внезапной смер-
ти — на 26%, частоты инсультов — на 44%, общей смертности —
на 42%. Несомненно, что диуретики, а также Са-блокаторы
улучшают прогноз при изолированной систолической АГ.
Что касается 0-адреноблокаторов, то они, по-видимому,
уступают диуретикам по способности предотвращать развитие
ИБС у больных АГ, а также снижать смертность от сердечно-со-
судистых заболеваний (Messerli F. et al., 1998). Установлено, что
гидрофильные 0-адреноблокаторы (атенолол и др.), в отличие от
липофильных препаратов (метопролол, тимолол, пропранолол),
не оказывают кардиопротективного действия у больных, пере-
несших инфаркт миокарда. Использование атенолола для на-
чальной терапии ЭГ у пожилых больных оправдано лишь при
наличии противопоказаний к назначению диуретиков, а также
при сочетании у больного АГ и ИБС (Сидоренко Б. А. и др.,
1999).
361
Ингибиторы АПФ, как и блокаторы АТ|-рецепторов, не мо-
гут быть отнесены к числу самых эффективных противогипер-
тензивных препаратов у пожилых больных, страдающих АГ. По
результатам исследования VACS (Veterans Affairs Cooperative
Study), активность каптоприла у больных 60 лет и старше не
превышала 54,5%. Этот показатель значительно ниже у негров
с АГ — 31,9%. Ингибиторы АПФ более показаны для лечения ЭГ
у больных, страдающих сахарным диабетом.
сц-адреноблокаторы (доксазазин и др.) остаются, как я уже
указывал, препаратами выбора для лечения больных ЭГ с сопут-
ствующей доброкачественной гиперплазией (аденомой) предста-
тельной железы. Агонисты центральных аг-адренергических ре-
цепторов (клонидин и др.) вызывают у пожилых больных АГ
слабость, сонливость, психическую депрессию. Кроме того, при
лечении клонидином нередко возникает «рикошетная» гипертен-
зия и, по-видимому, не происходит обратного развития гипер-
трофии левого желудочка (Сидоренко Б. А. и др., 1999).
В заключение этого раздела привожу итоговую таблицу, от-
ражающую эффективность различных противогипертензивных
препаратов у больных ЭГ разного возраста (исследование VACS —
Е. Freis, 1999).
Таблица 18
Эффективность различных противогипертензивных препаратов
в зависимости от возраста больных ЭГ
(1 год лечения больных с мягкой и умеренной формами ЭГ —
1292 мужчин)
Препарат Больные моложе 60 лет, % Больные 60 лет и старше, %
Атенолол 59,5 70,7
Г идрохлоротиазид 23,5 61,6
Дилтиазем 42,5 66,0
Каптоприл 48,7 54,5
Клонидин 65,6 68,3
Празозин 45,5 65,5
Хочу обратить внимание на достаточно высокую эффек-
тивность дилтиазема у пожилых больных с АГ. Это совпадает
362
с моими личными наблюдениями; особенно хорошие результаты
можно получить, комбинируя дилтиазем с периндоприлом.
Уместно рассмотреть еще один важный вопрос. Высказывалось
мнение, что антагонисты Са способствуют развитию онкологи-
ческих заболеваний у больных старше 65 лет. В широкомасштаб-
ном исследовании STEYII, длившемся 3 года, эти предположе-
ния не получили подтверждения (Trankwahlder R., 1997).
Уменьшение числа побочных, токсических эффектов дости-
гается назначением уменьшенных (!) доз всех препаратов и более
медленным, постепенным ходом лечения. Известная формула: «start
low, go slow» сохраняет свое значение (!).
Обращаясь к вопросу о влиянии противогипертензивных
средств на сопутствующие АГ заболевания, следует напомнить,
что Са-блокаторы являются не только гипотензивными, но и эф-
фективными антиангинальными средствами. Правда, больным, у
которых АГ сочетается с ИБС, Са-блокатор следует принимать
не слишком длительно и лучше с перерывами (паузами). Причи-
ны такой тактики были указаны в разделе о Са-блокаторах.
Весьма полезно старым людям, имеющим высокое систоли-
ческое давление, курсовое лечение препаратами, улучшающими
трофику мозга и мозговое кровообращение. К этой категории ве-
ществ относятся: трентал, винкапан, ноотропил, церебролизин,
ГАМК, циннаризин, эуфиллин и др. При необходимости боль-
ным назначают успокаивающие средства в малых дозах, включая
транквилизаторы (короткие курсы с перерывами). Разумеется,
больные этой группы нуждаются в систематическом врачебном
наблюдении, в контроле за АД (патронаж сестер). Принцип
«не навреди» особенно актуален при организации лечения АГ
у пожилых и старых людей.
Лечение ЭГ злокачественного течения
Это заболевание или фаза ЭГ требует от
врача быстрых и решительных действий. Ост-
рое нарушение функции почек, отек соска зрительного нерва,
тяжелая энцефалопатия, сердечная недостаточность — все это
означает, что решающее значение для конечного успеха терапии
могут иметь минуты или часы. Лечение ЭГ становится, следова-
тельно, неотложным. АД должно быть снижено без промедле-
ния, но не сразу до нормального уровня. Именно этими сообра-
жениями руководствуется врач при выборе лекарственных пре-
363
паратов, меньше заботясь об их отрицательных влияниях, кото-
рым придается столь важная роль при хроническом лечении
больных с доброкачественным течением ЭГ,
Диуретики «петли Генле» {фуросемид и др.) применяют в
больших дозах (если нет анурии). Известно, например, что
у ряда больных с острой азотемией и отеком соска зрительного
нерва лечение фуросемидом в дозе 200—640 мг в день в течение
32±7 мес способствовало явному улучшению функции почек,
исчезновению отека сетчатки, понижению среднего гемодинами-
ческого давления на 22% (Mroczek W. et al., 1977).
Из числа обязательно включаемых в программу лечения ва-
зодилататоров следует назвать антагонисты кальция, а ]-адре-
ноблокаторы (доксазозин до 10 мг/день), ингибиторы АПФ
(эналаприл до 20—40 мг/день); последние не противопоказаны
при почечной недостаточности (см. выше), но не назна-
чаются больным с двусторонним сужением
почечных артерий.
Используются предельные дневные дозы и других нейро-
тропных средств: клофелин — 1,5—2 мг; пропранолол — 1—2 г;
гуанетидин — 200—400 мг. Р. Kincaid-Smith и соавт. (1977) на-
блюдали высокую активность p-адреноблокаторов: гипотензив-
ный ответ прогрессирующе возрастал по мере увеличения суточ-
ной (дневной) дозы пропранолола до 1—3 г.
Можно, к примеру, рекомендовать некоторые сочетания ле-
карств (дозы суточные): 1) анаприлин (320 мг) + фуросемид
(500 мг) + доксазозин (10 мг); 2) гуанетидин (150 мг) + урегит
(150 мг) + эналаприл (20 мг); 3) клофелин (1,5 мг) + фуросемид
(200 мг) + доксазозин (10 мг) и т. д.
Разумеется, при таких массивных дозировках трудно избе-
жать побочных реакций, но с ними приходится мириться, по-
скольку речь идет о спасении жизни больного.
Следует в заключение обсудить вопрос о солевом режиме для
больных злокачественной ЭГ. Известная формула, что «соль
вредна для гипертоников», не подходит для больных со злокаче-
ственным течением ЭГ. Они часто утрачивают способность де-
понировать натрий и быстро впадают в состояние натриевого де-
фицита, что углубляет повреждение почек. При азотемии и
очень интенсивной терапии диуретиками нельзя резко понижать
содержание в диете поваренной соли. Лишь в некоторых случаях
злокачественной гипертензии может оказаться полезным сочета-
364
ние малонатриевой диеты, например, рисового стола Кемпнера
и активного лечения противогипертензивными препаратами.
По-видимому, у ряда больных со злокачественным течением ЭГ
с успехом может быть использован обменный плазмаферез
(Ализаде И. Г., Караева Н. Т., 1993).
Лечение гипертензивных кризов
ГК — угрожающее жизни больного осложнение, при котором
требуются быстрые и активные действия врача, направленные на
снижение АД. Благодаря синтезу новых гипотензивных препара-
тов и лучшему пониманию механизмов ГК, в последние годы не-
сколько изменились методы их лечения, но основные терапевти-
ческие принципы сохранили свое значение. Их можно кратко
сформулировать таким образом:
1. Обследуя больного и одновременно собирая анамнез (рас-
спрос больного и его родственников), врач не должен ограничи-
ваться измерением АД. Обязательными представляются: иссле-
дование пульса (частота, регулярность; наполнение на обеих ру-
ках), определение загрудинной пульсации, пальпация брюшной
аорты (если есть соответствующие жалобы), артерий на нижних
конечностях, печени и почек; перкуссия границ сердца, аускуль-
тация. При выслушивании сердца обращают внимание на харак-
тер I тона, появление III тона, наличие срединного или позднего
систолического «клика» или шума («клик»-синдром — результат
ишемического (нагрузочного) повреждения субэндокарда и (или)
папиллярных мышц под воздействием высокого АД); определя-
ют, есть ли акцент II тона на аорте, который при значительном
повышении АД приобретает музыкальный оттенок. Весьма жела-
тельны запись ЭКГ и сопоставление ее со старыми ЭКГ. Важно
ознакомиться с имеющимися у больного документами, выяс-
нить, переносил ли он ГК, как реагировал на гипотензивные
средства (эффективность, побочные реакции), были ли мозговые
инсульты, инфаркт миокарда, заболевания почек, нет ли у боль-
ного значительного увеличения предстательной железы (нельзя
назначать диуретик из-за угрозы задержки большого количества
мочи в мочевом пузыре). Все эти действия врача должны быть
оперативными, без потери времени, но и без суетливости. Нель-
зя реагировать на резкий подъем АД и тяжелое состояние боль-
ного неосторожными восклицаниями, которые могут причинить
ущерб больному и его родственникам.
365
2. При формулировке диагноза упоминается не только ГК
(его тяжесть и форма), но и основное заболевание, вызвавшее
криз, а также осложнения ГК, если они возникли.
3. Врач должен располагать сравнительно небольшим, но пол-
ноценным набором гипотензивных средств («обойма»), которые
способны сами по себе или в различных сочетаниях обеспечить
понижение АД с нужной скоростью и до неопасного уровня. В та-
кой набор можно было бы включить: нейротропные средства —
клофелин (гемитон); диуретик — лазикс (фуросемид); прямой ва-
зодилататор — нитропруссид натрия; Са-блокатор — нифедипин
(коринфар, адалат); ганглиоблокатор — пентамин.
4. Скорость понижения АД должна соответствовать тяжести
ГК и возрасту больных. Экстренного снижения АД (в течение
15—30 мин) добиваются при самом тяжелом течении ГК, когда
существует угроза сосудистой катастрофы или развития злокаче-
ственного гипертензивного синдрома. Во многих других случаях,
особенно у пожилых людей, у больных с выраженным атероскле-
розом сосудов головного мозга, у перенесших инсульт, у лиц с
хроническими заболеваниями почек, прибегают к постепенному,
более «физиологическому» понижению АД (в течение 1—2 ч).
Отнюдь не всегда имеется необходимость в полной нормализа-
ции АД, Для больных, перенесших инсульт и страдающих скры-
той почечной недостаточностью, это может оказаться вредным
из-за нарушения ауторегуляторных механизмов, опасности раз-
вития «синдрома обкрадывания» некоторых участков мозга, све-
жего тромбоза и дальнейшего ухудшения функции почек. Важно
«выйти из опасной зоны», т. е. уменьшить степень артериальной
гипертензии до уровня 150—170/95—100 мм рт. ст., при таком
уровне АД повреждение органов-мишеней явно замедляется.
Вместе с тем, есть категория больных, которые нуждаются в сни-
жении АД до величин 120—130/70—85 мм рт. ст. Это беременные
женщины с поздним токсикозом, дети и юноши, заболевшие
острым гломерулонефритом, больные АГ с начинающимся рас-
слаиванием стенок аорты. Таким образом, главная зада-
ча при лечении ГК — не достижение нормо-
тензии, а снижение АД к безопасному
уровню.
5. Базовыми препаратами в комплексном лечении ГК мы
считаем натрия нитропруссид и нифедипин, каждый из которых,
уменьшая ОПС — ведущий механизм АГ, не только понижает
366
АД, но и создает благоприятные условия для гипотензивного
действия других препаратов.
Натрия нитропруссид (ниприд) — один из наиболее мощных
препаратов, широко используемых для лечения ГК, особенно в
стационарных условиях. Расширяя артериолы и венулы, натрия
нитропруссид понижает как постнагрузку, так и преднагрузку,
уменьшая работу сердца и его потребность в кислороде. Этот эф-
фект особенно выгоден для больных, у которых АГ осложняется
слабостью левого желудочка или острой ишемией миокарда.
Противогипертензивное действие этого препарата сопровождает-
ся лишь умеренной синусовой тахикардией и небольшим пони-
жением МО сердца.
Действие ниприда наступает быстро; чтобы предотвратить
значительное падение и колебания АД, дозу препарата титруют
с помощью специального дозатора. Предпочтительно также в пе-
риод вливания ниприда мониторировать АД или производить ча-
стые его измерения. Начальная доза для внутривенного влива-
ния — 0,5 мкг/кг • мин, ее постепенно повышают, пока не дости-
гается нужный уровень АД. Превышение дозы 10 мкг/кг-мин,
а также длительное применение препарата в течение 24—48 ч
создает риск тиоцианатной интоксикации, особенно у лиц с на-
рушениями функции почек. Признаки такой интоксикации:
тошнота, рвота, головокружение, дезориентация, галлюцинации
и т. д. Иногда эти побочные реакции ошибочно воспринимаются
как проявления самого ГК.
Натрия нитропруссид быстро разрушается на свету: свеже-
приготовленный раствор имеет светло-коричневый цвет, при
разрушении он меняет окраску.
В амбулаторных условиях и на дому, в менее ургентных усло-
виях удобнее воспользоваться нифедипином, особенно в его
жидкой форме (капли, адалат). Здесь не требуется титрования
дозы и столь постоянного (частого) контроля за АД, поскольку
глубокая острая гипотензия угрожает больному в меньшей степе-
ни, чем при вливании натрия нитропруссида.
Однократный прием нифедипина (адалат) в дозе 10 мг обычно
ведет к снижению систолического и диастолического АД в среднем
на 25%. Эффект проявляется через 5—15 мин при введении пре-
парата под язык или за щеку и через 15—30 мин — при его прие-
ме внутрь. У половины больных в это время проявляется диуре-
тическая реакция в ответ на прием нифедипина. Самый низкий
367
уровень АД достигается через следующие 10—20 мин. Снижение
АД сохраняется от 2 до 6 ч. Очень пожилым людям, а также
больным, имеющим сосудистые повреждения мозга, дозу нифеди-
пина понижают до 5 мг (!). Если позволяют обстоятельства, т. е.
течение ГК не внушает опасений, можно сделать попытку ис-
пользовать нифедипин в качестве единственного средства устра-
нения ГК. Больному советуют принимать этот препарат по 10 мг
каждые 2—3 ч до общей дозы 60—90 мг.
Лечение нифедипином сопровождается побочными реакция-
ми, даже при однократном его приеме. По своему характеру они
могут быть ошибочно восприняты как осложнения ГК. Это —
головокружение (у 5—10%) больных, головная боль (у 4%), ощу-
щение прилива крови к голове, покраснение лица (у 6%), уме-
ренная синусовая тахикардия — число сердечных сокращений
в среднем возрастает на 15% (у 15% больных). Интенсивность
тахикардии находится в обратной зависимости от возраста боль-
ного.
Все же во многих случаях принятый однократно нифедипин,
хотя и улучшает ситуацию, оказывается недостаточным для
устранения ГК, особенно в тех случаях, когда отсутствует на-
чальная диуретическая реакция. Поэтому врачу после оценки ра-
зового эффекта нифедипина следует усилить лечение.
6. При нейровегетативной форме ГК препаратом выбора яв-
ляется клофелин, который с самого начала или после нифедипи-
на вводят внутривенно в дозе 0,5—1 мл 0,01% раствора, разве-
денного в 10—20 мл изотонического раствора натрия хлорида, —
в течение 5—10 мин, чтобы избежать начальной прессорной ре-
акции. Отчетливое понижение АД отмечается уже через 3—5 мин
после окончания вливания. В конечном счете АД снижается
на 50/30 мм рт. ст. Если клофелин вводят внутримышечно
(0,75—1,5 мл 0,01% раствора), то АД понижается через 10—
20 мин; эффект сохраняется у разных больных от 2 до 8 ч. При
комбинации нифедипина (под язык) и клофелина (парентераль-
но) нужный уровень АД достигается примерно у 80% больных.
Почти такой же результат может быть получен при приеме боль-
ными клофелина внутрь: сначала 0,15 мг, затем по 0,075 мг каж-
дый час до общей дозы 0,8 мг. Правда, в этом случае АД начи-
нает понижаться между 30 и 60 мин после первого приема пре-
парата.
368
Остальным 20% больных, не отреагировавших на такое соче-
тание препаратов, следует ввести внутривенно лазикс в дозе
40—80 мг, что в итоге обеспечивает успех лечения. Еще раз на-
помню, что нецелесообразна комбинация клофелина с празози-
ном (или с другим сц-адреноблокатором), поскольку действие
клофелина и его аналогов при этом тормозится.
7. При «отечной» форме ГК прежде всего прибегают к диуре-
тикам резерва (на фоне нифедипина): в менее тяжелых случаях
больной принимает внутрь 40—80 мг фуросемида или 50—100 мг
урегита; при более тяжелом течении ГК внутривенно струйно
вводят 40—80 мг лазикса. После внутривенной инъекции лазикса
понижение АД отмечается через 10—20 мин (иногда раньше); ги-
потензивная реакция может опережать диуретическую. Если
суммарный эффект нифедипина и лазикса представляется недо-
статочным, больному рекомендуют повторно ввести под язык
или за щеку 10 мг нифедипина.
У ряда больных, особенно у женщин с выраженной гипер-
гидратацией, выделение мочи под воздействием лазикса может
оказаться весьма значительным, даже чрезмерным, что приводит к
артериальной гипотензии, гиподинамии, общему угнетению, по-
тере аппетита. В подобных обстоятельствах (гипокалиемия, ги-
похлоремия, алкалоз) надо советовать больному принять 2—4 г
калия хлорида, растворенного в стакане томатного или апельси-
нового сока (при отсутствии противопоказания), или дважды с
интервалом в 2 ч по две таблетки панангина. Еще эффективнее в
этих случаях медленное внутривенное вливание 20 мл 4%-го рас-
твора калия хлорида в 150 мл 5% раствора глюкозы. Если же
больной переносил подобные чрезмерные диуретические реак-
ции, то ему следует принять две таблетки панангина до инъек-
ции лазикса и еще дважды по 1—2 таблетки панангина в течение
нескольких часов.
Для противодействия «рикошетным» (отечным) ГК, к кото-
рым особенно склонны некоторые больные этой группы, целесо-
образно сочетать введение диуретика с приемом 0,15 мг клофе-
лина или 5—10 мг вискена, которые будут тормозить ответные
симпатико-адреналовые реакции. Ингибирует ответную реакцию
системы ренин—ангиотензин II—альдостерон (т. е. вторичные
отеки) каптоприл — быстро действующий блокатор превращаю-
щего фермента; его принимают сублингвально по 25 мг (*/2 таб-
летки) через каждые полчаса в течение 2 ч.
369
8. При ГК, осложненном острой левожелудочковой недоста-
точностью (приступ удушья, отек легких), показано применение
пентамина (ганглиоблокатор). Его вводят внутривенно струйно,
титруя от 0,3 до 0,5—0,75—1 мл 5% раствора в 10 мл 5% раствора
глюкозы. АД понижается в течение 5—15 мин, быстро умень-
шаются застойные явления в легких, «фронт» влажных хрипов
смещается книзу, ослабевают и затем исчезают удушье и выделе-
ние жидкой «розоватого» цвета мокроты. Однако более чем
у 10% больных должной реакции АД на пентамин нет или она
недостаточна. В этих случаях следует приступить к более интен-
сивному лечению ГК и отека легких (внутривенно нитрогли-
церин и лазикс). Нитроглицерин является предпочтительным
препаратом для больных ИБС с умеренным подъемом АД
(Packer М., 1983). У таких же больных могут быть применены
ингибиторы АПФ в малых стартовых дозах (от 6,25 до 12,5 мг
каптоприла). Лабеталол и другие 0-адреноблокаторы в подобной
ситуации не показаны.
По наблюдениям А. П. Голикова и соавт. (1980), гипотензив-
ный эффект введения внутримышечно 5% раствора пентамина
(0,3—0,5—1 мл) может быть усилен дроперидолом (1—2 мл
0,25% раствора). К тому же дроперидол способствует успокое-
нию больных, подавляет рвотные и другие неблагоприятные
рефлексы. Вместе с тем, мы не рекомендуем использовать дропе-
ридол в качестве самостоятельного средства лечения ГК, к чему
иногда склоняются врачи скорой помощи. Особенно необходимо
соблюдать осторожность при введении дроперидола больным с
выраженным атеросклерозом, а также лицам, длительно полу-
чавшим гипотензивные препараты.
Прибегая к пентамину, не следует забывать и о ряде нежела-
тельных, иногда опасных осложнений, вызываемых этим ган-
глиоблокатором. Главное из них — резкое падение АД с карти-
ной коллапса, к чему могут быть склонны пожилые люди, боль-
ные с постинфарктным кардиосклерозом, женщины с распро-
страненным варикозным расширением вен и др. Ранние коллап-
сы иногда развиваются при внутривенном введении пентамина в
момент инъекции или через 10—15 мин после ее окончания.
Поздние коллапсы возможны при внутримышечном введении
пентамина. Коллапсы обычно имеют ортостатический характер,
но могут возникать и у больных, находящихся в горизонтальном
370
положении. Нельзя игнорировать и другие возможные опасности
ганглионарной блокады (острая атония мочевого пузыря с за-
держкой мочи, атония кишечника, вплоть до паралитического
илеуса, инактивация зрачковых рефлексов и аккомодации). Пен-
тамин мало подходит для лечения ГК у больных с почечной недо-
статочностью,
9. Следует специально рассмотреть вопрос о лечении ГК с
далеко зашедшей энцефалопатией («судорожная» форма ГК).
Этот вариант ГК необходимо дифференцировать с ишемическим
инфарктом мозга или с кровоизлиянием в мозг (компьютерная
томография мозга).
Лечение гипертензивной энцефалопатии начинают без промед-
ления. Лучшим препаратом для начальной терапии является
натрия нитропруссид. Контролируемым вливанием этого препа-
рата достигается снижение диастолического давления до 100—
НО мм рт. ст. в первые 60 мин. Если это сопровождается ухуд-
шением мозговой неврологической симптоматики, то вливания
нитропруссида прекращают. При благоприятном ходе лечения
результат достигается быстро, и он очевиден.
Альтернативным препаратом может быть лазикс, который
вводят внутривенно в дозе 80 мг, а также магния сульфат (20 мл
25% раствора — медленно внутривенно). Клофелин в этих случа-
ях не показан. Может использоваться лабеталол. Такой больной
подлежит неотложной госпитализации в неврологическое отде-
ление, особенно если появляются судорожные подергивания
мышц. Перед отправкой больному вводят медленно внутривенно
10—30 мг диазепама (седуксен, реланиум) в 20 мл 5% раствора
глюкозы (Ионин М. Л., 1989).
Здесь уместно сформулировать и другие показания к госпита-
лизации больных с ГК: тяжелое, осложненное течение, устойчи-
вость к фармакологическим средствам, ухудшение зрения, стено-
кардия, отек легких (после оказания на дому реальной помощи
больному), сердечные тахиаритмии, олигурия и анурия.
Можно упомянуть ряд иных препаратов, хотя и не основных,
но тоже используемых в комплексном лечении ГК. Среди них:
дибазол (6—10 мл 0,5% раствора внутривенно), раствор папавери-
на гидрохлорида или но-шпа. Эти спазмолитики должны рассмат-
риваться как вспомогательные средства, способствующие глав-
ным образом уменьшению регионарных сосудистых спазмов.
371
Некоторые вещества фенотиазинового ряда (аминазин, тропа-
зин) применяют с осторожностью в качестве симптоматических
средств, чтобы снять рвотный рефлекс, возбуждение, тревогу,
беспокойство, усиленную потливость (с этой же целью применя-
ют диазепам). Пирроксан (а-адреноблокатор) назначают в основ-
ном больным, страдающим диэнцефальными кризами симпатико-
тонического характера. Его вводят внутримышечно по 1—2 мл
1,5% раствора. Иногда в ответ возникает резкое, опасное паде-
ние АД. Поэтому пирроксан не показан больным с распростра-
ненным атеросклерозом, перенесшим нарушение мозгового кро-
вообращения, при сердечной недостаточности.
Для полноты изложения можно назвать еще ряд препаратов,
отличающихся высокой гипотензивной активностью, но пока
редко встречающихся в нашей практике. Мы имеем в виду пери-
ферический вазодилататор диазоксид (гиперстат), который вво-
дят больному быстро внутривенно в дозе 300 мг. АД понижается
у 75% больных в течение 1—2 мин. Во многих случаях действие
диазоксида сохраняется в течение 8 ч и дольше. К сожалению,
препарат вызывает гипергликемию и обостряет течение сахарно-
го диабета, что ограничивает возможности его применения. Диа-
зоксид не показан, если есть подозрение на внутричерепное кро-
воизлияние или ишемический инсульт у больного (Bertel О.
et al., 1984; Brown R. et al., 1985).
Другой препарат — уже упоминавшийся лабеталол гидрохло-
рид (трандат), ему присуще 0- и а-адреноблокирующее дейст-
вие. При внутривенной инъекции 50 мг лабеталола за 1 мин про-
исходит быстрое снижение АД как у больных с ЭГ, так и при
феохромоцитоме, или при ГК, связанном с внезапной отменой
клофелина. Если имеется необходимость, инъекции лабеталола
можно повторять через каждые 5 мин до общей дозы 200 мг.
Приводим также схему лечения адреналовых ГК у больных с
феохромоцитомой (Кушаковский М. С., 1983). Поднимают голов-
ной конец кровати под углом 45° для ортостатического снижения
АД, затем быстро вводят больному в вену 5 мг а-адреноблокато-
ра фентоламина метансулыроната (5 мг сухого фентоламина в
ампуле разводят ex tempore в 1 мл воды), с повторением такой же
инъекции каждые 5 мин до снижения АД. Диагноз феохромоци-
томного (адреналового) ГК становится сомнительным, если по-
сле введения 5—10 мг фентоламина отсутствует отчетливое по-
372
нижение АД — на 35/20 мм рт. ст. и больше — в течение 2 мин.
После стабилизации АД на умеренном уровне фентоламин вво
дят внутривенно по 2,5—5 мг каждые 2—4 ч, пока не будут на-
значены длительно действующие средства (феноксибензамин гид-
рохлорид и др.).
Лечение ГК, осложнившегося острым кровоизлиянием в мозг
Как внутричерепное паренхиматозное, так и субарахноидаль-
ное кровоизлияние сопровождается внезапным появлением го-
ловной боли, быстрой потерей сознания с переходом в глубокую
кому с утратой неврологических рефлексов. В подобных услови-
ях следует осторожно понижать АД, поскольку быстрое его паде-
ние может усилить ишемию мозга в соседних участках. АД пони-
жают, если систолическое давление превышает 200 мм рт. ст.,
диастолическое 120—130 мм рт. ст. Ряд авторов подчеркивает,
что АД не следует уменьшать больше чем на 20%. Кроме того,
следует снизить внутричерепное давление, чему способствует
введение маннитола.
У больных с субарахноидальным кровотечением смертность
выше, если систолическое давление превышает 160 мм рт. ст., а
среднее гемодинамическое НО мм рт. ст. (Nibbelink D. et al.,
1981).
Препаратом выбора является коротко действующий натрия
нитропруссид; с его помощью постепенно достигается нужный
уровень АД; если же усиливается отрицательная неврологическая
симптоматика, то АД может быть в течение нескольких минут
вновь повышено (уменьшением скорости вливания препарата). В
заключение привожу рабочую схему лечения инсультов, предло-
женную J. Terry, D. Hanley (1997).
Таблица 19
Гипотензивная терапия в первые часы инсульта
(пример рабочей схемы, J. В. Terry, D. F. Hanley, 1997)
I. Больные без тяжелой АГ в анамнезе:
1. ДАД >140 мм рт. ст. при измерении 2 раза через 5 минут:
начать инфузию нитропруссида натрия.
373
2. САД >230 мм рт. ст. и/или ДАД 121—140 мм рт. ст.:
— лабеталол в/в 20 мг каждые 10—20 мин (противопоказан при астме,
застойной сердечной недостаточности или нарушениях проводимости
миокарда из-за 0-блокирующего действия);
— клофелин в/в (0,5—1 мл в 10 мл изотонического р-ра NaCl медленно);
в/м 0,5—3 мл;
— пентаин в/в (0,3—0,5 мл в 20 мл изотонического р-ра NaCl медленно),
в/м 0,5—3 мл.
3. САД 180—230мм рт. ст. и/или ДАД 105—120мм рт. ст.:
отложить лечение; если через час АД не снизилось и неврологический
статус остался прежним — применять препараты внутрь (например,
0-блокаторы, мочегонные; эналаприл в/в и внутрь).
4. САД <180 мм рт. ст и/или ДАД <105 мм рт. ст. — лечение не показано.
II. Больные с тяжелой АГ в анамнезе: подходить еще осторожнее к снижению
АД.
III. Артериальная гипотензия: инфаркт миокарда, сепсис, поражение ствола моз-
га — лечение активное:
а) увеличение объема плазмы крови (изотонический раствор NaCl, раствор
альбумина, реополиглюкин и др.);
б) вазопрессоры (допамин); малоэффективны без адекватного объема жид-
кости.
Гипотензивная терапия в подостром периоде инсульта:
а) больным с АГ в анамнезе: постепенное снижение АД до:
160—170/90—100 мм рт. ст. или среднего АД 115—125 мм рт. ст.
б) больным без АГ в анамнезе: постепенное снижение до:
140—150/85—95 мм рт. ст.
или среднего АД 105— 115мм рт. ст.
Препараты: постепенный переход на препараты длительного действия.
Лечение ГК, осложнившегося острым инфарктом мозга
Ауторегуляторные механизмы мозгового кровотока утрачива-
ются под влиянием ишемии, отека мозга, ацидоза (Lavin Р.,
1986). Если у больного устойчиво удерживается диастолическое
давление на уровне 120—130 мм рт. ст., то его следует осторожно
понизить до 100—110 мм рт. ст. Это осуществляется с помощью
гипотензивных средств кратковременного действия (натрия ни-
тропруссид). При ухудшении неврологического статуса АД вновь
возвращают к более высокому уровню.
Необходимо дать некоторые дополнения по поводу профи-
лактики и лечения инсультов. Инсульт занимает второе место в
структуре причин смертности населения и является основной
374
причиной инвалидизации. За 2000 год в мире умерло от инсульта
более 5 млн человек. В России ежегодно регистрируется около
500 000 инсультов.
В 1996 г. было начато крупное международное исследование,
получившее название PROGRESS. По его условиям одна группа
больных, перенесших инсульт, принимала два препарата — пе-
риндоприл и индапамид — в течение всего периода исследова-
ния. Вторая группа больных продолжала принимать другие ле-
карства. Общее число наблюдаемых за время исследования со-
ставило более 6000 человек.
Через 5 лет в первой группе по сравнению со второй общее
число повторных инсультов было меньше на 28%, число гемор-
рагических инсультов уменьшилось на 50%, на 36% снизилось
количество инфарктов миокарда. Все полученные результаты
имеют высокую степень достоверности.
Результаты этого исследования оцениваются весьма высоко:
они открывают новые, реальные возможности профилактики по-
вторных инсультов у больных АГ. Той же цели служит синтези-
рованный фирмой Сервье препарат полипрел (2 мг периндоприла
+ 0,625 мг индапамида).
Лечение ГК, осложнившегося
острой коронарной недостаточностью
Раствор нитроглицерина предпочтительнее по сравнению с
другими гипотензивными средствами, правда, и натрия нитро-
пруссид может быть эффективным при контролировании АД
у больных с острым нарушением коронарного кровотока. Име-
ются указания о полезности применения у таких больных лабе-
талола, поскольку свойственная этому препарату сочетанная а- и
p-адренергическая блокада оказывает благоприятное воздействие
на гемодинамику и способствует понижению потребности мио-
карда в кислороде.
Лечение ГК, осложнившегося расслаиванием аорты
При таком опасном для жизни осложнении АД должно быть
снижено до нормы-, исключаются гипотензивные препараты, вы-
зывающие рефлекторную тахикардию и повышение МО сердца.
В отличие от описанных выше состояний, при надрыве (аневриз-
ма) аорты систолическое давление в пределах 100—110 мм рт. ст.
375
хорошо переносится больными. Лечение начинают с постепен-
ного вливания натрия нитропруссида и приема внутрь р-адре-
ноблокатора. Это позволяет выиграть время для последующего
хирургического вмешательства. При расслаивании, которое на-
чинается в нисходящем отделе грудной аорты вслед за местом
отхождения левой подключичной артерии, желаемый эффект
может быть достигнут почти в 80% случаев (Garcia J., Vidt D.,
1987).
Лечение ГК, возникшего в послеоперационном периоде
Изредка острые и значительные подъемы АД возникают у
больных, подвергшихся операции аортокоронарного шунтирова-
ния или каротидной эндартерэктомии. Для снижения АД обыч-
но применяют натрия нитропруссид; может быть использовано и
внутривенное вливание раствора нитроглицерина, особенно по-
сле эндартерэктомии (Flaherty J. et al., 1982).
Противогипертензивная терапия
у больных с хроническими заболеваниями почек
Центральная роль почек в развитии АГ неоднократно мною
подчеркивалась по мере изложения материалов. В большинстве
случаев это связано с задержкой выведения ионов натрия. Нару-
шение его экскреции может происходить при нормальном или
почти нормальном количестве функционирующих нефронов за
счет констрикции сосудов почек. При ЭГ сужение почечных со-
судов усиливает реабсорбцию натрия в почечных канальцах
(Шулутко Б. И., 2001; Ruilope L. et al., 1994). Почки могут стиму-
лировать образование как вазопрессорных веществ, к которым
относятся АП, эндотелии, так и вазодепрессорных веществ, та-
ких как кинины, простагландины, медуллолипины. Развитие АГ
может быть следствием дисбаланса между объемом внутрисосу-
дистой жидкости (ОЦП), степенью вазоконстрикции (артериол)
и вазодилатации.
Соотношение между этими факторами неодинаково при раз-
личных заболеваниях почек. Например, у больных с реноваску-
лярной АГ преобладает механизм образования АП, а задержка
Na почти полностью отсутствует. Сходный механизм повышения
АД наблюдается у больных с первично сморщенной почкой (фи-
нал ЭГ), а также у ряда больных с поликистозом почек, когда
376
функция почек еще сохранена (Kaplan N., 1994), но происходи!
усиление секреции ренина вследствие ишемии почечной ткани.
У больных ЭГ существует связь между степенью поражения
почек и показателем смертности от сердечно-сосудистых забо-
леваний.
Выделяют 2 прогностических признака заболеваемости и
смертности таких больных. Первый из них — уровень креатинина
сыворотки. Как свидетельствуют наблюдения N. Shulman и со-
авт. (1989), у больных, имевших уровень креатинина сыворотки
>1,7 мг/дл, смертность в течение 8 лет была более чем в 3 раза
выше по сравнению с остальными больными с более низким
уровнем креатинина.
Другим прогностически значимым признаком смертности от
сердечно-сосудистых заболеваний является протеинурия (Samuel-
son О., 1985).
В последние годы уделяется большое внимание такому про-
гностическому признаку в отношении смертности, связанной с
сердечно-сосудистыми заболеваниями, как микроальбуминурия.
Под этим термином понимают усиление экскреции альбумина с
мочой (до 200 мкг/мин, или до 300 мкг/24 ч) при отсутствии яв-
ной протеинурии. Микроальбуминурия является, по-видимому,
проявлением генерализованного нарушения проницаемости эн-
дотелия, что непосредственно связано с гиалинозом почечных
артериол — основным морфологическим субстратом эссенциаль-
ной гипертензии.
Единственными эффективными мерами, замедляющими
прогрессирование этих процессов, являются нормализация АД и
снижение количества белка в пище. Как я указал выше, целевым
уровнем АД при ЭГ, осложненной почечной недостаточностью,
а также при сочетании АГ и сахарного диабета является опти-
мальная величина — 120/75 мм рт. ст. Теперь уже ясно, что хро-
ническая почечная недостаточность не препятствует достижению
такого уровня АД, хотя могут понадобиться более высокие дозы
противогипертензивных препаратов (исследование НОТ).
По современным представлениям, ингибиторы АПФ отно-
сятся к числу препаратов, которые оказывают более благоприят-
ный эффект, сохраняя функцию почек как при диабетической
нефропатии, так и вообще у больных ЭГ (Sihm I. et al., 1995).
377
Более того, эти препараты способны уменьшать протеинурию и
микроальбуминурию (Ruilope L., Rodicio J., 1995).
Поскольку сами по себе их гипотензивные возможности не-
велики, рекомендуется сочетанное назначение ингибиторов
АПФ с гипотиазидом, которое к тому же устраняет задержку
жидкости в организме. Как я подчеркивал выше, тиазидовые ди-
уретики можно применять у больных, у которых уровень сыво-
роточного креатинина ниже 2 мг/дл. В более поздних фазах по-
чечной недостаточности используют петлевые диуретики (фуро-
семид, этакриновая кислота), а также индапамид (арифон). Дру-
гой приемлемой комбинацией является сочетание ингибиторов
АПФ с Са-блокаторами, особенно эффективное у больных са-
харным диабетом, нефропатией и артериальной гипертензией.
Заключение
В изложенной монографии сделана попытка обобщить наи-
более важные клинико-экспериментальные данные, накопивши-
еся в литературе за последнее десятилетие. Я исходил из того,
что сложность систем физиологической регуляции уровня АД
постоянно создает условия для нарушений их функции в каком-
либо звене или в нескольких звеньях. И хотя организм человека
обладает большим «запасом прочности», т. е. замещающими,
приспособительными механизмами, всегда сохраняются возмож-
ности для их «поломов» и возникновения заболевания, особенно
у лиц с наследственной предрасположенностью к таким наруше-
ниям. Эти теоретические предпосылки, а также эксперименталь-
ные факты, полученные на популяциях животных со спонтанной
наследственной АГ, наконец, широкие клинические наблюдения
явились основой для концепции о полиэтиологичности и поли-
патогенетичности ЭГ на основе наследственной предрасполо-
женности.
Очевидно, что имеется ряд ведущих ключевых патогенетиче-
ских механизмов, которые могут складываться в различные ком-
бинации, сообщающие заболеванию индивидуальное своеобра-
зие. Среди этих механизмов особое значение придается: а) пси-
хоэмоциональному стрессу с истощением центральных запасов
норадреналина, гипостимуляцией аг-адренорецепторов продол-
говатого мозга и гипоталамуса и активацией периферического
отдела симпатической нервной системы; б) избыточному потреб-
лению поваренной соли лицами с наследственными дефектами в
почках, утрачивающих способность выделять адекватное количе-
ство натрия, в условиях артериальной нормотензии; в) наследст-
венным изменениям проницаемости мембраны гладкомышечных
сосудистых клеток и неспособности их внутриклеточных орга-
379
нелл связывать (удерживать) в должной мере ионы кальция;
г) повышению толерантности тканей к инсулину, тоже, по-види-
мому, наследственной природы. Нельзя, конечно, не учитывать
и новые данные о центральной регуляции АД, связанные с от-
крытием 1[-имидазолиновых рецепторов.
Даже в пределах каждого из этих ключевых механизмов
встречаются множественные вариации и нюансы. Например, не-
полный перечень нейрогенных механизмов ЭГ представлен:
а) возникновением дефицита норадреналина в нейронах мозга;
б) недостаточной стимуляцией аг-адренорецепторов мозговых
нейронов, участвующих в регуляции активности симпатической
нервной системы на периферии; в) ослаблением барорефлекса;
г) нарушениями в системе депонирования норадреналина в сим-
патических терминалях; д) гипофункцией депрессорных допами-
нергических систем. Еще больше разновидностей почечных ре-
гуляторных дисфункций. С моей точки зрения, роль почечных
гипертензивных механизмов может быть: 1) видимой, т. е. оче-
видной, например: при органических заболеваниях почек;
2) мало видимой, т. е. не вполне очевидной, например, при та-
ких заболеваниях, как реноваскулярная АГ и других; 3) совсем
невидимой, например, при эссенциальной гипертензии.
Исходя из этой концепции, я выделил несколько клинико-па-
тогенетических форм ЭГ, что, в свою очередь, должно способст-
вовать более дифференцированному лечению больных.
Профилирование больных ЭГ является
важным составным элементом новой терапевти-
ческой стратегии, связанной с отходом от ранее принятого сте-
реотипного ступенчатого метода лечения ЭГ.
Представленная в монографии подробная характеристика со-
временных противогипертензивных средств и анализ перспектив
совершенствования лечения ЭГ в ближайшем будущем должны
служить достижению тех же целей.
СПИСОК ЛИТЕРАТУРЫ*
Азизов В. А., Савченко А. П., Атъков О. Ю., Арабидзе Г. Г. Особенности кли-
ники ишемической болезни сердца у больных с артериальной гипертензией //
Кардиология. — 1993. — Т. 33, № 6. — С. 38—41.
Айвазян Т. А., Зайцев В. П., Таравкова И. А. Психологические аспекты уча-
стия больных гипертонической болезнью в немедикаментозной терапии // Кар-
диология. — 1995. — Т. 35, № 1. — С. 42—44.
Алмазов В. А., Цырлин В. А. Гемодинамика в норме и патологии. — Л.:
I ЛМИ, 1978. - 169 с.
Алмазов В. А., Цырлин В. А., Маслова А. А, Темиров А. А., Шабров А. В. Регуля-
ция артериального давления в норме и при патологии. — Л.: Наука, 1983. —
158 с.
Алмазов В. А., Чирейкин Л. В. Трудности и ошибки диагностики заболеваний
сердечно-сосудистой системы. — Л.: Медицина, 1985. — 288 с.
Алмазов В. А. Артериальная гипертензия. — Л.: Ин-т кардиологии, 1988. —
142 с.
Алмазов В. А., Шляхто Е. В., Соколова Л. А. Пограничная артериальная ги-
пертензия. — СПб.: Гиппократ, 1992. — 189 с.
Алмазов В. А., Лиознова Э. А., Маслова Н. П., Баранова Е. И. Эффективность
длительной терапии празозином и возможности ее прогнозирования у женщин,
больных гипертонической болезнью // Кардиология. — 1994. — Т. 34, № 3. -
С. 26-29.
Андреев Н. А., Перфуриев И. Ф., Донников Б. И. и др. Гипноз, аутогенная тре-
нировка и акупунктура в лечении больных лабильной артериальной гипертен-
зией // Тер. арх. - 1982. - Т. 54, № 11. - С. 71-73.
Аничков С. В. Избирательное действие медиаторных средств. — Л.: Наука,
1974.- 395 с.
Анохин П. К. Очерки по физиологии функциональных систем. — Л.: Меди-
цина, 1975. — 447 с.
* В него включены в основном наиболее важные работы, преимущественно
80—90-х годов; более поздняя литература (до 2001 г.) указана на стр. 400.
381
Арабидзе Г. Г., Коздоба О. А., Матвеева Л. С. и др. Трудности дифференци-
альной диагностики различных форм артериальной гипертензии // Тер. арх. —
1979. - № 10. - С. 24-29.
Арабидзе Г. Г. Симптоматические артериальные гипертонии // Руководство
по кардиологии. — М., 1982. — Т. 4. — С. 65—100.
Арабидзе Г. Г. Слово об Ирвине Пейдже // Кардиология. — 1993. — Т. 33,
№ 9. - С. 58-60.
Баструков А. И. Влияние капотена на диастолическую функцию левого же-
лудочка у больных ишемической болезнью сердца в сочетании со стойкой арте-
риальной гипертензией // Кардиология. — 1993. — Т. 33, № 4. — С. 30—31.
Белова Е. В. Участие гипоталамо-гипофизарно-надпочечниковой системы в
повышении артериального давления под воздействием эмоциональной нагруз-
ки // Кардиология. - 1992. - Т. 32, № 9-10. - С. 37-39.
Белоусов Ю. Б., Ахадов Ш. В., Леонова М. В. и др. Гипотензивная эффектив-
ность различных форм нифедипина у больных со стабильной артериальной ги-
пертонией //Кардиология. — 1995.— Т. 35, № 1. — С. 33—36.
Бритов А. Н., Константинов Е. Н., Никулина Л. С. и др. Возможности, труд-
ности и перспективы массовой профилактики артериальной гипертонии // Бюлл.
Всесоюзн. кардиол. научн. центра. — 1985. — Т. 8, № 2. — С. 88—92.
Вальдман А. В. Нейрофармакология центральной регуляции сосудистого то-
нуса. — М.: Медицина, 1976. — 328 с.
Вальдман А. В., Алмазов В. А., Цырлин В. А. Клиническая нейрофармакология
гипотензивных средств. — М.: Медицина, 1978. — 270 с.
Вейкин А. К., Буравьев М. Б., Преображенский Д. В. Влияние гипотензивных
средств на липидный состав крови. — Кардиология. — 1995. — Т. 35, № 1.—
С. 69-76.
Виноградов А. В. Дифференциальный диагноз внутренних болезней. — 1980. —
Т. 1—2. — М.: Медицина. — 510 с.
Вихерт А. М., Коздоба О. А. Морфологические аспекты злокачественной ар-
териальной гипертензии (по данным операционной и пункционной биопсий) //
Артериальная гипертензия. — М.: Медицина, 1980. — С. 292—300.
Волков В. С., Никулин А. Е. О некоторых факторах риска развития гипертони-
ческой болезни у лиц с пограничной артериальной гипертензией// Клин. мед. —
1986. — № 1.-С. 101-110.
Волынский 3. М., Исаков И. И., Яковлев С. И., Кейзер С. А. Характеристика
артериального давления у жителей г. Ленинграда и о значении некоторых усло-
вий окружающей среды для развития гипертонической болезни // Труды Воен-
но-медиц. академии. — 1958. — Т. 86. — С. 9—56.
Волынский 3. М., Соловьева В. С. Гипертоническая болезнь у молодых лю-
дей. — Л.: Медицина, 1965. — 267 с.
Глезер Г. А. Динамика кровообращения при артериальной гипертензии. —
М.: Медицина, 1970.
382
Гогин Е. Е., Сененко А. Н., Тюрин Е. И. Артериальные гипертензии. — Л.: Ме-
дицина, 1983.— 272 с.
Гогин Е. Е. Прессорные механизмы в патогенезе гипертонической болезни //
Артериальная гипертензия и почки (современные проблемы). — СПб., 1993.—
С. 14-16.
Голиков А. П., Борисенко А. П., Бабков В. К. Гипертонические кризы (вопро-
сы классификации и экстренной помощи) // Тер. арх. — 1976. — № 10. —
С. 8-14.
Горнаев Б. И., Дорничев В. М. Реакции системы кровообращения при психо-
эмоциональном напряжении//Кровообращение. — 1986. — № 5.— С. 7—11.
Губачев Ю. М., Дорничев В. М. Сердечно-сосудистые нарушения при невро-
тических состояниях. — Л., 1989. — 20 с.
Гундаров И. А., Бритов А. Н., Константинов Е. Н. и др. Интегральная оценка
мозговой гемодинамики в норме, при пограничном уровне артериального давле-
ния и артериальной гипертонии//Кардиология. — 1988. — № 1. — С. 49—52.
Гуревич М. И., Бернштейн Г А., Соловьев А. И. Современные представления о
базальном тонусе сосудов // Кардиология. — 1988. — Т. 28, № 3. — С. 123—127.
Дзизинский А. А., Гомазков О. А. Кинины в физиологии и патологии сердеч-
но-сосудистой системы. — Новосибирск: Наука, 1976. — 208 с.
Дзизинский А. А., Щепотин Ю. Е. Реактивность сосудов и гипертоническая
болезнь // Кардиология. — 1980. — № 6. — С. 109—111.
Дмитриев К. В. Артериальная гипертензия у больных пороками сердца и не-
достаточностью кровообращения // Кардиология. — 1995.— Т. 35, № 1. —
С. 64-68.
Дядык А. И., Багрий А. Э., Лебедь Н. А., Яровая Н. Ф. Патогенез гипертрофии
левого желудочка сердца у больных артериальными гипертониями // Кардиоло-
гия. - 1995. - Т. 35, № 1. - С. 59-63.
Евсиков Е. М., Люсов В. А., Лаврова Т. П. Методика дифференциальной диа-
гностики гипертонической болезни // Артериальная гипертензия и почки (совре-
менные проблемы). — СПб., 1993. — С. 17—19.
Иванова Н. В. Влияние пропранолола на объем внеклеточной жидкости, со-
держание альдостерона, активность ренина плазмы и центральную гемодинамику
у больных гипертонической болезнью II стадии. — Л.: ГИДУВ, 1983.— 20 с.
Иванова Н. В., Смирнов Г Б. Лечение гипертонической болезни. — Л.:
ГИДУВ, 1988.- 20 с.
Ильинский Б. В., Астраханцева Г П. Электрокардиограмма при острых нару-
шениях мозгового кровообращения. — Ташкент: Медицина, 1971. — 125 с.
Ильюткин Г Н., Кушаковский М. С. Изменения гемодинамики у больных в
процессе гипотензивной терапии с автоматическим управлением// Артериальные
гипертензии. — Л., ГИДУВ, 1980. — С. 48—55.
Ионин М. Л. Гипертензивные кризы: Руководство для врачей скорой помо-
щи / Ред. В. А. Михайлович. — Л.: Медицина, 1989. — С. 348—353.
383
Исаков И. И. Нейрогенные влияния на сердце по данным ЭКГ // Дистрофии
миокарда. — Л., 1971. — С. 79—121.
Исаков И. И Артериальные гипертонии. — Л.: Медицина, 1983. — 200 с.
Какорин С. В. Нефармакологические методы лечения больных гипертониче-
ской болезнью // Кардиология. — 1993. — Т. 33, № 3. — С. 84—89.
Калашникова М. Н., Шурыгина В. Д. Клинико-биохимические особенности
у лиц с пограничной артериальной гипертензией // Тер. арх. — 1988. — Т. 60,
№ 6. - С. 8-12.
Калюжная Р. А. Гипертоническая болезнь у детей и подростков. — Л.: Меди-
цина, 1980. —207 с.
Кедров А. А. О механизме возникновения так называемых типичных голов-
ных болей у больных гипертонической болезнью // Тр. Всероссийской конф,
кардиол. — СПб., 1993. — С. 290—292.
Кныш С. В. Гемодинамическая характеристика артериальной гипертензии у
рабочих, подвергающихся воздействию интенсивного производственного шума //
Артериальные гипертонии. — Л., 1977. — С. 39—44.
Колкер Я. С. Объем плазмы, внеклеточной и интерстициальной жидкости
при гипертонической болезни: влияние на них диуретиков и блокаторов бета-ад-
ренергических рецепторов // Артериальные гипертонии. — Л., 1977. — С. 44—55.
Комаров Ф. И., Ольбинская Л. И., Голяков В. Л. Дифференциальная диагнос-
тика гипертонической болезни I стадии и нейроциркуляторной дистонии по ги-
пертоническому типу// Клин. мед. — 1979. — № 10. — С. 17—20.
Комаров Ф. И., Ольбинская Л. И., Брагина Г. И. Влияние различных классов
p-адреноблокирующих препаратов на клиническое течение заболевания, физиче-
скую работоспособность и эхокардиографические показатели у больных хрониче-
ской ишемической болезнью сердца//Тер. арх. — 1979. — № 8. — С. 13—17.
Комарова Л. А. Применение физических факторов при гипертонической бо-
лезни на разных этапах лечения // Вопр. курортол. — 1988. — № 4. — С. 54—57.
Конради Г П. Регуляция сосудистого тонуса. — Л.: Наука, 1973. — 325 с.
Корвасарский Б. Д. Психотерапия. — М.: Медицина, 1985. — 205 с.
Коротков И. С. К вопросу о методах исследования кровяного давления //
Изд. ВМА. - 1905. - № 9. - С. 365-371.
Кузнецов В. И. Значение минутного объема крови в формировании кровя-
ного давления при гипертонической болезни // Труды Воен.-мед. академии. —
1958.-Т. 82.-С. 118-126.
Кушаковский М. С. Нарушение гемодинамики и состояние прекапиллярного
русла при далеко зашедших стадиях гипертонической болезни// ВМА: тез. научн.
конф. - 1950.-С. 16-18.
Кушаковский М. С., Гисматуллин Р. И. Лечебное применение препарата диба-
зол АЛП как сосудорасширяющего и спазмолитического средства // Фарм. и
токсикол. — 1951. — № 3. — С. 70—73.
384
Кушаковский М. С. К вопросу об этиологии гипертонической болезни // Во-
енно-медицинский журнал. — 1955. — № 5. — С. 31—38.
Кушаковский М. С. Об особенностях гемодинамики в нефрогенной стадии
гипертонической болезни//Тер. арх. — 1957. — № 12. — С. 42—48.
Кушаковский М. С. Некоторые особенности гемодинамики при гипертонии у
лиц молодого возраста // Тр. ВМА. — 1958. — Т. 58. — С. 107—117.
Кушаковский М. С. Клиника нейроциркуляторной дистонии гипертензив-
ного типа и начальной стадии гипертонической болезни у молодых людей //
Тр. ВМА. - 1961. - Т. 130. - С. 36-46.
Кушаковский М. С., Кузнецов В. И., Михасев М. И. Об антигипертензивном
действии цистамина// Клин. мед. — 1961. — № 1. — С. 28—33.
Кушаковский М. С. О гемодинамических формах гипертонической болезни //
Гипертоническая болезнь, атеросклероз, коронарная недостаточность. — Киев,
1969. - С. 76-77.
Кушаковский М. С. Клинические формы повреждения гемоглобина. — Л.:
Медицина, 1968. — 322 с.
Кушаковский М. С. Гипертоническая болезнь. — М.: Медицина, 1977. —
215 с.
Кушаковский М. С. Пограничная артериальная гипертензия. — Л.: ГИДУВ,
1977. - С. 11-31.
Кушаковский М, С., Ильюшкин Г. Н. Изменения гемодинамики у больных в
процессе гипотензивной терапии с автоматическим управлением// Артериальная
гипертензия и атеросклероз. — Л., 1980. — С. 49—52.
Кушаковский М. С. Водносолевые гипертензивные кризы // Гипертониче-
ские кризы. — М., 1980. — С. 24—29.
Кушаковский М. С., Иванова И. В. Классификация гипертонической болезни:
целесообразность профилизации по ренину // Тезисы XVIII Всесоюзн. съезда те-
рапевтов. — М., 1981. — С. 225—227.
Кушаковский М. С., Иванова И. В. Влияние пропранолола на объем внекле-
точной жидкости у больных эссенциальной гипертензией // IX Всемирный кон-
гресс кардиологов. — М., 1982.— С. 189—194.
Кушаковский М. С., Иванова И. В. «Объем-зависимая» форма гипертониче-
ской болезни // Кардиология. — 1982. — № 3. — С. 9—13.
Кушаковский М. С. Гипертоническая болезнь и вторичные артериальные ги-
пертензии.— М.: Медицина, 1982 (1983). —286 с.
Кушаковский М. С. Первичная артериальная гипертензия: болезнь регуляции
или компенсации// Кардиология. — 1983. - № 5. - С. 102—105.
Кушаковский М. С. Гипертоническая болезнь: итоги изучения и перспективы
(актовая речь). — Л.: ГИДУВ, 1984. — 21 с.
13 Зак. 3207
385
Кушаковский М. С. Гипергидратационная форма гипертонической болезни и
отечные гипертензивные кризы // Тр. III Всероссийского съезда кардиологов. —
Свердловск, 1985. — С. 67—68.
Кушаковский М. С. Современные подходы к лечению гипертонических кри-
зов // Артериальные гипертонии. — Л.: Сангиг, 1986. — С. 90—95.
Кушаковский М. С., Иванова Н. В., Смирнов Г. Б. Место бета-адреноблокато-
ров в комплексном лечении артериальной гипертензии. — СПб: ГИДУВ, 1992. —
24 с.
Кушаковский М. С. Уроки Н. Н. Савицкого: к 100-летию со дня рождения //
Клин. мед. - 1993. - № 2. - С. 74-75.
Ланг Г. Ф. О гипертонии// Ошибки в диагностике и терапии: Арх. Гос. клин,
ин-та усоверш. врачей. — СПб., 1922. — № 1. — С. 16—25.
Ланг Г. Ф. Гипертоническая болезнь. — М.: Медицина, 1950. — 496 с.
Леонова М. В., Гуткин А. Б., Белоусов Ю. Б., Логинова В. А. Сравнительная
эффективность p-блокаторов с разными фармакодинамическими свойствами
у больных гипертонической болезнью// Кардиология. — 1995. — Т. 35. — № 1. —
С. 37-39.
Маколкин В. И., Аббакумов С. А. Нейроциркуляторная дистония в терапевти-
ческой практике. — М.: Медицина, 1985. — 192 с.
Малов Ю. С., Кучмин А. Н., Карпенко М. А. Новый способ расчета массы
миокарда левого желудочка//Тр. Всероссийск. конф, кардиол. — СПб., 1993. —
С. 312-313.
Маношкина Е. М. Антигипертензивные препараты и качество жизни больных
гипертонической болезнью// Кардиология. — 1993. — Т. 33, № 4. — С. 68—72.
Маношкина Е. М., Метелица В. И., Айвазян Т. А. и др. Влияние монотерапии
гидрохлоротиазидом на психологические особенности и качество жизни больных
гипертонической болезнью // Кардиология. — 1993. — Т. 33, № 11. — С. 7—9.
Марков X. М. Патофизиология артериальной гипертонии. — София, 1970. —
375 с.
Маслова Н. П., Баранова Е. И., Лиознова Э. А. и др. Длительная патогенетиче-
ская терапия гипертонической болезни у женщин и возможности ее прогнозиро-
вания И Кардиология: успехи, проблемы и задачи (актуальные вопросы ишеми-
ческой болезни и артериальных гипертензий). — СПб., 1993. — С. 314—315.
Маслова Н. П., Трешкур Т. В. К вопросу о действии глюкокортикоидов на
сердечно-сосудистую систему // Кардиология. —1974. - № 9. - С. 65—68.
Медведев В. П., Куликов А. М., Сергеева В. В., Чернова Л. А. Клиническая ге-
терогенность нейроциркуляторной дистонии у юношей//Тр. Всероссийск. конф,
кардиол. - СПб., 1993. - С. 319-320.
Меньшиков В. В., Князев М. Д., Большакова Т. Д. и др. Содержание некоторых
гормонов и медиаторов в крови надпочечников и в периферической крови
у больных гипертонической болезнью// Кардиология. — 1979. — № 12. —
С. 25-30.
386
Меньшиков В. В. Выделение катехоламинов с мочой при гипертонической
болезни и симптоматических гипертензиях // Кардиология. — 1961. — № 2. —
С. 18-29.
Метелица В. И. Справочник кардиолога по клинической фармакологии. —
М.: Медицина, 1987. — 368 с.
Метелица В. И., Дуда С. Г., Островская Т. П. и др. Основные различия гемо-
динамических эффектов кардиоселективного p-адреноблокатора ацебуталола и
неселективного p-адреноблокатора пропранолола при длительной антигипертен-
зивной терапии// Кардиология. — 1993. — № 4.— С. 32—38.
Морозов К. А. Состояние гемодинамики у лиц пожилого возраста // Тер. арх. —
1960. -№ 9. - С. 28-32.
Мухарлямов Н. М., Богословский В. А. О современном понимании и употреб-
лении терминов «гипер- и гипотензия», «гипер- и гипотония» // Тер. арх. —
1976. — № 5. — С. 152-154.
Мясников А. Л. Гипертоническая болезнь. — М.: Медгиз, 1954. — 392 с.
Мясников А. Л. Гипертоническая болезнь и атеросклероз. — М.: Медицина,
1965. - 615 с.
Наточин Ю. В. Ионорегулирующая функция почек. — Л.: Наука, 1976. —
267 с.
Некрасова А. А., Жарова Е. А., Шхвацабая И. К. Солевые нагрузки в оценке
транспорта натрия и воды почками у больных гипертонической болезнью // Тер.
арх. - 1980. - № 5. - С. 95-99.
Некрасова А. А., Ланцберг Л. А. Роль простагландинов почек в патогенезе ги-
пертонии И Кардиология. — 1969. — № 6. — С. 86—93.
Никитин В. П. Опыт изучения функционального состояния артериаль-
ной системы // Клин. мед. — 1959. — № 6. — С. 141—148.
Никитин В. П. Значение сфигмографии в диагностике нейроциркулятор-
ной дистонии // Военно-мед. журн. — 1960. - № 5. - С. 22—26.
Обрезан А. Г. Регуляция артериального давления сосудистыми факторами у
больных гипертонической болезнью // Тр. Всероссийск. конф, кардиол. — СПб.,
1993. - С. 326-327.
Оганов Р. Г., Бритов А. Н. Методические вопросы профилактики сердечно-
сосудистых заболеваний. — М.: Медицина, 1983. — 205 с.
Ольбинская Л. И., Голубев С. А., Большакова Т. Д. и др. Активность глюко- и
минералокортикоидной функций коры надпочечников при лечении каптоприлом
больных гипертонической болезнью // Кардиология. — 1993. — Т. 33, № 4. —
С. 28-30.
Ольбинская Л. И., Морозова Т. Е., Вартанова О. А. Сравнительная оценка
клинических и кардиогемодинамических эффектов антагонистов кальция из
группы дигвдропиридинов у больных с артериальной гипертензией // Кардиоло-
гия. - 1994. - Т. 34, № 3. - С. 33-36.
387
Орлов С. Н., Покудин Н. И., Постнов Ю. В. Са-аккумулирующая способность
клеточных мембран миокарда и гладкой мускулатуры крыс со спонтанной гене-
тической гипертензией//Кардиология. — 1980. -№ 2. - С. 94—100.
Осадчий Л. Н. Работа сердца и тонус сосудов. — Л.: Наука, 1975. — 188 с.
Павлов И. П. О нормальных колебаниях кровяного давления у собаки // Се-
ченов, Павлов, Введенский. Физиология нервной системы. — М., 1952. —
Вып. IV. - С. 30-39.
Палеев Н. Р, Одинакова В. Р., Мравян С. Н. Эндотелии: механизмы действия
и перспективы изучения // Кардиология. — 1993. — № 1. — С. 65—68.
Перера Дж. (Perera J.) Клиническое изучение гипертонии// Современ-
ные проблемы кардиологии. — М., 1960. — С. 189—196.
Полотебнов А. Г. Склероз артериальной стенки как причина последователь-
ного страдания сердца // Арх. клиники внутр, бол. проф. С. П. Боткина. — СПб.,
1869. -Т. 1. - С. 1-11.
Постнов Ю. В. Почки при хронической артериальной гипертензии: «пере-
ключение» и роль почечной медуллы в ее развитии // Кардиология. — 1979. —
№ 12. - С. 30-38.
Постнов Ю. В., Орлов С. Н. Первичная гипертензия как патология клеточ-
ных мембран. — М.: Медицина, 1987. — 189 с.
Постнов Ю. В. Первичная гипертензия: клеточный рейтинг и переключение
почки // Кардиология. — 1993. — Т. 33, № 8. — С. 7—15.
Ратнер Н. А. Артериальные гипертонии. — М.: Медицина, 1974.— 415 с.
Рябов С. И. Хронический гломерулонефрит. — В кн.: Гломерулонефрит. —
Л.: Медицина, 1980. - С. 125-142.
Савицкий Н. Н. Физические свойства нарушения гемодинамики при гипер-
тонии // Клин. мед. — 1948. — № 9. — С. 7—11.
Савицкий Н. Н. Биофизические основы кровообращения и клинические ме-
тоды изучения гемодинамики. — Л.: Медицина, 1974. — 311 с.
Савицкий Н. Н., Кушаковский М. С. Гипокинетическая реакция аппарата кро-
вообращения и значение сдвига в диссоциации оксигемоглобина при нефроген-
ных формах гипертонии // Труды ВМА. — Л., 1967. — Т. 179. — С. 27—34.
Смоленский В. С. Нейроэндокринная гипертония // Артериальная гипертен-
зия и почки. — СПб., 1993. — С. 30—31.
Смоленский В. С., Павлов А. А., Филатова Н. П. и др. Центральная и почечная
гемодинамика у больных гипертонической болезнью с высокой, нормальной и
низкой активностью ренина в плазме крови // Кардиология. — 1980. - № 9. -
С. 14-18.
Соколов Е. И., Белова Е. В. Эмоции в патологии сердца. — М.: Наука, 1983. —
205 с.
388
Судаков К. В., Белова Т. И., Юматов Е. А. Центральные нейрохимические
механизмы сердечно-сосудистых реакций при остром эмоциональном стрессе //
Артериальная гипертензия. — М.: Медицина, 1980. — С. 170—182.
Тареев Е. М. Злокачественная гипертоническая болезнь // Основы нефроло-
гии. — М.: Медицина, 1972. — Т. 1. — С. 418—469.
Темиров А. А. Некоторые вопросы патогенеза и принципы дифференциро-
ванной терапии гипертонической болезни // Клиническая диагностика и лечение
гипертензивных состояний. — Л.: 1 ЛМИ, 1979. — С. 5—11.
Ткаченко Б. И. Венозное кровообращение.— Л.: Медицина, 1979. — 224 с.
Токарь А. В. Артериальная гипертензия и возраст. — Киев: Здоров’я, 1977. —
141 с.
Харченко В. И., Евсиков Е. М. Содержание натрия, воды и показатели цент-
ральной гемодинамики у больных гипертонической болезнью// Кардиология. —
1980. - № 9. - С. 29-33.
Хаютин В. М. Сосудодвигательные рефлексы. — М.: Наука, 1964. — 376 с.
Хвиливицкая М. И. О некоторых клинических методах определения функцио-
нальных свойств аорты // Тер. арх. — 1929. — № 7. — С. 6—11.
Хирманов В. Н., Алмазов В. А., Щербак А. И. Натрийуретические гормоны
(предсердный и дигиталисоподобный) у больных с артериальной гипертензией в
условиях функциональных нагрузок // Кардиология. — 1992. — Т. 32, № 1.—
С. 55-60.
Цикулин А. Е. Внутренняя картина заболевания у лиц с пограничной арте-
риальной гипертензией и гипертонической болезнью // Кардиология. — 1987. —
№ 8. - С. 27-29.
Цфасман А. 3. Систолическая гипертония у людей старших возрастов. — М.:
Медицина, 1985. — 160 с.
Цырлин В. А. Нейрофармакология нового гипотензивного препарата катапре-
сана // Фармакологическое изучение гипотензивных средств центрального дейст-
вия. - Л., 1975. - С. 27-43.
Цырлин В. А., Екимов Е. Н. Влияние антигипертензивных соединений на ги-
поталамическую регуляцию барорецепторных рефлексов // Фармакол. и токси-
кол. - 1980. - № 1. - С. 49-52.
Цырлин В. А., Екимов Е. Н. Барорефлекторная регуляция артериального дав-
ления и регионарного кровотока при эмоциональном напряжении // Физиол.
журн. СССР. - 1970. - № 10.- С. 1466-1473.
Чазов Е. И. (Chasov Е. I.). Heart adaptation to acute pressure overload. An in-
volvement of endogenous prostaglandins // Circulat. Res. — 1979. — Vol. 45, N 2. —
P. 205-211.
Чернух A. M., Александров П. H., Алексеев О. В. Микроциркуляция. — М.,
1983. - 405 с.
389
Чурина С. К. Эколого-физиологические аспекты формирования артериаль-
ной гипертензии в условиях Ленинграда: факты и гипотезы // Физиол. журн.
СССР. - 1988. - № 11. - С. 1615-1621.
Чурин К. В., Кушаковский М. С. Кальций-зависимая форма первичной арте-
риальной гипертензии: некоторые особенности метаболизма кальция // Арте-
риальная гипертензия и почки. — СПб., 1993. — С. 24—25.
Шабров А. В. Гипоталамо-гипофизарная дисфункция у лиц с пограничной
артериальной гипертензией как причина развития гипертонической болезни //
Артериальная гипертензия и почки. — СПб., 1993. — С. 34.
Шапошников А. В., Титов В. Н, Михайловский Н. и др. Натрийуретический
фактор; обзор литературы // Лабор. дело. — 1986. — № 11. — С. 670—677.
Шляхто Е. В., Лебедев С. В., Лопатин Ю. М. и др. Участие барорецепторного
рефлекса в гипотензивном эффекте клофелина у больных гипертонической бо-
лезнью // Фармакол. и токсикол. — 1987. — № 1. — С. 91—94.
Шхвацабая И. К. Вопросы нейрогуморальной регуляции и патогенеза гипер-
тонической болезни // Кардиология. — 1980. — № 9. — С. 5—13.
Шхвацабая И. К. Гипертоническая болезнь // Руководство по кардиологии /
Ред. Е. И. Чазов. - М., 1982. - Т. 4. - С. 5-65.
Шулутко Б. И. Итоги 20-летнего изучения проблемы артериальной гипер-
тензии// Артериальная гипертензия и почки. — СПб., 1993. — С. 36—37.
Шулутко Б. И., Перов Ю. Л. Артериальная гипертензия. СПб.: МАПО,
1993. - 302 с.
Шутко Г. В., Иванова Н. В. К вопросу о лечении некоторых неотложных ги-
пертензивных состояний // Диагностика и лечение неотложных состояний. — Л.:
ГИДУВ, 1984. - С. 91-94.
Эрина Е. В. Лечение гипертонической болезни// Кардиология. — 1980. —
№9. -С. 114-121.
Яновский М. В. О клинической методике определения механизма измерений
артериального давления // Изд. ВМА. — 1905. — № 10. — С. 1—10.
Adair Т. Н, Gey Ж S., Montani J. Р. Growth regulation of the vascular system:
evidence for a metabolic hypothesis // Am. J. Physiol. — 1990. — Vol. 259. —
P. 393-404.
Amore P. A., Tompson R. W. Mechanism of angiogenesis // Ann. Rev. Physiol. —
1987. - Vol. 49. - P. 453-465.
Baumbach G. L., Heistadd D. D. Remodeling of cerebral arterioles in chronic hy-
pertension // Hypertens. — 1989. — Vol. 9. — P. 987—991.
Baumbach G. L., Heistadd D. D. Adaptive changes in cerebral blood vessels during
chronic hypertension //J. Hypertens. — 1991. — Vol. 9. — P. 987—991.
Bianchi S., Biggazi R., Valtriant C. et al. Elevated serum insulin level in patient with
essential hypertension// Hypertens. — Vol. 23 (part 1). — P. 681—687.
390
Blaustein M. P. Sodium ions, calcium ions, blood pressure regulation and hyperten-
sion: a reassessment and hypothesis // Am. J. Physiol. — 1977. — Vol. 232. —
P. 163-173.
Blaustein M. P. Sodium metabolism and hypertension// Klin. Wschr. — 1985. —
Bd 65. - S. 21-32.
Bongiovi S. Age and blood pressure-related changes in left ventricular diastolic fil-
ling// J. Hypertens. - 1990. - Vol. 10 (Suppl. 2). - P. 25-30.
Borhani N. O. Left ventricular hypertrophy, arrhythmias and sudden death in
systemic hypertension//Am. J. Cardiol. — 1981. — Vol. 60, N 17. — P. 131—181.
Boudier H, A. J., le Noble J. L., Messing M. J. et al. The microcirculation and
hypertension // J. Hypertens. — 1992. — Vol. 10 (Suppl. 7). — S147—S156.
Brown M. A., Whitworth J. A. Hypertension in human renal disease// J. Hypertens. —
1992. - Vol. 10, N 8. - P. 701-712.
Brown M. A., Zammit V. C.f Mitar D. M. Extracellular fluid volumes in pregnancy-
induced hypertension//!. Hypertens. — 1992. — Vol. 10, N 1. — P. 61—68.
Buhler F., Kiowski W., Bolli P. et al. The pathophysiology of essential hypertension:
adrenergic, cardiovascular and renal regulatory mechanisms. — Bondoz, Basle. — 1985.
Compex V. M. Salt-sensitivity in hypertension//Hypertens. — 1994. — Vol. 23. —
P. 531-550.
Cannesa M., Agregna N., Solomon N. S. et al. Increased sodium-lithium countert-
ransport in red cell patients with hypertension // New Engl. J. Med. — 1980. —
Vol. 32. - P. 772-776.
Chalmers J., Arnold L., Kapoor V. et al. Amino acid neurotransmitters in the arterial
control of blood pressure in man and in experimental hypertension // J. Hypertens. —
1992. - Vol. 10 (Suppl. 7). - S. 27-S. 39.
Cinak R., Widimsky J., Jansky P., Lefflerova К. Суточное амбулаторное монито-
рирование кровяного давления при лечении умеренной гипертонии исрадипи-
ном // Cor Vasa. - 1990. - 32. - (2 - Suppl.) - S. 63-69.
Cohike P., Linz W., Scholkens B. A. et al. Angiotensin-converting enzyme inhibiti-
on improves cardiac function hole of bradikinin // Hypertens. — 1994. — Vol. 23. —
P. 411-418.
Conwey J. Hemodynamic aspects of essential hypertension in human // Physiol.
Rev. - 1989. - Vol. 64. - P. 617-660.
Cowley A. L. Long-term control of arterial blood pressure // Physiol. Rev. —
1992. - Vol. 72. - P. 221-300.
Cowley A. L., Roman R. J., Fenoy F. J. Effect of renal medullary circulation on
arterial pressure // J. Hypertens. — 1992. — Vol. 10 (Suppl. 7). — S. 187—193.
Cox J. P., O'Brien E., O’Melloy K. The J.-shaped curve in elderly hypertensives //
J. Cardio-vasc. Pharmacol. — 1988. — Vol. 12 (Suppl. 8). — S. 17—23.
Cruickshank J. M., Torp J. M., Zacharis F. J. Benefits and potential harm of
lowering high blood pressure// Lancet. — 1987. — i. — 581—584.
391
Dahl L. К. Effect of chronic excess salt feding: induction of self-sustaining in
rats // J. Exper. Med. — 1961. — Vol. 114. — P. 231—236.
Dahl L. K., Heine M., Thompson K. Genetic influences of the kidney on blood
pressure // Circulat. Res. — 1974. — Vol. 34. — P. 94—101.
Davey M. J. Pharmacologic basis for the use doxazozin in the treatment of essential
hypertension // Am. J. Med. — 1989. — Vol. 87 (Suppl. 2A). — S. 36—44.
Devereux R. R. Importance of left ventricular mass as a predictor of cardiovascular
morbidity in hypertension // Am. J. Hypertens. — 1989. —Vol. 2. — P. 650—659.
De Wardener H. E., Clarcsson E. M. Concepts of natriuretic hormone // Physiol.
Rev. - 1985. - Vol. 65. - P. 658-759.
Di Bona G. F. The function of the renal nerves // Rev. Physiol. Biochem. Pharma-
col.// 1982. - Vol. 94. - P. 75-181.
Di Bona G. F. Neural control of renal function//Hypertens. — 1989. — Vol. 13. —
P. 533-548.
Di Bona G. F., Jones S. J. Central a2-adrenoreceptor responsiveness in borderline
hypertensive rats // J. Hypertens. — 1991. — Vol. 9. — P. 543—548.
Dipette D. J., Frohlich E. D. Cardiac involvement in hypertension // Am. J. Cardi-
ol. - 1986. - Vol. 61n. - H. 67-72.
Doyle A. E., Vanhoutte P., Robertson S. I. Age-related effects of antihypertensive
therapy//J. Cardiol. Pharmacol. — 1988. — Vol. 12 (Suppl. 8). — S. 1—S. 182.
Dubin D., Pratt R. E., Hai R. L. Characterization of prorenin activation using a
synthetic peptide substrate// J. Hypertens. — 1991. — Vol. 9, N 6. — P. 483—486.
Dustan H. P., Valdes G., Bravo E., Tarazi R. Excessive sodium retention as a
characteristic of salt-sensitive hypertension // Am. J. Med. Sci. — 1986. — Vol. 242. —
P. 67-74.
Drau V. I. Implications of local angiotensin production in cardiovascular physiology
and pharmacology // Am. J. Cardiol. — 1987. — Vol. 59. — A. 59—65.
Egan В. M. Insulin level are similar in obese salt-sensitive and salt-resistant hyper-
tensive subjects // Hypertens. — 1994. — Vol. 23. — P. 1—7.
Eggena P., Barrett J. D. Regulation and functional consequences of angiotensino-
gen gene expression // J. Hypertens. — 1992. — Vol. 10. — P. 1297— 1311.
Endre T, Mattiason I., Berglund G. et al. Insulin and renal sodium retention in
hypertensive-prone man // Hypertens. — 1994. — Vol. 23. — P. 370—374.
Enstrom I., Thalin Th., Lindcholm L. How good are standartized blood pressure
recordings for diagnosing hypertension? A comparison between office and ambulatory
blood pressure//}. Hypertens. — 1991. — Vol. 9, N 6. — P. 561— 566.
Erne P, Buhler F. Correlation of platelet calcium with blood pressure: effect of
antihypertensive therapy// N. Engl. J. Med. — 1984. — Vol. 310. — P. 1084—1088.
Felix D. Peptide and acetylcholine action on neurones of the cat subfornical organ
/ N-Schmied. Arch. Pharmacol. — 1976. — Vol. 292, N 1. — P. 15—20.
392
Fleckenstein A., Tritfhard H., Fleckenstein B. et al. A new group of < omprtilivr < и
antagonist (iproweratril, D600, prenylamine) with highly potent inhihiloiy cflrels <»l
excitation-contraction coupling in mammalian myocardium // PfUgcrs Arch Physiol
1969. - Vol. 307, N 2. - R. 25-40.
Ferrario С. M. The renin-angiotensin system: importance in physiology and pal ho
logy// J. Cardiovasc. Pharmacol. — 1990. — Vol. 15. — S. 1—5.
Folkow B. The hemodynamic consequences to aduptive structural changes of resis-
tant vessels in hypertension// Br. med. J. — 1973. —Vol. 1. — P. 505—510.
Folkow B. Physiological aspects of primary hypertension// Physiol. Rev. — 1982. —
Vol. 62. - P. 347-504.
Folkow B., Di Bona G., Hiemdahl P. et al. Measurement of plasma norepinephrine
concentrations in human primary hypertension // J. Hypertens. — 1983. — Vol. 5. —
P. 399-403.
Frank O. The theory of pulse waves// Z. Biol. — 1926. — Bd 85. — S. 91—130.
Freis E. D. Age and antihypertensive drugs// Amer. J. Cardiol. — 1988. — Vol. 61,
N 1. - P. 117-121.
Frohlich E. D. An epilogue: target organ involvement in essential hypertension ba-
sed on present concepts and discussions // Am. J. Cardiol. — 1987. — Vol. 60. —
P. 1271-1331.
Frohlich E. D. Reversal of target-organ involment in systemic hypertension:
a pharmacologic experience // Am. J. Cardiol. — 1987. — Vol. 60, N 17. — P. 31—37.
Frohlich E. D., Tarazi R. C. Is arterial pressure the sole factor responsible for
cardiac hypertrophy?//Am. J. Cardiol. — 1988. — Vol. 61, N 1. — P. 117—121.
Canten D. Renin in dog brain // Am. J. Physiol. — 1971. — Vol. 221. —
P. 1733-1737.
Garsia S. V., Vidt D. G. Current management of hypertensive emergencies //
Drugs. - 1982. - Vol. 34. - P. 263-278.
Gasselas D., Moore L. C. Autoregulation and tubuloglomerular feedback in juxta-
medullary glomerular arterioles // Am. J. Physiol. —1990. — Vol. 258. — F. 660—669.
Giles T. D., Massie В. M. Role of calcium antagonists as initial pharmacologic mono-
therapie for systemic hypertension in patient over 60 years of age // Am. J. Cardiol. —
1988. - Vol. 61. - P. 13-17.
Gonzales E., Krieger A., Sapru A. H. Central reseting of baroreflex in the spon-
taneously hypertensive rat // Hypertens. — 1983. — Vol. 5, N 3. — P. 346—352.
Grassi G, Seravalle G., Calhoun D. A. Physical training and baroreflector control of
sympathetic nerve activity in human // Hypertens. — 1994. — Vol. 23. — P. 249—301.
Gutkind J. S., Enero H. A. Different pharmacological interaction of clonidine
and guanabenz with antidepressive drugs // Clin, and exper. — theory a. practice. —
1987. - A9( 10). - P. 1531-1547.
Guyton A. C. Arterial pressure and hypertension. — Philadelphia: W. B. Sannders,
1980. - 564 p.
393
Guyton A. C. The surprising kidney-fluid mechanism for pressure control: its infini-
tive gain// Hypertens. — 1990. — Vol. 16. — P. 725—730.
Guyton A. C., Hall A. E., Lohmeser T, E, et al. Role of the kidney and volume
control in the pathogenesis of hypertension. — N. Y., 1983. — Vol. 1.— P. 216—238.
Hoddy F. I. Abnormalities of membrane transport hypertension // Hypertens. —
1983. - Vol. 5 (Suppl. 5). - R. 66-72.
Hall J. E. Renal and cardiovascular mechanisms of hypertension in obesity //
Hypertens. - 1994. - Vol. 23. - P. 381-394.
Hamlyn J. M., Blaustein M. P., Bova S. et al. Identification and characterization of
oubain-like compound from human plasma // Proc. Natl. Acad. Sci. USA. — 1991. —
Vol. 88. - P. 6259—6263.
Hamlyn J. M., Manunta B. Ouabain, digitalis-like factor, and hypertension //
J. Hypertens. - 1992.- Vol. 10 (Suppl. 7). - S. 99-S. 111.
Hatton D. C., McCarron D. A. Dietary calcium and blood pressure in experimental
model of hypertension. A review // Hypertens. — 1984. — Vol. 23. — P. 513—530.
Heine H., Weiss M. Life stress and hypertension // Europ. Heart J. — 1987. —
Vol. 8. - P. 45-55.
Heikmhaime P. J. Blood pressure in the very old // J. Hypertens. — 1990. —
Vol. 8. - P. 361-367.
Helber A. Evidence for a subgroup of essential hypertensives with nonsuppresible
excretion of aldosteron during sodium loading // Klin. Wschr. — 1980. — Bd 58,
N 9. - S. 439-447.
Henry D. P. Norepinephrine in urine and plasma following provocative maneures
in normal and hypertensive subjects // Hypertens. — 1980. — Vol. 2. — P. 20—28.
Hoffman В. B., Lefcowitz R. J. Alfa-adrenergic receptor subtypes // N. Engl. J.
Med. - 1980. - Vol. 32, N 25. - P. 1390-1396.
Hollenberg N. K. Vasodilatators, antihypertensive therapy and the kidney // Am. J.
Cardiol. - 1987. - Vol. 60, N 17. - P. 571-601.
Houston M. C. The comparative effects of clonidine hydrochloride and nifedipini in
the treatment of hypertensive crisis//Am. J. Heart. —1988. — Vol. 115, N 1 (part 1). —
P. 152-159.
Houston M. C. New insight in new approaches for the treatment of essential hyper-
tension, selection of therapy based on coronary heart disease risk factor analysis, hemo-
dynamic profiles, quality of life and subsets of hypertension // Am. Heart J. — 1989. —
Vol. 117, N4.-P. 911-951.
Ishizuka J., Miura J., Kimura Sh. et al. The baroreflex-mediated changes in plasma
norepinephrine and heart rate in patient with essential hypertension // Jap. Circul. J. —
1987. - Vol. 51, N 10. - P. 165-173.
Johnston C. L. Tissue angiotensin converting enzyme in cardiac and vascular hyper-
trophy, repair and remodeling// Hypertens. — 1994. — Vol. 23, N 2. — P. 258—268.
394
Julius S. Classification hypertension// Hypertension/Ed. Genest et al. — N. Y.,
McGraw-Hill company, 1977. — P. 9—12.
Julius S., Kausson L., Andren L. Borderline hypertension // Acta med. Scand. —
1980. - Vol. 208. - P. 495-511.
Julius S. Therapeutic decisions in management of borderline hypertension // Life-
long management of hypertension. — Boston, 1983. — P. 46—58.
Kaplan N. N. The deadly quartet: upper body obesity, glucose intolerance, hyper-
triglyceridemia and hypertension// Arch, intern. Med. — 1989. — Vol. 149. —
P. 1514-1520.
Kendall M. J. Cardioprotection managing the cardiovascular risks of hyperten-
sion//Clin. Cardiol. - 1991. - Vol. 14 (Suppl. III). - III.1-III.39.
Kiouski H., Buhler F., Fadayoni M. 0. et al. Age, race, blood pressure hypertensive
and normotensive and renin predictors for antihypertensive treatment with calcium
antagonist // Jap. Circul. J. — 1987. — Vol. 31. — P. 1208—1215.
Koepke J. P., Di Bona G. F. High sodium intake enhances renal nerve and anti-
natriuretic responses to stress in conscious SHR // Hypertens. — 1985. — Vol. 7. —
P. 357-363.
Koepke J. P., Di Bona G. F. Central adrenoreceptor control of renal function in
conscious hypertensive rats // Hypertens. — 1986. — Vol. 8. — P. 133—141.
Kollock K, Kobayashi K., De Quatro V. Dopaminergic control of sympathetic
tone and blood pressure: evidence of primary hypertension // Hypertens. — 1980. —
Vol. 2. - P. 390-394.
Komer P. L. Present status of the autoregulation theory in the pathogenesis of
hypertension // Clin, exper. Pharmacol. Physiol. —1980. — Vol. 7. — P. 521—526.
Kosterlitz H. W., Peterson S. L., Robson L. E. Characterization of the subtype of the
opiat receptor in the guinea pig brain // Brit. J. Pharmacol. — 1981. — Vol. 73. —
P. 939-949.
Krishna G. G., Kapoor S. C. Potassium depletion excurbates essential hyperten-
sion//Ann. Intern. Med. — 1991. — Vol. 115. — P. 77—83.
Kwan C. J. Disfunction of calcium handling by smooth muscle in hypertension //
Can. J. Physiol. Pharmacol. — 1985. — Vol. 63. — P. 366—374.
Kwan C. J.f Chaudhaty R., Zheng X.-F. et al. Effect of sarcoplasmatic reticulum
calcium pump inhibitors on vascular smooth muscle // Hypertens. — 1994. — Vol. 23
(Suppl. 1). - I. 156-160.
Laragh J. H. Cardiac pathophysiology and its heterogenity in patients with established
hypertensive disease//Am. J. Med. — 1988. — Vol. 84, N 1 (Suppl. 39). — P. 3—11.
Laragh J. H., Sealey D. P. (Лара X. Д., Силей Д. P.) Использование ренино-
натриевого профиля для диагностики и лечения артериальной гипертензии //
Артериальная гипертензия. — М.: Медицина, 1980. — С. 215—244.
395
Lawler S. E., Barker G. E, Hubbard J. W. et al. The effect of conflict on tonic
levels of blood pressure in the genetically hypertensive rats // Psichophysiology. —
1980. - Vol. 17. - P. 363-370.
Lawler S. E., Barker G. E, Hubbard J. W. et al. Blood pressure and plasma renin
activity responses in chronic stress in the borderline hypertensive rat// Physiol. Rev. —
1984. - Vol. 32. - P. 101-105.
Lee J. H. Familial agregation of blood pressure newborn infants and their
mothers // Pediatrics. - 1976. - Vol. 58. - P. 722-729.
Levanczuk R. Z., Resnick D. M., Blumenfeld J. D., Laragh J. H., Pang P. Rapid
communication. A new circulating hypertensive factor in the plasma of essential
hypertension // J. Hypertens. — 1990. — Vol. 8. — P. 105—108.
Lever A. E, Harrap J. B. Essential hypertension: a disorder of growth with origin
in childhood//}. Hypertens. - 1992. - Vol. 10. - P. 101-121.
Levy B. L, Million J.-M. Changes in compliance in physiological states: summary //
J. Hypertens. - 1992. - Vol. 10 (Suppl. 6). - P. 569-571.
Liard J. F. Effects of arginin vasopressin on regional circulation (Vasopressin). —
N. Y., 1985. - P. 59-67.
Luft F. C. Ptasma and urine norepinephrine values at extremes of sodium intake in
normal man// Hypertens. — 1979. — Vol. 1. — P. 261—266.
Luft P. C, Miller J. Z., Cohen S. J. et al. Heritabte aspects of salt sensivity //
Am. J. Cardioi. - 1988. - Vol. 61, N 16. - P. 1-6.
Lund-Johanson P. Hemodinamic concepts in essential hypertension// Triangle. —
1984. - Vol. 23. - P. 13-25.
MacCarron D. A. Low-serum concentration of ionized calcium in patients with
hypertension // N. Engl. J. Med. - 1982. - Vol. 307. - P. 226-228.
MacCarron D. A. Calcium metabolism and hypertension // Kidney Int. — 1989. —
Vol. 35. - P. 717-736.
MacGregor G. A. Sodium is more important than calcium in essential hypertension //
Hypertens. - 1985. - Vol. 7. - P. 628-637.
Mayhan Ж G., Heistad D. D. Role of veins and cerebral venous pressure in
disruption of the blood-brain barier// Circulat. Res. — 1986. — Vol. 39. — P. 216—220.
Mayhan Ж G., Taraci F. M., Heistad D. D. Disruption of brain-blood barrier in
the cerebrum and brain-stem during acute hypertension // Am. J. Physiol. — 1986. —
Vol. 20. - P. 1171-1175.
Mancia G, Ludbrook J., Ferrari A. et al. Baroreceptor reflexes in human hyper-
tension // Circulat. Res. - 1978. - Vol. 43. - P. 170-177.
Mancia G, Ferreri A., Gregorini L. Circulatory reflexes from carotid and extracaro-
tid baroreflexes in man // Circulat. Res. — 1977. — Vol. 41, N 3. — P. 309—315.
Marlettini M. G, Cassani A., Mouselli-Lubate A. M. et al. Role of prolactine in pre-
gnancy hypertension // Clin. Exper. Theory and Practic. — 1987. — Vol. 9A. —
P. 1099-1119.
396
Matsuda К Assesment of left atrial function in patients with hypertensive heart
disease // Hypertens. — 1988. — Vol. 8, N 9. — P. 779—785.
Mendonga M., Garay R. P. Abnormal erytrocyte cation transport in primary hyper-
tension: clinical and experimental studies // Hypertens. —1981. — Vol. 3 (Suppl. 1). —
1.179-183.
Messerli F. H. The heterogeneity of essential hypertension: hemodynamic aspects //
Am. Heart. J. - 1988. - Vol. 116, N 2 (part 2). - P. 590-593.
Ming J. Ch., Lee C., Ohta H. et al. Hemodynamics effects elicited by stimulation of
the Nucleus tractus solitarii // Hypertens. — 1991. — Vol. 23 (Suppl. 1). — 1.73—1.77.
Millar-Graig M. IK Circadian variation of blood pressure // Lancet. — 1978. — i. —
795-797.
Moril N. Increased tissue level of nefrial natriuretic polypeptide in the hypothala-
mus and septum of spontaneously hypertensive rats // J. Hypertens. — 1986. — Vol. 4
(Suppl. 3). - P. 309-312.
Moser M. Stepped-care hypertension therapy // Postgrad. Med. — 1987. —
Vol. 81. - P. 111-121.
Opie H. Drugs and the heart. I. Beta-blocking agent // Lancet. — 1980. —
Vol. 1. - P. 693-698.
Opie L. H. Clinical use of calcium channel antagonist drugs. — Boston: Kluwer
Academic Publischers, 1989. — 394 p.
Orlov S. N., Resnik T. J., Bernhardt J., Buhler F. R. Na+—K+-cotransport in
cultured vascular smooth muscle cells from spontaneously hypertensive and normoten-
sive rats: baselein activity and regulation // J. Hypertens. — 1992. — Vol. 10, N 8. —
P. 733-740.
Overlack A., Stumpe К. O., Ressel C. Normalisierung von erniedringter Urin—
Kallikrein—Aktivitat und erchOhtem Blutdruck dutch orale Kallikrein — Gale bei
essentieller Hypertonic // Klin. Wschr. — 1980. — Bd 58, H. 1. — S. 37—43.
Page I. H. The continuing failure to understand and treat hypertension // JAMA. —
1979. - Vol. 241, N 18. - P. 1897-1899.
Pang P. К. T., Harvey S., Doris P. A. Plasma PTH during development of sponta-
neous hypertension in rats // Can. J. Physiol., Pharmacol. — 1987. — Vol. 65, N 12. —
P. 2386-2389.
Pang P. К. T., Levanczuk R. Z. Parathyroid origin of a new circulatory hypertensive
factor in spontaneously hypertensive rats // Am. J. Hypertens. — 1989. — Vol. 2. —
P. 898-902.
Pfeiffer A., Fenerstein G., Zerbe R. L. et al. Receptors mediate opioid cardiovascular
effects at anterior hypothalamic sites through sympatoadrenomedullary and parasym-
pathetic pathways//Endocrinology. —1983. — Vol. 113. — P. 929—938.
Pickering G. Hypertension. — Edinburgh and London, 1974. — 150 p.
Pickering Th. G. The ninth six George Pickering memorial lecture// J. Hypertens. —
1992. - Vol. 90. - P. 401-408.
397
Person B.f Granerus G., Wysocki M. et al. Acute systemic and renal haemodynamic
effect and long-term antihypertensive action of gydralazine on patients preatreted with
B-blockers and diuretics // Eur. J. clin. Pharmacol. — 1987. — Vol. 31. — P. 513—518.
Prichard B. N. S. р-adrenoreceptor blocking agents in the management of hyper-
tension // Cardiology. — 1978. — Vol. 63. — P. 44—87.
Prisant D. M. How can we diagnose coronary-heart disease in hypertensive
patients? // Hypertension. — 1987. — Vol. 10, N 5. — P. 467—472.
O'Rourke M. F., Brunner H. R. Introduction to arterial compliance and function //
J. Hypertens. - 1992. - Vol. 10 (Suppl. 6). - S. 3-5.
Reaven G. M. Role of insulin resistance in human disease // Diabetes. — 1988. —
Vol. 37. - P. 1595-1606.
Reid J. L., Elliot H. L., Vincent J. Clinical pharmacology of selective alpha
blockers // Am. J. Med. - 1987. - Vol. 82 (Suppl. IA). - P. 15-20.
Reis D. J. (Рейс Д. И.) Центральная нервная регуляция артериального дав-
ления и связь с гипертензией// Артериальная гипертензия. — М.: Медицина,
1980. - С. 150-169.
Resnick L. М., Laragh J. Н. The hypotensive effect of short-term oral calcium
loading in essential hypertension // Clin. Res. — 1983. — Vol. 31. — P. 334—337.
Resnick L. M., Laragh J. H. Renin, calcium metabolism and the pathophysiologic
basis of antihypertensive therapy// Am. J. Cardiol. — 1985. — Vol. 56. N 6. —
P. 68H-74H.
Resnick L. M., Nicholson J. P.f Laragh J. H. Calcium metabolism in essential
hypertension. Relation to altered renin system activity// Fed. Proc. — 1986. — Vol. 45.
N 12. - P. 2739-2745.
Samuel P. Действие исрадипина — нового антагониста кальция на профиль
липидов у гипертоников// Cor Vasa. — 1990. — Vol. 32. (2-Suppl.). S.40—47.
Schmieder R. E., Bahr M., Langenitz W. et al. Efficacy of four antihypertensive
drugs (clonidine, enalapril, nitrendipine, oxprenolol) on stress blood pressure // Am. J.
Cardiol. - 1989. - Vol. 63. - P. 1333-1339.
Sempos C., Cooper R., Kowar M. G. et al. Dietary calcium and blood pressure in
National health and nutrition examination surveys I and II// Hypertens. — 1986. —
Vol. 8. - P. 1067-1074.
Simpson P. Norepinephrine-stimulated hypertrophy of cultured rat myocardial cells
in alpha-1-adrenergic response // J. Clin. Investig. — 1983. — Vol. 72. — P. 732—738.
Stassen J., Bulpitt C., Clement D. et al. Relation between mortality and treated
blood pressure in elderly patients with hypertension: report of the European working
party on high blood pressure in the elderly // Brit. Med. J. — 1989. — Vol. 298. —
P. 1552-1556.
Stassen J., Fugard R., Amery A. Blood pressure, caloric intake an obesity// Epide-
miology of hypertension. — Amsterdam, 1985. — P. 131—158.
398
Stem N., Lee D. B. N.f Silis V. et al. Effects of high calcium Intake on blood
pressure and calcium metabolism in young SHR // Hypertens. — 1984. Vol (»
P. 639-646.
Strandgaard S., Olsen J., Skinhy E. et al. Autoregulation of brain circulation In
severe arterial hypertension// Brit. Med. J. — 1973. — Vol. 1. — P. 507—510.
Strasser R. H.} Ih-Vahl R., Marquetant B. Molecular biology of adrenergic ir
ceptors // J. Hypertens. - 1992. - Vol. 10, N 6. - P. 501-506.
Swales J. D. Functional disturbances of the cell membrane in hypertension //
J. Hypertens. - 1990. - Vol. 8 (Suppl. 7). - P. 5203-5211.
Tamaki K., Sadoshima S., Baumbach G. L. et al. Evidence that disruption of the
blood-brain barier precedes reduction cerebral blood flow in hypertensive encephalo-
pathy // Hypertens. — 1984. — Vol. 6 (Suppl. 1). — P. 175—181.
Tabuchi J., Ogihara T.f Hachizume K. et al. Hypotensive effect of long-term oral
calcium supplementation in elderly patients with essential hypertension // J. Clin. Hy-
pertens. - 1986. - Vol. 3. - P. 254-262.
Tibirica E., Feldman J., Bousquet P. Contribution of catecholaminergic neurons of
the dorsomedial and ventrolateral medulla oblongata to hypertensive effect of clonidine
in spontaneously hypertensive rats // J. Hyperten. — 1992. — Vol. 10, N 11. —
P. 1327-1334.
Tobian L. Does hypertension lead to renal failure?//Am. J. Cardiol.—1987. —
Vol. 60. - P. 421-481.
Trimarco B., Le Luca N., De Simore A. et al. Impared control of vasopressin release
in hypertensive subjects with cardial hypertrophy // Hypertens. — 1987. — Vol. 10,
N 6. - P. 595-602.
Ueda К., Omae T., Hasuo Y. et al. Impact of high blood pressure on morbidity and
mortality // Hypertension in the elderly. — 1989. — P. 175—179.
Varts V. Weight reduction for control of systemic hypertension // Amer. J. Cardiol. —
1987. - Vol. 60, N 12. - P. 48-54.
van Zwieten P. A. The central action of antihypertensive drugs mediated via central
a2-receptors // J. Pharmacol. — 1979. — Vol. 25. — P. 89—95.
Vilner K. D., Ziegler M. Effect of alpha inhibition on renal blood flow and
sympathetic nervous activity in systemic hypertension // Am. J. Cardiol. — 1991. —
Vol. 59. - P. 82G.-86G.
Wallin B. G., Delius W.} Haglarth К. E. Comparison of sympathetic nerve activity
in normotensive and hypertensive subjects // Circulat. Res. — 1973. — Vol. 33. —
P. 9-11.
Weinberger M. H. Treatment of hypertension in the 1990s // Am. J. Med. —
1987. - Vol. 52 (Suppl. 1A), - P. 44-49.
Zanchetti A., Stella A., Leonetti G, Mancia G. The control of renin release //
Frontiers in hypertensive research. — N. Y., 1981. — P. 219—227.
399
Новая литература (конец 1990—2000 г.)
Алмазов В. А., Благосклонная А. В., Шляхто Е. В., Красильникова В. И. Мета-
болический сердечно-сосудистый синдром. — СПб. — 1999. — 202 с.
Алмазов В. А., Хирманов В. Н. Современное лечение артериальной гипертен-
зии. — СПб. — 1997. — 43 с.
Алмазов В. А., Шляхто Е. В., Шварц Е. И. и др. Полиморфизм генов ренин-
ангиотензиновой систолии и структурно-функциональное состояние миокарда у
больных гипертонической болезнью // Сб. научных трудов к 100-летию кафедры
им. Г. Ф. Ланга. — СПб. — 2000. — С. 5—11.
Арабидзе Г. Г., Арабидзе Гр. Г. Гипертонические кризы: классификация, диа-
гностика осложнений, лечение // Кардиология. — 1999. — Т. 39. — № 12. —
С. 86-90.
Арабидзе Г. Г, Арабидзе Гр. Г. Гипертонические кризы: классификация, диа-
гностика осложнений, лечение // Кардиология. — 1999. — Т. 39. — № 10. —
С. 86-90.
Баранова Е. И. Гипертоническая болезнь у женщин в постменопаузе: особен-
ности клинических проявлений, патогенеза и лечения. Автореф. докт. дис. —
СПб. - 1998.- 30 с.
Барт Б. Я. Систолическая гипертония у людей пожилого возраста в практи-
ческой деятельности участкового терапевта // Тер. арх. — 1994. — № 40. —
С. 79-81.
Белоусов Ю. Б. Клиническая эффективность и безопасность ирбесартана
у больных с мягкой и умеренной артериальной гипертонией. Результаты много-
центрового исследования // Кардиология. — 2000. — № 7. — С. 4—8.
Бондаренко Б. Б. Лекарственная терапия артериальной гипертензии (обзор
материалов многоцентровых кооперативных исследований) // Артериальная ги-
пертензия. — 1999. — Т. 5. — № 2. — С. 61—66.
Быстрова М. М., Бритов А. Н. Артериальная гипертония у женщин в постме-
нопаузе // Кардиология. — 1999. — Т. 39. — № 5. — С. 72—80.
Волков В. С., Мазур Е. С. Взаимосвязь циркадного ритма артериального дав-
ления и вторичных изменений сердца у больных гипертонической болезнью //
Кардиология. — 2000. — Т. 40. — № 3. — С. 27—30.
Воронин И. М., Игнатова Е. И., Белов А. М. Артериальная гипертензия и об-
структивные нарушения дыхания во время сна // Кардиология. — 2001. — № 3. —
С. 71-78.
Гогин Е. Е. Гипертоническая болезнь. — М. — 1997. — 400 с.
400
Голиков А. П., Рябинин В. А., Лукьянов М. М. и др. Особенности кризового те-
чения гипертонической болезни // Кардиология. — 1999. — Т. 39. — № 3. —
С. 13-17.
Голиков А. IT., Рябинин В. А., Лукьянов М. М. и др. Особенности кризового те-
чения гипертонической болезни // Кардиология. — 1999. — Т. 39. - № 9. -
С. 13-17.
Голиков А. П., Эстрин В. А. Гипертонические кризы. — Методические реко-
мендации. — М. — 1980.
Гончарук В. Д., Блюс Р. М. Функционально-морфологический статус супра-
хиазматического ядра гипоталамуса при первичной гипертензии: отношение к
нарушениям суточных ритмов гемодинамики // Кардиология. — 2000. — Т. 40. —
№ 4. - С. 36-39.
Донсков Л. С., Фадина 3. М., Голубь Т. В. и др. Нарушения пуринового обмена
у больных артериальной гипертонией // Кардиология. — 1998. — Т. 38. — № 10. —
С. 41-43.
Еремеев В. С., Хрусталева Р. С., Цырлин В. А. и др. Возможность участия ар-
териального барорецепторного рефлекса в длительном контроле симпатиче-
ской вазомоторной активности // Сб. научных трудов к 100-летию кафедры
им. Г. Ф. Ланга. - СПб. - 2000. - С. 29-39.
Еремеев В. С., Цырлин В. А. Нейрогенная гипертензия: история и современ-
ное состояние вопроса // Артериальная гипертензия. — 1995. — Т. 1. — № 1. —
С. 50-56.
Жуковский Г. С., Константинов В. В., Варламова Т. А., Капустина А. В. Арте-
риальная гипертония: эпидемиологическая ситуация в России и других стра-
нах // Русск. мед. журнал. — 1997. — № 5. — С. 552—558.
Задионченко В. С., Адашева Т. В., Сандомырская А. П. и др. Влияние небиво-
лола на суточный профиль артериального давления и морфофункциональные по-
казатели сердца у больных с мягкой и умеренной артериальной гипертонией //
Кардиология. — 2000. — № 7. — С. 12—15.
Задионченко В. С., Белякова Г. И., Горбачева Г. В. Гипертонические кризы //
Тер. арх. - 1998. - № 8. - С. 72-74.
Затейщиков А. А., Затейщиков Д. А. Эндотелиальная регуляция сосудистого
тонуса: методы исследования и клиническое значение // Кардиология. — 1999. —
Т. 39. - № 3. - С. 68-80.
Зимин Ю. В. Метаболические расстройства в рамках метаболического син-
дрома X (синдрома инсулинорезистентности): необходимость строгого при-
менения критериев диагностики синдрома // Кардиология. — 1999. — Т. 39. —
№8. -С. 37-41.
Зимин Ю. В., Родоманченко Т. В., Бойко Т. А. и др. Клиническая и гемодина-
мическая характеристика гипертонической болезни, ассоциированной с инсу-
линрезистентностью: связь массы миокарда левого желудочка сердца с гиперсек-
рецией ипарина // Кардиология. — 1998. — Т. 38. — № 4. — С. 9—13.
401
Ингибиторы ангиотензинпревращаемого фермента: тактика клинического
применения и перспективы использования // Кардиология. — 1999. — Т. 39. —
№ 5. - С. 85—95.
Карпов Р. С., Кошельская О. А., Ефимова Е. В., Врублевский А. В. Допплеро-
графическая оценка динамики почечного кровотока под влиянием цилазаприла
при сочетании артериальной гипертонии и сахарного диабета II типа на ранней
стадии нефропатии // Кардиология. — 1999. — Т. 39. — № 4. — С. 16—20.
Качалков Д. В., Веселова С. И. Исследование гипотензивной эффективности
и безопасности доксазазина у больных артериальной гипертонией в амбулатор-
ных условиях // Кардиология. — 1998. — Т. 38. — № 12. — С. 49—50.
Кедров А. А., Кедрова А. Н., Макеева Т. И. и др. Гемодинамика головного моз-
га (экспериментальное исследование) // Сб. научных трудов к 100-летию кафед-
ры им. Г. Ф. Ланга. — СПб. — 2000. — С. 50—56.
Кобалава Ж. Д. Лечение мягкой и умеренной гипертонии фелодипином.
Многоцентровое исследование фелодипина-ER в России // Клин. фарм. и тер. —
1998. - Т. 7. - № 3. - С. 43-44.
Кобалава Ж. Д. Международные стандарты по артериальной гипертонии:
согласованные и несогласованные позиции // Кардиология. — 1999. — Т. 39. —
№ 11.-С. 78-91.
Кобалава Ж. Д. Международные стандарты по артериальной гипертонии:
согласованные и несогласованные принципы // Кардиология. — 1999. — Т. 39. —
№ 11.-С. 78-91.
Кобалава Ж. Д. Эпросартан мезилат (Теветен) — новый блокатор рецепторов
ангиотензина II. Клинические достижения и перспективы // Клиническая фар-
макология и терапия. — 2000. — № 4. — С. 30—34.
Кобалава Ж. Д., Котовская Ю. В. Артериальная гипертензия 2000. — М. —
2001. - 208 с.
Кобалава Ж. Д., Котовская Ю. В., Моисеев В. С. Особенности утреннего
подъема артериального давления у больных гипертонической болезнью с различ-
ными вариантами суточного ритма // Кардиология. — 1999. — Т. 39. — № 6. —
С. 23-26.
Кобалава Ж. Д., Котовская Ю. В., Соколова М. А. и др. Эффективность и пе-
реносимость карведилола при лечении среднетяжелой эссенциальной гиперто-
нии // Кардиология. — 1998. — Т. 38. — № 2. — С. 52—57.
Кобалава Ж. Д., Мильто А. С. Исследование VAZUL — ожидаемые ответы на
актуальные вопросы кардиологии // Кардиология. — 2000. — № 7. — С. 78—81.
Кобалава Ж. Д., Школьникова Е. Э., Моисеев В. С. Особенности качества жиз-
ни у пожилых больных с изолированной систолической артериальной гиперто-
нией // Кардиология. — 1999. — Т. 39. — № 10. — С. 27—31.
Кобалава Ж. Д., Школьникова Е. Э., Моисеев В. С. Особенности качества жиз-
ни у пожилых больных с изолированной систолической гипертензией // Кардио-
логия. - 1999. - Т. 39. - № 10. - С. 27-31.
402
Комбинированная терапия артериальной гипертонии // Кардиология. —
1999. - Т. 39. - № 8. - С. 84-96.
Константинов В. В., Жуковский П. С., Оганов Р. Г. и др. Эпидемиология
систолической и диастолической артериальной гипертонии в связи с факторами
риска и образованием среди мужского населения в некоторых городах и зонах
России, стран СНГ, Прибалтийских государств // Тер. арх. — 1994. — № 1. —
С. 54-57.
Кошелева О. В. Нарушение систоло-диастолической функции левого желу-
дочка и их коррекция при гипертонической болезни (клинико-эхокардиографи-
ческое исследование). Автореф. канд. дис. — СПб. — 1998. — 24 с.
Крюков Н. Н., Качковский М. А. Комбинированные антигипертензивные пре-
параты: преимущества и недостатки // Кардиология. — 1999. — Т. 39. — № 2. —
С. 92-96.
Кушаковский М. С. О систолической артериальной гипертензии (краткий ана-
лиз проблемы и собственные наблюдения) // Кардиология. — 1997. — Т. 37. —
№ 10. - С. 50-56.
Кушаковский М. С. Размышления о первичной профилактике гипертони-
ческой болезни на основе представлений о ее патогенезе // Кардиология. —
1999. - Т. 39. - № 3. - С. 65.
Кушаковский М. С. Современные принципы лечения эссенциальной гипер-
тензии (гипертонической болезни). Анализ проблемы и собственные данные //
Артериальная гипертензия. — 1995. — Т. 1. — № 1. — С. 62—66.
Лазебник Л. Б., Комиссаренко И. А., Милюкова О. М. Лечение больных стар-
ших возрастных групп с мягкой и умеренной артериальной гипертонией валсар-
таном // Кардиология. — 1999. — Т. 39. — № 3. — С. 23—25.
Леонова М. В., Белоусов Ю. Б. Возрастные аспекты гипотензивного действия
антагонистов кальция у больных артериальной гипертонией // Кардиология. —
1999.— Т. 39. — № 11.-С. 18-21.
Леонова М. В., Белоусов Ю. Б. Сравнительная эффективность основных
групп гипотензивных средств у больных артериальной гипертонией // Кардиоло-
гия. - 1999. - Т. 39. - № 9. - С. 23-30.
Леонова М. В., Белоусов Ю. Б. Сравнительная эффективность основных
групп гипотензивных средств у больных артериальной гипертонией // Кардиоло-
гия. - 1999. - Т. 39. -№ 9. - С. 23-30.
Мазур Е. С., Гнедов Д. А., Богданова Е. К. Использование суточного монито-
рирования артериального давления для оценки тяжести артериальной гиперто-
нии // Кардиология. — 1999. — Т. 39. - № 5. - С. 24—27.
Мазур Н. А. (ред.). Небилет (небиволол). Клиническая фармакология и меж-
дународный опыт применения. — М. — 1999. — 54 с.
Маколкин В. И., Подзолков В. И., Большакова Т. Д. Особенности обмена
катехоламинов у больных с начальными стадиями гипертонической болезни //
Тер. арх. - 1992. - № 9. - С. 23-27.
403
Мартынов А. И., Задионченко В. С., Маличенко С. В. Новый гипотензивный
препарат омапатрилат — ингибитор вазопептидазы (по материалам 9-го европей-
ского конгресса по артериальной гипертензии) // Кардиология. — 2000. — № 8. —
С. 77-80.
Мартынов А. И., Остроумова О. Д., Коновалова В. В. Новый гипотензивный
препарат омапатрилат — ингибитор вазопептидазы // Кардиология. — 2000. —
№ 8. - С. 75-76.
Мартынов А. И., Остроумова О. Д., Ролик Н. Л. Артериальная гипертензия
у больных пожилого и старческого возраста: клиника, этиология, диагностика,
лечение // Клин. мед. — 1997. — Vol. 12. — Р. 8—14.
Марцевич С. Ю. Нифедипин. Различные лекарственные формы в лечении
сердечно-сосудистых заболеваний // Кардиология. — 1999. — Т. 38. — № 11. —
С. 66-74.
Марцевич С. Ю. Особенности лечения нифедипином больных с сердечно-со-
судистыми заболеваниями // Кардиология. — 1999. — Т. 39. — № 9. — С. 92—96.
Маслова Н. Л., Баранова Е. И. Гипертоническая болезнь у женщин. — СПб.,
Изд. СПб ГМУ. - 2000. - 214 с.
Медикаментозное лечение гипертонической болезни: обоснование выбора
препаратов // Кардиология. — 1999. — Т. 39. — № 3. — С. 86—96.
Международные направления в исследовании артериальной гипертензии //
М.: Сервис. — 2000. — № 10.
Международные направления в исследовании артериальной гипертензии //
Фирма Сервье. — 1999. — № 9. — 27 с.
Микушкина Л. О., Затейщиков Д. А., Сидоренко Б. А. Генетические аспекты
регуляции эндотелиальной функции при артериальной гипертонии // Кардиоло-
гия. - 2000. - Т. 40. - № 3. - С. 68—76.
Микушкина Л. О., Сидоренко Б. А., Затейщиков Д. А., Преображенский Д. В.
Применение блокатора ATI-ангиотензиновых рецепторов валсартана для лече-
ния гипертонической болезни // Кардиология. — 1999. — Т. 39. — № 12. —
С. 28-31.
Милягин В. А., Милягина И, В., Хозяинова И. Ю. Влияние эналаприла на су-
точный профиль артериального давления и морфофункциональные показатели
сердца у больных с различными формами артериальной гипертонии // Кардио-
логия. - 1999. - Т. 39. - № 11. - С. 22-26.
Моисеев В. С., Демуров Д. М., Кобалава Ж. Д. и др. Полиморфизм гена ангио-
тензинпревращающего фермента у пациентов с гипертонической болезнью, ги-
пертрофией левого желудочка и развитием инфаркта миокарда в молодом возрас-
те. Предварительное сообщение // Тер. арх. — 1997. - № 9. - С. 18—23.
Моисеев В. С., Демуров Л. М., Кобалава Ж. Д. и др. Полиморфизм генов ангио-
тензинпревращающего фермента у пациентов с гипертонической болезнью //
Тер. арх. — 1997. — № 9. — С. 18—23.
Небиеридзе Д. В. Контроль мягкой артериальной гипертонии — важнейшая
задача практического врача // Кардиология. — 1999. — Т. 38. — № 11. — С. 5.
404
НебиеридзеД. В., Бритов А. И, Апарина Т. В. и др. Моксонидин — современ-
ный препарат выбора при артериальной гипертонии и метаболических наруше-
ниях // Кардиология. — 1999. — Т. 39. — № 1. — С. 43—48.
Оганов Р. Г. Проблемы контроля артериальной гипертонии среди населе-
ния // Кардиология. — 1994. — № 3. — С. 80—83.
Оганов Р. Г. Профилактическая кардиология: успехи, неудачи, причины //
Кардиология. — 1996. — № 3. — С. 48.
Оганов Р. Г., Мустафаев И. И, Перова И. Н. и др. Влияние терапии обзида-
ном и пропранолом на липидный профиль железа крови и анопротеины липо-
протеидов высокой и низкой плотности у больных гипертонической болезнью //
Кардиология. — 1985. — № 4. — С. 44—47.
Ольбинская Л. И., Морозова Т. Е., Боченков Ю. В. Долгосрочная терапия мок-
сонидином больных гипертонической болезнью I—II стадии (по результатам
клинических испытаний) // Кардиология. — 1999. — Т. 39. — № 5. — С. 17—19.
Остроумова О. Д., Мамаев В. Н., Нестерова М. В., Мартынов Л. И. Артери-
альная гипертензия у больных пожилого возраста (по материалам 17—20 конгрес-
сов Европейского общества кардиологов) // Кардиология. — 1999. — Т. 39. —
№5.-С. 81-82.
Петров В. И., Недогода С. В., Тихонов В. П. Гипертоническая болезнь. —
Волгоград. — 1997. — 167 с.
Петросян К. Ю. Антагонисты Са сохраняют жизнь у больных гипертонией с
сопутствующими факторами риска // Кардиология. — 2000. — № 8. — С. 81—82.
Подзолков В. И., Косева К. И., Маколкин В. И. Клиническая эффективность
антагониста кальция второго поколения — фелодипина-ER — у больных гипер-
тонической болезнью // Кардиология. — 1999. — Т. 39. - № 5. - С. 20—23.
Подзолков В. И., Косева К. Н., Маколкин В. И. Клиническая эффективность
антагониста кальция второго поколения — фелодипина-ER — у больных гипер-
тонической болезнью // Кардиология. — 1999. — Т. 39. — № 5. — С. 20—23.
Попов С. Е. Николай Коротков. История неизвестного доктора с бессмерт-
ным именем. — СПб. — 1998. — ПО с.
Постнов Ю. В. К истокам первичной гипертензии: подход с позиций био-
энергетики // Кардиология. — 1998. — Т. 38. — № 12. — С. 41—48.
Постнов Ю. В. К истории описания первичной гипертензии: 150-летие Фре-
дерико А. Махолида (1849—1884) // Кардиология. — 1999. — Т. 39. — № 5. —
С. 68-69.
Преображенский Д. В., Сидоренко Б. А. Лечение артериальной гипертензии. —
М. - 1999.
Преображенский Д. В., Сидоренко Б. А. Лечение артериальной гипертензии. —
М. - 1999.
Преображенский Д. В., Сидоренко Б. А., Перелепко М. К. Принципы и цели
длительной антигипертензивной терапии при гипертонической болезни // Кар-
диология. — 1999. — Т. 39. — № 9. — С. 80—91.
405
Преображенский Д. В., Сидоренко Б. А., Сополева Ю. В., Иосава И. К. Физио-
логия и фармакология ренин-ангионтензивной системы // Кардиология. —
1997. - Т. 37. - № п. _ с. 91-95.
Преображенский Д. В., Сидоренко Б. А., Шатунова И. М., Меранич А. В. Место
диуретиков в лечении артериальной гипертензии // Российский кардиологиче-
ский журнал. — 1999. - № 6. - С. 46—53.
Преображенский Д. В., Степанова О. А., Сидоренко Б. А. Моксонидин — аго-
нист II-имидазолиновых рецепторов — в лечении гипертонической болезни //
Кардиология. — 1999. — Т. 39. - № 8. - С. 76—83.
Преображенский Д.В., Степанова О. А., Киктев В. Г., Шатунова И. М. Эпро-
зартан — новый блокатор ATI-ангиотензиновых рецепторов с симпатолитиче-
ским действием: клиническая эффективность и безопасность применения при
артериальной гипертензии // Кардиология. — 2000. — № 9. — С. 93—99.
Профилактика, диагностика и лечение первичной артериальной гипертензии
в Российской Федерации. Первый доклад научного общества по изучению арте-
риальной гипертензии // Medical Market. — 2000. — № 35. — С. 9—32.
Профилактика, диагностика и лечение первичной артериальной гипертонии
в Российской Федерации // Первый доклад экспертов научного общества по изу-
чению артериальной гипертонии. — 1999.
Рекомендации 1999 г. по лечению артериальной гипертензии международно-
го общества по вопросам артериальной гипертензии и всемирной организации
здравоохранения // Артериальная гипертензия. — 1999. — Т. 5. — № 2. —
С. 6-46.
Сидоренко Б. А. Современные подходы к лечению артериальной гипертонии:
вальсартан — новый антагонист рецепторов ангиотензина II // Кардиология. —
1998. - Т. 38. - № 6. - С. 66-67.
Сидоренко Б. А., Преображенский Д. В. Антагонисты кальция. — М.: Инфор-
матик. — 1997. —176 с.
Сидоренко Б. А., Преображенский Д. В. Гипертрофия левого желудочка: пато-
генез, диагностика и возможность обратного развития под влиянием антигипер-
тензивной терапии // Кардиология. — 1998. — Т. 38. — № 5. — С. 80—85.
Сидоренко Б. А., Преображенский Д. В. Ингибиторы ангиотензинпревраща-
ющего фермента. — М.: Информатик. — 1999. — Серия «Практическая кардио-
логия».
Сидоренко Б. А., Преображенский Д. В., Романова И. Е., Киктев В. Г. Гиперто-
ническая болезнь в пожилом возрасте: распространенность, клиническое значе-
ние и медикаментозная терапия // Кардиология. — 1999. — Т. 39. — № 12. —
С. 71-76.
Сидоренко Б. А., Преображенский Д. В., Шатунова И. И., Маренич А. В. Тиа-
зидные диуретики как краеугольный камень антигипертензивной терапии //
Кардиология. — 2000. — Т. 40. - № 4. - С. 80—86.
Сидоренко Г. И. Вопросы риска при клиническом применении диуретиков //
Кардиология. — 2000. — Т. 40. — № 4. — С. 77—78.
406
Сорокоумов В. А., Богатенкова Ю. Д., Нарбут Л. А. Особенности гипотен-
зивной терапии в разных периодах инсульта и для профилактики нарушений
мозгового кровообращения. — Современные аспекты применения ингибиторов
АПФ. — Гедеон Рихтер. — 10 февраля 2000 г. — С. 10—17.
Тареев Е. М. Гипертоническая болезнь. — М.: Музгиз. — 1948.
Толпыгина С. И., Ощепкова Е. В., Варакин Ю. Я, Мозговой кровоток при ар-
териальной гипертензии // Кардиология. — 2001. — № 4. — С. 71—78.
Хирманов В. Н., Маслова Н. П., Кирченков И. С. Гипертонические кризы //
Артериальная гипертензия. — 1995. — Т. 1. — № 1. — С. 74—79.
Цырлин В. А., Кузьменко Н. В., Плисс М. Г. Роль имидазолиновых рецепторов
в центральной регуляции кровообращения (история и современное состояние во-
проса) // Вестник аритмологии. — 2001. — № 21. — С. 91—96.
Чурина С. К, Рыжов Д. Б., Клюева Н. 3. и др. К патогенезу артериальной ги-
пертензии при дефиците кальция в питьевой воде (экспериментальное исследо-
вание) // Артериальная гипертензия. — 1995. — Т. 1. — № 1. — С. 25—30.
Шкарин В. В. Гемодинамическое действие целипролола у пациентов с арте-
риальной гипертензией // Кардиология. — 2001. — № 4. — С. 61—63.
Шляхто Е. В., Конради А. О., Захаров Д. В., Рудомякова О. Г. Структурно-
функциональные изменения миокарда у больных гипертонической болезнью //
Кардиология. — 1999. — Т. 39. — № 2. — С. 49—55.
Шулутко Б. И. Артериальная гипертензия. — СПб. — Ренкор. — 2001. —
382 с.
Abernethy D. R., Fox A. A., Simpel М. Moexipril in the treatment of mild to mode-
rate essential hypertension: comparison with sustained release verapamil I I J. Clin.
Pharmacol. - 1995. - V. 35. - P. 794-799.
Balogun M.f Dunn F. Systolic and diastolic function following regression of left
ventricular hypertrophy in hypertension.//!. Hypertens. — 1992. — V. 9. — Suppl. 5. —
21-26.
Bergman v. J. Funktionelle pathologic.—1936.
Bonsquet R, Feldman J., Tibirica E. et al. New concepts on the central regulation
of blood pressure. Alfa 2-adrenoreceptors and imidazoline receptors // Am. J. Med. —
1989. - Vol. 87. - P. 10-13.
Brazy P. C., Stead W., Fitzwilliam J. F. Progression of renal insufficiency: role
of blood pressure // Kidney int., 1989. — 336. — P. 670—674.
Brunner H., Waeber B. Do we need new antihypertensive drugs? // J. Cardiovasc.
Pharmacol. — 1996. — V. 27. — Suppl. 3.— SI—S4.
Cambien E, Athene-Ge las F.t Herberth G. et al. Familial resemblance of plasma
angiotensin-converting enzyme level // Am. J. Hum. Genet. — 1988. — V. 43. —
P. 774-780.
407
Canau A., Devereux R. В., Roman N. J. et al. Patterns of left ventricular hyper-
trophy and geometric remodeling in essential hypertension // J. Am. Coll. Cardiol. —
1992. -V. 19. - P. 1550-1558.
Chalmers J., Mac Mahon S., Anderson C. et al. Clinical manual on blood pressure
and stroke prevention. — London. — 1997.
Cheung B., Leung R. Elevated plasma levels of human adrenomedullin in cardio-
vascular, respiratory, hepatic and renal disorders // Clin. Sci (Colch). — 1997. —
V. 92. - P. 59-62.
Chrisp P., Faulds D. Moxonidine. A Review of its pharmacology and therapeutic
use in Essential Hypertension // Drugs. — 1992. — V. 44. — P. 993—1012.
Cruickshank J. M., Thorp J. M., Zacharias F. J. Benefits and potential harm of
lowering high blood pressure // Lancet. — 1987. — V. 1. — P. 581—584.
Curb I. D., Pressel S. L., Culter J. A. et al. For the systolic Hypertension in the
Elderly. Program Cooperative Research Group: effect of diuretic based antihypertensive
treatment on cardiovascular disease risk in older diabetic patients with isolated systolic
Hypertension //JAMA. - 1996. - V. 276. - P. 1886-1892.
Davidson N. C., Barr C. S, Struthers A. D. C-type natriuretic peptide. An endogenous
inhibitor of vascular angiotensin-converting enzyme activity // Circulation. — 1996. —
V. 93.-P. 1155-1159.
Desideri G., Ferri C., Bellini C. et al. Effect of ACE-inhibition on spontaneous and
insulin-stimulated endothelin-1 secretion: in vitro and in vivo studies // Diabetes. —
1997. -V. 46. - P. 81-86.
Devereux R. B., Savage P. D., Sachs Laragh J. H. Relation of hemodynamics load
to left ventricular hypertrophy and perfomance in hypertension // Am. J. Cardiol. —
1983. -V. 51. - P. 171-176.
Dickinson C. J. Cerebral oxidative metabolism in essential hypertension: a meta-
analisis // J. Hypertens. — 1993. — V. 13. — P. 633—638.
Dzau N. J., Sasamura H., Nein L. Heterogenety of angiotensin synthetic pathways
and receptor subtypes: Phisiological and pharmacological implications // J. Hypertens. —
1993. -V. 11. - S13-S18.
Elliot H. L. Monoxidine: A Clinical Apprisal. Report from an Official Satellite
Symposium of the XIX Congress of the European Society of Cardiologia // Stock-
holm.-1997.
Felson D. T., Sloutsicis D., Anderson J. J. et al. Thiazide diuretics and the risk of hip
fracture. Results from the Framingham study // JAMA. — 1991. — V. 265. —
P. 370-373.
Ferrario С. M., Barnes K. L., Block С. H. et al. Onthways of angiotensin formation
and function in the brain // Hypertension. — 1990. — V. 15. — P. 113—119.
Ficbach N. H., Hebert R. R., Stampfer M. J. et al. A prospective study of high
blood pressure and cardiovascular disease in women // Am. J. Epidemiol. — 1989. —
V. 130. - P. 646-654.
408
Fratolla A., Parati G, Guspidi C., Manehia G. Prognostic value of 24-hour pressure
variability // J. Hypertens. - 1993. - V. 11. - P. 1133-1137.
Galderisi M., Petrocelli A., Alfeni A. Impact of ambulatory blood pressure on left ven-
tri diastolic dysfunction in uncomplicated systemic hypertension // Am. J. Cardiol. —
1966. - V. 77. - P. 597-601.
Garcia A., Alonso T., Gonzalez L. Integral treatment of hypertension in menopausal
women I/ Am. J. Hypertens. — 1998. — V. 11. — P. 109A.
Gneyffier F, Boutitic E, Boissel S. P. et al. (The INDANA investigators.) Effect
of antihypertensive drug treatment for hypertension on morbidity and mortality from
cardiovascular disease: a review of randomized controlled trials // J. Hypertens. —
1957. - V. 15. - P. 591-600.
Gunthric С. P. Angiotensin receptors: physiology and pharmacology // Clin.
Cardiol. - 1995. - V. 18. - III29-III34.
Guyton A. C. Circulatory Phisiology III. Arterial pressure and Hypertension. —
Philadelphia—Toronto. — 1988.
Hanson L., Zanchetti A., Carruthers S. G. et al. For the HOT study group. Effect of
intensive blood pressure lowering and acetylsalycilic acid in patients with hypertension
principial results of the Hypertension Optimal Treatment (HOT) randomised trial //
Lancet. - 1998. - V. 351. - P. 1755-1762.
Hansson L. Clinical manual of hypertension. — London.—1998.
Hubert C., Houot A., Corvol P. et al. Structure of the angiotensin-converting enzy-
me // J. Biol. Chem. - 1991. - V. 266. - P. 15377-15383.
Isles C. Blood pressure in males and females // J. Hypertens. — 1993. — V. 13. —
P. 285-290.
Jespersen С. M., Arnung R., Hagen C. et al. Effects of natural estrogen therapy
on blood pressure and renin-angiotensin system in normotensive and hypertensive me-
nopausa women // J. Hypertens. — 1983. — V. 1. — P. 361—364.
Joint National Committee on prevention, detection, evaluation and treatment of
High Blood Pressure (JNC-VI) // Arch. Intern. Med. — 1992. — V. 157. —
P. 2413-2446.
Kang P. M., Landan A. J., Eberhardt R. T. et al. Angiotensin receptor II antago-
nists: A new approach to blockade of the renin-angiotensin system // Am. Heart J. —
1994.-V. 127.-P. 1388-1401.
Kannel W. B. Left ventricular hypertrophy as a risk factor in arterial hypertension //
Eur. Heart. J. — 1992. — 13 Suppl. — D. 82—88.
Kaplan N. M. Clinical hypertension.—7th Ed. Baltimore.—1998.
Kaplan N. M. The deadly quartet: uper body obesity, glucose intolerance,
hypertriglicedimia and hypertension // Arch. Intern. Med. — 1982. — V.149. —
P. 1514-1520.
Kaplan N. N. Renal parenchymal hypertension. In: Clinical Hypertension. —
1994. - P. 299-318.
409
Krumholz H., Larson M., Levy D. Sex differences in cardial adaptation to isolated
systolic hypertension // Am. J. Cardiol. — 1993. — V. 72. — P. 310—313.
Law M. Epidemiological evidence on salt and blood pressure // Am. J. Hypertens. —
1997. - V. 10 (Suppl.). - P. 425-435.
Levy D., Walmsley P. Principial results of hypertension and lipid trial (HALT):
a multicenter study of doxozosin in patients with hypertension // Am. Heart J. —
1996. - V. 31. - P. 956-973.
Lin C., Frishman W. H. Renin inhibition: A nevel therapy for cardiovascular disease //
Am. Heart. J. -1996.- V. 131. - P. 1024-1034.
Mac Machon S., Roggers A. The effects of blood pressure reduction in old patients:
an overview of five randomised controlled trials in elderly hypertensives // Clin. Exper.
Hypertens. - 1993. - V. 15. - P. 967-978.
Mahomed F. A. The etiology of Bright' disease and prealbuminic stage in classic
papers in Hypertension. Ed. by J. D. Swales. — London. — 1887. — P. 72—103.
Manson L. Артериальная гипертензия и сопутствующие заболевания. —
1996. - 60 с.
Messerli Е Н., Caravaglia G. Е., Schmieder R. Е. et al. Disperate cardiovascular
findings in men and women with essential hypertension // Ann. Intern. Med. —
1987.-V. 107.-P. 158-161.
Messerli F. H., Grossman E., Goldlourt H. Are beta-blockers efficacions as a first
line therapy for hypertension in the elderly? A systemic review // JAMA. — 1998. —
V. 279. - P. 1303-1307.
Messerli F. Simplications of discontinuation of doxazozin of ALLHAT // Lancet. —
V. 2000. - № 3351. - P. 863-864.
MRC Working Party. Medical research concil trial of treatment of hypertension in
older adults: principial results // Br. Med. J. — 1992. — V. 304. — P. 405—412.
Neaton J. D., Grimm R. H., Prineas R. J. et al. Treatment of mild hypertension
study: final results // JAMA. — 1993. — V. 270. — P. 713—724.
Netel J., Weber M., Poll I. et al. Valsartan, a new angiotensin II antagonists: anti-
hypertensive effects over 24 hours // Clin. Therap. — 1997. — V. 19. — P. 447—458.
Nishumura H., Hoffman S., Baltatu O. et al. Angiotensin I converting enzyme of
renin-angiotensin system and chymase in cardiovascular tissus // Kidney Int. —
1996.-V. 49. -S18-S23.
Oddon-Stack P., Getlin M., Koli P. et al. Comparison of two angiotensin II antago-
nists, losartan and valsartan in essential hypertensions // Am. J. Hypertens. — 1997. —
V. 10. - P. 84A.
Opic L. H. Drugs for the heart.—7th Ed. Philadelphia.—1995.
Pickering G. High blood pressure. N. J., 1968.
Pousse R.t Mblsch A., Fleming I. et al. Mechanisms of nitric oxide release from the
vascular endothelium // Circulation. — 1993. — Suppl. V. — V. 18 — V. 25.
410
Pudey L, Parker M., Berling I. et al. Effects of alcohol and caloric restriction on
blood pressure and serum lipids in over wright men // Hypertension. — 1992. — V. 20. —
P. 533-541.
Reaven G. M. Banting lecture. 1988. Role of insulin resistance in human disease //
Diabetes. - 1988. - V. 37. - P. 1595-1607.
Rigat B., Hubert C., Alhenc-Gelas F. et al. An I/D polymorphism in the ACE gene
accounting for half the variance of serum enzyme levels // J. Clin. Invest. — 1990. —
V. 86. - P. 1343-1346.
Ruilope L. M. Effects of ACE inhibitors on the progression of diabetic nephropathy //
J. Hypertens. - 1995. - Vol. 13 (Suppl. 2). - P. 591-593.
Ruilope L. M., Redicio J. L. Microalbuminuria in clinical practice // Kidney, 1995. —
Vol. 4.-P. 211-216.
Savage P., Pressel S. L., Curb J. D. et al. Influence of long-term, low-dose diuretic-
based, antihypertensive therapy on glucose, lipid, uric acid and potassium levels in older
men and women with isolated systolic hypertension // Arch. Intern. Med. — 1998. —
V. 356. - P. 741-754.
Sennings G. Exercise and blood pressure: walk, run or swim? // J. Hypertens. —
1997. - V. 10. - P.367-369.
Shear R., Ledue L., Rey E. Hypertension in pregnancy: new recomendations for
management // Cur. Hypertens. Reports. — 1999. — V. 1. — P. 529—539.
SHEP Cooperative Research Group. Prevention of stroke by antihypertensive drug
treatment in older persons with isolated systolic hypertension // JAMA. — 1991. —
V. 265. - P. 3255-3264.
Simpel M., Koch B. Moexipril is better tolerated then hydrochlorthiazide in post-
menopausal women with hypertension // Hypertension. — 1997. — V. 29. — P. 844.
Sleight P. Blood pressures, hearts and U-shaped curves // Lancet. — 1988. —
V. l.-P. 235.
Staessen G. A., Bulpitt C. J., Fagard R. et al. The influence of menopausa on blood
pressure // J. Hum. Hypertens. — 1989. — V. 3. — P. 427—433.
Staessen J. A., Thiis L., Fagard R. et al. Calcium-channel blocade and cardiovas-
cular protection in the European trial on isolated systolic hypertension // Eur. Heart J. —
1998. - 19: Abstr. Suppl. 186.
Standgaard S., Olsen J., Skinhof E. et al. Autoregulation of brain circulation in
severe arterial hypertension // Br. Med. J. — 1973. — № 1. — P. 507—510.
Taddei S., Virdis A., Mattei P. et al. Hypertension causes premature aging of
endothelial function in humans // Hypertension. — 1997. — V. 29. — P. 736—743.
The Sizth Report of the Joint National Committee on Prevention Evalution and
Treatment of High Blood Pressure // Arch. Intern. Med. — 1997. — V. 157. —
P. 2413-2446.
Trenkwalder P. Treatment with calcium-channel blocker does not incriase the risk
of fatal and non-fatal cancer in an elderly European population: results from
STEPY II // Eur. Heart J. — 1997. — 18: Abstr. Suppl. 363.
411
UK Prospective Diabetes Study Group. Effracy of atenolol and captopril in redu-
cing risk of macrovascular and microvascular complications in type 2 diabetes:
UKPDS 39 // BMJ. - 1998. - V. 317. - P. 713-720.
Urata H.f Brehm K. D., Philip A. et al. Cellular localisation and regional distribution
of an angiotensin II-forming chymase in the heart // J. Clin. Investig. — 1993. —
V. 91. - P. 1269-1281.
Vane J. R., Anggard E. E., Rotting R. M. Regulatory function of the vascular
endothelium // N. Engl. Med. — 1990. — V. 32. — P. 27—36.
Vanhoutte P. M. Other endothelium-derived vasoactive factors // Circulation. —
1993. - V. 87. - Suppl. V. - № 9. - V. 17.
Waeber B., Zanchetti A., Block H. K. et al. Omapatrilat, a vasopeptidase inhibitor,
is an effective antihypertensive agent in mild to moderate hypertension // J. Hyperten-
sion. — 1999. — 17: Suppl. 3. — P. 152.
Zusman R.f Atlas S., Kochar M. et al. Effectacy and safety of omapatrilat, a vaso-
peptidase inhibitor // J. Hypertension. — 1999. — 17: Suppl. 3. — P. 299.
1999 World Health Organization — International Society of Hypertension //
J. Hypertens. - 1999. - V. 17. - P. 151-183.
Оглавление
Список сокращений.....................................4
Предисловие...........................................5
Введение..............................................7
О наименовании заболевания..........................7
Краткая историческая справка........................8
Глава 1. Основные физиологические системы регуляции
(контроля) артериального давления....................22
Гемодинамические факторы, определяющие уровень АД. . . 22
Нейрогуморальные системы регуляции АД..............24
Депрессорные механизмы интегральной системы
регуляции АД.......................................38
/ Глава 2. Современные представления об этиологии
и патогенезе эссенциальной гипертензии
(клинико-экспериментальный анализ).....................47
Неоднородность причин и механизмов развития ЭГ .... 47
Состояние гемодинамики в начальной и развернутых
стадиях ЭГ.........................................49
Роль симпатической нервной системы в происхож-
дении ЭГ; центрогенно-нервная теория патогенеза ЭГ
Г. Ф. Ланга........................................55
Роль центральных отделов симпатической нервной
системы в развитии ЭГ..............................65
Система имидазолиновых рецепторов и АД.............72
Пептидергические системы мозга и АД................73
Почки, натрий, объемы жидкости и возникновение ЭГ. . . 82
Состояние клеточной мембраны: ионы Са++ и возник-
новение ЭГ.........................................93
413
Резистентность к инсулину и ЭГ......................98
Роль наследственности в развитии ЭГ................100
Глава 3. Нормативы артериального давления; его измен-
чивость; некоторые другие особенности при нормотензии
и гипертензии. Пограничная артериальная гипертензия ... 105
Глава 4. Клиническая картина при ЭГ: состояние органов-
мишеней; степени (стадии), формы, течение и исходы ЭГ. . . 124
Распространенность ЭГ, возрастные и половые особен-
ности больных......................................124
Становление заболевания и его течение.............128
Сердце и артериальные сосуды при ЭГ.............128
Повреждения ЦНС при ЭГ.............................164
Глазное дно у больных ЭГ; гипертензивная ангио-
ретинопатия ......................................176
Повреждения почек при ЭГ...........................177
Стадии ЭГ (старая классификация)...................184
Современная (последняя) классификация ЭГ..........191
Клинико-патогенетические формы ЭГ; профилирование
больных ЭГ........................................196
Особенности ЭГ у женщин...........................207
ЭГ и ожирение (клинические данные)................210
ЭГ и сахарный диабет (клинические данные).........212
Некоторые лабораторные данные при ЭГ..............214
Артериальная гипертензия у пожилых и старых людей . 218
Атеросклеротическая реноваскулярная гипертензия
и ее сочетание с ЭГ пожилых людей.................223
Крайние клинические проявления ЭГ.................225
Злокачественная (быстро прогрессирующая) ЭГ:
клиника...........................................225
Гипертензивные кризы: клиника......................228
Глава 5. Лечение эссенциальной гипертензии...........239
Общие замечания о принципах и целях лечения........239
Основные принципы лечения ЭГ......................242
Нефармакологические подходы при лечении ЭГ . . . . 248
Классификация и характеристика противогипертен-
зивных препаратов.................................254
Стимуляторы (агонисты) центральных аг-адренорецеп-
торов и I]-имидазолиновых рецепторов..............257
Блокаторы а]-адренорецепторов.....................265
414
Блокаторы кальциевых каналов клеточной мембраны
(антагонисты кальция)............................272
Диуретики (салуретики); части I и II.................282
Ингибиторы ангиотензинпревращающего фермента
(АПФ) (АСЕ-ингибиторы)...........................297
Блокаторы p-адренергических рецепторов...........317
Новые p-адреноблокаторы..........................331
Блокаторы рецепторов ангиотензина II.............342
Ингибиторы вазопептидазы (эндопептидазы).........346
Современная стратегия лечения ЭГ; выбор лекарствен-
ных препаратов для отдельного больного...........347
Лечение АГ у женщин, находящихся в периоде постмено-
паузы ...........................................354
Лечение АГ у пожилых и старых больных............357
Лечение ЭГ злокачественного течения..............363
Лечение гипертензивных кризов (ГК)...............365
Лечение ГК, осложнившегося острым кровоизлиянием
в мозг...........................................373
Лечение ГК, осложнившегося острым инфарктом
мозга............................................374
Противогипертензивная терапия у больных с хроничес-
кими заболеваниями почек.........................376
Заключение...........................................379
Список литературы....................................381
Новая литература.................................400