Автор: Дядык А.И. Багрий А.Э.
Теги: медицина гипертензия артериальное давление крови
ISBN: 978-966-97303-9-8
Год: 2014
Текст
j А.И. Дядык, А.Э. Багрий
Артериальные
гипертензии
в современной
клинической практике
Третье издание (дополненное и переработанное)
Киев-2014
А.И.Дядык, A3. Багрий
РТЕРИАЛЬНЫЕ
ГИПЕРТЕНЗИИ
в современной
клинической практике
Третье издание (дополненное и переработанное)
Киев-2014
Содержание
Список сокращений 5
Введение (А.И.Дядык, A3. Багрий) 9
Глава 1. Номенклатура, классификации, оценка степени
сердечно-сосудистого риска
(A3. Багрий, А.И.Дядык, И.С Маловичко) 11
Глава 2. Эпидемиология артериальной гипертензии
(AM Дядык, A3. Багрий) 18
Глава 3. Этиология артериальной гипертензии.
Патогенез эссенциальной артериальной гипертензии
(A3. Багрий, А.И.Дядык, В.Б. Гнилицкая) 21
Глава 4. Измерение артериального давления.
Мониторирование артериального давления.
Диагностика артериальной гипертензии.
Артериальная гипертензия «белого халата»,
маскированная артериальная гипертензия
(А.И.Дядык, A3. Багрий, А.Л. Христуленко, Н.И. Шпилевая) 31
Глава 5. Обследование больных артериальной гипертензией
(A3. Багрий, А.И.Дядык, Т.СДядык, СИ. Маловичко) 39
Глава 6. Общие вопросы лечебной тактики при артериальной
гипертензии.
Целевые уровни артериального давления.
Изменения образа жизни.
Целевые уровни гликозилированного гемоглобина,
холестерина липопротеидов низкой плотности.
Статины и ацетилсалициловая кислота при артериальной
гипертензии
(А.И.Дядык, A3. Багрий, М.В. Хоменко, Е.В. Щукина, О.Е. Зайцева,
Л.В.Лукашенко) 45
Глава 7. Начальный выбор лечебной программы.
Изолированная систолическая артериальная гипертензия.
Резистентная артериальная гипертензия.
Ортостатическая гипотензия.
Наблюдение за больным артериальной гипертензией
(А.И.Дядык, A3. Багрий, В.А. Ефременко) 51
Глава 8. Диуретики (тиазидовые/тиазидоподобные, петлевые,
калийсберегающие/антагонисты минералокортикоидных
рецепторов)
(А.И.Дядык, A3. Багрий, Н.В. Мальцева) 66
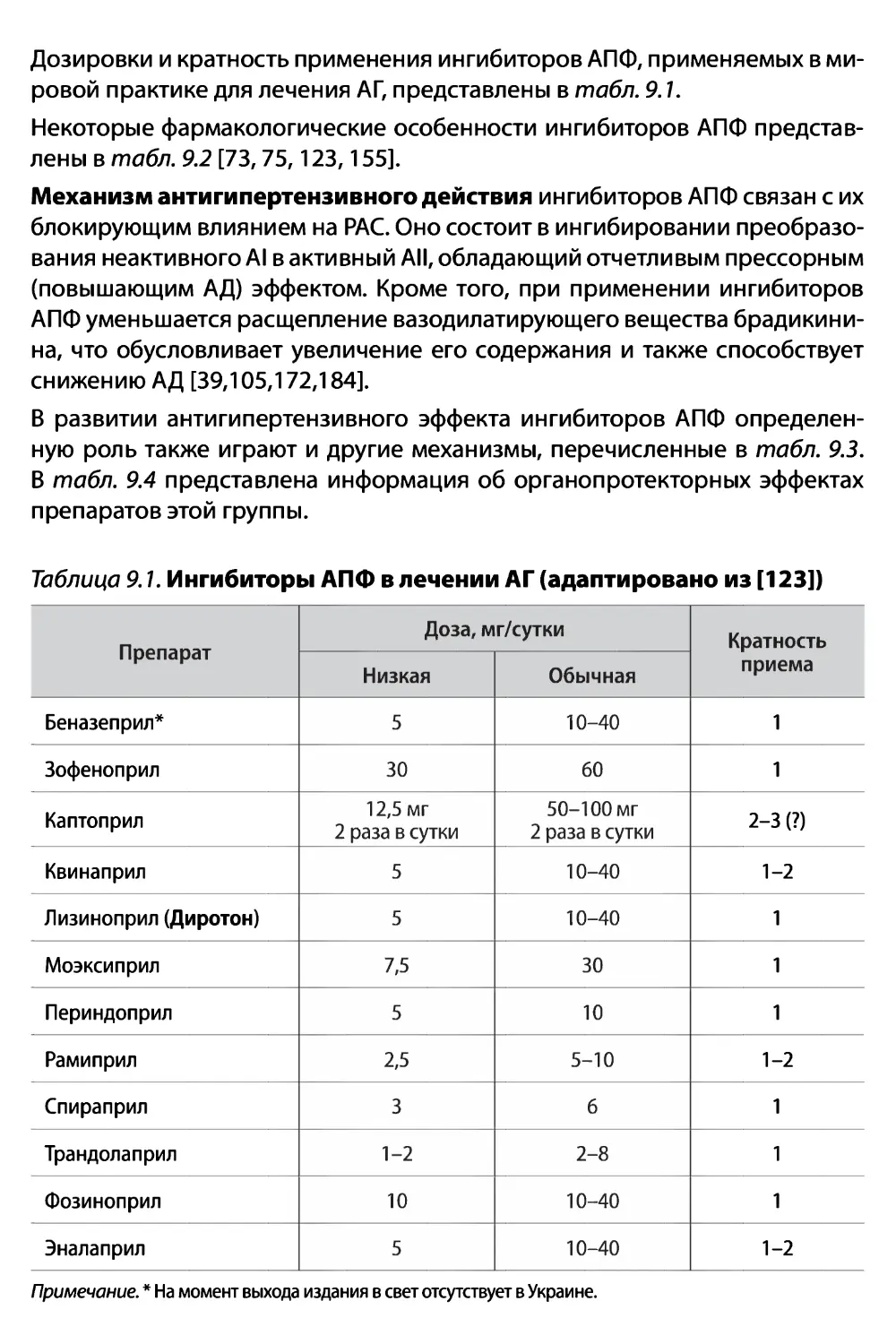
Глава 9. Ингибиторы ангиотензинпревращающего фермента
(А.И.Дядык, A3. Багрий, Ю.В. Сулиман, В.А. Багрий) 76
Глава 10. Антагонисты рецепторов ангиотензина II (сартаны)
(А.И.Дядык, A3. Багрий, О.В. Онищенко) 84
Глава 11. Блокаторы кальциевых каналов
(А.И.Дядык, A3. Багрий) 88
Глава 12. Бета-адренергические блокаторы
(А.И.Дядык, A3. Багрий) 97
Глава 13. Прочие антигипертензивные препараты
(А.И.Дядык, A3. Багрий, Е.И. Черняева) 100
Глава 14. Статины в кардиологии.
Лечение артериальной гипертензии у больных
хронической ишемической болезнью сердца
(А.И.Дядык, A3. Багрий, Е.В. Щукина, А.С. Воробьев,
А.Г. Туков, А.В. Приколота, Брызгалов А.Ю.) 105
Глава 15. Артериальная гипертензия
при хронических заболеваниях почек
(А.И.Дядык, A3. Багрий, Е.А.Дядык, Н.Ф. Яровая, М.В. Хоменко,
Л.С. Холопов, Е.Е. Ковыршина, Г.П. Паниотова) 120
Глава 16. Реноваскулярная артериальная гипертензия
(А.И.Дядык, A3. Багрий, М.В. Хоменко, П.Л. Паниотов) 143
Глава 17. Случайно обнаруженное образование надпочечника
(инциденталома)
(A3. Багрий, Е.Л. Стуликова) 150
Глава 18. Феохромоцитома и параганглиома
(A3. Багрий, И.Н. Цыба) 158
Глава 19. Первичный альдостеронизм
(A3. Багрий, О.А. Приколота) 168
Глава 20. Синдром Кушинга, болезнь Кушинга
(A3. Багрий, И.Л. Здиховская) 178
Глава 21. Артериальная гипертензия при беременности и лактации
(A3. Багрий, А.И.Дядык, ИМ. Вишнивецкий, СР. Зборовский,
И.Г. Багрий) 182
Глава 22. Гипертензивный криз
(А.И.Дядык, A3. Багрий, О.А. Приколота, К.В. Жуков) 189
Список литературы 195
Список сокращений
А —ангиотензин
АБ — адренергический блокатор
АВ — атриовентрикулярный
АГ — артериальная гипертензия
АД — артериальное давление
АКТГ — адренокортикотропный гормон
АКШ — аортокоронарное шунтирование
АЛТ — аланинаминотрансфераза
АМАД — амбулаторное мониторирование артериального давления
АПФ — ангиотензинпревращающий фермент
АРП — активность ренина плазмы
АРС — альдостерон-рениновое соотношение
АСК — ацетилсалициловая кислота
АСССЗ — атеросклеротическое сердечно-сосудистое заболевание
БКК — блокатор кальциевых каналов
ВОЗ — Всемирная Организация Здравоохранения
ГК — гипертензивный криз
ГН — гломерулонефрит
ДАД — диастолическое артериальное давление
ЖКТ — желудочно-кишечный тракт
ИБС — ишемическая болезнь сердца
ИМ — инфаркт миокарда
ИМТ — индекс массы тела
ИСАГ — изолированная систолическая артериальная гипертензия
КАГ — коронарная ангиография
КИМ — комплекс интима-медиа
КДР — конечно-диастолический размер
КТ — компьютерная томография
КРГ — кортикотропин-релизинг гормон
ЛЖ — левый желудочек
ЛПИ — лодыжечно-плечевой индекс
ЛПВП — липопротеиды высокой плотности
ЛПНП —липопротеиды низкой плотности
МАДД — мониторирование артериального давления дома
ММЛЖ — масса миокарда левого желудочка
МРТ — магнитно-резонанская томография
НПВП — нестероидный противовоспалительный препарат
ОКС — острый коронарный синдром
ОПП — острое повреждение почек
ОПСС — общее периферическое сопротивление сосудов
ОЦК — объем циркулирующей крови
ПА — первичный альдостеронизм
ПКП — поликистоз почек
ПЭ — преэклампсия
ПЭТ — позитронно-эмиссионная томография
ПОМ — поражение органов-мишеней
РАС — ренин-ангиотензиновая система
РКИ — рандомизированное клиническое исследование
САД — систолическое артериальное давление
СВ — сердечный выброс
СД — сахарный диабет
СЗ — сопутствующее заболевание
СИ — Международная система единиц
СКФ — скорость клубочковой фильтрации
СН — сердечная недостаточность
СРБ — С-реактивный белок
СРПВ — скорость распространения пульсовой волны
СС — сердечно-сосудистый
ССЗ — сердечно-сосудистое заболевание
ТГ —триглицериды
ТЗС — толщина задней стенки
ТИА — транзиторная ишемическая атака
ТМЖП — толщина межжелудочковой перегородки
УЗИ — ультразвуковое исследование
УО — ударный объем
ФК — функциональный класс
ФМД — фибромышечная дисплазия
ФП — фибрилляция предсердий
ФР —фактор риска
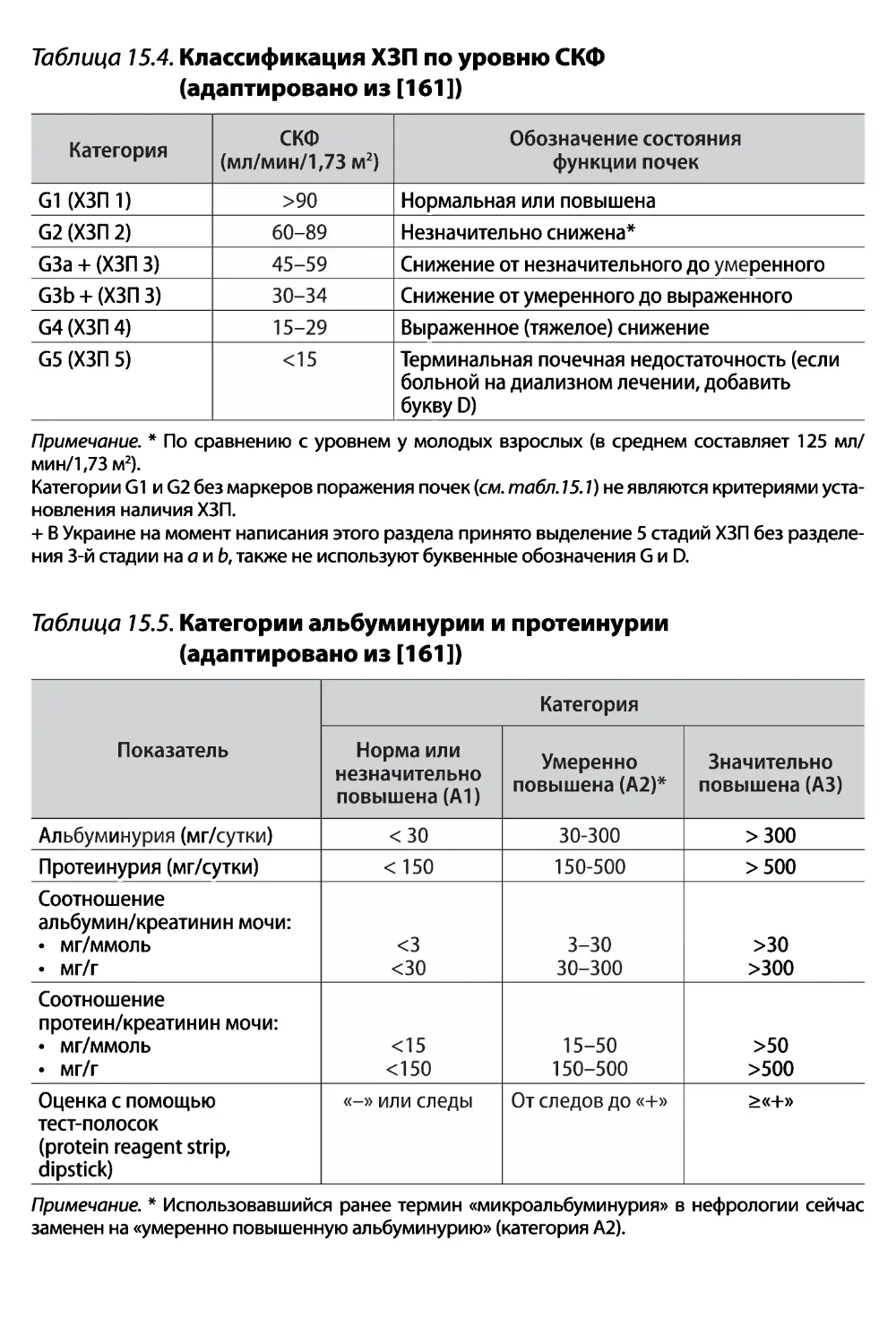
ХЗП — хроническое заболевание почек
ХП — хронический пиелонефрит
ХПН — хроническая почечная недостаточность
ХС — холестерин
ЦНС — центральная нервная система
ЧСС — частота сердечных сокращений
ЭКГ — электрокардиография
ЭхоКГ — эхокардиография
ЮГА — юкстагломерулярный аппарат
АСС (American College of Cardiology) — Американская коллегия
кардиологов
ADPKD (autosomal dominant polycystic kidney disease) — аутосомно-
доминантная поликистозная болезнь почек
AHA (American Heart Association) — Американская ассоциация сердца
ANCA (antineutrophil cytoplasmic antibodies) — антитела к антигенам
цитоплазмы нейтрофилов
ASE (American Society of Echocardiography) — Американское общество
эхокардиографии
ASH (American Society of Hypertension) — Американское общество
гипертензии
ESC (European Society of Cardiology) — Европейское общество
кардиологов
ESH (European Society of Hypertension) — Европейское общество
по борьбе с гипертензией
FDA (Food and Drug Administration) —Управление по контролю пищевых
продуктов и лекарственных средств США
НЬА1 с — гликозилированный гемоглобин
ISH (International Society of Hypertension) — Международное общество
по борьбе с гипертензией
JNC (Joint National Committee on Prevention, Detection, Evaluation and
Treatment of High Blood Pressure) — Объединенный национальный
комитет США по профилактике, диагностике, оценке и лечению
повышенного артериального давления
KDIGO (Kidney Disease: Improving Global Outcomes) — Болезни почек:
улучшение мировых результатов лечения (программа содействия
всемирной координации и интеграции инициатив по разработке
и выполнению клинических практических рекомендаций с целью
улучшения результатов лечения больных хроническими почечными
заболеваниями)
NICE (National Institute for Health and Care Excellence) — Национальный
институт здоровья и клинического совершенствования Великобритании
NYHA (New York Heart Association) — Нью-Йоркская кардиологическая
ассоциация
Введение
Артериальная гипертензия (АГ) — важнейший модифицируемый фактор
сердечно-сосудистого (СС) риска. Общепризнана связь повышенного ар-
териального давления (АД) с увеличением риска развития смертельного
и несмертельного инфаркта миокарда (ИМ) и мозгового инсульта, а также
с ускорением прогрессирования хронического заболевания почек (ХЗП).
Вопросы диагностики и выбора адекватных лечебных подходов при АГ
неизменно остаются в центре внимания отечественных и зарубежных кли-
ницистов, организаторов здравоохранения и общества в целом. В Украине
проблемам, связанным с АГ, уделяется большое внимание на самом высо-
ком государственном уровне, примером чего является Программа профи-
лактики и лечения АГ, осуществляемая с 1999 года.
Представления о лечебно-диагностической тактике при АГ постоянно об-
новляются и дополняются: публикуются результаты новых крупных рандо-
мизированных клинических исследований (РКИ) и метаанализов, эксперты
авторитетных кардиологических ассоциаций совершенствуют соответ-
ствующие рекомендации. Например:
• Приказ Министерства здравоохранения Украины №384 от 24.05.2012
и Унифицированный клинический протокол первичной, экстренной и
вторичной (специализированной) медицинской помощи «Артериаль-
ная гипертензия» [9,46,61];
• Рекомендации ESH (European Society of Hypertension, Европейское об-
щество по борьбе с гипертензией) и ESC (European Society of Cardiology,
Европейское общество кардиологов) по лечению АГ от 2013 года [136];
• Клинические рекомендации по лечению АГ ASH (American Society of
Hypertension, Американское общество гипертензии) и ISH (International
Society of Hypertension, Международное общество по борьбе
с гипертензией) от 2013 года [123];
• Рекомендации JNC (Joint National Committee on Prevention, Detection,
Evaluation and Treatment of High Blood Pressure; Объединенный нацио-
нальный комитет США по профилактике, диагностике, оценке и лечению
повышенного АД), 8-й пересмотр от 2014 года (JNC-8) [137].
Все это диктует необходимость своевременного критического анализа новой
информации и ее представления в доступной форме практикующим врачам.
Предыдущее издание, посвященное вопросам АГ, вышло в 2006 году
[31] и было достаточно тепло встречено читателями. Целью настоящего
(третьего) издания, во многом переработанного и дополненного, яви-
лось обобщение современных вопросов диагностики и лечения АГ. В нем
обсуждаются вопросы эпидемиологии и патогенеза АГ; подходы к класси-
фикации, оценке степени СС-риска, принципы обследования пациентов,
диагностики АГ. Представлен ряд новых глав, посвященных диагностике
и лечению симптоматических АГ. Обсуждаются взгляды на выбор анти-
гипертензивной терапии при различных вариантах АГ (включая лиц с АГ
«белого халата», маскированной АГ, резистентной АГ, ортостатической
гипотензией, АГ у беременных, кормящих, пожилых, пациентов с разны-
ми видами гипертензивного криза (ГК)); особое внимание уделено рас-
смотрению различных групп лекарственных препаратов, используемых
в лечении больных АГ.
Издание предназначено для врачей общей практики - семейной медици-
ны, врачей-терапевтов, кардиологов, нефрологов, врачей-интернов.
Глава 1
Номенклатура, классификации,
оценка степени
сердечно-сосудистого риска
Термином «АГ» обозначают состояние, при котором имеет место устойчи-
вое повышение уровней АД [38,106,223]:
• систолического АД (САД) > 140 мм рт. ст.
и/или
• диастолического АД (ДАД) >90 мм рт. ст.
Понятием «изолированная систолическая АГ» обозначают устойчивое
повышение значений САД >140 мм рт. ст. при нормальных (<90 мм рт. ст.)
уровнях ДАД [6,9,46,144].
Классификация уровней АД и степеней АГ представлена в табл. 1.1.
Таблица 1.1. Классификация уровней АД и степеней АГ [136]
Категория
Оптимальное АД
Нормальное АД
Высокое нормальное АД
АГ 1-й степени
АГ 2-й степени
АГ 3-й степени
Изолированная систолическая АГ
САД
< 120 мм рт. ст.
120-129 мм рт. ст.
130-139 мм рт. ст.
ДАД
<80 мм рт. ст.
80-84 мм рт. ст.
85-89 мм рт. ст.
140-159 и/или 90-99 мм рт. ст.
160-179 и/или 100-109 мм рт. ст.
>180 и/или >110 мм рт. ст.
> 140 мм рт. ст.
<90 мм рт. ст.
В Украине продолжают использовать выделение «стадий» АГ, основанное на
данных о поражениях органов-мишеней (ПОМ) (табл. 1.2) [42,59,60,61,110].
Выделяют первичную АГ (также применяют термин «эссенциальная АГ», у
нас общепринято обозначение «гипертоническая болезнь»), при которой
повышение АД непосредственно не связано с какими-либо органными
поражениями, и вторичные (или «симптоматические») АГ, при которых
АГ связана с поражениями различных органов/тканей (см. табл. 3.1, гл. 3)
[46,54,61,98,108].
Классификации АГ
по степени сердечно-сосудистого риска
Стандартным сейчас является выделение (и указание при формулировке
диагноза) степеней дополнительного СС-риска при АГ [46, 61] (табл. 1.3).
Для этого принято учитывать наличие у пациента, наряду с АГ, факторов
риска (ФР), ПОМ и сопутствующих заболеваний (СЗ) (табл. 1.4). В 2013 году
эксперты ESH/ESC изменили подходы к выделению уровней СС-риска
(табл. 1.5) [6,58,90,136].
Классификация АГ, используемая в США
Приведенную ниже классификацию АГ используют в США и некоторых дру-
гих странах. В Европе, в целом, и в Украине, в частности, ее не применяют;
в издании она представлена лишь с ознакомительной целью.
Эксперты ASH выделяют следующие градации уровней АД (и, соответ-
ственно, стадии АГ) [123,137]:
• Улице САД в пределах 120-139 мм рт. ст. или ДАД в пределах 80-89 мм рт. ст.
считают возможным использование термина «прегипертензия». Вы-
деление такой категории обосновывается тем, что у подобных людей
риск развития АГ выше, чем у имеющих меньшие уровни АД. Лицам
с «прегипертензией» считают целесообразным рекомендовать изме-
нения стиля жизни (немедикаментозные лечебные подходы, см. гл. 6)
в надежде замедлить (или даже предупредить) развитие АГ в последу-
ющем. Антигипертензивные лекарственные препараты таким пациен-
там не назначают.
• При САД 140-159 мм рт. ст. или ДАД 90-99 мм рт. ст. устанавливают нали-
чие 1 -й стадии АГ. У таких пациентов к изменениям стиля жизни уже на
начальном этапе лечения добавляют один антигипертензивный препа-
рат (то есть на начальном этапе возможно проведение монотерапии). В
последующем (при необходимости) могут быть использованы комбина-
ции >2 антигипертензивных препаратов (см. гл. 7).
• При САД >160 мм рт. ст. или ДАД >100 мм рт. ст. констатируют наличие
2-й стадии АГ. Таким пациентам с самого начала требуется назначение
комбинированной антигипертензивной терапии (обычно — комбина-
ция блокатора кальциевых каналов (БКК) или диуретика с ингибитором
ангиотензинпревращающего фермента (АПФ) или сартаном). В после-
дующем (при необходимости) назначают комбинации, включающие
>3 антигипертензивных препаратов (см. гл. 7).
Таблица 1.2. Классификация АГ в зависимости от ПОМ
(ВОЗ, 1993) [46,61]
1-я
стадия
2-я
стадия
3-я
стадия
Отсутствие объективных признаков ПОМ
Наличие как минимум одного из приведенных признаков ПОМ:
• гипертрофия ЛЖ, выявленная при ЭКГ или ЭхоКГ
• генерализованное или фокальное сужение артерий сетчатки
• ХЗП с уровнем креатинина плазмы крови <0,176 ммоль/л
• атеросклеротические изменения (бляшки) поданным УЗИ или ангиогра-
фии в бассейнах аорты, сонных, подвздошных или бедренных артерий
Кроме перечисленных, имеются следующие признаки ПОМ:
• сердце: стенокардия, ИМ, СН
• мозг: инсульт, транзиторное нарушение мозгового кровообращения, хро-
ническая гипертензивная энцефалопатия, сосудистые деменции
• сетчатка: геморрагии и экссудат с отеком диска зрительного нерва или без него
• почки: креатинин плазмы крови >0,177 ммоль/л
• сосуды: расслаивающая аневризма аорты, окклюзионные поражения ар-
терий с клиническими проявлениями
Примечания. ЛЖ — левый желудочек; СН — сердечная недостаточность; УЗИ — ультразвуковое
исследование; ЭКГ — электрокардиография; ЭхоКГ — эхокардиография.
Таблица 1.3. Уровни дополнительного СС-риска при АГ
(Приказ МЗ Украины №384,2012) [9,46]
АГ +
(ФВ пом,
СЗ)
НетФР
1-2ФР
>ЗФР
или
СД, ПОМ
СЗ
АД (САД/ДАД), мм рт. ст.
Нормальное
АД:
120-129/
80-84
Средний
риск
в популяции
Низкий
дополнитель-
ный риск
Умеренный
дополнитель-
ный риск
Очень высо-
кий дополни-
тельный риск
Высокое нор-
мальное АД:
130-139/
85-89
Средний
риск
в популяции
Низкий
дополнитель-
ный риск
Высокий
дополнитель-
ный риск
Очень высо-
кий дополни-
тельный риск
АГ
1-й ст.:
140-159/
90-99
Низкий
дополнитель-
ный риск
Умеренный
дополнитель-
ный риск
Высокий
дополнитель-
ный риск
Очень высо-
кий дополни-
тельный риск
АГ
2-й ст.:
160-179/
100-109
Умеренный
дополнитель-
ный риск
Умеренный
дополнитель-
ный риск
Высокий
дополнитель-
ный риск
Очень высо-
кий дополни-
тельный риск
АГ
3-й ст.:
>180/
>110
Высокий
дополнитель-
ный риск
Очень высо-
кий дополни-
тельный риск
Очень высо-
кий дополни-
тельный риск
Очень высо-
кий дополни-
тельный риск
Примечания. СД — сахарный диабет.
В соответствии с Фремингемскими критериями, термины «низкий», «средний», «высокий» и
«очень высокий» риск означают 10-летнюю вероятность развития СС-осложнений (смертельных и
несмертельных) <15%, 15-20%, 20-30% и >30%, соответственно [123].
Таблица 1.4. ФР, ПОМ и СЗ при АГ (ESC/ESH, 2013) [136]
ФР
пом
СЗ
сд
• Возраст (М >55 лет, Ж >65 лет)
• Курение
• Дислипидемия (общий ХС >4,9 ммоль/л, или ХС ЛПНП >3 ммоль/л, или
ХС ЛПВП <1 (М) и <1,2 ммоль/л (Ж), или ТГ >1,7 ммоль/л)
• Глюкоза плазмы крови натощак более чем в 2 измерениях — 5,6-6,9 ммоль/л
• Нарушение толерантности к глюкозе
• Ожирение (ИМТ >30 кг/м2)
• Абдоминальное ожирение (окружность талии >102 см (М), >88 см (Ж))
• ССЗ у родственников до 55 лет (М), до 65 лет (Ж)
• Высокое пульсовое АД у пожилых лиц (>60 мм рт. ст.)
• Гипертрофия ЛЖ: по данным ЭКГ* (индекс Соколова-Лайона >3,5 мВ
или произведение Корнелл >2440 мм • мс) или по данным ЭхоКГ**
(индекс ММЛЖ >115 г/м2 (М), >95 г/м2 (Ж))
• Утолщение стенки сонных артерий (толщина КИМ >0,9 мм) или бляшки
• СРПВ*** (на сонных/бедренных артериях) >10 м/с
• ЛПИ**** <0,9
• СКФ — 30-60 мл/мин/1,73 м2 (с/и. гл. 15)
• Микроальбуминурия — 30-300 мг/сутки или мг/мл
• Перенесенный инсульт, ТИА
• ИБС
• Хроническая СН при сниженной систолической функции ЛЖ, а также
с его сохранной фракцией выброса
• ХЗП (СКФ <30 мл/мин/1,73 м2; протеинурия >300 мг/сутки)
• Поражения периферических артерий с симптомами
• Тяжелая ретинопатия (геморрагии, экссудат, отек)
• Диагностика: НЬА1с >7%, или глюкоза плазмы натощак (>8 ч без приема
пищи) двукратно >7 ммоль/л, или глюкоза через 2 ч после глюкозной
нагрузки (75 г глюкозы) >11,1 ммоль/л
Примечания. ИБС — ишемическая болезнь сердца; ИМТ — индекс массы тела; КИМ — комплекс
интима-медиа; ЛПВП — липопротеиды высокой плотности; ЛПИ — лодыжечно-плечевой индекс;
ЛПНП — липопротеиды низкой плотности; ММЛЖ — масса миокарда левого желудочка; СКФ —
скорость клубочковой фильтрации; СРПВ — скорость распространения пульсовой волны; ССЗ —
сердечно-сосудистое заболевание; ТГ — триглицериды; ТИА — транзиторная ишемическая атака;
ХС — холестерин; НЬА1с — гликозилированный гемоглобин.
* ЭКГ-диагностика гипертрофии ЛЖ. Индекс Соколова-Лайона: SVi + (RVs или RV6). Произведение
Корнелл у мужчин: (RavL + SV3) х QRS (мс). Произведение Корнелл у женщин: (RavL + SV3 + 8) х QRS (мс).
** ЭхоКГ-диагностика гипертрофии ЛЖ. Для этого в настоящее время повсеместно используют формулу
ASE (American Society of Echocardiography, Американское общество ЭхоКГ): ММЛЖ = 0,8 х (1,04 х (КДР ЛЖ
+ T3C ЛЖ + ТМЖП)3 — (КДР ЛЖ)3)) + ОД где КДР ЛЖ — конечно-диастолический размер ЛЖ, T3C ЛЖ —
толщина задней стенки ЛЖ в диастолу, ТМЖП — толщина межжелудочковой перегородки в диастолу.
Для подсчета индекса ММЛЖ полученную при использовании этой формулы величину ММЛЖ делят на
площадь поверхности тела больного (в таблице указаны нормальные значения индекса ММЛЖ при таком
варианте подсчета). Некоторые эксперты считают более приемлемой индексацию ММЛЖ не на площадь
поверхности тела, а на рост больного в степени 2,7 (рост27) или рост в степени 1,7 (рост17) для улучшения
идентификации гипертрофии ЛЖ у лиц с избыточной массой тела или ожирением.
*** СРПВ оценивают с помощью механической или допплеровской регистрации пульсовой волны на
сонных и бедренных артериях.
**** ЛПИ — соотношение САД на лодыжке (манжета — на дистальном отделе голени) к САД на плече.
Таблица 1.5. Уровни дополнительного СС-риска при АГ
(ESH/ESC, 2013) [136]
Другие ФР,
бессимптомное ПОМ
НетФР
1-2ФР
>ЗФР
ПОМ,СД,ХЗПЗ-йст.
ССЗ с клиническими
проявлениями,ХЗП
>4 ст. или СД с ПОМ/ФР
АД (САД/ДАД), мм рт. ст.
Высокое нор-
мальное АД:
130-139/
85-89
Низкий
риск
Низкий
риск
Низкий/
средний
риск
Умеренный/
высокий
риск
Очень
высокий риск
АГ
1 -й ст.:
140-159/
90-99
Низкий
риск
Умеренный
риск
Умеренный/
высокий
риск
Высокий
риск
Очень
высокий риск
АГ
2-й ст.:
160-179/
100-109
Умеренный
риск
Умеренный/
высокий
риск
Высокий
риск
Высокий
риск
Очень
высокий риск
АГ
3-й ст.:
>180/
>110
Высокий
риск
Высокий
риск
Высокий
риск
Высокий/
очень высокий
риск
Очень
высокий риск
Примечание. Определение терминов, применяемых для обозначения степени риска, осталось прежним.
Оценка степени сердечно-сосудистого риска
на основании шкал SCORE
Эксперты ESC на основании значительных популяционных исследований,
в которые суммарно были включены приблизительно 250 000 жителей
разных стран Европы, разработали шкалы SCORE (Systematic COronary Risk
Evaluation) [136]. Эти шкалы позволяют оценить степень риска смерти от
CC3 в течение 10 лет у лиц общей популяции, не имеющих заболеваний
сердца и СД в возрасте >40 лет. Привлекательность этих шкал обусловлена
следующими показателями:
• простотой, наглядностью и понятностью как для врачей широкой практи-
ки, так и для пациентов;
• достаточно высокой точностью оценки риска;
• доступностью в электронном виде, в том числе как калькулятор риска на
сайте www.escardio.org.
В соответствии со шкалой SCORE, выделяют следующие категории 10-летнего
риска смерти от ССЗ:
• очень высокий риск (>10%);
• высокий риск (5-9%);
• умеренный риск (1 -4%);
• низкий риск (0%).
На рис. 1.1 представлен вариант шкалы SCORE, рекомендованный для стран
с исходно высоким популяционным уровнем СС-риска (в том числе для
Украины) [136]. Для правильного пользования шкалой следует найти кле-
точку, соответствующую тем показателям пола, возраста, САД и общего ХС,
которые имеет конкретный пациент. Указанная в клеточке цифра представ-
ляет примерную величину 10-летнего риска смерти от ССЗ (выраженную в
процентах). Следует принять во внимание, что использование этой шкалы
позволяет лишь ориентировочно установить степень риска, так как в ней
не учитывают иные возможные ФР. Авторы указывают, что риск может быть
выше того, который представлен в шкале, у следующих категорий лиц:
• ведущих малоподвижный образ жизни, а также у имеющих ожирение,
особенно — центральное;
• имеющих отчетливые данные семейного анамнеза о раннем начале ССЗ;
• социально незащищенных и социально неблагополучных;
• с СД (шкала SCORE пригодна для оценки риска только у лиц с СД1 -го типа
без ПОМ. Все иные больные СД имеют очень высокий риск);
• с низкими уровнями ХС Л ПВП, с повышенными уровнями ТГ (а также фибри-
ногена, аполипопротеина В, липопротеина (а) и, вероятно, С-реактивного
белка (СРБ), определяемого с помощью высокочувствительных методов);
• бессимптомных с данными о наличии доклинических проявлений ате-
росклероза (например, с атеросклеротическими бляшками, выявляемы-
ми при УЗИ артерий);
• со снижением функции почек (СКФ <60 мл/мин/1,73 м2).
Необходимо отметить, что в США принята иная система оценки уровня
СС-риска — определение 10-летнего риска атеросклеротических сердеч-
но-сосудистых заболеваний (АСССЗ). Она также доступна в виде электрон-
ного калькулятора (см. гл. 14).
ШКАЛА SCORE
ЖЕНЩИНЫ
Некурящие Курящие
МУЖЧИНЫ
Некурящие Курящие
н
н
Е
ci
<
180
160
140
120
180
160
140
120
180
160
140
120
180
160
140
120
180
160
140
120
■ТИП
з зЕШП
■■■■п
DDDDD
з з ПО
2 2 2 3 3
1 '■■■
HHHHD
12 2 2 3
, 1 , .■
■■■■■
■■■■■
11111
0 1111
■пидкипга
DDHQD
иииярия
DDIIDD
зЕШНВ
■■■DD
QDDQD
3 3
2 2 2 3 3
■■■■■
■■■■D
12 2 2 3
1 1 1 )■
0 0 1 ■■ ■■■ 1 1
0 0 0 0 0
0 0 0 0 0
0 0 0 0 0
0 0 0 0 0
ооо ■■
0 0 0 0 0
0 0 0 0 0
0 0 0 0 0
65
лет
60
лет
55
лет
50
лет
40
лет
■пиниЕяиа
DBQE
И1И1Н1Н1П
■■DDD
НШ11Я1Я
3 3
■■■■п
DDHDD
2 3 ПП
2 2 :■■
■■■■■
■■■■■
ннвнв
о i ннн
0 0 111
ОЕЗЕЭЕШЕЭ
11Я1И1Н1Я
1Е1В11Я1Я1Д
IBIB1
1И1Я1Л1ИКЯ
ш
DDDI
1ШИ1ЯВ1
Ю
3DBDI
■■■ПН
■■■■■
12 2 2 3
1 1 1 2 2
4 5 6 7 8 4 5 6 7
4 5 6 7
Общий ХС, ммоль/л
10-летний риск смерти от ССЗ
4 5 6 7
<1%
Рис. 1. L Шкала SCORE, оценивающая 10-летний риск смерти
от ССЗ в зависимости от пола, возраста, курения, САД и общего ХС
сыворотки крови (вариант, рекомендованный экспертами ESC
для стран, имеющих высокий уровень СС-риска в популяции,
в том числе для Украины и России)
Примечание. Существуют более сложные варианты шкалы, в которых учитывают и уровни ХС ЛПНП.
Все варианты шкал и электронные калькуляторы представлены на сайте www.escardio.org.
Глава 2
Эпидемиология
артериальной гипертензии
Распространенность артериальной гипертензии
в мире и Украине
АГ является одним из наиболее распространенных хронических забо-
леваний. АГ — самое частое хроническое заболевание в практике врача
первичного звена оказания медицинской помощи (врача общей практи-
ки - семейного врача) [55, 90]. АГ имеет место примерно у 1/3 населения
большинства развитых и развивающихся стран (приводимые цифры обыч-
но находятся в пределах 30-45%) [46,123,212]. Среди эпидемиологических
факторов, определяющих высокую распространенность АГ среди населе-
ния, особенно весомыми эксперты ASH/ISH считают [123]:
• тенденцию к старению населения в ряде стран мира;
• увеличение распространенности ожирения (как в развитых, так и в ряде
развивающихся стран);
• употребление значительного количества поваренной соли в рационе.
В Украине в 2011 году было зарегистрировано более 12 100 000 больных
АГ, что составило 32,2% взрослого населения. При анализе структуры АГ
по уровням АД отмечено, что у 1/2 имеет место АГ 1-й степени, у 1/3 —
АГ 2-й степени, у 1/6 — АГ 3-й степени [46,60,144].
Распространенность АГ увеличивается с возрастом. Не менее 60% лиц
в возрасте >60-65 лет имеют повышенное АД или получают антигипер-
тензивную терапию. Среди лиц в возрасте 55-65 лет вероятность раз-
вития АГ, по данным Фремингемского исследования, составляет более
90% [42, 98,117].
Артериальная гипертензия
и сердечно-сосудистый риск
ВОЗ рассматривает АГ как наиболее важную из потенциально предот-
вратимых причин смерти в мире [123].
АГ ассоциирована с увеличением CC-смертности и увеличением риска
СС-осложнений во всех возрастных группах. Имеется также независимая
связь между наличием АГ, с одной стороны, и риском развития CH, пора-
жений периферических артерий и снижения функции почек, с другой сто-
роны [181,182].
Риск перечисленных осложнений считается наименьшим при значениях АД
приблизительно 115/75 мм рт. ст. [123]. При уровнях АД выше этой величи-
ны дальнейшее его увеличение на каждые 20/10 мм рт. ст. ассоциировано с
двукратным повышением риска СС и сосудисто-мозговых осложнений [137].
Явная зависимость СС и почечного прогноза продемонстрирована как от
уровней АД, полученных при его измерении в кабинете врача (так называ-
емое «офисное» АД), так и от значений АД, полученных при его амбулатор-
ном или домашнем мониторировании (см. гл. 4) [54, 223].
Систолическое и диастолическое
артериальное давление:
значимость для прогноза у лиц разного возраста
Наиболее тесную связь с увеличением СС-риска демонстрируют уровни
САД. Это особенно верно для лиц в возрасте старше 50 лет. Значения САД
имеют тенденцию к увеличению в течение жизни; в то же время величины
ДАД с возраста 50-60 лет начинают уменьшаться.
Процесс увеличения САД и уменьшения ДАД (с повышением значений
пульсового АД, под которым понимают разницу между САД и ДАД) отража-
ет прогрессирующее увеличение жесткости стенки сосудов артериального
русла [144]. Точные механизмы этого процесса остаются недостаточно из-
ученными. Важно отметить, что повышенные уровни САД у лиц пожилого
возраста представляют важнейший независимый ФР развития СС и сосуди-
сто-мозговых осложнений, а также прогрессирования поражений почек. У
лиц в возрасте до 50 лет отчетливую связь со степенью СС-риска демон-
стрируют величины ДАД [59,108,120,144].
Сочетание артериальной гипертензии
и других факторов риска
У большинства лиц с АГ имеются и другие факторы СС-риска, включая [123]:
• дислипидемию;
• нарушение толерантности к глюкозе или СД;
• отягощенный по ССЗ семейный анамнез;
• ожирение;
• курение.
Сочетание этих факторов с повышенным АД способствует существенному
нарастанию общей степени СС-риска. Для достижения адекватного конт-
роля АД у таких пациентов обычно требуется использование комбиниро-
ванной антигипертензивной терапии; им также нередко требуется назна-
чение статинов [58,109,123].
Неудовлетворительный контроль
артериального давления
Успехи в лечении АГ, несмотря на использование современных диагнос-
тических и лечебных подходов, остаются скромными: во многих странах
мира менее половины лиц с АГ достигают контроля АД в пределах целевых
показателей [123]. Согласно эпидемиологическим данным, в странах За-
падной Европы примерно 50% больных АГ не знают о наличии у них
повышенного АД (то есть диагноз АГ у них не установлен), а среди лиц
с АГ лишь 10-15% имеют удовлетворительный контроль АД. Соответ-
ствующие данные по Украине в 2010-2011 гг. составляли: для муж-
чин — 40% и 10%, для женщин — 32% и 25% [46,112,156,182].
Глава 3
Этиология
артериальной гипертензии.
Патогенез эссенциальной
артериальной гипертензии
Этиология артериальной гипертензии
В зависимости от этиологии выделяют эссенциальную АГ (обозначаемую
также как первичная, или идиопатическая АГ, в отечественной практике
используют термин «гипертоническая болезнь») и симптоматические АГ
(табл. 3.1) [7, 38,46,195].
Таблица 3.1. Этиология АГ [46,123,137]
Первичная АГ (эссенциальная АГ, гипертоническая болезнь)
Вторичные АГ (симптоматические)
Ренальные АГ:
• Ренопаренхиматозные (гломерулонеф-
рит, пиелонефрит, поликистоз, диабе-
тический гломерулосклероз, др.)
• Реноваскулярные (атеросклеротиче-
ский стеноз почечных артерий, фибро-
мышечная дисплазия, васкулит с пора-
жением почечных артерий)
• АГ при ренин продуцирующих опухолях
• Ренопривная АГ (после нефрэктомии)
АГ, связанная с неврологическими при-
чинами: при опухолях головного мозга,
энцефалите, синдроме ночного апноэ,
синдроме Гийена-Барре
Эндокринные АГ:
• Надпочечниковые (при нарушениях в кор-
ковом слое — синдром Кушинга, первич-
ный альдостеронизм, врожденная гипер-
плазия надпочечников; при нарушениях
в мозговом слое — феохромоцитома)
• Тиреоидные (при гипер- или гипотиреозе)
• АГ при акромегалии, гиперпаратиреозе,
карциноиде
• АГ на фоне приема экзогенных гормональ-
ных препаратов (эстрогенов, глюко- и ми-
нералокортикоидов, симпатомиметиков)
АГ, обусловленная повышенным СВ: напри-
мер, ИСАГ при повышенной жесткости стенки
аорты у пожилых, АГ при недостаточности
клапана аорты, АГ при наличии артериове-
нозной фистулы, незаращении артериально-
го протока, болезни Педжета, бери-бери
АГ при коарктации аорты
АГ, обусловленная беременностью
Примечание. ИСАГ — изолированная систолическая АГ; ПА — первичный альдостеронизм; СВ —
сердечный выброс.
Под эссенциальной АГ понимают устойчивое повышение АД, не имеющее
доказанной патофизиологической связи с почечными, эндокринными,
нейрогенными, экзогенными и другими причинами [8, 207].
Группу симптоматических АГ составляют такие, повышение АД при кото-
рых является вторичным по отношению к перечисленным причинам. Эта
группа объединяет различные варианты АГ, перечисленные в табл. 3.1.
Среди симптоматических АГ выделяют [46,98,175]:
• группу ренальных АГ (включая ренопаренхиматозные, реноваскулярные,
ренопривные и связанные с наличием ренинпродуцирующих опухолей);
• группу эндокринных АГ (в том числе надпочечниковых, тиреоидных,
при акромегалии, гиперпаратиреозе, карциноиде, приеме экзогенных
гормональных препаратов);
• АГ при коарктации аорты;
• АГ, обусловленную беременностью;
• группу неврологических АГ;
• группу АГ, связанных с увеличенным СВ.
По данным эпидемиологических исследований, в структуре АГ доминиру-
ет эссенциальная АГ, частота которой среди всех вариантов АГ достигает
95%. Приводим данные о распространенности некоторых вариантов симп-
томатических АГ в общей структуре гипертензий [42,109]:
• ренопаренхиматозная АГ — 1,8-5,6% случаев;
• реноваскулярная АГ — 0,2-3,3% случаев;
• АГ, обусловленная коарктацией аорты, — 0,2% случаев;
• АГ, обусловленная ПА, — 0,3-1,5% случаев;
• АГ, обусловленная синдромом Кушинга, — 0,1 -0,6% случаев;
• АГ, обусловленная феохромоцитомой, — 0,1-0,3% случаев;
• АГ, обусловленная приемом оральных контрацептивов (в странах Запад-
ной Европы), — 0,2-1% случаев;
• АГ при беременности: у первобеременных — 10-15%, у повторнобере-
менных — 2-5% случаев [55, 90,107].
Патогенез эссенциальной артериальной гипертензий
С учетом доминирующей роли эссенциальной АГ в структуре АГ, считаем
необходимым рассмотреть ведущие факторы, определяющие ее развитие
[54, 84]. Давление крови в артериальном русле, обеспечивающее переме-
щение крови от сердца к периферическим тканям, определяется двумя ос-
новными факторами:
• СВ (объем крови, изгоняемый ЛЖ в циркуляцию за 1 минуту);
• общим периферическим сопротивлением сосудов (ОПСС).
Величина АД представляет собой произведение значений этих показате-
лей (рис. 3.1). Таким образом, увеличение АД, то есть развитие АГ, стано-
вится возможным либо при возрастании одного из них, либо при их соче-
танном увеличении. В свою очередь, значения СВ и ОПСС определяются
широким спектром патофизиологических факторов, ведущие из которых
представлены на рис. 3.1. На рисунке продемонстрировано, что возник-
новение АГ может быть связано с действием различных механизмов, при
этом у конкретного пациента они могут участвовать в развитии АГ в раз-
личных сочетаниях или, значительно реже, изолированно.
Ведущая роль в развитии эссенциальной АГ отводится генетическим
механизмам и основным экзогенным факторам:
• избыточному употреблению поваренной соли;
• психоэмоциональному стрессу;
• ожирению.
Точные механизмы, посредством которых эти факторы определяют воз-
никновение и становление АГ, остаются во многих случаях недостаточно
известными [56,108,156].
АД = СВ х ОПСС
АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
t
СВ
и/или
1
А объема крови
1
I ОПСС
А сократимости
миокарда
Функциональная
констрикция
сосудов
А тонуса
симпатической
нервной системы
Избыток натрия
в пище
Задержка натрия
почками
А тонуса
РАС
Гипертрофия
и ремоделирование
стенки сосудов
Оксид
азота
Инсулинорезис-
тентность и гипер-
инсулинемия
Генетические
факторы
Психоэмоциональный
стресс
Генетические
факторы
Ожирение
Рис. 3.1. Патогенез эссенциальной АГ
Генетические факторы. В популяционных исследованиях (втом числе
проводившихся в семьях больных эссенциальной АГ и среди близнецов)
представлены несомненные доказательства важной роли наследственных
факторов в развитии АГ [58, 63, 144]. Показано, что лица, имеющие 2 или
более родственников 1-й степени родства (ближайшее кровное родство:
родители-дети, братья-сестры) с АГ, развившейся в возрасте ранее 55 лет,
имеют риск развития АГ в 4 раза более высокий, чем лица без таких род-
ственников. В настоящее время эссенциальную АГ рассматривают как
«полигенное заболевание с неизвестной пенетрантностью» [117]. Здесь
необходимо отметить, что понятием «ген» обозначают участок хромосомы,
определяющий развитие какого-либо признака; под «пенетрантностью»
понимают вероятность фенотипического проявления генетически опре-
деленного признака. Уже идентифицированы или гипотетически обосно-
ваны многочисленные маркерные гены, детерминирующие различные
признаки, которые предрасполагают к развитию АГ. К последним относят
особенности клеточных мембран, выведения натрия почками, структуры
и функции мембранных рецепторов к инсулину, активации РАС и симпа-
тической системы, ауто- и паракринных факторов роста миокардиоцитов,
сосудистых миоцитов, фибробластов, др. [156].
Увеличение СВ нередко выявляют на ранних этапах становления эссен-
циальной АГ, в частности, при пограничной АГ. У лиц с развернутой кли-
нической картиной АГ значения СВ чаще находятся в нормальных преде-
лах или несколько увеличены, а повышение АД обусловлено в большей
степени высоким ОПСС. Повышение СВ при АГ может быть связано как с
увеличением сократительной способности миокарда, так и с возрастанием
преднагрузки (венозного возврата) [66,67,68].
Повышение сократительной способности миокарда, характери-
зующее наличие так называемого гиперкинетического типа гемодинами-
ки, определяется у 40-50% молодых лиц с пограничной АГ, а также в части
случаев у молодых нормотензивных родственников (1-й степени родства)
лиц с эссенциальной АГ. Повышение частоты сердечных сокращений (ЧСС)
и увеличение ударного объема (УО) ЛЖ, наблюдаемое у таких лиц, связы-
вают с гиперактивностью симпатической системы и, возможно, со сниже-
нием тонуса парасимпатической системы. Одной из причин повышения
сократительной способности миокарда на ранних этапах АГ может быть ги-
пертрофия ЛЖ, наличие которой при ЭхоКГ-исследовании констатируется
у таких пациентов в 10-40%, а у нормотензивных родственников больных
эссенциальной АГ — в 7-12% наблюдений. Полагают, что, по крайней мере,
в части случаев гипертрофия ЛЖ (или склонность к ее развитию) у таких
лиц может быть генетически детерминированной [60,109].
Перераспределению объема циркулирующей крови (ОЦК) от-
водят определенную роль в увеличении СВ при АГ. При отсутствии гипер-
волемии у части лиц с АГ выявляют увеличение кровотока в центральных
органах (сердце, легкие, головной мозг, почки) и его уменьшение на пери-
ферии вследствие периферической вазоконстрикции. При этом наблюда-
ют увеличение венозного возврата к сердцу и увеличение СВ [7].
Увеличение ОЦК является важным фактором повышения преднагрузки
и увеличения АД. Следует отметить, что у большинства пациентов со ста-
бильной АГ абсолютные значения ОЦК меньше, чем у нормотензивных лиц.
Несмотря на это, имеющийся ОЦК является относительно чрезмерно высо-
ким для повышенных уровней АД. Ведущими факторами, определяющими
увеличение ОЦК, являются избыточное употребление поваренной соли с
пищей и задержка натрия и воды почками [38,195].
Избыточное употребление поваренной соли с пищей играет,
несомненно, одну из ключевых ролей в развитии АГ. В масштабных эпи-
демиологических исследованиях представлены доказательства наличия
прямых высокозначимых корреляций между уровнями диетического упо-
требления поваренной соли, с одной стороны, и значениями АД и распро-
страненностью АГ — с другой. В одном из крупнейших подобных иссле-
дований (INTERSALT) которое охватило 10000 лиц обоего пола в возрасте
20-59 лет из 52 исследовательских центров по всему миру убедительно
продемонстрирована существенная зависимость частоты АГ от количе-
ства употребляемой поваренной соли. Впечатляющим примером важной
роли поваренной соли в развитии АГ могут служить данные о динамике
частоты цереброваскулярных катастроф, связанных с АГ, в Японии. В нача-
ле 1970-х годов Япония лидировала среди стран Тихоокеанского региона
по частоте гипертензивных цереброваскулярных катастроф, что, по край-
ней мере отчасти, связывали с высокой распространенностью избыточно-
го употребления поваренной соли в рационе японцев. В этот период была
разработана и получила широкое распространение Национальная обра-
зовательная программа по ограничению поваренной соли в диете, успе-
хом которой во многом объясняют тот факт, что спустя лишь 20 лет Япония
заняла одно из последних мест в регионе по частоте гипертензивных цере-
броваскулярных катастроф [84].
При обсуждении роли поваренной соли в развитии АГ следует упомянуть о
вариабельной чувствительности АД к избытку поступающего в организм на-
трия. В настоящее время широкое распространение получили термины «со-
лечувствительность» и «солерезистентность». Под первым из них понимают
склонность пациента к развитию повышения АД при употреблении избытка
натрия (поваренной соли) с пищей. Под солерезистентностью подразуме-
вают отсутствие повышения АД при приеме избытка поваренной соли. Не-
обходимо подчеркнуть, что степень солечувствительности, по крайней мере
в части случаев, определяется наследственными факторами. Важно также
то, что солечувствительность увеличивается с возрастом [109].
В течение последних лет представлены убедительные экспериментальные
и клинические свидетельства того, что избыточное диетическое употре-
бление натрия является весомым патофизиологическим фактором разви-
тия гипертрофии и концентрического ремоделирования ЛЖ как у пациен-
тов с АГ, так и у нормотензивных лиц [42,117].
Задержка натрия почками может быть обусловлена генетически де-
терминированными дефектами ренальной экскреции натрия. У здоровых
лиц при повышении АД наблюдают увеличение натрийуреза, приводящее
к уменьшению ОЦК и СВ, что способствует нормализации АД. Предполага-
ется, что у части лиц с АГ имеются первичные дефекты выведения натрия
(возможно, связанные с гетерогенностью нефронов), характеризующиеся
нарушением зависимости уровней натрийуреза от значений АД. При этом
увеличение натрийуреза у них развивается при более высоких уровнях
АД, чем в норме, что способствует становлению АГ [175].
Еще одним возможным фактором, способствующим задержке натрия поч-
ками, может быть врожденное уменьшение фильтрационной поверхно-
сти. Так, показано, что у 30-40% практически здоровых лиц в возрасте до
30 лет количество нефронов составляет менее 800000 в каждой из почек,
что меньше, чем в среднем в популяции здоровых людей. Эти лица имеют
меньшую способность к экскреции натрия, и, таким образом, рассматрива-
ются некоторыми авторитетными патофизиологами как предрасположен-
ные к развитию АГ. Представлены данные о генетической детерминиро-
ванности количества нефронов в почках [60].
Значительное место в патогенезе АГ отводится гиперактивности сим-
патической системы. Имеются многочисленные свидетельства связи
уровня АД и распространенности АГ с психоэмоциональным стрессом,
определяющим активацию симпатической системы. Широкую известность
приобрел тот факт, что у работников более «эмоциональных» профессий
риск развития АГ существенно выше, чем у лиц, не имеющих постоянных
эмоциональных перегрузок [55,107].
Механизмы, ответственные за увеличение активности симпатической сис-
темы при АГ, характеризуются как многогранные и недостаточно извест-
ные и включают в себя: комплекс изменений периферических баро- и хе-
морецепторов; нарушения механизмов обратной связи в регуляции актив-
ности симпатической системы; изменения эфферентных адренорецепто-
ров. Достаточно обоснованными представляются данные о генетической
предрасположенности к активации симпатической системы улице АГ. Так,
у больных АГ (в том числе, на ранних этапах развития гипертензии), а также
у их кровных нормотензивных родственников регистрируют повышенные
уровни норадреналина в плазме, увеличение плотности адренорецепто-
ров на мембранах миоцитов артерий и артериол (что обозначается тер-
мином up-regulation), имеет место чрезмерная выработка норадреналина
в ответ на физическую и эмоциональную нагрузку, показана повышенная
вазопрессорная чувствительность сосудов к норадреналину, выявляют
различные варианты дисфункции барорецепторов. Гиперактивности сим-
патической системы, развивающейся при АГ (или, возможно, предшеству-
ющей развитию АГ) отводят важное место в повышении ОПСС. Кроме того,
показано, что норадреналин является мощным фактором, стимулирующим
процессы гипертрофии миокардиоцитов и пролиферации миокардиаль-
ных фибробластов; с учетом этого повышенный тонус симпатической си-
стемы рассматривают как один из основных нейрогуморальных факторов
развития гипертрофии миокарда при АГ [7,8,68].
Ведущими факторами, обусловливающими повышение активности РАС
при АГ считают активацию симпатической системы, увеличение высвобо-
ждения вазопрессина, развитие вследствие почечной вазоконстрикции
ишемизации отдельных нефронов с формированием гетерогенности неф-
ронов и стимуляцией выработки ренина, повышение стимуляции баро-
рецепторов артериол почек и macula densa. Наряду с перечисленными
причинами определенную роль в активации РАС могут играть наруше-
ния баланса внутрипочечных простагландинов и увеличение локального
образования аденозина вследствие периферической вазоконстрикции.
Важным фактором может также явиться нарушение при АГ механизмов об-
ратной связи, обеспечивающих в норме снижение продукции ренина при
возрастании уровней ангиотензина II (АН) [71].
Основные циркуляторные эффекты активации РАС при АГ складываются
из периферической артериальной и венозной вазоконстрикции, почеч-
ной вазоконстрикции и повышения сократимости миокарда. Системная
вазоконстрикция обусловливает увеличение постнагрузки с возрастани-
ем АД. Дополнительными важными факторами участия АН в развитии АГ
являются его стимулирующее влияние на процессы ремоделирования
сосудов, трофическое (стимулирующее развитие гипертрофии) и токсиче-
ское воздействия на миокард. Стимулированное АН увеличение функции
фибробластов миокарда приводит к нарастанию его жесткости и ухудше-
нию параметров диастолической функции. Важное значение в реализации
неблагоприятных эффектов АН при АГ придается его влияниям, стимулиру-
ющим активность симпатической системы. Увеличение продукции АН спо-
собствует задержке натрия и воды в почках вследствие различных меха-
низмов, среди которых основными являются почечная вазоконстрикция,
гиперсекреция альдостерона в коре надпочечников и неосмотическое
освобождение вазопрессина [67,68].
Обсуждая роль гиперактивности РАС в развитии АГ, необходимо упомя-
нуть о современных представлениях о РАС как о двукомпонентной систе-
ме, представленной циркулирующим и тканевым (локальным) звеньями,
имеющими определенные функциональные различия. Представлены до-
казательства наличия всех компонентов РАС (таких как ангиотензиноген,
ренин, АПФ, АН, рецепторы к АН) в различных органах и тканях (структуры
сосудистой стенки, миокарда, головного мозга, почечных гломерул, надпо-
чечников, альвеол). Циркулирующее звено РАС обеспечивает более крат-
ковременный контроль СС и почечного гомеостаза, определяя колебания
сосудистого тонуса и уровней экскреции натрия и воды. Тканевые (ло-
кальные) РАС характеризуют механизм «более константного, пролонгиро-
ванного регулирования» структуры и функции соответствующих органов.
Повышенной активности именно тканевых РАС отводится ведущее место в
развитии таких определяющих характер течения и прогноз АГ процессов,
как генерализованная эндотелиальная дисфункция и ремоделирование
сосудов, гипертрофия миокарда и ремоделирование камеры ЛЖ сердца,
структурные изменения гломерулярных артериол со становлением и про-
грессированием интрагломерулярной гипертензии, гиперфильтрации,
гипертрофии и фиброзирования [73].
Многообразная патофизиологическая роль отводится повышенному
высвобождению альдостерона, развивающемуся в процессе активации
РАС. Во многочисленных экспериментальных и клинических сообщениях
продемонстрировано, что альдостерон наряду со стимуляцией задержки
натрия и воды, увеличением выведения калия и активацией симпатиче-
ской системы, вызывает также развитие дисфункции барорецепторов, по-
вышает жесткость артериальной стенки, индуцирует развитие интерстици-
ального и периваскулярного фиброза в миокарде, способствует прогрес-
сированию гипертрофии миокарда и ремоделирования ЛЖ [90].
Повышение ОПСС, признаваемое основополагающим механизмом ста-
билизации гипертензии, выявляют у подавляющего большинства больных
с устойчиво повышенным АД. Возрастание ОПСС при АГ обусловлено дву-
мя основными механизмами: функциональной констрикцией перифериче-
ских артерий и артериол и их ремоделированием [66].
Развитиефункциональной констрикции артерий и артериол при
АГ обусловлено сочетанием избыточного воздействия на сосудистые мио-
циты вазоконстрикторных медиаторов (норадреналина, АН, др.), повышен-
ной чувствительности рецепторного аппарата этих клеток к перечислен-
ным медиаторам, уменьшенной активности вазодилатирующих систем (ок-
сида азота, брадикинина, др.) и сниженной чувствительности сосудистых
миоцитов к вазодилатирующим влияниям. Перечисленные механизмы ва-
зоконстрикции обычно присутствуют у конкретного пациента с АГ не изо-
лированно, а в различных комбинациях [68,70].
Ремоделированием сосудов обозначается процесс их структурного
переустройства с утолщением стенки (из-за увеличения толщины медии,
гипертрофии сосудистых миоцитов) и уменьшением просвета. В развитии
процессов ремоделирования сосудов важная роль отводится гемодинами-
ческим (увеличенному механическому давлению на структуры сосудистой
стенки) и нейрогуморальным факторам (прямым ростостимулирующим
эффектам норадреналина, АН, альдостерона, инсулина, других цитокино-
вых, ауто- и паракринных медиаторов) [67]. Определенное место в разви-
тии ремоделирования сосудов отводят генетическим факторам. Процесс
ремоделирования определяет увеличение ОПСС как вследствие генерали-
зованного уменьшения просвета средних и мелких артерий, так и опосре-
дованно — из-за увеличения жесткости стенки аорты, крупных, средних и
мелких артериальных сосудов (связанного с увеличением тонуса сосудис-
тых миоцитов, локальных процессов фиброзирования) [144,155].
Понятием «инсулинорезистентность» обозначают уменьшение чув-
ствительности к инсулину клеток-мишеней (включая гепатоциты, сосуди-
стые миоциты, адипоциты, др.). Развитие инсулинорезистентности связы-
вают с генетическими факторами, гиперактивностью симпатической систе-
мы, которые определяют уменьшение количества рецепторов к инсулину
на мембранах клеток-мишеней. Возникающая в качестве компенсаторного
ответа гиперинсулинемия, вероятно, является существенным патофизио-
логическим фактором развития ремоделирования сосудов и гипертрофии
миокарда при эссенциальной АГ. Сочетание АГ, инсулинорезистентности,
гиперлипидемии, абдоминального ожирения и нарушения толерантности
к глюкозе объединяют понятием «метаболический синдром» [155].
В развитии АГ определенную роль отводят нарушениям продукции
вазоактивных веществ, образуемых эндотелием сосудов. В те-
чение предыдущего десятилетия сформировалась и получила всеобщее
признание точка зрения на сосудистый эндотелий как на активную физио-
логическую структуру, обладающую способностью секретировать много-
образные биологически активные вещества [155, 222]. Регуляция функции
эндотелия в норме и при патологических состояниях остается недостаточ-
но изученной; предполагается, что она осуществляется при комплексном
взаимодействии эндотелия с гемодинамическими (механическое растя-
жение), нейрогуморальными, тромбоцитарными и другими факторами.
Часть образуемых эндотелием биологически активных веществ обладает
вазоконстрикторными свойствами и может стимулировать процессы ремо-
делирования сосудов (эндотелин-1); другие являются вазодилататорами и
могут замедлять процессы ремоделирования (оксид азота), точная функция
некоторых из них остается невыясненной. Представлены свидетельства
того, что при АГ наблюдают уменьшение продукции эндотелием мощного
вазодилататора оксида азота, вследствие этого преобладание получают ва-
зоконстрикторные влияния, что способствует повышению ОПСС [222].
Другие факторы в патогенезе АГ. Проблемам патофизиологии АГ
посвящены тысячи ежегодно публикуемых экспериментальных и клини-
ческих сообщений, что является основой для постоянного расширения
представлений о механизмах ее развития. К числу патофизиологических
факторов, роль которых в развитии АГ активно обсуждается в современ-
ной кардиологической литературе, могут быть отнесены:
• дисбаланс в системе натрийуретических гормонов;
• повышение продукции паратиреоидного гормона;
• нарушения баланса магния и кальция (в первую очередь, у лиц с остео-
порозом, у женщин в постменопаузе);
• гипокалиемия;
• нарушения толерантности к кофеину;
• дисбаланс эстрогенов и андрогенов.
Детальное рассмотрение новых концепций патогенеза АГ выходит за рамки
настоящей главы, поскольку многие их элементы носят в настоящее время
гипотетический характер и нуждаются в серьезном обосновании [155,222].
Глава 4
Измерение артериального давления.
Мониторирование артериального давления.
Диагностика артериальной гипертензии.
Артериальная гипертензия «белого халата»,
маскированная артериальная гипертензия
Измерение артериального давления
«в кабинете врача»
Для измерения АД могут использоваться ртутные сфигмоманометры, а так-
же аускультативные или осциллографические полуавтоматические сфигмо-
манометры (последние получили значительное распространение в связи с
тенденцией к устранению ртути из широкого использования) [55,91,144].
Независимо от вида аппараты для оценки АД должны быть исправными;
точность измерений должна регулярно проверяться (при сопоставлении
с данными других аппаратов, обычно ртутных сфигмоманометров).
Перед измерением АД пациенту (при возможности) следует порекомен-
довать воздержаться от курения, приема пищи, тонизирующих напитков в
течение 30-60 минут.
Манжету манометра располагают плотно на плече на 3 см выше локтевого
сгиба. Нагнетание воздуха должно быть достаточно быстрым — до уровня
на 30 мм рт. ст. выше того, при котором исчезают тоны Короткова; удале-
ние воздуха из манжеты следует выполнять со скоростью не более 3-5 мм
рт. ст. в секунду [42,96,144,170].
В табл. 4.1 представлены рекомендуемые международными экспертами
правила измерения АД «в кабинете врача» (так называемого офисного АД).
Таблица 4.1. Измерение АД «в кабинете врача»
(адаптировано из ESH/ESC, 2013; NICE, 2011) [136,170а]
Правила измерения АД «в кабинете врача»
• Обеспечить пациенту возможность посидеть в течение 3-5 минут в спокойной обста-
новке перед измерением АД. Ноги пациента должны быть расположены не на весу.
• В положении сидя нужно выполнить не менее 2 измерений АД с перерывом
1-2 минуты. Если полученные значения сильно различаются (>10 мм рт. ст.), не-
обходимо измерить АД в 3-й раз. Учитывать следует среднюю величину из прове-
денных измерений.
• У лиц с аритмией (например, с ФП) для повышения точности оценки АД нужно
измерить несколько раз.
• Обычно следует использовать стандартного размера манжету для нагнетания
воздуха (12-13 см шириной и 35 см длиной). Однако при измерении АД у лиц с
большей (>32 см) или меньшей, чем обычно, окружностью плеча, нужно приме-
нять манжеты большей или меньшей длины, соответственно.
• Независимо от положения тела пациента манометр необходимо расположить
на уровне сердца.
• При использовании аускультативного метода измерения, для оценки САД и ДАД
используют I (первое появление ясного постукивающего звука) и V (исчезновение
постукивающего звука) тоны Короткова, соответственно.
• При первом визите больного АД нужно измерять на обеих руках. Учитывать сле-
дует более высокую из полученных величин.
• Если разница уровней АД на двух руках >20 мм рт. ст., то нужно измерить АД на
двух руках еще раз. При сохранении разницы >20 мм рт. ст. в ходе повторного
измерения следующие измерения нужно выполнять на той руке, где уровни АД
были более высокими/
• У пожилых лиц, у больных СД, а также при других ситуациях, когда можно пред-
положить наличие ортостатической гипотензии, следует измерить АД через 1 и
3 минуты после вставания (с соблюдением осторожности!). Показано, что наличие
ортостатической гипотензии (определяемой как снижение САД на >20 мм рт. ст.
или ДАД на >10 мм рт. ст. через 3 минуты после вставания) является самостоя-
тельным фактором СС-риска.
• Для измерения АД не рекомендуется использовать устройства с расположением
манжеты на запястье.
• После 2-го измерения АД в течение 30 секунд следует оценить ЧСС с помощью
пальпации.
Примечания. NICE (National Institute for Health and Care Excellence) — Национальный институт здоровья и
клинического совершенствования Великобритании. ФП — фибрилляция предсердий.
* Рекомендации экспертов NICE, 2011 г. [170а].
Диагностика артериальной гипертензии
Уровни АД характеризуются спонтанной вариабельностью в течение
суток, а также в течение более протяженных отрезков времени (недели-
месяцы).
Диагноз АГ обычно должен базироваться на данных неоднократных
измерений АД, выполненных при различных обстоятельствах.
Стандартно констатацию АГ предусматривают по данным не менее чем
2-3 визитов к врачу (во время каждого из визитов АД должно быть
повышено в течение не менее чем 2 измерений) [46,123,136,144].
Если при первом визите к врачу АД лишь умеренно повышено, то по-
вторную оценку АД следует выполнять через относительно более длитель-
ный период — через несколько месяцев (если уровень АД соответствует
1-й степени АГ (см. табл. 1.1) и нет ПОМ) [84,136].
Если при первом визите уровень АД повышен более значительно
(соответствует 2-й степени АГ — см. табл. 1.1), либо имеются возможно
связанные с АГ ПОМ, либо уровень дополнительного СС-риска высокий,
то повторная оценка АД должна быть сделана через относительно более
короткий интервал времени (недели-дни).
Если уровень АД при первом визите соответствует 3-й степени АГ
(см. табл. 1.1), имеется отчетливая симптоматика АГ и уровень дополни-
тельного СС-риска высокий, то диагноз АГ может базироваться на данных,
полученных при единственном визите к врачу [42,109,136,220].
Рекомендуется не только контроль АД врачом/медсестрой в условиях ста-
ционара/амбулаторно, но и самостоятельный его контроль дома (больным
или родственниками), а также выполнение амбулаторного мониторирова-
ния АД (АМАД)) [46,98,123,137,144].
В рекомендациях ESH/ESC (2013) указывается [136]:
• диагноз АГ рекомендуется устанавливать с учетом данных по меньшей
мере 2 визитов к врачу при не менее чем двукратном измерении АД
на каждом из этих визитов (I/B);
• оценка АД вне кабинета врача (с использованием АМАД или монитори-
рования АД дома (МАДД)) выполняется для подтверждения диагноза АГ,
идентификации ее типа, выявления эпизодов гипотензии и повышения
качества оценки СС-риска (Иа/В);
• выбор между АМАД и МАДД основывается на особенностях показаний, до-
ступности, простоте, стоимости и, возможно, предпочтениях пациента (ПЬ/С).
Контроль артериального давления
вне кабинета врача
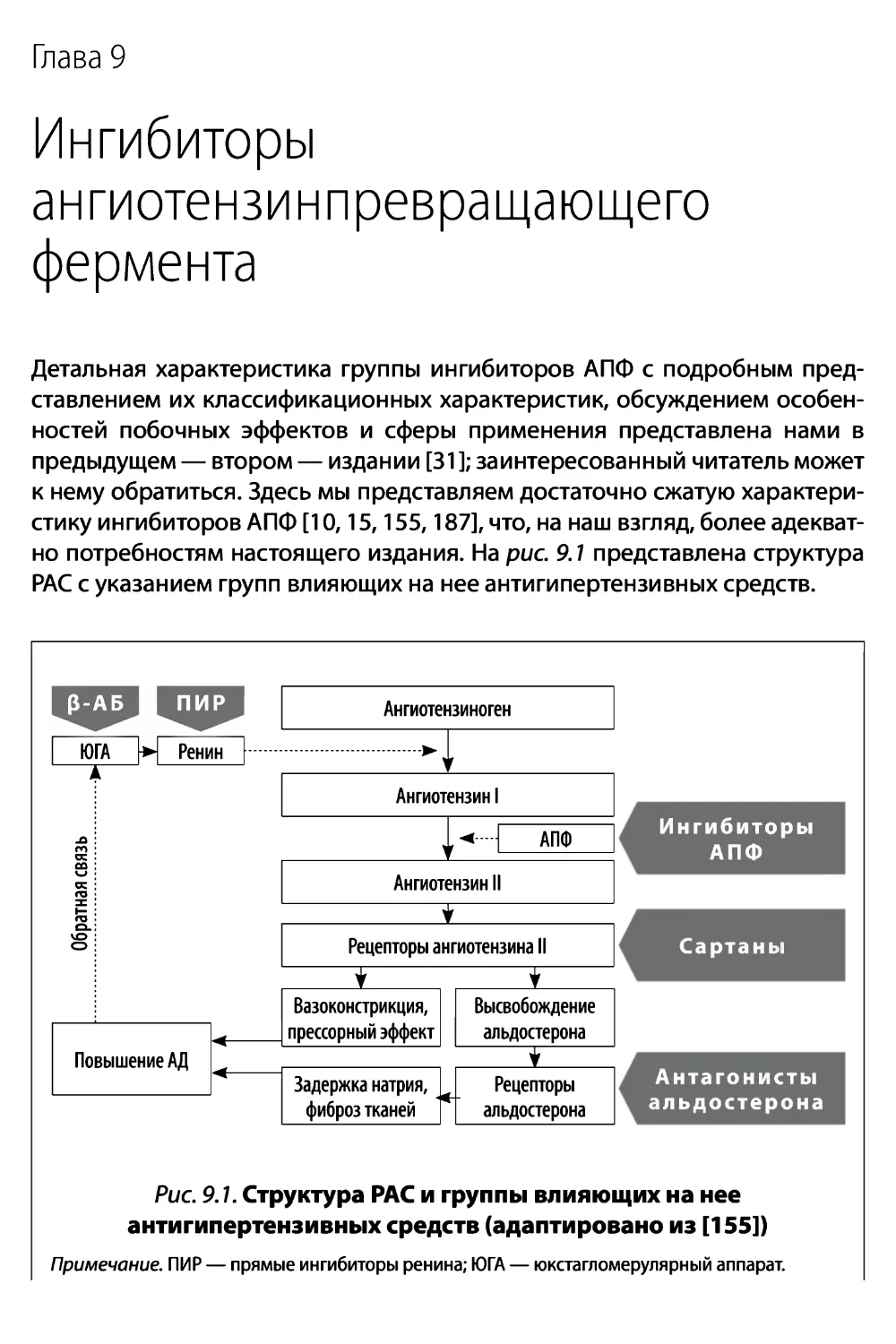
Этим подходам к оценке АД отводят важнейшее место как в диагностике
[табл. 4.2,4.3), так и в лечении АГ. Данные, полученные при использова-
нии таких методов оценки, более точно отражают истинные уровни АД по
сравнению с измерением АД в кабинете врача [58,115,170а].
Таблица 4.2. Определение АГ по данным измерения АД в кабинете
и вне кабинета врача (ESH/ESC, 2013) [136]
Категория
АД в кабинете врача
АМАД
Среднедневное (или в период бодрствования)
Средненочное (или в период сна)
Среднесуточное
МАДД
САД,
мм рт. ст.
>140
>135
>120
>130
>135
и/или
и/или
и/или
и/или
и/или
ДАД,
мм рт. ст.
>90
>85
>70
>80
>85
Таблица 4.3. Диагностика АГ (адаптировано из NICE, 2011) [170а]
Эксперты Великобритании (NICE, 2011) рекомендуют выполнение АМАД, а при не-
возможности его проведения — МАДД для подтверждения диагноза АГ у тех лиц,
уровни АД в кабинете врача у которых составляют 140-179/90-109 мм рт. ст.*
• Если АД при измерении в кабинете врача составило > 140/90 мм рт. ст., то следует вы-
полнить измерение АД еще раз в ходе этой же консультации, а при значительных раз-
личиях между этими двумя измерениями — в 3-й раз измерить АД. Записать меньшее
из измеренных значений как уровень АД в кабинете врача.
• Если АД в кабинете врача > 140/90 мм рт. ст., то для подтверждения диагноза АГ ре-
комендуется выполнить АМАД. Если выполнение АМАД невозможно, то для под-
тверждения диагноза АГ рекомендуется проведение МАДД.
• Если АД в кабинете врача >180/110 мм рт. ст., то антигипертензивная терапия должна
быть начата немедленно, не дожидаясь результатов АМАД или МАДД.
• В период, пока проводят АМАД или МАДД, следует выполнить дополнительные иссле-
дования для выявления ПОМ (гипертрофии ЛЖ, ХЗП, гипертензивной ретинопатии), а
также оценить степень СС-риска (см. гл. 1).
• Если наличие АГ не подтверждено, но имеются данные о ПОМ (например, гипертро-
фия ЛЖ, протеинурия), то рекомендуется проведение дополнительных исследований
для выявления альтернативных причин развития этих поражений.
• Если наличие АГ не подтверждено, то в последующем у этого человека следует регу-
лярно контролировать АД в кабинете врача/*
Примечания. * Эта и перечисленные ниже — рекомендации для Великобритании [170а]. Европейские
эксперты [136] в 2013 году, исходя из экономических соображений, не сочли возможным поддержать
столь императивную рекомендацию. Все же, АМАД в этих случаях, при возможности, должно выполняться.
** В отечественной клинической практике двукратное измерение АД является обязательным при каждом
визите к врачу (Приказ МЗ Украины №384,2012) [46].
В дополнение к рекомендациям в табл. 4.1, приводим указания между-
народных экспертов по АМАД и МАДД [60,90,98,136,170а]:
• принципы проведения АМАД и МАДД должны быть адекватно разъяснены
больному как устно, так и письменно. Выполнение самоконтроля АД требует
соответствующей тренировки (обучения) больного под наблюдением меди-
цинского персонала;
• АМАД и МАДД обеспечивают получение взаимодополняющей информации
об особенностях АД и о степени риска пациента;
• уровни АД, полученные при измерении в кабинете врача, обычно выше, чем
полученные при АМАД или МАДД; эта разница увеличивается с увеличением
значений «офисного» АД;
• аппараты для АМАД и МАДД должны быть исправны и адекватно прове-
рены (калибровка не реже 1 раза в 3 месяца).
В табл. 4.4 представлены преимущества АМАД и МАДД и показания к их
проведению.
Таблица 4.4. Преимущества АМАД и МАДД
(адаптировано из ESH/ESC, 2013; NICE, 2011) [136,170а]
АМАД
МАДД
Пригодны для диагностики АГ в целом, АГ «белого халата», маскированной АГ, АГ при
беременности, резистентной АГ, псевдорезистентной АГ, эпизодов гипотензии
Позволяют более точно оценивать антигипертензивный эффект лекарственных
средств, применяемых при лечении АГ
Результаты имеют высокую прогностическую значимость
• Обеспечивает получение данных об
уровне АД в ходе повседневной актив-
ности без влияния на эмоциональный
статус пациента
• Метод выбора для контроля уровней
АД у лиц с чрезмерной тревожностью
и фобиями
• Позволяет оценить ночное АД и соот-
ношение ночного/дневного АД
• Обеспечивает многократное
АД в течение нескольких дней,
риабельности АД день ото дня
• Дешевизна
• Доступность
• Возможность легко повторить
измерение
оценку ва-
Амбулаторное мониторирование
артериального давления
В табл. 4.5 представлены некоторые важные для практикующего врача
принципы проведения и оценки результатов АМАД.
Таблица 4.5. Принципы проведения АМАД
(адаптировано из ESH/ESC, 2013; NICE, 2011) [136,170а]
Принципы проведения АМАД
АМАД — один из важнейших методов исследования у лиц, у которых предполагается
наличие АГ (для ее диагностики), а также у тех, диагноз АГ у которых установлен (для
оценки особенностей АГ и лечебной тактики).
АМАД позволяет избежать возможных неточностей измерения, связанных с наруше-
нием его методики, неисправностью аппарата, волнением пациента; считается более
воспроизводимым, чем эпизодическое измерение; менее подвержено влиянию «эф-
фекта белого халата».
АМАД выполняют с использованием портативных устройств. Манжету обычно накла-
дывают на плечо недоминирующей руки. Длительность АМАД составляет 24-25 часа
(охватывает периоды бодрствования и сна).
Исходный уровень АД, измеренный устройством АМАД, не должен отличаться от того,
который ранее был измерен обычным манометром, более чем на 5 мм рт. ст. В против-
ном случае манжета АМАД должна быть снята и надета вновь.
Больного инструктируют придерживаться обычного для него режима активности, но
воздерживаться от чрезмерных нагрузок. В период нагнетания воздуха в манжету ре-
комендуют воздерживаться от движений и разговора, удерживать плечо по возмож-
ности неподвижным и на уровне сердца.
В ходе АМАД больному следует вести дневник, в котором он должен отражать время
приема лекарственных средств, пищи, пробуждения и засыпания, а также отмечать
любые симптомы, которые могут быть связаны с изменением АД.
При АМАД измерения АД обычно проводят каждые 15 минут днем и каждые 30 минут
ночью (возможны иные варианты, например, каждые 20 минут независимо от време-
ни суток). Значительных перерывов в измерениях следует избегать. При компьютер-
ном анализе не менее 70% всех измерений должны быть адекватного качества.
При интерпретации результатов АМАД в первую очередь следует учитывать данные
среднесуточного, среднедневного и средненочного АД. Меньшее значение имеют
данные измерений АД за более короткие периоды времени, а также более сложные
показатели (соотношения, индексы).
Важной является оценка соотношения средненочного/среднедневного АД. В норме
АД ночью снижается; лиц, имеющих такое снижение {dipping), обозначают как dippers
(с уровнями этого соотношения в пределах 0,8-0,9). Те, кто не показывает физиоло-
гического снижения АД ночью (при соотношении >1 или, в меньшей степени, 0,9-1),
демонстрируют более высокую частоту СС-осложнений по сравнению с имеющими
адекватное ночное снижение АД. Некоторые авторы также выделяют категорию лиц
с чрезмерным ночным снижением АД (соотношение <0,8), однако прогностическая
значимость этого феномена нуждается в уточнении.
Мониторирование
артериального давления дома
Подходы к выполнению МАДД в настоящее время вполне стандартизи-
рованы (табл. 4.6). С учетом важности данных МАДД для диагностики АГ,
оценки ее особенностей и их прогностической значимости, этот метод
оценки АД, несомненно, заслуживает более широкого применения в оте-
чественной клинической практике [46,123].
Таблица 4.6. Принципы проведения МАДД
(адаптировано из ESH/ESC, 2013; NICE, 2011) [136,170а]
Принципы проведения МАДД
• Данные, получаемые при МАДД, имеют большое значение для диагностики АГ
(см. табл. 4.2), оценки ее особенностей и прогноза. Так, результаты МАДД лучше корре-
лируют с ПОМ, а также СС-прогнозом, чем уровни АД, полученные при измерении в ка-
бинете врача. Представлены данные о том, что при корректном выполнении МАДД его
результаты имеют столь же высокую прогностическую значимость, что и данные АМАД.
• Не рекомендуется использование устройств для измерения АД, надеваемых на запя-
стье (они могут применяться только у очень тучных лиц с чрезмерно большой окруж-
ностью плеча).
• АД следует измерять ежедневно в течение не менее 3-4 последовательных дней (же-
лательно в течение 7 последовательных дней) утром и вечером. АД измеряют в тихой
комнате через 5 минут отдыха в положении больного сидя (спина и плечо, на котором
измеряют АД, должны иметь опору).
• Выполняют 2 измерения АД с перерывом 1 -2 минуты.
• Результаты следует записать по стандартной форме сразу же после измерения.
• Результат МАДД представляет собой усредненные данные всех измерений, за исклю-
чением показаний, полученных в 1-й день.
• Интерпретировать результаты МАДД должен врач.
• Большинство пациентов с АГ (при отсутствии когнитивных нарушений и физических
ограничений) должны быть обучены методике самоконтроля АД.
• Самоконтроль АД может быть не показан у лиц с чрезмерной тревожностью и фоби-
ями (где более предпочтительно АМАД), при очень большой окружности плеча, зна-
чимой нерегулярности пульса (например, при ФП), очень выраженном повышении
жесткости стенки сосудов (все имеющиеся для измерения АД портативные полуав-
томатические аппараты используют осциллометрический метод, который может об-
условливать искажение результатов у таких больных).
МАДД (обычно в виде самоконтроля, возможно — с помощью родствен-
ников) рассматривают в качестве необходимого компонента современной
тактики ведения больного с АГ. Данные МАДД менее подвержены искаже-
ниям, связанным с «эффектом белого халата», чем те, которые получены
при измерении АД в кабинете врача. Измерение АД дома демонстрирует
высокую точность в определении нормальных и повышенных уровней АД.
Данные МАДД хорошо коррелируют со среднедневными уровнями, реги-
стрируемыми при АМАД [114,115,170а].
Контроль АД в домашних условиях повышает дисциплинированность
больного и его приверженность к лечению [144].
Уровни МАДД обычно меньше тех, которые регистрируют в кабинете вра-
ча. Различия между уровнями АД, измеренными дома и в кабинете врача,
увеличиваются с возрастом, с повышением величины САД; они выше у
мужчин и у лиц, не получающих антигипертензивного лечения [123].
Антигипертензивная терапия обычно вызывает более значительное сни-
жение уровней АД, измеренного в кабинете врача, чем тех уровней, кото-
рые измерены дома (причины этого недостаточно ясны) [84,193].
Артериальная гипертензия «белого халата»
(АГ «в кабинете врача», «офисная» АГ)
АГ «белого халата» диагностируют, если АД, измеренное в кабинете врача,
составляет >140/90 мм рт. ст. не менее чем в 3 случаях при нормальных
значениях МАДД и АМАД. АГ «белого халата» более часто развивается у
лиц пожилого возраста и женщин [136,155, 222].
По эпидемиологическим данным, частота АГ «белого халата» в общей попу-
ляции может составлять 9-16%. Эффект «белого халата» (со значительным
увеличением уровней АД в кабинете врача по сравнению с теми, что выяв-
ляют при АМАД/МАДД) присутствует примерно у 1/3 лиц с АГ (более чем у
50% при 1-й степени АГ, у 10% —при 3-й степени АГ) [136,144].
Считают, что СС-риск у пациентов с АГ «белого халата» ниже, чем у больных
с персистирующей АГ (то есть с уровнями АД, которые превышают нор-
мальные и при МАДД, и при АМАД), но, вероятно, выше, чем у нормотен-
зивныхлиц [144,155].
Маскированная артериальная гипертензия
Под этим термином подразумевают ситуацию, когда уровни АД, по данным
АМАД/МАДД, повышены, а его значения, полученные при измерении в
кабинете врача, не превышают нормальных. Распространенность маски-
рованной АГ в популяции может достигать 10-17%. Факторами, ассоции-
рованными с этим состоянием, считают: молодой возраст, мужской пол,
курение, употребление алкоголя, АГ, связанную с физической нагрузкой,
тревожность, эмоциональные стрессы, ожирение, СД. Маскированная АГ
нередко сочетается с бессимптомным ПОМ (у больных СД с повышенным
риском развития диабетической нефропатии) [136,144,222].
Глава 5
Обследование больных
артериальной гипертензией
Обследование больных АГ, включая сбор анамнеза (табл. 5.1), объективное
исследование (табл. 5.2), лабораторные и инструментальные исследования
(табл. 5.3), должно быть направлено на поиск [46,123,136,137]:
• провоцирующих АГ факторов;
. ПОМ;
• данных о наличии симптоматических АГ;
• клинических проявлений СС-осложнений (хронической СН, сосудисто-моз-
говых и периферических сосудистых осложнений, др.);
• СЗ и сопутствующих состояний (СД, ФП, нарушений когнитивной функ-
ции, частых падений, шаткости при ходьбе, др.), которые могут повлиять
на выбор лечебной тактики [42, 91,109,189].
Подходы к измерению АД и выполнению его мониторирования (в том чис-
ле АМАД и МАДД) представлены в гл. 4 [56,58,63,98,170а].
С учетом важного места, которое при обследовании больных АГ отводят
ЭхоКГ-исследованию, в табл. 5.4 представлены пограничные значения
некоторых параметров, используемых для оценки ремоделирования ЛЖ
сердца, его диастолической и систолической функции у лиц с АГ. Обраща-
ем внимание читателя на примечания к этой таблице, а также к табл. 1.5
(см. гл. 1), которые могут быть полезны в практическом отношении [46, 95,
107,136,154,192].
В табл. 5.5 и 5.6 представлены основные принципы обследования при по-
дозрении на наличие различных вариантов симптоматических АГ (более
детально — гл. 15-20) [90,96,114,136, 221].
Таблица 5.1. Особенности сбора анамнеза у больных АГ
(адаптировано из ESH/ESC, 2013) [136]
Определение периода времени, в течение которого больному известно
о повышении АД (в том числе по данным самостоятельного измерения)
Поиск возможных причин симптоматических АГ:
• Семейный анамнез ХЗП (например, поликистоз почек).
• Данные анамнеза о наличии ХЗП (в том числе эпизоды дизурии, макрогематурии),
о злоупотреблении аналгетиками, НПВП.
• Прием лекарственных препаратов, которые могут способствовать повышению АД
(пероральные контрацептивы, вазоконстрикторные капли в нос, глюко- и минерало-
кортикоиды, НПВП, эритропоэтин, циклоспорин).
• Прием амфетаминов, кофеина, лакрицы (солодка).
• Эпизоды потливости, головной боли, тревоги, сердцебиения (феохромоцитома).
• Эпизоды мышечной слабости и судорог (гиперальдостеронизм).
• Симптомы, предполагающие наличие нарушения функции щитовидной железы.
Оценка факторов СС-риска:
• Наличие в индивидуальном или семейном анамнезе АГ, ССЗ, дислипидемии, СД (поли-
урия, уровни глюкозы, антигипергликемические препараты).
• Курение.
• Диетические привычки (поваренная соль, жидкость).
• Масса тела, ее недавняя динамика. Ожирение.
• Объем физических нагрузок.
• Храп, нарушения дыхания во сне (в том числе со слов партнера).
• Низкая масса тела при рождении.
• Для женщин — перенесенная преэклампсия при беременности.
Данные о ПОМ и ССЗ:
• Головной мозг и глаза: головная боль, головокружение, нарушения зрения, двига-
тельные нарушения, нарушения чувствительности, перенесенные ТИА/инсульт, проце-
дуры каротидной реваскуляризации.
• Сердце:боль в грудной клетке, одышка, отеки, синкопе, сердцебиение, нарушения рит-
ма (особенно ФП), перенесенный ИМ, процедуры коронарной реваскуляризации.
• Почки: жажда, полиурия, никтурия, макрогематурия.
• Периферические артерии: похолодание конечностей, перемежающаяся хромота, дис-
танция безболевой ходьбы, перенесенные процедуры периферической реваскуляризации
• Храп, хронические заболевания легких, апноэ во сне.
• Когнитивная дисфункция.
Данные о лечении АГ:
• Антигипертензивные препараты в настоящее время.
• Антигипертензивные препараты в прошлом.
• Данные о приверженности и неприверженности к лечению.
« Эффективность и побочные эффекты препаратов.
Примечание. НПВП — нестероидный противовоспалительный препарат.
Таблица 5.2. Особенности объективного исследования больных АГ
(адаптировано из ESH/ESC, 2013) [136]
Поиск симптоматических АГ:
• Выявление при осмотре особенностей, типичных для синдрома Кушинга
• Кожные признаки нейрофиброматоза (феохромоцитома)
• Пальпация увеличенных почек (поликистоз)
• При аускультации живота — шумы над проекцией почечных артерий (реноваскулярная АГ)
• При аускультации сердца и проекций крупных сосудов — шумы, характерные для коаркта-
ции аорты, иных поражений аорты (расслоение, аневризма) и артерий верхних конечностей
• Ослабление пульса и снижение давления на бедренных артериях по сравнению с та-
ковым на плечевых артериях (коарктация аорты, иные поражения аорты (расслоение,
аневризмы), поражения артерий нижних конечностей)
• Значительная разница в уровнях АД, измеренного на правой и левой плечевых артериях —
>20 мм рт. ст. САД и/или >10 мм рт. ст. ДАД (коарктация аорты, стеноз подключичной артерии)
Поиск ПОМ:
• Головной мозг: нарушения движения, нарушения чув-
ствительности
• Сетчатка: нарушения на глазном дне
• Сердце: ЧСС, верхушечный толчок, границы относитель-
ной сердечной тупости, III и IV тоны сердца, шумы, нару-
шения ритма, хрипы в легких, периферические отеки
• Периферические артерии: отсутствие, снижение или
асимметрия пульса, холодные конечности, ишемические
изменения кожи
• Сонные артерии: систолический шум
Оценка наличия
ожирения:
• Рост и масса тела
• Подсчет ИМТ:
вес/рост2 (кг/м2)
• Окружность талии:
измеряют в положении
стоя на уровне посредине
между нижним краем
реберной дуги и гребнем
подвздошной кости
Таблица 5.3. Лабораторные и инструментальные исследования при АГ
(адаптировано из ESH/ESC, 2013) [136]
Рутинные исследования:
• Общий анализ крови
• Глюкоза плазмы натощак
• Общий ХС, ХС ЛПНП, ХС ЛПВП, ТГ
• Натрий и калий сыворотки
• Мочевая кислота сыворотки
• Креатинин сыворотки, СКФ
• Анализ мочи,
тест на микроальбуминурию
• ЭКГ в 12 отведениях
Исследования, которые проводят
в условиях специализированной помощи:
• Дальнейший поиск мозговых, сердеч-
ных, почечных и сосудистых поражений
(при резистентной и осложненной АГ)
• Поиск причин симптоматических АГ, кото-
рые предполагают по данным анамнеза,
объективного исследования и ранее про-
веденных обследований (см. гл. 15-20)
Дополнительные исследования
(с учетом данных анамнеза,
объективного исследования
и результатов рутинных исследований):
• НЬА1с (если глюкоза плазмы
>5,6 ммоль/л и у лиц с СД)
• Натрий и калий мочи
• АМАД и МАДД
• ЭхоКГ
• Холтеровское мониторирование ЭКГ
• Нагрузочные тесты для выявления
коронарной ишемии
• УЗИ сонных артерий
• УЗИ периферических артерий, органов
брюшной полости
• Оценка СРПВ
• Определение ЛПИ
• Осмотр глазного дна
Таблица 5.4. Пограничные значения некоторых ЭхоКГ и тканевых
допплерографических показателей, используемых
для оценки ремоделирования ЛЖ сердца,
его диастолической и систолической функций у лиц с АГ
(адаптировано из ESH/ESC, 2013) [136]
Показатель
Индекс ММЛЖ (г/м2), формула подсчета — см. прим. к табл. 1.5
Относительная толщина стенки ЛЖ*
Параметры диастолической функции ЛЖ:
• Септальная скорость е'(см/с) **
• Латеральная скорость е'(см/с)
• Размер левого предсердия (мм)***
• Индекс объема левого предсердия (мл/м2)***
Давление наполнения ЛЖ: отношение Е/е'****
Фракция изгнания ЛЖ (%)
Конечно-диастолический размер ЛЖ (мм)
Конечно-систолический размер ЛЖ (мм)
Патологи-
ческий
уровень
>95 (Ж)
>115(М)
>0,42
<8
<10
>40
>34
>13
<45
>60
>45
Примечания.
* Формула подсчета относительной толщины стенки ЛЖ:
ОТС Л Ж = (ТМЖПд + ТЗСЛЖд) / КДР Л Ж, где ТМЖПд — толщина межжелудочковой перегородки в ди-
астолу, ТЗСЛЖд — толщина задней стенки ЛЖ в диастолу, КДР — конечно-диастолический размер.
Варианты ремоделирования ЛЖ с учетом индекса ММЛЖ и ОТСЛЖ:
1) нормальная геометрия ЛЖ (индекс ММЛЖ — норма, ОТСЛЖ <0,42);
2) концентрическое ремоделирование ЛЖ (индекс ММЛЖ — норма, ОТСЛЖ >0,42);
3) эксцентрическая гипертрофия ЛЖ (индекс ММЛЖ повышен, ОТСЛЖ <0,42);
4) концентрическая гипертрофия ЛЖ (индекс ММЛЖ повышен, ОТСЛЖ >0,42).
** Для оценки диастолической функции ЛЖ в настоящее время широкое применение получила им-
пульсно-волновая тканевая допплерография (которая позволяет оценивать скорость движения тка-
невых структур сердца, при этом высокоскоростные сигналы частиц крови отсеиваются специальны-
ми фильтрами).
Пик е'— скорость раннего движения фиброзного кольца митрального клапана в диастолу (оценива-
ют раздельно для его септального и латерального сегментов).
*** При отсутствии дилатации левого предсердия наличие нарушений диастолической функции ЛЖ
всегда вызывает сомнения.
Объем левого предсердия оценивают по формуле:
Олп = (Рлп1 + Рлп2 + РлпЗ) х 0,523, где Олп — объем левого предсердия, Рлп1, Рлп2 и РлпЗ — со-
ответственно размеры левого предсердия: передне-задний (позиция по длинной оси) и два орто-
гональных (четырехкамерная позиция) — поперечный и продольный. Индексация — на площадь
поверхности тела.
**** Е — скорость раннего трансмитрального потока (традиционная импульсно-волновая допплерография)
Таблица 5.5. Подходы к диагностике относительно частых вариантов симптоматической АГ
(адаптировано из [136,155])
Вариант
симптомати-
ческой АГ
ХЗП
(см. гл. 15)
Стеноз
почечных
артерий
(см. гл. 16)
Первичный
альдостеро-
низм
(см. гл. 19)
Клинико-лабораторные и инструментальные данные
Анамнез
Эпизоды инфекции и/или
обструкции мочевой сис-
темы, макрогематурия,
злоупотребление анал-
гетиками, поликистоз
в семейном анамнезе
Фибромышечная диспла-
зия: начало АГ в молодом
возрасте (чаще у женщин)
Атеросклеротический
стеноз: резкое начало или
ухудшение течения АГ,
сложность контроля АГ,
молниеносные отеки
легких
Мышечная слабость; в се-
мейном анамнезе — ран-
нее начало АГ и церебро-
васкулярные осложнения
в возрасте <40 лет
Объектив-
ные данные
Образования
при пальпа-
ции живота
(при поликис-
тозе почек)
Шум над про-
екцией почеч-
ных артерий
Аритмии (при
тяжелой гипо-
калиемии)
Лабораторные/
инструментальные
исследования
Протеинурия, эритроцит-
урия, лейкоцитурия, сни-
жение СКФ
Разница в размерах по-
чек при УЗИ >1,5 см, бы-
строе снижение функции
почек (спонтанное или на
фоне применения препа-
ратов, блокирующих РАС)
Гипокалиемия (спон-
танная или индуциро-
ванная применением
диуретиков); случайное
выявление образований
надпочечников(инци-
денталома)
Дополнительные исследования
Первой
линии
УЗИ почек
Дуплексная
допплерогра-
фия почечных
артерий
Оценка альдо-
стерон-рени-
нового соот-
ношения
Исследования
для уточнения
диагноза
Детальное обследование
для уточнения особенно-
стей почечного пораже-
ния (при гломерулонеф-
рите — биопсия почки)
Магнитно-резонансная
ангиография,спиральная
компьютерная томогра-
фия (КТ), ангиография
Подтверждающие тесты
(пероральная нагрузка
натрием, инфузия физио-
логического раствора,
каптоприловый или
флудрокортизоновый
тесты); КТ
Таблица 5.6. Подходы к диагностике более редких вариантов симптоматической АГ
(адаптировано из [136,155])
Вариант
симптомати-
ческой АГ
Феохромоци-
тома
(см. гл. 18)
Синдром/
болезнь
Куш и н га
(см. гл. 20)
Клинико-лабораторные и инструментальные данные
Анамнез
Пароксизмальная АГ или
ГК на фоне стабильной
АГ; головная боль, пот-
ливость, сердцебиение,
феохромоцитома в се-
мейном анамнезе
Быстрое увеличение мас-
сы тела, полиурия, поли-
дипсия, нарушения памя-
ти, внимания, депрессия,
эйфория, психозы
Объектив-
ные данные
Кожные
проявления
нейрофибро-
матоза(пятна
«кофе с моло-
ком»*, нейро-
фибромы**)
Типичный
внешний вид:
центральное
ожирение,
лунообразное
лицо, «буйво-
линый горб»,
красные стрии,
гирсутизм
Лабораторные/
инструментальные
исследования
Случайное выявление
образований в надпочеч-
никах или вне их
Гипергликемия
Дополнительные исследования
Первой
линии
Оценка уров-
ней метанеф-
ринов в плаз-
ме и суточной
моче
Экскреция
кортизола
с мочой
за 24 час
Исследования
для уточнения
диагноза
КТ или магнитно-резо-
нансная томография
(МРТ) живота и таза;
сканирование с мета-
иодобензилгуанидином,
меченным I135; генетиче-
ский скрининг
Подавляющие тесты
с дексаметазоном
(1 мгна ночь)
Примечания.
* Светло-коричневого цвета пигментированные «родимые» пятна. Наличие >6 подобных пятен размером >5 мм до пубертатного периода или >15 мм
после этого периода считают одним из диагностических критериев нейрофиброматоза I типа (также нужны и другие признаки).
** Образования тканевой плотности, разные по размеру, плотно прикрепленные к коже или располагающиеся на ножке, нередко впервые появляющие-
ся в пубертатном периоде; в последующем их количество может увеличиваться.
Глава 6
Общие вопросы лечебной тактики
при артериальной гипертензии.
Целевые уровни артериального давления.
Изменения образа жизни.
Целевые уровни гликозилированного
гемоглобина, холестерина липопротеидов
низкой плотности.
Статины и ацетилсалициловая кислота
при артериальной гипертензии
Благоприятные эффекты контроля АД в пределах целевых уровней у лиц с АГ
продемонстрированы в ряде крупнейших РКИ и метаанализов.Так, показано
уменьшение СС-смертности и частоты СС-осложнений, менее выраженным
был эффект на общую смертность [70,123,136,137,155]. Также отмечено от-
четливое уменьшение риска развития хронической СН. Снижение риска ин-
сультов на фоне антигипертензивной терапии более выражено, чем уменьше-
ние риска коронарных осложнений [98,123,202]. Например, уменьшение ДАД
всего на 5-6 мм рт. ст. приводит к снижению риска развития инсульта в тече-
ние 5 лет приблизительно на 40%, а ИБС — примерно на 15% [16,91,137,148].
Чем более выражена степень снижения АД (в пределах целевых уровней),
тем выше благоприятное действие на прогноз. Перечисленные благоприят-
ные эффекты показаны также у лиц пожилого возраста, в том числе у имею-
щих ИСАГ [144]. Благоприятные эффекты отмечены у больных разных этни-
ческих групп (в белокожих, чернокожих, азиатских популяциях, др.) [56,63].
Цели лечения артериальной гипертензии
Основная цель лечения АГ — это снижение СС-риска, уменьшение риска
развития хронической СН и хронической почечной недостаточности (ХПН)
[46, 70, 123, 136, 137]. Благоприятные эффекты лечения должны быть со-
отнесены с риском, сопряженным с возможными осложнениями лечения
[29, 66, 92]. Следует принять во внимание, что пожилые пациенты по срав-
нению с лицами среднего возраста имеют более высокую вероятность раз-
вития побочных эффектов лекарственных препаратов, нежелательных вза-
имодействий лекарственных средств; у них чаще имеет место применение
многокомпонентных лечебных программ (при этом следует стремиться
избежать полипрагмазии) [144]. В лечебной тактике важно предусмотреть
меры, направленные на коррекцию выявленных у больного потенциально
корригируемых факторов СС-риска, включая курение, дислипидемию, аб-
доминальное ожирение, СД [36,67,108, 202].
До недавнего времени вопрос о необходимости применения антигипертен-
зивных препаратов у больных АГ в возрасте 80 лет и старше был предметом
дискуссий, однако сейчас есть вполне определенные доказательства того, что
антигипертензивное лечение и у этой категории пожилых лиц сопровождает-
ся благоприятными изменениями СС-прогноза [34,66,88,103,123,144,155].
Целевые уровни АД, рекомендуемые экспертами Европы и США в ходе анти-
гипертензивной терапии у различных категорий больных, представлены в
табл. 6.1 и 6.2. Для категории пожилых больных АГ важно иметь в виду, что
у них уровни АД обычно более значимо варьируют; что они более склонны
к развитию эпизодов гипотензии (в том числе ортостатической, постураль-
ной, гипотензии). Выбор целевого уровня АД для конкретного больного дол-
жен быть индивидуальным [40,42,96].
Таблица 6.1. Целевые уровни АД для больных АГ различных категорий
[46,123,136,162,170а]
Категория
Неосложненная АГ
АГ в сочетании с ИБС (в том числе у постинфарктных)
АГ после инсульта
АГ в сочетании с поражениями периферических артерий
АГ в сочетании с ХЗП (при протеинурии <0,15 г/л)+
АГ в сочетании с ХЗП (при протеинурии >0,15 г/л)+
АГ в сочетании с СД 1 -го и 2-го типа
АГ у беременных**
АГ у больных в возрасте 65 лет и старше
АГ у ослабленных пожилых лиц
Целевое АД, мм рт. ст.
< 140/90
< 140/90
< 140/90
< 140/90
< 140/90
< 130/80*
< 140/85
110-129/65-79
САД 140-150
На усмотрение врача
В рекомендациях для пациента врачу следует указать значения АД, НЬА1 с
и ХС ЛПНП, которые он считает целевыми для этого конкретного пациента!
Примечания.
* При невысоких уровнях доказательной базы.
** Рекомендации экспертов США, 2013.+ Рекомендации KDIG0,2012 [162].
Таблица 6.2. Рекомендации по выбору целевого АД,
представленные экспертами JNC-8,2014 [137]
Рекомендации JNC-8 по выбору целевого АД
• В общей популяции лиц в возрасте > 60 лет фармакологическое лечение АГ следу-
ет начинать при уровнях САД >150 мм рт. ст. или ДАД >90 мм рт. ст.; целевые уров-
ни для этих больных составляют: САД <150 мм рт. ст., ДАД <90 мм рт. ст. (уровень А).
-Дополнение. В общей популяции лиц в возрасте >60 лет, в случае если фармакологи-
ческое лечение АГ привело к достижению меньших, чем указано выше, уровней САД
(например, < 140 мм рт. ст.), но хорошо переносится и не имеет побочных эффектов, то
изменение лечения не требуется (уровень Е).
• В общей популяции лиц в возрасте <60 лет фармакологическое лечение АГ следует
проводить при уровнях ДАД >90 мм рт. ст. для достижения целевого ДАД <90 мм рт. ст.
(для возраста 30-59 лет — уровень А; для возраста 18-29 лет — уровень Е).
• В общей популяции лиц в возрасте <60 лет фармакологическое лечение АГ сле-
дует проводить при уровнях САД >140 мм рт. ст. для достижения целевого САД
< 140 мм рт. ст. (уровень Е).
• Среди лиц в возрасте >18 лет с ХЗП фармакологическое лечение АГ следует начинать
при уровнях САД > 140 мм рт. ст. или ДАД >90 мм рт. ст.; целевые уровни для этих боль-
ных составляют: САД < 140 мм рт. ст., ДАД <90 мм рт. ст. (уровень Е).
• Среди лиц в возрасте >18 лет с СД фармакологическое лечение АГ следует начинать
при уровнях САД > 140 мм рт. ст. или ДАД >90 мм рт. ст.; целевые уровни для этих боль-
ных составляют: САД < 140 мм рт. ст., ДАД <90 мм рт. ст. (уровень Е).
Примечание. Уровень А — высокий уровень рекомендации, уровень Е — мнение экспертов.
Важно отметить, что те уровни АД, которые лечащий врач сочтет целевыми
для конкретного больного, следует указать в предоставляемых пациенту ре-
комендациях (наряду с указанием наименований и доз препаратов), а также
разъяснить желательность их достижения и поддержания на этом уровне
[46,61,66,109,123].
В лечении пациентов с АГ используют нефармакологические (изменения
образа жизни) и фармакологические лечебные подходы.
Изменения образа жизни
Перечисленные ниже изменения образа жизни способствуют снижению АД и
уменьшению СС-риска [46,70,136,137]:
• Снижение массы тела для пациентов с ожирением (ИМТ >30 кг/м2). По-
казано, что у таких пациентов стойкое уменьшение массы тела на 1 кг со-
провождается снижением САД на 1,5-3 мм рт. ст., ДАД — на 1-2 мм рт. ст.
[58,114].
• Регулярные физические нагрузки на воздухе: для гемодинамически
стабильного пациента — не менее 150 (а лучше — не менее 300) ми-
нут в неделю; у многих больных достаточно быстрой ходьбы в течение
30-45 минут ежедневно или не реже 5 раз в неделю). Изометрические
нагрузки (например, подъем тяжестей) способствуют повышению АД, их
желательно исключить [92,185].
• Уменьшение употребления поваренной соли. Показано, что сниже-
ние потребляемой соли до 5 г/сутки (столько ее содержится в 1/2 чай-
ной ложки) ассоциируется со снижением САД на 4-6 мм рт. ст., ДАД —
на 2-3 мм рт. ст. Снижение АД вследствие уменьшения употребления
соли более выражено у лиц пожилого возраста. В качестве достаточно
действенной меры (способствующей снижению приема соли пример-
но на 30%) может быть использована рекомендация убрать со стола
солонку [56, 90,192].
• Уменьшение употребления алкоголя. Универсально принято поня-
тие 1 дозы алкоголя (около 120 мл сухого вина, или 360 мл пива, или
30 мл крепкого спиртного). В отношении СС-риска считают достаточно
безопасным употребление <1 дозы/сутки для женщин и <2 доз/сутки
для мужчин. Вопрос о полезности употребления небольших количеств
спиртного остается недостаточно ясным. Алкоголь рекомендуют пол-
ностью исключить беременным, лицам с заболеваниями печени, с ал-
коголизмом [102,135].
• Уменьшение употребления насыщенных жиров (жиров животного
происхождения) [137].
• Увеличение употребления свежих фруктов и овощей (суммарно же-
лательно около 300 г/сутки) [102,135].
• Прекращение курения. Следует иметь в виду, что даже небольшие
количества выкуриваемых сигарет (1 -3 в сутки и даже не каждый день)
значимо увеличивают СС-риск. Существенное повышение риска отме-
чается также при «пассивном курении». Степень риска начинает сни-
жаться уже через несколько недель после отказа от курения, макси-
мум такого снижения отмечают спустя 2-3 года. Чем в более раннем
возрасте пациент бросает курить, тем больше благоприятный эффект
отказа от курения на прогноз [109].
В действующих сейчас международных рекомендациях, касающихся таких
категорий пациентов СС-профиля, как лица с хронической ИБС, также при-
ведены рекомендации, качающиеся изменений образа жизни [170]. С уче-
том частого сочетания АГ и ИБС, полагаем важным кратко привести и их.
К таким рекомендациям относят все рекомендации, перечисленные выше
для лиц с АГ, а также ряд дополнительных рекомендаций по изменению
пищевого рациона, включая [170]:
• уменьшение употребления транс-жирных кислот (образуются при пов-
торной жарке на одном и том же масле);
• снижение употребления углеводов;
• увеличение в рационе пищевых волокон;
• увеличение употребления рыбных продуктов (не менее 2 раз в неделю,
из них не менее 1 раза — жирной морской рыбы; здесь же в примечаниях
обычно указывается на то, что рыба, желательно, не должна быть вылов-
лена на прибрежном шельфе, где имеется высокий риск загрязнений);
• увеличение в рационе нежирных ферментированных молочных продуктов.
Целевые уровни гликозилированного гемоглобина
Стандартно рекомендуемым отечественными и международными экспер-
тами целевым уровнем НЬА1 с для лиц с СД как 1 -го, так и 2-го типа, является
величина менее 7% [136]. Ранее использовавшаяся цель (<6,5%) пересмо-
трена ввиду опасений (появившихся после завершения нескольких круп-
ных исследований, таких как ACCORD), что чрезмерно значительное сниже-
ние НЬА1 с может ассоциироваться с ухудшением СС-прогноза [155,222].
Для лиц с СД, имеющих хроническую ИБС, эксперты США отмечают воз-
можность поддержания даже более либерального целевого уровня НЬА1 с
[123,137]. Так, если в целом его желательный уровень оговаривается <7%
(особенно для более молодых и имеющих не очень длительный анамнез
СД), то у некоторых категорий допустимым считают уровень в пределах
7-9% (для пожилых, с наличием микро- и макрососудистых осложнений, с
тяжелыми СЗ, с эпизодами гипогликемии в анамнезе).
Рекомендуемая кратность оценки НЬА1 с у лиц с СД составляет:
• 1 раз в 6 месяцев, если НЬА1с достаточно стабильно находится в целе-
вых пределах, указанных выше;
• 1 раз в 3 месяца, если целевые уровни еще не достигнуты или проводят
изменения гипогликемической терапии [136].
Целевые для конкретного больного значения НЬА1 с, как и целевые уров-
ни АД, должны быть указаны во врачебных рекомендациях [34,185].
Целевые уровни
холестерина липопротеидов низкой плотности
В соответствии с рекомендациями отечественных и европейских экспер-
тов, целевые уровни ХС ЛПНП установлены в соответствии с имеющимся у
пациента уровнем СС-риска (см. гл. 1) и составляют [46,136]:
• для лиц с очень высоким риском — <1,8 ммоль/л;
• с высоким риском — <2,5 ммоль/л;
• для всех остальных — <3 ммоль/л.
Те уровни ХС ЛПНП, которые врач сочтет целевыми для пациента, сле-
дует указать в рекомендациях.
Для достижения целевых уровней ХС ЛПНП используют статины. Частота
контроля ХС ЛПНП обычно составляет в зависимости от уровня риска от
1 раза в год до 1 раза в 3-6 месяцев [136].
Статины и ацетилсалициловая кислота
при артериальной гипертензии
Эти лечебные подходы рассматривают как важные элементы лечебной стра-
тегии при АГ. Они необходимы для снижения степени выраженности имею-
щегося у пациента СС-риска [46,61,66,67,70,136].
В соответствии с действующими сейчас рекомендациями, статины (при
отсутствии противопоказаний) следует назначать больным с АГ, име-
ющим высокий или очень высокий уровень СС-риска [46, 61, 66, 67, 70,
136]. Наиболее значительным уровнем доказательной базы применения при
АГ среди препаратов этой группы обладает аторвастатин, который в специ-
ально спланированном крупном РКИ ASCOT-LLA при использовании в дозе
всего 10 мг/сутки у больных с АГ без сопутствующей ИБС и значимой гипер-
липидемии показал отчетливое снижение частоты СС-осложнений (инфар-
ктов, инсультов, СС-смертности). Более подробно изложение современных
подходов к применению статинов представлено в гл. 14.
Ацетилсалициловую кислоту (АСК) также используют у лиц с АГ, имею-
щих высокий и очень высокий уровни СС-риска [46, 61, 66, 67, 70, 136].
Благоприятное влияние АСК на прогноз у таких пациентов подтверждено в
серьезных РКИ. Обычной тактикой является назначение небольших дозиро-
вок препарата — 75-100 мг/сутки после еды, чаще — вечером, для дли-
тельного приема.
Назначение АСК оправдано лицам с АГ при условии, что уровень АД уже
находится в пределах целевых значений (в противном случае прием это-
го препарата может увеличить риск интракраниальных геморрагии) [46,61,
66,67,70,136]. С учетом важности этого положения, на него следует специ-
ально обратить внимание пациента, разъяснить нежелательность при-
ема АСК лицами с высокими цифрами АД, письменно отразить это во
врачебных рекомендациях [155,222].
Глава 7
Начальный выбор лечебной программы.
Изолированная систолическая
артериальная гипертензия.
Резистентная артериальная гипертензия.
Ортостатическая гипотензия.
Наблюдение за больным
артериальной гипертензией
Начальный выбор лечебной программы
Фармакологическое лечение (табл. 7.1) требуется большинству боль-
ных АГ. Основная цель этого лечения — улучшение СС-прогноза [34,216].
Показано, что применение антигипертензивных препаратов у больных АГ
в возрасте как до 80, так и >80 лет сопровождается улучшением СС-прогно-
за. Адекватное фармакологическое лечение АГ не оказывает неблагопри-
ятного действия на когнитивную функцию у пожилых больных, не повыша-
ет риск развития деменции; более того, оно, вероятно, может такой риск
снижать [42,88,108,144].
Лечение должно начинаться с малых доз, которые постепенно при необ-
ходимости можно повышать. Весьма желателен выбор препаратов с суточ-
ной продолжительностью действия [46,114].
Наиболее часто для лечения АГ применяют следующие классы антигипер-
тензивных препаратов [46,61,70,123,136,137,171]:
• ингибиторы АПФ;
• антагонисты рецепторов АН (сартаны);
• БКК (чаще — дигидропиридиновые);
• тиазидовые/тиазидоподобные диуретики;
• р-АБ.
Также в лечении АГ могут быть использованы и иные препараты: антагони-
сты минералокортикоидных рецепторов, а-АБ, симпатолитики централь-
ного действия, прямой ингибитор ренина [58,109,155,221].
Таблица 7.1. Общие вопросы фармакологического лечения
при АГ [46,123,136]
Фармакологическая терапия пациентов с АГ
Медикаментозная терапия АГ (в сочетании с немедикаментозными лечебными подхо-
дами) при устойчивом поддержании уровней АД в пределах целевых значений спо-
собствует значительному улучшению СС-прогноза (с уменьшением риска развития
смертельных и несмертельных мозговых инсультов и ИМ), а также почечного прогноза
(со снижением темпа прогрессии почечных поражений).
Лечение (немедикаментозное и медикаментозное) необходимо начинать как можно
раньше и проводить его постоянно, как правило в течение всей жизни. Понятие «курсо-
вого лечения» к антигипертензивной терапии неприменимо.
В соответствии с Рекомендациями по лечению АГ, представленными европейскими экс-
пертами (ESC/ESH, 2013) [136], изменились рекомендуемые подходы к началу лечения
АГ у некоторых категорий больных:
• Пожилым с АГ медикаментозную антигипертензивную терапию рекомендовано на-
чинать при уровнях САД > 160 мм рт. ст. (I/A). Антигипертензивные препараты могут
назначаться пожилым лицам в возрасте до 80 лет и при уровнях САД в пределах
140-159 мм рт. ст., если они хорошо переносятся (ИЬ/С).*
• До получения дополнительных данных не рекомендовано начинать антигипертензив-
ную терапию лицам с высоким нормальным АД — 130-139/85-89 мм рт. ст. (Ill/A).
Эта рекомендация в первую очередь распространяется на лиц, не имеющих сопутству-
ющих СС-поражений.
• Также пока не рекомендуют начинать антигипертензивную терапию у молодых лиц
с изолированным повышением АД на плече. За ними следует тщательно наблюдать
и изменить образ жизни (Ill/A).
• При терапии АГ наиболее часто используют 5 классов антигипертензивных препа-
ратов: диуретики, БКК, ингибиторы АПФ, сартаны, р-АБ.**
Для препаратов этих классов имеются крупные исследования, демонстрирующие их
благоприятные эффекты на прогноз. Могут также применяться и иные классы анти-
гипертензивных средств (относящиеся ко «второй линии»).
• Широкое распространение имеет комбинированная антигипертензивная терапия
(способствует повышению эффективности и безопасности лечения).
• Оправдано использование фиксированных комбинированных препаратов (улуч-
шает «приверженность» пациента).
• Предпочтение отдают антигипертензивным препаратам продленного действия (в
том числе ретардным формам).
• После назначения антигипертензивной терапии врач должен осмотреть больного
не позднее, чем через 2 недели. При недостаточном снижении АД следует увели-
чить дозу препарата, или поменять препарат, или дополнительно назначить препа-
рат иного класса. В дальнейшем пациента следует регулярно осматривать (каждые
1-2 недели) пока не будет достигнут удовлетворительный контроль АД. После
стабилизации АД осматривать больного следует каждые 3-6 месяцев (при удовлет-
ворительном самочувствии).
Примечания. * По вопросу о начале лечения АГ у пожилых также см. табл. 6.2.
** Эксперты JNC-8 (2014) [137] и ASH/ISH (2013) [123] указывают 4 ведущих класса лекарственных препа-
ратов в лечении АГ: тиазидоподобные диуретики, БКК, ингибиторы АПФ и сартаны.
Улиц с АГ в целом (и у пожилых больных, в частности) могут быть использо-
ваны любые из часто применяемых классов антигипертензивных средств.
Р-АБ не рассматривают сейчас как антигипертензивные средства выбора
для пожилых пациентов с неосложненной АГ, однако они должны быть на-
значены лицам, перенесшим ИМ (особенно в течение ближайших 1-3 лет),
а также у тех, кто имеет сопутствующую хроническую СН со сниженной
систолической функцией ЛЖ [61а, 144,170].
В табл. 7.2 представлены рекомендованные экспертами ESC/ESH (2013)
подходы к выбору антигипертензивных препаратов при наличии сопут-
ствующих состояний. Табл. 7.3 суммирует противопоказания к использова-
нию различных классов антигипертензивных препаратов [136].
Таблица 7.2. Выбор антигипертензивных препаратов
при отдельных сопутствующих состояниях
(адаптировано из ESC/ESH, 2013) [136]
Сопутствующее состояние
Препараты
Бессимптомные поражения
Гипертрофия ЛЖ
Бессимптомный атеросклероз
Микроальбуминурия
Снижение функции почек
Ингибитор АПФ, БКК, сартан
БКК, ингибитор АПФ
Ингибитор АПФ, сартан
Ингибитор АПФ, сартан
Клинически выраженные сопутствующие поражения
Инсульт в анамнезе
ИМ в анамнезе
Стенокардия
Хроническая СН
Аневризма аорты
ФП (для предупреждения эпизодов)
ФП (для контроля частоты ритма желудочков)
Явная протеинурия,
терминальная стадия ХЗП (диализ)
Поражение периферических артерий
Любой препарат, эффективно снижающий АД
(3-АБ, ингибитор АПФ, сартан
Р-АБ, БКК
Диуретик, Р-АБ, ингибитор АПФ, сартан,
антагонист альдостерона
р-АБ
Сартан, ингибитор АПФ, Р-АБ,
антагонист альдостерона
Р-АБ, недигидропиридиновый БКК
Ингибитор АПФ, сартан
Ингибитор АПФ, БКК
Прочие сопутствующие поражения
ИСАГ (у пожилых)
Метаболический синдром
сд
Беременность
Чернокожие
Диуретик, БКК
Ингибитор АПФ, сартан, БКК
Ингибитор АПФ, сартан
Метилдофа, р-АБ, БКК
Диуретик, БКК
Таблица 7.3. Противопоказания к использованию
антигипертензивных препаратов
(адаптировано из ESC/ESH, 2013) [136]
Препарат
Тиазидовые
диуретики
Р-АБ
БКК
(дигидропиридиновые)
БКК
(верапамил, дилтиазем)
Ингибиторы АПФ
Сартаны
Антагонисты
минералокортикоидных
рецепторов
Абсолютные
противопоказания
• Подагра
• Бронхиальная астма
• Атриовентрикулярная
блокада (2-3-й степени)
• Атриовентрикулярная
блокада (2-3-й степени,
трифасцикулярная)
• Фракция изгнания ЛЖ
<40%
• Беременность
• Ангионевротический отек
• Гиперкалиемия
• 2-сторонний стеноз
почечных артерий
• Беременность
• Гиперкалиемия
• 2-сторонний стеноз
почечных артерий
• СКФ <30 мл/мин
• Гиперкалиемия
Относительные
противопоказания
• Метаболический синдром
• Нарушение толерантности
к глюкозе
• Беременность
• Гиперкальциемия
• Гипокалиемия
• Метаболический синдром
• Нарушение толерантности
к глюкозе
• Высокая физическая
активность
• Хроническое
обструктивное
заболевание легких
(кроме небиволола
и карведилола)
• Тахиартимии
• Фракция изгнания ЛЖ
<40% (кроме амлодипина
и фелодипина)
• Женщины детородного
возраста
• Женщины детородного
возраста
Выбор лечебной тактики:
монотерапия или комбинированная
антигипертензивная терапия?
На рис 7.7 представлены подходы к выбору лечебной тактики при АГ, реко-
мендованные экспертами ESC/ESH в 2013 году [136].
При выборе в качестве начального подхода монотерапии антигипертен-
зивным препаратом предпочтение обычно оказывают БКК либо тиазидо-
вому диуретику, при необходимости к ним добавляют либо ингиби-
тор АПФ, либо сартан.
ВЫБОР ЛЕЧЕБНОЙ ТАКТИКИ
Небольшое
повышение АД
Низкий/умеренный СС-риск
1
г
МОНО-
ТЕРАПИЯ
/
Замена
на другой
препарат
1
*
Монотерапия
в максимальной
дозе
—>■
\
Повышение дозы
ранее назначенного
препарата
1
f
Комбинация
2 препаратов
в максимальных
дозах
—>
Значительное
повышение АД
Высокий/очень высокий СС-риск
¥
КОМБИНАЦИЯ
2 ПРЕПАРАТОВ
/
Эта же комбинация
в максимальной
дозе
1
*
Смена на другую
комбинацию
2 препаратов
—р-
\
Добавление
3-го препарата
1
f
Комбинация
3 препаратов
в максимальных
дозах
Рис 7. 7. Подходы к выбору монотерапии или комбинированной
терапии при АГ (адаптировано из ESC/ESH, 2013) [136]
Многим больным уже на начальном этапе лечения может быть назначе-
на комбинированная антигипертензивная терапия 2 препаратами.
На рис 7.2 представлены рекомендованные экспертами ESC/ESH (2013)
комбинации антигипертензивных препаратов [136].
При необходимости используют трехкомпонентную антигипертензивную
терапию (как правило, БКК + тиазидовый диуретик + ингибитор АПФ/сар-
тан). Не рекомендуется комбинировать ингибитор АПФс сартаном.
На рис 73 (+ табл.) представлен примерный алгоритм выбора тактики анти-
гипертензивной терапии, рекомендованный экспертами ISH/ASH (2013) [123].
Тиазидные
диуретики
Другие
антигипертшивные
препараты
Ингибиторы
АПФ
Рис 72. Комбинации антигипертензивных препаратов
(адаптировано из ESC/ESH, 2013) [136]
Примечания:
^-^ Предпочтительные (рациональные) комбинации
- - - Рациональные комбинации, но с некоторыми ограничениями
■•«»»•••« Возможные, но менее изученные комбинации
——-— Нерекомендованные комбинации
АД >140/90 для лиц >18 лет (для лиц >80 лет АД >150/90
или >140/90 + высокий риск (например, СД, ХЗП))
Рекомендации по изменению стиля жизни
(уменьшение массы тела, потребления соли и алкоголя, прекращение курения)
АД 140-159/90-99: лекарственная терапия
(возможно отсрочить, если нет высокого риска)
Чернокожие
=*=
Нечернокожие
БККилиТД
<60лет
>60лет
Если необходимо,
то добавляют
иАПФ или сартан
иАПФ или сартан
либо
комбинация
БКК + ТД
3=
БККилиТД
Если необходимо,
то добавляют
Если необходимо,
то добавляют
БККилиТД
3=
иАПФ или сартан
Если необходимо
БКК + ТД + иАПФ (или сартан)
Если необходимо, то добавляют другие препараты
(спиронолактон, центрального действия, р-АБ)
АД > 160/100:
лекарственная терапия (у всех)
=*=
Независимо
от расы
Сразу
2 препарата:
БККилиТД
+
или сартан
Специальные
группы:
. ХЗП
•СД
. ИБС
• Постинсульт-
ные
. ХСН
Если необходимо, то проводят
дополнительное обследование,
консультацию кардиолога
(специалиста по АГ)
Выбор антигипертензивных препаратов при сопутствующих состояниях (ASH/ISH, 2013) [123]
СЗ или состояние
СД
ХЗП
ИБС
Инсульт в анамнезе
ХСН
1-й препарат
Сартан или иАПФ
Сартан или иАПФ (+ПД при
СКФ<40мл/мин/1,73м2)
р-АБ + сартан или иАПФ
иАПФ или сартан
+ 2-й препарат
для достижения АД
<140/90ммрт.ст.
БККилиТД
БККилиТД
БККилиТД
БККилиТД
+ 3-й препарат
для достижения АД
<140/90ммрт.ст.
ТДилиБКК
ТДилиБКК
ТДилиБКК
ТДилиБКК
Обычно: сартан или иАПФ + р-АБ + диуретик + AMP. Если необходимо, то добав-
ляют амлодипин или фелодипин
Рис. 7.3. Подходы к лечебной тактике при АГ,
рекомендуемые экспертами ASH/ISH, 2013 [123]
Примечания. AMP — антагонист минералокортикоидных рецепторов; иАПФ — ингибитор АПФ;
ПД — петлевой диуретик; ТД — тиазидовый диуретик (эксперты JNC-8 (2014) [137] указывают термин
«тиазидоподобный диуретик»); ХСН — хроническая СН (со сниженной систолической функцией ЛЖ).
Изолированная систолическая
артериальная гипертензия
ИСАГ (при САД >140 мм рт. ст. и ДАД <90 мм рт. ст.) ряд мировых экс-
пертов рассматривает как отдельное патологическое состояние, прису-
щее пожилым, связанное с уменьшением податливости стенки артерий
[144]. Повышение САД является важным патофизиологическим факто-
ром, способствующим развитию гипертрофии ЛЖ сердца; снижение
ДАД может приводить к ухудшению коронарного кровотока. Распро-
страненность ИСАГ увеличивается с возрастом; у пожилых лиц — это
наиболее частая форма АГ (по оценкам западных специалистов, мо-
жет составлять до 80-90% всех случаев АГ среди лиц в возрасте 65 лет и
старше) [56, 98,144,202].
У пожилых лиц наличие ИСАГ сопряжено с более значимым увели-
чением степени СС-риска, чем наличие систоло-диастолической АГ (при
сравнимых величинах САД) [90,135,144].
Для оценки степени дополнительного СС-риска при ИСАГ следует ис-
пользовать те же уровни САД, те же обозначения ФР, ПОМ и СЗ, что и при
систоло-диастолической АГ. При этом следует иметь в виду, что особенно
низкие уровни ДАД (60-70 мм рт. ст. и менее) ассоциированы с допол-
нительным повышением риска [96,103,144].
В лечении лиц с ИСАГ могут использоваться те же классы антигипертензив-
ных препаратов, которые используют в лечении больных АГ в целом (не-
которое предпочтение эксперты ESC/ESH (2013) отдают диуретикам и БКК)
[135,144,217].
Резистентная
артериальная гипертензия
Понятия «плохо контролируемая» и «резистентная» АГ не являются сино-
нимами [192]. В табл. 7.4 представлены причины плохого (недостаточного)
контроля АД. Распространенность резистентной АГ среди всех лиц с АГ (по
данным некоторых регистров США) достигает около 9% [155,192].
Понятием «резистентная АГ» обозначают случаи, когда уровни АД удержи-
ваются выше целевых, несмотря на то, что пациент [61, 70,136]:
• придерживается рекомендаций по изменению стиля жизни (в том числе
по ограничению поваренной соли);
• принимает 3 класса хорошо сочетающихся между собой антигипертен-
зивных препаратов в полных дозах;
• один из этих 3 классов препаратов является диуретиком.
Таблица 7.4. Причины плохо контролируемой АГ
(адаптировано из [155,192])
Факторы,
зависящие от больного
Неприверженность:
• Низкий уровень
информированности
• Высокая стоимость
препаратов
• Сложный лекарственный
режим
• Побочные эффекты лечения
• Плохие отношения с врачом
• Отсутствие социальной
поддержки
Связанные с системой
здравоохранения:
• Отсутствие медицинской
страховки
• Отсутствие постоянного
наблюдения
Высокая распространенность
АГ в отдельных группах
больных:
• Пожилой возраст
• Лица с ожирением
Резистентная АГ(нечасто)
Симптоматические АГ
Факторы,
зависящие от врача
Недостаточная информированность о современных
рекомендациях:
• Нет информации о целевых уровнях АД
• Нет информации об ИСАГ
Чрезмерная приверженность к монотерапии
Чрезмерная надежда на приверженность
больного терапии:
• «Врачу следует отчетливо представлять себе,
что большинство больных с хроническими
заболеваниями имеют низкую приверженность
к длительному лечению. Наша задача — постоянно
и регулярно, доброжелательно и понятным
образом разъяснять необходимость длительного
лечения АГ, хронической ИБС, хронической СН...»
• «Есть три основные причины резистентной АГ.
Это: 1) неприверженность, 2) неприверженность
и 3) неприверженность» (гипербола фразы вполне
оправдана!)
Несогласие с современными рекомендациями:
• В вопросе об ИСАГ
• Опасения в отношении J-кривой
Вера в то, что офисное АД всегда выше домашнего
Нежелание лечить «бессимптомное состояние»
Отсутствие времени на визите
Если предполагают наличие резистентной АГ, на начальном этапе не-
обходимо проверить приверженность больного к лечению и адекват-
ность выполнения им рекомендаций по изменению стиля жизни. Так-
же необходимы поиск и лечение симптоматических АГ [192].
Если принято решение об использовании 4-компонентной антигипертен-
зивной терапии, то можно к уже применяемой комбинации, включающей
БКК, тиазидовый или тиазидоподобный диуретик и ингибитор АПФ или
сартан добавить [136,144,155,192]:
• антагонист альдостерона (эплеренон или спиронолактон в неболь-
шой дозе — 25 мг/сутки) с учетом важной роли гиперальдостеронизма,
в том числе субклинического, в развитии резистентной АГ;
• петлевой диуретик (фуросемид или торасемид), обычно у больных с со-
путствующим ХЗП при сниженной функции почек (СКФ <60 мл/мин/1,73 м2);
• калийсберегающий диуретик, не относящийся к антагонистам альдо-
стерона (триамтерен или амилорид), в части случаев они также могут
быть эффективны при резистентной АГ;
• другой БКК (если ранее был назначен дигидропиридиновый, то доба-
вить недигидропиридиновый, и наоборот);
• препарат центрального действия (моксонидин или урапидил) и/или
а-АБ (доксазозин, особенно у лиц с аденомой предстательной железы);
• нитрат (изосорбида динитрат или мононитрат).
В качестве компонента комбинированной антигипертензивной терапии мо-
жет быть также использован прямой ингибитор ренина алискирен (если
нет дополнительного высокого или очень высокого СС-риска). Не следует
сочетать алискирен с ингибиторами АПФ или сартанами [136,222].
При необходимости может быть использовано лечение, включающее бо-
лее 4 антигипертензивных препаратов, однако следует иметь в виду, что
в этом случае [144]:
• какие-либо определенные рекомендации, кроме перечисленных выше,
по созданию столь сложных лечебных программ отсутствуют, дальней-
ший выбор лечения основывается преимущественно на опыте врача;
• дополнительно возрастает риск лекарственных взаимодействий и раз-
вития эпизодов гипотензии.
В последнее время в лечении резистентной АГ находят применение инвазив-
ные лечебные процедуры (катетерная почечная денервация; имплантация
устройств, активирующих каротидные адренорецепторы) [136]. Подробное
рассмотрение вопроса об их использовании в лечении больных АГ выходит за
рамки настоящего издания. Авторы хотят лишь обратить внимание на то, что
эти методы являются предметом изучения и использования в крупных клини-
ках. Для их успеха несомненную важность имеет тщательный отбор больных
с подтвержденной, истинно резистентной АГ. Чтобы подчеркнуть сложность
проблемы, укажем лишь на опубликованное в 2014 году крупное исследова-
ние SYMPLICITY HTN-3 (включавшее 535 больных с резистентной АГ), в кото-
ром почечная симпатическая денервация не показала значимого снижения
САД по сравнению с «безрезультатной операцией» (то есть катетеризацией
почечных артерий без радиочастотной абляции симпатических структур) [92].
Ортостатическая гипотензия
Под этим термином понимают снижение САД на 20 мм рт. ст. и более или
ДАД на 10 мм рт. ст. и более при переходе из горизонтального положения
тела в вертикальное. Распространенность ортостатической гипотензии
увеличивается с возрастом; среди пожилых она может достигать 5-30%.
Ортостатическая гипотензия ассоциирована с повышенным риском паде-
ний и переломов [136,144,155, 222].
При быстром вставании примерно 10% ОЦК переходит из органов груд-
ной клетки в сосуды нижней части тела. В норме отсутствие снижения АД
достигается активацией нейрогуморальных систем и изменением функции
барорецепторов. С возрастом степень выраженности такой активации
уменьшается, что приводит к снижению АД при вставании [144].
Прогрессирующая ортостатическая гипотензия у пожилых характеризу-
ется медленным снижением САД при вставании (и компенсаторным уве-
личением ЧСС). Симптомы обычно возникают не сразу после вставания,
но через несколько минут [144]. Более часто ортостатическая гипотензия
наблюдается у лиц с сопутствующим СД, а также у больных, получающих
лечение с использованием антигипертензивных препаратов [136].
Клинических проявлений у части пациентов с ортостатической гипотензи-
ей может не быть. Наиболее распространенные клинические проявления
включают [67,144]:
• головокружение;
• нарушения зрения («потемнение в глазах», др.);
• пресинкопе/синкопе;
• необъяснимые падения;
• шаткость, потеряю равновесия.
Диагноз может быть подтвержден при измерении АД сначала через 5 ми-
нут пребывания больного в горизонтальном положении, а затем — после
вставания (ежеминутно, в течение 3-5 минут). Если АД продолжает сни-
жаться по истечение 3-5 минут, контроль АД следует продолжать более
длительно [144, 222].
Если больной не переносит пребывания в вертикальном положении в тече-
ние этого времени, то для регистрации АД используют наиболее возвышен-
ное переносимое больным положение головы. Альтернативой такому изме-
рению может быть проведение ортостатической пробы (тилт-тест) [144].
Ортостатические эпизоды наиболее часто возникают по утрам. Ортоста-
тическая гипотензия может быть проявлением синдрома вегетативной
(барорефлекторной) несостоятельности регуляции АД. У больных с син-
дромом вегетативной (барорефлекторной) несостоятельности отмечают
нарушение циркадного ритма АД, что может быть зарегистрировано при
его суточном мониторировании: АД в вертикальном положении наиболее
низкое — по утрам, в течение дня — постепенно возрастает. Важными про-
явлениями этого синдрома являются постпрандиальная гипотензия (сни-
жение АД после приема пищи, чаще — обильной) и гипотензия, возникаю-
щая при физических нагрузках [66,70,136,144].
Наиболее частой причиной возникновения эпизодов ортостатической гипо-
тензии у пожилых является прием лекарственных препаратов [144]. Их пе-
речень представлен в табл. 7.5. Другие причины перечислены в табл. 7.6.
Таблица 7.5. Лекарственные препараты, прием которых может
вызывать развитие ортостатической гипотензии [144,155]
Антигипертензивные:
• р-АБ
• а-АБ*
• ингибиторы АПФ
• сартаны
. БКК
• прямые вазодилататоры*
Диуретики:
• петлевые
• тиазидовые
• калийсберегающие
Антидепрессанты:
• трициклические
• селективные ингибиторы обратного
захвата серотонина
• ингибиторы обратного захвата
серотонина и норадреналина
Противопаркинсонические:
• леводопа
• антагонисты допаминовых рецепторов
Нитраты
Примечание. * Риск развития ортостатической гипотензии особенно выражен.
Таблица 7.6. Причины ортостатической гипотензии [144]
Лекарственные препараты {см. табл. 7.5)
Нейрогенные
• Первичные:
- истинная вегетативная
несостоятельность
- синдром Shy-Drager (комбинация
мультисистемной атрофии
с вегетативной несостоятельностью)
- вегетативная несостоятельность
при болезни Паркинсона
• Вторичные:
- при поражениях спинного мозга
(сирингоглобулия, сирингомиелия,
поперечный миелит, амилоидоз)
- при СД
- в пожилом возрасте
Прочие:
• При низком внутрисосудистом объеме (дегидратация, полиурия, несахарный диабет)
• При вазодилатации (гипертермия, прием алкоголя)
Лечебные подходы при ортостатической гипотензии включают [67,144]:
• Оценку лекарственных препаратов, которые использует больной, отме-
ну (при возможности) или коррекцию дозы тех из них, которые могут
способствовать развитию ортостатической гипотензии (табл. 7.5).
• В табл. 7.7 представлены нефармакологические лечебные подходы, ко-
торые могут быть использованы улиц с ортостатической гипотензией.
• Лекарственные препараты: унифицированных рекомендаций нет.
• Небольшая доза минералокортикоида (например, флудрокортизон
0,1 мг/сутки) может способствовать увеличению ОЦК и повысить чув-
ствительность а-адренорецепторов, благодаря чему уменьшается орто-
стаз. Побочные эффекты включают задержку жидкости и АГ.
• Мидодрин (а-адренергический агонист) в нескольких небольших иссле-
дованиях показывал обнадеживающие результаты. Начинают с дозы по
2,5 мг 3 раза в день, далее титруют; максимальная доза — 10 мг 4 раза
в день (последний прием — не позже 18:00). Побочный эффект — АГ.
Препарат не рекомендуют применять при САД >160 мм рт. ст.
• Десмопрессин (дериват вазопрессина) может быть применен у лиц с
вегетативной несостоятельностью. Его применение ограничено риском
развития гипонатриемии.
• Практически все перечисленные препараты повышают АД, что ослабляет
ортостаз. Необходим тщательный контроль АД [66,70,155,222].
Таблица 7.7. Нефармакологические подходы к терапии
ортостатической гипотензии [136,144,155]
• Эластические чулки на всю ногу
• Абдоминальный бандаж
• Увеличение употребления кофеина
• Увеличение употребления поваренной
соли и воды
• Реабилитационные программы
(включающие упражнения по тренировке
чувства равновесия)
• Частое дробное питание
• Сон с приподнятым изголовьем
• При предположении о наличии
барорефлекторной дисфункции — перед
вставанием после сна в положении
полулежа прием 100-150 мл жидкости.
• Прием 1-2 глотков ледяной воды (?)
Рекомендуется избегать:
• Резких движений головой (в стороны,
наклон вперед, запрокидывание,
вращение)
• Длительного постельного режима
• Натуживания при мочеиспускании
и дефекации
• Пребывания в жаре, в жарком помещении
(включая бани)
• Приема алкоголя
• Приема препаратов с вазодилатирующим
эффектом
В завершение обсуждения вопроса об ортостатической гипотензии считаем
важным еще раз подчеркнуть, что:
• ортостатическая гипотензия часто имеет место у пожилых, она ассоции-
рована с пресинкопе/синкопе и повышенным риском падений;
• наиболее частым провоцирующим фактором является прием лекар-
ственных препаратов;
• наиболее важный и действенный компонент лечебной тактики — выяв-
ление и устранение соответствующих провоцирующих препаратов;
• для снижения риска синкопе и падений важными являются нефармако-
логические подходы.
Наблюдение за больным
артериальной гипертензией.
Направление больного на консультацию к специалисту
Значительная часть больных с АГ могут находиться под наблюдением се-
мейного врача — врача общей практики [46,61,70,136,144]. Направле-
ние больного на консультацию к специалисту (кардиологу, нефрологу, др.)
оправдано, если:
• у больного на фоне имеющейся АГ развиваются такие осложнения, как
CH или снижение функции почек;
• имеет место недостаточный ответ на применение комбинированной
антигипертензивной терапии, включающей 3 и более классов анти-
гипертензивных препаратов;
• имеются значимые побочные эффекты лечения;
• есть сомнения в соотношении польза/риск при лечении данного больного.
В табл. 7.8 и 7.9 отражены, соответственно, основные подходы к наблю-
дению за больным АГ и подходы к повышению приверженности лечению
пациентов с АГ, на которые обращают внимание ведущие международные
эксперты [123,136,137,144].
Таблица 7.8. Подходы к наблюдению за больным АГ
(адаптировано из [136,137,144,155])
Наблюдение за больным АГ
• Для достижения целевых цифр АД при АГ требуются неоднократные визиты к врачу
с целью своевременного изменения лечения (включая титрование доз препаратов).
При наличии у больного (например, пожилого возраста) затруднений с передвижени-
ем могут требоваться визиты врача/медсестры на дом.
• После достижения целевого АД частота визитов может быть значительно уменьшена;
их кратность на этом этапе может составлять примерно 1 раз в 6 месяцев. Цели визита:
- проверка приверженности лечению;
- оценка побочных эффектов, включая ортостатическую гипотензию;
- проведение беседы с разъяснением полезности антигипертензивной терапии для
здоровья и поощрением больного к продолжению лечения.
• При длительном наблюдении за больным также необходимо проверять, насколько
взяты под контроль такие модифицируемые факторы СС-риска, как дислипиде-
мия, СД, курение, др.; следует повторно обсуждать с больным вопросы диеты и из-
менений стиля жизни.
• Не реже чем ежегодно рекомендуют контролировать состояние функции почек и
проводить ЭКГ с целью оценки состояния органов-мишеней при АГ. Больным, полу-
чающим комбинации ингибиторов АПФ или сартанов с антагонистами альдостерона,
требуется 1 раз в 3-6 месяцев контролировать состояние функции почек и уровни
электролитов крови.
• Лечение АГ обычно постоянное и продолжается пожизненно.
Таблица 7.9. Подходы к повышению приверженности лечению
лиц с АГ (адаптировано из [144])
Повышение приверженности лечению
• Следует информировать больного о риске, связанном с наличием АГ, и о благоприят-
ном влиянии эффективного лечения на этот риск.
• Инструкции по лечению АГ должны быть письменными и устными, максимально прос-
тыми, изложенными понятным для больного языком.
• Лечебные рекомендации должны быть подобраны в соответствии с особенностями
стиля жизни пациента.
• Желательно упростить схему лечения путем максимального уменьшения количества
применяемых лекарственных средств (для этого можно использовать комбиниро-
ванные антигипертензивные препараты).
• К обсуждению информации о заболевании и о планах по лечению может быть целе-
сообразно привлечь родственников больного (и лиц, обеспечивающих уход за ним).
• Во многих случаях полезно рекомендовать контроль АД на дому (также самоконтроль).
• При визитах обязательно контролировать побочные эффекты препаратов и соответ-
ственно изменять лечебные рекомендации.
• Для облегчения выполнения лечебного режима препараты удобно раскладывать в
разделенные по периодам приема пластмассовые контейнеры («утро — день — ве-
чер» и др.). Также применимы блистеры с календарной упаковкой (для препаратов
однократного в сутки приема). В целях напоминания больному о времени приема
препаратов можно использовать сигнал будильника (установленного в мобильном
телефоне ежесуточно на определенное время).
Типичные проблемы,
которые могут возникнуть при лечении пожилого больного АГ
• Ограничение поваренной соли в рационе у пожилых реализовать может быть
сложнее, чем у более молодых пациентов ввиду:
- связанного с возрастом ослабления интенсивности вкусовых ощущений;
-усложнения (из-за меньшей мобильности) приобретения свежих продуктов и приго-
товления пищи.
• Рекомендации по ограничению калоража пищи и снижению массы тела часто оказы-
ваются неуспешными.
• Наличие у больного СЗ может препятствовать назначению некоторых лекарственных
препаратов.
• Значительно снижают приверженность лечению когнитивные нарушения.
• Необходимость применения многокомпонентного медикаментозного лечения уве-
личивает риск развития взаимодействий между лекарственными препаратами, воз-
никновения побочных эффектов, снижения приверженности.
• Имеется повышенный риск развития эпизодов гипотензии (в том числе гипотензии
после еды, или постпрандиальной, ортостатической гипотензии). Это увеличивает ве-
роятность падений (и возможных переломов).
Глава 8
Диуретики
(тиазидовые/тиазидоподобные, петлевые,
калийсберегающие/антагонисты
минералокортикоидных рецепторов)
С более подробной характеристикой диуретиков читатель может озна-
комиться в предыдущем (втором) издании [31]; здесь приведены лишь их
классификация, основные фармакологические свойства и достаточно сжа-
то — основные подходы к применению диуретиков при АГ.
Дозировки и кратность применения диуретиков, применяемых для лече-
ния АГ, представлены в табл. 8.1. Некоторые фармакологические особен-
ности диуретиков представлены в табл. 8.2.
Для длительного лечения пациентов с АГ среди диуретиков наиболее ча-
сто применяют тиазидовые и тиазидоподобные препараты [136,171].
В основе антигипертензивного действия тиазидовых и тиазидоподобных
диуретиков лежит их способность увеличивать выведение натрия почками.
Кроме того, они обладают определенными самостоятельными вазодилати-
рующими свойствами. Для хлорталидона, индапамида и гидрохлоротиазида
установлены благоприятные эффекты на СС-прогноз (с уменьшением риска
развития инсультов и иных СС-осложнений); при этом эксперты отмечают,
что наиболее значительным объемом доказательной базы на этот счет об-
ладают первые два из перечисленных выше препаратов [11,17,78,136,171 ].
Хлорталидон по сравнению с гидрохлоротиазидом обладает более выра-
женным антигипертензивным эффектом и большей продолжительностью
действия [137,155,171].
Основными побочными эффектами препаратов этой группы являются метабо-
лические (гипокалиемия, гипергликемия, гиперурикемия). Вероятность раз-
вития этих эффектов может быть уменьшена при использовании более низких
доз (например, 12,5-25 мг/сутки гидрохлоротиазида или хлорталидона), а так-
же при комбинации диуретиков с ингибиторами АПФ или с сартанами (кото-
рые могут ослаблять такие метаболические изменения). У части больных для
предупреждения развития гипокалиемии может требоваться использование
комбинации с калийсберегающими диуретиками [75,139,155,171 ].
Таблица 8.1. Диуретики в лечении АГ
(адаптировано из ISH/ASH, 2013) [123]
Препарат
Доза, мг/сутки
Низкая
Обычная
Кратность
приема
Тиазидовые
Гидрохлоротиазид
Бендрофлуметиазид*
12,5
1,25-5
12,5-50
10
1
1
Тиазидоподобные
Индапамид
Хл орта л и дон
Метолазон*
1,25
12,5
2,5
2,5
12,5-25
5-10
1
1
1
Петлевые
Фуросемид
Торасемид
Буметанид*
20 мг 1 раз в сутки
5
0,5
40 мг 1 раз в сутки*
10#
1
1—2-3
1
1
Калийсберегающие
Спиронолактон**
Эплеренон**
Амилорид
Триамтерен
12,5
25
5
100
25-50
50-100
5-10
100
1—2-3
1-2
1
1
Примечания.
* На момент выхода издания в свет отсутствует в Украине.
** Относятся к антагонистам минералокортикоидных рецепторов (антагонистам альдостерона)
# При сниженной функции почек могут требоваться более высокие дозы.
Таблица 8.1. Некоторые фармакологические особенности диуретиков
(адаптировано из [136,155,171 ]
Препарат
Гидрохлоротиазид*
Бендрофлуметиазид*
Индапамид
Хлорталидон
Метолазон*
Фуросемид
Торасемид
Буметанид*
Спиронолактон
Эплеренон
Амилорид
Триамтерен
Продолжительность
действия, ч
12-18
18
24
24-72
24
3-6
12
4-6
8-12
12
24
12
Путь выведения
95% — почки
90% — почки
Метаболизм — печень,
выведение 70% — почки
65% — почки
80% — почки
85% — почки
Метаболизм 80% — печень,
выведение 20-60% — почки
80% —почки
80% — почки
70% — почки
50% — почки
90% — почки
Примечания.
# Гидрохлоротиазид содержится в препарате Ко-Диротон® (таблетки: 10 мг лизиноприла + 12,5 мг гидро-
хлоротиазида или по 20 мг лизиноприла + 12,5 мг гидрохлоротиазида; по 10 таблеток в блистере, 1 или
3 блистера в упаковке).
* На момент выхода издания в свет отсутствует в Украине.
Антигипертензивная эффективность диуретиков значительно повышается
при комбинации с ингибиторами АПФ или сартанами; они также показы-
вают высокую эффективность в сочетании с БКК. Следует иметь в виду, что
хотя комбинация диуретиков и ($-АБ также хорошо снижает АД, однако по-
скольку оба эти класса препаратов потенциально могут увеличивать уров-
ни гликемии, такую комбинацию следует использовать с осторожностью у
лиц, имеющих риск развития СД [137].
Иногда в лечении АГ могут применяться комбинации нескольких диурети-
ков, блокирующих реабсорбцию натрия в различных отделах нефрона (так
называемая концепция последовательной блокады нефрона) [171]. Так, у
лиц с АГ при сниженной функции почек может использоваться комбинация
тиазидового/тиазидоподобного диуретика с петлевым; при сохранной функ-
ции почек в лечении АГ такое сочетание диуретиков применения не находит.
У части пациентов для удовлетворительного контроля АД могут требовать-
ся комбинации петлевых или тиазидовых диуретиков с калийсберегающи-
ми. Примеры таких комбинаций:
• хлорталидон + антагонист минералокортикоидных рецепторов;
• гидрохлоротиазид + антагонист минералокортикоидных рецепторов +
триамтерен;
• петлевой диуретик + антагонист минералокортикоидных рецепторов +
амилорид.
Использование комбинаций нескольких диуретиков требует особенно тща-
тельного контроля состояния пациента (АД, масса тела, диурез), уровня элект-
ролитов крови, других параметров безопасности (см. далее) [14,75,155,171 ].
Тиазидовые/тиазидоподобные диуретики
(гидрохлоротиазид, индапамид, хлорталидон)
Механизм действия этих препаратов состоит в ингибировании натрий-
хлор-котранспорта в мембране начального сегмента дистальной собира-
тельной трубки нефрона (где в норме реабсорбируется 5-8% профиль-
трованного натрия) [171]. На начальном этапе использования диуретиков
этой группы происходит уменьшение ОЦП и экстрацеллюлярного объема
жидкости, а также снижение СВ, что и определяет снижение АД [155]. При
длительном применении диуретиков ОЦК практически возвращается к
исходному уровню, однако отмечается снижение ОПСС, это обеспечивает
сохранение устойчивого антигипертензивного эффекта [155]. Термин «тиа-
зидоподобный диуретик» обозначает группу тиазидовых диуретиков, не
имеющих в структуре молекулы бензотиадизиновый компонент (класси-
ческие тиазидовые диуретики его имеют) [171]. Механизмы действия тиа-
зидовых и тиазидоподобных диуретиков достаточно сходны, однако пре-
параты различаются по ряду фармакологических особенностей (табл. 8.2),
влиянию на обмен глюкозы и липидов, объему доказательной базы в отно-
шении благоприятного влияния наСС-прогноз [11,88,137,155,171,183].
Антигипертензивная эффективность тиазидовых/тиазидоподобных диуре-
тиков более высока у лиц, имеющих относительно невысокие уровни ак-
тивности ренина плазмы (обычно это — пожилые лица, а также больные
АГ с черным цветом кожи). Диуретики потенцируют эффективность всех
остальных классов антигипертензивных препаратов [137,171].
Тиазидовые/тиазидоподобные диуретики влечении АГ в настоящее время
используют преимущественно в небольших дозах. Так, гидрохлоротиазид
наиболее часто используют сейчас при АГ в дозах 12,5 мг/сутки (хотя в не-
которых случаях могут требоваться дозы 25-50 мг/сутки и более). Иногда
(обычно если диуретики используют в комбинации с другими препарата-
ми, такими как ингибиторы АПФ и (J-АБ) могут применяться даже меньшие
дозы — например, гидрохлоротиазид в дозировке 6,25 мг/сутки [171]. При
назначении низких доз диуретиков следует иметь в виду, что для разверты-
вания их полноценного антигипертензивного эффекта может требоваться
до 4-8 недель. Обычно используют однократный суточный прием тиазидо-
вых диуретиков [47,139,155].
Тиазидовые и тиазидоподобные диуретики рассматривают в качестве те-
рапии выбора при лечении АГ у пожилых (в том числе и при ИСАГ), у лиц с
избыточной массой тела, при наличии сопутствующей СН, у больных с реци-
дивирующими кальциевыми камнями в почках, а также при тяжелой резис-
тентной АГ в комбинации с другим(и) классом(ами) антигипертензивных
средств [137,144,171 ]. Важным для пожилых лиц является то, что тиазидо-
вые диуретики уменьшают потерю кальция и способствуют замедле-
нию развития остеопороза, представляющего серьезную проблему осо-
бенно у таких больных (в том числе у женщин в постменопаузе). По мнению
ряда крупных кардиологов, отсутствие тиазидовых (тиазидоподобных) ди-
уретиков в схеме антигипертензивной терапии является, вероятно, одной
из самых частых причин резистентности АГ к комбинированному антиги-
пертензивному лечению [155].
Следует отметить уменьшение диуретической и антигипертензивной эф-
фективности тиазидовых диуретиков у лиц со сниженной функцией почек;
уже при ХЗП 2-й стадии достигаемый уровень натрий- и диуреза при их ис-
пользовании обычно отчетливо ниже, чем при сохранной функции почек.
У таких пациентов (и, особенно, при ХЗП 3-5-й стадии), в соответствии с
представлениями предыдущих лет, сфера применения тиазидовых диуре-
тиков была весьма ограничена; к настоящему времени имеются сообще-
ния об эффективности сочетания тиазидовых диуретиков с петлевыми при
ХЗП 2-5-й стадии [11,171, 208].
Противопоказаниями к применению тиазидовых диуретиков являются:
повышенная индивидуальная чувствительность к ним, гипокалиемия, ги-
помагниемия, гипонатриемия, гипохлоремия, гиперкальциемия, гипово-
лемия, ПА. Тиазидовые диуретики противопоказаны больным с подагрой.
С осторожностью следует применять тиазидовые диуретики у больных СД,
с аортальным стенозом и идиопатическим гипертрофическим субаорталь-
ным стенозом [64,70,133,137].
Использование малых дозировок тиазидовых диуретиков (например,
гидрохлортиазида 12,5-25 мг/сутки и менее) при лечении АГ существен-
но уменьшает частоту и тяжесть их побочных эффектов [67]. Однако даже
при таком лечебном режиме возможно развитие целого ряда осложнений,
включающих: гипокалиемию, гипомагниемию, гипонатриемию, гипохлор-
емию, гиперкальциемию, гиперурикемию, гиповолемию, снижение толе-
рантности к глюкозе, гипергликемию, гипер- и дислипидемию (повышение
плазменных уровней ХС ЛПНП и ТГ), тошноту, головную боль, вялость, де-
прессию, а также снижение потенции. Лечение тиазидовыми диуретиками
также сопряжено с риском аритмий (в том числе и жизнеопасных), в разви-
тии которых важную роль играют гипокалиемия и гипомагниемия [78,132].
Длительное применение диуретиков (тиазидовых, петлевых и калийсбере-
гающих) может осложняться развитием интерстициального нефрита, дер-
матита, кожной сыпи [171 ].
С 2011 года эксперты США разрешили применение небольших дозировок
гидрохлоротиазида (12,5-50 мг/сутки) в лечении хронической АГ при бе-
ременности (см. гл. 21) [197].
Петлевые диуретики (фуросемид, торасемид)
Механизм действия петлевых диуретиков состоит в блокировании реабсор-
бции натрия посредством ингибирования натрий-калий-хлор-котранспорт-
ной системы в мембране клеток восходящего сегмента петли Генле (в этом
отделе нефрона реабсорбируется 35-45% профильтрованного натрия) [171].
Петлевые диуретики по сравнению с тиазидовыми имеют более выражен-
ный натрийуретический эффект и более быстрое начало действия. В то же
время, их антигипертензивная эффективность, а также спектр и частота раз-
вития побочных эффектов оказываются сравнимыми с таковыми у тиазидов
[155,171 ]. В качестве антигипертензивных препаратов для хроническо-
го приема петлевые диуретики используют, главным образом, у лиц со
сниженной функцией почек (для достижения эффективных концентраций
петлевых диуретиков в просвете почечных канальцев у таких больных бу-
дет требоваться их назначение в более высоких дозах) [61, 123, 136, 171].
Петлевые диуретики находят широкое применение для контроля задерж-
ки жидкости у больных с хронической СН со сниженной систолической
функцией ЛЖ (а также с его сохранной фракцией выброса — но особенно
осторожно!) [61а]. Парентеральное (обычно — внутривенное) введение пет-
левых диуретиков представляет важный компонент лечебной тактики у па-
циентов с ГК [25,64].
Фуросемид имеет относительно короткую продолжительность действия
(при приеме внутрь — от 3 до 6 часов). В этой связи при его однократном
приеме в течение суток за оставшееся за пределами периода действия
время происходит задержка натрия, в связи с чем суммарное выведе-
ние жидкости (особенно при использовании в течение нескольких дней)
существенно не увеличивается. Поэтому для устойчивого поддержания
небольшого снижения ОЦК (что необходимо для получения стабильного
снижения АД при применении диуретиков) требуется его не менее чем
двукратный прием в течение суток. Первый прием препарата при этом
рекомендуют осуществлять рано утром натощак, второй — до еды в сере-
дине дня, для того чтобы обеспечить максимум натрийуреза на период по-
требления натрия с пищей и избежать никтурии [155,171].
Торасемид имеет ряд достаточно значимых фармакологических отличий
от фуросемида: менее вариабельную биодоступность, большую продолжи-
тельность действия (не менее 12 часов, что обеспечивает возможность одно-
кратного приема в течение суток), преимущественное выведение печенью.
Влечении неосложненной АГ иногда применяют субдиуретические дозы то-
расемида (2,5-5 мг/сутки). В последнее время в отечественной клинической
практике при АГ (и, особенно, при хронической СН) все шире используют
пролонгированную форму торасемида (обеспечивающую приемлемый уро-
вень натрийуреза при большей комфортности для больного) [155,171,208].
Калийсберегающие диуретики
(амилорид, триамтерен)
Механизм действия амилорида и триамтерена состоит в прямом ингиби-
ровании реабсорбции натрия в натриевых каналах эпителиальных клеток
дистальных канальцев нефрона; при их применении также уменьшаются
секреция и экскреция ионов калия и водорода (эти эффекты не связаны с
влиянием на альдостерон и его рецепторы) [155,171].
Амилорид и триамтерен являются относительно слабыми натрийурети-
ками, в связи с чем в лечении АГ находят применение главным обра-
зом в сочетании с тиазидовыми препаратами: с одной стороны, это
взаимно усиливает их антигипертензивный эффект, а с другой стороны,
снижает риск гипокалиемии, развитие которой возможно при использо-
вании тиазидов [171].
Амилорид может использоваться в лечении ПА (у лиц, которые не пе-
реносят антагонисты минералокортикоидных рецепторов), а также у лиц
с синдромом Лиддла (Liddle) — см. гл. 19 и 15, соответственно. Он также
может быть применен в качестве вспомогательного лечебного подхода
у пациентов с резистентной АГ. Среди его побочных эффектов наиболее
частыми являются тошнота и метеоризм, а наиболее серьезным — гипер-
калиемия. Использование в комбинации с гидрохлоротиазидом также мо-
жет быть ассоциировано с повышением риска гипонатриемии, особенно у
пожилых лиц [155,208,222].
Триамтерен (как и амилорид — в фиксированном сочетании с гидро-
хлортиазидом) находит применение преимущественно в лечении рези-
стентной АГ (в качестве 5-6-го препарата при недостаточной эффектив-
ности иных комбинаций антигипертензивных лекарственных средств).
Побочные эффекты включают гиперкалиемию, усиление образования
кальциеоксалатных конкрементов в почках. Поскольку триамтерен явля-
ется антагонистом фолиевой кислоты, его не следует использовать при бе-
ременности [155,162].
Антагонисты минералокортикоидных рецепторов
(антагонисты альдостерона —
спиронолактон, эплеренон)
Препараты этой подгруппы блокируют действие альдостерона на ми-
нералокортикоидные рецепторы, расположенные в цитоплазме кле-
ток-мишеней (а именно эпителиальных клеток дистальных извитых ка-
нальцев нефрона, фибробластов и некоторых других) [155,171].
Выделяют два основных механизма взаимодействия альдостерона с клет-
ками-мишенями. Первый из них, обозначаемый как геномный, состоит
в связывании альдостерона с цитоплазматическими минералокортико-
идными рецепторами; эти комплексы затем переносятся в ядро клеток и
стимулируют синтез различных протеинов; такой механизм развивается
достаточно медленно (часы/дни). Второй механизм, именуемый негеном-
ным, в отличие от геномного, не требует участия ДНК, информационной
РНК и синтеза белка; его развитие быстрое (минуты).Тонкое разграничение
биологических эффектов, которые определяются каждым из этих механиз-
мов, остается делом будущего. Показано, что антагонисты минералокорти-
коидных рецепторов блокируют оба эти механизма; при этом умеренные
натрийуретические и антикалийуретические (калийсберегающие) их
эффекты связывают преимущественно с негеномным механизмом; а в раз-
витии органопротекторных (антифибротических, антипролифератив-
ных, противовоспалительных) эффектов этих препаратов, по-видимо-
му, играют роль как геномный, так и негеномный механизмы [155,208,222].
Расширение применения препаратов этой подгруппы рассматривают как
одно из важных недавних достижений в лечении АГ. Интерес к этим лекар-
ственным средствам существенно возрос после того, как они в целом ряде
крупных исследований продемонстрировали благоприятные эффекты на
СС-прогноз у больных хронической СН со сниженной систолической функци-
ей ЛЖ, а также улице острым ИМ и у постинфарктных пациентов [61 а, 155].
В течение предыдущего десятилетия антагонисты минералокортикоидных
рецепторов, при отсутствии противопоказаний, все активнее применяют
в лечении резистентной АГ: обычно — как 4-й или 5-й антигипертензив-
ный препарат при недостаточной эффективности обычной тройной
комбинации, включающей блокатор РАС (ингибитор АПФ или сартан),
БКК и тиазидовый/тиазидоподобный диуретик [123,137,155,171 ].
Более частое использование антагонистов минералокортикоидных рецеп-
торов в лечении АГ имеет достаточно веские патофизиологические обос-
нования. Показано, что даже «нормальные» количества альдостерона в
условиях диеты с относительно высоким содержанием натрия, присущей
современному образу жизни, способны активировать минералокорти-
коидные рецепторы в различных органах (стенка сосудов, сердце, почки,
головной мозг), что определяет развитие прессорного эффекта, а также ор-
ганных профибротических и провоспалительных эффектов [155,162].
Имеющиеся в распоряжении клинициста препараты этой подгруппы пред-
ставлены неселективным представителем — спиронолактоном (кото-
рый наряду с блокированием минералокортикоидных рецепторов также
взаимодействует с андрогеновыми и прогестероновыми рецепторами) и
селективным — эплереноном (который с андрогеновыми и прогестеро-
новыми рецепторами практически не взаимодействует) [123]. В силу этих
различий эплеренон значительно реже по сравнению со спиронолактоном
вызывает ряд побочных эффектов [171]. Оба препарата обладают органо-
протекторными эффектами и доказательной базой, подтверждающей их
благоприятное влияние на СС-прогноз [155].
Антигипертензивная эффективность антагонистов минералокортикоид-
ных рецепторов более выражена у больных с низкими уровнями ренина
и повышенным содержанием альдостерона плазмы; эта эффективность
существенно возрастает при их комбинации с ингибиторами АПФ или
сартанами, а также с диуретиками. При использовании сравнимых дози-
ровок антигипертензивная эффективность спиронолактона выше, чем
эплеренона [155].
Антагонисты минералокортикоидных рецепторов у лиц с АГ способны
уменьшать выраженность гипертрофии ЛЖ, улучшать его диастолическую
функцию; для них также продемонстрированы (косвенные?) противоарит-
мические эффекты (с уменьшением количества пароксизмов фибрилля-
ции/трепетания предсердий, а также желудочковых тахиаритмий) [171].
У лиц с диабетической нефропатией применение препаратов этой груп-
пы ассоциируется с уменьшением выраженности протеинурии. С учетом
представленных позитивных эффектов некоторые авторитетные эксперты
[155] ожидают в перспективе еще более значительного расширения
применения препаратов этой подгруппы при АГ (например, в каче-
стве 2-го антигипертензивного препарата при добавлении ктиазидо-
вому/тиазидоподобному диуретику).
Антагонисты минералокортикоидных рецепторов могут использоваться в
комплексной диуретической терапии (возможно — в сочетании с петлевы-
ми диуретиками) у лиц с отечным синдромом при циррозе печени и при
нефротическом синдроме [137].
Среди побочных эффектов антагонистов минералокортикоидных рецепто-
ров наиболее значимы гиперкалиемия и эффекты, связанные с влиянием
на андрогеновые/прогестероновые рецепторы (в первую очередь, гинеко-
мастия, но также дисменорея и снижение либидо).
Гиперкалиемия может развиваться при использовании обоих препаратов
этой подгруппы (распространенность ее составила около 2% при примене-
нии спиронолактона в дозе 25-50 мг/сутки у лиц с резистентной АГ в иссле-
довании ASCOT; для эплеренона в таких же дозировках, по данным EPHESUS,
она несколько ниже). Вероятность возникновения гиперкалиемии ниже у
лиц с сохранной функцией почек, а также при отсутствии сопутствующего
приема (3-АБ, ингибиторов АПФ, сартанов, прямых ингибиторов ренина и
калиевых добавок. У лиц, получающих антагонисты минералокортикоид-
ных рецепторов (особенно в сочетании с перечисленными выше классами
препаратов) рекомендуют контроль уровня калия крови не реже 1 раза в
3-6 месяцев. Эти препараты не следует использовать у лиц с СКФ менее
30 мл/мин/1,73 м2, а также при уровнях калия >5 ммоль/л [155,171].
Гинекомастия при использовании спиронолактона в дозах 25-50 мг/сутки
отмечается с частотой около 6%, для эплеренона в этих же дозировках ее
частота составляет менее 1%. Гинекомастия может развиваться у лиц обоего
пола, но чаще у мужчин; она представляет достаточно серьезное осложне-
ние и является нередкой причиной отмены препарата. Более высокая часто-
та ее развития при применении спиронолактона по сравнению с эплерено-
ном мотивирует рекомендацию некоторых авторов о предпочтительности
эплеренона в качестве препарата выбора из этой подгруппы лекарственных
средств как в целом, так и, особенно, в лечении мужчин [171,222].
Глава 9
Ингибиторы
ангиотензинпревращающего
фермента
Детальная характеристика группы ингибиторов АПФ с подробным пред-
ставлением их классификационных характеристик, обсуждением особен-
ностей побочных эффектов и сферы применения представлена нами в
предыдущем — втором — издании [31 ]; заинтересованный читатель может
к нему обратиться. Здесь мы представляем достаточно сжатую характери-
стику ингибиторов АПФ [10,15,155,187], что, на наш взгляд, более адекват-
но потребностям настоящего издания. На рис. 9.1 представлена структура
РАС с указанием групп влияющих на нее антигипертензивных средств.
ЮГА И Ренин [
-О
го
со
ее
го
1—
го
О-
VO
о
Повышение АД
м
Ангиотензиноген
*\
Ангиотензин 1
X
,«*--] АПФ
Ангиотензин II
i
Рецепторы ангиотензина II
V ♦
Вазоконстрикция,
прессорный эффект
Высвобождение
альдостерона
л , 1
■<
Задержка натрия, 1
фиброз тканей \
1 Рецепторы
\ альдостерона
Ингибиторы
АПФ
Сартаны
Антагонисты
альдостерона
Рис. 9.1. Структура РАС и группы влияющих на нее
антигипертензивных средств (адаптировано из [155])
Примечание. ПИР — прямые ингибиторы ренина; ЮГА — юкстагломерулярный аппарат.
Дозировки и кратность применения ингибиторов АПФ, применяемых в ми-
ровой практике для лечения АГ, представлены в табл. 9.1.
Некоторые фармакологические особенности ингибиторов АПФ представ-
лены в табл. 9.2 [73, 75,123,155].
Механизм антигипертензивного действия ингибиторов АПФ связан с их
блокирующим влиянием на РАС. Оно состоит в ингибировании преобразо-
вания неактивного AI в активный АН, обладающий отчетливым прессорным
(повышающим АД) эффектом. Кроме того, при применении ингибиторов
АПФ уменьшается расщепление вазодилатирующего вещества брадикини-
на, что обусловливает увеличение его содержания и также способствует
снижению АД [39,105,172,184].
В развитии антигипертензивного эффекта ингибиторов АПФ определен-
ную роль также играют и другие механизмы, перечисленные в табл. 9.3.
В табл. 9.4 представлена информация об органопротекторных эффектах
препаратов этой группы.
Таблица 9.1. Ингибиторы АПФ в лечении АГ (адаптировано из [123])
Препарат
Беназеприл*
Зофеноприл
Каптоприл
Квинаприл
Лизиноприл (Диротон)
Моэксиприл
Периндоприл
Рамиприл
Спираприл
Трандолаприл
Фозиноприл
Эналаприл
Доза, мг/сутки
Низкая
5
30
12,5 мг
2 раза в сутки
5
5
7,5
5
2,5
3
1-2
10
5
Обычная
10-40
60
50-100 мг
2 раза в сутки
10-40
10-40
30
10
5-10
6
2-8
10-40
10-40
Кратность
приема
1
1
2-3 (?)
1-2
1
1
1
1-2
1
1
1
1-2
Примечание. * На момент выхода издания в свет отсутствует в Украине.
Таблица 9.2. Ингибиторы АПФ в лечении АГ (адаптировано из [123])
Препарат
Беназеприл
Каптоприл
Зофеноприл
Эналаприл
Лизиноприл
(Диротон)
Рамиприл
Моэксиприл
Квинаприл
Периндоприл
Спираприл
Трандолаприл
Фозиноприл
Химическая
группа
в активном
центре молекулы
Карбоксильная
Сульфгидрильная
Сульфгидрильная
Карбоксильная
Карбоксильная
Карбоксильная
Карбоксильная
Карбоксильная
Карбоксильная
Карбоксильная
Карбоксильная
Фосфинильная
Активная
лекарственная
форма или
пролекарство
Пролекарство
Активная
форма
Пролекарство
Пролекарство
Активная
форма
Пролекарство
Пролекарство
Пролекарство
Пролекарство
Пролекарство
Пролекарство
Пролекарство
Липофиль-
ность
активного
метаболита
+
+
+
+
-
+
+
++
++
+
+
++
Продолжи-
тельность
действия, ч
24
6-12
24
18-24
24
24
12-18
24
24
24
>24
24
Доминиру-
ющий путь
выведения
Почки
Почки
Почки
Почки
Почки
Почки
Почки
Почки
Почки
Печень
Печень,
почки
Почки,
печень
Примечание.* Для всех ингибиторов АПФ имеются фиксированные комбинации с тиазидовыми/тиазидо-
подобными диуретиками: для периндоприла — с индапамидом, для остальных — с гидрохлоротиазидом
(лизиноприл + гидрохлоротиазид = Ко-Диротон®).
Таблица 9.3. Механизмы, лежащие в основе антигипертензивного
действия ингибиторов АПФ [123,155]
• Уменьшение синтеза мощного вазоконстриктора АН.
• Уменьшение образования альдостерона (может быть преходящим).
• Повышение уровней вазодилататора и вазопротектора брадикинина и связанное с
этим увеличение высвобождения тканевого активатора плазминогена (tPA).
• Увеличение активности 11 р-гидроксистероид-дегидрогеназы-2 — фермента, повы-
шающего экскрецию натрия почками (посредством протекции минералокортикоид-
ных рецепторов от действия кортизола).
• Блокирование активации симпатической нервной системы в ответ на вазодилатацию
(в результате, несмотря на снижение АД, не повышаются ЧСС и СВ, как это происходит
при использовании прямых вазодилататоров).
• Подавление образования эндотелина.
• Улучшение функции эндотелия.
• Снижение оксидативного стресса вследствие уменьшения продукции активных кис-
лородных радикалов и провоспалительных факторов.
• Стимуляция образования эндотелиальных клеток-предшственников.
Таблица 9.4. Органопротекторные эффекты ингибиторов АПФ [123,155]
Вазо- и кардиопротекция
• Увеличение податливости и снижение жесткости стенки аорты и крупных артерий;
уменьшение скорости распространения пульсовой волны; более сильное снижение
центрального аортального давления по сравнению с брахиальным; благоприятные
эффекты на циркадный профиль АД.
• Обратное развитие гипертрофии миокарда и гиперплазии структур сосудистой стенки.
• Blood Pressure Lowering Treatment Trialist's Collaboration: при АГ ингибиторы АПФ
обеспечивают достоверное снижение риска инсультов (на 19%), ИМ (на 16%), хрони-
ческой СН (на 27%) на каждые 5 мм рт. ст. снижения АД [123]. Более того, показано, что
даже без снижения АД ингибиторы АПФ способствуют снижению СС-риска примерно
на 9% (АД-независимая протекция).
• В целом ряде крупнейших исследований показаны выраженные благоприятные эф-
фекты ингибиторов АПФ на прогноз у больных с острым коронарным синдромом
(ОКС), хронической ИБС, хронической СН (они являются одними из ведущих классов
лекарственных препаратов в современном лечении таких больных).
Церебропротекция
• При АГ обеспечивают отчетливую первичную профилактику инсультов (возможно, что
сартаны обладают более выраженным протекторным эффектом в этом отношении).
• Способны обеспечивать вторичную профилактику (вероятно, в большей степени
не в виде монотерапии, но в комбинации с диуретиками, по данным исследования
PROGRESS).
Ренопротекция
• Уменьшение развития микроальбуминурии и протеинурии у больных СД (~ на 40%)
• Снижение степени выраженности уже существующей протеинурии у лиц с диабетиче-
скими и недиабетическими ХЗП.
• Уменьшение прогрессирования почечных поражений (повреждений подоцитов, раз-
вития гломерулосклероза) при диабетических и недиабетических нефропатиях, осо-
бенно при протеинурии 0,5 г/сутки и более.
• Несмотря на значительное снижение риска развития финальной стадии ХЗП, не отме-
чается уменьшения риска общей смертности.
• Снижение риска развития СД de novo (данные неоднозначны).
• Применение ингибиторов АПФ (как и сартанов) в современных рекомендациях веду-
щих почечных ассоциаций мира рассматривается как важный подход для профилак-
тики и замедления прогрессирования ХЗП.
Прочие благоприятные эффекты
• Снижение риска разрыва аневризмы брюшной аорты (подобный эффект не проде-
монстрирован для сартанов, диуретиков, (3-АБ, и БКК).
• Снижение степени выраженности полицитемии.
• Уменьшение гипертриглицеридемии у больных нефротическим синдромом.
• Уменьшение выраженности мигрени.
• Венодилатация и связанная с ней способность уменьшать образование отеков голе-
ней при сочетании с БКК.
Ингибиторы АПФ достаточно хорошо переносятся. Их основным побочным
эффектом является кашель (распространенность в белокожей популяции
составляет =10—15%; кашель более часто развивается у пожилых, женщин,
лиц азиатского и африканского происхождения) [123]. С частотой 5-6% при
приеме ингибиторов АПФ может наблюдаться бронхоспазм (в части случаев
в сочетании с кашлем) [155]. Кашель обычно сухой, непродуктивный, может
быть плохо переносимым, начинается либо через непродолжительное время
после начала приема ингибиторов АПФ, либо спустя несколько недель и даже
месяцев. Развитие кашля связывают с накоплением в организме брадикинина;
определенную роль отводят генетическому полиморфизму (Зг-рецептора бра-
дикинина. Устранение кашля наблюдают обычно в течение нескольких недель
после отмены ингибиторов АПФ. Обычным способом преодоления кашля в
этом случае является замена ингибиторов АПФ на сартаны [32,35,79,123,155].
Менее частым (но потенциально жизнеопасным в случае развития в области
гортани) побочным эффектом является ангионевротический отек (более
часто развивается у женщин и чернокожих) [123]. Развитие возможно как
сразу после начала приема ингибиторов АПФ, так и после их продолжитель-
ного использования. Больному, имевшему в анамнезе ангионевротический
отек, связанный с приемом ингибиторов АПФ, в дальнейшем не следует ни-
когда более назначать ни ингибиторов АПФ, ни сартанов [79,82,155].
Начало применения ингибиторов АПФ может сопровождаться увеличением
уровней креатинина сыворотки крови (степень выраженности может до-
стигать 30% от исходной величины, а у лиц, которые одновременно получают
диуретики и/или имеют относительно более значительное снижение АД, оно
может быть даже более значительным). Этот эффект связывают с уменьшением
давления в почечных клубочках и, как следствие, со снижением СКФ [123]. Та-
кое повышение креатинина является транзиторным и обычно не опасно [155]. В
случае, если степень его выраженности превышает 30% от исходных значений,
может требоваться снижение дозы ингибитора АПФ (и/или одновременно при-
меняемого диуретика). Значительное нарастание креатинина сыворотки может
наблюдаться улиц, которые наряду с ингибитором АПФ получают НПВП, а также
у имеющих стенозирующие поражения почечных артерий [66,76,80,111,123].
Большинство побочных эффектов ингибиторов АПФ обычно не являются дозо-
зависимыми (то есть примерно с равной частотой наблюдаются при использо-
вании как малых, так и больших дозировок). В связи с этим, улице АГ начинать
применение препаратов этой группы можно без титрования (то есть при
необходимости можно сразу использовать средние или высокие дозы) [123].
Единственным исключением является гиперкалиемия, вероятность разви-
тия которой повышается при использовании высоких доз ингибиторов АПФ.
Риск гиперкалиемии увеличен при использовании ингибиторов АПФ у лиц со
сниженной функцией почек, а также при их одновременном использовании с
калийсберегающими диуретиками и калиевыми добавками [70,130,131,155].
НПВП могут отчетливо уменьшать антигипертензивные эффекты ингибиторов
АПФ, что, вероятно, связано с блокированием образования вазодилатирую-
щих простагландинов. Ранее вызывавшее у экспертов опасение взаимодей-
ствие ингибиторов АПФ с небольшими дозами аспирина, применяемыми для
С/С-протекции, не имеет существенного клинического значения [123,132,147].
Наряду с широким использованием в лечении АГ, ингибиторы АПФ также при-
меняют в качестве одного из важных компонентов лечебной тактики у боль-
ных ИБС (как при ОКС, так и при хронических вариантах), хронической СН
(с систолической дисфункцией ЛЖ), СД1 -го и 2-го типов, а также ХЗП [61 а,
123, 155]. Они обладают огромной доказательной базой по разноплановой
органопротекции (вазо-, кардио-, рено-, церебропротекции), по улучшению
СС-прогноза у больных с перечисленными выше состояниями [123,155,167].
При использовании в режиме монотерапии ингибиторы АПФ обеспечива-
ют более выраженное снижение АД у белокожих пациентов по сравнению
с чернокожими, что связывают с исходно менее высокой активностью РАС
у чернокожих. В то же время, антигипертензивная эффективность комбина-
ций ингибиторов АПФ как с диуретиками, так и с БКК, идентична для лиц раз-
ных этнических и расовых групп [123].
В современной клинической практике не рекомендуют использование
комбинаций ингибиторов АПФ с сартанами (это касается применения
препаратов этих групп как при АГ, так и при иных состояниях). Несмотря на
то, что и ингибиторы АПФ, и сартаны порознь обладают значимыми рено-
протекторными эффектами, при применении в комбинации они могут ока-
зать неблагоприятные эффекты на состояние функции почек [123,167].
На начальном этапе применения ингибиторов АПФ у лиц, уже получающих
диуретики (а также у придерживающихся очень строгой низкосолевой диеты
и у пребывающих в состоянии дегидратации — работающих в условиях жары
или имеющих диарею) имеется риск развития гипотензии. Для тех пациентов,
которые уже принимают диуретик, рекомендуют снизить его дозу перед на-
значением ингибитора АПФ во избежание развития гипотензии [75,155].
Резкая отмена ингибиторов АПФ не ассоциирована с развитием «синдрома
рикошета» [123]. Ингибиторы АПФ противопоказаны при беременности
(особенно во II и III триместре), поскольку их применение может нарушить
нормальное развитие плода [155].
В табл. 9.5 и 9.6 представлена информация, касающаяся возможностей приме-
нения одного из авторитетных и хорошо изученных представителей ингибито-
ров АПФ — лизиноприла (препарат компании «Рихтер Гедеон» — Диротон).
Таблица 9.5. Общая характеристика лизиноприла [155]
(Диротон, Ко-Диротон®*)
• Лизиноприл — представитель ингибиторов АПФ — одного из 5 основных классов ан-
тигипертензивных препаратов. Лизиноприл является активным веществом, которое
для осуществления антигипертензивного и органопротекторного действия не требует
биотрансформации.
• Лизиноприл — гидрофильный ингибитор АПФ с незначительным метаболизмом в
жировой ткани; по данным ряда экспертов, это обеспечивает ему возможность эффек-
тивного использования у лиц с избыточной массой тела.
• Лизиноприл — классический длительно действующий ингибитор АПФ, применяется
1 раз в сутки (лучше — в одно и то же время), независимо от приема пищи.
• Лизиноприл выводится почками, в связи с чем требуется уменьшение дозы на
25-50% при использовании у лиц с СКФ <60 и, особенно, <30 мл/мин/1,73 м2 (на-
чальная доза лизиноприла улице СКФ в пределах 30-60 мл/мин/1,73 м2 — не более
5-10 мг/сутки; СКФ в пределах 10-30 мл/мин/1,73 м2 — не более 2,5-5 мг/сутки;
СКФ <10 мл/мин/1,73 м2, включая диализных больных — не более 2,5 мг/сутки).
Применение у лиц со сниженной функцией почек требует осторожности и особен-
но тщательного контроля СКФ и электролитов крови.
• С учетом почечного пути выведения лизиноприл может представлять один из ингиби-
торов АПФ выбора у лиц с заболеваниями печени.
• Лизиноприл — один из наиболее изученных представителей класса ингибиторов АПФ.
• Антигипертензивные эффекты лизиноприла изучены в целом ряде плацебо-контроли-
руемых исследований. Показаны:
- быстрое начало действия (примерно через 1 ч после приема внутрь); достижение
максимума этого эффекта примерно через 2-4 недели после начала применения;
- сохранение антигипертензивного действия в течение не менее 24 часов при одно-
кратном суточном приеме и его четкий дозозависимый характер;
- плавность и устойчивость снижения АД, низкая вариабельность эффекта в течение суток;
- отсутствие тахифилаксии (снижения выраженности антигипертензивного действия)
при многомесячном применении;
- отсутствие синдрома отмены;
-дополнительное значимое возрастание антигипертензивного эффекта при сочетан-
ном применении с гидрохлоротиазидом;
- отличная переносимость.
• Обладает впечатляющей доказательной базой о благоприятном влиянии на СС-про-
гноз (исследования ATLAS, GISSI-3, ALLHAT) и почечный прогноз (EUCLID, Chaturvedi N.
et al., 1997; Cinotti G.A., Zucchelli C, 2000; Schjoedt К J. et al., 2008).
• Представлены доказательства разнопланового органопротекторного действия:
- регрессия гипертрофии ЛЖ;
- уменьшение микроальбуминурии и протеинурии у больных АГ, СД 2-го типа, первич-
ным гломерулонефритом.
• Препарат располагает данными крупных исследований о высокой безопасности. Так,
в крупнейшем исследовании ATLAS при использовании в дозах 32,5-35 мг/сутки в те-
чение в среднем 46 месяцев у пациентов с хронической СН (включая лиц с СД) лизи-
ноприл не показывал увеличения риска гиперкалиемии и снижения функции почек.
Примечание.
* Генерическая комбинация лизиноприла и амлодипина под названием «Экватор» представлена в гл. П.
Таблица 9.6. Особенности применения лизиноприла
(Диротон, Ко-Диротон®*) при АГ
Общие особенности препаратов Диротон/Ко-Диротон®
• Препарат Диротон — таблетки по 5,10 и 20 мг лизиноприла (28 таблеток в упаковке).
Препарат Ко-Диротон® — таблетки по 10 мг/12,5 мг и 20 мг/12,5 мг соответственно лизи-
ноприла и гидрохлоротиазида (10 таблеток в блистере, по 1 или 3 блистера в упаковке).
• Производится авторитетной и в течение многих десятилетий присутствующей на оте-
чественном фармакологическом рынке компанией «Рихтер Гедеон». В отечественной
медицине препарат неизменно демонстрирует высокое качество, составил о себе хо-
рошее мнение у практикующих врачей.
• Применение: у пациентов с АГ, в том числе трудно контролируемой другими анти-
гипертензивными препаратами, хронической СН с систолической дисфункцией и со-
хранной фракцией выброса ЛЖ, у больных СД 1-го и 2-го типов, ХЗП (диабетическими
и недиабетическими), ИБС (включая ОКС во всех его формах, а также хроническую
ИБС), для первичной и вторичной профилактики инсульта.
• Действие препарата не зависит от приема пищи.
• Однократный прием в течение суток.
• Начальная доза лизиноприла — 2,5-5 мг/сутки, максимальная — 40 мг/сутки. Титро-
вание дозы при АГ не требуется, при хронической СН дозу следует титровать.
• Не сочетать с сартанами. Оба препарата отлично сочетаются с широко используемыми
в кардиологии классами лекарственных препаратов, включая антитромботические,
статины, сердечные гликозиды, нитраты, противоаритмики.
• Не требуется снижения дозы у лиц в возрасте >65 лет, при СКФ 60-90 мл/мин/1,73 м2,
при снижении функции печени. При СКФ < 30 мл/мин/1,73 м2 требуется снижение дозы.
• Противопоказан у беременных и кормящих.
Применение при АГ
• Широкие возможности использования при неосложненной АГ как в виде монотера-
пии, так и в составе различных комбинаций. Наилучшая тройная комбинация — лизи-
ноприл + диуретик + БКК.
• АГ у больных СД 2-го типа с нефропатией.
• АГ у больных ИБС.
• АГ у больных хронической СН с систолической дисфункцией ЛЖ: могут использовать-
ся и Диротон, и Ко-Диротон®. Для максимально благоприятного влияния на СС-про-
гноз желательно титрование дозы до целевой.
• АГ у больных хронической СН с сохранной фракцией выброса ЛЖ.
• АГ у больных СД 2-го типа без нефропатии, СД 1 -го типа независимо от наличия нефро-
патии; при ХЗП могут использоваться и Диротон, и Ко-Диротон®.
• АГ у больных остеопорозом (Ко-Диротон®).
• Важно отметить, что препараты Диротон (20 мг, 28 таблеток) и Ко-Диротон®
(10/12,5 мг — 30 таблеток) входят в перечень препаратов, рекомендованный Пилот-
ным проектом МЗ Украины для лечения больных АГ.
Примечание.
* Генерическая комбинация лизиноприла и амлодипина под названием «Экватор» представлена в гл. 7 7.
Глава 10
Антагонисты рецепторов
ангиотензина II (сартаны)
Как и для ингибиторов АПФ, в настоящем издании мы приводим лишь крат-
кую характеристику сартанов. Более детальное обсуждение представлено
в предыдущем, втором, издании [31].
В табл. 10.1 представлены дозировки и кратность применения сартанов
при АГ. Некоторые фармакологические особенности сартанов представле-
ны в табл. 10.2.
Как и ингибиторы АПФ, сартаны оказывают влияние на РАС (см. рис. 9.1,
гл. 9). В основе их антигипертензивного эффекта лежит блокирование
влияния мощного вазоконстриктора All на рецепторы к All 1-го типа
(АТ1-рецепторы) [1, 13, 88, 102]. Сартаны обеспечивают дозозависимое
снижение ОПСС при отсутствии значимого влияния на ЧСС и СВ. Вслед-
ствие соревновательного ингибирования АТ1-рецепторов при исполь-
зовании сартанов развивается повышение уровней АН в циркуляции; до
настоящего времени какого-либо клинически значимого негативного
или позитивного влияния этого эффекта не выявлено [23, 87, 123, 155,
187]. Блокада РАС при применении сартанов считается более полной,
нежели при использовании ингибиторов АПФ, так как блокируются
все эффекты All на ткани независимо от путей его образования (то есть
АПФ- или не-АПФ-зависимого, химазного) [17,111,155].
Сартаны демонстрируют хорошую переносимость. Поскольку они не вы-
зывают кашля, крайне редко ассоциированы с развитием ангионевроти-
ческого отека, а также оказывают сравнимые с ингибиторами АПФ анти-
гипертензивные и органопротекторные эффекты, сартаны (при отсутствии
противопоказаний и с учетом доступности) обычно оказываются пред-
почтительными по сравнению с ингибиторами АПФ [35, 123, 147,155].
В начале приема сартанов (как и ингибиторов АПФ) возможно повышение
уровней креатинина сыворотки крови, но этот эффект является преходя-
щим и опасности не представляет [24,137,198].
Если ранее считалось, что сартаны не оказывают влияния на уровни бради-
кинина, то сейчас продемонстрировано, что при их использовании наблюда-
ют достаточно значимое (примерно двукратное) их нарастание [45,77,123].
Таблица 10.1. Сартаны в лечении АГ (адаптировано из [123])
Препарат
Азилсартан
Валсартан
Ирбесартан
Кандесартан
Лосартан
Олмесартан
Телмисартан
Эпросартан
Доза, мг/сутки
Низкая
40
80
150
4
50
10
40
400
Обычная
80
80-320
150-300
8-32
50-100
20-40
40-80
600-800
Кратность
приема
1
1-2
1
1
1-2
1
1
1-2
Таблица 10.2. Некоторые фармакологические особенности сартанов
(адаптировано из [155])
Препарат
Азилсартан*
Валсартан
Ирбесартан
Кандесартан
Лосартан
Олмесартан
Телмисартан
Эпросартан
Период
полувы-
ведения,
ч
11
9
11-15
3-11
2 (6-9)
13
24
5-7
Актив-
ный
метабо-
лит
-
-
-
Да
Да
Да
-
-
Влияние
приема
пищи на
абсорбцию
-
Да
-40%
-
-
Да
-10%
-
Да,
-20...-6%
-
Путь
выведения
Почки —42%,
печень — 55%
Почки — 30%,
печень — 70%
Почки — 20%,
печень — 80%
Почки —60%,
печень — 40%
Почки —60%,
печень — 40%
Почки —10%,
печень — 90%
Почки — 2%,
печень — 98%
Почки — 30%,
печень — 70%
Дополнительные
свойства
-
-
Слабый агонист
PPARY-рецептора**
-
Урикозурические
-
Агонист
PPARy-рецептора**
Симпатолитик
Примечания.* Цпя всех сартанов имеются фиксированные комбинации с тиазидовыми/тиазидоподобны-
ми диуретиками: для азилсартана — с хлорталидоном, для остальных — с гидрохлоротиазидом.
** Влияние на пероксисомный пролифераторактивируемый рецептор у (PPARy) обеспечивает дополни-
тельные благоприятные эффекты на метаболизм глюкозы и липидов: более сильное — у телмисартана,
менее выражено — у ирбесартана.
Препараты этой группы не обладают дозозависимыми побочными эффек-
тами. В этой связи начало лечения сартанами вполне возможно сразу со
средних или даже (при необходимости) с максимальных дозировок [123].
Особо следует отметить отсутствие у сартанов такого нередкого для инги-
биторов АПФ побочного эффекта, как кашель. Развитие ангионевротиче-
ского отека при использовании сартанов наблюдается еще реже, чем при
применении ингибиторов АПФ [123,130].
Антигипертензивные и органопротекторные (локальные сосудистые про-
тивовоспалительные, улучшающие функции эндотелия, антиоксидантные,
выраженные ренопротекторные) эффекты сартанов близки к таковым у
ингибиторов АПФ (см. табл. 9.4, гл. 9) [155]. Сартаны обладают такими же
благоприятными эффектами на СС- и почечный прогноз, что и ингибиторы
АПФ [123]. Для кандесартана и валсартана показана возможность улучше-
ния когнитивной функции у пожилых лиц с АГ [134,136,155].
Сартаны, как и ингибиторы АПФ, могут уменьшать толерантность к органиче-
ским нитратам. Обе эти группы препаратов способны стабилизировать атеро-
склеротические бляшки (то есть снижают вероятность их разрыва) [123].
Сартаны в трех крупных исследованиях (два из них — с ирбесартаном,
одно — с лосартаном) показали отчетливую ренопротекцию (с уменьшени-
ем темпа прогрессии почечного поражения на 20-30%) у больных с нефро-
патией при СД 2-го типа. Однако в этих исследованиях не было отмечено
снижения общей смертности (как и для ингибиторов АПФ в соответствую-
щих исследованиях при диабетической нефропатии) [23,123,155].
Сартаны, возможно, обеспечивают более значимый нейропротектор-
ный (церебропротекторный) эффект по сравнению с другими класса-
ми антигипертензивных препаратов, однако четких данных из крупных
исследований, которые бы подтвердили это предположение, пока не
представлено [155].
В рекомендованных дозах (табл. 10.7) все имевшиеся до недавнего време-
ни в распоряжении клинициста сартаны (кроме азилсартана) демонстри-
ровали сравнимую антигипертензивную эффективность [155]. Азилсартан,
по данным ряда довольно серьезных сообщений, показывает несколько
более значимую антигипертензивную способность [123]. Антигипертен-
зивный эффект всех сартанов как по выраженности, так и по продолжи-
тельности существенно возрастает при их комбинации с тиазидовыми
диуретиками. Он также увеличивается при повышении дозировки сартана
(однако, кривая доза/эффект имеет пологую форму) [45, 77,155].
Как и ингибиторы АПФ, сартаны при изолированном применении пока-
зывают более высокую антигипертензивную эффективность у белоко-
жих и азиатских пациентов по сравнению с чернокожими [155]. Однако
при использовании в комбинации с диуретиками или БКК, их эффектив-
ность становится независимой от расы и этнической принадлежности
пациента [123].
Наряду с применением при АГ и диабетической нефропатии сартаны
также находят применение при:
• ОКС (валсартан);
• хронической ИБС (валсартан, телмисартан);
• хронической СН со сниженной систолической функцией ЛЖ (валсартан,
кандесартан, лосартан);
• СД (любые) [123].
Для этих показаний сартаны применяют как альтернативу ингибиторам
АПФ (обычно — при непереносимости ингибиторов АПФ) [155]. Для сарта-
нов (как и для ингибиторов АПФ) в нескольких исследованиях не было пока-
зано значимого благоприятного эффекта на диастолическую функцию ЛЖ и
на прогноз улице хронической СН с сохранной фракцией выброса ЛЖ [155].
Ряд исследователей полагают, что сартаны и ингибиторы АПФ могут умень-
шать количество пароксизмов фибрилляции/трепетания предсердий, но в
серьезных рандомизированных исследований такую способность ни од-
ной из этих групп препаратов продемонстрировать не удалось [80,123].
В одном из некрупных исследований у лиц с синдромом Марфана на фоне
лечения сартаном отмечено существенное уменьшение темпа прогресси-
рования дилатации корня аорты [155].
Как уже отмечалось, не следует комбинировать сартаны и ингибиторы
АПФ — несмотря на наличие у каждого из этих классов самостоятельных
ренопротекторных эффектов, их комбинация может повышать риск разви-
тия побочных эффектов со стороны почек [123].
В начале применения сартана у пациента, который уже использует диуре-
тик, обычно рекомендуют уменьшение дозы диуретика, что позволит избе-
жать возможного чрезмерного снижения АД [70].
Сартаны не следует использовать во время беременности (особенно во II и
III триместрах), так как они могут нарушать нормальное развитие плода [67,155].
Глава 11
Блокаторы кальциевых каналов
Как и остальные группы антигипертензивных препаратов, БКК в настоящем
издании охарактеризованы нами достаточно сжато; более подробное пред-
ставление об их особенностях, механизме действия и подходах к выбору
конкретного препарата можно найти в предыдущем (втором) издании [31].
Дозировки и кратность применения БКК, применяемых в лечении АГ, пред-
ставлены в табл. 11.1. Некоторые фармакологические особенности БКК
представлены в табл. 11.2.
Механизм антигипертензивного действия БКК состоит в артериальной вазо-
дилатации, развитие которой обеспечивается посредством блокирования
направленного внутрь гладкомышечных клеток артериальной стенки пото-
ка ионов кальция через вольтажные кальциевые каналы L-типа [4,77,155].
Как видно из табл. 11.1, выделяют два основных типа БКК:
• дигидропиридиновые производные, такие как амлодипин и нифедипин,
действие которых состоит в развитии артериальной дилатации;
• недигидропиридиновые препараты, такие как верапамил и дилтиазем, кото-
рые в несколько меньшей степени дилатируют артерии, но обладают также
способностью уменьшать ЧСС и снижать сократимость миокарда [57,123].
Наиболее изученными в лечении АГ среди представителей БКК являются ди-
гидропиридиновые, а среди них — амлодипин и нифедипин (продленного
действия); для этих препаратов имеются наиболее значительный объем дан-
ных доказательной медицины, документирующих их благоприятные эффекты
по снижению риска инсультов и других СС-осложнений при АГ [33,76,123].
Антигипертензивная эффективность различных БКК близка. По данным
12 крупных РКИ, как дигидропиридиновые, так и недигидропиридиновые
препараты обладают сравнимой с другими основными классами антигипер-
тензивных препаратов способностью снижать у лиц с АГ частоту коронарных
осложнений и риск развития СН [123,155]. БКК, возможно, обеспечивают бо-
лее выраженное снижение риска инсультов у лиц с АГ (первичная профилак-
тика) по сравнению с диуретиками, (3-АБ и ингибиторами АПФ [62,91,136].
Некоторые дигидропиридиновые препараты (фелодипин, нимодипин, ни-
федипин и, в меньшей степени, амлодипин) имеют умеренную способность
блокировать минералокортикоидные рецепторы [123]. Клиническая значи-
мость этого эффекта пока неясна (но ряд фармацевтических компаний ведет
Таблица 11.1. БКК в лечении АГ (адаптировано из [123])
Препарат
Доза, мг/сутки
Низкая
Обычная
Кратность
приема
Дигидропиридиновые
Амлодипин
Исрадипин*
Лацидипин
Лерканидипин
Нифедипин
продленного действия
Нитрендипин
Фелодипин
2,5
2,5 мг
2 раза в сутки
2
10-20
20
10
2,5
5-10
5-10 мг
2 раза в сутки
2-4
20-40
20-90
20
5-10
1
1-2
1-2
1
1-2
1
1-2
Недигидропиридиновые (снижающие ЧСС)
Верапамил
Дилтиазем
120
120
240-480
240-360
1-2
1-2
Примечание. * На момент выхода издания в свет отсутствует в Украине.
Таблица 11.2. Некоторые фармакологические особенности БКК [3,85,155]
Препарат
Амлодипин
Исрадипин*
Лацидипин
Лерканидипин
Нифедипин
продленного действия
Нитрендипин
Фелодипин
Верапамил:
• короткого действия
• продленного действия
Дилтиазем:
• короткого действия
• продленного действия
Время до дости-
жения пикового
эффекта, ч
6-12
1,5
0,5-1,5
1,5-3
6
1-2
2,5-5
0,5-1
4-6
0,5-1,5
6-11
Период
полувыведе-
ния, ч
30-50
8-12
13-19
8-10
7
8-24
11-16
4,5-12
4,5-12
2-5
2-5
Биодоступ-
ность (прием
внутрь), %
60-65
15-24
5-15
30**
30-50
60-70
10-25
40-50
40-50
40
40
Примечания. *На момент выхода издания в свет отсутствует в Украине.
** Снижение до 10% при приеме после еды.
активную разработку специальных препаратов из группы БКК, которые бу-
дут обладать этим эффектом в более выраженной степени). Ни верапамил,
ни дилтиазем такой способностью не обладают [155].
Короткодействующие БКК (в первую очередь, нифедипин) могут вызывать
резкое снижение АД, что может способствовать развитию коронарной и
церебральной ишемии [123]. В этой связи в настоящее время нифедипин ко-
роткого действия практически не находит применения в лечении как АГ, в
целом, так и ГК, в частности [25]. Длительнодействующие БКК способностью
вызывать резкое снижение АД не обладают; антигипертензивный эффект при
их применении развивается постепенно [85,123].
Антигипертензивное действие БКК более выражено у пожилых лиц по сравне-
нию с более молодыми и у чернокожих пациентов по сравнению с белокожи-
ми [33,155,144,213]. БКК оказывают небольшое натрийуретическое действие
(в этой связи их антигипертензивная эффективность может быть более высока
у солечувствительных пациентов) [123].
Препараты этого класса не имеют неблагоприятных эффектов на метаболизм
глюкозы, инсулина, липидов, вследствие чего представляют удачный выбор
антигипертензивных препаратов у лиц с СД (и факторами риска его развития),
метаболическим синдромом, гиперлипидемией, ожирением [123,217].
Важными для применения у больных АГ при наличии ХЗП могут быть следу-
ющие особенности этих препаратов:
• БКК не требуют коррекции дозы при сниженной функции почек (включая по-
жилых лиц со сниженной СКФ) [155,162];
• у лиц с наличием протеинурии при изолированном применении БКК пред-
почтителен выбор недигидропиридиновых препаратов; дигидропиридино-
вые производные применять следует не изолированно, а в комбинации с
ингибиторами АПФ или сартанами [123,162];
• амлодипин, верапамил и дилтиазем увеличивают сывороточные концент-
рации циклоспорина, а верапамил и дилтиазем повышают сывороточные
концентрации сиролимуса, эверолимуса и такролимуса (иммуносупрес-
сивных препаратов, используемых для предупреждения отторжения по-
чечных трансплантатов); в этой связи при их совместном использовании
требуются особая осторожность и тщательный контроль концентраций
этих препаратов в сыворотке крови. Привлекательна практика назначе-
ния перечисленных БКК в добавление к указанным дорогостоящим им-
муносупрессирующим лекарственным средствам (что позволяет снизить
дозы последних и, таким образом, удешевить лечение) [162].
БКК не взаимодействуют с НПВП [155].
Значимой фармакологической особенностью БКК, которая может лежать в
основе их некоторых побочных эффектов, является активация симпатиче-
ской нервной системы (присуща в большей степени дигидропиридиновым
препаратам; минимально выражена или отсутствует у амлодипина) [155].
При использовании длительнодействующих препаратов этой подгруппы
(фелодипин,лерканидипин) спустя несколько недель после начала приема
этот эффект существенно ослабевает [73,85,123].
Среди побочных эффектов БКК достаточно нередкими (затрудняющими их
применение примерно у 10% больных) являются: головная боль, приливы и
локальные отеки голеней. Все они связаны с локализованной вазодилатацией.
Отечность голеней при использовании БКК:
• дозозависима;
• не обусловлена генерализованной задержкой жидкости;
• не предотвращается и не устраняется приемом диуретиков [123].
При возникновении отечности голеней при использовании БКК можно:
• добавить к БКК ингибитор АПФ или сартан;
• сделать попытку перевода больного с дигидропиридинового препарата
на недигидропиридиновый [155].
В нескольких небольших по объему работах отмечена менее высокая частота
развития отеков при использовании лацидипина и лерканидипина по сравне-
нию с амлодипином, однако этот вопрос требует уточнения [31,62,155].
Необходимо упомянуть о феномене стереовращающих изомеров (примени-
тельно к молекуле амлодипина). Обычный амлодипин представляет собой
рацемат (смесь) двух изомеров — правовращающего (d-) и левовращаю-
щего (s-). Именно для рацемата представлена впечатляющая доказательная
база (авторитетные исследования — см. табл.11.3) о благоприятном влия-
нии на СС-прогноз и высокой безопасности. Нет оснований, чтобы перено-
сить эти позитивные данные на представленный сейчас на отечественном
фармакологическом рынке левовращающий амлодипин (s-). По причине
отсутствия этой доказательной базы о влиянии на СС-прогноз s-амлодипин
не зарегистрирован для применения в США. В достаточно беспристрастном
метаанализе LiuF. etal., 2010 [164], включившем 15 РКИ с прямым сравнением
s-амлодипина и рацемата амлодипина указывается, что:
• большинство (12 из 15) РКИ были относительно невысокого качества;
• антигипертензивная эффективность 2,5 мг/сутки s-амлодипина была
сравнима с 5 мг/сутки рацемата амлодипина;
• при суммации данных всех работ отмечено, что s-амлодипин существен-
но реже вызывал отеки, чем рацемат (при анализе только 3 высококаче-
ственных РКИ таких различий не выявлено);
• для изучения влияния s-амлодипина на СС-прогноз и оценки его безопас-
ности нужны длительные высококачественные РКИ с «жесткими» конеч-
ными точками (такими как общая и СС-смертность).
Применение нифедипина может быть ассоциировано с развитием гипер-
плазии десен [155].
Недигидропиридиновые БКК не следует применять у больных СН со снижен-
ной систолической функцией ЛЖ. Безопасным у этой категории больных явля-
ются амлодипин и фелодипин; они могут быть использованы у таких пациен-
тов (например, для лечения АГ и контроля стенокардии) в добавление к стан-
дартной терапии (включающей обычно ингибитор АПФ и (3-АБ) [61 а, 123,155].
Поскольку недигидропиридиновые БКК (верапамил и дилтиазем) обладают
способностью снижать ЧСС, они иногда оказываются предпочтительными у
пациентов со склонностью к тахикардии; они также могут быть использова-
ны для контроля частоты ритма при ФП у лиц, которые не могут переносить
Р-АБ [123]. Для недигидропиридиновых препаратов также показана способ-
ность уменьшать уровни протеинурии [155].
БКК являются мощными антигипертензивными препаратами, особенно при
совместном применении с ингибиторами АПФ, сартанами, диуретиками [70].
Кроме терапии АГ, БКК могут также применяться при [123]:
• хронической ИБС — как базисный антиангинальный класс;
• хронической СН со сниженной систолической функцией ЛЖ — для лечения
АГ и стенокардии (амлодипин или фелодипин);
• тахиаритмиях — только недигидропиридиновые БКК;
• ХЗП — для снижения протеинурии (в первую очередь — недигидропириди-
новые препараты, но также возможно применять и дигидропиридиновые,
если добавлять их к ингибиторам АПФ или сартанам);
• гипертрофической кардиомиопатии (верапамил или дилтиазем);
• аортальной регургитации;
• церебральных геморрагиях (нимодипин);
• периферических сосудистых поражениях, синдроме Рейно.
Дигидропиридиновые препараты, в отличие от недигидропиридиновых, мо-
гут безопасно комбинироваться с Р-АБ [123].
В табл. 11.3 представлена характеристика фиксированной комбинации амло-
дипина с лизиноприлом — препарат Экватор производства «Рихтер Гедеон»,
содержит 5 мг амлодипина + 10 мг лизиноприла, или 10 мг + 20 мг, соответ-
ственно; в упаковке по 10, 20, 30 и 60 таблеток. В табл. 11.4 дана характери-
стика фиксированной комбинации амлодипина с аторвастатином — препарат
Дуплекор® производства «Рихтер Гедеон», содержит соответственно амлоди-
пина и аторвастатина: 10 мг +10 мг; 10 мг + 20 мг; 5 мг +10 мг; 5 мг + 20 мг; в упа-
ковке по 30 таблеток). По мнению авторов, эти генерические фиксированные
комбинации характеризуются авторитетным уровнем производства, высокой
эффективностью и безопасностью, вследствие чего заслуживают широкого
использования в лечении различных категорий больных АГ.
Таблица 71.3. Характеристика препарата Экватор
(генерическая фиксированная комбинация
амлодипина и лизиноприла:
таблетки по 5 мг + 10 мг, 10 мг + 20 мг)
Общая характеристика
• Каждый из компонентов этой комбинации — представитель одного из наиболее часто
применяемых классов антигипертензивных препаратов: амлодипин — БКК, лизино-
прил — ингибитор АПФ.
• Комбинация БКК с ингибитором АПФ оправдана с патофизиологической и клинической
точек зрения. Например, взаимное усиление антигипертензивного действия, сниже-
ние риска развития отеков в ответ на амлодипин [155]. Эта комбинацию в современ-
ных (2013-2014 гг.) рекомендациях рассматривают как одну из наиболее предпочти-
тельных [123,136,137]. Подобные комбинации с успехом применялись в крупнейших
РКИ (ASCOT, ACCOMPLISH).
Характеристика компонентов препарата Экватор
• Подробная характеристика лизиноприла представлена в табл. 9.6 {см. гл. 9).
• Амлодипин — дигидропиридиновый БКК III поколения, один из наиболее назначае-
мых антигипертензивных и антиангинальных препаратов в мире [155].
• Амлодипин не оказывает неблагоприятных эффектов на липидный спектр и гликемию.
• Амлодипин имеет наиболее длительный среди препаратов своего класса период по-
лувыведения (30-50 ч), что обеспечивает ему:
- постепенное и плавное начало действия;
-длительный и стабильный антигипертензивный и антиангинальный эффекты;
- возможность приема 1 раз в сутки;
- высокую приверженность больных лечению;
- отсутствие риска подъема АД и усиления стенокардии при случайном пропуске па-
циентом приема препарата.
• Максимальная концентрация амлодипина в плазме достигается через 6-12 ч после
приема внутрь (вследствие чего отчетливые антигипертензивный и антиангинальный
эффекты развиваются уже через 6 ч после первого приема). Стабильное равновесие
концентрации происходит к 7-8-у дню после начала приема (клинические эффекты
препарата в начале терапии день ото дня могут постепенно нарастать и стабилизиро-
ваться к 7-8-у дню).
• Прием пищи не оказывает влияния на фармакодинамику и фа рма коки нетику амлодипина.
• Препарат обеспечивает подтвержденные в крупных работах: коронарную вазоди-
латацию/значимые антиангинальные эффекты (САРЕ II), отчетливые антиатероскле-
ротические эффекты (PREVENT, NORMALIZE), улучшение прогноза при хронической
ИБС (PREVENT, CAMELOT).
• В целом ряде авторитетных исследований амлодипин демонстрировал отчетливый
антигипертензивный эффект, улучшение суточного профиля АД, благоприятное вли-
яние на прогноз при АГ (в том числе почечный и цереброваскулярный) и отличную
переносимость (ALLH AT, VALUE, ASCOT).
• В исследованиях PRIME I и PRIME II амлодипин показал высокую безопасность при исполь-
зовании для контроля АД и стенокардии у лиц с СН с систолической дисфункцией ЛЖ.
Продолжение табл. 11.3 — на стр. 92.
Продолжение табл. 11.3
Возможности применения препарата Экватор при АГ
• Может широко применяться в лечении АГ:
- независимо от пола и возраста;
- как начальная терапия или при недостаточной эффективности предыдущих анти-
гипертензивных режимов;
- в качестве единственного антигипертензивного подхода или в составе многокомпо-
нентных комбинаций.
• Компоненты препарата Экватор (все варианты доз) включены в Пилотный проект по
лечению больных АГ (Украина, 2013).
• Экватор используют у следующих категорий больных АГ:
- при неосложненной эссенциальной АГ (гипертонической болезни);
- при АГ у пожилых (включая лиц с ИСАГ, а также пациентов с разнообразными сопут-
ствующими состояниями);
- при АГ у больных хронической ИБС — как при наличии ангинального синдрома, так
и при его отсутствии; независимо от перенесенных ИМ и процедур коронарной рева-
скуляризации; в сочетании с иными стандартными лечебными подходами — стати-
нами, антитромботиками (см. гл. 14);
- при АГ и/или стенокардии у больных хронической СН с систолической дисфункцией
ЛЖ (в сочетании с прочими стандартными лечебными подходами — диуретиками,
Р-АБ, антагонистами минералокортикоидных рецепторов);
- при АГ у лиц с СД, метаболическим синдромом, гиперлипидемией, ожирением;
- при АГ в сочетании с ХЗП (в качестве, в том числе, и ренопротекторного подхода; при-
меняется вплоть до ХЗП 4-й стадии включительно; улице ХЗП 3-4-й стадии требуется
снижение дозы в 2 раза);
- при АГ у больных хроническим обструктивным заболеванием легких;
- при АГ у постинсультных больных;
- при АГ у лиц с периферическими сосудистыми заболеваниями.
• Обычное применение: 1 таблетка 1 раз в сутки (в начале использования возможно
Уг таблетки в сутки. Доза требует снижения (не более Уг таблетки в сутки) при выра-
женном снижении функции почек и печени.
• Препарат не следует использовать при беременности и кормлении грудью.
Таблица 11.4. Характеристика препарата Дуплекор®
(генерическая фиксированная комбинация
амлодипина и аторвастатина: таблетки
по 10 мг+10 мг, 10мг + 20мг, 5мг+ 10 мг, 5 мг +20 мг)
Общая характеристика
• Препарат представляет собой пример нового варианта фиксированных комбинаций,
используемых в лечении больных АГ, — сочетание в одной таблетке:
-эффективного антигипертензивного препарата с самостоятельным благоприятным
влиянием на СС-прогноз (амлодипина) [155];
- представителя группы статинов (аторвастатина), обладающего выраженными вазо-
и кардиопротекторными свойствами и явственно снижающего риск СС-осложнений
при АГ [171].
• Суммарный эффект по уменьшению СС-риска при применении комбинации амлодипи-
на с аторвастатином, по данным крупнейшего исследования ASC0T-LLA, состоит в сни-
жении вероятности развития смертельных и несмертельных ИМ и инсультов на 27-36%
(независимо от возраста, исходных уровней липидов крови, наличия или отсутствия
ожирения и курения, состояния функции почек); в этом же исследовании отмечена от-
личная переносимость сочетания этих препаратов.
Характеристика компонентов препарата Дуплекор®
• Подробная характеристика амлодипина представлена в табл. 11.3.
• Аторвастатин — один из лидеров класса статинов (характеристика этого класса в
целом представлена в гл. 14), мощный современный статин с богатой доказательной
базой благоприятного влияния на СС-прогноз (ASCOT-LLA, CARDS, PROVE-IT,TNT, др.).
• В ряде больших исследований аторвастатин демонстрировал:
- уверенное и стойкое гиполипидемическое действие;
- комплекс благоприятных плейотропных эффектов;
- улучшение СС-прогноза у широкого спектра больных — АГ, СД, различными форма-
ми ИБС, ХЗП, периферическими сосудистыми поражениями, у перенесших ишемиче-
ский инсульт и ТИА;
- отличную переносимость с низким риском развития печеночных, мышечных побоч-
ных эффектов, а также гипергликемии.
• Также представляют ценность у лиц с АГ следующие эффекты аторвастатина:
- небольшое (на 2-3 мм рт. ст.), но отчетливое антигипертензивное действие;
- некоторый центральный симпатолитический эффект;
-уменьшение нитратной толерантности при сочетанном применении с органически-
ми нитратами;
-уменьшение протеинурии и замедление прогрессирования снижения функции по-
чек у лиц с ХЗП.
Продолжение табл. ПА — на стр. 94.
Продолжение табл. 11.4
Возможности использования препарата Дуплекор® при АГ
• Использование статинов — необходимый элемент лечебной стратегии при АГ у лиц с
высоким и очень высоким СС-риском (для оценки риска — см. гл. 1, табл. 1.3-1.5).
• Аторвастатин — один из наиболее изученных статинов именно при АГ; амлодипин —
один из наиболее популярных антигипертензивных препаратов. При совместном ис-
пользовании аторвастатин и амлодипин обеспечивают суммацию антиатероскле-
ротических, плейотропных, вазо- и кардиопротекторных эффектов, а также взаим-
ное усиление благоприятного влияния на СС-прогноз.
• Дуплекор® представлен разнообразными комбинациями доз амлодипина и аторваста-
тина. Это обеспечивает возможность гибкого подбора дозировки в соответствии с
особенностями конкретного больного. Как правило, у лиц с высоким уровнем СС-ри-
ска могут использоваться формы препарата Дуплекор®, содержащие 10 мг аторваста-
тина в таблетке, а для больных с очень высоким уровнем риска более пригодны те фор-
мы препарата, которые содержат 20 мг аторвастатина в таблетке.
• Дуплекор® используют у следующих категорий больных АГ:
- у лиц молодого и среднего возраста с неосложненной АГ, имеющих (с учетом ФР, ПОМ
и СЗ — см. табл. 1.5) высокий или очень высокий уровни СС-риска. Дуплекор® мо-
жет представлять удобный лечебный подход для социально активных лиц, нацелен-
ных на адекватный контроль АГ и снижение риска ИМ и инсульта, при этом стремя-
щихся к приему минимального количества лекарственных препаратов;
- у пожилых лиц (включая больных ИСАГ);
- у лиц с АГ в сочетании с СД, метаболическим синдромом, гиперлипидемией, ожирением;
- у лиц с АГ в сочетании с хронической ИБС (у таких больных оправдан выбор дозиро-
вок препарата Дуплекор®, содержащих 20 мг аторвастатина в таблетке);
- у лиц с АГ, перенесших ишемический инсульт или ТИА.
Глава 12
Бета-адренергические блокаторы
Более подробное изложение материала, касающегося препаратов этой груп-
пы, представлено в предыдущем (втором) издании [31]. Здесь, как и для других
групп антигипертензивных лекарственных средств, мы представляем лишь
основные особенности р-АБ, наиболее важные в практическом аспекте.
Бета-АБ являются конкурентными ингибиторами (З-адренергических рецеп-
торов. В основе антигипертензивного действия р-АБ лежит снижение СВ и
уменьшение высвобождения ренина в почечных структурах (рис. 9.1), неко-
торые из них также обладают самостоятельными вазодилатирующими свой-
ствами (препараты III поколения — небиволол, карведилол) [2,124,171].
Дозировки и кратность применения Р-АБ, применяемых для лечения АГ,
представлены в табл. 12.1. Некоторые фармакологические особенности
Р-АБ представлены в табл. 12.2.
В обычно используемых дозах (табл. 12.1) все Р-АБ обладают сравнимой
по выраженности антигипертензивной эффективностью; Р-АБ с вазодила-
тирующими свойствами (карведилол, небиволол) могут в такой же степени
снижать центральное аортальное давление, что и ингибиторы АПФ, сартаны
и БКК (у других р-АБ эта способность менее выражена) [155]. Представлены
данные о благоприятном влиянии небиволола на жесткость стенки крупных
артерий у лиц пожилого возраста, что позволяет говорить о возможности
более широкого его применения у лиц с ИСАГ [136,155].
Для р-АБ имеются доказательства благоприятного влияния на СС-прогноз
у больных ОКС, у лиц, перенесших ИМ и у пациентов с хронической СН
со сниженной систолической функцией ЛЖ [61а, 74,137,171]. Небиволол и
карведилол могут рассматриваться как предпочтительные представители Р-АБ
при выборе препаратов этой группы для кардиопротекции улиц с хроническим
обструктивным заболеванием легких (без выраженной бронхообструкции и
вне приема бронходилататоров) и у больных СД (вне декомпенсации) [171 ].
Бета-АБ являются эффективными антиангинальными препаратами, их при-
меняют в качестве лекарственных средств 1 -й линии в лечении больных ста-
бильной стенокардией [155].
Бета-АБ относятся к антиаритмическим препаратам II класса (по классифи-
кации Vaughan Williams), их применяют в лечении наджелудочковых и же-
лудочковых тахиаритмий [21,155].
Таблица 12.1. Бета-АБ в лечении АГ (адаптировано из [123,171])
Препарат
Атенолол*
Бетаксолол
Бисопролол
Карведилол
Л а бета лол
Метопролола сукцинат
Метоп рол ол а тартрат
Надолол**
Небиволол
Пропранолол
Доза, мг/сутки
Низкая
25
5
5
3,125 мг
2 раза в сутки
20
25
25 мг
2 раза в сутки
20
2,5
40 мг
2 раза в сутки
Обычная
100
10-20
5-10
6,25-25 мг
2 раза в сутки
20-90
50-100
50-100 мг
2 раза в сутки
40-80
5-10
40-160 мг
2 раза в сутки
Кратность
приема
1-2
1
1
2
1-2
1
2
1
1
2-3
Примечание. * В настоящее время имеется отчетливая тенденция к сокращению использования атеноло-
ла в лечении АГ и ИБС.
** На момент выхода издания в свет отсутствует в Украине.
Таблица 12.2. Некоторые фармакологические особенности 0-АБ
(адаптировано из [бб, 155,171 ])
Препарат
Атенолол
Бетаксолол
Бисопролол
Карведилол
Лабеталол
Метоп рол ол
Надолол*
Небиволол
Пропранолол
Соталол
Тимолол*
Эсмолол**
Р1-се-
лектив-
ность
++
++
+++
-
-
++
-
++
-
-
-
++
а-адрено-
блоки-
рование
-
-
-
+
+
-
-
-
-
-
-
-
11!
-
-
-
+
+
-
-
+
-
-
-
-
Липидо-
раство-
римость
-
-
+
+++
++
++
-
++
+++
-
++
-
Поколе-
ние
II
II
II
III
II
II
1
III
1
1
1
II
Дополнитель-
ные свойства
Антиоксидант
Антиоксидант,
влияние на NO
Антиаритмик
III класса
Ультракороткое
действие
Примечания. * На момент выхода издания в свет отсутствует в Украине.
** Преимущественно применяют для купирования атриовентрикулярной (АВ) реципрокной тахикардии
(если петля риентри включает АВ-узел), может использоваться в лечении ГК (см. гл. 22).
Бета-АБ также находят применение улице гипертрофической кардиомио-
патией, с выраженной митральной регургитацией, мигренью и тремором
(предпочтительные — некардиоселективные), тревожностью [86,155].
Бета-АБ могут не быть столь же эффективны, как другие ведущие клас-
сы антигипертензивных препаратов, в профилактике инсультов и других
СС-осложнений у лиц с неосложненной АГ, однако их рассматривают как
препараты выбора у пациентов, перенесших ИМ (бисопролол, карведилол,
метопролол, пропранолол) и у лиц, имеющих хроническую СН со снижен-
ной систолической функцией ЛЖ (бисопролол, карведилол, метопролола
сукцинат, небиволол) [70,84,123].
Многие из Р-АБ могут оказывать неблагоприятные эффекты на метаболизм глю-
козы и, следовательно, их не следует использовать у лиц, имеющих повышен-
ный риск развития СД (особенно в комбинации с диуретиками). Неблагопри-
ятные эффекты на гликемический профиль выражены в значительно меньшей
степени (или совсем отсутствуют?) у (J-АБ III поколения, обладающих дополни-
тельными вазодилатирующими свойствами (небиволол, карведилол) [86,136].
Применение (3-АБ может быть ассоциировано с развитием брадикардии и
нарушений атриовентрикулярной проводимости (преимущественно у тех,
кто имеет предрасположенность к этим нарушениям) [155].
Среди возможных побочных эффектов (3-АБ: снижение эректильной функ-
ции, слабость и уменьшение переносимости физических нагрузок (для
Р-АБ III поколения имеются данные о значительно меньшей выраженности
и этих побочных эффектов) [123]. К побочным эффектам (3-АБ также могут
быть отнесены: повышение массы тела, увеличение уровней ТГ (кроме кар-
ведилола), повышение частоты развития депрессий (особенно пропрано-
лол и атенолол), усиление периферических сосудистых нарушений (улиц,
уже имеющих таковые) [30,155].
Важно помнить, что резко отменять (3-АБ не следует во избежание синдрома
отмены (у лиц с АГ он может проявиться увеличением уровней АД вплоть до
развития ГК, а у лиц со стенокардией — усилением ангинального синдро-
ма) [171]. Развитие синдрома отмены связывают с тем, что при длительном
применении (J-АБ на клетках-мишенях увеличивается количество р-адре-
норецепторов (что обозначают термином up-regulation). При резкой отмене
препаратов симпатическая стимуляция этого увеличенного количества ос-
тающихся незаблокированными рецепторов и становится причиной «гипер-
адренергических тканевых эффектов», отмеченных выше. Возможный под-
ход к постепенной отмене Р-АБ состоит в уменьшении их дозы в 2 раза, а
затем через несколько (2-3) дней — еще в 2 раза, после чего спустя еще
2-3 дня возможна их полная отмена. В случае необходимости темп отмены
может быть еще более плавным [2,124, 155,171].
Глава 13
Прочие
антигипертензивные препараты
Антагонисты минералокортикоидных рецепторов
(спиронолактон, эплеренон)
Среди препаратов этой группы (см. гл. 8) в лечении АГ более изучен спиро-
нолактон [123, 147]. Накоплен достаточно большой опыт его применения в
лечении резистентной АГ. В течение предыдущего десятилетия подобные
данные были представлены и для эплеренона [155]. Эплеренон является бо-
лее новым препаратом, обладающим в сравнении со спиронолактоном луч-
шим профилем переносимости (с существенно меньшей частотой побочных
эффектов, связанных с влиянием на андрогеновые и прогестиновые рецеп-
торы, в том числе гинекомастии, снижения либидо, аменореи, др.) [63,155].
Оба препарата находят широкое применение (в первую очередь, для улуч-
шения СС-прогноза, но также и как кал ийсберегающие диуретики) влечении
больных хронической CH со сниженной систолической функцией ЛЖ [61а,
123,174]. Эплеренон также используют с целью улучшения СС-прогноза у па-
циентов с ОКС (включая как нестабильную стенокардию, так и все варианты
ИМ), а также у постинфарктных больных [41,123,219]. В недавно завершив-
шемся крупном исследовании спиронолактон не продемонстрировал суще-
ственного благоприятного влияния на прогноз у больных хронической СН с
сохранной фракцией выброса ЛЖ [175].
Антагонисты минералокортикоидных рецепторов в лечении АГ преимуще-
ственно находят применение у следующих категорий больных (если нет
противопоказаний) [69,124,155,171]:
• при отсутствии адекватного контроля АД на фоне стандартно используе-
мой комбинации из 3 групп антигипертензивных препаратов: ингибитора
АПФ или сартана + БКК + диуретика. Считают, что частой причиной рези-
стентности АГ к подобной комбинации трех препаратов в адекватных до-
зах является избыточное образование альдостерона;
• хронической СН со сниженной систолической функцией ЛЖ;
• после ИМ (эплеренон);
• у лиц с ПА (см. гл. 79).
Среди побочных эффектов антагонистов минералокортикоидных рецеп-
торов заслуживает отдельного рассмотрения гиперкалиемия. Частота ее
развития значимо увеличивается при комбинированном использовании
антагонистов минералокортикоидных рецепторов с ингибиторами АПФ
или сартанами, особенно у лиц со сниженной функцией почек [171]. Эти
препараты рекомендуют использовать с особой осторожностью у лиц с
СКФ 30-50 мл/мин/1,73 м2; их не следует назначать при СКФ <30 мл/мин/1,73 м2
[123,162]. При использовании в комбинации с ингибитором АПФ или сарта-
ном требуется контроль уровней калия и креатинина крови в течение первого
месяца, а далее — регулярно каждые 3-6 месяцев [56,130,137].
В табл. 13.1 представлены названия, дозировки и кратность приема некото-
рых других антигипертензивных препаратов, включая альфа-АБ, препараты
центрального действия, прямой ингибитор ренина, прямые вазодилататоры.
Таблица 13.1. Прочие антигипертензивные препараты
(адаптировано из [123,155])
Препарат
Доза, мг/сутки
Кратность
приема
Альфа1-АБ
Доксазозин*
Празозин*
Теразозин*
1-16
1-10
1-2
1
2-3
1
Агонисты а-адренорецепторов центрального действия
Клонидин
Метилдофа
0,075-0,9
250-2000
2-4
2
Периферический al-АБ и симпатолитик центрального действия
Урапидил
60-180
2
Агонист имидазолиновых рецепторов
Моксонидин
0,2-0,6
1
Прямой ингибитор ренина
Алискирен
150-300
1
Прямые вазодилататоры
Гидралазин**
Изосорбида динитрат**
25 мг 2 раза в сутки -
50 мг 4 раза в сутки
20-120
2-4
1-2
Примечания. * Могут вызывать ортостатическую гипотензию.
** В Рекомендации ESC/ESH (2013), ASH/ISH (2013) и JNC-8 (2014) эти препараты не вошли, однако их при-
менение в составе комбинированной антигипертензивной терапии в ряде ситуаций вполне возможно.
Препараты центрального действия
(клонидин, моксонидин, метилдофа)
Механизм антигипертензивного действия препаратов этой группы со-
стоит в развитии вазодилатации вследствие снижения симпатической
активации в структурах головного мозга. Эти препараты рассматривают
как эффективные средства для снижения АД практически у любых групп
пациентов с АГ. В настоящее время они находят применение главным
образом в качестве компонента комбинированной антигипертензивной
терапии [147,155,189].
Метилдофа широко используют как препарат выбора в лечении АГ при
беременности [137,187,197].
Применение клонидина ограничивают его известные побочные эффек-
ты, в первую очередь, сухость во рту и сонливость. Более новый предста-
витель этой группы моксонидин (по механизму действия известный как
агонист имидазолиновых рецепторов) переносится существенно лучше; с
ним накоплен определенный опыт использования в лечении АГ у лиц с СД,
метаболическим синдромом, ХЗП [137]. Эксперты KDIGO (2012) [162] специ-
ально указывают на целесообразность назначения моксонидина в каче-
стве компонента комбинированной терапии для преодоления резистент-
ной АГ у лиц с ХЗП (в том числе при тяжелом снижении функции почек).
Дозировки препарата у этих больных составляют 0,2-0,4 мг/сутки. Важным
достоинством моксонидина нефрологи считают то, что он практически не
взаимодействует не только со стандартными антигипертензивными пре-
паратами, но и иммуносупрессивными лекарственными средствами, ис-
пользуемыми в лечении больных ХЗП [162]. Моксонидин не следует назна-
чать больным тяжелой СН со сниженной систолической функцией ЛЖ (при
функциональных классах (ФК) III-IV) [61а, 155,187,196].
Альфа-адренергические блокаторы
(доксазозин, празозин, теразозин, урапидил)
Эти препараты снижают АД путем блокирования а-адренорецепторов в
структурах стенки артерий и развития вазодилатации. Их преимущественно
используют в качестве компонента комбинированной антигипертензивной
терапии. Они находят применение в лечении резистентной АГ [130,155].
Альфа-АБ могут использоваться для лечения АГ у лиц с ХЗП и при снижен-
ной функции почек; не требуют коррекции дозы, так как метаболизируются
в печени [162]. Поскольку а-АБ являются эффективными препаратами для
лечения доброкачественной аденомы предстательной железы, они могут
быть одним из предпочтительных антигипертензивных подходов у пожи-
лых мужчин с этим состоянием [171].
Нередким побочным эффектом а-АБ является ортостатическая гипотензия
[136]. Перед их назначением следует [144,155,171]:
• убедиться в исходном отсутствии выраженных ортостатических реакций;
• тщательно проинструктировать больного о простых подходах по умень-
шению выраженности и предупреждению ортостаза (см. гл. 7).
Начальная доза препаратов этой группы должна быть небольшой, чтобы
предупредить такой их побочный эффект, как гипотензия первой дозы [155].
Среди а-АБ несколько выделяется урапидил, обладающий комбиниро-
ванным механизмом действия. Он представляет собой селективный блока-
тор а1 -адренорецепторов (что предотвращает сосудосуживающие эфекты
катехоламинов) и агонист серотониновых 5-НТ1А-рецепторов продолго-
ватого мозга (модулирующий активность сосудодвигательного центра, что
предотвращает рефлекторные колебания тонуса симпатической нервной
системы) [66, 70]. Снижение АД под влиянием урапидила связано с пери-
ферической артериолярной вазодилатацией. В отличие от других вазо-
дилататоров, урапидил не вызывает развитие рефлекторной тахикардии,
возможно за счет дополнительного ваготонического эффекта препарата;
не вызывает повышения риска ортостатической гипотензии. Имеет бла-
гоприятные метаболические эффекты (умеренно снижает уровни общего
ХС, ХС ЛПНП, ТГ, повышает уровни ХС ЛПВП). С осторожностью следует ис-
пользовать для хронического применения у лиц пожилого возраста, при
выраженном снижении функции печени и почек. Урапидил не применяют
для лечения хронической АГ при беременности, при тяжелом аортальном
и митральном стенозе [66,70].
Урапидил находит достаточно широкое применение в лечении больных с
различными вариантами осложненного ГК [25].
Прямой ингибитор ренина (алискирен)
Механизм действия алискирена состоит в прямом блокировании влияния
ренина/проренина на рецепторы к ним, а также в ингибировании влияния
ренина на ангиотензиноген [171]. Алискирену присущи эффективное анти-
гипертензивное действие и отличная переносимость [67,155]. На препарат
возлагались значительные надежды в лечении АГ, ХЗП и хронической СН
со сниженной систолической функцией ЛЖ, однако в целом ряде недавних
крупных исследований (ALTITUDE, APOLLO, ASTRONAUT) свидетельств его
благоприятного влияния на СС- или почечный прогноз не было выявлено
[63,123]. Более того, при применении алискирена в комбинации с ингиби-
тором АПФ или сартаном отмечено увеличение риска развития гиперкали-
емии, гипотензии и снижения функции почек (ввиду чего применение та-
ких комбинаций сейчас не рекомендуется). В настоящее время препарат не
располагает данными о влиянии на прогноз у лиц с АГ (и большие исследо-
вания в этой области не проводятся; правда, еще не завершилось крупное
исследование ATMOSPHERE при хронической СН) [123]. Алискирен сейчас
может использоваться преимущественно в лечении неосложненной АГ
(в качестве компонента комбинированной терапии, но не в сочетании с
ингибитором АПФ или сартаном) [123,219].
Прямые вазодилататоры (гидралазин, нитраты)
Гидралазин обеспечивает прямой расслабляющий эффект на гладкомы-
шечные клетки стенки артериол, что обусловливает снижение АД [171].
При его использовании вследствие рефлекторной активации барорецеп-
торов происходит увеличение ЧСС и УО. Также может наблюдаться умерен-
ная задержка натрия и воды [155].
Гидралазин находит применение в комплексном лечении АГ (в качестве
5-6-го препарата) [171]. Может быть использован в лечении АГ при бере-
менности [63,130,155,197].
Его побочные эффекты включают: рефлекторную тахикардию, головную
боль, приливы, тошноту, рвоту, диарею, волчаночноподобный синдром.
Препарат требует осторожности при применении у больных ИБС (из-за ин-
дуцируемой им тахикардии); его не используют у лиц с расслоением аорты
и при недавно перенесенном геморрагическом инсульте [171].
Нитраты, среди которых для планового лечения АГ используют главным
образом изосорбида динитрат, являются донаторами мощного вазодила-
татора оксида азота (N0), благодаря этому эффекту обеспечивается их ан-
тигипертензивное действие [155]. Могут применяться в лечении АГ у боль-
ных [70, 123, 136, 162, 171]: ИБС (включая нестабильную стенокардию, ИМ,
хронические формы), ИСАГ, резистентной АГ, ХЗП.
Длительное применение нитратов может сопровождаться развитием нит-
ратной толерантности (для ее предупреждения следует в режиме приема
использовать адекватный по продолжительности нитратосвободный про-
межуток, возможно также сочетать нитраты с ингибиторами АПФ, карведи-
лолом, аторвастатином) [41,155].
Внутривенные формы нитратов (нитроглицерин, изосорбида динитрат) на-
ходят широкое применение в лечении осложненного ГК (в сочетании с оте-
ком легких, ОКС, при беременности [25], см. гл. 21).
Глава 14
Статины в кардиологии.
Лечение артериальной гипертензии
у больных хронической
ишемической болезнью сердца
Настоящая глава представлена тремя разделами: сначала представлена ха-
рактеристика одного из лидеров класса статинов — розувастатина; далее
обсуждаются подходы к лечению АГ у лиц с хронической ИБС; в завершение
обсуждаются позиции статинов в кардиологии в целом.
Место розувастатина в кардиологии
Гипер-, дислипидемию стандартно рассматривают как важнейший фактор
СС-риска (включая коронарный, цереброваскулярный, периферические
сосудистые бассейны) [170, 189]. Показано, что применение препаратов,
снижающих выраженность атерогенной гиперлипидемии (в первую оче-
редь, статинов), ассоциировано с отчетливым уменьшением СС-риска. Также
продемонстрировано, что статины могут обеспечивать выраженные благо-
приятные эффекты на прогноз не только в силу своих гиполипидемических
свойств, но также вследствие наличия у них дополнительных (нелипидных,
именуемых также плейотропными, включающих противовоспалительные,
антитромботические и некоторые другие) эффектов [171]. Применение ста-
тинов оказалось настолько эффективным в снижении степени выраженно-
сти сосудистого риска, что эта стратегия стала стандартом профилактики и
лечения во многих областях современной медицины [49,94,171].
В соответствии с современными представлениями, применение статинов в
стандартных дозировках предусматривают в качестве обязательного компо-
нента лечебной тактики у больных АГ, имеющих высокие или очень высокие
уровни СС-риска [61,70,136].
В табл. 14.1 представлена характеристика одного из востребованных в со-
временной кардиологии препаратов этой группы — розувастатина (генери-
ческий препарат Мертенил компании «Рихтер Гедеон», таблетки по 5,10,20
и 40 мг, по 10 таблеток в упаковке).
Таблица 14.1. Характеристика розувастатина
(препарат Мертенил, таблетки по 5,10,20 и 40 мг)
• Розувастатин — представитель группы ингибиторов HMG-коэнзимА-редуктазы (ста-
тинов) — ведущего класса гиполипидемических препаратов. Розувастатин является
синтетическим гидрофильным статином, не имеет активных метаболитов. Прием пищи
не влияет на его всасывание. Пиковая концентрация в плазме достигается через 3-5 ч
после приема внутрь. Период полувыведения — 19 часов. 90% препарата выводится
через кишечник [171].
• Розувастатин применяют 1 раз в сутки независимо от приема пищи. Таблетки реко-
мендуется проглатывать целиком, не разжевывая, запивать водой.
• Дозировки составляют 5-40 мг/сутки, выбор дозы зависит от:
- степени СС-риска (чем он выше, тем выше доза);
- возраста пациента;
- наличия сопутствующих поражений почек и печени;
- уровня ХС Л ПНП.
• Благодаря тому, что в метаболизме розувастатина практически не участвуют изофер-
менты цитохрома CYP450, розувастатин не взаимодействует с целым рядом других
сопутствующих препаратов (в частности, с клопидогрелем).
• Не требует снижения дозы при ХЗП 1-2-й степени; при ХЗП 3-й степени доза не должна
быть >5-10 мг/сутки; не используют при ХЗП 4-5-й степени (СКФ <30 мл/мин/1,73 м2).
• По данным 2013 года, розувастатин явился 5-м в списке самых продавае-
мых лекарственных препаратов в США (его продажи в этом году составили
=2,6 млрд долларов).
• Розувастатин — один из лидеров класса статинов, мощный современный препа-
рат, с большим объемом доказательной базы, включающей ряд крупных рандоми-
зированных исследований (JUPITER, SATURN, CORONA, METEOR, STELLAR, ANDROMEDA,
ASTEROID, LUNAR, др). В этих исследованиях продемонстрированы:
-выраженные гиполипидемические эффекты со значительным снижением уровней
ХС ЛПНП и ТГ, отчетливым повышением ХС ЛПВП;
- высокий процент достижения целевых уровней липидных показателей;
- существенные благоприятные нелипидные эффекты (плейотропные, например, сни-
жение уровней СРБ, др.);
- замедление прогрессии и даже обратное развитие атеросклеротических бляшек (по-
следнее — при длительном использовании в максимальных дозах);
- благоприятные эффекты на СС-прогноз;
- отличная переносимость (с низкой частотой развития таких побочных эффектов, как
печеночные, мышечные, гипергликемические).
Возможности применения препарата Мертенил (розувастатина) в кардиологии
• Для снижения СС-риска при АГ (при АГ без сопутствующей ИБС приемлемы небольшие
дозы — 5-10 мг/сутки).
• Для улучшения СС-прогноза также у больных:
- СД (обычно небольшие или умеренные дозы);
- ИБС (включая как острые, так и хронические формы, обычно используют средние или
высокие дозы — 20-40 мг/сутки);
- после перенесенного ишемического инсультаЯИА (средние или высокие дозы).
• У лиц с семейными дислипидемиями (высокие дозы).
Лечение артериальной гипертензии
при хронической ишемической болезни сердца
Основные подходы к лечению АГ у больных хронической ИБС включают
[89,116,136,170]:
• выбор в качестве приоритетных антигипертензивных препаратов инги-
биторов АПФ или сартанов, а также (3-АБ (особенно в первые 3 года по-
сле перенесенного ИМ) и/или БКК; при необходимости могут также при-
меняться и другие классы антигипертензивных лекарственных средств
(например, нитраты);
• обязательное применение статина (предпочтительно в средних или вы-
соких дозах);
• назначение АСК.
Здесь считаем важным привести основные принципы лечения больных хро-
нической ИБС, представленные в рекомендациях ESC [170] (табл. 14.2).
Таблица 14.2. Основные подходы к лечению пациентов
с хронической ИБС (стабильной болезнью коронарных
артерий), адаптировано из [170]
Подходы, направленные на контроль стенокардии
• Подходы 1-й линии
Короткодействующие нитраты +:
- р-АБ или ЧСС-снижающие БКК
- дигиропиридиновые БКК при низкой ЧСС
- р-АБ + дигидропиридиновые БКК (если ФК стенокардии >И)
• Подходы 2-й линии (их можно использовать как при недостаточной эффективности
первой линии, так и на начальном этапе наряду с подходами 1 -й линии):
-ивабрадин
- длительнодействующие нитраты
-триметазидин
Подходы, направленные на снижение СС-риска
• Изменения стиля жизни
• Контроль факторов СС-риска
• Образование больного
• АСК
• Стати ны
• Ингибиторы АПФ или сартаны
• По показаниям — проведение КАГ
• При необходимости — проведение реваскуляризации (стентирование или АКШ)
Примечания. АКШ — аортокоронарное шунтирование; КАГ— коронарная ангиография.
Скажем здесь несколько слов о лекарственных средствах, обозначаемых
иногда как «препараты с метаболическим действием». Из доступных в
мире, изученных в авторитетных исследованиях препаратов этого класса
(триметазидин, ранолазин, пергексилин) [170,171 ] в нашей стране имеется
лишь первый (предпочтение отдается ретардной (MR) форме, например,
генерическому препарату Предизин производства «Рихтер Гедеон»).
Триметазидин ингибирует окисление жирных кислот и переключает ме-
таболизм в миокарде на окисление глюкозы, увеличивая выработку АТФ
примерно на 30%. Оптимизация энергетического обмена в условиях
недостатка кислорода оказывает благоприятный эффект на метаболизм
кардиомиоцита, улучшая функции миокарда (прежде всего — сократитель-
ную). В ряде исследований триметазидин оказывал эффект по уменьшению
выраженности ангинального синдрома и улучшению переносимости физи-
ческой нагрузки у больных со стабильной стенокардией. Антиишемическая
эффективность триметазидина в небольших по объему исследованиях ока-
зывалась сопоставимой с таковой у (J-АБ [170]. Влияние триметазидина на
прогноз в крупных РКИ не изучалось, в нескольких исследованиях относи-
тельно небольшого объема данные о позитивном эффекте триметазиди-
на на прогноз при хронической ИБС, а также при хронической СН были
достаточно убедительно продемонстрированы [66,68,70,170].
Одним из интересных подходов является использование триметазидина в
качестве антиангинального препарата вместо нитратов у тех больных,
которые с целью лечения сопутствующей эректильной дисфункции
или легочной гипертензии принимают ингибиторы фосфодиэстера-
зы-5 (таким больным нитраты категорически противопоказаны) [171].
Антиангинальный эффект триметазидина сохраняется до тех пор, пока паци-
ент принимает лечение; отмена препарата приводит к исчезновению антии-
шемического действия и позитивного влияния на метаболические процессы
в кардиомиоците. С целью достижения стабильного контроля стенокардии
оправданным является длительное применение триметазидина MR [171].
Рекомендации по статинам
(KDIGO,ACC/AHA,2013)
Мы сочли необходимым подробно привести обсуждение двух опублико-
ванных в конце 2013 года серьезных документов, посвященных примене-
нию гиполипидемических лекарственных средств:
• Всемирных рекомендаций по контролю липидов у больных ХЗП (Kidney
Disease Improvement Global Outcome Clinical Practice Guideline for Lipid
Management in Chronic Kidney Disease), далее — KDIGO, 2013 [160];
• Рекомендаций экспертов АСС (American College of Cardiology, Аме-
риканская коллегия кардиологов) и AHA (American Heart Association,
Американская ассоциация сердца) по контролю холестерина крови для
снижения атеросклеротического СС-риска (2013АСС/АНА Guideline on the
Treatment of Blood Cholesterol to Reduce Atherosclerotic Cardiovascular Risk in
Adults), далее — ACC/AHA, 2013) [94].
Лечение дислипидемий у больных ХЗП
(KDIGO, 2013 [160]), табл. 14.3, 14.4
Комментарий. Для практикующего врача непривычной выглядит страте-
гия, при которой липидный статус предлагается оценивать у большинства
больных лишь в начале лечения без его динамического контроля в после-
дующем (принцип «выстрели и забудь»). Это явно упрощает применение
статинов улиц с ХЗП (признаем, что и до этой рекомендации динамический
контроль ХС ЛПНП на фоне статинотерапии у большинства наших больных
выполнялся редко). Безусловно, крайне важными являются следующие
пункты рекомендаций (табл.14.3 и 14.4) [160]:
• регламентация доз статинов в зависимости от состояния функции почек;
• напоминание врачу о важности поиска вторичных причин гиперлипидемии;
• официальное признание того, что статины у лиц с ХЗП обеспечивают не
только снижение СС-риска, но и уменьшение темпа прогрессии ХЗП;
• установление четких и понятных показаний к применению статинов у
разных категорий больных ХЗП.
В табл. 14.5 для удобства читателя представлены коэффициенты пересче-
та значений некоторых лабораторных показателей из системы измерения,
принятой в США, в Международную систему единиц (СИ) [160].
Таблица 14.3. Основные подходы к применению статинов
у больных ХЗП (адаптировано из [160])
• Взрослым в возрасте >50 лет с СКФ <60 мл/мин/1,73 м2, не получающим лечение
хроническим гемодиализом и не перенесшим трансплантацию почки (ХЗП 3-5-й ста-
дии), рекомендуют лечение статинами или комбинацией статина сэзетимибом (1А).
• Взрослым в возрасте >50 лет с ХЗП и СКФ >60 мл/мин/1,73 м2 (ХЗП 1-2-й стадии)
рекомендуют лечение статином (1 В).
• Взрослым в возрасте 18-49 лет с ХЗП, не получающим лечение хроническим гемоди-
ализом и не перенесшим трансплантацию почки, лечение статином показано, если
есть одно из следующего (2А): установленный диагноз ИБС (перенесенные ИМ и/или
процедуры коронарной реваскуляризации); СД; перенесенный ишемический инсульт-
риск смертельного и несмертельного ИМ в течение 10 лет > 10%.
• Взрослым, получающим диализное лечение, терапию статином или комбинацией
статина с эзетимибом не следует начинать (2А).
• Лицам, уже получающим статин или комбинацию статина с эзетимибом на момент
начала диализного лечения, эти препараты следует продолжать (2С)
• Взрослым, перенесшим трансплантацию почки, лечение статином следует назначить (2В).
Таблица 14.4. Лечение дислипидемий при ХЗП (адаптировано из [160])
Оценка липидного статуса
• Всем взрослым с недавно диагностированным ХЗП (включая лиц, получающих диализ-
ное лечение, а также перенесших трансплантацию почки) рекомендуют определение
липидного профиля (включая общий ХС, ХС ЛПНП, ХС ЛПВП и ТГ (1 С). Динамическое ис-
следование этих показателей у таких пациентов не требуется.
Пояснение: в большинстве случаев эксперты KDIGO считают более приемлемым не до-
стижение целевых уровней липидных показателей, но стратегию fire and forget — «вы-
стрели и забудь», то есть «назначь и не контролируй», поскольку результат лабораторной
оценки существенно не повлияет на выбор лечебной тактики, см. далее).
Общие принципы выбора лечебной тактики
1. Выявить возможные вторичные причины дислипидемий: нефротический синдром,
гипотиреоз, СД, чрезмерное употребление алкоголя, хронические заболевания печени,
употребление препаратов (антиконвульсантов, антиретровирусных, диуретиков, (З-АБ,
оральных контрацептивов, глюкокортикоидов, циклоспорина, сиролимуса, андрогенов).
2. Установить, нужно ли назначать статин (на основании оценки уровня СС-риска), вы-
брать препарат и дозу (с/и. далее).
Рекомендованные дозы (мг/сутки) статинов у взрослых с ХЗП
Статин
Ато рва статин
Розувастатин
Симвастатин/эзетимиб
Симвастатин
Питавастатин
ХЗП 1-2-й стадий
Дозы соответствуют тем,
что приняты для общей
популяции лиц без ХЗП
[см. табл. 14.7)
ХЗП 3-5-й стадий,
включая лиц на диализе
и перенесших
трансплантацию почки
20
10
20/10
40
2
Таблица 14.5. Перерасчет некоторых лабораторных показателей
с единиц, принятых в США, в единицы СИ [160]
Показатели
Общий ХС,
ХСЛПНП,ХСЛПВП
Креатинин
(сыворотка, плазма)
Триглицериды
(сыворотка)
Единицы США
мг/дл
мг/дл
мг/дл
Коэффициент
пересчета
0,0259
88,4
0,0113
Единицы СИ
ммоль/л
мкмоль/л
ммоль/л
Рекомендации АСС/АНА (2013)
по контролю холестерина крови
для снижения атеросклеротического СС-риска,
табл. 14.6-14.10 [94]
Комментарий. Прежде всего отметим, что эти рекомендации касаются, в
первую очередь, вопросов применения статинов для вторичной и первич-
ной профилактики АСССЗ у взрослых (к которым отнесены лица в возрасте
>21 года). Именно в этом возрасте были люди, изучавшиеся в РКИ, которые
стали основой для составителей обсуждаемого документа [94].
Авторы специально указывают, что данные этих РКИ не позволяют им с
определенностью установить место статинов в лечении 2 категорий боль-
ных: хронической СН II-IV ФК по классификации NYHA (New York Heart As-
sociation, Нью-Йоркская кардиологическая ассоциация) с систолической
дисфункцией ЛЖ и получающих диализное лечение. Что касается первой
из них, то для выбора тактики назначения статинов у таких пациентов
можно опереться на опубликованные в 2013 году американские Реко-
мендации по хронической СН, где статины не указывают как часто при-
меняемый класс препаратов у подобных больных, однако отмечают, что
при хронической СН ишемического генеза продолжение их применения
может быть вполне оправдано. Место статинов у диализных пациентов
несколько более ясно в уже представленных нами выше Рекомендациях
KDIGO [160] (речь идет, как мы видели, о том, что статины у таких больных
рекомендуют продолжать, если пациент принимал их ранее, но начинать
их на этом этапе не следует).
Весьма интересными и важными в практическом отношении моментами
рекомендаций АСС/АНА [94] являются:
• выделение 4 групп лиц (табл. 14.6), которым показана терапия стати-
нами (здесь также важны четкое определение того, какие именно состо-
яния относятся к АСССЗ, а также предлагаемый новый онлайн-калькуля-
тор подсчета 10-летнего риска АСССЗ;
• регламентация высоких, умеренных и низких доз статинов
(табл. 14.7-14.8) с явным указанием на приоритетность высоких доз у
подавляющего большинства больных с уже имеющимися АСССЗ (уме-
ренные дозы резервируются преимущественно для тех, кто не может
переносить высокие дозы или имеет дополнительные факторы, повы-
шающие вероятность развития побочных эффектов статинов);
• достаточно простой и понятный алгоритм выбора тактики примене-
ния статинов (рис. 14.1);
• детальное представление малознакомых отечественным клиницистам
вопросов первичной профилактики АСССЗ статинами (табл. 14.8);
• четкое указание на то, что место нестатиновых гиполипидемических
препаратов в настоящее время весьма зыбко, с уровнем доказательной
базы лишь ИЬ/С (табл. 14.8);
• подчеркивание важности установления возможных вторичных причин
гиперлипидемии (табл.14.9).
Одним из наиболее неожиданных, интригующих и, возможно, спорных, мо-
ментов рекомендаций [94] является устранение из стратегии лечения ста-
тинами того, что казалось совершенно стандартным ее элементом — целе-
вых уровней (прежде всего, ХС ЛПНП). Авторы объясняют это решение, в
первую очередь, тем, что имеющиеся в крупных РКИ данные не позволяют
точно установить такие уровни показателей липидного спектра, которые
можно было бы с уверенностью признать целевыми. Представляется, что
в условиях Украины буквальное следование этой рекомендации экспертов
США пока преждевременно. Принимая во внимание тот чрезвычайно сла-
бый уровень, который имеет статинотерапия в нашей стране (включая как
количество больных, получающих статины, так и дозы статинов, которые
им назначены), резкая «смена курса» неизбежно дезориентирует врача
широкой практики («раньше говорили одно, а сейчас — совершенно дру-
гое!») и еще больше ослабит интерес к статинам.
Очень важными в рекомендациях [94] представляются вопросы безопасно-
сти терапии статинами (табл. 14.10), в числе которых особо отметим:
• выделение факторов, предрасполагающих к развитию побочных эффек-
тов статинов;
• регламентацию оценки креатинкиназы (рутинно не требуется);
• признание необходимости стандартной оценки уровней аланинамино-
трансферазы (АЛТ) до начала терапии статинами;
• четкое указание на то, что достижение уровней ХС ЛПНП в пределах
1,8 ммоль/л не является показанием к снижению дозы статина;
• разъяснение того, что при развитии на фоне статинов СД статиновую те-
рапию следует продолжить;
• подробный алгоритм действий клинициста при возникновении на фоне
лечения статинами мышечных симптомов разной степени выраженности.
В заключение настоящей главы отметим, что представленные в ней 2 новых
документа, касающихся терапии статинами [94, 160], четко указывают на
возрастание роли этого класса лекарственных препаратов в лечении самых
разных категорий наших пациентов; многие вопросы этих рекомендаций
имеют большую практическую ценность для отечественного клинициста.
Таблица 14.6. Четыре группы лиц, у которых польза от применения
статинов явно превосходит риск (адаптировано из [94])
• Лица с уже имеющимся клинически значимым АСССЗ*
• Лица с уровнем ХСЛПНП >190мг/дл (>5 ммоль/л)
• Лица с СД в возрасте 40-75 лет с уровнем ХС ЛПНП 70-189 мг,дл (1,8-5 ммоль/л)
без клинически значимого АСССЗ*
• Лица без клинически значимого АСССЗ* и СД с уровнями ХС ЛПНП 70-189 мг/дл
(1,8-5 ммоль/л) и ожидаемым 10-летним риском АСССЗ >7,5%**
Примечания. * Клинически значимое АСССЗ — это ОКС, ИМ (в том числе анамнезе), стабильная
стенокардия, процедуры коронарной или иной артериальной реваскуляризации, инсульт, ТИА,
поражения периферических артерий предположительно атеросклеротической природы.
** Подсчет по специальным уравнениям Pooled Cohort Equations, калькулятор доступен онлайн:
http://my.americanheart.org/cvriskcalculator). У лиц, не получающих статины, не имеющих клини-
чески значимого АСССЗ и СД при уровнях ХС ЛПНП в пределах 1,8-5 ммоль/л этот показатель
рекомендуют подсчитывать каждые 4-6 лет.
Таблица 14.7. Высокие, умеренные и низкие дозы статинов
(использовавшиеся в РКИ, которые анализировали
авторы рекомендаций*), адаптировано из [94])
Высокие дозы
(терапия приводит
в среднем к снижению
ХСЛПНП
примерно на >50%)
Аторвастатин 40-80 мг
Розувастатин 20 (40) мг
Умеренные дозы
(терапия приводит
в среднем к снижению
ХСЛПНП
примерно на 30-50%)
Аторвастатин 10 (20) мг
Розувастатин (5)10 мг
Симвастатин 20-40 мг
Ловастатин 40 мг
Флувастатин XL 80 мг
Флувастатин 40 мг
2 раза вдень
Питавастатин 2-4 мг
Низкие дозы
(терапия приводит
в среднем к снижению
ХСЛПНП
примерно на <30%)
Симвастатин 10 мг
Ловастатин 20 мг
Флувастатин 20-40 мг
Питавастатин 1 мг
Примечание. * Авторами были отобраны для анализа самые авторитетные РКИ наиболее высо-
кого уровня. Статины и их дозы, указанные жирным шрифтом, изучали именно в этих РКИ. Те
препараты и дозы, которые в таблице приведены курсивом, в таких РКИ не изучались, однако
они разрешены к использованию FDA (Food and Drug Administration, Управление по контролю
пищевых продуктов и лекарственных средств США).
Таблица 14.8. Рекомендации по применению статинов для снижения
атеросклеротического СС-риска у пациентов >21 года
(адаптировано из [94])
Цели лечения
Эксперты не дают рекомендаций за или против использования целевых уровней
ХС ЛПНП или ХС ЛПВП для первичной или вторичной профилактики АСССЗ (без уровня
доказательной базы).
Вторичная профилактика
• Высокие дозы статинов должны быть начаты или продолжены в качестве терапии
1-й линии у лиц обоего пола в возрасте <75 лет при наличии у них клинически значи-
мого АСССЗ*, если нет противопоказаний (I/A).
• У лиц с клинически значимым АСССЗ* при наличии противопоказаний к применению
высоких доз статинов, а также при наличии факторов, предрасполагающих к развитию
побочных эффектов статинов, следует применять умеренные дозы статинов (I/A).
• Улиц с клинически значимым АСССЗ* в возрасте >75 лет для решения вопроса о выбо-
ре между высокими и умеренными дозами статинов следует дополнительно оценить
потенциальную пользу от их применения, возможные лекарственные взаимодействия
и предпочтения больного. У тех лиц, которые хорошо переносят статины, желательно
продолжение их применения (Па/В).
Первичная профилактика у лиц >21 года с ХС Л ПНП >5 ммоль/л
• Лиц с ХС ЛПНП >190 мг/дл (>5 ммоль/л) или ТГ >500 мг/дл (>5,65 ммоль/л) необходимо
обследовать для исключения вторичных причин гиперлипидемии (см. табл. 14.9) (1/В).
• Лицам >21 года с первичным (не связанным с другими причинами) повышением
ХС ЛПНП >5 ммоль/л следует назначить статины (подсчет 10-летнего риска АСССЗ у них
не требуется): при отсутствии противопоказаний — использовать высокие дозы стати-
нов; при невозможности их применения — использовать максимально переносимую
дозу статина (I/B).
• У лиц >21 года с первичным (не связанным с другими причинами) повышением
ХС ЛПНП >5 ммоль/л желательно интенсифицировать терапию статинами до достиже-
ния снижения ХС ЛПНП не менее чем на 50% (Иа/В).
• У лиц >21 года с первичным (не связанным с другими причинами) повышением
ХС ЛПНП >5 ммоль/л после назначения максимально интенсивной терапии статинами
при необходимости возможно добавление к ней нестатиновых препаратов для даль-
нейшего снижения ХС ЛПНП. Следует принять во внимание потенциальную пользу от
лечения, возможные лекарственные взаимодействия и предпочтения больного (ПЬ/С).
Примечание. * Клинически значимое АСССЗ — это ОКС, ИМ (в том числе анамнезе), стабильная
стенокардия, процедуры коронарной или иной артериальной реваскуляризации, инсульт, ТИА,
поражения периферических артерий предположительно атеросклеротической природы.
Продолжение табл. 14.8— на стр. 115.
Продолжение табл. 14.8
Первичная профилактика у лиц с СД
(ХС ЛПНП — 1,8-5 ммоль/л)
• Умеренные дозы статинов следует начать или продолжать у лиц в возрасте 40-75
летсСД(1/А).
• У лиц 40-75 лет с СД при уровне 10-летнего риска АСССЗ >7,5%** желательно ис-
пользовать высокие дозы статинов, если нет противопоказаний (Иа/В).
• У лиц с СД в возрасте <40 или >75 лет для решения вопросов о начале, продолже-
нии или интенсификации терапии статинами следует дополнительно оценить потен-
циальную пользу от их применения, возможные лекарственные взаимодействия и
предпочтения больного (Иа/С).
Первичная профилактика у лиц без СД
(ХС ЛПНП — 1,8-5 ммоль/л)
• Для решения вопроса о тактике применения статинов для первичной профилактики
у лиц с ХС ЛПНП 1,8-5 ммоль/л без клинически значимых АСССЗ* и СД следует ис-
пользовать подсчет 10-летнего риска АСССЗ** (I/B).
• Лица 40-75 лет с ХС ЛПНП 1,8-5 ммоль/л без клинически значимых АСССЗ* и СД при
уровне 10-летнего риска АСССЗ >7,5%** должны получать умеренные или высокие
дозы статинов (I/A).
• Лицам 40-75 лет с ХС ЛПНП 1,8-5 ммоль/л без клинически значимых АСССЗ* и СД
при уровне 10-летнего риска АСССЗ 5-7,5%** желательно рекомендовать умерен-
ные дозы статинов (Иа/В).
• Перед назначением статинов лицам 40-75 лет с ХС ЛПНП 1,8-5 ммоль/л без клини-
чески значимых АСССЗ* и СД следует дополнительно оценить потенциальную поль-
зу от их применения, возможные лекарственные взаимодействия и предпочтения
больного (Иа/С).
СН и гемодиализ
Эксперты не дают рекомендаций по началу или прекращению применения статинов у
лиц с СН II-IV ФК по NYHA со сниженной систолической функцией ЛЖ, а также улиц, полу-
чающих лечение программным гемодиализом (без уровня доказательной базы).
Примечания. * Клинически значимое АСССЗ — это ОКС, ИМ (в том числе анамнезе), стабильная
стенокардия, процедуры коронарной или иной артериальной реваскуляризации, инсульт, ТИА,
поражения периферических артерий предположительно атеросклеротической природы.
** Подсчет по специальным уравнениям Pooled Cohort Equations, калькулятор доступен онлайн:
http://my.americanheart.org/cvriskcalculator). У лиц, не получающих статины, не имеющих клини-
чески значимого АСССЗ и СД при уровнях ХС ЛПНП в пределах 1,8-5 ммоль/л этот показатель
рекомендуют подсчитывать каждые 4-6 лет.
Таблица 14.9. Вторичные причины гиперлипидемии,
наиболее часто встречающиеся в клинической практике
(адаптировано из [94])
Вторичные причины
гиперлипидемии
Диетические
Прием
лекарственных
препаратов
Патологические
состояния
Состояния с измененным
метаболизмом
Повышение уровней
ХСЛПНП
Употребление насыщенных
жиров, транс-жиров,
повышение массы тела,
анорексия
Диуретики, циклоспорин,
глюкокортикоиды,
амиодарон
Билиарная обструкция,
нефротический синдром
Гипотиреоз, ожирение,
беременность*
Повышение уровней
ТГ
Повышение массы
тела, диеты с низким
содержанием жиров,
высокоуглеводные диеты,
избыточное употребление
алкоголя
Пероральные эстрогены,
глюкокортикоиды,
ингибиторы протеаз,
анаболические стероиды,
Р-АБ (кроме карведилола),
спиронолактон, тиазиды
Нефротический синдром,
сниженная функция почек,
липодистрофии
СД (плохо
контролируемый),
гипотиреоз, ожирение,
беременность*
Примечание. * При беременности происходит постепенное повышение уровней ХС ЛПНП и ТГ.
Таблица 14.10. Вопросы безопасности терапии статинами
(адаптировано из [94])
Умеренные дозы статинов должны использоваться у лиц, которым показана тера-
пия высокими дозами статинов, но эти больные имеют особенности, предраспола-
гающие к развитию побочных эффектов статинов (1/В). Эти особенности включают:
• Наличие множественных или серьезных СЗ, включая нарушение функции почек или
печени.
• Данные анамнеза об имевшейся ранее непереносимости статинов или заболеваний
мышц.
• Необъяснимое повышение уровней АЛТ >3 верхней границы нормы.
• Возраст >75 лет.
Дополнительные критерии, которые могут препятствовать применению высоких
доз статинов, могут также включать:
• Данные анамнеза о перенесенном геморрагическом инсульте.
• Азиатское происхождение.
• Рутинная оценка уровней креатинкиназы у лиц, получающих терапию статинами, не
рекомендуется (Ill/A).
• Оценка уровней креатинкиназы до начала лечения статинами может требоваться у
лиц, для которых с учетом данных личного или семейного анамнеза о непереносимо-
сти статинов или заболеваний мышц, клинических особенностей, приема сопутству-
ющих препаратов предполагается повышенный риск развития мышечных побочных
эффектов (Иа/С).
• В ходе терапии статинами оценивать уровни креатинкиназы целесообразно у лиц с
мышечными симптомами, включая боль, судороги, уплотнения, локальную или гене-
рализованную мышечную слабость (Иа/С).
• До начала терапии статинами рекомендуется рутинная оценка уровней аминотранс-
фераз (АЛТ) (1/В).
• В ходе терапии статинами оценивать функцию печени целесообразно в случаях по-
явления симптомов, которые могут свидетельствовать о развитии гепатотоксично-
сти (например, необычной общей слабости, потери аппетита, боли в животе, темного
окрашивания мочи, пожелтения кожи или склер (Иа/С).
• О снижении дозы статинов можно думать, если в 2 последовательных анализах
уровни ХС ЛПНП составляют <40 мг/дл (<1 ммоль/л) (ИЬ/С).
• Начало применения симвастатина в дозе 80 мг/сутки или увеличение дозы симваста-
тина до 80 мг/сутки может быть опасным (Ill/A).
• Лиц, получающих терапию статинами, следует обследовать (в соответствии с име-
ющимися рекомендациями) для выявления возможного развития СД. Тем паци-
ентам, у которых на фоне терапии статинами наблюдается развитие СД, следует
советовать соблюдать здоровую диету, быть физически активными, стремиться
поддерживать рекомендуемую массу тела, не использовать табачные продукты,
а также продолжать применение статинов в необходимых дозах для снижения
риска развития АСССЗ (I/B).
Продолжение табл. 14.10—на стр. 118.
Продолжение табл. 14.10
• При использовании любой дозы статинов рекомендуется соблюдать особую осто-
рожность:
- у лиц в возрасте >75 лет;
- у пациентов, принимающих сопутствующие препараты, которые могут влиять на ме-
таболизм статинов;
- у принимающих многочисленные сопутствующие препараты;
- у перенесших трансплантацию органов;
- у получающих лечение по поводу ВИЧ.
До начала терапии статинами у таких больных следует дополнительно оценить инфор-
мацию, имеющуюся в инструкциях к соответствующим препаратам (Иа/С).
Рекомендуется следующий алгоритм выявления и лечения мышечных симпто-
мов, включающих боль, судороги, уплотнения, локальную или генерализованную
мышечную слабость (Иа/В):
• Чтобы избежать необоснованной отмены статинов, еще до их назначения следует
уточнить у больного, имеются ли или имелись ранее какие-либо мышечные симптомы.
• Если в ходе лечения статинами развились необъяснимые тяжелые мышечные сим-
птомы или слабость, следует полностью прервать терапию статином, оценить уров-
ни креатинкиназы, креатинина, а также выполнить исследование миоглобинурии.
• При развитии небольших или умеренных мышечных симптомов на фоне лечения
статинами нужно:
- прервать статин до выяснения причины этих проявлений;
-обследовать больного для выявления состояний, которые могут повышать риск
развития мышечных симптомов (например, гипотиреоз, снижение функции почек
и печени, ревматическая полимиалгия, стероидная миопатия, дефицит витамина D,
а также первичные заболевания мышц);
- при устранении мышечных симптомов и отсутствии противопоказаний, следует
возобновить тот же статин, что использовался ранее, в прежней или уменьшенной
дозе для установления причинной связи между приемом статина и мышечными
симптомами;
- если причинная связь такого рода установлена, этот статин следует отменить; пос-
ле устранения мышечных симптомов следует использовать низкую дозу другого
статина;
-если больной может переносить низкую дозу статина, необходимо ее постепенно
повышать;
- если спустя 2 месяца после отмены статина мышечные симптомы или повышенные
уровни креатинкиназы персистируют, следует предпринять обследование для по-
иска других причин мышечных симптомов (перечисленных выше);
-если установлено, что персистирующие мышечные симптомы не связаны с прове-
дением терапии статином, следует возобновить статин в прежней дозе.
• При развитии на фоне терапии статином ухудшения памяти или состояния сознания
следует обследовать больного в первую очередь в отношении нестатиновых причин
этих проявлений (например, приема иных препаратов, системных или нейропсихиче-
ских нарушений), принимая во внимание и возможность связи этих симптомов с при-
менением статинов (ИЬ/С).
В основе профилактики АСССЗ — изменение образа жизни.
У лиц в возрасте 40-75 лет без АСССЗ и СД,
при ХС ЛПНП 1,8-5 ммоль/л, не получающих статины,
необходимо оценивать 10-летний риск
развития АССССЗ каждые 4-6 лет
Возраст
>21 года и нет
противопоказаний
Да
Клинически значимое
АСССЗ
Нет
ХСЛПНП >5 ммоль/л
Нет
СД 1-го или 2-го типа,
возраст 40-75 лет
Польза от статина менее
ясна. Следует учитывать
другие факторы риска
АСССЗ*, соотношение
польза/риск,
предпочтения больного
Нет
10-летний риск АСССЗ
7,5%, возраст 40-75 лет
=*=
Нет
Возраст <75 лет: высокие дозы
статинов (умереные, если нельзя
Да [Д назначить высокие)
~Да~К
~ЖЦ
~Да~и
"Да~К
~жц
Возраст >75 лет ИЛИ нельзя
назначить высокие дозы —
назначают умеренные дозы
Высокие дозы статинов
(умереные, если нельзя
назначить высокие)
Умеренные дозы статинов
10-риск АСССЗ >7#5% —
высокие дозы статинов
Умереные/высокие
дозы статинов
Рис 14.7. Схематическое представление основных подходов
к выбору тактики применения статинов
для профилактики АСССЗ (адаптировано из [94])
Примечания. Высокие дозы статинов снижают ХС ЛПНП примерно на >50%, умеренные — при-
мерно на 30-50% (с/и. табл. 14.7).
* Первичное (не связанное с другими факторами) повышение уровней ХС ЛПНП до >4,2 ммоль/л
или другие свидетельства наличия семейных гиперлипидемий; данные семейного анамнеза о ран-
нем начале АСССЗ: у мужчин — <55 лет, у женщин — <65 лет; уровни высокочувствительного СРБ
>2 мг/л; индекс накопления кальция в коронарных артериях >300 единиц Agatston; ЛПИ <0,9; др.
Глава 15
Артериальная гипертензия
при хронических
заболеваниях почек
Изложение материала в этой главе состоит из 2 частей. Первая часть базиру-
ется на нескольких опубликованных в 2012 и 2013 годах всемирных рекомен-
дациях, обозначенных как KDIGO, включая Рекомендации по диагностике и
лечению ХЗП, Рекомендации по контролю АД у больных ХЗП, Рекомендации
по диагностике и лечению гломерулонефрита, др. [158-162]. В этой части мы
сочли важным кратко рассмотреть современную номенклатуру и принципы
классификации ХЗП и острого повреждения почек (ОПП); здесь же приведе-
ны подходы к оценке уровней протеинурии/альбуминурии и СКФ. Во второй
части главы обсуждены разные варианты поражений почек, которые могут
сопровождаться развитием АГ.
Номенклатура и классификация поражений почек
(KDIGO-2012)
Хроническое заболевание почек
Этот термин (в качестве синонимов также используют «хроническая бо-
лезнь почек», «хроническое поражение почек») является в настоящее вре-
мя общепринятым. В соответствии с определением KDIGO-2012, под ХЗП
понимают нарушение структуры и/или функции почек, присутствующее
в течение >3 месяцев (табл. 15.1) [161].
ХЗП — это собирательное понятие, объединяющее гетерогенные забо-
левания, которые, во-первых, нарушают структуру и/или функцию почек;
во-вторых, имеют различные клинические особенности; в-третьих, не-
однородны по этиологии, степени тяжести и темпу прогрессирования
[159,161]. На ранних этапах становления и развития ХЗП часто протекают
бессимптомно; их диагностика при этом обычно происходит в ходе скри-
нинговых или случайных исследований, а также при обследовании по
поводу СЗ. При быстропрогрессирующем характере течения некоторых
вариантов ХЗП развитие значимого снижения функции почек возможно
уже в течение нескольких недель-месяцев, однако во многих случаях темп
прогрессирования значительно меньше (годы-десятилетия), а в отдельных
ситуациях при многолетнем наблюдении за больными отчетливого про-
грессирования ХЗП выявить не удается [37,108,132,161 ].
Таблица 15.1. Критерии наличия ХЗП (адаптировано из [161])
Маркеры
поражения
почек
Альбуминурия >30 мг/сутки, или протеинурия >150 мг/сутки, или
соотношение альбумин/креатинин мочи >3 мг/ммоль (>30 мг/г)*
Изменения осадка мочи (например, гематурия, эритроцитарные
цилиндры, зернистые цилиндры, лейкоцитарные цилиндры, двоя-
копреломляющие жировые тела)*
• Электролитные и другие изменения, связанные с нарушениями
функции почечных канальцев (например, при почечном тубуляр-
ном ацидозе, нефрогенном несахарном диабете, синдроме Фанко-
ни, цистинурии)*
• Нарушения, выявленные при гистологическом исследовании по-
чечной ткани
Структурные нарушения, выявленные при инструментальном ис-
следовании (например, поликистоз, дисплазия почки, гидронефроз
вследствие обструкции, кортикальный инфаркт почки вследствие
пузырно-мочеточникового рефлюкса, стеноз почечных артерий, др.)
• Данные анамнеза о перенесенной трансплантации почек
Снижение
СКФ
СКФ менее 60 г
,73 м2н
Примечание. * Изменения в течение >3 месяцев.
Хроническое заболевание почек
и острое повреждение почек
Больные ХЗП на всех стадиях имеют повышенный риск развития ОПП (ра-
нее использовали термин «острая почечная недостаточность») [158]. Опре-
деление и современная классификация ОПП представлены в табл. 15.2.
В большинстве случаев в ходе длительного течения ХЗП на его фоне могут
развиваться один или более эпизодов ОПП. Дифференциальная диагно-
стика между ХЗП и ОПП при первом выявлении снижения функции почек
обычно базируется на особенностях конкретной клинической ситуации
[158]. Так, например, у больного, у которого снижение функции почек (при
СКФ <60 мл/мин/1,73 м2) впервые выявлено в ходе какого-либо острого
заболевания при отсутствии данных о существовании поражения почек
ранее, обычно предполагают ОПП. Улучшение функции почек в течение
нескольких дней-недель может подтвердить диагноз ОПП у такого паци-
ента. В то же время, у больного с аналогичным нарушением функции почек,
впервые выявленным в отсутствие острого заболевания, обычно можно
предполагать наличие ХЗП [161]. Сохранение сниженной функции почек
при последующем наблюдении служит подтверждением диагноза. В обо-
их случаях для более точного установления диагноза требуется повторная
оценка и состояния функции почек, и маркеров почечного поражения.
Кратность повторных исследований определяют индивидуально (более
частые исследования обычно проводят при предположении о наличии
ОПП, более редкие — если предполагают ХЗП) [105,143,158,161,165].
Таблица 15.2. Определение и классификация ОПП
(адаптировано из [158])
ОПП определяют при наличии у больного любой из перечисленных ниже
особенностей:
• повышение уровня креатинина сыворотки крови на >26,5 мкмоль/л в течение 48 часов;
• повышение уровней креатинина сыворотки крови в 1,5 раза и более по сравнению с
имевшимися (или вероятно имевшимися — с учетом клинической ситуации) в течение
ближайших 7 дней;
• уменьшение объема мочи до уровня <0,5 мл/кг/ч за 6 часов.
Классификация ОПП
Стадия
I
II
III
Креатинин сыворотки крови
Повышение в 1,5-1,9 раза по сравнению с исходным
или
повышение на >26,5 мкмоль/л
Повышение в 2-2,9 раза в сравнении с исходным
Повышение в >3 раза по сравнению с исходным
или
повышение до уровня >354 мкмоль/л
или
начало лечения с замещением функции почек*
или
улиц в возрасте <18 лет снижение СКФ до уровня
<35 мл/мин/1,73 м2
Объем мочи
< 0,5 мл/кг/ч
за 6-12 часов
< 0,5 мл/кг/ч
за >12 часов
< 0,3 мл/кг/ч
за >24 часа
или
анурия >12 часов
Примечание.
* 1. Диализное лечение рекомендуют начать безотлагательно в случае наличия жизнеугрожаю-
щих нарушений водно-электролитного и/или кислотно-щелочного баланса.
2. Следует также принимать во внимание развитие иных представляющих опасность ситуа-
ций, потенциально устранимых в ходе диализа.
3. Следует учитывать скорее динамику лабораторных показателей, чем просто абсолютные
значения креатинина сыворотки крови.
4. Не рекомендуют использование диуретиков для улучшения функции почек и/или для
уменьшения длительности диализного лечения.
Классификация хронических заболеваний почек
Эксперты KDIGO-2012 предложили классифицировать ХЗП по следующим
трем характеристикам [161]: этиология, СКФ, уровень альбуминурии (кате-
гории CGA (cause), GFR (glomerular filtration rate, albuminuria). Считаем важ-
ным привести эти классификации (табл. 15.3, 15.4 и 15.5 соответственно).
Таблица 15.3. Классификация ХЗП по этиологии, базирующаяся
на наличии или отсутствии каких-либо общих
(системных) заболеваний и особенностях
гистологической картины почек (адаптировано из [161 ])
Категория
Гломерулярные
заболевания
Тубуло-интерсти-
циальные
заболевания
Сосудистые
поражения
Кистозные
и врожденные
поражения
Примеры общих
(системных) заболеваний,
при которых
поражаются почки
СД, системные заболевания
соединительной ткани,
системные инфекции,
опухоли, амилоидоз, прием
лекарственных препаратов
Системные инфекции,
системные заболевания
соединительной
ткани, саркоидоз,
прием лекарственных
препаратов, токсинов,
подагра, опухоли
(миеломная болезнь)
Атеросклероз, АГ,
ишемическая болезнь
почек, холестериновая
эмболия, системный
васкулит, тромботическая
микроангиопатия,
системная склеродермия
Поликистоз почек,
синдром Альпорта,
болезнь Фабри, оксалатная
нефропатия
Примеры первичных ХЗП
(в отсутствие общих заболеваний,
при которых поражаются почки)
Диффузный, очаговый или
полулунный пролиферативный
гломерулонефрит, фокальный
сегментарный гломерулосклероз,
мембранозная нефропатия, болезнь
минимальных изменений
Инфекции мочевой системы,
мочекаменная болезнь, различные
варианты обструкции мочевой
системы
А1ЧСА*-ассоциированный васкулит
(с изолированным вовлечением
почек), фибромышечная дисплазия
Дисплазия почки, медуллярная
кистозная болезнь (medullary cystic
disease), подоцитопатии
Примечание. * ANCA (antineutrophil cytoplasmic antibodies) — антитела к антигенам цитоплазмы
нейтрофилов.
Наследственные заболевания отдельно не выделены, поскольку в каждой из представленных
категорий имеются состояния, для которых сейчас установлена генетическая предрасполо-
женность. Указанная в таблице дифференциация ХЗП является одним из возможных вариантов
(предложено Рабочей группой по ХЗП KDIGO).
Таблица 15.4. Классификация ХЗП по уровню СКФ
(адаптировано из [161])
Категория
G1 (ХЗП1)
G2 (ХЗП 2)
G3a + (ХЗП 3)
G3b + (X3n3)
G4 (ХЗП 4)
G5 (ХЗП 5)
СКФ
(мл/мин/1,73м2)
>90
60-89
45-59
30-34
15-29
<15
Обозначение состояния
функции почек
Нормальная или повышена
Незначительно снижена*
Снижение от незначительного до умеренного
Снижение от умеренного до выраженного
Выраженное (тяжелое) снижение
Терминальная почечная недостаточность (если
больной на диализном лечении, добавить
букву D)
Примечание. * По сравнению с уровнем у молодых взрослых (в среднем составляет 125 мл/
мин/1,73 м2).
Категории G1 и G2 без маркеров поражения почек {см. табл. 15.7) не являются критериями уста-
новления наличия ХЗП.
+ В Украине на момент написания этого раздела принято выделение 5 стадий ХЗП без разделе-
ния 3-й стадии на а и Ь, также не используют буквенные обозначения G и D.
Таблица 15.5. Категории альбуминурии и протеинурии
(адаптировано из [161])
Показатель
Альбуминурия (мг/сутки)
Протеинурия (мг/сутки)
Соотношение
альбумин/креатинин мочи:
• мг/ммоль
• мг/г
Соотношение
протеин/креатинин мочи:
• мг/ммоль
• мг/г
Оценка с помощью
тест-полосок
(protein reagent strip,
dipstick)
Категория
Норма или
незначительно
повышена (А1)
<30
< 150
<3
<30
<15
<150
«-» или следы
Умеренно
повышена (А2)*
30-300
150-500
3-30
30-300
15-50
150-500
От следов до «+»
Значительно
повышена (A3)
>300
>500
>30
>300
>50
>500
>«+»
Примечание. * Использовавшийся ранее термин «микроальбуминурия» в нефрологии сейчас
заменен на «умеренно повышенную альбуминурию» (категория А2).
Протеинурия, альбуминурия
Под термином «протеинурия» понимают наличие повышенного количества
белка в моче. Протеинурия может быть следствием потерь плазменных про-
теинов вследствие [161]: повышения проницаемости клубочкового фильтра
(альбуминурия, или гломерулярная протеинурия); недостаточной канальце-
вой реабсорбции профильтрованных низкомолекулярных протеинов (тубу-
лярная протеинурия); повышенной плазменной концентрации низкомоле-
кулярных протеинов (протеинурия переполнения, например, обусловлен-
ная экскрецией легких цепей иммуноглобулинов при миеломе).
Протеинурия также может отражать патологические потери белков, обра-
зованных непосредственно в почечных структурах (например, в канальцах
при их повреждении) или в структурах мочевыводящих путей (при инфек-
циях) [79, 113, 122, 214]. Считаем важным обратить внимание читателя на
то, что в течение предыдущих лет авторитетные международные эксперты
указывают на предпочтительность оценки при ХЗП скорее показателей, ха-
рактеризующих альбуминурию (экскреция альбумина, соотношение аль-
бумин/креатинин мочи), чем протеинурию [119,153,161,163].
Степень выраженности гломерулярной протеинурии (альбуминурии) рас-
сматривают в качестве важного фактора, определяющего темп прогресси-
рования ХЗП. Представлены доказательства ее непосредственного повре-
ждающего действия как на гломерулярные (подоциты — эпителиальные
клетки капилляров клубочка), так и на тубулярные структуры [116, 164,
208]. Степень выраженности гломерулярной протеинурии (альбуминурии)
может быть использована также в качестве одного из маркеров прогнози-
рования течения ХЗП и ответа на лечение (табл. 15.6).
Таблица 15.6. Значимость протеинурии у больных ХЗП [155]
Обозначение
Протеинурия является одним
из маркеров наличия ХЗП
Уровень протеинурии может быть
использован для определения ха-
рактера поражения почек
Протеинурия — фактор риска про-
грессирования ХЗП
Уровни протеинурии могут быть
использованы в качестве критерия
прогнозирования ответа на лечение
Динамика уровней протеинурии
используется для прогноза ХЗП
Пояснение
Уровни протеинурии >150 мг/сутки или соотно-
шение альбумин/креатинин мочи >3 мг/ммоль
(или >30 мг/г), удерживающееся >3 месяцев,
включены в определение ХЗП (табл. 15.7)
Более высокие уровни протеинурии свидетель-
ствуют о наличии значимого гломерулярного
поражения
При более высоких уровнях протеинурии про-
грессирование ХЗП более быстрое
Ответ на иммуносупрессивную терапию у больно-
го с гломерулонефритами нередко более значи-
тельный при высоких уровнях протеинурии
Уменьшение протеинурии является одной из це-
лей лечения
Оценка скорости клубочковой фильтрации
СКФ— важнейший показатель состояния функции почек [158,161]. Основ-
ные методы определения включают [121,145,160,161,187]:
• подсчет с использованием формул на базе определения уровня креатини-
на сыворотки крови (наиболее прост и дешев, используют повсеместно);
• подсчет с использованием формул на базе определения содержания
цистатин С (cystatin С) сыворотки крови;
• непосредственная оценка с использованием методик клиренса (инули-
на, эндогенного креатинина, др.).
Мы приводим две из имеющихся многочисленных формул подсчета СКФ,
базирующихся на уровнях креатинина сыворотки крови — Кокрофт-Гоулт
и MDRD. Эти формулы уже достаточно хорошо известны отечественным
клиницистам и вполне пригодны для использования в широкой практике:
Формула Кокрофт-Гоулт
(при уровнях СКФ <10-15 мл/мин/1,73 м2 не применяют):
(140 — возраст (лет)) х масса тела (кг) х 0,85 (для женщин)
0,81 х креатинин сыворотки (мкмоль/л)
Формула MDRD
(особо рекомендуется при уровне СКФ <10-15 мл/мин/1,73 м2)
СКФ = 170х (Осые. х 0,0113)-°>999х возраст (лет)~°'176х (Urcbie.x2,8)-0'17
х А1Ьсыв. х 0,762 (для женщин),
где Сгсыв. — уровень креатинина сыворотки, мкмоль/л; 1/гсыв. — уровень мо-
чевины сыворотки, ммоль/л; А/Ыыв. — уровень альбумина сыворотки, г/дл.
Для ряда ситуаций более точными могут явиться формулы, предлагаемые
экспертами KDIGO-2012 [161]: CKD-EPI creatinine, основанная на определе-
нии креатинина сыворотки, и CKD-EPI cystatin С, основанная на определе-
нии cystatin С сыворотки. Обе эти формулы весьма громоздки, что делает
их использование (при традиционном варианте подсчета — вручную) за-
труднительным. В то же время, они доступны онлайн (http://www.kidney.
org/professionals/kdoqi/gfr_calculator.cfm); их возможно перенести в элек-
тронные устройства индивидуального пользования (например, в мобиль-
ный телефон врача), что позволяет рассматривать эти формулы как вполне
удобное средство подсчета СКФ [161].
Поражения почек, которые могут сопровождаться
развитием артериальной гипертензии
Гломерулонефрит
Понятием «гломерулонефрит» (ГН) обозначают группу заболеваний, харак-
теризующихся двусторонним негнойным воспалением почек, чаще всего
иммунной природы, протекающих с преимущественным поражением клу-
бочкового аппарата и обычным вовлечением в патологический процесс
других почечных структур [65,161]. Термин ГН используется для обозначе-
ния таких гломерулярных поражений [65,161]:
• острый постинфекционный ГН;
• быстропрогрессирующий (подострый, полулунный) ГН;
• мезангио-пролиферативный ГН (в том числе lgA-нефропатия);
• мезангио-капиллярный ГН (также именуется как мембранозно-проли-
феративный);
• ГН при системных заболеваниях соединительной ткани и васкулитах.
Принято выделять первичные ГН, при которых основной патологический
процесс ограничивается почечными структурами, а нередко развивающи-
еся экстраренальные проявления (например, АГ) обусловлены различными
нарушениями структуры и функции почек [65,159,162]. Вторичными счита-
ют ГН, являющиеся проявлениями таких патологических процессов, как си-
стемные заболевания соединительной ткани, системные васкулиты, вирус-
ные гепатиты, инфекционный эндокардит, опухолевые процессы [65,161].
Для определения некоторых форм первичных гломерулярных поражений бо-
лее приняты термины «гломерулопатия» или «нефропатия», например [65]:
• нефропатия с минимальными изменениями;
• фокально-сегментарный гломерулосклероз;
• мембранозная гломерулопатия.
Термин «хронический ГН» в серьезной нефрологической литературе уже
достаточно давно не используют (это — собирательное понятие, которое
не может рассматриваться как окончательный диагноз; стандартным ме-
тодом диагностики гломерулярных поражений является прижизненное
морфологическое исследование почечной ткани с установлением гисто-
логической формы ГН) [65,131,147,180].
Распространенность и характер АГ. Они зависят от характера ГН,
клинической формы, стадии почечного поражения. АГ всегда представлена
при наличии нефритического (остронефритического) синдрома (например,
у лиц с классическим вариантом острого постинфекционного ГН, при бы-
стропрогрессирующих ГН) [65, 161]. У лиц с субклиническим (латентным)
течением гломерулярного процесса АГ длительно может отсутствовать, ее
развитие при ряде вариантов ГН по времени нередко совпадает с этапом
снижения функции почек, однако в части случаев АГ может быть представ-
лена уже на ранней стадии ГН [65,161]. По различным сообщениям, распро-
страненность АГ при мезангио-капиллярном ГН составляет 35-80%, при
lgA-нефропатии — 43-74%, при мембранозной гломерулопатии — 27-52%,
для нефропатии с минимальными изменениями развитие АГ нехарактерно
[161]. Наличие АГ рассматривают как важный критерий неблагоприятного
прогноза (АГ тесно ассоциирована как с увеличением темпа прогрессии по-
чечного поражения, так и с увеличением риска развития СС-осложнений)
[65]. Выраженность АГ при ГН варьирует достаточно широко; на этапах вы-
раженного/тяжелого снижения функции почек достаточно часто представ-
лена резистентная АГ, требующая для контроля АД применения многоком-
понентных режимов антигипертензивной терапии [65,155,158].
Определение и клиническая картина. Клинические проявления ГН
характеризуются большим разнообразием и могут быть представлены [65]:
• изолированным мочевым синдромом: протеинурия менее 1 г/сутки и
микрогематурия (чаще с гломерулярными, измененными эритроцитами
в осадке мочи, возможно с цилиндрами — гиалиновыми, эритроцитар-
ными, зернистыми);
• нефротическим синдромом: протеинурия >3 г/сутки, гипо- и диспротеи-
немия, гиперлипидемия, отеки);
• нефритическим синдромом/синдромом быстропрогрессирующего ГН:
с быстрым развитием и бурным прогрессированием АГ и снижения
функции почек;
• эпизодами макрогематурии.
Уровни протеинурии, гематурии, лейкоцитурии, особенности и выражен-
ность цилиндрурии характеризуются широкими колебаниями не только у
разных больных в пределах одной морфологической формы ГН, но и на
разных стадиях ГН у одного и того же больного [65, 161]. В части случаев
ГН может протекать латентно (практически без клинических проявлений),
в других — с обострениями, характеризующимися ухудшением мочевого
синдрома, развитием АГ или нарастанием степени ее выраженности, сни-
жением функции почек или прогрессированием уже имеющейся почечной
недостаточности [65,136,137,146].
Механизмы развития АГ при ГН многофакторны; ведущими среди них
являются [161,162]:
• активация РАС и симпатической систем, что связано с развитием гломе-
рулосклероза, тубулоинтерстициального фиброза и постепенной утра-
той функционирующей паренхимы почек;
• задержка натрия и воды;
• ремоделирование сосудов и эндотелиальная дисфункция;
• на этапах снижения функции почек также — вторичный гиперпаратире-
оз, анемия, у лиц на гемодиализе — наличие артериовенозного шунта.
Диагностика. Важная роль при ХЗП в целом и при ГН, в особенности,
отводится тщательному динамическому лабораторному исследова-
нию мочи [65]. Оценивают [65,161]:
• уровни и характер протеинурии (интермиттирующая, персистирующая, др.);
• мочевой осадок, включая наличие, степень выраженности и особенно-
сти лейкоцитурии (с экскрецией полиморфноядерных лейкоцитов или
лимфоцитов), гематурии (представленной измененными, гломеруляр-
ными эритроцитами или неизмененными, или их сочетанием), цилин-
друрии (гиалиновые, зернистые, восковидные, эритроцитарные, др.),
липидурии и иных параметров.
Необходим регулярный контроль уровней АД (в том числе самоконтроль).
Инструментальные методы обследования в диагностике ГН занимают
вспомогательное место; их преимущественно используют для исключе-
ния иных причин обнаруженных изменений в анализах мочи (УЗИ, КТ, МРТ,
др.). Стандартным является регулярный динамический контроль размеров
почек с использованием УЗИ.
Важнейшая роль в диагностике и установлении особенностей ГН (гломе-
рулярных интра- и экстракапиллярных изменений, тубуло-интерстици-
альных и сосудистых нарушений), выборе лечебной тактики и оценке ее
эффективности отводится прижизненному морфологическому иссле-
дованию почечной ткани (биопсии почки) с применением световой, им-
мунофлюоресцентной и электронной микроскопии [65,161]. Современные
показания к проведению биопсии почки включают:
• нефротический синдром — практически у всех взрослых больных;
• микро- или макрогематурию — при наличии измененных эритроцитов
(обычно более 50-80%) и эритроцитарных цилиндров; а также при нали-
чии изолированной микрогематурии длительностью 6 месяцев и более
при отсутствии данных о врожденных анатомических изменениях почек
или мочевыводящих путей, мочекаменной болезни, наличии кист, опу-
холей почек или мочевыводящих путей;
. ОПП;
• снижение функции почек (при быстром прогрессировании, в случае
неустановленного диагноза, если размер почек >9 см);
• системные заболевания соединительной ткани и васкулиты;
• подозрение на острое или хроническое отторжение почечного транс-
плантата.
При обсуждении вопросов диагностики ГН кратко перечислим ведущие
клинические характеристики тех системных заболеваний соединительной
ткани и системных васкулитов, которые протекают с развитием ГН [65,161 ]:
• системная красная волчанка: скуловая эритема, дискоидная сыпь, фо-
тосенсибилизация, язвы слизистой рта, неэрозивный артрит >2 суста-
вов, серозит; ГН (клиническая картина разнообразна — от латентного
до быстропрогрессирующего); поражение центральной нервной систе-
мы (ЦНС) — судороги или психоз; гематологические нарушения (анемия,
лейкопения, тромбоцитопения); иммунологические нарушения (антите-
ла к нативной ДНК, антифосфолипидные антитела), повышение уровня
антинуклеарного фактора; диагноз считают определенным при наличии
4 из вышеперечисленных критериев);
• гранулематоз Вегенера: синуситы и носовые кровотечения; в легких —
инфильтраты, каверны, альвеолярные инфильтраты; ГН — нередко по
типу быстропрогрессирующего; ANCA;
• микроскопический полиангиит: пурпура; альвеолярные геморрагии;
полинейропатии; ГН — обычно быстропрогрессирующий; ANCA;
• синдром Чарга-Стросса: астма; эозинофилия; нейропатия; ГН — в ча-
сти случаев по типу быстропрогрессирующего; ANCA.
Лечение. Лечебные мероприятия при ГН определяются его характе-
ром — особенностями почечного поражения и экстраренальных наруше-
ний, наличием и выраженностью АГ и снижения функции почек [65, 161].
Важнейшее место в лечебной тактике при ГН (как и практически при всех
вариантах ХЗП) занимают рено- и кардиопротекторные подходы, кото-
рые включают [65,161 ]:
• антигипертензивную терапию: целевые уровни АД обычно
<140/90 мм рт. ст., но для лиц с протеинурией >0,15 г/сутки —
< 130/80 мм рт. ст., правда, при достаточно невысоких уровнях доказа-
тельности — IID-IIC. В Рекомендациях ESC/ESH (2013) [136] эксперты ука-
зывают целевые уровни САД при ХЗП менее 140 мм рт. ст. (Иа/В), а при
явной протеинурии (без указания уровня) — менее 130 мм рт. ст. (ИЬ/В);
ДАД обычно должно быть в пределах 80-90 мм рт. ст. (I/A);
• применение ингибиторов АПФ или сартанов (в качестве самостоятельного
органопротекторного подхода их сочетание не должно использоваться);
• отказ от курения;
• прекращение или сведение к минимуму применения НПВП;
• контроль дислипидемии (статинами, целевой уровень ХС ЛПНП <2,5 или
даже <2 ммоль/л);
• контроль гипергликемии (целевые уровни НЬА1С обычно менее 7%);
• контроль анемии (препараты железа, эритропоэзостимулирующие пре-
параты — обычно до уровня гемоглобина не более 115 г/л);
• применение низкобелковой диеты;
• коррекция кальциево-фосфорного баланса.
При наличии показаний могут использоваться различные режимы
иммуносупрессивной терапии с применением препаратов цитотокси-
ческого действия, глюкокортикоидов, возможно — противомалярийных
препаратов. На этапах терминальной почечной недостаточности исполь-
зуют лечебные подходы, замещающие функцию почек (программный
гемодиализ, перитонеальный диализ, трансплантация почки) [161].
Диабетическая нефропатия
Распространенность АГ улиц сСД 1-го и 2-го типа с наличием диабе-
тической нефропатии составляет от 70 до 100% [161 ].
Определение и клиническая картина. Диабетическая нефропа-
тия — классическое микрососудистое осложнение СД как 1-го, так и 2-го
типа, протекающее с преимущественным поражением гломерулярного
аппарата и тубуло-интерстициальными нарушениями (морфологическая
картина почек при диабетической нефропатии у лиц с СД 1-го и 2-го типа
имеет существенные различия). Клинически диабетическая нефропатия
характеризуется протеинурией, прогрессирующим снижением СКФ (осо-
бенно после развития выраженной протеинурии), развитием и усугубле-
нием АГ [65,155,161].
Механизмы развития АГ при диабетической нефропатии включают
все, упоминавшиеся выше в разделе, посвященном механизмам развития
АГ при ГН. Кроме них, важную роль в развитии АГ при диабетической неф-
ропатии отводят собственно гипергликемии [65,155,161].
Диагностика. Всем больным с СД рекомендуется тщательный контроль
АД (включая самоконтроль) [65]. У лиц с СД 1 -го и 2-го типа при отсутствии
данных анамнеза о поражении почек обязателен регулярный (не реже
1 раза в год) контроль общих анализов мочи. При отсутствии изменений
в таких анализах всем лицам с СД рекомендуется ежегодное определение
экскреции малого количества альбумина (микроальбуминурии или, по
терминологии KDIGO-2012, умеренно повышенной альбуминурии). Также
необходим регулярный контроль уровней креатинина сыворотки крови с
подсчетом СКФ. Целесообразно выполнение УЗИ почек (размеры, структу-
ра), в том числе в динамике; иные инструментальные исследования — по
специальным показаниям (например, при присоединении мочевой инфек-
ции). Прижизненное морфологическое исследование почек (биопсия) у
лиц с диабетической нефропатией проводится реже, чем у больных с ГН,
преимущественно с целью исключения других (то есть дополнительных, не
связанных с СД) вариантов почечного поражения (например, быстропро-
грессирующего полулунного ГН) [61,65,70,71,161].
Лечение. В основе лечебной тактики лежит тщательное применение стан-
дартных рено- и кардиопротекторных подходов, которые перечислены выше
в разделе, посвященном лечению ГН (особую роль, естественно, отводят тща-
тельной коррекции гипергликемии) [65, 161]. Здесь лишь необходимо доба-
вить, что при диабетической нефропатии целевые уровни АД, в соответствии
с Рекомендациями KDIGO-2012, установлены такими же, как и при недиабе-
тических ХЗП (то есть обычно <140/90 мм рт. ст., но для лиц с протеинурией
>0,15 г/сутки — <130/80 мм рт. ст., однако при весьма невысоких уровнях
доказательности (IID). Достижение указанных целевых значений АД у значи-
тельной части больных с диабетической нефропатией требует использования
многокомпонентных режимов антигипертензивной терапии [161].
Хронический пиелонефрит
Распространенность АГ. АГ имеет место у 50-75% больных с хрониче-
ским пиелонефритом (ХП): АГ может развиваться как при одностороннем,
так и при двустороннем поражении почек [65,161 ]. Распространенность АГ
более высока у лиц со сниженной функцией почек. Для острого пиелонеф-
рита развитие АГ нехарактерно [161].
Определение и клиническая картина. ХП — неспецифическое ин-
фекционно-воспалительное хроническое заболевание почек (одно- или
двустороннее, с возможным формированием Рубцовых изменений почеч-
ной ткани), при котором в патологический процесс вовлекаются почечная
лоханка, чашечки и паренхима почки (в первую очередь и в основном —
интерстиций и канальцевый аппарат), а также клубочки и почечные сосуды
[65, 161]. ХП является причиной развития терминальной стадии почечной
недостаточности в 13-22% случаев.
Клиническая картина включает фазы ремиссии (при нормальном АД и
сохранной функции почек может протекать бессимптомно, также могут
отсутствовать и изменения в анализах мочи) и обострения (могут быть
представлены боли в пояснице и/или фланках живота, дизурия, частое
мочеиспускание, общая слабость, субфебрилитет; при тяжелом обостре-
нии — гектическая лихорадка, интоксикационный синдром) [65, 161].
При ХП могут отмечаться симптомы, связанные с тубуло-интерстициаль-
ными поражениями (увеличение экскреции натрия, полиурия, никтурия,
снижение концентрационной способности почек, гиперкалиемия, ацидоз).
В анализах мочи в период обострения обычно выявляют лейкоцитурию
различной выраженности, гематурию (чаще — микрогематурию, обычно
представленную неизмененными (негломерулярными) эритроцитами, но
может иметь и смешанный характер, то есть включать гломерулярные и
негломерулярные эритроциты), могут обнаруживаться лейкоцитарные и
бактериальные цилиндры [65,161]. Протеинурия чаще менее 1 г/сутки, од-
нако возможны уровни протеинурии в пределах 1 -3 г/сутки и более — при
развитии патологических изменений в гломерулярном аппарате, в частно-
сти, фокального и сегментарного гломерулярного гиалиноза и склероза в
области Рубцовых изменений почек [65,155,161].
Механизмы развития АГ. В развитии АГ у больных ХП важную роль
отводят ряду факторов (они могут играть как самостоятельную роль, так и
быть представлены в комбинациях) [65,116,131,155,161]:
• повышение активности РАС (чаще — при одностороннем поражении);
• гиперволемия (обычно — при двусторонних процессах);
• окклюзирующие поражения различных отделов сосудистого русла по-
чек — интралобулярных и аркуатных артерий, утолщение стенки и фи-
броз интимы артериол.
Диагностика. Больные ХП даже в отсутствие АГ нуждаются в регулярном
контроле АД и периодическом (1-2 раза в год при стабильном клиническом
состоянии) контроле креатинина плазмы [65, 161]. Необходим постоянный
контроль общего анализа мочи (как в период ремиссии, так и — более ча-
сто — в ходе обострений); для оценки концентрационной функции почек
используют определение удельной относительной плотности мочи в пробе
С.С. Зимницкого (обычно — с умеренным ограничением приема жидкости в
день сбора мочи). С целью установления структурных особенностей почек
(оценка размеров, контуров, толщины и однородности паренхимы, формы
и размеров чашечно-лоханочного аппарата, Рубцовых изменений) широ-
кое применение находят УЗИ и КТ, в последнее время также — МРТ. Суще-
ственно реже, чем раньше, сейчас используют экскреторную уронефрогра-
фию (что связано с присущими ей такими недостатками, как значительная
экспозиция ионизирующего излучения и йодосодержащих контрастных
веществ). Могут также использоваться (сейчас реже, чем ранее) радиону-
клидные методы — ренография и сцинтиграфия почек (позволяют оцени-
вать раздельную функцию каждой из почек, предоставляют дополнитель-
ную информацию об особенностях функционирования сосудистой системы
почек, обструкции мочевыводящих путей, рефлюксах) [65,161,163].
Лечение. У взрослых (старше 18 лет) с неосложненным пиелонефритом
отдаленный прогноз часто благоприятный, в подавляющем большинстве
сохраняется нормальная функция почек [65,161]. У многих пациентов АГ не
развивается. При развитии АГу лиц с ХП необходим строгий контроль АД ан-
тигипертензивными препаратами (в качестве компонентов комбинирован-
ной терапии предпочтительно назначение ингибиторов АПФ либо сартанов,
за исключением беременных) [65, 161]. При обострениях ХП необходимо
проводить адекватную антибактериальную терапию [161 ].
Поликистоз почек у взрослых
В англоязычной литературе для отграничения этого состояния от иных
форм кистозных поражений почек используют термин «аутосомно-доми-
нантная поликистозная болезнь почек» — autosomal dominant polycystic
kidney disease (ADPKD) [161].
Распространенность и характер АГ. АГ имеется не менее чем у 50-60%
больных поликистозом почек (ПКП); АГ является одним из наиболее частых
клинических проявлений при ПКП; ее развитие рассматривают как важный
критерий прогрессирования почечного поражения. Развитие АГ возможно
начиная с детского возраста [155,161 ].
Определение и клиническая картина. ПКП — врожденное систем-
ное нарушение с преимущественным поражением почек (также нередко с
вовлечением печени, поджелудочной железы, реже — головного мозга и
других органов). Может развиваться улиц обоего пола. Развитие ПКП связы-
вают с различными мутациями (их описано сейчас несколько сотен) одного из
двух генов, кодирующих образование протеинов полицистина 1 и 2 (PKD1 и
PKD2, соответственно), которые регулируют функцию кальциевых каналов в
мембране клеток тубулярного аппарата и сосудов почек, а также некоторых
других тканей). Мутации PKD1 наблюдают более часто (85% случаев), они бо-
лее рано приводят к развитию почечной недостаточности (средний возраст
развития терминальной стадии почечной недостаточности для мутаций по
PKD1 — 53 года, для мутаций по PKD2 — 69 лет). Патологический ген от роди-
теля с ПКП наследуется ребенком в 50% случаев. Примерно в 5% случаев ПКП
мутации указанных генов являются спонтанными [161 ].
Для ПКП характерно наличие билатеральных наполненных жидкостью
кист в почках (чаще — многочисленных; кисты могут содержать кровь по-
сле травматизации, могут нагнаиваться). У 85% лиц с ПКП также выявляют
кисты печени, у 30-40% — кисты поджелудочной железы; у 8% — аневриз-
мы интракраниальных сосудов; в части случаев могут также присутство-
вать кисты предстательной железы, поражения сердца (чаще — пролапс
митрального клапана, дилатация корня аорты), дивертикулез толстого ки-
шечника. Почечное поражение обычно является ведущим в клинической
картине и определяет прогноз.
Нередко наблюдают эпизоды мочевой инфекции. Примерно у 60% лиц с
ПКП могут наблюдаться эпизоды макрогематурии. Часто имеется тенден-
ция к увеличению размеров и количества кист, что приводит к прогресси-
рующему симметричному увеличению размеров почек. Несмотря на это,
в течение десятилетий функция почек может удерживаться в нормальных
пределах, однако с 3-4-го десятилетий жизни обычно начинается ее сни-
жение (при этом часто наблюдают развитие АГ). Лица с ПКП составляют до
10% среди больных с терминальной стадией почечной недостаточности,
получающих диализное лечение в западных странах [155,161 ].
Механизмы развития АГ. В развитии АГ могут играть роль различные
факторы [155,161]:
• сдавление интраренальных артерий кистами с развитием ишемизации
почечной ткани, хронической активацией РАС и симпатической систем;
• постепенная утрата функционирующей паренхимы почек, что также
способствует формированию и нарастанию нейрогуморальной гипер-
активности;
• задержка натрия почками.
Диагностика. Генетические исследования ввиду низкой специфично-
сти не используют для скринингового обследования. Инструментальным
методом выбора для скрининга и динамического контроля является УЗИ
(у взрослых позволяет выявлять кисты размером >1 см в диаметре); при
необходимости — у лиц с небольшими и немногочисленными кистами —
может использоваться КТ с внутривенным усилением (позволяет выявлять
кисты >0,3 см в диаметре, но сопряжена с экспозицией йодосодержащих
контрастных веществ и риском контрастиндуцированной нефропатии).
Критериями диагностики ПКП при УЗИ почек являются:
• >2 уни- или билатеральных кист у лиц в возрасте <30 лет;
• >2 кист в каждой из почек у лиц в возрасте 30-59 лет;
• >4 кист в каждой из почек у лиц в возрасте >60 лет.
Дополнительным критерием диагностики является выявление кист в пече-
ни и поджелудочной железе [161,208]. У лиц без семейного анамнеза ПКП
требуется проведение дифференциальной диагностики с другими вариан-
тами кистозного поражения почек [155,161]:
• простые кисты (единичные, без прогрессирования);
• приобретенные кисты (немногочисленные, могут развиваться у лиц,
имеющих сниженную функцию почек);
• аутосомно-рецессивная поликистозная болезнь почек (кисты многочис-
ленные, выявляются у новорожденных, детей раннего возраста).
Лицам с ПКП, имеющим интракраниальные аневризмы, ишемические ин-
сульты, а также отмечающим появление головных болей или иной новой
неврологической симптоматики, показано проведение МРТ-ангиографии
головы [155,161].
Лечение. До настоящего времени отсутствуют лечебные подходы, кото-
рые в РКИ показали бы замедление формирования кист и прогрессию ПКП
(определенные надежды возлагают на группу так называемых водных ди-
уретиков — ваптанов) [155,161]. Лечебные подходы зависят от особенно-
стей клинической картины.
При отсутствии АГ, снижения функции почек и иных клинических проявлений
рекомендуют наблюдение с регулярным контролем АД, уровней креатинина
крови, размеров почек по данным УЗИ. Лицам с АГ рекомендуют жесткий кон-
троль АД (целевые цифры — около 130/80 мм рт. ст.); важным является строгое
ограничение поваренной соли в диете; в качестве предпочтительных групп
антигипертензивных препаратов рассматривают ингибиторы АПФ или сар-
таны, обычно в комбинации с диуретиками (тиазидовыми и/или петлевыми),
возможно — с другими классами антигипертензивных препаратов [162].
При эпизодах макрогематурии — постельный режим, аналгетики, во время
эпизода — достаточная гидратация для поддержания объема мочи в пре-
делах 2-3 л/сутки (при отсутствии противопоказаний); при наличии таких
эпизодов в анамнезе — по возможности избегать применения антитром-
ботических препаратов и травматизации области живота и поясницы. У
лиц с эпизодами мочевой инфекции проводится стандартная антибактери-
альная терапия (первая линия — фторхинолоны). Лицам с терминальной
стадией почечной недостаточности показано диализное лечение и транс-
плантация почки [155,160,161,208].
Гидронефроз, обструктивная нефропатия
Распространенность и характер АГ. АГ не относится к частым кли-
ническим проявлениям при гидронефрозе, особенно у лиц с односторон-
ним характером поражения. Развитие АГ более часто наблюдают при дву-
стороннем тяжелом гидронефрозе, обычно совпадает по времени с этапом
снижения функции почек [155,161,162,208].
Определение и клиническая картина. Гидронефроз — патологи-
ческое состояние, характеризующееся дилатацией чашечно-лоханочного
аппарата почки, связанной с нарушением оттока мочи из почки (полной
или частичной обструкцией мочевыводящих путей). В качестве синонима
может использоваться термин «обструктивная нефропатия» [161]. Возмож-
ные причины гидронефроза включают [161, 208]:
• врожденные структурные нарушения почек, мочеточника, мочевого пу-
зыря или уретры, нарушающие отток мочи;
• приобретенные изменения этих структур вследствие травм, хирургиче-
ских вмешательств, облучения, др.;
• компрессии структур мочевыводящих путей извне (сосудами, опухоля-
ми, в том числе при аденоме предстательной железы, билатеральная
компрессия мочеточников при беременности, при ретроперитонеаль-
ном фиброзе, др.);
• обтурация просвета мочевыводящих путей конкрементами, сгустками кро-
ви (особенно часто — в месте впадения мочеточника в мочевой пузырь);
• различные виды рефлюкса (особенно — пузырно-мочеточниковый);
• нейрогенный мочевой пузырь.
Клинические проявления зависят от особенностей обструкции (острая или
хроническая, частичная или полная, одно- или двусторонняя) [161 ]. Напри-
мер, острая обструкция мочеточника конкрементом вызывает появление
интенсивной резкой боли в пояснице (почечная колика), также нередки
дизурия, тошнота/рвота; в то же время постепенное развитие гидронефро-
за может не вызывать клинических проявлений. Нарушение оттока мочи
может увеличивать риск образования конкрементов, повышает вероят-
ность развития/обострения мочевой инфекции (клинические проявления
могут включать дизурию, лихорадку, интокси кационный синдром, пиурию).
Возможны эпизоды макрогематурии. Вследствие дисфункции тубулярного
аппарата возможно также развитие гипонатриемии, гиперхлоремическо-
го метаболического ацидоза. Суммарная функция почек может оставаться
ненарушенной даже при тяжелом одностороннем гидронефрозе (контра-
латеральная почка обеспечивает компенсацию функции пораженной поч-
ки). По мере уменьшения объема суммарной функционирующей почечной
паренхимы развиваются снижение функции почек и АГ [208].
Механизмы развития АГ включают уменьшение функционирующей
почечной паренхимы и хроническую ишемизацию ткани почек с активиза-
цией РАС [155,161,162,208].
Диагностика. Для диагностики гидронефроза у плода используют анте-
натальное (in utero) УЗИ; диагноз подтверждают в случае, если передне-зад-
ний размер почки плода >4 мм во II триместре и >7 мм в III триместре бе-
ременности [161, 208]. Диагностика гидронефроза у взрослых базируется
на данных таких инструментальных исследований, как УЗИ, спиральная КТ,
МРТ; достаточно широко используют также экскреторную уронефрогра-
фию (для установления локализации и особенностей обструкции), ретро-
градную пиелографию, цистоуретерографию (особенно — для диагнос-
тики пузырно-мочеточникового рефлюкса) [161,208].
Улиц с почечной коликой предпочтительным начальным методом исследо-
вания является спиральная КТ (она позволяет выявлять до 99% конкремен-
тов в мочевыводящих путях; здесь следует отметить, что не все из таких кон-
крементов могут быть визуализированы при УЗИ и экскреторной уронеф-
рографии). При исследовании мочи у лиц с гидронефрозом в части случаев
изменений может не выявляться, в других случаях представлены: гематурия
(неизмененные, негломерулярные эритроциты чаще у лиц с наличием моче-
каменной болезни); лейкоцитурия (во время эпизодов мочевой инфекции);
снижение концентрационной способности почек в пробе С.С. Зимницкого;
увеличение рН мочи (из-за поражения дистальных канальцев) [161,208].
Лечение в качестве важнейшего компонента включает устранение об-
струкции и обеспечение дренирования почки. Тактика при этом определя-
ется характером обструкции [161,208]:
• при острой обструкции верхних мочевыводящих путей — возможно —
нефростомия;
• при их хронической обструкции — мочеточниковые стенты;
• при обструкции нижних мочевыводящих путей — катетеризация уре-
тры или надлобковая пункция и катетеризация.
У лиц с мочекаменной болезнью может использоваться литотрипсия; при
аденоме предстательной железы — соответствующие медикаментозные
подходы (например, антиандрогеновые препараты, др.). При обостре-
ниях мочевой инфекции проводят соответствующее антибактериальное
лечение [161, 208]. В случае развития АГ требуется жесткий контроль АД
(целевые уровни около 130/80 мм рт. ст.), предпочтительными группами
антигипертензивных препаратов являются ингибиторы АПФ либо сартаны,
обычно в комбинациях с диуретиками и БКК; при необходимости применя-
ют и другие классы лекарственных средств [162,208].
Гипоплазия почки
Распространенность и характер АГ. АГ представлена у 20-50%
взрослых с гипоплазией почки; степень выраженности АГ широко варьи-
рует [161,162,208].
Определение и клиническая картина. Гипоплазия почки — врожден-
ное нарушение ее развития, при котором почка уменьшена в размере и ха-
рактеризуется сниженным количеством нефронов [161, 208]. В большинстве
случаев имеются также нарушения структуры ткани почки (дефекты каналь-
цевого аппарата, интерстициальный фиброз, др.), что обозначается как ги-
подисплазия почки. Значительная часть случаев гипоплазии почки является
компонентом различных наследственных синдромов, связанных с мутациями
различных генов; обычно такие больные имеют множественные мальформа-
ции различных органов и систем, АГ и снижение функции почек (особенно при
двусторонней гипоплазии); диагноз у них устанавливается в детском (часто —
в раннем детском) возрасте [161,208]. Гипоплазия почки может представлять
изолированное врожденное нарушение; при одностороннем характере, от-
сутствии ишемизации почечной ткани и сохранной суммарной функции почек
клинические проявления могут полностью отсутствовать; диагноз у таких лиц
устанавливают случайно (например, при скрининговом УЗИ). В случаях нали-
чия сосудистых нарушений, способствующих ишемизации ткани гипоплазиро-
ванной почки (например, аномалий развития или ветвления почечных арте-
рий, в том числе интраренальных), возможно развитие АГ [70,161,208].
Механизмы развития АГ. Как правило, в основе развития АГ у таких
больных лежит связанная с гипоперфузией почки хроническая активация
РАС [155,162].
Диагностика. Предположение о том, что причиной АГ является гипопла-
зия почки, может возникнуть, если у пациента, по данным УЗИ, КТ, МРТ или
других инструментальных методов исследования (обзорная или экскре-
торная урография, сцинтиграфия почек) выявляют уменьшение размера
почки (нормальные размеры у взрослых: длина — 100-115 мм, ширина —
50-70 мм, толщина — 30-50 мм) [155,162]. Естественно, что таким больным
должны выполняться и стандартные общеклинические и биохимические
лабораторные исследования.
Лечение. При отсутствии эффекта от консервативного антигипертензив-
ного лечения, а также в случаях прогрессирующего снижения функции по-
чек могут требоваться хирургические вмешательства (реваскуляризация,
нефрэктомия) [162,208].
Ренинпродуцирующие опухоли
Распространенность и характер АГ. АГ присутствует у большинства
пациентов, однако описаны единичные бессимптомные случаи; АГ обычно
тяжелая, плохо контролируемая; АД чаще стабильно высокое, однако возмо-
жен и кризовый характер течения; обычно развивается у молодых взрослых
(2—3 десятилетия жизни), реже — улиц среднего возраста [155,161,208].
Определение и клиническая картина. В узком понимании ре-
нинпродуцирующие опухоли — это опухоли ЮГА почек (также обозначают
как рениномы) [161, 208]. Важно отметить (см. подраздел «Диагностика»),
что повышение образования ренина может наблюдаться и при иных опухо-
лях почек (например, почечно-клеточной карциноме, гемангиоперицито-
ме), а также при метастатических опухолях иных локализаций (легких, яич-
ников, печени, поджелудочной железы, саркоме, тератоме, параганглиоме,
др.). Повышению уровней ренина в циркуляции могут также способство-
вать крупные интраренальные опухоли, сдавливающие сосудистую систе-
му почки [161, 208]. Собственно рениномы — редкие доброкачественные
опухоли, нередко — небольшого размера (до 15-20 мм в диаметре), часто
протекающие с вторичным гиперальдостеронизмом и связанной с ним
гипокалиемией (нередко — тяжелой, с уровнями калия крови в пределах
2-3 ммоль/л) и очень высокими уровнями проренина и ренина крови [208].
Механизм развития АГ. АГ является ренинзависимой [155,162].
Диагностика. Предположение о наличии ренинпродуцирующей опухо-
ли возможно, если у молодого больного тяжелой АГ (нередко — с выражен-
ной гипокалиемией) наличие реноваскулярного поражения уже исключе-
но по данным артериографии [155, 162]. Рекомендуют выполнение УЗИ и
КТ. При подозрении на наличие опухолевого процесса иных локализаций
с метастазированием выполняют соответствующие исследования. Обычно
диагноз позволяет установить морфологическое исследование ткани уда-
ленной опухоли, однако в части случаев ввиду сходства гистологической
картины первичных опухолей почек (включая позитивность по актину и
CD34) окончательный диагноз остается неустановленным [161, 208].
Лечение. Хирургическое удаление опухоли (с различным объемом вме-
шательства — частичная или радикальная нефрэктомия) ведет к устране-
нию или значительному уменьшению выраженности АГ и гипокалиемии
(обычно в течение 1 недели после операции). В отдаленном послеопера-
ционном периоде рецидивы или метастазирование этих опухолей не на-
блюдают [122,131,208].
Травма почки
Распространенность и характер АГ. АГ не является частым прояв-
лением травмы почки. Однако в случаях развития перинефральной или
субкапсулярной гематомы и связанной с этим компрессии почки развитие
АГ возможно. Частота АГ при тупой травме почки оценивают как 2-10%. АГ
чаще развивается быстро (возможно — и отсрочено), в части наблюдений
плохо контролируется лекарственными препаратами [155,161,162, 208].
Определение и клиническая картина. Сдавление почечной парен-
химы извне — гематомой (при спортивной или иной травме, а также ятро-
генной природы — как осложнение биопсии почки), возможно — опухолью
или кистой — обозначается как «синдром Пейджа» или «почка Пейджа»
(Page kidney) [208]. Клиническая картина у лиц, имеющих АГ как следствие
травмы почки, может варьировать от бес- или малосимптомных случаев до
ситуаций с наличием болевого абдоминального синдрома, болей в поясни-
це (чаще — односторонних), макро- или микрогематурии [155,161,208].
Механизмы развития АГ. АГ является следствием гипоперфузии, ише-
мии почечной ткани и связанной с этим гиперактивации РАС [162].
Диагностика. У лиц с АГ (независимо от возраста) при сборе анамнеза
необходимо обратить внимание на данные о перенесенных травмах пояс-
ничной области и/или живота (различной давности); установить временную
связь развития АГ с подобной травматизацией. Диагностическим методом
выбора является КТ почек с внутривенным контрастированием [161,208].
Лечение. В части случаев достаточным может явиться выжидательный
консервативный подход с использованием общепринятых антигипертен-
зивных лекарственных препаратов. Может также использоваться хирурги-
ческая эвакуация гематомы [161, 208].
Синдром Лиддла (Liddle)
Распространенность и характер АГ. АГ присутствует практически у
всех больных; обычно она развивается у лиц молодого возраста (до 35 лет),
возможно — начиная с раннего детского возраста (первые годы жизни);
при отсутствии лечения уровни АД могут быть весьма высоки (3-я степень
АГ) [155,162, 208].
Определение и клиническая картина. Синдром Лиддла — редкое
генетически обусловленное (с аутосомно-доминантным типом наследо-
вания) нарушение функции дистальных почечных канальцев с усилени-
ем реабсорбции натрия и вторичным повышением секреции калия. В его
основе лежат мутации генов SCNN1B или SCNN1G, кодирующих бета- или
гамма-субъединицы амилоридчувствительных натриевых каналов эпите-
лия тубулярного аппарата почек.
Ведущие проявления синдрома Лиддла [155,162, 208]:
• гипокалиемия и гиперкалийурия;
• АГ;
• метаболический алкалоз;
• гипернатриемия;
• уровни ренина и альдостерона плазмы нормальные или сниженные;
• возможно — нарушения интеллектуального и/или физического развития;
• дегидратация, сонливость, мышечная слабость, миалгия, запор, сердце-
биение (как проявления гипокалиемии).
Механизмы развития АГ. АГ при синдроме Лиддла — солечувстви-
тельная и объемзависимая — с развитием хронической перегрузки натри-
ем и объемом [155,162, 208].
Диагностика. Предположение о наличии этого редкого синдрома мо-
жет возникнуть, если у молодого больного (возможно — у ребенка ран-
него возраста) АГ сочетается с перечисленными выше нарушениями элек-
тролитного и кислотно-щелочного баланса. Рекомендуют выполнение
исследования ренина и альдостерона плазмы. Целесообразно обследова-
ние кровных родственников обоего пола в разных поколениях. Для под-
тверждения диагноза рекомендуют проведение генетических исследова-
ний [155,161,162,208].
Лечение. Ограничение поваренной соли в диете; лечебный подход выбо-
ра — калийсберегающие диуретики, не относящиеся к группе антагонистов
альдостерона — амилорид или триамтерен, блокирующие чрезмерно повы-
шенную при синдроме Лиддла функцию натриевых каналов тубулярного ап-
парата почек [155,208]. Применение этих препаратов приводит к снижению
АД и коррекции гипокалиемии и метаболического алкалоза. Иные антиги-
пертензивные препараты (в том числе антагонисты альдостерона, напри-
мер, спиронолактон) малоэффективны. При адекватном лечении прогноз
считают достаточно благоприятным. Может быть использована трансплан-
тация почки (устраняются и АГ, и метаболические нарушения) [155,162,208].
Синдром Гордона (Gordon)
Синоним — псевдогипоальдостеронизм II типа [155,162,208].
Распространенность и характер АГ. Предположительно, около
60-70%; АГ развивается не сразу, в большинстве случаев — на 3-м де-
сятилетии жизни; при отсутствии лечения уровни АД могут быть весьма
высоки (3-я степень АГ) [208].
Определение и клиническая картина. Синдром Гордона — редкое
генетически обусловленное (саутосомно-доминантнымтипом наследования)
нарушение функции почечных канальцев [155, 162, 208]. Вовлечена тиази-
дочувствительная натрий-хлоридно-котранспортная система в дистальных
канальцах нефрона. Синдром вызывается мутациями двух различных, но
взаимосвязанных генов, кодирующих образование белков, которые обозна-
чают как WNK (with по lysine-kinase) с индексами 1 и 4 (WNK1 или WNK4); эти
белки участвуют в регуляции натрий-хлоридно-котранспортной системы.
Ведущими проявлениями синдрома Гордона являются [155, 162, 208]:
гиперкалиемия; АГ; метаболический ацидоз; нормальные уровни СКФ;
гиперхлоремия; гипоренинемия; уровни альдостерона плазмы и мочи —
от низких/нормальных до высоких/нормальных; невысокий рост; иног-
да — мышечная слабость; в некоторых случаях — нарушения интеллекту-
ального развития; нарушения развития зубов [208].
Механизмы развития АГ. АГ при синдроме Гордона — солечувстви-
тельная и объемзависимая с хронической перегрузкой натрием и объе-
мом [155,162,208].
Диагностика. Предположение о наличии этого редкого синдрома может
возникнуть, если у молодого больного АГ сочетается с перечисленными выше
нарушениями электролитного и кислотно-щелочного баланса. Рекомендуют
выполнение исследования ренина и альдостерона плазмы. Целесообразно об-
следование кровных родственников обоего пола в разных поколениях. Генети-
ческие исследования в широкой практике пока недоступны [155,162,208].
Лечение. Ограничение поваренной соли в диете; лечебный подход вы-
бора — тиазидовые диуретики. Применение тиазидовых диуретиков при-
водит к нормализации АД и уровней калия крови; их отмена — к возврату
этих и иных проявлений [155]. Хороший ответ на тиазиды сохраняется го-
дами/десятилетиями [208].
Глава 16
Реноваскулярная
артериальная гипертензия
Варианты поражений почечных артерий, которые приводят к разви-
тию реноваскулярной АГ, включают [28,105,162,208]:
• фибромышечную дисплазию (ФМД);
• атеросклероз;
• системные васкулиты (артериит Такаясу, узелковый полиартериит);
• расслоение аорты/почечных артерий;
• тромбозы (при антифосфолипидном синдроме, опухолях, др.);
• повреждения (травмы, после литотрипсии, трансплантации почки, облу-
чения, др.);
• сдавление извне (кистой, опухолью, гематомой, при ретроперитонеаль-
ном фиброзе, др.);
• артериовенозные мальформации или фистулы.
Далее мы более подробно охарактеризуем лишь первые два из перечислен-
ных состояний, поскольку именно они являются наиболее частыми.
Распространенность и характер
артериальной гипертензии
Реноваскулярные АГ составляют около 1% от всех случаев АГ. Среди лиц с
уровнем ДАД >125 мм рт. ст. и наличием ретинопатии III-IV степени рено-
васкулярные АГ составляют до 30% случаев [162, 208]. Поскольку наиболее
частой причиной реноваскулярных АГ является атеросклеротическое пора-
жение почечных артерий, распространенность их увеличивается с возрас-
том. Характер АГ широко варьирует: от бессимптомных форм и умеренного
повышения АД до устойчиво высоких цифр АД (АГ 3-й степени), резистент-
ной АГ с прогрессирующим снижением функции почек [44,146,207].
Определение и клиническая картина
В табл. 16.1 представлены некоторые клинические особенности пациентов
с реноваскулярными АГ.
Таблица 16.1. Клинические особенности реноваскулярных АГ
(адаптировано из [155])
Анамнез
• Начало АГ в возрасте <30 лет у женщин при отсутствии семейного анамнеза (ФМД)
• Резкое начало или ухудшение течения АГ
• Резистнтная АГ или АГ 3-й степени
• Распространенное атеросклеротическое поражение разных сосудистых бассейнов
• Курение
• Ухудшение функции почек при приеме ингибиторов АПФ или сартанов
• Рецидивирующие эпизоды стремительного отека легких
Обследование
• Шум над проекцией брюшной аорты или другими сосудами
• Тяжелая гипертензивная ретинопатия
• Повышение уровня креатинина сыворотки крови
• Гиперренинемия
• Гипонатриемия, гипокалиемия
• Протеинурия, обычно умеренная
• Разница в размере почек >1,5 см при сонографии
• Кортикальная атрофия при КТ-ангиографии
ФМД (фибромускулярная дисплазия)—патологическое состояние с
неизвестной этиологией (примерно у 10% констатируют генетическую пред-
расположенность с аутосомно-доминантным типом наследования), характе-
ризующееся фиброзированием и/или избыточной пролиферацией клеток
артериальной стенки [162, 189, 208]. Наиболее часто поражаются почечные
(75%), сонные и позвоночные артерии, реже — мезентериальные, плечевые,
подвздошные. Около 1 /3 лиц с ФМД имеют поражение >1 сосудистого бассей-
на. Изменений венозных и лимфатических сосудов при ФМД не развивается.
Распространенность ФМД в общей популяции точно не известна (^4-5%). Рас-
пространенность АГ при ФМД составляет 10-15% [162, 208]. Средний возраст
установления диагноза ФМД, по данным регистра экспертов США, составляет
50 лет, однако нередко (при раннем начале АГ) диагноз устанавливают у моло-
дых или детей. Несколько чаще поражаются лица женского пола [22,108,176].
В зависимости от особенностей принято выделять ФМД с поражением инти-
мы, медии (наиболее частый вариант), адвентиции. ФМД может приводить
к утолщению стенки артерий с уменьшением их просвета, также возможно
развитие осложнений, включая формирование аневризм и расслоения.
Клиническая картина вариабельна: в части случаев ФМД протекает бессимп-
томно, в остальных — симптоматика определяется локализацией, степенью
выраженности и особенностями сосудистого поражения [37, 92, 208]. Вари-
анты клинических проявлений могут включать [162,208]:
• при ФМД почечных артерий — АГ, шум над проекцией почечных артерий;
• при ФМД сонных и позвоночных артерий — головная боль (по типу ми-
грени), головокружение, боль в шее, пульсирующий шум вушахДИА/ише-
мический инсульт, шум над проекциями сонных артерий;
• при ФМД мезентериальных артерий — абдоминальная боль после еды,
снижение массы тела;
• при ФМД артерий конечностей — боль в конечности при нагрузке, купи-
рующаяся в покое, разные уровни АД на конечностях [195,224].
Улице ФМД почечных артерий стенозирование чаще локализовано в сред-
них и дистальных отделах сосуда, при динамическом наблюдении отчетли-
вое прогрессирование отмечается у 30-60% пациентов в течение 5 лет [107].
Атеросклеротическое поражение почечных артерий составля-
ет до 90% всех случаев стенозирования почечных артерий [162, 189, 208].
Среди лиц, которым проводят катетеризацию сердца, распространенность
атеросклеротического поражения почечных артерий достигает 30%, а среди
этих больных в возрасте старше 65-70 лет — 50%. Типичной локализацией
сосудистого поражения при атеросклерозе являются место отхождения по-
чечных артерий и их проксимальная треть в сочетании с поражением при-
лежащих отделов брюшной аорты [162,189,208]. На более далеко зашедших
этапах поражение может быть диффузным, с вовлечением интраренальных
артерий. При наблюдении в динамике прогрессирование степени стенози-
рования наблюдают в течение 5 лет примерно у 50% пациентов [107, 145].
Наряду с АГ важным клиническим проявлением считают снижение функции
почек (в западной литературе иногда используют термин «ишемическая
нефропатия»).Так, при обструкции >60% просвета почечной артерии наблю-
дают прогрессирующее уменьшение объема почечной паренхимы и разви-
тие азотемии. Примерно 30% больных с атеросклеротическим поражением
почечных артерий без лечения демонстрируют снижение функции почек в
течение 6 лет. По эпидемиологическим данным, атеросклеротическое по-
ражение почечных артерий является причиной 14% случаев терминальной
почечной недостаточности, получающих диализное лечение [127,155,199].
Механизмы развития артериальной гипертензии
Сужение почечных артерий (по мнению многих экспертов, до степени
>60-80% просвета) при ФМД или атеросклеротическом их поражении
приводит к ишемии почки, хронической активации РАС и симпатической
системы, периферической вазоконстрикции, задержке натрия и воды [162,
208]. При длительном существовании стенозирования почечных артерий
развиваются необратимые изменения микроциркуляторного русла почек,
тубулоинтерстициальный фиброз и гломерулосклероз [116, 201,205].
Диагностика
Подходы к диагностике стенозирования почечных артерий достаточ-
но подробно представлены в Рекомендациях ACCF (American College of
Cardiology Foundation, Американская коллегия кардиологов) и AHA по
ведению пациентов с поражениями периферических артерий, опублико-
ванных в 2011 году [189]. Полагаем важным привести основные положе-
ния этого важного документа. Авторы этих Рекомендаций считают, что
обследование с целью выявления клинически значимого стенозирования
почечных артерий показано в первую очередь (класс рекомендаций I) сле-
дующим категориям больных АГ [189]:
• с началом АГ в возрасте до 30 лет (уровень доказательств А);
• с началом тяжелой АГ (что определяют как уровни САД >160 мм рт. ст.
и/или ДАД >110 мм рт. ст.) в возрасте старше 55 лет (уровень доказа-
тельств В);
• с внезапным и устойчивым ухудшением ранее достаточно хорошо
контролировавшейся (accelerated) АГ (уровень доказательств С);
• с резистентной АГ (уровень доказательств С);
• с так называемым злокачественной (malignant) АГ (под этим понимают
АГ с сопутствующим наличием острого ПОМ, например, ОПП, острой/
декомпенсированной СН, остро возникших нарушений зрения или не-
врологических нарушений, тяжелой ретинопатии III—IV степени) (уро-
вень доказательств С);
• ухудшением функции почек на фоне применения ингибитора АПФ или
сартана (уровень доказательств В);
• с наличием уменьшения размера почки (атрофия), а также с различиями в
размере почек, превышающем 1,5 см (уровень доказательств В);
• с эпизодом внезапно развившегося необъяснимого отека легких (особен-
но у больного со сниженной функцией почек) (уровень доказательств В).
Обследование для выявления стеноза почечных артерий также считают
целесообразным (класс На, уровень доказательств В) у больных, демон-
стрирующих снижение функции почек, которое нельзя объяснить наличи-
ем предсуществующих почечных поражений, в том числе у лиц, получаю-
щих лечение с замещением функции почек (диализ, трансплантация) [189].
В диагностическом поиске рекомендуют применение следующих методов
обследования (класс I) [189]:
• дуплексной ультрасонографии почечных сосудов — как скринингово-
го теста (уровень доказательств В); метод позволяет оценивать размеры
почек, функциональный резерв кровотока, подсчитывать резистивный
индекс; в оценке гемодинамически значимого стеноза чувствительность
метода достигает 92%, специфичность — 85%;
• КТ-ангиографии как скринингового теста (уровень доказательств В); метод
требует осторожности в отношении риска развития контрастиндуцирован-
ной нефропатии (особенно при исходном значимом снижении функции по-
чек); результаты сложно интерпретировать при наличии выраженных каль-
цифицирующих поражений сосудов; чувствительность в оценке гемодина-
мически значимого стеноза составляет до 94%, специфичность — 60-90%;
• МРТ-ангиографии как скринингового теста (уровень доказательств В);
метод не используют у лиц, имеющих имплантированные устройства
разного рода (искусственные водители ритма, кардиостимуляторы, др.),
у больных клаустрофобией, а также у пациентов с тяжелой одышкой
(при исследовании необходима задержка дыхания); также требуется
осторожность ввиду риска нефротоксического действия гадолиний-
содержащего контраста у больных с умеренным/тяжелым снижением
функции почек; чувствительность и специфичность в диагностике сте-
ноза почечных артерий достигают 90-100%;
• при недостаточной информативности перечисленных выше неинвазив-
ных тестов и высокой вероятности наличия стеноза почечных артерий —
катетерная ангиография (уровень доказательств В).
Не рекомендуется использование в качестве скрининговых тестов для диаг-
ностики стеноза почечных артерий (класс III) [189]:
• каптоприлового теста со сканированием почек (уровень доказательств С);
• селективной оценки уровней ренина в почечных венах (уровень доказа-
тельств В);
• активности ренина плазмы (уровень доказательств В);
• каптоприлового теста с оценкой активности ренина плазмы после прие-
ма каптоприла (уровень доказательств В).
Пациентам с установленным диагнозом ФМД одной локализации рекомен-
дуют неинвазивные исследования иных сосудистых бассейнов с целью ис-
ключения мультифокального характера поражения. Больным ФМД сонных
или позвоночных артерий также рекомендуют проведение ангиографиче-
ского исследования интракраниальных артерий для исключения наличия
их аневризматических изменений (при их выявлении могут требоваться
соответствующие лечебные подходы) [162,189, 208].
Лечение
ФМ Д. При бессимптомном течении ФМД и отсутствии АГ состояние считают
доброкачественным, специальное лечение не проводят, за областью сосу-
дистого поражения рекомендуют инструментальный контроль.
Для снижения риска внутрисосудистого тромбозирования может исполь-
зоваться антитромбоцитарная терапия (АСК 75-100 мг/сутки) [140,155,187].
При наличии АГ для ее контроля могут применять различные антигипертен-
зивные препараты (наиболее изучены ингибиторы АПФ/сартаны, возможно
в комбинации с БКК и/или диуретиками), при этом крайне важен тщатель-
ный врачебный контроль и регулярная оценка состояния функции почек
[162,208]. Особая осторожность требуется при назначении препаратов, бло-
кирующих РАС, в случаях [189]:
• билатерального поражения почечных артерий;
• унилатерального поражения высокой степени;
• поражения сосудов единственной почки;
• атрофии контрлатеральной почки;
• СКФ <30 мл/мин/1,73 м2.
При отсутствии эффекта от антигипертензивной терапии, а также при тен-
денции к снижению функции почек и развитию иных осложнений пред-
почтительным методом лечения становится чрескожная баллонная ангио-
пластика (чаще без стентирования, однако при наличии повреждений или
чрезмерной податливости сосудистой стенки могут использоваться стенты)
[162, 208]. В случаях наличия аневризмы или расслоения стенки артерий
проводят реконструктивные вмешательства (шунтирование пораженного
участка сосуда) [143,155].
Атеросклеротическое поражение почечных артерий. Стандарт-
ное лечение включает [162,189,208]:
• настойчивую антигипертензивную терапию (с использованием тех же ле-
карственных препаратов и учетом тех же предосторожностей, что указа-
но для ФМД);
• применение высоких доз мощных статинов с достижением целевых уров-
ней ХС ЛПНП <1,8 ммоль/л или снижением их на 50% по сравнению с ис-
ходными величинами;
• прекращение курения;
• оптимальный контроль гликемии;
• АСК 75-100 мг/сутки (при достижении адекватного контроля АД).
Показания к реваскуляризации (ангиопластика со стентированием) у
таких пациентов существенно сузились за последние годы после опу-
бликования результатов крупных исследований ASTRAL, STAR и CORAL
[162, 201, 189, 208]. Авторы современных международных рекомендаций
указывают, что даже у лиц со сниженной функцией почек (без быстрого
прогрессирования дальнейшего снижения в течение предыдущих 6-12 ме-
сяцев), протеинурией >1 г/сутки, атрофией почки, диффузным поражением
интраренальных артерий медикаментозная терапия является предпочти-
тельным методом лечения (при условии достижения адекватного контро-
ля АД) [189].
В настоящее время реваскуляризация почечных артерий резервируется
преимущественно для случаев, когда имеются [162,189,208]:
• рецидивирующая и необъяснимая иными причинами острая СН/отек легких;
• рецидивирующая нестабильная стенокардия;
• прогрессирующее снижение функции почек;
• недостаточная эффективность медикаментозного антигипертензивного
лечения (или его непереносимость).
Хирургическую реваскуляризацию используют значительно реже, преиму-
щественно у лиц, которым невозможно выполнить ангиопластику со стен-
тированием, либо при их недостаточной эффективности [155,209,211].
Глава 17
Случайно обнаруженное
образование надпочечника
(инциденталома)
В структуре симптоматических АГ важное место отводится тем из них, кото-
рые связаны с нарушениями в надпочечниках, а именно [67,71,155]:
• ПА (с гиперпродукцией альдостерона);
• синдрому Кушинга (с гиперпродукцией кортизола);
• феохромоцитоме (с гиперпродукцией катехоламинов).
Обсуждению каждого из этих вариантов надпочечниковых АГ посвящены
три последующие главы. Здесь мы остановимся на рассмотрении доста-
точно частой и важной клинической проблемы — случайно выявленного
образования в надпочечнике, также именуемого инциденталомой надпо-
чечника (от англ. incidental — случайный) [103,155].
Этим термином обозначают образование надпочечника, обычно имеющее
размер >1 см, выявленное случайно в ходе КТ или МРТ, выполненных по
ненадпочечниковым показаниям [155, 227].
Обнаружение такого образования требует от врача значительного внима-
ния и проведения тщательного дифференциального диагноза. Это связано
с тем, что до 10-15% случаев инциденталом оказываются либо злокаче-
ственными, либо гормонально активными образованиями; в этих случаях
раннее хирургическое вмешательство по их удалению может оказаться
жизнеспасающим лечебным подходом. Следует отметить, что оставшиеся
85-90% случаев инциденталом оказываются доброкачественными и гор-
монально нефункционирующими структурами [83,155,178].
Распространенность
По данным аутопсийных исследований и КТ, частота выявления инцидента-
лом надпочечника может достигать 4-6%.
Их распространенность демонстрирует отчетливую связь с возрастом, со-
ставляя при проведении КТ лишь 0,2% среди лиц в возрасте 20-29 лет и
доходя до 7% среди обследованных в возрасте 70 лет и старше [227].
Дифференциальная диагностика
При выявлении инциденталомы надпочечника требуется проведение ком-
плекса исследований для исключения [155,227]:
• ее злокачественной природы;
• ее гормональной активности.
В табл. 17.1 представлены ведущие направления дифференциально диаг-
ностического поиска, которые включают карциному коры надпочечника,
метастазы в надпочечник, субклинический синдром Кушинга, феохромо-
цитому и альдостеронпродуцирующую аденому (ПА) [208,209, 227].
Таблица 17.1. Возможные клинические особенности у больных
со случайно обнаруженным образованием
надпочечника (адаптировано из [227])
Патологическое
состояние, %*
Синдром Кушинга,
7,9%
Феохромоцитома,
5,6%
ПА, 1,2%
Карцинома
надпочечника,
4,7%
Метастазы рака",
2,5%
Возможные клинические особенности
Увеличение массы тела, метаболический синдром (нарушение
толерантности к глюкозе, дислипидемия, центральное ожире-
ние) в сочетании с отложением жировой ткани в надключичных
областях, плетора лица, легкая ранимость кожи, стрии, слабость
проксимальных мышц, эмоциональные и когнитивные измене-
ния, оппортунистические инфекции, нарушения репродуктивной
функции, акне, гирсутизм, остеопороз, лейкоцитоз, лимфопения
АГ (устойчивая или пароксизмальная) в сочетании с эпизодами
потливости, головной боли, сердцебиения, побледнения кожи
Рефрактерная АГ с наличием гипокалиемии или без нее
Абдоминальная боль, синдром Кушинга (избыток кортизола),
вирилизация (избыток андрогенов), гинекомастия (избыток
эстрогенов), гипокалиемия (избыток альдостерона)
Наличие данных анамнеза о вненадпочечниковых онкологиче-
ских процессах; общие симптомы (слабость, снижение аппетита)
Примечания. * Процент от общего количества случайно обнаруженных образований надпочечника.
* При локализации первичной опухоли в легких, почках, желудочно-кишечном тракте (ЖКТ).
Исключение злокачественной природы
выявленного образования надпочечника
Этот раздел дифференциального диагноза является чрезвычайно важной
задачей. Обращает на себя внимание высокая частота выявления зло-
качественных форм среди инциденталом надпочечника — при анализе
2005 случаев таких образований карцинома коры надпочечника была вы-
явлена в 4,7%/ а еще в 2,5% наблюдений были обнаружены метастатиче-
ские поражения надпочечника [227]. Ключевыми при проведении диффе-
ренциальной диагностики со злокачественными вариантами поражений
надпочечника считают оценку размера и особенностей выявленного об-
разования поданным КТи МРТ(табл. 17.2) [210,227].
Таблица 17.2. Структурные особенности образований надпочечника,
выявляемые при инструментальных исследованиях
(адаптировано из [227])
Особенность
Размер*
Форма
Структура
Расположение
КТ-плотность (HU)*
Васкуляризация
Выведение кон-
траста при КТ
за 10 минут
МРТ-плотность**,#
Скорость роста
Аденома
надпочеч-
ника
Небольшой
(<3 см)
Округлая,
контур ров-
ный
Гомогенная
Односторон-
нее, 1 узел
<10
Низкая
<50%
Изоинтен-
сивна
Нет или мед-
ленный
(<1 см/год)
Карцинома
надпочеч-
ника
Большой
(>4 см)
Неправиль-
ная
Негомоген-
ная
Односторон-
нее, 1 узел
>10
Высокая
>50%
Гиперинтен-
сивна
Быстрый
(>2 см/год)
Феохромо-
цитома
Большой
(>4 см)
Округлая,
контур ров-
ный
Негомоген-
ная, с участ-
ками про-
светления
(некроз)
Односторон-
нее, 1 узел
>10
Высокая
>50%
Значительно
гиперинтен-
сивна
Медленный
(0,5-1 см/год)
Метастазы
рака
Различный
Неправиль-
ная
Негомоген-
ная
Часто двусто-
роннее
>10
Высокая
>50%
Гиперинтен-
сивна
Варьирует
Примечания. * В единицах Hounsefield. ** По отношению к печени вТ2-взвешенном изображении.
* Наиболее значимые диагностические признаки).
Размер образования. Карциномы коры надпочечника на момент обна-
ружения обычно имеют довольно значительный размер (примерно в 90%
случаев он составляет 4 см и более). Карцинома коры надпочечников была
представлена в 1 из 4 случаев с размером инциденталомы надпочечника
>4 см [227]. Чем меньше размер карциномы на момент ее хирургического
удаления, тем лучшим считают прогноз [155,227].
Особенности образования по данным КТ и МРТ {табл. 17.2).
В структуре аденомы надпочечника нередко представлено достаточно много
жировой ткани, имеющей характерные особенности по данным КТ и МРТ. Так,
при оценке в режиме Т2-взвешенного изображения МРТ, аденомы чаще пред-
ставлены как образования, изоинтенсивные по отношению к плотности пече-
ни. Они также характеризуются относительно невысокой плотностью при ис-
следовании с помощью неконтрастной КТ (<10 единиц Hounsefield) [155,227].
Однако до 30% аденом не имеют в своем составе значительного количества
жировой ткани, что затрудняет дифференциальную диагностику по дан-
ным неконтрастной КТ и МРТ со злокачественными новообразованиями и
феохромоцитомой [155, 227]. В этих случаях может оказаться полезной КТ с
контрастированием. Если выведение контрастного материала из образова-
ния превышает 50% в течение 10 минут после его введения, то весьма велика
вероятность того, что образование представляет собой доброкачественную
аденому. Выведение контраста из феохромоцитомы или злокачественных
поражений надпочечника обычно более медленное [208,227].
Метастатические поражения. В надпочечники чаще метастазируют
карциномы легких, почек и ЖКТ. Метастазы нередко представлены дву-
сторонними образованиями надпочечников. Метастатические поражения
надпочечников обычно выявляют на достаточно позднем этапе прогресси-
рования онкологического процесса, когда первичная локализация опухо-
ли уже выявлена [155,227].
Установление гормональной активности
выявленного образования надпочечника
В табл. 17.3 представлены основные скрининговые и подтверждающие
тесты, используемые для установления гиперпродукции опухолями над-
почечников кортизола (при синдроме Кушинга), катехоламинов (при фео-
хромоцитоме) или альдостерона (при ПА) [155, 227]. По данным анализа
3868 случаев инциденталомы надпочечников [Barzon I. etal., 2003], биохи-
мическое подтверждение наличия субклинического синдрома Кушинга
было получено в 7,9% случаев, феохромоцитомы — в 5,6%, ПА — в 1,2%.
Важно подчеркнуть, что 25-75% карцином коры надпочечников являются
гормонально активными образованиями. Наиболее распространенным ва-
риантом активности при этом является комбинированная гиперпродукция
кортизола и андрогенов; при выявлении подобных особенностей велика
вероятность наличия у пациента карциномы коры надпочечника [208].
Субклинический синдром Кушинга (табл. 17.1, 17.3). Заподозрить его наличие
у больного с инциденталомой надпочечника может помочь выявление слабо
выраженных/недиагностированных проявлений гиперкортицизма, включа-
ющих АГ, центральное ожирение, СД, слабость, легкую ранимость кожи [155,
227]. Однако у этих больных обычно не представлены признаки развернутого
синдрома Кушинга (такие, например, как широкие пурпурные стрии). С учетом
неспецифичности клинической картины, ее на этом этапе сложно отличить от
проявлений распространенного метаболического синдрома (за исключением
того, что пациент имеет еще и образование надпочечника) [155,208].
Стандартные скрининговые тесты, применяемые для выявления гиперкорти-
цизма, в том числе определение уровня экскреции свободного кортизола с
мочой за 24 часа и низкодозовый подавляющий тест с дексаметазоном (1 мг
на ночь) рассматривают как имеющие недостаточно высокую чувствитель-
ность (демонстрируют нормальные или слегка повышенные значения соот-
ветствующих показателей примерно у 25% больных синдромом Кушинг). Для
повышения чувствительности теста с дексаметазоном авторитетные специа-
листы-эндокринологи [MitchellI.C etal., 2007] рекомендуют снизить пороговое
значение патологического уровня кортизола, определяемого в 8:00, со стан-
дартных 5 мг/дл до 1 мг/дл. Во избежание ложноположительных результатов
данные должны быть подтверждены при повторном исследовании и допол-
нены биохимическим доказательством гиперсекреции кортизола [155,227]:
• с оценкой его экскреции с мочой за сутки при уровне, не менее чем в
2 раза превосходящем референтный;
• тестом подавления адренокортикотропного гормона (АКТГ);
• свидетельством проксимального стероидогенеза (уровень DHEA-S
(дегидроэпиандростерона сульфата — параметра, позволяющего оце-
нивать андрогенсинтезирующую функцию надпочечников) в плазме
<30 мг/дл) [208, 227].
Таблица 17.3. Обследование при случайном выявлении образования
в надпочечнике (адаптировано из [227])
Патологическое
состояние, %
Субклинический
синдром
Кушинга
Феохромоци-
тома
Первичный
альдостеронизм
Скрининговые тесты Подтверждающие тесты
Низкодозовый подавляющий Кортикотропин сыворотки,
тест с дексаметазоном кортизол в суточной моче,
(1 мг на ночь) кортизол в слюне, КТ, МРТ
Метанефрины плазмы ^Z^e™"™'
илимочи 1"'-М1Вб-сканирование*
Ренин плазмы и альдостерон ^^Гу^еГаГьдо-
сыворотки, суточная экскреция гтл„ '/Jl™ *„а D Uon™.£„
калия с мочой ZSSSSS*? В НаДП°ЧеЧ"
Примечание. * MIBG — метайодбензилгуанидин.
Скрытая феохромоцитома. Около5%инциденталомнадпочечника,по
данным авторитетной клиники Мауо [227], при обследовании оказываются
феохромоцитомами. Вероятность наличия феохромоцитомы у пациента с АГ
и наличием образования в надпочечнике в 25 раз выше, чем у больного АГ
без такого образования. Эксперты США считают, что в их стране примерно
в половине случаев феохромоцитомы выявляют при случайном обследова-
нии; среди них в половине наблюдений на момент обнаружения опухоли у
больного отсутствуют как АГ, так и иные классические проявления феохро-
моцитомы [155, 227]. Диагноз подтверждается на основании лабораторных
данных, при выявлении гиперсекреции катехоламинов (см. гл. 18).
Первичный альдостеронизм. Около 1% инциденталом надпочечни-
ков при обследовании оказываются альдостеронпродуцирующими адено-
мами. Наилучшим скрининг-тестом считают оценку альдостерон-ренино-
вого соотношения плазмы (см. гл. 19) [208, 227].
Диагностическая тактика
На рис. 17.1 представлен диагностический алгоритм для обследования
больного с инциденталомой надпочечника.
Инциденталома надпочечника
Анамнез, объективные данные
Скрининговые гормональные тесты: низкодозовый тест с дексаметазоном;
метанефрины плазмы или мочи; ренин плазмы, альдостерон сыворотки
Положительные
Отрицательные
Подтверждающие
гормональные тесты
Инструментальное
обследование (КТ, МРТ)
Положительные
Предположительно
доброкачественное
образование
Предположительно
злокачественное
образование
Хирургическое вмешательство
ПовторКТ,МРТ:6,12,24месяца|
Ежегодно: гормоны (4 года)
Если размер <4 см или рост
>1 см: хир. вмешательство
Тонкоигольная аспирация
Хирургическое вмешательство
Рис. 17.1. Диагностический алгоритм при инциденталоме
надпочечника (адаптировано из [227])
Исходное гормональное обследование должно включать следующие три
скрининговых теста [155, 227]:
• низкодозовый подавляющий тест с дексаметазоном (1 мг на ночь) — для
исключения субклинического синдрома Кушинга;
• оценку уровней свободных метанефринов в плазме и/или фракциони-
рованных метанефринов и катехоламинов в суточной моче — для ис-
ключения феохромоцитомы;
• определение уровней альдостерона сыворотки и активности ренина
плазмы с подсчетом альдостерон/ренинового соотношения — для ис-
ключения первичного альдостеронизма.
Даже скрытая (то есть протекающая без клинических проявлений) феохро-
моцитома представляет опасность развития потенциально летального
ГК, ввиду чего подлежит обязательному хирургическому удалению после
предоперационной адренергической блокады (см. гл. 18). Наличие альдо-
стеронпродуцирующей аденомы (если имеются АГ или гипокалиемия) так-
же рассматривают как показание к ее удалению, для чего обычно приме-
няют лапароскопическую адреналэктомию [227].
Подход к лечебной тактике при субклиническом синдроме Кушинга не
столь однозначен. Некоторые исследователи [Mitchell I.C. et al., 2007] по-
лагают целесообразным и у таких больных выполнение односторонней
адреналэктомии, мотивируя это ее благоприятными последствиями (улуч-
шение контроля АГ, уменьшение надключичных жировых отложений и
других клинических проявлений). В настоящее время [155, 227] адренал-
эктомию при субклиническом синдроме Кушинга считают показанной у
лиц в возрасте <40 лет с недавним началом или ухудшением течения АГ, СД
и других клинических проявлений гиперкортицизма. В среднем и пожилом
возрасте решение об удалении опухоли принимают преимущественно при
ее размере >2,5 см. В случае оперативного вмешательства во избежание
периоперационного надпочечникового криза проводят глюкокортикоид-
ную терапию [155,208].
Адреналэктомию считают показанной при наличии инструментальных
данных, заставляющих предположить карциному надпочечника (если
нет особых обстоятельств, препятствующих вмешательству, например,
особенно преклонного возраста или тяжелых СЗ). Резекции подлежат лю-
бые образования надпочечника размером >6 см; при размере в пределах
4-6 см в решении вопроса о тактике лечения большое значение придают
выявляемым при КТ или МРТ особенностям образования (см. табл. 17.2).
Улиц в возрасте до 30 лет инциденталомы надпочечника столь редки, что
даже при выявлении образования размером <4 см обычно принимают
решение о его удалении (особенно при наличии дополнительных инстру-
ментальных особенностей, свидетельствующих в пользу злокачественного
характера образования) [155,227].
С учетом высокой информативности КТ и МРТ, тонкоигольная аспираци-
онную биопсию сейчас редко используют для установления наличия зло-
качественного поражения надпочечника. Средой ее применения преиму-
щественно является исключение метастатического поражения, а также ин-
фекционного процесса (например, туберкулеза). Перед таким вмешатель-
ством следует обязательно исключить феохромоцитому, так как биопсия у
лиц с этой опухолью может спровоцировать развитие ГК [155,227].
Если случайно выявленное по данным КТ или МРТ образование надпочеч-
ника не демонстрирует признаков, подозрительных в отношении злока-
чественной опухоли, а скрининговые гормональные тесты дали отрица-
тельные результаты, то КТ или МРТ таким пациентам Young W.F. etal. (2007)
рекомендуют повторять 1 раз в полгода в течение 2 лет, а функцию надпо-
чечников оценивать ежегодно в течение 4 лет [208,227].
Глава 18
Феохромоцитома и параганглиома
Общий взгляд на симптоматическую
артериальную гипертензию,
связанную с нарушениями в надпочечниках
Как указывалось в гл. 17, каждый пациент с АГ и наличием случайно выявлен-
ного образования в надпочечнике, должен пройти комплекс обследований,
направленных на поиск возможной симптоматической АГ надпочечниковой
природы [224,228]. При отсутствии таких образований подобное обследова-
ние нужно проводить лишь некоторым категориям пациентов с АГ. Следует
иметь в виду, что заболевания надпочечников являются достаточно редкими
и что они характеризуются малоспецифичными клиническими проявлениями.
Так, многие пациенты с эссенциальной (первичной) АГ имеют повторяющиеся
приступообразные эпизоды, позволяющие предположить феохромоцитому;
у части имеется гипокалиемия, заставляющая подозревать ПА; у некоторых
присутствует центральное ожирение, направляющее на поиск субклиниче-
ского синдрома Кушинга. Однако у большинства таких лиц при исследовании
функции надпочечников патологических изменений не выявляют [72,186].
Корректная диагностика перечисленных нечасто встречающихся надпо-
чечниковых вариантов симптоматических АГ является важной задачей,
поскольку позволяет установить адекватную лечебную тактику (в том чис-
ле хирургическое вмешательство, а также специальные медикаментозные
подходы) [155]. Удаление секретирующей опухоли надпочечника или бло-
кирование влияния чрезмерных количеств гормонов на ткани-мишени мо-
жет представлять единственный эффективный путь контроля АГ и защиты
больного от развития тяжелых органных поражений и смерти (это особен-
но касается феохромоцитомы) [81,228].
Распространенность артериальной гипертензии
У большинства больных с феохромоцитомой имеется АГ (пароксизмальная
и/или стабильная) [155,224,228]. Феохромоцитома может протекать без АГ и
других клинических проявлений, у таких больных она может обнаруживать-
ся случайно (инциденталома надпочечника — см. гл. 17). Катехоламинпроду-
цирующие параганглиомы характеризуются наличием АГ; у лице несекрети-
рующей параганглиомой уровни АД могут быть нормальными [83,204,208].
Определение и клиническая картина
Феохромоцитома представляет собой катехоламинсекретирующую опу-
холь, происходящую их хромаффинных клеток надпочечников [70].
Термином «параганглиома» обозначают вненадпочечниковую опухоль,
происходящую из клеток симпатических или парасимпатических ганглиев.
В табл. 18.1 представлены варианты локализации параганглиом [224].
Таблица 18.1. Локализация параганглиом (адаптировано из [155,224,228])
Локализация
Парасимпатическая (несекретирующая):
• голова и шея
Катехоламинсекретирующая:
• парааортально (брюшная аорта)
• мочевой пузырь
• грудная клетка
• голова и шея
• тазовые органы
%
95
75
10
10
3
2
Катехоламинсекретирующие параганглиомы также обозначают как «вне-
надпочечниковые феохромоцитомы», они локализуются главным образом
в абдоминальной и тазовой областях. Несекретирующие параганглиомы
вагусного происхождения преимущественно располагаются в области
головы и шеи, обычно происходя из гломусных клеток каротидного тела.
В клинической практике термин «феохромоцитома» широко используют
для обозначения любой катехоламинпродуцирующей опухоли (как надпо-
чечниковой, так и вненадпочечниковой локализации) [208, 224].
В большинстве своем феохромоцитомы и параганглиомы секретируют и
норадреналин, и адреналин (с преобладанием первого из них). Некоторые
преимущественно продуцируют адреналин; имеются и такие, которые об-
разуют только допамин [155, 224,228].
При своевременных и правильных диагностике и лечении большинство
случаев феохромоцитом является курабельными. В то же время недиагно-
стированные и неоперированные феохромоцитомы представляют угрозу
жизни. Феохромоцитомы часто не диагностируют. По данным клиники Мауо,
среди 54 случаев феохромоцитомы, подтвержденных при аутопсии, лишь в
13 наблюдениях имела место прижизненная диагностика опухоли [173,227].
Распространенность феохромоцитомы в общей популяции лиц с АГ состав-
ляет менее 0,2%; она возрастает до 5% среди пациентов с инциденталомой
надпочечника (см. гл. 17) [155].
В табл. 18.2 и 18.3 представлены клинические проявления феохромоцито-
мы и дифференциальная диагностика клинических проявлений, подобных
пароксизмальным состояниям при феохромоцитоме.
Таблица 18.2. Клинические проявления феохромоцитомы
(адаптировано из [228])
Более частые
• АГ (устойчивая или пароксизмальная)
• Чрезмерная потливость
• Головная боль
• Сердцебиение
• Тахикардия
• Тревога, нервозность
• Побледнение кожи
• Дрожь
• Гипергликемия натощак
• Слабость, утомляемость
Менее частые
• Ортостатическая гипотензия
• Приливы, покраснение лица
• Снижение массы тела
• Запоры (редко — диарея)
• Тахипноэ
• Тошнота/рвота
• Боль в груди/животе
• Кардиомиопатия
• Парестезии
• Нарушения зрения
Таблица 18.3. Дифференциальная диагностика клинических
проявлений, подобных пароксизмальным состояниям
при феохромоцитоме (адаптировано из [155])
Сердечно-сосудистые:
• Лабильное течение эссенциальной АГ
• Пароксизмальная тахикардия
• Стенокардия
• Острый отек легких
• Эклампсия
• ГК во время или после хирургического
вмешательства
• Ортостатическая гипотензия
• Реноваскулярная АГ
Фармакологические:
• Отмена клофелина
• Прием симпатомиметиков, включая
фенилэфринсодержащие препараты,
используемые в лечении простуды,
кокаин, метамфетамины, препараты,
применяемые для устранения заложен-
ности носа
• Ингибиторы моноаминоксидазы
Психоневрологические:
Тревожность с гипервентиляцией
Паническая атака
Вегетативная нейропатия
Мигрень
Инсульт
Опухоль мозга
Диэнцефальные судороги
Вегетативная гиперрефлексия
Барорефлекторная дисфункция
Ортостатическая тахикардия
Эндокринные:
Непереносимость углеводов
Тиреотоксикоз
Инсулинома, эпизоды гипогликемии
Медуллярная опухоль щитовидной
железы
Климактерический синдром
Карциноид
Мастоцитоз
Ванкомицин
В клинической картине феохромоцитомы типично присутствие гипер-
адренергических пароксизмов. Их классические клинические проявления
связывают с эпизодами резкого увеличения секреции катехоламинов, что
обусловливает развитие массивной а- и (i-адренергической стимуляции
тканей-мишеней и развитие следующих 5 наиболее распространенных
проявлений [155,224, 228]:
• пароксизмов повышения АД (ГК);
• интенсивной головной боли;
• интенсивного диффузного потоотделения;
• сердцебиения;
• побледнения лица (реже — покраснения).
Дополнительными признаками гиперадренергического состояния явля-
ются СД и снижение массы тела. Лишь некоторые пациенты с феохромоци-
томой могут быть бессимптомными [155, 224, 228]. Считаем важным более
подробно рассмотреть некоторые из клинических проявлений.
Пароксизмальные эпизоды повышения АД рассматривают как
классический элемент клинической картины при феохромоцитоме, однако
случаи с исключительно пароксизмальным течением АГ считаются редки-
ми — у большинства больных имеется стабильная АГ с эпизодами ГК [155].
ГК при феохромоцитоме может провоцироваться [67, 71,155, 224,228]:
• механическим воздействием на опухоль — при физической нагруз-
ке, стоянии, мочеиспускании, дефекации, наклоне вперед, клизмении,
пальпации живота, сдавлении опухоли беременной маткой;
• парентеральным введением лекарственных препаратов — анестетиков
или рентгенконтрастных средств;
• приемом препаратов, увеличивающих синтез катехоламинов (глюко-
кортикоиды в средних или высоких дозах) или повышающих их секре-
цию (гистамин, опиаты, никотин);
• применением психоневрологических препаратов, блокирующих обрат-
ный захват аминов (трициклических антидепрессантов, селективных ин-
гибиторов обратного захвата норадреналина, др.);
• приемом (3-АБ (оставляющих без относительного противодействия
а-адренорецепторы).
ГК при феохромоцитоме может развиваться и без каких-либо провоцирующих
факторов (иногда — вследствие спонтанного некроза опухоли) [155,224,228].
Эпизоды кризов широко варьируют по частоте (от нескольких раз в течение
одного дня до 1 раза за несколько месяцев), продолжительности, степени вы-
раженности и клиническим проявлениям. Эпизоды могут иметь картину, ти-
пичную для панических атак. Могут быть представлены ощущение сдавления
или распирания в животе с распространением в область грудины или голову,
тревога, тремор, потливость, сердцебиение, слабость [155,224,228].
ГК при феохромоцитоме, как уже отмечалось, могут протекать с очень
высокими цифрами АД (>250/150 мм рт. ст.), ассоциироваться с развити-
ем ишемии миокарда, тахиаритмии, вызывать развитие катехоламинин-
дуцированной кардиомиопатии и симптоматики острой СН (отека легких)
[155,224,228].
Эпизоды гипотензии также могут быть представлены в структуре кли-
нической картины феохромоцитомы. Это более часто отмечают при наличии
феохромоцитом, преимущественно секретирующих адреналин (при этом ГК
перемежаются с периодами гипотензии). Развитие катехоламининдуциро-
ванной кардиомиопатии может быть ассоциировано с возникновением кар-
диогенного шока. Выраженная гипотензия может развиваться вследствие
спонтанного некроза опухоли [155,224,228].
Также возможно развитие эпизодов ортостатической гипотензии, сочета-
ющейся с тахикардией и слабостью (такие эпизоды связывают с гиповоле-
мией, возможно обусловленной избыточным натрийурезом после ГК). Счи-
тают, что у молодых лиц с АГ, не получающих а-АБ, эпизоды ортостатиче-
ской гипотензии с тахикардией могут быть важным ранним проявлением
феохромоцитомы [155, 224,228].
Менее частые клинические проявления феохромоцитомы могут
включать острый живот (вследствие спонтанного разрыва опухоли), гипер-
термию, энцефалопатию, внезапную смерть после небольшой абдоми-
нальной травмы [155,224, 228].
Правило «10%» раньше и сейчас. Ранее считалось, что среди всех фео-
хромоцитом примерно 10% являются вненадпочечниковыми (то есть
секретирующими параганглиомами); 10% имеют место у детей; 10% —
двусторонней локализации; 10% — рецидивируют; 10% — злокачест-
венные; 10% — обнаруживают случайно, 10% — являются семейными
[155,224, 228]. В настоящее время полагают (для США), что около 50% фео-
хромоцитом диагностируются случайно, а 15-25% являются семейными
(генотипы VHL, RET, NF-1,SDHD, др.) [208].
Механизмы развития артериальной гипертензии
Развитие АГ при феохромоцитоме (как ГК, так и стабильного повышения
АД) связывают с прессорными эффектами избыточных количеств секрети-
руемых опухолью катехоламинов [155].
Диагностика
Подавляющее большинство больных АГ не нуждаются в проведении скри-
нингового обследования для выявления феохромоцитомы [155]. Группы
лиц, для которых такой скрининг целесообразен, перечислены в табл. 18.4.
На рис. 18.1 представлен алгоритм диагностических мероприятий у боль-
ных с подозрением на феохромоцитому. Он включает два основных этапа
[155, 224, 228] — биохимическое выявление гиперсекреции катехолами-
нов и установление локализации опухоли.
Таблица 18.4. Группы пациентов, которым целесообразно проведение
скринингового обследования для исключения наличия
феохромоцитомы (адаптировано из [155])
Гиперадренергические кризы
Резистентная АГ
Феохромоцитома в семейном анамнезе
Повышение АД в ответ на анестезию
Начало АГ в возрасте до 20 лет
АГ в сочетании с дилатационной
кардиомиопатией
Инциденталома надпочечника
Феохромоцитома?
Отмена препаратов, влияющих на уровни метанефринов*
Устранение эмоционального стресса
Повышены
*
Метанефрины
(плазма и/или моча)
►
Норма
Феохромоцитома
исключена
Абдоминальное КТ или МРТ
Типичное образование надпочечниковой
или парааортальной локализации
Образование не выявлено
1131-М11&-сканирование', если:
• размер >10 см
• вненадпочечниковое
Т
Опухоль
обнаружена
I
Подумай об ином диагнозе
1131-М1ВС-сканирование*
МРТ всего тела
1п111-пентреотид (октреотид) —
сканирование (соматостатин)
ПЭТ
Генетический анализ
Периоперационная адренергическая блокада
Хирургическое удаление
Пожизненное наблюдение
Рис. 18.1. Диагностический и тактический алгоритм при
подозрении на наличие феохромоцитомы (адаптировано из [224])
Примечания. ПЭТ — позитронно-эмиссионная томография. * Антидепрессанты, леводопа, клофе-
лин, антипсихотики, а-АБ. * Сканирование с изотопом йода I131 (метайодбензилгуанидином) для выяв-
ления катехоламинсекретирующих опухолей. ** Сканирование с изотопом индия In111 для выявления
опухолей с рецепторами к соматостатину (оба метода в Украине не представлены).
Биохимическая диагностика феохромоцитомы претерпела суще-
ственные изменения за предыдущие полтора десятилетия. За это время в
широкую практику было внедрено исследование метанефринов (включая
метанефрин и норметанефрин, являющихся О-метилированными дерива-
тами катехоламинов) в крови и суточной моче, что оказалось существенно
более чувствительным методом, чем определение уровней катехоламинов
[155, 224, 228]. Оценка уровней метанефринов в плазме и моче (приемле-
мы оба варианта, из них первый удобнее для пациента, второй имеет не-
сколько более высокую чувствительность) рассматривают сейчас как без-
условный стандарт биохимической диагностики феохромоцитомы [224].
В отличие от катехоламинов, метанефрины не образуются в структурах
симпатических нервов; в отличие от ванилилминдальной кислоты, они
не продуцируются в печени; местом их образования служит только хро-
маффинные клетки (надпочечниковые или вненадпочечниковые — при
параганглиомах). Здесь отметим, что определение уровней ванилилмин-
дальной кислоты в диагностике феохромоцитомы совершенно вышло из
употребления [155, 224, 228]. В табл. 18.5 представлены верхние границы
нормы биохимических показателей, используемых сейчас для диагности-
ки катехоламинсекретирующих опухолей.
Таблица 18.5. Биохимическая диагностика
катехоламин-секретирующих опухолей
(адаптировано из [224])
Показатель
Анализы крови:
• Свободный норметанефрин плазмы
• Свободный метанефрин плазмы
• Норадреналин плазмы
• Адреналин плазмы
• Допамин плазмы
Анализы мочи:
• Общие метанефрины
• Норметанефрин
• Метанефрин
• Норадреналин
• Адреналин
• Допамин
Верхняя граница нормы
0,9 нмоль/л
0,5 нмоль/л
750 пг/мл
110пг/мл
30 пг/мл
1300мкг/сутки
900 м кг/сутки
400 м кг/сутки
170 м кг/сутки
300 мкг/сутки
50 мкг/сутки
Чаще из-за большего удобства для пациента используют определение
метанефринов плазмы. При их нормальных уровнях дальнейшее обсле-
дование не требуется. Повышение концентраций в 4 и более раз во срав-
нению с верхней границей нормы практически со 100%-й вероятностью
свидетельствует в пользу наличия катехоламинсекретирующей опухоли;
в этих случаях дополнительные биохимические тесты не требуются, и
пациенту показаны инструментальные методы исследования для уста-
новления локализации опухолевого процесса [155, 224, 228]. При менее
значительном повышении уровней метанефринов (например, в 2-3 раза
выше верхней границы нормы) говорят о так называемой серой зоне
(то есть о недостаточно определенном результате); в подобных случаях
рекомендуют повторное исследование метанефринов (возможно, в моче
и/или плазме) [97,186, 208].
Установление локализации феохромоцитомы является вторым
обязательным этапом в диагностике (после того, как четко продемонстри-
рована гиперсекреция катехоламинов) — см. рис. 18.1. Начальными мето-
дами исследования являются МРТ или КТ живота и таза (поскольку 90%
катехоламинсекретирующих опухолей локализованы в надпочечниках, а
98% — в структурах живота и таза) [155, 224, 228]. МРТ и КТ демонстри-
руют сходные чувствительность и специфичность в диагностике феохро-
моцитом надпочечника, однако МРТ с гадолинием более информативна в
диагностике тазовых параганглиом, ввиду чего и рассматривается как ин-
струментальный метод выбора [208, 224].
В случае, если при выполнении МРТ/КТ живота и таза опухоль не обна-
руживают, в качестве следующего диагностического шага рекомендуют
проведение 1131-М1ВС-сканирования (с метайодбензилгуанидином), при-
нимая во внимание достаточно высокую частоту ложноположительных
и ложноотрицательных результатов при его использовании (до 15-20%)
[155, 224, 228]. Могут также использоваться и другие инструментальные
методы (рис. 18.1). В части случаев при предположении о семейном ха-
рактере феохромоцитомы эксперты рекомендуют проведение генетиче-
ского обследования [210, 224].
Лечение
Лечебным подходом выбора является хирургическое удаление опухоли.
В большинстве случаев феохромоцитомы являются доброкачественными
образованиями и могут быть удалены радикально. В крупных центрах с
большим опытом выполнения подобных вмешательств операционная ле-
тальность составляет менее 3% [97,173, 228].
Предоперационное лечение. Для предупреждения развития ГК,свя-
занного с феохромоцитомой, во время операции необходимо проведение
эффективной предоперационной а- и (J-адренергической блокады. Для
предупреждения развития в послеоперационном периоде эпизодов гипо-
тензии проводят либерализацию употребления соли. Предоперационная
подготовка должна быть начата за 10 дней до вмешательства. Кратко рас-
смотрим основные компоненты этой подготовки, используемые в клинике
Мауо [228]:
1. Альфа-адренергическая блокада. В качестве препарата выбора исполь-
зуют феноксибензамин (необратимый а-АБ), обеспечивающий более полное
и стабильное а-адренергическое блокирование, чем более известные в ши-
рокой практике доксазозин, празозин или теразозин. Последние препараты
слабее, но имеют лучший профиль переносимости, ввиду чего их советуют
использовать скорее для длительного паллиативного лечения в целях бло-
кирования чрезмерных эффектов катехоламинов при неоперабельных фор-
мах злокачественных/метастатических феохромоцитом. Начальная доза фе-
ноксибензамина составляет 10 мг 2 раза в день с последующим ее повыше-
нием на 10-20 мг каждые 2-3 дня до достижения целевого АД в положении
сидя <120/80 мм рт. ст. (обычно для этого требуется суточная доза 20-100 мг
препарата). Ввиду высокой частоты развития ортостатической гипотензии
при таком уровне а-адреноблокирования больного нужно тщательно про-
инструктировать существенно увеличить употребление поваренной соли с
тем, чтобы САД в положении стоя не было менее 90 мм рт. ст.
2. Бета-адренергическая блокада является необходимой (за исключени-
ем лиц, которые ее не переносят) для контроля тахиаритмий, связанных с
избытком катехоламинов. Начинать применение (3-АБ следует только по-
сле 4-7 дней предварительного приема а-АБ (когда эффективный уровень
а-адреноблокирования уже будет достигнут). В случае изолированного
применения (3-АБ возможно усугубление АГ (вследствие вазоконстрикции,
медиированной а-адренорецепторами). Начинать (3-АБ рекомендуют с ма-
лой дозы и постепенно ее повышать (например, пропранолол 10 мг 4 раза
в сутки с постепенным увеличением дозы в течение ближайших 3-5 дней
и возможным переводом на препараты с пролонгированным действием).
Рекомендуемая ЧСС в положении сидя составляет 60-70 в минуту, стоя —
70-80 в минуту.
3. БКК могут использоваться либо в качестве дополнения к а-/(3-адренер-
гической блокаде, представленной выше, либо в качестве альтернативы
при непереносимости ее компонентов. БКК считаются достаточно безопас-
ными даже у лиц с нормальными уровнями АД, имеющими ГК. Наиболее
часто применяемым препаратом для предупреждения ГК в периопера-
ционном периоде среди БКК является никардипин (в Украине на момент
выхода издания в свет отсутствует), применяемый как внутрь (по 30-60 мг
2 раза в день), так и внутривенно (5-15 мг/ч).
4. Ингибиторы синтеза катехоламинов. Может быть использован мети-
розин (а-метил-паратирозин) — препарат, который ингибируеттирозино-
вую гидролазу, катализирующую начальный этап синтеза катехоламинов.
Его применяют преимущественно в случаях, когда невозможно обеспечить
эффективное а-/(3-адренергическое блокирование другими методами (на-
пример, при непереносимости (3-АБ из-за бронхоспазма).
Анестезия и хирургическое вмешательство. Детальное изложе-
ние этих вопросов выходит за рамки нашего обсуждения. Здесь отметим
лишь, что [155,224, 228]:
• хирургическое вмешательство по поводу феохромоцитомы относят к
высокорисковым процедурам. В случае развития ГК в периоперацион-
ном периоде для его купирования используют вводимые внутривенно
нитропруссид натрия, никардипин, значительно реже — фентоламин
(все они малодоступны или недоступны в лечебной практике Украины)
[173,228];
• некоторых препаратов при анестезии следует избегать (фентанил, кета-
мин, морфин, атропин);
• обычно используют лапароскопическую адреналэктомию, а при разме-
ре опухоли >8-10 см — открытую адреналэктомию;
• после вмешательства необходим очень тщательный контроль состоя-
ния больного в течение 24 часов (особенно за АД и гликемией).
Послеоперационное и длительное наблюдение. Уровни мета-
нефринов плазмы и/или мочи рекомендуют проконтролировать через 1 и
2 недели после вмешательства. При их полной нормализации операцию
считают успешной. Повышенные уровни метанефринов могут свидетель-
ствовать о наличии резидуальной опухоли, еще одного катехоламинпро-
дуцирующего образования (параганглиомы) или метастазов [208,228].
После успешной адреналэктомии уровни метанефринов в крови и/или
моче следует контролировать ежегодно в течение всей жизни пациента
(для своевременной диагностики рецидивов и возможных метастазов).
При повышении значений лабораторных показателей может возникнуть
необходимость в проведении МРТ или КТ [155,208, 228].
Глава 19
Первичный альдостеронизм
Распространенность артериальной гипертензии
АГ присутствует практически у всех пациентов с ПА [155,225].
Определение и клиническая картина
ПА (синоним — синдром Конна, Conn syndrome) — это синдром, обуслов-
ленный автономной (то есть независимой от РАС) гиперсекрецией альдо-
стерона в корковом веществе надпочечников (табл. 19.1) [225]. Наиболее
частыми непосредственными причинами его развития являются альдосте-
ронпродуцирующая аденома надпочечника или билатеральная гиперпла-
зия надпочечников; значительно реже — унилатеральная гиперплазия,
карцинома надпочечников, или семейный гиперальдостеронизм (выделя-
ют I и II типы) [118]. У лиц в возрасте до 40 лет причиной ПА значительно
чаще является аденома надпочечника, чем билатеральная гиперплазия
надпочечников [53,118].
Таблица 19.1. Причины гиперсекреции минералокортикоидов
(адаптировано из [155])
Причины гиперсекреции минералокортикоидов
• Альдостеронпродуцирующая аденома надпочечника
• Билатеральная гиперплазия надпочечников
• Первичная унилатеральная гиперплазия надпочечника (редко)
• Семейный гиперальдостеронизм (типы I и II), глюкокортикоидконтролируемый (редко)
• Карцинома надпочечника (редко)
Большинство случаев альдостеронизма (повышения уровней альдосте-
рона в плазме крови), которые имеют место в клинической практике,
являются вторичными по отношению к повышенной активности
РАС (в ответ на снижение почечной перфузии, например, при стенозе
почечной артерии или при некоторых хронических состояниях, сопро-
вождающихся развитием отеков) [53,118]. Для дифференциальной диа-
гностики можно использовать определение активности ренина плазмы
(АРП): при вторичном альдостеронизме это показатель повышен, при
ПА — снижен [93, 208].
Ранее доминировала точка зрения об относительной редкости ПА. Одна-
ко с более широким использованием методики оценки альдостерон-ре-
нинового соотношения (АРС), которая позволяет выявлять более мягкие
формы этого состояния (обычно при билатеральной гиперплазии над-
почечников), имевшиеся ранее представления о распространенности
ПА изменились [71]. В настоящее время полагают [155], что ПА — одна
из наиболее частых (если не самая частая (?)) среди причин развития
симптоматических АГ. Так, в некоторых сообщениях указывается на то,
что доля лиц с ПА среди общей популяции больных АГ может достигать
3-10%, а среди пациентов с АГ 3-й степени — доходить до 40% [51,129].
ПА может быть выявлено в любой возрастной группе (наиболее типич-
ный возраст — 30-50 лет), более часто у женщин. Классические клини-
ко-лабораторные особенности ПА включают [53,118, 225]:
• АГ;
• гипокалиемию;
• чрезмерное выведение калия почками;
• гипернатриемию;
• метаболический алкалоз.
Более подробно рассмотрим некоторые из этих проявлений.
АГ у лиц с ПА обычно характеризуется высокими уровнями АД, нередко
протекает как резистентная, злокачественная (malignant hypertension); при
АМАД выявляют нарушение циркадного ритма АД с отсутствием его адек-
ватного снижения ночью [99, 208]. Может выявляться значительная гипер-
трофия ЛЖ, нередко — непропорциональная степени выраженности и дли-
тельности АГ [53, 118, 225]. В ее развитии важную роль отводят усилению
процессов миокардиального фиброза вследствие действия избыточного
количества альдостерона на фибробласты миокарда. Профибротические
эффекты чрезмерной концентрации альдостерона (реализуемые через его
негеномные механизмы действия на клетки-мишени) могут быть достаточ-
но отчетливо представлены также в стенке сосудов (с ускорением темпов
прогрессирования атеросклеротических поражений) и почках (с усилением
процессов интерстициального фиброза и гломерулосклероза) [179,226].
Гипокалиемия представляет собой частое, но не универсальное про-
явление ПА [53, 118, 225]. Наличие и степень выраженности гипокалие-
мии могут зависеть от целого ряда факторов. Так, она практически всегда
присутствует и достаточно отчетливо выражена при альдостеронпроду-
цирующей аденоме надпочечника, но может отсутствовать при билате-
ральной гиперплазии надпочечников [53, 118, 225]. Гипокалиемия также
может отсутствовать либо быть незначительной по выраженности на
ранних этапах формирования ПА, а также при значительном ограниче-
нии поступления натрия в организм с пищей (например, в ходе ограни-
чения поваренной соли при изменении образа жизни, рекомендованном
пациенту с АГ). Эксперты [155] указывают, что уровень калия может повы-
шаться (а гипокалиемия — устраняться/маскироваться) при:
• длительном и болезненном осуществлении венепункции (механизмы
могут включать респираторный алкалоз при гипервентиляции; высво-
бождение калия из мышечных депо при повторных многократных сжа-
тиях кулака; венозный стаз при длительном пережатии жгутом);
• гемолизе любой природы;
• выходе калия из эритроцитов в случаях задержки центрифугирования
крови и при пребывании крови на холоде/льду.
Механизмы развития артериальной гипертензии
Прессорные эффекты избыточного количества альдостерона преимуще-
ственно связаны с развитием задержки натрия (этот эффект реализуется
через комплекс геномных механизмов действия альдостерона на натри-
евые каналы клеток тубулярного эпителия) и гиперволемии; определен-
ную роль также отводят повышению ОПСС [53,118, 225].
Диагностика
Диагностика ПА у лиц с АГ складывается из нескольких этапов (рис. 19.1)
[53,118,155,225]:
• выявление собственно ПА, для чего используют исследование электро-
литов крови и мочи, скрининговые тесты (в первую очередь, определе-
ние АРС) и верификационные пробы (с натриевой нагрузкой, каптопри-
лом, др.);
• установление типа поражения надпочечников — уни- или билатераль-
ного (KT и раздельное исследование содержания альдостерона в кро-
ви каждой из надпочечниковых вен).
Выявление собственно ПА. Исследование уровней калия и натрия
в крови представляет рутинный лабораторный тест при АГ [136]. Выяв-
ление гипокалиемии и гипернатриемии уже на начальном этапе диагно-
стического поиска позволяет предположить наличие ПА. Диагностика ПА
не представляет больших сложностей у больных, имеющих развернутую
картину синдрома Конна (в первую очередь, с отчетливой гипокали-
емией, не связанной с другими причинами) [53, 118]. Вместе с тем, в те-
чение предыдущих двух десятилетий отмечается нередкая возможность
наличия ПА среди лиц с нормокалиемией. С учетом этого считают необ-
ходимым проведение дополнительных исследований для исключения
ПА у достаточно широкой категории больных АГ [53,118,225]:
вид
^Ki^l
Рис. 19.1.3
• Резистентная АГ, АГ 3-й степени
• Лица с АГ и гипокалиемией/гипернатриемией
• Лица с АГ и объемным образованием надпочечника при КТ
1
*
При гипокалиемии —
исследование электролитов мочи
Оценка АРС (см. табл. 19.3)
1
АРС <30 (если альдостерон
в единицах СИ, то <750)
1
Эссенциальная АГ
КТ надпочечников
1
АРС >30 (если альдостерон
в единицах СИ, то >750)
\
Тесты с натриевой нагрузкой
и/или каптоприлом
1
Наличие ПА подтверждено
;
Исследование содержания альдостерона в крови каждой из надпочечниковых вен
1
Одностороннее поражение
(аденома):
хирургическое лечение
1
Двустороннее поражение
(билатеральная гиперплазия):
медикаментозное лечение
>тапы диагностики ПА, установления типа поражения
надпочечников и выбор лечебной тактики
(адаптировано из [225])
при уровне АД >160/100 мм рт. ст. (и, особенно, >180/110 мм рт. ст.);
при резистентной АГ (см. гл. 7);
у лиц с гипокалиемией (как спонтанной, так и индуцированной при-
менением диуретика, особенно если она сохраняется после приема
калиевых добавок);
при АГ у лиц с увеличением размера надпочечника по данным инстру-
ментальных исследований (инциденталома надпочечника — см. гл. 17;
показано, однако, что лишь ~1 % случаев всех инциденталом надпочеч-
ника являются причиной ПА).
1. Оценка экскреции электролитов (калия и натрия) в моче. Это ис-
следование занимает достаточно важное место в диагностике причин ги-
покалиемии [71]. Исследование уровней калия и натрия проводят в моче,
собранной в течение 24 часов у пациента, не получающего калиевых
добавок и не менее 3-4 дней воздерживающегося от приема любых ди-
уретиков. В случае, если экскреция натрия превышает 100 ммоль/сутки
(это тот уровень, при котором можно достаточно четко оценить степень
потери калия), уровень экскреции калия >30 ммоль/сутки указывает на
гиперкалийурию [53,118, 225]. Наряду с ПА увеличение экскреции калия
может быть следствием целого ряда причин, перечисленных в табл. 19.2.
Таблица 19.2. Причины гипокалиемии, связанной с увеличением
экскреции калия почками (адаптировано из [155])
Причины гипокалиемии, связанной с увеличением
экскреции калия почками
1. Увеличение выведения калия собирательными трубками нефрона:
• увеличение экскреции натрия (например, при приеме диуретика)
• увеличение осмолярности мочи (глюкоза, мочевина, маннитол)
2. Высокая концентрация калия в собирательных трубках нефрона:
• с увеличением внутрисосудистого объема крови (низкий уровень ренина плазмы):
-ПА
- синдром Liddle
- прием амфотерицина В
• с уменьшением внутрисосудистого объема крови (высокий уровень ренина плазмы):
-синдром Bartter
- синдром Giletman
- гипомагниемия
- увеличение экскреции бикарбонатов
- вторичный альдостеронизм (например, при нефротическом синдроме)
После того, как установлено, что причиной имеющейся у больного гипокали-
емии является повышение экскреции калия с мочой, считают желательным
сделать попытку коррекции гипокалиемии [155]. При отсутствии противопо-
казаний назначают калиевые добавки (калия 40-80 ммоль/сутки), отменяют
прием диуретиков. Для восстановления дефицита калия после пролонгиро-
ванного применения диуретиков может требоваться от 3 недель до несколь-
ких месяцев [225]. По прошествии этого периода прием калиевых добавок
прекращают, а через >3 дней после их отмены повторяют исследование
калия крови. Если уровни калия крови нормализовались, следует повторно
оценить содержание ренина и альдостерона в плазме [52,179,226].
2. Оценка АРС. Этот тест рассматривают в настоящее время как основной ме-
тод скрининга в диагностике ПА [53,118,225]. Нормальные значения уровней
альдостерона при заборе крови в положении пациента лежа составляют 5-12
нг/дл (в единицах СИ — 180-450 пмоль/л), АРП — 1-3 нг/мл/ч, АРС — до 30
(в единицах СИ — до 750) [53, 118, 225]. Важно отметить, что приведенные
нормальные значения показателей представляют собой лишь примерные
значения; для каждой конкретной лаборатории (и для конкретных лаборатор-
ных наборов) они могут различаться (требуется сравнение с показателями у
здоровых лиц и у лиц с эссенциальной АГ). С учетом подобной недостаточной
стандартизации метода можно согласиться с мнением [225] о том, что при ин-
терпретации результатов оценки АРС «от клинициста требуется гибкость су-
ждения». В табл. 19.3 представлены основные рекомендации по оценке АРС.
Таблица 19.3. Рекомендации по оценке АРС (адаптировано из [155])
Подготовка пациента
• Коррекция гипокалиемии при ее наличии.
• Либерализация приема поваренной соли.
• Отмена по крайней мере на 4 недели препаратов, повышающих уровень ренина и снижа-
ющих концентрацию альдостерона, что обусловливает получение ложных результатов:
- спиронолактона, эплеренона, амилорида, триамтерена;
- продуктов, содержащих лакрицу.
• Отмена по крайней мере на 2 недели других препаратов, которые могут повлиять на
результат исследования*:
- р-АБ, центральных а2-агонистов (клонидина), НПВП (снижают уровень ренина);
- ингибиторов АПФ, сартанов, прямых ингибиторов ренина, дигидропиридиновых
БКК (повышают уровень ренина, снижают содержание альдостерона).
• Отмена эстрогенсодержащих препаратов.
• При невозможности отмены этих лекарственных препаратов у больных АГ 3-й степени
допустимо сохранить их прием при обязательной отмене спиронолактона, эплерено-
на, триамтерена и амилорида по крайней мере в течение 6 недель до исследования.
Условия забора крови
• Кровь следует собирать в середине утра, спустя примерно 2 часа после пробуждения
и вставания пациента с постели. Непосредственно перед забором крови пациент дол-
жен посидеть в течение 5-15 минут.
• Набирать кровь нужно аккуратно, избегая стаза и гемолиза.
• Образец крови перед центрифугированием должен находиться при комнатной тем-
пературе (не на льду, что будет способствовать преобразованию неактивного ренина
в активный); после центрифугирования плазму следует быстро заморозить.
Факторы, которые следует принять во внимание
при интерпретации результатов
• Возраст (у лиц старше 65 лет имеется связанное с возрастом более значительное сни-
жение уровня ренина по сравнению с альдостероном).
• Время суток, недавний диетический режим, положение тела, длительность пребыва-
ния в этом положении.
• Принимаемые лекарственные препараты.
• Особенности забора образца крови, включая любые возникшие при этом сложности.
• Уровни калия крови.
• Сниженная функция почек (может иметь место увеличение альдостерона вследствие
гиперкалиемии и снижение секреции ренина).
Важной в практическом отношении представляется рекомендация
Kaplan ЛШ., Victor R.G. [155]: «Необходимо максимально тщательно следо-
вать рекомендациям по оценке АРС. Далее следует отдельно оценить уров-
ни альдостерона и АРП, пока еще без подсчета соотношения между ними.
Если показатель АРП явно низкий (<0,5 нг/мл/ч) и уровень альдостерона
плазмы явно повышен (>15 мг/дл), то желательно это измерение повторить
еще раз. Если низкие значения АРП и высокие уровни альдостерона будут
подтверждены, следует перейти к проведению верифицирующих тестов».
Изучение АРС, а также проведение всех дальнейших исследований требу-
ет обсуждения их цели с пациентом; диагностический поиск (с затратами
времени и средств) следует планировать с учетом готовности и желания
пациента подвергнуться в перспективе лапароскопической адреналэкто-
мии в случае, если будет обнаружена аденома надпочечника [53,155,194].
Верифицирующие тесты. При повышенных уровнях АРС требует-
ся подтверждение того, что уровень альдостерона у пациента не только
чрезмерно повышен, но и не подавляется при проведении верифици-
рующих тестов [53, 118, 225]. Наиболее распространенным является тест
с физиологическим раствором. Уровень альдостерона плазмы оценивают
до и после 4-часовой инфузии 2 литров физиологического раствора. У лиц
с ПА по сравнению с пациентами с эссенциальной АГ не только оказывают-
ся более высокими исходные уровни альдостерона плазмы, но у них еще и
не происходит снижения этих уровней после инфузии физиологического
раствора (они оказываются выше 5 нг/мл). В некоторых эндокринологиче-
ских центрах вместо внутривенного введения физиологического раствора
используют тест с пероральной солевой нагрузкой, в части случаев допол-
няя ее применением дексаметазона (все эти меры приводят к снижению
уровней альдостерона у здоровых лиц и у больных эссенциальной АГ, но
не у пациентов с ПА) [99, 226].
Еще одним из «подавляющих» тестов является проба с каптоприлом.
Уровни альдостерона плазмы оценивают до и спустя 3 часа после приема
внутрь каптоприла в дозе 1 мг/кг массы тела обследуемого (у здоровых,
у больных эссенциальной и реноваскулярной АГ уровни альдостерона
отчетливо снижаются, а при ПА этого не происходит). Нормальным отве-
том считают снижение содержания альдостерона на >30% от исходных
значений [226].
Типы нарушений надпочечников. После того, как наличие ПА у кон-
кретного пациента подтверждено, необходимо установить тип нарушения
[53, 118, 225]. Это является важным для выбора тактики лечения (хирурги-
ческое вмешательство — для аденомы надпочечника, длительное медика-
ментозное лечение — для билатеральной гиперплазии надпочечников).
Кратко рассмотрим некоторые особенности этих основных типов [208].
Альдостеронпродуцирующие аденомы составляют около 35-40% слу-
чаев в структуре ПА. Солитарные доброкачественные аденомы практиче-
ски всегда являются унилатеральными (односторонними). В большинстве
случаев они имеют небольшие размеры (в 20-85% наблюдений — ме-
нее 1 см [53, 118, 225]). За пределами аденомы в остальной ткани надпо-
чечника, а также в контралатеральном надпочечнике может иметь место
фокальная или диффузная гиперплазия ткани (что затрудняет дифферен-
циальную диагностику с билатеральной гиперплазией — см. далее).
Билатеральная гиперплазия надпочечников (идиопатический гипер-
альдостеронизм). В настоящее время долю этого состояния в структуре
причин ПА оценивают как доминирующую (достигает 60% и более). Генез
билатеральной гиперплазии надпочечников остается до настоящего вре-
мени неуточненным [155]. Некоторые исследователи полагают, что гипер-
плазия может быть вторичным ответом ткани надпочечников на действие
гипотетического стимулирующего фактора, имеющегося при АГ (возмож-
но, повышенной концентрации АН). Другие отмечают увеличение выявле-
ния гиперплазии с возрастом и рассматривают ее как вариант возрастных
изменений надпочечников, проявляющихся гиперпродукцией альдосте-
рона, прогрессирующим снижением уровней ренина в крови и формиро-
ванием низкорениновой АГ [53, 118, 225]. У части пациентов гиперплазия
надпочечников может иметь нодулярный характер, что делает достаточно
сложной дифференциальную диагностику с аденомой надпочечника на ос-
новании данных КТ [118].
Установление типа нарушений надпочечников. Начальным под-
ходом является КТ надпочечников (ее рассматривают как более информа-
тивный метод по сравнению с МРТ) [53, 118, 225]. Подчеркивают, что КТ у
многих пациентов не обеспечивает желательной точности диагностики.
Так, правильный диагноз с ее помощью устанавливают при ПА лишь у 53%
лиц как с уни-, так и с билатеральным поражением [118].
В некоторых авторитетных клиниках [225] данные КТ считают достаточны-
ми для проведения хирургического вмешательства только у определенной
категории больных ПА (при наличии солитарной односторонной макро-
аденомы размером >1 см, при нормальной структуре контралатерального
надпочечника и возрасте до 40 лет). В то же время большинство специали-
стов указывают на то, что во всех случаях, когда наличие ПА установлено,
для более точного диагностирования уни- и билатеральных поражений
друг от друга (что позволит избежать ненужного оперативного вмеша-
тельства) диагностическим методом выбора является раздельное ис-
следование содержания альдостерона/кортизола в крови каждой из
надпочечниковых вен с подсчетом индекса латерализации [53, 118,
225]. Здесь отметим, что требуемая для такого исследования катетериза-
ция центральных надпочечниковых вен является достаточно дорогой и
технически сложной процедурой; это делает метод малодоступным для
отечественной клинической практики [206,208].
Сцинтиграфия надпочечников (изотоп NP-59) в силу высокой частоты
ложнонегативных результатов не нашла применения в диагностике
причин ПА [155].
Лечение
Лечение пациентов, у которых на основании проведенного обследования
диагностирована явная аденома надпочечника, состоит в ее хирургиче-
ском удалении [71, 155]. Лицам с билатеральной гиперплазией надпочеч-
ников, а также тем, у которых диагноз после обследования остается не-
достаточно ясным, требуется проведение длительной медикаментозной
терапии [53,118, 225].
Хирургическое лечение. Перед вмешательством у лиц с установлен-
ным диагнозом аденомы надпочечников в течение 3-5 недель проводят
лечение спиронолактоном для коррекции водно-электролитных наруше-
ний, а также для улучшения пери- и постоперационного прогноза. Среди
операционных подходов в настоящее время все большее распростране-
ние получают лапароскопические. В случае выявления в ходе вмешатель-
ства гиперплазии надпочечников (вместо ожидавшейся ранее аденомы)
удалению подлежит лишь один из надпочечников (это связано с нередко
неудовлетворительным суммарным результатом билатеральной адренал-
эктомии и значительными сложностями в лечении таких послеоперацион-
ных больных) [155, 228].
После хирургического вмешательства улице аденомой надпочечника устра-
нение АГ без необходимости возобновления антигипертензивной терапии
отмечается у 35-60% пациентов; у остальных АГ начинает значительно луч-
ше поддаваться антигипертензивным препаратам [53,118,225] (см. далее).
Среди послеоперационных осложнений отдельного рассмотрения заслу-
живает гипоальдостеронизм. Он может развиваться даже несмотря на
периоперационный прием спиронолактона. Нарушение способности за-
держивать натрий и адекватно экскретировать калий может персистиро-
вать в течение некоторого времени (пока уровни ренина, которые были
супрессированы на фоне постоянно высоких уровнях альдостерона в цир-
куляции, не вернутся к нормальным значениям). Дефицит альдостерона у
этих больных обычно не слишком выраженный и длительный; для его кор-
рекции нередко достаточным является добавление умеренных количеств
поваренной соли в рацион (без необходимости применения глюко- или
минералокортикоидов) [155, 228].
Медикаментозная терапия. Длительное лечение с использованием
антагонистов минералокортикоидных рецепторов (спиронолактона или
эплеренона), при их непереносимости — амилорида; нередко сочетание
с тиазидовым диуретиком может быть лечебным подходом выбора у боль-
ных [53,118,225]:
• которым невозможно выполнить хирургическое вмешательство;
• которые не желают его выполнять;
• у которых АГ сохраняется после операции;
• диагноз ПА у которых остается не вполне подтвержденным несмотря на
проведенное обследование.
Применение антагонистов минералокортикоидных рецепторов у лиц с ПА
обеспечивает достаточно отчетливое снижение АД и позволяет достичь ре-
грессии гипертрофии ЛЖ. На начальных этапах лечения могут требоваться
дозы 50-100 мг/сутки и более спиронолактона или эплеренона, в последу-
ющем достаточно эффективны менее высокие дозировки (25-50 мг/сутки)
[53,118, 225]. Уменьшить дозу этих препаратов может позволить их комби-
нация с тиазидовыми диуретиками. Для длительного лечения больных ПА
селективный представитель антагонистов минералокортикоидных рецеп-
торов эплеренон с присущей ему значительно меньшей, чем у спироно-
лактона, частотой побочных эффектов может рассматриваться как препа-
рат выбора [155,225].
При необходимости применения других антигипертензивных препаратов
начальный выбор включает БКК (например, амлодипин), так как в высоких
дозах они обладают некоторой способностью блокировать рецепторы
альдостерона [155]. Для контроля АГ в качестве компонентов лечебной
тактики могут применяться и другие классы антигипертензивных средств
[53,118,225].
У лиц с карциномой надпочечника могут использоваться препараты из
групп антагонистов стероидогенеза [118] (см. гл. 20).
Глава 20
Синдром Кушинга,
болезнь Кушинга
Распространенность артериальной гипертензии
Распространенность АГ при синдроме Кушинга достигает 75-90%
[125,126,155]. Этот вариант симптоматической АГ нередко отличается реф-
рактерностью к проводимой антигипертензивной терапии [5,67, 71, 72].
Определение и клиническая картина
Термином «синдром Кушинга» (синдром Иценко-Кушинга, гиперкор-
тицизм) обозначают комплекс проявлений, связанных с длительной экс-
позицией чрезмерно высоких концентраций гормона кортизола (гид-
рокортизона — глюкокортикоида, продуцируемого корой надпочечников)
[125,126,155]. В основе развития этого состояния обычно лежат нарушения
на различных уровнях так называемой гипоталамо-гипофизарно-надпочеч-
никовой оси (схематически: гипоталамус секретирует кортикотропин-ре-
лизинг гормон (КРГ), который стимулирует образование АКТГ в гипофизе,
который, в свою очередь, стимулирует выработку гормонов коры надпочеч-
ников; таким образом повышение образования кортизола возможно при на-
рушениях как в надпочечниках, так и в гипофизе, и гипоталамусе) [125,126,
155,203]. Развитие синдрома Кушинга может быть связано с [155]:
• первичным чрезмерным образованием кортизола в надпочечниках
(при добро- или злокачественных опухолях коры надпочечников —
кортикостеромах; при гиперплазии коры надпочечников);
• чрезмерным образованием АКТГ (при аденоме гипофиза);
• чрезмерным образованием КРГ (при кортикотропиномах, которые мо-
гут иметь эктопическую локализацию — в бронхах, яичках, яичниках);
• приемом глюкокортикоидов (ятрогенный вариант, он представляет
собой самую частую причину развития синдрома Кушинга).
Понятием «болезнь Кушинга» обозначают ситуацию, связанную с из-
быточной продукцией АКТГ (или, реже, КРГ), что стимулирует гиперпро-
дукцию кортизола в надпочечниках [125, 203].
Среди неятрогенных вариантов синдрома Кушинга АКТГ-продуцирую-
щие опухоли гипофиза составляют до 70% случаев; эктопическая гипер-
секреция АКТГ — =10%; эктопическая продукция КРГ — 1%; аденома
надпочечников — =10%; карцинома надпочечников — =7%; микро-
нодулярная гиперплазия надпочечников — =1-2% [125,126,155, 203].
Также выделяют так называемый псевдосиндром Кушинга, при котором
нарушения в структурах гипоталамо-гипофизарно-надпочечниковой оси
отсутствуют, но повышение уровней кортизола и кушингоидные клиниче-
ские проявления имеют место [155]. Этот синдром может развиваться при
ожирении, алкоголизме, беременности, приеме оральных контрацептивов
(возможно, вследствие увеличения секреции КРГ). Дифференциальная ди-
агностика с истинным синдромом Кушинга может быть довольно затрудни-
тельной и требует исключения опухолевых поражений различной локали-
зации (см. далее раздел «Диагностика») [126,155].
Клинические проявления синдрома Кушинга (жирным шрифтом выделены
наиболее характерные) [71,125,126,155,203]:
• общие — ожирение (80-95%), абдоминальное ожирение (45-95%),
АГ (75-90%), головная боль (10-50%);
• кожные — покраснение лица (70-90%), гирсутизм (70-80%), широкие
пурпурные стрии (50-70%), угревая сыпь (30-70%);
• нейропсихические — нарушения памяти, внимания, депрессия, эйфо-
рия, психозы (60-95%);
• дисфункция гонад — дисменорея (75-95%), импотенция или снижение
либидо (65-95%);
• мышечно-скелетные — остеопения (75-85%), слабость вследствие ми-
опатии (30-90%);
• метаболические — нарушение толерантности к глюкозе/СД (40-90%),
мочекаменная болезнь (15-20%).
Механизмы развития артериальной гипертензии
Механизмы развития АГ при синдроме Кушинга разноплановые и могут
включать [95,155,141]:
• задержку натрия и воды вследствие действия чрезмерно высокой кон-
центрации кортизола. Несмотря на то, что минералокортикоидная ак-
тивность кортизола примерно в 300 раз меньше, чем у альдостерона,
его секретируется примерно в 200 раз больше (а при синдроме Кушин-
га — в 2 раза и более от этих показателей);
• прямое стимулирующее действие кортизола на глюко- и минералокор-
тикоидные рецепторы гладкомышечных клеток сосудов;
• повышение продукции минералокортикоидов;
• снижение активности некоторых вазодилататорных субстанций (напри-
мер, оксида азота);
• увеличение ответа гладкомышечных клеток сосудов на вазопрессорные
стимулы (ренин); увеличение образования эритропоэтина, эндотелина.
Диагностика
Скрининговые тесты для диагностики синдрома Кушинга [128,155]:
• Оценка уровня кортизола в сыворотке крови или слюне (забор образ-
цов — поздно ночью, с учетом суточного ритма секреции гормона). В
течение предыдущих 10 лет определение кортизола в слюне благодаря
удобству и достаточно высокой точности в западных странах существен-
но потеснило исследование его в сыворотке крови. Уровни кортизола
>0,3 мкг/дл (8,6 ммоль/л) считают повышенными.
• Для лиц, у которых на основании клинических данных вероятность на-
личия синдрома Кушинга считают высокой, рекомендуют использова-
ние оценки уровня свободного кортизола в моче, собранной за 24 часа.
Вследствие вариабельности секреции кортизола такое исследование
рекомендуют выполнить трехкратно. Нормальная концентрация корти-
зола в моче составляет 1,1-1,38 ммоль/л; диагностическим для синдро-
ма Кушинга считают уровень в 4 раза выше.
• Для лиц с относительно невысокой вероятностью наличия синдрома Ку-
шинга (например, у пациентов, имеющих СД, ожирение и плохо контроли-
руемую АГ), рекомендуют проведение низкодозового теста с дексамета-
зоном. При этом перед сном пациенту рекомендуют принять внутрь 1 мг
дексаметазона; в 8:00 на следующий день выполняют забор крови для
исследования уровня кортизола. Уровень выше 1,8 мкг/дл (48,6 ммоль/л)
считают диагностически значимым (следует иметь в виду возможность
получения ложноотрицательных результатов у 20% и ложно-положитель-
ных у 10% обследованных). Существенно повышает точность оценки ком-
бинированное использование двух последних скрининговых тестов.
• В качестве дополнительного метода может быть использован осмотр оку-
листа с оценкой полей зрения (при аденоме гипофиза вследствие сдавле-
ния chiasma opticum возможно развитие двусторонней гемианопсии).
Обследование для установления причины синдрома Кушинга
[125,126,155,203]:
• Оценка уровня АКТГ в плазме.
• Тест с введением КРГ и последующим определением содержания АКТГ.
• КТ или МРТ надпочечников. Еще раз отметим, что при выявлении ин-
циденталомы надпочечника (см. гл. 17) всегда требуются тщательное
дополнительное обследование для уточнения клинической значимо-
сти выявленного образования и динамический контроль для оценки
его склонности к прогрессированию.
• МРТ гипофиза.
Лечение
Контроль АГ.АнтигипертензивнуютерапиюулицссиндромомКушинга про-
водят с использованием стандартных групп препаратов [206,208]. С учетом
важной роли перегрузки объемом в развитии АГ при этом состоянии пре-
паратами первого выбора могут являться диуретики, обычно в комбинации
с антагонистами альдостерона (спиронолактоном или эплереноном) [125,
126,155,203]. Следует иметь в виду, что даже в случае адекватного контроля
АГ, иные факторы СС-риска (включая абдоминальное ожирение и инсули-
норезистентность) обычно длительно персистируют [208,215].
Лечебная тактика при синдроме Кушинга в целом. Принимая во
внимание неблагоприятный прогноз при неконтролируемом синдроме
Кушинга (увеличение смертности примерно в 5 раз по сравнению с об-
щей популяцией), лечение пациента с этим состоянием следует начинать
как можно более рано (сразу после уточнения диагноза) [125, 126, 155,
203]. У большинства больных, имеющих АКТГ-зависимую болезнь Кушин-
га с наличием опухоли гипофиза, лечебным подходом выбора считают
транс-сфеноидальное микрохирургическое удаление опухоли (еще один
вариант вмешательства — транс-фронтальная гипофизэктомия). При от-
сутствии эффекта от этих вмешательств (а также если не удается выявить
опухоль гипофиза) считают возможным проведение уни- или билатераль-
ной адреналэктомии [155]. Доброкачественная кортизолпродуцирующая
опухоль надпочечника подлежит хирургическому удалению (в последнее
время чаще лапароскопическому). В случае злокачественного новообра-
зования надпочечника, а также злокачественной эктопической АКТГ-про-
дуцирующей опухоли может требоваться комбинация хирургического ле-
чения с проведением химиотерапии. У части пациентов при подготовке к
хирургическому вмешательству (или при задержке его проведения) могут
быть использованы медикаментозные средства, влияющие на гипотала-
мо-гипофизарную систему: агонисты допамина (бромокриптин, лизурид);
антагонисты серотонина (ритансерин); аналоги соматостатина (октреотид);
ингибиторы синтеза гормонов коры надпочечников (митотан, метирапон);
антагонисты глюкокортикоидов (этомидат, мифепристон) [155, 206,208].
После выполнения хирургического вмешательства устойчивую ремиссию
с нормализацией уровня кортизола в плазме и моче, а также с устранением
клинических проявлений наблюдают у 70-80% пациентов с болезнью Ку-
шинга. У остальных в течение ближайших 5 лет после успешной операции
могут наблюдаться рецидивы, что требует тщательного и длительного
послеоперационного наблюдения [125,126,155, 203].
Глава 21
Артериальная гипертензия
при беременности и лактации
Распространенность артериальной гипертензии
Распространенность АГ при беременности составляет -8% (у первобере-
менных -10%) [197]. АГ при беременности значительно ухудшает прогноз
для матери и плода. Дети, рожденные от беременности с преэклампсией
(ПЭ), имеют повышенный риск развития АГ во взрослом состоянии. Пере-
несенная ПЭ и для матери — явный фактор риска развития хронической
АГ, а также ожирения, СД и ХЗП [65,100,155].
Классификация
Классификация АГпри беременности представлена в табл. 21.1.
Таблица 21.1. Классификация АГ при беременности
[46,67,70,136,197]
Хроническая АГ (АГ, имевшая место до беременности) — констатируют, если уровни
АД превышали 140/90 мм рт. ст. до начала беременности, или если они выявлены в сро-
ки менее 20 недель гестации, или если они сохраняются более 6 недель после родов
Гестационная АГ — АГ, впервые выявленная в сроки >20 недель гестации при отсут-
ствии протеинурии. Если АД нормализуется в течение 6 недель после родов, то это —
транзиторная гестационная АГ; если нет — то это хроническая АГ
ПЭ — АГ, впервые выявленная в сроки >20 недель гестации (возможно и ранее) при
наличии протеинурии (>0,3 г/сутки*)
Эклампсия — ПЭ с судорогами (при отсутствии других причин судорожного синдро-
ма). Судороги могут быть и после родов (в течение первых 2-3 дней или более)
ПЭ, сочетанная с хронической АГ (с АГ, имевшей место до беременности). Примерно у
20% женщин с хронической АГ во время беременности развивается ПЭ
Примечание. * Эксперты ESC [136] уровень протеинурии, при котором диагностируют ПЭ, увеличили с
0,3 г/сутки до 3 г/сутки.
Диагностика
АД необходимо измерять на обеих руках. Разница >10 мм рт. ст. имеется
примерно у 8% беременных. Учитывать следует более высокую величину.
По данным [155], в крупном метаанализе, включавшем 34 исследования
(61 000 беременных), ДАД >75 мм рт. ст. в сроки 13-20 недель гестации яви-
лось важным критерием риска развития ПЭ в ходе последующей беремен-
ности. У всех беременных (особенно при наличии ФР развития АГ/ПЭ) жела-
телен контроль АД дома [65,100,155]. Для ранней диагностики ПЭ (особен-
но у женщин с повышенным риском ее развития) и АГ при беременности
рекомендуют выполнение суточного мониторирования АД [104,150,204].
Изменения АД при физиологической беременности. Уже на
начальном этапе беременности (первые недели) отмечается физиологи-
ческое снижение АД (вследствие вазодилатации, обусловленной измене-
ниями функции яичников, гормональной активностью желтого тела, др.)
[65,100,155]. Максимальное снижение АД в норме наблюдают примерно к
20-й неделе гестации. Затем постепенно к сроку родов АД возвращается к
исходным (имевшимся до беременности) уровням. Отсутствие физиологи-
ческого снижения АД на начальных сроках беременности рассматривают
как важный фактор риска развития ПЭ. С ранних сроков беременности уве-
личивается СКФ, снижаются уровни мочевины и креатинина. К родам эти
показатели возвращаются к исходным значениям [19,20,142,155].
Преэклампсия
ПЭ обычно развивается в сроки >20 недель беременности, большая часть
случаев— в сроки >34 недель, 10-30% — в сроки 21-34 недели [136]. ПЭ и
эклампсия могут развиваться и после родоразрешения. Одна из 10 первых
беременностей протекает с ПЭ. При последующих беременностях частота
ПЭ примерно в 6-8 раз ниже (1 на 60-80 беременностей) [155,157,166].
Эпидемиология. Более часто ПЭ развивается у: возрастных и юных
(<16 лет) первобеременных, при многоплодных беременностях, при СД (1-го
типа или гестационный диабет), при АГ, ХПП, ожирении (ИМТ >35 кг/м2), ин-
фекции мочевой системы, наличии антифосфолипидных антител. К факто-
рам риска ПЭ также относят: ПЭ в анамнезе, низкая масса тела матери при
рождении, перерыв в родах 10 лет и более [138,149, 218].
Факторы риска. Констатируют наследственную предрасположенность
к развитию ПЭ. Ее риск повышен при наличии ПЭ в семейном анамнезе
(у матери, сестры, бабушки). Определенную роль, возможно, играют на-
следственные факторы со стороны отца (отец родился от беременности,
протекавшей с ПЭ; ПЭ имелась во время беременности у другой партнер-
ши) [65,100,155].
Патогенез ПЭ сложен и недостаточно изучен. Неясны индуцирующий фак-
тор и самые ранние этапы патогенеза. Предполагаются множественные ме-
ханизмы развития ПЭ.Отсутствуютэкспериментальные модели ПЭ (на живот-
ных). Нет скрининг-теста для прогнозирования развития ПЭ [151,166,200].
В развитии ПЭ принято выделять два основных этапа [100, 155]. Первый
из них включает плацентарные нарушения. На начальной стадии клю-
чевую роль отводят дефектам миграции и инвазии трофобласта, а также
отсутствию нормального ремоделирования спиральных артерий мио-
метрия. Это приводит к нарушениям маточно-плацентарной перфузии,
гиперпродукции плацентой антиангиогенных протеинов и других ва-
зотропных субстанций.
Второй этап характеризуется системным ответом организма матери
[100, 155]. Вследствие влияния гуморальных факторов, продуцируемых пла-
центой, развиваются генерализованная дисфункция эндотелия, вазоконстрик-
ция, ишемия органов-мишеней, увеличение оксидативного стресса, активация
тромбоцитов, повышается локальный воспалительный ответ [155,167,197].
Диагностика. Наиболее распространенным критерием диагностики
ПЭ у женщин, не имевших АГ до беременности, является обнаружение
уровней АД >140/90 мм рт. ст. в 2 измерениях с разрывом >6 часов. При
ПЭ имеется также протеинурия >0,3 г/сутки (или >0,3 г/л в 2 тщатель-
но собранных анализах с разрывом >4 часов [100, 155]. Эксперты ESC
[136] уровень протеинурии, при котором диагностируют ПЭ, увеличили
с 0,3 г/сутки до 3 г/сутки.
При ПЭ нередко выявляют гиперурикемию [177,191].
Клинические проявления. Спектр клинических проявлений ПЭ широ-
ко варьирует от легких до тяжелых форм. Прогрессия от легкой симпто-
матики к тяжелой чаще постепенная. Однако темп этой прогрессии может
быть очень разным: у одних пациенток симптоматика остается легкой;
у других прогрессирование более быстрое; у третьих — молниеносное
(дни-часы) с развитием эклампсии [100, 155]. В этой связи из-за непред-
сказуемой вариабельности многие эксперты указывают на желатель-
ность гипердиагностики ПЭ [155,197].
Клинические проявления тяжелой ПЭ. Уровни АД нередко состав-
ляют [155]: САД >160 мм рт. ст. и/или ДАД >110 мм рт. ст. Клинические про-
явления, связанные с внутрисосудистым свертыванием и депонированием
фибрина в органах-мишенях, могут включать [100]:
• в почках — массивную протеинурию (более 3-5 г/сутки), снижение СКФ,
олигурию (<500 мл/сутки);
• в ЦНС — судороги, кому;
• в печени — повышение трансаминаз (более чем в 2 раза выше верхней
границы нормы), боль в правом подреберье;
• в крови — коагулопатию потребления (тромбоцитопению, снижение
уровня фибриногена, пролонгацию протромбинового времени).
Проявлениями нарушения церебрального кровотока могут быть [155]: го-
ловная боль (часто имеется при ПЭ), судороги (эклампсия), кортикальная
слепота, гипертензивная энцефалопатия (вследствие вазоспазма и отека
мозга). В структуре тяжелой ПЭ выделяют так называемый синдром HELLP,
который включает [155, 207]:
• гемолиз;
• повышение трансаминаз;
• тромбоцитопению.
Для профилактики эклампсии важным подходом является внутривенное
введение сульфата магния (в настоящее время широко используют как в
отечественной, так и в зарубежной акушерской практике) [155,197].
Лечение. При тяжелой ПЭ обычно рекомендуют преждевременное родо-
разрешение (особенно если срок беременности <24 недель, но также и
при большем сроке) [155].
При нетяжелой ПЭ лечебные подходы включают [155,207]:
• госпитализацию;
• постельный режим (снижает риск развития тяжелой ПЭ и внутриутроб-
ной задержки роста плода);
• ограничение приема кофе и чая; не следует ограничивать потребление
поваренной соли;
• не следует стремиться снизить массу тела у женщин с ожирением при
беременности;
• антигипертензивную терапию (снижает риск для матери, но не для плода):
- метилдофа (препарат выбора, применяют в любые сроки беременности);
- Р-АБ (обычно метопролол, место других менее ясно; (3-АБ нежелатель-
ны в I триместре беременности, то есть до 13-й недели);
- БКК (нифедипин — преимущественно пролонгированного действия,
верапамил, другие препараты этой группы значительно менее изуче-
ны) [138,157,197].
Лечение острого значительного повышения АД при беременности
(ГК с АД >160/100 мм рт. ст., см. гл. 22)
Целевое ДАД составляет на начальном этапе 90-95 мм рт. ст. (чрезмерного
снижения АД советуют избегать, поскольку при этом может ухудшиться ма-
точно-плацентарный кровоток) [155].
Препараты для купирования ГК при беременности включают [25,155, 207]:
• нифедипин — короткодействующий, 10 мг сублингвально, можно по-
вторять каждые 20 минут до достижения суммарной дозы 30 мг. Нужна
особая осторожность при сочетании с сульфатом магния (опасность бы-
строго снижения АД!);
• лабеталол (внутривенный болюс — 20 мг, через 10 минут — 40 мг, затем
каждые 10 мин по 80 мг 2 раза, максимум — 220 мг);
• сульфат магнезии, урапидил, нитроглицерин, а при неэффективности
всех перечисленных подходов — нитропруссид натрия.
Последствия. Как уже было отмечено, женщины, перенесшие ПЭ, имеют
повышенный риск развития АГ, СД, ХЗП и ожирения в последующем [6, 66,
71, 155]. После перенесенной ПЭ АГ может сохраняться примерно у 40%
женщин. У 15-20% при повторной беременности ПЭ повторяется. У значи-
тельной части женщин (до 40%), перенесших ПЭ, спустя 5 лет отмечают из-
менения по данным серийных МРТ головного мозга [104,150,155].
Профилактика. Настойчиво рекомендуют [155, 207]: своевременное
лечение АГ, СД, борьбу с ожирением, рациональное питание, тщательный
контроль АД, изменения образа жизни, при повторных беременностях
(после перенесенной ПЭ, начиная с 12-й недели, частое (не реже 1 раза в
2-3 дня) измерение АД.
Первичная профилактика (если ПЭ не было в анамнезе) включает [155]: ре-
комендацию избегать беременностей в возрасте <16 лет; при искусствен-
ном оплодотворении — избегать многоплодных беременностей.
Вторичная профилактика (у женщин с ПЭ в анамнезе) предусматривает
[136, 155]: тщательное наблюдение с ранних этапов беременности для
своевременной диагностики повторной ПЭ. Могут использоваться низкие
дозы аспирина — 75 мг/сутки, начиная с 8-10-й недели гестации (по вопро-
су о полезности этой рекомендации данные нескольких крупных метаана-
лизов 2011-2012 годов противоречивы, но пока преобладает точка зрения
о целесообразности этой меры). Не снижают риск повтора ПЭ фолиевая
кислота, витамины С и Е, добавки кальция и рыбьего жира.
Эклампсия
Эклампсия характеризуется наличием судорог вследствие гипертензивной
энцефалопатии. Ее распространенность составляет примерно 1 % беременно-
стей в развивающихся странах; в развитых странах ее частота в 2-3 меньше
[155, 207]. В патогенезе эклампсии на начальных этапах имеет место обрати-
мый отек мозга, в последующем — необратимая церебральная ишемия и ин-
фаркты мозга. Лечебная тактика при эклампсии предусматривает [155]:
• родоразрешение — обычно после купирования судорог и достижения
контроля АД;
• сульфат магния для контроля судорог;
• лечение тяжелой АГ (см. ранее раздел о лечении ГК при беременности);
• рекомендацию избегать диуретиков;
• рекомендацию ограничить поступление жидкости (из-за риска усугубле-
ния отека мозга).
Хроническая артериальная гипертензия при беременности
Эпидемиология. Распространенность хронической АГ достигает 5% среди
всех беременностей в развитых странах [197]. При хронической АГ повышен
риск развития ПЭ, преждевременной отслойки плаценты. Также повышен риск
для плода (внутриутробная задержка роста, перинатальная смерть) [155,191].
Риск особенно повышен при уровнях ДАД >110 мм рт. ст. в I триместре, а
также при сниженной функции почек (СКФ < 60 мл/мин/1,73 м2, а тем более
<30мл/мин/1,73 м2) [197].
Женщинам с исходно высокой и плохо контролируемой АГ, а также с ХЗП при
сниженной функции почек желательно избегать беременностей [65,155].
Общие вопросы лечебной тактики. Лечебную тактику желательно
планировать до наступления беременности [197]. Во многих случаях (при
отсутствии противопоказаний) во время беременности оправдано про-
должение того лечения, которое было эффективным до ее наступления
[197]. При беременности не применяют ингибиторы АПФ, сартаны, прямые
ингибиторы ренина, триамтерен. Обычно после родов может требоваться
постепенное снижение дозы антигипертензивных препаратов [155,197].
Медикаментозное лечение. Препараты, наиболее часто используе-
мые для лечения хронической АГ при беременности, включают [197]:
• метилдофа (препарат выбора, применение возможно с ранних сроков, в
дозах до 1500-2000 мг/сутки в 2 приема);
• метопролол (со II триместра, может индуцировать бронхоспазм, иног-
да ассоциирован с развитием внутриутробной задержки роста плода;
дозы — до 200 мг/сутки в 2 приема);
• нифедипин продленного действия (начиная с 2011 года эксперты США
для лечения хронической АГ при беременности вместо короткодей-
ствующего нифедипина рекомендуют его пролонгированные формы,
мотивируя это более высокой безопасностью последних; применяют в
любые сроки беременности; дозы 30-120 мг/сутки в 1 -2 приема). Может
также использоваться верапамил (среди его побочных эффектов опре-
деленную проблему именно при беременности может составлять запор;
дозы — 120-240 мг/сутки на 2-3 приема). Место других БКК (например,
амлодипина) при беременности менее ясно, однако в нескольких сооб-
щениях отмечается его достаточная безопасность;
• гидралазин (применяют в любые сроки беременности, 50-300 мг/сутки
в 2-4 приема);
• гидрохлоротиазид (введен в число рекомендуемых для таких пациенток
в США начиная с 2011 года; указывается на то, что имевшиеся ранее опа-
сения побочных эффектов не оправдались; 12,5-50 мг/сутки на 1 прием
утром) [155,197].
Лечение артериальной гипертензии при лактации
Для лечения АГ при лактации разрешены Р-АБ (метопролол и пропрано-
лол), ингибиторы АПФ (каптоприл и эналаприл). Также возможен прием
диуретиков (гидрохлоротиазид, хлорталидон, фуросемид, торасемид) и
а-АБ празозина, однако есть указания, что все они при использовании в
высоких дозах могут уменьшать образование грудного молока. Вопрос о
безопасности применения при лактации нифедипина и верапамила про-
должает обсуждаться (ряд специалистов считают их использование воз-
можным, однако компании-производители упоминают лактацию в числе
противопоказаний) [155].
Кормящим не следует рекомендовать прием: метилдофа, индапамида,
амилорида, спиронолактона, эплеренона, амлодипина, лерканидипина и
всехсартанов [197].
Глава 22
пертензивныи криз
Определение
Рекомендации по купированию ГК в Украине обновлены сразу двумя доку-
ментами, изданными в 2012 году:
• Приказом МЗ Украины №384 [46];
• Междисциплинарным консенсусом «Гипертензивные кризы» [25].
Под ГК понимают значительное, нередко внезапное повышение АД,
которое может сопровождаться развитием тяжелых сосудистых ос-
ложнений с поражением жизненно-важных органов и требует ургент-
ной помощи. Развитие ГК определяется не только абсолютными (относи-
тельными) цифрами АД, но также скоростью повышения АД и наличием
сопутствующих органных поражений [18,25].
К критериям ГК относят [18,25,61,155]:
• внезапное начало;
• значительное повышение АД (например, на 30% от исходных величин,
либо САД на 20-100 мм рт. ст., ДАД — на 10-50 мм рт. ст.);
• появление или усиление симптомов со стороны органов-мишеней.
Повышение САД до 240 мм рт. ст. или ДАД до 140 мм рт. ст. расцени-
вают как ГК независимо от того, появились ли симптомы со стороны
органов-мишеней или еще нет (ввиду опасности такого уровня АД для
больного) [46].
Патофизиология
Риск развития ГК повышается при [26,101]:
• неадекватной терапии АГ (нарушениях режима или отказе от приема ле-
карственных препаратов);
• остром эмоциональном дистрессе;
• интенсивном физическом и психоэмоциональном перенапряжении;
• остром алкогольном опьянении.
Здесь лишь кратко укажем, что острое повышение АД в ходе ГК (особенно
при наличии исходной несостоятельности сосудов) может сопровождать-
ся [18,25,61,155]:
• срывом ауторегуляции органного (церебрального, коронарного, пла-
центарного, др.) кровообращения;
• разрывом атеросклеротической бляшки с формированием внутрисосу-
дистого тромба и развитием острой ишемии;
• разрывом микроаневризмы (для церебрального кровотока) с образова-
нием геморрагических осложнений.
Чрезмерно агрессивное снижение АД в ходе купирования ГК — важный
фактор риска развития различных осложнений (обычный рекомендуемый
темп снижения АД — не быстрее, чем на 20-25% от исходного за первые
несколько часов лечения, см. далее для отдельных вариантов ГК) [48,109].
Классификация
В зависимости от наличия или отсутствия признаков острого или прогрес-
сирующего ПОМ ГК подразделяют на осложненные (требуется госпита-
лизация в стационар, лечение внутривенным введением препаратов, сни-
жение АД требуется начать в сроки до 1 часа) и неосложненные (госпи-
тализация не обязательна, лечение возможно пероральными или парен-
теральными препаратами, снижение АД — в сроки до нескольких часов)
[18, 25, 46, 61, 155]. К осложненным относят ГК на фоне ОКС, отека легких,
острой гипертензивной энцефалопатии, инфаркта мозга, внутричерепных
геморрагии, расслоения аорты, эклампсии, острого кровотечения, а также
ГК при феохромоцитоме [27,101].
Номенклатура цереброваскулярных осложнений при артери-
альной гипертензии
Приводим номенклатуру цереброваскулярных осложнений при АГ (мно-
гие из них могут развиваться на фоне ГК) [155]:
• ТИА (очаговые, общемозговые и менингеальные симптомы устраняются
в сроки <24 часов); в настоящее время для установления этого диагноза
требуется исключение малосимптомного инфаркта мозга по данным то-
мографических исследований;
• острая гипертензивная энцефалопатия (общемозговые и менингеаль-
ные симптомы устраняются в сроки <24 часов); в качестве синонима
иногда используют термин «острый менингоэнцефальный отек»;
• малый инсульт (очаговые, общемозговые и менингеальные симптомы
устраняются в сроки <3 недель); возможен также термин «обратимый
неврологический дефицит»;
• инфаркт мозга;
• геморрагический инсульт:
- субарахноидальные геморрагии;
- паренхиматозные геморрагии (гематомы, геморрагическое пропиты-
вание);
- субарахноидально-паренхиматозные геморрагии;
• подострая гипертензивная энцефалопатия;
• хроническая гипертензивная энцефалопатия (например, в результате
многократных лакунарных инсультов).
Лечебная тактика
при неосложненном гипертензивном кризе
Клинические проявления неосложненного ГК могут включать выраженную
головную боль, боль в области сердца, перебои в работе сердца, сердцеби-
ение, вегетативные нарушения (частое мочеиспускание, тремор, др.) [46].
Еще раз отметим, что при неосложненном ГК госпитализация не обязатель-
на, лечение возможно пероральными или парентеральными препаратами,
снижения АД следует достигнуть в сроки до нескольких часов.
Препараты для лечения неосложненного ГК могут включать:
• каптоприл (12,5-50 мг внутрь или сублингвально);
• празозин (0,5-2 мг внутрь; побочное действие — ортостатическая гипо-
тензия);
• пропранолол (20-40 мг внутрь);
• метопролол (50-100 мг внутрь или 5-10 мг внутривенно медленно);
• фуросемид (40-120 мг внутрь или внутримышечно/внутривенно);
• торасемид (10-40 мг внутрь или внутримышечно/внутривенно);
• клофелин (0,075-0,15 мг внутрь или 0,01 % 0,5-1,0 мл внутримышечно);
• дибазол (подход устаревший, лучше использовать указанные выше аль-
тернативы) [25,48, 50,155].
В рекомендациях европейских экспертов в качестве возможных препара-
тов для лечения неосложненных ГК также указывают амлодипин (5-10 мг
внутрь) ифелодипин (5-10 мг внутрь) [136].
Нифедипин короткого действия указан в качестве возможного подхода к ле-
чению неосложненного ГК в Приказе МЗ Украины №348 [46], однако указано,
что его безопасность трудно контролировать и при его применении повы-
шается риск мозговой и коронарной ишемии (Междисциплинарный кон-
сенсус «Гипертензивные кризы» [25] прямо запрещает его применение, как
и рекомендации большинства мировых кардиологических ассоциаций) [25].
Лечебная тактика
при осложненном гипертензивном кризе —
общие подходы
При осложненном ГК обязательно требуется госпитализация в стацио-
нар с возможностью оказания специализированной помощи (например,
ГК с ОКС — в отделение кардиореанимации, ГК с мозговым инсультом —
в специализированное инсультное отделение, ГК с ТИА — в неврологиче-
ское или терапевтическое отделение, ГК с расслоением аорты — в отде-
ление реанимации или сосудистой хирургии либо кардиохирургии, ГК с
ОПП — в отделение реанимации или гемодиализа) [46].
Лечение осложненного ГК проводят с использованием внутривенного вве-
дения препаратов, снижение АД требуется в сроки от нескольких минут до
1 часа (обычный темп снижения — около 25% от исходного уровня в тече-
ние первых нескольких часов) [25,48, 50,155].
Основные препараты для купирования осложненного ГК (все пред-
ставлены в Украине):
• нитроглицерин (5-100 мкг/мин);
• фуросемид (40-80 мг);
• торасемид (10-40 мг);
• метопролол (5-10 мг);
• лабеталол (болюс — 20-80 мг, затем инфузия — 1 -2 мг/мин);
• эналаприлат (болюс — 1,25-5 мг);
• урапидил (болюс — 25-50 мг);
• нитропруссид натрия (в широкой практике недоступен) [25,48,50,155].
Лечение отдельных вариантов осложненного
гипертензивного криза [25,48,50,155]
• ГК с острой гипертензивной энцефалопатией: цель — снижение АД
на 25% за 6 часов; препараты выбора — лабеталол и урапидил; не реко-
мендованы — нитропруссид, нифедипин.
• ГК с ОКС: начинать купирование при САД >160 мм рт. ст. или ДАД
>100 мм рт. ст.; цель — снижение АД на 20-30%; препараты выбора —
р-АБ, нитроглицерин; не рекомендованы — нитропруссид, эналаприлат,
нифедипин. Здесь же укажем, что при ОКС уровни АД >170/100 мм рт. ст.
являются противопоказанием для применения антитромботических
препаратов (аспирина, ингибиторов Р2У12-рецепторов тромбоцитов,
тромболитиков, антитромбиновых); при наличии ГК сначала следует
снизить АД до уровней <170/100 мм рт. ст., а затем уже решать вопрос о
применении антитромботиков.
• ГК с острой левожелудочковой недостаточностью (острым отеком
легких): цель — снижение АД на 20-30%. Препараты выбора: основ-
ные — нитроглицерин + петлевой диуретик, нитропруссид; альтерна-
тивные — урапидил, эналаприлат; не рекомендованы — Р-АБ.
• ГК с острым ишемическим инсультом [101]:
- с проведением тромболитической терапии (ретеплаза (rt-PA); тера-
певтическое окно составляет до 3 часов после начала проявлений):
начинать купирование при САД >185 мм рт. ст. или ДАД >110 мм
рт. ст.; цель — снижение и поддержание САД <185 мм рт. ст. и ДАД
<110 мм рт. т.; препараты выбора — лабеталол, эсмолол, эналаприлат,
нитроглицерин, урапидил; не рекомендован — нифедипин;
- без проведения тромболитической терапии: при САД <185 мм рт. ст.
или ДАД <120 мм рт. ст. — временно (на 24 часа) рекомендуют отме-
нить все антигипертензивные препараты или уменьшить их (эксперты
ESC указывают, что при таких уровнях АД антигипертензивную терапию
не следует проводить в течение первой недели после начала инсуль-
та). Медикаментозная антигипертензивная терапия резервируется
только для лиц с очень высокими уровнями АД. Начинать купирова-
ние ГК у таких больных рекомендуют при САД >220 мм рт. ст. или ДАД
> 140 мм рт. т.; цель — снижение АД не менее чем до 185/120 мм рт. ст.;
препараты выбора — лабеталол, эсмолол, эналаприлат, нитроглице-
рин, урапидил; не рекомендован — нифедипин.
• ГК с геморрагическим инсультом: начинать купирование при САД
>180 мм рт.ст.; при нормальном внутричерепном давлении цель — сни-
жение и поддержание САД <180 мм рт. ст. и ДАД < 110 мм рт. ст. в течение
24 часов; при повышенном внутричерепном давлении цель — сниже-
ние САД < 180 мм рт. ст. (для этих больных снижение САД до 140 мм рт. ст.
считают безопасным); препараты выбора — лабеталол, урапидил; не ре-
комендованы — нитропруссид, нифедипин.
• ГК с субарахноидальным кровотечением: начинать купирование при
САД >160 мм рт.ст.; цель до операции — снижение и поддержание САД
<140 мм рт. ст., цель после операции — поддержание САД <220 мм рт. ст;
препараты выбора — лабеталол, урапидил, всем — нимодипин для пре-
дупреждения вазоспазма; не рекомендованы — нитропруссид, нифедипин.
• ГК с расслоением аорты: начинать купирование при САД >120 мм рт. ст.;
цель — снижение САД до 100-120 мм рт. ст. за 10-15 минут (желательно
также снижение ЧСС <60 в минуту); препараты выбора — (5-АБ (метопро-
лол, эсмолол, лабеталол), при противопоказаниям к ним — верапамил
или дилтиазем; препараты 2-го ряда (при недостаточном эффекте) —
нитропруссид, никардипин, эналаприлат, урапидил; не рекомендовано
применение вазодилататоров до использования (J-АБ.
• ГК у лиц с интра- и послеоперационным кровотечением:
-в целом: начинать купирование при САД, превышающем исходный
дооперационный уровень более чем на 20%; цель — снижение АД на
10-15% или до 110 мм рт. ст. за 30-60 минут, снижение АД выполнять на
фоне умеренной инфузионной терапии; препараты выбора — урапи-
дил, лабеталол, эсмолол.
-при кардиохирургическом вмешательстве: начинать купирование
при АД > 140/90 мм рт. ст.; цель — снижение и поддержание САД
<140 мм рт. ст., ДАД <90 мм рт. ст.; препараты выбора — урапидил,
нитроглицерин, лабеталол, эсмолол, нитропруссид; не рекомендовано
применение ($-АБ при сопутствующей СН.
• ГК при беременности (эклампсия/ПЭ), см. гл. 21: начинать купирование
при САД >160 мм рт. ст. или ДАД > 105 мм рт. ст.; цель — поддержание
САД в пределах 140-160 мм рт. ст., ДАД — 90-105 мм рт. ст.; препараты
выбора — сульфат магния, лабеталол, урапидил, нитроглицерин, в по-
следнее время также — нитропруссид; не рекомендованы — ингибито-
ры АПФ [66,68, 70,155].
I
Список литературы
1. Алексанян Л.А. Олмесартан: доказанная высокая эффективность при артериальной гипертен-
зии. Клинический обзор / Л.А. Алексанян, Е.Г. Силина // Consilium Medicum. — 2011. — Т. 13,
№1. —С. 19-24.
2. Амосова Е.Н. Являются ли адреноблокаторы препаратами первого ряда для лечения артериаль-
ной гипертензии? / Е.Н. Амосова // Серце i судини. — 2013. — №2 (42). — С. 8-15.
3. Антигипертензивные и метаболические эффекты комбинации лерканидипина с различными
антигипертензивными препаратами в условиях повседневной клинической практики / А.Ф. Чи-
черо [и др.] // Кардиоваскулярная терапия и профилактика. — 2012. — Т. 11, №1. — С. 36-40.
4. Антиппертензивна ефективнкть фксованоТ комбшацм валсартану та амлодипшу (препарату
ексфорж) у паш'снлв з артер1альною ппертенз1€ю (результат багатоцентрового дослщження) /
Ю.М. Оренко [и др.] // Артер1альна ппертенз1я. — 2012. — №1 (21). — С. 2-11.
5. Арапов С.Д. Болезнь Иценко-Кушинга / [С.Д. Арапова и др.; под ред. И.И. Дедова, Г.А. Мельничен-
ко]. — Москва, 2011. — 411 с.
6. Артериальная гипертензия в 2014 г.: классификации, диагностика, лечение / А.И. Дядык [и др.] //
Новости медицины и фармации. — 2013. — №18 (472). — С. 26-31.
7. Артериальная гипертензия и синдром обструктивного апноэ сна: резистентность к лечению и
роль дисфункции вегетативной нервной системы / В.В. Ростороцкая [и др.] // Кардиоваскуляр-
ная терапия и профилактика. — 2012. — Т. 11, №5. — С. 11 -17.
8. Артериальная гипертензия и системные метаболические нарушения в патогенезе гипертониче-
ской болезни / В.Н. Коваленко [и др.] // Журнал НАМИ УкраТни. — 2012. — Т. 18, №1. — С. 40-54.
9. Артер1альна ппертенз1я. Оновлена та адаптована клш1чна настанова, заснована на доказах /
В.З. Нетяженко, Т.М. Амбросова, I.M. Пдзинська [та ш.] // Артер1альна ппертенз1я. — 2012. — №1
(21). —С. 1-129.
10. Багрий A3. Антигипертензивная эффективность и переносимость фиксированной комбина-
ции рамиприла и гидрохлоротиазида (характеристика протокола и предварительные данные
многоцентрового проспективного исследования СТАРТ) / A3. Багрий, Ю.Н. Сиренко, Г.В. Дзяк //
УкраТнський кардюлопчний журнал. — 2009. — №3. — С. 39-43.
11. Багрий A3. Место тиазидных диуретиков в лечении АГ практике / A3. Багрий // Здоровье Укра-
ины. — 2011. — №3 (18). — С. 35.
12. Барабаш О.С. Вплив комплексно!' терапм артер1альноТ ппертензм i3 застосуванням сарташв на
ремоделювання серця / О.С. Барабаш // УкраТнський медичний часопис. — 2013. — №1 (93). —
С. 111-114.
13. Барбараш О.Л. Современные возможности медикаментозной терапии артериальной гипертен-
зии. Место кандесартана / О.Л. Барбараш, В.В. Кашталап // Системные гипертензии. — 2013. —
Т. 10, №4. —С. 55-58.
14. Барышникова Г.А. Диуретики при артериальной гипертонии: фокус на торасемид / Г.А. Барыш-
никова, И.И. Степанова // Системные гипертензии. — 2012. — Т. 9, №4. — С. 11 -16.
15. Барышникова Г.А. Роль ингибиторов ангиотензинпревращающего фермента в лечении артери-
альной гипертензии: фокус на лизиноприл / Г.А. Барышникова, И.И. Степанова, Н.В. Чупрова //
Лечащий врач. — 2013. — №2. — С. 13.
16. Ыловол О.М. Змши метабол1чних показнимв пщ впливом комбшованоТ антиппертензивноТ те-
рапм на тш цукрового д1абету 2 типу / О.М. Бтовол, В.В. Школьник, А.О. Андреева // Галиц. л1кар.
BicH. — 2012. — Т. 19, №2. — С. 5-7.
17. Бтовол О. М. Роль порушення вуглеводного та лтщного o6mjhjb у формуванш метабол1чних
зм1н у хворих на ппертокпчну хворобу з цукровим д1абетом 2 типу а Тх корекщя за допомогою
комбшаци JHri6iTopiB АПФ та лазидопод16них д1уретик1в / О. М. Бтовол, В. В. Школьник, А. О. Ан-
дреева // УкраТнський терапевтичний журнал. — 2011. — №3. — С. 34-37.
18. Боровков, Н. Н. Гипертонические кризы в клинической практике : учебное пособие / Н. Н. Боров-
ков, В. П. Носов, Н. В. Аминева; Нижегородская гоС. мед. акад. — Нижний Новгород, 2012. — 408 с.
19. Бухонкина Ю. М. Артериальная гипертензия и беременность: актуальные аспекты / Ю. М. Бухон-
кина // Здравоохранение Дальнего Востока. — 2010. — №2. — С. 73-78.
20. Бухонкина Ю. М. Изменение плодово-плацентарно-маточного кровотока и эндотелиальная дис-
функция у беременных с артериальной гипертензией / Ю. М. Бухонкина, Р. И. Бухонкина //Диаг-
ностическая и интервенционная радиология. — 2010. — Т. 4, №2. — С. 9-14.
21. Варунмв Н. Б. Ефективнкть застосування карведтолу у хворих з перенесеним шфарктом мю-
карда та артер1альною ппертензкю / Н. Б. Варунмв // Галиц. л1кар. вкн. — 2012. — Т. 19, №1. —
С. 13-16.
22. Визир В. А. Диабетическая нефропатия и реноваскулярные исходы артериальной гипертензии.
Роль хронической блокады ренин-ангиотензиновой системы / В. А. Визир, А. Е. Березин // Арте-
риальная гипертензия. — 2010. — №3. — С. 11-19.
23. Влияние терапии олмесартаном на показатели центрального аортального давления у больных ар-
териальной гипертензией / В. И. Целуйко [и др.] // Серце i судини. — 2013. — №2 (42). — С. 69-75.
24. Возможности применения олмесартана: результаты открытого проспективного исследования
ОРКЕСТР (Олмесартан (Кардосал) при артериальной гипертензии у больных с сахарным диабе-
том 2-го типа и микроальбуминурией) / А. Э. Багрий [и др.] // Новости медицины и фармации. —
2012. — №2 (тем. номер: «Кардиология»). — С. 11-14.
25. Гипертензивные кризы: диагностика и лечение. Консенсус ассоциации кардиологов Украины и
Украинской ассоциации по борьбе с инсультом. (Часть 2). Особенности коррекции артериального
давления при осложенных гипертензивных кризах в зависимости от поражения органа-мишени /
А. Н. Пархоменко [и др.] // Медицина неотложных состояний. — 2013. — №2(49). — С. 198-208.
26. Гипертонические кризы в кардиологии: место урапидила / Ж. Д. Кобалава [и др.] // Кардиоло-
гия. — 2012. — Т. 52, №1. — С. 86-90.
27. Гипертонический криз: патогенез, клиническая картина, лечение / Hypertensive crisis: pathogenesis,
clinic, treatment / А. Л. Верткин [и др.] // Кардиология. — 2013. — Т. 53, №6. — С. 66-70.
28. Гордиенко Б. В. Реноваскулярная артериальная гипертензия : учебное пособие / Б. В. Гордиен-
ко. — Москва, 2011. — 352 с.
29. Долженко М. Н. Лечение артериальной гипертензии у пациентов пожилого и старческого воз-
раста / М.Н. Долженко // Мистецтво люування. — 2011. — №5-6. — С. 16-26.
30. Достижение целевого уровня частоты сердечных сокращений покоя у пациентов со стабильной
стенокардией и артериальной гипертонией на фоне терапии [бета]-адреноблокаторами в ре-
альной клинической практике / Ж. Д. Кобалава [и др.] // Кардиология. — Т. 53, №7. — С. 13-23.
31. Дядык А.И., Багрий A3. Артериальная гипертензия в современной клинической практике. До-
нецк : Норд-Пресс, 2006. — 322 с.
32. Елисеев О. М. Оптимизация контроля уровня артериального давления. Какой вклад может дать
применение комбинаций фиксированных доз ингибиторов ангиотензинпревращающего фер-
мента и блокаторов кальциевых каналов / О. М. Елисеев // Терапевтический архив. — 2011. —
Т. 83, №5. — С. 70-75.
33. Ефективнкть i переносимкть фтсованоТ комбшаци S(-) амлодипш/аторвастатин у пацктчв з
артер!альною ппертензкю високогосерцево-судинного ризику/Л. Г. Воронков [та ш.] //УкраТн-
ський медичний часопис. — 2013. — №1 (93). — С. 73-75.
34. Ефективнкть унвфвкованого покрокового алгоритму лвкування для забезпечення контро-
лю артер1ального тиску у хворих з артер!альною ппертензкю в амбулаторнш практицк
результати дослвдження ПЕРФЕКТ / К. М. Амосова [та ш.] // Серце i судини. — 2014. — №1
(45). — С. 34-44.
35. Канорский С. Г. Блокаторы ренин-ангиотензин-альдостероновой системы в лечении артериаль-
ной гипертензии: классика против модерна / С. Г. Канорский // Кардиология. — 2013. — Т. 53,
№10. —С. 89-95.
36. Карпов Ю. А. Новые Российские рекомендации по артериальной гипертонии — приоритет
комбинированной терапии / Ю. А. Карпов // Терапевтический архив. — 2012. — Т. 83, №1. —
С 61-64.
37. Класиф1кац1я хвороб сечовоТ системи та морфолопчна класиф1кац1я хвороб нирок для нефро-
лопчноТ практики //УкраТнський журнал нефрологи та д1ал1зу. — 2010. — №2 (26). — С. 2-12.
38. Козиолова Н. А. Тендерные особенности развития и течения ортостатической гипотензии у боль-
ных гипертонической болезнью пожилого и старческого возраста / Н. А. Козиолова, Н. Ю. Петро-
ва // Проблемы женского здоровья. — 2011. — Т. 6, №3. — С. 31-36.
39. Косарев В. В. Рациональная фармакотерапия артериальной гипертензии и ассоциированных
состояний: место ингибиторов АПФ / В. В. Косарев, С. А. Бабанов // Русский медицинский жур-
нал. — 2013. — Т. 21, №9. — С. 441-447.
40. Котова О. В. Гипертензивная энцефалопатия: патогенез и общие принципы профилактики /
О. В. Котова, Е. С. Акарачкова // Фарматека. — 2010. — №12. — С. 66-71.
41. Ливенцева М. М. Виды рефрактерности к антигипертензивной терапии и возможные пути ее пре-
одоления / М. М. Ливенцева // УкраТнський медичний часопис. — 2013. — №4 (96). — С. 79-82.
42. Лутай М. И. Ведение больных с ишемической болезнью сердца и сопутствующей артериальной
гипертензией в Украине, результаты исследования престиж / М. И. Лутай // Украинский кардио-
логический журнал. — 2011. — №1. — С. 25-36.
43. Максимов М. Л. Клиническая эффективность блокатора медленных кальциевых каналов треть-
его поколения лерканидипина в лечении больных артериальной гипертонией / М. Л. Максимов,
А. И. Малыхина // Кардиология. — 2013. — Т. 53, №6. — С. 85-90.
44. Методика оптимизации клинического и параклинического обследования больных вазоренальной
гипертензией, и изменения гемостаза при этом заболевании / Б. И. Воробьёв [и др.] // Между-
народный журнал прикладных и фундаментальных исследований. — 2013. — №5. — С. 37-42.
45. Морозова Т. Е. Сартаны в лечении больных артериальной гипертензией высокого риска: возмож-
ности кандесартана / Т. Е. Морозова // Системные гипертензии. — 2013. — Т. 10, №2. — С. 13-18.
46. Наказ Мшктерства охорони здоров'я УкраТни вщ 24.05.2012 р. №384 «Про затвердження та
впровадження медико-технолопчних докуменлв 3i стандартизацм медичноТ допомоги при ар-
тер1альнш ппертензм. — Режим доступу: www.moz.gov.ua/ua/portal/dn_20120524_384.html
47. Недогода С. В. Диуретики при артериальной гипертензии: ангелы и демоны / С. В. Недогода //
Российский кардиологический журнал. — 2013. — №3 (101). — С. 62-66.
48. Недогода С. В. Место урапидила влечении гипертонических кризов с позиций клинической фармако-
логии и доказательной медицины / С. В. Недогода // Кардиология. — 2013. — Т. 53, №12. — С. 79-82.
49. Новые возможности терапии статинами при артериальной гипертензии / Е. М. Хурс [и др.] //
Рациональная фармакотерапия в кардиологии. — 2010. — Т. 6, №6. — С. 789-795.
50. Осложненные гипертонические кризы (клиника, диагностика и лечение) : учебное пособие /
[Н. Р. Палеев и др.]; М-во здравоохранения Московской обл., ГоС. бюджетное учреждение здра-
воохранения Московский обл. науч.-исслед. клинический ин-т им. М. Ф. Владимирского, Фак.
усовершенствования врачей. — Москва, 2012. — 235 с.
51. Оценка информативности определения активности ренина плазмы и прямого ренина при диа-
гностике первичного альдостеронизма / Н. П. Гончаров [и др.] // Проблемы эндокринологии. —
2012. —Т. 58, №5. —С. 21-27.
52. Первичный альдостеронизм (синдром Конна): основные сведения и собственное наблюдение /
Н. Т. Ватутин [и др.] // Украинский кардиологический журнал. — 2013. — №4. — С. 61-65.
53. Первичный альдостеронизм и резистентная артериальная гипертензия / Н. Э. Звартау [и др.] //
Артериальная гипертензия. — 2012. — Т. 18, №6. — С. 514-521.
54. Петрова Н. Ортостатическая гипотензия у больных гипертонической болезнью пожилого воз-
раста / Н. Петрова, Н. Козиолова // Врач. — 2012. — №3. — С. 71.
55. Предикторы артериальной гипертензии и профессия / Г. В. Артамонова [и др.] // Российский кар-
диологический журнал. — 2012. — №3. — С. 62-67.
56. Причины резистентности к терапии пациентов с неконтролируемой артериальной гипертензи-
ей: анализ работы специализированного центра / И. В. Емельянов [и др.] // Артериальная гипер-
тензия. — 2012. — Т. 18, №2. — С. 96-101.
57. Причины резистентности к терапии пациентов с неконтролируемой артериальной гипертензи-
ей: анализ работы специализированного центра / Емельянов [и др.] // Артериальная гипертен-
зия. — 2012. — Т. 18, №2. — С. 96-101.
58. Радченко А. Д. Некоторые аспекты применения дигидропиридиновых антагонистов кальция в
лечении артериальной гипертензии часть 1 / А. Д. Радченко // Артериальная гипертензия. —
2013. —№5(31). —С. 81-98.
59. Радченко А. Д. Нужна ли врачу в Украине стратификация риска пациентов с артериальной ги-
пертензией / А. Д. Радченко, И. М. Марцовенко, Ю. С. Сиренко // УкраТнський кардюлопчний
журнал. — 2009. — №5. — С. 7- 16.
60. Радченко А. Д. Почему мы боимся назначать бета-адреноблокаторы при артериальной гипер-
тензии? / А. Д. Радченко // Украинский кардиологический журнал. — 2013. — №4. — С. 66-90.
61. Рекомендацм УкраТнськоТ Асощацп кардюлопв з профилактики та л1кування артер1альноТ rinep-
тензм/ €.П. Свщенко, А. Е. Багрм, I. М. Горбась [та ш.]. — ТОВ «Б1знес Пол1граф», 2011. — 80 с.
61а. Рекомендацм Асощацм кардюлопв УкраТни з люування хрошчноТ серцевоТ недостатносп у
дорослих (перегляд 2011) / Воронков Л. Г., Амосова К. М., Багрш А. Е. [и др.] // Серцева недостат-
нкть. — 2011. — №1. — С. 101-116.
62. Роль дигидропиридиновых антагонистов кальция в лечении артериальной гипертензии [Текст] /
Г. А. Барышникова [и др.] // Трудный пациент. — 2012. — Т. 10, №12. — С. 4-9.
63. Роль системных метаболических нарушений в патогенезе гипертонической болезни и ее
исходов / В. Н. Коваленко [и др.] // УкраТнський кардюлопчний журнал. — 2011. — №2. —
С. 15-31.
64. Рязанцева Е. Е. Диуретики: особенности применения при отечном синдроме и артериальной ги-
пертензии / Е. Е. Рязанцева, А. В. Мелехов, Г. Е. Гендлин //Журнал сердечная недостаточность. —
2012. — Т. 13, №2. — С. 105-110.
65. Руководство по нефрологии / Под ред. А.ИДядыка, ЕАДядык. — К: Четверта хвиля, 2011. — 598 с.
66. Свищенко Е. П. Артериальная гипертензия / Е. П. Свищенко. — К.: МОРИОН, 2001. — 528 с.
67. Свищенко Е. П. Гипертоническая болезнь. Вторичные гипертензии / Е. П. Свищенко. — К. :
Либщь, 2002. — 504 с.
68. Серцево-судинш захворювання. Класифташ'я, стандарти д1агностики та л1кування; за ред.
В.М. Коваленка, M.I. Лутая, Ю.М. Оренка. — К.: ТОВ «Б1знес Пол1граф», 2010. — 96 с.
69. Сиренко Ю. Н. Влияние омега-3-полиненасыщенных жирных кислот на функциональные свой-
ства сосудов у больных артериальной гипертензией / Ю. Н. Сиренко, С. Н. Кушнир // УкраТнський
медичний часопиС. — 2012. №4. — С. 117-120.
70. Сиренко Ю. Н. Гипертоническая болезнь и артериальные гипертензии / Ю. Н. Сиренко. — До-
нецьк: Заславский А. Ю., 2011. — 352 с.
71. Сиренко Ю. Н. Симптоматические формы артериальной гипертензии / Ю. Н. Сиренко // УкраТнсь-
кий медичний часопиС. - 2008. — №3. — С.48-79.
72. Случай сочетания АКТГ-эктопического синдрома Иценко-Кушинга и феохромоцитомы / 3. Р. Ша-
фигуллина [и др.] // Российский семейный врач. — 2013. — Т. 17, №4. — С. 43-46.
73. Снижение риска развития побочных эффектов медикаментозной терапии артериальной ги-
пертензии ингибиторами апф и антагонистами кальция / Е. В. Слободенюк [и др.] // Вестник
Росздравнадзора. — 2013. — №3. — С. 36-38.
74. Сравнительная эффективность небиволола и бисопролола в плане влияния на центральное
артериальное давление и упруго-эластические свойства артерий у пациентов с мягкой и уме-
ренной артериальной гипертензией / Ю. Н. Сиренко [и др.] // Артериальная гипертензия. —
2013. —№1(27). —С. 9-19.
75. Сушинский В. Э. Опыт применения фиксированной комбинации ингибитора ангиотензинпре-
вращающего фермента и диуретика в лечении артериальной гипертензии / В. Э. Сушинский //
Международные обзоры: клиническая практика и здоровье. — 2013. — №5 (5). — С. 71-79.
76. Таратухин Е. О. Терапия артериальной гипертензии блокатором кальциевых каналов и ингиби-
тором АПФ. Преимущества комбинированной терапии / Е. О. Таратухин // Российский кардиоло-
гический журнал. — 2013. — №3 (101). — С. 100-103.
77. Терапия комбинацией «Амлодипин 10 мг + вальсартан 160 мг» снижает артериальное давление
у пациентов с артериальной гипертензией, не контролируемой комбинацией «ингибитор анги-
отензинпревращающего фермента + блокатор кальциевых каналов» / P. Trenkwalder [и др.] //
Артериальная гипертензия. — 2012. — №2. — С. 9-17.
78. Торасемид — эффективный петлевой диуретик для терапии артериальной гипертензии / Д. В.
Преображенский [и др.] // Кардиология. — 2011. — Т. 51, №4. — С. 67-73.
79. Трисветова Е. Л. Нефропротекция ингибитором ангиотензинпревращающего фермента лизино-
прилом при артериальной гипертензии / Е. Л. Трисветова // Международные обзоры: клиниче-
ская практика и здоровье. — 2013. — №4. — С. 85-95.
80. Федорова О. А. Блокада ренин-ангиотензин-альдостероновой системы у пациентов с высоким
кардиоваскулярным риском и коморбидными состояниями. Линотор / О. А. Федорова // УкраТн-
ський медичний часопис. — 2013. — №3 (95). — С. 87-94.
81. Феохромоцитома/параганглиома: клинико-генетические аспекты / М. Ю. Юкина [и др.] // Про-
блемы эндокринологии. — 2013. — Т. 59, №3. — С. 19-26.
82. Хабибулина М. М. Влияние ингибитора ангиотензинпревращающего фермента лизиноприла на
состояние сосудистого русла у женщин с артериальной гипертензией в период пременопаузы /
М. М. Хабибулина // Кардиология. — 2013. — Т. 53, №2. — С. 38-42.
83. Халимова 3. Ю. Артериальная гипертензия надпочечникового генеза при различных объемных
образованиях и заболеваниях, частота, этиология, диагностика, лечение (обзор литературы) /
3. Ю. Халимова, Ю. М. Урманова, 3. Д. Эгамбердиева // Международный эндокринологический
журнал. — 2013. — №8 (56). — С. 40-48.
84. Черная Ю. А. Ортостатические реакции артериального давления и клинические показатели кро-
вообращения у пациентов с постоянной формой фибрилляции предсердий на этапах терапии
бета-адреноблокаторами / Ю. А. Черная, Н. И. Яблучанский, Л. А. Мартимьянова // Експеримен-
тальна i клш1чна медицина. — 2011. — №3. — С. 70-74.
85. Чихладзе Н. М. Возможности дигидропиридинового блокатора кальциевых каналов фелодипина в
обеспечении органопротекции и снижении риска сердечно-сосудистых осложнений у больных ар-
териальной гипертензией / Н. М. Чихладзе // Системные гипертензии. — 2012. — №3. — С. 18-22.
86. Чубучна 1.1. Використання р-адреноблокатор1в та шпбггор1в анпотензинперетворюючого фер-
менту зметою корекцм ендотел1альноТфункцм/1.1. Чубучна,3.0. Гук-Лешневська//УкраТнський
кардюлопчний журнал. — 2010. — №5. — С. 90-95.
87. Эффективность и безопасность лозартана и комбинации лозартана и амлодипина в терапии артери-
альной гипертензии / С. А. Бойцов [и др.] // Клиническая медицина. — 2013.—Т. 91, №12. — С. 53-56.
88. Эффективность лечения на основе препарата Лориста HD-лозартан 100 мг + гидрохлортиазид
25 мг в сравнении с комбинацией бисопролол 10 мг + гидрохлортиазид 25 мг у пациентов с уме-
ренной и тяжелой артериальной гипертенией: исследование ЭЛИЗА / [А. В. Радченко, К. В. Михе-
ева, Ю. Н. Сиренко и др.]. — Донецк: Заславский А.Ю., 2011. — 64 с.
89. Юзвишина О. В. Вплив р1зних BapiaHTiB терапм аторвастатином на розвиток серцево-судинних
ускладнень при тривалш терапм у паш'енлв з ппертошчною хворобою та кальцинозом клапашв
серця / О. В. Юзвишина // Омейна медицина. — 2013. — №2. — С. 136-139.
90. Яковлев В. М. Изолированная систолическая артериальная гипертензия в пожилом возрасте
(патогенез, клиника, лечение) / В. М. Яковлев, А. В. Ягода. — Ставрополь, 2012. — 321 с.
91. A community health worker intervention to improve management of hypertension among Filipino
Americans in New York and New Jersey: a pilot study / R. A. Ursua [et al.] // Ethn. Dis. — 2014. —
Vol. 24, №1. —P. 67-76.
92. A controlled trial of renal denervation for resistant hypertension / Bhatt D.L, Kandzari D.E., O'Neil W.W.
[et al.] // N. Engl. J. Med. — 2014. — Vol. 370. — P. 1393-1401.
93. A prospective study of the prevalence of primary aldosteronism in 1,125 hypertensive patients / Rossi
G P. [et al.] // J. Amer. Coll. Cardiol. — 2006. — Vol. 48. — P. 2293-2300.
94. ACC/AHA Guideline on the Treatment of Blood Cholesterol to Reduce Atherosclerotic Cardiovascular
Risk in Adults [Электронный ресурс] / NJ. Stone, J. Robinson, A.H. Lichtenstein [et al.] //J. Amer. Coll.
Cardiol. — 2013. — Режим доступа: doi:10.1016/j.jacc.2013.11.002.
95. Accuracy of diagnostic tests for Cushing's syndrome: A systematic review and meta-analyses / Elamin
M. B. [et al.] // J. Clin. Endocrinol. Metab. — 2008. — Vol. 93, №.5. — P. 1553-1562.
96. ACT Study Investigators. Adapting hypertension self-management interventions to enhance their
sustained effectiveness among urban African Americans // Ameling J.M. Fam. Community Health. —
2014. — Vol. 37, №2. — P. 119-133.
97. Acute cardiomyopathy and multiorgan failure in a patient with pheochromocytoma and
neurofibromatosis type 1 / R. Ahmed [et al.] //J. Pak. Med. Assoc. — 2014. — Vol. 64, №2. — P. 214-216.
98. Adler S. Diabetic nephropathy: Linking histology, cell biology, and genetics / S. Adler // Kidney Int. —
2004. — Vol. 66. — P. 2095-2106.
99. Adrenocortical cancer: Pathophysiology and clinical management / Libe R. [et al.] // Endocrinol. Relat.
Cancer. — 2007. — Vol. 14. — P. 13-28.
100. Adverse perinatal outcomes and risk factors for preeclampsia in women with chronic hypertension:
A prospective study / Chappell L С [et al.] // Hypertension. — 2008. — Vol. 51. — P. 1002-1009.
101. AHA/ASA Guidelines for the Management of Patients with Acute Ischemic Stroke / E.C. Jauch, J.LSaver,
H.P. Adams [et al.] // Copyright AHA. — 2013. — 64P.
102. Aliskiren combined with losartan in type 2 diabetes and nephropathy / Parving H. H. [et al.] // N. Engl.
J. Med. — 2008. — Vol. 358. — P. 2433-2446.
103. American Association of Clinical Endocrinologists and American Association of Endocrine Surgeons
Medical Guidelines for the Management of Adrenal Incidentalomas / M.A. Zeiger, G.B.Thompson, Q.-Y.
Duh [et al.] // Endocrine Pract. — 2009. — Vol 15 (Suppl. 1). — P. 1 -20.
104. Antihypertensive medication use during pregnancy and the risk of cardiovascular malformations /
Caton A. R. [et al.] // Hypertension. — 2009. — Vol. 54. — P. 63-70.
105. Antiproteinuric response to dual blockade of the renin-angiotensin system in primary
glomerulonephritis: Meta-analysis and metaregression / Catapano F. [et al.] //Amer. J. Kidney Dis. —
2008. — Vol. 52. — P. 475-485.
106. Antman E. M. Clinical practice guidelines for chronic cardiovascular disorders: a roadmap for the
future / E. M. Antman, M. Jessup // J. Amer. Med. Ass. — 2014. — Vol. 311, №12. — P. 1195-1196.
107. Aursulesei V. Resistant hypertension: the role of interventional therapy /V. Aursulesei // Rev. Med. Chir.
Soc. Med. Nat. lasi. — 2013. — Vol. 117, №1. — P. 127-136.
108. Bakris G L The message for World Kidney Day 2009: Hypertension and kidney disease: A marriage that
should be prevented / G L. Bakris, E. Ritz // Kidney Int. — 2009. — Vol. 75. — P. 449-452.
109. Barton M. Postmenopausal Hypertension: Mechanism and Therapy / M. Barton, M. R. Meyer //
Hypertens. — 2009. — Vol. 54. — P. 11 -18.
110. Bartorelli A. L Contrast-induced nephropathy / A. L. Bartorelli, G. J. Marenzi // Interven. Cardiol. —
2008. — Vol. — 21. — P. 74-85.
111. Berl T. Maximizing inhibition of the renin-angiotensin system with high doses of converting enzyme
inhibitors or angiotensin receptor blockers/T. Berl // Nephrol. Dial. Transplant. — 2008. — Vol. 23. —
P. 2443-2447.
112. Berns J S. Viral nephropathies: Core curriculum 2008 / J S. Berns, R D. Bloom // Amer. J. Kidney Dis. —
2008. — Vol. 52. — P. 370-381.
113. Beta-blockers in the management of chronic kidney disease / Bakris GL [et al.] // Kidney Int. —
2006. — Vol. 70. — P. 1905-1913.
114. Blood pressure control and adherence/attachment in hypertensive users of primary health care /
С S. Silva [et al.] // Rev. Esc. Enferm. USP. — 2013. — Vol. 47, №3. — P. 584-590.
115. Blood pressure control, drug therapy, and kidney disease / Contreras G. [et al.] // Hypertension. —
2005. — Vol. 46, №.1. — P. 44-50.
116. Bogaert Y E. Assessing the benefits and harms of statin treatment in patients with chronic kidney
disease /YE. Bogaert, M. Chonchol // Nat. Clin. Pract. Nephrol. — 2008. — Vol. 4. — P. 470-471.
117. Campos-Outcalt D. The new cardiovascular disease prevention guidelines: what you need to know /
D. Campos-Outcalt // J. Fam. Pract. — 2014. — Vol. 63, №2. — P. 89-93.
118. Case Detection, Diagnosis, and Treatment of Patients with Primary Aldosteronism: An Endocrine
Society Clinical Practice Guideline /J.W. Funder, R.M. Carey, С Fardella [et al.] //J. Clin. Endocrinology
& Metabolism. — 2008. — Vol. 93, №9. — P. 3266-3281.
119. Chonchol M. Diagnosis and management of ischemic nephropathy / M. Chonchol, S. Unas // Clin. J.
Amer. Soc Nephrol. — 2006. — Vol. 1. — P. 172-181.
120. Chow С. К. Prevention and control of hypertension in different countries — reply / С. К. Chow, R. Yusuf,
R. Kelishadi // J. Amer. Med. Ass. — 2014. — Vol. 311, №4. — P. 419-420.
121. Chronic kidney disease is common: What do we do next? / Coresh J. [et al.] // Nephrol. Dial.
Transplant. — 2008. — Vol. 23. — P. 1122-1125.
122. Chronic kidney disease: Early identification and management of chronic kidney disease in adults in
primary and secondary care. — 2008. — [Электронный ресурс]. — Режим доступа: www.nice.org.
uk/accreditation.
123. Clinical Practice Guidelines for the Management of Hypertension in the Community A Statement by
the American Society of Hypertension and the International Society of Hypertension. / Weber M.A.
[et al.] //J.CIin.Hypertens. — 2013. — [Электронный ресурс]. — Режим доступа: www.ash-us.org/
documents/ASH_ISH-Guidelines_2013.pdf
124. Cruickshank J. 0-blocker therapy for patients with hypertension / J. Cruickshank // J. Amer. Med.
Ass. — 2014. — Vol. 311, №8. — P. 862.
125. Cushing's syndrome and Cushing's disease your questions answered. — The Pituitary Society. —
2013. —9 P.
126. Cushing's syndrome / Newell-Price J. [et al.] // Lancet. — 2006. — Vol. 367, №9522. — P. 1605-1617.
127. deMast Q.The prevalence of artherosclerotic renal artery stenosis in risk groups: A systemic literature
review / Q. de Mast, J. Beutler // J. Hypertens. — 2009. — Vol. 27. — P. 1333-1340.
128. Diagnosis and complications of Cushing's syndrome: A consensus statement / Arnaldi G. [et al.] // J.
Clin. Endocrinol. Metab. — 2003. — Vol. 88, №.12. — P. 5593-5602.
129. Diez J. Effects of aldosterone on the heart: Beyond systemic hemodynamics? /J. Diez// Hypertension. —
2008. — Vol. 52. — P. 462-464.
130. Effect of inhibitors of the renin-angiotensin system and other antihypertensive drugs on renal
outcomes: Systematic review and meta-analysis / Casas J.P. [et al.] // Lancet. — 2005. — Vol. 366. —
P. 2026-2033.
131. Effect of Lisinopril on the progression of renal insufficiency in mild proteinuric non-diabetic
nephropathies / G. A. Cinotti, P. С Zucchelli, Collaborative Study Group // Nephrol. Dial. Transplant. —
2001. — Vol. 16, №5. — P. 961-966.
132. Effect of low-dose perindopril/indapamide on albuminuria in diabetes: Preterax in Albuminuria
Regression: PREMIER / Mogensen С E. [et al.] // Hypertension. — 2003. — Vol. 41. — P. 1063-1071.
133. Effect of spironolactone on blood pressure in subjects with resistant hypertension / Chapman N. [et
al.] // Hypertension. — 2007. — Vol. 49. — P. 839-845.
134. Effect of telmisartan on renal outcomes: A randomized trial / Mann J.F. [et al.] // Ann. Intern. Med. —
2009. —Vol.151. —P. 1-2.
135. Elias M. F. Comment on optimal treatment for resistant hypertension: the missing data on pulse wave
velocity / M. F. Elias, K. J. Sullivan // Hypertension. — 2014. — Vol. 63, №3. — P. 16.
136. ESH/ESC Guidelines for the management of arterial hypertension. The Task Force for the
management of arterial hypertension of the European Society of Hypertension (ESH) and of the
European Society of Cardiology (ESC) / G. Mancia, R. Fagard, K. Narkiewicz [et al.] // J. Hypertens. —
2013. —Vol.31. —P. 1281-1357.
137. Evidence-Based Guideline for the Management of High Blood Pressure in Adults Report From the
Panel Members Appointed to the Eighth Joint National Committee (JNC 8) / P.A. James, S. Oparil,
B.L. Carter [et al.] // J. Amer. Med. Ass. — 2014. — [Электронный ресурс]. Режим доступа: http://
www.haoyisheng.com/upload/2014JNC8.pdf.
138. Expectant management of severe preeclampsia at less than 27 weeks' gestation: Maternal and
perinatal outcomes according to gestational age by weeks at onset of expectant management /
Bombrys A E. [et al.] // Amer. J. Obstet. Gynecol. — 2008. — Vol. 199. — P. 247-256.
139. Ferrari P. Forms of mineralocorticoid hypertension / P. Ferrari, 0. Bonny // Vitam. Horm. — 2003. —
Vol.66. —P. 113-156.
140. Fibromuscular dysplasia / Plouin P. F. [et al.] // Orphanet. J. Rare Dis. — 2007. — Vol. 2. — P. 28.
141. Findling J W. Cushing's Syndrome: Important issues in diagnosis and management / J W. Findling, H.
Raff//J. Clin. Endocrinol. Metab. — 2006. —Vol. 91, №10. — P. 3746-3753.
142. First-trimester risk factors for preeclampsia development in women initiating aspirin by 16 weeks of
gestation / D. M. Block-Abraham [et al.] // Obstet. Gynecol. — 2014. — Vol. 123, №3. — P. 611 -617.
143. Freedman В I. Hypertension-associated kidney disease: Perhaps no more / В I. Freedman, J R. Sedor//
J. Amer. Soc. Nephrol. — 2008. — Vol. 19. — P. 2047-2051.
144. Gray R. Cardiovascular disease in the elderly / Gray R., Pack L // Oxford, 2011. — 320 P.
145. Grantham J. J. Clinical practice: Autosomal dominant polycystic kidney disease / J J. Grantham //
N. Engl. J. Med. — 2008. — Vol. 359. — P. 1477-1485.
146. Graves J W. Diagnosis and management of chronic kidney disease /J. W. Graves // Mayo Clin. Proc. —
2008. — Vol. 83. — P. 1064-1069.
147. Griffin К A. Progression of renal disease: Renoprotective specificity of renin-angiotensin system
blockade / К A. Griffin, A K. Bidani // Clin. J. Amer. Soc. Nephrol. — 2006. — Vol. 1. — P. 1054-1065.
148. Hypertension as an expression of the lack of the well-balanced life //J. Amer. Med. Ass. — 2014. —
Vol. 311, №5. —P. 530.
149. Hypertension in pregnancy. — medical management. — Clinical Guidelines King Edward Memorial
Hospital Perth Western Australia, 2014. — 19 P.
150. Hypertension in pregnancy / Lindheimer M D. [et al.] // J. Clin. Hypertens. — 2009. — Vol. 11, №4. —
P. 214-225.
151. Hypertension in pregnancy. The management of hypertensive disorders during pregnancy. —
2011. — [Электронный ресурс]. — Режим доступа: www.nice.org.uk/CG107.
152. Hypertension. Clinical management of primary hypertension in adults. — 2011. — [Электронный
ресурс]. — Режим доступа: www.nice.org.uk/guidance/CG127.
153. IgA nephropathy in children and adults: Comparison of histologic features and clinical outcomes /
Haas M. [et al.] // Nephrol. Dial. Transplant. — 2008. — Vol. 23. — P. 2537-2545.
154. Isometric exercise training for blood pressure management: a systematic review and meta-analysis /
D. J. Carlson [et al.] // Mayo Clin. Proc. — 2014. — Vol. 89, №3. — P. 327-334.
155. Kaplan's Clinical hypertension / Ed. by N.M.Kaplan, R.G.Victor, J.T.FIynn: 10th edition. — Lippincott
Williams & Wilkins, 2010. — 456 P.
156. Karavitaki N. Nonfunctioning pituitary adenomas: The consequences of a 'watch and wait' approach /
N. Karavitaki // Clin. Endocrinol. — 2007. — P. 1365-2265.
157. Karumanchi S A. Advances in the understanding of eclampsia / S. A. Karumanchi, M. D. Lindheimer //
Curr. Hypertens. ReP. — 2008. — Vol. 10. — P. 305-312.
158. KDIGO Clinical Practice Guideline for Acute Kidney Injury /J.A Kellum, N. Lameire, P. Aspelin [et al.] //
Kidney Inter. — 2012. — Vol. 2 (Suppl.). — P. 1 -138.
159. KDIGO Clinical Practice Guideline for Anemia in Chronic Kidney Disease / J.A Kellum, N. Lameire,
P. Aspelin [et al.] // Kidney Inter. — 2012. —Vol. 2 (Suppl.). — P. 279-335.
160. KDIGO Clinical Practice Guideline for Lipid Management in Chronic Kidney Disease / G. Eknoyan,
N.Lameire, Kai-Uwe Eckardt [et al.] // Kidney International. — 2013. — Vol. 3 (Suppl.). — P. 1-56.
161. KDIGO Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease / A.
Levin, P. E. Stevens, R.W. Bilous [et al.] // Kidney Inter. — 2012. —Vol. 3 (Suppl.). — P. 1-150.
162. KDIGO Clinical Practice Guideline for the Management of Blood Pressure in Chronic Kidney Disease /
J.A Kellum, N. Lameire, P. Aspelin [et al.] // Kidney Inter. — 2012. — Vol. 2 (Suppl.). — P. 337-414.
163. Lewis E J. Treating hypertension in the patient with overt diabetic nephropathy / E J. Lewis // Semin
Nephrol. — 2007. — Vol. 27. — P. 182-194.
164. Liu F. Tolerability and effectiveness of (S)-amlodipine compared with racemic amlodipine in
hypertension: A systemic review and meta-analysis / Liu R, Qiu M., Zhai S-D. // Current Therapeutic
Research. — 2010. — Vol. 71. — P. 1-29.
165. Luther J M. Blood pressure targets in hemodialysis patients / J M. Luther, T A. Golper // Kidney Int. —
2008. — Vol. 73. — P. 667-668.
166. Magnesium sulfate decreases cerebral perfusion pressure in preeclampsia / Belfort M.[et al.] //
Hypertens. Pregnancy. — 2008. — Vol. 27. — P. 315-327.
167. Major congenital malformations after first-trimester exposure to ACE inhibitors / Cooper W. O. [et al.] //
N. Engl. J. Med. — 2006. — Vol. 354. — P. 2443-2451.
168. Markun S. Blood pressure treatment is irrelevant immediately after ischemic stroke / S. Markun //
Praxis. — 2014. — Vol. 103, №5. — P. 291-292.
169. Mattsson С Primary aldosteronism: diagnostic and treatment strategies / Mattsson C, Young W.F. //
Nat. Clin. Pract. Nephrol. — 2006. — Vol. 2 (4). — P. 198-208.
170. Montalescot G. 2013 Guidelines on the management of stable coronary artery disease / Montalescot G. [et
al.] // Eur.Heart J. — 2013. — [Электронный ресурс]. Режим доступа: www.escardio.org/guidelines-sur-
veys/escguidelines/GuidelinesDocuments/2013_Stable_Coronary_Artery_Disease_web_addenda.pdf
170а. National Institute for Health and Clinical Excellence (NICE). Clinical management of primary hy-
pertension in adults / 2011 // [Электронный ресурс]. Режим доступа: www.nice.org.uk/nicemedia/
live/13561 /56008/56008.pdf
171. Opie L, Gersh B. Drugs for the heart // Elsevier, 2013. — 592 P.
172. Optimal dose of lisinopril for renoprotection in type 1 diabetic patients with diabetic nephropathy: a randomised
crossover trial / K. J. Schjoedt, A.S. Astrup, F.Persson [et al.] // Diabetologia. — 2009.—Vol. 52, №1. — P. 46-49.
173. Pacak K. Preoperative management of the pheochromocytoma patient / K. Pacak // J. Clin. Endocrinol.
Metab. — 2007. — Vol. 92. — P. 4069-4079.
174. Parker M. G. Resistant hypertension: Core Curriculum 2008 / M G. Parker // Amer. J. Kidney Dis. —
2008. — Vol. 52. — P. 796-802.
175. Pitt B. Spironolactone for Heart Failure with Preserved Ejection Fraction / Pitt B. [et al.] // N.EnglJ.Med. —
2014. — Vol. 370. — P. 1383-1392.
176. Pleiotropic effects of statins may improve outcomes in atherosclerotic renovascular disease / Silva V. S.
[et al.] // Amer. J. Hypertens. — 2008. — Vol. 21. — P. 1163-1168.
177. PodymowT. Update on the use of antihypertensive drugs in pregnancy /T. Podymow, P. August //
Hypertension. — 2008. — Vol. 51. — P. 960-969.
178. Prevalence and natural history of adrenal incidentalomas / Barzon L [et al.] // Eur. J. Endocrinol. —
2003. — Vol. 149. — P. 273-285.
179. Prevalence of primary hyperaldosteronism in resistant hypertension: a retrospective observational
study / Douma S. [et al.] // Lancet. — 2008. — Vol. 371. — P. 1921 -1926.
180. Prevention and treatment of diabetic renal disease in type 2 diabetes: The BENEDICT study / Remuzzi
G. [et al.] // J. Amer. Soc. Nephrol. — 2006. — Vol. 17. — P. 90-97.
181. Progression of atherosclerotic renovascular disease: A prospective population-based study / Pearce J
D. [et al.] // J. Vase. Surg. — 2006. — Vol. 44. — P. 955-962.
182. Rahman M. M. Prevention and control of hypertension in different countries / M. M. Rahman,
S. Gilmour // J. Amer. Med. Ass. — 2014. — Vol. 311, №4. — P. 418-419.
183. Ram С V. Fixed-dose triple-combination treatments in the management of hypertension / С V. Ram //
Manag. Care. — 2013. — Vol. 22, №12. — P. 45-55.
184. Randomised placebo-controlled trial of lisinopril in normotensive patients with insulin-dependent
diabetes and normoalbuminuria or microalbuminuria / N. Chaturvedi, J. Stevenson, J.H. Fuller [et al.] //
Lancet. — 1997. — Vol. 349. — P. 1787-1792.
185. Rationale and design of Faith-based Approaches in the Treatment of Hypertension (FAITH), a lifestyle
intervention targeting blood pressure control among black church members / K. J. Lancaster [et al.] //
Amer. Heart J. — 2014. — Vol. 167, №3. — P. 301-307.
186. Reninoma: Case report and literature review /Wong L [et al.] // J. Hypertens. — 2008.—Vol. 26. — P. 368-373.
187. Renoprotective effects of rennin-angiotensin-system inhibitors / De Zeeuw [et al.] // Lancet. —
2006. — Vol. 367. — P. 899-900.
188. Resolution of Page kidney-related hypertension with medical therapy: A case report / Myrianthefs
P. [et al.] // Heart Lung. — 2007. — Vol. 36. — P. 377-379.
189. Rooke T.W. 2011 ACCF/AHA Focused Update of the Guideline for the Management of Patients With
Peripheral Artery Disease (Updating the 2005 Guideline): A Report of the American College of
Cardiology Foundation/American Heart Association Task Force on Practice Guidelines / Rooke T.W.
[et al.] // Circulation. — 2011. — [Электронный ресурс]. Режим flOCTyna:www.circ.ahajoumals.org/
content/early/2011/09/29/CIR.0b013e31822e80c3.full.pdf
190. Risk factors for end-stage renal disease: 25-year follow-up / Hsu CY. [et al.] // Arch Intern. Med. —
2009. — Vol. 169. — P. 342-350.
191. Roberts J. M. Preeclampsia: New approaches but the same old problems / J. M. Roberts // Amer. J.
Obstet. Gynecol. — 2008. — Vol. 199. — P. 443-444.
192. Ruilope L. M. Long-term adherence to therapy: the clue to prevent hypertension consequences / L. M.
Ruilope // Eur. Heart J. — 2013. — Vol. 34. — P. 2931-2932.
193. Sarkar O. Paroxysmal hypertension / O. Sarkar, M. Baumann // MMW Fortschr Med. — 2013.—Vol. 155,
№20. —P. 44,46-47.
194. Schirpenbach С Primary aldosteronism: Current knowledge and controversies in Conn's syndrome /
С Schirpenbach, M. Reincke // Nat. Clin. Pract. Endocrinol. Metab. — 2007. — Vol. 3. — P. 220-227.
195. Schlondorff D. O. Overview of factors contributing to the pathophysiology of progressive renal
disease / D. O. Schlondorff// Kidney Int. — 2008. — Vol. 74. — P. 860-866.
196. Schmieder R. E. The potential role of prorenin in diabetic nephropathy / R. E. Schmieder // J.
Hypertens. — 2007. — Vol. 25. — P. 1323-1326.
197. Seely E.W. Chronic hypertension in pregnancy / E.W. Seely, J. Ecker // N. Engl. J. Med. — 2011. —
Vol.365. —P. 439-446.
198. Skybchyk V. A. Erectile dysfunction in patients with hypertension: hope of sartans / V. A. Skybchyk //
Артериальная гипертензия. — 2012. — №1 (21). — С. 17-22.
199. Slovut D. P. Fibromuscular dysplasia / D. P. Slovut, J. W. Olin // N. Engl. J. Med. — 2004. -Vol. 350. —
P. 1862-1871.
200. Solomon С G. Hypertension in pregnancy / С G. Solomon, E. W. Seely // Endocrinol. Metab. Clin. North.
Amer. — 2006. — Vol. 35, №1. — P. 157-171.
201. Stenting and medical therapy for atherosclerotic renal-artery stenosis / Cooper C.J., Murphy T.P., Cutlip
D.E. [et al.] // N. Engl. J. Med. — 2014. -Vol. 370., №1. — P. 13-22.
202. Stepwise increase in the prevalence of isolated systolic hypertension with the stages of chronic kidney
disease / Cheng LT. [et al.] // Nephrol. Dial. Transplant. — 2008. — Vol. 23, №.12. — P. 3895-3900.
203. «Subclinical Cushing's syndrome» is not subclinical: improvement after adrenalectomy in 9 patients /
Mitchell I. С [et al.] // Surgery. — 2007. — Vol. 142. — P. 900-905.
204. Task force on hypertension in pregnancy. The American College of Obstetricians and Gynecology /
J.M. Roberts, P. A. August, G. Bakris [et al.] //The American College of Obstetricians and Gynecology. —
2013. —100 p.
205. Textor S. Current approaches to renovascular hypertension / S. Textor // Med. Clin. North Amer. —
2009. —Vol.3. —P. 717-732.
206. The Diagnosis of Cushing's Syndrome: An Endocrine Society Clinical Practice Guideline / L.K. Nieman, В. M. K.
Biller, J. W. Findling [et al.] // J. Clin. Endocrinology & Metabolism. — 2008.—Vol. 93, №5. — P. 1526-1540.
207. The effect of renal denervation added to standard pharmacologic treatment versus standard
pharmacologic treatment alone in patients with resistant hypertension: rationale and design of the
SYMPATHY trial / E. E. Vink E. E. [et al.] // Amer. Heart J. — 2014. — Vol. 167, №3. — P. 308-314.
208. The Kidney. 9th ed. /Taal M.W., Chertow G.M., Marsden P. A. [et al]. // Brenner and Rector's, 2012. — 3064 P.
209. The management of CKD: a look into the future / Khwaja A. [et al.] // Kidney Int. — 2007. — Vol. 72. —
P. 1316-1323.
210. The North American Neuroendocrine Tumor Society Consensus Guideline for the Diagnosis and
Management of Neuroendocrine Tumors Pheochromocytoma, Paraganglioma, and Medullary Thyroid
Cancer / H.Chen, R.S. Sippel, S.O'Dorisio, [et al.] // Pancreas. — 2010. — Vol. 39, №6. — P. 775-783.
211. The pathogenesis of diabetic nephropathy / Dronavelli S. [et al.] // Nat. Clin. Pract. Endocrinol.
Metab. — 2008. — Vol. 4. — P. 444-452.
212. The risk of cardiovascular events in primary care patients following an episode of severe hypertension /
Ewen E. [et al.] // J Clin Hypertens. — 2009. — Vol. 11. — P. 175-182.
213. Tolerability and effectiveness of (S)-amlodipine compared with racemic amlodipine in hypertension:
A systematic review and meta-analysis / F. Liu, M.Qiu, Suo-Di Zhai // Review Current Therapeutic
Research. — 2010. — Vol. 71, №1. — P. 1 -29.
214. Treating elderly people with diabetes and stages 3 and 4 chronic kidney disease / Abaterusso С [et
al.] // Clin. J. Amer. Soc. Nephrol. — 2008. — Vol. 3. — P. 1185-1194.
215. Treatment of adrenocorticotropin-dependent Cushing's syndrome: A consensus statement / Biller B.
M. [et al.] // J. Clin. Endocrinol. Metab. — 2008. — Vol. 93, №.7. — P. 2454-2462.
216. TRIple pill vs Usual care Management for Patients with mild-to-moderate Hypertension (TRIUMPH):
Study protocol / A. Salam [et al.] // Amer. Heart J. — 2014. — Vol. 167, №2. — P. 127-132
217. Triple-combination treatment with olmesartan medoxomil/amlodipine/ hydrochlorothiazide in
Hispanic/Latino patients with hypertension: the TRINITY study / A. J. Lewin [et al.] // Ethn. Dis. —
2014. — Vol. 24, №1. — P. 41 -47.
218. Use of uterine artery Doppler ultrasonography to predict pre-eclampsia and intrauterine growth
restriction: a systematic review and bivariable meta-analysis / Cnossen J.S., Morris R.K., terRiet G. [et
al.] // Canad. Med. Ass. J. — 2008. — Vol. 178, №6. — P. 701 -711.
219. Varon J. Treatment of acute severe hypertension: current and newer agents / J. Varon // Drugs. —
2008. — Vol. 68. — P. 283-297.
220. WaeberB. Ambulatory blood pressure monitoring:essentialfordiagnosing and treating hypertension?/
B. Waeber, G. Wuerzner // Rev. Med. Suisse. — 2014. — Vol. 10, №412-413. — P. 57-60.
221. Washinger K. An integrated approach: hypertension management in patients with chronic kidney
disease/K.Washinger//Adv. NPs.PAs. — 2014. — Vol.5,№1. — P. 16-17.
222. Wireman Cook H. Chronic arterial hypertension / Cook H. Wireman // J. Amer. Med. Ass. — 2014. —
Vol.311, №14. — P. 1451.
223. Worksite wellness for the primary and secondary prevention of cardiovascular disease in Japan: the
current delivery system and future directions /T. Okamura [et al.] // Prog. Cardiovasc. Dis. — 2014. —
Vol. 56, №5. —P. 515-521.
224. Young W F. Editorial: Paraganglioma-all in the family / W. F.Young, A L Abboud // J. Clin. Endocrinol.
Metab. — 2006. — Vol. 91. — P. 790-792.
225. Young W F. Primary aldosteronism: Renaissance of a syndrome / W F. Young // Clin. Endocrinol. —
2007. — Vol. 66. — P. 607-618.
226. Young W F. What are the keys to successful adrenal venous sampling (AVS) in patients with primary
aldosteronism? / W F. Young, A W. Stanson // Clin. Endocrinol. — 2009. — Vol. 70. — P. 14-17.
227. Young W. F. Clinical practice: The incidentally discovered adrenal mass / W F. Young // N. Engl. J.
Med. — 2007. — Vol. 356. — P. 601-610.
228. Young W. F. Pheochromocytoma / W. F. Young // ASH Clinical Hypertension Review Course Syllabus,
American Society of Hypertension. — 2007. — P. 481 -494.
Авторский коллектив:
Александр Иванович Дядык, заведующий кафедрой внутренних болезней и общей
практики — семейной медицины УНИПО ДонНМУ им. М. Горького МЗ Украины,
заслуженный деятель науки и техники Украины, доктор медицинских наук, профессор;
Андрей Эдуардович Багрий, профессор кафедры внутренних болезней и общей
практики - семейной медицины УНИПО ДонНМУ им. М. Горького МЗ Украины,
доктор медицинских наук, профессор.
Рецензенты:
Ю.Н. Сиренко, заведующий отделом симптоматических гипертензий ГУ «ННЦ Институт
кардиологии им. акад. Н.Д. Стражеско» НАМИ Украины, доктор медицинских наук,
профессор;
В.В. Коломиец, профессор кафедры внутренней медицины №2 ДонНМУ им. М. Горького
МЗ Украины, доктор медицинских наук, профессор.
Рекомендовано к печати решением Ученого совета при ДонНМУ им. М. Горького
МЗ Украины (протокол №3 от 25.04.2014).
Артериальные гипертензий в современной клинической практике: 3-е из-
дание / А.И. Дядык, А.Э. Багрий. — К.: 000 «Люди в белом», 2014. — 206 с.
ISBN 978-966-97303-9-8
Третье издание книги, во многом переработанное и дополненное, обобщает совре-
менные вопросы диагностики и лечения артериальной гипертензий (АГ). Представлены
вопросы эпидемиологии и патогенеза АГ, подходы к классификации, оценке степе-
ни сердечно-сосудистого риска, принципы обследования пациентов, диагностики АГ.
Представлен ряд новых глав, посвященных диагностике и лечению симптоматических
АГ. Обсуждены взгляды на выбор антигипертензивной терапии при различных вариан-
тах АГ (включая лиц с АГ «белого халата», маскированной АГ, резистентной АГ, орто-
статической гипотензией, АГу беременных, кормящих, пожилых, пациентов с разными
видами гипертензивного криза); особое внимание уделено рассмотрению различных
групп лекарственных препаратов, используемых в лечении больных АГ.
Издание предназначено для врачей общей практики - семейной медицины, вра-
чей-терапевтов, кардиологов, нефрологов, врачей-интернов.
ISBN 978-966-97303-9-8
© А.И. Дядык,
А.Э. Багрий, 2014.