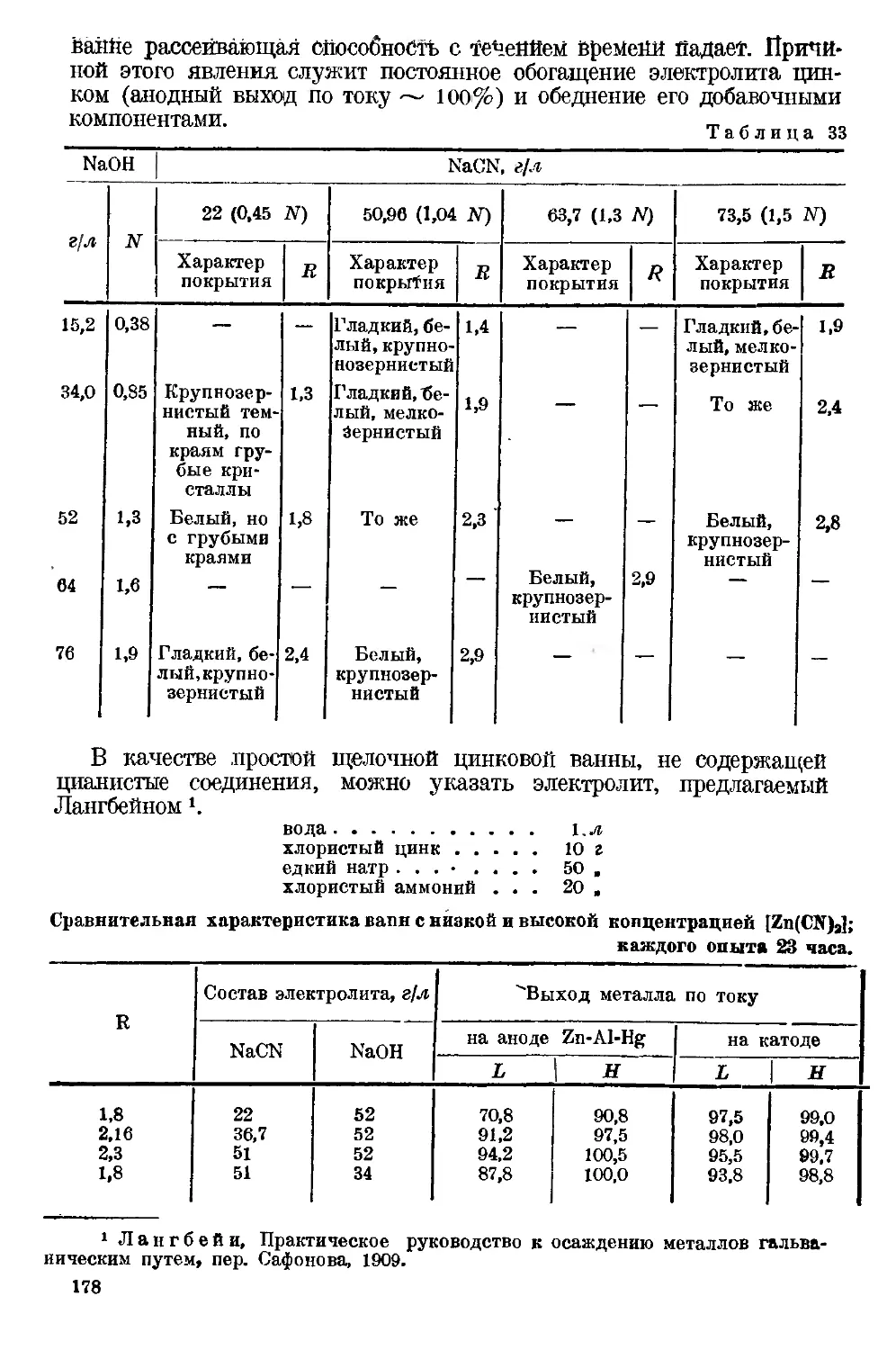
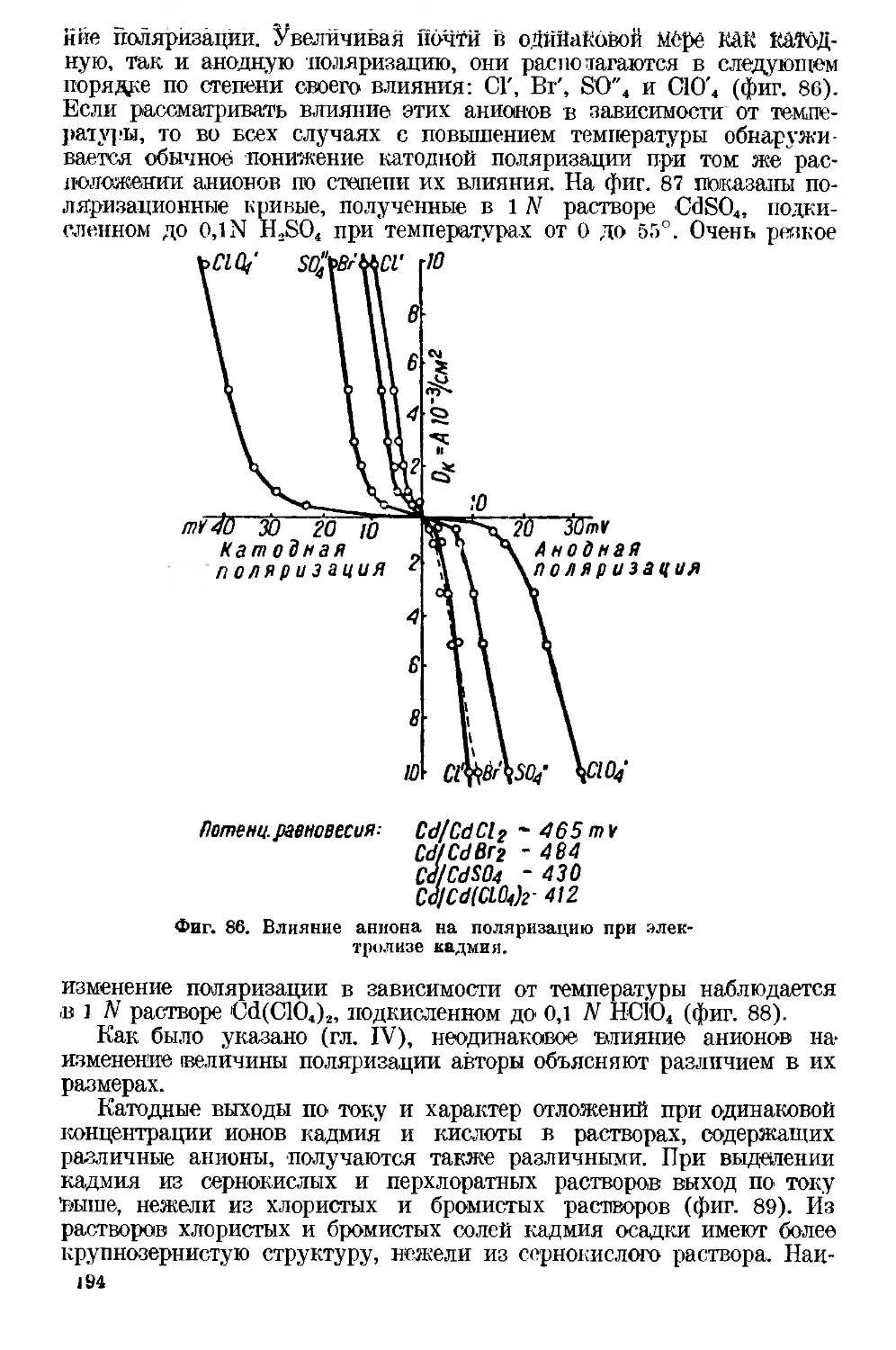
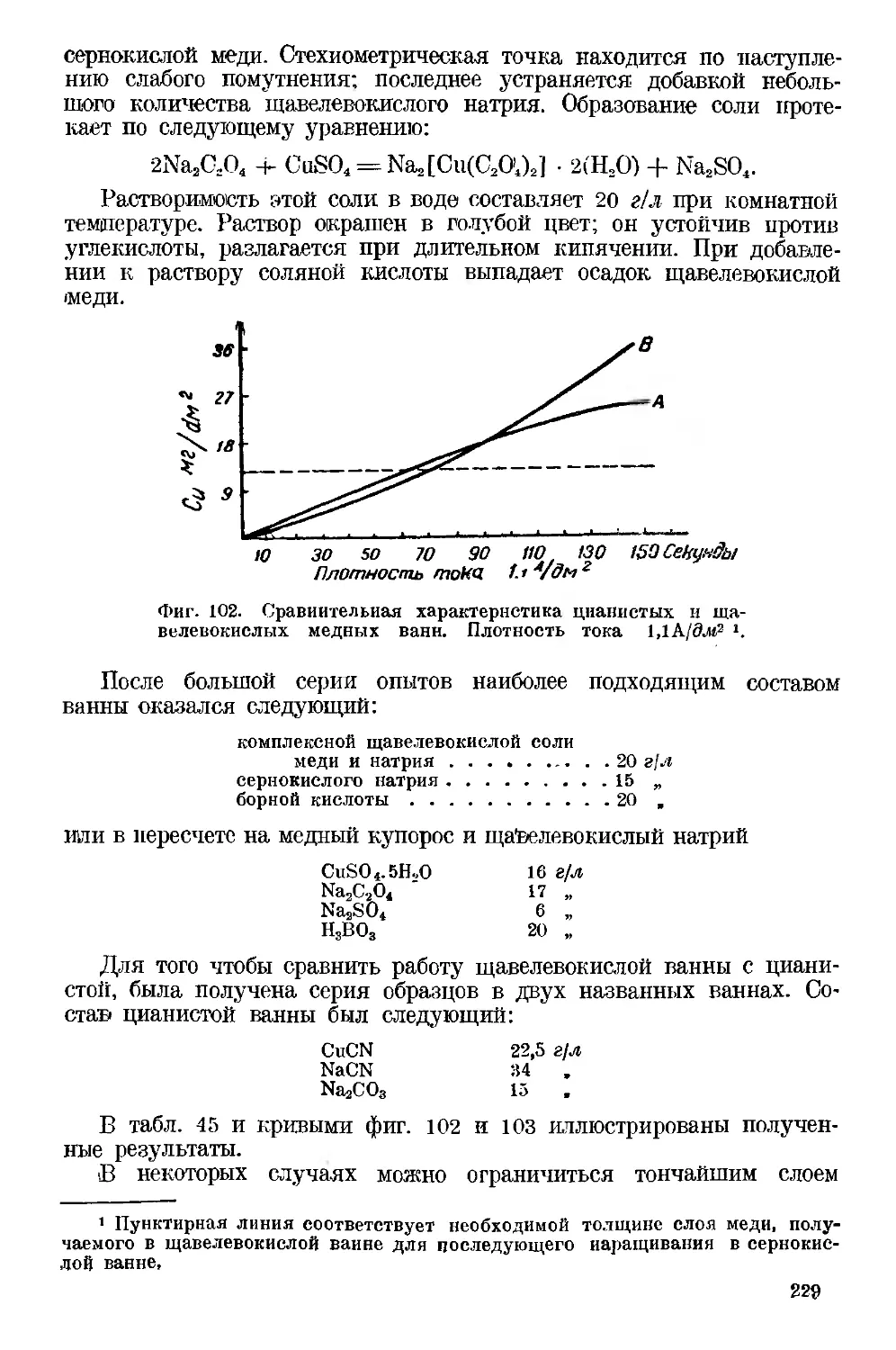
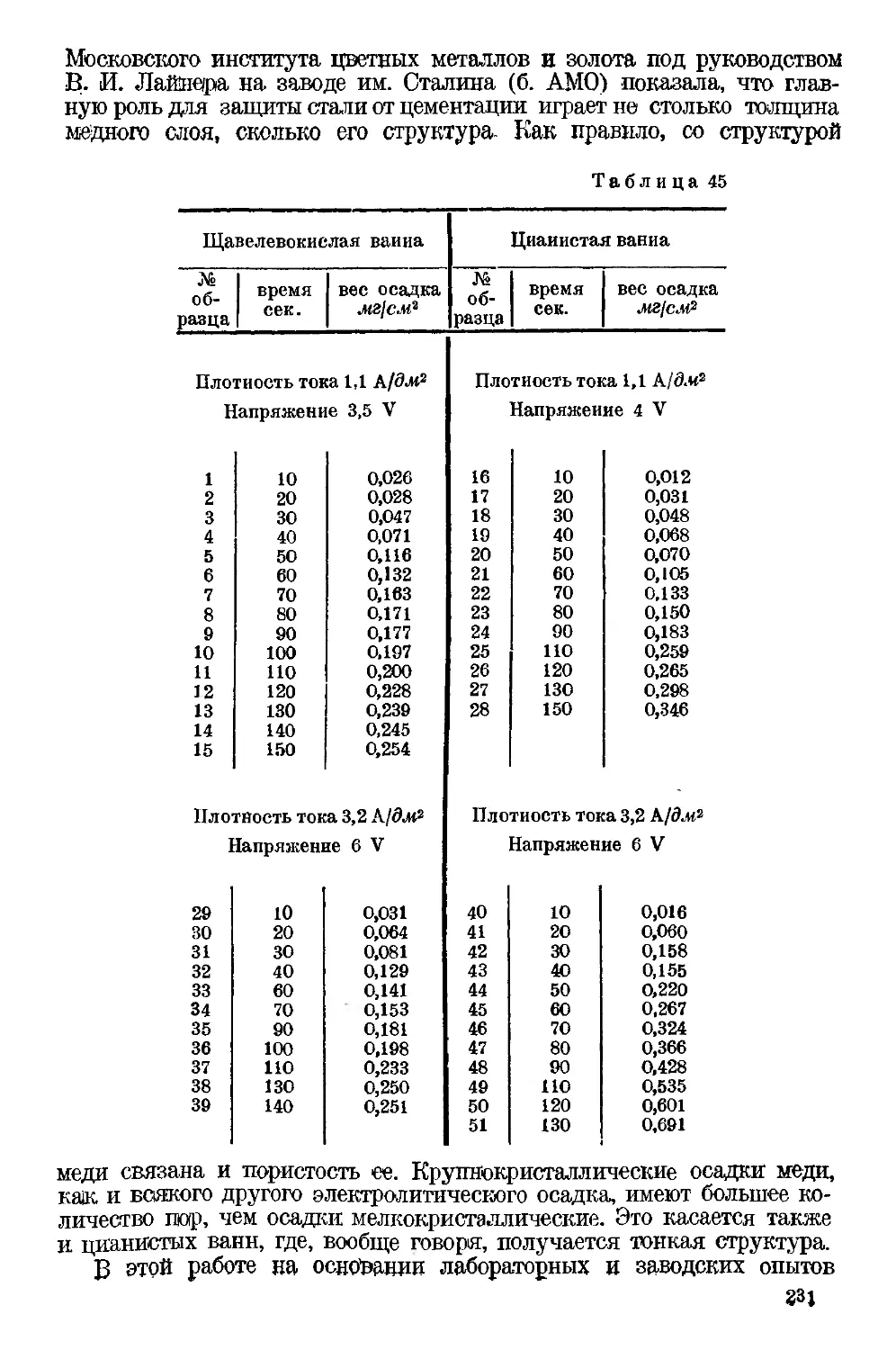
Текст
В. И. ЛАЙНЕР и Н. Т. КУДРЯВЦЕВ
ОСНОВЫ ГАЛЬВАНОСТЕГИИ
ЧАСТЬ ПЕРВАЯ
Под редакцией П. С. ТИТОВА
Рекомендовано ГУУЗ НКТП в качестве
учебника для втузов цветной металлургии
ОНТИ — НКТП — СССР
ГЛАВНАЯ РЕДАКЦИЯ ЛИТЕРАТУРЫ
ПО ЦВЕТНОЙ МЕТАЛЛУРГИИ
МОСКВА • 1936 • ЛЕНИНГРАД
ОТ РЕДАКТОРА
При организации подготовки инженеров-металлургов по специаль-
ности «Защита металлов от коррозии» в Московском институте цвет-
ных металлов и золота важным и насущным вопросом был вопрос
об учебных пособиях по специальным предметам. В частности это ка-
салось в первую очередь такой ведущей дисциплины, как гальвано-
стегия.
Существующая литература по гальваностегии, как русская, так и
иностранная, оказалась мало приемлемой по целому ряду причин.
С одной стороны, мы имеем книги рецептурно-прописного характера,
мало или совсем не касающиеся электрохимической сущности отдель-
ных процессов и с этой стороны непригодных как учебные пособия.
С другой стороны, имеется ряд работ, детально анализирующих от-
дельные гальваностегические процессы, но мало или совсем не рас-
сматривающие их технологическую реализацию.
Таким образом для работников кафедры электрохимии явилось не-
отложной и важной задачей создание книги, удовлетворяющей воз-
можно полно требования, предъявляемые к ней как к учебному по-
собию.
Первым из таких по нашему мнению был достаточно полный и
подробный анализ электрохимических процессов, имеющих место при
получении того или иного металлического покрытия при различных
условиях, так чтобы рецептурная часть процесса имела теоретическое
обоснование, так же как и все остальные условия технологического
процесса.
Такой же подробный теоретический подход по нашему мнению дол-
жен был иметь место и при рассмотрении подготовительных операций,
как-то: шлифовка, полировка, обезжиривание, травление и т. д.
Вместе с тем в руководстве должно было иметь место достаточно
полное рассмотрение вопросов конструирования основной и вспомо-
гательной аппаратуры и расчета технологического процесса.
Нельзя было также обойти и такие вопросы, как методы контроля
состава ванн и испытания свойств и качества покрытий.
Все эти требования вытекали непосредственно из опыта препода-
вания курса гальваностегии в Московском институте цветных метал-
лов и золота, читаемого доц. В. И. Лайнером, где первой и важнейшей
задачей была установка — подготовить достаточно глубоко теорети-
чески образованного инженера-металлурга соответствующей специаль-
ности.
Эту трудную и многообразную задачу взяли на себя доценты ка-
федры— авторы данной книги, имеющие достаточно большой стая»
*
3
как в области практической гальваностегии, так и обширный и успеш-
ный стаж исследовательской работы в данной области прикладной
электрохимии.
Авторами за исходное положение было принято, что читатель уже
имеет достаточно солидную подготовку -в общей, аналитической и
физической химии, металлографии и технологии металлов, а также
отчетливые и подробные знания электрохимии (особенно в области
теории электродных процессов при электролизе) и основ учения
о процессах коррозии.
Хотя как план, так и подробное содержание отдельных частей
книги авторами разрабатывались в тесном контакте, но в основном
гл. И, III, VI VII, VIH, IX и X-написаны В. И. Лайнером, а гл. I.
IV и V Н. Т. Кудрявцевым.
Сведение в систему большого и многообразного практического ма-
териала, а также значительного, но часто противоречивого в одной
области и весьма скудного в другой тео|ретического материала пред-
ставляло весьма трудную и большую задачу.
Поэтому данный труд разделен на две части. Ко второй части
отнесены вопросы осаждения железа, кобальта, благородных и пла-
тиновых металлов, вопросы получения покрытий из сплавов и про-
изводства электролитического биметалла, а также конструирование
аппаратуры, оборудование цехов и расчеты технологических про-
цессов. Над второй частью авторы сейчас работают, и она незамед-
лительно будет сдана (в печать.
Из иностранных руководств авторы в значительной степени вос-
пользовались материалами, изложенными в «Prinnciples of Elektropla-
ting and Elektroforming», W. Blum and Hogaboom; «Galvanotech-
nik», W. PfanhaYiser; «Modern Electroplating», W. Hughes; «Grund-
lagen des Verzinkenz», H. Bablik и, наконец, периодической оригиналь-
ной литературой и преимущественно журналов: «Trans, of the Anaeric.
Electrohem. Soc.»; «Zeitschrift fur Electrochemie und angewandte phys.
Chemie»; «Trans, of the Faraday Soc.»; «Korros. und Metallo-
schutz» и др.
Как во всякой сложной и новой работе, в данном труде может
иметь место ряд промахов и ошибок более или менее серьезного ха-
рактера. Полагаю, однако, что они вполне извинительны, если при-
нять во внимание трудность и обширность задачи, принятой на себя
авторами.
Они с внимательностью и благодарностью отнесутся ко всем за-
мечаниям о недочетах и указаниям, которые могут быть сделаны,
чтобы в дальнейшем их ^учесть и внести соответствующие измене-
ния и исправления.
Глубокоуважаемому учителю
проф. Н. А Изгарышеву
свой труд посвящают авторы
ВВЕДЕНИЕ
Гальваностегия — часть прикладной электрохимии, рассматри-
вающая методы нанесения металлических покрытий действием элек-
трического тока. По характеру охватываемых вопросов гальваностегия
наиболее близко подходит к электрометаллургии водных раство-
ров. Наиболее существенным отличием гальваностегии от этой части
прикладной электрохимии (электрометаллургии водных растворов)
является то особое внимание, которое уделяется качеству элек-
троосажденных металлов, главным образом структуре
и равномерности пок р ы т и я, — условиям, играющим доми-
нирующую роль в гальваностегии. В электрометаллургических про-
цессах, как известно, решающую роль играет расход электрической
энергии, тогда как в гальваностегии эта статья .расхода составляет
в среднем 15—20% всех расходов по проведению процесса.
В течение многих лет отдельные гальваностегические процессы,
давно применяемые на практике, не были теоретически изучены, в ре-
цептуре царил полный хаос, контроль и управление процессами про-
текали произвольно. Такое положение мыслимо было лишь в малень-
ких полукустарных установках. По мере выявления Преимуществ
электролитического метода нанесения металлических покрытий и
внедрения его в промышленность стали появляться мощные установ-
ки, рациональная эксгглоатация которых мыслима лишь при грамот-
ном, теоретически обоснованном процессе. Особенно большой сдвиг
в сторону теоретического оснащения гальваностегических процессов
можно было отметить во время империалистической войны, когда, во-
просы защиты металлов от коррозии и экономия металлов Приобрели
особо важное значение. Правда, и сейчас еще наука не сказала своего
последнего слова, и в целом ряде случаев мы не можем теоретически
обосновать некоторые явления, наблюдаемые при кристаллизации ме-
таллов на катоде. Но таких вопросов в настоящее время сравнительно
немного. Итак, если мы гальваностегию называем частью приклад-
ной электрохимии, то следует иметь в виду, что понимать и успешно
применять ее на практике можно лишь при достаточном знании
основ теоретической электрохимии.
Достаточно много труда и времени уделяется в гальваностегии
методам подготовки металлической поверхности к нанесению покры-
тия — операции, предшествующей процессу осаждения металла
в ванне и предрешающей успех или неуспех последнего.
По независящим от авторов причинам выпуск данйой книги за-
держался почти на полтора года. В связи с этим ряд новейших ли»
тературных и экспериментальных данных не могли найти отражения
в этой книге. Авторн надеются шшидаротать этот пробел w вто-
ром издании.
ГЛАВА ПЕРВАЯ
ПОДГОТОВКА МЕТАЛЛИЧЕСКОЙ ПОВЕРХНОСТИ ПЕРЕД
ПОКРЫТИЕМ
1. Влияние состояния поверхности на физические свойства
гальванического осадка
Одним из первых важнейших условий получения хорошего метал-
лического покрытия является полная химическая чистота покрывае-
мой поверхности.
Всякое изделие, как бы оно ни казалось чистым при наружном
грубом осмотре, почти всегда содержит на своей поверхности какие-
либо загрязнения, нарушающие процесс получения нормального галь-
ваностегического покрытия.
Загрязнения, наиболее часто встречающиеся на поверхности ме-
таллов, по своей природе разделяются на три основных вида:
1) окислы и им подобные соединения, 2) жиры, масла и другие орга-
нические вещества и 3) посторонние твердые тела различного проис-
хождения, остающиеся или механически попадающие на поверхность
при изготовлении изделий, как например графит, песок (в отливках),
шлак, пыль, поверхностные включения механически приставших ча-
стиц других металлов и пр.
В зависимости от рода и количества загрязнений осаждаемый ме-
талл или совсем не выделяется на катоде или получается <в виде
отдельных крупнокристаллических . наростов, неплотно спаянных
между собой и с поверхностью основного металла,- не сплошь закры-
вающих всю поверхность изделий. Такой осадок имеет иногда шишко-
ватую или порошкообразную губчатую форму от грязно-серого до
черного цвета и легко осыпается с катода.
В случае небольшого загрязнения поверхности изделий жирами,
маслами или окислами если и удается получить покрытие, нормаль-
ное по цветному оттенку и кристаллической структуре, то все же оно
никогда не бывает плотно сцепленным с основным металлом и .при
малейшем механическом воздействии (изгиб, удар и пр.) легко тре-
скается и отслаивается.
Тончайшей пленки, незаметной даже для глаза, как например
цлецки жиров и окислов па изделиях полированных или вышедших
после холодной обработки на различных станках, уже достаточно для
TQjq, цтобы. воспрепятствовать, плотному .сцеплению покрываемого ме-
талла 0 покрывающим.
а
При местном точечном загрязнении поверхности жирами, маслами
или окислами покрытие получается или несплошным (пористым), или
с небольшими пузырями, вздутиями (появляются обычно при на-
гревании в горячей воде или на воздухе), легко отскакивающими при
механическом воздействии.
Местные загрязнения третьего вида: песок, пыль и другие твер-
дые тела, также вызывают очень часто образование несплошных, по-
ристых или шишковатых, ломких и отслаивающихся (местами) по-
крытий.
Кроме внешних поверхностных загрязнений основного металла на
качество осадка оказывают влияние также материал и способ изгото-
вления или обработки изделия.
Как будет видно из дальнейшего, не вое виды покрытия с одина-
ковым успехом можно наносить на изделия из одного и того же ма-
териала и, наоборот, для одного и того же вида нокрытия, в зависи-
мости от материала и способа изготовления изделия, качество осадка
при прочих одинаковых условиях может быть различным. При этом
отложение металла на катоде, если оно вообще получается, может быть
более или менее плотным, мелкозернистым, пористым, хорошо пристаю-
щим или отслаивающимся и т. д. Так, например, большинство метал-
лов, дающих хорошее покрытие на обыкновенном железе, плохо осаж-
дается на сером чугуне, высокоуглеродистой и холодной рокатанной
стали, полированном никеле, на хромовых отложениях и никоторых
других металлах.
Чугунные изделия, полученные путем отливки, имеют неровную,
иногда бугристую и чрезвычайно пористую поверхность. Вследствие
этого покрытие на чугуне, выполненное слоем металла обычной сред-
ней толщины (—0,01—0,02 мм), получается также негладким, шеро-
ховатым и пористым.
Кроме того пористость чугуна придает его поверхности всасываю-
щую способность, вследствие которой при погружении изделия в ванну
оно пропитывается на некоторую глубину электролитом. Последний
через некоторое время после покрытия действует изнутри на слой
осадка и вызывает образование на нем пятен. Далее, в сером чугуне
всегда находится свободный углерод в виде графита, который при на-
личии пористости поверхности основания и покрытия обусловливает
образование микроэлементов, ускоряющих процессы разрушения ме-
таллических осадков.
Пористые, неплотные и негладкие покрытия получаются также и
на изделиях из плохого низкосортного железа и других металлов,
имеющих на своей поверхности дефекты обработки: поры, трещины,
бугры и т. д.
Для улучшения качества покрытия на изделиях из такого мате-
риала необходимо прежде всего хорошее заглаживание трещин и пор
путем предварительной механической обработки поверхности на стро-
гальных или шлифовальных станках. Уменьшить 'пористость покры-
тия можно и за счет увеличения толщины слоя покрытия. Однако в
последнем случае при получении сплошных и сравнительно беспо-
рист’ых осадков па пористом основании могут оказаться по проше-
ствии некоторого времени другие дефекты покрытия, например появле-
ние пузырей или вздутий покрывающего слоя. В данном случае это
1
явление объясняется тем, что при травлении пористого изделия ка-
пиллярные каналы его всасывают травильную жидкость, которая при
обыкновенном споласкивании поверхности плохо удаляется и остается
частично в порах металла.
Между- кислотой, застрявшей в порах, и основным металлом под
покрытием происходит реакция, в результате которой выделяющийся
водород производит разрушение металлического осадка. Если.давле-
ние водорода возрастает настолько, что оно может преодолеть силу
сцепления- осадка с основным металлом, то осадок. приподнимается и
вздувается в виде шишек или пузырей. Этот дефект может быть почти
совершенно устранен путем соответственно более продолжительного
промывания водой Пли посредством обработки травленого предмета
щелочами, лучше в нагретом состоянии.
Растворение водорода в металле, происходящее при химическом
травлении или электролитической обработке изделий, может быть
также причиной пористости или пузырчатости и неплотного приста-
вания осадка.
Совершенно другого характера пр происхождению и свойствам по-
лучаются пузырчатые вздутия после покрытия некоторых сортов хо-
лоднокатаной стали. Холоднокатаная сталь в зависимости от спо-
соба обработки может иметь различное состояние поверхности. Очень
часто приходится иметь дело с материалом, обладающим неодинако-
вой структурой внутри и на поверхности. Примером может быть сталь,
прокатанная сначала в горячем состоянии до требуемого размера,
затем протравленная в кислоте и прокатанная вхолодную без даль-
нейшей термической обработки (отжига). При последней холодной
прокатке на поверхности такой стали всегда образуется твердая корка,
так называемая «металлическая кожа», покрытая пленкой окиси в
имеющая искаженную мелкозернистую почти аморфную структуру *.
Если изделие из такой стали после удаления окиси покрывается в на-
гретом' электролите или если после покрытия оно нагревается при
промывке или сушке, то поверхность его делается бугристой, усеян-
ной мелкими или крупными пузырями.
При исследовании такой поверхности оказывается, что покрытие
не отслаивается, а пузыри являются результатом вздутия наружного
слоя самого основного металла вместе с покрытием. Эти пузыри бы-
вают настолько твердыми, что поддаются разрушению и удалению
только после сильного’ механического' воздействия. Если их разру-
шить, то под ними обнаруживается металл с крупнокристаллической
структурой (соответствующей структуре, получаемой после горячей
прокатки). Образование такого рода пузырей можно объяснить тем,
что получающаяся при холодной прокатке стали верхняя корка ме-
талла закрывает имеющиеся в металле углубления (каналы), в кото-
рых обычно' остаются включения воздуха и шлака. От тепла, сооб-
щаемого покрытому изделию, воздух расширяется и производит да-
вление на наружный слой металла (металлическую кожу), вызывая
местные вздутия поверхности.
Если деталь из такой стали долго и тщательно протравливать
в кислоте, то наружный слой металла разрушится, и под ним обнару-
1 Hagatfoom S, Metall 1пШг1 (N. U. № 8. IS31,
В
жится крупнозернистая шероховатая поверхность, покрытие которой
Другим металлом может оказаться тоже шероховатым. Для получения
гладкой поверхности и уничтожения мелких углублений с включе-
ниями шлака и воздуха в стали можно применять’ дополнительную
механическую обработку на шлифовальных и полировальных станках.
Не всегда, однако, получается вполне безукоризненное покрытие,
даже и на полированной, весьма гладкой поверхности изделия.
Известно, что, в .результате (полировки, так же как и после холод-
ной прокатки, поверхность некоторых металлов приобретает искажен-
ную, очень мелкозернистую, почти аморфную структуру, загрязнен-
ную, кроме того, включениями или тончайшими пленками окиси,
жиров и других веществ.
При относительно толстом отложении некоторых металлов на по-
верхности полированных изделий, даже очищенных от посторонних
загрязнений (жиров и окисей), но не протравленных в соответствую-
щем растворителе, сила сцепления осадка с основным металлом и его
сопротивление изгибу могут оказаться не в такой степени высокими,
как в случае покрытия изделий, хорошо протравленных, имеющих
слегка шероховатую поверхность.
Как известно, наибольшую силу сцепления осадка можно ожидать
в том случае, когда кристаллы осаждающегося металла принимают
ориентацию, соответствующую кристаллам основного металла и пре-
дыдущего слоя, и дают как бы непрерывное продолжение их роста.
Очевидно, что для этого прежде всего необходимо1, чтобы основной
металл имел поверхность чистую, с более или менее резко выражен-
ной кристаллической структурой, обеспечивающую наиболее тесное
соприкосновение между кристаллами основного металла и электро-
осажденного.
Можно предполагать, что при этом условии структура электроосаж-
денного металла, воспроизводя рост кристаллов основного металла,
будет меняться в той или иной мере в зависимости от структуры по-
следнего.
2. Механическая подготовка поверхности металлов
Шлифовка—’Процесс получения ровной, сравнительно гладкой
поверхности путем снятия тонкой стружки металла какими-либо твер-
дыми режущими, так называемыми абразивными материалами.
Операция шлифовки производится на механических станках, снаб-
женных вращающимися дисками или кругами и в специальных вра-
щающихся барабанах или колоколах. Обработка на станках является
более распространенным гидом шлифовки. По характеру обработки
поверхности и роду кругов процесс шлифования последними можно
разбить на две стадии: 1 — грубая шлифовка, или обдирка, и 2 —• тон-
кая шлифовка. Посредством грубой шлифовки-обдирки достигается
удаление грубых неровностей. При этом все выступающие части по-
верхности, небольшие бугристые возвышения, например на изделиях,
полученных путем отливки, а также глубокие царапины, поры де-
лаются менее заметными. Применяемые для этой цели круги состоят
из массы зерен абразивных материалов, связанный каким-либо опре-
деленным цементирующим веществом. Зерна шлифовальных кругов
выполняют роли-отдельных рейдов ни подобие зубров фрезы, но только
9
беспорядочно расположенных. При помощи шлифовального круга
благодаря очень большому количеству режущих зерен, действующих
одновременно, можно производить обработку металла в более совер-
шенном виде, нежели при работе каким-либо другим режущим ин-
струментом.
Преимуществом перед другими режущими инструментами для шли-
фовальных кругов является также и то, что последние в большинстве
случаев во время работы почти не теряют своей режущей способности.
После того как одни зерна затупятся, на их место 'выступают другие
благодаря выкроншванию первых. Происходит как бы самонатачива-
ние инструмента. Кроме того, но время работы шлифовальные круги
почти не требуют сильного нажима на поверхность обрабатываемого
предмета, в отличие от других режущих инструментов, для которых
это условие является необходимым. Благодаря чрезвычайной твер-
дости абразивных материалов, применяемых для шлифовальных кру-
гов, обработка поверхности путем Шлифования возможна для метал-
лов любой твердости.
Тонкая шлифовка металлов применяется для удаления
оставшихся едва заметных неровностей и получения более гладкой
поверхности изделий, идущих дальше или на покрытие или на более
тщательную механическую отделку-полировку.
Смотря по свойствам поверхности, эта операция или следует после
грубой шлифовки (обдирки) или заменяет последнюю в роли первой
стадии обработки. В отличие от грубой шлифовки тонкая шлифовка,
или предварительная полировка кругами, производится с более мел-
кими абразивными материалами.
Процесс полировки представляет собой известный вид шлифовки
металла, при котором происходит ’выравнивание и выглаживание ма-
лейших неровностей изделия и сообщение поверхности блестящего,
зеркального вида с большим коэфициентом отражения света.
Операция полировки, так же как и шлифовки, производится на
станках кругами и во вращающихся барабанах. Кроме этого, приме-
няется в отдельных случаях полировка вручную специальными поли-
ровальными приспособлениями.
Характер отделки поверхности — степень гладкости и чистота
глянца или блеска, получающегося после полировки, — зависит как
от характера предварительной обработки шлифовальными инструмен-
тами, так и от рода полирующих материалов, применяемых в самом
процессе полирования. Необходимо прежде всего, чтобы перед поли-
ровкой поверхность была достаточно хорошо сглажена уже при опера-
ции шлифовки.
Для полировки применяются еще более мелкие абразивные мате-
риалы, которые в смеси с другими веществами наносятся на круги,
состоящие из отдельных матерчатых дисков. При правильном подборе
материалов и правильном режиме работы процесс полировки, в отли-
чие от шлифовки, не должен сопровождаться потерей в весе металла.
Выравнивание поверхности при полировании происходит не за счет
срезания стружки и удаления ее с поверхности металла, а за счет
как бы раздавливания отдельных выступающих частиц металла и за-
полнения ими углублений. После полировки поверхность изделия не
имеет структуры-даннога металж, 'а пред-
J0
ставляет собой как бы массу отдельных кристаллитов, изломанных и
беспорядочно расположенных относительно друг друга. Под давлением
полирующих материалов и влиянием трения может происходить не
только разрушение или раздавливание целых кристаллических обра-
зований или групп кристаллов, но и деформация самой кристалличе-
ской решетки, в результате чего отдельные кристаллы металла прини-
мают вид изломанных и сдавленных кристаллических зерен.
Предполагается, что во время процесса полирования от действия
тепла, выделяющегося при трении, поверхностный слой металла при-
обретает склонность как бы растекаться в виде жидкости и тем са-
мым заполнять мельчайшие поры и царапины, оставшиеся после шли-
фовки. Такое явление было обнаружено при полировке серебра и зо-
лота в ряде опытов, проведенных Бильби *. Поверхность полирован-
ного металла по данным Бильби получается как бы оплавленной и
сглаженной за счет удаления выступающих частиц и заполнения ими
(в .расплавленном состоянии) углублений <в металле.
Можно считать, что явление растекания металла происходит также
и при шлифовании, но там царапины или углубления, образующиеся
на поверхности Ь результате режущего действия грубых зерен абра-
зивного материала, так велики, что такое растекание металла недо-
статочно для заполнения углублений.
При недостаточно хорошей предварительной подготовке поверхно-
сти металла при полировке в зависимости от рода полирующих мате-
риалов, в той или иной степени может происходить также и снятие
стружки. Однако, нормально этот процесс должен сводиться к среза-
нии» отдельных резко выступающих мелких частиц, которые при этом
пе удаляются совершенно с поверхности металла, а, находясь как бы
в размягченном состоянии, заполняют его углубления.
3. Шлифующие и полирующие материалы
Абразивные материалы. Основным материалом, выполняющим
процесс резания и сглаживания поверхности металла, как было уже
указано, являются, так называемые,- абразивные или твердые тела.
В качестве абразивного материала может служить всякий минерал
естественного или искусственного происхождения, зерна которого обла-
дают 'большой твердостью и режущей способностью. Кроме того, абра-
зивный материал должен обладать некоторой определенной внутрен-
ней связью (вязкостью) или внутренними силами оцепления, обес-
печивающими устойчивость составляющих его кристаллов против
скалывающих усилий до момента его затупления. Форма зерен имеет
также большое значение.
При одинаковой твердости круглые зерна, имеющие шарообразную
форму поверхности, обладают меньшей шлифующей способностью, не-
жели зерна, имеющие острые грани.
Минералы, служащие- в качестве шлифующих абразивных мате-
риалов или являющиеся источником их приготовления, согласно
шкале Мооса распределяются по степени твердости следующим обра-
» Hogaboom S.. „The Metall Ind.* (N. Y-), 29. 1931. Freeman B. a.
Happe F., .Electroplating,tyith Chromium, .Copper and NikJjel" .1930.
11
зом: тальк — 1, каменная соль — 2, известковый шпат — з, полевой
шпат — 4, апатит—5, ортоклаз — 6, кварц — 7, топаз —8, ко-
рунд — 9 и алмаз — 10.
В практике шлифования и полирования в качестве абразивных
материалов обычно применяются *: карборунд, корунд, наждак, тре-
пел, пемза, кремнезем, крокус, известь, окись железа в виде очень
мелкого порошка и пр.
Карборунд — материал, представляющий собой соединение
углерода с кремнием (SiC), получается искусственным путем в элек-
трических печах. По степени твердости он выше корунда и прибли-
жается к алмазу.
Зерна его имеют очень острые грани, но вязкость и удельный
вес его меньше корунда. Карборунд применяется, главным обра-
зом, для грубой шлифовки хрупких и обладающих низким сопротив-
лением разрыву металлов (чугун, бронза, латунь, цинк, олово и т. п.).
В продаже карборунд имеет различные названия: карборунд,
карболит, карболои, - карбосилит, карболакс, кристолон, карда-
рит и т. п.
При выборе материала необходимо иметь в виду, что качество его
тем выше, чем меньше он содержит графита (свободного) и чем
меньше в нем зерен, имеющих ступенчатую и плоскую форму.
Корунд бывает искусственный и природный. Природный корунд
содержит 90—95% окиси алюминия. Для шлифования в гальвано-
стегии пользуются больше искусственным корундом. Искусственный
корунд получается сплавлением продуктов, содержащих глинозем,
с углем или коксом в электрических печах. Твердость корунда тем
выше, чем больше содержится в нем глинозема (А1203). В продаже
встречается корунд с содержанием окиси алюминия от 90 до 99%
(лучшие сорта).
Корунд является- лучшим материалом для грубой шлифовки на
кругах. Он обладает большей вязкостью, чем карборунд и наждак,
и имеет меньшую хрупкость, чем последний. Зерна корунда много-
гранны и менее остроконечны, чем у карборунда. Все эти свойства
корунда делают его вполне пригодным для шлифования металлов бо-
лее вязких и обладающих бблыпим сопротивлением разрыву (закален-
ная сталь, ковкий чугун, марганцовистая бронза и пр.).
Наждак представляет собой естественную породу мелкозерни-
стого строения, состоящую из корунда и окиси железа. Содержание
корунда Т? наждаке доходит до 60%. Твердость наждака по шкале
Мооса 7—8. Степень его твердости зависит от содержания корунда.
Хорошим считается наждак с содержанием корунда около 50—60%
и магнитной окиси железа не более 33%.
Обычные продажные сорта наждака содержат около 30—40% ко-
рунда. В прессованном виде наждак выпускается различной степени
измельчения. Он применяется для шлифования всех металлов, осо-
бенно вязких, как например, железо. Присутствие окиси железа при-
дает наждаку также полирующее свойство. Поэтому некоторые, более
1 Freeman В. а. ПхрреР., .Electroplating with Chromium, Copper and
NikkoF, 1930; Ипполитов Г. M., »Щдифование‘‘, 1932.
ia
мелкозернистые, сорта наждака (с большим содержанием окиси же-
леза) могут быть пригодны и для полировки металлов.
Трепел представляет собой породу, состоящую главным обра-
зом из двуокиси кремния. По своей структуре трепел сильно отли-
чается от чистого кремнезема.
Зерна его мягки, пористы и- не имеют острых, режущих граней,
однако они достаточно крепки для того,- чтобы производить выравни-
вание поверхности и удаление мелких ее дефектов, например рисок,
царапин и др.
Трепел является универсальным полирующим веществом, имею-
щим широкое применение для самых разнообразных металлов. Очень
хорошие результаты получаются при полировке трепелом мягких ме-
таллов и сплавов, например латуни, алюминия и др.
Пемза является продуктом вулканического происхождения,
имеющим губчатое строение. Обычно она применяется для шлифовки
и полировки дерева, кожи, каучука, целлулоида, стекла и пр. Твер-
дость пемзы по шкале Мооса около 6.
Некристаллический кремнезем, вернее, кремнезем
с неупорядоченным кристаллическим строением, называемый также
аморфным, представляет собой продукт, совершенно отличный по
структуре от -обычного кремнезема. Зерна его твердые, но гладкие,
с закругленной формой и .не имеют острых режущих граней, которыми
обладает обыкновенный кремнезем. Режущая способность такого крем-
незема незначительна, и поэтому он применяется для отделки по-
верхности, обычно после обработки трепелом. Степень твердости его
ниже трепела и пемзы.
Крокус представляет собой окись железа с довольно твердыми
кристаллическими зернами. Американский крокус тверже европей-
ского. Он широко 'применяется для полировки и -отделки стальных
ножей, вилок и других стальных и железных изделий с хорошо под-
готовленной предварительно поверхностью. Английский крокус по
качеству выше других сортов, он дает более тонко- и гладкополиро-
ванную поверхность.
И з весть, применяемая в шлифовании и полировании, предста-
вляет собой свежекальцинированный известняк, состоящий из окиси
кальция, отчасти окиси магния, гидрата окиси кальция и углекислого
кальция. Она носит специальное название «венская известь». Зерна
венской извести мягче зерен некристаллического кремнезема, но
имеют такое же строение с закругленной поверхностью и без режущих
острых граней.
В смеси с различными связывающими веществами она является
прекрасным полирующим материалом почти для всех изделий и при-
меняется для полировки до высшего глянца.
Окись железа применяется в виде палочек из очень мелко-
дробленого, наиболее мягкого порошка, для весьма тонких операций
полировки металлов, например при изготовлении шлифов металла,
предназначаемых для микроскопического исследования. Палочки крас-
ной окиси железа применяются также для придания наибольшего
блеска поверхности при полировке золота, серебра, платины, стекла,
латуни, никеля и стали.
13
I Громе указанных продуктов, для полировки очень твердых метал-
лов, например хромового отложения, применяется также окись хрема
<(’г„О3).
Выбор абразивного материала и степени его зернистости определяй it-
ch природой обрабатываемого металла, свойствами его поверхности (ха-
рактер предварительной обработки) и требуемой степенью его отделки.
Кроме того, при шлифовке нужный размер зерна зависит от фор-
мы изделия и глубины резания.
Для шлифовки различных сортов железа применяются материалы,
стоящие в шкале Мооса то степени твердости между 3 и 8, для меди,
латуни и других медных сплавов 3—5, для цинка, олова и алюми-
ния 2—-3 и т. д. Чем тверже обрабатываемый металл, тем большая
твердость должна быть и у абразивного материала Ч
Для грубой шлифовки на кругах применяются обычно наждак,
карборунд, корунд, кварцевый песок, иногда пемза и т. д. в круипо-
или мелкозернистой форме в зависимости от природы и свойства по-
верхности обрабатываемого металла.
Для тонкой шлифовки железа и стали на кругах после грубой
шлифовки применяются мелкозернистый наждак, пемза, кварцевая
мука, мелкий порошок окиси железа, различные полировочные
краски, так называемая английская краска и пр.
Для тонкой шлифовки слабых.и мягких металлов (медь, латунь
и пр.) применяются порошкообразный трепел, мелкораздрсблеиный
кремнезем, мел и др.
Для полировки применяются, главным образом, венская известь,
иногда окись железа, окись хрома в смеси с известью и отдельно,
как, например, при полировке железа и стали.
Для полирования никеля, меди, латуни, нейзильбера и соответ-
ствующих сплавов употребляется чистая венская известь без. приме-
си окисей металлов (Fe„03 и Сг203).
В отношении величины зерна в абразивном материале следует
придерживаться того правила, что чем выше степень желаемой от-
делки, тем меньше должно быть зерно. При этом, конечно, должно
быть принято во внимание свойство поверхности или степень преды-
дущей обработки изделия.
Кроме того, для одинаковой степени отделки полируемой поверх-
ности зерна абразивного материала должны быть тем меньше, чем
больше их твердость.
По степени зернистости абразивные материалы делятся на не-
сколько групп2: весьма крупнозернистые № 10, 12; крупнозернистые
№ 16, 20. 24; среднезернистые № 36, 46, 60; мелкозернистые № 80,
100, 120; тонкие № 150, 180, 200, 240; минутники.
Зерна, обозначенные номерами, получаются путем просеивания че-
рез сита с различным числом отверстий на 1 линейный дюйм. Каждый
номер соответствует числу этих отверстий.
Минутниками называются зерна пыли, получаемые путем отму-
чивания в течение различного времени: 1, 3, 5, 10, 15, 30, 60 мин.
В соответствии с этим они называются одноминутниками.
1 Pfanhaueer W. .Die Electrolytischen Metallnkderschlage" 1928, Berlin,
a Ипполитов Г. M., .Шлифование*, 1933
14
пятиминутниками и т. д. Некоторые минутники — 1Л-, 1 3-. 5-минут-
пики — по степени зернистости приближаются к номерам зерен сито-
вой классификации, но тем не менее они различаются и выпускаются
в Двух сортах, так как минутники однороднее по величине зерна не-
жели последние. Величина зерна разных номеров приводится в табл. I.
Т а б .1 н ц а I
№ зерен 10 12 16 20 24 36 46 co SJ 100 120 150 200
Размер I or 1,68 1,19 0,84 0 71 0,50 0,35 0,25 0.177 0,149 0,125 0,088 0,074 0,062
MM 1 l до 2,00 1,86 1,19 0,84 0,71 0,50 0,35 0,250 0,177 0,149 0,125 0,088 0,074
Связывающие вещества. Для целей шлифования и полирования
металлов на станках абразивные материалы смешиваются с каким-
либо связующим веществом и формуются в круги (шлифовка) или
наносятся на поверхность кругов (по периферии), изготовленных из
какого-либо другого материала (полировка). Выбор материала связки
определяется главным образом способом обработки и характером тре-
буемой отделки поверхности.
Для грубой шлифовки, или обдирки, наждаком, карборундом и пр.
в качестве таковой связки, идущей на изготовление кругов, служат
различные глины, шпат, каучук, жидкое стекло, шеллак, масло, раз-
ные смолы и другие вещества, обладающие способностью плавиться
или спекаться при определенной температуре и удерживать зерна
шлифующих материалов при затвердевании после охлаждения.
Для тонкой шлифовки и полировки связкой служат различные
полутвердые жиры и масла: сало, стеарин, олеин, стеариновое масло,
воск, парафин и пр. Смешением этих веществ с соответствующими
мелкими абразивными материалами готовят специальные полировоч-
ные пасты, которые при полировке наносятся на поверхность сукон-
ных и полотняных или войлочных кругов.
Для тонкой шлифовки весьма употребительным веществом, свя-
зывающим абразивные материалы при нанесении их на деревянные
или войлочные круги, является клей. Клей должен быть высокого
качества; рекомендуется применять мездровый клей, обладающий
необходимой вязкостью, эластичностью и клеящей способностью.
Для глянцевой полировки лучшими и наиболее употребительными
связывающими материалами при приготовлении паст служат олеин и
стеарин. По Стивенсу наилучшее по качеству связывающее вещеспх)
должно удовлетворять следующим требованиям Ч
1. Изготовленный на данной связке шлифующий и полирующий
материал должен быть достаточно твердым, вязким и стойким при
‘Freeman В. a. HappeF., .Electroplating with Chrimium, Copper and
Nikkei". 1930.
15
обычных условиях колебаний температуры. Он не должен ломаться,
крошиться и истираться в эксплоагации и при перевозке, а также
при нанесении на круг.
2. Температура размягчения или плавления связывающего веще-
ства должна быть такова, чтобы то тепло, которое выделяется при
трении о круг полирующего материала (паста), обеспечивало нане-
сение последнего в достаточном количестве на поверхность круга (на-
гревание не должно быть слишком высоким). Полирующий материал
должен стираться постепенно. Степень твердости должна соответство-
вать требуемым условиям работы.
3. - Связывающее вещество должно легко и так сильно приставать
к кругу, чтобы шлифующий или полирующий материал оставался и
сохранялся на круге во все время его работы. Оно должно обладать до-
статочной связывающей или склеивающей способностью для того,
чтобы не было излишнего нагревания круга от трения волокон самого
материала, от трения круга и абразивного материала о поверхность
изделия, а также от той теплоты, которая может развиваться вслед-
ствие выламывания самих абразивных зерен.
4. Связывающие- вещества не должны- придавать глазированный'
вид поверхности круга, а также не должны оставаться на поверхности
круга в виде твердого, смолистого или угольного осадка.
5. Ввиду того что некоторые связывающие вещества могут приста-
вать к поверхности полируемого изделия, нужно избегать применения
веществ, оставляющих значительный осадок на изделиях.
6. В случае очистки изделий перед гальваническими покрытия-
ми, а также для других целей необходимо применять такое связы-
вающее вещество, которое легко омыляется или эмульгируется при
обезжиривании изделий.
Круги. Круги для грубой шлифовки можно различать по роду
шлифующего абразивного материала и по роду их связки. По роду,
шлифующего материала круги бывают карборундовые и корундовые
или алундовые (искусственный корунд) и наждачные. По роду связ-
ки их различают на круги керамиковой, растительной и минеральной
связки
Наиболее употребительны в промышленности круги керамиковой
связки. Для них связкой служат, главным образом, огнеупорная
глина, каолин, полевой шпат, тальк, кремневая пыль. Приготовля-
ются они двумя способами: прессованием и литьем. Способ прессо-
вания состоит из следующих основных операций: приготовление
сухой смеси абразивного материала со связкой, развеска, формовка,
прессование под определенным давлением (около 100 о на 1 см2},
сушка при определенной температуре (100—125° для керамиковых
кругов), обжиг, обточка, испытание и маркировка.
Изготовление керамиковых кругов способом литья отличается от
первого тем, что смешивание абразивного материала со связкой'
производится с добавлением небольшого количества воды, затем эта
жидкая масса разливается в цилиндрические формы-кольца разных
размеров, соответствующих размерам кругов, и затем поступает на
сушку, которая продолжается l—7 суток при 150°. После сушки 1
1 Ипполитов Г. М., „Шлифование" 1933.
16
получается достаточно мягкая болванка, которая идет в таком видб
на предварительную обточку, затем на обжиг, окончательную обточ-
ку и т. д.
Керамиковые круги, полученные способом литья, более пористы,
чем прессованные, и их лучше применять в том случае, когда не тре-
буется производить очень грубую обдирку поверхности металла, свя-
занную с большими усилиями в работе резания. Прессованные круги
применимы и для тяжелой работы.
Пористость керамиковых к-ругов, полученных тем и другим спосо-
бом, устраняет весьма нежелательное явление засаливания шлифую-
щих зерен связкой и тем самым сохраняет в работе их режущую спо-
собность. Этим особенно отличаются круги литые.
Круги растительной связки различаются по роду связки на шел-
лаковые (связка — шеллак), олеонитовые (связка — окисленное мас-
ло) и вулканитовые (связка — резина, сырая или вареная).
Все эти круги готовятся способом прессования. Давление, темпе-
ратура и продолжительность сушки кругов различны. В отличие от
керамиковых круги с растительной связкой не подвергаются обжигу.
Эти круги имеют специальное назначение..
Из группы кругов минеральной связки наибольшего внимания за-
служивают так называемые силикатовые круги, изготовляемые путем
прессования абразивных материалов со связкой из жидкого стекла
с добавкой окиси олова. В качестве связки для этих кругов приме-
няются также и другие смеси, например жидкое стекло, глина, крем-
невая пыль и др.
Силикато’вые круги мягкие, но достаточно прочные и пористые.
Они не теряют своих свойств под влиянием влажности, как это имеет
место для других кругов этой же 'группы, так называемых магне-
зиальных кругов, у которых связкой служит цемент Сореля. Эти по-
следние по своим свойствам вообще очень непрочны. Силикатовые
круги по своему качеству, одйако, стоят ниже керамиковых.
Правильный выбор круга (род шлифующего материала и связки,
зернистость, твердость, форма и размер круга в соответствии с ма-
териалом, размером и формой обрабатываемого изделия, а также
степенью предшествующей и требуемой обработки поверхности по-
следнего) является основным условием правильной работы кругов
и успешного выполнения процесса шлифования на станках.
Зернистость кругов определяется теми же условиями, которые
были кратко приведены выше при разборе абразивных материалов.
Нумерация и деление на группы кругов по степени зернистости
соответствуют классификации зерен соответствующих абразивных
материалов.
В отношении твердости круги имеют свою классификацию, совер-
шенно отличную и далеко не соответствующую степеням твердости
абразивных материалов по шкале Мооса.
Под твердостью круга разумеется не твердость шлифующих зе-
рен, а свойство связывающего материала удерживать отдельные зер-
на и оказывать сопротивление их выламыванию при работе круга.
Чем прочнее держатся шлифующие зерна, тем твердость круга боль-
ше. Твердость круга зависит от рода связки и процентного содержа-
ния ее в круге, от формы и величины зерен абразивного материала
2 Основы гальваностегии 1788
При одной и тб же сййзЁе, от различных условий изготовления круга
(давление при прессовании, температура и продолжительность обжи-
га и остывания круга и т. п.). Поэтому круг, изготовленный хотя и из
твердых зерен, может быть мягким.
Так как одним из требо'ваний, предъявляемых к шлифовальным
кругам, как было указано выше, является их свойство сохранять
во время работы свою режущую способность или самонатачиваться
(за счет легкого выпадения затупившихся зерен и освобождения но-
вых), то при шлифовании твердых металлов необходимо применять
мягкие круги, способствующие более быстрому выпадению затупив-
шихся зерен и оголению новых.
Затупливание зерен ускоряется с повышением твердости шли-
фуемого материала, следовательно, чем тверже шлифуемый мате-
риал, тем мягче должен быть круг. При шлифовании мягких метал-
лов зерна тупятся медленнее, и в этом случае круг может быть
более твердым. Во избежание засаливания круга для очень мягких
металлов (медь, латунь) следует применять, однако, круги более
мягкие.
Выбор твердости круга зависит также от скорости его вращения.
Естественно, что чем большее количество зерен участвует в работе,
тем, следовательно, больше и скорее они- тупятся. Количество же
одновременно (работающих верен зависит от скорости вращения или,
точнее, от линейной скорости. Поэтому, чем больше скорость враще-
ния, тем мягче должен быть круг.
В табл. 21 даны обозначения твердости кругов по ОСТ и Нортон.
Таблица 2
Характеристика кру- sr 3 ф св ф ф ф ф
« Я S S Я д s
гов по:твердости ф U о; Ф Ем' ф о; ч Ф Ем ЕЯ R
р-1 S га г S О S
Условные обозна- ВМ, м, СМ,
чения по ОСТ ЧМ м2
вм2 м3 см3
Условные обозиаче- F я к
ння по шкале Нортона Е I
для керамической и минеральной связи G J L
Условные обозиаче- —
ния по шкале Нортона — 1 2
для упругой связки — — 1*/3 2*,'3
Средние Средне- твердые Твердые Весьма твердые
Ci СТ, ст2 т, ВТ,
С2 ст3 Т3 ВТ3
м О р R т
N Q 8 и
з*/3 5 7
3 4 7 ——
з*/3 4 6 —
ЧТ,
ЧТ3
V
W
В отношении формы и размеров шлифовальные круги имеют очень
много разновидностей, стандартизованных и сведенных в таблицы
ОСТ’. Они выбираются в соответствии с характером работы и типом
станка. Наиболее употребительная форма круга — плоский цилин-
* Шиманов В. М., „Справочник шлифовальщика", 1933.
18
дрический круг, применяемый Почти для всех видов работ По шлифо-
ванию (круглое, 'внутреннее, плоское шлифование). Для шлифования
рельефных изделий применяются фасонные круги.
Круги для тонкой шлифовки в зависимости от свойств обрабаты-
ваемой поверхности изготовляются или из дерева (деревянные круги)
с наждачной набивкой или из пробки, войлока, ткани (сукно или
хлопчатобумажная ткань), щетины и т. д.
Деревянные круги изготовляются из сосновых, ольховых, топо-
левых крестообразно склеенных дощечек или из радиально соста-
вленных и склеенных деревянных клиньев.»
После обточки кругов на токарных станках их покрывают точиль-
ной кожей, для чего следует применять моржовую или буйволовую
кожу. Она обладает достаточной эластичностью и очень большой
'плотностью. Ввиду дефицитности этого материала обычно употре-
бляется воловья подошвенная кожа. Кожа укрепляется на поверх-
ности круга деревянными гвоздями. Предварительно поверхность
круга обмазывают один раз клеем, лучшим по качеству, а кожу сна-
чала размягчают ® воде, затем насухо вытирают сукном и натяги-
вают на круг, сильно расплющивая ее при этом. После полного вы-
сушивания кожи и проклейки круг вторично обрабатывается и точно
центрируется.
В качестве абразивного материала для такого круга служит наж-
дачный порошок. Для нанеЛния последнего поверхность смазывается
лучшим по качеству клеем. Последний перед употреблением размяг-
чается сначала Т> чистой холодной воде в течение нескольких часов,
затем при нагревании до 55—67°—в течение меньшего промежутка
времени. Перед нанесением горячего -клея круг и абразивный, мате-
риал рекомендуется подогревать до 50—60°. Обычно наносятся три
слоя клея, первый слой очень тонкий. После того как первый слой
клея высохнет,-наносится второй слой и, пока он еще горячий, круг
проводят, постепенно повертывая, по наждачному порошку требуе-
мой степени дробления в корыте или ящике. При этом наждак на-
катывается на поверхность круга и удерживается на нем при помощи
клеевой связки.
После накатки круги сушатся на воздухе или 5в печах в течение
нескольких часов в зависимости от качества клея и температуры
окружающей, среды.
Такой же способ нанесения тонкораздробленного абразивного ма-
териала (наждака) производится и на войлочные круги.
Очень хорошо работают круги с кожаным ободом, состоящим из
отдельных кожанных пластин, поставленных на ребро к плоскости
круга и связанных друг с другом внутри. Высота этих пластин дости-
гает 30 мм.
Все деревянные Круги с кожаной или войлочной набивкой приме-
нимы для тонкой шлифовки изделий, имеющих более или менее пра-
вильную форму. Они мало пригодны для округленных и рельефных
изделий вследствие своей жесткости и негибкости. При обработке изде-
лий они касаются только очень небольшой части их поверхности.
Для изделий неправильной формы применяются круги более гиб-
кие, состоящие из отдельных листов материи—из старого шинель-
ного сукна или хлопчатобумажной ткани. Такие круги составляются
15*
йз отдельных Матерчатых дисков путем Их прессования, склеивания
и сшивания.
Шлифующий материал — наждачный порошок, трепел и др.—
замешивается с маслом или расплавленным жиром в кашеобразную
массу и в таком виде наносится на шлифующую поверхность круга.
В продаже существуют готовые полирующие смеси в виде полутвердых
паст различной формы.
Для тонкой шлифовки фасонных выточенных изделий (применя-
ются круги фасонные, соответственным образом профилированные.
Для полировки как окончательной отделки поверхности перед по-
крытием и после него применяются круги полотняные, фетровые, зам-
шевые и др., составленные из отдельных тонких дисков — несшитые.
Они бывают различных размеров, смотря по форме и величине
изделия.
Полирующим материалом для этих кругов служат специальные
полирующие пасты — мастики, которые наносятся на поверхность
кругов путем натирания ее во время работы.
Для полирования серебра или посеребренной поверхности приме-
няются более тонкие, мягкие круги из муслина (шерстяная или бу-
мажная ткань тонкой пряжи), ситца, специального полотна и т. д.
Скорость вращения кругов устанавливается в зависимости от ма-
териала и характера обработки металла, а также от рода шлифующего
или полирующего материала. Чем грубее зерно шлифующего мате-
риала и чем тверже круг, тем меньше должна быть скорость его вра-
щения и наоборот.
Пфангаузер1 дает следующие примерные значения линейных ско-
ростей шлифовальных и полированных кругов, основанные на опыт-
ных данных: для грубого и тонкого шлифования железа, стали,
никеля, нейзильбера — 20 м/сек-, латуни, меди, бронзы, томпака, се-
ребра—16 м!сек; цинка, олова, свинца, алюминия и свинцовых спла-
вов—12—14 mJ сек; для глянцевой полировки железа, стали, никеля,
нейзильбера — 30 mJcck:, латуни, меди, бронзы, томпака, серебра —
25 м/сек; цинка, олова, свинца, алюминия, свинцовых сплавов —
20 mJcck.
При обработке деревянными кругами с наждачной шлифующей
массой или кругами из 'войлока, материи (сукно или хлопчатобумаж-
ная ткань), щетины, фибры и т. д. допускаемое число их оборотов
в зависимости от диаметра устанавливается по Пфангйузеру в соот-
ветствии с табл. 3.
Пасты, применяемые для полировки, очень разнообразны по со-
ставу. Зачастую к ним подмешиваются различные вещества, совер-
шенно лишние и не имеющие никакого положительного значения.
Ввиду сложности процесса и разнообразия свойств обрабатываемого
металла трудно установить вполне обоснованную количественную сто-
рону рецептуры. В зависимости от назначения и условий работы го-
товятся пасты различной твердости и различной вязкости. На основе
опытных данных инж. Томсоном Э. Г. предлагается следующий состав
пасты, дающий наилучшие результаты в работе: олеин — 10 частей,
стеарин — 5—6 частей в случае приготовления твердых паст и
1 Phanhauser, Die Eleetrolitischen Metallniederschlagen, 1928.
20
1—2 части — для получения мягкой пасты и венская известь в коли-
честве, определяемом консистенцией смеси, требуемой для отливки
или прессовки массы. Если почему-либо для определенной консистен-
ции массы необходимо ввести большое количество венской извести,
то для разжижения смеси перед отливкой в формы в нее добавляют
легко летучие жидкости, например бензин, спирт и пр.
Таблица 3
Материал полируемого изделия Диаметры кругов, мм
200 250 300 350 400
Железо, сталь, никель 2 850 2 300 1880 1 620 1 440
Латунь, медь и т, д 2 400 1 900 . 1590 1360 1 190
Цинк, британский металл и т. д. 1960 1 530 ' 1260 1090 960
Иногда вместо стеарина или дополнительно к нему в пасту приме-
шиваются другие вещества — сгустители: парафин или воск.
Для получения паст, которые должны содержать минимальное ко-
личество полутвердого жира, берут один лишь олеин, и массу с абра-
зивным материалом прессуют под большим давлением. В некоторых
случаях, чаще для придания красивого вида, в пасту добавляют не-
большое количество окиси железа — мумии (сорт капут-мортуум).
Ручная полировка. В некоторых случаях, главным образом для
полирования сильно рельефных изделий, употребляются специальные
ручные полировальники из очень твердой стали или камня (кровавик
и пр.). Они бывают различной формы, соответственно рельефу обра-
батываемого изделия. Полировка такими инструментами применима
для более мягких металлов и сплавов, например серебра, золота, меди
и ее сплавов (латуни, в частности), цинка, олова, свинца и др. Воз-
можно применение такого способа полирования и для изделий, покры-
тых никелем, если последний является достаточно плотным, прочно
приставшим к основному металлу и эластичным.
Барабанная шлифовка и полировка. Процессы шлифования и по-
лирования в барабане часто смешиваются друг с другом. Однако по
способу обработки и материалам применяемых абразивных веществ
они имеют много отличительных особенностей.
Шлифование в барабанах производится путем обработки изделий
очень грубыми абразивными материалами (гвозди, обрезки шлака или
какие-либо шлифующие вещества: песчаник, осколки гранита, крем-
ний, песок, пемза и пр.). Обычно при этом процессе изделия вместе
с абразивными материалами плотно набиваются в барабан почти до
самого верха.
Такой процесс шлифовки производится для удаления с поверхно-
сти изделий грубых неровностей и называется, собственно, голтовкой.
Голтовка длится иногда несколько дней. Иногда перед голтовкой,
в случае очень толстой окалины, на поверхности изделий производят
предварительно обработку последних в кислотах {серной или'соля'ной).
21
Полирование во вращающихся барабанах производится так же, как
и при шлифовании, твердыми веществами с различного размера зер-
нами и различной режущей способностью и твердостью.
В качестве таких веществ применяются: размолотый шлак, песок,
пемза, вулканическая зола, венская известь, крокус и др. Все эти
вещества имеют зерна боже меткого размера, нежели употребляе-
мые при шлифовании.
Полирование может производиться как в горизонтальных закры-
тых барабанам, так и в открытых колоколах. Так же, как и шлифова-
ние, полирование в барабанах производится сухим и мокрым спосо-
бами, в зависимости от характера требуемой обработки. Режущая спо-
собность полирующего вещества в значительной степени зависит от
количества присутствующей воды или какой-либо другой жидкости.
Обычно применяются в качестве жидкости растворы слабых щелочей
или солей, например аммиачные соли, цианистые, мыльная вода. Для
грубой шлифовки, а также иногда и для предварительной полировки
применяют слабые растворы кислот (соляной или щавелевой), способ-
ствующих удалению окислов. Существуют также специальные, в боль-
шинстве случаев запатентованные полировочные смеси, состоящие из
различных солей. Они служат для полировки и применяются иногда
с добавками цианистого калия. Так, например, за границей имеются
в продаже полирующие соли под названием «Saponal» и полирующие
мыла под маркой «LPW».
Очень хорошую отделку поверхности дает полировка в барабанах
закаленными стальными шариками, с применением различных поли-
ровочных составов. Кроме указанных смесей употребляют для этой
цели специальные полировочные железные соли. Они составляются
различным образом в зависимости от материала полируемых изделий.
При глянцевой полировке (до блеска) стальными шариками следует
избегать щелочной или кислой жидкой среды. В этом случае приме-
няют обычно чистую воду. В< отличие от шлифовки обработка шари-
ками во вращающихся барабанах не сопровождается удалением с по-
верхности слоя металла.
Так же, как и при полировке кругами, в данном случае блестя-
щая, гладкая поверхность получается в результате сдавливания кри-
сталлических образований и сглаживания малейших неровностей
путем деформации кристаллической решетки. При полировке в бара-
банах очень мелких изделий (пуговицы, заклепки и т. п.) специаль-
ные полирующие твердые материалы не применяются.
Усовершенствованным типом вращающихся барабанов является
барабан, оборудованный специальной тягой для удаления пыли из ка-
меры. Загрузка и выгрузка изделий в этих барабанах производятся
непрерывно автоматически.
По форме барабаны бывают круглые и многогранные — четырех,
шести, восьми и более граней — с круглыми или острыми углами.
В зависимости от формы барабана характер обработки при полировке
может быть различный. Барабаны многогранной формы дают лучшее
перемешивание изделий и более сильное полирующее действие. Для
голтовки обычно устраивают барабаны с небольшим наклоном к своей
оси.
При изготовлении барабана нужно выбирать такой материал, ко-
22
торый не вступал бы . в химическое или электрохимическое взаимо-
действие с полируемым изделием или полирующей смесью.
Для мокрого или сухого полирования более грубых изделий, тре-
бующих применения таких шлифующих веществ, как грубый песок
и гравий, применяются литые барабаны. Барабаны из цветных метал-
лов применяются для полирования изделий в кислотах, вызывающих
коррозию железа, а также для полирования изделий из высокосортной
латуни. В некоторых случаях лучше применять круглые литые бара-
баны, например при полировке стальными шариками. Барабаны из
цветных металлов применяются также для полирования мягких изде-
лий, например изделия из латуни, монель-металла и т. п.
Барабаны для шлифовки вращаются со скоростью около
25 об/мин. и работают в течение нескольких часов.
Барабаны для полировки в зависимости от своего диаметра и ма-
териала полируемых предметов вращаются со скоростью 20—
60 об/мин. и выше для изделий массивных и очень твердых.
Продолжительность полировки в барабанах зависит главным обра-
зом от материала полируемых предметов и колеблется в пределах
0,5—10 часов.
Пескоструйная очистка. Эффективной по качеству механической
обработки поверхности следует признать также очистку изделий
пескоструйным аппаратом. Очистка производится струей песка, вы-
рывающейся с большой силой из отверстия сопла под давлением вы-
ходящего из мундштука сжатого воздуха. При этом песок отдирает
с поверхности металла все находящиеся на ней окислы и делает ее
шероховатой. Пескоструйный способ очистки изделий дает наиболь-
ший успех в тех случаях, когда детали сухие и на поверхности их нет
большого количества жира или масла, вызывающих увлажнение и за-
грязнение песка.
Для обработки песком мелких изделий применяются специальные
барабаны.
Все пескоструйные аппараты снабжаются вентиляцией, обеспечи-
вающей полное удаление металлической пыли и песка. Для предохра-
нения рабочих мест от загрязнения песком и пылью пескоструйные
аппараты снабжаются специальными защитными приспособлениями.
Компрессоры, дающие воздух и песок в пескоструйный аппарат,
устанавливаются мощностью 2,5—5 л. с.
4. Обезжиривание химическое и электролитическое
А. Химическое обезжиривание
Обезжиривание щелочами и органическими растворителями. По
своей химической природе жирные Вещества делятся на две основ-
ные группы — омыляемые и неомыляемые.
К первой группе относятся все растительные и животные жиры,
которые состоят из сложных эфиров глицерина и высокомолекуляр-
ных органических кислот жирного ряда—стеариновой, олеиновой,
пальмитиновой и т. п. Эти жиры называются омыляемыми потому,
что под действием щелочи они разлагаются, давая мыла, предста-
Вддюпще собой метадлицесцце соли жирных кислот и глицерин.
Вторую группу жиров представляют минеральные масла, состоя-
щие из смеси углеводородов различного состава и различной конси-
стенции (от очень легких жидкостей до твердых тел): газолин, вазе-
лин, парафин, различные смазочные масла и т. д. Под действием
щелочей жиры этого вида химически не разлагаются и поэтому назы-
ваются неомыляемыми. Как те, так и другие жирные вещества практи-
чески в воде не растворимы и удаляются с поверхности металлов
путем химической или электролитической их обработки в растворах
определенного состава. При химическом способе обезжиривания при-
меняются растворы щелочей, щелочных солей и ряд специальных
органических растворителей.
Удаление животных и растительных жиров щелочами происходит
в результате их химического разложения и превращения в вещества
с другими свойствами. Процесс протекает по следующему уравнению,
показанному на примере реакции стеарина (стеарин — одна из со-
ставных частей сала) с едким натром:
(С17Н35СОО)зС3Н5 + 3NaOH = 3C„HKNa + С3Н5(ОН)3
(стеарин) + (едкий натр) = (стеарат натрия) -|- (глицерин).
Получающаяся в результате этой реакции натриевая соль стеари-
новой кислоты — стеарат натрия или мыло — (представляет собой
вещество, довольно легко растворимое в воде. Установлено, что рас-
твор мыла в воде по свойствам принадлежит к типу коллоидных.
Подобный эффект может быть получен также при обработке ще-
лочами и других соединений, входящих в состав жиров или масел
животного и растительного происхождения.
Минеральные масла или неомыляемые жиры химически не разла-
гаются щелочами, но они могут при известных условиях щелочной
обработки давать так называемые эмульсии и благодаря этому сравни-
тельно легко отделяться от поверхности металла.
Эмульсии представляют собой смеси не растворяющихся друг в
друге жидкостей, из которых одна распылена в мельчайшие капельки
по всему объему другой жидкости. Образование эмульсий и устойчи-
вость их, как известно, связаны с величиной и изменением поверх-
ностного натяжения на границе поверхности раздела двух жидкостей,
составляющих коллоидальную систему. Как показали опыты Б. Н. Ка-
банова1, уже при погружении металлического предмета, покрытого
маслом, в слегка щелочной раствор сернокислого натрия происходят
разрыв сплошной пленки масла и, вследствие изменения поверхност-
ного натяжения и увеличения смачивания поверхности металла рас-
твором, собирание ее в отдельные капельки. Такое явление в большей
или меньшей мере, очевидно, может иметь место и в другом щелоч-
ном растворе, дающем с маслом поверхности раздела с определенным
поверхностным натяжением. Однако для полного удаления масла с
поверхности металла и перевода его в состояние эмульсии одно это
условие может быть недостаточным. Не всякий раствор, даже содер-
жащий достаточное количество щелочи, может оказаться пригодным
для эмульгирования минерального масла, так как силы сцепления
* Кабанов Б. Н., „Механизм электролитического обезжиривания металлов",
„Жури, физнческ. химии", т. IV, вып. 5, 1933.
24
или притяжения между молекулами жидкости (масло)' и молекулами
твердого тела могут быть еще достаточно большими (гистерезис сма-
чивания поверхности маслом), чтобы удерживать капельки масла на
поверхности металлического предмета.
Разрыв масляной пленки и собирание ее в капельки при опуска-
нии предмета в раствор какой-либо едкой щелочи или щелочной соли
только облегчает в дальнейшем процесс полного -обезжиривания ме-
таллов. Мы считаем, что при химическом способе Обезжиривания в
щелочах необходимыми условиями, обеспечивающими скорое и полное
освобождение поверхности металла от неомыляемых жиров, являются
присутствие в растворе поверхностно активных веществ или эмульга-
торов, и наличие движения слоев жидкости вследствие нагревания
(лучше до температуры кипения), перетекания раствора или переме-
шивания его мешалками.
Механизм действия эмульгаторов, невидимому,
заключается в том, что, адсорбируясь на поверхно-
сти раздела двух фаз (масло — раствор), они, во-
первых, понижают поверхностное натяжение, спо-
собствуя тем самым отлипанию капелек масла от
поверхности металла (преодоление гистерезиса сма-
чивания маслом) и переходу их в состояние эмуль-
сии, и, во-вторых, образуя на поверхности каждой
частицы или шарика эмульсии прочный адсорб-
ционный слой, они предохраняют последнюю от рас-
слаивания или коагуляции.
Перемешивание раствора в значительной мере
способствует ускорению процесса удаления масла
с поверхности изделий. При этом происходит, во-
первых, обновление слоев эмульгирующей жидко-
сти вокруг металла, и, во-вторых, как бы механи-
ческое сбивание отдельных капелек масла с его
поверхности. Иллюстрацией процесса образования
стойкой эмульсии может служить схематически изображенное на
фиг. 1 строение насыщенной адсорбционной пленки эмульгатора,
обволакивающей шарик эмульсииНаибольшая устойчивость эмуль-
сии достигается в том случае, когда адсорбционная пленка предста-
вляет собой насыщенный поверхностный слой активных групп эмуль-
гаторов.
В качестве эмульгаторов, служащих добавками к щелочному рас-
твору при химическом способе обезжиривания металлов, могут слу-
жить следующие вещества, принимающие в растворе коллоидальное
состояние: жидкое стекло, мыло, жирные кислоты, декстрин, желати-
на, клей, различные белковые вещества и пр. Эти вещества добавля-
ются в обезжиривающий щелочной раствор в небольшом количестве
0,5—3,0 г/л. Необходимая концентрация их зависит от эмульгирую-
щей способности каждого из них и от рода и количества масляных
загрязнений, находящихся на поверхности металла.
При омылении и эмульгировании жиров и масел не обязательно
Фиг.Г.Строение ад-
сорбционной плен7
кн эмульгатора:
А—активные груп-
пы; С — углеводо-
родная цепь; О—
шарик эмульсий
(дисперсная фаза
углеводород— мас-
ло) в водной среде
(дисперсная сре-
да).
‘Вознесенский С. А. и Ребиндер П. А., Руководство к лаборатор-
ным работам по физической химии, 1926,
Я
употребление концентрированных растворов едких щелочей (NaOH
или КОН)1. В .некоторых случаях высокая концентрация их вредна,
так как она способствует образованию на поверхности некоторых
легко окисляющихся металлов окисных пленок в виде побежалостей.
При обезжиривании металлов, растворяющихся в щелочах, например
олово, свинец, цинк, алюминий, концентрированные растворы щело-
чей вызывают сильное и быстрое разрушение их поверхности.
Кроме того, в очень концентрированном растворе едкого натра мы-
ло почти не растворяется, и поэтому оно может осесть на поверхности
металлов1. По Вернику2 повышенное значение Ph раствора (увели-
чение щелочности) увеличивает его эмульгирующую способность, но
уменьшает устойчивость эмульсии.
Очень слабые растворы какой-либо щелочи тоже не пригодны,
ввиду того, что они быстро теряют свою силу в результате реакции
омыления жиров, а также вследствие поглощения углекислоты из воз-
духа и превращения в углекислые соли или вследствие нейтрализа-
ции кислотными парами, выделяющимися обычно из травильных рас-
творов, находящихся часто по соседству с щелочными баками.
Наиболее правильным и выгодным считается применение доста-
точно концентрированных растворов солей, подвергающихся легко
гидролизу с образованием свободной щелочи. В качестве таких со-
лей можно употреблять: углекислый натрий Na;2C03, углекислый ка-
лий K2C0s, фосфорнокислый натрий — тринатриевый фосфат Na3P04,
силикат натрия Na2SiOs, алюминат натрия NaA102, цианйстый натрий
или калий NaCN, KCN, буру Ка^От, мыло и пр.
Вследствие гидролиза этих солей щелочность (раствора поддер-
живается почти до полного их' разложения более или менее постоян-
ной, несмотря на расходование гидроксильных ионов на омыление
жиров.
Силикаты и алюминаты натрия при гидролизе, кроме того, дают
‘коллоидные растворы, обладающие' достаточно высокой эмульгирую-
щей способностью. Поэтому в растворы этих веществ можно не вво-
дить добавки других эмульгаторов. Если на поверхности обезжири-
ваемого предмета вместе с минеральным маслом присутствует доста-
точное количество также и животного или растительного жира, то
в этом случае щелочные растворы могут работать без специальных
добавлений эмульгаторов, так как мыло, получающееся в этих раство-
рах в результате омыления жира, будет в достаточной степени обес-
печивать их эмульгирующую способность. В большинстве случаев к
растворам всех слабощелочных солей для ускорения процесса омыле-
ния добавляют некоторое количество свободной щелочи (NaOH или
КОН).
На основании исследований различных щелочных растворов, глав-
ным образом, с точки зрения их эмульгирующего действия на мине-
ральные масла, Baker и Scheidwind3 считают, что наилучшей очисти-
тельной способностью обладают растворы едкого натра и фосфорно-
1 Вlum a. Hogaboom, Principles of Electroplating and Electroforming
1930.
3 We r nick, .Die Metallwaren Ind. u. Galw.*, 18, 1931.
3 .Trans. Am. Electrochenj Soc,*- v. 45. 19?4>
26
кислого натрия Na3PO4. Применение последнего более предпочтитель-
но в том отношении, что он не оказывает разрушающего действия на
поверхность металлов, особенно легко растворяющихся в щелочах, и
с поверхности изделий легко удаляется водой.
Наиболее эффективными эмульгаторами являются различные мыла
и жидкое стекло.
Смесь фосфорнокислого натрия и жидкого стекла является очень
хорошим очистителем, особенно широко применяемым за границей под
названием очистителя РЗ. При употреблении в качестве щелочного
очистителя мыльного раствора необходимо принимать во внимание
растворимость мыла и способность его легко отполаскиваться, т. е.
•легко удаляться с поверхности металла при промывке последнего -во-
дой после обезжиривания. Поэтому состав мыла, особенно когда оно
является не добавкой, а служит исходным веществом для приготовле-
ния обезжиривающего раствора, имеет большое значение, так как не-
которые сорта его, например мыло, содержащее сало и оливковое ма-
сло, канифольное мыло и др., плохо смываются тюдой с поверхности
изделий после обезжиривания и могут остаться на ней (поверхности)
в виде твердой пленки (при промывке в холодной воде). Лучше всего
применять мыло, приготовленное из ненасыщенных жирных кис-
лот, содержащихся, например, в льняном масле и рыбьем жире. Ка-
лийные мыла лучше смываются и легче растворяются, нежели
натриевые.
Нередко для повышения очистительной способности щелочных
растворов применяются добавки к ним твердых нерастворимых ве-
ществ к мелкораздробленной форме. Таковыми служат мелкие порош-
ки различных твердых тел, например мелкораздробленный уголь, гель
кремниевой кислоты, каолин, глинозем, песок и т. п. Влияние этих ве-
ществ может быть двоякого рода: с одной стороны, ударяясь о поверх-
ность металла (при нагревании и перемешивании раствора), они ме-
ханически раздробляют и отщепляют пленку масла или жира (по-
добно действию песочной струи) и уносят ее в раствор; с другой, —
вследствие очень большой общей поверхности весьма мелких частиц,
они подобно указанным выше эмульгаторам создают вокруг каждой
капельки масла прочный адсорбционный слой, стабилизируя эмуль-
сию и защищая ее от расслаивания.
Bancroft1 указывает, что' эмульгирующее действие твердых частиц
заключается в том, что они .располагаются между маслом и водой,' ад-
сорбируясь на поверхности раздела фаз, и делают поэтому эмульсию
более стойкой.
Повышенное эмульгирующее действие очень мелкораздробленных
твердых тел, взвешенных в горячем щелочном растворе, было отме-
чено также Watts2.
Практически нерастворимые твердые тела как добавки в щелочной
раствор при химическом и особенно электролитическом (см. ниже)
обезжиривании не имеют широкого применения, хотя при правильном
подборе материалов и правильно установленном режиме работы их
значение могло бы быть достаточно высоким. Основным условием,
1 Applied Colloid Chemistry, 1927.
2 „Monthly Rev. Am. Electroplaters’ Soc-', v. 8, 192J.
27
обеспечивающим эффективность этих добавок, является высокая сте-
пень их измельченное™.
Одним из очень важных условий, обеспечивающим полное удале-
ние с поверхности изделий как омыляемых, так и неомыляемых жи-
ров, является повышенная температура щелочных растворов. Повы-
шенная температура усиливает гидролиз щелочных солей, следова-
тельно, увеличивает щелочность раствора (это имеет значение ® слу-
чае применения слабощелочных солей),-ускоряя реакцию омыления
жиров (животных и растительных). Кроме того она создает известные
условия для циркуляции раствора, ускоряя тем самым процесс эмуль-
гирования масел.
Полученные в результате обезжиривания мыла растворяются в го-
рячих щелочах значительно легче, чем в холодных.
Рекомендуется держать температуру щелочных растворов от 70°
и выше до точки кипения.
Кроме щелочных растворов при химическом способе обезжирива-
ния часто применяются, главным образом, для удаления неомыляемых
жиров, I специальные органические растворители, например бензин,
газолин, бензол, керосин, трихлорэтилен, четыреххлористый углерод,
дихлорэтан и др. Действие этих веществ на жиры сводится к обыч-
ному процессу растворения.
Наиболее эффективным из них, усиленно рекомендуемым и ши-
роко применяемым за границей *, является трихлорэтилен, сокра-
щенно именуемый заграничными фирмами «ТРИ». В отличие от
других растворителей (бензин, керосин и пр.) он не огнеопасен, обла-
дает очень большой растворяющей способностью всех жиров (омыляе-
мых и неомылйтемых) и не оказывает разъедающего действия на ме-
таллы. Применение трихлорэтилена в специальных аппаратах, по
ваграничным данным, дает большую экономию.
Все органические растворители лучше работают при повышенной
температуре — процесс, растворения жиров при этом ускоряется. Обез-
жиривание производится последовательно в иесколькйх ваннах —
в двух или трех, из которых последняя должна содержать совершенно
чистый растворитель, непрерывно сменяемый свежими порциями. Это
условие является необходимым потому, что раствор масла, увлекае-
мый изделиями при выгрузке их из первой обезжиривающей ванны,
после испарения растворителя оставляет всегда на поверхности ме-
талла масляную пленку, толщина которой будет тем больше, чем
дольше работал данный растворитель, т. е. чем больше растворилось
в нем масла при операции обезжиривания.
Почти все органические растворители после их загрязнения жи-
рами легко поддаются регенерации. Очистка производится путем обыч-
ной дестилляции растворов при температуре их кипения в перегон-
ных аппаратах. При этом жиры как продукт, кипящий при более вы-
сокой температуре,, не перегоняются и остаются на дне аппарата. Это
свойство органических растворителей дает им большое преимущество
перед другими обезжиривающими растворами.
.Отрицательным моментом в применении трихлорэтилена, а также
1 Гебберлинг, «Обезжиривание металлических поверхностей посредством
„ТРИ“, Die Metallwaren Ind- U. Galw.’, 5, 1932.
28
И чепф&ххлорйстоло углерода для целей обезжиривания ® наших
условиях является дефицитность обоих продуктов и слишком высокая
их стоимость.
Общим недостатком способа обезжиривания органическими раство-
рителями служит то обстоятельство, что он требует обработки изделий
в нескольких ваннах с одним и тем же растворителем различной
степени чистоты, не всегда гарантируя, однако, полное освобождение
поверхности металла от масляных загрязнений даже при этом усло-
вии. Нужно очень большое количество операций (по количеству от-
дельных ванн) промывки изделий в чистом растворителе, чтобы до-
стигнуть положительного результата. Wernick1 считает, что полную
очистку органические растворители произвести не могут, так как по-
сле их испарения на поверхности выгруженного изделия всегда
должна остаться хотя бы очень тонкая, незаметная для глаза, жиро-
вая пленочка, достаточная для того, чтобы тюспрепятствовать приста-
ванию покрытия. Поэтому очень часто после сушки изделий, выгру-
женных из вайн с органическим растворителем, применяется допол-
нительное обезжиривание в щелочах: химическое или электролитиче-
ское или протирание щетками с (венской известью.
Б. Электролитическое обезжиривание
В последнее время широко стал применяться электролитический
метод обёзжиривания металлов. Эффективность этого метода в неко-
торых случаях во много раз превышает эффективность обычных хи-
мических способов очистки. Электролитическое обезжиривание произ-
водится большей частью на 'катоде в растворе какой-нибудь щелочи
или щелочной соли (5—15%), обладающей хорошей проводимостью.
Обычно для этой цели применяются в качестве электролитов: едкий
натр, углекислый натрий, углекислый калий, фосфорнокислый нат-
рий, цианистый натрий или калий и др. Иногда добавляется в эти
растворы небольшое количество каких-нибудь эмульгаторов — мыло
или жидкое стекло.
В качестве анодов при обезжиривании обычно применяются же-
лезные или стальные или еще лучше никелевые пластины. Преиму-
щество применения никеля в качестве анодов заключается в том, что
он почти абсолютно электролитически не растворяется в щелочном
растворе (исключение, составляет аммиачный раствор). Железо в
этом случае на аноде немного разрушается. При этом1 оно загрязняет
раствор и частично осаждается на катоде. Это имеет отрицательную
сторону, главным образом, при катодном обезжиривании полирован-
ных изделий непосредственно перед их покрытием. В тех случаях,
когда корпус ванны сделан из железа, анодом могут служить стенки
самой ванны.
Механизм процесса электролитического обезжиривания металлов
на катоде сводится, во-первых, к омылению жиров (животных и ра-
стительных) гидроксильными ионами, концентрация которых у ка-
тода бывает постоянно повышенной, благодаря электролитическому
разряду и выделению водорода, и, во-вторых, к эмульгирующему и
1 Wernick, ,Die Metallwaren Ind. u. Galw.“, 18, 1931.
29
механическому действию выделяющихся пузырьков водорода йа все
жиры и масла (омыляемые и неомыляемые).
Существуют различные взгляды на механизм процесса электроли-
тического обезжиривания. Его рассматривают и как каталитическую
химическую реакцию (Голомбик, Лев и Петин *) и как чисто механи-
ческий процесс разрыхления масляной пленки и сбивания ее с по-
верхности металла.
Мы считаем наиболее правильной точку зрения, высказанную и
подробно разобранную Б. Н. Кабановым, проделавшим специальную
исследовательскую работу по вопросу о механизме электролитического
обезжиривания.
Исследования Б. Н. Кабанова над электролитическим обезжирива-
нием покрытых вазелиновым маслом различных металлов (ртуть, же-
лезо и платина) в подщелоченном растворе Na2SO4 показали, что ос-
новную роль в процессе электролитического обезжиривания играют
явления смачивания и их зависимость от катодной поляризации. По
наблюдениям Б. Н. Кабанова уже погружение покрытого маслом ме-
таллического предмета в раствор электролита вызывает, вследствие
действия -силы поверхностного натяжения, разрывы пленки масла и
собирание ее в капельки. Автор показал далее, что при поляризации
металла без выделения газа краевые углы образовавшихся капель
значительно уменьшаются, вследствие чего прилипание масла к по-
верхности металла еще более ослабевает. Параллельно с этим смачи-
ваемость металла водой с повышением катодной поляризации увели-
чивается. Дальнейший ход процесса отделения масла от поверхности
металла при электролитическом обезжиривании автор объясняет сле-
дующим образом. Под влиянием силы поверхностного натяжения
мелкие пузырьки газа (в данном случае водород), отрываясь от
электрода около капли масла, задерживаются на поверхности послед-
ней, оставаясь на границе между маслом и раствором (фиг. 2). Проч-
ность такого положения пузырька определяется его размером. По
мере 4wo как размеры пузырька будут увеличиваться за счет вклю-
чений новых порций выделяющегося газа, капля масла под влиянием
поднимающей силы пузырька будет вытягиваться (фиг. 3), силы
сцепления ее с поверхностью металла (гистерезис смачивания) при
уменьшении краевого угла будут уменьшаться, и в конце концов она
оторвется, увлекаемая пузырьком газа на поверхность раствора.
При таком толковании механизма процесса электролитического
обезжиривания добавление в .раствор 1эмульгаторов— поверхностно
активных веществ — имеет меньшее значение, нежели при химиче-
ском способе очистки. Положительную роль они могут сыграть только
в смысле превращения отщепленной пузырьками-газа от поверхности
металла масляной пленки в состояние устойчивой эмульсии.
Однако и с этой точки зрения специальные добавки эмульгаторов
могут быть необязательными, так как, во-первых, увлекаемый на по-
верхность раствора слой неомыляемого жира может периодически или
непрерывно удаляться вместе с верхним слоем раствора путем осо-
бых приспособлений в ванне и, во-Ьторых, на поверхности предмета
всегда почти присутствует то или иное количество животного или
1 Журнал общей хнмин, т. 2, вып. 10, 1932 и т. 3, вып. 1, 1933.
30
растительного жира, в результате омыления которого будет получаться
в растворе мыл of Присутствие же большого количества эмульгаторов
в растворе может оказаться даже вредным для электролитического
обезжиривания, так как пена, (всегда образующаяся при этом на по-
верхности раствора, будет задерживать выделяющиеся у электродов
газы (водород и кислород), которые в случае искрения контактов
могут взорваться. Иногда взрыв бывает настолько сильным, что рас-
твор выбрасывается из ванны.
Фиг. 2. Пузырек газа,
на границе масло—
раствор.
Фиг. 3. Капля масла с пу-
зырьком перед отрывом от
железного'-катода, ув. 4,25.
Необходимость применения для электролитического обезжирива-
ния именно раствора щелочи или щелочной соли, а. не какого-либо
другого, вызывается тем обстоятельством, что, во-первых, в таких
растворах можно получить очень высокое значение катодной поляри-
зации (в противоположность кислым растворам), и, во-вторых, пу-
зырьки выделяющегося газа на катоде в щелочном растворе имеют
значительно меньшие размеры, чем в кислом. Мелкие же пузырьки
будут значительно легче и в большем количестве задерживаться на
границе между маслом и "Щелочным раствором, нежели крупные. Кро-
ме того щелочной раствор для электролитического обезжиривания
имеет значение как необходимая среда для омыления животного или
растительного жира.
Перемешивание электролита, вызываемое выделяющимися газами,
в значительной степени ускоряет процесс обезжиривания.
Повышенная температура (раствора (60—70°) при электролитиче-
ском обезжиривании оказывает примерно такое же влияние, как и при
химической обработке. Конечно, в данном случае скорость процесса
удаления жиров при повышении температуры увеличивается в мень-
шей степени, нежели при химическом обезжиривании. Повышение
температуры растворов, как известно, повышает их электропровод-
ность, понижая при одинаковой плотности тока напряжение на за-
жимах электродов. В этом смысле при электролитическом обезжири-
вании температура играет, следовательно, также роль фактора, умень-
шающего расход электроэнергии. Особенно это имеет значение в том
случае, когда в качестве электролита употребляются слабопроводя-
щие соли и электролиз производится при высоких шлюггностях тока.
81
Обычно при-электролитическом обезжиривании температуру элек-
тролита держат около 60°. Плотность тока при обезжириваний долж-
на быть такова, чтобы количество выделяющихся пузырьков газа
было достаточно и для механического отщепления капелек масла и
для перемешивания раствора, способствующего также более быстрой
очистке металла.
Повышение плотности тока, следовательно, должно оказывать
большое влияние на скорость процесса обезжиривания. Можно с уве-
ренностью сказать, что чем больше плотность тока при данном коли-
честве жировых загрязнений, тем быстрее будет предмет обезжири-
ваться, а также чем больше жиров, на поверхности предмета, тем
больше при заданной продолжительности процесса должна быть
плотность тока, и обратно. Разумеется, такая зависимость не может
быть строго пропорциональной, так как, во-первых, не все пузырьки
водорода принимают участие в работе по удалению капелек масла
(задерживаются на поверхности капелек масла главным образом мел-
кие. пузырьки), во-Рторых, величина этих пузырьков не всегда , оди-
наковая и меняется в зависимости от различных условий (плотность
тока, свойства и концентрация электролита). Обычно плотность тока,
применяемая при электролитическом обезжиривании, колеблется в
пределах 2—10 А/дл2. В некоторых особых случаях, например при
быстром электролитическом покрытии проволоки и ленты на конвей-
ерной установке (см. ниже), рлюггаюсть тока в обезжиривающей ванне
повышают до 50 А/дл2 и больше.
Напряжение на зажимах электродов при обезжиривании в обыч-
ных растворах едких щелочей и их солей колеблется в зависимости от
состава и концентрации раствора, плотности тока, температуры и
расстояния между электродами в пределах 2—12 V, а иногда и выше.
Расстояние между электродами при обезжиривании определяется,
главным образом, величиной и формой изделий, а также соображения-
ми наибольшей экономии электроэнергии и колеблется обычно в пре-
делах 5—15 см.
Одним из недостатков электролитического обезжиривания на ка-
тоде является влияние этого процесса на физические свойства обра-
батываемого металла. Дело в том, что при обезжиривании на катоде
выделяющийся водород в довольно значительном количестве (это за-
висит от свойств материала катода, плотности тока, продолжительно-
сти процесса и т. д.) проникает внутрь металла, нарушая известным
образом первоначальное состояние кристаллической решетки на
некоторой, по крайней мере небольшой толщине слоя. Рентгенографи-
ческий анализ структуры насыщенного водородом основного метал-
ла показывает растяжение первоначальной кристаллической решет-
ки1. Это вызывает понижение физических свойств металла: он
становится хрупким и ломким, особенно для стальных изделий. Неко-
торые из них, например изделия из пружинной стали, тонкой листо-
вой стали, после электролитического обезжиривания настолько
теряют свою механическую прочность, что ломаются уже при самом
незначительном физическом усилии. В большинстве случаев на по-
верхности такого изделия покрытие другим металлом получается
1 Die Matallwaren Ind. u. Galw.“, 7, 1933.
32
также неудовлетворительным, плохо пристающим, хрупким или с мел-
кими пузырчатыми вздутиями.
Во избежание различных осложнений, связанных с явлением на-
водороживания металла, применяют в некоторых случаях не катод-
ное, а анодное обезжиривание:.
Сущность процесса анодного обезжиривания в части механиче-
ского отделения капелек масла от поверхности катода выделяю-
щимся кислородом сводится к тем же основным принципам, которые
были высказаны при объяснении механизма процесса катодного обез-
жиривания.
1По данным Б. Н. Кабанова анодная поляризация уменьшает крае-
вые углы капелек масла не в меньшей степени, чем катодная. Высо-
кая анодная поляризация железа достигается благодаря его пасси-
вированию. Однако скорость процесса обезжиривания на аноде
значительно ниже, нежели При катодном обезжиривании. Это явление
объясняется следующими обстоятельствами. Во-первых, у анода про-
исходит понижение значения pH или степени щелочности, а, следо-
вательно, и ослабление реакции омыления жиров (животных и
растительных). Во-вторых, пузырьки кислорода вследствие большей
величины и меньшей способности задерживаться на поверхности
масляных капелек оказывают более слабое воздействие, нежели nv-
зырьки водорода.
При анодном обезжиривании в щелочах явлений ломкости и хруп-
кости металлов обычно не наблюдается.
Иногда применяют комбинированную обработку — сначала на
катоде, затем на аноде. В этом случае удается достигнуть за очень
короткий промежуток времени почти полного удаления водорода из
металла.
Выбор метода обезжиривания в зависимости от природы металла и
предварительной механической его обработки. Подбор рецептурных
условий, как и выбор самого метода обезжиривания, зависит не толь-
ко от характера и количества жировых загрязнений, но и от природы
металла и характера его предварительной механической обработки.
Мы рассматриваем операцию обезжиривания, разделяя ее на два
вида: как первичную операцию обработки в гальваническом цехе для
удаления жиров с грубо обработанных изделий, имеющих на своей
поверхности обычно большое количество различных загрязнений, и
как одну из последних операций подготовки, применяемую главным
образом при обезжиривании полированных изделий.
Для обезжиривания изделий с грубо обработанной поверхно-
стью применяются как химический, так и электролитический способы.
Разумеется, при желании достигнуть очистки металла, только от
жировых загрязнений щелочная обработка (химическая и электроли-
тическая) в любом щелочном растворе может быть применима только
для металлов трудно или совсем не растворяющихся в щелочах, на-
пример железо, сталь, чугун, медь и ее сплавы, никель и др.
Изделия из металлов, легко растворяющихся в щелочах, например
из олова, цинка, свинца, алюминия и др., .а также изделия из черных
металлов, имеющих на своей поверхности места оловянной пайки, при
обезжиривании в щелочном растворе будут разрушаться. Поэтому,
если разъедание поверхности таких изделий вредит дальнейшей обра-
3 Основы гальваностегии 3
(*ютке металла, следует ПройзвдДйть йх оНйсТку ОФ ЖйрбйЫХ загряз-
нений в органических растворителях. Конечно, если это обстоятель-
ство не имеет значения, то обработка в щелочах изделий из таких
металлов может одновременно выполнять и роль обезжиривания и
роль травления. Однако во избежание сильного разрушения металла
следует все же применять более слабые щелочные растворы, состоя-
щие главным образом из щелочных солей: углекислый натрий, угле-
кислый калий, фосфорнокислый натрий и др.
Химический способ обезжиривания металлов в щелочах применим
для изделий самой разнообразной формы.'
В практике существует большое разнообразие различных по со-
ставу щелочных очистителей. Мы считаем, что типичными простыми
щелочными очистителями при химическом способе обезжиривания
грубо обработанных изделий из стали, железа.и чугуна, а также и
изделий из. цветных металлов, не растворяющихся в щелочах, могут
служить следующие растворы:
1) еодкий натр или едкое кали — 50—100 Ил воды;
2) углекислый натрий или углекислый калий —100—150 г/л воды;
3) фосфорнокислый натрий —150—100 г/л и едкий натр или
едкое кали— 10—20 г/л воды.
В случае обработки изделий, содержащих на своей поверхности
кроме омыляемых жиров минеральные масла,' в перечисленные ще-
лочные растворы добавляют небольшое количество эмульгаторов:
мыло (0,5—2 г/л), жидкое стекло (1—2 г/л) или какие-нибудь твердые
тела из приведенных выше в том же или несколько большем коли-
честве.
Температура щелочных растворов должна быть от 70° и выше до
точки кипения.
Blum и Hogaboom1 предлагают, невидимому, как для химического,
так и электролитического обезжиривания следующий типовой раствор,
который может быть иОиользован как основа, к которой добавляются
другие вещества: углекислый натрий Na2COs. 10Н20—165 г/л и ед-
кий ,ратр NaOH —15 г/л. Тот же результат может быть получен при
употреблении 75 Н'л 20% технического едкого натра.
Фосфат натрия можно употреблять для замены всего или части
углекислого натрия.
При химическом способе обезжиривания грубых изделий из ме-
таллов, легко растворяющихся в щелочах, или изделий из черных ме-
таллов, содержащих на своей поверхности места пайки, можно при-
менять те же растворы, но с меньшей концентрацией щелочи или соли.
Лучше пользоваться для этой цели указанными растворами фосфор-
нокислого натрия (з), углекислого или двууглекислого натрия. Иногда
применяются также растворы извести (3—5%) с добавкой и без
добавок едкого натра или едкого кали (0,5—2%). Пользуются также
одним горячим раствором мыла (2—7%) или, чаще, с добавками в не-
большом количестве (0,.5—2%) какой-нибудь щелочи (едкого натра,
едкого кали, соды и др.).
Электролитический. способ обезжиривания металлов с грубо обра-
* Blum a. Hogaboom, Principles of Electroplating and Electroforming,
>30.
34
ботанной й сйЛьМо загрязйеййой жирами поверхностью с успехом
применяется для изделий, во-первых, трудно или совсем не раство-
ряющихся в щелочах, и, во-вторых, имеющих более, или менее! пра-
вильную форму, например листы, проволока, лента и различные
изделия, не.имеющие глубоких впадин и узких глубоких отверстий.
Для очень рельефных изделий этот способ менее пригоден вслед-
ствие того, что обычно применяемые для обезжиривания электролиты
не обладают Достаточной рассеивающей способностью или, как гово-
рят, работой в глубину.
Вопрос'о том, принять ли катодное или анодное обезжиривание
или и то и другое последовательно, зависит как от материала, так и
способа обработки изделия. Как уже было сказано, при катодном
обезжиривании происходит изменение физических свойств металла,
сопровождающееся нарушением его кристаллической решетки за
счет проникновения внутрь металла водорода. При этом металл в
большинстве случаев делается хрупким и ломким. Поэтому во избе-
жание этих осложнений для закаленных стальных изделий, главным
образом изделий из тонкой листовой или проволочной стали (сталь-
ные пластины, пружины и пр.), следует применять не катодное, а"—
как менее опасное — анодное обезжиривание, пренебрегая его мень-
шей скоростью, или лучше вместо электролитического обезжиривания
производить химическую обработку в слабых щелочах или органиче-
ских растворителях.
В тех йлучаях, когда, включения водорода в металле в отношении
Изменения его физических свойств не имеют большого значения, на-
пример, при обработке массивных железных, чугунных, а также иног-
да и толстых (Сйальных изделий, и опасны, главным образом, с точки
зрения качества покрытия их другими металлами (влияние на приста-
ваемость и эластичность покрытия), применяют после катодного обез-
жиривания обработку изделий на аноде в том или в другом таком же
по составу растворе.
Такую же обработку применяют для металлов (не растворяю-
щихся в щелочах) после их полировки перед покрытием (см.
ниже).
В качестве электролита для электролитического обезжиривания
грубо обработанных изделий из металлов, трудно растворяющихся в
щелочах, применимы все указанные выше для такого рода металлов
щелочные растворы (1, 2 и 3). Руководствуясь соображениями наи-
меньшей затраты электроэнергии, рекомендуется, главным образом
для плоских и цилиндрических изделий правильной формы из чер-
ных металлов (листы, проволока, лента), применять, как хороню про-
водящий электрический ток. 10% раствор едкого натра или едкого
кали.
Этот раствор по электропроводности стоит выше, чем все указан-
ные, а следовательно, он требует и меньшего расхода электроэнергии.
Более высокая концентрация едкого натра не требуется, так как при
дальнейшем повышении его содержания электропроводность раствора
увеличивается не на много.
В качестве примера можно привести данные, показывающие из-
менение электропроводности растворов едкого натра и углекислого
натрия в зависимости от концентрации при 18° (табл. 4).
35
Таблица 4
р NaOH КОН (15°) NajCOg К2С03
1000 п 104 к 1000 п ю4 к 1000 п io4 к 1000 п Ю4 к
4,2 0,777 1464 —
5,0 1,319 1969 — -— 0,991 451 0,756 561
8,4 •— 1,612 2723 — — — —
10,0 2,779 3124 — — 2,082 705 1,579 1038 ’
15,0 —. — , -— — 3,277 836 — —
16,8 — — 3,467 4558 —-• — —- —
20,0 6,122 3270 — — — — 3,448 1806
25,0 — — — — —— — — —
25,2 —• — 5,583 5403 — — —
30,0 10,015 2022 — — — — 5,641 2222
33,0 — — 7,978 5221 — — — —
Р — весовые проценты безводного вещества в 100 частях раствора;
п — число грамм-эквивалентов в 1 см3;
к — удельная электропроводность.
Опыты по электролитическому обезжириванию железных пласти-
нок 1 также показали, что напряжение на зажимах ванн при электро-
лизе (2—5 А/д.м2) раствора едкого натра примерно в 2—3 раза меньше,
нежели раствора углекислой соды (с одинаковым процентным содер-
жанием вещества) и в 4—5 раз меньше, нежели раствора фосфорно-
кислого натрия. При этом, чем выше плотность тока, тем эта разница
значительнее.
Повышение температуры в 10% растворе едкой щелочи увеличи-
вает электропроводность сравнительно не на много. Однако для луч-
шей очистки изделий, главным образом изделий из черных металлов,
следует поддерживать температуру около 40—60°.
Плотность тока для обезжиривания изделий с большой поверх-
ностью (листы и др.) рекомендуется применять от 2 до 10 А/дм2.
Более высокие плотности тока в данном случае применять невыгодно,
так как необходимая мощность динамомашины в связи с этим мо-
жет оказаться слишком большой.
Для обезжиривания проволоки и лент при покрытии на конвейер-
ной установке (см. ниже) применяемые плотности тока колеблются
в значительно больших пределах.
Здесь при выборе плотности тока помимо величины поверхности
имеет значение также толщина проволоки или ленты (опасность на-
гревания контакта), скорость движения или требуемая скорость про-
цесса и допускаемые размеры (по длине) обезжиривающей ванны.
Конечно, все это должно быть в соответствии с количеством жировых
загрязнений.,
Огчытные данные, полученные в стационарных ваннах и на полу-
‘Кудрявцев Н. Т. н Петрова В. Н. Электрохимическая лаборато-
рия вэи.
Зв
заводской конвейерной установке1 при обезжиривании проволоки
диаметром 0,з—5 мм (перед цинкованием, см. ниже) и ю%> раство-
ре NaOH показали, что плотности тока 50—300 к!дм2 дают высокий
эффект очистки. Удаление жиров с поверхности проволоки дости-
гается в течение нескольких секунд (2—Ю сек.). Напряжение на
ванне при расстоянии между электродами в 2 см колеблется в зави-
симости от диаметра проволоки, плотности тока и температуры
электролита в пределах от 2 до 6 V (при Д4 >=от ю до 275 к/дм2\
t=>60°; d = Q,8 и 1,4 мм).
Для электролитического обезжиривания металлов, легко раство-
ряющихся в щелочах, во избежание сильного разрушения поверхно-
сти применимы только более слабые, из указанных, растворы щелоч-
ных солей (2 и 3). При необходимости кроме обезжиривания произ-
водить в щелочах и протравливание таких изделий можно, и даже
лучше, применять анодную обработку взамен катодной или после
нее. Вообще обработка после катодного обезжиривания таких изделий
на аноде (лучше в отдельном растворе) весьма полезна и бывает
иногда необходима для удаления с поверхности различных соедине-
ний (гидратов, основных солей и пр.), образующихся во время катод-
ного обезжиривания.
Изделия из черных и некоторых цветных металлов, трудно раство-
ряющихся в щелочах (медь, латунь, никель и др.), после тща-
тельной их отделки, например после полировки
перед покрытием, могут обезжириваться также химическим и
электролитическим способами.
В случае щелочной обработки (химической или электролитиче-
ской) необходимо применять более слабые растворы, не меняющие фи-
зические свойства поверхности самого металла, например растворы,
указанные выше для химического обезжиривания металлов, легко
растворяющихся в щелочах (грубые изделия). Вообще в этом случае
выполнение операции обезжиривания требует известной осторожности
и аккуратности. Хорошо пользоваться растворами фосфорнокислого
натрия. При химическом обезжиривании хорошие результаты дает
раствор мыла. Полезно добавлять в растворы слабых щелочей, на-
пример соды или поташа, главным, образом при обезжиривании
меди (как химическом, так и электролитическом) и ее сплавов,
а также и никеля, небольшое количество цианистого калия (7—
10 е/л) 2. Он хорошо удаляет различные пленки, пятна, особенно при
электролитической очистке. Последний в более концентрированном
виде (2—3%) можно применять также и как самостоятельный
раствор при обезжиривании (полированных изделий химическим
способом.
Хорошие результаты дает комбинированный метод очистки, со-
стоящий из двух последовательных операций.
1. Химическое обезжиривание. Операция произво-
дится в горячем растворе мыла—15—20 г!л воды с добавкой 1—2 см3
1 К у д р я.в ц е в Н. Т. и сотрудники, Электрохимическая лаборатория
ВЭИ.
3Blum a. Hogaboom, Principles of Electroplating and Electroforming.
1030.
37
25% раствора аммиака или в горячем, почти кипящем растворе, со-
держащем в 1 литре воды 10 г мыла и 10. г углекислого калия.
2. Электролитическое обезжиривание. После хими-
ческой обработки детали мромывают в горячей воде и обезжиривают
электролитически сначала на катоде, затем на аноде в одной и той же.
или, лучше, другой ванне. В качестве электролита для железа
и стали служит раствор следующего состава: едкий натр—10 а;
углекислый натрий — ю—20 г; жидкое стекло — 1—2 г; вода —
1 л. Температура раствора от 70° и выше до точки кипения.
ч Плотность тока при катодной и анодной обработках 2—10 kJ дм2.
Продолжительность обезжиривания 1—5 мин. В качестве второго
электрода служат пластины из. никеля или хорошо никелированного
железа.
Для меди и ее сплавов, а также никеля рекомендуется дру-
гой, раствор, содержащий в составе цианистый калий:
1) углекислый натрий или калий — 15—?.о г; жидкое стекло —
1—2 г; цианистый калий — 2—3 г; вода— 1 л; или
2) углекислый калий —10—20 г; углекислый натрий — 10 г; жид-
кое стекло — 2 г; цианистый калий — 2 г; вода — 1л. Плотность тока
в обоих случаях 1—5 А/дм2. Температура раствора почти до точки
кипения *.
Последующая обработка этих металлов на аноде в других таких
же по составу растворах желательна, - а иногда необходима. В этом
случае анодная обработка хорошо предварительно промытых изделий
из меди и ее сплавов играет роль декапировки (см. ниже).
Иногда для обезжиривания полированных изделий (нерастворяю-
тцихся или трудно растворимых в щелочах) производят обработку их
поверхности в органических растворителях. Органические раствори-
тели при химическом обезжиривании необходимо применять в наи-
более чистом виде и лучше такие, которые легко испаряются и не
оставляют после себя следов каких-либо новых загрязнений, напри-
мер, трихлорэтилен, четыреххлористый углерод, спирт, бензин.
Следует отметить, что обезжиривание в органических раствори-
телях, как одна из последних операций подготовки поверхности поли-
рованных изделий, не всегда дает высокое качество их очистки и
поэтому применяется реже, нежели щелочная обработка. Почти всегда
после обезжиривания в органических растворителях приходится
прибегать к дополнительному обезжириванию в щелочах (химическое
или электролитическое) для окончательного удаления могущих
остаться следов жировых загрязнений.
Очень часто очистка полированных изделий от жиров перед по-
крытием производится путем протирки их поверхности мягкими воло-
сяными щетками, постоянно смачиваемыми каким-либо обезжириваю-
щим веществом.
В качестве таких обезжиривающих веществ применяются слабо-
щелочные смеси или растворы, состоящие из воды и тонкоизмельчек-
ной венской извести или мыла.
Обезжиривание вручную посредством очистки щетками с обезжи-
ривающей массой применяется в тех случаях, когда очистка другими
* Лайнер В, И., Хромирование, Цветметиздат, 1932.
38
способами или совершенно невозможна или представляет большие за-
труднения. Например, подвергают ручной очистке от жировых за-
грязнений изделия, имеющие большую поверхность, как цилиндры
(вальцы), листы и т. д., а также пустотелые изделия, некоторые
етлавы мягких металлов или такие металлы, ’которые - сильно- туск-
неют при соприкосновении со щелочными растворами, и, наконец,
детали, в углублениях которых электролитическая очистка не оказы-
вает обезжиривающего действия. Хотя обезжиривание вручную счи-
тают часто устаревшим способом, все же по указанным причинам без
него не всегда можно обойтись..
За границей для ручного обезжиривания существуют специальные
патентованные средства, например «Флюкс» — для всех металлов,
«Ланко Е»—для железа, и «Ланко М» —для. латуни, выпускаемые
заводами Акц. общ. Лангбейн-Пфангаузер.
Для полированных изделий из металлов, легко растворяющихся в
щелочах, применимы органические растворители, а также растворы
мыла, иногда с добавкой небольшого количества углекислого натрия,
углекислого аммония или буры.
Для обезжиривания мелких изделий при массовом производстве
очистки применяется обработка во вращающихся барабанах, напол-
ненных обезжиривающими смесями, например водная смесь извести,
мыла или извести с песком- и т. д., в зависимости от характера их
предварительной обработки и последующей отделки. Такая обработка
применяется также для очистки изделий после травления, перед по-
крытием (см. ниже).
Качество очистки изделий от жировых и масляных загрязнений
определяется по степени смачивания их поверхности водой. Процесс
испытания заключается в следующем: изделие, тщательно промытое
после обезжиривания (или высушенное в случае обработки органиче-
скими растворителями), погружается в холодную воду, затем осто-
рожно из нее извлекается и ставится в вертикальном положении или
под углом 45°. Если при этом на поверхности окажутся перерывы
водяной пленки, т. е. места, не смоченные водой, то, следовательно,
полной очистки изделий от жира не достигнуто. Равномерное и оди-
наковое смачивание всей поверхности водой возможно только при
условии полного освобождения ее от жировых загрязнений.
Обезжиривание железных изделий при одновременном их омед-
нении. Очень распространенным способом обезжиривания можно счи-
тать также электролитическую обработку поверхности изделий в циа-
нистых медных ваннах. При этом происходит' одновременно и обез-
жиривание и омеднение металла. Так как известно, что электролити-
ческое отложение меди возможно только на поверхности, совершенно
свободной от всяких жировых и масляных загрязнений, то вполне
понятно, что появление первого слоя меди- на катоде будет служить
признаком окончания очистки изделий.
Такой способ обезжиривания применяется для изделий из железа
и стали, реже из свинца, цинка и олова. Полученный слой электро-
литической меди, разумеется, не может служить защитой этих метал-
лов от коррозии. Наоборот, вследствие пористости этого слоя, который
обычно бывает очень тонким, разрушение поверхности будет проис-
ходить очень быстро и интенсивно. Поэтому электролитическое обез-
89
жиривание в цианистых медных ваннах производится только перед
покрытием таких изделий другим металлом, главным образом, нике-
лрм или медью в кислых ваннах.
Электролит в этом случае отличается от обычно применяемого спе-
циально для омеднения большим содержанием едкой щелочи или
карбоната и меньшей концентрацией меди и цианистого калия. Кроме
того, для ускорения (процесса обезжиривания плотности тока в данном
случае значительно превосходят те, которые считаются нормальными
при обычном процессе электролитического омеднения в цианистых
ваннах. Ясно, что в таких условиях трудно достигнуть одинакового,
равномерного действия тока на все участки катода, имеющего непра-
вильную форму. Вследствие плохой рассеивающей способности та-
кого электролита силовые линии тока будут концентрироваться, глав-
ным образом, на ближайших участках катода неправильной формы
(на остриях и вообще выступающих частях изделия), и таким обра-
зом,' скорость обезжиривания и качество медного покрытия в разных
местах изделия будут различными.
В случае сильной рельефности изделия, имеющего очень глубо-
кие и узкие впадины или отверстия, последние могут оказаться даже
совсем необезжиреннькми. Поэтому электролитическое обезжиривание
в цианистой медной ванне, применяется, как и в других случаях
электролитического обезжиривания, для изделий нерельефных, имею-
щих более или менее правильную форму.
'Кроме того, этот способ обезжиривания целесообразно применять
для изделий, не содержащих на своей поверхности большого коли-
чества окислов, например, окалину или ржавчину. Для такой цели
пригодны изделия, вышедшие из-под токарного станка или предва-
рительно отполированные.
Можно рекомендовать следующие примерные рецептурные усло-
вия для электролитического обезжиривания изделий с одновремен-
ным омеднением:
1) углекислый калий К2С032Н20— 100 а; цианистый калий KCN —
15 а; углекислая медь—СпС03. Сп(ОН)2— 7,5 а; вода—1 л. Плот-
ность тока около 5 А/д.м2. Температура комнатная. Продолжитель-
ность электролиза 0,5—1 мин. и выше, в зависимости от количества
жировых загрязнений;
2) едкий натр —100 а; цианистый калий — 30 а; медный купо-
рос — 20 а; вода — 1л. Плотность тока 0,8 А/дм2. Продолжительность
электролиза около 10 минут.
Г. Краузе1 указывает, что Проктор рекомендует для обезжирива-
ния и одновременно омеднения изделий следующий состав для
электролита:
3) едкий натр — 45 а; сода кальцинированная Na,CO3 — 45 а;
жидкое стекло — 7,4 а; кремнекислый алюминий—1,8 а; цианистый
натрий — 7,4 а; цианистая медь — 7,4 а; вода—1 л. Плотность тока
3—5 к!дм2. Напряжение 2—6 V, Температура 18—20°. Продолжитель-
ность процесса 2—<3 минуты.
1 Краузе Г., Гальванотехника (гальваностегия и гальванопластика). Цвет-
метиздат., перевод с 6-го немецкого издания, 1933,
40
5. Травление металлов
Процесс удаления с поверхности металлов окислов. путем обработ-
ки изделий в кислотах и щелочах или соответствующих солях назы-
вается травлением. Травление производится как химическим, так и
электролитическим способом. Выбор метода и всех рецептурных
условий, определяющих режим процесса, зависит от природы ме-
талла, характера и толщины слоя покрывающих его окислов, а также
от характера предварительной (механической) и дальнейшей его
обработки и т. д.
Разумеется, что род травящего вещества определяется прежде
всего его химическим взаимоотношением с окислами данного металла.
Необходимо иметь в виду, что успех травления возможен только в том
случае, если поверхность изделия предварительно была очищена от
жировых загрязнений. Поэтому операция травления должна следо-
вать, как правило, после операции обезжиривания. Исключение пред-
ставляет травление в щелочном растворе (химическое и электролити-
ческое), применяемое для металлов, легко растворяющихся в щелочах
(если в данной операции предусмотрены все условия, необходимые
также и для обезжиривания). В остальных случаях, если удается по-
лучить хорошие результаты без предварительного обезжиривания, то
это происходит только потому, что изделия действительно не содер-
жали на своей поверхности жиров и масел, например изделия, посту-
пающие на травление непосредственно после горячей прокатки, отлив-
ки и др. Успех возможен также и в том случае, когда изделия, покры-
тые очень тонким, незаметным для глаза слоем жира, подвергаются
обработке горячими растворами кислот или если эти изделия подвер-
гаются электролитическому травлению.
Химическое травление. Химический способ травления состоит в
простом погружении изделий в соответствующие растворы кислот или
щелочей, химически реагирующих с окислами данного металла.
Травление в кислотах применяется главным образом для изделий
из железа, стали, чугуна и некоторых цветных металлов — меди и ее
сплавов.
Травление черных металлов. Для удаления окислов
с поверхности черных металлов (ржавчина и окалина) применяются,
главным образом, серная и соляная кислоты. Реакции взаимодействия
железа, покрытого окислами, с серной кислотой можно выразить в
виде следующих уравнений:
FeO +H2S04 = FeS04 -f-H2O; (J)
Fe2O3 -]- 3H2SO4 = Fe2(SO4)3 + 3H2O; (2)
Fe +H2SO4 =FeSO4 +H2; (3)
Fe3O4 + 4H2SO4 = Fe2(SO4)8 + FeSO4 + 4 H2O. (4)
Последняя реакция протекает очень медленно, так как Fe304 — маг-
нитная окись железа (окалина)1 — растворяется в кислотах с боль-
1 Химический состав окалины не постоянен, количество кислорода в ней
колеблется. По Bablik (Glundlagen dee Verzinkene, 1930) она состоит из Fe304
(смесь окислов железа: FeO и Fe2O3) или очень близкого по составу соединения.
41
Шим трудом. Травлению помогает водород, выделяющийся при рас-
творении железа (3), который действует и химически, восстанавливая
Fe304 до FeO илиТе, и механически, отдирая нерастворенные, но уже
достаточно разрыхленные слой окалины. Влияние водорода, невиди-
мому, имеет большое значение также и при удалении с поверхности
металла плохо растворимого окисла Fe203. Одновременное растворе-
ние в серной кислоте металлического железа и его окислов можно
представить в виде следующих совместных реакций:
Fe + Fe304 + 4H2SO4 = 4FeS04 4- 4H2O; (5)
Fe -J-FegOg-f- 3H2SO4 = 3FeSO4 -J- 3H2O.- (6)
Выделение водорода при травлении окисленной поверхности чер-
ных изделий может происходить как за счет реакции указанных кис-
лот с металлическим железом самого основания (в свободных от окис-
лов местах поверхности), так и за счет растворения металлического
железа, находящегося иногда в виде включений в самой окалине. По-
этому пористость окалины и содержание в ней большого количества
мелко раздробленного металлического железа1 в значительной мере
способствуют удалению окислов с Поверхности. Очевидно, процесс уда-
ления окалины, облегчаемый химическим и механическим действием
водорода, является наиболее выгодным в том случае, когда происхо-
дит растворениё металлического Железа, включенного в окалину. Рас-
творение металлического железа самого основания — процесс нежела-
тельный, вызывающий ряд отрицательных явлений: излишний рас-
ход кирлоты, потерю металла, изменение его физических свойств, по-
явление хрупкости за счет диффузии выделяющегося водорода и т. д.
Кроме того, в результате неравномерного растворения металла поверх-
ность его может оказаться слишком разъеденной и шероховатой. По-
этому против такого течения реакции при процессе травления черных
металлов применяются специальные защитные средства — так назы-
ваемые црисадки (см. ниже), — почти совершенно предохраняющие
чистую металлическую поверхность от разъедающего действия дан-
ных кислот.
Скорость растворения окислов железа зависит как от их состава
и структуры, так и от природы, концентрации и температуры кислот.
Баблик2 приводит данные (табл. 5 и 6) относительно раствори-
мости металлического железа и его окислов (в отдельности) в раство-
рах соляной и серной кислот различной концентрации. В табл. 5
и 6 показано, какое количество железа, окиси и закиси железа в е
перешло в раствор в зависимости от концентрации кислоты из 100 г
исходного материала в течение 1 часа.
1 По данным опытов Уральского фйЗико-химического института (О. Есин
и А. Балабай, Электролитическая травка трансформаторной стали, Журнал
прикладной химии, т. 6, вып. 4, 1933) окалина на трансформаторной стали со-
держит: 73,5 — 77,4% Fe, 14,9 — 10% FeO, 2,1 —2,9% Fe2O3, 9,5-10% SiO2.
При этом металлическое железо находится в состоянии сильного раздробле-
ния, способствующего более быстрому его растворению в кислотах. Опыты по-
казали, что при растворении очищенной от окалины поверхности трансформатор-
ной стали и самой окалины (пластинки одинакового размера) в растворах серной
кислоты скорость выделения водорода в случае реакции кислоты с окалиной
больше, чем с чистой металлической поверхностью.
2 Bablik, Grundlagen des Verzinkene, 1930.
42
Как видно из табл. 5, закись железа растворяется в соляной кис-
лоте легче, чем окись железа.
Что касается действия на железо и его окислы серной кислоты
(табл. 6), то количество растворившейся в ней окиси железа (при
низких концентрациях кислоты 10%) значительно больше, чем
в соляной кислоте той же концентрации; зато растворение закиси же-
леза и металлического железа в серной кислоте протекает медленнее.
Таблица 5
Концентра- ция НС1 °/о Fo FeaO3 FeO
1 20,8 0,112 0,48
2 22,7 0,170 0,63
3 .31,6 0,360 0,76
5 40,7 0,710 0,83
7 50,1 1,600 1,80
10 72,0 10,600 7,50
Таблица 6
Концентра- ция H2SO« % Темпера- тура рас- твора, °C Fe Fea03 FeO
1 20 6 3,9 0,14
5 20 15 4,8 0,56
10 20 35 6,4 0,98
10 40 97,7 9,0 1,40
С повышением концентрации кислот скорость растворения окислов
увеличивается больше в соляной кислоте, нежели в серной. Особенно
заметна эта разница при растворении окиси железа. Растворимость
окислов в соляной кислоте увеличивается с повышением ее концен-
трации в большей степени, нежели растворимость металлического же-
леза.
Большое влияние на растворимость железа и его окислов в серной
кислоте оказывает повышение температуры.
Исследуя процесс растворения в соляной кислоте (7,5%) магнит-
ной окиси железа (смесь FeO + Fe-03), Баблик нашел довольно зна-
чительное повышение ее растворимости после добавления к ней
чистого восстановленного металлического железа. Это явление
объясняется восстановлением магнитной окиси железа водородом,
выделяющимся при действии кислоты на металлическое железо.
В табл. 7 показано количество железа, перешедшего в рас-
твор из смеси магнитной окиси желзза и металлического железа
43
в зависимости от содержания последнего. Растворение производилось
в течение 3 часов.
Табл и ца 7
Смесь, г Количество же- леза, перешедшее в раствор из Fe3O« 0
Fe3O4 Fe
0,5 0,0 0,1814
0,5 0,1 0,3124
0,5 0,2 0,3300
Баблик также показал, что скорость растворения магнитной оки-
си железа в соляной кислоте повышается в зависимости от концен-
трации в значительно большей степени, чем в серной. В табл. 8 пока-
зано количество железа (в г), перешедшего в раствор ври действии
той и другой кислоты на магнитную окись железа в течение 1 часа.
Магнитной окиси железа взято 1 г.
Таблица 8
НС1 % Количество железа, пере- шедшее в рас- твор г HiSO, % Количество железа, пере- шедшее в рас- твор г
5 0,035 5 0,0350
10 0,290 10 0,0387
151 — 15 0,0562
Из сказанного ясно, что при выборе условий для травления же-
лезной поверхности, покрытой окислами, концентрация, температура
травильного раствора и род применяемой кислоты имеют большое
значение. Учитывая различное влияние изменений концентрации и
температуры раствора на растворяющую способность данной кисло-
ты по отношению к определенному составу окислов, следовало бы
при травлении изделий устанавливать выбор этих условий в каждом
случае особо для того, чтобы эффект выполнения этой операции был
наиболее высоким.
В помощь для определения времени травления (в зависимости от
концентрации кислоты) и выбора наиболее выгодной концентрации
кислот могут служить данные Баблика, приводимые нами в табл. 9.
Из табл. 9 видно также, что скорость травления в серной кислоте
с повышением ее концентрации увеличивается до известного предела,
1 При содержании НС1 = 15% растворилось все количество магнитной окиси
железа уже в течение 40 мнн.
44
выше которого она начинает уже падать. Максимум скорости травле-
ния в серной кислоте лежит при концентрации ее в растворе около
25%. Однако во избежание сильного разъедания металла концентра-
цию кислоты выше 20% применять не рекомендуется, а увеличивать
скорость травления следует за счет повышения температуры. Высокая
Таблица 9
Концентра- ция НС1 °/о Продолжитель- ность травле- ния в растворе мин. Концентра- ция H2SO< °/о Продолжитель- ность травле- ния в растворе мин.
2 90 2 135
5 55 5 135
10 18 10 120
15 15 15 95
20 10 20 80
25 9 25 65
30 — 30 75
40 — 40 95
концентрация серной кислоты при травлении нежелательна также и
потому, что при этом происходит большое накопление в растворе же-
лезного купороса, который загрязняет изделие, выделяясь на его
поверхности, и кроме того понижает скорость травления. Что же
касается НС1, то наиболее выгодную концентрацию ее раствора можно
считать около 20%.. При. этой концентрации скорость травления в
соляной кислоте значительно превосходит максимум скорости трав-
ления в серной.
Время Правления в серной кислоте, как было уже отмечено, зна-
чительно сокращается при повышении температуры раствора.
Как видно из табл, ю, в сравнении с серной кислотой скорость
травления в растворе соляной кислоты (10%) увеличивается с повы-
шением температуры в меньшей степени. Однако и в этом случае,
т. fe при травлении в растворах с повышенной температурой, преиму-
щество в отношении скорости процесса при одинаковых условиях
остается все же за соляной кислотой.
Таблица 10
Концентрация НС1 % Скорость травл. в мин. прн температурах Концентрация H2SO< °/о Скорость травл. в мин, прн температурах
18 40 60 18 40 60
5 55 15 5 5 135 45 13
10 18 6 2 10 120 32 8
Более высокие, чем указанные в таблице, температуры травильных
растворов редко применяются, так как это' связано со значительными
45
потерями основного металла и с выделением большого количества
вредных паров и водорода, механически увлекающих с собой также
и кислоту. При очень сильном нагревании соляной кислоты доста-
точно большой концентрации возможно выделение также и хлорово-
дорода. Кроме того при высокой температуре травильного раствора
повышается степень поглощения металлом водорода.
Практически для растворов соляной кислоты не применяют тем-
пературу выше 30—40°. Для растворов серной кислоты можно по-
вышать температуру до 50—60°. Иногда допускают повышение тем-
пературы и до 80° (не выше), но, как сказано, это ведет к большим
осложнениям в работе.
Поскольку при травлении железа в растворах кислот накапли-
ниже приводятся также данные
о влиянии па скорость тра-
вления содержания железа
в растворе. Интересно от-
метить, что в данном слу-
чае тоже имеет место харак-
терная разница в поведении
растворов соляной и серной
«кислот. В т)о время гик при
травлении в серной кислоте,
по мере увеличения в ра-
створе «содержания железа,
скорость травления умень-
шается,— в соляной кисло-
те она, наоборот, повышает-
ся. На фиг. 4 изображены
кривые (Hansen Lindsay),
характеризующие измеие-
в раствор при процессе травле-
вается соответствующая соль железа,
Фиг. 4. Влияние содержания солей железа
в серной и соляной кислотах на раствори-
мость железа: 1 — серная кислота, 2— со-
ляная кислота.
ние количества железа, перешедшего
ния в серной и соляной кислотах в зависимости от содержания в
них солей железа.
Баблик приводит также данные о влиянии концентрации серноки-
Олого железа на продолжительность травления в 5%1 растворе серной
кислоты (табл. 11).
Таблица 11
5% H2S04 + FeSO4.7H3O
5% 10% 20%
Продолжитель- ность, мин. . . . 190 305 - 440
В дополнение к сказанному о серной кислоте эти данные также
подтверждают необходимость применения невысокой концентрации ее
раствора, так как одновременное понижение содержания кислоты в
46
Фиг. 5. Растворимость железа в серной
кислоте (кривые для 20, 15 и 10% рас-
творов серной кислоты, содержащих и
не содержащих сульфаты железа, иден-
тичны). t° = 80°.
растворе и повышёййё Концентраций В йем Железной соли будет
вызывать заметное понижение скорости травления.
Интересные наблюдения по поводу влияния солей железа на ско-
рость растворения металлического железа в растворах серной ки-
слоты различной концентрации были получены Тауссигом.
Диаграмма (фиг. 5) показывает, что влияние сернокислого железа
в растворе серной кислоты заметно только при низких концентра-
циях кислоты (2—5%); при более высокой концентрации серной ки-
слоты (10—20%) задерживающее влияние солей сернокислого железа
на скорость травления не имеет места. Автор добавлял к 20% рас-
твору серной кислоты до 300 г! л
сернокислой закисной соли желе-
за. Отсюда, конечно, не следует, что
травление всегда можно вести в
одном и том же несменяемом рас-
творе, если к нему добавлять
непрерывно серную кислоту до
10—20%. Существует какое-то
предельное содержание железа
(ниже предела его насыщения),
выше которого скорость травле-
ния последнего будет падать при
любой концентрации H2S04 в рас-
творе. По. крайней мере заводской
опыт Кудрявцева показал, что
при травлении железных изделий
(покрытых окалиной) в 10%. по-
стоянно пополняемом серной кис-
лотой травильном растворе ско-
рость травления начинает за-
метно падать уже после накопле-
ния в нем сернокислого железа
до 20%. Процесс ускоряется в
значительной степени за счет
повышения температуры раство-
ра. Хорошо работать, начиная
травление в 15—20% растворе
серной кислоты при комнатной
температуре или немного повышенной (до 30—40°) и затем по мере
накопления в травильном растворе сернокислого железа вести травле-
ние при постоянном нагреве, повышая температуру постепенно до
70—80°. При таком условии можно довести использование серной
кислоты до минимума, почти совсем не проигрывая во времени.
При травлении железа в минеральных кислотах, сопровождаю-
щемся выделением водорода, очень часто приходится встречаться
с явлениями хрупкости металла, вызывающей брак изделий. Это объ-
ясняется, как уже было сказано выше, диффузией водорода в слой
металла.
Caillet, исследовавший (в 1863 г.) диффузию водорода, указал, что
она происходит с силой, превышающей 14 ат. Reinolds (в 1874 г.) под-
47
твердил справедливость этих (указаний и установил, что явление диф-
фузии усиливается при травлении в нагретых растворах. Более но-
вые подробные исследования по этому вопросу произвел Edwards
Последний установил зависимость между концентрацией кислоты и
скоростью диффузии. На фиг. 6 и 7 изображены кривые изменения
скорости диффузии в за-
Фиг. 6. Влияние концентрации серной кислоты
на диффузию водорода в железо.
чением толщины скорость
диффузии уменьшается. На фиг. 8 приведены кривые изменения ко-
личества продиффундировавшего водорода в см3 при действии 20%'
раствора серной кислоты на железные пластины различной толщины
в течение 30 часов.
Весьма интересным
является тот факт, что
при травлении чистой
поверхности железа
диффузия водорода
меньше, нежели при
травлении железа, по-
крытого окалиной. Циф-
ровые данные приведе-
ны в табл. 12. Указан-
ное явление, повцдимо-
му. объясняется влия-
нием водорода, выде-
ляющегося при работе,
образующейся в мо-
мент отрыва окалины
гальванической пары
элемента: Fe/H,S04/H2.
Этот элемент обладает
электродвижущей си-
лой, которая в начале
процесса равна 0,699, а по прошествии 1 час. — 0,805 V. Катодом
в таком элементе служит Fe304.
Согласно исследованию Edwards, на диффузию водорода оказы-
висимости от концентра-
ции кислот и температу-
ры, полученные Эдвард-
сом. Как видно из диа-
грамм, скорость диффу-
зии увеличивается с по-
вышением концентрации
от минимального значе-
ния до 10—15%> и при
повышении температуры
от 0 до 50°.
Скорость диффузии за-
висит также от толщины
металла, причем с увели-
Фиг. 7. Влияние температуры на диффузию водо-
рода в железо.
1 Edwards, Iron and Steel Institute, 1924.
48
Та б л и ц а 12
Продолжительность диффузии мнн. Количество продиффундировавшего водорода, см3-
железо, покрытое окалиной железо, свободное от окалины
80 1,53 1,20
120 3,31 2,51
135 4,09 3,07
вает влияние добавка к раствору серной кислоты поваренной соли.
В табл. 13 приведено изменение количества продиффундировавшего
водорода в 'дм3 при травлении железа в растворе, содержащем H2S04<
108 г!л без добавки и с добавками NaCl (ю и 50 г/л).
Как видно из таблицы, до-
бавка поваренной соли к рас-
твору серной кислоты пони-
жает скорость диффузии водо-
рода при растворении железа.
Это явление, невидимому, объ-
ясняется понижением скорости
растворения металлического
железа в присутствии NaCl *в
растворе. По указанию Бубли-
ка в Германии существуют в
продаже присадки для травле-
ния (см. ниже), содержащие
иногда до 75% поваренной
Фиг. В. Зависимость диффузии водорода в
железо от толщины последнего.
СОЛИ.
Кроме указанных кислот для травления черных металлов приме-
няются также плавиковая и азотная кислоты.
Таблица 13
Время мин. H2SO4 h2so4 4- + NaCl (10 г/л) H2SO< + 4-NaCl (50 г/л)
30 4,08
50 8,99 — —
60 .— 4,0 2,09
75 — 6,88 4,21
90 — 10,32 6,49
95 —- — 11,38
Плавиковая кислота является единственной
собных растворять кремнезем по уравнению:
Si02 4- 4HF =. SiFt + 2Н2О.
из всех кислот, спо-
4 Основы гальваностегии. 1783
Благодаря этому плавиковая кислой применяется, главным об-
разом, для травления отливок, содержащих па своей поверхности по-
сле выхода из литейного цеха остатки формовомного песка. Для тра-
вления чугунных изделий применяется 1—2%’ раствор плавиковой
кислоты. Блюм и Хагебум1 указывают, что употребительной концен-
трацией плавиковой кислоты для целей травления является 4%.
В некоторых случаях применяют плавиковую кислоту в смеси с
серной (1 ч. HF + 3 ч. H„S04). Недостатком в работе с плавиковой
кислотой является ее чрезвычайная ядовитость — она причиняет
трудно заживающие ожоги на коже. Хранить ее следует только в
свинцовой или каучуковой посуде или же к- бутылках, покрытых из-
нутри резиной, смолой или парафином. Стекло и дерево разъедаются
плавиковой кислотой.
Азотная кислота при травлении черных металлов применяется
очень редко, вследствие сильно' разъедающего и окисляющего ее дей-
ствия на поверхность изделий. В смеси с соляной кислотой она упо-
требляется при травлении до блеска специальных сортов стали, на-
пример нержавеющей стали. Так, например, блестящая поверхность
хромоникелевой стали получается при травлении ее в растворе сле-
дующего состава 2:
% °Вё
HN03 10 40
НС1 1—2 19
Н20 88—89
Температура раствора 40—50°. В качестве присадки (см. ниже)
в цтот раствор добавляется еще сульфированный клей (0,1 %). За
границей травление хромоникелевой стали производится в двух рас-
творах, различных по составу3. В первом растворе снимается с по-
верхности стали приставший слой окалины. Состав его следующий:
°/о °Вё
НС1 26,7 19,0
II2S04 23,3 65,9 (уд. в. 1,84)
Н2О 50,0
Температура раствора 40—50°. Продолжительность травления
около 1 часа. Во избежание перетравливания в этот раствор доба-
вляется препарат Фогеля (см. ниже) — 0,15% по объему. После пер-
вой операции обработки сталь травится до блеска во втором растворе
приблизительно следующего состава:
0/ '0 °Вё
НС1 45 19
HN03 5 40
Н20 50
Препарат Фогеля около 0,1% по объему. Температура раство-
ра 50°. Продолжительность травления 3—5 минут.
1 Blum a. Hogaboom, Principles of Electroplating and Electroforming, 1930.
2 Рецепт выработан в результате опытов Кудрявцева Н. Т., проведенных
в Химическом институте им. Карпова Л. Я. в 1931 г.
3 Способ, применяемый в Германии на заводе Круппа.
50
Вместо кислот для травления изделий из черных металлов поль-
зуются иногда растворами кислых солей. Наиболее распространено
применение бисульфата натрия, являющегося отбросом производства
азотной кислоты.
Травление бисульфатом натрия происходит за счет большой кон-
центрации ионов водорода, образующихся при растворении этой соли
в воде. Реакции протекают по следующим уравнениям, показанным
на примере растворения закиси и металлического жеЛеза:
FeO + 2NaHSO4 — FeS04 -{- Na,S04 + H,O,
Fe, + 2NaHSO4 = FeS04 NalSO* + Hl.
Ввиду того, что растворы бисульфата натрия имеют меньшую
степень кислотности, нежели растворы серной кислоты той же кон-
центрации, скорость травления в первом случае будет значительно
ниже, чем во втором.
Для получения приблизительно одинакового эффекта необходимо
растворы бисульфата натрия нагревать до более высокой температу-
ры, чем это требуется для обычных растворов серной кислоты.
Присадки и их роль при химическом травле-
нии черных металлов. Травление покрытой окислами поверх-
ности железа в обычных растворах кислот сопровождается растворе-
нием металлического железа и выделением водорода. Это обстоятель-
ство вызывает ряд нежелательных явлений, вредно отражающихся на
свойствах металла, например перетравливание и разрушение самого
металла или возникновение хрупкости и ломкости изделий вслед-
ствие включений в слой металла большого количества водорода.
Кроме того водород, накапливаясь под поверхностным слоем ме-
талла (железо или сталь определенного сорта), может вызвать отста-
вание этого слоя или образование так называемых травильных пу-
зырей.
Очень интересны в этом отношении результаты опытов д-ра Фо-
геля \ полученные им при травлении двух одинаковых листов же-
леза, плотно сложенных друг с другом и сваренных по краям. После
довольно длительного травления образец такого двойного листа при-
обрел форму подушки, вследствие того, что несваренные участки по-
верхности раздвинулись под действием водорода, проникшего сквозь
блюй металла в пространство между листамп/ Д-р Фогель, демонстри-
руя этот образец, в своем докладе указал, что при испытании в од-
ном из исследовательских учреждений обнаружено, что давление
в таких травильных подушках достигает 75 пт2.
С целью предохранения изделий от всех перечисленных видов
брака при травлении в последнее время стали широко применять
растворы серной и соляной кислот с добавками, так называемых, тра-
вильных присадок. Присадки в большей или меньшей степени за-
медляют процесс растворения и разрушения поверхности металличе-
1 Доклад д-ра Фогеля, кратко изложенный в журнале „Oberflachentechmk",
1, 1933.
’ Появление пузырей или металлических вздутий небольшого размера,
(d = 2—3 см) наблюдалось Кудрявцевым при травлении железных форм для
головного сахара в 10% растворе серной кислоты без присадок на заводе
„Большевик" в Киеве и з-де им. Мантулина в Москве.
51
ского железа, мало оказывая влияййя на растворимость окалины.
Вместе с этим они уменьшают количество выделяющегося водорода и,
следовательно, устраняют возникновение хрупкости металла и тра-
вильных пузырей. На фиг. © кривыми показано влияние присадок
при травлении железа в 5% растворе серной кислоты.
В качестве присадок могут служить как органические, так и не-
органические вещества, относящиеся, однако, к определенным груп-
пам химических соединений. Обширный перечень этих веществ с ука-
занием их характеристик имеется в статьях КрейтпфельдтаСпелле-
ра и Чепелла* 2 и др. Авторы указывают, что to качестве веществ, 'за-
медляющих или устраняющих растворение железа кислотами, могут
служить: жиры, смолы, ржаная мука, кислое пиво, пивные дрожжи,
хлористый этилен, никотин анилин, хинолин, иодэтилхинолин, от-
ходы сахарного производства, сульфитные щелока, клей и пр. В по-
следние годы большое распространение получили травильные
присадки, приготовляемые искусственно. Исходными продуктами для
этих присадок служат обычно: сырой антрацен,
Потеря Веса, в железных
образцах
Фиг. 9. Влияние при-
садки Фогеля на рас-
творимость железа в
серной кислоте: 1-5%
раствор H.SO4; 2—5и/0
pacTuopHSO4c добав-
кой присадки Фогеля.
фенол, различные органические соединения, со-
держащие хинолиновую группу или белковые
вещества, альдегиды и т. п. Приготовление этих
присадок состоит to комбинации способов дестил-
ляции, экстракции и последующей обработки
их в минеральных кислотах, главным образом
в серной кислоте. Ряд присадок, рекомендуемых
за границей, выпускается на рынок в виде го-
'товых запатентованных препаратов почти совер-
шенно неизвестного состава. В продаже все они
носят специальные названия, из которых наибо-
лее известными являются: Rodine (Америка),
Piklene (Англия), Adacid, Optima, Adarit-Extra,
Ferrocleanol, препарат Фогеля и др.
Исходными продуктами препарата Фогеля, по-
лучившего наибольшее распространение в каче-
стве травильной присадки, являются: сырой ан-
трацен, остатки производства нафталина, кислые
смолы, остатки дестилляции органических соединений и органические
соединения, содержащие хинолиновую группу.
Под названием Антра3 присадка, подобная препарату Фогеля,
сравнительно большое распространение имела и в кашей промышлен-
ности. В последнее время в результате исследований лабораторий на-
ших институтов и заводоЬ появился ряд новых препаратов, входящих
в практику работы заводских предприятий. Как наиболее полно изу-
ченные 4 можно отметить препараты, полученные в результате спе-
циальной обработки (сульфирование) отходов животного происхожде-
* Creitzfeldt. W. Н., .Zeitschr. f. Anorg. Chemie*, Bd. 136 S. 213.
2 Speller a. Chappel, .Chemical a. Met. Eng.“, 1924.
8 Присадка Антра— продукт, получаемый в результате сульфирования антра-
ценового масла или сухого антрацена, — была проверена и передана в про-
мышленность Химическим институтом им. Карпова Л. Я.
4 Журн. „Вестник металлопромышленности", 1 и 2, 1934.
52
ния ряда протеинов (молочная сыворотка, кровяная сыворотка, кровь,
желчь, клеевая галлерта и др.).
Свойства присадок, степень их ослабляющего 'влияния на процесс
растворения железа кислотами зависят как от рода самого вещества,
так и концентрации его в травильных ваннах.
Спеллер и Чепелл, исследовавшие целый ряд препаратов органи-
ческого происхождения, считают, что наиболее сильное влияние на
процесс травления железа оказывают вещества основного характера,
обладающие наибольшим молекулярным весом. На фиг. 10 дана диа-
грамма (Спеллер и Чепелл), характеризующая влияние; этих присадок
на растворимость железа to 34%' растворе серной кислоты при 25°.
На диаграмме даны кривые изменения количества водорода (ось орди-
нат) в зависимости от продолжительности действия кислоты в при-
Фиг. 10. Влияние различных присадок на растворимость железа
в 34% H2SO4 прн 25°: 1—без присадок; 2—1% хлористый этилен;
3—1% карбозоль; 4—1% никотин; 5-1% этиловый спирт;
6—1% анилин;/— 1%параметиламинофенилсульфат;8—1% иодн-
стый этил; 9—0,05% клея; 1и—1% пиридин; Л —1% хниолин;
12—1% кислотная вытяжка нз каменноуголь' ой смолы; 13—
0,001% иодистый хинолин этнл; 14—0,1% иодистый хинолин
этил.
сутсТвии каждой присадки. Как видно по ходу кривых, наиболее за-
медляющее действие на процесс травления оказывают добавки хино-
лина, кислый экстракт каменноугольной смолы1 и иодэтилхинолин.
Количество присадок, добавляемых в травильные ванны, сравни-
тельно небольшое, оно колеблется обычно в пределах 0,1—2%. Более
высокие концентрации не оказывают заметного повышения их
действия. Спеллер и Чепелл дают (фиг. 11) кривую изменений коли-
чества водорода, выделяющегося при растворении стали в 34% рас-
творе серной кислоты (#=25°) to зависимости от концентрации до-
бавки! азотистых веществ. Как видно из диаграммы, количество выде-
ляющегося водорода резко снижается уже .при самых незначитель-
1 Этот препарат близок к патентованным препаратам Фогеля.
53
Фиг. 11. Влияние концентраций присадок на
выделение водорода. Выделение водорода
в чае при различной концентрации присадок,
сталь в 34°/о H2SO< прн 25°.
ных концентрациях введенной добавки. При содержании добавки
почти не изменяется.
На фит. 12 приведена
диаграмма (Спеллер и Че-
делл) влияния концентра-
ции той же присадки за бо-
лее продолжительное время.
Все остальные условия опы-
та те же, пто и в предыдущем.
Характерны диаграммы
выделения водорода при тра-
влении железа в зависи-
мости от содержания приса-
док в 5 N растворе серной
кислоты, приведенные Д. В.
Степано'вым и А- А. Тимо-
хиным1. В качестве приса-
док, которые авторы между
прочим называют «регуля-
торы травления» (А, В, С и
Р), применялись в данном
случае отходы животного
происхождения ряда проте-
инов, предварительно под-
вергнутые специальной обработке. Принимая во внимание при-
близительно одинаковый ход изменения кривых выделения водо-
рода в зависимости от рода и концентрации добавок исследуемых
авторами «регуляторов»,
мы приводим здесь на
фиг. 13 диаграмму, ха-
рактеризующую влияние
на процесс травления же-
леза «регулятора С». На
фиг. 14 дана также диа-
грамма (Степанов и Ти-
мохин) выделения водоро-
да при травлении железа
в 5 N растворе НС1 в зави-
симости от концентрации
«регулятора травления D».
Исследования указан-
ных авторов показали,
что введение «регулято-
ров травления» снижает
потери металла при та-
ком травлении до 1—1,5%'
против потерей металла при обычном травлении без присадок, дохо-
дящих до з—4%. Потеря металла при травлении с присадками идет
главным образом за счет окислов.
Продолжит? и пс. 71о травления в vac
Фнг. 12. Замедляющее действие присадок на ра-
створимость стали в 34% H2S0< при 25°. Концен-
трации присадки: 1—О г/л; 2—о,1 гл; 3—1 г/л;
4—10 г/л.
1 „Вестник металлопромышленности", 1, 2, 1934.
F4
Активность присадок в большей или меньшей степени зависит
.также и от температуры раствора. Повышение температуры вообще
ведет к ослаблению или прекращению влияния присадок на про-
цессы травления, но на одни вещества этот фактор оказывает боль-
шее, на другие меньшее влияние. Ослабление или прекращение дей-
ствия присадок при повышении температуры объясняется их коагу-
ляцией; такие присадки находятся в растворе обычно в коллоидаль-
ном состоянии. Наиболее удовлетворительными по качеству можно
считать присадки, выдерживающие температуры примерно до 80°
или около этого, т. е. щюделытые температуры, применяемые на прак-
тике. В табл. 14, по данным, приведенным в книге Погодина и Дыр-
Фиг. 13. Диаграмма выделения Н2 в
момент травления железа в 5 N H2SO<
в зависимости от содержания регу-
лятора травления С. Температура
травильного раствора 1.э°; поверх-,
ность железа 20 с.м'~.
Фиг. 14. Диаграмма выделения Н3 в
момент травления железа в 5N НС1
в зависимости от содержания регу-
лятора травления D. Температур а
травильного раствора 15°; поверх-
ность железа 20 см2.
модта1, показано изменение потери в весе железа при травлении его
в по объему растворе серной кислоты при 30 и 80й. Поверхность
образца—75 см2, количество присадки—1 г/л. При 30°' травление
производилось в течение 20 час., при 80° — з часа.
Как видно из таблицы, наиболее постоянными по силе своего дей-
ствия являются последние две запатентованные за границей присад-
ки— Ferrocleanol и Bodine. Достаточной стойкостью по отношению
>к температуре обладают также присадки (регуляторы А, В, С и D при
определенных наибольших их количествах В растворе), рекомендуе-
мое Степановым и Тимохиным. Авторы приводят диаграммы, дающие
наглядное графическое представление о степени растворимости же-
леза (диаграммы проницаемости) в 5 N H2SO4 и 5 N НС1 в зависимости
1 Погодин и Дыр монт, Ржавление и предохранение железа, Госмаш
метиздат, 1932.
45
от содержания «регуляторов травления» (А, В, С- и D) и температуры
травильного раствора. На диаграмме (фиг. 15) по оси «у» указаны
значенйя растворимости железа в присутствии регулятора травле-
ния А, выраженные в средних единицах измерения глубины корро-
зии или проницаемости в мм!месяцОтносительно механизма, за-
медляющего действия присадок, существуют различные мнения.
Сивертс и Луг1 2, исследовавшие в качестве травильных присадок
различные алколоиды, пиридин, хинолин и нафтохинолин, объяс-
няют замедляющее действие их на растворимость железа адсорбцион-
ными явлениями. По их мнению отдельные частички присадок, на-
ходящиеся в травильном растворе во взвешенном состоянии, адсор-
Таб лица 14
Наименование присадки Потеря веса а
30° 80°
Образец без присадки .... 1,0838 11,2477
Антрацен 0,6668 3,0290
Adacide 0,3445 1,5672
Деготь 0,1095 0,1436
Присадка Фогеля 0,1076 0,1407
Дрожжи 0,1026 0.1631
Ferrocleanol 0,0691 0,0591
Rodine 0,0653 0,0572
бируются чистой поверхностью металлического железа, образуя за-
щитную пленку, предохраняющую металл от разрушения .его ки-
слотами.
Крейтцфельдт3, проделавший большую экспериментальную рабо-
ту по вопросу о травильных присадках, дает следующую примерно
характеристику свойств и способа их влияния на процесс растворе-
ния железа кислотами. Автор предполагает, что понижающее дей-
ствие присадок на растворимость металла обусловлено. явлениями
коллоидно-химического характера. В связи с этим свойства приса-
док и активность их действия должны зависеть как от рода вещества,
так и от степени его раздробления. Испытания ряда различных по
химическому составу органических'добавок показали, что наибольшее
влияние на’ процесс травления железа оказывают вещества, обладаю-
щие большим молекулярным весом. Необходимо, чтобы эти вещества
были прежде всего нелетучими и обладали удельным весом, одииако-
1 Указанные на диаграмме величины вычислялись по формуле Speller:
где А — потеря в весе, в г/см?,
с — уд. вес металла,
т — время опыта, в месяцах.
2 Sieverts u. Lu eg, .Zeitschr. f. Anorg. Chemie*, Pd. 126, S. 193.
’ Creutzfeldt, „Zeitschr. f. Anorg. Chemie", Bd. 136, S. 213.
56
вым с удельным весом раствора, переходя в коллоидальное состояние.
Автор указывает, что влияние добавок объясняется исключительно
образованием на. известных участках поверхности металла адсорб-
ционных пленок, которые и защищают его от разрушения кислотами.
Действие этих веществ, очевидно, должно быть тем более сильны^:,
чем выше степень дисперсности их частиц, находящихся в растворе
в коллоидальном состоянии.
Несколько иной характер объясне-
ния механизма действия присадок
приводится в работе Chappel Roethell
и Carthy*.
Указанные авторы считают, что
понижение или даже прекращение
разрушающего действия кислот на
металлическое железо в присутствии
присадок связаны с явлениями изме-
нения перенапряжения водорода. Рас-
творение железа <и связанное с ним
выделение водорода они сЪюнны рас-
сматривать как электрохимический
процесс, идущий по следующей схеме:
на аноде Fe->Fe”4-2©.
на катоде 2Н' 2в -» 2Н,
2Н Н,.
Микроскопические исследования
показали, что выделение водорода
происходит главным образом на гра-
нях зерен и включениях шлака. Ис-
ходя из этого, они и полагают, что
причйной понижения растворимости
металла может служить образование
на катодных участках поверхности
пленок из разряженных частиц при-
садок, которые вызывают повышение
перенапряжения водорода. Исследуя
кривые изменения катодного потен-
циала в зависимости от плотности
тока при травлении железа в 1 N
растворе серной кислоты с добавкой
иодэтилхинолина и без него, авторы
установили довольно большое повы-
Фпг. 15. Диаграмма проницае-
мости (растворимость) железа в
5 N H2SO4 в зависимости от со-
держания регулятора трав ления А
и температуры травильного рас-
твора.
шение значений катодного потенциала с увеличением концентрации
этой добавки (фиг. 1с).
Варнер1 2 на основании своих исследований приходит тоже к за-
ключению, что действие присадок основано на явлениях электрохими-
ческого характера. Он считает, что здесь возможно Влияние или анод-
ного или катодного процесса. Замедляющее действие присадок на
1 Ind. Eng. Chemie, Р. 582 1928.
2 Warner, Vortrag auf dem Meeting der Am. Electrochem. Soc., июль, 1929.
57
растворимость железа за счет анодного процесса объясняется, очевид-
но, выделением на поверхности металла пассивных пленок, обра-
зующихся из труднорастворимых солей железа в комбинации с анио-
нами имеющейся в растворе присадки. Катодное влияние присадок
основано на повышении перенапряжения водорода. Исследуя свой-
ства желатины как присадки при травлении в 2 N растворе серной
кислоты, автор получил очень интересную зависимость между изме-
нением потери в весе металла и перенапряжением водорода, измеряе-
мого при плотности тока, равной 0,01 К!дм2. На фиг. 17 показан
характерный параллельный ход
кривых зависимости перена-
пряжения водорода и поте-
ри в весе металла от кон-
центрации желатины в 2 N
растворе H2SO4.
Травление цветных
металлов. Травление цвет-
ных металлов применяется
Фиг. 16. Влияние концентраций присадки
на катодную поляризацию. Катод — же-
лезо Армко; кислота—1 .V H2SO4; при-
садка — иодистый хинолиизтил. I — бС’з
присадки; 2 — 0,01 г/л; а —>0,1 г/л; 4 —
0,15 г/л; 5 — 0,25 г[Л; 6 — 0,40 г/л.
Фиг. 17. Соотношение между замед-
ляющим действием и перенапряже-
нием прн применении в качестве при-
садки желатины: 1—влияние концен-
трации желатины на перенапряже-
ние; II—влияние концентрации же-
латины на уменьшение раствори-
мости железа.
чаще для окончательной отделки их поверхности, нежели для целей
подготовки под металлическое покрытие.
Наиболее часто встречающимися объектами травления из группы
цветных металлов являются медь и ее сплавы. Для травления меди и
ее сплавов применяются обычно смеси кислот (HN03, H2S04, НС1).
Процесс делится на несколько последовательных операций — две или
три, из которых основными являются предварительное и глянцевое
травление.
По Пфангаузеру ’, изделия из меди или ее сплавов (латунь, брон-
1 Pfanhauser, Die Electrochemischen Metallniederschlage, 1928.
58
за, нейзильбер, мельхиор и др.), покрытые толстым слоем окислов,
травятся сначала в 10% растворе серной кислоты. Процесс длится до
тех пор, пока черный цвет окислов не примет желтого оттенка. В слу-
чае очень толстого и твердого слоя окислов часто такие изделия перед
следующей операцией травления подвергают еще обработке в крепкой
азотной кислоте (40° Вё). Если при этом слой окислов трудно размяг-
чается, то рекомендуется применять также очистку металлическими
щетками с повторным погружением в травильную ванну. После такой
очистки от толстых слоев окислов поверхность изделий из меди и ее
сплавов подвергается основным операциям обработки: предваритель-
ному и глянцевому травлению *. Предварительное травление произво-
дится в растворе следующего состава (по Пфангаузеру):
1) техническая концентрированная азотная кислота (36°Вё)—1 л:
2) концентрированная соляная кислота—10 с.м3.
В этом растворе изделия травятся до тех пор, пока поверхность не
станет совершенно чистой. Для глянцевого травления, применяемого
после предварительного травления, служит смесь следующего состава-.
концентрированная азотная кислота (40° Ве) ..1л
серная кислота (66° Вё)..................1 „
соляная „ ...........................20 см3
голландская сажа...................: ... 10 г
Продолжительность этой операции в зависимости от состояния
поверхности колеблется от нескольких секунд до 1 минуты.
После каждой протравы изделия тщательно промывают в холод-
ной воде. Перед глянцевым травлением во избежание разбавления
ванны водой изделия после холодной промывки опускаются еще
в горячую воду и затем быстро сушатся (обычно за счет теплоты, вос-
принятой от горячей воды).
После глянцевого' травления изделия, идущие на покрытие "в галь-
ванических войнах, промываются только в холодной воде. В осталь-
ных случаях промывка производится таким же образом, как и после
предварительного травления. Состав смеси, главным образом,
для глянцевого травления, часто меняется в зависимости от рода
травящегося материала (состав медных сплавов) и от характера
предварительной обработки изделий (вальцованный или литой мате-
риал).
Краузе рекомендует травильные смеси следующего состава:
1) предварительная протрава:
200 вес. ч. азотной кислоты (36° Вё)
1—2 „ „ поваренной соли
1—2 , , глянцевой сажи
2) глянцевая протрава:
75 вес. ч. азотной кислоты (40° Вё)
100 „ „ серной „ (66° Вс)
1 „ „ поваренной соли
Грахам1 2, подробно исследовавший химизм процесса глянцевого
травления, рекомендует применять более слабые растворы кислот,
1 В практике очень часто обходятся только этими двумя операциями, так как
изделия в большинстве случаев бывают свободны от толстых твердых слоев
окислов.
2 Graham. Trans, of the Am. Electrochem Soc., 1927.
59
разбавляя их известным количеством воды. -Хвтор указывает, что до-
бавка воды в травильную смесь увеличивает степень диссоциации ки-
слот, повышая, следовательно, активность протравы. Применение
разбавленных кислот, кроме того, способствует более быстрому и пол-
ному отполаскиванию поверхности изделий от остатков травильной
смеси и тем самым устраняет образование пятен.
Особенно это имеет значение для сильно рельефных, полых изде-
лий, а также при травлении мелких изделий *е> массовом порядке.
Исследуя влияние каждой из составных частей протравы на рас-
творение меди и цинка в латуни, Грахам пришел к заключению, что
быстрота растворения меди стоит в прямой зависимости от содержа-
ния азотной кислоты, в то время как растворение цинка в такой же
зависимости находится от концентрации соляной кислоты. Из диа-
грамм растворимости обоих металлов (фиг. 18 и 19) видно, что. при
определенной концентрации HN03 и H2S04 скорость растворения цинка
с повышением содержания НС1 увеличивается, в то Тремя как ско-
рость растворения меди немного даже понижается. При увеличении
же концентрации азотной кислоты при постоянном содержании дру-
гих компонентов скорость растворе'пия меди быстро повышается,
растворимость же цинка остается постоянной.
Повышение концентрации H2S04 при постоянном содержании про-
чих кислот изменяет растворимость одновременно обоих металлов, но
не в одинаковой степени для каждого (фиг. 20).
Грахам отмечает, что при травлении латуни наиболее правильным
является такое соотношение кислот, при котором скорости растворе-
ния обоих металлов будут соответствовать их содержанию, в латуни.
В случае травлеТгня без соляной кислоты поверхность латуни приоб-
ретает тусклый, бледкожелтый оттеннок, указывающий на избыток
цинка.
При очень большом содержании HG1 латунь делается пятнистой,
с коричневым оттенком, вследствие излишнего вытравливания цинка
и недостаточного растворения меди. Такой же эффект, но в более
слабой форме, получается и гари низком содержании HN03.
Сила действия протравы зависит также от соотношения между
взятыми количествами воды и серной кислоты и от температуры.
При повышении температуры травильной смеси скорость раство-
рения меди сначала увеличивается (до 50°), а затем быстро падает.
Скорость же растворения цинка с температурой изменяется мало,
причем сначала (приблизительно до 40°), она слегка понижается,
а затем (>40°) немного увеличивается (фиг. 21).
Травление в горячем растворе при температуре около 45° придает
латуни белый тусклый цвет вследствие того, что вытравливание
меди из сплава происходит значительно быстрее, нежели цинка. Уве-
личение температуры выше 50° ведет уже к разложению травильной
смеси.
По поводу различных добавок к указанным растворам кислот
Грахам отмечает, что они не являются активными компонентами и
что их роль сводится только к регулированию действия травильной
смеси. Автор считает, что лучшими добавками являются отруби,
сульфитцеллюлоза и сажа, находящаяся в растворе в коллоидальном
состоянии. Декстрин и опилки оказывают слабое действие.
60
Наиболее употребительной добавкой из указанных является сажа.
Грахам считает, что присутствие сажи в травильном растворе вызы-
вает его вспенивание препятствуя тем самым улетучиванию окисло®.
'В случае избытка соляной кислоты в растворе добавка сажи (в боль-
шом количестве) понижает силу ее действия и тем самым преду-
преждает появление на поверхности латуни пятен и коричневой
окраски.
Блюм и Хагебум1 считают, что действие сажи заключается в ад-
сорбции какой-нибудь из кислот (в данном случае, очевидно, соля-
ной) или продуктов реакции.
Краузе2 указывает, что в присутствии сажи азотная кислота ча-
стично восстанавливается в азотистую. Невидимому, это обстоятель-
ство может тоже служить объяснением механизма действия сажи, за-
ключающегося в предохранении меди и латуни от появления на их
поверхности различных пятен.
На основании своих исследований Грахам предлагает рецептур-
ные условия для предварительного и глянцевого травления, главным
образом латуни, приводимые нами в табл. 15.
1 Blum a. Hogaboom, Principles of Electroplating and Electroforming, 1930.
2 Краузе, Гальванотехника, перевод с немецкого, 1933.
61
Таблица 15
Удельный вес °Вё Предварительная протрава Глянцевая про- трава
г/л см3/л г/л см3/л
IloS04 1,84 66 700 380 800 435
hno8 1,38 40 100 72 100 72
НС1 1,17 20 5 4 25 2
н3о -— — 544 544 491 491
Контроль раствора для глянцевой протравы производится следую-
щим. образом. Общее содержание всех кислот определяется путем
титрования едким натром в присутствии индикатора метилоранжа.
Азотная кислота титруется железным купоросом в присутствии из-
бытка H2S04 на холоду до получения слабокрасной или коричневой
окраски. Титр раствора железного купороса устанавливается также
по азотной кислоте. При этом происходит окисление закисной соли
железа в окисную и превращение азотной кислоты в окись азота.
Реакция идет по следующему уравнению:
6FeSO4 4- 2HNQ, + 3H2S04 = 3Fe2(S04)5 + 2NO + 4Н20.
При избытке FeS04 окись азота может давать с ним нестойкое со-
единение, выражаемое формулой FeS04. NO, имеющее окраску от
красновато-коричневой до черной. Согласно приведенному уравнению
одна молекула азотной кислоты требует три молекулы сернокислого
закисного железа.
Соляная кислота определяется путем титрования раствора азотно-
кислым серебром.
Серная кислота определяется по разности между первым титрова-
нием и двумя последними.
В некоторых случаях для травления меди и ее сплавов, главным
образом для травления латунного литья, применяют раствор плави-
ковой кислоты или смеси ее с азотной и соляной кислотами.
Для удаления с поверхности латунного литья остатков кремне-
зема применяют раствор, состоящий из одной части плавиковой ки-
слоты и трех частей воды.
Для предварительного травления отливок из меди, латуни, бронзы
и нейзильбера применяют следующий состав раствора, содержащий
плавиковую кислоту: плавиковая кислота (уд. в. 1,13—1,15) — 4 л;
азотная кислота (уд. в. 1,35—1,38)—3 л; поваренная соль —
50—100 г.
Для травления до блеска в этом случае применяется более креп-
кий раствор указанных кислот с добавками некоторых солей: пла-
виковая кислота (уд. в. 1,13—1,15) — 15 кг; азотная кислота (1,35—
1,38) — 15 кг; сернокислый цинк — 5 кг; селитра NaN03 или KN03 —
1 кг; соляная кислота (уд. в. 1,18—1,19) — 350 г.
62
Эта протрава применяется в горячем виде. При изготовлении ее
сначала растворяют в плавиковой кислоте сернокислый цинк, при-
бавляют затем селитру, хорошо размешивают, после чего медленно и
при непрерывном перемешивании вливают сначала азотную кислоту,
затем соляную кислоту.
После этого травильная смесь некоторое время оставляется
в покое.
Для травления других сплавов меди применяются приблизи-
тельно такие же растворы с некоторым видоизменением по содержа-
нию тех или иных компонентов. Так, например, для травления
мельхиора до блеска Краузе рекомендует следующие рецептурные
условия.
1) Травление с целью удаления грубых окислов.
Изделие травится в растворе, содержащем около 3Q% серной кислоты,
в течение 0,5—1 час. при 25—30°.
2) П р е д в а р и те л ь н а я п р о т ра в а имеет следующий
Состав: азотная кислота (уд. в. 1,35—1,40) — 1 л; соляная кислота
(уд. в. 1,18—1,19) — 5 г; глянцевая сажа (предварительно разведен-
ная в азотной кислоте) — 2—3 г. Глянцевое травление производится
в растворе следующего состава: азотная кислота (уд. в. 1,35—1,40) —
3 л; серная кислота (уд. в. 1,84) — 5 л; поваренная соль — 30—50 г;
глянцевая сажа, предварительно разведенная в азотной кислоте, —
3—4 г.
Изделия из металлов, легко растворяющихся в щелочах, травятся
обычно в растворах едкого натра (10—20%) или едкого кали (10—
20%), иногда с добавкой поваренной соли (1—3%).
'Свинец травится в разбавленной азотной кислоте (5—10%'), цинк,
олово и алюминий — в соляной кислоте (5—10%). Олово и свинец
Травятся иногда в 5% растворе цианистого калия. Кадмий травится
в 5—15% растворе серной или соляной кислот или 5% растворе циа-
нистого калия.
Электролитическое травление. Электролитическое травление про-
изводится как на аноде, так и на катоде.
Анодное травление основано на электролитическом растворении
металла и механическом отрывании окислов выделяющимся кисло-
родом. На катоде при этом происходит бурное выделение водорода.
Процессы, протекающие на электродах, в случае травления железа
могут быть представлены в следующем виде:
на аноде Fe->Fe“ 6,
на катоде 2Н’-|-2б->Н2.
В качестве электролита при анодном травлении применяются
растворы кислот (почти исключительно серная кислота) или раствор
соли соответствующего металла. Электродами служат: в качестве
анода — травящийся металл, в качестве катода — свинец, медь, же-
лезо и др. Плотности тока применяются обычно высокие: 5—10 А/деи2
и выше.
Травление на катоде происходит за счет восстановления и меха-
нического отрывания окислов металла бурно выделяющимся водо-
ег
родом. Ё качестве электролита в этом случае может служить раствор
кислоты или любой соли, обладающий хорошей электропровод-
ностью.
Наилучшие результаты при катодном травлении, однако, дают
электролиты, содержащие, главным образом, серную кислоту.,
В этом случае одновременно с восстанавливающим и механиче-
ским действием водорода происходит также и химическое растворе-
ние окислов. Анодом при катодном травлении является какой-нибудь
металл, не растворимый в данном электролите. Обычно для этой
цели применяются свинцовые пластины. Плотности тока при катод-
ном травлении могут быть такого же порядка, как и при анодной
обработке.
Протравливание изделий электролитическим способом в большин-
стве случаев достигается значительно быстрее, нежели при одной
химической обработке. Скорость травления как при анодном, так и
при катодном процессах может быть увеличена за счет повышения
плотности тока. Однако, эта зависимость не является строго пропор-
циональной, и очень часто повышение плотности тока не дает ожи-
даемого эффекта очистки, несмотря на правильный подбор состава
электролита. Эффект очистки при электролитическом травлении
зависит, главным образом, от рода и состояния окислов на поверх-
ности травящегося металла. Предметы, покрытые толстым, сплош-
ным и плотным слоем окислов, очень трудно поддаются электроли-
тической очистке.
Бывают случаи, когда совсем не удается получить положитель-
ных результатов. Лучше всего удаляются окислы, имеющие большую
пористость и как бы разрыхленное состояние. При этом условии ме-
ханическая работа выделяющихся пузырьков газа при отрывании
окисных пленок значительно облегчается.
В практике, главным образом при очистке изделий, идущих
в дальнейшем на покрытие, наиболее распространенным видом
электролитического травления является травление на аноде. При
анодном травлении в соответствующем электролите изделие при-
обретает совершенно чистую, слегка шероховатую поверхность, хо-
рошо сцепляющуюся с электролитическим осадком другого металла.
Этот процесс требует очень строгого и тщательного соблюдения всех
условий работы, в частности внимательного наблюдения за продол-
жительностью травления, так как в противном случае поверхность
металла может оказаться настолько сильно и неравномерно разъеден-
ной, что изделие придет в негодность. При правильно установленном
режиме работы можно избежать перетравливания изделий и полу-
чить поверхность гладкую, но с резко выраженной кристаллической
структурой— условие, необходимое для наилучшего сцепления ме-
талла с покрытием.
Процесс катодного травления исключает почти совершенно опас-
ность перетравливания изделий (передержка изделий Ь ванне не
имеет значения) но он оказывает другое, не менее вредное влияние
на качество металла изделий. Дело в том, что при катодном травле-
нии, подобно тому, как указано было при катодном обезжиривании,
водород, разряжающийся на металлической поверхности (между ме-
таллом и окалиной или в порах окалины), частично проникает
ci
внутрь металла, делая его хрупким и ломким. Поэтому изделия ИЗ
тонкого листового материала, главным образом из стали (пружины,
пластины и пр.), травить на катоде не рекомендуется. В этом случае
возможно только легкое протравливание па аноде.
В большинстве случаев катодный процесс требует больше вре-
мени для полной очистки изделий от окислов. нежели анодное
травление.
Хорошие результаты в отношении очистки от окислов дает иногда
травление на катоде, как показывают опыты, некоторых массивных
изделий, изготовленных из определенных сортов стали и железа.
Подходя к вопросу о том. в каких случаях следует применять
анодное травление и когда дает хорошие результаты травление на
катоде, независимо от природы металла, и появления в нем хрупко-
сти, можно указать следующие основные положения, подробно и хо-
рошо разобранные О. Есиным и А. Балабай У
При травлении поверхности металла, покрытого окалиной, анод-
ный процесс при определенной плотности тока дает хорошие резуль-
таты, когда железная окалина очень пориста и содержит большое
количество примесей или включений металлического железа. В этом
случае будет происходить удаление окислов, главным образом, за. счет
электролитического и химического (если электролитом служит кис-
лота) растворения активной части окалины, т. е. включений метал-
лического железа. Механическое действие Выделяющихся пузырьков
газа (кислорода) при данном условии будет иметь меньшее значение,
так как на их долю выпадает работа отрывания очень небольшого
количества оставшихся окислов, превращенных, кроме того, в сильно
разрыхленное состояние. В случае же присутствия па поверхности
изделия плотной, сплошной и недостаточно пористой пленки окислов,
содержащей небольшое количество примесей металлического железа,
электролитический и химический процессы на. аноде (растворение
активной части окалины) будут протекать слабо. При- очень низкой
степени пористости пленки окислов механическое действие кисло-
рода, разряжающегося главным образом на поверхности металла или
на границе между металлом и окалиной (в порах окалины), также
теряет свою силу. Вследствие этого весь эффект очистки при таких
условиях будет значительно понижен.
Далее, в том случае, когда, окалина лежит на поверхности пред-
мета неровным слоем, причем имеются отдельные участки обна-
женного металла или разрывы окисной пленки, анодный процесс
травления может вызвать неравномерное, излишнее (в отдельных
местах ) разъедание поверхности. Последняя после такого протравлива-
ния становится очень шероховатой, с глубокими рытвинами, иногда
даже с дырами (листовой металл). Поэтому травление такой поверх-
ности производится (по крайней мере сначала) химическим спосо-
бом, иногда с последующей электролитической обработкой на аноде
для легкого протравливания.
При катодном травлении, как было указано, очистка металла от
окислов происходит, главным образом, за счет восстанавливающего
'Балабай А. и Есин О., Электролитическая травка трансформаторной
стати ,„Журн. прикладной химии", 4, 1933.
5 Основы гальваностегии. 17Ь8
65
и механического действия водорода, процесс же электролитического
растворения здесь не имеет места. Поэтому катодное травление будет
давать, повидимому, относительно лучший эффект, когда окалина
при одинаковой степени пористости содержит в процентном отноше-
нии большее количество окислов металла. Восстановление окислов
металла водородом ослабляет плотность и прочность сцепления
пленки окалины с поверхностью металла, превращая ее в рыхлое
состояние. Это обстоятельство в значительной мере облегчает также
и механическую работу отрывания окалины выделяющимися пу-
зырьками, газа (водорода).
В случае включений большого количества металлического железа
в алой окалины и при недостаточной пористости пленки эффект ме-
ханического действия пузырьков газа может оказаться очень слабым,
так как при этом условии разряд и выделение водорода будут про-
исходить частично на самой поверхности окалины, т. е. участках
поверхности, состоящих из включении металлического' железа.
Во время анодного травления железа или стали наблюдается ино-
гда резкое скачкообразное изменение напряжения на ванне. Уто
явление объясняется, повидимому, образованием пассивной пленки,
вызывающей скачок анодного потенциала. 1ак как образование пас-
сивного слоя возможно при выделении кислорода на поверхности
металлического железа — основного металла, то, очевидно, скачок
вольтажа будет указывать на полное или частичное удаление окис-
лов. Разумеется, как сам процесс образования пассивного слоя, так
и устойчивость его возможны только при определенных условиях.
При недостаточно равномерном и несплошном слое пассивной пленки
последняя быстро разрушается, вызывая обратное снижение вольтажа
до первоначального значения. Происходит это в большинстве случаев
за счет химической реакции с электролитом, имеющим достаточно
высокую кислотность, или добавки активаторов СГ и др., а также за
счет возможного механического воздействия выделяющихся пузырь-
ков газа. Наблюдается таким образом, периодическое изменение со-
стояния поверхности, вызывающее то повышение, то понижение воль-
тажа ванны. Изменения напряжения на ванне могут происходить
также за счет колебаний плотностей тока, происходящих вследствие
изменения формы и величины поверхности (пористая окалина, глад-
кое чистое железо, шероховатая поверхность основного металла с
частицами шлама).
Интересны результаты, полученные О. Есиным и А. Балабай, произ-
водивших анодное травление трансформаторной стали в 30 Jo рас-
творе серной кислоты при плотностях тока на аноде 0,5—7,5 А/дл2.
При этом они обнаружили, что через небольшой промежуток времени
(1—зо мин., в зависимости от плотности тока) напряжение резко
поднимается и в дальнейшем остается более или менее постоянным
при высоком значении. Скачок вольтажа совпадает обычно с момен-
том бурного выделения на аноде кислорода и началом сильного ме-
ханического воздействия его пузырьков на отрывание пленки ока-
лины. Приведенные на фиг. 22 и 23 диаграммы (О. Есин и А. Бала-
ев
бай) показывают, что резкий подъем напряжений начинается тем
скорее, чем выше плотность тока. Перерывы электролиза обусловли-
вают прохождение тока при вторичном включении цепи при низком
вольтаже, после чего последний опять быстро возрастает до макси-
мального значения (пунктир на фиг. 23).
По мнению авторов, резкое повышение напряжения при анодном
травлении происходит вследствие перехода металла из активного
в пассивное состояние. Объясняя это явление с точки зрения элек-
тронной теории Мюллера, они указывают, что пассивное состояние
металла, при анодной обработке наступает Вследствие образования на
его поверхности пленки, состоящей из твердой соли, например FeSO,
(в случае обработки железа), влияющей на изменение потенциала
железа в сторону более электроположительного значения (к потен-
циалу Fe’“). Временное снижение вольтажа после перерыва электро-
лиза объясняется, с одной стороны, растворением этого слоя, кото-
минуты
Фиг. 22. Напряжение на клеммах ванны при электролитическом травлении.
потенциала железа в сторону меньшего значения за счет восстана-
вливающего действия водорода1 и происходящего при этом активиро-
вания поверхности металла.
Электролитическое травление, главным образом травление на
аноде, так же, как и электролитическое обезжиривание, не рекомен-
дуется применять для очистки от окислов изделий, имеющих слож-
ную, очень рельефную поверхность. При анодном травлении желез-
ных изделий с более или менее правильной формой рекомендуются
следующие рецептурные условия2 3:
1 По данным Мюллера („Zeitschr. f. Electrochemie**, 35, 450, 1929) водород
диффундирующий в металл, при перерыве электролиза в результате растворе-
ния железа в серной кислоте ионизируется в решетке 6 и сдвигает
равновесие в металле Fe" Fe‘" + 0 в сторону образования Fe’*.
3 Кудрявцев Н. Т., «Подготовка поверхности металлических изделий перед
электролитическим покрытием" изд. Цитэин — Со, 1934 г.
67
Состав раствора для электролита:
1. Н28О4
2. H2S04
NaCl
3 >. FeSO4
MgSO4.711,0
H2SO4
4. FeCl3.6H.O
NaCl
H„SO4
3-4 jV
3 IV
0,25 N
2 W
0,5 N
0,01—0,1 Л’
2 N
0,5—1 TV
0,25—0,5
(15—20%)
(15%)
(1,5-3%)
Плотности тока, для всех электролитов при травлении изделий со
сравнительно большой поверхностью и покрытых окалиной приме-
няются от 5 до 10 А/д.и1 2. Температуру электролита можно держать
комнатную, но в некоторых случаях ее повышают до 50—60°.
Электролиты, содержащие в своем составе хлористые соединения,
при одинаковых прочих рецептурных условиях несколько сильнее
протравливают поверх-
ность, делая ее более ше-
роховатой. Поэтому, если
такие свойства поверхно-
сти нежелательны, лучше
пользоваться другими, из
указанных выше, раство-
рами. С другой стороны,
когда необходимо иметь
наибольшее сцепление по-
верхности основного ме-
талла с покрытием, тра-
вление в этих электроли-
тах дает иногда лучшие
результаты.
Для изделий, имею-
щих большое протяжение.
Фиг, 23. Напряжение на клеммах ванны при
алоктролитическом травлении.
например проволока и
лепта, при обработке их на. конвейерной установке (непрерывное
прохождение через ванну в развернутом виде) рекомендуется приме-
нять более высокие плотности тока, нежели указанные выше. Так,
например, опыт2 показал, что хорошие результаты можно получить
при травлении железной и стальной проволок с плотностями тока
50—300 А/дм2. При этом продолжительность процесса, составляет
лишь несколько секунд или десятков секунд. Для более или менее
светлой и так называемой «бронзированной» 3 проволоки, как пока-
1 При травлении грубой поверхности железа, покрытой окалиной, вместо
MgSO4 можно применять NaCl от 3 до 5% и концентрацию серной кислоты по-
вышать до 1—2%. Такой раствор, как показали исследования Кудряв-
цев а, II. Т. и П е т р о в о й В Н. дает лучшие результаты в смысле протрав-
ливания самого металла и ускоряет процесс удаления окислов.
2 Лаборатория химического института им. Карпова Л. Я. и ВЭИ. (Ка-
банов Б. Н, Кудрявцев Н. Т. и Петрова В. Н.).
3 Проволока, покрытая небольшим слоем меди, образующимся иа ее поверх-
ности во время протяжки через раствор медного купороса.
68
зали опыты на полузаводской конвейерной установке ВЭИ *, при
плотностях тока, например, too—200 А/дм1 2 3, достаточно 2.5—з сек.
Черная проволока, имеющая на своей поверхности слой окалины,
травится значительно дольше и в некоторых случаях совсем не под-
дается удовлетворительной обработке.
Плотности тока выше 300 к!дм2 дают плохие результаты; наблю-
дается излишнее разъедание поверхности и появление большого ко-
личества шлама. Напряжение, (потребное для обычного анодного
травления при 5—10 А/дм2, колеблется в пределах 2—6 V. При тра-
влении с очень высокими плотностями тока, (до 300 А/дм2) оно дохо-
дит до 10—12 V и в некоторых случаях увеличивается еще больше.
С целью снижения напряжения травление проволоки и ленты, таг: же
как и другие операции электролитической обработки их поверхно-
сти (при очень высоких плотностях тока), производится при наи-
меньшем расстоянии между электродами. Кроме того с этой же целью
.(главным образом) температуру электролита, повышают, как указано
выше, до 50—60°. Напряжение на зажимах ванны при этом сни-
жается приблизительно на 30—40% против значений, соответствую-
щих комнатной температуре.
Из приведенных выше электролитов наибольшее падение напря-
жения показывают слабо подкисленные растворы солей. Поэтому
при очень высоких плотностях тока целесообразнее применять или
растворы кислот или растворы солей с повышенной температурой.
На. фиг. 24 для примера приведена диаграмма изменения напря-
жения в зависимости от плотности тока при травлении проволоки
d — 1,4 мм в различных электролитах 2.
Очень часто для очистки изделий от окалины перед анодным
травлением применяют предварительно химическую обработку их
в кислотах (серной или соляной), так называемое «подтравливапие».
Такой комбинированной обработкой пользуются при травлении же-
лезных листов, иногда проволоки и лент, покрытых толстым н
неравномерным слоем окалины. Для катодного травления из ука-
занных электролите® применимы первые два раствора кислот.
Пригодны также для этой цели (при травлении железа) растворы
щелочей или соответствующих им солей. Эти последние, однако, дают
значительно худшие результаты, нежели кислые электролиты. За
границей получил известное распространение так называемый ме-
тод Буллард-Данна.
По этому методу катодное травление производится в кислом
электролите с одновременным осаждением на. очищенную от окислов
поверхность изделий тонкой пленки металлического свинца. Эта
пленка перед последующим металлическим покрытием очень легко
удаляется путем электролитической обработки изделий в щелочной
ванне на аноде.
В тех случаях, когда изделия гальваническому покрытию в даль-
нейшем не подвергаются, пленка свинца, по мнению фирмы, может
1 Работа электрохимической лаборатории ВЭИ, реферат отчета ио цинко-
ванию и лужению, проволоки при высоких плотностях тока. К у д р я в ц е в 11 Т.
н Державина Ю. Л., изд. Цитэин.
3 Результаты опытов, проведенных в стационарной ванне лабораторного
типа в электрохимической лаборатории ВЭИ.
69
служить сама, достаточной защитой железа, от коррозии при хорошей
последующей смазке поверхности маслом1.
6. Декапирование
От обычного процесса, травления металлов следует отличать еще
один вид обработки изделий, называемый декапированием.
Фиг. 24. Зависимо *ть напряжения от плотности тока при электролитическом
травлении проволоки.
d— 1,4 мм: 1 и 2 электролит: 15°/0 H.,SO4-|-5 /0 NaCl; 3, 4 и 5 элек-
тролит: 3 N FeSO4.7H2O -4-0,85 N MgSO4. 7 Н20; -р 0,1—0,2 N H2SO4.
Декапирование производится непосредственно перед погружением
изделия в гальваническую ванну. Эта операция необходима, прежде
всего для быстрого удаления легкого палета окиси, образующегося
•В последнее время некоторыми из наших работников, например работниками
Ленинградского отделения Электрохимета. в порядке проверки и применения
в производстве этого метода выработаны свои сравнительно хорошие рецептур-
ные условия. На автомобил- иом заводе им. Сталина в Москве этот метод
освоен в промышленных масштабах. Па этом заводе сконструирован и установ-
лен автомат для катодного травления, вследствие чего отпала необходимость
в обработке изделий песком.
70
очень часто на поверхности очищенных изделий при их транспорти-
ровке или то время хранения.
При правильно установленном режиме работы достигается лег-
кое протравливание верхнего металлического слоя, обусловливающее
выявление кристаллической структуры металла. Это условие, как
указано было выше, обеспечивает наилучшее сцепление поверхности
основного металла с гальваническим покрытием.
Для химического декапирования применяются более слабые тра-
вильные растворы, нежели указанные для обычного метода травле-
ния. При этом, во избежание разрушения поверхности, операция де-
капирования длится очень недолго, всего 0.5—2 минуты.
Для химического декапирования железа и стали применяется
слабый раствор серной или соляной кислоты (2—5%). Перед покры-
тием железных изделий в цианистых ваннах употребляют иногда
для декапирования слабые, растворы (2—3%) кислых солей или
органических кислот и их солей: бисульфат натрия, винная кислота,
уксусная кислота, кислая виннокалиевая соль (винный камень) и др.
Для изделий из меди и медных сплавов, особенно если они идут
на покрытие в щелочных или цианистых ваннах, применяют иногда
для декапирования вместо указанных кислых растворов растворы
цианистого калия или цианистого натрия (5—7 г 60% KCN или NaCN
на 100 г ILO).
Цинк и алюминий декапируются в 3% растворе соляной кислоты.
Для цинка, хорошие результаты дает также обработка в 3—5% рас-
творе серной кислоты. Кроме того, для обоих металлов применима
дека пироока в разбавленных растворах щелочей (КОН или NaOH) —
5—10% при комнатной температуре.
Декапирование свинца, олова и британского металла лучше про-
изводить в щелочном цианистом растворе.
Электролитический способ декапирования заключается в том,
что детали перед покрытием обрабатываются постоянным током на
аноде В’ чистом слабом растворе серной, реже соляной кислот
(2—3,%), а. также в растворах кислых, сернокислых солей.
Для полированных изделий из меди и ее сплавов применяют
иногда электролитическое декапирование в растворе цианистого ка-
лия (6—7 г 60% KCN на 100 г Н,0), чаще с добавкой углекислого
натрия или калия (1—3%). Такой раствор при двойной катодной и
анодной обработках служит одновременно и для обезжиривания и
для декапировки этих изделий. Плотности тока при электролитиче-
ском декапировании применяют обычно 1—>5 А/д.и2.
Продолжительность процесса 0,5—2 минуты.
7. Матирование
Матирование — процесс удаления с поверхности металла глянца
и придания ей матового оттенка. Такой обработке подвергаются изде-
лия. глат'ным образом, из цветных металлов, например, изделия из
алюминия, мрди и ее сплавов и др.
В большинстве случаев матирование таких изделий применяется
как отдельная специальная операция, не связанная с процессом
гальванического покрытия. Специальное матирование изделий из
71
черных металлов применяется реже. Матовый еид этих изделий по-
лучается одновременно при механической очистке их поверхности от
загрязнений перед последующим покрытием другим металлом. Из
механических способов обработки для матирования черных изделий
(железо, сталь, чугун) пригодны обдувка песком с помощью песко-
струйного аппарата или вращение в барабанах, наполненных песком
или другими абразивными материалами. При такой обработке по-
верхность делается пе только матовой, но и слегка шерохо-
ватой.
Матирование механическим способом применяется также и для
изделий и.? цветных металлов. В этом случае удовлетворитель-
ные результаты дает обработка изделий вращающимися щетками.
Для матирования щетками употребляют проволоку из более твер-
дого металла, нежели матируемым предмет. Например, для мати-
рования меди, латуни, томпака, нейзильбера, серебра и т. п. при-
меняют щетки из стальной проволоки; .для изделий же из золота,
британского металла, цинка и т. п могут быть пригодны щетки из
латунной проволоки. Кроме того щетки для матирования должны
иметь длинную связку проволок, иначе они будут давать глянец на
поверхности металла. Толщина проволоки тоже играет роль. Чем
толще проволока, тем грубее получается поверхность металла и
наоборот. Число оборотов щетки не должно быть слишком большим,
иначе поверхность будет принимать глянцевый оттенок. В зависи-
мости от твердости матируемого предмета применяют от 300 до G00,
а иногда до 1000 об,'мин.
Матирование цветных металлов можно производить также и с по-
мощью пескоструйного аппарата, по в этом случае поверхность по-
лучается более шероховатой. Механический способ матирования
вообще дает грубую, пе всегда желательную отделку. Поэтому он при-
меняется, главным образом для литых изделий, имеющих грубую
поверхность.
Красивая и тонкая матовая отделка металлов получается при хи-
мическом и электролитическом способах матирования.
Для химического матирования меди и ее сплавов? рекомендуются
следующие рецептурные условия’.
После того как эти изделия были подвергнуты предварительному
«цветному» травлению, их погружают в раствор следующего состава;
300 вес. ч. азотной кислоты (36° Вё)
200 „ „ серной .. (66° Вё)
1,5 , „ хлористого натрия
1—1.5 . , сернокислого цинка
Хлористый натрий добавляется для образования свободного
хлора. Чем больше сернокислого цинка в растворе, тем более мато-
вой будет поверхность изделий. Продолжительность процесса мати-
рования зависит от того, какой вид поверхности (степень мата) дол-
жен быть полечен. Повышенная температура ускоряет процесс мати-
рования. Выгруженные из такого раствора изделия вначале бывают
обычно некрасивыми, с глинистым оттенком; поэтому после такой
обработки их опускают па очень короткое время в глянцевую' про-
1 Г. Краузе, Гальванотехника, пер. с немецкого, 1933.
72
траву (см. выше). Передерживать изделия в этой протраве не следует,
так как мат может исчезнуть.
Очень тонкий мат получается при обработке медных сплавов
в так называемой французской протраве. Эта протрава имеет сле-
дующий состав:
азотная кислота (уд. в 1.35- 1.4) ... 1 кг
серная кислота (уд. в. 1,84; .... 1
хлористый аммоний (в кусках;.... 50 г
серный цвет........................50 „
глянцевая сажа.....................50 „
цинк...............................50 „
Роль глянцевой сажи — восстанавливать азотную кислоту в азо-
тистую. В азотной кислоте сначала растворяют 50 г металлического
цинка, а заТ’м ее смешивают с серной кислотой и с остальными
компонентами.
Матировка производится при 50°. Добавление в этот раствор не-
большого количества концентрированной серной кислоты (олеум)
дает блестящий мат, при добавках же азотной кислоты получается
тусклый мат.
Очень хороший тонкий мат получается также при обработке меди
и ее сплавов в хромовокислой протраве. Состав этой протравы сле-
дующий:
хромовокислый калий.............. 200 г
серная кислота (химия, чист.,
уд. в. 1,84)............... 60 „
хлористый натрий................... 1 .
вода............................... 1 „
Для матирования алюминия применяется протрава, состоящая из
10%> раствора едкого натра, насыщенного хлористым натрием.
Кроме указанных методов наведения мата применяется также
матирование гальванопластическое У Так, например, хорошо отдека-
пировапные предметы покрывают гальванопластическим осадком
меди при низких плотностях тока. В качестве электролита служит
раствор следующего состава:
CuS04.5H90 150 г
H2SO4 " 30 .
вода 1 л
Плотности тока применяются для этой цели о,5—0,8 А/д.и2.
Изделия из цинка, британского металла и т. д. предварительно
омедняют B’ цианистой медной ванне, а загем матируют.
8. Последовательность операций при подготовке металлической
поверхности, существующие варианты и техника
их осуществления
Успех работы по подготовке поверхности изделий перед покры-
тием зависит не только от выбора метода и правильно установлен-
ных рецептурных условий для каждого из рассмотренных выше
процессов. Большую роль в этой части гальванотехнического произ-
водства играет правильная расстановка выбранных операций как
1 Pfanhauser, Die Electrolytiechen Metallniederschlage, 1928.
в смысле последовательности перехода изделий по отдельным про-
цессам, так и в отношении размещения оборудования по цеху. Кроме
того важное, иногда решающее значение в работе имеют аккуратное
отношение к выполнению каждой операции, внимательное обслужива-
ние ванн и другого оборудования и, главное, содержание ванн и раз-
личных приспособлений, соприкасающихся с обрабатываемыми дета.-
лями, так же как и всего цеха, в надлежащей чистоте.
Из Всего предыдущего описания подготовки поверхности металлов
уже само собой вытекает, что этот участок работы в гальваническом
цеху состоит из следующих четырех основных операций, идущих
в порядке последовательности отдельных процессов: ]) обезжирива-
ние; 2) травление — удаление окислов; з) механическая очистка:
4) декапирование.
Под механической очисткой в данном случае разумеется операция
удаления с поверхности изделий, главным образом изделий из чер-
ных металлов, шлама или темного налета., остающегося очень часто
после травления. Кроме того механическая обработка изделий в виде
шлифовки и полировки, как известно из предыдущего^ применяется
специально для придания изделиям гладкого вида. Такой вид меха-
нической обработки не требует после себя дополнительной механиче-
ской очистки, за исключением того случая, когда необходимо при-
менять ручной способ обезжиривания поверхности после полирова-
ния (щетками с венской известью) и может заменить операцию
травления. После шлифовки и полировки, как указано, в обязатель-
ном порядке следует операция обезжиривания и после нее декапи-
рование. Само собой разумеется, что после каждой из операций
производится тщательная промывка, изделий водой. Условия чистоты
поверхности изделий требуют также очень внимательного отношения
к этому виду работы.
Качество подготовки поверхности зависит не только от тщатель-
ной очистки изделий от жиров и окислов, но также и от того, на-
сколько тщательно произведена промывка, их от остатков различных
загрязнений и той среды, в которой производилась их очистка (ще-
лочь или кислота).
Промывка изделий после обезжиривания должна, производиться,
как необходимое условие, не в холодной, а в горячей, подогретой
почти до кипения проточной воде. Горячая вода необходима для того,
чтобы удалить оставшиеся на. поверхности изделий мыла, пли пленки
эмульсий жиров (неомыляемых). Последние, как известно, в холод-
ной воде затвердевают и могут остаться в виде твердой пленки,
предохраняющей от плотного сцепления основного металла с покры-
тием. Эти пленки растворяются только в воде, подогретой до темпера-
туры кипения. Кроме того горячая вода, способствует более быстрому
и легкому удалению с поверхности изделий самой щелочи.
Промывку следует производить для белее полного удаления ще-
лочи и остатков загрязнений в двух или трех водах, из которых п.‘р.
вая, а лучше также и вторая должны быть подогреты до температуры
70—100°. Нагревание воды осуществляется так же, как и нагрева-
ние щелочных растворов, посредством паровых змеевиков или
электрическими грелками.
Если детали перед этим обрабатывались в каком-нибудь из
74
органических растворителей, то для удаления последнего их следует
высушить и подвергать промывке после предварительной обработки
химическим или электролитическим способом в растворах щелочи
или кислоты (в зависимости от характера предварительной обра.-
ботки). Эта обработка необходима в тех случаях, когда, детали не
требуют длительной протравы в кислотах для удаления толстых
слоев окалины, например полированные, или вообще все детали, по-
ступившие в гальванический цех после обработки на механических
станках. Эти детали бывают покрыты, главным образом, жиром и
маслом и не содержат па своей поверхности заметного количества
окислов.
После травления детали также тщательно промываются в одной
или нескольких водах. Температура воды в данном случае не обя-
зательно должна быть повышенная, так как остатки кислот на по-
верхности металла почти одинаково легко отмываются как в холод-
ной, так и в горячей воде.
После декапировки детали промываются также в двух или трех
водах, причем после декапировки в щелочном растворе первая вода
должна быть теплая, а остальные могут быть холодные. Необходимо
следить за тем, чтобы детали после декапировки, а также и до нее
были совершенно изолированы от каких-либо жировых и масляных
загрязнений, в частности не допускаются прикосновения к ним го-
лыми руками. В противном случае последующее покрытие будет не-
прочным и станет отслаиваться.
После травления деталей очень часто на. их поверхности остаются
частички шлама или темносерая пленка, получающаяся обычно
в результате перетравления поверхности черного металла. Последнее
зависит от сорта, железа или стали, а также от состава травильной
смеси, режима работы и аккуратности выполнения данной операции.
Для освобождения поверхности изделий от подобных загрязнений
производится обработка их щетками простой или мыльной водой,
песком, известью, мелом, пемзой и т. и., вручную- или механически
на станках, барабанах или колоколах. Обычно после грубой обра-
ботки изделий для их очистки применяется смесь — густая кашица,
состоящая из воды, извести и речного чистого песка или мела в от-
ношении 1 : з или 1:2.
Обработка щетками вручную — довольно несовершенный прием
работы и по производительности и по степени достигаемого -качества
очистки. Применяется он, главным образом, для особо тонких и изящ-
ных, иногда полированных изделий, идущих в небольшом количестве
на покрытие. Для этих изделий в качестве очистительной смеси при-
меняют большей частью капищу из тонко размолотой венской
извести.
Очистка на станках производится с помощью вращающихся
стальных, реже волосяных, щеток различной формы в зависимости
от рельефа и формы деталей. Часто пользуются щетками, только
слегка увлажненными водой, но лучше применять щелочную воду
или указанные выше смеси. В этом случае необходимо устройство
к станкам особых приспособлений, защищающих их и рабочего от
забрызгивания щелочной кодой или жидкой массой. Для очень боль-
ших рельефных предметов применяют иногда щетки, укрепленные
75
---Ход Операций для очень влаэкньгх изделий б случае обработки их
в пескоструйном аппарате
---- Хид операций для изделий загрязненных маслом в случае
обработки из в пескоструйном аппарате
---Ход операций для изделий идущих на покрытие непосредственно после
травления и промывки
---Iод операций при pa bore вез накопления запаса подготавренных изделии вцеху-
гравленые изделия идущие ни покрытие непосредственно после очистки и промывка
---Ход операций для изделий не требующих декапировки -хорошо протравленные
изделия, идущие на покрытие непосредственно после очисти и промывки
—•— Ход операций для изделий не требующих покрытия их поверхности
в гальванических ваннах
Фиг. 25.
па длинном гибком валу — гибкий рукав. Мелкие детали лучше
всего очищаются в барабанах, приводимых в движение моторами и
делающих 5—20 об/мин. Барабаны делают гранеными или круглыми
различно» величины— длиной от 50 до 1<ю см и диаметром от 30 до
40—50 см. Иногда они имеют небольшой наклон в своей оси. Затвор
у барабана должен быть плотным, герметичным. Их загружают до %
или '5 объема песком равномерного зерна, к которому добавляют
76
щелочной мыльной воды настолько, чтобы получилось однородное
тесто. В это тесто помещают обрабатываемые предметы так, чтобы
барабан заполнился примерно до 2/'3 своего объема. В случае очистки
деталей, имеющих сложные крутые профили или нарезку, не сле-
дует применять смеси, содержащие известь пли мел, так как эти по-
следние застревают плотной массой в углублениях и с трудом оттуда
удаляются. Барабанным способом очень быстро, в течение 5—1 о мин.,
достигается хорошая очистка поверхности. Последняя приобретает
совершенно светлый стальной оттенок и слегка шероховатую форму.
После очистки тем или иным Способом детали опять тщательно
промываются в одной или нескольких водах и следуют затем на дс-
капировку или прямо на покрытие.
Перед погружением изделий в гальваническую ванну не следует
примерять промывку их в горячей воде. Промытые в горячей воде
изделия очень быстро обсыхают и могут покрыться на поверхности
окисной пленкой. Поэтому после указанной очистки от шлама или
декапировки лучше промывать изделия непосредственно перед
опусканием их в гальваническую ванну в холодной комнатной воде.
Если ра деталях в углублениях поверхности остались следы при-
ставшей очистительной массы, то их нужно протереть чистой влаж-
ной волосяной щеткой и затем как следует опять промыть.
В том случае, когда детали не сразу идут на декапировку или па
покрытие, после очистки их нужно хранить в слабо щелочной воде,
например в 3% растворе соды, поташа или извести. Полезно до-
бавлять *в такой раствор небольшое количество аммиака, а лучше
хлористый аммоний, тяжелые пары которого, находясь над раство-
ром, будут защищать поверхность деталей от окисления кислородом
воздуха. Иногда применяют для хранения подкисленную воду, но
этот прием менее удобен, так как такая вода будет разрушающе дей-
ствовать на металл, в результате чего на. поверхности железных
изделий могут появиться опять частицы шлама. Перед покрытием
детали, выгруженные из ванны для хранения, опять тщательно про-
мываются и затем обязательно декапируются с последующей про-
мывкой в холодной воде.
Во всех случаях воду для промы'вки, даже горячую, рекомен-
дуется применять проточную. В том случае, когда после первой го-
рячей промывки следует еще ряд промывок. (1—3) в холодной воде,
можно первую горячую воду не делать проточной, а лишь сменять ее
периодически. Скорость перетекания или обмен воды т> ванне за еди-
ницу времени устанавливается в зависимости от количества и поверх-
ности пропускаемых деталей, объема ванны и пр. Обычно устана-
вливают обмен воды от 0,5 до 2-кратного за 1 час. Ванны делают по
объему такие же, как обезжиривающие и травильные или несколько
меньше. Материалом для промывных ванн служит дерево или же-
лезо. причем лучше употреблять дерево.
Таким образом можно дать примерную схему последовательного
проведения всех операций подготовки поверхности изделий в зави-
симости от характера их предыдущей и последующей обработки,
а также в зависимости от материала катота (фиг. 25).
ГЛАВА ВТОРАЯ
СТРУКТУРА ЭЛЕКТРООСАЖДЕННЫХ МЕТАЛЛОВ
Структура, электроосажденных металлов является одним из су-
щественных признаков, определяющих нормальное течение, а в не-
которых случаях и принципиальную возможность проведения элек-
трометаллургического процесса. Однако, между процессами электро-
литического рафинирования металлов или осаждения металлов
с нерастворимыми анодами, с одной стороны, и процессами по-
лучения покрытия, с другой, — с точки зрения роли структуры
имеется принципиальная разница.. В первых двух случаях прихо-
дится в первую голову считаться с расходом электрической энергии.
По этому признаку и выбирают состав электролита, режим и прочие
условия процесса. Структура металла в этих случаях играет подчи-
ненную роль, так как в большинстве случаев осаждающийся металл
подвергается переплавке; достаточно для этого получать плотные, не
осыпающиеся с катодной поверхности осадки. Важно также, чтобы
металл на. катоде не давал дендритов, которые могут вызывать корот-
кие замыкания. При электроосаждении цинка, например, приходится
сравнительно часто менять катоды также по соображениям ухудше-
ния качества металла (в структурном отношении) по мере его
наращивания. В гальваностегии структура осадка играет доминирую-
щую роль в процессе. Расход электрической энергии не отражается
сколько-нибудь заметно на. общей стоимости процесса покрытия, так
что1 выбирают не тот электролит, который обладает наименьшим оми-
ческим сопротивлением, а тот. который дает возможность получить
лучшие в структурном отношении осадки. Стоимость самого электро-
лита. также допускается более высокой, чем в электрометаллургиче-
ских (процессах. Помимо состава самого электролита все условия
выбираются такими, чтобы получать осадки плотные, мелкокристал-
лические, в некоторых случаях даже блестящие.
Не говоря уже о том. что такие требования являются обязатель-
ными при декоративных покрытиях, даже и *в случаях осаждения
электроотрицательных по отношению к железу металлов, например
цинка, или кадмия, химическая стойкость защищенного металла тем
выше, чем плотнее и мельче структура, электрооса ж денного металла.
Еще большую роль этот фактор играет при осаждении электрополо-
жительных металлов по отношению к основному металлу,- Фапример
при свинцевании или лужении железа. Как ниже будет показано,
механические свойства покрытий также находятся в сильной зави-
симости от их структуры. По этим причинам мы подробно остано-
78
Еймся на факторах, влияющих в той или иной степени на структуру
электроосажденных металлов.
Выделение металлов на катоде рассматривается как процесс кри-
сталлизации. Последняя протекает в две стадии: образование центров
кристаллизации (образование зародышей) и рост образовавшихся
центров кристаллизации. Каждый из этих двух процессов протекает
с определенной скоростью и в зависимости от условий электролиза
(температуры, плотности тока, перемешивания), природы осаждаю-
щегося металла и растворителя, наличия примесей в электролите
и т. д. преобладает тот или другой процесс, в связи с чем получается
та или ипая структура металла.. Число образующихся в единицу вре-
мени кристаллов, можно рассматривать как равнодействующую отно-
сительных склонностей разряжающихся ионов к образованию новых
зародышей и росту существующих кристаллрв.
В гальванотехнике, как выше упомянуто, представляют ценность
лишь равномерные, мелкокристаллические осадки. Такие металлы,
как железо, кобальт, никель, кристаллизуются из растворов своих
простых солей, особенно при низких температурах, в виде мелкокри-
сталлических блестящих, почти зеркальных осадков. Ближайшие к
катоду слои настолько мелкокристалличны, что они целиком вос-
производят форму металлической поверхности. Другие металлы
(медь, цинк, сурьма, висмут) при аналогичных условиях хотя и дают
более грубую структуру, но все же образуют плотные сплошные
осадки, по крайней мере в тонких слоях. Лишь по мере утолщения
осадка начинается, в первую очередь на. краях и углах катода (где
господствует большая плотность тока), образование дендритообраз-
ных осадков или наростов. Такие металлы, как свинец — в уксусноки-
слом или азотнокислом растворе, олово — в сернокислом или хлори-
стом растворе, в отсутствии специальных примесей не могут быть
осаждены в виде портного мелкозернистого осадка. Отдельные кри-
сталлы вырастают по направлению к аноду и в очень короткое время
могут достичь длины в несколько сантиметров, вызывая короткое за-
мыкание. При осаждении серебра из растворов простых солей также
преобладает рост кристаллов над скоростью образования центров
кристаллизации; золото и платина в растворах простых солей выде-
ляются на катоде в виде порошкообразных осадков.
В настоящее время мы располагаем достаточным количеством
данных, позволяющих кам вести процесс электроосаждения таким
образом, чтобы структура, покрытия отвечала своему назначению.
Вообще говоря, необходимо для каждого процесса соблюдать опре-
деленные условия, и общие положения, на которых ниже остановим-
ся, имеют не абсолютное, а относительное значение. Нельзя, напри-
мер, сказать, что если повышенная плотность тока, или пониженная
температура способствует получению мелкокристаллических осадков,
то можно во всех случаях в одинаковой степени повышать плотность
тока или понижать температуру. Все же, учитывая особенности каж-
дого конкретного случая, можно заранее сказать, в каком направле-
нии может повлиять такое-то изменение состава электролита или вы-
бор самого электролита, как повлияет, например, повышение плотно-
сти тока или температуры, перемешивание и т. д. Для этого нам
надо ближе познакомиться с процессами кристаллизации, с теми
79
факторами, которые влияют на относительную скорость образования
центров кристаллизации и роста кристаллов.
-Наиболее подробно мы остановимся на разработанной Блюмом и
Роудоном теории *, так как их теория шире других охватывает момен-
ты, которые могут в известной мере повлиять на структуру электро-
литических осадков. Установленные 10 лет назад этими авторами
принципы до сих пор никем не опровергнуты и находят подтвержде-
ние в повседневной практике гальванотехники. На других теориях мы
остановимся менее подробно. Необходимо только вначале оговориться,
что встречающиеся иногда указания на получение «аморфных» осад-
ков имеют в виду такие мелкокристаллические осадки, структура ко-
торых проявляется только при сильном увеличении.
Рентгеновскими и микроскопическими исследованиями было уста-
новлено, что большинство металлов кристаллизуется на катоде в
виде кубов с центрированными гранями. Структурными элементами
в металлических кристаллах являются атомы. Они расположены в
точках, соответствующих углам и центрам кубов, на. таком расстоя-
нии друг от друга, которое является характерным для каждого дан-
ного металла.
Силы кристаллизации, способствующие ориентации атомов, про-
тиводействуют стремлению металлических атомов к переходу в рас-
твор в виде ионов. Вследствие этого упругость растворения металли-
ческого .кристалла должна быть меньше, чем упругость растворения
отдельных атомов. Равным образом и упругость растворения
крупных кристаллов должна быть меньше, чем упругость растворе-
ния мелких кристаллов, вследствие наличия в последних большей
поверхностной энергии.
Согласно этой теории следует различать действительный потен-
циал металла в данном растворе, определяемый наблюдениями или
вычислениями, и первичный. Первый является функцией второго, но
зависит также от изменения потенциала, соответствующего уменьше-
нию упругости растворения металла, происшедшего вследствие распо-
ложения или ориентации атомов в кристалле. Этот поправочный фак-
тор определяется как «потенциал ориентации» в данной форме и
является показателем отклонения действительного потенциала, от
гипотетического первичного потенциала. Всякий металл в кристалли-
ческой форме должен иметь пониженную упругость растворенпя и
вследствие этого менее отрицательный потенциал, чем металл, нахо-
дящийся в аморфном или в неориентированном состоянии.
Если отдельные атомы имеют более высокую упругость растворе-
ния, чем кристалл, т. е. ориентированная группа атомов, то очевидно,
что для образования нового ядра требуется более высокий потенциал,
чем для продолжения роста уже существующих кристаллов. Отсюда
становится ясным, что Все факторы, способствующие увеличению
скачка потенциала на границе металл — раствор, должны также
благоприятствовать образованию новых зародышей. Такими факто-
рами могут являться повышение плотности тока и уменьшение кон-
центрации ионов металла в катодном слое. Последнее может быть до-
стигнуто одним из следующих способов: 1) разбавлением растворов,
1 „Trans. Am. Electrochem. Soc.“, 44, 1923.
80
2) понижением температуры (замедляется диффузия й конвекция),
3) прибавлением соли с одноименным с осаждающимся металлом
анионом, 4) введением коллоидов, замедляющих диффузию в катод-
ном слое, 5) увеличением вязкости и 6) образованием комплексных
ионов.
В зависимости от относительной величины скоростей образования
зародышей (центров кристаллизации) и роста кристаллов Блюм и
Роудон различают три воз-
можных группы структур
электролитных осадков.
Группа I. Все (или
почти все) первичные за-
родыши или кристаллы про-
должают расти в осадке:
а) отдельные кристаллы:
1) симметричные, 2) игло-
образные;
б) смежные кристаллы:
1) столбчатые, 2) волок-
нистые.
Группа II. Часть пер-
воначальных зародышей или
кристаллов продолжает ра-
сти:
а) конусообразные (нор-
мальные,
б) сдвоенные.
Группа III. Рост кри-
сталлов продолжается не-
долго:
а) ломаные (компакт-
ные),
б) дендритообразные,
в) порошкообразные, (губ-
чатые).
1 СиМл1Ц1П()ичнь1ь 2 Иглообразные (СтоАбчи/пые 1Вмо1<нис1ГШ9
О} Изолированные
Группа 1
6) Смежные
Фиг. 26. Схематическое изображение главных
типов кристаллов.
Эти разновидности изображены схематически на фиг. 26.
Структура, присущая I группе, может получиться из любого рас-
твора и при всяких условиях, когда у катода поддерживается сравни-
тельно высокая концентрация ионов металла. При наличии таких
условий поляризационные кривые идут почти по вертикальному на-
правлению. Пользуясь этими кривыми, можно предсказать, какого
типа осадок может образоваться на катоде. Характерными предста-
вителями этой группы можно назвать серебро, осажденное из раство-
ров азотнокислого серебра, свинец — из растворов азотнокислого
свинца ((риг. 27).
Но концентрация ионов металла не весгда поддерживается по-
стоянной вдоль всей катодной поверхности. В отдельных местах мо-
жет повыситься плотность тока, и кристаллы будут расти быстрее,
чем в других местах. Но в результате повышенной плотности тока
раствор, примыкающий к концам этих кристаллов, будет очейь бы-
стро беднеть ионами, и может наступить момент, когда атомы будут
6 Основы гальваностегии. 1783
скорее осаждаться на гранях кристаллов, примыкающих к. концу,
чем на самом конце. Вследствие этого поперечное сечение кристалла
увеличивается, и смежные кристаллы как бы вытесняются конусооб-
разными кристаллами. В таких случаях получаются кристаллы II
группы. При соответствующих условиях кристаллы II группы могут
образоваться при осаждении меди, железа, цинка из растворов про-
стых солей (фиг. 28).
Образование сдвоенных кристаллов часто наблюдается в медных
кислых ваннах. Теоретически образование сдвоенного кристалла при
электроосаждении может быть объяснено следующим образом: если во
время роста данного кристалла, имеющего, например, конусообразную
форму, повышается плотность тока, то катодный слой беднеет бы-
стрей, вследствие чего дальнейший рост этого кристалла задержи-
вается, и наблюдается склонность к образованию нового кристалла.
Для (последнего процесса, однако, требуется сравнительно более вы-
сокий. потенциал, чем для образования сдвоенного кристалла.
III группа представляет те случаи кристаллизации, когда условия
не благоприятствуют росту имеющихся кристаллов, например при
осаждении металла ив растворов простых солей при высоких плот-
ностях тока или при низких плотностях тока, но из растворов ком-
плексных солей или в присутствии коллоидов и других добавок
(фиг. 29 и 30).
Главными факторами, влияющими на структуру электролитиче-
ских осадков, авторы считают:
1. Потенциал разряда ионов металла на данном катодном участке,
причем величина этого потенциала определяется: а) первичным по-
тенциалом катодного металла, б) потенциалом ориентации катода,
в) фактической концентрацией ионов металла в катодном слое.
2. Другим фактором, влияющим на структуру осадка, является
скачок потенциала на границе металл — раствор, величина которого
обусловлена применяемой плотностью тона и сопротивлением элек-
тролита. В соответствии с этим положением условия электролиза, на-
пример плотность тока, температура, перемешивание и т. п., могут
влиять на структуру осадка лишь постольку, поскольку они влияют
на соотношение потенциалов.
Из прилагаемой здесь классификации электролитных осадков
можно видеть, что тип кристалла имеет большее значение, чем раз-
мер его, так как в каждом типе или разновидности имеются сравни-
тельно большие и малые кристаллы. Ряд исследователей наблюдал
при осаждении меди \ железа1 2 и других металлов уменьшение роста
кристаллов при увеличении плотности тока до известных пределов,
после чего наблюдалось увеличение роста.
При чрезмерно высокой плотности тока часто образуется дендрит-
ный осадок, который может состоять из одного или нескольких круп-
ных кристаллов. Исследование под микроскопом дендритов, специаль-
но полученных Блюмом и Роудоном из медной сернокислой ванны,
показало, что смежные части дендритов имеют совершенно разную
ориентацию и что дендрит состоит из большого количества мелких
1 Sieverts u. Wippelmann, „Zeitschr. f. Anorg. Chemie*, 21, I, 1915.
2 Sieverts u. Wippelmann, .Zeitschr. f. Anorg. Chemie*, 23, 287, 1916.
82
кристаллов (фиг. 31 и 32). Дендритные осадки, получающиеся при
высоких плотностях тока или в растворе, обладающем большим со-
противлением, а также при наличии в растворе добавочных агентов
(коллоидов), являются результатом сильного обеднения электролита
ионами- осаждающегося металла в катодном слое и повышения в
связи с этим катодного потенциала. Первый из этих факторов спо-
собствует беспрерывному образованию новых кристаллов, второй —
прорастанию кристаллических агрегатов в раствор.
При чрезмерно высоких плотностях тока (выше тех, при которых
образуется дендритный осадок) начинается выделение губчатой 'по-
рошкообразной массы, состоящей из чрезвычайно мелких отдельных
кристаллов. В известной степени образование губчатого осадка свя-
зано с выделением водорода, который разрыхляет кристаллы, хотя
и не исключена возможность, особенно в нейтральных или слабоки-
слых растворах, образования вследствие обильного выделения водо-
рода гидроокисей, которые сами включаются в осадок или по край-
ней мере препятствуют росту кристаллов.
Исходя из изложенных принципов, можно ожидать, что условия
электролиза — плотность тока, температура, перемешивание и т. п. —
могут влиять на структуру электролитического осадка лишь постоль-
ку, поскольку -они влияют на величину катодного потенциала. Если
величину катодного потенциала сохранить постоянной, то на одном
и том же основном металле можно получать оСадки с одинаковой
кристаллической формой независимо от того, происходило ли осаж-
дение при низкой плотности тока в разбавленном растворе или при
соответственно более высоких плотностях тока и более концентриро-
ванном растворе или при еще более высоких плотностях тока, но с
применением перемешивания (для поддержания высокой концентра-
ции ионов металла в катодном слое).
Колыпютер1 также стоит на той точке зрения, что между струк-
турой осадка и поляризацией существует определенная связь, однако,
по его мнению, существуют первичные причины, оказывающие непо-
средственное влияние на структуру,1 а уже эта, в свою очередь, влияет
на поляризацию. Иначе говоря, причиной ненормальной поляризации
служит не электролит, как обычно считают, а металл, точнее, поверх-
ность электрода.
Свою теорию Колыпютер строит на тех явлениях, которые наблю-
даются при осаждении электроотрицательных металлов, в частности
никеля. На катодной поверхности постоянно имеется .водородная
пленка; последняя представляет ту среду, в которой происходит элек-
троосаждение металла. Эта среда обладает значительной вязкостью,
так, как водород в пленке находится под значительным давлением.
Водородная пленка затрудняет соединение никелевых атомов даже в
мелкие кристаллы и препятствует развитию крупных кристаллов,
т. е. водородная пленка действует аналогично коллоидам. И повы-
шение потенциала, и дисперсность, и структура осадка объясняются
этой пленкой.
Все условия, содействующие уплотнению водородной пленки, бу-
дут соответствовать повышению катодного потенциала, и наоборот.
1 ,Trans. Am. Electrochem. Soc.",* * т. 55, 1924.
*
83
с
d
е
Фиг. 27—30. Главные типы кристаллов электролитических осадков.
а — изолированные, симметричные. Серебро из растворов AgNO3, ув. 16;
Ъ— изолированные, иглообразные. Серебро из растворов AgNO3, ув. 16;
с — столбчатые. Медь из сернокислых растворов, ув. 30‘;
d— волокнистые. Никель из сульфатных растворов, содержащих фто-
риды. ув. 100;
е—конусообразные. Никель из сульфатных растворов, содержащих
хлориды, ув. 100;
f__сдвоенные. Медь из сернокислых растворов, ув. 500;
£ —ломаные. Медь из сернрдалых растворов, у». 300.
85
a b
Фиг. 31. Структура дендритных осадков меди.
а — натуральный размер; Ь — поперечное сечение, ув. 2,5,
ФИГ» 32. Структура дендритных осадков меди, поперечное
сечение, ув. 100,
В доказательство такого положения Кольшютер указывает на благо-
приятную роль деполяризаторов и в частности наложения перемен-
ного тока на постоянный; в последнем случае катодная поляризация
никеля сильно уменьшается, осадки становятся мёнее напряженными
и легко сгибаются в трубку.
Аналогично Родородной пленке может действовать и пленка из
СО», но поляризация при этом будет меньше, так как степень вязко-
сти ее меньше, чем у водородной пленки.
В. А. Кистяковский \ так же как и Колршютер, предлагает при-
нимать во внимание не только процессы, протекающие в электролите,
но и состояние границы электролит — электрод.
Катодная поверхность покрыта субмикроскопическими выступа-
ми, объясняющимися кристаллической структурой металла. При
электролизе на этих выступах сосредоточиваются электроны. Как
только положительные ионы оказываются на расстоянии «ионного
обстрела», электроны направляются в сторону электролита, а группы
ионов теряют свои заряды. Лишенные заряда атомы оседают на по-
верхности катода, причем наступает только «упорядоченное электро-
литическое осаждение металла» (geordnete electrolytische Metallab-
scheidung).
Силы кристаллизации настолько велики, что мадо вероятно, что-
бы отдельный атом металла, оседая на поверхность растущего кри-
сталла, мог послужить началом для образования новых кристалличе-
ских центров.
«Чем дальше от поверхности катода, тем кристаллы становятся
крупнее, а сечение их больше. Кристаллы растут то'в направлении,
перпендикулярном к катоду, то в плоскости, параллельной катоду,
пока совсем не выродятся».
Медные кристаллы представляют собой как бы сложенные своими
основаниями пирамиды. Одна из вершин подобной двойной пира-
миды лежит ближе к поверхности катодного осадка, соприкасающе-
гося с электролитом, так что большие оси кристаллов.перпендику-
лярны плоскости катода. В некоторых случаях кристаллы насквозь
прорастают весь осадок.
Большое внимание уделяется многими исследователями структуре
первого слоя осаждающегося металла. Кольшюттер 1 2 переносил катод,
подвергавшийся недолгое время осаждению в цианистой' ванне, в
раствор азотнокислой соли серебра. Мелкокристаллический осадск,
обычно получающийся в цианистой ванне, продолжал расти и в
азотнокислой, точно осаждение продолжалось в цианистой ванне.
В данном случае, повидимому, мелкой структуре осадка cnoco6crBOj
Вали условия, благоприятствовавшие образованию большого количе-
ства центров кристаллизации в первой стадии осаждения.
Другой исследователь Voilleurriier3 также исходил из влияния
первого слоя металла на дальнейший рост его, но воспользовался им
для совершенно других целей — для- получения мелкокристалличе-
ских осадков. Перед электролизом катоды погружались Целиком или
1 Кистяковский В. А., Баймаков Ю. В., Кротова И. В.. .Известия
Академии наук СССР", 1929.
3 „Zeitschr. f. Electrohemie", 19, 181, 1913.
Trans. Am. Electrochem, Soc.“, 50, 1926.
частично в глицерин или раствор сахара; этого погружения было до-
статочно для образования топкого осадка в таких электролитах, где
без такого погружения осадки получаются грубыми,-крупнокристал-
лическими. Такие эксперименты были проведены в уксуснокислой
свинцовой и в азотнокислой серебряной ваннах, обычно дающих
крупную структуру. Между тем птицерин, добавленный непосред-
ственно в электролит, такого эффекта не давал. Эффект исчезал, ко-
гда катоды смачивались электролитом до начала прохождения тока,—
действие пленки при этом исчезало.
Влияние структуры основного металла на структуру осадка до-
вольно подробно и хорошо разобрано Блюмом и Роудоном *, а также
Брахамом 1 2. Исследования этих авторов показали, что при известных
условиях микроструктура электролитически осажденной меди, а так-
же латуни (Грахам) достаточно отчетливо воспроизводит структуру
основного металла; представляя собой как бы ее продолжение. Ре-
зультаты этих исследований хорошо иллюстрированы микрофотогра-
фиями, которые приводятся ниже.
Блюм и Роудон производили свои опыты на полосках из меди, по-
лученной различными способами и имевшей определенную структуру.
Каждый образец подвергался предварительно очистке в бензине и
спирте, а затем электролитической обработке на катоде в растворе
щелочи следующего состава: Na2CO3 — 60 г/л, NaOH — 7,5 г/л,
NaGN — 7,5 gjji. Катодная обработка производилась в течение 1 мин.
После этого все пластины тщательно промывались, и нижняя поло-
вина; каждой из них протравливалась в разбавленном растворе азот-
ной кислоты (1 : 1). Хорошо промытые пластины после этой опера-
ции покрывались по всей поверхности медью в электролите следую-
щего состава: CuSO,.5H2O (200 г/л) 4- H2SO4 (100 г/л). Осаждение
меди производилось при плотности тока 0,8 в течение 6 час.
После этого образцы покрывались толстым слоем никеля, для того
чтобы отметить границы первоначального медного слоя.
Чтобы облегчить последующую обработку (шлифовка и полировка)
образцов для исследования под микроскопом, на слой никеля снова
осаждался слой меди при тех же условиях. Выявление структуры
производилось на отдельных' кусках из всех образцов, взятых в по-
перечном сечении. После шлифовки поверхность этих кусков протра-
вливалась смесью из аммиака и перекиси водорода. На фиг. 33
верхняя часть, обозначенная а, представляет сечение поверхности,
очищенной на катоде в щелочном растворе, но не протравленной
кислотой; нижний снимок, обозначенный буквой Ъ, представляет
собой нижнюю часть, обработанную и в щелочном растворе и в рас-
творе азотной кислоты. На фиг. 33 и 34 представлен покрытый
образец литой меди, вырезанный из чушкового материла.. Из фо-
тографии образцов видно, что на поверхности меди, протравленной
азотной кислотой, микроструктура электролитически осажденной
меди почти не отличается от структуры основной меди, представляя
собой как бы ее иродолжеиие. В случае же очистки поверхности не
кислотой, а щелочью, осадок меди имеет волокнистое или столбчатое
1 Blum a. Row don. „Ттаге. Am Electrochtm. Sec 44, 1923.
2 Graham, , Traps, Am. Rlectrophem. Soc.’, 44, 1923-
88
строение, свойственное обычной структуре электролитной меди, по-
лучаемой при таких: условиях.
Такое различие в структуре осадка в зависимости от подготовки
основного материала авторы'объясняют тем, что на поверхности меди,
очищенной не кислотой, а щелочью, могут остаться: пленка водорода,
кислорода, окиси или
иного постороннего веще-
ства. Действие этой плен-
ки хотя и не достаточно
для того, чтобы воспре-
пятствовать приставанию
электроосажденного ме-
талла, однако она не до-
пускает тесного атомного
соприкосновения, необхо-
димого для воспроизведе-
ния осадком структуры
или продолжения роста
кристаллов основного ме-
талла. Это обстоятельство
подтверждает необходи-
мость абсолютной чисто-
ты поверхности металла,
являющейся непременным
условием для перехода
структуры основного ме-
талла в осадок.
Примерно такие же ре-
зультаты получил Гра-
хам после электролитиче-
ского осаждения меди
при плотности тока 1 А/д.м2
на полированной поверх-
ности листовой’ меди.
При этом автор считает,
что для воспроизведения
Фиг. 33. Влияние кристаллической структуры
основного металла на структуру электролитиче-
ского осадка, а—поверхность обезжирена перед
электроосаждением, травлению не подвергалась;
Ь поверхность обезжирена и подвергнута тра-
влению. На а и Ь снизу вверх расположены сле-
дующие зоны; w— основной металл; х - первый
слой осажденной меди; у—слой никеля; г—вто-
рой слой меди, ув. 100.
структуры основного ме-
талла в электроосажден-
ном не обязательна про-
трава в кислоте. Эффект
влияния основного метал-
ла зависит не столько
от способа химической
очистки, сколько от са-
мого состояния металли-
ческой поверхности, определяемого способом изготовления и механиче-
ской обработки материала. Влияние это определенно сказывается как
в случае крупнозернистого, так и отожженного, холоднокатаного
или полированного металла. Вопрос заключается в том, какова струк-
тура поверхности основного металла и насколько далеко проникает
ее влияние на структуру электроосажденного металла.
89
Фиг. 34. Влияние кристаллической структуры основного металла
(медь) на структуру электролитического осадка. Основной ме-
талл подвергнут глубокому травлению, ув. 500.
Фиг. 35. Влияние основного металла на структуру
электролитического осадка. Медь, осажденная иа
холоднокатаную листовую медь. Основной металл
подвергнут глубокому травлению. Плотность тока
1 А/д.и? Верх фигуры—основной металл, низ—•
электролитический осадок, ув. J30.
Полированная или другая аналогичная ей по состоянию поверх-
ность, особенно не подвергнутая специальной иротраве, не имеет
резко выраженной формы кристаллов, и поэтому их влияние ограни-
чивается только первым очень тонким слоем осадка, примыкающим
непосредственно к поверхности основного 'металла, и следовательно,
делается менее заметным.
Следующие слои электроосажденной меди очень быстро прини-
мают обычную столбчатую структуру электролитной меди. Если пер-
воначальные кристаллы основного металла крупнее и ясно выявлены
на поверхности, то влияние их иа рост кристаллов электроосажден-
ного металла простирается значительно глубже и окончательная
структура осадка становится крупнокристаллической. Подтвержде-
нием этого взгляда могут служить фотографии осадков, приведенные
на фиг. 35 и 36.. Осадки получены при одинаковых плотностях тока
1 kJ дм1 2 з. На фиг. 37 и 38 показан образец отожженной листовой меди,
который, после удаления толстого слоя окиси1, слегка протравли-
вался и обрабатывался перед покрытием медью в растворе цианида.
На фотографиях видно воспроизведение больших кристаллов основ-
ного металла, проникающее на большую толщину слоя осадка.
На фиг. 39 показано влияние на рост кристаллов осадка переры-
вов электролиза и промежуточной обработки поверхности. В качестве
катода был взят образец холоднокатаной листовой меди. Образец
покрывался при плотности тока 1 А/дм? в течение нескольких часов с
одним перерывом электролиза. В перерыве после первого покрытия
образец удалялся из раствора и промывался несколько раз в воде.
На фотографии ясно видна линия на осажденном, медном слое, вы-
званная этим перерывом. Кристаллическая структура после такого
перерыва, однако, не меняется, показывая полное сохранение и про-
должение структуры первого слоя.
На основании этих данных можно считать, что. перерывы при
электроосаждении меди не оказывают заметного влияния на характер
роста кристаллов' даже при условии различной химической обработки
поверхности перед осаждением нового слоя.
Hunt2, разбирая все предложенные до него теории по вопросу о
механизме электроосаждения металлов, образования зародышей, ро-
ста кристаллов и их ориентации, соотношения между структурой и
величиной катодной поляризации, отмечает, что во всех этих теориях
не уделено внимания современным взглядам на силы взаимодействия
между ионами и на сольватацию ионов как на причину, обусловли-
вающую величину потенциала и характер структур’ы металла.
Выдвинутая гипотеза сводится к следующему. Кристаллическая
структура электролитически осажденного металла зависит от концен-
трации ионов металла в катодном слое и концентрации других со-
ставных частей электролита в этом же слое. Если количество ионов
металла относительно прочих частиц сравнительно велико, то рост
кристаллов не будет встречать затруднений, и осадок будет иметь
грубокристаллическую форму. Если же вследствие малой степени
1 Окиси удалялись обработкой меди в горячем 1O7q растворе серной кислоты
И протравой двухромовокислой солью.
з „Journ. ot Physic. Chem.*, 36, 1932.
91
Фиг. 36. Медь, осажденная на холодно-
обработанную листовую медь. Основной
металл подвергнут блестящему травдению
(в концентрированных кислотах) и погру-
жению в цианид. Плотность тока 1 А/Ли2.
На снимке видна репродукция основного
металла а й осадок Ь, ув. 130.
Фиг. 37. Медь, осажденная на отожжен-
ную листовую медь. Основной металл
подвергнут глубокому травлению. Плот-
ность тока 1 А/й-и2. На снимке показан
рост кристаллов основного'металла а
в осадке Ь, ув. 130.
Фиг. 38. Медь, осажденная на холод-
нотянутый медиый пруток. Основной
металл подвергнут травлению. Плот-
ность тока 1 А./дмг. Структура основ-
ного металла полностью воспроизве-
дена осадком, ув- 500,
Фиг. 39. Медь осаждена на холодное брабо-
танную листовую медь. Перед электроосаж-
дением поверхность обезжирена в щелочи и
травлена в цианиде. Плотность тока 1 А/длА
Линия 1—1 показывает рост кристаллов после
перерыва электролиза: а—основной медадл,
й—осадок, ув. 500,
диссоциации, комплексообразования, Высокой степени гидратаций,
присутствия коллоидных частиц и т. д. концентрация ионов металла
в катодном слое относительно других составных, частей электролита
мала, то в этом случае рост кристаллов встретит затруднения, и будет
преобладать скорость образования центров кристаллизации. Иначе го-
воря, всякое затруднение поступления в катодный слой новых ионов
будет иметь своим следствием образование мелкокристаллических
осадков.
Механизм кристаллизации автор представляет следующим обра-
зом: ион металла, достигая катодной поверхности, стремится как
можно скорее Внедриться в кристаллическую решетку, и для этого он
должен освободиться от ионной атмосферы и от оболочки гидратной
воды. Можно допустить, что ионы металла в состоянии попасть в
кристаллическую решетку, удерживая при себе частично иодную ат-
мосферу и гидратную воду. Чем быстрее будет расти слой металла и
происходит оёаждение поверх данного иона, тем меньше шансов этим
посторонним Телам снова вернуться в раствор. При современном со-
стоянии наших знаний трудно определить характер приставания этих
частиц к решетке кристалла: адсорбция ли это или вандервальсов-
ские силы, — важно, что такая возможность допускается, и тем са-
мым не исключается возможность включения в осадок диполей воды,
комплексных катионов или недиссоциированных молекул. Такие слу-
чаи следует рассматривать аналогично установленному попаданию
в осадок органических коллоидов, коллоидальных гидроокисей и во-
дорода, которые, как известно, сильно влияют на структуру осадков.
К факторам, влияющим на структуру'осадка, цитируемый автор
относит: металл, природу аниона, условия осаждения. Такие металлы,
,как серебро, талий, кадмий, свинец, олово, дают при осаждении из
додных растворов грубую структуру, потому что степень гидратации
их мала. В тех растворителях, где сила притяжения между ионом ме-
талла и молекулой растворителя велика, осадки тех же металлов по-
лучаются мелкокристаллическими.
Влияние природы аниона согласно этой гипотезе определяется его
зарядом, объемом и склонностью к комплексообразованию.
Из внешних условий отмечается в первую голову влияние плотно-
сти тока, — чем выше последняя, тем вероятнее попадание примесей
в осадок. Повышенная температура уменьшает стремление посторон-
них частиц приставать к катодной поверхности, уменьшает возмож-
ность включения в осадок диполей или молекул, что облегчает рост'
кристаллов.
На влиянии коллоидов, которые применяются для уменьшения ро-
ста кристаллов, мы подробнее остановимся ниже.
Явления, сопровождающие процессы кристаллизации, агрегации
и образования катодного осадка, были изучены Колыпютером и Тор-
ричелли Ч Для того чтобы создать наиболее благоприятные условия
для роста кристаллов, был избран в качестве электролита раствор
азотнокислого серебра, в .котором отсутствует сколько-нибудь замет-
ная поляризация. При достаточно низком напряжении и соответ-
1 Uber electrolitische Kristallisatiorisvorgange, IV Versuche liber Einzelkristall-
bildung, .Zeitschr. f. Electrochem.’*, Bd. 38, 4, 1932.
93
ствеино низкой плотности тока представлялось возможным на не-
большом катоде наблюдать в микроскопе рост монокристалла и одно-
временно измерять силу проходящего через него тока.
Практически эти эксперименты были проведены следующим обра-
зом. Катодом служило померенное сечение З-.м.м серебряной прово-
локи, впаянной в стеклянную трубку таким образом, что поверхность
металла образовывала с пришлифованными краями стеклянной
трубки одну плоскость. Электролизер емкостью в 80 см3 находился на
площадке микроскопа; поверхность катода всесторонне освещалась
и при 80-кратном увеличении оставалась вся 'в поле зрения. Электро-
лит состоял из 3 N раствора AgN03.
Источником тока служил свинцовый аккумулятор, который замы-
кался накоротко при помощи двух последовательно включенных рео-
статов; сама ячейка помещалась в шунте от. третьего реостата. При
осторожном повышении напряжения до первого едва заметного откло-
нения стрелки гальванометра наблюдалось в микроскопе образование
зародыша, после чего исследовали рост кристалла и увеличение силы
тока. Эти наблюдения позволили установить следующие положения.
Растущий кристалл ведет себя как переменное сопротивление:
с увеличением его поверхности растет сечение проводника, и сопро-
тивление его падает. Так как сопротивление в шунте остается постоян-
ным, то росту кристалла соответствует увеличение силы тока. Пока
кристалл’ растет нормально, сила тока растет прямолинейно, и при
построении кривой сила тока — время получается прямая линия.
Если на кристалле по мере его роста возникают новые плоскости или
отдельные плоскости перестают расти, то соответствующая кривая
начинает убывать.
При (постепенном увеличении силы тока в процессе электролиза
маленькие кристаллы вырастали в большие: перерывы тока вызы-
вали явления пассивирования на отдельных индивидуумах, которые
вели к образованию новых зародышей и подавлению" роста имею-
щихся кристаллов. При непрерывном электролизе наблюдались меж-
катодные явления, которые обусловливали неодинаковый размер и ха-
рактер развития отдельных частиц, что исследователями приписы-
вается неравномерному распределению потенциала, а следовательно,
и плотности тока на различных частях кристалла.
Чтобы случаи образования монокристаллов перенести на харак-
терные электролитные осадки, было аналогичным образом изучено
осаждение серебра на больших катодных поверхностях. Если одно
и то же количество серебра осаждалось при разной силе тока, то
с увеличением последней количество индивидуумов уменьшалось,
размер увеличивался, причем одновремененно выступали все более
резко очерченные кристаллографические формы.
Соображения, приведенные относительно Факторов, влияющих на
структуру электролитических осадков, как-будто находятся в про-
тиворечии с теми явлениями, которые наблюдаются на практике.
В самом деле, если повышенная температура способствует получению
крупнокристаллических осадков, то для'чего в целом ряде случаев
сознательно повышают температуру? Такой же вопрос можно поста-
вить в случае применения электролитов с высокой концентрацией
соли осаждающегося металла. Наконец, если повышенная плотность
94
Тойа способствует получению Мелкокристаллических осадков, то
стоит ли вообще ограничивать высший предел плотности тока, тем
более, если исходить из соображений максимального форсирования
процесса?
Однако при внимательном рассмотрении явлений, сопровождаю-
щих процессы кристаллизации металла па катоде, можно с достаточ-
ным приближением определить роль каждого фактора, рассматривая
его не изолированно, а в тесной связи с другими факторами, дей-
ствующими в том же или противоположном направлении. Нельзя, на-
пример, рассматривать влияние плотности тока на структуру осадка
без учета природы электролита, его концентрации, температуры, ки-
слотности и т. п. То же можно сказать о роли, других факторов.
Можно лишь сказать, что если все прочие факторы будут постоянны,
то изменение плотности тока будет влиять в таком-то направлении.
Практически приходится для получения максимального эффекта ме-
нять не один фактор, а сочетать его со многими другими. Ниже нами
Фиг. 40. Влияние плотности тока на структуру медных электро-
литических осадков, а—4 А/ttw2; Й—10 A/Ди2, ув. 300.
будут разобраны отдельные процессы электролитического осаждения
металлов, где роль различных факторов, влияющих на кристаллиза-
цию, будет подробно рассмотрена. Здесь мы остановимся на несколь-
ких общих моментах.
Сильное влияние плотности тока на структуру электролитных
осадков сказывается особенно заметно to тех случаях, когда катодная
поляризация заметно меняется с плотностью тока. В свинцовых и оло-
вянных ваннах, где катодная поляризация очень слабо выражена
(в отсутствии коллоидов), катодная плотность тока почти не оказы-
вает заметного влияния на структуру осадка. Поэтому особенно при-
ходится считаться в этих случаях с дендритообразованием на краях
и остриях, где господствует более высокая плотность тока по сравне-
нию с вычисленной (средней) плотностью тока. При электроосаждении
таких металлов, как-никель, кобальт, железо, повышенная плотность
тока благоприятно влияет на структуру осадка, но при этом прихо-
дится считаться с одновременным выделением водорода, последнее
будет ощущаться тем сильнее, чем плотность тока выше. При недо-
статочной кислотности у катодной поверхности будут выпадать ги-
драты и частично включаться в осадок, при повышенной кислот-
95
иости выход дока сильно падает. Таким образом плотность тока
должна быть в строгом соответствии с кислотностью. Примерно та-
кая же зависимость должна быть между плотностью тока и концен-
трацией электролита.
При осаждении цинка ниже определенной плотности тока полу-
чаются не сплошные, а сетчатые осадки (большая скорость роста
кристаллов по сравнению со скоростью образования центров кристал-
лизации), но по мере увеличения плотности тока приходится также
и повышать соответственно кислотность и концентрацию электролита
(фиг. 40).
Фиг. 41. Структура электролитического Фиг. 42. Структура электролитического
осадка меди при покоящемся катоде, осадка меди при- движущемся катоде,
ув. 160. ув. 160.
Перемешивание электролита влияет так же, как (повышенная кон-
центрация соли осаждающегося металла или повышенная кислотность,
поскольку при этом быстрее восполняется убыль разрядившихся на
катоде ионов металла и водорода. И если фактор перемешивания, взя-
тый сам по себе, действует в сторону образования более крупнокри-
сталлических осадков, то практически перемешиванием пользуются
для того, чтобы можно было применять более высокие плотности тока.
Чем с более высокой плотностью тока мы хотим работать при прочих
равных условиях, тем интенсивнее должно быть перемешивание.
В некоторых случаях от перемешивания получаются грубые осадки,
что объясняется механическим включением взвешенных в электро-
лите частиц шлама и других загрязнений. Для устранения этого
явления прибегают к пе]>емешиванию с одновременным фильтрова-
нием (фиг. 41 и 42).
ее
К -повышенной температур во многих случаях прибегают с целью
увеличения растворимости применяемых солей для повышения анод-
ного выхода тока (устранения пассивности), для повышения электро-
проводности и для уменьшения количества включенного в электро-
литический осадок водорода. Р> конечном итоге повышенная темпера-
тура также дает возможность применять более высокие плотности
тока. Как видно, и в данном случае нельзя рассматривать действие
температуры изолированно от всех других факторов.
Если мы, например, в цинковой сернокислой ванне при содержа-
нии в ней 100 г/л сернокислого цинка и при плотности тока
в 1 к!дм2 повысим температуру от 20 до 30°, то осадок станет более
крупнокристаллическим, но если мы захотим работать с концентри-
рованными растворами при высоких плотностях тока, то повышенная
температура будет оказывать благоприятное влияние.
Фиг. 43. Влияние температуры иа структуру электролитических
осадков меди а—25°; 6—66°.
В некоторых случаях, однако, отрицательное влияние повышенной
температуры на структуру осадка сказывается настолько резко, что
ее избегают, — например в кислых оловянных ваннах. С отрицатель-
ным влиянием повышенной температуры на устойчивость электролита
приходится считаться в целом ряде случаев, особенно при примене-
нии цианистых электролитов (фиг. 43)."
Итак, необходимо констатировать, что общих правил для практи-
ческих случаев в отношении выбора режима процесса электрооса-
ждения установить нельзя. Можно лишь сказать, что для получения
осадков с удовлетворительной структурой следует повышать концен-
трацию соли осаждающегося металла и кислоты (для кислых электро-
литов) в соответствии с выбранной или заданной плотностью тока.
То же можно сказать относительно перемешивания и температуры.
Принятая на практике плотность тока в А/дм2 колеблется в пре-
делах от десятых долей до десятков. Например, для стационарных
холодных и относительно разбавленных никелевых ванн принята
плотность тока 0,3—0,5 kJ дм2', в концентрированных, работающих при
перемешивании и нагревании ваннах, можно плотность тока повысить
до 10 к/дм2. В цианистых ваннах плотность тока редко превышает
7 Основы гальваностегии 178В 97
1—2 к!дм2, в хромовых ваннах плотность тока редко бывает Ниже
5—10 А/дм2.
Помимо концентрации электролита, плотности тока, температуры
и перемешивания часто ДЬя улучшения структуры осадка вводятся
так называемые добавочные агенты. Их количество обычно невелико
по сравнению с концентрацией электролита, и физико-химические
свойства самого электролита меняются в их присутствии весьма не-
значительно. Из этих добавочных агентов наибольшее распростране-
ние имеют коллоиды, применение которых началось задолго до того,
как было предложено какое-либо теоретическое обоснование относи-
тельно механизма их действия.
По заявлению Аддикса, коллоиды стали впервые применяться
несознательно в медных рафинировочных ваннах при следующих об-
стоятельствах..
В целях борьбы с образованием дендритов при получении^ маточ-
ных листов для последующего осаждения на них меди были приме-
нены деревянные рамки. Впоследствии было замечено, что ъ тех ван-
нах, где в течение некоторого времени в электролите пребывали эти
рамки, медь осаждалась без наростов и без дальнейшего применения
рамок. На основании этого и было сделано предположение, что при
взаимодействии древесины: с кислым раствором медного купороса
в раствор перешли какие-то вещества (коллоидного характера), кото-
рые оказывают благоприятное влияние на структуру электролитной
меди.
В дальнейшем вопрос о применении коллопдов привлек внимание
многих исследователей, были выдвинуты различные объясняющие это
явление теории, и все большие и большие количества коллоидов
стали с различным успехом применяться при электроосаждении ме-
таллов. Само собой разумеется, что в гальваностегии, где структура
осадка играет большую роль, чем в любом другом электрометаллур-
гическом процессе и где представляется больше возможностей вводить
те или другие добавочные компоненты, коллоиды получили наиболее
широкое применение.
Введение добавочных агентов в электролиты до сих пор носит
эмпирический характер. Мы не располагаем в настоящее время доста-
точным количеством научно обоснованных данных, чтобы заранее, без
экспериментальной проверки, сказать, какой эффект произведет тот
или иной добавочный агент в данном конкретном случае. Наконец,
и_в отношении экспериментально проверенного добавочного агента
необходимо установить оптимальную концентрацию его, так как недо-
статок или избыток его в различных случаях ведут себя по-разному.
_Для коллоидов наиболее характерным свойством с электрохимиче-
ской точки зрения является связанное с ними повышение катодной
поляризации. В результате повышения катодной поляризации наблю-
дается уменьшение размеров кристаллов, образование осадков с ло-
маной структурой вместо волокнистой, столбчатой или конической
^(характерных для растворов простых солей), уменьшение наростов на
краях и более равномерное распределение металла на всей катодной
поверхости.
Влияние коллоидов на катодную поляризацию было изучено
98
II. А. Изгарышевым и П. С. Титовым1 при электролизе солей меди
и цинка.
При введении желатины и гуммиарабика поляризация вначале ра-
стет по мере добавления коллоидов, достигает максимума, после чего
она падает. Было установлено,
что для достижения макси-
мума поляризации концентра-
ция коллоидов должна быть
увеличена в соответствии с
концентрацией электролита. На
этом основании указанные ав-
торы делают заключение, что
коллоиды связываются с катио-
нами в комплексы типа —
цинк — коллоид, ' которые и
служат причиной повышения
катодной поляризации.
Количества коллоида/ вызы-
вающие максимум поляриза-
ции, различны в зависимости
от соли осаждающегося метал-
ла и природы коллоида. На-
пример, в 2 N растворе ZnS04
желатина дает максимум ка-
тодной поляризации, находясь
в количестве, равном 0,025%,
а гуммиарабик — в (количестве
2%. В 1 N растворе CuS04
Фиг. 44. Влияние концентрации желатины
на потенциал осаждения цинка.
Фиг. 45. Влияние концентрации жела-
тины на поляризацию цинка и вязкость
для максимума поляризации
требуется присутствие 0,3%
желатины, а в 1 А растворе
ZnS04 требуется 0,05% жела-
тины и 1 % гуммиарабика
(фиг. 44 и 45).
Можно, правда, указать так-
же на добавочные агенты, ко-
торые благоприятно влияют на
структуру электролитических
осадков и вместе с тем пони-
жают катодную поляриза-
цию, — это сероуглерод в сере-
бряных цианистых ваннах и
гипосульфит в медных циани-
стых ваннах.
Верник нашел, что «сере- раствора.
бряное число» различных кол-
лоидов (за исключением декстрина), т. е. весовые количества колло-
ида, необходимы^ для предупреждения коагуляции серебряного золя
солью, (приблизительно пропорциональны тому эффекту, который эти
Kolloidchemische Beihefte", 14 (1 — 2 Hefte), 1921.
99
коллоиды оказывают на уменьшение зерен кристаллов серебра при
осаждении его из растворов азотнокислой солж. Такое отношение по-
казывает, что коллоиды могут быть эффектигными благодаря своей
способности задерживать рост кристаллов.
Другие авторы нашли близкое сходство между способностью неко-
торых эфирных масел к адсорбции поверхностью металла и действием
этих масел на структуру осадков. Содержание 0,05% желатины в мед-
ном растворе делает катодный осадок настолько плотным, что он бле-
стит, как зеркало, но при этом появляются внутренние напряжения,
и осадок становится хрупким. Производя микроскопические исследо-
вания таких осадков, Грубе и Реус1 показали, что в катодном осадке
медь чередуется с желатиной в виде слоев (кристаллическую струк-
туру в медном осадке можно было фиксировать лишь рентгеногра-
фически,— в микроскопе никакой кристаллической структуры меди
нельзя было наблюдать). По мнению этих авторов, на катоде разря-
жаются ионы меди, но, благодаря электрофорезу, частицы желатины,
которые адсорбируют ионы меди, достигают также катодной поверх-
ности, где желатина, коагулируя, мешает разрастаться кристалли-
ческим зародышам меди в крупные кристаллы. В этом высоко-
дисперсном и пластичном осадке проявляются силы притяжения ме-
жду отдельными медными частицами, и когда эти силы приобретают
достаточную величину, медные частицы, освобождаясь от окружаю-
щих их частиц желатины, соединяются и образуют сплошной медный
слой.
Помимо коллоидов в последнее время широкое применение в галь-
ванотехнике получили так называемые капиллярно-активные веще-
ства; такое название подобные вещества имеют благодаря своей спо-
собности адсорбироваться на поверхности осаждаемых кристаллов.
Благоприятное действие капиллярно-активных веществ на структуру
электролитных осадков объясняется их способностью не в одинаковой
степени адсорбироваться на различных элементах поверхности, кон-
центрируясь преимущественно на гранях кристаллов.
Поверхностно активные вещества получили 'практическое ‘Приме-
нение при электроосаждении свинца и особенно олова. Эти металлы
склонны кристаллизоваться в виде отдельных игольчатых, не связан-
ных друг с (другом кристаллов, легко осыпающихся с катодной поверх-
ности. Введение фенола- крезола или их сульфокислот дает возмож-
ность получить плотные и ровные осадки. Адсорбируясь на образую-
щихся центрах кристаллизации, поверхностно активные вещества за-
держивают рост их и тем самым способствуют образованию новых
центров кристаллизации.
Шлеттер считает поверхностно активные вещества электрохимиче-
ски неактивными; они сами не разряжаются на катоде и не оказы-
вают влияния на потенциал разряда ионов металла.,
Тафт2 различает два рода добавок: к первой группе относятся те
добавки, которые в известной степени включаются электролитическим
осадком благодаря адсорбции; ко второй группе относятся такие до-
бавки, которые, (восстанавливаются на катоде одновременно с разря-
* Grube u. Reuss, «Zeitschr. f. Electrochemie", 27, 45, 1921.
s Taft, .Trans. Am. Electrochem. Soc.*, 63, 1933.
100
дом ионов осаждающегося металла. В отношении первого, рода добавок.
Тафт, как и многие другие, стоит на той точке зрения, что включение
посторонних веществ (коллоидов, анионов и др.) в электролитные
осадки и влияние их на структуру осадков являются, результатом
самопроизвольной адсорбции (Spontaneous adsorption). Лотя большая
концентрация добавочных агентов в электролите или высокая плот-
ность тока может привести к чисто механическому включению их
в осадок, однако экспериментально доказано, что такое явление
имеет место сравнительно редко. Тафт считает, что между металлом
и добавочными агентами в случае включения последних в осадок
имеются какие-то особые силы прилипания. Подробно Тафт рассма-
тривает поведение второго рода добавок. Рядом исследователей указы-
вается на целесообразность добавления азотнокислого аммония при
электроанализе меди; в то же время известно, что азотнокислые соли
на медном катоде восстанавливаются до аммонийных волей.
Итак, нет на сегодняшний день теории, которая дала бы исчерпы-
вающее! объяснение тем> явлениям, которые имеют место на катоде
в присутствии коллоидов или других добавочных агентов. Благоприят-
ное действие их в смысле уменьшения размеров кристалла объясняют
либо связанной с ними повышеной катодной. поляризацией, либо
включением их в катодный осадок. Последнее возможно вследствие
непосредственного переноса коллоидов по направлению к катоду или
переноса комплексных катионов, включающих добавочные агенты;
возможна также адсорбция их поверхностью кристаллов или нали-
чие ® электролитном осадке включении, связанных с металлам .в хи-
мические соединения.
В отдельных случаях может преобладать тот или иной путь
к включению добавочных агентов в электролитный осадок. Практика
применения добавочных агентов значительно опередила теорию их
действия; ниже будет приведен перечень тех из них, которые .дали
хорошие результаты при экспериментальной проверке и в значитель-
ной степени в промышленных масштабах.
Цинк, в особенности в кислых ваннах, склонен осаждаться в виде
крупных кристаллов и образовывать на краях дендриты (при длитель-
ном осаждении). С введением добавочных агентов осадок становится
гладким, ровным и мелкокристаллическим, чем увеличивается стой-
кость его против коррозии. Чаще всего в цинковые ванны вводится
сульфат алюминия, который поддерживает кислотность электролита
на уровне pH-—4 — 4,5. При уменьшении кислотности выпадает ги-
драт алюминия, который ведет себя как неорганический коллоид
и значительно улучшает структуру катодного осадка. Из органиче-
ских добавок в цинковые ванны вводят декстрин, глицерин, гумми-
арабик, солодовый корень, клей, 3 -нафтол. В кадмиевые кислые ванны
были предложены различные добавки, но все они не дают должного
эффекта — осадки в них получаются крупнокристаллические. Луч-
шим все же оказался пептон. В цианистых кадмиевых ваннах благо-
приятное влияние оказывают никелевые соли — осадки становятся
блестящими, хотя химизм этого действия до сих пор не выяснен; при-
меняются также казеин, гулак, пептон и гвоздичное масло. В оловян-
ных ваннах (кислых) применяются фенол, крезол или их сульфоки-
слоты, клей, алоэ. Часто вводится одновременно несколько добавочных
101
агентов. В щелочные ванны вводится .канифоль. В свинцовые элек-
тролиты борфтористо- и кремнефтористоводородные вводится клей,
а в перхлоратные — гвоздичное масло и пептон. Для хомовых ванн
до сих пор не найдены такие добавочные агенты, которые сколько-
нибудь улучшали бы условия осаждения металла.
Медные кислые ванны обычно работают без специальных добавоч-
ных агентов. Для получения блестящих тонких или гладких толстых
слоев меди предложено вводить клей, декстрин, мочевину, фенол,
сульфат алюминия. Благоприятное влияние этих компонентов в мед-
ной ванне, однако, оспаривается. В цианистых медных ваннах благо-
приятно сказывается присутствие гипосульфита — химизм его дей-
ствия не установлен.
При осаждении железа, кобальта и никеля следует избегать при-
сутствия! органических соединений и в частности коллоидов. Эти
соединения попадают часто в катодный осадок и делают его хрупким.
Этим, понятно, не исчерпываются те добавки, которые применяются
в различных процессах электроосаждения или которые, по крайней
мере, были предложены различными авторами. Их можно насчитать
десятками и сотнями. Необходимо, однако, подчеркнуть, что к доба-
вочным агентам следует прибегать только в том случае, когда без них
не удается получить хороших результатов. Уже то обстоятельство,
что органические соединения трудно поддаются контролю, что они
непостоянны, что оптимальная концентрация их часто лежит в узких
пределах, говорит за то, чтобы по возможности обходиться без них.
Блюм1 предъявляет следующие требования к добавкам:
1) добавки .должны давать возможность получать гладкий или
блестящий осадок при более высокой плотности тока, чем это воз-
можно в их отсутствии;
2) добавки не должны заметно снижать плотность тока, при кото-
рой осадок начинает «гореть»;
3) добавки должны оказывать благоприятное действие в широких
пределах концентрации, например 10:1, чтобы контроль их не был
затруднен. Это особенно важно, принимая во внимание, что добавки
вводятся в незначительных концентрациях и что их очень трудно
анализировать;
4) добавки должны поддаваться какому-то хотя бы приблизитель-
ному методу анализа — химическому или физическому;
5) добавки должны быть устойчивыми и не изменяться заметно
при выпаривании, осаждении, окислении или восстановлении электро-
лита:
6) если добавки разлагаются, то продукты разложения не должны
оказывать вредного влияния на раствор;
7) добавки не должны в заметных количествах включаться в ме-
таллический осадок, поскольку потребуется частое пополнение их;
8) если добавки включаются в металлический осадок, то они нс
должны оказывать влияния в смысле ухудшения на его состав и свой-
ства;
9) напряжение не должно возрастать на такую величину, чтобы это
могло существенно сказываться на экономике процесса: так как повы-
1 В1 u m, Addition Agents in Electrodeposition, Bureau of Standarts.
102
шенное напряжение, а следовательно, и повышенный расход энергии
почти всегда имеют место при употреблении добавочных агентов, то
они должны дать соответствующую экономию за счет повышения
качества готового продукта, сокращения времени (при увеличенной
плотности тока), капиталовложений;
10) добавочные агенты должны быть настолько дешевыми, чтобы
оправдать их применение для определенных целей.
Совместное выделение металлов и водорода. На
структуру электролитических осадков и н^ их физические и хи-
мические свойства оказывает большое влияние выделяющийся наряду
с металлом водород. Трудно найти такой случай в гальваностегии, где
можно было бы игнорировать вопрос о выделении водорода.
Поскольку речь идет об электроосаждении металлов в водной
среде, то ясно, что независимо от кислотности водородные ионы в ка-
ком-то количестве всегда присутствуют в электролите. Применительно
к электроотрицательным металлам; как, цинк, кадмий, железо, никель,
свинец, олово,, можно рказать, -что их осаждение в кислой среде было
бы невозможно, если бы отсутствовало на этих металлах перенапряже-
ние водорода. Как известно, величина перенапряжения зависит глав-
ным образом от природы катодного материала. Вот почему в гальвано-
стегии довольно часто (Прибегают к предварительному осаждению
такого металла, на котором! перенапряжение водорода достигает значи-
тельной (величины, после чего осаждается другой материал. Нацример.
в целях уменьшения выделения водорода при осаждении никеля на
железо последнее предварительно покрывается медью. Однако такой
метод может дать соответствующий эффект лишь в тех случаях,
когда речь цдет об осаждении тонких слоев. В противном случае
влияние промежуточного покрытия перестает сказываться, так как
после того как вся поверхность его покрывается осаждающимся ме-
таллом, меняется потенциал выделения водорода.
Наиболее частое явление, которое наблюдается в гальваностегии
(особено при осаждении группы железных металлов Fe, Со, Ni),—
отслаивание осадка— приписывается включенному гальваническими
осадками водороду. Считают, что отслаивание вызывается упругими
напряжениями, которые создаются благодаря неравномерному распре-
делению водорода в различных слоях гальванического осадка.
Колыпютер.1 со своими сотрудниками установил, что железные
металлы во время осаждения на катоде сокращаются, причем степень
этого сокращения может быть измерена стрелой прогиба тонкой пла-
тиновой пластины, на которой осажден металл, например никель. Чем
больше плотность тока и чем меньше концентрация никеля в растворе,
тем больше наблюдающееся сокращение осадка. На степень сокраще-
ния влияет также кислотность: в нейтральном растворе оно незна-
чительно, в сдабокислом растворе оно достигает максимума, а при
возрастающей кислотности и одновременном выделении водорода оно
уменьшается. Уменьшение степени сокращения пластинки наблю-
дается также с повышением температуры и при наложении перемен-
ного тока на* постоянный.
Эти наблюдения говорят за то, что потенциал выделения водорода
1 .Zeitschr. f. Electrochemie", 24, 300, 1918.
103
и господствующие в электролитном осадке внутренние напряжения
находятся в тесной связи, причем эта связь проявляется тем сильнее,
чем больше водорода может быть вхлючено в данный осадок.
С изменением степени сокращения и потенциала выделения никеля
меняется также структура осаждающегося никеля. В то время как
при незначительной поляризации из концентрированных или горячих
растворов получаются осадки, кристаллическое строение которых
видно невооруженным глазом,— три значительной поляризации и
сильном стремлении к ^сокращению получаются блестящие, почти
зеркальные осадки.
Химические и электрохимические свойства этих двух видов
осадка также отличны — крупнокристаллические осадки имеют менее
отрицательный потенциал и в меньшей степени растворяются в ки-
слотах.
Влияние выделяющегося водорода на структуру Колъшютер объяс-
няет тем, что группа железных металлов вначале выделяется в сильно
дисперсной форме. Этому способствует водород, который покрывает
Поверхность металла пленкой, служащей также причиной высокой
поляризации. Высоко дисперсная форма стремится с некоторой ограни-
ченной скоростью перейти в более устойчивую обычную кристалличе-
скую форму. При этом наступает сокращение, уменьшается свободная
энергия '(поэтому потенциал делается положительнее), и выделяется
водород. Чем больше имеется кристаллов с нормальной формой, тем
больше они способствуют уплотнению. Получающиеся друг на друге
слои металла уменьшаются в объеме, чем и обусловливают сокра-
щение.
Количество водорода в электролитных осадках обычно незначи-
тельно; например, в цинке оно равно 0,001—0,01 весовых процента,
в олове 0,0005—0,0002 весовых процента. В металлах группы железа
содержание водорода может достигнуть 0,1%, а в электролитически
осажденном хроме содержание водорода доходит до 0,45 весовых про-
цента.
Относительно возможной формы включения водорода в электролит-
ный осадок мы находим указания у Шлеттера. На фиг. 46 темные
точки указывают на включения водорода. На этой же микрофотогра-
фии видны две темные полосы, из которых первая более резко выра-
жена. Одна представляет собой водородную газообразную пленку, ко-
торая образуется в процессе осаждения никеля на никель и тем
самым мешает хорошему сцеплению. Вторая полоса, также предста-
вляющая газовую оболочку, иллюстрирует вызванные изменения на
катодной поверхности вследствие подкисления раствора в процессе
электролиза. К такому роду корректирования па практике часто при-
бегают, между тем это недопустимо, так как механические свойства
никеля сильно страдают.
Помимо механических включений водорода допускают и образо-
вание при электролизе химических соединений металлов с водородом
и твердого раствора водорода в металлах. Повышенную химическую
стойкость электролитически осажденных металлов, например железа,
свинца, цинка, Шлеттер относит за счет образования соединений с во-
дородом, так как эти сплавы имеют более положительный потенциал,
чем чистые металлы. В отношении факторов, влияющих на включение
104
водорода в электролитные осадки, Шлеттер 1 со своими сотрудни-
ками установил следующие положения:
1. С увеличением плотности тока содержание водорода в осажден-
ном металле уменьшается.
2. Чем больше pH раствора, тем меньше водорода поглощается
осадком.
3. С повышением температуры уменьшается содержание водорода
в электроосажденном металле.
4. Перемешивание электролита способствует уменьшению содержа-
ния водорода в осадке.
5. Растворимость водорода в металлах при одинаковых внешних
условиях различна и зависит от свойств самого металла.
6. Для одного и того же металла количество поглощенного водо-
рода зависит от аниона, с которым связан ион осаждающего металла.
Фиг. 46. Пустоты в осадке, обусловленные вклю-
чением водорода, ув. 100.
Нельзя, правда, сказать, что во всех случаях содержание водорода
в осажденном металле возрастает с плотностью тока. Вообще говоря,
следовало бы в данном случае руководствоваться ходом (кривых изме-
нения потенциала разряда ионов осаждающегося металла и перена-
пряжения водорода с плотностью тока. Если с повышением плотности
тока катодный потенциал металла в большей степени становится
отрицательным, чем перенапряжение водорода, содержание, последнего
в осадке увеличится; в противном случае будет наблюдаться обратное
явление.
До сих пор мы рассматривали влияние водорода главным образом
на хрупкость электролитически осажденного металла. Существует еще
целый ряд других отрицательных и положительных моментов, связан-
ных с совместным выделением металла и водорода.
В некоторых случая?: пузырьки газообразного водорода задержи-
ваются на катодной поверхности. В этих местах невозможен дальней-
ший разряд ионов металла, они разряжаются вокруг этих пузырьков.
Осадок вследствие этого становится ноздреватым, в нем оказываются
пустоты, которые иногда пронизывают осадок через всю его толщу.
Как с тонки зрения механических свойств, так и с точки зрения
стойкости против коррозии такие осадки считаются недоброкаче-
ственными.
1 Русско-германский вестник науки и техники № 2, 1932.
105
В других случаях выделяющийся водород как бы механически
разрыхляет осадок, делает его-губчатым или порошкообразным.
Незачем говорить, что с увеличением количества выделяющегося
водорода падает выход тока по металлу, т. е. помимо непроизводитель-
ной траты энергии уменьшается скорость осаждения металла.
С включением водорода Р электролитически осажденный металл
обычно связывают твердость последнего. В особенности это относится
к железу, никелю и хрому, к которым часто предъявляются жесткие
требования в смысле сопротивления их механическому износу. В зна-
чительной степени эти предположения (о связи между твердостью
электролитных осадков и содержанием водорода в нем) основаны на
том, что при термической обработке покрытых образцов удаление во-
дорода сопровождается уменьшением поверхностной твердости. В то
Фиг. 47. Структура электролитического осадка с включением
большого количества окислов, ув. 170.
же время условия осаждения металла очень часто способствуют по-
вышению поверхностной твердости при одновременном повышении со-
держания водорода. Другие авторы исключают наличие какой бы то
ни было связи между поверхностной твердостью и содержанием водо-
рода в металле.
Norman Pilling1 подвергал нагреву в вакуумной печи образцы
электролитного железа в пределах температур "от 100 до 950°. При
этом до 200° не наблюдалось никаких изменений твёрдости, при 300°
наблюдалось заметное повышение твердости, а при дальнейшем повы-
шении температуры наблюдалось постепенное уменьшение твердости.
Выделение водорода в тех же опытах наблюдалось уже при 90°,
при 200° оно достигало максимума, а полное удаление водорода было
достигнуто лишь при 950°'.
1 „Trans. Am. Electrochem. Soc.“, 42, 1922.
106
Термическая обработка никелированных и хромированных изделий
в целях устранения хрупкости сейчас находит уже большое практи-
ческое применение. Более подробно мы остановимся на этом вопросе
в главе «Хромирование».
Guichard и др.1 в противоположность другим исследователям
отрицают наличие какой бы то ни было связи между твердостью элек-
тролитических металлов (Fe, Со, Ni) и содержанием в них водорода.
Эти авторы показали, что длительным нагреванием водород может
быть удален из электролитного железа при такой температуре, при
которой твердость нисколько не понижается. Так, например, при на-
греве образцов электролитного железа в течение первых 24 час. при
165° и последующих 24 час. при 240° водород удаляется нацело, так
что в дальнейшем даже при температуре 1000° не обнаруживалось
следов водорода; твердость образцов при этом не изменялась.
Табл. 16 иллюстрирует отсутствие связки между содержанием во-
дорода и твердостью электролитного железа.
Таблица 16
Твердость по Бринелю до отжига 365 338 265 247 202
Содержание водорода в 1 г железа, см3 2Д 1,7 1,5 8,3 3
В данном случае опыты производились над образцами весом в
13,576 г каждый. Газ собирался после 24-часового нагрева при 250°.
Поскольку на настоящий день еще не установлена достаточно до-
стоверно форма, в виде которой водород включен в электролитные
осадки, то и трудно установить параллель между включением или
удалением водорода, с одной стороны, ’и твердостью — с другой. Бес-
спорным остается то положение, что какая-то связь между ними
(твердостью и содержанием водорода) существует, но эта связь может
быть не прямой, а косвенной, т. е. можно себе представить, что выде-
ление водорода таким образом влияет на ориентацию кристаллов, что
твердость определенным образом изменяется.1 Вопрос этот представляет
большой теоретический и практический интерес, и надо полагать, что
в ближайшее время он будет уточнен.
Наряду с включением водорода в электролитные осадки довольно
часто наблюдается включение в них окислов. Этот процесс предста-
вляется следующим образом. При электроосаждении металлов из ней-
тральных или слабокислых растворов и одновременном выделении
водорода в катодном слое сильно возрастает концентрация гидро-
ксильных ионов. При электроосаждении цинка, например, осадок
имеет по этой причине склонность становиться рыхлым, губчатым.
Для предупреждения таких явлений необходимо поддерживать
в электролите, особенно в катодном слое, определенную кислотность,
что достигается перемешиванием, введением буферных соединений,
1 „Comptes rendus*, 192, 193, 1931,
107
периодическим подкислением и т. п. Как и водород, окислы тоже
могут быть причиной хрупкости электролитных осадков вследствие
того, что содержание их в различных слоях металла не остается
постоянным (фиг. 47).
Нельзя, однако, сказать, что во всех случаях включение окислов
относится к вредным процессам. Будучи включенными в определен-
ных соотношениях, окислы могут даже улучшить физические свой-
ства электролитных осадков, как-то: структуру, твердость и т. п. Ни-
кель и хром, например, благодаря включению окислов приобретают
ценное для декоративных покрытий свойство — не смачиваться водой
и потом рук.
Macnaghtan и Normand1 изучали физические свойства никелевых
осадков в различных электролитах в зависимости от изменения pH.
При этом они установили, что чем выше pH, тем больше твердость ни-
келя, и объясняли они такую зависимость включением окислов в ме-
таллические осадки. В последних содержание кислорода обычно неве-
лико, но, невидимому, главное влияние на структуру и твердость
осадка оказывает концентрация окислов в катодном слое; допускается
также взаимодействие на катоде кислорода окислов с выделяющимся
водородом, но и это не мешает окислам оказать свое влияние на ме-
ханические свойства осадка.
Watts2 приводит случаи образования сильно пористых свинцо-
вых покрытий. Такие явления наблюдались обычно после более или
менее длительного перерыва в работе ванны, особенно по утртьм, когда
ванна в течение ночи успевала сильно охладиться. Тщательное изу-
чение причин, которые бы могли вызвать такое покрытие, привело
к тому заключению, что растворенный в электролите воздух прили-
пает в виде пузырьков к катодной поверхности, делая ее неэлектро-
проводной в этих местах, и тем самым задерживает разрядионов. Эти
явления устраняются через несколько часов после начала работы,
когда электролит успевает нагреться за счет проходящего через него
тока. В случае выделения наряду с металлом водорода на катодной
поверхности вредное действие присутствующего в растворе воздуха не
сказывается столь резко, например в латунных или медных циани-
стых ваннах, — в свинцовых ваннах водород почти не выделяется.
Предупредить образование пористых покрытий за счет прилипания
к катодной поверхности пузырьков воздуха можно предварительным
прогревом, ванны.
Hogaboom считает, что рекомендуемое многими авторами предва-
рительное кипячение свежеприготовленного электролита до начала
ецр работы или после длительного перерыва в работе базируется на
удалении растворенного в электролите воздуха.
1 .Trans. Far. Soc.‘, 27, 1931.
2 .Trans. Am. Electrochem. Soc.*, 35, 1919,
ГЛАВА ТРЕТЬЯ
РАСПРЕДЕЛЕНИЕ МЕТАЛЛА НА КАТОДНОЙ ПОВЕРХНОСТИ
Качество электролитического осадка в значительной степени опре-
деляется равномерностью распределения его по всей поверхности по-
крываемых изделий. Толщина гальваностегического покрытия исчис-
ляется из применяемой плотности тока и продолжительности осажде-
ния (с учетом выхода тока по металлу) по следующему уравнению:
I • С • 71 • t • 10
s— -------!----
Y
где:
$— толщина покрытия в мм,
I — плотность тока А на 1 см2,
С — электрохимический эквивалент в г/Ah,
т] — выход тока,
t — продолжительность электролиза в часах,
у — уд. вес осаждающегося металла.
Такого рода вычисление дает лишь представление о средней тол-
щине слоя покрытия, тем более приближающейся к фактической тол-
щине слоя, чем равномернее распределится ток по поверхности по-
крываемых изделий. Известно, что в целом ряде случаев физические
свойства электролитического осадка меняются по мере его наращи-
вания, почему неравномерное распределение металла может привести
также к получению неоднородного покрытия. Если при заданной тол-
щине покрытия в 0,01 мм за счет неравномерного распределения ме-
талла на одних участках толщина достигнет 0,015—0,020 мм, а на
других — 0,005 мм и даже меньше, то покрытое изделие будет в одних
местах быстрее подвергаться воздействию корродирующей среды, чем
в других; покрытие в тонких слоях может быть быстро совершенно
стерто, в то время как на других участках, в более толстых слоях,
покрытие может еще долго служить. Наконец, в том случае, когда
покрываемые изделия имеют сложную форму, в больших углублениях
часто без специальных мероприятий не удается вовсе осадить металл.
Естественно, что вопрос о причинах, вызывающих неравномерное рас-
пределение металла при электролитическом осаждении его, и о фак-
торах, способствующих более равномерному распределению металла,
равно как и о методике самого измерения способности данной ванны
давать равномерные осадки, привлекает к себе внимание многих ис-
следователей. Это внимание сильно возросло в последние годы в связи
с широким распространением процесса хромирования, где с фактором
109
равномерного распределения металла, точнее распределения тока,
приходится особенно считаться, так как внешний вид хрома сильно
меняется в зависимости от плотности тока, при (которой он (получен.
Однако и применительно ко всем остальным гальваническим покры-
тиям вопрос о равномерном распределении металла имеет большое
принципиальное значение (фит. 48).
Любому практику известно, что аноды, например в медной рафи-
нировочной ванне, быстрее срабатываются внизу и на. краях, чем
сверху и в середине. В целях большего использования аноды поэтому
отливаются заранее с утолщением в нижней части. Это наблюдение
послужило поводом для построения Пфангаузером1 теории о распре-
делении силовых линий в электролите подобно магнитным линиям.
Предпринятые им измерения сопротивления электролита, плотности
тока и падения напряжения между различными участками показали,
что распределение силовых линий в электролите, или, по выражению
Пфангаузера, «рассеивающая способность», увеличивается с увеличе-
нием расстояния между электродами и уменьшается с увеличением
поверхности электродов. В первом случае увеличивается попереч-
ное сечение электролита, через которое проходит ток, отчего сопроти-
вление уменьшается. Так, например, пусть удельное сопротивление
какого-либо электролита > —2,5 2, расстояние между электродами
I = 1 дм, а поверхность электродов равна 2 дм2, тогда в отсутствии
рассеивания сопротивление ванны:
Я^-Ц-^-^1,25 2;
если непосредственные измерения показывают 1,04 2, то разницу
1,25—1,04 = 0,21 2 следует отнести за счет рассеивания силовых
линий, т. е. фактически ток проходит через большее поперечное се-
чение, чем это соответствует поверхности электродов.
Аналогичное явление наблюдается в магнитной воздушной индук-
ции у динамомашины. Равномерное распределение магнитных линий,
поступающих в якорь от каждого полюса, имеет место только в воз-
душном пространстве, образующемся между полюсным башмаком
машины и якорной жестью. Вне этого пространства силовые линии вы-
ступают дугообразно, связывая магнитно полюс с якорем. Поэтому вы-
численное по измерениям машины поперечное сечение магнитопро-
вода должно быть увеличено на 20%, а индукция соответственно
уменьшена. Электроды сравниваются с полюсами и якорной жестью,
электролит — с воздушным пространством. На краях анодов и като-
дов господствует большая плотность тока, больше силовых линий, так
как там увеличивается электропроводящее поперечное сечение, и по-
этому там имеет место большее выделение и растворение металла.
В качестве мерила, определяющего способность данного электролита
к рассеиванию силовых линий. Пфангаузер принимает разность по-
тенциалов разряда иона осаждающегося металла и Иона «проводящей
соли» (Leitsalzkationen):
^рк—рк"—рк'.
1 Pfanhauser, Galvanotechnik, етр. 101, 1928.
110
Предложенная Пфангаузером формула имеет в виду лишь краевое
рас1сеивание ситовых .пиний (Rand-Stromlinienstreung). Ею нельзя
пользоваться для суждения о способности ванны работать в глубину,
т. е. давать равномерные осадки на сильно профилированных изде-
лиях. .Наиболее полное исследование в этом направлении было пред-
принято в Bureau of Standards в Вашингтоне Херипгом и Блюмом Ч
Этими авторами была установлена следующая терминология: 1) пер-
вичное распределение тока (primary current distribution), которое
определяется только размерами электродов и расстоянием между ними
в электролите; 2) вторичное распределение тока (secondary current
distribution), которое зависит’ от состава электролита, и 3) распреде-
ление металла (the metal distribution), которое зависит от вторич-
ного распределения тока и выхода тока.
Фиг. 48. Примерное распреде-
ление плотности тока в хро-
мовой ванне. Средняя плот-
ность тока 22 А./дм-.
Фиг. 49. Схема рас-
пределения тока на
профилированном ка-
тоде.
Первичное распределение тока возможно только при отсутствии
катодной поляризации, при одинаковой поляризации на различных
катодных участках или три пользовании переменным током такой
высокой частоты, чтобы поляризация была сведена к минимуму. Фак-
тическое или вторичное распределение тока в любом электролите
всегда более равномерно, чем первичное; распределение металла равно
произведению вторичного распределения тока на отношение выходов
тока при двух данных плотностях тока.
Рассеивающая способность (Throwing power) указанными авто-
рами определяется как «отклонение (в процентах) распределения ме-
талла от первичного распределения тока->. Для выяснения факторов,
влияющих на величину рассеивающей способности, рассматриваются
два катодных участка, находящиеся от анода на расстоянии в отно-
шении 1 :5. В процессе прохождения тока концентрация ионов не-
посредственно у катодной поверхности быстро уменьшается, в связи
с чем возрастает потенциал, необходимый для продолжения прохож-
дения тока. Эта концентрация будет быстрее уменьшаться около того
1 .Trans. Am. Electrochem. Soc.“, 44, 313, 1923.
Ill
участка катода, где плотность тока больше, соответственно и потен-
циал,' необходимый для продолжения прохождения тока, будет бы-
стрее возрастать на том участке катода, где плотность тока выше по
сравнению с участком, где плотность тока меньше. Так как, однако,
общее падение напряжения между анодом и различными частями ка-
тода одинаково, то необходимое повышение потенциала на ближай-
шем участке катода эквивалентно повышению сопротивления на дан-
ном участке. Вследствие этого плотность тока на ближнем участке
катода снижается, и распределение тока делается более равномерным,
чем первичное распределение. На фиг. 49 дана иллюстрация такого
случая распределения тока:
А — анод;
С —катод;
п — единица катодной площади, наиболее близко расположенной
off анода;
f — единица катодной площади, наиболее далеко удаленной от
анода;
Rn — сопротивление электролита от анода до участка я;
Rf—kRn — сопротивление электролита от анода до участка f;
кп — какая-нибудь определенная цифровая величина — 2,5 и т. д.
1„ —плотность тока на участке п;
If — плотность тока на участке f;
еп — катодный потенциал на участке и;
ef —катодный потенциал на участке f;
Е „ — падение напряжения в электролите от анода до участка п;
Ef —падение напряжения в электролите от анода до участка f.
Так как металл — анодный и катодный — является хорошим про-
водником по сравнению с электролитом, то для простоты рассужде-
ния можно допустить, что потенциал будет одинаковым во всех точ-
ках анода и катода. При электролизе разность потенциалов между
электродами складывается из трех величин: 1) анодной поляризации,
2) падения напряжения на преодоление омического сопротивления
и 3) катодной поляризации. Все эти три величины могут быть изме-
рены. Скачок потенциала на различных участках анод — раствор не
одинаков, однако для простоты можно допустить, что этот потенциал
одинаков, по крайней мере, его можно сделать одинаковым.
Разность потенциалов между анодом и какими-нибудь двумя
катодными участками будет так же одинакова, т. е. можно написать
уравнение:
еа~\~^п—€п — еа~\~ Ef ef (1)
Поскольку мы условились выше принять еа везде одинаковым,
можно написать:
En — en = Ef — ef, (2)
En = I„-Rj (3)
Ef = IfRf = Iflc-Rn, (4)
In’Rn en~ efi (5)
112
4
4
If-Rn’
- E,
к
(6)
(7)
In
If
(8)
f есть отношение плотностей тока на различных катодных участ-
*f
ках п и т, в то время как к служит мерилом первичного распределе-
ния тока и является только функцией расстояния. Мы видим, что
вторичное распределение тока равно первичному к минус коэфи-
циент.. Последний вместе с учетом катодного выхода тока определяет
«рассеивающую способность» и содержит только такие величины, ко-
торые известны или могут быть измерены.
Распределение металла на различных катодных участках будет
подчиняться ур-нию (7) только в том случае, если выход тока при-
нять равным 100% или, во всяком случае, независимым от плотности
тока. Так как такое положение не всегда верно, то для учета распре-
деления металла необходимо принять во внимание изменение выхода
тока с плотностью тока.
Пусть вес металлического осадка на участке и равен М„, а на
участке f равен Mf.
Выход тока на участке п равен Dn, а на участке f равен Df, тогда
отношение металла на участках п и f выразится:
М„_А, Д,
If'Df
(9)
Из ур-ния (9) нетрудно установить, что распределение металла
будет равномернее в тех случаях, когда выход тока уменьшается с по-
вышением плотности тока (например в цианистой медной или цинко-
вой ванне), и, наоборот, распределение металла будет менее равно-
мерным, чем это соответствует вторичному распределению тока в том
случае, когда выход тока, растет вместе с плотностью тока (например
при хромировании).
Вспомнив данное выше определение рассеивающей способности
как «отклонение (в процентах) распределения металла от первичного
распределения тока» и, приняв выход тока равным при плотностях
тока 1п и 7у, мы получим, что рассеивающая способность:
к—к( 1
•100= 100
Ef
(Ю)
Т
Если же учесть ур-ние (9),
тока, то получим:
Т= 100
т. е. изменение выхода тока с
1 % —
Е,
плотностью
(11)
£ Основы гальваностегии 1783
113
Ур-ние (11) переходит в ур-ние (10), когда у- принимает значение,
равное 1.
Наибольший интерес представляет ур-ние (10); оно показывает,
что если выход тока с плотностью тока не меняется, то рассеивающая
способность может быть вычислена путем двух, максимум трех из-
мерений.
Следующий пример дает представление о том, как пользоваться
этим ур-нием. Пусть
fc=5,
ef — en = 0,073,
£у= 0,800.
Согласно ур-нию (8) мы имеем
к
If
(1—°’-073\
Ef / \ 0,800/
= 4,54.
к
Если выход тока на участках п и f одинаков, то:
Т= 100 ) = ЮО = 9,1%.
\ Ef ] \ 0,800/ /0
Для выяснения влияния других факторов на рассеивающую спо-
собность преобразуем ур-ние (10):
В данном выражении рассеивающая способность определяется че-
тырьмя факторами:
1) разностью катодных потенциалов на удаленном и близком
катодном участке,
2) плотностью тока на более удаленном участке,
3) отношением расстояний различных катодных участков и
4) сопротивлением электролита от анода до ближнего участка.
£5 _£
отношении —- числитель определяет скорость изменения
1f
катодного потенциала в пределах двух плотностей тока. Рассеиваю-
щая способность тем больше, чем больше численная величина этого
В
отношения, чем более наклонна кривая поляризации. Иллюстрацией
этому служит хорошая рассеивающая способность в пианистых мед-
ных ваннах с сильно выраженной поляризацией по сравнению
с ничтожной рассеивающей способностью в медных сернокислых ван-
нах с незначительной поляризацией.
При данном значении к рассеивающая способность может быть
увеличена либо повышением катодной поляризации, увеличением аб-
ef~en л
солютного значения отношения —-—, либо увеличением электропро-
If
водности — уменьшением величины R. Известно, например, что для
114
последней цели часто вйодят соли, повышающие электропроводность
раствора, повышают температуру электролита и т. д. Но сказать за-
ранее, увеличится ли рассеивающая способность с гаовыдиением элек-
тропроводности, нельзя: если факторы, способствующие повышению
электропроводности, одновременно в большей степени уменьшат ка-
тодную поляризацию, то рассеивающая способность в конечном итоге
понизится.
С увеличением электропроводности падение напряжения на прео-
доление омического сопротивления Ef уменьшается и приближается
к величине, равной^—еп. Предельный случай равномерного распре-
деления тока можно представить себе, когда эти величины сделаются
равными (что возможно либо при увеличении ef—е„,либо при умень-
шении значения Ef). Если то рассеивающая способность для
этого предельного случая будет равна 80%:
к—1
А_
еп
ЁГ.
к
. 100 = J- • 100 = 80%.
Фиг. 50. Аппарат для изме-
рения рассеивающей спо-
собности. F — удаленный
катод; А — анод; N — близ-
кий катод; Ар—амперметр
для близкого катода; А^ —
амперметр для удаленного
катода; Af — амперметр для
общей силы тока; V—вольт-
метр; 8 — переключатель.
Катодная поляризация сама по себе представляет сложный про-
цесс, зависящий от множества факторов, как-то: скорости диссоциации
молекул или комплексных ионов (так на-
зываемой химической поляризации), под-
вижности ионов, диффузии и конвекцион-
ных токов. В растворах простых солей наи-
большее влияние На величину поляризации
оказывают конвекционные токи. Последние,
в свою очередь, зависят от применяемой
плотности тока и связанной с ней скоро-
стью обеднения электролита, непосредствен-
но примыкающего к катодной поверхности,
от разности в плотности основной массы
электролита и части его, примыкающей к
катодной поверхности, от вязкости раство-
ра и степени выделения водорода наряду с
металлом. В отношении вязкости необходи-
мо указать на поведение коллоидов: при-
сутствуя в незначительном количестве в
электролите, коллоиды не вызывают замет-
ного увеличения вязкости, но если колло-
иды током переносятся по направлению к
катоду, то около него (катода) электролит
становится сильно вязким. Итак, все те фак-
торы, которые косвенно или непосредствен-
но способствуют повышению катодной поля-
ризации, улучшают рассеивающую способ-
ность. Такие факторы, как перемешивание,
повышенная температура (если электропро-
водность при этом незначительно (возрастает) и т. п., которые умень-
шают катодную поляризацию, одновременно ухудшают рассеивающую
способность.
115
В подтверждение своей теории Херинг и Блюм провели ряд экспе-
риментов .и измерений.
Сосудом для измерения рассеивающей способности служил эбони-
товый ящик с поперечным сечением электролита 10 X Ю см и Дли-
ной в 60 см. В ящике были сделаны прорезы для Держателей анода
А и катодов п и f, находящихся от анода соответственно на расстоя-
нии 10 и 50 см, т. е. Ь отношении 1 : 5. Измерения показали, что
плотность тока и потенциалы были одинаковы на всей поверхности
каждого катода, так что все полученные данные могут быть приме-
нимы к двум различным участкам на катоде, находящемся на та-
ком же расстоянии от анода. Измерения потенциалов производились
при помоши нормального каломельного электрода и потенциометра
Лидса и Нордтропа (фиг. 50). В процессе электролиза измерялись
анодный и катодный потенциалы, их разность и падение напряжения
на омическое сопротивление между анодом и каждым катодом. Эти
данные приведены в табл. 17.
Таблица 17
Первичное отношение тока 5:1 (fc = 5); электролит:
CuSO4-5H3O - 1.5N • H.-SO4—1,5 N, сила тока 2 А; продол-
жительность электролиза 1 час; температура 21°; переме-
шивание отсутствует; вес осадка на катоде п 2,063 г, на
катоде f 0,456 г.
Результаты По нормальн. каломельному электроду V По водородному электроду V
Потенциал
еп — 0.073 + 0.210
ef + 0,000 4- 0,283
е/—еп (вычислены.) . . + 0,073 + 0,073
ef—en (измеренн.) . . . + 0,073 + 0,073
+ 0,0055 + 0,055
Равнов. потенц. меди на п и f + 0,030 + 0,313
Падение напряжения Еп .— + 0,729
Ef —— + 0,800
Е общее — + 0,856
Е вычисл. от А до п . — + 0,857
Е вычисл. от А до f . — + 0,855
отношению
Рассеивающая способность по
катодах может быть вычислена следующим образом:
2,063 5—4,53 0,47
— = 4,а3; 7=100-------— = 100.^-= 0,4»/,
На основании же проведенных измерений мы имеем:
ef — е„\ f 0,073
~ 5 V ~~ 0,800
/0,073\
= 1оЧоЖ> = 9’1%-
весов металла на двух
п
— 4,54,
к Е,
Т= 100
к Ef
116
Плотность тока А/дм2
Фиг. 51. Поляризационные кривые.
Мы видим, что разница между величиной, вычисленной по взве-
шиванию катодных осадков и по результатам измерения потенциалов,
весьма незначительна.
В указанном составе сернокислой медной ванны (условно назван-
ной стандартной) режим электролиза менялся — плотность тока, тем-
пература, леремешивание — и вводились различные добавочные
агенты.
На фиг. 51 нанесены соответствующие поляризационные кривые;
в стационарной медной сернокислой ванне плотность тока незначи-
тельно влияет на поляризацию, а следовательно, и на рассеивающую
способность. Повышенная температура и перемешивание заметно сни-
жают поляризацию и рассеивающую способность, которая в «стан-
дартной» ванне при 21° без перемешивания равна 9,4%, при 45° —
2,2;%\ а при 21° и воздушном перемешивании — 3,4%. Повышение
концентрации меди в растворе от однонормальной до двухнормаль-
ной вызывает уменьшение рассеивающей способности от 10,8 до 7,2%;
повышение кислотности от нормальной до двухнормальной увеличи-
вает рассеивающую способность от 6,6 до 10,8%. Это объясняется
тем обстоятельством, что повышенная концентрация меди уменьшает
поляризацию и незначительно увеличивает электропроводность, в то
время как повышенная кислотность мало влияет на поляризацию,
но заметно увеличивает электропроводность.
Из коллоидных добавок, которые часто вводятся для улучшения
качества медных осадков, резко выделяется желатина, которая сильно
увеличивает рассеивающую способность, особенно при низких плотно-
стях тока (до 0,5 А/Дм2), так как именно в этих пределах значи-
тельно увеличивается катодная поляризация. Декстрин увеличивает
рассеивающую способность при низких плотностях тока и уменьшает
ее при повышенных плотностях тока.
Таким образом мы видим, что далеко не при всех условиях кол-
Медные цканя
0,25 NCu CN (22,5 г/л)
0,60 NNa CN (30,0 „
0,30 NNa3CO3 (15,0 „
Сила тока А Темпера- тура °C Распределение тока Выход тока Получен- ное отно- шение металла S • ф К Ф г- ф ф S S" Св Й-'Я г g £ й о; 2 о о о св св С С К я m о я
получ. вычисл. на участке п на участке f
1 ( °’5 I 1,0 f 0,5 II { 1,0 1 1,0 ш ( ъо 21 21 45 45 21 21 21 4,18 4,58 3,06 3,89 4.20 4,21 4,68 4,13 4,55 3,07 3,90 4,19 4,17 4,67 61,4 49,1 87,3 72,4 66,8 71,4 80,2 75,4 97,1 97,1 90,4 85,1 78,4 3,20 2,99 2,75 2.91 3,10 3,53 36,0 40,2 45,0 41,8 38,0 29,4
Условные обозначения: 1- стандартное. II—воздушное перемешивание. Ill—до
118
лоидные добавки, как это принято считать, способствуют получению
более равномерных катодных осадков. Поляризационные кривые, по-
лученные для данного конкретного случая, дают представление о той
рассеивающей способности, на которую можно рассчитывать; поль-
зуясь поляризационными кривыми, можно подобрать и соответствую-
щие условия для получения лучшей рассеивающей способности —
состав электролита, режим и т. п.
Медные цианистые ванны, отличаясь большей катодной поляриза-
цией, имеют и большую рассеивающую способность по сравнению
скислыми ваннами. С увеличением плотности тока рассеивающая спо-
собность в них меняется незначительно. Это объясняется тем обстоя-
тельством, что с увеличением плотности тока выход тока падает.
Повышенная температура снижает катодную поляризацию, причем
при высоких плотностях тока в менйпсй степени, чем при низких.
Это объясняется тем обстоятельством, что выход тока уменьшается
с повышением плотности тока,, и выделяющийся водород интенсивно
перемешивает слой электролита', примыкающий к катоду, что влечет
понижение поляризации. Поэтому повышенная температура оказывает
меньшее влияние на уже сниженную поляризацию благодаря пере-
мешиванию водородом, чем при низких плотностях тока, где выход
тока больше и выделяется меньше водорода. Так как выход тока в хо-
лодных ваннах меньше, чем в горячих, то металл распределяется в
последних равномернее. Примерно так же, как и повышенная темпе-
ратура, сказывается перемешивание. Применяемый для получения
блестящих и мягких осадков гипосульфит в медных цианистых ван-
нах несколько снижает катодную поляризацию и рассеивающую спо-
собность.
Пэн (L. С. Рав)1 видоизменил несколько данные Херингом и Блю-
мом выражения для рассеивающей способности, сделав эти выражения
Таблица 18
етые растворы
рег перемешивания 1 час
Потенциал отно- сительно водород- ного электрода «Г 6f~en In If Ef R
стати- ческ.
—0,637 —1,547 —1,397 0,150 0,403 0,097 0,860 17,7
—0,637 —1,582 —1,442 0,140 0,821 0,179 1,560 17,4
—0,720 — 1,382 — 1,097 0,285 0,377 0,123 0,740 12,0
—0,720 — 1,497 —1,237 0,260’ 0,796 0,204 1,180 11,6
—0,592 —1,557 —1,277 0,280 0,807 0,193 1,720 17,8
—0,640 —1,377 —1,237 0,140 0,404 0,096 0,838 17,5
—0,640 —1,397 —1,297 0,100 0,824 0,176 1,500 17,1
бавлено 2 г/л Na2S2Oa.
1 „Trans. Am. Electrochem. Soc.“, vol. LVI1I, 1930.
*19
менее зависимыми от соотношения расстояний различных участков
катода от анода, т. е. от величины к. Для этого он ввел понятие об
идеальной (perfect) рассеивающей способности, соответствующей
равномерному распределению металла на всех катодных участках,
иначе говоря, соответствующей отношению распределения металла,
равному единице. «Идеальная» рассеивающая способность принимает
2_________________________________1
тогда при величине к = 2 значение —-—100 = 50%, при к = 3 зна-
чение * 3 -100 = 66,7%, при к= 4 значение^-^—• 100 = 75%. Чис-
ленное выражение рассеивающей способности увеличивается вместе
с величиной к и приближается к 100% при бесконечно большом зна-
чении к. Рассеивающий коэфициент полезного действия (Throwing
efficiency) определяется как отношение фактически полученной рас-
сеивающей способности к к идеально возможной.
Когда распределение металла везде одинаково, рассеивающий
коэфициент полезного действия равен:
фактическая рассеивающая способность
идеальная рассеивающая способность
Рассеивающая способность равна:
к—отношение распределения металла
_ •
к__1
Идеальная рассеивающая способность равна 100—
Рассеивающий коэфициент полезного действия равен:
к — отношение распределения металла
fc-^T •
Последний показывает не только улучшение в распределении ме-
талла от первичного распределения тока к, но н показывает, на-
сколько фактическая рассеивающая способность приближается
к идеально возможной. Так, например, при к =5 и распределении
металла на двух катодных участках в отношении, равном 2, полу-
чается, что рассеивающий коэфициент полезного действия равен:
5__о
100----- = 75%,
5— 1
рассеивающая способность равна:
к__о
1 оо-Ц-- = 60%.
э
В аппарате, предложенном Херингом и Блюмом для определения
рассеивающей способности, Пэн испытал электролиты для кадмиро-
вания, никелирования и цинкования. В кадмиевой ванне с положи-
тельной рассеивающей способностью рассеивающий коэфициент по-
лезного действия оказался менее зависимым от соотношения расстоя-
ний катодных участков; то же можно сказать в отношении цинковой
120
ванны с отрицательной рассеивающей способностью. В никелевой же
ванне, наоборот, рассеивающий коэфилиент полезного действия ока-
зался более чувствительным к измерению относительного расстояния
катодных участков от анода, чем рассеивающая способность (фиг. 52,
53, 54).
Таким образом единственное преимущество нового определения,
Отношение расстояний между анодом и частями катода
Фиг. 52. Рассеивающая способность и рассеивающий к. п. д. в кад-
миевой цианистой ванне: 1—рассеивающий к. п. д.; <?—рассеивающая
способность.
левой ванне: 1—рассеивающий к. п. д.; ‘2—рассеивающая способ-
ность.
121
заключается в том, что оно дает представление о степени приближе-
ния данного распределения металла, данной рассеивающей способно-
сти к идеальному случаю.
Еще новое более простое определение рассеивающей способности
бы!ло предложено Филдом (S. Fild) Ч
Рассеивающая способность
.р с »_ &—фактическое распределение металла
' ' ' идеальное распределение металла =1
Фиг. 54. Рассеивающая способность н рассеивающий к. п. д. в цин-
ковой кислой ванне: 1—рассеивающая способность; 2—рассеивающий
к. п. д.
За стандартное отношение расстояний принимается fc = 2; выра-
жения для рассеивающей способности иллюстрируются табл. 19.
Таблица 19
Относительное распре-
деление металла
Рассеивающая
способность
%
1
1,5
2
3
4
10
4-юо
+ 50
± о
— 100
— 200
— 800
Так как при распределении металла в отношении, большем чем
два, получаются бессмысленные отрицательные значения, то для этих
1 Met. Ind. (Lnd.) VXL, pp. 403-6, 1932.
122
случаев относительное распределение металла заменяется отношением
металла на ближнем участке к разности между ним и металлом, осев-
шим на удаленном участке.
Отрицательная рассеивающая способность равна (к— —100,
где А — вес осадка на ближайшем катодном участке,
В — вес осадка на удаленном катодном участке.
Применение этой формулы иллюстрируется табл. 20.
Таблица 20
Вес осадков А —В А (2- -л-в)- *“
А В А—В
2,54 1,27 1,27 2 0
3,20 1,44 1,76 1,818 —18,2
2,88 0,72 2,16 1,333 — 66,7
2,50 0,25 2,25 1,111 —88,9
2,40 0 2,40 1,000 —100
Аппарат для измерения рассеивающей способности изменен Фил-
дом в том направлении, что катоды располагаются по одну сторону
анода, причем для того, чтобы избегнуть взаимного влияния двух ка-
тодов, последние изолированы друг от друга стеклянным экраном.
Каждый катод может быть отдельно взвешен или приключен к ампер-
метру с таким ничтожным сопротивлением, чтобы им можно было
пренебречь по сравнению с сопротивлением электролита. В последнем
случае можно пользоваться показаниями амперметра вместо взвеши-
вания катодов (фиг. 55).
В кадмиевой цианистой ванне, содержащей 30 г/л металличе-
ского кадмия и 15 г/л цианистого натрия, Филдом получены значения
для рассеивающей способности, приведенные нами в табл. 21.
Таблица 21
Осадок Относитель- ное распре- деление ме- талла Рассеиваю- щая способ- ность Средняя
А В
0,931 0,659 1,413 58,7
0,289 0,203 1,379 62,1
0,544 0,386 1,409 59,1 58,9
0,372 0,259 1,436 56,4
0,312 0,220 1,418 58,2
Браун (Braund) внес температурную поправку в формулу, выве-
денную Херингом и Блюмом для рассеивающей способности. Дело
в том, что величина к, характеризующая относительное расположе-
123
ние двух катодов (или двух участков одного катода) от анода, дает
нам представление о первичном распределении тока при условии оди-
наковых физических свойств всего электролита. На самом деле разо-
гревание электролита в отдельных местах будет зависеть от силы
тока, следовательно, на ближнем катоде, где плотность тока больше,
электролит будет разогреваться в большей степени, чем на более от-
даленном катоде. Поэтому в тех случаях, когда с повышением темпе-
ратуры повышается заметно также и электропроводность, приходится
вводить соответствующую поправку. Если за счет повышенной темпе-
ратуры удельная электропроводность на ближнем катоде, где плот-
ность тока больше, равна С„, а на отдаленном соответственно Cf,
то «исправленное» отношение расстояний примет следующий вид:
В соответствии с исправленной величиной к' получается и испра-
вленная рассеивающая способность. Эта поправка, которая была вве-
дена Брауном и использована для измерения рассеивающей способ-
ности цинковых ванн, а впоследствии Флаурсом 1 и Вернером2 для
никелевых ванн, в некоторых случаях дает расхождение с неиспра-
вленной рассеивающей способностью порядка 10—12i% в сторону уве-
личения положительной рассеивающей способности или абсолютного
уменьшения отрицательных значений рассеивающей способности.
Во всех описанных нами выше методах измерения рассеивающей
способности ванн применялись параллельные электроды. Для прак-
тических целей эти методы представляют неудобства в том отношении,
что результаты измерений в лабораторных ваннах не могут быть при-
менены целиком для случая покрытия изделий сложной формы, на-
пример с большими углублениями. Второй недостаток этих методов
заключается в том, что приходится учитывать изменения выхода тока
с плотностью тока, которая может сильно меняться на неправильной
поверхности. Буссе 3 применял оригинальный метод, лишенный этих
недостатков. Он измерял падение потенциала на согнутом под углом
в 60° катоде, при помощи специального перемещающегося вспомога-
тельного электрода (Fiihlelektrode) находил в электролите точки, от-
вечающие одинаковым потенциалам и, соединяя эти точки, получал
так называемые эквипотенциальные кривые. Так как катодный потен-
циал является функцией, господствующей в данном месте плотности
тока, то такие кривые должны, казалось бы, дать представление о рас-
пределении тока в электролите.
На фиг. 55а даны разрезы по Н—J и Е—G смонтированного па
каучуковой плите углового катода вместе с приспособлениями для из-
мерения потенциалов. Вспомогательный электрод F может быть пере-
двигаем вдоль катода посредством шибера S15 сидяшего на штанге А,
и перпендикулярно к катоду посредством находящегося на масштабе
В шиберообразного держателя S2; на обеих шиберных штангах
имеются миллиметровые деления.
* ,Trans. Am. Soc.*, 27, 661, 1931.
3 „Trans. Am. Electrochem. Soc.", 62, 1933.
s .Zeitschr. filr,Electrochemie“, Bd. 38, Xs 10, 1932.
124
Вспомогательный электрод представляет собой оттянутый в острйе
капилляр, в который ©паяна 0,3-лсм платиновая проволока. Трубка
наполнена ртутью и имеет контактный винт, от которого платино-
вая проволока попадает в ртуть.
Клемма С служит для подводки то-
ка и одновременно для включения
гальванометра, измеряющего паде-
ние потенциала. Схема включения
показана па фиг. 56.
Падение потенциала на катоде
измеряется передвижением вспомо-
гательного электрода по штанге Д,
на постоянном расстоянии от ка-
мерения рассеивающей способ-
ности.
Фиг. 55. Аппарат Field для
измерения рассеивающей
способности.
тода. Точки, отвечающие одинаковым потенциалам в электролите, на-
ходят следующим образом. За исходное (основное) значение прини-
мается измеренное падение потенциала между платиновым острием
и катодом при расстоянии 2 на штанге А и при кратчайшем расстоя-
нии шибера S2 на В. Передвиже- ------------------,
нием шибера S) на штанге А и
одновременным передвижением
вспомогательного электрода F на
штанге В находятся те пункты,
которые соответствуют исходному
значению потенциала. Наиболее
воспроизводимые результаты были
получены при расстоянии между
чувствительным электродом и ка-
тодом, равным 0,45 см.
На фиг. 57 даны две кривые,
полученные в нейтральном элек-
тролите, содержавшем 100 г/л
CuS04.5Н20. На абсциссе отло-
Фиг. 56. Схема включения аппарата
Busse.
жены обратные (для большей на-
глядности) значения потенциалов, причем Е=1. На ординате дано
расстояние между электродами, причем и здесь L, = 1. Плотность
тока 0,5 А/дм2, температура 20°. Эти кривые отличаются друг от друга
125
только тем, что первая получена при расстоянии 1 (5,23 с.и), а вто-
рая— при расстоянии /V (16,73 см). Кривые могут быть выражены
показательным уравнением Z = Ua.
Распределение тока тем благоприятнее, чем меньшие значения
имеет а. Для того, чтобы напряжение 'ванны не оказывало влияния
на -значения величины а, Буссе приводит их к напряжению, равному
одному вольту, для чего найденные для отдельных опытов значения а.
делятся на напряжение Еь, но для удобства берутся обратные значе-
ния (чтобы иметь дело с большими числами).
Эти значения распределения тока обозначаются буквой т=—-
Измеренные потенциалы и вычисленные соответствующие значе-
ния у при различной температуре, плотности тока и составе электро-
лита показали, что распределение тока тем благоприятнее, чем ниже
температура и чем выше до-
пустимая при этом плот-
ность тока. В медных ван-
нах с увеличением электро-
проводности (при повыше-
нии температуры или содер-
жания кислоты) разности
значений у при увеличении
расстояния от анода стано-
Фиг. 57. Кривые падения потенциалов в раст- ВЯТСЯ большими. Влияние
воре медиого купороса при измерении аппа- ПЛОТНОСТИ ТОКа При ВЫСО-
ратом Busse. кой кислотности оказывается
меньше, чем при низкой.
В никелевых ваннах при плотности тока в 0,3 А/дм2 электропро-
водящие соли ухудшают распределение тока; это остается в силе и
при увеличенном расстоянии между электродами. При плотности тока
в 1 А/дм2 влияние электропроводящих солей меньше при 20°, чем
при 50°, однако значительно больше, чем при низких плотностях
тока. При дальнейшем повышении плотности тока до 3 А/дм2 влия-
ние проводящих солей становится незначительным. При увеличении
расстояния между электродами распределение тока становится более
равномерным, в отличие от явлений, наблюдаемых при низких плот-
ностях тока.
В кислых цинковых ваннах прибавление HgCl2 оказывает благо-
приятное влияние при любых плотностях тока. В щелочных цинковых
ваннах распределение тока с повышением плотности тока улучшается
в большей степени при меньшем расстоянии между электродами. По-
следнее обстоятельство противоречит установившемуся до сих пор
в технике мнению, что ток распределяется более равномерно при уве-
личении расстояния между электродами. Это положение было прове-
рено весовым методом на угловом катоде, состоявшем из набранных
на каучуковой подставке металлических полос. Из найденного в этих
опытах падения плотности тока были вычислены по показательной
функции значения а или обратные значения этих величин, которые
обозначаются буквой [?.
В табл. 22 приведены найденные значения ₽.
Из этой таблицы видно, что распределение тока с увеличением
126
расстояния между электродами ухудшается при различной темпера-
туре и плотности тока.
При изучении распределения тока в электролите методом экви-
потенциальных кривых последние не всегда согласовывались с най-
денными значениями у. При идеальном распределении тока эквипо-
тенциальные линии должнр протекать параллельно катоду, практи-
чески они больше или меньше отклоняются от него. Чем дальше от
вершины удалена точка пересечения эквипотенциальной кривой с
биссектрисой утла, тем хуже распределение тока в данном электро-
лите. Буссе считает метод эквипотенциальных кривых менее точным,
чем метод измерения падения потенциала.
Таблица 22
Состав электролита Плотность тока А/5.и2 Расстоя- ние I Расстоя- ние IV
20° 40° 20° 40°
100 г/л CuS04 4 7,5 г/л H»SO 0,5 0,415 0,405 0,174 0,155
100 1,5 0,600 — 0,216 —
100 „ CuS04-f-30 , H2SO 0,5 0,360 0,350 0,168 0,145
В результате проведенной работы Буссе пришел к заключению,
что электролиты, хорошо проводящие ток, плохо распределяют (нерав-
номерно) его на катоде: частным случаем могут служить хромово-
кислые ванны с хорошей электропроводностью и плохой рассеиваю-
щей способностью.
В качестве практического следствия из данных опытов указы-
вается на целесообразность работы с электролитами, имеющими как
можно большее значение у. Если налицо ванна с высоким значе-
нием :у, то для суждения о равномерном распределении тока необхо-
димо принять во внимание поляризационную кривую, в особенности
потенциал, соответствующий началу осаждения металла. По мнению
Буссе, «возможности для хорошей работы в глубину в ваннах с силь-
но отрицательным потенциалом заключаются в добавлении таких ве-
ществ, которые уменьшают электропроводность, не ухудшая одновре-
менно процесс в целом».
Мы видим, что в данной работе роль электропроводности, с точки
зрения влияния ее. на равномерность распределения тока, освещается
иначе, чем это было сделано Блюмом, и другими исследователями
в этой области. В противоположность Пфангаузеру Буссе считает,
что увеличение расстояния между электродами отрицательно влияет
на рассеивающую способность.
На роль минимальной плотности тока, необходимой для начала
осаждения металла, указывают в своей работе также Шлеттер и Кор-
пиум1. Эти авторы, между прочим, демонстрировали рассеивающую
способность ванн цветными нобилевскими кольцами: с увеличением
1 «Trane. Am. Electrochem. Soc.“, vol. 62, 1933.
127
рассеивающей способности ванн увеличивается, расстояние между
шэльцами. Нобиле получал такие кольца, осаждая перекись свинца
на аноде, — в данном случае получались тонкие (0,0002 л.«) осадки
железа, кобальта и никеля и путем нагревания докрасна осадки пре-
вращались в окисли (фиг. 58а). Образование этих колец объясняется
интерференцией света от тонких пленок: при монохроматическом осве-
щении пленка двойной толщины равна кратному числу полуволн.
Поэтому в кольцах Нобиле разница в толидине осадка в двух после-
дующих кольцах должна быть равной 0,5 длины волн. Так как
в то же время толщина пленки прямо пропорциональна плотности
тока, то последняя увеличивается или уменьшается в равных количе-
ствах при переходе от одного кольца к другому (фиг. 58).
Для. того чтобы вывести уравнение, связывающее факторы, влияю-
щие на распределение тока на катодной поверхности, Шлеттер и Кор-
пиум исходят из того положения, что электролит на
всем пути от ан'ода до катода подразделен силовы-
ми линиями таким образом, что- ток, проходящий по
одной линии или по полосе линий, одинаков по всей
длине. Если ширина такой полосы силовых линий по
катодной поверхности равна ds, а толщина этой поло-
сы по1 всей длине от анода к катоду равна h, то ка-
тодная плотность тока'
Фиг. 58. Схема
получения ко-
лец Нобиле:
п — железный
пластинчатый
анод; в—пла-
тиновый точеч-
ный катод.
Фиг. 58а. Демонстрация рассеивающей способности мето-
дом колец Нобиле.
d h-ds’
где 1 — часть тока, которая переносится полоской постоянных сило-
вых линий (фиг. 59).
Согласно закону Ома между падением напряжения вдоль этой
полоски Е, силой тока 1 и сопротивлением R существует следующая
зависимость:
I=Ia.h.ds = ^, (1)
где Е — потенциал катодной поляризации.
Для определения рассеивающей способности ванны необходимо
128
Принимать fed бнймаййе только катодную Поляризацию, — только ойа
определяет глубину проникновения металла.
Сопротивление й) зависит от положения на катоде полоски ds:
v.-h-ds
(2)
где г.— удельная электропроводность электролита, a F(s')—приве-
денное сопротивление (reduced resistance) части полосы достоянных
силовых линий.
F(s') есть значение функции Fs, соответствующее точке S' на ка-
тодной поверхности.
Из ур-ний (1) и (2) находим, что:
(3)
Фиг. 59. Схема распре-
деления силовых линий
между анодом и катодом.
(За)
1d
т *(Е-1)
d F(s)
Согласно ур-нию (За) плотность тока на
любой точке катодной поверхности не может
быть равной нулю, даже на наиболее удален-
ной от анода точке F(s) она будет иметь опре-
деленное значение. То обстоятельство, что
в некоторых случаях металл на определенных
участках не осаждается, говорит за то, что
там не достигнута, минимальная плотность
тока, необходимая для начала осаждения ме-
талла. Обычно эта минимальная плотность то-
ка колеблется в пределах от 1 • 10~5 до
10 • 10~5 А. Для хрома она значительно выше.
Исходя из этого положения, можно считать, что металл будет
осаждаться только в том случае, когда Е— В и соответствующее
сопротивление полоски силовых линий таковы, что плотность тока до-
стигнет своего минимального предела.
На основании ур-ния (3) можно рассеивающую способность выра-
зить отношением приведенного сопротивления при плотностях тока
/1 и 12 и данном расстоянии между электродами.
Рассеивающая способность
Г(а2)_
F(S1)
(4)
Если далее допустить, что падение напряжения на ванне Е равно
скачку потенциала 1 см3 раствора при d—h плюс потенциал поля-
ризации 1ц, соответствующей той же плотности тока, т. е
Е=
(5)
9 Оововы гальваностегии 1788
129
то, комбинируя ур-ния (4) и (5'> и принимая во внймайие, что F(-s')
1 см3 равна единице, мы получим ур-ние (рассеивающая способность'):
(6)
Таким образом можно рассеивающую способность выразить в чи-
словых значениях, которые дают понятие о величине приведенного
сопротивления вдоль пучка тока, который несет часть катодной поверх-
ности, чтобы получить видимый катодный осадок по сравнению с тем
значением приведенного сопротивления пучка тока на части катод-
ной поверхности, где господствует максимальная плотность тока и где
это сопротивление равно единице. Иными словами, рассеивающая спо-
собность дает понятие о той глубине, где может быть получен осадок.
Чем больше отношение приведенного сопротивления соответствующего
плотности тока /1 и 12 по сравнению с отношением самих плотностей
тока, тем равномернее будет осадок:
где qt и ok — выхода тока, соответствующие Л и 12.
Если катодная поляризация незначительна, то в ур-нии (6) выра-
жение в скобках становится равным единице, и отношение приведен-
ного сопротивления F(s2)F^s^ становится равным отношению
плотностей тока в соответствии с законом Кирхгофа.
*2
Всякая катодная поляризация увеличивает значение в скобках в
ур-нии (6), и. следовательно, отношение восстанавливающих сопроти-
влений, цоторые служат мерилом рассеивающей способности. При ми-
нимальной плотности тока поляризация Е.2 настолько мала по срав-
нению с что этой величиной .можно пренебречь, и упрощенное вы-
ражение для рассеивающей способности примет вид:
^=1+ j-(8)
111
Это ур-ние дает возможность вычислять рассеивающую способ-
ность лишь приближенно, так как поляризация при низких плотно-
стях тока на самом деле не равна нулю.
Следующие примеры иллюстрируют применимость ур-ния (8) для
вычисления рассеивающей способности медных ванн. В растворе, со-
держащем 250 г/л CuS’O4. бНоО, катодная поляризация при плотности
тока в 5 • 1О—3 А/см2 равна 0,033 V, удельная электропроводность —
0,164 мо/см3.
8”=1 +21^^ = 2,083.
S.10-®
При введении коллоидов в эту ванну катодная поляризация при
тех же условиях равна 0,144 V, тогда получим:
0,164-0,144
130
Рекомендуемые многими сернокислые соли щелочных металлов
для увеличения рассеивающей способности оказывают на нее в дей-
ствительности незначительное влияние, что видно из таблицы:
Таблица 23
Состав электролита: 250 г/л CuS0«.5H20 + 20 г/л H2SO4
Na2S04.10H20 г/л 5 'Л S"
С 50 200 В цианистых цинковы сбивающую способность ок дующих данных: K2Zn(CN)4 45 г/л 1 KCN 15 „ / NaCl 20 , NaOH 20 » Тот же электролит 4-2 г/л K2Hg(CN)4 0,030 0,033 0,041 х ваннах С азывают рт 0,168 0,334 0,000 0,096 0,102 лагоприятт утные сол1 7. (D) 0,1535 0,1515 1,54 1,62 1,84 гое влияние на рас- I, что видно из еле- s'' г5-1О~3 А/см2) 6,16 10,3
Помимо рассеивающей способности различают еще так называемую
кроющую способность (covering power). Последняя также характери-
зует способность ванны покрывать имеющиеся на катоде углубления,
но лишь с качественной стороны, а не с количественной. Если какой-
нибудь предмет сложной формы покрыт по всей поверхности, то это
еще не значит, что толщина осажденного металла везде одинакова. В
ряде случаев, правда, когда речь идет о весьма тонких покрытиях,
порядка тысячных или десятитысячных долей миллиметра, кроющая
способность ванны играет большую роль. Характерным примером для
этого является процесс электролитического осаждения хрома для деко-
ративных целей. В данном случае заботятся о получении блестящих
покрытий непосредственно из ванны. Для изделий со сложной формой
этЮ удается тем легче, чем больше рабочий интервал ванны, т. е. чем
выше отношение максимальной и минимальной плотности тока, при
которой получаются блестящие осадки хрома. Такое положение дей-
ствительно для любого процесса гальваностегии, — чем больше рабо-
чий интервал, тем лучше кроющая способность ванны. Но в то время
как рассеивающая способность дает нам представление о количе-
ственном распределении металла на катодной поверхности, крою-
щая способность дает представление о качественном распределении
его (фиг. 60).
Для измерения кроющей способности служит ванна с плоским ано-
дом и согнутым под прямым углом катодом. Графически кроющую
способность изображают вычерчиванием покрытых граней выпрямлен-
ного угла (фиг. 61).
Искусственные приемы для получения равно-
мерных покрытий. Помимо выбора должного состава электро-
*
131
лита, температуры, плотности тока и т. п. можно дли получения более
равномерных покрытий использовать и некоторые чисто механические
приемы, главнейшие из которых будут
Рассеивающая способность 87.
600 -М ~П5 S5
-65 -40 -г5 -15
Зависимость между рассе-
ивающей и кроющей спосебюсгм)
Фиг. 60. Графическое изобра-
жение кроющей способности.
ниже изложены.
1. Сообщение анодам формы покрывае-
мых изделий. Ясно, что при одинаковом
расстоянии различных участков покры-
ваемых изделий от соответствующих уча-
стков .анодов покрытие должно быть рав-
номерным, за исключением краев и ост-
риев.
2. Увеличение расстояния между анод-
ными и катодными штангами также спо-
собствует более равномерному осажде-
нию металла. Если представить себе
плоский анод, отстоящий от катодной
шины на Ю см, а на покрываемом
изделии имеется выступ, отстоящий от
анода только на 5 см, тогда на этом выступе согласно первичному
распределению тока должно высадиться вдвое больше металла '(при
полном отсутствии фак-
торов, стремящихся вы-
равнять это распреде-
ление тока), чем на бо-
лее отдаленных участ-
ках изделий; если
же расстояние между
штангами будет равно
20 см, то при тех же
условиях на выступе
осядет только на У3
металла, больше, чем
на отдаленных участ-
ках изделий (согласно
отношению расстояний
20 :15). С этой точки
зрения необходимо под-
держивать максималь-
ное расстояние между
электродами, но с уве-
личением расстояния
растет и напряжение
Фиг. 61. Прибор для определения кроющей спо-
собности.
за счет омического со-
противления. Кроме
того применение боль-
ших расстояний часто
лимитируется размерами ванны. Практически пользуются расстоя-
нием между электродами в пределах 10—30 см.
3. Образование «загара», или дендритов, на остриях или высту-
пающих частях покрываемых изделий вследствие скопления в этих
132
Фиг. 62. Дополнительные катоды
для регулирования распределе-
ния тока. Роль дополнительных
катодов играют конуса, диаметр
которых должен быть больше диа-
метра покрываемых изделий.
местах избытка силовых линий может быть устранено применением
«дополнительных» катодов. В этих случаях избыток силовых линий
концентрируется на дополнительных катодах, и изделие покрыва-
ется более равномерно (фиг. 62).
4. Такую же роль играют не-
металлические щиты, или экра-
ны, которые, будучи помещены
между выступающими участками
изделий и анодами, искуственно
увеличивают расстояние, которое
силовые линии должны пройти.
К последнему методу особенно
часто прибегают при серебрении
столовой посуда (фиг. 63).
Метод Херинга для
измерения поляриза-
ции и электропроводно-
сти электролитов1. Яв-
ления поляризации на электро-
дах и степень электропроводно-
сти электролитов являются глав-
нейшими факторами, регулирую-
щими всякий гальваностегиче-
ский процесс. G катодной поля-
ризацией связаны такие суще-
ственные факторы, как структу-
ра электролитического покры-
тия и распределение металла на
вающая способность). Выход тока, связанный в значительной
степени с катодной поляризацией, в гальваностегии не играет
такой существенной роли, как в электрометаллургии, с точки зрения
расхода энергии, но он определяет скорость процесса и в значи-
катодной поверхности (рассеи-
тельной степени качество электролитиче-
ского осадка: мы знаем, что выделяющийся во-
дород влияет на физические свойства электро-
литического осадка, сообщая ему в
случаях твердость, напряженность или
кость, а в других случаях делает его
стам, рыхлым или порошкообразным.
Анодная поляризация, хотя непосред-
ственно' и не оказывает влияния на качество
электролитического покрытия, все же дает
нам представление о возможности поддержи-
вания постоянства концентрации осаждающе-
гося металла и кислотности электролита, об-
висшей степени валентности за счет анодного
присутствия в растворе соединений, дающих
одних
хруп-
пори-
Фиг. 63. Серебрение ло-
жек с неметаллическим
экраном,
разевания соединений
окисления (в случае
ионы различной степени окисления);* все эти факторы могут КОС’
венно влиять ца качества электролитического осадка.
1 Haring Н. Е., „Trans- Am, Electroclwip, (ЗорЛ, vol. XLIX, 417, 1926.
133
Что касается электропроводности, то влияние ее на качества по-
крытий— структуру и равномерность — достаточно подробно нами
освещено; здесь мы укажем еще на одно большое практическое зна-
чение величины электропроводности в гальванотехнике. Очень часто
низкая электропроводность раствора лимитирует применение макси-
мально допустимых плотностей тока для данного тсл|учая, так как в
гальванотехнике часто применяются 6-вольтные динамомашины. Та-
кие случаи, например, наблюдаются в медных сернокислых ваннах при
недостатке свободной серной кислоты в электролите, — омическое со-
противление велико.
Естественно, что измерения электропроводности и поляризации не-
обходимы не только для какого-нибудь нового неисследованного про-
цесса, но и для периодического контроля призводственных процессов.
Для этого, однако, может оказаться приемлемым лишь компактный и
вместе с тем простой метод, не связанный со сложным и дорогим обо-
рудованием и не требующий для своего осуществления работников вы-
сокой квалификации. В качестве простого метода, дающего возмож-
ность одновременно определять электропроводность и поляризацию, мы
можем указать на метод Херинга, сущность которого ниже изложена.
Общее падение напряжения' во всякой работающей электролитной
ванне складывается из следующих трех величин: 1) падение напряже-
ния на преодоление омического сопротивления которое является
функцией сопротивления раствора, размеров электродов и расстояния
между ними и силы тока, 2) анодной поляризации и з) катодной по-
ляризации. На фиг. 64 такая зависимость иллюстрирована графиче-
ски, причем сплошные линии даны для так называемой стандартной
никелевой ванны, а пунктирные линии для той же ванны в присут-
ствии больших количеств сернокислого натрия1.
На этой диаграмме величина IR дает представление о падении на-
пряжения на преодоление омического сопротивления (при разных плот-
ностях тока в ванне со стандартным никелевым раствором при двух
параллельных никелевых электродах площадью в 100 см2 каждый и
расстоянии между электродами в ю w, эта величина фиксируется
двумя линиями АВ и АС, причем угол наклона этих линий зависит
от сопротивления применяемого электролита. Кривые, иллюстрирую-
щие изменение анодной и катодной поляризации с плотностью тока,
откладываются по обеим сторонам прямых АВ и АС. Таким образом
суммарное падение напряжения для каждой плотности тока графи-
чески изображается абсциссой, заключенной между кривыми анод-
ной и катодной поляризации.
В случае электролиза -с нерастворимым анодом помимо указанных
выше величин приходится еще учитывать потенциал разложения, т. е.
разность между статическими потенциалами продуктов электролиза.
На фиг. 64а схематически изображены отдельные составляющие обще-
го падения напряжения в медной сернокислой ванне при свинцовом
аноде. Потенциал разложения не зависит от применяемой плотности
тока, почему и величина его очерчена двумя вертикальными ли-
ниями. Падение напряжения на преодоление омического сопротивле-
ния разделено на две равные части только^ из соображений симметрии.
1 Эта ванна предложена Томпсоном для осаждения никеля на цинк „Trans.
Am. Electrochem. Soc.*, 47, 169, 1925.
134
На фиг. 65 показано простое приспособление для измерения поля-
ризации. Капиллярная стеклянная трубка наполняется тем же рас-
поляризация поляризация
Фиг. 64. Графическое изображение падения потенциалов при электро-
осаждении никеля. Сплошные линии даны для раствора следующего
состава: 1 W NiSO4; 0,25 N ХП4С1; 0,25 N H3BOS. Пунктирные линии
даны для раствора того же состава -J- 3 N NasSOt.
твором, который подвергается электролизу, в трубку вставляется про-
волока из того металла, который находится в растворе. Электродвижу-
щая сила ячейки, состоя-
щей из неполяризующе-
гося металла и изучае-
мого электрода, равна
поляризации последнего.
В этой системе отсут-
ствуют жидкостные сое-
динения, следовательно,
ошибки от контактных
потенциалов, которые воз-
можны при применении
каломельного или дру-
гого полуэлемента, устра-
нены.
Так как площадь про-
волоки, (погруженной в
капиллярную трубку, ма-
Фиг. 64а. Графическое изображение падения на-
пряжения при электроосажденин меди со свин-
цовым анодом.
135
Фиг. 65. Про-
стое приспособ-
ление для изме-
рения поляри-
зации. Проволо-
ка сделана из
того металла,
который под-
вергается осаж-
дению. Трубка
наполненаэлек-
тролитом.
ла, то потенциал может несколько измениться благодаря незначи-
тельной поляризации, возникающей от того тока, который проходит че-
рез систему в процессе измерения. Для устранения этой ошибки по-
мещают высокое сопротивление в цепь полуэлемента или увеличи-
вают поверхность металла, пользуясь сетчатой спиралью.
Сама ванна представляет собой четырехугольный эбонитовый ящик,
в стенках которого имеются прорезы для помещения в них электродов.
Перпендикулярно к длинный сторонам ванны помещаются параллель-
но друг к другу анод и катод, поверхность которых одинакова и равна
поперечному сечению электролита. Между этими двумя электродами
находятся Две сетки, которые также пересекают весь электролит. Для
удобства их располагают таким образом, что электролит оказывается
разделенным на три равные части: анодное отделе-
ние А, середина М и катодное отделение С.
Поверхность каждого электрода равна 1 дмг и рас-
стояние между электродами 1 дм, так что объем каж-
дого отделения составляет 1 дм3. На длинных стен-
ках ванны делаются дополнительные прорезы, чтобы
иметь возможность сблизить расстояние между элек-
тродами, что важно в случае оперирования с плохо
проводящим электролитом.
Для того чтобы предупредить поляризацию проме-
жуточных электродов, последние делаются не сплош-
ными, а сетчатыми (8 отверстий на линейный санти-
метр), при этом сохраняется достаточная площадь,
чтобы проходящий через ванну ток не вызвал замет-
ной поляризации, и вместе с тем обеспечивается хо-
рошая циркуляция электролита.
Поскольку промежуточные электроды не поляри-
зуются, то падение потенциала в среднем отделении
М представляет величину 1R, и так как размеры элек-
тродов и расстояние между ними, а также сила тока
известны, то отсюда можно вычислить сопротивление
электролита. В анодном и катодном отделениях, ко-
торые также равны среднему отделению, с такими же
электродами и расстоянием между ними, мы будем
иметь такое же падение напряжения на омическое
сопротивление плюс анодную или катодную поляри-
зацию.
Следовательно, необходимо' измерить падение по-
тенциала в трех отделениях при определенной силе
и плотности тока и вычесть показания, полученные в среднем отде-
лении, из показаний, полученных ® анодном отделении, чтобы полу-
чить величину анодной поляризации, и из показаний, полученных
в катодном отделении, чтобы получить величину катодной поляриза-
ции для данной плотности тока. Такие измерения можно точно осу-
ществить при помощи потенциометра, но так как площадь сетчатых
электродов велика, то возможно пользоваться более простым мето-
дом— чувствительным [вольтметром с достаточно высоким сопро-
тивлением.
Для того чтобы доказать пригодность своего аппарата и сравнить
136
степень точности различных методов измерения поляризации и сопро-
тивления, Херинг предпринял соответствующие измерения в серно-
кислом медном электролите, в нейтральном никелевом электролите и
Фиг. 66. Поляризационные кривые, полученные разными методами в
никелевой ванне. Условные обозначения: по каломельному полуэЛе-
меитуД по методу Hering с потенциометром Q; по методу Hering
с вольтметром 4-. 1—раствор D, N NiS04. 0,25 N Н3ВО3, 0,25 N
NH4C1; 2— раствор D -|- 2 N Na3SO4.
цианистом серебряном, причем анодная и катодная поляризация изме-
рялась по каломельному полуэлементу и потенциометру, по сетчатому
электроду и потенциометру и, наконец, по сетчатому электроду и
Фиг. 67. Поляризационные кривые получены раз-
ными методами в кислой медной ванне. Условные
обозначения: по каломельному полуэлемеиту | |; по
методу Hering с потенциометром Q; по методу
Hering с вольтметром-}-. 1 — раствор, А, 1,5 N CuS04,
1,5NH3SO4; 2— раствор А 0,002 г/л клея; 3 — рас-
твор А + 0,02 г/л клея.
137
вольтметру. Сопротивление измерялось по второму и третьему мето-
дам. Вс всех растворах электроды состояли из осаждающегося ме-
талла, только в серебряной ванне сетчатые электроды состояли из ни-
келя, покрытого толстым слоем серебра, в то время как анод и катод
были сглошь из серебра.
В табл. .24 и на кривых фиг. 66 и 67 приведены данные различных
методов измерения.
Таблица 24
Измерение поляризации и сопротивления электролита по Херингу
Температура 21 ± 1°
№ по по- рядку Состав электролита (раствор) Концентрация Сопротивление* (ом — CM3) Поляризация (кривая)
N . г/л по вольт- метру по по- тенцио- метру
1 CuSO4.5H2O . 1.5 188 4,24 4,26 1
Й H2S04 .... 1.5 74
2 Го же 4- клей . 1,5 0,002 4,33 4,34 2
3 То же -|- клей . 1,5 0,02 4,18 4.2J 3
1 NiSO4.7H2O . . 1,0 140
4 J NH4C1 .... 0,25 13 20,1 21,2 1
5 J Н3ВО3 .... 0,25 15
To же 4- Na,S04 2 142 10,1 10,5 2
6 | XgCl. . . . 0,25 36
J NaCN .... 0,75 37 18,0 18,9 1
7 To же 4- NaCN 0,25 12 12,0 19,2 1
8 To же 4- CS2 . — 0,001 13,1 14,3 2
9 To же 4- CS2 . — 0,01 13,4 14,4
В результате проведенных измерений в медном сернокислом рас-
творе было установлено, что сетчатые электроды и потенциометр дают
расхождения порядка+ !•%'. Вольтметр дает несколько преуменьшен-
ные поъазания, и -в растворе, который дает заметную поляризацию
при весьма низких плотностях тока, эти показания могут быть пре-
уменьшены на 5%., но и такая степень точности -вполне приемлема
для практических целей гальванотехники.
Поляризационные кривые, полученные по перечисленным методам,
довольно близко совпали: колебания не превышали 10 милливольт,
что является вполне приемлемым. Ввиду простоты этого прибора’ и ме-
тодов измерения с его помощью сопротивления и поляризации можно
его рекомендовать для определения концентрации коллоидов в элек-
тролите, так как непосредственные аналитические методы сложны
и; дороги. На фиг. 67 видно, какое сильное влияние оказывают даже
низкие концентрации клея в медном электролите на ход поляриза-
ционной кривой; изменение этой концентрации от 0.002 до 0,02 г!л
увеличивает катодную поляризацию примерно на сто милливольт
(при плотности тока в з А/дли2).
1 Результаты представляют средние значения, полученные для различных
плотностей тока при измерении лоляризации.
138
ГЛАВА ЧЕТВЕРТАЯ
ЦИНКОВАНИЕ
Цинкование — один из наиболее распространенных и старых видов
металлических покрытий. Первые опыты покрытия металла цинком
были произведены французским химиком Мелуэном (Melouin) в 1741 г.
Мелуэн получил цинковое покрытие на железных листах путем по-
гружения их в расплаЕ'леппую массу цинка. Позднее, в 1836 г., во
Франции был выдан патент на процесс покрытия цинком горячим
способом Сорелю (Sorel). Описанный им процесс по существу мало
отличался от современного горячего метода покрытия цинком.
В 1837 г. на такой же (почти метод покрытия металлов цинком был
выдан патент английскому изобретателю Н. В. Кроуфорду (Crawford).
Оба эти патента послужили началом промышленного применения и
распространения процесса цинкования как в Европе, так и в Америке.
Цинковые покрытия имеют большое значение в области защиты метал-
лов от коррозии и с большим успехом применяются для защиты изде-
лий из черного металла (железо, сталь и чугун). По своим химиче-
ским и, главное, электрохимическим свойствам, как защитный металл,
цинк имеет ’целый ряд преимуществ перед другими металлами, приме-
няемыми в технике защиты железных изделий от ржавления.
1. Свойства цинка
Цинк — сравнительно твердый металл и в холодном состоянии
хрупкий. Поэтому он прокатывается при loo—150°', когда он дела-
ется более мягким и достаточно пластичным. При температуре выше
25Ои цинк опять делается хрупким и настолько, что может быть
измельчен в порошок. Прокатанный торговый цинк имеет сопротив-
ление разрыву около 16 кг/мм1 2 при удлинении свыше 50%>. Удель-
ное сопротивление цинка 0,06 2 .
В сухом воздухе цинк почти не изменяется. Во влажном воздухе
и в воде, насыщенной углекислотой или кислородом, он покры-
вается пленкой, состоящей главным образом из основного углекислого
цинка. Эта пленка (защищает металл от дальнейшего разрушения.
Основным недостатком цинка как защитного металла является
его сравнительно легкая растворимость в кислотах и щелочах. Рас-
творение цинка в кислотах происходит значительно быстрее, когда в
нем присутствуют посторонние примеси. При растворении в щелочах
он образует цинкаты по реакции Zn + 2K0H='Zii(0K)2 + Нг. Цинк
также реагирует с сероводородом и сернистыми соединениями, обра-
зуя сернистый цинк.
139
Как известно, одним из основных условий антикоррозийное™ за-
щитного металла является его положение в ряде напряжений; в слу-
чае пористости слоя защитного металла на обнаженных участках при
наличии влаги образуется гальваническая пара: основной металл —
влага — защитный металл. Растворимым электродом в каждом таком
гальваническом элементе служит всегда металл, обладающий более
электроотрицательным потенциалом.
В паре железо — цинк последний является более электроотрица-
тельным металлом, представляя собой, таким образом, надежную за-
щиту железа от коррозии *.
Таблица 25
Материал Продолжительность службы в годах при атмосферных условиях
сельская местность морской берег слабо инду- стриальный район индустр. район
Цинковые торговые листы или полосы толщиной 0,5 мм 50—75 50 20—30 10-15
Оцинкованные железные листы. Вес цинкового отло- жения 375 г/м1 2 (толщина по- крытия 0,053 мм) 30—35 20—25 15—20 8—10
То же. Вес цинкового отло- жения 300 г)м* (толщина по- крытия 0,043 мм) 20—25 15 10—15 6—8
То же. Вес цинкового отло- жения 180 г/м* (толщина по- крытия 0.025 мм) 8—40 5-8 5 3-5
То же. Вес цинкового отло- жения 60-90 г!м2 (толщина покрытия 0,0085—0,013 мм) . 3-4 2—3 1—2 1
Хуббель и Финкельдей2 приводят интересные данные, характе-
ризующие стойкость или продолжительность службы неокрашенных
оцинкованных (горячим способом) предметов в зависимости от
свойств окружающей среды (различные атмосферные условия) и тол-
щины цинкового слоя (табл. 25).
2. Методы цинкования и их сравнительная характеристика
Покрытие цинком производится различными методами: 1) погруже-
нием предметов в расплавленную массу цинка — так называемый го-
рячий способ Покрытия, 2) методом цементации, 3) шоопированием,
4) электролитическим и 5) контактным способами.
Самым старым, широко применяемым еще до сих пор в промыш-
ленности, является способ горячего цинкования. Этот
способ заключается в простом погружении предметов, предварительно
очищенных от жиров и окислов, в ваппу с расплавленным цинком
на очень короткое время (несколько секунд).
1 Потенциал цинка—0,71 V, потенциал железа—0,43 V.
’Hubbela. Finkeldey, BTrans,*Am. Inst. Chem. Eng.*, 18. 1926.
140
Покрытие горячим способом основано на взаимной спайке метал*-
лов по’ поверхности и представляет собой обычно* оболочку цинка, за-
грязненную примесью основного металла (железо). По Роудону1 вну-
тренний или соединяющий слой покрытия, полученного применением
метода горячего погружения, состоит из большого -количества метал-
лических сложных соединений, — сплавов соединяемых металлов,—
вследствие чего эта часть покрытия имеет более твердое и хрупкое
Строение в сравнении с внешним слоем, состоящим почти исключи-
тельно из чистого цинка (фиг. 68)2. Относительная толщина соединяю-
щего внутреннего слоя при горячем цинковании бывает значительной,
в некоторых случаях она составляет большую часть покрытия. Вслед-
ствие загрязнений цинка антикоррозийность горячего покрытия в боль-
шинстве случаев уступает электролитиче-
скому покрытию одинаковой толщины.
Толщина всего слоя горячего покрытия
колеблется в очень больших пределах,
.точная регулировка ее в данном случае
невозможна. Она зависит от продолжи-
тельности пребывания изделий в ванне,
температуры, формы и характера обра-
ботки изделий. Комитет американского
цинкового института3 рекомендует вес
цинкового отложения для листов в
зоо г!м2 с каждой стороны, что соответ-
ствует толщине слоя 0,0428 мм.
В большинстве случаев толщина по-
крытия на поверхности одного и того же
изделия бывает очень неравномерной.
Так, например, при цинковании листов
из жести на разных участках поверхно-
сти толщина слоя может изменяться от
0,07 до 0,13 jmjh. Неравномерность покры-
тия предметов неправильной формы,
имеющих глубокие рельефы, неизбежна,
и разница в толщине слоя на различных участках поверхности очень
часто бывает значительно большей, нежели на плоских ровных изде-
лиях. Вследствие этого расход цинка на покрытие таких изделий' во
многих случаях бывает весьма большим. Расход металла при
горячем цинковании увеличивается кроме того за счет его потерь
на угар и взаимодействие со стенками ванны (отходы). Вследствие не-
равномерности покрытия образование утолщений и наплывов на от-
дельных частях поверхности, горячая оцинко’вка изделий с узкими от-
верстиями (сетка), резьбовых и некоторых других изделий совершенно
невозможна. Не применим также горячий способ цинкования для из-
делий, легко изменяющих свои механические свойства под влиянием
высокой температуры, например для стальных изделий. С другой сто-
Фиг._ 68. Схема структурного
строения цинкового покрытия,
полученного горячим методом.
1 — основной металл; 2— же-
лезоцинковый сплав, богатый
железом; 3 — железоцинковый
сплав, более бедный железом;
4—цинк.
1 Р о у д о н Г., Предохранительное покрытие металлами, перевод с англ.,
Цветметиздат, 1932.
2 Bablik, Grundlagen des Verzinkens, 1930.
* .Bull. Am. Zinc. Inst.“, 5, 12, 1925.
141
роны, для таких изделий, как ведра, тазы, различная сшивная посуда
и т. п., имеющих внутренние закатанные швы, горячий способ покры-
тия является .пока наиболее целесообразным. В этом случае расплав-
ленный цинк, заполняя отверстия и каналы швов, выполняет роль
спайки, обусловливая герметичность посуды. Промышленное развитие
горячий способ цинкования получил главным образом при оцинков-
ке указанной посуды, листов, проволоки, труб и скобяного товара.
Покрытие цинком методом цементации носит название процесса
шерардизации по имени изобретателя Шерард Каупер-Кольса
(Англця). Процесс шерардизации заключается в том, что изделия,
очищенные предварительно от жира, масла и окислов, приводятся в
соприкосновение по всей поверхности с мельчайшими частицами метал-
лической цинковой пыли и нагреваются в течение некоторого времени,
от получаса до нескольких часов, при 230—400°, иногда и выше, в за-
висимости от сорта изделий и характера применяемой пыли. При этом
на поверхности изделий, так же как и при способе покрытия погруже-
нием. ® расплавленную массу цинка, образуется тонкая пленка спла-
вов обоих металлов в различных соотношениях.
Этот способ цинкования применяется главным образом для покры-
тия мелких изделий и производится в (большинстве случаев во вра-
щающихся железных барабанах с хорошо притертой крышкой, защи-
щающей содержимое их от доступа воздуха. Качество покрытия, полу-
ченного методом шерардизации, зависит от целого ряда условий.
В отношении толщины цинкового слоя при шерардизации Роудон 1
указывает, что «для повсеместной службы рекомендуется как вполне
достаточное покрытие толщиной в б,062 мм. Такое покрытие полу-
чается приблизительно после 3 час. нагревания при 375° в пыли с
высоким; содержанием металлического цинка».
Процесс шерардизации не имеет столь широкого распространения в
промышленности, как способ горячего покрытия погружением. Круг
объектов покрытия этим способом ограничен. Выполненный правильно
процесс шерардизации дает достаточно' удовлетворительное по виду по-
крытие, но вследствие загрязнения цинка, неравномерности и пористо-
сти слоя антикоррозийность его следует считать более низкой, нежели
гальванического покрытия.
Пористость, характерный трещиноватый вид осадков (фиг. 69)
делает их менее стойкими даже Против покрытий, полученных путем
погружения to расплавленную массу металла. При известных откло-
нениях от нормального режима работы (слишком повышенная тем-
пература и повышенное содержание примесей в цинковой пыли) на
поверхности предметов, покрытых путем шерардизации, сравнительно
быстро появляется ржавчина.
Покрытие цинком путем шоопирования (методом
пульверизация) или методом распыления ме-
талла — процесс Сравнительно новый, получивший некоторую из-
вестность и применение в промышленности только за последние годы.
Этот способ заключается в том, что тонкая струя расплавленного ме-
талла, в данном случае цинка, распыляется на поверхность изделий
1 Р о у д о и Г., Предохранительное покрытие металлами, перевод с аигл.,
Цветметиздат, 1932.
142
ПОД Действием сйЛьйой струи сжатого воздуха. Обычно для распыле-
ния употребляют цинк в виде проволоки малого диаметра (1—1,5 мм),
которая продвигается сквозь насадку аппарата, состоящую из двух
концентрически расположенных трубок, и нагревается горящей га-
зовой смесью, например смесью ацетилена и кислорода. Роуден
указывает, что «согласно Касперовичу, для распыления цинка доста-
точна температура пламени светильного газа с воздухом». Осо-
бенность этого способа состоит в том, что он дает возможность покры-
вать изделия из любого материала, так как частицы распыляемого ме-
талла осаждаются на поверхность предметов в достаточной степени
охлажденными. В отличие от горячих способов покрытия погружением
и шерардизацией шоопирование не дает сплава, покрывающего метал-
ла— цинка с поверхностью основного металла — изделия. Структура
Фиг. 69. Схематическое строе-
ние цинкового покрытия, по-
лученного методом шерардиза-
ции. 1—основной металл —же-
лезо; 3— диффузионный слой,
богатый железом;Зи 4—железо-
цинковый сплав с постепенно
убывающим содержанием же-
леза вплоть до чистого цинка.
Фиг. 70. Схематическое строе-
ние цинкового покрытия, полу-
ченного методом распыления.
покрытия представляет собой вид
отдельных пластинчатых наслое-
ний, связанных с основной поверх-
ностью силой сцепления (фиг. 70).
Для лучшего сцепления цинкового слоя с поверхностью основного
металла рекомендуется применять предварительную обработку изде-
лий на пескоструйном аппарате. Хорошее влияние оказывает в этом
отношении предварительный нагрев покрываемой поверхности, осо-
бенно) рекомендуемый в случае толстых покрытий. Главное преиму-
щество способа шоопирования перед всеми другими заключается в
том, чрпо он допускает возможность покрытия цинком таких изделий,
которые нельзя цинковать другими методами, например крупные
сооружения различной формы и изделия неметаллические. В случае
оцинковки отдельных частей металлических сооружений после их
сборки (места клепки, сварки и пр.), а также в случае местных по-
вреждений ранее нанесенного покрытия имеется полная возможность
с помощью подвижного негромоздкого аппарата — пульверизатора —
производить частичное или ремонтное покрытие без разборки соору-
жения. В Германии и Франции при помощи шоопирования покры-
143
вают цинком мачты для электротехнических проводов, корпуса су-
дов, мосты и пр. Мелкие изделия можно- пюопировать во вращающем-
ся барабане, соединенном с аппаратом для распыления.
К достоинствам метода цинкования путем шоопирования следует
отнести также возможность регулирования количества цинка, наноси-
мого на поверхность изделий. Толщина покрытий зависит от продол-
жительности обработки, с учетом, в отдельных случаях, потерь ме-
талла от разбрызгивания. Для предохранения от коррозии рекоменду-
ется толщина покрытия в о,05 мм.
Вместе с этим покрытие цинком методом шоопирования имеет
крупные недостатки. Оно получается недостаточно плотным, хрупким
и пористым Ч Кроме того расход цинка вследствие потерь от разбрыз-
гивания бывает иногда очень большим, в некоторых случаях он дохо-
дит до 50% (Э. Маас)1 2.
Наиболее рациональным и совершенным методом покрытия метал-
лов цинком, получившим в последнее время широкое развитие в про-
мышленности (у нас и за границей), является метод электро-
литический.
Электролитическое осаждение цинка из растворов его солей, не-
смотря на сильно электроотрицателънй потенциал, этого металла, до-
стигается благодаря тому, что водород имеет на цинке большое пере-
напряжение и, таким образом, при обычных нормальных рецептурных
условиях электролиза почти не выделяется на катоде. В отличие от
горячего- покрытия при электролитическом цинковании железа не об-
разуется сплава между обоими металлами. Поэтому слой электроли-
тического цинкового покрытия отличается своей чистотой и не содер-
жит ни в каком виде примеси основного металла. Загрязнения этого
слоя другими металлами очень незначительными могут совсем отсут-
ствовать. Шварц3 указывает, что электролитически осажденный слой
цинка обычно- содержит 99,85—99,9%- Zn, и небольшие следы Си, РЬ,
Fe и некоторых других примесей, в зависимости от состава ванны и за-
грязнения исходных материалов. Растворимость в кислотах чистого
электролитического цинка меньше, чем загрязненного примесями же-
леза 4.
Исследования И. Сетгона, а также Н. Баблика5 6 над растворимо-
стью цинковых осадков весом в 1 г.!см2 (показали, что цинковые по-
крытия, полученные методом погружения в расплавленную массу,
растворяются в 1209 мин., методом шерардизации — в 2230 мин., ме-
тодом шоопирования — в 2641 мин. и гальваническим методом — в
2686 мин. Полученное при нормальных условиях электролитическое
цинковое покрытие не обладает той хрупкостью, которая отмечена
выше для других способов,- и обладает значительно большей эластич-
ностью и вместе с тем достаточно хорошей сцепляемостью с основным
металлом.
По данным испытаний Бургесса® сила сцепления гальванических
1 Н о р t е 1 d t, „Chem. Ztg.*, 5, 1923.
’Маас Э., Коррозия и защита железа, пер. с иемецк., Москва, 1903.
• Schwartz, „Electrochem. Soc.", 29, 1923.
4 Бай маков Ю. В., Электролитическое осаждение металлов, 1925.
5 Pfanhauser, Die Elektrolitischen Mettallniederschlage, 1928.
6 Burgess, .Electrochem. Met. Ind.“, 3, 17, 1905.
144
осадков цинка почти в два, раза, больше относительно покрытий, полу-
ченных горячим способом (погружением"). Пфангаузер 1 указывает, что
сила сцепления для горячего цинкового покрытия 16,8 кг/см2 против
33,6 кг/см2 для электролитического цинкового покрытия. Аптикорро-
зийпость электролитического цинкового покрытия по данным опытов
Ланге2 и ряда других исследователей более высокая, чем покрытия,
полученного другими методами при одинаковой толщине слоя.
Электролитический метод допускает возможность точно регулиро-
вать количество отлагаемого цинка и получать осадки на изделиях,
главным образом плоских и нерельефных, достаточно равномерными.
В связи с этим расход цинка на покрытие здесь значительно меньше,
нежели при других способах покрытия. Потери цинка, неизбежные
при горячем способе, <в данном случае очень незначительны. Эконо-
мия металла при электролитическом методе против горячего доходит
до 50i%, а в отдельных случаях бывает много больше.
Толщина покрытия, необходимая при электролитическом цинкова-
нии для защиты изделий от коррозии, зависит от материала и харак-
тера обработки покрываемых изделий, назначения, условий службы и
хранения изделий и колеблется в пределах от 6,005 до 6,05 мм.
Для защиты железных, сравнительно гладких и непористых изделий,
находящихся в условиях взаимодействия с обычной атмосферой влаж-
ного воздуха, можно считать вполне достаточной толщину цинкового
покрытия около 0,02 мм. По Вернику 3 минимальная толщина цинко-
вого покрытия на изделиях, подвергающихся действию наружной ат-
мосферы воздуха, должна быть в о,0125 мм.
При правильном ведении процесса электролитическое цинкование
не оказывает влияния на механические свойства изделий и поэтому
вполне допускает покрытие стальных изделий, невозможное при го-
рячем способе. Возникающая иногда небольшая хрупкость металла
вследствие включений водорода во время электролиза обычно исче-
зает после непродолжительного нагревания предмета при 105—110° 4.
Содержание водорода, по исследованиям Шварца5. в свежеосаждчь
иом слое цинка, доходит до 0,055%.
3. Электролитическое цинкование
В зависимости от условий процесса электролитического цинкова-
ния осадки цинка могут иметь различную форму: 1) нормальный свет-
лый осадок мелкозернистой структуры. 2") неплотный, пористый круп-
нокристаллический осадок, малонадежный для защиты железа от
ржавления, з) неровный, бугристый, не закрывающий иногда всю по-
верхность изделий' вследствие неправильного распределения силовых
линий или плохой подготовки поверхности изделий, 4") рыхлый, губ-
чатый осадок. Основными условиями, необходимыми для получения
вполне нормального беспористого и плотно пристающего электроли-
тического осадка помимо чистоты покрываемой поверхности изделий
1 Pfanhauser. Die Elektrolitischen Metallniederschlage, 1928.
2 Lange. „Zeitschr f Mettallkunde", 13. 1921.
3 Wernik, Zeitschr. f. Elektrochem ". 11,1931.
4 Роудои, Предохранительное покрытие металлов, Цветметиздат, 1932.
5 Schwartz, „Electrochem. Soc.“, 29, 1923.
10 Оечовы гальваностегли 1783
145
являются: 1) правильно подобранный состав электролита и правильно
установленный режим работы (плотность тока, температура, переме-
шивание и пр.) и 2) чистота анодов и всех материалов, входящих в
состав электролитической ванны.
Электролиты для цинкования делятся по характеру среды на две
основные группы: кислые и щелочные — цианистые или просто ще-
лочные. Процессы, протекающие при электролизе цинка как на аноде,
так и на катоде, по своему характеру сравнительно несложны.
Во всех электролитах цинк находится в виде двухвалентных ионов.
В слабокислых электролитах цинк выделяется на катоде путем раз-
ряда простого двухвалентного катиона: Zn" -f- 2 0 = Zn.
Высокое перенапряжение водорода на цинке затрудняет его выде-
ление на катоде, обусловливая тем самым высокий выход металла по
току.
Анодный процесс растворения цинка в слабокислом электролите
протекает без всяких затруднений и почти совершенно не сопровож-
дается выделением кислорода. Цинк переходит при этом в раствор
в виде двухвалентных ионов по схеме:
Zn — Zn" — 2 0.
Применяемые для кислых ванн цинковые соли очень хорошо рас-
творимы в воде. Величина катодной поляризации в обычном слабокис-
лом электролите незначительна. Поэтому при условии полного устра-
нения концентрационной поляризации в хорошо. подобранном по со-
ставу. кислом электролите, казалось, можно было бы достигать такого
идеального положения, когда анодное растворение и катодное выделе-
ние цинка будут происходить при одинаковых почти теоретических
выходах тока, т. е. без затраты тока на разряжение и выделение, на
катоде водорода и на аноде кислорода. Очевидно, состав электролита
во вр<Агя электролиза не должен был бы при этом изменяться, оста--
ваясь все время постоянным. Однако в практике в таком идеальном
Виде ход процесса при электролитическом цинковании наблюдается
редко. Вследствие загрязнений электролита различными примесями,
неравномерного распределения тока по поверхности катода и прочих
неблагоприятных моментов, неизбежных в производстве, даже при не-
значительном содержании свободной кислоты добиться полного устра-
нения выделения на катоде водорода почти невозможно. Поэтому в
производственных условиях обычно всегда имеет место немного пони-
женный, против теоретического, катодный выход металла по току.
Исключение иногда представляет электролиз цинка с сильным переме-
шиванием (лучше воздушным), снижающим поляризацию до миниму-
ма. В то же время на аноде благодаря присутствию-в растворе хотя бы
небольшого количества свободной кислоты наряду с электролитиче-
ским процессом перехода металла в ионное состояние происходит так-
же и химическое растворение цинка. Это вызывает, следовательно, из-
лишний расход цинка, понижение концентрации свободной кислоты в
растворе и ненужное повышение концентрации цинковой соли. По-
следний момент, впрочем, не является опасным для процесса цинко-
вания. Чаще наблюдаются случаи, когда при наличии указанных по-
бочных процессов на катоде и па аноде (частичное выделение водоро-
да На катоде и химическое растворение цинка на аноде) концентра-
146
ция сернокислого цинка даже понижается или, в лучшем случае, ос-
тается постоянной. Это происходит вследствие того, что при выгрузке
изделий часть электролита, иногда очень небольшая (зависит от фор-
мы и поверхности изделий), уносится из ванны и возмещается с целью
пополнения объема электролита до первоначального уровня одной
только водой.
В щелочных и, главным образом, цианистых ваннах указанные ос-
ложнения катодного и анодного процессов проявляются в более резкой
форме. В цианистых ваннах цинк находится в растворе, главным об-
разом, в виде комплексной соли Na2Zn(CN)4 или K2Zn(CN)4. Кроме
того, при приготовлении цианистой цинковой ванны в растворе обра-
зуется в том или ином количестве также натриевый или калиевый
цинкат Na2ZnO2 или K,ZnO„.
Комплексный цианистый анион, содержащий цинк, диссоциирован
в растворе в очень слабой степени. В отличие от растворов сернокис-
лых или хлористых солей цинка выделение его на катоде в растворе
комплексной цианистой соли происходит в результате разряда Zn”
образующегося при диссоциации комплексного аниона по следующей
схеме:
Na2Zn(CN)4 2Na’ 4. Zn(CN)"4,
zn(CN)"4:?=Zn”+4CN',
Zn” 2G = Zn.
Вследствие этого потенциал цинка и катодная поляризация в циани-
стых цинковых ваннах значительно выше, нежели в кислых. По дан-
ным Ферстера и Коффети1 и Шпицера2 катодный потенциал (di) цин-
ка в 1 N растворе ZnS04 = — 0,795 V, в то время как в цианистом рас-
творе. состоящем из 0,1 моля K,Zn(CN)4 и 1 г-экв KCN, катодный
потенциал равен — 1,033 V. Катодный потенциал при выделении цинка
по данным тех же авторов в случае электролиза 1 А раствора ZnS04
при плотности тока 0.003 Х'см2 составляет-- 0.838 V, в случае элек-
тролиза указанного цианистого раствора при той же плотности тока
катодный потенциал выражается величиной — 1,25 V. Таким образом
при плотности тока 0,003 АФ.н2 катодная поляризация в нормальном
растворе ZnS04 составляет лишь 43 милливольта, тогда как в циани-
стом растворе (0.1 моля K2ZnCN„ в 1 N KCN) она возрастает до
217 милливольт. На фиг. 71 показаны приведенные Пабликом3 кривые
изменения (катодного потенциала в зависимости от плотности тока
при выделении цинка из кислых и цианистых растворов. Как видно
из диаграммы, катодный потенциал в пиапистых цинковых ваннах
увеличивается с повышением плотности тока в более значительной
степени, нежели в кислей ванне.
Низкая концентрация ионов цинка, сравнительно высокая катодная
поляризация ,в цианистом электролите, — все это обусловливает более
’ Foerester u. Coffeti, „Perichte der Deutsch. Chcm. Ges.*, 3®, 2934, 1CO5.
2 Spitzer. „Zeitschr. f. ElektrochenHe*, 11, 345, 1905.
3 Bablik, Grundlagen des Verzinkens, 1930.
147
значительное развитие побочного процесса — выделение водорода на
катоде, — нежели это наблюдается при цинковании в слабокислой
ванне достаточно удовлетворительного состава. В связи с этим выход
металла по току в таких ваннах очень не постоянен. Он сильно изме-
няется, быстро уменьшаясь, при повышении плотности тока.
Практически плотности тока в цианистых цинковых ваннах приме-
няют не выше одного, реже двух К!дмг, ® то время как цинкование в
слабокислых вайнах возможно при плотностях тока 2—5 А/д.м2ивыше.
В некоторых случаях, например, при цинковании проволоки в кон-
центрированных растворах сернокислого цинка при условии воздуш-
ного перемешивания удается получать хорошие результаты даже при
плотностях тока 5<)—400 А/дл2. Применение воздушного перемешива-
ния в цианистых ваннах не
Фиг. 71. Поляризационные кривые ,при осаж-
дении цинк!.
рекомендуется, так как это
вызывает разложение имею-
щихся в растворе цианидов.
Повышение плотности то-
ка в цианистых ваннах вы-
зывает осложнение также и
в анодном процессе. Анод-
ная поляризация с повыше-
нием плотности тока в циа-
нистых ваннах, так ясе как
и катодная, увеличивается в
большей степени, нежели
в слабокислых растворах.
С течением времени при
электролизе с повышенной
анодной плотностью тока на поверхности цинка в цианистых ваннах
наблюдается образование пассивных пленок, обусловливающих силь-
ное повышение анодного потенциала. Это обстоятельство, в свою оче-
редь, вызывает обильное выделение кислорода и сильное снижение
анодного выхода металла по току.
Пассивирование анодов особенно сильно проявляется при недо-
статке свободных цианидов и щелочи. Так как растворимость цинка
в цианистых ваннах при этих условиях сравнительно тоже небольшая,
то, следовательно, в электролите будет происходить понижение кон-
центрации цинковой соли. Высокая (анодная) плотность тока в циа-
нистой ванне вызывает также уменьшение концентрации цианидов
вследствие окисления их выделяющимся на аноде кислородом. Кроме
того, псе цианистые цинковые ванны довольно быстро изменяются по
своему составу также и независимо от условий электролиза. Под дей-
ствием углекислоты воздуха цианистый натрий или калий разлага-
ются, переходя постепенно в углекислые соли. Вследствие этого кон-
центрация цианидов в ванне, а вместе с ними иногда и содержание
цинковой соли (при общем недостатке цианидов в ванне) сильно па-
дает, вызывая еще в большей степени указанные осложнения в катод-
ном и анодном процессах. Поглощаемая цианистым электролитом уг-
лекислота из воздуха понижает, кроме того, и концентрацию свободной
едкой щелочи (NaOH или КОН), переведя ее тоже в углекислые соли.
К числу недостатков цианистых ванн следует отнести также их ядо-
148
витость. В результате гидролиза и действия углекислоты воздуха сво-
бодные цианистые соли (KCN или NaCN) освобождают синильную
кислоту, обладающую, как известно, очень сильным токсическим дей-
ствием.
Щелочные ванны без цианистых, солей не ядовиты, но они помимо
карбонизации обладают еще и другими недостатками: более ограни-
ченный предел повышения .плотности тока, необходимость применения
высокой температуры раствора (60—80°)1 и худшая рассеивающая
способность по сравнению с цианистыми ваннами.
Относительно рассеивающей способности цианистых цинковых
ванн следует отметить, что они дают в этом отношении лучшие ре-
зультаты, чем какие-либо другие. Это обясняется как раз тем,' что
катодная поляризация в цианистых ваннах значительно выше, не-
жели в ваннах слабокислых и просто щелочных. Вследствие этого,
и осадки, получаемые из цианистых ванн, помимо равномерности
отличаются большей плотностью, мелкозернистостью и устойчивостью
против коррозии, нежели отложения из обычных кислых электролитов.
На фиг. 72 .показана структура осадков, полученных из сернокислой
и цианистой ванн2. Как видно из рисунков, структура цинкового
покрытия, полученного из цианистой ванны, значительно мельче, не-
жели из кислой. Впрочем, мелкозернистую структуру осадков, свой-
ственную осадкам из цианистых ванн, можно получить также, и при
электролизе сернокислых растворов, если к ним добавить специаль-
ные вещества, обладающие определенными свойствами: коллоиды или
поверхностно активные вещества (фиг. 73).
В табл. 26 приведены интересные данные Вернлунда 3 относитель-
но устойчивости против коррозии цинковых покрытий, полученных из
кислых и цианистых ванн. Покрытия, из цианистых ванн получены
как при электролизе с простыми цинковыми анодами, так и с анода-
ми, состоящими из сплава Zn и Hg (Hg до 2%).
Таблица 26
Условия покрытия Относительное сопротивление, коррозии
в брызгах раствора NaCl атмосферное воз- действие
стальные листы прово- лока авто- части прово- лока авто- части
Цианистая ванна; Zn + Hg аноды •— 100 100 100 100 100
Цианистая ванна; обыкновенного цинка . аноды из 80 84 85 79 81
Сернокислая ванна 36 37 21,5 39 8
Как видно из таблицы, антикоррозийность покрытий, полученных
из цианистых ванн, выше, нежели из кислых, причем иаилучшие ре-
зультаты получаются при цинковании с цинк-ртутными анодами. Та-
кие же примерно результаты были получены при испытании цинковых
1 При низкой температуре осадки получаются плохими: менее равномерными
и более темными.
2 Кудрявцев Н. Т., Державина Ю. Л. и Чамп на И. И., „Исследова-
ние рассеивающей способности цинковых и кадмиевых электролитов'' — работа
электрохимической лаборатории ВЭИ, 1934.
3 Wernlund „Am. Electrochem. Soc.“, 45, 273, 19_’4.
?49
покрытий на ускоренную коррозию методом многократного погруя?е-
ния оцинкованных изделий в раствор хлористого аммония (табл. 27) Ч
а Ь
Фиг. 72. Структура цинковых осадков, полученных из сернокислых и цианистых
ванн. У в. 250.
а —осадок из сернокислого электролита: 1,5 N ZnSO4-|-O,2N AL(S04),; Ph=3,8:
Z4-= 2,7 A/fiUt1 2, £ = 20е;'* —осадок из цианистого электролита: 1 N Zn (CN)2-|-1 N
NaCN 4-0,8 N XaOH; DK= 1 XjdM-; t = 20° (Кудрявцев H. T.).
Фиг. 73. Структура цинкового покрытия, получен-
ного из сернокислого электролита с добавкой дек-
стрина. Состав электролита: 1,5 N ZnS04 4- 0,25 N
A12(SO4)3 4- 0,3 N Na,S044-10 г/л декстрина;
Ph = 3,8; £ = 20°; Пк=2,5 Х/дм?. Ув. 250 (Куд-
рявцев Н. Т.).
Таблица 27
Ванна для покрытия Вес покрытия мг/дм2 Число погружений до появления ржавления
углубле- ния детали с вы- ступающи- ми углами плоские по- верхности
Цианистая 155 21 97 195
Цианистая 620 168 345 632
Сернокислая 775 10 27 559
1 Farnsworth F. a Hooker С, ,Trans, Am. Electrochem. Soc.“. у. 45,
p. 281 (1924),
150
А. Кислые ванны
Цинковые соли. Достаточно удовлетворительные результаты
по цинкованию можно получать из очень простых кислых ванн, со-
держащих только сернокислый или хлористый цинк и небольшое ко-
личество серной кислоты. Однако, ® практике для улучшения качества
покрытия обычно' вводят в такой раствор различные соли других ме-
таллов (не выделяющихся па катоде), слабодиссоциированные кисло-
ты, коллоиды, капиллярно-активные и другие вещества, оказывающие
то или иное влияние па качество осадка.
Из солей цинка наиболее употребительной для кислых ванн слу-
жит сернокислый цинк. Растворимость сернокислого цинка в воде
очень высокая. При комнатной температуре (около 25°) можно полу-
чить растворы, содержащие ZnS04 свыше 4,5 г-экв (предельное содер-
жание ZnSO4 в 100 г раствора' при 25° составляет 36,6 г)1. Очень
концентрированные, насыщенные сернокислым цинком, растворы в
практике применяются редко. Они необходимы только в специальных
случаях, например для цинкования определенного вида изделий
при очень высоких плотностях тока Применение очень слабых раство-
ров сернокислого цинка также не рекомендуется, так как при обычных
уже плотностях тока (1—2 А/д.м2) опи дают плохие осадки. Это объяс-
няется тем, что при недостатке цинковой соли катодное пространство
быстро обедняется металлическими ионами (Zn"), что вызывает по-
вышение катодного потенциала и выделение водорода. Естественная
диффузия при данных условиях недостаточна для возмещения убыли
ионов у катода, и ib результате осадок цинка получается неровным,
неплотным и пористым, постепенно образуя бугры или дендритные
разветвления. Вследствие недостатка свободной кислоты в растворе,
концентрация которой при этих условиях сильно понижается, у ка-
тода могут образоваться кроме того гидраты и основные соли, вызы-
вающие отложения рыхлых губчатых осадков. В практике чаще
• всего пользуются растворами, содержащими ZnS04.7Й20 от 150 до
300 г/л, т. е. приблизительно отН до 2 Л\ Растворы с большей кон-
центрацией сернокислого цинка при обычных средних плотностях
тока дают более грубые по кристаллической структуре осадки.
Хлористый цинк в качестве основного компонента для цинковых
ванн употребляется реже, нежели сернокислый. Недостатком в при-
менении хлористого цинка является,ио-первых, то. что эту соль труд-
ное получить в чистом виде, нежели сернокислый цинк, и, во-вторых,
большое содержание С1' в растворе вызывает сильное разрушение
цинковых анодов, а также коррозию цинковых покрытий при недо-
статочно ровной, пористой поверхности изделий и пористом отложе-
нии цинка, плохо промытом водой.
Добавки в кислый электролит солей других ме-
таллов. Из других солей в качестве добавок к серпокислому цинко-
вому электролиту применяются обычно сернокислые или хлористые
соли щелочных и некоторых щелочноземельных металлов, раствори-
мых в данной среде, например Na,SOt, (NH4),S04, NaCl, NH4C1.
MgSO4, AL(S04)3 и др. Сернокислые и хлористые соли щелочных ме-
1 Chemiker Kalender, s. 329, 1928.
151
таллов Na2S04, (NH4)2SO4, NaCl, NH4C1 вводятся в цинковый электро-
лит, главным образом, для повышения электропроводности раствора,
так как соли сернокислого цинка, как и все сульфаты двухвалентных
металлов (цинка, кадмия, никеля, меди, магния и др.), не отличаются
большой проводимостью.
Применяемые концентрации хороню проводящих солей в цинковом
электролите различны. Они колеблются в очень больших пределах
от 0,25 до 3 .V и выше.
Введения большого количества хлоридов в цинковую ванну обычно
избегают, так как последние, как указано выше, вызывают усиленное,
разрушение цинковых анодов и при известных условиях — коррозию
цинковых покрытий. Серпокислые соли магния и алюминия по элек-
тропроводности мало отличаются от эквивалентного количества серно-
кислого цинка. Поэтому их влияние на повышение проводимости
сернокислого цинкового электролита очень незначительно. По данным
Томпсона1 основное влияние, которое оказывает сернокислый алюми-
.ний в цинковом электролите, заключается в регулировании^кислот-
ности или. как говорят, в его буферном действии. Сернокислый
алюминий может находиться в растворе при условии, если концентра-
ция водородных ионов соответствует значению Ph, не превышаю-
щему 4 или 4,5. При Ph 5Z54—4,5 сернокислый алюминий (при обыч-
ных применяемых концентрациях) выделяется из раствора, превра-
щаясь в белую студенистую массу гидрата окиси алюминия.
Таким образом выделение белой мути в растворе может служить как бы
индикатором па кислотность ванны, именно соответствующую Ph
4—4,5.
Пока в растворе имеется достаточное количество сернокислого алю-
миния, Ph ванны не будет расти выше значения 4,5, .и. следовательно,
кислотность ее будет сохраняться постоянной. Кроме того гидрат
окиси алюминия, находясь в растворе во взвешенном коллоидальном
состоянии, может оказывать действие, вообще подобное влиянию кол-
лоидов. Исследования Фрелиха2 показали, что прибавление 0,75 г-экв
сернокислого алюминия к 1.5 .V раствору сернокислого цинка дает
эффект на катоде, сходный с действием в том же цинковом растворе
другого коллоида — желатины. По мнению автора, это объясняется
выделением при .высоком значении Ph катодной пленки.^ гидрата
окиси алюминия, находящегося, вероятно, тоже в коллоидальном со-
стоянии. Фрелих показал также, что присутствие в растворе серно-
кислого алюминия увеличивает катодную и анодную поляризацию.
Повидимому, улучшение качества осадка, обычно наблюдаемое при
цинковании в электролите с добавками сернокислого. алюминия
(блеск), объясняется именно тем, что последний в катодном слое ве-
дет себя как коллоид, вызывая повышение катодной поляризации и
улучшение качества осадка.
Следует отметить, что все указанные соли-добавки, прибавленное
к раствору сернокислого или хлористого цинка, в большей или мень-
шей мере тоже увеличивают катодную поляризацию. Фрелих приводит
следующие данные величин катодного и анодного потенциалов в рас-
1 Tompson М. R., „Trans. Am. Electrochem. Soc.“, 50, 1026.
2 F roll ch, „Trans. Am. Electrochem. Soc.“. 49, 1926.
152
ТЕ-орах сернокислого и хлористого цинка в зависимости от добавок
других солей (табл. 28). Измерение проводилось при плотности тока
2,5 К!дм1 2 и температуре 25°.
Т а б л и и а 28
Электролит Потенц. равновесия Потенц. катода Потенц. анода Катодн. выход по току % Анодн. выход по току %
ZnS04— 1,5/V ZnSO4—l,5Ni-AI2(S04)s— —0,789 —0,812 —0,763 99,1 100,4
—0.75 N ZnS04— 1,5 7V4-NII4C1- —0,783 —0,821 -0.74 — —
—0,75 N —0,787 —0,827 —0,758 99,5 103,0
ZnCL — 1,5 N ZnCl.,— 1.5 7V+NH4C1— —0,785 — 0,798 — 0,763 100,0 100,7
—0,75 N — 0,785 - 0,809 -0,764 — —
Как видно из таблицы, катодная поляризация в растворах хлори-
стого цинка меньше, нежели
влияние добавленных солей в
первом случае более слабое,
чем во втором. Еще более сла-
бое. влияние эти соли оказы-
вают в хлористом электролите
на анодную поляризацию.
Мюллер и Бархман 1 пока-
зали, что при электролизе кис-
лых цинковых растворов сте-
пень изменения величин ка-
тодной и анодной поляризации
определяется анионом других
солей, входящих в состав элек-
тролита. Авторы проводили
исследования в 1 N растворе
ZnS04, подкисленном серной
кислотой до 0,1 Л’ в присут-
ствии добавок СГ, Вт' S04" и
СЮ/2. Полученные ими поля-
ризационные кривые (фиг. 74)
показывают, что эти анионы
в сернокислом электролите, причем
ПО степени влияния на новы- Фиг. 74. Влияние анионов на поляризацию
шение как катодной, так и цинка.
анодной поляризации для
цинка располагаются в следующем последовательном порядке: Вт',
СГ, SO/' и СЮ/. Авторы объясняют это явление зависимостью между
величиной поляризации и размерами соответствующих анионов.
1 Muller u. Barchmann, „Zeitschr. f. Elektrochemie", В. 39, 6, 1933.
2 110/ вводился в виде перхлората цинка.
153
Кислотность электролитов и ее регулирование.
Кислотность цинкового электролита, как выше указывалось, не
должна быть высокой, так как в противном случае катодный выход по
току и качество осадка, в очень значительной степени будут пони-
жаться. При большом содержании кислоты цинковое покрытие может
быть неплотным крупнокристаллическим и шероховатым с отдель-
ными ветвистыми разрастаниями (дендриты), легко спадающими с по-
верхности катода. Вследствие обильного выделения водорода (сниже-
ние перенапряжения) осадок делается также хрупким, неплотно при-
стающим к поверхности основного металла, ломающимся при изгибе
или ударе. Кроме того поддержание постоянной высокой кислотности
в цинковом электролите представляет большие затруднения. Помимо
понижения концентрации кислоты за счет разряда и выделения во-
дорода на катоде, у анода, как указано выше, она быстро расходуется
на химическое растворение цинка. Обычно для целей покрытия цин
Фиг. 75. Влияние Ph электролита на структуру цинкового покрытия:
а — Ph = 4; Ъ — Ph = 6. Плотность тока 1,7 А./дм-. Толщина слоя
0,033 мм, ув. 500.
ком применяются электролиты, содержащие свободную кислоту в ко-
личестве, не большем o,oi N. Чаще применяется еще более низкая
кислотность, соответствующая концентрации водородных ионов, вы-
раженных значениями Ph = 3—4.5. Совершенно нейтральные цин-
ковые растворы тоже не пригодны, так как вследствие частичного вы-
деления . водорода, в катодном слое будут легко образовываться гид-
раты и основные соли, вызывающие губчатые, рыхлые отложения
цинка. По Томпсону, выделение гидрата окиси цинка наступает при
значении Ph — 6,2
На фиг. 75 показана структура осадков, полученных при Ph = 4 и
6 (Томпсон).
Для поддержания постоянной слабой кислотности в цинковой
ванне рекомендуется вводить в состав электролита вещества, проя-
вляющие при известных значениях Ph раствора буферные свойства.
В качестве буфера для цинковых ванн применяются слабодиссоции-
рованные кислоты, главным образом борная и уксусная. Последняя
создает в растворе большую кислотность, нежели борная, но- она все
же значительно слабее, чем серная кислота. Борная кислота представ-
ляет собой кислоту настолько слабую, что некоторые авторы счи-
тают ее буферное .влияние мало вероятным. Во всяком случае
при таком Ph, как 3,5 и ниже, буфером она служить совершенно
1 Величина Ph определялась колориметрическим методом с бромкрсзолом (пур-
пурового цвета) в качестве индикатора.
154
не может1. Добавляется она в количестве ю—30 г!л. Вместо уксус-
ной кислоты в .электролит вводят обычно уксуснокислый натрий,
который после прибавления небольшого количества серной кислоты
дает эквивалентное количество уксусной кислоты. Обычно применяе-
мая для этой цели концентрация уксуснокислого натрия колеблется
в пределах 15—30 г!л, т. е, от 0,1 до 0,2 Л'1. В качестве буфера, как
'указано выше, может служить также серпокислый алюминий. Буфер-
ное действие его проявляется наиболее эффективно при Ph = 4,5.2
Применяемая для этой цели концентрация сернокислого алюминия
колеблется в пределах 15—30 г/л, т. е. от о,15 до 0,3 N.
Томпсон, исследовавший подробно влияние различных буферов
па изменение кислотности в цинковой ванне, показал, что уксусно-
кислый натрий и серпокислый алюминий являютеА наиболее эффек-
M30.2N HgS04 CM^dlNNaQH
Фиг.76 Буферность цинковых раство-
ров. Кривые нейтрализации для 50см3
2 2VZnSO4:2 — без буфера; 2 — 0,25 2V
Н3В03:3 — 0,25 2V ХН4€1; 4 — 0,25 N
NaC2H3O2; а — 0,25 N Al2(S04)3.
Фиг. 77. Катодная поляризация в цинко-
вых растворах: А— типичный цинковый
электролит с уксуснокислым натром;
В — добавкаXa2SO4 к А; С—повышенное
Ph по сравнению с В; В—цинковый рас-
твор с NaCl и А1С1-;: Е—добавка дек-
строзы к D; F-^добавка декстрина к D;
G —добавка глицерина к В; Д—добавка
g-нафтола к В: 2—добавка лимонно-кис-
лого натрия к 1 2V ZnSO4. К — добавка
.NaCl к А.
тивными буферами. Наряду с указанными выше буферными добавка-
ми автор исследовал также влияние хлористого аммония, обнаружив
очень слабое его действие, подобное борной кислоте.
В качестве иллюстрации на фиг. 76 приведена диаграмма кривых,
показывающих изменение Ph при титровании 50 см3 2 N раствора
ZnSO4 в зависимости от присутствия той или иной буферной добавки
(Томпсон)2.
Добавки коллоидов и к а и и л л я р н о-a к т и в и ы х ве-
ществ. Добавки коллоидов и капиллярно-активных вешеств в элек-
тролитические ванны применяются с целью улучшения структуры и
наружного вида покрытия. Некоторые из этих добавок повышают
также в значительной мере рассеивающую способность электролитов.
Для цинковых электролитов в качестве таких добавок служат гум-
миарабик, декстрин, желатина, клей, лигноль, солодковый корень,
1 Blum a. Hogaboom, Principles of Electroplating and Electroforming, 1930.
2 Tompson M. E-, loc. cit.
.’55
Таблица 29
Ванна С о с 1 а в Ph Плотность тока А/сОР Рассеивающая способность1 %
А ZnS04 NaC'2HsOo 1,0 N 0,25 N 4 0,5 2,0 1 1 о» о
В А 4- Na2S04 2,0 N 4 1 0,5 J 2,0 - 1 4- 2
С В, но Ph = 6 6 1 0,5 J 2,0 + 5 4- 2
D ZnSO4 NaCl AlClg 1,0 N 3,0 N 0,25 N 4 1 0,5 ( 2,0 — 1 +1
Е О 4* декстроза 0,1 мол. 4 1 0,5 1 2,0 4- 1 4- 3
F D -j- декстрин 20 гл 4 1 0,5 J 2,0 0 4- 4
G D 4- глицерин 200 г/л 4 1 0,5 1 2,0 — 1 4- 8
Н D 4- ₽-нафтол од г/л 4 1 0.5 J 2.0 . ф|
I ZnS04 ЫадСвЩО; 1,0 N 1.0 N 5 1 0,5 1 20 — 1 4- 7
J Zn (CN)2 N-ON NaOH 1,0 N 0,5 N 1,3 W — 1 0,5 J 20 4- о 4-20
К A 4- NaCl 3,0 N 4 1 0.5 1 2,0 — 3 4- 1
глюкоза, глицерин, -пиридин, фенол, крезол, сульфокислоты, р-наф-
тол, амилоза и пр. Эти вещества, повышая катодную поляризацию,
уменьшают зернистость осадка, делая его гладким, светлым, иногда
блестящим и более равномерным.
Впрочем, эффект их действия бывает очень различным и непосто-
янным. Некоторые добавки не только не улучшают качество покры-
тия, но оказывают даже отрицательное влияние. Результаты зависят
кроме природы добавки от общего состава применяемого электролита,
Ph, плотности тока, температуры, концентрации добавки, продолжи-
тельности действия и пр.
На фиг. 77 показаны кривые, характеризующие влияние на ка-
тодную поляризацию различных добавок и изменение Ph раствора в
1 Рассеивающая способность определялась методом Херинга и Блюма (см. выще).
156
зависимости от плотности тока (Томпсон) Ч Состав ванн для иллю-
страции к диаграмме приведен в табл. 20.
Как видно из диаграммы (фиг. 77), одни добавки оказывают
большее влияние на катодную поляризацию только при очень низ-
ких плотностях тока, другие, наоборот, только при более высоких
(глицерин). Из этой диаграммы также видно, что изменение (в эле-
ктролите без коллоидов) Ph от 4 до 6 влияет на катодную поляриза-
цию очень) незначительно. Авторы отмечают, что декстроза повышает
рассеивающую способность, сообщая осадку белизну и глянец. Дек-
стрин повышает также катодный потенциал и делает покрытие более
светлым и мелкозернистым. Глицерин, повышающий катодную поля-
ризацию при относительно больших плотностях тока, дает при этих
условиях очень плохие осадки: темные и губчатые. Очень хорошие,
красивые осадки были получены авторами после добавления в серно-
кислую цинковую ванну I г/.ч р -нафтола.
Фиг. 78а. Структура цинкового по-
крытия, полученного в присутствии
клея, ув. 100. (Н. Т. Кудрявцев).
Фиг. 78. Структура цинкового покры-
тия,полученного в присутствии боль-
шого количества декстрина, ув. 250.
Следует отметить, что на качество осадка и изменение катодного
йоггенциала очень часто оказывают влияние также сорт и выработка
взятой добавки. Так как большинство из указанных коллоидных до-
бавок применяется в производстве в виде технического продукта, то,
невидимому, здесь имеют значение их примеси. Иногда технический
продукт, загрязненный родственными ему органическими примесями,
дает лучшие результаты, чем химически чистое вешество (крезол,
декстрин). Исследования Кудрявцева И. Т. показали, что в одном
случае декстрин, добавленный в цинковую ванну, дает положительный
эффект, увеличивая рассеивающую способность электролита и сооб-
щая осадку белый серебристый оттенок, в другом — он не оказывает
почти никакого влияния на катодную поляризацию, делая иногда
осадок темным и некрасивым.
Почти все указанные добавки коллоидального характера ухудшают
1 Т о ш р s о п М R.. 10С. cit.
157
качество осадка, при повышенной температуре электролита. Поэтому в
присутствии коллоидов в ванне рекомендуется цинковать только при
комнатной температуре. Повышенная кислотность (0.01—0,02 N и
выше) электролита, содержащего коллоиды, делает иногда осадки очень
блестящими, ио сильно хрупкими, легко спадающими с поверхности
изделий при ударе или изгибе. Например, очень красивые гладкие, с
ослепительным блеском, имеющим слегка золотистый оттенок, непохо-
жий на цвет металлического цинка, получаются осадки в цинковом
электролите при Ph = 1,5—2.5 и плотности тока 2—3 А/дм2 в присут-
ствии достаточно большого количества декстрина (20—50 г/л). Струк-
тура таких покрытий довольно своеобразна. Очень гладкие, ровные по
оттенку при осмотри невооруженным глазом, под микроскопом при
большом увеличении они обнаруживают как бы сотообразный, ноз-
Фиг. 70. Влияние желатины на
древатый вид поверхности (фиг. 78).
В присутствии добавок желатины
и клея, особенно первой, осадки цин-
ка принимают характерный желтый,
иногда блестящий золотистый отте-
нок. Однако по структуре и окраске
эти осадки, как правило, очень непо-
стоянны и резко меняются в зависи-
мости от различных условий (Ph,
плотность тока, способ приготовления
электролита и т. д.), переходя от глад-
ких и блестящих слоев металла к ше-
потенциал осаждения цинка. роховатым и темным (грязно-серым) с
белыми включениями, Невидимому,
гидратов и основных солей цинка (фиг. 78а). В большинстве случаев
покрытия, полученные в- присутствии желатины или клея, очень
хрупки и имеют поверхность, покрытую мелкими бугорками и изры-
тую небольшими ямками (рытвины) в виде точечных язвин — следы
прилипания пузырьков водорода (pitting).
В отношении рассеивающей способности, как показали исследова-
ния Кудрявцева Н. Т., Державиной Ю. Л. и Петровой В. Н., желатина
и клей дают лучшие результаты, нежели декстрин Б Катодная поля-
ризация в присутствии желатины и клея значительно Рыше, не-
жели в присутствий? декстрина.
Очень большое значение имеет концентрация коллоида в электро-
лите. Некоторые коллоиды дают хорошие результаты только в строго
определенных концентрациях. Изгарышев И. А. и Титов П. С.2, иссле-
дуя влияние коллоидов на электродные процессы, показали, что катод-
ная поляризация в цинковой ванне с повышением концентрации же-
латины и гуммиарабика (последний оказывает влияние в меныпей сте-
пени) сначала резко увеличивается, а затем падает, имея в определен-
1 Работа по рассеивающей способности цинковых и кадмиевых электролитов,
проведенная в ВЭИ, частично опубликована в сборнике „Борьба с коррозией—
борьба за металл*, 1935.
2 Изгарышев II. А. и Титов И. С„ Электродные процессы в присутствии
коллоидов, „Журн. русск. физик.-хим. ббщ.“, 49, 1917.
158
ттг
160
150
140.
wl
ной точке максимум поляризации (фиг. 79 и 80). Автору проходили
исследования в электролите следующего состава: 2N ZnS04 +
+ 1 % В(ОН)3 4- коллоид.
Было установлено, что
в присутствии желати-
ны максимум поляриза-
ции в этих условиях
лежит при концентра-
ции добавки (желатины)
о,025%, а в присутствии
гуммиарабика—2%. Из-
менения катодного потен-
циала в зависимости от
плотности тока показа-
ны на фиг. 81. Обозначе-
ния потенциалов I и II,
приведенные на диаграм-
мах (фпг. 79 и 80), ука-
зывают, что в первом слу-
чае измерение производи-
лось при постепенном по-
60l
70^.
S- 1.0 2.0 3.0 4.0 6.0 8.0 10.0
% Гумми
Фпг. SO. Влияние гуммиарабика на потенциал
осаждения цинка.
вышении плотности тока,
во втором, наоборот, по мере уменьшения тока после первой серии
промеров. Результаты измерения не совпадают. Авторы объясняют это
<1>11 г. S1. Влияние плотности тока
на катодный потенциал цинка в
присутствии коллоида.
явление, во-первых, той медленностью,
с которой электроды принимали соот-
ветствующий случаю потенциал (гисте-
резис) и, во-вторых, тем, что цинк,
осажденный из различных электро-
литов (разное содержание коллоида),
приобретает различные электродные
потенциалы, EJ0 и Е „ обозначают по-
тенциалы равновесия.
В отношении качества осадков в
присутствии желатины авторы не по-
лучили хороших результатов, зато
гуммиарабик оказался весьма полез-
ной добавкой. В присутствии гумми-
арабика. от 2% и выше, при .плотно-
сти тока 0,4—0,7 А/дм2 осадки получа-
лись очень красивого светлосерого
цвета с серебристым оттенком. При
меньших концентрациях, т. е. ниже
величины, 'соответствующей максимуму
поляризации, при равных прочих
условиях, осадки получались плохими,
особенно при концентрациях ниже
0,05%. В объяснение всех, явлений,
связанных с влиянием коллоидов на
электродные процессы, авторы выдвинули теорию о возникновении
определенных комплексов (адсорбционных соединений) между ионами
1.9
металла и коллоидом. Последние замедляют процесс образования
ионов цинка в катодном' участке раствора, вызывая тем самым повыше-
ние поляризации. Повышение анодной поляризации в присутствии же-
латины авторами не было обнаружено. Причиной этого они считают не-
способность аниона S0"4 образовывать комплексы с желатиной. Дру-
гие добавки, исследованные авторами, в отличие от желатины, оказы-
вали равное 'влияние как на катодный, так и на анодный процессы.
Влияние желатины на электродные процессы при цинковании из
кислых 1ванн было. подробно исследовано также Фрелихом *. Автор изу-
чал различные типы кислых электролитов (сернокислых и хлористых)
как в присутствии желатины, так и без нее при разных концентрациях
водородных ионов в растворах. В результате своих исследований автор
пришел к следующим выводам. На .поверхности катода имеется более
или менее стабильная тонкая пленка электролита. Концентрация водо-
Фиг. 82. Влияние кислотности
электролита на анодный и ка-
тодный выхода тока при осаж-
дении цинка из 1,5 У раство-
ра ZnS04 без добавок.
Фиг. 83. Влияние кислотности
электроли1а иа анодный и ка-
тодный выхода тока при осаж-
дении циика из 1,5ЛТ раств -
pa ZnS04 с добавкой 1 г/л же-
латины.
родных ионов на внутренней поверхности этой пленки ниже, чем в
основной массе раствора и соответствует значению Ph выше 5. Жела-
тина, прибавленная к электролиту, концентрируется в этой пленке.
При этом снаружи и. внутри пленки желатина имеет различные по
направлению заряды. В главной части электролита и во внешних
слоях катодной пленки она заряжена положительно и имеет щелоч-
ной характер. На внутренней поверхности катодной пленки, наоборот,
она заряжена отрицательно и имеет кислотный характер. Это измене-
ние заряда происходит при прохождении желатины через изоэлек-
трическую точку, которая соответствует Ph —4.7
По мнению автора, желатина, проходя через свое изоэлектрическое
состояние, превращается в другую модификацию, которая при диссо-
циации выделяет отрицательные желатиновые ионы. Как следствие
этого факта. Фрелих показал, что после прибавления к 1,5 А раствору
ZnS04 1 г/л желатины выход металла по току с понижением Ph очень
сильно падает, в то время как при электролизе в том же растворе без
1 Fro li ch, „Trans. Am. Electrochem. Soc.“, 49, 1926.
ICO
желатины ои изменяется в очень незначительной степени (фиг. 82 и
83). Автор объясняет это явление тем, что отрицательные частицы
желатины в катодной пленке нейтрализуют положительно заряжен-
ные (в кислом электролите) пузырьки водорода, уменьшая тем са-
мым их стремление прилипать к катоду Ч В результате происходит
обильное выделение водорода и, следовательно, уменьшение количе-
ства осаждающегося металла на катоде.
В электролите без желатины водород не выделяется так свободно
и в таком количестве, как в присутствии желатины, так как образую-
щиеся пузырьки водорода, несущие на себе положительный заряд,
притягиваются к катоду и прочно удерживаются на его поверхности.
При низкой кислотности (Ph = 4—5),.как показал Фрелих, к като-
ду пристает небольшое количество пузырьков водорода. При Ph = 3 и
ниже они становятся крупнее и многочисленнее. При этом осадок, вы-
деляющийся на свободных участках поверхности катода (между
пузырьками водорода) получается неплотным и клочковатым.
В присутствии желатины, по данным Фрелиха, отложения цинка
были также невысокого качества. При этом автор отмечает, что цин-
ковые покрытия, полученные из электролита, содержащего желатину,
ни в одном случае не содержали органических примесей. По мнению
Фрелиха, это обстоятельство объясняется низкой кислотностью катод-
ной пленки. Как только желатина подходила достаточно близко' к
катоду, так, вследствие .повышенного значения Ph в катодном слое,
она превращалась в анион, отталкивающийся от отрицательного
электрода.
Для сравнения автор приводит результаты опытов с медью,
имевшие обратный характер. В случае электролиза меди катодная
пленка кислотна. Вследствие этого желатина остается катионом, при-
тягивается к катоду и стремится отложиться на нем. Подобного ре-
зультата с цинком, по мнению автора, можно ожидать, применяя
сильро кислые электролиты при высокой плотности тока.. При этих
условиях накопление желатины у катода может быть так велико, что
часть ее войдет в контакт с поверхностью металла и включится в по-
крытие, несмотря на высокое значение Ph катодной пленки.
Катодная поляризация по данным Фрелиха в присутствии жела-
тины увеличивается как в сернокислом, так и в хлористом электро-
лите (вследствие накопления заряженных частиц желатины у като-
да). Анодная поляризация при этих условиях также увеличивалась,
но в гораздо меньшей степени. Прибавление же хлористого аммония
к 1.5 А раствору ZnS04 с добавкой желатины понижало действие
последней, что, по мнению автора, объясняется коагуляцией жела-
тины.
Некоторые авторы2 рекомендуют как хорошую добавку в кислую
цинковую ванну пиридин.
При этом цинкование вести можно в сильно подкисленной ванне
(до 0,1—0,2 А) с достаточно удовлетворительным для такой кислот-
ности электролита выходом по току (80—90%).
1 Согласно С о h е п у в кислом электролите пузырьки газа заряжены положи-
тельно и, следовательно, притягиваются, как правило, к катоду, отталкиваясь
от анода.
s Gambia, Devoto, Chem. Abstr., v. 26, № 19, 1932.
161
1 Основы гальваностегии 1783
Сато1, исследовавший влияние различных органических добавок,
(алкалоиды, протеины, амилоза и т. п.) на структуру цинковых покры-
тий, получаемых из сернокислых растворов, считает, что наилучшие
результаты дает, добавка амилозы. Осадки получаются гладкими и
плотно пристающими.
В последнее время делались попытки введения в кислый цинковый
электролит небольшого количества хлорной ртути (HgCl,)2. Предпола-
гается, что ода делает покрытие лучшим по виду и равномерности.
Наши исследования (Кудрявцев Н. Т. и Державина Ю. Л.) в серноки-
слом цинковом электролите показали, что в отношении равномерности
осадка добавка HgCl2 не дает большого эффекта. Рассеивающая способ-
ность кислой ванны в присутствии 1 г/л HgCL повышается незначи-
тельно. Качество осадка в некоторых случаях, наоборот, ухудшается.
Например, светлые мелкозернистые осадки цинка, обычно получаемые
из кислого электролита в присутствии декстрина, после добавления
к нему HgCL (1 г/л и больше) становятся темными и крупнозерни-
стыми. Положительное действие ртути на катодный процесс заклю-
чается главным образом в повышении перенапряжения водорода и по-
вышении выхода металла по току, что особенно имеет значение при
цинковании, например, чугунных отливок, имеющих очень пористую
шероховатую поверхность металла с (примесью графита (перенапряже-
ние водорода на графите меньше, нежели на чистом железе).
Предполагается, что ртуть в незначительном количестве, по край-
ней мере в первом слое отложения, осаждается на катоде, препятствуя
тем самым, выделению водорода. Нами было установлено поло-
жительное влияние этой добавки (1 г/л) при цинковании в слабокис-
лой ванне, содержащей желатину (0,1—0,3%). Обычно наблюдаемое в
присутствии желатины приставание пузырьков водорода и образование
на поверхности покрытия мелких рытвин (точечные углубления) после
добавки в раствор 1 г/л HgCl2 почти совсем устранялось. Также про-
падал при этом и золотистый оттенок покрытий, получавшийся в кис-
лой цинковой ванне, содержащей желатину, клей или декстрин
(в большом количестве). Рекомендуется применять ртуть также в виде
присадки к цинковому аноду, т. е. вести электролиз с анодом, состоя-
щим из сплава Zn-Hg или с анодом цинк-алюминий-ртуть (0,5%' А1,
0,3% Hg). В литературе вопросу применения таких анодов и доба-
вок солей ртути непосредственно в электролит уделяется внимание,
главным образом, при цинковании в цианистых цинковый ваннах.
Иногда в кислую цинковую ванну добавляют некоторые окислите-
ли, например надсерную кислоту или чаще ее соли (о,05—0,01%),
марганцовокислый калий (0,01—0,05%) и др. Эти последние дают
возможность получать хорошие осадки при более высоких плотностях
тока в достаточно кислых растворах (кислотность раствора может
быть очень высокая) с хорошим выходом металла по току. Они вы-
полняют, невидимому, роль деполяризаторов, устраняя выделение во-
дорода и образование рыхлых осадков.
Вредные примеси в цинковой ванне. Все материалы
(цинковые аноды, соли, кислоты, различные добавки), загружаемые в
1 sat о, Коггов u. Metallschutze, 9, 1931.
а Busse, „Zeitschr. f. Electrochem,", 10, 1932.
162
цинковый электролит, должны быть чйстымй й прежде всего свобод-
ными от примесей солей металлов более электроположительных, чем
цинк, как например: медь, мышьяк, серебро, олово, висмут, сурьма! и
пр. Присутствуя в электролите, эти примеси при электролизе цинковой
ванны снижают перенапряжение водорода на катоде (отлагаясь на его
поверхности) и тем самым облегчают процесс его выделения, обуслов-
ливая накопление в катодном слое гидроксильных ионов и образова-
ние гидратов и основных солей цинка. Это обстоятельство, в свою
очередь, вызывает выделение цинка на катоде в виде рыхлых губча-
тых осадков (Zinkschwamm) 1 темносерого, иногда черного цвета. Пре-
дельные концентрации этих примесей, при которых они способны! ока-
зывать такое влияние на качество цинковых отложений в обычном сла-
бокислом растворе, незначительны. Так, 0,<Ю4% мышьяковистой кис-
лоты или ее аммонийной соли достаточно для того, чтобы через 1 мин.
на катоде появился губчатый осадок пинка2.
Удаление этих примесей достигается проработкой электролита
постоянным током при одновременном подкислении серной кислотой
до явно кислой реакции.
Кроме указанных примесей вредными для цинковой ванны явля-
ются некоторые окислители, например перекись водорода и азотнокис-
лые соли3, основные соли и некоторые органические соединения: ски-
пидар, ацетон и др. Добавление 0,025% Н502 к. нейтральному раствору
сернокислого цинка (250 г/л) при электролизе с плотностью тока
1 А/дри2 через 10 мин. вызывает уже выделение губчатого цинка (Foer-
ster и Gunther). Механизм влияния этих примесей заключается, неви-
димому, также в понижении перенапряжения водорода, вызывающем
повышение концентрации гидроксильных ионов у катода. При этом
в случае, например, перекиси водорода и азотнокислых солей у ка-
тода происходит восстановление и переход Н»О» в воду и NO',. в ионы
аммония (NH'4).
В слабокислом растворе перекись водорода, по данным Ферстера
и Гюнтера, не оказывает вредного влияния.
Вредными примесями в цинковом электролите следует считать
также свинцовые и железные соли. Присутствие свинца в сернокислой
и хлористой ваннах почти неизбежно (он содержится в небольшом
количестве в цинковых анодах), по он растворяется в таких раство-
рах в очень незначительном количестве.
Железо в вице FeS04 иногда вводится в сернокислый электролит
специально для получения блестящих осадков.
Так, например, Cowper-Coles рекомендует добавлять к раствору
ZnS04 30 гКп FeS04. Невидимому, в этом случае на катоде образуется
сплав цинка с железом. Однако, при более высоком содержании же-
леза в цинковом электролите осадки получаются игольчатыми, а при
очень низком1 — темными, иногда губчатыми.
Железо, находясь в цинковом электролите в виде случайных
1 Foerster u. Gunther, „Zeitschr. f. Elektrochemie", № 1,1808 и № 22,1899.
2 Баймаков Ю. В., Электролитическое осаждение металлов, Ленинград,
1925.
8 В кислой ванне в присутствии NaN03 Кудрявцев Н. Т. получал спе-
циально губчатые осадки в большом t количестве как продукт, обладающий боль-
шой восстановительной способностью. (Неопубликованная работа).
183
йримесей, участвует в процессе электролиза, принимая различную
валентность у электродов. У анода оно' окисляется до Fe’” (окисное
железо), а у катода восстанавливается до Fe” (закисное железо), вы-
зывая тем самым излишний расход электроэнергии.
Рецептура кислых ванн. Кислые ванны для электролити-
ческого цинкования можно разбить на две основные группы: электро-
литы, работающие с обычными средними плотностями тока, из кото-
рых некоторые обладают относительно' лучшей рассеивающей способ-
ностью, и электролиты, допускающие применение очень высоких
плотностей тока для быстрого покрытия плоских изделий (лента, ли-
сты) и проволоки.
В литературе сравнительно мало данных о специальных работах по
определению рассеивающей способности цинковых (кислых) электро-
литов, причем результат проведенных исследований нельзя считать
достаточно удовлетворительным. Наиболее подробные данные по рас-
сеивающей способности кислых, цинковых ванн приведены Брауном Ч
Кроме кислых ванн автор исследовал также ванны цианистые. Опре-
деления рассеивающей способности производились им по методу Хе-
ринта и Блюма с введенной им поправкой на изменение электропро-
водности в зависимости от температуры. Последняя имеет, как пока-
зал автор, неодинаковую величину в различных слоях электролита
вследствие неравномерного распределения плотности тока на разных
участках поверхности катода.
Кроме данных по рассеивающей способности Браун приводит ре-
зультаты определения выходов по току в зависимости от плотности
тока и электропроводности — в зависимости от температуры. Исследо-
ванные автором электролиты имели следующий состав:
1. ZnS04.7Н2О (2 N), NaC2H802. ЗН2О (025 N), гуммиарабик 1 г/л
Ph = 4.
2. ZnS04.7Щ0 (2 N), NaCl (2N), NaC2H302.3H20 (0,25 N), гум
миарабик 1 г/л," Ph = 4.
3. Zn(CN)2 (1 N), NaCN (0,75 N), NH40H (0,5 N).
На фиг. 84 даны кривые, характеризующие изменение рассеиваю-
щей способности в зависимости от отношения распределения первич-
ного тока (от 1 :1 до 9 :1). Измерение производилось в кислых ваннах
при средней плотности тока 1,8 А/д;Чи1 2, в цианистой при плотности
тока 0,4 А/дм2.
Кац видно из диаграммы, рассеивающая способность в цианистой
Наине значительно выше, нежели в кислых. При отношении первич-
ного распределения тока 2 :1 она выражается величиной в 12 и за-
тем постепенно увеличивается, доходя при отношении 9:1 до 23%.
В кислых же ваннах рассеивающая способность, выражающаяся во-
обще низкой величиной, очень мало меняется при этих условиях и в
одной из них (ванна а) принимает даже отрицательные значения.
Выхода по току определялись автором при постоянном значении тем-
пературы 20°. Кривые (фиг. 85) показывают, что в кислых ваннах
1 В го und, „Trans. Faraday Soc.“, 27, 1931.
164
выход по току имеет больше тенденцию к увеличению, доходя при
плотности тока 1 А/д№ почти до 100%. Для цианистой ванны, как
и вообще для всех цианистых цинковых электролитов, характерно по-
нижение выхода по току при увеличении плотности тока, начиная с
0,3 А!дм1 2 и выше.
При плотности тока 0,3 А/дм2 выход по току в данной ванне имеет
максимум приблизительно • 98%'. Сравнительно удовлетворительные
результаты в отношении рассеивающей способности были получены
Кудрявцевым, Петровой и Державиной1 в сернокислой цинковой
ванне следующего состава:
ZnS04.?p20
NasSOi-lOHjO
A12(SO4)3.18H2O
NaCl
Декстрин
Вода
Ph
215 г (1,5 N)
30 г (~0,2 N)
25—30 г (—0,25 АО
5 г
10 г
1 л
3,5-4
Плотность тока 1—2 А/дм2, температура комнатная (18—20е). От-
носительная величина рассеивающей способности в этой ванне, полу-
ченная при измерении методом Херинга и Блюма2, составляет при-
близительно 20—30% 3.
Цианистая цинковая ванна, измеренная при плотности тока
0,5 А/дм2, при прочих равных условиях дает величину рассеиваю-
щей способности около 50—60%'4. Следует отметить, что значения
величин, которые получались при определении рассеивающей спо-
собности № методу Херинга и Блюма, главным образом в кислых
ваннах, были очень непостоянны и при повторном измерении коле-
бались иногда в больших пределах.
В производстве указанная кислая ванна дает хорошие результаты
как в отношении структуры и наружного вида, так и по равномер-
ности покрытия не очень рельефных изделий.
Получаемые осадки при плотности тока 1—2 А/дм2 и комнатной
температуре мелкозернистые, плотные, гладкие, со светлым слегка
серебристым оттенком. Ванна применима как для железных, так и
для стальных и чугунных изделий5. Примерно такие же по виду и
1 Работа по исследованию рассеивающей способности, проведенная в электро-
химической лаборатории ВЭИ, частично опубликована в сборнике «Борьба е
коррозией — борьба за металл*, 1935.
2 Метод Херинга и Влюма описан выше. Прибор, в котором производи-
лись измерения, несколько отличался по размерам и форме от описанного Хе-
рннгом и Блюмом.
3 Первоначально все цинковые растворы исследовались в присутствии бориой
кислоты около 1%. В дальнейшем оказалось, что при данном содержании в ванне
сернокислого алюминия отсутствие бориой кислоты, не оказывающей почти ни-
какого влияния на рассеивающую способность электролитов, ие отражается на.
качестве осадка и ие влияет на постоянство значения Ph.
* Цианистая ваниа была составлена по данным Хорша и Фува, см
ниже.
5 Кудрявцев Н. Т„ Цинкование, ЦИТЭИН, 1934; У с о $ В. В. и Куд-
рявцев Н, Т„ „Вестник электропромышленности*, 3. 1934.
166
0,25М НаСгНлОг 0.75N Na CM
1г. гуммиарабик 0,5 N Nfy ОН
Фиг. 85. Влияние плотности тока на выход тока
в цинковых ваннах.
структуре осадки цинка получаются из указанного электролита с до-
бавкой 10 г/л агар-агара вместо декстрина.
Дальнейшие исследования1 по методам Фильда2 и Бюссе3 пока-
зали, что поваренная соль в этом электролите ухудшает его рассеи-
вающую способность и, следовательно, с этой точки зрения является
компонентом излишним. Несколько лучшие результаты по рассеиваю-
щей способности дает эта ванна с добавкой желатины в количестве
1—3 г/л. Однако, как указано выше, физические свойства осадка в
присутствии желатины при плотности тока 1—2 А/дм2 значительно
ухудшаются. Лучшие результаты получаются в таком электролите
после добавки к нему 1 г/л Hg'Cl2 при электролизе с плотностями тока
0,5—1 А/дм2. Указанный электролит с добавкой клея (1—2%) вме-
сто декстрина дает при всех условиях плохие осадки: хрупкие, неров-
ные по окраске (темные и светлые), загрязненные включениями пены,
гидратов и основных солей цинка. Более или менее удовлетворитель-
ные результаты получаются иногда при плотностях тока 0.2—0,5 А/дм2.
Электролит с клеем рекомендуется употреблять предварительно про-
кипяченным; после этого осадки получаются менее хрупкими.
Следует отметить, что ванны с добавками коллоидов особенно же-
латины и клея, дают очень непостоянную величину рассеивающей
способности, изменяющуюся иногда в больших пределах.
Как общее правило, для сернокислых ванн повышение плотности
тока увеличивает, а повышение температуры уменьшает величину
рассеивающей способности.
Исследованйя, бензолдисульфоновых и фенолдисульфоновых цин-
ковых электролитов показали, что рассеивающая способность их не-
высокая, хуже чем в указанной сернокислой ванне. Физические свой-
ства осадков из этих ;ванн достаточно удовлетворительные: мелкозер-
нистые и светлосерые. Одна из таких ванн имела следующий состав:
фенолдисульфоновый цинк — C6H30H(S03),Zn —1,5 N,
фенолдисульфоновая кислота—C6H30H(HS03)2— 0,06 N,
клей — з—10 г/л.
Пфангаузер4 рекомендует цинковать сильно рельефные изделия
только в цианистой ванне или же применять двойное покрытие: пер-
вое— в цианистой, второе — в слабокислой или нейтральной ванне.
Среди целого ряда рецептов для цинкования в кислых ваннах автор
приводит следующий простой электролит по составу:
сернокислый цинк . . . 150 г
„ аммоний . . 50 „
борная кислота ....... 10 „
вода................. 1л
Ph.................. 4,0—4,2
Плотность тока 0,3—1 А/дм2, температура 15—20°. Выход по
току— юо%. Удельное сопротивление ванны —1,62 2. Плотность
’Кудрявцев Н. Т. и Д е р жа в и на Ю. Л., Сборник статей: „Борьба с
коррозией — борьба за металл', 1935.
3 Fild, „Met. Ind.,' 37, 1930.
* Busse, „Zeit. f. Elektrochemie', № 10, 1932.
♦Pfanhauser F., Die Electrplitischen Metallniederschlage, 1928,
16?
электролита 14,5° Вё. При этих условиях электролит показывает сле-
дующее изменение напряжения в зависмости от плотности тока и
расстояния между электродами (табл. 30).
Таблица 30
Плотность тока А/Аи2 Напряжение на за- жимах ванны при расстоянии между электродами 15 см V Падение напряже- ния на каждые 5 см расстояния между электродами V
0,3 1.0 0,25
0,5 1,4 0,41
0,75 1,9 0,61
1,00 2,5 0,83
За один час при плотности тока 1 А/дм2 в этом электролите можно
получить цинковое покрытие толщиной 0,0173 мм.
Для придания осадку блестящего вида Пфангаузер рекомендует
добавлять в кислые цинковые ванны различные коллоиды, указывая
уакже, что подобное коллоидам действие производят добавки серно-
кислого алюминия. Очень хорошие, красивые на вид, получаются
осадки, как указывает Пфангаузер, из ванны следующего состава1;
сернокислый цинк .... 130 г
, магний . . 0,75—1,5 г
„ алюминий . 4,25—8,5 „
декстроза.............. 3 г
вода................... 1л
Рекомендуется плотность тока в 1 А! дм2 при напряжении на ванне
около 4 V.
Для цинкования изделий с большой поверхностью, например ли-
стовое железо, лента и т. п., Пфангаузер рекомендует следующую
ванну:
ZnSO4.7H2O 300 г
A12(SO4),18H2O 70 „
NasSOa-lOH-jO 28 „
Н3ВО3 35 „
вода 1 л
Ванна требует периодического подкисления химически чистой
серной кислотой. При комнатной температуре плотность тока до
3 А/ди2,-при повышенной температуре и перемешивании раствора
плотность тока вдвое больше. Хорошие осадки получаются также при
применении бензойной кислоты вместо борной.
Прекрасные по своим физическим свойствам осадки дает электро-
1 В предлагаемом Пфангаузером рецепте этого электролита вместо
Д12 (' 04)3 и MgSO4 указано соединение, названное им сернокислый магналий,
которое должно содержать 15% магнезии. Магналий представляет собой сплав,
MgAl, растворенный в серной кислоте,
1'68
лит, выработанный Изгарышевым Н. А. и Титовым П. С.1 следующего
состава:
сернокислый циик ZnSO4.7НгО 250 г
борная кислота Н3ВО3 10 ,
гуммиарабик 40 „
вода 1 л
Плотность тока 2 А/дм1 2 3, температура комнатная.
Блюм и Хагебум2 приводят следующие как типовые по составу
кислые электролиты для цинкования (табл. 31).
Табл ица 31
Составные компоненты электролита 1-я ванна 2-я ванна 3-я ванна 4-я ванна
N г/л г/л N г/л N г/л
Сернокислый циик .... 1,7 240 3,0 . 410 2,5 0,6 360
Хлористый аммоний 0,3 15 — — — -— 30
Сернокислый алюминий. . . 0,25 30 —- —— — — — —
Лакрица — 1 — — — — — —
Хлористый цинк — — 2 136 — — — —
Хлористый натрий ’ — — 4 234 — — — —
Хлористый алюминий .... — — 0,25 20 0,25 20 — —
Сернокислый натрий .... — — — 1,0 75 — —
Уксуснокислый натрий . . . — — — — — — 0,1 15
Глюкоза — — — — — — 120
Авторы указывают, что эффект получается почти одинаковый: при-
меняется ли хлористый аммоний или хлористый ййтрий. При комнат-
ной температуре без перемешивания можно работать при плотностях
тока от 1,5 до 3 А/дм2. Перемешивание и повышенная температура
ванн дают возможность применять более высокие плотности тока до
10 А/дм2. Выход по току с повышением плотности тока в таких раство-
рах увеличивается, если концентрация цинковой соли в католите при
этом не уменьшается.
Для цинкования проволоки и ленты в промышленном производстве
необходимым условием является быстрота процесса приблизительно
такая, которая имеется при горячем методе покрытий. Увеличить ско-
рость процесса осаждения при электролитическом цинковании, как
известно, возможно только ,повышением плотности тока. Ряд таких по-
пыток за последние годы был сделан как за границей, так и у нас.
Наиболее удачное разрешение вопроса было получено в результате
работы), проведенной Степановым Д. В., Кабановым Б. Н. и Кудрявце-
вым Н. Т.4. Авторами был разработан процесс электролитического
цинкования при чрезвычайно высоких плотностях тока (50—400 А/дм2
1 Изгарышев Н. А. и Титов П. С., „Журнал Русского физ.-хим.
общ.*. 49, 1917; Изгарышев Н. А., Электрохимия цветных и благородных
металлов, Цветметиздат, 1933.
2 Blum a. Hogaboom, Principles of Electroplating and Electroforming. 1930.
3 Или хлористый аммоний 4,0 N — 214 г/л.
4 Степанов Д. В., Кабанов Б. И., Кудрявцев Н. Т., Техническое
цинкование проволоки и лент, „Цветные металлы", № 8 —9, 1930.
169
и 'выше до G00 А/дл2). Основными условиями для такого очень
быстрого процесса электролитического цинкования являются переме-
шивание электролита воздухом, высокая концентрация сернокислого
цинка и повышенная температура раствора. Воздушное перемешива-
ние производится посредством вдувания воздуха в электролит непо-
средственно под катод. Этим достигается быстрое выравнивание кон-
центрации электролита, что устраняет вредное для осадка обеднение
католита ионами цинка (уничтожение поляризации). Кроме того при
этих условиях, невидимому, имеет место и химическое действие кис-
лорода воздуха, окисляющего водород (в момент его выделения) в во-
ду. Воздушное перемешивание обусловливает хорошие качества осад-
ка и высокий выход по току. Рекомендуется пропускать в 1 мин.
0,5—1 л воздуха на 1 л электролита.
Электролит для цинкования предлагается очень простой по со-
ставу:
сернокислый циик ZnSQi - 7Н2О
борная кислота Н3ВО8
серная кислота H2SO4
pH = 3,5—2,5; температура 40—50°;
4 — 5 N (575—718 г/л)
7,5—15 г/л
0,0003—0,005 #
выход по току ОКОЛО 96%
Как показали опыты, большая концентрация сернокислого цинка в
растворе (от 4 до 5 г-эвк в 1 л) предупреждает образование дендритов
и повышает перенапряжение водорода.
Существенным и очень выгодным условием предлагаемого состава
электролита является его очень низкая кислотность. Это обусловли-
вает также, как и воздушное перемешивание, хорошее качество осадка,
высокий выход по току и не вызывает сильного разрушения
анода.
Температура ванны влияет как на величину затраты электроэнер-
гии, так и на качество осадка. Как показали лабораторные опыты,
в случае оцинковки отрезка проволока d = 5 мм при повышении тем-
пературы, например, с 20 до 62° напряжение падает с 6,8 до 3,3 V,
т. е. затрата энергии уменьшается вдвое.
По данным опытов на полузаводской конвейерной установке в
ВЭИ 1 при очень высоких плотностях тока (зоо—550 А/дм2) темпера-
туру электролита можно повышать до 60°. Температура электролита
выше 60° не рекомендуется, так как качество осадка при этом ухуд-
шается, покрытие получается менее блестящим и может быть серым и
матовым.
В качестве анода рекомендуется применять пластины из наиболее
чистого металлического цинка. Поверхность анода должна быть в не-
сколько раз больше поверхности катодов (в случае покрытия прово-
локи в 5—10 раз) для уменьшения сопротивления ванны и для равно-
мерности покрытия. Для предохранения электролита от загрязнений
анодным шламом, получающимся при электролитическом растворе-
нии цинковых пластин, содержащих обычно примеси железа, реко-
мендуется заключать их в чехлы из сукна или фильтровальной ткани.
Расстояние между электродами 2—4 см. При расстоянии в 2 см для
1 Кудрявцев И. Т., Работа, проведенная в электрохимической лабо-
ратории ВЭИ 1932 33 г., опубликована в виде реферата технич. отчета отдельное
брошюрой, ЦИТЭИН, 1935.
170
проволоки d = 0,4—1 мм напряжение колеблется'в зависимости от
плотности тока, диаметра проволоки и пр. от 3 до 11 V.
Рекомендуется перетекание электролита с фильтрованием. Перете-
кание может быть не быстрое, примерно соответствующее 3-5-крат-
ному обмену в 1 час. В случае применения анодных чехлов можно
ограничиться периодической фильтрацией или отстаиванием электро-
лита.
Покрываемая поверхность проволоки должна быть очень чистой.
Рекомендуются электролитические способы обезжиривания и травле-
ния с промывкой и очисткой. Скорость движения проволоки при
длине цинковой ванны до 6 м устанавливается в пределах от 10 до
100 м в минуту и выше, в зависимости от диаметра проволоки, плот-
ности тока и толщины покрытия.
При цинковании на конвейерной установке ленты допустимый
предел повышения плотности тока ниже, чем при цинковании прово-
локи. Поэтому при одинаковой длине ванн скорость движения ленты
меньше, чем для проволоки. В зависимости от ширины ленты (100—
10 лии) плотности тока могут применяться от 5 до 150 А/дм2. Плот-
ности тока от 100 ДО' 150 А/дм? возможны только в случае цинкова-
ния более узкой ленты (10 мм).
Получаемые при этих условиях осадки цинка на проволоке, а так-
же и на ленте, гладкие, блестящие, мелкозернистые, нехрупкие, плот-
ные и прочно пристающие к поверхности основного металла. При ис-
пытании на коррозию образцы проволоки, оцинкованные электроли-
тическим способом на полузаводской конвейерной установке, при дан-
ных условиях, оказались более стойкими, чем образцы, оцинкованные
горячим способом, — потери цинка в первом случае приблизительно
на 3Q% меньше, нежели во втором1.
Из работ по электролитическому цинкованию с высокими плотно-
стями тока, проведенных и опубликованных в иностранной литерату-
ре, заслуживает внимания статья Павека и Зейхсера *. Авторы разра-
ботали способ цинкования при очень быстром перетекании электроли-
та. Обмен электролита должен происходить 15—20 раз в минуту. Хо-
рошие осадки можно получать при плотности тока до 50 Х/дм?. Элек-
тролит состоял из концентрированного раствора сернокислого или
хлористого цинка с добавкой борной кислоты, температура 18—30”.
Для повышения электропроводности применялась очень высокая кис-
лотность ванны, около 0,75 N. При этом напряжение достигает 5—8 V.
Выход по току 68—86%. Основными недостатками этого способа, за-
трудняющими его использование, являются: громоздкость аппаратуры
при слишком мощном перетекании электролита, пониженный выход
по току и слишком быстрый нерациональный расход кислоты и цин-
ковых анодов при большой кислотности электролита.
Б. Щелочные цинковые ванны
Щелочные цинковые ванны, как указывалось выше, могут быть
разделены на два основные типа: щелочные цианистые и просто ще-
лочные. Наилучшие результаты в отношении равномерности и физи-
ческих свойств цинкового покрытия дают ванны цианистые. Основными
’ Р a w е с k u. Seihser, Cen(r, der Hutten- und Walzwerke. 23, 1927.
171
компонентами этих ванн являются цианистая соль цинка, циани-
стый калий или натрий и едкая щелочь (NaOH или КОН).
При взаимодействии цианистого цинка с цианистым натрием или
калием в растворе получается комплексная соль цианисто-натриевого
(или калиевого) цинка по следующему уравнению:
Zn(CN)2 + 2NaCN = NfuZn(CN)4.
Следует отметить, что формула для комплексной цианисто-натриевой
(или калиевой) цинковой соли, получающейся в растворе, может
быть представлена в виде цианистого цинка [Zn(CX)2] в соединении с
одной или двумя лишними молекулами цианида, т. е. Zn(CN)2. NaCN
или Zn(CN)2.2NaCN, так как образуются в соответствующих равно-
весных отношениях и та и другая соли.
Если цианистый цинк растворять в едкой щелочи, то помимо ком-
плексной цианистой соли образуется также цинкат по уравнению:
2Zn(CN,) + 4NaOH —Na2Zn(CN)4 -4- Na2ZnO2 + 2H2O.
Нормально цианистая цинковая ванна всегда содержит в растворе обе
эти соли. Блюм и Хагебум1 указывают, что отдельно растворы каждой
из этих солей не дают таких удовлетворительных результатов, как их
смесь.
При приготовлении электролита обычно исходят из окиси цинка
ZnO или гидрата окиси цинка Zn(0H)2. Гидрат окиси цинка для этой
цели рекомендуется применять всегда свежеосажденный. Получается
он при действии на раствор сернокислого цинка какой-либо щелочи
по уравнению:
ZnS04 + 2NaOH = Zn(0H)2 + Na2S04.
Так как в избытке щелочи гидрат окиси цинка растворяется, пере-
ходя в цинкаты, то осаждение следует производить в присутствии ин-
дикатора фенолфталеина. Появление неисчезающего розового окраши-
вания раствора указывает на окончание процесса выделения цинйа.
Полученный осадок тщательно отмывается от образующихся' в рас-
творе сульфатов и загружается непосредственно в раствор цианистого
натрия или калия. Гидрат окиси цинка, взаимодействуя с цианистым
натрием или калием, дает сначала цианистый цинк, который в избытке
цианидов переходит .в растворимое, указанное выше, комплексное со-
единение. При этом процессе образуется свободная едкая щелочь.
Реакция протекает по следующим уравнениям:
Zn(OH), + 2NaCN = Zn(CN)„ + 2Na£)H,
Zn(CN)2 + 2NaCN = Na2Zn(CN)4.
При действии на гидрат окиси цинка едкого натра получается цин-
кат натрия по уравнению:
Zn(0H)2 4- 2NaOH = Na2ZnO2 + 2Н20.
В случае едкого кали таким же образом образуется цинкат калия.
Цинкат совместно с комплексным цианидом образуется также и при
1Blum a. Hogaboom, Principles of Electroplating and Electroforming,
1930.
172
взаимодействии гидрата окиси цинка с цианистым натрием (или ка-
лием) пр уравнению:
2Zn(OH)a + 4NaCN = Na2Zn(CN)4 4- Na2ZnO2 + 2H20.
Примерно такая же реакция протекает при взаимодействии с циа-
нидами и окиси цинка по уравнению:
2ZnO + 4NaCN = Na2Zn(CN)4 4- Na2ZhO2.
В действительности состав цианистых цинковых ванн не имеет такого
идеального соотношения указанных в последних двух реакциях ком-
понентов. В растворе всегда находится избыток свободного цианида
или едкой щелочи, влияющий па изменение содержания той и дру-
гой соли в большую или меньшую сторону.
Небольшой избыток цианидов или щелочи необходим, во-первых,
для того, чтобы не могло (произойти вьщадения цинка в виде гидрата
окиси, образующейся вследствие гидролиза, во-вторых, потому, что
он дает лучшие по качеству покрытия, повидимому, благодаря пони-
жению концентрации ионов цинка в растворе. Кроме того присутствие
в электролите свободного цианида или щелочи устраняет пассивирова-
ние анодов, способствуя лучшему растворению их, и предохраняет
ваину от обеднения цинковой солью. Однако слишком большой избы-
ток свободного цианида или едкой щелочи вреден для процесса цин-
кования, так как при этом может сильно понизиться катодный вы-
ход металла по току, и осадки будут получаться пористыми и даже
губчатыми.
Блюм и Хагебум указывают, что цианистый цинковый электролит
должен содержать от 1 до 1,5 г-экв цинковой соли. При этом в 1 Л’по
цинку цианистой ванне общее содержание цианида (связанного и сво-
бодного) должно соответствовать 2 г-экв, т. е. по цианиду она должна
быть двухнормальной для образования комплексной цианистой соли
Na2Zn(CN)4. Общее содержание щелочи (связанной и свободной)
должно соответствовать тоже 2 г-экв (2 ЛГ) для образования Na2ZnO2.
Если такая ванна (1 N по отношению к цинку) содержит по 1,5 г-экв
всего цианида'и едкой Щелочи, то ее можно рассматривать по со-
ставу как: а) 0,5 W по отношению к связанному цианиду и цинкату
и 0,5 N по свободному цианиду и свободной щелочи, или б) 0,75 Д
по отношению к комплексной цианистой соли, 0,25 Д по цинкату и
1 N по едкой щелочи (свободной), или в) 0,25 N по отношению к
комплексной цианистой соли, 0,75 N по цинкату и 1 N по свобод-
ному цианиду.
Можно принять, что в цианистом растворе цинк сначала образует
комплексную цианистую соль и переходит в цинкаты только при недо-
статке цианидов. Цинкаты и свободные цианиды, по мнению авторов,
одновременно находиться в растворе не могут.
Кроме указанных соединений в цианистых ваннах могут нахо-
диться также углекислые соли натрия или калия. Эти соединения
образуются, как известно из предыдущего, за счет карбонизации едкой
щелочи или цианида под действием углекислоты воздуха Карбонаты
понижают содержание свободного цианида и едкой щелочи, изменяя,
следовательно, общий состав ванны. Кроме того, присутствуя в рас-
творе, они оказывают, очевидно, некоторое влияние и на качество по-
крытия. В этом отношении существуют, однако, различные мнения.
173
Ёерплуид1 считает, что присутствие в цианистой цинковой ванне
большого количества карбонатов оказывает полезное действие, глав-
ным образом в отношении равномерности растворения анодов.
Согласно исследованиям, произведенным Амер, бюро стандартов,
наоборот, наличие карбонатов, даже в таком небольшом количестве,
как 15 г/л, т. е-. около 0,25 Л’, является вредным для процесса осажде-
ния цинка. При более высокой концентрации их покрытие получается
пористым, — невидимому, вследствие понижения концентрации цинко-
вой соли и выделения водорода. По Блюму и Хагебуму, карбонаты в
большом количестве должны рассматриваться, безусловно, как вред-
ная примесь в цианистых цинковых ваннах. При охлаждении раствора
до—5° или ниже значительная часть карбонатов может быть выде-
лена в осадок (на дно ванны) вследствие понижения их раствори-
мости. Для освобождения растворов от карбонатов можно применять
также осаждение их цианистым барием.
В некоторых случаях в цианистые цинковые ванны вводят добавки
коллоидов, алюминиевых квасцов или сернокислого алюминия. Такого
рода добавки в цианистой ванне играют значительно меньшую роль,
нежели в кислых ваннах.
Блюм и Хагебум указывают, что применяемые добавки в цианистой
цинковой ванне улучшают внешний вид покрытия, сообщая ему бле-
стящий оттенок. Некоторые из них могут увеличивать также и рассей^
вающую способность электролита. Квасцы или сернокислый алюми-
ний в щелочах образуют алюминаты, например NaA102, и кроме того
могут частично находиться в виде гидрата окиси алюминия в коллои-
дальном состоянии.
Как указывалось выше, полезной добавкой в цианистых ваннах яв-
ляются соединения ртути. Влияние этой добавки в цианистой ванне,
также как и в кислой, заключается прежде всего в повышении пере-
напряжения водорода на катоде и увеличении выхода металла по току.
Исследования Томпсона показали, что в обычной цианистой цинко-
вой ванне [30 г/л NaCN 4- 30 г/л NaOH и 30 г/л Zn(CN)2] перенапря-
жение водорода на электродах из различных сортов железа выражается
очень низкой величиной, значительно меньшей, чем это соответствует
значениям потенциала, определяемым на чистом цинке при одинако-
вых прочих условиях. На основании своих данных автор приходит
даже к такому выводу, что покрытие цинком железных и стальных от-
ливок в цианистой ванне нельзя производить без добавления ртути
или каких-либо других веществ, осаждающихся вместе с цинком. По
его мнению ртуть, присутствуя в электролите, как наиболее электро-
положительный металл легко осаждается на железной поверхности (в
начале электролиза) в виде тончайшей пленки, образуя как бы ртут-
ный электрод, способствующий беспрепятственному выделению цинка.
Потенциал выделения металла (цинка) из обычного цианистого цинко-
вого электролита более электроотрицательный, нежели при выделении
металла (сплав: цинк-ртуть) из такого же раствора, но с добавкой
ртути. Перенапряжение водорода на чистом цинке и на сплаве цинка
Ю> ртутью также отличаются друг.от друга (табл- 32).
Холе указывает, чТо он получал сравнительно хорошие результаты
в цианистых ваннах с амальгамированными анодами при таких высо-
1 Wernlund. .Trans. Am. Electrochem. Soc.*, v. 40, 1921.
174
КИх МотйбсТЯх тдка, как 4,3—5,з к/ддк. Осадки были равномерные,
мелкозернистые и прочные, но очень темные.
Это последнее, а также неустойчивость цианистой ванны при высо-
кой плотности тока вынуждают автора признать такой процесс цинко-
вания, однако, неприемлемым для производства. При более низкой
плотности тока покрытие получалось хотя и блестящим, но неодина-
ковым по цвету —«-.с различными оттенками. Аноды растворялись до-
вольно равномерно в продолжение большого периода времени работы.
В отношении устойчивости против коррозии Холе, производивший
испытание осадков (толщина слоя 0,012—0,025 мм) солевой струей,
указывает следующее. При условии не очень сурового коррозионного
воздействия (коррозия во влажной атмосферной среде) цинковое по-
крытие, полученное с амальгамированными анодами, ведет себя так
Таблица 32
Плотность тока к/дм? Перенапряжение водорода V Потенциал элек- тродов V
Zn + 2% Hg Zn Zn + 2°/о Hg Zn
0,0001 0,48 0,56 0,47 0,48
0,001 0,8 0,78 0,46 0,57
0,01 1,08 1,10 0,79 0,89
0,02 — — 1,13 1,18
0,05 — — 1,15 1,25
0,1 1,14 1,16 —- •—
1,0 1,20 1,17 •— —
же, как и все обычные покрытия цинком. В условиях же очень су-
рового коррозионного воздействия это покрытие при одинаковой тол-
щине слоя оказалось более стойким, чем цинковый осадок, получен-
ный обычным способом.
Повышенная антикоррозийная способность цинковых покрытий, по-
лученных из цианистой ванны с цинк-ртутными анодами, была по-
казана также Вернлундом (см. табл. 20)..
Грахам1 рекомендует применять для цианистых ванн цинковые,,
аноды, содержащие 0,5% А1 и 0,3%' Hg.
В отличие от анодов из чистого цинка сплав Zn-Al-Hg при
электролизе в цианистой ванне не покрывается шламом и дает нор-
м;альный, не слишком высокий анодный выход по току.
Примеси, оказывающие вредное влияние на процесс осаждения
цинка из цианистых ванн, примерно те же, что и в случае цинко-
вания в кислых ваннах. Однако © цианистых ваннах эти примеси
оказывают гораздо меньшее влияние на изменение кристаллической
формы осадка, нежели в кислых. В данном случае благодаря сближе-
нию потенциалов (электроположительные металлы, образующие ком-
плексные соли в цианистых ваннах, выделяются на катоде при более
электроотрицательном потенциале, нежели из кислых растворов) впол-
не возможно совместное выделение металлов без образования пористых
1 Graham, .Trans. Am- El. Soc.», v. 63, 1033.
175
и губчатых осадков. В присутствии, например, меди в цианистой ван-
не можно получать вполне удовлетворительное по виду покрытие, со-
стоящее из сплава цинк-медь. Загрязнения цинковых осадков в виде
небольшого включения более электроположительных металлов пони-
жают, однако, его сопротивление коррозии.
Цианистые цинковые ванны дают удовлетворительные осадки как
при комнатной, так и при повышенной темпера-
туре. Для повышения проводимости раствора и получения более
равномерных осадков рекомендуется повышать температуру до
40—45°. Очень высокую температуру в цианистых ваннах держать не
следует, так как она ускоряет разложение цианистых соединений.
Предел плотностей тока в цианистых ваннах
очень ограничен. Во избежание чрезмерного падения выходов по току
как на катоде, так и на аноде и резкого изменения состава растворов,
не рекомендуется, применять в обычных цианистых ваннах плотности
тока выше 2 А/дм2.
Рецептура щелочных ванн. Блюм и Хагебум1 приво-
дят следующий, наиболее удовлетворительный состав цианистой ван-
ны, выработанный Американским бюро стандартов:
1 N (60 г/л)
0,5 N (23 г/л)
1,3 N (53 г/л)
цианистый циик Zn(CN)2
, . натрий NaCN
натр NaOH
едкий
ИЛИ
цинка ZnO
натр NaOH
1,0 N (45 г’л)
0,3 N (15 г/л)
1,5 N (15 г/л)
N (60 г/л)
N (49 0 г/л)
N (15 г/л)
N (30,0 г/л/
0,3
0,5
0,18 N (7,5 г/л)
1,0 г/л
7,5 „
цианидов в такой ванне соответ-
окись
едкий
цианистый натрий NaCN
Такой электролит (в обоих случаях) является i,5 N по отношению
к общему содержанию цианидов и 1,3 N — к общей щелочности. Верн-
лунд2 рекомендует ванну с большим содержанием цианидов и мень-
шей концентрацией едкой щелочи. Кроме того он вводит в состав
электролита различные добавки: коллоиды и соли щелочных метал-
лов. Состав этой ванны следующий:
цианистый цинк
. натрий
едкий натр
углекислый натр
хлористый натрий
гуммиарабик
кукурузный сахар
Как видно, общёе содержание
ствует 2 N раствору и общая концентрация едкой щелочи — 0,3 N.
Эта ванна дает светлые, гладкие покрытия без пятен и различных
оттенков. Блюм и Хагебум, не отрицая -этих достоинств ванны Верп-
лунда, советуют все же при употреблении ее в производстве умень-
шать количество дополнительных агентов.
Для цинкования главным образом мелких изделий в барабанах
Оплингер3 дает состав цианистого 'Электролита, допуская изменение
содержания основных компонентов в широких пределах:
" —” 37,5—60 г
22,5—37,5 г
30 —45,0 „
, 1 л
2
цианистый цинк Zn(CN)2
„ натрий NaCN
едкий натр NaOH
____ вода Н20
Blum a. Hogaboom, loc. cit.
Wernlund. loc. cit.
,Am. Electroplaters Soc. Convention Rep.*, p. 169, 1932.
176
Грахам1,1 производивший проверку всех указанных выше циани-
стых цинковых ванн, в результате своих исследований дает несколько
отличные, более совершенные, по его мнению, рецептурные условия
для цинкования. В основу характеристики состава цианистых цинко-
вых ванн Грахам принимает отношение суммарного количества грамм-
эквивалентов NaCN 4- NaOH к 1 г-экв Zn(CN)2, обозначая его зна-
ком R. Таким образом он получает для ванны, указанной Блюмом и
Хагебумом, значение Я = 1,3 и для ванны Вернлунда R= 1,8. Значе-
ния для, ванны Оплингера при этом будут колебаться, очевидно, в ин-
тервале от 1,5 до 2,98. Автор проводил исследование ванн, изучая па-
раллельно поведение в них анодов/состоящих из сплава: алюминий-
ртуть-цинк (0,5% А1; 0,3% Hg). Все опыты проводились при
плотности тока 2,2 А/дм2 и при температуре 49°. Продолжительность
опытов изменялась от 22 до 27 час. На основании данных определения
выходов по току (анодного и катодного), анодной поляризации, напря-
жения на ванне и каче<ства цинковых отложений Грахам приходит к
заключению, что наиболее благоприятное соотношение компонентов в
цианистой ванне при 1 N концентрации цианистого цинка соответ-
ствует значению R = 2 и выше. При этом он рекомендует концентра-
цию цианистого натра от 37,5 до 63,7 г/л и концентрацию едкого на-
тра от 33,8 до 75 г/л При этих условиях анодный и катодный выходы
ПО' току приближаются к 100%.
Анодная поляризация и напряжение на ванне при указанных зна-
чениях R выше двух выражаются более низкими величинами, нежели
при других условиях.
Осадки, полученные за 22—24-часовой электролиз из таких раство-
ров, были гладкими и мелкозернистыми (табл. 33 и 34). Аноды из
сплава Zn-Al-Hg в противоположность аноду из чистого цинка
не покрываются шламом. По данным Грахам добавки в цианистые
цинковые ванны углекислого натрия в количестве 30 г/л не вызы-
вают заметного изменений выхода по току, анодной поляризации и
напряжения на ванне. Понижение 'Концентрации Zn(CN)» до о,75 А
уменьшает анодный и катодный выходы по току, увеличивая в то же
время значения анодной поляризации и напряжения на ванне.
Следует отметить также ванну Хорша и Фува. Исследуя рассеи-
вающую способность различных электролитов, авторы показали, что
наилучшие результаты дает следующий состав ванны2:
цианистый цинк Zn(pN)j 59,2 г
» натрий NaCN 53,2 ,
едкий иатр NaOH 43,8 ,
сернокислый алюминий A12(SO4)3 18 Н20 4,7 „
лигноль II 8 „
вода 1 л
Плотность тока 2,15 А/дш2; температура 40°. Выход по току око-
ло 80%. По данным Хорша и Фува при непрерывной работе в этой
1 Graham. .Trans. Am. Electrochem Soc.*, 63, 1933.
’ Horsch a. Fuwa, .Trans. Am. Electrochem.Soc.*,41. 1922. Определение
рассеивающей способности авторы производили по относительным весовым ко-
личествам металла, выделявшегося на 3 катодных пластинах, расположен, ых
перпеидикулярио к плоскости анода. Выли проверены сернокислые, борфторво-
дородные, двойные серноаммиачио-цйнковые и цианистые ванны.
12 Основы гальваностегии 1788 177
Ваййе рассеивающая способность с теЧеййем Времени Падает. Причи-
ной этого явления служит постоянное обогащение электролита цин-
ком (анодный выход по току — 100%) и обеднение его добавочными
компонентами. m „ оо
NaOH NaCN, г/л
г/л 22 (0,45 N) 50,96 (1,04 N) 63,7 (1,3 N) 73,5 (1,5 N)
Характер покрытия R Характер покрьг!ня В Характер покрытия в Характер покрытия в
15,2 34,0 0,38 0,85 Крупнозер- нистый тем- ный, по краям гру- бые кри- сталлы 1,3 Гладкий, бе- лый, крупно- нозернистый Гладкий, Це- лый, мелко- зернистый 1,4 1,9 — — Гладкий, бе- лый, мелко- зернистый То же 1,9 2,4
52 64 1,3 1,6 Белый, но с грубыми краями 1,8 То же 2,3 Белый, крупнозер- нистый 2,9 Белый, крупнозер- нистый 2,8
76 1,9 Гладкий, бе- лый,крупно- зернистый 2,4 Белый, крупнозер- нистый 2,9 — — — —
В качестве .простой щелочной цинковой ванны, не содержащей
цианистые соединения, можно указать электролит, предлагаемый
Лангбейном *.
вода...................................... 1.л
хлористый цинк........ 10 г
едкий натр ........ 50 »
хлористый аммоний ... 20 »
Сравнительная характеристика ванн с низкой и высокой концентрацией [Zn(CN)a];
каждого опыта 23 часа.
R Состав электролита, г/л ''Выход металла по току
NaCN NaOH на аноде Zn-Al-Hg на катоде
L Н L 1 н
1,8 22 52 70,8 90,8 97,5 99,0
2,16 36,7 52 91,2 97,5 98,0 99,4
2,3 51 52 94,2 100,5 95,5 99,7
1,8 51 34 87,8 100,0 93,8 98,8
1 Лангбейи, Практическое руководство к осаждению металлов гальва-
ническим путем, пер. Сафонова, 1909.
178
Осаждение цинка рекомендуется вести при повышенной темпера-
туре 70—80°.
В. Контактный метод цинкования
Контактный способ, или способ цинкования без внешнего источ-
ника тока, состоит в том, что очищенные от всяких загрязнений из-
делия погружаются в раствор Цинковой соли и приводятся здесь в
соприкосновение с металлом, имеющим потенциал более электроотри-
цательный, нежели потенциал покрываемого металла. Покрытие
происходит за счет работы гальванической пары, образующейся при
контакте покрываемого металла с другим, более электроотрицатель-
ным металлом. При этом последний переходит в раствор, вытесняя
цинк на поверхности покрываемого изделия. Для цинкования железа
в качестве контактного металла применяют обычно алюминий и ведут
процесс в щелочном горячем растворе цинковой соли (в алюминие-
вых сетчатых корзинах) в течение нескольких часов. Этим методом
нельзя получить достаточно толстые хорошие покрытия. По внешнему
виду такие отложения цинка бывают неплохими, но защитные свой-
ства их невысоки. Применяется такой метод, главным образом, для
покрытия мелких неответственных по роду службы Изделий, напри-
мер гвоздей и пр.
Пфангаузер рекомендует для контактного цинкования раствор сле-
дующего состава:
сернокислый цинк .... 10 г
цианистый калий........... 3 »
едкий натр............• 15 »
вода...................... 1л
Температура раствора 80—90°. Контактом служит алюминий.
Г. Контроль цинковых ванн 1
Так как состав цинковых ванн во время электролиза обычно ме-
Таблица 34
L— 0,75 N Zn(CN)2; Н — 1 N Zn (С>')2; температура ванн 49°. Продолжительность
Плотность тока 2,2 А/дм2.
Анодная поляризация после 23 час. V Напряжение на ванне2 V Характер покрытия для L и Н электролитов
L я L
2,86 2,86 3,6 Плотный, грубый, серый
2,77 — 3,5 Плотный, гладкий, серый
2.85 0,04 3,2 Мелкозернистый, гладкий, белый
2,92 2,84 3,9 Кристаллический, гладкий, белый
1 Приведенные ниже методы анализа цинковых ванн взяты главным обра-
зом из книги Блюма и Хагебума, Principles of the Electroplating and Elec-
troforming, 1930.
2 Напряжение измерено по истечении 2 час. покрытия.
*
170
ЦЯется, особенно В случае Цйаййстых электролитов, то во избежание
брака необходимо время от времени его корректировать. Вследствие
того, что некоторая часть электролита совсем уносится из ванн (по-
верхностью выгружаемых изделий), корректировку приходится произ-
водить путем добавления в раствор почти всех компонентов, которые
входили в состав первоначально приготовленного электролита. Кор-
ректировать ванну следует после предварительно проведенного хими-
ческого анализа раствора. Ниже рекомендуются методы, из которых
некоторые дают не совсем точные результаты, но зато онц просты и
быстро выполнимы. Для корректировки производственных ванн, не
требующих обычно очень точного анализа, последнее условие является
очень важным.
Анализ кислых ванн. Анализ кислых цинковых ванн сводится,
главным образом, к определению содержания Zn", АГ", СГ, St)/', Н*,
иногда Mg" и из вредных примесей: Fe", реже Си" и As”*.
Цинк. Содержание цинка определяется титрованием раствором
железистосинеродистого калия [K4Fe(CN)e], приливаемого к подки-
сленной пробе электролита. При этом образуется осадок соли
K2Zn3[Fe(CN)e]2. Реакцию можно представить в следующем виде:
3ZnS04 + 2K4Fe(CN)e = K2Zn8[Fe(CN)e]2 ф- 3K2S04.
Блюм и Хагебум рекомендуют производить титрование с примене-
нием в качестве индикатора уксуснокислого урана. Раствор железисто-
синеродистого калия приготовляется с таким расчетом, чтобы 1 см3 его
был эквивалентен 0,005 г цинка. Для этого растворяют 22 г кристал-
лической соли K4Fe(CN)6. зН20 сначала в небольшом количестве
воды, а затем объем доводят до 1 л. Титр раствора устанавливается
по точной навеске химически чистого гранулированного цинка. Цин-
ковая пыль для этой цели не годится, так как она обычно содержит
примеси других металлов. Навеску цинка берут от 0,2 до 0,25 г. Ее
сначала растворяют в разбавленной соляной кислоте. Затем раствор
доводят до 100 см3 водей и к нему добавляют около 5 см3 концен-
трированной соляной кислоты и 5 г хлористого аммония. Получен-
ный раствор нагревают до, 80°, и йри сильном перемешивании его
титруют раствором желтой кровяной соли. Перед концом титрования,
который рассчитывают заранее по количеству взятых веществ со-'
гласно указанному выше уравнению реакции, каплю раствора поме-
щают на фарфоровую пластину и испытывают ее каплей раствора
уксуснокислого урана. Последний должен содержать 1 г кристалли-
ческого уксуснокислого урана в 10 см3 воды.
Путем нескольких повторных испытаний достигают момента,
когда раствор через 1 мин. принимает слабую коричневую окраску,
служащую признаком окончания реакции. Темпокоричневая окрас-
ка указывает на избыток прибавленного раствора K4Fe(CN)6 (раствор
перетитрован). Точно так же этим раствором K4Fe(CN)e производится
и определение содержания цинка в электролите. Для этого 5 см3 цин-
кового электролита разбавляют до 100 см3 водой и добавляют к нему
5 см3 концентрированной соляной кислоты и 5 г хлористого аммония.
В дальнейшем весь ход определения ничем не отличается от преды-
дущего. Присутствие в растворе железа мешает точности определения.
180
Поэтому в случае загрязнения электролита большим количеством же-
леза последнее предварительно удаляется из раствора путем осажде-
ния его аммиаком.
Кроме указанного метода хорошие результаты дает также более
простой по технике выполнения-, объемный метод определения цинка,
предложенный Сапе и Cady1. Метод этот основан также, на взаимо-
действии цинковой соли с желтой кровяной солью. При этом в каче-
стве индикатора служит 1% раствор дефиниламина или лучше ди-
фенилдибензидина в концентрированной серной кислоте. Титрование
производится следующим образом. К 1—5 с.н3 раствора (в зависимости
от концентрации цинковой соли в электролите) прибавляют 20 см3
25% раствора серной кислоты и 15 см3 20% раствора хлористого ам-
мония. Титруют 0,3 N раствором K4Fe(CN)c. В присутствии индика-
тора дифениламина прибавлять раствор K«Fe(CN)e следует не быстро,
так) как реакция протекает медленно. Перед концом титрования
нужно подождать 0,5—1 мин. В это время получившийся вначале си-
ний .цвет раствора постепенно переходит в голубой. Концом титрова-
ния служит резкий переход голубой окраски в светлозеленую от
1 капли раствора. В присутствии большого количества железных со-
лей такого перехода не наблюдается, так что в этом случае необхо-
димо к титруемому раствору прибавлять лимонную кислоту. Соли
алюминия мешают точности определения.
Алюминий и железо. Блюм и Хагебум рекомендуют сле-
дующий метод совместного определения алюминия и железа. К 25 с.м3
электролита, разбавленного до 100 см3 водой, прибавляют несколько1
капель азотной кислоты. После.этого раствор доводят до кипения и
прибавляют к нему раствор аммиака. При этом алюминий и же-
лезо осаждаются в виде гидроокисей. Осадок промывается горячей
водой, высушивается, прокаливается п взвешивается, как. смесь
А1203 + Fe2O3.
Так как по сравнению с алюминием железо в цинковой ванне на-
ходится обычно в незначительном количестве, то при отсутствии необ-
ходимости иметь точные результаты анализа можно пренебречь содер-
жанием его в прокаленном осадке и считать последний состоящим
из А1203. Если же железо присутствует в ванне в большом количестве,
то ОНО1 определяется в отдельной пробе раствора титрованием перман-
ганатом. Перед таким определением раствор предварительно обрабаты-
ваемся цинком для восстановления окисного железа в закисное. Рас-
чет ведется мри этом на окись железа (Fe203), вес которой вычитается
из первоначально полученного суммарного количества окислов
А1а03 + Fe203. Разность, дающая содержание А1203, пересчитывается
на ту соль алюминий, которая присутствовала в электролите 2.
Магний. Для определения магния в цинковом электролите Блюм
и Хагебум рекомендуют следующий метод. Электролит, подкислен-
ный уксусной кислотой, обрабатывается сначала сернистым аммо-
нием или сероводородом. Полученный осадок сернистого цинка от-
1 „Journ. Americ. Chem. Soc.". 40, 356, 1927.
3 Более точное описание метода определения алюминия и железа, подоб-
ное указанному, приводится также в ОСТ.
181
фильтровывается, и в фильтрат после нагревания его до кипения до-
бавляется хлористый аммоний, фосфорнокислый аммоний и аммиак.
Осадок, состоящий из магний-аммоииевого фосфата MgNH4P04, от-
фильтровывается, промывается разведенным аммиаком, прокали-
вается и взвешивается в виде пирофосфорного магния Mg2P207. Со-
держание сернокислого магния MgS04.7Н,0 определяется затем пере-
множением веса Mg2P207 на коэфициент 1,11 (отношение молекуляр-
ных весов Mg2P^O7: MgSO4. <Н._>0).
Содержание S04. Знание общего содержания сульфатов в
растворе дает возможность при установленной концентрации серно-
кислого цинка и сернокислого алюминия (если последний в растворе
имеется) определить содержание какой-либо проводящей соли Na2SO4
или (NH4)2S04. При отсутствии последних, методом определения об-
щего количества S04 при известной концентрации в растворе ZnSO4
можно пользоваться для установления концентрации MgS04 вместо
способа, указанного выше.
Как наиболее удобный и простой можно рекомендовать предложен-
ный Штебингером и Зомбори1 объемный метод определения сульфа-
тов в присутствии родизоновокислого натрия. Этот метод основан на
том, что водный раствор родизоновокислого1 натрия дает с солями ба-
рия осадок родизоновокислой соли, который имеет интенсивную крас-
ную окраску и является вполне устойчивым в нейтральном или сла-
бощелочном растворе. При титровании бариевых солей раствором
сульфата в присутствии родизоновокислого натрия красный цвет
осадка переходит в слабожелтый, как только количества барий-иона и
сульфат-иона- будут эквивалентны друг другу. В кислом растворе
этот метод не дает положительных результатов, так как свободная
родизоновая кислота в кислой среде быстро разлагается.
М. Л. Чепелевецкий и С. И. Поздняков2, проверившие этот метод,
предлагают следующий ход анализа сульфатов: «К 10 см3 0,5 N
раствора ВаС12, титр которого был заранее установлен весовым путем,
прибавляется свеже приготовленный раствор родизоновокислого ка-
лия (1—2 мг на несколько кубических сантиметров воды), 2—3 см3
спирта, затем 10—20 капель 30% раствора углекислого натрия (если
раствор был кислый) и, наконец, 5 см3 испытуемого раствора, при-
близительно 0,5 А. Остаток бариевой соли, не вступивший в реак-
цию, определяется титрованием 0.2 А раствором сернокислого ка-
лия. Конец титрования соответствует переходу красной окраски
в желтую».
Содержание СГ определяется обычным методом титрования
раствором азотнокислого серебра. Концентрация СГ дает возможность
установить количество хлористой соли в растворе (NaCl или NH4C1)
путем прямого или косвенного (по разности) подсчета, как и в случае
определения сульфатов.
Кислотность. Активная кислотность цинкового электролита,
или водородный показатель Ph, определяется обычно колориметриче-
ским или электрометрическим методом. Если содержание сильной
кислоты в растворе большое, то при отсутствии слабых кислот.
1Stebinger u. Z о mb or у, „Zeitschr. f Analyt. Chemie", 79. 1, 1930.
2 Жури. хим. промышленности, 13, 1931.
182
например уксусной или борной, свободную серную или соляную кис-
лоты можно также определять обычным объемным методом титрования
в присутствии метилоранжа. Для колориметрического метода, приме-
няемого при наличии слабых кислот в электролите, употребляют как
индикаторы бромфенолблау или тимолблау.
Анализ щелочных цинковых ванн. Контроль щелочных циани-
стых электролитов заключается, главным образом, в определении со-
держания цинка, цианидов, едкой щелочи и карбонатов. Наиболее
сложным является определение «свободного цианида» и «свободной
щелочи», дающее почти всегда недостаточно точные результаты.
Блюм и Хагебум рекомендуют следующий ход анализа цианистых
цинковых ванн, предложенный Carson С
Ц и н к. К 5 ам3 электролита добавляется по 5 см3 концентрирован-
ной азотной и концентрированной серной кислоты. Полученный рас-
твор выпаривается до 'Появления густого белого дыма. Прибавление
кислоты и выпаривание должно производиться в вытяжном шкафу.
По охлаждении оставшийся после выпаривания осадок рас-
творяется в соляной кислоте (з см3 концентрированной соляной кисло-
ты на 20 дм3 воды). Раствор не должен при этом показывать следов
синей окраски. Если же она появится, то необходимо добавить не-
сколько кубических сантиметров азотной кислоты и раствор снова
выпаривать.
Если в электролите присутствовали соли железа и алюминия, то
из полученного раствора их осаждают добавлением аммиака до ще-
лочной реакции по лакмусу. Осадок отфильтровывается, промывается
и анализируется затем, как указано выше, на содержание железа и
алюминия. Фильтрат же подкисляют соляной кислотой, и цинк опре-
деляют объемным методом, титруя раствором K4Fe(CN)e (см. выше).
Содержание цианида. 25 см3 электролита разбавляют до
500 см3 водой. Из полученного раствора берут 25 с.и3, разводят водой
до 200 /цм3 и добавляют сюда же окОло 5 см3 10% раствора едкого
натра и 1 см3 10%- йодистого калия. Раствор титруется 0,1 N раство-
ром AgN03 до получения постоянной желтой мути. Во время титрова-
ния раствор нужно сильно перемешивать. Для контроля к раствору
добавляется еще немного раствора гидрата окиси натрия, и в случае
исчезновения мути титрование азотнокислым серебром продолжают
опять до появления (постоянной желтой мути. 1 см3 0,1 N AgN03 соот-
ветствует 0,0098 г NaCN. Такой способ титрования дает общее содер-
жание цианидов как в виде цианистого цинка, так и в виде циани-
стого натрия.
Блюм и Хагебум указывают, что присутствие в растворе солей
алюминия не оказывает влияния на результаты титрования. В при-
сутствии гидрата окиси аммония результаты получаются преувеличен-
ными.
Общая щелочность. 25 см3 разбавленного, как указано
выше, электролита разводят до 200 см3 водой и к нему добавляют не-
большой избыток1 раствора K4Fe(CN)e для осаждения цинка. После
выделения цинка раствор титруют 0,2 N НС1 в присутствии фенол-
фталеина.
I Bureau of Standards. Techp. Paper., 195, 192(.
w
Этим методом определяется вся едкая щелочь и половина карбо-
ната. Концентрация карбоната определяется ® отдельной порции рас-
твора посредством осаждения С03" раствором хлористого бария. Из
полученных ранее результатов титрования и найденной концентрации
карбоната устанавливается содержание едкой щелочи и карбонатов в
электролите.
ГЛАВА ПЯТАЯ
КАДМИРОВАНИЕ
Кадмирование как один из видов металлических покрытий полу-
чило распространение сравнительно недавно. Развитие этого процес-
са тормозилось, главным образом, высокой стоимостью металлического
кадмия.
Кадмий не имеет достаточно распространенных руд. Он встре-
чается в виде редких минералов гренокита CdS и отавита CdC03.
В первом содержится металлического кадмия 77,8%,. во втором —
61,5%. В производстве металлического кадмия эти минералы вслед-
ствие их незначительного распространения не играют почти никакой
роли. В виде сернистых и углекислых соединений кадмий встречается
в цинковых и цинковосвинцовых сульфидных и окисленных рудах.
Однако содержание кадмия в этих рудах обычно составляет десятые
доли процента, в редких случаях доходит до 2—з%. Поэтому добы-
вается он из этих руд, главным образом, как побочный продукт при
производстве цинка.
Мировая добыча кадмия в 1922 г. составляла лишь 90 т. В 1930 г.
она возросла до 1300 т. Добыча кадмия в СССР определяется пока
сравнительно небольшими количествами. Так как производство цинка
в Союзе принимает все более и более значительные размеры, то при
более рационально установленном методе побочного извлечения кад-
мия можно ожидать, однако, что количество и стоимость последнего
в недалеком будущем будут определяться такими цифрами, которые
позволят широко внедрять этот металл в технику, в частности в ка-
честве одного из видов гальваностегических покрытий.
Применение кадмия в гальваностегии имеет очень большое значе-
ние. Он оказался одним из лучших материалов, защищающих по-
верхность черных металлов от ржавления. Покрытие кадмием как
средство защиты изделий от коррозии в некоторых случаях прево-
сходит даже цинковое покрытие. Получаемый при некоторых усло-
виях блестящий осадок кадмия может служить одновременно и как
декоративное покрытие.
1. Свойства кадмия и кадмиевых покрытий
По своим свойствам кадмий очень близко стоит к пинку, вслед-
ствие чего процесс выделения его на катоде, а также физические и
антикоррозийные свойства покрытия обнаруживают большое сход-
ство с таковыми для цинка.
Кадмий (Cd) довольно, мягкий и очень ковкий металл серебри-
185
сто-белого цвета. По степени твердости он стоит близко к олову и
золоту. Он несколько тверже олова, но мягче цинка, хорошо куется,
вальцуется в листы и легко поддается полировке. Совершенно чистый
свободный от посторонних примесей металлический кадмий, так же
к(ак и олово, при сгибании издает характерный треск.
В сухом воздухе при обыкновенной температуре кадмий почти
не изменяется. В атмосфере влажного воздуха он покрывается тон-
кой пленкой окиси, приобретающей при 200° соломенно-желтый цвет
и предохраняющей металл от дальнейшего разрушения. Замечатель-
ным свойством кадмия как защитного покрытия является способ-
ность проникать в поверхность покрываемого им металла, образуя
с ни£м поверхностный сплав:.
Технический кадмий хорошо растворяется в минеральных кисло-
тах с образованием соответствующих солей. Наиболее энергично дей-
ствует на кадмий азотная кислота. Химически (чистый кадмий (рас-
творяется в кислотах 'значительно хуже, чем технический. В отличие
от цинка кадмий не растворяется в щелочах и осаждается из раство-
ров солей в виде гидрата окиси кадмия, не растворимого в избытке
реагента. Исключение представляет действие на Cd(OH)2 водного
раствора аммиака и гидрата окиси аммония). В аммиаке гидрат окиси
кадмия растворяется, образуя химическое соединение Cd(NH3)4(OH)i.
Цианистый калий осаждает из растворов солей кадмия амморф-
пый порошок цианистого кадмия Cd(CN)2, плохо растворимый
в воде и хорошо — в избытке цианистого калия с образованием
в растворе комплексной соли K2Cd(CN)4. В чистом виде раствор этой
соли обычно получается при действии цианистого калия (в избытке),
на свежеосажденный гидрат окиси кадмия Cd(OH)2. Пары кадмия
ядовиты; при вдыхании вызывают тошноту и головную боль, ядовиты
также и растворимые соли его.
По своим электрохимическим свойствам кадмий относится
к электроотрицательной группе металлов и стоит близко к железу.
Ввиду того, что потенциалы кадмия и железа очень близки друг
к другу, относительное положение в ряду напряжений железа и
кадмия является еще до сих пор спорным вопросом. Lewis и Randall1
на основании экспериментальных исследований приводят значения
потенциалов для кадмия (Cd”) —0,3976 и для железа (Fe”)—0,441.
По данным же Willsmor2 потенциал кадмия (Cd”) — 0,42; потенциал
железа (Fe”)'—'0,34.
Как видно из приведенных значений потенциалов железа и
кадмия, нормальные потенциалы кадмия по данным различных
авторов мало отличаются друг от друга. Обращает на себя больше
внимания разница в определении потенциала железа.
Эванс3 на основании исследований элемента Fe/FeS04/CdS04/Cd,
проведенных Wrigt и Thompson, приводит порядок расположения по-
тенциалов Cd” и Fe" так, как это указывает Willsmor. Такое же
определение, как и Эванс, для обоих металлов дает Guertler4. В то же
1 Lewis a. Randall, Thermodynam. and Free Energy of Chemical Substan-
tes; Blum a. Hogaboom, Principl. of Electro pat. a. Electroform (New-Iork) 1924.
2 Willsmor. .Zeitschr. f. Phys. Chem.,* 35, 318, 1910.
3 E v a n s U. R., , Journ. Inst. Met.“, 30, 241, 1923.
4 Guertler, Metallographie, Pd. 2, Teil 1, 1921.
время Forsterl, Le Blanc2, Taylor3, Allmand и Fllingham4 ставят
в таблицах оба металла в общепринятом порядке, т. е. железо выше
кадмия. Для того, чтобы выяснить, как будет вести себя кадмий в кон-
такте с железом (в случае несплошного или пористого покрытия) при
действии на оба металла раствора поваренной соли, Роудон провел 5
следующие сравнительные испытания. Были приготовлены неболь-
шие пластинки из малоуглеродистой стали, в отверстия которых
вставлялись цилиндрические штифты из. различных других метал-
лов: цинка, кадмия, алюминия, меди, никеля, олова и свинца.
Образцы (штифты) этих металлов перед испытанием тщательно очи-
щались от всяких загрязнений, шлифовались, полировались, затем
обрабатывались мелким и влажным наждачным порошком и, нако-
нец, промывались в горячей воде и алкоголе. После этого пластины
со штифтами погружались в 0,5 N раствор поваренной соли и вы-
держивались в нем 18 и 48 час.
В результате этих испытаний оказалось, что кадмий как защит-
ное, покрытие проявляет себя подобно цинку, т. е. был установлен
в этих условиях более отрицательный потенциал кадмия по отноше-
нию к железу. При повторении этого опыта с дисками из электроли-
тического железа, взятых вместо пластин из мягкой стали, были по-
лучены такие же результаты. На основании своих испытаний Роудон
делает вывод, что «в условиях данного эксперимента кадмий в каче-
стве защитного покрытия не хуже цинка. Принятые же условия для
испытания в более слабой форме могут считаться типичными для той
среды, в которой обычно находятся кадмированные изделия из же-
леза и стали в эксплоатации».
Попутно с этим Роудон отмечает, что, «судя по скорости травления
цинка и кадмия в условиях данных испытаний, легко убедиться, что
разность потенциалов между находящимися в контакте цинком и
железом в растворе хлористого натрия значительно больше, чем ме-
жду кадмием и железом при тех же условиях». Это обстоятельство,
как видно, говорит также в пользу кадмия как защитного покрытия,
так как благодаря этому он является сам более коррозиеустойчивым,
чем цинк.
Не| касаясь вопроса идентичности условий, при проведении ука-
занными авторами определений абсолютных и относительных значе-
ний потенциалов железа и кадмия, следует отметить, что при том
разнообразии среды, в условиях которой находятся обычно кадмиро-
ванные изделия, эти значения будут колебаться еще в более резкой
форме. Как известно, потенциалы металлов, а в данном случае (для
железа и кадмия) также и расположение их относительно друг друга
зависят от целого ряда факторов, каковыми, например, могут быть:
состав, физические свойства, обработка металла (в данном случае
это относится прежде всего к железу), характер жидкой среды, со-
прикасающейся с поверхностью данного изделия, природа электроли-
тов, находящихся в растворе, и т. п.
* Forster, Elektrochemie wasseriger Losungen, 1922.
s L e Blanc. Lehrbuch der Elektrochemie, 1920.
3 Taylor, Treat, an Physikal Chemistry, 1925.
4 Allmand a. Ellingham. The Principles of applied Electrochemistry.
5 Raw don, .Trans, of the Am- Electrochem. Soc ", 49, 1926.
187
Сам Роудон в заключении своей статьи приводит следующее за-
мечание по этому поводу:
«Не нужно, однако, делать вывод, что обычные потенциалы трех
металлов: цинка., кадмия и железа обязательно расположены в том
порядке, в который их ставят результаты вышеприведенных испы-
таний. Потенциал металла, погруженного в электролит, например
в раствор одной из своих солей, зависит от многих факторов, в част-
ности от степени диссоциации этой металлической соли. И на осно-
вании теоретических соображений ясно, что два металла^ потенциалы
которых очень мало отличаются друг от друга, могут при известных
условиях занять совершенно другое место в ряду напряжений в за-
висимости от степени диссоциации соответствующих им солей в дан-
ном растворе».
Верник1, повторивший и продолживший исследования Роудона,
получил примерно те же результаты, как и последний. Соглашаясь
в общем с тем, что кадмиевое покрытие на железе дает электрохими-
ческую защиту, он также указывает на то, что последняя не всегда
бывает постоянной и может меняться в зависимости от условий
эксплоатации изделий. Бывают случаи, указывает автор, когда кад-
миевое покрытие, оставаясь почти, невредимым при очень суровых
коррозионных воздействиях, в других условиях проявляет очень сла-
бое защитное действие, вследствие чего ржавление наступает быстрее,
чем это можно было бы предполагать теоретически. Вполне возможно,
что причиной такого явления в отдельных случаях служит не столько
качество покрытия, неудовлетворительное по толщине и структуре,
сколько неблагоприятное электрохимическое взаимоотношение между
ним и основным металлом!.
Исследования Верника над коррозией цинковых и кадмиевых по-
крытии на холоднокатанной отожженной мягкой стали 0,5 N рас-
творе NaCl (температура комнатная) показали, что разрушение цинка
происходит значительно интенсивнее, нежели кадмия. В то время как
через 8 суток наблюдалось заметное растворение цинка и образование
на его поверхности объемистого белого осадка, поверхность кадмия
очень мало изменилась, покрывшись белым осадком в незначитель-
ном количестве. Сильное разъедание цинка было замечено уже после
суточного испытания, кадмий за это время слегка изменился только
по виду. В обоих случаях явлений ржавления на поверхности по-
крытых изделий не бйло.
Подобные результаты были получены нами2 при испытании цин-
ковых и кадмиевых осадков в атмосфере воздуха, насыщенного вла-
гой и в атмосфере тумана, получаемого от распыления 10% раствора
хлористого натрия при переменной температуре в обоих случаях.
Верник указывает, что белый осадок гидрата окиси металла на
поверхности цинка образуется в результате переменного действия
электрохимически образующихся продуктов: хлористого цинка на
аноде и гидрата окиси натрия на катоде.
1 Wernick. „Zeitsch. f. Elektroehemie", И, 1931.
8 H. T. Кудрявцев и Ю. Л. Державина. Неопубликованная работа
по электролитическому осаждению специальных сплавов для защиты изделий
от коррозии (Pb-Cd и Zn-Cd).
188
Так как цинк растворяется к едкой щелочи, то, йовидймому,
обычно наблюдаемое более сильное разъедание его объясняется не
только высокой разностью потенциалов, образующейся гальваниче-
ской пары (в случае пористости осадка), но и химической реакцией
между цинком и щелочью.
Отсутствие ржавления покрытых цинком и кадмием железных
изделий Верник, однако, не считает доказательством того, что в слу-
чае пористости обоих покрытий кадмий будет являться более надеж-
ной защитой, чем цинк. Дальнейшие исследования, произведенные
автором над коррозией никелевых, цинковых и кадмиевых осадков на
кусках из той же стали искусственно оголенных в отдельных участ-
ках поверхности, дали картину, характеризующую как раз обратное
положение. Испытания действием разбрызгиваемого раствора хлори-
стого натрия показали, что в этом случае цинковое покрытие, защи-
щает железо лучше, чем кадмиевое и никелевое. Автор наносил на
поверхности покрытий параллельные надрезы (перед испытанием)
шириной 0,025—ОД см. Результаты испытания приведены в табл. 34а.
Таблица 34а
Продолжит, опыта, чае Никелевыв осадок Цинковый осадок Кадмиевый осадок
Ю Ржавчина на всех над- резах, меньше всего на надрезе в 0,035 см Никакой ржавчины Никакой ржавчины
40 Дальнейшее развитие ржавчины Ржавчина показалась на надрезе шириной в 0,08 и 0,1 см Ржавчина показалась на надрезах шириной в» 0,05, 0,063, 0,8 и 0,1 см
75 Так же Надрезы в 0,05, 0,063 и 0,08 см поржавели. Надрез в 0,025 см — без ржавчины Кроме указанных слег- ка поржавел надрез в 0,025 см
По мнению Верника, высокие антикоррозийные свойства кадмие-
вых покрытий обусловлены, главным образом, присутствием на их
поверхности плотной окисной пленки. В атмосфере воздуха внутри
помещений благодаря присутствию на поверхности кадмиевых по-
крытий окисной пленки скорость дальнейшего их разрушения очень
незначительна и гораздо меньше по сравнению с коррозией цинковых
покрытий, окисная пленка которых имеет неплотное, рыхлое строе-
ние. С другой стороны, при длительном нахождении изделий на от-
крытом воздухе кадмиевое покрытие не проявляет такой высокой
антикоррозийной способности, как внутри помещения, и, как пока-
зали испытания Гиппенстил и Боргманн \ оказывается хуже чем
цинковое покрытие.
1 Hippensteel a. Borgmann, „Trans. Am. Electrochem. Soc.“, 58. 1030
18»
Гиппенстйл и Боргманн производили сравнительные испытания
кадмиевых и цинковых покрытий в атмосфере Нью-Йорка, богатой
промышленными газами и пылью. Испытания продолжались в тече-
ние полу года, причем последние два месяца половина образцов под-
вергалась «ускоренному действию атмосферы».
«Ускоренное действие атмосферы» создавалось искусственным
дождеванием образцов, которое производилось три раза в день, по
15 мин. каждый. Результаты этих испытаний, приведенные в табл. 35,
показывают, что в данных условиях, в атмосфере промышленных
районов, потеря в весе кадмиро’ванного образца значительно больше,
нежели цинкованного,, даже если сравнить с образцом, покрытым
цинком из сернокислой ванны. Из табл. 35 также видно, что кадмие-
вое покрытие, полученное при более высокой плотности тока
(3,2 А/длс2) является менее стойким против коррозии, нежели покры-
тие, полученное при обычном среднем значении плотности тока
1,1 А/дл/2. Повидимому, это объясняется более грубой структурой и
относительно- большей пористостью покрытия, полученного в первом
случае. Этим же самым объясняется и та разница, которая наблю-
дается в поведении цинковых покрытий, полученных из сернокислых
и цианистых ванн. По данным таблицы, в условиях -сурового воздей-
ствия атмосферы, кадмий ведет себя почти одинаково, как и в усло-
виях обычной атмосферы наружного воздуха.
Обращают на себя внимание приведенные в таблице данные отно-
сительно поведения цинка, полученного из цианистых ванн с цинк-
ртутными анодами. В противоположность утверждениям ряда авто-
ров (Верцлунд и др.) в данном случае покрытие, полученное' при
этих условиях, оказалось менее стойкий, нежели обычное (без при-
меси ртути в цинковых анодах).
Переходя к вопросу о толщине кадмиевых осадков, гарантирую-
щей защиту изделий от коррозии, следует отметить, что мнения раз-
личных авторов в этбм вопросе сильно расходятся. Планер1 считает,
что для гладких, ровных поверхностей достаточной толщиной слоя
можно считать 0,0025 мм, что соответствует весовому количеству
кадмия в 22 г!'см2. В целях гарантии безопасности можно рекомендо-
вать толщину осадка в 0,004 льи. Для пористых изделий толщина
слоя должна быть значительно повышена с таким расчетом, чтобы
кадмий мог заполнить все поры. По Планеру, осадки толщиной
в 0,0025 мм совершенно беспористы. Он указывает, что при испыта-
нии разбрызгиванием 20% раствора поваренной соли изделия, покры-
тые кадмием на толщину слоя 0,002—0,0035 .ил/, не обнаруживали
никаких следов ржавчины в течение 1860 час., в то время как хо-
рошо оцинкованные предметы выдерживали такое испытание Р сред-
нем 650 час., а никелированные покрытия той же толщины, как и
кадмиевые, давали пятна уже через 2 часа2.
Верник считает неверным утверждение Планера относительно бес-
пористости кадмиевых осадков толщиной в 0,0025 мм, указывая, что
все кадмиевые покрытия в начальной стадии осаждения (в тонких
слоях) пористы. Он справедливо замечает, что заключение Планера
1 Planer, .Zeitschr. f. Elektrochemie", 1, 1931.
’Planer u. Schlotter, „Zeitschr. f. Mettallkunde*, 22, 1930.
190
основано на Неправильном методе, испытания. пористости кадмиевых
осадков, который применял автор. Последний производил испытание
железосинеродистым калием, в то время как известно, что проба
раствором этой соли дает результаты только в случае покрытия же-
леза более электроположительными металлами х.
Рядом опытов Верник установил, что критическая толщина слоя
кадмиевого покрытия (толщина слоя, при которой покрытие стано-
вится беспористым) составляет приблизительно 0,004^0,005 мм, что
соответствует весу осадка в 35—43 г/м2. Минимальная толщина слоя,
гарантирующая надежность покрытия, по мнению автора, должна
быть увеличена на 50%. Для очень крупнозернистых осадкой, полу-
чаемых обычно из сернокислых ванн, критическая толщина слоя
должна быть значительно больше.
На основании своих исследований, а также испытаний, проведен-
ных Гиппенстилом. и Боргманном, Верник приходит к заключению, что
минимальную надежную защиту от коррозии может давать кадмие-
вый осадок толщиной в 0,0075—0,01 мм. В тех случаях, когда кадмие-
вые покрытия подвергаются продолжительному Воздействию наружной
атмосферы воздуха, минимальная толщина слоя должна соответство-
вать 0,0125 « Такая же толщина как минимум рекомендуется и
для цинковых покрытий.
2. Электролитическое кадмирование
Покрытие кадмием производится почти исключительно электро-
литическим способом. Вследствие дороговизны кадмия, ядовитости
паров его применение методов погружения изделий в расплавленную
массу металла или шоопирования при кадмировании нецелесообразно.
Электролитическое кадмирование производится как в кислых, так
и в щелочных цианистых ваннах. По своему характеру процессы,
протекающие: при электролизе кадмия, как и свойства осадков, из-
меняющиеся в зависимости от применения тех или иных рецептур-
ных условий, имеют большое сходство с явлениями, разобранными
выше при электролитическом цинковании. Рецептурные условия,
применяемые для кадмирования, также имеют много общего с опи-
санными выше для цинкования. В отличие от цинкования в щелоч-
ных ваннах кадмирование в простом щелочном растворе, не содер-
жащем цианистый калий, не производится, так как кадмий, как
указывалось выше, в избытке щелочи не растворяется2. В щелочных
цианистых ваннах кадмий находится в растворе в виде комплексной
соли Na2Cd(CN)4 или NaCd(CN)3. Выделение металла на катоде из
раствора этой соли происходит так же, как указывалось выше для
комплексной цианистой цинковой соли, т. е. в результате разряда
Cd”, образующегося при диссоциации комплексного аниона по схеме
указанной на стр. 192.
1 Планер в своей статье соглашается с тем, что кадмий на железе дает
анодную защиту, т. е. по отношению к последнему он является более электро-
отрицательным металлом.
а Аммиачные растворы без цианистых солей применения в гальваностегии
не имеют.
191
Атмосферная коррозия кадмиевых
Нормальные атмосферные
общая потеря общая потеря
в .«г ск1 за год; в мг/см2 за год1;
образец перед взве- образец пе; ед взве-
шиванием очищался шиванием очищался
мягкой щеткой жесткой щеткой
Кадмий из цианистых ванн при Dh 3,2 .Ии2 9,2 ±0 9,3 ±0
Кадмий из цианистых вани при /Дй= 1.1 Ь/Ом2 . ... 5,6 ±0,1 ’ 5,4 + ОД ’
Цинк из сернокислых ванн Dh — 1,6 А/Й.с2 3,7 ± 0,05 3,9 ± 0,35
Цинк из цианистых ванн с ртут- ными анодами (Hg до и°/п) Dk= 1,6 А/5и2 ... 3,3 ±0,15 3,2 ±0,1
Цинк из цианистых ванн с обыкно- венными анодами Dft=l,6 А/5лг< 2,4 ±0 2,4 ± 0,05
Na2Cd(CN)4^2Na* + Cd(CN)/',
Cd(CN)4"i=iCd'* + 4CN',
Cd“4-20 = Cd.
Вследствие этого потенциал кадмия и катодная поляризация
в цианистых кадмиевых ваннах значительно выше, нежели в кислых.
Это обусловливает, в свою очередь, высокую рассеивающую способ-
ность этих ванн и образование осадков с очень мелкозернистой струк-
турой. В отношении рассеивающей способности цианистые кадмие-
вые растворы, как показали исследования Н. Т. Кудрявцева и
Ю. Л. Державиной 2, а также практические данные производственной
работы этих ванн, дают относительно лучшие результаты, нежели
цианистые цинковые растворы. Очень рельефные изделия из циани-
стых кадмиевых ванн покрываются более равномерным слоем, не-
жели цинком из сответствующих цианистых цинковых растворов
вполне удовлетворительного состава. Плотности така для цианистых
кадмиевых ванн практически применяются обычно того же порядка,
как и для цинковых (1—2 А/дм2).
Кислые кадмиеЬые ванны без добавок коллоидов или поверх-
ностно активных веществ дают очень куппозернистые осадки, бо-
лее; грубые, чем такие же из цинковых ванн. Соответствующие до-
бавки уменьшают степень зернистости осадка, но не до такой степени,
какуй) имеют осадки, получаемые из цианистых ванн. Плотности
тока в кислых кадмиевых ваннах обычно допускаются не выше, чем
в цианистых. Высокие плотности тока, как показали исследования
1 Цифровые данные получены соответствующим пересчетом результатов
6-месячного испытания.
2 Кудрявцев Н. Т. и Державина Ю. Л. Исследования рассеиваю-
щей способности цинковых и кадмиевых ванн (работа проведена в электрохими-
ческой лаборатории ВЭИ).
192
Таблица 35
и цйивовых покрытии иа Стали
условия Ускоренное действие атмосферы
средняя троницаемость см}год общая потеря в мг/см? за год; образец перед взвешиванием очищался мягкой щеткой общая потеря в мг/см? за год; образец перед взвешиванием очищался жесткой щеткой средняя проницаемость см'год
0,00107 8,7 ± 0,4 8,5 ± 0,1 0,00099
0,00064 1 6,0 ±0,1 > 6,2 ±0,2» 0,0007
0,00053 5,8 ± 0,10 5,6 ±0,35 0,00079
0,00045 4,9 ± 0,10 4,7 ±0,5 0,00067
0,00033 4,2 ± 0,05 4,4 ±0 1 0,0006
Н. Т. Кудрявцева и Е. В. Осиповой, возможны только при опреде-
ленных рецептурных условиях, предлагаемых авторами для кадми-
рования проволоки (см. ниже). Поэтому в производстве для кадмиро-
вания изделий разнообразной формы цианистые ванны имеют боль-
шее распространение, нежели кислые, несмотря на то, что они, так,
же как и цианистые цинковые ванны, имеют ряд крупных недостат-
ков, например неустойчивость состава электролита, ядовитость, не-
экономичность вследствие высокой стоимости цианистого калия.
Последний момент в кадмиевых ваннах, впрочем, имеет меньшее
значение, так как стоимость самого кадмия пока очень высокая.
А. Кислые кадмиевые ванны
Наиболее изученными и заслуживающими внимания являются
сернокислые, кремнефтористоводородные, перхлоратные и фенол-
сульфоновые кадмиевые ванны. В зависимости от рецептуры и ре-
жима процесса получаемые осадки кадмия из этих ванн очень разно-
образны по своему характеру. Исследования различных авторов
показывают, что помимо известных факторов, влияющих на процесс
катодного осаждения металлов (плотность тока, концентрация ионов,
температура, кислотность добавки), имеет большое значение, как
отмечено выше (гл. IV), природа аниона, входящего в состав электро-
лита. Поскольку в указанных электролитах состав последнего очень
различен, то, невидимому, роль его в процессе осаждения кадмия
будет занимать не последнее место.
Мюллер и Бархманн 1 установили, что при электролитическом вы-
делении кадмия, так же как и цинка, различные анионы, присут-
ствующие в растворе, оказывают не одинаковое влияние на измене-
* Muller и. В ar ch man n, .Zeitschr. f. Elektrochemie*, 39, 1933.
13 Основы гальваностегии. 178В
193
ййе поляризации. Увеличивая нбчТи в оДййайбвой Мёре КАК КАТоД-
ную, так и анодную поляризацию, они располагаются в следующем
порядке по степени своего влияния: СГ, Вт', S0"4 и С10'4 (фиг. 86).
Если рассматривать влияние этих анионов в зависимости от темпе-
ратуры, то во всех случаях с повышением температуры обнаружи-
вается обычное понижение катодной поляризации при том же рас-
положении анионов по степени их влияния. На фиг. 87 показаны по-
ляризационные кривые, полученные в 1 N растворе CdSO4, подки-
сленном до 0,1 N HJS04 при температурах от 0 до 55°. Очень резкое
Потенц. равновесия: Cd/CdCl? ~465mv
Cd/CdBrg -484
Cd/Cd$04 ‘ 430
Cd!Cd(CL04)2- 412
Фиг. 86. Влияние аниона на поляризацию при элек-
тролизе кадмия.
изменение поляризации в зависимости от температуры наблюдается
.в 1 N растворе 'Cd(C104)2, подкисленном до 0,1 N НСЮ4 (фиг. 88).
Как было указано (гл. IV), неодинаковое влияние анионов) на-
изменение 1величины поляризации авторы объясняют различием в их
размерах.
Катодные выходы по току и характер отложений при одинаковой
концентрации ионов кадмия и кислоты в растворах, содержащих
различные анионы, получаются также различными. При выделении
кадмия из сернокислых и перхлоратных растворов выход по току
Выше, нежели из хлористых и бромистых растворов (фиг. 89). Из
растворов хлористых и бромистых солей кадмия осадки имеют более
крупнозернистую структуру, нежели из сернокислого раствора. Наи-
194
более плотные й Мелкозернистые осадки были получены из раствора.
перхлората кадмия.
Добавление в указанные раство-
ры желатины увеличивает значение
поляризации, но также не в одина-
ковой степени для каждого.
Наибольшее влияние желатины
оказывается в перхлоратных раст-
ворах, т. е. растворах, в состав
которых входит анион наибольшего
размера. Также и в сернокислом
растворе ото влияние больше, не-
жели в хлористом и бромистом
(фиг. 90 и 91). Авторы указывают,
что в растворах сернокислого кад-
мия с добавкой желатины можно по-
лучать такие же плотные и мелко-
зернистые осадки, какие выделя-
ются по их данным только из пер-
хлоратных растворов (без добавки
желатины).
Верник1, исследуя сернокислые
кадмиевые ванны с точки зрения
влияния изменений Ph, плотности
тока и температуры раствора на
кристаллическую структуру осадка
и выходы по току (анодный и ка-
тодный), установил следующее: со
временем электролиза концентрация
Полпнимл е
равновесия 6 20- 430 •«
сернокислом 55 - 418 "
растворе
Фиг. 87. Влияние температуры на
поляризацию кадмия.
кислоты в растворе сернокис-
Фиг. 88. Влияние температуры иа поляризацию кадмия.
1 Wernick, „Trans. Am. Electrocliem. Soc.", 62, 1932.
195
лого кадмия постепенно убывает (Ph возрастает). После некоторого
предела, получающиеся сначала мелкозернистые осадки становятся
потом более крупнозернистыми и темными (при Ph —6). Хорошие)
осадки, как указывает автор, получаются при Ph^=5—5,7. Для
сохранения постоянства Ph Верник рекомендует вводить в элек-
тролит соединения, обладающие буферным действием. В качестве
буфера им были проверены сернокислый алюминий, уксуснокис-
лый натрий, одна борная кислота и совместно с хлористым натрием.
Смесь борной кислоты с хлористым
таты св отношении поддержания
кислотности в указанных преде-
лах Ph.
Повышение плотности тока в
таком электролите сказывается
благоприятно па структуре осад-
ка, делая ее более мелкозерни-
стой, и мало отражается на анод-
ном и катодном выходе по току.
Достаточно удовлетворительные
осадки получаются при плотно-
стях тока 1—4,5 А/дм5 * * 8. В пре-
делах плотностей тока от 1 до
натрием дает лучите резуль-
Фиг. 90. Влияние желатины на поляри-
зацию при осаждении кадмия.
Фиг. 89. Выход тока при выде-
лении кадмия из кислых ванн.
5 А/дм2 изменение выхода по току составляет 1,4—1,6%. При очень
низких плотностях тока осадки очень грубые и состоят из отдель-
ных кристаллов или групп кристаллов. Заметное влияние на струк-
туру осадка в сернокислом электролите оказывает увеличение
температуры. При постепенном повышении температуры раствора
наблюдается сначала уменьшение зернистости осадка, а затем уве-
личение. Вследствие этого автор не рекомендует увеличивать темпе-
ратуру в сернокислом кадмиевом электролите выше 40—50°. Для
получения бодее светлых, гладких и мелкозернистых осадков Верник
рекомендует добавлять в ванну коллоиды.
196
Хорошие осадки даст сернокислая кадмиевая ванна в присутствии
добавки пептона. Такая ванна, с низким Ph и без буфера, получен-
ная в результате исследовательской работы Изгарышева Н. А. и Орло-
вой С. И.1, имеет следующий состав:
сернокислый кадмий [CdSO48/3H2O] . . 104,2 г
„ аммоний [(NH4)2SO4] ... 66 ,
пептон................................ 2,5 „
вода................................... 1л
Ph.................................... 2,8—4
Плотность тока 0,6—0,7 К!дм2, температура комнатная, напряже-
ние па ваннь 0,4 V при расстоянии между электродами 5 см и 1,4 V
при расстоянии 15 йи. Выход металла но току 95—99%. По мере ра-
Фиг. 91. Влияние желатины на поляризацию при
осаждении кадмия. Электролит: 1 N Cd (С1О4\ -|-
4-0,1 ДГ НС104.
Фиг. 92. Структура кадмиевых
покрытий в нейтральных крем-
нефтористоводородных раство-
рах при 18°, 100 Щдм?, ув. 500.
боты ’ванны необходимо периодическое подкисление раствора и вве-
дение пептона.
Получаемые из этой ванны осадки — светлые, слегка серебри-
стые. Достаточно удовлетворительные осадки приблизительно из та-
кого же раствора сернокислого кадмия получаются при замене пеп-
тона клеем в количестве 1—2 г/л 2.
ИзгарышевН. А. и Орлова С. И., „Цветные металлы* № 6, 1930.
» Кудрявцев Н. Т. и Осипова Е. В. Электролитическое кадмирование
при высоких плотностях тока, сборник Роскрепметиза, 1933; Сборник статей:
«Борьба с коррозией — борьба за металл*, 1935,
19?
Электролиты из кремнефтористоводородных, перхлоратных и фе-
нолсульфоновых солей кадмия достаточно подробно были исследо-
ваны Планером1. Полученные им осадки кадмия из кремнефтори-
стоводородных и перхлоратных ванн были недостаточно удовлетво-
рительного качества. Наихудшей в этом отношении оказалась ванна
перхлоратная, содержащая свободную кислоту до 0,1 N. Она давала
Фиг. 93. Структура кадмие-
вых покрытий в нейтраль-
ных кремнефтористоводо-
родных растворах в при-
сутствии солодкового кор-
ня при 18°, 100 А/дм2, у в. 500.
Фиг. 94. Структура кадмие-
вых покрытий в феиолсуль-
фоновых растворах в при-
сутствии коллоидов и
капиллярно - активных ве-
ществ, ув. 500.
сетчатое покрытие, не сплошь закрывающее поверхность основного
металла. Автор объясняет это -явление недостаточным смачиванием
катода перхлоратным раствором, отличающимся незначительным по-
верхностным натяжением. Кроме того эта ванна, имеющая кислот-
ность от 0,05 до 0,1 N без примеси коллоидов, дает очень крупнозер-
нистые осадки. Величина отдельных кри-
Фиг. 95. Структура кад-
миевых покрытий из
сульфофеиоловой ванны
с добавкой коллоида при
t — 15° и Dk = 5 А/дм2.
дов и кислоты до 0,1 N
изменялись в лучшую
сталлов, как отмечает автор, доходила до
0.5 мм в диаметре. Добавки коллоидов в
значительной степени уменьшают зерни-
стость осадков (приблизительно в 50 раз).
Наиболее мелкозернистые осадки получа-
лись после введения фенола, но при этом
они принимали темный оттенок и сильно
падал выход по току.
кремнефтористоводородная ванна с до-
бавками коллоидов в отношении мелко-
зернистости осадка дала лучшие результа-
ты, нежели перхлоратная. В нейтральной
ванне без добавок при плотности тока
1 А/дм? и температуре 18° получались также
плохие крупнозернистые и даже губчатые
осадки (фиг. 92). Но после введения коллои-
вид и кристаллическая структура их резко
сторону. Очень мелкозернистые красивые
осадки дает эта ванна после введения экстракта солодкового корня
1 „Zeitschr. f. Electrochemie", 37, t, 1931. Статья Планера имеется также в
русском переводе, Кадмий как предохранитель [от коррозии, Цветметиздат, 1933.
198
(фиг. 93). Однако эффект, получаемый от такой добавки, очень не-
постоянен. Наряду с положительным влиянием на качество осадка
добавка экстракта солодкового корня становится причиной появле-
ния местных губчатых образований на катоде. Повышение темпе-
ратуры как в этой, так и в других кислых ваннах увеличивает
зерно осадка. При очень низких температурах — при 0° и ниже — в
кремнефтористоводородной ванне Планер получал осадки кадмия
1гри плотности тока = 8А/дл1 2 необыкновенно блестящие, похожие на
полированную поверхность никелевых покрытий. Крупным недостат-
ком, препятствующим использованию таких покрытий в промышлен-
ности, является хрупкость и неплотность приставания их к поверх-
ности основного металла.
Наилучшие осадки по виду и степени зернистости были получены
Планером в фенолсульфоновых ваннах. Автор об'ьясняет это обстоя-
тельство влиянием аниона, указывая, что в растоворах сульфофеноло-
вой кислоты получается соль кадмия с более сложным анионом, не-
жели в других из приведенных выше растворов. Необходимым усло-
вием для получения хороших осадков из этой ванны является повы-
шенное содержание свободной кислоты приблизительно до 0,5 N. При
этой кислотности осадки получаются более темные, но почти с теоре-
тическим выходом по току. Нейтральная или слабо подкисленная
ванна до 0,1 N дает губчатые отложения. Повышение температуры и
плотности тока увеличивает зернистость осадков, делая их более гру-
быми. Хорошие осадки с высоким выходом по току дает кислая
0.5N сульфофеноловая ванна с коллоидом после добавления к ней
5 г/л капиллярно-активного вещества1 (фиг. 94).
При очень высоких плотностях тока, порядка 5 А/д.м2, осадки
кадмия из такой ванны при температуре 15° получаются блестящими,
но хрупкими, легко отслаивающимися (фиг. 95).
Как показали исследования Планера, с повышением плотности
тока и температуры раствора выход металла по току во всех кислых
ваннах увеличивается. На фиг. 96 и 97 даны кривые, характеризую-
щие изменение выходов по току 'вообще для кислых кадмиевых ванн
и в частности для перхлоратной ванны, содержащей свободную кис-
лоту около 0,1 N.
Отмечая фенолсульфоновую ванну как наилучшую из трех пере-
численных. Планер рекомендует применять в производстве для нее
плотности тока от 1 до 1,5 А!дм* и температуру электролита поддер-
живать около 40°. Более высокое значение плотности тока и темпера-
туры хотя и повышает выход по току в кислой ванне, но ухудшает
структуру осадка, делая его более крупнозернистым. К сожалению, в
сообщении Планера ни в одном случае не приводятся достаточно
полные данные в отношении состава и других условий, про'веренных
им электролитов.
Исследования сульфокислых ванн, проведенные Кудрявцевым Н. Т
и сотрудниками2 с целью получения наилучших условий в отно-
1 Автор ие указывает, какое капиллярно-активное вещество добавлялось
в сульфофеноловую кадмиевую ванну.
2 К у д р я в ц е в Н. Т., Державина Ю. Л. и Ч а м и и а И. И., Работы
jb электрохимической лаборатории ВЭИ.
ЩО
шении равномерности покрытия в кислых электролитах, показали,
что сравнительно хорошие по виду и структуре осадки дает ванна
следующего состава:
фенолдисульфоновый кадмий . . . C6H3Cd(SO3)2OH 1 N
фенолдисульфоновая кислота . . . C6H3(HS03)a0H 0,5 N
клей.......................................... 1 г/л
Плотность тока 1—3 А/дм2, температура комнатная: 18—22°.
Близкие результаты получаются при кадмировании из бензолди-
сульфоновых и фенолсульфоновых ванн такого же приблизительно
Фиг. 96. Влияние плотности тока
на выход тока при разных темпе-
ратурах.
Фиг. 97. Влияние температуры
на выход тока при разных плот-
ностях тока.
состава. Приготовляются эти электролиты путем растворения гидрата
окиси кадмия или углекислого кадмия в заранее приготовленной со-
ответствующей сульфокислоте. Рассеивающая способность этих ванн
невысокая, по крайней мере не выше обычных сернокислых элек-
тролитов.
Подобно тому как при процессе цинкования, хорошие осадки кад-
мия в кислых ваннах можно получать также и при очень высоких
плотностях тока, от 5 до 150 А/дм2 и выше, как показали исследова-
ния Кудрявцева Н. Т. и Осиповой Е. В.х.
’Кудрявцев Н. Т., Осипова Е. В., Сборник Роскрепметиза, 1933;
Сборник статей: „Борьба с коррозией — борьба за металл*, 1935.
200
Авторы производили осаждение кадмия на поверхность различ-
ных образцов проволоки как в стационарной ванне, так и на кон-
вейерной установке. Опыты показали, что основными факторами до-
пускающими применение высоких плотностей тока в кислых кадмие-
вых ваннах, так же как и в кислых цинковых, является: высокая,
почти насыщенная концентрация соли выделяющегося металла (серно-
кислый кадмии), воздушное перемешивание, определенная невысокая
кислотность и повышенная температура электролита. Кроме этого, в
отличие от цинковой ванны в кадмиевой оказалась весьма полезной
при этих условиях осаждения добавка в раствор небольшого количе-
ства клея. Без клея осадки получались менее гладкими и крупнозер-
нистыми, местами очень шероховатыми. Оптимальное содержание
клея в ванне было установлено около 1 г/л.
Рекомендуются следующие условия для кадмирования проволоки
при очень ’высоких плотностях тока на конвейерной установке:
Состав электролита:
сернокислый кадмий (CdSO4-8/3HsO). 350—380 г
борная кислота Н3ВО3............. 10 „
клей.............1г
вода.............1л
Ph...............3-4
плотность тока . . 30—150 к/дм'-
Перемешивание электролита — посредством вдувания сильной
струи воздуха непосредственно под проволоку. Количество пропу-
скаемого воздуха 0,5—1 л на 1 л электролита. Температура элек-
тролита при плотности тока (выше 50 А/д1м2 до 40°; выход по току
96—100%; аноды из чистого кадмия; расстояние между электродами
2,5—4 см. Рекомендуется перетекание и периодическая или непре-
рывная очистка электролита от шлама путем фильтрования или
отстаивания.
Б. Цианистые кадмиевые ванны
Основными компонентами цианистых кадмиевых ванн являются
цианистая соль кадмия, цианистый калий или натрий и едкая щелочь.
Приготовление электролита производится так же, как и цианисто-
цинкового раствора. Исходным материалом для получения в растворе
цианистой кадмиевой соли служит окись кадмия CdO, гидрат окиси
кадмия Cd(0H)2 и углекислый кадмий CdCO3. Несмотря на то, что
углекислый кадмий как исходный материал для цианистой ванны
очень часто упоминается в литературе, применения этой соли все же
следует избегать, так как в результате взаимодействия ее с циани-
дой в растворе образуются карбонаты — примесь излишняя и
нежелательная.
Реакция взаимодействия, гидрата окиси кадмия с цианистым нат-
рием (также и с цианистым калием) идет по уравнению:
Cd(0H)2 + 2NaCN^Cd(CN)2 + 2NaOH,
Cd(CN)2 + 2Na.CN = Na2Cd(CN)4.
201
Образующаяся комплексная цианистая соль является, как ука-
зано выше, единственным растворимым соединением кадмия в та-
ком растворе, и потому присутствие цианида, регулирование его кон-
центрации играет решающую рать в работе цианистой ванны.
Уэстбрук1 рекомендует для обычных целей концентрацию этой
соли в кадмиевой ванне около 0,7 N, что соответствует содержанию
металлического кадмия в растворе около 40 г/л. По Блюму и Хаге-
буму 2, содержание кадмия может колебаться в пределах от 15 до
30 г/л, т. е. от 0,25 до 0,5 N. Верник 3 допускает концентрацию кадмия
в ванне в более широких пределах, от 5 до 30 г/л. Изменение содержа-
ния кадмия в Ранне вызывает изменение и концентрации свободного
цианида.
По данным Уэстбрука, кадмиевая ванна с содержанием 40 г/л ме-
таллического кадмия (0,7- Л’) и выше - является более эффективной,
нежели ванны, предлагаемые другими авторами. Она допускает при-
менение сравнительно высокой плотности тока (до з,25 к/дм-) при
очень высоком выходе по току, хорошо работает в глубину, давая
равномерные, гладкие мелкозернистые осадки, и, кроме того, при про-
должительной работе почти не изменяется по составу.
Изменение выхода по току в зависимости от концентрации кад-
мия в цианистом растворе и- плотности тока, по данным Уэстбрука,
иллюстрируется цифрами табл. 36.
Таблица 36
Концентрация кадмия Выход металла по току, %
N г/л Dk = 2Д5К/дмя Dk = 3,23 А/д.и2
0,8 45 98 96
0,53 30 94 88
0,40 22,5 85 80
0,27 15 76 71
0,2 11 72 70
0,13 7 65 60
Автор отмечает, Ито приведенные им данные не выражают абсо-
лютную "величину максимального (возможного) выхода по току, по-
лученного для указанных концентраций кадмия в растворе, но дают
только относительное представление о типичной зависимости этих
значений для цианистой кадмиевой ванны.
Повышение концентрации в ванне других компонентов, главным
образом едкого натра, по данным Уэстбрука, способствует увеличе-
нию выхода по току.
Изменение выходов по току, как известно, ведет к изменению со-
става ванны.; Нарушение постоянства состава цианистого кадмиевого
1 W estbrook, .Trans Am. Electrochem. Soc.“. 55. 1929.
2Bluma a. Hogaboom, Principles of the Electroplating ?. Electrofor
ming, 1930.
3 We r nick. .Zeitschr. f. Electrochemie", 11, 1931,
202
электролита большей частью, как показывают практические данные,
вызывается понижением анодного выхода по току (при достаточно,
высоком выходе по току на катоде). Как указывалось выше, вщиани-
стых ваннам с увеличением анодной плотности тока выход тока на
аноде вследствие большого повышения величины анодной поляри-
зации понижается в сильной степени (пассивирование анодов), осо-
бенно если свободный цианид и едкая щелочь в растворе находятся
в недостаточном количестве. Кроме того кислород, выделяющийся
при этих условиях на аноде, реагируя с цианистыми солями, умень-
шает их содержание в ^растворе (окисление цианидов в цианаты:
KCN + 0 —► KCNO), вызывая тем самым еще большее понижение
концентрации кадмия. Как указывалось раньше, концентрация циа-
нидов независимо от условий электролиза понижается также за счет
углекислоты воздуха (разложение цианидов и образование карбо-
натов).
Для того чтобы состав цианистого кадмиевого электролита не под-
вергался сильным изменениям, Уэстбрук рекомендует соблюдать сле-
дуя щие условия.
1. Плотность тока на аноде должна быть низкой и не превышать
2,15 А/дмi 2. Таким образом поверхность кадмиевого анода следует де-
лать равной или, еще лучшеГв два раза большей поверхности катода.
2. Избегать совершенно применения инертных, нерастворимых
анодовх.
3. Количество свободного цианида в ванне всегда должно быть
достаточным.
Содержание свободного цианида в ванне способствует, как из-
вестно, понижению анодной поляризации и повышению растворимо-
сти металла на аноде. Кроме того присутствие избытка свободного
цианида в ванне понижает степень диссоциации цианисто-кадмиевой
соли (уменьшение концентрации ионов кадмия), повышая тем самым
катодную поляризацию. Это обстоятельство, в свою очередь, обуслов-
ливает, как известно, уменьшение зернистости осадка и повышение
рассеивающей способности электролита. Кадмиевое покрытие при этом
условии подучается более равномерным, гладким и блестящим. По-
нижение выхода по току на катоде, обычно наблюдаемое при избытке
цианидов, по мнению Уэстбрука, устраняется в кадмиевой ванне
соответствующим повышением концентрации едкого натра.
Уэстбрук рекомендует поддерживать концентрацию свободного
цианида в кадмиевой ванне таким образом, чтобы она соответствова-
ла приблизительно количеству связанного цианида, т. е. на 1 моле-
кулу NaCd(CN)3 должно приходиться з—4 молекулы NaC№. При
О J N Cd количество свободного цианида будет, поводимому, со-
ответствовать по Уэстбруку 1—1.4 N или на 40 г Cd 50—70 г свобод-
ного NaCN. Верник3 для своей ванны (5—30 г/л Cd) рекомендует
i В противоположность Уэстбруку В ери и к, отмечая высокую раствори-
мость кадмиевых анодов, рекомендует заменять 75% кадмиевых анодов нераст-
воримыми стальными. На основе практического опыта мы соглашаемся с заме-
чанием Уэстбрука и считаем мнение Верника неверным.
2 Уэстбрук выражает цианистую кадмиевую соль в растворе формулой
NaCd(CN)3, называя ее .двойной цианистой" солью,
з Loc, cit.
203
поддерживать концентрацию свободного цианида от 6 до 60 г/л. При
этом: он указывает, что свободный цианид в. количестве, соста-
вляющем не более 125% по отношению к связанному цианиду, не
оказывает заметного влияния на выход по току. Более высокая кон-
центрация свободного цианида вызывает уже заметное нарушение
нормального хода анодного и катодного процессов. Верник' справед-
ливо отмечает, так же как и Уэстбрук, что присутствие свободного
цианида уменьшает степень зернистости осадка, сообщая ему свет-
лую, белую окраску. Уменьшение зернистости осадка, по мнению
автора, достигается и добавками в ванну едкой щелочи.
Блюм.1 и Хагебум1, в отличие от указанных выше авторов, реко-
мендуют более низкую концентрацию свободного цианида, именно
7,5—30 г/л, т. е. 0,15—0,6 N.
В отношении содержания едкой щелочи в кадмиевой ванне мнения
различных авторов также расходятся. Если в качестве исходного про-
дукта для цианистой кадмиевой ванны служит Cd(OH)2 или СсЮ, то
едкий натр в эквивалентном количестве по отношению к цианистой
соли кадмия Cd(CN)2 образуется в растворе при самом уже приготов-
лении ванны. Однако в литературе очень часто состав цианистой
кадмневюй ванны приводится совершенно без указания на щелочь2
и)ли с указанием на содержание ее в незначительном количестве3.
Можно предполагать, что авторы, дающие такие рецепты, исходят при
приготовлении ванны из Cd(CN)2, избегая, невидимому, вообще при-
сутствия в растворе едкой щелочи.
Уэстбрук считает, что едкий натр и свободный цианид, находясь
совместно, в растворе оказывают друг другу услугу, взаимно уничтожая
отрицательное влияние каждого на характер процесса, не теряя в то
же время! и своего положительного влияния. Автор рекомендует при-
менять концентрацию едкого натра 0,25—1 N, т. е. 10—40 г/л раствора.
При таком содержании едкого натра в ванне наблюдается, как указы-
вает автор, увеличение проводимости электролита и катодного вы-
хода металла по току, повышение катодной поляризации, особенно
.при низком содержании свободного цианида и улучшения качества
покрытия. В присутствии едкого натра осадок кадмия получается бо-
лее светлым, блестящим и эластичным (увеличение пластичности).
Введения большого количества едкого натра В кадмиевую ванну
следует избегать, так как избыток щелочи может вызвать в отноше-
ния катодного выхода по току обратное явление'. Согласно указанию
Уэстбрука слишком низкая концентрация едкого натра в электролите
оказывается тоже вредной — осадки могут получиться хрупкими.
Блюм и Хагебум дают концентрацию едкого натра в кадмиевых
ваннах, соответствующую 0,5 А. или 20 г/л.
Помимо указанных основных компонентов в цианистых кадмие-
вых ванпах применяются иногда добавки коллоидов и других солей.
Уэстбрук считает полезным введение в цианистый электролит серно-
кислого натрия приблизительно около 0.5 А (35 г/л),, концентрация
этой соли не ограничивается определенными пределами. Он указы-
1 В1 u m a. Ilogaboom, см. выше.
s Planer, .Zeitschr. f. Electrochemie“, ,1, 1931.
• Изгарышев H. А. и О'рлова С. И., „Цветные металлы* *, № 5,
J93O.
204
лает, что эта добавка- да процесс осаждения кадмия не оказывает
почти никакого влияния. Практика показала, что сернокислый нат-
рий делает более устойчивым состав электролита, однако механизм
этого влияния точно не установлен.
Большое внимание в цианистых кадмиевых ваннах уделяется
добавкам различных веществ, влияющих на структуру и наружный
вид осадков. Уэстбрук разделяет эти добавки па два вида: 1) неор-
ганические вещества, придающие блеск (покрытию, и 2) органические
дополнительные агенты. К первому. виду относится определенная
группа металлов, которая при очень незначительном уже содержа-
нии в ванне вызывает заметное улучшение физических свойств по-
крытия, например усиление блеска, повышение ковкости и т. д.
К таким металлам относятся никель, кобальт и медь. Наибольшей
эффективностью обладает добавка никеля. По данным Уэстбрука, та-
кие незначительные количества никеля, как 0,001—0,01 г/л, дают за-
метное улучшение качества покрытия. При содержании Ni 6,01 г/л
покрытие делается уже заметно блестящим. Автор рекомендует при-
менять добавку никеля в количестве 0,2—0,3 г/л. Добавки кобальта
и меди оказывают влияние при больших концентрациях и в мень-
шей степени, нежели добавка никеля. Механизм влияния этих добавок
на (процесс осаждения металла является пока недостаточно выяснен-
ным. Повидимому, основной причиной улучшения качества покрытия
в присутствии никеля является повышение катодной поляризации, а
в некоторых случаях и частичное осаждение его совместно с кадмием,
хотя Уэстбрук, впрочем, указывает, что при обычном анализе осад-
ка, полученного из ванны, с небольшой добавкой никеля присутствие
последнего не было обнаружено. Такие случаи сильного влияния на
физические свойства покрытия незначительных количеств добавок к
раствору посторонних металлов известны также и при других видах
отложения металлов. Так например, Кудрявцевым Н. Т. и Держави-
ной Ю. Л. наблюдалось появление сильного блеска на поверхности
обычно темных свинцово-кадмиевых покрытий при незначительном
содержании В сплаве кадмия Ч Известно такое же влияние Cd при
электроосаждении никеля в соответствующем электролите.
Из группы органических дополнительных агентов в кадмиевых
ваннах -применяются различные органические соединения, например
сульфокислоты (нафтоловые и нафталиновые), сульфированные
масла1 2: касторовое, ализариновое и др. и вещества органического
происхождения с неизвестным сложным составом: гулак3, биндекс,
стходы Стеффенса, конденсированные сточные воды от крахмального
производства и т. д.4.
Действие этих добавок ь основном сводится к увеличению катод-
ной поляризации, повышению рассеивающей способности ванн и сте-
пени мелкозернистости осадка. Причина такого влияния органиче-
ских добавок объясняется, повидимому, проявлением коллоидных и
1 Кудрявцев Н. Т. и Держа вина Ю. Л. Исследования по электро-
литическому осаждению свинцово-кадмиевых сплавов; работа электрохимической
лаборатории ВЭИ.
а Патенты США и других стран.
3 Патенты США № 1681509 и 1564414.
4 Claussen a. Olin, .Trans. Am. Electrochem. Soc.“, 63,1933.
205
каййллярпо-актйойых свойств определенных соединений, ВХОДЯЩИХ
в состав каждого вещества.
Уэстбрук считает \ что наиболее сильное положительное влияние
на качество покрытия оказывает гулак. Это вещество представляет
собой продуют из отходов производства сульфит-целлюлозы. Кон-
центрация этой добавки в кадмиевой ванне не ограничивается опре-
деленными пределами; Уэстбрук рекомендует около 12 г/л. Из суль-
фированных масел он считает наилучшей добавкой специальный вид
сульфированного касторового масла (Tourkonail), которое может при-
меняться тоже в неопределенном количестве, рекомендуется употреб-
лять около 12 г/л. Действие этой добавки при электролитическом
осаждении кадмия продолжается, как отмечает Уэстбрук, очень долго.
По данным Клауссена и Олина1 2 отходы Стеффенса дают лучшие
результаты, нежели гулак, главным образом в отношении усиления
блрска покрытия и увеличения рассеивающей способности ванн. Этот
продукт получается при выделении сахара из сахаросвекловичной
патоки (путем известкования). Концентрация этой добавки строго не
ограничена, но лучшие результаты, повидимому, получаются при со-
держании от 12. з/л и выше (добавляемый продукт содержал 46%
твердого вещества). Хорошие результаты в отношении улучшения ра-
боты ванны в глубину дают также конденсированные сточные воды.
Получаемые после первичной замочки кукурузы в начальной стадии
процесса изготовления крахмала.
Кроме указанных веществ согласно литературным данным в по-
следние Поды было предложено добавлять в цианистую кадмиевую
ванну небольшое количество шерсти, растворенной в техническом ед-
ком натре, шеллак, казеин, сгущенное молоко, лакрицу или глюкозу3.
Эти добавки придают блеск покрытию. Рекомендуется применять
их в количестве, не большем 0,5%. Блестящие покрытия согласно па-
тентной литературе получаются также при добавлении в цианистую
кадмиевую ванну ячменного сахара, солодового' сахара или сиропа4,
цельной пшеницы или карамелизованного сахара 5.
По Планеру, хорошие результаты в цианистой кадмиевой ванне
дает добавка кофеина (2 г/л).
Н. А. Изгарышев и С. И. Орлова рекомендуют для своей ванны до-
бавку декстрина.
Следует отметить, что наряду с положительным действием указан-
ных добавок многие йз них, иногда после известного времени работы
или вначале, являются причиной возникновения хрупкости, пузырча-
тости и отслаивания покрытия.
Из примесей, оказывающих определенно вредное влияние на про-
цесс осаждения в кадмиевых ваннах, являются, примерно, те же ме-
таллы, которые были рассмотрены в главе «Цинкование». Сюда от-
носятся прежде всего' серебро, свинец, олово, сурьма и мышьяк. Их
содержание не должно превышать 0,005%. Мышьяк не допускается
уже свыше 0,0005%. Присутствие меди оказывает вредное влияние
1 Westbrook, .Trans. Am. Electrocb. Soc*, v. 55. 1929.
8 Loc. clt.
3 Патент США 1536858.
4 Английский патент 309071. •
6 Патент США 1692240.
206
только в кислых кадмиевых ваннах, так же как и в цинковых. Дру-
гие металлы, например цинк, алюминий, железо и металлы, не раст-
воряющиеся в щелочных цианистых ваннах (магний, марганец,
хром и т. д.), не оказывают почти никакого влияния на процесс
осаждения кадмия, и поэтому Уэстбрук называет их добавками
инертными.
Следует упомянуть также о влиянии карбонатов—соединений,
постепенно и непрерывно накапливающихся, как указано было выше,
во всех цианистых ваннах.
По Уэстбруку и .нашим практическим данным, присутствие не-
большого количества карбонатов не. влияет на характер работы кад-
миевой ванны. Большое количество карбонатов, не оказывая заметно-
го влияния на физические свойства покрытия, вызывает, однако,
понижение проводимости раствора и увеличение анодной поляриза-
ции, вызывая понижение растворимости металла и уменьшение кон-
центрации кадмиевой соли в растворе. Поэтому, как и в цинковых
цианистых ваннах, не рекомендуется допускать слишком большого
накопления карбонатов, и, в противном случае, следует удалять их
из ванны. Также, во избежание накопления карбонатов, следует брать
больше анодную поверхность кадмия (для уменьшения анодной плот-
ности тока) и работать при комнатной температуре.
Подводя итог всему сказанному о цианистых кадмиевых ваннах,
можно рекомендовать следующие рецептурные условия, предложен-
ные различными авторами. Типичные кадмиевые ванны, которые ре-
комендует Уэстбрук, имеют состав, показанный в табл. 37.
Таблица 37
Исходные компо- ненты ванны Ваниа для общих целей г/л Ванна для очень блестящих покрытий г/л
CdO 45 45
NaCN 120 120
Na2S0410H20. . . 50 50
NiS04.7H2O . . . 1,0 1,6
Гулак Сульфир. кастор. 12 —
масло — 12
Рабочий интервал плотностей тока, который допускается автором
для этой ванны, выражается в пределах 1,61—5,38 А/дм2. Рассеи-
вающая способность этой ванны, измеренная в приборе по Хериигу и
Блюму при fci = 5, составляет 40%. Выход металла по току 96%.
Если исходить из формулы, образующейся в растворе цианистой
кадмиевой соли, как указывает Уэстбрук, Блюм и Хагебум, т. е. в
виде NaCd(CN)3, то, очевидно, ванны Уэстбрука будут являться при-
близительно 0,65 W по NaCd(CN)s (тоже и по Cd), около 1,5 N по
свободному NaCN и 0,65 А" по NaOH*.
1 NaOH, как указывалось, образуется в эквивалентном
ношению к содержанию Cd при растворении CdO или Cd(OH)g
количестве по от-,
в растворе NaCN'
207
По Блюму и Хагебуму, типовые цианистые кадмиевые Ванны
должны иметь следующий состав:
а) окись кадмия CdO 0,6 N (32 г/л)
цианистый натрий NaCN 1,5 N (75 г/л)
или б) цианистый кадмий Cd(CN)3 0.5 Ат (41 г/л)
цианистый натрий NaCN 1 N (49 г/л)
едкий иатр NaOH 0,5 (20 г/л)
Как видно, обе ванны являются: 0,5 N по NaCd(CN)3, 0,75А по
свободному NaCN и 0,5 N по свободному NaOH. Для получения бле-
стящего покрытия авторы указывают на возможность применения к
этим ваннам добавок клея, казеина и сульфированного масла.
Планер1 работал с более слабым раствором цианистой кадмиевой
ванны. В качестве добавок он применял кофеин в количестве 2 г/л.
Состав его ванны следующий:
цианистый калий KCN . . . 0.57 мол.
„ кадмий Cd(CN)3 . 0,175 „
кофеин..................2 г
вода....................1л
Как видно, эта ванна является 0,346 А по отношению к содержа-
нию KCd(CN)3 и 0,4 А по Свободному K0N. Автор указывает, что
эта ванна при 40—6Q° и плотности тока 0,5—1,5 А/дм2 (наилучшие
условия, рекомендуемые Планером) дает очень хорошие осадки как
в отношении структуры, так и внешнего вида с добавкой коллоида и
без него. Выход по теку при этих условиях приближается к 100%>
(95—100%).
Исследования зависимости катодного выхода по току от плотно-
сти тока и температуры в этой 'ванне показали, что с повышением
температуры он увеличивается, а при увеличении плотности тока
уменьшается.
Изгарышев' Н. А., Орлова С. И. 2 рекомендуют ванну состава:
K3Cd(CN)«......... 75,56 г
КОН................. 6,22 ,
декстрин.......... 1,6 ,
вода................ 1л
Плотность тока 1,0—1,5 А/дм2; выход по току 97—99%; напряже-
ние 1—1,2 V при расстоянии между электродами в 4—5 см.
Методы анализа кадмиевых Ранн как кислых, так и цианистых,
очень сходны с таковыми для цинковых ванн, за исключением опре-
деления самого кадмия. Последний определяется обычно с помощью
электроанализа. Осаждение на катоде можно производить как из сер-
нокислых, так и из цианистых растворов при сильном их переме-
шивании 3.
1 Planer, „Zeitschr. f. Electrochemie', 1, 1931.
’Изгарышев H. А. и Орлова С. И., Труды Института прикладной
минералогии, 1931, Москва, Цветметиздат, 5. 1930.
3 Gerhardt Р. Metallwaren Ind. u. Colv. 1, 2 и 3 (1933); А. Фишер и
А. Шлейхер, Элекроанализ (методы ускоренного электроанализа), 1931.
208
ГЛАВА ШЕСТАЯ
ОМЕДНЕНИЕ
В электрохимическом ряду напряжений медь стоит в группе элек-
троположительных металлов, следовательно ее нельзя применять в
качестве электрохимического защитника железа, и его сплавов от кор-
розии. Мало того, вследствие большой разности потенциалов между
медью и железом, в случае ойолепия в каком-нибудь месте омедненно-
го железа, последнее начнет значительно быстрее корродировать, чем
неомедненное. Поэтому железо, как правило, не покрывается медью
с целью защиты от коррозии.
Медь сама по себе также малоустойчива на воздухе; она сравни-
тельно легко окисляется, особенно при нагревании. При образовании
на ее поверхности сернистых соединений медь окрашивается *в тем-
ный (от коричневого до черного) цвет; от углекислоты или хлористых
соединений в атмосферном воздухе (или водной среде) поверхность
меди покрывается основными углекислыми или хлористыми солями
меди. Таким образом и с точки зрения декоративной медь нельзя рас-
сматривать как подходящее покрытие.
Чаще всего медные покрытия применяются как промежуточные
слои между железом (или железными сплавами) и другими покры-
тиями, благодаря чему достигается хорошее сцепление между основ-
ным металлом и поверхностным покрытием.
Большое распространение имеют медные покрытия, применяемые
как средство, предохраняющее от цементации; этот процесс особенно
развит в машиностроительной промышленности.
В последнее время с успехом применяется биметалл — железо, по-
крытое медью механическим или гальваническим путем.
В ряде случаев применяются медные покрытия, которые подвер-
гаются оксидированию — окрашиванию в различные цвета.
Несмотря на сравнительно ограниченное применение, медные по-
крытия служили объектом многочисленных исследований. Явления,
сопровождающие процессы кристаллизации на катоде, условия, бла-
гоприятствующие равномерному распределению металла на катодной
поверхности, роль коллоидов и целый ряд других факторов изуча-
лись в процессе электроосаждения меди с тем, чтобы установленные
для меди закономерности перенести также на другие виды электро-
осаждения металлов.
Различают два рода электролитов, в которых можно производить
электроосаждение меди: кислый и цианистый. Из первых практиче-
ское применение получили сернокислые электролиты. Они отлича-
14 Основы гальваностегии 1783 209
ются простотой Своего состава, относительной дешевизной и устойчи-
востью. Вместе с тем кислые ванны при известных условиях дают
возможность применять высокие плотности тока, до 20—30 А/дм2.
Недостатками кислых ванн является их незначительная рассеи-
вающая способность, более грубая структура получающихся в них
осадков по сравнению с цианистыми, но самый главный недоста-
ток— невозможность покрывать непосредственно в кислых ваннах
железо и его сплавы; при погружении последних в кислый медный
электролит на поверхности основного металла выделяется контактная
медь, отличающаяся плохим сцеплением с основным металлом и
большой пористостью. По этой причине кислые ванны применяются
в определенных случаях для наращивания медных изделий или
осаждения поверх латуни. Изделия из железа и его сплавов (а также
из цинка) покрываются предварительно медью в цианистой ванне
или в некоторых случаях в никелевой ванне, а затем наращивание
продолжается в кислой ванне. В этом последнем случае желательно
получить промежуточный слой сплошным, беспористым, в против-
ном случае не исключается возможность образования на катодной
поверхности цементной меди в открытых местах, где железо вслед-
ствие образования местных элементов интенсивно растворяется, вы-
тесняя медь из раствора. Образование мелкокристаллических осадков
меди в цианистой ванне благоприятно отражается также на струк-
туре меди ж кислых ваннах, где продолжается осаждение меди, осо-
бенно в тонких слоях, поскольку продолжается рост первоначально
образовавшихся кристаллов. Цианистые медные ванны свободны от
перечисленных выше недостатке®, но они малоустойчивы, требуют
систематического добавления дорогих цианистых соединений и дают
возможность применять лишь ограниченную плотность тока. Боль-
шим недостатком цианистых юани является их ядовитость.
В силу этих соображений вопрос о замене цианистых медных ванн
другими, более устойчивыми, более дешевыми и менее ядовитыми
ваннами является весьма актуальным. Нельзя сказать, что изыскания
в этой области абсолютно безуспешны (ниже остановимся подроб-
нее на этом вопросе), но пока цианистые ванны играют доминирую-
щую роль при получении первого слоя меди на поверхности железа.
1. Медные кислые ванны
Кислый медный электролит в простейшем случае состоит из двух
компонентов: сернокислой меди и серЦой кислоты. Было заявлено
большое количество патентов на применение коллоидов или других
органических добавок в медных ваннах, но большого практического
значения они не получили ввиду того, что эти органические добавки
нередко попадают в катодный осадок и делают его хрупким. Поэтому
подробно остановимся на роли двух компонентов и на режиме ванны,
рассмотрев предварительно вкратце анодный и катодный процессы.
В растворах сернокислой меди медные аноды по преимуществу
растворяются с образованием двухвалентных ионов, в то время как
на катоде имеет место разряд этих ионов и осаждение металлической
меди. Однако наряду с этими превалирующими процессами имеют
место и другие процессы, нарушающие нормальный ход ванны. Воз-
можно также образование одновалентных ионов под действием элек-
210
Трйческого тока, Правда в весьма незначительной степени, что сле-
дует из значений нормальных потенциалов меди.
е Си / Си* = -J- 0,51 V,
в Си/Си" =4-о,зз V,
е Си*/Си" = 4-0,15 V.
В электролите, омывающем металлическую медь, имеет место так-
же химически обратимый процесс Си 4- Си **^ 2Си
При нормальной температуре константа равновесия этой реакции
С2
К — ~±- = о,5-10“4 и соответствующая ей концентрация Си * малы
Cfu" ’
(в 1 л раствора нормального по кислоте и двухнормального по окис-
ной меди содержится лишь 3,4 • 10“4 грамм-атома меди в виде закис-
ной соли). При повышении температуры концентрация Си* увеличи-
вается.
Накопление в растворе Си* в большем, чем это соответствует рав-
новесной системе, количестве, приводит к выпадению металлической
губчатой меди, т. е. реакция течет влево. Кроме того окисление серно-
кислой соли закиси меди может протекать за счет кислорода воздуха
и серной кислоты, особенно при применении воздушного перемеши-
вания:
Cu2SO4 4-04- H2SO4 — 2CuSO4 4- Н20.
Следовательно, кислотность ванн имеет тенденцию к уменьшению.
Наконец, эта соль легко подвергается гидролизу с выпадением тем-
нокрасной закиси меди:
Cu2S04 4- И20 —► Сп2О + H2S04.
Из последней реакции явствует, что нельзя вести электролиз меди
из нейтрального раствора, хотя серпокислая соль окиси меди также
подвержена гидролизу. Так, например, в 2 N растворе CuS04 для
предотвращения гидролиза кислотность должна быть не ниже, чем
0,01 N при комнатной температуре и 0,1 N при 100°.
На катоде, как указано выше, процесс преимущественно заклю-
чается в разряде двухвалентных ионов меди, но возможно также ча-
стичное восстановление их до одновалентных ионов; кроме того на
катоде может иметь место и разряд имеющихся в растворе одновалент-
ных ионов меди. Таким образом схематически мы можем катодный
процесс изобразить следующим образом1:
Си" 4-20 — Си,
Си" 4-0 —Си*,
Си' 4-0 —Си.
Неполное восстановление ионов двухвалентной меди до металла па
катоде имеет место тем в большей степени, чем ниже плотность тока
и выше температура. Такое положение иллюстрируется табл. 38.
1 Некоторые авторы стоят на той точке зрения, что медь осаждается на
катоде в результате вторичного процесса восстановления разряжающимся водо-
родом:
2Н- + 2е -> 2Н,
2Н +Cu" = Cu 4-2Н’.
211
Направление и удельный вес каждой из описанных выше реакций
в значительной степени зависит от условий электролиза — от состава
электролита и режима (плотность тока, температура, перемешивание),
так как эти факторы в известной мере влияют на величину анодной и
Таблица 38
Влияние плотности тока па выход тока по меди
в 2 N растворе CnS04 -|-1 N H2SO4
Температура °C Плотность тока иа катоде А/л<1 2 Катодный выход тока °/о
20 0,3 80
20 1,0 90
100 13 *3
100 37 60
100 1С0 83
катодной поляризаций. Этим вопросом занималось большое количе-
ство исследователей, изучавших медную кислую ванну под различ-
ным углом зрения.
Керн и Руйан1 измеряли анодную и катодную поляризацию меди
в зависимости от циркуляции, температуры, концентрации свободной
кислоты, примесей в анодах и наличия коллоидов в электролите. Во-
обще говоря, поляризация в сернокислых медных ваннах незначи-
тельна, и от изменения этих факторов она колеблется в пределах ты-
сячных или сотых долей V, но при одновременном действии несколь-
ких факторов.поляризация может достигнуть значительной величины.
Например, от применения циркуляции анодный потенциал стано-
вится отрицательнее на 0,001—0,002 V, по сравнению с таковым ib
покоющемся электролите, в то время как катодный потенциал стано-
вится менее отрицательным на) 0,02—0,03 V, т. е. перемешивание в
большей степени оказывает влияние на катодную поляризацию, чем
анодную. Такое же влияние оказывает повышение температуры: анод-
ная поляризация уменьшается с повышением температуры от 22
до 55°' на 0,001 V, катодная поляризация при тех же условиях умень-
шается на 0,04—0,08 V.
Изменения концентрации серной кислоты по данным этих авторов
не оказывают сколько-нибудь заметного влияния на катодную поляри-
зацию, в то время как другие авторы 2 обнаружили заметное влияние
серной кислоты на величину катодной поляризации меди. В большей
степени, чем серная кислота, сказывается присутствие сульфата нат-
рия, один эквивалент которого оказывает такое же влияние, как з N
серная кислота.
Присутствие примесей в анодах вызывает их поляризацию, физи-
ческое состояние анода также оказывает некоторое влияние, катаные
аноды поляризуются в большей степени, чем литые.
1 Kern a. Ro wan., „Trans. Am. Electrochem. Soc.“, 56; 378, 1929.
2 Forster u. Gabler. .Zeitschr. f. Elektrochemie", 130, 36, H. 1930.
212
Как выше указывалось, кислые медные ванны состоят в простей-
шем случае из медного купороса и серной кислоты. Этот электролит
в меньшей степени чувствителен к загрязнениям, чем это имеет место
в цинковых или никелевых ваннах. Потенциал меди значительно бла-
городнее потенциала цинка, железа и никеля, так что эти примеси мо-
гут присутствовать в значительных количествах, не вызывая ослож-
нений. Примеси, которые могут оказать вредное влияние на процесс
осаждения меди, — мышьяк и сурьма — обычно .присутствуют' в со-
лях в незначительных количествах, так как медный купорос обычно
получается как побочный продукт при электролитическом рафиниро-
вании меди, где эти примеси не могут быть допущены в заметных
количествах. Это, понятно, не означает, что медные сернокислые ван-
ны могут быть приготовлены из загрязненных солей или что можно
вообще не обращать внимания на возможность попадания примесей.
Общее правило о необходимости в любом гальванотехническом про-
цессе стремиться к максимальной чистоте растворов применимо, ко-
нечно, и к медным ваннам. Мы лишь обращаем внимание на то об-
стоятельство, что при неполадках в работе сернокислой медной ванны
надо в последнюю очередь искать причину в появлении каких-либо
металлических примесей в растворе.
Концентрация сернокислой меди в растворе не может быть выбра-
на произвольно, так как растворимость ее зависит от содержания сер-
ной кислоты в электролите!, что видно* из табл. 39.
Таблица 39
Растворимость CnSO4. 5Н20 в присутствии H2SO4 при 25°
Концентрация серной кислоты Растворимость CuSO4.5H2O
N г/л N г/л
0 __ 2,82 352
0.5 24,5 2,61 326
1.0 49 2,42 304
1.5 73,5 2,28 285
2,0 98,1 2,14 267
2,5 122,6 2,0 250
3,0 147,1 1,84 230
3,5 171,6 1,70 212
Ниже будет указано, что принятая кислотность для медных ванн
лежит В пределах 50—70 г/л H2S04, следовательно концентрация меди
в растворе не может превышать 285—304 г!л CuS04.5Н2О. Правда, с
повышением температуры растворимость медной соли увеличивается,
ио необходимо при этом учесть неудобства работы с насыщенными
растворами.. Во время перерывов в работе ванны, когда температура
окружающего воздуха ниже рабочей температуры ванны, начинает
выкристаллизовываться медный купорос. Кроме того в растворах,
близких к состоянию насыщения, сернокислая медь кристаллизуется
на анодах выше уровня электролита.
Низкие концентрации меди-неприемлемы, так как они позволяют
2ia
применять весьма ограниченную плотность тока. Например, при сред-
нем перемешивании верхний предел плотности тока для 1 N раствора
CuS04 лежит при 7 А/дм2, для 0,25 N — при 1 А/дм2. Поэтому практи-
чески применяют концентрацию медного купороса в пределах от 150
до 250 г/л.
Серная кислота в медном электролите представляет образец того,
как один компонент совмещает в себе целый ряд весьма ценных
свойств, столь необходимых для успешного проведения гальваносте-
гического процесса; она вызывает: 1) уменьшение омического сопро-
тивления электролита, 2) уменьшение концентрации ионов осаждаю-
щегося металла (что способствует образованию более тонкой струк-
туры) и з) предотвращает гидролиз сернокислой закиси меди, который
сопровождается образованием рыхлой закиси меди. Влияние серной
кислоты на электропроводность сернокислой меди иллюстрируется
табл. 40.
Таблица 40
CuSO4.5Н2О г Свободной H2SO4, г на 100 сл3
0 ! 5 10 15 20
Уде льная элект [ЮПРОВОДНОС! ь в обратны! омах
Температура раствора 25°
0 — 0,2165 0,4069 0,5559 0,6684
5 0,0148 0,1977 0,3714 0,5123 0,6195
иа 100 сл3 10 0,0252 0,1868 0,3480 0 4819 0,5729
15 0,0333 0,1772 0,3214 0,4392 0,5256
20 0,0402 0,1750 0,3017 0,4087 0,4852
Температура раствора 40°
0 — 0,2490 0,4722 0,6498 0,7901
5 0,0191 0,2233 0,4272 0,6016 0,7433
на 100 сл3 10 0,0320 0,2096 0,3989 0,5619 0,6792
15 0,0425 0,1992 0,3688 0,5133 0.6263
20 0,0517 0,1956 0,3480 0,4807 0,5810
Температура раствора 55°
0 — 0,2751 0,5262 0,7312 0,8981
5 0,0229 0.2418 0,4740 0,6731 0,8339
иа 100 см'1 10 0,0382 0,2250 0,4394 0,6313 0,7733
15 0,0510 0,2135 0,4059 0,5765 0,7144
20 0,0623 0,2059 0,3835 0,5403 0,6643
Из табл. 40 видно, что сама по себе сернокислая медь является
плохим проводником тока и что с повышением температуры электро-
проводность увеличивается незначительно. Прибавление серной кис-
лоты к раствору сернокислой меди существенным образом влияет на
повышение электропроводности; одновременное повышение темпера-
214
туры также способствует повышению электропроводности, причем
влияние температуры сказывается в различной степени в зависимости
от концентрации меди и серной кислоты в растворе (фиг. 98—101).
В нейтральных или слабокислых растворах сернокислой меди оми-
ческое сопротивление настолько высоко, что обычно применяемые в
гальванотехнике низковольтные динамомашины не позволяют плот-
ность тока поднять до 5—10 А/дм2. Таким образом помимо значитель-
ного снижения расхода электроэнергии присутствующая в электро-
лите свободная серная кислота дает возможность при данной динамо-
машине применять более высокие плотности тока.
В медных сернокислых ваннах не приходится опасаться выделе-
ния водорода (и связанного с этим уменьшения выхода тока по ме-
таллу) в присутствии больших количеств свободной кислоты; потен-
Фнг. 98. Поляризационные кривые медных ванн.
циал меди значительно благороднее потенциала водорода, и разряд
последнего возможен только тогда, когда концентрация ионов меди в
катодном слое чрезвычайно мала. Необходимо также учесть, что рас-
творимость меди падает с увеличением кислотности. Поэтому выби-
рают не ту кислотность, которая соответствует максимальной электро-
проводности, а значительно меньшую. Так как при перемешивании
концентрация ионов металла в катодном слое всегда больше, чем в
покоющемся электролите, то ясно, что при перемешивании кислот-
ность может быть допущена более высокой. Чем интенсивнее переме-
шйвание, тем большая кислотность может быть допущена.
Концентрация ионов металла в катодном слое убывает пропорцио-
нально применяемой плотности тока, так что и в данном случае также
существует прямая зависимость: чем выше плотность тока, тем интен-
сивнее должно быть перемешивание.
Для практических целей при интенсивном Воздушном перемеши-
вании применяют плотность тока в 10 К]дм2 для комнатной темпера-
туры и 20 А/д!1«2 для 45°, концентрацию кислоты—75 г/л и медной
соли—240 г!л.
2!3
216
a
I
1
0.7
0,6
0.5
0,4
0,3
0,2
0.1
6ез6и604
5г С и SO 4
507.0/100 см3
Юг CuSOj
5Н?0/100смЗ
15г CUSO4
HzO/IDO см3
20 г C11SO4
н/0/Ю0смЗ
I
I
0 5 i'o ' 15 20
C6o6. H2SO4 гс/дц£$М1
Фиг. 99. Электропроводность сернокислых
медных растворов при 25°.
P.O CuSOd
5г CuSOd
5Н?0/100смЗ
Юг CuSOd
5Н?0/Ю0смЗ
/5г CuSOd
Нгб/ЮОсмЗ
20 г CuSOg-
5Н20'/Ю0смз
Электропроводность. в обр. омах на /см3
0,8
0,7
0,6
0,5
0,4
0,3
0,2
0,1
О 5 /0 !5 20
Свод. H2SO4 ^/юр см3
Фиг. 100. Электропроводность сернокислых
медных растворов при 40°.
Повышенная кислотность оказывает благоприятное влияние так-
же на структуру осадка. Если нейтральный нормальный раствор сер-
нокислой меди подкислить серной кислотой тоже до нормальной кон-
центрации, то концентрация ионов меди соответственно уменьшится
с 0,11 Д до 0,06 N. Хотя такое изменение концентрации ионо’в значи-
тельно меньше той, которая достигается при комплексообразовании,
например в цианистой соли, все же благоприятное влияние серной
Off
<*> 0,8
§
§ 0.7
§
§ 06
|<к
0.1
О 5 10 15 20
C806.H2SO4 гс/юосм3
Oft C11SO4
5 г CuSO4
5Н20/Ю0смз
Юг Си SO4
5Н20/100 см3
!5г CuSOd
5Н20/Ю0смЗ
20 г CuSOd
ЪО/ГООСМЗ
Фиг. 101. Электропроводность сернокислых медных
растворов при 50°.
кислоты на структуру меди несомненно. Считают, что чем выше
кислотность электролита, тем выше лежит предел
плотности тока, при которой получаются мелко-
кристаллические осадки.
Имеющаяся в медном электролите в некоторых количествах серно-
кислая соль закиси меди в нейтральном растворе или при недостатке
кислоты легко подвергается гидролизу, причем образующаяся при
этом кристаллическая закись меди может случайно осесть на катод-
ной поверхности или механически быть на нее перенесенной. На осев-
217
ших рыхлых кристаллах закиси меди продолжается дальнейшее оса-
ждение меди за счет главного, превалирующего процесса разряда
двухвалентных ионов меди, и катодный осадок получается неплот-
ным, рыхлым. Таким образом мы видим, что и с точки зрения полу-
чения плотного гладкого осадка присутствие серной кислоты в мед-
ном электролите оказывает благоприятное влияние.
Вьппе мы указали, что коллоиды или другие органические соеди-
нения сравнительно редко применяются в медных кислых ваннах.
Благоприятное действие этих добавок сказывается в том, что они
благодаря повышению катодного потенциала уменьшают размеры зе-
рен и предупреждают образование наростов на краях или выступах.
Часто присутствие органических соединений в медной ванне вызы-
вает явления хрупкости, связанной, повидимому, с включением этих
добавок В' электролитический осадок.
По исследованиям Хутерсола1 желатина и пептон дают гладкие и
более твердые осадки, чем те, которые получаются в отсутствии этих
добавок. Микроструктура этих осадков показывает тонкое строение
медного осадка. С течением времени осадки начинают походить на те,
которые получаются в отсутствии добавок; невидимому, последние
осаждаются вместе с медью, почему их концентрация в’электролите
постепенно уменьшается. Декстрин оказывает благоприятное влияние,
когда он присутствует в количестве, не превышающем 1 г/л. Наилуч-
шими добавками в медных ваннах является фенол или его сульфо-
соединения в количестве 1—10 г/л.
В медных кислых ваннах ток распределяется неравномерно на ка-
тодной поверхности, так как катодный потенциал незначительно воз-
растает с плотностью тока. Так как в медных ваннах применяется к
тому же перемешивание, которое сводит на-нет и без того маленькую
поляризацию, то ток, а следовательно и металл, распределяются еще
менее равномерно. О этой точки зрения роль коллоидов, которые и
при наличии перемешивания могут все-таки несколько повысить ка-
тодную поляризацию, более ценна, чем с точки зрения уменьшения
размеров зерен. Лучше все же и в этих случаях пользоваться меха-
ническими приемами в роде «защитных» катодов, неметаллических
экранов и т. п.
К анодам в кислых ваннах не предъявляются высокие требо-
вания. Надо заботиться главным образом о том, чтобы аноды раство-
рялись с минимальным количеством шлама. Для этой цели оказы-
ваются одинаково пригодными катаные и электролитные (непосред-
ственно полученные при рафинировании) аноды. Первые предпочти-
тельнее, так как электролитная медь, когда она получена при низкой
плотности тока, часто бывает крупнокристаллической, и в процессе
анодного растворения в галНоаностегических ваннах нарушается
связь между отдельными кристаллами; последние, накапливаясь в
электролите, механически переносятся к катоду. Литые аноды менее
пригодны, так как они обычно содержат значительные количества за-
киси меди, которая наряду с другими присутствующими примесями,
особенно при медленном охлаждении, распределяется по границам
1 Hothersoll, „Met. Ind.', 10, 1930 и 27, 1931.
218
кристаллов. Это явление устраняется при соответствующей термиче-
ской обработке.
Повышенная температура в медных ваннах при прочих постоян-
ных условиях делает осадок более крупнокристаллическим. Тем не
минее при высоких плотностях тока приходится работать с повышен-
ной температурой, поскольку она способствует повышению концен-
трации ионов металла в катодном слое и, следовательно, позволяет
поддерживать большую кислотность. Таким образом, поддерживая
высокую кислотность, мы можем при более высокой температуре и
плотности тока получать такую же структуру, как при более низких
температурах и соответственно низких плотностях тока.
Практически для повышения плотностей тока поддерживают темпе-
ратуру 35—40°.
Суммируя эти особенности медных кислых ванн, можно следую-
щим образом формулировать условия их работы:
1. Быстрые ванны, работающие при плотности тока 15—20 А/дл2
и интенсивном перемешивании
CuS04.5Hs0—-250 г/л
H2S04- 75 „
Для плоских изделий или вращающихся цилиндрических тел
плотность тока может быть повышена до 30 А/д.«2 и выше.
2. Ванны с покоющимся электролитом, работающим при плотности
тока 2—з А/дм2,
CuSO4.5H2O — 200 г/л
H2S04 — 50 „
Помимо общих условий, которые должны быть соблюдены во вся-
ком гальваностегическом процессе (надлежащая подготовка поверх-
ности), необходимо заботиться о физической чистоте медного электро-
лита, зашишать катодную поверхность от взвешенного шлама или
других загрязнений. Так как в перемешивающемся электролите име-
ющийся шлам находится во взмученном состоянии, то необходимо
осуществлять беспрерывную фильтрацию раствора.
Причиной грубого, шероховатого осадка чаще всего являются взве-
шенные частицы.
Грубый осадок может получаться также при недостатке кислоты
в ванне, почему приходится периодически определять кислотность в
работающей ванне и поддерживать ее на более или менее постоянном
уровне. При недостатке кислоты цвет осадка становится темным за
счет закиси меди, осадок при этом становится грубым.
При наличии большого избытка свободной серной кислоты и недо-
статке меди последняя осаждается с водородными включениями, по-
верхность становится пятнистой. Такое же явление может наблюдать-
ся при недостаточном перемешивании или при полном отсутствии его,
при чрезмерной высокой плотности тока для данных условий.
Черные или коричневые полосы на катодной поверхности образу-
ются от примесей в растворе и в первую очередь мышьяка. В присут-
ствии последнего осадок становится иногда блестящим, но такое со-
стояние металла рассматривается как неустойчивое.
219
2. Медные цианистые ванны
Условия электроосаждения меди из цианистых раствЮров суще-
ственным образом отличаются от тех, которые считаются наиболее
благоприятными для кислых растворов. Прежде всего благодаря об-
разованию прочных комплексных ионов и очень слабой степени дис-
социации их концентрация ионов меди в цианистых растворах делает-
ся настолько малой, что потенциал ее становится примерно на 1 V*
отрицательнее, чем В сернокислых растворах.
С увеличением плотности тока катодный потенциал меди в циа-
нистых ваннах в противоположность кислым ваннам быстро растет, и
это обстоятельство определяет условия кристаллизации и распреде-
ления металла на катодной поверхности; с этой точки зрения условия
•в цианистых ваннах исключительно благоприятные. Но именно пото-
му, что катодная поляризация быстро растет с плотностью тока, по-
следнюю нельзя сильно увеличивать, в противном случае выход тока
по металлу может быть доведен до нуля.
Табл. 41 иллюстрирует изменения катодного потенциала и выхода
осока по металлу в электролите, содержащем 0,1 N раствор CuCN +
-j- 2KCJN при 18°, по данным Шпитцера1.
Таблица 41
Плотность тока А/а.м- Катодный потен- циал V Выход тока %
0 — 0,610
0,1 — 0,77 58
0,3 — 1,12 65
0,5 — 1,17 44
0,75 — 1,20 35,4
1,0 — 1,21 15,2
2,0 — 1,26 10,6
При дальнейшем повышении плотности тока на катоде начинает
выделяться один водород.
Другим существенным отличием цианистых ванн от кислых сле-
дует считать сильное изменение потенциала меди с концентрацией
свободного цианида, в то время как свободная серная кислота оказы-
вает очень незначительное влияние на потенциал меди в кислых ван-
нах. Если В растворе, содержащем 9 г меди на 1 л в виде цианистой
соли (0,1 молярный раствор CuCN) и 13 г/л KCN, потенциал меди ра-
вен— 0,60 V, то в присутствии 26 г/л KCN этот потенциал приобре-
тает значение —0,964 V, а в присутствии 65 г/л—1,169 V.
Это обстоятельство говорит за то, что мы весьма ограничены в вы-
боре концентрации цианида, являющегося главным компонентом в
электролите после медной соли.
,В цианистых ваннах мы не можем прибегать также широко к тем
приемам, которые дают возможность применять повышенные плот-
1 Spitzer, „Zeitsc'hr. f. Electrochem.*, 11. 345, 1905.
220
ности тока вроде перемешивания, повышения температуры по той
причине, что электролит и без того мало устойчивый при этих усло-
виях быстро приходит в негодность. Даже при стационарном состоя-
нии и комнатной температуре цианистый электролит быстрее пор-
тится, чем кислый, за счет поглощения углекислоты воздуха.
Анодный процесс в цианистых ваннах сопровождается часто
явлениями пассивирования, что тоже мешает поддерживать постоян-
ство электролита. И в данном случае мы встречаемся с явлением,
обратным тому, которое наблюдается в медных кислых ваннах, — там
анодный выход тока несколько больше катодного.
В цианистых ваннах медь осаждается на катоде из одновалент-
ных' ионов, следовательно за lAh мы должны получить вдвое боль-
ше меди, чем в кислых ваннах, где медь находится в виде двух-
валентной. Но так как выход тока в цианистых ваннах практически
редко превышает 50%, то количество выделяющейся меди при оди-
наковых плотностях тока в этих двух ваннах тоже одинаково.
Если же учесть, что омическое сопротивление цианистых ванн значи-
тельно больше, чем кислых, то станет ясным, что расход энергии
® первых больший, чем во вторых. Ограничившись этой общей харак-
теристикой цианистых ванн, мы перейдем к более детальному рас-
смотрению роли отдельных компонентов в них и к режиму.
До сих нор не установлен с достаточной достоверностью молеку-
лярный состав медных цианистых комплексов. В простейшем слу-
чае эта соль состоит из одной молекулы цианистой меди и одной
молекулы цианистого натра или калия: CuCN. NaCN или NaCu(CN)2.
Однако в зависимости от содержания свободного цианида в растворе
образуются и другие комплексные соли более или менее сложного
состава, и вообще следует писать CuCN • nNaCN, причем п может
колебаться в широких пределах.
Чем больше свободного цианида в растворе, тем менее будет в нем
ионов меди, что становится понятным, если учесть процесс диссоциа-
ции этих солей.
В первой стадии диссоциация идет по схеме!
N aCu(CN)2' Na’ 4- Cu(CN)/ (1)
и далее
CufCNV^Cu’ + sCN'. (2)
С увеличением в растворе концентрации свободного цианида
равновесие (2) сдвигается влево. По этой причине, между прочим, и
потенциал меди, являющийся функцией концентрации ионов меди
в растворе, становится более отрицательным с увеличением концен-
трации свободного цианйда.
При недостатке свободного цианида медная соль становится не-
устойчивой, и начинает выпадать нерастворимая цианистая медь.
Если для приготовления комплексной медной соли исходить из
двухвалентных соединений, то часть цианида непроизводительно рас-
ходуется на предварительное восстановление меди в одновалентную,
что ®идно из следующих реакций:
2CuT2 + 4NaCN — Cu2(CN)2 -f- (CN)2 + 4NaX
при этом выделяется ядовитый газообразный парациан.
221
Чаще всего исходят из сьежеосажденной основной углекислой
меди CuC03Cu(0H)2. При этом реакции протекают следующим
образом:
СиСОз + 4NaCN = Na2Cu(CN\ 4- Na2C03 +'CN,
Cu('0H)2 + 4NaCN = Na2Cu(CN)3 + 2NaOH + CN.
Для предупреждения непроизводительной траты цианида прибав-
ляют к медной соли сернистокислый натр Na2SO3, который предвари-
тельно восстанавливает двухвалентную медь в 'одновалентную. То-
гда протекают следующие реакции:
2СпСО3 + Na,S03 + Н20 + eNaCN = 2Na2Cu(CN)3 + Na,C03 Н-
4- Na2S04 + Н20 + С02,
2Cu(0H)« + Na,S03 + 6NaCN = 2N£kCu(CN)3 + 2NaOH +
+ NaJS04 + H26.
Углекислая медь готовится следующим образом: к раствору
сернокислой меди понемногу добавляют соду до тех пор, пока от
дальнейшего прибавления соды не перестанет выделяться осадок.
Последний несколько раз промывают водой декантацией. Темпера-
туру следует поддерживать при этом не выше 50°, в противном слу-
чае может образоваться трудно растворимая в цианиде черная окись
меди. Растворять лучше свежеосажденную влажную соль.
Медную цианистую ванну можно также приготовить из
так называемой соли Шевреля. Последняя представляет собой
сернистокислую соль закиси-окиси меди примерного состава
CuSQs. Cu2S03.2Н2О. Как видно из этой формулы, только часть
двухвалентной меди восстановлена в исходной соли сульфитом до
одновалентной. При взаимодействии раствора сернокислой меди с
сульфитом натра выпадает в осадок соль Шевреля кирпично-крас-
ного цвета, раствор сливают и осадок промывают декантацией, после
чего растворяют в цианиде. Протекающие при этом реакции можно
написать в следующем виде:
3CuS04 + 3Na2S03 + Н20 = CuS03. Cu.,S03 + 3Na2S04 + H2S04,
CuS03. Cu2S03 + 7KCN — 3KCu(CN)2 + 2K2S03 + CN.
Ванну Шевреля^ рекомендуется готовить следующим образом:
в небольшом количестве воды растворяют при 60—70° 37 весовых
частей медного купороса, отдельно растворяют 65 весовых частей
сульфита натрия также в небольшом количестве воды при той же
температуре. Второй раствор выливают в первый, и на дно выпадает
соль Шевреля, которая промывается, как указано выше. В другом
сосуде растворяют 46 весовых частей цианистого _ калия и соль
Шевреля. Точное содержание свободного- цианида определяется по-
тном титрованием, и в случае, надобности добавляют цианид до нуж-
ной концентрации.
Указанные здесь соотношения справедливы для исходных 100%
соединений. Часто сульфит оказывается частично окисленным в
сульфат, цианид также содержит много примесей, поэтому приходит-
ся сульфит и цианид брать с некоторым избытком, а точный состав
электролита установить лишь на основании анализа.
222
Преимущества, ванны Шевреля заключаются в том, что прихо-
дится оперировать только с двумя компонентами, что наряду с мед-
ной солью мы вводим в ванну полезный компонент1—'Сульфит, что,
наконец, исходные соли—'медный купорос и сульфит натрия или
калия — вещества сравнительно дешевые.
Помимо двух главных компонентов медной цианистой ванны —
комплексной цианистой соли и свободного цианида—в ней всегда
присутствуют большие или меньшие количества карбонатов, щелочи
и сульфатов. Если даже исходить) из одной цианистой меди CuQN и
растворять ее в цианиде, то со временем в ванне накапливаются кар-
бонаты. Этот процесс протекает за счет окисления цианида кислоро-
дом воздуха особенно интенсивно при нагревании:
2NaCN + 2Н20 + 2NaOH + 03 = 2Na2CO3 + 2NH3.
Улетучивание аммиака усиливается при нагревании и перемеши-
вании электролита. Если в ванне мало щелочи, то разложение циа-
нида сопровождается выделением синильной кислоты:
2NaCN + Н20 + С02 =. Na3OOs + 2HCN.
Синильная кислота подвергается также гидролизу с образованием
муравьиной кислоты или ее солей:
HCN + 2Н20 = НСООН + NH3.
Таким образом мы видим, что в медной цианистой ванне имеется
много путей для разложения цианидов, и это делает ее весьма не-
устойчивой. Сюда надо прибавить еще возможность частичного рас-
творения медного анода с образованием двухвалентных ионов меди,
а ие одновалентных. Для того чтобы их перевести в комплексный
ион, также затрачивается имеющийся в ванне свободный цианид.
Последнее может быть устранено при наличии в электролите суль-
фита, который восстанавливает двухвалентные ионы меди в одно-
валентные. Поэтому присутствие сульфита желательно не только
в ванне, приготовленной по методу Шевреля (где он вводится с мед-
ной солью), но и по другому методу.
Очень часто в медную ванну вводят также гипосульфит. Из прак-
тики известно, что небольшое количество его оказывает благоприят-
ное влияние на процесс осаждения меди, способствуя получению
блестящих покрытий. В присутствии больших количеств гипосуль-
фита в ванне медные осадки часто становятся черными и хрупкими,
повидимому, за счет образования сульфидов меди. Механизм действия
гипосульфита до сих пор точно не установлен, но считают, что он
основан на восстановительных Свойствах гипосульфита. Кроме того
это соединение не так легко разлагается, как сульфит.
Концентрация меди в цианистой ванне не может меняться в ши-
роких пределах по причине ограниченной растворимости ее в циа-
нистом растворе и неустойчивости растворов, близких к насыщению.
Мы уже говорили о различных причинах, вызывающих постоянную
убыль цианида в растворе. Отсюда ясно, что какой-то определенный
избыток несвязанного цианида должен всегда присутствовать
в растворе.
223
Практически концентрация меди в электролите .колеблется в пре-
делах 15—30 г/л. В зависимости от концентрации меди необходимо
поддерживать определенную концентрацию цианида. Таким образом
удобнее выражать состав электролита в молекулярном отношении
меди к цианиду.
Пиннер и Бекер1 использовали метод «углового катода» для
установления оптимальных отношений свободного цианида к мед-
ному комплексу в медной цианистой ванне. Эксперименты были про-
ведены! в ванне следующего состава:
Мол. г! л
NaCN................ 0,92 45
CuCN................0,34 30
Na^COg..............0,28 И
Na2S3Os-5H2o........ 0,0025 0,625
Температура раствора 49°, катодная плотность тока 2,58 К!дм2.
Качества покрытий определялись по внешнему виду, причем они
были расклассифицированы по 4 группам: 1) очень тонкий осадок
меди; 2) тонкий осадок; з) блестящий равномерный осадок; 4) бле-
стящий осадок в местах низкой плотности тока и темный, «загоре-
лый», в местах высшей плотности тока.
Таблица 42
Влияние изменения отношения свободного цианида к медному
комплексу на работу медных цианистых ванн
Классифи- кация Нормальность Отношение NaCN Режим
NaCu(CN)2 свободный NaCN
NaCu(CN)3
Нет Осадка 0,07 0,6 8,6 Температура
1 0,18 0,52 2,9 49°. Средняя
2 — 0.48 — катодная плот-
3 0,26 0,52 1,61 ность тока
4 0,26 0,52 2,00 2,58 А/Й.и2
3 0,26 0,58 2,22
4 0,33 0,52 1,56
4 0,39 0,54 1,38
3 0,40 0,72 1,80
3 0,44 0,68 1,54
4 0,45 0,62 1,38
3 0,45 0,74 1,54
3 0,54 0,80 1,48
4 0,58 0,78 1,34
Из табл. 42 видно, что минимальное отношение нормальности не-
связанного цианистого натра к нормальности медного комплекса,
при котором получаются хорошие осадки (з), равнялось 1,6:1 в тех
случаях, когда концентрация меди в растворе равна 0,26 N и 1,5 :1
при концентрации меди в растворе, равной 0,45 N. Хорошие осадки
по внешнему виду были получены также при отношении 2,2 : 1 и
1 Pinner a. Baker, „Trans. Am. Electrochem. Soc.“, 57, 1930.
224
0,26 N NaCu(CN')2 в растворе, ио при этих условиях катодный выход
тока сильно падает.
При плотности тока в 0,54 А/дм2 минимальное отношение свобод-
ного цианида (нормальности) к медному комплексу для получения
осадка хорошего качества (3) было 1:1. для плотности тока
1,08 к!дм2 минимальное отношение равнялось 1,2 :1.
Этими авторами было изучено также влияние соды в электролите,
причем оказалось, что даже концентрация в 225 г/л соды не оказы-
вает влияния на качество катодного осадка, но уже свыше 60 г/л
начинает расти напряжение на ванне вследствие пассивирования
анодов.
При постоянном составе электролита повышение температуры
или понижение плотности тока действует аналогично повышению
отношения нормальности NaCN: NaCu(CN)2. Понижение темпера-
туры и повышение плотности тока оказывает такое же влияние, как
уменьшение этого отношения.
Таковы общие выводы; которые были сделаны Пинером и Беке-
ром. Нельзя, однако, сказать, что эти выводы оказываются реаль-
ными для любых условий электролиза. В самом деле, если исходить
из тех реакций, которые имеют место в цианистой медной ванне, то
можно заранее с достаточным приближением сказать, какую плот-
ность тока можно допустить при данном количестве свободного циа-
нида или, наоборот, каково должно быть содержание свободного
цианида для того, чтобы можно было применить данную плотность
тока. Общие положения электроосаждения, которые предусматри-
вают возможность или даже необходимость повышения плотности
тока в соответствии с концентрацией ионов осаждающегося металла,
остаются в силе также и здесь. При увеличении концентрации сво-
бодного цианида в ванне равновесие Си(CN)/^ Си* Ц- 2CN' сме-
щается в сторону образования недиссоциированных комплексных
ионов, т. е. концентрация ионов меди уменьшается, а следовательно,
при прочих постоянных условиях мы должны применять более низ-
кую плотность тока. Иначе говоря, при желании работать с большими
плотностями тока мы должны в ванне поддерживать минимальную
концентрацию свободного цианида, но эта концентрация не должна
быть меньше той, которая обеспечивает устойчивость комплекса. Эта
концентрация должна также быть рассчитана на выполнение того
цианида, который разлагается за счет различных факторов (летуче-
сти, гидролиза), и, наконец, эта концентрация должна быть доста-
точной для предотвращения пассивирования анодов. В случае недо-
статка цианида ионы меди, поступающие в раствор с анодов, не
успевают переходить в комплекс, вследствие чего на поверхности
анода образуются трудно растворимые соединения меди. Анодная
плотность тока при этом возрастает (за счет уменьшения электро-
проводной части анодной поверхности), наступает еще большее пас-
сивирование, которое приводит к сильному повышению напряжения
вплоть до прекращения прохождения тока. Пр этой причине, между
прочим, в медных цианистых ваннах следует поддерживать неболь-
шую анодную плотность тока, поверхность анодов ни в коем случае
не должна быть меньше поверхности покрываемых изделий, —
лучше на % больше.
15 Основы гальваностегии. 1783 225
Содержанйе ЦйанйДй, Должно быть различным также в зависи-
мости от «возраста» ванны. Замечено, что в то время, как в свеже-
приготовленной ванне вполне достаточно иметь 10—20 г/л свободного
NaCN, это количество должно быть увеличено в давно работающей
ванне. Объяснить такое явление можно накоплением со временем
в ванне карбонатов, которые вызывают на аноде образование основ-
ных солей. Чем болтуне в ванне имеется карбонатов, тем в большей
степени этот процесс развит на аноде и тем больше требуется иметь
цианидов, чтобы перевести эти соединения в раствор. В случае на-
копления в ванне большого количества карбонатов (больше 60—70 г/л)
их можно удалить либо введением в электролит хлористого бария,
либо вымораживанием — охлаждением до —5°.
Содержание цианида в ванне может быть уменьшено при повы-
шенной температуре, так как при этом устраняется в значительной
степени пассивирование анодов; вместе с тем при повышенной тем-
пературе улучшается электропроводность и увеличивается концен-
трация ионов металла у катода, что дает возможность применять бо-
лее высокие плотности тока. Но так как с повышением температуры
увеличивается летучесть и гидролиз цианида, то, учитывая особую
ядовитость цианистых соединений, лучше придерживаться комнат-
ной температуры или во всяком случае иметь ее не выше 40—45°.
В целях уменьшения расхода цианида, который потребляется на
восстановление частично образующихся на аноде двухвалентных
соединений меди, целесообразно иметь в ванне, как уже выше указы-
валось, некоторое количество сульфита. Последний, во-первых, де-
шевле цианида, во-вторых, он способствует сохранению постоянства
ванны, а •продукты его окисления — сульфаты — не оказывают вред-
ного влияния на процесс. В табл. 43 дана зависимость между плот-
ностью тока, содержанием свободного цианида и выходом тока для
ванны, содержащей 20 г/л меди при 20°.
Таблица 43
Плотность тока Мдм» Содержание сво- бодного цианида г/л Выход тока °/о
0,3 15 82,8
0,5 15 77,3
1,0 15 60,0
0,3 20 79,0
0,5 20 59,0
1,0 20 50,0
0,3 30 46,0
0,5 30 32,2
1,0 30 26,1
Таким образом можно рекомендовать следующий состав элек”
тролита:
меди, считая на металл (в виде
комплексной соли)........15—20 г/л
свободного цианида.............10—20 .
сульфита натрия..............4—7 ,
плотность тока...............0,3—1 К/дм?
температура.................. 20—30*
226
Длй йлотйостй тока в 1 А/д.м8 содержание свободного цианида
в ванне не должно превышать 15 г/л; при 20 г/л свободного цианида
плотность тока не должна превышать 0,5 А/дм2.
Цианистые ванны нуждаются в тщательном контроле и периоди-
ческом корректировании, так как сами по себе они сохраняют свое
постоянство сравнительно недолго.
Помимо аналитических методов существуют чисто внешние при-
знаки определения состава ненормально работающих ванн. Так
например, чрезмерное повышение напряжения на ванне и соответ-
ственное уменьшение силы тока говорит за наступившее пассивиро-
вание анодов. В этих случаях на последних образуется серовато-
зеленый налет трудно растворимых соединений меди, раствор около
анода’ синеет. Причину такой аномалии следует искать в недостатке
цианидов в растворе или в большой анодной плотности тока.
В случае большого избытка свободного цианида в ванне наблю-
дается сильное выделение водорода на .катоде, аноды при этом
имеют блестящую поверхность, а катодный осадок становится мато-
вым или порошкообразным.
При низких температурах, высокой плотности тока и повышенном
содержании цианида в растворе катодный осадок, особенно в тол-
стых сдоях, включает в себя много водорода, что приводит к обра-
зованию вздутий в отдельных местах или к отслаиванию осадка.
На омедненных изделиях, чаще на литых чугунных или цинко-
вых, со временем наблюдается иногда образование пятен. Причину
этих пятен следует искать в остающихся в порах, имеющихся на по-
верхности изделий, кислотах (в процессе травки) и попадающих
в эти поры частицах электролита: образующаяся синильная кислота
растворяет в этих порах медь. Для цинковых изделий такие пятна
возможны и при отсутствии предварительной травки, за счет взаимо-
действия щелочного цианистого электролита с основным металлом.
Лучшим средством борьбы с такими пятнами является интенсив-
ная промывка изделий до омеднения (в случае предварительного
травления) в содовом растворе, а также хорошая промывка после
омеднения и быстрая сушка.
3. Непосредственное омеднение железа и стали в кислых ваннах
Оливер П. Уатте1 изучал возможность получения плотного хорошо
пристающего медного осадка в кислой ванне на железе, предвари-
тельно погружая его в раствЬры солей таких металлов, потенциалы
которых лежат между потенциалами железа и меди. Наилучшие ре-
зультаты были получены при предварительном погружении желез-
ных образцов в раствор, состоящий из разбавленной в отношении
1 : 1 соляной кислоты и 10—60 г/л As203. Хорошие медные осадки
получались при длительности погружения в пределах от 10 сек. до
60 мин. Не всегда, однако, железные образцы покрывались сплошь
мышьяком при их предварительном погружении, несмотря на тща-
тельную подготовку поверхности.
Удовлетворительные результаты были получены при предвари-
i Oliver Р. Watts, .Trans Am. Electrochem. Soc.*, 35,1919.
227
тельном погружении в раствор, состоящий из 40 см3 кремнефтористо-
водородного электролита для свинцевания, разбавленного десятью
частями 'воды. К этому раствору добавлялось 100 см3 кремнефтористо-
водородной кислоты и 4 г желатины; для получения хороших ре-
зультатов требовалось 30-секундное погружение. При предваритель-
ном погружении железа в растворы уксуснокислого или азотно-
кислого свинца медные осадки получались неплотными, — невиди-
мому здесь играет роль структура свинца, осаждающегося при
погружении железа. Аналогичные результаты были получены при
предварительном погружении железа в сильно кислый раствор хло-
ристой сурьмы, но для получения хороших медных осадков прихо-
дилось значительно повышать кислотность в медной ванне по
сравнению с другими методами погружения.
Предварительное погружение в растворы хлористого висмута и
хлористого олова не давало возможности получать плотные медные
осадки. Отрицательные результаты были получены также при пред-
варительном погружении в разбавленный раствор сернокислой меди
и большой концентрации кислоты.
Уатте полагает, что при погружении в раствор хлористого
мышьяка железа на поверхности последнего образуется хорошо при-
стающее покрытие, которое в состоянии защищать железо от воздей-
ствия медного раствора в течение 4—5 мин., достаточных для покры-
тия поверхности медью под действием тока.
В целях подыскания других комплексных медных солей, пригод-
ных для омеднения железа и стали, Гарри Листер 1 приготовил щаве-
левокислые, молочнокислые и фталевокислые комплексные соли
меди и при помощи измерения электродных потенциалов вычислил
их константы диссоциации (табл. 44).
Таблица 4Г
Название соли Формула Потен- циал [Си"] [Х"1 [СиХ2"] [Си"| |Х'| СиХ,"
Комплексная соль щавелевокислой меди и натра Na4ru(C2O4)2] " ДН2О 0,124 0,33-10-6 0,0100 0,0100 0,33-10-8
Комплексная соль молочнокислой меди и натра Na[Cu(C3H2O4)] 2Н2О 0,089 0,54-10 “Б 0,0100 0,0100 0,54-10-7
Комплексная соль фталевокислой меди и натра 2Н2О 0,004 0,46-10—2 0,0192 0,0054 о.зы о-4
Финк и Уонг 2 остановились на щавелевокислой соли как на наи-
более устойчивой и дешевой. Эта соль может быть легко пригото-
влена прибавлением щавелевокислого натра к горячему раствору
1 .Journ. Chem. Soc.*, 1929.
2 .Trans. Am. Electrochem. Soc.“, 63, 1933.
228
сернокислой меди. Стехиометрическая точка находится по наступле-
нию слабого помутнения; последнее устраняется добавкой неболь-
шого количества щавелевокислого натрия. Образование соли проте-
кает по следующему уравнению:
2Na2C2O4 4- CuS04 = Na2[Cu(C20,1)2] • 2(Н,О) + Na2S04.
Растворимость этой соли в воде составляет 20 г!л при комнатной
температуре. Раствор окрашен в голубой цвет; он устойчив против
углекислоты, разлагается при длительном кипячении. При добавле-
нии к раствору соляной кислоты выпадает осадок щавелевокислой
«меди.
Фиг. 102. Сравнительная характеристика цианистых и ща-
велевокислых медных ванн. Плотность тока 1,1А/Зл«2 *.
После большой серии опытов наиболее подходящим составом
ванны оказался следующий:
комплексной щавелевокислой соли
меди и натрия......................20 г/л
сернокислого натрия................15 „
борной кислоты.....................20 ,
или в пересчете на медный купорос и щавелевокислый натрий
CuS04.5H20 16 г/л
Na2C2O4 17 „
Na2SO4 6 „
Н3ВО3 20 „
Для того чтобы сравнить работу щавелевокислой ванны с циани-
стой, была получена серия образцов в двух названных ваннах. Со-
став цианистой ванны был следующий:
CuCN 22,5 г/л
NaCN 34 »
Na2C03 15
В табл. 45 и кривыми фиг. 102 и 103 иллюстрированы получен-
ные результаты.
В некоторых случаях можно ограничиться тончайшим слоем
1 Пунктирная линия соответствует необходимой толщине слоя меди, полу-
чаемого в щавелевокислой ваине для последующего наращивания в сернокис-
лой ванне.
229
меди. Для этих целей можно прибегать к простому погружению изде-
лий на весьма короткое время в следующий раствор:
CuSO*.5H3O ю г
h«so4 10,
Н30 1 л
Цинковые изделия могут таким же образом быть покрыты
в аммиачном растворе следующего состава:
CnS04.5H20 200 г
NH4OH 400 „
Н3О 1 л
При длительной выдержке изделий в растворе иди многократном
погружении медный осадок становится рыхлым и плохо пристающим
к основному металлу.
4. Омеднение перед цементацией
При защите поверхности металла от цементации медные покры-
тия должны быть совершенно беспористыми, в противном случае
диффузия углерода не будет предотвращена. Необходимо кроме
того, чтобы медные покрытия отличались достаточной стойкостью
при температуре цементации до 900°, чтобы поверхность тщательно
очищалась до покрытия от окислов и жиров.
Что касается толщины слоя меди, достаточной для защиты от
цементации, то по этому поводу имеется много работ исследователь-
ского характера и указаний, основанных на непосредственном опыте.
В большинстве случаев рекомендуется толщину медного слоя повы-
шать с температурой и длительностью процесса цементации.
Проведенная в этом направлении работа группой студентов
1 См. сноску вниву стр. 229.
230
Московского института цветных металлов и золота под руководством
В. И. Лайнера на заводе им. Сталина (б. АМО) показала, что глав-
ную роль для защиты стали от цементации играет не столько толщина
медного слоя, сколько его структура- Как правило, со структурой
Таблица 45
Щавелевокислая ваииа Цианистая ванна
№ об- разца время сек. вес осадка мг)см2 № об- разца время сек. вес осадка МЗ/СМ?
Плотность тока 1,1 А/3№ Плотность тока 1,1 А/З.и2
Напряжение 3,5 V Напряжение 4 V
1 10 0,026 16 10 0,012
2 20 0,028 17 20 0,031
3 30 0,047 18 30 0,048
4 40 0,071 19 40 0,068
5 50 0,116 20 50 0,070
6 60 0,132 21 60 0,105
7 70 0,163 22 70 0,133
8 80 0,171 23 80 0,150
9 90 0,177 24 90 0,183
10 100 0,197 25 110 0,259
И 110 0,200 26 120 0,265
12 120 0,228 27 130 0,298
13 130 0,239 28 150 0,346
14 140 0,245
15 150 0,254
Плотность тока 3,2 \]дм2 Плотность тока 3,2 Х/дм2
Напряжение 6 V Напряжение 6 V
29 10 0,031 40 10 0,016
30 20 0,064 41 20 0,060
31 30 0,081 42 30 0,158
32 40 0,129 43 40 0,155
33 60 0,141 44 50 0,220
34 70 0,153 45 60 0,267
35 90 0,181 46 70 0,324
36 100 0,198 47 80 0,366
37 110 0,233 48 90 0,428
38 130 0,250 49 110 0,535
39 140 0,251 50 120 0,601
51 130 0,691
меди связана и пористость ее. Крупнокристаллические осадки меди,
как и всякого другого электролитического осадка, имеют большее ко-
личество пор, чем осадки мелкокристаллические. Это касается также
и цианистых ванн, где, вообще говоря, получается тонкая структура.
В этой работе на основании лабораторных и заводских опытов
33J
доказано, что полученное при надлежащих условиях медное покры-
тие толщиной в 0,005 м вполне достаточно для защиты от цемента-
ции, Ь то время как пористые покрытия толщиной в 0,01—0,02 мм
(обычно рекомендуемая толщина) не дают должного эффекта.
Для суждения о пригодности медных покрытий для целей за-
щиты от цементации можно пользоваться реактивом Вокера (красная
кровяная соль и желатина); в случае обнаружения этим реактивом
пор металл не будет защищен от диффузии углерода.
В более точных условиях такая же работа была проведена груп-
пой студентов под руководством В. И. Лайнера в электрохимической
лаборатории Минцветметзолото. Покрытые при различных условиях
стальные образцы с содержанием углерода от 0,1 до 0,15% подвер-
гались цементации на глубину 1,7—2 л.и! в течение 36 час. Перед
покрытием в медной ванне все образцы подвергались электролитиче-
скому обезжириванию и декапированию в течение 3 мин. в 10% сер-
ной кислоте. После покрытия медью определялась пористость
фильтровальной бумагой, пропитанной реактивом Вокера. После це-
ментации были изготовлены шлифы для микроанализа. Результаты
некоторых опытов приводятся в табл. 46.
Таблица 46
Стойкость медных покрытий против цементации стали
А® образца Состав электро- лита Плотность тока, К/дм2 Продолжит, осажден., мин. °C Пористость по реактиву Вокера Результат ми- кроанализа после цемен- тации
метал, меди г/л свободн. KCN г/л
1 20 15 0,5 40 23 Беспорист. Цемент, не пропуск.
2 20 15 0,3 40 23 —
3 20 20 0,3 40 23 -
За 20 15 1,0 30 23 •
6 20 25 0,5 30 20
7 20 25 0,3 40
7а 20 25 0,3 40 20 Порист. Цемент, пропуск.
8 20 25 0,5 30 30 Беспорист. Цемент, ие пропуск.
И 20 • 25 0,3 40 20 »
12 20 25 0,5 30 20 я
12а 20 25 0,5 30 30 Порист. Цемент, пропуск.
Как видно из табл. 46, пористые медные покрытия оказываются
непригодными для целей защиты от цементации (само собой разу-
меется, что такие покрытия также непригодны для защиты от кор-
розии). Образец 7а оказался пористым потому, что в процессе его
покрытия электролит был взмучен, и присутствовавшие в электро-
лите загрязнения, повидимому, местами, осели на поверхность образ-
ца. Образец 12а был сильно изъеден ржавчиной, и, повидимому, не
было достаточно того травления, которое применялось для всех
образцов.
Чистоте электролита и тщательной подготовке поверхности сле-
дует уделять надлежащее внимание при омеднении образцов перед
цементацией.
233
Толщина слоя меди во всех случаях колебалась в пределах
0,005—0,007 ММ.
Так как омеднению при цементации подвергаются лишь отдельные
части поверхности изделий (те, которые подлежат дальнейшей меха-
нической обработке), то остальные части, которые не подвергаются
омеднению, покрываются воском. По окончании процесса омеднения
изделия погружаются в кипящую воду, воск при этом всплывает на
поверхность <и после застывания может быть вновь расплавлен и
использован по назначению.
5. Контроль медных ванн
А. Кислые ианны
Анализ медных кислых ванн упрощается благодаря тому обстоя-
тельству, что удельные 'веса растворов серной кислоты и медного
купороса при одинаковой концентрации совпадают. Поэтому, поль-
зуясь соответствующей таблицей и проанализировав свободную сер-
ную кислоту, можно вычислить содержание меди в растворе. Так как
кислые медные ванны обычно содержат только два компонента —
серную кислоту и сернокислую медь, — то этот метод дает достаточно
точные результаты. В табл. 47 приведены удельные веса при 25°
растворов, состоящих из смеси серной кислоты и сернокислой меди.
Таблица 47
°Вё Уд. вес Общее содержание CuS04.5H20-(-H2SO4 г/л °Вё Уд. вес Общее CuS04. содержание 5Н2О H2SO4 г/л
10,7 1,08 133 20,0 1,16 268
12,0 1,09 150 21,1 1,17 286
13,2 1,10 166 22,1 1,18 303
14,4 1>И 183 23,2 1,19 321
15,5 1,12 200 24,2 1,20 339
16,7 1,13 217 25,2 1,21 357
17,8 1,14 234 26,2 1,22 375
18,9 1,15 251 27,1 1,23 393
Для определения содержания свободной серной кислоты к 10 см3
раствора добавляют 50 воды и несколько капель метилоранжа и
титруют нормальным раствором щелочи до слабозеленого окрашива-
ния!. В случае надобности можно медь определить также титрованием
гипосульфитом или электроанализом.
Б. Цианистые медные ванны
В медных цианистых ваннах подлежат определению медь, свобод-
ный цианид и карбонаты.
Для определения меди необходимо предварительно раз-
рушить комплексную медную соль. 10 см3 отфильтрованного электро-
лита подвергают выпариванию с некоторым избытком разбавленной
серной кислоты до появления белых паров. Эта операция должна
быть произведена в хорошо вентилируемом шкафу, так как выде-
ляется ядовитая синильная кислота. Если раствор темнеет, то необ-
ходимо добавить несколько капель азотной кислоты и продолжать
выпаривание. Осадок растворяют в воде, добавляют несколько капель
азотной кислоты, и медь определяют обычным методом — титрова-
нием гипосульфитом или электроанализом.
Определение свободного цианида представляет бо-
лее сложную задачу, так как результаты титрования в сильной сте-
пени зависят от степени разбавления и наличия в электролите карбо-
натов и щелочи. Лучшие результаты получаются при пользовании
иодистым калием, который указывает конец титрования.
Для производства анализа берут 10 см* электролита, разбавляют
50 см3 воды, прибавляют 10 см3 0,5 iN йодистого калия и титруют
0,1 JV раствором азотнокислого серебра до появления осадка, который
остается при энергичном встряхивании. Протекающие при этом реак-
ции могут быть написаны следующим образом:
2NaCN + AgN03 = NaAg(CN), + NaNOg.
После того как серебро свяжет (весь свободный цианид в комплекс,
со следующими каплями азотнокислого серебра будет реагировать
йодистый кадий по уравнению:
KJ.+ AgNOs = AgJ + KN03.
Если в ванне имеется большое количество карбонатов, то реко-
мендуется предварительно добавить немного азотнокислого бария,
который вызывает осаждение углекислого бария; осадок отфильтро-
вы)вают и титруют так, как указано выше.
Определение карбонатов. К 10 см3 электролита доба-
вляют, около 1 см? крепкого аммиака, разбавляют затем пробу до
50 ом3, нагревают до1 кипения и добавляют избыток чистого раствора
Ba(N03)2 или ВаС12. Осадку дают Отстояться и отфильтровывают
углекислый барий. Однако весовым путем определить карбонаты
нельзя, так как в растворе обычно содержатся сульфаты, и в осадке,
следовательно, содержится сернокислый барий. Поэтому осадок рас-
творяют в избытке титрованного раствора кислоты, а избыток послед-
ней обратно оттитровывают щелочью, пользуясь метилоранжем в
качестве индикатора. Содержание соды затем вычисляется по най-
денному количеству углекислого бария.
ГЛАВА СЕДЬМАЯ
НИКЕЛИРОВАНИЕ
Фиг. 104. Структура никелевых
осадков, ув. 450.
В гальванотехнике никель стал применяться значительно позже,
чем медь и серебро, но уже с конца прошлого столетия никелирование
сделалось наиболее распространенным методом «облагораживания»
металлических поверхностей. Лишь в самое последнее время полу-
чил распространение другой процесс, конкурирующий с никелирова-
нием, — хромирование, но чаще оба
эти процесса применяются комбини-
рованно, т. е. изделия подвергаются
предварительному покрытию никелем,
а затем хромом. В этом последнем
случае роль никелевого покрытия
отнюдь не умаляется.
Широкое распространение никеля
в гальванотехнике объясняется преж-
де всего физико-химическими свой-
ствами электролитически осажденного
никеля. В ряду напряжений никель
стоит выше водорода, но вследствие
сильно выраженной способности к
пассивированию никель оказывается
достаточно стойким против действия
атмосферного воздуха, щелочей и
некоторых? кислот. По отношению к
железу никель почти всегда является более благородным металлом,
следовательно, основной металл — железо — будет защищен никелем
от коррозии лишь при отсутствии оголенных мест. Ниже будет изло-
жено, при каких условиях удается получать никелевые покрытия
с минимальным количеством пор, какая толщина слоя для этого тре-
буется и т. д., но уже сейчас мы можем отметить отличие никеля от
меди с точки зрения применения их в качестве покрытий для железа
и его сплавов.
В отлцчие от меди никель на воздухе проявляет большую устой-
чивость и долго сохраняет свой серебристый цвет.
В случае оголения основного металла медь будет в большей сте-
пени ускорять коррозию Основного металла (железа), чем никель,
поскольку разность потенциалов между медью и железом больше,
чем между никелем и железом.
Осажденный при определенных условиях никель повышает по-
23 &
верхностную твердость металла, и, вообще говоря, при всяких усло-
виях осаждения твердость никеля значительно больше, чем у меди,
благодаря чему никелированные изделия лучше противостоят исти-
ранию. Никелевые покрытия, полученные из растворов даже простых
солей, имеют (весьма тонкую структуру, и так как в то же время
электролитический никель прекрасно принимает на себя полировку,
то покрытия могут быть буквально доведены до зеркального блеска.
Это обстоятельство позволяет широко применять никелевые покры-
тия для декоративных целей (фиг. 104 и 105).
Чаще всего сочетаются две цели, преследуемые никелевыми по-
крытиями: защита основного металла от коррозии и сохранение
внешнего красивого вида. Нет нужды перечислять объекты, подвер-
гающиеся такого рода покрытию. Достаточно напомнить наружные
части автомобилей, велосипедов, блестящие части различных аппара-
Фиг. 105. Структура никелевых осадков, ув. 1500.
тов, приборов, хирургические инструменты, предметы домашнего
обихода и т. д.
За последнее время никель стал применяться для покрытия мо-
лочной посуды (Германия, Голландия), вытесняя издавна применяю-
щееся для этих целей олово. Здесь, понятно, играет роль исключи-
тельно химическая стойкость никеля. Все же превалирующее
применение до сих пор никелевые покрытия находят для' корро-
зионно-декоративных целей. В полиграфическом производстве нике-
лирование применяется для повышения поверхностной твердости при
производстве клише и стереотипов.
С электрохимической точки зрения никель может быть охаракте-
ризован как представитель металлов группы железа. Электролиз
этих металлов сопровождается значительной анодной и катодной no-
gs'’
Дяризацией. Ё сильно кислой среде осаждение этих металлов вообще
невозможно — на катоде выделяется почти один водород. Мало тойо,
даже в растворах, близких к нейтральным, малейшее изменение Ph
оказывает влияние .на 'выход тока и свойства металлических осадков.
Явлецие отслаивания осадка, больше всего присущее металлам
группы железа, также в сильной степени связано с кислотностью
среды. Отсюда и вытекает первейшая забота о соблюдении надлежа-
щей кислотности и регулировании ее при осаждении металлов
группы железа.
Поляризация этих металлов находится также в сильной зависи-
мости от температуры электролиза — в то же время температура
оказывает известное влияние на структуру и равномерность осадка.
Следовательно, выбор надлежащей температуры для правильного
ведения процесса в данном случае играет немаловажную роль.
Плотность тока оказывает не только влияние на структуру
электролитического никеля, но и на содержание водорода в нем,
следовательно, и на механические свойства. Такую же роль, при-
мерно, играет перемешивание. Одним словом, при электроосаждении
металлов группы железа режим процесса играет не меньшую роль,
чем состав электролита.
Исходными солями для приготовления никелевого электролита
служат простая или двойная никелевые соли: NiSO4. 7Н,0 и
NiS04. (NH4)2S04.6Н2О. В последнее время чаще применяется про-
стая соль, поскольку работают с повышенной плотностью тока. Серно-
аммиачная соль никеля имеет весьма ограниченную растворимость
(60—75 г/л), почему она применяется, главным образом, в стационар-
ных вайнах, работающих при низких плотностях тока. Содержание
металлического никеля в двойной соли равно 14,86%, в простой
соли — 20,9!%.
Растворимость сернокислого никеля NiS04.7Н20 при комнатной
температуре равна 300—350 г/л.
Вследствие меньшей растворимости двойная никелевая соль мо-
жет быть получена в процессе кристаллизации более чистой, а так
как долгое время вредная роль отдельных примесей не была в доста-
точной степени выяснена, то и лучшую работу ванн с двойной нике-
левой солью приписывали самой природе последней. Хлористые
соли никеля в настоящее время сравнительно редко применяются для
целей непосредственного никелирования железа.
Наряду с солью, служащей источником ионов осаждающегося ме-
талла на катоде, в никелевых ваннах обычно присутствуют соли ще-
лочных металлов, которые вводятся для повышения электро-
проводности.
Третьим компонентом никелевого электролита можно считать
соединения, играющие роль' буфера, поддерживающего кислотность
ванны в определенных пределах. Чаще всего пользуются для этих
целей борной кислотой.
Наконец, в никелевые ванны вводят соединения, способствующие
нормальному растворению анода, соединения, парализующие стрем-
ление никеля оставаться в пассивном состоянии. Эту роль выпол-
няют соединения, содержащие в анионе галоиды, например хлори-
стый никель, хлористые соли щелочных металлов или фториды.
237
1. Катодная поляризация при электроосаждении никеля
Процессы, протекающие на электродах при выделении металлов
группы железа, были предметом многих исследований. Больше дру-
гих этими вопросами занимались Ферстер со своими сотрудниками1.
В результате их исследований было установлено, что поляризацион-
ные кривые при осаждении металлов группы железа имеют опреде-
ленный логарифмический характер. Заметная катодная поляризация
наблюдается уже при самых низких плотностях тока, при которых
возможно выделение металла.
Чем выше температура, тем с меньшей поляризацией совершается
выделение металлов группы железа, тем круче вверх поднимаются
поляризационные кривые, тем более они приближаются в своих ча-
стях, соответствующих самым низким плотностям тока, к потенциа-
лам равновесия.
Считалось как-будтЪ установленным, что потенциалы выделения
металлов группы железа находятся в зависимости от концентрации
водородных ионов среды, а именно в том смысле, что с уменьше-
нием Ph (ib пределах от 5 до 2) эти потенциалы становятся более
отрицательными.
В противоречии с такими положениями находятся выводы, сде-
ланные Гластоном2. Последний определял потенциал выделения ни-
келя в буферированном растворе сернокислого никеля при различных
плотностях тока. При этом он нашел, что поляризационные кривые
всегда поднимаются медленно до —• 0,57 V, после чего начинается
крутой подъем вверх. В растворе ацетата натрия при Ph ?= 5 и отсут-
ствии ионов никеля в растворе кривая потенциал — плотность тока
на никелевом катоде при низких плотностях тока приблизительно
совпадает с потенциалами, наблюдаемыми для никелевых растворов,
но при потенциале, равном-—0,57 V, не наблюдается резкого излома
кривой, — она медленнЬ поднимается вверх. На этом основании Гла-
сгон делает заключение, что выделение никеля из 1 У раствора
NiSO4 начинается при 15° только при — 0,57 V, до достижения
этого потенциала имеет место лишь разряд ионов водорода. Подтвер-
ждение такого положения он находит в том, что если медленно по-
вышать потенциал медного катода в 1 N растворе NiS04, поддержи-
вая отдельные величины потенциалов постоянными в течение корот-
кого промежутка времени, то самый низкий потенциал, при котором
наблюдается выделение никеля, лежит всегда вблизи — 0,57 V.
Более высоким температурам соответствуют, по Гласуону, менее
отрицательные, но вполне определенные потенциалы, при которых
начинается выделение никеля.
Концентрация водородных ионов, по мнению Пластова, не оказы-
вает влияния на потенциал выделения никеля: при уменьшении Ph
наблюдается лишь смещение резкого подъема поляризационной кри-
вой — начала выделения металла — к более высоким значениям
плотности тока. Такие же данные Гластон приводит для осаждения
желоза и кобальта.
1 „Zeitchr. f. Electrochemie", 4, 160, 1897.
2 Glasstone, „Journ. Chemie Soc.“, London, 2, 887, 1926.
238
Одним словом, в отличие от многих других исследователей, счи-
тающих, что катодная поляризация при осаждении металлов группы
железа является результатом замедленного течения электродного про-
церса, подобно тому, как это имеет место при осаждении металлов из
растворов комплексных солей, Гластон считает, что в данном случае
(при осаждении металлов группы железа) значительная катодная по-
ляризация наблюдается лишь до начала выделения металла, в даль-
нейшем же поляризация незначительно превышает ту, которая наблю-
дается при выделении таких металлов, как свинец, ртуть или медь.
В табл. 48 приводятся полученные Гластоном значения катодных
потенциалов в 1 .N растворе NiS04 при 15°.
Таблица 48
Плоти, тока в Щсм? 10“4 Катодный потенциал в 1 N растворе NiS04
-N75O.H2SO4 Ph = 2,8 Ph = 4 Ph = 5 Ph = 6
0,14 — 0,14 — 0,18 — 0,21 — 0,25 — 0,26
0,28 J — 0,18 — 0,22 — 0,24 — 0,30 — 0,31
0,42 — 0,21 — 0,29 — 0,28 — 0,35 — 0,39
0,56 — 0,24 — 0,34 — 0,34 — 0,39 — 0,45
0,84 — 0,30 — 0,40 — 0,39 — 0,46 — 0,50
1.40 — 0,37 — 0,45 — 0,45 — 0,54 — 0,57
2,80 — 0,43 — 0,51 — 0,52 — 0,58 — 0,58
4,20 — 0,47 — 0,57 — 0,57 — 0,60 — 0,60
5,60 — 0,52 — 0,58 — 0,59 — 0,61 — 0,62
8,40 — 0,57 — 0,59 — 0,60 — 0,62 — 0,64
12,0 — 0,59 — 0,61 — 0,61 — 0,63 — 0,66
20,0 — 0,60 — 0,62 — 0,62 — 0,64 —
40,0 — 0,61 — 0,64 — 0,64 — 0,65 —
80,0 — 0,62 — 0,65 — 0,65. — 0,66 —
В ацетатном буферном растворе катодный потенциал на никелевом
электроде приобретает значения, приведенные в табл. 49.
Таблица 49
Плотность тока KI см1 IO-4 0,28 0,56 0,84 1,40 2,80 5,60 12,0 40
Ph = 5 ... — 0,19 — 0,39 — 0,48 — 0,54 — 0,60 — 0,67 — 0,73 — 0,80
Ph = 6 . . . — 0,36 — 0,44 — 0,54 — 0,72 — 0,83 — 0,92 — 0,97 — 1,00
Из этих таблиц и кривых (фиг. 106—107, 108) видно, что в нике-
левых растворах катодный потенциал после достижения величи-
ны — о,57 V изменяется с дальнейшим повышением плотности тока
весьма незначительно, в то время как в отсутствии ионов никеля в
растворе никакого излома кривой.не наблюдается.
239
Такие мсе измерения проведены Гластоном в растворе уксуснокис-
лого, хлористого и азотнокислого никеля, причем во .’всех случаях фи-
гурировала неизменная., величина —0,57 V, соответствующая началу
выделения никеля (при 15°). При изменении концентрации никеле-
вой соли в растворе до 0,01 W потенциал осаждения становился на
0,06 V отрицательнее, что соответствовало изменению концентрации
ионов никеля в растворе.
? 30]
J 70
% . 00
•* 50
сь
! 4/7-
£
S 30-
£
| го-
/д
Фиг. 106 Поляризационные кривые в 1 N растворе NiSO4
при различной Ph. Температура 15°; 1—0,5 N H2SO4; 2—
Ph = 2,8; 3— Ph = 4; 4 —Ph — 5;5— Ph = 6.
При повышенных температурах наблюдалась такая же картина —
увеличение катодного потенциала до определенной величины, после
чего дальнейшее повышение плотности тока" не оказывало сколько-
нибудь заметного влияния: при 95° эта величина равнялась — 0,29 V
(табл. 50).
Табл и ц а 50
1 Плотн.тока в А/сл/2 10-4 Катодный потенциал V, нормальный раствор NiSO4, 95 °C
Ph = 2,8 Ph = 4 Ph = 5 Ph = 6 Ph = 6 (без Ni)
1,8 — 0,16 — 0,19 — 0,23 — 0,28 — 0,25
4,2 — 0.17 — 0,21 — 0.24 — 0,29 — 0,29
5,6 — 0,18 — 0,23 — 0,25 — 0,30 — 0,31
8,4 -0,21 — 0,26 — 0,26 — 0.30 — 0,34
12.0 — 0,23 — 0,28 — 0,27 — 0,30 — 0,37
20,0 — 0,26 — 0,29 — 0,29 — 0,30 — 0,41
40 0 — 0,29 — 0,30 — 0,30 — 0,31 — 0,44
80,0 — 0,30 — 0,31 — 0.31 — 0,31 — 0,45
160 — 0,31 — 0,31 — 0,31 — 0,31 — 0,47
240
При 55° незначительные изменения потенциала с плотностью
тока начинались при —0,43 V.
Принимая равновесный потенциал в нормальном растворе серно-
кислого никеля равным — 0,24 V, Главстон выводит значения катод-
ной поляризации в момент начала выделения никеля. Эти значения
приводятся в табл. 51.
T я. Л л и и я. 81
Температура, °C 15 55 95
Потенциал осаждения Ni в V — 0,57 — 0,43 — 0,29
Полярвзации в V 0,33 0,19 0,05
Аналогичные измерения, предпринятые для осаждения железа из
растворов 1 A FeS04, дали результаты, приводимые в табл. 52.
Таблица 52
Температура, °C 15 36 55 70 90
Потенциал осаждения Fe в V . — 0,68 — 0,55 — 0,49 — 0,46 — 0,46
Поляризация в V 0,22 0,09 0.03 Нет Нет
Равновесный потенциал железа в 1 А растворе FeS04 при- нят— 0,46 V. Для кобальта были получены следующие данные (табл. 53):
Таблица 53
Температура, °C 15 55 95
Потенциал осаждения Со вУ — 0,56 — 0,46 — 0,36
Поляризация в V 0,25 0,15 0,05
Обратимый потенциал Co/NCoS04 принят в — 0.31 V, температур-
цый коэфициент не принят во внимание, а температурный коэфи-
циент поляризации при осаждении кобальта был принят — 0,0025 V/°.
Во всех этих случаях изменение концентрации водородных ионов
не оказывало влияния на величину потенциала осаждения металла,
но с увеличением этой концентрации значительно снижалась плот-
ность тока, при которой достигался потенциал ’выделения этих
16 Основы гальваностегии 1783 241
металлов. Между прочим, при Введении, деполяризаторов (перекиси
водорода) Гластон не пабдюдал изменения потенциала осаждения ни-
келя, что находится в противоречии с теорией Колыпютера, согласно
Фиг. 107. Катодный потенциал на никелевом электроде
в растворе уксуснокислого натрия. I—Ph=5; II—Ph=6.
которой разряд ионов, протекающий в пленке газообразного водорода,
сопровождается. значительной (связанной с этой пленкой) поляри-
зацией. В заключение Гластоном предлагается гипотеза, согласно ко-
торой металлы группы
железа осаждаются в
неустойчивой форме с
распределением атомов,
отличным от распреде-
ления в обыкновенной
устойчивой форме.
В более поздней ра-
боте Ферстер1 настаи-
вает на справедливости
сделанных ранее им
и другими исследовате-
лями выводов отно-
сительно электродных
потенциалов металлов
группы железа и обо-
сновывает эти выводы
новыми эксперимента-
ми. При этом оказы-
вается, что Гластоном
была допущена одна
для данной плотности
Фиг.?108. Поляризационные кривые в растворе
NiSO4 при 95°. 1 - Ph = 2,8; 2 — Ph = 4; В— Ph =
= 5; 4 — Ph = 6; 5 —Ph = 6 (без никеля).
существенная ошибка: значения потенциалов
тока фиксировались на основании кратковременных наблюдений, в
242
течение которых трудно было рассчитывать на устойчивость этих
потенциалов. Кроме торо не уделялось достаточно внимания изолиро-
ванию катодного пространства от доступу кислорода.
Устранив эти недостатки, Ферстер имел возможность высадить
прр 16°' никель из 1 <N раствора N1CL при потенциале — 0,42 V и вы-
числить катодный выход тока, что не оставляло никаких сомнений в
том, что) при этих значениях потенциала на катоде имеет место вы-
деление металла, а не какой-нибудь другой процесс.
В сернокислых растворах никель начинал осаждаться при потен-
циале— 0,50 V, т. е. на 0,07 V менее отрицательном, чем юб этом ука-
зывал Гластон. Природа аниона также оказывала влияние на потен-
циал выделения никеля — в хлористых растворах он был менее от-
рицательным.
Катодная поляризация, как известно, оказывает заметное влия-
ние на структуру электролитического осадка и на равномерность рас-
пределения металла на
катодной поверхности. С
этой точки зрения жела-
тельно катодную поляри-
зацию повысить насколь-
ко это возможно. В дру-
гих случаях без заметно-
го повышения катодной
поляризации процесс ни-
келирования вообще не
удается осуществить. Это
относится, например, к ни-
келированию цинка, алю-
миния и их сплавов. При
погружении таких метал-
лов (или сплавов) В рас-
твор Ni804 имеет место
реакция замещения:
Zn + NiS04=>ZnS04 + Ni.
При этом так же, как и в
случае погружения желе-
за в медный кислый
раствор, основной металл
покрывается неплотным,
плохо пристающим слоем
Фиг. 109. Поляризационные кривые в нормальных
никелевых растворах в присутствии других со-
лей. L — стандартная ванна N NiS04, 0,25 N
NH4C1, 0,25 N H3BOS; 2—стандартная ваииа при
5°; 3—стандартная ванна 4-0,25 N NaF; 4—
стандартная + 0,50 N лимоннокислый натр; б —
стандартная1 N лимоннокислый натр; 6 —
стандартная 4-1 N виннокислый натр; 7 — стан-
дартная 4- 1N уксуснокислый натр; 8—стан-
дартная 4 1 NaH,F04.
другого металла.
Для того чтобы этого избежать, приходится настолько повысить
катодный потенциал, чтобы он препятствовал стремлению цинка (или
алюминия) в силу своей.большой упругости растворения переходить
в раствор. Это удается либо заметным повышением начальной плотно-
сти тока о последующим понижением ее до нормальной, либо умень-
шением концентрации ионов осаждающегося металла в растворе
введением нейтральных солей с одноименным анионом, либо введе-
нием специальных компонентов, способствующих в той или иной сте-
пени повышению катодной поляризации. При никелировании цинко-
243
пых изделий приходится катодный потенциал сделать равным по
крайней мере-—0,8 V, что соответствует равновесному потенциалу
цинка в никелевом растворе. Для того чтобы достигнуть такого по-
тенциала, пришлось бы плотность тока повысить до 4 К/дм2, что не
всегда дает удовлетворительные результаты.
Введение, больших количеств солей с одноименным анионом ока-
зывает в никелевых ваннах отрицательное влияние на равномерное
растворение анодов, поэтому только за их счет также нельзя значи-.
тельно повысить катодную поляризацию. С введением же лимонно-
кислого натра удается настолько понизить концентрацию ионов ме-
талла в растворе, что уже при плотности тока в 1 А/д.и2 достигается
петенциал в — 0,8 V. На фиг. 109 нанесены кривые потенциал-—плот-
ность тока, полученные Томпсоном в так называемой стандартной
никелевой ванне в присутствии различных солей нйтрия: фтори-
стой, лимоннокислой, виннокислой, уксуснокислой и фосфорнокис-
лой. Наибольшая катодная поляризация Достигается при введении в
стандартную никелевую ванну 1 N раствора лимоннокислого натра.
2. Анодный процесс
Широкое применение в гальванотехнике никеля в качестве покры-
тия для декоративных целей в значительной степени объясняется
сильно выраженной способностью никеля к пассивированию. Это
свойство особенно резко сказывается при анодоном растворении. При
пассивировании анодов' в электролите быстро' растет концентрация
водородных ионов, и уменьшается концентрация металла. Давно Из-
вестно, что литые аноды легче растворяются, чем катаные; часто
прибегают к комбинированному завешиванию литых и катаных
анодов. Можно также встретить указания о нецелесообразности при-
менения анодов из чистого никеля ввиду плохого растворения его на
аноде, для предупреждения чего рекомендуется специально вводить
в алоды примеси других металлов, например железа. Однако широко
пользоваться этим на практике неудобно, такчкак катодное осажде-
ние никеля очень чувствительно к присутствию различных катионов
в электролите (в том числе и железа). Пассивирование никеля можно
довести до минимума значительным увеличением анодной поверхно-
сти — уменьшением анодной плотности тока, — однако и в этом
случае мы бываем .иногда ограничены из-за конструктивных сообра-
жений (при никелировании внутренних поверхностей), а также из-за
необходимости сообщить аноду наиболее благоприятную форму с
точки зрения равномерного распределения металла.
Естественно, что наиболее радикальным средством следует счи-
тать такие активирующие агенты, которые, будучи введены в элек-
тролит, не оказывали бы отрицательного влияния на катодный про-
цесс в смысле уменьшения выхода тока или ухудшения качества
осадка и одновременно способствовали бы нормальному растворению
анодов. Такими активаторами являются ионы хлора, которые
вводятся в определенных количествах в элек-
тролит в виде соли щелочного металла или в виде
хлористого никеля. За последние годы в американской
практике для целей никелирования приняты почти исключительно
ванны,, содержащие хлор-ион.
244
Активирующее влияние хлор-иона на никелевые аноды было де-
тально изучено Ферстером и Кригером *. Эти авторы нашли, что су-
ществует определенная зависимость между концентрацией сульфата
никеля в растворе, анодной плотностью тока и концентрацией хлор-
иона, достаточной для предотвращения анодной пассивности. Так на-
пример, при 0,025 N содержании хлор-иона и 0,5 N общей концентра-
ции никеля анодная плотность тока может быть повышена до 3 А/ди2
без того, чтобы анод потерял свою полную активность, в то время как
в 1 А растворе сульфата никеля частичная пассивность наступает
уже при 2 А/дм2, а в 2 А растворе никеля полная пассивность на-
ступает при анодной плотности тока в 1 А/дм2.
При одинаковом отношении Я': S04" плотность тока, необходимая
для наступления полной пассивности, увеличивается значительно
медленнее, чем концентрация хлористой соли:
в 0,5 N растворе Ni + 0,01 TV Cl' —► Ол = 1 K/dM?
„ 2,0 N „ Ni + 0,04 N Cl' —>DA = 2 „
Образующаяся при переходящем пассивировании на поверхности
никелевых анодов плотно прилегающая пленка темнокоричневого
цветка, по мнению цитируемых авторов, состоит из перекиси никеля;
в подкисленном растворе* йодистого калия эта пленка вызывает силь-
ное выделение иода. В этой стадии пассивности выделение кислорода
Иа аноде не заметно,'—чувствуется запах хлора. При полной пас-
сивности на аноде наблюдается выделение кислорода наряду с хло-
ром; поверхность покрыта слабым желто-коричневым налетом, под
которым анодная поверхность имеет светлый металлический вид.
В случае полной активности анодная поверхность приобретает серый
цвет вследствие сильного разъедания.
Разбирая процессы, протекающие на аноде при их пассивирова-
нии, и активирующую роль хлор-иона, Ферстер и Кригер считают,
что препятствия к переходу никеля в раствор могут встречаться и
при наличии разряда на аноде СГ по уравнению
2d' —20 —С12. (1)
Препятствия, нарушающие непосредственное анодное растворение
никеля
Ni — 20 —-Ni”, (2)
могут бытц преодолены, если никель будет быстро реагировать с
очень низкими концентрациями хлора и заметно деполяризовать раз-
ряд СГ
Ni । Cl2 —Ni’*-|-2C1'. (3)
Но активное состояние на аноде будет продолжаться до тех пор,
цока скорость процесса (з) не отстанет от скорости процесса (1). При
недстаточном выделении на аноде хлора роль последнего могут взять
на» себя SO/, как это бывает при электролизе разбавленной серной
кислоты с никелевыми атрэдами:
Ni-J-SO,—Nf-t-SO/. (4)
i .Zeitschr. f. Electrochemie', 33, .406, 1927.
Цоследняя реакция протекает значительно медленнее, чем реак-
ция (3), и по мере накопления SO4 у анода начинается разложение
его по, уравнению
so4-|-h2o—2H-4-SO/+0. (5)
Благодаря выделению кислорода наступает явление пассивности;
и в дальнейшем будет протекать следующий процесс:
Ni" —©—Ni*" (6)
Но трехвалентные ионы никеля неустойчивы, и при недостатке
кислоты на аноде идет реакция:
Ni**’ + зН20 Ni(OH)3 -ф ЗН*. (7)
Образующаяся при этом темнокоричневая перекись никеля покры-
вает частично анодную поверхность, делая ее неэлектропроводной,
отчего рабочая анодная поверхность уменьшается, а плотность тока
увеличивается, и поэтому легко протекают реакции (5) и (6). В то же
время образующиеся согласно процессу (6) Ni"* могут реагировать с
имеющимися в растворе хлор-ионами:
NF'-f-Cr->Ni~4-CJ, (8)
отчего равновесие (7) смещается влево; пленка, состоящая ид№(0Н)3,
сперва разрыхляется и затем растворяется. Вследствие увеличения
рабочей поверхности плотность тока понижается и наступает актив-
ное состояние. Последнее состояние будет поддерживаться до тех пор,
пока уменьшение концентрации хлор-иона на определенных участ-
ках анодной поверхности благодаря неравномерной плотности тока
снова не приведет к пассивному состоянию. Такие чередующиеся яв-
ления и характеризуют «переходящую» пассивность. В тех слу-
чаях, когда концентрация СГ настолько мала, что
она даже приблизительно не соответствует при-
меняемой плотности тока, на аноде будет иметь
место преимущественный разряд S04" с выделением
газообразного кислорода, и незначительное рас-
творение никеля, т. е. наступает явление полной
пассивности.
Влияние хлоридов щ. других компонентов на анодную поляриза-
цию никеля было изучено также Доррансом и Гардинером1. Изме-
рения поляризации производились в ванне Херинга вначале в 1 N
растворе NiS04.7НХ) + 0,25NH3B03 при плотности тока в 1 А/дм2, 17°
и Phj:= 5,4—5,8. В эту, так называемую стандартную, ванну вводил-
ся хлор-йон в виде солей аммония, натрия, магния, никеля и калия.
Как видно из табл. 54, от введения в сернокислую никелевую ванну
хлор-ионов в количестве 0,’25 N анодная поляризация уменьшается на
1,3—1,4 V- Катион, с которым хлор-ион вводится, существенного
влияния на анодную поляризацию не оказывает, но все же наилуч-
ший эффекГ дает КС1.
Помимо этих компонентов было изучено влияние фтористых и ли-
моннокислых солей на анодную поляризацию, а также хлористого
» Dorrance a. Gardiner, ,Trans. Am. Electrochem. Soc.“, 54, 303, 1928.
246
кадмия, часто добавляемого в сернокислые никелевые ванны для по-
лучения блестящих осадков. В результате соответствующих измере-
ний быль установлено, что фтористые соли сн Иж а ю т
анодную поляризацию весьма незначительно по
сравнению с хлоридами, а лимоннокислые соли вовсе не снижают ее,
а вызьивают даже некоторое повышение анодной поляризации.
Таблица 54
Электролит Концентра- ция (нор- мальность) N Поляризация Удельи. сопротив. дм/см3
анодная V катодная V
NiSO4.7H»O Н3ВО3 + NH4C1 СтаидаРт- ный + NiCl3 -t- KCl 1.0 0,25 0,25 0,25 0,25 0,25 0,25 1,78 0,43 0,39 0,49 0,43 0,32 0,56 0,87 0,73 0,83 0,73 0,84 40,0 20,4 22,4 24,4 30,8 20,0
Присутствие фторидов в никелевых ваннах, по данным других
исследователей, оказывает благоприятное влияние в смысле лучшего
растворения анодов и возможности применения более высоких плот-
ностей тока. Последнее связано, очевидно, с образованием фторбора-
тов (оф взаимодействия между фторидом и борной кислотой), кото-
рые способствуют регулированию концентрации водородных ионов в
ванне. Что же касается влияния фт/оридов на анодный процесс, то
преимущество их перед хлоридами заключается в том, что они пре-
дупреждают образование шлама (основных солей железа или нике-
ля); раствор остается чистым, и если железо присутствует в электро-
лите за счет ли анодного растворения или' загрязнений в солях, то
фториды способствуют осаждению его на катоде.
Помимо изложенных методов борьбы с пассивированием никеле-
вых анодов — введением активирующих агентов—для этих же це-
лей вводят примеси непосредственно в аноды в процессе их изго-
товления!. Чистые никелевые аноды пассивируются в большей сте-
пени, чем технические, загрязненные. Такие примеси, как углерод и
железо, не только способствуют лучшему растворению никелевых
анодов, но и снижают температуру плавления никеля. Незначитель-
ные примеси в анодах остаются также от введения в процесс плавки
раскислителей — магния, марганца и кремния. Еще 10 лет назад в
ходу были никелевые аноды с содержанием примесей (главным об-
разом железа), в кЬличестве до 10%'.
В последнее время с началом применения активаторов и перехо-
дом на высокие плотности тока чистоте никелевых анодов уделяется
большое внимание. В табл. 55 приводятся типичные анализы: никеле-
вых анодов, применяемых в США.
Так как хлориды, присутствующие в электролите в достаточном
количестве — 0,25 N, — активируют никель любой чистоты, то в
интересах сохранении чистоты электролита и получения нужного
247
качества покрытий следует по возможности избегать каких-либо при-
месей в анодах.
Наблюдается, правда, неравномерное растворение катаных ано-
дов вследствие наличия на их поверхности труднорастворимой плен-
ки, но ее можно устранить, обработав эти аноды предварительно в
5% растворе соляной кислоты.
Таблица 55
Формула М а Р К а
90—92 95-97 95-97 95—97 95- 97 99 + 99 + 99 + 99 +
Ni-j-Co 91,98 97,50 97,70 97,20 97,30 99,6 99,3 99,3 99,6
Fe 6,41 0,60 0,90 0,55 1,18 0,25 0,38 0,36 0,30
Си 0,26 0,20 0,15 0,12 0,26 0,02 0,15 0,10 —
С 1,20 1,50 0,81 1,26 0,73 0,03 0,10 — 0,01
Si 0,12 0,05 0,24 0,18 0,38 0,02 0,01 0,13 —
Мп — — — — — 0,02 0,05 — —
Sn — — —— 0,60 — — — — —-
S — — — — — — 0,03 0,01 —
О — — — — — — — — 0,10
Итого 99,89 99,85 99,70 99,91 99,85 99,94 100,02 99,90 100,01
Наличие примесей в никелевых анодах приводит часто к нерав-
номерирму растворению аиРдов. В случае наличия магниевых вклю-
чений в анодах образуются сквозные дыры, так как упругость
растворения магния больше, чем никеля. Включения углерода приво-
дят к образованию местных элементов и неравномерному растворению
анода.
Особенно вредно сказываются примеси серы в анодах; образую-
щиеся сульфиды никеля легче растворяются, чем чистый никель, а
так как эти сульфиды распределяются по границам зерен, то значи-
тельная часть никеля выпадает на дно в виде тонкого порошка. Та-
ким образом приходится заботиться не только о надлежащем хими-
ческом составе никелевых анодов, но и о равномерной и тонкой
структуре их..
Для более равномерного растворения никелевых анодов и луч-
шего их использования им сообщают форму эллиптического сечения.
Во время перерывов в работе аноды могут оставаться в ванне. Наблю-
дающееся иногда покраснение поверхности анодов после более или
менее длительного перерыва в работе является результатом контакт-
ного вытеснения присутствующей в электролите меди.. Последняя
удаляется с анодной поверхности механически при помощи металли-
ческой щетки или растворением в разбавленной азотной кислоте.
3. Никелевые ванны
Концентрация металла в никелевых электролитах может коле-
баться в широких пределах. Выше мы уже упомянули, что так
248
называемая двойная иикелево-аммонийиая соль [NiS04(NH4),S04.6H20]
растворима в значительно меньшей степени, чем сернокислый йикель
(iNS04 • 7Н2О). В то же время содержание металла в первой соли при-
мерно на 40%. меньше, чем во второй. По этой причине двойные соли
сернокислого никеля и аммония применяются исключительно для ни-
келирования при низких плотностях тока и получения относительно
тонких слоев никеля. К преимуществу никелевых ванн с двойной
солью следует отнести лучшую рассеивающую способность, вслед-
ствие большей катодной поляризации, по сравнению с электролитами,
приготовленными из простой никелевой соли. Структура никелевых
осадков в этих ваннах получается мельче, чем в ваннах с простой
никелевой солью, но вместе с тем они имеют больше упругих напря-
жений и в большей степени склонны, особенно в толстых слоях, к
отслаиванию.
Таблица 56 1
Сравнительная оценка никелевых ванн из двойной и простой соли
Двойная никелевая соль Простая никелевая соль
Концентрация Низкая. При комнатной тем- Высокая. При комнатной
металла в рас- пературе растворяется не боль- температуре может находить-
тноре ше 60 —90 г/л соли. По мере накопления сульфата аммония в ванне растворимость серно- аммонийной солн никеля еще больше уменьшается. Йо держа- ние металла в соли 14,87о/о. ся в растворе 270—360 г/л соли. • Содержание металла в соли—20,9%
Применяемая В стационарной ванне допу- При длительном осаждении
плотность тока скается 0,3—0,4 А./дм3 Хюз применял в стационарной ванне около 2 А./дм2
Катодный вы- Низкий. Редко он достигает Высокий. По измерениям
ход тока 90%; на практике равен чаще 70—80% Хюза катодный выход тока равен 98%. На практике ван- на 1000 л работала с выхо- дом тока 96,5%
Контроль Электролиты, содержащие двойную соль сернокислого ни- келя и аммония, требуют тща- тельного ухода, и работающие на ванне знают, что их успех зависит от соблюдения долж- ных соотношений отдельных компонентов в узких пределах Относительно легкий. Анод- ные и катодные реакции про- ще, и не возникает затрудне- ний от защелачивания элек- тролита Обычно получается гладкое
Покрытие Очень часто твердое и труд- но полируется. Часто полу- чается нехорошего цвета, тем- ное и желтоватое. Более склон- но к отстаиванию н точечной пятнистости. Возможно полу- чать только тонкие покрытия н мягкое, легко полируется. Менее склонно к отслаиванию или к точечной пятнистости. Легко получается в толстых слоях
1 Hughes, Modern Electroplating,
249
По этой причине в современных крупных установ-
ках’ пользу ются исключительно простой никеле-
вой сольно. Эта последняя применяется в концентрациях от 70 до
420 г/л, причем более высокой плотности тока соответствует большая
концентрация соли.
Мы уже упоминали выше о чувствительности никелевых ванн к
металлическим примесям, в частности железа, меди и цинка. При
определенных условиях можно получать никелевые покрытия со зна-
чительным содержанием железа. Это относится особенно к ваннам,
содержащим в качестве буфера лимоннокислые соли. Однако даже и
в этом; случае приходится следить за постоянным соотношением со-
держания железа и никеля в электролите, в противном случае хими-
ческий состав осаждающегося сплава, а следовательно и механиче-
ские свойства осадка будут в различных слоях отличны.
На вопросе об осаждении сплавов никеля с другими металлами
мы остановимся в соответствующей главе; здесь же мы будем рас-
сматривать влияние отдельных металлов в растворе с точки зрения
их вреда, т. е. мы будем говорить о случайных примесях, а не спе-
циально введенных компонентах.
Присутствие железа в электролите особенно вредно в том, случае,
когда оно находится в трехвалентном состоянии. Если pH электролита
выше/ 5, то железо почти нацело гидролизирует и осаждается в виде
гидрата окиси или основных солей. Последние служат часто причи-
ной образования пористых осадков. Для получения мягких покрытий
и в’ частности при последующем осаждении поверх никеля хрома,
следует избегать присутствия железа в электролите даже в незначи-
тельных количествах.
Медь, присутствующая в растворе, осаждается предпочтительно
перед никелем/ на катоде и приводит к образованию темных осадков.
Присутствие меди в растворе обнаруживается по покраснению ано-
дов, когда онц находятся не под током. Освободиться от меди можно
проработкой ванны некоторое время при низком напряжении.
Наиболее вредной примесью в никелевых электролитах является
цинк. Уже 0,051% Zn в растворе ухудщает качество осадка, а присут-
ствие Zn в больших количествах вызывает появление темных полос, и,
наконец, весь (осадок становится черным и хрупким. От меди и цинка
можно очистить никелевые растворы, если их нейтрализовать угле-
кислым кальцием, известковым молоком или аммиаком до pH =,(5,3
с последующим фильтрованием и подкислением до нужной степени.
Органические примеси, тем или иным путем попадающие в нике-
левый электролит, вызывают хрупкость и пятнистость.
Вредное действие примесей в никелевых ваннах, главным образом
пинка, меди и железа, изучали Томпсон и Томас Ч «Стандартная»
ванна была ими приготовлена из химически чистых солей (присут-
ствовал только сернокислый магний, не оказывающий вредного влия-
ния на процесс) и имела следующий состав:
№ЯО4-7Н..О 140 г'л
NH.C1 ' 14 „
Н3ВОз *6 .
1 .Trans. Ani. Electrochem. 8ос,“, 42, 79, 1922.
250
Никелевые осадки получались на латунных катодах при плотности
тока в 1 Л/диЛ Проведенные опыты дали возможность установить
Следующее влияние этих примесей.
Цинк, присутствуя в небольших количествах, служит причиной
образования блестящего осадка на краях и остриях катода. В боль-
ших количествах цинк вызывает образование темных полос и пятни-
стости на всей катодной поверхности. В еще больших количествах
цинк вызывает сильное газовыделение на катоде и образование че-
шуйчатого осадка. Присутствие цинка в ванне проявляется не сразу,
а по м;ере течения электролиза, невидимому благодаря скоплению
ионов цинка у катодной Поверхности. При получении тонких нике-
левых осадков вредное влияние цинка проявляется, когда он присут-
ствует в Соли в количестве 0,05%, а для толстых осадков это влия-
ние начинает сказываться уже -при 0,03%/.
Присутствие меди до 0,05 г/л не оказывает заметного влияния на
катодный осадок; При 0,07 г/л меди осадок начинает темнеть преиму-
щественно на нижних частях катодов, а при 0,14 г/л и выше осадок
становится губчатым. Таким образом содержание меди в никелевой
соли может быть терпимо до о,03% для тонких покрйгий и до 0,02'%
для более тодсПых.
В противоположность цинку медь осаждается на катоде преиму-
щественно перед никелем, почему концентрация ее в растворе со вре-
менем падает. Из анодов медь переходит, главным образом, в шлам, а
медь, присутствующая в растворе, цементируется на анодах во время
перерывов в работе ванны.
Что касается влияния железа, то авторы не могут категорически
утверждать, полезно ли оно или вредно при электроосаждении нике-
ля. Если в растворе имеются взвешенные частицы гидрата окиси же-
леза, то увеличивается пористость осадка. Вообще присутствие трех-
ватецтного железа в растворе следует, невидимому, считать нежела-
тельным, в то вре!мя как двухвалентное железо, осаждаясь вместе с
никелем, оказывает благоприятное влияние на структуру осадка.
В США существует спецификация никелевых солей, применяемых
для цейей никелирования, которую мы приводим в табл. 57.
Таблица 57
Наименование соли
NiSO4-7HsO NiSO4(NHJa SO4-6Ha0 NiCla 6Ha0
Минимальное содержание 24,3
Ni-j-Co в о/о 21,4 14,6
Нерастворимый осадок 0,10 0,10 0,10
Свободная кислота 0,10 0,10 0,10
Максимальное содержание примесей в % 1 Fe J Си 1 Zn 0,08 0,02 0,05 0,08 0.02 0,05 0,08 0,02 0,05
251
Свободная серная кислота в никелевых солях вредна по той при-
чине, что в процессе добавления в электролит соли одновременно
с| ней вводится кислота, что затрудняет регулирование устдновлен-
ной для данных условий концентрации водородных ионов.
Для увеличения электропроводности никелевых ванн вводятся
обычно сернокислые соли калия, натрия, магния, или аммония. В
прежний годы прибегали преимущественно к аммонийным солям,
предполагая, что они предупреждают выпадение основных солей ни-
келя на катоде (вследствие хорошей растворимости комплексного ам-
миачноникелевого основания — Ni(NH3)4(0H)2). Однако от этой соли
приходится (отказаться в тех случаях, когда желают работать с высо-
кой концентрацией никеля в растворе, так как в присутствии солей
сернокислого аммония образуется плохо растворимая двойная соль.
'В отношении солей магния имеются указания, что присутствуя
в растворе, магний в некоторой степени осаждается вместе с никелей,
способствуя образованию светлого мелкозернистого осадка.
С1 точки зрения максимального увеличения электропроводности
никедевых ванн (и одновременно их рассеивающей способности) сле-
дует отдать предпочтение сернокислому натрию, так как помимо того,
что эта соль обладает хорошей электропроводностью, образующиеся
двойные соли сернокислого никеля и натрия хорошо растворимы
в воде. Специальные добавки в роде тех, которые применяются при
электролитическом осаждении цинка, кадмия, олоЬа и др., для улуч-
шения структуры металла, в никелевых ваннах не применяются. Во-
первых, в этом нет* надобности, так как никель и в отсутствии спе-
циальных добавочных агентов кристаллизуется во вполне приемлемой
для гальваностегии форме. Во-вторых, процесс электроосаждения
никеля чрезвычайно чувствителен к присутствию в электролите кол-
лоидов, и (органических соединений вообще.
Уже незначительные количества клея могут вызвать растрескива-
ние никелевого осадка. Такое же действие может оказать декстрин.
Никелевые осадки становятся, правда, в присутствии некоторых орга-
нических соединений светлее, иногда даже блестящими, но вместе
с эт)им они приобретают хрупкость. Особенно следует избегать при-
сутствия органических соединений в никелевых ваннах в тех слу-
чаях, когда поверх никеля осаждается еще хром.
К вредным примесям в никелевых ваннах относят также свинец.
Этот металл, вообще говоря, мало растворим в сульфатных растворах,
но в присутствии хлоридов растворимость свинца значительно повы-
шается. Чаще всего загрязнения никелевых ванн свинцом могут по-
следовать в результате взаимодействия обкладки ванн с электроли-
том, иногда свинец вводится с хлористым никелем, если таковой при-
меняется в значительных количествах.
Специально для никелевых ванн некоторые рекомендуют вводить
глюкозу, которая позволяет получать в тонких слоях блестящие
осадки никеля; в Германии была одно время в ходу никелевая ванна,
содержавшая этилсернокислый эфир. Все же в крупных никелевых
установках не прибегают к добавкам каких-либо органических соеди-
нений.
Широко прибегают сейчас к введению кадмиевых солей в целях по-
лучения более блестящего осадка никеля. Механизм влияния кадмия
852
на кристаллизацию никеля до сих пор не установлен достаточно
твердо. Херинг1, например, считает, что действие кадмия в никеле-
вых ваннах аналогично цинку: при 0,4 А/дм2 Возможно получать
блестящие никелевые осадки в присутствии 0,001 N цинка или кадмия.
При низких плотностях тока и больших концентрациях этих метал-
лов никелевые осадки становятся, по опытам Херинга, более темными
в присутствии кадмия, чем, в присутствии цинка. Все же, как мы
выше указали, цинк относят к вредным примесям в никелевых ван-
нах, в то время как кадмий специально вводят.
Помимо перечисленных выше компонентов — солей никеля, ней-
тральных солей щелочных ванн и активаторов — в никелевые ванны
вводятся еще буферы, которые должны регулировать кислотность в
определенных узких пределах. На этом вопросе мы остановимся под-
робнее, поскольку при осаждении никеля он играет первостепенную
роль. На количественных соотношениях отдельных компонентов мы
также остановимся ниже при описании современных никелевых уста-
новок.
Влияние кислотности на работу никелевых
ванн. Выше мы уже указали, что процесс электроосаждения никеля,
как и других металлов группы железа, весьма чувствителен к неболь-
шим изменениям кислотности. Если в медной сорнокислой ванне кис-
лотйоСТь может меняться в весьма широких пределах без какого-ни-
будь заметного влияния на выход тока, то в никелевых ваннах изме-
нение величины pH на одну единицу может вызвать изменение вы-
хода тока на десятки процентов. Такое положение станет вполне по-
нятным, если мы учтем катодные потенциалы меди и никеля, с одной
cropojHH, и 'водорбда (при различной кислотности среды), с другой.
Медь в сернокислых растворах имеет положительный потенциал и на
катоде выделяется без заметной поляризации, никель — металл элек-
троотрицательный и выделяется к тому же с заметной катодной по-
ляризацией. Если в растворе концентрация ионов никеля и водорода
будет' одинакова, то на катоде будет практически выделяться один
водород, и лишь !при значительной плотности тока может быть до-
сшипнут потенциал выделения никеля, который при этом будет кри-
сталлизоваться в неудовлетворительной форме вследствие одновре-
менного выделения водорода. При данной кислотности выход тока по
металлу в никелевых ваннах повышается с плотностью тока (и одно-
временным повышением катодного потенциала) до определенного пре-
дела; с наступлением сильного обеднения ионами никеля катодного
слоя электролита выход тока по металлу начнет приближаться к
нулю. Таким образом мы можем констатировать, что каждой кислот-
ности: должна соответствовать определенная (с точки зрения выхода
тока) Плотность тока, и наоборот.
Необходимо, однайо, иметь в виду не только верхний предел кис-
лотности для каждой плотности тока, но и нижний, который обуслов-
лен началом выпадения гидрата окиси никеля. Последний процесс
протекает в большей степени в катодном слое, чем во всей массе
электролита, так как в большей или меньшей степени наряду с раз-
рядом ионов металла, вследствие разряда ионов водорода около ка-
тода, возрастает концентрация гидроксильных ионов.
1 Haring, .Trans. Am. Electroqjiem. Soc.“, 46, 107, 1929.
2«3
По этой причине кислотность электролита устанавливается в за-
висимости от выбранного режима, главным образом плотности тока-
Практически поддерживают в никелевых ваннах кислотность в преде-
лах pH — 4— 6,3; лучшие результаты получаются в более узких пре-
делах pH = 5 — 5,5. Для данного состава электролита и данного ре-
жима оптимальную концентрацию водородных ионов целесообразно
поддерживать в нредёлах + 0,2 pH.
Томпсон, изучавший влияние кислотности на работу никелевых
ванн, пришел к следующим выводам1:
1) хорошие никеле’вые покрытия получаются при высоком катод-
ном выходе тока, т. е. при незначительном газовыделении на катоде;
2) при обычных рабочих условиях катодный выход тока растет
при увеличении pH до 5,5;
3) при постоянном pH катодный выход тока растет с плотностью
тока до определенного предела, характерного для данного состава
электролита;
4) в ванне с большей кислотностью получаются лучшие осадки
при относительно высокой плотности тока;
5) если необходимо работать с низкой плотностью тока, например
при покрытии изделий с неправильной формой, то лучше поддержи-
вать относительно невысокую кислотность электролита;
6) осадки, полученные в электролите с низким значением pH (с
относительно высокой кислотностью), имеют более тонкую структуру;'
они более блестящи и более тверды, но вместе с тем более хрупки, чем
осадки, полученные при высоких значениях pH;
7) при pH < 4 никелевые -осадки получаются блестящими, но с
большим количеством трещин и точечных пятен. Таким образом 4 яв-
ляется нижним пределом pH для получения хороших осадков в ста-
ционарных ваннах;
8) при pH > 6 осадки становятся темными покрываются трещи-
нами и имеют тенденцию к отслаиванию. В стационарных ваннах
трудно получить удовлетвротилеьиые результаты при pH > 6. При
перемешивании возможно получить удовлетворительные результаты
и при pH = 6,5.
Эти (выводы основаны не только на основании лабораторных иссле-
дований, но и иа основании наблюдений над рядом промышленных
установок. Среднее значение pH из целого ряда больших установок
для никелирования, обследованных Томпсоном, равнялось 5,3. На
установках, работавших при относительно высоких плотностях тока,
pH в среднем равнялось 5; в случае применения повышенной тем-
пературы и средней плотности тока поддерживалась pH = 5,5. В кон-
вейерных и барабанных ваннах pH выше, чем в стационарных ваннах.
Эти положения, установленные Томпсоном 12 лет назад, в послед-
ние годы подвергнуты резким изменениям, особенно в части зависи-
мости между кислотностью и механическими свойствами никелевых
покрытий. Сейчас, например, больше склонны думать, что недоста-
ток кислоты в большей степени способствует получению хрупких
осадков, чем избыток ее.
С кислотностью никелевых ванн связывают обычно явления точеч-
1 Thompson, .Trans. Am. Electrochem. Soc.*, 41, 33, 1922.
254
иой' Пятнистости (pitting). На самом деле, это явление может быть
следствием многих других факторов: наличия посторонних взвешен-
ных частиц в электролите, металлических примесей в растворе и др.
Детально этот вопрос был изучен Макнанфтаном и Хутерсолом Ч Они
установили, что точечная пятнистость является следствием задержи-
вания на катодной поверхности пузырьков газа. Этот газ может пред-
ставлять собой водород, выделяющийся на катоде и задерживающийся
на нем; кислород, выделяющийся на аноде и механически перенося-
щийся на катодную поверхность, и, наконец, воздух, растворяющийся
й электролите при низких температурах и выделяющийся по мере ра-
зогревания электролита (в процессе прохождения через него тока).
Нередко пятнистость увеличивается по мере пассивирования анодов;
на первый взгляд казалось бы трудно установить связь между этими
Двумя явлениями. В действительности же на пассивированных ано-
дах выделяется в больших количествах кислород, который может ме-
ханически быть перенесен на катодную поверхность и задерживаться
на ней в виде пузырьков.
Из металлических примесей можно отметить цинк, присутствие кото-
рого вызывает явление пятнистости. В присутствии железа и недоста-
точн!ой кислотности электролита вблизи катодной поверхности выпа-
дает его гидрат, при недостаточной кислотности может, наконец, около
катода выпасть и гидрат никеля, — в обоих этих случаях на катод-
ной •поверхности образуются точечные пятна. Последние могут образо-
ваться и при наличии некоторых органических примесей в растворе.
Одним слойом, a priori связывать точечную пятнистость с повы-
шенной кислотностью нельзя. На этом вопросе мы остановимся еще
несколько позднее, в связи с обсуждением никелевых ванн, работаю-
щих при низких значениях pH.
Поскольку, как указано выше, допустимая плотность токов в ни-
келевых ваннах сильно связана с кислотностью электролита, а в то
же время для форсирования процесса желательно работать с макси-
мальной плотностью тока, то в последнее время уделяется много вни-
мания изучению никелевых ванн, работающих при относительно вы-
сокой кислотности. Нельзя утверждать, что этот вопрос в достаточной
мере изучен и практикой освоен. Можно сказать, что до сих пор на
практике руководствуются изложенными соображениями Томпсона.
Все же на крупных установках, где скорость процесса имеет большое
экономическое значение, оказывается часто более выгодным прене-
брегать некоторыми отрицательными моментами, связанными с оса-
ждением при высоких плотностях тока и высокой кислотности, в част-
ности с уменьшением катодного выхода тока.
Филиппе2, изучавший работу «быстрой» никелевой ванны
Уаттса при высокой кислотности, отметил преимущества и недостатки
последней. К преимуществам высокой кислотности Филлипс относит:
1) расширение «рабочих пределов» ванны, т. е. отношения верх-
ней и нижней границ плотностей тока, при которых получаются
удовлетворительные покрытия — не растрескивающиеся, не от-
1 Macknanghtan a. Hottersoll, „Trans. Am. Electrochem. Soc.", 24,
947, 1928.
a Phillips. „Trans. Am. Electrochem. Soc.", 58, 1930.
2'5
сдаивающиеся и т. д. (фиг. ПО и 111); ускорение процесса благодари
допустимой более высокой плотности тока позволяет эффективнее
использовать оборудование (фиг. 112 и ИЗ);
2) лучшее анодное рас-
Фнг. 110. Рабочий интервал никелевых ванн при
различной кислотности. Продолжительность оса-
ждения 5 мин.
творение;
3) отсутствие взвешен-
ных частиц в электролите;
4) восполнение выде-
ляющееся на катодах ни-
келя за счет анодного
растворителя, а не за счет
периодического введения
в электролит новых со-
лей.
Недостатками, связан-
ными с применением
высокой кислотности, яв-
ляются:
1) большая возмож-
ность образования точеч-
ных пятен на поверх-
ности изделий вследствие более интенсивного выделения водорода;
2) уменьшение катодного выхода тока;
3) сильное растворение анодов при определенных условиях;
4) затруднения, связанные со стремлиием pH к повышению;
5) необходимость выбора достаточно стойких материалов, по-
скольку большей кислотности должна соответствовать повышенная
температура;
6 У получение блестящих никеле-
вых покрытий в ваннах с низким pH
возможно при низких температурах,
в то время как низкая концентра-
ция 'водородных ионов позволяет
получать такие осадки в более широ-
ких температурных пределах;
7) в ванне с низким значением
pH нельзя покрывать изделия с вы-
сокой упругостью растворения, на-
Фнг. 111. Рабочий интервал никеле-
вых ванн при различной кислот-
ности. Толщина слоя 0,0125 мм.
пример цинк, алюминий, цинкалю-
миниевые сплавы и т. п.
Расширение рабочих пределов
никелевой ванны при низких значе-
ниях pH и высоких плотностях тока
имеет большое практическое значение, особенно в тех случаях, когда
подвергаются покрытию изделия с неправильной формой. По данным
Филлипса, ванна, работающая при pH = 1, позволяет получать хоро-
шие никелевые покрытия на таких предметах, где на выпуклых ча-
стях плотность тока достигает 16 тЗ/дл2, а на вогнутых местах она
равна только 1,1 А/дм2. При той же температуре — 50° и pH = 5
можно допустить плотность тока не выше 3 А/дм2, а при рН = б не
выше 1,7 А/дл2, в противном случае осадки получаются «загорелыми».
256
В отношении Лучшего анодного растворения отмечается, что Произ-
водственная ванна емкостью в 35 тыс. л работала, в течение is мес.
без введения дополнительных солей. Таким образом переходящий
в раствор с анодов никель не только компенсирует целиком то коли-
чество металла, которое осаждается на покрываемых изделиях, но и то
количество электролита, которое уносят с собой из ванны выгружае-
мые изделия. Зато это избыточное растворение никеля на аноде (по
сравнению с выделением никеля па катодах) не позволяет поддержи-
Фиг. 112. Влияние плотности тока и
температуры на рабочий интервал
никелевых ванн при различной кис-
лотности. Продолжительность осаж-
дения 5 мнн.
Фнг. ИЗ. Влияние плотности то-
ка и температуры на рабочий ин-
тервал никелевых ванн при раз-
личной кислотности. Толщина
слоя 0,0125 мм.
вать более или менее точно кислотность; последняя имеет тенденцию
к понижению и нуждается в постоянном корректировании.
Работа Филлипса дает представление о связи между кислотностью
среды и механическими свойствами никелевых осадков, полученных
при различной плотности тока (и низкой кислотности). Интересно
проследить также, какое Влияние оказывает кислотность никелевых
ванн на количественное распределение металла, т. е. на рассеивающую
способность.
Флоуерс и Уэрнер 1 пользовались формулой, предложенной Херин-
гом и Блюмом для определения рассеивающей способности в ни-
келевых ваннах при низком значении pH, по ввели поправку Брауна
на разность температуры электролита у ближнего и отдаленного ка-
тода и связанной с этим изменением температур различной электро-
проводности. Согласно этой поправке фактор первичного распределе-
ния тока К заменяется через выражение:
1 Flowers a. Warner, „Trans.. Am. Electrochem. Soc.“, 62, 1932.
17 Основы гальваностегии .1783 257
где С„ и Сг соответственно представляют удельную электропровод-
ность на ближнем и отдаленном катодах. Авторы считают необходи-
мым этой поправкой пользоваться, так как электропроводность
раствора оказывает свое влияние на рассеивающую способность.
Составы примененных электролитов и результаты изменения рас-
сеивающей способности приведены to табл. 58.
Таблица 58
Обозна- чения электро- лита NiSO*-7H2O г/л NH4C1 г/л N1C12-6H2O г/л н3во3 г/л Нормаль- ность Моляр- ность н3во3 Кислот- ность pH
Ni С1
А 140 13 15,45 1,0 0,25 0,25 5,6
В 140 13 15,45 1,0 0,25 0,25 1,9
С 288 — 20,7 46,30 2,3 0,75 0,75 5,3
D 288 — 29,7 46,30 2,3 0,75 0,75 1,9
Анодами служили никелевые пластины, катодами'—пластинки из
полосового железа, предварительно травленого в соляной кислоте и
Фиг. 114. Влияние плотности тока на выход тока
в никелевых ваннах.
тщательно промытого
в воде. Отношение рас-
стояний: /Г = 4,19.
Как видно из табл.
59 и 60, рассеивающая
способность во всех
случаях, при различ-
ных значениях pH раз-
личной концентрации
соли и температуре,
с повышением плотно-
сти тока стремится к
какой-то постоянной
величине. Здесь сказы-
вается, как это было
отмечено Херингом,
влияние плотности то-
ка на выход тока
(фиг. 114).
В растворах с высо-
ким значением pH по-
вышенная температура
оказывает некоторое
благоприятное влияние
на рассеивающую спо-
собность, но незначи-
тельное, в то время как
при низких значениях
pH рассеивающая способность заметно улучшается с повышением тем-
пературы; для концентрированных растворов рассеивающая способ-
258
Таблица 59
Рассепваю1цая сиособиость никелевых ванн при 25°
Суммарная сила тока Распредел. тока Выход тока, % Распредел. металла Рассеив. споеобн. неиспр. Темпера- туря. раза. Исправлен, первичн. распр. тока Исправлен, рассеивают, способность 0/0 Электролит.
ближн. катод отДал. катод
0,50 3,98 94,4 89 9 4,18 4-о,2 0,6 4,27 + 2,1
0,75 4,22 96,3 94,0 4,35 — 3,8 1,1 4,27 — 1,9
1,00 4,18 ‘ 97,3 93,4 4,39 — 4,8 1,3 4,27 — 3,3 • А
1,50 4,49 98,2 98,3 4,52 — 7,9 2,4 4,40 — 2,7
2,00 4,52 97,8 98,1 4,52 — 7,9 4,1 4,53 + 0,2
2,50 4,51 97,5 97,5 4,59 — 9,5 4,4 4,56 — 0,7
0,50 3,86 54,2 12.0 17,45 — 316 0,8 4,24 — 303
0,75 4,06 74,4 25,2 12,02 — 187 0,8 4,24 — 187
1,00 4,16 78,4 35,3 9,27 — 126 1,6 4,31 — 115 В
1,50 4,28 81,6 41,3 8,45 — 102 1,9 4,34 — 95
2,00 4,34 89,4 62,5 6,20 — 48 2,6 4,38 — 41
2,5 4,39 94,8 69,5 5,99 — 43 4,7 4,52 — 32
0,50 3,09 95,7 95,0 4,04 4-з,б 0,6 4,24 + 4,7
0,75 4,06 95,9 93,3 4,16 4-о,7 0,7 4,27 + 2,6
1,00 4,30 96,7 95,3 4,40 — 5,0 1,5 4,31 — 2,1 с
1,50 4,47 97,9 96,6 4,57 — 9,1 2,9 4,40 — 3,9
2,00 4,62 98,2 95,8 4,74 — 13,1 3,8 4,51 — 5,1
2,50 4,74 99,9 99,3 4,84 — 15,5 5,3 4,63 — 4,5
0,50 3,91 81,3 36,1 7,30 — 74 0,6 4,24 — 72
0,75 4,06 82,8 56,0 6,01 — 43 0,8 4,27 — 41
1,00 4,25 85,8 58 3 6,25 — 49 1,2 4,30 — 45 D
1,50 4,34 91,2 70,8 5,60 — 34 2,3 4,36 — 28
2,00 4,55 93,3 77,1 5,51 — 31 4,1 4,53 — 22
2,50 4,67 94,9 83,2 5,32 — 27 5,2 4,61 — 15
ность при повышенной температуре и низком pH только иа несколько
процентов меньше, чем ври высоком pH (фиг. 115 и 116),
Концентрация никеля в растворе не оказывает заметного влияния
на рассеивающую способность при высоком pH; при низких pH как
при комнатной, так и повышенной температуре в более концентриро-
ванных раствррах получается лучшая рассеивающая способность.
Вообще говоря, рассеивающая способность никелевых ванн при всех
условиях уменьшается с, повышением концентрации ионов водорода
в растворе, но при высоких плотностях тока и это влияние становится
минимальным.
Как известно, при определенных условиях повышенная электро-
проводность также способствует улучшению рассеивающей способ-
ности (когда одновременно поляризация уменьшается в меньшей сте-
пени). В никелевых растворах с повышением температуры электро-
проводность линейно возрастает (фиг. 117, 118).
На основании своих наблюдений Флоуер и Уэрнер приходят к сле-
дующим выводам:
1. Рассеивающая способность как при низких, так и высоких
• 259
Таблица 60
Рассеивающая способность йикслевых ванн при 52°
Суммарная сила тока Распредел. тока Выход тока, % Распредел. металла Рассеив. епособн. неиспр. Темпера- турн. разн. Исправлен, первичн. распр. тока Исправ- лен. рассеи- вают, способн. °/п Электролит.
ближн. катод отдал, катод
0,50 3,67 95,3 93,3 3,75 + 10.5 0,8 4,24 + 11.6
0,75 3.98 95,5 90,6 4.17 + 0,5 1,3 4,26 -- 2,0
1,00 3,93 95,9 95,3 3,99 -t- 4,8 1.5 4.27 -- 6,5 А
1,50 4.14 97,0 94,9 4,22 — 0,7 2.1 4.29 + 1,6 А
2,00 4,30 98,2 94,9 4,38 — 4,5 3,2 4,38 — 0,0
2,50 4,47 96,2 97,3 4,44 — 6,0 4,2 4,42 — 0,4
0,50 3,69 70,8 37,2 7,05 — 68,3 0,4 4,20 — 67,8
0,75 3,95 70.9 50,7 5,51 — 31,5 0,5 1 4,19 — 30,4
1,00 4,18 80,8 57,6 5,87 — 40,1 1,1 4^4 — 38 5 ту
1,50 4,20 84,0 64,2 5.51 — 31,5 1,1 4.24 — 30,0 В
2,00 4,23 89,6 69,1 5,35 — 27,7 1.4 4,27 — 25,3
2,50 4,21 87,2 72,7 5,05 — 20,5 1,6 4,27 — 18,3
0,50 3,85 95,1 89,2 4.14 + 1,2 0,8 4.23 + 2,2
0,75 3,98 97,8 93,5 4,16 + 0,7 1,4 4,26 + 2,6
1,00 4,06 97,5 95,8 4,06 + 3,1 1,6 4,32 + 4,1 Г
1,50 4,30 98,4 95,4 4,43 — 5.7 2,1 4,32 — 2,5 V
2,00 4,51 99,9 99.8 4,53 — 8,1 3,9 4,40 — 2,9
2,50 4,55 99,0 97,4 4,62 — 10,3 3,7 4,42 — 4,5
0,50 3,75 87,7 74,0 4,45 — 6,2 0,5 4,21 — 5,7
0,75 4,05 89,9 76,3 4,78 — 14,1 0,9 4,21 — 13,5
1,00 4,05 92,8 81,4 4,62 — 10,0 1,3 4,24 — 9,0 п
1,50 4,32 98,7 85,0 4,76 — 13.6 1,5 4,27 — 11,5 и
2,00 4,40 94,4 95,4 4,54 — 8,1 2,7 4.32 — 5,1
2,50 4,36 99,4 93,2 4,64 — 10,7 2,8 4,32 — 7,4
значениях pH с повышением плотности тока стремится к какому-то
общему пределу.
2. Растворы с высоким значением pH дают значительное умень-
шение рассеивающей способности с повышением плотности тока, в то
время как растворы с низким значением pH дают и значительное
повышение рассеивающей способности.
3. Повышение температуры дает значительное улучшение рассеи-
вающей с.посюбности в ваннах с низким pH, в то время как при вы-
соком pH это влияние незначительно.
4. Концентрация никеля в растворе не оказывает заметного влия-
ния на рассеивающую способность при высоких значениях pH, при
низких значениях pH повышенная концентрация улучшает рассеи-
вающую способность ванны.
5. В концентрированных никелевых растворах, работающих при
высокой температуре, высокой плотности тока и низком pH, рассеи-
вающая способность немного хуже, чем в обычно применяемых в на-
стоящее время ваннах. Сравнение между концентрированными никеле-
выми растворами, работающими при Высокой температуре и высокой
60
плотности тока, показывает мало преимуществ по сравнению с ван-
нами с высоким pH.
6. Выход тока находится в полном согласии с рассеивающей спо-
собностью. Растворы, которые показывают сильное повышение вы-
Фиг. 115. Рассеивающая способность
никелевых ванн при 25°.
Фиг. 116. Рассеивающая способность
никелевых ванн при 52°.
хода тока с плотностью тока,
собность.
дают плохую (рассеивающую
спо-
7. При прочих равных условиях выход тока растет с концентра-
цией никеля в растворе.
Это влияние более заметно
при низких значениях pH.
8. Электропроводность ра-
створов NiSO4 - 7Н»О линей-
но растет с повышением тем-
пературы в пределах 25—70°.
9. Изменение pH от 5,6
до 1,9 оказывает незначи-
тельный эффект на электро-
проводность приведенных
выше никелевых электро-
литов.
Точечная пятнистость,
иногда наблюдающаяся на
изделиях при их никелиро-
вании ‘в ваннах с высокой
плотностью, по мнению Фил-
Фиг. 117. Влияние температуры на электро-
проводность никелевых растворов при низких
концентрациях никеля.
липса, не является прямым
следствием применения этих
ванн, а результатом побоч-
ных процессов. К таковым
можно отнести большее растворение анодных примесей, воздействие
электролита на облицовку ванн, на завешивающие приспособле-
ния и т. д. С устранением этих недостатков* точечная, пятнистость
при низкой кислотности не только не увеличивается, но уменьшается.
261
Вопрос о точечной пятнистости никелевых покрытий в связи с кис-
лотостыо электролитов и их другими особенностями более детально
изучен Макнанфтаном с сотрудниками1. Помимо кислотности ими
изучалась роль различных компонентов электролита — катионов и
анионов—'При различной кислотности. Поскольку с этим вопросом
на практике часто сталкиваются, мы на этой работе остановимся не-
сколько подробнее. Отдельные компоненты электролитов обозначены
для удобства начальными буквами, например, никель обозначен бук-
вой N, сульфат буквой S, борная кислота — В, калий К и хлор С.
Составы испытанных при различной кислотности электролитов даны
в табл. 61.
Таблица 61
Условное обозначение
Состав электролитов, г/л
электролитов
NiSO4-7H2O
NiCl3-6H2O
КС1 K,SO4 H3BO3
Электролиты с
борной кислотой
NSBKC
NSBC
NSBK
NSB
240
210
240
240
30,3
30
30
30
30
Электролиты без
буферных соеди-
нений
NSKC
NSC
NSK
NS
240
210
240
240
Точечная пятнистость наблюдалась в большей или меньшей сте-
пени во всех изучавшихся растворах, за исключением ванны NSK.
Однако' на блестящих осадках и вообще в тех случаях, где pH ра-
створа было меньше з, пятен почти не наблюдалось, за исключением
ванны NSC, где даже при такой низкой pH, как 2,6, были обнаружены
следы точечной пятнистости. В двух растворах NSB и NSBK при pH
ниже з образовались незначительные изъязвления, видимые невоору-
женным глазом, а при pH = 2,5 и ниже наблюдалась тенденция
к образованию вертикальных полос, выходящих из этих язвин; подоб-
ные полосы обычно называются газовыми пузырями. В каждой из пе-
р,ечисленных выше восьми ванн точечная пятнистость наблюдалась
в определенных пределах pH, но в каждой ванне была определенная
кислотность, которая соответствовала максимальной пятнистости.
Сделанные наблюдения сведены в табл. 62.
1 Macknanghtan a. Garden, „Trans. Am. Faradey Soc.“, 29,7, 1933,
262
С уменьшением pH связано также уменьшение катодного- выхода
тока по металлу. Для всех растворов, содержащих борную кислоту
в качестве буфера, кривые изменения выхода тока в зависимости от
изменения pH имеют один и тот же характер — резкое уменьшение
выхода тока, начиная с pH = 3,5 и ниже. В двух растворах, не содер-
жащих хлоридов, кривые выхода тока проходят ниже, чем в растворах,
содержащих таковые-. Кроме того, сравнивая кривые для растворов
NSBKC и NSBC, мы видим, что присутствие щелочного металла спо-
собствует более быстрому уменьшению катодного выхода тока при
значениях pH ниже з,5. Таким образом катодный вь/ход тока при pH
ниже- 3,5 может быть повышен либо присутствием хлоридов, либо от-
сутствием щелочных металлов.
Таблица 62
№ по пор. Раствор Предел pH, в кото- ром наблюдалась пятнистость Значения pH, при которых пятнистость достигала максимума
1 1 NSB { NSBC 4,7 — 2,5 5,6 — 3,0 3.3 4,0 1 Сильная пятни-
1 NSC 6,3 — 3,0 6,3 [ стость
5,75
2 J NSBKC 1 NSKC 5,9 — 3,0 5,8 — 3,5 5,8 — 4,5 1 Незначительная J пятнистость
( NS 6,0 — | Весьма незначн-
3 J NSK 3,5 — > тельная рятни-
I NSBK 3,0 — 3,5 — J стость
5,65— 4,3 5,0
В растворах, не содержащих буферных соединений, также наблю-
дается понижение выхода тока с уменьшением pH, но нет такой за-
кономерности, как в растворах, содержащих борную кислоту: в неко-
торых случаях имеет место даже некоторое повышение выхода тока
с уменьшением pH, затем опять снижение. В общем же начало рез-
кого уменьшения выхода тока наблюдается значительно раньше, чем
при pH = 3,5. Как, и для буферных растворов, присутствие хлоридов
способствует большему выходу тока (фиг. 119 и 120).
Точечная пятнистость находится в тесн'ой связи с катодным выхо-
дом тока, т. е. с количеством водорода, 1выделяющегося одновременно
с металлом. В то время как другие исследователи считают, что точеч-
ная пятнистость увеличивается с кислотностью раствора, авторы дан-
ной работы наблюдали обратное явление. Объясняют они это тем
обстоятельством, что не при любых условиях выделяющийся водород
задерживается на катодной поверхности и служит началом образова-
ния точечных пятен. Если водород выделяется в большом количестве
в виде маленьких пузырьков и беспрепятственно удаляется в виде
газов, то он не будет образовывать пятен на катодной -поверхности.
Более сильное перемешивание, вызываемое увеличением скорости
образования пузырьков, влечет за Собой также ускоренное отделение
их с катодной поверхности.
Если в некоторых случаях наблюдается увеличение точечной пят-
263
пйстости при более низких значениях pH, то причину следует искать
в таких факторах, как наличие металлических примесей в растворе,
выделение кислорода на
аноде и т. п.
Таким образом при
данной кислотности и
данном выходе тока сте-
пень пятнистости будет
зависеть от той скорости,
с которой пузырьки водо-
рода удаляются с катод-
ной поверхности. С этой
точки зрения приходится
принимать
не только
водородных
тролите, но
цию их в катодном слое.
Известно, что благодаря
разряду ионов водорода
в катодном слое концен-
трация гидроксильных
ионов может принять та-
кие размеры, что начнут
выделяться основные со-
ли. Последние, по мнению
образуются коллоидной форме и
Положи-
веществ
Фиг. 118. Влияние температуры на электропро-
водность никелевых растворов при высокой кон-
центрации никеля.
во внимание
концентрацию
ионов в элек-
и концентра-
no
.ss
ков коек
авторов исследования, вначале
имеют положительный заряд,
тельная роль этих коллоидных
заключается в препятствии, которое они
оказывают росту кристаллов, и, следова-
тельно, в способствовании образованию
мелкокристаллических осадков.
При наличии вблизи катодной поверх-
ности отрицательно заряженных анио-
нов коллоидные вещества теряют свой
заряд и коагулирует. Образующийся
в результате этого осадок может смеши-
ваться со всем раствором и не оказывать
никакого влияния на свойства металла,
но он может оказать также косвенное
влияние, оставаясь вблизи катода в ви-
де пленки, иногда даже полупроницае-
мой.
В испытанных в данном случае {раст-
ворах степень пятнистости помимо кон-
центрации Водородных ионов зависела
также от наличия в растворе ионов хлора
или калия. Ионы хлора могут оказать
большее коагулирующее действие на образующиеся в катодном слое
коллоидные вещества, чем сульфат-иоиы, присутствие же в растворе
в®
}во
В
юве
KSB
блестящий—.
Лолувлестящий «в
Матовый <=□
Пятнистый ' а
7,0 6,0 s,a 4j) 3,0 г,о /о
Кислотность зя-та он по xvhcuopoh^
Фнг. 119. Влияние кислотности
никелевых растворов на выход
тока н внешний вид никеле-
вых покрытий в присутствии
борной кислоты.
264
калия, наоборот, препятствует коагуляции. Коагулирующий в при-
сутствии- хлор-иоиа коллоидальный слой препятствует свободному
доступу • раствора к катодной поверхности и, следовательно, способ-
ствует образованию наибольших количеств коллоидных веществ.
В присутствии ионов калия уменьшается вредное действие осадка,
что более чем перевешивает влияние его стабилизирующего’действия
на коллоидные вещества. Усиление (приставания пузырьков газа
к катодной поверхности вызывается мелкодисперсным электроней-
тральным осадком, поглощаемым поверхностью газ — жидкость.
Таким образом можно считать, что точечная пятнйстость при про-
чих постоянных условиях зависит в первую голову от кислотности
среды, во-вторых, от природы применяемого электролита: наличие
хлор-иона должно способствовать образованию пятнистости, нали-
чие ионов калия задерживает пятнистость. Табл. 63 дает! подтвержде-
ние такого положения.
Таблица 63
Электро- лит Прибавленный хлорид Количество добавленного хлорида, г/л Степень точечн. пятни- стости Изучавшийся интервал pH
NSB NSB N1C12 КС1 Сильное изъязвление Весьма незначнтельн. 5,5—3
NSB NaCl Эквива- изъязвление Весьма незначнтельн.
NSB НС1 лентно 19 г КС1 изъязвление Незначнтельн. изъяз-
NSB NSB NH4C1 MgCl2.6H2O вление Сильное изъязвление » и
NSBK K2SO4 0,05 0,15 0,35 » п Незначнтельн. изъяз- Только прн 3,6
0,75 вление Очень незначнтельн.
изъязвление
Из табл. 63 видно, что действие хлорида на точечную пятнистость
различно в зависимости от катиона, с которым этот хлорид введен.
Присутствие калия сильно влияет на уменьшение степени точечной
пятнистости, особенно в пределах pH = 4,2—3,4 для растворов, со-
держащих борную кислоту в качестве буфера, и в пределах
pH — 3,2—2,6 для растворов, не содержащих ее. Это можно объяс-
нить уменьшением количества хлопьевидного вещества вследствие
стабилизирующего действия ионов калия. Примерно аналогичное
действие оказывают ионы натрия и лития, в то время как аммоний
и магний почти совершенно не действуют в этом направлении.
В целях борьбы с точечной пятнистостью в никелевые ванны
иногда вводят окислители: перекись водорода, перманганат или дру-
гие. Эти добавки дают желательный эффект, но обычно отрица-
тельно влияют на выход тока и распределение металла. Перекись
водорода довольно скоро разлагается, особенно при 50° и перемеши-
265
вании. Перманганат дает перекись марганца в количестве, превы-
шающем его растворимость в ванне.
Марсель Биллей1 указывает на успешное применение во Фран-
ции для этих целей азотнокислых солей в небольших количествах
(десятые, г/л). Большие количества 'г? этом случае приводят к умень-
шению выхода тока. Азотнокислые соли, однако, тоже малоустой-
чивы, и их применение представляет паллиативное средство.
Кислотность никелевого электролита оказывает также влияние
на структуру и твердость электролитических осадков. Твердость ни-
келевых покрытий характеризует их доведение в процессе последую-
щей механической обработки — полировки, а также при непосред-
ственной эксплоатации,— очевидно более твердые осадки лучше
противостоят механическим воздействиям, главным образом исти-
ранию. В отношении металлов группы железа твердость электролит-
ных осадков обычно связывают с количесвом включенного в них
водорода. Казалось бы, что с увеличением концентрации водородных
ионов и часто связанного с этим уменьшением выхода тока по ме-
таллу количество включенного водорода увеличится и тем самым
твердость повысится.
Проведенные за последние годы Ь этом направлении исследова-
ния показали, что прямой зависимости между количеством включен-
ного водорода и твердостью электролитически осажденного никеля
нет, и что уменьшению выхода тока по металлу (увеличению коли-
чества выделяющегося водорода) не всегда соответствует повышение
твердости покрытий. Чаще наблюдается обратное явление — резкое
повышение твердости при уменьшении кислотности.
Макнанфтан и Хаммонд2 изучали влияние кислотности на твер-
дость никелевых покрытий, полученных в ваннах различного состава
Состав этих ванн приведен в табл. 64.
Таблица 64
Обозначение электролита Концентрация, г/л
NiSO4- 7IL0 (NH4),SO4 H3BO3 KC1 NaCl NaF
N 240 30 10
Y 120 21 — 8 — —
F 240 — 30 0 7,85 5,8
pH определялся колориметрически, причем по сравнению с хингид-
ронным электродом были получены следующие отклонения:
для раствора N 0,50
„ „ Y 0,20
„ . F 0,15
В растворе Y были измерены катодные потенциалы для различ-
ных значений pH при постоянной плотности тока (1,2 А/дл2) и тем-
1 Marcel Balia у, .Trans. Am. Electrochem. Soc.“, 62. 1933.
2 Macknanghtan a. Hammond, „Trans. Am. Faraday Soc.* 27, 10,
1931.
266
пературе 35 ±5°; параллельно с этим измерялась твердость образ-
цов. Полученные результаты сведены в табл. 65.
Таблица Q5
Влияние изменения pH на катодный
потенциал и твердость никеля
pH раствора Катодный по- тенциал V Твердость осадков по Бринелю
6,8 — 0,603 360
6,5 — 0,593 328
6,3 — 0,595 308
6,0 — 0,518 278
5,8 — 0.589 258
5.4 — 0,602 222
5,1 — 0,597 199
4,8 — 0,606 187
4,3 — 0,615 186
3,9 — 0,614 187
3,2 — 0,619 189
2,2 — 0,580 192
Из табл. 65 видно, что существует сильная зависимость между
твердостью осадка и pH раствора, в то же время отсутствует какая-
либо связь между катодным потенциалом и твердостью осадка. По-
следнее положение находится как-будто в 'противоречии с теорией
Блюма и Роудена, согласно которой для получения более мелкокри-
сталлических (и, следовательно, более твердых) осадков требуется
приложить более высокий потенциал.
Проведенные испытания Твердости образцов, подученных в дру-
гих ваннах, также показали наличие связи между кислотностью
среды и твердостью осадка. По мере повышения pH твердость нике-
левых осадков в ванне Y растет с 192 до 418, в ванне N от 178 до
285 и в ванне F от 152 до 379. Однако эти изменения твердости на-
ступают неравномерно, — для каждой ванны существует определен-
ное значение pH, около которого начинаются резкие изменения твер-
дости (фиг. 121 и 122).
Микроисследования соответствующих образцов дали следующие
результаты: осадок, имеющий твердость по Бринелю в пределах
140—190, имеет структуру, состоящую из относительно больших
продолговатых кристаллов, оси которых направлены перпендику-
лярно к катодной поверхности.
В пределах твердости 190—£б0 наблюдается такая же структура,
но размеры кристаллов значительно меньше В пределах твердости
260—420 наблюдается необычайно тонкая структура, а при еще
большей твердости наступает предел для наблюдения кристалличе-
ской структуры в микроскопе.
Сравнивая твердость полученных образцов при различных зна-
267
пениях pH и соответствующих выходах тока, можно отметить, что
сильное увеличение 'Твердости наблюдается при весьма незначитель-
ном изменении выходов тока, например с 98,8%' до 99,2%.
Фиг. 120. Вли. ние кислотности
никелевых растворов на внеш-
ний вид и выход тока нике-
левых покрытий в отсутствии
буфера.
В то же время во всех указанных трех
ваннах наблюдается резкое изменение
твердости при каком-то характерном для
каждой ванны значении pH, но общим
для всех ванн является повышение твер-
дости параллельно pH. Нетрудно допу-
стить, что здесь речь идет об образова-
нии в катодном слое гидроокиси никеля,
которая в той или иной степени влияет
на твердость. Известно, что в никелевых
ваннах pH выше в катодном слое, чем
в основной массе электролита. Чем луч-
ше буферирован раствор, тем меньшие
будут изменения в кислотности катод-
ного слоя и всей массы электролита. По-
этому-то для каждого из трех равбирае-
мых растворов существует свое «крити-
ческое» значение pH, при котором начи-
наются резкие изменения твердости осад-
ков:
для ванны F 5,5
„ N 5,3
. » Y 4,7
Состав электролита может влиять па большую или меньшую
pH по хингидрон.злеИгпролиду
Фнг. 121. Влияние кислотности электролита на твердость
никелевых осадков.
283
Стойкость образующейся йа катодной Поверхности гидроокиси ни-
келя. Например, в ванне, содержащей (NH4)2S04, имеются ионы, NH4,
образующие при реакции с гидроксильными ионами у катодной поверх-
ности аммиак, который растворяюще действует на гидроокись. Таким
образом ь каждом растворе можно, меняя кислотность среды, получать
твердые и мягкие осадки. Однако, по исследованиям Макнанфтана
и Хаманда, твердые осадки, полученные в ваннах N и F, имеют тре-
щины, Ь то время как осадки равной или еще большей твердости,
полученные в ванне Y, никаких трещин не обнаруживают, т. е. для
получения твердых осадков лучше применять в качестве буфера
сульфат аммония.
Для получения мягких осадков, при значении pH ниже л крити-
ческих» более подходят ванны N и F, содержащие в качестве буфера
H3BOS и NaF + Н3В03. В этих пределах pH их буферные свойства
выше, чем в ванне Y.
Из приведенных материалов видно, насколько широко может ко-
лебаться кислотность никелевых ванн (pH). Все же мы еще раз
подчеркиваем, что установленная для каждого конкретного случая
оптимальная величина pH должна, по возможности, поддерживаться
в определенных пределах. Иначе говоря, кислотность можно менять,
но вместе с ней должен быть изменен и режим, т. е. плотность тока,
температура, в некоторых случаях и перемешивание. Невидимому,
в ближайшее вре,мя, по мере того как будут исследованы некоторые
детали процесса, все больше и больше будут применяться ванны
с высокой кислотностью. Установившееся было ранее мнение, что
никелевые ванны могут удовлетворительно работать только при вы-
соких значениях pH основано на недостаточной в то время изучен-
ности роли кислотности никелевых ванн.
В целях предохранения электролита от резких изменений кислот-
ности прибегают к буферным соединениям. Чаще всего пользуются
для этой цели борной кислотой.
Если к 50 см* раствора сульфата никеля прибавить 0,5 см9 0,2 N
щелочи, то pH изменится от 4 до 6. Если же в растворе присутствует
борная кислота в количестве 30 г/л, то для такого же эффекта надо
ввести 3,5 с*.м3 щелочи. Присутствуя в количестве, меньшем, чем
15 г/л, борная кислота не обладает буферными свойствами. Обычно
применяют концентрацию в 20—30 г/л.
Смесь борной кислоты и фтористого натра отличается лучшими
буферными свойствами, чем одна борная кислота, в особенности при
высоких плотностях тока. В качестве буферных соединений в ни-
келевых ваннах применяются также винная, лимонная, уксусная
кислоты и их щелочные соли (фиг. 123).
Рецептура никелевых ванн и их режим. Патентная
литература по никелированию настолько богата, что представляется
очень затруднительным подвергнуть ее детальному обсуждению.
После выяснения нами роли отдельных компонентов остается ска-
зать, что электролит тем ценнее, чем проще он поддается контролю.
С этой точки зрения заслуживает большого внимания ванна Уаттча
(широко распространенная в Америке), в которую для активирова-
ния анодов вводится хлорид никеля. В такой ванне помимо суль-
фата и хлорида никеля присутствует лишь борная кислота, и, следо-
269
вательно, контроль ванны легче осуществляется, чем в тех случаях,
чогда хлорид присутствует в виде щелочной или аммонийной соли.
Если исходить из минимального количества компонентов, то
можно до некоторой степени стандартизировать их, руководствуясь
общими соображениями: чем более высокую плотность тока мы хо-
тим применить, тем. концентрированнее должна быть ванна по содер-
жанию никеля, электропроводящих солей и водородных ионов.
Режим ванны выбирают также, руководствуясь этими соображе-
ниями: для форсированного процесса прибегают к подогреву и пере-
мешиванию электролита. Необходимо учитывать то обстоятельство,
что при перемешивании взмучивается находящийся В электролите
шлам,- который обусловливает образование грубых осадков. По-
на
Фнг. 122. Влияние кислотности
твердость никелевых осадков.
Фиг. 123. Буферность никелевых растворов.
Кривые титрования для 50 сл«3: A—N
NiSO4; B—N NiSO4 0,5 мол. Н3ВО3; С—N
NiS04 0,5 мол. Н3ВО3, 0,2 N NaCl; D—N
NiSO4,0,5 мол. НВО3, 0,1 NNaF; Е—N NiS04,
0,5 мол. Н3ВО3, 0,2 N NaF; F—N NiSO4,
0,5 мол. Н3ВО3, 0,1 N—NaF.
этому наряду с перемешива-
нием необходимо осуществить
также беспрерывное .фильтро-
вание электролита.
Что касается выбора оптимальной кислотности, то, несмотря на
большие преимущества, которые никелевые ванны приобретают при
низких значениях pH необходимо указать, что в последнем случае
требуется очень внимательный уход за ваннами и тщательный кон-
троль их, что возможно при наличии квалифицированного рабочего
персонала. Особенно тщательно этот контроль должен быть осу-
ществлен, когда никелированные изделия подвергаются последую-
щему хромированию.
Для стационарных ванн можно
центом:
пользоваться следующим ре-
1) NiSO4.7H,O
NiCJ,.6H.,0
Н3вб3
70—100 г/л
15—20 „
15-20 Л
270
pH = 5,3; температура 20—30°; плотность тока 0,5—2 А/дм2.
2) NiS04(NH4)2S04.6H.,0 75 г/л
NH4C1 ' 15 „
Н3ВО3 15 „
pH .= 5,8; температура 20—30°; плотность тока 0.3—0,0 А/д.« 2.
Борная кислота может быть заменена, эквивалентным (0,25-мю-
лярпым) количеством уксуснокислого натра.
Для более высоких . плотностей тока рекомендуется применять
ванну Уаттча:
3) NiS04.7Ho0 200 г/л
NiCl,.6H;b 45 „
Н3ВО3 30 „
pH = 5 3; температура 50—60°; плотность тока 2—5 А/дм2\ энер-
гичное перемешивание.
Современные никелевые йаниы, принятые во Франции:
4) NiSO4.7H2O 400—450 г/л
NiCl2.6H2O 30
Н3ВО3 20 »
>рН = 4,5—5,5, температура около 50°; плотность тока до 10 А/дм2,
энергичное перемешивание.
В тех случаях, когда требуется высокая электропроводность
электролита, при значительной катодной поляризации (при покры-
тии изделий со сложной формой) рекомендуется применять ванны
с большим количеством сульфатов; в качестве активатора Bi таких
случаях лучше применять хлористый калий. Примерный состав та-
кой ванны следующий:
5) NiSO4.7H2O 140—200 г/л
Na,S0410НоО 80—160 „
КС1 " 20
Н3ВО3 20 „
pH = 5,3: температура 30—40°; плотность тока. 1,5—2,5 А/дм2.
В последнее время стали с успехом применять ванны, содержа-
щие вместо хлоридов фториды. Содержание их обычно колеблется
to пределах з—5 г/л. Как нами было указано в разделе о кислотности
никелевых ванн, преимущества фторидов заключаются в способство-
вании ими сохранению физической чистоты ванны, но активирующее
действие их на аноды хуже, чем у хлоридов. К безусловным преиму-
ществам фторидов относится их буферное действие при одновремен-
ном присутствии в ванне борной кислоты, особенно в пределах низ-
ких значений pH. Соотношения остальных компонентов сохраняются
такими же, как и В присутствии хлоридов *.
На встречающихся затруднениях при никелировании мы можем
сейчас подробно не останавливаться, поскольку роль отдельных
факторов нами достаточно подробно освещена. При тщательном
уходе, частом контроле и своевременном корректировании можно
долго работать бесперебойно, пЬлучая постоянные результаты. В ни-
келевых ванна! больше, чем to других случаях гальваностегии, необ-
1 Классификацию рецептов, предложенную Томсоном Э. Г. — см. „Никели-
рование", KOII3, 1934.
271
ходимо следить за. чистотой исходных материалов. Получение, не-
нормальных осадков тотчас после корректирования ванн обычно
связано с введением примесей (железа, меди, цинка) или изменением
кислотности.
Не рекомендуется корректировать ванны Ь то время, как в них
висят изделия, так как изменение условий осаждения приводит
к получению покрытия с различными механическими свойствами
в различных слоях.
Не рекомендуется также прерывать ток, так как в покрытиях
появляется слоистое строение, которое также ухудшает их механиче-
ские (Двойства.
Особенно большое внимание следует уделять при никелировании
подготовке поверхности — обезжириванию и декапировке. Прежде,
чем искать причину в изменениях электролита или принятого ре-
жима, следует в случае отслаивания никеля проверить тщательность
.подготовки поверхности.
Ухудшение качества покрытий наблюдается иногда после заве-
• шивания новых анодов. Последние, даже после предварительной
травки, в первые несколько дней растворяются хуже, чем старые
аноды с большей активной поверхностью. Необходимо поэтому аноды
менять постепенно, по одной, две штуки.
Если ванна работает без непрерывной фильтрации, то последняя
должна осуществляться периодически; не следует допускать накоп-
ления больших количеств взвешенных частиц в электролите.
Если ванна работает без подогрева, то необходимо, особенно в зим-
нее Время, перед началом работы несколько прогреть ее, что обычно
достигается отчерпыванием небольшой части электролита и нагрева-
нием его вплоть др температуры кипения. Ниже 16—18° никелевые
ванны дают неудовлетворительные покрытия.
4. Снятие никелевых покрытий
В случае получения недоброкачественных покрытий приходится,
прежде чем изделия вновь никелировать, последние снимать. Наибо-
лее совершенным методом в данном случае надо считать шлифовку
с последующим обезжириванием и декапировкой. Однако эта опера-
ция чрезвычайно дорога и трудоемка. Если, например, никель местами
лупится, вследствие плохой подготовки поверхности, или от других
причин, и он частично останется на катодной поверхности после
шлифовки, йо (вторично осажденный никель также получится недо-
брокачественным. К снятию никеля прибегают также в целях опре-
деления толщины слоя-
Различными авторами было предложено много вариантов снятия
никеля химическими или электрохимическими методами. На некото-
рых из них мы остановимся.
С железа и стали никель может быть снят в концентрированной
серной кислоте, меняя попеременно полюса. Если в кислоте нахо-
дится больше 5% воды, то начинает разрушаться основной металл.
Можно'' также снять никель, завесив изделия (железные или
стальные) в качестве анодов в концентрированную азотную кислоту.
Основной металл начинает слегка растворяться после того, как снят
272
весь никель. Следовательно, применяя этот метод для определения
толщины никелевого покрытия, необходимо проанализировать коли-
чество железа, перешедшего в раствор.
С латунных изделий никель может быть снят в разбавленной со-
ляной' кислоте (одна объемная часть концентрированной соляной
кислоты на 19 объемных частей воды). Изделия завешиваются в ка-
честве анодов, а катодами служат свинцовые лепты. Для точного
определения толщины покрытия необходимо проанализировать ни-
кель в растворе.
С латунных изделий никель может быть спят так же, как и с же-
лезных в концентрированной (90%) серной кислоте, меняя попере-
менно полюса.
5. Защитные свойства никелевых покрытий
Несмотря на большое количество исследований, посвященных вы-
яснению причин образования пор в никелевых покрытиях, а также
методам устранения этих пор, в настоящее время не существует до-
статочно разработанных методов получения никелевых покрытий,
свободных от этих недостатков.
В большинстве случаев покрытию никелем подвергаются изделия
из железа и стали, причем даже в тех случаях, когда преследуют цель
сообщения поверхности красивого, блестящего вида, нельзя игнори-
ровать вопроса пористости покрытий. По одному внешнему виду ни-
келированных (и полированных) изделий нельзя судить о качестве
покрытия и его долговечности. Поры бывают настолько малых раз-
меров, ’ что фиксировать их можно только весьма чувствительными
индикаторами. Но и этих маленьких пор достаточно, чтобы корроди-
рующие агенты имели доступ к основному металлу и вызывали его
ржавление. Нередко ржавчина появляется па никелированных из-
делиях уже на складе в процессе их храпения в неблагоприятных
условиях до использования их по назначению.
Таким образом к оценке никелевых покрытий необходимо подойти
серьезно, располагая определенными методами испытания качества
покрытия, и па основании результатов этих испытаний выбрать над-
лежащие условия как для процесса осаждения, так и для предше-
ствующих и последующих операций.
В частности, чрезвычайно1 важным является (вопрос о достаточной
толщине никелевого покрытия для более или менее совершенного
изолирования основного металла от окружающей среды. До сих пор
далеко не всегда руководствуются достаточными по толщине защит-
ными никелевыми покрытиями при выборе их толщины. Нередко
выпускаются никелированные изделия с толщиной покрытия в ты-
сячные доли миллиметра, между тем как химическая стойкость их
ничтожна. Помимо экономии металла, которая достигается при бо-
лее тонких покрытиях, очень часто прибегают к ним в целях увели-
чения производительности. Последнее имеет место особенно в стацио-
нарных ваннах, где применяются низкие плотности тока; для полу-
чения никелевого покрытия в 0,02—0,03 мм приходится осаждение
вести ® течение нескольких часов. В то же время считается устано-
вленным, что при прочих постоянных условиях пористость никеле-
вых покрытий уменьшается с их толщиной.
18 Основы гальваностегии 1783 273
Томас и Блюм1 пришли в результате подробного исследования к
заключению, что все никелевые покрытия, независимо от методов их
получения и методов подготовки поверхности, имеют большее или
меньшее количество пор и что единственным практическим приемом
для устранения этого недостатка и повышения защитных свойств ни-
келевых покрытий является увеличение их толщины. Независимо от
того, осаждается ли один никель, или с . медной прослойкой, или
тройное покрытие (никель — медь — никель) — суммарная толщина
покрытий не должна быть меньше, чем 0,025 хи.
Указанные выше исследователи испытывали стальные образцы,
никелированные в различных ваннах: в так называемой стандартной
никелевой ванне, в ванне с высоким содержанием сульфатов (213 г/л
Na,S04), в «скорой» ванне Уаттча и в хлористой ванне. Температура
во всех ваннах поддерживалась 21°, а плотность тока 1 А/дм2. Образ-
цами служили пластинки, свободные от поверхностных дефектов, раз-
мером ЮХЮ см. Чтобы выяснить влияние метода подготовки поверх-
ности на пористость покрытий, были испытаны следующие варианты:
1. Протирка пемзой (ПП). Образцы тщательно протирались
вручную при помощи жесткой щетки пемзой, взмученной в воде, по-
сле чего они промывались холодной водой.
2. Щелочное обезжиривание (ЩО). Образцы погружа-
лись на зо мин. в 0,5 N раствор NaOH при 100°;
3. О б е з ж и р и в ан и е: а) электролитическое холодное обезжи-
ривание (ЭХО); образцы помещались в качестве катодов в 0,5 N
раствор Na3PO4 на 2 мин. при 25° и плотности тока в 2 А/д.и2;
б) электролитическое горячее обезжиривание (ЭГО); те же усло-
вия, что выше, но температура 100°;
в) анодное холодное обезжиривание (АХО); те же условия, что
в случае За. ио образцы завешивались в качестве анодов;
4. Очистка бензином (ОБ). Образцы протирались ватой,
смоченной бензином или бензолом;
5. Травление в кислотах; а) сернокислотное травление
(H,SO4); применялась 2 N H2S04 при 50°;
б) солянокислотиое травление (НС1); применялся 2 N раствор НС1
при температуре 50°;
в) азотнокислое травление' (HNO3); применялась концентрирован
пая азотная кислЬта уд. в. 1.42, при комнатной температуре;
г) электролитические кислотное травление (ЭКТ); образцы заве-
шивались в качестве анодов в концентрированную серную кислоту
уд. в. .1,84 на одну минуту одри начальной плотности тока в 10 А/д.и2,
которая быстро падала до нуля; катодом служил свинец;
G. Полировка (П). После покрытия образцы подвергались по-
лировке на матерчатом кругу, смазанном торговой мастикой;
7. Промывка (Пр). Во всех случаях образцы тщательно про-
мывались водби после последней операции обезжиривания; в неко-
торых случаях образцы до последней операции обезжиривания пред-
варительно погружались в никелевую Ванну или другие расгворы
для специальных наблюдений.
1 Thomas a. Blum, .Trans. Am. Electrochem Soc’., 48, 69, 1923.
274
Аноды применялись литые; Содержание примесей в них было сле-
дующее:
%
углерод С...............0,28
медь Си.................0,02
железо Fe...............0,17
никель (по разности) Ni . . 99,5
Для исследования пористости никелевых покрытий применялся
метод испытания реактивом Вокера (РВ). Этот метод основан на том,
что в корродирующей среде, например в растворе поваренной соли,
железо, образуя в местах пор никелевого покрытия коротко замкну-
тый гальванический элемент, как более отрицательный металл пере-
ходит в раствор и, реагируя с красной кровяной солью (имеющейся в
том же растворе), образует турнбулевую синь. Для того чтобы зафик-
сировать поры, в этот реактив вводят еще коллоид, который способ-
ствует быстрому его застуживанию. В данных испытаниях приме-
нялся реактив следующего состава:.
агар-агар......... 10 гл
NaCl............... 10 „
K3Fe(CN)e......... 1 „
Максимальное количество синих пятен появлялось через 3—5 мин.
Для сравнения подсчитывалось количество пятен, которое появля-
лось на площади круга диаметром 5 см с Двух сторон образца. Так
как защитные свойства покрытий приблизительно обратно иропор-
пиональны количеству имеющихся пор в покрытии, то" результаты
этих испытаний расценивались частным ЮТ деления 100 на количе-
ство пятен; например, при наличии на одной стороне образца 19 пя-
тен, а на такой же площади с другой стороны (круг диаметром в 5 см)
15 пятен данное испытание имело оценку:
100:
19Д-15_
2 ~~
5,9.
Качество никелевых покрытий испытывалось также в корро-
зионной камере разбрызгиванием 20% раствора
поваренной соли (солевой струей — СС). При аналогичных
испытаниях цинковых покрытий последние постепенно растворяются,
в результате чего железо начинает ржаветь. Никель В этих условиях
не растворяется, но ржавчина появляется в открытых местах в коли-
честве, соответствующем числу и размерам пор. Началом разрушения
покрова считался тот момент, когда ржа’вчина была видна на рас-
стоянии одного метра. Результаты этих испытаний выражались в зна-
чениях шестичасовых периодов (для удобства сравнения), хотя самые
испытания протекали непрерывно, если не считать времени, потребного
для производства самих наблюдений.
Испытание методом перемежающегося погру-
ж е н и я (ПН). Образцы прикреплялись каучуковыми зажимами к
радиальному плечу колеса Гарнера диаметром около 90 см. Колесо
вращалось со скоростью 1 оборот в 15 мин. В течение одной поло-
вины оборота пластинка проходила через эбонитовый ящик длиной
около 60 -см, наполненный з% раствором поваренной соли. Для про-
* 275
хождения образцов через раствор требовалась приблизительно
1 мин., 1остальные 14 мин. образец пребывал на воздухе. При этих
испытаниях началом разрушения покрытия также считался момент
пояЩгения ржавчины, видимой на расстоянии одного метра. Резуль-
таты испытаний выражались количеством 15-минутных циклов, тре-
буемых для появления ржавчины.
Испытания на атмосферную коррозию (АК).
Образцы были выставлены на крыше одного из зданий Бюро стан-
дартов в Вашингтоне. Признаком разрушения в данном случае тоже
служил момент появления ржаЬчины, видимый на расстоянии одного
метра.
Результаты этих испытаний выражались числом прошедших не-
дель до появления ржавчины.
Испытания сцепления (ИС). Испытания производились
на- (приборе Эриксона вдавливанием стального стержня в образец, до
его растрескивания. Было замечено, что во всех случаях, когда по-
верхность образца была предварительно (перед никелированием) хо-
рошо подготовлена, никелевое покрытие обладало хорошим сцепле-
нием с основным металлом. Когда начальное сцепление было хоро-
шими, оно не нарушалось даже в тех случаях, когда испытуемые об-
разцы подвергались нагреву до 500°, затем опускались ® воду и
вновь испытывались на приборе Эриксона.
Испытания твердости (ИТ), Для этих испытаний слу-
жил аппарат Бирбаума, на котором сапфировая игла под нагрузкой
в 3 г наносила царапины по поверхности образца. Ширина царапины
измерялась наблюдением в микроскопе при увеличении ® 500 раз;
ширина черты измерялась в микронах.
В табл. 66 сведены результаты проведенных испытаний.
Из нее видно, что защитные свойства никелевых покрытий
возрастают с толщиной слоя в более чем прямолинейной зависимости.
С-увеличением толщины покрытия в 2 и 4 раза химическая стой-
кость покрытых образцов соответственно увеличилась в 2,8 и
7,64 раза.,Кроме того из этой таблицы усматривается, что при раз-
личных методах подготовки поверхности и при различных условиях
осаждения никель в тонких слоях не представляет сколько-нибудь
надежной защиты от коррозии железа.
Несколько повышенные результаты были получены при предва-
рительном пассивировании поверхности металла, что удавалось, на-
пример, при анодном травлении в азотной или серной кислоте или
при анодном обезжиривании в щелочном растворе. Невидимому, это
связано с повышенным перенапряжением водорода на пассивирован-
ной поверхности (по сравнению с таковым на активной поверхности).
Незначительное улучшение качества никелевых покрытий при
предварительном погружении образцов в концентрированный раствор
хлористого никеля или в разбавленный раствор соды может быть
следствием увеличенного отношения концентрации иойов никеля по
отношению к концентрации ионов водорода в катодном слое.
Несколько пониженные результаты испытания образцов, подверг-
нутых катодному обезжириванию, объясняются уменьшением пере-
напряжения водорода на поверхности, до некоторой степени насы-
щенной водородом (в процессе обезжиривания).
276
В табл. 66 приводятся результаты испытаний образцов, подверг-
нутых предварительному омеднения} с последующим никелированием
или тройному покрытию никель — медь — никель.
Как видно из таблицы. 66а, суммарная толщина покрытий играет
большую’роль, чем относительное расположение отдельных слоев ме-
талла (медь — никель., никель — медь — никель) и толщина слоя
каждого металла в отдельности.
Наилучшую стойкость показали образцы 40 и 44 при суммарной
толщине покрытий в 0,025 мм. Эти образцы отличаются от других
(см. образцы 39, 43) тем, что их поверхность была предварительно
протерта пемзой и до включения тока смочена рабочим электролитом.
В общем Томас и Блюм стоят на той точке зрения, что отдельные
факторы не играют столь существенной роли на защитные свойства
никелевых покрытий, как их толщина.
Благоприятными условиями для форсирования процесса осажде-
ния указанные авторы считают:
1. Поддерживание высокой концентрации никелевой соли и ионов
никеля в растворе.
2. Более высокую концентрацию водородных ионов, чем это при-
нято для более разбавленных электролитов, работающих при низких
плотностях тока.
3. Усовершенствованное механическое перемешивание — движе-
ние катодов.
4. Отсутствие в электролите взвешенных частиц.
5. Повышенную температуру.
6. Применение чистых никелевых анодов.
6. Электроосаждение «черного никеля»
Во время мировой войны получил довольно широкое распростра-
нение метод черного никелирования. Этот процесс чаще всего приме-
нялся для покрытия латунных изделий, причем лучшие результаты
получаются, если эти изделия предварительно покрывают медью.
«Черный никель», осажденный непосредственно на железо, отличает-
ся плохим сцеплением, поэтому железные и стальные изделия пред-
варительно покрываются медью или никелем. Однако в целях защиты
изделий от коррозии лучше применять цинковую прослойку. По дан-
ным Вашингтонского бюро стандартов1, стальные изделия, предва-
рительно покрытые цинком, а затем «черным никелем», показывают
при испытании на коррозию солевой струей такую же стойкость, как
если бы они были покрыты одним цинком.
Механизм процесса осаждения, как и состав «черного никеля», в
достаточной степени не установлен. Существует большая и весьма
сложная рецептура, применение которой лишает возможности осу-
ществлять какой-либо контроль процесса и точно его регулировать.
Характерным является то положение, что цинк, считающийся вред-
ной примесью в никелевых ваннах, специально вводится в больших
количествах для получения темных, почти черных осадков.
Хагебум и Шлеттер несколько упростили рекомендованные до
i .Technolog. Paper", 190, 1921.
2’7
Защитные свойства
№ образца! Подготовка поверхности Состав электролита Условия осаждения Результаты испытаний Общ. оценка
РВ ПП СО АК
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 А. Электролнти ческое холодное обезжи- ривание Протирка пемзой, окунание в эле- ктролит Протирка пемзой, сушка Щелочное обезжи- ривание; окуна- ние в электро- лит Электролитиче- ское холодное обезжиривание Электролитиче- ское горячее обезжиривание Полировка; элек- тролит. холоди, обезжир. Полировка; бензин, электрол., холод- ное обезжир. Пемза, травление в H2SO4 Пемза, травление в НС1 Пемза, травление В HN0; Пемза, электр. анодн. травл. Пемза, электр. катодн. травл. Протирка пемзой Пемза, окунание в NiCl2 Толщина покрытия NiSO4.7H,O 140 г/л NH4C1 ' 13.5 , Н3ВО3 15,5 . 1 1 NiSO4.7H.,O 140 г л NH4C1 ' 13.5 . *Н3ВО.; 15,5 „ 0,006 л 21’ 1А/сМ<2 21’ 1А/(Ы2 «и 1,0 1,7 1,0 0,9 0,9 1,6 1,3 1,6 2,2 1,4 1,2 1,1 1,3 1,2 1.5 1 2 1 1 1 2 1 1 1 1 4 '3 2 2 2 1 •2 1 1 1 1 1 1 1 1 1 3 3 1 3 1,0 1,3 0,3 од од 1,1 0,3 0,7 1.0 0,9 1,3 1 1 1,3 0,4 1,3 1,0 1,8 0,8 0,8 0,8 1,4 0,9 1,1 1,3 1 1 1,9 2,1 1,8 1,2 2,0
278
никелевых покрытий
Таблица 66
№ образца Подготовка поверхности Состав электролита Условия осаждения Результаты испытаний Общ. 1 оценка
РВ ПП СС АК
16 Пемза, окунание в H2SO4 2Г 1Х/дм2 1,0 1 1 0,4 0,9
NiSO4.7H2O 140 г', л 2,3 1,1 1,9
17 Пемза, окунание NH4C1 13,5 „ 2 Г 2 2
в Na2Co3 HSBO3 15,5 „ 1 А/дл-
18 Пемза, окунание 50е 1,3 2 2 1,0 1,6
в электролит 1 Х/дм2
19 Пемза, окунание I NiSO4.7H„O 245 г/л 21° 2,0 2 2 1,1 1,8
в электролит } NiCl2.6H2O 1 H3BO3 30 15,5 „ 2А/д.м2
20 То же 140 ef л 50° 5А/д.и' 2.0 2 2 1,о 1,8
I NiS04.7Ho0
Na,S04.10H,0 2 3 „
21 То же | NH4C1 13,5 „ 21° '1,7 2 1 1,7 1,4
1 H3BO3 ,15.5 „ iX/дм2 -
22 То же 1 NiCl2.6H„O I H,BOS 120 г/л 15,5 „ 21° 1А дм2 1,0 2 1 1,1 1,3
Среднее. . 1,4
В. Толщина no к р ы т и я 0,013 м и
23 Электролитическое холодное обезжи- ривание i 140 г/л 21° 1 А/дм" 1,4 5 3 4 3,4
NiSO4.7H„O
24 То же NH4C1 H B03 13,5 „ 15,5 , 50° 1,7 4 3 10 4,7
25 То же . 50° 5А/5.М3 1,3 4 3 4 3,1 3,1
26 То же ) Ph = 5 1,3 4 3 4
27 То же ) NiSO4.7H,O 245 г'л 21° 1,3 4 3 10 4,7
I NiCI„.6H20 ! п3вб3 30 15,5 „ 1 Х/дм" 3,4
23 То же 5 А /дм- 1.5 4 3 5
То же 1 NiCl2.6H,0 120 г/л 21° 2,5 4 3 7 4,1
29 1 H3BO3 15,5 , 1Х/дм2
N1SO4.7H2O 140 г/л
То же Na»S04.10H20 213
30 NH4C1 21° 2,0 4 4 10 5,0
113BO3 15,5 . 1АДи2
Среднее . .
3,9
279
П.р о до л ж. т а б л. 66
№ образца Подготовка поверхности Состав электролита Условия осаждения Результаты испытаний •5 . М S’ в О о
РВ ПП сс АК
С. Толщина покрытия 0,025 мм
31 Электролит, хо- лоди. обезжири- вание NiSO4.7H,O NH4C1 Н3ВО3 1401 г/л 13.5 . 15,5 . 21° 1 \/дм2 6,7 15 8 15 11,2
32 Протирка пемзой; окунание в элек- тролит 12,0 16 16 12 14,0
33 То же 4- 0,05 NFe 6,7 14 16 12 12,2
34 То же + 0,05 NFe 2,8 6 14 16 9,7
35 36 То же Протирка пемзой, анодное травлен, окунание в эле- ктролит NiS04.7H,0 NiCU.6H2O H3BO3 245 г,'л 30 „ 15,5 . 50° 5к/дм* 5,0 3,8 7 6 12 12 10 12 8,5 8,5
10,7
Среднее . .
этого сложные рецепты и предложили два новых более простых ва-
рианта. Они растворяли сернокислый никель в избытке цианида и
добавляли туда мышьяковистокислый натр. В таком составе полу-
чаются сероватые осадки. Лишь в присутствии в растворе цинка
осадки принимают нужный вид.
Назначение цинка в этих ваннах недостаточно выяснено, в по-
крытиях его находят очень мало. Для того чтобы раствор был про-
зрачным, необходимо иметь большой избыток цианида.
Примерный состав этих ванн следующий:
NiSO4(N[I4).,SO4.6H2O 4,5 г/л
ZnSO4.7H,O 3,8 „
(NH4)2CO3“ 37,5 „
AS2Os 5,0 „
NaOH 5,0 ,
NaCN 45,0 ,
При длительной работе ванны цвет покрытий постепенно стано-
вится светлым, раствор мутнеет и меняется в составе: поскольку
ванны работают с никелевыми анодами, концентрация мышьяка и
цинка постепенно падает, да и концентрация никеля падает, так как
р присутствии цианида никелевые аноды медленно растворяются. По
эТой причине ванны требуют очень частого контроля и корректиро-
вания, что сильно затрудняет промышленную эксцлоатацию их.
Лучшие результаты получаются в присутствии роданистых солей
280
Состар таких ванн, часто рекомендуемый многими авторами, сле-
дующий:
NiSO4(NH4)EcOi.6H2O 60 г/л
ZnSO4 7.5 „
NaCNS 15 ,
Анализы осадков, получающихся в этих ваннах, обычно расхо-
дятся.. очевидно, по причине различной степени нейтральности ис-
ходных компонентов и колебаний в вольтаже. Малейшие изменения в.
вольтаже оказывают влияние на химический состав, а следовательно,
и на цвет «черного никеля». Лучшие результаты получаются при об-
щем палении напряжения на ванне в 0,5—0,7 V, в то время как при
1.5 — 2 V осадок получается светлым.
Таким образом при осаждении «черного никеля» приходится уде-
лять большее внимание вольтажу, чем плотности тока; последняя
обычно невелика и равна примерно 0,1 А/дм*.
Хорошие покрытия, получающиеся Ь ваннах, имеющих в своем
составе (роданиды, содержат 40—60% никеля, 20—‘30% цинка,
10—14% серы и 10 или больше процентов органических соединений
неопределенного состава. Последние, повидимому, получаются от раз-
ложения при электролизе роданидов. Отношение серы к никелю обыч-
но бывает меньше, чем это соответствует сернистому никелю. Таким
образом вероятный состав «черного никеля» представляет собой смесь
сульфида никеля, металлического никеля, цинка и органического
вещества.
В этих ваннах нормальный процесс может быть нарушен следую-
щими изменениями: 1) уменьшением содержания роданида в ванне.
2) уменьшением содержания цинка и 3) повышением концентрации
нимедя. Первое происходит за счет разложения электролизом, второе
и третье вследствие применения никелевых анодов. Завешивать в
ванну цинковые аноды наряду с никелевыми нельзя по той причине,
что цинк будет очень быстро растворяться, что приведет к увели-
чению концентрации цинка в растворе. Поэтому необходимо приме-
нять никелевые аноды, которые трудно растворяются, или ограничить
их поверхность.
В последнем случае будет происходить закисление раствора, что
тоже нежелательно. Для поддерживания надлежащей кислотности и
концентрации цинка в растворе хорошо пользоваться углекислым
цинком. Нейтрализовать кислоту аммиаком, как это обычно делается
в никелевых ваннах, нельзя, так как может выпасть трудно раство-
римый гидрат цинка; углекислым никелем нельзя нейтрализовать
кислотность, так как из-за него еще в большей степени увеличится
концентрация никеля в растворе.
Имея на дне ванны избыток карбоната цинка, можно доЬольно
долго поддерживать состав ванны постоянным.
Joseph Haas 1 предлагает для получения «черного никеля» ванну
без роданидов:
NiS04 (NH2)SO4.6H..O 90 г/л
ZnSO4 7Н2О 4 „
Na2SO4 15 ,
NaKC4H4OG 4 „
i „Metal Industry", 19, 1931.
281
Защитные свойства никелевых
образца Подготовка поверхности Осажден- ный металл Состав электролита
CuCN
NaCN
Na^COj
22,5 г/л
30 „
37 Электродитнческо ное обезжиривание jхолод- Медь Никель
38 То же Медь Никель
39 То же Медь Никель
40 Протирка пемзой; । не в электролит . о куна- Медь Некель
41 Электролитическое холод-
ное обезжиривание • • ♦ • Никель Медь Никель
42 То же Никель Медь Никель
43 То же . . Никель Медь Никель
44 Протирка пемзой; нне в электролит . t куна- Никель Медь Никель
NiSO4.7H,O
NH4C1
H2B0s
CuS04 5Н О
H.,S04
140 г! л
13,5 „
15,5 .
200 г л
49 .
Весьма вероятно, что «черный никель», получающийся в этих ван-
нах, представляет собой губчатый никель, или смесь никеля с цин-
ком, загрязненным их основными солями.
7. Контроль никелевых ванн
Содержание никеля может быть определено объемным ме-
тодом— титрованием цианистым натром, электроанализом или коло-
риметрически.
Объемный метод определения никеля основан на образовании
комплексной соли цианистого никеля и натра и изменении по окон-
чании титрования интенсивного голубого окрашивания в желтоватое.
Конец титрования определяется точнее по растворению йодистого
серебра (которое специально вводится в присутствии свободного циа-
нида). Для того, чтобы железо удержать в растворе (если оно присут-
ствует в качестве загрязнения), к пробе прибавляют пирофосфорно-
кислый натр, лимонную или винную кислоту. Если в цианиде имеется
какое-то определенное количество серебра, то количество (образую-
щегося и растворяющегося йодистого серебра пропорционально коли-
честву добавленного цианида.
Для производства определения необходимо приготовить следую-
щие растворы;
покрытий с медной прослойкой
Таблица 66а
Условия осаждения Толщина покрытия мм Результаты испытаний Общая оценка
РВ ПП СС АК
50’ С 1 Х/дм- 0,036 5 10 4 10 .7,3
0,006
0,006 20 12 4 10 11,5
0,013
21° С 1А/Й.И2 0,013 0,013 20 15 8 10 13,3
0013 0.013 20 16 14 27 19,0
0,0013 0,005 2 2 3 10 4,3
0,006 0,0013 0,005 2 2 19 5.5
0/4 3 0,0025 0,010 0,013 * 5 3 15 10,8
0,006 20 20 12 27 20,0
0,006 0013
1) 0,5 N раствор пирофосфорнокислого натра
Na4P2O7.10Н20.......................• . 50 г/л
2) 0,05 N раствор йодистого калия KI . . 8 „
3) 0,5 N „ цианистого натра NaCN . 25 „4-1,7
гл Ag\'<>3
пирофосфорнокислого
К 10 см3 электролита добавляют 50 см3
натра. Затем к раствору добавляют по каплям аммиак до тех пор,
пока раствор не сделается голубым, после чего добавляют 1 о <1м3 рас-
твора, йодистого калия. После этого проба, титруется цианистым нат-
ром до тех пор, пока не растворится первоначально образующийся
осадок. Титр цианистого раствора устанавливается по чистому элек-
тролитному никелю или по никелевому раствору, предварительно под-
вергнутому электроанализу. Для практических целей можно принять
раствор, содержащий 51 г/л NiS04(NH4)2S04. бН2О, что соответ-
ствует 7.5 г/л металлического никеля. 25 см3 электролита оттитровыва-
ются 25,4 см5 раствора цианистого натра. Тогда 1 см3 NaCN соответствует
25 0,0075 = _ 0,0074 г никеля. Если на 10 с.и3 электролита
25,4 2э,4
расходуется 37,5 г NaCN, то содержание никеля равно:
37 -0,0074= 27,8 г/л.
283
Для определения содержания никеля электроанализом берут. 25 см3
электролита, к нему добавляют около 5 г сернокислого аммония и
25 см3 концентрированного аммиака и разбавляют водой до 200 см3.
Никель осаждают на медном катоде при платиновом аноде. При на-
личии перемешивания применяют плотность тока в 2 Х/дм2 в течение
часа, а в отсутствии перемешивания электролиз ведут при 0,5 к! дм2
в течение нескольких часов. После обесцвечивания раствора берут
одну каплю раствора и испытывают на полноту осаждения однопро-
центным спиртовым растЕором диметилглиоксима. По окончании
электролиза катод промывается, высушивается и взвешивается.
Содержание хлоридов определяется объемным или ве-
совым методом. В первом случае нейтрализованная проба электро-
лита титруется стандартным раствором азотнокислого серебра в при-
сутствии хромовокислого натра. Конец титрования определяется по-
явлением красного, непропадаюшего осадка хромовокислого сереб.ра.
При весовом методе берут пробу электролита В 10 см3, разбавляют
водой до 100 см3 и добавляют несколько капель азотной кислоты.
После этого раствор нагревается до 'кипения и вводится избыток
азотнокислого серебра. Выпавший осадок отфильтровывается на тиг-
ле Гуча, промывается, сушится и взвешивается.
Борную кислоту можно определить после удаления никеля
из раствора и в отсутствии плавиковой или какой-либо другой слабой
кислоты. Никель удаляется из раствора электролизом, раствор от-
фильтровывается от гидрата железа и кипятится до прекращения вы-
деления аммиака. Затем к пробе добавляется несколько капель бром-
фенолсини или метилоранжа, растТор подкисляется немного серной
кислотой, кипятится до прекращения выделения СО2 и ' титруется
едким натром до изменения цвета индикатора. С этого момента толь-
ко и начинается непосредственное титрование борной кислоты. Тогда
к пробе добавляют несколько капель фенолфталеина и 25 см3 глице-
рина и продолжают титровать щелочью до появления яркорозового
окрашивания, которое остается и после добавления некоторого нового
количества глицерина. Нейтрализация борной кислоты протекает по
следующему уравнению:
Н3В03 + NaOH = NaBO, Д- 2Н2О.
pH определяете^ по хингидронному электроду или колориметри-
чески. В последнем случае необходимо заранее вычислить поправку.
ГЛАВА ВОСЬМАЯ
ХРОМИРОВАНИЕ
Ни один гальваиостегический процесс не имеет столь разнообраз-
ного применения, как хромирование.
Хром был впервые электролитически осажден Бунзеном в 1854 г.,,
между тем как широкое распространение хромирование получило в
двадцатых годах текущего столетия. Надо было изучить механизм
процесса, наладить его контроль, регулировку и целый ряд других
деталей, чтобы получив хорошие и воспроизводимые результаты,
выявить особенности хромирования изделий. В настоящее время
хром получил в мире гальваностегов название «чудесного» металла.
В Западной Европе и Америке организовано большое количество
акционерных обществ, специально занимающихся изготовлением обо-
рудования для хромировочных установок, а равно хромированием ча-
стей различных механизмов, инструментов и т. п. В СССР сейчас
имеются установки для хромирования почти на 'всех более или менее
крупных машиностроительных заводах.
Главными особенностями электролитического хрома, которые и по-
служили причиной такого широкого распространения его, являются
высокая химическая стойкость и сопротивление механическому
износу.
Хром, как известно, в ряду напряжений стоит в группе электро- -
отрицательных металлов (выше железа), но благодаря сильно выра-
женной способности пассивироваться, он приобретает свойства благо-
родных металлов. Органические кислоты на него не действуют, он хо-
рошо противостоит азотной кислоте. В атмосферном воздухе хром со-
вершенно не меняет своего цвета, в противоположность серебру на
него не действует сероводород. Осажденный на предварительно от-
полированную поверхность, хром имеет зеркальный блеск и платино-
образный с синеватым отливом цвет. Хромовые отложения жаро-
устойчивы и начинают изменять свой цвет при 480—500°. Отража-
тельная способность хромовых осадков несколько ниже серебряных,
зато она отличается постоянством — со временем не меняется.
Полученные при надлежащих условиях хромовые осадки тверже
самых твердых сортов закаленной стали. Хромированные предметы
в домашнем обиходе считаются практически неснашиваемыми.
Хромовые отложения удается получить сплошными (на-глаз) в
самых тонких слоях — стотысячных долях миллиметра.
Осадить электролитическим путем хром можно почти на все ме-
285
таллы, зато Другие металлы, электролитически осажденные иа хром,
отличаются плохим сцеплением.
На перечисленных здесь особенностях электролитического хрома
мы ниже остановимся подробнее — пока воспользуемся этими дан-
ными, чтобы определить те области, где хромирование может с успе-
хом применяться.
Различают Две основные цели, преследуемые хромированием: со-
хранение красивой блестящей поверхности и повышение сопротивле-
ния механическому износу. В Америке большее распространение до
последнего времени имело защитно-декоративное хромирование и глав-
ным образом в автомобильном деле.
Несмотря на высокую химическую стойкость, хром не предста-
вляет надежную защиту железа от коррозии. Причиной тому служит
гальваническая пара хром — железо, которая образуется в открытых
местах, причем в этой паре железо является анодом. Поэтому вместо
непосредственного хромирования применяется предварительная ни-
келировка или, что еще надежнее, тройное осаждение медь — никель —
хром. Слой хрома при этом бывает очень незначителен и колеб-
лется в пределах 0,00005—0,0005 В больших масштабах таким
методом сейчас хромируются блестящие части автомобилей, велосипе-
дов, трамвайных и железнодорожных вагонов, различные измеритель-
ные приборы (в особенности для химических лабораторий), столовая
посуда, водо- и паропроводная арматура, пишущие машины, карман-
ные часы и т. д.
Хром широко применяется вместо серебра в производстве рефлек-
торов. Имея коэфициент отражения, равный Id—72% вместо 95 %> для
серебра, хром имеет то преимущество перед серебром, что Ьн не окис-
ляется и не тускнеет со временем!.
В производстве стекла хром применяется для покрытия форм, бла-
годаря чему значительно увеличивается срок их службы.
Большой эффект дает хромирование штампов и матриц при изго-
товлении различных изделий из пластических масс. Здесь сочетаются
химические и механические свойства хрома.
В производстве клише и стереотипов хром оказывает неоценимую
услугу. Херинг1 приводит результаты испытания хромированных пе-
ча/гных плит в Бюро стандартов в Вашингтоне. Хромирование по-
верх никеля значительно увеличивает срок службы их, хромовый
слой при этом не превышает 0,005 мм и по мере износа может возобно-
виться. По предварительным подсчета^ экономия от этого нововведе-
ния исчисляется в сотнях тысяч долларов.
Хороший обзор применения хромирования в машиностроительной
технике дает Блюм2. Цилиндры двигателя на одном пароходе были
покрыты слоем хрома в 0,076 мм. Сопротивление износу по сравне-
нию с нехромированным цилиндром увеличилось в девять раз.
С большим успехом хромирование применяется для предельных
калибров. Срок службы их при этом увеличивается в 5—10 раз. Ка-
либры предварительно соответствующим образом отделываются, при-
чем доводка размера делается с учетом дополнительного наращива-
ния определенной толщины хромового слбя. Толщина этого слоя
1 Haring, ,Chem. and Metal. Engin.“, 32, 1925.
2 Blum, .Machinery', 5—6, 1925.
286
обычно не превышает 0,005—0,01 леи; после износа остающийся хром
с калибров снимаемся, и их вновь наращивают.
В инструментальном деле хромирование завоевывает все больше и
больше объектов. Правда, встречаются значительные затруднения при
•хромировании режущих инструментов вследствие способности хрома
отлагаться преимущественно на остриях в виде крупных кристаллов,
отчего он делается хрупким и легко скалывается, но применением
специальных «защитных» катодов эти затруднения в значительно!)
степени парализуются. Во всяком случае, такой инструмент, как свер-
ла, метчики, развертки, дают уже вполне удовлетворительные ре-
зультаты.
Конечно, с наибольшим успехом может применяться хромирование
изделий, подвергающихся действию трения: валы водяных насосов,
лопатки водяных и паровых турбин, различные ответственные тру-
щиеся части станков.
Перечислив здесь все преимущества, которые приобретают изде-
лия в результате хромирования, остановимся на тех зутруднениях,
которые возникают при практическом проведении этого процесса;
1) удовлетворительные результаты можно получать при хромирова-
нии лишь при соблюдении определенных условий — температуры и
плотности тока, 2) хромирование требует применения специальных
контактных приспособлений, иногда трудно выполнимых, 3) обычно
Требуется высокая, по сравнению с другими случаями гальваносте-
гии, плотность тока, 4) требуется высококвалифицированная рабочая
сила, 5) необходимо тщательно вентилировать помещение ввиду вред-
ности процесса, 6) трудно обрабатывать хромированные изделия (до-
водка, полировка).
1. Теория процесса
Осаждению хрома из растворов его соединений высшей валентно-
сти предшествовал длительный этап исследований с соединениями
-двух- и трехвалентного хрома. Начало электролитическому осажде-
нию хрома было положено Бунзеном в 1854 г.х. Он применял концен-
трированный раствор СгСК, содержащий примеси СгС13. Электролиз
велся с диафрагмой, анодом служили внутренние стенки графитового
тигля, катодом — узкая платиновая пластинка, которая помещалась
по оси тигля. Анолит состоял из соляной кислоты и отделялся от ка-
толита пористой глиняной диафрагмой. Необходимым условием для
получения металлического хрома Бунзен считал высокую плотность
тока (G7 А/дм* 2) и подогретый электролит. Хром получался совершен-
но чистый, по хрупкий. В 1892—1894 гг. Placet и Bonnet2 в своих
многочисленных патентах рекомендовали осаждать хром из 1—2%>
растворов хромовой кислоты с прибавлением серной, соляной и бен-
зойной кислот или их солей, затем из растворов хромовых квасцов,
сернокислого хрома и щавелевой кислоты, наконец, из растворов трех-
валентного хрома (сульфатов или хлоридов) в присутствии коллоидов,
а также тяжелых металлов (медь, цинк, никель) для непосредствен-
ного получения сплавов и целый ряд других рецептов.
> .Poggend. Annal.“, 619, 1854.
2 „Comptes Rendus", 115, 1892.
2*7
{Затем следуют патенты Cowper Ooles1 (CrGl3--J-НС1), Ferree8
(CrCl3 + KCI), Marino 8 (CrCl3 -j- CoSOJ, но все они, как и предыду-
щие, не получили практического применения. Рекламируемые авто-
рами патентов результаты не получали подтверждения при проверке
их другими.
Работы Neumann4, а затем Corveth и Mott5 * * внесли некоторую
ясность в вопрос о поведении растворов трехвалентного хрома. Элек-
тролиз велся у них с диафрагмой, анолитом служила соляная кис-
лота для хлористых растворов и серная — для сульфатов. Подбором
анолита и (католита, температуры и плотности тока Neumann’y удава-
лось получать чистый хром с выходом тока около 90%. Он, а также
Corveth и Mott наряду с природой и концентрацией электролита
уделили достаточно внимания влиянию температуры и плотности
тока на качество осадка и выход тока. Они также высказали пред-
положение о необходимости присутствия в растворе ионов- двух-
валентного хрома для выделения металла.
Бее перечисленные патенты и работы могут представлять интерес
с точки зрения получения металлического хрома как такового, но не
поверхностного покрытия металлов — гальваностегии. Во-первых, хро-
мовые осадки получаются в этих условиях чрезвычайно хрупкими и
склонны к отслаиванию, во-вторых, необходимость работ с диафраг-
мами вносит большие затруднения, и, наконец, что самое главное,
трудность поддерживания постоянства электролита (следовательйо,
невозможность регулирования процесса) — все эти недостатки лишили
возможности применять ванны, составленные из соединений низшей
валентности хрома, в промышленности.
Из растворов трехвалентного хрома Лайнер® достаточно подробно
проверил хромовые квасцы. Опыты велись с растворами различных
концентраций K2SO4Cr2(SO4)3l 2Н2О в сосуде емкостью в 250 см3. Элек-
тродами служили Pt-Pt, И-Fe, Pt-Cu, Fe-Fe, Pb-Сп. Концентрации
хромовых квасцов брались 25, 60, 75, 100 и 200 г на 100 см3 воды.
Плотность тока испытывалась в пределах 0,02 — 2 А/с.м2; опыты ве-
лись в разнообразных условиях температуры, начиная от 7—8 е и
до 50—60°.
При всех этих опытах ни разу не удалось получить равномерный
осадок чистого металлического хрома. Прибавление 1—2 г H2SO4 на
250 см3 раствора сказывалось несколько благоприятнее, по и тут
светлые осадки поручались лишь на краях пластинки. Несколько
лучшие результаты были получены при следующих условиях:
K2S04Cr-,(S04)3 Г?Н О 1*0 г
КОН 5 „
Н2О 250 „
Плотность тока 7 А/дм2, температура 20°; электроды Pt-Cu. Но вос-
производить эти рзулътаты было трудно.
1 „Chem'c. news". 81, 16, 1900.
= Brit. Pat. 15427, 1902.
3 .Bull. Soc. Chemie", 3, 25. 1901.
4 „Zeitschr f. Electrochem", 7, 625, 1901.
5 „Journ. Phisik. Chem.", 1905.
8 Дипломная работа В. И. Лайнера под руководством проф. Н. А. Изга-
рышева (1926—1927) гг.
288
Фнг. 124. Поляризационные кривые
в растворе хромовой кислоты.
В настоящее время продолжатся Пойыткй работать с солямй
хрома низшей валентности, но трудности еще не преодолены, и прак-
тическое применение находят исключительно ванны с хромовой кис-
лотой. Последняя более или менее подробно была впервые исследо-
вана в качестве исходного препарата для электролитического хроми-
рования Корветчем и Кюри *. Ими было ©первые установлено, что чи-
стая хромовая кислота почти не восстанавливается в процессе элек-
тролиза, в то время как примеси сульфатов совершенно меняют кар-
тину.
В настоящее Время господствуют две теории электролитического
выделения металлического хрома из растворов хромовой кислоты:
теория промежуточного восстановления и теория непосредственного
восстановления ее до металла. Этим двум теориям посвящено боль-
шое количество исследований.
Главными представителями первой теории является Е. Либрайх,
второй — Е. Мюллер. На работах
этих двух авторов мы и остановим-
ся несколько подробнее.
Либрайх, изучая периодические
явления при электролизе хромовой
кислоты, заметил, что с увеличе-
нием напряжения сила тока ме-
няется скачками, и в . некоторых
случаях имеет место уменьшение
силы тока при увеличении напря-
жения. Опыты велись с мерковским
препаратом «чистой хромовой кис-
лоты» различной концентрации. На-
пример, если начать электролиз хро-
мовой кислоты при напряжении
в 1 V и постепенно увеличивать
его, то при значении в 1,7—1,8 V
наступает скачок, характеризующий
вой кислоты. При дальнейшем увеличении напряжения до 2,84 V
сила тока соответственно увеличивается, после чего самопроизвольно
наступает скачок напряжения с 2,84 до 3,25 V, в то Время как плот-
ность тока падает с 0,283 А/с.и2 до 0,279 А/см2 (фиг. 124). Электролит
содержал СгО3 100 г на 100 г воды; электроды Pt-Pt. Аналогичные
опыты Либрайх провел с другими концентрациями.
При этом он заметил, что абсолютные величины точек перегибов
непостоянны, но характер кривых идентичен. Кроме того он заметил,
что если дойти, постепенно повышая напряжение, до некоторого зна-
чения, скажем 4—5 V, и затем постепенно уменьшать его, т о в н о в ь
полученная кривая будет лежать под первой,
т. е. скачки наступают при более низких плотностях тока. Эти явле-
ния объясняются Либрайхом восстановлением электролита в течение
предшествовавшего электролиза. Большое количество опытов, проде-
ланных Либрайхом с различными концентрациями хромовой кисло-
ты при электродах из Pt, Ее» и Сг, привело его к убеждению, что кри-
напряжение разложения хромо-
i »Journ. Physik. Chem.*, 9, 353, ЩО5.
19 Основы гальваностегпи 178g
289
вая напряжения разложения хромовой кислоты состоит из Четырех
ветвей. Строго определенных значений напряжения и силы тока, со-
ответствующих скачкам, установить нельзя; до 1,7—1,8 V таких скач-
ков нет. Что касается пределов плотностей тока, характерных для той
или другой ветки кривой, то можно было установить, что ветви 1, 2
и 3 не существуют выше плотности токов в 1 А/см2, ветвь 3 вообще
неустойчива. В общем же тенденция кривой напряжения разложения
хромовой кислоты переходит при уменьшении плотности тока на
расположенную влево ветвь, при увеличении — на расположенную
вправо. Каждая ветвь кривой, по Либрайху, характеризуется электро-
литическим процессом, который меняется вместе с переходом на дру-
гую ветвь. Например, при электролизе с платиновым катодом до на-
пряжения в 1,7—1,8 V на нем (на катоде) нельзя обнаружить каких-
либо Прочных выделений; вынутый катод при этих условиях покрыт
пленкой золотистого цвета,
ОБ
обусловленного, очевидно,,
хроматом (фиг. 125).
На ветви 2 золотистый
цвет переходит в темноко-
ричневый до карминово-
красного, и при этом па ка-
тодной поверхности обра-
зуется нелегко смывающий-
ся осадок. На ветви 3 осадок
имеет темнокоричневый вид.
На ветви 4 наблюдается вы-
Pt/ft
20г Ъг0уЮ0гНг0
Фнг. 125. Поляризацнонные^кривые в
воре хромовой кислоты.
деление водорода и металли-
ческого хрома.
Резюмируя все эти поло-
жения, Либрайх представ-
ляет процесс осаждения хрома на отдельных ветвях кривой напря-
жения разложения хромовой кислоты в следующем виде:
частичное восстановление хромовой кислоты
CrVI4-3C->Crm; (1)
усиление восстановления
2СгО84-6Н' + 60—*Сг2О34-ЗН2О; (2)
восстановление Ст111 —* Сг11
Сг2О84-2Н‘4-2е-*2СгО4-Н2О; (3)
выделение водорода и металлического хрома
2Н’4-2©->Н2; СгО+2Н' + 2е->Сг + Н20. (4)
Несколько замечаний сделаем по поводу ветви 4, соответствующей
выделению металлического хрома, так как практически именно она
нас интересует. В опытах Либрайха плотность тока, при которой воз-
можна последняя ветвь, была чрезмерно высока: 0.4—0.5 А/см2, да
и получавшийся при этих условиях хром плохо приставал к катоду
и не имел металлического блеска. При еще более высокой плотности
290
тока в 2—з А/сз? структура хрома становилась слишком крупнозер-
нистой, явление весьма нежелательное для гальваностегии.
По этому поводу Либрайх буквально пишет так: «Этими резуль-
татами я бы удовлетворился, если бы в одном старом растворе хро-
мовой кислоты, подвергшемся продолжительному нагреву, я не
получил хромовый осадок металлического блеска, чрезвычайно
плотно пристающий к поверхности, — осадок, которого я не получил
из других растворов различной концентрации хромовой кислоты».
'Йцательно проделанным химическим анализом было установлено,
что этот электролит Ь значительной степени содержал хромовые
соединения низких валентностей. В этом растворе кривая напряже-
ния разложения хромовой кислоты сколько-нибудь заметных скач-
ков не обнаруживала, выделение водорода и металла начиналось
при значительно низших плотностях тока. На этом основании Либ-
райх предложил брать для электролиза такие растворы, в которых
шестивалентные ионы находятся в большинстве в состоянии хромово-
кислых окисей, т. е. двойных соединений шести- и трех-, трех- и
двухвалентных, иначе говоря, растворы с сильной восстановительной
способностью.
С целью выяснения характера промежуточных соединений, воз-
можности их парализовать или сделать нестойкими, одним словом,
добиться скорейшего Восстановления электролита до металла были
растворены собранные -на катоде отложения — слизи и подвергнуты
диализу; раствор при этом весь прошел через мембрану, — в диали-
заторе! же осталось небольшое количество хлопьев светлокоричневого
цвета, что говорит за коллоидный характер этих соединений.
Итак, точка зрения Либрайха сводится к постепенному восста-
новлению хромовой кислоты через трех- и двухвалентные соединения
до металла. В реакциях восстановления принимает участие водород,
т. е. осаждение металла рассматривается как вторичный процесс.
Стадией, предшествующей выделению металлического хрома, по
Либрайху, является образование двухвалентных соединений хрома.
Работы Либрайха подверглись критике со стороны многих исследо-
вателей.
Котаро Ойаби1 подвергал электролизу растворы хромовой кис-
лоты с катодами из платины, хрома и меди и пришел к выводу, что
количество ветвей кривой напряжения разложения зависит от при-
роды катода.
Клеффнер2 нашел, что в абсолютно чистом растворе кривая на-
пряжения разложения до Е — 6,5 V имеет только одно или два на-
рушения плавности.
Мюллер подверг сомненно точность кривых, заснятых Либрайхом,
райпо как и выводы, сделанные им о ступенчатом восстановлении
хромовой кислоты, по той причине, что тот не имел дела с химически
чистой хромовой кислотой. Последнее обстоятельство соответствует
действительности, так как на влияние примесей Либрайх в своих
более поздних работах указал.
Однако, как увидим ниже, работы Либрайха оказали огромную
1 Cotaro Oyaby, „Zeitschr. f. Elektrochemie". 29, 1923.
2 Kleffner, .Zeitschr. f. Elektrochemie", 29, 1923.
291
ycfiyty войросу о Ьййсйеййй харйМерй бЛёК1фОЛйТйЦёС1<оТО ОбйЖДе*
ния хрома как с теоретической, так и с практической сторон.
Мюллер1 в своих работах уделял максимальное внимание чи-
стоте хромового ангидрида. Опыты им велись с платиновыми анодами
и катодами из углерода, платины и хрома.
Первое, что им было установлено, это то, что заметное прохожде-
ние тока (после потенциала напряжения разложения хромовой кис-
лоты) начинается значительно раньше, чем это имело место у Либ-
райха, и вообще для различных катодов прохождение тока начи-
нается при различных потенциалах.
На угольном катоде подъем кривой вверх начинается при потен-
циале отрицательнее на 1,3 V, чем водород, которому в том же
растворе соответствует потенциал 0,28 V.
На платиновом катоде кривая достигает некоторого максимума,
падает и, ьновь подымаясь, идет затем вместе с кривой для хромо-
вого катода после начала осаждения металла (так как с этого вре-
Фиг. 126. Поляризационные кривые в
растворе хромовой кислоты при различ-
ных катодах.
Фиг. 127. Влияние присутствия КаСгО«
на электролитическое восстановление
KJO3.
мени мы уже имеем платину, покрытую хромом). Что же касается
изгиба, то он объясняется способностью платины окисляться в хро-
мовой кислоте до прохождения тока (фиг. 126).
В цитированной работе Мюллер, очевидно, не обращал внимания
на качество получаемого хрома при соответствующих потенциалах,
но в Своих выводах- он говорит, что «из тщательно очищенной СгОя
удалось получить только черный порошкообразный хром». Это
обстоятельство, равно как и незначительный выход тока, получаю-
щийся при электролизе чистой хромовой кислоты. Мюллером на
основании ранее проделанных работ объясняется диафрагмой, обра-
зующейся на катоде.
При электролизе KJOS в присутствии К2СгО4 процесс восстанов-
ления первого при известном значении напряжения вдруг останав-
ливается. Причина заключается в том, что хромат в довольно не-
значительной степени также восстанавливается, и образующаяся
при этом окись хрома, вероятно, хромовокислая окись хрома, покры-
вает катод непроводящей пленкой, так что JOS' не могут больше до-
стигать поляризованного катода; не могут сделать это и СгО4"-иоиы,
1 Muller, „Zeltschr. f. Elektrochemie", 32, 192б.
292
следовательно и К2СгО4 не может дальше восстанавливаться
(фиг. 127).
Но малые водородные ионы по достижении известного потен-
циала могут пронизывать эту диафрагму. Если при этих условиях
электроду, покрытому окисью хрома, сообщить потенциал выше
того, при котором хромовые ионы могут быть восстановлены до ме-
талла из растворов такой же концентрации, то и диафрагма восста-
новится. Непроводящая пленка делается проводящей, СгО3 имеет
свободный доступ (в местах, разрушенных Водородными ионами)
к электроду и может восстанавливаться до металла без промежуточ-
ных соединений. Образно выражаясь, на катоде образуется клапан,
открывающийся и запирающийся, пропускающий и отталкивающий
хромовую кислоту.
На угольном катоде клапан вначале открыт, закрывается с обра-
зованием и открывается при восстановлении окиси хрома. Для пла-
тинового катода клапан вначале закрыт, немного открывается
d восстановлением окиси платины, закрывается с образованием
окиси хрома и открывается с восстановлением. При хромовом катоде
клапан Вначале закрыт и открывается при повышении напряжения
и достижении потенциала восстановления окиси хрома.
Таков взгляд Мюллера на процесс электролиза СЮ3 в отсутствии
посторонних ионов. Если же ввести таковые, в частности SO/', то по-
лучается картина, данная Либрайхом, т. е. типичные периодические
Явления. Но в то время как Мюллер объясняет их последовательным
уплотнением и разрыхлением диафрагмы, Либрайх приписывает каж-
дому скачку наступление определенного электрохимического про-
цесса.
Относительно факторов, способствующих разрыхлению диафрагмы
(и тем самым дающих возможность восстанавливаться хромовой
кислоте), Мюллер1 высказывал несколько положений. Во-первых,
как Ьыше указывалось, механическое действие водородных ионов,
потом химическое воздействие SO/' и, наконец, комбинированное
действие обоих факторов.
В чистой СгО3 диафрагма, которой приписывают формулу:
Сг\ =(ОН)2
>СгО4
Сщ =(ОН)2
может разрушаться только механически выделяющимся водородом,
причем при низких потенциалах Crvi восстанавливается только до
СгП1 .который тут же связывается в хромат, и диафрагма утолщается.
При высших потенциалах после разрыва диафрагмы восстановление
идет до металла. В присутствии SO/' химический эффект совпадает
с механическим, и с увеличением концентрации SO/' растет количе-
ство разрушенных точек диафрагмы. Роль посторонних анионов
Мюллером подробнее разбирается в более поздних работах.
Диафрагма, образующаяся на поляризованном катоде, представ-
ляет собой основную хромовокислую окись хрома, основная часть ко-
торой обращена к катоду, а кислая — к аноду. Эта диаграгма играет
» М tiller, „Zeitschj. f, Elektrochemie‘7'32, 1927.
293
роль защитной перегородки, и через нее могут проникать только во-
дородные ионы (малые по размеру). Последние диффундируют из
электролита и действуют только в том случае растворяюще на
диафрагму, если они проходят через нее вместе со своими анионами.
Но если анионы из-за своей большой величины не могут проникнуть
через поры диафрагмы, то они задерживаются, и растворяющего дей-
ствия не происходит. При дальнейшей катодной поляризации и до-
стижении известного потенциала могут и большие анионы пройти
через диафрагму благодаря большому электростатическому влиянию.
Поляризационные кривые, полученные из 30%, растворов Сг03
в присутствии 0,008 эквивалента ’NaF, NaCl, NaNO3, NaC10s"
NaC104, Na2SO4 и Na3P04, подтвердили такое положение.
Прибавление NaCIO4 и NasP04 в чистую хромовую кислоту не
вносит никаких изменений на ход поляризационных кривых: замет-
ное прохождение тока начинается лишь при достижении потенциала
выделения водорода.
Таблица 67
Влияние анионов на восстановление хромовой кислоты
из
с
о
к
о
к
2
§ S
И 1=
ч в .
g S tb
S =г ч
я Й о
Д-СО сь
Ф И о
Молекулярный
объем соли
Объем аниона
Числа переноса
аниона
Na3PO4
NaC104
Na2SO4
NaF
NaN03
NaC103
NaCl
— 0,38 На
— 0,34 Н2
— 0,36 На
±0,00 Сг
--0,10 Сг
--0,14 Сг
--0,21 Сг
--0,56 Сг
— Na2CrO4 59,5 CrO4" 50,1 51,1
— Na3P04 64,6 PO4" 50,8 52,0
—• NaC104H2 0 69,5 C1O4' 46,9 47,3
0,38 Na2S04 53,2 SO4" 44,0 44,8
0,48 NaF 15,4 F' 10,8 11,2
0,52 NaNO, 37,4 NO3' 32,8 33,2
0,59 NaC163 42,6 C10s' 38,0 38,4
0,94 NaCl 26,9 СГ 22,3 22,7
IICrO4' —72,0 (18°)
H2PO4' — 71,2 (25°)
C1O4' — 78,9 (25°)
HSO/ —80,0 (25°)
F' —55,0 (25°)
N03' — 70,6 (25°)
C1O3' —64,1 (25°)
Cl' —76,3 (25°)
С ч в
Остальные соли — Na2SO4, NaF, NaCl, NaN03 и NaC103 вызывают
значительно раньше заметное прохождение тока. Но каждая из ука-
занных солей оказывает свое влияние при отличных от Na^S04 зна-
чениях потенциала (табл. 67). В первом столбце табл. 67 указаны
сюли, добавляющиеся в эквивалентных количествах в 30 % раствор
хромовой кислоты; во втором столбце даны потенциалы на плати-
новом катоде при плотности тока 0,4.10—5 KIсм2. Затем в после-
довательном порядке идут процессы, протекающие на катоде и депо-
ляризующее влияние прибавляемых солей; последнее характеризует
степень прободения диафрагмы. Дальше даны молекулярные объемы
кристаллизующихся солей. Принимая объем иона натрия одинако-
вым в различных солях, можно вычислить объем аниона, вычтя пер-
294
вый из объема соли *. Наконец, в последнем столбце приведены
числа переноса ионов. Из этой таблицы видно, что иойы Сг"„ Р0"4
и СЮ/ имеют наибольший объем; они же имеют и наименьшую вос-
становительную способность (способность проникать через поры
диафрагмы). То, что F', резко выделяющийся по размерам, не имеет
соответственно сильной восстановительной способности, объясняется
склонностью его к образованию комплексов; СЮ3' имеет большую вос-
становительную способность, чем это соответствует его размеру, бла-
годаря частичному восстановлению его до СГ.
Схематически проникновение анионов через поры диафрагмы
Мюллером объясняется следующим образом. В растворе одной хромо-
той кислоты при незначительном напряжении образуется диафрагма,
основная часть которой обозначена буквой О, а кислая — буквой К.
Знаком + обозначаются водородные ионы, которые по мере увеличе-
ния напряжения проходят через поры и накопляются все в
и большем количестве, в то время как НСгО/, имеющие
размеры, задерживаются. Сами по себе водород-
ные ионы, достигнув основной части диафрагмы
или даже катодной поверхности, не могут дей-
ствовать растворяющим образом на диафрагму
из-за отсутствия анионов, необходимых для
двойного обмена. Когда же достигается потен-
циал разряда водорода до того, как анион прохо-
дит через диафрагму, начинается механическое
разрушение ее выделяющимся газом и свобод-
ный доступ анионов (фиг. 128).
Если же мы имеем дело не с одной хромовой
большем
большие
* ♦ ®
I
I- ®
М
Ж
кислотой, но .в растворе (присутствуют и другие
анионы, например СГ, то благодаря своим незна-
чительным размерам последние, вследствие элек-
тростатического .взаимодействия с водородными
ионами проходят через поры диафрагмы зна-
Фиг. 128 Схема стро-
ения и разрушения
диафрагмы при элек-
тролизе растворов
хромовой кислоты.
чительно раньше достижения потенциала выде-
ления водорода, причем здесь легко происходит
диафрагмы:
растворение
Сг(ОН)СгО4 + НС1 = Сг’" + НЮ + СГ + СгОД
Так называемое химическое прободание диафрагмы должно на-
чинаться тем раньше потенциала выделения водорода, чем меньше
диаметр действующего аниона; при этом предполагается, что анионы
при прохождении через поры диафрагмы деформируются.
Мюллер высказывает также предположение, что потенциал про-
бодения в весьма незначительной степени зависит от концентрации
постороннего аниона.
В цитируемой выше работе автор подчеркивает, что идеальная
диафрагма образуется только на абсолютно гладких поверхностях.
1 Конечно, его объем не соответствует тому, который он имеет в растворе,
так как вследствие явления гидратации объем иона увеличится, но, принимая
приблизительно одинаковую степень гидратации анионов, можно полагать, что
расположение их будет в последовательности увеличения диаметра совпадать
( вычисленным из объема кристаллической соли.
296
Практически на электродах имеются неровности, царапины или
острия, где диафрагма разрывается, и ВСЮ/ имеет возможность
электростатически или простой диффузией черей нее проникнуть.
Там, где это имеет место, прохождение тока заметно растет до начала
выделения водорода. Автор этим объясняет то обстоятельство, что
на гладких, тщательно отполированных электродах не наблюдается
прохождение тока (в чистой хромовой кислоте) до начала выделения
(водорода, а также разница между поляризационными 'кривыми на
гладкой и платинированной платине и угле.
Сравнивая эти две теории электролитического осаждения хрома
из растворов хромовой кислоты — теории промежуточного и непо-
средственного восстановления — с данными практического хромиро-
вания, приходится склониться в пользу первой. Далеко не все
анионы, объем которых равен или меньше, чем у S04, положительно
действуют на электролитическое осаждение хрома (мы не говорим
о начале прохождения тока). Это относится хотя бы к N03'.
Известно, что в присутствии значительного количества азотной
кислоты осаждение хрома возможно только при очень высокой плот-
ности тока. Да и в отношении SO/' практика показывает, что с уве-
личением концентрации- их необходимо сильно повысить плотность
тока для начала осаждения металлического хрома. На это обстоя-
тельство обратил внимание Либрайх еще в 1923 г. *. При электро-
лизе 22% раствора хромовой кислоты в присутствии 8,1% и
0,042% H^SQ, (по отношению к хромовой) плотность тока для начала
осаждения металлического хрома в первом случае должна быть вдвое
бодьре, чем во втором. Следовательно, концентрация SO/' может
быть безразличной лишь в отношении начала прохождения тока
(что может отвечать .какому-нибудь восстановительному процессу,
например, Civl-*-Cr111), но не в отношении выделения металла.
Либрайх полагает, что серная кислота замедляет катодное восста-
новление, но в известных количествах она способствует началу про-
цесса, и, следовательно, является полезной. Если хотят получать
хром при возможно меньшей плотности тока, что для практики часто
является желательным, а иногда и необходимым, то следует брать
растворы по возможности свободные от посторонней кислоты (кроме
хромовой). Четыре ветви поляризационной кривой лежат непосред-
ственно за потенциалом разложения хромотой кислоты, но до того
густо, что практически они сливаются в одну. В отсутствии серной
кислоты на катоде образуются лишь окиси и для дальнейшего вос-
становления их требуется подкислить раствор, при этом отдельные
ветви кривой дальше располагаются друг от друга, они более резко
вычерчиваются. Этому способствует также и повышение температуры
(фиг. 129).
Теоретически влияние кислоты и повышенной температуры
Либрайх объясняет следующим образом. Если исходить из того по-
ложения, что осаждение металлического хрома заключается в про-
цессе Ст** 4- 20 Ст, т. е. что выделение металла зависит от (присут-
ствия двухвалентных ионов хрома, то исходя из равновесия:
Сг**4-2Н*^Сг-4-Н2,
1 Liebreich, , Zeitschr, f. Elektrochemie«t 29, 1923,
296
следует заключить, что даже небольшое подкисление переводит
Сг" в Сг'". Таким образом становится ясным, что при подкислении
хромовой кислоты требуется больший расход энергии, чтобы произ-
вести восстановление х}юма до двухвалентного.
Вместе с тем ясно, что чем меньше концентрация ОН' в растворе,
тем менее возможно образование гидроокиси и тем более вероятно
получение чистого металла. Количество двухвалентных ионов зави-
сит кроме степени кислотности раствора также и от количества уже
восстановленных трехвалентных ионов, от степени диссоциации
присутствовавшей или под влиянием тока возникшей гидроокиси.
Константа равновесия последней
^_[Сг“] [ОН']2
Сг(ОН)2
зависит от температуры,
увеличиваясь с увеличе-
нием ее, а наряду с кон-
центрацией ОН' растет и
концентрация Сг" (что
должно, бы вести к уве-
личению выхода метал-
ла). Но так как склон-
ность к окислению 'Двух-
валентных ионов хрома
также увеличивается с
повышением температуры,
то выделение металличе-
ского хрома затрудняется.
Повышенная температура
таким образом действует
как введение слабой кис-
Фиг. 129. Вид отдельных участков поляриза-
ционной кривой в растворах хромовой кислоты
при надлежащей концентрации серной кислоты.
ЛОТЫ.
На этом мы закончим обзор существующих взглядов на сущность
процессов электролиза растворов хромовой кислоты. В изложенной
ниже практической части, где подробно освещено влияние темпера-
туры, плотности тока и серной кислоты на выход тока, начало оса-
ждения металлического хрома и форму его осаждения, видно будет,
насколько легко эти моменты объясняются теорией о промежуточном
восстановлении хромовой кислоты, предложенной Либрайхом.
Что касается последних работ Мюллера, посвященных химпко-
мсханическим процессам, протекающим на диафрагме, то они, на
наш взгляд, не находятся в противоречии с теорией Либрайха.
Мюллер преимущественно изучал процессы, протекающие до по-
тенциала Выделения водорода и непосредственно за ним.
Либрайх пошел дальше и дал полную картину электролитиче-
ского получения металлического хрома из растворов хромовой
кислоты.
2. Состав электролита и его режим
Предварительные замечания. Электролитическое оса-
ждение хрома протекает при весьма отрицательном потенциале и
297
сопровождается значительным выделением водорода. По этой при-
чине выход тока по металлу в редких случаях может быть поднят
до 50%. Практически при получении хромовых покрытий надлежа-
щего качества выход тока колеблется в пределах 8—30%:. Если
Таблица 68
Толщина хромового слоя (в мм)
Плотность тока к/дм? Выход тока °/о Продолжительность осаждения
0,5 час. 1 час 2 часа
5 10 0,00125 0,0025 0,0050
10 12 0,00300 0,00600 0,01200
15 15 0,00062 0,0112 0,0224
20 18 0,00900 0,0180 0,360
25 20 0,0125 0,0250 0,0500
30 22 0,0165 0,0330 0,0660
учесть еще небольшой
ворах хромовой кислоты
электрохимический эквивалент хрома в раст-
52,01 \
——— = 0,325 г I, то мы увидим, что за
о X 26,8 /
1 A/h практически выделяется 0,025—0,1 г металла, т. е. в 10—40 раз
меньше никеля (табл. 68). Единственное средство, к которому можно
прибегать для форсированного осаждения хрома, — это максималь-
ное повышение плотности тока. С этой точки зрения вопрос обстоит
благополучно, поскольку хромовокислые ванны позволяют приме-
нять высокие плотности тока.
При хромировании приходится уделять большое внимание внеш-
нему виду изделий, особенно в тех случаях, когда покрытие пресле-
дует декоративные цели. Если медь, никель, латунь и другие ме-
таллы могут быть легко отполированы до высокого глянца, то хроми-
рованные изделия очень трудно поддаются полировке, и во всяком
случае эта операция дорогая и трудоемкая. По этой причине прихо-
дится заботиться о получении блестящих хромовых покрытий непо-
средственно из ванны. Между тем получение блестящих по-
крытий хрома возможно только в узких пределах
плотности тока и температурь!.
Для хромовокислых ванн необходимо отметить очень сильную
зависимость выхода от плотности тока и температуры. С повышением
плотности тока повышается также и выход тока, причем в большей
степени, чем это свойственно какому-либо другому процессу. Между
выходом тока и температурой существует обратное соотношение:
с повышением температуры резко снижается выход тока.
В пределах плотностей тока, при которых получаются блестящие
хромовые осадки, катодная поляризация незначительно повышается
с плотностью тока, отчего вторичное распределение тока мало
отличается от первичного. В то же время па катодных участках, где
господствует большая плотность тока, выход тока также больше,
почему распределение металла на катодной поверхности получается
298
крайне неравномерным — рассеивающая способность всегда имеет
отрицательную 'величину. Это обстоятельство заставляет уделять осо-
бенно большое внимание форме анодов, относительному расположе-
нию их и покрываемых изделий в ванне, завешивающим приспособ-
лениям, «защитным катодам» и т. д.
Практическое применение до сих пор получил электролиз хромо-
вой кислоты при нерастворимых анодах; несмотря на наличие боль-
шого количества предложений работать с растворимыми анодами,
последние в силу множества встречающихся при их применении за-
труднений не вышли из стадии лабораторных исследований. Таким
образом осаждение хрома на покрываемых изделиях протекает за
счет металла, находящегося в электролите, и постоянство последнего
может поддерживаться путем систематического корректирования.
Фиг. 130. Анодная и катодная поляризация в хромовокислых
электролитах.
Кроме того для поддерживания постоянства электролита необходимо
на аноде вновь окислять частично восстановленные на катоде, шести-
валентные соединения хрома. Это удается выбором соответствующего
анодного материала и анодной плотности тока.
После этих предварительных замечаний мы можем перейти к бо-
лее детальному изучению роли отдельных компонентов в электро-
лите и режима.
В разобранной теории электролиза хромовой кислоты было1 ука-
зано на трудность восстановления последней в отсутствии какого-
либо постороннего аниона (с небольшим объемом). Практически
нашли себе применение электролиты, состоящие из хромовой кислоты
в присутствии небольших количеств сульфатов. Однако в силу боль-
шого интереса, проявленного к хромированию, появилось огромное
количество патентов, предусматривающих то или иное отклонение от
этого основного электролита. Большинство этих изменений вносит
29»
очень мало улучшений в работу хромовых ваял, — в некоторых слу-
чаях они даже ухудшают их работу.
Херинг и Барроус1 подвергли тщательному изучению следующие
три типа ванн, составленных на основе хромовой кислоты:
1. «Кислые ванны», состоящие из хромовой и серной кислот.
2. «Нейтральные ванны», состоящие из хромовой кислоты и серно-
кислого хрома.
3. ««Основные ванны», состоящие из хромовой кислоты, серно-
кислого хрома и хром-хромата.
Эти ванны были испытаны при одинаковом содержании хромо-
вой кислоты (250 г/л СгО3) и сульфатов (2,5 г/л S04) в виде серной
кислоты, сернокислого хрома или другой сернокислой соли.
Фиг. 131. Влияние температуры иа электропровод-
ность хромовых ванн.
Поляризационные кривые, удельная электропроводность, катод-
ный выход тока и рассеивающая способность всех трех типов ванн
оказались совершенно идентичными.
На фиг. 130 видно, что катодная поляризация в хромовых ваннах
незначительна в пределах тех плотностей тока, которые на практике
применяются.
Одинаковые значения во всех трех типах ванн были получены
также при измерении электропроводности, и лишь в так называемой
основной ванне получалось повышенное сопротивление электролита,
что может быть объяснено уменьшением концентрации свободной
хромовой кислоты,'часть которой связывается с карбонатом хрома.
Внешний вид хромовых осадков, полученных при одинаковых
условиях во всех трех ваннах, также был совершенно одинаковый.
Таким образом можно считать установленным, что непосредствен-
ного влияния на характер электролиза катион, с которым введен
сульфат-ион, не оказывает. Необходимо лишь остановиться на опти-
мальной концентрации его. Но, как это имеет место в ряде других
случаев гальваностегии, концентрации двух главных (в данном слу-
чае единственных) компонентов хромовой ванны должны находиться
в определенном соотношении. Нельзя, например, сказать, что опти-
мальная концентрация сульфатов в хромовой ванне равна 2 г/л,
‘Haring a. Barrows. ,Technolog. Paper of the Bureau of Standards*,
346, 1827.
300
5 г/л й т. д.; Можно сказать, что при такой-то концентрации хромовой
кислоты в ванне оптимальное содержание сульфатов такое-то или
отношение хромовой кислоты к сульфатам такое-то. При содержании
хромовой кислоты (ангидрида) в ванне, равном 250 г!л, и содержании
сульфатов, равном 2,5 г/л, мы будем иметь:
1Оо.
S()4 2,5
хромовой кислоты в ванне без
ФИТ. 132. Влияние концентрации CrOs
на электропроводность хромовых
ванн.
Поскольку доминирующим компонентом в ванне является хромо-
вая кислота, мы остановимся раньше, на ней.
Влияние концентрации хромовой кислоты. Можно
очень широко менять концентрацию
наступления какого-либо видимо-
го ухудшения качества осадка.
Например, при 45° и плотности
тока в 10 А/дм2 можно получить
на плоских изделиях блестящие
хромовые осадки при содержании
в ванне хромовой кислоты в пре-
делах 50—500 г/л. Однако отсюда
нельзя сделать вывод, что можно
произвольно менять концентра-
цию хромовой кислоты, что нет
никагого оптимума.
Прежде всего концентрация
хромовой кислоты нас интересует
с точки зрения электропровод-
ности хромовых ванн, поскольку
других компонентов, которые, при-
сутствуя в заметных количествах,
в той или иной степени влияют
на электропроводность, в них
нет. Удельная электропровод-
ность хромовой кислоты в зави- j
симости от концентрации дана 1
в табл. 69 и на фиг. 132 К
Из табл. 69 видно, что при
25° максимум электропроводности соответствует концентрации хромо-
вой кислоты в 375 г/л, а для 45° максимум «соответствует концентра-
ции в 450 г/л. Чтобы не возвращаться к этому вопросу, мы отметим,
что с повышением температуры электропроводность хромовых ванн
растет по прямой линии, что показало в табл. 70 и на фиг. 131.
Повышая концентрацию хромовой кислоты в ванне (и одновре-
менно повышая температуру), можно в значительной степени сни-
зить омическое сопротивление электролита, а следовательно, и
общее падение напряжения на ванне. К таким мероприятиям прихо-
дится в частности прибегать при ограниченном вольтаже, в сети,
1 Cherry, .Trans. Am. Electrechem. Soc.“, 57, 1930.
301
если необходимо поддерживать очень большое расстояние Между
анодом и катодом и одновременно покрывать большие поверхности.
Однако повышение концентрации хромовой кислоты имеет к ряд
отрицательных моментов.
Таблица 69
Концентрация СгО3, г/л Электропроводность в обр. ом1см:>
25° 45°
50 0,1725
100 0,2965 —
150 0,3940 —-
200 0,4725 —
250 0,5200 0,6150
300 0,5700 0,6810
350 0,5790 0,7070
375 0,5815 —
400 0,5810 0,7225
450 0,5770 0,7285
500 0,5720 0,7245
С увеличением концентрации хромовой кислоты при прочих по-
стоянных условиях — содержании сульфатов, плотности тока и тем-
пературе —выход тока падает (фиг. 133). Например, на стальных
катодах при 25° и плотности тока в 10 А/дл2 выход тока в ванне, со-
держащей 500 г/л хромовой кислоты, на 50% меньше, чем в ванне,
содержащей 250 г*/л хромовой кислоты.
Таблица 70
Влияние температуры па электропровод-
ность хромовых ванн при концентрации
250 г/л
Температура ’С Уд. электропроводность в обр. om]cms
25 30 35 40 45 50 55 0,5200 0,5410 0,5700 0,5910 0,6150 0,6410 0,6600
Механические потери электролита за счет распыления выделяю-
щимся водородом и за счет уноса покрываемыми изделиями, конечно,
более ощутительны в концентрированных электролитах, чем в раз-
бавленных.
Рабочий интервал — отношение верхней и нижней плотности
802
тока, при которой получаются блестящие хромовые осадкй — в кон-
центрированных ваннах ^же, чем в разбавленных (фиг. 134).
По опытам Шнейдевинда на медных катодах при 25° ванна, со-
держащая 250 г!л СгОз, дает блестящие хромовые осадки в пределах
Фиг. 133. Влияние концентрации СгО3 на выход тока при
различном содержании S04". 1 — 250 г/л СгО3; 2— 75 г/л
СгО3; 3— 500 г/л СгО3.
плотностей тока 2,5—8,3 А/'дм2 (отношение 3,3), в то время как ванна
с 350 г/л СгО3 дает такие1 же результаты в пределах 3,9 и 10,2 к/дм2
(отношение 2,6).
Рассеивающая способность понижается с повышением концентра-
ции хромовой кислоты при постоянном отношении ее к содержанию
сульфатов. Это происходит от
того, что в более разбавленных
растворах выход тока боль-
ший и более равномерный.
Когда желательно получить
максимальную рассеивающую
способность при данной плот-
ности тока, целесообразно рабо-
тать с более разбавленными
растворами. Так как, однако,
менее концентрированные ван-
ны также и менее электропро-
водиы, то для данной плотно-
сти тока необходимо приме-
нять более высокий вольтаж.
Фиг. 134. Влияние концентрации СгО3 иа
рабочий интервал хромовых ваин.
Например, в ванне Херинга о
для определения рассеивающей способности (Zq=2) при 45 и плотно-
сти тока в 15 kJ дм2 растворы с концентрацией хромовой кислоты
в 150—250 и 400 г!л соответственно показывали падение напряже-
ния в 5,2; 4,6 и 4,5 V, а рассеивающая способность их равна —50,
зоз
— 65 и — 85i%. Если же допустить, что постоянным будет напря-
жение (а не плотность тока), например 5 V, то вычисленная путем
интерполяции рассеивающая способность оказывается соответственно
равной в трех растворах: —55, —45 и —40%: Ч
Таким образом для определенного (ограниченного и постоянного)
вольтажа более концентрированный раствор дает лучшую рассеиваю-
щую способность. Выбор наилучшей концентрации, следовательно,
зависит от условий и характера работы.
Принимая во внимание кроме упомянутых факторов большие
потери В концентрированных ваннах (выгружаемыми изделиями и
разбрызгиванием) и по-
Фиг. 135. Влияние концентрации S04' и F" на вы-
ход тока по металлу в хромовых ваннах. 1—
кривая фторидов; 2—кривая сульфатов. Участки
между стрелками соответствуют блестящим
осадкам.
вышенное напряжение в
разбавленных растворах,
обычно останавливаются
на средней концентрации
в 250 г хромовой кисло-
ты на 1 л воды.
Надо прибавить, одна-
ко, что концентрирован-
ные Баппы имеют то пре-
имущество перед разбав-
ленными, что в них не
изменяется так резко от-
СгО3
ношение ^уЧкак в силь-
но разбавленных раство-
рах, где резкое изменение
этого отношения может
привести к серьезным
осложнениям.
Влияние концен-
трации сульфатов. Мы уже упомянули, что существенным
является не абсолютное содержание сульфатов в хромовой ванне,
____ СгОо w
а лишь отношение с/=г\и что природа применяемых сульфатов за-
метно не сказывается. Так как разница между молекулярным весом
H2SO4 Ц S04 незначительна, то практически удобнее говорить об отно-
шении между концентрацией хромоного ангидрида и радикала суль-
фата. Соотношение между концентрацией хромового ангидрида и
сульфата можно выразить либо отношением молярности хромового ан-
„ /МСгО8\ л
гидрида к нормальности серной кислоты I I» либо весовыми со-
отношениями этих двух компонентов. Ясно, что числа, выражающие
первое отношение, будут вдвое меньше чисел, выражающих второе от-
ношение, поскольку молекулярный вес Сг03 почти вдвое больше
Н2804 (100 и 98). Мы будем пользоваться весовыми соотношениями.
Рядом теоретических исследований было установлено, что чистая
хромовая кислота в отсутствии посторонних анионоЬ неприемлема
1 Farber a. Blum, .Bureau of Standards Recherch Paper’, 131, 1930.
304
для целей хромирования и что наиболее удобным из таких анионов
является сульфат-ион. Рыночная хромовая кислота содержит боль-
шее или меныпее количество примесей сульфатов. Американские и
германские фирмы поставляют сейчас хромовую кислоту высокой
чистоты (99,75—99,85%), причем цена на этот препарат тем выше,
чем он чище1.
Поэтому содержание примесей сульфатов в исходном продукте
должно быть учтено, хотя бы оно и было незначительно.
Либрайх2 показал, что с увеличением концентрации серной
кислоты в ванне повышается минимум плотности тока, при котором
начинается осаждение металлического хрома.
Шнейдевинд3 увеличи-
вая постепенно концентра-
цию S04" в -ванне, содержа-
щей 250 г/л СгО3, получал
металлический хром, когда
эта концентрация достига-
ла 0,75 г/л, а при концен-
трации в 6 г/л резуль-
таты стали ухудшаться. С
точки зрения выхо-
да тока по металлу,
рабочего интервала
рассеивающей и кро-
ющей способности
наи лучшие отиоше-
СгО3
ния gQ лежат в пре-
делах 100—200. Но не
для всех температур и плот-
ностей тока это соотноше-
ние оказывается самым луч-
рабочий интервал хромовых ванн.
ШИМ.
Для более слабых концентраций сульфатов выход тока будет
выше при малых плотностях тока и ниже для больших. Увеличение
СгО»
содержания ь04 до отношения „= 50 : 1 значительно уменьшает
рассеивающую способность. Более низкое содержание сульфатов,
чем в отношении 200: 1. неприемлемо, так как при этом появляются
темные полосы.
В отношении кроющей способности получается незначительная
СгО,?
разница в пределах изменения _gQ2L°T 200 до 100 и сильное ухуд-
Сг°3 ..
шение при g^- = об.
1 В настоящее время у нас налажено производство высококачественного
хромов >го ангидрита, который вполне может конкурировать с лучшими загра-
ничными образцами.
а Liebreich, „Zeitschr. f. Elektrochemie," 29. 1923.
3 Schneidewind A., Study of Chromium Plating, Michigan, 1928.
20 Основы гальваностегии
П83
305
Сравнительная характеристика поведения
сульфатов и фторидов в хромовых ьаннах. Разбирая
теорию электролиза хромовой кислоты, мы указывали на ту роль,
которую Мюллер приписывает радиусу присутствующих посторон-
них анионов. По этой теории фториды должны вести себя не хуже, чем
сульфаты, как способствующие восстановлению хромовой кислоты.
Херинг и Барроус1 отметили, что в то время как сульфаты повы-
шают выход тока в хромовых ваннах при повышении их концентрации
до некоторых незначительных размеров, после чего начинается резкое
падение выхода тока, — фториды не оказывают никакого влияния на
выход тока в предедах изменения их концентрации от 0,1 до 0,55 N
(соответствующей максимальному выходу тока). По мнению этих ав-
торов, разница между поведением сульфатов и фториДов объясняется
меньшей степенью диссоциации последних (фиг. 135).
Фиг. 137. Влияние температуры на выход тока в хромо-
вых ваннах.
В поисках различных факторов, могущих улучшить работу хро-
мовых ванн, главным образом расширить рабочий интервал и пони-
зить плотность тока, при которой возможно получать блестящие хро-
мовые осадки, фториды, особенно в последнее время, находятся в цен-
тре внимания.
Мюллер и Россоу2 изучали сравнительное влияние сульфатов и
фторидов на выход тока и внешний вид хромовых осадков при раз-
личной температуре и плотности тока. В ванну, содержащую 250 г/л
СЮз, вводился в одпЬм случае сульфат в виде Na.,S04.. 10 Н2О, а в
другом случае фторид в виде KF - 2Н..0. При этом было установлено,
что при 22° выход тока в’ присутствии фторидов для одинаковых
плотностей тока меньше, чем в присутствии одинаковой концентра-
ции (0,01 N) сульфатов, зато в присутствии фторидов удается полу-
чить блестящие осадки при более низких температурах и в более ши-
роких рабочих интервалах. При более высоких температурах (40°)
1 Haring a. Bar rows, „Technolog. Paper of the Bureau of Standards*, 346,
1927.
2 Muller u. Rosso w, .Zeitschr. f. Elektrochemie", 11, 1932.
306
наблюдается обратное явление: в ваннах, содержащих фториды, выход
тока остается более высоким, чем это наблюдается в ваннах, содер-
жащих сульфаты.
При высоких плотностях тока в ваннах, содержащих фториды, на
краях сравнительно быстро появляются дендриты.
Таблица 71
Сравнительное действие сульфатов и фторидов в хромовых ваннах
Концентрация СгО3 250 г/л; катод — медь; анод — свинец
Плотность тока А/0л«а Темпера- тура, СС Выход тока в % при доба- ' вленин, г/л Внешний вид осадка
Na3S04-10Ho0 1,7011 KF-2IU) 0,4969 в ванне с сульфатом в ванне с фторидом
2 22 12,90 8,55 Матовый Блестящий
3 22 10,70 9,30 Слабо блестя- Слабо блестя-
4 22 10,30 9,40 щий щий
5 22 15,97 14,3Q Блестящий Сильно бле- стящий
6 22 21,00 13,80 Матовый Блестящий
12 22 32,70 21.10 Матовый Матовый
6 40 7,24 11,33 Сильно бле- стящий Блестящий с наростами
6 40 8,04 11,23 Сильно бле- стящий Блестящий с наростами
Изменение концентрации фторидов в пределах 0,005—0,05 N не
оказывает заметного влияния на выход тока и внешний вид осадка,
но оптимальные результаты все же были получены при концентрации
в 0,01 N.
Было отмечено также, что в случае длительных перерывов в рабо-
те Ранны, содержащей фториды, требуется при ее включении ненор-
мально высокое напряжение. Это явление объясняется образованием
на поверхности анодов фтористого свинца, отличающегося высоким
сопротивлением. Поэтому в ванне, содержащей фториды, не рекомен-
дуется при длительных перерывах оставлять в пей аноды (это, впро-
чем, относится также и к ваннам, содержащим сульфаты).
Из положительных моментов отмечается также благоприятное
влияние фторидов на рассеивающую способность.
В настоящее время фториды не получили еще широкого примене-
ния в хромовых ваннах, но можно уверенно утверждать, что по мере
уточнения оптимальных условий при их пользовании фториды будут
находить все больше и больше сторонников, поскольку они позволяют
получать блестящие осадки при более низких температурах и плот-
ностях тока.
Влияние трехвалентного хрома. Трахвалентпый хром
всегда присутствует в работающей ванне в большем или меньшем ко-
личестве. Он, во-первых, часто находится в виде примесей в применя-
емом хромовом ангидриде и образуется в результате восстановитель-
ных процессов на катоде при электролизе наряду с протекающим вы-
делением металлического хрома л водорода. Он, наконеп, часто вво-
» :;о7
Фиг. 138. Влияние содержания S04" па
работу в глубину хромовых ванн при
постоянной температуре.
дится в ванну при ее приготовлении. Либрайх считал обязательным
для нормального течения процесса, присутствие в электролите наряду
с хромовой кислотой соединений хрома низшей степени окисления.
Интересно поэтому установить, в каких пределах присутствие трех-
валентного хрома сказывается благоприятно па качестве металличе-
ского осадка. На выход тока трехвалентный хром заметного влияния
не оказывает, но интервал получения блестящих опоев хрома сужи-
вается с возрастанием его содержания. При значительной концентра-
ции трехвалентного хрома получаются темные осадки, подобные тем,
которые получаются при недостаточном содержании в ванне сульфа-
тов или при низких температурах. На рассеивающей способности трех-
валентный хром как-будто сказывается благоприятно. Это становится
заметным при значительных кон-
центрациях его. Так, например,
при концентрации Сгш, соответ-
ствующей 1 .V и 2 2V, рассеиваю-
щая способность соответственно
равна — 43 и — 29 % вместо—65 %
в нормальной ванне. Этот эффект
вызывается образованием хром-
хромата из трехвалентного хрома
и части свободной хромовой кис-
лоты. Получается впечатление,
что рассеивающая способность
увеличивается только потому, что
уменьшается концентрация сво-
бодной хромовой кислоты. В 2,5 Д'
растворе СгО3, содержащем 1N
раствор Сгш, рассеивающая спо-
собность почти такая (—43%),
как в 1,5 N растворе СгО3 без
Сг1П (—50%). Известно, что рас-
сеивающая способность больше
в менее концентрированных ваннах (фиг. 136).
С увеличением концентрации трехвалентного хрома в ванне силь-
но повышается напряжение, например при содержании- его в количе-
стве 17 г/л напряжение достигает 8,1 против 6 V в нормальной ванне.
Это обстоятельство надо учесть особенно в тех случаях, когда распо-
лагают агрегатом низкого вольтажа. Из сказанного ясно1, что нет смы-
сла вводить значительные количества трехвалентного хрома в ванну
или позволять ему накопляться. Небольшое количество, примерно эк-
вивалентное сульфатам, находящимся в ванне, мы считаем полезным
ввести. Нам представляется, что, вводя небольшое количество Сг1П,
мы тем самым надлежащим образом сразу устанавливаем то равнове-
сие между шести- и трехвалентным хромом, которое само по собе В
процессе электролиза устанавливается не сразу.
Во всяком случае, нужно следить за содержанием Сгпт в ванне, и
по мере накопления необходимо его окислять. Это достигается остав-
лением ванны на некоторое время под током со свинцовыми промыты-
ми анодами (возможно большей поверхности) и случайными катодами.
Влияние железа и других примесей. В большинстве
308
случаев для целей хромирования применяются железные ванны (чаще
со свинцовой обкладкой);- иногда пользуются и железными или сталь-
ными анодами. Хотя железо в присутствии хромовой кислоты нахо-
дится в пассивном состоянии, оно все же частично растворяется и
с течением времени может накопиться в изрядном количестве.
В периодической печати часто помещаются запросы о плохо ра-
ботающих храмовых ваннах и так же часто указывается в ответах иа
большое скопление железа в этих ваннах, обнаруженное при анализе.
Шнейдевинд приводит случай из практики, когда хромовая ваша, со-
держащая 150 г/л хромовой кислоты, 19,4г трехвалеитного хрома,
19,1 jg железа и 4,98г сульфатов, совершенно выбыла из строя.
Ванна эта в течение года работала со стальными анодами. Характер-
ным для такого большого количества железа является то, что трудно
поддерживать постоянство тока, — наблюдается беспрерывное колеба-
ние его, а в связи-с этим невозможно установить режим для получе-
ния блестящего хрома.
Подобно трехвалентному хрому значительная концентрация желе-
за суживает интервал получения блестящих осадков. На рассеиваю-
щую способность железо также влияет, как трехвалентный хром, но
действие его несколько слабее. Сопротивление электролита увеличи-
вается с концентрацией железа (следовательно, повышается необходи-
мое напряжение), невидимому, от образования феррохромата и умень-
шения свободной хромовой кислоты. Таким образом присутствие
железа в хромовой ванне является нежелательным. Необходимо под-
черкнуть еще то обстоятельство, что освобождаться от железа далеко
не так легко, как от трехвалентного хрома.
Другие металлы, присутствующие в хромовой Ванне в качестве
случайных примесей, ведут себя примерно так же, как и железо. Во-
обще можно отметить, что хромовые ванны не так чувствительны к
примесям металлов, как это свойственно, например, цинковым, нике-
левым ваннам и ряду других. Отсюда, конечно, нельзя сделать вывод,
что при хромировании не следует уделять внимания сохранению до-
статочной чистоты электролита. Однако в случае нарушения нормаль-
ной работы ванны следует в последнюю очередь искать причину в
металлических примесях. Немецкая фирма Chrom Interessen Gesel-
schaft, Wommer рекомендует ванны с бихроматом. По исследованиям
Фарбера и Блюма большое количество бихроматов увеличивает рас-
сеивающую способность хромовых ванн при наличии в них значи-
тельного содержания сульфатов. Если же бихромат добавляется к
раствору с низким содержанием сульфатов, то рассеивающая спо-
собность ухудшается. Бихромат уменьшает электропроводность рас-
твора и при данных условиях требует большего вольтажа, чем при
эквивалентном количестве чистой хромовой кислоты.
Бор пая кислота, по некоторым данным, присутствующая в
количестве до 5 г/л, несколько понижает плотность тока, при которой
начинается осаждение металлического хрома.
Азотная кислота. К числу безусловно вредных примесей
следует отнести азотную кислоту. Уже при концентрации ее, равной
1 г/л, необходимо значительно повысить плотность тока, при которой
309
начинается осаждение хрома. При значительном содержании азотной
кислоты в электролите нормальное проведение процесса делается во-
обще невозможным. Кроме того даже небольшие примеси азотной кис-
лоты в электролите действуют разрушающе па свинцовую Ьбкладку
ванны.
Влияние температуры и плотности тока. Ни в
одном гальваностегическом процессе температура и плотность тока не
играют такой существенной роли, как при электроосаждении хрома из
растворе® хромовой кислоты.
При данном электролите плотность тока и температура являются
решающими факторами. Мало того, нет почти такого электролита
(если только он содержит хромовую кислоту), для которого нельзя
было бы недобрать такую комбинацию из этих двух факторов, при ко-
торой можно получить удовлетворительные осадки, но эта комбина-
ция может оказаться непрактичной и при том слишком ограничен-
ной, не терпящей никаких отступлений.
Как с точки зрения получения доброкачественных по внешности
осадков, так и с точки зрения Выхода тока по металлу температура и
плотность тока находятся в тесной зависимости друг от друга и с из-
менением одной из них необходимо изменить и другую.
О влиянии температуры на выход тока можно сделать заключение
из такого сопоставления: при плотности тока в 10 А/дм2 выход тока
при — 6° равен 60%; при 0° равен 40%; при 8° равен 30%; при
60° равен 7% (фиг. 137).
Внешний вид хромового осадка настолько чувствителен к темпе-
ратуре, при которой он получается, что колебание ее (температуры)
для установленного режима допускается в пределах dr 1, zr: 2°.
Особенно с этим обстоятельством приходится считаться при хро-
мировании для декоративных целей, т. е. при получении блестящих
слоев хрома поверх заранее отполированного предмета. Известно, что
хромированные изделия трудно поддаются полировке, и во всяком
случае эта операция весьма удорожает процесс хромирования.
Наиболее широко применяемой при хромировании является темпе-
ратура в 45°. Она считается удобнее других потому, что ей соответ-
ствует относительно широкий рабочий интервал и что практически
легко поддерживать эту температуру постоянной при соответствую-
щих плотностях тока (около 10 А/дл2).
При более высоких*" температурах рабочий интервал уменьшается,
увеличивается испарение электролита и требуется более высокая
плотность тока.
Если необходимо покрывать хромом при низких плотностях тока
(при хромировании очень больших предметов и наличии ограничен-
ного ампеража), то температуру соответственно понижают.
С точки зрения получения минимума пор в хромовых осадках
Бекер и Рент показали \ что здесь повышение температуры сказы-
вается благоприятно.
Изменения плотности тока оказывают влияние, совершенно отлич-
ное от влияния температуры; при увеличении плотности тока выход
тока повышается, а при уменьшении — понижается. Для каждой тем-
1 Raker a. Rente, .Trans. Am. Electro.chem. Soc.“, 54, 1928.
3JO
поратуры при прочих неизменных условиях существует определенный
минимум плотности тока, ниже которого хром вовсе не осаждается.
Этот минимум тем больше, чем выше температура. По этой причине
и случается часто, что на углубленных частях покрываемых предме-
тов хром тювсе не осаждается — там не достигнут минимум плотности
тока.
Лайнеру 1 удавалось получать хорошие, равномерные, блестящие
осадки хрома при 7—8° (на латуни) и плотности тока 0,5 А/дм2 3, но
с очень незначительным выходом тока—около 5%. При этих усло-
виях хромовая ванна обладает лучшей рассеивающей способностью.
Выход тока особенно заметно повышается с плотностью тока в
пределах получения блестящих слоев хрома; для 45° это будет со-
ответствовать плотности тока 10—25 К!дм2. При дальнейшем повыше-
нии плотности тока кривая выхода тока очень медленно идет вверх.
Практически выход тока лежит fe пределах между 6 и 20%, а при
осаждении блестящего хрома он равен 13—15%.
Если при заданной температуре плотность тока будет ниже необ-
ходимой, то хром может вовсе не высадиться или же становится ма-
товым. Когда плотность тока превышает нормальную, хром полу-
чается загорелым, темным и может начать лупиться.
При 45° нормальной плотностью тока считают 10 К/дм2. Не сле-
дует широко выходить за эти пределы при хромировании для декора-
тивно-защитных целей, и особенно осторожно следует обращаться с
плотностью тока, когда применяют промежуточные прослойки из ме-
ди и никеля. Выделяющийся при хромировании водород диффунди-
рует в лежащую под ним прослойку, содержание водорода становится
чрезмерно большим, и хром начинает отслаиваться вместе с лежа-
щими под ним никелем или медью.
Для получения твердых слоев применяют повышение плотности
тока, достигая иногда величины в 100 А/дм2. Сравнивая стойкость
против истирания изделий хромированных при различных плотно-
стях тока, Грант Л. Е. и Грант Л. Ф. нашли2, что наилучшие ре-
зультаты получаются при 60 К!дм2. С точки зрения хорошего рассеи-
ваний силовых линий благоприятно сказываются повышенная плот-
ность тока и. пониженная .температура. Так как невозможно произ-
вольно манипулировать этими двумя факторами, а, как говорилось
выше, повышению плотности тока должно следовать и повышение
температуры, то для лучшей рассеивающей способности в пределах
получения блестящих слоев хрома придерживаются относительно вы-
соких температур и высоких плотностей тока. На фиг. 137 видно, что
с повышением температуры выход тока становится более равномерным
в пределах получения блестящих слоев хрома.
С повышением температуры увеличивается электропроводность
раствора, в связи с чем понижается потребный для данной плотности
тока вольтаж. Но для получения блестящих осадков при высокой
температуре плотность тока должна быть повышена значительно
больше, чем это соответствует повышению электропроводности. В ко-
1 Лайнер В. И., Дипломная работа под руководством проф. Н. А. Изга-
рышев а.
3 Grant L. Е. a. Grant L. F., „Trans. Am. Electrochem. Soc.“, 53, 192в.
311
нечном итоге необходимо применить при повышенной температуре
больший вольтаж, чтобы получить блестящие осадки с такой же рас-
сеивающей способностью, как и при низкой температуре.
Практически целесообразно применять 'высокую температуру и
соответственно высокую плотность тока, если другие обстоятельства
позволяют. При комнатной температуре в 25° можно получить бле-
стящие осадки на меди и латуни (но не на стали) при соотношении
тока 2:1. Следовательно, если предметы удовлетворительно покрыва-
ются при низких температурах, то они, очевидно, имеют такую форму
и так расположены В ванне, что ток распределяется более или менее
равномерно на всех предметах. При температуре около 55° и соответ-
ственно высокой плотности тока рас-
сейвающая способность приближается
к нулю (для хромовых ванн это счи-
тается хорошо).
Если в распоряжении имеется ше-
стивольтовый генератор, то напряже-
ние на клеммах ванны не превышает
5 V. В таких случаях работают с тем-
пературой 35—45° и с такой плот-
ностью тока, которая позволяет полу-
чать при этих условиях блестящие
осадки хрома.
Ониченко1 видоизменил метод
«углового катода» для изучения крою-
щей способности хромовых ванн в том
направлении, что он ввел некоторые
количественные элементы в методы из-
мерения. С этой целью он применил
угловой катод, состоящий из шести
разборных частей, каждая из которых
могла быть отдельно взвешена. Взве-
шиванию подвергались только четыре
части, причем отношение весов двух
крайних частей к сумме весов двух
внутренних частей (примыкающих
Фиг. 139. Влияние температуры
на работу в глубину хромовых
ванн при постоянных плотности
тока н содержании SO4.
к вершине угла) давало понятие о кроющей способности или работе
ванны в глубину:
т,- _ £7i
Чем больше величина К, тем хуже работает ванна в глубину, в иде-
альном случае К=1 и кроющая способность ванны равна 100%.
Пятая и шестая части катода представляют собой узкие 3,5 мм
пластинки и расположены по краям частей 1—4 с целью предохране-
ния образования наростов или крупных кристаллов.
Размеры отдельных частей катода были следующие:
-^д + -^в = 1° см2>
F1 -J- F2 F3 -j- F4 = 40 см2.
1 .Zeitschr. f. Elektrochemie", 39, 10, 1933.
312
Все эти части были смонтированы на эбонитовой подставке. Ано-
дом служили свинцово-сурьмянистые (5% Sb) полосы с суммарной
поверхностью, в два раза превышающей площадь катода; расстояние
между электродами равнялось 15 см (фиг. 140).
Опыты проводились в электролите, содержащем 300 г/л Сг03, в
течение 30 мин., переменными факторами были: содержание сульфа-
тов, плотность тока и температура. При изучении роли какого-нибудь
одного из этих трех факторов, остальные поддерживались постоян-
ными.
С увеличением содержания серной кислоты в ванне работа в глу-
бину хромовой ванны ухудшается (как это было установлено Фарбе-
ром и Блюмом), но если исходить из того содержания сульфатов,,
которое соответствует максимальному выходу тока, то оптимум будет
Фиг. 140. Прибор Оппченко для исследования работы в
глубину и выхода тока хромовых ванн.
соответствовать 3 г/л SO4, т. е. отношение Сг03: SO4 = 100 : 1, которое
практически чаще всего применяется; при таком содержании серной
кислоты выход тока равен 25,4%, а к = 3,55. Если же пойти на не-
которое снижение выхода тока, то можно добиться лучшей работы в
глубину: при содержании серной кислоты в ванне, равной 1,55 г/л, вы-
ход тока становится равным 20%, в то время как К = 2,95
(фиг. 138).
С увеличением плотности тока при прочих постоянных условиях
К увеличивается, т. е. работа в глубину ухудшается. В данном слу-
чае, очевидно, сказывается резкое увеличение выхода тока с плот-
ностью тока.
Температурные изменения, по данным Ониченко, не оказывают
влияния на работу в глубину хромовых ванн при постоянной плот-
ности тока (фиг. 139), но внешний вид осадка становится' лучше
по мере повышения температуры; при 20° хромовый осадок имеет
серый вид, при 35° вторая и третья части катодов становятся свет-
лыми. а при 50° становятся светлыми даже самые крайние части ка-
тода F А и FB
Влияние природы и состояние поверхности
покрываемого металла. Фарбер и Блюм показали, что состоя-
ние поверхности покрываемых изделий оказывает большое влияние
на выход тока и качество осадка. В стандратной ванне при отношении
313
расстояний катодов от анода, равном 2 :1 на пластинках, обработан-
ных пескоструйным аппаратом, выход тока равнялся 10 и 1% (соот-
ветственно на близком и отдаленном катодах) при рассеивающей спо-
собности, равной —1000%. Такая разница в катодном выходе тока
находится в связи с уменьшением перенапряжения водорода на ше-
роховатых поверхностях: выход тока по хрому падает вследствие об-
.легчения выделения водорода.
Таким образом преимущества полированных поверхностей оче-
видны.
Что касается природы самого металла, то рассеивающая способ-
ность выше на стали и латуни, чем на меди и никеле. Это особенно
наглядно видно из опытов по определению кроющей способности на
различных металлах.
Итак, в отношении выбора состава электролита и режима хромо-
ной ванны можно сделать следующие выводы:
1. Главные „три типа ванн-—кислый, нейтральный и основной — со-
вершенно идентичны как с теоретической, так и практической точек
зрения. Выгоднее, поэтому, остановиться на той ванне, которая легче
поддается контролю.
2. Чтобы не вводить трудно контролируемые примеси в качестве
добавок к хромовой кислоте, целесообразно пользоваться сернокислым
хромом или серной кислотой. Необходимо при этом учитывать то ко-
личество сульфатов, которое сопутствует хромовому ангидриду как
загрязнение.
3. Для получения не только блестящего слоя хрома, но и лучшего
СгО3
выхода тока по металлу, весовое отношение - в ванне должно
быть не меньше 100.
4. При хромировании изделий со сложными профилями, особенно
при хромировании изделий с точно доведенной поверхностью, когда
самым существенным является получение равномерного слоя хрома,
СгО3
лучше придерживаться отношения -g-g— — 200.
5. Концентрация хромовой кислоты в пределах 200—250 а/л яв-
ляется наиболее приемлемой. При ограниченном вольтаже (5—6V)
щелесообразно пользоваться более концентрированными ваннами — до
400 г хромовой кислеты на литр.
6. Не рекомендуется накапливать в ванне большие количества
трехвалентного хрома и железа.
7. Выход тока находится в зависимости от состава электролита,
•температуры, плотности тока, природы и состояния покрываемого
металла.. „
При данных условиях выход тока по металлу падает с увеличе-
нием концентрации хромовой кислоты и сульфатов.
С повышением температуры и понижением плотности тока выход
•тока по металлу падает.
С понижением температуры и повышением плотности тока выход по
металлу возрастает.
На гладких и полированных поверхностях выход тока больший,
чем на шереховатых и матовых.
3’4
8. Наилучшая рассеивающая способность (—13%)
может быть получена в ванне, содержащей (на 1 л)
250 г хромовой кислоты и 1,25 г сульфатов при 55° и
средней плотности тока в 35 А/дм2.
Такие условия рекомендуется соблюдать, когда располагают де-
сяти-, двенадцативольтной машиной и задаются целью получать слой
хрома наибольшей (практически возможной) равномерности.
9. Наиболее приемлемыми ваннами, таким образом, являются: при
неограниченном вольтаже:
1) хромовой кислоты . . . 200 — 250 г\л
серной кислоты ... 1 — 2,5 „
или сернокислого хрома. . . 1,3— 3,3 „
При ограниченном вольтаже:
2) хромовой кислоты . . . 350 —400 г/л
серной кислоты ... 2 — 2,4
или сернокислого хрома . . 2.6 — 5,2 „
Аноды и анодный процесс. Во всяком гальваническом
процессе стремятся подобрать электролит и аноды такими, чтобы пер-
вый оставался более или менее постоянным, а вторые в единицу вре-
мени давали столько металла в раствор, сколько его осаждается на
катоде, т. е. чтобы анодный и катодный выхода тока были одинако-
в|ые. Так, например, в никелевые ванны для борьбы с пассивирова-
нием анодов (которое вызывает обеднение раствора металлом) bibo-
дят хлор-ион, комбинируют литые и катаные аноды и т. д.
Применять растворимые аноды в хромовых ваннах оказалось прак-
тически невыгодным. Хромовые аноды нецелесообразно применять
лютому, что х,ром с них в несравненно большей степени переходит
в раствор, чем осаждается}-ла покрываемых предметах, что в зависи-
мости от условий электролиза — температуры и плотности тока. — хром
переходит в раствор в виде поноЫ различной валентности, и, что, на-
конец, в силу хрупкости самого металла аноды трудно поддаются
механической обработке, а следовательно, не всегда возможно им при-
дать должную форму.
Изучению анодного материала для целей хромирования посвя-
щено много исследований, и почти toce они отвергают применение
растворимых или частично растворимых анодов. Имеющиеся па-
тенты, предусматривающие применение такого рода анодов, практи-
ческого применения не нашли.
Для наглядности приведем выдержку из работы Оливер И. Уатча
который провел систематические испытания различных анодов
© электролите из 250 г/л хромовой кислоты и 4 г сернокислого хрома
при средней плотности тока в 13 А/дм2 и 32—35°.
При хромовом аноде за 157 Ah было высажено на катоде 4.1 г
металла, а перешло в раствор 58,2е; содержание металла
в растворе увеличилось за это время на 277% от начального. При-
мерно такую же картину дали другие хромсодержащие сплавы:
Таким образом остается ьопрос о применении нерастворимых ано-
дов. Ванна в таких случаях должна периодически пополняться исход-
ным продуктом, главным образом хромовой кислотой. Материалом
1 Watch О. Р, „Trans. Am. Electrochem. Soc.', 52, 1927.
315
для нерастворимых анодов может служить 'платина, железо (мало-
углеродистая сталь) и свинец. В полном смысле нерастворимой
является только, платина, но говорить о широком применении такого
дорогого металла не приходится. Железо и свинец частично раство-
ряются в хромовой кислоте, но свинец выпадает в осадок в виде
хромокислого свинца (растворимость последнего незначительна), в то
время как железо остается в растворе в виде феррохромата и, как
нами выше указано, является нежелательной примесью.
О растворимости железных анодов в хромовой ванне можно су-
дить по опытам Шнейдевинда1: при пользовании для хромирования
железными сосудами в качестве анодов концентрация железа
в ванне после 1242 Ah дошла в четырех случаях до 50 г/л и в пятом
случае до 96,2 г. Правда, в этих опытах перешло в раствор такое
большое количество железа вследствие большой анодной поверхности
(малой анодной плотности тока), но и в других случаях растворение
железа имеет место в заметных количествах.
В опытах Уатча при одних и тех же условиях за 342 Ah со свин-
цовыми анодйми было высажено 15 г металлического хрома, а с же-
лезными только 9,23 г.
Если и не учитывать явление растворения железа, то с точки зре-
ния поддерживания выгодного равновесия между шести- и трех-
валентным хромом в ванне предпочтительно остановиться на свинцо-
вых анодах.
Как известно, наряду с выделением металлического хрома на ка-
тоде имеет место выделение водорода и восстановление хромовой
кислоты до низших степеней окисления. На аноде же выделяется
кислород и происходит окисление восстановленных продуктов. Мно-
гими исследованиями доказано, что это окисление идет энергичнее
именно на свинцовых анодах. Это объясняется большим перенапря-
жением кислорода на свинце по сравнению с железом.
Определенное равновесие устанавливается в электролите и при
свинцовых и при железных анодах, но концентрация трехвалентного
хрома при этом в четыре раза превышает таковую для свинцовых.
На окислительно-восстановительные процессы оказывает влияние
также и площадь анодов, или анодная плотность тока. В отношении
выбора анодной плотности тока в литературе имеются противоречи-
вые указания.
Пфангаузер предостерегает от применения больших анодных по-
верхностей, так как они вызывают неравномерное распределение
силовых линий и служат часто причиной матовости хромового
осадка, или «загара». Кто практически сталкивался с продолжитель-
ным хромированием предметов неправильной ф^рмы (а иногда даже
пластинок), тот имел возможность убедиться в справедливости та-
кого утверждения.
Однако с точки зрения окислительной способности анодов лучше
поддерживать на них низкую плотность тока, почему Шнейдевинд
и другие авторы рекомендуют применять аноды максимально допу-
стимой поверхности.
1 Schneidewind. A. Study of Chromium Plating, Michigau 1928.
316
В «Бюллетене» 346 Бюро стандартов в Вашингтоне приводятся ре-
зультаты параллельного испытания при одинаковых условиях же
лезных и свинцовых анодов, но разной площади (табл. 72).
Таблица 72
Отношение анодной пло- щади к катод- ной Анодный материал Содержание трехвалентн. хрома, г/л
начальное * конечное
1-3 / Свинец . . - 0,46 0,15
1.3 | Железо . . . 0,46 1,24
31 / Свинец . . . 0,46 0,05
3.1 j Железо . . . 0,46 0,93
Из этой таблицы видно, что по сравнению с материалом площадь
анодов незначительно влияет на конечное равновесие.
При аналогичных опытах исключительно со стальными анодами
Шнейдевинд показал, что анодная плотность тока в пределах
17,8—5,4 К/дм2 почти не сказывается на равновесии, и лишь при
анодной плотности тока в 3,8 А/дл2 концентрация трехвалентного
хрома заметно понижается. Интересно отметить, что в Американ-
ском бюро гравирования и печатания принято отношение анодной
поверхности к катодной 1 :2, при' котором поддерживается постоян-
ное и выгодное равновесие в электролите.
На этом основании и по соображениям, указываемым Пфангаузе-
ром, мы рекомендуем поддерживать отношение анодной поверхности
к катодной в пределах от 1 : 2 до 2 : 3.
На повышенное содержание Ь ванне трехвалентного хрома благо-
приятно действуют также высокая температура и частые перерывы
в процессе электролиза. Кстати укажем, что катодный материал и ка-
тодная плотность тока тоже оказывают свое влияние на окислительно
восстановительные процессы.
С. Лукенс 1 приводит следующее изменение электролита, содержа-
щего 250 г/л Сг03 и 3,3 г Cr,(SO4)„ после 1 часа электролиза в зави-
симости от материала катода (табл. 73).
В случае накопления в ванне большого количества трехвалентного
хрома его нетрудно окислить. Это обычно достигается завешиванием
большого количества свинцовых анодов и случайных катодов (же-
лезных или медных листоЬ) и пропусканием тока в течение несколь-
ких часов.
В некоторых случаях, однако, свинцовые аноды не являются при-
емлемыми в силу невысоких физико-механических свойств свинца.
Главным образом с этим приходится сталкиваться при хромировании
внутренних поверхностей трубок небольшого диаметра. Известно, что
тонкую свинцовую проволоку нельзя сильно натягивать, следова-
тельно; и центрировать ее трудно. Лучшим металлом в таких случаях
является платина, но по указанным уже выше соображениям широко
1 Lukens, „Metal Industry", 507,, 1928.
317
пользоваться ею нельзя, почему и прибегают к стальной освинцован-
ной проволоке.
На свинцовых анодах, особенно при частых и продолжительных
перерывах в работе, образуется твердая корка хромокислого свинца;
эта корка вызывает значительное сопротивление для прохождения
тока и этим обусловливает повышенное рабочее напряжение. Для из-
бежания образования такой корки рекомендуется на ночь оставлять
аноды в Тюде, а для снятия уже образовавшейся корки — чистка
стальной щеткой или травление в растворе слабой соляной кислоты.
В Америке получили распространение аноды из гартблея, сплава
свинца с 6—8% Sb. Стойкость последних в хромовой кислоте выше
чем чистого свинца.
Таблица 73
Влияние катодного материала на изменение хромового электролита
Катод Плотность тока, А/Ди2 CrVI, г/л Сг111, г/л Разница
до после до после
Электролит, никель . . 5 126,42 121,37 3,12 4,67 + 1,55
я п 10.5 130,08 128,59 1,’2 1,49 + 0,37
20 132,31 129,10 1,60 1,20 + 0,40
Электролит, медь» . . . 5 120,42 120,98 3,12 5,06 + 1 94
Я я 10,5 130,08 127,09 1,12 1,87 + 0,75
я » 20 132,3' 130,50 1,60 1,21 — 0,39
Листовой свинец . . . 5 126,42 120,98 3,12 7,78 + 4,66
»♦ V 10,5 130,09 127,09 1,21 1,87 + 0,76
» я 21 132,31 128,10 1.60 1,60 + 0,00
Для хромирования больших поверхностей применяются свинцовые
листы, просверленные в нескольких местах для свободной циркуля-
ции электролита. Толщина анодов, в зависимости от остальных раз-
меров бывает 3—6 мм.
Вследствие неблагоприятного распределения металла на катоде
приходится в хромовых ваннах особое внимание уделять форме ано-
дов. Идеальным является такой анод, все части которого находятся
на одинаковом расстоянии от соответствующих частей покрываемых
предметов. Следовательно, плоские аноды можно рекомендовать только
дая предметов, не имеющих сильных выступов или углублений.
Чем больше расстояние между анодами и покрываемыми предметами,
тем больше сглаживается разница в толщине хромового слоя на от-
дельных участках, почему и приходится при хромировании изделий
со сложным рельефом максимально увеличить расстояние между
электродами.
Для цилиндрических предметов, когда их много завешивается в
ванне, можно рекомендо’вать вогнутые аноды с таким расчетом, чтобы
против каждого предмета приходилось по два анода. Внутренние от-
верстия изделий хромируются специальными анодами. Последние при
помощи изоляционного материала заранее закрепляются вместе с
предметами и в таком виде завешиваются в ванны.
3'8
Вообще же для предметов сложной конфигурации надо подобрать
аноды, максимально приближающиеся по своей форме к форме по-
крываемых изделий. Свинец в этом отношении является благодар-
ным металлом, поскольку он легко поддается обработке в холодном'
виде.
Контактные приспособления. В то время как в дру-
гих гальваностегических процессах бывает достаточно самого легкого-
соприкосновения покрываемого предмета с источником отрицатель-
ного тока, при хромировании необходимо заботиться о самом тщатель-
ном контакте. Нередки случаи, когда из-за плохого контакта хром не
только осаждается неудовлетворительно, но и совсем не осаждается.
Гак как предметы в силу плохого рассеивания хромовых ванн нельзя’
произвольно завешивать, а необходимо их поместить в определенном
положении по отношению к анодам и друг другу, то необходимо поль-
зоваться соответствующими завешивающими приспособлениями. Из-
делия заранее набираются на эти приспособления — рамки, тщатель-
но на них закрепляются, в таком виде обезжириваются, промываются
и завешиваются в ванны. Из соображений экономии времени такие-
приспособления также заслуживают самого серьезного внимания. При
индивидуальном завешивании предметов нередко тратится больше
времени на эту операцию, чем на процесс самого хромирования. Удач-
ный выбор контактного приспособления — это уже 50% успешного;
результата.
Невозможно, конечно, стандартизировать такого рода приспособ-
ления ввиду большой разновидности изделий, подвергающихся хро-
мированию. Есть, однако, соображения общего характера:
1. Приспособление должно быть достаточного сечения, чтобы сво-
бодно проводить ток соответствующей силы.
2. Приспособление должно давать свободный доступ силовым ли-
ниям к покрываемым предметам.
3. Приспособление должно иметь хороший контакт как с катод-
ной линией, так и с покрываемыми предметами.
4. Приспособление должно быть изолировано материалом, не реаги-
рующим с раствором.
о. Если в‘ этом встречается необходимость и имеется возможность,
приспособления должны быть снабжены «защитными катодами», бе-
рущими на себя избыток силовых линий и тем самым предущда-
ждающими образование «загара» на выпуклых частях предметов или
дендритов и отслаивания на остриях.
В отношении выбора надлежащих контактов особенно много не-
доразумений возникает у практиков, привыкших работать с относи-
тельно низкими плотностями тока, как это имеем место при никелиро-
вании, латунировании и т. д. В самом деле, предположим, что пред-
мет с определенной поверхностью в никелевой ванне потребляет 10 А;
предположим дальше, что сопротивление контакта у крючка, на ко-
тором предмет висит, или на катодной штанге равняется 0.01 •
Тогда общая потеря напряжения на преодоление этого сопротивления
будет равняться 10 X 0,01—0,1 V. Такая потеря не Очень ощути-
тельна и остается незаметной.
При хромировании предмет с такой же поверхностью потребляет'
100, 200, 300 А и даже больше. .При таком же сопротивлении в коп-
219
тактах соответственная потеря напряжения составит 1, 2, 3i «V или
больше. Ясно, что при таких потерях мы можем и не достигнуть
потенциала выделения металлического хрома.
Таким образом основное правило при выборе контактных приспо-
соблений для хромирования — это достаточное поц,еречное
сечение, дающее минимум потери напряжения и отсутствие оки-
слов в местах контакта. Штанги, подводящие ток и крючки, на котс-
фых висят рамки, не рекомендуется делать круглого сечения, так как
при этом контакт очень часто осуществляется только в одной точке.
Наиболее практичными являются ушки, изогнутые сверху под пря-
мой угол: шины, подводящие ток, делаются из полосовой меди, причем
их берется по две штуки, и концы ушков закрепляются между ними
при помощи винтовых гребешков.
Часто отдельные предметы завешиваются в ванну при помощи про-
волоки, пропущенной через отверстия, имеющиеся на этих предметах.
Если проволока не натянута, то под ней и около нее остается участок,
не покрытый хромом.. Это объясняется тем, что силовые линии пересе-
кают преимущественно проволоку, и на ней концентрируется большая
плотность тока, чем на соседних участках предмета. Такое же явление
наблюдается в никелевых и других ваннах, но так как интервалы
плотностей тока там не так ограничены, то это неощутительно.
При изготовлении рамок для одновременного завешивания несколь-
ких изделий тоже надо принимать меры, чтобы отдельные части этих
рамок не препятствовали нормальному покрытию изделий, т. е. они
не должны быть ближе расположены от анодов.
В ряде случаев, однако, приходится на рамках специально делать
такие выступы. При хромировании калибров, например, приходится
придерживаться максимальной точности размеров. Калибры склонны
на краях, и особенно на нижнем конце при вертикальном положении,
давать утолщения, которые должны быть потом механически сняты.
Это дорогая операция. Если же рамки снабдить кольцами, большими
на некоторую величину по диаметру размера калибра, то избыточный
ток и потребляется этими кольцами, в результате чего получается
равномерное покрытие.
К такого рода «защитным катодам» приходится прибегать также
при хромировании предметов с остриями, например: сверла, резцы,
фрезы и т. п.
На этих «защитных катодах» осаждается значительная часть хро-
ма, но тут не приходится говорить об излишней трате материалов или
тока, так как у упомянутых предметов рабочая поверхность бывает
невелика, и хороший эффект получается только при отсутствии на
остриях дендритов или крупных кристаллов. Надо прибавить еще,
что, пользуясь подобными '«защитными катодами», можно допустить
без риска очень высокие плотности тока. Рамки делаются с таким
расчетом, чтобы они были пригодны для предметов одинакового про-
филя, но различных геометрических размеров; для этой цели один из
поперечных прутков делается передвижным. В процессе хромирова-
ния отверстия на боковых стенках рам должны быть закрыты вин-
тами, в противном случае от постепенного наращивания, в них хрома
они уменьшаются в размере. Кроме того нерационально оставлять от-
верстия открытыми еще и потому, что Ь этих местах уменьшается по-
320
Фиг. 141. Непокрытые
хромом места около
отверстия (обозначены
точками).
перечное сечение и, следовательно, увеличивается сопротивление.
Большие затруднения встречаются при хромировании внутренних
поверхностей. Эти затруднения тем больше, чем меньше диаметр и
чем длиннее отверстие. Если требуется большая точность и равномер-
ность хромового слоя, то необходимо применить внутренние аноды.
Так как последние должны быть строго центрированы и обязательно
изолированы от покрываемого предмета, то их пропускают через эбо-
нитовые пробки и надлежащим образом закрепляют. Пробки не
должны плотно прилегать к стенкам предмета, так как тогда они не
дают выхода выделяющимся газам и препятствуют циркулщщи эле-
ктролита. Дли устранения этих явлений на
пробках прорезают каналы. Если, однако, от-
верстия очень длинны, то эта мера недоста-
точна: электролит быстро обедняется. Необхо-
димо беспрерывно подавать в отверстие све-
жие порции электролита.
Для хромирования широких, но недлин
ных отверстий можно и не прибегать к вну-
тренним анодам. Для большей равномерности
необходимо при этом поддерживать максималь-
но возможное расстояние между электродами,
и наружные стенки, не подлежащие хромиро-
ванию, изолировать.
Вообще говоря, хромирование внутренних
поверхностей, хотя и возможно, но требует
большой затраты времени.
При массовом хромировании однотипных
изделий можно и для этого случая удачно по-
добрать завешивающие приспособления, кото-
рые экономили бы время и давали гарантию
доброкачественного покрытия. Наилучшими
в таких случаях являются рамки с пружин-
ными контактами.
При хромировании полых изделий с отвер-
стием на одной из стенок часто наблюдается, что вокруг этого отвер-
стия остается непокрытый хромом участок. Впечатление такое, что
силовые линии проходят через отверстие к задней стенке, отчего во-
круг отверстия плотность тока становится уменьшенной против других
участков (фиг. 141).
Это явление устраняется путем закрытия отверстия пробкой. В ре-
зультате достигается равномерность покрытия.
Добавим еще, что нельзя завешивать полые изделия так, чтобы
водород не имел возможности свободно удаляться. Скопляющийся
водород мешает осаждаться хрому.
Перечисленными примерами, конечно, не исчерпываются все ва-
рианты, к которым на практике приходится прибегать. Перед тем как
приступить к хромированию каких-нибудь новых образцов, в первую
голову надо подумать, в каком положении они должны висеть в
ванне, какое для них применить завешивающее приспособление, учиты-
вая при этом все изложенные нами моменты. Рамки и те части предме-
тов, которые не подлежат хромированию, изолируются непроводя-
21 Основы гальваностегии 1783 321
щим материалом. Это делается и по соображениям экономии хро-
м)овых препаратов и электрической энергии, а главным образом для
понижения потребляемого ампеража. Нередко хромируемые поверхно-
сти составляют небольшую часть всей поверхности изделий и рамок.
При этом надо различать изоляцию временную и длительную. Под
временной мы разумеем такую, которая должна противостоять дей-
ствию хромовой кислоты и электрического тока в течение 2—4 час.
(максимальный срок процесса хромирования). Такого рода изоляция
может быть осуществлена резиной, резиновым клеем, которым смазы-
вают предметы два или три раза через 15 мин., целлулоидным лаком
(раствор целлулоида в ацетоне или амилацетате), бананским маслом
и специальными сортами цапюн-лака.
Эти изоляционные материалы нельзя считать совершенными; при
длительном пребывании их в ванне, постепенно растворяясь, они за-
грязняют ванну и кроме того затрудняют правильный под-
счет плотности тока. Наиболее идеальной изоляцией являет-
ся стекло, но не всегда оно является практичным. Когда рамки изго-
товлены из меди,, можно отдельные части ее поместить в толстостен-
ные стеклянные трубки. Более практичными и стойкими являются
фарфор и целлулоид. Как нами упоминалось, не подлежат изоляции
те части рамок, которые способствуют равномерному покрытию из-
делий.
3. Твердость и пористость хромовых покрытий
Электролитическое хромирование применяется преимущественно
для повышения твердости поверхности изделий и для защиты основ-
ного металла от коррозии. Условия хромирования*1—плотность тока
и температура — оказывают большое влияние на твердость и пори-
стость хромовых покрытий. В зависимости от цели, преследуемой
хромированием, необходимо выбрать оптимальные условия электро-
лиза. Во многих случаях хромовые покрытия с максимальной твер-
достью отличаются в то же время наибольшим количеством тре-
щин, т. е. они наименее подходящи для защиты основного' металла пт
коррозии.
Сравнительная оценка твердости металлических покрытий вообще,
и в частности хромовых, может быть произведена нанесением черты
сапфировой или алмазной иглой при определенной нагрузке на аппа-
рате Бирбаума или Мартенса. Чем тверже металл, тем уже получается
черта.
В противоположность многим исследователям, утверждавшим, что
электролитически осажденный хром тверже самых твердых сортов
стали, Шнейдевинд установил *, что азотированная сталь тверже элек-
тролитного хрома, что видно из таб#. 74.
Как видно из табл. 74, подвергнутый нагреву хром значительно те-
ряет в твердости. Многие авторы объясняют это явление удалением
при термической обработке покрытых образцов водорода, обусловли-
вающего большую твердость хрома. Это мнение другими авторами от-
вергается. Они считают, что между твердостью хрома и содержанием
водорода в нем нет прямой зависимости. Однако наряду с уменыпе-
1 „Oberflachentechnik", 1, 1933.
322
кием твердости хромированных изделий устраняется также и хруп-
кость их. Можно поэтому считать, что в процессе термической обра-
ботки устраняются упругие напряжения, которые в ряде случаев воз-
никают за счет включенного водорода. То обстоятельство, что устра-
нение хрупкости наблюдается при нагреваний изделий в течение
некоторого времени при такой низкой температуре, как 100—150°,
дает все же основание допускать наличие связи между механиче-
скими свойствами осадков и количеством включенного водорода.
Таблица 74
Твердость хромовых покрытый
Материал Ширина царапины на аппарате Бир- баума Твердость по Моосу Твердость по Бринелю
Азотированная стапь 1,3 8,5 730
Хромовые покрытия 2,0 8,0 —
„ .. нагр. до 325°. 4,8 5,5 —
. . „ „ 1050°. 5,5 4,3 —
К несложной термической обработке хромированных изделий с
остриями настоятельно рекомендуется прибегать. Хромированный ре-
жущий инструмент, не подвергнутый последующей термической об-
работке в процессе эксплоатации, быстро искрашивается вследствие
сильной хрупкости хрома, осажденного на краях и остриях. Несмотря
на некоторое уменьшение твердости, термическая обработка дает по-
ложительный эффект. Проведенная недавно исследовательская ра-
бота на 1-!м часовом заводе в Москве Малышевым А. Н. под руковод-
ством Лайнера В. И. дала достаточно убедительные с этой точки
зрения результаты.
Испытанию подвергались хромированные при различных усло-
виях метчики, фрезы и перовые сверла. Часть этих инструментов не
подвергалась никакой термической обработке после хромирования,
другая часть выдерживалась после хромирования в машинном масле
при различной температуре в течение 30—45 мин. После этого ин-
струмент поступал непосредственно в цех для обработки деталей
карманных часов. В табл. 75 мы приводим данные одной серии
опытов.
Как видно из табл. 75, для данных деталей оптимальными усло-
виями являются: осаждение хрома при 20 А/дм2 и 45° с последую-
щим нагревом при 150°.
При 'проведении серии опытов для выяснения оптимальной тол-,
щины слоя было установлено, что таковой является 6 р. Эти условия
нельзя считать оптимальными для всякого рода режущего инстру-
мента. Необходимо принимать во внимание форму и размеры режу-
щего инструмента, а также природу обрабатываемых изделий и усло-
вия этой обработки.
Во всяком случае, благоприятная роль последующей термической
обработки была установлена на большом количестве инструментов,
работающих в различных условиях.
323
С повышением плотности тока твердость хромируемых осадков
возрастает. Трудно сказать, связана ли эта повышенная твердость с
увеличением абсолютного количества водорода, выделяющегося в еди-
ницу времени (относительно выделяющегося металла количество водо-
рода уменьшается, так как выход тока по металлу возрастает с плот-
ностью тока) или с изменением структуры основного металла. По-
вышенная температура при постоянной плотности тока по данным
ГИПХ влияет в сторону понижения твердости *.
Таблица 75
Влияние термической обработки на твердость хромовых покрытий
О о и 3
и ? сЗ ° -Сн 03 Cw сЗ О< Хф сЗ B'S
Наименова хромнр. инструмен1 * * >> ь и 03 Г? С2и о (D Q, К Еч Л О О < д g.'g» g S S Е й и )ЛИЧ. об] !талей >5 >5 ЕГ « «св *е< w те q Примечание
Е- § Е-1 И ч ,5 & рч О
Метчики 40 10 — 71 3 1,1 Хрупкий хром, быстро искро-
ШИЛСЯ
• 40 10 150 2 122 2,0 Хром стерся
40 10 200 172 2,9
J, 40 1О 280 15 0,4 Мягкий, затупился
» 45 15 — 16 0,4 Хрупкий хром, быстро искро-
ШИЛСЯ
45 15 150 355 5,9 Хром постепенно стерся
- 45 15 200 177 2,8
N 45 15 280 3 0,05 Мягкий, затупился
и 45 20 — 180 3,0 Хром местами искрошился
45 20 150 391 6,5 Хром постепенно стерся
45 20 200 280 4,6
• 45 20 280 55 1,0 Мягкий, затупился
* 50 25- — — — Режущие кромки сильно
пригорели
По данным других авторов температура не оказывает заметного
влияния на твердость электролитического хрома. Это можно видеть из
работы Грант Л. Е. и Гарант Л. Ф.4. Эти авторы подвергали хромиро-
ванию образцы из малоуглеродистой стали в ванне следующего
состава:
СгО3 209 г/л
СгаО3 23 „
Cr2(SO4)3 6,4 .
Перед осаждением хрома образцы покрывались латунью и затем
тонким слоем никеля. Твердость определялась на аппарате Бирбаума
царапанием сапфировой иглой при нагрузке в 3 г,. На каждый образец
наносились две царапины, и для каждой царапины производилось
1 Лапин Н. П. и Гольц Л. Н., Электролитическое хромирование, Госхим-
технздат, 1933.
11 Температура отпуска после закалки для данных инструментов принята
190* С.
8 Нехромированные метчики в среднем обрабатывают 60—65 деталей.
4 .Trans. Am. Electrochem. Soc.', 53, 1928.
324
десять определений. Таким образом полученные результаты пред-
ставляют среднее из двадцати определений. Данные собраны в
табл. 76.
Таблица 76
Влияние плотности тока на твердость хромовых осадков
Плотн. тока А/дм2 Темпера- тура °C Ширина царапины, |* Наличие сетки
максималь- ная минималь- • ная средняя
6,7 30 4,42 3,57 3,92 Отсутствует
13,3 30 3,57 3,25 3,28 Присутствует
20,0 30 3,93 3,46 3,67 Отсутствует
11,1 45 3,25 2,89 3,18
22,2 45 2,46 2,14 2,23 Присутствует
33,3 45 2,21 1,86 1,97
22,2 60 4,07 3,39 3,71 Отсутствует
44,6 60 2,39 2,14 2,30 Присутствует
66,7 60 2.43 1,93 2,15 •
Трещины, которые сообщают хромовым осадкам вид сетки, наблю-
даемой под микроскопом, присутствуют в более твердых и отсут-
ствуют в более мягких осадках. В зависимости от характера сетки, от
Фиг. 142. Сетка трещин в хро-
мовом покрытии при темпера-
туре 60°, плотности тока
66,7 А/5.И3, ув. 500.
Фиг. 143. Сетка трещин в хро-
мовом покрытии при 45°, плот-
ности тока 11 А/5.иа, ув. 1000.
порядка распределения трещин и их количества находится также и
пористость покрытий. В тех случаях, где трещины чаще пересекаются
в толще осажденного металла, вероятнее всего образование сквозных
пор (фиг. 142 и 143).
Пирсоль1 Роберт измерял стойкость хромированных образцов про-
тив истирания на наждачном круге Нортона диаметром 6 см и ши-
1 Pie г sol R., .Trans. Am. Electrochem. Soc.*, 56, 1930.
325
риной ® 6 мм при вращении со скоростью в 3,65 м в минуту. Хро-
мовые осадки были получены на стальных пластинках размером
5 X И см при 49°. Электролит содержал 250 г/л СгОя и з г/л Cr2(S04)3.
Сопротивляемость истиранию определялась по количеству времени,
необходимого для снятия слоя хрома в 0,025 мм. Для того чтобы
исключить _ влияние температуры, повышающейся от трения образца
о наждачный круг, испытания и наблюдения велись с двухсекунд-
ными интервалами. Переменным фактором служила только плотность
тока, причем сопротивление износу хромовых осадков, полученных
при 16,0 К/дм2, принято за единицу (табл. 77).
Таблица 77
Стойкость против истирания хромовых
осадков
Плотность тока Необходимое время для снятия слоя хрома 0,025 мм Относитель- ное сопроти- вление износу
16 о,41 1
31 2,7 6
49 3,8 9
62 17,5 43
78 10,5 26
93 9,7 24
109 94 23
Как видно из табл. 77, сопротивление механическому износу воз-
растает с плотностью ток^ь лишь до определенного максимума, после
чего, с дальнейшим повышением плотности тока, сопротивление меха-
ническому износу падает. На основании этих опытов можно судить,
что твердость и сопротивление механическому износу хромовых осад-
ков зависит от их структуры; последняя же, в свою очередь, зависит
от условий осаждений, главным образом плотности тока.
Выше мы упомянули о наличии связи’ между сетчатой структурой
и пористостью хромовых осадков. По Колыпютеру 1 хромовые осадки
подобно никелевым, сокращаются после того, как они электролитиче-
ски выделены на катоде. Когда хромовые осадки тонки, они обладают
незначительной прочностью, й под влиянием сокращения они дезин-
тегрируют на большое количество мельчайших кусков. С увеличением
толщины хромового слоя прочность осадка возрастает, и он больше не
дезинтегрирует, а разламывается на более или менее большие куски.
В .этом случае на поверхности наблюдаются длинны^ волокнистые
трещины, а не отдельные отверстия. При дальнейшем возрастании
толщины хромового слоя увеличивается вероятность пересеченпя не-
скольким трещин с образованием сквозных пор (фиг. 144).
Беккер и Рент2 определяли пористость хромированных образцов
осаждением на их поверхность меди в ванне, содержащей 1,6 A CuSG(
и 1,6 N H2S04 при 3 А/дм2. Основным металлом служил никель,
1 „Zeitschr. f. Elektrochemie", 33, 1927.
а Baker a. Rente, „Trans. Am Electrnlun. Snc 51, 337. L92s. *;
326
поскольку он применяется чаще других металлов в качестве промежу-
точного слоя (при декоративном хромировании). Медь осаждается при
этом только в порах хромового покрытия, — на хроме медь не выде-
ляется, невидимому, вследствие его пассивного состояния.
Относительная пористость хромовых покрытий определялась на-
гл аз по количеству медных точек. Переменными факторами служили
температура и концентрация электролита. Для каждого случая опре-
делялась максимальная толщина слоя, которая соответствовала ми-
нимальному количеству пор. Для оценки качества покрытий
(с точки зрения пористости) были приняты следующие условные обо-
значения:
прекрасный хромовый осадок, немного пор........А
хороший » , ...................................в
удовлетворительный „ ..........................С
плохой хромовый осадок, много пор..............D
очень плохой осадок, очень много пор...........Е
На фиг. 145 видно, что в стандартной ванне (250 г/л Сг03
и 2,5 г/л H2SO4) с повышением температуры до 55° пористость умень-
шается, после чего она вновь возрастает. С повышением температуры
необходимо повысить толщину слоя для получения минимального
количества пор. При 55° получается прекрасный осадок, но минимум
пор лежит при толщине слоя, в два раза превышающей таковую для
температуры 45°. Пористость понижается также с увеличением кон-
центрации хромовой кислоты, но и в данном случае необходимо уве-
личить толщину слоя для получения минимума пор (фиг. 146).
Распределение пор, определяемых по осаждению меди, дает пред-
ставление о структуре хромовых осадков. В тонких слоях поры рас-
пределены беспорядочно по всей поверхности, в более толстых слоях
они группируются по каким-то определенным линиям, в еще более
толстых слоях точки группируются по 4—5 на линии (фиг. 147). На
отдельных линиях наблюдается 12—20 таких группировок.
В отдельных местах линии разрываются, от них отходят другие,
более короткие линии, которые, пересекаясь, образуют узлы или
пучки.
На основании полученных данных Бекер и Рент приходят к сле-
дующим выводам:
1. При соблюдении надлежащего соотношения между концентра-
цией хромовой кислоты и сульфатов пористость (при 45°) умень-
шается по мере увеличения концентрации электролита.
2. В стандартной хромовой ванне (250 г/л Сг03) минимальная
пористость достигается при 55°; оптимальная толщина хромового
слоя, с точки зрения минимума пор, равна 0,0009 мм. Удовлетвори-
тельные результаты могут быть получены также при толщине хро-
мового слоя'окЪло 0,0003 лад в пределах температур между 40 и 60°'.
3. По мере повышения концентрации электролита и температуры
необходимо для получения минимума пор повысить также толщину
слоя хрома.
4. Хромирование с промежуточными прослойками
Поскольку хром сам по себе не представляет надежной защиты
железа и его сплавов от коррозии, прибегают к комбинированному
327
Фиг. 144. Сетча-
тая структура
хромовых по-
крытий. В ме-
стах пресече-
ния нескольких
трещин образу-
ются сквозные
поры, в кото-
рых протекает
коррозия основ-
ного металла,
ув. 1000.
Фиг. 145. Влияние температуры иа пористость
хромовых покрытий.
Фиг. 146. Влияние концентрации СгО3 на пори-
стость хромовых покрытий.
328-
Фиг. 147. Пористость хромовых
покрытий, обнаруженная эле-
ктроосаждеиием меди на по-
верхность.
покрытию .никелем и хромом, или многослойному покрытию: никель—
медь — никель—хром.
Такая комбинация из промежуточных прослоек применяется чаще
других, повидимому, по той причине, что декоративное хромирование
явилось придатком к широко распространенному ранее процессу ни-
келирования. С теоретической точки зрения никель ни в коем случае
не может быть признан идеальной прослойкой под хром.
Известно, что никель имеет большую склонность к отслаиванию
вследствие поглощения значительного количества водорода. Очень
часто этот недостаток проявляется в хромовой ванне, когда отслаи-
вается металлический хром вместе с нижележащим слоем никеля.
Многими исследователями доказано, что причина в таких случаях
кроется именно в недоброкачественном никеле, а отнюдь не в* хро-
мовой ванне. Можно указать и на другой весьма существенный не-
достаток никеля при применении его в качестве прослойки под
хром — на незначительное перенапряжение водорода на никеле. По-
следнее обстоятельство весьма затрудняет хромирование изделий не-
правильной формы.
Херинг и Барроус1 показали, что «рабочий интервал» (plating
range') больше на меди и латуни, чем на никеле и стали. Табл. 78 ил-
люстрирует это положение.
Таблица 78
Рабочая диаграмма хромовой ванны, содержащей 250 г л CrOs и 2,5 г/л IL SO
Катодный мате- риал Темпера- тура °C Отноше- ние плот- ности тока Наилучшая средняя плоти, тока А/^2 Приблизит, средн, вы- ход тока Время, необходи- мое для получения слоя в 0,005 мм в минутах
Сталь или никель 35 2,5 3,5 7 255
40 2,5 6,5 10 96
45 2,6 10,5 12 50
50 2,7 16,0 13 30
55 2,6 21,5 14 21
Медь или латунь 35 2,6 7,5 11 76
40 3,1 11,0 13 44
45 4,7 20,0 15 21
50 5,11 25,0 17 15
Никель электр. 35 3,2 6,0 9 116
40 3,2 1",5 12 50
45 2,7 15,5 14 29
50 2,4 22,0 15 19
Из этой таблицы мы видим, что для 45—50° рабочий интервал
почти вдвое больше на медном и латунном катоде, чем на стальном и
никелевом.
В своих выводах авторы подробно останавливаются на влиянии
1 .Technolog. Paper of the Bureau of Standards*, 346, 1927.
329
катодной поверхности при хромировании предметов сложной формы
и, между, прочим, говорят: «Предметы неправильной формы с низким
перенапряжением водорода, например стальные (также и никелевые),
могут быть более совершенно покрыты блестящим слоем хрома, если
они предварительно покрыты слегка слоем другого металла с более
высоким перенапряжением водорода, например медью».
Патентная литература, касающаяся промежуточных прослоек при
хромировании, весьма пестра1. Мы здесь упомянем лишь о некото-
рых патентах, чтобы показать, насколько этот вопрос требует спе-
циального разрешения, применительно к каждой конкретной об-
становке.
По патенту Humphries С. Н. 2 применяются две прослойки: первая
из электроотрицательного металла относительно железа, вторая из
электроположительного металла по отношению к первой прослойке и
к хрому, например кадмий и медь. Тот же автор в другом патенте3
рекомендует промежуточный слой из одной только меди.
Германский патент Electro-Chrom. Gesellschaft4 № 458632 рекомен-
дует прослойки из кадмия, свинца или цинка.
Langbein-Pfanhauser-Werke 5 рекомендует применять двойной
промежуточный слой: металл, легко сплавляющийся с кадмием, на-
пример цинк или олово, и поверх него металлический кадмий.
По английскому патенту «Metrpol-Vickers Electr. С°»6 приме-
няется промежуточный слой из кобальта или меди и кобальта.
«Farbenindustrie» 7 применяет никелевую прослойку. После хроми-
рования следует нагревание в нейтральной среде в вакууме.
Для того чтобы обосновать целесообразность той ийи иной про-
слойки, под хром, мы пытались применить предложенную Г. В. Аки-
мовым теорию многоэлектродного элемента8 9.
Еще в 1929 г. мы столкнулись в электрохимической лаборатории
Института цветных металлов с аналогичным вопросом при изыскании
прослоек для железа, подлежащего серебрению °. В поисках металлов,
которые делают железо катодом в контакте с медью и серебром, нами
были испытаны цинк и кадмий, но В обоих случаях (наличие цинка
и кадмия) железо оставалось анодом, т. е. корродировало. Испытания
велись в водопроводной воде.
Когда мы железо покрываем никелем и хромом или медью, нике-
лем и хромом, то никакого сомнения нет ц том, что железо остается в
данной системе анодом; речь будет итти, следовательно, лишь о «ме-
ханической» защите железа. Если же мы железо покроем цинком и
хромом или цинком, медью и хромом, то вопрос о полюсности железа
в данной системе может быть решен лишь электрохимическими изме-
1 См.. „Korrosion und Metallschutz“, Apr.,' 1931.
2 USA, Pat. № 1614303.
3 USA, Pat. № 1651278.
4 DRP, № 458632.
5 DRP, № 433037.
* Brit. Pat. № 259363.
’ Brit. P. № 303034, опубл. 27/XII, 1928 r.
8 Коррозия металлов. Сборник статей под редакцией Изгарышева Н. А.
я Топольницкого П. К, 1931.
9 Лайнер В. И. и Глоба Т. В., Замена никелевой прослойки медной при
хромировании. ЦИТЭИН, 85, 1934.
330
рениями в интересующей нас среде, так как известно, что ряд напря-
жений действителен лишь при нормальной концентрации ионов дан-
ного металла и отсутствии явлений пассивирования.
Применительно к многослойным металлическим покрытиям можно
следующим образом пользоваться теорией многоэлектродного эле-
мента *. Пусть основной металл (железо) последовательно покрыт цин-
ком, никелем и хромом, причем в интересующей нас среде пип к
является наиболе электроотрицательным из этих металлов, а хром
наименее отрицательным. Тогда полюсность основного металла в дан-
ной системе определяется следующим выражением:
(Ере--Ezn)---(Есг --Ер,.).
Когда эта разность больше нуля, железо в данной системе являет-
ся анодом, и оно электрохимически не будет защищено от коррозии.
Проведенные нами в этом направлении измерения потенциалов р
растворах поваренной соли, соды и в водопроводной воде показали,
что наблюдается именно такое соотношение. Это' положение было
подтверждено также испытанием на сопротивление коррозии покры-
тых таким методом железных образцов.
Железо не будет катодом, если предварительно осадить на него
цинк, а затем хром, не говоря уже о том, что на цинке трудно, если не
невозможно, получать блестящие хромовые покрытия и что вслед-
ствие пористости последних цинк начинает быстро разрушаться я
продукты коррозии вызывают отслаивание хрома. С этой точки зре-
ния кадмий является более благоприятным объектом, однако, и с ним
результаты нами были получены не совсем удовлетворительные.
Таким образом остается говорить только о «механических» или
катодных покрытиях. Помимо широко применяемого для этих целей
никеля можно говорить о меди. Проведенные нами в этом направле-
нии опыты показали, что в случае получения беспористых медных
осадков можно добиться таких же, если не лучших, результатов, как
и с никелевой прослойкой.
Недостатком меди, по сравнению с никелем, является то обстоя-
тельство, что медные или омедненные изделия реагируют с хромовой
кислотой. Это заставляет завешивать изделия под током и соблюдать
ряд других предосторожностей.
В то же время медь является более доступным и более дешевым
металлом, чем никель, и учитывая перечисленные выше преимуще-
ства меди при осаждении на его поверхность хрома, можно рекомен-
довать в определенных случаях применять относительно толстые
(0,02—0,025 ми), беспористые медные прослойки.
Когда в качестве прослойки применяется один никель, толщина
ейо слоя должна быть не меньше, чем 0,01 мм, более надежные ре-
зультаты получаются при толщине в 0,025 мм. Вместо одного никеля
лучше применять омеднение с последующей никелировкой. Это
объясняется тем, что никелировать омеднённые изделия лучше, чем
железные или стальные: никель тогда содержит меньше водорода и
более эластичен. Суммарная толщина прослойки при этом может
остаться той же, так-например, 0,0075 мм меди и 0,0175 мм никеля.
1 А ким о в Г.
331
Наконец,, наилучптие результаты дают: никель—'медь— никель'—
уро|м в таких сочетаниях:
никель................................0,0045 мм
медь...........0,0075 „
никель.........0,0090 „
хром ...... 0,00'125—0,00050 мм
При этом рекомендуется медь полировать, не говоря, конечно, о
никеле, лежащем под хромом, который надлежит обязательно и очень
тщательно полировать.
Не надо приводить никаких теорий, чтобы доказать, что тройная
прослойка лучше двойной, а последняя лучше одинарной. Ясно, что
чем больше слоев, тем меньше вероятности оголения самого железа,
а ведь только этого и надо добиваться. Конечно, тут есть и соображе-
ния другого порядка; омеднять железо или сталь в кислой ванне
нельзя (имея в виду беспористый мелкокристаллический, хорошо при-
стающий осадок), в то врем как предварительно частично отникели-
рованные изделия можно омеднять в кислых ваннах, и кроме того
никель, осажденный на меди, имеет преимущества перед никелем,
осажденным непосредственно на железе.
Невольно возникает вопрос: зачем при такой многократной стра-
ховке еше дополнительно хромировать, да и при том, какова может
быть роль хрома при такой незначительной толщине? Здесь выступают
большие преимущества как химические, так и механические, кото-
рые хром имеет по сравнению с другими металлами. В то время как
никель со временем тускнеет, хром сохраняет свой блестящий вид,
практически не меняя его, пока «живут» покрытые им изделия. Хром
не боится резких температурных колебаний, действия различных га-
. зов и т. п. Наконец, хром, хотя и в тонких слоях, значительно тверже
никеля, благодаря чему он предохраняет изделия От истирания.
А ведь мы знаем, что многие никелйрованные изделия, находящиеся
в частом соприкосновении с человеческой рукой, довольно часто
истираются (ручки в трамвайных Вагонах, части пишущих машин,
швейных машин и т. д.).
Нет смысла осаждать толстые слои хрома, так как эксперименталь-
но, доказано, что его защитные свойства, несколько возрастая в пре-
делах от 0,00025 до 0,0005 мм, порле 0,00067 мм заметно падают, так
как увеличивается пористость его. И все же при такой незначитель-
ной толщине хромоного слоя химическая стойкость покрытых им
изделий (в комбинации с другими покрытиями) увеличивается боль-
ше чем вдвое. Уместно здесь прибавить, что сам хром приобретает
наиболее приятный цвет, когда он осажден на никель. Удорожание
процесса металлического покрытия при дополнительном хромирова-
нии никелированных изделий весьма незначительно.
При практическом проведении такого рода комбинированного по-
крытия необходимо соблюсти ряд предосторожностей, и в. первую
голову они относятся к никелевым ваннам. Известно, что никелевые
осадки в зависимости от кислотности, плотности тока, состава эле-
ктролита и других факторов содержат большее или меньшее количе-
ство водорода "(или окислов). Еще ib большей степени это относится к
хромовым осадкам. При хромировании водород частично диффундирует
в никель; если слой последнего очень мал или в нем было заранее
332
большое Количество водорода, то осадок разрывается И отслаивается
вместе с хромом. Многие ® таких случаях склонны искать причину
в неисправности хромовой ванны, между тем как исключитель-
ное внимание надо уделять никелевым ваннам. Прежде всего не-
обходимо' поддерживать кислотность, установленную для данных ра-
бочих условий. Электролит сам по себе и условия осаждепия должны
быть такими, чтобы возможно было получать никелевые осадки с
минимальным содержанием водорода и окислов.
5. Вентиляция
Процесс хромирования протекает с незначительным выходом тока
по металлу. Значительная часть тока тратится на газообразование —
выделение водорода на катоде и кислорода на аноде. Так как про-
цесс при этом протекает при очень высоких плотностях тока, то газы
выделяются настолько интенсивно, что они увлекают с собой ча-
стицы электролита в распыленном виде, создавая над ванной туман.
Помимо того, что при этом уносится значительная часть ценного
электролита, создается невозможная обстановка как для обслуживаю-
щего персонала, так и для лиц, находящихся вблизи или случайно
соприкасающихся с хромовыми установками.
Вопрос этот занимает умы многих изобретателей, и много патен-
тов заявлено применительно к обезвреживанию процесса хромирова-
ния. Например, по патенту Фрида Бласберга, на поверхности электро-
лита находится несмешивающаяся с ним жидкость «Chromprotekt»
не горючая и не взрывчатая, способная поглотать все выделяющиеся
газы и тем самым делающая атмосферу безвредной.
Общая вентиляция, хотя бы и мощная, неудовлетворительна, так
как содержание незначительных примесей хромовой кислоты в воз-
духе болезненно отражается на работающих и на тех, кто так или
иначе соприкасается с хромовыми ваннами. В настоящее время хро-
мовые ванны почти везде вентилируются отсасыванием брызг
электролита в щели, расположенные почти у самых бортов ванны
(фиг. 148).
Ниже приводим краткие выдержки1 из специального обследова-
ния Американским отделом здравоохранения ряда установок для
хромирования2.
1. Естественная вентиляция весьма редко способна удалять брызги
и испарения хромовой кислоты, появляющиеся в процессе хромиро-
вания.
2. Вертикальная вентиляция, применяемая в химических про-
цессах, не соответствует цели, ибо хромовые испарения проходят на-
встречу работающему у ванн.
3. При помощи соответствующей системы щелевой вентиляции,
при надлежащей скорости прохождения воздуха, возможно снизить
содержание хромовой кислоты ниже 1 мг на 10 м3 воздуха.
4. Непрерывный, ежедневный контакт с хромовой кислотой
1 Более подробно см. Лайнер В. И., Хромирование металлов, Цветметиз-
дат, 1932.
2 Bloomfied a. Blum, Healtlv Hazards in chrom. Plating, 1930.
333
концентрации выше 1 мг на 10 м3 определенно вреден для носовых
тканей работающих.
5. Наиболее эффективным методом вентиляции Является боковая
(вытяжка воздуха поверх ванн к вытяжным протокам шириной
25*—-50 мм, протянутым по всей длине Ьдной или нескольких сторон
ванны.
6. - Для большей эффективности не следует допускать, чтобы воз-
дух вытягивался через проток на боковом расстоянии свыше 450 мм.
У более широких ванн делают два протока с каждой стороны или два
протока в центре.
Фиг. 148. Ванна для хромирования с
щелевой вентиляцией.
7. Уровень раствора дол-
жен быть по крайней мере на
200 мм ниже поверхности ван-
ны, а проток должен быть на
уровне поверхности бака.
8. Для эффективной вен-
тиляции необходимо, чтобы
скорость прохождения воздуха
в протоке достигала 700 м в
минуту.
9. Ванна может быть за-
щищена створчатыми крышка-
ми, предохраняющими от
сквозняков из открытых окон
или вентиляторов.
10. Работающие должны принимать меры предосторожности про-
тив повреждений носовых тканей, смазывая их по нескольку раз
в день вазелином или ментолом.
11. По возможности необходимо ввести в употребление резиновую
обувь, перчатки и передники для предохранения потрескавшейся
кожи от соприкосновения с хромовой кислотой.
12. Если рабочие не пользуются перчатками, необходимо часто
мыть руки водой и смазывать все порезы и ссадины смесью из трех
частей вазелина и одной части ланолина.
13. Полы по соседству с ваннами должны часто мыться.
14. Рабочие должны часто подвергаться медицинскому осмотру
S3*
с быстрым излечиванием маленьких накожных поражений и повре-
ждений в области носа.
6. Снятие хромовых покрытий
К смятию хромоьых осадков приходится прибегать во многих слу-
чаях. Хромированные калибры, пришедшие в негодность вследствие
износа (полного или частичного) покрытия или его отслаивания,
должны быть перед вторичным покрытием освобождены от остатков
хрома на них.
Хром должен быть удален также и в тех случаях, когда он вслед-
ствие изменения состава электролита или несоблюдения надлежащего
режима получился «загорелым», сильно матовым или неудовлетво-
рительным по другим признакам.
Наконец, хром удаляют с поверхности покрываемых изделий при
определении толщины слоя покрытия.
С латуни и никеля хром может быть удален в теплой соляной
кислоте (1 объемная часть концентрированной НС1 на 9 частей воды).
Если обрабатывать хромированные изделия при комнатной тем-
пературе b 90% H2S04 с переключающимся током, то хром может быть
удален вместе с никелем.
С жедава и стали можно удалить хром по одному из изложенных
выше вариантов, а также в 5—6% растворе щелочи, установив хро-
мированные изделия в качестве анодов»; катодом может служить
свинец.
Для количественного определения хромового осадка можно поль-
зоваться разбавленной соляной кислотой (5%) при 50°; при этих
условиях медь и латунь переходят в' раствор Ь ничтожных коли-
чествах. ;
Если основной металл состоит из стали, то анодная обработка
в щелочи может служить количественным методом определения хро-
мового осадка на данной поверхности. При снятии хрома соляной
кислотой с железа и его сплавов, алюминия и цинка необходимо
аналитически установить количество растворившегося хрома, так как
наряду с последним может растворяться также и основной металл.
7. Методы анализа хромовых ванн
Главными компонентами хромовых ванн являются хромовая кис-
лота и сульфаты, а также трехвалентные соединения хрома. По-
скольку преобладающим компонентом электролита является хромо-
вая кислота, можно для приближенных анализов определять кон-
центрацию по удельному весу (фиг. 149). Для точного анализа реко-
мендуется метод, опубликованный в Бюллетене № 346 (1927 г.) Бюро
стандартов в Вашингтоне.
В электролите могут со временем накапливаться также и примеси
других металлов — железа, меди, цинка, никеля — главным образом
за счет взаимодействия электролита со стенками ванны, с токопод-
водящими шинами, со случайно упавшими с подвесок изделиями
335
Уд Вес 1,05 UO U51,201,251301,351,401,45
Фиг. 149. Удельный вес хромовых электролитов.
•И т. д. Поэтому в некоторых случаях Прибегают к' более Полному ана-
лизу электролита.
Определение CrVIn Сгш.Для производства анализа необхо-
димо приготовить следующие растворы:
1. Раствор бихромата — точно 5,884 г, измельченного в порошок
и перекристаллизованного К2Сг2О7 (х. ч.) растворяется в воде и раз-
бавляется до 1 л. Раствор соответствует 0,0400 моля Сг03.
2. Соль Моора.— приблизительно" 40 г FeS04(NH4)2S04.6Н2О и
75 ел8 H2S04 (уд. в. 1,84) растворяется в воде и разбавляется до 1 л.
Титр этого раствора должен быть проверен непосредственно перед
употреблением.
3. Перманганат — при-
близительно 3,2 г (х. ч.)
КМпО4 растворяется; в
воде и доводится до 1 л.
4. Сернокислый мар-
ганец — приблизительно
1 г MnSO4.4Н2О раство-
ряется (в 100 еле3 воды.
5. Азотнокислое сере-
бро— 2,5 г AgNO3 рас-
творяется (В 1 л воды.
6. Персульфат аммо-
ния— около 10 г (NH4)2
S2O8 растворяется ь
100 C.W,8 холодной воды.
Этот раствор легко разла-
гается и должен быть при-
готовлен непосредственно
перед пользованием.
Определение CrVI
заключается в "восстано-
влении СгУ1до Сг111 из-
бытком титрованной соли
Моора и обратным отги-
тровыванием перманганатом соли, не пошедшей на восстановление.
Объем сульфата железа, фактически потребный для восстановле-
ния CrVI, и общее «содержание Сг03, находящегося в ванне, могут
быть легко вычислены. Прежде ваего вычисляют количество соли
Моора, эквивалентное раствору перманганата. Разбавляют 25 см3
FeS04(NIl4)2S04 • бН20 в 300 см3 воды и выливают в стакан на 600 см3,
куда добавляется 25 см3 концентрированной П2^О4. Этот раствор
титруется перманганатом до первого появления ярко розового окра-
шивания, не пропадающего в продолжение одной минуты.
Соль Моора затем устанавливается по стандартному раствору
бихромата. 25 сма последнего, эквивалентные точно 0,001 молярности
раствора или 0,1 'г СгО3, разбавляется до 300 сл3 и прибавляется
25 см* концентрированной H2S04. По охлаждении до комнатной тем-
пературы добавляется 50 см? соли Моора (которых достаточно для
восстановления CrVI), и избыток оттитронтвается перманганатом до
получения окрашивания, не пропадающего в течение одной минуты.
336
Хотя| цвет раствора несколько маскируется, но конец титрования
мржет быть установлен легко. Поправка для объема перманганата,
необходимого для полного титрования, может быть установлена ки-
пячением раствора в течение 10 мин. (для разрушения избытка
КМпО4), после чего раствор охлаждают до комнатной температуры и
опять титруют до конца. Небольшой объем КМпО4, потребный второй
раз для получения окраски, за вычетом его из объема, пошед-
шего первый раз, дает истинное количество КМпО4, эквивалентное
избытку соли Моора. Фактически потребное количество соли Моора
для восстановления CrYI и, следовательно, эквивалентное количество
соли Моора в молях может быть легко вычислено. Если ванна, под-
лежащая анализу, содержит приблизительно 2,5 мол. Сг03, удобно
брать для пробы 0,5 с.и3 (0,001 Л’). Такая проба может быть получена
разбавлением 10 см3 раствора до 0,5 л и отбиранием 25 см3. Моляр-
ность общего количества в ванне равна двукратному количеству
молей СгО3, найденных в пробе.
Определение Сг1П заключается В окислении его до CrVI и
титровании всего количества CrVI. Сг111 находится вычетом из коли-
чества, найденного при окислении, нормальность равна трехкратной
разности молярности СгО3. Проба берется такого же объема, как и для
определения CrVI, и разбавляется до 300 см3. Берется приблизи-
тельно 25 см3 концентрированной H2S04, добавляется несколько ка-
пель MnS04, и раствор доводится до кипения. (Рекомендуется вво-
дить бусы.) Добавляют 10 см3 AgN03 и после 20 см3 (NH4)2E208. Пол-
ное окисление узнается по образованию МпО4. Если этого нет, надо
добавить персульфата. Раствор кипятится 10 мин., затем прибавляют
5 см3 НС1 (1 :3), после чего продолжают кипятить, пока не исчезнет
окраска После охлаждения до комнатной температуры титруют Crv,
как раньше. Разница между количеством молей СгО3 найденная
при титровании окисленной и неокисленной пробы, умноженная на 6,
. равняется нормальности трехвалентного хрома.
Определение S04. Анализ может быть сделан путем осажде-
ния ВаС.12 в присутствии НС1, препятствующей образованию ВаСгО4.
Однако трудно получить BaS04, свободный от следов хромата, и по-
этому предлагается следующий метод.
Если подлежащая анализу ванна приблизительно содержит 0,05 N
S04, то удобно брать для пробы 10 см3 раствора. После разбавления
до 125 см3 прибавляются 10 см3 НС1 (уд. в. 1,18) и 10 см3 этилового
спирта. Раствор кипятится, пока не удалится избыток алкоголя и
образуется альдегид. Затем осторожно прибавляется 10 см3 5%. рас-
твора ВаС1э • 2Н,0 и кипятится в течение 5 мин. После отстаивания
в теплом месте В течение нескольких часов раствор фильтруется,
осадок промывается, высушивается и взвешивается, как BaS04. Вес
BaS04 в 10 см3 раствора, разделенный на 1,167, дает нормаль-
ность S04.
Определение Си. 10 см3 раствора наливают в стакан на
400 см3 и разводят водой примерно до 200 см3. Нагревают до кипения
и приливают избыток насыщенного раствора азотнокислого свинца.
Убедившись Bi полноте осаждения, отфильтровывают осадок и хо-
рошо промывают горячей водой.
337
22 Основы гальваностегии 1783
Полученный осадок хрдмокйслогб свйпца выбрасывают как йё-1
нужный. Фильтрат обрабатывают перекисью натрия до щелочной;
реакции и вводят небольшой избыток перекиси. Кипятят несколько,
минут и фильтруют, хорошо промывая осадок горячей водой.
Фильтрат сохраняют для определения цинка. Осадок растворяют
в небольшом количестве горячей соляной кислоты и повторяют обра.-
ботку перекисью натрия для полного удаления следов хрома. Промы-
вают осадок горячей водой и еще раз растворяют в горячей разведен-
ной соляной кислоте. Приливают 10 см3 концентрированной серной
кислоты и выпаривают до начала выделения белых паров. Разба-
вляют водой примерно' до 75 см3 и оставляют в покое для оседания
сернокислого свинца. Отфильтровывают сернокислый свинец, промы-
вают разведенной серной кислотой и пропускают через фильтрат
сероводород для осаждения сернистой меди. Осадок меди отфильтро-
вывают и сохраняют фильтрат для последующего определения же-
леза, никеля и цинка. Сернистую медь растворяют в азотной кислоте'
и определяют медь электролизом.
Определение Fe. Фильтрат после отделения сернистой меди
кипятят для удаления сероводорода. Окисляют раствор несколькими
кубическими сантиметрами азотной кислоты. К раствору прибавляют
3—4 см3 хлористого аммония и небольшой избыток аммиака. Нагре-
вают раствор до кипения и через несколько минут отфильтровывают
осадок гидрата окиси железа через плотный фильтр, промывая тща-
тельно горячей водой. Фильтрат сохраняют для последующего опре-
деления- никеля и цинка. Железо можно определять или весовым спо-
собом после прокаливания гидрата окиси, или объемным, после рас-
творения ® серной кислоте.
Определение Ni. Фильтрат после отделения гидрата окиси
железа подкисляют слегка уксусной кислотой, нагревают до кипения
и приливают раствор диметилглиоксима в избытке. Нейтрализуют
раствор аммиаком, отфильтровав осадок через тигель Гуча, высуши-
вают и взвешивают.
Определение Zn. Фильтрат после обработки перекисью натрия
при определении меди соединяют с фильтратов после отделения ни-
келя, подкисляют серной кислотой, приливая избыток, в количестве
около 10 см3. Выпаривают до нужного объема и определяют цинк ве-
совым путем в форме фосфорнокислой соли.
ГЛАВА’ДЕВЯТАЯ
ЭЛЕКТРОЛИТИЧЕСКОЕ ЛУЖЕНИЕ
Олово относится к разряду катодных покрытий, и железо оказы-
вается им защищенным от коррозии лишь при отсутствии оголенных
мест, в противном случае олово ускоряет процесс коррозии железа.
Тем не менее оловянные покрытия имеют широкое применение, и
производство белой жести — луженого железа — представляет боль-
шую и самостоятельную отрасль промышленности. Широкое приме-
нение оловянных покрытий обусловлено их химической стойкостью и,
главным (образом, безвредностью оловянных соединений, переходящих
в раствор в процессе изготовления или приема пищи. В силу этого
обстоятельства оловянные покрытия широко применяются для молоч-
ной посуды, пищеварных котлов, мясорубок, консервных банок и т. д.
Олово хорошо противостоит действию серы, поэтому лужение и при-
меняется также перед вулканизацией изоляции проводов.
На воздухе при обычных температурах олово не окисляется, со-
храняя красивый серебристый цвет, поэтому Во многих случаях оло-
вянные покрытия применяются и для чисто декоративных целей,
иногда с последующей окраской методом оксидирования.
К положительным свойствам оловянных покрытий, нанесенных
как на железо, так и на медь, следует отнести хорошее сцепление
между покрытием и основным металлом, поэтому луженая жесть мо-
жет быть подвергнута глубокой штамповке или другим механическим
воздействиям без опасения отслаивания покрытия от основного ме-
талла.
Другой особенностью олова является его низкая температура
плавления (231,8°), почему сравнительно легко удается покрытие
оловом горячим методом. Последний метод применялся еще издавна
и в настоящее время является доминирующим. В то же время метод
горячего лужения, как и вообще горячие методы покрытия, не эконо-
мичен. Лишь в самое последнее время электрохимические методы лу-
жения начинают завоевывать большие производственные участки, в
то время как раньше они применялись только для готовых изделий
и притом неответственных и в небольших размерах. Главные затруд-
нения, которые электролитический метод должен преодолевать для
того, чтобы он мог конкурировать с горячим методом, лежат в улуч-
шении качества покрытий — получении плотных покрытий с
минимальным количеством пор в тонких слоях ив
ускорении процесса, т. е. в максимальном повышении плот-
ности тока и механизации процесса. Шлеттер описывает установку, в
* 339
которой ему удалось Преодолеть эти затруднения й получать в одном
агрегате один луженый лист железа в каждые 40 сек. при хорошем
качестве покрытий. Детали этой установки как в технологической,
так и конструктивной части, к сожалению, не сообщаются.
Из растворов простых солей олово в отсутствии специальных до-
бавочных агентов кристаллизуется на катоде в неудовлетворительной
форме. Для щелочных электролитов характерным является образова-
ние губчатых осадков, для кислых — образование отдельных, не свя-
занных между собой кристаллов. К преимуществам кислых ванн от-
носится большая скорость процесса, так как олово находится в них в
Двухвалентной форме, в то время как в щелочных олово преобладает
в четырехвалентной форме: за 1 Ah в кислых ваннах при 100% вы-
ходе тока выделяется 2,2 г олова, а в щелочных соответственно 1,1 г.
Если к тому же учесть что в кислых ваннах допускается значительно
ббльшая плотность тока, чем в щелочных, — примерно в 6—8 раз
больше, — и что выход тока В щелочных ваннах даже при самых низ-
ких плотностях тока едва достигает 60%, в то время как в кислых
он превосходит 90%, то станет ясным, что с точки зрения форсирова-
ния процесса следует безусловно предпочтение отдать кислым ваннам.
Преимущества щелочных ванн заключаются в их лучшей рассеи-
вающей способности, с чем особенно приходится считаться при по-
крытии изделий со сложной формой. Затем оловянные покрытия, по-
лученные в щелочных ваннах, имеют очень тонкую структуру. Глав-
нейшим недостатком щелочных ванн является (помимо перечислен-
ных выше) их неустойчивость и пассивирование анодов.
Необходимо отметить, что как в щелочной, так и в кислой среде
олово может находиться в виде двух- и четырехвалентных соедине-
ний. Почти всегда удается получать удовлетворительные в структур-
ном отношении катодные осадки только в том случае, когда в элек-
тролите присутствуют ионы одной валентности, высшей или низ-
шей, ионы другой валентности могут присутствовать только в не-
значительных количествах. С этим фактом приходится считаться при
проведении процесса электролитического лужения, особенно учиты-
вая способность анодов к пассивированию.
1. Щелочные оловянные ванны
Несмотря на ряд существенных недостатков, присущих щелочным
электролитам, последние и в настоящее Время имеют широкое рас-
пространение при покрытии готовых изделий, главным образом бла-
годаря лучшей рассеивающей способности их, по сравнению с кис-
лыми. Толщина слоя олова, осажденного в щелочных ваннах, обычно
ничтожно мала и измеряется микронами. Тем не менее уже в таких
тонких слоях покрываемое изделие приобретает красивый внешний
вид. Для получения более толстых слоев олова в щелочных ваннах
длительность процесса измеряется часами, так как допустимая плот-
ность тока весьма ограничена и выход тока (рассчитанный по 8п *''
значительно меньше 100%. Кроме того из щелочных ванн олово име-
ет тенденцию .выделяться в виде губчатых осадков, поэтому приходит-
ся периодически вынимать изделия из ванны, промывать и вновь за-
гружать в ванну. Считают, что осадки становятся губчатыми в при-
340
сутствии большого избытка щелочи в электролите (невидимому,
вследствие образования более прочных комплексов и уменьшения
допустимой плотности тока), однако с точки зрения лучшего анодного
растворения избыток свободной щелочи необходим.
Для приготовления щелочных оловянных ванн чаще всего исходят
из двуххлористого олова, растворяя его в едкой щелочи. При этом
должен образоваться станнит, т. е. соединение двухвалентного олова:
SnCL + 2NaOH = Sn(OH)2 + 2NaCl,
Sn(0H)2 + 2NaOII = Na^SnO, + 2H20.
Эти соединения, однако, нестойки и имеют тенденцию к окисле-
нию, следовательно, практически выделение олова на катоде происхо-
дит из его- четырехвалентных соединений.
Имеющиеся в электролите хлориды не оказывают отрицательного
влияния на качество катодных осадков, — в то же время они в состоя-
нии несколько парализовать пассивирование анодов. Неустойчивость
является наиболее существенным недостатком электролитов, приго-
товленных из двухвалентных соединений олова. В щелочном растворе
станнита наблюдается самопроизвольное выделение металла. Такое
явление объясняется большим стремлением ионов высшей валентно-
сти к комплексообразованию, в связи с чем потенциал ионов с низ-
шей валентностью (наиболее способных к восстановлению) в щелоч-
ной среде оказывается значительно отрицательней, чем в кислой.
В растворе, содержащем 0,44 г атома Sn" в виде станнита и з V
NaOH, потенциал олова равен при 18°—0,906V; в том же растворе
станнита и щелочи, но в присутствии .0,024 г атома Sn”” В виде стан-
нита на свежеприготовленной поверхности платины возникает окисли-
тельно-восстановительный потенциал — 0,875V, т. е. менее отрица-
тельный, чем предыдущий, и металлическое олоВо не должно было бы
при этом выделяться. Однако при недельном стоянии, и особенно при
нагревании, начинает выпадать металлическое олово (хотя бы и без
доступа воздуха). Большая часть двухвалентного олЬва при этом
исчезает за счет реакции:
2Sn" —> Sn + Sn"",
и потенциал eSn Sn -, как и eSn.. _, Sn--, получает значение
— 0,94V.
Переход Двухвалентного олова в четырехвалентное до равенства
потенциала eSn__>sn- и окислительно-восстановительного потенциала,
определяемого уравнением:
____________RT, КОП-
eSn --*Sn 2Fln_C^“ ’
(что должно наблюдаться при равновесии) возможен только в том слу-
чае, когда Csir- убывает В растворе в большей степени, чем Csn-
Так как, однако, в растворе кроме металлического олова ничего не
выделяется, то это, 1вероятно, возможно за счет образования трудно
растворимой коллоидной оловянной кислоты, которая смещает равно-
весие в сторону исчезновения Sn" .
Sn""4-60H' + 2Na 5=± 2Na + SnO3"+3H2O>±Na2SnOs + 3H2O,
Na2SnO3 4- 2HjO ^=±2NaOH -J- H?SnO3.
341
С анода олово переходит в щелочном растворе преимущественно
в виде двухвалентных ионов, но так как закись олова плохо раство-
рима в разбавленной щелочи, то она частично оседает на поверхно-
сти анодов. Когда эта пленка (из двухвалентных соединений олова)
еще достаточно тонка и пориста, двухвалентное олово может благо-
даря повышению анодной плотности тока и потенциала начать
окисляться в четырехвалентное. Последнее легко растворяется в ще-
лочи, и поверхность анода может быть очищена от пленки, после
чего возобновится процесс растворения анода с образованием двух-
валентных ионов. Протекающие при этом реакции можно изобразить
следующим образом:
Sn —► Sn”-|-2 0. (1)
Sn" + 40Н' -> Sn08" 4- 2Н20.
Процесс (1) протекает при наименьшем потенциале, но так как
равновесные потенциалы eSn_Sll.. и sSn-—►sn-- для одинаковых кон-
центраций станни-станнатных щелочных растворов близки, то уже
при незначительном повышении плотности тока наступают процессы:
Sn” —► Sn"~ + 2 0. (2)
Sn’"’ + 6ОН' 5-: SnO8" + ЗН2О.
В случае образования на аноде плотной пленки трудно раствори-
мых оловянных соединений наступает механическая пассивность,
начинает выделяться кислород, и анод практически делается не-
растворимым. Чем 'выше температура и чем ниже плотность тока, тем
в меньшей степени пассивируется анод. Трудно растворимые соеди-
нения олова надо удалять периодической чисткой анодов щетками.
Условия кристаллизации олова на катоде зависят от соотношения
двух- и четырехвалентных соединений его в электролите. В щелоч-
ных растворах, содержащих наряду с четырехвалентными соедине-
ниями олова также и Двухвалентные, катодные осадки получаются
неплотными, в виде иглообразных или листоподобных кристаллов,
в то время как при наличии одних станнитов осадки получаются
плотными и мелкокристаллическими. Такое явление объясняется
характером электродных процессов в обоих этих случаях. Олово оса-
ждается путем непосредственного разряда двухвалентных ионов по
схеме:
Sn’4-2 0 — Sn.
Этот процесс протекает без заметной катодной поляризации, и
поэтому на краях и остриях, где господствует большая плотность
тока, беспрепятственно вырастают большие кристаллы по направле-
нию к аноду.
Если же раствор содержит олово только в четырехвалентной
форме, то оно предварительно восстанавливается до двухвалентного
по схеме:
Sn"~-J-2 0—►Sn”.
Потенциал восстановления четырехвалентного олова в сильной
степени зависит от плотности тока, он становится отрицательней на
выступах — краях, остриях и т. п., где господствует большая плот-
342
ность тока, по сравнению с другими участками катодной поверхности.
Поэтому восстановление четырехвалентного' олова до двухвалентного,
а следовательно, и выделение металлического олова будет задержи-
ваться и протекать преимущественно на участках с меньшей плот-
ностью тока, в углублениях (между кристаллами). Вот почему в ще-
лочных растворах олова в отсутствии соединений двухвалентного
олова получаются более гладкие и; плотные осадки.
Исходными материалами для приготовления щелочных оловян-
ных ванн чаще всего служат двуххлористое! влево и едкий натр.. Для
растворения олова в щелочи требуется на каждую грамм-молекулу
двуххлористого олова взять четыре грамм-молекулы едкого натра.
Кроме того (Для устойчивости электролита требуется наличие в нем
определенного количества свободной щелочи. Концентрация олова,
вообще! говоря, может меняться в широких пределах. Даже при содер-
жании олова в растворе в количестве 0,5—1 г/л можно получать хоро-
шие катодные осадки. Однако с уменьшением концентрации олова
в растворе уменьшается выход тока, падает допустимая плотность
тока и увеличивается склонность к образованию губчатых осадков.
Более приемлемой является концентрация олова, соответствующая
0,25—0,5 N. или 30—60 г/л SnCla. 2Н,О.
Помимо этих двух главных компонентов в щелочные ванны часто
вводят цианиды, главное назначение которых — активирование
анодов.
Наконец для щелочных ванн предложено также большое коли-
чество коллоидных добавок, например, пептон, крахмал, глюкоза и др.
Блюм и Хагебум рекомендуют следующий состав электролита,
успешно применявшийся во время мировой войны:
SnCls.2Ha0 30 г/л
NaOH 75 .
CeHijOe 60 „
Катодная плотность тока допускается до 1 А/дм2 при 50°. Глюкоза
может быть заменена пептоном (около 1 г/л), цианистый калий обыч-
но вводится в количестве 10 г/л.
Как выше указывалось, в щелочных ваннах аноды проявляют
сильную склонности к пассивированию, почему рекомендуется анод-
ную плотность тока поддерживать в 1У2—2 раза меньше катодной.
Содержание Свободной щелочи в ванне должно обеспечивать раство-
рение анодов при напряжении на клеммах ванны, равном 3V. Жел-
тый налет на поверхности анодов служит доказательством перехода
олова в раствор в четырехвалентной форме. Необходимо периодически
вводить в ванну щелочь, но большого избытка следует остерегаться,
таж как он приводит к образованию губчатого осадка. Оптимальной
концентрацией несвязанной щелочи считают 1—1,5 N.
Анодный шлам рекомендуется периодически счищать щеткой не
только для предупреждения полного пассивирования анодов, но и
для предупреждения попадания этого шлама на поверхность покры-
ваемых изделий. В последнем случае на покрываемых изделиях по-
являются темные пятна. Такое явление особенно часто наблюдается
при покрытии внутренних поверхностей.
Для покрытия меди и других цветных металлов оловом предло-
343
жено применять фосфорнокислые соли олова. Старейшая ванна Ро-
зелера имеет следующий состав:
пирофосфорнокислый натр.........40 г/л
хлористое олово плавленое ...... 16 „
„ „ кристаллическое . . 4 „
По мнению автора этой ванны, кристаллическое хлористое олово
дает возможность получать красивые светлые осадки, но плохо при-
стающие к основному металлу. Плавленое же олово способствует хо-
рошему сцеплению, но само по себе дает серые покрытия.
Оплингер1 приводит данные крупных промышленных установок
для электролужения, где применяются щелочные ванны в присут-
ствии уксуснокислого натра. Согласно этим данным в щелочных ук-
суснокислых ваннах оловянные покрытия получаются гладкими, хо-
рошо пристающими к основному металлу, причем они сохраняют
пЬлублестящее состояние даже в слоях значительной толщины.
К другим преимуществам этих Ванн, по сравнению с другими щелоч-
ными ваннами, Оплингер относит:
1) большую экономичность в эксплоатации вследствие того, что
соли олова не выпадают на дно, как это обычно имеет место в дру-
гих щелочных оловянных ваннах;
2) большее постоянство ванны вследствие совпадения анодного и
катодного выхода тока;
3) возможность применения более высоких плотностей тока
(а следовательно, ускорение процесса осаждения) при сохранении хо-
рошего качества осадков и постоянства электролита.
Состав электролита рекомендуется следующий:
Допустимые Оптимальный
колебания состав
г/л г/л
NajSnO3 60—135 90
NaOH 4—15 7,5
CH3COONa 15—30 15
H262 1,25—5 2,5
или NaB0< 1—2 1
Катодная плотность тока допускается в пределах 2—7 К!дм2, на-
пряжение при этом^ равно 4—6V. Температуру следует подцерж!
вать в пределах 60—70°. При более низких температурах осадок ci
ноВится матовым, и выход тока понижается; при более высоких тем -
пературах возникает опасность выпадения нерастворимых соединен!:1
олова. Анодную плотность тока рекомендуется поддерживать не выпи
2 А/дм2, т. е. анодная поверхность должна быть больше катодном
в 2—3 раза.
По мнению цитируемого автора, роль уксуснокислого натрия ь
оловянных ваннах такая же,, как и борной кислоты в никелевых ва-.-
нах. Он играет роль буфера и позволяет получать удовлетворител^
ные осадки в более широких пределах, чем это возможно без него.
Перекись водорода, или перборат натрия, способствует переходу
олова в раствор В четырехвалентное состояние, и, следовательно.
О р 1 i n g е г, „Met. Industry*, 12, 1931.
344
уменьшается вероятность появления в ванне двухвалентных соедине-
ний олова, в присутствии которых структура катодного осадка стано-
вится грубее.
Наибольшее внимание следует уделять концентрации щелочи в
электролите. При наличии большого избытка щелочи осадки стано-
вятся темными и губчатыми. Для устранения вредного влияния из-
бытка щелочи рекомендуется добавить соответствующее количество
уксусной кислоты в присутствии окислителя — перекиси водорода
или пербората натрия. Окислители должны вводиться, по возможно-
сти, ежедневно в количестве 1—2 г/л.
2. Кислые оловянные ванны
Поскольку электрохимические свойства олова в значительной сте-
пени совпадают с таковыми для свинца, были сделаны попытки при-
менения кремнефтористоводородных и борфтористоводородных со-
лей для электролитического рафинирбЬания олова (для электролиза
свинца эти электролиты имеют большое применение). В присутствии
незначительных примесей серной кислоты (играющей роль при оса-
ждении примесей свинца) эти электролиты применялись некоторое
время с переменным успехом при рафинировании олова.
Однако для целей лужения эти электролиты не могли получить
большого распространения в силу сложности приготовления, недо-
статочной устойчивости (для кремнефтористоводородных) и дорого-
визны (для борфтористонодородных) солей.
В процессе поисков других электролитов (главным образом для
целей рафинирования), позволяющих вести электролиз олова из
двухвалентных его соединений, Керн и Капиллон 1 нашли, что струк-
тура олова, становится мельче и образование иглообразных кристал-
лов на краях катода сводится к минимуму при введении в электролит
клея в количестве 1 г/л. Еще более благоприятное влияние на струк-
туру оловянных покрытий оказы'Е-ает совместное присутствие в элек-
тролите нескольких добавочных агентов, например' клея и крезола,
клея и никотин-сульфата, клея и алоэ (вытяжка из растения) или
клея крезола и никотин-сульфата. Практическое применение для
целей рафинирования олова нашли себе впервые в США электро-
литы, состоящие из сернокислого олова, Свободной серной кислоты и
сульфокрезоловой кислоты (без клея).
Ферстер и Фишер 2 нашли, что при длительном электролизе можно
получать гладкие и плотные осадки из электролита состава:
SnS04
H2S04
крезолсульфоновой
кислоты
г/л молярность
54 0,25
15 0,15
30 0,16
Крезосульфоновую кислоту можно приготовить, если смешать кре-
зол и концентрированную серную кислоту в эквимолярных соотноше-
1 „Trans, Am. Electrochem. Soc.“, 45, 1924.
a .Zeitschr. f. Elektrochemie*/ 32, 1926.
345
ниях *и разогревшуюся при этом до 80—90° смесь подогревать затем
в течение часа при 100—110°. Образование сульфокрезоловой ки-
слоты протекает по следующей схеме:
/ОН /ОН
С6Н4< +H2S04-*HOsSC6H3< +Н2О.
хсн3 \сн8
Полученную после охлаждения смесь можно непосредственно вво-
дить в электролит. Если исходят из технического (неочищенного)
крезола, то смесь приобретает коричнево-красное окрашивание и со-
держит некоторые посторонние вещества, повидимому коллоидного
характера. .Первые катодные осадки получаются хотя и мелкокри-
сталлическими, но неплотными-и темными. После кратковременного
употребления электролита эти посторонние вещества удаляются, и на
новом катоде осадки получаются уже плотными, с серебристым от-
тенком.
Лучше всего исходить из мета-крезола, катодные осадки при этом
даже при длительном осаждении свободны от наростов, которые
сравнительно быстро появляются на краях и на углах, если исходить
из Ьрто- 'Или пара-крезола.
Благоприятное влияние на структуру оловянных осадков оказы-
вает не только сульфокрезоловая кислота, но и сульфоновые кислоты
фенола,. (? -нафтола, нафталина или а-нафтиламина, причем доста-
точно ввести непосредственно в электролит (без предварительного
сульфирования) в эквимолярных соотношениях эти соединения й
концентрированную серную кислоту.
По наблюдениям Ферстера и Фишера плотность тока в указанных
выше электролитах может быть допущена для тонких покрытий в
пределах 4 А/диР. Для получения более толстых покрытий требуется
плотность тока снизить до 1 А/дм2.
При плотности тока в 0,25—0,5 А/дм2 можно получить плотные и
гладкие осадки, свободные от всяких наростов даже в пределах не-
скольких миллиметров, особенно' в тех случаях, когда для приготов-
вления электролита исходят из мета-крезола. Выход тока почти
всегда теоретический — выделения Водорода не наблюдается даже
при снижении плотности тока до 0,1 А/дм2 и 6-кратном увеличении
(против нормального) содержания серной кислоты в ванне.
Ферстер и Клемм 1,«а затем Ферстер и Декерт 2 установили, что бла-
гоприятное влияние на структуру оловянных осадков оказывают
смолы, которые Ь неочищенном крезоле присутствуют в Незначитель-
ных количествах. Если при 116° долго нагревать сульфокрезоловую
кислоту, то ее можно разложить на крезол и серную кислоту; при 130°
разложение идет до конца, и крезол может быть отогнан. При по-
вторном сульфировании отогнанного крезола и введении полученно-
го таким образом продукта в кислый раствор сернокислого олова ка-
тодные осадки получаются такими же, как и в отсутствии добавоч-
ных агентов.
По данным Ферстера и Декерта сульфокрезоловая кислота, приго-
товленная при одночасовом нагреве (при 105°) смеси из одного моля
1 „Zeitschr. f. Elektrochemie*, 35, 1929.
а „"Zeitschr. f. Elektrochemie", 36, 1930.
S4G
98% мета-крезола и одного моля 96% серной кислоты, имеет сле-
дующий состав:
°/о
сульфокрезоловая кислота 75,2
сериал кислота 8,2
мета-крезол 7,6
вода 8,8
смолы 0,4
Входящие в состав неочищенного крезола смолы в воде плохо
растворимы, но если приготовить алкогольный раствор их и ввести в
раствор сернокислого олова, то, недмотря на то, что большая часть
этих смол выпадает в осадок, достаточно даже того небольшого коли-
чества смол, которое остается в растворе, чтобы при 0,5 А/д.м2 полу-
чить в течение 0,8 Ah/д.м2 относительно гладкий осадок.
Сульфокрезоловая кислота является растворителем для входящего
в состав неочищенного крезола смол. В этом можно убедиться, если
такую кислоту подвергнуть диализу через пергаментную бумагу или
коллодиевую мембрану и растворить в ней сернокислое олово. Ка-
тодные осадки при этом получаются гладкими и мелкокристалличес-
кими.
В неочищенном крезоле имеются также вещества коллоидного ха-
рактера, действие которых сравнительно быстро (по мере течения
электролиза) исчезает вследствие электрофоретического переноса их
к катоду: во Вновь приготовленном электролите получаются губчатые
осадки. Смолы же предупреждают образование иглообразных осад-
ков благодаря адсорбции. Очищенный крезол как капиллярно-актив-
ное вещество также обладает адсорбционной способностью, однако
его необходимо в(водить в несравненно больших количествах то срав-
нению с неочищенным (содержащим смолы), для того чтобы он ока-
зал такое же благоприятное влияние на структуру осадков.
С повышением температуры благоприятное влияние сульфокре-
золовой кислоты на структуру оловянных осадков исчезает, что мо-
жет быть объяснено уменьшением адсорбции. В насыщенном по кре-
золу оловянном электролите можно изменением температуры от 0°
до 95° получать по форме такие же осадки, как при 20°, но перемен-
ном содержании крезола. Так как адсорбция больше всего проявля-
ется на остриях кристаллов и в то же время в оловянных кислых ван-
нах, в которых электроосаждение протекает с незначительной катод-
ной поляризацией, имеет место преимущественный рост кристаллов
на углах и краях катода (где плотность тока больше), то поверх-
ностно активные вещества адсорбируются преимущественно в этих
местах. По этой причине и рекомендуется наряду с капиллярно-ак-
тивными веществами, главное назначение которых заключается в
предупреждении образования наростов на краях и углах, Вводить
также| и коллоиды (клей), которые должны способствовать получению
мелкокристаллических осадков по всей катодной поверхности.
Изучая работу кислых оловянных ванн, В. И. Лайнер1 наблюдал
следующее влияние отдельных компонентов на структуру осадков.
1 .Электролитическое лужение — неопубликованная работа, выполненная
в Центральном научно-исследовательском циституте цветных металлов.
347
Фиг. 150. Виедаиий вид оловянных покрытий, полученных без’добавочных
агентов.
Фиг. 151. Внешний вид оловянных по-
крытий, полученных в присутствии
Фиг. 152. Внешний вид оловянных
покрытий, полученных в присутствии
Клея и крезода-
Ё растворах сернокислого олова при различном- содержании свобод-
ной серной кислоты (10—60 г/л) и сернокислого натрия в .пределах
плотностей тока от 0,1 до 10 А/дм2 на краях катода,быстро растут ден-
дриты, и весь осадок получается грубым, неравномерны}!. 6 введе-
нием клея в электролит структура осадка на всей- катодной,.поверхно-
сти становится мелкой, но на краях остаются наросты, хотя"в значи-
тельно меньшей степени, чем без клея.. Лишь при добавлении к клей-
содержащему электролиту фенола или крезола осадок становится
плотным как на всей поверхности катода, так и на его краях и углах
(фиг. 150—152).
Из испытанных различных составов электролита лучшие резуль-
таты дал следующий:
г/л
SnS04 50
Na2S04.10Hs0 50
H2S04 30—50
мета-крезол 10
клей столярный 10
Клей предварительно замачивают в холодной воде, после чего его
растворяют при 40—50°. Нельзя было установить какую-либо раз-
ницу при введении ib 'ваину сульфированного крезола или мета-кре-
зола. Последний, будучи введен в электролит, вначале всплывает на
поверхность, но после энергичного перемешивания он растворяется.
Электролит мутнеет первое время после Введения крезола, но посте-
пенно он светлеет и долго остается таковым, если только поддержи-
вать достаточную кислотность.
Плотность тока в пределах 1—2,5 А/дм2 не оказывает заметного
влияния на качество осадка и на выход тока. При интенсивном пере-
мешивании плотность тока может быть повышена до 3—4 А/дм2 (для
тонких слоев).
Повышение температуры оказывает резко отрицательное влияние
на структуру осадка.
Было обнаружено, что при длительном электролизе без переме-
шивания электролит расслаивается таким образом, что концентрация
олова в нижней части ванны становится в 2—3 раза- больше, чем в
верхней (повидимому, благодаря более интенсивному растворению
анодов на углах и нижних краях). Механические свойства катодного
осадка при этом резко меняются по высоте катода: в нижней части
олово осаждается В виде плотного мелкокристаллического осадка, в
то время как в верхней части катода образуется губка. Таким образом
перемешивание электролита следует считать весьма • благоприятным
фактором при электроосаждении олова в кислых ваннах.
Вредное влияние на структуру оловянных осадков в кислых вай-
нах оказывают также ионы хлора.
Олово очень медленно растворяется в серной кислоте, почему сер-
нокислое олово готовят электролизом или вытеснением оловом меда
из медного купороса.
Для приготовления сернокислого олова электролизом поступают
следующим образом. Берут такое количество серной кислоты, которого
было бы достаточно, чтобы связать нужное- количество металличе-
ского олова в сернокислую соль и чтобы оставалось 30—50 г/л сво-
бодной серной кислоты. К этому раствору серной кислоты добавляют
349
нужное количество сернокислого натрия н вводят в него оловянные
аноды. Затем готовят подкисленный раствор сернокислой меди и
вливают этот раствор в пористую кислотоупорную диафрагму. Пер-
вый раствор, таким образом, служит анолитом, а второй — католитом.
Катодами могут служить медные или алюминиевые листы. В процессе
электролиза олово переходит в раствор и с серной кислотой связы-
вается в сернокислое олово, а в католите происходит осаждение меди.
На каждые 118,7 г металлического олова приходится 96 г S04, и в
сумме получается 214,7 г сернокислого олова. При стопроцентном
анодном выходе тока на каждый Ah растворяется 2,2 г металличе-
ского олова; практически можно рассчитывать на 2 г. Точное содержа-
ние олоВа определяется титрованием раствором иода в присутствии
крахмала. Во избежание пассивирования не следует анодную плот-
ность тока повышать выше, чем 2—2,5 К!дм2.
Получение сернокислого олова методом Вытеснения им меди из ее
сернокислой соли протекает согласно реакции:
CuSO4 -f- Sn = SnS04 -}~ Cu.
Интенсивно реакция протекает только с мелкоистертым металличе-
ским оловом при нагревании и перемешивании. При наличии боль-
ших кусков олова последние покрываются слоем цементной меди, и
реакция замедляется или вовсе прекращается. Кроме того необхо-
димо раствор .подкислить серной кислотой, в противном случае обра-
зующееся сернокислое олово будет тут же подвергаться гидролизу.
3. Лужение без внешнего тока
Для ^получения тонких оловянных покрытий можно ограничиться
погружением соответствующим образом подготовленных изделий в
растворы, содержащие олово. Таким методом покрываются в массо-
вом масштабе пуговицы, наперстки, булавки и т. п. мелкие изделия.
Получающиеся при этом оловянные покрытия отличаются хорошим
внешним видом и хорошим сцеплением с основным металлом.
Для получения мелкокристаллических оловянных покрытий вы-
бираются электролиты с незначительной концентрацией олова.
Наибольшее распространение имеют растворы, состоящие из насыщен-
ного в воде однозамещенного виннокислого калия (КНО4Н40в) и
3—4 g/л хлористого Ьлова. Подлежащие покрытию обезжиренные и
освобожденные от окислоВ изделия вносятся в этот раствор (в оловян-
ной корзине или сетке) и выдерживаются в нем некоторое время
при близкой к кипению температуре. При этом необходимо изделия
встряхивать или перемешивать в электролите.
При лужении без внешнего тока медных и латунных изделий вво-
дят в раствор куски цинка. Последний. как наиболее электроотрица-
тельный металл (в данной системе) вытесняет из раствора олово, ко-
торое выделяется на поверхности покрываемых изделий. Концентра-
ция олова в этом случае берется большей, чем в предыдущем.
Например, для покрытия латунных изделий нашел успешное приме-
нение электролит следующего состава:
SnCl2.2H2O 25 г/л
КИСЛА ю „
350
Латунные изделия могут быть таким методом покрыты также и- в
щелочном растворе олова следующего состава:
SnCl2.2H2O 30 г/л
NaOH 60 „
Операция длится 2—3 часа и протекает при 90°.
4. Контроль оловянных электролитов
Как в кислых, так и в щелочных электролитах важно знать общее
содержание олова в растворе и соотношение в нем двух- и четырехва-
тентных ионов олова. Для этой цели проба электролита восстаиавли-
зается при помощи алюминиевого порошка целиком до двухвалент-
того, и титрованием иодом в присутствии крахмала определяется об-
щее содержание олова. В отдельной пробе определяется четырехва-
тентное олово приливанием избытка закисного сернокислого железа и
зттитровыванием этого избытка перманганатом. Разность между об-
щим содержанием олова в растворе и содержанием в нем четырехва-
пентного олоШ, очевидно, соответствует содержанию двухвалентного
злова.
Щелочные растворы подкисляются перед анализом соляной кисло-
той (если в электролите присутствуют цианиды, то они должны быть
удалены при помощи длительного кипячения), и олово осаждается
зероводородом. Осадок затем прокаливается, и олово определяется в
виде SnO2 или растворяется, восстанавливается и титруется иодом.
ГЛАВА ДЕСЯТАЯ
СВИНЦЕВАНИЕ
Свинцовые покрытия до последнего времени получались преиму-
щественно методом погружения в расплавленный металл или так на-
зываемым методом гомогенного свинцевания., Оба эти метода наряду с
преимуществами имеют существенные недостатки.
При горячем методе свинцевания приходится вводить в распла-
вленный металл примеси сурьмы, олова, меди или цинка, так как чи
стый свинец плохо смачивает основной металл. Качество покрытий ,
точки зрения их механических свойств и химической стойкости хуже
чем у покрытий, получаемых гальваническим методом. К положитель-
ным моментам горячего метода свинцевания следует отнести в пернув
голову большую скорость процесса и затем заполнение швов в свг
рочной аппаратуре.
При гомогенном свинцевании требуется на подготовленную по
верхность (обезжиренную и потравленную) предварительно нано
сить тонкий слой олова. В тех случаях, когда можно ограничиться
тонкими свинцовыми покрытиями, гомогенный метод неэкономичен
Для покрытия же больших поверхностей толстым слоем свинца гомо
генный метод и в настоящее время является наиболее приемлемым.
Для свинцевания больших поверхностей или собранных конструк-
ций прибегают также в металлизации. Однако при этом методе полу
чаются значительные потери металла за счет распыления, покрытия
содержит значительное количество окислов и должно быть в не-
сколько раз толще покрытий, полученных гальваническим методом.,
для того чтобы в достаточной степени защитить основной металл о
коррозии.
Электролитический метод свинцевания представляет большие пре-
имущества. Электрохимический эквивалент свинца равен 3,865 г/Ah
т. е. самый большой после серебра. Благодаря высокой чистоте эле-
ктролитически осажденный свинец отличается большей химическог
стойкостью по сравнению с покрытиями, полученными другими ме
тодами. Хотя <в. ряду напряжений свинец стоит ниже железа и эле-
ктрохимически его от коррозии не защищает, представляется возмож-
ным в сравнительно короткое время получать относительно толстые •
беспористые покрытия, которые представляют надежную «механиче-
скую» защиту железа от коррозии.
Свинцовые покрытия обычно имеют большую толщину, чем другие
металлы, применяемые в гальванотехнике. Эта толщина измеряется
несколькими сотыми долями миллиметра, а в специальных случаях
например на химической аппаратуре, наращивают слои в десятые
352
Оли й даже целые мйллиМетры. По этой йричйпе, несмотря на боль*
ой электрохимический эквивалент свинца конкурентоспособными
огут явиться такие методы свинцевания, которые позволяют приме-
нять более или менее высокие плотности тока.
Наибольшее применение свинцовые покрытия находят по линии пре-
дохранения металла от воздействия серной кислоты, сернистых га-
зов и других сернистых и сернокислых соединений. При этом уста-
новлено, что стойкость чистого электролитного свинца больше техни-
ческого торгового.
При взаимодействии свинца с серной кислотой или с солями сер-
ной кислоты на поверхности металла Образуется тонкая пленка сер-
нокислого свинца, которая служит предохранением от дальнейшего
разрушения металла. Концентрированная серная кислота действует
на свинец энергично только при повышенных температурах ((выше
200°), но и в этом случае.электролитный свинец устойчивее обыкно-
венного торгового свинца.
С разбавленной сдпяной кислотой свинец реагирует медленно, в то
время как в концентрированной соляной кислоте наблюдается уси-
ленная коррозия.
Свинец отличается боль-
шой стойкостью против от-
равляющих веществ, чем
объясняется широкое при-
менение его в военной про-
мышленности (защита вну-
тренних стенок химических
снарядов и т. и.). Газооб-
разный хлор при обыкно-
венной температуре, медлен-
но реагирует со свинцом, в
то время, как фтор на него
действует разрушительно.
Фиг. 153. Свинцовые осадки, полученные
в уксуснокислом электролите без добавочных
агентов при jD^ = 0,2 А/д.иа.
Свинец плохо противостоит
азотной кислоте, хотя бы и
разбавленной.
Органические кислоты —
уксусная, молочная, щавелевая — также действуют на свинец. По-
этому его нельзя применять для покрытия посуды, предназначенной
для хранения пищевых продуктов (свинцовые соли ядовиты).
В присутствии едких щелочей свинец сравнительно быстро разру-
шается. Любопытно, что в дестиллированной воде свинец растворяется
е большей степени, чем в водопроводной, что объясняется образова-
нием на поверхности металла пленки из углекислого свинца за счет
растворенной в воде углекислоты.
На воздухе свинец быстро окисляется только с поверхности,
©глубь окисление не распространяется. Согласно сообщению Шле-
тера электролитическому свинцеванию подвергаются мосты для за-
щиты их от атмосферной коррозии.
Наиболее широкое применение свинцевание все же находит в хими-
ческой промышленности. Так например, свинцеванию подвергают вну-
тренние стенки автоклавов, кристаллизаторов, вакуум-аппаратов и т. п.
23 Основы гальваностегии 1783
353
В ряде случаев путем применения освинцованной железной аппа-
ратуры вместо сплошной свинцовой можно значительно повысить ме-
ханическую прочность ее, так как свинец несравненно мягче железа,
и в то же время значительно уменьшить вес аппаратуры, так как сви-
нец значительно тяжелее железа.
1. Применяемые электролиты и их режим
Обычно применяемые в гальванотехнике хлористые и сернокисль
электролиты не могут быть применимы для осаждения свинца воле,
ствие малой растворимости этих солей в воде. Уксуснокислые
азотнокислые раст-
воры также мало
пригодны, так как
свинец в них оса-
ждается в виде пло-
хо держащихся на
катодной поверхно-
сти дендритов или
губки (фиг. 153).
Успешное примене-
ние нашли только
Фиг. 154. Катодные потенциалы свинца в различных
влектролитах при нормальной концентрации свинца.
1 — борфторвстоводородный; 2 — перхлоратный; 3 — борфто' кПСМНв- И бОПФТОРИ-
ристоводороджелатиня; 4—азотнокислый; Б— кремнефто *
ристоводородвый; 6— кремнефтористовод -+- желатина; 7—
кислый борфтористоводородный; 8 — кислый перхлоратный;
9 — кислый бор фтор и отоводород 4- желатина; 10 — кислый
перхлора* + желатина.
стоводороднью СОЛИ
Свинца и соли хлор-
ной кислоты (пер-
хлораты).
Кремнефтористоводородная кислота была впервые применена в
качестве электролита для рафинирования свинца Беттсом. Эти элек-
тролиты могут быть применены для покрытия железа и стали дишь
после предварительного осаждения меди. Последняя операция отпа-
дает в борфтористоводородных электролитах, предложенных Блюмом.
Перхлоратные ванны были подробно изучены Матсерсом.
Хотя в последних трех электролитах склонность к дендритообразо-
ванию значительно меньше, чем в других, все же и в них приходится
прибегать к коллоидным добавкам. С этой точки зрения свинец, как
и олоНо, представляет исключительный интерес. По способности да-
вать крупнокристаллические осадки Фрелих1 располагает свинцовые
электролиты в следующем порядке: уксуснокислые, азотнокислые,
кремнефтористоводородные, борфтористоводородные и перхлоратные.
Этот ряд находится в полном согласии с существующим у нас пред-
ставлением о связи между катодной поляризацией и структурой осад-
ка; 5в последнем наблюдается заметная поляризация, в то время как
в первом она почти совершенно отсутствует.
В то же время мы наблюдаем при осаждении свинца увеличение
роста кристаллов с плотностью тока,, т. е. обратное тому, что наблю-
дается в большинстве других случаев электроосаждения металлов.
Введение свободной кислоты и коллоидов в перхлоратные, кремне-
и борфтористоводородные ванны вызывает увеличение катодной по-
ляризации и одновременно с этим уменьшение размеров кристаллов.
1 .Trans. Am. Electrochem. Soc." 49, 1926.
854
Таблица 1Q
Сравнительная характеристика различных свинцовых электролитов
Концентрация свинца везде нормальная_______________________
Состав электро- лита Своб. ки- слоты нор- мальность Желатина г/л Плотность тока 1 Равновес- ный потен- циал V Катодный потенциал V Характер осадка
1. Уксуснокис- лый свинец. • • 2. То же плюс 0,5№ уксуснокис- лого аммония . . — — 1 1 —0,1965 —0,2530 -0,1973 —0,2575 Осыпающиеся дендриты То же
3. Уксуснокис- лый свинец . . . 0,5 — 1 —0,1968 —0,1978 »
4. Уксуснокис- лый свинец . . . 0,5 0,5 1 —0,1960 —0,2000 »
5. Азотнокис- лый свинец. . . — — 1 —0,1578 —0,1582 •
6. Азотнокис- лый свинец . . . 7. Перхлорат- ный свинец. . . 0,5 — 1 1 —0,1584 —0,1638 —0,1588 —0,1682 Кристаллин, плохое сцеплеи. осадки лучше, чем без желатины Гладкий и проч- ный
8. Перхлорат- ный свинец . . . 0,5 0,5 1 —0,1640 —0,1756 Очень гладкий
9. Борфтористо- водородный сви- иец 10. Кремнефто- ристоводородный свинец 0,5 — 1 1 —0,1402 —0,1578 —0,1435 —0,1635 Гладкий; наблю- дается тенденция к пглообразоваиию на краях; сцепле- ние хорошее Очень гладкий, хорошее сцепление
11. То же . . . 0,5 0,5 1 —0,1575 —0,1690 Очень гладкий, но структура круп- нее, чем в № 8
12. „ ... 0,75 — 3,0 —0,1588 —0,1617 Большинство металла осело в виде дендритов
13. „ ... 0,75 — 1,0 —0,1588 —0,1643 Такой же, как № 12
14. „ ... 0,75 0,75 3,0 —0,1588 —0,1705 Гладкий, но иа краях утолщенный
355
Наиболее заметная поляризация и наиболее топкая структура наблю-
дается в кислых перхлоратных ваннах, содержащих желатину.
Благоприятное влияние желатины & указанных выше электроли-
тах объясняется тем, что катодный слой, как и в медном электролите
кислый (водород почти не выделяется), положительно заряженные
коллоиды достигают катодной поверхности и затрудняют рост кри-
сталлов (способствуют образованию мелкокристаллических осадков).
Соотношение между катодной поляризацией и структурой свин-
цовых осадков показано в табл. 79 и на фиг. 154.
Кремне фтористые электролиты. Исходными мате-
риалами для приготовления электролита служит плавиковая кислота,
кварцевый песок и глет. Вначале готовят кремнефтористоводородную
кислоту, часть которой должна присутствовать в электролите в сво-
бодном виде, другая часть ее служит для образования кремнефто-
ристоводородного свинца.
Образование кремнефтористоводородной кислоты протекает по
уравнению:
Si02 + 6HF = H2SiFe + 2Н2О.
На одну весовую часть двуокиси кремния необходимо брать две
весовых части стопроцентной плавиковой кислоты. Практически при-
готовление кремнефтористоводородной кислоты производят описан-
ным ниже методом.
На дно свинцового сосуда укладывается слой крупного кварца
(0,5 еде в диаметре), а поверх его насыпается мелкий песок (0,5 .mjk).
Песок поливается затем горячей .водой до тех пор, пока температура
его не повысится до 80°. В дне сосуда имеется отверстие, в кото-
рое пропущена свинцовая крестовина для направления вытекающего
из него раствора. Когда кварцевый песок прогреется, то через него
фильтруется плавиковая кислота, при этом она почти полностью
переходит в кремнефтористоводородную кислоту, которая поступает
в приемник (свинррвый бак). Реакция экзотермична, и ко-
личество выделяющегося тепла достаточно для поддержания всей
смеси В горячем состоянии. Мало того, приходится еще специально
охлаждать смесь, для чего прибавляют холодную воду (можно вво-
дить лед) с таким расчетом, чтобы получить 30%. кислоту. Добавляя
периодически плавиковую кислоту, воду и изредка песок, можно по-
лучить нужное количество кремнефтористоводородной кислоты.
В технической плавиковой кислоте обычно присутствует в каче-
стве примесей серная кислота; кроме того небольшая часть плавико-
вой кислоты остается в свободном виде, не успевая прореагировать с
кварцем. Обе эти примеси удаляются в процессе приготовления свин-
цовой соли кремнефтористоводородной кислоты, так как фтористый
свинец и сернокислый свинец мало растворимы. Поэтому необходимо
брать избыток свинца (в виде окиси) по сравнению с заданной кон-
центрацией, и выпавший осадок промывать затем декантацией, ис-
пользуя промывные воды для разбавления электролита до нужной
концентрации.
Кремнефтористоводородная кислота частично подвергается раз-
ложению с образованием летучей плавиковой кислоты и кремнезема:
H2SiFe 4- 2Н20 SiO2+6HF.
356
Эта реакция протекает интенсивнее при недостаточном количестве
свободной кремнефтористоводородной кислоты в электролите. Помимо
того, что летучая плавиковая кислота отравляет рабочую атмосферу
и разрушающе действует на металлические части, при этом повы-
шается сопротивление электролита. С другой стороны, необходимо
избегать также большого избытка свободной кремнефтористоводород-
ной кислоты, поскольку возможно одновременное выделение со свин-
цом водорода, что приводит к снижению выхода тока по металлу и
ухудшению качества осадка. Точнее говоря, необходимо поддерживать
определенное соотношение между Свинцовой солью и свободной ки-
слотой.
Рекомендованные Беттсом ванны для электрического рафи-
нирования свинца оказываются пригодными также и для покрытия
свинцом.
Их состав следующий:
РЪ ч 80 г/л или 0,8 N
SiF6 15О-16Э „ „ 2 N
Свободной кремнефтористоводородной кислоты в этом электролите
около 1,2 ДО или 90—96 г/л H2SiFe.
Для электролитического свинцевания Рив1 рекомендует следую-
щий состав электролита:
РЪ 180 г/л или 1,75 N
SiF6 140 , , 2,0 N
т. е. свободной кремнефтористовородной кислоты 0,25 N.
Помимо этих двух главных компонентов в электролите необходимо
присутствие коллоида для получения более тонкой структуры и пре-
дупреждения наростов на краях. Наибольший эффект оказывает же-
латина В количестве 0,1—0,5 г/л; вместо желатины можно применять
клей в количестве 1—2 г/л.
Плотность тока рекомендуется поддерживать в пределах 1—2 К/дм2,
температуру — комнатную.
Омическое! сопротивление электролита незначительно, так же как
анодная и катодная поляризация; общее падение напряжения в
ванне колеблется в> пределах 0,15—0,2 V.
Рассеивающая способность кремнефтористовородных ванн незна-
чительна, так что для Свинцевания предметов со сложной формой
необходимо пользоваться фигурными анодами.
Мы видим, что концентрация свинца в электролите может коле-
баться в широких пределах. Для больших плотностей тока необхо-
димо применять более концентрированные по свинцу растворы; в от-
ношении свободной кремнефтористоводородной кислоты мы имеем
другое положение: чем больше ее !в электролите, тем меньше допу-
скаемая плотность тока.
Борфтористоводородные ванны были предложены
Беттсом наряду с кремнефтористоводородными для целей рафиниро-
1 Reeve, .Trans Am.’Electrochem. Soc.* 36, 1919,
357
вания свинца. Ряд авторов предложили пользоваться борфтористоио-
дородным свинцовым электролитом для кулометра.
Образование борфтористоводородной кислоты при взаимодействии
борной кислоты с плавиковой может быть выражено уравнением:
4HF + Н3В03 = HBF* + зН2О.
На самом деле реакция протекает сложнее, и в зависимости от тем-
пературы, концентрации исходных компонентов и прошедшего после
смешения этих двух кислот времени могут образоваться различные
соединения. Опыты, произведенные А. Д. Беллом в Американском
бюро стандартов, показали, что при добавлении борной кислоты к
плавиковой возрастает концентрация ионов водорода, причем макси-
мум достигается при смешении пяти молей плавиковой кислоты с
одним молем борной кислоты.
Если насыщать борфтористоводородную кислоту основным карбо-
натом свинца, то раствор получается 1,2 N по свинцу, т. е. в нем ока-
зывается больше свинца, чем это отвечает формуле Pb(BF4)2. Поэтому
состав этой соли обычно выражают в эквивалентах свинца, общей
концентрации борфтористоводородной кислоты и избытке борной ки-
слоты против того количества, которое необходимо для связывания
плавиковой кислоты в борфтористоводородную. Такой раствор содер-
жит 103,6 г/л свинца или 129 г/л 2РЪС03 • РЬ(0Н)2, 88 г/л HBF4 для
образования которой требуется 80 г/л 100% HF и 62 г/л Н3ВО3; кроме
того в растворе будет находиться 12,4 г!л избытка) борной кислоты.
Обычно пользуются для приготовления электролита основной уг-
лекислой солью -свинца, в которой содержание металла не ниже 98%’
от теоретического, исходя из формулы 2РЬС03. РЬ(ОН)2. Плавиковая
кислота применяется обычно 50%. В ней почти всегда присутствует в
качестве примесей серная кислота, для удаления которой затрачи-
вается определенное количество свинца. Борную кислоту рекомен-
дуется применять кристаллическую, а не порошкообразную, так как
последняя бурно реагирует с плавиковой кислотой.
Блюм1 рекомендует следующий метод приготовления электро-
лита. В свинцовый (или освинцованный) сосуд наливают потребное
количество плавиковой кислоты и понемногу добавляют борную ки-
слоту; так как при этом происходит сильное разогревание, то раствор
понемногу разбавляют водой, тем самым охлаждая его. Углекислый
свинец рекомендуется добавлять в виде густой кашицы при постоян-
ном перемешивании. После растворения свинца дают раствору некото-
рое время отстояться (при наличии серной кислоты выпадает серно-
кислый свинец), затем раствор сифонируют, переливают в асфальти-
рованную ванну, добавляют нужное (количество коллоида и разба-
вляют водой до нужной концентрации.
Проведенные Блюмом измерения электропроводности и равновес-
ных потенциалов свинца в зависимости от концентрации металла и
кислоты в растворе показали, что электропроводность увеличивается
1 Blum, , Trans. Am. Electrochem. Soc.*, 36, 1919.
358
Ьместе о концентрацией этих двух компонентов, но в большей степени
с увеличением концентрации кислоты. Потенциал свинца незначи-
тельно изменяется с концентрацией металла в растворе и сильно
уменьшается (абсолютная величина увеличивается) при изменении
отношения металла к кислоте от 1:1 до 1 :1,5. Табл. 80 иллюстрирует
это положение:
Таблица 80
Влияние концентрации металла и кислоты иа потенциал
свинца
Содержание свинца в эк- вивалентах Концентра- ция HBF4 N Удельный вес Сопротивле- ние Q/cm3 Потенциал V
1 1 1,16 9,2 —0,146
1 1.5 1,17 4,5 —0,167
1,5 1,5 1,23 6,8 —0,143
1,5 2,25 1,25 3,5 —0,168
2 2,0 1,32 5,6 —0,145
2 3,0 1,34 3,1 —0,173
На основании этих данных можно рассчитывать на улучшение
структуры осадка с увеличением концентрации кислоты. Это проис-
ходит вследствие уменьшения концентрации ионов свинца и связан-
ного с этим повышения катодной поляризации. Что касается влияния
повышенной концентрации свинца в растворе, то оно сводится к по-
вышению допустимой плотности тока, при которой не растут ден-
дриты.
Повышение плотности тока способствует получению более мелкой
структуры, но Ь то же время способствует дендритообразованию на
краях, так что пределом должна служить для каждого случая та
плотность тока, при которой на краях не образуются дендриты.
Избыток борной кислоты в электролите не оказывает заметного
влияния на качество осадка, но способствует устойчивости электроли-
та и предупреждает образование шламообразного фтористого свинца.
Повышение температуры не вносит улучшений, но вызывает от-
ложение с более крупной структурой.
Блюмом рекомендуется следующий состав электролита для полу-
чения относительно тонких покрытий свинца — до 0,125 мм:
2РЬСО3.РЪ(ОН3) 129 г/л
HF 100% 120 »
н3во8 106 »
клей 0,2 „
удельный вес раствора 1,17 (21° Вё)
Для получения более толстых слоев при более высоких плотностях
тока следует концентрацию этих компонентов увеличить примерно
вдвое. Плотность тока можно поддерживать <в пределах 1—3 А/дм2,
причем для концентрированных растворов можно применять более
высокую плотности тока. Напряженке колеблется В пределах десятых
969
долей вольта (в зависимости от формы покрываемых предметов! и
расстояния между электродами) и редко превышают 1V.
Температуру рекомендуется поддерживать комнатной, и если от
проходящего тока происходит разогревание электролита, то последний
приходится даже искусственно охлаждать.
Наилучшей подготовкой поверхности перед покрытием в борфто-
ристо’водородной ванне является обработка пескоструйным аппаратом.
Подготовленная таким образом поверхность и покрытая свинцом мо-
жет выдержать разогрев до 250° без того, чтобы покрытие не вздува-
лось и не отслаивалось.
Для получения беспористых покрытий (по ферроксилиндикатору)
в случае хорошо подготовленной поверхности и мелкокристаллической
структуры свинца достаточно 0,075 ж.н; для большей надежности,
ввиду мягкости свинца и легкости его механического повреждения,
рекомендуется 0,125 мм. В отдельных случаях для защиты от корро-
зии при сильно действующих агентах толщина свинцового покрытия
превышает 1 мм.
Автором перхлоратных ванн для элетролитического оса-
ждения свинца является Матсерс. Как выше указано, наиболее плот-
ные и тонкокристаллические осадки получаются в перхлоратных ван-
нах. Для получения хлорной кислоты исходят обычно из ее калиевой
или натриевой соли; эти соли обрабатываются серной кислотой, и по-
лучающаяся хлорная кислота подвергается перегонке. В этой кислоте
затем растворяется основной карбонат свинца.
Перхлоратные растворы устойчивы, и практика не знает случаев
взрыва при попадании в эти растворы дерева, бумаги или тому по-
добных веществ.
Что касается состава элетролитоВ! для перхлоратных ванн, то
самим Матсерсом было предложено несколько видоизменений.
Например:
1. НСЮ4 45 г/л
РЬ 54 »
Пептон 0,5 „
2. НС1О4 61г/л
РЬ 73 .
Пептон 0,5 „
Вместо пептона „можно с успехом применить гвоздичное масло.
Коллоидные добавки частично осаждаются вместе со свинцом, почему
приходится периодически их вводить.
Ванны работают при плотности тока 1—2 РЛдм2 и комнатной тем-
пературе. Анодный и катодный выходы тока близки к 100%. Обычно
аноды растворяются равномерно; если на них образуется шлам, то
это признак недостатка Свободной кислоты. Появление крупнокри-
сталлического осадка на катоде связано с недостатком коллоидов в
электролите.
Изучая работу щелочных свинцовых электролитов, Матсерс нашел,
что хотя в присутствии некоторых органических добавок можно полу-
чить удовлетворительные по структуре осадки, последние при испы-
тании их на стойкость в серной кислоте дани худшие результаты, чем
осадки, полученные в кремнефтористоводородных электролитах. Во-
обще говоря, такие электролиты имеют преимущества перед всеми
360
другими, применяемыми на практике, поскольку они готовятся из бо-
лее доступных и дешевых материалов—растворением окиси свинца
или уксуснокислого свинца Ь щелочи.
Матсерс работал, с электролитом, который содержал 200 г/л едкого
натра и 40 г/л свинца в виде уксуснокислой соли. В присутствии раз-
личных коллоидных добавок были получены удовлетворительные
результаты при плотности тока в 1 К!дм2 и температуре 80°. Кол-
лоидные добавки^ вводились непосредственно в теплый щелочной
электролит. В то время как целый ряд органических соединений ока-
зывает отрицательное влияние на структуру осадка, а некоторые не
оказывают никакого влияния, другие, как, например, клей, олеиновая
кислота, канифоль, шеллак, давали возможность получать мелко-
кристаллический и плотный осадок. Так как эти добавки имеют огра-
ниченную растворимость в электролите и остающиеся взвешенные
частицы прилипают к катодной поверхности, обусловливая образова-
ние губчатых осадков, то лучше растворить их (коллоиды) отдельно в
щелочи: в едком кали растворимость больше, чем в едком натре.
Наилучшие концентрации коллоидов: сандарак 3—5 г/л, канифоль
5—10 г/л.
Выход тока на катоде * *в ванне указанного выше состава равен
99,6%, а на аноде (при плотности тока в 1,75 А/дм2) 73,9%. Увеличи-
вая анодную поверхность (и соответственно уменьшая анодную плот-
ность тока), можно поднять анодный выход тока до 100%. Это до-
стигается при плотности тока в 1 А/дм2 и повышенной температуре.
Главным недостатком щелочных электролитов является пори-
стость осадков, которые в них получаются. В 5% серной кислоте же-
лезные 'Образцы, покрытые свинцом, в щелочных ваннах быстро раз-
рушаются.
Уксуснокислые электролиты. В отсутствии коллои-
дов и капиллярно-активных веществ уксуснокислые ванны позволяют
применять только очень низкие плотности тока, да и при этих усло-
виях не исключается возможность образования дендритов после до-
стижения сколько-нибудь заметной толщины катодного осадка.
В поисках более дешевого и безвредного (по сравнению с применяе-
мыми до сих пор) электролита Н. А. Изгарышев и А. Н. Иванова1
предприняли исследование по линии улучшения структуры свинцо-
вых осадков в уксуснокислых ваннах путем введения в них коллои-
дов или поверхностно активных веществ. В качестве таковых приме-
нялись желатина, гуммиарабик, декстрин, столярный клей, фенол и
пиридин. Эти добавочные агенты вводились в различных концентра-
циях в ванну следующего состава 2:
РЪ(СН3СОО), 5 г/л
СНзСООН 5 „
Во всех случаях можно было допускать плотность тока меньшую,
чем 0,1 А/дл2. Лишь в присутствии 0,1 г/л клея представлялось воз-
можным плотность тока повысить до 0,2 К!дм2.
В дальнейшем Н. А. Изгарышев и А. Н. Крестовников разработали
’ .Минеральное сырье и цветные металлы*, № 9, 1929.
* Состав ванны рекомендовав Пфаигаузером,
301
более сложный рецепт, который позволял при плотностях тока в
0,13 А/дм2 получать плотные мелкокристаллические осадки, обладаю-
щие хорошим сцеплением с основным металлом, толщиной до 0,5 мм.
Состав этого электролита следующий:
РЪ(СН3СОО)а
СНзСООН
желатина
пиридин
ортотолуидии
25 г/л
26 »
1 »
2 смР/л
18 капель/л
Последний рецепт был видоизменен М. И. Гамовым в таком на-
правлении, что плотность тока представлялось возможным повысить
до Ю к/дм2 (при комнатной температуре). Вместо пиридина был при-
менен сероуглерод, и концентрация свинцовой соли в электролите
была доведена до 300 г/л. Разработанный М. И. Гамовым уксуснокис-
лый свинцовый электролит'Имеет следующий состав:
РЪ(СН3СОО)а 100-300 г/л
СН3СООН 30—40 „
ортотолуидии 1 ел3
' сероуглерод 1 .
желатина 3 гл
Перед введением желатины раствор подвергается кипячению до
тех пор, пока он не примет темной окраски.
К недостаткам уксуснокислых ванн следует отнести улетучивание
из них уксусной кислоты, что вызывает необходимость частого доба-
вления последней Все же они имеют преимущества перед другими
электролитами благодаря дешевизне в легкости оперирования.
Интересно отметить, что в уксуснокислых ваннах присутствия
одного коллоида для получения плотных мелкокристаллических осад-
ков недостаточно, наряду с ними необходимо присутствие поверхно-
стно активных веществ.
Метабензолдисульфонкислнеэлектролиты, пред-
ложенные д-ром Шлеттером в Германии, были детально изучены в
институте им. Карпова Беляевым и Никитиной1. 'Метабензолдисуль-
фоновая кислота получается сульфированием бензола дымящей сер-
ной кислотой:
СеЩ + 2H2S04->C6H4(S03H)2 + 2Н20.
Свинцовая соль этой кислоты получается насыщением последней
глетом. Соль при этом может быть получена почти В сухом виде, что
представляет большие удобства при транспортировке ее. В сульфиро-
ванном продукте! обычно содержится значительное количество серной
кислоты, которая вызывает повышенный расход глета (образуется
сернокислый свинец) при приготовлении свинцовой соли. Этого мож-
но избегнуть, если предварительно осадить серную кислоту углекис-
лым кальцием.
Образование свинцовой соли метабензолдисульфоновой кислоты
протекает согласно уравнению:
‘Беляев П. П., Электролитическое свиицевадие, Госхимтедиздат, ОНТИ,
1933.
>63
CeH4(S03H)2 + PbO=(WSOs^Pb + H20.
Для приготовления электролита рекомендуются следующие соот-
ношения компонентов:
СбЩ(8О3)2РЬ
C6H4(SO3H)2
клей
г/л N
220—445 1—2
30—180 0,25—1,5
1—2
Более высокой плотности тока соответствует большая концентра-
ция электролита. В пределах плотностей тока 0,25—5 А/дл<2 полу-
чаются мелкокристаллические осадки светлосерого цвета, обладающие
хорошим сцеплением! с основным металлом. По данным П. П. Беляева
можно катодную плотность тока повысить и до 20 К! дм2.
.Удовлетворительные результаты можно получить от введения
метабензолдисульфонкислоты в раствор уксуснокислого свинца; при
этом отпадает необходимость в прибавлении к электролиту пиридина,
ортотолуидина и сероуглерода.
В качестве такого упрощенного комбинированного электролита
приводится следующий состав:
г/л N
(СН3С00)2РЪ 80—325 0,5—0,2
C6H4(SOsH)2 30—180 0,25—1,5
Допустимая катодная плотность тока лежит несколько ниже по
сравнению с борфтористоводородными.
Мы видим, что электролитическое осаждение свинца возможно из
большого количества электролитов, причем в этих последних концен-
трация отдельных компонентов может колебаться в широких преде-
лах. В начале главы мы уже указали, что обычно (применяемые в
гальванотехнике сернокислые и хлористые растворы в данном случае
неприемлемы ввиду ничтожной растворимости свинца в этих рас-
творах.
.Что же касается разобранных нами электролитов, то наиболее про-
стыми, устойчивыми и удобными в эксплоатации являются борфто-
ристоводородные электролиты.
При большом масштабе, где приходится считаться со стоимостью
самого электролита, предпбчтение можно отдать кремнефтористово-
дородным.
В тех случаях, когда' максимальное внимание уделяется структуре
осадка, следует остановиться на перхлоратных ваннах. Уксуснокис-
лые и бензолдисульфонкислые ванны в настоящее время еще не апро-
бированы в достаточно больших производственных масштабах, почему
и нельзя их широко рекомендовать.
Рив1 описывает установку для электролитического свинцевания
Внутренних поверхностей химических снарядов. Для тщательной
изоляции газов от стальных стенок сосуда необходимо заботиться о
получении плотных беспористых покрытий. Большую роль в этом
отношении играет метод подготовки поверхности перед покрытием.
После удаления масла газолином снаряд наполняется горячим ще-
1 „Trans, Am. Electrochem. Soc.“, 35. 1919,
303
лочным раствором и подвергается электролитическому обезжирива-
нию. Снаряды диаметром 118—155 мм подвергаются предварительно
очистке пескоструйным аппаратом и электролитическому травлению
(катодному) в 20% НС1 и после тщательной промывки водой напол-
няются медным раствором для нанесения прослойки под свинец. Сна-
ряды с меньшим диаметром (75 мм) очищаются металлической щет-
кой с последующим травлением, после чего также наносится медная
прослойка в ванне следующего состава:
основной углекислой меди 60 г/л
цианистого натрия 150 .
Для свинцевания внутренних поверхностей снарядов можно при-
менять кремнефтористо- и борфтористоводородные ванны. В послед-
них не требуется медной прослойки.
Анод вставляется сверху, и так как объем*электролита очень мал
по сравнению- с тем количеством металла, которое должно быть выса-
жено, то его соединяют в нижней части с деревянной (кленовой) ме-
шалкой и вращают со скоростью 320 об/мин. Для вращения служит
шпиндельный аппарат, рассчитанный на одновременное покрытие
52 снарядов. Последние распределены на 4 батареи, гв каждой батарее
последовательное включение. Толщина слоя свинца колебалась в пре-
делах 0,25—0,35 мм.
В табл. 81 помещены данные для анодной и катодной поверх-
ностей и необходимого времени гксилы тока для получения такого
слоя.
Таблица 81
Диаметр снаряда мм Площадь ано- да, погружен, в электролит см* Катодная поверхность см3 Вес осажден, свинца г Сила тока А Необходи- мое время час.
75 18 100 127 5 6,62
117,5 31 229 289 10 7,50
155 58 412 529 20 6,84
Состав электролита
"Be Pb % Общ. содерж. H2SiFe Своб. H2SiF6 Клей %
43 18,02 14,14 2,90 0,4
2. Методы контроля свинцовых электролитов
Во всех электролитах содержание свинца определяется весовым
методом — осаждением его серной кислотой в виде сернокислого
свинца. Для этой цели берут 10—15 см? электролита, разбавляют де-
стиллированной водой примерно до 150 см3, нагревают до кипения и
364
прибавляют некоторый избыток титрованной разбавленной серной
кислоты. Осадку дают отстаиваться несколько часов, после чего его
отфильтровывают через взвешенный предварительно тигель -Гуча,
промывают вначале разбавленной серной кислотой, а под конец сла-
бым водноспиртовым раствором. Затем осадок высушивается, взвеши-
вается, и свинец перечисляется на ту соль, в виде которой он нахо-
дится в электролите.
Свободная кремнефтористоводородная кислота может быть при-
близительно определена титрованием фильтрата после осаждения
свинца щелочью в присутствии фенолфталеина как индикатора. Ее
можно также определить осаждением в виде K2SiFe при помощи спир-
тового раствора уксуснокислого' калия, последующим растворением
этого осадка и титрованием щелочью.
Борфтористоводородную кислоту лучше всего определять методом
кондуктометрического титрования. Непосредственное титрование ще-
лочью дает неверные результаты, так как в разбавленных растворах
идет разложение борфтористоводородной кислоты на борную кислоту
и плавиковую.
Свободная хлорная кислота может быть определена непосредствен-
ным титрованием щелочью или, более точно, предварительным осаж-
дением свинца избытком титрованной серной кислоты и последующим
титрованием фильтрата щелочью. ,
3. Электролитическое осаждение перекиси свинца
В главе VII нами разобран метод электролитического осаждения
черного никеля. По внешнему виду такие же осадки получаются на
аноде при электролизе растворов плюмбата, причем так же, как и в
случае осаждения черного никеля, Свинец на аноде, окисляясь в раз-
личной степени (в зависимости от состава электролита и условий
электролиза), меняет свой цвет от желтого до бархатно-черного.
Измеряя анодные потенциалы свинца в растворе едкого натра,
Грубе установил, что при определенной плотности тока наступает рез-
кий скачок потенциала, и вместо растворения анода начинается ВЦ-
деление кислорода с образованием коричневой перекиси свинца. Этот
скачок наступает при тем меньшей плотности тока, чем концентриро-
ваннее щелочь. Например, в 1V NaOH анодный потенциал меняется
с увеличением плотности тока от 2,33 до 2,67 А/дм2, от — 0,505 до
+ 0,695 V, в з NaOH (наступает скачок при повышении плотности
тока от 2 до 2,33 А/дм* (—0,480 V и +0,701 V). В 12 N NaOH при-
мерно такой же скачок наступает уже при плотности тока в 0,67 А/дм*.
После начала выделения кислорода и образования на поверхности
анода .перекиси свинца можно плотность тока значительно снизить,
причем растворение анода больше не имеет места.
Условия, благоприятствующие получению перекиси свинца на
аноде в виде плотного темного осадка, были изучены Эльбсом и Фор-
селём Ч Эти авторы рассматривают образование перекиси свинца на
аноде как вторичный процесс. Вначале разряжаются анионы
НРЬО2' с образованием окиси свинца и кислорода по схеме 2НРЪ02'->
->2РЪ0+ 0 + Н20; при дальнейшем окислении окись свинца пере-
* „Zeitsch. f. Elektrochem.“-8, 760, 1902.
J65
ходит в перекись. Что касается влияния плотности тока па характер
образующегося осадка, то ими были установлены положения:
1. При низких плотностях тока на аноде образуется перекись свин-
ца в виде плотного, похожего на графит слоя бархатно-черного
цвета.
2. При плотностях тока, больших чем 0,5 А/дм2, образуется обыч-
ная коричневая перекись свинца.
3. При высоких плотностях тока образуется желтый осадок, со-
стоящий из окиси свинца, загрязненной гидратом окиси и перекисью
свинца.
Оптимальной плотностью тока для получения плотных и темных
осадков перекиси свинца Эльбе и Форсель считали 0,3—0,4 К!дм2.
На характер осадка и на выход тока оказывает благоприятное вли-
яние также повышение температуры. Например, при повышении тем-
пературы от 15,5 до 88° выход тока соответственно возрастает от 27
до 85,4%. Получающиеся при температуре ниже 50° осадки рыхлы,
пористы и плохо держатся на поверхности.
Пользуясь этими данными, Н. А. Изгарышев и А. А. Кузнецова’
предприняли исследование по линии изыскания устойчивого состава
электролита и режима электролиза, позволяющих получать плотные,
красивые осадки перекиси свинца, обладающие хорошим сцеплением
с основным металлом. При этом было установлено, что в отсутствии
специальных добавочных агентов осадок перекиси свинца, получен-
ный в электролите с различной концентрацией щелочи и свинца, а
также при различной плотности тока и температуре, отличается хруп-
костью и отскакивает при изгибе покрываемых изделий.
В качестве добавочных агентов было испытано большое количе-
ство органических и неорганических соединений, которые оказывали
различное влияние на качества осадков.
Хорошо держащиеся эластичные черные осадки перекиси свинца
были получены в электролите следующего состава:
н4о 1 л
NaOH 40 „
Pb(C2H3O,)j.3HjO 19,2 „
резорцин О,ОО1°/о
Электролит можно приготовить следующим образом: необходимое
количество уксуснокислого свинца растворяется в воде и осаждается
едким натром. Полученный гидрат свинца промывается декантацией
и растворяется в однонормальном растворе едкого натра. В пригото-
вленном таким образом электролите растворяется резорцин.
Осадки, полученные на меди и латуни, отличаются лучшими меха-
ническими свойствами по сравнению с таковыми, полученными на
железе и чутуне. Лучше, следовательно, получать предварительно
медную прослойку.
К числу недостатков данного метода получения покрытия необхо-
димо отнести одновременное осаждение свинца на катоде (в виде ме-
талла) и окисление его на аноде в виде перекиси. Это обстоятельство
сильно затрудняет поддержание постоянства состава электролита.
1 Zeitsch. f. Elektrochem., 37, 7, 1931.
ОГЛАВЛЕНИЕ
От редактора...................................................... 3
Введение.......................................................... 5
ГЛАВА ПЕРВАЯ
Подготовка металлической поверхности перед покрытием.............. 6
1. Влияние состояния поверхности иа физические свойства гальвани-
ческого осадка ............................................... 6
2. Механическая подготовка поверхности металлов.............. 9
3. Шлифующие и полирующие материалы......................... 11
4. Обезжиривание химическое и электролитическое............. 23
А. Химическое обезжиривание........................... 23
В. Электролитическое обезжирование.................... 29
5. Травление металлов....................................... 41
6. Декапирование..........................................
7. Матирование.............................................. 71
8. Последовательность операций прн подготовке металлической по-
верхности, существующие варианты и техника их осуществления . 73
ГЛАВА ВТОРАЯ
Структура алектроосаждениых металлов............................. 78
ГЛА ВА ТРЕТЬЯ
Распределение металла на катодной поверхности . ................ 109
ГЛАВА ЧЕТВЕРТАЯ
Цинкование...................................................... 139
1. Свойства цинка.......................................... I39
2. Методы цинкования и их сравнительная характеристика .... 140
3. Электролитическое цинкование............................ 145
А. Кислые цинковые ванны............................ 151
В. Щелочные цинковые ванны............................ 171
В. Контактный метод цинкования........................ 178
Г. Контроль цинковых ванн............................ 179
ГЛАВА ПЯТАЯ
Кадмирование.................................................... I85
1. Свойства кадмия и кадмиевых покрытий...................
2. Электролитическое кадмирование.......................... J9J
А. Кадмиевые кислые ванны............................ *93
Б. Цианистые кадмиевые ваниы........................' 201
ГЛАВА ШЕСТАЯ
Омеднение.........................................................
1. Медиые кислые ваииы......................................
2. Медиые цианистые ваииы...................................
3. Непосредственное омеднение железа и стали в кислых ваннах •
4. Омеднение перед цементацией..............................
5. Контроль медных ваин .,..............................• • •
209
210
220
227
230
233
367
ГЛАВА СЕДЬМАЯ
Никелированно......................... . . . ... .................. 235
1. Катодная поляризация при электроосаждеиии никеля........... 238
2. Анодный процесс........................................... 244
3. Никелевые ваииы............................................ 248
4. Снятие никелевых покрытий.................................. 272
5. Защитные свойства никелевых покрытий....................... 273
6. Экектроосаждеиие .черного никеля".......................... 277
7. Контроль никелевых ванн.................................... 282
ГЛАВА ВОСЬМАЯ
Хромирование....................................'................... 285
1. Теория процесса ........................................... 287
2. Состав электролита и его режим............................. 297
3. Твердость и пористость хромовых покрытий................... 322
4. Хромирование с промежуточными прослойками................. 327
5. Вентиляция................................................. 333
6. Снятие хромовых покрытий................................... 335
7. Методы анализа хромовых ванн............................... 335
ГЛАВА ДЕВЯТАЯ
Электролитическов лужение........................................... 339
1. Щелочные оловянные ванны................................... 34С
2. Кислые оловянные ваииы..................................... 345
3. Лужение без виешнего..тока................................. 35С
4. Контроль оловянных электролитов............................ 351
ГЛАВА ДЕСЯТАЯ
Свинцевание......................................................... 352
1. Применяемые электролиты и их режим......................... 354
2. Методы контроля свинцовых электролитов..................... 364
3. Электролитическое осаждение перекиси свинца................ 365
Редактор М. В. Румянцев. Техн, редактор М. Л. Темерлии
ТКК <№ 117. Договор № 3025. Изд № 23. Индекс МЦ-40-5-2. Тираж 2 000. Сдаи<
в набор 14/XI 1935 г. Подп. в печ. 19 VI 1936 г. Формат бумаги 62 X 94. Уч.-авд
лист. 72,5. Бум. лист.П1/^ Печати, знак, в бумажн. л. 101000. Заказ № 178J
Уполиом. Главл. В-32345. Выход в свет июль 1936 г.
3-я тип. ОНТИ им. Бухарина. Ленинград, ул. Моисеенко, 10.