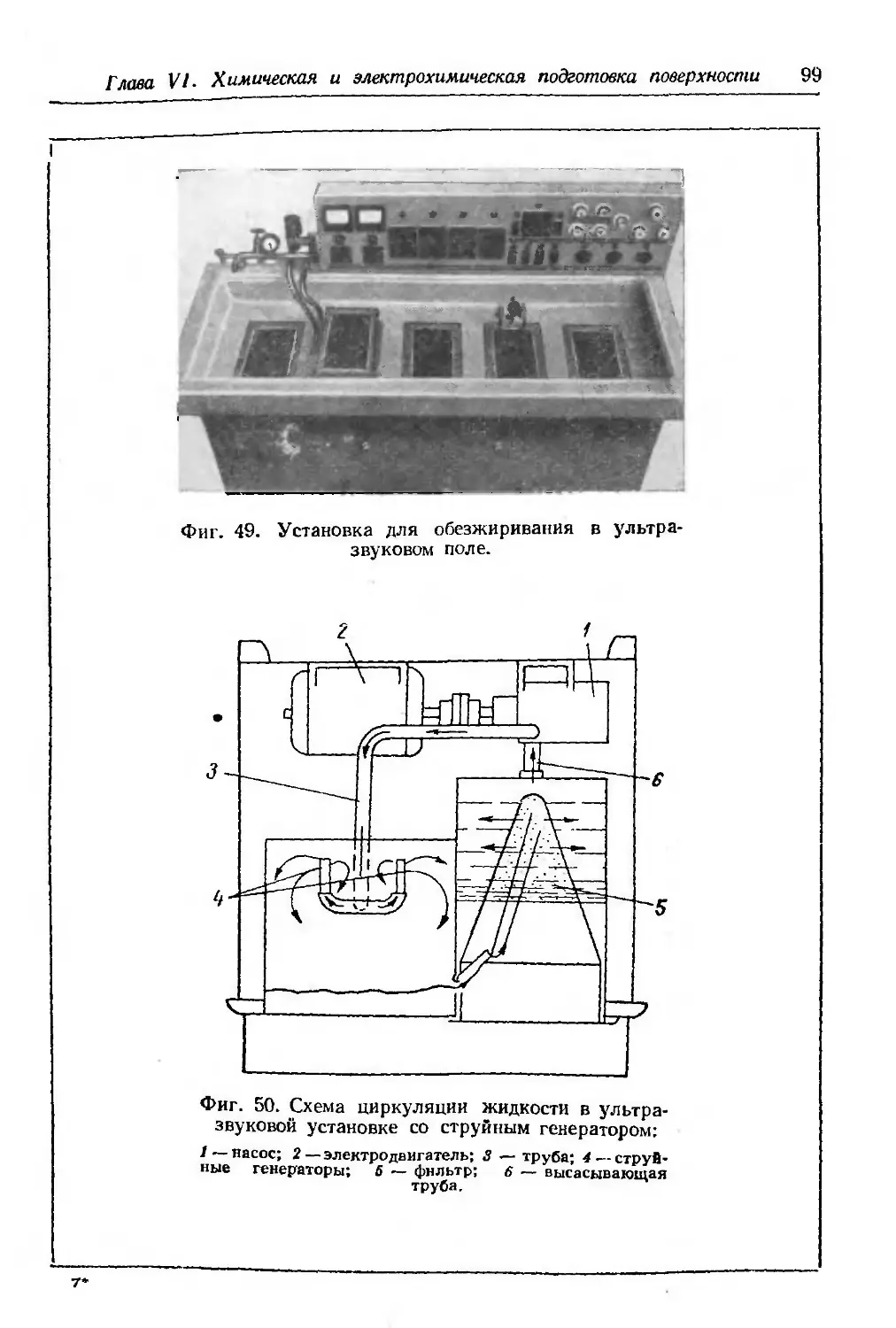
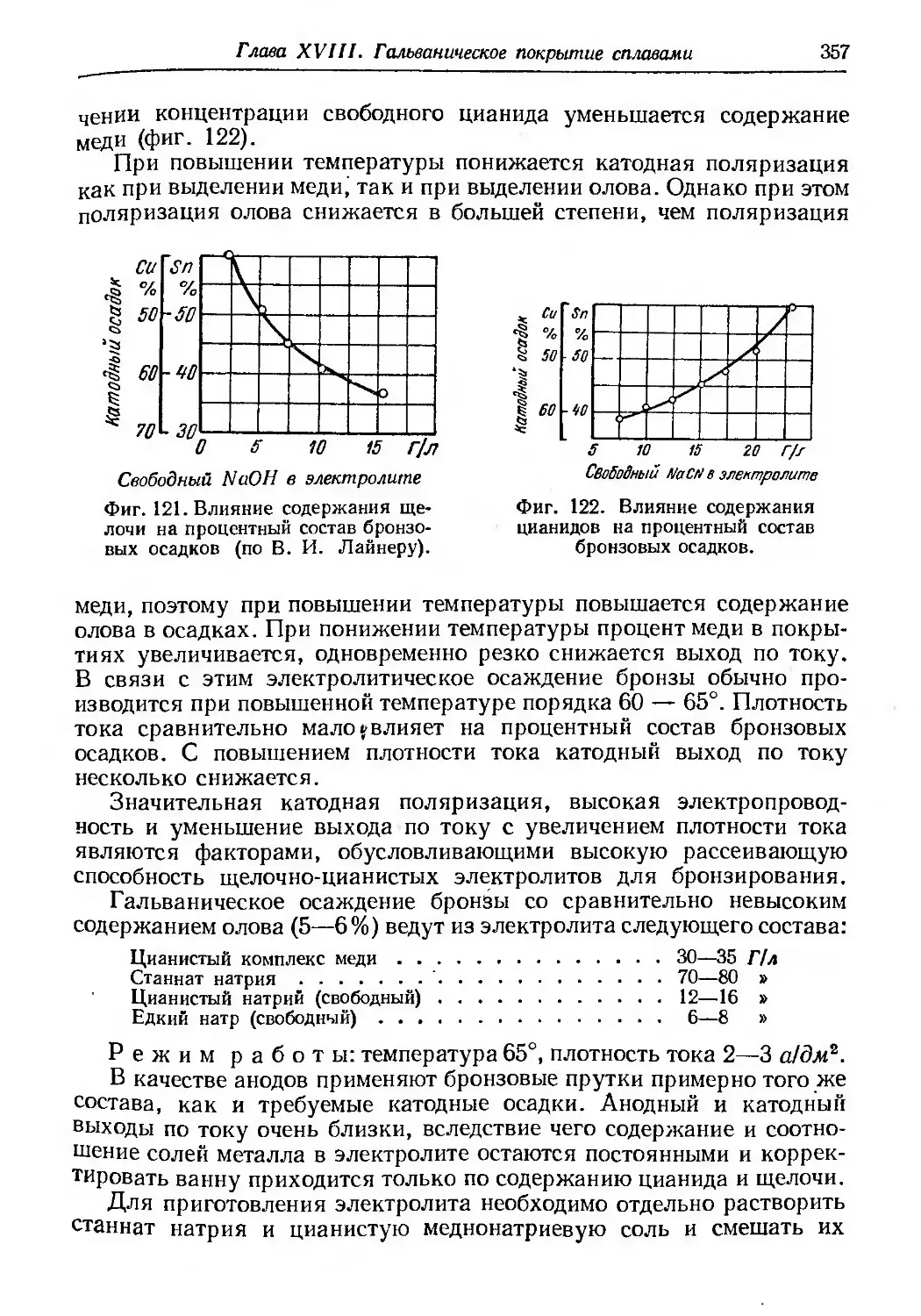
Текст
t
HBOOVWW
«eiHMvas'K
^hiptnakerri1
ВВЕДЕНИЕ
Коррозия металлов, т. е. разрушение вследствие электрохими-
ческого или химического воздействия среды, причиняет народному
хозяйству огромный вред. Ежегодно из-за коррозии выбывает
из строя около 33% всего вырабатываемого металла. Считают, что
примерно 60% корродированного металла используется для повтор-
ной переработки в металлургической промышленности. Таким обра-
зом, безвозвратные потери металла составляют около 10% от всего
вырабатываемого металла. К этому следует добавить преждевре-
менный выход из строя пораженных коррозией инженерных соору-
жений, судов, машин, приборов, станков, а также вызываемые
коррозией несчастные случаи, например взрывы котлов, обруши-
вания строительных ферм, аварии судов и т. п.
На защиту от коррозии ежегодно расходуются огромные суммы,
исчисляемые миллиардами рублей.
Вопросы борьбы с коррозией приобретают в Советском Союзе
особо важное значение в связи с резким увеличением в ближай-
шем будущем количества выплавляемого металла, производства
машин, станков, расширением строительства.
Для снижения потерь металла и предохранения.изделий от кор-
розии наряду с использованием химически стойких материалов
широко применяются различные виды защитных покрытий: лакокра-
сочные; металлические, оксидные и ряд других.
Лакокрасочные покрытия получают путем нане--
сения на поверхности деталей или изделий пленки лака или краски.
Лакокрасочные покрытия могут либо механически изолировать
поверхность металла от вредного действия внешней среды, либо могут
содержать активные пигменты — пассиваторы, оказываю-
щие пассивирующее действие на металл и затормаживающие процесс
коррозии.
Оксидирование, фосфатирование и хро-
матирование заключаются в создании на поверхности металла
неорганической защитной ш^енки путем химической или электро-
химической обработки деталей^-в специальных растворах. К этой
категории покрытий относятся-: оксидирование и фосфатирование
стали, оксидирование и хроматирование меди и медных сшгавов,
цинка, олова, алюминия и алюминиевых сплавов.
4
Введение
Гальванические покрытия получают путем оса-
ждения при помощи тока на поверхности деталей слоя металла
из электролитов, содержащих ионы данного металла. Широко при-
меняются гальванические покрытия цинком, медью, никелем, хро-
мом, оловом, кадмием, свинцом, серебром, а также сплавами медь—
цинк, медь—олово, свинец—олово, олово—никель и т. п.
Способ покрытия расплавленными метал-
лами (горячий способ) заключается в том, что изделия
или полуфабрикаты погружаются в ванну с расплавленным металлом
или же нагретую поверхность деталей натирают расплавленным
металлом. Горячие покрытия широко применяются для листового
материала или изделий, имеющих швы, требующие герметизации.
Они используются для нанесения металлов, имеющих низкую
температуру плавления, например цинка, олова, свинца и т. п.
К недостаткам горячего способа нанесения покрытий следует
отнести неравномерность толщины слоя и большой расход металла.
Способ непригоден для деталей сложной конфигурации и деталей,
имеющих узкие отверстия, а также резьбу.
Способ плакирования состоит в соединении слоев
нескольких различных металлов или сплавов прокаткой или про-
тяжкой при нагреве. Этот способ широко применяется для покрытия
железа медью, латунью, томпаком, нержавеющей сталью и т. п.,
а также для покрытия листов из алюминиевых сплавов чистым алю-
минием.
Диффузионный способ нанесения металлических
покрытий основан па диффузии в поверхностные слои деталей какого-
либо металла или сплава при высокой температуре. Диффузионные
покрытия наносятся при нагреве деталей в твердой (порошкооб-
разной), жидкой или газообразной фазе металла. Применяют диф-
фузионные покрытия цинком, алюминием, хромом, кремнием и т. п.
с целью повышения коррозионной устойчивости, износо- и жаро-
стойкости.
Способ металлизации распылением заключается
в нанесении на поверхность деталей или изделий слоя металла
путем распыления расплавленного металла. Широко применяется
металлизация цинком, алюминием, кадмием, никелем, свинцом,
оловом, медью, бронзой, нержавеющей сталью и др.
Разновидностью данного способа является распыление в вакууме.
Способ эмалирования состоит в нанесении на поверх-
ность изделий тонкого слоя стеклообразной массы, являющейся
продуктом сплавления кремнезема и алюмосиликатов с различными
плавнями (бура, селитра, криолит и т. п.), а также окислами метал-
лов (титан, кобальт, никель и др.).
Способ электронатирания позволяет наносить
покрытия без погружения изделий в ванну. Он удобен для нанесения
слоя незначительной толщины в малодоступных местах, а также для
Введение
5
покрытия небольших оголенных участков. Электронатиранием можно
нанести свинец, цинк, кадмий, серебро и другие металлы.
Химический способ позволяет наносить покрытия
из металлов или сплавов без применения электрического тока.
Осуществляется это с помощью веществ, способных восстанавливать,
металлы из растворов их солей. На практике находят применение
химическое серебрение и никелирование. В некоторых случаях метал-
лические покрытия могут быть получены при термическом разло-
жении газообразных соединений. Покрытия, получаемые химиче-
ским способом, отличаются равномерностью слоя, беспористостью
и могут достигать значительной толщины.
Способ контактного осаждения осуществляется
без применения внешнего источника тока, за счет вытеснения менее
благородными металлами более благородных из растворов их солей.
Толщина контактных покрытий, как правило, мала и защитные
свойства их невысоки. Контактные покрытия применяют для мелких
неответственных изделий. Стальные изделия покрываются контактно
медью, оловом, никелем, серебром, золотом и т. п.
Из перечисленных покрытий наиболее широкое использование
в промышленности нашли лакокрасочные, гальванические и горя-
чие покрытия.
Гальванические покрытия по механическим свойствам, чистоте,
коррозионной стойкости и экономичности являются одними из наи-
лучших. Возможность регулирования толщины слоя путем измене-
ния продолжительности процесса и плотности тока, возможность
уменьшения расхода цветных металлов на покрытие поверхности
выгодно отличают гальванический метод покрытия от других.
Гальванические покрытия могут применяться не только для
защиты деталей от коррозии, но и для придания их поверхности
ряда ценных специальных качеств: повышенной поверхностной твер-
дости, износостойкости, улучшенных антифрикционных свойств,
высокой отражательной способности и т. д. Нанесение гальва-
нических покрытий используют для восстановления изношенных
деталей, для облегчения пайки и т. д. Гальванические покрытия
позволяют во многих случаях заменить цветные металлы черными.
Советские ученые являются основоположниками многих важней-
ших методов нанесения покрытий. Создание гальванотехники —
заслуга русского ученого акад. Б. С. Якоби. Работы В. В. Петрова,
Э. X. Ленца и других крупных русских ученых явились основой
развития химических и электрохимических методов защиты метал-
лов. Большой вклад в развитие гальваностегии внесли своими
теоретическими и практическими работами советские ученые
В. А. Кистяковский, Н. А. Изгарышев, Г. В. Акимов, Ю. В. Бай-
маков, Н. П. Федотьев, В. И. Лайнер, Н. Т. Кудрявцев, К. М. Гор-
бунова, А. Т. Баграмян, А. П. Машовец, В. П. Машовец и мно-
гие другие.
6
Введение
До Великой Октябрьской социалистической революции потреб-
ность в применении защитных покрытий в России была весьма
ограничена. Индустриализация Советского Союза коренным образом
изменила положение. Потребность в защитных покрытиях неиз-
меримо возросла. Развитие машиностроения, приборостроения
и химической промышленности создало базу для внедрения пере-
довых методов нанесения защитных и декоративных покрытий.
Борьба за повышение срока службы машин, приборов, станков
и агрегатов, за экономию цветных металлов связана с использова-
нием эффективных методов защиты от коррозии и износа, вследствие
чего нанесение различных покрытий на металлы в настоящее время
применяется в широких масштабах.
За последние годы была проделана большая работа по стандарти-
зации и нормализации процессов нанесения покрытий. Введен ряд
стандартов на толщину покрытий, регламентированы многие методы
определения толщины и пористости слоя, в ряде отраслей промыш-
ленности введены эффективные составы электролитов и режимы
электролиза, разработаны типовые технологические процессы нане-
сения покрытий. Внедрены интенсифицированные методы покры-
тий: применяются реверсирование постоянного тока при электро-
лизе, перемешивание электролитов, непрерывная или периодиче-
ская фильтрация, подогрев электролитов, перенос деталей из ванны
в ванну при помощи автоматизированных тельферов и т. д.
На ряде передовых предприятий Советского Союза осуществлена
автоматизация и механизация электрохимических и химических
методов нанесения покрытий. Большие работы в области конструи-
рования отечественных автоматов для покрытий проведены
А. И. Андреевым, М. А. Тржецяком и М. Е. Фроловым. На многих
заводах установлены и успешно используются для нанесения
покрытий автоматы с программным управлением. Создаются уста-
новки и приборы для регулирования основных параметров режима
электролиза: температуры, плотности тока, кислотности и состава
электролита. В соответствии с решениями XXII съезда КПСС работы
по автоматизации и' механизации процессов нанесения покрытий
в ближайшие годы будут значительно расширены и ускорены.
Основной задачей учебника по курсу «Технология электрохими-
ческих покрытий» является ознакомление будущих техников-галь-
ваников с основами теории и практики нанесения защитных покры-
тий, с современными составами растворов и электролитов, приме-
няемыми на передовых предприятиях Советского Союза и за рубе-
жом. В учебнике приводятся также данные по приготовлению и кор-
ректированию электролитов и исправлению дефектов покрытий.
В последней главе даются краткие сведения, необходимые при выпол-
нении дипломного проектирования.
ЧАСТЬ ПЕРВАЯ
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ГАЛЬВАНОСТЕГИИ
ГЛАВА I
НЕКОТОРЫЕ ПОНЯТИЯ ИЗ ОБЛАСТИ ЭЛЕКТРОХИМИИ
Свойства электролитов и закономерности электролиза подробно
изучаются в курсах теоретической электрохимии. В данной главе
эти вопросы рассматриваются очень сжато и лишь для того, чтобы
облегчить учащимся понимание материалов последующих разделов
учебника. При этом уделено внимание ряду типовых расчетов,
повседневно встречающихся в гальваностегической практике.
1. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
Вода, даже тщательно очищенная от посторонних примесей,
обладает некоторой электропроводностью, т. е. является
электрол итом, хотя и "весьма слабым. Электропроводность
чистой воды обусловливается наличием в ней некоторого количества
ионов водорода и гидроксильных ионов, образованных вследствие
диссоциации воды:
Н2О = Н+ + ОН-.
Соотношение
к [Н+] [ОН-]
Л ~ [Н2О]
(1)
где квадратными скобками обозначена концентрация соответствую-
щих веществ, называется константой диссоциации
воды.
Ввиду незначительности диссоциации воды концентрацию недиссо-
циированных молекул [Н2О] можно считать практически постоян-
ной. Поэтому постоянным является и ионное произведение воды:
[Н+ 1 ЮН" 1 = const = Kw. (2)
При 25* — К)-14. Важно отметить, что величина эта является
постоянной не только для чистой воды, но и для всех водных раство-
ров вообще.
8
Часть первая. Теоретические основы гальваностегии
В нейтральном растворе или в чистой воде [Н + ] = [ОН 1,
поэтому
[Н + ] = ЮН" ] = У^= Ю-7 Г-ион/л. (3)
По предложению Зёренсена отрицательный лога-
рифм концентрации водородных ионов был
назван pH раствора.
Следовательно,
pH = — lglH + ], или [Н + ] = 10_рН. (4)
Согласно формуле (3), для нейтрального раствора, для которого
[Н + ] = IO"’, pH = 7.
Из сказанного следует, что чем меньше [Н+ ], тем больше pH.
Из уравнения (2) видно, что
lg[H+ ] + 1g ЮН’] = Igl/Cj = -14
или
-lg[H4-lglOH-] =-lg[/CJ = 14; (5)
pH + pOH = pKw = 14.1
Подкисляя раствор, мы увеличиваем концентрацию ионов водо-
рода, а концентрация ионов гидроксила уменьшается в соответствии
с уравнением (2); pH раствора уменьшается. При подщелачивании
раствора наблюдается обратная картина.- Схематически это взаимо-
отношение может быть представлено следующим образом:
раствор
Нормальность кислот и оснований связана с pH растворов,
как показано в табл. 1.
Величиной pH обычно пользуются для растворов начиная от
1-н. концентрации (по кислоте или щелочи) и ниже. Для более
концентрированных растворов кислот и щелочей пользуются только
понятием нормальности.
1 По аналогии с pH стали употреблять обозначения рОН = (—1g [ОН |),
РКШ = (—1g Kw) и т. п.
Глава I. Некоторые понятия из области злектрохимии
9
Таблица 1
Расчетные значения pH растворов различных концентраций 1
Концентрация кислоты в Г-экв/л (нормальность) Концентрация щелочи в Г-экв/л (нормальность) [н+] [он-] ig 1 н+] pH
10 10 + 1 IO-*5 1 —1
1 IO" Ю-и 0 0
10-1 10-1 IO-'3 —1 1
10-2 IO'2 Ю-I2 —2 2
IO’3 IO"3 10-п —3 3
10-« io-* 10-ю —4 4
10“в 10-5 IO"9 —5 5
10-0 Ю-о IO"8 —0 6
10'7 ю-’ ю-’ —7 7
10'» 10-8 IO'® —8 8
10-6 IO-» IO’5 —9 9
10--* IO’10 ю--* 10 10
IO’3 IO’11 IO”3 -11 11
10“2 10-12 10“2 — 12 12
10-1 10-!3 io-* — 13 13
1 Ю-M 10° -14 14
10 10-ю IG-4-i —15 15
1 Истинные значения pH несколько отличаются от приведенных здесь величин, так как прн расчете не учтены степень диссоциации и различие между концентра- цией и активностью нонов.
2. БУФЕРНЫЕ РАСТВОРЫ
Добавление кислоты или щелочи во многие солевые растворы
приводит к значительно меньшему сдвигу pH по сравнению с вели-
чинами, приведенными в табл. 1 для чистой воды. Способность таких
растворов противостоять изменению pH называется буферным
действием.
Буферное действие растворов имеет большое практическое зна-
чение при проведении процессов, требующих постоянства pH, в том
числе процессов электролитического осаждения многих металлов.
Специально подбираемые составы с сильно выраженными буфер-
ными свойствами в. той или иной области pH получили название
буферных смесей. Как правило, они содержат слабую
кислоту или основание и соль этой кислоты или основания. Буферное
10
Часть первая. Теоретические основы гальваностегии
действие их связано с подавлением диссоциации кислоты или осно-
вания при введении в раствор ионов водорода или гидроксила.
Оно может быть иллюстрировано на примере смеси, состоящей
из 0,1-н. раствора СН3СООН и 0,1-н. раствора CH3COONa.
Концентрация ионов водорода в этой смеси вычисляется из рав-
новесия
СН3ССЮН^СН3СОО" + н+.
Константа диссоциации равна
к _ [СН3СОО-] [Н+]
х [СН3СООН] ’
откуда концентрация водородных ионов
rTJ+l ____________________ 1Z [СН3СООН] .7.
[Н ] - к [CHsCOO_j - (')
Поскольку степень диссоциации слабой уксусной кислоты мала,
то концентрацию аниона СН3СОО" можно приравнять к концен-
трации, получаемой в результате диссоциации соли, для которой
[СН3СОО-] _
[CH3COONa]
где а — степень диссоциации соли.
Поэтому значение [Н + ] можно выразить в виде
гн+1 - к [СНзСООН] я
[Н 1 “ -К [CH3COONa] а •
Это соотношение называют формулой буферной
смеси.
Подставляя значение К, равное 1,86-10'6, и значение а для
0,1-н. раствора CH3COONa, равное 0,79, найдем
[Н+] = 1,86-10~6 р О’* /9 =2,35-10- или pH = 4,627.
Итак, мы определили концентрацию водородных
ионов в буферной смеси. Покажем теперь, как выражается буфер-
ное действие этой смеси.
Пусть данная буферная смесь разбавлена в 10 раз (т. е. вместо
0,1-н. взята 0,01-н.).
Степень диссоциации соли при таком разбавлении возрастет
до 0,87. Тогда
[Н+] = 1,86-10~Б-^^7 = 2,14-10- или pH = 4,67.
Доведем теперь разбавление уксусной кислоты и ее соли до 0,001-н;
тогда
с; = 1, [Н+] = 1,86-10-, или pH = 4,73.
Глава I. Некоторые понятия из области электрохимии
11
На примере видно, что буферный раствор при изменении кон-
центрации в широких пределах сохраняет pH на постоянном уровне.
В практике гальваностегии буферные смеси применяются в галь-
ванических ваннах и в качестве эталонных растворов для измере-
ния концентрации водородных ионов колориметрическим и электро-
метрическим методами.
Ниже приводятся некоторые буферные смеси, применяемые для
изготовления растворов с соответствующими интервалами pH:
С3Н4 (ОН) (СО2Н)3 + Na2HPO4......................2,2—8,0
СН3СООН + CHgCOONa...............................3,8—5,6
Na2HPO4 + КН2РО4................................. 5,3—8,0
Н3ВО3 + Na2B4O7................................ . 6,8—8,4
Na2B4O7 + NaOH ...................................9,2—12,3
Na2HPO4 + NaOH.................................... 11,0—12,0
^ЗАКОНЫ ЭЛЕКТРОЛИЗА И ИХ ПРИМЕНЕНИЕ В ГАЛЬВАНОТЕХНИКЕ
Явление электролиза с количественной стороны впервые было
изучено Фарадеем, которому принадлежит честь открытия следующих
двух важнейших законов электрохимии.
1. Количество вещества, которое окисляется на аноде или вос-
станавливается на катоде, пропорционально количеству протекшего
электричества:
т — aQ, (9)
где т — количество граммов вещества,к которое окисляется или
восстанавливается у электродов при прохождении Q куло-
нов электричества;
а — коэффициент пропорциональности, зависящий от экви-
валентного веса.
2. Количества окисляющихся или восстанавливающихся на элек-
тродах веществ при прохождении одного и того же количества
электричества пропорциональны эквивалентным весам:
т = ЬМ, (10)
где М — эквивалентный вес данного вещества;
b — коэффициент пропорциональности, зависящий от вели-
чины Q.
Общим выражением для обоих законов служит уравнение
т= cMQ, (11)
где с зависит только от единиц измерения величин т и Q.
Если т выражено в граммах, a Q в кулонах, то с представляет
собой количество вещества, окисляющегося на аноде или восста-
навливающегося на катоде при прохождении единицы количества
электричества, и носит название э ле кт р о х и м и ч ес к ого
эквивалента.
12
Часть первая. Теоретические основы гальваностегии
Электрохимические эквиваленты и некоторые другие данные
для различных металлов приведены в табл. 2.
Таблица 2
Электрохимические эквиваленты и другие характеристики простых веществ
Элемент Химиче- ское обо- значение Атомный вес Валент- ность Эквива- лентный вес Электрохи- мический эквивалент Удельный вес. г; см*
мГ/ку л Г fa-ч
Водород и 1,008 1 1,008 0,010 0,0376 0,09’
Железо Fe 55,85 3 18,61 0,193 0,694 7,8
Золото Au 197,20 3 65,73 0,681 2,452 19,5
Золото Au 197,20 1 197,20 2,043 7,357 19,5
Индий In 114,76 3 38,25 0,399 1,429 7,31
Кислород О 16,0 2 8,0 0,083 0,298 1,431
Кобальт Co 58,94 2 29,47 0,204. 0,733 8,5
Медь Си 63,57 2 31,78 0,329 1,186 8,9
Медь Си 63,57 1 63,57 0,658 2,372 8,9
Никель Ni 58,69 2 29,34 0,304 1,095 8,8
Олово Sn 118,70 4 29,67 0,307 1,107 7,3
Олово Sn 118,70 2 59,35 0,615 2,214 7,3
Палладий Pd 106,7 2 53,35 0,551 1,99 11,9
Платина Pt 195,23 4 48,83 0,506 1,821 21,45
Платина Pt 195,23 2 97,65 1,012 3,642 21,45
Родий Rh 102,91 2 51,45 0,533 1,920 12,44
Свинец Pb 207,21 2 103,60 1.074 3,86 11,4
Серебро Ag 107,88 1 107,88 1,118 4,025 10,5
Хром Cr 52,01 6 8,66 0,090 0,323 6,5
Цинк Zn 65,38 2 32,69 0,339 1,22 7,0
1 Удельный вес водорода .и кислорода выражен в Г/л.
При т = М из уравнения (11) следует, что
(12)
где F — количество электричества, при прохождении которого
у каждого из электродов окисляется или восстанавливается
один грамм-эквивалент вещества; это количество электри-
чества, равное 96 500 к (26,8 а-ч), называется постоян-
ной Фарадея, или Фарадеем.
Глава I. Некоторые понятия из области электрохимии
13
Из уравнений (11) и (12) следует:
т=М® ^cQ^cIt, (13)
где I -— сила тока,
t — время.
Уравнение (13) позволяет найти т для данного вещества при
прохождении через электролизер Q кулонов электричества или
найти Q, если известно т.
Электролизеры, служащие для определения количества электри-
чества, называются кулометрами. Для точной работы куло-
метра необходимо, чтобы в нем протекал лишь один электрохимиче-
ский процесс без каких-либо побочных реакций и чтобы продукты
электролиза поддавались точному взвешиванию или измерению.
Этим условиям удовлетворяет ряд кулометров (серебряный, мед-
ный, ртутный и др.). Простейшим и наиболее доступным из них
является медный кулометр. Электролитом для данного кулометра
служит 10—20-процентный водный раствор сернокислой меди,
в который добавляется серная кислота (из расчета 50 Г на 1 л элек-
тролита) и этиловый спирт (50 Пл).1
Материалом для электродов служит медь. Поверхность катода
должна быть в несколько раз больше поверхности анода.
Медный кулометр находит широкое применение в электрохими-
ческой практике.
На электродах при электролизе часто протекают два или несколько
электрохимических процессов, один из которых в зависимости
от назначения электролиза рассматривается как главный, а осталь-
ные — как побочные. Так, например, при электроосаждении метал-
лов, стоящих в ряду напряжений выше водорода, часть электри-
чества расходуется на выделение водорода. Для этих процессов глав-
ным является осаждение металла, а побочным — выделение водорода.
Законы Фарадея не указывают, какое из веществ в растворе
подвергается при электролизе изменению, а только выражают
зависимость между прошедшим количеством электричества и коли-
чеством грамм-эквивалентов всех веществ, претерпевающих хими-
ческие изменения в результате электролиза. Следовательно, при
применении законов Фарадея должны быть учтены как главные,
так и побочные процессы.
Однако, поскольку электролиз ведется с целью получения какого-
либо определенного продукта, появляется необходимость в опре-
делении доли израсходованного на этот процесс электричества.
1 Подкисление раствора необходимо для предотвращения образования закиси
меди; спирт добавляется для получения плотного мелкокристаллического осадка
на катоде.
14
Часть первая. Теоретические основы гальваностегии
Для этого было введено понятие выхода по току т], опре-
деляемое отношением количества вещества, фактически полученного
при электролизе тф, к теоретическому количеству его тТ, рассчи-
танному по закону Фарадея в предположении, что побочные про-
цессы отсутствуют:
= (14)
1 тт ' 7
Подставляя вместо
ния (13) и выражая т]
тт эквивалентную ему величину из уравне-
в %, получим
Л = 100.
1 cQ
(15)
Выход по току различных металлов, осаждаемых в гальваниче-
ских ваннах, приведен в табл. 3.
Таблица 3
Выход по току металлов для некоторых гальванических ванн
Металл покрытия Выход по току в %
Свинец 90—100
Бронза 95—100
Хром (блестящий) 8—12
Хром (твердый) 12—28
Кадмий (из кислого электролита) 85—95
Медь (из цианистого электролита) 40—75
Медь (из кислого электролита) 95—100
Латунь - 60—85
Никель 90—100
Серебро 95—100
Цинк (из цианистого электролита) 75—95
Цинк (из кислого электролита) 95—100
Цинк (из цинкатного электролита) 85—100
Олово 70—95
Золото 90
В электрохимических расчетах часто пользуются величинами
катодной и анодной плотности тока, определяя их как силу тока,
приходящуюся на единицу площади данного электрода:
= (16)
= (17)
ьа
Глава I. Некоторые понятия из области электрохимии
15
где DK и Da — катодная и анодная плотности тока в а!дм2;
sK и sa — площади катода и анода в дм2;
I — сила тока, идущего через ванну, в а.
В ряде случаев, например, если продукты реакции при электро-
лизе остаются растворенными в электролите, важно знать силу тока,
приходящуюся на единицу объема электролита. Эта величина назы-
вается концентрацией тока, или объемной плот-
ностью тока, и определяется соотношением
<18>
где^/ — сила тока в а;
V — объем электролита в л;
i — объемная плотность тока в а/л.
Если анод отделен от катода пористой перегородкой, то различают
концентрацию тока в катодном iK и анодном ia пространстве (като-
лите и анолите), и тогда
iK = 4~' ' <19>
V к
ia=4~' <20>
v а
где Ел и Va — соответственно объемы католита и анолита.
Широкое применение законы Фарадея находят в гальванотехнике
для определения количества осаждающегося при электролизе
металла, толщины получаемых покрытий и продолжительности про-
цесса электролиза.
При этом пользуются следующими формулами:
1) определение веса подлежащего осаждению металла в Г
т = 106ys, (21)
где ё — толщина слоя покрытия в мм;
у — удельный вес осаждаемого металла в Псм&;
s — поверхность, подлежащая покрытию, в дм2;
2) определение веса осаждаемого металла в зависимости от вре-
мени электролиза, силы тока и выхода по току
где с — электрохимический эквивалент в Па-ч;
I — сила тока в а;
t — время электролиза в час.;
т] — выход по току в процентах;
16
Часть первая. Теоретические основы гальваностегии
3) определение толщины слоя металла (в мм), отлагаемого
на катоде, в зависимости от плотности тока и времени электролиза
где DK—катодная плотность тока в а/дм2‘,
4) определение времени (в час.), потребного для получения слоя
определенной толщины при данной плотности тока
5) определение силы тока, необходимой для получения слоя
определенной толщины в заданное время
, ду 1000 /о. .
; = Л^г; <24а>
6) определение выхода по току в процентах:
n = JpOO. (25)
Формулы (22) и (25) отличаются от формулы (13) наличием в них
величины выхода по току в данных условиях электролиза; формулы
(23) и (24) получены из равенства правых частей формул (21) и (22),
с учетом формулы (16).
Используя соответствующие данные табл. 2 и 3, с помощью
формул (22)—(24) можно построить графики, показывающие зави-
симость толщины или веса покрытия от продолжительности осажде-
ния в данных условиях электролиза. Они очень удобны для практи-
ческого пользования.
Ниже приведены некоторые типовые задачи и примеры, решаемые
на основании законов электролиза.
1. Найти вес олова, осажденного на поверхности размером
15 дм2, слоем толщиной 0,015 мм.
Подставляя в формулу (21) приведенные в условиях задачи зна-
чения толщины слоя олова, размер поверхности и уд. вес олова 7,3
(см. табл. 2), получим
т = lOSys = 10 X 0,15 X 7,3 х 15 = 16,425 Г.
2. Найти вес осадка серебра, осажденного на изделиях с общей
поверхностью 100 дм2\ толщина слоя 0,001 мм.
Подставляя в формулу (21) данные из условий задачи и учитывая,
что удельный вес серебра составляет 10,5, получим
т = lOSys = 10 X 0,01 X 10,5 X 100 = 10,5 Г,
т. е. удельному весу серебра.
3. Сколько меди выделится из раствора сернокислой меди при
пропускании через ванну 125 к электричества?
Согласно формуле (13),
т = cQ.
Глава 1. Некоторые понятия из области электрохимии
17
Подставляя вместо с значение электрохимического эквивалента
меди 0,329 мг/а-сек (табл. 2) и вместо Q — количество кулонов по усло-
виям задачи, получим количество выделившегося металла (прини-
мая т] = 100/6):
т = 0,329 X 125 = 41,1 мГ.
4. Сколько граммов меди выделится из раствора сернокислой меди
в течение 15 мин. при силе тока 24 а?
Для решения этой задачи воспользуемся тем же уравнением (13)
т = clt.
Подставляя значение с в Г!а-ч для меди из табл. 2 и значения I и t
соответственно в а и час. из условий задачи, получим количество
выделившейся при электролизе меди в Г:
т = 1,186 X 24 X 0,25 = 7,116 Г.
5. Сколько металла выделится на 1 дм2 поверхности изделия
в никелевой ванне, если плотность тока DK = 1,8 а!дм2, продолжи-
тельность покрытия t = 0,75 час., выход по току т] = 90%; электро-
химический эквивалент никеля с — 1,095 Г/а-ч?
Подставляя значения перечисленных величин в формулу (22)
получим
1,095x1,8 x 0,75 x 90 , QQ
т =---------(об-------= !’33 Г ’
6. Чему равна толщина слоя цинкового покрытия, полученная
в течение 1,5 час., при плотности тока 0,75 а!дм2 и выходе по току
90 %?
Задача решается с помощью уравнения (23):
х cDKti\ 1,22 x 0,75 x 1,5x90 nn1o
6 = W =-----------ЮООхЛО-----= 0.018 мм.
7. Сколько времени требуется для получения слоя никеля тол-
щиной 10 мк (0,01 мм), если плотность тока равна 1,5 а!дм2, а выход
по току составляет 85 % ?
Задача решается с помощью формулы (24):
dylOOO _ 0,01x8,8x1000
cDKr\ ~ 1,095x1,5x 85
= 0,63 час.
8. При прохождении через ванну 53,6 а-ч электричества на катоде
выделилось 200 Г свинца. Найти выход по току.
По закону Фарадея, при пропускании 26,8 а-ч на катоде должен
выделиться 1 Г-экв (103,6 Г) свинца, а 53,6 а-ч электричества должны
выделить соответственно 2 Г-экв, т. е. 207,2 Г свинца. Так как фак-
тически выделившееся количество свинца составило 200 Г, то выход
по току равен отношению 207°2 = 9,965 или 96,5%.
2
Вайнер и Да соя н
18
Часть первая. Теоретические основы гальваностегии
4. ПОЛЯРИЗАЦИОННЫЕ ЯВЛЕНИЯ ПРИ ЭЛЕКТРОЛИЗЕ
Как известно из курса электрохимии, между раствором и погру-
женным в него металлом возникает разность потенциалов, обуслов-
ливаемая обменом ионами между твердой и жидкой фазами. Потен-
циал металла относительно раствора его соли выражается уравне-
нием Нернста
<Р = Ф° + -^1пС, (26)
где с — концентрация раствора;
<р — равновесный потенциал;
<р° — значение нормального потенциала (при с = 1).
Прохождение электрического тока через границу металл — рас-
твор сопровождается сдвигом потенциала. Явление это называется
поляризацией. Причины поляризации могут быть различ-
ными. Важнейшие из них рассмотрены ниже.
Концентрационная поляризация
Электролитическое выделение металла сопровождается убылью
его ионов из слоя электролита, непосредственно примыкающего
к поверхности катода. Чем выше плотность тока, тем интенсивнее
идет уменьшение концентрации разряжающихся катионов в при-
катодном слое жидкости. Изменению концентрации препятствует
приток ионов из более отдаленных слоев раствора за счет процессов
диффузии и миграции (движения ионов вдоль силовых
линий под воздействием электрического поля). Значительное влияние
оказывает также перемешивание электролита — искусственное или
естественное вследствие конвекционных потоков.
Скорость диффузии пропорциональна градиенту концентрации
ионов. Миграция ионов определяется долей тока, переносимой
ионами осаждаемого металла (их «числом переноса»). Конвекция
раствора зависит от взаимного расположения электродов, их кон-
фигурации, скорми сосуда и ряда других факторов.
Сразу после включения тока, пока градиент концентрации отсут-
ствует, скорость диффузии ионов в направлений катода равна нулю,
конвективное перемешивание тоже отсутствует. По мере убыли
катионов осаждаемого металла из прикатодного пространства про-
цесс диффузии ускоряется, усиливается также и конвекция вследствие
изменения удельного веса слоя жидкости, прилегающего к катоду.
Если скорость осаждения металла постоянна (т. о электролиз
ведется при постоянной силе тока), то спустя некоторое время уста-
новится стационарное состояние, при котором суммарная скорость
доставки ионов сравняется со скоростью их разряда. Это состояние
характеризуется определенной концентрацией разряжающихся
Глава I. Некоторые понятия из области электрохимии
19
ионов около поверхности катода, более или менее отличающейся
от концентрации их в объеме электролита.
Так как потенциал электрода зависит от концентрации ионов
в соприкасающемся с ним растворе, то потенциал катода при про-
хождении тока будет отличаться от равновесного потенциала на вели-
чину, определяемую уравнением
= (27)
Фиг. 1. Схема электролитической ячейки
для изучения концентрационной поля-
ризации.
где фраек — равновесный потенциал;
Ф — потенциал катода при прохождении тока;
с0 — концентрация ионов металла в объеме раствора;
с — концентрация ионов металла около поверхности катода.
Сдвиг потенциала
Аф = фра№—Ф (28)
называется концентра-
ционной поляриза-
цией. Чтобы дать количествен-
ное выражение для концентра-
ционной поляризации, надо най-
ти связь между плотностью тока
и концентрацией ионов у по-
верхности катода.
В общем виде эта зависимость
достаточно сложна и вряд ли
может быть выражена в мате-
матической форме, так как диффузия ионов и конвекция электро-
лита зависят от большого числа зачастую трудно учитываемых
факторов. В частных случаях задача может быть решена.
Для примера разберем один из наиболее простых случаев. Пред-
ставим себе, что электролиз раствора азотнокислого серебра, содер-
жащего кроме того какую-либо индиферентную соль, ионы которой
не принимают участия в электродных реакциях (например, KNO3),
проводится в электролизере, форма которого показана на фиг. 1.
Катод в этом сосуде помещен в узком боковом отростке, благодаря
чему практически устраняется конвективное движение жидкости.
Присутствие достаточного количества индиферентной соли сводит
к минимуму роль миграции ионов Ag+ к катоду, так как ток в основ-
ном будет переноситься ионами калия. В выбранных условиях под-
вод ионов серебра к катоду будет осуществляться только за счет
процесса диффузии.
Количество Г-ионов вещества, проходящее через 1 см2 попереч-
ного сечения электролита вблизи катода за одну секунду, выра-
жается уравнением
/7 — D t. (29)
2*
20
Часть первая. Теоретические основы гальваностегии
где ё — расстояние от катода, на котором имеется градиент кон-
центрации ионов (толщина так называемого «диффузного
слоя»);
П — диффузионный поток;
D — коэффициент диффузии ионов;
с0— концентрация ионов Ag+ в объеме электролита;
с — концентрация ионов Ag+ у поверхности катода.
Так как после установления стационарного состояния диффу-
зионный поток и скорость разряда ионов равны, то
i = nF D^~c} ; (30)
здесь i — катодная плотность тока в а!см\
п — валентность ионов, в данном случае равная единице;
F — число Фарадея.
Как видно из уравнения (30), максимальное значение плотности
тока соответствует с = 0. Физически это обозначает, что все ионы,
достигающие катода, немедленно разряжаются; возможность доставки
ионов путем диффузии использована полностью. Это максимально
возможное значение плотности тока получило название пре-
дельной плотности тока.
Для предельного тока уравнение (30) перепишется в виде
(31)
Уравнение (30) можно переписать следующим образом:
= ------------(32)
д о о \ с„ ) v '
или, учитывая (31),
Отсюда
и, подставляя это выражение в уравнение (27) и (28), получим
= фрав« — ф = — 1п (1 — . (35)
Уравнение (35) дает искомую связь между концентрационной
поляризацией и плотностью тока. Величина id является постоянной
для данных условий электролиза и может быть определена экспе-
Глава 1. Некоторые понятия из области электрохимии
21
риментально путем снятия поляризационном кривой. Форма послед-
ней в нашем простейшем случае показана на фиг. 2.
Конвективное движение жидкости и другие явления, сопрово-
ждающие электролиз в реальных практических условиях, искажают
зависимость, выражаемую уравне-
нием (35), однако оно может быть
использовано для качественной
характеристики некоторых общих
закономерностей электродных про-
цессов, сопровождающихся чисто
концентрационной поляризацией.
Исследование уравне-
ния концентрационной
поляризации
Фиг. 2. Зависимость плотности тока
„ . _ . ~ от потенциала электрода при концеи-
При I 0 Дф О, Т. е. при трационной поляризации.
отсутствии тока поляризация элек-
трода также .отсутствует. При увеличении плотности тока ф сдви-
гается в отрицательную сторону из-за уменьшения концентрации
потенциалобразующих ионов у поверхности катода.
При малых плотностях тока, когда можно считать Uid < 1,
уравнение (35) принимает более поостой вид:
. RT i
(36)
Это значит, что при малых плотностях тока концентрационная
поляризация пропорциональна плотности тока и обратно пропор-
циональна предельному значению последней.
Когда плотность тока приближается к предельному значению,
поляризация по абсолютной величине неограниченно растет. Дей-
ствительно, подставляя в уравнение (26) с — 0, получим ф = —со
(фиг. 2).
Этот вывод вытекает из предположения о возможности проте-
кания только одной электродной реакции. В действительности,
однако, при возрастании Дф становятся возможны другие электро-
химические процессы, например, выделение водорода, благодаря
чему задерживается дальнейшее изменение потенциала.
Уравнение (35) для использования его в дальнейшем целесооб-
разно несколько видоизменить.
Количество Г-ионов катионов, разряжающихся в единицу вре-
мени на единице поверхности электрода, равно отношению UnF,
где i — плотность тока.
Количество грамм-ионов катионов, приносимых током к катоду,
будет меньше, чем UnF, так как часть тока переносится анионами.
Число грамм-ионов катионов, приносимых током к катоду, равно
22
Часть первая. Теоретические основы гальваностегии
it/nF, где t — число переноса катионов при отсутствии в растворе
других электролитов.
Следовательно, скорость уменьшения концентрации катионов
в прикатодном слое v составит
n = — 4г(1— 0- (37)
Если в растворе присутствуют другие электролиты, катионы
которых не разряжаются, то доля тока, переносимого разряжаю-
щимися катионами, будет меньше и составит xt, где х < 1. Коэффи-
циент х представляет собой отношение удельной электропроводности
электролита, катион которого разряжается, к сумме удельной элек-
тропроводности всех присутствующих в растворе электролитов.
Например, если электролит состоит из смеси солей AgNO3 и KNO3 то
л -— -----:----—— ,
xAgNO3 + XKNO3
здесь к — удельные электропроводности соответствующих солей.
Следовательно, в общем случае, т. е. когда при составлении
раствора используется не один, а несколько электролитов, фор-
мула (37) должна быть записана так:
v^-^ril-xt). (39)
Скорость подачи катионов к поверхности катода за счет диффу-
зии va равна
v2 = D (с0 — с).
Обозначения D, с0 и с имеют прежние значения.
В установившемся процессе электролиза = v2, т. е.
Г>(с0 — с) =-^(1— xt),
или
С-С
с ~ с° DnF
Кроме того, из этого же уравнения следует:
. _ nFD (св — с)
1 — xt
или при с —> О и i -> id
. _ nFDc0
td ~ 1 —х/ ’
(40)
(41)
(42)
(43)
(44)
Уравнения (35), (42) и (44) будут использованы в гл. IH при
рассмотрении влияния различных факторов на качество гальвани-
ческих покрытий.
Глава I. Некоторые понятия из области электрохимии
23
Электрохимическая поляризация
Общие сведения
Электродные реакции обычно проходят ряд стадий. Например,
реакция выделения водорода при электролизе может быть пред-
ставлена следующей схемой:
Н3О+ Н+ -> Н -> Н2^ H2f.
Гидратированный ион водорода, подходя к поверхности катода,
дегидратируется, т. е. освобождается от гидратной оболочки; затем,
нейтрализуясь электроном, переходит в атомарное состояние; два
атома водорода объединяются в молекулу водорода. Наконец,
молекулярный водород насыщает раствор и выделяется в виде пузырь-
ков газа.
Естественно, что скорость суммарного процесса
2Н3О+ + 2е -> 2Н2О + Н2 f
определяется скоростью наиболее медленной из перечисленных ста-
дий. В большинстве случаев катодного выделения водорода такой
стадией является разряд ионов
Н+ + е Н.
Скорость этой реакции увеличивается при смещении потенциала
электрода в отрицательную сторону. Связь между* потенциалом
электрода и плотностью тока выражается полулогарифмическим
уравнением
Дф = а + b 1g i, (45)
где Дф — поляризация (перенапряжение) катода;
а и b — постоянные, зависящие от условий проведения про-
цесса.
Пока разряд ионов Н+ остается «узким местом», весь процесс под-
чиняется этому уравнению. Так как разряд ионов — реакция элек-
трохимическая, то и связанное с ней смещение потенциала (пере-
напряжение) называют электрохимическим.
Первоначально уравнение (45) было найдено эмпирически
и по имени исследователя стало называться уравнением Тафеля.
Позже оно было выведено из теоретических соображений.
Перенапряжение водорода и его зависимость от условий про-
ведения электролиза изучены достаточно подробно. Для нас эти
данные представляют интерес с двух точек зрения.
Во-первых, выделением водорода сопровождается осаждение
многих металлов, в том числе наиболее распространенных в гальва-
нической практике — Zn, Ni, Сг. Выделение водорода является
здесь побочным процессом, уменьшающим выход металла по люку
и вызывающим ряд осложнений в работе ванн.
24
Часть первая. Теоретические основы гальваностегии
Во-вторых, осаждение металлов тоже сопровождается более или
менее значительной поляризацией. Во многих случаях и здесь
наиболее медленной стадией является электрохимическая реакция
разряда катионов.
Поскольку явление перенапряжения наиболее полно изучено
применительно к процессу выделения водорода, укажем на не-
которые закономерности этой реакции, лежащей в основе многих
электрохимических процессов.
Многочисленными исследованиями установлено, что перенапря-
жение водорода зависит от природы металла, плотности тока, тем-
пературы раствора, концентрации водородных ионов и ряда дру-
гих факторов. В неявной форме они входят в уравнение Тафеля,
определяя значение констант а и Ь.
Так, постоянная а зависит от материала катода. В табл. 4 при-
ведено ее значение для различных металлов.
Таблица 4
Значения констант а и b уравнения Тафеля для различных металлов
Материал катода Состав электролита а. в Ь
Свинец 1,0-н. H2SO4 1,56 0,110
Ртуть , 1,0-н. H2SO4 1,415 0,140
Кадмий 1,3-н. H2SO4 1,40 0,120
Цинк 1,0-н. H2SO4 1,24 0,118
Медь 1,0-н. H2SO4 0,80 0,115
Железо 1,0-и. НС1 0,70 0,125
Вольфрам 1,0-н. НС1 0,23 0,040
Платина 1,0-н. НС1 0,1 0,13
Из данных таблицы следует, что выделение водорода на свинце,
ртути, кадмии и цинке значительно затруднено по сравнению с метал-
лами группы железа, вольфрамом и платиной. Значение постоян-
ной Ь, напротив, почти одинаково для всех металлов.
Если зависимость, выражаемую уравнением Тафеля, представить
в графическом виде, отложив по оси ординат величину перенапря-
жения в вольтах, а по оси абсцисс — логарифм плотности тока
в alcjA2, то мы получим прямую, изображенную на фиг. 3. Тангенс
угла наклона прямой к координатным осям численно равен кон-
станте Ь. Отрезок, отсекаемый прямой на оси ординат, численно
равен постоянной а (т. е. представляет величину перенапряжения
при плотности, тока, равной 1 о/сл2).
Глава I. Некоторые понятия из области электрохимии
Прямолинейный ход кривой перенапряжения водорода в указан-
ных координатах, как правило, сохраняется и при изменениях
концентрации и кислотности раствора, температуры и т. д.
Рассмотрим вкратце зависимость перенапряжения от этих фак-
торов.
Фиг. 3. Зависимость электро-
химической поляризации от
плотности тока.
Фиг. 4. Зависимость перенапряжения
водорода на ртутном электроде от плот-
ности тока в концентрированных
растворах соляной кислоты.
Фиг. 5. Зависимость перенапряжения
водорода на ртутном электроде от плотно-
сти тока в буферных растворах в интер-
вале pH от 1 до 7.
Зависимость перенапряжения водорода на ртутном электроде
от концентрации соляной кислоты показана на фиг. 4. Из фигуры
видно, что с увеличением концентрации кислоты перенапряжение
падает. Так, например, при
плотности тока 10-4а/сж2 пере-
напряжение водорода для 0,1-н.
НС1 составляет 1,0 в, а для
12,5-н. НС1 оно равно —0,5 в.
Следовательно, при одном и
том же потенциале по мере уве-
личения концентрации кислоты
скорость выделения водорода
будет увеличиваться.
Линия АА' на этом рисунке
показывает, что эффект сниже-
ния перенапряжения с ростом
концентрации весьма значите-
лен. Например, при переходе
от 0,1-н. НС1 к 12,5-н. НС1
эффект этот соответствует увеличению плотности тока (скорости
реакции выделения водорода) в несколько тысяч раз.
На фиг. 5 представлена зависимость перенапряжения водорода
на ртутном катоде от плотности тока. Электролитом служили буфер-
ные растворы со значением pH от 1 до 7. Из этих данных также
следует, что в кислых растворах перенапряжение водорода с повы-
шением pH раствора увеличивается. Однако в щелочных растворах
характер зависимости перенапряжения от pH резко меняется, как
26
Часть первая. Теоретические основы гальваностегии
это видно из графика, изображенного на фиг. 6, где по оси абсцисс
отложены значения pH. Связано это явление с тем, что в щелочных
растворах, где концентрация ионов водорода ничтожно мала,
на катоде идет восстановление молекул воды. Наклон обеих вет-
вей кривой приблизительно одинаков по абсолютной величине и со-
ставляет около 58 мв на единицу pH.
Величина водородного перенапряжения снижается с повышением
температуры. Это видно из фиг. 7,
щиеся к ртутному катоду в 0,25-н.
растворе H2SO4. Температурный
где приведены данные, относя-
/,2 -
Фиг. 7. Зависимость перенапряжения
водорода па ртутном электроде от плот-
ности тока в растворах 0,25-н. H2SO4
при разных температурах.
Фиг. 6. Зависимость перенапряжения
водорода на ртутном электроде от pH
раствора при плотности тока 1 • 10“ 4 а!см2.
коэффициент для металлов с высоким значением водородного пере-
напряжения (например, для ртути, свинца, кадмия, цинка) при
средних значениях плотности тока (порядка 10~3-Н0~6 а/см2)
составляет 2—4 мв на 1 градус.
Явление перенапряжения водорода имеет важное значение
в технике.
Если выделение водорода является главной целью данного
процесса (например, при электролизе воды), то желательно иметь
минимальное значение перенапряжения т], чтобы уменьшить расход
электроэнергии.
В гальванотехнике выделение водорода — побочный процесс,
снижающий использование тока и часто являющийся причиной
недоброкачественных покрытий. Поэтому повышение водородного
перенапряжения здесь желательно.
Благодаря высокому перенапряжению водорода на цинке (см.
табл. 4) возможно выделение этого металла из водных растворов,
так как разряд ионов Zn + + идет при потенциалах, лежащих намного
отрицательнее равновесного водородного потенциала. Напротив,
из-за низкого значения водородного перенапряжения на вольфраме,
молибдене, тантале использовать эти металлы в гальванотехнике
не удается — на катоде разряжаются только ионы водорода.
Глава 1. Некоторые понятия из области электрохимии
Высокая электрохимическая поляризация свойственна выделе-
нию металлов группы железа (Fe, Со, Ni). Поляризация при осажде-
нии меди, цинка, кадмия, олова и некоторых других металлов
из растворов простых солёй является в основном концентрационной,
так как перенапряжение, связанное с разрядом ионов, для них мало.
В заключение отметим, что поляризация, наблюдаемая при прак-
тическом осуществлении тех или иных электрохимических процес-
сов, является суммарным результатом сдвига потенциала, вызывае-
мого как концентрационными изменениями в приэлектродном слое
электролита, так и замедленностью отдельных стадий собственно
электродной реакции.
Совместное выделение металла и водорода на катоде
Рассмотрим подробнее различные случаи совместного выделения
металла и водорода в зависимости от хода изменения значений
их потенциалов в процессе электролиза. Это удобно сделать с помо-
щью кривых плотность тока—катодный .потенциал, которые назы-
ваются поляризационными кривыми.
Фиг. 8. Зависимость катодного потен-
циала ионов металла и водорода от
плотности тока при выделении только
металла.
Фиг. 9. Зависимость катодных потен-
циалов ионов металла и водорода от
плотности тока при выделении только
водорода.
На практике могут иметь место следующие случаи.
1. Потенциал осаждения металла <р;! в ходе электролиза остается
более положительным, чем потенциал выделения водорода при всех
значениях применяемых плотностей тока (фиг.8). Этот случай имеет
место при электроосаждении серебра, золота, меди, свинца и неко-
торых других электроположительных металлов, потенциалы выделе-
ния которых значительно отличаются от потенциала выделения
водорода. Выход по току при осаждении указанных металлов состав-
ляет 100% (выделение водорода наступит только после того,'как
будет достигнут предельный ток по металлу).
2. При всех плотностях тока потенциал водорода остается более
положительным, чем потенциал <рл, при котором начинается выделе-
ние металла (фиг. 9).
28
Часть первая. Теоретические основы гальваностегии
Случай противоположен предыдущему и характерен для электро-
отрицательных металлов (магний, алюминий и др.), осаждение
которых из водных растворов невозможно, так как в указанных
условиях выделяется только водород.
3. При малых плотностях тока потенциал металла положительнее
потенциала выделения водорода, но начиная с некоторого значения
плотности тока d катодный потенциал достигает потенциала выде-
ления водорода ф„. В этом случае при плотностях тока, меньших d,
выделяется только металл. При большей плотности тока металл
и водород выделяются совместно в количествах, пропорциональных
плотностям тока dM и dHa, соответствующих рабочему потенциалу
катода <р. Суммарная плотность тока на катоде равна dM + dH2,
Расположение поляризационных кривых показано на фиг. 10.
4. Поляризационные кривые металла и водорода пересекаются
в некоторой точке (фиг. 11).
В точке пересечения поляриза-ционных кривых металл и водород
выделяются в эквивалентных количествах. При меньших плотностях
тока преобладает выделение металла, при больших — водорода.
В заключение укажем, что приведенные в данном параграфе рас-
суждения в равной мере относятся и к одновременному (совместному)
Фиг. 10. Зависимость катодных потен-
циалов ионов металла и водорода от
плотности тока при преимущественном
выделении металла.
Фиг. 11. Зависимость катодных
потенциалов ионов металла и
водорода от плотности тока при
преимущественном выделении
водорода.
выделению двух металлов, не образующих твердого раствора или
химического соединения. Если же такие растворы или соединения
образуются, то потенциал осаждения сплава может оказаться менее
отрицательным, чем это следует из расположения поляризационных
кривых, построенных отдельно для каждого металла. При малых
плотностях тока преимущественно будет выделяться более благород-
ный металл, но с увеличением плотности тока катодный потенциал
становится все более отрицательным и в осадке увеличивается отно-
сительное количество более электроотрицательного металла.
ГЛАВА II
МЕХАНИЗМ ОБРАЗОВАНИЯ ЭЛЕКТРОЛИТИЧЕСКИХ
ОСАДКОВ
1. СТРУКТУРА ЭЛЕКТРООСАЖДЕННЫХ МЕТАЛЛОВ
Защитно-декоративные, а также механические свойства гальва-
нических покрытий во многом зависят от их структуры. Многочис-
ленными исследованиями установлено, что чем плотнее и мельче
структура электролитических (гальванических осадков), тем выше
их защитно-декоративные и механические свойства.
Поэтому в гальваностегии состав электролитов и режим работы
ванн подбирают таким образом, чтобы они обеспечивали получение
плотных и мелкокристаллических осадков. Однако далеко не все
металлы при обычных условиях электролиза способны образовать
такие осадки.
Мелкокристаллические гладкие осадки из растворов простых
солей образуют только железо, никель и кобальт, причем лишь при
низких температурах. Осадки цинка, меди, сурьмы и висмута
являются сравнительно мелкокристаллическими лишь при неболь-
ших толщинах, при значительных же толщинах осадки указанных
металлов получаются крупнокристаллические, а иногда даже ден-
дритообразные.
Неудовлетворительные осадки дают также серебро, золото и пла-
тина, если их осаждение ведется из растворов простых (некомплекс-
ных) солей.
Осадки свинца из уксуснокислых и азотнокислых растворов,
а также олова из хлористых и сернокислых электролитов также
имеют крупнокристаллическую структуру. Мелкокристаллические же
осадки этих металлов могут быть получены лишь при наличии в элек-
тролите поверхностноактивных веществ.
Гальваностегия располагает средствами, позволяющими полу-
чить осадки необходимой структуры всех технически важных ме-
таллов.
Прежде чем рассматривать эти условия электролиза, познако-
мимся с механизмом образования и роста кристаллов из растворов
электролитов.
30
Часть первая. Теоретические основы гальваностегии
2. ПРОЦЕСС ЭЛЕКТРОКРИСТАЛЛИЗАЦИИ МЕТАЛЛОВ
И ЕГО ОСОБЕННОСТИ
Процесс электрокристаллизации металлов, как и всякий другой
процесс кристаллизации твердых тел, имеет две фазы: возникновение
центров кристаллизации (так называемых кристаллических зароды-
шей) и рост кристаллов. Каждая из этих фаз процесса характери-
зуется определенной скоростью, зависящей от условий, в которых
идет кристаллизация. В тех случаях, когда скорость образования
новых центров кристаллизации превышает скорость роста уже обра-
зовавшихся кристаллов, образуется большое число мелких кри-
сталлов (т. е. осадок имеет мелкокристаллическую структуру). При
обратном соотношении скоростей, т. е. когда скорость роста кристал-
лов велика по сравнению со скоростью образования новых зароды-
шей, относительно небольшое число кристаллов вырастает до круп-
ных размеров (в пределе могут расти единичные кристаллы).
Фактором, определяющим скорость возникновения кристалличе-
ских зародышей при кристаллизации твердого тела из раствора,
является степень пересыщения последнего, характеризуемая отно-
шением
₽ = (46)
где с — концентрация раствора, из которого идет кристаллизация;
сн — равновесная концентрация насыщенного раствора.
Чем больше Р отличается от единицы, тем выше скорость образо-
вания зародышей и тем, следовательно, мельче кристаллы, состав-
ляющие осадок.
Для расплавов роль пересыщения играет степень переохлаждения
жидкой фазы. Для случая катодного выделения металла за степень
пересыщения может быть принята величина, пропорциональная
плотности тока. Коэффициент пропорциональности зависит от при-
роды металла. Он представляет собой величину, обратную так
называемому току обмена, физический смысл этой величины заклю-
чается в следующем: поверхность металла, погруженного в раствор
его соли и находящегося в равновесии с ним, обменивается ионами
с раствором, т. е. за единицу времени какое-то число ионов из кри-
сталлической решетки металла переходит в раствор, а такое же
число ионов из раствора переходит в твердую фазу. Реальность этого
обмена доказана методом радиоактивных изотопов. Поскольку ионы
несут вполне определенный электрический заряд, то скорость обмена
может быть выражена в электрических единицах, например
в а на 1 см2 поверхности металла. Эта величина и называется током
обмена.
Таким образом, для процесса электрокристаллизации
₽ = (47)
*0
Глава Ч. Механизм образования электролитических осадков 31
где i — плотность тока, при которой ведется осаждение;
г0 — ток обмена.
Для разных металлов величина тока обмена составляет от10~2
до 10° а/см?', она зависит также от концентрации соли металла
в растворе, температуры и других факторов, но в значительно мень-
шей мере, чем от природы металла. Поэтому при одной и той же плот-
ности тока металлы, для которых ток обмена мал (например никель,
железо), образуют плотные мелкокристаллические осадки, а металлы
с большим током обмена в тех же условиях кристаллизуются в виде
отдельных крупных кристаллов (например, олово и свинец).
Для одного и того же металла увеличение плотности тока приводит
к уменьшению размеров кристаллов, из которых состоит осадок.
Величина тока обмена в неявном виде входит в уравнение Тафеля,
определяя значение постоянной а. Поэтому имеется связь между
величиной р и поляризацией катода. Действительно, давно было
замечено, что мелкокристаллические осадки образуются в условиях
значительной катодной поляризации, в тех же случаях, когда поля-
ризация мала, осадки, как правило, имеют крупнокристаллическую
структуру. Математически эта связь описывается уравнением
1Г=-4-, (48)
е«
где W — вероятность (или, что то же, скорость) образования
кристаллических зародышей;
г] •— катодная поляризация (перенапряжение);
е — основание натуральных логарифмов;
А и В — постоянные величины.
Из уравнения (48) вытекает, что чем больше перенапряжение,
тем больше скорость образования кристаллических зародышей
и, следовательно, тем больше вероятность образования осадков
с мелкокристаллической структурой. Величина поляризации тесно
связана с условиями, при которых ведется осаждение металла.
Это дает возможность в широких пределах изменять структуру
и свойства гальванических осадков, соответствующим образом выби-
рая условия их получения.
Рассмотрим теперь, как происходит рост уже возникших на катоде
кристаллических зародышей.
Микроскопические наблюдения за развитием кристаллов металла
на катоде позволили обнаружить ряд интересных особенностей
этого процесса. Оказалось, что рост кристалла происходит слоями
в строго определенной последовательности: образование каждого
нового слоя начинается на ребре или вершине кристалла, откуда
этот слой распространяется по всей грани. При этом осаждение
металла сосредоточено на кромке растущего слоя — так называемом-
«фронте роста», перемещающемся по грани кристалла. Вся остальная
32
Часть Первая. Теоретические основы гальваностегии
поверхность кристалла сохраняет инертность. Характерно, что
каждый новый слой имеет совершенно гладкую поверхность, парал-
лельную грани, по которой он распространяется. Распространение
слоя прекращается, как только он достигнет противоположного
ребра кристалла. В итоге растущая грань как бы периодически
перемещается параллельно самой себе. Возникновение нового слоя
и распространение его по грани может начаться и до того, как закон-
растущей грани кристалла:
1 — наиболее активное место; 2 —
менее активное место; 3 — наи-
менее активное место.
чилась постройка предыдущего. Тогда
на грани видны сразу несколько переме-
щающихся ступенек — «фронтов роста».
Объяснение наблюдаемой картины
роста кристалла (изложенное здесь в схе-
матическом виде) заключается в том,
что поверхность кристалла не однородна
в энергетическом отношении, т. е. на
ней имеются точки, где достройка кри-
сталлической решетки происходит легче
(следовательно, процесс идет при мень-
шем перенапряжении). Такими точками
на правильно ограненном кристалле
являются вершины и ребра, так как
меньшее число соседей и,
атомы, занимающие эти места, имеют
значит, их валентные связи менее насы-
щенны. Поэтому рост нового слоя на грани начинается от ребра или
вершины. По этой же причине достройка возникшего слоя предпочти-
тельнее, чем образование нового: энергетически выгоднее дострои-
вать незавершенные слои кристаллической решетки, чем начинать
новые. Фиг. 12 поясняет сказанное.
Если ничего не препятствует росту уже существующих .на катоде
кристаллов, то образования новых зародышей не происходит и осадок
получается крупнокристаллическим (условия электролиза могут
быть выбраны так, что на катоде будет расти вообще только один
кристалл). Причинами, вызывающими прекращение роста кри-
сталла, могут быть либо местное обеднение электролита ионами
осаждаемого металла, либо блокирование поверхности кристалла
посторонними частицами, адсорбирующимися из раствора. В обоих
случаях поляризация катода возрастает и начинается образование
новых зародышей.
ГЛАВА HI
ВЛИЯНИЕ РАЗЛИЧНЫХ ФАКТОРОВ НА СТРУКТУРУ
И СВОЙСТВА ЭЛЕКТРОЛИТИЧЕСКИХ ПОКРЫТИЙ
1. ВЛИЯНИЕ РЕЖИМА ЭЛЕКТРОЛИЗА
Плотность тока. Большое влияние на структуру катодных осад-
ков оказывает плотность тока. При малых значениях этой величины
концентрационные изменения вблизи катода не оказывают суще-
ственного влияния на процесс электрокристаллизации, и рост обра-
зовавшихся зародышей кристалла происходит беспрепятственно.
В итоге получаются осадки, состоящие из отдельных крупных
кристаллов.
При переходе к большим значениям плотности тока концентра-
ционные изменения вблизи катода становятся настолько ощутимыми,
что это приводит к резкому изменению картины электролиза: повы-
шение плотности тока, согласно уравнению (42), ведет к уменьшению
концентрации ионов осаждаемого металла у поверхности катода,
что в свою очередь приводит к большему сдвигу потенциала катода.
Благодаря этому создаются условия, при которых возникают все
новые и новые центры кристаллизации, т. е. условия образования
осадков с мелкокристаллической структурой.
Таким образом, повышение плотности тока способствует получе-
нию мелкокристаллических осадков.
Однако при осаждении металла из водного раствора соли плот-
ность тока нельзя повышать неограниченно, так как после достиже-
ния предельного тока сдвиг потенциала станет настолько велик, что
потенциал катода достигнет величины, при которой возможен интен-
сивный разряд других имеющихся в растворе ионов, например ионов
водорода. Осадок может получиться рыхлым, дендритообразным или
губчатым; выход металла по току резко падает.
В связи с тем, что предельно допустимая плотность тока в силь-
ной мере зависит от прочих условий электролиза, оптимальное
ее значение подбирают с учетом факторов, определяющих условия
электролиза (концентрация соли выделяемого металла и других
солей, кислотность электролита, температура, перемешивание элек-
тролита и т. д.).
3 Вайнер и Дасоян
34
Часть первая. Теоретические основы гальваностегии
Температура электролита. Повышение температуры электролита
влечет за собой существенные изменения: увеличивается раствори-
мость солей, увеличивается электропроводность электролита, умень-
шается пассивация анодов (повышается анодный выход по току).
В ряде случаев с ростом температуры электролита связано появление
или исчезновение в растворе коллоидных образований (гидроокисей
железа, никеля и т. д.). Изменяется потенциал разряда ионов (сни-
жается перенапряжение выделения водорода и металлов) и т. д.
Так как каждое из этих изменений в свою очередь влияет на качество
осадков, то воздействие температуры оказывается сложным, и в раз-
личных условиях электролиза проявляется по-разному.
Однако в качестве общего положения можно отметить, что повы-
шение температуры, улучшая условия диффузии ионов и уменьшая
перенапряжение, снижает катодную поляризацию и тем самым спо-
собствует образованию осадков крупнокристаллической структуры.
Это нежелательное для практики влияние повышения температуры
на структуру покрытия может быть компенсировано применением
более высоких плотностей тока. В итоге повышается интенсивность
работы ванны, поэтому в гальваностегии электролиз часто ведется
при повышенных температурах.
Перемешивание электролита. Перемешивание электролита благо-
даря увеличению скорости диффузии уменьшает концентрационную
поляризацию и ведет к образованию осадков более крупнокристал-
лической структуры. Однако перемешивание вместе с тем позволяет
применять более высокие плотности тока, что, как уже отмечалось,
оказывает обратное перемешиванию действие на ход электрокри-
сталлизации.
В перемешиваемых ваннах путем правильного сочетания темпе-
ратуры электролита и плотности тока возможно получение плотных
мелкокристаллических осадков. Поскольку же на практике выгодно
работать с большими плотностями тока, то часто предпочитают
работать с перемешиванием, чтобы повысить плотность тока. При этом
чем выше предполагаемая плотность, тем интенсивнее должно быть
перемешивание электролита.
Перемешивание электролита обычно осуществляют одним из сле-
дующих способов: продуванием сжатого воздуха, путем периодиче-
ского приподнимания и опускания катодных штанг с подвесками,
либо, наконец, с помощью механических мешалок.
Перемешивание сжатым воздухом неприменимо для железных
и всех цианистых электролитов, состав которых под действием кисло-
рода и углекислоты воздуха подвержен изменению.
Для того чтобы осевшие на дно нерастворимые загрязнения после
взмучивания в процессе перемешивания электролита не осаждались
на катоде, рекомендуется непрерывная фильтрация электролита,
который циркулирует через фильтры и возвращается в ванны сво-
бодным от механических загрязнений.
Глава III. Влияние различных факторов на структуру покрытий
35
Влияние структуры основы. Установлено, что в ряде случаев
структура осадка воспроизводит структуру основы. Так, например,
если осаждение меди из кислой ванны производить на катоде, пред-
ставляющем собой литую крупнокристаллическую медь, то струк-
тура основы настолько точно воспроизводится осадком, что границу
между осадком и основой нельзя заметить даже на микрошлифе.
Срастание осадка с основой особенно усиливается при осаждении
металла на предварительно протравленной поверхности с обнажен-
ной структурой. Перерывы в процессе электролиза несколько ослаб-
ляют силу срастания, но не препятствуют полностью этому процессу.
Воспроизведение структуры в электролитическом осадке наблю-
дается и при покрытии одного металла другим, отличающимся от пер-
вого как по своей природе, так и параметрами кристаллической
решетки. Примером может служить осадок кадмия на олове. Однако
следует заметить, что описанное явление наблюдается лишь для
покрытий и основ, имеющих крупнокристаллическую структуру.
Если же покрытие (например, медь из цианистых ванн) или основа
(например, катод из гальванически осажденного никеля) имеют
мелкокристаллическую структуру, то явления воспроизводимости
структур не наблюдается.
Влияние выделяющегося при электролизе водорода. Выше уже
рассматривались условия совместного выделения металла и водорода.
Теперь коротко остановимся на тех последствиях, которые влечет
за собой разряд ионов водорода на катоде.
В больших или меньших количествах водород образуется при
работе почти всех используемых на практике гальванических ванн.
Исключение составляет процесс осаждения меди из кислого электро-
лита, для которого поляризационная кривая катода лежит вне обла-
сти потенциалов разложения водных растворов. Для хромовых ванн
до 90% всего пропускаемого электричества тратится на выделение
водорода. В большинстве же других ванн оно составляет несколько
процентов. Количество образующегося на катоде водорода зависит
как от природы осаждаемого металла, так и от условий электролиза
(температуры, плотности тока, pH электролита). Металлы по-раз-
ному ведут себя по отношению к водороду. Никель, железо и в осо-
бенности" хром растворяют его, при этом атомы водорода внедряются
в кристаллическую решетку металла (располагаются между
узлами ее), что приводит к нарушению роста кристаллов. Кроме
того, значительные количества водорода удерживаются на границах
между кристаллами, ослабляя их связь между собой. Содержание
водорода в хромовых покрытиях достигает 0,45%, в никелевых —
до 0,1 %, в цинковых 0,001—0,01 %. Поглощение водорода оказывает
влияние на механические свойства осадков, твердость которых повы-
шается, но значительно увеличивается также и хруйкость.
Частично водород поглощается также стальной основой, вызы-
вая появление водородной хрупкости. Поэтому нельзя, например,
36
Часть первая. Теоретические основы гальваностегии
подвергать хромированию стальные пружины, не нанеся на них пред-
варительно подслой металла, не растворяющего водород. Накапли-
вание водорода в микротрещинах основного металла может со вре-
менем вызвать отслаивание и вспучивание покрытия (например, цин-
кового или кадмиевого).
Разряд ионов водорода приводит к уменьшению их концентра-
ции около поверхности катода, т. е. к повышению pH в прикатодном
слое раствора. Если в никелевой ванне pH электролита достиг-
нет величины 6,7, то начнется образование гидрата закиси
никеля Ni(OH)2 — сначала в коллоидной форме, а затем в форме
хлопьевидного осадка. Так же ведут себя другие металлы:
например, гидрат окиси цинка образуется при pH = 5,2, гидрат
закиси железа при pH = 5,5, гидрат окиси алюминия — при
pH = 4,1.
Включаясь в катодный осадок, гидраты окислов металлов (или
основные соли) оказывают очень сильное влияние на структуру
металла (о чем еще будет идти речь ниже). Как правило, это связано
с резким ухудшением качества покрытий.
Наконец, прилипание пузырьков водорода к поверхности катода
служит причиной появления неровностей и пор на покрытии (так
называемый питтинг). Для предотвращения прилипания пузырь-
ков водорода к поверхности катода последний время от времени
встряхивают. Рекомендуется также перемешивание электролита
и проведение электролиза при повышенной температуре. Иногда
в состав электролита вводят специальные добавки, снижающие
поверхностное натяжение раствора. Это способствует отрыву пузырь-
ков газа. Такие добавки получили название антипиттин-
г о в ы х.
Таким образом, выделение водорода в гальванических ваннах
во всех отношениях нежелательное явление. Поэтому всегда стре-
мятся принять меры к тому, чтобы свести его к минимуму.
Влияние изменения направления тока. Мы уже видели, что осадки
металлов, полученные из электролитов, в которых электролиз проте-
кает с незначительной катодной поляризацией, имеют крупнокри-
сталлическую структуру. Примером такого покрытия может
служить осадок меди, полученный из сернокислого электро-
лита.
В ряде трудов доказано, что периодическим изменением направ-
ления тока (реверс и-рованием тока) при условии, что
продолжительность пребывания покрываемых изделий в качестве
анодов значительно короче катодной части цикла, можно получить
осадки мелкокристаллической структуры. Замечено также, что
осадки, полученные в условиях применения реверсированного тока,
отличаются большим блеском и лучшими защитными свойствами,
чем обычные покрытия. Предполагают, что это различие связано
с процессом периодического анодного растворения осадка, поверх-
Глава III- Влияние различных факторов на структуру покрытий
37
ность которого в результате этого сглаживается, становится более
ровной.
Реверсирование тока в ряде случаев нашло практическое приме-
нение в гальванических цехах.
2. ВЛИЯНИЕ СОСТАВА ЭЛЕКТРОЛИТА
Влияние концентрации ионов осаждаемого металла. Рассмот-
рим, как действует на структуру полученных при электролизе
катодных осадков концентрация ионов осаждаемого металла в элек-
тролите.
Для простоты возьмем случай, когда выделение металла сопро-
вождается только концентрационной поляризацией. Сравним два
раствора (раствор 1 и раствор 2), концентрации которых соответ-
ственно равны с, и с2; пусть сЛ > с2.
Согласно выведенному выше уравнению (44), величины предель-
ных токов для этих двух растворов должны удовлетворять нера-
венству
id2-
Пусть, например, i : idl = 0,01 и i : id2 = 0,1.
Тогда
л 2.37771 । л л RT
Дф. =--------— 1g 0,99 — 0,04 -=-
nF ь ’nF
А Z.SRT , n nn n 1 RT
Дф, =------=.— 1g 0,90 — 0,1 -ft .
rz nF ь ’ ’ nF
Следовательно, по абсолютной величине
Дф! < Дф2,
т. е. сдвиг потенциала во втором (более разбавленном) электролите
больше, чем в первом (более концентрированном).
Иными словами, по мере разбавления раствора
значение предельного тока уменьшается, что
приводит к большему смещению потенциала катода, а это, как мы уже
знаем, создает условия, необходимые для образования мелкокри-
сталлических осадков.
Таким образом, уменьшение концентрации ионов осаждаемого
металла в электролите способствует образованию мелкокристалличе-
ских осадков.
Не следует, однако, думать, что удовлетворительные осадки
могут быть получены при любом способе снижения концентрации
ионов осаждаемого металла в электролите, например, при простом
разбавлении. Чрезмерное разбавление приводит не к улучшению,
а наоборот, к ухудшению качества осадков, которые обычно полу-
чаются рыхлыми (например, медь) или игольчатыми (например,
свинец).
38
Часть первая. Теоретические основы гальваностегии
Получение покрытия удовлетворительного качества возможно
только из таких растворов, в которых при малой концентрации сво-
бодных катионов осаждаемого металла имеется достаточно высокая
концентрация этого металла в виде недиссоциированных молекул
или комплексных ионов, служащих резервом, пополняющим убыль
катионов в процессе электролиза.
Осаждение металлов из растворов комплексных солей. Осаждение
металлов из растворов комплексных солей характеризуется повы-
шенной поляризацией катода; катодные осадки
отличаются равномерностью и имеют мелкокристалличе-
скую структуру. Особенно выделяются в этом отношении
цианистые комплексы, нашедшие благодаря высокому качеству
получающихся покрытий широкое распространение в гальвано-
технике.
Причины образования мелкокристаллических осадков из раство-
ров комплексных солей и механизм процесса электроосаждения
были предметом многочисленных исследований. В результате были
высказаны две принципиально различные точки зрения. Сторонники
первой из них считают, что на катоде имеет место разряд простых
ионов металлов, образующихся в электролите за счет частичной
диссоциации комплексных ионов.
Для цианистых ванн процесс может быть представлен следующей
схемой:
КМе (CN)2 К+ + Me (CN)F
Me (СМ)Г Ме+ + 2CN-
Ме+ + е -> Me.
Чем прочнее комплексный ион х, тем меньше концентрация в элек-
тролите простых ионов металла, а следовательно, тем выше кон-
центрационная поляризация при разряде их на катоде. Высокая
поляризация обусловливает равномерное распределение металла
по поверхности катода и мелкокристаллическую структуру осадка.
Однако такое представление вызывает ряд серьезных возражений.
Специально поставленные опыты показали, что поляризация при
осаждении металлов из растворов комплексных солей носит не кон-
центрационный, а химический характер. Расчет концентрации
ионов Ag+ в растворе KAg (CN)2 дал величину порядка 10-23 Г-ион/л,
т. е. на литр раствора приходится всего около 8 ионов. Чтобы они
успели разрядиться на катоде, скорость движения ионов в этом
1 Прочность комплексного иона количественно выражается так называемой
константой неустойчивости, определяемой в данном случае выражением
У _ [Ме+ПСЫ-р
[Me(CN)^] ‘
Глава III. Влияние различных факторов на структуру покрытий 39
случае должна превышать скорость света, что физически не имеет
смысла.
Поэтому в настоящее время следует считать правильной вторую
точку зрения, согласно которой на катоде-происходит непосредствен-
ный разряд комплексных ионов. Хотя в цианистых комплексах
металл входит в состав аниона, все же вполне возможно представить
себе присутствие их в адсорбированном виде на поверхности катода
(тем более, что восстановление других анионов на катоде является
доказанным фактом). Под действием электрического поля двойного
слоя комплексный анион деформируется, превращаясь в диполь,
и удерживается у поверхности электрода за счет притяжения поло-
жительного конца диполя. Разряд цианистого комплекса может
быть представлен схемой
КМе (CN)2 К+ + Me (CN)F
Me (CN)F + e -> Me + 2CN~
Высокая катодная поляризация связана с затратой энергии на раз-
рушение комплексного иона.
Некоторая зависимость качества осадков от природы аниона соли
осаждаемого металла наблюдается и в тех случаях, когда в электро-
литах отсутствуют цианистые соединения. Так, например, свинцовые
покрытия, получаемые из чистых азотнокислых и уксуснокислых
электролитов, имеют крупнокристаллическую структуру, а осадки,
получаемые из борфтористоводородных, кремнефтористоводородных
и перхлоратных электролитов — мелкокристаллическую структуру.
Это различие также связано с величиной катодной поляризации
в соответствующих ваннах.
Влияние посторонних электролитов. Добавление в раствор дан-
ного электролита кислот и солей, переносящих ток, но не участвую-
щих в катодном процессе, наряду с увеличением электропроводности
раствора приводит к повышению катодной поляризации, что, как
известно, способствует улучшению качества осадков.
Например, если к раствору сернокислого никеля добавить раствор
сернокислого натрия, то ток будет переноситься обоими электро-
литами, играющими в данном растворе роль двух параллельных
проводников. Ток между ними распределяется в первом приближе-
нии пропорционально электропроводности чистых растворов (серно-
кислого никеля и сернокислого натрия). Но поскольку ионы натрия
не могут разряжаться на катоде, концентрация ионов никеля
У поверхности катода уменьшается и вследствие этого происходит
увеличение катодной поляризации. Катионы же натрия, не разря-
жаясь на катоде, накапливаются в прикатодиом слое электролита
и повышают его электропроводность, что позволяет применять более
высокие плотности тока.
40
Часть первая. Теоретические основы гальваностегии
Влияние проводящих, но не участвующих в катодном процессе
солей на структуру осадка видно также из уравнения (42). Действи-
тельно, поскольку входящий в это уравнение коэффициент х пред-
ставляет собой отношение электропроводности соли, катионы кото-
рой разряжаются на катоде, к сумме электропроводностей всех
присутствующих в растворе электролитов, то для указанного выше
примера
xNiSO4
X — -----——-------.
xNiSO4 + xNa2SO4
Таким образом, добавление проводящей соли в основной электро-
лит должно вызвать уменьшение величины указанного коэффициента.
Но с уменьшением коэффи-
Фиг. 13. Действие посторонних катионов на
поляризацию при электроосаждении никеля.
циента х возрастает второй
член правой части уравнения
(42) и, следовательно, умень-
шается концентрация ионов
осаждаемого металла у по-
верхности электролита, а это,
как мы уже знаем, приводит
к измельчению структуры
осадка.
Влияние различных со-
лей, переносящих ток, но не
участвующих в катодных про-
цессах, на качество гальва-
нических осадков исследо-
валось Н. А. Изгарышевым и его сотрудниками. На фиг. 13 приве-
дены данные, иллюстрирующие действие посторонних катионов
на поляризацию при осаждении никеля из растворов хлористого
никеля. Из этих данных следует, что вводимые соли (кроме солей
алюминия и кобальта) в той или иной степени увеличивают катод-
ную поляризацию и, следовательно, могут рассматриваться как
полезные добавки.
Посторонние электролиты добавляются в гальванические ванны
не только с целью повышения катодной поляризации. Они могут
сообщать основному электролиту буферные свойства (например,
сернокислый алюминий, борная кислота, уксусная кислота и ее соли
в растворах сернокислого цинка и сернокислого никеля), способ-
ствовать получению блестящего покрытия (например, ничтожные
количества солей никеля, кобальта и меди в цианистом кадмиевом
электролите), препятствовать образованию губки на катоде (соли
свинца, олова и ртути в цинкатных электролитах).
Влияние поверхностноактивных и коллоидных веществ. Много-
летняя практика показала, что существует ряд веществ, преднаме-
ренное или случайное попадание которых в гальванические ванны
Глава III. Влияние различных факторов на структуру покрытий
41
оказывает очень сильное влияние на свойства катодных осадков,
хотя количество их в электролите может быть ничтожно малым.
Вещества эти обычно относятся к классу органических соединений,
преимущественно (хотя и не всегда) с большим молекулярным весом;
особенно выделяются среди них такие, которые образуют коллоидные
или полуколлоидные растворы.
Внешним проявлением их действия является изменение структуры
катодных осадков, которые приобретают значительно более тонко-
кристаллическое строение. Например, такие металлы, как олово,
свинец, цинк и ряд других, выделяются при электролизе растворов
простых солей в виде крупных изолированных друг от друга кри-
сталлов. Введением специально подобранных органических добавок
удается получить плотные мелкокристаллические покрытия, пригод-
ные для практического использования. При введении добавок в элек-
тролиты, дающие уже сами по себе тонкозернистые осадки (напри-
мер, никелевые ванны) образуются осадки настолько тонкой струк-
туры, что она не различима под микроскопом, и кристаллическое
строение металла может быть установлено только рентгенографиче-
ским методом.
Изменение структуры покрытий сопровождается изменением
их физических и механических свойств. Особенно сильно возрастает
твердость осадков, но, как правило, они становятся бодее хруп-
кими.
Следует отметить еще одну особенность действия рассматриваемых
веществ: оно носит явно выраженный специфический характер,
т. е. добавка, оказывающая благоприятное влияние на свойства,
например, медных осадков, может ухудшать качество никелевых
покрытий и не оказывать действия на цинковые.
Многочисленные исследования показали, что действие добавок
связано с явлениями адсорбции и блокирования
поверхности растущих кристаллов металла. За это говорит
ряд экспериментально наблюдаемых фактов:
1) действие добавок проявляется при очень малом содержании
их в электролите (иногда это тысячные доли процента, и менее); оно
усиливается при повышении концентрации, но уменьшается при
повышении температуры;
2) при введении добавок увеличивается катодная поляризация,
но равновесный потенциал металла не изменяется;
3) катодные осадки содержат включения неметаллических ве-
ществ, например серу, углерод и другие, атомы которых входят
в состав вводимой добавки;
4) наиболее эффективны вещества, обладающие защитными свой-
ствами для коллоидных растворов металлов, и вещества, резко тормо-
зящие растворение металлов в кислотах. Известно, что такими свой-
ствами обладают вещества, прочно адсорбирующиеся на поверхности
42
Часть первая. Теоретические основы гальваностегии
Выше мы рассмотрели процесс образования металлических кри-
сталлов на катоде. Адсорбция посторонних частиц на поверхности
растущего кристалла затрудняет доступ к ней разряжающимся
ионам, образование же плотного адсорбционного слоя вообще пре-
кращает рост кристалла. Поэтому в присутствии добавок часть
катодной поверхности оказывается блокированной, что вызывает
увеличение фактической плотности тока на свободных участках (если
сила тока в цепи поддерживается постоянной, как это обычно имеет
место на практике). Увеличение плотности тока сопровождается
повышением поляризации, что облегчает образование новых кри-
сталлических зародышей. Не вдаваясь в детали, картину образова-
ния поликристаллического осадка на катоде для случая, когда элек-
тролит содержит поверхностноактивные вещества, можно предста-
вить себе следующим образом. Адсорбция добавки и образование
блокирующего слоя требуют известного времени. Поэтому если ско-
рость обновления поверхности кристалла велика, то блокирующий
слой образоваться не успевает и кристалл продолжает расти. Однако
блокирование поверхности сразу наступает, если плотность тока
на гранях растущего кристалла опустится ниже некоторого предела.
Понижение же плотности тока на растущих кристаллах происходит
вследствие локального обеднения ионами металла прилегающего
к кристаллу слоя электролита: на катоде все время происходит пере-
распределение тока между теми кристаллами, которые уже успели
истощить вокруг себя электролит, и теми, которые только начинают
свой рост. Чем интенсивнее добавка блокирует поверхность металла,
тем короче оказывается период роста каждого кристалла и тем
мельче структура получающегося осадка.
Из изложенного следует, что наиболее эффективными добавками
являются те, которые обеспечивают быстрое и полное блокирование
граней растущих на катоде металлических кристаллов. Однако
ответить на вопрос, какие именно вещества должны удовлетворять
этому требованию применительно к той или иной гальванической
ванне, непросто. В настоящее время можно лишь в общих чертах
указать на те признаки, по которым может производиться подбор
добавки.
Так, известно, что склонность к адсорбции возрастает с увеличе-
нием молекулярного веса. Поэтому многие добавки принадлежат
к классу высокомолекулярных веществ.
Поверхность металла, погруженного в электролит, несет электри-
ческий заряд. Он может быть отрицательным, но может быть и поло-
жительным, даже несмотря на то, что металл подвергается катодной
поляризации. Естественно, что частицы, имеющие заряд, противо-
положный по знаку заряду металла, обладают повышенной склон-
ностью к адсорбции. Многие органические вещества диссоциируют
в растворе с образованием крупных ионов. Анионы, например,
получаются при диссоциации органических кислот с длинной угле-
Глава III. Влияние различных факторов на структуру покрытий
43
водородной цепью. Аминокислоты и другие вещества амфотерной
природы диссоциируют по кислотной или основной схеме в зависи-
мости от pH раствора и, следовательно, в кислых растворах пред-
почтительнее адсорбируются на отрицательно заряженной поверх-
ности, а в щелочных — на положительно заряженной. Коллоидные
частицы также несут, как известно, электрический заряд. Склон-
ность их к адсорбции очень велика, так как молекулярный вес частиц
огромен. Коллоидные вещества, например, коллоидные гидроокиси
металлов, часто образуются в процессе работы ванны в результате
изменения состава приэлектродного слоя жидкости (повышения pH
и др.). Они оказывают на катодные осадки такое же действие, как
и искусственно вводимые добавки.
Кроме частиц, несущих заряд, на поверхности электрода адсор-
бируются дипольные молекулы, ориентирующиеся соот-
ветственно знаку заряда металла. Склонность к адсорбции нейтраль-
ных молекул зависит от их поляризуемости, т. е. превра-
щения в диполи под влиянием электрического поля на границе
металл—раствор.
На основании изложенного А. К. Лоренцем сделан вывод, что
адсорбируемость или поверхностная активность G добавки может
быть представлена некоторой функцией, имеющей вид
G = Ф (z, М, a, MR); (49)
здесь z — заряд частиц;
М — молекулярный вес;
а — поляризуемость;
MR — молекулярная рефракция.
Величины а и MR характеризуют силу связи между электриче-
скими зарядами в молекуле и ее деформируемость.
Естественно, что в тех или иных конкретных случаях одно или
два из этих свойств могут иметь превалирующее значение. Вместе
с тем выражение (49) показывает, что добавки не могут быть класси-
фицированы только по одному какому-либо признаку.
Доказательством справедливости развитых А. К. Лоренцем пред-
ставлений может служить то, что применяемые на практике поверх-
ностноактивные вещества действительно отвечают одному из требо-
ваний функции (49), как это следует из табл. 5.
Так, например, из таблицы видно, что для серебра, меди, кадмия,
свинца и олова, у которых в кислом электролите при потенциалах
осаждения поверхность металла заряжена поло-
жительно, на практике в качестве полезных добавок находят
применение кислоты и сульфокислоты, образующие в растворе
Отрицательно заряженные частицы — анионы.
Для цинка, поверхность которого в кислом элек-
т Р о л и т е при потенциале выделения металла заряжена о т р и -
пительно, в качестве добавок находят практическое применение
Таблица 5
Классификация применяемых в гальваностегии добавок по функциям, определяющим их
поверхностную активность (по А. К. Лоренцу)
Условия электролиза Применяемые добавки в зависимости от функций, определяющих их поверхностную активность
Осаждае- мый ме- талл Природа электро- лита Знак заряда поверхности металла при потенциале его катодного выделения G т Ф (г, MR) G « 0(MR) G & Ф (г, Rd) G и Ф(«, MR)
Серебро Кислый Положитель- ный Кислоты (изова- лериановая, молоч- ная, янтарная и др.) — — — —
Циани- стый Отрицательный — — Сероуглерод Тиосульфат, роданистый калий, тио- мочевина Мочевина
Медь Кислый Положитель- ный Сульфокислоты (фенола, лигносуль- фоната), некаль, гардиноль, суль- фа иол, контакт Петрова — Декстрин Тиосульфат Фенол
Циани- стый Отрицательный — — — Тиосульфат, роданистый калий —
Кадмий Кислый Положитель- ный Сульфокислоты (бензола, фенола, крезола) Желатина, пептон, клей, гидроокись алюминия — — Крезол
Часть первая. Теоретические основы гальваностегии
Продолжение табл. 5
Условия электролиза Применяемые добавки в зависимости от функций, определяющих их поверхностную активность
Кадмий Циани- стый Отрицательный Сульфокислоты (нафталина, наф- тола, лигносульфо- ната, касторового масла) Казеин Декстрин — Фурфурол
Свинец Кислый Положитель- ный Сульфокислоты (бензола, фенола, крезола) Желатина, пептон, клей Сероуглерод — Фенол, кре- зол, нафтол, резориин, ортотолуидин
Щелоч- ной Положитель- ный Олеиновая кис- лота, канифоль Клей — — —
Олово Кислый Положитель- ный Сульфокислоты (фенола, крезола, нафталина, Р-иаф- тола), трибензкл- амин Желатина, клей Декстрин — Фенол, ксиле- нол, крезол, нафтол
Никель Кислый Отрицательный Сульфокислоты (нафталина, толуи- дина) Альбумин, пептон, клей Сероуглерод Сульфид нат- рия, меркап- тан, соедине- ния Se, Те, As Формальдегид, ацетальдегид, нафтол, моче- вина
Цинк Кислый Отрицательный 2,6- или 2,7-наф- тал и ндисульфокис- лота, метиламин, этиламин, бутила- мин, пиридин Желатина, гидроокись алюминии Декстрин, гуммиарабик амилоза — Фенол, крезол, нафтол
Циани- стый Отрицательный — — Декстрин Сульфид натрия, тиосульфат Мочевина
Глава III. Влияние различных факторов на структуру покрытий
46
Часть первая. Теоретические основы гальваностегии
пиридин и другие амины — вещества, которые образуют в рас-
творе положительно заряженные частицы —
катионы.
Адсорбция на металлах органических и неорганических коллои-
дов (гр. 5 и 6 табл. 5), разнообразных по составу — таких, например,
как белковые вещества, углеводы или гидроокиси металлов, оче-
видно, определяется общим для всех коллоидов признаком — высо-
ким молекулярным весом.
Поверхностная активность коллоидов, показанных в гр. 6 табл. 5,
в значительной мере обусловлена содержанием карбонильного кисло-
рода (=С=О) в декстрине и гуммиарабике и двухвалентной серы
в сероуглероде, благодаря которым указанные вещества отличаются
высокой молекулярной рефракцией (MR).
Поверхностная активность веществ, приведенных в гр. 7 табл. 5
(сульфида, гипосульфита, роданида, тиомочевины, этилмеркаптана,
H2Se, Н2Те, H3As), определяется большими величинами атомных
рефракций входящих в них элементов: серы, селена, теллура
и мышьяка, а также противоположностью знаков заряда поверхности
электрода и адсорбирующихся частиц.
Наконец, применение в ряде гальванических электролитов моче-
вины, фенола, крезола, фурфурола и других указанных в гр. 8
табл. 5 веществ обусловлено их высокой поляризуемостью. Известную
роль в адсорбируемости этих веществ играют также достаточно высо-
кие молекулярный вес и молекулярная рефракция.
В заключение следует указать, что далеко не все вещества, хорошо
адсорбирующиеся на поверхности катода и препятствующие росту
крупных кристаллов, могут использоваться на практике в качестве
добавок в соответствующие электролиты. Для того, чтобы та или
иная добавка нашла практическое применение, она должна удовлетво-
рять ряду дополнительных требований:
1) добавка не должна ухудшать механических свойств покрытий,
в частности, не повышать чрезмерно хрупкость осадков (это требова-
ние выполняется, к сожалению, лишь в редких случаях, по этой при-
чине добавки в ванны стремятся вводить в минимальном количестве);
2) действие добавки должно быть стабильным; продукты разру-
шения добавки (например, окисления на аноде) не должны оказы-
вать вредного влияния в ванне;
3) содержание добавки в электролите должно поддаваться кон-
тролю химическим или иным способом для того, чтобы можно
было производить корректировку ванны (необходимость выполне-
ния этого требования особенно затрудняет эксплуатацию ванн,
в которых предусмотрено введение двух или еще большего числа
добавок).
Из огромного числа исследованных веществ пригодными для
практического использования оказались лишь сравнительно немно-
гие. Однако каждый год появляется большое число патентов и
Глава III. Влитие различных факторов на структуру покрытий
47
других публикаций, в которых предлагаются все новые добавки.
В большинстве случаев применение их может быть рекомендовано
только после тщательной лабораторной и опытной производствен-
ной проверки.
Блескообразующие добавки. Среди поверхностноактивных доба-
вок большой интерес представляет группа веществ, в присутствии
которых удается получить блестящие осадки непосредственно
из гальванических ванн. Эти осадки обладают столь высокой отра-
жающей способностью, что не нуждаются в последующем полирова-
нии и глянцевании. Такие добавки, известные также под названием
блескообразователей, получили довольно широкое рас-
пространение в гальванических цехах и особенно часто успешно
применяются в электролитах для никелирования, меднения и цинко-
вания. К числу таких добавок относятся: сульфированный нафталин,
мочевина, желатина, тиокарбамид, декстрин, фенол, крезол, нафтол,
сульфид натрия, тиосульфат и др.
О способах введения этих добавок в соответствующие электролиты
будет сказано при рассмотрении технологических процессов нанесе-
ния отдельных видов покрытий.
Огромное преимущество ванн, дающих блестящие покрытия,
состоит в том, что становятся ненужными профессионально вред-
ные, дорогостоящие и трудно механизируемые операции поли-
рования и глянцевания обычных покрытий, на проведение кото-
рых затрачивается много материала, электроэнергии и рабочей
силы.
Особенно ощутим выигрыш при нанесении многослойных покры-
тий медь—никель—хром, когда детали дважды демонтируются
с подвесок, отправляются на полирование, каждый раз снова прохо-
дят операции обезжиривания и опять монтируются на подвески.
Нанесение блестящих медного и никелевого покрытий не только
намного сокращает число технологических операций, но и открывает
возможность полной механизации и автоматизации всего процесса
нанесения покрытия, так как требуется лишь переносить подвески
с деталями из одной ванны в другую, а промежуточные операции
сводятся к промывке.
Внедрение ванн для нанесения блестящих покрытий имеет и дру-
гие положительные стороны. В частности, это дает экономию цветных
металлов, так как при определении толщины обычных покрытий зара-
нее исходят из повышенной против требуемой толщины с учетом пред-
полагаемых потерь металла при полировании и глянцевании осадков.
(Такие потери доходят до 20% от общего веса осадков.)
Кроме того, блестящие осадки всегда имеют повышенную твер-
дость и, следовательно, более износоустойчивы. Это дает возможность
еЩе уменьшить их толщину по сравнению с осадками из обычных
ванн. Это имеет немаловажное значение при нанесении покрытий
из благородных металлов — серебрении, золочении и др.
48
Часть первая. Теоретические основы гальваностегии
Несмотря на большой интерес, вызываемый ваннами для нанесе-
ния блестящих покрытий, сущность действия блескообразующих
добавок остается не выясненной.
Не вызывает сомнения лишь то, что процессам адсорбции принад-
лежит здесь первостепенная роль — все блескообразователи либо
сами адсорбируются на поверхности катодного осадка, либо пре-
терпевают химические превращения с образованием адсорбирую-
щихся веществ. Однако одного этого условия недостаточно, так как
многие вещества, относительно которых заведомо известно, что они
хорошо адсорбируются на поверхности металла, не проявляют
никаких признаков блескообразующего действия.
Для объяснения явления было предложено две гипотезы. Одна
из них исходит из того, что блескообразователи настолько измель-
чают структуру осадка, что размеры выступающих на поверхности
покрытия граней и вершин кристаллов не превышают длины полу-
волны падающего света. Такая поверхность не рассеивает света —
падающий луч испытывает только зеркальное отражение. Вторая
гипотеза сводится к тому, что под действием добавки рост кристаллов
происходит строго упорядоченно, в результате чего все они оказы-
ваются ориентированы одной и той же кристаллографической гранью
параллельно поверхности катода. Однако ни та ни другая гипотезы
экспериментально не подтвердились, и вопрос пока остается
открытым.
ГЛАВА IV
РАСПРЕДЕЛЕНИЕ ТОКА НА КАТОДЕ
1. РАССЕИВАЮЩАЯ И КРОЮЩАЯ СПОСОБНОСТЬ ЭЛЕКТРОЛИТОВ
Одним из основных требований, предъявляемых к качеству галь-
ванических покрытий, является равномерность распределения осадка
металла, т. е. одинаковая толщина слоя покрытия по всей поверх-
ности покрываемых изделий. Толщина покрытия определяется
по формуле (23), однако в действительности она никогда не бывает
одинаковой по всей поверхности, и расчет по формуле (23) дает пред-
ставление лишь о средней толщине осад-
ка. На практике толщина покрытия на
краях и в углах гораздо больше, чем на
средней части поверхности катода, причем
степень неравномерности зависит от мно-
гих факторов, в том числе от природы
электролита и осаждаемого металла, а
также от режима электролиза.
Неодинаковая толщина покрытия ука-
зывает на неравномерное распределение
тока по поверхности катода. Фиг. 14 ил-
люстрирует это на примере осадка хрома
из ванны обычно принятого состава и плот-
ности тока 22 а/дм? (при хромировании
неравномерность покрытия по толщине
сказывается особенно резко). Плотности
тока, указанные на фигуре, вычислены по
Фиг. 14. Примерное рас-
пределение плотности тока
по поверхности катода в хро-
мовой ванне.
толщине осадка в разных частях катода. Катод и анод одинаковых
размеров и расположены параллельно друг другу.
Как показывают эти данные, плотность тока на краях и в углах
катода почти в 5 раз больше, чем на середине. Иными словами, при
средней плотности тока 22 а! дм'1 на части участков катода (на углах
и краях) плотность тока доходит до 50 а! дм1, в то время как на сере-
дине катода она составляет всего лишь 11 а!дм~.
Неравномерность распределения тока и, следовательно, толщины
покрытия увеличивается при переходе к профилированным катодам.
ь таких случаях особенно высокие плотности тока устанавливаются
Вайнер и Дасоян
50
Часть первая. Теоретические основы гальваностегии
на тех участках катода, которые расположены ближе к аноду;
на сильно удаленных от анода участках, наоборот, плотность тока
окажется сильно пониженной, иногда эти участки могут вообще
остаться непокрытыми.
Воздействием ряда факторов, о которых будет сказано ниже,
неравномерность распределения тока на катоде сложной формы
можно заметно уменьшить, и тогда удается получить достаточно
равномерные покрытия.
Однако существуют электролиты, способные и без всяких допол-
нительных приемов давать осадки равномерной толщины даже
в сравнительно неблагоприятных условиях. Например, металличе-
ский шарик диаметром 4—5 см, помещенный в цианистый электролит
для золочения на расстоянии 10—15 см от анода, при электролизе
покрывается золотом со всех сторон, причем толщина полученного
слоя покрытия во всех точках оказывается практически одинакова.
Другим примером равномерного покрытия катода сложной формы
может быть осаждение олова из щелочной ванны. Катодом служил
плотно свитый кабель из 84 медных проволок диаметром 0,7 мм
каждая. Все проволочки кабеля, даже лежащие у его оси, оказались
покрытыми слоем олова.
Способность электролита давать равномерные по толщине покры-
тия на катодах сложной формы характеризуется величиной, которая
называется рассеивающей способностью ванны.
Наибольшей рассеивающей способностью обладают цианистые
электролиты и щелочной электролит лужения, а наименьшей —
хромовый электролит.
В гальваностегии иногда пользуются термином кроющая
способность, под которым подразумевают способность элек-
тролита покрывать металлом углубленные участки поверхности
катода. В этом случае степень равномерности покрытия во внимание
не принимается. Кроющая способность электролита имеет меньшее
практическое значение, чем рассеивающая способность. Первая
может интересовать гальваностегов лишь в тех сравнительно редких
случаях, когда требуется покрыть всю поверхность изделия тонкой
металлической пленкой, хотя бы и не одинаковой толщины, в то время
как вторая, характеризующая равномерность покрытия,
является одним из основных требований, предъявляемых к гальвани-
ческим электролитам.
2. КОЛИЧЕСТВЕННАЯ ФОРМУЛИРОВКА РАССЕИВАЮЩЕЙ
СПОСОБНОСТИ
Познакомимся вначале с картиной распределения тока в гальва-
нической ванне.
Сила тока I, проходящего через гальваническую ванну, согласно
закону Ома, равна напряжению на штангах ванны Е, деленному
на общее сопротивление ванны R. Последнее для любой гальваниче-
Глава 1V. Распределение тока на катоде
51
ской ванны представляет собой сумму трех составляющих: сопротив-
ления металлических электродов RMem, сопротивления электролита,
заключенного между электродами, R3Jl, переходного сопротивления
на границе металл—электролит Rnep:
R Ruem Т Кэл “4
Rnep
(50)
Переходное сопротивление обусловлено поляризацией электро-
дов. Поскольку рассматривается распределение тока на катоде,
то нас будет интересовать только катодная поляризация.
Принимая во внимание, что сопротивление металлов электро-
дов ничтожно мало по сравнению с другими сопротивлениями, урав-
нение (50) можно переписать так:
R = R3A + Rnep- (51)
Теперь представим себе, что электролиз ведется в ванне с двумя
катодами одинакового размера, расположенными на разных рас-
стояниях от анода по одну сторону от него (фиг. 15). Катоды отделены
один от другого стеклянной перегородкой.
Если ток, идущий через ближний катод, обозначить через 16,
а ток, протекающий через дальний катод 1д, то можно написать:
/ ________
6 Р^ер + ^ЭЛ
/ Е
д R&nep + ^эл
(52)
(53)
где индексы сопротивлений означают соответственно «ближний»
и «дальний».
Разделив уравнение (52) на уравнение (53), получим
1б __ Rdnep + ROM
'<> R6nep+R63A ’
(54)
т. е. ток на катодах распределяется в зависимости от соотношения
сопротивлений.
Если R3Jl намного больше Rnep, то последним можно пренебречь,
и распределение тока в основном будет определяться сопротивле-
нием электролита, т. е. межэлектродным расстоя-
нием. В этом случае уравнение (54) примет вид
'б Rd™
^эл
Иными словами, сил’ы (плотности) тока на ближнем и дальнем
катодах обратно пропорциональны сопротивлениям слоев электро-
литов, заключенных между анодом и дальним и ближним катодами.
4*
(55)
52
Часть первая. Теоретические основы гальваностегии
Отношение силы тока на ближнем и дальнем катодах в указан-
ном случае, т. е. когда переходное сопротивление почти отсутствует,
принято называть первичным распределением
тока. Оно обычно обозначается буквой К'
(56)
Следовательно, если, например, расстояние дальнего катода
от анода в пять раз больше, чем расстояние от анода до ближнего
катода, то, исходя из уравнения (56), получим, что К = 5.
Первичное распределение тока имеет место в том случае, когда
электрод не поляризуется.
При наличии заметной поляризации катода распределение тока
изменится и станет более равномерным. Это объясняется тем, что
поляризация растет с увеличением плотности тока и, следовательно,
э. д. с. поляризации снижает плотность тока на ближнем катоде
в большей степени, чем на дальнем, уменьшая тем самым неравно-
мерность первичного распределения тока. Отношение силы тока
на ближнем и дальнем катодах с учетом поляризации называется
вторичным распределением тока.
Если R3JL, наоборот, намного меньше Rn„p, то сопротивлением
можно пренебречь. В этом случае различив. ~ •расстояниях между ано-
дом и катодом не отражается."распределении тока между ближним
и ^лекто/хпитл? дг.,,-л и уравнение (54) принимает вид
______Rdllcp
fe~ Кбпер
(57)
Вместо Rnep можно пользоваться пропорциональной ему величи-
ной поляризации.
Количество осажденного металла на ближнем и дальнем электро-
дах пропорционально плотностям тока и выходам по току. Если
последний зависит от плотности тока, то
Gp __ /бЛб
Gg ~
(58)
где — отношение количеств металла, выделяемого в единицу
Gg
времени соответственно на ближнем и дальнем катодах.
„ и — выходы по току на ближнем и дальнем катодах.
Рассеивающая способность Т в процентах определяется по фор-
муле
Gc
т = —-£«-.1оо.
Л
(59)
Глава IV. Распределение тока на катоде
53
Согласно этой формуле, рассеивающая способность определяется
как отклонение распределения металла от первичного распределения
тока, выраженное в процентах.
Если в описанном выше электролизере (К — 5) количество выде-
лившегося на ближнем катоде металла в четыре раза больше, чем
на дальнем, то рассеивающая способность Т равна
Т =---- =——-100 = 20%.
D
При равномерном отложении металлов на ближнем и дальнем
катодах, т. е. когда G6: Gd = 1, рассеивающая способность соста-
вит 80%. Это максимальная теоретически возможная в данном слу-
чае величина рассеивающей способности.
Вторичное распределение тока всегда равномернее первичного.
Однако вторичное распределение металла может быть и менее рав-
номерным, чем первичное, т. е.
G6 : Gd > К.
В этом случае рассеивающая способность будет иметь отрицатель-
ное значение. Последнее наблюдается в ваннах, где с увеличением
плотности тока резко возрастает выход по току.
3. МЕТОДЫ ИЗМЕРЕНИЯ РАССЕИВАЮЩЕЙ СПОСОБНОСТИ ЭЛЕКТРОЛИТОВ
Из большого числа методов, предложенных для измерения рассеи-
вающей способности электролитов, будут рассмотрены лишь некото-
Фиг. 15. Прибор для измерения рас-
пределения тока и металла на ка-
тоде: а — общий вид; б — вид при-
бора сверху (схема):
1—дальний катод; 2—анод; 3—ближ-
ний катод; 4—стеклянная перегородка.
рые, получившие сравнительно широкое применение и основанные
на измерении распределения тока и металла на катоде.
Наибольшее распространение получил метод Г. Херинга и
В. Блюма. Измерения производят в электролизере, устройство
54
Часть первая. Теоретические основы гальваностегии
которого показано на фиг. 15. О распределении металла судят по при-
весу обоих катодов после электролиза. При идеальной рассеи-
вающей способности количество металла, осажденного на ближнем
и дальнем катодах, должно быть одинаковым.
Фиг. 16. Схема прибора для изучения
распределения металла на поверхно-
сти катода.
Для определения распределе-
ния металла на поверхности ка-
тода Н. Т. Кудрявцев и А. А. Ни-
кифорова предложили применять
катод, согнутый в двух местах под
углом 60°, который установлен
посередине между двумя анодами
(фиг. 16). О распределении металла
судят по толщине покрытия на
разных участках катода, опреде-
ляемой струйным методом.
Более точные данные о количе-
стве металла, осажденного на раз-
ных участках электрода, дает при-
менение предложенных различ-
ными авторами разборных электродов. Каждую составную часть
такого электрода взвешивают до и после электролиза и по величине
привеса судят о распределении металла на катоде.
Фиг. 17. Схема разборного катода для изучения распределения
металла на поверхности катода
(1—4 номера участков углового разборного катода).
Такой разборный катод, предложенный А. Ониченко, показан
на фиг. 17.
Очень удобные конструкции углового и цилиндрического разбор-
ных катодов были предложены А. Т. Баграмяном и Т. Б. Ильиной-
Какуевой. Угловой катод собирается из нескольких металлических
плабтинок. Он устанавливается вдоль двух сторон треугольных плит
из непроводящего материала таким образом, что они образуют
острый угол, обращенный к аноду.
Глава IV. Распределение тока на катоде
55
Цилиндрический разборный катод состоит из набора металли-
ческих шайб, плотно пригнанных друг к другу и надетых на общий
стержень; торцовая часть катода снизу и сверху закрывается шай-
бами, изготовленными из оргстекла или винипласта. Осаждение
металла происходит на боковой поверхности цилиндра.
Анод представляет собой пластинку, согнутую в виде трубки,
в центре которой устанавливается катод. Распределение металла
в обоих случаях оценивается по привесу отдельных участков катода.
Фиг. 18. Распределение различных металлов при элек-
троосаждении иа разборном плоском (а) и цилиндриче-
ском (б) катодах:
I — хром из стандартного электролита; II — цинк из серно-
кислого электролита; III —медь из цианистого электролита.
Преимущество указанных катодов состоит в том, что они просты
в изготовлении и сборка и разборка их производятся легко.
При сравнительном изучении распределения ряда металлов
на электроде с применением разборных катодов плоской и цилин-
дрической формы были получены следующие данные. Наилучшее
распределение металла имело место при осаждении серебра, меди
и цинка из цианистых электролитов. Наихудшее распределение
наблюдалось при осаждении хрома. Цинк, никель и медь, осажден-
ные из кислых электролитов, занимают среднее положение. Некото-
рые показатели, относящиеся к хромированию, цинкованию из кис-
лых электролитов и меднению из цианистых электролитов, приве-
дены на фиг. 18. По ординате отложено отношение привеса на
56
Часть первая. Теоретические основы гальваностегии
ближнем и дальнем катодах. Качественное совпадение результа-
тов для плоского (фиг. 18, а) и цилиндрического (фиг. 18, б) раз-
борных электродов, а также совпадение этих данных с ранее из-
вестными относительно распределения различных металлов на ка-
тоде указывают на то, что предложенные А. Т. Баграмяном и его со-
трудниками методы изучения распределения металла на катоде отли-
чаются не только простотой исполнения, но и надежностью полу-
чаемых результатов.
4. ВЛИЯНИЕ РАЗЛИЧНЫХ ФАКТОРОВ ЭЛЕКТРОЛИЗА
НА РАССЕИВАЮЩУЮ СПОСОБНОСТЬ ЭЛЕКТРОЛИТОВ
Je
Yffi Yh 4>би
Фиг. 19. Зависимость катодной
поляризации от плотности тока на
ближнем и дальнем катоде при раз-
личных формах поляризационных
кривых.
На рассеивающую способность электролитов действуют следующие
три группы факторов:
1) электрохимические факторы (наклон поляризационной кривой
катода, выход по току);
2) геометрические факторы (форма и размер ванн, межэлектрод-
ные расстояния, расположение электродов);
3) преходящие (случайные) факторы (природа покрываемого
металла, неоднородность поверхности катода, состояние его поверх-
ности и т. д.).
Рассмотрим, как влияют эти фак-
торы на рассеивающую Способность
ванн.
Влияние катодной поляризации.
Высокое значение катодной поляри-
зации способствует более равномер-
ному распределению тока на поверх-
ности катода. Известно, например,
что цианистые ванны, отличаясь
большой катодной поляризацией,
имеют и большую рассеивающую
способность по сравнению с кислыми
ваннами.
Определяющую роль при этом
играет наклон поляризационной кри-
зависимость потенциала катода от
вой: чем сильнее выражена
плотности тока, тем выше рассеивающая способность электролита.
Так, из двух ванн, поляризационные кривые для которых предста-
влены на фиг. 19, большей рассеивающей способностью обладает
вторая. Как следует из фигуры, при одном и том же соотноше-
нии плотностей токов /й: Jd разность потенциалов Д«р ближних
и дальних участков I и II катодов соответственно равны: для
I катодов
для II катода
АФт = Фб i — Фа I
Дфп — фб п — фа п
Глава IV. Распределение тока на катоде
57
и поскольку Дф! < Лфп, то распределение тока на втором катоде
носит более равномерный характер, чем на первом катоде.
Повышение температуры электролита и перемешивание рас-
твора, уменьшая катодную поляризацию, приводят к ухудшению
равномерности распределения тока и, следовательно, к снижению
рассеивающей способности электролита.
Обратное действие оказывают добавки поверхностноактивных
веществ и коллоидов.
Влияние выхода по току. Выход металла по току, как правило,
зависит от плотности тока. Из уравнения (58) видно, что в тех слу-
1 II
2 и е
Номер участка
Фиг. 20. Распределение
.металла на разных уча-
стках плоского катода
в зависимости от формы
электролизера. (Размеры
сосудов: I — 60 X 500;
II — 400 X 500; меж-
электродное расстояние
160 мм.)
Фиг. 21. Распределение металла на раз-
ных участках углового катода в зависи-
мости от формы электролизера. (Ближай-
шее расстояние от анода до катода 60 леи;
кривые I и II соответствуют ячейкам
I и II.)
чаях, когда выход по току уменьшается с повышением плотности
тока, как это имеет место при осаждении благородных металлов,
распределение осадка на поверхности становится более равномерным,
т. е. рассеивающая способность возрастает. В тех случаях, когда
выход металла по току увеличивается с повышением плотности тока
(это характерно для металлов, стоящих в ряду напряжений до водо-
рода), рассеивающая способность снижается.
Влияние формы и размера ванны. Влияние, оказываемое формой
и размером гальванической ванны на распределение тока, тесно свя-
зано с формой и размером электродов. Совместное действие этих
факторов на распределение тока для некоторых простейших случаев
показано на фиг. 20—21.
На этих рисунках показан вид ванн сверху и расположение в них
электродов. В нижних частях рисунков показано распределение
металла на различных участках разборных катодов, причем на оси
збецисс указан номер участка катода, а на оси ординат привес
металла в мг/елг.
58
Часть первая. Теоретические основы гальваностегии
Номер участка
Фиг. 22. Распределе-
ние металла на разных
участках углового ка-
тода в зависимости от
размеров сосуда: / —
50x62,5;//—400X500.
Из фиг. 20 видно, что распределение металла в ванне / более рав-
номерное, чем в ванне //. Это связано с тем, что во второй ванне ток
проходит не только через слой электролита, заключенного между
электродами, но и через прилегающий боковой
слой раствора. Однако не во всех случаях
узкие ванны предпочтительны. Так, например,
из фиг. 21, где приведены те же ванны, но
с угловым катодом, следует, что распределение
металла в ванне / гораздо хуже, чем в ванне//.
Это объясняется тем, что в широкой ванне
имеются более благоприятные условия про-
хождения тока к удаленным участкам катода,
чем в узкой ванне.
Таким образом, можно сделать вывод, что
влияние, оказываемое формой ванны на рав-
номерность распределения металла, изменяется
в лучшую или худшую сторону в зависимо-
сти от формы катода.
Некоторое влияние на характер распределения металла оказы-
вает и размер ванны. Как видно из фиг. 22, для одних и тех же
катодов, находящихся на одинаковом расстоянии от анода, распре-
деление металла в большой ванне лучше, чем в маленькой.
। । । । ।__1
12 3 4 5 6
Номер участка
Фиг. 24. Распределение ме-
талла на разных участках
плоского катода в зависи-
мости от межэлектродного
расстояния в широком (ци-
линдрическом) сосуде.
Номер участка
Фиг. 23. Распределение метал-
ла на разных участках пло-
ского катода в зависимости
от межэлектродного расстоя-
ния в узком прямоугольном
сосуде.
Влияние межэлектродного расстояния. Влияние межэлектрод-
ного расстояния на распределение металла видно из данных, приве-
денных на фиг. 23 и 24.
На фиг. 23 представлена схема распределения плоских элек-
тродов в узкой прямоугольной ванне, причем расстояние между
Глава IV. Распределение тока на катоде
59
электродами составляет соответственно 10, 160 и 480 мм. Как видно
из фигуры, распределение металла на каждом из катодов не зависит
от положения катода в ванне, так как во всех трех случаях ток про-
ходит только через слой электролита, находящегося между электро-
дами. Поскольку увеличение межэлектродного расстояния вызывает
одинаковое увеличение сопротивления электролита для любого
участка катода, то распределение тока (металла) от этого не ме-
няется.
На фиг. 24 представлена схема расположения плоскопараллель-
ных электродов в широкой цилиндрической ванне, где расстояние
между электродами составляет 1 =
= 10 и II = 107 мм. Распределе-
ние металла здесь заметно зависит
от межэлектродного расстояния: рав-
номерность распределения металла
с увеличением межэлектродного рас-
стояния резко понижается. Это
объясняется повышением плотности
тока на краях электрода из-за уве-
личения доли тока, проходящего
через боковые слои раствора. Приме-
нение в описанном опыте углового
катода взамен плоского делает рас-
пределение металла мало зависящим
от межэлектродного расстояния по
двум причинам. Во-первых, по мере
удаления электродов друг от друга
уменьшается относительное различие
в расстояниях между ближними
5 801- Г—
§ 1 J I . I I I l_i
0 2 4 6 8 10
Номер шайБы
Фиг. 25. Распределение металла
иа разных участках цилиндриче-
ского катода в зависимости от глу-
бины его погружения в электролит
(поверхность шайбы ~ 8,5 см2).
и дальними участками углового ка-
тода; во-вторых, доля тока, проходящего через боковой слой элек-
тролита, увеличивается.
Взаимное расположение электродов. Большое влияние на рас-
пределение металла имеет местонахождение катода в ванне.
Рассмотрим фиг. 25, где приведено распределение металла
на поверхности цилиндрического катода при различной глубине
его погружения в электролит. Из фигуры видно, что при погру-
жении катода до дна ванны металл выделяется преимущественно на
верхних участках катода, и наоборот: если катод находится в верх-
ней части ванны, то осадок выделяется преимущественно на ниж-
них участках катода. В двух указанных случаях распределение
металла неравномерное. При погружении катода в среднюю часть
ванны распределение металла тоже будет неравномерным, но в дан-
ном случае эта неравномерность вызвана преимущественным отло-
жением металла на обоих концах катода. Равномерное распреде-
ление металла на поверхности катода будет иметь место лишь
60
Часть первая. Теоретические основы гальваностегии
в том случае, когда уровень электролита в ванне не превышает
высоты самого катода.
Этот пример показывает, что одним лишь изменением положения
катода в ванне можно добиться значительного изменения распределе-
ния металла на его поверхности.
Влияние природы и состояния поверхности покрываемого металла.
Получение равномерного слоя покрытия в ряде случаев зависит
также от природы катода. Например, медь покрывается никелем
относительно равномерно, в то время как осаждение серебра на ни-
кель обычно связано с большими трудностями, так как покрытие
либо получается неравномерным, либо плохо пристает к основе.
Затруднения, связанные с природой покрываемого металла, иногда
проявляются в том, что не удается получить сплошные покрытия.
На отдельных участках катода металл не осаждается.
Для устранения этих недостатков целесообразно применять
следующий прием: в первый момент электролиза плотность тока
повышается в несколько раз против нормы — дают так называемый
«толчок» тока, а затем снижают его до нормального значения. Реко-
мендуется также использовать промежуточное покрытие, отличающее-
ся хорошим сцеплением как с основой, так и с главным покрытием;
например, для хромирования меди рекомендуется подслой никеля.
Распределение тока на поверхности катода будет неравномерным
и в том случае, если поверхность его неоднородна по составу; процесс
осаждения на различных включениях может быть либо облегчен,
либо, наоборот, затруднен по сравнению с основным металлом катода.
Кроме того, большую роль играет величина перенапряжения
водорода на включениях. При низких значениях водородного пере-
напряжения на отдельных участках катода, последние могут вообще
не покрываться, на них будет выделяться только водород.
На равномерность распределения тока заметное влияние оказы-
вает также предварительная подготовка поверхности катода. Для
получения сплошных и относительно равномерных покрытий необ-
ходимо, чтобы поверхность катода была чиста, т. е. свободна от окис-
лов или адсорбированных веществ. Иногда здесь помогает кратко-
временный начальный «толчок» тока.
5. ИСКУССТВЕННЫЕ ПРИЕМЫ УЛУЧШЕНИЯ РАВНОМЕРНОСТИ
РАСПРЕДЕЛЕНИЯ ТОКА
Для получения равномерного покрытия кроме выбора соответ-
ствующего состава электролита и режима работы на практике при-
меняется ряд искусственных (механических) приемов, которые
улучшают распределение тока на поверхности катода. С метал-
лами, для которых не удается подобрать ванны с хорошей рас-
сеивающей способностью, применение этих специальных мер осо-
бенно необходимо.
Глава IV. Распределение тока на катоде
G1
Фиг. 26. Способ завеши-
вания рефлектора с внут-
ренним анодом:
1 — рефлектор; 2 — анод.
Важнейшими из приемов, применяемых для получения равно-
мерного покрытия, являются следующие.
1. Применение дополнительных анодов, примерно повторяющих
форму покрываемых изделий (фиг. 26). Расстояние между различ-
ными участками катода и соответствую-
щими участками анода при этом получается
одинаковым, а покрытие — более равно-
мерным.
2. Увеличение расстояния между анод-
ными и катодными штангами, что приводит
к уменьшению относительной разности рас-
стояний выступающих и углубленных участ-
ков катода от анода.'
3. Применение дополнительных защит-
ных катодов (фиг. 27). Расположенные
вблизи выступающих частей покрываемых
изделий дополнительные катоды, принимая
на себя часть тока, устраняют образова-
ние на этих участках «загаров» или дендритов и способствуют получе-
нию равномерных покрытий.
4. Применение непроводящих щитов или экранов. Эти приспособ-
ления, помещенные между выступающими участками катода и ано-
Фиг. 27. Схема расположения анода и покрываемой детали:
а — при свободной завеске в ванну; б — при хромировании
с дополнительными катодами.
Дом, заметно увеличивают протяженность соединяющих их силовых
линий и тем самым снижают плотность тока на них. Равномерность
покрытия при этом увеличивается.
Часть вторая
МЕТОДЫ ПОДГОТОВКИ МЕТАЛЛИЧЕСКОЙ
ПОВЕРХНОСТИ ДЕТАЛЕЙ ПЕРЕД НАНЕСЕНИЕМ
ПОКРЫТИЙ
Получение доброкачественных покрытий, их хороший внешний
вид, а также прочное сцепление покрытий с основным металлом
деталей могут быть обеспечены только при тщательной подготовке
поверхности к нанесению металлических покрытий.
Детали должны быть обработаны перед поступлением в гальва-
нический цех согласно техническим требованиям к классу чистоты
поверхности.
Даже совершенно чистая на вид поверхность металлических изде-
лий и деталей, поступающих для химической или электрохимической
обработки, на самом деле всегда покрыта тонкой пленкой окислов
и жировых загрязнений. Присутствие их, как правило, приводит
к совершенно неудовлетворительному сцеплению покрытий с основ-
ным металлом. Наличие же ржавчины, окалины или значительных
жировых загрязнений может привести к тому, что детали либо
вовсе не покрываются осадком, либо покрытия получаются неудов-
летворительного качества.
Различают следующие методы подготовки поверхности металли-
ческих деталей перед нанесением покрытий: механический, химиче-
ский и электрохимический.
Механическая подготовка заключается в шлифо-
вании, полировании, галтовке, крацеваиии, пескоструйной, дробе-
струйной или гидро-абразивной обработке. Задачей механической
подготовки является удаление неровностей, царапин, раковин,
а также придание деталям в случае необходимости блестящей по-
верхности. Иногда перед механической обработкой ставится задача
удаления окалины.
Повышение чистоты поверхности увеличивает износостойкость
деталей и повышает их противокоррозионную устойчивость.
Классы чистоты поверхности регламентируются ГОСТ 2789—59.
Шероховатость поверхности определяется средним арифметическим
отклонением Ра или высотой неровностей /?2.
По ГОСТ 2789 — 59 предусмотрено 14 классов чистоты. Для 1-го
класса высота неровностей не должна превышать 320 мк, а для
14-го класса она должна быть не более 0,05 мк.
Химическая и электрохимическая подго-
товка имеет задачей удаление жиров и масел (обезжиривание),
Часть вторая. Методы подготовки поверхности деталей ЬЗ
удаление окислов, ржавчины или окалины (травление), удаление тон-
чайшей пленки окислов и выявление структуры металла (декапирова-
ние, матирование), сглаживание неровностей и придание блеска
поверхности деталей (химическое и электрохимическое полирова-
ние) и т. п.
По степени блеска ГОСТ 9791—61 подразделяет гальванические
покрытия на матовые, блестящие, глянцевые
и зеркальные.
Перед фосфатированием чистота поверхности деталей должна быть
в пределах 4—6-го классов, перед оксидированием — в пределах
6—Ю-го классов. Для деталей, на которые наносят матовые покры-
тия, рекомендуется чистота поверхности от 5 до 7-го классов. По-
верхность деталей, на которые наносят блестящие покрытия, должна
быть обработана по 7—9-му классам.
ГЛАВА V
МЕХАНИЧЕСКАЯ ПОДГОТОВКА ПОВЕРХНОСТИ
Существует несколько способов механической подготовки деталей
перед нанесением покрытий. Выбор способа зависит от состояния
поверхности деталей, поступающих на покрытие, от требований,
предъявляемых к внешнему виду деталей, а акже от их размеров.
Как уже упоминалось, в комплекс механической подготовки
входят:
1) шлифование и полирование;
2) галтовка;
3) крацевание;
4) пескоструйная, дробеструйная и гидро-абразивная обработка.
Шлифование и полирование являются самыми дорогостоящими
операциями из всех применяемых при нанесении покрытий, поэтому
они целесообразны в случае высоких требований к классу чистоты
поверхности и невозможности использования другого способа. Песко-
струйная обработка является эффективным методом подготовки
поверхности деталей перед нанесением покрытий, однако связанная
с ней профессиональная вредность заставляет свести применение
данного метода к минимуму.
1. ШЛИФОВАНИЕ И ПОЛИРОВАНИЕ
Шлифованием называют механический процесс получе-
ния pg^Hofi и гладкой поверхности путем снятия тонкой стружки при
помощи мелких зерен абразивных материалов.
Различают грубое шлифование, или обдирку, и тонкое шлифова-
ние — декоративное.
Грубое шлифование, как правило, производится в механических
цехах при помощи кругов, состоящих из абразивных материалов,
сцементированных какой-либо связкой. Иногда для этой цели при-
меняют также круги из эластичных материалов, на которых закреп-
лены грубые сорта абразива.
Тонкое, или декоративное, шлифование осуществляется при
помощи эластичных кругов или непрерывной ленты, на которые нане-
сен слой абразива.
Полированием называют процесс получения блестящей
зеркальной поверхности путем сглаживания мельчайших неровностей
предварительно шлифованной поверхности деталей.
Глава V. Механическая подготовка поверхности
65
По поводу природы процессов, происходящих при полировании,
существуют разные точки зрения. Так, по мнению акад. И. В. Гре-
бенщикова, во время полирования зерна абразива снимают окисную
пленку, образующуюся на обрабатываемом металле под воздействием
окружающей среды, а также веществ, входящих в состав полироваль-
ных паст. В первую очередь пленка удаляется с микровыступов обра-
батываемой поверхности, обнаженная поверхность металла вновь
покрывается пленкой окислов, которая опять-таки удаляется поли-
ровальником. Так процесс продолжается до полного сглаживания
Таблица 6
Последовательность переходов при шлифовании и полировании деталей
из различных материалов
Шлифование Шлифова- ние с «за- садкой» Полирование
Характеристика обраба- тываемого материала Зернистость аб азива в мешах Паста
о ю а 6 ь к W со о
1 8 СО 1 § д со 2 со 7 о сч о к Р. W * = о СО К п « К со S о X
Чугунные отливки и сварные детали ± + + + + + + ±
Стальные кованые детали — + -L + + +
Стальные штампованные детали больших и средних размеров — + 4- + ± +
Детали из нержавеющей стали — — “Г -L + ±
Стальные болты, шурупы н детали небольших разме- ров — — ± + — -и
Детали простой конфигу- рации из латуни и цинко- вых сплавов — — — + + + +
Детали сложной конфи- гурации из латуни и цин- ковых сплавов — — — + 4- +
Детали из алюминиевых сплавов — ± -р ± +
Детали из пластмасс — — — + -4~
Условные обозиа мнется в отдельных случаях. ч е и и я: -р применяется; — не применяется; ± приме-
5
Вайнер и Дасоян
66
Часть вторая. Методы подготовки поверхности деталей
поверхности. По мнению других исследователей, выравнивание
поверхности мягких металлов при полировании происходит путем
раздавливания отдельных выступающих частиц металла и запол-
нения ими углублений.
Некоторые объясняют явление сглаживания поверхности тепло-
вым эффектом, вследствие которого металл растекается по поверх-
ности, заполняя все неровности.
Шлифование производят с таким расчетом, чтобы риски, остав-
шиеся от предыдущих переходов, устранялись последующими пере-
ходами.
Для этой цели необходимо правильно чередовать номера зер-
нистости абразивных материалов, а также следить за тем, чтобы
риски от абразивов на металле были направлены перпендикулярно
или под углом 30—40° к рискам от предыдущего перехода.
Последний переход должен быть продольным, так как при этом
обеспечивается наилучшее сглаживание поверхности.
Примерная последовательность операций при шлифовании и поли-
ровании приведена в табл. 6.
Шлифованием абразивами получают чистоту поверхности в пре-
делах 6—10-го классов. При полировании на кругах с пастами чис-
тота поверхности повышается до 10—13-го классов. Чистота поверх-
ности деталей, поступающих на полирование, не должна быть
ниже 7-го класса, так как иначе значительно увеличится про-
должительность обработки и появится опасность искажения геомет-
рии поверхности.
Абразивные материалы
В практике шлифования и полирования применяются абразивные
материалы, состоящие из зерен, обладающих высокой твердостью
и режущей способностью. Для шлифования применяют более твер-
дые абразивные материалы, чем для полирования.
Для шлифования и полирования обычно используют следующие
абразивные материалы: карбид кремния, корунд, наждак, трепел,
кремнезем, крокус, известь, окись хрома и др.
- Карбид кремния SiC получается искусственным путем
в электропечах. Уд. вес 3,12—3,22, температура плавления 2200°.
По твердости приближается к алмазу, хрупкий. Частицы SiC имеют
острые ребра и гладкие грани. Применяется для грубого шлифова-
ния хрупких материалов (например, чугуна).
Корунд — абразивный материал значительной твердости.
Чаше всего применяется электрокорунд, получаемый сплавлением
глинозема А12О3 с коксом. Уд. вес 3,2—4,0; температура плавления
1950—2000°. Твердость корунда повышается с увеличением содержа-
ния глинозема. Лучшие сорта электрокорунда, содержащие 90—
99% окиси алюминия, обладают твердостью, равной 9 ед. по шкале
Мооса.
Глава V. Механическая подготовка поверхности
67
Корунд, отличающийся большей вязкостью, чем карбид кремния,
применяется для грубого шлифования материалов, обладающих
большим сопротивлением на разрыв (закаленная сталь, ковкий чу-
гун и т. п.).
Наждак — смесь корунда (60—70%) с окислами железа,
кремния, титана, кальция, магния и т. д. Твердость наждака, завися-
щая от процентного содержания корунда, равна 7—8 ед. по шкале
Мооса. Наждак может применяться для шлифования всех металлов.
Мелкозернистые сорта используются для приготовления полировоч-
ных паст.
Фиг. 28. Зерна крокуса (X 33 000).
Кварц по химическому составу представляет собой более
или менее чистый кремнезем SiO2. Твердость кварца 7 ед. по шкале
Мооса. Частицы кварца не имеют острых режущих граней, поэтому
кварц чаще всего применяется для очистки деталей в барабанах
и колоколах. Пылевидный кварц под названием «маршалит» употреб-
ляется для приготовления полировочных паст.
Трепел состоит главным образом из кремнезема в виде ча-
стично или полностью сохранившихся скелетов микроскопических
водорослей. Твердость его составляет 5—6 ед. по шкале Мооса.
Зерна его пластичны, пористы и не имеют острых режущих граней.
Трепел, являясь универсальным полирующим материалом, осо-
бенно пригоден для полирования мягких металлов и сплавов (латуни,
алюминия и т. п.).
Крокус (фиг. 28) — материал, состоящий в основном из
окиси железа Fe,O3 (70—95%); получается путем измельчения и от-
мучивания чистых разновидностей красного железняка (гематита).
Полировальники из кристаллической окиси железа — крова-
вики — применяются для полирования драгоценных металлов.
5*
68
Часть вторая. Методы подготовки поверхности деталей
Крокус может быть получен и искусственным путем из отходов
сернокислотного производства — так называемых пиритных огарков
с содержанием окиси железа в пределах от 75 до 85%.
Крокус широко применяется для полирования стальных деталей.
Венская известь является продуктом обжига извест-
няка и доломита. Содержит не менее 94,5% окиси кальция с неболь-
шим количеством примеси окиси магния, окиси железа и др. Зерна
венской извести имеют закругленную форму без острых режущих
граней. Пригодна для полирования почти всех металлов до высокого
блеска.
Окись хрома получают прокаливанием измельченного
двухромовокислого калия с серой при температуре 800° в течение
4—5 час.
Окись хрома употребляется для полирования твердых металлов,
а также для приготовления пасты ГОИ.
Согласно ГОСТ 3647—59, абразивные материалы делятся на
группы и обозначаются номерами в зависимости от размеров зерна
(табл. 7).
Таблица 7
Группа зернистости
Наименование группы Номера зернистости
Шлнфзерно Шлифпорошки Микропорошки 200, 160, 125, 100, 80. 63, 50, 40, 32, 25. 20, 16 12, 10, 8, 6, 6, 4, 3 М40, М28, М14, М10, М7, М5
В табл. 8 приведено сопоставление обозначений зернистости
по ГОСТ 3647—59 (метрическая) с ранее действовавшей дюймовой си-
стемой обозначения в мешах.
Таблица 8
Обозначения зернистости абразивных материалов
По IOCT 3647—59 (в 0,01 мм) 200 160 125 100 80 63 50 40 32 25
По дюй- мовой системе ! (в мешах) 10 12 16 20 24 30 36 46 54 60
По ГОСТ 3647—59 (в 0,01 мм) 20 16 12 10 8 6 5 4 3
По дюй- мовой системе (в мешах) . 70 80 100 120 150 180 230 280 320
Глава V. Механическая подготовка поверхности
69
Шлифовально-полировальные круги
Шлифование и полирование осуществляется при помощи кругов
или непрерывной гибкой абразивной ленты, укрепленных на стан-
ках, полуавтоматах и автоматах.
Шлифовальные круги различаются по твердости.
Твердостью абразивных кругов, применяемых для гру-
бого шлифования, принято считать сопротивле-
ние связки круга выкрашиванию абразив-
ных зерен под воздействием внешних усилий. Твердостью
накатных войлочных и матерчатых кругов
считается величина сопротивления материала
круга деформации при воздействии внешних усилий.
11ри выборе абразивного круга руководствуются следующими
требованиями: чем тверже обрабатываемый материал, тем мягче
должен быть круг (за исключением весьма мягких и вязких мате-
риалов); чем больше площадь соприкосновения круга с деталями,
тем мягче должен быть круг; обдирочное шлифование должно
производиться более твердыми кругами, чем получистовое; чем
больше скорость вращения круга, тем мягче должен быть круг.
Для получения чисто отшлифованной поверхности рекомендуется
употреблять круги, твердость которых на одну ступень выше
твердости круга, применявшегося при предыдущем переходе.
Принятые обозначения твердости шлифовальных кругов при-
ведены в табл. 9.
Обозначения твердости шлифовальных кругов
Таблица 9
Название круга Обозначение
Мягкий Средиемягкий Средний Средиетвердый Твердый Весьма твердый Чрезвычайно твердый Ml, М2, М3 СМ1, СМ2 Cl, С2 СТ1, СТ2, СТЗ Т1, Т2 ВТ1, ВТ2 ЧТ1, ЧТ2
При шлифовании твердого материала, как правило,
следует пользоваться кругами, входящими в группы средне-
М я Г к И X и мягких.
Наибольшее применение при грубом шлифовании имеют круги,
зготовленные на керамической, бакелитовой и вулканитовой
70
Часть вторая. Методы подготовки поверхности деталей
связках. Керамические связки готовятся на основе глины, плавней
или кварца. Бакелит представляет собой искусственную смолу, по-
лучаемую при совместной полимеризации фенола и формальдегида.
Вулканитовая связка состоит в основном из искусственного или на-
турального каучука, вулканизированного серой, и наполнителей.
Для отделочного шлифования применяются войлочные, фетро-
вые, шерстяные, хлопчатобумажные, кожаные и другие круги.
При отделочном шлифовании, а также при поли-
ровании необходимо для более мягких метал-
лов подбирать и более мягкие, т. е. бо лее э л а с
т и ч н ы е круги.
Фиг. 29. Кожаный наборный
круг с деревянным основанием,
(/—основание; 2—втулка; 3—кожа).
Фиг. 30. Наборный круг из
наждачного полотна.
В качестве основы для приготовления кругов часто приме-
няют дерево или сталь.
Деревянные круги для обработки деталей простой конфигурации
бывают секторные, фанерные и пластинчатые. Круги обтачи-
вают, балансируют и обтягивают кожей, на которую наносят абра-
зивные зерна.
Кожаные наборные круги изготовляют с металлической или дере-
вянной основой (фиг. 29). Кусочки кожи перед насадкой на бурт
смазывают мездровым клеем. После балансировки и накатки абразив-
ного зерна круги высушивают.
Наборные круги с толщиной кожаного покрова 30 мм, диамет-
ром 300 мм и шириной 3—5 мм служат в течение 6000—12 000 час.
С увеличением диаметра круга или толщины кожаного покрова срок
службы кругов значительно повышается.
Применяют также наборные круги из войлока, фетра и наждач-
ного полотна. Наборный круг, составленный из кусков наждачного
полотна, показан на фиг. 30.
^Войлочные круги бывают различной твердости и эластичности.
Они различаются по удельному весу, который колеблется от 0,08
до 0,60 и выше. Обыкновенно наиболее тяжелые круги являются
•и наиболее твердыми.
Глава V. Механическая подготовка поверхности
71
Фетровые круги отличаются высокой плотностью и применяются
в тех случаях, когда требуется высокая твердость круга. Они очень
удобны для шлифования твердых металлов, а также деталей с ост-
рыми и прямыми углами, отверстиями и т. п.
В связи с тем, что фетровым и войлочным кругам можно придать
различные профили, ими удобно пользоваться при шлифовании дета-
лей сложной конфигурации.
Матерчатые круги изготовляются путем сшивания круглых
дисков, вырезанных из парусины, брезента, бязи, байки, фланели
Фнг. 31. Способы прошивки матерчатых шлифовальных кругов: кон-
центрический; радиальный; спиральный; тангенциальный; крестообраз-
ный (а — твердый круг; б — мягкий круг).
и других подобных материалов. Круги состоят из 12—15 секций
толщиной по 8—10 мм. В каждой секции 16—20 дисков, сшитых или
склеенных. Вырезка дисков производится вручную или на прессах.
На фиг. 31 показано несколько методов сшивания кругов. Наи-
большее распространение имеют концентрические и спиральные
прошивки. От метода сшивания зависит твердость круга: чем чаще
сделаны швы, тем тверже круг. У твердых кругов расстояние между
швами составляет 5—10 мм, у мягких доходит до 15—20 мм,
В табл. 10 приведен вес кругов из хлопчатобумажной ткани.
Круги подвергаются центрованию и балансированию на специаль-
ных станках.
Центрование заключается в выравнивании окружности круга;
сцентрованный шлифовальный круг при вращении на станке не дол-
жен иметь биения.
После центрования шлифовальные круги подвергают балансиро-
ванию на установке, приведенной на фиг. 32. Поворачивая круг,
устанавливают его в различные положения, при этом выравнивают
72
Часть вторая. Методы подготовки поверхности деталей
Таблица 10
Вес хлопчатобумажных кругов при ширине 25 мм
Диа- метр в мм Вес круга в кГ из ткани: Диа- метр в мм Вес круга в кГ из ткаии
обычной кипериой обычной кипериой
150 0,210—0,220 0,240—0,250 400 1,430—1,510 1,670—1,760
200 0,360—0,375 0,430—0,450 450 1,820—1,895 2,150—2,280
250 0,575—0,600 0,680—0,715 500 2,210—2,320 2,670—2,790
300 0,770—0,800 0,940—0,970 550 2,580—2,840 3,330—3,520
350 1,100—1,55 1,350—1,410 600 3,360—3,570 4,020—4,250
Фнг. 32. Балансировоч-
ный станок.
круг по толщине или утяжеляют свинцовым грузом более легкую его
часть. Выверенные, уравновешенные круги не имеют биения и обес-
печивают производительную и безопасную
работу.
Поверхность уравновешенного круга сма-
зывается жидким стеклом, декстрином, ка-
зеиновым или столярным клеем.
Плиточный столярный клей кладут в воду
на 6—12 час. для набухания, затем его
нагревают до температуры 65—70°.
Степень густоты клея при накатке кру-
гов наждаком приведена в табл. 11.
Нагретый клей наносится на рабочую
поверхность круга, после чего производится
накатка абразивным зерном, также подогре-
тым до 40—45°. Накатка производится вруч-
ную или на специальных станках.
Круги можно накатывать абразивным зерном в 2—3 слоя, при
этом каждый слой слегка подсушивают, а окончательную сушку про-
изводят после нанесения последнего слоя.
Таблица 11
Густота клея при накатке кругов
Зернистость абразива Содержание в % Зернистость абразива Содержание в %
клея ВОДЫ клея ВОДЫ
63—80 50 50 10—12 33 67
32—40 45 55 6-8 30 70
20—50 40 60 4—5 25 75
10—16 35 65 3 20 80
Глава V. Механическая подготовка поверхности.
73
В случае применения войлочных кругов первый слой обязательно
накатывают с применением мездрового клея, а последующие слои
можно накатывать и с жидким стеклом. Для накатки первого слоя
зерна жидкое стекло не применяется, так как оно плохо соединяется
с войлоком. На текстильные круги первый слой зерна можно на-
клеивать жидким стеклом, так как ткань хорошо сцепляется с ним.
Абразивный слой уплотняют прокатыванием на гладком листе,
затем круги сушат в естественных условиях при температуре 18—25°
или в искусственных условиях при 30—40° и относительной влаж-
ности атмосферы, равной 50%. В естественных условиях длительность
сушки круга с однослойной накаткой равна примерно 24 час., а с двух-
слойной — 48 час. Длительность сушки при повышенной температуре
составляет для круга с однослойной накаткой 12 час., а с двухслой-
ной — 24 часа.
Для шлифования цветных металлов применяют круги из мягкого
войлока. Шлифование стальных деталей! производится кругами
из жесткого войлока. Алюминиевые детали шлифуют кругами из мяг-
кого войлока, накатанными электрокорундом, при скорости около
30 мкек. и небольших давлениях. Обычно войлочные круги исполь-
зуют для получения 8—9-го классов чистоты. В этих случаях приме-
няются шлифпорошки № 4—6. Текстильные круги той же зернистости
позволяют получать чистоту поверхности на один класс, грубее,
обычно 7—8-го классов.
При шлифовании, как уже указывалось, достигается чистота
поверхности, соответствующая 6—10-му классу по ГОСТ 2789—59.
При полировании чистота достигает 13-го класса.
Перед полированием рекомендуется производить «засалку», или
матирование, т. е. шлифование выполнять при помощи засаленного
круга. При этом сглаживаются мельчайшие неровности поверхности.
Для этой цели круг с мелким образивным зерном, такой же, как
применявшийся при предыдущем переходе шлифования, смазывают
техническим салом, стеарином, парафином или пастами, состав кото-
рых приведен в табл. 12.
Полировальные круги изготовляют из следующих
материалов: фетра, войлока, бязи, миткаля, байки, сукна, киперной
ткани ит. п., на которые в процессе работы наносится полирующая
паста. Одним из лучших материалов для изготовления полировочных
кругов является киперная ткань.
Полировочные круги могут быть непрошитыми или сшиваться
из секций. Основные виды прошивок показаны на фиг. 33. Спираль-
ная прошивка, как наиболее простая, получила широкое распростра-
нение.
Непрошитые круги представляют собой диски материала одного
сорта, смонтированные на шпинделе станка при помощи гаек или
' специальных конусов, которые позволяют ускорить установку
и снятие круга.
!ч Часть вторая. Методы подготовки поверхности деталей
Таблица 12
Рецептура паст для засаливания кругов
Обрабатываемые металлы Составные части пасты Количество в вес. ч.
Наждачная пыль 60—70
Парафин 20
Сало говяжье 10—20
Черные металлы Масло смазочное 2
Маршалит 80
Парафин 10
Солидол Т 19
Церезин 0,2
Медь, цинк, алюминий и их Наждачная пыль 40
сплавы Стеарин 60
Непрошитые круги
ного блеска деталей
применяются для полирования до интенсив-
сложной конфигурации.
Фиг. 33. Основные ви-
ды прошивки полиро-
вальных кругов.
На фиг. 34 показаны полировочные круги с самоохлаждением.
Подобные круги собирают из отдельных сложенных определенным
образом дисков, которые затем сшивают или скрепляют штырями,
Глава V. Механическая подготовка поверхности
75
имеющимися в секциях ступицы. Полировочные круги указанной
системы хорошо удерживают пасту, при работе охлаждаются, вслед-
ствие чего допустимы более высокие скорости вращения при полиро-
вании.
Полировочные пасты (табл. 13) содержат абразив,
связующие вещества и некоторые добавки. В качестве абразива при-
меняются окислы металлов: окись железа, окись хрома, венская
цзвесть, окись алюминия. В качестве связующего вещества приме-
няются стеарин, парафин, олеиновая кислота, говяжье сало и жирные
Фиг. 34. Самоохлаждающийся полировочный круг.
синтетические кислоты и т. п. В качестве специальных добавок
в пасты вводятся сера, скипидар и керосин — с целью изменения
вязкости пасты и улучшения ее полирующих свойств. Заслуживает
внимания добавка в состав пасты поверхностноактивных веществ
типа ОП-7 или ОП-10, облегчающих последующее удаление пасты.
Пасты готовят следующим образом: на умеренном закрытом
огне расплавляют жиры, вводят специальные добавки и затем абра-
зив. Полученную массу тщательно перемешивают и отливают в бу-
мажные или металлические формы.
Некоторые сорта паст, особенно содержащие венскую известь,
имеют ограниченный срок хранения и сохраняются в герметичной
упаковке.
Широкое распространение получили хромовые пасты, разработан-
ные Государственным оптическим институтом (пасты ГОИ).
Пасты эти подразделяются на грубые, средние и тонкие; состав их
приведен в табл. 14.
76
Часть вторая. Методы подготовки поверхности деталей
Таблица 13
Полировочные пасты
Состав пасты
Полируемый металл Наименование компонентов Содержание в вес. % в пастах
№ 1 № 2 № 3
Углеродистая и не- ржавеющая сталь, хром Окнсь хрома /. Стеарин Олеиновая кислота * Парафин >Воск 65 23 4 8 72 14 14 —
Алюминий, никель, медь и ее сплавы Парафин Олеиновая кислота Окись железа Стеарин Венская известь Церезин Техническое сало Скипидар Воск 7.8 25,0 49,0 18,2 23,0 71,8 1.5 1,5 2,2 10,0 10,0 70.0 10
Сталь, никель, медь и ее сплавы Окись железа Стеарин Олеиновая кислота Церезин Окись хрома 73,0 18.6 1.0 2,0 5,4 35,0 3,0 27,0 35,0 —
Алюминий, иикель, хром Окись храма Парафин Олеиновая кислота 70 28 2 — —
Цинковые сплавы Окись хрома Окись железа Окись алюминия Стеарин Олеиновая кислота Техническое сало Церезин Скипидар 80,0 10,7 1.3 8.0 35,6 35,6 8,8 4,4 13,4 2,2 1 1 1 1 II 1 1
Глава V. Механическая подготовка поверхности
77
Таблица 14
Состав паст ГОИ
Наименование компонентов Содержание в вес. %
грубая паста средняя паста тонкая паста
Окись хрома 81 76 74
Силикагель 2 2 1,8
Стеарии 10 10 10
Расщепленный жир 5 10 10
Олеиновая кислота — — 2
Сода двууглекислая — — . 0,2
Керосин 2 2 2
Пасты ГОИ, применяемые для отделочных и притирочных работ,
обладают хорошей полирующей способностью. Процесс полирования
с применением указанных паст протекает быстрее, чем с другими
пастами.
Пасты, изготовленные с синтетическими жи-
рами СЖК — шлифовальная паста (№ 1) и по-
лировальная (№ 2) — имеют следующий состав:
1) СЖК:
фракция С1?_20 .
» С21 . .
абразив
М7—М14 . .
2) СЖК:
фракция С17_20 .
крокус ....
18%
10%
72%
40—45%
60—55%
Фиг. 35. Установка
для автоматической по-
дачи пасты.
Эти пасты легко удаляются при обезжи-
ривании.
Рабочая поверхность полировочных кругов
должна периодически смазываться пастой. В по-
следнее время разработаны конструкции уста-
новок для автоматической подачи пасты (фиг.35).
В некоторых случаях применяют п о л и р о -
в очи ы е эмульсии, позволяющие исполь-
зовать полуавтоматические установки (фиг. 36)
для подачи их на круги.
При полировании пастой должно быть смазано примерно три
етверти поверхности круга, так как края его удобно использовать
Для окончательной отделки. Практика работы показывает, что как
78
Часть вторая. Методы подготовки поверхности деталей
избыток пасты, так и недостаток ее приводят к ухудшению качества
полирования.
Рекомендуется при полировании вначале обрабатывать детали
от середины к
также вначале
краям, а затем от краев к середине. Целесообразно
полировать детали наклонно влево и вправо, а затем
вдоль. Окончательную глянцовку следует
производить в продольном направлении.
В последнее время широкое распро-
странение получило шлифование и поли-
рование непрерывной абразивной лентой.
Применяемый для этой цели станок с абра-
зивной лентой показан на фиг. 37.
Преимущества обработки абразивными
лентами заключаются в следующем:
1) возможность обработки деталей слож-
конфигурации;
НОЙ
3
Фиг. 37. Схема станка с беско-
нечной абразивной лентой:
- 1—лента; 2 — контактная шайба;
3 — ведущий ролик; 4—крон-
штейн.
Фиг. 36. Полуавтоматическая
установка для подачи поли-
ровочной эмульсии:
1—сопло; 2 — шайба; 3—стойка;
4—трос; 5—педаль; 6—провод
от компрессора; 7 — ш.лаиг;
8—регулировочный виит; 5—ба-
чок; 10 — шланг.
Фиг. 38. Метод
склейки беско-
нечной абразив-
ной ленты.
2) возможность работы при больших скоростях, чем на кругах;
3) скорость перемещения и радиус кривизны остаются постоян-
ными;
4) безопасность работы;
5) большая возможность механизации процесса.
Абразивные ленты изготовляют на бумажной или тканевой
основе. Зернистость абразива колеблется от 24 до 320. Рациональный
метод склеивания концов ленты показан на фиг. 38. Для склеивания
применяют клей БФ, казеиновый и др.
Глава V. Механическая подготовка поверхности
79
Большое значение для качества ленточного шлифования имеют
контактные ролики, изготовляемые обычно из алюминия
и покрытые резиной различной эластичности.
На фиг. 39 показан ленточно-полировальный станок, применяемый
для полирования турбинных лопаток.
Чистота поверхности обрабатываемого изделия улучшается
по мере износа ленты, так как новая лента имеет более шероховатую
поверхность.
Класс чистоты повышается с увеличением скорости ленты:
при скорости 20 м/сек достигается 5-й класс чистоты,
» » 35 м/сек » 6-Й » »
Особенно большое влияние оказывает зернистость абразива:
при зернистости 16 достигается
» » 6—10 »
» » 5
При шлифовании абразив-
ными лентами применяют спе-
циальные эмульсии или ма-
шинное масло для смазыва-
ния ленты; зачастую для
этих целей используется и
животный жир, который осо-
бенно эффективен при шли-
фовании деталей из углеро-
дистых сталей.
Сухое ленточное шлифо-
вание используется для обра-
ботки неметаллических ма-
териалов, за исключением
стекла и термореактивных
пластмасс.
При ленточном полирова-
нии применяют различные
пасты, в частности, может
быть использована паста сле-
дующего состава: стеарин —
Ю.8%; парафин — 11,5%,
технический вазелин—5,7%
с помощью лент может быть
ности.
чистота по 5—6-му классу,
» » 7-му »
и абразив — 72%. При полировании
достигнут 11-й класс чистоты поверх-
При обработке плоских поверхностей деталей из чугуна, бронзы,
тали рекомендуется работать со скоростью ленты 15—20 м/сек.
Ри чистовом шлифовании цилиндрических стальных деталей ско-
п°СТЬ ле«ты может достигать 35—40 м/сек. При шлифовании и по-
ровании легких металлов применяют скорости, равные 45—м/сек,
80
Часть вторая. Методы подготовки поверхности деталей
а при шлифовании дитана скорость не должна превышать 10—
15 м1сек.
Давление на ленте при обработке алюминиевых и медных сплавов
должно находиться в пределах 0,3—0,4 кПсм\ а при обработке
стальных и чугунных деталей — в пределах 0,5—2,0 кПсм*.
В процессе шлифования рекомендуется изменять параметры
обработки и производить чистку ленты.
2. галтовка
Галтовка производится для удаления с поверхности металлических
деталей различных загрязнений, травильного шлама, неровностей и
заусенцев, а также для шлифования и полирования мелких деталей.
Сущность операции галтовки состоит в об-
катке деталей совместно с абразивными или поли-
рующими материалами в барабанах или коло-
колах (фиг. 40, а, б).
Фиг. 40. Галтовочный
барабан (а) и галтовочный колокол (б).
Для плоских деталей предпочтительно употребление барабанов;
для деталей, имеющих наружную резьбу, рекомендуется применение
колоколов. Скорость вращения колоколов 20—60 об/мин, бараба-
нов — 10—50 об/мин. При вращении барабана происходит переме-
щение и взаимное трение деталей и полирующих или шлифующих
материалов, в результате чего снимается тонкий слой металла,
в основном с выступающих частей поверхности.
В качестве шлифующего или полирующего материала применяют
кварцевый песок, стальную сечку, битое стекло, наждак, опилки,
куски кожи, фарфоровый и мраморный бой, стальные шарики и т. п.
Различают сухую и мокрую галтовку. При сухой галтовке детали
обрабатываются сухими материалами, при мокрой к ним добавляется
2—3-процентный раствор каустической соды, серной кислоты или
Глава V. Механическая подготовка поверхности
81
мыла- Мокрая галтовка применяется обычно перед нанесением покры-
тий для очистки от травильного шлама, а также для сглаживания
поверхности. Сухая галтовка производится чаще всего для оконча-
тельной очистки поверхности, удаления заусенцев и других неров-
ностей.
Фиг. 41. Схема выравнивания поверхности при галтовке: а—исход-
ная поверхность (высота гребешков 30 мк); б — вид поверхности после
8 час. галтовки (высота гребешков 5 мк}\ в — вид поверхности после
22 час. галтовки (высота гребешков около 0,6 мк).
Продолжительность галтовки колеблется от нескольких часов
До нескольких суток. Детали с окалиной или грубым слоем окислов
редварительно подвергаются травлению, а после этого — галтовке.
ЦеТак„их слУчаях в качестве абразивного материала применяется квар-
выи песок, туда же добавляется 2—3-процентный раствор соды,
ъем песка должен превышать объем деталей. Выравнивание по-
Рхности в зависимости от продолжительности галтовки показано
на фиг. 41.
Вайнер и Дасояи
82
Часть вторая. Методы подготовки поверхности деталей
Фиг. 42. Схема установки для под-
водного полирования.
На многих предприятиях применяют подводное шлифо-
вание и полирование, отличающееся от обычной гал-
товки тем, что обработка деталей производится в перфорированных
барабанах, помещаемых в ванны с растворами, чаще всего растворами
мыла. Скорость вращения барабанов 25—30 об/мин.
Схема установки для подводного полирования показана на
фиг. 42.
В качестве абразивного материала при подводном шлифовании
применяется бой абразивных электрокорундовых кругов зернис-
тостью 150—180. Бой абразива составляется из трех равных по весу
частей: куски размером 5—10, 10—20 и 20—30 мм. Перед приме-
нением абразивный бой обкатывают в барабанах при скорости 40—
50 об/мин. в течение 2—10 час. Ра-
бочей жидкостью служит 0,1—0,2-
процентный раствор ядрового мыла.
В качестве полирующего матери-
ала применяется бой фарфора со
стальными калеными шариками. Фар-
форовый бой готовится аналогично
абразивному, только обкатка произ-
водится в течение 24 и более часов.
Фарфоровые куски сортируются по
тем же размерам, что и абразивные.
В барабан загружаются стальные
шарики трех размеров, диаметром
от 3 до 10 мм. Необходимо исключать такие размеры, которые
могут застревать в отверстиях деталей.
Общий объем абразива должен быть в 3—5 раз больше общего
объема деталей. Загрузка деталей и абразива не должна превышать
60% объема барабана. Уровень раствора должен быть на 30—50 см
выше уровня деталей в барабане.
Чистота поверхности при подводном шлифовании повышается
с 4—6-го до 7—8-го класса. При подводном полировании классы
чистоты поверхности повышаются с 6—7-го до 9—10-го.
В некоторых случаях применяется обработка деталей в барабанах
стальными полированными шариками. В барабан добавляют раствор
мыла, полирующую пасту или специальные эмульсии.
Диаметр шариков зависит от конфигурации деталей и обычно
выбирается в пределах 2—10 мм. Общий объем шариков должен быть
примерно в два раза больше объема деталей. Загрузка составляет
70—80% объема барабана. Скорость вращения барабана 20—
50 об/мин. Продолжительность обработки 0.5—10 час. После работы
шарики должны храниться в содовом растворе.
В последнее время разработаны конструкции барабанов для
галтовки деталей средних размеров. Барабан вращается на неподвиж-
ной оси, к которой прикрепляются детали, подлежащие полирова-
Глава V. Механическая подготовка поверхности
83
нию. Барабаны вращаются в ванне, содержащей мыльный раствор
и полирующий раствор, который при этом взмучивается, перемеши-
вается и полирует укрепленные на оси детали. Продолжительность
обработки стальных деталей составляет 2—12 час., латунных —
2—8 час.
Подводное шлифование и полирование являются прогрессив-
ными методами подготовки деталей, позволяющими значительно
повысить производительность труда и снизить расход материалов.
Применяемые при подводном шлифовании и полировании мате-
риалы, наполнители (кожа, опилки и т. п.), а также рабочие растворы
приводятся в табл. 15 и 16.
Таблица 15
Абразивные материалы и наполнители для подводного
шлифования н полирования
Обрабатываемый материал Абразивные материалы и наполнители
для шлифования для полирования
Углеродистая и не- ржавеющая сталь Куски абразивных кру- гов Э24-80 СТ1-СТ2 Куски электрокорунда размером 10—30 мм Шлифовальный порошок Э36-100 Крупный кварцевый пе- сок Чугунная дробь 0 5— 15 мм Фарфоровый бой обка- танный (5—40 мм) Микропорошок М40— М28 Венская известь Стальная дробь каленая, полированная Кожа мягкая (шевро, хром) Древесные опилки
Медь, латунь, алю- миниевые и магние- вые сплавы Куски гранита 10—30 мм Куски мрамора 5—20 мм Куски фарфора 5—20 мм Шлифпорошки 36—80 Фарфоровый бой обка- танный (5—20 мм) Венская известь Стальная дробь кале- ная, полированная Кожа Древесные опилки
Цинк и цинковые сплавы Куски гранита 10—30 мм Куски мрамора 5—20 мм Куски фарфора 5—20 мм Шлифпорошки 36—80 Цинковая дробь 0 5— 15 мм Фарфоровый бой обка- танный (5—20 мм) Фарфоровые шарики 5— 10 мм Куски кварца 1,5—5 мм Древесные опилки Микропорошки, окись хрома
6*
84
Часть вторая. Методы подготовки поверхности деталей
Таблица 16
Рабочие растворы, применяемые для подводного шлифования
и полирования
Обрабатываемый материал Состав рабочих растаоров
для шлифования для полирования
Углеродистая сталь а) 0,8-процентнын три- натрийфосфата, 0,2-про- цеитиый нитрита натрия; б) 1—2-процеитный каль- цинированной соды, 0,5- процентной каинфоли; в) 1,5—5-процентный ед- кого натра а) 0,8-процентный жид- кого стекла и 0.3 % трииат- рийфосфата б) 0,2-процентный нит- рита натрия; 0,2-процент- нын кальцинированной со- ды и 0,2-процентный извести в) I—2% мыльной эмуль- сии
Нержавеющая сталь а) I-процентный кальци- нированной соды; 0,25-проиентцый нит- рита натрия; 0,2-процентный извести б) 0,8-проиентный три- натрнйфосфата, 0,2-про- цеитный нитрита натрия; в) 2—3-процентный ед- кого иатра а) 1-процентный кальци- нированной соды, 0,25-про- центный нитрита натрия; 0,2-процеитный извести; б) 1—2% мыльной эмульсии
Медь, латунь 0,5—1-проиентный каль- цинированной соды, 0,8- процентный тринатрийфос- фата а) 1-процентиый хромо- вого ангидрида, 0,5-про- центный хлористого нат- рия; б) 1—2% мыльной эмульсии
Алюминий, магний, .алюминиевые и цин- ковые сплавы 0,8-процентиый тринат- рийфосфата а) 1-процентный хромо- вого ангидрида, 0,5-про- центный серной кислоты; б) 1—2% мыльной эмульсии J
Глава V. Механическая подготовка поверхности
85
3. КРАЦЕВАНИЕ
Крацеванием называется операция очистки по-
верхности деталей при помощи щеток, которые
обычно монтируются на валу мотора или станка (фиг. 43). Иногда
крацевание производится ручными щетками.
Крацевание деталей, изготовленных из черных металлов, как
правило, не изменяет класс чистоты поверхности. При крацевании
деталей из медных сплавов, изготовленных по 5—7-му классу,
чистота их поверхности повышается на один класс.
Крацевание предназначено для очистки деталей от шлама,
” этих случаях крацевание
заусенцев и разрыхленной окалины, j
производится сухими щетками. Мокрое
крацевание применяется также для
улучшения внешнего вида некоторых
гальванических покрытий.
В некоторых случаях крацевание
применяется как промежуточная опера-
ция при нанесении толстых слоев метал-
ла (олово, серебро и др.) гальваниче-
ским путем. Эта операция способствует
получению плотных ровных покрытий.
В этом случае используются 2—3-про-
центный раствор соды, мыла или поташа.
Растворы либо непрерывно подаются на
обрабатываемые детали, либо последние
помещаются при крацевании в таз
с раствором.
При крацевании вращающиеся щет-
ки должны касаться деталей только
кончиками проволоки, так как при
Фиг. 43. Крацевальный станок
с подачей жидкости при кра-
цевании.
сильном прижиме деталей к щеткам увеличивается съем металла
и изгибается проволока.
*Для изготовления щеток применяется стальная, медная или латун-
ная проволока. Иногда применяют щетки из щетины или травы.
Основные характеристики крацовочных щеток приводятся
в табл. 17.
Таблица 17
Технические характеристики крацовочных щеток •
Крацуемый материал Материал проволоки щеток Диаметр про- волоки В Ai-W
Чугун, сталь, бронза Никель, никелевые покрытия Цинковые, оловянные, медные и ла- ‘унные покрытия еребро и серебряные покрытия ——Д1ОТо и ^Р-ч отые покрыта я Сталь Сталь, нейзильбер Латунь, медь Латунь, нейзильбер Латунь 0,05—0,3 0,15—0,25 0,15—0,20 0,10—0,15 0,07—0,10
86
Часть вторая. Методы подготовки поверхности деталей
Между диаметром крацевальных щеток и скоростью их вращения
существует определенное соотношение (табл. 18).
Таблица 18
Соотношение между диаметром крацевальных щеток
и скоростью их вращения
Диаметр щетки ! в мм Скорость вращения в об/мин. Диаметр щетки в мм Скорость вращения в об/мин.
нормальная максималь- ная нормальная максималь- ная
130 2500 2800 200 1800 2100
150 2500 2800 300 1500 1800
180 2100 2400 400 1200 1500
Чем больше диаметр щеток и окружная скорость их вращения,
тем тоньше должна быть проволока.
Износ стальных крацовочных щеток составляет 0,02—0,15 мм
на 1 л*2 обрабатываемой поверхности.
4. МЕТАЛЛО-ПЕСКОСТРУЙНАЯ И ГИДРО-АБРАЗИВНАЯ ОЧИСТКА
Пескоструйной обработкой называется операция очистки поверх-
ности деталей струей песка (или другого материала), подаваемого
с большой скоростью на обрабатываемую поверхность при помощи
сжатого воздуха, пескометного аппарата или жидкости.
Пескоструйная очистка может применяться для удаления окислов,
окалины, старых покрытий и в ряде иных случаев, когда другие способы
очистки не могут быть использованы (подготовка к покрытию боль-
ших поверхностей листового материала, стальных конструкций
и др.).
Абразивный материал (металлический песок, чугунные опилки
и др.), ударяясь с большой силой о поверхность деталей, очищает
ее от всех загрязнений и придает ей равномерную шерохова-
тость. После очистки поверхность деталей становится матовой,
покрытой большим количеством кратеров, способствующих прочному
сцеплению покрытия с основным металлом.
До последних лет в качестве основного материала при пескоструй-
ной очистке применялся кварцевый песок. Однако в связи с большой
производственной вредностью для работающих (силикоз) применение
кварцевого песка для очистки деталей в пескоструйных аппаратах
в СССР в настоящее время запрещено. Вместо него применяются
металлический песок, стальная рубленая проволока, чугунная дробь
или опилки и т. п. Широко используется также так называемый гидро-
абразивный метод очистки.
Глава V. Механическая подготовка поверхности
87
Для очистки черных металлов применяется рубленая стальная
проволока с прочностью на растяжение 130—170 кг/ммг и твер-
достью HRC 38—55, чугунные опилки (металлический песок), полу-
чаемые при размоле чугунной дроби, с твердостью НRC 58—62. Метал-
лический песок может быть получен при дроблении закаленной
стружки. Металлический песок и чугунные опилки не пригодны для
очистки деталей из нержавеющей стали и цветных металлов, так как
остающиеся на поверхности частицы металла ржавеют. В данном
случае рекомендуется применять дробленые фруктовые косточки
(абрикосовые, вишневые и др.), дробленые пластмассы и т. п., пригод-
ные для очистки деталей, изготовленных из меди, цинка, алюминия
и их сплавов. Материалы для очистки должны храниться в сухом
помещении и в закрытой таре.
Перед очисткой детали должны быть тщательно обезжирены
и высушены. При наличии грубой окалины рекомендуется предва-
рительное травление.
Очистка перед нанесением покрытий производится зернами
с диаметром 0,6—0 8 мм, если толщина стенок деталей превышает
5 мм. и диаметром 0,2—0,4 мм при толщине стенок до 2,5 мм.
Давление воздуха в сети должно быть не менее 4 ати. Тонкостен-
ные детали и детали из хрупких и мягких материалов обрабатывают
при малых давлениях мелкими и легкими зернами.
На производительность очистки оказывают влияние применяемый
материал, давление воздуха, диаметр сопла и его расстояние от обра-
батываемой поверхности, а также угол направления струи.
Очистка деталей производится в камерах и аппаратах различной
конструкции. Мелкие детали могут быть очищены в барабанах,
в которые под давлением подается абразивный материал.
Заслуживают внимание вакуумные аппараты для очистки дета-
лей (фиг. 44). Абразивные материалы (чугунные опилки, металли-
ческий песок и др.), находящиеся в бункере /, подаются при помощи
сжатого воздуха через шланг 2 в сопло пистолета 3. После обработки
поверхности абразивный материал поступает через шланг 4 в кон-
тейнер 5, где при помощи воздушной сепарации отделяются пыль
и посторонние частицы. Очищенный материал попадает в бункер 7,
а пыль и окалина через шланг 6 в сборник 8. В верхней части аппа-
рата расположен фильтр для очистки воздуха перед выбросом его
На фиг. 45 показана схема устройства сопла. В нижней части
сопла установлена щетка, изготовленная из тонкой проволоки,
опло, подающее воздух, находится внутри второй трубы несколько
с льшего диаметра. Отработанный абразивный материал вместе
н Ь1Лыо, окалиной и грязью отсасывается в зазор между наружным
^Утренним соплом и поступает в пылесборник.
_ 10сле °бработки металлическим песком или чугунными опилками
еРхность деталей обдувается сжатым воздухом. Поверхность
88
Часть вторая. Методы подготовки поверхности деталей
после пескоструйной очистки, являясь весьма активной, может быстро
окисляться, поэтому между очисткой и дальнейшей обработкой дета-
лей не должно быть большого перерыва (не более 2—3 час.).
Фиг. 44. Вакуумный аппарат для
беспылевой очистки.
Гидро-абразивн
рация очистки по
Фиг. 45. Схема пистолета—аппа-
рата для беспылевой очистки:
/ — сопло; 2 — всасывающий ко-
нус; 3 — щетки.
ой обработкой называется о п е -
верх и ости деталей струей
суспензии, состоящей из воды
и абразивных материалов. Преимуще-
ство гидро-пескоструйной обработки по
сравнениюссухой пескоструйной заклю-
чается в отсутствии пыли.
Для осуществления гидро-абразив-
ной обработки применяются установки
различного типа. Одна из установок
устроена следующим образом: пульпа,
состоящая из водной суспензии песка,
подается из нижнего бачка в напорный
бак, откуда она самотеком поступает
в распылитель, к которому подведен
сжатый воздух давлением 5—6 ати.
Через сопло смесь подается на детали.
Отработанная пульпа непрерывно сте-
кает в нижний бачок, где она переме-
шивается воздухом или механической
мешалкой (фиг. 46).
В качестве абразивного материала
кроме песка можно использовать на-
ждачный порошок и другие абразивы.
Глава V. Механическая подготовка поверхности
89
При обработке стальных деталей применяется пульпа, состоя-
щая из 30% песка, 70% воды; для цветных металлов — пульпа,
состоящая из 20% песка и 80% воды. Для предохранения деталей
от ржавления после гидро-пескоструйной очистки в пульпу добавляют
кальцинированную соду, нитрит натрия, мыло и т. п.
Производительность гидро-пескоструйной очистки зависит от дав-
ления воздуха и скорости струи, номера зернистости и концентрации
Фиг. 46. Установка для гидро-абразивной очистки.
абразива в жидкости, угла падения струи и расстояния сопла от обра-
батываемых деталей и т. д. Чем больше давление воздуха и чем круп-
нее зерно, тем выше производительность. Для каждой зернистости
существует оптимальное давление воздуха. При зернистости абра-
зива М28—М40 наивыгоднейшим является давление воздуха 4 ат,
при зернистости 100—125 —давление 5—8 ат.
Давление жидкости не оказывает влияния на чистоту поверхности.
Расстояние сопла от обрабатываемой поверхности должно быть
впределах50—100мм. а угол направления струи в пределах 15—45°.
Микрорельеф поверхности при гидро-пескоструйной обработке
получается мельче и более равномерный, чем при обдувке сухим
Имеются данные о том, что износостойкость гидрополированных
Деталей на 25—30% выше, чем механически полированных. Уста-
вная прочность стали, обработанной гидрополированием, повы-
Шается на 15%.
ГЛАВА VI
ХИМИЧЕСКАЯ И ЭЛЕКТРОХИМИЧЕСКАЯ ПОДГОТОВКА
ПОВЕРХНОСТИ
1. ХИМИЧЕСКОЕ И ЭЛЕКТРОХИМИЧЕСКОЕ ОБЕЗЖИРИВАНИЕ
Обезжириванием называется процесс удале-
ния жировых загрязнений с поверхности деталей.
Практически все детали, поступающие в гальванический цех,
покрыты в той или иной степени жировыми загрязнениями в резуль-
тате механической обработки, смазки, прикосновения рук-и т. п.
Жировая пленка препятствует прочному сцеплению покрытия с основ-
ным металлом и поэтому она должна быть полностью удалена.
Жировые загрязнения можно разделить на две группы:
1) жиры животного и растительного происхождения;
2) минеральные, а также нефтяные смазочные масла;
Жиры и масла обеих групп не растворимы в воде, но растворимы
во многих органических веществах, например, керосине, бензине,
дихлорэтане, трихлорэтилене и т. п.
Обезжиривание в органических растворителях сводится практи-
чески к растворению жировых загрязнений. Предварительное снятие
жиров и масел производится протиркой деталей паклей, ветошью,
сухими или смоченными в органических растворителях.
V.Обезжиривание керосином или бензином осуществляется про-
тиркой при помощи волосяных щеток или тряпок, а также промывкой
деталей в двух-трех последовательно установленных баках, напол-
ненных растворителем. Последняя промывка должна быть произве-
дена в наиболее чистом растворителе.
После промывки в бензине или керосине детали протирают тряп-
ками или промывают горячей водой.
Бензин и керосин дешевы, но представляют опасность в пожар-
ном отношении.
Лучшими растворителями жиров являются трихлорэтилен
С2НС13, дихлорэтан С2Н4С12, четыреххлористый углерод СС14 и др.
Они не горючи, поэтому обезжиривание ими можно производить
по одному из перечисленных ниже-способов:
1) обработкой в парах кипящего растворителя;
Глава VI. Химическая и электрохимическая подготовка поверхности 91
2) окунанием в растворитель с последующей сушкой;
3) окунанием в горячий растворитель с последующей обработкой
в его парах;
4) душевой промывкой с последующей обработкой в парах
растворителя.
Комбинированное обезжиривание более эффективно, чем очистка
только погружением в жидкий растворитель.
Для обезжиривания низкокипящими негорючими растворителями
имеются специальные аппараты, в которых обезжиривание осуще-
ствляется в три приема: 1) погружение в бак с нагретым растворите-
лем; 2) погружение в бак с холодным растворителем; 3) обезжири-
вание в парах растворителя. Пары конденсируются на холодной
поверхности детали и смывают с нее остатки загрязнений.
Отработанные органические растворители могут быть очищены
от загрязнения — регенерированы. В простейшем случае
очистка осуществляется фильтрацией через войлочные фильтры.
Более совершенным методом является дистилляция растворов при
температуре их кипения в специальных установках, обычно имею-
щихся в аппаратах для обезжиривания.
Недостатком перечисленных растворителей является их токсич-
ность и высокая стоимость.
После обезжиривания в органических растворителях на поверх-
ности деталей все же остается очень тонкая пленка жиров, которая,
тем не менее, препятствует прочному сцеплению покрытия с основным
металлом. Поэтому после очистки в органических растворителях,
как правило, проводят химическое или электрохими-
ческое обезжиривание. Во многих случаях, особенно
при отсутствии на поверхности деталей нефтяных масел, ограничи-
ваются обезжириванием в щелочных растворителях.
Жиры животного и растительного происхо-
ждения являются омыл яемыми, так как вступают во вза-
имодействие со щелочными растворами (особенно горячими), обра-
зуя при этом растворимые в воде мыла. Нефтяные и сма-
3 °„ч ные (минеральные) масла не омыляются под
действием щелочи, поэтому они называются неомыляемыми.
Минеральные масла могут при воздействии, щелочи
образовывать э м у л ь с и ю, т. е. мельчайшие капли масла, распре-
деленные по всему объему раствора. Для образования эмульсии
необходимо уменьшить силы сцепления молекул масла с поверхностью
Деталей. С целью облегчения процесса отрыва капелек масла
поверхности металла и образования эмульсии в щелочной раствор
Добавляют поверхностноактивные вещества, так называемые э м у л ь -
n т° Р ы. В качестве эмульгаторов применяют мыло, контакт
ниеР°Ва’ жидкое стекло, декстрин, ОП-7, ОП-Ю и др. Послед-
вы ДВа ЭмУльгат°ра. представляющие собой полиэтиленгликоле-
эфиры, являются особенно эффективными: они значительно
92
Часть вторая. Методы подготовки поверхности деталей
сокращают продолжительность обезжиривания и улучшают качество
очистки. Применение эмульгаторов ОП-7 и ОП-10 позволяет во многих
случаях отказаться от предварительного обезжиривания в органи-
ческих растворителях.
При химическом обезжиривании следует применять разбавлен-
ные растворы щелочи, так как концентрированные щелочные рас-
творы обладают способностью образовывать окисные пленки
на поверхности деталей, изготовленных из стали, меди и медных
сплавов. Кроме того, образовавшиеся при обезжиривании мыла
в концентрированных растворах щелочи не растворяются, что также
отрицательно сказывается на прочности сцепления покрытий. Кроме
едкого натра, растворы для обезжиривания обычно содержат легко
гидролизующиеся соли щелочных металлов, например, углекислый
натрий, тринатрийфосфат и др.
Концентрация едкого натра в растворах для обезжиривания
стальных деталей обычно не превышает 100—150 Пл, в растворах
для обезжиривания меди и ее сплавов она не выше 50 Пл. Для обез-
жиривания деталей из металлов и сплавов, растворяющихся в щелочи
(алюминий, цинк, олово, свинец и их сплавы), применяют углекис-
лый натрий или калий, тринатрийфосфат и т. п.
Химическое обезжиривание производят при температуре 70—
90°, при которой омыление и процесс эмульгирования протекают
более интенсивно. Продолжительность обезжиривания зависит от сте-
пени загрязнения деталей и составляет примерно 10—60 мин.
Для ускорения процесса обезжиривания и улучшения его каче-
ства применяют покачивание деталей, перемешивание растворов
или струйную подачу щелочного раствора в специальных камерах
и машинах.
Составы, применяемые для химического обезжиривания, при-
ведены в табл. 19.
Корректирование щелочного раствора в процессе работы осуще-
ствляется добавкой химикатов согласно данным анализа. Периоди-
чески в зависимости от размеров обезжиривающей ванны и количе-
ства обрабатываемых деталей щелочной раствор заменяется свежим.
Электрохимическое обезжириваниев щелоЧ
ных растворах производится при помощи постоянного, а иногда
и переменного тока. В случае применения постоянного тока обезжи-
ривание осуществляется как на катоде, так и на аноде. В процессе
электролиза на поверхности деталей происходит интенсивное выде-
ление пузырьков газа, облегчающих отрыв капелек масла от поверх-
ности деталей, чем значительно ускоряется обезжиривание.
При электрохимическом обезжиривании с увеличением поляри-
зации уменьшается прочность сцепления масла с поверхностью
электрода. Параллельно с усилением поляризации увеличивается
смачиваемость металла водой. По представлению Б. Н. Кабанова,
мелкие пузырьки газа под воздействием силы поверхностного натя-
Глава VI. Химическая и электрохимическая подготовка поверхности 93
жения. отделяясь от электродаi
около капли масла, задержива-
ются ею. По мере увеличения
размеров пузырька за счет при-
соединения соседних мелких
пузырьков капля масла будет
вытягиваться и в некоторый мо-
мент она оторвется от поверх-
ности металла (фиг. 47).
Наиболее часто применяют
обезжиривание на катоде. В ряде
случаев применяется комбини-,
рованное обезжиривание: сна-
чала на катоде, затем на аноде.
В качестве вторых электродов
рекомендуется применять сталь-
ные никелированные или нике-
левые пластины.
Скорость обезжиривания де-
талей на аноде меньше, чем на
катоде. Это объясняется тем, что
в прианодном про-
странстве не проис-
ходит защелачивания
электролита, вследствие
чего процесс омыления расти-
тельных и животных жиров
у анода происходит медленнее.
Кроме того, количество выде-
ляющегося при электролизе
кислорода меньше, чем пузырь-
ков водорода, а сами пузырьки
кислорода больше пузырьков
водорода и меньше задержива-
ют на поверхности капелек
масла, а поэтому и удаление
масла с поверхности происхо-
дит менее интенсивно. Однако
процесс катодного обезжирива-
ния связан с крупным недостат-
ком: наводороживани-
е м стальных деталей,
вследствие чего при продолжи-
тельном обезжиривании на ка-
тоде закаленные или тонкостен-
ные стальные детали, пружины
94
Часть вторая. Методы подготовки поверхности деталей
и т. п. могут становиться хрупкими. Поэтому катодное обез-
жиривание подобных деталей не допускается.
Скорость электрохимического обезжиривания значительно выше,
чем скорость химического. Качество обезжиривания также лучше.
При электрохимическом обезжиривании применяют в основном те же
химикаты, что и при химическом, только в меньшей концентрации.
Недостатком электрохимического обезжиривания является низ-
кая рассеивающая способность применяемых растворов, вследствие
чего очистка сложнопрофилированных деталей затруднительна.
Электрохимическое обезжиривание деталей, изготовленных
из меди, цинка, алюминия и их сплавов, осуществляется только
на катоде.
Составы электролитов и режимы работы при элек-
трохимическом обезжиривании некоторых металлов
приведены в табл. 20.
В процессе электрохимического обезжиривания
необходимо удалять накопляющуюся на поверхно-
сти электролита пену, так как в ней могут задер-
живаться выделяющиеся пузырьки водорода и кис-
лорода, образующие гремучий газ. Из этих сообра-
жений следует избегать добавления в ванну элек-
трохимического обезжиривания большого количества
эмульгаторов.
Корректировку обезжиривающих растворов производят периоди-
чески согласно данным анализа. При накоплении большого коли-
щества загрязнений раствор заменяют свежеприготовленным. Одно-
временно следует произвести чистку ванны.
Качество обезжиривания не может быть проведено визуально,
так как тонкие пленки жира невидимы. Однако существует простой
способ убедиться в отсутствии жировых загрязнений. Для этого
достаточно ополоснуть деталь в воде и посмотреть, как стекает вода:
чистая поверхность металла хорошо смачивается и пленка влаги
будет сплошной. Разрывы пленки или образование на поверхности
капель служат признаком недостаточного обезжиривания.
В последнее время на некоторых установках для очистки стальной
полосы при обезжиривании применяют переменный ток. Для этой
цели рекомендуется электролит состава:
Фиг. 47. Схема
обезжиривания
пузырьками во-
дорода.
Едкий натр NaOH..................................... 10 Г/л
Углекислый натрий Na2CO3 .......................... 25 э
Тринатрийфосфат Na3PO4-12H2O........................ 25 »
ОП-7.............................................. 1—2 »
Режим работы: температура 70—80°, плотность тока
5—ю а/дм2, продолжительность обезжиривания 0,5—2 мин.
На ванну подается ток промышленной частоты, трансформиро-
ванный до 6—12 в.
Глава VI. Химическая и электрохимическая подготовка поверхности 95
Таблица 20
Составы электролитов и режимы работы при электрохимическом
обезжиривании
Наименование компонентов и режимы работы Содержание в Г/л в растворах
для стальных деталей для деталей из меди и ее сплавов ДЛЯ цинка н его сплв- ВОВ для деталей из алюминия и сплавов цинка
№ 1 № 2 № 3 № 1 № 2 № 1 № 1 № 2
Едкий натр NaOH Углекислый натрий Na2CO3 Тринатрийфосфат Na3PO4- 12Н2О Жидкое стекл о N a2SiO Углекислый калий К2СО3 Цианистый натрий NaCN Мыло Плотность тока в а/дм2 Напряжение в в Температура в °C Продолжительность в мин. 30—60 40—60 5—10 3—5 3—8 6—10 60—80 5—10 30—40 20—30 50—60 8—10 Р е ж и 3-8 6—10 60—80 5—10 20—30 30—50 2—3 м р а 3—8 6—10 60—80 5—10 5—10 20—30 2—3 боты 3—8 6—10 60—80 5—10 30—40 20—30 50—60 8—10 3—8 6—10 60—80 5—10 40—50 3—5 6—10 60—80 1—3 40—50 30—40 3—5 3—5 6—10 60—80 0,5 5—10 20—30 1—3 3—8 6—10 60—80 5—10
Использование переменного тока для обезжиривания дает сле-
дующие преимущества:
а) экономию электроэнергии вследствие использования штанг
обоих полюсов;
б) взрывобезопасность;
Экономию химикатов в связи с использованием разбавленных
Растворов;
О отсутствие наводороживания.
°безжКОТОР°е РаспРостРанение получил способ электрохимического
лей Э РИВЗНИЯ стальнь,х Деталей с одновременным омеднением дета-
ванйя (°Т спос°б позволяет судить о качестве и полноте обезжири-
1так как медь осаждается только на освобожденной от жира
96
Часть вторая. Методы подготовки поверхности деталей
поверхности), а также и получать на стальных деталях подслой меди,
необходимый в случае последующего никелирования или меднения
в кислом электролите.
Применяемые для электрохимического обезжиривания с одно-
временным меднением электролиты отличаются от обычных ванн
для цианистого меднения тем, что содержат сравнительно большое
количество цианистых солей и малое количество меди.
Ниже приводятся некоторые составы и режимы электрохими-
ческого обезжиривания с одновременным меднением:
1) Едкий натр NaOH.................................. 50 Пл
Углекислый натрий Na2CO3 ........................... 50 »
Цианистый натрий NaCN . . .................. 50 »
Цианистая медь CuCN . . ................. 12 »
Жидкое стекло Na2SiO3......................... . . 6 »
Режим работы: Температура 18—25°; плотность тока 5—15 а/д.и2;
продолжительность 1 — 2 ми».
2) Углекислый калий К2СО3 . ............. 100 Пл
Цианистый калий KCN . ........ 15 »
Углекислая медь СиСО3................................ 7 »
Режим работы: температура 18—25°, плотность тока 3—5 а/дм-, продол-
жительность 1—5 мии.
3) Едкий натр NaOH........................... . 100 Г/л
Цианистый натрий NaCN........................... 30 »
Медный купорос CuSO4-5H2O......................... 20 »
Режим работы: температураа 18—25°, плотность тока 0,8 а/дм2, про-
должительность 8—10 мин.
Приготовление этих растворов не отличается от приготовления
обычных цианистых электролитов для меднения.
2. ОБЕЗЖИРИВАНИЕ С ПРИМЕНЕНИЕМ УЛЬТРАЗВУКА
Качество обезжиривания деталей и скорость проведения данной
операции можно значительно повысить путем ультразвуко-
вой обработки деталей.
Обезжиривание деталей с помощью ультразвука осуществляется
в ванне с органическими растворителями или щелочными раство-
рами, в которую вмонтирован излучатель (вибратор), передающий
жидкости колебания (фиг. 48).
Сущность метода ультразвуковой очистки заключается в сле-
дующем. При распространении ультразвуковой волны в жидкости
возникают области резко повышенного давления, чередующиеся
с областями пониженного давления. При достаточной интенсивности
колебаний в местах пониженного давления (узлах волны) проис-
ходят разрывы жидкости, которые с силой захлопываются при про-
хождении через пучность. При этом развиваются огромные силы,
Глава VI. Химическая и электрохимическая подготовка поверхности 97
остигающие нескольких тысяч ат. Это явление называется к ави-
ацией. Кавитация обычно начинается вблизи границы раздела
жидкости и твердых тел. Огромные механические усилия, разви-
аюшиеся при возникновении кавитации, не только удаляют с поверх-
ности жировые загрязнения, но могут разрушать также пленки окис-
пов например удалять окалину со стальных-изделий. Таким обра-
зом’ при ультразвуковой обработке поверхность изделий не только
обезжиривается, но и протравливается.
Фиг. 48. Схема ультразвуковой очистки:
а — с пьезокварцевым излучателем:
/ _ бак; 1 — жидкая среда; 3 — змееаик; 4 — сосуд; 5 — моющий раствор; 6— диафрагма;
7 — кварцевая пластинка; 8 — металлические обкладки;
б — с магнитострикционным излучателем:
/ — бак; 2 — моющий раствор; 3 — трансформатор ультразвуковых колебаний;
4 — магнитострикционный преобразователь; 5 — обмотка возбуждения электрических
колебаний и подмагничивания.
Интенсивность влияния ультразвука повышается с температу-
рой. Состав жидкости, применяемой при ультразвуковой очистке
также влияет на скорость и качество обезжиривания. Если жид-
кость не оказывает химического воздействия на загрязнения,
то обезжиривание происходит в основном за счет механического
воздействия кавитационных пузырьков. Если же жидкость раство-
ряет или омыляет загрязнения, то очистка осуществляется как за счет
физико-химического действия жидкости, так и за счет механического
разрушения пленки жиров.
Ультразвук высокой частоты применяют главным образом при
кгт^Ке ”елкчх деталей, когда не требуется большой амплитуды
3arn«aHHH’“ Н°гт Не°бходима значительная мощность для удаления
пени₽ЗНеНИИ' ДЛЯ очистки крупных деталей рекомендуется приме-
попялкЯУ?гРаоЗВуКОВЬ1Х колебаний относительно низкой частоты,
при пя(п кгЧ- Детали простой конфигурации обезжириваются
Детали °^еИ частоте колебаний 20—25 кгц, сложнопрофилированные
Улольн,» м°"™!®5СЯ„ °бе.3*"Р"“ТЬ пр" частоте 150—200 кгц.
находить мощность при ультразвуковом обезжиривании должна
? ся в пределах 5—10вт/см2. Считают, что повышение частоты
Пайпер п Дасоян
98
Часть вторая. Методы подготовки поверхности деталей
колебаний позволяет снизить мощность ультразвукового генератора
без ухудшения качества обезжиривания. Однако повышение частоты
колебаний выше 1 мг гц ведет к ухудшению качества обезжиривания.
В табл. 21 приводятся некоторые составы моющих растворов,
применяемые при ультразвуковом обезжиривании.
Таблица 21
Составы моющих растворов
Наименование компонентов Содержание в Г/л в растворах
№ 1 № 2 № 3 № 4 № 5 № 6 № 7
Едкий натр NaOH 10 — — — — — 10
Углекислый натрий Na2CO3 30 — 30 5 40 70
Тринатрийфосфат Na3PO4-12H2O 30 30 — — — — 30
Мыло хозяйственное — — 2 — — — —
Азотнокислый натрий NaNO3 — — — 50 50 50 —
Жидкое стекло Na2SiO3 — — — — 3 3 —
ОП-7 3 3 — 3 — — 3
Продолжительность обезжиривания в приведенных выше мою-
щих растворах при температуре порядка 50—60° составляет 1—2 мин.
Особенно широкое применение нашло обезжиривание с применением
ультразвуковых колебаний для очистки деталей от полировальных
паст в часовой промышленности.
Ультразвуковая очистка часовых деталей осуществляется сле-
дующим образом:
1) промывка в растворе, содержащем 30 Пл тринатрийфосфата
и 3 Пл ОП-Ю;
2) очистка в течение 1 мин. в таком же растворе в ультразвуко-
вой ванне;
3) промывка в горячей и холодной воде;
4) промывка в 1-процентном растворе триэтаноламина при тем-
пературе 75—80°;
5) сушка горячим воздухом.
Установка для обезжиривания показана на фиг. 49.
Для очистки от остатков полировальной пасты ГОИ деталей
счетных и пишущих машин до и после никелирования применяют
раствор состава: три натрийфосфат — 30 Пл, ОП-Ю — 3 Пл.
Обезжиривание производится при температуре 60—70° в тече-
ние 0,5—3,0 мин. Имеются конструкции установок, в которых
ультразвуковая очистка осуществляется под вакуумом. Под действием
вакуума воздух отсасывается из глухих отверстий, а также из рас-
твора, в результате чего значительно усиливается кавитационное
действие ультразвука и улучшается качество очистки.
Глава VI- Химическая и электрохимическая подготовка поверхности 99
Фиг. 49. Установка для обезжиривания в ультра-
звуковом поле.
Фиг. 50. Схема циркуляции жидкости в ультра-
звуковой установке со струйным генератором;
1 — насос; 2 — электродвигатель; 3 — труба; 4_струй-
ные генераторы; 5 — фильтр; в — высасывающая
труба.
1U0 Часть вторая. Методы подготовки поверхности деталей
Для очистки крупных деталей применяют ультразвуковые уста-
новки со струйными генераторами, принцип работы которых показан
на фиг. 50. Насос 1 подает раствор через трубу 3 в струйный ге-
нератор 4. После очистки деталей раствор через фильтр 5 и всасы-
вающую трубу 6 вновь попадает в насос. Приводом насоса слу-
жит электродвигатель 2. Обычно в одной установке имеется
несколько струйных генераторов, которые являются весьма эффек-
тивными при очистке деталей от грубых загрязнений.
3. ТРАВЛЕНИЕ ЧЕРНЫХ И ЦВЕТНЫХ МЕТАЛЛОВ
Травление черных металлов
Травлением называется процесс удаления
окалины, ржавчины и окислов с поверхности
металлических деталей при помощи кислых
или щелочных растворов. При травлении происхо-
дит также выявление структуры основного
металла. ..
Травление можно осуществлять химическим или электрохими-
ческим способом.
Для травления черных металлов обычно применяют растворы
серной или соляной кислот.
При травлении могут наблюдаться два процесса: химическое
растворение окислов и растворение железного слоя’под окислами,
приводящее к отставанию и удалению последних. Эти два процесса
могут протекать одновременно; в зависимости от природы кислоты,
ее концентрации и температуры меняется скорость, а также преиму-
щественное значение того или другого процесса.
Окислы, которыми покрыты детали из черных металлов, бывают
разного состава: FeO, Fe2O3 или Fe3O4.
При травлении в соляной или серной кислоте могут протекать
следующие реакции.
1) При травлении в соляной кислоте:
FeO + 2НС1 = FeCl2 + Н2О
Fe2O3 + 6НС1 = 2FeCl3 + ЗН2О
Fe3O4 + 8НС1 = 2FeCl3 + FeCl2 + 4H2O
Fe + 2HC1 = FeCl2 + H2
2) При .травлении в серной кислоте:
FeO + H2SO4 = FeSO4 + H2O
Fe2O3 + 3H2SO4 = Fe2 (SO4)3 + 3H2O
Fe3O4 + 4H2SO4 = FeSO4 + Fe2(SO4)3 + 4H2O
Fe + H2SO4 = FeSO4 + H2
Если при данной концентрации и температуре окислы раство-
ряются легче, чем металлическое железо, то преимущественно
Глава VI. Химическая и электрохимическая подготовка поверхности 101
растворяется окалина, стальная же основа детали поражается слабо.
В других условиях железо растворяется легче окислов; тогда про-
никающая через поры окалины кислота растворяет главным образом
основной металл детали, а окалина отрывается механически, чему
способствуют выделяющиеся пузырьки водорода.
Растворение стальной основы — нежелательное явление, так как
это вызывает излишний расход кислоты, потерю металла, выделение
вредных испарений, а также возможно наводороживание металла^.
Кроме того, поверхность металла может оказаться разъединенной
и шероховатой. Для предотвращения растравливания металла
к травильному раствору добавляют специальные присадки — так
называемые ингибиторы травления.
В табл. 22 приводится зависимость продолжительности травле-
ния от концентрации кислот.
Таблица 22
Зависимость продолжительности травле-
ния от концентрации кислот (при комнат-
ной температуре)
Концентрация кислоты в вес. % Продолжительность травле- ния в мин.
в соляной кислоте в серной кислоте
2 00 135
5 55 135
10 18 120
15 15 90
20 10 85
25 9 65
30 — 75
40 — 95
Таблица 23
Продолжительность травления в зави-
симости от температуры
Коицеи- трация кислот r вес, % Продолжительность травления (в мин.) в соляной кислоте при температуре
18° 40° 60°
5 10 55 18 15 6 2
Концен- трация кислот в вес, % Продолжительность травления (в мин.) в серной кислоте прн температуре
18° 40° 60°
5 10 135 120 45 32 13 8
Данные табл. 22 показывают, что при концентрации кислот
орядка (J /о наблюдается наибольшая скорость травления,
днако во избежание сильного разъедания металла концентрацию
кислоты выше 20% применять не рекомендуется.
Продолжительность травления в растворах серной и соляной
'и лот значительно сокращается при повышении температуры
” табл. 23 показана зависимость продолжительности
травления от температуры.
Данные табл. 23 и фиг. 51 показывают, что скорость травления
в растворе соляной кислоты сильнее зависит от концентрации кисло-
ты. а в растворе серной кислоты — от температуры. Таким образом.
102
Часть вторая. Методы подготовки поверхности деталей
при травлении стальных деталей в растворах серной кислоты выгодно
повысить температуру до 40—70°. Травление в соляной кислоте
при повышенных температурах (выше 40°) нецелесообразно, так как
при этом выделяется значительное количество вредных паров, а также
происходит интенсивное растворение металла.
На продолжительность травления большое влияние оказывает
содержание солей железа в травильном растворе. Кривые фиг. 52
показывают, что активность серной кислоты при увеличении содер-
жания железа падает, а активность соляной кислоты растет примерно
Фиг. 51. Зависимость скорости трав-
ления углеродистой стали от темпера-
туры и концентрации серной кислоты.
жания железа на скорость
травления в соляной
серной кислотах.
При исследовании процесса травления черных металлов Г. Баб-
ликом установлено, что процесс травления в соляной кислоте про-
исходит таким образом, что в разбавляемых растворах часть окалины
удаляется в результате растворения основного металла, а в более
концентрированных растворах металл почти не растворяется; раство-
ряется главным образом слой окислов, из которых состоит окалина.
Травящее действие серной кислоты сводится преимущественно
к растворению основного металла и механическому удалению ока-
лины.
Практически скорость травления в серной кислоте не на-
много уступает скорости процесса в соляной кислоте, так как тра-
вление в серной кислоте производят при более высоких темпе-
ратурах.
Приведем сравнительную характеристику преимуществ травле-
ния в соляной и серной кислотах.
Соляная кислота
1) Работа при комнатной температуре
2) Меньшее разъедание поверхности
3) Более светлая поверхность деталей
Глава VI. Химическая и электрохимическая подготовка поверхности 103
Малое поглощение водорода
Легкое смывание травильных солей с поверхности.
Серная кислота
Невысокая стоимость
Более полное использование травильного раствора.
4)
5)
1)
2)------- - - - _
Обычно все же предпочитают пользоваться серной кислотой,
учитывая ее меньшую стоимость и меньший расход.
У При травлении железа, покрытого сравнительно толстым слоем
окалины целесообразно применять смесь серной и соляной кислот
или серную кислоту с добавкой хлористого натрия.
В некоторых случаях для травления деталей, изготовленных
из черных металлов, применяются плавиковая, фосфорная и азот-
ная кислоты. Так, плавиковая кислота (чаще всего в смеси с серной)
применяется для травления чугунных отливок, к поверхности кото-
рых припекаются остатки формовочного песка.
Фосфорная кислота применяется главным образом для подго-
товки деталей перед нанесением лакокрасочных покрытий. Фосфор-
ную кислоту применяют также в тех случаях, когда детали покрыты
толстым слоем ржавчины, и абсолютно недопустимо растравливание
основной поверхности.
В случае применения 10—20-процентной фосфорной кислоты
для подготовки деталей перед нанесением гальванических покрытий
необходимо детали после тщательной промывки дополнительно
подвергнуть травлению в горячем 1—2-процентном растворе фосфор-
ной кислоты в течение 0,3—0,5 мин.
Азотная кислота в смеси с соляной применяется для травления
нержавеющей стали.
Иногда для травления черных металлов применяют растворы
кислых сернокислых солей, например, 10—20-процентный раствор
NaHSO4.
Скорость травления во всех случаях можно повысить встряхи-
ванием или качанием деталей и особенно применением струйных
методов травления или ультразвука.
В связи с тем, что толщина слоя окалины или окислов неоди-
накова, а также вследствие неоднородной структуры по всей поверх-
ности удаление окислов происходит неравномерно. Имеются данные
о том, что в течение 2/3 времени травления примерно 80% уже обна-
ннои поверхности деталей подвергается действию травителя,
ВЬ13Ь1вае„т излишний расход кислоты и потери металла. Обильно
высокЯ”ЭЩИ^СЯ ВОДОрод частично диффундирует в железо. При
п ои температуре травильного раствора повышается степень
иазып'ЦеНИЯ металлом водорода, в связи с чем появляется так
ваемь2еМаЯ водоР°Яная хрупкость. Изменения, вызы-
товле'6 Поглощением водорода, особенно опасны для деталей, изго-
нных из высокозакаленной стали, для тонкостенных деталей.
104
Часть вторая. Методы подготовки поверхности деталей
а также для пружин. В некоторых случаях водород, накапли-
ваясь под поверхностными слоями металла, образует так назы-
ваемые травильные пузыри, часто обнаруживаемые
только при последующем нанесении гальванических покрытий или
хранении.
Для уменьшения количества выделяющегося водорода, предо-
хранения поверхности деталей от перетравливания, а также для эко-
номии кислоты в настоящее время при травлении черных металлов
пользуются специальными присадками. Ими могут служить
различные органические вещества, как, например, жмыхи, пшенич-
ные отруби, патока, сульфированное антраценовое масло «Антра»,
контакт Петрова и т. п. Длительное время на отечественных заводах
применяли ингибиторы марки КС и «сульфошлам», представляющие
собой продукты сульфирования отходов мясной и молочной про-
мышленности.
Хорошие ингибиторы травления должны резко снижать скорость
растворения металла, но не препятствовать растворению окислов,
быть устойчивыми в травильной ванне и легко удаляться с поверх-
ности деталей при промывке. Этим требованиям удовлетворяют
новые, более эффективные регуляторы травления, получившие
уже широкое распространение. К ним в первую очередь сле-
дует отнести разработанные кафедрой коллоидной химии МГУ
им. М. В. Ломоносова и кафедрой химии МГПИ им. В. И. Ленина
присадки «Уникод», ПБ, МН, ЧМ и некоторые другие.
Ингибиторы марки ПБ-5 применяются для торможения раство-
рения металлов (стали, цинковых и алюминиевых сплавов) только
в соляной кислоте. Они представляют собой вязкую жидкость
черного цвета, являющуюся продуктом взаимодействия анилина
и уротропина, которая вводится в количестве 0,8—1 % в 15—
20 процентный раствор соляной кислоты. Ингибитор может приме-
няться при температуре травления до 50°.
Присадка ЧМ, применяемая в качестве добавки при травлении
черных металлов в серной кислоте, состоит из двух компонентов —
ингибитора Р и пенообразователя П. Ингибитор Р — вязкая темная
жидкость с характерным запахом, трудно растворимая в воде; пено-
образователь П — липкая темная жидкость, без запаха, легко раство-
римая в воде. Ингибитор Р, предварительно растворенный в горячей
кислоте, вводится в травильную ванну из расчета 0,5 кПм? ваннг
при незначительном слое окалины и температуре травления ниже
50°. При наличии на деталях толстого слоя окалины и температуре
травления выше 50° в ванну добавляют 1,5 кГ регулятора на 1 ж3
травильного раствора. Пенообразователь П добавляют в травильную
ванну для предотвращения образования кислотного тумана. Коли-
чество пенообразователя зависит от площади зеркала травильного
раствора; оно колеблется от 0,5 до 1,0 кГ на 1 ж2 поверхности
ванны.
Глава VI. Химическая и электрохимическая подготовка поверхности 105
В табл. 24 приводятся результаты сравнительных испытаний
серной кислоты и ингибированной соляной кислоты при травлении
стали.
Таблица 24
Характеристика процессов травления стали в серной кислоте, -
содержащей ингибиторы КС и ЧМ, и в соляной кислоте,
содержащей ингибитор ПБ-5
Состав травильного раствора Температура в °C Время уда- ления ока- лины в МИИ. Скорость 1 растворения металла в г/м. ч
1. Сталь м арки Ст. 4
НС1 10%; ПБ-5 0,496 20 115 0,09
30 95 0,21
40 50 0,9
H2SO4 10%; КС 0,4% 60 50 23,0
H2SO4 10%; ЧМ 0,2% 60 55 8,0
2. Сталь м арки Ст. 2
НС1 10%; ПБ 0,4% 20 19 0,12
30 10 0,24
40 6 1,1
H2SO4 10%; КС 0,4% 60 6 28
H2SO4 10%; ЧМ 0,2% 60 6 9
На фиг. 53 помещена диаграмма, характеризующая расход сер-
ной кислоты при травлении черных металлов. Из диаграммы видно,
что при травлении без ингибитора 80% количества серной кислоты
расходуется на растворение металла, находящегося под окалиной.
Ингибиторы оказывают большое влияние на наводороживание
и на скорость диффузии водорода в сталь. Действие некоторых
ингибиторов сказывается только на скорости растворения стали,
не влияя на количество поглощаемого водорода, другие же ингиби-
торы влияют на оба эти процесса. К таким ингибиторам относятся ЧМ,
применяемый в растворах серной кислоты, и ПБ-5, замедляющий
коррозию в соляной кислоте.
Результаты, полученные И. Н. Путиловой, С. А. Балезиным
Ь- П. Баранником при исследовании травления стали в 5-н. сер-
ой кислоте, приведены на фиг.. 54. Они свидетельствуют о том,
° в присутствии ингибиторов количество диффундировавшего
Дорода значительно снижается. Скорость растворения стали
106
Часть вторая. Методы подготовки поверхности деталей
ческих свойств. Результаты
и диффузия водорода увеличиваются с повышением содержания
углерода до определенных пределов (0,9%) в металле.
По данным тех же авторов, наличие ингибиторов при травлении
металлов в значительной степени предотвращает снижение механи-
сравнительных испытаний изменения
пластических свойств стальной
проволоки после травления, приве-
| | -Уносится из ванны вместе с
металлом
Ф77\ -Идет на растворение окалины
Фиг. 53. Диаграмма относительного
расхода кислоты: а — без инги-
битора; б — с ингибитором, умень-
шающим скорость растворения ме-
талла в 4 раза; в—с ингибитором,
уменьшающим скорость растворе-
ния металла в 20 раз.
Содержание углеродов стам, %
Фиг. 54. Влияние ингибиторов на
диффузию водорода при растворе-
нии стали в 5-и. серной кислоте:
1 — без ингибитора; 2 — с 1% акри-
хина; 3 — с 1% КС; 4 — с 1% ЧМ;
5 — с 1 % тиодигликОля.
денные в табл. 25, показывают, что наличие ингибитора ЧМ при трав-
лении почти полностью нейтрализует вредное влияние травления
на механические свойства стальной проволоки.
Механизм действия ингибиторов объясняется адсорбцией частиц
ингибитора на поверхности металла. Адсорбционные слои повышают
перенапряжение водорода и тормозят растворение металла. На оки-
слах металла ингибитор не адсорбируется и не препятствует его
растворению. При повышении температуры защитное действие
ингибиторов ослабляется, что связано с уменьшением их адсорбции-
Интересно отметить, что в качестве своеобразного регулятора при
травлении черных металлов в серной кислоте может служить хлори-
Глава VI. Химическая и электрохимическая подготовка поверхности 107
Таблица 25
Зависимость пластичности проволоки из стали марки У-71
от травления в ингибированной и иеиигибированной серной кислоте
Условия травления Число изгибов проволоки до ее разрушения
Состав травильного раствора Наименование присадки Продолжитель- ность травления в часах
До травления 2-н. серная кислота То же ЧМ 2—3 2—3 9; 11; 10 2; 2; 2 9; 9; 8
стый натрий, который в несколько раз ускоряет процесс удаления
окалины и предотвращает наводороживание металла.
В табл. 26 приведены рекомендуемые растворы для химического
травления углеродистой стали.
Таблица 26
Составы растворов и режим работы при химическом травлении деталей
из углеродистой стали
Наименование компонентов и режим работы Содержание в Г/л в растворах
№ 1 № 2 № 3 № 4 № 5 № 6 № 7
Серная кис- лота H2SO4 70—100 200—250 100—150 100—180 — 125—175 80—100
Соляная кис- лота НС1 100—150 — — — 150—200 — —
Хлористый натрий NaCl — — 200—250 •— 3-5 —
Ингибитор ЧМ — 3-5 3-5 5—10 —
Ингибитор КС 2—3 — — -—. — 1—2
Ингибитор ПБ-5 — — — — 3—5 —- —
Ингибитор МН-10 — — — — 15—20
Режим работы
Температура раствора в °C 30—40 | 50—60 | 50—60 1 20—70 1 30—40 I 20—60 | 20—40
Продолжи- тельность в мин. До полного удаления окислов (10—( >0 мин.)
108
Часть вторая. Методы подготовки поверхности деталей
В случае образования на поверхности травильного шлама он
может быть удален одним из следующих способов:
а) погружением деталей в концентрированный раствор азотной
кислоты;
б) погружением деталей в раствор, содержащий 200—250 Пл
хромового ангидрида и 3—5 Пл серной кислоты;
в) анодной обработкой в 5—10-процентном растворе едкого
натра при плотности тока 5—10 а!дм\
Для травления отдельных участков или деталей крупных габари-
тов, которые не могут быть помещены в ванны, применяются спе-
циальные травильные пасты, состоящие из травильных
растворов, ингибитора и наполнителя (инфузорная земля, легкие
суглинки или асбест).
Растворы и режим работы, применяемые при травлении высо-
колегированных и нержавеющих марок стали, приведены в табл. 27.
Таблица 27
Составы электролитов и режим работы при травлении деталей
из высоколегированной и нержавеющей стали
Наименование компонентов Содержание в Г/л в растворах
№ 1 №2 №3 № 4 № 5
Соляная кислота НС1 .—. — 250—290 400—500 100—120
Хлористый натрий NaCl 30—59 8—10 — — —
Серная кислота H2SO4 160—180 160—180 210—250 — —
Азотная кислота HNO3 — — — 40—60 —
Ингибитор КС — — 3-5 3—5 —
Азотнокислый натрий NaNO3 - — 40—60 — — —
Фтористоводородная кис- лота HF •— — — 4—5
Режим р а б о т ы
Температура раствора в °C 70—90 45—55 40—50 40—60 30—40
П р одо лжй тел ьн ость в мин. 80—90 15—30 50—70 3—5 3—10
Необходимо иметь в виду, что сталь, содержащую 18% хрома и 8%
никеля, можно подвергать травлению только после соответствующе?
термической обработки, так как в противном случае в металле может
развиться межкристаллитная коррозия.
Глава VI. Химическая и электрохимическая подготовка поверхности 109
Фиг. 55. Схема установки для гибрид-
ного травления.
Растворы № 1 и 3 применяются для чернового (предварительного)
травления, а растворы № 2, 4 и 5 — для чистового травления.
Для очистки поверхности Деталей из кислотоупорной и жаро-
прочной стали применяется также комбинированное травление,
состоящее из предварительной обработки в ванне с расплавом кау-
стика и селитры, а затем в кис-
лотном растворе.
На заводе «Серп и молот»,
например, применяется следу-
ющая технологическая схема
травления листов нержавеющей,
жаропрочной и жаростойкой
стали:
1) обработка в расплаве ще-
лочи и селитры (80% NaOH +
+20% NaNOg) при температуре
400—520° в течение 5—20 мин;.
2) промывка в проточной
холодной воде;
3) травление в 18-процент-
ном растворе серной кислоты
с добавкой 396 хлористого нат-
рия при температуре 70—80°
в течение 5—10 мин.;
4) промывка в проточной воде;
5) пассивирование в 6—8 процентном растворе азотной кислоты
при температуре 45—50° в течение 3—5 мин.;
6) промывка в проточной воде;
7) промывка и сушка.
За рубежом довольно широкое распространение получило так
называемое гидридное травление, т.е. удаление окалины,
ржавчины и окислов с поверхности деталей в ванне с расплавленным
едким натром, содержащим 1,5—2% гидрида натрия.
Гидрид натрия, получаемый при взаимодействии водорода
с металлическим натрием при температуре 200—400°, обладает
сильной восстановительной способностью; он легко растворяется
в расплавленном NaOH.
Реакции между гидридом натрия и окислами различных металлов
можно выразить следующими уравнениями:
Fe3O4 + 4NaH = 3Fe + 4NaOH
CuO + NaH = Cu + NaOH
NiO + NaH — Ni + NaOH
c J^P11 гидридном травлении детали погружаются в ванну (фиг. 55)
натпСПЛавом ПРИ температуре 370 ± 10° на 10—12 мин. Гидрид
Рвя приготовляется в особом отделении этой же установки.
110
Часть вторая. Методы подготовки поверхности деталей
После окончания травления детали тщательно промывают холод-
ной водой и нейтрализуют в 5—10-процентном растворе серной кис-
лоты, после чего вновь промывают.
Детали из алюминиевых сплавов нейтрализуются в растворе
азотной кислоты, а детали из нержавеющей стали и титановых спла-
вов — в смеси азотной и плавиковой кислот.
Гидридным травлением обеспечиваются следующие преимуще-
ства по сравнению с травлением в кислотах:
1) чистая поверхность металла,
свободная от точечной коррозии и
растравливания;
2) отсутствие наводороживания.
К недостаткам данного метода
относятся:
1) необходимость в специальном
оборудовании;
г
Фиг. 56. Агрегат для струйного травления листов.
2) более высокая стоимость (на 40%) по сравнению с травлением
в кислотах.
Ускорение процесса химического травления черных металлов
в 3—4 раза может быть достигнуто применением струйного травления.
Струйная обработка по сравнению с методом окунания интенсифи-
цирует все процессы, поскольку к обрабатываемым деталям все
время подводятся свежие порции раствора. Кроме того, струя ока-
зывает и механическое воздействие, способствуя быстрому удалению
с очищаемой поверхности продуктов растворения окалины и ржав-
чины. Установлено, что при струйном травлении происходит мень-
шее наводороживание, чем при травлении в стационарных ваннах.
Продолжительность травления уменьшается при возрастании
скорости подачи раствора, повышении температуры и увеличении
угла подачи струи от 0 до 90°.
На фиг. 56 приведена схема установки для струйного травления
листовой стали, состоящей из двух камер, разделенных уплотняю-
щими щетками. Первая камера служит для подогрева листов и пред-
варительного травления их слабым раствором кислоты. Вторая камера
Глава VI. Химическая и электрохимическая подготовка поверхности 111
предназначена для струйного травления 20-процентной ингибиро-
ванной соляной кислотой. Обе камеры обслуживаются кислотоупор-
ными насосами 8 и 9 производительностью по 85 м?/час и напором
до 30 мм. Во второй камере имеется бак 6 небольшой емкости, из кото-
рого насос 8 подает кислоту к коллектору камеры 7. Камера обслу-
живается насосом 9, а в качестве емкости используется ванна 4.
Лист стали горизонтальными роликами вертикального рольганга
подается к роульсам 1, проталкивающим его через уплотнение 2.
В камеру 3 насосом 9 соляная кислота, подогретая до 60—70°,
подается из ванны 4 через коллектор 5. По распределительной трубе
кислота попадает в трубы коллектора 10, откуда она со скоростью
около 22 м/сек омывает обе стороны листа.
Большой интерес представляет совмещение операций обезжири-
вания и травления, что значительно сокращает число технологи-
ческих операций и необходимые производственные площади. Основ-
ными компонентами составов для одновременного обезжиривания
и травления являются органический растворитель, кислота и эмуль-
гатор.
Для промышленного использования А. П. Галактионов,
Л. Ф. Дрибин и М. В. Сордановский рекомендуют следующий состав:
Серная, фосфорная или соляная кислота . . 100—250 Г/л
Уайт-спирит ... . 20—25 мл .
ОП-7 или ОП-Ю 3—5 Г/л
Тиомочевина . 3—5 »
Режим работы: температура раствора 20—60°, продолжи-
тельность очистки 3—5 мин.
Раствор указанного состава может быть использован при очистке
как в стационарных ваннах, так и в моечных камерах или машинах.
Электролитическое травление черных металлов
Процесс травления деталей при помощи элек-
трического тока называется электролитическим
травлением.
Электролитическое травление может вестись как на аноде, так
и на катоде.
При анодном травлении удаление окислов происходит вследствие
химического и электрохимического растворения металлов и механи-
ческого отрывания окислов пузырьками выделяющегося кислорода.
При анодном травлении детали приобретают совершенно чистую,
слегка шероховатую поверхность, что способствует сцеплению
покрытий с основным металлом.
При анодном травлении в серной кислоте через некоторое время
наблюдается повышение напряжения на клеммах ванны и одновре-
менное снижение силы тока. Подобное явление, очевидно, объяс-
няется удалением окисной пленки и образованием на деталях
112
Часть вторая. Методы подготовки поверхности деталей
пассивной пленки. При этом преобладает электрохимический про-
цесс—разряд ионов — ОН~ и выделение газообразного кислорода:
4ОН- -> 2Н,0 + О2 + 4е.
При выгрузке деталей из ванны и повторении операции травле-
ния вновь наблюдается увеличение напряжения. Анодное трав-
ление требует внимательного наблюдения, так как оно протекает
очень интенсивно и поверхность деталей может быстро оказаться
перетравленной.
При катодном травлении на деталях происходит разряд ионов
водорода:
Н+ 4- е --> Н; Н 4- Н -> Н2.
Атомы водорода, реагируя с окислами металла, оказывают
на них восстанавливающее действие, пузырьки водорода разрых-
ляют пленку окислов и удаляют ее. При катодном травлении опас-
ность перетравливания невелика, однако выделяющийся на деталях
водород частично может проникнуть в металл и сделать его хрупким*
Поэтому катодное травление тонкостенных деталей, а также деталей
из высокозакаленной стали или работающих под нагрузкой, не допу-
скается.
Анодное травление применяется для углеродистой и легирован-
ной стали, но не рекомендуется для деталей сложной конфигурации
и деталей с точными размерами.
Катодное травление применяется главным образом для деталей
из углеродистой стали. Никелевые и хромовые стали, а также
динамное и трансформаторное железо, содержащее кремний, плохо
поддаются катодному травлению.
Составы электролитов и режимы травления углеродистой стали
приведены в табл. 28.
Электролиты — 1—3 используются для анодного, а № 4—5 —
для катодного травления. Электролиты № 1 и 3 применяются для
травления деталей с грубой окалиной, остальные —для деталей
с незначительным слоем окислов. В качестве катодов применяют
сталь или свинец.
При травлении в электролите № 4 в качестве анодов применяется
кремнистый чунгун, содержащий 20—24% кремния, или сплап
свинца с сурьмой.
В процессе катодного травления в электролите № 5 (по способу
Буларда-Данна) освобождающаяся от окислов поверхность деталей
покрывается за счет растворяющихся свинцовых анодов тонким
слоем свинца, который предохраняет очищенный металл от перетрав-
ления и вредного явления наводороживания. В некоторых случаях
к электролиту № 5 добавляют небольшие количества солей олова;
при этом на очищенную поверхность деталей осаждается тонкий слой
Глава VI. Химическая и электрохимическая подготовка поверхности 113
Таблица 28
Составы электролитов и режим работы при электрохимическом
травлении углеродистой стали
Наименование компонентов Содержание в Г/л в растворах
№ 1 № 2 № 3 № 4 № 5
Серная кислота H2SO4 200—250 280—320 — 100—150 50—60
Сернокислое железо, за- кисное FeSO4 — 10—12 —- — —
Соляная кислота НС1 — 300 — 25—30
Хлористый натрий NaCl — — 0,2—0,3 — 15—20
Фтористоводородная кис- лота HF F ’ежим з а б о т ы
Плотность тока в al дм2 5—10 10—60 5—10 3—10 8—10
Температура в °C 40—50 18—25 30—40 40—50 60—70
Продолжительность в мин. 10—20 0,5—3 1—5 10—15 10—15
олова. Защитные пленки олова или свинца могут быть легко удалены
анодной обработкой в горячем щелочном растворе.
Электролитический способ травления отличается меньшей про-
должительностью и меньшим расходом химикатов по сравнению
с химическим травлением. Электролитическое травление особенно
целесообразно в конвейерных и автоматических установках, где уско-
рение процессов очистки поверхности деталей играет особо важную
роль.
Однако следует указать, что толстые слои окалины или ржавчины
поддаются электролитическому травлению лишь с трудом, а детали
со сложным профилем травятся неравномерно из-за низкой рассеи-
вающей способности ванн. В этих случаях преимущество остается
за химическими методами травления.
Электролитическое травление легированной стали может быть
уществлено в одном из приведенных в табл. 29 электролитов.
Травление цветных металлов
чатады^Л“еНИе ц,ветнЬ1Х металлов может производиться как для окон-
ванием °И отделки поверхности деталей с последующим пассивиро-
сению ™ЛИ лакиР°ванием, так и для подготовки поверхности к нане-
g гальванических покрытий.
Вайнер в Дасоян
114
Часть вторая. Методы подготовки поверхности деталей
Таблица 29
Составы электролитов и режим работы при электрохимическом
травлении легированной стали
Наименование компонентов Содержание в Г/л в растворах
№ 1 № 2 № 3
Серная кислота H2SO4 35—40 80—100 35—40
Азотная кислота HNO3 25—30 — —
Ортофосфорная кислота Н3РО4 — — 45—55
Режим работы
Плотность тока в а]дм2 5—10 (ток переменный, напряжение 15— 20 в) 20—30 5—6 ।
Температура в °C 15—20 40—50 30—40
Продолжительность в мин. 5—10 5—10 5—10
Травление меди и ее сплавов осуществляется в смеси азотной
кислоты с серной или соляной. Если на поверхности медных, латун-
ных или бронзовых деталей имеется плотный слой черной окалины,
то перед травлением «отбеливают» детали, погружая их в 10-процент-
ный раствор серной кислоты до тех пор, пока окислы не окрасятся
в желтый цвет или не растворятся. Для ускорения процесса отбели-
вания раствор можно подогреть до 60°.
В табл. 30 приводятся некоторые растворы, применяемые для
химического травления деталей из меди и ее сплавов.
При составлении травильных растворов нужно вначале налить
в ванну азотную кислоту, а затем постепенно прибавить к ней сер-
ную. Сажу предварительно разводят в небольшом количестве азот-
ной кислоты.
Травление меди в азотной кислоте протекает по следующим
реакциям:
3Cu + 8HNO3 = ЗСи (NO3)2 + Н2О + 2NO (6П
Си + 4HNO3 = Си (NO3)2 + 2Н2О + 2NO2. (61)
При травлении в разбавленной кислоте имеет место реакция (60),
в концентрированной кислоте растворение меди протекает по реак-
ции (61). у
Процесс травления латуни подробно изучался Грэхемом, которь*11
установил, что с повышением концентрации азотной кислоты раство-
римость меди увеличивается, растворимость же цинка остается без
Таблица 30
Составы растворов и режим работы при травлении меди и ее сплавов
Наименование химикатов Растворы для травления медных и латунных деталей Растворы для трав- ления медного литья Растворы для трав- ления мельхиора
предвари- тельного глянце- вого предвари- тельного глянце- вого предвари- тельного глянце- вою предвари- тельно! о глянце- во! о
Содержание в Г/л
Лзотная кислота 270-330 80—100 950—1000 750—800 700—800 580—620 950—1000 700—720
Серная кислота 630—670 650—700 950—1000 — — — 880—920
Соляная кислота 4—5 4—5 — — — 20—25 3—5 —
Плавиковая кислота — — — — 1060 450—500 — —
Хлористый натрий — — 2 Ю—20 20 — — 30—50
Азотнокислый натрий — — — — — 60—65 —
Сернокислый цинк — — — — — 320—350 — .
Сажа ацетиленовая — — 2 10 — — 2—3 3—4
F ’ежим работы
Температура раствора в °C 18—25 18—25 18—25 18—25 18—25 18—25 18—25 18—25
J Продолжительность травления в мин. 0,3—0,5 0.1—0,2 0,3—0,5 0,1—0,2 3-5 0,3—0,5 3—5 0,3—0,5
Глава VI. Химическая и электрохимическая подготовка поверхности
116
Часть вторая. Методы подготовки поверхности деталей
изменения (фиг. 57). Повышение содержания соляной кислоты
(фиг. 58) увеличивает скорость растворения цинка, но не сказывается
на скорости растворения меди. Повышение концентрации серной
кислоты до 500 Пл (фиг. 59) повышает скорость растворения как меди,
Фиг. 57. Зависимость скорости
растворения меди и цинка от кон-
центрации азотной кислоты.
Фиг. 58. Зависимость скорости рас-
творения меди и цинка от концен-
трации соляной кислоты. И
так и цинка. Повышение температуры больше сказывается на ско-
рости растворения меди (фиг. 60).
Таким образом, чрезмерно высокая концентрация азотной кислоты
при травлении латуни ведет к вытравливанию меди, и сплав приобре-
Содержание Нг30<,, Г/л
Фиг. 59. Зависимость скорости
растворения меди и цинка от
концентрации серной кислоты.
Фиг. 60. Зависимость скорости
растворения меди и цинка от тем-
пературы травильного раствора.
тает бледно-желтый цвет. При повышении концентрации соляной
кислоты преимущественно вытравливается цинк и детали приобрб'
тают коричневый оттенок. В связи с тем, что повышение температур^
также приводит к преимущественному растворению меди, травление
латуни, как и других медных сплавов в смеси кислот, производите^
при комнатной температуре.
Грэхем рекомендует для травления медных сплавов типа лату^
растворы следующего состава (табл. 31).
Глава VI. Химическая и электрохимическая подготовка поверхности 117
Таблица 31
Состав растворов для травления сплавов меди типа латуни
Наименование компонентов Удельный вес Предвари- тельное трав- ление (мл/л) Глянцевое травление (мл/л)
Серная кислота H2SO4 1,84 380 435
Азотная кислота HNO3 1,38 72 72
Соляная кислота НО 1,17 4 21
Вода — 544 472
Травление медных сплавов должно производиться в вытяжных
шкафах или специальных агрегатах, так как при этой операции
выделяется большое количество вредных паров окислов азота и кис-
лот.
Детали перед травлением должны быть обезжирены и высушены
во избежание разбавления травильных растворов. После предвари-
тельного травления детали рекомендуется погрузить в горячую
воду, тщательно промыть, высушить на воздухе и погрузить в раствор
для глянцевого травления, после чего следует тщательная промывка
в проточной воде.
Растворы для глянцевого травления используются до накопле-
ния в них 200—250 Пл солей.
Для травления монель-металла и константана применяется
раствор состава:
Серная кислота H2SO4 ........................ 100 Г/л
Хромовокислый натрий Na2CrO4..... .... 20 »
Температура 60—80*.
Травление цинка и кадмия осуществляется в 5—20-процентных
растворах серной или соляной кислот при комнатной температуре.
Свинец травят в 5—10-процентном растворе азотной кислоты.
Травление деталей из алюминиевых сплавов производится
в 10—20-процентном растворе едкого натра с добавкой 20—30 Пл
хлористого натрия при 50—80°. После травления и промывки детали
осветляют погружением в концентрированную азотную кислоту.
Для осветления деталей из кремнийсодержащих алюминиевых спла-
вов (силумина) применяется смесь азотной и плавиковой кислот.
Для. травления магниевых сплавов используется раствор состава:
Азотная кислота (уд. вес 1,4) HNOS .... . 75—65 мл!л
Двухромовокислый калий К2Сг2О,............. 6—7 Пл
Серная кислота (уд. вес 1,84) H2SO4.... 2,5—3,0 мл!л
118
Часть вторая. Методы подготовки поверхности деталей
Режим работы: температура 18—25°, продолжительность
10—20 сек.
Серый налет, образующийся на деталях после травления, удаляют
погружением на 5—10 мин. в 5-процентный раствор плавиковой
кислоты при 15—30°.
4. ДЕКАПИРОВАНИЕ
Декапированием называется процес удаления
с поверхности металлических деталей тон-
чайшего, зачастую незаметного глазу слоя окислов,
которые могли образоваться в промежутках между операциями.
При декапировании одновременно происходит легкое протрав-
ливание верхнего слоя металла ивы явление криста л-
лической структуры металла, что благоприятствует
прочному сцеплению покрытия с основой.
Операция декапирования применяется непосредственно перед
загрузкой деталей в ванны для нанесения покрытий.
Если детали поступают в гальванический цех непосредственно
после механической обработки и на их поверхности имеется только
тонкая окисная пленка, то операция декапирования может осуще-
ствляться без предварительного травления деталей.
Процесс декапирования с применением постоянного тока назы-
вается электрохимическим декапированием.
Электрохимическое декапирование осуществляется исключительно
на аноде.
Состав растворов для химического и электрохимического декапи-
рования различных металлов и режим работы ванн приведены
в табл. 32. Катодами при электрохимическом декапировании в кислых
растворах служат свинцовые пластины, в щелочных — железные.
Электрохимическое декапирование особенно рекомендуется при
подготовке стальных деталей перед никелированием.
В последнее время Л. И. Каданером, П. П. Беляевым и др. вы-
двинуто положение о благоприятном влиянии пассивирования поверх-
ности перед нанесением покрытий на прочность их сцепления с осно-
вой. Авторы считают, что пассивирование деталей перед нанесением
покрытий в некоторых случаях уменьшает пористость, повышает
равномерность и увеличивает прочность сцепления. Это может быть
достигнуто в случае, если на поверхности деталей искусственны*1
путем создается окисная пленка малой толщины и определенной
структуры. В частности, в некоторых случаях анодная обработка
деталей в щелочном растворе способствует улучшению качества
цинковых покрытий. Л. И. Каданер предлагает производить пассИ'
вирование стальных деталей в азотной кислоте перед лужением, j
Стальные детали перед хромированием подвергают анодно11
обработке в хромовом электролите, содержащем 150 Пл хромовог0
Составы растворов и режим работы при химическом и электрохимическом декапировании
Таблица 32
Сталь Медь и ее сплавы Цинк и его сплавы Алюминий и еге сплавы Сви- нец и свин- цовые сплавы
Наименование компонентов химиче- ское электро- химиче- ское хими- ческое элек- трохн- миче- ское химическое химическое хими- ческое
Содержание в Г/л в различных растворах
Серная кислота Нг5О4 30—50 или 700—800 — — 30—50 — -— — — —
Соляная кислота НС1 30—50 — — — 30—50 — 30—50 — —
Едкий натр NaOH — -— — — — 50—100 — 50-100 —
Цианистый калий KCN 1 —. 30—40 30—40 — — — — -— —
Углекислый калий К2СО3 — — 20—30 — — — — —
Азотная кислота HNOS — — — — — — — — 30—50
Двухромовокислый калий К4Сг2О, — 20—30 — — — — — — — —
Режим работы
Температура раствора в °C 18-25 18-25 18—25 18—25 18-25 18—25 40—60 18—25 40—60 18—25
Плотность тока в а! дм- — 5—10 — 3—5 — — — — —
Продолжительность травления в сек. 30—60 3—5 5—10 20—30 3—10 3—10 3—10 3—5 3—5 3—10
Глава VI. Химическая и электрохимическая подготовка поверхности
о
120
Часть вторая. Методы подготовки поверхности деталей
ангидрида и 0,5 Г/л серной кислоты, в течение 0,5—2 мин. Детали
после декапирования тщательно промывают в проточной воде (водной
или нескольких ваннах) и погружают в электролитическую ванну.
5. МАТИРОВАНИЕ
Процесс придания матового оттенка поверх-
ности металлических деталей называется мати-
рованием. Матированию подвергаются главным образом детали,
изготовленные из меди, алюминия и их сплавов. Оно может осуще-
ствляться механическим и химическим способами.
Механическое матирование производится путем металлопеско-
струйной обдувки, крацевания стальными или латунными щетками,
а также специальной обработкой (штриховое матирование, гильоши-
рование).
Химическое матирование изделий из меди и медных сплавов про-
изводят в растворах следующего состава:
1) Азотная кислота HNO3 ... . 1000 Г/л
Соляная кислота НС1 ............................ 100 »
2) Двухромовокислый калий К2Сг2О7 ................ 200 »
Серная кислота H2SO4 ............................ 60 »
3) Азотная кислота HNO3........................... 600 »
Серная кислота H2SO4 ........................... 60 »
Сернокислый цинк ZnSO4-7H2O...................... 60 »
Температура растворов 20—25°.
При приготовлении раствора № 3 сернокислый цинк растворяют
в азотиой кислоте, затем к раствору осторожно добавляют серную
кислоту.
Матирование латунных изделий с выявлением структуры металлов
осуществляется в растворе состава:
Хлорное железо FeCl3-6H2O . . ........... 150—200 Г/л
Соляная кислота НС1 ..................... 30
Температура 35—40°.
Изделия предварительно подвергают травлению в смеси серной
и азотной кислот (1:1) и после промывки их матируют.
Матирование изделий из меди и ее сплавов может быть осуще-
ствлено в растворе состава:
Азотная кислота HNO3 .... 100 Г/л
Серная кислота H2SO4........ . 100 »
Сернокислый цинк ZnSO4-7H2O ...................... 5 »
Хлористый аммоний NH4C1 .......................... 5 »
Серный цвет ............................... . 5 »
Сажа.............................................. 5 »
Температура 45—50°.
Глава VI. Химическая и электрохимическая подготовка поверхности 121
При составлении протравы сернокислый цинк растворяют в азот-
й кислоте, затем осторожно, помешивая, доливают серную кислоту,
после чего вводят остальные компоненты. Повышение содержания
серной кислоты в ванне приводит к образованию крупнокристалличе-
ской структуры, а увеличение концентрации азотной кислоты—к мел-
кокристаллическому матированию. После матирования и промывки
рекомендуется детали окунуть в раствор для глянцевого травления.
1 Электролитическое матирование производится в 10—15-процент-
ном растворе серной кислоты или в электролите следующего состава:
Серная кислота H2SO4 ....... . . 50 Пл
Соляная кислота НС1 ......................... 30 »
Хлористый натрий NaCl............... . . . . 2 »
Режим работы: плотность тока 7,5—10 а/дм\ температура
50—70°. Катоды — из кремнистого чугуна.
Матирование деталей, изготовленных из чистого алюминия и его
сплавов, представляющих собой твердые растворы, может произ-
водиться в смеси, содержащей 3—5-процентную серную кислоту
и 5-процентную азотную кислоту. Температура 75—80°. Продолжи-
тельность процесса 2—10 мин.
Муаровое матирование деталей из алюминия и его сплавов может
быть проведено в растворе:
Фтористый аммоний NH4F........... ........... 30 Пл
Серная кислота (уд. вес 1,84) H2SO4........... 30 мл/л
Матирование при 18—25° производится в течение 15—20 мин.,
а при 40—50° — в течение 5—10 мин.
Для матирования алюминиевых деталей может быть использо-
ван 10-процентной раствор едкого натра, насыщенный хлористым
натрием.
6. промывка
После каждой операции подготовки и нанесения гальванических
покрытий детали должны тщательно промываться. Особенное вни-
мание следует уделять тому, чтобы в гальванические ванны не попа-
дало даже следов обезжиривающих, травильных и декапировочных
растворов. Попадающие загрязнения могут стать причиной ухудше-
ния сцепления покрытий с основой, появления пятен и других
нарушений нормальной работы электролита. Вода должна быть
к можно меньшей жесткости, ее необходимо часто менять. Реко-
идуется применение проточной воды, которая должна подаваться
СкизУ и сливаться из верхней части промывочного бака или ванны.
Hy^P°CTb смены проточной воды — 1—3 объема в час. Промывку
Для Н° ПР°ИЗВ°ДИТЬ в течение 1—3 мин., особенно после травления —
вни Удаления из всех пор остатков кислоты п солей железа. Особое
мание следует уделять промывке литых деталей и чугуна.
122
Часть вторая. Методы подготовки поверхности деталей
Качество промывки может быть улучшено перемешиванием воды
сжатым воздухом, а также применением разбрызгивающих устройств
и струйных установок.
Полированные детали рекомендуется промывать дистиллирован-
ной водой или конденсатом. Весьма целесообразно обессоливание
Фиг. 61. Вид иеобезжирениой (а) и обезжиренной (б)
поверхности.
воды при помощи ионообменных смол. В результате подобной обра-
ботки содержание солей в воде может быть доведено до 20—40 мГ'л.
После обезжиривания промывку нужно производить внач; '
в горячей, затем в холодной воде. -Хорошо обезжиренная пове
ность должна равномерно покрываться водой (фиг. 61).
После декапирования непосредственно перед загрузкой в вш
детали не следует промывать в горячей воде, так как при этом пове
ность деталей быстро высыхает. В данном случае это нежелатель
так как тонкая пленка влаги препятствует контакту металла с кисло*
родом воздуха, предохраняя его от окисления.
После нанесения покрытий промывка производится в проточи1'111
холодной воде, а затем в горячей, что облегчает сушку. ИнргДа
Глава VI Химическая и электрохимическая подготовка поверхности 123
в горячую воду добавляют некоторое количество кальцинированной
соды или какой-либо пассивирующей соли. Промывные воды не
должны содержать кислот или солей более 0,2%.
Хранение подготовленных деталей, если они не поступают сразу
в ванны для нанесения покрытий, производится в 3—5-процентном
растворе кальцинированной соды с добавкой небольшого количества
аммиака.
После хранения детали вновь декапируют, промывают и погру-
жают в ванну для нанесения покрытий.
ГЛАВА VII
ЭЛЕКТРОХИМИЧЕСКОЕ И ХИМИЧЕСКОЕ
ПОЛИРОВАНИЕ МЕТАЛЛОВ
В последнее время довольно широкое распространение получило
химическое и электрохимическое полирование поверхности деталей
как до, так и после нанесения покрытий.
1. ЭЛЕКТРОПОЛИРОВАНИЕ
Процесс электрополирования, изобретенный в 1910 г. Е. И. Шпи-
тальским и усовершенствованный позднее Жаке, заключается в том,
что обрабатываемые детали завешивают
со специальным электролитом. В каче-
стве катодов используются какие-либо
пластины, устойчивые в данном элек-
тролите.
Схема установки для электрополи-
рования приведена на фиг. 62.
в качестве анодов в ванну
Фиг. 63. Схема располо-
жения плеики на поверх-
ности анода:
/—анод; 2 — анодная плен-
ка; 3 — катод.
Фиг. 62. Схема установки для элек-
трополирования:
/ — электролит; 2 — катоды; 3 — анод;
, 4 — источник постоянного тока.
В процессе электролиза поверхность деталей в результате различ-'
ной скорости растворения микровыступов и углублений сглажи-
вается и приобретает блеск.
Несмотря на довольно широкое применение процесса электро-
полирования, единой теории этого процесса пока нет. Жаке выдвинул
теорию «вязкой пленки». Она заключается в следующем. При раство-
рении металла в определенных электролитах на поверхности детали
Глава VII. Электрохимическое и химическое полирование металлов 125
образуется вязкая нерастворимая пленка. Толщина этой пленки
неравномерна (фиг. 63). Во впадинах пленка толще, на вершинах
выступов она тоньше вследствие более интенсивной диффузии состав-
ляющих ее частиц в электролит. Из-за высокого электрического
сопротивления пленки плотность тока на выступах обрабатываемой
поверхности значительно выше, чем в углублениях. Неравномерная
скорость растворения металла приводит к сглаживанию поверхности
и к появлению блеска.
Н П. Федотьев и С. Я- Грилихес объясняют возникновение
блеска образованием на металле поверхностной тонкой окисной
пленки, предотвращающей или тормозящей травящее действие рас-
твора на металл. Толщина пленки неодинакова на микровыступах
и микровпадинах. Поэтому раствор сильнее действует на те участки,
где толщина пленки меньше, т. е. на микровыступы. Результатом
этого процесса является сглаживание мельчайших неровностей на по-
верхности металла. Наличие вязкого солевого слоя, задерживаю-
щегося в микровпадинах, также способствует процессу выравнивания.
Электролиты, пригодные для электрополирования, должны удо-
влетворять следующим требованиям:
1) обеспечивать образование окисной и вязкой пленки на поверх-
ности деталей;
2) быть стабильными во времени;
3) не действовать разрушающе на полируемый металл в отсут-
ствие тока;
4) обладать широким рабочим интервалом, причем применяемая
плотность тока, напряжение и температура не должны быть чрез-
мерно высокими.
Наибольшее распространение в качестве электролита для электро-
полирования получили фосфорная, серная и хромовая кислоты
с добавками или без них. За рубежом довольно широко применяется
при электрополировании и хлорная кислота.
Эффективность электрополирования в значительной степени зави-
сит от исходной чистоты поверхности обрабатываемых деталей,
а также от режима электролиза. Наибольшее сглаживание поверх-
ности наблюдается в первые минуты процесса.
Многочисленные исследования показали, что при электрополи-
Ровании стальных деталей, обрабатываемых по 5—7-му классам,
чистота поверхности повышается на один класс, 7агмы. •Злгщ’ой
чистоте 8—10-го классов чистота улучшается на два L катодная :
Наибольшее распространение получил процесс элеК1?Я—40°, /-
ния таких материалов, механическое полирование которых зй-
ВооД^тельно: нержавеющей стали, медных и алюминиевых спла-
Гу ’ Целесообразно электрополирование деталей сложной конфи-
тий Цтп’ 3 также отделка деталей до и после нанесения покры-
и Широко применяется электрополирование никелированных
сребренных деталей.
126
Часть вторая. Методы подготовки поверхности деталей
Следует отметить, что электрополированиё деталей после нане-
сения покрытий приводит также к повышению их коррозионной
стойкости.
Во многих случаях электрополирование применяется с целью
снижения коэффициента трения, а также облегчения скольжения
материалов, соприкасающихся с полированной поверхностью
(детали текстильных машин).
Основными преимуществами процесса электрополирования
являются:
1) высокая производительность, поскольку процесс не зависит
от площади деталей;
2) хорошее сцепление гальванических покрытий с электрополи-
рованной поверхностью;
3) высокая коррозионная стойкость электрополированных
деталей;
4) возможность включения процесса в поточную линию и авто-
матизации операции электрополирования;
5) исключение операций последующего обезжиривания;
6) улучшение условий труда, так как отпадает необходимость
механического полирования.
К недостаткам процесса электрополирования относятся:
1) необходимость в частой смене электролитов;
2) отсутствие универсального электролита для различных
металлов;
3) необходимость предварительной механической подготовки
поверхности деталей;
4) повышенный расход электроэнергии.
Электрохимическое полирование меди и ее сплавов
Для электрополирования меди и ее сплавов применяют концен-
трированные растворы ортофосфорной кислоты и смесь ее с хро-
мовым ангидридом.
Наиболее распространенным при электрополировании меди
и ее сплавов является раствор ортофосфорной кислоты уд. веса 1,55.
Температура процесса 18—25°, анодная плотность тока 1,4—
1,6 а!дм2 при полировании меди и 0,8—1,0 а!дм2 при полировании
сплавов меди; продолжительность электрополирования 10—20 мин.
Пот’—алектргоополировании меди и ее сплавов рекомендуется
1 ‘ ~у5?ировать не по плотности тока, а по напряжению.
свежем электролите должно быть равным 1,6—1,8 в;
J?<$om проработанном электролите оптимальное напряжение^
к
в
составляет 1,4н-1,6 в (при расстоянии между электродами 100—
200 ~мм).
Если используется более концентрированный раствор кислоты,
то плотность тока должна быть снижена; при повышении темпе-
ратуры, а также в случае перемешивания электролита плотность тока
Глава VII. Электрохимическое и химическое полирование металлов 127
следует увеличить. Рекомендуется объемную плотность тока под-
держивать в пределах 0,3—0,5 а!л. Катодами служат медные листы.
Соотношение поверхности анодов и катодов должно быть в пре-
делах 1 : 3—1 : 5. До начала работы рекомендуется электролит
проработать с медными анадами при плотности тока 1—2 а/дм2
в течение 3—5 час.
в растворах
Кривые зависимости потенциала анода от плотности тока при
электрополирова
дены на фипС'Ь4.
Длр' электрополирования меди и
ее сплавов может быть применен
также электролит следующего со-
става ;
Ортофосфорная кислота Н3РО4 74 вес %
Хромовый ангидрид СгО3 ... 6 » °/0
Вода.......................... 20 »%
Удельный вес электролита . . 1,6—1,65
Режим электролиза:
анодная плотность тока 30—50 а!дм2,
температура 20—40°; продолжитель-
ность полирования 1—3 мин.
Катоды изготовляются из свинца.
При плотности тока, равной
40 а! дм2, и температуре 20° за 1 мин.
растворяется слой меди толщиной
2—3 мк.
Электролит указанного состава
готовят путем растворения хромо-
фосфорной кислоты приве-
Фиг. 64. Зависимость потенциала
анода от плотности тока при элек-
трополировании меди в фосфорной
кислоте. Температура электролита
30°, удельный вес растворов при 15°:
1 — 1.55; 2 — 1.52; 3 — 1,40; 4— 1,30;
5 — 1.20; 6—1,10.
вого ангидрида в ортофосфорной кислоте с последующим упари-
ванием при 100—110° до получения требуемого удельного веса.
Перед употреблением электролит должен быть проработан с мед-
ными анодами током из расчета 10 а-ч/л.
При накоплении в электролите свыше 1,5% трехвалентного хрома
последний должен быть окислен до шестивалентного. Для этого
в ванну завешивают свинцовые аноды большой поверхности, а неболь-
шие катоды помещают в пористые керамические диафрагмы. Элек-
тролиз ведется при анодной плотности тока 4—5 а!дм2\ катодная
плотность тока 7—10 а!дм2, температура электролита 20—40°,
напряжение в ванне 10—12 в.
• Ванны для электрополирования меди и медных сплавов нужно
время от времени очищать от губчатой меди, падающей с катодов.
В табл. 33 указаны основные неполадки, встречающиеся при
электрополировании меди и ее сплавов в электролитах, содержащих
ортофосфорную кислоту и хромовый ангидрид.
128
Часть вторая. Методы подготовки поверхности деталей
Таблица 33
Неполадки при электрополироваиии меди и ее сплавов
Признаки неполадок Причины возникновения Способы устранения
Поверхность дета- лей матовая Накопление в электро- лите трехвалентного хрома Анодное окисление трех- валентного хрома
Неравномерный блеск поверхности деталей а) Плохой контакт дета- лей с подвесными приспо- соблениями б) Экранирование одних деталей другими а) Улучшить контакт де- талей с подвесными приспо- соблениями б) Изменить положение деталей в ванне
Точечное травление на плоских участках деталей при работе электролита менее 30 а-ч[л а) Низкая температура электролита б) Низкая анодная плот- ность тока в) Электролит ие про- работан а) Повысить температуры электролита до 35—40° б) Повысить анодную плот- ность тока до 40—55 а!дм2 в) Проработать электро- лит с медными анодами (5 а-ч!л)
Точечное травле- ние на различных участках детали а) Избыток воды в элек- тролите (уд. вес меньше 1,6) б) Низкая анодная плот- ность тока а) Упарить электролит при температуре 100—110° до достижения уд. веса рас- твора 1,60—1,62 б) Повысить анодную плотность тока до 40— 50 а1дм?
Электрохимическое полирование никеля
Электрохимическое полирование никеля и никелевых покрытий
может производиться в электролитах следующего состава:
Сериая кислота H2SO4................................ 1750 г
Хромовый ангидрид СгО3 ............................... 30 »
Глицерин СНОН (СН2ОН)2................................ 15 »
Вода............................................. До 1 л
Удельный вес электролита......................... 1.6—1,62
Режим работы: анодная плотность тока 25—30 а! дм2,
температура 20—35°, напряжение 12—15 в. Продолжительность
полирования 30—45 сек. (съем металла при этом 3—5 мк).
При электрополировании применяются свинцовые катоды, при-
чем соотношение поверхности анодов и поверхности катодов должно
составлять примерно 1:3.
Электролит готовится следующим образом. Ванну заливают
требуемым количеством серной кислоты, при этом объем кислоты
Глава VII. Электрохимическое и химическое полирование металлов 129
должен занимать не более г/з объема ванны. В кислоту осторожно,
непрерывно помешивая, добавляют концентрированный раствор
хромового ангидрида. После этого в ванну добавляют небольшими
порциями глицерин, восстанавливающий шестивалентный хром
в трехвалентный. При этом электролит разогревается и происходит
бурное выделение газов. После перемешивания электролита и пре-
кращения выделения газов добавляют новую порцию глицерина.
Добавление глицерина продолжается до тех пор, пока электролит
Не примет изумрудно-зеленой окраски и не прекратится газовы-
деление. Электролит прорабатывается с никелевыми анодами до на-
копления в растворе 5 Г/л никеля.
Неполадки, наблюдаемые при электрополировании никеля в опи-
санном выше электролите, и меры их устранения приведены в табл. 34.
Таблица 34
Неполадки при электрополироваиии никеля и никелевых покрытий
Признаки неполадок Причины возникновения Способы устранения
Слабый блеск по- а) Низкая плотность а) Повысить анодную плот-
дированной поверх- тока ность тока до 30 а/дм~
ности б) Высокий удельный вес электролита в) Электролит мало проработан б) Разбавить электролит дС удельного веса 1,6 в) Проработать электролит до содержания 5 Г/л никеля
Большой съем ни- а)- Большая продол- а) Уменьшить продолжнтель-
келя при интенсив- жите л ьн ость полир ова- ность полирования до 20—
ном блеске поверх- иия 30 сек.
ности б) Высокая темпера- тура в) Низкий удельный вес г) Низкая концентра- ция хрома б) Охладить электролит до 20° в) Упарить электролит до достижения уд. веса 1,61—1,64 г) Добавить хромового ан- гидрида и восстановить его глицерином
Отсутствие блеска поверхности Высокая температура Охладить электролит до 20°
Для электрополирования никеля и никелевых покрытий может
)ыть применен также электролит следующего состава:
Серная кислота H2SO4 .... ................... 900 Г/л
Ортофосфорная кислота Н3РО4 ... . . 750 »
Лимонная кислота С3Н4(ОН) (СО.2Н);, . 20 »
Уд. вес электролита......................... . . 1,65
темпЛЖ И м Р а б о т ы: анодная плотность тока 30—50 а/дм\
9 Ратура 20—30°. Продолжительность — 30 сек.
Вайнер и Дасоян
1зи
Часть вторая. Методы подготовки поверхности деталей
Катоды — свинец или никель. Соотношение поверхности анодов
к катодам — 1:5.
Электролит готовят смешиванием ортофосфорной и серной
кислот, после чего осторожно добавляют водный раствор лимон-
ной кислоты. В случае, если удельный вес электролита меньше
требуемого, излишек воды испаряется при 90—95°.
Приготовленный электролит перед эксплуатацией прорабатьй
вается током с никелевыми анодами (8—10 а-ч/л).
Электрополированные никелированные детали перед хромиро-
ванием должны быть продекапированы в 5-процентной соляной
кислоте.
Электрохимическое полирование алюминия
Для-электрополирования алюминия применяют фосфорнокислые,
борфтористоводородные и щелочные электролиты.
Наибольшее распространение получили электролиты, содержа-
щие фосфорную кислоту, благодаря хорошему блеску, получаемому
в таких электролитах. Однако в связи с высокой стоимостью фосфор-
ной кислоты много внимания уделяется также и другим растворам,
особенно щелочным. Широкое применение электрополирования дета-
лей из алюминия и его сплавов объясняется трудоемкостью и слож-
ностью механического полирования этих материалов, а также и высо-
ким качеством поверхности после электрополирования. Так, после
механического полирования коэффициент отражения света деталями
из алюминия высокой чистоты составляет 78%, а после электропо-
лирования коэффициент отражения достигает 90%.
Следует отметить, что хорошие результаты могут быть получены
путем электрополирования только для чистого алюминия, а также
для сплавов, содержащих медь и магний. Для сплавов же, содержа-
щих в значительных количествах другие примеси, например, крем-
ний, хорошего блеска при электрополировании получить не удается.
В табл. 35 приводятся составы электролитов на основе фосфорной
кислоты.
Наличие в электролите серной кислоты улучшает его электропро-
водность и позволяет поддерживать плотность тока на необходимом
уровне, а также предотвращает точечное разъедание поверхности.
Присутствие в электролите хромового ангидрида повышает блеск,
так как способствует образованию в ходе полирования окисной
пленки на поверхности ^дюминия.
Следует отметить, что в процессе работы электролита напряжение
на клеммах ванны повышается. При увеличении плотности тока
(в указанных пределах) сокращается продолжительность процесса
полирования, а при повышении температуры улучшается блеск.
Электролиты готовятся следующим образом. Необходимое коли-
чество хромового ангидрида растворяют в минимальном количестве
воды и декантируют в рабочую ванну. Затем туда же вливают орто-
Глава VH. Электрохимические и химическое полирование металлов 131
Таблица 35
Составы электролитов и режим работы при электрополиросании алюминии
Наименование компонентов ! Содержание в вес. проц, в растровах
№ I № 2
Ортофосфорная кислота П3РО4 (уд. вес 1,6) Серная кислота H2SO4 (уд. вес 1,84) Хромовый ангидрид СгО3 Вода Удельный вес электролита Режим работы Температура раствора в °C Анодная плотность тока в а/дм2 Напряжение иа клеммах ванны в в Продолжительность процесса в мин. Катоды 45 30 4 21 1,68—1,70 65—75 20—30 10—12 3—10 Свинец 34 34 3,6 28,4 1,59—1,60 85—90 30—35 10—15 5—10 Свинец
фосфорную кислот;
непрерывно rw
нагревают пр
пературе до
величины,
батывают в
электролит
бавляют в
Количе
воды для добавле
осле охЛ
шивая, добавл
елйЯРРуре 1QQ.—1
пор, пока удел
ажденный свежеп
чение 1—2 час. с aJ
ет плотность выше у
ения раствора к нему осторожно,
серную кислоту. Электролит
и выдерживают при этой тем-
!С его не достигнет требуемой
рвленный электролит прора-
!ниевыми электродами. Если
энной в табл. 35, то его раз-
рассчитывается по формуле
Ф)
1
ды,
водимое для разбавления электро-
где V — колич!
лита, _
Л — объем электролита, подлежащего корректировке;
— удельный вес электролита до разбавления;
di — требуемый удельный вес электролита.
При работе электролита происходит восстановление шестива-
лентного хрома и накопление в ванне алюминия. Предельно допу-
4пИр,ое содержание алюминия в растворе составляет примерно
за I !л\ при большем содержании электролит частично или полностью
:^еняется новым. Трехвалентный хром,' накопившийся в элек-
н лите, окисляется в шестивалентный по методике, описанной
вы^е (стр. 127).
132
Часть вторая. Методы подготовки поверхности деталей
Корректирование электролита осуществляется добавлением воды
до требуемого удельного веса, прибавлением необходимых кислот
а также окислением трехвалентного хрома.
Для электрополирования алюминия может быть применен 1,25-
процентный раствор борфтористоводородной кислоты.
Режим работы: температура 30—35°; анодная плотность
тока 1,5—3,0 а!дм2\ напряжение 20—30 в; продолжительность
10—20 мин.
Электролит готовится добавлением небольшими порциями бор-
ной кислоты к плавиковой кислоте. Полученный раствор борфтори-
стоводородной кислоты разбавляют водой.
Образующуюся при полировании алюминия на поверхности тон-
кую пористую пленку удаляют обработкой в растворе, содержащем
70 Пл ортофосфорной кислоты и 18 Пл хромового ангидрида при
температуре 75—80° в течение 1—3 мин. После указанной обработки
детали должны подвергаться анодированию.
В табл. 36 приведены наиболее часто встречающиеся неполадки
при электрополировании деталей из алюминиевых сплавов в опи-
санных выше электролитах.
Таблица 36
Неполадки при электрохимическом полировании алюминия
и способы их устранения
Признаки неполадок Причины возникновения ; .Способы устранения «я,
Точечное травле- ние поверхности де- талей Общее растравли- вание поверхности Белые матовые по- лосы или пятна а) Наличж электро- лите мельчгп^их частиц хромового айЖдрида б) Низкий сдельный вес электролита в) Плохой кчгтау дета- лей с подвескам* г) Недостаток сецной кислоты Отклонение плотности тока и состава электро- лита от требований техно- логии а) Высокий удельный вес электролита б) Низкое содержание серной кислоты а) Прогреть электролит до полного растворения хро- мового ангидрида б) Прогрет» электролит при температуре 100—110" до достижения требуемого удельноцр веса в) Улучшить контактиро вание г) Добавить серную кис- лоту Откорректировать режим работы и состав электролита а) Разбавить электролит до требуемого удельного веса и прогреть его nprf 80—90° в течение 2—3 час. б) Откорректировать электролит
Глава VII. Электрохимическое и химическое полирование металлов 133
Продолжение табл. 36
Признаки неполадок Причины возникновения 1 | Способы устранения
Отсутствие блеска деталей Матовые участки н» поверхности де- талей 1 1 Растравленные по- лосы на.поверхности деталей' Растравливание по- верхности отдельных деталей Образование тон- чайших непрозрач- ных пленок, замет- ных после анрдиро- вания Низкий удельный вес электролита а) Местный перегрев электролита б) Плохой контакт де- талей с подвесками в) Большое количество трехвалентного хрома г) Высокая плотность тока а) Высокий удельный вес электролита б) Следы от выделяю- щихся пузырьков кисло- рода в) Накопление в элек- тролите трехвалентного хрома выше 35—40 Г/л г) Накопление алюми- ния выше 45—50 Г/л Плохой контакт а) Высокая температура электролита б) Накопление значи- тельного количества алю- 1 миниевых солей Прогреть электролит при 80—90° до требуемого удель- ного веса а) Снизить температуру электролита до 70—80° б) Улучшить контакти- рование в) Окислить трехвалеит- ный хром г) Снизить плотность тока до 20 а/дм2 а) Разбавить электролит до требуемого удельного веса б) Встряхивать детали при полировании в) Окислить трехвалент- ный хром г) Заменить часть элек- тролита Улучшить контакт а) Снизить температуру б) Заменить часть элек- тролита или обрабатывать детали после электрополи- рования в течение 20— 30 сек. в растворе, содержа- щем 5 Г/л каустической и 10 Г/л кальцинированной соды, прн температуре 40— 50°
Состав щелочного раствора для электрополирования алюминия:
Фосфорнокислый натрий Na3PO4-12H2O 50 Пл
Кальцинированная сода Na»CO3 . 150’ »
тока <?Жим Работы: температура 85—90°, анодная плотность
г, 6 а/дм-; напряжение 12—15 в. Продолжительность 5—8 мин.
Пом ЛИ погружаются в ванну при плотности тока 5—6 а/дм2.
ность^6 °бРазования на поверхности деталей тонкой пленки плот-
тока падает примерно до половины начального значения.
134
Часть вторая. Методы подготовки поверхности деталей
В процессе полирования в щелочных электролитах накапли-
вается щелочь. Поэтому необходимо периодически контролировать
содержание свободной щелочи, количество которой не должно пре-
вышать 15—18 Пл.
После электрополирования некоторые алюминиевые детали могут
поступать на дальнейшую обработку — анодирование и окрашива-
ние. В ряде случаев электрополирование является заключительной
операцией.
Электрохимическое полирование стали
Электрохимическое полирование стали осуществляется в электро-
литах, содержащих ортофосфорную и серную кислоты с небольшим
количеством хромового ангидрида.t
Состав электролита, применяемого для электрополирования сталь-
ных деталей, и режим работы приведены в табл. 37.
Таблица 37
Составы электролитов и режимы работы при электрополироваиии стали
Наименование компонентов Содержание в вес. проц, в растворах
для углероди- стых и низко- легированных марок стали для нержа- веющей стали
Ортофосфориая кислота Н3РО4 65—70 38—43
Сериал кислота H2SO4 15—12 37—40
Хромовый ангидрид СгО3 5-6 3—4
Вода 15—12 22—13
Удельный вес 1,70—1,74 1,65—1,68
Режим работы
Температура в °C 70—80 70—80
Анодная плотность тока в alдм2 35—50 35—50
Продолжительность в мин. 5—10 1—10
При электрополировании стали применяют свинцовые катоды.
Течение процесса электрополирования и съем металла в основном
зависят от плотности тока, температуры электролита и продолжи-
тельности электролиза. С повышением температуры увеличивается
скорость растворения металла и усиливается блеск деталей; стано-
вится возможным снизить плотность тока. Повышение плотности
тока увеличивает скорость сглаживания и позволяет сократить про"
должительность полирования. Наибольшая скорость сглаживания
наблюдается в первые минуты работы.
Глава VIJ. Электрохимическое и химическое полирование металлов 135
Пои обработке деталей, имеющих малый допуск на изменение раз-
меров, электрополирование ведут при повышенной плотности тока,
равной 50—100 а/дм2, в течение0,5—Змии. Если электрополирование
производится перед нанесением гальванических покрытий, то про-
цесс может быть осуществлен при анодной плотности тока 25—30 а!дм2
в течение 3—5 мин.
При накоплении в электролите свыше 1,5% трехвалентного хрома
необходимо производить его окисление по указанной выше методике
(стр. 127). При накоплении в электролите свыше 7% Fe2O3 электро-
лит должен быть заменен новым.
Детали в ванну электрополирования погружаются на стальных
освинцованных подвесках, причем нерабочую часть подвесок реко-
мендуется покрывать электроизоляционным материалом. Подвески
должны обеспечивать надежный контакт с деталями и токоведущими
штангами.
Количество химикатов, необходимое для приготовления 1 л
электролита, рассчитывается по следующим формулам.
1. Количество ортофосфорной кислоты
. щ-гМООО
где А — требуемое количество ортофосфорной кислоты в мл;
d — удельный 'вес готового электролита;
аг — содержание Н3РО4 в электролите в вес. %;
— удельный вес ортофосфорной кислоты; (
— содержание Н3РО4 в ортофосфорной кислоте,, взятой для
приготовления электролита, в вес. %.
2. Количество серной кислоты
о____ (z2-d-1000
где В — требуемое количество серной кислоты в мл;
d — удельный вес готового электролита;
я2 — содержание H2SO4 в готовом электролите в вес. %;
— содержание H2SO4 в серной кислоте, взятой для при-
готовления электролита, в вес. %;
^2 — удельный вес серной кислоты.
3. Количество хромового ангидрида
с = a3d-10,
Де я ~~ тРебУемое количество хромового ангидрида в Г;
d- удельный вес электролита;
~°з‘ содержание СгО3 в готовом электролите в вес. %.
РастЛеКТР°ЛИТ для полиРования приготовляют следующим образом,
воряют в воде требуемое количество хромового ангидрида
136
Часть вторая. Методы подготовки поверхности деталей
и к раствору небольшими порциями, непрерывно помешивая, добав-
ляют ортофосфорную и затем серную кислоты. Раствор упаривают
при 80—110° до получения удельного веса 1,7—1,74 и прорабаты-
вают при анодной плотности тока 20—40 а/дм2 из расчета 5—6 а-ч
на 1 л раствора.
Убыль воды в результате испарения во время работы ванны
восполняется добавлением ее в соответствии с измеряемым удельным
весом электролита. Следует учитывать, что в связи с накоплением
в электролите железа вязкость его повышается. Поэтому добавление
воды в электролит для электрополирования углеродистой стали
производят в следующем порядке: до 75 а-ч/л электролита вода
добавляется для удельного веса раствора 1,74—1,76, свыше 75 а-ч/л —
до удельного веса 1,76—1,78.
Количество воды, необходимое для получения электролита
требуемого удельного веса, подсчитывают по формуле, приведенной
при описании электрополирования алюминия.
Неполадки, встречающиеся при электрополировании стальных
деталей, и способы их устранения описаны в табл. 38.
Таблица 38
Неполадки при электрополироваиии стали и способы их устранения
1 Признаки неполадок Причины возникновения Способы устранения
1. В свежем электр о л и т е
Точечное травление поверхности Наличие взвешенных частиц хромового ан- гидрида Прогреть электролит при 90—110° до полного рас- творения хромового анги- дрида. Если удельный вес до нагрева выше 1,73, раз- бавить водой
Отсутствие блеска, желтоватые пятна Низкий удельный вес электролита Упарить электролит до удельного веса 1,74
Отсутствие блеска, беловатые пятна Большое содержание трехвалентного хрома Окислить трехвалентный хром
Коричневая на деталях пленка Высокий удельный вес электролита Разбавить электролит до уд. веса 1,74 и прогреть при 40° в течение часа
Матовость с синева- тым оттенком, заметная после протирки деталей а) Электролит не про- работан или не про- грет б) Низкая темпера- тура электролита а) Прогреть электролит при 100—110° в течение 1 часа или проработать при плотности 40 а/дмг из рас- чета 5—10 а-ч/л б) Нагреть электролит до 70—80°
Глава VII. Электрохимическое и химическое полирование металлов 137
Продолжение табл. 38
Признаки неполадок Причины возникновения X Способы устранения
2. В электролит- е, проработавшем длительное время
Белые полосы Высокий удельный вес электролита (свыше 1,82) Разбавить электролит до удельного веса 1,74 и про- греть при 90—110° в течение часа
Отсутствие блеска, желтоватые пятна Низкий удельный вес электролита Прогреть электролит до достижения удельного веса 1,74
Отсутствие блеска, теми о-коричневые пятна а) Высокая концен- трация трехвалентного хрома б) Высокая темпера- тура электролита в) Высокая анодная плотность тока г) Плохой контакт деталей с подвесками а) Окислить трехвалент- ный хром б) Понизить температуру до 70° в) Снизить плотность тока до 25—35 а/дм2 г) Улучшить контактиро- вание
Отсутствие блеска вблизи места контакта деталей с подвеской Плохой контакт Улучшить контакт. Зачи- стить место контактирова- ния
Волнистость у краев и отверстий деталей а) Высокая темпера- тура электролиза б) Большая продол- жительность полирова- ния в) Высокая анодная плотность тока а) Понизить температуру до 60—70° б) Уменьшить время по- лирования в) Снизить плотность то- ка до 25 а/дм2
Серебр исто-белые пятна на вогнутых участках деталей вблизи контакта с под- весками Экранирование во- гнутых участков краями деталей или подвесками Изменить положение де- талей в ванне, сблизить электроды, повысить плот- ность тока до 50 а/дм2
Коричневые пятна, видимые сразу после электрополирования Недостаточная про- должительность Элек- тр ополирова ния Увеличить время до 8— 10 мин.
Полосчатость, чередо- вание крупно- и мелко- зернистой структуры Влияние прокатки и последующего отжига Уменьшить продолжи- тельность электрополирова- ния до 5 мин.
Электрохимическое полирование серебра
произвКТР°ПОЛИрОВание сеРебРяных илн серебренных деталей может
комплекДИТЬСЯ В спеЦиальиых растворах цианистого серебряного
серебрен? рЛИ непосредственно в гальванических ваннах для
мая из на ° послеДнем случае детали после серебрения, не выни-
нны, перевешивают на анодные штанги, а серебряные
138
Часть вторая. Методы подготовки поверхности детален
аноды — на катодные. Достоинство такого способа — отсутствие
потерь серебра.
Для проведения процесса электрополирования серебра надо
правильно выбрать плотность тока и условия перемешивания элек-
тролита.
Оба эти фактора связаны один с другим и, кроме того, зави-
сят от состава электролита: чем выше концентрация свободного
цианида и чем ниже содержание серебра в ванне, тем выше должна
быть плотность тока.
С увеличением интенсивности перемешивания плотность тока
также должна быть увеличена. Обычно она лежит в пределах
от 2 до 5 а!дм2. Иногда рекомендуется прерывать ток через каж-
дые 3—4 'сек. электролиза. Тщательный выбор режима работы
применительно к составу ванны нужен потому, что оптимальное
сглаживание поверхности достигается при вполне определенном
для каждого электролита анодном потенциале. Поэтому, подобрав
один раз режим, далее за нормальным ходом процесса можно сле-
дить по напряжению на ванне.
Состав электролита для электрохимического полирования
серебра в тех случаях, когда оно ведется в специально предназна-
ченных для этого ваннах, приведен в табл. 39.
Таблица 39
Составы электролитов для электрополирования серебра и режим работы
Наименование компонентов Содержание в Г/л в растворах
№ 1 № 2 № 3
Серебро цианистое AgCN Калии цианистый KCN Калий углекислый К2СО3 Режим р Температура в °C Анодная плотность тока в al дм* Напряжение на ванне в в Продолжительность полирования в ми- нутах 20 30 а б о т ы 18—25 1—1,2 1,2—1,3 3—4 30 20 41 20 3,3 2,5 16-60 35 38 15 18—20 2—5 18—20 _ _ ,—
Процесс электрохимического полирования серебра особенно
эффективен для изделий сложного профиля, механическая полировка
которых затруднена.
Съем металла при электрохимической полировке колеблется
от долей микрона до 2 мк.
Глава VII. Электрохимическое и химическое полирование металлов 139
2. ХИМИЧЕСКОЕ ПОЛИРОВАНИЕ
Наряду с электрическим способом находит примейение и хими-
ческий способ полирования металлов и сплавов. Механизм электро-
химического и химического способов полирования имеет много
общего. По-видимому, и здесь возникновение блеска связано с нали-
чием на поверхности тонкой пленки, предотвращающей или тормо-
зящей травящее действие раствора на металл в углублениях.
Преимущественное растворение выступов достигается как за счет
их повышенной химической активности, так и вследствие большей
скорости диффузии ионов металла от выступов в электролит и све-
жего электролита — к выступам.
Преимущество химического полирования перед электрополиро-
ванием заключается в том, что оно не требует применения источни-
ков постоянного тока и контактирующих приспособлений. При
химическом способе можно полировать детали сложной конфигу-
рации и больших размеров. К недостаткам данного способа отно-
сятся меньший блеск по сравнению с блеском, получаемым при
электрополировании, а также то, что применяемые растворы срав-
нительно недолговечны, а работа с ними сопровождается выделением
значительного количества агрессивных газов.
Составы растворов для химического полирования и режимы
работы приведены в табл. 40.
Таблица 40
Составы растворов и режимы работы при химическом полировании
Полируемый металл Состав раствора для полирования Режим полирования
Наименование компонентов Содержание Темпера- тура в °C Продол- житель- ность в мин.
Алюминий 1. Ортофосфорная кислота Н3РО4 (уд. вес 1,7) Азотная кислота HNO3 (уд. 650 мл 150 » 100—110 0,5—2,0
вес 1,4) Серная кислота (уд. вес 1,84) Мочевина NH/ZONH2 2. Едкий натр NaOH Азотнокислый натрий NaNO3 Азотистокислый натрий 200 » 10 Г 300—600 г 300—500 » 200—300 » 120—140 0,5—2,0
NaNO2 Тринатрийфосфат Na3PO4- 12Н2О Вода Н2О 100—300 » 100—300 мл
140
Часть вторая. Методы подготовки поверхности деталей
Продолжение табл. 40
Полируемый металл Состав раствора для полирования Режим полирования
Наименование компонентов Содержание Темпера- тура в °C Продол- житель- ность в мин.
Алюминий 3. Ортофосфорная кислота (уд. вес 1,7) Н3РО4 Уксусная кислота СН3СООН (уд. вес 1,05) Азотная кислота HNO3 (уд. вес 1,4) 800 мл 150 » 50 » 100—110 0,2—1,0
Медь, латунь, нейзильбер Ортофосфорная кислота Н3РО4 (уд. вес 1,7) Азотная кислота HNO3 (уд. вес 1,4) Уксусная кислота СН3СООН (уд. вес 1,05) Соляная кислота НС1 (уд. вес 1,19) 40 объемн.% 20 » » 40 » » 0,01 » » 20—60 0,5—1,0
Сталь 1. Ортофосфорная кислота (уд. вес 1,7) Н3РО4 Азотная кислота HNO3 (уд. вес 1,4) Соляная кислота НС1 (уд. вес 1,19) Вода Н2О 2. Щавелевая кислота Н2С2О4 Перекись водорода Н2О2 Серная кислота H2SO4 Вода Н2О 15—25 объемн. % 2—4 объемн. % 2—5 объемн. % 81—86 объемн. % 22—25 Г 10—15 мл 0,1 » 1000 » 70—80 20—30 1—10 30—60
Сталь нержа- веющая (типа 1Х18Н9Т) Азотная кислота HNO3 Соляная кислота НС1 Серная кислота H2SO4 Краситель кислотный черный Хлористый натрий NaCl Клей костный 40 мл 70 » 230 » 6 Г/л 6 » ; 10 » 70—75 5—30
Цинк Хромовый ангидрид СгО3 Натрий уксуснокислый CH-jCOONa Алюминий азотнокислый Al (NO3)3 Азотная кислота HNO3 (уд. вес 1,38) Серная кислота H2SO4 (уд. вес 1,84) 120 Пл 60 » 10 » 100 мл 30 » • 40—50 0,1—0,3
Глава VI1. Электрохимическое и химическое полирование металлов 141
Продолжение табл. 40
Состав раствора для полировиння Режим полирования
Полируемый металл Наименование компонентов Содержание Темпера- тура в °C Продол- житель- ность в мин.
Цинк и кадмий Хромовый ангидрид СгО3 Серная кислота H2SO4 Вода Н2О 100—150 Г 1,7—3,8 » 1000 мл 20—30 0,2—1
Серебро Цианистый натрий NaCN Перекись водорода Н2О2 (30-процентная) Вода Н2О 18—22 Г 70—90 мл 1000 » 30—32 0,1—0,2
Магний Хромовый ангидрид СгО3 Кальций азотнокислый Са (NO3)2 Магний фтористый MgF2 Вода Н2О 150—170 Г 40—45 » 2 » 850 мл 68—86 0,5—3
Перед химическим полированием изделия должны быть обез-
жирены, промыты водой и высушены (для того, чтобы не разбавлять
рабочие растворы).
В процессе химического полирования детали следует периоди-
чески встряхивать. После полирования детали необходимо быстро
и тщательно промыть в проточной воде.
ЧАСТЬ ТРЕТЬ fl
ТЕХНОЛОГИЯ НАНЕСЕНИЯ МЕТАЛЛИЧЕСКИХ
ПОКРЫТИЙ
ГЛАВА VIII
ЦИНКОВАНИЕ
1. ОБЩИЕ СВЕДЕНИЯ
Цинк — металл светло-серого цвета, отличающийся хрупкостью
и сравнительно малой твердостью (50-—60 единиц по Бринелю).
Цинк обладает следующими физико-химическими свойствами: удель-
ный вес 7,2 Г/см3, атомный вес — 65,38, валентность 2; стандартный
потенциал по отношению к нормальному водородному электроду
составляет —0,76 в; электрохимический эквивалент 1,22 Г1а-ч\
температура плавления 419° С; при нагреве до 100—150° С цинк
становится пластичным и может подвергаться прокатке и ковке,
при 200° С и выше цинк снова теряет пластичность и делается
настолько хрупким, что его можно легко превратить в порошок.
В сухом воздухе цинк устойчив. Во влажном воздухе и в пресной воде
он покрывается белой пленкой углекислых и окисных соединений,
защищающих его от дальнейшего разрушения.
В морской воде цинк обладает умеренной устойчивостью. Ско-
рость коррозии цинка в воде при различных температурах связана
с изменением свойств продуктов его коррозии: при низких (20—40° С)
и высоких (выше 90° С) температурах цинк покрывается плотными,
прочно пристающими к нему продуктами коррозии, которые, однако,
в определенном интервале температур (50—80° С) становятся рых-
лыми и легко отстают от поверхности.
Цинк быстро разрушается кислотами и щелочами и легко реа-
гирует с сероводородом и сернистыми соединениями, поэтому в таких
средах цинковые покрытия неприменимы.
В кислотах цинк растворяется с выделением водорода. Примеси
ртути и свинца с высоким значением перенапряжения водорода
не оказывают существенного влияния на скорость растворения
цинка, в то время как примеси меди, олова и других электрополо-
жительных металлов, на которых перенапряжение водорода незна-
чительно, повышают скорость растворения цинка в кислых средах-
Основными областями применения цинковых покрытий являются-'
защита от коррозии деталей машин, крепежа, стальных листов-
Глава VIII. Цинкование
143
проволоки и деталей ширпотреба, работающих вне помещений
в различных климатических районах, а также в закрытых помеще-
ниях с умеренной влажностью и в помещениях, загрязненных
газами и продуктами сгорания; защита изделий из черных металлов
от коррозии в атмосфере, загрязненной сернистым газом, и от кор-
розионного воздействия бензина и масла; защита водопроводных
труб, питательных резервуаров и предметов домашнего обихода
из черных металлов, соприкасающихся с пресной водой.
Широкое распространение цинковых покрытий в гальванической
практике для защиты от коррозии изделий из черных металлов
объясняется их высокими защитными свойствами. Потенциал цинка
отрицательнее потенциала черных металлов (стали, железа иЧ чу-
гуна), т. е. цинк для указанных металлов является анодным
покрытием и защищает их от коррозии электрохимически. Защитные
свойства таких покрытий сохраняются даже при малой толщине
слоя, а также при наличии в нем пор или обнаженных участков,
так как в образующихся микрогальванических элементах цинк —
железо цинковое покрытие подвергается растворению с образова-
нием продуктов коррозии цинка, само же изделие при этом раз-
рушению не подвергается.
Важную роль играет также низкая стоимость цинка по сравнению
с многими другими цветными металлами.
Согласно ГОСТ 3002—58, минимальная толщина цинковых покры-
тий на стали в зависимости от условий работы изделий устанавли-
вается: 5 мк для легких, 15 мк для средних и 30 мк для жестких
условий. Легкими условиями считаются закрытые,
сухие отапливаемые и вентилируемые помещения (аналогичные
жилым). К средним условиям относится пребывание
изделий в атмосфере, загрязненной промышленными газами и пылью
(в помещении или на открытом воздухе), а также в прибрежных райо-
нах, где воздух содержит соли (в виде аэрозоля). Однако непосред-
ственному воздействию дождя и снега изделия не подвергаются.
Жесткими условиями считается пребывание изделий
в атмосфере, загрязненной значительным количеством промышлен-
ных газов н пыли, непосредственное периодическое воздействие
на изделие дождя, снега или брызг морской воды.
1 г, ]°гОСТЬ Разрушения цинкового покрытия составляет примерно
’ мк в год для местности, характеризующейся наличием
газо™00^6^6 значительных количеств сернистого и углекислого
пеп^ ?СЛовиях высокой влажности воздуха, при резких сменах тем-
с троп^Ы И °®ильном выпадении росы, что имеет место в странах
сильноИЧеСКИМ климатом> скорость разрушения цинковых покрытий
3 в°зрастает и они оказываются малоэффективными.
покры Ч11тельное уменьшение скорости разрушения цинковых
п тин достигается специальной обработкой их в растворах солей
144
Часть третья. Технология нанесения металлических покрытий
хромовой кислоты, а также за счет фосфатных и оксидных пленок,
образующихся в результате применения химических и электрохи-
мических видов обработки цинкового покрытия.
2. СПОСОБЫ ЦИНКОВАНИЯ И ИХ СРАВНИТЕЛЬНАЯ
ХАРАКТЕРИСТИКА
Практическое применение находят следующие способы нанесения
цинковых покрытий:
1) погружение изделий в расплавленный цинк (горячий способ);
2) цементация, или метод термической диффузии;
3) металлизация распыленным металлом из пульверизатора;
4) контактный метод осаждения цинка;
5) электролитический метод.
Рассмотрим вкратце перечисленные методы цинкования.
Горячий способ
Горячий способ цинкования является самым старым и благодаря
своей простоте наиболее распространен в промышленности. Этот
метод покрытия применялся еще в 1740 г.; в настоящее же время
на горячее цинкование расходуется около
половины добываемого в мире цинка.
При данном способе покрываемые из-
делия погружают в ванну с расплавлен-
ным цинком, выдерживают в ней корот-
кий промежуток времени и вынимают затем
на воздух с осевшим на них слоем цинка.
Этот способ нанесения покрытия воз-
можен благодаря способности расплавлен-
ного металла смачивать и равномерно по-
крывать поверхность защищаемого изде-
лия, взаимному расплавлению основного
металла и покрытия и сравнительно низ-
кой температуре плавления цинка. 1
Структура покрытия, полученного го-
рячим способом, характеризуется наличием
ряда слоев (фиг. 65), различающихся
между собой по составу и физическим
свойствам. Внутренний слой наиболее
богат железом, внешний слой почти не содержит его. Промежуточные
слои тем менее обогащены железом, чем ближе они расположены
к внешнему слою. Толщина отдельных слоев и покрытия в целом
зависит от режима работы ванны (температуры жидкого металла,
времени выдержки и т. д.).
На качество цинкового покрытия влияет природа примесей
и их содержание в ванне. Вредными являются примеси железа
Фиг. 65. Схема строения цин-
кового покрытия, получен-
него горячим способом:
1 — основной металл; 2 — же-
лезо-цинковый сплав, богатый
железом; 3 — железо-цинко-
вый сплав, бедный железом;
4 — цинк.
Глава VI11. Цинкование
145
и окиси цинка. Содержание железа не должно превышать 0,05%.
Наличие в ванне алюминия (0,2%) и олова (1—3%), напротив,
способствует образованию равномерных и блестящих цинковых
покрытий.
В технологии горячего цинкования важное место занимает опе-
рация флюсования, которой подвергают изделия непосред-
ственно перед погружением в ванну. Основное назначение этого
процесса заключается в удалении с поверхности изделий влаги,
остатков окислов и не растворяющихся в кислотах примесей и шла-
ковых включений. Кроме того, флюс предупреждает окисление
поверхности в момент погружения изделий в расплавленный цинк.
флюсование перед цинкованием может быть проведено двумя
способами: нанесением флюса в виде покровного слоя на поверх-
ность расплава в ванне и смачиванием жидким флюсом поверхности
изделий перед загрузкой их в ванну цинкования.
В первом случае в качестве флюса применяют хлористый аммо-
ний, а во втором — 40—50-процентный водный раствор хлористого
цинка.
Изделия после обработки в жидком флюсе до погружения в ванну
цинкования нагревают в сушильной печи в течение 1—1,5 мин. при
120—200° для удаления с поверхности избытка воды и-повышения
концентрации раствора.
Горячее цинкование применяется для покрытия листов, прово-
локи, труб, сшивной посуды, имеющей внутренние закатанные швы,
металлического скобяного товара.
Вследствие неравномерности слоя цинка, возникновения утолще-
ний и наплывов на отдельных участках поверхности горячий способ
цинкования неприменим для покрытия изделий с узкими отвер-
стиями (сетка) и резьбой.
Горячее цинкование листов производится по следующей техноло-
гической схеме:
1)
чение
2)
3)
лоты
4)
5)
травление в 5—10-процентном растворе серной кислоты в те-
30—35 мин.;
промывание в проточной воде в течение 25—30 мин.;
декапирование в 0,5—3,0-процентном растворе соляной кис-
или в подкисленном растворе хлористого цинка;
флюсование;
, Цинкование при температуре 435—460° С. ;
Скорость движения листов в ванне составляет от 3 до 20 м/мин
зависимости от толщины листа.
оп ихла>кДаются оцинкованные листы сжатым воздухом. Правка
инкованных листов осуществляется на специальном стане.
ЦИа анна горячего цинкования листов изготовляется из спе-
кир'пЬНОГ° железа или углеродистой стали. Вверху ванна разделена
ности’ЧНЬ1МИ стенками на ТРИ части: в среднем отделении на поверх-
10 расплавленного свинца находится флюс, а в двух других —
Вайнер и Дасоян
146 Часть третья. Технология нанесения металлических покрытий
слой цинка толщиной всего в несколько сантиметров. Листы вво-
дятся через флюс в расплавленный свинец, затем в течение очень
короткого промежутка времени их проводят через слой цинка.
Назначение свинца в ванне заключается в быстром нагреве листов
без доступа воздуха. Кроме того, слой свинца предотвращает непо-
средственное соприкосновение жидкого цинка с корпусом ванны.
При цинковании проволоки мотки ее надевают на специальные
катушки, и проволока, сматываясь с них, подается к травильной
ванне, содержащей раствор соляной кислоты. Далее проволока
проходит через ванну с 25-процентным раствором хлористого цинка
и поступает в ванну для цинкования. Из цинковой ванны проволока
проходит через чан с водой, в котором она охлаждается, после чего
наматывается на катушки. Проволока диаметром 1,8 мм покрывается
цинком со скоростью 3—6 м/мин\ более толстая проволока подается
с меньшей скоростью, тонкая же — со скоростью 15—35 м/мин.
Метод термической диффузии (цементация)
Сущность диффузионного метода покрытия заключается в том,
что изделия, уложенные в соответствующие упаковочные приспособ-
ления и пересыпанные порошкообразной смесью определенного
состава, нагреваются до температур, при которых покрывающий
металл сначала осаждается на поверхности изделий, а затем диффун-
дирует в глубину. Этот способ применяется для покрытия как метал-
лами, имеющими сравнительно низкую температуру плавления
(например, цинком и алюминием), так и металлами, характеризую-
щимися высокой температурой плавления (например, хромом).
Диффузионный метод цинкования применяется для защиты
металлов от коррозии, а покрытие алюминием, хромом и кремнием —
для придания изделиям свойств жаростойкости. Он удобен для
обработки мелких изделий, таких, как болты, гайки, гвозди, мелкие
отливки и др. Покрытие цинком методом цементации в зависимости
от рода изделий производят либо во вращающихся герметически
закрытых железных барабанах (для мелких изделий), либо в спе-
циальных газонепроницаемых муфельных печах (для цементации
труб и других изделий).
Изделия, подлежащие диффузионному цинкованию, предвари-
тельно очищают пескоструйной обработкой либо травлением. Цинк
применяется в виде пыли, получающейся в качестве побочного
продукта при дистилляции цинка.
Цинковая пыль содержит 85—90% металлического цинка.
На каждые 100 кГ изделий берется 5—10 кГ цинковой пыли. Скорость
вращения барабана в процессе нагрева составляет в среднем
15 об/мин. Продолжительность нагрева обычно составляет один час.
Температура в барабане поддерживается в пределах 300—400° С-
По окончании цинкования барабан охлаждается в течение 10—
15 час., после чего изделия выгружают. Кривые изменения веса
Глава VIII. Цинкование
147
покрытия в зависимости от температуры цементации и продолжи-
тельности процесса представлены на фиг. 66.
Температура наврееа, Сс Продолжительность выдержкиt час
Фиг. 66. Зависимость толщины цинкового покрытия от темпера-
туры (а) и продолжительности выдержки (б).
Диффузионный слой цинкового покрытия отличается заметной
пористостью и неравномерностью по толщине.
Метод металлизации
Металлизацией принято называть процесс получения покрытий
распылением расплавленного металла. Этот метод применяется до-
вольно широко для нанесения покрытий из цинка, кадмия, свинца,
Фиг. 67. Схема строения цин-
кового покрытия, получен-
ного распылением.
алюминия, олова, никеля, меди и стали.
Металлизация основана на прилипании
распыленных частиц металла. Выбрасыва-
емые из распылителя с большой скоростью,
они при встрече с поверхностью изделия
расплющиваются, наслаиваются на сосед-
ние частицы и в целом образуют довольно
пористое чешуйчатое покрытие (фиг. 67).
Основным инструментом, применяемым
Для металлизации, является металлораз-
брызгиватель (пульверизатор), обычно
называемый пистолетом (фиг. 68).
Для распыления употребляется металл
в виде проволоки диаметром I—1,5 мм,
которая продвигается сквозь насадку писто-
лета, состоящую из двух концентрически расположенных трубок. На-
гревается проволока либо горящей смесью ацетилена и кислорода
1 газовом металлизаторе), либо электрической дугой (в электри-
еких металлизаторах конструкции Линника и Катца).
дит ИНК°Вание стали с помощью газового металлизатора произво-
20f)C”, !1° СЛеДУющему режиму: расстояние от сопла до экрана 150-
скорость подачи проволоки 2,5 м/мин, давление воздуха
200 лиц,
10‘
148 Часть третья. Технология нанесения металлических покрытий
3,5 ат, кислорода — 1,3 ат, ацетилена — 1,2 ат. Скорость пере-
мещения сопла вдоль покрываемой поверхности должна быть около
6 м/мин. Толщина цинкового покрытия за один проход аглларата
составляет 0,025 мм. Расход воздуха 30 лгУч; расход кислорода
0,75 м3/ч, расход ацетилена 0,70 м3/ч.
Распыление цинка с помощью электролизатора производится
при давлении воздуха 5—6 am; напряжение электрического тока для
Фиг. 68. Металлизаторы: а — газовый типа ГИМ-2; б — электрический
типа ЭМ-ЗА.
дуги 20—-35 в; расход воздуха составляет 90—120 м?1ч\ потребление
энергии 3—6 кет.
Достоинством метода металлизации распылением является воз-
можность покрывать цинком и другими металлами крупные конструк-
ции различной формы в собранном виде, подвергать покрытию метал-
лами любые материалы: металл, бумагу, дерево, гипс, пластмассу
и т. д., большая скорость процесса нанесения покрытия; хорошая
адгезия лаков и красок к покрытиям, полученным методом рас-
пыления.
Недостатком метода металлизации распылением является повы-
шенная пористость покрытий даже при значительной их толщине,
а также большие (до 50%) потери металла.
Контактный способ осаждения цинка
Цинкование без внешнего источника тока осуществляется за счет
работы гальванической пары, образующейся при погружении сталь-
ных изделий в контакте с алюминием в раствор цинковой соли.
Цинк при этом вытесняется алюминием.
Покрытия, получаемые данным способом, отличаются незначи-
тельной толщиной и низкими защитными свойствами. Поэтому"
контактный метод цинкования применяется лишь для обработки
Глава VIII. Цинкование
149
неответственных изделий: гвоздей, шурупов и других подобных
металлических предметов.
Для контактного цинкования рекомендуется раствор следующего
состава:
Сернокислый цинк . . .10 вес. частей
Цианистый калий . 3 » »
Едкий натр . 15 » »
Вода .............................. . 100 » »
Температура раствора — 80—90°.
Контактом служит алюминий.
Электролитическое цинкование
Электролитический метод цинкования является наиболее рацио-
нальным, благодаря чему он нашел широкое распространение
.на практике.
Хотя цинк в ряду напряжений стоит намного левее водорода
(значение стандартного потенциала цинка составляет — 0,76 в), однако
осаждение его не встречает затруднений, что объясняется высоким
значением перенапряжения выделения водорода на цинке. Бла-
годаря этому в обычных условиях электролиза водород на катоде
выделяется в незначительном количестве, и ток в основном расхо-
дуется на осаждение цинка.
Основными преимуществами электролитического метода цин-
кования перед рассмотренными выше методами являются:
1) высокая степень чистоты электролитически осажденного цинка,
зависящая главным образом от чистоты анодов и химикатов, при-
меняемых для составления ванн;
2) высокая химическая стойкость цинковых покрытий, получен-
ных электролизом, обусловленная чистотой осадка;
3) малый расход цинка, обусловленный возможностью точного
регулирования количества отлагаемого цинка и толщины покрытия;
4) хорошие механические свойства покрытия (эластичность покры-
тия и хорошая сцепляемость его с основой).
3. СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА ЦИНКОВЫХ
ЭЛЕКТРОЛИТОВ
Для цинкования применяют три типа электролитов: кислые,
Щелочные цианистые и щелочные нецианистые (цинкатные).
ио Во всех этих электролитах цинк находится в виде двухвалентных
Из кислых электролитов цинк выделяется в резуль-
ате разряда на катоде двухвалентных катионов цинка:
Zn SO4 = Zn + + + SO4_ ~;
Zn++ + 2е = Zn.
150 Часть третья. Технология нанесения металлических покрытий
Как уже отмечалось, на разряд ионов цинка расходуется почти
весь ток, так как выделение водорода ничтожно мало.
Убыль ионов цинка из растворов компенсируется растворе-
нием анодов. Последнее протекает без выделения кислорода.
Протекание указанных электродных процессов на практике
несколько нарушается из-за присутствия в электролите примесей,
выделение которых наряду с выделением водорода несколько сни-
жает катодный выход по току.
Кроме того, наряду с чисто электрохимическим растворением
анодов происходит частичное химическое растворение цинка благо-
даря присутствию в растворе не-
которого количества свободной
кислоты.
Оба эти процесса — разряд по-
сторонних катионов и химическое
растворение анодов — изменяют
коэффициенты использования тока
на электродах и требуют периоди-
ческой корректировки электро-
лита.
Как видно из кривых фиг. 69,
в кислых электролитах катодная
поляризация весьма незначитель-
на. Осадки, полученные из кислых
электролитов, по этой причине
имеют относительно крупнокри-
сталлическую структуру. Однако
Фиг. 69. Зависимость катодного потен-
циала от плотности тока при осажде-
нии цинка из электролитов:
1 — кислого; 2 — щелочного; 3 — циани-
стого.
при введении в кислые электролиты специальных добавок колло-
идных веществ удается получить осадки, сопоставимые по струк-
туре с осадками из цианистых и цинкатных ванн.
Рассеивающая способность кислых электролитов весьма низ-
кая.
В последнее время разработаны новые кислые электролиты
для цинкования — борфтористоводородные, отличающиеся сравни-
тельно лучшей рассеивающей способностью.
Сульфатные же ванны, несмотря на целый ряд преимуществ
(устойчивость в работе, высокий выход металла по току, отсутствие
в составе электролита ядовитых веществ), применяются главным
образом для цинкования изделий простой конфигурации (листов,
ленты, проволоки и т. п.).
Плотность тока в кислых перемешиваемых ваннах составляет
от 2 до 10 а/дм2 и выше.
В некоторых специальных случаях, например, при цинкований
ленты или проволоки в концентрированных растворах сернокислого
цинка при условии интенсивного перемешивания электролита,
применяются плотности тока порядка 50—400 а! дм2.
Глава VIII. Цинкование
151
Основным компонентом цианистых цинковых элек-
тролитов является комплексная соль Na2[Zn(CN)4]. Диссо-
циация этой соли происходит по уравнению
Na2[Zn (CN)J 7Г 2Na+ + Zn (CN)4"-.
Таким образом, цинк в растворе находится в составе аниона.
Разряд на катоде требует значительной энергии активации;
этим объясняется высокая поляризация, сопровождающая осажде-
ние цинка из цианистых электролитов и мелкокристаллическая
структура покрытий.
Осаждение цинка из растворов цианистого комплекса, содер-
жащих избыток свободного цианида, идет при потенциале —1,7—1,9е.
Это приблизительно на 1 в отрицательнее равновесного водородного
потенциала в этих растворах. Поэтому, несмотря на высокое водород-
ное перенапряжение на цинке, осаждение цинка из указанного
раствора должно сопровождаться интенсивным выделением водо-
рода. Действительно, выход металла по току составляет здесь
менее 10%.
Потенциал осаждения цинка может быть снижен до—1,4—1,5 в
введением в раствор свободной щелочи. Одновременно снижается
концентрация ионов водорода. Условия процесса изменяются
в пользу выделения металла, и при достаточном количестве щелочи
осаждение цинка идет с выходом по току 95—99%.
Цианистое цинкование может вестись при относительно высоких
(по сравнению с другими цианистыми ваннами) плотностях тока —
до 5—6 а/дм2. Осадки цинка получаются плотными, весьма тонко-
кристаллическими, а электролит обладает хорошей рассеивающей
способностью. Иногда в цианистые ванны вводят добавки солей алю-
миния, ртути, сахар или некоторые коллоидные вещества. Они
улучшают внешний вид покрытия (осадки становятся более светлыми).
Характерной особенностью анодного процесса при цинковании
в цианистых электролитах является склонность цинковых анодов
к пассивированию и, следовательно, к уменьшению концентрации
цинковой соли в ванне, что проявляется особенно заметно при недо-
статке в электролите свсбодного цианида. Этим отчасти объясняется
непостоянство состава цианистого электролита.
Другой причиной является то, что цинковые аноды подвержены
химическому растворению в цианистом калии и в щелочи. Это при-
водит к накапливанию цинка в электролите. Третья причина неста-
ильности электролита цианистых ванн — взаимодействие с угле-
кислотой воздуха (по этой причине не применяют перемешивания).
Основной недостаток цианистых электролитов заключается в их
ксичности, что обусловлено возможностью выделения синильной
элСЛ0ТЫ’ ЯВЛЯ1°Щейся сильнейшим ядом. Поэтому цианистые
*тР°Лять1 следует применять только в тех случаях, когда
РУгие, не содержащие цианистых солей электролиты не могут
152
Часть третья. Технология нанесения металлических покрытий
обеспечить получение покрытий необходимого качества, например,
при покрытии деталей сложного профиля.
Цинкатные электролиты очень просты по составу.
В основном они содержат цинк в виде цинката и едкую щелочь.
Как показывают кривые, приведенные на фиг. 70, катодная
поляризация в цинкатных электролитах заметно меньше катодной
Фиг. 70. Катодная по-
ляризация в кислых
цинковых электроли-
тах (pH = 3,8—4,4;
t = 20 ± 0,5°):
/ — 1.5-н Zn SO<; 2 — то
же + 30 Пл A1z(SO4)3-
•18HSO.
поляризации в ваннах с цианистыми электро-
литами. Различие связано с тем, что прочность
комплексных ионов ZnO2_ " во много раз мень-
ше прочности комплексных ионов Zn (CN)4~~.
Выход металла по току в цинкатных ван-
нах близок к 100% и мало меняется с изме-
нением условий электролиза. Осадки, получен-
ные из цинкатных электролитов, имеют круп-
нокристаллическую структуру и отличаются
неравномерной толщиной слоя. Обе эти осо-
бенности цинкатных ванн связаны с малой
катодной поляризацией.
Большую роль в распространении на прак-
тике цинкатных электролитов сыграли работы
Н. Т. Кудрявцева и его сотрудников, которые
помогли устранить главный недостаток, свой-
ственный данным электролитам: склонность
давать губчатые осадки, легко осыпающиеся
с катода даже при специально подобранных
благоприятных условиях электролиза (повышен-
ная температура электролита, малая толщина
покрытия и т. д.). Улучшение качества осадков,
полученных из цинкатных ванн, было достигнуто благодаря добавке
в электролит небольших количеств солей олова, свинца и ртути.
Рассеивающая способность цинкатных ванн в присутствии солей
указанных металлов и при низкой плотности тока достаточно высока.
Цинкатные электролиты могут быть рекомендованы к применению
взамен цианистых для покрытия рельефных изделий. По производи-
тельности, однако, они уступают цианистым ваннам, работающим при
более высоких плотностях тока.
4. ЦИНКОВАНИЕ В КИСЛЫХ ЭЛЕКТРОЛИТАХ
Основные компоненты и их назначение
В состав кислых электролитов для цинкования обычно входят-’
соль цинка; соединения, сообщающие электролиту буферные свой-
ства; соли, вводимые в ванну для повышения электропроводности
электролитов, и, наконец, поверхностнсактивные добавки, вводимы4 * 6
для улучшения качества цинковых осадков.
Глава VIII. Цинкование
153
Обычно ванны готовится на основе сульфата, отличающегося
очень высокой растворимостью в воде (примерно 700 Пл) при обыч-
ной температуре. При выборе концентрации сернокислого цинка
в ванне руководствуются следующими соображениями. Осадки
цинка из сильно разбавленных растворов отличаются пористостью
и склонны к образованию дендритов. Кроме того, повышенная кон-
центрационная поляризация (особенно при отсутствии перемеши-
вания) приводит к тому, что наряду с цинком начинает выделяться
водород. Применение сильно концентрированных электролитов для
обычных целей тоже нежелательно: такие электролиты менее эко-
номичны и обладают склонностью давать дендритообразные осадки.
Концентрированные электролиты, содержащие около 700 Пл серно-
кислого цинка, все же находят применение в ваннах, предназначен-
ных для непрерывного цинкования ленты и проволоки и работающих
при очень высоких плотностях то.ка. Оптимальная концентрация
сернокислого цинка в обычных кислых электролитах составляет
150—300 Пл.
За последние годы некоторое применение нашел борфтористо-
водородны» электролит для цинкования. Как и для сернокислой
ванны, высокая растворимость бортфтористоводородного цинка обе-
спечивает применение высоких плотностей тока, по из-за малой вели-
чины катодной поляризации ванна имеет низкую рассеивающую
способность по сравнению с цианистыми электролитами. Однако
качество получаемых из этих электролитов осадков очень высокое.
Хлористый цинк, несмотря на то, что электропроводность его
почти в два раза выше, чем электропроводность растворов серно-
кислого цинка, в настоящее время не применяется в кислых цинковых
электролитах. Это объясняется тем, что он содержит большее коли-
чество примесей, вызывает сильное разрушение анодов и, наконец,
оставаясь в порах покрытия при недостаточной промывке готовых
изделий, снижает коррозионную стойкость цинковых покры-
тий.
Для нормальной работы кислых цинковых ванн необходимо под-
держивание кислотности раствора в довольно узком интервале
(PH = 3,5 —4,5). При pH < 3,5 резко снижается выход металла
по току вследствие усиленного выделения водорода. Осадки при этом
получаются неравномерные и низкого качества. Имеет место также
излишний расход цинковых анодов вследствие их химического рас-
творения. Электролиты с pH >4,5 тоже непригодны, так как такие
лектролиты склонны к защелачиванию. Образующиеся при этом
Дроокиси и основные соли у катода загрязняют цинковые осадки
увеличивают их пористость.
ЭЛеля поддержания постоянства кислотности кислых цинковых
сеонТР°ЛИТЯв используются буферные добавки. Обычно применяют
30 °хислый алюминий (15—30 Пл). уксуснокислый натрий (15—
Л> или борную кислоту (10—20 Г/л).
154
Часть третья. Технология нанесения металлических покрытий
Для повышения электропроводности в кислые цинковые ванны
лучше всего добавлять сернокислый натрий. Изменение электропро-
водности ’растворов приведено в табл. 41.
Таблица 41
Электропроводность растворов для цинкования в сернокислом электролите
Исходный состав электролита Добавки Электропроводность
формула концентра- ция в / /л в ол-1-Ю2 В %
1,5-н ZnSO4 — — 4,04 100
1,5-н ZnSO4 А1а (SOJg- 18НаО 30 4,20 . 104
1,5-н ZnSO4 NaaSO4 50 5,84 144
4-30 Г/л A12(SO4)3. . 18НаО 90 6,39 158
Введение в состав ванны сернокислого алюминия заметно увели-
чивает также катодную поляризацию (фиг. 70), способствуя тем самым
улучшению качества осадков.
Поверхностноактивные добавки. В качестве поверхностноактив-
ных добавок в кислых цинковых ваннах применяют дисульфонафта-
линовую кислоту, декстрин, столярный клей, глюкозу и др. Эти
добавки повышают катодную поляризацию, увеличивают рассеи-
вающую способность электролита, улучшают структуру осадков
и расширяют рабочий интервал плотности тока.
В присутствии некоторых поверхностноактивных добавок (напри-
мер, дисульфонафталиновой кислоты) осадки цинка получаются
блестящие непосредственно из электролита. Механизм воздействия
поверхностноактивных веществ на гальванические осадки был под-
робно рассмотрен в гл. IV.
Вредные примеси. Кислые цинковые электролиты весьма чувстви-
тельны к разного рода загрязнениям (примеси электроположитель-
ных металлов, азотнокислых солей, перекиси водорода и др.). В при-
сутствии даже небольших количеств меди, свинца, серебра, мышьяка,
висмута, сурьмы, олова и других металлов на катоде образуются губ-
чатые осадки темно-серого или черного цвета, особенно при повышен-
ных значениях pH. Удаление этих примесей из раствора достигается
проработкой электролита постоянным током при одновременном
подкислении его серной кислотой. Примеси перекиси водорода
оказывают вредное влияние на осадки цинка лишь при пониженной
кислотности электролита. Весьма эффективным способом удаления
органических примесей из цинкового электролита является филь-
трация загрязненного электролита через древесный или активи-
рованный уголь. Органические вещества при этом адсорбируются
Глава VHI. Цинкование
155
углем. Примеси азотнокислых солей приводят к образованию губ-
чатых осадков. Загрязненные азотнокислыми солями электролиты
обычно заменяют новыми, так как удаление этих примесей в произ-
водственных условиях затруднительно. 'Вредно действующими яв-
ляются также такие органические соединения, как скипидар,
ацетон и др. Для удаления этих веществ прорабатывают электролит
постоянным током при плотности тока 5—10 а/дм2, с применением
свинцовых анодов.
К числу вредных примесей в кислом цинковом электролите отно-
сится также железо, загрязняющее раствор коллоидальной гидро-
окисью, что приводит к образованию пятнистых неравномерных
осадков.
Удаление железа при содержании его в количестве 0,5—0,8 Г/л
производится следующим образом: добавляют в кипящий раствор
электролита 30-процентную перекись водорода из расчета 0,5 мл/л
для перевода двухвалентных ионов железа в трехвалентные; затем
электролит подщелачивают слабым раствором щелочи или соды,
энергично перемешивая; при этом выпадает коричневый осадок гидро-
окиси железа, который затем удаляется фильтрованием или декан-
тированием. Этот метод может быть применен также для удаления
примеси свинца.
Состав электролитов и режим работы ванн
Рекомендуемые составы кислых электролитов цинкования при.
ведены в табл. 42.
Электролит № 1 рекомендуется для покрытия изделий неслож-
ной формы на подвесках, в барабанах и колоколах. Осадки цз этого
электролита получаются светлыми, имеют мелкокристаллическую
структуру и равномерную толщину. Вместо сернокислого алюминия
можно применять алюмокалиевые квасцы в количестве 50 Пл.
Электролит хорошо работает и без декстрина.
Электролит № 2, предложенный Н. А. Изгарышевым и П. С. Тито-
вым, позволяет получать осадки отличного качества. Недостатком
этого электролита, ограничивающим его применение, является дефи-
цитность входящего в его состав гуммиарабика.
Электролит № 3 рекомендуется для цинкования листового мате-
риала при повышенной плотности тока.
Электролит № 4 рекомендуется для цинкования проволоки
и ленты и обеспечивает получение гладких светлых мелкозернистых
осадков цинка.
Основными условиями нормального ведения процесса являются
• еремешивание электролита сжатым воздухом, высокая концентра-
, я_электролита и повышенная температура.
Нен Х°ДЯщая в состав электролита борная кислота может быть заме-
а сернокислым алюминием (30 Г/л) или алюмокалиевыми квасцами
Таблица 42
Состав цинковых кислых электролитов и режим работы вами
Наименование химикатов и режим работы Содержание в Г/л в растворах
№ 1 № 2 № 3 № 4 № 5
Сернокислый цинк ZnSO4-7H2O 215 250 430—500 575—718 215—430
Сернокислый алюминий AI2(SO4)3-18НаО 30 — 30 30 30
Сернокислый натрий Na2SO4-10H2O 50—100 — — — 50—100
Борная кислота Н3ВО3 — 10 — — —
Декстрин 10 — — — —
Гуммиарабик — 40 — — —
Натриевая соль 2,6- или 2,7-нафталии-дисульфо- [кислоты Ci0He(SO3Na)2 — — — — 2—3
[ Кислотность pH 3,8—4,4 3,5—4,5 3,8—4,4 3,5—4,5 3,8—4,4
1 Температура в °C 18—22 18—25 18—25 40—50 18—25
Плотность тока в а/д.и2:
без перемешивания 1—2 2 1—3 — 3—8
с перемешиванием 3—5 — 8—10 50—400 —-
Выход по току \ 95—98 95—98 95—98 95—98 95—98
Часть третья. Технология нанесения металлических покрытий
Глава VIII. Цинкование
157
Таблица 43
Продолжительность осаждения цинка из кислых ванн (в мин.)
при выходе по току 100%
Толщина слоя в л:к Плотность тока в а/дм*
0,5 0,75 1.0 1.5 2,0 3.0 4.0 5,о
1 7 4,6 3,5 2,3 1,7 1,16 0,9 0,7
3 21 14 10,5 7,0 5,2 3,5 2,6 2,1
5 35 23 18 12 8,7 5,8 4,3 3,5
7 46 - 33 25 16 12 8 6,1 4,9
9 63 42 31 21 16 11 7,9 6,3
10 70 47 35 23 17 12 8,7 7,0
30 210 140 105 70 52 35 26 21
50 350 232 175 116 87 58 43 35
80 560 372 280 186 140 93 70 56
100 700 465 350 232 174 116 87 70
Таблица 44
Неполадки при работе кислых цинковых электролитов
Признаки неполадок Причины возникновения Способы устранения
Осадок вается отелаи- а) Плохая подготовка поверхности изделий б) Наводороживание из- делий в процессе их элек- трохимической подготовки а) Улучшить качество подготовки изделий б) Электролитическое обезжиривание производить на аноде и и а катоде по- переменно
Осадок и губчатый темный Наличие в электролите пр имесей мед и ил и мышьяка Проработать электролит под током
Осадок темного цвета; образование хлопьевидной взвеси в электролите и его помутнение а) Повышенная катод- ная плотность тока б) Малая кислотность в) Недостаток в электро- лите сернокислого алю- миния или борной кислоты а) Уменьшить плотность тока б) Откорректировать pH в) Добавить сернокислый алюминий или борную кис- лоту
Осадок очень хрупкий „ Образование ден- ДРитов i Повышенная кислот- ность электролита Слишком высокая плот- ность тока на катоде при низком содержании цинка в электролите Понизить кислотность электролита и проработать его под током; добавить перекись водорода Понизить плотность тока; повысить концентрацию сернокислого цинка в элек- тролите
158
Часть третья. Технология нанесения металлических покрытий
(50 Г/л). Электролит непрерывно фильтруется. Скорость пере-
текания электролита должна обеспечивать 5—6-кратный обмен его
в течение часа. Движение проволоки в ванне происходит со ско-
ростью от 10 до 100 м/мин в
Плотность тока.,а./8м!
Фиг. 71. Изменение выхода по току
в зависимости от плотности тока
и температуры в борфтористоводо-
родном электролите.
зависимости от диаметра проволоки
и условий электролиза.
Поверхность анодов должна быть
в 5—10 раз больше поверхности ка-
тода.
Электролит № 5, разработанный
Н. Т. Кудрявцевым и А. А. Ники-
форовой, рекомендуется для получе-
ния блестящих цинковых покрытий
непосредственно из ванн.
Для перемешивания рекомендует-
ся применять сжатый воздух; филь-
трование желательно непрерывное;
аноды следует заключать в по-
лотняные чехлы.
Как уже отмечалось, за последние годы некоторое распростра-
нение получили борфтористоводородные ванны для цинкования.
Состав электролита и режим работы ванны приводятся ниже.
Фторборат цинка Zn(BF4)2 ................... 280—300 Г/л
фторборат аммония NH4BF4.................... 28—30 »
Хлористый аммоний NH4C1...................... 28—30 »
Солодковый корень ........................ . 0,5—1. »
Борфтористоводородная кислота HBF4 до pH . . 1—2
Режим работы: температура электролита 35—40°, плот-
ность тока 50—10 а/дм2.
Выход металла по току в борфтористоводородном электролите
зависит от плотности тока и от температуры электролита. Эта зави-
симость графически показана на фиг. 71.
Электролит отличается удовлетворительной рассеивающей спо-
собностью и позволяет получать светлые мелкозернистые покрытия.
Продолжительность осаждения цинка из кислых электролитов
приведена в табл. 43, а характеристика неполадок, встречающихся
при работе этих электролитов, — в табл. 44.
Приготовление электролитов
Соли, входящие в состав кислых цинковых электролитов и отве-
чающие соответствующим техническим условиям, растворяются каж-
дая отдельно в небольшом количестве теплой (50—60“) воды-
После отстаивания взвешенных примесей растворы переводят чере3
фильтр в рабочую ванну, доливают водой до требуемого объем9-
корректируют кислотность и прорабатывают постоянным током
Глава VJJJ. Цинкование
159
со случайными железными катодами. Во время проработки реко-
мендуется перемешивать раствор сжатым воздухом. Добавление
в ванну декстрина или дисульфонафталиновой кислоты производится
так’ декстрин растворяют сначала в небольшом количестве холодной
воды, затем нагревают до €0—70° и добавляют через фильтр в элек-
тролит. Дисульфонафталиновую кислоту (готовый препарат или
приготовленный на месте) растворяют в небольшом объеме воды,
нейтрализуют слабым раствором щелочи и добавляют через фильтр
в электролит.
Для приготовления борфтористоводородного электролита борфто-
пистоводородную кислоту HBF4, необходимую для получения
Zn(BF4)2 и NH4BF4 готовят смешением борной и плавиковой кислот.
Количества реагентов рассчитывается по уравнению
Н3ВО3 + 4HF = HBF4 + ЗН2О.
К плавиковой кислоте при непрерывном перемешивании доба-
вляют небольшими порциями сухую борную кислоту. Для получения
указанных солей цинка и аммиака в приготовленную борфтористо-
водородную кислоту добавляют при перемешивании окись цинка
и водный раствор аммиака в количествах, соответствующих их
содержанию в готовом электролите. Все растворы готовятся в ванне,
выложенной свинцом или винипластом. Солодковый корень перед
добавлением в ванну размалывают в фарфоровый ступке и вымачи-
вают в течение 1—2 суток в необходимом количестве воды. Затем
раствор фильтруют и вводят в ванну.
^б^ЦИНКОВАНИЕ В ЦИАНИСТЫХ ЭЛЕКТРОЛИТАХ
назначение
основными компонентами
Основные компоненты и их
В цианистых электролитах цинкования
являются: цианистая комплексная соль цинка Na2Zn (CN)4, цинкат
натрия Na2ZnO2, свободный цианид NaCN, свободная щелочь NaOH.
Концентрация цинка в цианистых электролитах выбирается
в пределах от 5 до Е0 Г/л. Свободная щелочь способствует заметному
метаИЧеНИЮ электРопРов°Дности электролита и повышению выхода
Присутствие свободного цианида наряду со щелочью способствует
пое^ЧеНИЮ Доброкачественного покрытия. Они взяты в количествах,
ныхВсШа^>Щ,ИХ ~°’ котоРое необходимо для образования комплекс-
анодо°ЛеИ цинка- Избыток цианида и щелочи устраняет пассивацию
в поот’ °®еспечивает устойчивость комплексных солей, которые
вЬ1зь1ваИВН°М СЛучае МОГУТ гидролизоваться. Избыток этих веществ
самым также усиление катодной поляризации, способствуя тем
Динка П°Лучению мелкокристаллических равномерных осадков
160 Часть третья. Технология нанесения металлических покрытий
В связи с тем, что концентрацию свободного цианида и свободной
щелочи в цианистом цинковом электролите раздельно установить
трудно, иногда пользуются их суммарной концентрацией R, прихо-
дящейся на 1 Г-экв цинка в электролите:
о __ нормальность (NaCN + NaOH)
нормальность Zn
Однако следует учитывать, что важное значение для качества
покрытия и для величины выхода по току имеет также относительное
содержание цианида и щелочи в электролите.
Кроме указанных выше соединений, в цианистых электролитах
всегда присутствуют карбонаты щелочных металлов, образующиеся
за счет карбонизации цианида и едкой щелочи углекислотой воздуха.
В небольших количествах (до 0,5 Г-экв/л, а в ваннах с повышенным
содержанием цинка — до 1 Г-экв/л) карбонаты не оказывают влияния
на работу ванны. В случае чрезмерного накопления карбонатов
их можно удалить вымораживанием (охлаждая электролит до —5°)
или осаждением в виде ВаСО3.
Добавки к цианистому электролиту. Для увеличения блеска цин-
ковых покрытий, полученных из цианистых электролитов, к послед-
ним добавляют небольшие количества соединений ртути, ^сернистый
натрий и глицерин. Первая из этих добавок, повышая перенапря-
жение выделения водорода, способствует увеличению выхода металла
по току. Эффективность добавки ртути сохраняется и в том случае,
когда ее вводят не в электролит, а в состав анодов. Так, например,
хорошие результаты получаются при содержании в аноде 0,3% ртути
и 0,5% алюминия. Такие аноды почти не дают шлама при электролизе.
Глицерин и сернистый натрий периодически добавляются в состав
некоторых цианистых электролитов в количествах до 5 Пл. Для ком-
пенсации убыли этих веществ через каждые 2—3 дня их добавляют
по 0,1—0.3 Пл.
Вредные примеси. Как и в кислых, в цианистых электролитах
вредными являются примеси электроположительных металлов: меди,
серебра, мышьяка, висмута, сурьмы, олова и др. Для удаления их
в электролит добавляют сернистый натрий. Примеси в цианистых
электролитах цинкования оказывают гораздо меньшее влияние
на качество осадков, чем в кислых. Это различие обусловлено тем,
что в цианистых электролитах эти примеси, образуя комплексную
соль в растворе, выделяются электролитически совместно с цинком
без губчатых образований, т. е. не ухудшая внешний вид получен-
ных осадков. Однако наличие этих металлов в составе цинковых
покрытий все же нежелательно, так как они заметно снижают кор-
розионную устойчивость покрытия.
Глава VIII. Цинкование
161
Состав электролитов и режим работы ванн
рекомендуемые составы цианистых цинковых электролитов при-
ведены в табл. 45.
Таблица 45
Составы цианистых электролитов цинкования и режимы работы
Наименование компонентов Содержание в Г/л в растворах
№ I № 2 № 3
Окись цинка ZnO 40—45 40—45 4—10
Цианистый натрий NaCN 80—90 80-§г,О 15—40
Едкий натр NaOH 80—95 40—60 8—24
Глицерин С3Н5 (ОН)3 3—8 — —
Сернистый натрий NaaS 0,5—5 — —
Режим работы
Температура в °C 18—35 18—25 25—40
Плотность тока (без перемешивания) в а/дя? 2—2,5 2—5 0,5—2
Выход по току в % 70—85 80—90 60
Электролит № 1 позволяет после осветления цинкового покрытия
получать блестящие покрытия, обладающие повышенными декора-
тивными качествами. Эти покрытия невосприимчивы к «захватам»
от рук при сборке оцинкованных деталей.
Электролит № 2 имеет широкое распространение и применяется
как для стационарных, так и для барабанных ванн.
Электролит № 3 характеризуется значительным избытком свобод-
ного цианида. Рекомендуется для покрытия деталей особо сложного
профиля.
Приготовление электролитов
^ля пРИгот°в-пения цианистых цинковых электролитов исполь-
уется окись цинка или гидрат окиси цинка. Последнее вещество
из Г °,ыть приготовлено непосредственно в гальваническом цехе
нению1^313 цинка путем осаждения раствором щелочи по урав-
ZnSO4 + 2NaOH = Zn(OH)2 + Na2SO4.
соды gleTOM кРисталлизаЦионной воды на каждые £0 Г каустической
РаствораеТСЯ Г сульфата цинка. Осадок Zn(OH)2 отделяют от
н Декантацией, отмывают от сульфата натрия.
П Вай-Р и Дасояи
162
Часть третья. Технология нанесения металлических покрытий
Таблица 46
Продолжительность осаждения ияниа (в мин.) из цианистой ванны
при выходе по току 70%
Тол- шина слоя R Д'* Плотность тока в о/Ом* Тол- щина слоя в мк Плотность тока в а /ом*
0.5 1.0 2.0 4.0 5.0 0.50 1.0 2,0 4.0 5.0-
1 9,5 5,0 2,4 1,2 1 30 285 143 72 36 30
3 28 15 7,2 3.6 3 50 475 240 120 60 50
5 47 25 12 6,0 5 70 665 350 168 84 70
7 66 35 17 8,4 7 90 855 450 216 108 90
9 85 43 22 11 9 100 950 480 240 120 10
10 95 48 24 12 10
Таблица 47
Неполадки в работе цианистых цинковых электролитов
Признаки неполадок Причины возникновения Способы устранения
Осадок хрупкий Электролит загрязнен органическими приме- сями Проработать электролит под током
Плохая рассеиваю- а) Высокая конпен- а) Снизить концентра-
щая способность элек- трания цинка цию цинка
тролита б) Малая концентра- ция цианида и щелочи в) Высокая темпера- тура электролита б) Добавить цианистый натрий и едкий натр в) Снизить температуру
Осадок темного цвета Наличие в электро- лите примесей свинца и железа Профильтровать электро- лит и проработать под то- ком. В электролит ввести Na2S
Обильное выделение а) Слишком высокая а) Снизить плотность
водорода на катоде; низкий выход по току плотность тока на ка- тоде б) Избыток цианида или недостаток цинка в электролите тока б) Ввести в электроднт окись или гидрат окиси > цинка
Образование на ано- Недостаток свобод- а) Добавить цианистый
дах пленки; низкий ного цианида в элек- натрий
анодный выход по току тролите б) Увеличить поверх- ность анодов
Содержание пннка Плохая раствори- а) Увеличить анодную поверхность, зачистить 214^' ды, добавить цианистый н трнй
в электролите быстро мость анодов вследствие
уменьшается образования на них пленки
Глава VIII. Цинкование
163
Продолжение табл. 47
Признаки неполадок Причины возникновения Способы устранения
Содержание цинка в электролите быстро увеличивается Низкий катодный вы- ход по току при высо- ком анодном выходе б) Уменьшить катодную плотность тока; прекратить добавку цианистых солей в ванну. Применять нераст- воримые аноды
В отдельных сосудах приготовляют концентрированные водные
растворы цианистого натрия и едкого натра1.
К окиси (или гидроокиси) цинка, доведенной водой до пасто-
образного состояния, тщательно помешивая, добавляют сначала
раствор цианистого натрия, а затем раствор едкого натра.
При образовании цианистого цинкового электролита из окиси
цинка имеют место следующие реакции:
2ZnO + 4NaCN = Na2Zn (CN)4+Na2ZnO2,
ZnO+2NaOH = Na2ZnO2+H2O.
Полученный раствор переливают в рабочую ванну, к нему добав-
ляют необходимое количество воды, и в течение нескольких часов
раствор прорабатывают током.
При приготовлении и эксплуатации указанного электролита
необходимо соблюдать правила техники безопасности. Продолжи-
тельность осаждения цинка из цианистой ванны приведена в табл. 46,
а неполадки, встречающиеся при работе с указанными ваннами, —
в табл. 47.
6. ЦИНКОВАНИЕ В ЩЕЛОЧНЫХ (ЦИНКАТНЫХ)
ЭЛЕКТРОЛИТАХ
Основные компоненты цинкатных электролитов и добавки к ним
Основными компонентами цинкатных электролитов являются
Цинкат натрия Na2ZnO2 (или K2ZnO2) и свободная щелочь. Однако
осадки цинка, полученные из таких электролитов, обычно имеют тем-
ыи оттенок и губчатую структуру, даже если плотности тока значи-
ьно ниже предельных. Губчатые осадки из этих электролитов отли-
ЮТСя от губки, образующейся при высоких плотностях тока, тем,
для Раб<^ДННеНИЯ натРня используются как более дешевые. Без всякого ущерба
ниямн вВанн онн могут быть заменены соответствующими калиевыми соедине-
оличествах, отвечающих стехиометрическому отношению.
164
Часть третья. Технология нанесения металлических покрытий
что они возникают сначала в отдельных точках в виде темных рых-
лых наростов, число и размеры которых постепенно увеличиваются
Механизм образования неудовлетворительных осадков из цинкат-
ных электролитов без специальных добавок был исследован Н. Т. Куд-
рявцевым, по мнению которого причиной возникновения губки в рас-
сматриваемых условиях являются коллоидные частицы цинка или
частицы не полностью окисленного цинка. Последние попадают
в раствор из-за неравномерного растворения цинка на аноде и в виде
металлических золей электрофоретически переносятся на катод.
Введение в состав цинкатных ванн небольших количеств солей ртути
(0,1—0,2 Пл Hg), олова (0,25—0,5 Пл Sn) и свинца (0,05 Пл РЬ),
а также использование цинковых анодов, содержащих примеси этих
металлов, при плотностях тока ниже предельных позволяют полу-
чить очень плотные светлые осадки, совершенно свободные от губ-
чатых образований. Предполагают, что в присутствии этих металлов
происходит полное окисление части цинка, переходящего в раствор
и выделение ртути, олова и свинца на катоде в эквивалентных коли-
чествах. В связи с тем что получение доброкачественных осадков
цинка из цинкатных электролитов возможно лишь при наличии
в электролите упомянутых добавок, последние также должны быть
отнесены к числу основных компонентов цинкатных электролитов.
На практике чаще всего применяется добавка станната натрия
Na2SnO3.
Состав и режим работы цинкатных электролитов
При сопоставлении свойств кислых, цианистых и цинкатных
электролитов цинкования было обращено внимание на то, что цинкат-
ные электролиты призваны
Фиг. 72. Влияние концентрации
цинка в цинкатном электролите
и температуры на допустимый
верхний предел плотности тока
при цинковании:
1 — 0.05-н.; 2—0,12-н.; 3 — 0.26-н.;
4 —0,45-н..
заменить в ряде случаев ядовитые циа-
нистые электролиты при обработке из-
делий сложного профиля. При этом
чем сложнее профиль изделия, тем мень-
ше должна быть концентрация цинка,
особенно в ваннах, работающих с пере-
мешиванием электролита.
Избыток свободной едкой щелочи
в свою очередь находится в зависимости
от концентрации цинка в электролите:
чем выше концентрация цинка, тем
больше должно быть содержание щело-
чи. Допустимая для цинкатных элек-
тролитов величина катодной плотности
тока находится в прямой зависимости
от концентрации цинка в растворе и от
температуры (фиг. 72).
В зависимости от сложности пр0'
филя обрабатываемых изделий рексмен
Глава VIII. Цинкование
165
пуется применять электролиты и режимы работы ванн, указанные
р табл. 48.
Таблица 48
Состав и режим работы цинкатных электролитов
Наименование компонентов Содержание в Г/л в растворах
№ 1 № 2 № 3 № 4
Цинк Zn 15—17 8—10 3,5—6,8 40—50
Едкое кали КОН 190—250 100—140 90—110 200—250
Олово Sn 0,2—0,5 0,2—0,5 0,2—0,5 0,15—0,25
Р е ж и м работы
Температура электролита в °C 50 50 50 60—70
Плотность тока в а1дм*:
без перемешивания 2,0—2,5 1,2 0,7 —
с перемешиванием 3-4 2,0—2,5 1,5—2,0 1,5—2,0
Выход по току в % 95—100 95—100 95—100 95—100
Электролиты № 1 и 2 употребляются для покрытия простых
изделий или изделий средней сложности; электролит № 3 рекомен-
дуется для покрытия наиболее сложных по рельефу изделий. Электро-
лит № 4 предназначен для осаждения толстых слоев цинка.
Неполадки в работе цинкатных электролитов приведены в табл. 49.
Таблица 49
Неполадки в работе цинкатных электролитов
Признаки неполадок Причины возникновения Способы устранения
Осадок темный и губ- чатый ках1ап2ТДельных Участ- ий Те2Верхнос™Дета- места _21“®тнепокрытые а) Низкое содержа- ние олова в электро- лите б) Слишком низкая концентрация цинка в) Повышенная плот- ность тока г) Пониженная тем- пература электролита Деталь экранируется другой деталью или подвеской а) Добавить олова б) Добавить окись или гидроокись цинка в) Снизить плотность тока г) Довести температуру электролита до 50—55° Правильно расположить детали на подвеске, избе- гая их соприкосновения
166
Часть третья. Технология нанесения металлических покрытий
Продолжение табл. 49
Признаки неполадок Причины возникновения Способы устранения
Осадок темного цвета Загрязнение электро- лита примесями, глав- ным образом, железом в виде гидроокиси Дать электролиту от- стояться, декантировать его и проработать током
Отсутствие покрытия по всей поверхности детали; выделения во- дорода также не наблю- дается а) Короткое замыка- ние б) Нарушение кон- тактов а) Устранить короткое замыкание б) Прочистить катодные штангн и крючки на под- весках
Осадок отсутствует в местах сварки или в углублениях детали, изготовленной из стали н обдутой песком Указанный материал и обработка способст- вуют снижению перена- пряжения водорода, вследствие чего выде- ление водорода облег- чается, а осаждение цинка затрудняется 1) Повысить плотность тока, не превышая допу- стимый предел 2) Добавить к электро- литу около 10 Пл едкого кали 3) Поверхность детали предварительно покрыть тончайшим слоем олова (из щелочного электролита)
Приготовление электролитов
Необходимое для ванны количество едкой щелочи растворяют
в воде (V10 объема ванны), нагревают раствор до £0—100° С и доба-
вляют окись цинка. Окись цинка может быть заменена свежеосажден-
ным гидратом окиси Zn(OH)2, методика приготовления которого
изложена на стр. 161.
Раствор разбавляют горячей водой до половинного объема ванны
и перемешивают; образующийся при этом раствор комплексной соли
цинка отстаивается, и его декантируют в рабочую ванну, куда доли-
вают теплую воду. Доливку производят осторожно, чтобы предотвра-
тить выпадение гидрата окиси цинка.
Олово вводится в ванну в виде станната натрия Na2SnO3, кото-
рый может быть приготовлен из соли двухвалентного олова
SnCl2-2H2O следующим образом. Соль двухвалентного олова в коли-
честве, соответствующем расчетному, растворяют в отдельной порции
нагретого электролита; Образовавшийся станнит натрия Na2SnOa
окисляется в станнат действием перекиси водорода Н2О2, прибавляе-
мой к раствору при интенсивном перемешивании из расчета 2 мл
30-процентной перекиси водорода на каждый грамм SnCl2-2H20‘
Полученный раствор вводят в ванну. Введение в цинкатный электро-
лит станната натрия можно осуществить также добавлением станнат-
ного электролита из ванны щелочного лужения.
Глаза VIII. Цинкование
167
Свежеприготовленный электролит анализируют на содержание
NaOH и ZnO и корректируют. Затем электролит прорабатывается
током до получения удовлетворительных осадков.
Наличие губчатых темно-серых покрытий свидетельствует о том,
что не все олово перешло в окисленную четырехвалентную форму. •
В этом случае необходимо добавлять в электролит перекись водорода
при энергичном перемешивании.
7. ЦИНКОВАНИЕ В ПИРОФОСФАТНЫХ И АММИАКАТНЫХ
ЭЛЕКТРОЛИТАХ
В последние годы нашли применение еще два типа электролитов
для цинкования: пирофосфатные и аммиакатные.
Основной компонент пирофосфорнокислого электролита — пиро-
фосфорнокислый натрий — является недефицитным и дешевым мате-
риалом. Этот электролит устойчив в работе, обеспечивает получение
мелкозернистых плотных цинковых покрытий. Рассеивающая спо-
собность пирофосфорнокислых электролитов превосходит рассеи-
вающую способность сернокислых электролитов. Поэтому он может
быть рекомендован взамен цианистых электролитов для покрытия
изделий сложной формы. Важным преимуществом этих электролитов
является еще и то, что их эксплуатация не требует установки вытяж-
ных устройств, поскольку электролит, как уже отмечалось, совер-
шенно безвреден.
Ниже приводится состав пирофосфорнокислого электролита:
Пирофосфат натрия Na4P2O7 . . ...... 150—200 Пл
Сернокислый цинк ZnSO4-7H2O ........ 40—50 »
Фтористый калнй KF . ........... 5—10 »
Величина pH раствора . ........ 8—9,5 »
Режим работы: температура электролита 50° С, плотность
тока 1,0 а/дм2.
Осаждение цинка из пирофосфатного электролита происходит
из комплексных солей, в которых цинк входит в состав комплексного
аниона. Для приготовления пирофосфорнокислого электролита сна-
чала получают пирофосфорнокислый цинк по реакции
2Zn SO4+Na4P2O7=Zn2P2O7+2Na2SO4.
нат^ЭТеМ П0ЛУченнУю соль растворяют в избытке пирофосфата
Zn2P2O7+Na4P2O7 = 2NaJZn (Р2О7)2]
Или
Zn2P2O7 +3Na4P2O7 = 2Nae [Zn (P2O7)21.
Кал^аЛее B электролит вводят необходимое количество фтористого
ия и п°сле проработки под током приступают к его эксплуатации.
168
Часть третья. Технология нанесения металлических покрытий
Аммиакатные электролиты отличаются хорошей электропроводно-
стью и достаточно высокой рассеивающей способностью. Это позво-
ляет применять их для покрытия довольно сложных поверхностей.
Полученные из аммиакатных электролитов осадки по своей рав-
номерности уступают лишь покрытиям, полученным из цианистых
электролитов. Это видно из фиг. 73, где представлены данные,
характеризующие равномерность распределения цинка на разборном
катоде при электроосаждении
Фиг. 73. Распределение цинка при
его осаждении из различных элек-
тролитов:
J — бопфтогиство лодочного: 11 — циа-
нистого: /// — аммиакатного; IV — пи-
рофосфорнокислого.
из различных электролитов. На оси
абсцисс отложены номера отдельных
секций цилиндрического разборного
катода, расположенного при электро-
лизе перпендикулярно к поверхности
анода (1 — наиболее удаленная часть
катода, а 5 — наиболее близкая); на
оси ординат отложена величина при-
веса цинка в Г на деталях катода.
Рекомендуемые составы аммиакат-
ных электролитов:
1) Окись цинка ZnO .... 12—15 Пл
Хлористый аммоний NH4C1 240—260 »
Борная кислота Н3ВО3 . . 20—25 »
Клей столярный......... 1—2 »
Режим работы: температура
электролита 18—25° С; плотность
тока 0.8—1,0 а/дмг. Выход по току
98—99%.
2) Сернокислый цинк ZnSO4-7H2O . ........... 80—140 Г/л
Хлористый аммоний NH4C1 ............... . 180—200 »
Уксуснокислый натрий NaC2H3O2-3H2O . . . 25—30 »
Желатина ................................ 0,4—-1,0 »
Величина pH электролита.................. 5,8—6,2 »
Режим работы: температура электролита 15—25° С, плот-
ность тока: без перемешивания 1,5—1,8 а/дм2, с перемешивани-
ем — до 2,5 а/дм2.
Аммиакатные электролиты применяют также для покрытия мел-
ких деталей во вращающихся барабанах. В этом случае скорость
нанесения покрытия может быть увеличена за счет применения более
высоких плотностей тока.
Для приготовления аммиакатного электролита к подогретому
до 40—Е0э С концентрированному раствору хлористого аммония
прибавляют при непрерывном помешивании цинковую соль. Борная
кислота растворяется отдельно в горячей воде. Желатину или клеи
вводят в состав электролита после того, как предварительно зама-
чивают их сначала в холодной воде для набухания, а затем раство-
Глава VIIL Цинкование
169
пяют в горячей воде. Приготовленные растворы комплексной соли
цинка и борной кислоты декантируют или переливают через сукон-
ный фильтр в рабочую ванну, куда затем добавляется раствор клея,
желатины и др-
8. ОБРАБОТКА цинковых ПОКРЫТИЙ
Оцинкованные в обычных ваннах детали подвергают осветлению,
которое проводится в 1—3-процентном водном растворе азотной
кислоты в течение 2—3 сек. Для пассивирования цинковые покрытия
обрабатываются в растворе следующего состава: хромовый ангидрид
ЮО—150 Пл и серная кислота 3—4 Пл либо растворы хроматов.
Поверхность изделий после пассивирования имеет желтый опалес-
цирующий оттенок. Образующаяся хроматная пленка улучшает анти-
коррозионные свойства цинковых покрытий. Такая обработка осо-
бенно рекомендуется для деталей, оцинкованных в цианистых элек-
тролитах.
Благодаря высокой пористости, которой отличаются пассивирую-
щие пленки, они существенно улучшают адгезионные свойства
оцинкованных поверхностей, облегчая тем самым нанесение на них
лакокрасочных покрытий защитного и специального назначения.
Употребительными являются также растворы для пассивирова-
ния цинковых покрытий приведенные в табл. 50.
Таблица 50
Составы растворов для пассивирования цинка
Наименование компонентов Содержание в Пл в растворах
№ 1 № 2 № 3 № 4 № 5 6 Л 7
Двухромовокислый натрий * Na2Cr2O7 200 50 — — 10—25 —
Хромовый ангидрид СгО3 — — 150 < 175 150 — 18—25
Кислота серная H2SO4 10 5 20 z 1-2 20 — —
Кислота азотная HNO3 — — 20/ 170 — 8—20 2—5
Натрий сернокислый Na2SO4 3 е ж и м р а б О т ь ’•'•ч 5—20 5—10
Температура в °C 15—20 15—20 15—20 15—20 15—20 15—20 15—30
Продолжительность обработ- ки в сек. 5—10 5—8 5—10 3—5 5—10 10 3—5
П01щаСТВ^Ы ' и 2 применяются преимущественно для цинковых
рьттий, полученных из цианистых электролитов; раствор № 3
170
Часть третья. Технология нанесения металлических покрытий
может быть эффективно использован для обработки покрытий, полу-
ченных из кислых электролитов. В растворе № 4 можно обрабаты-
вать цинковые покрытия из любых электролитов. Образующаяся
при этом пассивная пленка отличается особенно высокой коррозион-
ной стойкостью. Раствор № 5 дает пассивные пленки удовлетвори-
тельного качества, занимающие промежуточное положение между
пленками, полученными в растворах № 1 и 3. Растворы № 6 и 7
отличаются экономичностью: в них заметно снижен расход хромовых
солей. Коррозионная стойкость пассивной пленки достаточно высока.
Сушка изделий, обработанных в концентрированных растворах,
должна быть произведена при умеренных температурах.
Растворы для пассивирования готовят в стальной ванне, имеющей
кислотоупорную облицовку, например из винипласта. Ванну напол-
няют на 2/3 горячей водой, в которой растворяют бихромат натрия
или аммония и сульфат натрия. К раствору бихромата, непрерывно
помешивая, приливают тонкой струйкой серную, а затем азотную
кислоту, после чего ванну доливают водой и раствор тщательно
перемешивают.
Цинковые покрытия часто подвергаются фосфатированию в ра-
створе состава: окись цинка — 20—35 Г/л; фосфорная кислота —
20—30 Г/л; натрий азотистокислый — 1,5—2 Г/л; температура ра-
створа 28—30° С; продолжительность обработки 25—30 мин. Изде-
лия после фосфатирования пассивируются в растворе бихромата
натрия (50—80 Пл) при температуре 50—80° С в течение 2—Зсек.
9. УДАЛЕНИЕ НЕДОБРОКАЧЕСТВЕННЫХ ЦИНКОВЫХ ПОКРЫТИЙ
Цинк с поверхности стальных изделий может быть удален раство-
рением в 5—10-процентной соляной кислоте при комнатной темпера-
туре. Для уменьшения растворения стали в раствор добавляют
немного окиси сурьмы или хлорида сурьмы (3—5 Пл). Для растворе-
ния цинка можно использовать 10—15-процентный раствор щелочи.
ГЛАВА IX
КАДМИРОВАНИЕ
1. ОБЩИЕ СВЕДЕНИЯ
Кадмий характеризуется следующими физико-химическими кон-
стантами: удельный вес 8,6 Г/см?, атомный вес 112,41, валентность 2;
стандартный потенциал —0.409 в; электрохимический эквивалент
2,096 Па-Ч', температура плавления 321 ° С.
Кадмий по своим физико-химическим свойствам весьма близок
к цинку. Цвет металла серебристо-белый с синеватым отливом.
По твердости он близок к олову. Кадмий легко обрабатывается:
он мягок, легко полируется, режется ножом, хорошо куется, валь-
цуется в листы и вытягивается в проволоку. Высокая пластичность
кадмия используется при кадмировании резьбовых деталей для гер-
метизации резьбовых соединений. Чистый, свободный от примесей
металл при сгибании издает характерный треск. На воздухе при
обыкновенной температуре кадмий не изменяет своего внешнего вида.
Во влажной атмосфере кадмий окисляется, покрываясь с поверхности
тонкой пленкой окиси, предохраняющей его от дальнейшего окисле-
ния.
Кадмий значительно медленнее, чем цинк, растворяется в мине-
ральных кислотах. Наиболее энергично действует на кадмий азот-
ная кислота. Скорость растворения технического кадмия гораздо
выше, чем химически чистого кадмия. В отличие от цинка, кадмий
не растворяется в щелочах и осаждается при добавлении щелочи
из растворов солей в виде нерастворимого гидрата окиси
кадмия.
Кадмирование применяется для защиты стальных изделий от кор-
розии. Защитные свойства кадмиевых покрытий во многом зависят
от Условий, в которых покрытия эксплуатируются. Это объясняется
отчасти тем, что потенциалы кадмия и стали, довольно близкие по зна-
ению, могут претерпеть такйе изменения, в результате которых
ано КТеР заЩиты стали кадмием также изменится. Он может быть
Дным. подобно защите цинком, или стать катодным, как у олова,
МеДи и никеля.
фера)РаСТВ°Рах’ содеРжащих хлориды (морская вода и морская атмос-
Р ), кадмиевые покрытия защищают сталь лучше, чем цинковые.
172 Часть третья. Технология нанесения металлических покрытий
В средах же, содержащих SO2 и СО2 и продукты испарения органи-
ческих веществ, защитные свойства кадмиевого покрытия ниже
чем цинкового.
В соответствии с этим кадмиевые покрытия применяются в сле-
дующих случаях:
1) для защиты от коррозии металлических изделий, работающих
в условиях морской атмосферы, а также в других средах, содер-
жащих хлориды (за исключением кислоты);
2) для защиты от коррозии деталей машин, главным образом
резьбовых деталей и изделий, эксплуатируемых в закрытом помеще-
нии с умеренной или сильной влажностью и в наружной атмосфере
с неагрессивной коррозионной средой (легкие и средние коррозион-
ные условия);
3) для защиты от коррозии электрических контактов.
Согласно ГОСТ 3002—58, толщина кадмиевого покрытия на дета-
лях машин и приборов должна составлять:
для деталей общего назначения:
Легкие условия эксплуатации.......................... 5 мк
Средние » » ......................... 15 »
Тяжелые » » ........................ . 30 »
для деталей аппаратуры, подвергающихся воздействию морской
воды, —<0— £0 мк;
для резьбовых деталей и деталей, имеющих плотные соедине-
ния, — 7—15 мк.
Кадмиевые покрытия не могут быть рекомендованы для защиты
от коррозии в атмосфере, загрязненной сернистым газом, от действия
бензина и масла, а также для защиты водопроводных труб и пред-
метов домашнего обихода, соприкасающихся с пресной водой.
Во всех этих случаях следует применять цинковые покрытия.
2. СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА КАДМИЕВЫХ
ЭЛЕКТРОЛИТОВ
Электролитическое кадмирование производится в кислых или
цианистых электролитах.
Из кислых электролитов осадки удовлетворительной структуры
можно получить только при введении специальных добавок — кол-
лоидов. В противном случае осадок кадмия имеет грубое и крупно-
кристаллическое строение. В присутствии некоторых добавок удается
получить осадки, приближающиеся по структуре к осадкам, полу-
ченным из цианистых электролитов.
Кислые электролиты кадмирования, как без добавок, так и с добав-
ками, имеют малую рассеивающую способность и для покрытия
сильно профилированных изделий не пригодны.
Глава IX. Кадмирование,
173
Плотность тока в кислых электролитах, работающих в стацио-
нарных условиях, обычно не превышает 2 а/дм2-, а выход металла
по току близок к 100 Уо.
Цианистые электролиты позволяют получать плотные осадки
мелкозернистого строения даже без применения специальных добавок.
Плотность тока в цианистых электролитах составляет 1—2 а/дм?,
выход металла по току 90—95%.
Основным недостатком цианистых электролитов является их ядо-
вистость; однако, несмотря на это, при кадмировании изделий слож-
ного профиля они незаменимы и находят широкое применение
в промышленности. В последнее время предложен ряд рецептов,
призванных заменить цианистые электролиты при кадмировании
сложных деталей.
3. КИСЛЫЕ ЭЛЕКТРОЛИТЫ КАДМИРОВАНИЯ
Из кислых электролитов наиболее известны сернокислые и борфто-
ристоводородные.
Основным компонентом сернокислых электролитов является суль-
фат кадмия, концентрация которого в гальванических ваннах может
достигать 400 Пл\ оптимальной, однако, следует считать концентра-
цию 50—100 Пл.
К раствору сернокислого кадмия обычно добавляют соли, повы-
шающие электропроводность электролита и отчасти катодную поля-
ризацию. К таким соединениям относятся сернокислый аммоний,
сернокислый алюминий и сернокислый натрий. Борная кислота
и отчасти сернокислый аммоний играют роль буферных добавок,
регулирующих кислотность ванны. Последняя для сернокислых
электролитов должна поддерживаться в пределах pH =2 — 5,5.
Дальнейшее повышение кислотности усиливает выделение во-
дорода, снижает выход металла по току; недостаточная же
кислотность, вызывает образование темных шероховатых рыхлых
осадков.
Для улучшения качества кадмиевых осадков, получаемых из
кислых элктролитов, к последним добавляют коллоидные вещества:
пептон (0,5—2,5 Пл}, желатину (0,5—3,0 Пл}, столярный клей
(0,5 5,0 Г/л} и крезол (4—9 Пл}. Наиболее эффективным из них
является клей. Действие коллоидов сводится к повышению катодной
поляризации.
Состав и режим работы сернокислых электролитов кадмирования
поРкИВеДеНЫ В та^л- 51. Первые два электролита применяются для
ровРЫТИЯ металлических изделий, а электролит № 3 — для кадми-
ания проволоки на конвейерной установке.
дена Р°Должительность осаждения кадмия из кислых ванн приве-
трОлиВ Та®л- 52, а неполадки, встречающиеся при работе этих элек-
174
Часть третья. Технология нанесения металлических покрытий
Таблица 51
Составы и режимы работы сернокислых кадмиевых электролитов
Наименование компонентов Содержание в Г/л в электролитах
№ 1 № 2 № 3
Сернокислый кадмий CdSO4-8/3H2O 60—65 100 350—380
Сернокислый аммоний (NH4)2SO4 30—35 — —
Сернокислый алюминий A12(SO4)3- 18Н2О 25—30 — —
Желатина или клей 0,5—0,7 5 I
Борная кислота Н3ВО3 — 20 10—20
Хлористый натрий NaCl — 30 —
Величина pH электролита Режим 3,5—5,5 ) а б о т ы 2,5—4,5 3,0—4,0
Температура электролита в °C 18—20 20—25 40
Плотность тока в а!дмг 0,5—1 1,0—2,0 30—150
Выход по току в % 97—98 97—98 96—100
Таблица 52
Продолжительность осаждения кадмия из кислых ванн (в мин.)
при выходе по току 100%
Толщина слон в мк Плотность тока в а/дм*
0,5 1,0 1,5 2,0 3,0 5,0
1 4,9 2,5 1,6 1,2 0,8 0,5
3 15 7,4 4,9 3,7 2,5 1,5
5 25 12 8,2 6,1 4,1 2,4
7 34 17 11 8,6 5,7 3,4
9 44 22 15 11 7,4 4,4
10 49 24 16 12 8,2 4,9
30 147 74 49 37 25 15
50 245 123 82 61 41 25 !
Глада IX. Кадмирование
175
Таблица S3
Неполадки при работе кислых кадмиевых электролитов
Признаки неполадок Причины возникновения Способы устранения
. Появление на ано- дах белого налета Осадок иа изде- лиях губчатый ' и темный Блестящие полосы на покрытиях Наличие свинца Ь ано- дах а) Повышенное значение кислотности б) Повышенная плот- ность тока в) Наличие примесей Избыточное содержание в электролите никеля, ко- бальта, попадающих в ван- ну с деталями или из исход- ных реактивов Один раз в смену чистить аноды и вынимать их из ванны во время перерыва в работе а) Добавить раствор ам- миака б) Снизить плотность тока в) Проработать электро- лит под током Проработать электролит под током до исчезновения блестящих полос
Приготовление электролитов
Входящие в состав сернокислых электролитов соли растворяют
в теплой воде, дают раствору отстояться, после чего вливают в ванну.
Клей сначала выдерживают в холодной воде в течение 1 —2 суток,
после чего воду с набухшего клея сливают, а клей растворяют в горя-
чей воде. Полученный раствор вводят в ванну.
Свежеприготовленный электролит прорабатывают током для
удаления вредных примесей. Проработка производится при катодной
плотности тока 0,5—0,8 а/дм? в течение 8—10 час. Рекомендуется
в зависимости от загрузки ванны (но не реже одного раза в месяц)
производить фильтрацию электролита и химический анализ его
на содержание кадмия и других солей.
в Определение величины pH производят не реже одного раза
Плотные мелкозернистые осадки кадмия можно получить из бор-
фтористоводородного электролита следующего состава:
Фторборат Cd(BF4)2 ........................ 143
Борфтористоводородная кислота HBF4 . . . . 35
Клей.......................................... ।
Величина pH электролита . . .............. 3—5
плотне Ж И м Работы: "-емпература электролита 18—23° С,
ость тока 3,5—4 а/дм2. Выход по току 96—98%.
ЛоврпЛ нагРевании электролита до 50° плотность тока может быть
ДОВеДена до 9—ю а/дм2.
Г/л
»
176
Часть третья. Технология нанесения металлических покрытий
Борфтористоводородный электролит готовится следующим
образом.
Сначала из HF и Н3ВОЯ получают борфтористоводородную кис-
лоту, как описано в разделе о цинковании. В готовой Кислоте
растворяют небольшими порциями углекислый кадмий. Образова-
ние борфтористоводородного кадмия протекает согласно реакции
CdCO3+2HBF4=Cd (BF4)2+H2O+CO2.
Полученный таким образом раствор фторбората идет на соста-
вление электролита; для этого к нему добавляют соответствующее
количество борфтористоводородной кислоты и приготовленный
указанным выше способом раствор клея. Кислотность электролита
поддерживается на уровне рН-3—5.
4. ЦИАНИСТЫЕ ЭЛЕКТРОЛИТЫ КАДМИРОВАНИЯ
Основными компонентами цианистых кадмиевых электролитов
являются: комплексная цианистая соль кадмия, свободные цианиды
и щелочь.
Таблица 54
Состав цианистых кадмиевых электролитов и режим работы ванн
Наименование компонентов Содержание в Г/л в растворах
№ 1 № 2 № 3
Цианистый кадмий Cd(CN)2 — 50 —
Окись кадмия CdO — — 45
Сернокислый кадмий CdSO4-8/3H2O 80 — —
Цианистый натрий NaCN 120 80 120
Едкий натр NaOH 30 30 —
Сернокислый натрий Na2SO4-10H2O — 50 50
Сернокислый никель NiSO4-7H2O 1,5 1,5 1,5
Касторовое масло сульфированное — 12 —
Режим j а боты
Температура в °C 25—30 25—30 25—30
Плотность тока (без перемешивания) б а/дм2 1,5 1,5 1,5
Выход по току в % 90—95 90—95 90—95
Глава IX. Кадмирование
177
Таблица 55
Продолжительность осаждения кадмия (в мин.) из цианистых ванн
при выходе по току 90%
Толщина
Плотность тока в а,'дмг
о «а
1 5 2,7
3 16 8,2
5 27 14
7 38 19
1,5 2.0 3,0
1,8 1,4 0,9
5,5 4,1 2,7
9,1 6,8 4,5
13 9,5 6,4
Толщина слоя в мк Плотность тока в а/дм3
0,5 1,0 1,5 2,0 3,0
9 49 25 16 12 8,2
10 55 27 18 14 9,1
30 164 82 55 41 27
50 273 136 91 68 45
Таблица 56
Неполадки при работе цианистых кадмиевых электролитов
Признаки неполадок Причины возникновения Способы устранения
Блестящие полосы на изделии. Пористость осадка Темные осадки па ка- тоде при одновременном потемнении поверхности анодов Пригорелый и шерохо- ватый осадок Хрупкий осадок и воз- растание напряжения. Низкий выход по току и повышение газовыделе- иия иа катоде Темный цвет осадка кад- мия и пятнистость Наличие органических примесей. Наличие боль- шого количества карбона- тов Недостаточное содержа- ние цианидов и щелочи в электролите Высокая плотность тока, взвешенные примеси а) Недостаток щелочи или избыток свободного цианида б) Наличие в ванне при- месей органического про- исхождения в) Недостаточное содер- жание в электролите кад- мия а) Наличие в электро- лите примесей олова, свинца, сурьмы и мышь- яка б) Недостаток цианидов Проработать элек- тролит под током. Ох- ладить и отфильтро- вать электролит Добавить щелочь и цианистый калий Снизить плотность тока. Профильтровать электролит Откорректировать электролит и привести его в соответствие с рецептом а) Проработать электролит током б) Добавить NaCN или KCN
12 Вейнер и Дасоян
178
Часть третья. Технология нанесения металлических покрытий
Продолжение табл. 56
Признаки неполадок Причины возникновения Способы устранения i
Почернение анодов при нормальном составе элек- тролита Повышенная анодная плотность тока вследствие недостаточной поверхности анода Увеличить анод- ную поверхность
Чрезмерное газовыделе- ние на катоде при нор- мальном качестве катодного осадка Низкое содержание кад- мия при избытке щелочи Повысить содержа- ние кадмия
Почернение и плохая растворимость анодов; электролит мутный, на- блюдается выпадение осад- ков на дно ванны Недостаточное содержа- ние в электролите цианида Откорректировать и профильтровать - электролит, очистить аноды
Концентрация кадмия в цианистых электролитах обычно'соста-
вляет 30—Е0 Пл.
Роль свободных цианидов сводится к повышению растворимости
анодов, увеличению катодной поляризации и улучшению рассеиваю-
щей способности электролитов.
Кадмиевые электролиты допускают изменение содержания циа--
нидов в широких пределах. Однако оптимальным является такое
соотношение комплексной цианистой соли и свободного цианида,
которому отвечало бы Е0—70 Г свободного цианистого натрия
на 40 Г кадмия.
Едкая щелочь увеличивает устойчивость комплексной соли
кадмия. Карбонаты в малом количестве способствуют образованию
светлых и мелкокристаллических осадков.
К цианистым кадмиевым электролитам добавляется сернокислый
натрий в количестве 30—Е0 Пл. Эта добавка способствует стабильно-
сти состава электролита.
Для улучшения внешнего вида кадмиевых осадков к цианистым
кадмиевым электролитам добавляют соли никеля, кобальта, меди
или органические вещества. Наилучшие результаты получаются
при введении в электролит сернокислого никеля (1 — 1,5 Г/л) или
сульфированного касторового масла (10—12 Г/л).
Состав и режим работы наиболее распространенных цианиЛых
кадмиевых электролитов приведены в табл. 54. Продолжительность
осаждения кадмия из цианистых электролитов указана в табл. 55.
а неполадки, встречающиеся при работе этих электролитов,
в табл. 56.
Глава IX. Кадмирование
179
Приготовление электролитов
Электролит № 1 (табл. 53) готовят следующим образом. В отдел ь-
х сосудах растворяют CdSO4, NaCN и NaOH. После отстоя и декан-
тации постепенно, перемешивая, вливают раствор NaOH в раствор
CdSO4- При этом выпадает белый осадок Cd(OH)2 согласно реакции
CdSO4+2NaOH=Cd(OH) 2+Na 2SO4.
После полного осаждения гидрата окиси кадмия сливают с осадка
раствор и к осадку, осторожно перемешивая, прибавляет раствор
NaCN, под действием которого Cd(OH)2 переходит в комплексное
цианистое соединение, согласно реакции
Cd(OH)84-4NaCN=Na2Cd (CN)4+2NaOH.
Затем в полученный раствор цианистой кадмиевой соли вводят
раствор сернокислого никеля и раствор, отдекантированный при
осаждении Cd(OH)2. Полученный электролит фильтруют и разбавляют
водой до необходимого объема. Согласно приведенным реакциям,,
из 30 Г CdSO4-8/3H2O и 20,5 Г NaOH получается 37,5 Г Cd(OH)2.'~
Это соединение с 50,3 Г NaCN дает 67,2 Г Na2Cd (CN)4 и 20,5 Г NaOH.
В готовом электролите содержится 67,2 Г Na2Cd (CN)4, 120—
50,3 = 69,7 свободного NaCN и 30 Г NaOH.
Электролит .Ns 2 готовится растворением в половинном количе-
стве теплой воды NaCN, NaOH и CdCN2 в указанной последо-
вательности. Затем добавляют отдельно приготовленную смесь рас-
творов Na2SO4 и NiSO4, раствор фильтруют в рабочую ванну и доли-
вают водой до нужного объема.
Для приготовления электролита № 3 к раствору добавляют CdO,
а затем смесь растворов солей Na2SO4 и NiSO4.
При Составлении кадмиевых электролитов иногда исходят из ме-
таллического кадмия. Путем растворения в H2SO4 его сначала пере-
водят в Cd SO4, затем добавлением избытка щелочи получают Cd(OH)2
и дальше поступают так, как было описано выше.
Возможно также приготовление цианистого кадмиевого электро-
лита анодным растворением металла. Для этого в ванну, напол-
ненную раствором NaCN установленной согласно рецепту концентра-
ции, завешивают кадмиевые аноды. Катодами служат стальные
палочки, погруженные в пористые глиняные сосуды, наполненные
3-процентным раствором NaOH. Электролиз ведется при Da —• 1,5 —
\-2 а/дм2 и при напр’яжейии 4—6 в; продолжительность электролиза
определяют исходя из заданной концентрации кадмия в готовом
элекгр°лите и скорости анодного растворения его, равной примерно
'а-ч. При электролизе уровень щелочи в глиняных сосудах сни-
ется, поэтому необходимо время от времени добавлять в них воду.
То ^Ианистые кадмиевые электролиты не нуждаются в проработке
п м> так как присутствие в них небольших количеств металлических
180
Часть третьи. Технология нанесения металлических покрытий
примесей отражается на качестве кадмиевых осадков не так резко
как в кислых кадмиевых электролитах.
В процессе эксплуатации электролита необходимо заботиться
о поддержании постоянства концентрации кадмия, свободного NaOH
и NaCN. Для этого следует один раз в неделю вводить в ванну 5 Г/л
NaCN, 1,5—2 Г/л CdS()4 и 3 Пл NaOH.
Как уже отмечалось, в последние годы разработаны нецианистые
электролиты для кадмирования, в которых удается покрывать
изделия сложного профиля. Приводим два рецепта таких электро-
литов:
1) Окись кадмия ................................. .30 Г/л
Сернокислый аммоний ................ . 300 »
Борная кислота .... 20 »
Декстрин........................................ 2 »
Флюоресцепн . 0,01 »
Режим работ ы: температура электролита +18—20° С,
плотность тока DK = 1,5—2,0 а/дм2-, выход по току 40%.
Покрытие толщиной более 4 мк не имеет пор
2) Хлористый аммоний .............................. 250 Г/л
Окись кадмия . . ........... 8 »
Хлористый кадмий ...............................20 »
Столярный клей . ........................ 1 »
Тиомочевнна . . .......... ............... 2 »
Режим работы: тггяпература 18 С, плотность тока 1,5—
—2,0 а! дм2. Электролит перемешивается.
5. ОБРАБОТКА ИЗДЕЛИЙ ПОСЛЕ КАДМИРОВАНИЯ
Для устранения хрупкости пружин и других ответственных дета-
лей после кадмирования рекомендуется прогревать их в течение
2—3 час. в трансформаторном масле при температуре 150—170° С.
Для сохранения светлой поверхности кадмированных изделий
их погружают на 5—10 сек. в раствор, содержащий 150 Пл СгО3
и 4 Пл H2SO4, а затем промывают проточной водой.
6. УДАЛЕНИЕ НЕДОБРОКАЧЕСТВЕННЫХ КАДМИЕВЫХ ПОКРЫТИЙ
Для снятия недоброкачественных кадмиевых осадков изделие
обрабатывают в растворе следующего состава: 100 мл соляной кис-
лоты (1 : 1) + 15 Г окиси сурьмы.
Кадмиевые покрытия могут быть удалены с поверхности изделия
также электрохимическим растворением в 10—15-процентном раС‘
творе цианистого натрия при температуре 18—25е С. Материалом
для подвесок служит железо.
ГЛАВА X
МЕДНЕНИЕ
1. ОБЩИЕ СВЕДЕНИЯ
Медь — ковкий металл; удельный вес 8,9 Г/см?, температура
плавления 1083°. Атомный вес меди 63,57. В химических соединениях
медь двух- и одновалентна. Электрохимический эквивалент однова-
лентной меди равен 2,372 Па-ч, двухвалентной —1,186 Г1а-ч\ стандарт-
ный потенциал Сп/Сп 2 + равен + 0,34 в, а Сп/Сп+ равен + 0,52 в.
В атмосферных условиях в присутствии влаги и агрессивных со-
единений медь легко окисляется. При наличии в воздухе сернистых
соединений медь быстро покрывается серым или темно-коричневым
налетом сернистой меди. Под воздействием влаги и- углекислоты
атмосферы медь постепенно покрываетсязеленым налетом основных
углекислых солей. Под действием хлористых соединений медь покры-
вается хлористыми солями.
В азотной и хромовой кислотах медь легко растворяется. Концен-
трированная серная кислота хорошо реагирует с медью, особенно
при нагревании. Соляная кислота и разбавленная серная кислота
на медь практически не действуют. Однако в присутствии окисли-
телей или кислорода скорость коррозии становится заметной. Медь
неустойчива в аммиаке, в других же щелочах она быстро темнеет,
но растворяется весьма медленно.
Медь имеет более положительный потенциал, чем железо, поэтому
медные покрытия не могут защищать поверхность железных деталей
от коррозии электрохимически, а только механически и при отсут-
ствии пористости. При наличии пор в медном покрытии во влажной
атмосфере образуется гальванопара с железом. В этой паре железо
является анодом и коррозия его протекает весьма интенсивно.
Как правило, медные покрытия без дополнительной обработки
самостоятельного защитно-декоративного значения не имеют. Мед-
Ные п°крытия легко полируются до высокой степени блеска и создают
прочное сцепление со многими металлами: никелем, хромом, сереб-
I м и др. Поэтому медные покрытия широко применяются в качестве
Дслоя при никелировании, серебрении и т. д.
едные покрытия получили довольно широкое распространение
защиты отдельных участков деталей от науглероживания при
182
Часть третья. Технология нанесения металлических покрытий
цементации. Меднение применяется также во многих специальных
случаях. В табл. 57 приводятся наиболее распространенные области
применения меднения и толщина слоя покрытий.
Таблица 57
Область применения и толщина медных покрытий
Назначение медных покрытий Толщина по- крытий в мк
Подслой при никелировании, хромировании и т. д. Защита от науглероживания при цементации Притирка поверхностей машин, а также зубчатых соединений Облегчение пайки черных металлов Восстановление изношенных деталей Покрытие валов для глубокой печати Повышение электропроводности железных деталей Подслой для последующего окрашивания Получение копий при производстве патефонных пластинок 5—30 20—40 5—15 15—20 До 3000 - До 3000 10—200 15—25 1000 и более
2. СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА ЭЛЕКТРОЛИТОВ
ДЛЯ МЕДНЕНИЯ
Меднение может производиться в кислых и щелочных (цианистых)
электролитах. Из кислых электролитов могут использоваться серно-
кислые, пирофосфорные, борфтористоводородные, кремнефтористо-
водородные, щавелевокислые и др., но широкое применение в про-
мышленности нашли только сернокислые, которые отличаются про-
стотой состава и эксплуатации. Сернокислые электролиты для медне-
ния позволяют применять сравнительно высокие плотности тока, дают
почти 100-процентный выход по току, стабильны в работе и не тре-
буют частых корректировок. Основные недостатки сернокислых
электролитов:
1) крупнокристаллическая структура осадков;
2) относительно низкая рассеивающая способность;
3) вдвое более низкий электрохимический эквивалент двухвалент-
ной меди по сравнению с одновалентной медью, входящей в состав
цианистых электролитов;
4) невозможность получения непосредственно на железных
деталях покрытий, имеющих прочное сцепление с основным ме"
таллом.
Последний самый важный недостаток объясняется тем, что при
погружении железных деталей в сернокислый электролит происходит
контактное выделение меди, имеющей плохое сцепление с основой
Глава X. Меднение
183
и отличающейся большой пористостью. В связи с этим перед медне-
нием железных или стальных деталей в сернокислых электролитах
детали покрывают предварительно тонким слоем меди в цианистых
электролитах или слоем никеля в никелевом электролите.
Цианистые медные электролиты обладают весьма высокой рассеи-
вающей способностью, позволяют осаждать медь’ непосредственно
на железных и стальных деталях и создают хорошее сцепление
с основным металлом. Осадки из цианистых электролитов отличаются
мелкокристаллической структурой и незначительной пористостью.
Однако цианистые электролиты приготовляются из ядовитых, дефи-
цитных и дорогих солей и требуют частой корректировки. Кроме того,
цианистые медные электролиты характеризуются пониженным выхо-
дом по току.
Цианистые электролиты позволяют работать при комнатных
температурах и невысоких концентрациях только при довольно
низких плотностях тока. Выход по току при меднении в циа-
нистых электролитах обычно не превышает 60—70% и, несмотря
на то, что в их состав входят одновалентные соли меди, скорость
наращивания медного слоя в большинстве этих электролитов значи-
тельно меньше, чем в кислых медных электролитах.
Цианистые электролиты для меднения с высоким содержанием
цианистой меди и добавкой сегнетовых или роданистых солей могут
применяться при повышенной температуре, плотности тока порядка
4—10 а! дм2. Выход по току в этих условиях повышается до 95%
и более.
3. ЦИАНИСТЫЕ ЭЛЕКТРОЛИТЫ ДЛЯ МЕДНЕНИЯ
Основные компоненты и их назначение
Основными составляющими компонентами медных цианистых
электролитов являются комплексная цианистая соль меди и свобод-
ный цианистый натрий.
Молекулярный состав присутствующих в растворе медных циа-
нистых комплексов точно не известен. В простейшем случае формулу
комплекса можно написать в виде NaCu(CN)2. Однако при избытке
NaCN возможно образование соединения Na2Cu (CN)3. Этим, по-види-
мому, объясняется повышение катодной поляризации при увеличе-
нии содержания свободного цианида в ванне.
В табл. 58 приводится зависимость катодного потенциала и выхода
меди по току от плотности тока, характеризующая увеличение катод-
ной поляризации и снижение катодного выхода по току при повыше-
нии плотности така в цианистых электролитах. Значительная катод-
ная поляризация является причиной высокой рассеивающей способ-
ности цианистых электролитов, мелкозернистости, плотности и бес-
пористости получаемых в них осадков.
184
Часть третья. Технология нанесения металлических покрытий
Таблица 58
Влияние плотности тока на катодный потенциал и выход по току
(раствор 0,1-н. CuCN + 0,2-н. KCN)
Плотность тока в а/дм2 Катодный потенциал в в Выход по току в %
0,60 —0,61 —
0,10 —0,77 53,0
0,30 —1,12 65,0
0,50 —1,17 44,0
0,75 —1,20 35,4
1,00 —1,21 15,2
2,00 — 1,26 10,6
Влияние содержания свободного цианида и плотности тока
на выход по току при меднении характеризуется данными фиг. 74,
подтверждающими, что выход по току
уменьшается с увеличением плотности
тока и с увеличением содержания циа-
нида.
Состав электролитов и режимы работы
В табл. 59 приводятся составы и ре-
жим работы цианистых электролитов
для меднения.
Скорость осаждения меди из циани-
стых электролитов приведена в табл. 60.
В медных цианистых электролитах
допускается колебание содержания меди
не более 8—10%, свободного цианида
20—25%. Содержание меди в электро-
лите во время работы обычно умень-
шается вследствие недостаточной рас-
Фиг. 74. Влияние концентрации
цианистого натрия на выход по
току меди в цианистых электро-
литах с содержанием CN:
1 — 15 Г/л, 2 — 20 Г/л, 3— 30 Г/л.
творимости анодов. Содержание циа-
нидов уменьшается быстрее из-за взаимодействия с углекислотой
воздуха и образования карбонатов.
Разрушение цианидов происходит также вследствие воздействия
кислорода, выделяющегося на анодах при их пассивирований-
Кроме того, частично цианиды расходуются на восстановление обра-
зующихся в электролите двухвалентных ионов меди.
Корректировку электролитов производят согласно данным ана-
лиза, причем содержание цианидов следует определять ежедневно,
а содержание меди —2—3 раза в неделю.
Глава X. Меднение
185
Таблица 59
Составы и режимы работы цианистых электролитов для меднения
— Наименование компонентов Содержание в Г/л в растворах
№ I № 2 Ns 3 Ns 4
Комплексная цианистая меднонатрие- вая соль NaCu(CN)2 • 40—55 45—50 —
Цианистая медь CuCN — — 110—125 100—110
Цианистый натрий (свободный) NaCN 10—20 15—20 3,5—4,0 4—5
Едкий натр NaOH — 15—20 30—35 25—30
Сегнетова соль KNaC4H4O6 - 40—60 — 55—65
Роданистый калий KCNS — — 15—17
Режим работы
Температура в °C 15—25 40—50 70—75 60—65
Плотность тока в а!дм2 0,3—0,5 1,5—2 8—10 2—4
Выход по току в % 60—70 60—70 97—100 60—70
Таблица 60
Продолжительность осаждения слоя меди (в мин.)
из цианистых электролитов при выходе по току 75%
Толщина СЛОЯ в мк Плотность тока в а/дм*
0,3 0,5 0,7 1,0, 1,5 2,0 3,0
1 10,0 6,0 4,3 3,0 2,0 1,5 1,0
3 30,0 18,0 12,9 2,0 6,0 4,5 3,0
5 50,0 30,0 21,4 15,0 10,0 7,5 5,0
7 70,0 42,0 30,0 21,0 14,0 10,5 7,0
10 100,0 60,0 42,9 30,0 20,0 15,0 10,0
30 300 180 129 90 60 45 30,0
50 500 300 214 150 100 75 50,0
70 700 420 300 210 140 105 70
90 900 540 386 270 180 135 90
100 1000 600 430 300 200 150 100
300 3000 1800 1280 900 600 459 300
186
Часть третья. Технология нанесения металлических покрытий
Добавку меди целесообразно вводить в виде соли Шевреля,
которую нужно хранить в темной посуде. Цианиды добавляются
в виде концентрированного раствора цианистого натрия.
Как уже указывалось, в цианистом медном электролите всегда
должен быть избыток свободного цианида, необходимый для устой-
чивости медного комплекса в растворе и обеспечения растворимости
анодов. При недостатке свободного цианида на анодах образуется
зеленоватая пленка из-за того, что ионы меди не в состоянии перейти
в комплексное соединение. Анодная пленка становится все толще,
до тех пор пока не наступает полная непроводимость анодов и элек-
тролиз не прекращается.
Для катодного процесса также
требуется некоторый избыток сво-
бодного цианида, так как при этом
можно проводить электролиз при
более высоких плотностях тока.
Неполадки, встречающиеся при
эксплуатации медных цианистых
электролитов, и меры их устране-
ния приведены в табл. 61.
Большое снижение концентра-
Те мпература,°С
Фиг. 75. Зависимость выхода меди по
току
от температуры электролита при
плотности тока 10 а/дм2.
при
ции ионов меди в электролитах
зачастую приводит к образованию
пористых осадков. Кроме того,
работе с малоконцентрированными медными электролитами
можно применять только пониженные плотности тока, что снижает
скорость осаждения меди.
Сегнетова соль и роданистые соли (электролиты № 3 и 4) приме-
няются в качестве депассиваторов, т. е. они обеспечивают растворе-
ние анодов при высокой анодной плотности тока. Присутствие депас-
сиваторов позволяет резко снизить содержание свободных цианидов
в электролите. Взамен них добавляется едкий натр, в отсутствии
которого происходит осаждение темных медных покрытий.
На фиг. 75 приводится установленная Н. Д. Лиознер зависи-
мость выхода меди по току от температуры в медном цианистом элек-
тролите с добавкой роданистого калия и едкого натра.
Присутствие карбонатов в небольших количествах полезно,
поскольку при этом повышается электропроводность электролитов.
Однако при накоплении их свыше 70 Г/л аноды проявляют склон-
ность к пассивированию, а покрытия получаются пористыми. Удале-
ние карбонатов может быть осуществлено при помощи хлористого
бария или вымораживанием, путем охлаждения электролита до —5 -
Следует отметить, что карбонаты натрия легче выпадают в осадок
при охлаждении, чем калиевые.
Сульфаты существенного влияния на процесс электролиза не ока-
зывают.
Глаза X. Меднение
187
Таблица 61
Неполадки при работе медных цианистых электролитов
Признаки неполадок Причины-возникновения Способы устранения
Темные порошкооб- разные осадки. Бурное выделение газа на де- талях. Пористые, тем- но-красные осадки а) Избыток цианидов или недостаток солей меди б) Высокая плот- ность тока а) Откорректировать со- став электролита б) Снизить плотность тока
Низкий выход по току. Сильное газовы- деление Избыток цианидов или недостаток солей меди Откорректировать состав электролита
Пассивирование ано- дов Голубоватый налет на анодах' Синеватый оттенок электролита. Пассиви- рование анодов. Осадки темные, пятнистые Пористые осадки Уменьшение концен- трации солей меди в электролите Плохое сцепление • а) Низкая темпера- тура б) Низкое содержа- ние цианидов в) Велико значение pH г) Велико содержа- ние карбонатов а) Высокая анодная плотность тока б) Низкое содержа- ние цианидов в) Высокая плотность тока г) Низкое значе- ние pH Недостаток цианидов в электролите Велико содержание карбонатов Образование нераст- воримого осадка на анодах а) Низкое содержа- ние цианидов б) Плохая подго- товка а) Подогреть электролит б) Откорректировать со- став электролита с таким расчетом, чтобы содержание свободного цианида равня- лось 2/3—% содержания меди в) Довести pH до 11,5 г) Очистить электролит от карбонатов охлаждением или добавлением бариевых солей а) Завесить дополнитель- ные аноды в ванну б) Откорректировать элек- тролит в) Отрегулировать режим г) Довести pH до 11,5 Откорректировать состав электролита Удалить избыток карбо- натов Добавить в электролит цианистый натрий, сульфит натрия. Почистить аноды. Снизить анодную плотность тока а) Откорректировать со- став электролита б) Улучшить подготовку
188 Часть третья. Технология нанесения металлических покрытий
Продолжение табл. 61
Признаки неполадок Причины возникновения Способы устранения
Вздутие и отслаива- ние медных осадков. Пятна на осадках Шероховатое .осадки а) Избыток цианидов б) Высокая анодная плотность тока и низ- кая температура в) Попадание элек- тролита в поры основ- ного металла а) Загрязнение элек- тролита б) Низкое содержа- ние цианидов а) Откорректировать со- став электролита б) Отрегулировать режим электролиза в) Изделия до нанесения покрытая промывать в рас- творе соды. Тщательно про- мывать и сушить детали после нанесения покрытий а) Огфильтровать элек- тролит. Применить чехлы для анодов б) Добавить цианистый натрий
Сульфиты, вводимые в электролит или получаемые при приго-
товлении его из соли Шевреля, йграют роль восстановителя, преду-
преждая накопление в ванне двухвалентных ионов меди.
Меднение с использованием реверсированного тока
В течение последних лет способ осаждения металлов с примене-
нием реверсированного.тока привлекает к себе внимание.
Сущность способа заключается в том, что покрываемые изделия
в ванне попеременно включаются то как катоды, то как аноды.
Переключение тока осуществляется с помощью специальных комму-
тирующих устройств. Процесс характеризуется как общей продол-
жительностью цикла (Т), так и отношением катодной• части периода
(7\) к анодной (Та). Естественно, что это отношение всегда должно
быть более единицы. Выбор этих параметров, а также оптимального
режима электролиза производится экспериментальным путем для
каждого электролита.
Преимущества описываемого способа, объясняющие интерес
к нему со стороны исследователей и работников промышленности,
заключаются в возможности значительного увеличения скорости
нанесения покрытий и улучшения их качества: осадки равномернее
распределяются по поверхности катода (особенно это заметно
на кромках изделий), обладают более тонкой кристаллической струк-
турой и гладкой поверхностью, а при специальном подборе режима
в ряде случаев могут быть получены блестящие Аокрытия, не требую-
щие дополнительного полирования.
Изменение структуры осаждаемого металла связано с тем, чт0
кратковременное пребывание электрода в качестве анода вызывает
Глава X. Меднение
189
прерывание роста кристаллов, в результате чего последующее отло-
жение металла протекает путем образования новых центров кристал-
лизации. Во время анодной части цикла выступающие участки
поверхности осадка растворяются.более интенсивно, благодаря чему
происходит его выравнивание. Кроме того, периодическое изменение
направления тока уменьшает концентрационную поляризацию, что
позволяет увеличить плотность тока.
При меднении в цианистых электролитах с применением тока
переменной полярности на основании производственного опыта
И. И. Бибиков рекомендует:
1) применять простые электролиты, содержащие цианистую
соль, свободный цианид (примерно 10 Пл) и соду;
2) применять длительные периоды реверсирования тока (Т =
18—20 сек.);
3) перемешивать электролиты или устроить приспособление для
качания катодных штанг;
4) периодически, или лучше непрерывно, фильтровать электролит.
Рекомендуемый состав эл юлита и режим работы:
Медь цианистая CuCN.......................... 70—90 Г/л
Натрий цианистый (свободный) NaCN 6—10 »
Натрий углекислый NaaCO3 .................. . 15—30
Натр едкий NaOH ............................. 15—30 »
Полный период Т.............................. 18 сек.
Катодный период Тк . ... 15 »
Анодный период Та............................ 3 »
Плотность тока на деталях ............... 4—6 а/дм2
Температура ................... ... . 50—60°
В качестве анодного депасспватора можно применять фосфорно-
кислый двузамещенный аммоний в количестве 4—6 Пл.
Поданным Г. Г. Бахвалова, электролиз с реверсированным током
обеспечивает меньшую пористость покрытий (толщиной свыше 2 мк),
чем при получении их обычным электролизом.
Цианистые электролиты для блестящего меднения
В последнее время на предприятиях Советского Союза получил
распространение разработанный в Чехословацкой Социалистической
Республике электролит, в котором может быть осуществлено блестя-
щее меднение деталей, изготовленных из черных металлов. Ниже при-
водятся рецептура электролита и режим работы:
Медь (металлическая) ......................... 40—65 Г/л
Цианистый натрий (свободный) NaCN ............ 15______25 »
Роданистый аммоний NH4CNS..................... 10—15 »
Виннокислый натрий NaaC4H4O6.................. 5—10 »
Едкий натр NaOH ......................... .... 10—20 »
Блескообразователь............................ 0,03—0,05 »
190
Часть третья. Технология нанесения металлических покрытий
Режим работы: плотность тока2,0—3,0а/дм2, температура 55—60°.
Реверсирование тока Тк: Та = 40 — 50 : 8 — 10 сек. Качание штанг
40—50 кол,мин. Выход по току 65—70%.
Блескообразователь готовят путем растворения 50 Г сернокис-
лого марганца и 40 Г винной кислоты в 1 л дистиллированной воды.
По данным Я- В. Вайнера и А. А. Тарасовой, возможна замена
виннокислого натрия двузамещенным фосфорнокислым натрием в ко-
личестве ЮГ/л и-исключение из состава раствор а едкого натра. Полу-
ченные из видоизмененпогоеэлсктролита медные осадки отличаются
высоким блеском, эластичностью и прочным сцеплением с основным
металлом. Высокий блеск осадков сохра-
няется при нанесении медных осадков
толщиной 50 мк и более.
Корректирование электролита за-
ключается в регулярной добавке недо-
стающих компонентов в соответствии
с данными анализа.
В. П. Лабутинрекомендуетприменять
активированный уголь для очистки элек-
тролита от органических примесей.
Д
Фиг. 76. Схема биполярного мед-
нения (по А. М. Ямпольскому).
Биполярный метод меднения
При меднении деталей, требующих
одностороннего покрытия (например,
труб, шестеренок и т. д.)> может быть
применен так называемый биполяр-
ный метод. Сущность его заклю-
чается в том, что детали располагают в ванне между анодом и
катодом (фиг. 76). Поверхность деталей, расположенная напротив
анодов, заряжаясь отрицательно, покрывается медью. Поверхность же
деталей, находящихся напротив анодов, остается непокрытой.
Приготовления цианистых электролитов
Медные цианистые электролиты могут быть приготовлены путем
растворения цианистой меди в растворе цианистого натрия. Для этой
цели в горячей воде (60—70G), взятой в количестве 1/2 объема ванны,
растворяют все расчетное количество цианистого натрия, туда Же,
помешивая, вводят постепенно цианистую медь. Раствору дают
отстояться и осторожно сливают в рабочую ванну. Остальные состав-
ные части растворяют в небольшом объеме воды и после отстаивания
вливают в ванну, затем доливают холодной в.одой до требуемого
объема, тщательно перемешивают, производят анализ на содержа-
ние меди и свободного цианида; в случае необходимости корректиру1Рт
и приступают к работе.
Глава X. Меднение
191
При отсутствии цианистой меди комплексную соль меди готовят
из сернокислой меди, которую необходимо предварительно перевести
в углекислую медь или в соль Шевреля (CuSO3-Cu2SO3-2H2O).
Цианистый натрий может быть заменен эквивалентным коли-
чеством цианистого калия. ''
Цианистые соли перед употреблением анализируют на содержа-
ние циана и по результатам анализа добавляют в электролит необ-
ходимое количество соли.
Пример. Вместо 10 Г 100-процентного цианистого натрия
надо взять 12,5 Г 80-процентного или 17 Г 60-процентного препарата.
Приготовление электролита на основе углекислой меди. Для при-
готовления электролита в нагретой до 50‘ воде растворяют сернокис-
лую медь из расчета 85 Г на 1 л электролита. В другом сосуде в теплой
воде (40—50°) растворяют кальцинированную соду из расчета 45 Г/л
(или 120 Г/л кристаллической соды). К раствору сернокислой меди,
помешивая, приливают раствор соды. При этом выпадает зеленова-
тый осадок основной углекислой соли, согласно реакции
2CuSO4 + 2Na2CO3 = CuCO3-Cu (ОН)2 4- 2Na2SO4 + СО2.
При проведении данной работы важно сохранение температуры
(40—50е), так как при более низкой температуре осадок очень мед-
ленно отстаивается, а при более высокой — образуется труднорас-
творимый осадок безводной окиси меди.
Проверив полноту осаждения, сливают раствор, а осадок 2—3
раза промывают теплой водой.
В небольшом количестве теплой воды отдельно растворяют сер-
нокислый натрий из расчета 35 Г/л и цианистый натрий из расчета
55 Пл электролита.
К углекислой меди добавляют при помешивании раствор серни-
стокислого натрия (для восстановления двухвалентной меди в одно-
валентную) и затем, также помешивая, — раствор цианистого нат-
рия. Осадок растворяется согласно следующей реакции:
2CuCO3-Cu (ОН)2 + 2Na2SO3 + 12NaCN = 4Na2Cu (CN)3 +
+ 4Na2SO4 + Na2CO3 + 2NaOH + CO2 + H2O.
Раствору дают отстояться, осторожно сливают его в ванну и тща-
тельно перемешивают. Состав электролита по данным анализа коррек-
тируется.
При растворении цианистых солей и приготовлении цианистых
ектролитов следует соблюдать правила обращения с сильнодей-
вУ1ощими ядовитыми веществами.
тов ,Риготовление электролита на основе соли Шевреля. Для приго-
Натп6НИЯ электРолита № 1 в воде при 65—70° растворяют сульфит
ЛяюРтИя Из расчета 160 Г на 1 л электролита^ другом сосуде приготов-
пРи той же температуре раствор сернокислой меди из расчета
192
Часть третья. Технология нанесения металлических покрытий
80 Г на 1 л электролита. Затем, поддерживая ту же температуру
приливают при помешивании к раствору сернокислой меди раствор
сульфита. При этом синий раствор обесцвечивается и выпадает осадок
кирпично-красной соли Шевреля:
3CuSO4 + 3Na2SO3 + ЗН2О = CuSO3-Cu2SO3-2H2O +
-l~3Na2SO4 + H2SO4.
Раствор сливают, а осадок несколько раз промывают теплой водой.
В отдельных сосудах в теплой воде приготовляют раствор цианистого
натрия из расчета 65 Г на 1 л электролита и углекислого натрия —
20 Г/л. К осадку соли Шевреля приливают, помешивая, вначале рас-
твор углекислого, а затем цианистого натрия; при этом соль Шевреля
должна полностью раствориться, согласно реакции
2 (CuSO3-Cu2SO3-2H2O) + 14NaCN = 6NaCu(CN)2 +
4- 4Na2SO3 + (CN)2 + 4H2O.
В полученном растворе содержится некоторое количество суль-
фита, поэтому дополнительно его вводить не следует.
После отстаивания раствор переливают в ванну, доводят количе-
ство электролита до требуемого, вводят остальные соли, производят
химический анализ. В случае необходимости раствор корректируют.
Обезвреживание цианистых растворов
Отработанные и пришедшие в негодность медные цианистые
электролиты могут быть спущены в канализацию только после раз-
рушения цианидов. Для этой цели приготовляют 10—12-процентный
раствор сернокислого железа и вводят в него 5% гашеной извести.
Смесь эту взбалтывают и добавляют в электролит из расчета 20—
25 мл на 1 Г/л свободного цианистого натрия. Раствор тщательно пере-
мешивают и оставляют на несколько часов. Д'аким же образом обез-
вреживают тару из-под цианистых солей.
Отработанный электролит спускается в канализацию в сопро-
вождении обильного потока воды. Выливание отработанных циани-
стых электролитов в сеть, куда спускаются растворы, содержащие
кислоту, не допускается.
4. НЕЦИАНИСТЫЕ ЭЛЕКТРОЛИТЫ ДЛЯ НЕПОСРЕДСТВЕННОГО МЕДНЕНИЯ
ЧЕРНЫХ МЕТАЛЛОВ
В связи с ядовитостью цианистых электролитов было проведено
много исследований для изыскания нецианистых электролитов,
пригодных для непосредственного меднения деталей, изготовленнЫ-'
из черных металлов. Были предложены щавелевокислые, аммиачные,
пирофосфатные и другие электролиты. Однако в связи с малой
Глава X. Меднение
193
устойчивостью большинства данных электролитов производственное
применение получили только пирофосфатные электролиты следую-
щего состава:
Натрий пирофосфорнокислый Na4P2O7-ЮНаО . . 120—140 Г/л
Натрий фосфорнокислый двузамещенный
Na2HPO4- 12Н2О................................ 85—95 »
Сернокислая медь CuSO4-5HaO................. 30—40 »
pH.......................................... 7,5—8,9
Режим работы: температура 25—40°, плотность тока
0,5—0,75 а/дм2. Выход по току 75—80%.
Детали, изготовленные из черных металлов, рекомендуется перед
меднением в пирофосфатном электролите декапировать при анодной
плотности тока, равной 10 а/дм2 в растворе:
Фосфорная кислота Н3РО4 ........................... 200 Г/л
Серная кислота H2SO4............................... 50 »
Хромовый ангидрид СгО3 . .................... 10 »
Загрузка деталей в электролит производится под током при плот-
ности тока 5—6 а/дм2. Через 5—10 сек. плотность тока снижается
до нормы.
Приготовление пирофосфатного электролита заключается в рас-
творении всех составных частей в воде, подогретой до 60—70°. После
остывания электролит декантируют или фильтруют в рабочую ванну.
Электролит имеет темно-синий цвет.
. Корректировка pH электролита осуществляется добавкой орто-
фосфорной кислоты или раствора едкого натра. При pH > 9 аноды
начинают пассивироваться, а внешний вид осадков меди ухудшается.
При pH < 7 медь контактно выделяется на поверхности деталей.
Пирофосфат.ный электролит может применяться также для меднения
Деталей, изготовленных из алюминиевых сплавов.
Некоторое применение находят аммиачные электролиты следую--
Щего состава:
Сернокислая медь CuSO4-5H2O . ............ 80—100 Г/л
Сернокислый никель NiSO4-7H2O . . 18—20 »
Сернокислый натрий Na2SO4-10H2O ............. 35—40 х
Сернокислый аммоний (NH4)2-SO4 .............. 70—90 »
Аммиак NH4OH (25-процентный раствор) ... 180—200 мл/л
2 5—з £ И/^ работы: температура 20—25°, плотность тока
рас^еРеД загРУзкой рекомендуется декапирование в 10-процентнрм
ЗагпВ°Ре азотн°й кислоты с последующей тщательной промывкой.
^Рузка деталей в ванну должна производиться под током. В начале
Вайнер и Дасоян
194
Часть третья. Технология нанесения металлических покрытий
электролиза рекомендуется дать «толчок» тока (т. е. на короткое время
в несколько раз увеличить плотность тока).
Применяются для меднения также щавелевокислые электролиты
следующего состава:
Сернокислая медь CuSO4-5H.,O . . ............... 25 Г/л
Щавелевокислый аммоний (NH4)2C.2O4 . .......... 56 »
Щавелевая кислота Н2С.2О4 ...................... 10 »
pH..............................................3,5—4,5
Режим работы: температура 18—25°, плотность тока
0,3—0,5 а/дмг.
При составлении электролита все компоненты растворяют
отдельно в горячей воде, затем раствор сернокислой меди добавляют
небольшими порциями при перемешивании к раствору щавелевокис-
лого аммония. Туда же вливают раствор щавелевой кислоты.
В процессе работы электролит приходится подкислять щавеле-
вой кислотой, так как он имеет тенденцию к защелачиванию.
5. МЕДНЕНИЕ В КИСЛЫХ ЭЛЕКТРОЛИТАХ
Сернокислые электролиты
В табл. 62 приведены рецептура и режим работы наиболее рас-
пространенных сернокислых электролитов для меднения.
Таблица 62
Составы и режимы работы при меднении в сернокислых электролитах
Наименование компонентов Сотержание в Г/л в растворах
№ I № 2 № 3
Сернокислая медь CuSO4-5H2O 200. 250—350 250—275
Серная кислота H2SO4 50 60—75 50—75
Спирт этиловый С2Н5ОН Режим работы — 8—10
Температура в °C 18—25 30—40 40—45
Плотность тока в а! дм? 1—2 4—10 5—15
Перемешивание — Обяза- тельно Обяза- тельно
Фильтрация — Обяза- тельна Обяза- тельна
Серная кислота значительно повышает электропроводной^
сернокислых электролитов меднения и понижает активность ион°
Глава X. Меднение
195
меди, что способствует получению мелкокристаллических осадков
и преДстзРащает гидролиз сернокислой соли меди. Повышение содер-
жания серной кислоты в электролите не связано с понижением
катодного выхода по току, так как потенциал выделения меди в серно-
кислых электролитах значительно электроположительнее потенциала
водорода- С этой точки зрения желательно максимальное содержание
кислоты в растворе. Необходимо, однако, учесть, что с повышением
кислотности электролита понижается растворимость сернокислой
меди, что снижает верхний предел допустимой плотности тока.
Этиловый спирт в известных пределах предотвращает образование
' одновалентных ионов меди и тем самым способствует получению
плотных мелкокристаллических осадков.
Катодная поляризация в сернокислых медных электролитах
незначительна и потому электролиты эти не отличаются высокой рас-
сеивающей способностью.
Повышение температуры электролита позволяет работать при
более высоких плотностях тока. Обычно при этом повышают также
и кислотность электролитов, так как повышение температуры благо-
приятствует образованию одновалентных ионов меди.
Катодный и'анодный выход по току в сернокислых электролитах
меднения близок к теоретическому. Продолжительность осаждения
слоев меди заданной толщины при различной плотности тока приве-
дена в табл. 63.
Таблица 63
Продолжительность осаждения меди (в мин.) из кислых электролитов
Толщина слоя в мк Плотность тока в а!дм?
1.0 . 2.0 3.0 5.0 10.0 15.0 20.0
1 4,5 2,2 1,5 0,9 0,5 0,3 0,2
5 22 11 7,5 4,5 2,2 1,5 1,1
9 40 21 14 8,1 4,0 2,7 2,1
30 135 67 45 27 14 9,0 7,0
50 220 ПО 75 45 22 15 11
100 450 225 150 90 45 30 23
300 1350 675 450 270 135 90 69
500 2200 1100 750 450 220 150 ПО
—
Приготовление сернокислого электролита для меднения заклю- Ра СЯ В РаствоРении медного купороса, декантации отстоявшегося up TR°Pa иди фильтрации его в рабочую ванну и добавлении туда же кислоНеПРеРЬ1ВНОМ помешивании необходимого количества серной
13*
196
Часть третья. Технология нанесения металлических покрытий
Корректировка электролита сернокислой медью и серной кисло-
той производится по данным анализа. Этиловый спирт добавляют
еженедельно в количестве 0,5—2 Г на 1 л электролита.
Электролит меднения менее чувствителен к растворимым при-
месям, чем никелевые и цинковые электролиты, однако наличие
большого количества ионов цинка, никеля, железа и других металлов,
более электроотрицательных, чем медь, является нежелательным, так
как при этом осадки меди становятся рыхлыми. Вредно влияют ионы
мышьяка и сурьмы, приводящие к образованию темных или коричне-
вых полос. Наличие органических веществ в сернокислых электроли-
тах вызывает хрупкость медных осадков и образование полос.
Нерастворимые примеси, возникающие вследствие шламообра-
зования при растворении анодов, могут быть причиной создания гру-
бых и шероховатых осадков.
Неполадки, встречающиеся при меднении из сернокислых элект-
ролитов, приводятся в табл. 64.
Таблица 64
Неполадки при работе сернокислых электролитов меднения
Признаки неполадок Причины возникновения Способы устранения
Грубая крупно- кристаллическая структура осадков Хрупкие осадки Темные наросты на краях Непрочный по- рошкообразный оса- док Темный шерохова- тый осадок Шероховатые осадки Пористые осадки Низкая рассеи- вающая способность а) Недостаток кислоты или избыток сернокислой меди б) Высокая плотность тока Большой избыток кис- лоты при недостатке сер- нокислой меди Высокая плотность тока а) Недостаточное коли- чество кислоты или серно- кислой меди • б) Недостаточное пере- мешивание электролита Образование на катоде закиси меди Загрязнение электролита механическими примесями Загрязнение электролита солями железа а) Мала поверхность анодов б) Велико значение pH а) Откорректировать со- став электролита б) Снизить плотность тока Откорректировать состав электролита Снизить плотность тока а) Откорректировать со- став электролита б) Усилить интенсивность перемешивания Добавить серной кислоты Отфильтровать электро- лит Добавить щелочи и от- фильтровать а) Увеличить количество анодов б) Добавить серной к1|С лоты
Глава X. Меднение
197
Продолжение табл. 64
Признаки неполадок Причины возникновения Способы устранения
Медленное осаж- дение меди Светлые полосы на осадках, хруп- кие осадки а) Мала поверхность анодов б) Плохой контакт Загрязнение электролита органическими веществами а) Увеличить количество анодов б) Улучшить контакт у подвесок Отфильтровать электро- лит. Проработать током
^Меднение с использованием реверсированного тока
Для интенсификации процесса меднения в сернокислых электро-
литах рекомендуется проводить процесс электролиза реверсирован-
ным током. В этих случаях можно применить электролит следующего
состава:
Медь сернокислая CuSO4-5H.,O........... . . 250 Г/л
Кислота серная H2SO4 ... ......... .... 50 »
Режим работы: температура 50—60°, плотность тока
25—30 а/дм2. • '
Отношение катодного периода к анодному составляет Тк : Та —
= 5:1. Длительность периода 10 сек. Медные покрытия, полученные
при токе переменной полярности, имеют более мелкокристалличе-
скую структуру и пониженную пористость по сравнению с осадками,
полученными при постоянном токе. Осадки эти к тому же легче поли-
руются. По данным Н. Н. Бибикова, при толщине слоя в 10 мк. мед-
ные покрытия, полученные этим способом, беспористы.
Особенно целесообразно меднение при токе переменной полярно-
сти для получения значительных по толщине покрытий: при восста-
новлении размеров деталей, при изготовлении биметаллической
проволоки, при покрытии вал^ в машин для глубокой печати в поли-
графической промышленности и т. п.
Л Получение блестящих медных покрытий
Для получения блестящих медных осадков применяется электро-
лит следующего состава:
Сернокислая медь CuSO4-5H«O . . . . 210 Г/л
Серная кислота H2SO4 ............................... 20 »
Тиомочевина NH2CSNH2 ........................ 0,03—0,05 »
Дисульфонафталииовая кислота Cl0He(SO8H)8 . . 0,1-0,2 »
198
Часть третья. Технология нанесения металлических покрытий
Фиг. 77. Узорчатые осадки меди
Режим работы: температура 15—18°, плотность тока
2—3 а/дм2. В процессе работы необходимо воздушное перемеши-
вание или качание штанг.
Получаемые в электролите указанного состава медные осадки
отличаются высоким блеском, однако они более хрупки по сравнению
с осадками, полученными из сернокислых электролитов без добавки
тиомочевины. Следует отметить, что в кислых электролитах с тиомо-
чевиной при некоторых условиях на осадках появляются матовые
полосы или узоры, чередующиеся со свет-
лыми участками. При этом светлые уча-
стки выступают над матовыми. Образец
с узорчатыми медными осадками при-
веден на фиг. 77. Это явление вызы-
вается частичным пассивированием по-
верхности катодов и связанным с ним
неравномерным распределением плот-
ности тока. Это можно устранить, уве-
личив катодную плотность тока; если
это не помогает, то надо обработать
электролит активированным углем и
откорректировать содержание добавок
или же заменить электролит.
^Фтористоводородные электролиты
Наряду с сернокислыми медными
электролитами в последнее время в про-
мышленную практику внедряются бор-
фтористоводородные и крем-
нефтористоводородные электро-
литы для меднения. Указанные электро-
литы обладают более высокой рассеивающей способностью, чем
сернокислые, и позволяют работать при более высоких плотностях
тока.
Состав борфтористоводородного электролита:
Фторборат меди Cu(BF4)2 ...................... 220—230 Пл
Борная кислота Н3ВО3 ......................... 15—16 »
Борфтористоводородная кислота (свободная) HBF4 2—3 »
pH ... . .............. 1,2—1,7 »
Режим работы: температура 70—75°, плотность тока
10—20 а/дм2. Электролит перемешивается сжатым воздухом.
Для приготовления электролита 130 Г борной кислоты растворяют
в 640 Г 25-процентной плавиковой кислоты. В полученный раствор
после охлаждения добавляют малыми дозами 230 Г свежеосажденнои
углекислой меди.
Глава X. Меднение
199
Корректировку электролита производят углекислой медью и
борфтористоводородной кислотой.
При увеличении концентрации фторбората меди до 400—500 Пл
и свободной борфтористоводородной кислоты до 15 Пл плотность
тока может быть повышена до 30—35 а/дм2.
Состав кремнефтористоводородных электролитов для меднения:
Медь кремнефтористоводородная CuSiF6 ......... 300—450 Пл
Кремнефтористоводородная кислота H2SiF6 (сво-
бодная) ................................. ... 12—18 »
Режим работы: температура 18—25°, плотность тока
6—10 а!дм2.
6. УДАЛЕНИЕ НЕДОБРОКАЧЕСТВЕННЫХ МЕДНЫХ ПОКРЫТИЙ
Недоброкачественные медные покрытия или медные слои, нане-
сенные перед штамповкой или протяжкой, можно удалить химиче-
ским растворением в растворе, содержащем 250 Пл хромового ангид-
рида и 100—120 Пл сернокислого аммония или электрохимическим
путем: помещая их в качестве анодов в 10—30-процентный раствор
цианидов (плотность тока около 1 а!дм2) или 10-процентный раствор
нитрата натрия.
7. КОНТАКТНОЕ МЕДНЕНИЕ
Контактное меднение применяется для покрытия неответствен-
ных деталей тонким слоем меди, а также для нанесения смазочного
слоя меди перед протяжкой или штамповкой.
Меднение погружением производится при комнатной темпе-
ратуре в растворе следующего состава:
Сернокислая медь CuSO4-5H2O .... ... 5—15 Пл
Серная кислота H2SO4.......... 5—15 »
Выдержка 5—10 сек. После меднения детали промывают и про-
тирают тряпками (ветошью).
Для меднения путем натираний применяется водный раствор
следующего состава:
Сернокислая медь CuSO4-5H2O.......................... \2Пл
Соляная или серная кислота НС1 или H2SO4 ... 7 »
Хлористое олово SnCI2 .............................. 1 »
и Детали перед меднением должны быть тщательно обезжирены
промыты. Процесс омеднения натиранием производится при ком-
атной температуре в течение 5—10 сек,
200 Часть третья. Технология нанесения металлических покрытий
8. АНОДЫ ДЛЯ МЕДНЕНИЯ
Аноды для меднения должны быть из чистой электролитической
меди. Чистота их должна соответствовать требованиям ГОСТ 767—4}
(марка Ml). В цианистых электролитах применяются анодные пла-
стины из электролитической меди или литые аноды. В кислы^ элект-
ролитах следует применять вальцованные аноды. Аноды изготов-
ляются из листовой меди толщиной 5—10 мм. Перед употреблением
рекомендуется протравить их в 5—10-процентной азотной кислоте,
тщательно промыть и зачистить стальными щетками.
В цианистых электролитах анодная поверхность должна быть
примерно в два раза больше катодной; для кислых электролитов это
не играет важной роли. Аноды рекомендуется помещать в чехлы
из хлорвиниловой ткани.
ГЛАВА XI
НИКЕЛИРОВАНИЕ
1. ОБЩИЕ СВЕДЕНИЯ
Никель — металл серебристо-белого цвета; удельный вес никеля
8,9; атомный вес 58,69; валентность 2; стандартный потенциал —
0,25 в; электрохимический эквивалент 1,095 Па-ч\ температура плав-
ления 1450°. Твердость матовых осадков никеля 150—250 кПммъ,
блестящих — 500—550 кПмм2.
На воздухе при нормальной температуре внешний вид никеля
почти не изменяется, при наличии же в атмосфере различных газо-
вых загрязнений, в частности SO2 и SO3, наблюдается быстрое потуск-
нение, а затем и коррозия никеля. При нагревании выше 500° никель
окисляется.
В щелочных растворах, а также в расплавленных щелочах
никель устойчив. Он нестоек в окислительных средах. Азотная кис-
лота любой концентрации растворяет никель. С разбавленными рас-
творами серной кислоты (до 50%) на холоду никель не реагирует,
при повышении же температуры начинается его растворение. Соля-
ная кислота действует на никель значительно сильнее, чем серная.
Он устойчив в растворах хлористых, сернокислых и азотнокислых
солей. С никелем заметно реагируют горячие жиры и уксусная кис-
лота, оставляя на нем темные пятна. В окислительных средах никель
подвергается коррозии.
Никелирование широко применяется в приборостроении и в маши-
ностроении для защитно-декоративных целей. После цинкования
никелирование является самым распространенным видом отделки.
Никелевые покрытия могут быть отполированы до высокого блеска.
Никелем покрывают хирургические инструменты, предметы
Домашнего обихода, молочную посуду, детали самых различных при-
боров и аппаратов, авто-, мото- и велочасти; в полиграфиче-
ском производстве никелирование нашло широкое применение как
средство повышения поверхностной твердости клише и стереотипов,
оптической промышленности широко распространено как обычное,
ак и черное никелирование. В последнее время внедряется в про-
мышленность так называемое химическое н и к е л и р о в а -
е> °беспечивающее большую равномерность распределения тол-
ы покрытия по поверхности деталей, а также твердость покрытия.
202
Часть третья. Технология нанесения металлических покрытий
Электродный потенциал никеля более положителен, чем железа
поэтому никелевые покрытия по отношению к железу являются
катодными и защищают основу лишь «механически», изолируя
ее от воздействия внешней атмосферы.
Никелевые покрытия на черных металлах отличаются большой
пористостью, которая уменьшается с повышением толщины'4 слоя
никеля. Толщина слоя никеля, при которой покрытие становится
беспористым, зависит от класса чистоты обработки поверхности
деталей. В среднем можно принять, что беспористые никелевые покры-
тия получаются при толщине слоя в 20 мк и более. Следует отметить,
что пористость зависит также от состава электролита и режима элект-
ролиза. Для уменьшения пористости покрытия на детали из черных
металлов вначале осаждают подслой меди, а затем никелевое покры-
тие.
Комбинированное осаждение меди и никеля можно осуществить
по следующим вариантам:
1) медный подслой из цианистого электролита и слой никеля;
2) тонкий медный подслой из цианистого электролита, медный
подслой из кислого электролита и слой никеля;
3) тонкий никелевый подслой, подслой меди из кислого электро-
лита и слой никеля.
На практике большое распространение получило нанесение трех-
слойных защитно-декоративных покрытий медь—никель—хром.
Установленная ГОСТ 3002—58 минимальная толщина слоев по-
крытий на окончательно изготовленных изделиях приведена в табл. 65.
Таблица 55
Толщина никелевых и многослойных (медь — никель — хром)
покрытий на стали
Условия эксплуатации Условные обозначе ним групп покрытий Толщина покрытий в мк
Минимальная Средне- расчетная
никеле- вого без подслоя многослойных: мель-|- 4-никель или ни кел1 Ч-медь-р никель хромового
изделий
суммар- ная верхнего слоя никеля
Легкие л 10 10 5 0,5
Средние с 30 30 10 0,5
Жесткие Ж — 45 15 0,5
При никелировании деталей, изготовленных из меди и ее сплавов
и эксплуатируемых в легких, средних и жестких условиях, рекомен-
дуется толщина слоя никеля соответственнС 3,6 н 9 мк.
Глава XI. Никелирование . 203
2. КАТОДНЫЕ И АНОДНЫЕ ПРОЦЕССЫ ПРИ НИКЕЛИРОВАНИИ
Процесс никелирования сопровождается значительной катод-
ной поляризацией. Выход металла по току обычно близок к 100%,
однако выделение небольшого количества водорода всегда сопро-
вождает осаждение никеля.
Повышение плотности тока, уменьшение pH ванны, а также
уменьшение концентрации ионов никеля в электролите приводят
к повышению катодной поляризации и увеличению выделения водо-
рода. Соответственно снижается выход металла по току. Наоборот,
повышение температуры, концентрации электролита, а также переме-
шивание приводят к снижению катодной поляризации, увеличению
катодного выхода по току и повышению допустимого верхнего предела
плотности тока.
При никелировании деталей из цинковых и алюминиевых сплавов
процесс необходимо проводить при таком, значении катодного потен-
циала, который препятствовал бы переходу цинка или алюминия
в раствор. Это осуществляется либо повышением начальной плот-
ности тока, либо введением в электролит специальных добавок,
повышающих катодную поляризацию. При нормальном течении
процёсса никелевые аноды растворяются с образованием раствори-
мых солей никеля. Однако процесс этот тоже сопровождается зна-
чительной поляризацией. В неблагоприятных условиях анодный
потенциал может достичь потенциала выделения кислорода (+0,3 в).
Выделение кислорода приводит к окислению поверхности анодов,
которые перестают растворяться. Происходит так называемое пас-
сивирование анодов. Оно приводит к уменьшению содержа-
ния никеля в ванне и к снижению pH.
Пассивирование анодов увеличивается с повышением анодной
плотности тока и понижением температуры электролита. Существен-
ное значение имеет наличие примесей в анодах. Так, аноды марки
НПНА, содержащие некоторое количество серы, имеют значительно
меньшую склонность к пассивированию. Некоторые другие примеси
(например, железо) тоже препятствуют пассивированию анодов.
Однако добавление железа в аноды нежелательно, так как, переходя
в раствор, ионы железа нарушают нормальное течение процесса нике-
лирования.
Наиболее радикальный метод борьбы с пассивированием никеле-
вых анодов — введение в состав электролита хлористых солей,
Резко снижающих анодную поляризацию. Активизирующее влияние
на никелевые аноды оказывают также фтористые соли.
3. pH НИКЕЛЕВЫХ ЭЛЕКТРОЛИТОВ
Весьма существенное значение для процесса никелирования
пгДет величина pH электролита. Из сильнокислых растворов никель
₽ ктически не осаждается и идет разряд лишь ионов водорода.
204
Часть третья. Технология нанесения металлических покрытий
С другой стороны, из растворов, близких к нейтральным, на катоде
образуется гидрат закиси никеля, который, включаясь в никелевые
осадки, делает их шероховатыми, темными и хрупкими.
Если вести электролиз раствора, содержащего только соль никеля,
например NiSO4 или NiCl2, то очень скоро катодный процесс нару!
шается, осадок становится темным, начинается обильное выделение
водорода, а затем на поверхности катода образуется рыхлый осадок
гидрата закиси никеля, выделение же металла прекращается. Это
происходит вследствие заще-
лачивания прикатодного слоя
электролита, которое идет тем
интенсивнее, чем выше плот-
ность тока.
Фиг. 78. Зависимость механиче-
ских свойств никелевых осадков
от плотности тока:
1 — микротвердость; 2 — внутрен-
ние напряжения.
pH электролита
Фиг.79. Зависимость механических свойств
никелевых осадков от величины pH:
1 — удлинение; 2— микротвердость; 3— внут-
ренние напряжения; 4 — предел прочности.
Чтобы не было этих явлений, никелевый электролит должен обла-
дать буферными свойствами. Это достигается введением
в состав ванны борной кислоты или других веществ, пригодных
для этой цели. Тогда в условиях нормальной эксплуатации ванны pH
прикатодного слоя жидкости не достигает порога осаждения гидрата
закиси никеля и выделение металла идет беспрепятственно. Все же
и в этих условиях некоторое количество гидрата закиси или основных
солей включается в катодный осадок, оказывая существенное влия-
ние на механические свойства никелевого покрытия. Из кривых,
показанных на фиг. 78—80, видно, что наиболее резкие изменения
твердости осадков, внутренних напряжений в них и прочности
на разрыв наступает при pH > 5,5. Химический анализ показывает,
что одновременно в осадках возрастает количество кислорода
(т. е. гидратов).
В практике никелирования в зависимости от состава применяе-
мого электролита и от режима электролиза (плотности тока и темпе-
Глава XI. Никелирование
205
туры) ванны устанавливают в пределах от 2 до 6. Колебания же
P?j для определенного электролита и определенного режима
ре должны превышать ± 0,2.
В Влияние pH на процесс никелирования и качество никелевых
садков в основном сводится к следующему:
1) при обычных условиях никелирования оптимальный выход
металла по току наблюдается при pH ~ 5,5;
2) при неизменном pH электролита катодный выход по току
повышается с увеличением плотности тока до некоторого предела,
зависящего от состава электро-
лита;
3) хорошие никелевые осадки
получаются при высоком выходе
металла по току;
4) при никелировании в элек-
тролитах с низким pH необходимо
применять высокие плотности тока;
5) при pH > 6 никелевые осад-
ки становятся темными и склонны
к отслаиванию.
В последнее, время стали ши-
роко применять никелевые элек-
тролиты с pH < 4. Преимуще-
ством подобных электролитов, по-
мимо сказанного выше, является
возможность применения высоких
плотностей тока, что позволяет
Фиг. 80. Зависимость механических
свойств никелевых осадков от темпе-
ратуры электролиза:
1 — предел прочности; 2 — удлинение;
3 — микротвердость.
значительно интенсифицировать процесс никелирования. К отрица-
тельным сторонам электролитов с низким pH относятся: понижен-
ный выход по току, сравнительно узкие рабочие интервалы тем-
пературы и необходимость частого корректирования pH.
4. ЭЛЕКТРОЛИТЫ ДЛЯ НИКЕЛИРОВАНИЯ И РЕЖИМЫ
ИХ РАБОТЫ
Состав электролитов и режимы работы
/Йтя никелирования применяют электролиты, в которых никель
На Ддится главным образом в виде двухвалентного катиона Ni++.
состав электролитов кроме никелевых солей входят компо-
НеВД ы, предназначенные для повышения электропроводности, стаби-
Д11з1|щии кислотности, улучшения растворимости анодов,' придания
олешка осадкам, а также для предотвращения различных дефектов,
Отвечающихся при никелировании (антипиттингсвые добавки), и др.
*Дз различных никелевых солей для приготовления никелевых
ЭлекУролитов наибольшее распространение получила сернокислая
206
Часть третья. Технология нанесения металлических покрытий
соль. Применяемый за рубежом хлористый никель у нас почти
не используется из-за дороговизны и ограниченности его производ-
ства. Распространенная прежде ванна с двойной сернокислой солью
никеля и аммония в настоящеее время применяется очень редко,
так как вследствие своей малой растворимости эта соль позволяет
работать только со слабоконцентрированными электролитами
и соответственно при низкой плотности тока.
В зарубежной промышленной практике находят применение
электролиты на основе борфтористого никеля, отличающиеся повы-
шенной рассеивающей способностью и высокой производительностью.
В электролиты для никелирования, приготовленные на основе
сернокислого никеля, с целью повышения электропроводности
иногда добавляют сернокислый натрий и сернокислый магний. Про-
водимость растворов сернокислого натрия выше, но в присутствии
сернокислого магния получаются более мягкие, светлые и легко
полируемые осадки никеля.
В качестве буферного соединения, препятствующего быстрому
изменению кислотности электролита, обычно применяют борную
кислоту. Органические кислоты (лимонная, винная, уксусная)
и их соли в настоящее время используются в качестве буфера
довольно редко и лишь в специальных случаях.
Для облегчения растворения анодов в ванну вводят хлористые
соли натрия или калия. За рубежом для этой цели широко исполь-
зуется хлористый никель. Активизирующее действие на никелевые
аноды оказывает фтористый натрий, который к тому же усиливает
буферные свойства раствора.
В табл. 66 приведены составы и режимы работы наиболее рас-
пространенных сернокислых электролитов для никелирования.
В табл. 67 дана лродолжительиость нанесения слоев никеля раз-
личной толщины.
Следует подчеркнуть, что ни один процесс нанесения гальвани-
ческих покрытий не требует такой тщательной подготовки поверх-
ности деталей и строгого соблюдения режима, как никелирование.
Никелевые ванны весьма чувствительны ко всякого рода загрязне-
ниям, поэтому на чистоту исходных реактивов следует обращать
особое внимание. *
Никелирование мелких деталей часто осуществляется в колоколь-
ных и барабанных ваннах. Для этих целей применяют обычные эДекТ'
ролиты никелирования, необходимо только подведение более в'Ыс0"
кого напряжения, порядка 8—12 в. :
Основным недостатком колокольных ванн является несоответс4'вие
между поверхностями анодов и катодов, вследствие чего при выссДИ*
плотностях тока аноды пассивируются, напряжение повышае^гсЯ’
Концентрация никеля в электролите понижается, и уменьшается грФ'
чение pH; оно может достигнуть таких пределов, при которых jnpe
кращается осаждение никеля. В связи с этим при никелировав11'
Глава XI. Никелирование
207
Таблица 66
Составы и режим работы сернокислых электролитов для никелирования
Наименование ком- понентов Содержание а Г/а в растворах
№ 1 № 2 № 3 № 4 № 5
Сернокислый ни- 140—180 280—300 400—420 400—420 200—220
кель NiSO4-7H2O
Сернокислый на- трий ^la2SO4- ЮН2О 40—50 — 140—160 — —
Сернокислый маг- ний MgSO4-7H2O 25—30 50—60 — — —
Хлористый нат- рий NaCl 5—10 5—10 — — 8—10
Фтористый нат- рий NaF — — 2—3 2—3 —
Хлористый ни- кель NiCl2-6H2O — — 25—30 — —
Борная кислота Н3ВО3 20—25 25—30 25—30 25—30 25—30
pH 5,0—5,5 3,0—5,0 3,5—4,5 2—3 4,2-4,6
Режим р а б о т ы
Температура в °C 20—35 30—40 55—60 50—60 50—60
Плотность тока в а1д1лг 0,5—1,0 2—4 8—12 5—10 1,2—1,5
Катодный выход по току в % 99—95 90—95 90 85—30 90—95
ПеремеЙйвание Не обяза- Обяза- Обяза- Обяза- Не обяза-
тельно тельно тельно тельно тельно
Непрерывная Не обяза- Не обяза- Обяза- Обяза- Не обяза-
фильтрация тельна тельна тельна тельна тельна
Таблица 67
Продолжительность осаждения слоя никеля (в мин.)
заданной толщины при выходе по току 95%
Толщина Cj‘OM в мк ~ Плотность тока в
О.б' 1.0 2.0 3,0 4.0 5,0 1.00
1 10 5,0 2,5 2,0 1,3 1,0 0,5
3 30 15 8,0 5,0 4,0 3.1 1,5
5 51 25 13 8.5 6,5 5,1 2,5
9 92 46 23 15 11 9,0 4,6
20 205 102 51 34 25 20 10
60 615 304 153 102 76 61 31
208
Часть третья. Технология нанесения металлических покрытий
в колокольных ваннах рекомендуется введение повышенного количе-
ства хлористых солей.
При никелировании в барабанных и колокольных ваннах наблю-
дается иногда растравливание середины поверхности плоских дета-
лей. Для устранения растравливания необходимо повысить pH
электролита, а также улучшить перемешивание деталей в ванне.
Образующиеся наросты на стенках колоколов и барабанов следует
регулярно удалять, так как в противном случае скорость никелиро-
вания может заметно снизиться.
Основные неполадки, встречающиеся при никелировании, опи-
саны в табл. 68.
Таблица 68
Неполадки при работе сернокислых электролитов для никелирования
Признаки неполадок Причины возникновения Способы устранения
Поверхность деталей покрывается пятнами, никель не осаждается Темные или пятни- стые осадки Хрупкие, растрески- вающиеся осадки Плохое сцепление осадков а) Слишком низкая плотность тока б) Низкая темпера- тура электролита а) Высокое значение pH б) Примеси меди или цинка а) Низкое значение рн б) Органические при- меси в) Примеси железа а) Плохая подготовка деталей б) Слишком кислый или холодный элек- тролит в) Велика сила тока г) Примеси солей свинца д) Перерывы в про- цессе никелирования а) Зачистить контакты и повысить плотность тока б) Повысить температуру электролита (>15°) а) Откорректировать pH б) Очистить электролит от цинка и меди а) Откорректировать pH б) Проработать электро- лит током, обработать КМпО4 или активированным углем в) Очистить электролит от железа а) Улучшить подготовку б) Добавить в электролит раствор щелочи и подогреть электролит в) Откорректировать ре" жим г) Проработать элек- тролит током д) Не допускать выклю- чения тока
Глава XI. Никелирование
209
Продолжение табл. 68
Признаки неполадок Причины возникновения Способы устранения
Осадки серого цвета Примеси солей меди Очистить электролит от меди
«Пригар» на углах а) Высока плотность а) Откорректировать ре-
И выступающих частях деталей тока или низка темпе- ратура б) Мала концентра- ция сернокислого ни- келя жим электролиза б) Откорректировать со- став электролита
Осадок грубый и ше- а) Высока концент- а) Разбавить электролит
роховатый. После по- рация солей в электро- водой до нужной концентра-
лирования на покры- лите ции
тиях остаются точечные б) Электролит загряз- б) Отфильтровать элек-
поры и мелкие риски нен взвешенными ча- стицами, анодным шла- мом и пылью тролит, на аноды надеть чехлы
Осадок светлый, но а) Плохое обезжири- а) Улучшить подготовку
местами отсутствует вание б) Неправильное за- вешивание деталей в ванну (они экранируют ДРУГ ДРУга) в) Неправильное рас- положение анодов деталей । б) Изменить расположе- ние деталей в ванне в) Распределить аноды равномерно по всей ванне
Осадок имеет желтый оттенок Высокое значение pH электролита Откорректировать pH
Образование питтинга а) Загрязнение элек- тролита органическими примесями б) Ненормальное зна- чение pH а) Проработать электро- лит, добавить Н,О9 или КМпО4 б) Откорректировать pH
При хранении изде- Плохая промывка Улучшить промывку хэ-
лии на покрытиях по- являются зеленые пятна или сушка деталей лодной и горячей водой, а также сушку
При хранении изде- а) Покрытие слиш- а) Увеличить время ни-
ЛИЙ на покрытии по- ком тонкое кодирования
являются желтые пятна б) Имеются примеси б) Очистить электролит
железа от примесей железа
4 Вайнер И Дасоян
210
Часть третья. Технология нанесения металлических покрытий
Приготовление и очистка электролитов
Приготовление сернокислых электролитов для никелирования
заключается в растворении в горячей воде сернокислых и хлористых
солей; борная кислота и фтористые соли растворяются в кипящей
воде. После отстаивания растворы декантируют или фильтруют
в рабочую ванну. После перемешивания и проверки кислотности
ее корректируют 3-процентным раствором едкого натра в случае пони-
женного значения pH и 5-процентным раствором серной кислоты при
повышенном значении pH. При наличии в электролите примесей
требуется проработка его до получения доброкачественных осадков
никеля.
Очистка никелевых электролитов от вредных примесей меди,
железа и цинка производится следующим образом? При накоплении
в ванне солей железа электролит подкисляют до pH = 3,5—4,0,
^подогревают до 60—70° и окисляют закисное железо до окисного
перекисью водорода? при интенсивном перемешивании электролита
в течение 2—3 часЗЗатрм железо осаждается в виде гидрата окиси
железа|путем подщелачивания электролита до pH = 6,0;/электролит
фильтруют и подкисляют до нужного значения pH. Одновременно
при такой обработке удаляется часть органических примесей.
*Медь удаляется проработкой подкисленного до pH = 2,5—3,0
электролита при низкой плотности тока..
Для удаления цинка к электролиту добавляют измельченный
мел до получения pH — 6,5 и тщательно его перемешивают. Раствору
дают отстояться, после чего его декантируют, а выпавший на
дно осадок удаляют .^Электролит подкисляют до требуемой кислот-
ности.
Органические примеси целесообразно удалять обработкой элек-
тролита активированным углем и проработкой ванны током.
Примеси металлов можно также удалять путем проработки током.
Так, цинк может быть полностью удален из электролита проработ-
кой при плотности тока 0,2—0,3 а/дм2. Удаление железа произво-
дится при плотности тока 0,5—0,6 а/дм2, удаление солей свинца
и меди — при плотности тока 0,5 а/дм2. Процесс очистки реко-
мендуется проводить при перемешивании и подогреве электролита
до 50—55°.
д^рорфтористоводородные электролиты
Наряду с сернокислыми электролитами для никелирования
применяются также борфтористоводородные электролиты, получив-
шие в последнее время довольно широкое распространение за рубе-
жом. Электролиты на основе борфтористоводородного никеля отли-
чаются высокой электропроводностью, высокой рассеивающей спо-
собностью и большей устойчивостью, а также высоким качеством
осадков.
Глава XI. Никелирование
211
рекомендуется следующий состав ванны:
фторборат никеля............................ 300 Пл
Борная кислота ................. ....... 30 »
Эмульгатор ОП-7 ........................ 0,2—0,3 1лл!л
Формалин (40%) ........................ 1,5—3,0 »
pH ванны................................ 2,7—3,5 »
режим работы: температура 25—50плотность тока
5__10 а!дм2.
5. БЛЕСТЯЩЕЕ НИКЕЛИРОВАНИЕ
В связи с тем что никелирование в подавляющем большинстве
случаев применяется в декоративных и защитно-декоративных целях,
после нанесения никелевых покрытий производится полирование
(глянцовка) деталей.
Возможность получения блестящих покрытий непосредственно
из ванны весьма желательна. Применение ванн для блестящего нике-
лирования значительно сокращает число производственных операций
и намного упрощает задачу автоматизации отделочных операций.
Блестящий никель может наноситься на детали со сложным про-
филем, не поддающиеся механическому полированию. Осадки бле-
стящего никеля обладают способностью в значительной мере сгла-
живать мелкие неровности на деталях, остающиеся после механи-
ческой обработки. Поэтому даже детали из-под резца с нанесенным
на них слоем блестящего никеля имеют хороший декоративный
вид. Защитная способность блестящих никелевых покрытий и обыч-
ных матовых при равной толщине их одинакова. Блестящее никели-
рование сокращает расход никеля и устраняет опасность прополиро-
вывания покрытия на кромках и ребрах изделия. Таким образом,
интерес, проявляемый к ваннам этого типа, вполне оправдан.
В литературе по гальванотехнике и в патентных заявках описано
очень большое число ванн для блестящего никелирования. От обыч-
ных они отличаются тем, что в состав электролита вводятся те или
иные добавки, чаще всего органических веществ.
В табл. 69 приведен состав ванн блестящего никелирования,
нашедших применение в отечественной промышленности.
Следует отметить, что ванны для блестящего никелирования
требуют более тщательного ухода, чем ванны без добавок, а процесс
нанесения покрытий требует точного соблюдения технологического
режима. Для предотвращения попадания в электролит анодного
шлама аноды помещаются в матерчатые чехлы. Вообще наличие взве-
шенных частиц в электролите недопустимо, поэтому желательно обо-
рудовать ванны для блестящего никелирования установками непре-
рывного фильтрования.
.Осадки блестящего никеля из электролита № 1 обладают повышен-
ной твердостью и хрупкостью. Хрупкость увеличивается при укло-
нении от заданного режима работы ванны в сторону снижения темпе-
14*
212
Часть третья. Технология нанесения металлических покрытий
Таблица 69
Состав электролитов для блестящего никелирования и режимы работы
Наименование компонентов Содержание в Г/д в растворах
№ 1 № 2
Сернокислый никель NiSO4-7H2O 200—240 250—300
Хлористый никель NiCl2-6H2O — 60—80
Хлористый натрий NaCl 7—10 —
Борная кислота Н3ВО3 25—30. 30—40
Фтористый натрий NaF 4—5 — 1
Дисульфонафталиновая кислота C|0H6(SO3H)2 3—4 —
Паратолуолсульфамид CH3C6H4SO2NH2 — 2
Кумарин — 0,1
Формальдегид СН2О 1—1,5 —
Антипиттинговая добавка «Прогресс» 0,01 мл!л
рн 5,5—5,8 4,5—5,0
Режим работы
Температура в °C 40—45 55—60
Плотность тока в а!дм1 4—5 4—6
ратуры электролита, увеличения плотности тока и повышения pH.
В этих случаях даже небольшая деформация деталей может привести
к растрескиванию покрытия.
При пониженных значениях pH блеск осадков уменьшается.
Особое внимание при блестящем никелировании следует обращать
на качество обезжиривания изделий перед покрытием. Блестящие
осадки весьма чувствительны к малейшим жировым загрязнениям
и в этом случае неизбежно их отслаивание.
Электролит № 2 (табл. 69) обладает сильно выраженным выравни-
вающим действием благодаря наличию кумарина. В электролит кума-
рин вводится в виде раствора в уксусной кислоте (125 Г кумарина
растворяется в 450 мл ледяной уксусной кислоты и нейтрализуется
150 Г свежеосажденного углекислого никеля, после растворения
которого доводится водой до 1 л).
Осадки никеля, получаемые из электролита № 2, по эластичности
почти не отличаются от матовых никелевых осадков.
Оптимальное выравнивание осадков никеля наблюдается при
содержании 0,1 Г кумарина на 1 л электролита. При дальнейшем
увеличении количества кумарина степень блеска уменьшается-
Кумарин адсорбируется на микровыступах поверхности катода»
Глава XI. Никелирование
213
создавая благоприятные условия для преимущественного осажде-
ния никеля в углублениях. При большой концентрации кумарин
может адсорбироваться как на выступах, так и во впадинах и эффект
выравнивания ослабляется. Важную роль играет перемешивание
электролита. Без перемешивания невозможно при указанном содер-
жании кумарина получить блестящие осадки. Это, очевидно, объяс-
няется тем, что прикатодный слой быстро обедняется выравнивающей
и блескообразующей добавкой, и только интенсивное воздушное
перемешивание обеспечивает достаточное количество добавок в при-
катодном слое.
6. ПРОЦЕСС «ЧЕРНОГО НИКЕЛИРОВАНИЯ»
Осаждение «черного никеля» представляет собой своеобразный
вид отделки, нашедший применение в ’оптической промышленности
и в некоторых других специальных случаях. Поверхность осадков
имеет густо-черный цвет. Защитная способность их невелика, они
слабо сцеплены с поверхностью деталей, особенно изготовленных
из черных металлов. Поэтому стальные детали предварительно
меднятся или никелируются.
Состав электролита для нанесения «черного никеля» и режимы
работы приведены в табл. 70.
Таблица 70
Состав электролитов для «черного никелирования» и режимы работы
Наименование компонентов и режим Содержание в Г/л в растворах
№ 1 № 2
Сернокислый никель NiSO4-7H2O 50 75
Двойной сульфат никельаммония NiSO4(NH4)2SO4-6H2O — 45
Сернокислый цинк ZnSO4-7H2O 25 40
Роданистый калий KCNS 32 —
Роданистый аммоний NH4CNS — 15
Сернокислый аммоний (NH4)2SO4 15 —
Борная кислота Н3ВО3 — 25
рн 4,5—5,5 4,5—5,5
Режим работы
Температура в °C Плотность тока в а/дм2 15—25 0,1—0,15 45—55 В течение 10 мин. повышается от 0,02 до 0,2 а/дм2
214
Часть третья. Технология нанесения металлических покрытий
«Черный никель» не представляет собой чисто металлического
осадка. Во время электролиза на катоде вместе с металлическим
никелем осаждаются сульфиды никеля и цинка и гидрат окиси цинка.
По-видимому, осадок представляет собой мельчайшие частицы
никеля, включенные в массу гидроокиси и сульфидов. Осадки имеют
черный цвет, подобно черному фотографическому изображению,
образованному частицами серебра, распределенными в массе жела-
тины.
Толщина осадков составляет 0,5—1 мк.
7. ХИМИЧЕСКОЕ НИКЕЛИРОВАНИЕ
В последние годы широкое распространение получил процесс
химического никелирования, позволяющий получать иа деталях
сложной конфигурации равномерные осадки, отличающиеся высо-
кими декоративными качествами, малой пористостью и вместе с тем
большой твердостью и износостойкостью.
Процесс химического никелирования основан на восстановлении
ионов никеля гипофосфитом в водных растворах.
Механизм реакций, протекающих при химическом никелирова-
нии, весьма сложен и пока еще недостаточно изучен. Реакция восста-
новления никеля имеет ступенчатый характер. Предполагается, что
первой стадией процесса является разложение гипофосфита водой
с выделением атомарного водорода:
NaH2PO2 + Н2О = NaH2PO3 + 2Н.
Водород, адсорбируясь на поверхности деталей, вступает в реак-
цию с ионами никеля, в результате чего выделяется металлический
никель:
Ni++ + 2Н = Ni + 2Н+.
Одновременно атомарный водород восстанавливает фосфор, кото-
рый включается в состав покрытия:
Н3РО3 + ЗН = Р + ЗН2О.
Относительное содержание фосфора в покрытии определяется
главным образом pH раствора, снижаясь с понижением кислотности
ванны. По-видимому, это связано с тем, что скорость восстановления
ионов никеля с возрастанием pH раствора увеличивается быстрее,
чем скорость восстановления фосфора.
При pH, близком к 3, реакция осаждения никеля прекращается
почти полностью. Повышение pH увеличивает скорость процесса
химического никелирования, но способствует выпадению осадка фос-
фита никеля, а также порошкообразного никеля. На фиг. 81 приве-
дена зависимость толщины никелевого покрытия от pH раствора.
Глава XI. Никелирование
215
Фнг. 81. Зависимость толщи-
ны никельфосфорного слоя
от pH раствора:
S S
/----= 1,5:1; 2-----=3:1.
v v
(s — поверхность, v — объем).
Для стабилизации скорости процесса в растворы для химического
никелирования добавляют соединения, придающие ему буферные
свойства (молочная кислота, уксуснокислый, лимонокислый, гли-
колевокислый натрий и др.). Органические добавки в известных
пределах стабилизируют процесс, препятствуют выпадению в осадок
фосфита никеля и увеличивают срок службы ванны.
Накопление фосфитов в растворе оказывает отрицательное влия-
ние на процесс химического никелирования вследствие образования
труднорастворимого соединения — фосфита никеля. Фосфиты никеля,
находясь во взвешенном состоянии, попадают на детали, портят
их поверхность. Кроме того, фосфиты никеля могут стать центрами
кристаллизации, в результате чего никель
начнет выделяться во всем объеме ра-
створа.
Процесс восстановления никеля про-
текает только на поверхности металлов,
способных каталитически влиять на эту
реакцию.К числу таких металлов относятся
палладий, никель, железо, алюминий и не-
которые другие. Покрытия на меди и ее
сплавах могут быть получены только в слу-
чае контакта их в начале процесса с более
электроотрицательным металлом — желе-
зом, алюминием или никелем. В дальней-
шем роль катализатора выполняет оса-
ждающийся никель. На некоторых метал-
лах, например свинце, кадмии, олове
и др., вообще не удается получить
никелевого покрытия. Попутно следует
указать, что химическому никелированию
могут быть подвергнуты и некоторые неметаллические материалы,
как-то: керамика, стекло, полистирол и т. д. Поверхность неметал-
лических деталей перед этим должна быть активизирована.
Покрытия, полученные методом химического никелированияТ
имеют слоистую аморфную структуру: атомы Ni и Р располагаются
беспорядочно. Осадки имеют относительно невысокую твердость
и слабое сцепление с основные металлом. ^Качество осадков (твер-
дость, йзноссстойкость 1Г~прочность сцепления) резко повышается
но^ле^термияеской обработки, приводящей к изменению их ххрук-
ХУРьй-Котррая становится кристаллической. Образуются две фазы:
твердый раствор никеля с небольшим содержанием фосфора и хими-
ческое соединение Ni3P. Зависимость микротвердости рсадков
от режима термообработки приведена на фиг. 82. 13 0 время термооб-
работки происходит небольшая усадка покрытия. На фиг. 83 пока-
зана зависимость веса отслойвшегося^никелевого осадка от темпера -
туры во время термообработки. / *7X3/22/1^
См.
216
Часть третья. Технология нанесения металлических покрытий
Никельфосфорные покрытия деталей, не подвергающихся дефор-
мации, при толщине слоя не выше 5 мк могут применяться без
термообработки в случае их использования с целью антикоррозион-
ной защиты, поскольку термообработка несколько снижает стойкость
против коррозии. Термообработка стальных деталей произво-
дится при 300—400°, медных, латунных и алюминиевых — при
200—220°.
Осадки, получаемые в кислых растворах, по данным ряда иссле-
дований, отличаются меньшей пористостью, чем получаемые в щелоч-
Фиг. 82. Влияние режима термообра-
ботки на твердость никельфосфорных
покрытий (no С. А. Вишенкову):
I — 9% Р; 2 - 5% Р.
Фиг. 83. Влияние темпе-
ратуры термообработки
на хрупкость никельфо1-
форных покрытий (по
С. А. Вишенкову).
ных растворах. Получаемые в кислых электролитах осадки при
толщине слоя выше 12 мк практически беспористы.
Никельфосфорные покрытия можно наносить в кислых (pH =
= 4—6) или щелочных (pH = 8—10) растворах. Химическое нике-
лирование деталей из алюминиевых сплавов производится в щелоч-
ных растворах. Для химического никелирования могут быть исполь-
зованы растворы, приведенные в табл. 71. •
В качестве щелочного раствора для химического никелирования
может быть рекомендован следующий состав:
Никель сернокислый ... ........................... 35—55 Г.’л
или хлористый никель............................... 20—25 »
Гипофосфит натрия.............................. . 20—25 »
Лимоннокислый натрий ... . . 30—45 »
Хлористый аммоний......................... . . . 30—35 »
Аммиак (25) ..................... . . 70—100 мл!л
pH................................................ 8—8,5
Температура ...................................... 85—88°
Глава XI. Никелирование
217
Таблица 71
Составы и режим работы при химическом никелировании в кислых электролитах
Наименование компонентов и режим работы Содержание в Г/л в растворах
№ 1 № 2 № 3
Хлористый никель NiCl2-6H2O 30 — —
Сернокислый никель NiSO4-7H2O — 30 20
Гипофосфит натрия NaH2PO2 10 15 20
Уксуснокислый натрий NaC2H3O2 10 — 8
Яблочная кислота — 30 —
pH (начальное значение) 4,9—5,2 5—6 5—6
Температура в °C 83—87 86—92 90—92
Между величиной никелируемой поверхности s и объемом v
раствора существует определенное соотношение. Считают, что боль-
шая скорость никелирования и лучшее использование раствора
достигаются при отношении s : и > 1,0. При прочих равных усло-
виях плотность загрузки влияет также на качество осадков. В прак-
тике используют загрузки, близкие к s : v = 1-н5.
Химическое никелирование может осуществляться в непроточных
и проточных растворах. На подавляющем большинстве предприятий
применяются непроточные растворы; при таком способе никелирова-
ние деталей ведут до значительного истощения раствора. Если за это
время не будет достигнута требуемая толщина, то детали переносят
в другой реактор со свежим раствором.
Скорость осаждения никеля в свежем растворе составляет при
плотности загрузки 1 дмЧл примерно 12—14 мк!ч. Кислые растворы
с трудом поддаются корректировке. Более легко корректировать
щелочные растворы, так как, добавляя в ванну основные компоненты
вместо израсходованных, можно благодаря комплексообразующим
свойствам аммиака и лимоннокислого натрия длительное время
поддерживать скорость осаждения никеля на постоянном уровне.
pH раствора поддерживается периодическим добавлением 25-про-
центного аммиака. Добавка гипофосфита производится из расчета
5—6 Г на получение 1 Г металлического никеля.
Никелирование производится в стеклянных, фарфоровых или
железных эмалированных ваннах. Могут быть использованы желёз-
ные ванны, футерованные полиэтиленовой пленкой или термостойким
пластикатом. Некоторые предприятия используют обкладки из раз-
личных мастик. В частности, рекомендуется мастика, составленная
из равных количеств окиси хрома и резинового клея Б-88, измельчен-
ных в шаровой мельнице и растворенных в смеси бензина Б-70
с бутил- или этилацетатом в соотношении 1 : 2.
218 Часть третья. Технология нанесения металлических покрытий
8. УДАЛЕНИЕ НЕДОБРОКАЧЕСТВЕННЫХ НИКЕЛЕВЫХ ПОКРЫТИЙ
Удаление недоброкачественных никелевых покрытий со сталь-
ных, медных и латунных деталей производится электрохимическим
растворением никеля в растворе серной кислоты (уд. вес 1,74), к кото-
рому добавляется до 10 Пл глицерина. Анодная плотность тока
3—8 а/дм2, температура раствора 18—25°. Катоды — свинец. Реко-
мендуется применение реверсированного тока.
Удаление никеля со стальных деталей может быть осуществлено
также в растворе, содержащем 300—400 Пл азотнокислого натрия,
при анодной плотности тока порядка 10 а/дм2 и температуре 90°.
Удаление никеля с деталей, отлитых под давлением из цинко-
вых сплавов, производится в 50-процентном растворе серной кислоты
при плотности тока 3—6 а/дм2 и температуре 65°.
ГЛАВА XII
ХРОМИРОВАНИЕ
1. ОБЩИЕ СВЕДЕНИЯ
Электролитический хром — серебристо-белый металл с синева-
тым оттенком, отличающийся высокой твердостью и хрупкостью.
Хром был впервые электролитически получен в 1854 г. Однако
промышленное значение процесс хромирования получил только
в двадцатых годах текущего столетия. Первоначально хромирование
применяли в декоративных целях, но уже в тридцатых годах оно стало
широко использоваться для получения износостойких покрытий,
а также для восстановления изношенных частей деталей машин
и станков. В настоящее время хромирование наряду с цинкованием
и никелированием является одним из наиболее распространенных
видов покрытий.
Атомный вес хрома 52,01; удельный вес 6,9 — 7,1 Псы?', тем-
пература плавления 1750 —1800°; электрохимический эквивалент
0,323 Па-ч\ стандартный потенциал Сг/Сг++ равен —0,56 е, Сг++/Сг+++
составляет —0,41 в и Сг+++/Сг++++++ равен 4-1,3 в. Твердость хрома
колеблется в широком интервале: от 300 до 1100 кГ/мм*.
Хром вполне устойчив во влажной атмосфере, в атмосфере серо-
водорода и сернистого газа, в растворах щелочей, азотной кислоты
и органических кислот. Галоидоводородные кислоты и горячая кон-
центрированная серная кислота растворяют хромовые покрытия.
В растворах щелочи хром легко растворяется под действием тока.
В атмосферных условиях хром сохраняет цвет и блеск длительное
время, что объясняется образованием на его поверхности тонкой,
но очень прочной окисной пленки. Наличием этой пленки объясняется
высокая антикоррозионная стойкость хромовых покрытий. На воз-
духе (в присутствии влаги) и в окислительных средах хром принимает
потенциал +0,2 в, т. е. хромовые покрытия являются катодными
по отношению к стали. Поэтому защитные хромовые покрытия
должны быть беспористыми.
Электролитические слои хрома хорошо сцепляются со сталью,
никелем, медью и ее сплавами при тщательном проведении подгото-
вительных операций и соблюдении режима хромирования. Наносить
поверх хромовых покрытии другие металлы трудно, так как в этом
случае сцепление отсутствует (из-за окисной пленки нав хроме).
220
Часть третья. Технология нанесения металлических покрытий
Физико-механические свойства электролитического хрома (струк-
тура, твердость, хрупкость, внешний вид, износоустойчивость
антикоррозионная стойкость и т. д.) зависят в сильной степени
от режима хромирования.
Важнейшими областями применения электролитического хроми-
рования являются:
1) защита от износа и придание поверхности деталей высоких
антикоррозионных свойств;
2) восстановление изношенных деталей машин;
3) защита от коррозии при высоких температурах;
4) защитно-декоративная отделка деталей.
Хромирование в ряде случаев позволяет применять при изготов-
лении деталей вместо высоколегированной стали низколегированную
или даже нелегированную сталь.
Примерная толщина износоустойчивых хромовьпРйокрытий для
различных изделий приведена в табл. 72.
Таблица 72
Толщина износоустойчивых хромовых покрытий для различных изделий
Наименование изделия Толщина слоя в мк
Мерительный инструмент (пробки, скобы, шаблоны) 50—100
Режущий инструмент 5—8
Резьбовые калибры 2—20
Пресс-формы для пластмассы или стекла, штампы, печатные 20—60
ДОСКИ
Детали машин (шейки валов, ступицы зубчатых колес, пальцы, червяки, винты, оси и т. д.) 50—100
Матрицы, пуансоны 50—100
Гильзы цилиндров 100—300
Поршневые кольца 100—150
При нанесении многослойных покрытий толщина слоя хрома
обычно не превышает 0,5—3 мк.
2. ОСОБЕННОСТИ ПРОЦЕССА ХРОМИРОВАНИЯ
Механизм образования осадков хрома
В отличие от большинства электролитов, применяемых при
нанесении гальванических покрытий,, хромирование производится
в электролитах, содержащих не соли осаждаемого металла, а хромо-
вую кислоту. При этом установлено, что в электролитах, содержа-
Глава XII. Хромирование
221
щих ионы одной хромовой кислоты, процесс не может быть осущест-
влен. Электролит должен содержать определенное количество посто-
ронних анионов; чаще всего серную кислоту или фториды.
Механизм осаждения хрома, по-видимому, весьма сложен и еще
не вполне ясен. Разные исследователи придерживаются различных
точек зрения на природу происходящих на катоде процессов. Наибо-
лее экспериментально обоснованная теория, развиваемая совет-
скими учеными А. Т. Баграмяном, М. А. Шлугером и др., может быть
коротко изложена в следующем виде.
Осаждение хромового покрытия.протекает при наличии на катоде
коллоидной пленк'и^которая образуется в самом начале электролиза,
В отсутствие этой пленки (а она не может образоваться, если в рас-
творе хромовой кислоты'нет ионов SO4_~ или F") возможно только
восстановление хрома до трехвалентного или- выделение водорода.
Что представляет собой катодная пленка, выяснить пока не уда-
лось, так как толщина ее очень мала существует она только
в течение того времени, пока идет электролизу сразу после
выключения тока она растворяется в электролите. Тем не менее
существование ее доказано прямыми опытами. В состав этой пленки
входят шестивалентный и трехвалентный хром, а также ионы SO4" ~
(если ванна содержит серную кислоту).
Предполагается, что на катоде протекают следующие процессы:
ионы серной и хромовой кислот образуют хроматно-сульфатный комп-
лекс, который восстанавливается выделяющимся водородом. При этом
в прикатодном слое накапливаются ионы трехвалентного хрома и сни-
жается pH. Ионы трехвалетного хрома вступают во взаимодействие
с хроматно-сульфатным комплексом, образуя коллоидную пленку.
Возникновение пленки препятствует доступу шестивалентного хрома
к катоду, поляризация резко возрастает, и становится возможным
восстановление трехвалетного хрома до металла.
Поскольку осаждение хрома происходит при отрицательном потен-
циале, а водородное перенапряжение на хроме мало, процесс сопро-
вождается обильным выделением водорода. В обычно применяемых
электролитах выход по току составляет 10—15%.
Структура и свойства электролитического хрома
Анализ осадков хрома обнаруживает значительное содержание
в нем кислорода, что указывает на наличие в металле примеси окис-
лов или других кислородсодержащих соединений. Кроме того, элект-
ролитический хром содержит значительные количества растворенного
водорода.
Включение в осадок неметаллических веществ нарушает нормаль-
ный ход электрокристаллизации, поэтому осадки хрома отличаются
чрезвычайно мелкой кристаллической структурой. При микроскопи-
ческом исследовании поперечных шлифов ее вообще не удается обна-
ружить, в то время как осадки других металлов, в том числе осадки,
222
Часть третья. Технология нанесения металлических покрытий
получаемые из цианистых электролитов, имеют четко выраженное
кристаллическое строение. Лишь рентгеновским методом можно уста-
новить кристаллический характер электроосажденного хрома.
Фиг. 84. Зависимость твердости
осадков хрома от температуры
и плотности тока:
Фиг. 85. Влияние режима
хромирования на потери
в весе при сжатии (толщина
слоя 0,1 мм).
Режим хромирования:
I — i = 50*: 2 - t = 65°:
3 — t = 80°.
1 —10 а/дм2; 2 — 20 а/дм*-, 3 —
50 а/дм2; 4—100 а/дм2; 5—500 а/дм2.
Состав электролита: CrOs — 250 Г/л;
H,SO4 — 2,5 Г/л.
Особенностями строения осадков хрома обусловлены их специ-
фические свойства. Хромовые покрытия имеют очень высокую твер-
Фиг. 86. Влияние толщины слоя
хрома на потери в весе при
сжатии.
Режим хромирования:
1 — DK = 40 а/дм2; i = 65°;
2 — £>,. = 20 а/дм2, t = 65°.
дость, значительно превышающую твер-
дость закаленной стали (в то время
как металлургический хром — относи-
тельно мягкий металл).
На фиг. 84 показана зависимость
твердости осадков хрома от условий
их получения. Приведенные кривые
зависимости твердости от температуры
проходят через максимум, смещающийся
в сторону высоких температур при уве-
личении плотности тока.
Хромовые покрытия отличаются по-
вышенной хрупкостью. На фиг. 85 и
86 показано влияние режима хромиро-
вания и толщины хромового слоя на
хрупкость, определяющуюся методом
сжатия хромированных образцов и уста-
новления веса осыпавшегося хрома.
Кривые свидетельствуют о том, что при повышении температуры
электролиза и постоянной плотности тока хрупкость хрома снижается
и, наоборот, при повышении плотности тока и постоянной темпера-
Глава XII. Хромирование
223
ре хрупкость-повышается. С увеличением толщины слоя хрома
хрупкость его также повышается.
1 Осадкам хрома свойственны высокие внутренние напряжения.
В ряде случаев они настолько велики, что превосходят предел проч-
ности металла; тогда осадки, достигнув некоторой толщины, растрес-
киваются. Поверх растрескавшегося нарастает новый слой, который
спустя короткое время тоже растрескивается. Таким образом, хро-
мовое покрытие оказывается прони-
занным густой сеткой трещин. Такое
строение характерно, в частности,
для блестящего хрома. Границы ре-
жимов хромирования, при которых
происходит растрескивание осадков,
Фиг. 88. Влияние продолжи-
тельности хромирования на
число перегибов (£>к =
30 а! дм1).
Фиг. 87. Граница осадков хрома,
имеющих и не имеющих сетки тре-
щин (по Ю. Б. Федорову).
показаны на фиг. 87. При повышенной температуре электролита
внутренние напряжения уменьшаются и число трещин сокращается.
Осадки «молочного хрома» беспористы.
Высокие внутренние напряжения вызывают не только растрес-
кивание хромовых покрытий и, следовательно, уменьшение их защит-
ных свойств, но также снижение усталостной прочности стальных
деталей, причем снижение предела усталости растет с увеличением
толщины слоя хрома.
Влияние осадков хрома 'на механические свойства покрываемого
материал^ .может быть иллюстрировано изменением числа перегибов,
которое выдерживают стальные пластины до и после хромирования
(фиг. 88). После прогрева хромированных пластин прочность их
восстанавливается, хотя и не до исходного состояния (фиг. 89).
часть третья. Технология нанесения металлических покрытий
Медленное восстановление прочности пластин происходит и при
обычной температуре (фиг. 90). 1
Фиг. 89. Влияние прогрева на из-
менение числа перегибов:
1—число перегибов; 2—потери в весе.
Фиг. 90. Влияние длительности хранения
на число перегибов хромированных сталь-
ных образцов.
При нагревании осадков электролитического хрома происходит
выделение водорода, поглощенного при электролизе. Около 80%.
Фиг. 91. Влияние температуры
прогрева на твердость электро-
литического хрома:
1—Пк — 60 а/дм*, /=65‘: 2-£>к=
= 40 а/дм*, /=65*; 3—£>к=20 а/дм*.
t=G5"; 4—DK — 30 а/дмг, /=80°.
Фиг. 92. Влияние температуры на
хрупкость хромовых осадков:
1—DK — 30 а/дм*, /=80°; 2— 1>к— 20 а/дм1,
t = 65°; 3 — DK — 40 а/дм*. t — 65°;
4— £>к = 60 а/дм*; 1=65°.
всего водорода освобождается при нагревании до 300°, а оставшиеся
20% — только при значительно более высокой температуре. При тем-
пературе около 900° начинается рекристаллизация хрома. Соответ-
Глава XII. Хромирование
225
ственно изменяются и механические свойства хромовых покрытий.
На фиг. 91 показано уменьшение твердости электролитического
хрома под влиянием прогрева при различных температурах. При на-
гревании до 900° твердость снижается до 250—300 кПмм2, т. е. до зна-
чения, присущего металлургическому хрому. Металл при этом приоб-
ретает нормальную кристаллическую структуру. Хрупкость осадков
также снижается в результате прогрева (фиг. 92).
Фиг. 93. Характер скалывания хрома при сдавливании цилиндрических образцов.
При нагревании улучшается сцепление хромовых покрытий
с основным металлом. Однако нагрев не должен превышать 600°,
так как при этом на границе между сталью и хромом образуется хруп-
кий карбидный слой, по которому происходит отслаивание при дефор-
мации образцов. Характер скалывания хрома при сдавливании
цилиндрических образцов показан на фиг. 93. Минимальное скалы-
вание наблюдается после прогрева при 600°. Скалывание зависит
также от условий нанесения хромового покрытия.
3. ВИДЫ ХРОМОВЫХ ПОКРЫТИЙ И ИХ НАЗНАЧЕНИЕ
В зависимости от режима электролиза могут быть получены
осадки хрома с различными свойствами. Условно хромовые покры-
тия разделяются на следующие виды:
J5 Вайнер и Дасоян
226
Часть третья. Технология нанесения металлических покрытий
1) м о л о ч н ы е — получаются при температуре 65° и выше
и сравнительно невысоких плотностях тока; характеризуется твер-
достью порядка 250—750 кПмм2 и отсутствием сетки трещин в тон-
ких слоях;
2) блестящие — получаются при температурах 45—60°
при средних плотностях тока; обладают твердостью порядка 750—
900 кГ1мм2 и широко разветвленной сеткой трещин;
3) матовые — получаются при высокой плотности тока
и сравнительно низкой температуре, характеризуются высокой твер-
достью, хрупкостью и наличием сетки трещин.
Следует упомянуть еще о так называемом мало напряжен-
ном хроме, осаждаемом при высоких температурах (порядка
90°) и высоких плотностях тока (90—100 а/дм2). Осадки, получаемые
в данных условиях, отличаются беспористостыо, высокими механи-
ческими свойствами и малой усадкой при нагревании.
Декоративное, защитное и защитно-декоративное хромирование
При декоративном и защитно-декоративном хромировании сталь-
ные детали, как правило, подвергают меднению в цианистой и кислой
ваннах, никелированию и блестящему хромированию. Толщина слоя
хрома при декоративном и защитно-декоративном хромировании,
как правило, не превышает 2 мк. Если применение цианистых элект-
ролитов нежелательно, то можно принять следующую схему нанесе-
ния многослойных покрытий: никелирование, меднение в кислом
электролите, никелирование и хромирование. Некоторые рекомен-
дуют хромирование производить по подсл'ою цинка или кадмия.
Медные и латунные детали, предназначенные для эксплуатации
в средних и жестких условиях, перед хромированием предварительно
покрывают слоем никеля, а детали, предназначенные для легких
условий службы, хромируются непосредственно.
Стальные детали могут быть достаточно надежно защищены от кор-
розии в атмосферных условиях однослойным хромированием, причем
толщина слоя хрома должна быть не меньше 40 мк (осадки «молоч-
ного» хрома).
В случае,- если в процессе эксплуатации детали подвергаются
нагреву, предпочтительно применение малопапряженного хрома.
Если .хромовые покрытия должны предохранять не только от износа,
но и от коррозии, их следует покрывать «молочным» хромом. Для обес-
печения надежной защиты деталей хромом рекомендуется поверх-
ность их обработать по 7—8-му классу чистоты.
Износоустойчивое хромирование
Хромирование с целью повышения износоустойчивости де^^й
машин или станков, а также с целью восстановления изр/^
размеров, как правило, производится без нанесения про*'
Глава XII. Хромирование
227
сЛоев. Толщина хромовых покрытий в этих случаях колеблется
в очень широких пределах и может достигать нескольких сотен
мИкроп. Отлагаемые толстые слои хрома зачастую подвергают
доводке или шлифованию.
При износоустойчивом хромировании применяются обычно раз-
бавленные электролиты, обеспечивающие наибольшую равномерность
и скорость осаждения хрома, а также возможность работы при высо-
ких плотностях тока и получения осадков с высокими механическими
свойствами.
При износоустойчивом хромировании необходимо особое внима-
ние уделить выбору конструкции подвесок и правильному монтажу
деталей в них. Конструкции подвесок должны обеспечивать макси-
мально равномерное осаждение хрома по всей покрываемой поверх-
ности деталей. Для улучшения равномерности осаждения хрома
на деталях сложной конфигурации применяют профилированные
аноды. На рабочих участках и в углублениях не должны скапли-
ваться пузырьки водорода, создающие газовые мешки и препятствую-
щие отложению хрома. В углублениях необходимо помещать допол-
нительные аноды При хромировании труб должны применяться внут-
ренние аноды.
^лектролиты для хромирования]
Состав электролитов и режимы работы
Состав электролитов,' чаще всего применяемых при хромирова-
нии, и режимы их работы приведены в табл. 73.
Таблица 73
Составы электролитов для хромирования и режимы работы
Наименование компонентов и режим работы ¥ Содержание в Г/л в растворах
№ I / № 2 № 3
Хромовый ангидрид 150 250 350
Серная кислота 1,5 2,5 3,5
Режим р а б о т ы
Плотность тока в а!дм2 45—100 15—60 10—30
Температура в “С 55—65 45—55 35—45
—-—- — _
Характеристика хромовых электролитов, приведенных в табл. 73,
Дана в табл. 74.
Скорость осаждения хромовых покрытий и толщина слоя хрома,
получаемая в единицу воемени, в основном зависят от применяемой
15*
228
Часть третья. Технология нанесения металлических покрытий
Характеристика хромовых электролитов
Таблица 74
Номер электро- лита (табл. 73) Техническая характеристика Область применения
1 ч 2 3 Выход по току 13—15%. Рассеиваю- щая способность выше, чем у других хромовых электролитов. Твердость осад- ков высокая. Интервал температуры и плотности тока, при которых полу- чаются блестящие осадки, невелик. По- тери электролита меньше, чем в более концентрированных электролитах. Воз- можно применение высоких плотностей тока. Состав электролита меняется до- вольно быстро в процессе работы Выход по току 12—14%. Рассеивающая способность средняя. Рабочий интервал широкий. Состав электролита изменяется медленно Выход потоку 10—12%. Рассеивающая способность низкая. Кроющая способ- ность хорошая. Рабочий интервал широ- кий. Электролит стабилен Твердое (износостойкое) хромирование Декоративное и износо- стойкое хромирование де- талей простой и сложной формы. Хромирование по никелю, меди и т. д. Декоративное хромиро- вание по медному и нике- левому подслоям деталей простой $ сложной формы
плотности тока, температуры электролита и концентрации хромового
ангидрида. Все эти факторы оказывают существенное влияние
нд выход по току.
Данные о продолжительности осаждения хрома приведены
в табл. 75.
Качество хромовых покрытий в значительной степени опреде-
ляется соотношением количеств хромового ангидрида и серной
кислоты. Величина отношения CrO3 : H2SO4 должна находиться
в пределах 90—120.
Концентрация хромового ангидрида в электролите может
меняться в довольно широких пределах без заметного ухудшения
качества осадка. Однако с увеличением количества хромового
ангидрида при прочих равных условиях, как видно из кривых
фиг. 94, выход по току падает. Рабочий интервал — отношение
верхнего и нижнего значений плотности тока, при которых полу-
чаются блестящие осадки,—сужается с увеличением концентрации
хромовой кислоты. Рассеивающая способность электролита при этом
также уменьшается.
В концентрированных электролитах отношение количества хро-
мового ангидрида к количеству серной кислоты меняется не так
Глава XII. Хромирование
229
Таблица 75
Продолжительность осаждения хрома (в мин.) при выходе по току 13%
Толщина слоя хрома в мк Плотность тока в а/дм2
10 15 25 35 50 75 100
1 10 6,5 4,0 3,0 2,0 1,3 1,0
3 29 20 12 8,0 6,0 4,0 3,0
5 49 33 20 14 10 6,5 5,0
7 69 46 28 20 14 9,2 7,0
10 98 65 39 28 20 13 10
50 491 327 196 140 98 65 49
100 981 654 392 280 196 130 98
400 3925 * 2615 1569 1121 785 520 392
Концентрация сульфатов
Фиг. 94. Влияние концентрации суль-
фатов на выход по току в хромовых
электролитах при различном содер-
жании в них хромового ангидрида:
1 — 75 Г/Л-, 2 — 250 Г/л; 3 — 500 Г/л.
быстро, как в разбавленных. Как уже указывалось, отношение
хромового ангидрида к серной кислоте или сульфат-иону должно
быть постоянным. Так как это отношение близко к 100, то ясно,
что содержание сулы' ат-ионов не
может меняться в широких пре-
делах. При минимальной концен-
трации сульфатов выход по току
выше при малых плотностях тока
и ниже при больших. Увеличение
содержания SO4 до отношения
СгО8 : SO4 = 50 : 1 приводит к
ухудшению- рассеивающей и кро-
ющей способности. Увеличение со-
держания трехвалентного хрома
приводит к повышению вязкости
растворов и снижению электро-
проводности. Сужается интервал
плотностей тока, при которых по-
лучаются блестящие осадки. С уве-
личением содержания трехвалент-
ного хрома (15—20 Г/л) осадки
становятся хрупкими, а при зна-
чительной концентрации трехвалентного хрома получаются темные
осадки, так же, как при недостаточном содержании сульфатов или
пРи низких температурах. Примеси железа в хромовых электро-
литах действуют примерно так же, как и трехвалентный хром. При-
сутствие азотной кислоты вредно влияет на работу хромовых ванн.
230
Часть третья. Технология нанесения металлических покрытий
Особенно большое влияние на нормальную работу хромовых
электролитов оказывают плотность тока и температура; при этом
оба фактора находятся в тесной взаимозависимости и с изменением
одного надо менять другой. При увеличении температуры электро-
лита снижается выход по току (фиг. 95), уменьшается рабочий интер-
вал, повышается испарение электролита и должна быть повышена
плотность тока. Наряду с
Фиг. 95. Влияние температуры
на выход по току в хромовых
электролитах при различной
плотности тока:
1 — 5 o/(?jw2; 2 — 10 а/дм2*, 3 —
22 а/дм2\ 4 — 45 а/дм\ 5—85 а/дм2.
этим при повышении температуры пони-
жается и твердость хромовых осадков.
При увеличении плотности тока вы-
ход по току повышается. Для каждой
температуры хромирования существует
определенный минимум плотности тока,
ниже которого уже не происходит вы-
деление металлического хрома. Чем вы-
ше температура хромирования, тем выше
нижний предел плотности тока. Рассеи-
вающая способность электролитов не-
сколько улучшается с увеличением
плотности тока. Для получения опти-
мальной рассеивающей способности
при осаждении блестящих хромовых
покрытий процесс хромирования осуще-
ствляют при сравнительно высокой
плотности тока и высокой температуре.
Особенности процесса хромирования деталей из различных металлов
Медные или латунные детали при хромировании во избежание
их растравливания следует опускать в электролит под током. Перед
погружением в электролит их необходимо прогреть в горячей воде.
Стальные и железные детали прогревают непосредственно в хро-
мовой ванне или в ванне для анодного декапирования. Перед началом
хромирования рекомендуется анодное декапирование в хромовом
электролите в течение 0,5—3 мин. В начале хромирования нужен
«толчок» тока, т. е. ведение процесса в течение 0,5—1,0 мин. при
плотности тока, превышающей нормальную в 2—3 раза.
При осаждении хрома на хромовый слой необходимо после «обрат-
ного» тока продолжительностью до 0,5 мин. начать хромирование
при пониженной плотности тока, которая в течение 3—5 мин. должна
быть доведена до нормы.
Чугунные детали перед хромированием обезжиривают только
химически и тщательно протирают опилками или венской известью.
При хромировании деталей из нержавеющей^ стали анодное
декапирование или вовсе не применяется, или применяется в течение
очень непродолжительного времени. В начале хромирования реко-
мендуется на 1—2 мин. дать «толчок» током, превышающим по силе
в 2—3 раза нормальный. После этого детали хромируют как обычно.
Глава XII. Хромирование
231
циеся при хромировании. Таблица 76 и способы их устранения
Неполадки, встречаю!
Признаки неполадок Причины образования Способы устранения
Отслаивание хромо- вых осадков а) Плохая подготовка б) Длительные пере- рывы тока а) Улучшить подготовку, проверить время анодного декапирования б) Предотвратить возмож- ность перерывов тока
- в) Недостаточный прогрев деталей перед хромированием г) Неметаллические включения в основном металле д) Низкая концентра- ция хромового ангид- рида в) Прогреть детали г) Улучшить обработку деталей д) Откорректировать электролит
Отслаивание хрома а) Недостаточная а) Увеличить толщину
вместе с никелем толщина никелевого подслоя б) Слишком большая продолжительность хро- мирования в) Плохая подготовка перед никелированием подслоя никеля б) Откорректировать вре- мя хромирования в) Улучшить подготовку
Матовые осадки а) Низкая темпера- тура б) Недостаточный прогрев деталей перед включением тока а) Повысить температуру электролиза б) Улучшить прогрев де талей
Матовые пятна а) Высокая плотность тока б) Прополировка подслоя никеля в) Примеси железа г) Слишком большое содержание серной ки- слоты а) Отрегулировать силу тока б) Увеличить толщину слоя никеля в) Заменить часть элек- тролита новым г) Осадить серную кис- лоту при помощи бариевых солей
Пригар на краях Большая плотность тока на краях Установить экраны, за- круглить края
Коричневые пятна а) Примеси железа б), Велико содержа- ние трехвалентного хрома в) Недостаточное со- держание серной кис- лоты а) Заменить часть элек- тролита б) Окислить трехвалент- ный хром в) Добавить серную кис- лоту
232
Часть третья. Технология нанесения металлических покрытий
Продолжение табл. 76
Признаки неполадок Причины образования Способы устранения
Радужные пятна Незахромированные участки Наличие отдельных точек и пор на хроми- рованной поверхности Видимые невоору- женным глазом тре- щины в слое хрома и в стали Темные осадки, рас- творение свинцовой об- кладки ванны. Прекра- щение осаждения хрома ! Серый слой хрома на нижней поверхности вертикально подвешен- ных деталей Неравномерное рас- пределение хрома по толщине Высокое напряжение на клеммах ванны На некоторых участ- ках покрытие блестя- щее, иа других — мато- вое а) Недостаточное со- держание серной кис- лоты б) Окисление подслоя а) Плохое обезжири- вание б) Остатки окислов в) Возникновение га- зовых мешков г) Наличие отверстий в деталях д) Соприкосновение деталей а) Поры и раковины в металле б) Пузырьки водо- рода задерживаются на поверхности деталей Наличие закалочных напряжений в стали Наличие азотной кис- лоты в хромовом элек- тролите Недостаточное рас- стояние от дна ванны до деталей а) Слишком толстое наслоение хрома с не- профили рован ними анодами б) Образование пленки на анодах Слишком большое со- держание трехвалент- ного хрома а) Велика плотность тока б) Низкая темпера- тура в) Неодинаковая плотность тока на всех деталях а) Добавить серную кис- лоту б) Улучшить декапирова- ние перед хромированием а) Улучшить обезжирива- ние б) Улучшить травление и декапирование в) Проверить правиль- ность завешивания деталей г) Заделать отверстия свинцовыми пробками д) Проверить расположе- ние деталей в ванне а) Улучшить механиче- скую подготовку деталей б) Улучшить подвешива- ние деталей. Периодически встряхивать их Прогреть детали перед хромированием при 150— 180°. Хромировать при низ- кой температуре и плотности тока Заменить электролит Перевесить детали в ванне а) Подобрать аноды соот- ветствующей формы б) Зачистить аноды Окислить трехвалентпый хром а) Снизить плотность тока б) Отрегулировать темпе- ратуру в) Применить вспомога- тельные аноды пли экрану /
Глава XI1. Хромирование
233
Никелированные’детали следует хромировать сразу после извлече-
ния из никелевой ванны, подвергнув их лишь декапированию
и промывке. Хранившиеся некоторое время детали хромируются
с трудом.
Электрополированные детали рекомендуется погрузить на корот-
кое время в 3—5-процентный раствор соляной кислоты.
Хромирование деталей, изготовленных из деформируемых алю-
миниевых сплавов, рекомендуется проводить после двойной
цинкатной обработки. Некоторые рекомендуют перед хромиро-
ванием производить цинкатную обработку, нанесение слоя ни-
келя толщиной 15—20 мк и термообработку при 220—250° в тече-
ние 30 мин.
Детали из литейных алюминиевых сплавов после обезжиривания
и травления можно без добавочной обработки подвергать хромиро-
ванию.
Хромирование деталей из магниевых сплавов рекомендуется
производить после контактного осаждения цинка из пирофосфатного
раствора и меднения в цианистом растворе до получения слоя
толщиной в 3—5 мк.
Детали из титановых сплавов перед хромированием обезжи-
ривают органическими растворителями, подвергают травлению
в смеси азотной и плавиковой кислот, а затем анодному травлению
в растворе, содержащем 6 вес. % плавиковой кислоты, 6% фтористого
цинка и 88% этиленгликоля. Сцепление хрома с титаном улучшается
в результате термообработки в течение 2 мин., при 800°.
Азотированные стальные детали могут подвергаться хроми-
рованию после удаления поверхностного наиболее богатого нитри-
дами слоя.
Стальные детали перед блестящим хромированием должны быть
обработаны по 7-му или более высокому классу чистоты. Медные
или латунные детали могут быть обработаны по 4-му и последующим
классам. Если поверхность деталей не должна быть блестящей,
то слой хрома можно наносить на детали, изготовленные по 4-му
и более высоким классам чистоты.
Неполадки в работе электролитов для хромирования и способы
их устранения приведены в табл. 76.
Приготовление электролита и его корректирование
Электролиты для хромирования рекомендуется готовить на ди-
стиллированной воде или конденсате. Необходимое количество
хромового ангидрида загружают в ванну с водой; хорошо куски
аигидрида поместить в перфорированный винипластовый или свин-
цовый бачок, либо в корзину, которые подвешиваются в ванне,
створ хромовой кислоты тщательно перемешивают и дают ему
устояться в течение суток. Обычно технический хромовый ангидрид
держит достаточную примесь сульфатов, поэтому необходимость
234
Часть третья. Технология нанесения металлических покрытий
введения в ванну серной кислоты определяют после взятия пробы
на анализ.
По данным анализа корректируют электролит до нормального
содержания составных частей, перемешивают и производят хромиро-
вание на пробных катодах.
В случае избытка в электролите серной кислоты для ее удаления
применяется гидрат окиси бария или свежеосажденный углекислый
барий. Для осаждения 1 Г серной кислоты требуется примерно
2 Г углекислого бария. После добавления в ванну, нагретую
до 45—60°, гидрата окиси бария или углекислого бария раствор
тщательно перемешивают и отстаивают в течение суток. Сернокислый
барий оседает на дно и не влияет на последующее хромирование.
Для корректирования хромовых электролитов необходимо в за-
пасном баке приготовить концентрированный раствор хромового
ангидрида, осадить находящуюся в нем серную кислоту, произвести
анализ и пользоваться им при необходимых добавках.
При накоплении в электролите больших количеств трехвалент-
ного хрома (больше 12—15 Г/л при концентрации CrOs 150 Г/л
и 15—20 Пл при концентрации 250 Г/л) раствор прорабатывают
постоянным током со свинцовыми анодами большой поверхности.
Анодная плотность тока примерно 1—1,5 а/дм2. В качестве катодов
применяют железные стержни небольшого диаметра. Катодная
плотность тока должна быть возможно большей. При наличии ванн
больших размеров целесообразно часть ванны выделить для непре-
рывной переработки электролита. Она осуществляется в отгоро-
женной части ванны или с применением дополнительных анодов
с катодами, помещенными в пористые сосуды и подвешенными таким
образом, чтобы края их были несколько выше уровня электролита.
Накопление в растворе больших количеств железа (больше
8—12 Г/л) нежелательно, так как при этом качество осадков ухуд-
шается и окисление трехвалентного хрома затрудняется. В этом
случае приходится электролит частично или полностью заменить
новым.
Аноды для хромирования
При хромировании рекомендуется применять аноды из чистого
свинца или лучше из сплава свинца с 7—10% сурьмы. Обычно при
хромировании употребляют аноды в виде полос шириной 50 мм
и толщиной 3—5 мм, хотя целесообразнее применять аноды в виде
стержней диаметром 10—15 мм. Образец приспособления со стержне-
выми анодами приводится на фиг. 96. Применять растворимые аноды
при хромировании нецелесообразно, так как растворение хрома
происходит значительно интенсивнее, чем его осаждение, и в^рас*
твор хром переходит преимущественно в виде трехвалентных ионов.
Размеры и расположение анодов оказывают чрезвычайно большое
Влияние на равномерность распределения толщины слоя хрома
Глава XII. Хромирование
235
на деталях и поэтому им приходится уделять много внимания.
В связи с тем, что при хромировании применяют высокие плотности
тока, необходимо всегда следить за чистотой и надежностью кон-
тактов. Для создания надежного контакта аноды припаивают к мед-
ным уголкам, которые при помощи болтов прикрепляются к анодным
штангам.
Отношение между анодной и катодной поверхностью должно
находиться в пределах от 1 : 2 до 2 : 3. Однако при хромировании
внутренних полостей в из-
делиях сложной формы со-
отношение это выдержать
не удается и площадь ано-
да оказывается в несколько
раз меньше поверхности ка-
тода. Это создает благо-
приятные условия для
образования трехвалент-
ного хрома, поэтому необ-
ходимо принять специаль-
ные меры для окисления
его до шестивалентного.
При хромировании Фиг. 96. Приспособление для хромирования со
крупных деталей, требую- стержневыми анодами,
щих больших токов, а
также при хромировании внутренних поверхностей рекомендуется
применение железных или медных анодов, покрытых слоем электро-
литического свинца. Для деталей, имеющих сложную конфигурацию,
нужно изготовлять аноды, все части которых находятся примерно
на одинаковом расстоянии от соответствующих частей покрываемых
деталей. Для этой цели следует применять листовой свинец тол-
щиной 1—2 мм.
Свинцовые аноды в процессе работы покрываются слоем перекиси
или хромовокислого свинца, увеличивающим переходное сопроти-
вление анодов. Поэтому рекомендуется ежедневно производить
чистку анодов стальными щетками. На ночь или при длительных
перерывах в работе ванны аноды должны быть вынуты из электро-
лита и погружены в воду. Очистку свинцовых анодов можно произво-
дить раствором соляной кислоты (1 : 1) или 10-процентным раствором
Щелочи; после обработки в кислоте или щелочи окисный слой легко
стирается. После удаления его аноды тщательно промывают водой.
При хромировании употребляют аноды следующего состава:
1) аноды из свинца: свинец не менее 98,5—99,3%, железо
не более 0,1%, кислород 0,005%, мышьяк — следы, висмут —
следы;
2) аноды из сплава свинца с сурьмой: свинец 92,5—93,3%,
сУРьма 6—7%, железо — 0,1%, мышьяк — следы, висмут — следы.
236
Часть третья. Технология нанесения металлических покрытий
5. ХРОМИРОВАНИЕ В САМОРЕГУЛИРУЮЩИХСЯ ЭЛЕКТРОЛИТАХ
Хромирование в электролитах с добавками серной кислоты
имеет ряд недостатков: выход металла по току низкий, обычно
колеблющийся в пределах 10—16%, к тому же непостоянный; состав
электролита и в частности отношение CrO3 : SO4 в процессе работы
изменяется.
Этот недостаток устранен в так называемых саморегу-
лирующихся электролитах для хромирования.
Принцип саморегулирования состоит в том, что ионы SO^ вво-
дятся в ванну не в виде серной кислоты, а в виде труднорастворимого
сульфата стронция, который берется в избытке, с тем чтобы часть
его находилась в твердом виде на дне ванны. Тогда концентрация
ионов SO4 в электролите будет все время постоянной, соответ-
ствующей растворимости сульфата стронция при рабочей температуре
ванны. Небольшое количество ионов Sr++ на процесс хромирования
влияния не оказывает.
Известно, что увеличения выхода по току при хромировании
можно достичь, если наряду с ионами SO^" вводить в электролит
ионы F- или SiF~~. Пользуясь тем, что растворимость кремне-
фторида калия K2SiFe невелика, можно вводить избыток этой соли
в ванну вместе с сульфатом стронция и получать таким образом
электролит, саморегулирующийся как по ионам SO~~, так и по
ионам SiF~ —. Саморегулирующийся комбинированный электро-
лит сульфатно-кремнефтористоводородного типа отличается высокой
стабильностью и повышенным использованием тока. Это делает
его особенно пригодным для износостойкого хромирования и восста-
новления с помощью хромирования изношенных деталей (т. е. в тех
случаях, когда требуется нанесение толстых слоев хрома).
Для приготовления саморегулирующегося электролита исход-
ные вещества берутся в следующих количествах (на 1 л):
Хромовый ангидрид................................ 200—300 Г
Сульфат стронция.................................5,5—6,5 »
Кремнефторид калия .............................. 18—20 »
Оптимальный режим работы этой ванны: температура 50—70°,
плотность тока 40—80 а/дм2. Выход по току составляет 17—19%.
Приготовление электролита заключается в растворении необ-
ходимого количества хромового ангидрида и в определении содержа-
ния СгО3 и SQF~. Нейтрализация избытка сульфатов производится
углекислым стронцием, который осторожно вводят в раствор
из расчета 1,53 Г SrCO3 на 1 Г H2SO4. После введения всех солей,
указанных в рецептуре, электролит нагревают до 50—60° и тща-
тельно перемешивают несколько раз.
Нагревание продолжается 16—18 час., после чего электролит
может быть пущен в эксплуатацию.
Глава XI1. Хромирование
237
При последующих корректировках электролита по хромовому
ангидриду нужно вместе с ним вводить углекислый стронций для
перевода сульфатов в осадок. Корректировку электролита по
SrS04 и K2SiF6 производят, когда поверхность отхромированных
деталей составит примерно 1 м2 на литр электролита. При этом
в ванну вводится 1 Г SrSO4 и 6 Г K2SiFe.
При хромировании в саморегулирующихся электролитах реко-
мендуется применять аноды из сплава свинец — олово (10% Sn),
сравнительно мало подвергающиеся разрушающему воздействию
электролита. На время перерывов в работе аноды помещают в ванну
с проточной водой. Ванны для хромирования рекомендуется футеро-
вать винипластом или, еще лучше, термостойким пластикатом толщи-
ной 2—3 мм. Это позволяет производить нагрев электролита при
помощи пароводяной рубашки.
Саморегулирующиеся электролиты менее чувствительны к изме-
нению температуры, чем обычные сернокислые хромовые электро-
литы. Отклонение температуры от предписанного режима допустимо
в пределах ±5°. Электролиты сравнительно мало чувствительны
к загрязнению раствора железом, медью и другими металлами.
Наряду с этим следует отметить, что саморегулирующийся электро-
лит оказывает растравливающее действие на некоторые металлы,
в том числе на железо; поверхность стальных деталей, находящихся
в ванне без тока, слегка подтравливается. Поэтому сложнопро-
филированные детали следует хромировать при высоких плотностях
тока или предварительно покрывать никелем.
Рассеивающая и кроющая способность саморегулирующегося
и обычного электролитов примерно одинакова.
6. ХРОМИРОВАНИЕ В ХОЛОДНЫХ ЭЛЕКТРОЛИТАХ
Хромирование в электролитах, не требующих специального
нагревания, имеет ряд преимуществ перед обычно применяемым
процессом хромирования: отпадают затраты на нагрев, необходи-
мость изготовления специальных ванн, становится возможным хро-
мирование в барабанах и колоколах. Эти электролиты имеют лучшую
рассеивающую способность и более высокий выход по току.
Для хромирования при комнатных температурах могут быть
применены следующие электролиты.
1. Сульфатно-фторидный электролит:
Хромовый ангидрид ....................... 235—250 Г/л
Серная кислота........................... 0,5—0,6 »
Фтористый натрий......................... 6—8 »
Температура электролита 18—25\ плотность тока 5—7 а/дм2;
выход по току составляет 10—16%. При хромировании мелких
Деталей в барабанах сила тока устанавливается из расчета 30—50 а
на 1—2 кГ деталей.
238
Часть третья. Технология найесения металлических покрытий
Наряду с преимуществами данный электролит имеет некоторые
недостатки, а именно: возможность получения доброкачественных
осадков только в тонких слоях и недостаточная стабильность электро-
лита .
Электролит следует периодически пополнять хромовым ангидри-
дом и фтористым натрием. Корректировку электролита фтористым
натрием в количестве 0,3—0,8 Г/л при двухсменной работе нужно
производить один раз в месяц. При недостатке фтористой соли
возникают шероховатость и пригар на углах.
2. Тетрохроматный электролит:
Хромовый ангидрид .... ............ 350—400 Г/л
Серная кислота................. .... 2,0—2,5 »
Едкий натр . ...... ... ... 40—60 »
Сахар .............................. 1—2 »
Режим работы: температура 17—23°, плотность тока
30—80 а/дм2.
В качестве анодов применяются свинцовые пластины или сплав
свинца с сурьмой. В процессе работы электролит рекомендуется
охлаждать.
Выход по току в тетрахроматном электролите составляет при-
мерно 30%. Рассеивающая способность его выше, чем у обычных
хромовых электролитов, работающих при повышенной температуре.
Осадки хрома имеют твердость порядка 350—400 кПмм2, легко
поддаются полированию, непосредственно после электролиза полу:
чаются матовыми. Осадки из тетрахроматных электролитов обла-
дают практически такой же пористостью, как и «молочный» хром
из обычных ванн. Внутренние напряжения, возникающие в покры-
тиях, намного ниже, чем при хромировании из обычных электро-
литов.
Тетрахроматный электролит рекомендуется применять:
1) для нанесения защитно-декоративных покрытий без подслоя
меди и никеля (толщина хромового покрытия при этом должна быть
в пределах 10—15 мк)-,
2) для восстановления деталей хромированием в тех случаях,
когда не требуется высокой твердости.
7. ПОРИСТОЕ ХРОМИРОВАНИЕ
Хромированная поверхность очень плохо смачивается жидко-
стями. Вследствие этого хромирование деталей, эксплуатируемых
в жестких условиях при высоких давлениях и температурах, не при-
водит к повышению износоустойчивости, так как смазка не удержи-
вается на хромовых покрытиях, что вызывает сухое или полусухое
трение.
Для улучшения смачивания хромированных поверхностей
и создания условий, способствующих хорошему удержанию смазки
и повышению износоустойчивости, рекомендуется трущиеся детали,
Глава XII. Хромирование
239
аботающие при повышенных температурах или давлении (цилиндры
двигателей, валы, поршневые кольца и т. д.) подвергать так назы-
ваемому пористому хромированию. При пористом
хромировании получаются износоустойчивые покрытия, поверхность
которых испещрена каналами и порами, удерживающими смазку.
Пористые хромовые покрытия могут быть получены механиче-
скими и электрохимическими способами.
К механическим способам получения пористости относятся виды
обработки, связанные с нанесением мельчайших углублений в виде
каналов или точек на детали перед хромированием. Углубления
в основном металле могут быть нанесены накаткой, пескоструйной
или дробеструйной обработкой, резцом, шлифовальным камнем и др.
Электрохимический способ получения пористости заключается
в анодной обработке деталей после хромирования в хромовом элект-
ролите; при этом на поверхности образуется видимая сетка пор.
Наиболее широкое применение получил электрохимический спо-
соб вследствие возможности регулировать степень пористости
а также благодаря его простоте и доступности.
Электрохимический процесс получения пористого хрома состоит
из двух основных операций: осаждения электролитического хрома
(хромирования) и анодного травления осадка с целью получения
на нем пористости (дехромирования).
Роль анодного травления заключается в выявлении сетки трещин,
характер которой определяется в основном режимом хромирования
(плотностью тока, температурой и продолжительностью).
Пористость хрома бывает двух типов:
1) канальчатая, представляющая собой беспорядочную сетку
множества пересекающихся ручейков, каналов различной ширины
и глубины;
2) точечная, напоминающая обработанную песком поверхность
с множеством вершин и углублений.
Для получения пористости канальчатого типа хромирование
производится при плотности тока 60 а/дм2 и температуре 60—65°.
Пористость точечного типа образуется при плотности тока 50 а/дм2 '
и температуре 50—52°. Следует иметь в виду, что тип пористости-
определяется главным образом температурой электролита. Колеба-
ния температуры в процессе электролиза не должны превышать ±1°.
Повышение температуры или плотности тока приводит к образо-
ванию редкой сетки каналов и увеличению ширины и глубины самих
каналов. Одновременное увеличение катодной плотности тока
и температуры электролита создает условия для образования широ-
ких каналов. Увеличение отношения СгО3 : SO4 в ванне приводит
к образованию слишком частой сетки трещин. Целесообразно под-
держивать отношение CrOs:H2SO4 в пределах 95 :110.
Режим анодного травления также играет важную роль в создании
пористости. Так, повышение анодной плотности тока приводит
240
Часть третья. Технология нанесения металлических покрытий
к увеличению ширины и глубины каналов. Повышение температуры
способствует уменьшению ширины каналов и увеличению их густоты
Увеличение продолжительности травления от 2,5 до 10 мин
развивает сетку трещин и их ширину до такой степени, что процент
пористости увеличивается примерно в 2 раза. С дальнейшим увели-
чением длительности травления площадки хрома, окруженные
со всех сторон каналами, постепенно уменьшаются и в конце концов
на поверхности могут остаться почти одни трещины.
Точных установившихся предпосылок для выбора типа пористо-
сти в настоящее время не существует. Обычно для поршневых колец
рекомендуют точечную пористость, для гильз цилиндров — пори-
стость канальчатого типа, с редкой сеткой глубоких каналов.
Существует несколько вариантов схемы технологического про-
цесса пористого хромирования. При одном из них травление произво-
дят сразу после хромирования, т. е. до механической обработки.
Указанный вариант удобен тем, что не требуется точно выдерживать
размеры деталей при хромиройании. К тому же образующиеся
при хромировании дендриты, неровности, наплывы и т. д. сошли-
фовываются при механической обработке.
По второму варианту механическая обработка предшествует
анодному травлению. При этом способе отпадает необходимость
в излишней толщине хромовых покрытий, поверхность их полу-
чается более гладкой и быстрее йрирабатывается.
Анодное травление для получения пористой структуры про-
изводится в электролите такого же состава, какой применяется
для хромирования. Травление производят при плотности тока
порядка 50—55 а/дм? в течение нескольких минут. При увеличении
времени травления канальчатая пористость переходит в точечную
и до известных пределов увеличивается глубина пор.
Рекомендуется следующий состав электролита для получения
износоустойчивого пористого хромового слоя:
Хромовый ангидрид...................... 200—250 Г!л
Серная кислота......................... 2—2,5 »
Режим работы: плотность тока 50 —60 а!дм2, температура
50—65°.
Толщина слоя:
Для поршневых колец...................... 0,1—0,25 мм
Для гильз цилиндров ..................... 0,2—0,75 »
Для валов, шпинделей..................... 0,1—0,2 »
После хромирования изделия подвергают анодному травлению
в отдельной ванне в электролите того же состава при следующем
режиме: анодная плотность тока 40—50 а!дм2, температура 50—60°,
продолжительность обработки 5—10 мин.
После анодного травления детали промывают, сушат и прогревают
в течение 1,5—2 час. при 150—180° для устранения хрупкости
Глава XII. Хромирование
241
деформации. После контроля годные детали подвергают хонинго-
ИаНию, притирке или полированию. При большой глубине пор
опускается тонкое шлифование. При хонинговании деталей с густой
сеткой каналов зернистость камня равна 180—240, а деталей с редкой
сеткой каналов—400. Притирка, производите я с помощью тонкого
абразивного порошка, взвешенного в минеральном масле (напри-
мер, 40% тридцатиминутного корундового порошка и 60% машин-
ного масла). После механической обработки остатки абразива уда-
ляют из пор промывкой керосином, бензином, водными эмульсиями
и продувкой сжатым воздухом.
Как уже упоминалось, в некоторых случаях окончательная
механическая обработка производится перед анодным травлением.
При этом верхний наиболее пористый слой хрома, образующийся
после травления, не сошлифовывается и поры не забиваются абразив-
ными остатками. Недостатком указанного варианта является необ-
ходимость повторного монтажа и демонтажа изделий на подвески,
а также промежуточного обезжиривания.
8. КОМБИНИРОВАННЫЕ ХРОМОВЫЕ ПОКРЫТИЯ
В случае необходимости получения защитных хромовых покры-
тий применяется хромирование при повышенных температурах, при
котором получаются беспористые «молочные» осадки. Слой «молоч-
ного» хрома толщиной 30—40 мк является надежной защитой от
коррозии. Однако режим «молочного» хромирования непроизводите-
лен, так как выход по току не превышает 10%. В связи с этим реко-
мендуется следующий режим хромирования. Наносятся два слоя
хрома. Первый слой «молочного» хрома толщиной 20 мк осаждается
при плотности тока 30 а/дм2 и температуре 70°, второй слой блестящего
хрома толщиной 20—30 мк осаждается при плотности тока 55 а/дм2
и температуре 50°. Подобная комбинация позволяет одновременно
защищать от коррозии и от механического износа, а также интен-
сифицировать процесс хромирования.
9. ЧЕРНОЕ И ЦВЕТНОЕ ХРОМИРОВАНИЕ
Черное хромирование применяется для деталей, которые должны
иметь поверхность, обладающую низким коэффициентом отражения
света. В связи с низкой коррозионной стойкостью черного хрома на
детали предварительно наносят слой никеля или хрома требуемой
толщины, после чего помещают их в электролит для черного хроми-
рования. Применяемые для этой цели электролиты не должны содер-
жать серной кислоты.
Для черного хромирования можно рекомендовать электролит
следующего состава:
Хромовый ангидрид.............................. 200—250 Г/л
Азотнокислый натрий ........................... 7—12 »
Уксуснокислый барий ........................... 3—7 »
Борная кислота ................................ 12—15 »
Вайнер и Дасоян
242
Часть третья. Технология нанесения металлических покрытий
Режим работы: температура. электролита 15—65°, плот-
ность тока 40- 150 а/дм2, продолжительность 5—15 мин.
Получаемые в этом электролите осадки хрома имеют глубокий
черный цвет. Для черного хромирования может быть применен
также следующий электролит:
Хромовый ангидрид ...................... 260—300 Г/л
Уксусная кислота ........................ 5—6 мл)л
Режим работы: температура электролита 20—30°, плотность
тока 80—100 а/дм2, продолжительность электролиза 4—6 мин.
Черные хромовые покрытия рекомендуется после промывки
и сушки протереть маслом.
Черные осадки состоят из хрома и его окислов. По литературным
данным, осадки, полученные из электролитов с уксусной кислотой,
содержат 75% металла и 25% окислов.
Для получения декоративного «агатового» покрытия, предста-
вляющего сложный рисунок тонких серо-голубых полос на темно-
синем фоне, применяется следующий электролит:
Хромовый ангидрид . ...................... 300—400 Г)л
Углекислый барий ............................. 5—10 »
Уксуснокислый кальций......................... 4—8 »
Уксуснокислый цинк ........................... 2—5 »
Режим работы: плотность тока 30—100 а/дм2, температура
25—40°, продолжительность 10—20 мин.
Предполагают, что «агатовое» покрытие представляет собой элек-
тролитический сплав хрома с небольшим количеством цинка.
10. СНИЖЕНИЕ ПОТЕРЬ ХРОМОВЫХ ЭЛЕКТРОЛИТОВ
При хромировании значительная часть тока расходуется на раз-
ложение воды. При этом выделяются водород и кислород, увлекающие
с собой пузырьки хромового электролита.
Мельчайшие частицы электролита в виде тумана поднимаются
над ванной. Подобное явление связано с непроизводительными
потерями хромового ангидрида и необходимостью устройства мощной
бортовой вентиляции, поскольку наличие хромового ангидрида
в атмосфере вредно отражается на здоровье работающих. Унос хро-
мового ангидрида в вентиляцию составляет примерно 50% от общего
его расхода.
Для уменьшения уноса электролита предложены различные спо-
собы. Одним из наиболее рациональных методов является применение
поплавков, помещаемых в ванну. Поплавки изготовляются из пено-
пласта, полихлорвинила, полиэтилена и других материалов,'стойких
в хромовых электролитах. Наиболее удачной формой поплавков
следует признать форму закрытых с обоих концов трубок. Поропласт
и пенопласт могут применяться в виде кусков. Поплавки не мешают
загрузке и выгрузке деталей.
Глава XII. Хромирование
243
Продолжительность электролиза, час
Фиг. 97. Изменение концентрации хро-
мового электролита:
1 — с поплавками; 2 — без поплавков
(по' М. А. Шлугеру).
Пузырьки газа, проходя между поплавками, задерживаются
на их поверхности и частично лопаются. Образование тумана и унос
хромового электролита в вентиляционные трубы резко снижаются,
установлено также, что электролит, имеющий на поверхности по-
плавки, нагревается быстрее и охлаждается медленнее, чем электро-
лит без поплавков. Считают, что применение поплавков для
защиты электролита хромирования снижает на 50% его потери
ла унос и значительно уменьшает количестве энергии, необходимой
для поддержания температуры
электролита.
На фиг. 97 показано измене-
ние концентрации хромовых
электролитов, эксплуатируемых
с поплавками и без них.
Наряду с поплавками могут
быть применены специальные
добавки к хромовым электро-
литам, задерживающие их испа-
рение и унос. За рубежом для
этой цели применяют таблетки
под наименованием «хром-про-
тект». При добавлении таблеток
в процессе хромирования на поверхности электролита образуется
тонкий слой пены, быстро спадающей по прекращении электролиза.
Слой пены препятствует выделению брызг и хромового тумана.
Таблетки «хром-протект» состоят из органического соединения —
пенообразующего вещества и неорганического — бикарбоната натрия.
Согласно данным М. А. Шлугера, химические вещества, рекомендо-
ванные зарубежными фирмами для уменьшения уноса хромового
электролита, с успехом могут быть применены лишь для декоратив-
ного хромирования в связи с тем, что при получении толстых износо-
стойких слоев хрома существует опасность осаждения хромовых
покрытий с пониженными физико-механическими свойствами.
11. ПРИСПОСОБЛЕНИЯ ДЛЯ ХРОМИРОВАНИЯ
При конструировании приспособлений для хромирования необ-
ходимо придерживаться следующих основных правил.
1. Токопроводящие части должны иметь такое поперечное сече-
ние, чтобы при нужной плотности тока не наблюдалось заметного
нагрева контактов или подвесок. По практическим данным можно
признать допустимой следующую силу тока на 1 леи2:
Для меди............................................. 2,5 а
» алюминия . ... .... 1,8 »
» латуни ........ 0,9 »
» стали . . ... 0.5 »
» никеля............................................ 0,4 »
16*
-'44
Часть третья. Технология нанесения металлических покрытий
Фиг. 98. Неправильное заве-
шивание штампа с плоским
анодом. (Хром в глубине
штампа не осаждается.):
1 — крепление штампа; 2 —
штамп; 3 — анод; 4 — экрани-
рующее кольцо.
Фиг. 99. Неправильное
завешивание штампа
с профильным аиодой.
Пузырьки задержива-
ются внутри штампа.
(Обозначения те же, что
на фиг. 98.)
Фиг." 101. Схема завешивания детален
в ванну: а — неправильное; б — пра-
вильное.
Фиг. 100. Правильное завешивание
штампа с перфорированным профиль-
ным анодом. Пузырьки газа свободно
удаляются.
(Обозначения те же, что на фнг. 98.)
Фиг. 102. Приспособление с экра-
нирующей проволокой.
Глава XII. Хромирование
245
2. Детали должны прочно соединяться с подвесками, что может
быть достигнуто устройством пружинящих контактов, резьбовых
соединений и т. д.
3. Контактные поверхности всегда должны плотно прилегать
одна к другой и быть совершенно чистыми.
Штанги и крючки, на которых висят приспособления, не реко-
мендуется делать круглого сечения, так как при этом контакт осу-
ществляется в одной точке. Наиболее подходящими являются
крючки, изогнутые под прямым углом.
4. Металлические проводящие поверхности приспособлений (за
исключением мест контактов), а также все не подлежащие хроми-
рованию участки должны быть тщательно изолированы полиэтилено-
вой или полихлорвиниловой пленкой, пластикатом, целлулоидом
и т. п.
5. Полые детали, мерительные кольца, броши и др. нужно
помещать в ванну таким образом, чтобы предотвращалось образо-
вание газовых мешков или задержка пузырьков газа.
На фиг. 98—100 показаны схемы правильной и неправильной
завески штампа в ванну. Длинные детали, помещенные в ванну
горизонтально, необходимо время от времени поворачивать.
6. Детали необходимо помещать в электролит таким образом,
чтобы концентрация силовых линий на выступах была наименьшей
(фиг. 101).
Острые края и углы деталей необходимо «экранировать» допол-
нительными катодами -из фольги или проволоки, изгибая их в соот-
ветствии с видом и формой деталей. На фиг. 102 показано приспо-
собление с экранирующей проволокой.
При хромировании деталей с пазами или боковыми отверстиями
часто вокруг них наблюдаются нехромированные участки. Для
избежания этого рекомендуется пазы и отверстия закрывать проб-
ками из свинца или другого материала, стойкого к хромовой кислоте.
12. ИЗОЛЯЦИЯ МЕСТ, НЕ ПОДЛЕЖАЩИХ ХРОМИРОВАНИЮ
Не подлежащие хромированию участки можно изолировать
материалами, которые должны быть химически стойкими в обезжи-
ривающих и травильных растворах и выдерживать, не разрушаясь,
°бРаб°токУ в хромовых электролитах при повышенной температуре
При изоляции деталей, подвергаемых износостойкому хромиро-
ванию, применяют пластикат, полиэтилен, фторопласт, целлулоид,
свинцовую или алюминиевую фольгу, ' хлорвиниловые трубкщ
перхлорвиниловый лак и др. Резина применяется главным образом
Дря предохранения от хромирования рельефных поверхностей,
олиэтиленом, фторопластом, пластикатом, целлулоидом обворачи-
НоЮт глаДкие поверхности или наклеивают их на изолируемую поверх-
сть. Резину или целлулоид рекомендуется сверху покрыть перхлор-
246
Часть третья. Технология нанесения металлических покрытий
виниловым лаком или цапон-лаком. Надо учитывать, что целлулоид
и в'особенности резина и текстолит, постепенно разрушаясь в хромо-
вой ванне, несколько загрязняют ее и способствуют накоплению
трехвалентного хрома.
Свинцовая или алюминиевая фольга способствуют уменьшению
неравномерности толщины покрытий: прикрепленные к краям дета-
лей, они принимают на себя часть силовых линий. Для этой же цели
Фиг. 103. Шай-
бы, применяемые
для улучшения
равномерности
толщины слоя
хрома.
могут быть применены стальные шайбы (фиг. 103).
Применение свинцовой или алюминиевой фольги
в качестве защитного катода более предпочтительно
чем использование «экрана» из проволоки.
Кроме указанных материалов для изоляции могут
служить специальные мастики, в частности монтан-
битумная изоляция (МБИ), состоящая из 53 вес. ч.
монтана (технического неочищенного монтанного вос-
ка) и 47 вес. ч. битума N-III или N-IV. Смесь распла-
вляется при 180° и при этой температуре наносится
на подлежащие изоляции участки.
Перед загрузкой деталей в ванну необходимо про-
верить тщательность изоляции и убедиться в отсут-
ствии ее на участках, подлежащих хромированию.
13. УДАЛЕНИЕ НЕДОБРОКАЧЕСТВЕННЫХ ХРОМОВЫХ ПОКРЫТИЙ
Хромовые покрытия неудовлетворительного качества могут быть
удалены одним из следующих способов:
1) растворением при комнатной температуре в 15—20-процент-
ном растворе соляной кислоты; этот способ пригоден для стальных,
медных, латунных, медненых и никелированных деталей;
2) анодным растворением в 5—10-процентном растворе едкого
натра при плотности тока 10—20 а/дм? и комнатной температуре;
указанный способ пригоден для стальных и никелированных деталей.
Для удаления хромового покрытия вместе со слоем никеля реко-
мендуется анодное растворение в 80-процентном растворе серной
кислоты при плотности тока 3—5 а!дм2.
В случае, если окажется, что толщина слоя хрома на деталях,
выгруженных из ванны, недостаточна, такие детали могут быть
повторно хромированы. С этой целью их вторично загружают в ванну
и после прогрева и анодного декапирования производят хромирова-
ние. Для получения прочного сцепления второго слоя с первым
вторичное хромирование должно начинаться при пониженной плот-
ности тока, которая в течение 3—5 мин. доводится до нормальной.
ГЛАВА XIII
ЛУЖЕНИЕ
I. ОБЩИЕ СВЕДЕНИЯ
Олово — мягкий ковкий металл серебристо-белого цвета с мягким
голубым оттенком. Удельный вес 7,3 Г/см'л, температура плавления
232°, атомный вес 118,7. Твердость олова равна НВ 5,0 кГ/мм2.
При изгибе оловянных палочек слышен треск, так называемый
«хруст», возникающий от перемещения кристаллов и образования
сдвигов по плоскостям скольжения. Электрохимический эквива-
лент двухвалентного олова равен 2,214 Па-ч, четырехвалент-
ного 1,107 Г!а-ч. Стандартный потенциал Sn/Sn + + равен — 0,14 в,
Sn++/Sn++++ = +0,20 в, Sn/Sn + + + + = +0,05 в.
В 3-процентном растворе хлористого натрия электродный потен-
циал олова равен —0,25 в.
Олово имеет три модификации: а, р и у. В обычном виде олово
существует как модификация р, устойчивая в пределах от +18
до +161. Модификация а — серое олово — устойчива при темпера-
турах ниже 18°. Аллотропическое превращение p-формы в а-форму
сопровождается увеличением объема и уменьшением удельного веса
до 5,85 Г/см'л. Наибольшая скорость превращения наблюдается при
—50°, причем скорость перекристаллизации увеличивается с повы-
шением чистоты белого олова. Появление первых кристаллов
«-формы в белом олове резко ускоряет переход его из одной модифика-
ции в другую. При этом компактный светлый металл превращается
в серый порошок (процесс этот получил название «оловянной чумы»).
Переплавкой можно вернуть олово в первоначальную модификацию.
Модификация у, устойчивая при температуре от 161 до 232°,
характеризуется хрупкостью олова: металл легко истирается в поро-
шок.
Для оловянных покрытий, полученных электролитическим мето-
дом, при хранении луженых деталей характерен самопроизволь-
ный рост нитевидных кристаллов олова, достигающих в длину
Д° 5 мм. Нитевидные кристаллы могут привести к коротким замы-
каниям при эксплуатации электрорадиотехнической аппаратуры.
Скорость роста нитевидных кристаллов связана с природой ме-
Талла или сплава, на которые наносятся покрытия. Так, наибольшая
248 Часть третья. Технология нанесения металлических покрытий
скорость роста кристаллов наблюдается в случае осаждения олова
на цинк, латунь или медь или на латунные и медные подслои. Опла-
вление оловянных покрытий затормаживает рост нитевидных кри-
сталлов олова.
В атмосферных условиях даже в присутствии влаги олово окис-
ляется медленно. Разбавленные растворы минеральных кислот
при комнатной температуре практически не растворяют олова.
В концентрированных соляной и серной кислотах олово при нагре-
вании легко растворяется. В растворах едкой щелочи олово неустой-
чиво и при кипячении растворяется с образованием станнатов.
Сернистые соединения на олово почти не влияют. Олово образует
комплексные соединения с рядом органических кислот и потенциал
его становится отрицательнее потенциала железа.
Высокая устойчивость, а также безвредность большинства оло-
вянных соединений обусловили широкое применение оловянных
покрытий в пищевой промышленности, особенно для приготовле-
ния консервной тары. Около 50% добываемого олова расходуется
на изготовление белой жести.
Лужение используется для защиты медного кабеля от воздействия
серы, содержащейся в резиновой изоляции. Лужение применяется
для облегчения пайки электрических контактов, для создания на тру-
щихся поверхностях машин легко прирабатывающегося слоя и для
некоторых других специальных целей. Следует упомянуть еще
о применении оловянных покрытий при частичном азотировании
стальных деталей. В этом случае оловом покрывают участки деталей,
не подлежащих азотированию. Олово при температуре азотирования
образует на поверхности расплавленный слой, предохраняющий
основной металл от диффузии азота.
Лужению подвергаются детали из железа, меди, алюминия и их
сплавов. Защитные свойства оловянных покрытий на железных
деталях в атмосферных условиях надежны только при условии
отсутствия пор.
Покрытия оловом хорошо выдерживают механические деформации
(изгиб, вытяжку, вальцовку и штамповку).
Оловянные покрытия могут наноситься как горячим путем,
так и методом гальванического или контактного осаждения. Харак-
теристика качества осадков, получаемых при различных методах
лужения, приведена в табл. 77.
При горячем лужении 15—20% олова безвозвратно теряется
в результате окисления (угара), образования сплавов Fe— Sn и т. п.
Стойкость против коррозии электролитически луженой жести
может быть повышена увеличением толщины, пассивированием луже-
ных деталей, промасливанием, лакированием и другими методами.
Олово — дорогой и дефицитный металл; оно дороже никеля,
меди, алюминия, цинка и свинца. Поэтому экономия олова является
важной народнохозяйственной задачей.
Глава XIII. Лужение
249
Таблица 77
Характеристика методов нанесения оловянных покрытий
Метод нанесения покрытий Достоинства и недостатки
Горячий Высокая производительность процесса, краси- вый внешний вид, устойчивость против химиче- ских воздействий и превращения в серую модифи- кацию Большой расход олова, неравномерность тол- щины покрытий, высокая пористость
Гальванический Равномерность толщины, меньший расход олова, чем при горячен? методе, сравнительно меньшая пористость Меньшая устойчивость в жидких средах по сравне- нию с горячим лужением, внешний вид уступает покрытиям, полученным горячим способом
Контактный Простота проведения процесса, малый расход олова Низкие антикоррозионные свойства, применим только для неответственных деталей
Толщина оловянных покрытий в зависимости от назначения
и условий эксплуатации изделий приводится в табл. 78.
Таблица 78
Толщина оловянных покрытий в зависимости от их назначения
Назначение покрытий Основной металл Толщина покрытий В мк
Жесть для изготовления консервной тары Защита кабели от действия серы Облегчение пайки деталей приборов Местная защита стали от азотирования Защита посуды и столовых приборов от кор- розии Защита от коррозии пищеварных котлов, мо- лочных бидонов, питьевых бачков, чайников, кастрюль Защита от коррозии неответственных мелких зделий: пуговиц, обойных гвоздей и т. п. Сталь Медь Медь, алюми- ний и их сплавы Сталь Сталь Сталь, медь и ее сплавы Сталь 1,5—2,0 3-4 2—5 8—10 10—25 20—25 1—2
Следует отметить, что способность к пайке деталей, луженых
^ектролитическим путем, ухудшается при хранении. Через
250
Часть третья. Технология нанесения металлических покрытий
несколько недель хранения луженых деталей пайка осуществляется
с трудом, а иногда становится совсем невозможной. Прочность
спая на разрыв после длительного хранения снижается примерно
на 50%.
2. ГОРЯЧЕЕ ЛУЖЕНИЕ
Оловянные покрытия, полученные горячим способом, состоят
из двух слоев: наружного, представляющего чистое олово, и внут-
реннего, прилегающего к основному металлу и состоящего из железо-
оловянистого сплава.
Технология горячего лужения предусматривает предваритель-
ную подготовку изделий путем травления в серной и соляной кисло-
тах. После травления изделия очищают от шлама, промывают и погру-
жают в раствор хлористого цинка. Операция, называемая флюсо-
ванием, предназначена для удаления остатков окислов и солей
железа с поверхности изделий, а также для того, чтобы покрыть
изделия легкоплавким флюсом, предохраняющим их от дальнейшего
окисления. Подсушенные изделия поступают в лудильную ванну,
нагретую до 270—300°. После лужения детали очищают пеньковыми
щетками, встряхивают или центрифугируют для удаления избытка
олова.
С течением времени в лудильной ванне накапливается сплав
FeSn2, называемый «скрапом», или «тяжелым металлом». Он обра-
зуется в результате взаимодействия олова, с изделиями, а также
со стенками лудильной ванны. Скрап, отличающийся большим
удельным весом, чем олово, оседает на дно ванны, откуда его время
от времени при помощи дырчатого ковша извлекают для регенерации.
Значительные количества скрапа увеличивают вязкость расплава,
вызывают повышенный расход олова и ухудшают качество оловян-
ных покрытий.
Технологический процесс горячего лужения листов осуществ-
ляется следующим образом. Производится первый отжиг листов,
затем первое травление в 4—5-процентном растворе серной кислоты.
После этого следует второй отжиг и второе («белое») травление
в 2—3-процентном растворе серной кислоты в течение 3—5 мин.
После тщательной промывки листы сушат. Поверхность листов
должна быть равномерного светло-серого цвета.
Перед лужением листы подвергают травлению в третий раз
путем погружения в 0,5-процентный раствор соляной кислоты.
Лужение листов в настоящее время осуществляется главным
образом в машинах. Схема одной из таких машин представлена
на фиг. 104. Машина состоит из двух соединенных внизу отделении.
Нижняя часть лудильной машины заполнена расплавленным оло-
вом, нагретым до 270—300°. Наверху в первом отделении машины
расположен контейнер с флюсом. Состав его: 700—800 Г/л хлористого
Глава XIII. Лужение
251
иНКа, 6—12 Пл соляной кислоты. Высота слоя флюса не менее
70 см. Флюс все время должен пополняться водой, подкисленной
соляной кислотой. Допустимое содержание примесей в растворе
(Ьчюса: SO7~ — не более 0,2 Г/л, Са++ — не более 1 Г/л, Fe2O3 —
не более 0,2 Г/л, РЬ++ следы. Загрязненный флюс следует заме-
нить новым. При прохождении через флюс листы очищаются, нагре-
ваются и высушиваются.
Над поверхностью флюса под определенным углом расположена
пара вращающихся валков, захватывающих лист и погружающих
его через слой флюса в расплавлен-
ное олово в нужном направлении.
По направляющим лист попадает
к паре валков, установленных на
дне машины, и, пройдя через них,
передается к «жировым» валкам,
расположенным над поверхностью
олова, покрытого толстым слоем
хлопкового масла или говяжьего
жира. При движении в масле слой
расплавленного олова на поверх-
ности железного листа постепенно
охлаждается. Выдающие валки, Фиг. 104. Схема работы двухванного
расположенные в вертикальной лудильного аппарата,
плоскости, равномерно распреде-
ляют застывающее олово по поверхности листа. Масло с листов
удаляется протиркой отрубями или древесными опилками.
Соблюдение теплового режима при горячем лужении имеет
большое значение для получения доброкачественных покрытий.
При повышении температуры расплавленного олова во время лужения
толщина наружного слоя покрытия (т. е. слоя чистого олова) умень-
шается, в то время как толщина железооловянного слоя относительно
увеличивается. Качество полуды при этом резко ухудшается, так
как покрытие становится хрупким. Наоборот, понижение темпера-
туры олова обусловливает увеличение толщины покрытий из-за
повышения вязкости расплава, увеличивающего его прилипаемость
к железному листу. Расход олова при этом возрастает.
Чем больше скорость прохождения листа через расплавленное
олово, тем меньше время пребывания листа в жидком олове и тем
тоньше получаемый слой полуды. При скорости движения листа
w м/мин. осаждается приблизительно 15 Г олова на 1 м2 поверхности.
Для лужения применяется олово марки 01 или 02. Наличие
Нескольких процентов цинка в расплавленном олове улучшает стой-
покрытия против коррозии. Введение в оловянную ванну 5—
0/6 висмута придает жести особенную белизну и блеск. Добавка
олову железа в количестве 0,5—1,5% увеличивает твердость
°лУды и ее сопротивление истиранию. Лужение жести для пищевой
252
Часть третья. Технология нанесения металлических покрытий
тары производится только оловом марки 01, введение других металлов
не допускается.
В современном лудильном производстве получили распростране-
ние специальные установки, в которых листы автоматически пере-
даются из травильного агрегата в лудильную машину, пропускаю-
Фиг. 105. Схема работы автомата горячего лужения ленты:
1 — лента; 2 — разматыватели; 3 — травильная ванна; 4 — душевая установка; 5 — флю-
совая коробка; 6 — ванна с оловом; 7 — жировой бак; S, 9 — агрегаты очистки; 10 — ло-
пасти для перемешивания отрубей; 11 — нротиры; 12 — моталки.
щую несколько листов одновременно. Имеются машины для непре-
рывного лужения стальной ленты. На фиг. 105 показана схема
работы автомата горячего лужения ленты. Длина всей линии сдвоен-
ного автомата 90 м, ширина 5,6 м. При средней скорости движения
ленты 2,5 м/мин, средней ширине ленты 220 мм и толщине 0,30 мм
Таблица 79
Классификация оловянных покрытий
в зависимости от количества пор
Количество пор на 1 сл2 поверхности Качество покрытия
Меньше 3 4—12 Больше 12 Первоклассное Малопористое Очень пористое
производительность этого
автомата составляет 8—10 Т
в сутки.
Качество оловянных по-
крытий проверяется по ха-
рактеру и степени пористо-
сти: чем меньше пор в покры-
тии, тем выше его качество.
В табл. 79 приведена клас-
сификация, согласно которой
покрытия разбиваются на три
группы: первоклассные по-
крытия, малопористые и
очень пористые.
Изделия, не связанные с приготовлением или хранением пищи,
можно покрывать оловянно-свинцовистыми сплавами: химическая
стойкость их выше, а стоимость значительно ниже, чем чисто оловян-
ных покрытий.
Возможные дефекты покрытий при горячем лужении и способы
их устранения приведены в табл. 80.
Глава XIII. Лужение
253
Таблица 80
Неполадки при горячем лужении и их устранение
Признаки неполадок Причина возникновения Способ устранения
Нарушение сплош- ности слоя олова а) Недостаточное тра- вление изделий б) Недостаточная очи- стка изделий в) Повреждение в чи- стильных агрегатах, при сортировке, упа- ковке и т. д. а) Улучшить травление б) Улучшить подготовку поверхности, сменить за- грязненный флюс в) Устранить причины повреждений
Пористость слоя, чер- ные точки, флюсовые пятна Загрязнения флюса Заменить флюс
Слои олова имеют матовую поверхность а) Жировые загряз- нения на поверхности изделий б) Загрязнение флюса в) Контактное осаж- дение меди из травиль- ного раствора а) Улучшить подготовку поверхности б) Сменить флюс в) Сменить травильный раствор
Слой окислов на по- верхности олова Повышенная темпе- ратура масла Снизить температуру масла. Она должна быть в пределах 240—250°
Потери олова при горячем лужении в настоящее время достигают
30—35%, однако при повышении культуры производства они могут
быть доведены до 20%.
Расход хлопкового масла при горячем лужении составляет 3—5 кГ
на тонну жести.
При горячем лужении необходимы следующие меры предосторож-
ности:
а) создание хорошо функционирующей проточно-вытяжной вен-
тиляции;
б) опускание в лудильную ванну полностью просушенных чушек
олова и других металлических предметов (ковшов, вилок и т. п.);
в) работа в защитной спецодежде;
г) аккуратное обращение с намоточными барабанами.
3. ЭЛЕКТРОЛИТИЧЕСКОЕ ЛУЖЕНИЕ ИЗ КИСЛЫХ ЭЛЕКТРОЛИТОВ
Для электролитического лужения могут применяться как кислые,
ак и щелочные электролиты. К кислым электролитам,
Рименяемым при лужении, относятся сернокислые, галогенидные
254
Часть третья. Технология нанесения металлических покрытий
в борфтористоводородные электролиты. Наиболее широкое примене
ние имеют сернокислые электролиты, остальные применяются сравни-
тельно редко.
В кислых электролитах ионы олова находятся в двухвалентной
форме.
Сернокислые электролиты
К преимуществам сернокислых электролитов и получаемых из
них оловянных осадков следует отнести:
1) высокий выход по току, незначительно снижающийся при
увеличении плотности тока;
2) хорошее сцепление с основным металлом;
3) устойчивость при эксплуатации и возможность работы при
комнатной температуре;
4) высокая пластичность осадков.
К недостаткам указанных электролитов относятся:
1) сложность состава, затрудняющая корректировку электролита;
2) сравнительно крупнокристаллическая структура осадков.
В состав сернокислых электролитов для лужения входит серно-
кислое олово, серная кислота, а также коллоиды и поверхностно-
активные вещества. В некоторых случаях в электролит прибавляют
сернокислый натрий, повышающий электропроводность раствора.
Серную кислоту вводят в электролит для снижения гидролиза оло-
вянных солей, а также с целью предотвратить окисление двухвалент-
ного олова в четырехвалентное и образование шероховатых осадков.
В отсутствие органических веществ в кислых электролитах невоз-
можно получить приемлемые осадки олова из-за образования круп-
ных кристаллов и усиленного роста дендритов на краях деталей.
Примерный состав сернокислых электролитов и режим работы
приведены в табл. 81.
Таблица 81
Состав и режим работы сернокислых электролитов для лужения
Наименование компонентов и режимы работы Содержание в Г [л в электролитах
№ 1 № 2
Сернокислое олово 40—50 45—55
Серная кислота 50—80 90—100
Сернокислый натрий (водный) 40—60 —
Фенол технический (сырая карболовая кислота) или крезол 2—10 20—30
Клей столярный 2—3 2—3
Температура в °C Плотность тока в а! дм2: 18—25 20—35
без перемешивания 1—2 1,5—2
с перемешиванием 3—4 3—4
при лужении проволоки — 15—20
Глава XII!. Лужение
255
Продолжительность осаждения оловянных покрытий
-оЛ1Иины’ получаемых из сернокислых электролитов,
, табл. 82.
Продолжительность осаждения слоя олова (в мин.)
из сернокислых электролитов при выходе по току 90%
различной
приведена
Таблица 82
-—-— Толщина слоя в мк Плотность тока в а{дм*
1,0 2,0 3,0 4,0 5,0
1 2,2 1,1 0,8 0,6 0,4
3 6,6 3,3 2,4 1.7 1,3
5 11 5,5 4,0 2,8 2,2
7 15 7,7 5,6 3,9 3,1
10 22 11 8,0 5,5 4,4
20 44 22 16 И 8,8
60 132 66 48 33 26
80 176 88 64 44 35
100 220 НО 80 55 44
400 880 440 320 220 176
Электролиты для лужения имеют склонность к расслаиванию.
Концентрация олова в нижних слоях может в 3—4 раза превышать
концентрацию в верхних слоях. Для устранения этого явления реко-
мендуется непрерывное или периодическое перемешивание электро-
лита механическими мешалками или качанием штанг.
При лужении в сернокислых электролитах применяют оловянные
аноды марки 01 и 02. Анодный процесс при лужении протекает без
заметной поляризации, олово переходит в раствор в основном в виде
Двухвалентных ионов. Поверхность анодов имеет вид растравленного
металла и покрыта легко удаляемым тонким слоем черного шлама;
при повышенных плотностях тока поверхность анодов имеет резко
выраженную кристаллическую структуру; пленок на поверхности
пе наблюдается. Анодный выход по току, как правило, превышает
При отсутствии добавок в сернокислом электролите катодная
поляризация весьма незначительна и является чисто концентрацион-
ном. При добавлении крезолсульфоновой кислоты или смеси ее
столярным клеем наблюдается значительная катодная поляриза-
ция, достигающая 500—600 мв.
256
Часть третья. Технология нанесения металлических покрытий
Любопытно, что хотя сам по себе столярный клей не вызывает
значительной поляризации, однако присутствие его обязательно
для получения плотных мелкокристаллических осадков.
Сернокислые электролиты для лужения отличаются сравнительно
высокой рассеивающей способностью, стоящей приблизительно на
одном уровне с рассеивающей способностью медных цианистых
электролитов. Выход по току сернокислых оловянных электролитов
равен примерно 90—95%.
Изменение концентрации сернокислого олова в пределах 30—
60 Г/л не сказывается заметно на характере катодного процесса.
Пониженная концентрация сернокислого олова снижает максималь-
ный предел рабочей плотности тока, но положительно влияет на
рассеивающую способность электролита. При повышенном содер-
жании сернокислого олова аноды склонны к пассивированию.
Серная кислота повышает электропроводность электролита, предо-
храняет электролит от гидролиза и появления шероховатости на
осадках. Концентрация серной кислоты может колебаться в преде-
лах от 20 до 100 Г/л, но при малых концентрациях кислоты увели-
чивается опасность гидролиза и окисления сернокислого олова.
Слишком большое содержание серной кислоты приводит к снижению
выхода по току, к быстрому разрушению коллоидных добавок и пасси-
вированию анодов.
Сернокислый натрий иногда добавляют в электролит лужения
для повышения электропроводности, а также для понижения степени
диссоциации сернокислого олова. Впрочем, указанные функции
с большим успехом выполняются серной кислотой.
Присутствие хлоридов и нитратов сказывается вредно на нормаль-
ной работе сернокислого электролита лужения. Ионы меди также
оказывают отрицательное влияние на качество оловянных осадков.
Присутствие в сернокислом электролите лужения ионов свинца,
железа, цинка и никеля до известных пределов не оказывает влияний
на ход катодного процесса.
Режим электролиза — плотность тока и температура — оказы-
вают значительное влияние на качество осадков. При малых плотно-
стях получаются осадки с крупнокристаллической структурой,
отличающиеся повышенной пористостью. При чрезмерно высокой
плотности тока осадки становятся шероховатыми, на краях растут
дендриты. При перемешивании электролита или качании штанг
может применяться повышенная плотность тока. При электролити-
ческом лужении жести в конвейерных автоматах возможно примене-
ние сравнительно высокой плотности тока, намного превышающей
(в 10—15 раз) плотность тока, применяемую при лужении в немехани-
зированных ваннах.
При получении тонких покрытий (порядка 1—2 мк) допустимо
применение больших плотностей, чем в случае нанесения более тол-
стых покрытий.
Глава XIII. Лужение
257
Повышение температуры при работе с сернокислыми электроли-
тами приводит к снижению катодной поляризации, уменьшению
пассеивающей способности и ухудшению качества осадков. Так,
пои нагреве сернокислого электролита выше 40° получаются грубо-
кписталлические шероховатые осадки. При повышенной температуре
Уменьшается стабильность ванны.
У Приготовление сернокислого электролита заключается в раство-
пении сернокислого олова в теплой воде при непрерывном помеши-
вании. Воду подкисляют, небольшим количеством кислоты (20—
>5 Г/л). После фильтрации раствора в рабочую ванну добавляют
ютальные компоненты.
Столярный клей предварительно заливают холодной водой,
выдерживают в течение 1—2 суток для набухания и растворяют
в горячей воде при 60—70° на водяной бане.
Крезол или карболовую кислоту для предупреждения всплыва-
ния добавляют в ванну совместно с раствором клея. Тщательно пере-
мешанную смесь вливают в ванну, помешивая. Раствор в ванне при
этом мутнеет, но скоро светлеет и приобретает нормальный желто-
вато-зеленый цвет. Приготовленный электролит прорабатывают при
плотности тока 1—1,5 а/дм2 в течение 3—5 час. со случайными като-
дами.
- В связи с отсутствием в продаже сернокислого олова его зачастую
приходится приготовлять в гальваническом цехе.
Электрохимический метод растворения олова с применением диа-
фрагмы. В ванне с раствором, содержащим 70—75 Пл серной кис-
лоты, подвешивают пористые керамические сосуды, заполненные
тем же раствором. На анодные штанги ванны завешивают оловянные
аноды. В сосуды помешают свинцовые полосы, которые соединяют
с катодной штангой. Растворение олова производится при анодной
плотности тока 2—3 а/дм2. На катодах происходит выделение водо-
рода, так как пористая диафрагма препятствует проникновению
ионов олова к катоду. Для получения в электролите нужной концен-
трации сернокислого олова требуется около 15 а-ч на 1 л оас-
твора.
Электрохимический метод растворения олова без применения
Диафрагмы. В рабочую ванну заливают на 70—80% ее объема воды,
вводят все составные части в количествах, требуемых для составле-
ния электролита (кроме серной кислоты, которая должна быть
взята примерно в удвоенном количестве по сравнению с цифрами,
приведенными в табл. 78, так как часть ее будет израсходована
на приготовление сернокислого олова). В качестве анодов и катодов
применяются оловянные пластины. Отношение анодной поверхности
катодной должно составлять примерно 4:1, анодная плотность
р ка Должна быть около 2 а/дм2, катодная — 8 а/дм2. В процессе
У Тв°Рения электролит следует часто перемешивать. При таких
овиях работы анодный выход по току примерно на 40% превышает
Вайнер и Дасоян
258
Часть третья. Технология нанесения металлических покрытий
катодный, что способствует накоплению ионов олова в электро,
лите. Рекомендуется через несколько часов работы менять ме-
стами аноды и катоды для растворения ранее осажденного олова
Для получения требуемого количества солей олова в электролите
необходимо израсходовать примерно 50 а-ч на 1 л. Указанный спо-
соб отличается простотой, однако он более длителен, чем приведенный
выше, и связан с некоторыми потерями олова.
Химический способ растворения олова. Сернокислая медь рас-
творяется в воде из расчета 60 Пл. К раствору добавляют 50 Пл
серной кислоты и нагревают его до 70—80°, после чего туда постепенно
насыпают гранулированное или порошкообразное олово. Олово
переходит в раствор, а медь в виде шлама выпадает на дно:
Sn + CuSO4 = Си -f- Sn SO4.
Перемешивание раствора производят до полного его обесцвечи-
вания, которое наступает по израсходовании сернокислой меди.
Раствору дают отстояться в течение 10—12 час. и фильтруют в рабо-
чую ванну. Производится анализ электролита на содержание серно-
кислого олова и серной кислоты и в случае необходимости корректи-
руют его по этим компонентам. После этого добавляют остальные
компоненты.
Гранулированное олово может быть получено выливанием рас-
плавленного металла тонкой струйкой в воду.
Порошкообразное олово можно получить растиранием выливае-
мого на брезент небольшими порциями расплавленного олова.
В момент застывания олово легко растирается в порошок.
Электрохимический способ без внешнего тока. Ванна запол-
няется раствором, содержащим 60 Пл сернокислой меди и 50 Пл
серной кислоты. На одну штангу завешивают оловянные, на другие —
медные пластины, которые соединяют между собой. Раствор нагре-
вается до 60—80° и перемешивается. В результате работы замкнутого
гальванического элемента Sn/Cu SO4/Cu металлическая медь выде-
ляется на медных катодах, а олово переходит в раствор.
По окончании реакции бесцветный раствор фильтруют и доба-
вляют остальные компоненты.
Во время эксплуатации ванны производится периодическое кор-
ректирование электролита по данным анализа. Через каждые 8—
10 а-ч на 1 л электролита в ванну добавляют 0,2—0,3 Пл столярного
клея и 0,4—0,6 Пл крезола или карболовой кислоты.
Образующийся на анодах в процессе работы шлам препятствует
нормальному прохождению тока. В связи с этим рекомендуется
несколько раз в смену прочищать аноды щетками и промывать их.
Шлам следует собирать, так как он может быть использован для
приготовления олова по химическому способу.
Описание неполадок, встречающихся в работе сернокислых
электролитов, и способы их устранения приводятся в табл. 83.
Глава XIII. Лужение
259
Таблица 83
Неполадки в работе сернокислых электролитов для лужения
—
Признаки неполадок Причины возникновения Способы устранения
- - Темные осадки Наличие меди е элек- тролите Проработать электролит
Темные плотные осадки Добавка большого количества сернокис- лого олова Проработать электролит током
Неплотные крупно- кристаллические осадки Грубокристалличе- ская структура осадков Недостаточное коли- чество добавок а) Недостаточное ко- личество клея б) Попадание хлори- дов Добавить столярный клей и крезол или фенол а) Добавить столярный клей б) Заменить часть элек- тролита
Губчатые осадки а) Высокая плотность тока а) Уменьшить плотность тока
б) Большая поверх- ность анодов б) Уменьшить поверх- ность анодов
в) Попадание при- месей в) Проработать электро- лит при плотности тока 0.2—0,3 а! дм*
г) Недостаточное со- держание кислоты г) Добавить кислоты
Пористые осадки Недостаток солей олова Добавить сернокислое олово
Образование в элек- тролите нерастворимого осадка Гидролиз из-за недо- статка серной кислоты Добавить серную кислоту
Неоднородная струк- тура поверхности де- талей Расслоение электро- лита Перемешать раствор
Шероховатость осад- ков Загрязнение электро- лита взвешенными ча- стицами Отфильтровать электро- лит
Сильное газовыделе- иие на анодах Пассивирование ано- дов вследствие наличия в них примесей свинца Заменить аноды
Пониженная рассеи- вающая способность а) Большое содержа- ние сернокислого олова б) Недостаток серной кислоты в) Недостаток сто- лярного клея а) Разбавить электролит б) Добавить серную кис- лоту в) Добавить столярный клей
—
1/*
260
Часть третья. Технология нанесения металлических покрытий
Прочие кислые электролиты для лужения
Из большого количества исследованных кислых электролитов
для лужения промышленное применение нашли немногие. Основное
внимание привлекают ванны, которые позволяют работать при
высоких плотностях тока и которые могут быть использованы для
электролужения жести. В табл. 84 приводятся литературные данные
о составе и режиме работы некоторых новых электролитов для луже-
ния.
Таблица 84
Состав и режимы работы галогенидных электролитов для лужения
Наименование компонентов Содержание в Г/л в растворах
№ 1 №2 № 3 № 4
Хлористое олово 40—50 50—60 50 75
Соляная кислота 0,5—1,0 12—18 3 12,5
Фтористый натрий 50—60 — 30 37,5
Фтористый аммоний — — 30 37,5
Хлористый натрий 5—7 8—0 — 22,5
Фенол — 20 — —
Желатина 1,0 — — —
Клей столярный — 3 — —
f-нафтол — 0,1 — —
Днсульфопафталиновая кислота — — — 1,0
Роданистый аммоний — — — 0,25
Йодистый тетрабутиламмоний Режим ) а б о т ы — 0,065
Температура в °C Плотность тока в а!дмг'. 20—25 20 70 65
без перемешивания 0,5—1,0 — — —
с перемешиванием 2—3 До 15 40 50
Выход по току в % 95—98 95 95 97
Электролит № 1 рекомендуется для лужения деталей, остальные—
для лужения листов, проволоки и т. п. Перед лужением в электро-
лите № 2 рекомендуется нанести подслой олова толщиной порядка
0,01 мк из станнатного электролита. По данным некоторых иссле-
Глава XIII. Лужение
261
ователей, высококачественные оловянные осадки удается получить
галогенидных электролитах, содержащих ионы С1“ и ионы F"
в определенном соотношении (1 : 1), что способствует образованию
прочного комплексного иона [SnF2Cl2]_“, смещающего потенциал
выделения олова в более отрицательную область.
Приготовление электролитов заключается в отдельном растворе-
нии хлористого олова и фтористого натрия в теплой воде, подкислен-
ной соляной кислотой, и последующем соединении обоих растворов.
Из кислых электролитов для лужения следует упомянуть еще
о фенолсульфоновых (фенолсульфоновая кислота имеет формулу
/он ж
C6H4\SO3H/ И борфтористоводородных.
Фенолсульфоновый электролит
Олово фенольсульфоновое кислое (в пересчете на металл) 25—45 Г/л
Серная кислота.............................. ...... 40—60 »
Диметиламинопиридилметан............................0,5—1,0 »
Режим работы: температура 30—45°, плотность тока 20—
30 а/дм2', выход по току составляет 90—95%.
Б о р ф т о р и с то в о д о р о д и ы й электролит
Фторборат олова.............................. . 180—200 Г/л
Борфтористоводородн:,! кислота ... . . 50—150 »
Борная кислота . ....................... 25—30 »
Клей столярный..................... .............. 4—6 »
f-нафтол.......................................... 1 »
Режим работы: температура 20—38°, плотность тока 3—
20 а/дм2.
Приготовление электролита состоит в получении борфтористо-
водородной кислоты:
4HF 4- Н3ВО3 = HBF4 4- ЗН2О
и последующем растворении в ней гидроокиси олова:
Sn(OH)2 4- 2HBF4 = Sn (BF4)2 4- 2H2O.
Остальные компоненты вводят согласно описанной выше методике.
Высокая стоимость плавиковой кислоты несколько препятствует
ирокому распространению борфтористоводородных электролитов.
Днако возможность достижения высоких скоростей осаждения олова
^лает их применение перспективным, особенно для электролужения
262
Часть третья. Технология нанесения металлических покрытий
Блестящее лужение
В Институте химии Академии наук Литовской ССР разработан
электролит для получения блестящих оловянных покрытий. Состав
его:
Сернокислое олово ..................................... 54 Пл
Серная кислота...................................... 100 »
Фенол ....................... . . ............ 30 »
Клей столярный.......................................... 2 »
Камфора............................................. 0,2 »
Формалин .... 0,6 »
Фурфурол ............................................ 0,04 »
Режим работы: температура 18—25°, плотность тока 4—
7 а!дм2.
В связи с наличием в электролите четырех компонентов, не под-
дающихся анализу, применение его затруднительно.
Другой электролит для блестящего лужения содержит в качестве
блескообразователя древесный деготь, диспергированный в октил-
серной кислоте. Состав электролита:
Сернокислое олово ...................................... 100 Пл
Серная кислота......................................... 100 »
Сульфированный октиловый спирт....................... 10 »
Продукты перегонки древесного дегтя ...................... 8 »
Режим работы: температура 18—25°, плотность тока 3—
4 а!дм2.
Необходимо перемешивание или качание штанг.
Сульфирование спирта производится следующим образом: к 100 мл
октилового спирта при 5° добавляют, постепенно перемешивая,
100 мл серной кислоты уд. веса 1,84. Смесь выдерживают в течение
30 мин. при 5° и при помешивании выливают в литровую колбу
с охлажденной водой. Необходимое количество древесного масла
вливают в раствор сульфированного октилового спирта и тщательно
перемешивают взбалтыванием. Затем фильтруют смесь в рабочую
ванну. Электролит нуждается в предварительной проработке, причем
осадки по внешнему виду проходят следующие стадии: они бывают
пятнистые, полублестящие и блестящие. Осадки приобретают блеск
только при катодной обработке после лужения в 3-процентном рас-
творе углекислого натрия.
По пористости и коррозионной стойкости блестящие оловянные
осадки не отличаются от покрытий, полученных в сернокислых элек-
тролитах без добавок.
По мере снижения блеска покрытий в ванну вводят новые пор-
ции добавки.
По данным М. Е. Сандигурской, Р. Г. Ковалевой и Э. С. Брука>
в качестве блескообразователя могут быть использованы продукты
Глава XIII. Лужение
263
перегонки дегтя при температуре 180—310°, вырабатываемые Вет-
пужским лесохимкомбинатом. Вместо октилового спирта можно
применять смесь гептилового, октилового и гексилового спиртов,
являющихся отходами нефтеперегонной промышленности.
Необходимо отметить, что метод и тщательность сульфирования
спирта, а также эмульгирования масс оказывает большое влияние
на вид и качество покрытий.
4. ЩЕЛОЧНЫЕ ЭЛЕКТРОЛИТЫ ДЛЯ ЛУЖЕНИЯ
♦Состав электролитов и режимы работы
Основными компонентами щелочных электролитов, применяемых
для лужения, являются станнат натрия и едкий натр. В щелочных
электролитах олово находится в виде станната натрия
Na2SnO3. Присутствие двухвалентного олова способствует образо-
ванию губчатых крупнокристаллических осадков.
К преимуществам щелочных электролитов для лужения и полу-
чаемых из них осадков относятся:
1) высокая рассеивающая способность, превосходящая рассеи-
вающую способность всех известных в настоящее время электролитов;
2) весьма мелкокристаллическая структура осадков;
3) меньшая пористость по сравнению с осадками из кислых
электролитов;
4) простота состава применяемых электролитов.
Недостатки щелочных электролитов:
I) меньшая скорость осаждения, чем из кислых электролитов,
что объясняется применением солей четырехвалентного олова и более
низким выходом по току;
2) необходимость работы при повышенной температуре;
3) склонность анодов к пассивированию.
Щелочные оловянные электролиты имеют безусловное преиму-
щество перед кислыми во всех случаях, когда речь идет о покрытии
готовых изделий или деталей сложной конфигурации. При лужении
же листов, ленты и др., т. е. когда решающую роль играет форсиро-
вание процесса, предпочтение следует отдать кислым электролитам.
В табл. 85 приводятся состав и режим работы применяемых
е промышленности щелочных электролитов для лужения.
Продолжительность осаждения слоя олова различной толщины
Из щелочных электролитов приведена в табл. 86.
Как уже указывалось, щелочные электролиты для лужения не
Должны содержать двухвалентных ионов олова. В случае, если
в электролите одновременно содержатся двух- и четырехвалентные
воны олова, на катоде в первую очередь будет происходить разряд
и°нов, в состав которых входит двухвалентное олово, так как раз-
°жение станната начинается при значительно более отрицательном
264
Часть третья. Технология нанесения металлических покрытий
Таблица 85
Состав и режим работы щелочных электролитов для лужения
Наименование компонентов Содержание в Г/л в растворах
№ I № 2 № 3
Двух лор истое олово SnCl2-2H2O 40 — —
Четыреххлорнстое олово SnCl4 — 107 —
Станнат натрия Na2SnO3 — — 75—90
Едкий натр (общий) NaOH 60 90 —
Едкий натр (свободный) — — 10—15
Уксуснокислый натрий NaC2HsO2 — 15 15—25
Перекись водорода Н2О2 — — 1—2
Режим работы
Температура в °C 65—70 65—70 70—80
Плотность тока в а! дм2 0,5 1,5—2 1,5—3
Таблица 86
Продолжительность осаждения слоя олова (в мин.)
из щелочных электролитов при выходе по току 80%
Толщина Плотность тока в а/дм*
слоя в мк 0.5 1.0 1.5 2.0 3.0
1 10 5,0 3,3 2,4 1,7
3 30 15 9,9 7,2 5,1
5 50 25 16 12 8,5
7 70 35 23 17 12
10 100 50 33 24 17
20 200 100 66 48 34
40 400 200 132 96 68
60 600 300 198 144 102
80 800 400 264 192 136
100 1000 500 330 240' 170
Глава XIII. Лужение
265
равнои
отенпиале. Это обстоятельство приводит к тому, что из таких
дектролитов олово выделяется в виде губчатых и рыхлых осадков.
Если же раствор содержит олово только в четырехвалентной форме, то
осаждение металла происходит при высокой катодной поляризации,
” примерно 500—600 мв, что, как известно, способствует полу-
мелкокристаллической структуры.
Растворение оловянных анодов в случае электролиза при низкой
плотности тока сопровождается образованием станнитов, поскольку
этот процесс протекает при менее положительном потенциале,
чем процесс образования соединений четырехвалентного олова.
С увеличением плотности тока на аноде образуется пленка желто-
вато-зеленого (золотистого) цвета, приводящая к увеличению анод-
ного потенциала. При некотором значении плотности тока дости-
гается потенциал, при котором олово переходит в раствор в форме
станната, а образование станнита прекращается. При дальнейшем
повышении плотности тока на анодах образуется черная пленка
и происходит полная их пассивация (т. е. растворение их прекра-
щается полностью).
В связи с этим при лужении в щелочных электролитах очень
важно поддерживать аноды в таком состоянии, чтобы они были
частично пассивированы (внешним признаком этого является нали-
чие на анодах желтовато-зеленой пленки) и чтобы при растворении
они образовывали исключительно четырехвалентные ионы олова.
Для достижения указанной цели можно вести процесс лужения
с нерастворимыми анодами. Однако такое решение вопроса неце-
лесообразно, так как при этом прекращается пополнение элек-
тролита ионами олова и затрудняется его корректирование.
На практике работу производят с предварительным пассивиро-
ванием или, как иногда называют этот процесс, «формированием»
анодов. Формирование анодов производят в щелочном электролите
при повышенной плотности тока путем постепенного включения их
по одному или обработкой в отдельной ванне. Формирование анодов
можно осуществить постепенным погружением в электролит. При
этом активная поверхность анодов все время остается небольшой —
следовательно, на ней будет повышенная плотность тока.
Образование пассивной желтовато-зеленой пленки сопровождается
резким увеличением напряжения на клеммах ванны и значительным
газовыделением. После сформирования пленки анодная плотность
тока может быть снижена.
Когда оловянные аноды находятся в щелочном электролите без
т°ка, пассивная пленка растворяется, поэтому при перерывах
в работе и по окончании работы необходимо до выключения тока
Выгрузить аноды из электролита и поместить их в ванну с водой.
агРузка анодов в ванну также должна производиться под током.
^Концентрация станната натрия практически не влияет на внеш-
Ии вид осадков. При повышении содержания станната натрия
266
Часть третья. Технология нанесения металлических покрытий
в электролите возможно применение более интенсифицированных
режимов осаждения; повышается катодный выход потоку и несколько
уменьшается анодный выход.
Концентрация едкого натра играет очень важную роль в работе
станнатных электролитов, подобную той, которую играет концен-
трация цианидов в цианистых электролитах для меднения. При уве-
АноВная поляризация, в
Фиг. 106. Влияние концентрации
свободной шелочи на анодную по-
ляризацию олова.
накапливаться углекислый
личении концентрации едкого натра ка-
тодная поляризация возрастает, а анод-
ная — снижается.
На фиг. 106 приводятся данные, по-
казывающие, что с повышением содер-
жания свободной щелочи увеличивается
плотность тока, при которой происхо-
дит пассивирование анодов. С увеличе-
нием содержания щелочи катодная плот-
ность должна быть снижена, а анодная—
повышена. Выход по току при повы-
шении содержания щелочи снижается,
а рассеивающая способность увеличи-
вается. Большой избыток щелочи в элек-
тролите приводит к образованию тем-
ных губчатых осадков.
В станнатных электролитах может
натрий вследствие поглощения едким
натром углекислоты из воздуха. Наличие в электролите до 60—70 Пл
углекислого натрия не сказывается заметно на процессе лужения.
При накоплении больших количеств карбонатов или хлоридов
электролиты заменяют новыми, а из
отработанных электролитов извле-
кают олово. Для этой цели к ним
добавляют постепенно соляную кисло-
ту до полного осаждения олова в виде
белого студенистого осадка оловянной
кислоты. Раствор сливается, а осадок
после промывки растворяется в подо-
гретом растворе едкого натра.
Уксуснокислый натрий, добавляе-
мый в некоторые станнатные элек-
тролиты, придает раствору буферные
свойства.
Фиг. 107. Влияние плотности тока
на анодный (/, 2) и катодный (<?. 4)
выход по току.
Повышение плотности тока в щелочных электролитах, приго-
товленных на основе станната натрия, приводит к снижению выхода
по току (фиг. 107). Снижение катодного выхода по току особенно
заметно в случае работы при пониженной температуре и малых кон-
центрациях олова. Из-за резкого падения выхода по току работа
при плотности тока выше 3 а/дм? нецелесообразна.
Глава XIII. Лужение
267
Температура оказывает значительное влияние на процесс луже-
ния в станнатных электролитах. Как видно из данных табл. 87,
повышение температуры при электролизе приводит к увеличению
выхода по току.
Таблица 87
Влияние температуры на катодный выход по току и напряжение
(содержание олова в ванне 45,8 Пл, плотность тока 1 а!дм2)
Температура в ° С Катодный выход по току в % Напряжение на ванне в в
50 47,6 3,2
60 72,1 2,6
65 81,7 2,4
70 93,3 2,2
80 98,3 1,8
При повышении температуры наблюдается уменьшение как
катодной, так и анодной поляризации, что объясняется в основном
увеличением скорости диффузии.
Аноды для лужения из щелочного электролита должны быть
изготовлены из чистого олова марки 01 и 02; примеси мышьяка,
меди и свинца недопустимы. Аноды следует периодически очищать
от шлама.
Ширина анодных пластин не должна быть чрезмерной, так как
в противном случае середина нерабочей части анодов может оказаться
непассивированной и в раствор будут попадать станниты.
Корректируют щелочные оловянные электролиты в основном
оловом и едким натром (в соответствии с данными анализа), которые
рекомендуется вводить как можно чаще, небольшими порциями.
Олово добавляется в виде отдельно приготовленного раствора стан-
ната натрия. Количество свободной щелочи, вводимой в электролит
вместе с оловом, должно соответствовать содержанию свободной
щелочи в электролите. Рекомендуется также ежедневно добавлять
1 2 Г/л 10-процентного раствора перекиси водорода и воды, чтобы
Доводить электролит в ванне до требуемого уровня.
Описание неполадок, встречающихся при работе натрийстаннат-
НЫх электролитов, приводится в табл. 88.
В последние годы много внимания уделяется исследованию воз-
можности применения ка л и йста н натн ых электролитов для
лужения. По данным ряда исследователей, электролиты на основе
Станната калия при лужении обладают следующими преимущест-
вами перед электролитами на основе станната натрия: более высо-
кой растворимостью (в 1,5—2 раза), лучшей электропроводностью
268
Часть третья. Технология нанесения металлических покрытий
Неполадки в работе станнатных электролитов
Таблица 88
.
Признаки неполадок Причины возникновения Способы устранения
Темные губчатые осадки, интенсивное газовыделеиие на дета- лях Высокая плотность тока. Большое содер- жание щелочи; низкая температура; наличие двухвалентных ионов олова Довести плотность тока до нормы. Добавить станнат натрия. Отрегулировать тем- пературу. Зачистить аноды и вновь их запассивиро- вать. Добавить 1—2 мл/л 10-процентной перекиси во- дорода
Потемнение анодов Ненормальный режим работы электролита Зачистить аноды и вновь их пассивировать
Пассивирование ано- дов с появлением на них тёмной пленки Высокая анодная плотность тока Увеличить число анодов или уменьшить число де- талей. Проверить контакты анодов со штангой
Появление мажу- щейся пленки на ано- дах Низкое содержание щелочи Добавить щелочи
Помутнение раствора, выпадение осадка, бе- лый налет на анодах Недостаток щелочи в электролите Произвести анализ элек- тролита и по его резуль- татам добавить щелочи
Малый выход по току, бурное газовыде- ление на деталях Избыток щелочи Добавить станнат в элек- тролит
Пористые, рыхлые осадки Присутствие двухва- лентных ионов олова в электролите Добавить 1—2 мл!л 10- процентпого раствора пере- киси водорода. Зачистить аноды и вновь запассивиро- вать их
(примерно на 25%), более широким пределом рабочей плот-
ности тока и несколько более высоким выходом по току. По имею-
щимся данным, электролиты на основе станната калия более ста-
бильны, чем электролиты на основе станната натрия, так как менее
подвержены гидролизу. Следует отметить, что с повышением анодной
плотности тока растворимость оловянных анодов в калиевых элек-
тролитах заметно снижается. В связи с этим было предложено
использовать оловянные аноды, содержащие около 1 % алюминия.
Аноды из сплава олова с алюминием, так же как оловянные аноды,
в процессе работы должны быть покрыты пассивной пленкой.
Считают, что аноды, изготовленные из указанного сплава,
пассивируются при рабочей плотности тока. Анодная поляризация
несколько меньше, а анодный выход по току выше, чем в случае
Глава XIII. Лужение
269
ппменения оловянных анодов. Повышение содержания олова
электролите приводит к лучшему использованию тока. Повышение
содержания едкого кали снижает катодный выход по току, повышает
аНОдный выход по току и одновременно критическую плотность
тока, при которой наступает пассивирование анодов; повышается
проводимость электролита. Повышение температуры увеличивает
проводимость, а также анодный и катодный выход по току.
Рекомендуются следующие состав и режим работы электролита
на основе станната калия:
Станнат калия (в пересчете на металлическое олово) 75—80
Едкое кали свободное...............................22—25
Пл
»
Режим работы: температура 80—90е, плотность тока 6—
10 а! дм2. Выход по току около 80%.
Учитывая высокую стоимость едкого кали, электролиты на основе
станната калия в первую очередь следует рекомендовать для тех
случаев, когда интенсификация процесса особенно важна, а именно
для лужения ленты и проволоки.
Приготовление электролитов
Существует несколько химических и электрохимических методов
приготовления щелочных оловянных электролитов.
Химический метод
Приготовление из металлического олова. Этот способ заклю-
чается в непосредственном получении станната натрия из металли-
ческого олова в присутствии азотнокислого натрия:
2Sn + 3NaOH -J- NaNO3 = 2Na2 SnO3 + NH3.
В железный сосуд наливают 250 мл 50-процентного раствора
едкого натра, добавляют 85 Г азотнокислого натрия, размешивают
До полного растворения и нагревают до 130—140°. Затем при пере-
мешивании небольшими порциями добавляют гранулированное или,
лучше, порошкообразное олово. Смесь продолжают нагревать в пре-
делах 140—180° и периодически ее перемешивают. Через несколько
часов станнат выщелачивается водой из застывшего расплава,
а нерастворенный осадок олова используется при следующем приго-
товлении станната.
Раствор переливают в ванну, анализируют, в случае необходимо-
сти корректируют и добавляют остальные компоненты. Описанный
'-пособ, хотя он и длителен, является одним из наиболее надежных.
Приготовление из четыреххлорного олова. Способ основан насле-
дующей реакции получения станната олова:
SnCl4 + 6NaOH = Na2SnO3 + 4NaCl + 3H2O.
270
Часть третья. Технология нанесения металлических покрытий
Требуемые количества четыреххлористого олова и едкого натра
растворяют в возможно малом количестве нагретой воды. Затем
энергично перемешивая, вливают раствор четыреххлористого олова
в раствор едкого натра. Небольшой осадок метаоловянной кислоты
удаляется декантацией или фильтрованием. После анализа, кор-
ректирования и введения остальных добавок электролит готов
к работе.
Приготовление из двухлористого олова. В отдельных сосудах
растворяют едкий натр и двухлористое олово. Затем, осторожно
помешивая, добавляют раствор щелочи к теплому раствору дву.
хлористого олова. При этом вначале получается осадок Sn(OH)21
который затем растворяется в избытке едкого натра, образуя рас-
твор станнита олова NaSnO2, в котором олово находится в двух-
валентном состоянии.
Перевод двухвалентного олова в четырехвалентное осущест-
вляется добавлением перекиси водорода, а также путем проработки
электролита с частично запассивированными анодами.
Электрохимический метод
Ванну заполняют 5—6-процентным водным раствором едкого
натра, подогревают до 65—70° и завешивают оловянные пластины.
На катодную штангу подвешивают несколько пористых керамических
сосудов, служащих диафрагмами, которые заполняют тем же рас-
твором. В сосуды помещают стальные или стальные никелированные
стержни, которые соединяют с катодной штангой.
Растворение олова производится при анодной плотности тока 1 —
2 а/дм2, катодная плотность при этом может достигать 30 а/дм2.
Для обеспечения равномерного растворения анодов рекомендуется
установить 3—4 диафрагмы с катодами.
Чтобы олово переходило в раствор в виде станната, а не станнита,
в начале процесса в течение 10—15 мин. резко повышают анодную
плотность тока (до 4—5 а/дм2). При этом аноды приобретают желто-
золотистый цвет, что служит внешним признаком образования
станната. В,дальнейшем плотность тока снижается до 1—2 а/дм2,
но аноды должны сохранять желтоватый цвет. Если аноды потемнеют,
их надо почистить и снова на 10—15 мин. повысить плотность тока.
При пассивировании анодов в ванну добавляют необходимое
количество перекиси водорода.
Продолжительность процесса зависит от силы тока и от объема
электролита. Можно считать, что 1 а-ч электричества переводит
в раствор 0,6—0,8 Г олова.
По окончании анодного растворения (требуется примерно 56
60 а-ч на 1 л раствора) производят химический анализ электролита
на содержание станната натрия и едкого натра, проверяют содержа-
ние двухвалентного олова, которое должно быть не выше 1—2 Г/л,
Глава XIII. Лужение
271
„сбавляют в ванну остальные компоненты и воду, и электролит
готов к работе.
Электролиты на основе станната калия готовят аналогичным
образом.
5. ЛУЖЕНИЕ БЕЗ ВНЕШНЕГО ТОКА
Лужение мелких изделий, а также нанесение тонких слоев олова
может быть осуществлено без внешнего источника тока, посредством
так называемого внутреннего электролиза.
Принцип данного метода заключается в том, что при погружении
в раствор двух металлов, находящихся в электрическом контакте,
металл с более электроотрицательным потенциалом начинает пере-
ходить в раствор, вытесняя оттуда ионы более благородного металла,
которые разряжаются на поверхности металла, играющего роль
катода.
Различают две разновидности лужения без внешнего тока: кон-
тактное лужение и лужение методом погружения.
Контактное лужение применяется для деталей, изготовленных
из металлов или сплавов, менее электроотрицательных, чем олово,
а именно из меди или латуни.
Обезжиренные и промытые медные или латунные изделия нани-
зывают на проволоку вперемежку с цинковыми пластинами и погру-
жают в один из следующих растворов.
1) Хлористое олово........................... 25 Г!л
Однозамещенный виннокислый калий ........ 200 »
2) Хлористое олово........................... 30 »
Едкий натр ............................... 60 »
Процесс ведется при температуре 90°. При этом цинк переходит
в раствор, а олово осаждается тонким слоем (1 мк) на изделиях.
Продолжительность осаждения 2—3 часа.
Можно погружать изделия в раствор насыпью, в корзинах, поло-
жив туда кусочки цинка. Корзины необходимо время от времени
встряхивать.
Лужение методом погружения заключается в том, что олово
на поверхность других металлов наносится погружением изделий
в раствор, содержащий соль олова, без применения контакта. Этот
метод применяется для покрытия изделий, изготовленных из метал-
лов более электроотрицательных, чем олово, например для лужения
мелких стальных и алюминиевых изделий.
Лужение железных деталей производится в кипящем растворе
оледующего состава;
Хлористое олово ............................ 3—4 Г/л
Однозамещеиный виннокислый калий...............До насыщения
272
Часть третья. Технология нанесения металлических покрытий
Подготовленные детали загружают в сетки или корзины и опу-
скают на несколько минут в раствор. При этом необходимо детали
встряхивать.
Алюминиевые детали покрывают оловом в растворе состава:
Хлористое олово ................................... 30 Г/л
Едкий натр....................................... 20 »
при температуре 70—75э; продолжительность лужения 3—5 мин.
6. ПАССИВИРОВАНИЕ ЭЛЕКТРОЛИТИЧЕСКИ ЛУЖЕНОЙ ЖЕСТИ
Для повышения стойкости электролуженой жести, а также
консервных банок из горячелуженой жести разработан метод пасси-
вирования.
Состав раствора для пассивирования:
Двухромовокислый калий ............................ 3 Пл
Едкий натр........................... . . . . 10 »
ОП-7.......................................... . 3—5 »
В этот раствор детали погружаются на 3—5 сек. при 85—95°.
7. ОПЛАВЛЕНИЕ ОЛОВЯННЫХ ПОКРЫТИЙ
После длительного хранения способность электролитических
осадков олова к пайке значительно снижается. Поэтому луженые
электролитическим способом изделия рекомендуется оплавлять. Эта
операция вообще значительно улучшает качество покрытия, в част-
ности, заметно уменьшает его пористость.
Как правило, оплавление оловянных покрытий осуществляется
тем успешнее, чем меньше толщина слоя олова. Многочисленные
опыты и производственная практика показали, что количество
«корольков» и наплывов, образуемых при оплавлении, увеличивается
с ростом толщины оловянных покрытий. Успешно осуществляется
оплавление электролуженой жести, предназначенной для изготовле-
ния консервной тары при толщине слоя олова 1—2 мк. Широко
применяется в различных отраслях промышленности оплавление
оловянных покрытий без каплеобразования при толщине слоя олова
до 4 мк.
Во избежание перегрева и стекания олова с поверхности деталей
продолжительность операции оплавления оловянных покрытии
должна быть минимальной.
Следует считать, что доброкачественное оплавление оловянных
покрытий может быть получено лишь в том случае, когда силы сцеп-
ления кристаллов олова с основой деталей больше силы межатом-
ного притяжения в оловянном слое. Поэтому важно уделить особое
внимание тщательности подготовки поверхности перед лужением
и получению плотных мелкокристаллических оловянных покрытий.
Глава X///. Лужение
273
Существует несколько способов оплавления оловянных покрытий:
1) погружение в нагретые муфельные или шахтные печи;
2) погружение в касторовое масло или глицерин;
3) нагрев электрическим током;
4) нагрев индукционным методом токами высокой частоты.
Два последних способа применяются главным образом при опла-
влении электролуженои жести, первые
луженых деталей более сложной кон-
фигурации.
Оплавление в печах продолжается
Ю—15 сек., температура нагрева печи
550-600°.
При оплавлении в жидких средах
наиболее часто в качестве теплоноси-
теля применяют нагретые до 250—260°
глицерин или касторовое масло.
Контактный метод оплавления за-
ключается в нагреве луженой ленты
при прохождении через нее переменного
электрического тока. На фиг. 108 пока-
зана схема установки для оплавления
этим способом. Потребная мощность для
нагрева ленты шириной 500 мм и тол-
щиной 0,28 мм при скорости движения
ееЮОлг/лшн ссетавляет около 400 кет.
Напряжение от трансформатора ТР
подводится к ленте посредством контакт-
ных роликов Рг и Р2.
К недостаткам контактного метода
два — при оплавлении
Фиг. 108. Принципиальная схема
оплавления методом сопротивле-
ния:
Тр—силовой трансформатор; ТТ —
трансформатор тока; TH — тран-
сформатор напряжения; Г — гене-
ратор переменного тока; В — воз-
будитель; Эв — электроламповый
ваттметр; У—электронный усили-
тель; М. У—электромагнитный уси-
литель; Plt Р2 — контактные ро-
лики; D — приводной двигатель;
ТГ—тахогенератор станции; Л —
лента; А — амперметр.
относятся:
• 1) сложность осуществления сопри-
косновения токоведущих роликов с лен-
той;
2) опасность прожога жести в случае плохого контакта ролика
с лентой;
3) возможность неравномерного прогрева ленты;
4) опасность порчи ленты с расплавленным слоем олова при
наличии дефектов на роликах.
Оплавление оловянных покрытий индукционным методом про-
исходит в результате нагрева ленты токами высокой частоты (200—
500 кец). Нагрев олова до температуры плавления и даже выше
осуществляется вихревыми токами, возникающими на поверхности
ленты. Принципиальная схема высокочастотной установки для
оплавления луженой ленты приведена на фиг. 109.
Процесс оплавления луженых деталей осуществляется следую-
щим образом. Детали после лужения смачивают 5—6-процентным
18
Вяйиер и Дасояи
274
Часть третья. Технология нанесения металлических покрытий
раствором флюса, состоящего из смеси хлористого цинка (3 вес. ч
и хлористого аммония (1 вес. ч.), сушат, а затем помещают в печь
или в нагретый жидкий теплоноситель (глицерин или масло). После
оплавления детали промывают в холодной и го-
рячей воде и сушат.
Фиг. 109. Принци-
пиальная схема высо-
кочастотной установки
с ламповыми генера-
торами:
/—ламповый генератор;
2 — индуктор; 3 — ртут-
ный выпрямитель; 4—си-
ловой трансформатор;
5 — индукционный регу-
лятор; 6 — фотореле;
7—осветители; S—элек-
тронный регулятор; Р —
усилитель; 10 — серво-
двигатель.
8. ПОКРЫТИЕ «КРИСТАЛЛИТ»
Довольно широкое применение получила
разновидность лужения под названием «крц.
сталлит», применяемая с целью придания по-
верхности изделий красивого декоративного
вида.
Сущность метода заключается в нанесении
слоя олова небольшой толщины (3—4мк), опла-
влении его, проявлении кристаллической струк-
туры застывшего слоя олова и закреплении его
лаком. В результате такой обработки поверх-
ность изделий приобретает красивую ярко вы-
раженную узорчатость, напоминающую измо-
розь на окнах.
Покрытие «кристаллит» применяется для от-
делки электротехнической арматуры и бытовых
приборов (пылесосов, настольных ламп, стоек
сатураторов и т. п.). Лужению по способу «кри-
сталлит» могут подвергаться изделия, изготов-
ленные из железа, меди, алюминия, их спла-
вов и др.
Процесс кристаллизации олова был подробно изучен А. П. Эйчи-
сом. Было показано, что структура покрытия зависит от температуры
оплавления, скорости охлаждения и вида основного металла илл
подслоя, на которые наносится слой олова. При нагреве до темпера-
туры, равной примерно температуре плавления олова (235е), на
поверхности образуется мелкокристаллическая структура. При
повышении температуры нагрева до 250° получаемая микроструктура
укрупняется.
Скорость охлаждения оказывает большое влияние на внешний
вид покрытия, размеры и форму кристаллитов; особенно сильно
сказывается резкое местное охлаждение. В случае нанесения олова
на стальную и алюминиевую поверхности кристаллический узор
получается крупным; при нанесении же олова на подслой цинка,
кадмия, латуни, меди и т. п. образуется мелкий узор.
Стальные изделия после шлифования, обезжиривания, декапиро-
вания и тщательной промывки подвергаются лужению. Для лужения
обычно применяют сернокислый электролит, хотя могут быть
использованы и станнатные электролиты.
Глава ХШ. Лужение
275
Силуминовые изделия после шлифования или пескоструйной
чистки и притирки венской известью подвергают травлению в тече-
0 з____5 сек. в 10-процентном растворе едкого натра при 70°, про-
мывают, осветляют в смеси азотной и плавиковой кислот. Перед
лужением на них наносится контактным или гальваническим спо-
собом слой никеля или железа.
Применение контактного или гальванического метода нане-
сения железа или никеля зависит от того, предусматривается ли впо-
следствии электрохимическое окрашивание или нет. Если указанное
окрашивание не предусмотрено, то достаточно контактного никели-
рования или железнения, в противном случае необходимо нанесение
гальваническим способом слоя никеля или железа толщиной 3—5 мк.
Контактное железнение производится в растворе следующего
состава:
Хлорное железо . ............ 25 Г/л
Соляная кислота (уд. вес 1,19)..............20 мл/Г
Температура 98—100°; продолжительность обработки 3—4 мин.
Для контактного никелирования служит раствор состава:
Хлористый никель . . .................... 200 Пл
Соляная кислота (уд. вес 1,19) . .......... 30 мл/Г
Продолжительность обработки 3—5 мин. при 70—75°.
После контактного железнения или никелирования изделия
промывают и 'подвергают лужению. Для лужения силуминовых
изделий применяют только сернокислые электролиты.
Лужение в сернокислых электролитах производится при катод-
ной плотности тока 2 а/дм? в течение 5—10 мин. до получения покры-
тия толщиной 3—5 мк.
После лужения, промывки и сушки производят флюсование,
т. е. смачивают изделия 5—6-процентным водным раствором смеси
75% хлористого цинка и 25% хлористого аммония. Изделия из алю-
миния и его сплавов не рекомендуется подвергать флюсованию,
так как флюс может проникнуть сквозь поры покрытия и вызвать
усиленную коррозию основного металла.
Оплавление слоя олова производится в термостатированной
печи при температуре 300—350° до начала плавления олова, что
легко заметить по появлению цветов побежалости на изделии. Про-
должительность оплавления может колебаться в значительных
пределах. В каждом конкретном случае она устанавливается в зави-
симости от массы загружаемых изделий и конструкции печи.
Изделия после оплавления охлаждаются естественным путем,
причем можно произвести местное охлаждение струей воздуха
или прикосновением медного стержня с целью создания искусствен-
ных центров кристаллизации. Остывшие изделия декапируют в 3—
процентном растворе серной кислоты в течение нескольких секунд.
18*
276
Часть третья. Технология нанесения металлических покрытий
Проявление кристаллического узора производится посредством
лужения в сернокислом электролите. Желательно, чтобы содержа-
ние сернокислого олова соответствовало верхнему пределу (45—
50 Пл), а клея и фенола — нижнему (т. е. клея 1—1,5 Пл, а фенола
не более 3 Пл). Плотность тока при лужении 0,2—0,3 а!дм*, про-
должительность проявления узоров 10—15 мин.
После лужения и сушки изделия покрывают бесцветными неокра-
шенными лаками. Для этой цели пригодны мочевиноформальдегид-
ные лаки типа УВЛ-1 или УВЛ-3, нитролаки, нитроцеллюлозные
лаки и др. При необходимости получения окрашенных пленок «кри-
сталлит» покрывают лаками, к которым добавлены светопрочные
красители. Лакирование «кристаллита» может производиться кистью,
обливанием, погружением или распылением.
В некоторых случаях после проявления производят электрохи-
мическое окрашивание. Для этого изделия непосредственно после
проявления и промывки погружаются в раствор состава:
Бура............. 125—150 Г/л
Сернокислая медь ............ 8—15 »
Режим работы: температура 35—40°, плотность тока: на-
чальная 0,1—0,2 а/дм*, рабочая 0,005—0,01 а/дм*. Продолжитель-
ность начального периода 1,5—2,0 мин., общая продолжительность
15—20 мин.
После электрохимической обработки изделия промывают, сушат
и покрывают бесцветными лаками типа УВЛ-1 или УВЛ-3.
9. УДАЛЕНИЕ НЕДОБРОКАЧЕСТВЕННЫХ ПОКРЫТИЙ
И РЕГЕНЕРАЦИЯ ОЛОВА
Удаление недоброкачественных оловянных покрытий со стальных
деталей может быть осуществлено анодным растворением в 5—
10-процентном растворе едкого натра при температуре 60—70° и анод-
ной плотности тока 5—10 а! дм*.
С алюминиевых изделий оловянные покрытия снимают в 50-
процентном растворе азотной кислоты.
Химическое растворение оловянных осадков может производиться
в следующих ваннах:
1) Метаиитробензойная кислота . . ... 25 Пл
Натр едкий .... ...... 50 »
Температура ванны 70—75°; за 1 час растворяется слой покрытия
толщиной 3—5 мк.
2) Соляная кислота (уд. вес 1,17)..................... 1л
Окись сурьмы 12 Г
Вода............... ... .... 125/44
Глава XI11. Лужение
277
Температура комнатная.
регенерация олова с обрезков жести, консервных банок и других
пуженых деталей может быть осуществлена следующим образом.
Изделия, с которых требуется удалить олово, загружают в специаль-
ные корзины, рамы или сетки, крупные куски разрезают. В случае
необходимости предварительно производится обезжиривание.
Корзины завешиваются на анодные штанги в ванну следующего
состава:
Станнат натрия 30—40 Г/л
Едкий натр . 70—80 »
Растворение олова ведется при температуре 60—70° и плотности
тока 1 а/дм2. В качестве катодов используются железные листы,
на которых олово осаждается в виде губчатой массы.
Признаком окончания растворения может служить повышение
напряжения на клеммах с 1,3—1,4 в до 2,5 в.
Растворение можно производить в 6—8-процентном растворе
едкого натра при том же режиме. В этом случае в начале электро-
лиза олово будет переходить в раствор, а после накопления доста-
точного количества станната олово начнет осаждаться на катоде
в виде губчатого металла, который легко удаляется механическим
путем.
Промытое губчатое олово сушат при 100—120° до полного удале-
ния влаги, брикетируют и плавят. Полезный выход олова состав-
ляет 90% от количества губчатого. Удаление примесей свинца, меди
и железа производится переплавкой с березовым углем. Цинк можно
удалить обработкой в 15—20-процентной соляной кислоте.
Губчатое олово может быть переведено в раствор по описанному
выше методу — сплавлением с едким натром и селитрой.
ГЛАВ А XIV
СВИНЦЕВАНИЕ
1. ОБЩИЕ СВЕДЕНИЯ
Свинец — синевато-серый металл, мягкий, легко поддающийся
механической обработке. Он легко режется ножом и вальцуется
в тонкие листы, ленты и фольгу. Важнейшие физико-химические
свойства свинца: удельный вес 11,34 Г!см?\ атомный вес 207,21;
валентность 2 и 4; стандартный потенциал электродов РЬ/РЬ++ =
~ —0,13 <з; РЬ/РЬ+ + + + = 1,8 в\ электрохимический эквивалент
двухвалентного свинца 3,866 Г1а-ч\ температура плавления 327°.
Свинец легко растворяется в щелочах и в органических кислотах;
в слабой соляной кислоте свинец довольно стоек, но в концентриро-
ванной он растворяется. Свинец практически устойчив в растворах
серной кислоты, сернокислых соединений. Стойкость свинца в ука-
занных средах связана с образованием на его поверхности пленки
сульфата свинца, обладающей защитными свойствами. Заметное
растворение свинца в концентрированных растворах серной кислоты
наблюдается лишь при высоких температурах (180—200°). Свинец
электроположительное железа, потенциал которого равен —0,44 в.
Следовательно, свинцовое покрытие для железа не является электро-
химической защитой. Однако можно получить толстые беспористые по-
крытия свинца, которые надежно будут защищать железо от коррозии
«механически».
Свинцеванию подвергаются изделия, изготовленные из железа,
стали, чугуна, меди и медных сплавов, из алюминия и его сплавов.
Основные области применения электролитического свинцевания:
1) защита от коррозии металлических конструкций, работающих
в условиях непосредственного контакта с серной кислотой и раство-
рами сульфатов;
2) защита от газовой коррозии в атмосфере, содержащей сернистые
соединения;
3) защита от рентгеновских лучей.
Так как свинец очень мягок и легко истирается, а также ввиду
того, что он защищает сталь лишь «механически», обычно для надеж-
ной защиты рекомендуется применять покрытия с толщиной слоя
от 50 до 2000 мк, в зависимости от условий эксплуатации покрывае-
мых изделий.
Глава XIV. Свинцевание
279
2. МЕТОДЫ НАНЕСЕНИЯ СВИНЦОВЫХ ПОКРЫТИЙ
Свинцовые покрытия в настоящее время получают либо методом
догружения изделий в расплавленный металл (горячий способ),
чйбо электролитическим путем.
При горячем способе свинцевания для получения удовлетвори-
тельных покрытий необходимо добавление в ванну металла, хорошо
сплавляющегося как с железом, так и со свинцом, например олова,
цинка или сурьмы. Чаще всего применяется олово в количестве 15%.
Связующий металл (олово) можно вводить либо непосредственно
в свинцовую ванну, либо предварительно наносить каким-либо
способом на изделие тонкий слой покрытия. Горячее свинцевание
с применением промежуточного покрытия называется г о м о ген-
н ы м.
Гомогенный способ для покрытия мелких деталей неэко-
номичен, для покрытия же больших поверхностей толстым слоем
свинца этот способ является наиболее рациональным.
Достоинства горячего способа свинцевания заключаются в боль-
шой скорости процесса, а также в том, что при покрытии стальных
изделий свинец хорошо заполняет отверстия и каналы швов. Однако
качество свинцовых покрытий, полученных горячим способом,
хуже, чем у электролитических покрытий. Покрытия, полученные
электролизом, отличаются экономичностью и высокой химической
стойкостью. Но электролитический способ свинцевания уступает
горячему способу по производительности, особенно при осаждении
толстых покрытий.
Технология горячего свинцевания сводится к следующему.
Изделия с предварительно подготовленной поверхностью обрабаты-
вают в ванне с горячим маслом в течение 15—20 мин. и погружают
в первую из трех последовательно расположенных ванн с жидким
свинцом, в который добавлено олово. Через несколько минут изделия
вынимают из первой ванны и загружают во вторую ванну со свин-
цом, где выдерживают в течение нескольких секунд. Затем изделия
вынимают для осмотра; после очистки они поступают в третью,
последнюю ванну с чистым .свинцом также на несколько секунд
и быстро передаются в ванну с горячим маслом.
Заключительной операцией является протирка листов отрубями
или древесными опилками. В ваннах горячего свинцевания темпера-
тур3 металла поддерживается в пределах 340—360°.
3. СОСТАВ И РЕЖИМ РАБОТЫ ВАНН ЭЛЕКТРОЛИТИЧЕСКОГО
СВИНЦЕВАНИЯ
К настоящему времени разработано большое количество различ-
«ых электролитов для свинцевания: борфтористоводородные, крем-
нефтористоводородные, сульфаминовые, фенолсульфоновые, метабен-
золдисулЬфоновые> уксуснокислые, щелочные, перхлоратные.
280
Часть третья. Технология нанесения металлических покрытий
пирофосфатные и др. Большинство этих электролитов (кроме Двух
последних) находит практическое применение в гальваностегии. '
В качестве добавок, улучшающих структуру свинцовых покрытий
в различных электролитах применяются: столярный клей, пептон’
канифоль, глицерин, пиридин, ортотолуидин, желатина, сероугле-
род, лигносульфоновая кислота и др.
Борфтористоводородные электролиты
Примерный состав электролита:
Основной углекислый свинец 2РЬСО3-РЬ(ОН)„ . 120 Пл
Плавиковая кислота HF . 120 »
Борная кислота Н3ВО3 106 »
Столярный клей ... 0,1—0,5 »
Работа ведется при 18—25°, плотность тока 1—3 а/дм2, выход
по току 90—99%.
Увеличение концентрации борфтористоводородной кислоты
в электролите приводит к некоторому улучшению структуры осадков
вследствие уменьшения концентрации ионов свинца и связанного
с этим повышения катодной поляризации. Избыток борной кислоты
способствует устойчивости электролита и предупреждает образо-
вание шламообразного фтористого свинца. Повышение концентра-
ции свинца в электролите повышает величину допустимой плот-
ности тока, при которой дендритообразование не наступает.
Увеличение температуры электролита способствует образованию
крупнокристаллических осадков. При работе форсированным режи-
мом с целью получения толстых покрытий рекомендуется применять
электролиты, содержащие все компоненты обычного борфтористо-
водородного электролита в удвоенном количестве.
Лучшей подготовкой поверхности перед покрытием в указанной
ванне является пескоструйная обработка.
Кремнефтористоводородные электролиты
Наряду с борфтористоводородными электролитами известное
распространение в промышленности имеют также кремнефтористо-
водородные.
Примером может служить электролит следующего состава:
Фторосиликат свинца PbSiF6 ... 90—250 Г/л
Кремнефтористоводородная кислота H2SiF6 15—70 »
Борная кислоты Н3ВО3 . . 5 »’
Столярный клей ... 1 »
Режим работы: температура 18—40\ плотность тока 1-"
2 а!дм2. Выход по току составляет 90—95%.
Эти электролиты применяются в основном при электрорафинирО'
вании свинца и реже для получения свинцовых покрытий. ОднаК°
Глава XIV. Свинцевание
281
кремнефтористоводородный электролит обладает рядом существен-
ных преимуществ перед другими свинцовыми электролитами; в част-
ности, он в 5—8 раз дешевле борфтористоводородного электролита
и прост в изготовлении, тем более, что в настоящее время кремне-
фтористоводородная кислота выпускается в продажу, а для приго-
товления борфтористоводородного электролита необходимо предва-
рительно готовить борфтористоводородную кислоту из борной и пла-
виковой кислот. Последняя операция связана с необходимостью
работы с очень вредной плавиковой кислотой.
Кремнефтористоводородный электролит дает возможность вести
электролиз при достаточно высоких плотностях тока. Концентрация
свинца в электролите может колебаться в значительных пределах.
Более концентрированные растворы употребляются для составления
ванн, работающих форсированными режимами.
Величина допустимой плотности тока зависит от концентрации
свободной кислоты в электролите: чем больше ее в электролите, тем
меньше допустимая плотность тока.
Рассеивающая способность кремнефтористоводородного электро-
лита примерно равна рассеивающей способности борфтористоводо-
родного электролита.
В качестве поверхностноактивной добавки в кремнефтористо-
водородный электролит обычно применяется столярный клей. Как
показали исследования И. А. Агуфа и М. А. Дасояна, эффективной
добавкой является также натриевая соль лигносульфоновой кислоты
НК (применяемая в производстве свинцовых аккумуляторов).
Введение этого вещества в электролит в количестве 1—2 Пл заметно
улучшает качество покрытий, увеличивает допустимую плотность
тока до 4—5 а/дл12.
Парафенолсульфоновые и метабензолдисульфоновые
электролиты
Примерный состав парафенолсульфонового электролита:
Свинцовая соль парафенолсульфокислоты
(СбН4ОН5О3)2РЬ................ 140—200 Г/л
Парафенолсульфокислота CeH4OHSO3H 20—40 »
Столярный клей . . .... 0,5—1 »
Режим работы: температура 18—60°, плотность тока 0,5—
‘,0 а/дм2. Выход по току 90—95%. Ванна позволяет получать
светлые осадки, обладающие хорошим сцеплением с основным
металлом.
Метабензолдисульфоновый электролит:
Свинцовая соль метабензолдисульфоновой кислоты
CeH4(SO3)2Pb............................... 220—445 Пл
Метабензолдисульфокислота С6Н4 (SO3H)2 . . 30—180 »
Столярный клей............................... 1—2 »
282
Часть третья. Технология нанесения металлических покрытий
Режим работы: температура 18—25°, плотность тока
5 а/дм2; выход по току 90—95%.
По технологическим данным оба эти электролита являются
вполне приемлемыми. Благодаря высокой растворимости свинцовой
соли метабензолдисульфоновой кислоты, вторая ванна может работать
при больших плотностях тока, по данным П. П. Беляева,
до 20 а/дм2. Оба электролита находят применение в гальвано-
стегической практике.
Уксуснокислые электролиты
В состав уксуснокислых электролитов входят:
а)
Уксуснокислый свинец РЬ (СН3СОО)2 75 Пл
Едкий натр NaOH ................................. 20 »
Сегнетова соль KNaC4H4O6-2H2O • . . 50 »
Фиг. ПО. Внешний вид осадков свинца, полеченных из уксуснокислых электро-
литов: а — электролит без добавки, электрод цилиндрической формы; б — электро-
лит без добавки, электрод прямоугольной формы; в — электролит с добавкой 30 Г/л
лигносульфоновой кислоты, электрод прямоугольной формы.
Электролиз ведется при 60—70°, плотность тока 1,5—2 а/дм2;
выход по току составляет 90—95%.
Эти электролиты без поверхностноактивных добавок не пригодны
для гальваностегических целей, так как они не позволяют получать
покрытия сколько-нибудь удовлетворительного качества.
Глаза XIV. Свинцевание
283
Осадки из таких ванн состоят из дендритов (фиг. ПО).
В качестве поверхностноактивных добавок, улучшающих струк-
туру осадков, применяются пиридин, ортотолуидин, сероуглерод
и НК- Влияние последней добавки было исследовано А. К. Лорен-
цом; им установлено, что при добавлении к уксуснокислому элек-
тролиту 30 Пл НК последняя, адсорбируясь на катоде, резко
изменяет условия электрокристаллизации свинца и приводит к об-
разованию ровных, светлых, плотных и блестящих осадков
(фиг. ПО).
Уксуснокислые электролиты отличаются своей дешевизной и про-
стотой приготовления.
Недостатком указанных электролитов является некоторое непо-
стоянство состава, связанное с летучестью уксусной кислоты. Это
вызывает необходимость частой корректировки ванны.
Перхлоратные электролиты
Наиболее плотные осадки свинца получаются из перхлоратных
электролитов.
Один из рекомендованных рецептов приводится ниже:
Хлорная кислота . . 45—60 Пл
Углекислый свинец . 55—70 »
Пептон ......... 0,5 »
Осаждение" ведется при 18—25°, плотность тока 1—2 а!дм2.
Хлорная кислота НС1О4, необходимая для составления электролита,
готовится обработкой натриевой или калиевой соли хлорной кислоты
серной кислотой. Полученную при этом хлорную кислоту перегоняют
и растворяют в ней основной углекислый свинец. Перхлоратные
ванны не получили распространения в промышленности из-за доро-
говизны хлорной кислоты и ее солей, а также из-за ее взрывоопас-
ности.
Щелочные электролиты
Плотные осадки свинца могут быть получены из щелочного
электролита следующего состава:
Уксуснокислый свинец 75 Г/л
Едкий натр ... 200 »
Сегнетова соль 50 »
Канифоль . 6 »
Режим работы: температура 60—70°, плотность тока
* 4 а!дм2. Площадь анодов должна превышать площадь катодов
в 2—4 раза. Сегнетова соль вводится для предупреждения пассива-
ции анодов, наблюдаемой при малом содержании щелочи в ванне.
284
Часть третья. Технология нанесения металлических покрытий
При осаждении толстых слоев свинца рекомендуется применять
перемешивание электролита сжатым воздухом; плотность тока при
этом может составлять 6 а!дм?.
В табл. 89 приведена продолжительность осаждения свинца
в зависимости от требуемой толщины покрытия и применяемой
плотности тока. В табл. 90 указаны неполадки, встречающиеся при
работе свинцовых ванн.
Таблица 89
Продолжительность осаждения свинца (в мин.)
при выходе по току 95%
Толщина слоя в мм Плотность тока в а!дмг
0,5 0,75 1.0 1.5 2,0 2,5 3.0 3,5 4,0
5 19 14 9,4 7,0 4,7 4,1 3,5 2,9 2,3
10 38 28 19 14 9,4 8,2 7,0 5,8 4,7
30 113 85 56 42 28 25 21 17 14
50 188 141 94 70 47 41 35 29 23
70 263 197 132 99 66 57 49 41 33
200 752 564 376 282 188 164 140 116 94
600 2256 1692 1128. 846 564 492 420 348 282
1000 3760 2820 1880 1410 940 820 700 580 470
Таблица 90
Неполадки, встречающиеся при свинцевании
Признаки неполадок Причины возникновения Способы устранения
Крупнокристалличе- ский осадок по всей поверхности изделия Образование шлама из фтористого свинца Плохое сцепление свинца с металлом из- делия Недостаток клея, высокая температура и пониженное содержа- ние свободной кислоты Недостаток борной кислоты при приготов- лении борфтористоводо- родной кислоты' а) Наводороживание поверхности изделия в процессе обезжири- вания и травления б) Недостаточно тща- тельная подготовка по- верхности основного металла Добавить клей и кислоту, понизить температуру - Брать больше бориой кис- лоты для приготовления бор- фтористоводородной КИС- ЛОТЫ Вместо обезжиривания и травления опескоструить детали. Нагревать изделия перед свинцеванием до 100 150°
Глава XIV. Свинцевание
Продолжение табл. 90
Признаки неполадок Причины возникновения Способы устранения
Неравномерность толщины осадка на от- дельных участках по- верхности изделия Наросты на краях изделий, значительное газовыделение на ка- тоде во время работы ванны Плохая рассеиваю- щая способность элек- тролита а) Высокая катодная плотность тока б) Избыток свобод- ной кислоты Увеличить расстояние между электродами и применить дополнительные местные аноды Откорректировать элек- тролит по содержанию кис- лоты, снизить плотность тока
4. ПРИГОТОВЛЕНИЕ СВИНЦОВЫХ ЭЛЕКТРОЛИТОВ
Приготовление всех свинцовых электролитов производится под
тягой.
Приготовление борфтористоводородного электролита. Борфто-
ристоводородную кислоту получают так, как описано на стр. 159.
В раствор HBF4 при постоянном помешивании добавляют основ-
ной углекислый свинец, растертый в воде в густую кашицу. Затем
дают раствору отстояться от осевшего на дне ванны нерастворимого
осадка и переливают в ванну для электролиза, а осадок выбрасы-
вают.
Ванну с чистым электролитом доливают водой до нужного объема
и вводят необходимое количество столярного клея. Клей пред-
варительно выдерживают в течение 1—2 суток в холодной воде,
затем растворяют в горячей воде.
Полученный электролит перед пуском в эксплуатацию прораба-
тывается током в течение нескольких часов. Электролит должен
содержать приблизительно 40—45 Г/л свободной борфтористоводо-
родной кислоты, которая способствует образованию гладких осад-
ков и повышает электропроводность раствора.
Приготовление кремнефтористоводородного электролита. Исход-
ными веществами являются кремнефтористоводородная кислота
и свинцовый глет.
Если готовой кислоты не имеется, ее приготовляют следующим
образом. В свинцовый сосуд насыпают два слоя кварца: первый
слой из кусков величиной до 0,5 см, второй из более мелких частиц
кварца.
Сосуд помещают на водяную баню и прогревают. Нагретый кварц
обливают плавиковой кислотой. Образование кремнефтористоводо-
родной кислоты протекает по реакции
SiO2 + 6HF = H2SiFe + 2H2O.
286 Часть третья. Технология нанесения металлических покрытий
Для охлаждения раствора добавляют в него холодную воду или
лед, следя за тем, чтобы концентрация кислоты оставалась выще
30%. В приготовленный таким образом раствор засыпают свинцо-
вый глет. Для связывания присутствующей в HF серной кислоты
количество глета берут с некоторым избытком.
Осадку дают отстояться, раствор переводят в ванну для электро-
лиза, доливают водой, добавляют клей и борную кислоту.
Перед пуском в эксплуатацию полученный электролит прораба-
тывается током в течение нескольких часов.
Приготовление парафенолсульфокислого электролита. Процесс
составления электролита из готовых химикатов сводится к растворе-
нию их в количествах, указанных в рецепте.
В случае необходимости парафенолсульфокислота готовится
обработкой фенола концентрированной серной кислотой в эмалиро-
ванных или чугунных котлах—сульфаторах. Сульфаторы должны
быть снабжены мешалками и иметь паровой обогрев. В сульфатор
загружают фенол и нагревают до 45°. После расплавления фенола
небольшими порциями добавляют концентрированную серную кис-
лоту из расчета 1—1,2 вес. ч. на каждую часть фенола, затем темпе-
ратуру в сульфаторе повышают до 100—110° и поддерживают на этом
уровне в течение 24 час.
Процесс сульфирования фенола и образования парафенолсуль-
фокислоты протекает по реакции
CeH5OH + H2SO4 = CeH4OHSO3H + Н2О.
Свинцовую соль парафенолсульфокислоты готовят насыщением
последней углекислым свинцом. Реакция насыщения протекает так:
2C6H4OHSO3H 4- РЬСО3 = [C6H4OHSO3I2 Pb + Н2О + СО2.
Углекислый свинец вводят в кислоту небольшими порциями.
Парафенолсульфокислый электролит перед пуском в эксплуатацию
прорабатывается током в течение нескольких часов.
Приготовление метабензолдисульфокислого электролита. Состав-
ление электролита из готовых химикатов сводится к растворению
их в количествах, указанных в рецепте. Метабензолдисульфоновая
кислота представляет собой продукт взаимодействия бензола с дымя-
щей серной кислотой. Сульфирование бензола серной кислотой про-
изводится в эмалированных или чугунных котлах, снабженных
мешалками и паровым подогревом.
Реакция сульфирования бензола осуществляется при температуре
100° и протекает по уравнению
CeHe + 2H2SO4
С„Н4 [SO3HI2 + 2Н2О.
Глава XIV. Свинцевание
Ж
Для получения 1 кГ метабензолдисульфоновой кислоты берется
330 Г бензола и 820 Г серной кислоты. Продолжительность сульфи-
рования 1' 2 часа.
г Для получения свинцовой соли метабензолдисульфоновой кисло-
ты последнюю очищают от содержащейся в ней серной кислоты угле-
кислым кальцием и насыщают глетом.
5. УДАЛЕНИЕ НЕДОБРОКАЧЕСТВЕННЫХ СВИНЦОВЫХ ПОКРЫТИЙ
Снятие недоброкачественных свинцовых покрытий производится
электрохимическим растворением свинца в 10-процентном растворе
щелочи при температуре 60—70°. Анодная плотность тока 1—3 а/дм2.
Материалом катода служит сталь.
i
ГЛАВА XV
ПОКРЫТИЕ ЖЕЛЕЗОМ И КОБАЛЬТОМ
I. ОБЩИЕ СВЕДЕНИЯ
Атомный вес железа 55,85; удельный вес электролитического
железа 7,71 Псм9, температура плавления 1650°, электрохимический
эквивалент двухвалентного железа 1,042 Па.-ч, трехвалентного
0,694 Па-ч, стандартный потенциал Fe/Fe++ равен —0,44 е,
Fe++/Fe+ + + = +0,75 в, a Fe/Fe+ + + = —0,04 в.
Железнение применяется в полиграфической промышленности
с целью повышения износостойкости гартовых стереотипов, медных
клише, гальваностереотипов и т. д. Железные покрытия предохра-
няют поверхность медных клише от химического воздействия неко-
торых типографских красок. Тиражеспособность медных печатных
форм после нанесения железного слоя повышается в 5—8 раз. В поли-
графической промышленности железные покрытия имеют некоторые
преимущества перед никелевыми благодаря их легкой растворимости
в разбавленной серной кислоте (удаление же никелевого слоя без
порчи оригинала довольно затруднительно). Железнение применяется
в некоторых отраслях промышленности, например тракторной,
автомобильной и т. ц., для восстановления размеров изношенных
деталей. Иногда производят железнение чугунных деталей, чтобы
получить прочное сцепление с цинковыми или оловянными покры-
тиями. В некоторых случаях практикуется железнение деталей,
изготовленных из легированных марок стали, перед оксидированием.
В последнее время электролитическое железнение применено
для покрытия пластинок твердого сплава перед соединением их
наплавкой. Железный слой предохраняет пластину твердого сплава
от окисления при нагреве, увеличивает прочность сцепления и предо-
храняет от образования трещин при заточке и эксплуатации резцов-
Железнение в некоторых случаях используется для жесткого закреп-
ления неметаллических материалов. Области применения процесса
железнения приведены в табл. 91.
Железо, полученное электролизом, содержит большое количество
водорода (0,003—0,1% по весу). Количество поглощенного водорода
снижается с увеличением температуры, повышением концентрации
электролита и понижением катодной плотности тока.
Глава XV. Покрытие железом и кобальтом
289
Области применения покрытий железом
Таблица 91
Назначение покрытия Толщина слоя в мк
Повышение износостойкости гартовых стереотипов, мед- ных клише и т. п. Защита медных клише от действия типографских красок Улучшение сцепления оловянных или цинковых по- крытий с поверхностью чугунных деталей Подготовка поверхности деталей, изготовленных из вы- соколегированных марок стали, перед оксидированием Восстановление изношенных деталей 10—100 10—100 5—15 5—10 От 0,1 до не- скольких мм
Покрытие пластин твердого сплава перед наплавкой 120—180
Удаление водорода из железных осадков может быть достигнуто
путем нагрева их до 800—900°. При этом происходит укрупнение
структуры осадков, а также снижение твердости и хрупкости.
При температурах 200 и 400° (фиг. Ill) наблюдается резкое повыше-
ние твердости электролитического железа.
Повышение твердости объясняется обра-
зованием непрочных химических соедине-
ний железа с водородом — гидридов. При
дальнейшем нагреве гидриды распадаются
и твердость железа падает.
Восстановленные железнением детали
зачастую подвергают цементации, в резуль-
тате которой поверхностный слой насы-
щается углеродом. При этом улучшается
Фиг. 111. Влияние темпера-
туры нагрева на твердость
электролитического железа
(по М. П. Мелкову).
также сцепление слоя железа с основным
металлом за счет образования в погранич-
ном слое феррита. Цементация осущест-
вляется в твердом карбюризаторе при
температуре 830—850° с охлаждением в со-
леной воде; отпуск — при температуре 180—200° в течение 30 мин.
После цементации могут быть произведены закалка и отпуск, в резуль-
тате которых твердость в слое покрытия становится равномерной,
а граница между покрытием и основным металлом — почти не раз-
личимой.
2. ЭЛЕКТРОЛИТЫ ДЛЯ ЖЕЛЕЗНЕНИЯ
Железнение производится в электролитах, содержащих двух-
валентные ионы железа. Для железнения применяют сернокислые,
^лористые или смешанные электролиты, которые подразделяются
Две группы — холодные и горячие.
Вайнер и Дасоян
290
Часть третья. Технология нанесения металлических покрытий
Осадки, получаемые из холодных сернокислых электролит
отличаются твердостью и хрупкостью. Наращивание слоя желез’
в холодных электролитах проходит довольно медленно. За 1 ч а
может быть осажден слой железа толщиной 1—1,5 мк. с
В концентрированных горячих хлористых электролитах могут
применяться высокие плотности тока, благодаря чему удается
за сравнительно короткий срок получить толстые осадки железа
Они отличаются высокой степенью чистоты, что видно из следующих
данных:
Элемент....... Fe С S Р Si
Содержание в % 99,9950 0,0001 0,0001 0,0002 0,0001
Механические свойства железа, полученного из горячих хлори-
стых электролитов, как видно из данных табл. 92, близки к свой-
ствам меди.
Таблица 92
Сравнение механических свойств электролитического железа и меди
Свойства Желе- зо Медь Свойства Желе- зо Медь
Сопротивление на раз- рыв в кГ/мм^ Удлинение 24—30 45—48 22—25 40—50 Сопротивление ска- лыванию в кПмм- Твердость по Бринелю 20—24 42—47 16-18 43—45
Электролитическое железо, полученное из сульфатных электро-
литов, только после отжига обладает такими же свойствами.
Твердость и хрупкость железных осадков, как правило, увели-
чиваются с уменьшением концентрации солей железа в электролите
и с понижением кислотности и температуры ванны.
Сернокислые .электролиты менее подвержены окислению, чем
хлористые; осадки, получаемые из этих ванн, отличаются повышенной
твердостью. Электролиты эти менее агрессивны, чем хлористые,
поэтому они проще в эксплуатации.
Рекомендуемые рецептура и режим электролиза при железне-
нии в сернокислых электролитах приведены в табл. 93.
При эксплуатации сернокислой ванны необходимо следить
за тем, чтобы содержание свободной кислоты в электролите находи-
лось в пределах 2—2,5 Пл, так как в противном случае наблюдается
гидролиз солей железа и ухудшается качество осадка. Добавка ДВУ"
углекислого натрия имеет целью создание пленки на поверхности
электролита, предохраняющей его от окисления. Применени
электролита № 4, содержащего сернокислый алюминий, позволяет
получить осадки железа твердостью порядка 300—330 кГ/мК •
С повышением температуры твердость осадков снижается, а с увели
Глава XV. Покрытие железом и кобальтом
291
Таблица 93
Состав электролита и режим электролиза в сернокислых электролитах
Наименование компонентов Содержание в Г/л в растворах
№ I № 2 № 3 № 4 № 5
Сернокислое железо FeSO4-7H2O 180—240 180—240 325 420 420
Сернокислый магиий MgSO4-7H2O 40 125—200 280 —
Двууглекислый иатрий NaHCO3 25—30 — — —
Сернокислый алюминий A12(SO4)3- 18Н2О — — — 100 —
Сернокислый калий K2SO4 — — — — 150
Режим работы
Температура в °C 18—20 20—25 90—100 20—70 20—70
Плотность тока в а!дмг 0,1—0,15 0,1—0,15 10—20 3—12 3—12
Выход по току в % 95—98 95—98 90—100 80—90 80—90
Перемешивание — — Обяза- тельно — —
Фильтрация — — То же —
чением плотности тока — повышается. Износостойкость этих осадков
ниже.
Осадки железа из электролита № 5, содержащего сернокислый
калий, тверже и отличаются более мелкозернистой структурой,
чем осадки с добавкой сернокислого алюминия.
Приготовление сернокислых электролитов заключается в раство-
рении всех составных частей, перемешивании раствора и фильтрации
или декантации их в рабочую ванну.
Состав хлористых электролитов для железнения и режим электро-
лиза приведены в табл. 94.
Электролиты № 1—3 позволяют получать осадки твердостью
350—400 кПмм2. Гладкие осадки получаются при толщине слоя,
не превышающей 1 мм. При нанесении более толстых слоев реко-
мендуется промежуточная механическая обработка.
Электролит № 4 обеспечивает получение очень твердых (600—
650 кГ/мм?) покрытий толщиной до 1,5 мм. Электролит № 5 позво-
ляет получать плотные гладкие покрытия с повышенными механи-
ческими свойствами и твердостью до 500—550 кПмм\ толщиной
До 2—3 мм.
19*
292
Часть третья. Технология нанесения металлических покрытий
Таблица 94
Состав хлористых электролитов и режим работы
Наименование компонентов Содержание в Г/л в растворах —
№ 1 № 2 № 3 № 4 № 5
Хлористое железо 180—200 350—500 700—800 200—220 450—500
» натрий 80—100 80—100 — 80—100 80—100
» марганец — — — 8—10 8—10
Соляная кислота 3—3,5 0,5—2,0 0,3—0,5 0,5—0,8 0,5—0,8
Режим работы
Температура в °C 70—80 90—100 75—80 60—80 60—80
Плотность тока в а/дм2 8—10 5—20 10—20 10—50 10—60
Выход по току в % 75—100 90—95 75—80 75—80 75—80
Ниже приводится электролит «смешанного» типа, в котором при
комнатной температуре и повышенной плотности тока можно полу-
чать осадки удовлетворительного качества:
Сернокислое железо........................... 150 Г/л
Хлористое железо . . 7—5 »
Сернокислый аммоний . . 6—10 »
Щавелевокислый аммоний . . 6—10 »
Режим работы: температура 18—20°, плотность тока
0,8—1,2 а/дм2.
Для железнения твердосплавных пластинок марок ВКЗ, ВК6,
Т15К6 и др. применяется электролит следующего состава:
Сернокислое железо....................... 240—260 Пл
Хлористый натрий . . .............. 45—55 »
Режим работы: температура 98—100°, плотность тока
4—5 а!дм2.
Слой железа наносится из расчета 20—30 мк на каждый милли-
метр толщины пластинки в местах напайки. Детали очищают дробе-
струйной обработкой. После загрузки их в ванну производится
анодная обработка в течение 5—10 сек. при плотности тока 10 а/дм2,
затем направление тока меняется и производится наращивание.
Электролитическое железо с содержанием углерода 0,5—0,6%
можно получить из электролита:
Хлористое железо.......... ............. 350—400 Пл
Хлористый натрий . ... 70—80 »
Соляная кислота . . 1—1,5 »
Глицерин . . . 60—70 »
Сахар............................ 30—40 »
Глава XV. Покрытие железом и кобальтом
293
режим р аботы:температура90—95°, плотность тока 10— \5а!дм2.
Осадки, полученные из такой ванны, принимают закалку,
в результате которой твердость их достигает твердости закаленной
стали" Режим термической обработки сводится к отжигу при 600—
700°, закалке при 800—900° с охлаждением в воде и последующему
отпуску на требуемую твердость.
Для изготовления хлористых электролитов помимо исполь-
зования готовой железной соли можно растворить железные стружки
в соляной кислоте. Чистая, предва-
рительно обезжиренная стружка из
малоуглеродистой стали (сталь 10
и 20) растворяется в разбавленной
соляной кислоте (1 : 2). После пол-
ного растворения стружки добавляют
воду и поваренную соль. Раствор
отстаивают, перекачивают в ванну
и после добавления остальных состав-
ных частей проверяется кислотность
и содержание железа. В случае необ-
ходимости производится корректи-
ровка электролита.
При эксплуатации хлористых
электролитов необходимо следить за
Содержание HCle электролите^I-
Фиг. 112. Выход по току при желез-
нении в зависимости от кислотности
электролита.
их кислотностью. При умень-
шении содержания свободной кислоты наблюдается гидролиз элек-
тролита (электролит .мутнеет) и включение гидроокиси железа
в осадок. Покрытия вследствие этого приобретают хрупкость. Чем
выше температура и концентрация электролита, а также применяе-
мая плотность тока, тем выше должна быть кислотность.
С увеличением кислотности электролита выход по току резко
снижается (фиг. 112); одновременно, однако, улучшается качество
осадков: они становятся более мягкими, эластичными и гладкими.
Хлористый электролит для железнения должен быть зеленого
цвета. В электролите не должно содержаться заметных количеств
трехвалентного железа, иначе снижается выход по току, а осадки
становятся хрупкими и губчатыми. Пожелтение раствора свидетель-
ствует о накоплении трехвалентных ионов железа. Добавлением
в раствор железных стружек и проработкой током трехвалентные
ионы железа восстанавливают в двухвалентные.
При железнении применяются аноды из углеродистой стали 10
или 20. Железные аноды рекомендуется заключать в чехлы из стекло-
ткани. Соотношение между анодной и катодной поверхностями
Должно находиться в пределах 1—2. Стальные аноды необходимо
время от времени вынимать из ванны и тщательно очищать от шлама
стальными щетками.
Аноды в электролит завешивают одновременно с загрузкой
Деталей. По окончании процесса и на ночь аноды следует вынимать
294
Часть третья. Технология нанесения металлических покрытий
из ванны: это предотвращает бесполезное растворение анодов и непро-
изводительный расход кислоты. 1
В табл. 95 приведены данные по продолжительности нанесения
слоя железа различной толщины при выходе по току, равном 95%.
Таблица 95
Продолжительность осаждения железа (в мин.)
Толщина слоя в мк Плотность тока в а[дмг
о.1 0.5 1.0 3,0 5,0 10,0
Г 47 9,6 5,0 1.6 1,0 0,5
3 142 28 15 4,7 2,8 1.4
5 237 48 24 8,0 4,8 2,4
7 332 66 33 И 6,6 3,3
10 475 95 47 16 10 5,0
30 1425 286 143 47 29 14
50 2375 476 237 79 48 24
70 3325 664 332 111 66 33
100 4750 950 475 158 95 48
При применении высоких плотностей тока необходимо механи-
ческое перемешивание электролита. Перемешивание воздухом про-
тивопоказано, так как оно приводит к окислению электролита.
Электролиты, работающие при комнатной температуре, не пере-
мешиваются.
Описание неполадок, встречающихся при железнении, и меры
их устранения приведены в табл. 96.
Таблица 96
Неполадки при железнении и способы их устранения
Признаки неполадок Причины возникновения Способы устранения
Отслаивание осад- ков а) Плохая подготовка б) Перерывы в процессе электролиза в) Низкое значение pH а) Улучшить подготовку б) Устранить причины перерывов тока в) Откорректировать pH
Темные осадки 1 а) Наличие ионов трех- валентного железа б) Низкое значение pH а) Проработать электро- лит током б) Откорректировать pH
Темные полосы на покрытии Попадание органических веществ в электролит Профильтровать элек- тролит через активирован- ный уголь и проработать током
Глава XV. Покрытие железом и кобальтом
295
Продолжение табл. 96
Признаки неполадок Причины возникновения Способы устранения
' Разрывы рачявание и заво- осадков а) Неудовлетворительное обезжиривание б) Неправильный режим травления в) Низкая температура а) Обеспечить тщательное обезжиривание б) Отрегулировать режим травления в) Повысить температуру ванны
Малая покрытий толщина а) Чрезмерно высокая кислотность электролита б) Недостаточная плот- ность тока в) Утечки тока а) Отрегулировать кис- лотность б) Отрегулировать режим в) Проверить изоляцию ванн
Шероховатый оса- док а) Загрязнение электро- лита шламом б) Высокая плотность тока в) Высокое содержание трехвалентного железа а) Профильтровать элек- тролит б) Отрегулировать режим в) Проработать электро- лит током
Хрупкие осадки а) Низкая температура б) Наличие ионов трех- валентпого железа в) Наличие органиче- ских загрязнений г) Наличие примесей других металлов д) Низкая кислотность а) Повысить температуру б) Проработать электро- лит в) Профильтровать через активированный уголь г) Проработать электро- лит при низкой ПЛОТНОСТИ тока д) Откорректировать pH
Характеристика технико-экономических показателей процессов
хромирования и железнения, применяемых для восстановления раз-
меров изношенных деталей, приведена в табл. 97.
Таблица 97
Технико-экономические показатели процессов хромирования и железнения
Показатели Железнение Хромирова- ние
Электрохимический эквивалент в Г!а-ч 1,042 0,323
Выход по току в % 85—98 12—15
Плотность тока в а! дм2 10—30 25—100
Толщина покрытий (в л(л), получаемых за 1 час при применяемых плотностях тока 0,12—0,32 0,02—0,07
Максимально допустимая толщина покрытий в мм 0,75—1,0 0,3—0,5
Продолжительность электролиза для получения слоя толщиной 0,1 мм в часах 0,8—0,5 4,5—1,5
Затрата электроэнергии на покрытие поверхности -Площадью в 1 м2 толщиной 0,25 мм в квт)ч 19 129
296
Часть третья. Технология нанесения металлических покрытий
Приведенные данные показывают экономические преимущества
применения железнения перед хромированием для восстановления
изношенных деталей. В ряде случаев целесообразно применять
двухслойное наращивание: электролитическое железнение и затем
хромирование.
3. ПОКРЫТИЕ КОБАЛЬТОМ
Кобальт — металл сероватого цвета с красным оттенком. Удель-
ный вес 8,8 Г/см3, атомный вес 58,93; валентность 2 и 3; электрохи-
мический эквивалент двухвалентного кобальта 1,099 Г la-ч. Темпе-
ратура плавления 1490°. Твердость 130—180 кГ/лои2.
Таким образом, физико-механические свойства кобальта близки
к свойствам никеля. Кобальтовые осадки отличаются несколько
большей твердостью, чем никелевые, вследствие чего они могут найти
применение в тех случаях, когда требуется повышенная износо-
стойкость.
Однако в связи с высокой стоимостью кобальтовых солей, их
подверженностью окислению при повышенной температуре, а также
меньшей коррозионной устойчивостью по сравнению с никелевыми
осадками кобальт практически не используется как самостоятельное
покрытие. Иногда применяются сплавы никеля с кобальтом, в част-
ности в тех случаях, когда требуются покрытия с определенными
магнитными свойствами.
Для кобальтирования может быть использован электролит
следующего состава:
Сернокислый кобальт CoSO4-7H2O . . 500 Пл
Хлористый натрий NaCl .... 15 »
Борная кислота Н3ВО3......................... 45 »
Режим р а б о т ы: температура 30—40°, плотность тока
5—15 а!дм?. В качестве анодов применяют пластины из кобальта.
ГЛАВА XVI
ПОКРЫТИЕ БЛАГОРОДНЫМИ И РЕДКИМИ
МЕТАЛЛАМИ
А. СЕРЕБРЕНИЕ
1. ОБЩИЕ СВЕДЕНИЯ
Серебро — ковкий, пластичный металл; удельный вес серебра
10,5 Г/см3, атомный вес 107,88, валентность 1; стандартный потен-
циал по отношению к водородному электроду +0,81 в; электрохими-
ческий эквивалент 4,025 Па-ч\ температура плавления 960°. Удель-
ная электропроводность равна 62-104 ом~1см~1. Серебро отличается
высокой электропроводностью, высокой отражательной способностью
и достаточной химической стойкостью во многих агрессивных сре-
дах, например в едких щелочах и во многих органических кислотах;
концентрированная серная кислота растворяет серебро лишь при
кипячении, а концентрированная азотная кислота — при нагрева-
нии, На серебро действуют хлор и сернистые соединения, вызывая
его потускнение.
Благодаря своим физико-химическим свойствам серебро, несмотря
на дефицитность и дороговизну, находит широкое применение для
гальванических покрытий. Эти покрытия имеют следующее назна-
чение: повышение отражательной способности светотехнических
и оптических изделий (покрытие фар, зеркал и рефлекторов, рабо-
тающих как в помещениях, так и в атмосферных условиях); макси-
мальное снижение переходного сопротивления в местах контактов
электротехнических изделий; повышение коррозионной стойкости
изделий, работающих в щелочах и других агрессивных средах.
Большое распространение находит серебрение в быту в качестве
защитно-декоративного и декоративного покрытия (нагрудные знаки,
портсигары, корпуса металлических часов и различные ювелирные
изделия). Толщина серебряных покрытий для легких условий атмо-
сферной коррозии должна быть не менее 5 мк, для средних усло-
вий— не менее Юлией для жестких — не менее 20 мк. Толщина сереб-
ряных покрытий для фар, прожекторов и электрических контактов
составляет примерно 10—20 мк, а для химической посуды и прибо-
ров, работающих в щелочах, — от 10 до 100 мк.
Для серебрения применяются главным образом цианистые элек-
тР°литы, так как из большинства предлагавшихся кислых
298
Часть третья. Технология нанесения металлических покрытий
электролитов серебро вытесняется химически менее благородными
металлами и образуются рыхлые и неплотные осадки. Отдельные
новые нецианистые электролиты заслуживают внимания. Некото-
рое распространение имеют контактное серебрение и серебрение
натиранием.
2. ЦИАНИСТЫЕ ЭЛЕКТРОЛИТЫ СЕРЕБРЕНИЯ
Состав электролитов и режимы работы
Основными компонентами цианистых электролитов для серебре-
ния являются комплексная серебряная соль KAg (CN)2 или
NaAg(CN)2 и свободный цианид (KCN или NaCN). Калиевые соли
предпочтительнее, так как
по сравнению с натриевыми
они обладают большей рас-
творимостью, имеют боль-
шую электропроводность
и позволяют применять
более высокие плотности
тока.
Осадки, полученные из
электролитов на основе
калиевых солей, обладают
лучшими физическими
свойствами. Кроме ука-
занных двух основных со-
ставляющих, цианистый
Фиг. 113. Микроструктура электролитических
серебряных покрытий, полученных в обыч-
ных условиях (а) и при реверсировании
тока (б).
электролит для серебрения
содержит также некоторое количество карбонатов, вводимых искус-
ственно или образующихся вследствие гидролиза цианида и погло-
щения углекислоты воздуха. Для получения блестящих серебряных
покрытий в электролит вводят сероуглерод (1,5—2 мл!л), аммиак
(2 льд/д), гипосульфит (1 Пл) и другие добавки. Получению блестя-
щих электролитических осадков серебра способствует также электро-
лиз с реверсированием тока. Образующиеся при этом осадки имеют
более мелкокристаллическую структуру по сравнению с осадками,
полученными из обычных ванн (фиг. 113).
Состав некоторых цианистых электролитов для серебрения
и режим работы ванн приведены в табл. 98. Первые три электролита
применяются в обычных стационарных ваннах, а электролит № 4 —
в ваннах с механическим перемешиванием. Этот электролит предназ-
начен для покрытия проволоки, непрерывно протягиваемой через
ванну. Аноды во всех ваннах серебряные (ГОСТ 6836—58) и должны
соответствовать марке Ср. 999,9. Скорость осаждения серебра при-
ведена в табл. 99.
Глава XVI. Покрытие благородными и редкими металлами
299
Таблица 98
Состав цианистых электролитов для серебрения и режим работы ванн
Наименование компонентов Содержание в Г/л в растворах
№ I № 2 №3 № 4
Серебро цианистое AgCN 50—60 — — 40—45
Калий цианистый KCN 60—70 35—50 55—70 40—45
Серебро хлористое AgCl — 35—40 40—45 —
Калий углекислый К2СО3 — 45—50 — 45—50
Едкое кали КОН — — — 8—15
Режим заботы
Температура электролита в °C 18—25 18—25 18—25 40—50
Плотность тока в а!дм? 0,1—0,5 0,1—0,5 0,1—0,5 До 10
Выход по току в % 90 95—100 95—100 95—100
Таблица 99
Продолжительность осаждения серебра (в мин.)
Толщина слоя в мк Плотность тока ъ а/дм2 Толщина слоя в мк Плотность тока в а/дм2
0.2 0.3 0.5 0,7 1 1,5 0.2 0,3 0,5 0.7 1 1.5
1 7,9 5,3 3,2 2,3 1,6 1,1 10 79 53 32 23 16 11
2 15,8 10,5 6,3 4,1 3,2 2,1 30 237 158 95 68 47 32
3 24 16 9,5 6,8 4,7 3,2 50 395 264 158 113 79 53
5 40 26 16 11 7,9 5,3 80 632 422 253 181 126 84
7 55 37 22 16 11 7,4 100 790 527 315 230 158 ПО
9 71 48 28 20 14 9,5
Приготовление электролитов
Для приготовления цианистых электролитов серебрения обычно
исходят из азотнокислого серебра. При отсутствии азотнокислого
серебра последнее может быть получено из металлического серебра.
Для этого серебро растворяют в двойном по весу количестве хими-
чески чистой азотной кислоты (уд. вес. 1,4), которая предварительно
300
Часть третья. Технология нанесения металлических покрытий
разбавляется 3—5 объемами воды. Растворение ведется под тягой
при 50—60°. Нагревание продолжается до полного упаривания
и получения сухой соли азотнокислого серебра. Затем соль расплав-
ляют и вновь охлаждают.
Входящее в состав электролитов № 1 и 4 (табл. 98) цианистое
серебро готовится следующим образом: к 1 л 40-процентного раствора
азотнокислого серебра прибавляют 3 л 5-процентного раствора циа-
нистого калия; при этом выпадает белый творожистый осадок циа-
нистого серебра. После пробы на полноту осаждения осторожно под
тягой прибавляют небольшое количество азотной кислоты (для пред-
отвращения перехода цианистого серебра в растворимое комплекс-
ное соединение), перемешивают, дают осадку отстояться, затем раствор
декантируют, осадок тщательно промывают до нейтральной реак-
ции и, не высушивая, используют для получения электролита.
Приготовление электролита производится при красном свете или
затемнении. Приготовление цианистого серебра из металлического
серебра может быть осуществлено анодным растворением металла
в 5-процентном растворе цианистого калия с применением диафрагмы.
Катодом служит железо. Растворение ведется при комнатной темпе-
ратуре, анодная плотность тока 0,5 а/дм2.
Входящее в состав электролитов № 2 и 3 (табл. 98) хлористое
серебро приготовляют добавлением раствора соляной кислоты или
поваренной соли к раствору азотнокислого серебра. Выпадающий
белый творожистый осадок хлористого серебра несколько раз про-
мывают водой и употребляют для приготовления цианистого электро-
лита серебрения. При составлении электролитов цианистое или
хлористое серебро переводится в цианистый комплекс согласно сле-
дующим реакциям:
AgCN + KCN = KAg (CN)2;
AgCl + 2KCN = KAg (CN)2 + KC1.
Образующийся в процессе приготовления электролитов № 2 и 3
хлористый калий не является вредной примесью; эта соль увели-
чивает электропроводность электролита.
Все работы, связанные с приготовлением цианистых элейтро^-
литов серебрения, необходимо выполнять под тягой и с большой
осторожностью, так как цианистые соединения очень ядовиты.
Особенности технологического процесса
серебрения
Нанесение серебряных покрытий на латунные и медные
изделия имеет некоторые особенности. После операций обезжи-
ривания (органическими растворителями и катодного), промывки
1 лава XVI. Покрытие благородными и редкими металлами
301
Таблица 100
Неполадки при серебрении и меры их устранения
Признаки неполадок Причины возникновения Способы устранения
Шелушение и отслаи- вание покрытий при полировании а) Неудовлетвори- тельное амальгамирова- ние б) Недостаток сере- бра в электролите в) Плохая подготовка поверхности перед амальгированием а) Проверить состав ванны амальгамирования; увеличить выдержку изде- лий в растворе амальгами- рования б) Добавить в электролит хлористое или цианистое серебро в) Улучшить подготовку перед амальгамированием
Образование черных пятен на изделиях при амальгамировании а) Плохая подготовка перед амальгамирова- нием б) Нарушен состав раствора амальгамиро- вания а) Улучшить подготовку (обезжиривание) б) Откорректировать амальгамирующий раствор
Плохая рассеиваю- щая способность ванны (фигурные изделия по- крываются плохо) а) Высокое содержа- ние серебра в электро- лите б) Недостаток свобод- ного цианида в) Отсутствие карбо- натов Откорректировать элек- тролит согласно рецепту
Осадок рыхлый, тем- ный или пятнистый и имеет желтоватый от- тенок а) Наличие в элек- тролите взвешенных частиц б) Недостаток циа- нида в) Обеднение элек- тролита серебром г) Повышенная плот- ность тока а) Отфильтровать элек- тролит б) Добавить цианистый калий в) Добавить хлористое или цианистое серебро г) Понизить плотность тока
Аноды покрываются темным налетом Недостаток цианида Добавить цианистый ка- лий
Серебро осаждается грубыми кристаллами или дендритами Слишком высокая плотность тока на катоде Понизить катодную плот- ность тока
Бурное газовыделе- Ние на катоде, хруп- кие осадки, интенсив- ное растворение анодов Избыток цианида в электролите Проработать электролит под током, добавить хлори- стое или цианистое серебро 1
302
Часть третья. Технология нанесения металлических покрытий
и декапирования следует амальгамирование поверхности изделий
в растворе следующего состава:
Окись ртути HgO................................. 6—8 Пл
Цианистый калий KCN............................. 60—70 »
В этот раствор изделия погружаются на 3—5 сек. при темпера-
туре 15—25°. Амальгамирование предотвращает контактное выделе-
ние серебра при погружении деталей в ванну для серебрения.
Операция амальгамирования может быть заменена серебрением
в цианистом электролите с низким содержанием металла и большим
избытком свободного цианида:
Цианистое серебро................................... 2 Г/л
Цианистый калий . 18 »
Углекислый калий . . . . 3 »
В эту ванну изделия погружаются под током (плотность тока
6—20 а/дм?) на 1—5 сек.
По данным А. М. Ямпольского, хорошие результаты дает пред-
варительное серебрение в электролите следующего состава:
Цианистая комплексная соль серебра (в пересчете
иа металл)................................... 0,8—1,5 Г/л
Цианистая комплексная соль меди (в пересчете
на металл)................................... 6,0—7,5 »
Цианистый калий . . ................... 50—60 »
Осаждение ведется при 15—25е, плотность тока 0,1—0,2 а/дм2,
продолжительность обработки 5—10 мин.
Детали завешивают в ванну под током.
Возможные неполадки при работе с серебряными цианистыми
электролитами, их причины и способы устранения приведены
в табл. 100.
«Твердое» серебрение
Серебряные покрытия, полученные из обычных электролитов
(табл. 96), не отличаются достаточной твердостью.
Н. П. Федотьевым и его сотрудниками был разработан электро-
лит, позволяющий повысить твердость покрытия в полтора раза.
а износоустойчивость — почти в три раза.
Состав и режим работы этого электролита:
Комплексная цианистая соль серебра (в пересчете на
металл).......................................... 30 Г/л
Комплексная цианистая соль кобальта (в пересчете на
металл).......................................... 1 »
Цианистый калий . . 20 »
Углекислый калий ........ 30 »
Режим работы: температура 15—25", плотность тока 0,8
1,0 а/дм?.
Глава XVI. Покрытие благородными и редкими металлами
303
Прибор для контроля веса осадков
Для контроля веса осадков серебра и других драгоценных
металлов применяют специальные вольтаметрические установки.
Они сконструированы так, что после отложения в кулометре, вклю-
ченном в цепь ванны, рассчитанного количества меди (и нужного
количества серебра или золота в ванне) ток в рабочей цепи преры-
Фиг. 114. Схема вольтаметриче-
ских весов.
Кванне
вается, и одновременно включается звуковой или световой сигнал,
оповещающий о завершении процесса нанесения покрытия. Схема
одной из таких установок показана на фиг. 114.
В цепь постоянного тока включена рабочая ванна с измеритель-
ными приборами и реостатом и медный кулометр. В цепь перемен-
ного тока включены магнитный пускатель, сигнал и специальные
контактные устройства на коромысле весов. При установке на весы
гири и включении кнопки «пуск» катушка 6 магнитного пускателя 5
притягивает сердечник 7, связанный механически с контактами 2 и <?,
замыкающими рабочую цепь постоянного тока (рубильник 4 постоян-
ного тока включен всевремя), и контакт/, шунтирующий кнопку пуска
в момент включения. Когда кулометр перетягивает гири, происходит
разрыв контакта 9, включенного параллельно в цепь намагничиваю-
щей катушки 6; это влечет за собой включение магнитного пускателя,
благодаря чему рабочая цепь постоянного тока прерывается. Сигнал 8
включается в сеть переменного тока последовательно с блок-кои-
тактами, связанными с сердечником пускателя. В момент включения
пускателя замыкаются блок-контакты и включается сигнал 8.
3. НЕЦИАНИСТЫЕ ЭЛЕКТРОЛИТЫ СЕРЕБРЕНИЯ
Серьезным неудобством в работе с цианистыми электролитами
является их ядовитость.
В настоящее время разработаны электролиты для серебрения, кото-
рые в ряде случаев могут заменить вредные цианистые электролиты.
Ниже приводится состав некоторых из нецианистых электролитов
серебрения, нашедших промышленное применение.
304 Часть третья. Технология нанесения металлических покрытий
Железистосинеродистые электролиты
Хлористое серебро AgCl.................... 3—15 Г/л
Железистосинеродистый калий KjFe (CN)6-3H2O . . . 10—30 »
Кальцинированная сода Na2CO3-10H2O .... . . 25—75 »
Режим работы: температура 15—25 , плотность тока
0,15 а/дм2.
Указанный электролит рекомендуется применять для нанесения
относительно тонких покрытий. В качестве анодов можно исполь-
зовать серебро или графит. В последнем случае ванну корректируют
периодическим добавлением свежеприготовленного электролита.
Для получения толстых слоев серебра рекомендуется ванна
с большим содержанием серебра:
Хлористое серебро AgCl.............................. 40 Г/л
Железистосинеродистый калий K4Fe (CN)6-3H2O . . 200 »
Поташ К2СО3......................................... 20 »
Режим работы: температура 25—80°, плотность тока 1 —
1,5 а/дм2.
Ванна работает с применением растворимых серебряных анодов.
Оба электролита обладают высокой рассеивающей способностью
и имеют выход потоку, близкий к 100%. Осадки светлые, мелко-
кристаллические.
Указанные электролиты готовят смешением нагретых до кипения
растворов углекислых солей и железистосинеродистого калия
и добавлением смеси этих растворов к раствору хлористого серебра.
Образование комплексной соли серебра может быть представлено
реакцией
2AgCl + K4Fe (CN)e -> K4Ag2 (CN)e + FeCl2.
Далее происходят реакции:
FeCl2 4- Н2О + Na2CO3 = Fe (OH)2 + CO2 + 2NaCl;
2 Fe (OH)2 + O2 + H2O = 2Fe (OH)3.
Полученный таким образом гидрат окиси железа отделяют фильтро-
ванием или декантированием, а отфильтрованный электролит светло-
желтого цвета доливают водой и пускают в эксплуатацию.
Сульфитные электролиты
В состав сульфитного электролита входит комплексная соль
серебра состава NaAgSO3 в количестве от 25 до 100 Пл. Осаждение
серебра ведется при температуре 15—25° и плотности тока 0,2—
0,3 а/дм2 без перемешивания либо с механическим перемешива-
нием электролита или покачиванием деталей при плотности тока
Глава XVI. Покрытие благородными и редкими металлами
305
дО 1,5 а/дм2. Аноды из серебра. Выход металла по току составляет
100о/о. Электролит обладает высокой рассеивающей способностью и поз-
воляет получить легко полируемые мелкокристаллические осадки.
Для приготовления сульфитного электролита к насыщенному
раствору сульфита натрия добавляют расчетное количество азотно-
кислого серебра. При этом образуется сернистокислое серебро:
Na2SO3 + 2AgNO3 = Ag.2SO3 + 2NaNO3,
которое затем растворяется в избытке сульфита с образованием
комплексной соли серебра, т. е. готового для эксплуатации сульфит-
ного электролита:
Ag2SO3 + Na2SO3 = 2NaAgSO3.
Йодистые электролиты
Йодистое серебро растворимо в растворе йодистого калия. При
этом образуется комплексная соль K2AgJ3, которая может быть
использована как электролит для серебрения. Например, предложен
электролит следующего состава:
Комплексная соль K2AgJ3..................... ^0—100 Г/л
Йодистый калий KJ........................... 230—300 »
Осаждение серебра ведется при 20—25°, плотность тока 0,15—
0,25 а/дм2.
Заслуживает внимания также электролит, предложенный
А. И. Левиным. Состав его более сложный:
Серебро сернокислое............................... 30 Г/л
Йодистый калий..................................... 630 »
Пирофосфорнокислый калий................. • . . . 50 »
Аммиак (25-процентный раствор)...................... 75 мл/л
Йодистые электролиты устойчивы в работе и позволяют получать
плотные и мелкокристаллические осадки. Серебряные осадки имеют
слегка желтоватый оттенок. Рассеивающая способность этих электро-
литов ниже, чем железистосинеродистых электролитов. Основным же
недостатком иодистых электролитов является то, что для их состав-
ления требуется дорогостоящий иодистый калий.
Необходимая для составления иодистых электролитов комп-
лексная соль серебра готовится растворением хлористого или серно-
кислого серебра в концентрированном растворе йодистого калия.
При этом протекают следующие реакции:
AgCl + 3KJ = K2AgJ3 + КС1
или Ag2SO4 + 6KJ = 2K2AgJ3 + K2SO4.
Хлористый и сернокислый калий, образующиеся по этим реак-
циям, входят в состав иодистых электролитов и способствуют увели-
чению их электропроводности.
20
Вайнер и Дасояи
306
Часть третья. Технология нанесения металлических покрытий
Роданистый электролит
Серебро образует растворимые комплексы также с роданистыми
солями щелочных металлов. Для серебрения был предложен электро-
лит следующего состава:
Серебро в пересчете на металл........................ 25 Пл
Роданистый аммоний NH4CNS............................ 300 »
Борная кислота Н3ВО3 ................................ 20 »
pH................................................... 5,8—6,2
Режим работы: температура электролита 15—25°, плот-
ность тока 0,5—1,0 а/дм2-. Электролиз производится с серебряными
анодами и требует предварительного амальгамирования изделий.
Электролит находит применение при покрытии медных провод-
ников радиоаппаратуры, а также для металлизации картона, тек-
столита, керамики и прочих материалов, неустойчивых в щелочных
средах.
Азотнокислый электролит
С. Я- Попов и П. С. Чечаль (Новочеркасский политехнический
институт) разработали ряд нецианистых электролитов, которые,
по их данным, дают плотные мелкокристаллические осадки и устой-
чивы в работе. Для серебрения этими авторами предложен следую-
щий электролит:
Азотнокислое серебро AgNO3 ............................ 20 Пл.
Аммиак (25%) ........................ . . 50 »
Сернокислый аммоний (NH4)2SO4 ............. . . . 150—200 »
pH электролита . '................................ 6,6—6,9
Режим работы: температура 18—30°, плотность тока
0,8 а/дм2.
Детали предварительно катодно поляризуются в растворе,
содержащем аммиака (25%) 20 Пл, сернокислого аммония 150—
200 Пл и препарата ПБ-8 (производное уротропина) 2 Пл. Темпе-
ратура этого раствора 45°; плотность тока 0,5—3,0 а!дм2. Продол-
жительность обработки 2 мин.
4. ХИМИЧЕСКОЕ (КОНТАКТНОЕ) СЕРЕБРЕНИЕ
Основным назначением химического серебрения является изго-
товление зеркал и осаждение электропроводящего слоя серебра
на изделиях, изготовленных из пластмассы, керамики, стекла и ДРУ"
гих неметаллических материалов. Некоторое применение химиче-
ское серебрение находит при покрытии латунных и медных мелких
изделий очень тонким слоем серебра.
Глава XVI. Покрытие благородными и редкими металлами
307
Для серебрения пластмассы, керамики и стекла отдельно при-
готовляют растворы соли серебра и восстановителя. Для этого
4__5 Г азотнокислого серебра предварительно растворяют в 100 мл
дистиллированной воды, добавляют каплями 25-процентный раствор
аммиака (до растворения первоначально выпадающего осадка гидро-
окиси серебра), затем добавляют раствор щелочи и снова несколько
капель аммиака (для осветления слегка мутнеющего раствора).
раствор доливают водой до 1 л и хранят в темном месте (не более
суток, так как он постепенно разлагается).
Восстановительный раствор готовят растворением 80—90 Г
сахара в небольшом объеме горячей воды, к раствору добавляют
2—3 мл серной кислоты, кипятят в течение 3—5 мин. и доводят затем
объем раствора до 1 л. Непосредственно перед серебрением оба рас*-
твора смешивают в пропорции: 20 объемов раствора серебряной
соли на 1 объем раствора восстановителя.
Детали из пластмассы, стекла и керамики, подлежащие хими-
ческому серебрению, тщательно обезжиривают известковым раство-
ром до полного смачивания водой, затем подвергают кратковремен-
ной (3—5 сек.) обработке в водном растворе хлорного олова
(2—3 Пл), промывают дистиллированной водой и укладывают в ванну
для химического серебрения так, чтобы покрываемая сторона дета-
лей была обращена кверху. После осаждения на них слоя серебра
изделия промывают и сушат.
Покрытие тонким слоем серебра мелких металлических изделий
без применения тока обычно производится из горячих цианистых
электролитов. Рекомендуемые составы растворов и режимы обра-
ботки приведены в табл. 101.
Таблица 101
Состав растворов для серебрения способом погружения и режим работы ванн
Компоненты электролита Содержание в Г/л в растворах
№ 1 Ns 2 № 3
Азотнокислое серебро AgNO3 10 10 200
Цианистый калий KCN 30 50 150
Едкое кали КОН —— — 375
Поташ К2СО3 — — 250
Режим работы
Температура раствора в °C 60—70 60—70 60—70
Продолжительность погружения в мин. 2—3 2—3 До 1
20*
308 Часть третья. Технология нанесения металлических покрытий
Тщательно подготовленные изделия погружают в растворы дЛя
химического серебрения в цинковых корзинах или перфорирован-
ных ведрах и несколько раз интенсивно встряхивают. После извле-
чения из ванны изделия промывают в горячей воде и сушат.
5. ДОПОЛНИТЕЛЬНАЯ ОБРАБОТКА ПОСЕРЕБРЕННЫХ
ИЗДЕЛИЙ
Как указывалось выше, серебренные изделия, так же, как и метал-
лическое серебро, под действием сернистых соединений покрываются
тонкой пленкой сернистого серебра и тускнеют. Толщина этой пленки
ничтожно мала и не превышает 0,07 мк, однако появление ее неже-
лательно, так как покрытие теряет декоративный вид.
Для защиты серебренных изделий от потускнения поверхность
их в зависимости от условий эксплуатации может быть покрыта
либо тонкой пленкой бесцветного лака, либо тонкой металлической
пленкой из цинка, кадмия, хрома или родия.
Хорошие результаты дает химическое пассивирование серебра
в 5—10-процентном растворе хромпика. Температура раствора 15—25°,
продолжительность обработки 20 мин. Получаемая при этом бесцвет-
ная пассивная пленка повышает стойкость серебра против оки-
сления.
Пассивация серебренных изделий может быть достигнута также
осаждением на них пленки гидроокиси бериллия гальваническим
путем из раствора сернокислого бериллия (2,2—2,4 Г!л). Осаждение
ведется при температуре 15—25°, плотность тока 0 005— 0,010 а/дм2.
Продолжительность обработки 30 мин. pH раствора должно состав-
лять 5,6—5,8. В качестве анода применяют пластинки из нержа-
веющей стали. Получаемая при этом пленка имеет радужный
оттенок.
В некоторых случаях для улучшения внешнего вида покрытые
серебром изделия подвергают специальной химической обработке,
в результате которой поверхность изделий покрывается равномер-
ным слоем сернистого серебра толщиной около 1 мк. Этот вид обра-
ботки, известный под названием оксидирования серебра, проводится
в растворах сернистых соединений. Оксидирование серебряных
покрытий для декоративных целей производится в горячем растворе
серной печени. Последняя готовится сплавлением 1 вес. ч. серы
и 2 вес. ч. порошкообразного поташа. Раствор для оксидирования
составляется из расчета 20—30 Г/л серной печени; продолжительность
обработки 3—5 мин. Иногда изделия после оксидирования зачи-
щают пемзой, при этом покрытие получает вид старого серебра.
Местное оксидирование серебряного покрытия осуществляется
не погружением, а нанесением горячего раствора на оксидируемым
участок поверхности.
Глава XVI. Покрытие благородными и редкими металлами
309
Кроме описанного способа оксидирования окунанием применяется
также анодное оксидирование в ванне следующего состава:
Сернистый натрий Na2S.................................. 30 Пл
Серноватистокислый натрий NaaS2O3.................. 20 »
Серная кислота H2SO4...............................6—10 »
Ацетон................................................ 5 мл/л
режим работы: плотность тока 0,15—0,5 а/дм2, темпера-
тура —25°, продолжительность операции 1—5 мин.
Полученная при этом пленка окрашена в серо-черный цвет,
прочно сцеплена с основанием и стирается с трудом. Снять оксиди-
ровку с поверхности серебряных изделийможно путем промывки
лхТ^насщданнрм растворе^ цианистого калия.
6. УДАЛЕНИЕ НЕДОБРОКАЧЕСТВЕННЫХ СЕРЕБРЯНЫХ ПОКРЫТИЙ
Недоброкачественные серебряные покрытия снимают со сталь-
ных изделий электролитическим растворением серебра в растворах
цианистого калия или цианистого натрия при температуре 20—30°.
Плотность анодного тока составляет 0,3—0,5 а!дм2.
Материалом катода служит медь или латунь. С изделий из ней-
зильбера и латуни серебро снимается в нагретом до 80° растворе
из 19 объемных частей концентрированной серной кислоты и 1 части""
концентрированной_азотной кислоты.
Б. ЗОЛОЧЕНИЕ
1. ОБЩИЕ СВЕДЕНИЯ
Физико-химические свойства золота: удельный вес 19,3 Псмя,
атомный вес 197,20; валентность 1 и 3; стандартный потенциал трех-
валентного золота +1,38 в, одновалентного +1,50 в, электрохими-
ческие эквиваленты равны соответственно 2,451 и 7,370 Па-ч. Тем-
пература плавления золота 1063°.
Золото — мягкий, тягучий и ковкий металл, отличается очень
высокой химической стойкостью. Кислоты, щелочи, сероводород
и другие сернистые соединения не оказывают на него заметного
действия. На воздухе золото не окисляется и не тускнеет. Оно рас-
творяется в царской водке и в смеси соляной и хромовой кислот,
з также в водных растворах цианистых соединений.
Золотые покрытия отличаются высокими декоративными свой-
ствами. Золочение распространено в ювелирном деле; в частности,
Широкое применение находят цветные золотые покрытия, получае-
мые электролизом путем введения в электролит или присадки к аноду
различных металлов. Так, например, «красное» золото получается
при добавлении в электролит для золочения меди; «зеленое» золото
получается при добавлении в электролит серебра или мышьяка,
«белое» золото — при добавлении никеля.
310
Часть третья. Технология нанесения металлических покрытий
Золотые покрытия используются в приборостроении, в часовом
производстве и для специальных целей. Золочение находит довольно
большое применение в радиотехнической промышленности для покры-
тия роликов, поясков и крепежных деталей электропроводным слоем.
Толщина золота при покрытии ювелирных изделий колеблется
в пределах от 0,25 до 3 мк и иногда до 10 мк. При покрытии хими-
ческой посуды, употребляемой в агрессивных средах, толщина слоя
золота достигает 30 мк. Нанесение золотых покрытий может быть
осуществлено несколькими способами.
Листовом метод. Листы золота толщиной 0,1—0,3 мк наклеи-
вают на предварительно подготовленную поверхность изделия
с помощью копалового лака.
Огневом метод. Изделия покрывают 10-процентной амальгамой
золота и подвергают нагреву. После возгонки ртути на изделиях
остается тонкий слой золота, который затем полируют окисью железа.
Метод плакирования. На листы меди или мельхиора наклеивают
тонкие листы золота и нагревают до температуры, обеспечивающей
их сварку. Из плакированных золотом листов после их прокатки
изготовляют штамповкой различные изделия, например корпуса
часов. Толщина слоя золота составляет примерно 25—75 мк.
Электролитический метод. Позволяет получать золотые покрытия
различной толщины и оттенков. В качестве электролитов для золо-
чения применяют цианистые растворы и раствор, содержащий желе-
зистосинеродистый калий.
Контактный метод. Разновидность электролитического метода
покрытия, при котором электролиз протекает за счет разности потен-
циалов, возникающей между покрываемым изделием и цинковым
контактом. В этой паре роль катода выполняет изделие, а роль
анода — цинк.
Метод погружения. Разновидность электролитического метода
покрытия, при котором процесс осаждения протекает за счет скачка
потенциала на границе поверхность изделия — электролит.
Из всех перечисленных методов в настоящее время наибольшее
распространение имеет электролитический.
2. ЦИАНИСТЫЕ ЭЛЕКТРОЛИТЫ ДЛЯ ЗОЛОЧЕНИЯ
Состав электролитов' и режим работы
Основным компонентом цианистых электролитов для золочения
является комплексная цианистая соль золота. Кроме этой соли
электролит содержит некоторое количество свободного цианида,
который предотвращает выпадение цианистого золота, увеличивает
электропроводность электролита и способствует активации анодов.
Наиболее употребительные составы цианистых электролитов для
золочения приведены в табл. 102.
Глава XVI. Покрытие благородными и редкими металлами
311
Таблица 102
Состав цианистых электролитов для золочения и режим работы ванн
Наименование компонентов Содержание в Г/л в растворах
№ 1 № 2 № 3 № 4
——
Золото (в пересчете на металлическое) KAu(CN)2 3—5 15—25 4 1,5
Цианистый калий свободный KCN 3—6 8—10 16 15
Поташ К2СО3 — До 100 10 35
Едкое кали КОН — До 1 — —
Комплексная цианистая соль кобальта (в пересчете на металл) — — 12 —
Цианистая комплексная соль никеля (в пересчете на металл) — — — 3,5
Режим работы
Температура в °C 60—70 55—60 70 20—60
Плотность тока в а/дм? 0,2—0,3 2—4 2 0,2
Выход по току в % 60—80 50 25 25—60
Электролит № 1 — один из наиболее распространенных. Элек-
тролит № 2 рекомендуется применять для получения относительно
толстых покрытий. Завеска изделий в этот электролит производится
под током. Ванна хорошо работает также при применении реверси-
рования тока. Электролит № 3, разработанный на кафедре электро-
химии Ленинградского технологического института, позволяет полу-
чать покрытия повышенной твердости и износоустойчивости, что
достигается за счет добавки в электролит комплексной цианистой
соли кобальта. Интересно отметить, что кобальт при этом не входит
в состав катодного осадка. Электролит № 4 также позволяет полу-
чать покрытия повышенной твердости. Выход по току в этом элек-
тролите составляет 25% при 20° и достигает 60% при повышении
температуры электролита до 60°. Повышенная твердость золотых
покрытий из этой ванны достигается за счет добавки никеля, содер-
жание которого в осадке составляет 1,8%.
Твердость покрытий, полученных при 20°, в четыре раза, а покры-
тий, полученных при 60°, в два раза выше, чем покрытий, полу-
ченных из той же ванны, но без добавки никеля.
Цианистые электролиты для золочения отличаются высокой
рассеивающей способностью и позволяют получать мелкокристал-
лические, плотные и блестящие осадки золота, обладающие хоро-
шим сцеплением с основой.
312
Часть третья. Технология нанесения металлических покрытий
Скорость осаждения золотых покрытий из цианистых электро-
литов приведена в табл. 103, а неполадки, встречающиеся при золо-
чении, — в табл. 104.
Таблица 103
Продолжительность осаждения золота (в мин.)
из цианистых электролитов (выход по току принят равным 90%)
Толщина слоя в мк Плотность тока в а}дм* Топщина слоя в мк Плотность тока в а[дм*
0.1 0.5 1.0 2.0 0.1 0.5 1.0 2.0
1 18 3,5 1,8 0,9 7 123 25 12 6,2
2 35 7,0 3,5 1.8 9 158 32 16 7,9
3 53 11 5,3 2,6 10 176 35 18 8,8
5 88 18 8,8 4,4
Таблица 104
Неполадки, встречающиеся при золочении, и меры их устранения
Признаки неполадок Причины возникновения Способы устранения
Осадок имеет зелено- ватый оттеиок Осадок имеет красно- ватый оттенок Темный рыхлый оса- док 'Пассивирование ано- дов, быстрое уменьше- ние содержания золота в электролите Присутствие серебра в электролите а) Наличие меди в электролите б) Высокая концен- трация электролита в) Высокая темпера- тура г) Низкая плотность тока а) Очень низкая плот- ность тока б) Малая концентра- ция золота в электро- лите в) Низкая темпера- тура а) Чрезмерно высокая анодная плотность тока б) Низкое содержание в растворе свободного цианистого калия Проработать электролит под током а) Проработать электро- лит под током б) Разбавить электролит водой в) Снизить температуру ванны г) Повысить катодную плотность тока а) Повысить катодную плотность тока б) Добавить в ванну гре- мучее золото в) Подогреть электролит а) Снизить анодную плот- ность тока б) Добавить цианистый калий
Глава XVI. Покрытие благородными и редкими металлами
313
Приготовление цианистых электролитов
Цианистые электролиты для золочения готовят растворением
хлорного или гремучего золота в растворе цианистого калия.
Хлорное золото АиС13-2Н2О получается растворением металли-
ческого золота в царской водке (3 вес. ч. соляной кислоты + 1 вес. ч.
азотной кислоты). Растворение производится при нагревании смеси
на песочной бане при 70—Е0° до прекращения выделения бурых
паров и образования густой темной маслянистой массы.
Полученное хлорное золото разбавляется пятикратным объемом
горячей воды и служит исходным продуктом для приготовления
рабочего электролита.
Часто при составлении электролитов (электролиты № 1—4)
исходят из гремучего золота. Для этого к полученному раствору
хлорного золота прибавляют 5—10-кратное количество аммиака
(при постоянном помешивании), избыток которого удаляется на-
греванием. Полученный при этом осадок гремучего золота
отфильтровывают, многократно промывают горячей водой и во влаж-
ном состоянии переносят в заранее приготовленный раствор циани-
стого калия, в котором он растворяется с образованием комплекса
KAu(CN)2.
При приготовлении гремучего золота необходимо предупреждать
высыхание осадка, так как в сухом виде он легко взрывается от толчка
или удара.
Цианистые электролиты для золочения технологически проще
готовить путем электролитического растворения золота в цианистом
растворе. При этом непосредственно образуется комплекс KAu(CN)2.
Для приготовления электролита ванну наполняют раствором циа-
нистого калия (20—30 Г/л) и подогревают до 70°. На анодные штанги
завешивают тонкие гофрированные листы золота, а в качестве като-
дов используют стальные стержни, которые помещают в неглазиро-
ванные глиняные или фарфоровые сосуды, наполненные 30-процент-
ным раствором щелочи. Сосуд-диафрагма довольно хорошо пропу-
скает электрический ток, но препятствует смешению анолита и като-
лита. Уровни щелочи в диафрагме и цианистого раствора в ванне
поддерживаются примерно одинаковые. Электролиз ведется при
анодной плотности тока 1 —1,5 а/дм2. Продолжительность электро-
лиза определяется формулой
, P-vlOO
t — —7----час.,
I-C-fla
Р — заданная концентрация золота в электролите
в Г/л',
v — объем электролита в л\
I — сила тока в а\
с ~ 7,357 Г/а-ч — электрохимический эквивалент золота;
т)о — анодный выход по току, равный примерно 70%;
где
314
Часть третья. Технология нанесения металлических покрытий
По окончании электролиза диафрагму удаляют и доливают ванну
водой до требуемого уровня. После химического анализа и коррек-
тировки состава ванна готова к эксплуатации.
3. ЖЕЛЕЗИСТОСИНЕРОДИСТЫЕ ЭЛЕКТРОЛИТЫ
Железистосинеродистые электролиты во многом уступают циа-
нистым электролитам золочения. Во-первых, в указанных электро-
литах аноды больше подвержены пассивации, и для того, чтобы
обеспечен был нормальный режим электролиза, поверхность анодов
должна быть в несколько раз больше' поверхности покрываемых
изделий. Во-вторых, электролит из-за малой скорости растворения
анодов отличается нестабильностью и нуждается в частой коррек-
тировке солями золота. В-третьих, скорость осаждения золота
из железистосинеродистого электролита почти в три раза меньше,
так как золото в нем находится в трехвалентной форме, а не в одно-
валентной, как в цианистом электролите.
Несмотря на эти технологические недостатки, железистосине-
родистые электролиты для золочения находят некоторое практиче-
ское применение благодаря тому, что они не ядовиты. Покры-
тия из них удовлетворительны по качеству.
Состав двух типовых железистосинеродистых электролитов золо-
чения и режимы работы их приведены в табл. 105.
Таблица 105
Состав железистосинеродистых электролитов для золочения
и режимы работы
Компоненты электролита Содержание в Г/л в растворах
№ 1 № 2
Синеродистый комплекс золота (в пересчете иа ме- талл) 25 1.5
Железистосинеродистый калий 200 15
Углекислый натрий 50 15
Режим работы
Температура в °C 75 50
Плотность тока в а!дмг 4—6 0,1—0,2
Выход по току в % 50 35
Для приготовления железистосинеродистого электролита нагре-
вают растворы железистосинеродистого калия и углекислого натрия,
сливают их вместе и продолжают нагревать до кипения, затем при-
бавляют необходимое количество хлорного или гремучего золота
Глава XVI. Покрытие благородными и редкими металлами
315
и снова кипятят в течение 10—15 мин. (в случае прибавления гре-
мучего золота кипятят до исчезновения запаха аммиака).
После охлаждения раствор разбавляют дистиллированной водой
и фильтруют. Железистосинеродистый электролит корректируют
добавками K4Fe (CN)6 и АиС13 по данным анализа.
4. ЗОЛОЧЕНИЕ БЕЗ ВНЕШНЕГО ТОКА
Золочение методом погружения
Золочение методом погружения основано на создании разности
потенциалов на границе поверхность покрываемого изделия —
раствор.
Осадки золота лучшего качества удается получить на латунных
изделиях. Поэтому при золочении изделий из других металлов
рекомендуется их предварительно латунировать. Толщина слоя
золота, полученного методом погружения, обычно не превышает
0,1 мк, однако осадки отличаются высокой плотностью. Растворы,
рекомендуемые для золочения методом погружения, приведены
в табл. 106. •
Таблица 106
Состав электролитов для золочения методом погружения и режим работы ваин
Наименование компонентов Содержание в Г/л в растворах
№ 1 № 2 № 3 № 4
Двухзамещенный фосфорнокислый натрий Na2HPO4- 12Н2О 6 —- -
Хлорное золото АиС13 — 0,4 3,5 1.5
Едкий натр NaOH 1 — — —
Кислый углекислый калий КНСО3 — 150 — 100
Хлористый натрий NaCl — — 2.0 —
Цианистый калий KCN 10 — — —
Сернистокислый натрий Na2SO3 3 — 30 —
Железистосинеродистый калий K4Fe (CN)e-3H2O — — 3 —
Золотохлористоводородная кислота НАиС14-4Н2О 0,6 — — —
Режим р а б о т ы
Температура раствора в °C 90 70—80 70—80 70—80
Продолжительность в мин. 3—5 3—5 5—10 5—10
316
Часть третья. Технология нанесения металлических покрытий
Контактное золочение
Разность потенциалов, необходимая для осаждения золота кон-
тактным способом, создается гальваническим элементом, в котором
катодом служит покрываемое изделие, а анодом — цинковая пла-
стинка, погруженная в концентрированный раствор поваренной
соли и соединенная с изделием проволокой. Контактное золочение
выполняется в аппарате, схематически изображенном на фиг. 115.
Электролит для золочения отделен от раствора поваренной соли
пористой перегородкой. Контактное золочение позволяет получать
плотные покрытия небольшой толщины. Составы растворов, реко-
мендуемые для контактного золочения, приведены в табл. 107. Для
этой же цели пригодны электролиты для золочения, указанные
в табл. 103, при нагреве их до 70°.
Фиг. 115. Схема
аппарата для кон-
тактного золочения:
1 — цинковый элек-
трод; 2 — покрыва-
емый объект; 3 — по-
ристая диафрагма;
4 — контактирующий
прутик.
Таблица 107
Состав растворов для контактного золочения и режим работы
Название компонентов Содержание в Г/л в растворах
№ 1 № 2 № 3
Двухзамещенный фосфорнокислый натрий Na2HPO4-12Н2О 5,0 50 —
Хлорное золото АиС13 1,0 — 7,5
Цианистый калий KCN 16,0 6 —
Едкий натр NaOH 3,0 — —
Железистосинеродистый калий K4Fe (CN)e-3H2O — — 3,5
Сернистокислый натрий Na2SO3 — 15 3,5
Хлористый натрий NaCl — — 3,5
Золотохлористоводородная кислота НАиС14-4Н2О — 1,5 —
Режим работы
Температура в °C 60—80 70—90 60—70
Продолжительность в мин. 3—5 3—5 3-5
б. УДАЛЕНИЕ НЕДОБРОКАЧЕСТВЕННЫХ ПОКРЫТИЙ Й ИЗВЛЕЧЕНИЕ
ЗОЛОТА ИЗ ОТРАБОТАННЫХ РАСТВОРОВ
Недоброкачественные покрытия снимают электролитическим
растворением золота в соляной или серной кислоте при температуре
18—25° и плотности тока 0,1—1,0 а/дм2. Материалом катода служит
железо или свинец. Изделия завешивают на медных подвесках.
Глава XVI. Покоытие благородными и редкими металлами
317
Другой способ удаления недоброкачественных золотых покры-
тий состоит в следующем. Изделия погружают в нагретую до 70°
смесь концентрированных серной и соляной кислот, взятых в соот-
ношении 4 : 1 по объему, и добавляют туда понемногу концентри-
рованную азотную кислоту.
растворы, в которых производилось удаление золотых покрытий,
подлежат утилизации.
Существует несколько способов извлечения золота из отработан-
ных растворов.
Золото из цианистых электролитов может быть осаждено цин-
ковой пылью или алюминиевым порошком. Выпавший осадок обра-
батывают соляной кислотой для перевода в раствор избытка цинка,
а затем азотной кислотой для удаления примесей серебра и меди.
Промытый золотой порошок растворяют в царской водке для при-
готовления хлорного золота.
По другому способу цианистый электролит сначала разрушается
избытком серной кислоты, а затем извлекают золото из электролита
цинковым порошком или стружкой, как указано выше.
Извлечение золота считается полным, если цинковый стержень,
погруженный в раствор, не покроется темным налетом.
Извлечение золота из отработанных электролитов на Таллинской
ювелирной фабрике производится путем предварительной обработки
этих электролитов 10-процентным раствором каустической соды.
Раствор после добавления щелочи подогревают до 60°, после чего
производится осаждение золота с помощью алюминия. Полноту
осаждения проверяют по сохранению блеска контрольной алюминие-
вой полоски.
Безвозвратные потери золота при применении указанного метода
не превышают 0,012—0,022% от общего количества золота, содер-
жащегося в отработанных электролита^.
Наконец, извлечение золота из отработанных электролитов,
и особенно из промывных вод, может быть осуществлено посредством
ионообменных смол (например, анионитных смол марок Н-0, МН,
ЭД-10Г1, АИ-1). Используются высокие адсорбционные способности
этих смол по отношению к катионам и коллоидным частицам благо-
родных металлов.
Процесс извлечения драгоценного металла (золота, серебра и т. д.)
из отработанных электролитов и промывных вод по данному методу
ведется по схеме, приведенной на фиг. 116.
Раствор из сборника 1 перекачивается центробежным насосом
в осадитель 2, где он обрабатывается пылевидными отходами анио-
нообменных смол при энергичном перемешивании воздухом, который
поступает в осадитель из воздуходувки 3 через барботер 4. Затем
Раствор подают на нутч-фильтр 5, где при отсасывании воздуха
вакуум-насосом 6 твердые частицы смолы отделяются вместе с метал-
лом. Для контроля работы фильтра и полноты отделения твердой
318
Часть третья. Технология нанесения металлических покрытий
Фиг. 116. Схема установки для улавливания драгоценных
металлов из производственных отходов:
/ — сборник промывных вод (емкость 150 л) с насосом; 2 — осади-
тель (емкость 150 л); 3 — воздуходувка; 4 — барботер; 5 — нутч-
фильтр; 6 — вакуум-насос; 7— адсорбционная колонка; -8 — напор-
ный бак (емкость 150 л); 9 — ловушка; 10 — водомерные стекла;
11 — вентили для отбора проб.
Фиг. 117. Адсорбцион-
ная колонка из вини-
пласта:
/—трубка; 2—патрубок;
3 — фланец; 4 — сетка;
5—прокладка из пласти-
ката; 6 — днище.
Глава XVI. Покрытие благородными и редкими металлами
319
Лазы периодически берут пробы фильтрата. Он должен быть совер-
шенно прозрачным. Мутные пробы фильтрата возвращают на фильтр,
а прозрачную жидкость спускают в канализацию. Осадок на фильтре
промывают водой, а затем высушивают и сжигают. Из зольного
остатка благородные металлы выплавляют обычным способом. Выход
металла близок к 100% от первоначального содержания металлов
в растворах. Расход адсорбентов составляет 0,1—1,0% от количе-
ства обрабатываемой жидкости.
При большом объеме производства улавливание драгоценных
металлов можно производить непрерывно, пропуская промывные
воды и растворы через адсорбционную колонку 7, наполненную
анионитной смолой. Колонка (фиг. 117) изготовлена из винипласта.
Промывные воды пропускаются со скоростью 40 мл раствора
в минуту на 1 см2 площади сечения колонки. Адсорбция драгоцен-
ных металлов происходит с частичным восстановлением их до металла.
Для разрыхления постепенно уплотняющегося слоя смолы в колонке
в нижний патрубок адсорбционной колонки периодически подается
вода. Вес колонки около 2 кГ. Она работает при атмосферном дав-
лении.
Возможные потери золота при технологическом процессе золо-
чения приведены в табл. 108. Значения этих потерь по отдельным
Таблица 108
Возможные потери золота в технологическом процессе золочения
Наименование операций, на которых возможны потерн золота Безвозвратные потери в % от общего количества затраченного золота
Приготовление электролита методом анодного растворения золота Приготовление электролита растворением золота в царской водке Гальваническое покрытие золотом а) Унос электролита в вентиляцию с пу- зырьками водорода и кислорода б) Осаждение золота на контактах под- весок или сеток (потери при регенерации) Промывка деталей после золочения в уловителях с непроточной водой Периодическое фильтрование электролитов зо- лочения 0,10 0,50 2,0 0,50 0,1—0,3 (в зависимости от сложности профиля) 0,2
операциям приведены ориентировочно по данным ювелирной про-
мышленности. Указанные потери металла на отдельных технологи-
ческих операциях характерны и для процессов осаждения других
Драгоценных металлов, например, серебра, платины” и пр.
320 Часть третья. Технология нанесения металлических покрытий
В. РОДИРОВАНИЕ
1. ОБЩИЕ СВЕДЕНИЯ
Родий — металл белого цвета с розоватым оттенком. Родий обла-
дает следующими физико-химическими свойствами: удельный вес
12,44 Псм?, атомный вес 102,91; валентность 3; стандартный потен-
циал +0,68 в; электрохимический эквивалент 1,28 Па-ч\ удельная
электропроводность металла 16,6-104 ом~1 -см-1; температура плав-
ления 1966°.
Родий отличается высокой химической устойчивостью в растворах
кислот (азотной, соляной), щелочей и сернистых соединений. В отли-
чие от платины родий не поддается действию царской водки. Родий
растворяется в концентрированной серной кислоте, в расплавлен-
ном бисульфате калия и в расплавленной поваренной соли в при-
сутствии хлора.
Несмотря на высокую стоимость родий находит некоторое при-
менение в гальваностегии. Главными особенностями родиевых покры-
тий, обусловивших их распространение, являются высокая отража-
тельная способность и большая твердость. Коэффициент отражения
родиевых покрытий достигает 75% и уступает лишь коэффициенту
отражения серебряных покрытий. Отражательная способность родия,
в отличие от серебра, не изменяется от воздействия сернистых соеди-
нений. Твердость родиевых покрытий по шкале Бринеля достигает
700 ед. и уступает лишь электролитическому хрому.
Родиевые покрытия применяются для получения отражающих
поверхностей в оптических приборах, а также для защиты серебря-
ных покрытий от потускнения и для повышения их износоустойчи-
вости. Толщина родиевых покрытий обычно не превышает 0,1—•
0,15 мк.
2. ЭЛЕКТРОЛИТЫ ДЛЯ РОДИРОВАНИЯ И РЕЖИМЫ РАБОТЫ
Для электролитического родирования нашли применение фосфат-
ный и сульфатный электролиты.
Интенсивность окрашивания фосфатных электролитов изме-
няется соответственно содержанию в них родия. Это позволяет
контролировать содержание родия в ванне, пользуясь колориме-
трическим методом. Сульфатные электролиты обладают высокой
электропроводностью и широким интервалом рабочих плотностей
тока.
Фосфатный электролит
Фосфатный электролит для родирования имеет следующий состав:
Хлорородиат калия K3RhCle (в пересчете на металл) 2 Пл
Фосфорная кислота Н3РО4............................ 50 »
pH электролита.................................... 1,1—1,3
Глава XVI. Покрытие благородными и редкими металлами
321
режим работы: напряжение на клеммах ванны 2,5—5 в,
плотность тока 0,15 а/дм2, температура электролита 18—25°.
Для приготовления электролита порошкообразный родий сме-
шивают с пятикратным по весу количеством хлористого калия.
Смесь нагревают в трубчатой печи до 700° и хлорируют пропусканием
влажного хлора в течение 4—5 час. В результате образуется хлоро-
родиат калия, который служит исходным веществом для составле-
ния ванны.
Выход родия по току для фосфатного электролита весьма низок.
Ванна применяется главным образом для получения блестящих
осадков родия.
Электролит требует периодического корректирования хлороро-
диатом калия или гидратом окиси родия.
Регенерацию фосфатного электролита производят добавлением
муравьинокислого натрия при нагревании. Выпавший осадок
отфильтровывают, промывают азотной кислотой и восстанавливают
в токе водорода в трубчатой печи при 700—800°. Полученный таким
образом металлический родий используется для приготовления
нового электролита.
Сульфатный электролит
В состав сульфатного электролита для родирования входят:
Серная кислота......................................... 35 Пл
Гидроокись родия (в пересчете на металл) ............... 2 »
Режим работы: температура электролита 50°, плотность
тока 1,8 а/дм2, напряжение на ванне 2,5—5 в, выход по току дости-
гает £0%.
Необходимая для составления ванны гидроокись родия оса-
ждается из раствора трех хлор истого родия действием на него ам-
миака.
Осадок растворяют в серной кислоте, разбавляют водой с таким
расчетом, чтобы содержание родия составило 2 Г/л, и добавляют
необходимое количество серной кислоты.
В качестве анодов при родировании применяется металлический
родий в виде тонких пластин или лент. Оба электролита для роди-
рования обладают хорошей рассеивающей способностью.
Г. ПЛАТИНИРОВАНИЕ
1. ОБЩИЕ СВЕДЕНИЯ
Платина — металл серебристо-белого цвета со следующими
физико-химическими свойствами: удельный вес 21,5 Г/см9-, атомный
вес 195,23; валентность 2 и 4, стандартный потенциал перехода
платины в четырехвалентное состояние равен 4-0,86 в; электро-
21
ВаЙиер в Дасояи
322
Часть третья. Технология нанесения металлических покрытий
химический эквивалент 1,82 Па-ч\ температура плавления 1777°
удельная электропроводность равна 9,1-104 аи_1-си-1.
Платина исключительно устойчива по отношению к большинству
агрессивных сред; при нагревании до высоких температур не окис-
ляется. На платину действуют расплавленные щелочи, фосфор,
цианистые соединения, сульфиды и галлоиды. В царской водке пла-
тина растворяется гораздо медленнее золота. Сплавы платины с се-
ребром, свинцом и золотом растворяются также в азотной кислоте.
Благодаря высокой химической стойкости платиновых покрытий
они в ряде случаев успешно заменяют платиновые изделия. Плати-
нирование нашло применение в ювелирном деле, в приборостроении,
для изготовления некоторых видов хирургических инструментов
и т. п. Во всех этих случаях толщина слоя платины колеблется
в пределах от 1 до 10 мк.
Платинирование может быть осуществлено электролитическим
и контактным способами.
2. ЭЛЕКТРОЛИТЫ ДЛЯ ПЛАТИНИРОВАНИЯ И РЕЖИМЫ РАБОТЫ
Из числа предложенных составов электролитов платинирования
заслуживают внимания фосфатные и нитратные электролиты.
Фосфатные электролиты
В табл. 109 приведен состав фосфатных ванн для платинирования
с применением фосфатных электролитов.
Реактивы, входящие в состав электролитов № 1 и 2, раство-
ряют каждый отдельно; раствор фосфорнокислого аммония доба-
вляют к платинохлористоводородной кислоте. Полученный осадок
(NH4)2 PtCle отфильтровывают, добавляют к нему раствор
фосфорнокислого натрия и кипятят смесь до исчезновения запаха
аммиака. Электролит ванны №3 готовят растворением компонентов
в теплой воде и кипячением в течение 10 час. (периодически попол-
няя испаряющуюся воду).
Таблица 109
Состав фосфатных электролитов и режим работы ванн
для платинирования
Наименование компонентов Содержание в Г/л в растворах
№ 1 № 2 № 3
Платинохлорнстоводородная кислота H2PtCl« 5 8 —
Двухзамещенный фосфорнокислый ам- моний (NH4)2HPO4 45 26 16
Глава XVI. Покрытие благородными и редкими металлами
323
Продолжение табл. 109
Наименование компонентов Содержание в Г/л в растворах
№ 1 № 2 № 3
Двухзамещенный фосфорнокислый натрий Na2HPO4-12Н2О 240 120 80
Хлористый натрий NaCl — — 4
Бура Na2B2O7-ЮН2О — — 1,5
Хлорная платина PtCI4 —- — 3,5
Режим р а б о т ы
Температура в °C 65—70 65—70 60—70
Плотность тока в al дм? 0,1—0,15 0,1—0,5 0,1—0,3
Выход по току в % 30—40 15—25 50
Нитритные электролиты
Нитритные электролиты для платинирования по сравнению
с фосфатными более устойчивы в работе, имеют лучшую рассеиваю-
щую способность, позволяют применять высокие плотности тока
и дают осадки, которые даже при незначительной толщине покрытия
являются стойкими против коррозии. Наилучшим является электро-
лит следующего состава:
Диаминоплатинонитрит Pt (NH3)2 (NO2)2 (в пересчете
иа металл).................................... 10 Пл
Азотнокислый аммоний NH4NO3 . 100 »
Азотнокислый натрий NaNO3 ...........• . 10 »
Едкий натр NaOH ............................ 50 »
Режим работы: температура электролита 80—90°, плот-
ность тока 1—1,5 aJdr<i2‘, выход по току 10%.
Диаминоплатинонитрит содержит примерно 60% платины;
растворимость в воде его мала (0,08 Пл при 25° и 2,32 Пл при 75°);
в растворе аммиака она сильно возрастает, и содержание металла
можно довести до 10 Пл.
Необходимый для составления электролита диаминоплатино-
нитрит получается следующим образом.
Водный раствор хлорной платины смешивается с 10-кратным
объемом азотистокислого калия при слабом нагревании. Четырех-
валентная платина восстанавливается в двухвалентную с образова-
нием платинонитрита калия K2 IPt (NO2)4L
Эта соль при прибавлении водного раствора аммиака переходит
в tPt(NH3)2(NO2)2] и выпадает в виде объемистой кристаллической
21*
324
Часть третья. Технология нанесения металлических покрытий
массы, которая после очистки употребляется для составления ванны
Для этого диаминоплатинонитрит растворяют в 5-процентном растворе
аммиака и прибавляют водные растворы остальных компонентов
электролита. Полученную смесь перед употреблением для целей пла-
тинирования кипятят в течение 1—2 час. Анодами в ваннах пла-
тинирования служит платиновая фольга или лента.
3. КОНТАКТНОЕ ПЛАТИНИРОВАНИЕ
Контактное платинирование производится в следующем растворе:
Хлорплатинат аммония (NH4)2PtCle ......... 40 Г/л
Хлористый аммоний NH4CI ............... 320 »
Процесс ведется при температуре 70—100°, продолжительность
обработки 60 мин.; изделия после покрытия полируют мылом.
4. РЕГЕНЕРАЦИЯ ЭЛЕКТРОЛИТОВ И УДАЛЕНИЕ
НЕДОБРОКАЧЕСТВЕННЫХ ПОКРЫТИЙ
Платина из отработанных электролитов и промывных вод улав-
ливается в виде сернистой платины; для этой цели через отработан-
ные растворы после подкисления соляной кислотой пропускается
струя сероводорода. Выпавшую в осадок сернистую платину отфиль-
тровывают, высушивают и прокаливают на воздухе для восстановле-
ния до металла.
Удаление платиновых покрытий с поверхности изделий произво-
дится путем анодного растворения в рабочем электролите с примене-
нием серебряного или графитового катода.
Д. ПАЛЛАДИРОВАНИЕ
1. ОБЩИЕ СВЕДЕНИЯ
Палладий — мягкий и ковкий металл серебристо-белого цвета;
он наиболее дешевый из металлов платиновой группы. Физико-хими-
ческие свойства палладия: удельный вес 12,0 Г/см'л, атомный вес
106,7; валентность 2 и 4; стандартный потенциал равен +0,91 в;
электрохимический эквивалент двухвалентного палладия 1,99 Па-ч,
четырехвалентного — 1,0Г/с-ч. Удельная электропроводность
9,1-10* олГ*-с.и“температура плавления 1555°.
Палладий растворяется в царской водке, в азотной кислоте и мед-
ленно — в соляной кислоте. Палладирование применяется в электро-
технической промышленности при изготовлении электрических кон-
тактов с неизменной электропроводностью. В приборостроении спосо-
бом палладирования изготовляются зеркала с высокой отражатель-
ной способностью. Кроме того, палладирование применяется для
защитных и декоративных целей. Толщина покрытия обычно бывает
в пределах 0,5—5 мк.
Глава XVI. Покрытие благородными и редкими металлами
325
Палладиевые покрытия наносят непосредственно на медь или се-
ребро. При покрытии других металлов палладием необходим под-
слой меди или серебра.
Палладирование производится из фосфатных, нитритных и амино-
хлоридных электролитов.
2. ЭЛЕКТРОЛИТЫ ДЛЯ ПАЛЛАДИРОВАНИЯ И РЕЖИМЫ РАБОТЫ
Фосфатные электролиты
Состав и режим работы фосфатных электролитов палладирования
приведены в табл. ПО.
Таблица 110
Состав и режим работы фосфатных электролитов для палладирования
Наименование компонентов Содержание в Г/л в растворах
№ 1 № 2
Хлорпалладиоводородная кислота H2PdCl4 — 3,5
Двухзамещенный фосфорнокислый аммоний 20 20
(NH4)2HPO4
Двухзамещенный фосфорнокислый натрнй 100 100
Na2HPO4- 12НаО
Хлористый аммоний NH4C1 — 25
Аммиак NH4OH — До получения
pH = 7
Хлористый палладий PdCla 3,7 —
Бензойная кислота С7НвОа 2,5 —
Режим работы
Температура электролита в °C 50 20
Плотность тока в а! дм? 0,2—0,3 0,25
Выход по току в % 90—95 90—95
Электролит № 1 приготовляют следующим образом. Рассчитан-
ное количество палладия растворяют в царской водке при нагрева-
нии1. Остаток после выпаривания разбавляют водой и вливают
в водный раствор фосфорнокислого аммония. Электролитический
метод получения хлористого палладия основан на анодном растворе-
нии палладия в концентрированной соляной кислоте. Выход по току
при анодных плотностях тока от 5 до 25 а/дм2 составляет 97—100%.
Устройство электролизера показано на фиг. 118. Катодное простран-
ство / электролизера 2 заполняют концентрированной соляной
1 Если имеется готовый препарат хлористого палладия, он может быть исполь-
зован для приготовления палладиевых электролитов.
326
Часть третья. Технология нанесения металлических покрытий
Ч
5
г
Фиг. 118. Схема элек-
тролизера для получе-
ния хлористого пал-
ладия.
кислотой так, чтобы уровень ее был несколько выше уровня кислоты
в электролизере во избежание диффузии ионов палладия к катоду з
В качестве катода используется медная прово!
лока. Применять палладиевый катод нельзя
так как в процессе электролиза он быстро раз-
рушается выделяющимся водородом.
Электролизер описанной конструкции обес-
печивает достаточно быстрое и полное раство-
рение палладия. Благодаря применению в ка-
честве диафрагмы стеклянного фильтра 4 пал-
ладиевый анод 5 при электролизе растворяется
в основном снизу. При применении же обычной
керамической пористой диафрагмы наиболее
энергичное растворение происходит на границе
электролит — воздух, что приводит к сравни-
тельно быстрому обрыву части анода, погру-
женной в электролит.
Электролитический способ, предложенный
И. А. Агуфом, значительно ускоряет процесс
приготовления хлористого палладия.
Бензойную кислоту и фосфорнокислый на-
трий растворяют и добавляют, к раствору хло-
ристого палладия. Полученный раствор перели-
вают в ванну, перемешивают, доливают водой до требуемого объема.
Электролит № 2 приготовляют смешиванием водных растворов
компонентов в следующей последовательности: H2PdCl4, (NH4)2HPO4,
Na2HPO4 и NH4C1.
Полученный раствор разбавляют водой до нужного объема и до-
бавляют NH4OH до появления слабощелочной реакции.
Нитритные электролиты
Состав нитритных электролитов и режим работы ванн для палла-
дирования приводятся в табл. 111.
Таблица 111
Состав и режим работы нитритных электролитов для палладирования
Наименование компонентов Содержание в Г/л в растворах
№ I № 2
Хлорпалладит натрия Na2PdCI4 10 —.
Нитрит натрия NaNOa 10 —
Хлористый натрий NaCl 50 —
Азотнокислый аммоний NH4NO3 — 100
Глава XVI. Покрытие благородными и редкими металлами
327
Продолжение табл. 111
————— Наименование компонентов Содержание в Г/л в растворах
№ I № 2
Аммиак NH4OH — 25
Диаминопалладионитрит Pd [(NH3)2(NO2)2] — 10,7
Режим работы
Температура электролита в °C 50 50
Плотность тока в а/дм2 1,0—1,5 0,5—1
Выход по току в % 90—95 90—95
Величина pH электролита 7—7,5 4—5
Анод Палладиева я пластинка
Электролит № 1 приготовляется растворением хлорпалладита
натрия в половинном объеме воды, затем в ванну вводят NaNO2,
NaCl и доливают воду. Электролит № 2 приготовляют растворением
диаминопалладионитрита в половинном количестве аммиака, затем
добавляют раствор азотнокислого аммония и остальное количество
аммиака.
Аминохлоридный электролит
В состав аминохлоридного электролита входят:
Тетрааминохлорид палладия [Pd (NH3)4J С12 (в пересчете
на металл)........................................ 35 Г/л
Аммиак 25-процентный NH4OH ....................... 55 »
Хлористый аммоний NH4C1 18 »
pH электролита.......... ... ............. 8,5—9,5
Осаждение ведется при температуре 15—25°, плотность тока
1—2 а/дм2, выход по току 98%.
Анодами служат палладиевые пластинки; соотношение площади
анода и катода 3:1.
Электролит готовится растворением хлористого палладия в соля-
ной кислоте. В нагретый до 70—90° раствор, постепенно перемеши-
вая, приливают 25-процентный раствор аммиака до растворения
кирпично-красного кристаллического осадка. В полученный желто-
зеленый раствор тетрааминохлорида палладия добавляют хлористый
аммоний, затем разбавляют водой до требуемого объема. Приготов-
ленный таким образом электролит после проработки под током готов
к эксплуатации
Неполадки при работе аминохлоридного электролита для палла-
Дирования приведены в табл. 112.
328
Часть третья. Технология нанесения металлических покрытий
Таблица 112
Неполадки при палладировании в аминохлоридном электролите
Признаки неполадок Причины возникновения Способы устранения
Темные налеты или полосы а) Высокая концен- трация хлористого ам- мония б) Детали расположе- ны очень близко к ано- дам а) Откорректировать со- став электролита по данным анализа б) Перемонтировать де- тали на подвеске
Шелушение или от- слаивание покрытия Электролит загрязнен органическими приме- сями или солями меди, цинка, олова и т. д. Регенерировать соль палладия из электролита и приготовить его вновь
Темное неравномер- ное покрытие Низкая концентрация солей палладия в элек- тролите Откорректировать состав электролита поданным ана- лиза
Осаждение желтых солей палладия на ано- дах. Темно-серые по- крытия а) Отсутствие свобод- ного аммиака б) Высокая катодная плотность тока в) Высокая темпера- тура а) Добавить аммиак до содержания 2—5 Пл б) Снизить плотность тока в) Охладить электролит
Блестящие покрытия малой толщины На катоде выделяется только водород Высокая концентра- ция свободного аммиака Очень высокая кон- центрация свободного аммиака Повысить концентрацию солей палладия Подогреть электролит до 50—60° для удаления избытка аммиака
Блестящие покрытия с течением времени ста- новятся матовыми Занижена плотность тока- Повысить плотность тока до 1—2 а!дм2
Регенерацию электролита производят путем приливания к нему
соляной кислоты. При этом выпадает желто-оранжевый осадок
диаминохлорида палладия. Осадок отфильтровывают, промывают
малым количеством очень холодной воды и переводят снова в тетра-
аминохлорид палладия путем растворения в аммиаке.
Е. ИНДИРОВАНИЕ
1. ОБЩИЕ СВЕДЕНИЯ
Индий — очень мягкий и легкоплавкий металл белого цвета.
Он принадлежит к числу редких элементов, содержание его в земной
коре составляет 2-10“6%. Удельный вес индия 7.31 Г/см'Л\ атомный
вес 114,76; валентность 3; стандартный потенциал равен—0,35 в;
Глава XVI. Покрытие благородными и редкими металлами
329
электрохимический эквивалент 1,35 Г/а-ч\ удельная электропровод-
ность 12-104 ом~1-см~1; температура плавления 164°.
На сухом воздухе и при обычных температурах индий не изме-
няется. Индий устойчив в солевых растворах, а также не корродирует
под действием органических кислот, образующихся при окислении
смазочных масел. Индий является наилучшим металлом для изготов-
ления зеркал, так как он наиболее равномерно отражает световые
волны всех цветов спектра. Благодаря этому индирование нашло
применение в оптической промышленности. Толщина слоя индиевых
покрытий обычно не превышает 0,3—3 мк. Индиевые покрытия нахо-
дят применение также в машиностроении при изготовлении подшип-
ников с высокими антифрикционными свойствами.
Электролитическое индирование производится в цианистых и сер-
нокислых электролитах.
2. ЭЛЕКТРОЛИТЫ ДЛЯ ИНДИРОВАНИЯ И РЕЖИМЫ РАБОТЫ
Цианистый электролит
Состав цианистой ванны для индирования:
Гидроокись индия In (ОН)3 ....................... 45 Пл
Цианистый натрий NaCN ........................... 150 »
d-глюкоза CeHl2Oe.................................... 15 »
Электролиз ведется при плотности тока 10—15 а!дм?, темпе-
ратура электролита 18—25°; анод—нержавеющая сталь.
Непременными условиями нормальной работы электролита яв-
ляются применение свежеприготовленной гидроокиси индия и нали-
чие в ванне d-глюкозы из расчета 0,5 Г на 1 Г металла.
Недостатками этого электролита являются: непостоянство состава,
малый выход по току (около 50%) и содержание ядовитых пре-
паратов.
Сернокислый электролит
Сернокислый электролит для индирования применяется чаще,
чем цианистый. В состав его входят:
Сернокислый индий ln2(SO4)3-9H2O................... 70 Пл
Сернокислый натрий Na2SO4-10H2O ................... 10 »
pH электролита..................................... 2—2,2
Осаждение ведется при плотности тока 1,1—4,3 а/дм2, напряже-
ние на ванне составляет 1,1—2,7 в. Ванна работает при комнатной
температуре (18—25°).
При повышении pH до 2,7 напряжение на ванне при тех же усло-
виях увеличивается до 3—6 в. Сернокислые электролиты отличаются
стабильностью, хорошей рассеивающей способностью, не содержат
ядовитых веществ и дают сравнительно большой выход по току
(60—80%).
330
Часть третья. Технология нанесения металлических покрытий
Для сернокислых электролитов важное значение имеет вели-
чина pH, которая в зависимости от материала покрываемых изделий
и применяемых плотностей тока должна поддерживаться в пределах
2—2,7.
В качестве анодов применяется металлический индий в виде ленты
Сернокислый электролит для индирования готовится растворе-
нием в воде сульфата индия и сульфата натрия. Электролит можно
готовить также непосредственным растворением измельченных лис-
точков индия в горячей серной кислоте. Раствор отфильтровывают
добавляют необходимое количество сульфата натрия, разбавляют
водой до содержания 20 Г/л индия, устанавливают необходимую для
данного случая кислотность и приступают к работе.
3. РЕГЕНЕРАЦИЯ ОТРАБОТАННЫХ ЭЛЕКТРОЛИТОВ
Вследствие дороговизны индиевого электролита все промывные
воды собираются и обрабатываются с целью улавливания индия.
Индий осаждается аммиаком в виде гидроокиси, которая после
фильтрации и промывания растворяется в серной кислоте и возвра-
щается в рабочую ванну.
ГЛАВА XVII
НАНЕСЕНИЕ ГАЛЬВАНИЧЕСКИХ ПОКРЫТИЙ
НА АЛЮМИНИЙ, МАГНИЙ, ЦИНК И ИХ СПЛАВЫ
А. ПОКРЫТИЯ НА АЛЮМИНИИ И ЕГО
СПЛАВАХ
1. ОБЩИЕ СВЕДЕНИЯ
Благодаря ряду важных преимуществ (весьма малый удельный
вес, достаточно высокие механические характеристики, доступность
и дешевизна) алюминиевые сплавы находят применение в ряде отрас-
лей народного хозяйства и в быту, причем область применения рас-
ширяется с каждым годом. В связи с этим вопросы нанесения различ-
ных металлических покрытий на поверхность изделий из алюминия
и его сплавов с целью увеличения коррозионной стойкости или при-
дания поверхности новых физико-химических и механических свойств
имеют большое практическое значение. В настоящее время алюминий
и его сплавы с электролитическими покрытиями находят важное при-
менение (табл. 113), причем чаще всего используются многослойные
Таблица 113
Виды покрытий на алюминии и его сплавах и их назначение
Назначение покрытия Вид покрытия (нижние сдои покрытия указаны в скобках)
Для декоративных целей, глав- ным образом в помещении и в хороших атмосферных условиях Хромовое (медь—никель), серебряное (медь), золотое (медь), родиевое (медь—се- ребро, медь—никель)
Защита от коррозии Никелевое (медь), медное
Снижение переходного сопро- тивления электрических контак- тов Серебряное (медь), родиевое (медь—се- ребро), олово, олово—свинец (медь, медь— никель, а также олово, нанесенное методом погружения)
Перед гуммированием Латунь
-
332
Часть третья. Технология нанесения металлических покрытий
Продолжение табл. Из
Назначение покрытия Вид покрытия (нижние слои покрытия указаны в скобках)
Повышение стойкости против износа и повышение твердости Для смазки и скольжения Хромовое (непосредственно на деталь или на покрытие медь—никель), никелевое (медь) Хромовое (непосредственно иа деталь или на покрытие из меди и никеля), оловян- ное (медь), а также оловянное, нанесенное методом погружения
покрытия медь — никель — хром. Такое покрытие наносят на детали
фотоаппаратов, на корпуса утюгов, на ручки холодильников и т. п.
В автомобильной промышленности применяют алюминиевые колпаки
для колес с никельхромовыми покрытиями. Алюминиевые изде-
лия бытового применения обычно покрывают хромом, латунью (окон-
ные задвижки, вешалки, дверные ручки, упоры и т. д.). На изделия,
подлежащие пайке, наносят медные, оловянные или никелевые
покрытия. Детали, предназначенные для работы в условиях низких
температур, покрывают медью. Для крепежных деталей используется
цинковое покрытие. Покрытие из сплава свинца с оловом приме-
няется для алюминиевых подшипников и т. д.
Технология нанесения гальванических покрытий на алюминий
и его сплавы отличается некоторой сложностью по сравнению с тех-
нологией нанесения этих покрытий на изделия из черных металлов,
меди или латуни. Эта сложность обусловлена наличием на поверх-
ности алюминия и его сплавов прочной и легко восстанавливающейся
окисной пленки, препятствующей удовлетворительному сцеплению
осаждаемого металла с основанием. Образование на поверхности
алюминиевых сплавов окисных пленок в свою очередь связано
с высоким сродством этого металла к кислороду. Другой важной
причиной, осложняющей технологию нанесения электрохимических
покрытий на алюминий и его сплавы, является высокое отрицатель-
ное значение потенциала алюминия и его стремление к переходу
в ионное состояние. Этот процесс вызывает контактное вытеснение
из растворов электролитов более электроположительных металлов:
цинка, меди, серебра, никеля, олова, хрома и т. д. Контактные
осадки, как правило, не отличаются необходимым сцеплением.
Существенные затруднения в технологию вносит также взаимодей-
ствие алюминия с кислыми и щелочными электролитами, применяе-
мыми для получения обычных гальванических покрытий, а также
наличие на поверхности литых алюминиевых изделий трещин и пор,
в которых задерживаются эти электролиты.
Глава XV/1. Нанесение покрытий на алюминий, магний и цинк
333
Нанесение некоторых видов металлических покрытий на алюми-
ний и его сплавы практически стало возможным только после того,
как удалось разработать способы подготовки поверхности, преду-
сматривающие удаление окисных пленок с поверхности покрываемых
изделий, уменьшить активность ионов осаждаемых металлов, а также
выбрать режимы электролиза, сводящие к минимуму возможность
контактного вытеснения металлов. Хотя оба эти обстоятельства —
особый способ подготовки поверхности и условия электроосаж-
дения, уменьшающие возможность контактного вытеснения, очень
важны для покрытия алюминия и его сплавов, первое из них
является решающим и заслуживает более детального рассмо-
трения.
2. МЕТОДЫ ПОДГОТОВКИ АЛЮМИНИЕВЫХ ИЗДЕЛИЙ ПЕРЕД НАНЕСЕНИЕМ
ГАЛЬВАНИЧЕСКИХ ПОКРЫТИЙ
Различают два основных метода нанесения гальванических покры-
тий на алюминий и его сплавы.
По первому методу окисную пленку удаляют перед нанесением
электролитического покрытия и заменяют тонким слоем контактно
вытесненных тяжелых металлов (контактный метод),
а по второму — толщину пленки увеличивают специальной анодной
обработкой с целью получения высокопористого слоя, что обеспечи-
вает прочность сцепления с нанесенным затем покрытием (метод
анодной обработки). Известное распространение также
получили так называемые термодиффузионные ме-
тоды Вогта и Ора. Сущность этих методов состоит в том, что после
нанесения тонких слоев цинка, латуни и никеля изделия подвергают
термообработке и затем загружают в обычные ванны для осаждения
любого покрытия необходимой толщины. Различие методов Вогта
и Ора, кроме составов и режимов ванн, предназначенных для полу-
чения слоев предварительных покрытии, состоит в том, что первый
применил термообработку только после осаждения подслойного
покрытия, а второй — также и после осаждения основного (послед-
него) покрытия.
Контактный метод
Контактный метод нанесения металлов основан на высокой реак-
ционной способности алюминия, благодаря чему на его поверхности
происходит контактное (химическое) выделение более электроположи-
тельных металлов (Zn, Fe, Ni, Cd, Sn, Ag и др.). На практике
в качестве подслоя для последующего осаждения металлов электро-
лизом может быть использован любой из перечисленных металлов,
ОДнако чаще всего используется цинк, поэтому данный метод известен
также под названием цинкатного (от названия раствора цин-
ката натрия, в котором обрабатываются изделия).
334
Часть третья. Технология нанесения металлических покрытий
Контактное осаждение цинка. Для нанесения контактной пленки
цинка распространен раствор состава:
Едкий натрий NaOH ....................... 400—500 Г/л
Окись цинка ZnO.......................... 50—100 »
Обработка ведется при температуре 20—30° в течение 0,5—1 мин.
Структура полученных осадков зависит от концентрации раствора.
Из разбавленных растворов получают крупнокристаллические
пленки, в то время как осадки из более концентрированных по цинку
растворов имеют мелкокристаллическую структуру и обеспечивают
хорошее сцепление с гальваническим покрытием. Более равномерные
по толщине покрытия цинка получаются при добавлении к приведен-
ному выше составу раствора хлорида железа (1 Г/л} и сегнетовой соли
(10 Г/л). Эти добавки особенно эффективны при обработке алюминие-
вых сплавов, содержащих магний. При обработке дюралюминия (сплав
алюминия с медью) рекомендуется заменить окись цинка в цинкатном
растворе эквивалентным количеством сернокислого цинка. Для неко-
торых случаев обработку алюминиевых сплавов рекомендуется вести
в более разбавленном растворе цинката натрия (до 20 Г/л ZnO
и до 100 Г/л NaOH). Обработка в этом растворе ведется при 25°
в течение не более ЗОсек. Толщина цинковой пленки в 2—5 раз
больше, чем в концентрированных растворах, прочность сцепления
с основой заметно снижается. Часто практикуется двукратная обра-
ботка в цинкатном растворе. Для этого полученную при первой обра-
ботке пленку удаляют травлением изделий в разбавленной азотной
кислоте (1 : 1) и после тщательной промывки вновь обрабатывают
в растворе цинката. Хотя механизм улучшения сцепления пленки
при двукратной обработке не вполне ясен, результаты такой обра-
ботки для ряда сплавов весьма заметны, и она применяется на прак-
тике довольно часто. Поэтому на фиг. 119, где приведена схема обыч-
ной подготовки поверхности алюминиевых сплавов по цинкатному
способу, предусмотрен и этот вид обработки. После нанесения кон-
тактного цинка можно осадить на нем покрытия из других металлов.
Непосредственно на цинк можно наносить медь, цинк, латунь, кад-
мий, серебро и хром.
Контактное осаждение железа. Изделия после электролитического
обезжиривания и промывки в холодной воде подвергают обработке
в подкисленном растворе хлорного железа. Состав этого раствора:
Хлорное железо ....................... .... 20—35 Г/л
Соляная кислота .... . . 15—20 »
Температура раствора 90—95', продолжительность обработки
0,5—2 мин. В результате этой обработки на поверхности деталей
образуется достаточно прочйый контактный слой железа, который
может быть использован как самостоятельнее покрытие, а также
в качестве подслоя для электролитического осаждения железа
(см. ниже).
Глава XVII. Нанесение покрытий на алюминий, магний и цинк
335
Фиг, 119. Схема подготовки поверхности алюминиевых сплавов по цинкатному
способу.
336
Часть третья. Технология нанесения металлических покрытий
Контактное осаждение кадмия. Процесс контактного осаждения
кадмия аналогичен-процессу осаждения цинка. Применяется раствоп
следующего состава:
Сернокислый кадмий ................................ 3,6 Г/л
Плавиковая кислота ................................ 105 »
Гидролизованный клей ................................ 2 »
Температура раствора 25°, продолжительность обработки 5_____
15 сек.
Контактное кадмирование рекомендуется как подслой для нане-
сения толстых слоев меди.
Метод анодной обработки
Наибольшее распространение для анодирования алюминия и его
сплавов перед обработкой в гальванических ваннах получили фос-
фатные электролиты. Лучшие результаты дает анодирование в рас-
творе, содержащем от 250 до 500 Пл фосфорной кислоты при плот-
ности тока 1,3—2 а/дл«2; напряжение на ванне 10—40 в. Продол-
жительность обработки при 18—35° — 10—15 мин.
Толщина и качество пленки зависят от напряжения, температуры
и продолжительности обработки, а также от концентрации кислоты.
Необходимая степень пористости обеспечивается применением кон-
центрированных растворов кислоты и повышенной температуры.
Для улучшения качества оксидных покрытий, полученных из фос-
форнокислых растворов, рекомендуется перемешивание раствора.
На фиг. 120 показана схема технологического процесса гальвани-
ческого покрытия алюминия и его сплавов с предварительным аноди-
рованием в фосфорной кислоте. На полученные таким образом пленки
можно наносить непосредственно медь, кадмий и серебро. Так как
при использовании сильно щелочных электролитов существует опас-
ность растворения анодной пленки до того, как начнет осаждаться
металл, рекомендуется сначала нанести промежуточное покрытие
меди из пирофосфорного раствора.
Для анодирования алюминиевых сплавов перед нанесением галь-
ванических покрытий применяется также 20-процентный раствор
серной кислоты. Анодная обработка ведется при 18—25°, плотность
тока 1 а/дм2. Продолжительность обработки 10 мин. Последующая
обработка анодированных изделий производится в растворе соды
при температуре 50—55° в течение 2—3 мин.
Эта методика применяется при изготовлении биметаллических
(алюминий — медь) форм для офсетной печати. Осаждение меди
на изделиях, анодированных в серной кислоте, производится из обыч-
ных кислых электролитов.
Для анодирования может быть использован 3—5-процентный
раствор щавелевой кислоты. Обработка ведется при плотности
тока 0,5 а/дм2-, продолжительность 10 мин. Напряжение вначале 5 в.
Глава XVII. Нанесение покрытий на алюминий, магний и цинк
337
Механическое
шлифование
и полирование
Обезжиривание
органическими
растворителями
4-
Монтаж
на подвески
4-
Щелочное
обезжиривание
4-
Промывка
в воде
Обезжиривание
органическими
раствор ител ями
4-
Химическое
полирование
4-
Фиг. 120. Схемы технологического процесса гальванического покрытия алюминие-
вых сплавов с предварительным анодированием в фосфорной кислоте.
99
* Вайнер и Дасоян
338
Часть третья. Технология нанесения металлических покрытий
затем оно быстро повышается до 50 в. Полученная таким обра-
зом оксидная пленка обрабатывается в цианистом растворе или
в 1-процентном растворе плавиковой кислоты. Продолжительность
обработки составляет несколько секунд. Для повышения равномер-
ности оксидной пленки изделие после обезжиривания перед оксиди-
рованием рекомендуется обработать в следующих растворах: в рас-
творе едкого натра (50 Г/л) при температуре 65—70° в течение 3—
10 сек.; в растворе карбоната натрия (30 Г/л) или тринатрийфосфата
(30 Г/л) в течение 10 сек. Затем изделия промывают в холодной воде
опускают на 10 сек. в концентрированную азотную кислоту, снова
промывают и переносят в щавелевую ванну для анодирования.
Термодиффузионные методы
Сущность термодиффузионного метода подготовки по способу
Вогта состоит в том, что изделия после нанесения промежуточных
покрытий подвергают перед нанесением последнего слоя покрытия
термической обработке: нагреванию до 230° в течение 30 мин. Указан-
ный способ подготовки применим ко всем алюминиевым сплавам,
за исключением сплавов, содержащих более 3% магния. В качестве
подслоя используют цинк, латунь и никель, а в качестве окончатель-
ного покрытия — хром.
Схема технологического процесса никелирования чайников
и аналогичных изделий под хром по методу Вогта приведена ниже:
1) обезжиривание — 30 сек.
2) промывка — 5 »
3) травление в HF — 5 »
4) промывка — 5 »
5) осветление в HNO3 — 5 »
6) промывка — 5 »
7) покрытие тонкой пленкой цинка — 3- -4 сек.
8) промывка — 5 »
9) покрытие тонкой пленкой латуни — 3— 4 сек.
10) промывка — 5 »
11) нейтрализация в растворе винной кислоты — 5 »
12) никелирование — 20 мин.
13) промывка в холодной воде — 5 сек.
14) промывка в горячей воде — 5 »
15) термообработка
16) удаление окисной пленки.
Другая разновидность термодиффузионного метода была предло-
жена Ором. Она состоит в том, что термической обработке подвер-
гается не только подслойное покрытие, но и покрытие хрома. Терми-
ческая обработка заключается в нагреве изделий до 175—205
в течение 5 мин.
Кроме рассмотренных здесь основных методов подготовки алю-
миниевых сплавов под покрытия, в ряде случаев применяют также
Глава XVII. Нанесение покрытий на алюминий, магний и цинк
339
механический метод подготовки, заключающийся в пескоструйной
обдувке изделий с целью получения шероховатой поверхности.
Недостатком данного метода является то, что он не применим к поли-
рованным изделиям.
з рецептура ванн для нанесения гальванических покрытий
НА АЛЮМИНИЕВЫЕ СПЛАВЫ
Ванны для меднения. Для осаждения промежуточного слоя
меди перед нанесением декоративного никель-хромового покрытия
применяется следующий электролит:
Цианистая медь....................................... 40 Г/л
Цианистый натрий (общий) ............................ 50 »
Свободный цианид...................................... 4 »
Карбонат натрия..................................... 30 »
Сегнетова соль....................................... 60 »
pH ванны..........................................10,2—10,5
Температура электролита 30—35°. Изделия погружаются в ванну
под током. Сначала дают толчок тока (2 а/дм2), затем плотность тока
снижается до 1 а/дм2 и производится электролиз в течение 5—7 мин.
Хорошие результаты дают также пирофосфатные и уксуснокислые
электролиты.
1) Медь.......................................... 30 Г/л
Пирофосфат натрия............................ 210 »
Аммиак......................................... 3 »
pH ванны...................................... 7,5—8,5
Температура 40—60°, осаждение ведется при плотности тока
2—4 а/дм2. Электролит перемешивается воздухом.
2) Уксуснокислая медь Си(СН3СОО)2.................. 20 Г/л
Цианистый калий KCN.............................. 20 »
Углекислый натрий Na2CO3......................... 20 »
В ванну для меднения детали загружаются под током. Осаждение
ведут в течение 3—5 мин. при плотности тока 0,5 а/дм2. Более тол-
стые слои наращиваются из обычных медных кислых электролитов.
Ванны для латунирования. Для нанесения латуни на контакт-
ный слой цинка применяются обычные цианистые электролиты для
латунирования.
Ванны для цинкования. Для цинкования алюминия с уже имею-
щимся контактным слоем цинка могут использоваться как кислые,
так и щелочные электролиты.
Для цинкования алюминиевых сплавов с большим содержанием
кремния применяется ванна состава:
Окись цинка....................................... 42—45 Пл
Цианистый натрий.................................. 78—85 »
Едкий натр........................................ 35—70 »
Сернокислый натрий................................0,5—5 »
Глицерин............................................ 3,5 мл/л
22*
340 Часть третья. Технология нанесения металлических покрытий
Режим работы: температура 18—20°, плотность тока
2,0—2,5 а/дм2, продолжительность осаждения 10—12 мин.
Изделия перед нанесением контактного слоя цинка тщательно
обезжиривают в бензине и просушивают сжатым воздухом. Сухие
детали травят в 10-процентном растворе щелочи в течение 10—15 сек.
при комнатной температуре и осветляют в крепкой азотной кислоте
с добавкой 1—2-процентной плавиковой кислоты.
После цинкатной обработки изделия завешивают в гальвани-
ческую ванну под током. Нужно следить за тем, чтобы изделия
не экранировали друг друга. Оцинкованные изделия подвергают
осветлению в 1—3-процентном растворе азотной кислоты в течение
1—3 сек. и пассивируют в растворе бихромата натрия (200 Пл),
подкисленном серной кислотой (15—20 Г/л). Температура ванны
для пассивирования 18—20°, продолжительность обработки 15 сек.
Изделия быстро и тщательно промывают в проточной холодной
воде, обдувают сжатым воздухом и высушивают на воздухе. Покры-
тия, полученные по данной технологии, отличаются хорошим внеш-
ним видом и высокими антикоррозионными свойствами.
М. А. Шлугер и А. И. Липин, изучавшие условия получения
покрытий на алюминиевом сплаве марки АК4, рекомендуют следую-
щий состав электролита для цинкования:
Фторборат цинка Zn(BF4)2 .............. 180—250 Г/л
Фторборат аммония NH4BF4 .... 25—30 »
Солодковый корень ....................... 1—1,5 »
pH ванны................ ... 3,3—3,9
Перед погружением в ванну изделия обрабатывают в 10-про-
центном растворе щелочи при 60—80° в течение 10—15 сек., затем
осветляют в смеси серной (240 Г/л) и азотной (210 Пл) кислот в тече-
ние 5—7 сек. Загрузка изделий в ванну для цинкования произ-
водится без тока. После выдержки в электролите в течение 45—60 сек.
изделия подвергают кратковременной (до 10 сек.) анодной поляри-
зации при плотности тока 5—7 а/дм?. Затем направление тока
меняется на обратное и производится цинкование при той же плот-
ности тока. Наносится слой цинка 5—7 мк.
Авторы установили, что при погружении алюминиевых изделий
в электролит для цинкования указанного выше состава на 20 сек.
при температуре 18—20° и на 10 сек. при температуре 38—40° цинк
не осаждается на изделиях, а идет в основном процесс стравлива-
ния окисной пленки с поверхности алюминиевых изделий. Только
после стравливания пленки начинается процесс осаждения контакт-
ного цинка. Далее было установлено, что осаждение контактного
цинка практически прекращается по истечении 3 мин. при темпе-
ратуре 18—25° и 1 мин. при температуре 38—40°. Непосредственно
перед электролитическим осаждением цинка контактный слой цинка
лучше удалить. Это достигается кратковременной анодной поляриза-
Глава XVII. Нанесение покрытий на алюминий, магний и цинк
341
цией- Правда, одновременно на поверхности алюминия образуется
тонкая окисная пленка, но она, по-видимому, не в состоянии пре-
пятствовать катодному отложению цинка, которое ведется при высо-
кой плотности тока.
При использовании цинкового покрытия в качестве подслоя
для хромирования изделия далее меднят в цианистом электролите
и в кислом электролите, полируют на войлочных кругах с пастой
ГОИ и хромируют в обычном электролите при плотности тока
45—50 а/дм2 и температуре 55—57°. Погружение изделий в ванну
хромирования производится под током.
Ванны для кадмирования. Для получения хороших кадмиевых
покрытий на алюминиевых сплавах последние предварительно обра-
батываются без тока в разбавленном растворе состава: окись кадмия
7,5 Пл и цианистый натрий 60 Пл в течение 1 мин. при комнатной
температуре, а затем переносятся в основной раствор (окись -кадмия
26 Пл, цианистый натрий 100 Г/л), где кадмируются при плотности
тока 1,5—4,0 а/дм?.
Ванны для серебрения. Покрытие наносят путем обработки
в ваннах, состав которых указан в табл. 114.
Таблица 114
Состав и режим работы ванн для серебрения
Наименование компонентов и режим работы Содержание в Г/л в растворах
«№ 1 № 2 № 3
первый элек- тролит пред- варительного серебрения второй элек- тролит пред- варительного серебрения электролит серебрения
Цианистое серебро Цианистый натрий общий Цианистый калий » Карбонат калия Свободный цианид Режим Плотность тока в а/дм2 Температура в °C Продолжительность осаждения в мин. 1 90 работы 1,5—2,5 25 10 5,3 67,5 1,5—2,5 25 10 30 55,5 45 40—42 0,5 25 В зависимости от требуемой толщины осадка
Ванны для никелирования. Никель наносится обычно на слой
меди, полученный в одной из указанных выше ванн. Перед никели-
342
Часть третья. Технология нанесения металлических покрытий
рованием омедненную поверхность полируют. Для никелирования
может быть использована ванна:
Сернокислый никель................................... 140 Пл
> натрий......................................... 70 »
Борная кислота ....................................... 30 »
Поваренная соль................................... 2—3 »
Температура электролита 18—25°, плотность тока 0,8—1,0 а/дм?.
Недоброкачественные никелевые покрытия на алюминиевых спла-
вах резко снижают антикоррозионные свойства покрытия. Поэтому
необходимо следить за тем, чтобы слой никеля на изделиях был
по возможности сплошным.
В последнее время значительное распространение получило хими-
ческое никелирование алюминиевых деталей, которое производится
в ванне следующего состава:
Хлористый никель ... . . .30 Пл
Гипофосфит натрия . ................................ 7,5 »
Цитрат натрия.................................... 16 »
Хлористый аммоний.................................... 50 »
Гидроокись аммония (25-процентный раствор)........... 13 мл!л
pH ванны......................................... 9—10
Температура электролита 80—90°. В течение первых 30 мин.
осаждается слой 5 мк, в дальнейшем скорость осаждения падает.
Обычно покрытия имеют толщину 12 мк. Зажимные приспособления
и корзины для загрузки изделий изготовляют из углеродистой стали.
Основным преимуществом химического никелирования является
высокая рассеивающая способность раствора.
Перед химическим никелированием изделия протравливают
в смеси хромовой и серной или азотной и плавиковой кислот. Нике-
лированные детали для повышения твердости покрытия нагревают
до 230° в течение 20 мин. Химическое никелирование нашло некоторое
применение в авиационной промышленности США. Однако широкому
распространению этого способа препятствует дороговизна элек-
тролита.
На никель, полученный из ванн химического никелирования,
хром не отлагается из-за содержания в покрытии до 7% фосфора.
Хромирование алюминия и его сплавов. Хром наносится намедно-
никелевый подслой. Покрытия получаются из обычных электроли-
тов, предложенных для твердого или блестящего хромирования.
Изделия из алюминиево-магниевых сплавов могут хромироваться
непосредственно, без осаждения промежуточных покрытий. После
щелочного обезжиривания и промывки в воде их травят в 5-про-
центном растворе плавиковой кислоты, в смеси HNO3 : HF (3:1)
и смеси HNO3 : H2SO4 (1 : 1), промывают и хромируют в электро-
лите обычного состава.
Глава XVII. Нанесение покрытий на алюминий, магний и цинк
343
Б. ПОКРЫТИЯ НА МАГНИЕВЫХ СПЛАВАХ
Сочетание ряда ценных свойств (низкий удельный вес, высокая
удельная прочность, отличная обрабатываемость, незначительное
изменение механических свойств с понижением температуры) обес-
печивает магниевым сплавам значительное распространение в совре-
менной технике. Прессованием из них изготовляют прутки, трубы
и изделия более сложной конфигурации с большей точностью раз-
меров; методом литья под давлением изготовляются изделия сложной
формы с минимальными припусками на обработку. Однако более
широкому использованию магниевых сплавов препятствует недоста-
точная коррозионная стойкость их в атмосферных условиях и в рас-
творах электролитов’.
Для повышения коррозионной стойкости магниевые сплавы
оксидируют химическими или электрохимическими методами (см.
гл. XIX) и покрывают дополнительно лако-красочными защитными
покрытиями и смазками. Для защиты магниевых сплавов от износа,
в защитно-декоративных целях и, наконец, для облегчения процесса
пайки на них наносят различные гальванические покрытия.
Как и для алюминия, нанесение гальванических покрытий
на магний и его сплавы осложнено наличием на поверхности окис-
ной пленки и способностью магния контактно вытеснять из раство-
ров все применяемые в гальваностегии металлы.
В связи с этим основное внимание при нанесении гальванических
покрытий уделяется процессу подготовки изделий перед погружением
их в гальванические ванны. Сущность подготовки магниевых спла-
вов перед покрытием сводится к удалению окисной пленки и нане-
сению сначала тонкого промежуточного подслоя цинка методом
погружения изделий в раствор пирофосфата цинка, а затем прочно
сцепленного медного слоя достаточной толщины из цианистого элек-
тролита. Дальнейшее гальваническое покрытие магниевых сплавов
различными металлами производится в обычных электролитах и мало
отличается от покрытий черных металлов.
В. И. Лайнер, детально исследовавший процессы подготовки
и гальванического покрытия магниевых сплавов, рекомендует сле-
дующий порядок работы:
1) обезжиривание органическими растворителями;
2) электролитическое обезжиривание в растворе, содержащем
25 Г/л Na2CO3 и 15 Пл NaOH, при комнатной температуре и плот-
ности тока 10 а/дм2\
3) промывка в теплой и холодной воде;
4) травление в растворе 180 Пл СгО3, 30 Пл NaNO3, 2,5 Пл CaF2-
Температура комнатная; продолжительность 1—2 мин. Литейные
сплавы лучше травить в 85-процентном растворе фосфорной кислоты
при комнатной температуре в течение 1—2 мин.;
5) промывка в холодной воде;
344
Часть третья. Технология нанесения металлических покрытий
6) активирование поверхности в растворе, содержащем 250 мл! л
85-процентной Н3РО4 и 100 Пл KHF2. Температура 18—25°, про-
должительность 2 мин.;
7) промывка в холодной воде;
8) контактное осаждение цинка из раствора45Пл ZnSO4-7H2O;
210 Пл Na4P2Q7; 7 Пл KF-2H2O и 5 Пл Na2CO3. Температура 85—90°;
время выдержки 7—9 мин.;
9) промывка в холодной воде;
10) меднение в цианистом электролите следующего состава:
41 Пл CuCN; 51 Пл NaCN (общ.); 5,6 Пл NaCN (своб.); 30 Пл Na2CO3;
45 Пл KNaC4H4Oe-4H2O; pH = 12,2 — 12,8. Температура ванны
65—70°.
Изделия завешиваются в ванну под током. Плотность тока в тече-
ние первых 30 сек. составляет около 4 а/дм2. Дальнейшее осаждение
меди до получения слоя заданной толщины производится при плот-
ности тока 1—2 а1дмг. При нанесении толстых медных слоев можно
комбинировать меднение в цианистых и кислых электролитах.
Осаждение других металлов (никелирование, серебрение, золоче-
ние, хромирование и т. п.) после нанесения медного слоя осуще-
ствляется, как уже указывалось, из обычных электролитов при
общепринятом режиме.
В. ПОКРЫТИЯ НА цинковых СПЛАВАХ
Цинковые сплавы находят довольно широкое применение в авто-
тракторной промышленности, где получил распространение метод
литья под давлением. Многие изделия из цинковых сплавов под-
вергают декоративному хромированию с подслоем меди и никеля,
но встречаются и другие виды покрытий.
Трудности, возникающие при нанесении гальванических покры-
тий на цинк и цинковые сплавы, обусловлены электроотрицатель-
ным потенциалом этих материалов и большой химической актив-
ностью их как в кислых, так и в щелочных электролитах. Большие
затруднения вызывает также пористость литых изделий из цинковых
сплавов, так как в поры во время электролиза попадают различные
растворы, которые в дальнейшем, реагируя с цинком, могут вызвать
отслаивание и разрушение покрытий.
Промежуточные слои меди на изделия из цинковых сплавов
наносятся из цианистых электролитов. Очень важно при этом полу-
чить беспористые сплошные покрытия, которые надежно изолиро-
вали бы основу от действия агрессивных растворов. Омедненные
изделия без полирования подвергаются никелированию и хромиро-
ванию в электролитах обычного состава.
Непосредственное никелирование цинковых изделий без под-
слоя в обычных электролитах затруднено, так как никель контактно
вытесняется цинком. В связи с этим были предложены специальные
электролиты; некоторые из них приведены в табл. 115.
Глава XVII. Нанесение покрытий на алюминий, магний и цинк
345
Схема технологического процесса нанесения многослойного (медь —
никель — хром) покрытия на детали из цинкового сплава (принятая
в автомобильной промышленности) выглядит следующим образом:
1) шлифование;
2) полирование;
3) протирка ветошью;
Таблица 115
Электролиты для никелирования изделий из цинковых сплавов
Наименование компонентов Содержание в Г/л в растворах
№ 1 Ns 2 № 3 № 4
Сернокислый никель NiSO4-7H2O 110 75 75 ПО
» натрий Na2SO4-10H2O 220 100 100 120
Хлористый аммоний ЫН4С1 22 18 20 18
Борная кислота Н3ВО3 22 18 15 15
pH ванны 5,6—6,0 6,0—6,2 5,8—6,2 4,9—5,4
Режим р а б о т ы
Температура в °C 30 20 20 25—30
Плотность тока, а!дм? 1,5 1,3—2,7 1.2 2,4—3,0
4) обезжиривание, производимое в растворе, содержащем
50—60 Пл фосфорнокислого натрия, 25—30 Пл кальцинированной
соды, 3—5 Пл калийного мыла. Обезжиривание ведется при тем-
пературе 70—75° в течение 3—5 мин.;
5) промывка в горячей воде;
6) анодная обработка в растворе пирофосфорнокислого натрия
(50—70 Пл) при температуре 45—50° и анодной плотности тока
3—5 а/дм2. Продолжительность процесса 1 мин.;
7) меднение в цианистой ванне:
Медь цианистая..................... ................. 25—28 Г/л
Натрий цианистый (общий)........... . 38—40 »
» » (свободный) .... . . . 3—5 »
Сода кальцинированная ............................... 20 »
Сегнетова соль....................................... 40 »
Режим работы: плотность тока 5—7 а/дмг, температура 35—40°,
продолжительность 1 мин.
В случае необходимости получения более толстых слоев меди (6—8 мк}
используется ванна другого состава:
Медь цианистая..................................... 50—55 Г/л
Натрий цианистый (общий)........................... 75—80 »
» » (свободный)........................... 3—5 »
Сода кальцинированная...............................18—20 »
346
Часть третья. Технология нанесения металлических покрытий
Режим работы: плотность тока 3—4- а/дм2, температура 55____________60*
Осаждение ведется реверсированным током (Тк/Та = 20 : 1);
8) промывка;
9) никелирование, производимое в ванне состава:
Сернокислый никель ... ............... 200—250 Г/л
» натрий . . ............... 70 »
Борная кислота................. . . . 30 »
Хлористый натрий............... 10—15 »
Дисульфонафталиновая кислота............... 2—4 »
pH электролита............................. 5,8—6,0
Режим работы: температура электролита 35—40°, плотность тока 1—
1,5 d/дм2. Продолжительность никелирования для получения 25—30 мк—75—
90 мин.;
10) промывка;
11) сушка;
12) глянцовка;
13) обезжиривание после глянцовки;
14) промывка в горячей воде;
15) промывка в холодной воде;
16) хромирование в ванне обычного состава;
17) промывка в горячей воде;
18) сушка;
19) глянцовка.
ГЛАВА XVIII
ГАЛЬВАНИЧЕСКОЕ ПОКРЫТИЕ СПЛАВАМИ
1. СПЛАВЫ, ПОЛУЧАЕМЫЕ ЭЛЕКТРОЛИЗОМ,
И ИХ НАЗНАЧЕНИЕ
Получение сплавов гальваническим путем известно давно. Так,
например, латунирование, т. е. осаждение сплава меди с цинком,
было известно еще в 1841 г. Однако систематическим изучением
общих закономерностей электролитического осаждения сплавов
стали заниматься относительно недавно. Практическое значение
этих работ состоит в том, что они расширяют ассортимент гальвани-
ческих покрытий; в ряде случаев покрытия из сплавов обладают
ценными свойствами, отсутствующими у металлов, из которых
состоит данный сплав.
В настоящее время электролизом в довольно широких масштабах
получают несколько десятков технически важных сплавов; боль-
шинство этих сплавов являются двухкомпонентными,
т. е. состоят из двух металлов.
Указанные сплавы в зависимости от их назначения делятся на
следующие группы:
а) Сплавы, применяемые для защиты основ-
ного металла от коррозии. К данной группе относятся
сплавы цинка с кадмием и оловом, коррозионная стойкость которых
выше, чем у обычных цинковых покрытий. Сюда относится также
сплав свинца с оловом.
б) Защитно-декоративные сплавы. К этой
группе принадлежат блестящие никелевые покрытия (сплавы никеля
с кобальтом, кадмием и цинком), сплавы золота с медью, никелем
и серебром, сплав меди с оловом (белая бронза) и т. д.
в) Сплавы, заменяющие дорогостоящие
металл ы. К этой группе относятся сплавы золото—медь,
обладающие повышенной твердостью и износоустойчивостью и позво-
ляющие экономить до 30—40% золота; сплавы свинец—олово,
заменяющие более дорогие оловянные покрытия; к этой же группе
принадлежат сплавы медь—никель, иногда заменяющие более
Дорогие покрытия из чистого никеля.
348
Часть третья. Технология нанесения металлических покрытий
г) Антифрикционные сплавы. К этой группе отно-
сятся сплавы свинца с серебром, индием, оловом, цинком, медью
и сурьмой. Эти сплавы обладают низким коэффициентом трения
в движущихся узлах машин, хорошей прирабатываемостью и высо-
кой стойкостью в смазочных маслах.
д) Сплавы, улучшающие сцепление стали
с резиной при горячем прессовании. Лучшим
сплавом для этой цели является сплав меди с цинком, в котором
содержание цинка составляет 25—30%.
е) Жаропрочные сплавы. К этой группе принадле-
жат сплавы хрома с марганцем, молибденом и вольфрамом, сплавы
вольфрама с железом, никеля с кобальтом, сплавы молибдена с ни-
келем; сплавы железа с титаном и т. д.
ж) Сплавы, обладающие магнитными свой-
ствами. К числу таких сплавов прежде всего относятся сплавы
системы никель — кобальт.
Эти сплавы применяются в качестве магнитожестких покрытий,
обладающих высокой коэрцитивной силой. Они используются для
записи звука или импульсов в запоминающих устройствах вычисли-
тельных машин.
Гальваническое покрытие сплавами сопряжено с рядом специ-
фических трудностей. Так, например, требуется более точная регу-
лировка таких параметров технологического процесса, как плот-
ность тока на электродах, концентрация ионов осаждающихся
металлов и т. д.
В ряде случаев осаждение сплавов производится гальвано-
термическим путем.
Сущность этого метода состоит в чередующемся нанесении тон-
ких слоев каждого из металлов и последующей термической обра-
ботке изделий, во время которой металлы взаимно диффундируют,
образуя сплав переменного состава. Данный метод менее распростра-
нен, чем гальванический.
2. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ЭЛЕКТРОЛИТИЧЕСКОГО МЕТОДА
ПОЛУЧЕНИЯ СПЛАВОВ
Для совместного выделения двух металлов на катоде при эле к
тролизе необходимо, чтобы значения их разрядных потенциалов
были достаточно близки.
Разрядный потенциал <р каждого из металлов определяется зна-
чением его стандартного потенциала <р°, концентрацией с (точнее,
активностью) его ионов в растворе и величиной перенапряжения Л
Ф = <р° + 1пс — Т]. (^2)
Глава XVIII. Гальваническое покрытие сплавами
349
Таким образом, для совместного осаждения двух металлов необ-
ходимо более или менее точное соблюдение равенства
<₽1 + -^-1пс1 —+-^г1ПС2 — Т]2, (63)
где индексы 1 и 2 обозначают первый и второй металлы.
Рассмотрим несколько частных случаев.
1. Стандартные потенциалы двух металлов близки друг к другу,
осаждение металлов происходит без существенной поляризации
<р; ~ <р°; ni ~ 0; т]2 ~0.
Примером могут служить свинец и олово, стандартные потен-
циалы которых соответственно равны —0,13 в и —0,14 в. Эти металлы
могут совместно осаждаться из растворов простых солей, напри-
мер, из растворов хлоридов или фторборатов. В зависимости от
соотношения концентраций ионов обоих металлов в растворе катод-
ный осадок может содержать либо больше свинца, либо больше
олова.
2. Стандартные потенциалы металлов достаточно близки друг
к другу, но разряд ионов металла М L с более электроотрицательным
потенциалом сопровождается большей поляризацией, чем разряд
ионов металла М2 с менее электроотрицательным потенциалом
Ф1 ~ <₽2> ’ll > '•12-
Образование сплавов в данном случае затруднено, в чем можно
убедиться, изобразив на графике ход поляризационных кривых.
3. Стандартные потенциалы металлов и Л12 заметно разли-
чаются, но поляризация металла /Иг с более электроотрицательным
потенциалом меньше, чем поляризация металла М2 с менее электро-
отрицательным потенциалом
<Р, + q£; < П2-
Совместное осаждение металлов в данном случае облегчается
по мере повышения плотности тока, с увеличением которой воз-
растает и содержание более электроотрицательного металла в сплаве.
Следует, однако, иметь в виду, что применение высоких плотностей
тока, приближающихся к значению предельного тока или превы-
шающих его, может неблагоприятно сказаться на качестве покрытия,
особенно если осаждение сплава производится на сильно профи-
лированных изделиях. Можно использовать другой путь, а именно:
сблизить потенциалы осаждения металлов и М2, соответствую-
щим образом изменяя концентрацию (активность) ионов этих метал-
лов в электролите.
Из уравнения (63) видно, что для смещения потенциалов разряда
Двухвалентных ионов на 0,029 в при прочих равных условиях необ-
350
Часть третья. Технология нанесения металлических покрытий
ходимо десятикратное изменение концентрации этих ионов в растворе
Чтобы сместить потенциал разряда на 0,058 в, нужно изменить
концентрацию ионов в 100 раз, и т. д. Поэтому сближение потенциа-
лов выделения двух металлов, стандартные потенциалы которых
сильно различаются, потребовало бы такого колоссального различия
концентраций ионов этих металлов в растворе, которое при работе
с простыми солями практически неосуществимо.
Поясним сказанное на конкретном примере. Пусть требуется
осадить сплав серебра со свинцом, стандартные потенциалы которых
ФрЬ = —0,13 в и фдв = 0,79 в. Как показывает подсчет, для сближе-
ния потенциалов выделения этих металлов концентрация ионов
свинца в растворе должна в десятки и сотни миллиардов раз пре-
вышать концентрацию ионов серебра. Создание столь громадной
разницы концентрации за счет повышения содержания свинца
в электролите невозможно вследствие ограниченной растворимости
солей. Создание же требуемой разницы концентрации путем умень-
шения концентрации ионов более положительного металла —
серебра — хотя и возможно, но не представляет практического
интереса, так как при этом для осаждения серебра совместно со свин-
цом плотность тока должна быть ограничена величиной порядка
10-18а/д;и2. При обычных же плотностях тока (порядка 0,1—0,2 а/дм2)
содержание серебра в осадках будет ничтожным.
4. Во многих случаях, когда совместное осаждение металлов
из растворов их простых солей неосуществимо, получение сплавов
возможно, если применяются комплексные электролиты.
Величина катодной поляризации при осаждении металлов
из растворов комплексных соединений, как правило, значительно
превышает поляризацию при осаждении их из растворов простых
солей. Разница тем больше, чем прочнее комплекс (количественно
прочность комплекса выражается константой его нестойкости).
Для получения сплава нужно, чтобы различие стандартных потен-
циалов осаждаемых металлов компенсировалось разницей в проч-
ности их комплексов, т. е. чтобы более благородный в данной паре
металл давал с выбранным комплексообразователем более прочное
соединение.
На практике этим условиям отвечает ряд цианистых комплексов.
Приведем следующий пример. Из растворов сульфатов осаждение
меди идет при потенциале около +0,28 в, а ионы цинка разряжаются
при потенциале около —0,85 в. Поэтому сплав из смешанного элек-
тролита получить нельзя. Однако из цианистых электролитов оса-
ждение и того и другого металла идет при потенциале, близком
к —1,3 в. Поэтому из цианистых ванн, содержащих соли меди
и цинка, с успехом могут быть получены покрытия латунью. Циа-
нистые ванны для латунирования применяются на практике и будут
описаны ниже.
Глава XVI/1. Гальваническое покрытие сплавами
351
Из растворов комплексных солей (тоже цианистых) получают
сплавы серебра с золотом, золота с медью и ряд других.
5. Существует еще один путь сближения разрядных потенциалов
металлов, не осаждаемых из обычных электролитов в виде сплавов.
Этот путь заключается в подборе таких поверхностноактивных
добавок, которые сильно тормозят разряд более благородного в дан-
ной паре металла, но совсем не оказывают действия (или оказывают
значительно меньшее действие) на осаждение менее благородного
металла.
Примером может служить система Си(С1О4)2—РЬ(С1О4)2. Раз-
ница потенциалов осаждения меди и свинца из перхлоратного элек-
тролита составляет около 0,45 в, и катодный осадок содержит только
медь. Добавка в раствор тиомочевины CS(NH2)2 сдвигает поляри-
зационную кривую для меди более чем на 0,5 в, почти совершенно
не влияя на потенциал разряда ионов свинца. В результате начи-
, нается образование сплава.
М. А. Лошкаревым было показано, что причина избирательного
действия многих добавок заключается в различной проницаемости
образующегося на поверхности катода адсорбционного слоя для
ионов разных металлов.
Структура сплавов, полученных электролитическим путем
Большое значение для технологических свойств электролитиче-
ских сплавов имеют особенности их структуры. Так же, как при
кристаллизации из расплавов, при электрокристаллизации может
иметь место раздельная кристаллизация компонентов или образо-
вание твердых растворов, в которых кристаллическая решетка
построена из атомов обоих металлов. При этом состав фаз может
значительно отличаться от равновесных. Например, свинец практи-
чески нерастворим в меди, а в сплавах, полученных гальваническим
путем, до 12% свинца может входить в состав смешанных кристаллов.
С другой стороны, при совместном осаждении золота и меди оба
металла кристаллизуются независимо друг от друга, хотя из расплава
образуются твердые растворы.
Для перевода таких сплавов в равновесное состояние требуется
отжиг. Так, электролитический сплав золота с медью, тускнеющий
на воздухе из-за окисления меди, образующей в нем самостоятель-
ную фазу, в результате термообработки приобретает структуру
твердого раствора и перестает окисляться на воздухе.
Судить о структуре того или иного образующегося на катоде
сплава можно не только на основании рентгенографического анализа
или данных металлографических исследований, но и на основании
поляризационных измерений. Дело в том, что образование твердых
растворов оказывает деполяризующее действие на осаждение метал-
лов, т. е. потенциал выделения каждого из металлов в отдельности
352
Часть третья. Технология нанесения металлических покрытий
отрицательнее, чем потенциал, при котором идет образование сплава
(при образовании твердого раствора потенциальная энергия его
компонентов уменьшается). Эта разница может быть настолько
большой, что на катоде разряжаются ионы металлов, осаждение
которых в чистом виде вообще невозможно из водных растворов
Примером может служить электролитическое получение сплавов
вольфрама с никелем, железом и другими металлами, в то время
как чисто вольфрамовые покрытия получить не удается. Осаждение
сплавов Си—Zn, Аи—Ag, Си— Sn, Fe—Ст и многих других происхо-
дит в виде твердых растворов. В тех случаях, когда кристаллизация
осаждаемых на катоде металлов происходит раздельно, осаждение
сплава начинается только после достижения потенциала выделения
более благородного металла. Так происходит осаждение сплавов
Си—Au, Cd—Ag и некоторых других.
В заключение следует отметить, что электролитическое осаждение
сплавов — сложный процесс, зачастую связанный с рядом затруд-
нений: состав сплава в большинстве случаев весьма чувствителен
к концентрации компонентов электролита, плотности тока, темпера-
туре и другим условиям электролиза. На различных участках поверх-
ности изделия могут осаждаться сплавы разного состава. Анодный
выход по току далеко не всегда соответствует катодному, поэтому
электролиты требуют тщательного контроля и частой корректи-
ровки. Тем не менее, ценные свойства многих сплавов делают рацио-
нальным использование электролитического способа для их получе-
ния.
Кроме уже рассмотренных факторов (значения стандартных потен-
циалов, катодная поляризация, относительная концентрация ионов),
важное значение для осаждения сплавов имеет также режим электро-
лиза: плотность тока, температура, перемешивание и т. д. Повышение
плотности тока и понижение температуры обычно приводят к увели-
чению содержания в сплаве металла с более электроотрицательным
потенциалом. Такая зависимость наблюдается в тех случаях, когда
поляризационные кривые для отдельных металлов расположены
параллельно друг другу, например, при латунировании. Переме-
шивание электролита способствует преимущественному выделению
более электроположительного металла.
3. ЛАТУНИРОВАНИЕ
Общие сведения
В технике медноцинковые сплавы подразделяются на томпак
(80—90% Си), желтую латунь (66—72% Си), зеленую медь (55% Си)
и серую латунь (32% Си). Электролизом могут быть получены
сплавы, содержащие медь и цинк в различном соотношении, что
определяется составом ванны и плотностью тока. Обычно получают
Глава XVIII. Гальваническое покрытие сплавами
353
латунь с содержанием 60—80% Си. Удельный вес латуни около
8,5 Псы3. Латунь легко растворяется в азотной, несколько труднее
в серной и плохо в соляной кислоте. В щелочах латунь довольно
стойка. На воздухе она быстро темнеет.
Латунные покрытия отличаются прочным сцеплением с различ-
ными металлами и легко полируются, вследствие чего они приме-
няются в качестве подслоя перед никелированием, лужением, сере-
брением и т. п.
Латунные осадки часто наносят с целью последующей химической
окраски. Латунирование находит также применение в качестве под-
готовительной операции перед гуммированием, так как латунь
отличается хорошим сцеплением с каучуком. Толщина латунных
покрытий обычно не превышает 3—5 мк.
Электролиты для латунирования и режим работы
Латунирование производится в цианистых электролитах. Предла-
гались и нецианистые электролиты, как, например, щавелевокислые,
роданистые, тиосульфатные, пирофосфатные и др., однако ни один
из них не нашел промышленного применения. По-видимому, они могут
иметь лишь ограниченное применение для покрытия неответственных
изделий.
Составы цианистых электролитов для латунирования, нашедших
наиболее широкое применение, и режим работы ванн приведены
в табл. 116.
Таблица 116
Состав электролита и режим работы ванн для латунирования
Наименование компонентов Содержание в Г/л в растворах
№ 1 № 2 №3
Цианистая медь CuCN 20 20 75—105
Окись цинка ZnO 7,5 5 3—9
Цианистый натрий (общий) NaCN — — 90—135
Цианистый натрий (свободный) NaCN 10,0 8—10 4—19
Натрий сернокислый Na2SO4-7H2O 10,0 — —
Аммиак (25-процентный раствор) nh4oh 0,25 0,25 —
Едкий натр NaOH — — 45—75
Режим работы
Температура в °C 30—40 25—30 79—95
Плотность тока в а/дм2 0,3—0,5 0,2—0,4 2,5—5,5
23
Вайнер н Дасоян
354
Часть третья. Технология нанесения металлических покрытий
Данные по продолжительности осаждения слоя латуни (60%
Си+ 40% Zn) при выходе потоку, равном 60%, приведены в табл. 117.
Таблица 117
Продолжительность осаждения латунных покрытий
в мин.
Толщина слоя в мк Плотность тока в а/дм* Толщина слоя в мк Плотность тока в а/дм*
0,2 0.3 0,5 0.75 0,2 о,3 0,5 0,75
1 21 14 8 6 7 147 98 ' 56 39
2 42 28 16 11 8 168 112 64 44
3 63 42 24 17 9 189 126 72 51
4 84 56 32 22 10 210 140 80 56
5 105 70 40 28 50 1050 700 400 280
6 126 84 48 33
Электролит № 1 — общего назначения; электролит № 2 приме-
няется для получения подслоя латуни под гуммирование; электро-
лит № 3 используется в конвейерной установке для латунирования
стальной ленты (скоростное латунирование); pH электролитов
№ 1—3 колеблется в пределах 10,5—11,5.
Свежеприготовленный электролит рекомендуется прорабатывать
постоянным током или же применять его в смеси со старым электро-
литом, беря последний в количестве 5—10% (по объему).
Наличие аммиака в составе электролитов для латунирования улуч-
шает внешний вид покрытия, способствует постоянству состава элек-
тролита и некоторому повышению суммарного выхода по току.
При латунировании применяют аноды такого же состава, какой
желательно получить в осажденном слое. Поверхность анодов
должна в 2—3 раза превышать катодную поверхность. Применяемые
при латунировании аноды должны содержать 75 ± 2% меди, 25 ±
±2% цинка; примеси никеля, мышьяка, олова, сурьмы и свинца
не могут превышать 0,005% (каждого в отдельности), а примесь
железа — 0,01 %.
Применять отдельные медные и цинковые аноды не рекомен-
дуется, так как при этом чрезвычайно усложняется регулирование
состава электролита.
Если латунирование производится при плотности тока ниже
0,5 а1дмй, возможно применение литых анодов; при более высокой
плотности тока используют катаные аноды, которые необходимо
подвергнуть отжигу, травлению в слабой азотной кислоте (5-про-
центной), промывке и крацеванию стальными щетками.
Неполадки, встречающиеся при латунировании, и способы их
устранения приводятся в табл. 118.
Глава XVII/. Гальваническое покрытие сплавами
355
Таблица '118
Неполадки в работе электролитов для латунирования
Признаки неполадок Причины возникновения Способы устранения
Катодный осадок ненормально крас- ного цвета (преиму- щественное осажде- ние меди) Катодный осадок ненормально белого цвета (преимуще- ственное осаждение цинка) Ненормальный цвет латуни на . отдельных деталях Повышенное на- пряжение на ванне Вздутие и отслаи- вание осадка латуни Уменьшение выхо- да по току. Бурное газовыделение на катодах, осадок не- нормально бледного цвета Низкая катодная плот- ность тока. Повышенная температура электролита. Пониженное содержание свободного цианида. Повы- шенное содержание меди в электролите Высокая катодная плот- ность тока. Низкая тем- пература электролита. Повышенное содержание цианида или цинка в элек- тролите Плохие контакты. Не- правильное расположение деталей в ванне Высокая анодная плот- ность тока. Образование на анодах плотной, нера- створимой пленки и прекра- щение растворения анодов. Недостаток цианидов Большой избыток сво- бодного цианида. Высокая плотность тока. Плохая подготовка изделий Большой избыток сво- бодного цианида. Низкая концентрация солей меди и цинка в электролите. Высокая плотность тока. Низкая температура элек- тролита Откорректировать состав электролита. Повысить со- держание цинка в электро- лите. Отрегулировать режим Добавить аммиак Откорректировать состав электролита. Отрегулиро- вать режим электролиза. Повысить содержание меди в электролите Проверить расположение деталей в ванне. Проверить и зачистить контакты Увеличить поверхность анодов. Почистить аноды щетками в 5-процентном растворе цианистого нат- рия. Добавить цианистой соли Откорректировать состав электролита. Уменьшить плотность тока. Улучшить качество подготовки Понизить плотность тока. Повысить температуру элек- тролита. Откорректировать состав электролита
4. ПОКРЫТИЕ СПЛАВОМ МЕДЬ—ОЛОВО (БРОНЗИРОВАНИЕ)
Для бронзирования применяются станнатно-цианистые электро-
литы, в которых олово находится в виде станната, а медь — в виде
комплексной цианистой соли. Химический состав и внешний вид
бронзовых осадков может меняться в широких пределах. При содер-
жании в осадках 2—3% олова они по внешнему виду не отличаются
23*
356
Часть третья. Технология нанесения металлических покрытий
от меди; при содержании 15—20% олова осадки становятся золо-
тисто-желтыми, а при содержании свыше 35% покрытия становятся
серебристо-белыми.
Бронзовые осадки отличаются малой пористостью, и поэтому
они могут найти применение в качестве подслоя вместо никелиро-
вания перед хромированием. Покрытия с небольшим содержанием
олова применяются для защиты отдельных участков деталей при азо-
тировании. Покрытия с высоким (около 45%) содержанием олова, так
называемая белая бронза, в последнее время получили довольно
широкое распространение. Покрытия эти цветом напоминают серебро,
отличаются высокой твердостью и хорошо паяются. В отличие от
серебра белая бронза не тускнеет под действием сернистых соедине-
ний. Осадки белой бронзы легко полируются. Белую бронзу приме-
няют для отделки деталей радиоаппаратуры, столовых приборов,
музыкальных духовых инструментов идругих металлических изделий.
При бронзировании деталей, изготовленных из меди и ее сплавов,
рекомендуется толщина слоя 12—14 мк, для стальных деталей —
25—30 мк.
Зависимость некоторых свойств бронзовых осадков от их состава
приведена в табл. 119.
Таблица
Характеристика бронзовых покрытий (по В. И. Лайнеру)
Содержание Sn в сплаве В % Внешний вид покрытия Твердость НВ Устойчивость к потускнению
50—40 Блестящее, серебри- стого цвета 400—420 Лучшая, чем у серебра и никеля
20 Блестящее, золотисто- желтого цвета 300—320 Хорошая; хуже, чем у предыдущего, но лучше, чем у меди
10 Золотисто-красного цвета 260—280 Хорошая; хуже, чем у предыдущего, но лучше, чем у меди
Состав бронзовых осадков в сильной степени зависит от отно-
сительной концентрации медной и оловянной соли в электро-
лите, а также от концентрации свободного цианида и свободной
щелочи.
По данным Е. Г. Кругловой, при отношении в электролите
Си : Sn = 8 : 1 в покрытиях содержится около 4% олова, а при
соотношении 1 : 1 в осадках содержится около 20% олова. Абсолют-
ная концентрация металлов оказывает некоторое воздействие на катод-
ный выход по току, не влияя существенно на химический состав
осадков. При повышении содержания свободной щелочи в электро-
лите уменьшается процент олова й покрытиях (фиг. 121), а при увели-
Глава XVI11. Гальваническое покрытие сплавами
357
чении концентрации свободного цианида уменьшается содержание
меди (фиг. 122).
При повышении температуры понижается катодная поляризация
как при выделении меди, так и при выделении олова. Однако при этом
поляризация олова снижается в большей степени, чем поляризация
Фиг. 121. Влияние содержания ще-
лочи на процентный состав бронзо-
вых осадков (по В. И. Лайнеру).
Фиг. 122. Влияние содержания
цианидов на процентный состав
бронзовых осадков.
меди, поэтому при повышении температуры повышается содержание
олова в осадках. При понижении температуры процент меди в покры-
тиях увеличивается, одновременно резко снижается выход по току.
В связи с этим электролитическое осаждение бронзы обычно про-
изводится при повышенной температуре порядка 60 — 65°. Плотность
тока сравнительно малоувлияет на процентный состав бронзовых
осадков. С повышением плотности тока катодный выход по току
несколько снижается.
Значительная катодная поляризация, высокая электропровод-
ность и уменьшение выхода по току с увеличением плотности тока
являются факторами, обусловливающими высокую рассеивающую
способность щелочно-цианистых электролитов для бронзирования.
Гальваническое осаждение бронзы со сравнительно невысоким
содержанием олова (5—6%) ведут из электролита следующего состава:
Цианистый комплекс меди............................. 30—35 Г/л
Станнат натрия...............'...................... 70—80 »
Цианистый натрий (свободный)........................12—16 »
Едкий натр (свободный).............................. 6—8 »
Режим работы: температура 65°, плотность тока 2—3 а/дм2.
В качестве анодов применяют бронзовые прутки примерно того же
состава, как и требуемые катодные осадки. Анодный и катодный
выходы по току очень близки, вследствие чего содержание и соотно-
шение солей металла в электролите остаются постоянными и коррек-
тировать ванну приходится только по содержанию цианида и щелочи.
Для приготовления электролита необходимо отдельно растворить
станнат натрия и цианистую меднонатриевую соль и смешать их
358
Часть третья. Технология нанесения металлических покрытий
в требуемом соотношении. Цианистый меднонатриевый раствор гото-
вят растворением цианистой меди в цианистом натрии. Можно мед-
Фиг. 123. Электрическая схема раз-
дельного питания током медных и оло-
вянных анодов:
1, 3—амперметры; 2—вольтметр; 4, Б—рео-
статы; 6—шунт; 7—оловянные аноды; 8—
детали; 9—медные аноды.
ную комплексную СОЛЬ ГОТОВИТЬ
исходя из сернокислой соли, кото-
рая предварительно переводится
в углекислую. Последняя раство-
ряется в растворе цианистого нат-
рия.
Станнат натрия готовят смеше-
нием растворов щелочи и хлори-
стого олова, при этом на каждую
грамм-молекулу хлористого олова
требуются две грамм-молекулы
щелочи. Выпавший осадок гидрата
закиси олова тщательно промы-
вают и растворяют в избытке ще-
лочи.
Для получения сплавов типа бе-
лой бронзы, содержащих 40—45%
олова и напоминающих по внеш-
нему виду серебро, необходимо
поддерживать в электролите отно-
шение Си : Sn = 1 : 3.
Практическое применение на-
шел электролит следующего со-
Цианистый комплекс меди (в пересчете на металлическую
медь).................................................12—15 Г/л
Станнат натрия (в пересчете на металлическое олово) 36—46 »
Цианистый натрий (свободный).........................12—15 »
Едкий натр (свободный)............................... 7—10 »
Режим работы: температура 65°, плотность тока 1,5—
2,0 а/дм2.
В качестве анодов рекомендуются листы бронзы, содержащей
62% Си и 38% Sn. Аноды указанного состава растворяются равно-
мерно, пополняя электролит ионами обоих металлов. Возможно
применение также нерастворимых стальных и никелевых или комби-
нированных анодов: медь и сталь, медь и олово.
При употреблении комбинированных анодов (медь и олово) при-
меняют раздельную регулировку анодной плотности тока, которая
на медных анодах должна быть не выше 1 а/дм2, а на оловянных —
примерно 2,0—2,5 а/дм2.
Электрическая схема с раздельным питанием медных и оловян-
ных анодов приведена на фиг. 123.
Неполадки, встречающиеся при бронзировании, и методы их устра-
нения описаны в табл. 120.
Глава XVIII. Гальваническое покрытие сплавами
359
Таблица 120
Неполадки в работе электролитов для бронзирования
Признаки неполадок Причины возникновения Способы устранения
Медленное осаждение сплава Малооловянистые брон- зовые покрытия (<15% Sn) приобретают розовый цвет и становятся матовыми. Высокооловяиистые брон- зовые покрытия (>35% Sn) имеют золотистый оттенок Малооловянистые бронзо- вые покрытия (<20% Sn) приобретают светло-золо- тистый цвет и становятся блестящими. Высокооловя- нистые бронзовые покры- тия (>45% Sn) становятся матовыми а) Малое содержание меди и олова в ванне б) Высокое содержа- ние цианидов в) Низкая темпера- тура г) Высокая плотность а) Низкая темпера- тура б) Высокое содержа- ние едкого натра в) Низкое содержа- ние цианистого натрия г) Высокое содержа- ние меди а) Низкое содержа- ние едкого натра б) Высокое содержа- ние цианистого натрия в) Высокое содержа- ние олова а) Откорректировать электролит б) То же в) Повысить темпера- туру г) Снизить плотность тока а) Повысить темпера- туру б) Проработать элек- тролит при высокой анодной плотности тока в) Откорректировать электролит г) Добавить соли олова а) Добавить едкий натр б) Откорректировать электролит в) Добавить соли меди
5. ПОКРЫТИЕ СПЛАВОМ СВИНЕЦ—ОЛОВО
Покрытия сплавом свинец — олово получили довольно широкое
промышленное применение для антифрикционных целей, для облег-
чения пайки деталей, а также в целях защиты от коррозии. Свинцо-
вооловянные покрытия менее пористы, чем свинцовые или оловянные,
что позволяет применять их для защиты деталей от действия морской
воды и других агрессивных сред. Для антикоррозионной защиты при-
меняются сплавы, содержащие около 5% олова. Для антифрикцион-
ных целей используются свинцовооловянные сплавы, содержащие
5—11% олова. Для пайки деталей употребляют покрытия сплавами,
содержащими 18—60% олова. Покрытия чистым оловом, нанесенные
гальваническим способом, со временем пассивируются вследствие
образования на их поверхности пленки окислов. Пленка эта затруд-
няет пайку деталей. Свинцовооловянные сплавы не пассивируются,
поэтому способность их к пайке после длительного хранения почти
не изменяется. Следует учесть и то, что температура плавления спла-
вов, содержащих 40—60% олова, значительно ниже температуры
плавления чистого олова.
360
Часть третья. Технология нанесения металлических покрытий
Покрытия сплавом свинец—олово не склонны к образованию ните-
видных кристаллов, наблюдаемых на оловянных покрытиях. Тол-
щина слоя покрытия сплавом, применяемого для пайки, должна быть
в пределах 10—20 мк.
Свинцовооловянные покрытия можно получить из борфтористо-
водородных, кремнефтористоводородных и фенолсульфоновых элек-
тролитов.
Электролитическое осаждение свинцовооловянных сплавов из
кислых электролитов сравнительно легко осуществимо, что объяс-
няется близостью их электродных потенциалов. Катодная поляриза-
ция указанных металлов в кислых растворах незначительна. Выход
по току сравнительно мало меняется в пределах используемых плот-
ностей тока. Рассеивающая способность электролитов, применяемых
для осаждения сплавов свинец—олово, невелика. Состав покры-
тий можно менять в довольно значительных пределах, изменяя
относительную концентрацию солей олова и свинца в электролите,
а также режим электролиза.
Наибольшее распространение для электролитического осаждения
свинцовооловянных сплавов получили борфтористоводородные элек-
тролиты. Рецептура электролитов для осаждения свинцовооловян-
ных покрытий приводится в табл. 121.
Таблица 121
Состав электролитов и режим работы при осаждении свинцовооловянных сплавов
Наименование компонентов Содержание в Г/л в растворах
№ 1 № 2 № 3 № 4 № 5 № 6 №7
Фторборат олова (в пере- счете на металл) 6 8,5 13 22 35 45 55
Фторборат свинца (в пере- счете на металл) 90 88 80 65 44 35 25
Борфтористо- водородная кислота (сво- бодная) 40 40 40 40 40 40 40
Столярный клей 0,5 0,5 Р е ж I 1,0 IM раб 1,0 ОТЫ 3,0 4,0 5,0
Плотность тока в аЮмг 0,8—1,0 0,8—1,0 0,8—1,0 0,8—1,0 0,8—1,0 0,8—1,0 0,8—1,0
Температура в °C 20—25 20—25 20—25 20—25 20—25 20—25 20—25
Состав осаж- даемого сплава (% олова) 7 10 15 25 40 50 60
Глава XVIII. Гальваническое покрытие сплавами
361
Фиг. 124. Схема установки для на-
сыщения электролита оловом:
1 — оловянный анод; 2 — диафрагма;
3 — катод; 4 — медный электролит;
5 — электролит.
Борфтористоводородные электролиты для осаждения сплава
свинец—олово готовят следующим образом. В гуммированный или
винипластовый сосуд наливают нужное количество плавиковой кис-
лоты и при постоянном помешивании добавляют туда небольшими
порциями борную кислоту. Полученную борфтористоводородную
кислоту перемешивают, отстаивают и декантируют в другой сосуд,
где ее насыщают свинцом (в виде 2РЬСО3РЬ(ОН)2 или РЬО), пред-
варительно доведенным водой до консистенции жидкой кашицы.
При этом происходит реакция (с гле-
том)
РЬО + 2HBF4 = Pb (BF4)2+H2O.
В полученный свинцовый электро-
лит олово вводят путем анодного рас-
творения. Для этой цели в ванну
помещают сосуд из необожженного
фарфора или другого пористого мате-
риала, в .который наливают раствор
фторбората меди. В качестве анодов
применяются оловянные пластины,
катодом служит латунная или медная
пластина. Схема установки для насы-
щения электролита оловом показана
на фиг. 124. При электролизе элек-
тролит в диафрагменном сосуде не-
сколько раз заменяют свежим. Через некоторое время рядом с диаф-
рагмой подвешивают стальную пластинку, осаждают на ней сплав
и определяют процентный состав осадков.
После получения осадка требуемого состава удаляют диафрагму
с раствором, анализируют электролит и разбавляют его водой до
требуемого объема.
Можно получить электролит для осаждения сплава свинец •—
олово также химическим способом. Для этой цели готовят фтор-
бораты свинца и олова. Последняя соль готовится замещением меди
в растворе фторбората меди при помощи измельченного олова по
реакции
Cu(BF4)2+ Sn= Sn(BF4)2-|-Cu.
При осаждении свинцовооловянных сплавов применяют аноды
примерно такого же состава, как предполагаемый осадок.
Наличие свободной борфтористоводородной кислоты необходимо
Для нормального растворения анодов, а также для повышения элек-
тропроводности. Клей добавляется для предотвращения образования
Дендритов, а также с целью получения мелкокристаллических осад-
ков. Зависимость состава сплава от плотности тока, а также от содер-
жания олова в электролите приведена на кривых фиг. 125 и 126.
362
Часть третья. Технология нанесения металлических покрытий
Для получения свинцовооловянных сплавов могут быть использо-
ваны также кремнефтористоводородные электролиты. В частности,
для получения сплава, содержащего 18—25% олова, применяется
электролит следующего состава:
Свинец кремнефтористоводородный............... 100—150 Пл
Олово кремнефтористоводородное................ 46—60 »
Кислота кремнефтористоводородная (свободная) . 60—100 »
Столярный клей...................................... 1 »
Режим работы: температура 18—25°, плотность тока 4—
5 а/дм*. Аноды — свинец и олово. Электрическое питание анодов
раздельное.
Фиг. 125. Завнснмость состава
свинцовооловянных осадков от
плотности тока.
Содержание олова в электролите
Фиг. 126. Зависимость состава
свинцовооловянных осадков от
содержания олова в электролите.
Приготовление кремнефтористоводородных электролитов произ-.
водится химическим способом. Часть кислоты насыщается свинцом
в соответствии со следующей реакцией:
PbO+H2 SiFe=PbSiFe+H2O.
Другая порция кремнефтористоводородной кислоты насыщается
углекислой медью
CuCO3+Н 2 S i Fe=Си Si FeН 2О+СО 2.
Затем в раствор добавляют растертое в порошок олово
Си SiFe4~ Sn= Sn SiFe+Cu.
Третий тип ванн, применяемых для осаждения свинцовооловян-
ных сплавов — фенолсульфоновые. Они готовятся из недефицитных
химикатов, дешевы и стабильны в работе. Ванны, в которых приме-
няются фенолсульфоновые электролиты, не требуют вентиляционных
устройств.
Глава XVIII. Гальваническое покрытие сплавами
363
Ниже приводятся состав парафенолсульфоновых электролитов
и режим работы для осаждения свинцовооловянных сплавов.
Раствор № 1
Свинец парафенолсульфоповокислый . . 95—140 Пл
Олово парафенолсульфоновокнслое . . . 22—26 »
Парафенолсульфокислота (свободная) . . 50—85 »
Желатина ........................... 2 »
Температура в °C....................20—40
Плотность тока в а/дм2..............1—2
Раствор № 2
40—ПО/7л
60—120 »
70—120 »
1,5—3,0 »
18—25
1
Электролит № 1 предназначен для получения сплава, содержа-
щего 8—12% олова, а электролит № 2 — для сплавов, содержащих
20—60% олова.
Аноды изготовлены из сплава свинец—олово с соответствующим
составу катодного осадка относительным содержанием свинца и
олова.
Приготовление электролита заключается в предварительном суль-
фировании фенола по реакции
СвНБОН + H2SO4 = CeH4OHSO3H + Н2О.
После сульфирования кислоту разбавляют примерно до 1,5-н. кон-
центрации. Затем в отдельных сосудах приготовляют парафенол-
сульфоновый свинец и парафенолсульфоновре олово.
Насыщение свинцом происходит по реакции
РЬСО3 + 2CeH4OHSO3H = Pb(CeH4OHSO3)2 + Н2О + СО2.
Фенолсульфоновое олово может быть получено растворением све-
жеосажденного гидрата закиси олова в фенолсульфоновой кислоте
Sn(OH)2+2CeH4OHSO3H=Sn(CeH4OHSO3)24-2H2O.
Повышение плотности тока при работе с фенолсульфоновыми
электролитами приводит к увеличению содержания олова в осадках,
а понижение плотности тока — к повышению содержания свинца.
При снижении содержания солей катодные осадки становятся тем-
ными, шероховатыми.
6. ПОКРЫТИЕ СПЛАВОМ ОЛОВО—НИКЕЛЬ
Оловянноникелевые покрытия, содержащие 50—65% олова и
50—35% никеля, отличаются высокими механическими свойствами,
красивым внешним видом и высокой твердостью.
Блестящие покрытия олово—никель могут быть получены непо-
средственно из ванны. По внешнему виду эти покрытия напоминают
блестящие никелевые или хромовые осадки, но имеют розоватый
оттенок. Оловянноникелевые покрытия легко паяются и сохраняют
эти свойства при длительном хранении. К недостаткам оловянно-
никелевых осадков следует отнести их несколько повышенную хруп-
кость.
364
Часть третья. Технология нанесения металлических покрытий
Для осаждения сплава, содержащего 65% олова и 35% никеля,
может быть применен электролит следующего состава:
Никель хлористый . . ....................... 250—300 Г/л
Олово хлористое ............................. 40—50 »
Натрий фтористый ............................ 28—30 »
Аммонии фтористый............................ 35—38 »
pH........................................... 4,0—4,5
Режим работы: температура 45—55°, плотность тока
0,5—0,4 а/дм2. В качестве анодов следует применять пластины из
олова и никеля при соотношении их поверхностей 1 : 20. Средняя
анодная плотность тока 0,5—1,0 а/дм2.
Состав катодного осадка мало зависит от концентрации олова
и никеля в электролите и сохраняется постоянным при изменении
плотности тока от 0,5 до 4,0 а/дм2 и температуры от 45 до 70°.
Рассеивающая способность электролита примерно такая же,
как у никелевых электролитов.
Электролит для осаждения оловянноникелевых осадков готовят
путем растворения в воде хлористого никеля и добавления в раствор
фторидов, а затем хлористого олова. При введении части фторидов
раствор мутнеет, однако после добавления хлористого олова опять
становится прозрачным; при добавлении остальной части фторидов
муть больше не образуется:
Оловянноникелевые покрытия на стальные детали наносятся
слоем толщиной 15 мк при подслое меди толщиной 30 мк. Для защиты
деталей из меди и ее сплавов рекомендуются покрытия сплавом
толщиной 5—15 мк.
Твердость осадков сплава олово—никель находится в пределах
500—600 кГ/мм2.
Для увеличения эластичности осадков Н. Т. Кудрявцев
и К. М. Тютина рекомендуют добавлять в электролит парафенолсуль-
фоновую кислоту из расчета 0,5 Г-мол/л. При добавлении парафенол-
сульфоновой кислоты содержание олова в осадке снижается до 50%,
что объясняется повышением катодной поляризации выделения олова
из хлоридфторидного электролита.
7. ПОКРЫТИЕ СПЛАВОМ ЦИНК—КАДМИЙ
Применение цинккадмиевых сплавов представляет интерес для
защиты от коррозии стальных деталей, эксплуатируемых в условиях
морской атмосферы.
Имеются данные о том, что сплавы, содержащие 80—85%. Cd
и 15—20% Zn, обладают наибольшей стойкостью против коррозии
в атмосфере влажного воздуха с переменной температурой и в тумане
раствора хлористого натрия.
Глава XVIII. Гальваническое покрытие сплавами
365
Н. Т. Кудрявцев и Е. Ф. Перетурина рекомендуют следующий
электролит для осаждения сплавов, содержащих 20% Zn и 80% Cd:
Цианистый комплекс цинка (в пересчете на металл) . . 6 Пл
Цианистый комплекс кадмия (в пересчете на металл) . . 21 »
Калий цианистый...................................100 »
Режим работы: температура 18—20°, плотность тока
1 а/дм2.
В качестве анодов применяются пластины из сплава, содержа-
щего 80% Cd и 20% Zn.
Согласно исследованиям П. М. Вячеславова и С. М. Рутковской,
для получения цинккадмиевых сплавов, содержащих 5—10% Zn,
можно использовать электролит следующего состава:
Фтор бор ат цннка........................... 180—200 Г/л
Фтор борат кадмия............ . ........ 60—70 »
Фторборат аммония............................ 50—60 »
Борфтористоводородная кислота (свободная) . . . 30—50 »
Столярный клей............................... 1 »
pH электролита.................................... ~1,0
Режим работы: температура 18—25°, плотность тока 1,5—•
2,0 а/дм2. Аноды — пластинки из сплава, содержащего 90% Cd
и 10% Zn.
Электролит готовится из борфтористоводородной кислоты, в кото-
рой отдельно растворяют окиси или углекислые соли цинка и кадмия.
После смешения растворов добавляют борфтористоводородную кис-
лоту, фторборат аммония и клей. Кислотность электролита коррек-
тируется раствором аммиака.
Повышение плотности тока приводит к уменьшению содержания
кадмия в осадках, а повышение температуры — к уменьшению содер-
жания цинка. При увеличении отношения кадмия к цинку содержание
кадмия в осадках повышается.
Покрытые детали рекомендуется пассивировать погружением
на 5—10 сек. в раствор, содержащий 150 Пл бихромата аммония
и 10 Пл серной кислоты.
ЧАСТЬ ЧЕТВЕРТАЯ
ЭЛЕКТРОХИМИЧЕСКИЕ И ХИМИЧЕСКИЕ МЕТОДЫ
ОКСИДИРОВАНИЯ И ОКРАШИВАНИЯ МЕТАЛЛОВ
ГЛАВА XIX
АНОДНОЕ ОКСИДИРОВАНИЕ АЛЮМИНИЯ
И АЛЮМИНИЕВЫХ СПЛАВОВ
1. ОБЩИЕ СВЕДЕНИЯ
Алюминий и его сплавы в естественных условиях покрыты окис-
ной пленкой толщиной порядка 40—50 А. Эта пленка сообщает
металлу некоторую пассивность, однако вследствие малой толщины,
высокой пористости и низкой механической прочности она не в состоя-
нии обеспечить надежную защиту основы от коррозии.
Создание на поверхности- алюминия искусственных оксидных
пленок значительной толщины, полученных главным образом элек-
трохимической, а иногда химической обработкой, является одним
из лучших способов защиты его от коррозии.
Химическое оксидирование, не требующее применения электри-
ческого тока — самый простой и дешевый способ обработки алюми-
ния и его сплавов.
Химическое оксидирование может быть .достигнуто, например,
3—5-минутной обработкой изделий в растворе, содержащем 50 Пл
кальцинированной соды и 15 Пл двухромовокислого натрия, при
температуре 80—100°. Оксидированные таким образом изделия под-
вергают дополнительной обработке в течение 2—5 сек. в 2-процент-
ном растворе хромовой кислоты при комнатной температуре.
Пленки, полученные при химическом оксидировании, имеют
незначительную толщину (2—3 мк) и значительно уступают по защит-
ным свойствам оксидным пленкам, получаемым электрохимическим
методом. По этой причине химическое оксидирование алюминия
и его сплавов имеет ограниченное применение.
Электрохимическое оксидирование (анодирование) является наи-
более распространенным способом защиты алюминия и его сплавов
от коррозии. Свойства анодных пленок существенно зависят от состава
электролита и режима процесса. Из предложенных электролитов
наибольший интерес с точки зрения совокупности свойств получае-
Глава XIX. Анодное оксидирование алюминия и алюминиевых сплавов 367
мых пленок, простоты проведения процесса и доступности исполь-
зуемых материалов представляют сернокислотные, хромовокислот-
ные и щавелевокислотные электролиты?-—
Механизм образования оксидной пленки на алюминии
и ее свойства
-Известно, что металл, погруженный в электролит и включенный
в электрическую цепь в качестве анода, может вести себя по-разному:
он либо растворяется с образованием растворимых соединений,
либо пассивируется. В последнем случае электродный потенциал
быстро возрастает и начинается разряд ионов гидроксила.
Алюминий принадлежит к числу легко пассивирующихся метал-
лов. В большинстве кислых и нейтральных электролитов поверх-
ность его сразу покрывается тонким плотным слоем окислов и весь
ток расходуется на выделение кислорода.
Кислород в виде атомов и ионов проникает через пленку и вызы-
вает дальнейшее окисление металла. Однако с ростом толщины пленки
проникновение через нее кислорода все более затрудняется, поэтому
ионам гидроксила приходится сообщать все большую энергию путем
повышения напряжения на ванне. Возникающий таким образом
плотный слой окислов называется барьерным слоем. Если
не увеличивать напряжение, то рост его прекратится.
Дальнейший ход процесса зависит от способности электролита
растворять окись алюминия. Если пленка нерастворима в электро-
лите (борная кислота, нитраты и другие соли), то электролиз пре-
кращается, как только толщина пленки достигнет предела, отвечаю-
щего приложенному напряжению. Электролиты, не растворяющие
окись алюминия (растворы борной кислоты, растворы нитратов,
хроматов, боратов и других солей), применяются для получения так
называемых вентильных пленок в производстве электролитиче-
ских конденсаторов. Толщина таких пленок не превышает 1—2 мк.
Для получения оксидных пленок, предназначенных для защиты
от коррозии, в качестве подслоя для нанесения лакокрасочных покры-
тий, для декоративной отделки изделий и т. д. используются элек-
тролиты, частично растворяющие барьерный слой (растворы серной,
хромовой и щавелевой кислот). В этом случае рост окисной пленки
зависит от двух- параллельных процессов: электрохимического
окисления- алюминия проникающим к поверхности кислородом
и химического растворения окислов в электролите. В начале окси-
дирования скорость первого процесса больше, чем скорость второго
(иначе окисный слой вовсе не может образоваться, как это имеет
место, например, в щелочах или в соляной кислоте). Но с течением
времени пленка со стороны, обращенной к электролиту, становится
все более пористой и рыхлой. Площадь контакта ее с электролитом
увеличивается, а это приводит к дальнейшему увеличению скорости
368
Часть четвертая. Электрохимические и химические методы
растворения. В некоторый момент времени скорость образования
пленки и скорость ее растворения становятся одинаковыми и рост
пленки прекращается (хотя окисление металла, естественно, продол-
жается с прежней скоростью).
Чем выше растворяющая способность электролита по отношению
к окиси алюминия, тем тоньше получаемая пленка. Растворяющее
действие электролита зависит от концентрации кислоты в ванне,
температуры и других факторов, подбирая которые соответствующим
Фиг. 127. Зависимость толщины оксид-
ной пленки и выхода по току от ко-
личества электричества, пропущенного
через электролит:
1 — выход по току; 2 — эквивалентная
толщина; 3 — наблюдаемая толщина.
Продолжительность электролиза,
мин
Фиг. 128. Зависимость толщины оксид-
ной пленки и потенциала анода от вре-
мени оксидирования:
1 — толщина пленки; 2 — анодный потен-
циал.
образом, можно регулировать ход процесса. Например, при оксиди-
ровании в охлажденных до 0° и ниже растворах серной кислоты могут
быть получены пленки толщиной 100—300 л<к. При комнатной темпе-
ратуре в том же электролите образуются пленки толщиной до 20 мк.
Кинетика роста пленок при оксидировании в 15-процентном рас-
творе серной кислоты показана на фиг. 127 и 128.
Структура и свойства оксидных пленок
Оксидные пленки значительно увеличивают коррозионную стой-
кость алюминиевых изделий в различных средах и служат эффектив-
ной мерой защиты этих изделий от преждевременного разрушения.
Окись алюминия обладает очень высокой твердостью: ’например,
природный корунд в этом отношении лишь немногим уступает алмазу.
Полученные искусственным путем окисные пленки на алюминии
также чрезвычайно тверды. Алюминий же и большинство его спла-
вов — относительно мягкие материалы. Поэтому анодирование
во много раз повышает сопротивляемость алюминиевых изделий
механическим воздействиям — истиранию, царапанию и т. -п. Нако-
нец, адгезия оксидной пленки к алюминию очень высока, а сама
Глава XIX. Анодное оксидирование алюминия и алюминиевых сплавов 369
пленка благодаря своей пористой структуре хорошо удерживает
красители и служит надежным подслоем для нанесения лакокрасоч-
ных покрытий.
Оксидные пленки на алюминии являются хорошими изоляторами,
это их свойство часто используется в электротехнических изде-
лиях.
Эти и ряд других эксплуатационных качеств оксидных покрытий
в значительной степени зависят от их структуры. Схематически
строение оксидных пленок изображено на фиг. 129.
Во всех случаях пленки состоят из двух слоев — беспористого
барьерного слоя толщиной 0,01—0,03 мк и пористого слоя толщиной
от нескольких микрон до нескольких сотен микрон. Барьерный слой
представляет собой так называемую у-модификацию окиси алюминия
А12О3. Внешний пористый слой более или менее гидратирован.
Для пленок, полученных в серной и щавелевой кислотах, он отве-
чает химической формуле А12О3-Н2О. Пленки, полученныев хромовой
кислоте, практически безводны. Пленки, получаемые на сплавах
алюминия, содержат примеси других металлов и их окислов.
Толщина, степень пористости и наличие примесей являются реша-
ющими факторами, определяющими перечисленные выше свойства
пленок. Так, твердость и износоустойчивость тем выше, чем меньше
пористость пленок. Наличие примесей значительно снижает твер-
дость оксидных сЛоев. Наоборот, адсорбционная способность выше
у пористых пленок. Такие пленки хорошо окрашиваются органи-
ческими красителями и неорганическими пигментами. Оксидные
пленки, предназначенные служить грунтом для лакокрасочных
покрытий, должны иметь по возможности более шероховатую поверх-
ность, так как это способствует лучшему сцеплению слоя краски.
Как показывает фиг. 130, этому требованию удовлетворяют пленки,
образующиеся на сплаве типа АК4-1 в электролитах 3 и 7—10.
Удельное сопротивление пленок на чистом алюминии при комнат-
ной температуре составляет примерно 109 ом/см2. Пробивное напря-
жение 200—500 в, а в ряде случаев оно может быть доведено
до 2000 в.
Диэлектрические свойства оксидной пленки зависят как от ее
толщины, так и от способа получения. Это видно из фиг. 131, показы-
вающей зависимость пробивного напряжения пленок от времени
их образования. Кривые 1 относятся к пленкам, полученным в 2-про-
центном растворе щавелевой кислоты, кривые 2 — в 2-процентном
растворе серной кислоты, а кривые 3 — в 2-процентном растворе
хромовой кислоты. Как показывают эти данные, пробивное напряже-
ние пленок, полученных с применением постоянного тока, выше, чем
у пленок, полученных переменным током. Минимум пробивного
напряжения наблюдается для пленок, полученных в хромовокислот-
ном электролите. Пористость и толщина оксидных пленок определя-
ются растворяющим действием электролита, поэтому от выбора ванны
24 Вайнер и Дасоян
370
Часть четвертая. Электрохимические и химические методы
Фиг. 129. Схема образования оксидной пленки на алю-
минии.
Фиг. 130. Изменение чи-
стоты обработки поверх-
ности сплава АК4-1 в за-
висимости от режима ано-
дирования.
Глава л/Х. Анодное оксидирование алюминий и алюминиевых сплавов 371
и условий оксидирования в сильной степени зависят эксплуата-
ционные свойства покрытий.
Промышленное анодирование алюминия и его сплавов, как уже ука-
зывалось, чаще всего производится в серной, хромовой и щавелевой
кислотах, причем наибольшее распространение получило анодиро-
вание в серной кислоте.
Оксидные пленки, полученные из сернокислотного электролита,
обладают высокой адсорбционной способностью и стойкостью против
коррозии. Важным достоинством данного электролита является то,
Продолжительность оксидирования, Продолжительность оксидирования,
мин. мин.
Фнг. 131. Зависимость пробивного напряжения оксидных
пленок от продолжительности оксидирования постоянным (а)
и переменным (б) током.
что в нем можно анодировать почти все алюминиевые сплавы, в то
время как в других электролитах, например в хромовокислотном, ано-
дирование сплавов с высоким содержанием меди и кремния затруд-
нительно.
Анодирование в серной кислоте требует примерно на 30—50%
меньшей затраты электроэнергии по сравнению с анодированием
в хромовокислотном и щавелевокислотном электролитах и меньшей
длительности обработки. Наконец, разбавленная серная кислота, при-
меняемая для составления сернокислотного электролита, является
наиболее дешевой и доступной из трех указанных электролитов.
К недостаткам сернокислотного электролита относятся:
1) необходимость охлаждения электролита при работе и неко-
торая сложность технологического процесса анодирования, вызван-
ная необходимостью последующей обработки анодированных деталей
горячим раствором хромата (наполнение пленки) для повышения
ее коррозионной стойкости;
2) невозможность длительного пребывания деталей в элек-
тролите при случайном перерыве тока ввиду значительного
24*
372
Часть четвертая. Электрохимические и химические методы
растворяющего действия серной кислоты на оксидную пленку и на
металл;
3) необходимость применения специальной кислотоупорной
футеровки ванн.
В серной кислоте не рекомендуется обрабатывать детали, имеющие
узкие щели, зазоры, клепаные соединения, от которых трудно отмыть
кислоту.
Хромовокислотные электролиты анодирования рекомендуются
для получения антикоррозионных пленок на изделиях сложной кон-
фигурации. К достоинствам данного электролита относятся: сохра-
нение класса чистоты поверхности и размеров обрабатываемых дета-
лей; повышенная коррозионная стойкость пленок, полученных
из хромовых электролитов, благодаря чему они применяются без
дополнительной обработки; высокая эластичность и пластичность
пленок; отсутствие отрицательного влияния на усталостные характе-
ристики изделий; в несколько раз большее электросопротивление
этих пленок по сравнению с пленками такой же толщины, получен-
ными в сернокислотном электролите.
К недостаткам хромовокислотных электролитов, кроме тех, кото-
рые уже были отмечены, относятся также дороговизна электролита
и сложность контроля ванн (стоимость хромовокислотного электро-
лита в 5—8 раз выше стоимости сернокислотного электролита,
а контроль его обычно осуществляется, потенциометрическим или
кондуктометрическим методом), необходимость подогрева электро-
лита, больших выдержек изделий в ванне и использования постоян-
ного тока довольно высокого напряжения.
Анодное оксидирование в щавелевой кислоте применяется для
получения электроизоляционных, а также износоустойчивых' пле-
нок. Щавелевая кислота, используемая в качестве электролита, ока-
зывает относительно слабое растворяющее действие на пленку. Поэ-
тому толщина оксидного слоя растет почти пропорционально про-
должительности анодирования.
Щавелевокислотные электролиты просты по составу, не требуют
охлаждения, но процесс анодирования в них идет при высоком
напряжении; продолжительность процесса обычно больше, чем при
других методах анодирования. Анодирование в растворах щавелевой
кислоты может вестись как постоянным, так и переменным током.
Пленки, полученные при анодировании переменным током, несколько
более рыхлы, они имеют пониженное сопротивление коррозии
и износу.
2. АНОДИРОВАНИЕ В СЕРНОЙ КИСЛОТЕ
Для анодирования алюминия в качестве электролита применяют
15—20-процентные растворы серной кислоты. Анодирование произ-
водится постоянным либо переменным током.
Г лава XIX. Анодное оксидирование алюминия и алюминиевых сплавов 373
Анодирование в серной кислоте постоянным током является уни-
версальным методом обработки алюминия и позволяет получить
плотные и твердые пленки, обладающие высокими защитно-декора-
тивными качествами.
Анодирование в серной кислоте переменным током применяется
преимущественно для покрытия тонкой алюминиевой ленты и про-
волоки с целью получения пористой пленки незначительной тол-
щины.
При анодировании переменным током для получения покрытия
определенной толщины необходимо затратить вдвое больше времени,
чем при анодировании постоянным током. Однако при этом изделия
могут завешиваться одновременно на обеих штангах, в то время как
при работе на постоянном токе изделия навешиваются только на
аноде.
Для анодирования алюминия и плакированного дюралюминия
используется раствор, содержащий 180—200 Пл серной кислоты.
Температура ванны должна поддерживаться в пределах 15—23°.
Процесс ведется при анодной плотности тока 1,5—2 а!дл? для алю-
миния (напряжение на ванне 12—13 в) и 0,8—1,2 а/дж2 для дюралю-
миния (напряжение 13—28 в). Продолжительность оксидирования
составляет 40—50 мин.
При повышении температуры электролита до 30° и при анодной
плотности тока 2,0 а/дж2 продолжительность анодирования может
быть уменьшена до 10 мин., однако по качеству пленки при таком
форсированном режиме уступают пленкам, полученным в нормаль-
ных условиях.
Анодирование алюминия и его сплавов переменным током
производится в растворах, содержащих 125—130 Пл серной
кислоты. Температура электролита 13—25°, плотность тока 1,8—
2,8 а/дм2, для алюминия и 1,5—2,0 а/дм2 для сплавов; напря-
жение соответственно 21—28 ей 19—26 в. Продолжительность про-
цесса составляет 40—50 мин. для алюминия и 30—40 мин. для
сплавов.
Для получения толстых износостойких пленок анодирование про-
изводят в холодных электролитах; температура,электролита при этом
должна быть в пределах 1—3°, плотность тока 2—2,5 а!дм.\ продол-
жительность анодирования 3—4 часа.
При анодировании дюралюминия переменным током в электро-
лите накапливается медь, что приводит к ухудшению качества окис-
ной пленки. Для устранения вредного действия меди в электролит
добавляют 2—3 Пл хромовой кислоты. В присутствии этой добавки
предельное содержание меди в электролите может составить 0,3—
0,4 Пл.
Неполадки, встречающиеся при анодировании алюминия и его
сплавов в серной кислоте, и способы их устранения приведены
в табл. 122.
374
Часть четвертая. Электрохимические и химические методы
Таблица 122
Неполадки при оксидировании алюминия в серной кислоте,
их причины и способы устранения
Признаки неполадок Причины возникновения Способы устранения
О к с и д н р ование постоянным током
Пережог металла (цвета побежалости, пятна) а) Недостаточно плот- ный контакт оксиди- руемой детали с под- весным приспособлением б) Короткое замыка- ние между деталью и ка- тодом в) Соприкасание дета- лей Проверить правильность завески деталей
Сползание пленки Перегрев электролита Охладить электролит, ввести перемешивание элек- тролита
Низкая стойкость пленки против корро- зии а) Низкая анодная плотность тока б) Недостаточная про- должительность оксиди- рования а) Повысить плотность тока до 1—2 а/дм2 б) Увеличить продолжи- тельность оксидирования до 40—50 мин.
Отсутствие пленки на отдельных участках де- тали а) Плохой контакт оксидируемой детали с подвесным приспо- соблением б) Отклонение состава электролита от нормы а) Улучшить контакт, изменить конструкцию под- весного приспособления б) Откорректировать со- став электролита
Черные пятна и раз- рушение металла Присутствие в элек- тролите хлоридов, повы- шение температуры рас- твора выше 30° Охладить электролит до 15—20°. При наличии хлора сменить электролит
Серый порошкообраз- ный налет на оксиди- рованных деталях На поверхности дета- лей до оксидирования имелись продукты кор- розии Улучшить очистку дета- лей перед оксидированием
Хрупкие пленки Температура электро- лита ниже 15° Повысить температуру электролита до 15—23°
Растравливание ок- сидной пленки а) Температура элек- тролита выше 25° б) Большая продол- жительность оксидиро- вания а) Охладить электролит до 15—23°, ввести переме- шивание раствора б) Уменьшить время ок- сидирования
Местное растравлива- ние оксидной пленки после оксидирования Плохая промывка от серной кислоты деталей после оксидирования Улучшить промывку дета- лей после оксидирования
Глава XIX. Анодное оксидирование алюминия и алюминиевых сплавов 375
Продолжение табл. 122
Признаки неполадок Причины возникновения Способы устранения
О к с и д и р Зеленоватый оттенок оксидной пленки Растравливание ок- сидной пленки Серые полосы на пленке (при оксидиро- вании в свежеприготов- ленном электролите) ование переменг Присутствие в элек- тролите примеси меди Большое содержание меди в электролите Присутствие в элек- тролите примесей ме- таллов (помимо А1 и Си) Ы М ТОКОМ Проработать электролит постоянным током для оса- ждения меди на* катоде Проработать электролит постоянным током или сме- нить электролит
3. АНОДИРОВАНИЕ В ХРОМОВОЙ КИСЛОТЕ
Хромовая ванна для анодирования алюминия и его сплавов
постоянным током содержит 90—100 Пл хромового ангидрида. Про-
цесс ведется при 35—37°, плотность тока 0,3—0,4 а/дм2 для алюми-
ния и 0,3—0,25 а/дм? для сплавов. При этом начальное напряжение
на ванне составляет 40—50 в, а затем оно постепенно повышается
до 100 в.
Работоспособность электролита зависит от концентрации свобод-
ной хромовой кислоты, которая падает по мере растворения алюми-
ния. Контроль за содержанием свободной кислоты в ванне осуще-
ствляется путем измерения электропроводности раствора.
Содержание в электролите примесей допускается в следующих
пределах: серной кислоты не более 0,5 Г/л, хлора 0,2 Пл.
Корректировка электролита заключается в периодическом доба-
влении в него хромового ангидрида, согласно данным анализа.
Неполадки при анодировании в хромовом электролите приведены
в табл. 123.
Таблица 123
Неполадки при оксидировании алюминия в растворе СгО3
Признаки неполадок Причины возникновения Способы устранения
Растравливание оксидной пленки, желтые пятна Уменьшение концентра- ции СгО3 в электролите. Недоброкачественность ок- сидируемого металла (не- равномерное распределение меди в сплаве). Плохой кон- такт подвесного приспособ- ления с деталью и анодной штангой Откорректировать элек- тролит. Провести повтор- ную термообработку для неплакированного металла. Проверить завеску деталей
376
Часть четвертая. Электрохимические и химические методы
Продолжение табл. 123
Признаки неполадок Причины возникновения Способы устранения
Растравливание или прогар металла Плохой контакт подвес- ного приспособления с де- талью и анодной штангой. Короткое замыкание между деталью н катодом или со- прикасание деталей между собой Улучшить контакт. Устра- нить короткое замыкание или соприкасание деталей
Низкое качество оксидной пленки Плохой контакт подвес- ного приспособления с де- талью и анодной штангой. Нарушение режима оксиди- рования Улучшить контакт. Отре- гулировать режим оксиди- рования
4. АНОДИРОВАНИЕ В ЩАВЕЛЕВОЙ КИСЛОТЕ
Для анодирования алюминия и его сплавов используются 2—
10-процентные растворы щавелевой кислоты.
Анодирование в щавелевой кислоте, как и в серной, может
производиться с помощью постоянного и переменного тока.
Для анодирования постоянным током может быть рекомендован
электролит, содержащий 50—70 Пл щавелевой кислоты. Режим
работы: анодная плотность тока 1—2 а/дм2, температура электролита
28—32°. При этом напряжение на ванне составляет 40—60 в.
Продолжительность процесса —30—40 мин.
При анодировании постоянным током в щавелевокислотном элек-
тролите получаются окрашенные пленки. Интенсивность окраски
зависит от толщины оксидного слоя, которая в свою очередь опреде-
ляется выбором условий электролиза (табл. 124).
Таблица 124
Зависимость окраски оксидных пленок от режима электролиза
в 10-процеитном растворе щавелевой кислоты
Цвет пленки Толщина пленки в мк Темпера- тура электро- лита в °C Плотность тока в а{дм2- Напряже- ние в в Продолжи- тельность анодиро- вания в мин.
Серебристый 5 25 1,5—2,0 35—40 35—40
Желтый (под латунь) 15 40 3,0 50 35—40
Коричневый (под бронзу) 100 50 4—5 50 35—40
Для анодирования переменным током применяется электролит,
содержащий 40—50 Г/л щавелевой кислоты и 5—10 Пл хромового
ангидрида. Температура электролита 25—30°, процесс ведется при
Глава XIX. Анодное оксидирование алюминия и алюминиевых сплавов 377
плотности тока 1,5—4,5 а/дм2. При этом напряжение на ванне соста-
вляет 40—60 в. Продолжительность процесса —30—40 мин.
Для получения пленок толщиной в несколько сот микрон необ-
ходимо искусственное охлаждение электролита до 3—5°. Плотность
тока 1—2 а/дм2.
5. ЭМАТАЛИРОВАНИЕ
Эматалирование — новый вид отделки, представляющий собой
разновидность процесса анодирования. Эматалирование позволяет
получить совершенно непрозрачные пленки цвета слоновой кости,
напоминающие по внешнему виду фарфор, пластмассу или эмаль.
Пленки имеют высокую твердость (600—700 кГ/мм2), большое удель-
ное сопротивление (10®—1014 ом-см) и высокую прочность на элек-
трический пробой. Они хорошо переносят удары и резкие изменения
температуры. Эматалированию могут подвергаться изделия из алю-
миния и его сплавов с магнием и марганцем.
Эматалевые пленки отличаются стойкостью к органическим
растворителям, минеральным и животным маслам, органическим
кислотам, а также к пищевым продуктам и напиткам. Эматалирова-
ние нашло применение в производстве кухонной и столовой посуды,
медицинских инструментов, оборудования магазинов, боен и холо-
дильников и т. д. Для эматалирования применяют электролиты,
содержащие соли титана, циркония и тория. В табл. 125 приводится
рецептура двух электролитов для эматалирования.
Полученные пленки могут быть окрашены в светлые тона путем
пропитки растворами органических красителей (см. табл. 127).
Таблица 125
Состав и режим работы электролитов для эматалирования
; Наименование компонентов Содержание в Г/л в растворах
№ 1 № 2
Двойная щавелевая соль калия и титана 40
Сернокислая соль циркония 5
Лимонная кислота 1,5 —
Щавелевая кислота 1,2 —
Серная кислота — 7,5
Борная кислота 8,0
Режим работы
Анодная плотность тока в а!дм2 2—3 8
Температура в °C 50—60 35
Выдержка в мин. 40—60 30
Род тока Переменный Постоянный
378
Часть четвертая. Электрохимические и химические методы
6. ОБОРУДОВАНИЕ И ПРИСПОСОБЛЕНИЯ,
ПРИМЕНЯЕМЫЕ ПРИ АНОДИРОВАНИИ
Для анодирования листов обычно применяют стационарные ванны,
снабженные вытяжными устройствами и приборами, регулирующими
режим работы этих ванн.
Для анодирования алюминиевой проволоки или ленты применяют
непрерывно действующие установки, подобные тем, которые исполь-
зуются для нанесения на проволоку и ленту гальванических покры-
тий. Эти установки состоят из последовательно расположенных ванн,
через которые непрерывно протягивается обрабатываемая проволока
или лента. После анодирования проволока или лента собирается
в бухты на намоточных барабанах.
Для обработки деталей средних габаритов на подвесках при
крупносерийном производстве применяется автомат типа АГ-5.
В основу автомата положена усовершенствованная технология ано-
дирования, характерной особенностью которой является замена опе-
раций щелочного травления и последующего осветления, применяе-
мых обычно для деталей из алюминиевых сплавов, химическим обез-
жириванием в растворе тринатрийфосфата с повышенной концентра-
цией эмульгатора. Все операции, кроме монтажа деталей на под-
веске и демонтажа деталей, выполняются автоматически (операция
пропитки анодной пленки олифой и сушка производится вне авто-
мата). Операция анодирования производится при анодной плотности
тока равной 2 а/дм2, при токе 420 а и напряжении 10—12 в.
Так как анодированная деталь получает некоторое приращение
размеров (около V2 толщины нанесенного оксидного слоя), то при
обработке деталей с малыми допусками необходимо предусмотреть
соответствующее занижение размера при предшествующем изгото-
влении и предварительной обработке. Для этого детали предвари-
тельно сортируют по знаку допуска, причем детали, не имеющие тре-
буемого недомера, подвергаются осторожному травлению в щелочном
или кислотном растворах. Продолжительность травления устанавли-
вается опытным путем. При анодировании деталей сложной конфи-
гурации и с точными размерами рекомендуется интенсивное переме-
шивание электролита и строгое соблюдение температурного режима.
Для толстослойного анодирования внутренней поверхности алю-
миниевых втулок применяется приспособление, приведенное на
фиг. 132.
Анодирование заклепок, винтов, болтов, шайб и других мелких
деталей производится в перфорированных корзинах (фиг. 133) или
барабанах (фиг. 134).
При этом рекомендуется:
1) для уменьшения поверхности соприкосновения деталей загру-
жать в барабан детали, различные по форме (так, например, плоские
шайбы загружают одновременно с болтами или -заклепками);
Глава XIX. Анодное оксидирование алюминия и алюминиевых сплавов 379
Фиг. 133. Корзинка для
анодирования мелких де-
талей (стрелками указана
циркуляция электролита).
Фиг. 132. Схема приспособле-
ния для толстослойного ано-
дирования внутренней по-
верхности алюминиевой втул-
ки:
1—втулка; 2—корпус приспо-
собления; 3 — зажимная гайка;
4 — прокладочное кольцо; 5 —
уплотнительное кольцо; 6—кон-
такт для подачи тока на втулку;
7 — штуцер для подачи воды,
охлаждающей втулку.
Фиг. 134. Схема ванны
для анодирования с ци-
линдрическим бараба-
Ju >3 ном и с внешним охла-
---' ждением электролита:
I _ барабан; 2 — ванна с электролитом;
3 _ катоды; 4 — аиоды; 5 — насос; 6 — кон-
трольный клапан [И — высота напора).
380
Часть четвертая. Электрохимические и химические методы
Фиг. 135. Схема переносной установки для исправления дефектов и для
местного анодирования:
1 — понижающий трансформатор 220/54/32/20 в; 2 — амперметр; 3 — прикрепляемый
к изделию контакт; 4 — изделие, подлежащее анодированию; 5—противень; 6—катод
для натирания; 7 — сосуд с электролитом; 8 — шланг для подачи электролита;
9—зажим; 10—проводник; //—продолжение шланга <?; 12—свинцовая накладка;
13 — изоляционная трубка; 14 — проволочный хомут; 15—изоляционная трубка;
16 — тампон из ткани.
Фиг. 136. Устройство ван-
ны для анодирования
с катодами-карма нами,
наполняемыми льдом:
/—водяная рубашка;’ 2—кор-
пус ванны; 3 —карман-катод;
4—лед; 5—катодные штанги;
6—анодные штангн; 7—под-
вески с изделиями.
Глава XIX. Анодное оксидирование алюминия и алюминиевых сплавов 381
2) Для осуществления постоянного прочного контакта между
деталями и токоотводом прижимать детали в барабане с помощью
специального приспособления;
3) в целях улучшения циркуляции электролита и теплообмена
внутри барабана, кроме обычной перфорации стенок барабана,
осуществить в нем принудительную
с помощью специальной трубы, уста-
новленной по оси барабана.
Для исправления дефектов оксид-
ной пленки и для местного анодирова-
ния (например, деталей судов, оби-
вок стен и т. д.) разработаны методы
электронатирания с применением рас-
творов хромовой и серной кислот
и наложением переменного или пос-
тоянного тока.
Анодирование натиранием произ-
водят пропусканием свежего элек-
тролита из специального сосуда через
электрод, обернутый тампоном. Схема
установки для исправления дефектов
анодирования электронатиранием
показана на фиг. 135.
Как указывалось выше, в ряде
случаев процесс анодирования дол-
жен проводиться при низких темпе-
ратурах (1—5°) электролита. Отвод
тепла, выделяющегося при электро-
^циркуляцию .электролита
Фиг. 137. Электрическая схема при-
бора для определения плотности
тока при анодировании:
/—ванна для анодирования; 2—ампер-
метр; 3 — вольтметр.
лизе, и охлаждение электролита мо-
жет осуществляться несколькими способами:
а) применением свинцовых катодов-карманов, наполненных льдом
(фиг. 136);
б) добавлением непосредственно в электролит твердой углекис-
лоты;
в) пропусканием холодной воды через полые детали;
г) с помощью холодильных установок, например, фреоновой
установки 4 ФУ 30/60 производительностью 30—60 тыс. ккал/ч.
Для определения средней плотности тока в ваннах анодирования
рекомендуется применять прибор конструкции завода «Электрик»,
представляющий собой совокупность вольтметра и амперметра.
Удлиненные стрелки этих приборов показывают соответственно
напряжение и силу тока, а пересечение этих стрелок указывает на
специальной шкале среднюю плотность тока. Схема указанного
прибора показана на фиг. 137.
Кривые 1, 2 и 3 на шкале прибора показывают соответственно
плотность тока в 1, 2 и 3 а!дм2.
382
Часть четвертая. Электрохимические и химические методы
7. обработка анодированных изделий
.Окскдные пленки, полученные электрохимической обработкой
изделий, обычно подвергают дополнительной обработке: уплотнению
с целью повышения коррозионной стойкости и электроизоляцион-
ных свойств или декоративной отделке — окрашиванию в различ-
ные цвета..
Уплотнение оксидных пленок
Из известных методов уплотнения оксидных пленок большое
распространение имеют следующие: заполнение пор жирами (пара-
фином, ланолином, церезином) и растворами пленкообразующих
веществ (олифа, лаки); ^заполнение пор гидратом окиси алюминия
путем обработки анодной пленки в горячей воде или паром; пассиви-
рование металла у основания пор пленки и пропитываниепленки
растворами- хроматов. Рекомендуемые составы растворов и режимы
обработки пленок в хроматных растворах приводятся ниже:
Раствор № 1 Раствор № 2
Двухромовокислый калий в Пл . . . .. 100 15
Сода кальцинированная » » ... 18 4
Температура раствора, °C ... . . . . 90—95 90—95
pH раствора . . . 6—7 6,7—7,5
Продолжительность пропитки в мин. 2—10 2—10
Анодированные изделия перед уплотнением предварительно про-
мывают в проточной воде, а после уплотнения подвергают промывке
в горячей проточной воде и сушке.
Адсорбционное окрашивание оксидных пленок
Декоративные изделия из алюминия и его сплавов после аноди-
рования подвергаются адсорбционному окрашиванию в растворах
минеральных пигментов и органических красителей. В сочетании
со специальной механической подготовкой поверхности такое окра-
шивание придает изделиям красивый вид и может имитировать раз-
личные породы дерева и камня. Наиболее пригодны для адсорбцион-
ного окрашивания пленки, полученные из сернокислых электролитов
при электролизе постоянным током. Изделия подвергают адсорб-
ционному окрашиванию в соответствующих растворах сразу после
анодирования и тщательной промывки для полного удаления следов
электролита.
Окрашивание неорганическими красителями производится путем
осаждения в порах пленки цветного химического соединения. Для
этого анодированные изделия обрабатывают сначала в растворе одной
соли, затем промывают в воде и погружают в раствор другой соли.
Продолжительность обработки в каждом растворе составляет при-
близительно 5—10 мин.; температура раствора — комнатная. Составы
Глава XIX- Анодное оксидирование алюминия и алюминиевых сплавов’ 383
некоторых растворов неорганических красящих пигментов для окра-
шивания анодированного алюминия приведены в табл. 126.
Таблица 126
Составы растворов неорганических солей
для окрашивания оксидированного алюминия
Цвет окраски Раствор № 1 Раствор № 2 Наименование окрашиваю- щего соеди- нения
Наименование соли Концен- трация в Г/л Наименование соли Концен- трация в Пл
Синий или голубой Калий железо- синеродистый 10—15 Хлорное железо 10—100 Берлинская лазурь
Коричневый Калий железо- синеродистый 10—50 Медный купорос 10—100 Железоси- неродистая медь
Черный Кобальт уксуснокислый 50—100 Калий мар- ганцевокислый 15—25 Окись кобальта
Желтый Калий- дву- хромовокислый 50—100 Свинец уксуснокислый 100—200 Двухро- мовокислый свинец
Золотисто- желтый Г ипосульфит натрия 10—50 Калий мар- ганцевокислый 10—50 Окись марганца
Белый Свинец уксуснокислый 10—50 Натрий сернокислый 10—50 Сернокис- лый свинец
Оранжевый Калий хромовокислый 5—10 Серебро азотнокислое 50—100 Хромово- кислое серебро
В табл. 127 указаны органические красители, применяющиеся для
адсорбционного окрашивания анодных пленок. Для приготовления
красильного раствора растворяют соответствующее количество кра-
сителя в горячей воде, кипятят раствор в течение 10—15 мин. и затем
фильтруют. Температура красильного раствора зависит от его кон-
центрации: чем больше концентрация, тем выше должна быть тем-
пература. Соответственно сокращается и время выдержки. Опти-
мальной температурой раствора считается 60—80°. Концентрация
красителя для указанной температуры приведена в табл. 127. Изде-
лия после окрашивания промывают в горячей воде и сушат при
температуре 100—150°.
Для повышения коррозионной стойкости окрашенных пленок
изделия на 5—15 мин. погружают в один из приводимых ниже
растворов, нагретых до 80—85°, и промывают в горячей воде.
Вайна № 1 Вайна № 2
Сернокислый никель в Пл . . . . 4,2 —-
» кобальт » . . * ... 0,7 0,1
Уксуснокислый натрий » . . . ... 4,8 5,5
Борная кислота . . 5,3 3,5
pH раствора . . . . . . . 4,7—5,7 4,7—5,7
384
Часть четвертая. Электрохимические и химические методы
Таблица 127
Органические красители для окрашивания оксидированного алюминия
Наименование красителя Концен- трация красителя в растворе в Г/л Продолжи- тельность окраши- вания в мин. Цвет окраски
Анилиновый черный ФФ 5—10 15—30 Черный
Кислотны й ч е р ны й Д л я шерсти 5—10 15—30 »
Анилиновый прямой чер- ный 3 3—5 10—20 »
Прямой диазочеряый С ани- линовый 5—10 10—20 »
Черный 2К 5—10 15—30 »
Основной коричневый 3—5 10—20 Коричневый
Ализариновый желтый Р - 1—3 5—10 Желтый с зеленым от- тенком
Прямой желтый 1—3 5—10 Желтый с зеленым от- тенком
Кислотный хром желтый Н 1—3 5—10 Желтый с зеленым от- тенком
Протравной чисто-желтый 1—3 5—10 Желтый с зеленым от- тенком
Кислотный алый 2—5 5—10 Оранжево-красный
Оранжевый 2Ж 2—5 5—10 Оранжевый
Ализариновый красный С 2—5 5—10 От розового до красного
Кислотный рубиновый 3—5 5—10 Красный
Кислотный хром ярко-крас- ный 1—5 5—10 Малиновый
Прямой красный 2С 3—5 5—10 Красный
Кислотный хром бордо 1—5 5—10 От розового до красного
Кислотный синий антрахино- новый 1—5 5—10 Синий
Прямой синий М 3—5 5—10 Синий
Анилиновый прямой чисто- голубой 2—3 5—10 Голубой
Метиленовый голубой 2—3 5—10 »
Прямой зеленый ЖХ 3—5 5—10 Зеленый
Основной ярко-зеленый 3-5 5—10 »
» фиолетовый 3—5 5—10 Фиолетовый
Глава XIX. Анодное оксидирование алюминия и алюминиевых сплавов 385
Таблица 128
Составы растворов для окрашивания анодированного алюминия
в цвет золота
Номера растворов Концентрация красителя в Г (л Режим пропитки Цвет окраски
Оранже- вый 2Ж Желтый 3 Кислот- ный черный М Темпера- тура в °C Продол- житель- ность в мин.
1 1,0 0,1 0,1 20 5—7 Под чистое зо- лото
2 0,1 0,01 0,01 50—70 1—4 То же
3 1,0 — — 20 7—9 Под розовое зо- лото
4 0,1 — 0,01 50—70 4—7 То же
5 1,6 0,4 — 60—65 1—2 Под чистое зо- лото
Таблица 129
Неполадки при адсорбционном окрашивании
оксидированного алюминия
Признаки неполадок Причины возникновения Способы устранения
Мажущий налет на поверхности изде- лий Наличие неокра- шенных участков металла Окраска стирается Слишком темная окраска Мелкие светлые точки на окрашен- ной поверхности Плохая промывка после окраски а) Недоброкачественное оксидирование б) Низкое качество под- готовки изделий перед оксидированием а) Недоброкачественное оксидирование б) Низкая температура красителя а) Большая концентра- ция красителя б) Высокая температура раствора красителя в) Большая продолжи- тельность окрашивания Недостаточная промывка после оксидирования Тщательно промыть дета- ли в проточной воде Повторить оксидирова- ние, обратив внимание на качество химической подго- товки а) Повторить оксидирова- ние б) Нагреть раствор кра- сителя до 60—70° а) Разбавить красильный раствор б) Понизить температуру раствора в) Уменьшить продолжи- тельность окрашивания Удалить оксидную пленку и после повторною оксиди- рования тщательно промыть
25
Вайнер и Дасоян
386
Часть четвертая. Электрохимические и химические методы
Для изделий, эксплуатируемых в жестких коррозионных усло-
виях, рекомендуется после сушки дополнительно пропитывать
пленку бесцветным лаком или парафином.
Широко применяется процесс отделки алюминия под золото.
Изделия при этом предварительно подвергают тщательной механи-
ческой, химической подготовке и электрохимическому полированию.
Анодирование производится в 15-процентном растворе серной кислоты
при температуре 15—23°. Плотность тока при анодировании постоян-
ным током составляет 1—2 а/дм2, а при использовании переменного
тока 2—3 а/дм2. Продолжительность обработки 15—40 мин.
Анодированные таким образом изделия после тщательной про-
мывки подвергаются адсорбционному окрашиванию в растворах,
приведенных в табл. 128.
Красильные растворы № 1—4 содержат некоторое количество
кальцинированной соды: в растворах № I и № 4 количество ее состав-
ляет 0,5 Г/л, а в.растворы № 2 и №3 сода добавляется до получения
pH = 6,5 —7,5.
Изделия после окрашивания промывают и затем выдерживают
20—30 мин. в кипящей дистиллированной воде. Для дальнейшего
повышения коррозионной стойкости на покрытия после сушки нано-
сится тонкий слой бесцветного лака, воска или парафина.
В табл. 129 приведены неполадки, встречающиеся при адсорб-
ционном окрашивании анодированных изделий.
ГЛАВА XX
ХИМИЧЕСКОЕ И ЭЛЕКТРОХИМИЧЕСКОЕ
ОКСИДИРОВАНИЕ МАГНИЯ И ЕГО СПЛАВОВ
1. ОБЩИЕ СВЕДЕНИЯ
Решающим фактором, определяющим коррозионную стойкость
магния и его сплавов, является степень их чистоты. Магний высокой
чистоты (99,986%) хорошо противостоит коррозии в атмосферных
и морских условиях даже без специальных мер защиты, тогда как
магний обычной чистоты даже в оксидированном виде заметно корро-
дирует в тех же условиях.
Оксидирование значительно повышает стойкость магниевых спла-
вов против коррозии, но все же не в такой мере, чтобы можно было
полностью обеспечить сохранность изделий в жестких условиях
эксплуатации.
На практике удовлетворительное решение задачи защиты магние-
вых сплавов от коррозии в агрессивных условиях достигается ком-
плексными мерами, а именно:
а) применением возможно чистых металлов;
б) созданием на поверхности изделий плотных, не стирающихся
оксидных пленок повышенной стойкости против коррозии;
в) нанесением на оксидированную поверхность лакокрасочных
покрытий.
2. ХИМИЧЕСКИЕ СПОСОБЫ ОКСИДИРОВАНИЯ
В табл. 130 приведены составы растворов и режимы работы ванн
для химического оксидирования магния и его сплавов.
Растворы № 1 и 2 позволяют получить пленки, отличающиеся
хорошими защитными свойствами. Недостатком этих ванн является
заметное уменьшение размеров обрабатываемых деталей вследствие
растворения металла. Обработка в растворе № 3 представляет собой
дальнейшее усовершенствование метода обработки магниевых спла-
вов в растворе хромпик — азотная кислота и имеет то преимущество
перед старым способом, что позволяет получать доброкачественные
оксидные пленки на сплавах с высоким содержанием алюминия
(для литья под давлением). Изделия перед оксидированием в раст-
25*
388
Часть четвертая. Электрохимические и химические методы
Таблица 130
Состав растворов и режим работы ваин для химического оксидирования магния
и его сплавов
Номера раство- ров Наименование компонентов Химическая формула Содержание в Г/л температура 5 в °C * я а продолжи- “О дельность & обработки о в мин. У
1 2 3 4 5 6 7 8 9 10 11 Двухромовокислый калий Азотная кислота Хлористый аммоний Двухромовокислый калий Азотиая кислота Хлористый аммоний Двухромовокислый калий Азотная кислота Серная кислота Селенистая кислота Хлористый натрий Мажеф (фосфат железа и марганца) Фтористый натрий Плавиковая кислота Двухромовокислый калий Хромовокалиевые квасцы Двухромовокислый калий Хромовокалиевые квасцы Двухромовокислый калий Сернокислый магний Двухромовокислый калий Сернокислый магний Двухромовокислый калий Сернокислый магний Сернокислый марганец К2Сг2О, HNO3 NH4C1 K2Cr 2О7 HNO3 NH4C1 К2Сг2О7 HNO3 H2SO4 H2SeO3 NaCl Fe (H2PO4)2 Mn (H2PO4)2 NaF HF K2Cr2O7 KCr (SO4)2-12H2O K2Cr2O7 KCr (SO4)2-12H20 K2Cr2O7 MgSO4-7H2O K2Cr2O7 MgSO4-7H2O K2Cr2O7 MgSO4-7H2O MnSO4-7H2O 50 ПО 1 20 30 1 150 100 7—8 100 1—5 32 0,3 20% 40 20 50 10 40 60 20 60 50 30 30 70—80 70—80 18—25 18—25 60—80 18—25 60—80 60—80 70—90 70—90 80—90 2 2 2 5 20 5 До 1 До 1 40 40 30
Глава XX. Химическое и электрохимическое оксидирование магния 389
воре № 3 рекомендуется в течение 1 —2 мин. травить в 50-процентном
растворе едкого натра при температуре 120—130°. Процесс оксиди-
рования ведут до получения желаемого тона окраски пленки.
Раствор № 4 дает защитные пленки, близкие по качествам к оксид-
ным пленкам, полученным в растворах № 1 и 2, но не изменяет разме-
ров обрабатываемых деталей. Однако существенным недостатком
этого метода является дороговизна селенистой кислотьй вследствие
чего он не нашел широкого практического применения.
Раствор № 6 позволяет обрабатывать изделия, отлитые обычными
способами и под давлением. Цвет покрытия зависит от состава сплава
и меняется от коричневого до черного. Размеры обрабатываемых
изделий полностью сохраняются. Состав раствора изменяется очень
мало; раствор расходуется только за счет уноса с изделиями.
Раствор № 7 предназначается для оксидирования готовых изде- •
лий. Оксидирование можно проводить в нем и при комнатной темпе-
ратуре; в этом случае продолжительность оксидирования увеличи-
вается до 10—15 мин. Цвет оксидной пленки зависит от состава сплава
и меняется от желтого до коричневого; размеры деталей сохра-
няются. Состав раствора отличается относительной устойчивостью
и требует корректирования лишь после обработки 200 м2 поверхности
в 100 л раствора.
pH свежеприготовленного раствора составляет 2,5.
Раствор № 8 незначительно отличается от раствора № 7 и служит
для оксидирования полуфабрикатов (чушки, литье в землю и в ко-
киль). Перед оксидированием объекты подвергают предварительному
травлению в 10-процентном растворе азотной кислоты в течение
10—30 сек.
Для растворов № 7 и 8 характерны малый расход материалов,
простота обслуживания и корректировки.
Раствор № 9 быстро истощается: ванна объемом 100 л после
оксидирования в ней 15 м2 поверхности требует корректировки
(добавляется 80 Г серной кислоты и 50 Г хромпика), кислотность
свежеприготовленной ванны отвечает pH = 5,2. Цвет пленки — от
коричневого до черного.
Растворы № 10 и 11 составляют разновидность раствора № 9
и служат для непосредственного покрытия изделий с окраской
в черный цвет (например, в оптической промышленности). При этом
обработка в растворе № 10 ведется в контакте с железом, а в раст-
воре № 11 обрабатываются изделия (без контакта с железом), отли-
тые под давлением.
3. ЭЛЕКТРОХИМИЧЕСКИЕ СПОСОБЫ оксидирования
В табл. 131 приведены составы растворов и режимы работы
ванн для электрохимического оксидирования магния и его спла-
вов.
390
Часть четвертая. Электрохимические и химические методы
Таблица 131
Состав электролитов и режим работы ваии для электрохимического
оксидирования магния и его сплавов
Номера раст- воров Состав электролита Режим работы 1 Материал катода
Наименование компонентов Химическая формула Содержа- ние в Г/л Темпера- тур» в °C Напряже- ние в в Плотность тока в а/дм1 Время обработки в мин.
1 Едкий натр Кальцинирован- ная сода NaOH Na2CO3 50 50 25—30 50 3 30 Желе- зо
2 Двухромовокис- лый калий Фосфор нокислый натрий однозаме- щеняый К2Сг2О7 NaH2PO4- 2Н2О 100 50 50 6 2 60 Сви- нец
3 . Хромовая кис- лота Углекислый мар- ганец СгО3 МпСО3 230 140 18—25 0,25-0,5 — 40—60 Гра- фит
4 Едкий натр Трннатрийфос- фат NaOH Na3PO4- •12Н2О 50—55 30—35 70—75 4 1,0—1,5 30—40 Желе- зо
5 Едкое кали Фтористый калий КОН KF-2H2O 80—90 300 40—50 60—70 3—4 40 Желе- зо
При эксплуатации электролита № 1 необходимо учитывать, что
по мере оксидирования плотность тока падает, а напряжение растет;
нужно следить за тем, чтобы оно не превышало 50 в.
Режим работы электролита № 2 регулируется по плотности тока,
которая поддерживается на уровне 2 а/дм2. Электролит № 3 работает
по принципу внутреннего электролиза (без внешнего тока) с приме-
нением графитового катода и дает оксидные пленки черного цвета.
Размеры деталей, обработанных в электролитах №1,2, 3, не изме-
няются.
Электролит № 4 позволяет получить плотные оксидные пленки
мышино-серого цвета толщиной до 10 мк.
Пленки, полученные из электролита № 5, обладают очень боль-
шим сопротивлением истиранию. Износоустойчивость этих пленок
приближается к устойчивости оксидированного алюминия.
Глава XX. Химические и электрохимическое оксидирование магния 391
Пленки, полученные из электролитов № 4 и 5, рекомендуется
уплотнять в 5-процентном растворе хромовокислого калия или под-
вергать адсорбционному окрашиванию органическими красителями
(для декоративных целей). Техника адсорбционного окрашивания
аналогична применяемой для алюминиевых сплавов. Для временной
защиты магниевых сплавов от коррозии рекомендуется обрабаты-
вать их в 20-процентном растворе хромового ангидрида при 25—80°.
Продолжительность обработки 8—10 мин.
Применяется также оксидирование в 4-процентном растворе фто-
ристого натрия с последующей пропиткой в 10—15-процентном
растворе двухромовокислого калия. Продолжительность оксидиро-
вания 5 мин., а пропитки—25—35 мин.
ГЛАВА XXI
ОКСИДИРОВАНИЕ ЧЕРНЫХ И ЦВЕТНЫХ
МЕТАЛЛОВ
1. ОБЩИЕ СВЕДЕНИЯ
Оксидирование черных металлов, известное также под названием
воронения, состоит в искусственном создании на поверхности
этих металлов пленки магнитной окиси железа FesO4.
Оксидная пленка на поверхности стали может быть получена
по одному из следующих способов: химической обработкой изделий
в щелочных или кислых растворах; электрохимической обработкой
изделий на аноде, проводимой в щелочи или хромовой кислоте;
наконец, термической их обработкой при относительно высокой
температуре (400—800°).
Наибольшее распространение получило химическое оксидирова-
ние. При этом образуются черные пленки толщиной до 1,5 мк, которые
могут служить защитно-декоративным покрытием для изделий,
эксплуатируемых в легких коррозионных условиях. Защитная спо-
собность пленок может быть повышена путем пропитки маслом или
лаками.
Химическое оксидирование может производиться в кипящем кон-
центрированном растворе щелочи, содержащем окислители, или
в растворе фосфорной кислоты.
Оксидные пленки, полученные химической обработкой в кислых
растворах, помимо окислов железа содержат фосфорнокислые соли.
По этой причине они могут быть названы оксиднофосфатными.
Механические и защитные свойства их несколько выше, чем у пле-
нок, полученных в щелочи.
Оксиднофосфатные пленки являются хорошим грунтом для лако-
красочных покрытий.
Электрохимическое оксидирование также может производиться
либо в щелочной, либо в кислой ванне. Однако способ этот имеет
ограниченное применение, так как требует более сложного оборудо-
вания и отличается большей трудоемкостью (особенно при обработке
мелких деталей, которые приходится укреплять на подвесках) по
сравнению с химическим оксидированием.
Глава XXI. Оксидирование черных и цветных металлов 393
2. ХИМИЧЕСКОЕ ОКСИДИРОВАНИЕ ЧЕРНЫХ МЕТАЛЛОВ
Оксидирование в щелочных растворах
При щелочном оксидировании изделия, предварительно очищен-
ные от окислов, ржавчины, жира и других загрязнений (как это опи-
сано в гл. V—VI), обрабатываются в кипящем 50—80-процентном
растворе каустической соды, содержащем в качестве окислителя
азотно- или азотистокислые соли натрия или калия. В результате
такой обработки на поверхности металла образуется оксидное покры-
тие, обладающее защитной способностью против коррозии и окраши-
вающее изделие в черный цвет.
Способ щелочного химического оксидирования широко приме-
няется для окончательной отделки различного рода инструментов
и изделий ширпотреба (винты, детали весов, гири, пряжки, пуговицы,
оконные и дверные ручки, задвижки и т. д.). Исследование процесса
оксидирования показало, что образование пленки проходит несколько
стадий:
1) растворение железа в щелочи с образованием закисной соли
Fe -> Na2FeO2;
2) окисление закисной соли до окисной
Na2FeO2 -> Na2Fe2O4;
3) взаимодействие закисной и окисной соли с образованием
магнитной окиси
Na2FeO2 + Na2Fe2O4 -> Fe3O4;
4) гидролиз окисной соли железа
Na2Fe2O4 + (т + 1) Н2О-> Fe2O3-mH2O;
5) частичная дегидрация гидрата окиси железа
Fe2O3-mH2O Fe2O3 (m — п) Н2О.
Указанные стадии процесса оксидирования могут быть объеди-
нены в одну общую схему процесса:
Fe -> Na2FeO2 -> Na2Fe2O4 -> Fe2O3 -> Fe2O3 (m — n) H2O
Красные налеты,
осадок на дне
ванны
Таким образом, магнитная окись железа кристаллизуется на по-
верхности железа из раствора. Формирование оксидной пленки начи-
нается с появления на металле кристаллических зародышей магнит-
ной окиси железа, которые, разрастаясь, образуют сплошную пленку.
Fe3O4
(Оксидная пленка)
394
Часть четвертая. Электрохимические и химические методы
Структура пленки и ее толщина зависят от соотношения скоро-
стей образования центров кристаллизации и роста отдельных
кристаллов: если скорость образования центров кристаллизации
значительно превышает скорость их роста (что имеет место при повы-
шенной концентрации окислителей в растворе), то на поверхности
быстро образуется тонкий плотный слой окисла и взаимодействие
металла со щелочью прекращается. При обратном соотношении ско-
ростей (что имеет место при повышенной концентрации щелочи
в растворе) образуются более толстые, но рыхлые пленки. При
этом возможно появление красно-бурого налета гидрата окиси
железа, снижающего качество покрытия.
Толстые окисные покрытия (толщиной 2—3 мк), свободные от
указанного налета, могут быть получены оксидированием изделий
в двух растворах, в первом из которых концентрация щелочи ниже
обычной. В этом растворе поверхность изделия покрывается тонкой
пассивирующей пленкой, замедляющей растворение металла, а во вто-
ром, концентрированном растворе продолжается рост окисной
пленки без образования гидроокиси железа.
Азотнокислые и азотистокислые соли, применяемые в качестве
окислителей, по-разному окрашивают окисную пленку: в присутст-
вии азотнокислых солей щелочных металлов образуются матовые
пленки черного цвета, а в присутствии азотистокислых солей —
блестящие пленки с синеватым оттенком. Первые из этих пленок
обладают большей стойкостью против коррозии, чем вторые.
Изделия из цветных металлов, а также стальные, имеющие части
из цветных металлов (запайка оловом или свинцом, вкладыши и т. д.),
оксидированию в концентрированных щелочно-окислительных раст-
ворах не подвергаются из-за возможности растравливания.
В табл. 132 приведены составы растворов и режимы химического
щелочного оксидирования. В растворах № 1 и 3 образуются преиму-
щественно блестящие пленки, а в растворах № 2 и 4 — матовые
пленки, которые, как уже указывалось, отличаются повышенной
коррозионной стойкостью. Оксидирование в растворах № 3 и 4
производится в двух ваннах, причем при переносе изделий из первой
ванны во вторую промежуточная промывка нужна лишь в случае
использования раствора № 4.
Режим оксидирования (температура раствора и продолжитель-
ность выдержки) зависит как от состава ванны, так и от марки стали.
Оксидирование производится при температуре кипения раст-
вора. Поэтому по мере испарения воды температура ванны повы-
шается. Для высокоуглеродистых сталей начальная температура
оксидирования составляет примерно 135—137°, а для легированных
сталей 140—145°.
Контроль оксидирующего раствора осуществляется путем наблю-
дения за температурой его кипения. При повышении температуры
кипения ее необходимо снизить до оптимальной путем доливания
Глава XXI. Оксидирование черных и цветных металлов
395
Таблица 132
Составы растворов и режимы химического щелочного
оксидирования стали
6 Состав раствора Режим оксидирования
Номера раств ров наименование компонентов химичес- кая формула концентрация в Г/л температура раствора в °C продолжи- тельность оксидиро- вания Q МИН.
1 Едкий натр Азотнокислый натрий Азотистокислый натрий NaOH NaNO3 NaNO2 700—800 200—250 50—70 При загрузке 138—140, при выгрузке 142—146 20—120
2 Едкий натр Азотнокислый натрий NaOH NaNO3 1000—1100 130—140 При загрузке 145—150, при выгрузке 160—165 60—90
3 Ванна 1
Едкий натр NaOH 800—900 140—145 5—10
Азотнокислый калий KNO3 25—50
Ванна 2
Едкий натр NaOH 1000—1100 150—155 30—45
Азотнокислый калий KNO3 50—100
4 Ванна 1
Едкий натр NaOH 800—900 140—145 5—10
Азотнокислый калий KNO3 25—50
Ванна 2
Едкий натр NaOH 1300—1400 160—165 20—30
Азотнокислый калий KNO3 50—100
5 Едкий натр NaOH 650—700 135—140 40—60
Азотистокислый натрий NaNO2 16—18
Азотнокислый натрий NaNO3 30—35
Хлористый натрий NaCl 18—20
396
Часть четвертая. Электрохимические и химические методы
воды; при понижении температуры кипения производится коррек-
тировка состава раствора добавлением исходных компонентов до
первоначальной концентрации.
Состав оксидирующего раствора контролируется также химиче-
ским анализом, при котором определяется содержание щелочи
азотнокислых и азотистокислых солей.
Зависимость выдержки от состава металла приведена в табл. 133.
Таблица 133
Зависимость выдержки при оксидировании от состава металла
Металл Выдержка в мии. Цвет оксидной пленки
Сталь с содержанием углерода:
0,1—0,4% 50 Синевато-черный
0,4—0,7% 30 То же
Свыше 0,7% 20 »
Легированные стали 60—120 От коричневого до сииевато- черного
Чугун и кремнистые стали 30—60 От соломенно-желтого до ко- ричневого
Оксидирование производится в железной ванне, снабжен-
ной вытяжным устройством. Ванна должна быть заземлена и тепло-
изолирована. Изделия погружают в ванну на стальных подвес-
ках или в проволочных корзинах. Температура раствора контро-
лируется термометром, погруженным в ванну в железном чехле.
На крупных предприятиях Советского Союза используются специаль-
ные автоматы типа ТОА (ТФА) для оксидирования и фосфатирования
стали. Сменная производительность этих автоматов в зависимости
от Inna составляет от 3,2 до 11,0 Т изделий.
При погружении деталей в оксидирующий раствор необходимо
следить за тем, чтобы в углубленных частях деталей не оставался
воздух. Вся поверхность деталей должна свободно омываться окси-
дирующим раствором. В процессе оксидирования при применении
стационарных ванн детали через каждые полчаса подвергаются
промежуточным ополаскиваниям холодной водой. Постепенно в ван-
нах накапливается осадок гидроокиси железа, который периодически
удаляется при помощи специальных скребков.
В табл. 134 перечислены неполадки, встречающиеся иногда при
щелочном оксидировании, и способы их устранения.
Изделия после оксидирования тщательно промывают струей
воды до полного удаления следов щелочи и подают на последующую
отделку, которая осуществляется следующим образом: изделия в те-
чение 3—5 мин. обрабатывают в кипящем мыльном растворе, содержа-
Глава XXI. Оксидирование черных и. цветных металлов
397
Таблица 134
Неполадки при химическом щелочном оксидировании
Признаки неполадок Причины возникновения Способы устранения
Оксидная пленка не образуется а) Большое содержа-* ние воды в растворе б) Весьма высокая концентрация компо- нентов а) Упарить раствор, повы- сив таким путем темпера- туру кипения б) Разбавить раствор до температуры кипения (140°)
Появление белого на- лета иа деталях при их хранении Недостаточная про- мывка деталей после оксидирования Удалить белый налет тща- тельной промывкой деталей в воде с добавлением хромо- вого ангидрида
Светлый цвет пленки или неоднотойность цвета а) Недостаточная про- должительность оксиди- рования б) Малая концентра- ция едкого натра а) Увеличить продолжи- тельность оксидирования б) Добавить раствор ед- кого натра, подняв таким путем температуру кипения
Появление красно- бурого налета на дета- лях а) Большая концен- трация едкого натра в растворе б) Большое содержа- ние в ванне гидратов окиси железа а) Разбавить раствор во- дой, снизить температуру кипения б) Удалить из ванны осадок гидрата окиси же- леза в) Промыть детали в раст- воре хромовой кислоты
Желто-зеленый налет на деталях Высокая температура раствора Понизить температуру раствора; тщательно про- мыть оксидированные де- тали
щем 20—30 Пл твердого мыла, сушат при температуре 100—110°,
и погружают на 5—7 мин. в нагретое до 100—110° минеральное
масло (машинное, веретенное, вазелиновое) или протирают прома-
сленными салфетками. Можно пропитать пленку олифой. Для этого
изделие погружают в 15—25-процентный раствор олифы в бензине
а затем сушат 2 часа при 90—95°.
Оксидирование в кислых растворах
Данный процесс, известный также под названием бесщелоч-
ного оксидирования, позволяет получать фосфатно-
оксидные пленки, антикоррозионные, адгезионные и механические
свойства которых в несколько раз превосходят свойства обычных
оксидных пленок. Другими важными преимуществами бесщелоч-
ного оксидирования являются: быстрота процесса, малый расход
тепла на обогрев ванны и возможность одновременной обработки
деталей из черных и цветных металлов.
398
Часть четвертая. Электрохимические и химические методы
В состав растворов для бесщелочного оксидирования входят
ортофосфорная кислота и окислители — двуокись марганца, азотно-
кислый кальций или барий. Фосфаты, входящие в состав пленок,
образуются в результате взаимодействия металла и фосфорной
кислоты. Образованию фосфатов способствует также препарат
Мажеф. Иногда в раствор вводится добавка ингибитора Уникол,
предотвращающая образование белого налета нерастворимых солей
на обрабатываемых изделиях.
Составы наиболее часто употребляемых растворов для бесщелоч-
ного оксидирования приведены в табл. 135.
Таблица 135
Составы растворов для бесщелочного оксидирования
Наименование компонентов Содержание в Г/л в растворах
№ 1 № 2 № 3
Ортофосфорная кислота Н3РО4 4—10 4—10 3—10
Азотнокислый кальций Ca(NO3)2-4H2O 70—100 — —
Азотнокислый барий Ba(NO3)a — 70—100 70—100
Двуокись марганца МпО2 10—20 10—20 10—20
Уникод — 8—10 —
Препарат Мажеф | — — 30—40
Оксидирование производится при температуре раствора около 100°
в течение 40—45 мин. Признаком завершения процесса оксидирова-
ния служит прекращение обильного газовыделения.
Изделия, подлежащие оксидированию в кислых растворах после
операции подготовки поверхности (т. е. после обезжиривания,
промывки, травления или пескоструйной обработки), непосредст-
венно перед оксидированием промывают в разбавленном растворе
фосфорной кислоты (8—10 Пл) при комнатной температуре.
После оксидирования детали промывают холодной, затем горя-
чей водой, помещают на 2—3 мин. в кипящий мыльный раствор,
высушивают и промасливают. По охлаждении детали протирают от
избытка масла и оставшегося налета.
Составление ванны оксидирования начинают с растворения окис-
лителя. Азотнокислый кальций и препарат Мажеф растворяют в хо-
лодной воде, а азотнойислый барий — в горячей воде при интен-
сивном перемешивании. Двуокись марганца для предотвращения
взмучивания насыпают в мешочки из хлопчатобумажной ткани,
которые укладывают на дно ванны.
Процесс бесщелочного оксидирования производится в железной
ванне, нагреваемой паром или электричеством. Контроль раствора
Глава XXI. Оксидирование черных и цветных металлов
399
для бесщелочного оксидирования осуществляется определением
содержания в нем главным образом свободной кислоты и нитрата
(кальция или бария).
Для определения содержания свободной кислоты 10 мл оксиди-
рующего раствора титруют децинормальным раствором едкого натра
в присутствии метилоранжа до изменения окраски раствора (пожелте-
ния). Израсходованный при этом определении объем (в мл) титро-
ванного раствора щелочи указывает на кислотность раствора в «точ-
ках», как это принято при контроле растворов для фосфатирования.
Кислотность оксидирующего раствора может колебаться в пределах
от 2 до 10 «точек».
Низший предел свободной фосфорной кислоты, допустимый при
загрузке деталями, соответствует 3,5—4 «точкам». Контроль раствора
и корректировку его по нитрату производят периодически, в зависи-
мости от загрузки ванны, по результатам анализа на нитрогруппу,
с последующим пересчетом на соль кальция или бария.
Содержание перекиси марганца, препарата Мажеф и присадки Уни-
кол не контролируется и не корректируется. Эти материалы вводятся
в оксидирующий раствор только при первоначальной зарядке ванны.
Неполадки, возможные при бесщелочном оксидировании, приве-
дены в табл. 136.
Таблица 136
Неполадки при химическом бесщелочном оксидировании
Признаки неполадок Причины возникновения Способы устранения
Неравномерная окра- ска поверхности Плохое обезжирива- ние изделий Улучшить подготовку из- делий перед оксидированием
Крупнокристалличе- ское строение пленки Низкая температура раствора Нагреть раствор до кипе- ния
Черный мажущий на- лет на поверхности де- талей после оксидирова- ния Большая концентра- ция свободной орто- фосфорной кислоты в растворе Уменьшить кислотность раствора, добавить к нему известь, углекислый каль- ций или барий
Тонкая просвечиваю- щая пленка с отдель- ными светлыми участ- ками Малая концентрация свободной ортофосфор- ной кислоты Добавить ортофосфорную кислоту
3. ЭЛЕКТРОХИМИЧЕСКОЕ ОКСИДИРОВАНИЕ ЧЕРНЫХ МЕТАЛЛОВ
Электрохимическое оксидирование черных металлов, так же как
и химическое оксидирование, может производиться в щелочном
либо в кислом электролите. Ниже приводятся составы ванн и режимы
оксидирования черных металлов в указанных электролитах.
400
Часть четвертая. Электрохимические и химические методы
1. Щелочной электролит
Едкий натр.............................350—600 Г/л
Режим работы: температура раствора 65—80°, плотность
тока 3—5 а/дм?, продолжительность обработки 10—30 мин.
Оксидные пленки, полученные из более концентрированных
ванн, отличаются лучшим качеством. Продолжительность оксидиро-
вания с уменьшением концентрации щелочи увеличивается. Предва-
рительно подготовленные изделия завешиваются на аноды на сталь-
ных подвесных приспособлениях, обеспечивающих хороший кон-
такт. Особенностью подготовки изделий перед электролитическим
оксидированием является то, что их после обезжиривания и декапи-
рования подвергают 10—15-минутной анодной обработке в 5-процент-
ном растворе хромпика при температуре 45—55° и плотности тока
3—5 а/дм2.
2. Кислый электролит
Хромовый ангидрид................................ 150—250 Г/л
Борфтористоводородная кислота.................... 1—2 »
Режим работы: температура 40—50°, плотность тока
5—10 а/дм2, продолжительность обработки 10—15 мин.
. Оксидные пленки, полученные электролитическим путем, имеют
глубокий черный цвет и отличаются хорошими защитно-декоратив-
ными качествами.
4. ТЕРМИЧЕСКОЕ ОКСИДИРОВАНИЕ ЧЕРНЫХ МЕТАЛЛОВ
Термическое оксидирование, т. е. окисление металла
при высоких температурах, производится в различ-
ных средах. Наиболее часто для этой цели применяют расплавленные
соли, льняное масло, водяной пар, аммиачно-спиртовые смеси и дру-
гие жидкости.
Оксидирование в солевом расплаве
Могут использоваться расплавы следующего состава:
Ванна Ki 1 Ванна Кг 2
Азотнокислый натрий NaNO3 . . .50 вес. ч. —
Азотистокислый натрий NaNO2 . . . . 50 » » —
• Хлористый кальций СаС12................ — 70 вес. ч.
Хлористый натрий NaCl.................. — 25 » »
Хлористый калий КС1 ................... — 5 » »
Режим работы: температура 400—600° (№ 1) и 500—800°
(№ 2). Продолжительность процесса 30—40 мин.
Цвет пленки, получаемой из ванны № 1, в зависимости от темпе-
ратуры может быть от красного до фиолетового, а из ванны № 2 —
от коричневого (после дополнительной обработки в льняном масле)
до черного. Эти ванны рекомендуется применять для оксидирова-
ния азотированных деталей.
Глава XXI. Оксидирование черных и цветных металлов
40
Оксидирование в парах
Для обработки стальной ленты, идущей на изготовление бритвен-
ных лезвий, применяется оксидирование в парах аммиачно-спир-
товой смеси. Лента сначала проходит через горизонтальную муфель-
ную печь длиной Зли сечением 10 X 25 см, разделенную на три
температурные зоны: 520—600° в первой, 620—680° во второй и 730—
880° в третьей. Оксидирование завершается в третьей зоне печи, где
наряду с термическим происходит и химическое воздействие паров
аммиачно-спиртовой смеси, подаваемой в печь со скоростью 50—
60 капель в минуту. Скорость движения ленты при этом составляет
12—13 м/мин. Обработанная таким образом лента имеет интенсивный
синий цвет и после охлаждения разрезается на отдельные лезвия.
При оксидировании трансформаторного железа находит широкое
применение термическое оксидирование горячим воздухом и паром.
При данном способе обработки изделия загружают в печь, повышают
температуру до 200°, включают подачу пара давлением 0,3—0,5 ат,
доводят температуру до 480° и выдерживают при этой темпера-
туре один час, затем изделию дают остыть в печи и выгружают.
5. ОКСИДИРОВАНИЕ ЦВЕТНЫХ МЕТАЛЛОВ
Одним из распространенных способов отделки поверхности изде-
лий, изготовленных из цветных металлов, является оксидирование,
которое может производиться химическим и электрохимическим
способами.
Оксидирование меди и ее сплавов
Фиг. 138. Ванна для химического окси-
дирования меди.
Химическое оксидирование ме-
ди производится в горячем пер-
сульфатно-щелочном растворе, со-
держащем 50 Пл едкого натра
и 15 Г/л персульфата калия. Про-
должительность оксидирования со-
ставляет 5 мин. Для оксидирования
латуни и оловянистой бронзы со-
держание персульфата калия в ука-
занной ванне рекомендуется сни-
зить вдвое, а продолжительность
процесса увеличить в 3—5 раз.
Оксидирование производится в ванне, устройство которой видно
из фиг. 138. Полученные этим способом пленки имеют толщину при-
близительно 1—2 мк и отличаются высоким качеством. Недостатком
этого способа является ограниченная область его применения. Он
26 ВаАиер и Дасояи
402
Часть четвертая. Электрохимические и химические методы
пригоден только для оксидирования меди, но не может быть реко-
мендован для обработки большинства медных сплавов. Недостатком
персульфатного способа является также необходимость тщательного
регулирования температуры раствора, которая должна поддержи-
ваться в узком интервале 60—65°; обработка при более низких темпе-
ратурах ухудшает качество пленки и удлиняет время оксидирова-
ния, а повышение температуры ускоряет самопроизвольное разло-
жение персульфата калия.
Химическое оксидирование латуни, содержащей около 65% меди,
производится в медноаммиачном растворе, содержащем 50—200 Г
углекислой меди на 1 л 25-процентного аммиака; температура рас-
твора 15—25°, продолжительность оксидирования 5—15 мин. Недо-
статки данного способа:
1) медно-аммиачный способ оксидирования обеспечивает получе-
ние черных пленок только на латуни, содержащей 65% меди. Латунь
с другим содержанием меди после оксидирования приобретает темно-
синюю окраску;
2) состав ванны (концентрация аммиака в растворе) в процессе
работы быстро меняется;
3) оксидные пленки, полученные данным способом, обладают
низкой механической прочностью и для защиты от повреждений
должны покрываться бесцветным лаком.
Электрохимический метод оксидирования меди и ее сплавов по
сравнению с химическими методами обладает рядом преимуществ,
главными из которых являются: возможность получения оксидных
пленок смолисто-черного цвета как на меди, так и на ее сплавах;
высокая механическая прочность получаемых пленок, исключающая
необходимость покрытия их лаком; доступность и дешевизна при-
меняемого электролита (раствор щелочи); малая зависимость про-
цесса оксидирования от концентрации раствора и простота контроля
ванны; высокая рассеивающая способность ванны электролитиче-
ского оксидирования и т. д.
Для электрохимического оксидирования меди и ее сплавов при-
меняется раствор, содержащий 150—250 Пл едкого натра. Режим
работы: анодная плотность тока 0,6—1,3 а/дм2, температура
электролита 80—90°. Продолжительность оксидирования состав-
ляет 20—30 мин. Раствор перед пуском в эксплуатацию прорабаты-
вают с медными анодами до появления светло-голубой окраски.
Катодами при оксидировании служат листы стали. Детали загружают
в ванну на медных подвесках с хорошими электрическими контак-
тами. При этом рекомендуется выдерживать детали в электролите
без тока 1—2 мин., затем включать ток и вести электролиз, посте-
пенно повышая плотность тока. Продолжительность оксидирования
может быть сокращена за счет соответствующего увеличения плот-
ности тока. Рекомендуется следующий форсированный режим окси-
дирования: в течение первых 5 мин. плотность тока равна 2—5 а/дм2',
Глава XXI. Оксидирование черных и цветных металлов
403
следующие 5 мин. — 15—10 а! дм2. Возможные при электролитиче-
ском оксидировании меди и ее сплавов неполадки и способы их
устранения приведены в табл. 137.
Таблица 137
Неполадки при электрохимическом оксидировании меди и ее сплавов
Признаки неполадок Причины возникновения Способы устранения
Оксидная пленка схо- дит при протирании деталей или при про- мывке водой Красноватый оттенок оксидной пленки Наличие на поверх- ности деталей отдель- ных участков, не по- крытых оксидной плен- кой Плохая подготовка деталей перед оксиди- рованием Низкая анодная плот- ность тока Плохой контакт дета- лей с подвесным при- способлением Снять оксидную пленку в 15—20-процентном рас- творе НС1, протравить и обезжирить детали и вто- рично оксидировать Повысить плотность тока до 5—8 а!дм? Протравить или зачистить подвесное приспособление, улучшить контакт его с ок- сидируемыми деталями
Оксидированные изделия промывают в проточной воде, сушат
при 90—100° и протирают минеральным маслом.
Оксидирование цинка
Для химического оксидирования цинка или цинковых покрытий
применяется следующий раствор:
Бертолетова соль КСЮ3............................... 20 Г/л
Медный купорос CuSO4-5H2O ......................... 200 »
Температура раствора 15—25°, продолжительность оксидирова-
ния 2—5 мин. Пленка имеет черный цвет и служит главным образом
для защитно-декоративной отделки изделий.
Электролитическое оксидирование цинка может быть произведено
в ваннах следующего состава (в Пл}\
Ванна Na 1 Ванна Na 2
Едкий натр ......................... 20 —
Двухромовокислый калий.............. — 60
Режим работы:
анодная плотность тока в а/дм? . . 6—12 0,5
температура раствора в °C ......... 40—45 15—25
Продолжительность обработки в мин. 8—10 10
Пленка, полученная из ванны № 1, имеет черный цвет, а из
ванны № 2 — черный цвет с зеленоватым оттенком. Продолжитель-
ность обработки цинковых сплавов, содержащих алюминий и медь,
в ванне № 1 должна быть увеличена до 40—60 мин.
26*
404
Часть четвертая. Электрохимические и химические методы
Оксидирование кадмия
Оксидирование кадмия и кадмиевых покрытий также применяется
для защитно-декоративной отделки изделий. При этом часто пред-
почитают электролитический метод обработки, который может быть
произведен в ванне следующего состава:
Едкое кали .........
Сода кальцинированная
25 Пл
50 »
Режим работы: анодная плотность тока 5 а/дм2, темпе-
ратура электролита 15—25°, продолжительность процесса 1—2 мин.
Полученная оксидная пленка имеет белый цвет. Для повышения
механической стойкости пленки последнюю покрывают бесцветным
лаком.
ГЛАВА ХХП
ФОСФАТИРОВАНИЕ
1. ОБЩИЕ СВЕДЕНИЯ
Фосфатирование — один из распространенных методов защиты
металлов от коррозии. Сущность данного метода заключается в созда-
нии на поверхности защищаемого металла пленки
нерастворимых фосфатов. Фосфатные покрытия после
дополнительной обработки маслами, лаками или красками надежно
защищают металлы от коррозии.
Фосфатные покрытия обладают высоким электросопротивлением
и выдерживают напряжение в пределах от 300 до 500 в. По твер-
дости фосфатная пленка превосходит медь и латунь, но она мягче
стали. Растворимость фосфатной пленки в воде при комнатной
температуре составляет около 1,5мПл, при 90° — 10,6 мПл. В кис-
лотах и щелочах фосфатные покрытия неустойчивы. Фосфатные по-
крытия выдерживают кратковременный нагрев до 400—500°, при
более высокой температуре защитная способность покрытия сни-
жается. Защитная способность обычных фосфатных покрытий выше,
чем у оксидных пленок, получаемых при щелочном оксидировании
стали. Фосфатные покрытия применяются для защиты от коррозии,
для уменьшения трения и для электроизоляции. Кроме того, фосфат-
ные покрытия служат очень хорошим грунтом для нанесения лако-
красочных покрытий.
2. ФОСФАТИРОВАНИЕ ЧЕРНЫХ МЕТАЛЛОВ
Фосфатирование может вестись химическим или электролити-
ческим путем. Существует несколько способов химического фосфати-
рования черных металлов: нормальный, ускоренный, струйный и так
называемое холодное фосфатирование.
Химическое фосфатирование
Нормальное фосфатирование
Для получения фосфатных покрытий применяют нагретые до кипе-
ния разбавленные растворы первичных фосфатов двухвалентных
металлов: марганца, железа, цинка и кадмия. При растворении
406
Часть четвертая. Электрохимические и химические методы
в горячей воде происходит гидролиз первичных фосфатов на вторич-
ные и третичные соединения и на свободную фосфорную кислоту.
При погружении в такой раствор стальных изделий железо бурно
реагирует с фосфорной кислотой и на поверхности изделия кристал-
лизуется слой нерастворимых фосфатов. Как только пленка станет
сплошной, взаимодействие железа с раствором прекращается, что
легко наблюдать по прекращению выделения водорода. Температура
раствора при фосфатировании должна поддерживаться на уровне
96—98й. Осадки, полученные при низших температурах, имеют грубо-
кристаллическую структуру, а применение более высоких температур
приводит к загрязнению покрытия шламом. Продолжительность
фосфатирования при указанной температуре составляет 0,5—2 часа.
Концентрация исходной соли, применяемой для фосфатирования
(препарата Мажеф, ГОСТ 6193—52), составляет примерно 32—35 Пл.
Фосфатирование производится в железных ваннах, снабженных
паровым или электрическим обогревом.
Для снижения расхода энергии на нагрев ванны поверхность
раствора покрывают слоем пушечного сала толщиной в 3—5 мм.
Расплавленная смазка вместе с тем предохраняет раствор от испаре-
ния. Неполадки, встречающиеся при нормальном фосфатировании,
приведены в табл. 138.
Таблица 138
Неполадки при нормальном фосфатировании черных металлов
Признаки неполадок Причины возникновения Способы устранения
Тонкая светло-серая просвечивающая фос- фатная пленка Крупнокристалличе- ское строение фосфат- ной пленки; понижен- ная стойкость против коррозии Неравномерная пят- нистая пленка Пониженная стой- кость фосфатной пленки против коррозии Недостаточная продолжи- тельность фосфатирования Травление деталей перед фосфатированием а) Плохая подготовка деталей перед фосфатирова- нием б) Материал деталей — высоколегированная сталь а) Низкая концентрация Мажефа б) Низкая температура раствора в) Неправильное соотно- шение между общей и сво- бодной кислотностью Увеличить продолжи- тельность фосфатирова- ния Заменить травление пескоструйной обработ- кой а) Улучшить очистку поверхности деталей б) Применить специ- альный раствор а) Повысить концен- трацию Мажефа до 30 Пл б) Повысить темпера- туру раствора до 97— 99° в) Откорректировать раствор
Глава XXII. Фосфатирование
407
Ускоренное фосфатирование
Нормальному фосфатированию присущи некоторые недостатки:
большая продолжительность процесса, высокая температура нагрева
раствора и необходимость ведения процесса в узком интервале тем-
ператур. Для устранения этих недостатков был разработан и получил
широкое промышленное применение процесс ускоренного фосфати-
рования. Состав и режим работы ванны ускоренного фосфатирования
приводятся ниже.
Препарат Мажеф 30 Г/л
Азотнокислый цинк Zn(NO3)2.6H2O.................... 60 »
Азотнокислый натрий NaNO3....................... 4—5 »
Фосфорная кислота Н3РО4.........................0,1—1,0 »
Рабочая температура ванны 92—96°, продолжительность процесса
8—10 мин.
Пленки, полученные из ванн ускоренного фосфатирования,
характеризуются относительно малой толщиной слоя и пониженной
коррозионной стойкостью. Детали после ускоренного фосфатирова-
ния обрабатывают в растворе двухромовокислого калия и сушат.
Полученные таким образом пленки являются хорошим грунтом для
последующего нанесения лакокрасочных покрытий.
Одной из разновидностей ускоренного фосфатирования является
струйное фасфатирование, при котором рабочий рас-
твор распыляется по предварительно подготовленной поверхности
металлических изделий. Технологический процесс струйного фосфа-
тирования, по данным автозавода им. Лихачева, сводится к следую-
щему. Детали обезжиривают в содовом растворе при температуре
75—80° в течение 1—3 мин., промывают в горячей и теплой воде
и подают на струйное фосфатирование. В состав раствора входят
Однозамещенный фосфат цинка Zn(H2PO4\ . . 14 Пл
Азотнокислый натрий NaNO3 ................... . 28 »
Углекислая медь СиСО3........................ . . 0,06 »
Распыление производится при температуре раствора 55—65*
в течение одной-двух минут. Затем изделия промывают в теп-
лой воде, обрабатывают в растворе хромовых солей, промывают
в конденсатной воде и сушат при температуре 160—180°.
Холодное фосфатирование
Пленки, полученные в растворах, не требующих подогрева,
также характеризуются относительно малой толщиной и, как пра-
вило, применяются в качестве грунта под окраску.
В настоящее время предложено большое количество рецептов
растворов для холодного фосфатирования. Состав некоторых упо-
требительных ванн и режим их работы приведены в табл. 139.
408
Часть четвертая. Электрохимические и химические методы
Таблица 139
Состав и режим работы ванн холодного фосфатирования
Наименование компонентов Содержание в Г/л в растворах
№ I K's 2 № 3 № 4
Маже* Fe <Н2Р°4)2 мажеф Мп (НарО4)2 25—30 — —
Азотнокислый цинк Zn (NO3)2-6H2O 35—40 80—100 — —
Фтористый натрий NaF 5—10 — 6 —
Монофосфат цинка Zn (Н2РО4)2 — 60—70 100 —
Нитрит натрия NaNO3 — 0,3—1,0 2 1—2
Ортофосфорная кислота Н3РО4 — — — 80—85
Окись цинка ZnO — —- — 18—21
Общая кислотность (pH или число — 75—95 75—80 рН=2,7—
«точек») «точек» «точек» 3,2
Продолжительность процесса в мин. 40 15—25 30—40 15—20
Для приготовления раствора № 1 в ванну загружают расчетное
количество Мажефа и после кипячения и отстаивания добавляют
азотнокислый цинк и фтористый натрий. Последний предварительно
растворяется в небольшом количестве кипящей воды. Монофосфат
цинка, входящего в состав ванны № 2, готовят в цеховых условиях
путем добавления к ортофосфорной кислоте расчетного количества
окиси цинка.
При приготовлении растворов № 2 и 3 сначала растворяют моно-
фосфат цинка, затем к полученному раствору добавляют остальные
компоненты по рецепту. Раствор № 4 готовится добавлением к орто-
фосфорной кислоте сначала окиси цинка, затем нитрита натрия.
Электрохимическое фосфатирование
Электрохимическое фосфатирование может производиться с при-
менением переменного или постоянного тока. Пленки, полученные
под действием тока, используются как грунт под окраску.
Недостатком этого способа фосфатирования является необходи-
мость установки в цехе дополнительного оборудования. Кроме того,
ванны имеют малую рассеивающую способность, что затрудняет полу-
чение равномерных фосфатных пленок на изделиях сложной формы.
Оба эти фактора ограничивают применение данного способа.
Для фосфатирования с применением переменного тока рекомен-
дуются следующий состав и режим работы:
Глава XXII. Фосфатирование
409
Ортофосфорная кислота ............................ 22 Пл
Окись иинка................................... . 9 »
Тринатрийфосфат .................................... 25 »
Температура раствора 65—70°, плотность'тока 2—3 а/д-м2, про-
должительность процесса 15—20 мин.
Ванна питается трехфазным током напряжением 15—20 в. Детали
завешивают на трех шинах, так, чтобы они не соприкасались между
собой и со стенками ванны Для фосфатирования с применением
постоянного тока предложен следующий состав и режим работы:
Мажеф.................................... . . 60—80 Пл
Азотнокислый цинк .... ....... 50—100 »
Окись цинка...................................*. 3—10 »
Фтористый натрий................................ 2—10 »
Температура раствора 20—30°, катодная плотность тока 0,3—
0,5 а/дм2, продолжительность процесса 10—15 мин. .Изделия заве-
шивают на катодных штангах. В качестве анодов применяют пластины
цинка. Напряжение на ванне составляет 10—15 в.
3. ФОСФАТИРОВАНИЕ ЦВЕТНЫХ МЕТАЛЛОВ
Помимо стальных изделий фосфатированию часто подвергаются
цинк, алюминий, магний и другие цветные металлы. Для цинка
и алюминия фосфатные пленки служат грунтом под окраску, а для
магния — средством защиты от коррозии. Ниже приведена рецеп-
тура ванн для фосфатирования указанных цветных металлов
Таблица 140
Состав раствора и режим работы ванн для фосфатирования цветных металлов
Наименование компонентов и режим работы Содержание в Г/л в растворах
№ I № 2 № 3
Ортофосфорная кислота 10—15 — —
Азотнокислый цинк 20 — 50
Фторборат цинка 10—15 -— —
Мажеф —- 27—32 60—65
Фтористый натрий — 0,2—0,3 8
Окись цинка —- -— 10—15
Температура раствора в °C 75—85 97—99 20—30
Продолжительность процесса в мин. 1—5 30—40 20—25
(табл. 140). Электролит № 1 применяется для фосфатирования алю-
миния, электролит № 2 — для фосфатирования магния и его сплавов,
а электролит № 3 — главным образом для фосфатирования цинка,
но может быть использован и для обработки алюминия и некоторых
его сплавов.
ГЛАВА XXIII
ЭМАЛЕВЫЕ И ЛАКОКРАСОЧНЫЕ ПОКРЫТИЯ
Эмалирование и покрытие металлов органическим материалами
(лаки, краски),* наряду с гальваническими покрытиями, находят
очень большое применение для защиты металлов от коррозии. Так,
например, окраске подвергается более 60% всей поверхности ме-
талла, защищаемой от коррозии покрытиями, причем во многих
случаях лакокрасочные покрытия применяются в сочетании с галь-
ваническими, оксидными и цинк-фосфатными покрытиями. Однако
эмалирование и окраска металлов не относятся к числу электро-
химических методов покрытий и изучаются обычно самостоятельно,
в других курсах.
Включение некоторых кратких сведений об этих видах защитно-
декоративных покрытий в данный учебник обусловлено требова-
ниями действующей программы по спецдисциплине «Технология
электрохимических покрытий» для учащихся техникумов.
А. ЭМАЛЕВЫЕ ПОКРЫТИЯ
1. ОБЩИЕ СВЕДЕНИЯ
Эмали представляют собой глухие (непрозрачные) белые или
окрашенные легкоплавкие стекла. Они применяются для покрытия
(эмалирования) тонким слоем металлических изделий с целью за-
щиты их от коррозии. Кроме того, эмалирование изделий придает
им красивый внешний вид. В соответствии с этим эмали подразде-
ляются на две большие группы: технические и художественные.
Технические эмали применяются для эмалирования изделий из
чугуна и стали (бытовая посуда, стиральные машины, электрохоло-
дильники, санитарно-техническое оборудование и химическая аппа-
ратура: кристаллизаторы, автоклавы, вакуум-фильтры, реакторы
и т. Д-), а художественные эмали—для украшения изделий из золота,
серебра и меди, а иногда и из черных металлов.
Технические эмали для стальных и чугунных изделий
в свою очередь делятся на две группы: грунтовые и пок-
ровные.
Грунтовые эмали служат для создания промежуточного
силикатного слоя между металлом и покровной эмалью. Грунтовая
Глава XXIII. Эмалевые и лакокрасочные покрытия
411
эмаль изолирует поверхность металла от воздействия коррозионной
среды. Наличие такого промежуточного слоя улучшает сцепление
покрытия и в целом благоприятствует получению более прочных
эмалевых покрытий. Промежуточный слой компенсирует механи-
ческие и термические напряжения, возникающие между металлом
и покровной эмалью.
Покровные эмали служат для защиты грунта от меха-
нических повреждений и придают изделиям красивый внешний вид.
Эти эмали, кроме того, должны обладать достаточно высокой.хими-
ческой стойкостью в различных агрессивных средах. Покровные
эмали бывают глухие — белые (криолитовые, оловянные, сурьмя-
ные, циркониевые и др.) и окрашенные, а также прозрачные —
бесцветные и окрашенные.
В соответствии с указанными назначениями к грунтовым и по-
кровным эмалям предъявляют следующие требования. Температура
плавления грунтовой эмали должна быть на 50—100° выше темпера-
туры плавления покровной эмали. Температура плавления грунтовых
эмалей обычно составляет 800—1000°, а покровных эмалей 750—
900°.
Эмали в зависимости от их состава и условий получения могут
отличаться повышенной кислото- и щелочестойкостью, термостой-
костью и иметь любую окраску. Для приготовления эмалей ма-
териалы, входящие в состав шихты, сплавляют в печах при тем-
пературе’ 1150—1300° и вливают расплав в воду для гранулиро-
вания. Гранулы эмали размалывают в шаровых мельницах с во-
дой и глиной для получения эмалевого шликера, который
поступает затем в цех эмалирования.
В последнее время разработана новая технология грануляции,
схематически показанная на фиг. 139. Расплавленная эмаль из
печи 1 вытекает струей 2 на валки 3, охлаждаемые изнутри водой.
Из-под валков выходит лента охлажденной эмали 4 шириной
500—600 мм и толщиной 0,5—0,8 мм, которая на вибрационном
транспортере 5 распадается на отдельные лепестки размером6— 10-м.м.
Полученная эмалевая фритта подается транспортером через ма-
гнитный сепаратор в упаковочную машину 6 или бункер запаса.
Производительность описанной установки составляет 400—500 кГ/ч.
2. ТЕХНОЛОГИЯ ЭМАЛИРОВАНИЯ И ПРИМЕНЯЕМОЕ ОБОРУДОВАНИЕ
Металлические изделия перед эмалированием, так же как и перед
нанесением других видов покрытий, подвергают химической или
пескоструйной очистке. На крупных предприятиях химическая
очистка изделий осуществляется на конвейерных установках; в этом
случае длительность всего процесса очистки (обезжиривание, трав-
ление, промывка, нейтрализация и сушка) составляет около 4 мин.
Для нанесения эмали применяют либо мокрый, либо сухой
(пудровый) способ. Технология грануляции' эмали представлена
412
Часть четвертая. Электрохимические и химические методы
на фиг. 139. Эмалирование по мокрому способу складывается
из следующих операций:
1) нанесение грунтовой эмали погружением, обливом или пуль-
веризацией;
2) сушка покрытых изделий;
3) обжиг первого слоя эмали в печах непрерывного или периоди-
ческого действия;
4) охлаждение изделий;
5) нанесение покровной эмали;
6) обжиг эмали в тех же печах.
Из перечисленных операций наиболее трудоемкой является по-
крытие изделий эмалевым шликером. Плоские детали, подлежащие
покрытию, укладываются на транспортер, который проходит через
камеру с непрерывно действующими пульверизаторами. Покрытие
полых изделий производится на специальных устройствах.
Одно из таких устройств, применяемое для покрытия цилиндров
водогрейных установок, показано на фиг. 140. Изделия поступают
в камеру на транспортере. В камере они приподнимаются роли-
ками и получают медленное вращение, во время которого произво-
дится пульверизация внутренней поверхности при помощи пульве-
ризаторов. При сухом способе эмалирования изделия предвари-
тельно нагревают в печах. Затем раскаленные изделия извлекают
из печи, опудривают 2—3 раза с помощью электрических сит тонким
порошком эмали и обжигают каждый слой до полного расплав-
ления эмали.
В последнее время Е. Н. Подклетновым разработана и внедрена
в промышленность совершенно новая технология эмалирования,
основанная на индукционном нагреве изделий токами высокой ча-
стоты. При этом вместо нагрева металла на всю толщину, как это
Глава XXIII. Эмалевые и лакокрасочные покрытия
413
делается в обжигательных печах, нагревается лишь поверхностный
неглубокий слой металла. Было установлено, что одновременное
оплавление эмали по всей поверхности, производимое в печах, можно
заменить оплавлением отдельных участков поверхности в электро
магнитном поле с последующим оплавлением промежуточных участ
ков; при этом места сплавления
эмалевых пленок по своим свой-
ствам не отличаются от основной
эмалевой пленки. На основании
этих данных были созданы уста-
новки, в которых обжиг эмалей
производится в электромагнитном
поле на механических станках с
автоматическим управлением.
Одна из таких установок пред-
ставляет собой неподвижный коль-
цевой индуктор с тележкой, на
которой располагается эмалиру-
емое изделие. Существуют также
установки, в которых изделие
укрепляется неподвижно, а ин-
дуктор совершает рабочее движе-
ние вдоль изделия.
Предложенный Е. Н. Подклет-
Фиг. 140. Устройство для покрытия
больших цилиндров водогрейных уста-
новок.
новым метод эмалирования на станках-автоматах имеет большие
преимущества перед процессом эмалирования в печах:
1) значительно сокращается продолжительность процесса эмали-
рования;
2) индукционная установка экономичнее печных установок;
3) качество эмали, полученной на индукционных установках,
лучше, чем эмали, полученной на печных установках;
4) имеется возможность эмалирования больших поверхностей
при относительно малой мощности генератора;
5) исправление брака возможно без удаления эмали со всей по-
верхности изделия.
Б. ЛАКОКРАСОЧНЫЕ ПОКРЫТИЯ
1. ОБЩИЕ СВЕДЕНИЯ
Лакокрасочными покрытиями называются пленки, образующиеся
на поверхности металла, дерева, штукатурки, стекла и других кон-
струкционных материалов в результате нанесения на них жидких
лаков, олифы, красок или эмалей.
Лаки и олифы представляют собой чистые пленкообра-
зующие вещества; смеси их с пигментами и наполнителями назы-
ваются красками и эмалями.
Ч1Ч
часть четвертая. Электрохимические и химические методы
Для приготовления пленкообразователей используются расти-
тельные масла, животные жиры, естественные и искусственные
смолы.
Одним из важнейших лакокрасочных материалов являются
олифы. Натуральные олифы приготовляют из чистых
высыхающих масел (льняного, конопляного), полунатураль-
ные (экономические) олифы готовят из пол у высыхающих расти-
тельных масел методом полимеризации, оксидации и вулканиза-
ции. Основное назначение их — разведение густотертых красок
до малярной вязкости. Искусственные олифы полу-
чаются из самого разнообразного сырья. Они совсем не содержат
высыхающих масел и применяются только для окрасочных работ
внутри помещений.
Лаками называются жидкости, которые при нанесении на по-
верхность тонким слоем способны высыхать с образованием тонкой
эластичной блестящей пленки.
Различают лаки двух видов: смоляные лаки, высыхание
которых происходит за счет испарения растворителя, и масля-
ные лаки, отверждение которых идет не столько за счет испа-
рения растворителя, сколько главным образом за счет окисления
и полимеризации.
Красками называются пригодные для малярных работ
разбавленные олифой или лаком пигментные пасты. Можно также
сказать, что краски представляют собой дисперсные системы, состоя-
щие из нерастворимых красящих веществ — пигментов, перетер-
тых на лаках или олифах. Пигменты улучшают атмосферостойкость
лаковых пленок и их механическую прочность.
Основными пигментами при покрытии железа являются свинцовые
белила, цинковые белила, литопон, свинцовый сурик, железный
сурик, сернистый кадмий, киноварь, сажа, ультрамарин и др.
Краски делятся на масляные, в которых пленкообразователем слу-
жит масло или натуральная олифа, и лаковые или эмалевые, где
в состав пленкообразователя входят смолы или эфиры целлюлозы.
Кроме указанных материалов, в малярной технике широко при-
меняются грунтовки и шпаклевки.
Грунтовки представляют собой масляные или лаковые
композиции, с соответствующими пигментами, наносимые непосред-
ственно на покрываемое изделие для обеспечения сцепления после-
дующего покрытия с изделием.
Шпаклевками называются пигментные пасты, изготовлен-
ные на различных связующих и предназначенные для устранения
неровностей окрашиваемой поверхности.
Для растворения различных лакокрасочных материалов, а также
для их разведения до рабочей вязкости применяют олифу, скипидар,
спирт, толуол, ксилол, бутанол, уайт-спирит, этил целлозольв
и другие органические жидкости.
Глава XXIII. Эмалевые и лакокрасочные покрытия 415
2. КЛАССИФИКАЦИЯ ЛАКОКРАСОЧНЫХ МАТЕРИАЛОВ
Из большого количества лакокрасочных материалов, классифи-
цируемых обычно по роду пленкообразователя, рассмотрим вкратце 1
следующие основные группы: битумные, масляные, алкидные, фенол-
формальдегидные, виниловые, эпоксидные, материалы, материалы
на основе эфиров целлюлозы и кремнийорганические соединения.
Битумные материалы состоят из битумов, асфальтов
и каменноугольного пека, растворенных в ксилоле, сольвентнафте
или уайт-спирите (лаковый бензин). Лакокрасочной промышлен-
ностью выпускаются чистые битумные материалы, а также битумно-
масляно-смоляные материалы. Покрытия из первых отличаются
хорошей водостойкостью, а покрытия из вторых — повышенной
атмосферостойкостью. Битумные лакокрасочные материалы при-
меняются для защиты металлических изделий от коррозии (лак
№ 67, ГОСТ 312—43, Кузбасслак, ГОСТ В-1709—42) и в качестве
грунтовочных покрытий для транспортного оборудования (лак № 177
и краска АЛ-177, ГОСТ 5631—51, эмаль черная 4-1, ГОСТ 2346—43,
и эмаль черная 4-2, ГОСТ 2347—43).
Масляные лакокрасочные материалы вклю-
чают масляно-канифольные и масляно-глифталевые краски, эмали
и лаки. Они отличаются хорошими физико-механическими свойст-
вами.
В настоящее время выпуск масляных лаков ограничен ввиду
дефицитности сырья (высыхающих растительных масел). Некоторое
применение находят лак № 17А (ГОСТ 3862—47), применяемый для
временной защиты металлических деталей при складском хранении;
лак изоляционный № 302 (ТУ МХП 1355—46), применяемый для по-
крытия металлических поверхностей электрооборудования, лак
№ 331, «Мороз» (ТУ МХП 1045—43) и т. д.
Алкидные (полиэфирные) материалы пред-
ставляют собой продукты взаимодействия многоосновных кислот
и спиртов. Они являются в настоящее время наиболее распростра-
ненным видом лакокрасочных материалов. Особенно широкое приме-
нение находят глифталевые и пентафталевые лако-
красочные материалы. Первые из них получают модифицирова-
нием глифталевых смол различными высыхающими и полувысыхаю-
щими маслами, а вторые изготовляются на смоле, получаемой при
взаимодействии фталевого ангидрида с пентаэритритом.
Глифталевые эмали применяют для окраски авто-
мобилей, автобусов; для окраски сельскохозяйственных машин
и всевозможных аппаратов и приборов, эксплуатируемых в закрытых
1 Более детальные сведения о лакокрасочных материалах, выпускаемых нашей
промышленностью, можно найти в книгах Б. В. Любимов «Специальные лакокра-
сочные материалы в машиностроении», Машгиз. 1959 и А. Я. Дринберг н др. «Техно-
логия пленкообразующих веществ», Госхимиздат, 1955.
416
Часть четвертая. Электрохимические и химические методы
помещениях; успешно используются глифталевые эмали марки ФСХ
(ГОСТ 926—52); к этой же группе лакокрасочных материалов отно-
сятся глифталевые эмали общего назначения марки ФО (ГОСТ 64—56);
эмали для электроизоляционных (ТУ МХП 1557—43) и теплоизоля-
ционных (ТУ МХП 1924—49) покрытий.
Среди пентафталевых эмалей особенно выделяются эмали
марки ПФ (ГОСТ 6465—53) и эмали 560 (белая), 670 (красная), 680
(черная), 690 (защитная), выпускаемые по ТУ МХП 1764—51. Эти
материалы применяются для защитно-декоративных целей.
Пентафталевые лаки № 170 (ТУ МХП 1308—45) и 170а (ТУ МХП
4123—53) используются для разведения пентафталевых эмалей и для
нанесения последнего слоя покрытия.
К этой группе лакокрасочных материалов относятся также алкид-
номеламиновые эмали горячей сушки различных цветов (ВТУ МХП
4506—57), применяемые для окраски легковых автомобилей.
Фенолформальдегидные материалы получают
из смол. Необходимые для приготовления этих лакокрасочных мате-
риалов смолы получают конденсацией фенола с формальдегидом
в присутствии кислого или щелочного катализатора. В зависимости
от условий конденсации получаются смолы с различными свойствами.
Так, при избытке формальдегида и применении щелочного катали-
затора образуются термореактивные (резольные) смолы, а при избытке
фенола и кислом катализаторе — термопластичная смола.
Фенолформальдегидные лакокрасочные материалы изготовляют
из резольной смолы растворением ее в спиртах. Главнейшими пред-
ставителями этих материалов являются бакелитовые лаки марки
А (ГОСТ 901—56). Эти лаки применяют для покрытия металлов при
защите их от коррозии и для покрытия неметаллических материалов
(гетинакса, текстолита) с целью улучшения их диэлектрических
свойств. Для повышения водостойкости и маслостойкости в состав
бакелитовых лаков, применяемых для защиты металлов от корро-
зии, добавляют 10—15% алюминиевой пудры.
Лакокрасочные покрытия на основе 100-пропентных фенолфор-
мальдегидных смол, модифицированных льняным и тунговыми мас-
лами, а также алкидными смолами, отличаются высокими механике;
скими свойствами, устойчивостью к действиям обычной атмосферы,
разбавленных кислот, щелочей и минеральных масел. К числу этих
материалов относятся: грунты ФЛ-ОЗК, ФЛ-013, ФЛ-ОЗОК
и ФЛ-ОЗКК (ГОСТ 9109—59), применяемые в покрытиях, эксплуати-
руемых в тяжелых коррозионных условиях (первые два грунта при-
меняются для покрытия черных металлов, а остальные — для покры-
тия цветных металлов); покровные эмали ФЛ-14 и ФЛ-76,
применяемые для отделки изделий, работающих в условиях тропиче-
ского климата.
Лакокрасочные материалы на основе вини-
ловых смол (грунты, эмали и лаки) готовятся растворением
Глава XXIII. Эмалевые и лакокрасочные покрытия
417
перхлорвиниловых смол в соответствующих растворителях. Эти
материалы отличаются атмосферостойкостью, водостойкостью и
устойчивостью к ряду агрессивных химических сред. Они широко
применяются как защитно-декоративные покрытия, работающие
в обычных условиях и в тропическом климате. Из числа пер-
хлорвиниловых лакокрасочных материалов, выпускаемых про-
мышленностью, необходимо отметить следующие: эмали ПХВ
различных цветов (ГОСТ 6993—54), применяемые для окраски метал-
лических и деревянных конструкций; эмали ХВЭ разных цветов,
применгемые в самолетостроении для окраски изделий из алюми-
ниевых и магниевых сплавов; химически стойкие эмали ХСЭ
различных цветов (7313—55), применяемые для защиты металлокон-
струкций; эмали ПХВ-714 и ПХВ-715,“применяемые для окраски
приборов и аппаратов, направляемых в страны с тропическим клима-
том; грунты ХСГ-26 и ХВГ-1, применяемые для грунтования метал-
лических и деревянных изделий; бесцветный лак ХСЛ, применяе-
мый в составе перхлорвиниловых эмалей в количестве до 50% для
увеличения глянца при нанесении последнего слоя покрытия, и т. д.
Лакокрасочные материалы на основе
эпоксидных смол представляют значительный интерес
среди новых видов лакокрасочных материалов. Они представляют
собой продукты поликонденсации, образующиеся при сочетании
многоатомных фенолов с различными органическими соединениями,
содержащими эпоксигруппы.
Эпоксидные смолы, известные за границей под названием
эпоны, эпикоты, эпоксисилины и т. д., получили
распространение в технике благодаря комплексу ценных свойств.
Указанные смолы обладают высокой прочностью, отличной адгезией
к металлам, малой усадкой при отверждении (0,5—1.0%), весьма
высокой стойкостью во многих агрессивных средах (соляная и фос-
форная кислоты, едкие щелочи, хлорсодержащие соединения), водо-
стойкостью и, наконец, очень высокими электроизоляционными
свойствами.
На основе этих смол изготовляются грунты и эмали.
Из эпоксидных смол выпускаемых в СССР, необходимо отметить
следующие марки:
смола Э-40 — для изготовления шпаклевок, заливочных масс
и клеев;
смола Э-41 — для изготовления водощелочестойких лаков
и эмалей:
смола Э-44 — для изготовления высококачественных защитных
покрытий.
Лакокрасочные материалы на . основе
к р е м н и й о р г а н и ч е с к и х смол. К числу новых синтети-
ческих материалов для изготовления высококачественных лаков
и эмалей относятся кремнийорганические смолы.
27 Вайнер и Дасоян
418
Часть четвертая. Электрохимические и химические методы
Кремнийорганическими называются такие органические соеди-
нения, в цепях которых часть атомов углерода замещена атомами
кремния. Цепи кремнийорганических веществ, образованные по-
очередно связанными друг с другом атомами кремния и кислорода,
называются силоксанами. Наличие силоксановой связи в кремний-
органических соединениях обусловливает повышенную теплостой-
кость, высокие диэлектрические показатели, инертность по отноше-
нию к химическим реагентам и т. д.
В зависимости от требований практики кремнийорганические
соединения могут быть получены с теми или иными физико-хими-
ческими свойствами. Так, например, наличие длинных углеводород-
ных цепей или уменьшение числа силоксановых связей обусловли-
вает эластичность продукта. И, наоборот, увеличение содержания
кремния сообщает продукту хрупкость, но зато повышает его термо-
стойкость.
Хорошая растворимость кремнийорганических соединений
в органических растворителях позволяет применять их в виде лаков
и эмалей. Они характеризуются термостойкостью (могут работать
при нагреве до 350—450°), химической инертностью (не окисляются
кислородом и сильными окислителями), водостойкостью, обладают
незначительной летучестью, имеют высокие электроизоляционные
характеристики.
Кремнийорганические жидкие полимеры используются для изоля-
ции конденсаторов, применяются в качестве пластификаторов для
получения морозостойких пластмасс, резины. Они могут успешно
применяться в качестве уплотнителей и защитных покрытий, способ-
ных работать как при низких, так и при высоких температурах.
Распространенными являются следующие кремнийорганические
лакокрасочные материалы: лак ФГ-9 (ТУ МХП 2273—53), состоя-
щий из смеси раствора смолы марки Ф-9 в ксилоле или толуоле
и раствора полуфабриката ФХ-02 в смеси уайт-спирита и ксилола;
эмаль № 9 состоит из 94 частей лака ФГ-9 и 6 частей алюминиевой
пудры; применяются для теплостойких и коррозионностойких покры-
тий; эмаль КО-81 (ТУ МХП 5—56) зеленого цвета состоит из суспен-
зии окиси хрома в кремнийорганическом лаке; применяется в качестве
теплостойких покрытий, выдерживающих нагрев до 250°; эмаль
АСМЛ-31 белого цвета, представляет собой смесь лака марки К-44
с окисью титана. Пленки из этой эмали выдерживают воздействие
температуры до 350°.
Лакокрасочные материалы на основе эфи-
ров целлюлозы также являются весьма распространен-
ными. Исходное сырье — целлюлоза — изготовляется из хлопка
или древесины. После обработки целлюлозы смесью азотной и серной
кислот получают нитроцеллюлозу, а при обработке уксусной кисло-
той — ацетилцеллюлозу. Первая применяется для приготовления
нитролака, а вторая — ацетилцеллюлозного лака. Взаимодействием
Глава XXIII. Эмалевые и лакокрасочные покрытия
419
целлюлозы с эфирами получают также метилцеллюлозиые или этил-
целлюлозные лаки.
Из перечисленных лаков наибольшее распространение получили
нитролаки и нитроэмали, отличающиеся высоким блеском, бензо-
и маслостойкостью, удовлетворительной атмосферостойкостью и элас-
тичностью. Основным же преимуществом тех и других целлюлозных
лакокрасочных материалов является их быстрое высыхание при
обычных температурах.
Нитроцеллюлозные лакокрасочные материалы, -выпускаемые
промышленностью, обычно делятся на авиационные, автомобильные
и материалы общего назначения. К числу авиационных марок нитро-
эмалей и нитролаков относятся: эмаль МВ (ТУ МХП КУ 2477—56)
разных цветов; эмаль ДМ (ТУ МХП 520—54) для окраски авиацион-
ных изделий, не подвергающихся непосредственному воздействию
атмосферы; эмали НП разных цветов для окраски различных при-
боров и аппаратов; лак АВ-4 для самолетных винтов, лыж и пр.
Автомобильные нитроэмали выпускаются по ТУ МХП 4508—56
и по ГССТ 7930—56. Они предназначаются для окраски наружных
поверхностей легковых и грузовых автомашин. К группе лакокра-
сочных материалов общего промышленного назначения относятся
нитроэмали марок ДМО (ГОСТ 5406—50). Эти эмали приме-
няются для окрашивания изделий, эксплуатируемых в помещениях.
В табл. 141 приводится качественная характеристика стойкости
основных видов лакокрасочных материалов в условиях воздействия
различных агрессивных сред.
Таблица 141
Качественная характеристика стойкости основных видов лакокрасочных
покрытий в условиях воздействия различных агрессивных сред
Вид покрытия
ф • гг tf ф 2 ф
ф ч Sts т О S к
Агрессивная среда ф 2 ж ф 3 я ф 3 со ф Ч га со ф Ч га •е га S о •&ф ф 2 со о к S’ h 2 Ч ф о о «5 К 2 2 S Ч К
ч •е О X S “o' . о. О <V
S га S S с S СП га ж •е Хо к (П
Атмосферные условия средних широт н У п п п п У X X п
Тропический климат н н X X п п н У X п
Пресная вода X У У У X п У У X п
Морская вода У н У У У X н У У X
Минеральные масла н н X X X п У п У X
Углеводороды н н У У X У X X н п
Кислоты У н У н X п У У У X
Щелочи н н н н X У У У н п
Обозначения:
Н — низкая;
X — хорошая;
У — удовлетворительная;
П — превосходная.
27*
420
Часть четвертая. Электрохимические и химические методы
3. ТЕХНОЛОГИЯ НАНЕСЕНИЯ ЛАКОКРАСОЧНЫХ ПОКРЫТИЙ
И ПРИМЕНЯЕМОЕ ОБОРУДОВАНИЕ
Технологический процесс нанесения лакокрасочных покрытий
состоит из следующих операций:
1) подготовка изделия к окраске;
2) грунтование;
3) шпаклевание;
4) шлифование;
5) окраска;
6) сушка.
Подготовка металллических изделий
к окраске преследует цель очистить металл от окалины, ржав-
чины, жировых и других загрязнений, чем обеспечивается непосред-
ственный контакт между металлом и покрытием. Это достигается
обычными методами подготовки, которые были рассмотрены
в гл. V и VI.
Грунтование — нанесение на изделие первого лакокрасоч-
ного слоя (грунта), который обеспечивает прочное сцепление после-
дующих лакокрасочных слоев с покрываемым материалом. Грунт
может наноситься кистью, распылением или окунанием. Лучшим спо-
собом является распыление. К грунтам, предъявляются следующие
требования: хорошее сцепление с окрашиваемой поверхностью; сов-
местимость с лакокрасочными материалами, наносимыми по этому
грунту. Кроме того, они должны отличаться по цвету от слоя окраски
(для возможности визуального контроля сплошности окраски).
Широкое применение находят также фосфатирующие грунты,
представляющие собой суспензии пигментов, растертых на спирто-
растворимых смолах, с добавкой фосфорной кислоты. Последние
придают грунту высокие антикоррозионные свойства.
Шпаклевка наносится на высушенный грунт с целью вырав-
нивания поверхности изделия.
Нанесение шпаклевки производится с помощью механического
или ручного шпателя, а также методом воздушного распыления.
При отделке изделий под декоративные покрытия шпаклевание и шли-
фование слоя производится многократно: местное шпаклевание
(выравнивание отдельных наиболее глубоких неровностей); сплош-
ное шпаклевание всей поверхности; выравнивание мелких дефектов
(царапинотшкурки) на зашпаклеванной поверхности. Общая толщина
слоя шпаклевки не должна превышать 0,5 мм. Эпоксидная шпаклевка
может наноситься слоем до 1,5—2 мм.
Шпаклевка, улучшая внешний вид лакокрасочных покрытий,
одновременно ухудшает их механическую прочность и защитные
свойства. Поэтому там, где это допустимо, следует обходиться без
применения шпаклевки. Шпаклевка производится с помощью дере-
вянных, резиновых или стальных шпателей.
Глава XXIIJ. Эмалевые и лакокрасочные покрытия
421
Шлифование поверхности производится с целью сглажи-
вания неровностей слоя шпаклевки или слоев лакокрасочных покры-
тий. Шлифование выполняется путем обработки поверхности абра-
зивными материалами или шлифовальными шкурками.
В качестве абразивных материалов применяются: пемза, корунд,
наждак, карборунд и др. Для шлифования различных лакокрасоч-
ных покрытий используются следующие шкурки: тонкие (размер
зерен 10—30 мк)—для шлифования нитролаков и нитроэмалей;
средние (размер зерен 40—100 мк) — для шлифования масляных
лаков; грубые (размер зерен 80—200 мк) — для шлифования шпак-
левки. К шлифованию приступают только после полного высыхания
поверхности и производят его либо вручную, либо механизированно,
с применением пневматических или электрических шлифовальных
машин.
Различают сухое и мокрое шлифование. В последнем случае
поверхность изделий в процессе работы обильно смачивают водой,
уайт-спиритом или скипидаром и применяют водостойкие шкурки,
изготовленные на неразмокаемой бумаге. Сухое шлифование приме-
няется для твердых и хрупких покрытий (тощие лаки и краски,
шпаклевка), а мокрому шлифованию обычно подвергают масляно-
лаковые, глифталевые и другие покрытия.
Окраска загрунтованных, зашпаклеванных и отшлифован-
ных изделий производится последовательно наносимыми слоями
лакокрасочного покрытия. Последующий слой может наноситься
только после полного высыхания предыдущего.
Окраска изделий может выполняться кистью, окунанием или
обливанием, воздушным распылением (пульверизацией) или рас-
пылением в электростатическом поле, накаткой краски вальцами
и др.
Окраска кистью не требует специального оборудования
и сложных приспособлений, отличается простотой, применима для
изделий любого размера. Недостатком метода является большая
трудоемкость и низкая производительность. Окраска кистью непри-
менима для нанесения быстросохнущих и плохо растушевываю-
щихся лакокрасочных материалов.
Кисти и щетки, употребляемые для нанесения лакокрасочных
покрытий, различаются по форме, величине, качеству и длине волоса
и щетины. Для густых красок обычно используют кисти с короткой
щетиной, а для жидких материалов — кисти с длинной щетиной.
Внешний вид наиболее часто применяемых кистей приведен
на фиг. 141. Для лучшей сохранности кистей их после работы сле-
дует промывать растворителем и теплой водой с мылом и хранить
в специальном сосуде с водой (фиг. 142).
Окраска окунанием и обливанием пригодна
для покрытия изделий обтекаемой формы и больших размеров.
Метод отличается простотой и высокой производительностью.
Часть четвертая. Электрохимические и химические методы
Глава XXIII. Эмалевые и лакокрасочные покрытия
423
Он особенно рекомендуется в конвейерных установках, где процесс
окраски сочетается с процессом последующей сушки окрашенных
изделий.
Участок конвейерной установки с ванной для окраски показан
на фиг. 143. Как видно из фигуры, изделия подвешиваются к роликам,
движущимся по монорельсу. Над ванной монорельс изогнут вниз,
благодаря чему детали погружаются в ванну и затем выходят из нее.
Недостатком метода является необходимость установки больших
ванн для крупногабаритных изделий, а также подтеки краски
и неравномерность толщины получающейся пленки. Важное значение
имеет способ подвески изделий. На
фиг. 144 изображены правильные
{1, 3) и неправильные (2, 4) способы
подвески предметов различной
формы.
Для покрытия объектов с боль-
шими поверхностями вместо оку-
нания может применяться окраска
обливанием. Простейшим оборудо-
ванием для этого метода является
ванна, закрываемая сеткой, на
которой устанавливают изделия,
предназначенные для окраски.
Краска подается по шлангу из рас- Фиг. 144. Правильная и неправильная
положенного на некоторой высоте подвеска изделий,
бачка. Излишняя краска стекает
в ванну, откуда насосом накачивается обратно в бак.
Недостатком этого способа окраски является необходимость
частой очистки обливающих аппаратов и камер.
Окраска воздушным распылением (пульве-
ризацией) заключается в том, что лакокрасочный материал рас-
пыляется под действием струи воздуха на мельчайшие частипы, ко-
торые с большой скоростью направляются на покрываемую поверх-
ность.
Распыление производится сжатым воздухом (3—8 ат) с помощью
специальных пульверизаторов. Этот метод окраски применим для
покрытия изделий любой формы и отличается высокой производи-
тельностью труда. Он обеспечивает высокое качество покрытия.
Недостатком метода является повышенный расход краски и рас-
творителя, в более или менее значительных количествах распыляе-
мых в воздух, а также и необходимость устройства распылительных
камер. Одним из распространенных типов краскораспылителей яв-
ляется пистолет-распылитель КР (фиг. 145). Подача краски в рас-
пылитель может осуществляться самотеком — из прикреплен-
ного сверху стаканчика или с подсасыванием — из прикрепленного
снизу стаканчика и от красконагнетательного бачка. Большое
Фиг. 145. Разрез корпуса краскораспылителя типа КР:
/— головка; 2— сопло; 3— верхний патрубок; 4 — вилка; 5— ось; 6—муфта;
7 — пружина; 8~ ручка; 9 — воздушная трубка} 10 — крючок; //—нижний
патрубок; 12 — игла.
Фиг. 146. Бестуманный пистолет-распылитель
типа 0-31А:
1 — корпус; 2 — заглушка; 3 — игла; 4— штуцер
сопла; 5 — головка; 6 — сопло; 7 — ниппель
краски; 8 — курок; 9 — ручка; 10 — ниппель
воздуха; 11 — регулятор.
424 Часть четвертая. Электрохимические и химические методы
Глава XXIII. Эмалевые и лакокрасочные покрытия
425
Фиг. 147. Схема, поясняющая преимущества краскораспылителя БТО-Зм:
а — распылитель типа К.Р-Ю; б — распылитель БТО-Зм.
Фиг. 148. Распылительная тупико- Фиг. 149. Распылительная проходная ка-
вая камера для мелких деталей. мера для крупногабаритных изделий.
Часть четвертая. Электрохимические и химические методы
Фиг. 150. Схема окраски в электростатическом поле:
/ — высоковольтный трансформатор и выпрямитель (выпрямительный блок); 2 — подвесной конвейер; 3 — кабель
высокого напряжения; 4 — детали; 5 — чашечные распылители; 6 — пневматические цилиндры для качения рас-
пылителей; 7 — изолятор стойки чашечных распылителей; 8 — бачок для краски; 9 — шланг сжатого воздуха;
10 — пульт управления.
Глава XXIII. Эмалевые и лакокрасочные покрытия
427
распространение нашел также пистолет-распылитель типа 0-31А
(фиг. 146); конструкция распылительной головки этого пистолета
позволяет снизить туманообразование, а следовательно, уменьшить
потери краски. Однако этот распылитель требует большего расхода
воздуха. Наиболее современным является бестуманный пистолет-
распылитель типа БТО-Зм (фиг. 147). Образование тумана при
работе этим пистолетом устраняется путем создания воздушной
завесы, обволакивающей струю краски, а также за счет применения
низкого давления (1—1,5 ат) воздуха для распыления краски.
Окраска с воздушным распылением обычно производится в спе-
циальных распылительных камерах, снабженных вентиляционными
устройствами; различают камеры тупико-
вые (фиг. 148) и проходные (фиг. 149);
последние обычно применяются в конвейер-
ных установках.
Окраска распылением в
электростатическом поле
производится следующим образом. Окра-
шиваемый предмет заряжают одним зна-
ком заряда, а частипы распыляемой крас-
ки— другим. Благодаря этому частицы
Фиг. 151. Схема окраски иа
вальцах.
краски равномерно покрывают поверх-
ность изделий и, что очень важно, дости-
гается практически полное использование
краски. Важными преимуществами метода являются также отсут-
ствие красочного тумана, высокая производительность труда и воз-
можность полной механизации процесса окраски.
Благодаря этим преимуществам данный метод рекомендуется
для окрашивания изделий массового производства. Схема уста-
новки для окраски в электростатическом поле показана на фиг. 150.
Недостатками данного способа окраски являются трудности,
связанные с покрытием внутренних поверхностей изделий сложного
профиля, и сложность самой установки.
Окраска на вальцах применяется для покрытия пло-
ских предметов, например листового железа, досок, фанеры и т. п.
Сущность процесса заключается в том, что лакокрасочный мате-
риал предварительно наносится на валик, который прокатывается
затем по плоской поверхности, окрашивая ее.
Схема окраски на вальцах показана на фиг. 151. Окрашиваемый
предмет 1, перемещаемый на роликах 6, входит в соприкоснове-
ние с поверхностью рабочего валика 2, на который непрерывно
подается краска из ванны 5 при помощи двух промежуточных вали-
ков 8 и 4. Данным способом можно окрашивать изделия либо
с одной, либо с двух сторон. Окрашивание на вальцах целесообразно
объединить с непрерывно действующими сушильными установками.
Транспортировка окрашенного изделия осуществляется конвейерами.
428
Часть четвертая. Электрохимические и химические методы
Важным фактором, обусловливающим нормальный ход техноло-
гического процесса окраски, является вязкость применяемого
лакокрасочного материала.
Вязкость зависит как от природы материала, так и от способа
его нанесения. Поэтому перед использованием лакокрасочные мате-
риалы доводятся до рабочей вязкости соответствующими раствори-
телями и разбавителями. Данные о них приведены в табл. 142.
Таблица 142
Растворители и разбавители для разведения различных
лакокрасочных матеоиалов
Лакокрасочный материал Растворители и разбавители
Эмали и лаки глифталевые Эмали и лаки пеитафталевые Эмали масляные Эмали «муар» Эмали мочевиноформальдегидные и меламиноформальдегидные Эмали перхлорвиниловые Эмали меламиноалкидные Нитроэмали, нитролаки и нитрошпак- левка Масляные лаки Битумные и масляно-битумные лаки Масляные краски Грунт АЛГ-1 Грунты № 138, ФЛ-03 (К, Ж, КК) ФЛ-013, шпаклевки ЛШ-1 и ЛШ-2 Эпоксидные грунты, лаки и эмали Поливинилбутиральные эмали Пслистирольные краски Кремнийорганические лаки и эмали Акриловые лаки и эмали Нитроэмали НКО Ксилол + уайт-спирит Ксилол, толуол, сольвент, уайт- спирит Уайт-спирит Уайт-спирит, ксилол Ксилол + бутанол (1 : 1) Разжижители Р-4 и Р-5 Уайт-спирит -|- бутанол (9 : 1) Растворители № 646 и № 647; разбавитель РДВ Уайт-спирит, скипидар Уайт-спирит, ксилол, толуол Уайт-спирит, олифа, скипидар Скипидар, уайт-спирит Ксилол, ксилол уайт-спирит (1 : 1) Ксилол + этилцеллозольв 4- аце- тон (4:3:3) Этиловый спирт + этилцеллозольв (1 1) Ксилол, скипидар Толуол, скипидар, этилцеллозольв Уайт-спирит + ксилол (4:1) Растворители № 649 и № 646
Фактический расход лакокрасочного материала зависит от техни-
ческих условий на нанесение покрытия, от метода окраски и многих
других факторов. Некоторые ориентировочные данные по расходу
отдельных лакокрасочных материалов и растворителей приведены
в табл. 143.
Глава XXIII. Эмалевые и лакокрасочные покрытия
429
Таблица 143
Ориентировочные данные по расходу лакокрасочных материалов
(при окраске одним слоем)
Наименование материалов Метод нанесения Расход материала в Г/м*
Грунт 138 Грунты АЛГ-1 и АЛГ-5 Шпаклевки Лаки масляные светлые Лаки и эмали масляные черные Эмали глифталевые разных цветов Нитроэмали разных цветов Растворители для разведения масля- ных красок и эмалей Растворители для нитроэмалей Кистью Распылением Кистью Распылением Шпателем Кистью Распылением Кистью Распылением Кистью Распылением Распылением Кистью 60—100 80—120 45—80 60—100 130—300 100—120 120—140 45—90 60—90 60—130 75—160 120—200 75—180 5—10% от веса краски 100—120% от веса эмали
Сушка окрашенных изделий является одной
из важных операций технологического процесса; невысохшие слои
грунта, шпаклевки или предыдущего слоя краски часто служат
причиной быстрого разрушения всего лакокрасочного покрытия.
Для эфирцеллюлозных лакокрасочных материалов процесс сушки
завершается в основном после полного испарения растворителя.
Для масляных же материалов этот процесс является лишь частью
сушки, на которую затрачивается только 10—20% времени, необхо-
димого для полного просушивания покрытия. Остальные 80—90%
времени затрачивается на течение процессов окисления, конденсации
и полимеризации нанесенного покрытия.
Окончательным результатом сушки является образование твер-
дой пленки, обладающей защитными свойствами.
Провесе высыхания большинства лакокрасочных материалов
при обычной температуре занимает от нескольких часов до несколь-
ких суток. Поэтому в весьма широких масштабах применяется искус-
ственная сушка лакокрасочных покрытий, проводимая при темпера-
турах 50—200°. Масляные краски и лаки сушат при температурах
ПО—120°; глифталевые эмали и лаки — при 80—150°; эма/и светлых
оттенков при 70—75°; эмали на мочевиноформальдегидных смолах
допускают нагрев до 100—130°; кремнийорганические и асфальтовые
лаки и эмали сушат при температуре до 180° и т. д.
Сушильные устройства по конструкции весьма разнообразны,
но по принципу действия их можно разделить на следующие основные
430
Часть четвертая. Электрохимические и химические методы
классы: конвекционные, с обогреванием окрашенных изделий горячим
воздухом; терморадиационные (отражательные), с обогреванием теп-
ловой радиацией; индукционные, с нагреванием индукционными
токами.
Конвекционные сушильные установки
наиболее распространены. Они бывают камерные (тупиковые) перио-
дического действия или туннельные (проходные) непрерывного
действия. Сушка лакокрасочных покры-
Фиг. 152. Панель терморадиа-
циойного излучения с газовым
обогревом:
/ — излучатель; 2 — рефлектор;
3— изоляция; 4— газовая горелка.
тий в них осуществляется горячим воз-
духом.
Сушка изделий горячим воздухом
в конвекционных сушилках происходит
довольно медленно. Это объясняется,
во-первых, малой теплопроводностью
воздуха, во-вторых, тем, что образую-
щаяся при данном методе сушки поверх-
ностная пленка, препятствуя улетучи-
ванию растворителя, удлиняет сушку
покрытия.
Работа терморадиацион-
н ы х (отражательных) сушильных уста-
новок основана на поглощении окра-
шенной поверхностью и отчасти лако-
красочной пленкой тепловых лучей на-
гретого тела. Поскольку передача тепла
слою покрытия при данном способе
сушки происходит в основном от поверхности изделия, нагреваемой
за счет тепловой радиации, то образование твердой лакокрасочной
пленки начинается на границе металл — покрытие и постепенно рас-
пространяется к внешней поверхности покрытия. Это обеспечивает
быстрое высыхание лакокрасочного слоя и превращение его в твер-
дую пленку.
Терморадиационные сушильные устройства строят в виде щито-
вых конструкций, на лицевой (обращенной к покрытию) стороне
которых монтируют лампы инфракрасного излучения или панели
темного излучения (керамические, стальные или чугунные плиты,
нагреваемые газом или электричеством; фиг. 152). Ламповые излу-
чатели в настоящее время находят ограниченное применение, так
как они менее практичны и менее экономичны, чем панели темного
излучения.
По конструкции терморадиационные сушильные установки
делятся на стационарные, передвижные, периодического и непрерыв-
ного действия. Общий вид передвижной рефлекторной портальной
установки для сушки железнодорожных вагонов приведен на фиг. 153.
Принцип действия индукционных сушильных
установок состоит в нагревании окрашенных изделий индук-
Глава XXIII. Эмалевые и лакокрасочные покрытия
431
Фиг. 153. Рефлекторная передвижная сушилка желез-
нодорожных вагонов.
Фиг. 154. Индукционная сушильная камера для эмалированных автомо-
бильных деталей (а) и схема включения аппаратуры установки для индук-
ционной сушки (б):
/ — пусковой реостат; 2 — реостат возбуждения; 3 — генератор; 4 — индукцион-
ные катушки; 5—конденсатор; 6 — шунтовый электродвигатель.
432
Часть четвертая. Электрохимические и химические методы
ционными токами, возникающими при помещении изделий в перемен-
ное электрическое поле обычной, повышенной или высокой частоты.
Указанное поле создается внутри контура проводника, повторяю-
щего в основном форму нагреваемых изделий. При последовательном
соединении ряда однотипных контуров образуются сушила туннель-
ного типа, в которых производится сушка лакокрасочных покрытий.
Внешний вид одной из таких установок для сушки окрашенных авто-
мобильных деталей показан на фиг. 154, а, а на фиг. 154, б приведена
схема включения аппаратуры установки для индукционной сушки.
Температура сушки регулируется подбором электрических
характеристик установки (мощности индуктора, частоты переменного
тока и т. д.), продолжительностью пребывания изделия в электриче-
ском поле, величиной зазора между изделиями и индуктором и т. д.
Преимуществом индукционного способа является быстрота
сушки, обусловленная тем, что здесь, как и в предыдущем случае,
нагрев передается от изделия к покрытию. Недостатком метода
следует считать необходимость приготовления контуров, повторяю-
щих профиль окрашиваемых изделий.
ЧАСТЬ ПЯТАЯ
ОСНОВЫ ПРОЕКТИРОВАНИЯ ЦЕХОВ
ЭЛЕКТРОХИМИЧЕСКИХ ПОКРЫТИЙ
Изучение курса «Технология электрохимических покрытий»
завершается выполнением учащимися курсовых и дипломных проек-
тов (темой которых обычно является проектирование небольших
цехов или участков покрытий), в процессе чего учащиеся знакомятся
с основами проектирования. В связи с этим ниже приводятся
краткие сведения по методике проектирования и освещаются основ-
ные принципы некоторых технологических расчетов, необходимые
при выполнении учащимися курсовых и дипломных работ.
При работе над курсовым и дипломным проектами учащиеся
должны исходить из решений XXII съезда КПСС о необходимости
максимальной автоматизации и механизации производственных про-
цессов и необходимости применения передовой технологии, бази-
рующейся на основе последних достижений науки и техники.
Проектирование цехов электрохимических покрытий осущест-
вляется по следующим этапам:
а) составление проектного задания;
б) составление технического проекта;
в) составление рабочего проекта.
При проектировании должны быть разрешены связанные между
собой экономические, технические и организационные вопросы.
К экономическим вопросам относится установление производ-
ственной программы цеха или участка с указанием номенклатуры
изделий или деталей, количества, веса, себестоимости одного изделия
и всего количества по программе и пр.
К числу технических задач относятся:
а) выбор вида и толщины покрытия на основе условий эксплуата-
ции и хранения изделий;
б) определение технологического процесса;
в) установление режима работы цеха, участка и определение-
фондов времени оборудования и рабочей силы;
г) выбор и расчет размеров и количества основного и вспомогатель-
ного оборудования;
д) определение потребного количества основных и вспомогатель-
ных материалов;
е) определение потребного количества электроэнергии, пара,
воды, сжатого воздуха и др.;
28 Вайнер и Дасоян
> 34
Часть пятая. Основы проектирования цехов
ж) разработка вопросов транспорта;
з) определение вопросов вытяжной и приточной вентиляции;
и) расчет потребных площадей, планировка и т. д.
К организационным вопросам относятся:
а) разработка структуры управления цехом, участком;
б) разработка рациональной организации рабочих мест.
В процессе обучения учащиеся техникумов выполняют курсовой
и дипломный проекты.
1. СОДЕРЖАНИЕ И ОБЪЕМ КУРСОВОГО ПРОЕКТА
Курсовой проект состоит из пояснительной записки и графической
части.
Пояснительная записка должна занимать не менее 20—25 стра-
ниц и содержать:
а) описание назначения и работы детали в узле, а также условия
ее службы при эксплуатации изделий;
б) выбор и обоснование вида покрытия и его толщины;
в) выбор и обоснование технологического процесса обработки
деталей;
г) краткое описание всех операций технологического процесса;
д) выбор оборудования для всех операций технологического
процесса;
е) описание наиболее сложной конструкции применяемых приспо-
соблений;
ж) расчет времени, необходимого для нанесения покрытия;
з) определение нормы времени на обработку деталей (основное
и вспомогательное);
и) описание методов контроля;
к) расчет количества анодов, химикатов и вспомогательных мате-
риалов, потребных на выполнение программы и на пуск;
л) определение количества пара для ванн, требующих подогрева;
м) расчет потребности в электроэнергии;
н) технико-экономическое сравнение вариантов обработки.
Графическая часть проекта должна состоять из двух-трех листов
чертежей и содержать следующее:
а) схему технологического процесса;
б) чертеж единицы наиболее сложного типа запроектированного
оборудования;
в) чертеж приспособления для одной из операций технологиче-
ского процесса.
2. содержание и объем дипломного проекта
Дипломный проект состоит из объяснительной записки с расчетами
и из графической части проекта: чертежей, диаграмм, схем.
В объяснительной записке должны содержаться следующие
сведения:
Часть пятая. Основы проектирования цехов 435
1) назначение, программа и режим работы цеха;
2) обоснование принятых видов покрытий и их толщины;
3) описание технологического процесса покрытия;
4) перечень и расчет основного оборудования цеха;
5) расход основных и вспомогательных материалов;
6) рабочий состав цеха и штаты;
7) задания: на строительную часть проекта; энергетику; пром-
разведки; сеть постоянного тока; вентиляцию; пароснабжение, водо-
провод и канализацию; снабжение сжатым воздухом; транспортные
устройства; автоматизацию технологических процессов;
8) инструкции по технике безопасности и промсанитарии;
9) составление ведомостей на оборудование материалов, машин
и агрегатов.
Перечисленные вопросы отражают основные характеристики
производственного, вспомогательного и энергетического обору-
дования и представляют собой задание на изготовление чер-
тежей потребного оборудования или приобретение его в готовом
виде.
Графическая часть дипломного проекта состоит из следую-
щего:
1) планировки цеха (план расположения оборудования; схемы
коммуникации пара, воды, сжатого воздуха; коммутация постоян-
ного тока и т. д.);
2) чертежей на ванны, автоматы или полуавтоматы для обработки
изделий;
3) схемы энергосети постоянного и переменного токов;
4) схемы расположения приточно-вытяжной вентиляции;
5) схемы, отражающей принцип работы автоматических узлов
(регулировка тока, времени покрытия, температуры, кислотности
электролита и т. д.).
Графическая часть дипломного проекта выполняется на 3—6
листах бумаги формата № 24.
Все чертежи выполняются карандашом.
По формату, условным обозначениям, шрифту надписей и масшта-
бам чертежи должны удовлетворять требованиям стандартов.
3. ЗАДАНИЕ НА ПРОЕКТИРОВАНИЕ
Для того чтобы приступить к разработке проекта цеха, надо
иметь задание на проектирование, на основе которого будут произ-
водиться все расчеты и решение всего комплекса вопросов, входящих
в состав проекта.
Задание на проектирование должно содержать:
характеристику продукции;
производственную программу;
вид покрытия.
28* 1051
436
Часть пятая. Основы проектирования цехов
При проектировании цеха электрохимических покрытий нужно
учесть мероприятия по повышению производительности труда, улуч-
шению качества покрытия, улучшению условий труда, а именно:
1) применение высокопроизводительного механизированного
оборудования (полуавтоматы, автоматы, автоматы с программным
управлением);
2) прогрессивные технологические процессы (интенсифицирован-
ные режимы, электролиты с блескообразователем) и др.
3) автоматический контроль и управление операциями технологи-
ческих процессов.
4. ОПРЕДЕЛЕНИЕ ФОНДОВ РАБОЧЕГО ВРЕМЕНИ
В расчетах по определению фондов рабочего времени (в сутках)
при проектировании различают:
То — номинальный годовой фонд времени рабочих и оборудова-
ния;
Т — действительный фонд времени рабочих и оборудования;
1\ — общие годовые потери от номинального фонда времени
рабочих и оборудования.
Номинальный годовой фонд времени рабочих и оборудования
выражается в сутках и составляет То = 365 — 58 = 307, где 365 —
общее количество суток в году; 58 — количество нерабочих дней
в году.
При определении номинального фонда времени необходимо
учесть, что продолжительность рабочей смены в предпраздничные
и предвыходные дни составляет 6 часов. С учетом этого номинальный
фонд времени в часах при односменной работе составляет 2093 часа
при 7-часовом рабочем дне.
Для определения действительного фонда времени рабочих
из номинального фонда вычитают продолжительность дополнитель-
ного отпуска (6 или 12 дней, в зависимости от степени вредности)
и потери времени, неизбежные на производстве. Эти потери вместе
с дополнительным отпуском составляют 11—12% от номинального
фонда.
Для определения действительного фонда времени оборудования
из номинального фонда времени вычитают годовые потери времени
на неизбежные простои оборудования. Эти потери зависят от режима
работы и в процентах от номинального фонда времени составляют:
2%—для односменной работы, 3%—для двухсменной работы и 4% —
для трехсменной работы.
Связь номинального и действительного фондов времени оборудо-
вания, выраженных в часах, дается уравнением
Tz = Toz — Тгг (64)
где z — количество рабочих часов в сутки.
Часть пятая. Оснсеы проектирования цехов
437
5, УСТАНОВЛЕНИЕ ПРОИЗВОДСТВЕННОЙ ПРОГРАММЫ
ЦЕХА ИЛИ УЧАСТКА
Производственная программа цеха или участка может быть рас-
считана па год, на сутки или на один час, причем наиболее употреби-
тельными являются первые две формы выражения.
11ри установлении производственной программы необходимо
\ читывать и работы, связанные с исправлением некоторых видов
дефектов обработки.
Процент исправимого брака в свою очередь зависит от процесса
обработки и режима работы цеха. Он обычно колеблется в преде-
лах 0,5—3% от программы по каждому виду покрытия. Для одно-
слойных покрытий процент исправимого брака принимается от
0,5 до 1%, а для многослойного — от 1 до 3%. С учетом процента
брака, допускающего переделку, годовая производственная про-
грамма цеха или участка РгОд может быть рассчитана по формуле
РгВд = Рзаэ + ^°/0, (65)
где Psa5 — заданная годовая программа цеха или участка;
а — процент исправимого брака.
Эту программу необходимо представить в виде сводной ведомости
с разбивкой деталей на группы по основным видам обработки и
с указанием количества деталей, веса и размера поверхности деталей
по каждой группе.
Расчет суточной производственной программы Рсут ведется по
формуле
= (66)
где То — номинальный годовой фонд времени оборудования, т. е.
фонд времени без учета потерь, в сутках.
Производственная программа цеха в 1 час Рц№ определяется
по формуле
= (67)
где Тг — действительный фонд времени оборудования, т. е. фонд вре-
мени с учетом общих годовых потерь на простой оборудо-
вания, в час.
6. ОПРЕДЕЛЕНИЕ ВЕЛИЧИНЫ ЗАГРУЗОЧНОЙ
ИЛИ РАСЧЕТНОЙ ЕДИНИЦЫ
Для расчета оборудования выбирается величина загрузочной
единицы. Для одинаковых по форме и габаритам изделий исходной
загрузочной единицей служит либо одна штука детали (детали круп-
ных размеров), либо 1 кГ деталей (мелкие детали, покрываемые
438
Часть пятая. Основы проектирования цехов
в колоколах или барабанах). Иногда эти величины пересчитывают
в единицах поверхности (дм2).
Если покрываемые изделия существенно отличаются друг от друга
по форме, габаритам и площади поверхности, то в этом случае они
предварительно разбиваются на отдельные группы и подгруппы
в зависимости от материала, размеров, вида покрытия, применяемого
оборудования. Составляют загрузочные ведомости, в которых указы-
вается количество деталей, завешиваемых на одну подвеску (ванну),
и количество подвесок (ванн), необходимых для обеспечения годовой
или суточной программы цеха или участка; следовательно, загрузоч-
ной единицей в данном случае является не изделие или деталь,
а подвеска или ванна.
В колоколе или барабане загрузочной единицей служит средний
вес и средняя поверхность деталей, загружаемых в один барабан,
колокол или корзину.
7. ОПРЕДЕЛЕНИЕ ВРЕМЕНИ ОБРАБОТКИ ДЕТАЛЕЙ
В проектных расчетах при определении времени обработки дета-
лей принимают во внимание следующие величины:
тг — основное . или технологическое время, необходимое для
обработки деталей;
т2 — вспомогательное время, затрачиваемое на загрузку и вы-
грузку изделий;
т — время, потребное для обработки деталей на данной операции
технологического процесса;
t — время, затрачиваемое для организации и проведения перво-
начальной загрузки и конечной выгрузки ванны. Оно назы-
вается также временем, затрачиваемым на подготови-
тельные и заключительные операции.
Величины т, Tj и т2 связаны между собой формулой
-т = тх + т2. (68)
Первое из этих слагаемых — технологическое время — для гальва-
нических покрытий определяется по формуле (24), приведенной
на стр. 15. Для этой цели могут быть использованы также специально
составленные таблицы, где дана скорость осаждения покрытия
в минутах в зависимости от выхода металла по току в процентах.
При определении технологического времени нанесения покрытия
на мелкие детали в барабанах и колоколах необходимо учесть, что
действительная плотность тока в этих случаях заметно выше, чем
входящая в формулу средняя плотность тока.
Поэтому технологическое время т1( вычисленное на основании
средней плотности тока по формуле (24) для покрытий, наноси-
мых в барабанах и колоколах, следует увеличить примерно на 15—
25%.
Часть пятая. Основы проектирования цехов
439
Вспомогательное время т2 в зависимости от условий работы
колеблется от 1 до 10 мин. Для оборудования, работающего непре-
рывно (автоматы, полуавтоматы), т2 принимается равным от 1
до 3 мин., а для оборудования, работающего с перерывами (стацио-
нарные ванны, колокола, барабаны), — от 5 до 10 мин.
Время t, затрачиваемое на подготовительные и заключительные
операции, учитывается только при прерывной (некруглосуточной)
работе цеха в одну или две смены. Величина t складывается из за-
траты времени на монтаж подвесок и подготовку поверхности деталей,
на конечные кратковременные операции (промывка, осветление,
пассивация, сушка и демонтаж приспособления), а также на проведе-
ние первоначальной загрузки и конечной выгрузки деталей из ванны.
В упрощенных расчетах значение t для стационарных ванн, колоко-
лов и барабанов принимается равным 30—50 мин., для полуавтома-
тов — продолжительности одного цикла прохождения деталей
в полуавтомате с учетом времени на подготовку первой и отделку
последней партии подвесок, для автоматов — продолжительности
полного цикла прохождения деталей в автомате. Время I в процентах
от времени работы цеха за сутки для стационарных ванн, колоколов
и барабанов в зависимости от сменности принимается равным
от 2 до 10 %, причем оно меньше при работе цеха в три смены и больше
при работе цеха в одну смену. В формулах расчета количества
единиц оборудования время рекомендуется учитывать в виде коэффи-
циента, значение которого при 1, 2 и 3-сменной работе цеха равно
1,06—1,1; 1,03—1,05 и 1,02—1,06 соответственно.
8. ВЫБОР ТОЛЩИНЫ ПОКРЫТИЙ И ТЕХНОЛОГИЧЕСКОГО
ПРОЦЕССА
Вид и толщина покрытия указываются на чертежах деталей,
подлежащих обработке, по ГОСТ 9791—61 на основании ведомствен-
ных нормалей. Если такие указания отсутствуют, то эти вопросы
решаются дипломантом на основании заданных условий эксплуата-
ции и хранения изделий с учетом экономической целесообразности,
особых требований, размеров и конфигурации покрываемых деталей.
При описании условий службы и хранения покрытых деталей
необходимо указать, какого рода внешним воздействиям они подвер-
гаются (механический износ, соприкосновение с газообразной или
жидкой средой, примерный состав и температура среды и пр.)
и какие требования предъявляются к внешнему виду покрытия.
На основе материалов предыдущих глав настоящего учебника,
а также литературных и практических данных (ГОСТ, ТУ и т. п.)
обосновывается выбор наиболее приемлемого вида и толщины покры-
тий. Далее дипломант на основании тех же источников выбирает
схему технологических процессов, намечая их в виде последователь-
ного перечня всех операций.
440
Часть пятая. Основы проектирования цехов
Технологические ппоцессы нанесения покпытий
солепжат три группы операций: подготовка к нанесению
покпытия; нанесение покрытия; обработка изделий
после нанесения покрытия. Схемы технологического процесса уста-
навливаются в зависимости от назначения покрытия, характера
деталей и состояния их поверхности.
Одновременно в дипломном проекте приводятся более подробные
сведения о технологическом процессе. Последние излагаются по
форме № 1, где указываются условия проведения той или иной
операции (состав электролита, режим работы ванны и т. д.).
Форма № I
Схема технологического процесса
Af2 п/п Операция Состав электролита Режим работы
химикаты концентра- ция в Г/м темпера- тура в °C плотность тока в а/дм* время процесса В МИЯ. особые показа- тели
В заключении данного раздела диплома излагается способ приго-
товления электролитов и их корректировка, а также приводится
описание рекомендуемых методов контроля качества покрытий.
9. ВЫБОР ОБОРУДОВАНИЯ ДЛЯ ПОДГОТОВКИ И ПОКРЫТИЯ
И МЕТОДЫ РАСЧЕТА
Все оборудование гальванических цехов по характеру выполняе-
мых операций делится на две группы:
1) основное (производственное),
2) вспомогательное.
К первой группе относятся ванны для покрытия, обезжиривания,
травления, декапирования и промывки, барабаны, колокола, источ-
ники постоянного электрического тока, электродвигатели, шлифо-
вальные и полировальные станки.
К вспомогательному оборудованию относятся столы, стеллажи,
приспособления для крепления и подвешивания деталей или изделий
при покрытии, хранении, перевозке и пр., подъемники и транспорт-
ные устройства.
По конструкции, принципу работы и условиям или особенностям
эксплуатации оборудование для химической и электрохимической
обработки деталей можно разделить на следующие виды:
1) стационарные ванны (немеханизированные и частично механи-
зированные;
Часть пятая. Основы проектирования цехов
441
2) оборудование для покрытия мелких деталей (барабаны и коло-
кола);
3) полуавтоматы (овальные, прямолинейные и кольцевые);
4) автоматы и конвейерные установки.
Вид основного оборудования обусловливается характером обра-
батываемых деталей и производственной программой цеха, а .также
принятым технологическим процессом.
Применение автоматов целесообразно при следующих условиях:
а) при большой программе и при ограниченной номенклатуре
изделий,
б) в случае применения интенсифицированных процессов,
в) при равномерном и непрерывном поступлении изделий.
Для заводов, выпускающих изделия средних размеров, и при
широкой номенклатуре рентабельными являются полуавтоматы,
так как они занимают меньше производственной площади цеха, чем
стационарные ванны.
При небольшой производственной программе и продолжительном
процессе покрытия выгоднее устанавливать стационарные ванны.
При работе на стационарных ваннах рекомендуется механизи-
рованная загрузка и выгрузка изделий с помощью электро- или
пневмотельферов.
Мелкие детали могут быть обработаны в колоколах и барабанах.
Ниже приводятся типовые расчеты некоторых из упомянутых
видов оборудования.
Расчет стационарных ванн для покрытия деталей,
завешиваемых на подвесках
Определению подлежат: количество ванн, необходимое для обес
печения работы цеха, и их размеры.
При расчете ванн исходят из суточной программы цеха, выражен-
ной числом подвесочных приспособлений Потребное коли-
чество стационарных ванн В определяют по формуле
В = , (69)
п-т
где п — количество подвесок, загружаемых в ванну одновременно;
т — количество загрузок в ванну в сутки.
Число загрузок в сутки т определяется по формуле
T — t
т =------
(70)
где у — суточный фонд времени работы ванны (с учетом простоев)
в мин.
t — потери времени на подготовку подвесок в начале смены
(30—50 мин);
442
Часть пятая. Основы проектирования цехов
тх — основнсе (технслогическсе) время в мин;
т2 — вспомогательное время в мин.
Рекомендуемые загрузки стационарных ванн в зависимости от их
размеров и вида обработки приведены в табл. 144.
Таблица 144
Средние нормы загрузки для стационарных ванн
Наименование процессов и виды покрытий Средние нормы загрузки в м2 на 1 пог. м штанги при глубине ванны в м
0.8 0,9 1.0 1.2
Защитные покрытия (цинкование, кад- мирование, меднение,, лужение, латуни- рование и др.) 0,45— 0,55 0,55— 0,65 0,65— 0,75 0,8—1,0
Декоративные покрытия (меднение, никелирование, хромирование ’) 0,35—0,4 0,4—0,5 0,45— 0,55 0,6—0,75
Меднение перед цементацией 0,15—0,2 0,2—0,25 0,25—0,3 0,3—0,35
Анодирование, химическое оксидиро- вание и фосфатирование, производимые на подвесках 0,9—1,1 1,3—1,5 1,3—1,5 1,6—2,0
1 Для хромирования рельефных деталей нормы загрузки снижаются на 25%.
Размеры стационарных ванн могут быть либо выбраны по дан-
ным нормалей, либо рассчитаны по формулам.
В первом случае рекомендуется пользоваться машинсстроитель-
ной нормалью МН2-58, которая устанавливает основные параметры,
размеры, конструкцию узлов и деталей стандартных ванн. Для
выбора ванны по этой нормали необходимо руководствоваться сле-
дующими данными. Если ванны работают с непрерывной фильтра-
цией электролита, то плотность загрузки (отношение объема элек-
тролита к поверхности изделий, одновременно загружаемых в ван-
ну) не должна превышать 8—12 л!дм~; если же ванны предназна-
чаются для работы с периодической фильтрацией электролита, то
плотность загрузки должна составить 20—30 л!дм-.
При определении габаритов стационарных ванн расчетным путем
внутренние ее размеры в мм вычисляют при помощи следующих
формул:
длина ванны
L = nh + (п - 1) /2 + 2/3, (71)
где п — количество подвесок, завешиваемых на одной штанге
по длине ванны;
/1 — размер подвесок по длине ванны;
/2 — расстояние между подвесками в ванне (300—100 мм);
Часть пятая. Основы проектирования цехов
1з “ МечВДУ торцовой венкой ванны и краем подвески
(1UU—15U л/л/);
ширина ванны W равна
w = + 2nKW 2 + 2U73 + naD, (72)
где пк — количество катодных штанг;
№'1 — наибольший размер подвески по ширине ванны;
W2 — расстояние между анодом и ближайшим краем подвески
(100—150 мм для простых и 150—250 мм для рельефных
деталей);
U73 — расстояние между продольной стенкой ванны и анодом
(50—100 мм для футерованных ванн и 150 мм — для ванн
нефутерованных);
па — количество анодных штанг;
D — толщина анодов;
высота ванны Н
H = h3 + h6, (73)
где h3—высота уровня электролита;
h6—расстояние от поверхности электролита до борта ванны
(100—150 мм для ванн без перемешивания и 150—250 мм
для ванн с перемешиванием).
При определении наружных размеров стационарных ванн исходят
из внутренних размеров, найденных расчетным путем, и из толщины
стенок и дна ванны. Для нефутерованных, железных ванн толщина
стенок и дна составляет 4—8 мм, а для деревянных ванн — от 50
до 100 мм.
Расчет барабанов и колоколов
Количество барабанов и колоколов рассчитывают исходя из годо-
вой программы гальванического цеха. Величину загрузки удобно
выражать в весовых единицах (кГ). Суммарная поверхность S за-
грузки одного барабана или колокола составляет
5 = 51У + 32, (74)
где у — величина загрузки в кГ,
Sj и S2 — поверхность 1 кГ деталей и нерабочая поверхность,
в дм*.
Сила тока на один барабан или колокол определяется формулой
I = SDK , (75)
К<Р
где DK — средняя плотность тока.
При выборе габаритов барабанов и колоколов руководствуются
следующими положениями: загрузка барабана деталями произво-
дится по высоте их укладки на плоской грани, составляющей Ve—V,
444
Часть пятая. Основы проектирования цехов
диаметра вписанной окружности. При расчете габаритов барабана
за исходную величину принимают его длину. Объем, занимаемый
деталями, определяют опытным путем или приблизительным расчетом
(по насыпному весу). Этот объем зависит от конфигурации, толщины
и веса деталей и равен приблизительно 3—10-кратному объему
металла в них.
Для того чтобы рассчитать емкость колокола, необходимо знать
объем, занимаемый деталями, соответственно принятой величине
загрузки для каждого колокола.
Таблица 145
Ведомость расчета количества ванн, барабанов и колоколов
№ п/п Вил обработки и характеристика оборудования Длина катодной штан- ги на единицу оборудо- вания в м Годовая программа в мг илл кГ (для бара- бана и колоколов) Единовременная задув- ка единицы оборудова- ния в м1 или к! (для ба- рабана и колоколов) Годовое количество загрузок в шт. Продолжи- тельность покрытия Количество единиц оборудовнния
одной загруз- ки в мин. ГОДО- ВОЙ про- граммы в часах расчет- ное при- нятое (факти- ческое)
1 2 3 4 5 6 7 я 9 10
1 2 Лужение в стацио- нарной ванне Цинкование в ко- локоле 3 41 415 70 000 1,8 5 23 008 14 000 зо+з 110+5 12 650 26 800 2,86 6,1 3 7
— Формулы для расчета Р год Р X = Ргзд р Т = —TI "1" Ч~ ^2 St = тх ~ '60' Г?! = _Хх-К ~ Tz п
Примечание. При определении для обработок 1 и 2 принято К — 1,03. а Тг — 4550.
Объем загрузки определяется опытным путем по насыпному весу.
Объем электролита вместе с объемом, занимаемым деталями, прини-
мают равным 3—6-кратному объему, занимаемому деталями (в зави-
симости от величины насыпного веса и 'конфигурации деталей).
Объем всего колокола в зависимости от соотношения диаметров дна
и верхнего отверстия, а также угла его наклона к плоскости пола
принимают равным 1,5—2-кратному объему электролита вместе
с объемом, занимаемым деталями. Пример расчета по определению
количества ванн, барабанов и колоколов для выполнения годовой
программы цеха приведен в табл. 145, где приняты следующие обозна-
чения:
Ргод — годовая программа в м2 или кГ;
р — единовременная загрузка единицы оборудования в м2
или кГ;
Часть пятая. Основы проектирования цехов
445
х — годовое количество загрузок в шт.
X р ,
т — продолжительность обработки одной загрузки в мин.
(т = Tj + т2, где тх — основное, а т2 — вспомогатель-
ное время);
St — продолжительность обработки годовой программы в часах
(*;=-£);
Tz — действительный фонд времени работы оборудования
в часах;
К — коэффициент, учитывающий потери времени на подготовку
изделий первой партии и на доделку изделий последней
партии. Значения К в зависимости от количества смен
в сутки колеблется от 1,02 до 1,1;
п n nL — принятое и расчетное количество единиц оборудования,
соответственно.
Выбор автоматов для гальванических покрытий
Автоматические и полуавтоматические установки, предназначен-
ные для полной или частичной обработки изделий, в настоящее время
получили большое распространение в цехах электрохимических
покрытий. Поэтому в дипломных работах часто приходится решать
вопросы, связанные с выбором типа автомата и определением потреб-
ности цеха в таких аппаратах для выполнения годовой программы.
В соответствии с этим в данном разделе приводятся краткие сведения
о современных типах автоматов, рекомендуемых для химическдй
и электрохимической обработки изделий, завешиваемых в электролит
на подвесках или барабанах, а также предназначенных для покрытия
ленты и проволоки.
Рассмотрим ряд конструкций.автоматов.
Оригинальный тип автомата для оксидирования ТОА, отличаю-
щийся «нежесткой» системой управления, создан А. И. Андреевым,
Б. И. Андреевым и А. П. Грызловым. Автомат состоит из ряда после-
довательно установленных ванн и механического оператора, передви-
гающегося над ними по подвесному пути. Автоматически по заранее
заданной программе оператор переносит траверсы с изделиями
из одной ванны в другую. Сменная производительность подобного
автомата около 3 Т.
По принципу автомата ТОА впоследствии были созданы автоматы
для фосфатирования (ТФА) и для различных гальванических процес-
сов (ТГА).
Технические характеристики автоматов с подвесными траверсами
приведены в табл. 146.
446
Часть пятая. Основы проектирования цехов
Таблица 146
Техническая характеристика автоматов с подвесными траверсами
Показатели Автоматы для нанесения металлических покрытий Автомат для оксидирования
малогабаритный крупногабарит- ный
Производительность, м2/час 12,5 40 40
Темп выхода (количество подвесок в час) 40 50 —
Размеры подвески, м Э, 18X0,10X0,5 0,12X0,45X0,6 ,14X0,25X0,55
Поверхность загрузки на одну подвеску дм2 32 80 100
Размеры автомата, м 9,5Х 2,5X2 8,5X2,8X2,3 10,2X2.5X0,3
Вес автомата, Т 9 9 14
Потребная мощность, кет 2,8 2,8 4,5
Широкое распространение в последнее время получили также
автоматы с гидравлическим подъемом (табл. 147). Принцип действия
этих автоматов заключается в следующем: над ванной вдоль осевой
линии натянута цепь с толкателями, передвигающими подвески
с деталями вдоль катодной штанги. Звездочки конвейера укреплены
на мосту. При переносе деталей над стенками ванны мост со звездоч-
ками поднимается, перемещается на один такт и опускается в следую-
щую ванну. Подъем и опускание моста, а также поворот приводной
звездочки производятся электродвигателями.
Таблица 147
Технические характеристики гидравлического автомата
Показатель Характеристика
Размеры подвески, мм Вес деталей на одну подвеску, кГ Количество подвесок в ваннах, шт. Габаритные размеры автомата, м Производительность, кГ!час 140X290X550 10 74 10X2,5X3,0 400
Автоматы типа АГ, разработанные М. А. Тржецяком и М. Е. Фро-
ловым, представляют собой агрегаты, которые без участия рабочего
выполняют подавляющее большинство операций технологического
процесса по. электрохимической обработке деталей.
Часть пятая. Основы проектирования цехов
447
Разработаны и нашли широкое практическое применение на мно-
гих заводах нашей страны автоматы: АГ-2М для серебрения мелких
деталей в колоколах; АГ-3 для гальванических покрытий деталей
в колоколах (рекомендуется применять в мелкосерийных производст-
вах); АГ-4 для цинкования деталей в колоколах или на подвесках;
АГ-5 для анодирования деталей. Краткие характеристики этих
автоматов приведены в табл. 148.
Таблица 148
Характеристики автоматов АГ
Показатели ЛГ-2М(ЛГ-2) А г-3 АГ-4 А Г-5
Количество колоколов 28 1—5 4 —
Количество траверс, несу- щих подвески — — 24 28
Габариты подвесок с де- талями в мм — — 240X 350X 450 220X150X450
Длина наи- большей сто- роны деталей прямоугольно- го сечения к мм 6 6 6
Наибольший вес деталей, за- груженных в колокол, в кГ 1,2 — 1,2 —
Наибольший вес деталей с подвеской в кГ — — 4 4
Площадь де- талей, загру- женных в ко- локол, в дм2 30±2 20 30±2 —
Площадь де- талей, загру- жаемых на одну подвеску, в дм2 — 30±2 40
Размер оди- нарной ванны в мм 280X 550X 600 — 290X550X600 290X 550X 500
Производи- тельность ав- томата в дм2/ч 250 — 600 500
Габариты автомата в м 5,5X2,2X2,1 3,6X0,ЭХ 1,14 5,5X2,2X2,1 5.5Х2.2Х 1,5
448
Часть пятая. Основы проектирования цехов
В последние годы теми же авторами разработан ряд новых авто-
матов: АГ-8 для цинкования в колоколах; АГ-14 для травления алю-
миниевых корпусов и др. Особо выделяется автомат типа АГ-16 ПУ
(табл. 149). Указанный автомат с программным управлением предназ-
начается для одновременного осуществления нескольких гальвани-
ческих процессов. Секционный принцип конструкции позволяв! соче-
тать в различной последовательности основные и вспомогательные
ванны, что обеспечивает выполнение различных по характеру про-
цессов: никелирования, меднения, цинкования, кадмирования,сереб-
рения и т. д. Кроме загрузки все операции выполняются автомати-
чески без участия рабочего.
Таблиц! 149
Технические характеристики автомата АГ-16 ПУ
Показатели чарактерисгики
Производительность при покрытии на подвесках в м2/ч Производительность при покрытии в барабане н м2/ч Грузоподъемность автомата в кГ Общая катодная поверхность деталей загружаемых на под- весках в, м2 Общая катодная поверхность деталей, загружаемых в ба- рабанах Р м2 Наибольшие размеры подвески с деталями в мм Наибольшие размеры деталей, загружаемых в ба азан, в мм: длина диаметр Размер одной ванны в мм Общая потребляемая мощность в кет Источники постоянного тока (селеновые выпряйители): напряжение в в ток в а 5 1 60 0,6 2 400X700 X 550 100 50 600Х 1000X800 175 6—12 200
Автоматы для покрытия проволоки и ленты состоят из последова-
тельно расположенных ванн, через которые непрерывно протяги-
вается обрабатываемая проволока. После обработки проволока или
лента сматывается в бухты на намоточных барабанах.
Расчет количества автоматов и полуавтоматов, необходимых для
выполнения годовой программы гальванических работ, производится
исходя из данных о производительности указанных агрегатов и годо-
вой программы цеха. Указанный расчет дипломант оформляет в виде
ведомости, приведенной в табл. 150.
Часть пятая. Основы проектирования цехов
449
Таблица 150
Ведомость расчета автоматов
Назначение автомата Габариты в м Производитель- ность (количество подвесок) Годовая программа цеха(ко- личество подвесок) Потребное количество автоматов
в час В год расчет- ное приня- тое
Автомат для цинкова- ния 10X2,5X2,5 60 270 000 220 000 0,815 1.0
Полуавтомат для мед- нения 5,0X1,IX 1,2 40 180 000 310 000 1,72 2,0
Как видно из этих данных, расчетное количество автоматов
и полуавтоматов определяется как частное от деления годовой про-
граммы цеха на годовую производительность.
to. РАСЧЕТ ПОВЕРХНОСТИ ЗАГРУЗКИ И СИЛЫ ТОКА
Сила тока на ванне (7) равна произведению катодной плотности
тока (DK) на поверхность загрузки S. Последняя для одной ванны
определяется формулой
5 = (S, + S2) п, (76)
где — рабочая (подлежащая покрытию) поверхность;
S2 — нерабочая поверхность;
п — число подвесок с деталями в одной ванне.
Следовательно,
I = S-DK. (77)
Суммарная поверхность одновременной загрузки ряда одинаковых
ванн 2S и сила тока на все указанные ванны 27 определяется по фор-
мулам:
2S = (Sj + S2) п-т, (78)
2/ = 2S -DK = Im, (79)
где т — число одинаковых ванн.
11. РАСЧЕТ РАСХОДА ОСНОВНЫХ И ВСПОМОГАТЕЛЬНЫХ
МАТЕРИАЛОВ
При расчете потребного количества материалов необходимо
учесть расход материалов на первоначальный пуск оборудования
и расход на выполнение заданной программы.
29 Вайнер и Дасояи
450
Часть пятая. Основы проектирования цехов
Расчет расхода материалов на первоначальный пуск
При определении материалов, необходимых для первоначального
пуска оборудования, следует рассчитать количество:
а) растворимых и нерастворимых анодов,
б) химикатов для составления растворов и электролитов,
в) кругов шлифовальных и полировальных,
г) материалов для изготовления подвесочных приспособлений.
Количество растворимых и нерастворимых анодов определяется
формулой
Qa = Ibfd, (80)
где Qa — вес анодов в кГ;
I — длина анодов в м;
b — суммарная ширина анодов в м, которая не должна быть
меньше 60% длины анодных штанг в ванне;
/ — площадь поперечного сечения анода в м2;
d — удельный вес металла анода.
Примечание. Соотношение площади растворимых и нерастворимых
анодов определяется технологическим процессом.
Количество’химикатов для приготовления электролитов рассчиты-
вается по формуле
(80
где Qx — вес каждого компонента в кГ;
п — содержание каждого компонента в Г/л;
V — рабочий объем ванны в л;
k — содержание рассчитываемого компонента в примененных
химикатах в %.
Расход кругов зависит от числа вновь устанавливаемых шлифо-
вально-полировальных станков; оборотный фонд кругов составляет
на каждый шпиндель в смену примерно 15, щеток — 1 шт.
Расход материалов на изготовление подвесных приспособлений
составляет примерно 5—8кГна 1 м2 покрываемой поверхности в смену.
Расчет расхода материалов на выполнение программы
Расход анодов
Теоретически потребное количество металла для заданной тол-
щины покрытия рассчитывается по формуле
<2г = ~. (82)
где QT — теоретически потребнее количество металла в кГ;
S — обрабатываемая поверхность в дм2;
б — толщина покрытия в мм;
d — удельный вес металла.
Часть пятая. Основы проектирован.
------------------------------------------'.'.я цехов 453
Практически потребное количество метал.
по формуле 44 этои Цели источ-
Qn ~ 'бходимой
где kx — коэффициент, учитывающий сложность геометрической
формы деталей, а также технические условия на приемку
покрытий. Для деталей простой формы kx = 1. Для слож-
нопрофилированных деталей при назначении толщины
покрытий по выпуклым участкам kr = 0,7н-0,95; для
сложнопрофилированпых деталей при назначении толщины
покрытий по углубленным участкам = 1,1 -5-1,3;
k2 — коэффициент, учитывающий непроизводительные потери
анодов (потери на покрытие неизолированной части под-
весок, потери на шламообразование и на переплавку
анодов). Максимальное значение k2 = 1,15.
Расход нерастворимых анодов выражают в процентах от перво-
начального расхода анодов.
Годовой расход свинцовых анодов составляет: при хромировании
40—50%; при электрополировании, анодировании, электродекапиро-
вании и т. п. — 15—20%.
Стальные аноды в щелочных электролитах заменяются примерно
раз в год.
Расход химикатов
Расход химикатов при нанесении электрохимических покрытий
(кроме хромирования) в основном складывается из следующего:
а) унос электролита с деталями и подвесными приспособлениями;
б) унос брызг в вентиляционную систему;
в) потери при фильтрации электролита, чистке ванн;
г) потери при разложении электролита.
Унос электролита с деталями (при отсутствии ванны-уловителя)
в зависимости от рельефности деталей составляет 100—120 мл на 1 м2
для деталей простой конфигурации и 180—200 мл1м2 для деталей
сложного профиля. При нанесении покрытий в колоколах и бараба-
нах унос составляет: для деталей простой конфигурации 200—230 мл,
а для деталей сложной конфигурации — 350—380 мл с 1 м2 покрывае-
мой поверхности.
При скоростных режимах электроосаждения и при высоких тем-
пах производства, когда продолжительность перекидки подвесок
с деталями из ванны в ванну значительно сокращается, потери элек-
тролита вследствие уноса возрастают в 1,5—2 раза по сравнению
с немеханизированными ваннами. Для уменьшения этих потерь
устанавливают ванны-уловители, наполняемые чистой непроточной
водой, в которых ополаскивают подвески с деталями, извлеченные
из рабочей ванны. После накопления в ванне достаточного количества
химикатов раствор используется для пополнения рабочих ванн.
29*
450
Часть 1Цпятая. Основы проектирования цехов
Расчет рз^ванн-уловителеи расход химикатов сокращается
При опс" ” •
.<лери цианидов в результате их окисления на аноае во время
работы ванны составляют примерно:
0,5—0,7 Па-ч прц температуре электролита 18—20°;
0,7—0,8 Па-ч при температуре 40—45°;
0,8—0,9 Па-ч при температуре выше 45°, а также при работе
в колокольных ваннах.
При работе с использованием реверсирования тока расход циани-
дов уменьшается примерно в два раза.
Расчет расхода хромового ангидрида может быть произведен
по формуле
Р = 37,5 + 6-19,55, (84)
где Р — количество хромового ангидрида в Г на 1 м2 покрываемой
поверхности;
37,5 — расход хромового ангидрида в Г на 1 м2 на унос с деталями
и потери при фильтрации;
б — толщина слоя хрома в мк\
19,55—расход хромового ангидрида в Г на 1 м2 поверхности
деталей (13,3 Г на осаждение хрома и 6,25 Г на унос в венти-
ляционные трубы).
Расчет расхода химикатов для обезжиривания, травления и дека-
пирования производится с учетом сменности этих растворов
(от 10 до 50 смен в год в зависимости от объема ванн, поверхности
обрабатываемых деталей и их количества).
Данные расчета расхода анодов и химикатов могут быть
оформлены в виде ведомости, приведенной в форме № 2.
Форма № 2
Ведомость расхода материалов
№ п/п Наименова- ние химика- тов, материа- лов или анодов Назна- чение ТОСТ или ТУ Едини- ца из- мере- ния Расход на I м* обрабаты- ваемой поверх- ности Обрабаты- ваемая ко- вер хи ость в год в № Расход Обща я годо- вая по- треб- ность
при пуске цеха на про- грамму
12. РАСЧЕТ ПОТРЕБНОЙ МОЩНОСТИ И ВЫБОР ИСТОЧНИКОВ
ТОКА
Постоянный ток
Напряжение источников тока определяется на основании расчета
баланса напряжений на штангах ванн с учетом падения напряжения
в шинах от источника тока до ванн. Потери напряжения в сети
Часть пятая. Основы проектирования цехов
453
постоянного тока не должны превышать 10%, для этой цели источ-
ники тока размещают по возможности близко от ванн.
Выбор источников тока определяется силой тока, необходимой
для питания электрических ванн, требуемым напряжением и коли-
чеством ванн, а также существующими стандартными типами двига-
тель-генераторов и выпрямителей.
Не следует применять источники тока с большим запасом мощ-
ности, так как это снижает коэффициент загрузки агрегатов и уве-
личивает расход электроэнергии вследствие уменьшения их
к. п. д.
Предпочтительно каждую ванну питать отдельными источниками
тока, однако в случае необходимости целесообразно отдельные ван-
ны, потребляющие ток одинакового напряжения, подключить парал-
лельно к одному и тому же агрегату.
Сеть переменного тока
Электродвигатели переменного тока для шлифовально-полиро-
вальных и крацевальных станков, вентиляции, насосов, автоматов,
подъемников и т. п. устанавливаются в соответствии с мощностью,
потребляемой данным типом оборудования и существующими дви-
гателями.
Коэффициентом загрузки электродвигателей назы-
вается отношение мощности, потребляемой для выполнения про-
граммы, к установленной.
Расчет расхода электроэнергии
Суммарный суточный расход электрической энергии в квт-ч
состоит из расхода электроэнергии на следующие основные статьи:
1) электрический нагрев ванн;
2) работу электродвигателей;
3) электролиз.
Расчет расхода электроэнергии производится на основе расчета
отдельных статей.
1. Расход электроэнергии при электрическом нагреве ванн равен
(85)
где Рнагр — мощность нагревателя в кет;
п — число часов работы в сутки.
2. Расход электроэнергии на работу двигателей равен
W2 = Рдвиг-п, (86)
где Рдвиг — мощность электродвигателей в кет.
1051
454
Часть пятая. Основы проектирования цехов
3- Расчет расхода электроэнергии на электролиз равен
<87>
где 2/—суммарная сила тока ванн в а;
V — среднее рабочее напряжение ванн в в;
т]0 — к. п. д. источника постоянного тока.
Полученный суммарный расход электроэнергии необходимо умно-
жить на коэффициент загрузки оборудованиями источника тока.
Данные расчета потребности в источниках постоянного тока, мощ-
ности электродвигателей и расхода электроэнергии заносятся
в специальные ведомости.
Расчет шин и проводов
Расчет шин и проводов, применяемых в гальванических цехах
для подведения тока к ваннам, производится на основании формул,
приведенных в табл. 151.
Таблица 151
Формулы для расчета шин и проводов
Род тока Расчет падения напряжения Расчет сечения проводов
Постоянный и переменный ток (при безындукционной нагрузке): если известна сила тока 2а Г kq 2al q = ~kiT
если известна мощность 2aW е — м kqE 2aW q~ keE
Трехфазный ток:
если известна сила тока l,73al cos <p 6 ~ kq 1,73а/ cos <p q~ ke
если известна мощность aW e = -т-р kqE aW q~ keE
Обозначения:
Е — рабочее напряжение между обоими проводами в двух-
проводных установках и между двумя главными в трех-
фазных установках в в;
е'— допускаемое падение напряжения от начала до конца
провода в в;
W — передаваемая мощность в в;
I — сила тока в а;
а — длина провода (шины) в м;
q — сечение провода (шины) в мм\
k—удельная электропроводность материала провсдов и'шин.
Часть пятая. Основы проектирования цехов
455
13. РАСХОД ВОДЫ, ПАРА И СЖАТОГО ВОЗДУХА
Расход воды
Расход воды на технологические нужды определяют исходя
из сменяемости ванн:
а) в ваннах для холодной промывки 1—2 объема в час;
б) в ваннах для горячей промывки 0,5—1,0 объема в час.
Расчет расхода воды суммируется в ведомость (форма № 3).
Ф о р м а № 3
Ведом</сть расхода воды на производственные нужды
№ п/п Наименова- ние ванны- потребителя Количество ванн Объем вани В Л объема в ча- сах Расход воды В ЛГ8/ч Число часов работы обо- рудования в сутки Расход холодной воды в м* Примечания
.макси- мальный средний
едини- цы всего в сутки В год
Расход пара
Общая потребность пара для производственных нужд соста-
вляется согласно табл. 152 и суммируется в ведомости по форме № 4.
Таблица 152
Примерные нормы расхода пара давлением 2 ати для нагрева
растворов и воды в ваннах
Конечная температу- ра рас- твора всС Расход пара на 100 л в кГ/ч
При нагревании раствора Для промывной воды при нагревании змеевиком
змеевиком пароводяной рубашкой На разогрев На поддержание температуры при сменяемости воды
на разогрев при работе на разогрев при работе один раз в г часа один раз в 3 часа
30 4,3 0,27 10 0,86
35 5,3 0,37 11,1 0,92 -— — -—
40 6,4 0,49 12,2 0,98 -— — ——
45 7,4 0,62 13,3 1,07 — — —
50 -8,5 0,78 14,4 1,18 8,5 4,64 3,36
55 9,6 0,97 15,5 1,32 — — —
60 10,7 . 1.18 16,6 1,49 10,7 6 4,39
70 13,0 1,72 — — 13,5 7,5 5,56
80 15,8 2,44 .— — 15,8 9,2 6,95
90 18,1 3,44 — — 18,1 11,15 8,6
100 2U.9 4,78 — — — •— —
456
Часть пятая. Основы проектирования цехов
Расход сжатого воздуха
Расход сжатого воздуха на перемешивание 1 л раствора соста-
вляет
При слабом перемешивании...........................0,5 л!мин
» среднем » 1,0 »
» сильном » 1,5 »
На обдувку деталей расход воздуха равен примерно 20—50 мЧч.
Годовой расход сжатого воздуха мсжно рассчитать, умножив
количество воздуха, потребляемого в течение 1 часа, на годовой
фонд времени в часах.
14. РАСЧЕТ ПРОИЗВОДСТВЕННЫХ И ВСПОМОГАТЕЛЬНЫХ
ПЛОЩАДЕЙ
Расчет площадей производится на основании данных табл. 153.
Вспомогательная площадь с вентиляционным оборудованием
составляет 40—50% от производственной при цехе, занимающем
свыше 200 м2, и 50—60 % при производственной площади до 200 м2.
Таблица 153
Примерные нормы площади на единицу оборудования, принимаемые
при проектировании гальванических цехов
(по данным Гипроприбора)
Наименование оборудования Габаритные размеры в м Норма площади на единицу оборудования в мг
Ванны То же » Полуавтоматы 1,0X0,8 1,2X0,8 1,5X0,8 Не регламентиро- ваны 6 7 8 Габар ит п олу автомата с коэффициентом 3,5—4
Часть пятая. Основы проектирования цехов
457
Продолжение табл. 153
Наименование оборудования Габаритные размеры в м Норма площади на единицу оборудования в мг
Автоматы Не регламентированы Габариты автомата с коэффициентом 2,0— 2,2
Шлифовал ьн о-полир овальные станки — 9
Мотор-генераторы 1000/1500 а — 10
То же 5000/2500 а — 16
Если вентиляционные установки располагаются на -площадках,
вспомогательная площадь уменьшается на 10—20%.
Гальванические цехи целесообразно располагать в 1-м этаже.
Рекомендуется использовать подвальные помещения гальвани-
ческих цехов для установки источников постоянного тока, располо-
жения кладовой химикатов, растворного узла, вентиляционных
камер и воздуховодов.
Расстояния, принимаемые при размещении оборудования
Нормы расстояния между оборудованием и элементами зданий
и между отдельными видами оборудования приведены в табл. 154.
Таблица 154
Нормы расстояний (ориентировочные), принимаемые при планировке оборудования
Показатели Ванны при односто- роннем об- служива- нии Шлифова- льно-поли- ровальные станки Колокола Автоматы
Расстояние от стены до оборудования 0,5—0,6 0,6—0,8 0,8—1,0 1,2—1,5
Проходы между рядами оборудования 1,5—2,0 2,0—2,0 1,5—2,0 —
Расстояние между отдельными видами оборудования в одном ряду 0,15—0,2 1,0—1,5 0,8—1,0 —
Расстояние между рядами оборудова- ния, расположенными тыльными сторо- нами друг к другу 0,1—0,2 0,6—0,8 0,5—0,8 —
15. РАБОЧИЙ СОСТАВ И ШТАТЫ ЦЕХА
Штат рабочих, занятых в цехе, делится на производственных
и вспомогательных рабочих. Расчет производственной рабочей силы
производится на основании норм, приведенных в табл. 155 и 156.
458
Часть пятая. Основы проектирования цехов
Таблица 155
Примерные нормы обслуживания стационарных, колокольных
и барабанных ванн производственными рабочими
(Г. Т. Бахвалов, Л. Н. Биркган, В. П. Лабутин)
Электролитическое покрытие в ваннах Электролитическое покрытие или химическая обработка в колоколах и барабанах
Продолжительность процесса в мин. Длина катодной штанги на одного рабочего в м Продолжительность обработки в'мин. Число единиц оборудования иа одного рабочего
5 0,6 60 5
10 1,25 80 6
20 2,5 100 8
30 3,5 120 10
40 5,0 — —
50 6,0 — 1
60 7,0 — —
Таблица 156
Примерные нормы обслуживания полуавтоматов и автоматов
производственными рабочими
(Г. Т. Бахвалов, Л. Н. Биркган, В. П. Лабутин)
Производительность агрегата (подвесок в час) Число рабочих в смену на один
полуавтомат автомат
овальный прямолиней- ный овальный прямолиней- ный
До 25 2 3 1 2
» 50 3 4 2 3
» 75 4 5 3 4
» 100 7 8 4 5
Таблица 157
Нормы для определения числа вспомогательных рабочих, ИТР, СКП и МОП в %
от числа производственных рабочих
Количество производствен- ных рабочих в цехе Процентное отношение числа работаю цих по группам
к производственным рабочим ко всем рабочим (без ОТК)
вспомогатель- ные рабочие (без ОТК) контролеры ОТК инженерно- технические работинки (ИТР) служащие (СКП) младший обслуживаю- щий персонал (МОП)
До 25 40—45 9—12 12—15 3—4 2—3
25—50 35—40 8—10 8—12 3—4 3—4
50—100 30—35 7—8 7—9 3—4 1,2—2,5
Часть пятая. Основы проектирования цехов
459
Штат вспомогательных рабочих, инженерно-технических работ*
ников (ИТР), счетно-конторского (СКП) и младшего обслуживаю-
щего персонала (МОП) определяется по нормам, приведенным
в табл. 157.
Полученные данные по расчету рабочей силы сводят в «Веде'
мость рабочей силы».
Ведомость рабочей силы
№ п/п У часток, отделение Специ- альность Тарифный разряд Потребное количество рабочих в смену Число -смен Потребное количество рабочих в сутки !
16. РАСЧЕТ ВЫТЯЖНОЙ И ПРИТОЧНОЙ ВЕНТИЛЯЦИИ
Система отопления и вентиляции в гальванических цехах долЖ*13
поддерживать температуру не ниже 18° при относительной вла^’
ности в помещении не выше 70%.
Ванны с вредными выделениями необходимо оборудовать ме^т
ными и бортовыми отсосами. Этим путем достигается наибо/е®
эффективное удаление вредных испарений, пока они не успс’л
распространиться по помещению.
Такой способ вентилирования называется местной 0 ы'
тяжнойвентиляцией.
Местные отсосы устраиваются в виде шкафов или KojJSX4
хов, когда источник вредности находится внутри пространен3"»
огражденного стенками. Для наблюдения и работы в таких orp;1 X
дениях оставляют проемы, снабженные створками или д*’еР\
цами’ - пен
Иногда местные отсосы делаются в виде вытяжного зонта, устр* ч
ного таким образом, чтобы по возможности большая часть выдеЛЯ^У
щихся испарений и брызг попадала под зонт. Наиболее совер11,е^.
ными и надежными вентиляционными устройствами являИ’т<Д
бортовые отсосы, расположенные вдоль одной или
сторон ванны.
При ширине зеркала ванн свыше 1,2 м применяется комбин*’ *4
одностороннего отсоса с передувным устройством. Всасывай?
бортовой отсос расположен вдоль одной из сторон ванны, а
дувное устройство находится на противоположной стороне.
Кроме бортовых отсосов, в гальванических цехах устрай
общую вытяжку из верхних зон помещения и общий приток,
считанный так, чтобы не допустить концентр*аций паров, )в
и ядовитых выделений больше допустимых норм.
460
Часть пятая. Основы проектирования цехов
При проектировании вентиляции с помощью зонтов необходимо
установить скорость воздуха во всасывающем сечении с таким расче-
том, чтобы все выделяющиеся пары и брызги отсасывались.
Скорость отсоса воздуха в вытяжных шкафах, применяемых
при травлении меди и медных сплавов в азотной кислоте,
1,0—1,5 м/сек-, при этом отсос примерно 2/3 общего объема воздуха
производится из нижней зоны.
Шлифовально-полировальные станки также должны оборудо-
ваться вентиляцией.
Вытяжную вентиляцию шлифовальных и полировальных станков
не следует объединять, так как это может привести к воспламенению
пыли от искр. Взнтиляционные трубы периодически прочищают.
Над пастоварками и клееварками устраивают местные отсосы
в виде зонтов. Скорость движения воздуха в них 0,3—0,5 м/сек.
Наряду с вытяжной вентиляцией в гальванических цехах необ-
ходимо предусмотреть и приточную вентиляцию для подачи свежего
воздуха в помещение примерно 85—95% объема отсасываемого воз-
духа. Количество воздуха, отсасываемого из помещения, должно
быть несколько больше, чем воздуха, принудительно нагнетаемого,
так как разница давлений вызывает засасывание в помещение через
двери, неплотности в окнах и т. п. некоторое количество воздуха
и тем самым предотвращается проникновение вредных испарений
в соседние помещения.
Нагнетаемый воздух в зимнее время должен предварительно
нагреваться при помощи калориферов до комнатной температуры.
Выбор вентиляторов производят на основании суммирования
общего количества воздуха, который предполагается удалить от
ванн, объединенных в одну вентиляционную систему.
В гальванических цехах для удаления воздуха обычно применяют
вентиляторы низкого давления с разностью полных давлений
до 100 кГ/мг.
Для отсасывания пыли от шлифовально-полировальных станков
применяются лылевые центробежные вентиляторы среднего давления
типа ЦАГИ.
Для укомплектования вентиляторов применяются электродвига-
тели трехфазного переменного тока серий А, АО, АЛ, АОЛ и АК,
а также взрывобезопасные двигатели серий МА-140 и ТПГ.
Мощность мотора вентилятора определяется по формуле
N = 3600-102-1)Гт]2 ' (88)
где Q — потребная производительность вентилятора в мя/ч\
Н — потребный полный напор в мм вод. ст.-,
т] 1 — к. п. д. вентилятора (0,4—0.6);
— к. п. д. ременной передачи (0,8—0,9).
Часть пятая. Основы проектирования цехов
461
17. ЗАДАНИЕ НА АВТОМАТИЗАЦИЮ ТЕХНОЛОГИЧЕСКИХ
ПРОЦЕССОВ И ТЕХНИКУ БЕЗОПАСНОСТИ;
ТЕХНИКО-ЭКОНОМИЧЕСКИЕ ПОКАЗАТЕЛИ
Автоматизация технологических процессов
Задание должно содержать перечень оборудования, требующего:
1) автоматического регулирования плотности тока;
2) автоматического регулирования кислотности раствора;
3) автоматического измерения толщины покрытия в процессе
его нанесения;
4) автоматического регулирования температуры растворов;
5) реверсирования электрического тока.
Техника безопасности и промсанитария
Учитывая характер производственного процесса и специфику
принятого для обработки заданного выпуска изделий, учащийся
должен разработать и коротко изложить конкретные мероприятия
по технике безопасности и промышленной санитарии, которые
должны быть применены в проектируемом гальваническом цехе.
Указанные мероприятия разрабатываются на основании «Правил
техники безопасности и производственной санитарии при производ-
стве металлопокрытий», изд. 1961 г.
Технико-экономические показатели
К числу важнейших технико-экономических показателей цеха
относятся: разновидности обрабатываемых изделий и покрытий;
расход нормированного времени на обработку одного изделия или
1 м2 поверхности; сменность работы цеха; годовой фонд времени
рабочего и оборудования; число единиц оборудования и их
загрузка; средняя площадь на единицу оборудования и кубатура
на одного производственного рабочего и на единицу производствен-
ного оборудования; энерговооруженность на одного рабочего; расход
пара, воды и сжатого воздуха на 1 изделие; фонд заработной платы;
стоимость материалов на 1 изделие и себестоимость 1 м2 покрытия.
ЛИТЕРАТУРА
К части первой
1. Фрумкин А. Н., Баго ц кий В. С., И оф а 3. А., Каба-
нов Б. Н. Кинетика электродных процессов. Изд. МГУ, 1952. 319 с.
2. Изгарышев Н. А.. Горбачев С- В. Курс теоретической электро-
химии. Госхимиздат, 1951. 503 с.
3. Л а й н е р В. И. и К у д р я в ц е в Н. Т. Основы гальваностегии. Часть I.
Металлургиздат, 1953. 647 с.
4. Бай маков Ю. В. Электролиз в металлургии. Т. I. Металлургиздат,
1939- 468 с.
5. Хомяков В. Г., Машовеи В. П. иКузьмин Л. Л. Техноло-
гия электрохимических производств. Госхимиздат, 1960. 676 с.
6. Баграмян А. Т. иСоловьева 3. А. Методы исследования элек-
троосаждения металлов. Изд. АН СССР, 1960. 446 С.
К части второй
1. Грилихес С. Я- Подготовка поверхности деталей перед гальваниче-
ским покрытием. Машгиз, 1961. 79 с.
2. Б е л а Б. Справочник гальваностега. Машгиз, 1960. 396 с.
3. Д е м ч у к И. С. Ультразвуковая интенсификация технологических про-
цессов. Машгиз, I960.
4. Бартл Д. иМудрох О. Технология химической и электрохимиче-
ской обработки поверхности металлов. Машгиз, 1961.
К части третьей
1. Лайнер В. И. иКудрявцев Н. Т. Основы гальваностегии. Части I
и II. Металлургиздат, 1953 и 1957 . 624 с. и 647 с.
2’. Ильин В. А. Цинкование и кадмирование. Машгиз, 1961. 51 с.
3. Ямпольский А. М. Меднение и никелирование. Машгиз, 1961. 60 с.
4. Горбунова К. М. и Никифорова А. А. Физико-химические
основы процесса химического никелирования. Изд. АН СССР. 1960. 207 с.
5- Ч е р к е з М. Б. Хромирование и железиение. Машгиз, 1961. 87 с.
6. Э й ч и с А. П. Декоративные покрытия металлов. Машгиз, 1955. 155 с.
7. И л ь и н В. А. Лужение и свинцевание. Машгиз, 1961. 36 с.
9. Ямпольский А. М. Покрытия благородными металлами. Машгиз,
1961. 51 с.
10. Л а й н е р В. И. Гальванические покрытия легких сплавов. Металлург-
издат, 1957.
11. Вериик С иПиннер Р. Химическая и электрохимическая обра-
ботка алюминия и его сплавов. Судпромгиз, 1960. 387 с.
12. Электролитическое осаждение сплавов. Под ред. В. А. Аверкина. Машгиз,
1961.
13. В я ч е с л а в о в П. М. Покрытие сплавами. Машгиз, 1961. 68 с.
14- Блащук Е. Ф. и Лаворко П. К-Гальванотехника.Машгиз, 1961.245с.
Литература
463
15- Бахвалов Г. Т., Биркган Л Н. иЛабутин В. П Справоч-
ник гальваиостега. Изд. ГИТИ черной и цветной металлургии, 1954 . 650-1:.
16 Вайнер Я. В. п Д а с о я н МА. Оборудование, автоматизация и меха-
низация цехов электрохимических покрытий. Машгиз, 1961. 404 с.
К части четвертой
1. Шрейдер А. В. Оксидирование алюминия и его сплавов. Металлург-
издат, 1960. 220 с.
2. Г р и л и х е с С- Я. Защита металлов оксидными и фосфатными пленками.
Машгиз, 1961. 79 с.
3. ФедотьевН. П. и Грилихес С. Я. Электрохимическое травле-
ние, полирование и оксидирование металлов. Машгиз, 1957. 243 с.
4. Ямпольский А. М. Технология оксидирования и фосфатирования
металлов. Леннздат, 1969. 106 с.
5. В а й н е р Я. В., Д а с о я н М. А., Д р и н б е р г А. Я. и др. Справоч-
ник по защитно-декоративным покрытиям. Машгиз, 1951. 489 с.
6. Любимов Б. В. Специальные лакокрасочные покрытия в машинострое-
нии. Машгиз, 1961. 191 с.
К части пятой
1. ЛайнерВ. И. иКудрявцев Н.Т. Основы гальваностегии. Часть II.
1957. 647 с.
2. ФедотиковА. П. Краткий справочник технолога-машиностроителя.
Металлургиздат, 1960. 402 с,
3. Л е в и н з о н А. О. Проектирование цехов металлопокрытий. 1959.
4. Гольдберг И. Г. Источники постоянного тока для цехов гальвано-
покрытий. 1960. ЛДНТП.
ОГЛАВЛЕНИЕ
Введение.............................................................. 3
Часть первая
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ГАЛЬВАНОСТЕГИИ
Глава 1. Некоторые понятия из области электрохимии.................... 7
1. Ионное произведение воды.................................... —
2. Буферные растворы............................................ 9
3. Законы электролиза и их применение в гальванотехнике........ 11
4. Поляризационные явления при электролизе..................... 18
Глава II. Механизм образования электролитических осадков . 29
1. Структура электроосажденных металлов......................... —
2. Процесс электрокристаллизации металлов и его особенности . . 30
Глава III. Влияние различных факторов иа структуру и свойства электро-
литических покрытий.................................................. 33
1. Влияние режима электролиза................................... —
2. Влияние состава электролита.......................... .... 37
глава IV. Распределение тока на катоде............................... 49
1. Рассеивающая и кроющая способность электролитов.............. —
2. Количественная формулировка рассеивающей способности .... 50
3. Методы измерения рассеивающей способности электролитов ... 53
4. Влияние различных факторов электролиза на рассеивающую спо-
собность электролитов .......................................... 56
5. Искусственные приемы улучшения равномерности распределения тока 60
Часть вторая
МЕТОДЫ ПОДГОТОВКИ МЕТАЛЛИЧЕСКОЙ ПОВЕРХНОСТИ ДЕТАЛЕЙ ПЕРЕД
НАНЕСЕНИЕМ ПОКРЫТИЙ
Глава V. Механическая подготовка поверхности ........................ 64
1. Шлифование и полирование . .................................. —
2. Галтовка..................................... . . . -. 80
3. Крацевание ................................................. 85
4. Металло-пескоструйная и гидро-абразивная обработка.......... 86
Глава VI. Химическая и электрохимическая подготовка поверхности . 90
1. Химическое и электрохимическое обезжиривание........
2. Обезжиривание с применением ультразвука..................... 96
3. Травление черных и цветных металлов........................ 100
4. Декапирование ......... ... . 118
5. Матирование........................................ .... 120
6. Промывка................................................... 121
Глава VII. Электрохимическое и химическое полирование металлов .... 124
1. Электрополирование ........................................ —
2. Химическое полирование .................................... 139
Оглавление 465
Часть третья
ТЕХНОЛОГИЯ НАНЕСЕНИЯ МЕТАЛЛИЧЕСКИХ ПОКРЫТИЙ
Глава VIII. Цинкование............................................. 142
1. Общие сведения .............................................. —
2. Способы цинкования и их сравнительная характеристика ... 144
3. Сравнительная характеристика цинковых электролитов.......... 149
4. Цинкование в кислых электролитах........................... 152
5. Цинкование в цианистых электролитах........................ 159
6. Цинкование в щелочных (цинкатных) электролитах............. 163
7. Цинкование в пирофосфатных и аммиакатных электролитах .... 167
8. Обработка цинковых покрытий................................. 169
9. Удаление недоброкачественных цинковых покрытий.............. 170
Глава IX. Кадмирование............................................... 171
1. Общие сведения ............................................... —
2. Сравнительная характеристика кадмиевых электролитов .... 172
3. Кислые электролиты кадмирования............................. 173
4. Цианистые электролиты кадмирования.......................... 176
5. Обработка изделий после кадмирования................ . . 180
6. Удаление недоброкачественных кадмиевых покрытий ..........* —
Глава X. Меднение ................................................... 181
1. Общие сведения ............................................
2. Сравнительная характеристика электролитов для меднения .... 182
3. Цианистые электролиты для меднения.......................... 183
4. Нецианпстые электролиты для непосредственного меднения черных
металлов....................................................... 192
5..М еднение в кислых электролитах.................•. . . . 194
6. Удаление недоброкачественных медных покрытий................ 199
7. Контактное меднение........................................... —
8. Аноды для меднения ......................................... 200
Глава XI. Никелирование.................. ............ 201
1. Общие сведения................................................ —
2. Катодные и анодные процессы прн никелировании............... 203
3. pH никелевых электролитов........................... . —
4. Электролиты для никелирования и режимы их работы ... . 205
5. Блестящее никелирование..................................... 211
6. Процесс «черного никелирования» ................... . . 213
7. Химическое никелирование.................................... 214
8. Удаление недоброкачественных никелевых покрытий ... . 218
Глава XtH. Хромирование.............................................. 219
1. Общие сведения................... . ......
2. Особенности процесса хромирования.......................... 220
3. Виды хромовых покрытий и их назначение.......... . . 225
4. Электролиты для хромирования............................... 227
5. Хромирование в саморегулирующихся электролитах . ... 236
6. Хромирование в холодных электролитах....................... 237
7. Пористое хромирование...................................... 238
8. Комбинированные хромовые покрытия....................... . • 241
9. Черное и цветное хромирование................................ —
10. Снижение потерь хромовых электролитов . .............. 242
И. Приспособления для хромирования.......................... 243
12. Изоляция мест, не подлежащих хромированию.................. 245
13. Удаление недоброкачественных хромовых покрытий............. 246
30 Вайнер и Дасоян
466
Оглавление
Глава XIII. Лужение . ....................................... 247
1. Общие сведения................................................ —
2. Горячее лужение............................................. 250
3. Электролитическое лужение из кислых электролитов . . . 253
4. Щелочные электролиты для лужения............................ 263
5. Лужение без внешнего тока................................... 271
6. Пассивирование электролитически луженой жести............... 272
7. Оплавление оловянных покрытий................................. —
8. Покрытие «кристаллита....................................... 274
9. Удаление недоброкачественных покрытий и регенерация олова . 276
Глава XIV. Свинцевание................................................ 278
1. Общие сведения ................................................ —
2. Методы нанесения свинповых покрытий.......................... 279
3. Состав и режим работы ванн электролитического свинцевания ... —
4. Приготовление свинцовых электролитов........................ 285
5. Удаление недоброкачественных свинцовых покрытий ..... 287
Глава XV. Покрытие железом и кобальтом.............................. 288
1. Общие сведения .............................................. —
2. Электролиты для железнения ................................. 289
3. Покрытие кобальтом.......................................... 296
Глава XVI. Покрытие благородными и редкими металлами...................297
А. Серебрение....................................................... —
1. Общие сведения ................................................ —
2. Цианистые электролиты серебрения............................ 298
3. Нецианистые электролиты серебрения............................ 303
4. Химическое (контактное) серебрение............................ 306
5. Дополнительная обработка серебреных изделий.................. 308
6. Удаление недоброкачественных серебряных покрытий.............. 309
Б. Золочение.....................................................
1. Общие сведения .............................................. —
2. Цианистые электролиты для золочения.......................... 31
3. Железистосинеродистые электролиты............................ 31
4. Золочение без внешнего тока................................. 31..
5. Удаление недоброкачественных покрытий и извлечение золота из
отработанных растворов.........................................
В. Родирование............................ ........................
1. Общие сведения ................................
2. Электролиты для родирования и режимы работы.........
Г. Платинирование ...............................................
1. Общие сведения...........................................
2. Электролиты для платинирования и режимы работы ...
3. Контактное платинирование................................._
4. Регенерация электролитов и удаление недоброкачественных покрытии
Д. Палладирование................................................
1. Общие сведения ............................................
2. Электролиты для палладирования и режимы работы ....
Е. Индирование..................................................
1. Общие сведения ....................................... ...
2. Электролиты для индирования и режимы работы............
3. Регенерация отработанных электролитов.......................
Глава XVII. Наиесеиие гальванических покрытий иа алюминий, магний,
цинк и их сплавы....................................................
А. Покрытия на алюминии и его сплавах ....
1. Общие сведения ..............................................
Оглавление 467
2. Методы подготовки алюминиевых изделий перед нанесением галь-
ванический покрытий........................................... 333
3. Рецептура ванн для нанесения гальванических покрытий на алю-
миниевые рплавы............................................... 339
Б. Покрытия 'на магниевых сплавах................................. 343
В. Покрытии на цинковых сплавах................................. 344
XVJIjf. Гальваническое покрытие сплавами....................... 347
1. Сплавы, получаемые электролизом, и их назначение.............. —
2. Теоретические основы электролитического метода получения спла-
вов .......................................................... 348
3. Латунирование............................................... 352
4. Покрытие сплавом медь—олово............................ 355
5. Покрытие сплавом свинец—олово............................ 359
. 6. Покрытие сплавом олово—никель . . 363
7. Покрытие сплавом цинк—кадмий............................ 364
Часть четвертая
ЭЛЕКТРОХИМИЧЕСКИЕ И ХИМИЧЕСКИЕ МЕТОДЫ ОКСИДИРОВАНИЯ
И ОКРАШИВАНИЯ МЕТАЛЛОВ
рва XIX. Анодное оксидирование алюминия и алюминиевых сплавов . . . 366
1. Общие сведения................................................ —
2. Анодирование в серной кислоте............................ 372
3. Анодирование в хромовой кислоте............................. 375
4. Анодирование в щавелевой кислоте ........................... 376
5. Эматалирование .............................. 377
6. Оборудование и приспособления, применяемые прн анодировании 378
7. Обработка анодированных изделий............................. 382
рва XX. Химическое и электрохимическое оксидирование магния и его
сплавов........................................................... 387
1. Общие сведения................................................ —
2. Химические способы оксидирования.............................. —
3. Электрохимические способы оксидирования.......... . . • 389
рва XXI. Оксидирование черных и цветных металлов.................. 392
1. Общие сведения .............................................. —
2. Химическое оксидирование черных металлов.................... 393
3. Электрохимическое оксидирование черных металлов............. 399
4. Термическое оксидирование черных металлов................... 400
5. Оксидирование цветных металлов......................... ... 401
ава XXII. Фосфатирование....................................... 405
1. Общие сведения .............................................. —
2. Фосфатирование черных металлов.............................. —
3. Фосфатирование цветных металлов............................. 409
taea XXIII. Эмалевые и лакокрасочные покрытия.................. . 410
А. Эмалевые покрытия ............................................. —
1. Общие сведения ....................................... —
2. Технология эмалирования и применяемое оборудование. . . . 411
Б. Лакокрасочные покрытия...........:..................... .... 413
1. Общие сведения ............................................. —
2. Классификация лакокрасочных материалов.................... 415
3. Технология нанесения лакокрасочных покрытий и применяемое
оборудование ................................................. 420
30*
468
Оглавление
Часть пятая
ОСНОВЫ ПРОЕКТИРОВАНИЯ ЦЕХОВ ЭЛЕКТРОХИМИ ЧЕСКИ/Х ПОКРЫТИЙ
1. Содержание и объем курсового проекта............L............ 434
2. Содержание и объем дипломного проекта...........X . .... —
3. Задание на проектирование.......................- • • 435
4. Определение фондов рабочего времени ......................" 436
5. Установление производственной программы цеха или участка .
6. Определение величину загрузочной или рас 1етной единицы ... __
7. Определение-времени обработки деталей.................. 438
8: Выбор толщины покрытий и технологического процесса..... 439
9. Выбор оборудования для подготовки и покрытия и методы расчета 440
. 10. Расчет поверхности загрузки и силы тока............... 449
11. Расчет расхода основных и вспомогательных материалов .... —
12. Расчет потребной мощности и- выбор источников тока.... -452
13. Расход воды, пара и сжатого воздуха.................... 455
14. Расчет производственных и вспомогательных площадей..... 456
15. Рабочий состав и штаты цеха............................ 457
16. Расчет вытяжной и приточной вентиляции....................... 459
17. Задание на автоматизацию технологических процессов и технику
безопасности; технико-экономические показатели.................. 461
Литература . '......................................................... 462
Редактор издательства А. И. Варксвецкая
Переплет удожника А. И. Никитина
Технический редактор М. М. Петерсон Корректор В. М. Хорошкевич
Сдано в производство 22/VI 1962 г. . Подписано к печати 20/Х 1962. м-04899
Формат бумаги 60 X 9O’/ia Печ. листов 29.25 Уч.-изд. листов 30,0 Тираж 16000 экз.
Цена 1 р. 20 к. Заказ 1051
Типография № 6 УЦБ и ПП Ленсовнархоза, Ленинград, ул. Моисеенко, 10