Текст
И. А. КАКОВСКИЙ
ю. М. ПОТАШНИКОВ
КИНЕТИКА
ПРОЦЕССОВ
РАСТВОРЕНИЯ
И. А. КАКОВСКИЙ, Ю. М. ПОТАШНИКОВ
КИНЕТИКА ПРОЦЕССОВ
РАСТВОРЕНИЯ
tf
МОСКВА «МЕТ дллурrия)), 1 пs
УДК 669.2: 531.3.532.73
Кинетика процессов растворения. К а к о в с к 11 {I И. А.,
П о т а ш н и к о в Ю. l\'\., «Мсталлурrия», 1975. 224 с.
Рассмотрены вопросы теории и методики исследования ки,
нетики реакции раствореlIИЯ, используемых в rидромета.rrлур'
rии цветных, блаrородных и редких металлов. Описан порядок
работы при изучении кинетики растворения методом вращаю-
щеrося диска. Приведены и обсуждены результаты исследо
вания стехиомеТРШI, термодинамики и кинетики раствореНIIЯ
ряда металлов, сп.тНIВОВ, сульфидов, теллуридов, окислов и co
лей. Даны некоторые пра[{тические рекомендации для выбора
теХllолоrllческих условий и расчета основных кинетических
парамеТРОБ технических rидрометаллурrических процессов.
Киша преДllазначается для работников rидрометаллурrи
ческих заводов и заводских лабораторий, СОТРУДНIшов исследо
вательских н проектных институтов, а также может быть по-
лезна аспирантам и студентам соответствующих специально
стей. Ил. 69. Табл. 16. Список лит.: 67 назв.
ИrоРь АНТОНОВИЧ КАКОВСКИЙ,
ЮРИЙ МОИСЕЕВИЧ ПОТАШНИКОВ
КИНЕТИКА ПРОЦЕССОВ РАСТВОРЕНИЯ
Редактор С. В. Тарарин
Редактор издательства Л. М. Эпькинд
ХУДQжественный реДакТОр А. И. rофwтенн
1ехннческий редактор Н. В. Сидорова
Корректоры Н. Л. ЗаПУЦКilЯ, Р. К. rаврипина
Обложка Художника М. П. 1епьцовон
Сдано в набор 1З/V111 1974 r. Подписано в печать 22/[ 1975 r.
1-01745 Формат бумаrи 84Х 108'/32 Бумаrа типоrрафская N 2
Усл. печ. л. 11,76 Уч-изд. л. 12,0
Т'1рёlЖ 2300 экз. Заказ 306. Изд. N!? 2491. Цена 1 р. 20 к.
Издатепьство «Метаnnурrия», 119034, Москва, r 34,
2-0быденский пер., д. 14
Владимирская типоrрафия Союэполиrрафпрома
при rocYAapcTBeHHoM комитете Совета Министров СССР
по AenaM издатепьств, поп... rрафии и КНИЖflОЙ Jорrовли
r. Владимир, ул. Победы, д. lв б.
@ ИЗД;lТСс1!JСТВО «Металлурrия», 1975
31002 064
1( 040(O1) 75 30 75
Светлой памяти
Влади.мира Яковлевича Мостовича
посвящается
ПРЕДИСЛОВИЕ
в книrе изложены результаты исследованиЙ, выпол
ненных в течение последних двадцати лет под руковод-
ством И. А. KaKoBcKoro в лабораториях ряда учебных
и исследовательских учреждений. Книrа характеризует
ся некоторыми особенностями, о которых авторы счита
ют необходимым предупредить читателя.
Во первых, она посвящена кинетике растворения не-
орrанических поликристаллов в водных растворах.
BO BTOpЫX, весь материал, положенный в основу
-I<ниrи , получен с помощью единоrо метода метода вра-
щающеrося диска, широко применяемоrо теперь во MHO
rих лабораториях Москвы, Ленинrрада, Еревана, Крас-
ноярска, Иркутска, а также за рубежом при исследова-
нии кинетики reTeporeHHbIx реакций, в том числе и тео-
ретических основ промышленных rидрометаллурrических
процессов. В определенных разделах книrи подробно об
суждены достоинства и недостатки 3Toro метода. Первые
позволили внести значительный элемент новизны в TpaK
товку важнейших, в том числе наиболее полно изучен-
ных друrими методами процессов, вторые внекоторой
степени оrраничилн возможность полноrо использования
полученных результатов на практике в силу недостаточ-
ной изученности всех особенностей работы промышлен-
ных аппаратов. Тем Не менее даже в этих случаях метод
вращающеrося диска позволяет четко установить влия-
ние ряда переменных факторов на скорость протекания
промышленных процессов.
В-третьих, Книrа посвящена изучению кинетики рас-
творения специально очищенных металлов, сннтетиче
ских сплавов и друrих труднорастворимых соединений,
соответствующих по содержанию основных компонентов
1
3
ПРИРОДНbJМ t практически важным минералам. Поэтому
полученные величины скоростей растворения относятся
к идеальным процессам растворения и MorYT СЛУЖИТЬ t
с одной стороны, в качестве теоретических KOHcTaHT t
а с друrой в качестве базовых величин для сравнения
с соответствующими параметрами реальных технолоrи
ческих процессов. Так, например, в ряде случаев, коrда
процесс протекает в кинетическом режиме, удается
однозначно связать результаТЫ t полученные методом
вращающеrося диска и методом растворения порошко
образных рудных минералов.
Теоретические представлеНИЯ t положенные в основу
книrИ t были развиты в фундаментальных работах акад.
А. Н. Фрумкина t а технические идеи в ориrинальных
исследованиях ЧЛ. кор. АН СССР И. Н. Плаксина.
Термодинамические KOHcTaHTbI t необходимые для pac
четов реакций, взяты из известных справочников и руко-
водств М. Х. Карапетянца и М. Л. Карапетянц 1, В. А. КИ
реева 2 и В. М. Латимера 3. В соответствии с характером
книrи и для удобства пользования ею авторы решили не
приводить в тексте ссылки на ориrинальные работы
при необходимости читатель сможет найти нужные CBe
дения в списке литературы, приведенном в конце книrи.
Материал, изложенныЙ в книrе, существенно перера-
ботан и дополнен в соответствии с результатаМIl, полу-
ченными в последние rоды авторами и друrими исследо-
вателями мноrие экспериментальные работы повторе-.
HbI t а расчеты уточнены. Несмотря на ЭТО t авторы
вполне допускают вероятность ошибок, обусловленных
сложностью изучаемых процессов и трудностями, возни-
кающими при их описании, а поэтому будут чрезвычаЙно
признательны BceM t кто поможет им замечаниями и кри-
тикоЙ.
Авторы считают приятным долrом выразить rлубо-
кую блаrодарность своим учителям, а также сотрудни-
кам, принявшим участие в выполнении эксперименталь-
ных исследований.
1 К а рап е т я н Ц М. Х., К а рап е т я Il Ц М. Л. Основные тер-
МОДlIнамические константы неорrанических и орrанических веществ.
1\1., «Химия», 1968. 472 с. .
2 К И Р е е в В. А. Методы ПРШ,ТИЧССI<ИХ расчетов в термодина-
мике ХИМlIческих реакций. М., «Химия», 1970. J 9 с. с ил.
3 Л а т и м е р В. ,IV\. Окислительные состояния элеМентов н их
потеНUllа,rты R водных паСТВОР<1Х. М.. ИЛ. 1954. 396 с. <: ил.
4
rЛ41lsа 1
О&ЩИЕ СВЕДЕНИЯ
О ПРОЦЕССАХ РАСТВОРЕНИЯ
t. РОЛЬ ПРОЦЕССОВ РАСТВОРЕНИЯ
. rИДРОМЕТ Аллурrии
Проrресс современной металлурrИIl цветных, блаrо
родных и редких металлов тесно связан с усовершенст
вованием rидрометаллурrических методов извлечения
ценных компонентов из рудноrо сырья.
Среди известных преимуществ rидрометаллурrии пе
ред пирометаллурrией по крайнеЙ мере четыре в послед-
ние rоДЫ стали наиболее важными. Первое HaMHoro
меньшее, чем в пирометаллурrии, заrрязнение окружаю-
щей среды. Достаточно сравнить пирометаллурrический
и rидрометаллурrический методы переработки сульфид
ных руд. Кроме Toro, в ряде случаев (например, при пе
реработке руд радиоактивных металлов) сравнение вооб-
ще невозможно, поскольку rидрометаллурrический метод
является единственно приемлемым. Второе возмож
ность создания автоматизированных систем управлеНIlЯ
процессами переработки руды, начиная от выщелачива
ния и кончая восстановлением металла. Третье BЫCO
кая ЭКОНОМIIЧНОСТЬ rидрометаллурrических методов пе
реработки бедноrо сырья труднообоrатимых руд, шла
ков и отвальных продуктов. Четвертое преимущество
rидрометаллурrии большое разнообразие конечных
форм TOBapHoro продукта, который может быть получен
в виде компактноrо металла, разнообразных солей или
специальных порошков металличеСКIIХ, неметалличе
ских, комбинированных. Особенно важна возможность
получения порошкообразных металлов, применение KOTO
рых является более экономичным 11 мноrосторонним.
Указанные преимущества открывают широкую пер-
спективу внедрения rидрометаллурrии в производство
всех практически важных металлов на базе прямоrо BЫ
щелачивания Бсех БИДОВ исходноrо сырья. На этом пути,
несомненно, встретятся определенные трудности, связан
ные с отставанием теории от практики rидрометаллур-,
rии, с недостаточностью наших знаниЙ о кинетике про
цессов растворения, со слаБОlI изучеIlН()СТЫО ХIIМН1М(]
растворения труднораствор 11М ых веlllеств.
5
До настоящеrо времени rидрометаллурrия имеет дe
ло в основном с леrкорастворимыми соединениями, ПрII
родными или получаемыми при пирометаллурrической
ПОДrотовке руды. Например, при спекании и обжиrе
обычно образуются водорастворимые соли ценных метаЛ
лов. Скорость и полнота извлечения в последующих опе
рациях выщелачивания, как правило, достаточно велики.
Отказ от предварительной пирометаллурrической об.
работки повысит удельный вес процессов растворения
в технолоrических схемах и изменит структуру технико
экономических показателей rидрометаллурrических про
изводств. Важнейшим резервом повышения их произво
дительности станет интеНСИфllкация процесса выщелачи-
вания, которая невозможна без детальноrо изучения ero
теоретических основ. В связи с этим возникает необхо-
димость исследования взаимодействия ряда металлов и
их труднорастворимых соединений с ВОДНЫМIl paCTBopa
ми кислот, солей, щелочей и комплексообразователей,
поиска эффективных комбинированных растворителей,
определения оптимаЛЬНbJХ условий протекаНIlЯ процессов
растворения.
Разработанные в последние rollbI методы математи
ческоrо планирования эксперимента, используемые для
получения технолоrических моделей rидрометаллурrиче
ских процессов, предполаrаlOТ наличие исходной инфор
мации о материальном балансе (стехиометрии), химизме
(макромеханизме) и скоростях (макрокинетике) ПIДро
металлурrических реакuий. Недостаточная надежность
указанной информации полностью исключает применение
этих проrрессивных и экономичных методов исследо-.
вания.
1. ОСНОВНЫЕ ЭТАПЫ ЭКСПЕРИМЕНТАльноrо
ИССЛЕДОВАНИЯ КИНЕТИКИ РАСТВОРЕНИЯ
в процессах растворения твердых веществ основные
акты взаимодеЙствия осуществляются на поверхности
раздела фаз, обычно весьма незначительной по cpaBHe
нию с общим объемом системы. Формирование этой об
v1асти (называемой поверхностью реакции) II ее своЙства
полностью определяются типом или режимом взаимодей-
ствия.
ОсновноЙ задачеЙ при IIзучен!!!! КI1неТI1КИ ХlIмичеСЮIХ
реакций является определение абсолютноЙ неЛИЧИIIЫ
i)
константы CKOpOCТlI 1I ее зависимости от различных фак
торов. Поскольку в большинстве случаев химические
взаимодействия являются СЛОЖНЫМII, устанавливаемая
экспериментально зависимость скорости реакции от ряда
факторов позволяет вычислить лишь некоторую услов.
ную величину константы, которая количественно xapaK
теризует наиболее медленную стадию процесса. Ее мож
но назвать экспериментальной константой скорости. Не':.
смотря на свою относительность, эта величина так же,
как и абсолютная константа скорости, зависит только от
природы реаrирующих веществ.
Скорость процесс а растворения можно выразить I{QЛИ
чеством вещества, переходящеrо в раствор за единиuу
времени. В общем случае на нее оказывают влияние сле
дующие факторы: а) величина поверхности растворяе
Moro вещества; б) температура; в) скорость движения
жидкости относительно этой поверхности (интенсивность
перемешивания); r) характер движения жидкости в объ
еме и у поверхности раздела фаз (rидродинамика про
цесса); д) парциаЛЫlOе давление rазовой фазы над pac
твором 1; е) концентрация реаrента растворителя; ж) KOH
центрация pacTBopeHHoro вещества (продукта реакuии);
з) концентрация примесей в растворе II в твердой фазе.
Определение заВИСJlмостей скорости от каждоrо из
указанных факторов при пассивном эксперименте воз
можно тоЛько при условии cTpororo постоянства осталь
ных параметров опыта. Очевидно, что ВbIполнение этоrо
условия возможно лишь в тоЙ мере, в какой уровень
экспериментальной техники (методика) соответствует
требованиям теории.
Рассмотрим методы, при меняемые для исследования
процессов растворения, чтобы уяснить, в какой степени
они позволяют изучить влияние перечисленных выше
факторов на скорость этих процессов.
Растворение порошков
Методики, основанные на растворении дисперсноrо
твердоrо вещества при перемешивании с растворителем
в открытых или закрытых сосудах, чаще использовали
при изучении скоростей растворения минералов, реже
металлов. При растворении порошков определение ис
1 В случае, если rаз участвует в реакции, либо Cl\Ma ре<lКЦI!Я
протекает с выделеl!ием rазообраЗI!ЫХ продуктов.
7
тинной поверхности твердоЙ фазы представляет значи
тельные трудности. Не rоворя уже об обычных ошибках
измерений (кстати, весьма больших даже при использо
вании наиболее точных методов), необходимо учитывать
наличие в растворяемых частицах различноrо рода мик
po И макродефектов (трещины, царапины, капиллярные
поры), возможность их слипания и, наконец, изменение
поверхности, связанное с самим процессом растворения,
который сопровождается не только уменьшением линей
ных размеров частиц, но lf совершенно неопределенным
изменением их формы.
При изучении диффузионных процессов некоторые из
этих факторов (физическая неоднородность и неболь
шие колебания величины rеометрической поверхности
дисперсной фазы) не оказывают заметноrо влияния на
воспроизводимость результатов. Однако они MorYT при
вести к существенным ошибкам при исследовании реак-
ций растворения, протекающих в кинетической обла-
сти l . Особо следует сказать об условии равнодоступ
ности поверхности, которое соблюдается лишь
в исключительных случаях (например, при растворении
вращающихся дисков, см. ниже). Между тем это условие
иrрает исключительную роль прн исследовании диффу
ЗIIOННЫХ и кинетических процессов, переходных режимов
и при определении пор дка реакции 2 .
Применение методов, основанных на растворении по
рошков, не позволяет также получить однозначные pe
зультаты и при выяснении влияния концентрации pac
творителя на скорость растворения. При растворении
дисперсноrо вещества скорость реакции может быть
чрезмерно высокой, и в этих условиях нельзя пренебре
raTb влиянием концентрации pacTBopeHHoro вещества
(продукта реаI{ЦИИ) на; скорость растворения. В боль-
шинстве случаев стремятся поддерживать эту KOHцeHTpa
цию на возможно более низком уровне, что вызывает
необходимость увеличения объема раствора. При проек:.
тированпи компактной устаJЮВIШ необходимо либо
1 Более подробно о диффузионном и кинетическом режимах рас.
творения см. стр. 12 13.
2 Выполнение этоrо условия особенно I3ажно при IIзучении про-
цессов, сопровождающихся изменением характера поверхности (ре.ак.
ции цементации, адсорбция, взаимодействие peareHToB с поверхно-
стью минералов при флотации, растворение с образованием проме.
жуточных твердых продуктов и т. п.).
8
учесть влияние концентрации продукта реакции, либо
позаботиться об «освежении» раствора.
С друrой стороны, концентрация растворителя в ходе
опыта должна оставаться постоянной. Этоrо можно до-
стичь двумя путями: либо пеРИОДllчески подкреплять
раствор, либо вести процесс при высокой концентрации,
чтобы ее относительное изменение не было слишком рез-
КИМ. Первое не всеrда удобно, например при исследова
нии автоклавных процессов; второе создает реальную
опасность нарушения I1зотермичности процесса, так как
реакции при высокой .степени дисперсности твердоrо ве-
щества и высокой концентрации растворителя нередко
протекают настолько бурно, что становится невозможноЙ:
не только компенсация, но и контроль температуры в зо-
не реакции. r лавная же трудность методики состоит
в том, что при исследовании скоростей растворения по-
ротков наблюдаемый порядок реакции будет иным, чем
истинный порядок реакции на rранице раздела фаз.
Очевидно, в этом случае изменение скорости paCTBope
ния обуслов.ТIено изменением не только концентрации
растворителя, но и величины реаrирующей поверхности.
Эта поверхность в процессе растворения может либо
уменьшаться (за счет уменьшения линейных размеров
частиц), либо увеличиваться (например, при разобщении
кристаллических конrломератов, при пептизации и т. п.),
В результате чеrо определяемый порядок реакции будет
либо ниже, либо выше ИСТIIнноrо.
Существенными недостаткаМII описываемой методи-:.
ки являются также затруднения, которые возникают при
определении фазовых изменений в твердом веществе при
ero раствореНИII в виде порошка. В этом случае новую
фазу, образовавшуюся на поверхности частиц в виде
пленки, очень трудно отличить II, rлавное, отделить от
исходноrо вещества.
Растворение ко,ипаКТНblХ веществ
Для исследования кинетики растворения широко при-
меняют также методы, основанные на растворении KOM
пактных образцов определенной rеометрической формы,
рабочая поверхность которых может быть измерена.
. Эти методы MorYT быть разбиты на четыре rруппы,
в зависимости от Toro, как осуществляется относитель-
Ное движение жидкости н КрIlсталла.
1\. пер в о й r р у п 11 е можно отнести сравнительно
9
редко применявшиеся методы, в которых не предусмот
рено перемешивание раствора и образец в течение опы
та остается неподвижным. Ко в т о рой r р у п п е отно-
сятся методы, в которых также используют неподвижный
образец, но движение жидкости относительно рабочей
поверхности осуществляют с помощью мешаЛКII, расПо
ложен ноЙ над, под образцом или сбоку от Hero. Т р е т ь ю
r р у п п у составляют методы, основанные на растворе-.
нии оrраниченноrо числа кристаллов правильной формы
при перемешиваНIIИ мешалкоЙ, при вращении или встря
хива нии закрытоrо сосуда с кристаллами или на раство-
рении в восходящем потоке растворителя (метод «вита
ющеrо» кристалла»). в ч е т в е рту 10 r ру п п у входят
методы с вращающимся образцом, имеющим форму Ka
кой либо из фиrур вращения (цилиндр, диск, кольцо и
т. п.).
Методы, в которых ЖИДКОСТЬ и образец остаются не-
ПОДВИЖНЫМII, совершенно неприrодны для изучения
реакциЙ растворения, так как в этом случае неизбежно
торможение реакций за счет увеличения концентрации
растворенных веществ у поверхности раздела фаз, не
rоворя уже о невозможности отбора надежной средней
пробы раствора на анализ. Кроме Toro, при изучении
этим методом реакций, идущих с участием rазовой фазы,
невозможно ни насыщение раствора реаrирующим ra
зом, ни удаление rазообразных продуктов с поверхности
растворяющеrося вещества. При этом имеет место co
вершенно случайный rидродинамический режим переме-
шиваIШЯ и невозможно устранить неопределенность вли-
нния конвекции.
Методы с закрепленными и произвольно движущими
ся кристаллами имеют один общий недостаток: они не
позволяют количественно оценить такой важный фактор,
как интенсивность перемешивания. Причиной этоrо яв-
ляется неопределенность rидродинамическоrо режима
движения жидкости у поверхности растворяемоrо веще
ства. При исследовании диффузионных процессов, как
уже было сказано, эта неопределенность отрицательно
влияет на ВОСПРОИЗВОДИМОСТЬ результатов.
Некоторую возможность количественноrо изучения
режима перемешивания дают так называемые «проточ-
ные» методы, которые позволяют осуществить линеi'lНое
движение растворителя вдоль плоской поверхности pac
творяемоrо веществ::!.. ПrIl постоянной скоростн ДI3Itже
10
ния жидкости В условиях ламинарноrо режима воспро _
изводнмость rидродинамической картины обтекания пло
екОЙ пластинки может быть достаточно высокой. Однако
теоретический расчет скорости растворения с помощью
уравнений rидродинамики для случая движения paCTBO
рителя вдоль плоской пластинки (омываемой раствори
телем) весьма сложен.
Это связано в первую очередь снеравнодоступностью
реаrирующей почерхности и, как следствие, с неравно-
мерностью ТОЛЩИIlЫ неПОДВlIжноrо слоя раствора, приле
rающеrо '{ поверхности растворяемоrо вещества. Кроме
Toro, при изучении ЭТIIМ методом реакций, идущих с вы-
делением ПРОl\.]ежуточных твердых продуктов, послеДНllе
MorYT образовывать на новерхности вещества слои, тол
щина которых также не будет одинаковой во всех точ
ках. Следует указать, что пС?добные реакции инконrру
энтноrо растворения встречаются rораздо чаще, чем при-
нято считать. О них можно даже rоворить как об особом,
самостоятельном типе реан:ций ра творения.
3. СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ
О ПРОЦЕССАХ РАСТВОРЕНИЯ
Большинство рассмотренных методик исследования
реакций растворения не отвечает в полной мере требова
ШIЯМ cOBpeMeHHoro эксперимента. Все они базируются
на известной теории Нернста, в основе которой лежит
представление о неподвижном слое ЖИДКОСТII, прилеrаю-
щей к поверхности твердоЙ фазы и участвующей в про
цессе растворения.
В последние [оды эта теория была пересмотрена и
развита 11 а основе \\онкретизаЦIlИ представлений о по-
rраничном слое с точки зрения современной rидродина-
мики. Еще в начале 20 x [одов появились сообщения
о том, что при ламинарном обтекании кристалла проис-
ходит послойное перемешение жидкости на расстоянии
0,4 мкм от ero поверхности, а при движении жидкости
в капиллярах с внутренним диаметром 5,59 9,35 мкм
аналоrичное явление обнаруживается на расстоянии
0,02 O,03 мкм от стенок. Таким образом, было показано,
что предположение Нернста о полной неПОДВИЖНОСТIl
прилеrающеrо к поверхности твердоrо вещества слон
жидкости толщиной порядка 1 O 3 см противоречит опы-:.
ту И должно быть oTBeprHYTo.
11
БОЛЬШIlМ вкладом в теорию кинетики растворения
ЯВИЛIIСЬ работы Фрумкина 1 и Левича 2, посвященные ис
следованию кинетики электродных процессов и YCTaHOB
ленню количественных закономерностей конвективной
диффузии. Эти работы стали существенной частью со-
временных представлений о кинетике растворения,
соrласно которым процесс растворения состоит нз трех
основных стадий.
Пер в о й с т а Д 11 е Й является подвод реаrирующих
частиц к реакционноЙ поверхности, который мож т ocy
ществляться либо за счет молекулярноЙ диффузии, либо
R результате конвекции. В первом случае перемещение
частиц происходит за счет разности их концентраций
в различных точках раствора, во втором имеет место
макроскопический перенос реаrllРУЮЩИХ веществ вместе
с раствором. Этот перенос может иметь случаЙныЙ (вли-
яние температурных полей, перемешивание раствора при
выделении rазовоЙ фазы) или закономерный (вынужден.
ная, направленная или реrулируемая конвекция) xapaK
тер. Независимо от причины, вызывающей конвективный
перенос вещества, ero необходимо учитывать при любых
рассуждениях и расчетах, связанных с первым этапом
растворения.
В т о р а я с т а Д н я процесса растворения или цe
ментации состоит I1З совокупностн собственно ХИl\fиче-
CКI1X актов на поверхности твердой фазы. К HIIl\1 MorYT
быть отнесены: адсорбция ионов или молекул на peaK
ционноЙ поверхности, разряд и образование ионов и MO
лекул в результате химичеСI<оrо или электрохимичеСI<оrо
взаимодействия, кристаллохимические превращения
в твердоЙ фазе и образование новой твердой фазы и, на-
конец, десорбция ПРОДУК,тов реакЦlIИ.
т р е т ь е Й с т а Д 11 е й является отвод ионов или мо-
леI<УЛ растворяемоrо вещества от реаrирующей поверх-
ности в объем раствора.
Если скорость процесса в целом лимитируется CKOpO
стыо первой или третьей стадиЙ, то протеI<ание ero будет
определяться закономерностями диффузионной кинети-
ки; если же лимитирующей является вторая стадия, то
I Кинетика электродных процессов. М., ИЗД. Mry, 1952, 319 с.
с ил. Авт.: А. Н. Фрумкин, В. С. БаrоцкиЙ, З. А. Иофа, Б. Н. Ка-
банов.
2 Л е в и ч В. [. ФИ3ИКО ХИМlIчеСI{ая rИДрОДИllамика. М.. ФИЗ
матrиз, 1959. 699 с. с 11.'1.
12
процесс будет определяться условиями химической кине-
тиКИ. Наконеи, если скорость транспортировки реаrиру=-
ющих веществ близка к скорости самой ХИМIIческой ре,
акции, то rоворят, что процесс протекает соrласно зако
номерностям смешанной кинетики. Следует заметить,
что подобный переходный режим процесса может иметь
место даже в том случае, коrда скорости диффузии и
собственно химической реакции выражаются численны-
ми значениями, отличающимися на целый порядок.
С точки зрения химии наиболее интересны те reTepo-
reHHbIe процессы, скорость которых определяется кине-
тикоЙ межфазовых превращений. Однако большинство
реакций растворения протекает по диффузионному меха-
низму. В этом случае нельзя с достаточной точностью
определить С1'юрость химическоrо взаимодействия. С оп
ределенностью можно утверждать лишь то, что она зна-
чительно выше наблюдаемой. Тем не менее эксперимен-
тальное изучение диффузионной кинетики имеет боль-
шое значение в тех случаях, коrда известно теоретиче-
ское выражение для скорости диффузионной стадии.
Наиболее простой вид уравнения ,rидродинамики име-
ют в том случае, коrда поверхностью реакции служит
поверхность вращающеrося диска (или шара). Решение
уравнений конвективной диффузии для вращающеrося
диска является одним IIЗ немноrочисленных случаев точ-
Horo решения полноЙ системы уравнений rидродинами-
ки. Кроме Toro, вращающийся диск как поверхность
реакции обладает одной особенностью, отличающей ero
от друrих поверхностеЙ реакций в движущейся жидко-
сти: условия переноса реаrирующих частиц в любой точ-:.
ке диска, независимо от расстояния ее до оси вращения,
совершенно идентичны. Такие поверхности называются
равнодоступными в диффузионном отношении.
В случае равнодоступной поверхности концентрация
вещества и скорость реакции на ней сохраняются посто-
янными. В общем же случае, например, при обтекании
плоской пластинки, служащей поверхностью реакции,
толщина rраничноrо слоя Прандтля, как и толщина по-
rраничноrо диффузионноrо слоя, изменяется от точки
к точке. Неэквивалентность в диффузионном отношении
различных точек на таких поверхностях существенно
Сказывается на постоянстве величины диффузионноrо
Потока. Поэтому теоретический расчет скорости реакции
в таких случаях затруднен, а иноrда невозможен.
13
Следует отметить, что теория конвективной диффу-
зин и в особенностн теория вращающеrося диска под
Bepr лись широкой экспериментальной проверке советски
ми и зарубежными исследователями. Однако до 1956 ro
да не было сделано попытки применить новые методы
для изучения теоретических основ промышленных rид
рометаллурrических процессов.
Авторами книrи с rруппой сотрудников изучены кине-=.
тика и микромеханизм мноrих reTeporeHHbIx реакций
растворения, положенных в основу технических про
цессов. Метод вращающеrося диска избран нами как наи
более простой и совершенныЙ из современных способов
изучения reTeporeHHbIx химических реакций. Однако, он
как и всякий друrой метод, имеет и некоторые слабые
стороны.
Первый недостаток заключается в том, что пока еще
трудно увязать кинетические характеристики процессов
растворения, полученные с помощью метода вращающе-
rося диска, со скоростями растворения исследуемых фаз
при выщелачиваНИII в условиях, близких к промышлен-
ным. Причиной Э1'оrо является несопоставимость rидро-
динамических, rеометрических и физико::химических xa
рактеристик реакционноЙ поверхности вращаlOщеrося.
диска и витающей дисперсной частицы. rидродинамика
диска математически проста, а rидродинамика частицы
руды, увлекаемоЙ потоком жидкости, очень сложна.
Поверхность вращающеrося диска является раюIOДО
ступной в диффузионном ОТНОШЕ::I1ИИ, а различные точки
на поверхности растворяемой руды в этом смысле He
эквивалентны. rеометрическая величина повеРХНОСТII
диска мало изменяется в ходе опыта, в то время как
суммарная поверхность растворяемоrо рудноrо матери-
ала изменяется от максимальной величины до нуля
(выщелачивание обычно проводится до полноrо извле
чения ueHHoro компонента в раствор). Истинные вели-
чины поверхности диска II растворяемой дисперсной фа
зы трудно измерить, но еще труднее сравнить их влия
иие на протекание реакций в кинетическом режиме.
Вторая слабая сторона метода вращающеrося диска
состоит в том, что этот метод не моделирует технолоrи
ческий процесс ВbIщелачивания руды, особенно такие
важные факторы, как т:ж, тип перемешивающеrо уст-
ройства, rидродинамика перемешивания, изменение KOH
центраций растворителя и продуктов реакuии по ходу
14
опыта и связаНIIЫХ с ними веЛИЧИII вязкости и коэффи
циентов диффузии ионов в образующихся растворах.
Третий недостаток метода связан с затруднениями,
которые возникают при необходимости сравнить кинети-
ку растворения синтетических! и природных минералов.
Во первых, некоторые природные минералы обладают
малой механической прочностью. Ее можно повысить
путем спекания, однако Прll этом MorYT измениться фи-
зико химические характеристики минерала. Можно при
менить склеивание, например, эпоксидной смолоЙ, НО это
ведет к уменьшению истинной реакционноЙ поверхности,
затрудняет ее определение. Во-вторых, каждый природ
ный минерал, даже имеющий одинаковое содержание
основных компонентов, обладает специфическим качест-:.
венным и количественным набором примесей различа.
ются между собой даже одинаковые минералы, взятые
из разных месторождений. Сказанное о природных ми
нералах в еще БОЛЫIlей степени относится к рудам и дру-
rOMY сырью. .
Перечисленные недостатки не дискредитируют метод
вращающеrося диска, так как они относятся в сущности
не к самому методу, а к способам, направлениям и
целям ero использоваllИЯ, к трактовке результатов, полу
чаемых с ero помощью, J{ оценке возможностей обобще-
ния этих результатов и распространения сделанных вы-
водов на реальные процессы. Несомненно, что в подавля-.
ющем большинстве случаев данные, полученные этим
методом, служат достаточно надежной основой научных
представлений о реальных процессах растворения и BeCb
ма полезным дополнением при проектировании и усо-
вершенствовании отдельных технолоrических схем.
4. ОСНОВЫ МЕТОДА ВРАЩАЮЩЕrося ДИСКА
п рисотовление образцов и подсотовка
поверхности реакции
Определяющая роль твердой фазы в reTeporeHHoM
.процессе обусловливает высокие требования, предъяв.
ляемые к химическому составу, степени чистоты, струк-
турным, механическим характеристикам и состоянию по-
верхности образцов. Эти требования относительно леrко
1 Для краткости I1спользоваIlЫ наз!3<шпя соответствующих мине.
ралов.
15
MorYT быть удовлетворены при использоваНIIII металли
ческих дисков. При работе с минералами наиболее ваЖ
ными качествами дисков являются высокая прочность и
достаточная твердость, обеспечивающие возможность Me
ханической обработки и шлифовки рабочей поверхности.
Особенно важно исключить механическое разрушение
диска в процессе раствореНIlЯ, набухание и растрески .
ванне рабочей поверхности. Но даже при отсутствии
этих явлений необходимо учитывать возможность суб
микронноrо растворения, особенно при высоких CKOpO
стях вращения диска. Сохранение молеКУЛЯРНО ИОНI-Iоrо
характера растворения является признаком BbIcoKoro
качества диска 11 очевидным критерием применимости
метода вращающеrося диска для исследования скоростей
растворения Toro или иноrо минерала.
Перечисленным требованиям в наибольшей степени
удовлетворяют монокристаллы и образцы, приrотовлен
ные из плавленых минералов. Но следует отметить, что
применение дисков, полученных путем прессования и
спекания порошкообразных веществ, при выполнении ря
да условий также позволяет достиrнуть удовлетворитель-
ных результатов. Ниже приведены краткие методики син
теза и очистки некоторых исходных веществ II способы
приrотовления дисков из них.
С е р е б р о было MHoroKpaTHo перечищено (paCTBO
рение в азотной кислоте, осаждение соляной кислотой,
плавка с содой), полученный слиток прокатан в ленту
тол.щиноЙ 0,5 мм, из которой пуансоном вырублены дис
ки диаметром 20 мм, которые были затем отожжены
в вакуумной печи при 6000 С в течение 6 ч, промыты рас-
твором кислоты, щелочи и спиртом, вклеены в эбонито-
вый держатель и после сушки снова тщательно промыты
спиртом. Каждый диск можно ПрIIменять для нескольких
опытов, результаты которых хорошо ВОСПРОIIЗВОДЯТСЯ.
В отдельных опытах использовали rотовыЙ металл Map
ки СР 999,9. Аналоrично rОТОВIJЛИ диски 11З очищснноrо
золота.
р т у т ь была очищена последовательной промывкой
растворами щелочи, азотной кислоты и спирта, отфиль
трована через замшу и высушена при 2000 С. ДЛЯ СНЯТIIЯ
кинетических кривых был применен способ «обратноrо
диска» (см. ниже).
С п л а в ы п а л л а Д и я с с е р е б р о м, содержащие
75 и 50% (ат.) серебра, rОТОВИЛII из чистых металлов.
16
Сплавление проводили в индукционноЙ печи ПрIl 1450
15600 С (в зависимости от состава сплава) под слоем
боросиликатноrо шлака в алундовых тиrлях. Сначала
расплавляли серебро под слоем шлака, а затем добавля
ли палладий. После охлаждения сплав прокатывали и
из полученноЙ ленты вырезали диски диаметром 20 мм,
которые затем подверrали rомоrенизирующему отжиrу
в течение 6 ч rlрИ 900 1100° С в зависимости от состава
сплава. [отовые диски шлифовали и вклеивали в эбони
товые диско;rержатели клеем БФ 2.
Основным критерием rомоrенности сплавов была эк":.
вивалентность скоростей растворения палладия 11 се-
ребра.
Сплавы серебра со ртутью. Исходными Ma
териалами для получения амальrам служили дважды
hереrнанная ртуть, химически чистое азотнокислое и ме-
таллическое серебро. Твердые амальrамы необходимоrо
химическоrо состава rотовили различными методами (цe
ментация металлическоЙ ртутью, электролиз из комп
лексноrо цианистоrо раствора серебра и ртути, механи
ческое смешивание металлическоrо серебра со ртутью).
Для предотвращения улетучивания ртути отжиr полу-
ченных амальrам ПРОВОДII.'11I в запаянных ампулах из
туrоплавкоrо стекла, предварительно откачанных при
температуре 100 + 1 о С в сушильном шкафу с автомати-
ческим термореrулятором.
С п л а в ы з о л о т а с о р т у т ь ю, содержащие до
12% золота (жидкие амальrамы), получали насыщени-
ем дважды дистиллированной и промытой ртути порош .
ком чистоrо золота; твердую aMa.ТJbraMY (51,6% золо
та) двукратным прессоваIшем (давление 1 О тс/см 2 )
С последующим отжиrом при 3000 С в течение 20 ч в за
паянных вакуумированных ампулах. После отжиrа про-
дукт измельчали в ступке, повторно прессовали II отжи
rали. Диски (диаметр 26 мм, поверхность 5,3 см 2 ) поли-
ровали, промывали и вклеивали в дискодержатель.
В ы с ш и й с у л ь Ф и Д м е Д и синтезирован по ме-
тодике одноrо из авторов. Плавленый халькозин и серу
особой чистоты измельчали отдельно в яшмовых ступ-
ках, затем стехиометрнческую смесь peareHToB подвер-
rали принудительной rомоrенизации в механической ara
Товой ступке объемом 250 см 3 в течение 60 ч. Полученный
порошок темно-синеrо цвета прессовали под давлением
20 Krc/cM 2 и при 2000 С (продол и е льность выдержки
2 306
17
при прессовашш 125 MIIH). После этоrо ДIlСЮI (диаметр
50 мм, высота 5 мм) спекали при 4000 С в течение 2 ч
в медной rерметичной бомбе в присутствии небольшоrо
количества серы.
r е р м а н II Й. Были использованы монокристаллы
(р-типа), удельное сопротивление 1 Ом. см, вырезанные
параллельно кристаллоrрафичеСl\ОЙ плоскости 111 и IIMe
ющне форму дисков размером 3Х30 мм.
Диск вклеивали в оБОIIМУ ИЗ орrаНlIческоrо стекла,
перед началом опыта зачищали тонкой наждачной бума
rой, прикрепляли к валу, протирали спиртом, промывали
водой, сушили фильтровальной бумаrоЙ и поrружали
в реакционныЙ сосуд. По окончаlIИИ опыта ДlICK промы
вали водой и IIспользоваЛIl для следующеrо опыта. Рабо
чую поверхность диска шлифова.'lИ периодически через
10 ]5 опытов, снимая ero с вала.
Д в о Й н о й с у л ь Ф И Д М е Д и и с е р е б р а (штро
мейерит) получали сплавлением стехиометрической сме-
си чистых арrентита и халькозина при 8000 С в течение
30 мин в rрафитовом тиrле, Jf из слитка вытачивали ди
ски диаметром 25 мм.
Т е л л у р JI Д З О л о т а rотовили сплавлением хими
чески чистых элементов в вакуумированных lшарцевых
ампулах при 6000 С с последующей rомоrеНlIзацией спла
ва. Золото было очищено осаждением щавелевой кисло
той и сернистым rазом, теллур (98,5%) окислением
азотной кислотой, переосаждением двуокиси теллура и
восстанпвлеНIIем из щеЛОЧlIоrо раствора электролизом.
, Х л о р и Д с е р е б р а выделяли из раствора хими
чески чистоrо HIITpaTa серебра соляной кислотой, про
мываЛII водой, спиртом 1I высушивали при 1000 с. Далее
хлорид плавили в муфельной печи в термостойких ста-
канчиках с последующим медленным охлаждением
(вместе с печью), чтобы не было трещин. Из полученных
блоков вытачивали диски и вклеивали в дискодержате
ли. Рабочую поверхность перед каждым опытом шлифо
вали тонкой шкуркой и полировали фетром, затем про-
l\Iывали водоЙ 11 спнртом.
Д Н С I{ Н И З в о л ь фра м а т а к а л ь Ц И Я rОТОВИЛI!
или распиливанием цилиндрическоrо монокристалла ди
аметром 1 см, полученноrо по методу Чохральскоrо, или
прессованием при давлении 3000 Krc/cM 2 с последующим
спеканием при 11000 С в течение 8 ч порошкообразноrо
CaW0 4 , полученноrо осаждением из водных растворов.
18
в о ль фра м а т б а р II я. Для ПРIIrотовления дисков
порошок вольфрамата бария смешивали с полИ1rnНIfЛО
Bы,M спиртом (l О % по массе) и прессовали под давле
ни ем 3000 Krc/cM 2 в таблетки диаметром 24 мм, которые
затем спекали при 965::!: 150 С в течение 6 ч с предвари
тельной четырехчасовой выдержкой при 4000 С. rOToBbIe
образцы, представлявшие собой прочнуlO керамику,
лишенную микропор (усадка около 1 О % ), обрабатыва
ли на токарном станке победитовым резцом.
Д в у о к и с ь r е р м а н н я. Из слеrка увлажненной
двуокиси, содержащеЙ 99,99% Ge02, прессовали диски
(диаметр 50 мм и толщина 5 7 мм) при давлении
3000 Krc/cM 2 . После высушивания и десятичасовоrо спе
кания при 9000 С получались прочные, напоминающие
фарфор образцы rексаrона,льноii модификащш двуокиси
rермания. РентrеноаморфнуlO двуокись rерманиЯ 110ЛУ
чали плавлением rексаrона.1ЫroЙ Ge02 (tn.'I == 11160 С) .
Приrотовление дисков хорошеrо качества из плавле
ной двуокиси связано с некоторыми трудностями: Ge02
леrко восстанавливается, прочно сваривается со стенка-
ми тиrлеи, в том числе с плаТIIНОИ; при охлаждении сли
ток растрескивается и т. д. Ge02 сплавляли в TOHKOCTeI-l
ном алундовом стакане, ИЗОЛJIрованном от восстанови-
тельной атмосферы печи с rрафИТОВЫМII наrревателями
сопротивления вертика.1JЬНОЙ трубоЙ из a.rтYHдa, через
которую проходил воздух. Для полноrо удаления пу
зырьков расплав наrревали до 15000 С и выдеРЖIlвали
при этой температуре около 2 ч. После медленноrо ox
лаждения расплава тиrель осторожно разрушали, извле-
кая прозрачныЙ однородныЙ СЛlJТОК диаметром 20 мм и
высотой 10 мм.
Конструкция при60ров и порядок раБОТbl
Для исследования кинетики растворения металлов
при нормальном давлении сначала была применена oд
носекционная установка, состоящая из peaKUlIolIHoro co
суда емкостью 2 л, водяноrо термостата с нихромовым
наrревателем и термореrулятором и эле тродвиrателя с
редуктором, приводящеrо в движение вал с насажен
ным на ero конец диском.
Вторая установка (автоклав системы Вишневскоrо)
БЫла использована в серии. опытов по изучеНIJЮ зависи
Мости СКОРОСТII растворения от давления кислорода над
2*
19
растrюром. Автоклав изrОТО8лен из нержавеющей CTa
ли, рабочий объем ero 2 л, он снабжен приспособлением
с холодильником для отбора проб во время работы aB
токлава под давлением. Подоrрев автоклава до задан.
ной температуры вели в электрической печи с HarpeBa
телем из нихрома, реrулировку температуры контакт-
ным термометром (=,=0,50 С) .
Несколько позднее была сконструирована трехсек-
ционная установка, получившая наибольшее распрост
6 ранение. Отдельная ceK
ция (рис. 1) состоит из
стеклянноrо реакционно-
ro сосуда 2 (батарейный
стакан емкостью 2 л),
плотно закрытоrо эбони
товоЙ крышкоЙ, диска
1, электродвиrателя 6 с
шестеренчатым редукто-
ром 7 и ведомоrо вала 8,
шариковые подшипники
KOToporo сидят в специ
альных втулках, укреп
ленных на кронштейнах
5. Кронштейны с втулка-
ми жестко закреплены на
опорноЙ штанrе 4 винто
Рис. 1. Схема одной из секций устаIЮО- выми фиксато р ами. Для
ки ДЛЯ исследования кинетики растви-
рения методом вращающеrося диска поддержания ПОСl0ЯННОЙ
температуры раствора во
время опыта применяли компактный нихромовыЙ Harpe-
ватель 3, заключенныЙ в чехол из термостойкоrо стекла,
и ртутныЙ термореrулятор 9. Было предусмотрено также
реrулирование и контроль напряжения, подводимоrо к
электродвиrателю.
Специальными измерениями показано, что при со-
блюдении этих предосторожностей колебания темпера
туры составляют Bcero + 0,20 С, а скорость вращения ве-
дущеrо вала электродвиrателя остается практически по
стоянной. Для изменеНIIЯ скорости вращения диска в
пределах от 60 до 1100 об/мин были применены редук-
тор и сменные шестерни, закрепляемые на ведомом ва-
лу установки. Электродвиrатель с редуктором и Beдo
мый вал имели независимое крепление. Перед ВКЛlOче
нием электродвиrателя выходные шестерни редуктора
3
7
4
2
20
вводили в зацепленпе с шестернями, расположенными
на ведомом валу, и в таком положении жестко з-а-креп-
ляли все детали установки. Скорость вращения вала
контролировали фотоимпульсным тахометром.
Н)стировку дисков на валу осуществляли следую'
щим образом. Диск приклеивали к специальной эбони-
товой оправке, зажатой в цанrовом держателе; держа
тель закрепляли в патроне TOKapHoro станка, 11 диск ос.
торожно обтачивали так, чтобы ero ось совпала с осью
держателя (н, следовательно, с осью вращения), ара.
бочая поверхность была перпендикулярна ей. Разрабо.
танные режимы спекания вполне допускают подобную
механическую обработку. Так, например, при обтачива
нии дисков из сульфида серебра до спекания получает-
ся порошок, а после спекания стружка, как при обра.
ботке металлических дисков.
После обтачивания поверхность диска обрабатывали
на станке сначала rрубой, затем тонкой наждачной бу-
маrой, шлифовали и диск вместе с держателем тщатель-
но промывали водой и этиловым спиртом. После про
мывки и сушки держатель 11 диск (за исключением pa
бочей поверхности) покрывали химически стоЙким лаком
и высушивали с помощью фена. В заключение на край
рабочей поверхности диска кисточкой, зажатой в резце-
держателе', при малом ЧIlсле оборотов наносили слой
лака такой ширины, чтобы оставшаяся ОТI<рытой рабо-
чая поверхность диска имела заданную величину. Под-
rОтовленный таким образом держатель с диском укреп
ляли на ведомом валу установки.
Описанная система подrотовки диска обеспечивает
радиальное биение не свЫШе 0,2 мм при условии, если
диск расположен на расстоянии не более 250 мм от ниж
Hero подшипника. В этих условиях rидродинамический
режим процесс а растворения можно считать посто
янным.
Исследование влияния давления кислорода на ско-
рость растворения сульфидов проводили в автоклаве с
экранированным приводом. Скорость вращения диска в
этом случае была постоянна, 1400 об/мин. .
Опыт, как правило, начинают с ПрQМЫВКИ образца в
растворе заданной концентрац,Ии. Для этоrо вал с под-
1 Все перечислеlIвые операЦIIИ следует проводить, Не вынимая
диск из патрона станка.
21
rотовленным и юстированныJ\.1 диском опускают во вспо-
моrательный сосуд объемоJ\.1 lOO 200 мл и вращают с
заданной скоростью в течение 30 40 мин. Затем днск
переносят в рабочий сосуд с раствором, HarpeTbIM до
необходимой температуры, и включают секундомер.
Для определения скорости растворения периодиче
ски анализируют пробы раствора. Объем проб в зависи
мости от скорости растворения составляет от 25 до
600 мл. Объем проб и промежутки времени, через кото-
рые их отбирают, MorYT быть, вообще rоворя, произволь
НЫМII, но при этом необходимо соблюдать два условия.
Во-первых, содержание pacTBopeHHoro вещества в пробе
должно обеспечивать достаточную точность анализа.
Поэтому объем первой пробы должен быть максималь-
ным, а объем последующих убывать с увеЛl!чением
номера пробы. В ряде случаев объем проб может быть..
постоянным. BO BTOpЫX, продолжительность отбора
проб должна быть минимальной и тем меньшей, чем KO
роче промежутки времени между отборами. Кроме Toro,
если опыты ведут при повышенных температурах, сле
дует позаботиться об охлаждении пробы. В особо OTBeT
ственных случаях пробы раствора необходимо взвеши-
вать.
КОНТРОЛЬ скоростн растворения в большинстве слу
чаев осуществляют по количеству металла, переходяще
[о в раствор за определенныЙ промежуток времени. При
работе с минералами определяют и содержание BToporo
Компонента.
Несколько иной порядок работы принят при исполь
зовании способа «обратноrо» диска. Этот способ при-
менен для изучения кинетик!! растворения ртути 11 жид
ких амальrам в кинетическом режиме. Он состоит в
следующем.
К центру дна описанноrо выше реакционноrо сосуда
приклеивают эбонитовую чашечку заданноrо BHYTpeHHe
[о диаметра, заливают в нее жидко растворяемое веще-
ство, а на конец вала (см. рис. 1) надевают lIмпеллер-
ную мешалку, ось котороЙ совпадает с осью неподвиж
HOrO диска. При вращении мешалки На образец направ
ляется поток растворителя, rидродинамически эквива
лентный тому, который создается при вращении «пря
Moro диска». Для экспериментальноrо подтверждения
ЭТОrо в чашечке закрепляют диск из твердоrо вещества,
кинетика растворения KOToporo подробно изучена ранее
22
(нами использована корректировка по растворению ме-
таллическоrо серебра). Совпадение скоростей раство-
рения при работе с «прямым» И «обратным» диском слу-
жит достаточным обоснованием применимDe'Н4... описы-
BaeMoro способа.
Уникальная возможность проверКJf rидродинамиче-
ской эквивалентности «прямоrо» (твердоrо) и «обратио
[о»' (жидкоrо) дисков представляется при работе с по
луЖИДКIIМИ амальrамами, содержащими свыше 7 8%
серебра. Они остаются жидкими в течение 3 суток, а за-
тем твердеют, и кинетику их растворения можно lfЗУ-
чать по оБЫЧНОI'i методике.
Расчеты и воспроизводи.мость результатов
Количество pacTBopeHHoro компонента раССЧIlтыва
ют с учетом ero содержания в пробах и изменения об
щеrо объема раствора.
При изменении объема проб расчетное уравнение
имеет вид:
I
V L'i
V.
L
i
+ qi'
1
(1)
Qi == qi
а при Vi == const
i
Qi == qi ( i) + Qi'
1
(2)
Здесь v общий объем раствора, мл;
'i.'l объем i-той пробы, I\IЛ;
q, количество металла в i-той пробе, r-ионов;
Qi общее количество paCTBopeHHoro металла,
[- ионов.
Метод вращающеrося диска позволяет раССЧIlТывать
удельную скорость раствореНIIЯ, не зависящую от обще
ro объема раствора в случае, если концентрация про-
дукта реакции далека от насыщения. Если кинеПlче-
ские кривые линейны, скорость растворения вычисляют
обычным способом, относя Qi r-ион к т, выраженному в
секундах. В остальных случаях приходится вычислять
Qo количество pacTBopeHHoro вещества при T O, а
таКЖе веЛIIЧIIНУ ао количество pacTBopCHHoro компо
неНта за время от начала опыта до момента отбора
23
первой пробы (то). Тоrда скорость растворения опреде'
ляется отношением ао/то.
Константу скорости вычисляют после установления
функциональных зависимостей скорости растворения от
концентрации растворителя, числа оборотов диска, пар
циальноrо давления кислорода и т. п. В случае линей
ных зависимостей скорости растворения от указанных
факторов константу получают как частное от деления
скорости растворения на величины S. С, пиро:. Так,
например, при исследовании кинетики растворения суль
фида серебра, растворяющеrося в кинетическом режиме,
коrда скорость реакции не зависит от ЧlIсла оборо
тов диска, прямо пропорциональна концентрации циа
нида в первой степени и давлению кислорода на paCT
вор в степени 1/2. В этом случае расчет константы CKOpO
сти k (л/см 2 . ат 1 (2. с) вели по уравнению
k==
SC p l/2 Т '
О:
Q
(3)
rде C концентрация KCN, моль/л;
РО: п;арциальное давление кислорода, ат;
s рабочая поверхность диска, см 2 .
Для процеССQВ растворения, протекаЮЩIIХ в диффу
зионном режиме:
k==
Q
SCn 1/2 т
(4)
Здесь II скорость вращения диска, об/с;
k KoHcTaHTa скорости, л/(см 2 '0Б I / 2 'C 1 / 2 ).
ДЛЯ высшеrо сульфида меди скорость растворения
зависит толь.ко от КОlщентращш цианида в первой CTe
пени и не зависит ни от скорости вращения диска, ни
от давления кислорода над раствором. В этом случае
k выражают в л/см 2 . с, а количество pacTBopeHHoro Me
талла может быть рассчитано по уравнению
Q == kSCT.
(5)
В случае растворения хлорида серебра в растворах
NaCI был принят несколько иной способ обработки pe
зулыатов. Высокая концентрация реаrента растворите
ля и сравнительно lIизкая концентрация серебра в pac
ТБорах ПОЗВОЛИЛII предположить, что самым медленным
24
звеном процесса будет не диффузия хлорида натрия к
поверхности, а отвод от нее продукта реаКЦИII комп
лекса AgCl ж .
Для вывода уравнения кинетики этой реакции, по
скольку, как показали опыты, она протекает в диффу-
зионном режиме, воспользуемся уравнением Фика:
dQ == DS dC dT.
dll
При установившемся стационарном процессе rради-
ент концентрации можно заменить выражением
C s - С
б
rде Cs концентрация насыщенноrо раствора у поверх-
ности;
С концентрация серебра в объеме;
б толщина поrраннчноrо диффузионноrо слоя.
Тоrда
d Q ==DS CS С dT
{j .
Интеrрирование этоrо уравнения дает нелинеЙнуlO
зависимость Q от т:, поскольку сомножитель (Cs c)
убывает по мере увеличения продолжительности опыта,
а это осложняет обработку экспериментальных данных.
Поэтому заменим Q на CV (V объем раствора), раз-
делим переменные и проинтеrрируем полученное урав-
нение:
=== DS dT' ln DS т' 19 == DS 't
С s С V б ' С s С V {j , с s С 2,303. V {j .
Из физико химической rидродинамики известно, что
для вращающеrося диска
{j == 1 62.103. D 1 / 3 . v 1 / 6 . (t) 1/2
, I
rде v кинематическая вязкость.
Тоrда
Ig == DSffi 1 / 2 't
C s с 2,303. У.1 ,62.103.Dl/З.vl/О
25
6, 2.10 -t. D 2 / 3 .s. 't === G, 2. 10 '1 (2п)1/:2 Х
2,303.V.v 1 / J 2,303
Х D 2 / 3 .S.п 1 /2. 't === 6 73.10 4 D2/3.S.пl/2. 't.
V.v 1 / 6 ' V.v 1 / 6
При 250 С
С D 2/3 S 1/2
1 ::::= 1 477. 1 o 3 .. п . 't
g C s С' V
В отличие от уравнения Нернста, в этом уравнении
учтена и интенсивность перемешивания; оно является
уравнением кинетики реакции первоrо порядка (это
характерно для большинства reTeporeHHbIx реакций pac
творения) и в полулоrарифмических координатах изо
бражается прямой линией, что облеrчает обработку
экспериментальных данных и позволяет устранять
ошибки анализа. Ero можно записать и так:
19 CsC с === рт: или Ig (C s С) :== 19 C s рт:,
rде p фактор пропорциональности, зависящий от ус-
6 73.10 4.D2/3.S.пl/2
ловий опыта и равный '
v 1jO . V
Это уравнение применимо, если объем раствора не
слишком велик или если концентрация насыщенноrо
раствора (C s ) относительно мала, т. е. как раз для изу
чаемой реакции растворения хлорида серебра. По
скольку в уравнение входит объем раствора, который
изменяется вследствие отбора проб, оно было преобра-
зовано:
Ig(C" С) == IgCs р' .
Метод вращающеrося диска обеспечивает хорошую
воспроизводимость результатов, что не всеrда достижи-
мо при использовании друrих методов исследования
кинетики растворения. При изучении скоростей paCTB()
рения металлов обычно Не приходится прибеrать к до-
полнительным операциям, повышающим надежность
опытных данных (прессование и спекание дисков, меха-
ническая обработка повеРХНОСТl1 11 др.). При работе
26
с минералами положение несколько осложняется особы
ми свойствами твердой фазы, в связи с чем приrотовле.
иие дисков сопряжено со значительными трудностями.
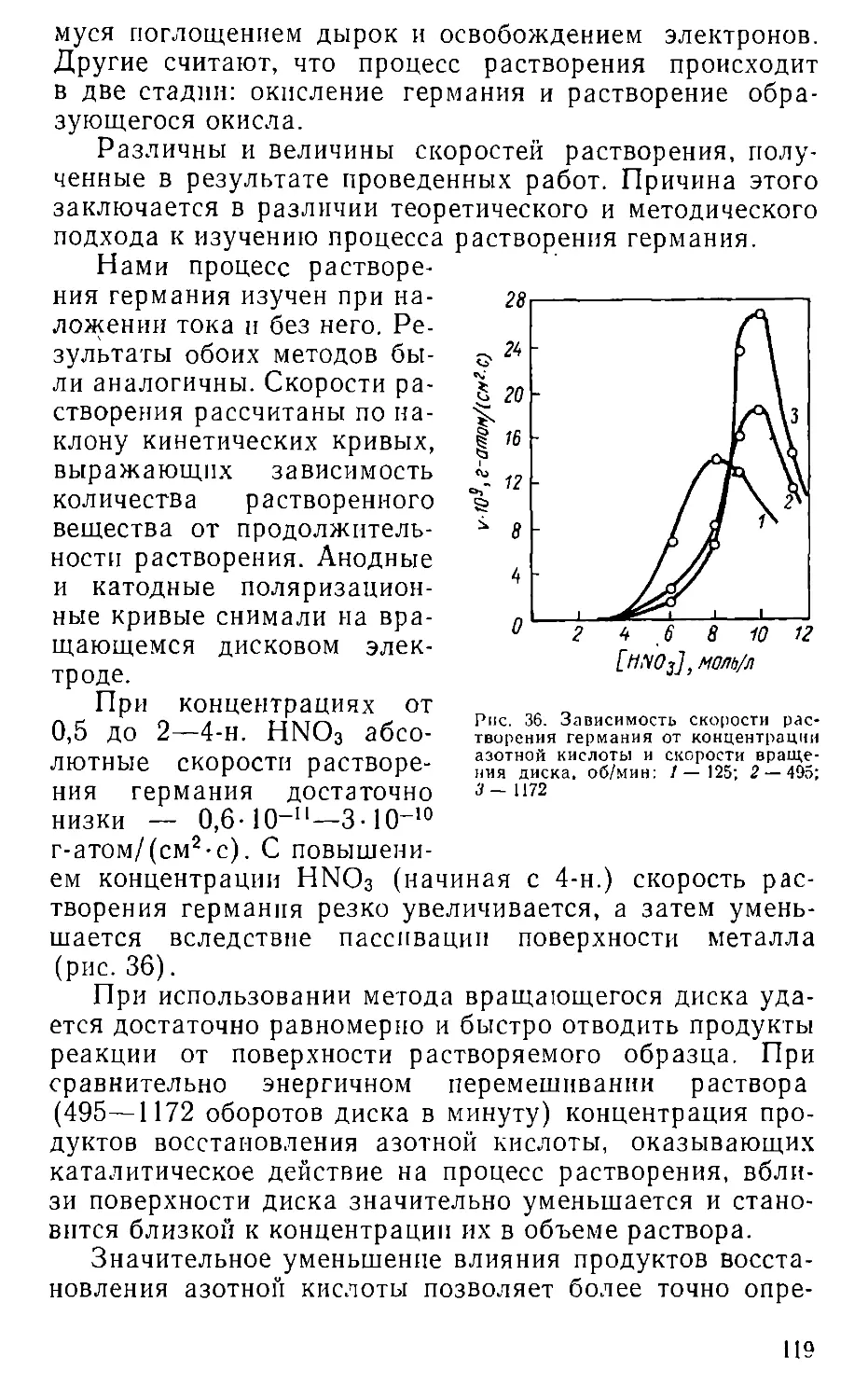
Проиллюстрируем это примерами из практики исследо
ваНия кинетики растворения в цианистых растворах
наиболее сложных объектов сульфtщ.oв серебра и
меди.
Диски из сульфида серебра, в отличие от металличе-
ских, нельзя применять для повторных опытов раство-
рения без промежуточной подrотовки рабочей поверх
ности, так как она сильно изменяется уже после Б 6 ч
контакта с цианистым раствором; На ней образуются ка-
верны, раковины, микротрещины и т. п. Подтверждени-
ем этоrо является следующая серия опытов, проведен
ных с четырьмя различными образцами.
Рабочая поверхность первоrо образца была подrо
товлена очень тщательно (зеркальная полировка), на
поверхности DToporo были оставлены незначительные
дефекты, третий образец был подrотовлен небрежно
(большое количество дефектов), а четвертый взят после
предыдущеrо опыта, без обрабоТIШ поверхности
(табл. 1).
Таблица 1
Зависимость количества pacTBopeHHoro серебра от характера
подrотовки поверхности диска из сульфида серебра
Продолжи-
тельность опыта, Ч
j(оnичсство р<lОВОрСННОro серебра Q. 10<' r lюн/см2
для образцов
2 3
3 0,91 0,91 0,91 1,37
6 1 ,41 1,48 1,72 2,23
9 1,93 1,98 2,21 2,78
ПриведеНIIые данные свидетельствуют о том, что He
значительные дефекты подrотовки диска (микроrеомет.
рия поверхности) сравнительно мало сказываются на
скорости растворения, однако при большом количестве
дефектов и особенно при повторном использовании
диска воспроизводимость результатов резко снижается.
Поэтому для получения ВОСПРОIIЗВОДИМЫХ результатов
при повторном использоваНIlII диска необходимо сни-
27
мать поверхностный слой на r лубину не менее 1 мм и
после этоrо тщательно шлифовать и полировать поверх-
ность. Лучше Bcero в таких случаях использовать
«свежие» диски, приrотовленные в стандартных усло-
виях.
Полезна также предварительная промывка полно
стью подrотовленноrо диска в слабом растворе циани
да, без которой кинетические кривые часто не проходят
через начало координат. Причина этих отклонений за-
ключается в том, что после шлифовки и полировки ра-
бочей поверхности на ней остается небольшое количе
ство окисленных продуктов и тонкой пы и, растворяю
щихся в первые минуты контакта с цианистым pac
твором.
Соблюдение всех ЭТIIХ условий Прll исследовании ки
нетики растворения сульфида серебра позволило полу-
чить значения константы, мало отличающиеся от сред-
ней величины, равной 2,7.10 8 л/(см 2 .с.ат 1/2).
При растворении низшеrо сульфида меди важную
роль иrрает режим спекания дисков. Было изучено пове
дение образцов из неспеченноrо халькозина, спрессован
ных под давлением 2000 KrC/CM 2 , и спеченных, но с раз-
личным, искусственно созданным микрорельефом по-
верхности.
Как следует из данных, приведенных на рис. 2, ха-
рактер растворения дисков из неспеченноrо халькозина
(опыты 4 II 5) совсем иной, чем для спеченных образцов
(опыты 1 3). Кинетические кривые в опытах 4 и 5 пр я-
молинейны, тоrда как в опытах 1 3 они искривлены
скорость растворения уменьшается с увеличением про
должительности опыта. Кроме Toro, скорость растворе-
ния неспеченноrо халькозина несколько выше, чем
спеченноrо, но на нее не влияет различие микрорельефа
поверхности, в то время как для спеченных образцов
это влияние выражено достаточно четко. Очевидно, рас-
ТВОРIjтель действует на вращающийся диск из неспечен-
Horo сульфида не только химически, но и механически.
При этом в объем раствора переходят не только ионы
медноrо комплекса, но и отвалившиеся частицы СУЛЬфl1-
да, которые продолжают растворяться вдали от диска,
повышая количество растворенной меди за счет увели-
чения реаrирующей поверхности. Поверхность диска
после опыта как бы «набухает», и этот набухший слой
леrко можно смыть струеЙ воды.
.28
При работе с такими дисками невозможно добиться
воспроизводимых результатов, даже если диски получе
НЫ прессованием при 20000 Krc/cM 2 . Спекание же дис-
ков, полученных при более низких давлениях, обеспечи
вает вполне надежную сходимость результатов и явля-
ется, по-видимому, обязательным при исследовании ско-
рости растворения минералов.
3
....
-=
2
..
с:, f
/
/
/i
/
// .
./ ./
/ . ......... о 1
/6 tl.2
АЗ
6 ч
.5
о
J
1 2
'l,ч
Рис. 2. Зависимость У.сличесrВ<I
растворенной меди от продол
жительности опыта при р<I3ЛНЧ
...ЫХ условиях подrотовки об
разцов:
J спеченныЙ су.rrьфид меДII.
поверхность ДНСК<I ОТПОЛИРОВ<I
...а; 2 то же, поверхность об-
работана тонкоЙ шкуркой;
3 то же, rрубоit наждачн:)Й
бумаrой; 4 неспеченный суль
фид меди, ПОD{;РХНоСТЬ пбrтбо-
та на тонкой шкуркой; 5 ТО lКi',
rрубой наЖД<IЧНОЙ БУ lаrоЙ
J
'"
t
\.J 2
,
с\>
1
. 1
02
J..
о
1 2
fJ 11
3
Рис. 3. Кинетика растворе-
ния плавленоrо (1) и спечен-
Horo (2) хаЛЬКОJииа
Для проверки Toro,
является ли спекание
достаточным условием
применения метода
вращающеrося диска,
было проведено сравнение скоростей растворения СПе
чеНноrо и плавленоrо халькозина. Подrотовка дисков
БЫла такой же, как описано ВЫШе. .
Результаты опытов приведены на рис. 3. Видно, что
точки, соответствующие растворению плавленоrо (точ
ки 1) и спеченноrо (точки 2) образцов с достаточной
степенью точности ложатся на одну и ту же кривую.
Поскольку прессование с последующим спеканием
ЯВляется наиболее простым, а для некоторых сульфи-
дов (CuS, ZnS, CuFeS2 и др.) и единственно возможным
Способом приrОТОRЛСПIlЯ дисков, в аелях уннфикации
29
принятоrо метода и количественноrо сравнения CKOpOC
тей растворения различных минералов при проведении
опытов были использованы только диски из спеченных
сульфидов. После обработки результатов опытов была
вычислена средняя величина константы скорости peaK
ции растворения халькозина в растворах цианида ка-
лия, приведенная к одному обороту диска в секунду при
250 С, равная 0,76. 1 0 6 лj (см 2 . с 1 / 2 061/2) .
Следует отметить, что в одной из серий опытов по
выяснению влияния концентрации цианида на скорость
растворения халькозина была получена величина кон-
станты, равная 0,5 .10 6. Специально поставленные опыты
показали, что малые значения константы скорости ре-
акции растворения халькозина в этих опытах вызваны
прежде Bcero характером самой реакции и условиями
подrотовки дисков. Поскольку при растворении сульфи
дов меди в присутствии кислорода на поверхности дис
ков образуется новая фаза твердые продукты peaK
ции, менее растворимые в цианиде, чем исходное веще
ство, скорость растворения резко снижается, особенно
при повторном использовании дисков.
Таким образом, CL12S в процессе растворения ведет
себя иначе, чем сульфид серебра, скорость растворения
KOToporo возрастает при повторном использовании пло-
хо подrотовлеНIIЫХ дисков. Однако и в этом случае с
применением «свежих» халькозиновых дисков, приrо-
товленных в стандартных условиях, устраняются воз-
можные ошибки при исследовании кинетики их раство-
рения.
Высший сульфид меди является более трудным объ-
ектом для применения метода вращающеrося диска по
сравнению с арrентитом п халькозином. Для сульфида
серебра, обладающеrо высокой пластичностью, спека-
ние имеет меньшее значение, чем для халькозина. rлав-
ная опасность применения неспеченных образцов из
низшеrо сульфида меди заключается в изменении харак-
тера кинетических кривых и набухании диска. Послед-
нее при достаточно высоких скоростях вращения диска
может привести к субмикронному растворению. Высший
же сульфид меди обладает более низкой пластичностью
и очень плохо поддается прессованию. По методу одноrо
из авторов, он получается в виде очень TOHKoro порошка.
После I1рессования при комнатной Tel\.lIlepaType силы
сцепления между частицами оказываются весьма сла-
30
быми. Для упрочнения диска можно рекомендовать прес-
сование при повышенноЙ температуре и пос.ТIедующее
спекание, при котором происходит рекристаллизаuия
и образование текстуры. Использование же неспечен-
ных образцов ковеллина часто приводит к их полному
механическому разрушению.
Это иллюстрируется ПРИВОДIlМЫМlI НIIже результата
ми опытов, проведснных с двумя образцами, один из
которых (N? 1) был приrотовлсн прессованием и спека-
ниеМ в оптимальных условиях, а друrой (N? 2) только
прессованием при 20000 KrcjcM 2 (табл. 2).
Таблица 2
Влияние условий приrотовления дисков
на скорость растворения высшеrо сульфида меди
Продолжительность
опыта, ч
Количество раствореIlIlОЙ меди
Q . 104 r ИОIl/см2
образец N2 1
образец И2 2
2
4
6
8
0,421
0,719
] ,033
1,310
0,950
3,600
4,350
4,500
Если принять, что на 1 r ион меди при растворении
ковеллина расходуется от 3,5 до 4 r ионов цианида (в за
Висимости от типа протекающей реакции), то расход
цианида в этом случае Mor составить от 3,08. 1 0 2 до
3,52. 1 0 2 r ионов, т. е. за 8 ч должно было прореаrиро
вать около половины Bcero имевшеrося в растворе циа-
Нистоrо калия (объем раствора 2 л). Этим и объясняет
ся резкое снижение скорости растворения BToporo об-
разца в конце опыта. После вскрытия сосуда оказалось,
что диск ковеллина разрушился и на дне находится не-
которое количество порошка высшеrо сульфида меди.
Результаты опыта с обраЗЦОJ\I NQ 1, приrотовленным
в оптимальных условиях, позволили ВЫЧIIСЛИТЬ констан-
ту скорости растворения, равную 1,22. 1 0 7 лj (см 2 . с). Эта
величина Bcero на 2,5% ОТЛIlчается от средней, получен
ной по результатам нескольких серий опытов: 1, 19Х
XIO 7 лj(см 2 .с).
Особо следует остановиться "а разработаНIIОМ нами
методе «ПОRТОРlIоrо растворения». Суть cro состоит в
31
следующем. Определяют среднюю из нескольких опытов
скорость растворения Vj «стандартноrо» диска из мине
рала, подrотовленноrо, как описано выше, а затем изме
ряют среднюю скорость повторноrо растворения V2 Toro
же диска без сушки и промежуточной подrотовки по
верхности. Если rrpouecc растворения происходит с обра
зованием промежуточной твердой фазы, то V2 < V!.
В этом случае можно рассчитать уменьшение (депрес
сию) скорости растворения, вызванное образованием
новой твердой фазы, по уравнению
D v == Vl V 2 . 1 00 % (6)
Vl
Величина депрессии скорости растворения Dv служит
количественным показателем наличия осложнений, BЫ
зываемых механическими и структурными особенностя
ми образующихся пленок. В ряде случаев для исследо
вани я макромеханизма процесса растворения полезно
изучить зависимость этой величины от концентрации
раствора, интенсивности перемешивания, температуры
и друrих фаI<ТОРОВ. Аналоrично ведут себя и диски из
вольфраматов I<альция, стронция и бария.
Далее везде приняты следующие обозначения KOH
стант скорости реакций растворения: k константа
скорости в допредельной области, контролируемой pea
rентом растворителем; k' константа в запредельной
области, контролируемой реаrентом-окислителем при
выражении ero концентрации в молях на литр; k П кон-
станта в запредельной области, коrда концентрация
окислителя определяется ero парциальным давлением,
выраженным в атмосферах.
rлава 2
КИНЕТИКА РАСТВОРЕНИЯ МЕТАЛЛОВ
t. МЕТАЛЛЫ В ЦИАНИСТЫХ РАСТВОРАХ
Медь, золото и серебро
Медь, золото и серебро входят в состав природных
сплавов, содержащихся в рудах, концентратах и OTXO
дах пронзводства. Ведущим компонентом этих сплавов
является золото. Для ero извлечения применяют процес-
32
сы 100 200 летней давности. За последние 100 лет HO
вЫХ методов растворения золота не предложено. Ниже
приведены теоретичест{ие основы растворения золота.
Реакции
Ан е ==о Au+(E o == + 1 J88 В)
и Au 3e==Au3+ (Eo===I J 588)
являются окислительными н требуют в водных paCTBO
рах чрезвычайно большой затраты энерrии: для первоrо
процесс а дО;98 == +43,35 ккал, для BToporo до ;98 ==
== + 109 J 3 ккал. Этим окислительным процессам дол
жен сопутство вать ' восстановительный процесс (поrло
щение электронов). Но большинство технически прием
лемых окислителей менее электроположитеЛЬНЫ J чем
ЗОЛОТО J и процесс перехода электронов от золота к этим
'Окислителям неВОзможен.
Однако поскольку потенциал металла в растворе за
висит от концентрации (активности) ero ионов pac
творе
RT
Е == Ео + lпа ме п+,
nF
имеется возможность создать необходимые условия Д Я
протекания редокси процессов. Понижая концентрацию
ионов золота в растворе, что проще Bcero достиrают свя
зыаниемM ионов золота в достаточно прочный комплекс,
можно так изменить потенциал поверхности металла
(сделать металл небл аrородным). что переход электро
Нов с ero поверхности к частицам окислителя станет
термодинамичестш возможным и при определенных yc
Ловиях кинетически осуществимым.
Наиболее употребительным в rидрометаллурrии
Окислителем является кислород. Для процесса
20H 2е === Н 2 О + 02
2
стандартный потеНQиал Ео== +ОАОl В. с понижением
концентрации ионов rидроксила этот процесс становит.
ся блаrороднее J т. е. кислород сильнее проявляет свои
ОКИС.lJительные свойства, E==0,401 0,05916 19 [OH ]==
== +'1,22g. В при а н + == 1. Окисление золота с отдачей
электронов кислороду неВОЗ1\lОЖНО. В этом случае нужно
Использовать достаточно активный комплексообразова.
306
эз
тель, делающий потеllциал золота более электроотрица.
тельным.
Более 100 лет тому назад П. Р. Баrратионом был
предложен для этой цели ЦJI3HIIд, которыи дает с золо-
том очень прочный комплекс Ли (CN) , константа дис
социации 1\0Top.oro пр 1I 25° С равна 1, t . 1 O 41. ДЛЯ про-
цесса
Au е + 2CN === Au (CN)2', Eo=== O,543 В, I1G O == nРЕо==
:::::: 23060,9 ( 0,543) == 12522 кал.
Реакция растворения золота в цианистом растворе
в присутствии КIIслорода может быть записана так:
2Au + 4CN 2е == 2Au(CN)2; I1GO === 25044 кал
HzO.+ 1I20 2 (r) + 2е == 20H ; Go === 18500 кал
1 1202 (р) === 1/20 2 (r); I1GO == 1972 I{ал
2Au+4CN + 1/20 2 (р)+Н 2 О===
== 2Au (CN)2+20H I1GO == 45516 кал
Константа равновесия Эl0И реакции равна 2,3.1033.
Для реальных условий (концентрации кислорода 2,6Х
XI0 4, золотоrо комплекса I,O.10 5, щеЛОЧII 10 2 и циа
нида 2. 1 O 3 моль! л) убыль свободной энерrии rиббса
еще на 1921 кал больше. Подробные исследования ки
неТИI\И 11 механизма этоЙ реаКЦIlИ подтвердили термо-
динамическиЙ расчет, однако ПОЗВШIИЛИ установить, что
реаКЦllЯ протекает в несколько стадий.
Почти так же активно протекает и растворение се-
ребра в цианистых растворах:
I1G O === 40304 кал, k == 3,5. 1029.
К большинству работ, по изучению кинеТИI<И pac
творения золота и серебра в цианистых растворах, мож
но предъявить ряд претензиЙ, rлавным образом по
поводу методики проведения опытов: не всеrда было
обеспечено постоянство концентраЦI/И кислорода и циа
нида в растворе в начале и конце опыта, не всеrда под-
держивалась постоянноЙ температура раствора. Но ос-
новным недостатком большинства работ следует счи-
тать неудачно выбранныЙ rпдродинамический режим
процесса.
34
Одни исследователи растворяли неподвижно подве
шенные пластинки без перемешивания раствора II обыч-
но без пополнения убыли расходующеrося юrслорода
(влияние rлубины поrружения пластинки; конвекция),
друrие перемешивали раствор воздухом или кнслоро
ДОМ, аrитировали колбы с раствором II пластинками зо-
лота. Некоторые исследователи перемеШIfвали раствор
мешалкой, расположенной над образцом или в стороне
от Hero (влияние расстояния между образцом и мешал
кой), растворяли диск, подвешенный к вращающемуся
стеклянному кольцу, или вращающийся цилиндр. В oд
ноЙ из работ изучали поведение золотой пластинки, ко-
торая была укреплена на пробке и плава а На поверх-
ности растворс1В медленно (6 об/мин) вращающемся на
валках закрытом ЦИЛlJндре, в друrих растворение при
перемешиванин порошка, сферических частиц II даже
Рудноrо золс,rа.
При выборе методики исследования мноrие авторы
стреМИЛJlСЬ моделировать технолоrичеСКlIЙ процесс, oд
нако при растворении пластинок, поверхность которых
во время опыта остается постоянной, нельзя .моделиро-
вать растворение полидисперсной смеси металлических
зерен, протекающее в очень разнообразных и обычно не
поддающихся точному rидродинамическому расчету yc
ловиях.
Вследствие изложенноrо не удалось приблнзиться к
условиям проведенпя технолоrическоrо процесса,
а вследствие несовершенства меТОДИКIJ не были одно-
значно изучены теореТI1ческне основы процесса paCTBO
рения блаrородных металлов в цианистых растворах и
ВЛияние переменных факторов на скорость этоrо про-
цесса. Можно предполаrать, что расхождения между
Данными работ отдельных авторов обусловлены не
столько ошибкаМII измерениЙ, сколько различным ре-
жимом перемешивания.
Недостаточность исследований скорости растворения
золота и серебра в цианистых растворах заключается
еще и в том, что при постоянной и ВОСПРОИЗВОДliМОЙ ме-
тодике экспериментирования (вращающийся диск) не
были систематически изучены факторы, влияющие на
сКорость процесса, а именно: а) концентрация peareH-
тов (циэнид, кислород, щелочь, примеси) ; б) состав
твердой фазы; в) влияние внешних факторов (перемеши-
вание, температура и т. д.).
3*
35
Все это обусловило различие теоретических концеп
ций и взrлядов на процесс растворения серебра и золо
та в цианистых растворах. ОДНИ авторы считали, что
фактором, лимитирующим скорость процесса paCTBope
ния, является скорость химической реакции, протекаю
щей на поверхности растворяющеrося металла, тоrда
как друrие наиболее медленным этапом считали CKO
рость диффузии peareHToB (цианида и кислорода) к этой
поверхности, третьи же исходили из теории локальных
короткозамкнутых элементов, обращая особое внимание
на процесс восстановления кислорода.
Растворение серебра
Цианид очищали растворением в метиловом спирте
(раствор имость калиевой соли равна 4,91 r в 100 r
спирта при 19,5° С, а натриевой 6,44 r при 15° С). Пос
ле перечистки цианид был промыт абсолютным этило
вым спиртом И сухим эфиром (без перекиси) и высушен
в ваКУУМ ЭI(сикаторе. Чистота полученноrо препарата
более 99%. Концентрацию цианида в растворе до нача
ла опыта и в конце ero определяли по методу Либиха
Дениже, серебра весовым KcaHToreHaTHbIM методом
после разложения цианидов выпариванием пробы с кис-
лотами.
Как уже было отмечено, методом растворения Bpa
щающихся дисков можно получить хорошо воспроизво
димые результаты при тщательной юстировке диска OT
а
о
Рис. 4. Поверхность серебряноrо диска ПОСле раствореJlНЯ
(а) и схема движения жидкости у поверхиости вращающеrо-
ся диска (6)
36
носительно оси вращения. Точность юстировки может
быть оценена, как показали наши мноrочисленные опы-
ты, по появлению своеобразных фиrур на поверхности
диска после растворения (рис. 4). При неправильной
установке диска ламинарное движение жидкости вдоль
ero поверхности переходит в турбулентное, скорость рас-
творения металла увеличивается и «фиrуры травления»
исчезают.
ля проверки влияния микроструктуры поверхности
дисков на скорость растворения серебра были поставле-
ны два опыта. В первом поверхность диска была отшли
фована и отполирована, а во втором обработана [ру-
бой шкуркой (на поверхности были заметны царапины
и бороздки). Q.пыты показали, что скорость растворения
почти не зависит от микроструктуры поверхности. Это
соrласуется с даННЫМII друrих авторов и очень упроща
ет подrотовку дисков для исследования.
В л и я н и е к о н Ц е н т р а Ц и и Ц и а н и Д а. Условия
опытов: концентрация цианида калия от 3,85 .10 3 до
1,54.10 2 моль/л, защитная щелочь 10 3 моль/л, давле
ние кислорода 1 ат, скорость вращения диска 1100
об/мин, поверхность диска 3,14 см 2 , температура 250 С.
Кинетические кривые имеют вид прямых, проходя-
щих через начало координат. Воспроизводимость CKOpO
сти растворения при различной продолжительности pe
акции очень хорошая точки мало отклоняются от пря-
мой. По результатам опытов составлена табл. 3, в кото-
рой приведены значения удельных скоростей растворения
v моль/(см 2 .с) серебра в растворах с различной кон-
центрацией цианида.
Постоянство отношения удельной скорости paCTBope
ния и концентрации цианида в растворе позволяет в
этом случае применить уравнение (5).
Среднее значение приведенной скорости из данной
серии опытов (без учета первоrо)
== 2,91.10 6 л/(см 2 .с).
С
Скорость растворения серебра увеличивается с по-
вышением концентрации цианида калия в растворе дО
[KCN] 9,3.10 3 моль/л (0,061 %).
Это объясняется избытком цианида по отношению к
кислороду в слое раствора, прилеrающсм к поверхности
серебра. Скорость диффузии КlIслорода постоянна при
,37
Таблица 3
v
Величины v и С при различных концентрациях цианида в растворе
IKCN] .101
V.108
IKCN) .101
...::........ 10
С
v 10' 1+ . 10'
3,85 1',10 2,86 9,24 2,75 2,98
5,00 1,44 2,88 11,60 2,63 3апре
7,70 2,23 2,90 11,60 2,62 Дельная
8,80 2,62 2,98 11,60 2,67 область
9,24 2,67 2,80 15,40 2,70
постояннс,и концентрации ero в paCTBope избыточный
же цианид растворять серебро не может.
Вопрос о предельной концентрации цианида являет-
ся очень важной и характерной особенностью цианисто
ro процесса и более подробно будет рассмотрен в следу
ющих разделах.
Зависимость скорости растворения от
ч и с л а о б о р о т о в Д и с к а. На рис. 5 даны значения
приведенной скорости реакпии как функции корня KBaд
3
12 24
vn
Рис. 5. Зависимость приве
денной скорости растворения
серебра от числа оборотов
Диска в минуту
3
3
10
Ь
С'2 8
'"
6
<::>
<\> 1 4
<Q'
2
О 5 10 15 О 10 20 30
[XCNj .Ю З } 110ЛЬ/Л
Q tf
Рис. б. Влияние давления кислорода и кон-
центрации цианистоrо калия на скорость рас-
творення серебра: а: 1, 2 Ро =-0,21 ат, t
2 0 С 2
О : 3, 4 P02 1 ат. t=<35 0 C; б: I P02==
,'I,U ат; 2 (!О2 -"'2,7 <1Т. f 2:;O С
paTHoro IIЗ числа оборотов ([ KCN] == 8,8Х 1 о з; [КОН] ==
::::: 10 З; РО2 == 1 ат; t==25° С).
Результаты опытов подтверждают применимость ypaB
нения (4) для описания реакции растворения серебра в
цианистых растворах скорость реакции cTporo пропор-
циональна числу оборотов в степени 0,5.
В л и я н и е Д а в л е н и я к и с л о р о Д а и п р е-
Д е л ь н а я к о н Ц е н т р а Ц 11 Я Ц И а н и Д а. Взаимо
связь между скоростью растворения блаrородных метал
лов в цианистых растворах и давлением кислорода над
раствором рассматривали мноrие авторы, но окончатель
но этот вопрос еще не решен. Для изучения указанной
взаимосвязи и определения предельной концентрации
цианида п аЗЛIlЧНЫХ температурах и давлениях были
проведены опыты по растворению серебра в растворах
с различной концентрацией цианида калия. Окончатель
ные результаты опытов представлены на рис. 6.
Анализ этих данных позволяет сделать ряд важных
выводов. Ниже приведена зависимость предельной KOH
центрации цианида Сп от температуры при POz=== 760 мм
рт. ст.
Температура, ос. . . .
Скорость вращенин дис
ка, об/мин .
Предельная KOHцeHTpa
ция цианида, моль/л. 1 02
15
1100
1,18
25
1100
1,00
35
1400
0,88
45
1400
0,80
50
1400
0,77
Влияние давления кислорода на скорость paCT ope
ния серебра в цианистых растворах имеет сложныи ха-
рактер. На наклонном участке кривых (см. рис. 6), т. е.
при концентрации цианида ниже предельной, скорость
растворения не зависит от давления кислорода над раст-
вором и, следовательно, от ero концентрации в растворе
(прямые, полученные с воздухом и кислородом при раз
личных давлениях, налаrаются одна на друrую). Это
вполне лоrично, так как у поверхности металла ки лород
имеется в избытке и скорость растворения определяется
концентрацией цианида в растворе. Для этоЙ области
приведенная скорость реакции определяется отношением
удельной скорости растворения к концентрации цианида
в растворе и равна при 250 С и 1100 об/мин 2,91 Х
XI0 6 л/( см 2. с ).
Повышение давления кислорода нзд раствором сопро-
39
вождается увеличением предельноЙ концентрации циани-
да. Если концентрация циаНlIда 13 растворе выше предель-
ной для наибольwеrо ИЗ сравнивае:VIЫХ дав.1ениЙ, то ско-
рость растворения изменяется пропорционально
давлению кислорода в первоЙ степени (rоризонтальные
участки кривых на рис. 6), независимо от концентрации
цианида.
Если же концентрация цианида в растворе находится
между значениями, предельными для сравниваемых дав-
лении (точки а и Ь на рис. 6), то скорость растворения с
повышением давления изменяется пропорционально дав-
лению кислорода в степени от О до 1; показатель степени
будет тем выше, чем ближе изучаемая концентрация циа-
нида к предельной для более BbIcoKoro давления.
Таков сложныЙ характер влияния давления на ско-
рость растворения серебра в цианистых растворах: до
точки а скорость не зависит от давления, между точками
а и Ь изменяется с давлением в степени от О до 1 и после
точки Ь пропорциональна давлению в первоЙ степени,
независимо от концентрации цианида.
Приведенный анализ лияния давления кислорода на
скорость растворения серебра в цианистых растворах по
зволяет объяснить сложный характер кривых, получен-
ных некоторыми авторами при постоянной концентрации
цианида и различном давлении кислорода.
Необходимо отметить, что при концентрации цианида
выше предельноЙ процесс контролируется не цианидом,
который имеется в избытке, а кис.тIОРОДОМ. Для зтой об-
ласти концентраций константа скорости реакции опреде-
ляется отношением удельной скорости растворения к
концентрации кислорода в растворе и равна при 250 С и
5.31XI0 6 л/(см.с!/2 ооб l ,2).
Понижение скорости растворения блаrородных метал
лов при цианировании руд (концентрация свободноrо
цианида сравнительно невелика) связано с уменьшением
концентрации кислорода, которыЙ интенсивно поrлоща
ется окисляющимися минералами руды. В результате
3Toro к поверхности металла 1I0ступает так мало кислоро
да, что предельная концентрация цианида становится
меньше имеющейся в растворе и процесс переходит в об-
ласть, контролируемую кислородом, а не цианидом.
С повышением давления концентрация кислорода у по
верхности металла увеличивается и растворение протека
ет с большей скоростью.
40
Для определения IIредельноЙ концентрации цианида
при растворении серебра можно применить уравнение
1 9 СП == 1 11 94 .
с ' т
02
(7)
Из соотношения между предельноЙ концентрацией
цианида в растворе и давлением (а, следовательно, и KOH
центрациеЙ в растворе) кислорода можно сделать неко'
торые выводы о механизме реакции растворения серебра
в цианистых растворах.
Четырехэлектронная реакция восстановления кисло-
рода расп ется на две двухэлектронные стадии, кото-
рые входят в уравнения Бодлендера:
а) 2Ag+4CN +О2(Р) + 2H20==2Ag(CN)2+H202+20H
б) 2Ag + 4CN + Н 2 О 2 == 2Ag(CN)2 + 20H
в) 4Ag+8CN .+02(P) + 2H20==4Ag(CN)2+40H
При IIредельноii концентрации циаНl1да кислород и
цианид расходуются на растворение серебра в стехиомет
рических количествах:
с KCN ( DKCN ) ' '2/3
т==
С О2 Doz
(8)
Отношение концентрациЙ цианида и кислорода в дaH
ном выражении при 250 С равно 7,79 (см. уравнение 7).
Коэффициенты диффузии равны: для Юlслорода 2,ОХ
Х 1 O 5 CM 2 jc, для циаНJJда ка.т1ИЯ 1,84. 1 O 5. Отношение ко-
эффициентов диффузии в степени 2/3 равно 0,946 и, сле-
довательно, n===7,79.0,946==7,36. НаЙденное отношение
между числом реаrирующих ионов цианида и молекул
КИслорода несколько ниже, чем вытекающее из суммар-
Horo уравнения реакции, что вызвано образованием пле ,
нок на реакционноЙ поверхности и возможным разложе-
нием На ней части образующейся I1ерекиси водорода.
В л и я н и е к о н Ц е н т р а Ц и и Щ е л о ч и в р а с-
т в о ре. Отрицательное влияние повышенноЙ щелочности
раствора на скорость растворения блаrородных метал-
лов в цианистых распзорах отмечал ось в литературе Не-
однократно. Одна КО ПОАедеНIfl' Сt'ребра в ВЫСОКОЩСЛОЧ
41
ных цианистых пульпах изучено менее детально, чем по
веДение золота (см. рис. 11).
Опыты проводили при следующих условиях: концент-
рация цианида 7,7. 10 З моль/л, концентрация щелочи
(КОН) от 10 З дО 0,8 моль/л, температура 250 С, давле-
ние кислорода 1 ат, п 1100 об/мин.
Опыты показали, что при повышении концентрации
щелочи до, 0,1 моль/л (рН 12,9) константа скорости
уменьшается незначительно (примерно 4% на единицу
рН), но затем наблюдается более резкое уменьшение ско-
рости растворения вследствие кинетических затруднениЙ,
возникающих при восстановлении кислорода. При кон-
центрации щелочи менее 1 о з моль/л скорость paCTBope
ния также уменьшается вследствие rидролиза и потерь
цианида.
В л и я н и е т е м пер а т у р ы р а с т в о р а. Мноrие
исследователи изучали влияние этоrо фактора, но полу
ченные ими выводы далеко не однозначны. Причина это-
ro в методике опытов авторы не учитывали различий
в характере реакции растворения до предельной концент-
рации цианида и выше нее. Результаты наших опытов
сведены в табл. 4. Опыты NQ 1, 2, 3 и 4 проведены в стек-
лянном сосуде (1100 об/мин), 5 и 6 в автоклаве
(1400 об/мин).
По кинетическим кривым вычислены константы CI{OpO
сти реакции (k == c /2 ) для допред.ельной по цианиду
области. Результаты опытов, lIроведенных в стеклянном
сосуде и автоклаве, соrласуются с точностью порядка
1,7%. По данным, приведенным в табл. 4, вычислено
уравнение зависимости константы скорости реакции
растворения серебра в циаНIIСТЫХ растворах от темпера-
турь!:
800
19 k == 3,483 .
т
Экспериментальная энерrия активации процесса равна
800.4,5757 == 3,660 ккалjмоль, что неплохо соrласуется с
величиной, найденной Лундом, 3,20 ккал/моль*. По дан-
ным опытов 1 6 вычислены уравнение Аррениуса и экс-
периментальная энерrия активации той же реакции, но
для «запредельной» области по цианиду, KorAa скорость
,. 1. u n d. "" Т . «Acta сl1(\[П. Sсапd», 1951. N!! 5, 'р. 555 557.
42
процесса контролирует диффузия кислорода (прп пар-
циальном давлении 760 мм рт. ст.):
Ig k' == 2,3636 868 , ДЕ::=: 3972 кал/моль.
т
Температурный коэффициент реакции в допредельноЙ
области, вычисленный из найденноrо уравнения, равен
1,24 в интервале 15 25° С и постепенно уменьшается с
повышением температуры (до 1,206 в интервале 35
450 С), как это и следует из уравнения Аррениуса. Эта
величина выше определенной Майером для золота, так
как она относится к допредельной по цианиду области.
В области же, контролируемой диффузией кислорода, за-
висимость скорости от температуры более сложна с
повышеIOte.м температуры увеличивается скорость диффу
зии и снижается кинематическая вязкость раствора, но
уменьшается и растворимость кислорода.
Таблица 4
Влияние температуры на скорость растворения серебра
НО",Р олы," I
" ос
1000
Т. К
k
Ig К
1 15 3,4704 5,49.10 7 5,2605
2 25 3,3540 6,82.IO 7 5, 1662
3 25 3,3540 б,80.IО 7 5, 1677
4 35 3,2452 8 , 41 . 1 o 7 5 ,0753
5 35 3,2452 8,27.10 7 5,0826
6 50 3,0945 11,0.10 7 4,9547
Наши опыты были проведены при атмосферном дaB
лении 730 735 мм рт. ст., И расчетное повышение CKOpO
сти реакции в интервале 25 350 С равно
k ( D 2/Э v ) 1/65 ( 2 б4'IО 5 ) 2!3
.2!.::::::; ) . ( == ' х
k'!5 D 25 ,V З 5 525 2,00.IO 5
X ( 8'929'10 3 ) 1/6. ( l,ОI'IО З ) == 1,053.
7,237. 1 0. 3 1 , 195. 1 0 3
Экспериментальная же величина отношение макси
мальных скоростей растворения при ]100 об/мин (см.
рис. 6, а) равна 2,85.10 8: 2,71.10 B== 1,051. Расчетные
43
и экспериментальные величины хорошо соrласуются меж
ду собой и с данными Плаксива.
Сравнительно небольшое значение эксперименталь-
ной энерrии активации позволяет сделать вывод о том,
что для реакции растворения серебра в цианистых paCTBO
рах кинетически определяющим этапом является диффу
зия: в допредеJlЬНОЙ области цианида, а в запредель-
ной кислррода.
Для определения количества pacTBopeHHoro серебра
при щелочности раствора 1 о з моль/л можно испо.пьзо
вать уравнение (4). Константа скорости для серебра paB
на 8,55. 1 0 6 л/ (см 2 . с 1 /2 . об 1/2),
19 k' === 2,5123 762 , дЕ ==3,487 ккал/моль.
т
Предельные концентрации цианида Ю1ЛИЯ при РО2 ==
== I ат и температурах 25,35 и 450 С равны COOTBeTCTBeH
но 1,06; 0,935 и 0,85.10 2 моль/л. При постоянноЙ темпе
ратуре соблюдается зависимость Сп: Р О! ===const. В yc
ловиях проведения нашИх опытов (1100 об/мин, aTMOC
ферное давление 732 мм рт. ст., 25 350 С (см. рис. 6)
отношение максимальных скоростей растворения было
равно 4,47 .10 8: 4,37 .lO 8=== 1,022, т. е. несколько меньше,
чем при растворении серебра в запредельной области.
Экспериментальный стехиометрическиii коэффициент при
250 С равен
СП ( D KCN ) 2/3 1.06'1O '2 ( 1 ,84.10 5 ) 2/3
,п .
C Oz Doz ',28.IO 3 2,OO.IO- :;
== 8,28. 0,946 == 7,83,
что почти совпадает со стехиомеТРИЧССКИl\1 коэффициен
том cYMl\fapHOrO уравнения Эльснера, равным 8,0.
Растворение золота
Сначала было изучено влияние интенсивности переме-
шивания И концентрации цианида на скорость растворе-
ния золота в водных растворах цианида калия (рис. 7, 8
и 9). Из этих данных следует, что поведение золота в циа
нистых растворах отлично от поведения серебра и меди.
С увеличением числа оборотов днска скорость paCTBO
рения зОЛота возрастает только до определенноrо пре-
44
дела До 2,5 об/с, а затем уже не зависит от интен
сивности перемешивания, т. е. процесс переходит из диф
фузионноrо режима в кинетический.
Для\ уточнения этоrо была поставлена серия опытов
при прojдувке воздухом, а не кислородом. И в этой серии
опытов переход из диф
фузионноrо режим а в
КlIнетическиЙ наблю-
дался при том же чис
лс оборотов диска,
7
t:;' б
....;
S 5
4
3
'ь"
2
1
О
4
2
3
1
4 6 8 10 12 14 16 .1
[KCN] '103, поль/л
в
2
4
...;
6
'-'
;::.
4
CI>
;:,.
3
5
о
4 8 12
[I(CN]- 103, "'0176/11
Рис. 8. За висимость скорости paCTBope
иия ЗОЛОТа ОТ концентрации циаНllда п
числа оборотов диска в секунду:
l O; 2 O,2; 3 1.67; 4 2,5; 5 6,1;
6 18.3. [К,)Н] IО 3, POz l 8Т, t 25°(
Рис. 7. Зависимость скорости рас-
ТDорения золота от концентрации
цианида и давления кислорода:
1 t 2So с; РО: O.21 ат; 2 t
250C; POz"" 1 ат; 3 t 350C;
POz O.21 ат; 4 t 35°C; РО: l ат
18
к
4
3
2
1
О
5 10 15 20 25 30
v7i,OJjI1UH
Рис. 9. Зависимость кон-
ставты скорости растворения
золота (1. 2). С рt:бра (3) и
меди (4) от скорости враще-
ния диска при Р О. 1 ат
и, з, 4), 2 O,21
с тем только отличием, что при продувке воздухом при
увеличенном числе оборотов скорость растворения оста.
ется постоянной, а при продувке кислородом снижа-
ется примерно в два раза (рвс. 9, кривая 1).
в диффузионном режиме процесс растворения золота
в цианистых растворах аналоrичен процессу растворения
45
серебра и меДИ. Налицо две области допредельная, в
которо"''! скорость растворения пропорциональна KOHцeHT
рации циаНllда в первоiI crellCIНl [ПрIl 250 С среднее зна
чение константы СКОрОСТН НЗ f\Тноrих опытов равно 0.83Х
1/2 1/,)
Х О б л/ (см 2 . С . об .1 и запредельная скорость про
порциональна концентрации кислорода в растворе в пер
воЙ степени, [(при 250 С k'===4,15. О б л/(см 2 .с 1 /:! .061/2)].
Предельная концентрация цианида калия при 25 0 С и
парциальном давлении кислорода над раствором 760 мм
рт. ст. равна 6,41.] о з моль/л, а стехиометрический KO
эффициент реакции
т == Сп ( D KCN ) 2/3 == 6,41.10 'З . ( 1,84'10 5 ) 2/3 =::о
S02 Doz 1, 28 .10 3 2, 0.10 5
::::= 5.01.0.946 ::::= 4,74.
Эта величина близка к стехиомеrрическому коэффи-
циенту первой стадии уравнения Бодлендера. Некоторое
превышение, видимо, вызвано разложением перекиси во-
дорода и повышением концентрации кислорода в припо-
верхностном слое, однако ясно, ЧТО окислительная спо-
собность кислорода при этом используется не полностью.
Кроме Toro, следует отметить, что при изучении влия
ния различных условий на скорость растворения золота
необходимо обращать особое внимание на интенсивность
перемешивания раствора, поэтому в дальнейшем опыты
проводили при скорости вращеНI1Я диска 100 и
] ] 00 об/мин.
в л 11 Я Н И е Д а в л е н и я к и с л о р о д а н а Д р a
с т в о ром. Как уже отмечал ось, в диффузионном режи
ме зависимость скорости растворения золота от парци
альноrо давления кислорода над раствором ( а следова
тельно, и от ero концентрации в растворе) такая же, как
для скорости растворения серебра. В допредельной обла-
сти скорость не зависит от давления, а в запредельной
определяется этим параметром. Повышение давления
кислорода сопрово)кдается увеличением предельной кон-
центрации цианида и максимальной скорости раство-
рения.
При постоянной температуре отношение максималь-
ных скоростей растворения при различных давлениях
кислорода равно отношению предельных концентраций
цианида или отношению парциальных давлениЙ кислоро-
да над раствором.
46
В кинетическом режиме картина иная. Поскольку
самым медленным звеном процесса является скорость
ХИМllческои реакции, скорость растворения должна быть
пропорциональна давлению кислорода в степени 0,5,
что и подтверждается опытом. Так (рис. 10), при 250 С,
365 об/мин, продувке раствора кислородом и воздухом
отношение максимальных скоростей растворения равно
5,3.10 9:2,4.10 9==2,21, а при 1100 об/мин 4,47.10 9:
6
/
/
t:;' 5
с-:
:t:
4
<:>
3
2
:::.
Рис. 10. ЗаВИСIIМUСТЬ
скорости раСТвореllИЯ зо-
лоТа в КИН('ТИЧ СI,О\l
рсжиме UT концеll-
трации ЦJlанида (250 С;
365 об/мии); l продувкз
ВОЗДУХОМ; 2 I1родув!,а
кислородом
: 2,09.10 9===2,14, т. е. в среднем скорость растворения
увеличивается ПРОIlорциона,IIЫIO корню квадратному I1З
отношения парциальных даВ.'IениЙ Юfслорода (1 О :
: 0,20951/2=:2,18). Следовательно, v===k" pi]; ==k'Ci];.
Однако различное влияние воздуха и кислорода На
скорость растворения золота ОТJшчается одноЙ особенно
стью: в области, кОнтролируемой диффузиеЙ цианида,
константа скорости реакции при продувке воздухом paB
На 2,40. 1 0 9 : 1,85. 1 о з== 1,30. 1 0 6, а при продувке кисло-
родом 5,30.10 9: 8,8.10 З==0,60.10 6 л/(см 2 .с), т. е. в
2,17 раза меньше (при 1100 об/мин соответственно 1,15.
.10 б: О,51'10 б== в 2,21 раза).
В области, контролируемой диффузиеЙ кислорода, По
скольку при этом v == k' Ci].2 константы одинаковы как
при продувке воздухоы, так II кислородом: 2,40. 1 O 9 :
: 1,58. 1 0 2=== 1,52. 1 0 7 И 5,30. 1 0 9 : 3,46. 1 0 2== 1,53.
.10 7 Л . моль'j2 /(см 2 .с) (при атмосферном давлении
732 мм рт. ст. И 250 С растворимости кислорода равны
2,50.10 4 и 1,195.IО З моль/л). Интересно отметить, что
47
хотя скорости растворения изменяются пропорционально
корню квадратному из отношения растворимостей кисло
рода, предельные концентрации цианида изменяются про
порционально отношению растворимостей в первоЙ CTe
пени (8,8. 10 3 : 1,85. 10 3==4,67). То, что при продувке
раствора кислородом скорость растворения золота ниже,
чем при продувке воздухом, объясняется более интенсив
ным пассивированием поверхности металла кислородом.
В л и я н и е Щ е л о ч н о с т и р а с т в о р а. Мноrие
авторы отмечали замедление растворения золота в циа
нистых растворах при повышении их щелочности. Следо
вало выяснить влияние концентрации щелочи с учетом
поведения золота при большоЙ и малой скорости враще
ния диска (250 С, РО2 == 1 ат).
Как и при растворении серебра, с повышением щелоч
Ности раствора скорость растворения золота уменьшает-
ся (рис. 11). До концентрации КОН, равной 0,1 моль/л,
7
...,j
5
I
<IJ
Qo,"
;;.
Рис. 11, Зависимость СКОрОСТII
растворения блаrородных MeTa.'1
лов от щелочности раствора
(25 О С: 1 ат; 1,67 об/с); 1 зол()-
то ([I(CNI 7,7.IO 3: 18,3 об/с);
2 З0ЛОТО ([KCN] I,14.IO 2;
з серебро ([KCN] 7,7.IO 3)
0,001 0.01 0.1 1,0
[ХОН], 110ЛЬ/Л
уменьшение скорости линеЙно: при 100 об/ыин С повыше
нием рН на единицу скорость снижается на 8,9%, а при
1100 об/мин на 6,2%, т. е. золото несколько чувстви
тельнее к изменению щелочности, чем серебро. П ри даль
нейшем повышении щелочности наблюдается резкое
уменьшение скорости растворения и сближение кривых
1 и 2. Это объясняется кинетическими осложнениями при
восстановлении кислорода при высоком значении рН и
преобладающим их влиянием по сравнению с пассивиро
ванием поверхности золота.
48
Следует обратить внимание на влияние характера ка-
тиона щелочи. Известь и rидроокись бария при одинако.
вом рН даже в чистых непромышленных растворах силь
нее замедляют растворение блаrородных металлов, чем
rидроокиси калия и натрия. Это связано со взаимодеi'Iст
вием щелочноземельных катионов с перекисью водорода
и образованием на поверхности металлов плотных и пло
хо растворимых пленок СаО2 и ВаО2, а также карбона.
тов кальция и бария.
В л и я н и е т е м пер а т у р ы р а с т в о р а. Опыты
были проведены в диффузионном и кинетическом режи.
мах (100 и 1100 об/мин). При диффузионном режиме и в
области, контролируемой диффузиеЙ цианида ([KCN] ===
==3. 1 0 3), найдены следующие величины приведенных
Ofоростей реакции при 25; 35 и 450 С : 1,05; 1,27 и 1,52Х
10 6 л/(см 2 .с).
Уравнение зависимости константы скорости от тем.
пературы по этим данным:
760
Ig k == 3,5314 , E == 3478 кал/моль.
т
Для области, контролируемоЙ диффузией кислорода
802
19 k'== 2,691 , E===3670 кал/моль. Зависимость
т
отношения С П /С0 2 от температуры можно О'lfИсать ypaB
нением
Ig С СП == 0,8404 Е.. .
02 Т
в кинетическом режиме влияние температуры на ско-
рость растворения золота иное. В допредельной области
при продувке кислорода через раствор при 15; 25 и 350 С
найдены следующие величины приведенных скоростей ре-
акции (в кинетическом режиме они же являются и кон-
стантами скорости): 2,23; 5,10 и 11,0.10 7 л/(см 2 .с).
ЭТИМ величинам соответствует уравнение 19 k===4,0611
З 7 .
т и дЕ.==- 14,125 ккал!моль. В запредельнои области
Д. Е===9,77 ккал/моль (концентрация цианида 10 2 моль/л
при 640 об/мин). Энерrии активации как в до-, так и в за
предельной области значительно большие, чем в диффузи-
ОНном режиме, и характерны для процессов, самым Meд
ленным звеном которых является скорость химической
реакции.
4 306
49
При 250 С константЬ! k и k' (ДЛЯ дo и запредельной
областей) равны соответственно 0,68 и 5,3. 1 О б, а для
друrих температ их можно вычислить из приведенных
выше (стр. 49) уравнений. Для Toro чтобы учесть влия
ние щелочности (в пределах рН == 11--7-13), надо YMeHb
шить константу скорости примерно на 4 % на каждую
единицу рН. Величины предельных концентраций циани-
да калия приведены На стр. 44 для температур от 25
до 450 С. ДЛЯ друrих давлений их можно рассчитать,
учитывая, что Сп/С 02 ==const.
Следует подчеркнуть, что численное значение Сп оп
ределяет переход процесса растворения из области, KOHT
ролируемоi'I диффузиеi'I цианида, в область, контролиру
емую диффузией кислорода, и, следовательно, предопре
деляет и выбор уравнения скорости растворения, точнее
ero константы k или k'.
Если через раствор продувать не кислород, а воздух, то
при 250 с учетом упруrости пара воды при атмосферном
давлении 732 мм рт. СТ.
3 736 732 -t
Сп == 1,00.10 . .0,2095 == 1,95.10 моль/л.
760 760
Растворение меди
Эта реакция аналоrична реакции растворения сереб-
ра: кинетические кривые линейны, процесс протекает в
диффузионном режиме в интервале скоростеЙ вращения
диска 0 2500 об/мин; скорость растворения прямо про-
порциональна числу оборотов диска в степени 0,5; име
ются две области контролируемая диффузией цианида
и контролируемая диффузиеЙ кислорода; в обеих облас
тях реакции имеют первый порядок.
В области, контролируемой диффузией цианида, KOH
станта скорости при 250 С равна 1,О35.10 б л/(см 2 .с 1 / 2 х
700
Хоб 1f2 ), 19 k== 3,638 , Е===3,203 ккал/моль. В об.
т
ласти, контролируемоЙ диффузией кислорода, при 250 С
k' === 8,551 O 6 и Е === 3,487 ккал/моль.
Результаты изучения скорости растворения ыеди,
серебра и золота в цианистых растворах позволяют OTMe
тить некоторые общие черты кинетики процессов их paCT
ворения. В табл. 5 собраны константы скорости растворе.
ния этих металлов при 250 С и Р02 === 1 ат для диффузион
I1oro реЖИI\'lа (уравнение 4) и кинетическоrо (уравнение
50
i",
=1--
:Е О
(\)
:S:;s:
:<::с
'-'(\)
(\)0.
;:0
f-ol--
(\)<.)
:с",
;20.
(\)
,:.;:(\)
(\):.::11
o.u;>:
О(\):С
(\)".",
E--<i:i:t:
(\)
=
:с
(\)
о.
с
ш
f-o
U
<о
С.
!
;ii
Q)
о.
3
:r:
:r:
=--
-&
-&
;s:
t:1:
(\)
;
=--q
qo
00.
0.0
J::t:;
u
:S::S:
0.:':
J::
......
l.O
О
I
о
ф
о
м
L1)
о
l.O
c"j
c"j
t-.
CТI
М
r--..
00
м
о
r--..
r--..
CТI
о
uj
о
о
r--..
ф
м
=
!--
g U
(\]
!:: t:::
<.) \о
;s: О
о.
(\) .. 11<
1-- ::: '::о:: ,= ,= '::: t:::
::<: foo g .д о о .........
ro u :I: :I: ..i:I
О. :о t:::
'" ..а О .а .а t:::
Х t::: r::: :а t::: t::: О
\0 <1) <1) <1) <1)
о о-{ t::t: ........ q q :а
t:::
11< <1) <1) <1) <1)
о- с. :<: с. о- C<I
'о J:: J:: J:: t:: 3
О (\] Щ о (\]
...... q с') q с')
t:
.J:( <.] C,J
(\)
:.:
:;;
>'0
q><
о>,
0.1:(
1::",
О
::::0:1
о.
1::
l.O
......
u')
о
о
о
о
CТI
L1)
м
м
<о
f-o
О
1';
:;;
м
00
о
ф
00
r--..
м
'<11
<о
14-
\о
СУ";)
uj
о
ф
ф
м
00
ф
о
=
q
со>
uj
м
о
LC
LC
00
м
о
м
CТI
О
l.O
М
r--..
uj
M
r--..
l.O
CIO
......
О
LC
CIO
r--..
r--..
00
CIO
j C,J0
00
CТI
о
CIO
О
'<11
Ф
о
ф
о
ф
о
51
3) режима (для золота при п>2,5 об/с). Дополнительно
лриведены и рассчитанные теоретичсски константы для
диФФузионноrо режима.
Кинетические константы для друrих температур мож
но вычислить из уравнения
1 k == 1 k + E (Т 298 )
g т g 298 ] 364 , 2 Т .
При вычислении отношения Сп: С 02 В это уравнение
надо подставлять разность энерrиЙ активации в за- и дo
предельной областях.
Особенности растворения блаrородных
металлов
Изученные реакции несколько необычны: с одноЙ CTO
роны ИХ скорость зависит от числа оборотов диска, на ero
поверхности образуются фиrуры травления, эксперимен
тальная энерrия активации равна 3,20 3,66 ккал/моль,
что характерно для процессов, контролируемых диффу
зиеи; с друrой скорость растворения зависит от приро
ды растворяемоrо металла.
Чтобы разобраться в этом кажушемся противоречии,
сделаем теоретический расчет скорости растворения. По
ток цианида калия к поверхности вращающеrося диска
(моль/с) при 25 С С равен
. 6, ]8.10 4 (2л) 1/2 D 2 / 3 1/2
/ == SCn ==
v 1 / 6
6, 18 . tо -l (2л) I/2. (1 ,84 . 10 5 ) '2/3
SCn 1/2 == 2,37 .1 0 6 SCn 1/2.
(8, 929.10 З)'/t;
Так как при растворении блаrородных металлОв в ци
анистых растворах два иона цианида реаrируют с одним
атомом металла (171 === ), эту величину надо разделить
на 2. Тоrда k===I,18..l0 6 л(см2.сl/2'0б1/2). НаЙденные
экспериментальные величины (табл. 5) меньше, чем pac
считанная теоретически; наиболее близка к неЙ KOHCTaH
та скорости реакции растворения меди (87,5% от расчет
ной), затем золота (70,5%) и серебра (57,5%).
Ответ на это следует искать в том, что на поверхно
сти раС1'воряющеrося металла образуются пленки про
межуточных продуктов реакции: на поверхности серебра
52
и меди простые цианиды этих металлов (MeCN) и их
окислы, а на поверхности золота только ero высшиЙ
окисел. ОДНаКО характер действия этих пленок пока еще
не совсем ясен, хотя известно, что пленки нроницаемы и
лишь HeMHoro тормозят доступ кислорода к поверхности
металла. Видимо, кислород диффундирует сквозь капил
ляры, заполненные раствором, а это создает дополнитель
ное диффузионное сопротивление; причем оно тем боль
ше, чем толще пленка.
Но если бы это торможение сказывалось только на
анодноЙ фазе процесса, то цианид должен был бы быстро
растворить пленку и устранить это осложнение. Наши же
работы показывают, что в допредельной области пленки
простых цианидов довольно толсты до 1000 условных
м нослоев на меди и до 100 на серебре, причем толщина
пл ок зависит от концентрации цианида и кислорода,
интенсивности перемешивания, температуры и продолжи
тельности растворения. Все это позволяет высказать
предположение о том, что значительную роль иrрает и
скорость растворения самоЙ плснки. При этом возникает
динамическое равновесие у поверхности, при котором CKO
рость роста пленки и ее растворения уравновешиваются,
и пленка приобретает какую то постоянную толщину
(и определенную скорость раствоrения), зависящую от
условий опыта (концентрации, температуры, интенсивно-
сти перемешивания). Однако первый IIОрЯДОК реакции по
цианиду остается неизменным, поскольку скорость ра-
створения пленки определяется ero концентрацией. Сле-
дует отметить, что даже IIрИ более простых реакциях
без деполяризаЩIII кислородом (растворение AgCl в циа
нистых растворах, тиомочевине и друrих растворителях)
константы скорости реакций были найдены меньшими,
чем рассчитанные теоретически (см. с. 196).
Интересно отметить, что экспериментальные энерrии
активации в допредельной области примерно такие же,
как и рассчитанная теоретически, тоrда как в запредель
ной области они значительно 1\.lеньше теоретической (см.
табл. 5), хотя толщина пленки при этом минимальна. За-
Метно ниже теоретическоrо и отношение Сп: Со 2 . Здесь
MorYT влиять два фактора. Во первых, поскольку диффу
зия кислорода через пленку затруднена, для прохожде-
ния через нее необходим rрадиент концентрации кисло
Рода (да и площадь капилляров меньше поверхности ди-
ска), а следовательно, часть кислорода будет унесена по
53
током, покидающим диск (концентрация у поверхности
не равна нулю, как принято при теоретическом расчете).
Во-вторых, осложнение ДОЛЖНО быть более заметно в за
предельноЙ области, коrда на поверхности металла Ha
ходятся тонкие пленки. При этом может сказаться ката.
литическое разложение на неЙ перекиси водорода, что
будет сопровождаться неllОЛНЫМ использованием окисли.
тельной способности кислорода, снижением скорости ра-
створения и отношения Сп: СО 2 . Чем больше избыток
цианида, тем тоньше пленка, тем полнее разложение пе
рекиси водорода и тем ниже скорость растворения. Хотя
на меди пленки и толще, чем на серебре, тем не менее
они более проницаемы, в результате чеrо выше скорость
ее растворения (87,5%, в допредельной области и 85,5%
в запредельной) и больше отношение Сп : С OJ (8,28 про
тив теоретическоrо 8.45, т. е. меньше Bcero на 2 %) .
Образованием пленок на поверхности блаrородных
металлов при их растворении в цианистых растворах MO
жно объяснить так называемую «утомляемость» циани
стых растворов уменьшение скорости растворения Me
таллов при ПОВЫШеНИИ содержания комплексов тяжелых
металлов в рабочих цианистых растворах.
Представляет интерес подсчет соотношения между KO
личествами ч-ианида 11 кислорода. вступающими в реак-
цию с металлом, т. е. полноту использования окислитель
ной способности ,кислорода. Большинство исследователей,
изучавших этот вопрос, нашло предельные концентрации
цианида выше наших; на приводимых ими rрафиках за-
висимости скорости растворения от концентрации циани-
да обычно нет Toro четн:оrо излома кривоЙ, который по
зволяет надежно определить истинную величину пре-
дельной концентрации цианида. Причина этоrо в том,
что исследования проводились на неравнодоступной по-
ьерхности, на котороЙ толщина образующейся пленки
бы.'Iа неодинакова в разных местах.
При растворении ЗОЛОТа в диффузионной области
Сп===6,4.10 З мо.'Iь/л, а Сп: C02 5,0. Тоrда стехнометри
( DJ<CN . ) 2/3
ческое отношение т == 5,0 v;;: ;::::: 5.0.0,946 == 4,73.
Следовательно, молекула кислород.а принимает 2,37 эле-
ктрона вместо 4 ОН лишь частично восстанавливается
до иона rид.роксила, а большая часть перекиси водорода
остается неIlспользованнои. ИНЫ1\1И словами, paCTBope
54
ние золота в uнаНИСТОJ\1 растворе протеI(ает corJIaCHo
только первой стадии уравнения Бодлендера:
2Au+4CN +О2+2Н20=::: 2Au(CN)7 +20H +Н 2 О 2 ,
что соrласуется с опытами Андреева. В кинетическоЙ об
ласти использование окислительных своЙств значительно
меньше (0,3 электрона на молекулу при 1100 оборотах
диска в минуту).
2.0
.::s 1,6
1 о ,
"" 2010 1,2
<::.
\ 2 0,8
;. /0'10
[ 0.4
I..J 3
2 3 О
8реня, ч
Pl\c. 12. I\ннеТИК<l росТа плеНI\И
AgCN на ссребре при 250 С, 1 аТ.
БОа об/мин в КОIIЦСlIтрациях ЦII<lIшда
2,5'lo :J (1), 4,8. ]o 3 (2) И 12,7><
X10 3 (3) МОJ1Ь/Л
Рис. 13. 3аВIIСИМО ТЬ содсржания
циаlIид иона в ПОВСРХIIOСТIIОЙ Плен
кс от СКОрОСТII r ращеНIIЯ диска при
250 С, 1 аТ и КОНЦСНТ(1ациях ЮlаllИ
.1а 2,1 '10 3 (1) н 12,0' IO (21
lо.1Ь/Л
Влияние пленок промежуточных продуктов при pa
створен ии блаrородных металлов дополнительно изучали
по сходноЙ методике (отличие разъеl\.IНЫЙ дискодсржа-
тель, позволяющиЙ извлекать металлический диск) с ис
пользованием цианида калия, меЧСНlIоrо 14С. JV\етод pa
ДИоактивных индикаторов позволИл установить зависи-
мость толщины и скорости роста lIленки от концентрации
цианида, интенсивности перемешивания и температуры.
Так, например, толщина пленки на серебре (рис. 12) мо-
Жет достиrать 100 монослоев и с повышением концентра-
ции цианида в растворе становится тоньше (до 4 MOHO
слоев). Пленка растет постепенно, достиrая постоянноЙ
Толщины через 1 3 ч.
Влияние интенсивности l1еремешивания зависит от
концентрации цнанида (рис. 13). В допредельноЙ области
повышение интенсивности I1сремешивания сопровождает.
ся утолщением Ilленки от 20 ДО 70 1\10НОСЛОСВ, тоrда как в
55
запредельной области, при избытке цианида, эффект об-
ратныЙ: рост числа оборотов ведет к уменьшению толщи
ны пленки, и при 1180 об/1\I ин она ПО.iIНОСТЬЮ растворяет-
ся. Это объясняется тем, что в допредельной области
с увеЛllчением ИIIтенсивности перемешивания увеличива
ется абсолютныЙ избыток кислорода и п.rIенка становится
толще, тоrда как в запредельноЙ области с увеличением
числа оборотов диска увеЛИЧIIвается абсолютныЙ избы.
ток цианида, что и приводит К уменьшению толщины
пленки вплоть до полноrо ее удаления.
С повышением температуры уменьшается толщина
пленки на серебре при любой концентрации цианида.
Очевидно, с повышением температуры увеличивается от-
ношение концентрациЙ ЦI!анида и кислорода в потоке,
так как одновременно с увеличением коэффициента диф
фузии кислорода снижается ero растворимость. Так, при
повышении температуры от 25 до 350 С отношение кон-
центраций равно 1,11, в результате чеrо пленки становят-
ся тоньше.
В отличие от IIленок на серебре толщина цианидноЙ
пленки На меди с П08ышение!\] концентрации цианида
вначале увеличивается. а затем уменьшается. Кроме то-
ro, цианидные пленки на меди, как показали электроно-
rрафические и микроскопические исследования, имеют не
сплошной, а локальныЙ характер. Они рыхлы, хорошо
проницаемы и. не вызывают серьезных диффузионных за-
труднений. Это обеспечивает большую скорость протека-
ния анодной стадии процесса растворения. Об этом же
свидетельствует и тот фа т, что экспериментальная вели-
чина константы скорости растворения меди значительно
ближе к теоретической (87,5 %), чем скорость растворе-
ния серебра (57,5%).
Повышение температуры приводит к уменьшениlO тол-
щины цианидноЙ пленки на меди по той же причине, что
на серебре.
Характер поверхностных пленок на золоте оказался
более сложным, чем на серебре и меди. Исследования, вы-
полненные в том же объеме и по той же методике, пока-
зали, что на поверхности золота в ходе растворения за-
крепляются очень малые количества цианида. КакоЙ-ли-
бо зависимости толщины цианидноЙ пленки от основных
факторов скорости вращения диска, концентрации ци-
анида и теl\lпературы не обнаружено.
Пленки на меди, золоте и серебре были исследованы
G6
метода ми электроноrрафическоrо (поверхностные слои
о
до 1 ОООА) и рентrенофазовоrо (r лубинные слои) анализа.
При избытке ЮIслорода на меди образуются толстые,
рыхлые пленки темно коричневоrо цвета. Электронно
микроскопически в них обнаружены простоЙ цианид и
окись, рентrеновским анализом закись (очевидно, в
слоях, прилеrающих к металлу). Пленки на серебре co
держат простой цианид, окись и rидроокись, на З0лоте
только окись. При повышении концентрации цианида на
меди и серебре остается только простоЙ цианид.
Полученные результаты позволяют существенно уточ
ни механизм растворения меди, золота и серебра в ци
aH TЫX растворах в присутствии кислорода. Рассмотрим
этот механизм в применении к наиболее простому слу
чаю растворению серебра. Используя зависимость тол
щины пленки от отношения [KCN]/[02] в растворе, мож
но установить, что она максимальна, коrда это отноше
ние равно 2. Это позволяет уточнить первую стадию cxe
мы Бодлендера, поскольку она не может объяснить обра
зования простоrо цианидCl. на поверхности растворяемоrо
металла:
2Ag + 02 + Н 2 О:::::: Ag'l,O + Н 2 О 2 (а)
Ag 2 0 + 2CN -t Н 2 О :::::: 2AgCN + 20H (б)
2Ag + 02+2CN.... +2H20==2AgCN+H202+20H (В)
2AgCN + 2CN === 2Ag(CN)2" (r)
2Ag+Oz+4CN +2H 2 0::::::2Ag(CN)2" +Н 2 О+ 20H (д)
Как следует из приведенных уравнений, первая ста-
дия схемы Бодлендера должна включать промежуточное
образование окиси и простоrо цианида серебра.
На основании полученных данных можно также пред-
Ложить механизм окисления серебра кислородом в циа-
Нистых растворах:
02 ОН 2 02 Н ОН
2Ag+0 2 +H 2 0 == A A [1g gl : AgOH + H 2 0z.
57
Соrласно этоii схеме, пеРВЬ!I\) продуктом окисления
серебра является ero окись ИЛИ rидроокись (а), которая
в цианистых растворах превраtЦается в простоп цианид
(б). Сумма реакций (а) и (б) дает (в), для которой xa
рактерна молярное отношение цианида и кислорода, paB
ное 2. Простой цианид серебра, реаrируя с цианид-ио
нам (r), дает комплексный ион Ag(CN)z' а окончатель
ное уравнение (д) пыражает первую стадию реакции
Бодлендера.
В отличие o серебра поверхность золота покрыта
только пленкой АU20з, которая взаимодействует с uиа
нид ионом медленнее, чем простой циан ид золота. По
этому механизм цианирования золота несколько отличен
от механизма растворения серебра.
Поляроrрафическое исследование IlрО
цесса растворения золота
ОсобеННОСТlI поведения золота в цианистых растпорах
по сравнению с поведением меди и серебра выявлены и
при снятии поляризационных кривых на враtЦаЮtЦеыся
дисковом золотом электроде. Прибор был аналоrичен
описанному, вспомоrательным электродом служила пла
тинированная платина, измерение потенциалов было
проведено с насыщ нным каломельным полуэле\lентом.
Число оборотов исследуемоrо электрода было постоян
ным во всех опытах и равным 885 об/мин, что обеспечи
вала протекание процесса в кинетическом режиме, РО2 ===
==0,21 ат; t==25° С. Результаты опытов прнведены на
рис. 14.
Так как содержание кислорода в растворе постоян
но (2,45ХI0 4 моль/л), то катодные кривые стремятся к
предельному значению плотности тока, равному
6,O.10 4 А/см 2 . Величина стационарной плотности тока,
характеризующая скорость растворения в исследуемом
интервале концентраций цианида постоянна и равна
2,1 .1 O 4 А/см 2 , Т. е. процесс растворения золота в цианис
тых растворах протекает с химической поляризацией и не
имеет диффузионноrо контроля по кислороду. Если бы
кинетические осложнения отсутствовали, то при KOHцeH
трациях цианида выше предельных скорость процесса
должна была бы определяться диффузией кислорода.
Исходя из представлений, принятых при составлении
Н:ОРРОЗИОННЫХ диаrрамм, получается, что аНQдные ПО.1JЯ-
58
ризащюнные кривые пересекаются с катодными в обла-
сти потенциалов, при которых плотность катодноrо тока
не достиrает предельноrо значения. Для выяснения сте-
пени торможения электродных реаКЦIIЙ следует сопоста-
вить значения paBHoBecHoro и стационарноrо потенциа
лов золота в цианистых растворах. При молярной KOH
центрации цианида 2,1.IО З (рис. 11, кривая 1) стацио-
нарный потенциал равен o, 157 В по водородной шкале,
а стандартный O,543 В и, следовательно, разность их
достаточно велика (учет концентраций цианида и золо-
Toro комплекса мало изменяет значение стандартноrо
pa\8HoBecHoro потенциала). Соrласно электрохимическо
тефрии растворения металлов, это показывает, что в yc
ловиях самопроизвольноrо растворения золuта процесс
ero ионизации протекает за медленно, подобно процессу
восстановления кислорода.
Рассматривая кривые на рис. 14, можно далее отме-
тить, что с изменением концентрации цианида в растnоре
стационарныЙ ток изменяется незначительно. Это xopo
1,1(
I
1,0
0,8
..:}. о.в
I 2
0,4
0,2
О 0,5 O 1.5 2,5 3,0 . ,5
P IC. l-t По.1ЯРНЗ<lЦI>ОIIIII.IL' Kl'IIBJ,'t' раСТВО[1СIJJlЯ ЗОЛОТil IJрll Р3J.1I1ч[юr"1
I\tJIJЦL'JJТj>:1ЦIIII ЦIJQIJII. iI. 10.1!)'.1' I' .::?l: 2 5,j; З I4,'I'IU 3
59
шо соrласуется с тем, что в области концентраций циа \
нида выше предельных скорость растворения золота
практически постоянна. При п == 18,3 об/с она равна 2,09Х
Х 1 0 9 [ aTOM/ (см 2 . с).
Этой скорости растворения, определенной химическим
анализом растворов, соответствует плотность тока caMO
растворения, равная 2,02. 1 0 4 А/см 2 , которая хорошо со-
rласуется с величиной, полученной из поляризационных
кривых. С ростом концентрации цианида в растворе на.
блюдается смещение стационарноrо потенциала в отри
цательную сторону и некоторое уменьшение анодной по-
ляризации (анодные кривые смещаются на 0,25 В в об
ласть более отрицательных потенциалов, а равновесныЙ
потенциал вследствие повышения концентрации ЦИClни-
да только на 0,11 В). Наряду с этим растет перена-
пряжение катодноrо процесса.
Зная из опыта величину предельноrо тока по кислоро-
ду и используя уравнение для дисковоrо электрода, мож-
но определить среднее количество электронов, принима.
емых молекулой кислорода при ее восстановлении. Зна.
чение коэффициента диффузии кислорода принято 2,ОХ
Х 1 0 5 см 2 /с, ero молярная концентрация 2,51. 1 0 4, вяз
кость раствора 8,93 .10 3 см 2 /с п== 14,75 об/с, предельная
плотность тока 6,0.1 Or 4 А/см 2 .
Проведенный расчет показывает, что при растворении
золота в цианистых растворах на одну молекулу кисло
рода приходится 2,58 электрона (в одной из предыдущих
работ найдено 2,37 электрона). Следовательно, основное
количество кислорода восстанавливается до перекиси во.
дорода и лишь часть последней до rидроксила, что
соrласуется с работами Бодлендера и Андреева.
Неполное использование окислительных свойств кис
лорода при цианировании золота отмечено и на с. 54, но
методика расчета при этом была иной, а lIолученный ре-
зультат справедлив для эквивалентной точки, в которой
концентрация цианида предельна и процесс протекает в
основном соrласно уравнению (8) (см. с. 41). Было изу
чено влияние перекиси водорода на скорость электрод-
ных реакций, протекающих на поверхности растворяемо-
[о металла.
Поляризационные кривые этой серии опытов показа-
ли, что добавка перекиси водорода не сказывается на
значении стационарноrо потенциала, но резко увеличи-
вает катодную и анодную поляризации. При этом на 110-
60
верхности золота образуются видимые невооруженным
rлазом бурые пленки, что, по видимому, и является при
чиной повышения анодной поляризации.
Поскольку при одном из исследований мы наблюдали
пассивирование золота кислородом в растворах цианида,
следовало уточнить механизм ero действия на кинетику
процесса цианирования. С этой целью были сняты поля
ризационные кривые при давлении кислорода 0,21 и 1 ат,
анализ которых показал, что с ростом концентрации кис
лорода в растворе при прочих равных условиях значи
тельно снижается ток саморастворения и стационарный
потенциал смещается в область положительных значе
ний.
Таким образом, с увеличением концентрации кислоро-
да в растворе усиливается пассивирование поверхности
золота, следствием чеrо является сильное анодное тор-
можение процесса растворения. Однако при анализе
этих кривых нужно учитывать влияние обоих компонен
тов реакции цианида и кислорода на процесс пасси
J.шрования. Торможение растворения при смещении CTa
ционарноrо потенциала в положительную сторону в pac
творах с повышенной концентрацией кислорода и
ослабление пассивирующеrо действия кислорода при IIO
вышении концентрации цианида можно, вероятно, объяс
нить исходя из представления о промежуточном адсорб
ционном характере взаимодействия кислорода и циани-
да с поверхностью золота.
Поскольку ион цианида обладает поверхностно aK
тивными свойствами, при повышении ero концентрации
в растворе часть адсорбированноrо кислорода будет BЫ
теснена с поверхности металла и степень пассивирования
снизится; повышение же концентрации кислорода вызо-
вет обратный эффект поверхность металла будет пас
сивирована сильнее.
Избежать пассивирования поверхности золота и пере.
хода процесса ero растворения в цианистых растворах
из диффузионноrо режима в кинетический можно, при.
менив друrие, кроме кислорода, окислители. Было иссле.
довано окислительное действие феррицианида калия
поставлена серия опытов на обескислороженном paCTBO
ре при переменном числе оборотов диска (рис. 15). Как
следует из полученных данных, процесс растворения зо
лота в цианистом растворе с окислителем феррициани
дом протекает только в диффузионном режиме, тоrда
61
как при деполяризации кислородом переход в кинетичес
киЙ режим наблюдается уже при 2,5 об/с. Хотя CKOpOCtb
растворения при малой интенсивности перемешиванияlс
феррицианидом и меньше, чем С кислородом, с повыше
2
f
Рис. 15. Зависимость приведеиноi\ ско-
рОСТИ растворения золота (и/С) в рас-
творе циаиида калия от ЧИсЛа оборо-
тов диска в ЛРНСУТСТВИII окислителеЙ:
1 КИс.'Тород; 2 воздух; 3 ферри-
ЦИ<lИИД каЛIIЯ
,...
4 vli
нием интенсивности перемешивания она увеличивается
пропорционально числу оборотов в степени 0,5.
Следовательно, при растворении золота в цианистых
растворах самой медленноЙ стадией процесса, определя-
ющий ero скорость, является не катодное восстановление
кислорода, а анодное окисление металла.
П алладuй
Кинетика растворения палладия в цианистых pacrBO'
рах имеет ряд особе ностеЙ. Так, например, в отличие 01
процессов растворения золота, серебра и меди в процессе
растворения палладия более сложным является влияние
концентрации цианида. Это обусловлено своеобразием
химизма процесса и особыми свойствами пленок на по-
верхности металла.
Скорость растворения палладия изучена в широком
диапазоне концентрации цианида калия в зависимости
от температуры, давления кислорода и числа оборотов
диска.
Результаты серий опытов при разных температурах
для малоrо и большоrо числа оборотов диска приведены
на рис. 16. Кривые на рис. 16 имеют одинаковый харак-
тер: сначала скорость растворения с повышением концен-
трации циан ида в растворе увеличивается нелинейно. а
затем становится постоянной. Это дел ает кривые v:=:: f (С)
похожими на те, которые были получены при изучении
кинетики растворения меди, серебра и золота в циal-{и-
стых растворах. Однако концентраЦJШ uианида, при ко-
G2
торых скорость растворения 1\'1 аl\СIIМ альн а, ПРИi\Iерно на
порядок выше, чем при растворении золота и серебра, и
ув 'личение скорости растворения на первом этапе про
'i:i 24
16
<::)
I
'IJ
с:.,
8
О 8 15 24 32
(I<СN},NОJ1Ь/Л
Рис. l(j. ЗаВIIСИМОСТЬ скорости раСТВорен/и
палладия от концентрации цианида при
температуре. ос: 35 (1 и 1'), 45 (2 и 2') 11
55 (3 и 3'). ЧНСЛО оБОIЮТОВ диска В МИ IУ'
ту 67 (1, 2, 3) н 1000 (1', 2', 3'). POz 1 аТ
цесса пропорционально ero концентрации в степени, боль-
шем единицы.
Анализ кривых v=== f ( С) в допредельноЙ области при
скорости вращения диска 1 ooo 1 О 14 об/мин показал,
что их можно удовлетворительно описать кинетическими
уравнениями:
v === 1,76. IO 7 . c J ,63; v === 1,О3.10 6.с!.БS И
V == 2,51.10 б. с l.бS
соответственно для 35; 45; 550 С.
Показатель степени в этих уравнениях справедлив в
области средних концентрациЙ, но с понижением KOHцeH
трации цианида в растворе он уменьшается. Порядок ре-
акции по цианиду больше первоrо свидетельствует о на-
личии нескольких этапов процесса.
Для расчета теоретической скорости растворения
двухвалентноrо металла в цианистых растворах в допре-
дельной области предположим, что осложнения, ВblЗbIва-
емые образованием пленок на поверхности металла, от-
сутствуют. Для расчета используем величину константы
63
скорости при 250 С, равную 0,59. 1 O 6 л/ (см 2 . с) I И энер-
rию активации 3,73 ккал/моль. При 6,67 об/с 1I0ЛУЧИrv.
приведенные скорости растворения, т. е. отношения v/t
.для 35; 45 и 550 С соответственно равными; 2,93; 3,60 и
4,30. 1 O 6 л/см 2 . с.
При сравнении экспериментальных величин с Teope
тическими следует учесть, что экспериментальные ОПIO
шения и/с увеличиваются с повышением концентрации
цианида в растворе, поскольку кривая и == f (С) обращена
выпуклостью к оси абсцисс. ]v\аксимальные значения
и/С можно вычислить, проведя касательную J{ кривоЙ в
точке, соответствующей предельной концентрации циани
да. Найденные таким образом величины для 35; 45 и
55 0 С равны 1,3; 4,0 и 6,9.10 7 л/(см. 2 с), т. е. составляют
4,4; 11,1 и 16,0% от теоретических 2 .
Следовательно, с повышением концентрации цианида
и температуры скорость растворения палладия стре ит-
ся к величине, характерной для диФфузионноrо режима
растворения, и при 550 С является уже количественно
сравнимой со скоростью растворения серебра и меди в
цианистых растворах. В то же время в области MaollbIx
концентраций цианида и особенн6 при низких темпера-
турах кинетические осложнения выражены значительно
сильнее, так как скорость растворения зависит от кон-
центрации цианида в степени, большей единицы. По то-
му теоретически рассчитанная и экспериментальная ско-
рости для диФФузионноrо режима отличаются одна от
друrой уже более чем на порядок.
Однако резкоrо изменения характера процесса нет,
поскольку и приведенная скорость растворения, и поря-
док реакции изменяются плавно. Изучаемый процесс
нельзя считать и протекающим по закономерностям сме-
шанноЙ кинетики потому, что в допредельной области по
цианиду скорость растворения не зависит от интенсивно-
сти перемешивания. Поэтому можно предположить, что
основная причина кинетических затруднений связана с
образованием и ростом окисной пленки на поверхности
палладия.
Рассмотрим запредельную область по цианиду. Мак-
J При всех расчетах использована уrловая скорость вращения,
ВbIраженная в оборотах в секунду.
2 Без учета изменения I{оэффициента диффузии и вязкости В креп-
I\ИХ растворах; если их учесть, то совпадение с теоретичеСКИМII вели-
чинами будет несколько лучшее.
64
симальной скорости растворения соответствует концен-
трация циаIIида, которую только условно можно назвать
предельной, поскольку она не имеет Toro четкоrо физиче-
cKoro смысла, как ври растворении золота и серебра в
цианистых растворах, и не характеризует стехиометри-
ческие коэффициенты протекающей реакции, однако поз-
воляет сделать некоторые ДОIIолнительные выводы о ха-
рактере изучаеl\ЛОI'О процесса. Поскольку предельные
концентрации при растворении палладия очень велики
(0,294; 0,108 и 0,063 моль/л при 35, 45 и 550 С и числе
оборотов диска 1000 1014 в минуту), то велико и отно-
шение Сп: С 02 . Если при растворении серебра в диффу
зионном режиме это отношение стремится к восьми, то
при растворении палладия оно уменьшается с повышени-
еМ температуры и уменьшением интенсивности переме-
шивания от 294 (350 С и 16,91 об/м) до 13,9 (550 С и
1,11 об/с).
В допредельной области скорость раствор ния при
низких концентрациях цианида практически не зависит
от интенсивности перемешивания, а в области более вы-
соких концентраций увеличение числа оборотов диска
даже вызывает снижение скорости растворения (избы-
ток кислорода). В области же заlIредельных KOHцeHTpa
ций цианида повышение максимальной скорости расТIЮ-
рения примерно пропорционально увеличению числа обо-
ротов диска в степени 0,5 (отношение максимальных ско-
ростей в среднем ра вно 5,5, а отношение чисел оборотов
3,87) .
Для области запредельных концентрациЙ цианида по
данным рис. 12 составлены уравнения Аррениуса:
1 v 10 1 G v 975
g === 2,080 и 19 =o: 1462
с т с ' т
для 1,11 и 16,67 об/с соответственно.
Экспериментальная энерrия активации составляет
4,65 ккал/моль, что несколько больше, чем при растворе-
нин меди, сС'ребра и золота в диффузионном режиме.
В допределыюIr же области, в интервале концентраций,
для которых справедливы уравнения скорости растворе-
IIIIЯ, приведенные на стр. 63, энерrIIЯ активации значи
тельно выше: в интервале температур от 35 до 45:'1 С она
равна ПрЮ\olерно 35 КI(ал/моль и интервале 45 550 С
(с лучшей воспроизводимостью) 18,6 ккал/моль. CTO.ТIЬ
5 ЗО6
65
резкое изменение величины энерrии активации с темпе
ратурой указывает на сложность изучаемоrо \ процесса.
Сравним экспериментальные значения скор6стей pac
творения с рассчитанными теоретически для запредель-
ной области, контролируемоЙ кислородом. Для этоrо рас-
считаем плотность потока кислорода (на 1 см 2 поверхно-
сти диска) при 16,67 об/с и 250 С (поскольку величины,
необходимые для расчета, известны пока только для
этой температуры l ):
2/3 .
1 . == 6 18. 1 O ( 2л ) I/2 S п 1/2:==:
, 1/6 O
'v
== 1 549.10 3 (2,0.10 5)2/3 .1 195.10 3.4 09::::::
, (0,008975)1/6' ,
=== 1,23. 1 0 8 моль/(см 2 . с).
Если принять, что деполяризатором при растворении
палладия является только кислород2, потребляющий че-
тыре электрона на молекулу, и что палладий отдает два
электрона, то максимальная скорость растворения пал
ладия должна быть равна удвоенному потоку кислорода,
т. е. 2,46. 1 0 8 r-атом/см 2 . с. Из уравнения Аррениуса IJа
ходим для 250 с:
vjC== 1,85. ]O 5; и== 1,85.105 .1,195. ]0 3==2,30.10 8
r aToM/ (см 2 . с). Совпадение опытной величины с расчст
ной очень хорошее (93,5 % ) .
При м алой интенсивности перемешивания (1,1 t 06/с)
расчетная скорость растворения при 250 С равна 6,35.
. ] 0 9 r aTOMjCM2. с, а величина, вычисленная из уравнения
Аррениуса, 3,24.10 БХl,195.10 3==3.88.10 9 [ aTOM/(CM2.
. с), что составляет 60% от теоретической. Поэтому OTHO
шение максимальных скоростей растворения не совпада-
ет с отношением чисел оборотов диска в степени 0,5, xo
тя и В этом случае снижение скорости растворения не
больше, чем, например, при растворении серебра в циа
нистых растворах типичном диФФузионноы процессе.
I Растворимость кислорода 1,195.10 3 моль/л принята для сред-
неrодовоrо атмосферноrо давлеНIIЯ в Свердловске, paBHoro 720
740 мм рт. ст.
2 СпециальноЙ сериеЙ опытов в обескислороженном растворе по-
казана, что палладиЙ при отсутствии кислорода не реаrирует с циз
IIИДОМ.
56
ПроведенныЙ анализ экспериментальных данных поз-
воляет несколько более подробно охарактеризовать про
цесс растворения палладия в цианистых растворах. В за-
предельной по цианиду области процесс протекает по чи
сто диффузионному механизму, на что указывают:
совпадение экспериментальной скорости растворения с
рассчитанной теоретичеСКII, невысокое значение энерrии
активации, зависимость максимальной скорости раство-
рения от интенсивности перемешивания раствора. OДHa
ко, как и при растворении ыеди, серебра и золота в ци-
анистых растворах, некоторое осложнение вносит обра-
зование окисных пленок на поверхности растворяемоrо
металла. Этим, в частности, можно объяснить то, что при
небо.пьшой интенсивности перемешивания максимальная
скорость растворения несколько меньше теоретической.
Видимо, в этом случае сказывается более низкая кон-
центрация цианида в растворе или более плотное CTpoe
ние окисной пленки.
Более сложно протекает процесс в допредельноЙ по
цианиду области. Большое значение энерrии активации,
независимость скорости растворения от перемешивания
свидетельствуют о том, что процесс протекает в кинети-
ческой области. При изучении кинетики растворения зо-
лота в цианистых растворах было наЙдено, что даже в
кинетической области скорость растворения зависит от
концентрации цианида пропорциональна первой степе-
ни ero концентрации. Это было объяснено образованием
окисных пленок на поверхности золота. Еще сильнее
сказывается образова,чие таких пленок на поверхности
растворяемоrо палладия, которые не только затрудняют
диффузию peareHToB к поверхности металла, но и реаrи
руют с цианидом с большими кинетическими затрудне-
НИЯМи.
По мере повышения концентрации цианида в растворе
не только увеЛIlчивается скорость растворения плен-
ки, но и снижается создаваемое ею дополнительное
диффузионное сопротивление. Поэтому скорость раство-
рения пропорциональна концентрации uианида в степени
больше единицы.
Этим же можно объяснить и то, что скорости раство-
рения палладия при небольшой интенсивности перемеши-
вания значительно выше, чем прп большой (Сl\1. рис. 16).
Скорости растворения в области низких концентраций
цианида практически не зависят от интенсивности пере-
5*
67
мешивания, но в области средних концентраций они вы-
ше при малом числе оборотов, чем при большом.
Однако это явление нельзя объяснить переходом про
цесса растворения из диффузионной области в кинетиче-
скую, как при растворении золота, а следует связывать
с относительным преобладанием процессов пассивирова-
ния, с образованием и растворением окисных пленок
на поверхности металла.
Таким образом, растворение палладия в цианистых
растворах имеет MHoro общеrо с растворением друrих
блаrородных металлов. В этом процессе также можно
выделить две области: контролируемую кислородом и
контролируемую цианидом. Однако имеются и сущест-
венные различия: растворение в области, контролируе
моЙ IШСЛОрОДОl\I, МОЛШО осуществить только при очень
высоких концентрациях цианида, причем ero концентра-
ция должна быть тем выше, чем интенсивнее перемеши
вание раствора. В области же, контролируемоЙ циани
дом, процесс протекает в кинетическом режиме, что при
раСТIзорении друrих блаrородных металлов наблюдается
только для золота при интенсивном перемешивании рас-
твора. Причиной этих различий является наличис плот-
ной, реаrирующей с циаНIlДОМ окисной пленки, обра-
зующейся на поверхности металлическоrо паллаДIlЯ при
взаимодействии ero с кислородом.
Влияние пленок TaKoro типа на скорость растворения
блаrородных металлов отмеча.тюсь ранее, и было выска-
зано предположение о наличии особоrо класса реакциЙ,
для которых промежуточным звеном является образова-
ние и paCTBopeHlIe OlOlCHbIX плевок на поверхности
металла. Эти пленки создают cBoero рода псевдокинети-
ческий режим, прн котором скорость растворения мета.П-
ла зависит от конuеIlтраШIII OCIIOBlIOro pearchta-раство-
рителя.
В области, контролируемоЙ IщаНИДОl\I, заВИСИl\IOСТЬ
скорости растворения от основных переменных факторов
очень сложна и пок2. ещс недостаточно изучена. Поэтоr-.1У
дать необходимые расчетные уравнения, кроме частных
эмпирических зависимостеЙ скорости растворения, при-
веденных выше, нельзя.
Для области, контролируемоЙ кислородом при доста.
точной интенсивности переl\1ешивания (коrда влияние
пленок сведено к минимуму), можно использовать урав-
нение (4). При 250 С k' == 4,54. 1 O 6 .'1/ (см 2 . С 1/2. об 1 / 2 ), а для
68
друrих температур ее можно наЙТlI IIЗ уравнеНIIЯ Appe
ниуса
19 k' === 2,073 975 .
Т
Проведенное исследование позволяет сделать заклю,
чение о стехиометрии суммарной реакции и полноте ис.
пользования окислительных свойств кислорода.
2Pd + 8CN + 02 + 2Н 2 О == 2Pd(CN) + 40H .
Молекула Кllслорода присоединяет четыре электро-
на, а не два, как при раствореНИII золота в J(инетиче
ском режиме, что подтверждает высказанное положе
ние об отсутствии кинетнчеСКIIХ осложнениЙ в электро
химической стадин процесса.
Однако это положение, как и косвенные подтверж.
дения об образовании на поверхности растворяемоrо
палладия пассивирующих пленок или слоев, требовали
проверки. Для этоrо были сняты кривые анодной и ка-
тодной поляризации в цианистых растворах при различ
ных температурах, концентрациях цнанида в растворе,
интенсивностях перемеШIlвания раствора и давлениях
кислорода над раствором.
Опыты показали (рис. 17), что стационарные потен
циалы электрода (отрезки прямых, параллельных оси
абсцисс) значительно положительнее равновесных (стан-
дартныЙ потенциал палладия в ЦlIанистом растворе
О,71В) и сдвиrаются в отрицательную сторону при по
вышепии концентрации Цllанида. Это СВlIдетельствует
о том, что электрод паССIlвируется кислородом, особен
но в слабых цианистых растворах, в крепких же он ме*
нее пассивен, что 11 ВЫЗblвает смещение ero потенциала
в отрицательную сторону.
При анодноЙ поляризации до HeKoTopoi', КРИТllческоЙ
ПЛОТНОСТ/I тока палл аДl1евый электрод поляризуется
сравнительно мало, смещеllие потенциала относительно
стационарноrо не превышает 0,1 В. Видимо, степень пас-
сивации палладия, уже пассивированноrо кислородом,
при наложении анодноrо тока сначала возрастает не-
значительно, как и в процессе анодной поляризации
железа. Однако после превышения критическоЙ плот-
ности тока потенциал резко смещается в положитель
ную сторону, причем плотность тока, соответствующая
скачку потеНЦl1ала, тем больше, чем выше концентраlllIЯ
6.9
цианида в растворе. Видимо, при этом резко возрастает
толщина и плотность пассивирующей пленки, площадь
пор значительно уменьшается и в порах пленки увели-
чивается перенапряжение анодноrо процесса ионизации
палладия.
B
о
-1,0
. 5
0,5
1,0
1
2
l,gi +5, lI/cl'1 z
3
Рис. 17. ЗаВIIСИМОСТЬ потенциала палладисвоrо 3Jlектрода (.т
плотности тока при 35" С, 1016 об/мин, 1 ат и концентрациях
цианида, моль/л: 2,41.10 2 (1), 4,72. 10 2 (2), 9,45 'IO 2 (3),
18,8 . 10 2 (4), 25,2'10 2 (5) и 37,3 . lo 2 (6)
При дальнейшем повышении плотности тока начи
нает оказывать сильное влияние концентрационная по-
ляризация, и потенциал резко смещается в отрицатель-
ную область. На катодной кривой обнаружена только
волна, соответствующая восстановлению кислорода до
rидроксила, переходящая в водородную волну. Переrиб
кривой, соответствующиЙ предельному току диффузии
кислорода, происходнт при ПЛОТIIOСТ/I тока ПОРЯДI{а
5,2. 1 O 3 A,ICM 2 .
70
Для сравнения этоЙ величины с теоретической cдe
лаем расчет, используя необходимые данные из работ
(температура 250 С):
. 6, 18.10 4 D 2 / 3 (2л)1/2 1/2
l ==-= S (U . zF ==
о:. '\11/6 Ot
6,18.1O 4(2,0.10 5)2/3(2л)1/2 1,195.10 3(16,9)1/2 Х
(8, 93.10 3)1/6
Х 96487.4 == 4,74.10 3 А/см 2 .
Совпадение расчетной величины с опытной вполне
удовлетворительное. При 350 С получается почти такая
же величина, так как увеличение коэффициента диффу
зии компенсируется снижением растворимости кисло
рода.
Кривые концентрационной поляризации несколько
менее круты, чем следовало бы ожидать при предель
ном токе диффузии кислорода. Видимо, пленки служат
дополнительным сопротивлением при диффузии кисло
рода. Влияние этих пленок проявляется при плотностях
тока, меньших, чем предельные: в порах пленки возни
кает значительный перепад концентрации кислорода,
и потенциал смещается в отрицательную сторону. При
дальнейшем повышении плотности тока потенциал элек
трода становится все более отрицательным и поверх.
ность электрода постепенно освобождается от пленок.
Этот процесс заканчивается при потенциалах порядка
O,8 O,9 В.
Пассивирование и депассивирование палладия силь
но зависят от температуры, давления кислорода над
раствором и интенсивности перемешивания.
К сожалению, поляризационные опыты не поз оли-
ли количественно подсчитать скорости саморастворения
палладия путем нахождения точки пересечения катод.
ных и анодных кривых, так как начальные участки кри
вых нелинейны. Потенциал электрода с б6льшим при
ближением можно считать линейной функцией плотно
СТН тока, а не лоrарифма плотности. Зависимость TaKoro
вида наряду со сравнительно небольшим сдвиrом потен
циалов относительно стандартных показывает, что при
исследованных плотностях внешнеrо анодноrо тока с за
метной скоростью протекает JI саморастворение палла-
71
дия, т. е. paCTBopCHlle с кислородноi'l деполяризацией.
Прll дальнеЙшс1\t ПОВblшеlIIlIl ПЛОТНОСПI аНОДIlоrо тока
наблюдается резкос, СI\<l.ЧI{ообразное изменение потен
циала. Начальные участки кривых (на rрафиках отдель
но не показаны) выrлядят бо.'1ее сложно на их ход
оказывает существснное влияние анодный процесс рас-
творения металла, а при BbICOКIIX ПЛОТIIОСТЯХ тока
ДИФФУЗllонные оrраничения.
Для проверки этих предположений был сделан aHa
лиз раствора после пропускания через Hero определен
Horo количества электричества. Плотность внешнеrо
анодноrо тока была ниже критической (8,75.10 4 А/см 2 );
скорость растворения по количеству палладия в раство-
ре ],7.]0 8 r ион/(см2.с). Выход по току в расчете на
Pd 2 + равен 370%, что свидетельствует о преобладании
проuесса самораСТБореНJlЯ.
Таким образом, IIсследование катодной и анодной
поляризации паЛJlадия в цианистых растворах позволи
ло получить хорошее качественное (а для предельноrо
тока диффузии и количественное) подтверждение пред
положений, высказанных при исследовании кинетики
этоrо процесса.
Ртуть
В практике обработки золотых руд при цианиро
вании хвостов амальrамации, при измельчении в циа
ЮIСТЫХ растворах приходится учитывать возможность
взаllмодействия ртути с ионаМI1 циаIJида. Переход PTY
ти в раствор нежелателен: при последующем осаждении
золота ЩIНКОМ она придает СТРУЖI{е хрупкость, повы-
шает расход цинка, попадает в золотоЙ шлам II вызы-
вает затруднения при ero переработке.
Скорость растворения РТУТJI в цианистых растворах
мало изучена, хотя она представляет 1I теоретический
интерес, поскольку ртуть ЖИДКИЙ металл без актив
ных центров на повеРХIIОСТН, с высоким перевапряже
нием разряда rазов на ней. Образующийся при paCTBO
рении ртути промежуточный продукт простой цианид
ртути хорошо растворим в воде и не должен осложнять.
процесс цианирования вслеДСТВIIе образования пленок,
как это наблюдается при растворении твердых металлов.
Кинетика раствореIIИЯ РТУТН I1зучена методом обрат
Horo диска (см. с. 22). Проведены три серии опытов.
В первой при 250 С, КОJlцентраЩ1lJ Цl1анпда 2,5.] 0 3
7'2
моль/л, давлении кислорода над раствором. 1 ат и ЧИС-
ле оборотов мешаЛКII в минуту о; 46; 63; 79; 149 по-
лучены скорости растворения 1,8; 5,3; 5,6; 5.3 и 5,4.
. 1 0 10 r-атом/см 2 . с). При 250 С, 6,6. 1 о з моль/ л Цllани-
да, 0,21 ат и 60; 106; 284; 640 об/мнн скорости paCTBO
рения равны 2,0; 2,1; 2,05 и 2,3. 1 0 10 r aTOM/CM2. с COOT
ветственно. По этим дан-
ным, скорость paCTBope
ния ртути не заВИС1lТ от
интенсивности переl\1еши
вания, что облеrчает про-
ведение исследования, по
скольку отпадает необхо
ДIIМОСТЬ моделировать
rllдродинамический pe
жим. Лишь при очень
высокой интенсивности
перемешивания поверх
ность металла начинает
!(олыхаться If CKOpOCT!J
растворения увеличивает
ся. При ОТСУТСТВIIИ пере-
мешивания скорость в ТрIl
раза ниже О,8. 1 0 10 B!\1e
сто 5,4. 1 0 10), НО УЛОВИТi)
переход процесса из диф
фузноrо режима в кинеПI
ческий не удалось.
В л и я н и е к о н Ц с н т р а ц 1111 Ц И а 1I и Д а и Д а B
ленин кислорода. Как ПОI\:азали опыты (рис. ]8),
кинетические кривые линейны, убыль цианида в про-
цессе опыта нсзначительна. Поэтому вычисление CKOpO
стей растворения, отнесенных к 1 см 2 поверхности рту-
ти, не представляет затруднений. Характер кривых та-
коЙ же, как 11 при раСТ80реНIIII блаrОрОЮ-IЫХ металлов.
Имеются две области: в одной скорость растворения
прямо пропорциональна концентрации цианида и не за-
висит от давления КIfслорода над раствором, в друrоЙ
скорость не зависит от концентрации цианида, но ее
максимальное значение прямо пропорционально давле-
нию Ю1слорода [(при давлении 0,21; 1 и 2 ат оно равно
0,22; 1,06 н 2,05.10 9 r aToM/(cM2.c)]. Предельная кон-
центрация ЦИ3ШIДа тоже IIрЯМО ПРОПОРЦlIональнз дав-
леJШЮ Кllслорода и IIpIl fJo t === 700 J\] м рт. СТ. равна 4,5.
2,0
r
""'
....; 1,5
<:::>
1.0
t'I> '
2
' I
od
0,005 0,010 0.015 0,020 QШS
[KCN], /10)/Ь/;1
::. 0,5
(.>/lC. 18. Зависимость скорости I)(IC
Т80реllИ я ртути от концснтрацни
цианида и давлення кислорода над
растворам. ат: J 0,21: 2 1,0:
3 2,0 [КОН] (о з; ' 250 С, п-<=
150 об/мнн
73
.10 3 моль/л, что соответствует 4,9.10 3 моль/л при
760 мм рт. ст.
В Л И Я Н И е Щ е л о ч н о с т и р а с т в о р а изучали
потому, что при исследовании кинетики растворения ce
ребра и золота было отмечено снижение скорости pac
творения при повышении щелочности растворов. Усло
вия проведения опытов: температура 250 С, n===
=== 150 об/мин, продувка раствора воздухом, KOHцeHTpa
ция цианида 2 .10 2 моль/л, концентрация щелочи пе
ременная.
UЦелочность раствора влияет на скорость paCTBope
ния ртути примерно так же, как и на скорость paCTBO
рения блаrородных металлов: при высокой щелочности
растворение ртути заметно замедляется, что свидетель
ствует не только о снижении окислительноrо потенциала
кислорода, но и об усилении кинетических осложнений
при восстановлении кислорода на поверхности ртути.
В л и я н и е пер е к и с и в о Д о р о Д а. Сравнитель
но небольшая величина предельной концентрации uиа
нида позволяет предположить, что окислительная спо-
собность кислорода используется не полностью и он
восстанавливается только до перекиси водорода. В раство-
рах после растворения ртути найдена примерно посто
янная концентрация H202 OT 3,5.10 6 до 4.10 6 моль/л,
независимо от продолжительности растворения (части'I
ное разложение), что составляет при коротком контакте
около 30 % от теоретической величины.
Были поставлены два опыта с добавкой Н 2 О 2 : в пер
вом начальная концентрация Н 2 О 2 была равна 7,8 .10 3
моль/л и через 22 ч ее оста.тIOСЬ 2,7 .10 3 моль/л; во вто-
ром соответственно 2,34 .10 2 моль1/л и через 48 ч
4,4. 1 0 3 моль/л. Значительно более высокие KOHцeHTpa
ции перекиси водорода в (276). 103 раз выше, чем
в рабочих растворах должны были бы сильно увели
чить скорость растворения ртути, однако этоrо не про
изошло: в первом опыте скорость растворения была
равна 3,0. 10 lo, во втором 6,7. 10 lo, тоrда как без дo
бавки перекиси она равнялась 2,4. 1 O IO r aTOM/CM2. с.
Некоторое повышение скорости растворения объясняет
ся интенсивным разложением перекиси с выделением
кислорода и пересыщением им рабочеrо раствора (пу
зырьки rаза были заметны).
Следовательно, предположение о неполном использо-
вании окислительных возможностей кислорода можно
74
считать доказанным, Надо отметить, что перекись водо-
рода при высоких ее концентрациях в растворе окисляет
цианид, с заметной скоростыо в первом опыте было
окислено 40 %, во втором 62%, но при низких KOHЦeHT
рациях ее окислительное действие незначительно.
В л и я н и е т е м пер а т у р ы р а с т в о р а. Было
поставлено MHoro опытов как в области допредельных
(2,5. 1 O 3 мольjл при продувке через раствор кислоро
да), так и в области запредельных (6,1.10 3 мольjл при
продувке воздуха) концентраций цианида в интервале
температур от 6 до 450 С (рис. 19).
Полученные резуль
таты несколько необыч-
ны. При температурах
ниже 250 С эксперимен
тальная величина энер
rии активации реакции
равна 7,85 ккалjмоль, а
выше 250 С скорость
растворения постоянна
и не зависит от темпе
ратуры как для допре
дельных, так и для за-
предельных KOHцeHTpa
ции цианида. Такая за
висимость скорости от
температуры была OT
мечена и друrими aB
торами. Она характерна для сложноrо процесса, коrда
с повышением температуры интенсифицируется процесс
пассивирования.
Из величины предельной концентрации циан ида при
250 С можно вычислить стехиометрическое соотношение
реаrирующих со ртутью веществ цианида и кислоро-
да (подробности расчета см. в работе [13, с. 170]):
8}0
3,20
8)40
8,50
8,60
8, 70
8,80 З, 10
3,30 3, 40
1000/Т
3,50
Рис. 19. Зависимость скорости растворе-
ния ртути от т['мпсратуры: 1 КОНЦСII-
:J
трация цианида 2,5.10 моль/л. nrю-
дувка:} в[)здухом; 2 то же, 6.1 Х
Х 10 мо.'Iь/л, продувка кислородом
с ( D ) 2/3 4 5 10 3
т== KCN KCN == '.. . 0,946 == 3,57.
С 02 D 02 1, 195. 1O 3
Полученное стехнометрическое отношение меньше
четырех, т. е. меньше величины, соответствующей вос-
становлению кислорода только до перекиси водорода.
То, что окислительная способность кислорода использу-
ется не полностью, соrласуется с данными опытов по
75
ВЛИЯНlIЮ переI<ИСИ водорода на скорость растворения
ртути, 110 значеllие т требует уточнения.
Ртуть дает с цианидом несколько соединений с близ
кима значениями констант ДIIссоциации, и можно пред
положить, что при ее растворении у поверхности метал
ла образуется не высший цианrIСТЫЙ комплекс, а низ.
ший пли даже простой цианид ртути. Для проверки
этоrо были поставлены опыты по растворению в циани-
стых растворах орrаничеСI<ИХ соединений ртути, взятых
в избытке. При растворении диэтилдитиофосфата ртути
(произведение активности 1,3. 1 0 32) соотношение KOH
центраций цианида и ртути в равновесном растворе рав.
но 2,07, а при растворенrш диБУТlIлдитиофосфата ртути
(при котором ПА значительно ниже, а именно 1,2.10 35)
оно равно 2,64. В первом опыте в растворе только
Hg(CN)2' а во втором смесь Hg(CN)2 и Нg(СN)з-.
При растворении металлической ртути в цианистых
растворах находятся оба комплекса, и уравнение peaK
ции можно записать так:
2Hg + 7CN + 202 + 4Н 2 О === Hg (CN)3" +
+ Hg (CN) .+ 2Н з 0 2 + 40H .
Оно справедливо для СООТIIошения стсхиометрических
коэффициентов, р aBHoro 3,5; но при друrих температу'
рах и давлениях кислорода может быть друrое соотно.
тенне цианистых комплексов, образующихся при рас-
творении ртути.
Для расчета скорости растворения ртути в циани-
стых растворах при 250 С можно рекомендовать уравне.
ние (5). В это ypaBHeHIIe для расчета в допредельной
по цианиду области подставляют концентрацию циани-
да в растворе и k==2,35.10 7 л/(см 2 .с), а в запредель.
ной концентр ациlO кислорода и k' == 0,9. 1 0 6 л/ (см 2 . с) .
в запредельной области можно применять и уравнение
Q == k" SP02 Т,
в котором Р О2 парщrальное давление кислорода над
раствором, а k" == 1,15. 1 0 9 r aToM/ (см 2 . с. ат) .
Для температур от О до 250 С значеШIЯ констант CKO
рости реакции МОЖНО вычислить, IIСПШ1ЬЗУЯ величину
76
энерrии активации 7,85 ккал/моль, одинаковую как для
дo , так и для запредельной области по цианиду:
т 298
Ig k == Ig k 298 +.5,75
т
Закономерности растворения ртути в цианистых pac
творах в lIекоторой части такие же, как и при paCTBO
рении золота в кинетическом режиме: наличие до- и эа
пределыIйй областей по цианиду, первый порядок
реакции по ЦIlаниду в допредельвой области, независн-
мость скорости от интенсивности перемешивания рас-
твора, неполнота IIспользования ОКИСЛIIТельных свойств
кислорода, снижеllие скорости растворения при повы
шении щелочности раствора. Но есть и отличия: зави
симость максимальной скорости растворения от давле-
ния кислорода в нервой степени, очень леrкий переход
из диФФузионноrо режима в кинетический, сложная за
висимость скорости растворения от температуры, MeHЬ
шая экспериментальная величина энерrии активации.
Однако, хотя последняя и меньше, ртуть растворяется
в цианистых растворах медленнее, чем золото: при дaB
лени и кислорода над раствором 1 ат в допредельноЙ
области в 2,6 раза и в запредельной в 5,0 раза; при
давлении воздуха, равном 1 ат, в допредельной обла
сти в 5,6 раза и запредельноЙ в 11 раз. Это можно
объяснить отсутствием активных центров на поверхно-
сти жидкоrо металла и значительными кинетическими
осложнениями при восстановлении кислорода, !l возмож-
но и более интенсивной адсорбциеЙ ионов на поверхно-
сти ртути и вытеснеlIИем ими молекул кислорода.
Цинк
Для суждения о том, в каком режиме ДИФФУЗIIОН-
ном или КИIIетическом протекает процесс растворения
цинка в циаlIИСТЫХ растворах, были поставлены опыты
по изучению влияния числа оборотов диска.
Кинетические кривые линейны и проходят через На-
чало координат. Зависимость приведенной СКОрОСТII рас-
творения (ОТlIошение v/C) от корня Iшадратноrо из чис-
ла оборотов диска показана на рас. 20. Приведенная
скорость растворения до 470 об/мин (число Рейнольдса
1,9.104) пропорциональна числу оборотов диска в CTe
пени 0,5, что является доказательством диФФузионноrо
77
характера протекающей реакции [(k==0,28.10 G л/(см 2 .
. C 1 / 2 . об 1 / 2 )]. Однако Прl! большеl\'1 числе оборотов дис
ка процесс растворения псреходит в кинетическую об-
ласть (независимость от интенсивности перемеШlIвания),
что характерно почти для всех случаев растворения ме-
таллов в цианистых растворах (пассивирование поверх-
ности металла избыточным кислородом).
о. 75
. 0,60
45
30
Q1S
О
G'
.,;
4
'"
"' 2
3
2
о
20 40 ба
[KCN) '1O NОЛЬ/Л
2
3
4 {7i
Рис. 20. 3аВIIСIIМОСТЬ привсден-
НО\( скорости растворения НС'
амальrамироваllноrо цинка or
числа оборотов днск9.
Рис. 21. Зависимость скорости ие.
аМiJльrамированноrо (1. 2) 11 амаль-
rамироваиноrо (3) цинка от кон-
цеитрации цианида при рззличном
давлении кислорода, ат: / 0,21;
2, з 1,0
Зависимость СJ(ОРОСТИ раствореНIIЯ цинка от кон-
центраЩIII цианида и кислорода в растворе при [КОН] ==
== 1 о з моль/л, 250 С и 100 об/мин показана на рис. 21.
Как и при растворении блаrородных металлов в циа-
нистых растворах с кислородной деполяризацией, при
раствореНИIl цинка на кривых имеются два участка:
область, контролируемая цианидом, JI область, контро-
лируемая кислородом. Сопоставляя зависимость скоро-
сти растворения от интенсивности перемешивания рас-
твора и характер кривых V == t (С), можно сдел ать
заключение о диффузионном характере процесса paCTBO
рения цинка в цианистых растворах в допредельной об-
ласти.
Однако этот процесс отличается и некоторыми осо-
бенностями, которые следует рассмотреть подробнее.
Во-первых, скорость растворения амальrамированноrо
цинка ВЫше, чем неамальrамированноrо (и тах равны
соответственно 4,9 и 4,5. 1 0 9 r-атом/см 2 . с), а предель-
ная концентрация цианида ниже (7,9 и 13,4.10 З моль/л).
78
Во-вторых, зависимость максимальной СКОРОСТI1 раство-
рения от давления кислорода над раствором отлична от
теоретической заВIJСИМОСТII для процессов, контролиру
емых диффузией кислорода. НаЙденное из опыта COOTHO
шение максимальных скоростей растворения при про
дувке раствора кислородом и воздухом для неамальrа
мированноrо цинка равно 4,5.10 9: 1,6.10 9===2,81
вместо 4,77.
Эти явления объясняются различным характером
окисных пленок, образующихся на поверхности цинка,
их толщиной, плотностью и проницаемостыо. Поскольку
цианистые комплексы цинка являются наименее проч
ными соединениями этой rруппы, следовало ожидать
особенно заметноrо влияния пленок на процесс paCTBO
рения цинка.
PaCCMOTplIM сначала СКОРОСТIl растворения амальrа
мированноrо и неамальrамированноrо цинка. Покрытие
поверхности цинка слоем ртути сопровождается проник-
новением ее под окисленный слой (явление, хорошо из
вестное Нз теории амальrамацни) II ослаблением проц
НОСТII связи этой пленки с поверхностью металла. В ре-
зультате увеличивается скорость растворения (в области,
контролируемой как цианидом, так и кислородом) 11
снижается предеЛЫ-Iая концеlIтрация цианида. В этом
случае цианид предпочтителыlO взаимодействует с Me
таллом JI не нужен ero избыток для удаления пленки.
Аналоrично ВЛIIяние пленок Jl при изменении давле
ния кислорода над раствором чем выше давление кис
лорода, тем толще и плотнее пленки и ниже скорость
растворения, поскольку, как было найдено нами, такие
пленки взаимодействуют с цианидом несколько медлен-
нее, чем металл. Однако в этих случаях в области, KOHT
ролируемой циаНIIДОМ, обычно нет линейноЙ. зависимо-
сти между скоростью растворения и концентрацией циа-
нида, так как по мере повышения ero концентрации
окисная пленка становится тоньше за счет более интен
сивноrо ее раствореНlIЯ. При этом зависимость v == f (С)
нелинейна, выпуклость кривой обращена к оси KOHцeHT
рации.
Но в системе «ионы цианида ионы цинка» есть еще
один фактор образование двух комплексов Zn (СN)з-
и Zn (CN) , . относительное количество которых зави
сит от I{онцентрации свободноrо цпанида. Совершенно
79
ясно, что при образовании высшеrо комплекса скорость
растворения, выражаемая в rpaMM aToMax металла, бу
дет ниже, чем при образовании низшеrо комплекса.
Таким образом, при повышении концентрации циа
иида в растворе деЙствуют два фактора: растворение
окиснои пленки (увеличение скорости растворения) и
образование высшеrо ЦIIанистоrо КОI\.IПлекса цинка
(уменьшение скорости). Видимо, влияние этих факторов
на скорость растворения взаимно уравновешивается и в
области, контролируемоЙ цианидом, в пределах точно
стн опыта наЙдена линейная зависимость скорости pac
творения от КОlщеlIтрацrrи цианида (см. plIC. 21). Вза
имное влияние этих ф('}JПОрОВ сказывается IJ в области,
запредельной по цианиду, поскольку максимальная CKO
рость pacTBOpeHII51 остается праКТIlчески постоянной.
Попутно IIадо отмстить, что скорость растворения
цинка в обескислороженных цианистых растворах YMe
ренной концентраЦИIl и щелочности очень невелика по
сравнению со скоростью растворения в присутствии кис
лорода и в обычных условиях ее можно не принимать
во внимание.
Поскопы<у цинк в отличие от блаrородных металлов
образует с ионом цианида два комплекса, а расчет Teo
ретической скорости растворения требует знания сте-
хиометрии процесса, была изучена реаКЦIlЯ
Zn (CN)3' + CN Zn (CN) .
ДЛЯ нее найдена константа Dавновесия К ==300 (ПDИ
250 С и ПОННОЙ силе Jlr, равной нулю), для друrих зна-
чений ионной силы вводили фактор пропорционально'
сти:
I
Ig f == I ,023 tc"
Кроме Toro, были проведены опыты по растворению
цинковой пыли в растворах цианида калия. Процесс Be
ли в склянках, которые аrитировали 24 ч в термостате
при 250 С.
В качестве примера приведем один из опытов: при
исходной концснтраЦИII цианида 3,14. 1 0 3 "моль/л И из
бытке цинковой пыли (100 r/л) после аrитаЩIlI в paBHO
весном растворе IIайдено 1,О33Х IО З r атом/л цинка.
Вычисленное по этим данным координационное число
комплекса равно 3,14.10 З: 1,033.10 З==3,04. Следова-
80
тельно, в этих условиях (избыток цинка, как и при рас-
творении диска) образуется только низший комплекс
Zп (СN)з-, что хорошо соrласуется со значением KOOpДII
llационноrо числа, вычисленным при lIспользовании
приведенной выше константы равновесия.
YpaBHeHlIe рсакции растворения !\1сталлическоrо цин
ка в цианистых растворах в присутствии кислорода
можно записать так:
2Zn + 6CN + 02 + 2Н 2 О 2Zn (СN)з + 40H .
Зависимость СI\ОрОСТИ раствореНIIЯ цинка в циани
стых растворах от интенсивности персмешивания (про
порционалыюсть числу оборотов диска в степеНII О,5)
являстся основным доказательством Toro, что этот про
цесс протекает в диффузионном рсжиме (до Re 1,9Х
Х 10 4). Для окончательноrо подтверждения этоrо рас-
считаем теоретичсские константы скорости растворения
цинка при 250 с:
6, IB.IO I (2л)I/:2 D '2/З
k
mv 1 / 6
З,40.10 3.D'2/3
т
Для области, контролируемоЙ цианидом (т 3; Ко-
эффициент дrrффузии цианида калия при ero концентра-
ции в растворс 0,01 моль/л, по нашим определениям,
равен 1,77.10 5 см 2 ,/с), находим: k 0,78.10 6 л/(см 2 Х
Хс 1 / 2 .об 1 / 2 ). Для области, контролируемой скоростью
диффузии кислорода, k' == 5,0. 1 0 6 л/ (см'2. C I / 2 .об 1 / 21
так как т 0,5. коэффициент ДlIффУЗИИ кислорода
2,00. 1 0 5 см 2 /с.
Для сравнения тсоретических величин с эксперимен-
тальными рассмотрим растворение амальrамированно-
ro цинка, коrда осложняющее ВЛИЯНИС' окисных пленок
МИНИМально.
В области, контролируемой цианидом (по рис. 21),
приведенная скорость растворения цинка равна 6,2Х
XI0 7 л/(см 2 (с). Поскольку В этоЙ серии опытов число
оборотов диска в секунду было 1,67, константа скорости
реакции растворения равпа 6,2. 1 0 7 : 1,291 0,48X
Х I О б л/ (см 2 . c1/ .об 1 / 2 ) ИЛII 62 % от теореТIIческоrо
значения, а предельная концентрация цианида Сп
7,9.10 3 моль/л.
6 306
81
В области, контролируемой скоростью диффузии
кислорода:
k' ==
V m
n 1 /2 S
02
4 ,9 . 1O 'J
1,29.1, 195.1O 3
6 ( .) I '.) 1 ") )
=::: 3,18.10 л! CM 'C / 'об / ,
IIЛIl 64% от тсоретическоrо значения.
Для неам альrамированноrо цинка (рис. 21, кри-
вая 2) эти константы соответственно равны: k==0,27X
XI0 6 (34% от теоретическоrо значения) и k'==2,9X
Х 10 6 (58% от теоретическоrо значения), а с п == 13,4Х
Х 1 O 3 моль/л.
Интересно отметить, что при продувке через раствор
воздуха (рис. 21, КРIIвая 1) константа скорости реакции
в области, КОНТРОЛl!руемоЙ кислородом, еще выше:
k ' 1 ,6.10 9 4 95 1 O 6 /( 2 1/'2 б 1 / 2 )
== === ,. л см. с . о ,
1,29.2 ,50. 1O .1
или 98% от теоретическоrо значения.
При растворении неамальrированноrо цинка на-
блюдается заметное расхождение между скоростями
реакции, выраженными в процентах от теоретических
значений, в областях, контролируемых цианидом и кис-
лородом (38 и 59%).
Как было показано, это характерно для тех случаев,
коrда проявляется сильное тормозящее действие пленок
на поверхности растворяемоrо металла. Но в области,
контролируемоЙ диффузией кислорода, эти осложнения
обычно выражены слабее, так как в ней имеется избы-
ток цианида, и окисные пленки становятся тоньше. Как
следствие, экспериментальные константы скорости реак-
ции ближе к теоретической 11 закономерности процесса
растворения проявляются более четко. То же саМое на-
блюдается и при продувке через раствор воздуха вме-
сто кислорода.
Выше было определено отношение стехиометриче-
CКIIX коэффициентов уравнения реакции на основании
изучения равновесия и расчетов. Теперь используем для
этой цели данные кинетических ОПbIТОВ соотношение
концентраЦIlЙ циаНI1да 11 кислорода в точке их эквива.
лентноrо расхода, в точке перехода процесса из обла-
82
ста, I\онтролируемой циаННДО!\1, в область, контролируе-
мую кислородом, т. е. про предельноЙ концентрации
цианида.
Для амальrамнрованноrо цинка (см. рис. 21, кривая
3), коrда осложняющее влияние окисныIx пленок сведе-
но к минимуму:
m 2 ( DKCN ) 2/3::= 7.9.10 3 ( 1.84'10 5 ) 2/3 ==
802 D 02 1, 195. 10 З 2, 00. 1O 5
6,60.0,946 === 6,] 9.
Вычисленная величина очень близка к коэффициен-
ту в приведенном выше уравнении реакции растворения
цинка в цианистых растворах. Образуется в основном
низший цианистый комплекс цинка, что cor ласуется
с приведенными выше оПытами (см. стр. 80 81) Il термо-
динамическими расчетами.
Некоторое превьrшение против стехнометрнческоrо
отношения объясняется тем, что вследствие тормозяще-
ro действия ОIШСНОЙ пленки у поверхности IlIlНка имеет-
ся небольшой избыток свободноrо цианида, способству-
ющиЙ образованию определенноrо количества высшеrо
цианистоrо комплекса цинка.
В связи с этим следует отметить, что при растворе-
нии металлов, образующих смесь комплексов, расчет
константы скорости и ее отклонения от теоретическоrо
значения правильнее вести не по количеству растворен-
Horo металла, а по количеству подведенноrо цианида.
Правда, ошибка невелика: Прll растворении амальrами-
pOBaHHoro цинка и концентрации цнанида 7,9Х
Х] 0 3 моль,/л использование цианида, поведенноrо к по-
верхности, составляет 71 %, т. е. на 9 % больше (учтен
и rидролиз цианида) , чем при расчете по количеству
paCTBopeHHoro металла.
Второй вывод, который можно сделать из соотноше-
ния стехиометрическнх коэффициентов, заключается
в том, что при растворении цинка в цианистых раство-
рах окислительная способность кислорода используется
полностью он восстанавливается до rидроксила, как
это имеет место при растворении меди, серебра и палла-
дия, но не золота или ртути, коrда восстановление кис-
лорода идет только до перекиси водорода.
При растворении неамальrированноrо цинка стехио-
метрическое отношение равно 10,4, т. е. значительно вы.
6*
83
ше. Это обусловлено более прочным сцеплением пленок
с поверхностью металла и наЛIIчием в растворе свобод-
Horo избыточноrо цианида, который взаимодействует
с этими пленками несколько медленнее, чем с металлом.
При 25° С и продувке раствора кислородом для
амальrамированноrо цинка можно рекомендовать сле
дующие константы скорости: k==0,48.10 6 и k'==3,18X
XIO 6 л/(см 2 .с 1 / 2 'об 1 / 2 ); для неамальrамированноrо
цинка: k==O,27.10 6 и k'==3,O.lO 6. При 25° С и продув
ке раствора воздухом константа скорости растворения
для неам альrамированноrо цинка k' == 4,95. 1 O 6 л/ (см 2 Х
Х С 1 /2 . О б 1/2) .
Проведенное исследование позволяет конкретизиро-
вать представления о предварительном обескислорожи
вании как об ОСНОвном мероприятии для снижения pac
хода цинка при цементации блаrородных металлов. По
тери цинка вследствие ero взаимодействия с кислородом
прямо пропорциональны концентрации кислорода в рас-
творе. Образующаяся на повеРХIIOСТИ цинка окисная
пленка сравнительно слабо защищает ero от растворяю-
щеrо действия цианида: она лишь несколько замедляет
скорость этой реакции при высоких концентрациях кис-
лорода в растворе и совсем не влияет на скорость при
низких ero концентрациях (при продувке через раствор
воздуха скорость растворения составляет 98 % от теоре-
тическоrо значения).
2. МЕТАЛЛЫ В РАСТВОРАХ
друrих КОМПЛЕКСООБРАЗОВА ТЕЛЕЙ
Золото и серебро в растворах тuосульфата натрия
Золото с тиосульфат ионом образует прочный ком-
плекс, который не разлаrается при подкислении с выде-
лением серы, и из Hcro может быть получена свободная
кислота НзАи (520з) 2' 1:12Н20. Золото из этоrо комплекса
очень медленно осаждается даже сульфидом натрия 1.
Известна пониженная окисляемость ионов сульфита
и тиосульфата, входящих в состав комплекса, высокая
термическая устойчивость этоrо комплекса.
Для определения константы ДIIссоциации комплекса
1 Сульфид AU2S самое труднорастворимое соединение золота;
при 250 С ero произведение активности раВ110 примерно IO 78.
84
была изучена реакция растворения этилксантоrената зо
лота в разбавленных растворах тиосульфата. Реакция
протекает достаточно полно, соrласно уравнению
AuC 2 H 5 0CSS + 2S20 === Аи (S20з) C2H5OCSS ;
Ко === 6.10 .
Произведение активности этилксантоrената золота
было определено равным 2,5. 1 о зз. Следовательно, KOH
станта диссоциации ТIIосульФатноrо комплекса равна
2,5.10 33: 6.10 4==4,2.10 30, а для процесса Au e+
+2S20 ==Au (S20з) , E == +0,1422 В. Поскольку по
тенциал рассчитан по экспериментальным данным, он
не зависит от значения стандартноrо потенциала зо-
лота.
Располаrая вычисленной величиной, можно оценить
термодинамическую вероятность процесса растворения
золота в тиосульфатных растворах при 250 С:
2Аи + 4S20j 2е === 2Аи (S20з) ; E ==0,1422В;
дОО == + 6559 кал.
HzO + 1/202 (r) + 2е == 20H ; !J.G o == 18500 кал.
1/202 (р) =::: 1/202 (r); !J.G o == 1972 кал
2Аи + 4S20 + 1/202 (r) + Н 2 О == 2Аи (SzОз) +20Н;
!J.GO == 13913 кал. К == 1,5.1010.
Для серебра, которое дает комплекс Toro же типа
с Kd==2,3.10 14, при протекаНИII аналоrичной реакции
дGО== 20827 кал и К== 1,85.1015,
Расчеты, проделанные при стандартных условиях
(активности всех компонентов равны 1), необходимо
проверить для реальных у'словий, так как результаты
в этом случае Moryr сильно отличаться.
Примем заведомо неблаrоприятные условия. Пусть
концентрация золотоrо комплекса равна 1 о з мольjл
(200 мrjл), концентрация тиосульфата 10 I мольjл
(16 r/л) , концентрация кислорода в растворе 10 4 моль(л
85
(3,2 мr/л), концентрация нонов rlIдроксила 10 2 моль/л
(8 10 моль/л NH 4 0H). Тоrда
I1G == I1G o + RT ln [Аи (520з)J Р' [OH j2
298 298 [5 0 2 ] 4 1/2
2 3 .502
[ Au ( 5 О )] З . [ OH ] :2
== I1Go + 1364 2 ln 2 з 2
298 ' [5 p ]4 'Sb;
О 1 О
== I1G 298 + 1364,2 ln 1 O == дG ЪJ8 5457 ==
:== 13913 5457 == 19370 кал.
K==I,3.10 1J .
Для реальных условиii термодинамическая вероят-
ность процесса растворения золота в тиосульфатных
растворах даже больше, чем для стандартных. Еще
сильнее можно увеличить термодинамическую вероят-
ность, создав более высокую концентрацию тиосульфата
и кислорода (константу равновесия К можно довести
ДО 1020).
Близкое сходство реакций растворения золота в циа
Н1IСТЫХ и тиосульфатных растворах, которое выражает-
ся в смещении потенциала золота в такую область, rде
возможно ВОССтановление кислорода, позволяет сделать
косвенное заключение и о сходстве механизмов сравни-
ваемых реакций. А поскольку для реаКЦИIl цианирова-
ния механизм изучен подробно, можно считать это под-
тверждением термодинамическоrо обоснования возмож
ности растворения золота в тиосульфатных растворах.
Однако термодина мические расчеты недостаточны
для суждения о возможности протекания реакции, так
как при этом не MorYT быть учтены }шнетические ослож-
нения, с которыми приходится сталкиваться в реальных
условиях, особенно если окислителем является кисло
род. Поэтому было изучено поведение метаЛЛIIческих
золота J{ серебра в тносульфатных растворах для полу-
чения необходимых сведений о характере процесса рас-
творения и выяснения ВЛИЯНIIЯ некоторых факторов на
ero скорость.
Опыты, проведенные в автоклаве, показали, что од-
новременно с растворением золота и серебра происхо
дит окисление тиосульфата. Хотя скорость растворения
86
блаrородных металлов в ЧlIСТЫХ тиосульфатных paCTBO
рах и не очень велика t тем не менее эти данные под-
тверждают правильность вышеприведенных термодина
мическнх расчеТОВ t но свидетельствуют о наличии КИНе-
тических осложнений, ВИДимо, связанных с трудностью
перехода электронов с поверхности металл а к молеку-
лам кислорода.
Специальными опытами установлеНО t что в раство-
рах аммиака без ПIOсульфата золото не растворяется
даже при 2000 С, а серебро растворяется уже при 60
800 C t особенно если к аммиачному раствору добавить
сульфат аммония или СОJlИ меди. Иными словаМИ t ос-
новным процессом, определяющим переход золота в
раствор при автоклавном аммиачном выщелачивании
сульфидных концентратов, является образование не ам-
миаЧНЫХ t а тиосульфатных комплексов золота. На неко-
торых особенностях этоrо процесса необходимо остано-
виться более подробно.
При изучении растворения золота н серебра в тио-
сульфатных растворах было замечено образование слоя
сульфида серебра на поверхности металлическоrо се-
ребра t а при наличии в тиосульфатном растворе соеди-
нений меди слоя сульфида меди на поверхности золо-
та. Образовавшийся сульфидный слой изолирует метал-
лы от раствора, и кинетически определяющим этапом
реакции растворения становится диффузия растворите-
ля сквозь этот слой. Толщина слоя изменяется во вре-
мени н определяет изменение скорости растворения Ме-
талла.
Золото и серебро 8 смеси тиосульФата натрия
u аммиака
При аммиачном выщелачивании медных сульфидных
концентратов в автоклаве образуется значительное ко-
личество тиосульфата t который является эффективным
растворптелем блаrородных металлов. В связи с этим
проведено исследование поведения золота и серебра при
концентрациях тиосульфата (0,0570,23). 1 0 2 11 MeAHoro
купороса (0,4.10 271,8) .lO 2 МОЛЬ/Л t аммиака 16,87
767tO r/Л t сульфата аммония 14,3 r/л, температуре 650 С
н давлении 2 ат.
Кинетические кривые имеют сложный характер
скорость реакции вследствие растворения СУJ1ЬфИДНОi'l
пленки увеличивается со временем. Для расчета сум-
87
марной CKOpOCТII этоrо процесса было использовано по
луэмпирическое ур авнение, выведенное в предположе
нии, что скорость реакции определяется скоростью окис
ления и растворения пленки сульфида:
Q kDSC 2 I Q
2а 't т О,
(9)
rде Q количество pacTBopeHHoro металла за Bpe
мя Т'
Qo количе тво pacTBopeHHoro металла к началу
отсчета времени (растворение за время разо-
[рева автоклава);
D коэффициент диффузии растворителя через
сульфидный слой;
S поверхность растворяющеrося металла;
a толщина сульфидноrо слоя;
С конuентрация растворителя;
T продолжительность растворения;
k константа скорости окисления Il растворения
сульфидноrо слоя.
Если для даIIIIЫХ условий принять k, D, 5, а постоян
ными, то уравнение римет более простой вид:
Q == k' т 2 + Qo
(1 О)
Построенные в соответствии с этим уравнением в KO
ординатах Q 't2 кинетические кривые линеЙны, что поз-
воляет рассчитывать константу скорости! и по ее величи-
не судить о влиянии переменных факторов на скорость
растворения блаrородных металлов в тиосульфатных
растворах.
К а т а л и т и ч е с к о е Д е й с т в и е и о н о в м е Д и.
Добавка сульфата меди к тиосульфатному раствору рез
ко (в 18 20 раз) увеличивает скорость растворения бла
rородных металлов, по-видимому, блаrодаря ката.тrити-
ческому действию ионов меди.
При растворении блаrородных металлов лимитирую-
щим этапом процесса является деполяризация металла,
т. е. отвод электронов с поверхности, так как сам процесс
комплексообразования (например, AgCl+2S20 ===
I Эту величину правильнее наЗblвать фактором ПРОПОРЦИОIlально
сти СКОРОСТИ СЛОЖIIОЙ реакции, но в дальнейшем для краткости мь!
будет пользоваться теРМИIIОМ «КОНСТШIТ3 СI{ОРОСТИ реакции», помня
о ПрlIнятоI"I здесь ОТНОСIlТелыlO(' УСЛОВIIОСТИ этоrо ПОIIЯТШ1.
88
===Ag (S20з)t"- +CI ) протекает достаточно быстро. Дей
ствие кислорода как окислителя, воспринимающеrо
электроны в несколько стадий, обычно сопровождается
заметными осложнениями. М.едь, леrко изменяющая свою
валентность в аммиачных растворах за счет приема или
отдачи одноrо электрона, способна облеrчить процесс дe
поляризации. Концентрация комплекса одновалентной
меди в растворе очень невелика, и аммиачный комплекс
двухвалентной меди леrко может проявить свою способ
ность деполяризатора: принимать электроны с поверхно-
сти серебра и передавать их кислороду, т. е. выступать
в роли катализатора окислительноrо процесса при рас-
творении серебра или золота.
Требует HeKoToporo обсуждения вопрос о форме, в ко-
торой золото находится в растворах автоклавноrо выще
лачивания. Аммиакаты одновалентноrо золота устойчивы
только в жидком аммиаке, а в водных растворах они
разлаrаются. Аммиакаты трехвалентноrо золота Moryr
быть получены только в растворах, насыщенных нитра
том аммония. Они довольно прочны, но разлаrаются ще
лочами с образованием rремучеrо золота. Если учесть,
кроме Toro, чрезвычайно леrкое восстановление солей
трехвалентноrо золота (даже комплексных) до OДHOBa
лентноrо при помощи тиосульфаrа, то кажется очень ма-
ловероятным образование в присутствии тиосульфата aM
миакатов трехвалентноrо золота. Одновалентное же золо
то, не образуя прочноrо аммиаката, дает чрезвычайно
прочный тиосульфатныii комплекс. Для золота вообще
характерна более ярко выраженная способность к обра
зованию анионных комплексов, чем катионных. Если,
кроме сказанноrо, учесть еще и то, что металлическое
золото растворяется в тиосульфатных растворах в OTCYT
ствие аммиака, то можно прийти к заключению, что зо
лото, как и серебро, IJрисутствует в растворах в виде
анионных тиосульфатных комплексов.
В растворах, содержащих, кроме аммиака, ион тио
сульфата, процесс деполяризации, видимо, протекает бо
лее сложно. Возможно, что в этих условиях в пере носе
электронов участвуют и тиосульфатные комплексы меди:
Си (S20з) + е == Си (S20з) ,
Но каковы бы ни были детали механизма процесса
деполяризации .растворяющеrося блаrородноrо металла,
89
важен основноЙ вывод о том, что IIменно соединения Me
ди служат переносчиками электронов между метаv1ЛОМ
и кислородом. Серебро в отличие от золота может pac
творяться в аммиачных растворах, не содержащих ион
тиосульфата, тоrда как для растворения золота присут
ствие этоrо иона обязательно. Соответственно и катали-
тическое действие меДII наблюдается только до тех пор,
пока в растворе имеется тиосульфат, так как при OTCYT
.:'
,
!iI::""
I,J :t:.
:t:
Ag Аи
8.0 0,8
6.0 0.6
4,0 0,"
2,0 0.2
00'"
Рис. 22. Зависимость константы
СКОрОСТИ раствореl!ИЯ золота и
серебра от концентрации эффек-
ТИ8ноrо растворителя: J Ан;
2 Ag
'0 0/15 О, 10 О, 15 0,20 0,25
соrJeржаНIJё' Na; 52 0з 8
Эффё'кти8ffОI1 растВорителе) /'fO/lbjЛ
ствии последнеrо золото становится настолько блаrород
ным, что отдача электронов не только катализатору, но
и более сильным окислитеv'lЯМ, исключается.
Предварительные опыты показали, что оптимальное
молярное отношение тиосульфата к меди равно 12,5.
В дальнейшем это соотношение сохранялось при изуче
нии друrнх переменных факторов, и раствор с таким со-
отношением тиосульфата и меди был сокращенно назван
«эффективным растворителем».
В л и я н и е к о н Ц е н т р а Ц и и «э Ф Ф е к т и в н о r о
р а с т в о р и т е л я». Опыты поставлены при KOHцeHTpa
ЦJIИ ТИОСУv1ьфата от 0,04 до 0,225 мо.'lь/л и температуре
650 С; остальные УС.'lовия сохранялись прежними
(рис. 22).
Константа скорости реакции растворения золота и се-
ребра почти линейно увеличивается с повышением KOH
90
центрации «эффективноrо растворителя», но ее абсолют-
ное значение для серебра почти в 8,6 раза больше, чем
для золота. Это можно объяснить тем, что серебро pac
творяется в растворах, содержащих аммиак и сульфат
аммония, за счет образования аммиачноrо комплекса,
а золото в разбавленных аммиачных растворах соеди.
нений TaKoro состава не дает. Зависимость константЫ
скорости реакции от концентрации «эффективноrо pac
творителя» нелинейна, что можно объяснить различной
толщиной и неодинаковой скоростью растворения суль-
фидноrо слоя на поверхности металла.
В л и я н и е к о н Ц е н т р а Ц и и а м м и а к а. Как
показали опыты при [Nа2S20з] ===0,115, [CUS04] ===
===0,9. 10 2 моль/л, температуре 60 0 С и давлении 2 ат,
скорость растворения серебра очень сильно зависит от
концентрации аммиака в исходном растворе. Констан-
та скорости линейно изменяется с изменением KOHцeH
трации аммиака, но прямая не ПРОХОДIIТ через начало
координат, так как некоторое количество аммиака необ
ходимо для образования медноrо комплекса.
В отлиЧИе от серебра скорость растворения золота
практически не зависит от исходной концентрации aM
миака в растворе.
В л и я н и е к о н Ц е н т р а Ц и и с у л ь Ф а т а а м м o
н и я. Как показали результаты опытов при KOHцeHTpa
ции сульфата аммония от О до 43 r/л, аммиака 33 r/л,
температуре 650 С и давлении 3 ат (остальные условия
прежние), константа скорости реакции увеличивается
для золота в 7,5 раз, для серебра в 4,3 раза и растет
линейно с повышением концентрации сульфата аммония
до HeI{OTOpOro предела (18 r/л для золота и 28 r/л для
серебра). Положительное деЙствие сульфата аммония
объясняется тем, что в ero присутствии быстрее окисля
ется и растворяется сульфидныЙ слой на поверхности ме.
таллов, что подтверждается видом кинетических кривых,
полученных в присутствии су.rтьфата аммония.
В л и я н и е Д а в л е н и я к и с л о р о Д а. Константа
скорости для серебра изменяется пропорционально дав-
лению кислорода в первой степени, тоrда как скорость
растворения золрта практически не зависит от давления
кислорода. Это различие, ВИДIIМО, вызвано тем, что при
растворении серебра в тиосульфатных растворах лими.
тирующим этапом являетсп окисление образующеrося
сульфида серебра.
91
в л и я н и е т е м II е р а т у р ы. Опыты проведены
при РО2 === 3 ат в следующих растворах:
а) для опытов с серебром:
тиосульфата, моль/л.
сульфата меди, моль/л
сульфата аммония, r/л
аммиака, r/л. . . .
б) для опытов с золотом:
тиосульфата, моль/л .
сульфата меди, моль/л
сульфата аJ\IJ\10НИЯ, r/л
эмми ака, r/ л. .
0,115
О 9.1O 2
, 14,3
33
0,173
0,014
14,3
18,0
НаЙденные значения экспериментальной энерrии aK
тивации реакции раствореНIIЯ (серебра 6,6 ккал/мо.тIЬ
и золота 5,2 ккал/моль) довольно близки к вели
чине, полученной при растворении сульфида меди
(7,5 ккал/моль) в автоклаве. Это совпадение косвенно
подтверждает, что скорость растворения блаrородных
металлов в тиосульфатных растворах определяется ско-
ростью растворения сульфидноrо слоя, образовавшеrося
на их поверхности.
Золото u серебро в пОЛUСУЛЬФllдных растворах
Поведение золота в водных растворах полисульфидов
щелочных металлов при повышенных температурах и
давлениях IIзучено недостаточно, и для соответствую-
щих реакций отсутствуют термодинамические данные.
Однако этот процесс представляет большой интерес для
rидрометаллурrии золота в связи с возможностью при-
менения ПО.тJисульфидноrо выщелачивания при повышен-
ных температурах и давлениях. Установлено, что в этих
условиях золото растворяется Б растворах, содержащих
ионы rидросульфида, с образованием прочноrо комплек-
са Al1S .
Образование ионов rидросульфида является следст-
вием реакции rидролиза
S2 + Н 2 О == SH + OH ; к == 0,0775 при 250 С.
Было показано, что скорость растворения золота Воз-
растает с повышением концентрации Na 2 S до HeKoToporo
предела, которыЙ зависит от степени rидролиза. Различ
ные добавки, связывающие избыточную щелочь (кремне-
92
зем, сульфиды и т. д.), увеличивают скорость paCTBope
ния золота.
Термодинамические расчеты свидетельствуют о высо-
кой термодинаl\lической вероятности растворения золота
в rидросульфидных растворах. При rидрометаллурrиче-
скоЙ обработке руд, rде присутствие кислорода неизбеж-
НО, более вероятно взаимодействие золота с rидросуль-
фидом и кислородом. Реакция в данноМ случае анаЛО-
rична осповной реакции процесса цианирования,
описываемоЙ уравнением Эльснера, и близка к ней по
энерrетическому эффекту. При характеристике мехаfШЗ-
ма этоrо процесса необходимо учитывать, что кпслорОД
может выступать или как приемник электронов, отнимае-
мых у золота, или, взапмодеЙствуя с сульфидными и
rидросульфиднымн ионами, превращать их в соответст-
вующие полисульфидные соединения, обладающие окис
лительными своЙствами и способные взаимодействовать
с золотом даже в отсутствие кислорода.
Для экспериментальноЙ проверки этих предположе-
ний были поставлены опыты при повышенных темпера-
турах и давлениях в автоклаве. В качестве исходных
растворителей примеНЯЛIIСЬ водные растворы аммиака
11 едкоrо натра с добавлением элементарной серы, а TaK
же заранее приrотовленные растворы полисульфидов
аммония и натрия определенной концентрации.
В л и я н и е к о н Ц е н т р а Ц и и а м м и а к а. Опы-
ты проведены при 1800 С, содержанпи серы 8 r/л (к рас-
твору аммиака была добавлена элементарная сера), на-
чальноЙ концентрации аммиака от 1,2 до 4,2 моль/л;
продолжительность растворения золота во всех опытах
была равна 3 ч.
Установлено, что скорость растворения золота не-
сколько уменьшается по мере увеличения продолжитель-
ности растворения' вследствие образования сульфпдных
пленок на поверхности золотоrо диска.
В л и я н и е к о л и ч е с т в а э л е м е н т а р н о i'I с e
ры, добавленноЙ к раствору аммиака. Ив
этой серпи опытов (температура 1800 С, концентрация
аммиака 2,3 моль/л) скорость растворения золота He
сколько уменьшалась с увеличением продолжительности
контакта, причем тем слабее, чем ниже концентрация се-
ры в растворе. Начальная скорость растворения была
ТaI{же пропорциональна содержанию полисульфидной
серы в растворе.
93
в л и я н и е т е м пер а т у р ы р а с т в о р а. При
концентрации аммиака 2,3 моль/л и количестве серы, дo
бавленноЙ к раствору, 8 r/л, в этих условиях было YCTa
новлено, что золото растворяется в ПО.JIисульфидных
растворах с заметной скоростыо при температурах
свыше 1000 С. Экспериментальная энерrия активации pe
акции растворения золота в полисульфидных растворах,
вычисленная из наклона кривой Аррениуса, равна при-
мерно 1 0,6 ккал/r атом; процесс протекает в кинетиче
ской области.
Специальными опытами показано, что если раствор
полисульфидов аммония заменить раствором полисуль-
фида натрия, то скорость растворения в нем золота за-
метно уменьшается. Это обусловливается тем, что при
более высокой щелочности растворов повышаются кине-
тические осложнения и уменьшается степень rидролиза.
Наличие небольших ){оличеств кислорода в растворе,
явно недостаточных для заметноrо окисления полисуль-
фИДIIЫХ ионов, может блаrоприятно влиять на про
цесс растворения золота. Можно предположить, что
кислород окисляет низшие полисульфиды до высших, oд
нако ero присутствие в растворе не обязательно. Так,
в наших опытах золото растворялось в полисульфидных
растворах, приrотовленных на воде, предварительно про-
кипяченной в течение одноrо двух часов для удаления
pacTBopeHHoro в ней кислорода.
Каковы бы ни были детали механизма этоrо процес-
са, важно то, что золото достаточно хорошо растворяет
ся в водных растворах полисульфидов аммония при по-
вышенных температурах и давлениях. Это представляет
интерес для объяснения поведения золота при HeKOTO
рых вариантах автоклавноrо выщелачивания золотосо
держащих руд и продуктов или для разработки MeTO
дов специальноrо полисульфидноrо извлечения золота
нз боrатых и упорных золотосодержащих концентратов.
Серебро 8 аммиачных растворах
Был исследован процесс растворения серебра в аМ-
миачных растворах с различными добавками.
Убыль свободной энерrии реакции
2Ag + 11202 (r) + Н 2 О + 4NН з (р) == 2Ag (NНз)f + 20H ;
ao == 2 ( 4,13) + 2 ( 37,60) ( 56,70)
4 ( 6,36) == 1,32 Кl\аЛ.
94
при стандартных УСЛОВJlЯХ сравнительно неве.пика, но
для pea.'lbHbIX условиЙ (концентрации серебряноrо комп
лекса и иона rидроксила равны 10 3, аммиака
2,5 моль/л) положение более блаrоприятно:
дG == Go + RT ln [Ag (NН з )lY [OH P
[ NН з ] 4 ph1 l
==: 1,32 + 1,36421g (1O 3)2(1O 3)2 == 1,32 +
( 2 , 5) 11 . 11 /2
+ l,36421g 2,5.10 1c1 ==.... 1,32 18,54 === 19,86 ккал.
Соrласно этому расчету, серебро должно хорошо pac
творяться в аммиачных растворах в присутствии кисло
рода, однако не исключена возможность 1'oro, что кине
тические осложнения MorYT уменьшить скорость этоrо
процесса.
10,0
'\)
с::. 8.0
оД
I;::
"""
40
е:. .
(.)с:::,
2,0
:::.
о 50
Рис. 23. Кинетика растворения серебра
в раСТВоре аммиака с добавками.
моль!л: J 3,36 NН э : 2 то же+О,Il
(NH.)2S04: 3 то же,+О,ОI Cu 2 +; 4 те
же+О,I! (NH 4 )2S0.+0,OI Cu 2 +
6,0
..
4.0
2,0
.
о
" 6
[Си 2 :] '1O МОЛЬ/Л
Рис. 24. Зависимость скорости p:.JC-
творения серебра от концентраЦlIl1
меди
Для выяснения этоrо вопроса были поставлены опыты
(рис. 23), позволившие вычислить удельные скорости
растворения серебра в растворах различноrо состава.
В растворе, содержащем только аммиак (опыт 1), ско-
рость равна 4,3.10 9 моль/(см 2 .с), в растворе, coдep
жащем аммиак и сульфат аммония (опыт 2), 1,7.10 8;
В растворе, содержащем аммиак и медный аммиачный
95
комплекс (опыт 3), 5,4. 1 0 8, а Прll наличии в раство-
ре NН з , J\lедноrо комплекса 11 (NH4)2S04 (опыт 4)
7,2.10 8.
Опыты при переменной концевтраЦIIII аммиака пока
зали, что скорость раствореНIIЯ увеличивается пропор
Цlюнально первоЙ степеНII концентрации аммиака в pac
творе.
Для выяснения в.rшяния концентрации медноаммиач
Horo комплекса была поставлена третья серия опытов
при ро/==3 ат; 700 С и [NH 4 0H] ==2,3 моль/л (рис. 24).
Как и предполаrалось, изучаемая реакция осложне
на медленно протекающим процессом деполяризации
скорость растворения серебра в чистых аммиачных pac
творах очень невелика. Добавка сульфата аммония за
метно повышает скорость растворения, но действие ero
значительно слабее, чем медноаммиачноrо комплекса.
Прибавленпе сульфата аммония к раствору, содержаще
му IIОНЫ меди и аммиак, увеЛlIчивает скорость paCTBope
ния серебра примерно на такую же величину (7,2 .10 8
5,4. 1 0 8=== 1,8. 1 0 8), как и без ионов меди (1,7. 1 0 8
0,4.10 8==1,3.10 8). Действие сульфата аммония, види
мо, не является каталитическим (ero можно рассматри
вать как буфер по отношению к иону rидроксила, KOTO
рый замедляет восстановление кислорода), тоrда как
медный аммиачный комплекс може леrко воспринимать
один электрон и облеrчить деполяризацию растворяю
щеrося блаrородноrо металла.
Известно, что в аммиачных растворах медь леrче Me
няет свою валентность, чем в сульфатных, и продукт pe
акции ион Си(NНз)t устойчив и может накапли
ваться в растворе в заметном Iюличестве, тоrда как ион
ClI+ диспропорционирует (2Си+==Си 2 ++Си; Ко==
== 1,22. 106. Для реакции!
Си (NНз) + + е == Си (NНз'Jt + 2NН з (р).
tJ.Go == 15,52 + 2 ( 6,36) ( 29,11) == + 0,87 ккал,
Ко == 0,23; Ео == + 0,038 В.
1 СrЮUО.11Iые Эllерrии обраЗОВ(lIШЯ пеществ. участвующих n peaK
ЦИЯХ. раССЧIJТ(lllЫ нами с ИСПО.'JьзоваllИеы ПОС.l)('ДIIIIХ AaHlIbIX, так как
величины, ПР!lВО;1IJмые в СПР<Jf\ОЧIIНКtJх, ЧilСТО неверны. Так, IIспример,
ОШlltJочно З[!(]ЧСlше OO== 40,8 1,l\a.'l для Cu (NНз) +, приводимое
n спраВОЧ!lике Л<Jтимера.
96
Стандартная свободная энерrия этоrо процесса близ-
ка к нулю, но если концентрация аммиачноrо комплекса
одновалентной меди в растворе невелика (за счет окис
ления кислородом), то комплекс двухвалентной меди бу
дет леrко воспринимать электроны, восстанавливаться
и затем передавать полученные электроны кислороду.
Этот процесс протекает леrко вследствие одноэлектрон
Horo характера обеих реакций. Термодинамическую Be
роятность последней реакции можно иллюстрировать
следующим расчетом:
2Си (NНз)t + 1/202 (r) + Н 2 О + 4NН з (р) ==
== 2Си (NНз) + + 20H .
i1Go == 2( 29,11) + 2( 37,60) 2( 15.52)
( 56,70) == 20.24 ккал.
ПриведенныЙ расчет и результаты опытов подтверж-
дают, что аммиачный комплекс одновалентной меди
леrко и без кинетических осложнений окисляется кисло
родом, поступающим в раствор из rазовой фазы. OTCYT
ствие кинетических Осложнений при переносе электронов
от металла к кислороду аммиачными комплексами меди
подтверждается следующим простым опытом: если к рас-
твору, содержащему аммиачный комплекс двухвалент
ной меди, добавить металлическую медь и закрыть кол-
бу пробкой, то происходит быстрое ее обесцвечивание
(восстановление меди до одновалентной); при OTKpЫBa
нии колбы раствор снова синеет (окисление кислородом
воздуха) .
При интенсивном окислении аммиачноrо комплекса
одновалентной меди ero концентрация в растворе силь-
но снижается, и аммиачный комплекс двухвалентной ме-
ди может проявлять своЙства деполяризатора прини
мать электроны с поверхности серебра и передавать их
кислороду, т. е. выступать в роли катализатора процес
са растворения серебра в аммиачных растворах. Приве-
денный расчет потенциала восстановления меди в амми-
ачном растворе и значеНIIе стандартноrо потенциа.Т1а ce
ребра в аммиачном растворе (+0,3728) позволяют
сделать заключение о том, что для успешноrо перехода
электронов с поверхности серебра к ионам Си (NНз) +
необходима низкая концентрация аммиачных комплек
7 306
97
сов серебра и одновалентноi') меди. В присутствии кис-
..юрода )<онцентраЦШI нона Cll (Nнз)t очень Ma.'Ia, и по
тенциал восстаНОВ.'1СIШЯ двухвалентноrо комплекса
будет удовлетворить требоваllИЮ, предъявляемому к по-
тенциалам катализаторов находиться между потенциа-
лами реаrирующих веществ серебра и кислорода.
Растворение серебра в аммиачных растворах являет
С'я реакциеЙ первоrо порядка по аммиаку, константа CKO
рости которой t == В присутствии катализато-
S .с."[
ра ионов меди достиrает величины 2,1.10 872,4.10 8
.11/ (см 2 . с). Это примерно на 2 3 порядка ниже величин
констант скоростей reTeporeHHbIx реакций растворения
металлов, КОlIтролируемых скоростью диффузии.
Опыты (см. рис. 24) показали, что для определенных
условий (состав раствора, температура, давление кис-
лорода) имеется некоторая «предельная» концентрация
медноаММllачноrо КОМП,l1екса, выше которой скорость
растворения серебра остаетсЯ практически постоянной.
Эта предельная концентрация связана со скоростью диф-
фузии реаrирующих КОl\Iпонентов к поверхности серебра
и характерна для мноrОКОМlIонеитных reTeporeHHbIX ре-
акций (например, реакции растворения блаrородиых ме-
таллов в цианистых растворах в присутствии кислоро
да). Наличие предельноЙ концентрации медноаммиачно
ro комплекса является убедительным доказательством
Toro, что он принимает участие в реакции растворения
серебра в аммиачных растворах, увеличивая скорость
процесса за счет переноса электронов от металла к кис-
лороду, т. е. с,пужит катализатором.
Золото в растворах ацетонцuансидрина
Замена ядовитоrо I1 дороrоrо циаlIистоrо натрия, не-
оБХОДИМоrо для цианирования руд блаrородных метал
лов, более дешевыми инетоксичными орrаническими реа-
[ентаМII И:Vlеет большой праКТIlчеСЮНUI интерес.
Ацетонцианrидрин (Aur)
СН З ОН
-"-- /
С
СН з / CN
л.еrко растворим в воде, имеет плотность 0,932 r/CM 3
и расщепляется в щелочноЙ среде, выделяя ионы циани
98
да и ацетон. ИОНЫ цианида растворяют золото в присут
ствии окислителя (кислорода).
3 а в и с и м о с т ь с к о р о с т и р а с т в о р е н и я з o
л о т а о т II Н Т е н с и в н о с т и пер е м е ш и в а н и я.
Скорость растворения золота в растворах ацетонциан
rпдрина увеличивается с повышением числа оборотов
диска только до определенноrо предела (2,25 об/с), но в
этой области оНа пропорциональна числу оборотов в CTe
в
о
""'
'i::. 6
<:.;i
'OJ
4
J::
0."
;;.. 2
1.2
о
CI)
0,8
I
ОА
о
(J ,
" 8 12
С 'fO моль/л
2 3
v'П
4
.'j
Рис. 25. Зависимость СКОрОСТII растворс-
ния золота от интеисивности перемеШll
ванин раствора ([ЛUП 2,64)(
X10 3 моль/л; [К:OH] 4; 10 2 моль/л;
P Oz 1 ат; t 25°C): / лцr: 2 Цl1а,
нид калия
Рис. 26. ЗаВНСIIМОСТЬ CK0[10
сти растворения золота от
давлення кислорода над
раствором: /, 2 1 ат; З,
4 0,21 ат; /, 3 лцr; 2 и
4 KCN
пени 0,5, т. е. подчиняется уравнению конвективной
диффузии, коrда поверхностью реакции является поверх
ность вращающеrося диска (рис. 25). При более интен.
сивном перемешивании раствора скорость реакции праJ{
тически не зависит от числа оборотов диска, т. е. процесс
аналоrичен растворению золота в растворах цианида
калия.
Изучение в,'!ияния некоторых \[еременных факторов
на скорость реакции было проведено при 0,75 об/с (диф
фузионныЙ режим) и 8,5 об/с (кинетическиЙ режим).
Величина константы скорости реакции растворения, по-
лученная в первоЙ серии опытов, равна 0,81. 1 О б
л/ (см 2 . С 1/2 . об 1 / 2 ) .
Единственное различие между растворяющим деЙст
BIIeM аuетонщrанrИДРlIна Ii UlIашща калия заключается
в том, что при применении первоrо peareHTa скорость
растворения золота в кинетической области не снижает
7.
99
ея при увеличении интенсивности перемешивания, а оста-
ется постоянной.
Влияние температуры и концентрации
Aur на скорость растворения золота в
д и Ф фу з и о н н о м р е ж и м е. Условия опытов: KOH
центрации Aur и КОН 2,64.10 3 И 4,O.10 2 моль/л,
n==0,75 об/с; давление кислорода 1 ат, температура 15,
25, 35 и 450 е.
Экспериментальная энерrия активации равна 3,08
ккал/моль, величина константы скорости при 250 е
0,73.10 6 л/(см2.сl/2'0бl/2), а ее зависимость от темпера-
туры Ig k=== 3,88 673. T I.
Полученные данные о влиянии интенсивности пере-
мешивания, концентрации ацетонцианrидрина и величи-
ны энерrии активации позволяют сделать заключение
о том, что растворение золота в водных растворах Aur
и цианида калия качественно и количественно однотипны.
е к о р о с т ь р а с т в о р е н и я з о л о т а в к и н е т и-
ч е с к о м р е ж и м е. Опыты проведены при интенсив-
ном перемешивании раствора (п == 8,6 об/с) , обеспечиваю
щем протекание процесса растворения в кинетической об-
ласти.
Изучено влияние концентрации Aur на скорость pac
творения золота при 250 е, давлении кислорода 0,21
(кривые 3 и 4) и 1 ат (кривые 1,2); на рис. 26 приведены
для сравнения кривые скорости растворения золота в
растворах цианида калия для тех же условий.
Влияние концентрации Aur на скорость растворения
иное, чем цианида калия: в кинетической области CKO
.рость и концентрация связаны нелинейной зависимостью,
и с повышением концентрации отношение v/C убывает.
Зависимость скорости растворения от концентрации
сложна, она определяется влиянием нескольких факто
ров и не может быть описана I<аким-либо простым урав-
нением при всех концентрациях Aur. Однако для обла-
сти низких и средних ero концентраций (от О до 5
6 .10 3 моль/л), имеющих практическое значение, можно
предложить следующие уравнения (для 15,25 и 350 е со-
ответственно) :
v 1 , 17. 1 o в
С 1 + 185С' С
v
2 ,50. 1 0 6
1 + 365С
v
5. 10. 1 0 6
1 + 605С
с
Поскольку процесс протекает в кинетическом режиме
и ero скорость не зависит от интенсивности перемешива-
100
ния, и/С является константой скорости реакции раство.
рения. Однако из вида эмпирическоrо уравнения не сле
дует делать выводы о характере процесса изучаемая
реакция имеет первыЙ порядок по Aur, а наличие в зна.
менателе уравнения члена, содержащеrо С, свидетельст
вует только о том, что с изменением концентрации циан-
rидрина изменяются и условия протекания реакции.
Хотя величина константы с.корости реакции постепен.
но уменьшается, скорость растворения золота в раство-
рах Aur всеrда выше, чем в растворах цианида калия.
Преимущество Aur особенно очевидно при более BЫCO
ком содержании кислорода в растворе и более низких
концентрациях реаrента растворителя. Начальная кон.
станта скорости реакции с Aur в 4 раза выше, чем с ии-
анидом калия (2,50.10 6 и 0,6.10 6 л/(см 2 .с). Но И при
более высоких, предельных концентрациях Aur тоже
имеет преимущества перед цианидом, так как с 'первым
MorYT быть достиrнуты в 1,4 раза большие максималь-
ные скорости растворения: с кис.породом 7,5. 10. 9 вместо
5,3.10 9 и с воздухом 3,4.10 9 вместо 2,4.10 9 r aToM/
/ (см 2 . с). Несколько выше и предельные концентрации
цианrидрина: 2,7 .10 З моль/л при насыщении раствора
воздухом и 1,3. 1 0 2 моль/л при насыщении кислородом
при давлении 1 ат.
Необходимо отметить, что при применении Aur кри.
вые в допредельной области, контролируемой ero концен.
трацией при цианировании с воздухом и кислородом,
полностью совпадают, тоrда как при растворении в циа
ниде замена воздуха кислородом сопровождается умень-
шением константы вследствие большей пассивации по-
верхности золота кислородом.
Давление кислорода над раствором Aur влияет так
же, как и при растворении золота в растворах цианида
калия. Оно сказывается только в запредельной области
концентрации Aur, коrда скорость растворения уже не
зависит от ero концентрации. При повышении давления
кислорода от 0,21 до 1 ат максимальная скорость раство-
рения увеличивается от 3,4 до 7,5. 10 9 r.aToM/ (см 2 . с),
т. е. в 2,2 раза; это отношение совпадает с отношением
парциальных давлений кислорода над раствором в сте-
пени 0,5 (1 ,00 : 0,21 )1/2 == 2,18, как это и должно быть
в том случае, коrда меД.'Iенным этапом процесса является
кинетическая стадия.
Влияни-е температуры при растворении золота в рас-
101
творах Aur тоже имеет некоторые особенности. Из при
веденных уравнениЙ констант скорости реаКЦИJl можно
вычислить энерrию активации, но поскольку при изме
нении температуры влияние концентрации Aur на CKO
рость растворения различно, можно ожидать, что и энер
rия активации будет зависеть от ero концентрации. Pac
четы показывают, что веЛИчина экспериментальной энер
rии активации плавно уменьшается по мере повышения
концентрации ацетонцианrидрина в растворе:
Концентрация
Ацr, МОЛЬ/Л о
Энерrия актива-
ЦИИ, ккал/моль.. 13, t
10,4
t ,5.10 3 2.5: 1O 3
9,6 8,3
5. 1O 3
1 . 1 о з
6,55
Такое изменение величины экспериментальной (сум-
марной) энерrии активации свидетельствует о том, что
с повышением концентрации Aur в растворе появляется
ДОIIолнительный фактор, уменьшающий влияние кинети
ческих осложнений, однако даже минимальное из приве
денных значениЙ энерrии активации характерно для ки
нетичеСl\оrо режима процесса растворения, что подтвер
ждается независимостью скорости растворения от числа
оборотов диска и зависимостью скорости от давления ки
слорода в степени 0,5.
Замедляющее действие щелочи качественно такое же,
как.и при растворении золота в растворах цаНlIстоrо ка-
лия, но несколько более слабое (уменьшение скорости
растворения при повышении щелочности до 1,0 моль/л
в 1,5 раза вместо 2,5 раз при использовании цианида) .
Надо отметить, что при переходе от использования циа-
нида на Aur следует обращать особое внимание на ще-
лочность раствора. так как реакция расщепления Aur
обратима. и в растворе нужно поддерживать избыточную
оптимальную концентрацию щелочи, которую леrко оп-
ределить опытным путем.
Заметное повышеНlIе скорости растворения зОлота
при замене цианида калия Aur позволяет полаrать, что
последний является не просто поставщиком ионов циани
да; блаrоприятным фактором:, влияющим на скорость
растворения, является и второй продукт расщепления
ацетон. Для проверки этоrо предположения была постав
,'1ена серия опытов (рис. 27) по растворению золота в ще
,10ЧНЫХ растворах циаIтстоrо ка,lИЯ с добавками aцeTO
на (1). н бутиловоrо (2) н Н Оl{Ти,rJOвоrо (4) спиртов и
102
диизопропиловоrо эфира (8). Видно, что добавки поверх
IIOСТl10 aKТllВHЫX веществ (ПАВ) резко увеличивают
скорость растворения золота в цианистых растворах.
С уве.'IИчением активности ПАВ снижается концентрация
цианида, при которой наблюдается максимум скорости,
но увеличивается и IIассивирующее влияние избытка реа-
reHTa (октиловыЙ спирт даже в малых концентрациях
llOнижает константу
скорости) .
Для объяснения
причины повышения
скорости растворения
при добавке в циани
стый раствор ПАВ
можно выдвинуть
предположительно два
механизма: физиче
ский (адсорбционный)
и химический (восста-
новительный) .
Рассмотрим некото-
рые положения в поль
зу адсорбционноrо ме-
ханизма. Как извест
но, при растворении
золота в цианистых
растворах наБЛlOдает
ся четко выраженное
пассивирование ero по-
верхности кислородом.
Так, скорость растворения золота в кинетическом режи-
ме при давлении кислорода над раствором 0,21 ат в 2,2
2,7 раза больше. чем при давлении 1 ат, что можно объ
яснить разницеЙ в величине адсорбции кислорода на по
верхности металла.
Можно предположить, что при добавке ацетона в
цианистый раствор, насыщенныЙ кислородом, адсорбция
поверхностно активноrо кетона на поверхности металла
изменяет количество адсорбнрованноrо кнслорода, т. е.
кетон вытесняет кислород с поверхности и депассивирует
металл. На подобный механизм депассивирования было
указано Фрумкиным при изучении действия ионов rа
лоидов нд кинетику электродных процессов.
Из данных рис. 27 следует, что ускоряющее действие
foo)
1,5
.....
10
'-- '
"
"
1234567
I(Оtfцентрация по8ерхностно
oKти8l1bU' ВещестВ С'10 I'fОЛ/)/Л
Рис. 27. Зависимость величин констант
СКОРОСТII реакции растворения золота
от концентрации поверхностно актив-
ных веществ: I ацетон; 2 н бутило
выЙ спирт; 3 диизолролиловый эфир;
4 1I,0КТИЛОВЫЙ спирт
10.3
ацетона наблюдается только до концентрации 4,5Х
Х IО З моль/л, а при более высокой концентрации CKO
рость растворения снижается. Видимо, это вызвано тем,
что при высоких концентрациях поверхностно активноrо
кетона имеет место ero избыточная адсорбция на поверх-
ности растворяемоrо металла, реакционная поверхность
KOToporo вследствие этоrо уменьшается.
В свете изложенноrо становится более ясным xapaK
тер зависимости скорости растворения золота от концен-
трации Ацr. При повышении ero концентрации скорость
процесса растет не только за счет увеличения KOHцeHTpa
ции образующеrося цианида, но и депассивирующеrо воз
действия ацетона, т. е. прирост скорости является CYM
марным результатом влияния двух факторов. Однако
один из них действие аиетона сначала сказываетсн
на скорости процесса положительно, а затем отрицатель
но И, наконец, процесс переходит в область, в которой
скорость уже не зависит от концентрации. Все это и оп-
ределяет сложный характер кривоЙ v==t(C), которую
трудно описать одним простым уравнением в области
всех концентраций Aur.
Возможность BToporo механизма депассивирования,
коrда молекулы ацетона вступают в окислительно-вос
становительное взаимодействие с пассивированной ки
слородом поверхностью золота, восстанавливают ее, а
сами при этом окисляются, менее вероятна.
Поскольку цианrидрины являются депассиваторами,
их следует применять в тех случаях, коrда поверхность
золота пассивирована кислородом, т. е. имеются кинети-
ческие осложнения. Лишь при наличии последних добав-
ки MorYT повысить скорость процесса и обеспечить ero
интенсификацию, а также получение больших макси-
мальных скоростей растворения золота, особенно при
цианировании под давлением и при повышенной темпера
туре. Однако при этом не следует забывать о том, что
для успешноrо применения цианrидринов необходимо
поддерживать оптимальную щелочность пульпы. Кроме
повышения извлечения золота, цианrидрины имеют по
сравнению с цианидами и друrие п'реимущества: более
низкий расход peareHTa, меньшую токсичность, менее ак-
тивное взаимодеЙствие с некоторыми сопутствующими
минералами. Кроме Toro, стоимость мноrих из них, явля
ющихся отходами ряда химических производств, может
быть ниже, чем стоимость циаНl1да (например, лактонит-
104
рил отход производства акрилонитрила) , что позволя-
ет Не только снизить себестоимость цианистоrо процесса,
но и использовать цианrидрины вместо цианидов при
флотации руд цветных металлов.
Серебро в раСТ80рах тu.омоче8Uf-lbl (Т)
ДЛЯ процесса
Ag + 3Т е == AgTt; Ео == + О,023В,
что свидетельствует о термодинамической вероятности
растворения серебра в растворах тиомочевины даже в
присутствии относительно слабых окислителей. Прове
денные опыты (рис. 28) показали, что скорость paCTBO
t;B
...
6
t::I
c>, 4
::;.
2
о
1 22'з.;
[K 8 rOs]-10, 'чОЛЬ/Л
2 4 5 В
[/{z Cr z 07]- 10: моль/л
Рис. 28. Зависимость скорости p<1C
творения серебра в растворах тио
мочевинЬ! от концентрации окисли
телеЙ: 1 бромат калия; 2 бихро
мат калия
"9
10
rS
а., 6
...
4
::..
02
2
О
4 8 12 16 20' 24 28
С r . 1а 110116//1
Рис. 29. Зависимость скоросТИ рас-
творения серебра от концентрации
тиомочеВИНI,1 при [Fe 3 +I,=O,OI5 (/) и
0,023 (2) r ион/.Т'I
рения серебра зависит от свойств окислителя: в присут-
ствии КВrОз оно растворяется быстрее, чем при исполь-
зовании K2Cr207 (микроспектральный анализ на приборе
«Камека» показал наличие на поверхности диска плот-
ных пленок, содержащих серебро, серу и хром). Наимень
шая скорость отмечена при продувке через раствор воз-
духа [0,9.10 9 r aToM/(cM2.c)], что объясняется низкой
концентрациеЙ кислорода в растворе (2,5. 1 0 4 моль/л),
хотя константа скорости составляет 36% от расчетной.
Посколы<у в кислой среде ТIюмочевина может быть окис
105
лена до (SCNH 2 NH)2, можно было предположить, что по-
следниЙ является внутреННИ!\-I окислителем переносчи-
ком электронов. ТермодинамичеСКИI'i расчет подтвердил
это предположение:
(SCNH 2 NH)2 + 2Н+ + 2е == 2SC(NH 2 )2; Ео =-== О,42В;
дG О === 19,37 ккал;
2Ag + БSС (NH 2 '2 2е == 2Ag [SC (NH )2]t; Ео == 0,0238;
дG О == + 1 ,Об ккал
2Ag + (SCNH 2 NH)z + 4SC (NH 2 )2 + 2Н+ ==
== 2Ag [SC(NH 2 )2]i; дGО:== 18,31 ккал.
Максимальная скорость растворения наблюдается при
молярном соотношеНИIl тиомочеВIIНЫ 11 ее дисульфида
4 : 1 (см. суммарную реакцию).
Более дешевыЙ окислитель сульфат окиси железа
участвует в образовании KOl\-Iплексов тина FeT + и
FеТSО I--, что и было подтверждено анализом растворов,
содержащих тиомочевину и ионы трехвалентноrо железа.
До 270 оборотов диска в минуту скорость растворения
серебра в растворах Fe2 (S04) 3 пропорциональна п 1 / 2 , а
при увеличении п эта зависимость нарушается.
Интересна зависимость скорости растворения серебра
от концентрации тиомочеВIIНЫ при постоянноЙ KOHцeHT
рации ионов трехвалентноrо железа (рис. 29): без тиомо
чеВИНbI серебро растворяется со скоростью 6,8Х
Х 10 9 r-атом/ (С1\12. с), а IlрИ концентрации ее 0,02
0,04 моль/л скорость растворения резко снижается ВСJlед
ствие образования на поверхности диска плотной серой
пленки, темнеющей на воздухе (содержит Ag, Fe, S).
При увеличении концентрации тиомочевины свыше
0,04 моль/л скорость растворения растет линейно до He
котороЙ постоянной величины (V т ), зависящей от KOH
центрации ионов трехвалентноrо железа. Такой характер
кривых всеrда наблюдается при reTeporeHHbIx реакциях
растворения с участием окислителя II комплексообразо-
вателя. В рассматриваемом случае на наклонном участ-
ке кривоЙ скорость нроцесса контролирует диффузия
ТIIомочеВJflIЫ, а на rОРIIзонтальном I\C.JHOB железа (111).
106
Величина рассчитанной теоретически константы ско-
рости реакции при 25° С равна
3 ')/3
k 3,4010 .D 5 9 1 O 7 /( 2 1/2 б 1 / 2 )
== == " Л см. с . о ,
т
rде D коэффициент диффУЗИII ТИОl\Iочевины, равный
1,2. 10 5 CM 2 jc, а т стехиометрический коэффициент
реакции, равныЙ 3. Экспериментальная же величина KOH
станты, вычис.rlенная по рис. 29, на порядок ниже
6,1 . 1 0 8, что объясняется образованием плотных пленок
На поверхности диска.
Зависимость скорости растворения серебра от KOH
центрации трехвалентноrо железа при постоянноЙ KOH
центрации тиомочевины ана Т'Iоrична прнведенной на
рис. 29. В области, контролируемой диффузиеЙ трехва-
лентноrо железа, константа СКОРОСТII при 25° С равна
7,1.10 7 л/(см 2 .с 1 / 1 .об l / 1 ), а в области, контролируемой
диффузиеЙ тиомочевины, скорость растворения уменьша
ется, так как избыточные ионы трехвалентноrо железа,
образуя комплексы с тиомочевиноЙ, снижают KOHцeHTpa
циlО ее молекул в растворе.
Влияние температуры на скорость растворения сереб
ра было изучено в интервале 15 35° С при числе оборо
тов диска ]00 в минуту, концентрации трехвалентноrо
железа 0,02, серной кислоты 0,051 и тиомочевины 0,065,
0,16 и 0,30 r-,.юль/л. Экспериментальные величины энерrии
активации реакции соответственно равны 9,61; 7,29 и
5,56 ккал/моль. Чем больше избыток тиомочевины, тем
тоньше Ш1енки и меньше энерrlJЯ аI<.тивации, что харак-
терно для осложненноrо диффузионноrо режима.
Полученные данные интересны своей сложностью и
противоречивостью. С одной стороны, экспериментальная
скорость растворения на порядок ниже рассчитанноЙ тео-
ретически и экспериментальная энерrия активации дости
raeT почти 1 О ккал/моль. С друrоЙ скорость paCTBope
ния зависит от интеНСIIВНОСТИ перемешивания, а это
основноЙ признак диффУЗlIонноrо режима. Такие проти-
воречия характерны для процессов растворения, ослож
ненных образованиеы пленок на поверхности, и исследо-
ванная реакция является исключительно ярким пр им е-
ром TaKoro процесса. Характерно также и уменьшение
энерrии активации до 5,56 ккал/моль (что уже близко
к велнчинам при диффузионном режиме) при повышении
107
концентрации комплексообразователя тиомочевины.
Об осложняющеl\-1 действии I1ленок свидетельствует
и отношение концентраций комплексообразователя и
окислителя в точке перехода из допредельной области
в запредельную, равное 1 o 13 вместо 3 (аналоrичное яв-
ление было отмечено при цианировании палладия и ero
сплавов с серебром, теллуридов золота и серебра). Kpo
ме Toro, при вычислении экспериментальных констант
скорости не учтено комплексообразование тиомочевины
и ионов железа. а также rидролиз последних. Все эти
осложнения сопровождаются снижением скорости pac
творения серебра, но не вызывают переход процесса
в кинетическиЙ режим.
Однако с повышением температуры расхождение ме-
жду численными значениями экспериментальной и рас-
считанной теоретически констант скорости становитсн
все меньше, так как энерrия активации реакции значи-
тельно превышает энерrию активации диффУЗIIН.
Физический смысл этоrо соотношения энерrий активации
заключается в том, что с повышением температуры по-
верхностные пленки становятся тоньше и комплексообра-
зование ионов железа и тиомочевины все менее интен-
сивно.
Серебро в растворах трехвалентносо железа
Стандартные IIотенциалы серебра lf системы FеЗ+
Fe 2 + довольно близки, н возможно протекание реакции
Ag + Fe31 == Ag+ + Fe 2 +; Ео === + 0,7991 0,7698 ==
== + 0,0293В и Ко == 0,320.
Концентрация ионов серебра в растворе будет ДOCTa
точно велика для извлечения ero из руд и концентратов.
И с точки зрения кинетики действие ионов трехвалентно-
ro железа одноэлектронноrо окислителя не должно
сопровождаться кинетичеСКИМII осложнениями.
Было изучено влияние концентрации солей TpeXBa
лентноrо железа на скорость растворения серебра при
25 0 С, 40 об/мин и [H 2 S0 4 ] ==0,05 моль/л (рис. 30). При
реакции с нитратом скорость растворения прямо пропор-
циональна ero концентрации (рис. 30. кривая 2), а с суль-
фатом при концентрациях более 0,02 0,03 r-экв/л на-
блюдается заметное торможение процесса растворения
(рис. 30, кривая 1), что может быть вызвано только об-
108
разованием пленок на поверхности диска. Диски после
растворения серебра в сульфатных растворах были по.
крыты пленками. Просмотр на микроанализаторе «Ka
мека» снятых с диска пленок показал линиl1 Ag, Fe и S
(возможно соединение типа арrентоярозита).
Для выяснения характера процесса была изучена за-
висимость скорости растворения от интенсивности пере
мешивания, которая оказалась типичной для диффузион-
Horo режима v==f(n 1 / 2 ).
Энерrии активащш реакций с сульфатом и нитратом
соответственно равны 8.19 и 5,55 ккал/моль, а константы
9 96
б 80
64
48
<u
32
Рис. за. 3аВИС\JМОСТЬ СКОРОСТИ 16
растворения серебра ОТ концент-
рации трехвалентноrо железа.
добавлениоrо в ВИде нитрата
(1) и сульфата (2)
скорости при 250 С (средние из всех серий опытов) 4,0 и
4,6. 1 0 7 л/ (см 2 . С 1/2. об 1/2). Вел ичины энерrий активации
хорошо соrласуются с большиrvш скоростями растворения
в нитратных растворах. Для окончательноrо суждения
о характере и осложнениях процесса растворения следует
сравнить величины экспериментальной и рассчитанной
теоретически констант скорости. Коэффициент диффузии
нитрата трехвалентноrо железа при 250 С был вычислен
по эквивалентным электропроводностям, равным 1,2X
XIO 5 см 2 /с, следовательно, k==3,40.10 3 (D)2/З "=3,40Х
ХIО 3(l,2.10 5)2/З == 1,78.10 6 л/(см 2 .с 1 / 2 .об 1 / 2 ). Экспе-
риментальная же величина составляет 26% от теоретиче-
ской, что характерно для реакциЙ, протекающих в диф
фузионном режиме, но осложненных неполной диссоциа
цией соли, ее rидролизом, образованием комплексных
соединений, а также образованием пленок На реакцион-
ной поверхности (особенно в сульфатных растворах).
Подкисление раствора серной кислотоЙ до 0,82 мольjл
повысило константу скорости от 4,0 до 4,75. 1 0 7, а до-
109
бавка 0,04 моль/л сульфата двухвалентноrо железа сни-
зила ее до 1,25.10 7.
Ниже сопоставлены величины констант скоростеЙ ре-
акциЙ растворения (k.l0 7 ) металлическоrо серебра в
водных растворах изученных peareHToB при 250 с:
Цианид натрия .
Соли железа
(IП) . . . .
Тиомочевина и 1
Fеz(SО4)З f
5,9
4,G 4,0
0,61 (по Т), 7,0 (по Fe (III))
ИЗ этих данных следует, что соли трехвалентноrо же
леза по скорости растворения серебра мало уступают
цианиду натрия, имея перед ним бесспорные преимуще
ства экономическоrо и санитарно rиrIlеническоrо xapaK
тера.
Следует отметить незна ЧJlтельное различие скоростей
растворения серебра в растворах железа (111) в присут
ствии тиомочевины и без нее. Роль тиомочевины, ПО ВII
димому, сводится К уменьшению толщины пленок на по-
верхности серебра, для чеrо, однако, требуется ее значи
тельный избыток (константа скорости по тиомочевине
на порядок ниже, чем по железу (111)).
Соли железа (lII) перспективный peareHT для
извлечения серебра из руд и концентратов некоторых
типов. Особенно блаrоприятным объектом являются ce
ребро-марrанцевые руды: во первых, они при использо
ванни друrl1Х методов оказываются очень упорными и
требуют сложной и дороrой предварительной подrотовки;
во-вторых, по предлаrаемой схеме можно дополнительно
извлекать и марrанец; в третьих, наличие в руде мине-
ралов марrанца высшей валеНТНОСТII будет способство
вать окислению Fe 2 + до Fe 3 + (можно применять вместо
сульфата окиси железа более дешевый железный купо
рос) .
Пути интенсификации предлаrаемоrо процесса: энер
rичное перемешивание (кроме усиленноrо подвода pea
rента-растворителя к поверхности, оно будет способст
вовать стиранию пленок), поВышение концентрации ио-
нов железа (lII) и температуры.
Предложенная схема позволила получить высокие
технолоrические показатели при обработке упорной се-
ребро марrанцевой руды одноrо из месторождений: Из
влечение серебра составило 94 % и марrанца 92 %. Более
11 О
сложная схема (процесс 1\1ак К.пюски) предваритель
ное выщелачивание руды сернистым rазом, промывка
кека и ero пос.педующее цианирование дает 92 93 %
извлечения серебра, т. с. даже HeMHoro меньше, че-r-..1 пред-
.'lаrаемая схема.
Кроме BbICOKoro извлечения, предлаrаемая схема име
ет ряд преимуществ: а) отпадают операции выщелачива
ния сернистым rазом и отмывки кека; б) peareHT pacTBo
ритель значительно дешевле цианида, менее токсичен и
менее дефицитен, а при наличии окислов MapraHua pac
ход ero невелик; в) можно получить значительно боль
шие максимальные скорости растворения [даже при KOH
центрации ионов железа (III), равной 0,03 r ион/л, или
].7 r/л, эта скорость на порядок выше, чем при цианиро-
вании с продувкоЙ раствора воздухом]; r) rораздо про-
ще обезвреживание ПрОI\'1ышленных СТOI<ОВ.
Золото в водных растворах хлора
Процесс хлоринаЦIll[ применяли еще во второй поло
вине XIX в. для извлечения золота из руд и KOHцeHTpa
тов. В последние rоды намеТШ1ИСЬ новые направления
в rидрохлорировании в связи с возможностью комплекс-
ной переработки сырья с низким содержанием ценных
компонентов ИЛИ особо упорных руд и концентратов,
а также и потому, что хлор и особенно белильная из
весть значительно дешевле цианида.
В первой серии опытов было найдено, что скорость
растворения золота пропорциональна KOpHIO квадратно-
му из числа оборотов диска как при использовании хло
ра, так и белильноЙ извести, т. е. процесс протекает
в диффузионном реЖИ!\-fе даже при очень интенсивном
перемешивании (] 270 об/мин). Дальнейшее исследование
показало, что скорость растворения золота зависит как
от концентрации хлора в растворе, так и от KOHцeHTpa
ции и состава ЮIСЛОТ. Азотная и серная кислоты повыша
ют скорость растворения золота в меньшеЙ степени, чем
соляная. Подкисление УВеличивает скорость растворения
более чем на два порядка; так, например, при концен-
трации хлора 2,75. 1 0 3 моль/л без подкисления скорость
равна 2,2.10 11 r aToM/(CM2.c), а при добавке 0,2 моль/л
соляноЙ кислоты она достпrает 8. ] O 9, 1'. е. увеличивае1'
ся в 365 раз.
Повышение скорости растворения в кислых раство-
рах объясняется снижением степени rидролиза хлора
111
и увеличением концентрации ero в молекулярной форме,
являющейся более активным окислителем. rидролиз хло-
ра протекает очень активно:
CI 2 + Н 2 О == Н+ + Cl + HCIO, к === 4,7 . 1 0 4
и в разбавленных растворах (lO 2 10 3 моль/л) дости
raeT 90 99,8 %. Большая активность соляной кислоты
r по сравнению с азотной и
серной объясняется тем, что
она не только подавляет
rндролиз хлора, но и рас-
творяет пленку ЛиСl про-
межуточноrо продукта pe
акции, образующеrося на
поверхности золота.
При достаточном под
кислении раствора НС! CKO
рость растворения золота
прямо пропорциональна ис-
ходной концентрации хлора
(рис. 31), т. е. процесс хло
ринации является реакцией
первоrо порядка по хлору.
Изучение зависимости
скорости растворения золота
от температуры подтвердило наличие пленок на поверх
ности металла. Экспериментальная энерrия активаЦИI1
в неподкисленных растворах равна 7,82 ккал/моль, при
подкислении до 0,1 моль/л НСl 7,44, при 0,5 моль/л
НС! 7,23, а в растворах белильной извести, подкислен-
ных серной кислотоЙ, E === 8,1 О ккал/моль. Численное
значение E больше, чем для диффузионных процессов,
не осложненных образованием поверхностных пленок
или ступенчатым протеканием реакции, но, как было от-
мечено ранее (с. 107), этот критерий не BcerAa характе-
ризует механизм процесса.
Для уточнения механизма сравним величины экспе-
риментально найденной и рассчитанной теоретически
констант скорости. Как было вычислено для 250 С,
...
40
I
0."
о
Рис. 31. Зависимость скорости
растворения золота от концент-
рации хлора при 25" С,
505 об/мин н {HCI], моль/л:
о (1); 0,1 (2) и 0,5 (3) моль/л
k == 3,40.10 3 D 2 / З .
т
t 12
...;
8
0,'
о
....
12
C\J
0.'
z
Рис. 32. Зависимость скорости
растворсни золота vT KOHцeHT
рации белильной извести при
250 с: 505 об/мин; 0,012 моль/л
H 2 S0 4
о
0.1
концентрация кислоты,
МОЛЬ/Л
Рис. 33. Зависимость скорое 111
растворення золота в водных
растворах белильной извести от
кислотности раствора и состава
кислоты, моль/л: I H 2 S0 4 :
ICaOCI2\ 1.25.10 2; 2 НСI
3
[CaOCJ,\ 6,75 . 10 моль/л
Приняв 1 коэффициент диффузии хлора равным
2 02.10 6
l,42.10 5 см 2 /с, находим k=== ' . Эксперимен
т
тальная же величина k (из мноrих серий опытов) равна
1,02. 1 0 6 л/ (см 2 . C 1 / 2 .оБ I / 2 ). Если принять стехиометриче
ский коэффициент равным 1,5 (Au+ 1,5 C1 2 ), то экспери-
ментальная величина k составит 76% от теоретической,
а если т=:=:0,5 (Au+O,5C1 2 ), то 25%. Пока возможны ДВа
предположения: или AuCI 2 реаrирует с хлором
(AuC1 2 +CI 2 ) в пр и поверхностном слое (т== 1,5) и со-
rласие с теорией очень хорошее (см. величины k теоре-
тические и экспериментальные для меди, серебра и зо-
лота в цианистых растворах), или эта реакция протека-
ет вдали от поверхности и скорость в четыре раза ниже
расчетной (что также бывает, например, при растворе-
нии неамальrамированноrо цинка в циан идах.
Была исследована кинетика растворения золота в
подкисленных растворах белильной извести в зависимо-
сти от ее концентрации в растворе (рис. 32) и концентра-
ции кислот (рис. 33). В растворах, подкисленных соляной
кислотой, константа скорости примерно такая же, как
и в растворах хлора, а при подкислении серной кисло-
t Н i m m е 1 Ь 1 а u D. \. Cherl1. Reviews. 1964, v. 64, N!! 5,
с. 527 550.
8 306 113
той она в 2,5 4 раза ниже в зависимости от кислотно
сти И концентрации белильной извести. Причина этоrо
снижения скорости состоит в образовании более толстых
пленок на поверхности золота, что соrласуется и с боль
шей энерrией активации. Хотя растворы хлора, подкис
ленные соляноЙ кислотой, и позволяют достиrнуть боль
ших скоростеЙ растворения, Дv'Iя практики более подхо
дит смесь белилыlйй извести с серной кислотой (YMeHb
шается коррозия аппаратуры, улучшаются условия
труда) .
Соотношение количеств белильноЙ извести и серной
кислоты в известных пределах взаимозаменяемо, и для
каждоrо вида обрабатываемоrо сырья можно подобрать
такое, которое обеспечит приемлемую скорость растворе-
ния золота. Поскольку процесс протекает в диффузион
ном режиме, для расчетов можно использовать уравне-
ние (4). При 250 С и достаточной концентрации HCl
k == 1,02. 1 0 6 л/ (см 2 . с 1 / 2 . об 1 / 2 ), а для друrих температур
константу можно вычислить из уравнения
1580
1 9 k == o 692-
, т .
С точки зрения кинетики, хлор как растворитель зО
лота имеет определенные преимущества перед циани
дом. Во первых, реакция rидрохлорирования протекает
в диффузионном режиме даже при очень интенсивном
перемешивании, тоrда как цианистый процесс при
n 150 об/мин JIереходит в кинетическую область, что
лишает нас возможности ero интенсифицировать. При
чина этоrо в потенциале поверхности. Золото в хло
ридных растворах блаrороднее, чем в цианистых (CTaH
дартные потенциалы +0,995 и 0,543 В). При столь по
ложительном заряде поверхности образование на ней
окисных пассивирующих пленок исключено, так как
потенциал процесса Аи 3е + 30H Аи (ОН) з по
Б. и. Пещевицкомуl равен +0,59 В, а по нашим расче
там он равен +0,53 В. BO BTOpЫX, растворимость хлора
в воде выше, чем кислорода, что обеспечивает по.пучение
больших скоростей растворения. Так, например, макси
мальная скорость растворения золота в цианистых рас-
творах при их продувке кислородом при 250 С равна
8,05.10 9 r aToM/(cM2.c), И.r:IИ 5,7 мr/(см 2 .ч), а при про-
Пещевицкий Б. И., Еренбурr А. М., Белеванцев В. И., Каэз
ков В. П. «Изв. СО АН СССР», 1970, вып. 4, N!? 9, с. 75 83.
114
дувке воздухом соответственно 2,4.10 9, или 1,7. При
хлоринации же (250 С, 1500 об/мин, 0,02 моль/л C J
и 0,3 моль/л HCI) и=== 1,02.10 7 r aToM/(cM2.c), или
73 мr/(см 2 .ч). В третьих, хлор и особенно белильная из
весть значительно дешевле ЦИанида. Кроме Toro, при хло
ринации леrче осуществить комплексное использование
друrих ценных компонентов обрабатываемоrо сырья и не
так опасны некоторые примеси, осложняющие процесс
цианирования (медь, сурьма и др.), проще осуществля
ется осаждение золота и обезвреживание промышлен
ных стоков.
Золото в водных растворах иода u брома
Реакции между золотом и бромом ИЛИ иодом пред
ставляlOТ теоретический интерес для выяснения механиз-
ма реакции золота с rалоидами, поскольку валентность
ето при взаимодействии с этими элементами в BOД
ных растворах различна AuBr3 и AuI. При исследова-
нии для обоих элементов наЙдена обычная зависимость
скорости растворения от интенсивности перемешивания:
скорость пропорциональна числу оборотов диска в сте-
пени 0,5, т. е. режим диффузионный. Дальнейшее ис
следование показало, что скорость растворения зависит
не только от концентрации rалоидов, но и от KOHцeHTpa
ции их калиЙных солей. В водных растворах, содержа
щих только бром, золото растворяется очень медленно
(рис. 34, кривая 2), а в растворах иода не растворяется
совсем, так как на поверхности образуются очень труд-
норастворимые пленки AuBr и AuI (аналоrия с реакцией
Au+O,5 CI 2 ===AuCI, но выраженная более четко). rало-
идные соли растворяют эти пленки (Aur +r ===Aur2)'
и золото начинает переходить в раствор со скоростыо
тем большей, чем выше концентрация этих солей
(рис. 35).
Серия опытов при переменной концентрации rалои
дов и достаточном избытке их солей позволила устано-
вить, что изучаемые реакции первоrо порядка по KOH
центрациям rалоидов (см. рис. 34). в последней серии
опытов было изучено влияние температуры (от 5 до
450 С) на скорость взаимодеЙствия золота с обоими ra
лоидами, которое можно описать следующими уравне-
ниями:
Igk == 2,188 l O ; i1E == 5,35 ккал (бром)
8* 115
и 19 k ::=: 1, 1.585 1 5 ; i1E 6,91 ккал (иод).
Средние значения констант скорости при 250 С: 0,77
и 0,66. 1 О б л/ (см 2 . С 1/2 . об 1/2) (для бром а и иода).
10
0.01 0,02
С OpO/'fa и иода, /'fОЛtJjЛ
f Рис. 34. Зависимость CKOP()
сти растворения золота от
концеитрации брома (1, 2) и
иода (3, 4) при 250 С и
' 505 об/."" I 0.515 ММ'/Л
КВТ; 2 без бромида калия;
3 0.5 моль/л Ю; 4
0.0145 моль/л Ю
50
.....
'"
'--'
30
C:J
.u
Do"
о
24
.
.......
.....
.,;
.....
12
?
<1>
o,
6
РИс. 35. Зависимость скоро-
сти растворения золота от
концентрации иодида (1,3) и
бромида (2) калия при 250 С
и 505 об/м ии. Концентрации:
0,005 (1). 0,0125 моль/л (3)
иода, 0,0083 моль/л брома (2)
о
0,2
с еароиUoВ, НОЛЬ/Л
0.8
Сопоставляя полученные данные
и термодинамическими константами
с кинетическими
реакции золота
116
с хлором (табл. 6), можно сделать вывод об общности
механизма всех этих реакции.
rалоиды являются элементами одной rруппы перио.
дической системы, и их своЙства изменяются с увеличе-
нием порядковоrо номера. rидролиз rалоида и склон-
ность к образованию соединений с золотом высшей
валентности снижаются, но усиливается комплексооб
разование rалоида и ero способность давать более труд-
норастворимые соли и БШIее прочные комплексы с золо
том; уменьшается чувствительность реакции к кислотно
сти раствора.
ТаБЛИЦ86
Кинетические и термодинамические константЬ!
I)еакции золота с хлором
Растворитель
6u
°0
U":)
0<:>1
;о:
'-':>:
Q.
«11::
f-o
ж:S:
«1 Ж
f-o::l'
r.J;.:
:1:«:
0<1)
o.
:s: .!I
;S:<:;
::1'0
l'.
:s:o;
f-o ro
:.::<:
ro :.:
tJ::i
:S::S:
....::1'
:.:
CJ'"
ЖQJ
(!)
«1
«1r:(
f-o;s:
ЖО
«1<:;
С«1
..,
=
<:;
О
r:(
:s:
....
6
<1)<:;
<:; «1
1::....
::Е
оtl:
:<::>:
:1:
«1'"
«1«1
g«1
OOq
8:>:
:s:
f-o
:.:
«1
<1)
:s:
5t...
r:( ;::!
:;:;<
.., :r:
:s: f-o
О u
:::.. о
t:: :r::
Хлор 1 ,02. 1 0 6 7,23 4 , 7 . 1 0 4 1 ,5. 10 12
Бром 0,77. 1 0 6 5,35 5,8.10 9 17 2.9.10 16
Иод. 0,60.10 6 6,91 3.0.10 13 720 1 ,6.10 23
Константы скорости реакций золота с rалоидами oд
Horo порядка наталкивают на предположение о сходном
механизме этих реакций их ступенчатом характере
с образованием промежуточноrо соединения rалоида
одновалентноrо золота Aur (при взаимодействии золота
с иодом, точнее с ТРИОДид ионом, это единственно Воз
можная первая стадия реакции Аu+l з ==AuI +AuI 2 ").
Для Toro чтобы выяснить, какая стадия процесса
определяет ero скорость, рассчитаем теоретическую Be
личину константы скорости реакции растворения зоЛота
в водных растворах иода, содержащих 0,5 моль/л KI:
k == 1 ,549 .10 3. D 2 / 3
mv 1 / 6
1 ,549.10 3(J ,25.10 5)2/3 3 72 10 6 /( 2 1/2 б 1 / 2 )
== _' Л см' с . о .
0,5(8, 1.10 3)1/6
117
Экспериментальная ве..'1ичина 0,60. 1 0 6 или 16 % от Teo
ретической (для реакции ЗОJIота с хлором 25 %). Од-
нако с повышением температуры расхождение между тео-
рией и опытом становится 1\1еньше, так как энерrия акти-
вации реакции превышает энерrию активации диффу-
зии скорость реакции золота с иодом при 500 С равна
30 % от теоретическоЙ величины.
Интересно отметить, что константа скорости реакции
AgCl+2Cl ==AgCl при 250 С равна 1,06.10 6, т. е. TO
ro же порядка, что и константы скорости реакций ЗО.пота
с rалоидами. Это позволяет Ilредположить, что все эти
реакции имеют общую медленную стадию на поверх-
ности образуются пленки Aur, толщина которых посте-
пенно увеличивается, в результате чеrо замедляется
анодная фаза процесса (взаимодействие золота с rалои-
дами) до тех пор, пока не наступит динамическое равно-
весие сравняются количества образующеrося II рас-
творимоrо Aur. Такой характер процесса для reTeporeH-
ных реакций явление далеко не единичное. Даже бо-
лее активные растворители, как например, цианид, не
MorYT воспрепятствовать образованию пленок простых
цианидов на поверхности металлов, хотя константа paB
новесия реакции MeCN+CN ==Me (CN)2 дЛЯ золота, се-
ребра и меди на четыре порядка выше, чем для реаКЦIIИ
АиТ +r ===Aur2'
Для вычисления скорости растворения золота в рас-
творах rалоидов примеНИ1\1O обычное уравнение (и==
== kcп 1 / 2 ), величина констант скорости при 250 С и энер-
rии активации приведены в таб.1J. 6. Надо только отме-
тить, что эти расчеты примеНИI\IЫ для ОПТIIмальных усло-
виЙ: при растворении ЗОJIота в водных растворах хлора
они должны содержать достаточное КОЛIIчество HCl,
а при растворении в водных растворах брома и иода
необходимыЙ изБЫТОI<: соответствующеi'I rалоидной со.'] и.
3. МЕТАЛЛЫ В РАСТВОРАХ МИНЕРАЛЬНЫХ КИСЛОТ
rерманий в азотной кислоте
Различные авторы по-разному представляют меха-
низм растворения rермания. Некоторые, учитывая полу-
проводниковые свойства rермания, основную роль отво-
дят электрохимическому растворению, сопровождающе-
118
муся поrлощеНIIем дырок и освобождением электронов.
Друrие считают, что процесс растворения происходит
в две стаДIlИ: ОКIIсление rермания и растворение обра-
зующеrося окисла.
Различны и величины скоростей растворения, полу-
ченные в результате проведенных работ. Причина этоrо
заключается в различии теоретическоrо и методическоrо
подхода к изучению процесса растворения rермания.
Нами процесс paCTBope .
ния rермания изучен при на- 28
ложен ни тока II без Hero. Ре-
зул таты обоих методов бы
ли аналоrичны. Скорости ра.
створения рассчитаны по на.
клону кинетических кривых,
выражаЮЩIlХ зависимость
количества растворениоrо
вещества от продолжатель.
ности растворения. Анодные
и катодные поляризацион
ные кривые снимали на Bpa
щающемся дисковом элек-
троде.
При концентрациях от
0,5 до 2 4-H. НNО з абсо-
лютные скорости растворе-
ния rермания достаточно
низКи 0,6.IO 11 3.IO lO
r-атом/(см 2 .С). С повышени
ем концентрации НNО з (начиная с 4-н.) скорость рас-
творения rермаНIIЯ резко увеличивается, а затем умень-
шается вслеДСТВllе паССJlваЦИIl поверхности металла
(рис. 36).
При использовании метода вращающеrося диска уда-
етсЯ достаточно равномерно и быстро отводить продукты
реакции от поверхности растворяемоrо образца. При
сравнительно энерrичном перемеШlIваюш раствора
(495 1172 оборотов диска в минуту) концентрация про.
дуктов восстановления азотной кислоты, оказывающих
каталитическое деЙствие на процесс растворения, вбли-
зи поверхности диска значительно уменьшается и стано-
ВIIТСЯ близкой к концентраЦИII их в объеl\'lе раствора.
Значительное уменьшенпе влияния продуктов Восста.
новления азотноn кис оты позволяет более точно опре-
24
20
16
:. 12
s. 8
4
о
2
12
j")IIC. 36. Зill!ИСИМОСТl> скорости рас-
твuрения rерманиЯ от концентраЦl1Ii
азотной кислоты и скорости враще-
ния диска, об/мин: 1 125; 2 495;
;] 1172
119
делить экспериментальные величины энерrии активации
процесса. В растворах до 8 H. НNО з среднее значение
энерrии активации равно 12,7 + 0,3 ккал/r атом, в более
концентрированных 9,6.
Поляризационные измерения позволили выяснить
причину этих различий. СтационарныЙ потенциал rep
мания с ростом концентрации НNО з становится более
блаrородным, что rоворит об увеличении анодноrо TOp
можения по сравнению с катодным. Соотношение вели
чин уrлов наклона катодных и анодных кривых менЯеr
ся при изменении концентрации НNО з . Это свидетельст-
вует о неодинаковом влиянии анодной и катодной стадий
процесса растворения на ero скорость при различноЙ кон-
центрации НNО з . В достаточно разбавленных растворах
азотной кислоты (0,5 6.o H.) по ходу поляризационных
кривых можно предполаrать катодный контроль процес
са. По мере увеличения концентрации кислоты характер
поляризационных кривых изменяется. При плотностях
тока более 0,4 А/см 2 наблюдается резкое увеличение
анодноrо потенциала, связанное с пассивацией поверхно-
сти электрода. В 11 ,4 H. НNО з процесс пассивации Ha
ступает еще скорее и наблюдается анодная поляризация.
Так как при растворении rермания вначале образует
ся ero двуокись с последующей rидратациеЙ до MeTarep
маниевой кислоты (Н2GеОз), мы предполаrали, что CKO
рость растворения rермания в крепких растворах азот
ноЙ кислоты (> 1 O H.) определяется либо скоростью
окисления металлическоrо rермания и образованием ДBY
окиси (Ge02), либо скоростью rидратации двуокиси rep
мания до метаrерманиевой кислоты. При длительном
(в течение нескольких часов) саморастворении rермания
в этих растворах на поверхности диска невооруженным
rлазом можно видеть пленку двуокиси rермания, обра
зование которой можно объяснить тем, что повышение
концентрации азотной кислоты, резко уменьшая paCTBO
римость двуокиси rермания, приводит и к снижению ско-
рости ее растворения.
Результаты исследования позволяют сделать ВЫАОД
о том, что лимитирующим фактором растворения repMa-
ния в крепких растворах азотной кислоты (> 10 H.) яв-
ляется не скорость окисления поверхностных атомов
rермания до ero двуокиси (так как окислительная способ
ность азотной кислоты растет с повышением ее концен-
трации, а скорость растворения rермания уменьшается)
120
и тем более не скорость диффузии частиц. а скорость
rидратации Ge02 первичноrо продукта, образующеrося
на поверхности металла в процессе ero окисления.
Олово в соляной кислоте
При разработке технолоrических схем комплексноrо
извлечения ряда цветных металлов из вторичноrо сырья
необходимо знать кинетику растворения олова в paCTBO
рах соляной кислоты. Скорость растворения олова изу
чали в зависимости от интенсивности перемешивания,
'-температуры раствора и концентрации кислоты.
. Скорость вращения дис- 90
ка 'изменяли от 125 до
1172 об/мнн. Найденная за-
висимость v от п 1/2 (рис. 37)
выражается во всех случаях
прямой линией, проходящеЙ
через начало координаТI.
Скорость растворения олова
увеличивается с ростом кон-
центрации растворителя (от
1 до 1 O,5 H.) (рис. 38), а при
дальнейшем повышении кон-
центрации уменьшается. Оп-
ределены также скорости
при температарах 15; 25; 35;
45; 550 С и переменных C HC1
и п. По найденным скоро-
стям построены rрафики
уравнения Аррениуса и вы-
числены значения экспери-
ментальной энерrии активации, которые при 125 об/мин
увеличиваются с повышением концентрации кислоты:
rHC1), 11 . ., 1
д Е, I<кал/моль 4, 1
80
...; 70
60
50
1,0
<\>
с., "' 30
::.. 20
10
Рис. 37. Зависимость скорости рас-
творения олова от интенсивностИ
перемешиваиия при различных кон-
ценТрациях соляной кислоты:
1 '-н' 2 3-Н' 3 6-н' 4 9,н .
5 11 ,S:H.; 6 ]0,5-н." .,
3
6,7
6
8,7
11 .5
7,0
9
10,2
При одинаковых концентрациях HCl энерrия актива-
ции уменьшается с увеличением числа оборотов диска:
[HCI], н . . .
п, об/мин . . . 125
{). Е. ккал/моль 6,7
3
475
5,2
1172
3,8
6
125 495
8,7 5,3
9
125 495
10,2 6,4
Анодные и катодные поляризационные кривые сняты
на вращающемся дисковом электроде. Стационарный по-
121
тенцизл олова с увеличением концентрации HCl смеща
ется в область бопее электроотрицательных значениЙ.
Перенапряжение анодноrо процесса незначительно, и он
протекает без заметноrо оrраНl1чения.
Линейная заВИСИ!\fОСТЬ скорости растворения олова от
скорости вращения диска и зависимость тока caMopac
творения от числа оборотоI3 Сl3lfдетсльствуlOТ о диффузи
90
"" 70
50
I
""'
0....
f:::)
: 30
10
2
Рис. 38. Зависимость СКОРОI;ТИ
растворения олова от концент-
рации соляноЙ КИСЛОТЫ при раз-
личноЙ ИНТСНСИВНОСТII псремеши-
паtlИЯ при 250 С. об/мнн: 1 125;
2 495; 3 778; 4 1172
онном характере процесса. Это же подтверждают и вели
чины энерrии активации, полученные при 495 и
1172 об/мин (4 5 Кl<ал/моль).
Считая режим процесса диффузионным, можно пред
положить, что скорость растворения олова лимитируется
скоростыо диффузии НСl к поверхности диска (или про.
дуктов реакции от Hero) .
При 125 об/мин и [HCl] ==:::3 H. (кроме и2, для которой
[HCl] :::= 1 H) получены следующие значения скоростей
процесса растворения, r aTI (см 2 . с) :
V 1 == 1,1 . 1 O 9 ИЗ кинетических кривых при caMopac
творении;
V 2 ==0,72. 10- 9 нз поляризационных кривых по току
само растворения;
v з ==:: 4,6. 1 0 6 по предельному диффузионному пото-
ку водорода;
V 4 === 9,8. 1 o a ПО потоку цианида к поверхности дис
ка (с. 52).
Сравнивая значения скоростей, полученные экспери
ментально при растворении без (и1) и при наложении
122
(и2) тока с рассчитанными по предельному диффузион-
}-!Ому потоку водорода (vз) и по уравнению конвективноЙ
диффузии (и4), видим, что первые два (иl и [12) хорошо
соrласуются между собой, но на три порядка ниже двух
вторых (из и и4) .
Результаты сравнения MorYT вызвать сомнения в
утверждеНИII о диффузионном режиме процесса раство-
рения олова и требуют специальноrо объяснения. Рас.
хождение скоростеЙ можно объяснить образованием
плотных труднорастворимых пленок на поверхности оло
ва. Однако обнаружить пленки на поверхности TpaB.1]eH
Horo диска рентrеноrрафическими и электроноrрафиче.
СКИl\1И методами нам не удалось.
Таким образом, выявлен ряд противоречий. Если пря-
молинейная зависимость v от n l / 2 и четкая зависимость
тока саморастворения от числа оборотов диска свиде-
тельствует о диффузионных оrраничениях, то расхожде.
ние скоростей, рассчитанных (и4) и экспериментально
найденных при саморастворении (иl), не подтверждает
3Toro. Сомнение вызывает и значительный рост экспери
ментальной энерrии активации от 4, 1 ккал/r атом в 1 H.
HCl до 10,2 ккал/r атом в 9-н. HCl при низких
значениях п (125 об/мин). Если первая из них
(4, 1 I{кал/r атом) характерна для процессов, KOHTpO
лируемых диффузией, то вторая (10,2 ккал/r-атом)
для процессов, контролируемых скоростыо самой
химической реакции. При этом важно отметить,
что величИНЫ энерrии активации резко уменьша.
ются с увеличением числа оборотов ДИСI{а. Например,
при 1172 об/мин в 3 H. НС! t..E уменьшается до
3,8 ккал/r атом против 6,68 IIрИ 125 об/мин и т. д. Эти
значения t..E уже БО.1ее убедительно характеризуют про
цессы, контролируемые диффузией.
Итак, с увеличением оборотов диска повышается CKO
рость растворения олова и уменьшается значение экспе
риментальноЙ энерrии активации. Для объяснения этой
закономерности рассмотрим влияние водорода на про.
цесс растворения олова.
Ионы водорода, разряжаясь на активных центрах
поверхности диска, образуют пузырьки rаза и как бы
покрывают всю поверхность rазовой вуалью. При малых
числах оборотов дисн:а (не более 125 в минуту) заметен
как рост отдельных пузырьков водорода, так и обра.зо-
вание плотноЙ rазовоЙ Bya.1fl на I10верхности диска. При
123
более быстром вращении, особенно в концентрирован
ных растворах HCl, наблюдается интенсивное удаление
пузырьков rаза с поверхности диска. Естественно, что
при больших скоростях вращения диска значительноrо
роста пузырьков не наблюдается, а, следовательно, и [a
30вая вуаль в этом случае меньше. Полосы травления,
которые остаются на диске после опыта, по-видимому,
и появляются в результате движения rазовоrо потока на
поверхности вращающеrося диска.
Диффузионный процесс растворения олова представ
ляется нам движением частиц к поверхности диска и
продуктов реакции от Hero через rазовую вуаль, а также
через изъяны в ней. В результате блокирования олова
rазовой вуалью величина поверхности, доступная для
реакции, видимо, во MHoro раз М,еньше поверхности дис.
ка. ЭТИМИ двумя факторами мы и объясняем то, что CKO
рости, полученные при саморастворении, HaMHoro MeHЬ
ше скоростей, рассчитанных теоретически (с. 122).
rазовая вуаль на поверхности растворяемоrо диска
позволяет более определенно rоворить и о причинах воз
никновения концентрационной поляризации. В слабых
растворах HCl олово растворяется медленно, и выделе
ния водорода не наблюдается. rазовая вуаль на диске
устойчива, надежно экранирует ero поверхность, что BЫ
зывает скачкообразное понижение потенциала катодно
поляризуемоrо электрода. По мере Toro, как i!< становит
ся больше ia, т. е. по достижении значительной катодной
поляризации диска, размеры пузырьков, способных yдep
живаться на поверхности электрода, уменьшаются, rазо
вая вуаль становится тоньше, подвижней и в ней появля-
ется большое количество изъянов. При определенных
отрицательных значениях потенциалов размеры пузырь
ков становятся настолько малыми, что практически не
MorYT удерживаться на поверхности: rазовая вуаль ис
чезает и концентрационная поляризация снимается. Pac
творение олова в крепких растворах HCl начинается при
более отриuательных значениях потенциалов, и экрани-
рование диска rазовой вуалью в этом случае Менее за-
метно. Требует объяснения также и уменьшение E с
увеличением интенсивности перемешивзния. Рассмотрим
два случая.
1. Растворение олова при малых оборотах диска.
Толщина rазовоrо слоя на поверхности диска достаточ
но веЛИка. При повышении тсмпературы раствора возра-
124
стает смачиваемость образца, что в свою очередь YMeab
Шает краевой уrол прилипания пузырька к твердоЙ
поверхности. Последнее обусловливает уменьшение раз
меров пузырьков, способных удерживаться на поверхно-
сти диска. Чем выше температура раствора, тем тоньше
rазоВая вуаль и тем больше в неи изъянов.
С повышением температуры увеличивается скорость
диффузии НС! в растворе; но так как диффузия частиц
происходит через запирающиЙ слой rазовои вуали и че
рез изъяны в неи, то скорость растворения олова при
повышении температуры растет быстрее, чем за счет YBe
личения только диффузии частиц в растворе. Поэтому
экспериментальные энерrии активации, полученные при
Малых числах оборотов диска, имеют сравнительно высо-
кие значения.
2. Растворение олова при высоких оборотах диска.
fазовая вуаль в этом случае, как указывалось ранее,
значительно тоньше, и увеличение температуры не ве-
дет к такому резкому уменьшению толщины rазовоrо
слоя, а следовательно, и к росту скорости растворения
олова, как при малых оборотах диска. Эксперименталь-
ные энерrии активации имеют меньшие величины
и приближаются к значениям, соответствующим диффу-
зионному режиму. Поэтому Можно считать, что процессу
растворения олова и в слабых, и в крепких растворах
НСI присущ диффузионный контроль.
Исходя из диффузионноrо характера процесса рас-
творения, нетрудно понять и рост скорости растворения
олова с увеличением концентрации растворителя. Сни-
жение же скорости при концентрации> 10,5-н. HCI сле
дует, по-видимому, объяснять либо пассивацией поверх-
HocTHoro слоя диска в крепких растворах кислоты, либо
значительной адсорбцией водорода на нем, как это, на-
пример, нашел для металлов платиновой rРУППbJ
А. Н. Фрумкин.
rлава з
КИНЕТИКА РАСТВОРЕНИЯ СПЛАВОВ
к важным факторам, влияющим на скорость раство-
рения блаrородных металлов в цианистых растворах от-
носится состав твердой фазы. В связи с этим была изу-
125
чена скорость растворения сплавов золота с серебром
и медью.
1. ЗОЛОТО СЕРЕБРО
Были приrотовлены сплавы, содержащие 75, 50 и
25% (ат.) золота. J\:\етодика приrотовления дисков 11
постановка опытов были такими же, как и с чистыми ме-
таллами. Опыты проводили при концентрации цианида
7,7 .10 З моль/л, заЩИТIIОЙ щелочи 10 З моль/л, давления
кислорода 1 ат, температуре 350 С и числе оборотов ди
ска 1100 в минуту, состав сплава переменный
Кинетические кривые, построенные раздельно для зо
Лота и серебра, линейны на всем протяжении и проходят
через начало координат, т. е. и в этом случае paCTBope
ние золота и серебра из сплава, независимо от состава
последнеrо, rрафически изображается в виде плавных
непрерывных линий. Вид этих кривых свидетельствует
о том, что система Au Ag состоит из непрерывноrо
ряда твердых растворов, что соrласуется с данными ис
следователей, изучаВШIIХ эту систему друrими методами
физико химическоrо анализа.
Для Toro чтобы оценить скорости растворения золота
и серебра из сплава в цианистом растворе, их удельные
скорости растворения были отнесены к единице aTOM
Horo содержания (т. е. пересчитаны на 100% Hoe coдep
жанпе). Вид полученных кривых свидетельствует о
том, Что золото из сплава растворяется быстрее, чем
чистое золото, и тем быстрее, чем больше содержание се-
ребра в сплаве (табл. 7; для 100% Au дана скорость
растворения в диффузионном режиме).
Таблица 7
Скорость растворения золота и серебра из сплавов
Состав СП,l1
ва. % (ат.)
Удел ыl а я скnрость
растворення. ,'. 109,
r-аТОМ/(С\1 2 . с)
УдеJlьная скорость растворения,
Jтнесенная к мплярноА доле компо
I1снта, paBHoii единице. и/NX 109
AlI Ag Ан .\g Ао А!!
100 8,60 8,46
75 25 6,78 2,70 9,04 10,80
50 50 4,86 5,95 9,72 11,90
25 75 3,04 IO, 8 12,16 14,51
100 27,50 27,50
126
с J(овышением содсржания серебра в сплаве CKOpO
сти растворения, отнесеНIIые к 1\I0ЛЯРНОЙ доле металла
в сплаве, растут для обоих металлов. Это объясняется
тем, что при 1100 об/мин чистое золото растворяется
в кинетическом режиме, а серебро в диффузионном.
Следовательно, с повышением содержания серебра 13
сплаве уменьшаются I<инетические осложнения, наблю
даемые при растворении золота. Для уточнения режима
4
Рис. 39. Зависимость скоро-
сти f1i1 створеиия золота из
50%.иоrо сплава с серебром
от IIIIТСНСIIВНОСТИ перемеши-
вания. об/мин: J допре-
дельная область, [I(CN]
1,5 . IO 3 моль/л; 2 заПf1С-
дельная область, [KCNI
1,5 . lo 2 моль/л
<?
з
?2
""
о, .
..1
20 30 1t0
fп
процесса были поставлены две серии опытов при 250 С;
0,21 ат; [КОН] == 10 3 моль/л (рис. 39). В обеих сериях
скорость растворения оказалась прямо пропорциональ
ной числу оборотов диска в степени 0,5, а этот критерий,
как известно, является самым надежным при определе
нии режима процесса.
Следовательно, добавка серебра к сплаву переводит
процесс растворения золота в цианистых растворах из
кинетическоrо режима в диффузионныЙ либо с KOHTpO
лем по цианиду, либо по кислороду.
Далее изучено влияние температуры на скорость
растворения сплава Toro же состава (продувка ВОЗДУ4
хом, 470 об/мин, концентрация цианида 1,5. 1 0 2 моль/л).
При 25; 35 и 450 С найдены удельные скорости paCTBope
ния: 1,69; 2,00 и 2,36.10 9 [ aTOM/CM2.c. Однако посколь-
ку эти опыты НРОВОДИЛИСЬ В запредельной но цианиду
области, в которой скорость растворения зависит и от
температуры и от растворимости кислорода, следовало
.Устранить влияние последнеrо фактора, чтобы более чет
Ко выявить роль диффузии. Для этоrо были вычислены
«приведенные» скорости растворения (V/C o ), а по этим
.величинам составлено уравнение Аррениуса
1 /С == О 6 285 1355
gv, О, т
127
и наЙдена экспериментальная энерrия активации, paB
ная 6,2 ккал/моль. Эта величина значительно ниже, чем
при растворении чистоrо золота (число оборотов диска
640 в минуту), коrда энерrии активации в дo и запре
дельной областях соответственно равны 14,1 ккалjмоль
и 9,77 ккал/моль. Кроме Toro, скорость растворения чи
cToro золота в этих условиях не зависит от интенсивно-
сти перемешивания н пропорциональна давлению кис-
3
1: ,...
I
2 I
I
I
...
f
::;.
о
10 20 30
l((JнцентРОllUЯ цuанur}а
с . 10 J , 110/lЬ/Л
Рис. 40. Зависимость скорости рас-
творен я золота из 50%-иоrо сплава
от КОНЦеНТраЦИИ цнанида
лорода над раствором в степени 0,5, что также отлично
от растворения сплавов.
Кинетика растворения сплавов и чистоrо золота в
диффузионной области (для золота до 150 об/мин) так-
же имеет некоторые различия. При растворении сплава
экспериментальная энерrия активации для области, KOHT
ролируемоЙ диффузией кислорода, равна 6,2 ккал/моль,
тоrда как при растворении чистоrо золота она меньше,
3,67 ккал/моль (с учетом изменения растворимости кис
лорода с температурой). Для выяснения причин этоrо
различия была поставлена серия опытов с переменной
концентрацией цианида при 350 с; 0,21 ат; 640 об/мин и
[КОН]:::= 10 З моль/л (рис. 40).
Как следует из полученных данных, при растворении
50% -Horo сплава нет четкоrо перехода из допредельнои
по цианиду области в запредельную. ТакоЙ вид кривых
характерен для тех случаев, коrда на поверхности диска
образуются толстые и плотные пленки промежуточных
продуктов реакций, создающие дополнительное диффу-
зионное сопротивление, но толщина которых уменьшает-
ся с повышением температуры. При растворении сплавов
золота с серебром такие пленки были заметны невоору-
женным rлазом.
128
Эту систему неоднократно изучали различными фиэл-
ко химическими методами, в результате чеrо установле.
но, что свойства и строение сплавов зависят от режима
их термическоЙ обработки (закалка или отпуск). При за.
калке образуются твердые растворы, а при отпуске хи-
мические соединения AuCu и АUСl1з.
Из химически чистых
металлов были приrотов-
лены сплавы с 75; 50; 25
и 12,5% (ат.) Au. Диски
из этих сплавов либо за-
каливали, либо отжиrа-
ли при 4500 С в течение
12 ч, а затем подrотавли-
вали как обычно. Опыты
проводились при кон-
центрации циаНИДа ка-
лия 7,7. 10 3 И щелочи
1 0 3 моль/л, 35 О С,
1 100 оборотах диска в
минуту и продувке рас-
твора кислородом. При-
сутствие меди, как и се-
ребра, сильно повышает
скорость растворения зо-
лота из закаленных спла-
вов II переводит процесс
из кинетическоrо режима
в диффузионный (рис.
41). При растворенаи отожженных сплавов, содержащих
химические соединения, картина более сложна. При до-
бавке меди до 25% (ат.) скорость растворения золота
повышается в два раза, при дальнейшем увеличении со-
держания меди от 25 до 50% (ат.) снижается, стано-
Вится равной скорости растворения чистоrо золота и
остается постоянной до 75% (ат.) меди, после чеrо на-
Чинает быстро повышаться.
Минимальная скорость растворения золота нз отож-
женных сплавов приходится на область существования
интерметаллидов. Однако поскольку рудное золото
минерал rидротермальноrо происхождения, интерметал-
лидов в нем быть не может и, следовательно, медистое
1. ЗОNОТО МЕДЬ
9 306
30
/{
1/'
у I
" /2 J
.,,
20
j@
?
""
10
;;.
I/и 100 7$
Си О 25
Рнс. 41. Зависимость скорости
растворения золота (/) и меди
(2) от состава сплава (сплошные
JIИННИ для отожженных спла-
вов, ПУНl\тнрные для закален-
ных)
129
золото будет растворяться так же, как и серебристое,
т. е. значительно быстрее, чем не содержащее эти J{ОМПО
ненты.
Опыты же, проведенные с отожженными сплавами,
содержащими интерметаллиды, представляют теорети-
ческий интерес, поскольку полученные диаrраммы типа
состав свойство хорошо соrласуются с данным иссле
дователей, применявших друrие физико химические
методы, в том числе и термодинамические. Следует отме-
тить и тот факт, что химические соединения (в исследо
ванном случае интерметаллиды) растворяются значи-
тельно медленнее, чем обычные твердые растворы.
Таким образом, наличие в составе золотых сплавов
серебра или меди блаrоприятно сказывается на скорости
их растворения процесс переходит из кинетическоrо
режима в диффузионный и, следовательно, появляется
дополнительная возможность ero интенсификации за
счет перемешивания. Однако при растворении сплавов
наблюдаются некоторые особенности. Величины KOH
стант скорости растворения, 50%-Horo сплава Au Ag за-
висят от концентрации цианида и кислорода. При про-
дувке раствора воздухом в запредельной области (избы-
ток цианида) k' 7,O.lO 6 л! (см2.сl/2'0БI/2), или 56% 01
теоретической величины, как и при растворении чистоrо
серебра, а в допредельноЙ области (избыток кислорода)
она ниже 0,53. 1 0 6 или 36,5 % от теоретической, что
вызвано образованием на поверхности сплава более тол-
стых пленок. При продувке через раствор кислорода кон-
станта еще ниже, чем при продувке воздухом 0,33Х
Х 1 O 6, или 23 % от теоретической. Однако максимальная
скорость растворения сплава при продувке кислородом
в три раза выше, чем при продувке воздухом.
Золото медные закаленные сплавы (без интерметал-
лидов) растворяются быстрее золотосеребряных это
особенно заметно в области, контролируемоЙ диффузиеЙ
цианида при продувке через раствор кислорода, коrда
их скорости растворения равны 2,05 и 1,08. 1 0 8 r-атом/
/(см 2 .с).
3. СЕРЕБРО ПАЛЛАдиft
При цианировании руд блаrородных металлов иноr-
да приходится иметь дело с природными сплавами пал-
ладия с серебром. Поведение этих минералов в процессе
обработки руд совершенно не изучено. Кроме Toro, ce
130
ребро и палладий сильно отличаются своим отношением
к химически активным растворителям, поэтому исследо-
вание поведения их сплавов должно представлять инте
рес для теории reTeporeHHbIx реакциЙ растворения.
Как известно, серебро и палладий образуют непре
рывный ряд твердых растворов. Поэтому следует ожи-
дать проявлений как взаимноrо влияния, так и законо
мерностей, характерных для растворения отдельных ком-
понентов сплавов в цианистых растворах. При изучении
химических свойств системы Ag Pd обнаружено их
резкое изменение при содержании 50% (ат.) Pd так
называемая «rраница воздействия», которая лежит OKO
.710 4/8 атомной доли палладия. Можно предполаrать,
что сплавы, более боrатые серебром, будут взаимодейст-
вовать с цианистыми растворами аналоrично ЧИСТОМУ
серебру. Следует ожидать изменений закономерностей
растворения при содержании палладия в сплаве не Me
нее 50% (ат.) и последующеrо приближения к законо
мерностям растворения чистоrо палладия.
Растворение сплава, содержаще20 75 % (а т.) серебра
Контроль процесса растворения вели по оБОIlМ компо-
нентам. Все величины скоростеЙ растворения, вычислен
ные по результатам опытов. отнесены к единице поверх
ности (1 см 2 ) С учетом атомной доли компонента в спла
Ве. Кинетические кривые опытов выпуклые, скорость
растворения сплава уменьшается с увеличением продол
жительности растворения, что объясняется снижением
концентрации цианида в растворе (rидролиз и унос возду
хом или кислородом). Это было установлено специальны
ми опытами и расчетами.
Приведенная скорость растворения, т. е. отношение
количества pacTBopeHHoro в единицу времени металла
к концентрации цианида в растворе, была постоянной
в течение Bcero опыта. Кинетические кривые с достаточ
ной степенью точности MorYT быть выражены уравнением
Q === a't b't 2 ,
(11 )
rде Q количество растворяемоrо металла,
r aToM/cM2;
T продолжительность растворения, с;
а и b коэффициенты, постоянные для данноrо
опыта.
9* 131
Путем математической обработки опытных данных
по методу конечных разностей для каждоrо опыта бы
ли определены }<оэффициенты а и Ь и скорость рас-
творения компонентов сплава при исходной концентра-
ции цианида (она численно равна постоянной а для дан-
Horo опыта). Как уже было отмечено, отношение скоро-
сти растворения в любой момент, вычисленный по
уравнению
dQ
v == === а 2Ь1:,
d1:
К концентрации цианида за тот же отрезок времени оста-
ется постоянным, т. е. постоянна в течение Bcero опыта
(12)
30
i?
...
20
l::
?
с\>
.... 10
::.
r ,
,
'/ 3 .........................Т
/1
о
10 20 ЗА 40
[KCN) 10 З , НОЛЬ/J1
Рис. 42. Зависимость скоро.
СТJI растворения сплава. со-
держащеrо 75% (:1Т.) сереб.
ра. пт концентраЦИII циани-
да при 1'35 об/мин, rKOH]==
,",,1.IO 3 моль/л: 1 250C.
0,21 ат; 2 250 С, I аТ;
З 350С; I dT
И «приведенная скорость» растворения. Эть l\luжет слу-
жить доказательством Toro, что основной причиной
уменьшения скорости растворения с увеличением про-
должительности растворения является убыль концентра-
ции цианида в растворе. В некоторых случаях (высокая
концентрация цианида, низкая температура) выпуклость
кинетических кривых была настолько мала, что в преде-
лах точности опыта их можно было считатъ прямыми,
проходящими через начало координат.
В л и я н и е к о н ц е н т р а Ц и и Ц и а н и с т о r о к а-
л и я. Скорость растворения серебра (рис. 42) сначала
возрастает практически линейно, затем отклоняется. от
линеЙной зависимости и приближается к HeJ<OT9poMY пре-
делу (штриховая линия), что особенно хорошо заметно
в серии опытов, поставленных при 350 С. Штриховая ли-
ния ИМеет небольшоЙ наклон, соответствующий сниже-
нию окислительной способности кислорода в щелочных
растворах, а для серии опытов при 250 С уменьшению
132
максимальной скорости растворения на 5% (вследствие
дифФузионноrо характера процесса, что будет показано
ниже) .
Максимальные скорости растворения равны: 2,6.10 8
и 2,45. 1 0 8 r-атом/ (см 2 . с) при 35 и 250 С, а предельные
концентрации цианида калия соответственно 8,4. 1 0 3 И
9,6.10 3 моль/л, что практически совпадает с предельны-
ми концентрациями, наЙденными при растворении чи-
cToro серебра и меди. На rрафике показаны только ско-
рости растворения серебра. Скорость растворения пал-
ладия в данной п последующих сериях опытов изменяется
по тем же закономерностям, что и скорость растворе-
ния серебра, отличаясь по абсолютным значениям в сред-
нем не более чем на 10% в меньшую сторону (причины
этоrо будут разобраны ниже). В дальнейшем на rрафи-
ках будут показаны только результаты, относящиеся
к серебру (это относится также 1I к сплаву, содержаще-
му 50% (ат.) Pd).
В л и я н и е Д а в л е н и я к и с л о р о Д а. При низких
концентрациях цианида кривые опытов, проведенных с
кислородом и с воздухом, совпадают. Отношение макси-
мальных скоростей составляет 24,5 .10 9 : 5,6. 1 O 9 4,4,
т. е. максимальная скорость растворения пропорциональ-
на давлению кислорода в первоЙ степени. Обе эти зако-
номерности характерны для диФФузионноrо режима.
Влияние интенсивности перемешива-
н и я. Приведенные скорости растворения (и/С) возра-
стают пропорционально корню квадратному из числа
оборотов диска, следовательно, сплав растворяется в
диффузионном режиме при всех исследованных интен-
сивностях перемешивания. Константы скорости реакции
растворения равны 8,5.10 7 л/(см 2 .с 1 / 2 '0б 1 /:2) при 25 0 С
и 1,04. 1 O 6 при 350 С. Эти величины несколько выше,
чем константы скорости растворения чистоrо серебра
(см. с. 43).
В л и я н и е т е м пер а т у р ы. Данные для 25 и
350 С взяты из предыдущеЙ серии опытов. Дополнитель-
но были поставлены опыты при 45 и 550 С (n
535 об/мин, концентрация цианида 2,8 3,0. 10 З и ще-
лочи 10 З моль/л, давление кислорода 1 ат).
По rрафику Аррениуса найдены уравнение зависимо-
сти константы скорости реакции растворения от Темпе-
р а тур ы
800
19k === 3,387
т
lЗЗ
и экспериментальная энерrия активации реакции
3,66 ккалjмоль, тоже характерная для диФФузионноrо
режима процесса растворения и численно совпадающая
с величиной энерrии активации при растворении чистоrо
серебра.
Опыты показали, что скорость перехода серебра в
раствор несколько выше, чем палладия, и зависимость
скорости растворения сплава от концентрации цианида
нелинейна при высоких концентрациях последнеrо. При-
чину этоrо следует искать или в точности химическоrо
анализа, или в некоторых особенностях процесс а раство-
рения сплава.
Дело в том, что после опытов на поверхности диска
заметна белая или желто-бурая пленка. Белая пленка
это, видимо, цианид палладия, а желто бурый цвет ха-
рактерен для ero кислородных соединений. Эти пленки
не MorYT быть стерты с поверхности диска. Точность ана-
лиза была проверена и оказалась достаточной, провере-
на была и rOMoreHHocTb сплава.
По-видимому, осложнения вносят, как это будет по.
I{азано далее, именно пленки, образующиеся на поверх-
ности диска, хотя расхождение между скоростями рас-
творения серебра и палладия не превышают обычно 10%,
а при высоких концентрациях цианида и Toro меньше.
Предельная концентрация,цианида калия остается та-
кой же, как и при растворении серебра и меди. Констан-
та скорости реакции растворения изученноrо сплава не-
сколько больше, чем для чистоrо серебра, и примерно
равна константе скорости растворения .золота, но все же
меньше теоретической, что связано опять-таки с образо
ванием пленок на поверхности диска, создающих допол-
нительное сопротивление диффузии реаrирующих ве-
ществ.
Этим же можно объяснить и нелинейный характер
зависимости скорости растворения от концентрации циа-
нида в растворе. Энерrия активации близка к найден-
ным при растворении серебра и меди в цианистых рас-
творах значениям, и в изученных пределах интенсивности
перемешивания также не обнаружена область кинетиче-
cKoro режима растворения.
Основным расчетным уравнением для концентраций
цианида калия, при которых еще сохраняется линейная
зависимость скорости растворения от концентрации, MO
жет служить
13-!
Q == kSCп 1j2 NL.
(13)
Это уравнение отличается от (4) только сомножите-
лем N молярной долей компонента в сплаве и позво
ляет рассчитывать скорости растворения серебра и пал-,
ладия для сплавов, содержащих до 30 40% (ат.) Pd.
При более высоких концентрациях цианида калия CKOpO
сти растворения целесообразно определять по приведен
ным rрафикам.
Растворение сплава, содержащесо 50% (ат.) серебра.
Исходные кинетические кривые подобны таковым для
сплава, боrатоrо серебром. rеометрически они анало-
rичны, но степень их кривизны больше, чем это следова-
ло бы из убыли цианида в растворе. На основании дан-
Рис. 43. 3ависимось приведениоi1
скорости растворения сплава
при 350 С, 1 ат, [KCN] 4.7X
Х lO З моль/л, [к.OН] l,OX
Х lO З моль/л. содержащеrо 50%
(ат.) серебра. от скорости вр l-
щения диска. об/с
1,0
<о
о
4
ных, приведенных на рис. 43, может создаться впечатле
ние, что с увеличением числа оборотов диска до более
250 в минуту процесс переходит в кинетическую область,
коrда скорость растворения не зависит от интенсивности
перемешивания (см. штриховую линию на рис. 43). Од-
нако два обстоятельства заставляют усомниться в этом.
Во первых, и это самое rлавное, на поверхности диска
ясно видны фиrуры травления самое надежное ДOKa
зательство диффузионноrо режима (они сохраняются
даже под пленками видны, если пленка тонка, и про-
являются после стирания толстой пленки). Во-вторых,
экспериментальные точки располаrаются несимметрич-
но. Если провести кривую с охватом всех точек (сплош-
ная линия), то ровной rОРИЗ0нтальной площадки, харак-
терной для кинетическоrо режима, обнаружить нельзя.
Поэтому следовало изучить влияние тех факторов,
которые позволяют более обоснованно сделать ВЫВОД о
1З5
характере процесса. С этой целью проведены опыты при
различном числе оборотов диска (140 и 1030 об/мин),
различном давлении кислорода над раствором (0,21 и
1 ат) при 350 С и переменноЙ концентрации цианида.
Оказалось, что максимальная скорость растворения пря-
мо пропорциональна давлению кислорода над раствором
в первоЙ степени (2,58.10 8:5,6.10 9 4,61 при
1030 об/мин и 9,7.10 9:2,15.10 9 4,51 при 140 об/мин,
что равно отношению давлениЙ кислорода над paCTBO
ром 1,0: 0,2095 4,77). Таково первое доказательство OT
сутствия кинетическоrо режим а.
Отношение максимальных CKopocTei'r растворения
при различных числах оборотов диска равно отношению
чисел оборотов в степени 0,5 (2,58. 1 0 8 : 9,7. 1 0 9 2,66
с кислородом и 5,6.10 9:2,15.10 9 2,61 с воздухом; ве-
личина, вычисленная из отношения чисел оборотов, рав-
на 2,71). Однако характерно, что эта зависимость, ти-
пичная для диФФузионноrо режима, получается только
при сравнении максимальных скоростеЙ растворения,
полученных при избытке цианида в растворе. Эта осо-
бенность (как мы увидим далее, вызванная образовани-
ем пленок на поверхности диска) и создала ложное пред-
ставление о возникновении кинетическоrо режима. Пре-
дельная концентрация цианида калия для сплава с
50% (ат.) Ag такая же, как для сплава с 75% (ат.) Ag
и для чистоrо серебра.
Таким образом, три основных критерия (зависимость
от давления кислорода в первой степени, от числа оборо-
тов диска в степени 0,5 и наличие фиrур травления) поз-
воляют утверждать, что процесс растворения сплава с
50 % (ат.) Ag протекает в диффузионной области.
Однако влияние концентрации цианида на скорость
процесса требовало дальнеЙшеrо изучения, для чеrо бы-
ла поставлена большая серия опытов при различных
температурах (от 25 от 450 С), концентрации цианида от
1 . 10 3 до 0,08 моль/л и скорости вращения диска, равной
1030 об/мин. Опыты показали, что зависимость скорости
растворения от концентрации цианида очень сложна.
Кинетические !<ривые в большинстве случаев линейны.
так как температура опытов была невысока, а KOHцeHT
рации цианида высоки. Выпуклость кривых была замет-
на при высоких температурах и низких концентрациях
цианида; в этом случае кривые были подверrнуты опи-
санной вЫше математической обработке.
136
Как и при растворении сплавов с 75% (ат.) Ag, на
поверхности дисков образуются желто-бурые пленки, но
значительно более толстые, I{OTOpbIe являются основной
причиной возникающих осложнениЙ. Кривые, выражаю
щие зависимость скорости растворения сплава от кон-
центрации цианида, при различных температурах сбли-
жаются в области ВЫСОКИХ концентрациЙ цианида. Это
является последним, четвертым, доказательством отсут-
ствия кинетическоrо режима, так как при высоких кон-
центрациях циан ида скорость процесса растворения
сплава определяется концентрацией 02 в растворе.
Как известно, с повышением температуры увеличива-
ется скорость диффузии кислорода, но снижается ero
растворимость. В результате влияния этих противопо-
ложно действующих факторов максимальная достиrае-
емая скорость растворения очень мало увеличивается
с повышением температуры, конечно, в том случае, Kor-
да скорость растворения определяется скоростью диффу-
зии кислорода. Это является доказательством Toro, что
растворение сплава с 50% (ат.) Pd протекает по диффу-
зионному I\lеханизму.
С целью определения констант скоростеЙ и энерrии
активации в до предельной области концентраций циани-
да была проведена дополнительная серия опытов при
различных температурах (35 650 С). Условия опытов:
СК0РОСТЬ вращения диска 530 540 об/мин, давление кис-
лорода 1 ат, концентрация цнанида ниже 4. 1 о з моль/л,
концентрация защитноЙ щелочи 10 З моль/л.
Экспериментальные точки характеризуются довольно
значительным разбросом и слабо криволинейной зави-
симостью скорости растворения от концентрации циа-
нида, что объясняется сложным влиянием образующихся
на поверхности ДIIСI\ОВ пленок, которые даже на равно-
доступной поверхности получаются несколько различны-
ми по проницаемости. Однако, учитывая широкий тем-
пературный интервал и большое число опытов, можно
подсчитать некоторые средние значения констант скоро-
стей и энерrии активации. Константы скорости раство-
рения при 35; 45; 55 и 650 С соответственно равны: 0,7,
09 11 И 135.10 6л / ' ( см2.с]/2.0б]/:2 )
, " , ..
Зависимость константы скорости от температуры мо-
жет быть выражена уравнением
990
19k == 2,942 .
т
137
Вычисленная из этоrо уравнения энерrия активации по
рядка 4,5 ккал/моль, но ее следует рассматривать только
как величину, качественно характеризующую процесс
растворения сплава, так как она отражает сложное влия
ние температуры как на скорость растворения металла
и пленки на ero поверхности, так и на проницаемость
этой пленки. Однако наЙденное значение энерrии актива
. ции ближе к таковой для диф-
20 фузионноrо, чем для кинети
ческоrо процесса.
Рассчитанные величины
констант скоростей при 250 С
равны: для сплава с 75% (ат.)
Ag 0,95. 1 0 6 И для сплава с
50% (ат.) АgО,79.10 6л/(см2><
>< с 1 / 2 . об'/2), а эксперименталь-
ные значения 0,85.10 6 и 0,55><
><10 6 соответственно, что co
ставляет 90 и 70 % от теорети
ческих значений. На поверх
ности дисков из сплава, более
боrатоrо палладием, образует-
ся более толстая пленка (это
обнаружено визуально), что и
ПРИВОДI1Т К уменьшению CKO
рости растворения. Однако
надо отметить, что сплав с
50% (ат.) Ag все же раство-
ряется несколько быстрее чи-
cToro серебра (0,68. 1 0 6 или
57% от теоретической величины).
Растворение сплава, содержаще20 15% (ат.) серебра.
Кинетические кривые в основном подобны кривым для
ЧIIстоrо палладия. На рис. 44 по оси ординат отложены
скорости растворения палладия с учетом ero атомной
доли в сплаве. Скорость растворения серебра подчиняется
тем же закономерностям, отличаясь по абсолютным зна
чениям на 10 12% в большую сторону и Меньшей CTa
бильностью результатов, что объясняется меньшей точ
ностью определения в этих растворах.
Как и при растворении палладия, зависимость CKOpO
сти растворения этоrо сплава от концентрации цианида
нелинейна. Основное отличие заключается в том, что
сплав растворяется значительно быстрее чистоrо палла-
16
t't
12
8
J
с\)
0.'" 4
о
Рис. 44. Зависимость скоро-
сти растворения сплава, со.
держащеrо 15% (ат.) сереб-
ра, от концентрации цианида
при 350 С. 1 ат и СКОРОСТII
Вf1ащення диска, об/мин: Ы
(1) и 1014 (2)
138
дия, одни и те же скорости MOrYT быть AOCTHrHYTbI при
значительно более низких концентрациях циан ида. OДHa
ко качественное подобие закономерности сохраняется,
В заключение следует подчеркнуть, что при исследо
вании столь сложных процессов, как растворение спла
вов палладия, да еще осложненных образованием упор-
ных пленок, получить, воспроизводимые результаты и
дать им объяснение удалось только блаrодаря примене-
нию метода вращающеrося диска. Любые друrие методы
обеспечить этоrо не Mor ли.
В процессе исследования не обнаружено перехода
растворения в кинетическую область при повышении co
держания палладия в сплаве от 25 до 50% (ат)., хотя это
можно было ожидать, учитывая «rраницы воздеЙствия».
По видимому, это связано и с изменеНllем «блаrородст
ва» металлов в цианистых растворах: стандартные по
тенциалы серебра и палладия в отсутствие комплексооб-
разователей равны+О,799 и +0,987В, 'а в цианистых ра-
створах 0,43 и 0,71 В, т. е. в первом случае палладии
На 0,2 В блаrороднее серебра, а во втором на 0,3 В
менее блаrороден. Относительное смещение потенциалов
почти на 0,5 В приводит к тому, что в контакте с сереб
ром процесс окисления палладия в цианистых растворах
не является лимитирующеЙ стадией растворения сплава.
В электрохимической стадии процесс а может проте
кать только эквивалентное окисление компонентов спла
ва, так как поверхностные слои более медленно окисля-
ющеrося компонента будут защищать более rлубокие
слои менее блаrородноrо компонента. Переход же в ра-
створ ионов обоих компонентов определяется несколько
иными факторами для паллаДIlЯ это будет скорость
растворения окисноЙ пленки в цианистых растворах, ко-
торая несколько замедлена и протекает с несколько
большеЙ энерrией активаЦIlИ. Это, в частности, под
тверждается и пониженными концентрациями палладия
в растворе по сравнению с концентрациями серебра.
Электрохимическая стадия не лимитирует скорость
процесса растворения, поскольку он протекает в диффу-
зионной области, однако некоторое тормозящее действие
оказывают пленки окисленных соединений палладия, об-
разующиеся в процессе растворения на поверхности
сплава. Их действие тем заметнее, чем интенсивнее про-
текает процесс растворения (увеличение концентрации
цианида в допредельной области, увеличение числа обо-
139
ротов диска и т. д.), И это вызывает некоторое искаже-
ние закономерностеЙ, характерных для обычноrо раство-
рения, контролируемоrо только диффузией реаrирующих
веществ. Осложнения, вызываемые пленками, позволя
ют применять расчетные уравнения в оrраниченных пре-
делах и только для сплава, содержащеrо около
75% (ат.) Ag.
%
60
40
20
О I/f} 20 40 40
Рис. 45. Зависимость скорости раствореlll;Я серебропал
ладиеВLlХ сплавов (% от расчетной) от состава Сl1лава
при lО[4(а) и 67(6) об/мин и концснтрациях циаНИД.I.
моль/л: I 1 . 10 2; 2 2 . IO 2; 3 5 . IO 2H 4 [О . IO 2
Однако некоторые общие особенности диффузионно-
ro растворения металлов в цианистых растворах с кисло
родной деполяризацией, изложенные выше, остаются в
силе и для сплавов системы Ag Pd: зависимость скоро-
сти растворения от интенсивности перемешивания рас-
твора, от давления кислорода над раствором, наличие об-
ластей, в которых скорость растворения контролируетсп
цианидом или кислородом, наличие предельной концент-
рации цианида, фиrур травления. Несколько отлично
влияние температуры (температурный коэффициент и энер
rия активации у сплава с 50 % (ат.) Pd несколько выше,
чем у сплава с 25 % (ат.) Pd или чистоrо серебра) и кон-
центрации цианида в растворе. Зависимость скорости
растворения от концентрации цианида отклоняется от
линейной. Объяснить это можно тем, что для серебро-
палладиевых сплавов зависимость между скоростью ра-
створения и концентрацией цианида более сложна, чем
для серебра. Если рассматривать обе области до- и
140
запредельную по цианиду, то Можно отметить, что кои
тролирующий скорость растворения фактор в зтих двух
областях различен, различен и результат ero действия.
В допредельной области кислород имеется в избытке, и
с повышением концентрации цианида возрастает CKO
рость растворения и толщина образующейся на поверх-
ности сплава окисной пленки, которая и вызывает Hapy
шение линейной зависимости между скоростыо paCTBO
рения и концентрацией цианида. В запредельной обла
сти налицо недостаток кислорода и избыток цианида,
который способствует удалению пленки с поверхности
диска и достижению максимальной скорости растворе.
ния. Из сказанноrо становится ясной важность правиль-
Horo выбора концентрации цианида при растворении се-
ребропалладиевых сплавов.
На рис. 45 приведены кривые типа состав свойство
для серебропалладиевых сплавов.
4. СЕРЕБРО РТУТЬ
Были изучены амальrамы серебра, так как они явлЯ-
ются сплавами двух металлов с различными кинетичес-
кими свойствами (растворение серебра в цианистых pa
створах протекает в диффузионном режиме, а ртути в
кинетическом) и различным положением в ряду напря-
жений. Эти металлы образуют, кроме Toro, интерме
таллические соединения. Было интересно выяснить, свой-
ства KaKoro из компонентов определяют кинетику ра-
створения .сплава.
Следует отметить, что изучение 3Toro вопроса имеет
и определенное практическое значение, так как техноло
rический процесс амальrамации до сих пор при Меняют
при обработке руд блаrородных металлов, правда, сей-
час уже как вспомоrательный. Амальrамацию применя
ют также при измельчении руд или концентратов в циа
нистых растворах, способных растворять как свободные
блаrородные металлы, так и амальrамированные.
Для ведения технолоrическоrо процесса очень важно
знать соотношение скоростей растворения обоих метал-
лов. Но даже если процесс цианирования следует за
амальrамацией, проводимой в воде, в контакт с paCTBO
рителем вступают, кроме частиц свободноrо золота, и
снесенные частицы хрупкой и леrко переизмельчаемой
амальrамы или золотинки, частично освобожденные от
141
пустой породы, поверхность которых покрыта тонким
слоем ртути. Блаrородные металлы в таких формах pac
творяются очень медленно, и это является одной' из oc
новных причин потерь металла в хвостах.
Однако работ, посвященных изучению скорости pa
створения амальrам блаrородных металлов в цианистых
растворах, несмотря на их большое практическое значе
ине, очень мало.
Полужидкие и жидкие амальrамы серебра были ис-
следованы методом «обратноrо» диска (см. с. 22).
Изучение скоростей растворения твердой амальrамы
и металлическоrо серебра методами прямоrо и «обрат
Horo» диска позволило оценить влияние интенсивности
перемешивания в обоих случаях и определить зависи-
мость скорости растворения от числа оборотов им-
пеллерноЙ мешалки, необходимую для расчетов при Мо-
делировании процесса растворения. Так, например, при
растворении серебряноrо диска в растворе, содержащем
6, I.IО З моль/л цианида, при зазоре между поверхностью
металла и мешалкой, равном 15 мм, были получены сле
дующие скорости растворения при 150; 283 и 646 об/мин:
0,67; 1,0 и 2,1.10 8 r-атом/см 2 .С. По этим данным най-
дено уравнение скорости растворения серебра,
Q == 0,56 .IO 6 SCпO. 7 J, 'Т'
в котором интенсивнОсть перемешивания выражена, KaI{
обычно, в оборотах в секунду. Величина константы ско-
рости растворения мало отличается от полученной мето-
дом вращающеrося диска (0,68. 1 0 6), что свидетельст-
вует об удачном подборе зазора, но показатель степени
у сомножителя п (число оборотов диска) знаЧIlтельно
больше (0,74 вместо 0,5), вследствие заметной турбулиза-
ции потока при работе импеллерноi'I мешалки.
Найти константы скорости для жидких амальrам мо-
жно из npocToro соотношения k /k ==k /k , в котором
k д и k M константы скорости, полученные методами
вращающеrося и обратноrо диска, а индексы штрих и
два штриха означают жидкую амальrаму и металличес
кое серебро. В наших опытах k : k == 1,22. Конечно,
этим соотношением можно пользоваться только в том
случае, коrда растворение серебра и жидкоi'[ амальrqМЫ
при перемешивании раствора мешалкой проведено в од-
них и тех же условиях.
142
Растворение твердой амаАЬёамы серебра( 'I( фазы)
р а с т в о р е н и е п р е Д в а р и т е л ь н о а м а л ь r а м и
рованных серебряных дисков
Изучение скорости растворения амальrамированноrо
серебра проведено на дисках, натертых избыточным ко-
личеством ртути и выдержанных при температуре 25 и
1000 С в течение 1 О суток до полноЙ диффузии ртути
внутрь дисков, на поверхности которых образовался слой
химическоrо соединения Аg з Нg 4 ('I( фазы). Опыты ПрОБе-
дены в следующих условиях: температура 250 С, давле-
ние кислорода над раствором 1 ат, рабочая поверхность
диска 3,05 см 2 , концентрация цианида 7,5. IО З моль/л,
интенсивность перемешивания 700 9IO оборотов диска
в минуту.
Кинетические кривые, характеризующие скорость ра-
створения, сначала имеют прямолинеЙный участок (пока
на поверхности присутствует интерметаллическое соеди
нение), а при увеличении продолжительности растворе-
ния становятся более полоrими. Начальная скорость ра-
створения практически не зависит .от Toro, были ли дис-
ки предварительно выдержаны при высокоЙ температуре
или нет, но в обоих случаях ОНа в 1 5 20 раз меньше
скорости растворения чистоrо серебра в тех же условиях.
Для выяснения причин малой скорости растворения
и' уменьшения ее во времени была поставлена следующая
серия опытов.
В л и я Н и е с о с т о я Н и я n о в е р х н о с т и. Пред-
варительными опытами установлено, что при растворе-
нии твердых амальrам серебра даже одинаковоrо фазо-
Boro состава наблюдается непрерывное уменьшение ско-
рости растворения во времени за счет обоrащения их
ртутью, что затрудняет вычисление скорости растворе-
ния. Следует отметить, что аналоrичное явление наблю-
далось и при растворении друrих соединений.
ДЛЯ ТОТО чтобы свести это осложнение к минимуму,
была изменена методика подrотовки дисков. Если в пер-
вых опытах диски из твердых амальrам серебра были
отшлифованы, протравлены в цианистом растворе и под
BeprHYTbI MHoroKpaTHoMY растворению без дополнитель
ной обработки их поверхности между опытами, то в по-
следующих опытах диски растворяли в аналоrичных yc
лов иях, но перед каждым опытом снимали поверхност-
ный слоЙ толщиноЙ O,5 I,O мм, обезжиривали и травили
143
подrотовленную поверхность. Эта подrотовительная опе
рация позволила уменьшить колебания скорости раство-
рения с 30 40% до 6 10%и повысить воспроизводи-
мость результатов.
В л и я н и е 11 н т е н с и в н о с т и пер е м е ш и в а.
н и я. Опыты проведены в стеклянном сосуде при 250 С,
давлении кислорода 1 ат, концентрации цианида 7,4. 1 о з
и КОН 10 З моль/л; числе оборотов диска в минуту от
60 до 953. Кинетические кривые линейны и проходят че
рез начало координат. Скорости растворения повышают
ются с увеличением числа оборотов диска очень незначи-
тельно: 4,0; 4,34; 4,37; 4,95 и 5,40. 10 5 r aToM/ (см 2 . с)
соответственно при 60; 150; 288; 645 и 953 об/мин. Такая
же величина (4,40.10 9) получена и в автоклаве при
1400 об/мин с применением методики обратноrо диска.
Некоторое незначительное повышение скорости paCTBope
ния в данной серии опытов не связано с rидродинами-
кой процесса, а объясняется, по-видимому, субмикрон-
ным растворением не очень хорошо спрессованных образ-
цов амальrамы при интенсивном перемешнвании.
Независимость скорости растворения от интенсивнос-
ти перемешивания является первым доказательством '1'0-
ro, что растворение амальrамы Сv-фазы) протекает в
кинетическом режиме, коrда скорость процесса в целом
определяется скоростью самой химической реакции, а не
диффузией peareHToB к поверхности растворяемой твер-
дой фазы.
В л и я н и е к о н ц е н т р а Ц и и Ц и а н и Д а и Д а в-
л е н и я к и с л о р о д а. Характер зависимости скорости
растворения от концентрации цианида (рис. 46) такой
Же, как и при растворении блаrородных металлов:
в области концентраций цианида до 6,8. 1 о з моль/л CKO
рость процесса не зависит от давления кислорода над
раствором, прямо пропорциональна концентрации циани
да, а приведенная скорость растворения (отношение
и/С) равна 0,65. 1 0 6 л/ (см 2 . с); при более высоких (за-
предельных) концентрациях цианида скорость растворе-
ния мало зависит от ero концентрации.
Максимальные скорости растворения определяются
давлением кислорода над раствором: они равны 2,0;
4,4 и 6,3. 1 0 9 r-аТОМ/СI\l2. с при давлениях кислорода 0,21;
1 и 2 ат и, следовательно, пропорциональны изменению
давления в степени 0,5 (отношения скоростей равны от-
ношению давлениЙ в степени 0,5).
144
Предельная концентрация цианида при давлении 1 ат
равна 6,8.10 3 моль/л, а при друrих давлениях изменя-
ется тоже пропорционально давлению в степени 0,5 (при
продувке через раствор воздуха она равна 3,1 Х
XI0 3 моль/л).
Зависимость скорости растворения от давления кис-
лорода в степени 0,5 является вторым доказательством
1,0
t.
0,004 0.008 0,072 0.016 0.020
[KCNJ J /'fОЛЬ/Л
6,0
.... 5,0
-...
4,0
I 3,0
t\)
0....
; 2р
о
Рис. 46. Зависимость скорости растворения
серебра (1, 2, 3) и ртути (1'. 2', 3') ИЗ твер-
дой амальrамы состава l' фазЫ при 250 С
и 930 об/мин от концентрации ЦИанида и
давления кислорода над раствором, ат: J и
J' 0,21; 2 и 2' 1,0; 3 и 3' 2,0
протекания изучаемоЙ реакции в кинетическом режиме.
Поскольку скорость реакции не заВИСIlТ от интенсивно-
сти перемешивания, приведенная скорость растворения
является и константой скорости реакции для допредель-
ных концентраций цианида.
На рис. 46 приведены также скорости перехода в ра-
створ ртути из той же амальrамы (кривые 1', 2' и 3')
для указанных условий опытов. Ртуть растворяется зна-
чительно медленнее серебра: при концентрациях цианида
Ниже предельных константа скорости равна 0,13. 1 О б
л/ (см 2 . с), т. е. в 5 раз меньше, чем для серебра. Предель-
ные концентрации цианида 11 зависимость скорости от
давления кислорода для ртути такие же, как и для се-
ребра. Это объясняется тем, что стадиеЙ, определяющеЙ
1 O 306
145
скорость процесс а в целом, является растворение интер
металлическоrо соединения (i' фазы), а различие CKOpO
стей перехода в раствор серебра и ртути связано с нало-
жением на первичную реакцию растворения вторичной
реакции цементации ртути, в результате которой скорость
перехода серебра в раствор увеличивается дО 0,65Х
XI0 6 л/(см 2 .с), а ртути уменьшается дО 0,13Х
Х 1 0 6 л/ (см 2 . с). Эта вторичная реакuия, кроме Toro, BЫ
зывает обоrащение твердоЙ фазы ртутью и постепенное
уменьшение скорости растворения амальrамы.
В л и я н и е Щ е л о ч н о с т и р а с т в о р а. Условия
проведения опытов: температура 250 С, давление кисло-
рода 1 ат, число оборотов диска в минуту 930, KOHцeHT
рация цианида 6,7. IО З моль/л, щелочность раствора пе
ременная.
Характер зависимости скорости растворения серебра
от щелочности раствора для i' фазы примерно такой же,
как 11 для блаrородных металлов (с. 48, рис. 11) в об
ласти рН === 10712 уменьшение скорости растворения He
значительно около 2,3% на единицу рН, а затем Ha
ступает резкое падение скорости растворения, связанное
с возникновением кинетических осложнений при восста-
новлении кислорода и образованием окисных пленок на
поверхности твердой амальrамы.
В л и я н и е т е м пер а т у р ы. Изучение влияния
температуры на скорость растворения необходимо не
только для Toro, чтобы выяснить, насколько можно ин-
тенсифицировать процесс, но и для получения дополни
тельных сведений о ero механизме. Опыты (рис. 47)
-z{v
.
8,30
8,40
8.50
8,60
8,70
8,80 J 10 3,20
Рис. 47. ЗаВИСII IOСТЬ Jl0rарифма
скорости раствореиия серебра из
твердой амальrамы состава ,\, фазы
от температуры при 1 ат,930 об/мии,
r кон!"" 10 3 моль/л И концентрациях
циаlJида 3,7. 10 З (1) и 7,2. 10 3
ЗО 3,40 3-50 !()ОО/Т (2), моль/л
проведены с твердой амальrамой (у-фазой) при про-
дувке через раствор кислорода.
Установлено, что влияние температуры на скорость
растворения одинаково при различных концентрациях
цианида в растворе. При температурах до 350 С ско.
146
рость растворения зависит от температуры (энерrия
активации равна 4,9 ккал/моль), а выше 350 С уже не
зависит. Хотя энерrия активации при 250 С и не очень
веЛИI<а, но она примерно такая же, как и при paCTBope
нии сульфидов серебра и меди в цианистых растворах.
Постоянство скорости растворения при более BЫCO
ких температурах явление, отмеченное нами при изу
чеНии кинетики растворения ртути в цианистых paCTBO
рах (с. 75), характерно для сложноrо мноrостадийноrо
процесса.
Выщелачивание порошкообразной ама-
л ь r а м ы с е р е б р а с о с т а в а ,\, фазы.
Условия опытов: температура раствора 250 С, дав-
ление кислорода 1 ат, концентрация цианида 2,4.
.10 2 моль/л, навеска амальrамы 4,0 r, общая продол-
жительность выщелачивания в стакане с мешалкой 49 cy
ток. Через каждые 5 11 суток раствор отделяли от
амальrамы и определяли в нем содержание серебра и
Таблица 8
Скорость выщелачивания порошкообразной у-фазы
в цианистом растворе
Продолжительность ВLlЩСJlа. Средняя СКОрОСТЬ Отиошение 1<0-
Очеред- чивания, ч растворення
н"сть (! . 104, r-атом личества рас-
растворе- I в сутки твореиных
ния в данном суммар- серебра
опыте ная I и ртути
Ag Hg
1
2
3
4
5
6
168
163
113
216
264
124
168
331
444
660
924
1048
13,86
4,70
1,45
0,92
0,78
0,62
0,90
0,84
0,41
0,41
0,41
0,39
15,4: 1
5,6: 1
3 , 54: 1 *
2,24: 1
1,90: 1
1,59: 1*
'" Содержание ссребра в твердом остаткс после TpeXKpaTHoro выщелачива-
ния 20,09%. послс шестикраТllоrо 14,63%.
ртути, а в стакан заливали свежий раствор Toro же coc
тава. Периодически проводили анализ твердой фазы.
Результаты анализов приведены в табл. 8.
Микроrрафическое и'сследование твердоrо остатка
после каждоrо выщелачивания показало непрерывное
изменение структуры амальrамы: рост кристаллов твер-
10*
147
дой амальrамы и накопление между ними свободной
ртути. Частицы твердой амальrамы при выщелачивании
постепенно обоrащаются ртутью и собираются в сферо
литы размером 0,1 0,5 мм, сливающиеся в дальнейшем
в один комок, из KOToporo можно отжать капли ртути.
По мере выщелачивания серебра и обоrащения амаль
raMbI ртутью кинетические кривые приобретают линей
ный характер и приближаются к кривым скорости paCT
ворения ртути.
Растворение а.мальсам с apYcllJrt содержанием серебра
Поскольку основные закономерности растворения
амальrам серебра в цианистых растворах были деталь
но выяснены при исследовании ,\, фазы, амальrамы дpy
roro состава были IIзучены менее подробно. Была опре
ределена только зависимость скорости растворения
1з юд
7,5
5Л
;;.
2
о
з
о,иl() 020 0,030
[KCN] IfОЛ6/Л
Рис. 48. Зависимость скорости рас-
творения при 250 С. 1 ат серебра
и, 2) и PTYTII (3) от КОlIцс'нтраЦИII
цианида для полужидких амальrам
с различным содержанием серебра,
% (ат.): I 17,24, 2, 3 8,62
аМальrаl\I, содержащих 8,62 и 17,24 % серебра от
концентрации цианида, чтобы иметь возможность BЫ
числить константы скорости реакции их растворения
(рис. 48) .
Характер кривых v == f (С) такой же, как и для ,\, фа-
зы. Для I{онцентраций цианида меньше предельных KOH
станты скорости растворения амальrам, содержащих
8,62; 17,24 и 40,62% серебра, равны 0,10; 0,19 и
0,90.10 6 л/(см 2 .с). Предельная концентрация цианида
для 8,62% -ной амальrамы такая же, как для ,\, фазы,
6,8.10 3 I\lOльjл, а для [З фазы 7,4.10 3. Скорости раство-
рения обеих индивидуальных фаз (,\, и (3) примерно про
порциональны молярной доле в них серебра. Амальrа-
мы, содержащие 8,62 и 17,24% серебра, растворяются
значительно медленнее, поскольку содержат избыточную
148
ртуть. Для них отношение констант скорости к молярной
доле серебра (0,68. 1 0 6) В 2,2.') раза меньше, чем для
чистых,\, и фаз.
Конечно, ожидать cTpororo соблюдения этоrо COOT
ношения для амальrам не приходится, так как они яв
ляются rетероrенными системами и ИХ взаимодействие
с растворами цианида является сложным процессом
(растворение и цементация). Однако опыты ясно пока
зали, что избыток жидкой ртути сильно тормозит paCT
ворение се,ребра. Становится понятным отмеченное ра-
нее уменьшение скорости перехода серебра в раствор по
мере увеличения продолжительности растворения, так как
ртуть вследствие ее цементации переходит в расТВОр в
меньшем количестве, чем серебро. В амальrаме постепен
но увеличивается избыток ртути, система становится
rетероrенноЙ, а для нее характерно меньшее значение
константы скорости реакции.
Следует отметить, что поскольку при растворении
амальrам различноrо состава предельная концентрация
цианида примерно постоянна, максимальная достиrае-
мая скорость растворения серебра тем меньше, чем
меньше константа скорости реакции (V N == kC n ) или со-
держание серебра в амальrаме. Для разбавленных reTe-
poreHHbIx амальrам молярная константа скорости peaK
ции растворения (т. е. отношение : ) составляет при
мерно 0,68.10 6 r aToM/(cM2.c) и численно равна KOH
стаНте скорости растворения металлическоrо серебра.
Но это равенство только кажущееся. Поскольку Me
таллическое серебро растворяется в диффузионном pe
Жиме, скорость ero перехода в раствор увеличивается с
повышением интенсивности перемешивания, тоrда как
на растворение серебра из амальrамы этот фактор не
Влияет.
Скорость перехода в раствор ртути из reTeporeHHbIx
амальrам меньше, чем серебра, примерно в 7 раз (см.
рис. 48, кривая 3), а также меньше, чем ртути из ,\, фазы
и тем более чистой ртути [для двух последних констан-
ты скорости равны 0,13 и 0,24.10 6 л/(см 2 .с)]. Следова-
тельно, влияние процесса цементации ртути соединениями
серебра увеличивается по мере перехода к более раз-
бавленным амальrамам.
149
о механизме растворения "(-фазы
Изучение влияния ряда переменных факторов на ско-
рость растворения твердоЙ амальrамы серебра (у-фазы)
позволяет высказать определенное суждение о механиз-
ме ее растворения в цианистых растворах. Постоянство
скорости растворения при различной интенсивности пе-
ремешивания раствора, зависимость скорости растворе-
ния от давления кислорода в степени 0,5 свидетельству.
ют о том, что изученная реакция протекает в кинетиче
СКО1\1 режиме. Это представляет интерес в связи с тем,
что амальrамы являются сплавами металлов, обладаю-
щих раЗЛИЧНЫМII кинетическими свойствами: в циани-
стых растворах серебро растворяется в диффузионном
режиме, а ртуть в кинетическом, и она придает черты
cBoero более пассивноrо поведения всему сплаву.
Интересно отметить, что кинетика растворения
у-фазы очень сходна с растворением золота в кинетиче-
ском режиме: независимость скорости растворения от
интенсивности перемешивания и зависимость ее от давле-
ния кислорода в степени 0,5, численно близкие значения
предельных концентраций цианида (9,4 .10 3 моль/л для
золота и 7,3. 1 0 3 для амальrамы) и связанное с этим
наличие двух областей (контролируемой цианидам и
контролируемой кислородом), примерно одинаковое
влияние lЦелочности раствора на скорость растворения
и даже близкие величины констант скорости реакции
[в ДQпредельной области по цианиду 0,5-7-0,6.10 6 для
золота и 0,65. 1 0 6 л/см 2 . С для амальrамы, в запредель-
ной области соответственно] ,52. 1 O 7 И ] ,28. 1 0 7 r-атом 1 / 2 х
Х л 1 / 2 / (см 2 . с) *.
Однако есть и некоторые отличия: значительно мень-
шая экспериментальная энерrия активации и очень леr-
кий переход из диффузионноrо режима в кинетический,
аналоrично тому, как это наблюдалось для ртути.
Для расчетов начальных скоростей растворения се-
ребра из амальrам можно рекомендовать обычные урав-
нения:
а) допредельная область,
у.фаза: Q == 0,65. 1 0 .6 SСт;;
-фаза; Q == О,90.} 0 6 SСт;;
жидкая амальrама: Q==O,68.10 6 N AgSC't;
* Здесь вместо давления кислорода взята ero концентрация в рас-
творе (r атом/л).
150
б) запредельная область,
7 1/2
I' фаза: Q 1,28. 1 O SC o . т;
фаза: Q == 1,92. 1 o 7 SC {2 т;
жидкая амальrама: Q=== I,35.10 7 NAgSC ;T.
Полученные результаты указывают на необходи
масть применения методики вращающеrося диска и в
тех случаях, коrда важна не столько возможность rид
родинамическоrо расчета, сколько равнодоступность
реакционной поверхности во время растворения, позво-
ляющая выявить тонкие детали механизма reTeporeHHoro
процесса.
s. золото РТУТЬ
Так как растворение жидких амальrам (до 12% Аи)
протекает в кинетическом режиме, был применен метод
«обратноrо» диска. Изучение кинетики растворения твер-
дых амальrам проведено как обычно. Продолжитель
насть опытов от 5 до 50 ч в зависимости от КОЛИЧества
paCTBopeHHoro золота.
Растворение жидких ам.альса.A-t
.Изучены две reTeporeHHbIe амальrамы, содержащие 2;
8 и 12% (ат) Аи, в стеклянном сосуде при 25° С, давле
нии кислорода 1 а т, концентрации цианида 4,1. 1 0 3 И
[КОН] == 10 3 моль/л, числе оборотов мешалки от 10 до
860 в минуту. \
Кинетические кривые несколько необычны: наиболь-
шая скорость наблюдается в начале процесса, а затем
она уменьшается и далее остается постоянной. В YCTaHO
вившемся режиме скорость растворения не зависит от ин.
тенсивности перемеШI1вания 11 равна 1,05+ 1,35Х
XIO ll r-атом/(см 2 .су, следовательно, процесс протекает
в кинетическоЙ области. При этом скорость растворе-
ния золота из rOMoreHHblx амальrам (ДО 0,13%) примерно
в два раза выше (2,3. 1 O ll), быстрее растворяется золото
и из лежалых амальrам (1 ,8 2,7. 1 O ll). Правда, это от-
носится только к первому периоду до установления посто
янной скорости.
Для определения влияния концентрации цианида и
давления кислорода были проведены опыты при 25° С,
90 об/мин, давлении кислорода 1 и 0,21 ат, щелочности
151
10 3 И концентрации цианида 0,475,4, 10 3 моль/л. Най
дено, что скорость растворения не зависит ни от KOHцeHT
рации цианида, ни от парциальноrо давления кислоро-
да, ни от содержания золота в rетероrенной амальrаме.
При давлении кислорода 1 ат она равна для 2; 8 и
12% HЫX амальrам 1,18; 1,33 1I 1,15.10 ll [-атом!(см 2 .с)
соответственно, а при продувке воздухом (для 12% HЫX
амальrам) 1,15. 10 ll. Вследствие очень малоЙ скорости
растворения установить предельную концентрацию циа-
нида не удалось.
С этими же амальrамами (2,8 и 12%) были поставлены
опыты при различных температурах. Скорости paCTBope
ния при 25,35,45 и 550 С соответственно равны: 1,11; 1,16;
1,22 и 1,33. 1 0 11 [ aTOM/ (см 2 . с). Экспериментальная энер
rия активации порядка 1 ккал/моль.
Растворение твердых амальсам
Изучено 'растворение амальrамы, содержащей 51,6%
Ли, при давлении кислорода 1 ат, 250 С, щелочности
раствора 10 3 моль/л и концентрации цианида 2,2Х
Х 10 3 моль/л. Скорости растворения при 102. 320, 639,
862 и 974 об/мин равны: 4,9; 6,2; 7,2; 6,1 и 6,1.1 O IO r
атом/ (см 2 . с); среднее значение 6,0. 1 O IO. Следова
тельно, скорость раствореНIIЯ не зависит от интенсивно
сти перемешивания, и процесс протекает в кинетическом
режиме.
При давлении кислорода 1 ат 250 С и 639 об/мин
было исследовано влияние концентрации цианида на
скорость растворения. Эта зависпмость иная, чем при
растворении жидких амальrам, и похожа на ту, которая
получена при растворении металлов и амальrам серебра.
Налицо две области дo и запредельная по циаНIIДУ
(предельная концентрация цианида 4,4 ,10 3 моль/л).
Константы скорости реакции растворения в допредель
ной области 2,75. 1 0 7 л/ (см 2 . с) В запредельной 9,6Х
Х 1 0 7.
Влияние температуры изучено в допределыlif обла
сти. При 25, 35, 45 и 550 С скорости растворения оказа-
лись равными 0,84; 1,01; 1,07 и 1,0I,10 9 r aToM/ (см 2 , с).
Влияние давления кислорода изучено на лежалой
(в течение двух лет) твердой амальrаме Toro же соста-
ва (рис. 49), Условия проведения опыта: 250 С. щелоч
ность 10 3 моль/л, давление кислорода 1 и 2 ат (авто-
клав, 720 об/мин) п 0,21 ат (стеклянныЙ сосуд. продув
152
Ка воздухом) при переменной концентрации цианида.
Скорость растворения в запредельноЙ области про
порцианальна давлеНИIО кислорода в первой степени.
Константа скорости реакции в допредельной области
0,95.10 6 л/(см 2 .с), в запредельной k'==3,2.10 6 л/(см 2 Х
Хс), предельная концентрация цианида 4,3Х
ХIО З моль/л.
Константы скорости реакции
для лежалой амальrамы в 3,4 ра-
за больше, чем для свежеприrо
товленной, что cor ласуется с
результатами peHTreHocTpYKTYP
Horo исследования этих амальrам
и высказанными ранее предполо
жениямl'l.
Было изучено влияние темпе-
ратуры на скорость растворения
лежалой амальrамы (автоклав,
давление кислорода 2 ат,
720 об/мин, концентрация циани
да 3.10 3 моль/л). При 25; 35;
45 и 550 С найдены следующие
величины: 2,5; 4,2; 4,1 и 4,1 Х
XI0 9 r aToM/(cM2,c.aT). Влия
НИ.t. температуры сказывается
только дО 35 0 С (энерrия актива
ции 9,2 ккал/моль).
Для выяснения стехиометрии
процесса растворения твердой
амальrамы (51 % Au) 6 r по
рошка перемешивали с циаIIИ
стым раствором (4,5.10 3 моль/л)
в сосуде с мешалкой при продув
ке кислородом в течеНlIе 96 суток. Через каждые 10 16
суток раствор отделяли от амальrамы и определяли в
Нем содержание золота и ртути, а в стакан заливали
новую порцию раствора то!"{ же концентрации.
Соотношение количества растворенных золота и
ртути Несколько колебалось, 110 суммарный баланс по
казал, что золота растворено 9,09. 1 0 3 r aTOMa, а PTY
ти 8,80. 1 о з, т. е. I3 соотношеНШI 1,033: 1, что хорошо
соrласуется с молярным соотношением компонентов в
исходной твердой фазе (1,085: 1). Химический анализ
оставшейся амальrамы подтвердил, что состав ее не из-
8
6
t\,
'"
4
,
'\)
>0"2
2
4
1
10 20
[/(сн), 'O NОЛЬ/Л
Рис. 49. Зависимость скоро-
сти растворения твердых
амальrам З0ЛОТ'I оТ концснт-
рации цианида, срока вы-
держки и давления кислоро-
да над раствором; лежалая
амальrама, давление киспо.
рода, ат: 1 0,21; 2 1,0;
3 2,0; 4 свежая амальrа-
ма; давление 1,0 ат
153
менился, а рентrеновский что фазовый состав также
остался прежним. Следовательно, амальrама растворя
ется конrруэнтно. Экспериментальные энерrии акти
вации до 350 С равны: для ртути 7,85, для амальrамы
золота 9,2 ккал/моль.
Аналоrичное ВЛIlяние температуры наблюдалось и
при цианировании твердоЙ амальrаМbI серебра (I' фа
зы). Однако между амальrамами этих двух металлов
имеются и различия: максимальная скорость paCTBope
ния амальrамы золота, как и металлической ртути, про
порциональна давлению кислорода над раствором в
первой степени, а амальrамы серебра давлению в CTe
пеНII 0,5. Следовательно, амальrама золОта более «pTY ,
теподобна» и можно предположить, что медленным зве
ном процесса явЛяется растворение ртути, а обнажаемое
золото растворяется без дополнительных осложнений
происходит как бы послойное растворение амальrамы,
и оба ее компонента переходят в раствор в том же COOT
ношении, в каком они были в твердой фазе. Это под
тверждается и ОПbIТОМ растворения твердой порошкооб
разной амальrамы.
Цементация ртути амальrамой не может изменить
конrруэнтноrо характера процесса, так как осевшая на
поверхности ртуть при дальнейшем послойном раство-
рении снова перейдет в раствор, и при этом BOCCTaHO
вится эквивалентное сОотноШение растворенных компо
нентов. Конrруэнтный характер растворения второе
отличие процесс а цианирования амальrам золота от
aMa braM серебра, соrласующееся с очень медленным
образованием первых.
Скорость растворения жидких амальrам на два по
рядка ниже, чем твердых, и для reTeporeHHbIx не зависи.т
от содержания в них золота. Это объясняется тем, что
содержание золота в жидкой фазе амальrаМbI постоянно
(0,13% при 250 С), а остальное ero количество лежит
На ДНе и только обеспечивает поддержание этой KOH
центрации. Скорость растворения жидких амальrам не
зависит от концентрации цианида и давления кислоро
да над раствором потому, что при очень малых CKOpOC
тях растворения аналитически определяемые ero KOH
центрации уже являются запредельными.
Рассмотрим некоторые практические выводы. Амаль
rамирование поверхности золота резко уменьшает CKO
рость ero растворения в цианистых растворах. Для
154
практики наиболее важно рассмотреть жидкие reTepo
reHHbIe амальrамы, которые по составу и свойствам
ближе Bcero к сросткам золота с пустой породой, обна
женная поверхность которых смочена ртутью, еще не
прореаrировавшей с золотом химически. Таковы же
свойства и частиц снесенной амальrамы.
Во всех случаях избыток ртути покрывает поверх-
ность частиц золота жидкой пленкой и сильно уменьша.
ет скорость ero растворения, и, кроме Toro, уменьшает
реакционную поверхность, заполняя уrлубления и поры.
Сравним скорость растворения золота в кинетичес
ком режиме, в котором она значительно меньше, чем
в диффузионном, со скоростью растворения reTeporeH
ной жидкой амальrамы. Отношение максимальных CKO
ростей- растворения при продувке кислородом равно
5.3. 1 O 9 : 1,15. 1 O l1 == 460, а при продувке воздухом
2,4. 1 O 9 : 1,15. 1 O II == 21 О. Если золотники достаточно
крупные, то при лежании за счет ДllффУЗИИ ртути обра
зуется твердая амальrама, скорость растворения кото-
рой уже не так сильно будет отличаться от скорости
растворения золота в кинетическом (но не в диффузион
ном) режиме. Но даже из лежалой амальrамы золото
растворяется в 1,4 раза медленнее ПрIl продувке кисло
родом и В 3 раза при продувке воздухом.
Растворение жидких амальrам в особом кИнетичес
ком режиме и их «ртутеподобность» оставляют мало
возможностей для интенсификации процесса их циани
рования, так как скорость растворения не увеличивает.
ся с повышением интенсивности перемешивания, ростом
концентращIИ цианида, давления кислорода над paCTBO
ром и температурой. Все это наrлядно показывает, Ka
кие осложнения MorYT возникнуть при цианировании
хвостов амальrамации, если не принимать меры дЛЯ YCT
ранения сноса амальrамы. При этом надо еще раз под
черкнуть, что из за краткости контакта поверхности ча-
стиц амальrамы и золота в пульпе будут образовывать-
ся только жидкие амальrамы, наиболее медленно ре а-
rирующие с цианистыми растворами.
r л а в'а 4
КИНЕТИКА РАСТВОРЕНИЯ
ТРУДНОР АСТВОРИМЫХ СОЛЕЙ И ОКИСЛОВ
1. СУЛЬФИДЫ И ТЕЛЛУРИДЫ В ЦИАНИСТЫХ РАСТВОРАХ
Сульфиды и теллуриды тяжелых цветных и блаrо
родных металлов содержатся в рудах как в качестве oc
новных минералов, так и примесей. При rидрометаллур
rической переработке руд, содержащих примеси этих
минералов, MorYT возникать связанные с их присутстви-
ем осложнения технолоrическоrо процесса (особенно
при извлечении блаrородных металлов из руд цианиро
ванием) . Это побудило исследователей заняться изы-
сканием рациональных схем переработки сложных руд,
в частности руд, содержащих медные минералы . Тем не
менее проведенные исследования не дают исчерпываю-
щих сведений ни о механизме ВЛИШIИя примесей на про-
цесс цианирования, ни о химизме и относительных ско-
ростях взаимодействия различных минералов с цианис-
тыми растворами.
Систематическое исследование процессов цианирова-
ния мноrих отечественных руд сложноrо состаВа и ис-
кусственных смесей чистых минералов было проведено
И. Н. Плаксиным с сотрудниками. В последнее время
опубликован ряд статей, посвященных изучению пове-
дения сульфидных минералов в rидрометаллурrических
процессах, в частности определению скоростей процес-
сов окисления и растворения сульфидов.
Данные этих работ представляют большую ценность,
однако они далеко не однозначны.
В связи с этим было проведено исследование раство-
рения сульфидов и теллуридов в цианистых растворах
методом вращающеrося диска.
Сульфид серебра
Поведение а рrентита (Ag 2 S) в цианистых растворах
представляет большой теоретический интерес, потому
что СУJIЬфИД серебра в отличие от сульфида одновалент-
ной Меди очень плохо растворим в растворах цианидов
в отсутствие кислорода. При pH-ll (щелочность, приня-
тая в наших опытах) протекает следующая реакция
с очень небольшим значением константы равновесия:
Ag 2 S + 4CN t Н 2 О : :. 2Ag (CN)l SH +OH ;
к === 2,0.1 0- 9.
156
При концентрации цианида калия 0,1 моль/л (0,65%)
концентрация серебра в насыщенном растворе после
достижения равновесия составит Bcero 7,4.10 4 r-ион/л,
а при концентрации цианида 10 2 моль/л 3,4.10 5 r-ион/л.
Скорость растворения должна быть очень небольшой и
уменьшаться по мере повышения концентрации ионов
rидросульфида и серебряноrо цианистоrо комплекса в
растворе, т. е. по мере приближения к равновесию.
Влияние скорости враЩ,ения диска и
концентрации цианида. Опыты проводили в CTeK
лянном сосуде при 350 С, рН == 11, р 02 + 1 ат; число обо.
ротов и концентрация цианида переменны. Вычисленные
по TaHreHcy уrла наклона кинетических кривых величины
констант скорости реакции растворения приведены в
табл. 9.
Таким образом, в широком интервале изменения CKO
рости вращения диска от 21 до 1100 об/мин константа
скорости реакции остается практически постоянной, т. е.
скорость растворения не зависит от интенсивности пере
мешивания. Этоrо и следовало ожидать, если учитывать
термодинамику изучаемой реакц,Ии; с друrой стороны,
это свидетельствует о том, что процесс контролируется
не диффузией, а скоростью химической реакции на По-
верхности сульфида.
Таблица 9
Константы скорости реакции растворения Ag 2 S в цианиде
Скорость вращения
диска, об/мин
Концентрация цианида. ! Константа скорости реак-
мольjл ции lI( ?g)ения.
128 и 800
21 и 800
500 и 1100
1 39.10 2
i ,9.IO 2
1 ,O.10 l
2 7. 1 о э
2 ' 9. 1 0 8
2> . 1 0 8
Данные о влиянии концентрации циаНI1да свидетель-
ствуют о том, что изучаемая реакция имеет первый по-
рядок по цианиду.
В л и я н и е Д а в л е н и я к и с л о р о Д а н а Д р а с-
у в о ром. Зависимость скорости растворения от давле
ния кислорода параболическая. Но если по оси абсц,Исс
отложить величины давления в степени 1/2, то экспери
Ментальные точки хорошо укладываются на ПРЯМУЮ t
проходящую через начало I<оординат (рис. 50). Эту за-
Висимость и следовало ожидать, поскольку растворение
157
сульфида серебра в цианистых растворах может проте
кать только при ero окислении. Наш вывод совпадает
с данными друrих авторов, изучаВШIIХ сходные про
цессы.
Вторая серия опытов была проведена в стеклянном
сосуде (350 С, 128 об/мин, концентрация цианида 1,9X
Х 10 2 моль/л). При продувке раствора кислородом CKO
рость растворения равнял ась 1,43. 1 0 9, а при продувке
воздухом 0,62. 1 0 9 r
ион/ (см 2 . с). Отношение
скоростей растворения
составило 2,3, а отноше
ние корней квадратных
из парциальных давле
ний кислорода в этих
Опытах равно 2,2.
В л и я н и е т е м п e
р а т у р ы. Опыты прово
дили В стеклянном сосуде
при пропускании кисло
рода. Концентрация циа
нида калия в опытах,
проведенных при 45
750 С, равна 2,68. 1 0 2; ЕрИ
25°C 8,16.10 2 моль/л;
щелочность везде 1 0 3
моль/л, скорость враще
ния диска 800 об/мин
(при 250 С 128 об/мин).
Для 350 С принято значение константы скорости реакции
2,7.10 8 л/(см 2 .с.ат 1 / 2 ).
При построении кривой Аррениуса было учтено из
менение парциальноrо давления кислорода над раство-
ром с температурой: величины констант скорости, BЫ
численные по кинетическим кривым, приведены к пар-
циальному давлению кислорода, равному 1 ат. Для этоrо
экспериментальные значеНIIЯ констант скорости были
разделены на корень квадратный из парциальноrо
давления кислорода в rазовой смесо при данной темпе
paTYr>e (paBHoro 1 ат за вычетом давления пара воды).
Такая поправка необходима, особенно при высоких тем-
пературах, Н9 делают ее не всеrда.
Вычисленные таким образом величины кОнстант ско-
рости реаКЦИII в пределах температур от 25 до 750 С
8
.
6
,
1\.)
4
2
о
O 1,5
%2
2,0 2,5
Рис. 50. Влияние давления кислоро-
да на кинетику растворения суль-
фида серебра пр!! 250 С. 1400 об/мин,
IRCN1 2,5.10 2 моль/л, [КОН]'=
== 10 3 моль/л
158
(через интервалы 100) соответственно равны: 1,85; 2,70;
3,63; 4,98; 6,90 и 8,67.10 8 л/(см 2 .с.ат 1 / 2 ). По тан-
reHcy уrла наклона кривой Аррениуса вычислено значе-
ние экспериментальной энерrии активадии, равное
6,43 ккал. Практически такая же величина (6,35 ккал)
получена в друrой серии опытов, проведенных в авто-
клаве (1400 об/мин, концентрация цианпда 0,1 моль/л,
продувка кислородом, температура 15 и 250 С).
Таким образом, изученная реакция IIмеет первый по-
рядок по цианиду и протекает в кинетической области,
что подтверждается независимостью скорости от интен
сивности перемешивания и зависимостью ее от давле
ния кислорода в степени 1/2 (диссоциация молекул на
поверхности твердоЙ фазы, обычно сопровождаемая ки-
нетическими осложнениями).
Выше отмечалось, что в отсутствие кислорода суль
фид серебра очень слабо растворим в разбавленных
растворах цианидов щелочных металлов. Нами эта ре-
акция была изучена при продувке раствора азотом 11
показано, что скорость растворения и количество пере-
шедшеrо в раствор серебра ничтожны. Следовательно,
кислород, бесспорно, необходим для обеспечения техни-
чески приемлемой скорости растворения сульфида се-
ребра.
В области исследованных температур (25 750 С)
целесообразно обсудить следующие возможные меха-
низмы действия кислорода: а) окисление сульфида ce
ребра с переходом окисленноrо продукта в раствор и
последующим образованием цианистоrо комплекса ce
ребра; б) взаимодействие llианида с сульфидом сереб-
ра с последующим окислением сульфидных ионов;
в) образование на повеРХНОСТII труднорастворимоrо про-
межуточноrо частично ОIшсленноrо соединения.
Исследование не подтвердило наличпе первоrо меха-
низма. Были поставлены опыты по растворению суль
фида серебра в 25 % HOM растворе аммиака в авто-
клаве, но ни при 25 и 750 С, ни при давлении кислоро-
да 2 и 5 ат серебро в заметных количествах в p CTBope
обнаружено не было. Следовательно, эффективность
окисления сульфида серебра ПОВЫШается в присутствии
цианида. Цианид может взаимодействовать с сульфи
дом серебра (скорость реакции зависит от концентра-
ции цианида) , замещая ионы S2 , окисление которых
протекает в момент, KorAa они в адсорбированном co
159
стоянии еще находятся на поверхности твердой фазы
(зависимость скорости реакции от V PoJ , а не в раство-
ре, так как в последнем случае скорость окисления за-
висела бы от интенсивности перемешивания. Цианид
может как бы «расшатывать» решетку сульфида сереб-
ра, адсорбируясь на ней и облеrчая окисление. Возмож-
но, что образующееся на поверхности промежуточное
окисное соединение, которое не взаимодействует с aM
миаком, растворяется в более сильном комплексообра-
зователе цианиде, и тем быстрее, чем выше ero кон-
центрация. Этот вопрос остается еще недостаточно
ясным и требует дальнейшеrо изучения.
Для расчета количества серебра, переходящеrо в ра-
створ при взаимодействии Ag 2 S с растворами цианида
калия, можно использовать уравнение (3).
При 250 С констаНта скорости реакции растворения
равна 1,85.10 8 лj(см 2 .с.ат 1 / 2 ), (kl==5,35.10 7 л З / 2 /
j (молы / 2 . см 2 . с), а для друrих температур ее можно
вычислить из ур авнения
19 k" == 3,018 1405 .
Т
в заключение рассмотрим некоторые практические
выводы, которые можно сделать из сказанноrо. Суль
фид серебра (арrентит) растворяется в цианистых раст-
ворах значительно медленнее, чем металлическое сереб-
ро; различно и ВлияНИе переменных технолоrических
факторов на скорость их растворения: 1) повышение
температуры более эффективно при растворении суль-
фида серебра (энерrия активации в два раза больше);
2) концентрация цианида влияет на скорость растворе-
ния обоих минералов одинаково (обе реакции первоrо
порядка по цианиду) ; 3) повышение давления кислоро
да оказывает большее влияние на скорость растворения
металлическоrо серебра (ускорение пропорционально
давлению в первой степени, а не корню квадратному,
как для сульфида серебра); 4) повышение интенсивно-
сти перемешивания сильно ускоряет растворение метал-
лическоrо серебра, но бесполезно при растворении ero
сyrльфида.
Но так как в пульпе кислород будут поrлощать и
друrие минералы, можно предположить, что при циани-
ровании промышленных руд, содержащих арrентит, по-
160
вышение концентрации pacTBopeHlIoro кислорода (при
менение пневматических аrитаторов) будет lIнтенсифи-
цировать процесс не менее активно, чем при цианиро
вании руд с самородным серебром. В связи с этим
можно ожидать заметноrо эффекта от применения дру-
rих окислителей, не разрушающих цианид.
Роль концентрации цианида при цианировании руд
также нуждается в уточнении. При обработке руд, co
держащих самородное серебро, повышение KOHцeHTpa
ции цианида лимитируется концентрацией кислорода в
пульпе, тоrда как при растворении сульфида серебра
это оrраничение не имеет места и, следовательно, повы
шение концентрации цианидп может быть использовано
в технически ДОIlУСТИМЫХ пределах.
Таким образом, процесс цианирования сульфидных
серебряных руд может быть интенсифицирован в боль
шей мере, чем растворение самородноrо серебра из
обычных руд (повышение температуры, концентрации
цианида и кислорода в растворе). Сделанныс на OCHO
вании кинетическоrо исследования выводы неплохо co
rласуются с практикой обработки руд, содержащих ap
rентит.
Рекомендуемое некоторыми авторами добавление
соединений свинца не повышает скорость растворения
сульфида серебра в цианистых растворах в присутствии
кислорода, во первых, потому, что СУЛЬфИД IIОНЫ aд
сорбированы на поверхности твердой фазы (в растворе
их нет), rде они и окисляются, а, BO BTOpЫX, вследствие
образования свинецсодержащих пленок на поверхности
сульфида серебра, замедляющих процесс ero растворе-
ния (проверено нами).
Н uзшuй сульфид .меди
Известны следующие уравнения реакции взаимодей-
ствия низшеrо сульфида меди (халькозипа) с paCTBopa
ми цианида в присутствии кислорода:
2Cu 2 S + 4NaCN + 2Н 2 О + 02 == CU 2 (CN)2 +
+ CU 2 (CNS)2 +. 4NaOH,
2Cu 2 (CNS)2 + 6NaCN + Н 2 О + 1/202 ==
== 2Си (CNS)2 + CU 2 (CN)2' 4NaCN + 2NaOH.
11 306
161
Хотя их неоднократно цитировали, форма, в котороЙ
роданид Ilрисутствует в цианистых растворах, была не
ясва. Плаксин изучил состав ЦIlанистых комплексов ме-
ди, а Владимирова 11 КаКОВСIШЙ определили константы
их диссоциации и показаЛII, что в цианистых растворах
роданид присутствует в виде свободноrо иона, а не BXO
дНТ в состав медноrо комплекса. В указанных работах
не была выяснена роль кислорода при растворении
.., 20
"<
t 15
:;s
<\>
1O
.",
<::::1
5
Рис_ 51. Кинетика растворе-
"ИЯ lIизшсrо сульфида М, ;1.И
в цианистых растворах:
' 4 номера опытов
о
2 J 4 '!:J'y
CU2S В цианистых растворах: СЧIIтали, что он участвует
только в окислении серы и образовании роданида и не
подчеркивали различие в химизме процесса в присутст-
вии кислорода и без Hero. Между тем было показано,
что при действии На CU2S растворов хлорноrо и серно-
кислоrо окисноrо железа, хлорной меди, концентриро-
ванной серной и азотной кислот образуется CuS и соот-
веТСТВУЮЩIIе растворимые соеДJшения меди, а при pa
створении образовавшеrося CuS элементарная сера и
чаСПIЧНО соединеНIIЯ серы высших валентностей. Учи-
тывая это, мОжно предположить, что взаимодействие
Cu 2 S с цианистыми растворами в присутствии кислорода
протекает ступенчато, с образованием отмеченНых про-
межуточных соединений.
На рис. 51 приведены Кинетические кривые четырех
последовательных опытов растворения одноrо и Toro
же диска CU2S в водном растворе цианистоrо калия, про-
вед.енных без промежуточной обработки рабочей по-
верхности диска (без СIIЯТИЯ образующейся поверхно
стной пленки Jl шлифовки поверхности) . Поскольку в
данной серIlИ опытов поверхность диска не очищали от
продуктов реакции, обоrащенных серой, содержание по-
162
следней в растворе также увеличивалось (в конце пер-
Boro опыта 1 ,45; BToporo 1 ,28; TpeTbero 1 ,45; чет
BepToro 1,65. 1 O 5 мол ь/ л) .
Как показали визуальные наблюдения и анализы
растворов, на поверхности диска CU2S после несколь
ких часов контакта с раствором цианида калия в при
СУТСТВIIИ кислорода 06разуется пленка синеrо цвета, KO
торая при более длительном контакте покрывается бе-
лой пленкой, а растворение меди резко замедляется и
затем почти прекращается. Аналоrичные результаты
были получены при исследоваНИI1 кинетики растворения
rаленита в водных растворах ацетата аммония: отме.
чено, что уменьшение скорости растворения rаленита
связано с образованием на ero поверхности пленки эле
ментарной серы (все же обладающей некоторой прони
цаемостью ).
Константы скорости реакции для опытов 1 4 (см.
рис. 51) соответственно равны: 7,6; 3,9; 3.2 и 2,5. 10 7
л/(см 2 .с l / 2 '061/2). Константа начальной CKOPOCTJI paCT
ворения свежеrо диска (опыт 1) хорошо соrласуется с
той величиной, которую можно ВЫЧИСЛIlТЬ для. процесса
растворения, протекающеrо по диффузионному меха-
низму, с учетом содержания меди в CU2S, и близка к
константе скорости растворения меДII. Фазовым элект
ронномикроскопическим и рентrеновским анализаМII
показано, что синяя пленка CuS (ковеллин) , белая
элементарная сера.
Химический анализ пленок, соскобленных с поверх-
ности диска, после Опыта 2 (I\Овеллин) дал 68,5% Cu
и 31,9% S (должно быть 66.44 lf 33,56%). а после опыта
3 (сера) 7,8% Cu и 92,6% S.
При химическом анализе растворов было выяснено,
что сера переходит в раствор в значительно меньших
количествах, чем медь: молярное отношение меди к сере
резко отлично от их соотношения в твердой фазе 1I со-
ставляет от 17: 1 (опыт 1) до 7 : 1 (опыт 4). Иными сло-
вами, образующаяся в результате BToporo этапа реак-
ции сера реаrирует с цианидом значительно медленнее,
чем медь.
В соответствии с изложенным можно предл"ОЖИТЬ
следующую схему основных этапов взаимодеиствия
сульфида меди с ВОДНЫми растворами щелочных циа-
НИДов в ПРИСУТСТВИИ КИС.7юрода.
2Cu 2 S + 6CN + Н 2 О + 1/202 == 2CuS +
11*
16.1
+ 2Си (CN) + 20H ; (а)
!1ОО == 57,27 ккал; КО 9,5. 1041.
2Си5 + 6CN + Н 2 О + 1/202 == 25 +
+ 2Си (CN) + 20H ; (б)
!1Go == 52,87 ккал; КО == 5,7.1038
5 + CN == 5CN ; !1О" == 18,17 ккал;
КО == 2,1 .1013. (в)
в отсутствии кислорода, как показали ваши иссле
дования, процесс протекает иначе:
Си 2 5 + 6CN == 2Си (CN) + 52 ;
!1ОО == 13,75 ккал; КО == 1,2. 1010. (r)
Расчеты свидетельствуют о большой термодинамиче
ской вероятности протекания реакций, но опытным пу
тем это подтверждено для реакций (а), (6) и (с); реак-
ция (в) в силу кинетических осложнений протекает
очень медленно, хотя ее цитируют без всяких oroBopoK.
Для уточнения реакции (r) нами проведено paCTBO
рение порошка Си 2 5 в растворе цианида калия, приrо
товленном на обескнслороженной воде (кипячение и
охлаждение при продувке водородом), аrитацией в закры
тых колбах, наполненных раствором доверху (темпера
тура 25° С, концентрация цианида 5,36.10 2 моль/л, на
1 л цианистоrо раствора взята 1,83 r или 1,15.10 2 моль/л
сульфида меди, продолжительность перемешивания
24 ч.
Были получены следующие результаты. При раство-
рении исходной навески содержание меди и серы было
равно 1,75. 1 0 2 И 0,85. 1 0 2 r ион/л, а отношение их кон-
центраций 2,06: 1. При повторном растворении донной
фазы от первоrо OllbITa (осталось примерно 25% ис-
ходной навески) концентрации меДИ и серы были равны
0,57.1 0 2 и 0,275. 1 0 2 r-ион/л, а их отношение 1,96: 1.
Следовательно, без кислорода протекает обычное раст-
ворение сульфида одновалентной меди: состав твердой
фазы не изменяется, медь и сера переходят в раствор в
эквивалентном соотношении.
164
в присутствии кислорода первую фазу реакции мож-
но выразить уравнением
CU2S е == Си5 + Си+.
ХаЛЬКОЗИlI превращается в ковеллин, а электроны
воспринимает ОКИСЛIIТель, который в отдельных случаях
может окислит!) и ионы одновалентной меди (если в ра-
створе нет очень сильноrо комплексообразователя, CTa
билизирующеrо эти ионы). При малых концентрациях
цианида в присутствии кислорода может быть запи
сана:
2Си 2 5 + 4CN + 1/202 + Н 2 О == 2Си (CN)2 +
+ 20H + 2CuS. (д)
Вторая фаза реакции более сложна, и для нее мож
но написать следующее суммарное уравнение:
2Си5 + 4CN + 1/202 + Н 2 О ==
== 2Си (CN)2 + 20H - + 25.
(е)
Обе фазы реакции протекают, частично налаrаясь oд
на на друrую. Если бы не было осложняющих процес-
сав, в раствор переходила бы только медь, но не сера.
Видимо, взаимодействие сульфидов меди с цианидам в
присутствии кислорода осложнено частичным окисле-
нием элементарной серы и реакцией ее с ионами циани-
да и щелочи, чему способствует аморфный характер
слоя серы, образующеrося на Ilоверхности диска (как
показали наши опыты, плавленая сера при низкой ще
лочности раствора практически не взаимодействует с
цианидам) . Это подтверждается наличием HeKOToporo
КОличества серы, наЙденноrо в растворе.
Характерно, что скорость перехода меди постепенно
уменьшается вследствие блокировки поверхности диска
более труднорастворимыми продуктами реакции (ковел-
лин и сера). В рсзультате этоrо отношение количества
меди к количеству серы в растворе постепенно снижает-
ся. Эти побочные процессы почти не имеют места на по-
верхности HOBoro халькозиновоrо диска (отношение в
растворе [Си] : [5] ==20,7 : 1). Возможно, что персход
серы в раствор объясняется частичным взаимодеЙстви-
ем хаЛЬКОЗlIна по рсакшш (r) с последующим Оf{нсле
165
нием сульфидноrо иона в растворе ИЛII непосредствен
ным окислением сульфида меди кислородом, независи
МО от наличия цианида.
Для оценки термодинамической возможности проте
кания некоторых реакций между сульфидами меди и рас-
творами цианида на ми уточнены опуБЛИI{ованные рапее
физико химические константы цианистых комплексов
меди. Для процесса
Си + 2CN е === Си (CN)2; i1G;98 === 20093 кал;
E === О,8713В.
Для сульфида одновалентноЙ меДИ нами было вычис-
лено:
2Cu + S'1 2е === CU2S i1G-;98 =:..: 40084 кал;
E 0,8691 В.
Сопоставляя эти значения. находим для реакции вза
имодействия хаЛЬКОЗИflа с "онами цианида (все расчеты
сделаны для температуры 250 С):
Cu 2 S + 4CN ::=:: 2Си (CN)l- + S2
Go === 102 кал; К == 1,19.
Даже при образовании низшеrо комплекса меди про-
цесс протекает достаточно полно и в отсутствие КИслоро
да. особенно если учесть rидролиз сульфидноrо иона
(K r ==O,077) :
Cu 2 S + 4CN + Н 2 О === 2Cu (CN); + SH + OH ;
К :::::: 0,092. (ж)
Из уравнения можно вычислить, что при рН === 11 и
КОI-щентрации свободноrо циан ида в растворе ] O .2
r-ион/л концентрация меДflоrо KOl\-lIJЛСКСCJ будет равна
5,7. IО З r-ион/л. Но в таких растворах, в которых имеет-
ся избыток цианида, образуется более прочный высший
цианистый комплекс:
.)
Си (CN)i + CN === Си (СN)з ; K' 1 . 105.
Учитывая это, !\lOжно Ilредполаrать. что в отсутстпие
J{ислорода не ДОЛЖНО быть IJреПЯТСТВИII для растворения
1()6
Ctl2S В цианистых растворах, в отличИе от растворения
сульфида серебра:
Cu 2 S + 6CN + Н 2 О ::::= 2Cu (CN) + SH + OH ;
К::::::; .109; ЛО;98 == 12,28 ккал. (3)
Реакции взаимодействия сульфидов меди с цианидом
в присутствии кислорода реакции (д и е) также тер-
модинамически вполне возможны, хотя они протекают с
неполным окислением серы. Убыль свободной энерrии
для реакций (д) и (е) соответственно равна 4З,63 и
39,23 ккал. Однако, как было отмечено выше, образо-
вание пленок на реаrирующеЙ поверхности тормозит и ос-
ложняет изучаемые процессы.
На основании изложенноrо Можно предполаrать, что
скорость растворения халькозина в цианистых растворах
(равновесие практически lIеобратимо сдвинуто в сторону
растворения и не осложнено термодинамическими о.'ра-
ничениями) должна контролироваться скоростью подво-
да цианида к ero поверхности, и процесс возможен при
отсутствии кислорода, тоrда как растворение сульфида
серебра (равновесие сдвинуто в сторону осаждения суль
фида из цианистых растворов) возможно только в при-
сутствии кислорода и контролируется скоростью самой
химической реакции. Это очень интересный пример вли
яния термодинамических оrраничений на кинетику про-
цессов. Приводим результаты кинетических опытов.
Влияние скорости вращения диска и
к о н Ц е н т р а Ц и и Ц и а н и Д а. Кинетические кривые
свидетельствуют об уменьшении скорости растворения
хаЛькозина в присутствии кислорода, что объясняется,
как было показано выше, ступенчатым протеканием ре-
акции и образованием пленок на реаrирующей поверхно-
сти. Для Toro чтобы найти истинную скорость растворе-
ния, были экстраполированы экспериментальные скоро-
сти к нулю по методу последовательных разностей.
Обработка большоrо числа опытов показала, что по-
лучаемое уравнение несложно:
Q == а + Ьт сс 2 ; (14)
v == Q а =-= Ь ет == Ь (l с' т),
т
Наличие свободноrо члена в уравнении (кривая не
проходит через начало координат) объясняется налипа
167
нием на поверхности диска HCKoToporo количества тон-
I{ИХ частиц, которые растворяются в первые минуты JЮН-
такта с раствором, знак минус у TpeTbero члена обра-
зованием пленок н а поверхности диска. Коэффициен r Ь
при втором члене уравнения леrко найти методом после-
довательных разностей с достаточной степенью точности.
Для иллюстрации этоrо ниже приведены величины CKO
ростей растворения, вычисленные по этому методу и,
кроме Toro, величины скоростей, приведенные к 1 об/с де-
лением на корень квадратный из числа оборотов диска
в секунду, поскольку rрафическая обработка получен-
ных данных показала наличие именно этой зависимости.
Скорость вращения ДlI-
ска, об/мин 13 80 128
Скорость растворе\lИЯ,
r ион/(см2.с) 3,54 8,33 10,60
Скорость растворения,
приведенная 1\ 1 об/сХ
> 1 09 r-lIоll/(сl\12. с 1/2)<
X06 1 / l ) 7,61 7,12 7,24
Продолжение
CI\OpOCTb вращения Дl1
ска, об/мин 167 250 500
Скорость растворения, 15,30 20,40
r-ион/(см 2 .с) 11,20
CI<OpOCTb растворени я,
прив!'денная к 1 об/сХ
х 109 r-ион/ (см 2 . С 11'2 Х
Хо6 1 / 2 ) 7,16 7,49 7,07
Из приведенных данных следует, во-первых, что ско-
рость растворения халькозина в цианистых растворах
пропорциональна корню квадратному из числа оборотов
диска, и, во-вторых, что принятый метод нахождения на-
чальноЙ скорости растворения дает соrласующиеся ре-
зультаты во всех опытах, кроме первоrо (13 об/мин, ос-
ложнение естественноЙ конвекцией и диффузией ионов),
приведенная величина скорости растворения практически
одинакова. Средняя константа скорости реакции равна
7,3.10 9: 9,6.10 З==7,6.10 7 л/(см2.сl/2'0бl/2).
, Влияние концентрации цианида изучали в интервале
0,55+9,2. 1 O 2 моль/л при 350 С, 1 ат, 128 об/мин. Была
получена линейная зависимость скорости раСТRорения
халькозина от концентрации цианида в растворе
(рис. 52).
168
В л и я н и е те м пер а ту р ы. Условия опытов: KOH
центрация цианида 9,6. 1 0 3 моль/л, число оборотов дис
Ка в минуту 128, давление кислорода 0,21 ат, температу
ра от 25 до 650 С.
50
......
u .
.-; 40
JO
20
C>o
10
о
Рис. 52. ЗаВI1СIIМОСТЬ удс.lьнаН
скорости растворения халькозина
ОТ I\ОlщентраЩIll KCN 11 paCТlJo!)('
."
:t.
?
""
()
2 3
'l ..
4
Рис. ;jЗ. Зави(:нмость КО. ичесТnа
растворснной меди от продол-
ЖИТс.lbJJOСТИ ОJlыта в атмосфере
водорода
Экспериментальная энерrия активации, вычисленная
по TaHreHcy уrла наклона кривой Аррениуса, равна
3,30 ккал/моль, а изменение константы скорости с темпе
ратурой выражается уравнением
]g k == 3,073 + 720fT.
в л и я н и е Д а в л е н и я к и с л о р о Д а. Были по
ставлены опыты при различном парциальном давлении
кислорода над раствором. Начальная скорость paCTBO
рения оказалась при этом одинаковоЙ, но с увеличением
давления кислорода кинетические I<ривые становились
более изоrнутыми, увеличивался коэффициент с в ypaB
неНИII (14), что можно объяснить более интенсивным об
разованием пленок на реакционноЙ поверхности, замед
ляющих растворение, как это уже было отмечено выше.
Такая зависимость скорости растворения от давления
кислорода для реакции, в которой он участвует в качест-
ве окислителя, l\южет показаться, на первый взrляд, не-
понятноЙ. Для выяснения этоrо вопроса были поставле-
ны опыты по растворению халькозина при полном отсут-
ствии кислорода. Вода для приrотовления цианистоrо
раствора была прокипячена при продувке водородом в
течение 2 ч, охлаждена в токе водорода в колбе с клапCl-
169
ном Бунзена и залита в реакционный сосуд так, чтобы
исключить возможность попадания в Hero воздуха (в кол
бе было создано необходимое давление водорода и вода
была передавлена в сосуд, наполненный водородом).
При растворении в воде цианистоrо калия и в течение
Bcero опыта через раствор пропускали ззот, ОЧIlщенныЙ
от кислорода.
Результаты одноrо из OllblTOB (350 с; 128 об/мин,
[KCN] ===7,6. 10 З моль/л) приведены нз рис. 53. Кинети-
ческая кривая линеЙна, т. е. скорость растворения пос ro-
янна, что свидетельствует о полноте удаления кислорода
из раствора, отсутствии образования пленок на реаrиру
ющей поверхности и протекании реакции соrласНО ypaB
нению (3). Это было дополнительно подтверждено ана-
лизом раствора на серу: отношение меди к сере OCTaBa
лось постоянным в течение Bcero опыта и было равно
2 : I кривая скорости растворения серы практически COB
падала с кинетической кривой для меди.
Константа скорости реакции, вычисленная по TaHreH
су уrла наклона прямоЙ (см. рIIС. 53) Н приведенная I(
I об/с, равна 0,89. 1 О б л/ (см 2 . С 1/2.0бl:' ), т. е. это прак-
тически та же величина, что и для реакции растворения
халькозина в цианистых растворах в ПРНСУТСТВIIИ кисло-
рода. Обе эти реакции MorYT протекать параллельно и яв
ляются как бы «взаимозаменяемыми» при отсутствии
кислорода протекает только реакция (ж), а в ero при
сутствии реа кция (д).
Вклад этих реакций в суммарный нроцесс определя-
ется количеством кислорода, поступающеrо к поверхно
сти: чем ero больше, тем больше и относительное количе-
ство халькозина, pacTBopeHHoro в результате протекания
реакции (д), и наоборот. Однако поскольку скорости ре-
акций (д) и (з) равны, суммарное количество меди, пе
решедшей в раствор, остается одинаковым н нсзавнеи-
мым от количества кислорода в растворе. но соотноше
ние меди и серы в растворе будет переменным: от очень
большой величины при протека н ии только реа I\ЦИИ (д)
до 2 при полном отсутствии кислорода и протекании
реакции (з).
В силу изложенноrо, константа скорости реакции pac
творения халькозина в цианистых растворах, вычислен-
ная по количеству меди, перешедшей в раствор, не зави-
сит от парциальноrо давления над ним кислорода; 1I0
этому отсутствует и соответствующая eJ\IY преде.аы{ая
170
концентрация цианида. Скорость обеих реакциЙ опреде-
ляется скоростыо диффузии цианида к реаrирующей l10
верхности и может быть рассчитана по уравнению (4).
Величина k равна 0,76.10 6 л/(см .сl/2,обl/ ) при
250 С, а для друrих температур ее можно вычислить из
уравнения, l1риведенноrо на с. 169.
В присутствии кислорода скорость реакции постепен
но уменьшается вследствие образования пленок продук-
тов взаимодействия на поверхности твердой фазы, d по
уравнению (14) можно вычислить ТОЛЬКО скорость peaK
ции в начальный момент, пока этих пленок еще нет. За
медление реакции тем сильнее, чем толще пленка и чем
хуже она проницаема для растворителя. Ilоэтому CKO
рость растворения ненрерывно уменьшается (и b ct)
с увеличением продолжительности контакта твердой фа
зы с раствором и в более концентрированных по цианиду
растворах, т. е. с увеличением абсолютноrо количества
меди, перешедшеЙ в раствор.
. Пленка ковеллина меньше тормозит растворение, чем
пленка серы, так как она способна взаимодеЙствовать с
цианидоМ, правда, со значительно меньшеii скоростью,
чем халькозин (см. ниже). При 250 С константа скорости
реакции растворения халькозина в цианистых растворах
равна 0,76.10 б, л/(см 2 .с 1 / 2 _об l / 2 ), тоrда как металличе
скоЙ меди 1,03. lО б, а рассчитанная теоретически
1,18.10 б л/(см2.сl/2'0бl/l).
Следовательно, скорость растворения халькозина co
ставляет 64% от теоретической; она меньше скорости рас-
творения металлической меди, но больше чем металли
ческоrо серебра. СеЙчас трудно сказать с полной опреде-
JIенностью, чем вызвано это расхождение с теорией
образованием пленок простых цианидов на поверхности
халькозина при отсутствии кислорода, как это имело ме-
сто при растворении меди, серебра и золота в цианистых
растворах, тем, что молярная доля меди в ее низшем
сульфиде равна Bcero 0,67, а теоретический расчет спра
ведлив, cTporo rоворя, для l\Iатериалов, содержащих
100% реаrирующеrо I<омпонента, или тем, что вследствие
небольшой величины константы равновесия часть циани
да остается свободноЙ. Можно только отметить, что об
разование пленок простых цианидов в присутствии суль
фидноrо иона м аловероятно и что константа скорости
растворения хлорида серебра в растворах KCN при 250 С
равна, по нашим опытам, 0}8.10 б л/(см2.сli2'0бlj2)
171
т. е. больше. чем константа для ыеталлическоrо сереб-
ра, но меньше, чем рассчитанная теоретически, и IIракти
чески такая же, как при растворении халькозина. Воз
можно, что в наших условиях образуется комппекс
Си (CN) , тоrда рассчитанная величина константы ско-
рости равна 0,79. 10 б, что практически совпадает с най
денноЙ экспериментально.
Высишй сульфид меди
Учитывая описанные особеННОСТII IIроцесса paCTBope
ния сульфида одновалентноЙ меДII. сначала было изу
чено влияние давления кислорода на скорость растворе-
ния ковеллина при 250 С, концентрации цианида 1,85Х
Х 1 0 2 моль/л И скорости вращения диска 128 об/мин.
Оказалось, что присутствие кислорода не влияет на
начальную скорость растворения ковеллина: при парци
альных давлениях, ра вных 1; 0,21 и О ат (ПрОДУВI{а pac
твора кислородом, воздухом и ВОДОРОДОl\I), константы
скорости реа кции равны соответственно 1,13; 1,09 и 1, 17Х
XI0 7 л/(см 2 .с) (колебания в пределах точности опыта).
Однако с повышением парциальноrо давления кислоро
да над раствором увеличивается выпуклость кривых
(скорость растворения снижается) по мере увеличения
IIродолжительности контакта вследствие образования
пленки серы на lJоверхности ковеллиновоrо диска.
Влияние скорости вращения диска на
р а с т в о р е н и е Cl1S изучено при 250 С, концентрации
цианида 1,85. 1 0 2 моль/л в атмосфере водорода. Как
видно из следующих данных, скорость растворения KO
веллина не зависит от интенсивности перемешивания
(средняя величина 1,=== l,18.10 7).
Скорость ВРl1ще1НН1,
об/мин . . 128
k, (л/см 2 .с) .10 7 1,24
250
1,1 G
500
1,05
1000
1,27
Зависимость удельной скорости растворения кове.тIЛИ-
на [ от концентрации циаНИДа cTporo линейна (опыты
проведены при 250 С в атмосфере водорода при скорости
вращения диска 128 об/мин).
1 ПG>СКОЛЬКУ В отсутствие КИСЛОРОДl1 медь и сера переходят в рас-
твор в ЭI<вимолекулярных количествах, расчет МОЖIIО вести не
в rраММ ИОЕНjХ Меди, К<1К это сделано в преДЫДУЩIIХ сериях опытов,
а в rp<lMM-МОЛЯХ, CuS.
172
На основании полученных данных можно сделать BЫ
вод, что реакция растворения ковеллина в цианистых pa
створах имеет первыЙ порядок по цианиду; среднее зна
чениеконстанты скорости се равно 1,20.10 7 л/(см 2 .с).
В Л И Я Н И е т е м пер а т у р ы на скорость paCTBope
ния CuS изучено при концентрации цианида 1,85. 1 0 2
МОЛЬ/Л t п 128 об/мин в атмосфере водорода. По данным
этой серии опытов рассчитана экспериментальная энер
rия активаЦИИ t равная 5,56 ккал/моль.
О м е х а н и з м е р а с т в о р е н и я С u S. в OTCYTCT
вие кислорода процесс растворения CuS имеет более
сложный характер, чем аналоrичная реакция для низше
[о сульфида меди. При изучении кинетики этоrо процесса
мы систематически обнаруживали в растворе не только
сульфид , но и роданид ионы. Это заставило нас критиче
ски рассмотреть предложенные ранее уравнеНИЯ t кото-
рые должны были бы отражать взаимодеЙствие между
CuS и цианидом. Анализ этих ураIНlеIIИй показал их lIe
удовлетворительность, что побудило нас к более деталь
ному изучению этоrо вопроса.
Порошок ClIS перемешивали с раствором цианида Ka
лия, приrотовленным на обескислороженной воде, в за
крытых колбах в течение 30 суток при 250 С. KOHцeHTpa
ция цианида калия 5,57 .10 2 моль/л; на один литр циани
cToro раствора было взято 2,0 r или 2,09. 1 0 2 МО.iIей,
твердой фазы высшеrо сульфида меди. После paCTBO
рения исходной навески было найдено следующее coдep
жание меди и серы в растворе: 1 А6. 1 0 2 И 1.4 7Х
Х 1 0 2 r ион/л соответственно, а при повторном paCTBope
нии данной фазы 0,54. 10 2 и 0,57. 1 0 2 r ион/л (повтор
ное растворение проведено при недостатке твердой фа
зы). Таким образом, состав твердой фазы в процессе ра-
створения не изменялся, медь и сера переходили в раствор
в том же соотношении, в каком были в исходном препара
те; осадок был растворен нацело.
Для определения ионноrо состава раствора была при
нята следующая методика. Пробу раствора из пипетки
вливали в колбу с рассчитанным количеством раствора
уксусной кислоты. Колбу доливали обескислороженной
водой доверху, закрывали резиновой пробкой и оставля
ли на 1 o 12 ч. При подкислении образуются молекулы
СиНильной кислоты, снижается концентрация ионов циа
нида и сульфид ионы взанмодействуют с присутствую
щей в растворе медью. Образовавшийся осадок отфильт-
173
раван через стеклянный пористыЙ фильтр, промыт под-
l(исленной и обескислороженной подоЙ и разбавленным
аммиаком для удаления роданида меди.
Вместо описанноЙ в литературе методики определения
роданида в присутствиии цианида, !шторая не позволяла
получить устойчивые результаты в присутствии ионов ме-
ди, нами был применен следующий путь определения po
данида. К отфильтрованному от сульфида меди раствору
добавляли избыток нитрата серебра, образовавшийся
осадок промывали и растворяли в аммиаке, серу в амми-
ачном растворе окисляли бромом (роданид превращали
в сульфат ион), бромид серебра отфильтровывали и про
мывали, а в фильтрате определяли серу.
В фильтрате после отделения роданистоrо серебра
сера не была найдена, т. е. в исходном растворе не было
окисленных соединений серы. В промывных водах после
промывки осадка сульфида меди аммиаком обнаружены
незначительные количества меди и серы, поскольку при
подкислении исходноrо раствора частично выпадает в
осадок роданистая медь. Найденное в промывных водах
количество роданида было прибавлено к содержанию ero
в фильтрате от осадка сульфида меди. Содержание ком-
понентов приведено в табл. 10.
Таблицз 10
Результаты определения меди и серы
Компоненты
Содержание компонентов, r ион/л. в
осадке сульфида I
меди ФИЛЬТIНlте сумма
Медь
Сера
1 404.10 2
о: 750. IO 2
о 056. 1 0 2
о: 720. 10 2
I 46.10 2
1:47.10 2
Анализ приведенных данных позволяет сделать ряд
важных выводов о характере изучаемой реакции.
После достижения равновесия медь присутствует в
растворе тольк в одновалентноЙ форме, поскольку обра-
зовавшийся при подкислении осадок имеет' состав, отве-
чающиЙ соединению Cu 2 S.
Это можно объяснить либо восстановлением соедине
ний двухвалентной меди в растворе до одновалентной,
174
либо тем, что в составе ковеллина вообще нет ионов ДBYX
валентноЙ меди (в обычном представлении).
Нами было найдено, что около половины всей серы
находится в растворе в виде сульфид-иона, а остальная
в форме роданида. Эти результаты получены неоднократ-
но и MorYT считаться достаточно надежными. Их можно
объяснить тем, что в составе высшеrо сульфида меди име-
ются два типа ионов серы. При растворении CuS первый
из них переходит в раствор в виде сульфид ионов, а BTO
роЙ при взаимодействии с цианидом дает роданид. Кри-
сталлохимические исследования показали, что в reKcaro-
нальной решетке ковеллина действительно имеются и S2
и молекулярные ионы S . Однако если принять состав
ковеллина таким, как предлаrает, например, Б. Ф. Ор-
монт ! (СU2СUSЗ=== CU2S' CUS2), то уравнение соответству-
ющеЙ реакции
CUzS. CuS 2 + 11 CN == ЗСн (CN) +
+ 2S2 + CNS + 1/2 (CN)z (а)
дает отношение в растворе сульфидной серы к роданид-
ной, равное 2: 1, что не cor ласуется с нашими экспери-
ментальными данными.
Видимо, состав ковеллина несколько иной. Можно
предположить, что вся медь в нем одновалентна, а вся
сера или часть ее находится в полисульфидной форме.
В этом случае состав ковеллина должен быть выражен
формулами: CU O S2=== CU2 (S2) или CU4S4== CU2S' Сu 2 Sз.
Ltля этих соединений реакции взаимодействия с циани
дим следует написать так:
CU Z S 2 + 7CN == 2Cu (CN) + S'l + CNS , (б)
Cu 2 S. Сu 2 S э + 14CN 4Си (CN)5' + 2S2 + 2CNS . (в)
В реакциях (б) и (в) соотношение между сульфидной
и роданидноЙ серой равно 1 : 1, т. е. такое же, как в на-
ших опытах. На 1 r-ион растворенной меди при этом дол-
ЖНО быть израсходовано 3,5 r иона цианида; а по нашим
данным, 3,8 r-иона. Это незначительное превышение мож-
НО объяснить тем, что даже в условиях равновесия в ра-
створе должно присутствовать некоторое количество сво-
бодноrо цианиЛ,а.
I О Р м о 11 Т Б. Ф. Структуры неорrаlIичеСI<ИХ веществ. М., roc
техтеоретиэдат. ]950.968 с. с ил.
175
Следующим очень важным выводом является то, что
при отсутствии кислорода образование ионов роданида
возможно только за счет взаимодействия цианида с поли
сульфидной серой. Следует отметить, что реакцию взаимо-
действия цианида с полисульфидами широко использу
ют в аналитической химии, поскольку она протекает KO
личественно и быстро. Кроме Toro, наши исследования
показали, что и плавленая, и порошкообразная сера при
невысокой щелочности раствора не взаимодействуют с
цианидом. Поэтому неверны все те уравнения реакциЙ,
которые MorYT быть сведены к схемам:
S2 + 0 S'
2 ,
S + CN CNS
Однако при достаточно высокоЙ щелочности или наличии
в растворе S2 образовавшаяся при окислении элемен
тарная сера может давать полисульфиды (nS+S2
S +l' Go<O, К>l), способные взаимодействовать
с цианидом с образованием роданида, т. е. и в этом слу
чае последняя фаза реакции обусловлена наличием поли
сульфидов (S +l +п CN S2 +п CNS ).
При изучении процессов растворения сульфидов меди
в цианистых растворах в присутствии кислорода показа
но, что основным конечным твердым продуктом реакции
является элементарная сера, а не роданид. Образование
роданида обусловлено либо побочными процессами, о ко-
торых было сказано выше, либо недостатком в растворах
кислорода, коrда минералы, содержащие полисульфид
ную серу (CuS, 1V1nS2, NiS 2 , CoS 2 , пирротины И др.),
MorYT взаимодеЙствовать с цианидом, минуя стадию
образования элементарной серы, соrласно реакциям ти
па (б) и (в). Только этими процессами и можно объяс
нить наличие роданидов в рабочих цианистых растворах.
отмечаемое мноrими авторами.
Вышесказанное давало основание предполаrать, что
исследование кинетики растворения ковеллина будет
затруднено вследствие образования пленки элементар-
ной серы на поверхности диска, менее проницаемой, чем
пленка CuS, получающейся при растворении CU2S в ци.
анистых растворах в присутствии кислорода. Изучение
зависимости скорости растворения ковеллина от давле-
ния кислорода и последующие опыты в атмосфере во-
дород(\ показали, что при растворении CuS (как
176
и CU2S) протекают две сопряженные конкурирующие
реакции:
2CuS + 8CN + 02 + H20 == 2Си (CN) +
+ 2S + (CN)2 + 40H , (r)
2CuS + 7CN == 2Cu (CN)j + S2 + CNS . (д)
в присутствии кислорода MorYT протекать обе peaK
ции; вклад каждоЙ из них в общий процесс растворения
определяется концентрациеЙ pacTBopeHHoro кислорода:
чем она выше, тем больше относительное количество
CuS, pacTBopeHHoro по реакции (r), и наоборот. По
скольку скорости реакциЙ (r) и (д) вычисляют по коли
честву перешедшей в раствор меди, о преимущественном
протекании тоЙ или иноЙ из них можно судить только по
соотношению концентрациЙ меди и серы в растворе.
Если оно равно единице, то протекает только реакция
(д), если больше единицы то обе; чем больше числен
ное значение этоrо соотношения, тем больше преоблада
ет реакция (r).
Независимость скорости растворения CuS от числа
оборотов диска, а также сравнительно высокое значение
экспериментальной энерrии активации позволяет ут-
верждать, что кинетически определяющей стадией про
цесса является не диффузия ионов, а химические явле-
ния на rранице раздела фаз, в результате которых на
поверхности растворяемых сульфидов, по видимому,
образуются промежуточные соединения, чем и можно
объяснить линейную зависимость скорости растворения
ковеллина от концентрации цианида.
Скорость растворения ковеллина в водных растворах
цианида калия может быть рассчитана по уравнению
(5). k 1,19.10 7 л/(см 2 .с 1 ) при 25°С, а для друrих тем-
ператур её можно вычислить из уравнения
19 k == 2,850 .
т
в заключение интересно использовать данные, полу-
ченные ври помощи метода .вращающст'ося диска, для
сравнения поведения сульфидов серебра и меди (apreH-
ТИта, хаЛЫ<ОЗИIlа и ковелина) в I/pOltecCe цианирования.
12 30б
177
Общая черта кинетики растворения этих трех минера
лов линейная зависимость скорости растворения от
концентрации цианида. Общими для арrентита и ковел
лина являются независимость скорости растворения от
интенсивности перемешивания и более высокое значение
экспериментальной энерrии активации (соответственно
6,43 и 5,56 ккал/моль), тоrда как при растворении халь
козина E 3,30 ккал/моль. Растворение первых двух
минералов протекает в кинетическоЙ области, а послед
Hero в диффузионной.
Однако наЙденные энерrии активации значительно
меньше, чем полученные друrими авторами для кислых
и щелочных растворов. Объяснение этому следует ис
кать в явлении адсорбции ионов цианида (сильных
комплексообразователей по отношению к ионам серебра
и меди) на поверхности сульфидов, в расшатывании их
кристаллической решетки и снижение затрат энерrии на
химические превращения На твердой поверхности. Ин
тересно отметить, что увеличение скорости растворения
в ряду Ag2S CUS [константы равны соответственно
1,85.10 8 л/(см 2 .с.ат 1 / 2 ) и 1,19.10 7 л/(см 2 .с)] сопро-
вождается снижением энерrии активации процесса (зна-
чения !:!.Е соответственно 6,43 и 5,56 ккал/моль).
Начальные скорости растворения ковеллина и халь
козина не зависят от присутствия окислителей, тоrда как
арrентит растворяется только при наличии ки лорода.
Более Toro, скорость растворения простых сульфидов
меди в присутствии кислорода в течение времени умень-
щается и тем сильнее, чем больше парциальное давление
кислорода над раствором; скорость же растворения ар-
rентита увеличивается пропорционально корню квадрат-
ному из величины парциаЛЫIOrо давления кислорода.
Простые сульфиды меди взаимодеЙствуют с растворами
цианида даже в атмосфере водорода.
Повышение температуры в большеЙ степени ускоря-
ет растворение арrентита и ковеллина, чем халькозина
(температурные коэффициенты у kзо/k20 равны соот-
ветственно 1,44; 1,37 и 1,20).
Теллурuд серебра
Теллурид серебра (rессит) встречается в природе
реже арrентита, но отмечен в рудах ряда месторожде-
ниЙ. Поведение ero в rидрометаллурrических процессах
совершенно не изучено, но представляет теоретический
178
интерес, так как один из продуктов ero окисления ( ТеО 2)
нераСТВОРИl\l в воде и l\!Ожет вызвать кинетические ос-
ложнения.
В л и я н и е к о н Ц е н т р а Ц и и ц и а н и Д а к а л и я.
Характер кривых v === t (С) указывает на существование
двух областей влияния концентрации цианида: в одной
из них скорость растворения прямо пропорциональна
d
G'
ls 6
OQ
i!3
4
"о""
Рис. 54. Зависимость СКОРОСТl1
растворения теллурида серебра
от концентрации цианида и тем-
пературы раствора: 1 240 С
5 ат; 2 300 С 5 ат; 3 4()0 С
5 ат; 4 300 С 15 ат
2
з
5 10 15 20
C XCN '10 2 } /'fОЛЬ/Л
величине CKCN в первой степени, а в друrой от нес не
зависит (рис. 54). При 5 ат и 24, 30, 400 С максималь-
ные скорости и предельные концентрации цианида co
ответственно равны 2,25, 2,80 и 3,85.10 B r-атом/(см 2 .С)
и 3,5; 6,0; 11.10 2 моль/л; при 15 ат и 300 С 7,15.10 8
r-атом/(см 2 .С) и 7,25.10 2 моль/л.
Найденные «предельные» концентрации значительно
выше рассчитанных из уравнения реакции, что объясня-
ется ступенчатым протеканием реакций и образованием
пленок на реаrирующеЙ поверхности.
В л и я н и е ч и с л а о б о Р о т о в Д и с к а. Скорость
растворения зависит от интенсивности перемешивания
только в запредельной области: при давлении 12 ат и
1470 об/мин она равна 1,12.IO ", а при 720 об/мин
6,48. 1 O B r-атом/ (см 2 . с). Отношсние скоростей paCTBope
ния, равное 1,73, близко, но не равно отношению чисел
оборотов диска в степени 0,5 (равному 1,43). Это весо-
ответствие одно из проявлениЙ осложняющеrо влия-
ния пленок.
В л и я н и е т е м пер а т у р ы. Изучено в дo и за
предельной областях. Полученные данные очень необыч
ны: в допредельноЙ области с повышением температуры
скорость растворения уменьшается (Jg === 12,30+
12*
179
1810 .
+ . E*== 8,28 ккал/моль), а в запредеЛЬНО!"1
т
1415
растет (lg Vm== 2,886 , E == +6,48 ккал/моль).
т
В л и я н и е Щ е л о ч н о с т и р а с т в о р а. С повыше
нием щелочности раствора скорость растворения теллу
рида серебра уменьшается в допредельной области. Как
и было предположено, растворение теллурида серебра
в цианистых растворах потекает с очень большими oc
ложнениями, вызванными сложным, ступенчатым xapaK
тером реакции.
Теллурид серебра, как и ero сульфид, взаимодейству
ет с цианидом только в присутствии кислорода, но с тем
отличием, что на ero поверхности образуются толстые,
видимые rлазом пленки окисленных соединений. Эти
реакции схематически можно записать так:
Ag 2 Те + 02 == 2Ag + Те0 2 ;
2Ag + 4CN + 1/202 + Н 2 О == 2Ag (CN); + 20H .
В л и я н и е Д а в л с н и я к и с л о р о Д а н а Д р а с T
в О ром. В запредельноЙ области максимальные CKO
рости растворения пропорциональны давлению кислоро
да в первой степени (рис. 55). а на поверхности диска
( Paт)2/J
2 4 6
..;
6
s:.
Q:) 4
..
2
......
8" :t
'-'
5to....
2
рис. 55. 3аrшсимость максима.'1ЬНОЙ
скорости растворения теллурида се"
ребра (з<lпределыI ая область, J) и
к()нстаllТЬ! скорости реакции (допрс.
дельная область, 2) от давления
)\\Н:.'I0рода над paCTRoJ1oM
5 10
р,ат
1S
явно видны фиrуры травления. В допредельной области
показатель степени меньше, примерно 2/3.
Влияние кислорода на скорость перехода серебра
в раствор в допредельной области очень сложно. С oд
в этт.I случае Е нельзя называть ЭllерПlеЙ активации.
180
ноЙ стороны, избыток кислорода вызывает образование
пленок, тормозящих процесс, что подтверждается YMeHЬ
шением скорости ПрIl повышении температуры (пленки
становятся толще). С друrой стороны, повышение давле
ния ускоряет растворение серебра за счет увеличения
скорости диффузии кислорода сквозь пленку.
О двойственном влиянии кислорода свидетельствуют
и величины стехиометрическоrо коэффициента реакции
(отношение числа молей цианида и кислорода в точке
эквивалентности (Сп: 502 ), равные при 5 ат и температу
рах 24; 30 и 400 С соответственно 2,8; 10,7 и 37, а при
15 ат и 300 C 4,5 (теоретическая величина 2,67). Такое
сложное влияние кислорода сказываеl'СЯ и на количест
венных закономерностях процесса растворения. Отноше
нне приведенных скоростеЙ растворения (и/С) при 15 и
5 ат равно 9,9.10 7: 4,7.10 7==2,1, тоrда как отношение
давлений в первоЙ степени, равное трем, характерно для
стадии растворения Jнеталлическоrо серебра, а в степени
0,5, равное 1 ,73, для стадии окисления теллурида. Для
cYMMapHoro же процесса окисления растворения ско-
рость зависит от давления в степени 0,67. По-видимому,
и серебро, которое содержится внутри пленки, тормозит
окисление теллурида вследствие уменьшения ее порис-
тости.
Однако с повышением концентрации цианида харак-
тер процесса изменяется. В запредельной области кисло
род по отношению к цианиду присутствует уже в MeHb
шем количестве, пленки становятся тоньше, и процесс
нереходит в область, контролируемую диффузией кисло
рода к реакционной IIовеРХНОСТII. Первым доказательст
вом этоrо является зависимость скорости растворения от
интенсивности llереl\lешивания, вторым зависимость
скорости от давления кислорода в первой степени, треть-
им появление четких фиrур травления на поверхности
диска. Четвертым и наиболее надежным доказательст
вом является близость экспеРИl\'lентальноrо и теорети-
ческоrо значениЙ скорости растворения.
О механизме растворения теллурида
с е р е бра. Сказанное позволяет уяснить характер про
цессов на реаrирующей поверхности. Если твердое тело
растворяется в диффузионном режиме с кислородной
деполяризацией и без осложнений, вызываемых наличи-
ем пленок на поверхности, то увеличение скорости
растворения с температуроЙ очень невелико, так как YBe
181
личение коэффициента диффузии кислорода почти ком-
пенсируется снижением ero растворимости, а эксперимен
тальная энерrия активации этоrо процесса (при условии,
что поддерживается постоянным общее давление) очень
мала. При растворении теллурида серебра в запредель-
ной области, хотя оно и протекает в диффузионном ре-
жиме, энерrия активации равна 6,48 ккал/моль, т. е.
значительно выше.
Это объясняется более полным удалением пленок
с поверхности, при llOвышении температуры, и экспери
ментальная энерrия активации характеризует весь этот
суммарный IIроцесс. Об осложнении, вызываемом плен
ками, свидетельствует явление, которое наблюдали при
растворении палладия в цианистых растворах, зависи-
мость скорости от числа оборотов диска в степени боль-
шей 0,5.
Электроноrрафическим анализом пленок, образую-
щихся на диске из Ag 2 Те, установлено, что пленка состо-
ит ИЗ двух слоев: Аg5Тез (внутренний, толстый) и AgTe
(наружный, тонкиЙ). Следовательно, растворение тел
лурида серебра в цианистых растворах в присутствии
кислорода протекает не менее чем в три стадии:
1. 6Ag 2 Te + 4CN + 1/202 + Н 2 О -== 2Аg 5 Те э +
+ 20H + 2Ag (CN)2
11. 2Аg s Те з + 12CN + 3Ч 2 О 2 + Н 2 О === 4AgTe +
+ 6Ag (CN)2 + 2TeO + 20H
111. 4AgTe + 8CN + 502 + 40H === 4Ag (CN)2' +
2
+ 4ТеОз + 2Н 2 О,
6Ag 2 Te + 24CN + 902 === 12Ag(CN)2 + 6TeO
Ag 2 Te + 4CN + Р/202 == 2Ag(CN)2' + TeO .
Найденные скорости перехода в раствор серебра и
теллура позволяют сделать некоторые выводы о CKOpO
стях отдельных стадий реакции. Отношение количества
pacTBopeHHoro серебра к теллуриду для стадии 1 рав-
но 00, дЛЯ I II равно 4, а дЛЯ I+II+I11 (суммарной)
равно 2. Данные, полученные для запредельной области,
182
дают величину 2,99. Если обозначить количества paCTBO
ренных элементов в стадиях 1, 11 и 111 соответственно
через х, у и Z, то можно написать следующее уравнение:
Ag/ Те === (2х + 6у + 42)i(2y + 42) === 2,99;
х + O,Oly == 3,982.
Членом 0,01 у можно пренебречь, и тоrда z==x/3,98, т. е.
скорость стадии 111 в 4 раза меньше, чем скорость 1.
При установившемся режиме будут протекать все три
стадии, а на поверхности диска будут пленки всех про.
межуточных продуктов, относительные количества KO
торых должны определяться условиями опыта (состав
раствора, температура, интенсивность перемешивания).
В запредельной области концентрация цианида и
скорость ero диффузии сквозь пленку достаточно велики,
но кислород находится в недостатке по отношению к
цианиду, что способствует протеканию стадий 1 и 11. На
поверхности накапливается не только Аg5Тез, но и AgTe.
растворение KOToporo и будет определять скорость про.
цесса в целом.
В допредельной области, коrда у реакционной по
верхности имеется избыток кислорода по отношению к
цианиду, стадия 111, т. е. растворение AgTe, не должна
быть лимитирующей. Скорость растворения будет опре
деляться доставкой peareHTOI3, особенно цианида, к внут.
ренним слоям AgTe и Аg5Тез, хотя скорость собствен
но химическоrо акта стадий 1 и 11 может быть и больше,
чем стадия 11 1. В этом случае пленка на поверхности
диска состоит только из Аg5Тез.
Исходя из сказанноrо, можно объяснить, почему
одни и те же факторы (состав раствора, ero температу
ра, давление кислорода) по разному влияют на скорость
процесса в до- и запредельной областях по цианиду.
Для расчетов в допредельноЙ области можно использо
вать уравнение v298===2,O.IO 7 C.p'ij: r. aToM/(cM2.c),
dE === 8,28 ккал/мол, а для запредельноЙ и т ===
==6,1.IO 10'P02 .п 3 /\ dE===6,48 кка-п/моль.
Теллурuд золота
Теллурид золота встречается в рудах в виде мине.
рала калаверита АнТе2, которыЙ с трудом поддается циа.
нированию.
Процесс растворе ия теллурида золота в цианистых
]83
растворах очень сложен влияние отдельных факторов
на ero скорость не характерно ни для чисто диффузион
Horo, ни для чисто кинетическоrо режима. Можно OTMe
тить следующие отклонения (рис. 56): зависимость CKO
рости растворения в допредельноЙ области и от KOHцeHT
рации цианида, и от давления кислорода; независимость
скорости растворения от интенсивности перемешивания
12
с:;-
о,;
в
.....
'
4
.0
4
3
2
0,1 0,2 0,3
С,I10 ПЬ i Л
Рис. 56. Зависимость скорости раство-
рения теллурида золота от концентра-
ции цианида. давления кислорода и
иитенсивности перемешивания: 1 I ат,
600 об/мин; 2 0.21 ат, 100 об/мин:
3 1 ат, 100 об/мии; 4 0.21 ат,
600 об/мин
о
3
'"
2
.S?
:. 1
0,1 0,2
С,f10ЛЬ/Л
Рис. 57. Зависимость скорости
растворения теллурида золота
от щелочности раствора
в допредельной области и зависимость в запредельной;
очень высокая предельная концентрация цианида; зави
симость скорости растворения от давления кислорода и
числа оборота диска в степенях <0,5; большие и прак
тически одинаковые энерrии активации в до и запре
дельной областях; своеобразное влияние щеЛО1lНОСТИ
раствора повышение скорости растворения при низких
концентрациях цианида и торможение ее при высоких.
Все эти наблюдения свидетельствуют о сложном и CTY
пенчатом характере процесса.
При изучении процесса растворения AuTe2 в первую
очередь было обращено внимание на влияние щелочи.
Кинетические опыты (рис. 57) показали, что при увели
чении концентрации КОН от 10 З до 10 1 мольjл CKO
рость растворения увеличивается в 1 О раз.
Затем был поставлен следующиЙ опыт: навески AuTe
и КОН поместили в I\ОIIИЧССКУIO колбу и наполнили ее
184
доверху дистиллированноЙ водоЙ, содержащеЙ 8,9 мrjл
или 2,78. 1 0 4. моль/л кислорода. Колбу закрыли пробкой
и вращали в термостате при 250 С три месяца; зат м
раствор отфильтровали.
Анализ показал, что в раствор перешел только тел-
лур в количестве 35,7 мr/л, или 2,80. 1 0 4 r-атом/л. Сле-
довательно, процесс протекал соrласно уравнению
AuTe 2 +. 202 + 40H. ::::=- Au + 2TeO + 2Н 2 О.
Второй опыт был поставлен иНаче: в открытом ста-
кане перемешивали навеску 30 Mr, или 6,65. 1 O IO моль/л
AuTe2, с О, l-м. раствором КОН. В отфильтрованном раст-
воре был найден только теллур (14,7 Mr, или 1,l6X
Х 1 0 4 r-атом/л), а в остатке золото (12,54 Mr, или
6,37. 10 5 r-атом/л). Этот опыт показал, что в щелочной
среде теллурид золота разлаrается полностью.
ТретиЙ опыт был поставлен с вращающимся диском
из АиТе2 (концентра ция цианида 1,98. 1 о з моль/л и
0,1 моль/л КОН 250 С, Р О 2=== 1 ат, 600 об/мин). По кинети-
ческим кривым вычислены скорости перехода в раствор
золота и теллурида: 2,09.10 IO и 8,7.10 IO r-атом/(см 2 .С),
т. е. переход компонентов в раствор не эквивалентен: на
1 атом золота приходится не 2, а 4,15 атома теллура.
Поскольку скорость растворения в допредельной об-
ласти не зависит от интенсивности перемешивания, а
приток кислорода значительно превышает ero потреб-
ность при растворении теллура (9,8. 1 0 9 И 8,7. 1 O IO),
можно предполаrать, что вначале протекает реакция
разложения теллурида золота под действием щелочи, а
затем растворение обоих продуктов теллура и золо-
та. Поэтому скорость растворения теллурида золота в
допредельной области зависит и от щелочности, и от
концентрации цианида (рис. 58). С повышением щелоч-
ности увеличивается скорость разложения теллурида
золота и растворения выделяющеrося при этом тонко-
дисперсноrо теллура, а также количество выделяющеrо-
ся золота и скорость ero растворения при одной и той
же концентрации цианида.
Однако блаrоприятное действие щелочности наблю-
дается только при более низких концентрациях циани-
да. Максимальные же скорости растворения золота, до-
стиrаемые при высоких концентрациях цианида, будут
тем выше, чем ниже щелочность. При щелочности
185
10 I моль/л КОН и POz == 1 ат v max ==2,26. 10 lo, а при
10 З 'уlOль/л 11.6.10 IO r-аТОI\1/(сМ 2 .С), т. е. в 5,1 раза
выше.
Большие скорости растворения золота возможны в
области очень высоких концентраций цианида, условно
названной запредельной, в которой скорость процесса
уже зависит от интенсивности перемешивания, что яв
ляется характерным признаком диффузионноrо режима.
Для уточнения обратимся ко второму критерию вели
чине теоретической скорости растворения. С использо
З
""
2
s;:."
1
Рис. 58. Совместное влияние
концентрации цианида и щелоч-
ности раствора на кииетику рас-
творения теллурида золота:
1 [к.ОНl==IО З моль/л. I ат;
2 IO 2 моль/л. I ат; 3
I o l моль/л, I ат
(l
ванием данных о растворимости и коэффициентах диф-
фузии кислорода был рассчитан удельный поток кисло-
рода на диск для 15, 25, 35, 45 и 550 С: 2,88; 3,00; 3,15; 3,33
и 3,40.IO 9 моль/(см 2 .с), при скорости вращения диска
1 об/с и общем давлении 1 ат. При парциальном давле-
нии кислорода 0,21 ат и 100 об/мин скорость растворе-
ния золота в слабощелочном растворе (IO 3 моль/л)
равна 1,27. 1 0 9 при 550 С, а поток кислорода для усло-
вий этоrо опыта 3,40.IO 9.0,21.1,671/2 ==9,20.10 IO
моль/ (см 2 . с).
Получается несколько необычный результат: если
верить общепринятому уравнению реакции растворения
теллурида золота в цианистых растворах
2AuTe 2 + 4CN + 4Ч 2 О 2 + 60H ===
== 2Аи (CN)2' + 4TeO + 3Н 2 О,
(а)
соrласно которому на 1 r aToM золота расходуется
2,25 молей кислорода, то наблюдаемая скорость раство-
рения получается значительно больше теоретической.
186
Причина этоrо расхождения в сложном, ступенчатом xa
рактере реакции.
В условиях рассматриваемоrо опыта, при недостатке
кислорода реакция протекает иначе:
2АиТе 2 + 4CN + 11/202 + 60H ==
== 2Аu (CN)2" + 2Te2 + 2TeO + 3Н 2 О. (6)
Соrласно этому уравнению, на один моль кислорода
в раствор переходит 1 ,33 r aTOMa золота, а 2 r aTOMa тел
лура окисляются не на поверхности диска, а в объеме
раствора, так как реакция протекает при недостатке
кислорода у поверхности. Если принять этот стехиомет
рический коэффициент (1,33), то рассчитанному потоку
кислорода соответствует следующее количество золота:
9,20.10 1°.1,33=== 1,23.10 9 r aToM/(cM2.c), которое очень
хорошо соrласуется с найденным экспериментально:
1,27.10 9 r-атом/(см 2 .С). Растворение протекает в He
осложненном диффузионном режиме, пленки на поверх
ности диска электроноrрафически не обнаружены.
При повышении давления кислорода над раствором,
увеличении числа оборотов диска, снижении температу
ры стехиометрический коэффициент реакции изменяет
ся потребление кислорода на 1 атом золота увеличи
вается. Был поставлен такой опыт: раствор с KOHцeHTpa
цией кислорода 2,77. 10 4, цианида 9,4. 10 2 И КОН
0,1 моль/л перемешивали с навеской теллурида золота
в закрытой колбе 90 суток при 250 С. В отфильтрован
ном растворе было найдено 1,69. 1 0 4 r атома/л золота,
что соответствует расходу 1,64 моля кислорода На
1 r-атом золота. Повышенный по сравнению с предыду
щим опытом расход кислорода вызван тем, что образу
ющийся теллурид ион частично окислился, но все же
потребление кислорода значительно меньше, чем по
реакции (а). Следовательно, в зависимости от состава
раствора, ero температуры и интенсивности перемеши-
вания потребление кислорода на 1 r aTOM золота может
изменяться от 0,75 до 2,25 молей.
Ввиду сложности исследуемоrо процесса влияние
температуры было исследовано более подробно: при раз-
личных концентрациях цианида (8.10 3 и 0,15 моль/л),
давлениях кислорода (0,21 и 1 ат), различной щелочности
(1 0 3 И 0,1 моль/л). скоростях вращения диска (100 и
600 об/мин) и температурах J от 17 до 550 С). ДЛЯ серий
187
1 2 (допредельная область) в табл. 11 приведеНbI вели
ЧИНbI k.l0 9 , для серий 3 4 (запредельная область)
максим аЛЬНbIе скорости итах' 1010.
Таблица 11
Кинетика растворения теллурида золота
:.:
:.: Константа скорости Максимальная скорость
со
Q)
u
со "ОС 1 2ООС I 25°С I ЗООС I ,оос I "ос 150'С I "ос
Q)
::!! 35 0 С
О
:I:
с:: ::10
:S:",::!!
'-'<Q.......
0.:':1:;:
4;1-0'"
:r:::(:(
(7)",:(
1 5,6 7,5 8,7 10,7 12,7 15,6 7,85
2 1,89 3,4 4,82 7,4 8,46 7,2
3 1,87 2,26 2,48 3,06 4,43 7,65
4 3,15 3,60 5,13 9,0 12,7 8,15
Среднее значение энерrии активации 7,7 +
0,5 ккалjмоль, что свидетельствует о малом влиянии на
эту константу давления кислорода (серии 1 и 2), ще
лочности раствора (серии 1 и 3), интенсивности переме-
шивания (серии 2 и 4). ТемпераТУРНbIЙ коэффициент
одинаков в до- и запредельной областях, если не УЧИТbI
вать изменения растворимости кислорода с температу
рой. Однако если это учесть, то энерrия активации в за
предельной области будет значительно ВbIше вследствие
уменьшения ТОЛЩИНbI пленок при ПОВbIшении темпера
TypbI.
БbIЛО изучено также действие перекиси натрия, кото-
рую часто применяют при цианировании теллуристых
руд. В одной из серий ОПbIТОВ (250 С, 600 об/мин, кон-
центрация цианида 10 2 моль/л) при добавках перекиси
натрия 0,25; 0,5 и 1,00 r/л получеНbI следующие скорости
растворения: 0,7; 1,8 и 6,1.10.10 r aToM/(cM2.c), а без
перекиси, при той же концентрации цианида, 0,34 и
0,56.10 IO r aToM/(cM2.c) (продувка воздухом и кислоро
дом соответственно).
Налицо значительное ускорение процесса, причем
пропорциональное увеличению расхода перекиси в сте-
пени > 1. Это объясняется тем, что увеличивается не
только концентрация окислителя, но и щелочность раст-
вора, которая, кю< показаl!О выше, СI1ЛЫЮ ускоряет про-
цесс растворения.
188
Действие перекиси натрия эффективнее, чем дейст-
вие щелочи. Если сравнить скорость растворения при
одинаковом расходе щелочи и перекиси (примерно
lO 2 моль/л) и концентрации цианида 10 2 моль/л, то
достиrаемая скорость растворения с перекисью почти
на порядок выше: O,83.10 IO и 6,1.10 IO r aToM/(cM2.c).
Для расчетов скоростей растворения при щелочности
раствора 10 3 моль/л можно использовать следующее
уравнение:
Q == kSCpl/3 Т*.
(15)
При 250 С, k==5,6.10 9, tJ.E===7,85 ккал/моль. В этоЙ
области рН константа скорости реакции очень мала: при
продувке раствора кислородом она на два порядка ниже,
чем для металлическоrо золота в кинетическом режиме
(5,5. 10 7). Еще больше это различие скоростей при
продувке раствор а воздухом: 1,30. 1 0 6: 3,4. 1 0 9 ==
==400 раз.
За счет сильноrо повышения щелочности до pH 13
это различие можно уменьшить: отношение максималь-
ных скоростей растворения при продувке раствора кисло-
родом равно 4,9.10 9:2,26.10 IO==22, а при продувке воз
духом 2,2.10 9:1,1.10 lo==20. В области высоких кон-
центраций цианида (0,5-'7-1,0 % ), при низкой щелочности
раствора и повышенной ero температуре можно почти
полностыо устр апить кинетические осложнения, перевес-
ти процесс в диффузионную область и достиrнуть более
высоких скоростей растворения, хотя вряд ЛИ это будет
рентабельно при обработке руд, но возможно, будет ВЫ 4
rодно при автоклавной переработке боrатых KOHцeHTpa
тов.
На основании полученных результатов можно оце-
нить пути интенсификации процесса цианирования тел-
луридов: применение перекиси натрия, повышение
температуры, повышение щелочности при умеренных кон-
центрациях цианида и снижение ее при высоких. Увели-
чение давления кислорода сильнее сказывается при вы-
сокой щелочности раствора, чем при низкой, НО в обоих
случаях показатель степени <0,5. Интенсивность пере-
мешивания не влияет на скорость растворения при YMe
* При pH-13 скорость растворения изменяется пропорциональ-
но Р I /2
О. .
189
ренных концентрациях цианида и низкой щелочности.
При высоких концентрациях цианида, в запредельной об-
ласти и диффузионном режиме показатель степени ра-
вен 0,4 0,45, т. е. близок к теоретическому. Кроме Toro,
следует рекомендовать очень тонкий помол (теллурид зо-
лота довольно хрупок), поскольку величина удельной по-
верхности входит в кинетическое уравнение и ее увеличе-
ние может компенсировать малое значение константы ско-
рости. Желательны также предварительное выделение
теллуридав флотацией с получением боrатоrо концент-
рата, приrодноrо для переработки по более сложной
схеме, и предварительная аrитация в сильно щелочном
растворе.
1. ТЕЛЛУРИД ЗОЛОТА В ХЛОРИДНЫХ РАСТВОРАХ
Учитывая перспективность процесса rидрохлорирова-
ния, была исследована возможность ero применения для
растворения теллурида золота. Использовались те же
,1
"" с
'i
8
cji @
cu t::I
с.о"
с:.,"
c:zr 4
:;.
0,05
о
20 30
'С,,.,ин
O
Рис. 59. I(инетичсские .rи&ы(' раст'
ворения теллурида зоЛота в вопных
растворах Хлора: 1 [CI2]==
O.DI5 моль/л; 2 [CllJ (),D26 и
[HCI] D,1 мольfл
Рис. 50. Зависимость скорости
перехода золота в раствор от
концентрации хлора: / без
пощшслеНIIЯ; 2 0,1 моль/л НС!
диски. что и при исследовании взаимодействия между
теллуридам и цианистыми растворами.
При проведении опытов было замечено, что на по-
верхности ДИСКа образуются довольно толстые пленки.
1-90
Анализ этих пленок и раствора на золото и теллур пока
зал, что растворение протекает инкоrруэнтно и зависит
от кислотности раствора. При невысокой кислотности на
поверхности образуются пленки теллура, в результате
чеrо скорость растворения снижается во времени
(рис. 59). Взаимодействие между теллуридом золота и
водными растворами
хлора протекает в диф т а б л н U а 12
фузионном режиме, так Результаты растворения золота
как скорость растворе- и теллура при различной кислотности
раствора
ния пропорuиональна
числу оборотов диска в
степени 0,5.
Была проведена ce
рия опытов при 250 С,
515 об/мин, концентра-
ции хлора 0,015 моль/л
и переменной кислотно
сти раствора. В непод
кисленных растворах
отношение теллура I(
золоту в пленке равно 5,9, а, при подкислении до 0,1
моль/л HCl 4,3 (вместо 2). Скорости перехода в pac
твор золота и теллура в зависимости от кислотности pac
твора приведены в табл. 12.
Как следует из этих опытов, при НИЗКОЙ кислотности
пленки обоrащены теллуром, а раствор им обеднен,
а при концентрации НС} выше 0,1 моль/л наоборот, так
как при низкой кислотности на поверхности диска обра-
зается ТеО2 соединение, довольно плохо растворимое
в воде, скорость ero перехода в раствор меньшая, чем зо
Лота. С повышением кислотности образуются хорошо рас-
творимые AuCI4" и TeCI . Однако стандартные потен-
циалы реакций образования AuCI4' и TeCl различны:
+0,995 и +0,55 В, и на поверхности образуются rальва
нические микропары (золото катод, теллур анод) .
Это приводит К некоторому уменьшению скорости рас-
творении золота и к увеличению скорости растворения
теллура (возможно и осаждение золота теллуром).
Подтверждением электрохимическоrо механизма про-
цесса может служить различное влияние увеличения кис
лотности раствора на скорость растворения металличе-
cKoro золота JI извлечения ero из теллурида: в первом
[HCII.
моль/л
v.l0 9 . r aToM/(cM2 .с)
t.'Au
Au
Те
VTe
о 4,05 2,5 1,62
0,1 3,80 5,2 0,73
0,33 3,20 10,4 0,31
0,66 3,00 18,0 0,17
191
случае скорость резко увеличивается (см. стр. 111), а во
втором уменьшается. 06разование пленок на поверх
Ности диска сопровождается неполным использованием
хлора, подводимоrо к поверхности. Так, при кислотности
0,66 моль/л соляной кислоты оно составляет 42% от Teo
ретическоrо.
При ПОДlшслении раствора около 0,1 моль/л HCl CKO
рость перехода золота в раствор прямо пропорциональ
на концентрации хлора, а в неподкисленных растворах
наблюдается некоторое отклонение кривой к оси абсцисс,
по которой отложены величины концентрации хлора
(рис. 60). Влияние температуры на скорость paCTBope
ния теллурида золота изучено в неподкисленных и под
кисленных растворах и оказалось одинаковым, дЕ==
'==4,85 ккал/моль величина, характерная для диффу
зионных процессов, осложненных поверхностными плен-
ками.
Для расчета скорости перехода золота в раствор
(ввиду инкоrруэнтности растворения теллурида золота
скорость вычисляем по более ценному компоненту зо
лоту) применимо уравнение (4). При 250 С k==8,6X
XIO 8 л/(см 2 .с 1 / 2 '061/2).
Преимущества процесса хлоринации теллурида золо
та по сравнению с цианированием те же, что и для Ме-
таллическоrо золота. Представляет интерес сравнение
скоростей растворения золота в этих процессах. При циа
нировании получение высоких скоростей растворения
возможно за счет повышения концентрации цианида в
растворе до 0,5 1 %, но максимальная достиrнутая при
этом скорость при продувке пульпы воздухом и
600 об/мин равна 7. 1 O IO r aToM/ (см 2 . с), тоrда как при
таком же числе оборотов и концентрации хлора
0,03 моль/л (в 7 раз ниже !) скорость хлоринации равна
8,2. 1 0 9, т. е. в 14 раз больше.
Если же проводить цианирование при более низких
конце -IТрациях цианида, компенсируя это повышением
щелочности раствор а (см. стр. 184, рис. 57), то скорость
цианироваНIIЯ составит Bcero 2 2,2. 1 O IO r aToM/ (см 2 . с),
т. е. будет в 40 раз меньше, чем при хлоринации.
Кроме Toro, скорость процесс а хлоринации можно
еще повысить за счет увеличения концентрации хлора
в растворе. Некоторое уменьшение скорости растворения
за счет образования пленок на поверхности теллурида
золота будет менее заметно при хлоринации пульп вслед
192
ствие стирания пленок частицаМJI пустоЙ породы. Изве
стные же отрицательные стороны хлоринации можно oc
лабить, комбинируя флотацию тС'ллуридов золота с пос
ледующеЙ хлоринациеЙ концентратов, выход которых
при правильном реЖИ1\lе флотаЦШI невелИ!<. Перед хло-
ринациеЙ полезно доизмельчеlIне КОНЦСIIтрата. Опти
мальные условия хлоринации: тонкиЙ IIОМОЛ, интенсив-
ное перемешивание, незначителыюе подкисление, доста-
точная концентрация хлора в растворе. Повышение TeM
пературы особоrо эффекта не дает энерrllЯ активации
сравнительно невелика и вызовет СIlижение раетворимо-
сти хлора.
3. ХЛОРИД СЕРЕБРА В РАСТВОРАХ
КОМПЛЕКСООБР АЗОВА ТЕЛЕЯ
Тиосульфат натрия и aJrtMuaK
Хлорид серебра (керарrирит) часто встречается в ce
ребряных рудах, в orapKax хлорирующеrо обжиrа особо
упорных руд и концентратов, содержащих сульфосурь-
мяные или сульфомышьяковые минералы серебра, а, кро-
ме Toro, может присутствовать и в различных полупро-
дуктах металлурrических заводов, например в шламах
электролитическоrо производства меди и никеля после
хлорирования.
Извлечение хлорида серебра цианированием протека-
ет без всяких осложнений и с большой СIЮрОСТЬЮ, так как
при этом не нужен окислитель кислород, который
обычно определяет скорость процесса при растворении
металлическоrо. или сульфидноrо серебра. Однако циа-
нид обладает шпроко известными недостатками: он ядо-
вит, Aopor, дефицитен и энерrично взаи:\юдействует со
мноrими минералами или соединениями, сопутствующи-
ми серебру. Поэтому уже более ста лет TO;\/IY назад были
сделаны попытки наЙти друrие растворители хлорида се-
ребра.
Для сравнения скоростей протекания тех ических
процессов необходимо изучить скорости реакции раство-
рения хлорида серебра в водных растворах цианидов,
аммиака и тиосульфата натрия. Влияние числа оборотов
диска на CJ<OpOCTb растворения изучено при концентра-
ции тиосульфата 0,1 моль/л и аммиака 0,154 молы ,,
температуре 25 0 С и переменнам числе оборотов диска.
13 306
193
Результаты исследования показали, что СКОрОСТИ рас-
творения постоянны во времени и CTpOrO пропорциональ-
ны числу оборотов в степени 0,5 (рис. 61). Следователь-
но, медленное звено процесса диффузия peareHToB к
поверхности диска.
Опыты, позволившие определить порядок реаl{ЦИИ,
проведены при 25 0 С и переменной концентрации реа-
[ентов. В опытах с тиосульфатом скорость вращения
ДИска была 375, с аммпаком 830 об/мин. Зависимость
30
1: .
25
20
111)'
15
2 3
vп
Рис. 61. Зависимость скорости paCTBO
рения хлорида серебра от иитенсивно-
сти перемешивания: J тиосульфат
(левая шкала); 2 аммиак (праваl1
шкала)
5
скорости растворения от концентрации линейна, т. е:
оба процесса протекают соrласно закономерностям ре-
акции первоrо ПОрЯДКа. Вычисленные по данным этоrо
rрафика константы скорости для тиосульфата и аммиа
ка равны COOTBeT TBeHHO 5,05. lO 7 И 1,17. 1 O 7 л/ (см 2 Х
Х C I / 2 . об l / 2 ).
Исследование влияния температуры проведено с
тиосульфатом (концентрация 0,1 моль/л, скорость вра-
щения диска 375 об/мин) и аммиаком (0,154 моль/л и
830 об/мин); температура от 25 до 550 С. Полученные
ЗаВИСИМОСТИ MorYT быть выражены уравнениями:
Ig k == 2,599 11 ОО/Т (для тиосульфата)
Ig k == 3,586 1 ООО/Т (ДЛЯ аммиака).
Экспериментальные энерrии активащш соответствен-
но равны 5,03 и 4,58 ккал/моль.
Кроме перечпсленных Основных факторов, было изу-
чено влияние рН на скорость растворения хлорида ce
ребра в растворах тиосульфата и абразивное действие
добавок кварца.
194
При рН, равном 4,6; 7,0; 9,75; 11,3 и 12,1, константы
скорости соответственно равны 3,43.IO 2; 5,15.I0 1;
4,83.10 7; 4,12.10 7 И 3,45.10 7 л/(см 2 .с l / 2 .об'j2). Как
в кислой, так и в щелочной среде скорость растворения
хлорида серебра в водных растворах тиосульфата сни-
жается. Причина этоrо разложение тиосульфата в
кислой среде с выделением сероводорода или тиосуль
фатноrо комплекса в щелочноЙ среде, образовании
на поверхности диска тонкой, видимой r лазом пленки
сульфида серебра и уменьшении вследствие этоrо peaK
ционной поверхности. Однако надо отметить, что YMe
ренная щелочность раствора (до рН==9+ 10) сравнитель
но мало влияет на скорость растворения, тоrда как даже
в слабокислой среде (рН === 4+6) скорость уменьшается
в полтора раза.
При растворении хлорида серебра в пульпах, содер-
жащих 3 5 % кварцевоrо песка, увеличения скорости
растворения заметить не удалось. По-видимому, это
объясняется тем, что хлористое серебро очень пластич-
но и мало поддается истиранию.
Зависимость скорости проuесса от корня квадратно-
ro из числа оборотов диска является, по-видимому, наи
более надежным критерием, характеризующим меха-
низм процесса и дополняемым характерными фиrурами
травления на поверхности диска. Вторым надежным
критерием следует считать совпадение эксперименталь-
ной величины константы скорости реакции растворения
с теоретической. Если рассчитать значение константы
скорости реакции растворения хлорида серебра в пре-
дельно разбавленных растворах тиосульфата натрия, то
она будет равна 8,8. 1 O 7, а найденная эксперименталь
Ho 5,15.10 7 л/(см 2 .с 1 / 2 .об'/2), т. е. 58,5% от ВЫЧИс-
ленной.
Сопоставление этой величины с константами скоро-
сти растворения в цианистых растворах хлорида серебра
(7,8.10 7, или 67,5% от теоретическоЙ величины 1 ) и ме-
таллическоrо серебра (6,8. I O 7, ил И 57,5 %) показыва-
ет, что скорости всех трех сравниваемых реакциЙ прак-
тически одинаковы, хотя и ниже теоретических вели-
чин. Две последние реакции протеI<ают в диффузионном
режиме, энерrия активаЦIlИ растворения металлическоrо
I При ИСПО.'JьзоваIlИИ цианида натрия, а не калиЯ, константы со-
OTBeTCTBeHIIO рзБIIы 6.8.1O 7 Н 5.9. ]o 7 л/(см 2 .с l / 2 .об l / 2 ).
13.
195
серебра равна 3,66 ккал/моль, что тоже характерно для
диффузионноrо режима, TorAa как для тиосульфата на-
трия она равна 5.03 ккал/моль. Т. е. ПОЧТИ такая же, как
для реакции растворения Си5 в цианиде. протекающей
в кинетическом режиме.
Отсюда можно сделать очень важный вывод о том.
что экспериментальная энерrия аКТIIвации. отражаю-
щая влияние нескольких налаrающихся один на друrой
процессов. не BcerAa может служить надежным крите-
рием характера изучаемой реакции. При растворении
хлорида серебра в растворах тиосульфата на диффузию
ионов и вязкость раствора накладываIОТСЯ ступенчатое
протекание реакции (комплексы Аg5 2 О з и Ag (520з) )
И неполная диссоциация иона Na5 2 0 3' Повышение тем-
пературы стимулирует протекание этоrо процесса.
Растворение хлорида серебра в аммиаке тоже про-
текает в диффузионном режиме, хотя величина констан-
ты скорости и отличается от вычисленной теоретически
на целый порядок. Причину этоrо расхождения следует
искать в термодинамике. Константы равновесия изучен-
ных реакций следующие:
AgCI + 2520 == Ag (520з) + Cl . К == 3.85.103,
AgCl + 2NН з (раствор) === Ag (Nнз)t + Cl . К === 2.9'10---3.
Если paCTBOpCI-I1Iе хлорида серебра в растворах тио-
сульфата натрия протекает с достаточной полнотой (в
реаКЦIIЮ вступает около 99% тиосульфата), то аммиак
должен быть у поверхности диска в избытке; большая
часть ero не используется, I1 константа скорости peaK
ции. естественно, получается значительно меньше вычи-
сленной теоретичеСКII, поскольку при этом расчете пред-
полаrается. что весь peareHT, подведенный к поверхно-
сти диска. вступает в реакцию (если судить по величине
константы равновесия, в действительности реаrирует
только около 10% аммиака). Это интересный пример
обратимой реаКЦИIl, протекающей в диффузионной об-
ласти. которую надо рассчитывать с учетом полноты ис-
пользования peareHTa.
Из сопоставления констант скорости реакций рас-
творения хлорпда серсбра l\110ЖlIO сделать заключение.
что тиосульфат натрия как растворитель нисколько не
уступает цианиду, имея перед Ним преимущества ЭКО-
196
номические и анитарно rиrиенические. Аммиак же
вследствие малои ero активности следует признать ре а-
reHToM невыrодным и технолоrически (сложная аппара
тура), и экономически.
Процесс растворения хлорида серебра в водных pa
створах тиосульфата натрия и аммиака может быть
описан обычным уравнением (4).
Факторами интенсификации процесса следует счи-
тать: энерrичное перемешивание, повышение KOHцeHTpa '
ции реаrента комплексообразователя и повышение TeM
пературы. Повышение температуры несколько более
эффективно, чем в цианистом процессе (большая энер-
rия активации).
Для снижения расхода тиосульфата и получения бо
лее чистых растворов материал перед выщелачиванием
следует промыть водой или разбавленной H 2 S0 4 дЛЯ
удаления ионов некоторых тяжелых металлов. Промыв-
ные растворы можно использовать как оборотные.
Тuомочевuна
Растворы тиомочевины можно использовать для pac
творения золота и серебра из «упорных» руд и KOHцeH
тратов (сурьмянистых, мышьяковистых, медистых и др.),
переработка которых методом цианирования не дает хо-
роших результатов. Комплексные соединения золота и
серебра с тиомочевиной были получены еще в прошлом
веке, установлен и их состав. Для серебра найдено:
АgNО з . nCSN 2 H 4 , rде п от 1 до 3 (для краткости далее
в тексте молекула тиомочевины обозначена Т).
Реакция
AgCI + 3Т :с== Ag rt + CI
характеризуется константой равновесия К ==2,103 Н близ-
ка к константе равновесия реакции растворения AgCI в
тиосульфате.
Результаты изучения зависимости скорости paCTBope
ния от интенсивности перемешивания (число оборотов
диска от 60 до 1180 в минуту, концентрация тиомочевины
0,03 моль/л, температура 250 С) и концентрации тиомо-
чевины (250 С, 505 об/мин) типичны для диффузионноrо
режима: зависимость от числа оборотов в степени 0,5 и
от концентрации в первой степени. Среднее значение кон-
станты скорости реакции, рассчитанное по данным этих
опытов, равно 0,60.10 6 л/(см 2 .с 1 / 2 -об 1 / 2 ). Опыты (кон-
197
центрация тиомочевины 0,035 моль/л, 505 об/мин), про
веденные при 5; 15; 25, и 350 С, дали следующие CKOpO
сти: 4,04; 5,09; 6,12 и 7,45.10 8 моль/(см 2 .с). ПО этим И
предыдущим данным была ВЫЧIlслена эксперименталь-
ная энерrия активации, равная 3,45 1шал/моль, и COCTaB
754
лено уравнение Аррениуса 19 k== 3,698 .
т
Невысокая энерrия активации и характерные фиrу-
ры травления на поверхности диска также свидетельст-
вуют о диффузионном режиме изученноЙ реакции.
Для сравнения найденной константы скорости (6,ОХ
Х 1 0 7 .'1/ (см 2 . c 1 / 2 . об 1/2) с вычисленной теоретически был
рассчитан коэффициент диффузии тиомочевины по коэф-
фициенту диффузии мочевины и отношения их молеку
лярных масс и приведен к 250 С. Полученное значение
равнялось 1,2.10 5 см 2 /с. TorAa константа скорости
k == 6, 18.10 4 (2л)I/2 D 2 / 3 === З,40.10 3 (1 ,2.10 5)2/3
mv 1/6 m
1,78.10 6 /( 2 1/2 б lf2 )
== л см . с . о .
m
Коэффициент 'n изменяется от 1 ДО 3 в зависимости от
соотношения молярных концентраци)[ серебра и тиомоче-
вины. у поверхности диска, rAe тиомочсвина расходует-
ся почти полностью, ОН, по видимому, близок к 2, и экс-
периментальная скорость растворения ра вна 68 % от TCO
ретической.
Как следует из приведенных данных, тиомочевина
очень «быстрый» растворитель хлорида серебра, мало
уступающий даже цианиду натрия.
Для расчета количества pacTBopeHHoro хлорида сере-
бра применимо обычное уравнение (4).
При 25 0 С k==6,0.10 7 л/(см 2 .с l /'2 '061/2), а для друrих
температур ее можно вычислить из приведенноrо выше
уравнения Аррениуса.
Скорость растворения AgCl очень сильно зависит от
рН раствора. В щелочных растворах хлорид серебра сов-
сем не растворяется, так как на ero поверхности образу-
ется плотная пленка сульфида серебра в результате rиД-
ролиза тиомочевины и выделения сероводорода. Ионы
Же серебра, связывая сероводород. смсщают равновесие
реакции rидролиза до полноrо разложения (эта реакция
была использованCI Н::t1\1И дЛЯ арrентометрическоrо опре-
I!)Я
деления тиомочевины). В кислых растворах скорость
растворении резко уменьшается с повышением КИслопIO
сти раствора, а затем остается примерно постоянноЙ. в
6,5 раза меньшеЙ, чеrн в неЙтральном растворе (тномоче
вина разлаrается в кислой среде с выделением элемен
тарной серы и образованием мочевины). Выделившаяся
сера покрывает поверхность хлорида серебра ПЛОТНО{I
пленкой и уменьшает скорость ero растворения. В ней
тральной среде на поверхности диска тоже образуется
пленка сульфида серебра, но она очень рыхлая, леrко OT
слаивается и не замедляет протекание реакции (кинети-
ческие кривые ПРЯl\10линейны). Поскольку в растворах
есть кислород, эта пленка постепенно раСТRоряется в тио-
мочевине.
Проведенное исследование позволяет сделать заклю-
чение о том, что тиомочевина ЯШlяется достаточно эф
фек1'ИВНЫМ растворителем. При ее применении жела
тельно соблюдать следующие рекомендации: поддержи-
вать рН пульпы около 7, интенсивно ее перемешивать, но
Не повышать теl\шературу и концентрацию тиомочевины
слишком сильно, поскольку два последних фактора спо
собствуют ее раз,rrожению.
Хлорид натрия
Для растворения AgCl можно использовать и хлорид
Ные растворы, особенно для извлечения серебра из про
дуктов хлоринации или для улучшения rидрохлорирова
ния серебристоrо золота. При взаимодействии AgCl с ио
нам Cl в разбавленных растворах образуется комплекс
AgCI 2 , а в более концентрированных и имеющих практи-
чеСкое значение AgCl (по нашим дзнным, при 250 С
термодинамические константы равновеси.я COOTBeTCTBeH
но равны: 3,1.10 5 и 5,5.10 6).
Более подробно была изучена кинетика растворения
AgCI в растворах поваренной со,Т]и как более дешевоrо
peareHTa, и лишь для сравнения были приведены опыты
с соляной кислотой и хлористым аммонием. Методика
проведения опытов и анализы обычные, расчеты по
уравнению (4).
ДЛЯ ИЛЛЮСТРЗЦIIII этих расчетов (см. стр. 26) приве
дем один из опытов (250 С, 615 об/мнн, S==4,91 см 2 ,
[NaCl] ==3,38 моль/л, начальныЙ объем раствора 1200 МЛ,
табл. 13).
199
ТаБЛIlца 13
К расчету константЬ! скорости растворения AgCI в растворах
Интервалы
между отбо-
ром проб, ч
Объем
раствора.
мл
Концентрация
серебра
r-ионfл . 104
т
I
V
C s
19
Cs C
Фактор
пропорци-
ональ
ности
v
1,5
1,5
] ,О
1, О
1,0
1200
1000
900
800
700
1 27
2'69
3:67
4,68
5,78
1,25
1,50
1 , 11
1,25
1,43
2,75
3,86
5, 11
6,54
0,0318
0,0703
0,0900
О, 1308
О, 1 G81
0,0254
0,0256
0,0256
0,0256
0,0257
C s == 1 ,83.10 3
Из среднеrо значения фактора Ilропорционально
сти O,0256 лjч вычислена константа скорости реакции
растворения в обычных единицах:
k == 2,303.0,0256 == 2,303.0,0256
3, 6. 103 S п 1/2 3 I 6. 103 . 4 , 91 . 3 , 205
== 1,04.10 6 л/(см .с1/2'0бl/:2).
Опытами установлено, что скорость растворения за
висит от числа оборотов диска в степени 0,5. Среднее
значение константы СКОРОСТII реакции равно 1,06.1 0 6 и
не зависит от концентрации хлорида натрия (рис. 62) .
Влияние температуры на скорость растворения иссле-
довано в интервале от 15 до 550 С при различных концен-
трациях хлорида натрия и различных ЧlIслах оборотов
962
диска. По этим данным 19 k === 2,746 , ь..Е ==
т
==4,40 ккалjмо,'!ь. Эта велнчина ЛИШЬ HeMHoro выше, чем
для обычных реакций, протекающих в диффузионном
режиме, что, вероятно, связано с увеличением раствори
мости AgCJ ПрII повышении температуры II с невысо-
ким значением КОЭффПЦIlента диффузии комплекса
AgCl . C.ТIeдyeT отметить, что ь..Е не зависит от кон-
центраЩIII хлорида натрия 11 интеНСНВНОСТlI перемеши-
вания. Близкие величины энерrий активации были най-
дены п при растворении AgCl в растворах тиосульфата
1I аммиака (5,03 и 4,58 ккалjыоль).
Следует уточнить некоторые особенности :исследо-
ванной реакции. Концентрация хлорида натрия, Не ска-
200
зываясь на веЛИЧIIне константы скорости, заметно влия
еТ На скорость растворения, так как v==k (Сз С), а
растворимость AgCl (C s ) оч нь сильно увеЛИЧIfваетс _ с
повышением концентрации хлорида натрия в растворе,
6
о 1
)( 2
А 3
. 4
4 6
<о
<n / t.)
" 4
.
"-3
2
Рис. 62. Влияние интенСИВIIССТИ пере- c\,j .
мешивания на скорость растворения
AgCI при различных концентрациях
ХЛОРllда патршr. моль/л: 1 3,38;
2 4,08; з . 4,38; 4 4,85
о
vп
Используя найденное значение константы скорости
реакции, можно вычислить и величину коэффициента
диффузии комплекса AgCI5 при 250 С в концентриро
ванных растворах N aCI, так как
1 06 10 6 1/6
D 2 / 3 == ,. v == 6,84. I O v I / б .
6,18.IO 4 (2n)1/2
Для 3,0; 4,0 II 5,0 !\fОЛЯРНЫХ растворов NaCl KHHeMaTII
чеСlше ВЯЗI<ОСТИ равны соответственно 1,096; 1,228 11
1,385.10 2 см 2 /с, а коэффициенты диффузии 0,58; 0,595
и 0,61.10 5 см 2 /с, которые хорошо соrласуются с дaHHЫ
ми Берне и Вейля, получеННЫМII независимым радиохи-
мическим методом. 1
Константы скорости реакций растворения AgCl в
водных растворах НСI И NH 4 CI равны 1,45 и 1,68Х
XIO 6 л/(см 2 '0б 1 /:2 .с 1 /:2) при 25° С. Однако, несмотря на
большую величину константы скорости, скорость paCTBO
рения AgCI (при ОДIшаковых концентрацпях комплексо-
образователя) в растворах соляной кислоты ниже, чем
в растворах хлорида натрия. Это вызвано более низкой
растворимостыо AgCl в растворах HCI. Рис. 63 иллю-
стрирует кинеТIIКУ растворения AgCl в растворах HCI
при 250 С, 500 об/мин, общем объеме раствора 1 л, по-
201
16
10
50
.... 12
8
"':I
<::,
Рис. 63. Кинетика растворсния X.-10[)I1Дl
серебра в растворах НС! (1), NaCl (2)
и NH 4 CI (3)
верхности диска 10,2 см 2 , концентрации ХЛОРИД IIОНОВ
5,0 моль/л.
Рассмотрев кинетику растворения хлорида серебра
в различных растворителях, можно оценить IIХ эффек-
тивность (табл. 14).
Таблица 14
Относительная эффективность исследованных
реаrентов растворителей хлористоrо серебра
PeareHT
комплексообраэоватсль
Константа скорости.
k. 106 (Л/С'd 2 . С .об 1 / 2 )
Энерrия активации,
ккал(моль
Цианид калия
Циан ид натрия .
Тиосульфат натрия
Аммиак . . .
Тиомочевина . .
Хлорид натрия .
Соляная кислота .
Хлористый аммониЙ
0,78
0,68
0,52
0,12
0,60
1,06
1,45
1,68
5,03
4,58
3,45
4,40
Из данных, ПРlшеденных в таб.'I. 14, следует, что хло
ристый натрий по своим кинетическим свойствам не
только не уступает друrим комплексообразователям
(кроме хлористоrо аммония), но и имеет перед ними
1 I3 е r n е Е., \V с i 11 1\\. J. «JОUП1. PllYS. с11ст.», 1960, \'. 64,
N!1 2', р. 258.
202
ряд преимуществ: нетоксичность, дешевизну и недефи-
цитность. Прп ero llспользовании следует обратить вни-
мание на выбор оптимальной концентрации, которая
определяется содсржанием серебра в обрабатываемом
сырье. Насыщенный (5,46 моль/л) раствор NaCl при
250 С может растворить до 10 r/л серебра. При расчете
концентрации NaCl в вышелачивающем растворе надо
учесть содержание серебра в сЫрье и отношеНие ж: т,
т. е., найти концентрацию серебра в конечном растворе,
а затем из уравнения растворимости AgCl в NaCl вычи
слить необходимую для этоrо концентрацию соли. Та-
кие же расчеты MorYT быть использованы для определе
ния необходимой концентрации NaCI при rидрохлори-
ровании серебристоrо золота.
4. ВОЛЬФРАМАТЫ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
В РАСТВОРАХ МИНЕРАЛЬНЫХ
И КОМПЛЕКСОО&РАЗУЮЩИХ КИСЛОТ
Вольфраматы ряда металлов широко представлены
в полиметаллических рудах, подверrаемых rидрометал-
лурrической переработке. В состоянии особой чистоты
мноrие из них СЛУR{ат для приrотовления пьезосеrнето-
электриков, кристаллических матриц оптических кван-
товых reHepaTopoB, активаторов, сцинтилляторов илю:
минофоров. В аналитической химии труднорастворимые
вольфраматы служат в качестве весовых форм при оп-
ределении ряда металлов.
Вольфра,иат ка.1ьu,ия в растворах щавелевой
и соляной кислот
В последние rоды уточнены и дополнены сведения о
составе и свойствах комплексов, образуемых шестива-
лентным вольфрамом и анионом щавелевой кислоты,
однако данных о растворимости и скоростях растворе-
ния вольфраматов в щавелевокис.тrых растворах в лите-
ратуре нет.
В л и я н и е у с л о в и й при r о т о в л е н и я о б Р а з-
Ц о в. Сначала были поставлены стандартные опыты по
выяснению влияния метода приrотовления исходноrо
препарата и способа подrотовки рабочей поверхности
диска на скорость растворения Са W0 4 , цель которых
получение наиболее воспроизводимых результатов. Бы-
ло проведено сравнение скоростей растворения дисков
203
из монокристаллическоrо вольфрамата и дисков, приrо-
товленных прессованием и спеканисм порошкообразно
ro Са W0 4 . Опыты показали, что скорость растворения
спеченноrо вольфрамата (k==5,9.10 9 лj(см 2 .с 1 ) He
сколько ниже скорости растворения монокристалличе-
cKoro образца (k==6,5.10 9 .ТJ.jCM 2 .C). Однако посколь-
ку порядок величины константы при этом сохранился,
все последующие опыты были проведены с использова-
нием МОIJокристалличеСКIIХ дис
ков (средняя величина констан-
ты скорости при 250 С равна
6,57. 1 O 9) .
Скорость растворения СНIIжа.
ется при повторном использо-
вапии необработанных дисков
вследствие образования пленок
на их поверхностн.
Учитывая это обстоятельство,
во всех опытах осуществляли
тщате.Т'IЬНУЮ подrотовку поверх-
ности днсков, а рпсчет константы
вели по начальной скорости рас-
творения, при 'Т O.
Влияние концентрации
Рис. 64. Зависимость CKOP() Щ а в е л е в о й к и с л о ты.
стн растворения вольфрама-
та кальция от КОllцеПТРЩIlII При 250 С Ii скорост[[ враще
щавелевой кислот 1,1
ния диска 38 обjмин* зависи-
мость скорости растворения воль-
фрамата от концеlпращJИ щавелевой КIIСЛОТЫ имеет ли
неЙныи характер (рис. 64). Среднее значение I\:oHcTaHTbI
равно 6,54.10 9 лj(см 2 .с).
В Л И Я Н И е т е м пер а т у р Ы. Опыты были проведе-
ны при температуре от 20 до 600 С с интервалом 1 О rрад.
Результаты ЭТIIХ опытов MorYT быть описаны ypaBHe
нием
)5
12
.....
9
t.:
6
..
3
о 10 20 30
[Hzczll41-IO} ,.,О/1Ь/Л
19k=== I,062 2140.T I,
Величина эксперимента.Т'IЬНОЙ энерrин активаЦИII, вычис-
денная из TaHreHca уrла наКДона кривой Аррениуса, рав-
на 9,8 ккалjмо.ТJ.Ь.
* По нашим данным, скорость рпстворения вольфрамата в рас-
нюрах щавелеВОII кислоты не заВИСIJТ от числа оборотов ДlIска.
204
Полученные данные ПОЗВОЛЯЮТ охарактеризовать
растворение вольфрамата кальция в щавелевой кислоте
KalK сложный rетероrенный процесс, сопровождающийся
образованием промежуточной твердой фазы. Стадия
процесса, определяющая кинетику перехода вольфрама
из вольфрамата кальция в водный раствор щавелевой
кислоты, в изученных условиях реализуется как peaK
ДИЯ первоrо порядка. Количество pacTBopeHHoro воль
фрама можно рассчитать по уравнению (5).
Поскольку скорость растворения не зависит от ин
тенсивности перемешивания, можно предполаrать, что
процесс растворения протекает в кинетической области.
Такое предположение подтверждается теы, что числен
ное значение экспериментальной энерпш аКТlIвации
(9,8 ккал/моль) превышает величины, получаемые при
исследовании реакций растворения, контролируемых
диффузий. Это может быть объяснено блокированием
поверхности растворяемоrо вещества пленкоЙ промежу
точноrо продукта реакции.
Образование пленки на монокристалле отмечено ви
зуально после ДЛJlтельноrо (более 10 ч) Н:ОIlтакта с pa
створом Н 2 С 2 О 4 при концентраЩIlI последнеЙ 3,2Х
XI0 2 r-ион/л, при концентрации 51,2.10 2 r ион/л
пленка появилась через несколько минут.
О наличии пленки СВIIдетельствует также характер
кинетических кривых, полученных при высоких KOHцeHT
рациях щавелевоЙ кислоты и при температуре 600 С.
UЦавелевая кислота в процессе растворения CaVV0 4
ВЫПОлняет две функции: разлаrает вольфрамат с Bыдe
лением двух твердых продуктов оксалата кальция и
вольфрамовой кислоты:
CaVV0 4 + H 2 C 2 0 J == СаС З 0 4 + H \\.T04 (а)
и участвует в комплексообразовании:
H 2 VV0 4 + Н 2 С 2 О 4 === Н 2 [WО з (С 2 О 4 )1 + Н 2 О. (б)
Поскольку скорость процесса измеряют по количест-
ву переходящеrо в раствор вольфрама, то с этой точки
зрения первую функцию щавелевой кислоты следует
Считать отрицательной, вторую положительной. Соот-
ношение скоростей указанных стадий процссса опреде
ЛЯется скоростью образования и проницаемостью плен-
ки промежуточноrо твердоrо продукта реакции. При
205
малых концентрациях и температурах разложение воль-
фрамата протекает медленно, ТОЛЩIIна пленки ничтож
но мала, а ее проницаемость достаточно велика. Поэто-
му количество днффУlIдирующеrо в раствор вольфрама
растет почти линейно с увеличением продолжительно-
сти опыта. При более высоких температурах и концент-
рациях в первые же минуты контакта ДlIска с paCTBO
ром резко возр астает толщина и снижается проницае-
мость пленки, что резко оrраничивает переход вольфра-
ма в раствор.
При этом следует иметь в виду, что диффузия peareH
та растворите,'IЯ через пленку к поверхности исходноrо
вольфрамата осуществляется леrче, чем редиффузвя
более rромоздких комплексных ионов [WО з (С 2 О 4 ) p ,
вследствие чеrо протекание реакции (б) затрудняется,
а роль реакции (а) в общем ходе процесса еще более
возрастает.
Рентrенофазовый и термоrрафический анализы f!o-
казали, что пленка представляет собой оксалат каль-
ция. То, что весь кальциЙ в указанных условиях оста-
ется в твердой фазе, подтверждается анализами раство-
ров после кинетических опытов. Воды в пленке содер-
жалось 10,59%, кальция 27,32%, вольфрама (заrрязне-
ние поделоем) 1,96%, что приблизительно соответствует
моноrидрату.
После э-тоrо были проведены некоторые дополни-
тельные опыты с целью более полноrо объяснения ме-
ханизма изучаемоrо процесса, исследована температур-
ная зависимость скорости растворения вольфрамата
кальция в водных растворах lltавелевой кислоты в при
сутствии эквпмолярноrо количества НС) (условия те
же, что и в предыдущей серии, концентрация соляноЙ
кислоты 6,4. IO 2 моль/л). Константы скорости раство-
рения l при 20; 30; 40; 50 и 600 С равны соответственно
11,28; 16,49; 20АО; 28,65; 43,40. 1 0 9. Уравнение Арре-
ниуса имеет вид:
19 К === 3,698 1245.T l,
энерrия активации составляет 5,7 ккал/моль.
Таким образом, добавление HCI к раствору Н 2 С 2 О 4
1 Следует указать, что полученные величины представляют со-
бой некоторые УС.10вные сравнительные константы, поскольку при
расчете не учитывалась концеl!траЦI!Я соляной кислоты.
206
приводит К ПОЧТII двукраТНОl\IУ (в 1 t7 раза) снижению
экспериментальной энерrии активации процесса и соот-
ветствующему (в С9 раза при 250 С) увеличению скоро-
сти растворения вольфрамата (среднее численное зна-
чение константы скорости 12t8. 1 0 9) .
Состояние рабочей поверхности диска после опыта
при визуальном рассмотреНИII остается неизмеННЫМ t
характерные для МОНОКРIIстаЛЛIIческоrо вольфраl\'1ата
прозрачность и стекловидность сохраняются при MHoro-
кратном использовании диска t кинетические кривые во
всех опытах cTporo ЛIlнеЙНЫ t постоянной при одинако-
вых условиях остается и скорость растворения вольфра-
мата. Отношение молярных l\Онцентраций вольфрама
и кальция в растворе во ВСех случаях практически сов-
падает с их отношением в исходном вольфрамате.
Это свидетельствует о существенном уменьшении
тормозящеrо влияния пленки. ВОЗМОЖНО t оно по-преж-
нему определяет общий характер растворения CaW0 4 :
энерrия активации все же остается достаточно высокой
и скорость растворения не зависит от числа оборотов
диска. Таким обраЗОМ t процесс не может контролиро-
ваться диффузиеЙ в растворе.
Анализ полученных результатов позволяет выска-
зать некоторые предположения о макромеханизме этих
реакций.
В первой стадии реакции образуется оксалат Ka.[Ib-
ция. Вольфрамовая кислота растворяется в момент об-
разования и, ПО-ВИДИМОМУt представляет собой более
растворимую белую форму Н 2 W0 4 . Растворение воль
фрама может быть описано также и уравнением
2H 2 W0 4 + H 2 C Z 0 4 == Н 2 [W 2 0 6 (С 2 О 4 )] + 2Н 2 О.
При проведении кинетических опытов (в УСЛОВИЯХ t
далеких от равновеСИЯ t при большом избытке Н 2 С 2 О 4 }
кальций в растворе нами не обнаружен. Очевидно, про-
цесс растворения соответствует уравнению [сумма (а)
и (б)]:
CaW0 4 + 2Н 2 С 2 О 4 == СаС 2 О 4 + Н 2 [\\'Оз(С 2 О 4 )] + Н 2 О. (в)
Специально поставленные опыты по растворению По-
рошкообразноrо вольфрамата показаЛИ t что при
[Н 2 С 2 О 4 ] ==Ot003 мольjл кальций переХОДIlТ в раствор в
количествах, знаЧIIтельно (на порядок и даже более)
207
превышаЮЩIIХ ero содержанпе в растворе ПрIl раство-
рении СаС 2 О 4 в щавелевой кислоте той же KOHцeHTp -
ЦIШ. ЭТО ОЗШlчает, что ПрIf уменьшеНIIИ удельной (yc
лов но отнесенной к величине реакционной поверхности
исходноrо вольфрамата) концентраЦIШ Н 2 С 2 О 4 в систе
ме создаются УСЛОВIIЯ дЛЯ конrруэнтноrо растворения
вольфрамата кальция и протекания реакции.
Са \\'04 + Н 2 С 2 О 4 === Са [WО з (С 2 О 4 )] + Н 2 О. (r)
Для ОПIIсания процесса растворения CaW0 4 в смеси
щавелевоЙ и соляной КIlСЛОТ на основании наших опы-
тов и литературных данных может быть предложено
уравнение
Са W0 4 + Н 2 С 2 О 4 + 2НСl =-= CaCl 2 +
+ Н 2 l\\'Оз(С 2 О 4 )] + Н 2 О.
(д)
Совместная функция кислот, очевидно, состоит в
том, что соляная вытесняет вольфрамовую, а щавелевая
связывает ее в комплекс. В результате происходит бо-
лее быстрое и полное растворение вольфрамата каль-
ция.
То, что величина экспериментальноЙ энерrии акти-
вации процесса растворения CaW0 4 в смеСII кислот
(5,7 ккал/моль) превышает максимальные значения
для диффузионных процессов в растворах, позволяет
сделать два предположения: 1) процесс переходит в чи-
сто кинетическую область; 2) оrраничивающим факто
ром по..преЖJIСj\,r)' остается днффузия IlOHOB через pac
твор, заполняющиЙ поры и кашuтяры плеllКII промежу
точноrо TBep.n.oro IIPO}1,YKTa реаКЦИII. ПрII этом, если до-
пустить сущсствоваШlе пленки оксалата, следует счи
тать, что она становится несколько более ПРОНIIцаемой.
Однако не исключено, что в этих условиях изменяется и
состав плеНЮl либо за счет образоваНIIЯ труднораство-
римоrо ОI{салато вольфрамовокислоrо кальция:
2CaW0 4 + 2Н 2 С 2 О 4 + 2НСl === CaC1 2 +
+ Са {""ТО З (С 2 О 4 )] + Н 2 [\\iО з (С 2 О 4 )] + 2Н 2 О, (е)
либо в результате реаКЦИ1l разложения Са W0 4 соляной
кислотоi'I (последнее подтверждается при достаточн()
высоких, выше 0,2 r-моль/л, концентрациях HCI, о чем
сказано ниже).
208
Следующая серия опытов была поставлена для бо-
лее подробноrо исследования влияния концентрации
НС} На скорость растворения Са W0 4 в водных смесях
щавелевой и соляной кислот. Условия опыта: t==25° С,
п == 168 об/мпн [Н 2 С 2 О 4 ] == 0,08 молЬ((л, концентрация
НС} переменная от 0,0025 до 5,12 моль/л.
На рис. 65 (кривая 2) показана зависимость CKOpO
сти растворения Са W0 4 в растворах HCl и Н 2 С 2 О 4 ОТ
15
2
......
<;.)
",'
10
"
5
Рис. 65. Зависимость скорости paCT
ворения CaW0 4 в водных растворах
Н 2 С 2 О 4 от КОllцентrации щавелево1'i 0,5
(1) КИСЛОТЫ И В водиых смесях
Н 2 С 2 О 4 и НС! от концентрации ('О.
ляной (2) кислоты
[H2CZ04l' 10, 110ЛЬ/Л
tO 1,5 2.О
о) 0,5 1,0 5,0 25,0
[HCll' 1О,110ЛЬ/Л
концентрации соляной кислоты. Значение скорости, со-
ответствующее [HCl] ==0, можно определить по рис. 65
(1): при концентрации щавелевой кислоты 0,08 моль/л
скорость растворения вольфрамата кальция равна
5,25. 1 O IO r ион/ (см 2 . с). Если рассчитать некоторую yc
ловную величину константы скорости l растворения пу
тем деления скорости на концентрацию щавелевой кис
лоты (без учета концентрац,ии HCl), то максимальная
величина [в нашем случае 12,5.10 9 л/(см 2 .с)] будет
достнrнута при 1I30МОЛЯРНОМ отношении концентраций
кислот, а минимальная при двукратном и выше из
бытке соляной КIIСЛОТЫ.
Начальный период возрастания скорости растворе-
Ния может быть объяснен существенным уменьшением
замедляющеrо влияния оксалата на скорость растворе-
ния CaW0 4 . Но наиболее вероятно предположение о
двойной функции соляной кислоты, коrда она не только
растворяет оксалат, НО и разлаrает вольфрамат кальция,
усиливая действие щавелевой кислоты.
Следующее за этим периодом линейное повышение
скорости растворения связано с усилением разлаrающе-
.--
1 Истинную KOIICTaHTY скорости I\IOЖIЮ рассчитать. зная ПОРЯДОК
реRКЦИИ раствореIШЯ ПО СОЛ5lIIOI' IШСJIоте.
14 306
209
[о деЙствия НС! по мере роста ее концентрации. При
этом, очевидно, имеющеrося в растворе количества
Н 2 С 2 О 4 достаточно для перевода вольфрама в раствор
по реакции (д) ([НС!] : [Н 2 С 2 О 4 ] ==2) или (е)
([НС!] : [Н 2 С 2 О 4 ] == 1). Уменьшение скорости paCTBope
ния при дальнейшем (выше 0,08 моль/л) увеличении
концентрации НС! свидетельствует о преобладании ре-
акции (е); при [НС!] >0,2 моль/л на поверхности воль-
фраматноrо диска образуется пленка желтой вольфра-
мовой кислоты, а скорость растворения перестает зави-
сеть от концентрации соляной кислоты. Поэтому и ско-
рость растворения Са \V0 4 , и величина констаНТЫ скоро-
сти (равные соответственно 5,55.10 IO r-ион/(см 2 .с) 11
6,94. 1 0 9 л/ (см 2 . с) близки к значениям, которые полу-
чены для процесса растворения в чистой щавелевой кис-
лоте.
Вольфрамат стронция в растворах щавелевой
u соляной КllСЛОТ
Поведение вольфрамата стронция в процессах раст-
ворения представляет интерес для синтеза особочисто-
[о SrW0 4 . Ero поведение в растворах Н 2 С 2 О 4 во MHoroM
аналоrично поведению вольфрамата кальция.
В л и я н и е п л е н о к про м е ж у т о ч н ы х п р o
д у к т о в р е а к ц и и. Константа скорости растворения
ранее использованных дисков оказалось равной 15,3Х
Х 1 о з, т. е. значительно меньшей, чем при раствореНИIl
«стандартноrо» диска. Это можно объяснить образова-
нием пленки промежуточноrо продукта, затрудняющеЙ
диффузию растворителя к поверхности диска и редиф-
фузию продуктов реакции.
В л и я н и е с к о р о с т и в р а Щ е н и я Д и с к а. Как
показали опыты, проведенные при 250 С и [Н 2 С 2 О 4 ] ==
=== 4.1 0 3 моль/л, скорость растворения не зависит от
интенсивности перемешивания: константы скорости ра-
створения при скоростях вращения диска 220; 550 и
1100 об/мин составляют соответственно 21,5; 22,5 и
22,4. I о з.
В л и я н и е к о н ц е н т р а Ц и и Щ а в е л е в о й к и с-
л о т ы. Опыты проведены при 250 С, скоростях враще-
ния дисков 168 и 220 об/мин и концентрациях кислоты
2; 4; 6 и 8. I о з моль/л. Значения скоростей растворения
соответственно равны 5,00; 8,62; "'13,05 и 18,00. 1 O IO r-
ион/ (см 2 . с). Полученные данные свидетельствуют о ли-
210
нейном характере зависимости скорости растворения 01
концентрации щавелевоЙ I{ИСЛОТЫ.
В л И я н и е т е м пер а т у р ы. Опыты пров дены при
[Н 2 С 2 О 4 ] ===4 .10 ЗI скорости вращения диска 550 об/мин.
Температуру изменяли в пределах от 20 до 600 С, с ин-
тервалом 10 rрад. Кривая Аррениуса описывается урав-
нением
19 k == 0,643 1786T I.
Величина экспериментальной энерrии активации равна
8,4 ккал/моль.
Как If при растворении вольфрамата каЛЬЦТIЯ, следо
вало ожидать изменения механизма процесса P(}CTBope
30
Рис. 66. ЗаВl1СИМОСТЬ скорости p,lC
творения SrW0 4 в водных раство-
рах Н 2 С 2 О 4 от концентрации щаве-
левой (1) кислоты и в водных сме-
сях Н 2 С 2 О 4 и НС! от коицентрации
соляиой (2) кислоты при 250 С.
550 об/мин. rH.C j 0 4 1 4.0. IO 3 молЫЛ
5
2
у 25
20
а
15
10
ния вольфрамата стронция при добавлении соляной кис-
лоты в раствор Н 2 С 2 О 4 .
Вначале были поставлены опыты для выяснения
влияния числа оборотов диска (интенсивности переме-
шивания) на скорость растворения вольфрамата CTpOH
ция в смеси кислот. Оказалось, что скорость растворе-
ния в присутствии HCl увеЛИЧIlвается, но как и без нее,
не зависит от интенсивности псремешнвания: при 550 обо-
ротах диска в минуту I<olIcTaHTa СКОРОСТl1 растворения
SrW0 4 равна 29,86.10 З, а при 68 об/мин 31,25.10 З.
Далее исследовано влияние концентрации соляной
кислоты на скорость растворения вольфрамата строн-
ция в водных смесях Н 2 С 2 О 4 п HCl (рис. 66).
Наблюдалось резкое повышение скорости растворе-
ния, а в интервале концентраЦIIЙ от 8,0.10 З дО 512,ОХ
Х 10 З моль/л HCI скорость растворения росла значи-
14*
21 J
тельно медленнее. ЭффеКТИDная: величина константы
скорости реакции, полученная путем деления скорости
растворения на концентраЦIlIО щавелевоЙ КI!СЛОТЫ при
[Н 2 С 2 О 4 ] : [HCI] ===4 : 2, равна 38,20 .10 3 и при
[Н 2 С 2 О 4 ] : [HCI] ==2: 2, 30,55.10 3 л/(см 2 .с).
Влияние температуры изучено при [Н 2 С 2 О 4 ] ===4Х
XIO 3 и [HCI]==2.10 3 моль/л, п==550 об,мин l. Экс
периментальная энерrия активаЦНII процесса растворе-
ния вольфрамата СТРОIIЦИЯ: в смеси щавелевой и
соляной кислот, взятых в соотношении 4: 2, равна
5,35 ккал/моль, Ig k=== 3,14 984.T 1.
Некоторое увеличение (в 1,7 раза при 250 С) констан-
ты скорости и снижение (в 1,6 раза) энерrии активации
процесса растворения SrW0 4 в присутствии соляноЙ
кислоты свидетельствует о частичном снятии оrраниче
ний, накладываемых пленкой оксалата, хотя следует
признать, что «эффект соляноЙ кислоты» для вольф-
рамата стронция выражен слабее.
Вольфрам.ат бария в растворах щавелевой кислоты.
При растворении BaW0 4 характер процссса сильно
зависит от концентрации щавелевоj'[ кислоты. Ha!\HI Из
мерены депрессия СКОРОСТII растворения (см уравне-
ние 6) и СООТIlOшеllие между вольфрамом II барием в
растворе при различных концентрациях Н 2 С 2 О 4
(табл.15).
Таблица 15
Влияние концентрации Н 2 С 2 О 4 на депрессию скорости
растворения BaW0 4 и соотношение [W] : [Ва] в растворе
Номер I [Н2СД.].102, I t'l.1Q9. I t'z.IQ9. I D о/с I
опыта моль/л МОЛЬ/(СМ 2 .с) МОЛЬ/(СМ2.с) V' о
[WJ:[Ba]
1 0,02 0,06 0,06 О 0,92
2 0,20 0,60 0,59 1,7 1,15
3 2,00 2,53 2,10 17 1,44
4 50,00 11 ,10 1,55 860 6,31
Результаты, представленные в таблице, позволяют
заключить, что при малых концентрациях Н 2 С 2 О 4 на по-
верхности диска образуются ПЛСНКII продуктов реакции,
более растворимых, чем исходныЙ вольфрамат. При бо-
лее высоких концентрациях растворимость образующих-
212
ся пленок понижается и приближается к растворимости
БаWО 4 . Прп дальнейшем повышении концентрации
Н 2 С 2 О 4 в промежуточной твеРДО!1 фазе начинают пре-
обладать вещества, растворимость I\OTOpbIX в данных
условиях ниже, чем исходноrо BaW0 4 . Опыты показа
ли, что при 2.10 4<[H2C204]<20.10 4 процесс соответ-
ствует схеме
Ва\\'0 4 + Н 2 С 2 О 4 == Ба [WО з (С 2 О 4 )] + Н 2 О. (а)
Абсолютное содержание вольфрама в растворе при
[Н 2 С 2 О 4 ] 1 .10 4 моль/л, (п== 1,1 об/с, t==25° С, т==
1 О ч оказалось равным 2,78. 1 0 6 r-ат/л, а в тех же
условиях при [Н 2 С 2 О 4 ] ==0 1,80 .10 6 r-ат/л. Это означа-
e что при очень низких концентрациях Н 2 С 2 О 4 следует
учитывать собственную растворимость вольфрамата
бария. При увеличении концентраЦIIИ Н 2 С 2 О 4 ее вклад
в протекание процесса резко уменьшается (по нашим
опытам с 65% при [Н 2 С 2 О 4 ] == 1 .10 4 до 30% при
[H2C204] 2.10 4 и ДО 4% при [H2C204]==20.10 4).
В интервале 20. 10 4< [Н 2 С 2 О 4 ] <200 .10 4 возможна
реакция
БаWО 4 + 2Н 2 С 2 О 4 == ВаС 2 О 4 + Н 2 [\VО З (С 2 О 4 )] + Н 2 О. (6)
При [Н 2 С 2 О 4 ] ===20.10 4 п== 1,1 об/с; {==55 0 с; т==
3 ч абсолютное содержание бария в растворе (l,2X
Х 10 5 r-ат/л) меньше, чем растворимость оксалата
(2,00. 1 0 4 моль/л), вследствие чеrо твердая фаза на по-
верхности диска не накапливается.
Это подтверждается и малыl'vШ значениями Dv в ука-
занном интервале концентраций Н 2 С 2 О 4 . Следует отме-
тить, что при использовании величины Dv для обнаруже-
ния пленок на поверхности растворяемоrо вольфрама
Horo диска нужно помнить, что и V! И V2 по абсолютной
величине всеrда меньше, чем скорость при полном от-
сутствии промежуточной твердой фазы. Так, например,
при растворении BaW0 4 в эквимолярной смеси Н 2 С 2 О 4
и НС! ([H2C204J==[HCIJ==20.10 4, п===I,I, t 25°C)
скорость процесса возросла в 1,57 раза по сравнению с
величиной V!, полученной в опыте 2 (см. табл. 15). Од-
нако дЕ Не только не уменьшилась, а возросла в 1,8 ра-
за (7,83 ккал/моль). Опричинах этоrо будет сказано
ниже.
213
При увеличении концентрации от 2,00 дО 50,00Х
Х 10 2 моль/л депрессия СКОрОСТII возрастает в 50 раз,
а пленка ПрОl\Iежуточной твердой фазы приобретает
характер крупнокристаЛЛllческоrо осадка, обладающеrо
достаточноЙ проницаемостью для диффундирующих
частиц, но нерастворимоrо ни в Н 2 С 2 О 4 , ни В HCl. Один
из Д HCKOB испытывали при [Н 2 С 2 О 4 ] == 0,5; n 1,1 и
t=== 250 С в течение 6 суток, и на ero поверхности образо
вались крупные кристаллы, леrко отделяемые от исход'
Horo твердоrо вещества.
Рентrенофазовый, ИК спектромеТРliческиЙ IJ термо-
rравиметрический анализы показали, что пленка пред-
ставляет собой диrидрат кислоrо оксалата бария.
Результаты химическоrо анализа Ва {НС 2 О 4 )2Х
Х2Н 2 О подтверждают сделанные выводы: процентное
содержание бария в продукте оказалось равным 38,2%
(расчетное 38,8%), оксалат иона 51,2% (50,0%), воды
1 О, 1 % (10,2 % ) .
Кислый оксалат барня получен нами и путем раство-
рения ВаС 2 О 4 в Н 2 С 2 О 4 .
Сказанное позволяет считать, что при увелнчеНИIl
концентрацrш щавелевой кислоты от 2,00 дО 50,00Х
Х 10 2 моль/л возможен процесс
BaW0 4 + 3H Z C 2 0 4 == Ва (HC Z 0 4 )z +
+ Н 2 [WО з (С 2 О 4 )] + Н 2 О. (в)
В л и я н и е с к о р о с т и в р а Щ е н и я Д и с к а. Сле
довало подробно изучить функцию v===f{n), чтобы за-
фиксировать изменение кинетики процесса, связанное с
rидродинамическими условиями и характером пленок
промежуточных продуктов реакции. Опыты, проведен
ные при [Н 2 С 2 О 4 ] ==20.10 4, 1==250 С, n 0,18--7-24,35 об/с
(рис. 67), позволили установить, что при п до 5,00 об/с
скорость растворения пропорциональна числу оборотов
диска в степеНII 0,5. ПрlI п> 5,00 об/с показатель степени
уменьшается и при п>24,23 об/с приближается к нулю.
Величина скорости, рассчитанная из зависиМости Ig v==
==f(lg п) в интервале 0,1875.0 об/с, равна 30,1.lO 8
лj (см 2 . C I / 2 . об 1/2) .
Влияние концентрации щавелевой КИс-
л о т ы.
Как следует из рис. 68, линейный характер функции
Ig v== f (1g С) сохраняется в интервале концентр31ЩЙ
214
Н 2 С 2 О 4 от 1 до 50.10 4 моль/л, а при [Н 2 С 2 О 4 ] > 100.lO 4
он нарушается, и степень, в которой концентрация BXO
дит В кинетическое уравнение, становится значительно
меньше единицы.
В л и я н и е т е м пер а т у р ы. Опыты были проведе
вы при концентраЦIIИ Н 2 С 2 О 4 20. 1 O 4, п == 1,1 об/с, TeM
пературу изменяли от 25 до 650 С с интервалом в 10 rрад.
8
.8,5
8.8
.9
t:7-
...,
9
:::..
t:).
0,5 1.0
Znn
1,5
о
1
2 . J
19
4
РIIС. Ы. ЗаВIIСИМОСТЬ скорост!{
растворения вольфрамаrа бария
от числа оборотов диска
Рис. 68. 3aBllrllMocTb скорост!{ paCTBO
реНIIЯ вольфра мата ба рия от конце',т-
рацин щавслевоfi КIIСЛОТЫ
Зависимость константы скорости раствореНИЯ от TeM
пературы выражается уравнением
19 k == 3,67 950T I,
экспериментальная энерrия активациIt равна
4,34 ккалjмоль.
Поскольку при изучении зависимости 19 v === f (lg п)
отмечено изменение константы скорости при n>
3,00 об/с, свидетельствующие об изменении механизма
процесса, следовало ожидать, что при повышении числа
оборотов диска изменится и величина энерrии актива
ции. Это предположение было Ilодтверждено: при
2,75 06/с величина !1Е оказа.паСl) раВIlОЙ 6,10, а при
24,35 об/с 1 0,1 О ккал/ыоль.
215
Таким образом, при п<5,00 об/с и 1.10 4<
< [Н 2 С 2 О 4 ] 50. 1 0 4 процесс может быть представлен
схемами (а) и (б). Отсутствие пленок обусловливает
преимущественно диффузионный характер растворенпя.
Об этом свидетельствует вид функциональных зависи
мостей скоростей растворения от интенсивности переме
шивания (и "'" п о ,5) и от концентрации щавелевой кислоты
(и"'" С), а также величина экспериментальной энерrии
активации 4,34 ккалjмоль, близкая к значениям, xapaK
терным для процессов, протекающих в диффузионноЙ
области. Процесс растворения в указанном интервале
подчиняется уравнению (4).
Вместе с тем можно отметить и вклад кинетической
составляющей в суммарныЙ процесс, выражающийся в
отсутствии характерных спиралевидных фиrур травления
на поверхности диска, так и в несовпадении эксперимен
тальной и теоретической скоростей растворения (коэф-
фициент диффузии оксала та принят равным 1,2. 1 0 5) :
k 1, 78 .lO 6 /( 2 1/2 б 1/2 )
== Л см. с . о .
т
Если принять стехиометрическиЙ коэффициент paB
ным 2 (реакция (б), протекающая в области значений
[H 2 C z 0 4 J, [де сохраняется линейныЙ характер зависимо-
сти 19 v == 19 С), то теоретическая скорость составит
8,9. 1 0 7, Т. е. почти в 3 раза больше найденной экспери-
ментально (3,0. 1 O 7) .
В области 5,00<п<24,00 06/с и 1,0.10 4<
< [H 2 C z 0 4 ] <50.10 4 (т. е. в условиях, коrда твердые
пленки отсутствуют) переход процесса растворения в КII-
нетический режим связан, по-видимому, с изменением
структуры пленки продукта реакции. При [H 2 C z 0 4 ] >
>50. I 0 4 образующиеся пленки препятствуют диффузии
ионов растворителя и реДИФФУЗIIИ продуктов реакции.
Напоминаем, что речь идет не о диффузии в твердой фа-
зе, а о диффузии в растворе, заполняющем поры пленки.
Естественно, что в этом случае IIзменение интенсивности
перемешивания не влияет на скорость диффузии в порах
и капиллярах образовавшейся пленки.
Эта совокупность макроскопических факторов созда
ет особый режим протекания процесса, который может
быть назван псевдокинетическим.
В заключение следует остановиться на особенностях
влияния HCl на скорость растворения BaW0 4 в щавелс
216
вой кислоте по сравнению с влиянием HCl на растворе-
ние CaW0 4 II SrW0 4 . Соляная КIIслота в изомолярной
концентрации резко (почти в 2 раза) увеличивает ско-
рость растворения вольфрамата кальция в растворах
Н 2 С 2 0 4 за счет устранения тормозящеrо влияния пленки
СаС 2 О 4 и снижает энерrию активации процесса. При
растворении SrW0 4 пленка оксалата более проницаемая,
и скорость при повторном растворении одноrо и Toro же
диска уменьшается Bcero на 30% (для CaW0 4 почти на
250%). Это обусловливает относительно меньшим «эф
фект сОляной кислоты» при растворении SrW0 4 в экви
молярноЙ смеси Н 2 С 2 О 4 с HCl, чем при растворении
CaW0 4 (увеличение константы скорости в 1,37 и сниже
вие энерrии активации в 1,56 раза).
Изменение характера влияния НС! при растворении
BaW0 4 можно объяснить тем, что роль промежуточной
твердоЙ фазы оксалата при [Н 2 С 2 О 4 ] == 20. 1 0 4 относи
тельно невелика (Dv== 1,7), а добавление сильной кисло-
ты способствует подавлению диссоциации Н 2 С 2 0 4 и об
разованию кислоrо оксалата бария, пленка KOToporo об-
ладает значительно меньшей проницаемостью. К тому
же, ни вольфрамат, нн биоксалат бария не растворя
ются в соляной кислоте при [НС]] == 20. 1 0 4, вследствие
чеrо положительная функция HCl не имеет места, чем и
обусловливается некоторое увеличение эффективной
энерrии активации процесса.
5. ДВУОКИСЬ rЕРМАНИЯ В ВОДНО-АЦЕТОНОВЫХ РАСТВОРАХ
Этот процесс очень своеобразен. Ero скорость не за-
висит от интенсивности перемешивания (кинетический
режим), энерrия активации равна 11 + 1 ккал/моль
(среднее для различных растворителей). Но самое не-
обычное, что скорость растворения в относительно
концентрированных растворах (от 0,5 до 4 8 моль/л)
не зависит от концентрации и природы кислот, основа-
ний и солей. В области более разбавленных растворов
имеет место зависимость между скоростью растворения
и концентрацией ионов Н+ или OH , но с очень низким
показателем порядка реакции: 0,170,2.
Все эти данные позволили высказать предположение
о том, что самым медленным звеном процесса paCTBope
ния является стадия rидратации. Для проверки Этоrо
была поставлена серия опытов по растворению Ge02 в
217
смесях ацетона с водным буферным раствором
(рН==3,4). Полученные данные приведены на рис. 69,
из KOToporo следует, что скорость растворения увеличи-
вается с повышением молярной доли воды в смеси. He
линейный характер этой зависимости объясняется неиде
альностью BOДHo aцeTOHOBЫX
растворов.
Следовательно, первой и
наиболее медленной стади
еЙ процесса является rидра
тация поверхности и образо
вание MeTarepM аниевой кис
лоты (Ge02+aq---+GеО2аq---+
Н2GеОз), а последующее
ее взаимодействие с ионами
раствора протекает быстро и
не влияет на суммарную ско-
рость растворения. Констан-
та скорости реакции при
25 0 С равна: для плавленой
Ge02 1,9. 1 0 6 И для криста
ллической rексаrональной
2,0.10 9 моль/(см 2 .с) (в рас-
творах с концентрациями во-
ды от 0,5 до 4,8 моль/л).
Плавленая Ge02 растворя-
ется в 100 раз быстрее кри-
сталлической, так как у сте-
клообразных веществ с силь-
но деформированными решетками на поверхности име
ется MHoro активных центров, ускоряющих в условиях
кинетическоrо режима процесс растворения.
7.0
1.4
1,8
...,)
,
114
6 0,8 O
C IfzO , МОЛ. доля
Рис. 69. Зависимость константы
скорости реакции раствореНJlЯ
плавленой ДВУОКИСИ rермания в
BOДHo aцeTOHOBЫX смесях от мо.
лярной доли ВОДЫ
6. ТРЕХОКИСЬ ВОЛЬФРАМА В ЩЕЛОЧНЫХ РАСТВОРАХ
в отличие от Ge02, трехокись вольфрама практически
не взаимодействует с водой, однако скорость процесса
растворения линейно зависит от концентрации rидро-
КСИЛЫIЫХ ионов ЛИШЬ до [NaOH] 0,2, а при более высо-
кой щелочности она перестает зависеть от концентрации
едкоrо натра.
Независимость скорости растворения от числа оборо-
тов диска, отсутствие пленок и сравнительно высокое
значение энерrии активации ( E == 12,2 ккал/моль) поз-
218
воляют утверждать, что процесс протекает в кинетиче-
ской области. Как и в случае растворения Ge02, самым
медленным звеном (при [NaOH] >0,2) здесь является
rидратация WО з . Взаимодействие образовавшейся
вольфрамовой кислоты с rидроксил ионами при высокой
Таблица 16
Сравнительные данные о растворении трехокиси вольфрама
Растворитель
v/C. r-ион/(см2. с),
при 25 0 С
/1Е, ккал/моль
NaOH
Nа 2 СО з
Н 2 С 2 О 4
1 3.IO 8
1 ' 8. 1 0 8
4:9.10 12
12,2
13,3
13,0
концентрации щелочи может происходить достаточно
быстро. Аналоrичные результаты получены и при pac
творении WО з в друrих растворителях (табл. 16).
СПИСОК ЛИТЕРАТУРЫ
в л а Д и м и р о в а М. r., К а к о в с к и Й И. А. Физико химическнс
константы, характеризующие образование и состав низшеrо циани
CToro комплекса меди Журнал при кл. химии, 1950, т. 23, N 6,
с. 580 598.
К а к о в с к и й И. А. Флотация самородных металлов. В кн.: Тру-
ды 111 научно технической сессии института Механобр, М., Метал-
лурrиздат, 1955, с. 237. 271.
1\ а к о в с к ий И. А. Рецензия на Кlшrу В. М. Латимера «Окисли-
тельные состояния элементов и их потенциалы в водных paCTBO
рах». ЖФХ, 1955, NQ 12, с. 2268 2273.
К а к о в с к и й И. А. 1\ теории rидрометаллурrии блаrородных ме-
таллов, «Изв. АН СССР ОТН», 1957, ,N'Q 7, с. 29 34.
Тю р и н Н. [., Х о л м а н с к и х Ю. Б., К а к о в с к н й И. А. Ла-
бораторный автоматический записывающий прибор для исследования
кинетики rидрометаллурrических процессов при высоких температу-
рах и давлениях. «Изв. вуз. Цветная металлурrия», 1958, т. 1, NQ 5,
с. 69 80.
Т 10 Р И Н Н. [., 1\ а к о в с к II Й И. А. Исследование поведения золо-
та и серебра при повышенных температурах и давлениях. «Бюл.
ЦИИН ЦМ», 1959, N 22 ,с. 26 32.
К а к о в с к и й И. Д., Х о л м а " с к и х Ю. Б. Изучение ЮiНетИlПI про-
цесса цианирования серебра. «Изв. АН СССР ОТН. Металлурrия
н топливо», 1959, N 5, с. 97 106.
К а к о в с к и й И. А., Т ю р и 11 Н. r. Каталитическое действие ионоn
меди при растворении металлов с кислородной деполяризацией.
ДАН СССР, 1960, т. 130, NQ 4, с. 812 .815.
219
т ю р и н н. [., К а к о в с к и й И. А. О поведении золота и серебра
в зоне окисления сульфидных месторождений. «Изв. вуз. Цветная
металлурrия», 1960, т. 3, Ng 2, с. 6 13.
К а к о в с к ий И. А., Х о л м а н с к и х Ю. Б. Изучение кинетики
процесса цианирования меди и золота. «Изв. АН СССР, ОТН, Ме-
таллурrия и топливо», 1960, N'2 5, с. 207 218.
Т ю р и н Н. [., К а к о в с к и й И. А. Исследование поведения золо
та и серебра в тиосульфаТНbIХ растворах при повышенных температv
рах и давлениях. В кн.: Сборник материалов по применению aBTO
клаВНbIХ процессов в металлурrии цветных и драrоценных металлов.
М., ЦИИН ЦМ, 1960, с. 173 188.
П о т а ш н и к о в Ю. М., Паз Д н и к о в П. А. Сухой метод по-
лучения высшеrо сульфида Меди (ковеллина) . ЖНХ, 1961, т. 6,
вып. 3, с. 526 530.
К а к о в с к и й И. А., Т ю р и I! Н. [. Поведение золота в поли-
ульфидных растворах при повышеННbIХ температурах и давлениях.
«Изв. вуз. Цветная металлурrия», 1962, т. 5, N'2 2, с. 104 111.
К а к о в с к и й И. А., П о т а ш 11 и К О В Ю. М. Исследование кине
тики растворения сульфида серебра в растворах циаIlида калия.
«Изв. АН СССР, Металлурrия и топливо», 1962, N'2 3, с. 41 50.
П о т а ш н и к о в Ю. М., к а к о в с к и й И. А. О некоторых особен-
ностях растворения Cu 2 S в присутствии кислорода. ДАН СССР,
1962, т. 145, М'2 6, с. 1311 1313.
К а к о в С к ий И. А., П о т а ш 11 И К О В Ю. М. Исследование про-
цессов растворения lIизшеrо сульфида меди в цианистых растворах.
«Изв. АН СССР. Металлурrия и топливо», 1962, ,N'g 5, с. 8l 91.
П о т а ш н и к о в 10. М., К а к о в с к и й И. А. О механизме рас-
творения высшеrо сульфида меди в uианистых растворах. «Изв.
вуз. Цветная металлурrия», 1962, т. 5, Л'\! 6, с. 62 65.
Тю р и 11 Н. [., К а к о в с к и Й И. А. Автоматическая установка ДЛ I
исследования кинетики окислеНИ51 в растворах. «Изв. вуз. Цветная
металлурrия», 1963, т. 6, М 2, с. 172 173.
К а k о v s k у 1. А. Etudc de lа cinctique et du mecanisme de certains
procedes l1ydrometallurgiques. «Revue dc I'industrie minerale».
Compte rendu scientifique, av'ril 1964, numero special А, р. 157 180.
К а к о в с к и й И. А., П о т а ш н и к о в Ю. М. Кинетика растворе-
ния CuS в водных растворах циаllистоrо К<lЛИЯ. ДАН СССР, 1964,
т. 158, N'2 3, с. 714 717.
Л е б е д е в А. Н., К а к о в с к и й И. А. Изучение кинетики раство-
рения золота в водных растворах ацетонцианrидрина. «Цветные
металлы», 1965, N'27, с. 17 23.
К а к о,в с К И Й И. А., Л е б е д е n А. Н. О влиянии поверхностно ак-
ТИВНbIХ веществ на скорость растворения золота в цианистых рас-
TBopax. ДAH СССР, 1965, т. 164, М 3, с. 614 617.
1\ н я з е в Е. А., К а к о в с к и Й И. А., Х о л м а н с к и х Ю. Б. Вза-
имодействие двуокиси rермания с ВОДНbIМИ растворами кислот и осно.
ваний. ЖНХ, 1965, т. 10, ВbIП. 12, с. 2698 2705.
К а к о в с к и й И. А., К у л и r и н С. А. Кинетика растворения
в циаНИСТbIХ растворах. ДАН СССР, 1966, т. 169, М 5, с. 1126 1129.
Л е б е д е в А. Н., К а к о в с к и Й И. А. О механизме растворения
золота в циаНИСТbIХ растворах. «Электрохимия», 1966, т. 2, Ng 9,
с. 1079 1084.
220
С в е т л о в В. А., К а к о в С к ий И. А. Исследование кинетики про-
цесса цианирования палладии и ero сплава с серебром. «Изв. ву-
зов. Цветная металлурrия», 1967, т. 10, N2 2, с. 68 74.
К а к о в с к иЙ И. Л., С в е т л о в В. А. Кинетика цианирования спла-
вов палладия с серебром. «Изв. АН СССР. Металлы», 1965, N!? 3,
с. 50 58.
К а к о в с к и Й И. А., С в е т л о в В. А. О кинетике взаимодействия
с цианистыми растворами Шlлладия,серебра и серебропалладиевых
сплавов. «Изв. вуз. Цветная металлурrия», 1967, т. 10, N2 3,
с. 36 39.
Щ е р б а к о в О. к., К а к о в с к ий И. А. Изучение поведения цин-
ка в цианистых растворах с применением метода вращающеrося ди-
ска. «Научные труды» (Уралмеханобр), вып. 13. Свердловск, Урал-
механобр, 1967, с. 167 176.
К У л и r и н С. А., т к л я р Р. т., К а к о в с к и й И. А. К вопро-
су о получении и структуре амальrам серебра. «Научные труды»
(Уралмеханобр), вып. 13. Свердловск, Уралмеханобр, 1967, с. 187 lg9.
К а к о в с к и й И. А., К у л и r и н С. А. Кинетика растворения амаль-
[ам серебра в циаllИСТЫХ растворах. «Научные труды» (Уралмеха-
нобр), вып. 13. Свердловск, УралмеХaJlOбр, 1967, с. 200 216.
К а к о в с к и Й И. А., Л е б е д е в А. Н., Щ е р б а к о в О. к. Изме-
рение коэффициентов диффузии цианида калия и цианистых комплек-
сов серебра и золота. «Научные труды» (Уралмеханобр), вып. 13.
Свердловск, Уралмеханобр, 1967, с. 177 186.
П о т а ш н и к о в Ю. М., к а к о в С к и й И. А., Е л и С е е в Е. И.
Синтез и некоторые свойства штромейерита. ЖНХ, 1968, т. 13,
N2 1, с. 7 10.
Ка к о в с к ий И. А., r у б а Й л о в с ]( и Й В. В. Кинетика раство-
рения хлористоrо серебра в BOAIIbIX растворах аммиака и тиосульфа-
та натрия. ДАН СССР, 1969, т. 184, N2 5, с. 1157 1160.
Х а л е з о в Б. Д., К а к о в с к и Й И. Л. Кинетика растворения rep
мания в аЗОТIIОЙ кислоте. «НаУЧIIые труды» (Унипромедь), вып. 11.
Свердловск, Унипромедь, 1969, с. 311 318.
К а к о в с к и Й И. Л., Х а л е з о в Б. Д., Л е б е д е в А. Н. ИЗУ!Iе-
ние влияния некоторых факторов на растворение олова в соляной
кислоте. «Научные труды» (Унипромедь), вып. 11. Свердловск,
Унипромедь, 1969,' с. 346 356.
К а к о в с к и й И. А., С в е т л о в В. А., Х а л е з о в Б. Д. Иссл -
дование анодной и катодной поляризации палладия в цианистых рас-
творах. «Изв. вуз. Цветная металлурrия», 1969, т. 12, N2 3,
с. 5l 57.
П о т а ш н и к о в Ю. М., К а к о в с к и й И. А., r у б а й л о в-
с к и й В. В. КИllетика растворения штромейерита в водных раство-
рах азотной кислоты. «Изв. вуз. Цветная металлурrия», 1969, т. 12,
М 6, с. 22 25.
К а к о в с к и й И. А., Л е б е д е в А. Н. О пассивировании и депас-
сивировании золота в цианистых растворах: «Изв. вуз. Цветная ме.
таллурrия», 1970, т. 13, N2 1, с. 56 59.
П о т а ш 11 и К О В Ю. М., r а м о л ь с к и 1"1 А. М., М о х о с о е в М. В.,
К о з .'1 О В а Ф. М. Исследование кинетики растворения вольфрамата
кальция в растворах щавелевоЙ IШСЛОТЫ. ЖНХ, 1970, т. 15, вы.. 2,
с. 502 508.
221
r а м о л ь С К И Й А. М., М о х о с о е в М. В., П о т а ш н и к о в Ю. М.
Кинетика растворения CaW0 4 в щавелевокислых растворах в присут-
ствии HCI. «Изв. вуз. Химия и химическая технолоrия», 1970, т. 13,
NQ 5, с. 730 732.
К а к о в с к и й И. А. Исследования кинетики и механизма rидроме
таллурrичеСКIIХ процессов. «Цветные металлы», 1970, М!! 12,
с. 18 21.
П о т а ш н и к о в Ю. М., С т е ц и I{ В. В., М о х о с о е в М.. В. КИ
нетика растворения вольфрамовоrо анrидрида в растворах еДКОl'О
натра, соды и щавелевой КИСЛОТЫ. «Химия И технолоrия молибде-
на и вольфрама». (НаУЧIIые труды КБ университета, вып. 1). Наль-
чик, изд. КБ университета, 1971, с. 213 219.
r а м о л ь с к и й А. М., П о т а ш н и к о в Ю. М., М о х о с о е в М. В.
О растворении шеелита в щавелевой Кllслоте. ЖНХ, 1971, т. 16,
вып. 11, с. 3131 3134.
П о т а ш 11 и К О В Ю. М., r а м о л ь С К И i'I А. М., К у с е л ь м а н И. И.
о макромеханизме растворения CaW0 4 в щавелевоЙ кислоте. «Хи-
МИЯ редких Э,JJeмеIIТОВ» (Научные труды УПИ М!! 193). Свердловск,
изд. УПИ 1971, с. 133 138.
П о т а ш 11 и К О В Ю. М., r а 1\1 о л Ь с к и й А. М., К о в а л е в.
с 1\ И Й О. И., М о х о с о в .1\1. В. КIIIIетика растворения вольфрамата
стронция в щавелевой кислоте в присутствии HCI. «Изв. вуз. Хи-
мия и химическая технолоrия», 1971, т. 14, вып. 9, с. 131O 1313.
П о т а ш н и к о в Ю. М., r а 1\1 о л Ь С 1( И Й А. М., М о х о с о е в М. В.
Исследование процесса растворения вольфрамата стронция в paCTBO
рах щавелевоЙ кислоты. ЖНХ, 1971, т. 16, вып. 12, с. 3334 3338.
С о р о к и н а Н. И., К а к о в с к ий И. А. Кинетика и механизм
растворения теллурида серебра в цианистых растворах. ДАН
СССР. Сер. химическая, 1971, с. 199, М!! 4, с. 844 847.
Л е б е д е в А. Н., А р а м я н К. Т., К а к о в с к и й И. А. Кинетика
JI механизм взаимодействия амальrам золота с цианистыми раство-
раМJI. Изв. вуз. Цветная металлурrия», 1971, с. 14,.N'!! 6, с. 65 69.
А р а м я н К. т., ш к л я р Р. Ш., К а к о в с I( Jf Й И. А. Получение
и структура амальrам золота. «Изв. вуз. Цветная металлурrин,
1972, т. 15, М!! 1, с. 57 60.
К а к о в с к и й И. А., А р а м я н К. Т. Кинетика растворения амаль-
raM золота в цианистых растворах. «Изв. вуз. Цветная металлур-
rия», 1972, т. 15, .N'!! 2, с. 52 56.
r у б а й л о в с к ий В. В., К а к о в с к и й И. А., Х а л е з о в Б. Д.
Исследование кинетики растворения хлорида серебра в водных рас-
творах тиомочевины. «Цветные металлы», 1972, М!! 5, с. 32 33.
К а к о в с к и й И. А., С о р о к и н а Н. И. Кинетика цианирования
теллурида золота. «Изв. вуз. Цветная металлурrия», 1972, т. 15,
М 3, с. 96 103.
К а к о в с к ий И. А., С о р о к и н а Н. И. Некоторые особенности
процесса растворения тел.rlурида серебра в цианистых растворах.
ДАН СССР. Сер. химическая, 1972, т. 206. N!! 2, с. 387 390.
К а к о в с К и Й И. А., Ч е р К а с о в [. Ф., П а н к р а т о в В. Д.
Изучение поверхностных плеIlOК в системах Me KCN H20 02
с использованием радиоактивных ИIlдикаторов. «Изв. вуз. Цветная
металлурrия», 1973, т. 16, М 2, с. I07 IIl.
222
ч е р к а с о в [. Ф., К а к о в с I И IVI И. А., П а н к р а ш о в а В. Д.
Изучение повеРХllOСТНЫХ пленок при взаllмодеi'tствии меДИ и золота
с ВОДlIЫМИ растворами KCN. «ИЗ13. вуз. Цветная м('таллурrия»,
1973, т. 16, N2 4, с. 51 54.
r у б а й л о в с к и iI В. П., к а к о 13 С К ий И. А., Х а л е з о в Б. Д.
Кинетика растворения золота в водных растворах, содержащих
хлор. «Изв. АН СССР. lЧеталлы», 1973, Jlig 6, с. 106 111.
П о т а ш 11 и К О В Ю. М., 1\1 о х о с о е в М. В., К о в а л е в с к и {, О. И.
КинетИ!{а растворения вольфрамата барllЯ в щавелевоЙ кислоте.
ЖНХ, 1973, т. 18, вып. 4, с. 880 884.
П о т а ш н и к о в Ю. М., к о в а л е в с к и й О. И. о растворении
BaW0 4 в щавелевой кислоте. ЖОХ, 1973, .М 9, с. 1869 1874.
Ч е р к а с о в [. Ф., К а к о в с к и й И. А., Х о л м а н с к и х Ю. Б.
Взаимодействие сурьмянистоЙ меди с водными растворами серной
кислоты. «Научные труды» (Унипромедь), вып. 16. Свердловск, Уни-
промедь, 1973, с. 176 183.
К а к о в с к ий И. А., r у б а Й л о в с к и й В. В., Пир м: а r о м e
Д о в Д. А. Исследование взаимодеi'1СТВIIЯ теллурида золота с BOДHЫ
ми растворами хлора. «Цветные метал.IJЫ», 1974, N! 2, с. 36 39.
Ш а м и с Л. А., К а к о в с к ий И. А., JI о д ей Щ и к о в В. В.,
Х м е л ь н и Ц к а л О. Д. Кинетика растворения металлическоrо се-
ребра в водных растворах солеЙ трехвалентноrо железа. ДАН
СССР, 1974, т. 216, NQ 3, с. 611 614.
К а к о в с к и й И. А., Ч е р к а с о в [. Ф. о механизме взаимодей-
ствия Аи. Ag и Си с водными растворами KCN. «Изв. вуз. ЦBeT
пая металлурrия». 1974, т. 17, NQ 4, с. 87 91.
:к а к о в с к ий И. А., r у б а й л о в с к и й В. В. Кинетика растворе-
ния хлорида серебра в водных растворах, содержащих ионы хлори-
да. «Изв. вуз. Цветная металлурrия», 1975, т. 18, N!? 1.
Л о д е й Щ и к о в 13. В., Ш а м и с Л. А., К а I{ о в С к и й И. А,
Х м е л ь н И Ц К а я О. Д. Исследование кинетики растворения сереб
ра в водных растворах тиомочеВIШЫ. «Изв. вуз. Цветная металлур-
rия», 1975, т. 18, NQ 2.
Х о л м а н с к и х Ю. Б., К а к о в с к 11 I'i И. А., С о р о к и н а Н. И.
Кинетика растворения сплавов золота с серебром и медью в циани-
стых растворах. «Изв. АН СССР. Металлы», 1975, N!? 2.
К а к о в с к и й И. А., r у б а й л о в с к и й В. В. Исследование ки-
нетики взаимодействия золота с водными растворами брома 1-1 иода
в присутствии их солей. ЖОХ, 1975.
оrЛАВЛЕНИЕ
етр.
Предисловие 3
r л а в а 1. Общие сведения о процессах растворения . 5
1. Роль процессов растворения в rидрометаллурrии . .. 5
2. Основные этаПbl экспериментальноrо исследования ЮIнеТИЮi
растворения . . . . . . . . . . . 6
3. COBpeMeHlIble представления о процессах растворения 11
4. Основы метода вращающеrося ДИСI а . 15
r л а в а 2. Кинетика растворения металлов 32
1. МетаЛЛbl в циаНИСТblХ растворах. .. 32
2. Металлы в растворах друrих комплексообразоватслеЙ 84
3. Металлы в растворах МlIнеральных кислот 118
r л а в а 3. Кинетика растворения сплавов 125
1. Золото серебро . . 126
2. Золото медь . . 129
3. Серебро палладий . 130
4. Серебро ртуть ; 141
5. Золото ртуть 151
r л а в а 4. Кинетика растворения труднораСТВОРИМbIХ солей
и окислов . .. ...... 156
1. Сульфиды и теллуриды в цианистых растворах . 156
2. Теллурид золота в ХЛОРИДJJЫХ растворах . . . . . 190
3. Хлорид серебра в растворах комплеI{сообразователеir 193
4. Вольфраматы щелочноземельных металлов в растворах MII
нераЛЬНblХ и комплексообразующих IШСЛОТ . . 203
5. Двуокись rермания в водно-ацетоновых растворах 217
б. ТрехOl<ИСЬ вольфрама в щелочных растворах 218
Список литературы . . 219