Текст
П-Е-ПАВЛОВСКИИ В-В-ПАЛЬМ ИН
БИОХИМИЯ МЯСА
Под редакцией члена-корреспондента АН СССР А. М. КУЗИНА
Издание второе, переработанное и дополненное
Допущено Министерством высшего и среднего специального образов#" ния РСФСР в качестве учебно^0 пособия для студентов высших учебных заведений
МОСКВА ПИЩЕВАЯ ПРОМЫШЛЕННОСТЬ 1975
УДК 637.5:577.1
Биохимия мяса. Павловский П. Е., Пальмин В. В., 1975.
Рецензент д-р биол. наук Н. Н. Демин
ПЕТР ЕВГЕНЬЕВИЧ ПАВЛОВСКИЙ ВИКТОР ВАСИЛЬЕВИЧ ПАЛЬМИН
Биохимия мяса
Редактор Л. Л. Циперсон Художник Л. М. Чернышев Художественный редактор £. К. Селикова - Технический редактор Г. Б. Жарова Корректор В. Б. Грачева
Т-120713. Сдано в набор 10/VI 1974 г. Подписано в печать 30/XII 1974 г. Формат 84Х108!/з2. Бумага типограф. № 2. Печ. д. 10,75+0,063 вкл. Усл. п. л., 18,16. Уч.-изд. л. 18,92. Тираж 9000 экз. Зак. 454. Цена 83 коп.
Издательство «Пищевая промышленность»
113035, Москва, М-35, 1-й Кадашевский пер., д. 12
Ярославский полиграфкомбинат «Союзполиграфпрома» при Государственном комитете Совета Министров СССР по делам издательств, полиграфии и книжной торговли. 150014, Ярославль, ул. Свободы, 97.
(£) Издательство «Пищевая промышленность», 1975 г.
31703—062
П-----------
044(01)—75
62—75
Введение
Биохимия мяса — наука о химическом составе тканей и органов сельскохозяйственных животных и о химических и биохимических процессах, происходящих в этих тканях и органах после убоя животных и в процессе переработки.
Биохимические превращения в изолированных тканях и органах, происходящие на молекулярном уровне, могут быть правильно поняты только в сопоставлении со сведениями, накопленными при изучении прижизненных биохимических процессов. Поэтому данный раздел науки объединяет функциональную и техническую биохимию.
В основе технологических процессов, протекающих при изготовлении мясопродуктов, в большинстве случаев лежат биохимические и связанные с ними физико-химические превращения различных компонентов исходного сырья. Качество готовых изделий зависит в основном от изменений белков в процессах технологической обработки животного сырья. Поэтому изучение строения физико-химических и биохимических свойств белков тканей, а также их изменений в результате воздействия различных факторов является одной из важнейших задач данной отрасли знания. Вместе с тем большое значение имеет изучение свойств и биологической роли в прижизненных и посмертных превращениях других компонентов тканей: углеводов, липидов, экстрактивных веществ, витаминов и т. и. В связи с этим в курсе «Биохимия мяса» значительное место отводится изучению химической природы тканей и органов животного, рассмотрению их функцио
3
нальных биохимических особенностей; большое внимание уделяется также явлениям, происходящим после убоя животного, когда обмен веществ в тканях прекращается и происходят в основном процессы автолитического распада, обусловливающие изменения свойств сырья животного происхождения.
Процессы автолитического распада протекают при самых разнообразных способах обработки мяса и других органов и тканей, причем характер изменений сырья в значительной степени зависит от происшедших ранее изменений мяса. Поэтому для инженера-технолога мясной промышленности особое значение имеет изучение ферментных систем и биохимических процессов, протекающих в животных тканях в послеубойный период и в процессе технологической обработки. Академик А. Н. Бах — основоположник советской технической биохимии — указывал, что только на основе глубокого понимания ферментативных явлений мы можем действительно рационально управлять технологическими процессами и гарантированно получать продукты высокого качества.
В технической биохимии большое внимание уделяется изучению пищевой ценности отдельных органов и тканей. Пищевая ценность мясопродуктов определяется прежде всего биологическими свойствами составляющих их веществ (белков, липидов, витаминов и других органических и минеральных веществ). Изменение этих веществ в процессе технологической обработки решающим образом влияет на качество готовой продукции, его пищевую, биологическую ценность.
В последнее время большое внимание уделяется вопросам безвредности способов обработки и применяемых добавок, биологической оценке различных способов воздействия.
На питательную ценность и усвояемость пищи влияют также ее вкусовые и ароматические свойства. Образование и накопление веществ, придающих мясопродуктам специфический вкус и аромат, происходят при технологической обработке и чаще всего в результате биохимических превращений при участии ферментов.
Необходимым условием максимального сохранения питательных и вкусовых свойств готовых мясопродуктов в период их хранения является рациональное ведение таких процессов, как созревание, замораживание, посол и
4
ряд других, также связанных с биохимическими превращениями сырья.
Основными продуктами, вырабатываемыми предприятиями мясной промышленности, являются мясо и различные мясопродукты. Мясо (туша животного или птицы в целом) представляет собой комплекс следующих тканей: мышечной, соединительной, жировой, костной и в меньшем количестве хрящевой, нервной, железистой, крови и некоторых других. Среди продуктов убоя большое пищевое значение имеет печень, широко используемая также в качестве сырья для получения биоактивных препаратов.
В мясной промышленности из животного сырья получают различные биологические препараты: липиды (холестерин, лецитин), ферментные (пепсин, ренин, гиалуронидаза и др.) и гормональные препараты (АКДТ, инсулин, стероидные гормоны и др.), гепарин и т. д. При производстве их в сырье происходят разнообразные биохимические превращения. Глубокое знание природы этих процессов, биологических особенностей, химических и физико-химических свойств веществ позволяет приготовить препараты необходимой чистоты и активности.
Использование крови убойных животных для получения медицинских препаратов также целиком основано на биохимических свойствах крови и ее отдельных компонентов.
Изготовление из животного сырья высококачественных технических продуктов стало возможным благодаря рациональному управлению биохимическими и химическими процессами.
Знание основ биохимии играет важнейшую роль в усовершенствовании технологических процессов и создании новых направлений в переработке сырья животного происхождения. Известно, например, что мясо, взятое для изготовления пищи сразу после убоя, не обладает хорошими потребительскими достоинствами. Наилучшие вкусовые, питательные свойства и оптимальную усвояемость оно приобретает в результате созревания. Биохимические исследования способствовали установлению оптимальных условий ведения данного процесса. Основоположником этого направления является профессор И. А. Сморо-динцев.
Многие биохимические исследования посвящены изучению исключительно сложных превращений, лежащих в
5
основе образования аромата, вкуса, консистенции и окраски колбасных и ветчинных изделий.
Успехи в развитии физики, химии, биологии, биохимии позволяют применять новые средства в целях улучшения и интенсификации технологической обработки мяса и мясопродуктов. Заключение о пригодности того или иного нового метода обработки мяса и мясопродуктов может быть сделано только в результате изучения сущности биохимических и химических превращений, происходящих с компонентами животного сырья во время его обработки.
Таким образом, дисциплина «Биохимия мяса» является основополагающей в формировании специальности инженера-технолога мясной промышленности. Она вооружает его знанием свойств и возможностей рационального использования животного сырья, пониманием необходимости ведения технологического процесса так, чтобы обеспечить сохранение в сырье ценных исходных качеств при изготовлении пищевых, лечебных или технических препаратов.
Во втором издании книги (первое издание «Биохимия мяса и мясопродуктов» вышло в 1963 г.) внесены все необходимые дополнения и изменения, вызванные стремительным развитием как общей, так и технической биохимии. В учебнике освещаются вопросы ультраструктуры, химического состава, строения и свойств компонентов тканей (мышечной, соединительной, жировой, покровной, крови и др.), а также органов (мозга, печени, почек, эндокринных и пищеварительных желез и др.). Рассматриваются наиболее важные биохимические процессы, свойственные этим морфологическим образованиям. При этом наибольшее внимание уделяется изучению процессов, происходящих после убоя животных. Приводится описание особенностей химического состава мяса, компонентов, определяющих его органолептические свойства. Рассматриваются биологические и физико-химические факторы, влияющие на изменение свойств мяса в процессе его созревания, а также воздействия микрофлоры, отрицательных температур, химических веществ (посол, копчение).
Главы II и V составлены проф. П. Е. Павловским, главы III и IV — проф. В. В. Пальминым. Введение и главы I, VI и VII написаны совместно. В главе I материал о строении, составе белков тканей, сокращении и расслаб
6
лении мышц составлен проф. В. В. Пальминым; о других компонентах ткани и автолизе — проф. П. Е. Павловским. В главе VI материал о биохимии созревания, холодильной обработке, воздействии микрофлоры написан проф. П. Е. Павловским, остальной материал — проф. В. В. Пальминым. В главе VII описание эндокринных желез принадлежит проф. П. Е. Павловскому, пищеварительных — проф. В. В. Пальмину.
Отзывы и пожелания просьба направлять по адресу: 113035, Москва, М-35, 1-й Кадашевский пер., д. 12, издательство «Пищевая промышленность».
Глава I.
БИОХИМИЯ МЫШЕЧНОЙ ТКАНИ
БИОХИМИЧЕСКИЕ ФУНКЦИИ,
СТРОЕНИЕ И СОСТАВ
МЫШЕЧНОЙ ТКАНИ
БИОХИМИЧЕСКИЕ ФУНКЦИИ МЫШЕЧНОЙ ТКАНИ
Мышечная ткань, составляющая свыше 40% массы тела животного, осуществляет важные физиологические функции организма:
принимает участие в механизме движений тела, в процессе дыхания и переработки пищи (скелетная мускулатура);
обеспечивает кровообращение, дыхание, передвижение пищевой массы в пищеварительном канале и т. п. (мускулатура внутренних органов).
Деятельность мышечной ткани регулируется нервной и гормональной системами и тесно связана с постоянным притоком и ассимиляцией пищевых веществ, доставляемых кровью. В свою очередь продукты обмена, выделяемые в кровь в результате жизнедеятельности мышечной ткани, существенно влияют на функции других органов, в том числе на центральную нервную систему. Для выполнения биохимических функций мышечная ткань потребляет большую часть энергии, используемой организмом в процессе жизнедеятельности.
Химическая энергия органических соединений в результате биохимических процессов превращается в механическую работу мышц с помощью специализированного аппарата, состоящего из сложных морфологических образований и последовательно действующих многообразных ферментных систем.
По питательным и вкусовым достоинствам мышечная ткань — наиболее важный компонент мяса и мясопродуктов.
8
МОРФОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА МЫШЕЧНОЙ ТКАНИ
Мышечная ткань — это сочетание мышечных клеток (мышечных волокон) с неклеточной структурой, объединенных в единую живую систему, характеризующуюся определенным составом, строением и функциями.
Отдельные мышечные волокна объединяются рыхлой неоформленной соединительной тканью в небольшие пучки, а небольшие пучки в более крупные, которые входят в состав отдельных мускулов, покрытых плотными соединительнотканными пленками (фасциями). Между пучками и волокнами проходят и разветвляются кровеносные сосуды и нервы.
Пространство между пучками содержит также в небольшом количестве полужидкое, слизеподобное бесструктурное вещество.
По морфологическому строению различают мускулатуру поперечнополосатую, к которой относится скелетная мускулатура, и гладкую, входящую в состав тканей желудочно-кишечного тракта, диафрагмы, кровеносных сосудов, матки и т. д. Мускулатурой особого — смешанного — типа является сердечная мышца.
Наибольший интерес в технологии мяса представляет поперечнополосатая скелетная мускулатура.
Основным морфологическим и функциональным тканевым элементом поперечнополосатой мускулатуры является мышечное волокно.
Мышечное волокно представляет собой своеобразную гигантскую многоядерную клетку толщиной от 10 до 100 мкм и длиной до 12 см и больше (у крупных животных). Структура мышечного волокна очень сложна. Поверхность его покрыта эластичной оболочкой — сарколеммой.
Помимо сарколеммы в структуре мышечного волокна можно различить тонкие продольные структуры — миофибриллы, а также ядра и ряд органелл: митохондрии, рибосомы, лизосомы и др. Меньшую часть клетки (40— 35%) составляет саркоплазма, полностью окружающая все другие образования.
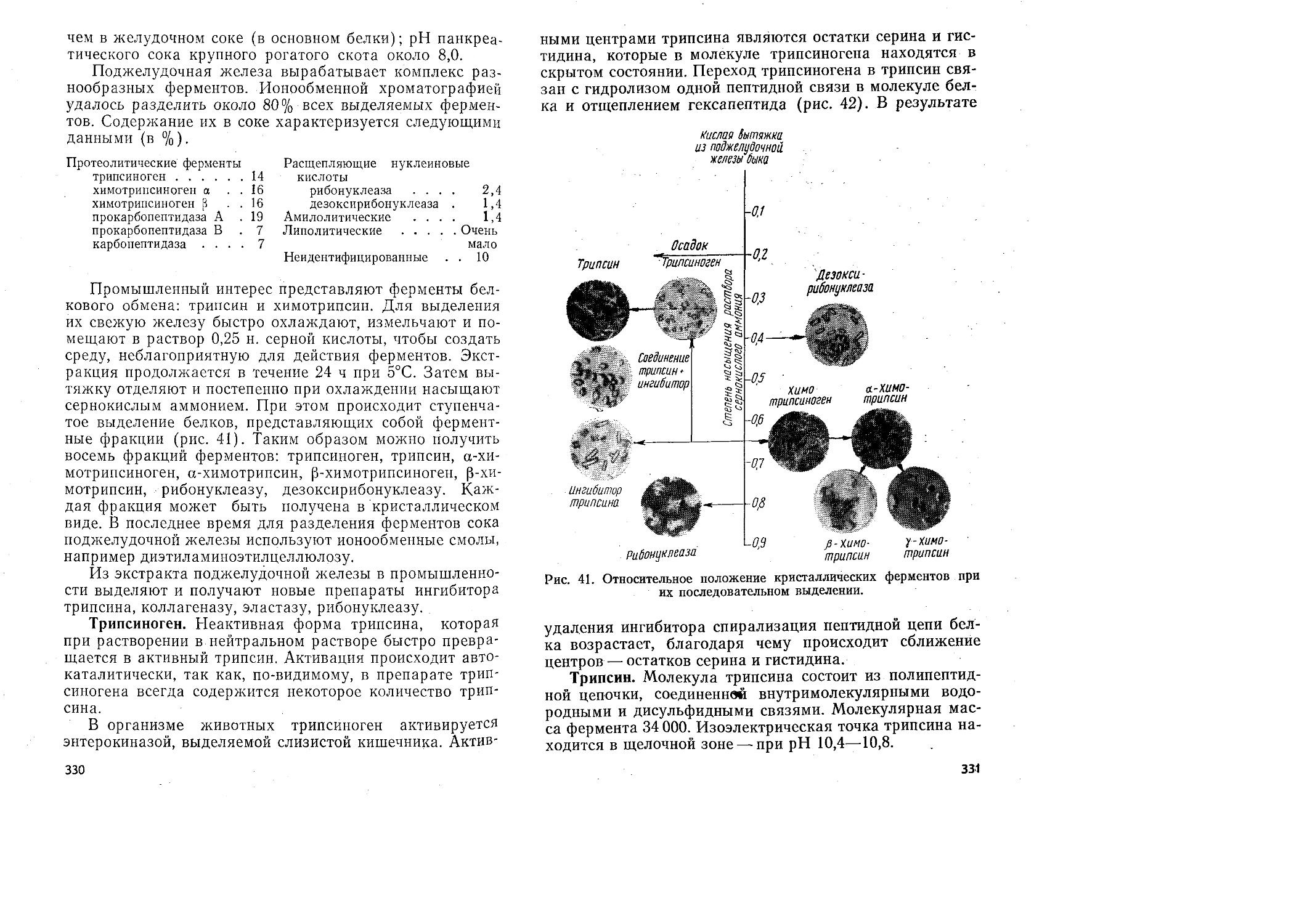
Электронная микрограмма и схема строения мышечного волокна изображена на рис. 1.
9
С помощью дифференциального центрифугирования гомогената мышечной ткани в растворе сахарозы можно выделить отдельные субклеточные компоненты. Этот метод основан на последовательном применении различных скоростей центрифугирования. Отдельные структурные
Рис. 1. Электронная фотография (вверху) части двух миофибрилл, их схематическое изображение (внизу) и поперечный разрез (справа).
компоненты оседают в зависимости от ускорения свободного падения g и их плотности (табл. 1).
Рассмотрим отдельные структурные компоненты мышечного волокна.
Сарколемма. Построена из двух слоев с липидной прослойкой. Внутренний (плазматический), слой представляет собой мембрану толщиной 0,1 мкм; внешний (базальный) слой состоит из густой сети волокон двух видов: преимущественно поперечноисчерченных коллагеновых (диаметром около 2 нм) и бесструктурных эластиновых.
Сарколемма обладает избирательной проницаемостью. В норме через нее проходят молекулы углеводов, жирных кислот, аминокислот', белков. Их передвижение зависит от осмотического давления и активной регуляции 10
ТАБЛИЦА 1
Ускорение свободного падения g, м/с2 Продолжительность центрифугирования, мин Компоненты клетки Надосадочная жидкость
1000 10000 50—60000 150000 10 20—30 60 60 Ядра, обрывки клетки Митохондрии и лизосомы Обрывки органелл и ретикулума Рибосомы Клеточный сок, белки, низкомолекулярные вещества
сарколеммы. Ее проницаемость регулируется нервной системой и изменяется при мышечной работе, связанной с подкислением содержимого волокна.
Миофибриллы. Активные сократительные элементы мышечного волокна, занимающие большую часть клетки (около 60—65%). Это волокнистые, поперечноисчерчен-ные структуры (толщиной 1—2 нм), которые расположены в протоплазме мышечного волокна продольно направленными параллельными пучками (см. рис. 1).
Под микроскопом при большом увеличении можно увидеть правильно чередующиеся участки (диски), одни из которых в проходящем свете кажутся темными, другие — более светлыми. При исследовании в поляризационном микроскопе темные участки миофибрилл обнаруживают двойное лучепреломление (анизотропные диски, или диски А), а светлые не обладают этим свойством (изотропные диски, или диски /). Такая оптическая неоднородность этих участков обусловливается неодинаковым их строением и белковым составом.
Основной участок миофибрилл, ограниченный линиями — мембранами Z, называют саркомером. Длина саркомера 2—3 нм. Каждая миофибрилла состоит из нескольких саркомеров. В зависимости от обработки мышечных волокон и их физиологического состояния можно наблюдать и другие детали строения миофибрилл (например, сублинии N, М).
11
На электронной микрограмме (см. рис. 1) хорошо видны миофибриллы, анизотропные и изотропные диски, а также поперечные полосы Н, М и Z.
Каждую миофибриллу можно расщепить (например, с помощью ультразвука) на многочисленные тончайшие нити (1000—2000), видные только под электронным микроскопом. Эти элементарные волоконца (нити), составляющие миофибриллы (см. рис. 1), получили название протофибрилл (filaments). Различаются толстые и тонкие нити. Толстые нити (диаметром около 100 нм и длиной около 450 нм), построенные из белка миозина, расположены параллельными рядами в диске А. Посредине диска Л в области зоны Н толстые нити несколько увеличиваются в диаметре, образуя зону М.
Тонкие нити (диаметром около 58 нм), состоящие из белка актина, идут от линии Z через диск /; их концы заходят между толстыми нитями в диск А. В зоне Н тонкие нити отсутствуют. Толстые и тонкие нити соединены поперечными перемычками (мостиками) толщиной примерно 30 нм.
Строение толстых и тонких нитей довольно сложно. Первые состоят из параллельно расположенных, сжатых молекул миозина (каждая нить, входящая в диск А, содержит от 200 до 400 молекул белка). Через определенные промежутки (429 и 143 нм) вдоль нити расположены выступы, соприкасающиеся с тонкими нитями. Они как бы закручены вокруг спирали и образуют пики, подобные зубцам (ножкам). В этих выступах сосредоточена АТФ-азная активность миозина (см. с. 31). Тонкие нити состоят из двух спирально переплетенных цепей актина (построенных из мономерного актина). Одна цепь закручена вокруг другой, осевой.
На поперечном разрезе миофибрилл толстые и тонкие нити ориентированы так, что образуют гексагональную структуру. Фибриллы окружены и тесно связаны с особой структурой, состоящей из трубочек и пузырьков и называемой саркоплазматическим ретикулумом.
Ядра. Расположены по периферии клетки под оболочкой. Форма их овальная, плоская. Структура ядер неоднородна. В них содержатся главным образом дезоксирибонуклеопротеиды. Ядра покрыты тончайшей оболочкой, состоящей из двух слоев белковых молекул, между которыми находится липидная прослойка. Ядра можно выде-
12
дитьхпутем центрифугирования гомогената мышечной ткани с небольшой скоростью.
Митохондрии. Образования шарообразной или продолговатой формы диаметром (0,74-1,0) (24-7) мкм (рис. 2). Они ограничены двухслойной мембраной толщиной до 180 нм, состоящей из глобулярных белковых молекул и слоя молекул липидов. Внутри митохондрии также расположены двухслойные мембраны, состоящие из
Рис. 2. Субмикроскопическая организация митохондрии:
— трехмерная модель митохондрии; б — криста митохондрии; Г—кристы; 2 — внешняя мембрана; 3— внутренняя мембрана; 4 — матрикс; в — детали структуры кристы: Б — белок; Л — липиды.
белково-фосфолипидных комплексов в виде перегородок, гребней (крист). Эти субмикроскопические структуры содержат строго фиксированные ферментные системы, выполняющие функции окислительного катализа — окислительного фосфорилирования.
13
Митохондрии, по-видимому, расположены между миофибриллами поперечными рядами и связаны с дисками Л. Особенностью митохондрий является их чувствительность к внешнему воздействию, в частности они набухают в гипотонической среде. При этом нарушается упорядоченность структур и частично взаимосвязь процессов, протекающих в митохондриях.
При действии фторацетата (ингибитора ряда ферментов) в концентрации 10~3 М митохондрия меняет свою форму и становится из вытянутой шарообразной.
Рис. 3. Схематическое изображение структуры саркоплазматического ретикулума двух фибрилл (а, б) из мышцы кролика:
а — саркомер с интактным ретикулум; б — саркомер с частично удаленным ретикулум; Р— плазмолеммы; Т — концевые цистерны триад; А, I — диски; С — саркоплазма; М — митохондрии, О — основное вещество; Н — псевдозона;
Z — граница саркомера.
Рибосомы (саркосомы). Образования круглой или овальной формы диаметром от 200 до 300 нм. Молекулярная масса рибосом 3—4 млн. Они состоят главным образом из белковой оболочки и рибонуклеиновых кислот (РНК). Экспериментальные данные свидетельствуют о том, что рибонуклеиновые кислоты рибосом являются как бы матрицами, на которых при участии рибонуклеотидов и ферментных систем синтезируются специфические белки клетки. Нуклеиновым кислотам принадлежит ведущая роль в передаче специфичности строения белков и регуляции механизма их синтеза.
14
Лизосомы. Неустойчивые образования сферической формы\(средним диаметром около 0,4 мкм), окруженные липопротеидной мембраной. В структуре локализованы различные, гидролитические ферменты. Физиологической функцией дизосомов является внутриклеточное переваривание.
Саркоплазма. Неоднородная масса, состоящая из основного полужидкого вещества (белковый золь низкой вязкости) — гиалоплазмы (матрикс) с капельками жира, гликогеном и саркоплазматической сети (ретикулум) — сложной системы ультрамикроскопических трубочек (диаметром около 40 нм), проходящих вдоль миофибрилл (рис. 3). Между дисками А и I эти трубочки и особые пузырьки (цистерны) контактируют между собой и образуют поперечные триады. Трубочки соединяют отдельные участки фибрилл между собой и сарколеммой.
Благодаря способности этой системы к удержанию и выделению ионов Са она принимает участие в передаче нервного импульса от постсинаптической мембраны к миофибриллам.
ХИМИЧЕСКИЙ СОСТАВ МЫШЕЧНОЙ
ТКАНИ
Мышечная ткань характеризуется сложным химическим составом. В нее входит значительное количество лабильных веществ, содержание и свойства которых могут изменяться в зависимости от многих факторов как при жизни животного (предубойное содержание), так и сразу после убоя. Поэтому химический состав ткани изучают при строго определенных условиях, к которым относится быстрое извлечение ткани после убоя животного, охлаждение, быстрое измельчение при охлаждении, обработка при низких температурах и т. д.
При исследовании химического состава мышечную ткань освобождают по возможности от других тканей (соединительной, жировой и др.) и измельчают (гомогенизируют). После этого выделяют и разделяют химические компоненты, входящие в состав ткани. Такое разделение чаще всего основывается на избирательной растворимости отдельных химических веществ мышечной ткани в различных растворителях: воде, водно-солевых растворах при различном значении pH, органических раствори-
15
телях и т. д. Для извлечения липидов измельченную ткань перед экстракцией предварительно высушивают. /
Содержание основных групп химических веществ в мышечной ткани млекопитающих характеризуется следующими данными (в %).
Вода....................................'• 70—75
Органические вещества.................. . 23—28
белки .............................. . 18—22
азотистые экстрактивные вещества . • • 1—1,7 безазотистые экстрактивные вещества • • 0,7—1,35 липиды ............................... 2—3,0
Неорганические соли....................... 1—1,5
Содержание воды в мышцах колеблется в зависимости от возраста животного: чем оно моложе, тем больше влаги в мышцах. Неодинаково содержание воды в различных группах мышц и уменьшается оно по мере увеличения содержания жира. Вода, входящая в состав мышечной ткани, неоднородна по физико-химическим свойствам и роль ее неодинакова.
Различают две формы воды — свободную и связанную. Свободная жидкая вода имеет квазикристалличе-скую, тетраэдрическую координированную структуру. Она ограничена степенями свободы за счет образования водородных связей между отдельными молекулами. Этим объясняется высокая диэлектрическая постоянная воды. С помощью тяжелой воды (D2O) и применения метода ядерно-парамагнитного резонанса установлено, что свободная вода мышечной ткани также имеет явно выраженную подобную координированную, тетраэдрическую структуру. Другая часть воды находится в связанном состоянии — ионная и гидратная вода, активно удерживаемая главным образом белковыми веществами и некоторыми другими химическими компонентами клеток (например, углеводами, липидами). Такое состояние объяс; няется наличием химической или физико-химической связи между водой и веществом. Около 70% воды ткани ассоциируется с белками миофибрилл.
Гидратация белковых молекул обусловлена полярными свойствами молекул воды (дипольным строением) и наличием функциональных групп (аминных, карбоксильных, гидроксильных, пептидных и др.) в молекуле белков. При этом диполи воды образуют гидратные слои вокруг 16
активных групп и белковой молекулы в целом. При гидратации часть воды, связываясь с гидрофильными группами бедка, располагается вокруг белковых молекул в виде мономолекулярных слоев. Первые слои удерживаются довольЦо прочно, а последующие — значительно слабее, располагаясь в виде рыхлого диффузного облака. Окружая функциональные группы соседних белковых цепей, связанная вода существенно влияет на стабилизацию их пространственной конфигурации, и, следовательно, определяет их функциональную деятельность.
На некоторых участках молекул белков могут образоваться водные мостики.
Связанная вода удерживается белком довольно прочно. Она характеризуется рядом специфических свойств: более низкая точка замерзания, меньший объем, отсутствие способности растворять вещества, инертные в химическом отношении (находящиеся в небольших концентрациях) — сахара, глицерин, некоторые соли. Связанная вода составляет 6—15% от массы ткани.
За слоем гидратной воды расположены, слои относительно слабо удерживаемых молекул воды, представляющей собой раствор различных веществ, — это свободная вода. В ткани ее содержится от 50 до 70% • Удерживается она большей частью за счет осмотического давления и адсорбции структурами клеток — сеткой белковых мембран и белковых волокон, а также в результате заполнения макро- и микрокапиллярных внутриклеточных и межклеточных пространств ткани. Поэтому такую воду рассматривают как иммобилизованную воду, которая в значительном количестве сравнительно легко может быть удалена из ткани путем отпрессовывания или центрифугирования (в суперцентрифуге).
После высушивания мышечной ткани сухой остаток составляет около 30%, в том числе органические вещества 23—28%; 1—1,5% приходится на долю неорганических солей.
Главным компонентом органических веществ ткани являются белки. На их долю приходится около 80% сухого остатка, или 18-—22% массы ткани. Из других постоянных органических гкомпонентов ткани особое место занимают многочисленные экстрактивные вещества (азотистые и без азотистые), выполняющие важную роль в биохимических превращениях мышц. Некоторые из них
17
являются промежуточными или конечными продуктами обмена. В состав сухого остатка входят также жиры и другие, липиды. В мышечной ткани содержатся различные витамины.
БЕЛКОВЫЕ ВЕЩЕСТВА
МЫШЕЧНОЙ ТКАНИ
Входящие в мышечную ткань белки характеризуются сложным составом, разнообразны по строению, физико-химическим свойствам и биологическим функциям. Некоторые из них находятся в растворенном состоянии в гиалоплазме, а большая часть включена в плотные структуры клетки: миофибриллы, ядра, митохондрии, рибосомы, оболочку ретикулум и др.
Наблюдаемое под микроскопом строение мышечной ткани в основном является результатом своеобразного сочетания различных белков, определяющих физико-химические свойства мышечной ткани: плотность, упругость, эластичность. Эти свойства мышц зависят от природы, состояния белков и взаимосвязи их с водой.
ПРИНЦИПЫ ВЫДЕЛЕНИЯ И РАЗДЕЛЕНИЯ БЕЛКОВ
Для исследования белков мышечную ткань измельчают (прием, часто применяемый при технологических операциях), в результате чего получается полужидкий мышечный гомогенат, состоящий из смеси разрушенных морфологических элементов клеток.
При измельчении ткани могут измениться свойства белков и других ее компонентов, поэтому механическую обработку и последующие операции по извлечению белков необходимо проводить быстро и на холоду. Это необходимо также и для того, чтобы затормозить действие ферментов на компоненты ткани.
Из полученного гомогената извлекают белки путем последовательной экстракции с помощью различных растворителей: воды, водно-солевых растворов с различным pH, глицерина и т. п. Поэтому нередко (хотя и не совсем точно) белки мышечной ткани подразделяют на растворимые в воде, растворимые в солевых растворах и нерастворимые в водно-солевых растворах (белки стромы).
18
Для выделения белков саркоплазмы из мышц при низкой положительной температуре можно отпрессовывать жидкую фазу, получая мышечную плазму — жидкость красноватого или красно-бурого цвета, которую используют Для изучения содержащихся в ней белков и других веществ.
Растворимость белков зависит от соотношения в молекуле количества неполярных гидрофобных и полярных гидрофильных групп, их взаимного расположения, а также силы взаимодействия между белковыми молекулами.
Фракция водорастворимых белков характеризуется обычно глобулярным строением молекул. Эти белки в основном входят в состав жидкой части саркоплазмы. Они относительно легко растворимы в воде, так как взаимодействие между молекулами белка и растворителя сильнее, чем взаимодействие между соседними белковыми молекулами. Водорастворимые белки условно рассматривают как белки саркоплазмы.
Большинству белков мышечной ткани, нерастворимых в воде, присуще фибриллярное строение. Молекулы их взаимодействуют между собой и с молекулами других белков сильнее, чем с молекулами растворителя (воды). Поэтому для их растворения требуется создать условия, при которых нарушается межмолекулярное взаимодействие белков. Такое явление наблюдается в случае применения растворов солей с ионной силой М* свыше 0,35. Белки, извлекаемые солевыми растворами, в основном составляют структуру миофибрилл; т. е. сократительного аппарата мышц.
Белки, составляющие оболочку клетки, и белки, прочно удерживаемые в структуре мышечных клеток и нерастворимые в солевых растворах, условно называются белками стромы. Их (кроме белков сарколеммы — коллагена, эластина) можно извлечь 0,25%-ным раствором NaOH.
Особыми свойствами характеризуются белки ядер. Они также относятся к белкам стромы, так как не переходят в вытяжку при водной и водно-солевой экстракции.
Некоторые белки мышечной ткани (актин, тропомиозин) находятся в связанном состоянии с липидами, поэтому для перевода их в раствор необходимо разрушить эту связь.
* Ионная сила — полусумма произведения концентрации ионов на квадрат их валентности.
19
Путем экстракции 0,62 М КС1 с 0,01 М. пирофосфатом при pH 6,2 можно перевести в раствор все белки мышечной ткани, кроме белков сарколеммы.
Большинство экстрактов, полученных из мышечных гомогенатов в результате применения различных растворителей, большей частью представляет собой смесь белков. Используя методы высаливания, адсорбции, диализа, электрофореза, хроматографии, гельфильтрации и др., можно выделить из этой смеси фракции белков, близких по биологическим свойствам, или индивидуальные белки.
Для разделения белков саркоплазмы применяется электрофорез свободный, на бумаге, на гелях — агаровом, крахмальном, полиакриламидном и др. Широко используется для очистки разделения белков также метод гельфильтрации — способ разделения белковых смесей с помощью адсорбционной хроматографии с использованием различных синтетических адсорбентов (сефадексы, продукты модификации целлюлозы и Др.).
При экстракции в раствор вместе с белками переходят водорастворимые азотистые и безазотистые экстрактивные, а также минеральные вещества, которые при изучении белков необходимо удалять (обычно диализом).
Чистоту выделенных белков оценивают путем определения диаграммы растворимости, установления седиментационного равновесия в ультрацентрифуге, выделения кристаллических белков, получения электрофоретических кривых и др.
Полученные белковые экстракты или осадки можно использовать для количественного определения содержания данной фракции белков в мышечной ткани. Для этого применяют химические и специфические (биологические) методы, а также методы, основанные на использовании физико-химических свойств белков.
Химические и физико-химические методы основаны на исследовании содержания какого-либо компонента белковой молекулы, например белкового азота, определении пептидных связей, а также содержания отдельных аминокислот.
Из физических методов в настоящее время широко пользуются, помимо весового, рефрактометрическими и спектрофотометрическими методами количественного определения белков.
20
Биологические методы основаны главным образом на применении реакций иммунитета или определении специфической каталитической активности некоторых белков.
БИОЛОГИЧЕСКИЕ И ФИЗИКОХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ
При изучении белкового состава мышц основной интерес представляют белки саркоплазмы, миофибрилл, ядер и сарколеммы.
Белки саркоплазмы
К группе белков саркоплазмы относятся миоген, миоглобин, глобулин X, миоальбумин. Все они, за исключением миоглобина, представляют собой гетерогенные системы, фракции белков, близких по физико-химическим и биологическим свойствам, поэтому обозначение их носит в известной степени условный характер.
Миоген. Группа белковых веществ, выполняющих главным образом ферментные функции. Фракция миогена составляет около 20% всех белков мышечной ткани. Миоген легко растворяется при экстрагировании водой гомогената мышечной ткани и содержится в отпрессованном мышечном соке. Из водного экстракта его можно выделить путем высаливания, например, сернокислым аммонием. При этом ряд фракций получен в кристаллическом виде.
По физико-химическим свойствам (растворимости, высаливанию) миоген довольно близок к альбуминам. Молекулы миогена имеют глобулярную форму. Молекулярная масса миогена от 150 000 до 81 000, изоэлектрическая точка фракции находится в интервале pH 6,0—6,57. Температура свертывания в растворе 55—66° С.
Во фракции миогена содержатся все жизненно необходимые аминокислоты, т. е. он является полноценным белком. Аминокислотный состав основных белков мышечной ткани млекопитающих представлен в табл. 2. При комнатной температуре часть белков фракции миогена, находящегося в растворе, свертывается, т. е. переходит в нерастворимое состояние, образуя тонкий осадок в виде пленок (нитей) — миогенфибрин (назван так по аналогии
21
с белком крови, однако вопрос о ферментативной природе данного явления выяснен недостаточно).
ТАБЛИЦА 2
Аминокислоты
Аланин........................
Глицин .......................
Валин ........................
Лейцин .......................
Изолейцин................ . . .
Пролин........................
Фенилаланин ..................
Тирозин ......................
Триптофан ....................
Серин ........................
Треонин ......................
Цистин .......................
Цистеин ......................
Метионин .....................
Аргинин ......................
Гистидин .....................
Лизин ........................
Аспарагиновая кислота ........
Глютаминовая кислота .........
Аминокислотный состав (в %) основных белков
О X X
X \о
X 2 о
S
f ,
о о о
X
2 СЗ 2 ь т 2
6,5 6,3 8,56 8,8 7,95
1,9 5,0 5,61 0,4 5,85
2,6 4,9 7,4 3,13 4,09
15,6 8,25 11,5 15,6 16,8
— 7,5 —— — —
1,9 5,1 5,71 1,3 3,34
4,3 4,8 3,06 4,6 5,09
3,4 5,8 5,31 3,1 2,4
0,8 2,05 2,31 0,0 2,34
4,33 5,9 7,3 4,38 3,46
5,1 7,0 7,47 2,9 4,56
1,4 1,34 1,12 0,76 0,0
— —— — — 0,0
3,4 4,5 1,17 2,8 1,71
7,36 6,6 6,33 7,8 2,2
2,41 2,9 4,21 0,85 8,5
11,92 7,6 9,54 15,7 15,5
8,9 10,9 9,7 9,10 8,2
22,1 14,8 11,4 32,9 16,48
В составе фракции миогена содержатся многие ферменты мышечной ткани, которые выполняют функции, связанные с окислительными превращениями углеводов и других соединений, и, по-видимому, входят в состав митохондрий. Один из белков фракции миогена обладает альдолазной активностью, т. е. способностью расщеплять 1,6-фруктозодифосфат на две фосфотриозы. Альдолаза связана в дисках I с актином, другие белки — это различные дегидрогеназы, изомеразы и др.
Отдельные фракции миогена представляют собой комплекс белков, удерживаемых прочными связями и не разрушающихся при обычных методах изолирования. Только специальными методами можно установить комплексную природу этих белков и их различные фермента-
22
дивные свойства. Путем сопоставления физико-химических и биологических свойств миогенов установлено, что соответствующие фракции их у разных животных весьма близки между собой.
Миоглобин (миохром). Растворимый в воде белок, окрашивающий мышцы в красный цвет.
Рис. 4. Молекула миоглобина:
а третичная структура; б — участки полипептидных цепей, соответствующие а-спиральной конфигурации.
Миоглобин представляет собой пигмент хромопротеид, чростеотической группой которого является гем — комплекс порфирина с железом, имеющий кислый характер, лобин, входящий в состав протеида в качестве белково-0 компонента, наоборот, имеет основной характер и по Минокислотному составу является полноценным белком ^см. табл. 2).
23
Миоглобин получен в кристаллическом виде. По свойствам и природе он близок к пигменту крови — гемоглобину.
Молекулярная масса миоглобина 16 800. Миоглобин отличается от гемоглобина спектром поглощения, а также аминокислотным составом. Сейчас довольно подробно изучено тонкое строение миоглобина. Молекула белка состоит из одной полипептидной цепи, с одной N-конце-вой группой.
С помощью рентгено-структурного анализа установлено, что 75% этой цепи находится в а-спиральной форме. На рис. 4 эти участки — прямые линии. Внутри эти цепи описывают сложные кривые, расположенные в виде одного или двух слоев; в итоге образуется плоский.диск размером 43X25X23 нм. Внутри его фиксирована молекула гема.
Характерной особенностью миоглобина является его способность легко соединяться за счет дополнительных связей с различными газами — кислородом, окисью азота, сероводородом и др. При этом железо гема не окисляется (остается двухвалентным). Соединение миоглобина с кислородом — оксимиоглобин, —• имеющее ярко-красную окраску, легко диссоциирует на миоглобин и кислород, а соединение миоглобина с окисью азота и сероводородом может разрушаться при действии некоторых реагентов. При длительном воздействии кислорода воздуха, окиси азота, K3Fe(CN)6 и некоторых других реагентов железо гема окисляется в трехвалентное, а миоглобин превращается в метмиоглобин — соединение, раствор которого окрашен в коричневый цвет. Метмиоглобин может быть вновь восстановлен в миоглобин
мйоглобин или другие соединения сопровождается изменением спектра поглощения (рис. 5).
Несмотря на небольшое содержание в мышечных ^летках (около 1 % к сумме всех белков ткани), миоглобин играет ответственную роль в передаче кислорода, доставляемого кровью, ферментным системам клеток. Исключительно важное значение в механизме этого процесса имеет то обстоятельство, что миоглобин обладает . более высоким сродством к кислороду, чем гемоглобин. Так, при парциальном давлении кислорода 533 Па миоглобин насыщается им на 60%, а гемоглобин — на 38%.
Выполняя роль передатчика кислорода, миоглобин осуществляет функцию своего рода кислородного буфера, или кислородного резерва. Это свойство белка имеет весьма важное значение, особенно когда в процессе мышечного сокращения (в условиях сильного напряжения) циркуляция крови может временно затрудняться. Миоглобин выполняет также важную роль мощного фактора,
облегчающего проникновение кислорода внутрь клетки. Вследствие этого в интенсивно работающих мышцах (с активно протекающими аэробными окислительными процессами) содержится относительно больше миоглобина, поэтому они окрашены темнее (например, мышцы ног и шеи у крупного рогатого скота, грудные мышцы летающих птиц, мышцы лошади), чем мышцы неработающие или работающие менее интенсивно.
Содержание миоглобина в мышцах быка и свиньи характеризуется следующими данными (в мг на 1 г).
Рис. 5. Спектр поглощения производными миоглобина: t — оксимиоглобин; 2 — миоглобин; 3 — метмиоглобин.
4- о2 Миоглобин------► Оксимиоглобин
(пурпурная окраска) «----(красная окраска)
Fe2+ - о2 Fe2+
Восстановление \ / Окисление
Метмиоглобин
(коричневая окраска) Fe3+
Водный раствор миоглобина характеризуется специфичным спектром поглощения; максимум поглощения при длине волны 555 нм. Переход его в оксимиоглобин, мет-
Мышцы быка
скелетные . . . . . 3,7
сердца...............2,1
Мышцы свиньи скелетные
красные.......1,44
белые ...... 0,79
сердца..........0,92
24
25
После убоя животного в поверхностном слое мяса тол. щиной около 40 мм миоглобин, присоединяя кислород переходит в светло-красный оксимиоглобин. Более тем' пая окраска мяса в нижележащих слоях обусловлена наличием восстановленного миоглобина. При длительном хранении мяса оксимиоглобин на его поверхности, окисляясь, переходит в метмиоглобин и мясо приобретает коричневый оттенок.
Исключительно важное значение (для придания мясопродуктам окраски натурального свежего мяса) имеет соединение миоглобина с окисью азота в NO-миоглобин (спектр поглощения, близкий к спектру поглощения оксимиоглобина, максимум длины волны 543 и 573 нм), NO-миоглобин после тепловой денатурации сохраняет красную окраску.
Глобулин X. Белок, составляющий около 20% всего количества белковых веществ мышечной клетки. Глобулин является псевдоглобулином, так как для растворения его достаточно незначительных концентраций солей (например, 0,006 М КС1). Поэтому наличие небольшого количества неорганических солей (1 —1,5%) в мышечной ткани оказывается достаточным, чтобы при водной экстракции глобулин X перешел в раствор. При диализе водного экстракта мышц глобулин X осаждается. Белок можно выделить также добавлением к водному экстракту метилового спирта на холоду или высаливанием сернокислым аммонием при полунасыщении. Растворы глобулина X не обладают двойным лучепреломлением и характеризуются небольшой вязкостью. Изоэлектрическая точка глобулина X находится при pH 5,2. Молекулярная масса 160 000. В растворе белок коагулирует при 50°С.
Биологическая роль глобулина X еще не вполне ясна.
Имеются данные (Иванов, 1961) о том, что глобулин X представляет собой так же, как и миоген, смесь белков и что некоторые фракции его проявляют свойства ферментов.
Миоальбумин. В водорастворимой фракции белков мышечной ткани содержится 1—2% миоальбумина. Он не может быть выделен из мышечной плазмы путем осаждения ацетоном на холоду. По физико-химическим свойствам является типичным альбумином, т. е. растворяется в воде, не осаждается хлористым натрием при насыщении, но осаждается сернокислым аммонием при полном
дасыщении. Мышечный альбумин отличается от альбуми-на крови по аминокислотному составу и физико-химиче-сКим свойствам. Изоэлектрическая точка миоальбумина находится при pH 3—3,5, а альбумина крови — при pH 4,64. Температура коагуляции 45—47°С.
Нуклеопротеиды. В состав белков саркоплазмы нуклеопротеиды входят в небольшом количестве; они сосредоточены в основном в рибосомах, саркоплазматическом ретикулуме. Особенностью их является наличие в основном в структуре молекулы рибозы, т. е. нуклеиновые кислоты нуклеопротеидов саркоплазмы являются рибонуклеиновыми кислотами (РНК). Общее содержание их в мышцах составляет 207—245 мг%.
С помощью электрофореза на бумаге или на агаровом геле белки водного экстракта мышц можно разделить на фракции.
Установлено, что белки саркоплазмы способны желировать. Особенно легко это происходит в присутствии АТФ. При высоких концентрациях Са++ гель разжижается. Желирование белков саркоплазмы зависит от присутствия в среде фрагментов саркоплазматического ретикулума. Удаление этих фрагментов лишает белки возможности образования геля. По-видимому, это свойство ретикулума связано с его ролью в перемещении Са и в клетке, о чем будет сказано дальше.
Белки миофибрилл
К этой группе белков относятся миозин, актин, актомиозин, тропомиозин и др. Извлекаются они значительно труднее, чем белки саркоплазмы, благодаря комплексообразованию между белками, а также между белками и Другими химическими компонентами миофибрилл.
Миозин. Наиболее важный белок мышечной ткани как по биологическим особенностям, так и по содержанию (около 40% от суммы белков ткани).
Большая заслуга в изучении миозина принадлежит А. Я- Да' нилевскому (1839—1923). В 1881 г. он предложил для извлечения миозина использовать раствор хлористого аммония, описал ряд физико-химических свойств миозина, например явление двойного лучепреломления в растворе белка, способность его к осаждению при Диализе и т. п.
27
26
Важные исследования по изучению свойств миозина проведены Вебером, а также Фюртом, Эдсаллом, Бейли, Дюбюиссоном, Штрау. бом, В. А. Энгельгардтом, Хаксли, Бендоллом и др. В 1943 г. Сент-Дьердьи выделил миозин в чистом кристаллическом виде.
Выделение миозина из мышц довольно сложно, так как он взаимодействует с другими структурными белками миофибрилл — с органическими компонентами миофибрилл, а также с различными ионами. Миозин выделяют из измельченных мышц только что убитого животного путем быстрого экстрагирования на холоду 0,6 М КС1 в фосфатном буфере при pH 6,5 и разбавления полученного экстракта. Кристаллический миозин получают по способу, предложенному Сент-Дьердьи, описанному ниже.
Тотчас после убоя срезают мышцы, охлаждают льдом, измельчают в охлажденной мясорубке. Экстрагируют фарш раствором 0,3 М КС1 и 0,15 М К-фосфатного буфера (pH 6,5). Экстракт разводят водой до концентрации 0,1 М КС1. Осадок выпавшего актомиозина отделяют центрифугированием и разводят 1,5 объема воды. После перемешивания в течение 10 мин выделяются кристаллы миозина.
Кристаллы белка сохраняются только в маточном растворе. Под микроскопом они прозрачны, имеют игольчатое строение и способны соединяться в виде пучков. Правильнее считать кристаллы миозина кристаллитами, так как они представляют собой не строго упорядоченное распределение молекул, а нити, расположенные параллельно одна другой.
В дистиллированной воде кристаллы миозина набухают, образуя прозрачный гель — студнеобразную массу. При понижении концентрации миозина получается раствор, обладающий двойным лучепреломлением (ДЛП) в потоке, что объясняется ассоциацией частиц миозина в вытянутые структуры.
В поляризационном микроскопе растворы белка, помещенные между призмами микроскопа, дают темное поле, что объясняется хаотичным расположением белковых молекул, имеющих палочковидное строение. При этом поляризованный луч поглощается раствором, так как палочковидные частицы пропускают свет вдоль длинной и короткой оси с разной скоростью. Однако, если сообщить такому белковому раствору течение, то поле зрения микроскопа будет казаться освещенным, так как в протекающем растворе вытянутые частицы белка будут ориенти-28
роваться в одном направлении и в результате двойного лучепреломления поляризованный световой луч будет проходить через раствор.
Двойное лучепреломление растворов миозина может сильно снижаться или полностью исчезать при добавлении некоторых веществ. Так, оно исчезает при подщелачивании раствора миозина до pH 8,3 или добавлении 0,5 М КС1, так как при этом нарушается ассоциация молекул миозиновых нитей. Оптические свойства миозина исчезают и при подкислении раствора до pH 4. Очевидно, и в этих условиях ассоциированные нити распадаются.
В спокойном состоянии палочковидные частицы белка в растворе миозина агрегируются, образуя студнеобразную структуру, которую можно легко разрушить механическим колебанием. Такое явление разрушения структур называется тиксотропией. Наблюдается оно даже в 0,3%-ных растворах миозина.
При добавлении к растворам миозина солей, например 0,006—0,04 М КС1, белок выпадает в осадок, но при дальнейшем повышении концентрации соли (5—10%) вновь растворяется. Из 0,5 М раствора КС1 миозин осаждается сернокислым аммонием при полунасыщении.
Молекулярная масса миозина окончательно еще не установлена из-за сложности строения его молекулы и способности белка к ассоциированию с другими белками. По мнению большинства авторов его молекулярная масса находится в пределах 500 000, что согласуется и с теоретическими расчетами.
Характерны реакции миозина с солями. Миозин связывает кальций (около 40% кальция, находящегося в мышечной плазме), магний и калий. Заряд белка зависит от количества связанных ионов, главным образом калия. Однако интенсивность связывания миозином ионов зависит от pH и уменьшается при сдвиге его в более кислую область.
Для миозина характерно взаимодействие с АТФ, АДФ. Его молекула способна связывать три молекулы АДФ или две молекулы пирофосфата (РР),но это связывание зависит от концентрации двухвалентных ионов. Связывание РР миозином, как и АТФ, происходит через Ион Mg2+. Образуется комплекс миозина — Mg — РР или Mg—АТФ.
29
Молекулы миозина легко ассоциируют друг с другом, образуя частицы с молекулярной массой примерно в 8 раз больше исходного. Скорость ассоциации уменьшается под влиянием АТФ и пирофосфата и увеличивается в присутствии КС1.
Кроме того, миозин взаимодействует с другими белками и с иными компонентами клетки, например миозин образует прочные комплексы с гликогеном.
Способность связывать катионы металлов и ряд других физико-химических свойств миозина объясняется особенностями состава его первичной структуры и строения молекулы.
В молекуле миозина содержится около 5000 аминокислотных остатков, принадлежащих 20 аминокислотам, в том числе и все незаменимые (см. табл. 2), причем по количеству половину составляют пять аминокислот: лизин, глютаминовая и аспарагиновая кислоты, лейцин и аргинин. Около 30% всего аминокислотного состава миозина приходится на долю дикарбоновых кислот, что придает кислый характер белку и обусловливает специфическую способность связывать ионы калия, кальция, магния (имеется много свободных карбоксильных групп). Поэтому изоэлектрическая точка миозина лежит в кислой зоне при pH 5,4. Представляет интерес соотношение аминокислот гистидина, аргинина и лизина, находящихся в белке в соотношении 2:7:12. Способность миозина соединяться с АТФ или актином и его АТФ-азная активность, по-видимому, зависят от наличия в молекуле белка свободных сульфгидрильных групп. На долю цистеина в молекуле приходится 1,4%. Недавно в составе молекулы миозина был обнаружен метилгистидин, хотя его содержание и невелико — 1,44—1,81 молекул на 500 000 молекулярной массы белка.
В клетках миозин находится в комплексе с липидами (в составе этой фракции находится холестерин). Миозин свертывается при 45—50'3 С.
Миозин обладает ферментативной активностью, катализируя гидролитический распад аденозинтрифосфор-ной кислоты на аденозиндифосфорную и фосфорную кислоты:
Миозин
АТФ + Н2О-----► АДФ + Н3РО4 + 8 ккал.
30
Распад АТФ под влиянием миозина сопровождается рыделением из высокоэнергетической связи нуклеотида большого количества энергии, которая используется для осуществления акта мышечного сокращения. Аденозин-трифосфатазная (АТФ-азная) активность миозина зависит от наличия в составе молекулы свободных SH-групп и присутствия некоторых солей (кальция, магния) и pH среды.
Электронно-микроскопические исследования показали, что молекула миозина имеет удлиненное строение с утолщением на конце в виде головки. Примерная величина осей симметрии частиц миозина 6X140 нм (рис. 6).
Молекула построена из четырех полипептидных цепей — двух больших и двух малых. Рентгеноструктурный анализ свидетельствует о том, что две большие цепи свернуты в а-спираль. Эти
тми (шт)
ЛММ([!ОТ) .ТШ(№Г)'Г~^\
а ' Л*
В SSI
цепи закручены в свою очередь вокруг оси в виде двойной спирали и образуют нить длиной 60—90 нм — 80%
Рис. 6. Молекула миозина: а — схема строения; б — электронные микрофотографии.
длины молекулы. Две другие цепи, присоединяясь, как бы продолжают эту нить, но находятся в свободном (не связаны в общую спираль) виде и затем заканчиваются своего рода головкой (шаровидное утолщение) диаметром около 30—60 нм, состоящей из двух спиралей (см. рис. 6, а). . :
Важное значение для понимания строения и свойств миозина имеют результаты использования методов фрагментации молекулы этого белка. Было установлено, что при действии на кристаллический миозин трипсина и химотрипсина миозин распадается на два компонента. Эти Компоненты получили название меромиозинов: тяжелый (Н-меромиозин) ТММ с молекулярной массой 340000 и легкий (L-меромиозин) ЛММ с молекулярной массой 140 000.
В структуре молекулы миозина ЛММ входит в двухспиральный тяж (80% длины молекулы); свободно расположенные цепи и шаровидное утолщение головки состоят из ТММ (см. рис. 6, б).
31
Следовательно, молекула миозина, имеет четыре субъ единицы, в результате объединения которых происходит образование четвертичной структуры.
В молекуле миозина ТМ.М, локализованный в его булавовидной головке, имеет один активный центр для соединения с актином и другой центр, осуществляющий ферментативную активность. Проявление этих свойств белком обусловлено наличием свободных сульфгидрильных групп. Однако в состав активного центра фермента входят NH2-rpynna, по-видимому, лизина, а также радикалы триптофана, фенилаланина, тирозина, и как считают некоторые исследователи, и метилгистидина.
Применение других методов фрагментации показало, что под действием гуанидинхлорида или мочевины из молекулы миозина можно выделить главную часть, состоящую из полипептидных цепей, а 5% его массы падает на долю низкомолекулярной фракции. В свою очередь эту фракцию с помощью электрофореза можно разделить на три подфракции. Одна из них была названа «metin» — так называемый миозин-агрегирующий фактор. Все эти фракции тесно ассоциируют с миозином. Следовательно, миозин, выделяемый с помощью общепринятых способов, еще не чистый белок. Помимо низкомолекулярных белковых фракций, в миозин включены и нуклеиновые кислоты. Все это усложняет вопрос изучения молекулы миозина, ее функций и определение истинной молекулярной массы.
Актин. Это белок прочно удерживается в структуре мышечного волокна и обычными приемами (экстракцией водой или солевыми растворами) выделить его нельзя, поэтому иногда актин относят к белкам стромы.
Актин выделяют из мышечной ткани только что убитого животного. После измельчения на холоду из мышечного гомогената солевым раствором (0,1 М. борнокислый калий и 2М КС1 в соотношении 4:1) быстро извлекают экстрагируемые белки и экстрактивные вещества. Затем мышечную ткань отмывают водой, обрабатывают ацетоном (с целью разрушения связей с липидами), высушивают и экстрагируют актин водой. В 100 г мышц содержится около 3 г актина, т. е. он составляет около 12—15% общего количества белков мышц.
Актин может существовать в двух формах, различных по физико-химическим свойствам: глобулярной Г-актин (молекулы шаровидные) и фибриллярной Ф-актин (молекулы вытянутые). Молекулярная масса Г-актина 47 000, диаметр 5,5 нм. Благодаря значительному содержанию пролина в его молекуле она не может образовывать а-спираль.
32
В живой мышце в спокойном состоянии актин находится в фибриллярной форме. Возможен переход фибриллярного актина в глобулярный, и наоборот.
Описанным выше методом из мышечной ткани извлекают Г-актин, а при добавлении солей, например 0,1 М КС1 и MgCl, в растворе образуется Ф-актин. При диализе происходит обратное явление:
+ Соли Г-Актин ~~ * Ф"Актин.
— Соли
Ф-Актин появляется в результате образования из двух молекул Г-актина димера (молекулярная масса около 94 000) и последующей полимеризации глобул в цепочки.
Процесс полимеризации осуществляется при участии некоторой части сульфгидрильных групп белка и критической концентрации ионов магния. Ниже этой концентрации существует Г-актин, выше — образуется димер, при более высоких концентрациях Mg2+ и достаточного количества актина возникает Ф-актин. В глобулярном актине всегда содержится небольшое количество связанной АТФ; при удалении ее обработкой ультразвуком глобулярный актин не теряет способности к полимеризации.
Нить Ф-актина представляет собой двухспиральную структуру (рис. 7). Каждая спираль — это цепочка, состоящая из 200—300 отдельных глобул-бусинок (мономеры Г-актина); молекулярная масса Ф-актина до 1500 000. Каждый мономер в двухспиральной цепочке фиксирован с помощью двух типов связей с четырьмя соседними мономерами. Полимерный актин может изменять свою конформацию под влиянием АТФ.
В живой мышце присутствует Ф-актин.
Раствор Ф-актина характеризуется двойным лучепреломлением, значительной вязкостью и тиксотропией. При диализе и переходе его в Г-актин эти свойства исчезают. По аминокислотному составу актин относится к полноценным белкам (см. табл. 2).
Актомиозин. Это сложный комплекс, состоящий из двух белков — актина и миозина. Как указывалось, характерным свойством миозина, помимо ферментативной активности, является способность его образовывать ассоциативные высокомолекулярные соединения, например 2—454 зз
с белками. В результате взаимодействия миозина с актином образуется актомиозин. При образовании актомиозина молекулы миозина прикрепляются своими головами к бусинкам двойной спирали актина (одна молекула на две бусинки), а хвостовая часть располагается в виде спирали вдоль оси актомиозина.
Рис. 7. Схематическое изображение структуры актиновых (тонких) и миозиновых (толстых) нитей:
а — двойная суперспираль актина и нить миозина, из которой выступают расположенные спирально головы молекул (шесть голов на виток спирали), образующие шесть рядов, параллельных оси нити; б — поперечное сечение (напротив каждого ряда выступов расположена одна нить актина); в — структура толстых нитей (последние рентгеновские данные).
Если раствор миозина соединить с раствором Ф-акти-на, то получится очень вязкий раствор актомиозина, характеризующийся двойным лучепреломлением.
Эти свойства раствора актомиозина (вязкость и двойное лучепреломление) не меняются при небольших сдвигах pH и изменении концентрации солей, по-видимому, потому, что в данном случае они обусловливаются не поверхностной ассоциацией, а пространственной асимметрией частиц актомиозина. Степень вязкости растворов актомиозина зависит от соотношения в них актина и миозина: чем больше содержится актина, тем выше вязкость. Искусственно можно получить актомиозин с различным соотношением миозина и актина.
Вещества, обладающие способностью связывать сульфгидрильные группы, препятствуют возникновению
34
^Тоййозйнй. Это дает основание считать, что актомиозиновый комплекс образуется через сульфгидрильные группы миозина и оксигруппы актина.
Было установлено, что реакция соединения актина с миозином возможна не только для белков животных данного вида, но и для протеинов из организмов разных классов и типов, весьма далеко отстоящих друг от друга. Удалось, например, соединить актин и миозин, полученные от лягушки и голубя, лягушки и морской свинки и даже от кролика и таракана. Имеются экспериментальные данные, свидетельствующие о том, что актин лишен видовой специфичности и не обладает антигенными свойствами.
Актомиозин не растворим в воде. При диализе солевого раствора или разбавлении водой до концентрации 0,05 М К.С1 белок выпадает в осадок. Путем многократного переосаждения можно получить очищенный актомиозин.
Характерным свойством актомиозина является его взаимодействие с солями и АТФ. Происходящие при этом изменения белка весьма сложны и многообразны и зависят от условий опыта.
Если к раствору актомиозина добавить ничтожное количество АТФ (на 100 000 г актомиозина одну молекулу АТФ), то резко снижается вязкость раствора и исчезает способность двойного лучепреломления, что связано с диссоциацией актомиозина на актин и миозин. Диссоциация актомиозина на исходные компоненты происходит и при повышении концентрации солей, например КС1, до 2М.
При разведении раствора актомиозина водой выпадают хлопья белка, которые после центрифугирования оседают, образуя плотный студневидный гель, содержащий 98% воды. Под действием АТФ этот гель быстро и резко сокращается в небольшой мало гидратированный плотный комочек.
Если раствор актомиозина разбавлять водой до небольшой концентрации, то осаждение белка будет мало заметно, но при добавлении АТФ быстрее образуются хлопья актомиозина, выпадающие в осадок. Это явление носит название суперпреципитации.
Гель актомиозина можно также получить по способу, предложенному Вебером. Если концентрированный раствор актомиозина выдувать тонкой струей в воду, то образуется гель, застудневающий в виде тончайших нитей.
При добавлении АТФ к актомйозинным нитям, взвешен-, ным в 0,05 М КС1, каждая нить быстро сжимается, а из геля выжимается вода. Гель актомиозина, уплотнившийся под действием АТФ, практически полностью дегидратирован.
В комплекс с миозином могут входить обе разновидности актина, но сократительной способностью под действием АТФ обладает только гель, в состав которого входит Ф-актин. Актомиозиновый гель, полученный в виде тонких нитей, сохраняет АТФ-азную активность.
Однако его активность иная, чем у свободного миозина. Актомиозиновый комплекс проявляет Mg2+ АТФ-азную активность, непосредственно связанную с механизмом передвижения протофибрилл.
Сокращение актомиозинового геля, сопровождающееся распадом АТФ и использованием выделяемой энергии для сокращения геля, рассматривают как своеобразную модель механизма физиологического акта мышечного сокращения.
Это новое направление в физиологии и биохимии мышечного сокращения получило название механохимии мышечного сокращения. В механохимии изучаются вопросы, связанные с превращением химической энергии органических соединений в механическую энергию, которую осуществляют белковые вещества. Согласно современным взглядам, протофибриллы, входящие в состав анизотропного диска миофибрилл, представляют собой толстые миозиновые нити (нити А) и тонкие нити актина (нити Б), которые, взаимодействуя между собой, образуют актомиозиновый комплекс — первичный сократительный элемент мышц.
При добавлении АТФ в измельченную мышечную ткань, отмытую водой, а затем взвешенную в слабом солевом растворе, наблюдается сокращение мышечных волоконец. Следовательно, при сокращении мышц обнаруживается явление, аналогичное сокращению актомиозинового геля, что свидетельствует об одинаковой природе процесса, хотя характер сокращения нитей актомиозина и мышц под действием АТФ несколько различен.
В мышечной ткани миозин может находиться или в комплексе с актином, или в диссоциированном состоянии, в зависимости от физиологического состояния мышцы.
Сразу после прекращения жизни животного из из
36
мельченной на холоду мйтшцы с помощью солевого pact1 вОра выделяют миозин, который можно получить в кристаллическом состоянии. В дальнейшем в экстракт будет переходить миозин, соединенный с актином, т. е. актомиозин с постепенно возрастающим содержанием актина.
Если мышечную, ткань после измельчения экстрагировать на холоду не быстро, а в течение 24 ч, то полученный экстракт, представляет собой густую вязкую массу, из которой при разбавлении водой выделяется уже актомиозин. Следовательно, таким методом можно также получать актомиозин. Характерной особенностью выделенного актомиозина является соотношение актина и миозина 1:5 (хотя в мышце соотношение актина и миозина 4:1) в отличие от искусственно приготовленного актомиозина, в котором соотношение актина и миозина может варьировать.
При выделении белков актомиозинового комплекса из измельченных мышц обычно в раствор переходит их смесь.
Ввиду способности миозина к ассоциации и комплексообразованию с актином в различных соотношениях молекулярная масса актомиозина колеблется в широких пределах —от 1600 000 до 3900 000. В мышце содержится актомиозина 50% (к общему количеству белков) , т. е. на долю миозина приходится 36%, а на долю актина 15%.
Тропомиозин. Структурный белок миофибрилл, впервые выделенной из поперечнополосатых мышц Бейли (1948). Тропомиозин составляет 10—12% белков миофибрилл, или 2,5% от суммы белков мышц. Тропомиозин растворим в воде, но из мышечной ткани он извлекается только солевыми растворами с высокой ионной силой, что свидетельствует о связи его с нерастворимыми в воде белками миофибрилл. Для получения тропомиозина Мышцу после удаления белков саркоплазмы дегидратируют путем последовательной обработки спиртом различной концентрации и этиловым эфиром, после чего высушивают. Из высушенного порошка тропомиозин извлекается 1 М КС1. Раствор белка характеризуется высокой Кизкостью и двойным лучепреломлением, что, по данным электронной микроскопии, объясняется асимметричным строением его молекулы: отношение осей симметрии ^5:1, около 80% молекулы — а-спираль. Молекула тропо-
37
Миозина состоит из двух замкнутых полипептидных цепей, т. е. это циклопептид. Между цепями одна дисульфидная связь.
Молекулярная масса белка 53 000, изоэлектрическая точка находится при pH 5,1.
Тропомиозин получен в кристаллическом виде; его кристаллы имеют форму больших гексагональных пластин. По аминокислотному составу (см. табл. 2) тропомиозин отличается от миозина: в его молекуле нет, например, триптофана. Вместе с тем у него высокое содержание дикарбоновых и основных аминокислот. Характерная особенность белка — устойчивость к денатурации. В 0,1 М солевом растворе тропомиозин не осаждается при нагревании до 100° С при pH 6,3. Тропомиозин находится в миофибриллах, в которых он сосредоточен в изотропных дисках в области Z-мембран.
Тропомиозин является сложным комплексом из двух белков: тропомиозина Б и тропонина. Первый увеличивает чувствительность актомиозина к Са2+, а тропонин в процессе активации мышечного сокращения способствует связыванию Са2+, необходимого для увеличения энзиматической активности миозина. Тропонин в свою очередь состоит из двух различных по функциям фракций. Фракция тропонина А ответственна за чувствительность к Са2+ одного уцастка молекулы миозина, а фракция Б тропонина — другого. Система тропомиозин Б — тропонин связана с тонкими нитями миофибрилл — с актином. При выделении актина из высушенного ацетоном порошка она всегда присутствует в препарате. При добавлении тропомиозина к Ф-актину образуется комплекс: одна весовая часть Ф-актина и две части тропомиозина.
Тропомиозин и тропонин входят в состав тонких протофибрилл.
В процессе сокращения мышц тропомиозин выполняет функцию, связанную с передачей кальция. Особо велика роль этого белка в гладких мышцах, обладающих «запирательной функцией», где он находится в больших количествах. Эти мышцы способны пребывать в состоянии длительного тонического сокращения, связанного с крайне малым расходом химической энергии.
Другие белки миофибрилл. В миофибриллах обнаружено небольшое количество других белков (водорастворимых). Их получают из мышечного гомогената после
38
удаления саркоплазматических белков и актомиозина. у Недавно (1965 г.) были открыты и теперь изучены новые белки — а- и 0-актинины. Белок а-актинин сильно активирует взаимодействие Ф-актина с тропомиозином. Комплекс, образуемый а-актинином, с Ф-актином, ингибирует тропомиозин Б, и, следовательно, влияет на процесс связывания Са2+, т. е. эти белки выполняют регуляторную роль. Белок а-актинин участвует в образовании поперечных связей между тонкими нитями в диске I.
Распределение белков в саркомерах скелетных мышц приведено в табл. 3.
таблица з
Белок Содержание нативных фибрилл
абсолютное количество» мг/мл % от общего количества белков фибриллы Локализация
Актин . . . Тропомиозин Миозин . . . Неизвестные 38,2 27,3 98,4 18,2 54 7 Нити в диске / Толстые нити диска А Z-, N-, Н-уча-стки и др.
Итого 182,1
Белки ядер
Ядра мышечной ткани обычно выделяют путем обработки тканевого гомогената раствором лимоннокислого натрия, подавляющего деятельность нуклеаз. После этого гомогенат обрабатывают препаратом пепсина для освобождения ядер от остатков клеточных белков.
В результате такой обработки и последующего центрифугирования получают очищенные ядра, из которых экстрагируют белки.
Ядра мышечных клеток построены главным образом Из нуклеопротеидов, составляющих около 50% сухого вещества. Нуклеопротеиды можно выделить экстракцией Щелочами или 1 М Nad. В структуру ядерных нуклео-
5?
протеидов входят дезоксирибонуклеиновые кислоты. Их содержится 40—45 мг%.
Молекулярная масса ДНК достигает нескольких миллионов (от 3 до 20), диаметр частиц 1,5—2,0 нм при длине до 50,0 нм. Форма молекул довольно разнообразна: сферическая, эллиптическая, цилиндрическая. Форма молекул нативных нуклеиновых кислот обычно сильно удлиненная, что обусловливает структурную вязкость растворов протеида.
Белковыми компонентами нуклеопротеидов являются гистоны, имеющие щелочной характер ввиду преобладания в составе их молекул диаминокислот (аргинина, лизина). В молекулах гистонов не обнаружен триптофан.
Помимо нуклеопротеидов, в ядрах содержится «кислый белок» (около 30—50% сухого вещества ядер), растворимый в щелочах, с изоэлектрической точкой около pH 5,0. Этот белок по свойствам напоминает глобулины, так как осаждается при насыщении хлористым натрием.
В отличие от гистонов в молекуле кислого белка содержится триптофан (до 2,5%). После удаления нуклеопротеидов и кислого белка в ядрах остается желеобразная масса — «остаточный белок» (около 4—10%), по свойствам и аминокислотному составу похожий на коллаген.
Таким образом, в ядрах содержится по крайней мере три белковые фракции: нуклеопротеиды, кислый белок и остаточный белок.
Приведенные данные о составе и свойствах ядерных белков мышечной ткани почти полностью характеризуют и белки ядер других тканей.
Белки сарколеммы
К этой группе относятся белки, входящие в состав сарколеммы и рыхлой соединительной ткани, объединяющей мышечные волоконца в мышечные пучки.
Каждое мышечное волокно покрыто тончайшей эластической оболочкой •— сарколеммой, состоящей из мембран. В составе мембран сарколеммы, помимо белков, существенными компонентами являются фосфолипиды, играющие важную роль в проницаемости оболочки: лецитин, серин и этаноламин фосфатиды и лизолицетин примерно в равных количествах (по 70%), сфингомиелины
40
(18,3%) и инозитолфосфатиды (18,3%). По составу онй близки к фосфолипидам других структур мышечной ткани. На поверхности сарколеммы расположены соединительнотканные волокна, состоящие из белков соединительной ткани (протеиноидов): коллагена, эластина и ретикулина (см. с. 127). В межклеточном пространстве мышечной ткани встречаются муцины и мукоиды — слизеподобные белки, выполняющие защитные функции и облегчающие скольжение мышечных пучков. Эти белки извлекаются щелочными растворами. На поверхности сарколеммы и в межмышечных промежутках находятся нервные волокна и нервный аппарат клеток, в состав которых входят липопротеиды и нейрокератины.
* * *
Распределение белков в структурных элементах мышечной ткани можно представить в виде схемы
Мышечное волокно
Мио/рибриллы
Миозин Актин
Актомиозин
Тропомиозин
Саркоплазма
мЗогён |
ГлобулинX
Миоглобин
Миоальбумин
Ядра Сарколемма
Кислый белок Остаточный белок
Коллаген (проколлаген)
Нуклеопротеиды Эластин (ДНК)
Актинии Нуклеопротеиды
Тропонин (РНК)
Муцины и мукоиды
Нейрокератины
Липопротеиды
Содержание основных фракций белков мышечной тка-Ни характеризуются следующими примерными соотношениями (в % к общему количеству белков):
Миоген .......20
Глобулин X .... 20
Миозин .......35
Актин..............15
Прочие белки ... 10
41
Необходимо иметь в виду, что по физико-химическим й биологическим свойствам индивидуальные белки или фракции белков, изучаемые в изолированном виде, вне ткани, существенно отличаются от этих же белков, входящих в качестве компонентов в белковые системы протоплазмы и отдельных структурных элементов мышечного волокна,
ФЕРМЕНТЫ МЫШЕЧНОЙ ТКАНИ
Мышечная ткань осуществляет свои функции благодаря активному участию ферментных систем, специфически локализованных в структурах ткани. Ферментные системы обеспечивают получение большого количества энергии, необходимой для осуществления мышечной деятельности. Мышечные клетки характеризуются большой концентрацией ферментов гликолиза, а также ферментов цикла трикарбоновых кислот и дыхательной цепи.
Считается, что осуществление процесса гликолиза и связанное с ним выделение энергии не нуждается в высокой дифференциации структурно-ферментного аппарата, а поэтому протекает в матриксе саркоплазмы. Вместе с тем различные воздействия на мышечную ткань повышают интенсивность гликолитических процессов, что может свидетельствовать о выходе ферментов из ограничивающих структур и их активации.
В матриксе саркоплазмы содержатся многие ферменты синтеза белков, липидов и полисахаридов.
Аэробное окисление продуктов обмена происходит в митохондриях (саркосомах). Большинство ферментов, участвующих в процессах окисления, обнаруживается именно в этих органеллах. Во всех мышечных клетках митохондрии занимают значительную часть саркоплазмы, и в каждой из них гораздо больше крист (складчатые внутренние мембраны митохондрий), чем в менее многочисленных митохондриях других клеток. Процессы, протекающие в складчатых внутренних мембранах митохондрий при участии локализованных в них ферментных систем, играют основную роль в снабжении мышечной клетки энергией.
Разные мышцы в зависимости от функциональных особенностей характеризуются различным соотношением
42
концентрации ферментных систем, катализирующих анаэробные и аэробные превращения. Так, в красных мышечных волокнах содержится больше митохондрий, чем в белых; активность дыхательных ферментов в них в б раз больше, чем в белых. В белых мышцах интенсивность анаэробного гликогенолиза примерно в 2 раза выше, чем в красных.
Интенсивность окисления жиров в мышцах относительно невелика, но после углеводов они являются важнейшим источником энергии. При недостатке углеводов в процессы обмена вовлекается большее количество жиров. К циклу трикарбоновых кислот непосредственно примыкают реакции окисления жирных кислот. В митохондриях обнаружены ферменты, окисляющие жирные кислоты.
Такие процессы обмена аминокислот, как дезаминирование и переаминирование, также примыкают к циклу трикарбоновых кислот. Многие ферменты дезаминирования аминокислот обнаружены в митохондриях. Синтез многих аминокислот, как и «непрямое» их дезаминирование, осуществляется реакциями переаминирования. Переаминирование аминокислот, открытое впервые А. Е. Браунштейном и М. Г. Крицман в мышечной ткани, связано с активностью аминофераз, содержащихся в митохондриях.
Вместе с тем ферменты переаминирования обнаружены также в жидкой части саркоплазмы.
Таким образом, в митохондриях мышц содержатся сложные ферментные системы, составляющие единый комплекс, к которому примыкают ферменты других компонентов клетки. Изменение физико-химического состояния этих органелл сказывается на активности их ферментов. Деструкция митохондрий нарушает координированное осуществление сложного комплекса взаимосвязанных процессов обмена, происходящих в них.
Саркоплазматический ретикулум содержит, кроме активируемой ионами магния АТФ-азы, также обладающую очень высокой активностью АМФ-аминогидролазу.
В ядрах содержатся гликолитические, окислительные, Гидролитические ферменты, а также ферменты белкового синтеза. Кроме того, в ядрах имеются ферменты син-Геза нуклеиновых кислот (ДНК-полимераза и РНК-по-лимераза).
43
С миофибриллами связана основная АТФ-азная активность, которой, как известно, обладает миозин и она зависит от присутствия катионов Na+, К+, Li+, Са2+, Mg2+, NH4+. Очищенный миозин активируется ионами кальция и ингибируется ионами магния. Наряду с этим имеется также растворимая АТФ-аза, отличная от миозина, содержащаяся в различных структурах клетки: в ядрах, митохондриях и мембранных элементах саркоплазмы. Эта АТФ-аза активируется ионами магния.
АТФ-азной активностью обладает определенная часть молекулы миозина — его компонент — Н-миозин. Многократно переосажденный миозин наряду с АТФ-азной активностью обладает еще и активностью АМФ-аминогид-ролазы, ацетилхолинэстеразы. Активность этих ферментов сосредоточена в L-миозине. Кроме того, миофибриллы характеризуются глютаминазной активностью. В проявлении активности ферментов в миофибриллах играют роль фосфолипиды. При делипировании миофибрилл в них резко снижается активность АТФ-азы, АМФ-амино-гидролазы и ацетилхолинэстеразы.
В сарколеммной мембране обнаружено наличие АМФ-аминогидролазы и весьма активной ацетилхолинэстеразы.
К рибосомным относят ферменты, принимающие участие на тех стадиях синтеза белка, которые происходят на рибосомах. Эти ферменты участвуют в прикреплении, передвижении и отделении от рибосомной поверхности И-РНК и Т-РНК; перенос недостроенных полипептидов от одной молекулы Т-РНК и сопутствующее образованию пептидной связи. К рибосомным ферментам относят также рибонуклеазу I, ГТФ-азу и др.
Лизосомы содержат клеточные гидролазы: кислую рибонуклеазу, дезоксирибонуклеазу, кислую фосфатазу, катепсины, эстеразы, гликозидазы. В живой клетке эти ферменты могут действовать в основном на фагоцитированный материал, попавший внутрь лизосомы. Мышечной клетке это необходимо для обновления ее важнейших структур и компонентов. Если целостность лизосомы нарушена, то гидролазы высвобождаются и переваривают компоненты клетки.
Наличие в лизосомах липопротеидной мембраны надежно удерживает гидролитические ферменты и предотвращает переваривание субстратов мышечного волок-
44
йа тотчас после забоя животного. Однако в дальнейшем дод воздействием различных факторов происходит высвобождение гидролаз.
НЕБЕЛКОВЫЕ КОМПОНЕНТЫ
ЛИПИДЫ
Липиды, входящие в состав мышечных волокон, выполняют функции двоякого рода. Часть их, главным образом фосфолипиды, является пластическим материалом и входит в структурные элементы мышечного волокна — миофибриллы, клеточные мембраны, прослойки гранул.
В состав миофибрилл входят различные глицерофос-фолипиды, многие из них способствуют проявлению активности ряда ферментов. Особенно большим содержанием фосфолипидов отличается саркоплазматический ретикулум. Глицерофосфолипиды содержат и сарколем-мные мембраны. Однако общее содержание фосфолипидов в сарколеммной мембране значительно ниже, чем в митохондриях, причем качественный состав их в ней не отличается от состава субклеточных структур.
Другая часть липидов выполняет роль резервного энергетического материала. Такие липиды содержатся в саркоплазме в виде мелких капелек на полюсах митохондрий. В большом количестве липиды содержатся в межклеточных пространствах, между пучками мышц в соединительных прослойках.
Суммарное содержание триглицеридов в мышцах разных животных резко варьирует. При усиленной работе содержание их в межклеточных пространствах сокращается до минимума.
Из глицерофосфатидов мышечной ткани выделены холинглицерофосфолипиды, этанолглицерофосфолипиды, плазмогены, сфингомиэлин и др. Они содержат больше Ненасыщенных жирных кислот (65—75%), чем глицеро-фосфатиды других тканей. Всего глицерофосфатидов в Мышцах 0,2—1%. На долю связанных белками приходится 20—27%. Обычно при работе мышц распадается небольшое количество глицерофосфатидов; заметным распад их становится при истощающей работе мышц.
Из стероидов в мышечной ткани содержатся свободный и связанный холестерин: в гладких мышцах 0,8% к
45
сухой ткани, в сердечных 0,5%, в скелетных 0,3%. Характерной особенностью холестерин-белковых комплексов, выделенных из мышц млекопитающих, является прочная связь холестерина с белком.
Общее содержание липидов в мышечной ткани, а также их компонентов подвержено значительным колебаниям в зависимости от состояния животного, его вида, возраста, пола, условий содержания и кормления.
УГЛЕВОДЫ
Одним из основных углеводов мышечной ткани является гликоген — важнейший энергетический материал. Он расходуется при мышечной работе и накапливается при отдыхе. Содержание его зависит от тренированности и упитанности животного, а также физиологического состояния: в мышцах уставшего и голодного животного содержится мало гликогена.
В свежих мышцах убойных животных содержится 0,3—0,9% (иногда 2%) гликогена и 0,05% глюкозы.
Мышечный гликоген представляет собой сильно разветвленный полисахарид, построенный из сотен молекул а-глюкозы. Молекулярная масса его равна 1 • 106. Большая степень разветвленности мышечного гликогена необходима, поскольку действию ферментов подвергаются концы молекулы; чем больше свободных концов, тем быстрее может быть использована молекула гликогена или быстрее может быть она заново синтезирована во время таких периодов клеточного метаболизма, когда происходит его регенерация. В период распада молекул гликогена наряду с последовательным разрушением его боковых цепей под действием эндоамилаз происходит и образование его частей — «затравок», которые также могут затем расти за счет присоединения глюкозы. Мышечная ткань отличается высокой концентрацией ферментов и факторов системы, синтезирующей гликоген.
В мышечных волокнах обнаруживается определенная связь гликогена с миофибриллами. Наблюдается локализация гликогена у анизотропных дисков и он не обнаруживается в изотропных. Кроме того, гликоген более или менее равномерно распределен в саркоплазме (с преобладанием в околоядерной саркоплазме). Возможно, что связь гликогена V миозином анизотропных дисков мио
46
фибрилл и миогеном саркоплазмы обеспечивает необходимый темп расщепления полисахарида при его гликолитическом распаде. В этих превращениях более лабильной является фракция легкорастворимого гликогена. Наряду с этим труднорастворимый гликоген метаболически не инертен и является резервом, находящимся в состоянии непрерывного обновления.
В процессе интенсивной мышечной работы гликоген подвергается анаэробному гликолитическому распаду с образованием молочной кислоты. При небольшой работе и на отдыхе содержание лактата в мышцах относительно невелико, а при усиленной работе может достигать 400— 500 мг%. В процессе превращения гликогена образуются фосфорные эфиры гексоз и триоз, пировиноградная кислота и другие продукты распада, однако количество их относительно невелико.
Гликоген распадается в мышцах не только фосфори-литическим, но и гидролитическим (амилолитическим) путем под действием а-амилазы, нейтральной у-амилазы, олиго-1,4—И,4-глюкантрансферазы и амило-1,6-глюко-зидазы. В качестве конечных продуктов такого распада гликогена образуются глюкоза, линейные и разветвленные олигоглюкозиды. Дальнейшее расщепление олигоглюкозидов осуществляется специфичными а-олигоглю-козидазами.
В послеубойный период превращения гликогена мышечной ткани являются первопричиной многих дальнейших биохимических сдвигов.
АЗОТИСТЫЕ ЭКСТРАКТИВНЫЕ ВЕЩЕСТВА
Из азотистых небелковых веществ мышечной ткани в экстракт легко переходят карнозин, ансерин, карнитин, креатин, креатинфосфат, аденозинтрифосфорная кислота, которые при жизни животного выполняют специфические функции в процессе обмена веществ и энергии. Другая часть азотистых экстрактивных веществ — пуриновые основания, свободные аминокислоты и др. — представляет собой промежуточные продукты обмена белков. Наконец, часть азотистых экстрактивных веществ, например мочевина, мочевая кислота и аммонийные соли, является конечными продуктами обмена белков. В об
47
щем в свежих мышцах содержится 0,3% небелкового азота в расчете на сырую ткань, или 1,2% в расчете на сухой остаток.
Содержание отдельных азотистых экстрактивных веществ в свежих мышцах млекопитающих характеризуется следующими данными (в % на сырую ткань).
Карнозин .... 0,2 —0,3
Ансерин .... 0,09—0,15
Карнитин .... 0,02—0,05
Холин ...........0,08
Креатин + креа-
тинфосфат . . . 0,2—0,55
Аденозинтрифосфор-
ная кислота . . 0,25—0,4
Инозиновая кислота 0,01 Пуриновые основания 0,07—0,23 Свободные амино-
кислоты .... 0,1—0,7
Мочевина.......... 0,002—0,2
После убоя животного азотистые экстрактивные вещества и продукты их превращения участвуют в создании специфического вкуса и аромата мяса.
Карнозин (р-аланилгистидин). Специфический дипептид
N—С—СН2—CH—СООН
II II I
НС CH NH—СО—СН2—СН2—NH3
Карнозин стимулирующе действует на секрецию пищеварительных желез. При жизни животного карнозин участвует в процессах окислительного фосфорилирования, что способствует образованию в мышце макроэрги-ческих фосфатных соединений (АТФ и КрФ). Содержание карнозина в скелетных мышцах различных убойных животных колеблется в широких пределах: у лошади оно составляет 70—180, коровы 14—265, свиньи 296, барана 96 мг%. В мышцах хорошо упитанных и тренированных животных карнозина содержится больше, чем в мышцах слабых животных, например у быка количество его достигает 1 %.
Ансерин (метилкарнозин). Гомолог карнозина
N—С—СН2—СН—СООН
НС CH NH—СО—СН2—СН2—nh2
N—СН3
48
Ансерин впервые выделен из мышечной ткани гусей, в связи с чем и получил свое название (лат. anser — гусь), однако он широко распространен и в мышцах жирных. Ансерину приписывают те же функции, что и гарнизону. В мышцах убойных животных его содержание составляет 90—-200 мг%
Карнитин. Производное у-амино-р-оксимасляной кислоты
---№(СН3)3
I нсн о неон нсо —с=о
Роль карнитина в превращениях мышечной ткани еще не достаточно ясна. Считают, что он является одним из источников метильных групп. В мышцах содержится 20—50 мг°/о карнитина.
Холин. Аминоэтиловый спирт с тремя метильными группами у атома азота
НО—СН2—СН2—N = (СН3)3
ОН
Холин необходим для образования фосфолипидов и ацетилхолина — соединения, играющего важную роль в процессе передачи нервного возбуждения при сокращении мышц.
Свободный холин вызывает перистальтику кишечника. Как веществу, поступающему с продуктами питания, емУ приписывается значение витамина.
Глютатион (глютаминилцистеилглицин). Специфический трипептид
СО—NH---CH—CH2SH
СН2 СО
СН2 NH
I I
chnh2 сн2
I I
СООН СООН
49
Глютатион является сильным восстановителем и, по. добно цистеину, легко подвергается окислению. В живых тканях глютатион в основном находится в восстановленной форме и по мере необходимости переходит в окисленную форму
— 2Н
2GSH GS—SG
+ 2Н
Глютатиону, очевидно, принадлежит особая роль в поддержании окислительно-восстановительного потенциала мышечной клетки и активации ферментов, содержащих в активном центре SH-группы. Так, в мышцах при жизни содержится общего глютатиона 25,8—41,5, окисленного 0,3—5,7, восстановленного 20,1—41,2 мг%.
Креатин. По строению является метилгуанидинуксус-ной кислотой
nh2
C=NH
I
N—СН3
CH2
I
соон
Установлено, что синтез креатина связан с превращениями аргинина, метионина и гликокола. Содержание креатина в мышцах разных животных не одинаково: у лошади его содержится 0,058, барана 0,153, свиньи 0,239, быка 0,41%. При жизни животного свободного креатина в мышцах содержится сравнительно мало; 70— 80% его связано с фосфорной кислотой в макроэрги-ческом соединении, называемом креатинфосфатом (КрФ):
/ОН NH</?P=O C^NH4011
N-СН3
СН2
I
СООН
Креатинфосфат — богатое энергией соединение, выполняющее роль легко мобилизуемого резерва энергии. Креатинфосфата содержится много в интенсивно работающих мышцах. * * #
Наиболее важными азотистыми экстрактивными веществами мышечной ткани являются свободные нуклеотиды- Так как эти вещества являются также и органическими фосфорными соединениями, они рассматриваются ниже при описании органических фосфатов мышечной ткани.
ОРГАНИЧЕСКИЕ ФОСФАТЫ
Органическим (небелковым и нелипидным) фосфатам принадлежит особая роль в обмене энергии. Наиболее важным из них являются такие нуклеотиды, как АТФ и другие нуклеозидтрифосфаты: гуанозинтрифосфат (ГТФ), уридинтрифосфат (УТФ), инозинтрифосфат (ИТФ), цитозинтрифосфат (ЦТФ). Концентрация различных нуклеозидтрифосфатов в мышечной ткани по сравнению с концентрацией АТФ невелика, например концентрация ГТФ и УТФ в 30—50 раз меньше, а другие нуклеозидтрифосфаты содержатся еще в меньшем количестве.
Нуклеозидтрифосфаты — ГТФ, УТФ, ИТФ, ЦТФ — подобно АТФ, содержат богатые энергией фосфатные связи и так же, как АТФ, принимают участие в качестве Донаторов энергии в важнейших синтетических процессах— синтезе гликогена (АТФ, УТФ), синтезе белков (АТФ, ГТФ), синтезе фосфолипидов (АТФ, ЦТФ) и др.
Мышцы также содержат дифосфорилированные нуклеотиды — АДФ, ГДФ, УДФ, ИДФ и ЦДФ — и моно-Фосфолированные нуклеотиды — АМФ, ИМФ, ГМФ и УМф. Между различными нуклеотидами и АТФ имеется постоянный обмен лабильными фосфатными группами, "уклеозидмоиофосфаткипазы переносят фосфатную гРуппировку с нуклеозидтрифосфатов на нуклеозидмо-н°фосфаты. Например,
АТФ + УМФ АДФ + УДФ.
Нуклеозиддифосф аткиназы осуществляют перефос-Форилирование между нуклеозидтри- и нуклеозидди-Фосфатами. Например,
АТФ + УДФ УТФ + АДФ.
50
51
Эти реакции обратимы. Однако практически в мышцах происходит постоянное образование АТФ. Поэтому АТФ является источником синтеза различных нуклеозид, ди- и нуклеозидтрифосфатов.
В заметных количествах АМФ и ИМФ появляются при усиленной активности мышц, сопровождающейся интенсивным распадом компонентов адениловой системы (АТФ, АДФ). Избыток АДФ превращается под воздействием аденилаткиназы: 2АДФ<±АТФ + АМФ.
ИМФ, как и АМФ, обладает сильным фармакологическим действием, поэтому ткань имеет биохимические механизмы быстрого обезвреживания их избытка.
АМФ под воздействием аденилдезаминазы переходит в ИМФ, а избыток ее распадается на гипоксантин, рибозу и фосфорную кислоту. Гипоксантин, окисляясь, переходит в ксантин, а затем в мочевую кислоту.
Кроме нуклеотидов, мышечная ткань содержит другие важнейшие органические фосфаты: с высокой энергией — энолпируват-2-фосфат, глицероилфосфат-3-фосфат, ацетилфосфат; с относительно низкой энергией — глюкозо-1-фосфат, фруктозо-1,6-дифосфат, глюкозо-6-фосфат, фруктозо-6-фосфат, глицерин-1-фосфат и др.
Небелковые и нелипидные органические фосфатные соединения очень хорошо растворяются в воде. Однако в водный экстракт наряду с этими соединениями переходят белки, мешающие их определению. Поэтому органические и неорганические фосфорные соединения ткани определяют в трихлоруксусном экстракте, не содержащем белков. Определяемый суммарный фосфор безбелкового фильтрата получил название кислоторастворимого фосфора. Фосфор отдельных органических фосфатов, например АТФ, КрФ и др., может быть определен после предварительного осаждения их из трихлоруксусного экстракта.
Суммарное содержание различных фракций фосфора свежей мышечной ткани характеризуется следующими данными (в мг% на сырую ткань).
Общий ....... 250—300
Белковый..........20—25
Фосфолипидов . . . 25—35
Кислоторастворимый До 200
Неорганический . . 40—50
КпФ ................50—55
АТФ и АДФ..........25—30
АМФ и ИМФ..........15—20
Гексозомонофосфатов . 30—40
Глицерофосфатов . . . 10—20
52
После убоя животного в мышечной ткани под воздействием ферментов органические фосфаты распадаются, поэтому уменьшается содержание фосфора органических фосфатов и увеличивается количество более простых азотистых продуктов и неорганического фосфата.
МИНЕРАЛЬНЫЕ ВЕЩЕСТВА
Минеральные вещества мышечной ткани входят в состав структурных элементов волокна и участвуют во многих процессах обмена между клетками и межклеточной жидкостью, используются при образовании буферных систем, среди которых важную роль играют бикарбонатная и фосфатная. Минеральные вещества влияют также на состояние внутриклеточных белков мышечной ткани: от них зависит растворимость и набухание белков.
Среди минеральных элементов мышечной ткани наиболее распространенными являются Na+, £+, Са2+, Mg2+. Они участвуют в поддержании осмотического давления и электролитического равновесия внутри и вне клетки. Натрий содержится главным образом во внеклеточной жидкости и связан с хлором и бикарбонатными ионами. Значительная доля К+ и Са2+ связана с белками. При изменении реакции среды в мышцах в процессе мышечного сокращения катионы освобождаются от такой связи.
Взаимодействие ионов К+, Mg2+ и Са2+ с актином, миозином, АТФ и биологическими активаторами служит в качестве контрольного механизма и системы уравновешивания в процессах сокращения и расслабления миофибрилл.
В небольшой концентрации магний активирует водорастворимую АТФ-азу, а при больших концентрациях может быть ингибитором этого фермента. Магний активирует также ряд ферментов обмена углеводов в мускулах: энолазу, декарбоксилазы кетокислот и др.
Кальций, кроме указанных выше функций, уменьшает проницаемость мембран клетки.
Среди других неорганических элементов специфическими функциями характеризуется марганец, цинк, никель, кобальт, ионы которых активируют мышечные пептидазы. Ионы меди необходимы для активации тирозиназы, оксидазы аскорбиновой кислоты и некоторых других ферментов.
53
После убоя животного меняется характер связывания неорганических ионов белками мышечной ткани и дру. гими органическими соединениями, в значительной мере они освобождаются от такой связи. Кроме того, в результате ферментного распада компонентов происходит накопление неорганических ионов, например ортофосфата и аммиака (не следует смешивать этот процесс с резким выделением аммиака в процессе микробного разложения ткани).
СОКРАЩЕНИЕ
И РАССЛАБЛЕНИЕ МЫШЦ
Мышечная деятельность животного является результатом многообразных химических процессов, протекающих при участии тканевых ферментов под контролем нервной и гуморальной систем. Наиболее важными и характерными для мышечной ткани являются процесс сокращения мышц, т. е. изменение физического состояния мышечных белков, обеспечивающий выполнение механической работы, и процесс расслабления мышц, характерный для спокойного состояния мышц. Мышечную ткань можно рассматривать как своеобразный сложный физиологический аппарат, в котором химическая энергия превращается в механическую.
На основании термодинамических расчетов и очень точных химических опытов (выявлялось, например, повышение температуры в мышцах всего на 0,000002°С) установлено, что живые организмы не могут превращать тепло, выделяемое в клетках при химических реакциях, в работу и что источником энергии для сокращения мышц является только химическая энергия.
Существующие гипотезы о механизме мышечного сокращения основываются на изменении свойств миозина и актина, связанные с расщеплением аденозинтрифос-форной кислоты (АТФ)
М + АТФ Н2О —> М + АДФ + Н3РО4 + энергия Миозин
При взаимодействии аденозинтрифосфата и миозина, проявляющего ферментную активность, большой запас энергии, накопленный в высокоэргических фосфатных связях этого нуклеотида (около 8000 кал на одну моле-
54
хулу отщепляемой Н3РО4), освобождается и используется при сокращении (рис. 8).
Деятельность мышечной ткани проявляется в двухфазном процессе, состоящем из периода сокращения (работа) и расслабления (покоя). Мышечное сокращение и расслабление осуществляется с помощью специального аппарата миофибрилл —
™ЕТ(а(™н“ни” даиявдвпй тей (см. с. 12 и рис. 7) в д б
результате последователь
ных и сопряженно протекающих реакций. По современным представлениям сокращение мышцы
Рис. 8. Сокращение отмытых мышечных волокон в присутствии АТФ:
а — до добавления АТФ; б — после добавления АТФ.
происходит в результате скольжения нитей актина в саркомере между нитями миозина (рис. 9).
На основании данных электронной микроскопии установлено, что скольжение нитей возникает при замыка
нии перемычек-мостиков между толстыми и тонкими нитями и изменения угла их наклона (рис. 10). В покойной мышце поперечные мостики находятся в перпендикулярном положении к толстым нитям ( они образованы загнутыми головками миозина) и не соединены с тонкими нитями (см. рис. 10, б). В состоянии сокращения изменяется угол наклона мостиков и они соединены с тонкими нитями. В результате замыкания мостиков и изменения угла их наклона развивается сила, вызывающая перемещение одних нитей относительно других (см. рис. 10, а).
В состоянии окоченения перемычки принимают особое состояние и как бы тормозят скольжение протофибрилл. С помощью фазово-контрастной микроскопии показано, что при укорочении мышц (см. рис. 9, б) пластинка Z смещается в направлении к диску А, в результате чего диск I сужается. При этом ширина диска А сохраняется. Причины, вызывающие скольжение протофибрилл, пока еще не ясны. Вместе с тем установлено, что переход протофибрилл из состояния покоя в сокращение обусловлено изменением свойств белковых структур под влиянием ряда факторов.
При покойном (эластическом) состоянии мышц миозин находится в комплексе с ионами, гликогеном и АТФ.
55
АТФ с помощью трех ионов Mg присоединен к участку молекулы миозина, отдаленному от его ферментного центра. При этом тропомиозин-тропониновый комплекс связывает Mg2+ АТФ-азу и тем самым ингибирует ее и препятствует взаимодействию миозина с актином.
Рис. 9. Передвижение нитей актина и миозина в процессе сокраще* ния. мышц:
а ~ электронная фотография; б — схема: / — зона Н открыта; 2—4 —тонкий нити перемещаются в диск A (Z — пластинка).
В состоянии мышечного покоя миозин не проявляет своего аденозинтрифосфатазного действия. Нахождение АТФ в комплексе с ферментом миозином является существенным обстоятельством. Только в присутствии связанного АТФ миозин находится в эластическом состоянии. Удаление АТФ из комплекса (например, путем от-
56
мывания) вызывает потерю эластичности у белка, так называемое явление окоченения в результате возникновения поперечных мостиков между нитями миозина и
актина.
В состоянии покоя все ионы Са миофибрилл связаны
в саркоплазматическом ретикулуме.
Переход мышц из состояния покоя к сокращению и вся полнота процесса обусловлена работой следующих четырех основных систем: элементов нервных окончаний, возбуждающих мышечное волокно; саркоплазм матической сети; окислительного аппарата; системы актомиозиновых нитей.
Рис. 10. Толстые (миозиновые) и тонкие (актиновые) нити:
Физико-химические и биохимические процессы, возникающие под влиянием нервного им-
а
пульса в сарколемме и саркоплазме, распространяются на белки миофибриллы, локализованные определенным образом, в саркомерах (см. с. 10). Здесь
а — в состоянии сокращения; б — в состоянии покоя; между ними перемычки в свободном (б) и замкнутом (а) состоянии.
под влиянием ионов и других веществ эти белки претер-
певают конформационные и иные превращения, сопровождающиеся проявлением ферментативной активности и
изменением структуры мышечного волокна —- его сокращением. Краткая схема развития основных реакций в процессе сокращения представлена на рис. 11.
В результате нервного импульса (см. с. 201) и изменения разности потенциалов происходит перераспределение ионов в волокне. Это вызывает выделение Са2+ из саркоплазматического ретикулума. Ион Са диффундирует внутрь волокна, вызывает сближение миозина с Ф-ак-тином, образование актомиозина и активирование мизи-новой Mg+2 АТФ-азы (см. с. 36).
Все эти превращения протекают почти одновременно. С выделения иона кальция (по Дэвису), насыщающего активные центры миозина, и начинается активация мышечного сокращения.
АТФ в этот момент попадает в сферу шарообразного Утолщения молекулы миозина (локализация ТММ) и
57
подвергается гидролитическому расщеплению. Однако при этом концевая фосфатная группа АТФ (как было показано в опытах с мечеными атомами) не освобождается а сохраняется вместе с запасом энергии на миозине, обра-
Рис. 11. Схема развития процесса мышечного сокращения и расслабления:
I — выделение Са2+, вызванное нервным импульсом; II — нейтрализация АТФ-комплекса и сближение миозина с актином; III — образование актомиозина и катализация активированными ионами Са актомиозином распада АТФ; IV — работа; V — диссоциация актомиозина в результате всасывания Сах+; VI — комплексообразование миозина с ресинтезированной молекулой АТФ;
VII— переход в расслабленное состояние.
зуя макроэргическую связь миозин ~ фосфат (промежуточное соединение — фосфорилированный миозин). Затем от фосфорилированного миозина, находящегося в комплексе с актином, отделяется неорганический фосфат, и освобождаемая при этом энергия используется на переме
58
щение актиновых протофибрилл по отношению к миозш вовым.
Во время этих процессов при взаимодействии миозина с ф-актином происходят конформационные превращения миозина из a-состояния (исходного — фосфорилированного АТФ) в p-состояние (в результате дифосфорилиро-Бания) и при этом изменяется ориентация поперечных тостиков и как результат — скольжение нитей.
В этом процессе активная роль принадлежит миозину, актин выполняет пассивную роль. Решающим обстоятельством в этих сложных преобразованиях является то, что ни миозин ни актин не обладает способностью проявлять Mg2+ АТФ-азную активность. Только соединение миозина с актином дает новую систему—активируемую Mg2+ АТФ-азу, которая и способна осуществлять процесс расщепления АТФ с одновременным перемещением протофибрилл. Следовательно, активным катализатором, обусловливающим мышечное сокращение, и является актомиозиновая АТФ-аза. Вслед за этим актомиозиновый комплекс распадается, миозин переходит вновь в состояние, характерное для расслабленной спокойной мышцы. Это происходит прежде всего потому, что выделение Са2+ прекращается и наступает обратное всасывание его в саркоплазматический ретикулум и сарколемму. Всасывание ионов Са сопровождается затратой энергии — 1 моль АТФ на каждый ион. Реализация энергии осуществляется специфической АТФ-азой, локализованной в стенках ретикулума и сарколеммы. После всасывания Са2+ наступает рефосфорилирование АДФ и АТФ с помощью окислительного аппарата волокна. АТФ вновь через магний присоединяется к миозину и процесс расщепления ингибируется.
Таким образом, в процессе сокращения и расслабления мышц огромную роль играет перемещение ионов Са2+, осуществляемое с помощью так называемого «кальциевого насоса» — локализованного в саркоплазматическом ретикулуме. В промежутках между импульсами Са2+ вновь связывается ретикулумом, который концентрирует кальций в количестве, в 808 тыс. раз большем, чем в окружающей среде. Следовательно, саркоплазматическая сеть выполняет двойную функцию — передает импульс в виде Са2+ для сокращения и вызывает расслабление миофибрилл.
59
Модельными опытами было подтверждено, что именно фрагменты саркоплазматического ретикулума и вызывают эффект расслабления.
Добавление АТФ также сопровождается расслаблением окоченевшей (сокращенной) мышцы, так как нуклеотид в форме Mg2+ АТФ играет роль пластифицирующего агента, предотвращая образование поперечных связей между миозином и актином.
В процессе мышечного сокращения при активации миозина большую роль играет система тропомиозин —-тропонин, взаимодействующая с тонкими филаментами актина. Тропонин и недавно открытый а-актинин и некоторые другие белки миофибрилл осуществляют своеобразную регуляцию и контроль процесса переноса Са2+ и сокращения мышц.
В процессе мышечной деятельности постоянно потребляется энергия аккумулированной АТФ, поэтому деятельность биохимического аппарата мышечных клеток направлена на пополнение ее запаса. Только благодаря постоянному ресинтезу содержание АТФ в мышцах поддерживается на определенном уровне. Основным источником, пополняющим расход АТФ в мышцах, являются процессы гликогенолиза и гликолиза. И поэтому, когда расслабление мышцы заканчивается, включаются эти реакции. В момент мышечного сокращения из комплекса с миозином освобождается гликоген.
В результате фосфоролиза при участии фосфорной кислоты, выделившейся из АТФ, гликоген быстро вовлекается в гиалоплазме в процесс анаэробной оксидации и участвует в образовании молочной кислоты и АТФ (рис. 12, поз. /). Путем последовательных превращений образуются продукты распада молекулы глюкозы (1,3-дифосфо-глицериновый альдегид, 2-фосфоглицериновая кислота), которые при дальнейшем окислении, преобразуя запас потенциальной энергии, становятся донаторами высокоэр-гических фосфатных групп, за счет которых в результате перфосфорилирования из АДФ образуется АТФ:
RxR + АДФ -» АТФ + R—ОН.
Другим очень важным источником получения запаса АТФ является аэробное окисление молочной кислоты, накопившейся в результате гликолиза. Она стимулирует процесс дыхания, вызывает усиленный приток к мышцам
60
,фови, а следовательно, й кислорода, что создает условия для окисления лактата.
Молочная или пировиноградная кислота (от 1/6 до 1/3 ее количества) окисляется по аэробному циклу (рис. 12, иоз. 2). Значительная часть выделенной энергии в результате процессов фосфорилирования используется для ресинтеза АТФ и креатинфосфата.
При дыхании в процессе аэробного окисления молочной кислоты в мышцах выделяется некоторое количество тепла. Большая часть молочной кислоты, образовавшей-
Рис. 12. Схема пополнения запаса АТФ при работе мышц:
1 — гликогенолиз; 2 — цикл трикарбоновых кислот; 3 — перенос при участии креатинкиназы; 4 — перефосфолирование
ся в мышцах, окисляется не в их ткани, а транспортиру-ется кровью в печень, где частично подвергается аэробному окислению. При этом основное количество лактата используется в печени на ресинтез гликогена.
В результате полного аэробного окисления молекулы глюкозы аккумулируется около 38 высокоэргических фосфатных связей, которые используются для ресинтеза АТф. Из 686 ккал энергии солнечного света, поглощенных при фотосинтезе гексозы, животный организм в процессе аэробного окисления потребляет на образование подвижной энергии фосфатных связей около 456 ккал, т. е. 67%. Остальная энергия выделяется в виде тепла и тоже используется организмом.
При работе изолированной мышцы в атмосфере азота вся химическая энергия тратится только во время работы. После прекращения ее энергия не расходуется. Но если мышцу сразу же поместить в атмосферу кислорода, то температура ее повысится, причем также затратится
61
Некоторое количество энергий. Следовательно, при аэробном окислении, которое может протекать как во время работы, так и по окончании ее, окисление химических соединений частично сопровождается выделением тепла. Однако это является результатом последующих химических реакций, не связанных с актом сокращения.
Третьим процессом, обеспечивающим систему энергией в фазах сокращения, является перенос энергии с креатинфосфата (Крф) на АДФ с образованием АТФ и креатина (Кр) (рис. 12, поз. <?) при участии фермента креа-тинкиназы по следующей реакции:
АДФ + КрФ дг АТФ + Кр.
В молекуле креатинфосфата, как и АТФ, имеется вы-сокоэргическая фосфатная связь. Этот запас энергии вместе с фосфатом переносится на АДФ в условиях усиленного распада АТФ. Следовательно, креатинфосфат является своего рода аккумулятором энергии. Поэтому при выключении гликогенолиза и гликолиза креатинфосфат оказывается единственным источником пополнения расхода АТФ. Сам же креатинфосфат непосредственного участия в механизме мышечного сокращения не принимает. Синтез креатинфосфата осуществляется в результате аэробного процесса окисления углеводов, при котором происходит ресинтез не только АТФ и гликогена, но и креатинфосфата. Вследствие этого содержание креатинфосфата в мышцах увеличивается по мере повышения их работоспособности — тренировки.
Наконец, в мышцах имеется еще один возможный путь (четвертый) образования АТФ за счет превращения двух молекул АДФ в одну молекулу АТФ и АМФ при участии биокатализатора — фермента аденилаткиназы. Этот фермент встречается не только в мышцах, откуда он был впервые выделен (см. рис. 12, поз. 4), но и в других тканях:
Аденилаткиназа
2АДФ-----------> АТФ 4- АМФ.
Адениловая кислота (АМФ) является сильнодействующим веществом. Она обезвреживается путем дезаминирования (выше было указано, что дезаминазное каталитическое действие проявляет особый фермент, связанный с миозином) с выделением аммиака и образованием ино-62
зиновой кислоты. Инозиновая кислота не используется организмом для ресинтеза АТФ и подвергается дальнейшему гидролитическому расщеплению. Почти все процессы, направленные на ресинтез АТФ, относятся к окислительным, связанным с тканевым дыханием. АТФ образуется в результате переноса энергии на АДФ с веществ, образовавшихся в итоге окислительных превращений. Наиболее важным источником энергии для мышечного сокращения являются анаэробные и аэробные превращения гликогена.
Для ресинтеза АТФ в процессе аэробного окисления, кроме молочной и пировиноградной кислот, частично могут быть использованы продукты окислительного распада жиров и белков, вовлекаемые в цикл Кребса.
Скорость окислительных превращений углеводов в мышцах в определенной мере зависит от содержания карнозина, ансерина, витаминов. Витамины РР, С и В] в известных концентрациях активируют или ингибируют процесс гликолиза. Например, аскорбиновая кислота ускоряет окислительные превращения одного из промежуточных продуктов гликогенолиза и гликолиза гексозодифосфата. Тиамин входит в состав кофермента карбоксилазы, катализирующей распад пировиноградной кислоты, которая образуется в процессе гликолиза. Ниацин, соединяясь с рибозой и нуклеотидом, образует кодегидро-геназу — переносчик протонов в процессе анаэробного и аэробного окисления углеводов.
Биохимические превращения, совершающиеся в мышечной ткани в связи с процессом мышечного сокращения, происходят в структурных элементах клетки в следующей последовательности. Аппарат миофибрилл непосредственно выполняет акт мышечного сокращения. В других системах, сосредоточенных в митохондриях, саркоплазме, протекает ряд сложных биохимических превращений, связанных в основном с процессами окисления, переносом энергии, синтезом веществ (АТФ, КрФ), необходимых для осуществления акта сокращения.
В мышечной ткани, помимо процессов, связанных с осуществлением физиологического акта сокращения, протекают сложные биохимические превращения, постоянный обмен веществ, направленные на обновление структур клеток (биосинтез белков), а также другие жизненные явления. ;
63
АВТОЛИТИЧЕСКИЕ
ПРЕВРАЩЕНИЯ МЫШЦ
Автолитическими процессами называются процессы распада компонентов тканей под влиянием находящихся в них ферментов. Автолиз (греч. autos — сам и lysis — растворение) начинается в тканях животного сразу же после его убоя.
В соответствии с особенностями метаболизма, концентрацией и локализацией ферментов в мышечной ткани протекают специфические автолитические превращения. В начальный период происходят в основном автолитические превращения, связанные с теми системами, которые относятся к функциям движения: интенсивный распад углеводов, АТФ, резкие изменения сократительного аппарата. В этот же период автолиза для белков характерны конформационные изменения, стимулирующие агрегационные взаимодействия. В дальнейшем преобладающими постепенно становятся изменения, связанные с гидролитическим распадом. В зависимости от состава ткани, концентрации гидролаз, степень деструктивных превращений компонентов для разных видов мышечной ткани неодинакова.
ПРЕВРАЩЕНИЯ ГЛИКОГЕНА
Автолитические превращения гликогена связаны с его фосфорилитическим распадом и дальнейшим процессом анаэробного гликолиза, который приводит к накоплению в мышцах большого количества молочной кислоты и заметного количества пировиноградной кислоты (рис. 13). Наряду с этим в мышечной ткани накапливаются и другие продукты гликолитических превращений, в частности, глюкозо-1-фосфат и глюкозо-6-фосфат (ре-дуцйрующие углеводы).
Таким образом, посмертный гликогенолиз в отличие от прижизненного характеризуется повышенным содержанием различных промежуточных продуктов гликолитического распада. Накопление молочной и пировиноградной кислот обусловливает подкисление мышечной ткани.
64
Интенсивность гликолитических превращений в автолизирующей мышечной ткани различных видов животных определяется предубойным состоянием животного, функциональными особенностями соответствующих мышц и находится в зависимости от концентрации ферментов
проВолжитемнот, ч
Рис. 13. Накопление кислот при автолизе (4°С) дорзальных мышц крупного рогатого скота:
/ — пировиноградной; 2 — молочной; 3 — коэффициент К (соотношение содержания молочной и пировиноградной кислот).
гликолиза и содержания гликогена. В зависимости от функциональных особенностей разные мышцы одного и того же животного характеризуются разной интенсивностью гликолитических превращений. Так, интенсивность гликолитических превращений в белых мышцах примерно в 2 раза выше, чем в красных.
3—454
65
В процессе хранения мышц наряду с гликолитически-ми превращениями мышечный гликоген под воздействц. ем гликозидаз подвергается и гидролитическому распаду с накоплением редуцирующих углеводов: линейных й разветвленных олигоглюкозидов и глюкозы (рис. 14). Многие из этих веществ являются редуцирующими углеводами. Гидролитический распад гликогена в автолизирующих мышцах отличается специфичностью. В первый период интенсивность его сравнительно невелика, а в дальнейшем гидролитический распад гликогена резко повышается. Это объясняется тем, что в мышечных во-
Рис. 14. Накопление редуцирующих сахаров при распаде гликогена в процессе автолиза (4°С) дорзальных мышц крупного рогатого скота.
локнах имеется два ферментативных механизма гидролитического расщепления гликогена: а-амилаза и нейтральные олигоглюкозидазы (1,4-глюкантрансфераза и амило-1,6-глюкозидаза, содержащиеся в матриксе саркоплазмы), которые постоянно участвуют в гидролизе гликогена; у-амилаза и кислые олигоглюкозидазы находятся в лизосомах, выход из которых и обусловливает повышение интенсивности гидролиза гликогена.
Схема распада гликогена в автолизирующих мышцах приведена на с. 67.
66
3* а
Разные условия хранения и обработки мышц характеризуются различным соотношением гликолитических и гидролитических превращений гликогена. В течение первого периода хранения мышц при низких положительных температурах обычно преобладает гликолитический распад мышечного гликогена. Однако в условиях, тормозящих гликолитический распад (посол, замораживание) и способствующих разрушению лизосом, а следовательно, и выходу кислой у-амилазы и кислых олигоглюкозидаз, гидролитический распад гликогена может преобладать над гликолитическим.
Превращения гликогена в автолизирующей мышечной ткани являются первоначальным и своего рода запускающим приспособлением других биохимических превращений, а также основным фоном, на котором протекают все автолитические превращения различных субстратов. Подкисление ткани способствует выходу гидролаз из ограничивающих структур (лизосом) и проявлению значительной их активности.
ПРЕВРАЩЕНИЯ МОНОНУКЛЕОТИДОВ
В автолизирующих мышцах под каталитическим воздействием миозиновой (оптимум pH 6,5) и растворимых АТФ-аз происходит распад АТФ. Наряду с этим АТФ, как и другие нуклеозидтрифосфаты, расходуется в различных биохимических превращениях. Параллельно с этим в начальных стадиях автолиза мышц вследствие интенсивно протекающих гликолитических реакций образуется АТФ. Таким образом, определяемое содержание АТФ в автолизирующих мышцах характеризует суммарный результат двух процессов — распада и ресинтеза.
Исследования показали, что уровень содержания АТФ на отдельных этапах автолиза разных мышц в значительной ^степени зависит от предубойного состояния животного и их функциональных особенностей, определяющих начальное содержание АТФ и гликогена, а также от интенсивности гликолитических превращений, в ходе которых ресинтезируется этот нуклеозидтрифосфат. Наряду с этим уровень содержания АТФ зависит от величины активности миозиновой АТФ-азы.
Главным источником пополнения АТФ в процессе автолиза мышц является гликолитический распад гликоге-
68
ла, а также глюкозы, образующейся в результате гидролитического распада этого полисахарида. Наряду с этим перенос фосфорильного остатка от креатининфосфата (КрФ) на АДФ является одной из реакций, пополняющих АТФ, описанной выше (см. с. 62). В автолизирующих мышцах по мере нарушения равновесия между распадом й ресинтезом АТФ заметно проявляется указанная реакция, выявляемая по распаду креатинфосфата.
Второй вспомогательной реакцией, в ходе которой пополняется запас АТФ, является аденилаткиназная реакция (см. с. 62).
При хранении мышц аденилаткиназная реакция устраняет избыток АДФ и в отличие от креатинфосфокиназной реакции является источником пополнения АТФ в течение длительного периода. АМФ или адениловая кислота подвергается гидролитическому дезаминированию с образованием инозиновой кислоты (ИМФ) и аммиака.
В процессе хранения мышц распад нуклеозидтрифосфатов преобладает над ресинтезом: резко уменьшается содержание АТФ и почти полностью исчезает ГТФ и УТФ. Происходит значительное уменьшение содержания АДФ и других дифосфорилированных нуклеотидов, в результате чего повышается содержание АМФ и особенно ИМФ. В меньших количествах накапливаются УМФ и ГМФ. Вместе с этим постепенно выявляется распад и монофос-форилированных нуклеотидов.
Последовательный распад АТФ в автолизирующей мышечной ткани может быть представлен в виде следующей схемы:
АТФ------► АДФ-----> АМФ----► Инозиновая
кислота--► Инозин > Гипоксантин + H3PO4-f-NH3
Пентоза
Подобным превращениям подвергаются и другие ну-клеозидтрифосфаты.
Таким образом, в результате полного распада свободах нуклеотидов в автолизирующих мышцах, кроме неорганического фосфата и аммиака, накапливается некоторое количество свободных пуриновых и пиримидино-вых оснований и рибозы. Вместе с тем не все мононуклеотиды подвергаются распаду, а поэтому и после длительно
69
го хранения автолизирующая мышечная ткань содержит какое-то количество АТФ, АДФ и в больших количествах монофосфорные нуклеотиды.
МЫШЕЧНОЕ ОКОЧЕНЕНИЕ И ЕГО РАЗРЕШЕНИЕ
Через некоторое время после убоя животного в мышечной ткани развивается так называемое мышечное окоченение (rigor mortis). Нежные, гладкие и растяжимые мышечные волокна в процессе окоченения становятся твердыми, плохо растяжимыми и непрозрачными.
Развитие посмертного окоченения мышечной ткани, в начальных этапах сходного с сокращением мышц, заключается в изменении миофибрилл — в нарастающем уменьшении длины и увеличении толщины саркомеров. Уменьшение длины саркомеров в процессе окоченения происходит в основном за счет резкого уменьшения длины /-дисков. При полном развитии окоченения /-диски сильно сужаются или совсем не проявляются.
Наряду с этим в отличие от прижизненного сокращения в процессе окоченения длина A-диска также заметно уменьшается.
Различные стадии окоченения отличаются глубокими изменениями структур белков актомиозинового комплекса. В процессе окоченения реактивность сульфгидрильных и дисульфидных групп в этих белках уменьшается и достигает минимума при наибольшем развитии окоченения (рис. 15).
Исследования показали, что начальные стадии окоченения резко зависят от уровня содержания АТФ. Чем быстрее он уменьшается, тем скорее наступает и окоченение. Как известно, в прижизненных условиях распространение по плазматической мембране потенциала действия вызывает приток ионов Са2+, которые способствуют сокращению. Во время фазы расслабления ионы Са2+ вновь возвращаются к соответствующим местам связывания. В начальных стадиях автолиза значительная часть ионов Са2+ переходит из связанного состояния в свободное. Накопление свободных ионов является результатом структурных изменений белков матрикса саркоплазмы и эндоплазматического ретикулума. Взаимодействие ионов Са2* с бел-
70
л1и миофибрилл приводит к изменению их фермента' 0Вцой активности. Опыты показали, что извлеченные миозин и актомиозин в начальный период автолиза обладают повышенной ферментативной активностью. Таким образом, уже в начальных стадиях автолиза создаются условия для гидролиза АТФ, сокращения миофибрилл и последующего возникновения новых внутри- и межмоле-кулярных связей.
Рис. 15. Реактивность SH-групп актомиозина с белых 1 и красных 2 мышц кур в процессах окоченения и расслабления.
В процессе развития окоченения конформационные изменения контрактильных белков, а также сильная агрегация этих белков обеспечивают дальнейшее уменьшение Длины и увеличение диаметра саркомеров. Первопричиной этих процессов могут быть не только изменения, вызы-ваемые воздействием АТФ, но также и сдвиги, возникающие вследствие воздействия продуктов автолиза небелковой природы (подкисление), дегидратация и другие Факторы, изменяющие конформацию и перераспределе-нИе зарядов миофибриллярных белков.
Интенсивность окоченения в мышцах разных видов Животных неодинакова и определяется особенностями
7.1
конформационных изменений контрактильных белков, характером межмолекулярного взаимодействия, зависящего от целого ряда причин: концентрации АТФ, степени подкисления, интенсивности накопления продуктов авто-лиза небелковой природы и в большой степени — от особенностей строения сократительного аппарата.
При окоченении мышц выявляется неравномерность перехода отдельных волокон в сокращенное состояние, что, вероятно, зависит от разной локализации продолжающегося синтеза АТФ и степени подкисления. В мышечных волокнах, имеющих значительное количество кислородсодержащих резервов, в начальных стадиях автолиза аэробный механизм некоторое время продолжает обеспечивать накопление АТФ и передачу его на сократительный аппарат. Это обусловливается также характерной локализацией митохондрий, которые находятся в контакте с контрактильными участками миофибрилл. В дальнейшем уже в анаэробных условиях основным поставщиком АТФ становятся гликолитические превращения, локализация ферментов которых может быть различной, что в значительной мере и обусловливает неравномерность перехода отдельных волокон в сокращенное состояние.
В процессе последующего разрешения окоченения увеличение длины саркомеров вызвано в основном увеличением длины изотропных дисков. Саркомеры миофибрилл удлиняются до первоначальной величины или больше и уменьшаются в диаметре, особенно в области /-дисков, прилегающей к Z-мембране.
Разрешение окоченения в процессе автолиза мышц сопровождается специфическими конформационными изменениями миофибриллярных белков. В этот период ослабляются агрегационные взаимодействия, по-видимому, за счет перераспределения энергии (зарядов) в белках миофибрилл. При разрешении окоченения повышается экстрагируемость белков, реактивность тиоловых групп в белках актомиозинового комплекса и всех кислых и основных групп в белках мышц. Повышение реактивности (общей доступности) различных химических групп миофибриллярных белков в процессе разрешения окоченения в определенной мере обусловлено и протеолитической деструкцией.
72
ПРЕВРАЩЕНИЕ ЛИПИДОВ
При автолизе мышечной ткани происходят гидролитические, а также окислительные превращения липидов. Липиды под действием соответствующих ферментов гидролизуются, вследствие чего увеличивается количество свободных жирных кислот и других продуктов распада. В результате гидролитических превращений триглицеридов накапливаются продукты начальной ступени гидролиза — диглицериды, а затем продукты второй ступени гидролиза — моноглицериды. Автолитический распад глицеро-фосфатидов обусловливает накопление лизофосфатидов и только на глубоких стадиях — глицерина, азотистых оснований и других составляющих.
При длительном хранении автолизирующей мышечной ткани в ней накапливаются перекиси — первичные продукты окислительных превращений липидов, из которых образуются альдегиды, кетоны, низкомолекулярные жирные кислоты и другие продукты. При этом в первую очередь окисляются высоконенасыщенные жирные кислоты глицерофосфатидов. Первичными катализаторами окислительных превращений липидов являются гемпротеиды, к числу которых относятся миоглобин, геминовые ферменты (каталаза, пероксидаза и др.).
ФИЗИКО-ХИМИЧЕСКИЕ ИЗМЕНЕНИЯ МЫШЕЧНОЙ ТКАНИ ПРИ АВТОЛИЗЕ
В результате интенсивного накопления кислых продуктов в начальных стадиях автолиза происходит насыщение буферных систем мышечной ткани. Значительное накопление фосфорной, молочной, пировиноградной кислот является причиной почти полного разрушения бикарбонат-ного буфера и выделения углекислоты уже в первые часы после убоя животного. Наиболее важным является буферное действие белков. Однако интенсивное накопление кислот приводит к сдвигу pH в кислую зону сначала до 6,2—6,0, а затем до 5,8 и 5,6.
Характерное изменение свободной кислотности мышечной ткани в значительной мере обусловлено особенностями изменений белков. Так, в период мышечного окоченения уменьшение буферной способности белков является следствием уплотнения их структур и результатом
73
интенсивных агрегационных взаимодействий. При разрешении окоченения и протеолитической деструкции проявляется более высокое связывание белками водородных ионов и убыль их в среде (повышение pH). Этому же спо-собствует (повышает буферную способность) накопление веществ небелковой природы (продуктов автолиза).
В автолизирующих мышцах накапливающиеся активные кислоты вытесняют катионы из различных комплексов, в которых они были связаны при жизни животного. Воздействие электролитов и автолитический распад липопротеидов приводят к нарушению целостности внутриклеточных и клеточных мембран, что обусловливает перераспределение ионов и жидкости. Некоторое количество ионов калия диффундирует из клеток во внеклеточную жидкость, а ионы натрия, наоборот, поступают из внеклеточной жидкости в клетки. Другие катионы, как и анионы, свободно диффундируют через клеточную мембрану, вследствие чего pH клеток и внеклеточной жидкости выравнивается.
В результате перераспределения катионов и анионов изменяются физико-химические свойства белков, что является одной из причин изменения их растворимости и гидратации, изменяется активность ферментов.
ИЗМЕНЕНИЕ РАСТВОРИМОСТИ БЕЛКОВ
В начальных стадиях автолиза мышечной ткани происходит уменьшение растворимости мышечных белков, а затем после достижения определенного минимума повышение их экстрагируемости. В этот период автолиза мышц млекопитающих и птиц для всех белков характерны связанные с изменением зарядов конформационные сдвиги, стимулирующие агрегационные взаимодействия белков. Характер этих изменений для однотипных белков разных мышц неодинаков и соответствует интенсивности накопления кислот (продуктов автолиза небелковой природы). Поэтому и извлекаемость однотипных белков разных мышц при одинаковых условиях автолиза различна.
Белки саркоплазмы. В начальный период автолиза наибольшее снижение экстрагируемости белков саркоплазмы выявляется у мышц, в которых интенсивно происходит накопление продуктов автолиза небелковой при
74
роды (фосфорной, молочной, пировиноградной, кетокис-дот и др.). Действие этих продуктов обусловливает изменения, способствующие большому межмолекулярному рзаимодействию белков (рис. 16). Взаимодействие белко-рых частиц в этот период, по-видимому, осуществляется в основном за счет электростатических сил, так как извлечение белков саркоплазмы буферными растворами физиологической концентрации с высокой диэлектрической постоянной повышает их экстрагируемость.
Рис. 16. Суммарная экстрагируемость белков саркоплазмы при автолизе (4° С) мышц:
/ —' крупного рогатого скота; 2,3 — соответственно белых и красных мышц кур.
Извлекаемость разных фракций белков саркоплазмы при автолизе уменьшается неодинаково. Наиболее заметно уменьшается экстрагируемость белков фракций глобулина X (рис. 17, фракция II) и миоальбуминов (рис. 17, Фракция /). Свойства белков миогеновой группы (рис. 17, фракции III, IV и IV д) изменяются меньше. У этих белков хорошо сохраняется растворимость и ферментативная активность. У высокомолекулярных белков (фракция V) Изменения незначительны.
После достижения минимума (по времени для различных видов мышц неодинаково) в зависимости от интенсивности прошедших агрегационных взаимодействий и Особенно величины протеолитической активности экстрагируемость и электрофоретическая подвижность белков Саркоплазмы увеличиваются. :
75
Рис. 17. Изменения экстрагируе-мости фракций (7—V) белков саркоплазмы:
1 — дорзальных мышц крупного рогатого скота; 2, 3 — соответственно белых и красных мышц кур (IV д —дополнительная фракция миогеновой группы белков).
Белки миофибрилл.
В начальных стадиях автолиза мышц уменьшается растворимость миозина в результате образования менее растворимого комплекса актомиозина. Актин довольно прочно удерживается в структуре мио-фибрилл, поэтому и связанный с ним миозин не извлекается без воздействия веществ, деполимеризующих актомиозиновый комплекс. Уменьшение экстрагируемости миозина в автолизирующих мышцах в этот период происходит за счет снижения концентрации АТФ (добавление к измельченным мышцам АТФ или пирофосфата восстанавливает растворимость миозина) .
В процессе окоченения белки миофибрилл претерпевают конформационные изменения, способствующие интенсивным агрегационным взаимодействиям. Понижение экстрагируемое™ миофибрйл-лярных белков продолжается до определенного периода. Например, в мышцах крупного рогатого скота до 24—48 ч автолиза, а для мышц птиц этот срок значительно меньше. Затем происходит повышение их растворимости за счет как диссоциации
76
актомиозинового комплекса, так и ослабления агрегационных взаимодействий вследствие перераспределения зарядов. Одной из причин повышения экстрагируемости является также ограниченная протеолитическая деструкция миофибриллярных белков.
ИЗМЕНЕНИЕ ВОДОСВЯЗЫВАЮЩЕЙ
СПОСОБНОСТИ МЫШЕЧНОЙ ТКАНИ
Непосредственно после убоя животного мышечная ткань характеризуется высокой способностью к гидратации. В первый период автолиза водосвязывающая способность у разных видов мышц весьма специфично уменьшается:
интенсивность уменьшения водосвязывающей qo
способности и сроки наступления минимума, а затем последующего нарастания резко различны (рис. 18). В мышцах с глубоким и длительным окоченением наблюдается также длительное и интенсивное уменьшение водосвязывающей способности. Интенсивность уменьшения водосвязывающей способности согласуется с особенностями изменений миофибриллярных белков, а также особенностями их агрегационных взаимодействий. Выявляется определенный параллелизм между Уменьшением водосвязывающей способности мышц и уменьшением ре-
2д\-----1----1 1——1—1----1-----1-L—1—1
О I 4 6 810 20 40 0080
Продолжительность [1g о], ч
Рис. 18. Водоудерживающая способность при хранении (4° С) мышц:
/ — дорзальных мышц крупного рога-того скота; 2, 3 — соответственно белых и красных мышц кур.
активности гидрофиль-
ных — кислых и основных — групп в белках мышц, в частности, также реактивности сульфгидрильных групп в Миозине.
Наряду с миофибриллярными белками существенное
Вдияние на водосвязывающую способность мышечной
77
ткани оказывает характер изменений и остальных белков мышечной ткани. В начальных стадиях автолиза в ре. зультате подкисления большая часть белков мышечной ткани переходит в изоэлектрическое состояние, что способствует лучшей агрегации белков и уменьшению гид-ратационной способности. Поэтому как повышение, так и понижение pH среды от изоэлектрического состояния белков (pH 5,5) приводит к повышению гидратации мышц.
С началом разрешения окоченения происходит постепенное повышение водосвязывающей способности мышц. При повышении водосвязывающей способности четко выявляется повышение активности гидрофильных групп в белках мышц, «разрыхление» белковых структур. При этом активность свободных кислотных групп в белках мышц выявляется в большей степени, чем основных. Это объясняется тем, что белки мышц содержат больше дикарбоновых аминокислот (глютаминовой и аспарагиновой) , чем диаминокислот (лизин и аргинин).
Таким образом, белки мышц являются главными связывающими воду соединениями и в первую очередь от их состояния, изменения их структуры и состояния гидрофильных групп зависит водосвязывающая способность мышечной ткани.
ИЗМЕНЕНИЕ АКТИВНОСТИ
ФЕРМЕНТОВ
В процессе автолиза мышечной ткани характер автолитических превращений меняется во времени, изменяется соотношение скоростей биохимических реакций. Выход ферментов из структур при автолизе мышечной ткани повышает объем ферментативных превращений. В полифер-ментных системах реакции легко протекают и тогда, когда ферменты отделены друг от друга, а доступ к ним осуществляется путем свободной диффузии.
В начальных стадиях автолиза наиболее активными оказались ферменты гликолитической системы, а-амила-за, а-олигоглюкозидазы, миозиновая АТФ-аза; активны ряд оксидоредуктаз — сукцинатдегидрогеназа, цитохро-моксйдаза и др.
По мере накопления продуктов автолиза небелковой природы и подкисления в клетках мышечной ткани происходят распад липопротеидных оболочек лизосом, вы
78
сВобождение катепсинов, гликозидаз, кислой фосфатазы, рибонуклеазы и дезоксирибонуклеазы и других гидролитических ферментов, а также их активация. Почти все эти ферменты наиболее эффективны в слабокислой среде и поэтому известны под общим названием кислых гидролаз.
Активными оказались и ферменты, связанные с митохондриями. По мере разрушения в процессе автолиза этих органелл и выхода ферментов активность их проявлялась в достаточной степени. Так, значительную активность проявили аминоферазы и декарбоксилазы целого ряда аминокислот.
Однако в дальнейшем по мере развития автолитических превращений в результате накопления продуктов автолиза, высвобождения и перераспределения анионов и катионов и взаимодействия их с ферментами происходит снижение активности многих энзимов. Это является результатом химических взаимодействий с отдельными функциональными группами активного центра фермента, специфического взаимодействия с отдельными участками апофермента, неспецифической адсорбции на поверхности белка, а также взаимодействия с-теми группами, которые поддерживают специфическую конформацию молекулы белка — фермента. Кроме того, для многих ферментов, в том числе и для миозиновой АТФ-азы, потеря активности может быть и следствием протеолитической деструкции самого фермента.
ПРОТЕОЛИТИЧЕСКИЕ ПРЕВРАЩЕНИЯ
В соответствии с особенностями метаболизма разные виды мышечной ткани отличаются различной концентрацией катепсинов. Наряду с этим в соответствии с функциональными особенностями разные мышцы одного и того же Животного также отличаются различной концентрацией этих ферментов. Как указывалось ранее, катепсины заключены в лизосомы. В начальных стадиях автолиза номере распада одинарной липопротеидной оболочки лизосом катепсины выходят из ограничивающих их структур в Цитоплазму, в результате чего и происходит нарастание свободной протеолитической активности. Возможно, в силу различных способов ограничения начальная свободная активность, степень нарастания протеолитической актив
79
ности у разных видов автолизирующих мышц неодинако вы. У мышц с высоким прижизненным метаболизмом в начальных стадиях автолиза протеолитическая актив. ность нарастает быстрее, что и обусловливает соответст-вующие интенсивные протеолитические превращения.
Высвобождение катепсинов и проявление их активности находятся в прямой связи с течением гликолитических и других автолитических превращений компонентов небелковой природы, связанных с накоплением электролитов. Развитие этих процессов способствует разрушению липопротеидной оболочки лизосом. Кроме того, подкисление ткани является также важнейшим фактором для стимуляции действия катепсинов, нарушающих целостность оболочки лизосом изнутри.
Однако длительное воздействие электролитов приводит к снижению протеолитической активности. Опыты по введению в измельченную мышечную ткань хлористого натрия показали инактивацию катепсинов в этих условиях. Вместе с тем воздействие указанных факторов является неравномерным, поэтому автолизирующая мышечная ткань на различных сроках автолиза обладает определенной остаточной (и для многих видов мышц — значительной) протеолитической активностью. Величина остаточной протеолитической активности находится в прямой зависимости от концентрации катепсинов и в значительной мере в обратной зависимости от количества накопившихся продуктов автолиза небелковой природы.
Ограниченному протеолизу в соответствии с локализацией в первую очередь подвергаются белки саркоплазмы под воздействием высвобождающихся тканевых эндопептидаз. Это приводит к возникновению в белках N-конце-вых и С-концевых остатков аминокислот, некоторой деструкции белковых макромолекул. Такие превращения обусловливают повышение общей растворимости и электрофоретической подвижности белков саркоплазмы. С увеличением продолжительности автолиза электрофоретическая картина в целом изменяется, появляются группы модифицированных белковых фракций, подвижности которых варьируют с небольшой дисперсией.
Миофибридлярные белки также подвергаются ограниченной протеолитической деструкции. В белках фракции миозина накапливаются N-концевые группы аминокислот. Среди N-концевых остатков большинство составляют
80
^{отаминовая и аспарагиновая кислоты, лейцин, в меньшем количестве выявляются серин, треонин, тирозин и ва-лйн. В результате такого ограниченного протеолиза мио-лцбриллярные белки становятся более растворимыми, пОвь1шается доступность их сульфгидрильных, дисульфидных и других химических групп.
В результате ограниченного протеолиза всех белков повышается реактивность кислых и основных групп в белках мышц, водосвязывающая способность, пластичность и нежность мышц.
Накопление в процессе автолиза относительно значительных количеств свободных аминокислот по сравнению с исходным их содержанием свидетельствует о проявлении наряду с эндопептидазами также достаточной активности различных тканевых экзопептидаз, атакующих концевые пептидные связи, а также трипептидаз и дипептидаз. Преимущественное накопление в процессе автолиза * мышц а-аланина, глицина, глютаминовой кислоты, валина, фенилаланина, тирозина, треонина, лейцина и изолейцина отражает специфическое совместное воздействие на белки и пептиды тканевых эндопептидаз и экзопептидаз.
Накопление 0-аланина является также следствием ферментативного гидролиза специфических дипептидов. Наряду с этим в автолизирующей мышечной ткани накапливается орнитин. Начальное содержание этой аминокислоты невелико. Однако в процессе автолиза мышц происходит рост ее содержания, который, очевидно, связан с распадом аргинина, поскольку одновременно происходит и накопление мочевины.
В процессе автолиза мышц наряду с накоплением многие аминокислоты подвергаются различным превращениям. Такие аминокислоты, как гистидин, тирозин, глютаминовая кислота, триптофан, заметно декарбоксилируются. То же наблюдается для 5-окситриптофана и цистеиновой кислоты — продуктов обмена триптофана и цистеина. В результате этого автолизированные мышцы содержат заметное количество циклических аминов (в порядке возрастания): гистамина, тирамина, триптамина. Накапливается в больших количествах таурин. Накопление аминов при стерильном автолизе мышц является не только следствием декарбоксилирования аминокислот, но и результатом торможения окислительного дезаминирования 4—454 81
аминов, поскольку отсутствует поступление кислорода g клетки мышц.
В процессе автолиза мышц происходит сравнительно небольшой объем переаминирования аминокислот и накопление их кетоаналогов. К числу аминокислот, заметно вступающих в реакции переаминирования, относятся: а-аланин, глютаминовая и аспарагиновая кислоты.
Наибольшим количественным превращениям в процессе автолиза мышц подвергается глютаминовая кислота. Помимо декарбоксилирования и участия в процессах переаминирования, значительная часть глютаминовой кислоты, по-видимому, расходуется в реакциях биохимического связывания аммиака и образования ее амида — глютамина.
ИЗМЕНЕНИЯ УЛЬТРАСТРУКТУР
В ПРОЦЕССЕ АВТОЛИЗА
Автолиз мышц сопровождается изменениями структур органелл, миофибрилл, саркоплазматического ретикулума, сарколеммы и других образований мышечного волокна. На начальных стадиях автолиза начинает изменяться форма частиц гликогена в мышечном волокне. К 12 ч при низких положительных температурах резко уменьшается содержание гликогена, а к исходу 24 ч гистохимически гликоген уже не обнаруживается.
К концу первых суток автолиза при низких положительных температурах выявляется деструкция саркоплазматического ретикулума, изменяется форма митохондрий, отмечается развитие липофанероза в миофибриллах — отщепление и диссоциация липопротеидных комплексов с выходом их в область Z-пластинок, изменяется хроматин ядер, происходит отслоение сарколеммы с деструкцией ее плазмолеммы. В дальнейшем в связи с более интенсивным выходом гидролаз из ограничивающих структур указанные изменения становятся более выраженными. Кроме того, отчетливо выявляются расщепление миозиновых протофибрилл, локальные деструкции миофибрилл, деструкция митохондриальных крист, хроматина ядер.
При длительном автолизе в зависимости от степени деструктивных изменений мышечные волокна теряют способность сокращаться при добавлении АТФ. По уменьше-82
рию контр акционной способности можно судить о степени деструктивных изменений миофибриллярной структуры. Добавление АТФ к автолизированным мышечным волокнам вызывает растворение разрушенных микроструктур, после чего остается только «остов» миофибриллярных структур.
Изменение ультраструктур в автолизирующих мышцах следует рассматривать не только как следствие ферментативных гидролитических превращений, но и как результат физико-химических и коллоидно-химических изменений белков мышечного волокна. Такие изменения интенсивно проявляются в процессах окоченения и расслабления мышечной ткани. Изучение сложных и многообразных превращений при окоченении и расслаблении мышц показало, что уже в начальных стадиях этих процессов происходит молекулярная перестройка белков актомиозинового комплекса, а это ведет к перестройке субмолекулярных структур. Значительные изменения ультраструктур в мышцах выявляются в процессах холодильной обработки и посола.
Высокие агрегационные взаимодействия белков при замораживании и хранении в мороженом виде мышц обусловливают и изменения субмолекулярных структур. Изменение ультраструктур вызывает и растворяющее действие гипертонических растворов при размораживании и посоле.
1*
Глава 11.
БИОХИМИЯ КРОВИ
БИОХИМИЧЕСКИЕ
ФУНКЦИИ, СВОЙСТВА И СОСТАВ КРОВИ
БИОХИМИЧЕСКИЕ ФУНКЦИИ КРОВИ
Кровь (жидкая ткань животного организма) является внутренней средой организма, которая объединяет между собой органы и ткани и выполняет дыхательные, питательные, выделительные, регуляторные и защитные функции. Она доставляет к органам и тканям питательные вещества, поступающие из внешней среды через пищеварительный тракт, и в нее выделяются из тканей различные продукты обмена. Артериальная кровь переносит кислород, необходимый для тканевого дыхания.
В кровь выделяются гормоны, т. е. она способствует гормональной регуляции. Кроме того, регуляторные функции крови обусловливаются постоянным обогащением ее ферментами и другими биологически активными веществами. Регуляторные функции заключаются также в поддержании постоянства осмотического давления, активной реакции среды и температуры тела.
Важнейшей функцией крови является транспортировка конечных продуктов тканевого обмена (например СОг, мочевины, мочевой кислоты, аммонийных солей и других азотистых веществ, а также избытка минеральных солей) к органам выделения.
Кровь выполняет защитные функции организма, участвуя в борьбе организма с многими видами заболеваний. При попадании в кровь или ткани животного организма инородных высокомолекулярных веществ (белки или полисахариды), называемых антигенами, образуются антитела — белки, специфически реагирующие с исходными антигенами. Антитела вырабатываются плазматически-
84
jib клетками, которые сходны с лимфоцитами и находятся в селезенке, лимфатических узлах, стенке пищеварительного тракта, печени и в других органах. Антитела способствуют агглютинации (лат. agglutinare — приклеивать) бактерий и связыванию антигенов.
Обнаруживают антитела по способности соединяться с исходным антигеном. Они исключительно специфичны и не реагируют даже с молекулами, сходными по строению с антигеном.
Защитные функции крови определяются также лейкоцитами, которые богаты протеолитическими и липолитическими ферментами, способствующими быстрому распаду и перевариванию различных микробных тел при фагоцитозе.
МОРФОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА КРОВИ
Кровь состоит из жидкой части — плазмы — и взвешенных в ней форменных элементов. К форменным элементам относятся:
эритроциты (красные кровяные тельца) — специфические клетки крови, безъядерные у большинства животных или с ядрами, например, у птиц, амфибий, рептилий;
лейкоциты (белые кровяные тельца) — лимфоциты, моноциты, нейтрофилы, эозинофилы и базофилы; в этих клетках имеются ядра, однако циркулирующие лейкоциты не делятся;
тромбоциты (кровяные пластинки, бляшки) — продукты фрагментации (распада) особых гигантских клеток костного мозга — мегакариоцитов.
В крови разных видов животных содержание форменных элементов неодинаково. Количество их в среднем составляет у крупного рогатого скота 33%, у мелкого 28%, свиней 43,6%, лошадей около 40% от массы крови.
Общее количество крови у различных видов животных также неодинаково. Так, у крупного и мелкого рогатого скота оно составляет 7,6—8,3%, свиней 4,5—6,0%, домашней птицы 8,1%, лошадей 9,8%, кроликов 5,5—6,2% к массе животных.
85
ХИМИЧЕСКИЙ СОСТАВ И ФИЗИКОХИМИЧЕСКИЕ СВОЙСТВА КРОВИ
Химический состав крови у животных одного вида в норме постоянен, а у животных разных видов имеются некоторые колебания в содержании компонентов.
Химический состав цельной крови убойных животных (средние данные) приведен в табл. 4.
ТАБЛИЦА 4
Содержание составных частей (в г) в 1000 г цельной крови
Состав крови быка ОВЦЫ КОЗЫ СВИНЬИ лошади
Вода 808,9 821,67 803,89 790,56 749,02
Сухой остаток В том числе: 191,1 178,33 196,11 209,44 250,98
гемоглобин .... 103,1 92,9 112,58 142,2 166,9
другие белки . . . 68,8 70,8 69,72 42,61 69,7
сахар 0,7 0,7325 0,829 0,686 0,526
холестерин .... 1,935 1,339 1,299 0,444 0,346
лецитин 2,349 2,22 2,46 2,309 2,913
жир 0,567 0,937 0,525 1,095 0,611
жирные кислоты . . — 0,488 0,395 0,475 —
натрий 3,636 3,638 3,579 2,406 2,691
калий 0,407 0,405 0,396 0,309 0,758
окись железа . . . 0,544 0,492 0,577 0,696 0,828
кальций ...... 0,069 0,07 0,06 0,068 0,051
магний 0,0356 0,03 0,04 0,0889 0,064
хлор 3,079 3,08 2,923 2,69 2,785
Кровь является средой, в которую поступают различные продукты тканевого обмена, кислород, а также питательные вещества. Несмотря на это, кровь большого круга кровообращения характеризуется довольно постоянным составом. Такое динамическое постоянство поддерживается различными механизмами, регулирующими поступление в кровь продуктов питания и выделение из нее продуктов обмена. Благодаря постоянному составу плазмы крови создаются неизменные условия среды, необходимые для существования клеток.
Осмотическое давление крови животных обусловливается в основном содержанием в ней неорганических ве-
86
щсств (их молекул и ионов), а также частично белками ддазмы и другими органическими соединениями. Осмотически наиболее активными веществами являются соли pJaCl, NaHCO3, Na2HPO4, СаС12, КС1, при диссоциации которых образуются ионы, ведущие себя как осмотически активные частицы. Постоянство осмотического давления крови обеспечивается деятельностью регуляторных механизмов, способствующих выделению из организма избытка как воды, так и осмотически активных веществ.
Осмотическое давление выражают величиной депрессии (А), характеризующей температуру понижения замерзания крови по сравнению с температурой замерзания чистой воды. Депрессия крови убойных животных составляет: коровы 0,611, овцы и свиньи 0,618, лошади 0,558, кролика 0,595.
Ряд жизненных функций клеток, в частности сохранение ими определенной формы, способность воспринимать извне и отдавать во внешнюю среду вещества, зависит от осмотического давления клеточного сока и омывающей клетки жидкости, т. е. лимфы и связанной с ней плазмы крови.
Осмотическое давление белков плазмы и других коллоидов называется коллоидно-осмотическим, или онкотическим, давлением. Оно примерно составляет около 0,004—0,006 общей величины осмотического давления крови.
Осмотическая (онкотическая) активность белков плазмы неодинакова. Например, сывороточные альбумины обусловливают 3/4 осмотического давления, создаваемого белками, хотя по количеству составляют приблизительно */2 всех белков плазмы. Сравнительно высокая осмотическая активность сывороточных альбуминов является следствием большей их концентрации (в результате меньшей величины молекул) по сравнению с другими белками плазмы.
Распределение воды между тканями и кровью при одинаковой концентрации в них солей определяется концентрацией белков в плазме. Если в кровь вводится большое количество физиологического раствора, изотоничного плазме, то концентрация сывороточных белков в крови резко снижается. При этом онкотическое давление в плазме уменьшается, что создает предпосылки для перехода
87
воды из крови в ткань, поскольку осмотическое давление белков в тканевой жидкости остается прежним.
Для крови животных характерно также относительное постоянство концентрации ионов водорода (pH). Реакция крови убойных животных слабощелочная и колеблется обычно в небольших пределах.
Кровь
Коровы Овцы . .
Барана . .
Козы . . .
рн
7,36—7,50
7,40—7,58
7,82
7,65
Кровь Свиньи . . Лошади . . Кролика
pH 7,85—7,95 7,20—7,60 7,33—7,40
Изменение pH крови может быть вызвано рядом причин. В продуктах переваривания, поступающих в кровь, имеются различные кислоты и основания. Кроме того, в продуктах внутриклеточного обмена, поступающих вначале в тканевую жидкость, а затем в кровь, также содержится значительное количество кислот и оснований. Прижизненный сдвиг pH крови в кислую сторону называется ацидозом, в щелочную — алкалозом. Компенсированный сдвиг кислотно-щелочных отношений в сторону алкалоза характерен для травоядных животных, в сторону ацидоза — для плотоядных.
ТАБЛИЦА 5
Буферные системы Плазма Эритроциты
Бикарбонатная Н2СО3 . Н2СО3
NaHCO3 КНСОд
Фосфатная NaH2PO4 Na2HPO4 КН2РО4 К2НРО4
Белковая (плазмы) Н — белок Na — белок —
Гемоглобиновая — Н(НЬ) К(НЬ)
Оксигемоглобиновая — Н(НЬ)О2 К(НЬ)О2
88
Постоянство активной реакции среды обусловлено наличием в крови буферных систем и непрерывным освобождением ее от конечных продуктов обмена путем экскреции. Главные буферные системы крови приведены в табл. 5. Буферные системы крови отличаются высокой кислотной емкостью. Температура замерзания и электропроводность крови постоянны, что обусловлено в основном постоянным количеством электролитов. Минеральных веществ содержится около 0,9%.
Плотность крови животных разных видов различается незначительно (г/см3).
Крупный рогатый скот............ 1,050—1,060 Свиньи.......... 1,049—1,055
Овцы ..... 1,055—1,065 Куры ........... 1,040—1,060
ПЛАЗМА КРОВИ
В плазме крови содержится 90—91% воды и 9—10% плотного остатка. Большую часть плотного остатка составляют белки, а остальную часть — азотистые и без-
ТАБЛИЦА 6
Состав плазмы Содержание составных частей (в г) в 1000 г плазмы
крупного рогатого скота ОВЦЫ свиньи лошади
Вода 913,64 917,44 917,61 902,05
Сухой остаток 86,36 82,56 82,39 97,95
В том числе
белки 72,50 67,50 67,741 84,24
сахар 1,05 1,06 1,212 1,176
холестерин 1,238 0,879 0,409 0,298
лецитин 1,675 1,709 1,426 1,720
жир 0,926 1,352 1,956 1,300
жирные кислоты . . . — 0,71 0,794 —
натрий 4,312 4,303 4,251 4,434
калий 0,255 0,256 0,27 0,263
кальций 0,1194 0,117 0,122 0,1113
магний 0,0446 0,041 0,0412 0,045
хлор . . 3,69 3,711 3,627 3,73
общий фосфор .... 0,244 0,232 0,1972 0,240
в том числе неоргани-
ческий фосфор . . . 0,085 0,073 0,0524 0,071
89
азотистые экстрактивные вещества, липиды, углеводы и минеральные вещества. Общий химический состав плазмы крови убойных животных представлен в табл. 6.
БЕЛКИ ПЛАЗМЫ
Биохимические и физико-химические свойства белков плазмы
Основными фракциями белков плазмы крови являются сывороточные альбумины, сывороточные глобулины и фибриноген. Альбумины и глобулины активно участвуют в обмене веществ, быстро расходуются на нужды организма и так же быстро восстанавливаются. Содержание белковых фракций в плазме разных животных неодинаково (табл. 7).
ТАБЛИЦА 7
Белковые фракции Содержание (в %) в плазме крови
крупного рогатого скота мелкого рогатого скота свиней
Сывороточные альбумины 3,61 3,83 4,42
'» глобулины 2,90 3,00 2,96
Фибриноген 0,60 0,46 0,65
Фибриноген является главным компонентом системы свертывания крови (см. с. 112). Он нерастворим в воде, но хорошо растворяется в разбавленных растворах нейтральных солей и в щелочах, осаждается сернокислым магнием и хлористым натрием ранее, чем наступает полное насыщение.
Фибриноген — белок с молекулярной массой 330 000. Молекулы фибриногена состоят из трех глобулярных структур с диаметром около 6 • 10~9 м, соединенных между собой более тонкими белковыми тяжами (рис. 19).
Молекула фибриногена построена из шести полипеп-тидных цепей, соединенных дисульфидными связями — двух А- и двух В- цепей, несущих у разных животных в
90
Рис. 19. Схематическое изображение половины молекулы фибриногена (места действия тромбина показаны стрелками).
качестве N-концевых групп различные кислотные остатки и двух С-цепей — с тирозильными остатками на jsj-конце (см. с. 113).
Сывороточные альбумины. Эти белки у различных убойных животных сходны по своим биологическим и физико-химическим свойствам. Сывороточные альбумины, образуемые в печени, поддерживают коллоидно-осмотическое (онкотическое) давление крови. При физиологических значениях pH они заряжены отрицательно, а молекулы их близки по размерам.
Внутренняя вязкость сывороточных альбуминов сравнительно невелика, что существенно для кровообращения, так как при этом уменьшается работа, выполняемая сердцем. Сывороточные альбумины участвуют в регуляции кислотно-щелочного равновесия и играют особую роль в транспортировке различных соединений.
Сывороточные альбумины выполняют ответственную роль в переносе метаболитов. Они связываются с углеводами, липидами и другими соединениями. Альбумины — непосредственные акцепторы жирных кислот. Они переносят липиды от жировых депо к местам потребления. Очень
велика роль сывороточных альбуминов в переносе углеводов, с которыми они образуют различные глюкопротеиды. Очень легко возникают комплексы сывороточных альбуминов с различными катионами и анионами, а также с многочисленными продуктами обмена. Наиболее важными являются питательные функции сывороточных альбуминов. В некоторых случаях при очень интенсивном обмене они могут быть единственным источником белкового питания тканей. Альбумины выполняют важную роль в транспортировке и регуляции активности гормонов.
По физико-химическим свойствам сывороточные альбумины являются типичными альбуминами: они растворяются в воде и солевых раствор ах средн ей концентрации,
91
причем растворимость их во многих растворителях выще растворимости большинства других компонентов плазмы В связи с этим методы их выделения основаны на осажде.' нии других компонентов, тогда как альбумины остаются в растворе. Но ввиду того, что сывороточные альбумины легко взаимодействуют с другими белками, а также могут быть связаны с липидами и углеводами, растворимость их в естественных системах может отличаться от растворимости в изолированном состоянии.
Очищенный сывороточный альбумин остается гетерогенным, что показано при помощи электрофореза, хроматографии и иммунохимических методов.
Способность сывороточного альбумина легко вступать в реакцию с целым рядом веществ обусловлена наличием в его молекуле 55 е-аминогрупп лизина, высокоактивных тиоловых и имидозольных групп, большого количества карбоксильных групп (активность последних при физиологических значениях pH относительно невелика).
Сывороточные глобулины. Эти белки представляют собой смесь компонентов, обозначаемых как а-, (3-, у-гло-булины. При электрофорезе они разделятся на фракции (в порядке уменьшения подвижности): сц- и а2-глобули-ны, Pi- и р2-глобулины и уг и у2-глобулины. Содержание их в плазме крови животных характеризуется данными табл. 8.
ТАБЛИЦА 8
Животное Содержание глобулиновых фракций в плазме животных (в %) к общему количеству белков
а-глобулины 3-глобулины -(глобулины
Корова 17,5 18,2 21,6
Овца 6,4 16,8 _ 27,5
Коза 13,6 16,0 32,4
Свинья 19,9 16,4 32,2
Лошадь 17,5 18,2 21,6
Сывороточные глобулины также участвуют в переносе различных веществ. Например, а- и р-глобулины связывают в сложные биокомплексы такие важные соединения, как углеводы, холестерин, фосфолипиды, витамины, 92
гормоны (тироксин, эстрон, тестостерон и др.) и различные минеральные ионы.
Во фракцию глобулинов входят антитела. Большинство антител представляет собой у-глобулины. Долгое время антитела рассматривали как особый класс у-глобули-нов, отличающихся от тех у-глобулинов, которые лишены соответствующих свойств. Показано, что антитела очень сходны по свойствам со всеми у-глобулинами и эти антитела называют иммуноглобулинами.
В плазме крови содержится комплемент, представляющий собой комплекс многочисленных факторов: одни из них термостабильны, другие термолабильны. Символом С' принято обозначать весь этот комплекс в целом. Комплемент вызывает лизис сенсибилизированных эритроцитов и клеток бактерий. Первый компонент комплемента С'1 является ферментом со специфичностью, близкой к трипсину. Четвертый компонент комплемента С'< представляет собой глюкопротеид. О свойствах и функциях остальных компонентов известно еще немногое; все они необходимы для выполнения указанных выше функций. Компоненты комплемента принимают участие в реакции взаимодействия антител с антигенами.
Пропердин (perdere — разрушать). Это сложный белковый комплекс, состоящий из молекул у- и р-глобулинов и частиц углеводов. Он входит в пропердиновую систему веществ сыворотки, состоящую из комплемента, пропердина и ионов магния. Эта система обеспечивает резистентность животного организма к инфекциям, так как способна лизировать некоторые бактерии и инактивировать некоторые вирусы.
Отсутствие пропердина в сыворотке новорожденных (т. е. безмикробных) животных и его появление после контакта с бактериальной флорой среды служит подтверждением того, что данное активное вещество имеет природу антител.
Сложные белки и белковые комплексы плазмы крови. Физиологическое значение комплексов белков и белков с веществами небелковой природы плазмы крови связано с ее транспортными функциями. Кроме того, комплексы белков с веществами небелковой природы имеют большое значение для регуляции проницаемости их, обезвреживания некоторых токсических веществ (например, связывание бидирубина, соединение тяжелых металлов с сыворо
93
точным альбумином), изменения активности ионов и т. п
Липопротеиды. Липиды в основном связываются с а- и |3-глобулинами. Большинство липопротеидов, особенно холестерин-белковые комплексы, отличается лабильными связями. Наряду с этим существуют липопротеиды, являющиеся вполне определенными химическими соединениями. Функции липопротеидов не ограничены только их транспортной ролью. Например, р-глобулин, содержащий липиды, является антиоксидантом. Липопротеиды принимают участие в реакциях иммунитета. Липопротеидную природу имеют и некоторые компоненты свертывания крови.
Гликопротеиды. Одна часть гликопротеидов при фракционировании выделяется с альбуминовой фракцией. Другая часть гликопротеидов образуется в результате соединения углеводов с а- и р-глобулинами.
Некоторые сложные белки плазмы и сыворотки крови имеют смешанный состав (например, гликолипопротеиды) .
Металлсодержащие белки. В глобулиновой фракции белков обнаружены р-глобулины, в состав которых входят медь и железо.
Железосодержащий белок — трансферрин — выполняет функции переноса железа, которое используется при синтезе гемпротеинов (гемоглобин и миоглобин) и железопорфириновых ферментов. Молекулярная масса трансферрина 90 000. Каждая молекула его способна присоединять два атома железа.
Медьсодержащий белок, выделенный из плазмы крови, получил название гемокупреина, или церулоплазмина. В нем содержится 0,34% меди. Молекулярная масса его 150 000. Очевидно, этот белок выполняет функции переноса меди.
Ферменты плазмы
В плазме крови постоянно присутствуют так называемые эндоферменты — церуплазмин, псевдохолинэстераза, липаза, специфические протеиназы и пептидазы, каталаза, пероксидаза, а также ферменты и коферменты свертывающей и противосвертывающей систем крови. Эндоферменты выполняют регуляторные функции в процессах липидного обмена, свертывания крови и окисления.
94
Экзоферменты плазмы — ферменты, поступающие в кровеносное русло в результате тканевого распада или нарушения проницаемости мембран. Эти ферменты обладают определенной тканевой специфичностью и поэтому представляют большой интерес для диагностики заболеваний.
В число своеобразных протеиназ плазмы входит фермент системы свертывания крови — тромбин, образующийся из протромбина, который, синтезируясь в печени, поступает в кровь. Синтез протромбина подавляется при недостаточности витамина К. Образование тромбина из протромбина представляет собой серию реакций «ограниченного протеолиза» (см. с. 112). Активный тромбин хорошо расщепляет пептидные связи аргинин — глицин в процессе превращения фибриногена в фибрин.
Своеобразной протеиназой плазмы также является плазмин (фибринолизин), образующийся из плазминогена, который, синтезируясь по крайней мере частично в клетках (эозинофилах) костного мозга, поступает в кровь и другие ткани. Активаторы плазминогена представляют собой протеолитические ферменты, способные гидролизовать пептидные связи основных аминокислот. В отличие от тромбина и других протеиназ плазмин может гидролизовать широкий спектр различных белков плазмы. Обладая высокой гидролитической активностью к фибрину и фибриногену, он является одним из основных компонентов противосвертывающей системы. Действие плазмина связано с процессом фибринолиза, т. е. с процессом лизиса сгустков фибрина.
В плазме крови содержатся протеолитические ферменты — калликреины, освобождающие гипотензивные пептиды (кинины) при действии на белки плазмы крови, а также ферменты, осуществляющие последующую деградацию кининов. При действии на а-глобулин плазмы (кининоген) калликреин освобождает нонапептид брадикинин, обладающий способностью снижать кровяное давление, вызывать сокращение гладкой мускулатуры и оказывать другие физиологические воздействия. Кининоген бычей плазмы является а-гликопротеидом с изоэлектрической точкой при pH 3,3—3,6, с подвижностью «-глобулина и молекулярной массой 50 000. Калликреин образуется в результате ограниченного протеолиза из калликреиногена, который, подобно большинству других
95
белков плазмы, синтезируется в печени. В плазме крови содержится карбоксипептидаза N, вызывающая инактивацию брадикинина и каллидина (кинин, образующийся при воздействии панкреатического калликреанина на глобулин плазмы) в результате отщепления С-концевого остатка аргинина. Из эндоферментов в плазме крови содержатся компоненты комплемента, обладающие протеолитической активностью, и другие протеиназы. Наряду с этим имеются и ферменты со свойствами пептидаз. Кроме карбоксипептидазы N, плазма крови содержит различные аминопептидазы.
Выделение и методы фракционирования белков плазмы
При исследованиях, а также при производстве препаратов часто возникает необходимость, выделить из плазмы крови отдельные белковые фракции. Основными методами их фракционирования являются дробное осаждение неорганическими солями, дробное осаждение с применением спирто-водных растворителей, разделение в электрофоретических приборах.
Метод дробного высаливания белков нейтральными солями нашел широкое применение благодаря своей простоте и доступности. Однако для получения большого количества белковых фракций он непригоден, так как на удаление солей путем диализа с применением антисептиков требуется много времени.
Разделение белков плазмы с применением в качестве осадителя этилового спирта во избежание денатурации производят при низкой температуре. Спирт затем легко удаляют путем диализа или при высушивании белков в замороженном состоянии под вакуумом.
Метод фракционирования белков с применением спирто-водных растворителей основан на различной растворимости белков в зависимости от ряда факторов: ионной силы (обусловливает силы взаимного притяжения и отталкивания и зависит от концентрации и валентности анионов и катионов соли), диэлектрической проницаемости, или диэлектрической постоянной (влияет на растворимость белков и диссоциацию солей в растворе), температуры (понижение температуры способствует уменьшению
96
растворимости белков, что используется при осаждении), концентрации водородных ионов (влияет на растворимость белков — плохая растворимость белка в изоэлектрической точке используется для осаждения при фракционировании), концентрации белка (для наиболее полного осаждения существует оптимальная концентрация белка) . Изменяя эти условия, выделяют из сыворотки крови отдельные белковые фракции.
Так, например, при обработке плазмы охлажденным (до 0°С) 8—10%-ным этанолом осаждается преимущественно фибриноген. Осаждение у- и ^-глобулинов происходит при повышении концентрации этанола до 25% (при —5°С). Белки, растворимые в 20%-ном этаноле, состоят из Pi-глобулинов, а в осадке содержатся у-глобули-ны, протромбин и другие протеолитические ферменты. р-Глобулины нерастворимы в 17%-ном этаноле при pH 5,2, тогда как у-глобулины остаются в этих условиях в растворе и осаждаются при увеличении ионной силы до 0,05. Осадок содержит большую часть антител.
После осаждения у- и р-глобулинов из надосадочной жидкости осаждается а-глобулин путем понижения концентрации этанола до 18% и доведения pH до 5,2. Повышая затем концентрацию этанола до 40% и доводя pH до 4,8, получают осадок альбуминов.
Для разделения белков сыворотки крови широко используется зонный электрофорез. Выбор носителя для зонного электрофореза зависит главным образом от поставленной задачи. Если основной целью является разделение компонентов, то в качестве носителей используется крахмал или полиакриламидный гель. Для получения препаратов чистого белка используют крахмальный блок или колонну, внося большие количества материала.
Для очистки белковых препаратов из сыворотки крови используют ионообменные колонки. Для этих целей обычно применяют ДЭАЭ-целлюлозу (анионообменник, образующийся в результате присоединения к целлюлозе диэтиламиноэтильных групп) и КМ-целлюлозу (катионо-обменник, образующийся в результате присоединения к целлюлозе карбоксиметильных групп). Пропуская через колонку белковые смеси, а затем буферные растворы с возрастающей ионной силой или же растворы с возрастающей (или убывающей) величиной pH, получают чистые препараты.
97
Избирательное адсорбирование отдельных белков та-кими носителями, как гель фосфата кальция, алюмогель целит, крахмал и гидр оксид апатит, и последующая их избирательная элюция используются для очистки белков при получении препаратов из сыворотки крови. Такое фракционирование может производиться как на колонках, так и на пластинках адсорбента.
Для получения чистых препаратов из сыворотки крови используют также молекулярную фильтрацию. Широкое распространение получили сефадексы — полимеры в виде гранул, построенных из нитевидных молекул полисахарида декстрана, сшитых через определенные промежутки поперечными связями. Молекулярные сита с диэтилами-ноэтильными и карбоксиметильными группами позволяют одновременно фракционировать смеси как по размерам частиц, так и по их заряду.
НЕБЕЛКОВЫЕ КОМПОНЕНТЫ
ПЛАЗМЫ
Углеводы плазмы. В плазме крови животных всегда содержатся моносахариды, в основном глюкоза и фруктоза.
Содержание сахара в плазме крови животных характеризуется следующими данными (в мг%).
Корова Овца Коза . Свинья Лошадь
40—100
20—65
40—65
40—250
60—110
Кролик . . . . . . 100
Курица .... . . . 130—260
Индейка . . . . . . 170—210
Утка, гусь . . . . . 150
Кроме того, в плазме имеется небольшое количество комплексно связанных полисахаридов, а также продукты промежуточного обмена углеводов: молочная, пировиноградная, а-кетоглутаровая, янтарная и другие кислоты. Количество этих продуктов, особенно молочной кислоты, в плазме крови разных животных неодинаково. Так, в плазме крови быка и барана содержится 11,2 мг%, свиньи 43,1 мг%, лошади 18,1 мг°/о молочной кислоты. В результате напряженной мышечной работы повышает -98
а распад гликогена, что ведет к увеличению содержания Удочной кислоты, количество которой в плазме крови мОжет достигать 150 мг%.
Липиды плазмы. В плазме обычно содержатся нейтраль111’16 жиры и продукты их распада (глицерин и жир-pbie кислоты), а также лецитины, кефалины и их комплексы с сывороточными альбуминами и глобулинами. Свободного холестерина и его эфиров в плазме крови животных значительно меньше, чем холестерина, связанного в холестерин-белковые комплексы. В качестве белкового компонента в этих комплексах чаще встречаются глобулины и реже альбумины. Общее содержание нейтральных жиров и других липидов в плазме крови зависит от состава принимаемой пищи и в среднем составляет у крупного рогатого скота 0,09%, у мелкого рогатого скота 0,13%, у свиней 0,19%.
Азотистые и безазотистые низкомолекулярные вещества плазмы. В плазме крови всегда содержатся азотсодержащие экстрактивные вещества, среди которых имеются как промежуточные (пуриновые основания, аминокислоты, полипептиды), так и конечные продукты азотистого обмена (мочевина, мочевая кислота, аллантоин, креатинин, аммонийные соли, гиппуровая кислота, билирубин и другие соединения). Азот всех небелковых веществ плазмы крови называется остаточным азотом. Количество его в плазме крови обусловлено интенсивностью белкового обмена (при отсутствии патологических явлений, когда определяющее значение имеет функция почек) и колеблется от 20 до 60 мг %.
Ниже приведены данные о содержании остаточного азота в крови у различных животных (в мг%).
Корова........30—65
Овца..........25-—45
Свинья........20—40
Лошадь........30—58
Птица ........20—60
Содержание остаточного азота может служить показателем свежести крови и продуктов крови при их хранении и переработке; увеличение остаточного азота свидетельствует о гнилостном распаде белков.
99
Витамины крови. Кровь транспортирует к тканям витамины, поступающие с пищей. В крови убойных животных в значительном количестве содержатся тиамин, рибофлавин, аскорбиновая кислота, витамин А и каротины, биотин, ниацин, пантотен, цианокобаламин, а также витамины D, Е, К.
Минеральные вещества плазмы. Из минеральных веществ в крови находятся соли, всасываемые через кишечник, а также соли, подлежащие выведению из организма. В среднем в крови животных содержится примерно 0,9% минеральных веществ, что соответствует ионной силе 0,15. У разных животных минеральный состав крови неодинаков, а у одного и того же животного характеризуется известным постоянством, значительные отклонения от него наблюдаются только при заболеваниях.
К минеральным соединениям плазмы крови относятся NaCl, КС1, СаС12, MgCl2, NaHCO3, СаСО3, К2НРО4, NaEEPCU Na2SC>4, Са3(РО4)г и др. В ней содержатся также в небольшом количестве соединения железа, йода, меди, цинка, кобальта и других элементов. Минеральные соединения находятся в крови в ионизированном состоянии, в виде молекулярно-дисперсных систем, биохимических комплексов с белками и т. п.
Пигменты плазмы. Кровь интенсивно окрашена в красный цвет, что в основном обусловлено содержанием гемоглобина в эритроцитах крови. Окраска плазмы крови зависит от содержания пигментов: билирубина, биливердина, уробилина, липохромов и лютеинов.
Биливердин (зеленая окраска) и билирубин (золотисто-желтая окраска) являются продуктами распада гема. В плазме крови их содержится около 0,2—0,5 мг%. Уробилин — продукт окисления билирубина.
На окраску сыворотки влияет количество липохромов и лютеинов. Липохромы — сборное название пигментов, принадлежащих к группе каротиноидов. Лютеины — растительные пигменты (каротины и ксантофиллы). Эти пигменты поступают в организм животного с пищей. У крупного рогатого скота сыворотка крови красно-желтая, что обусловлено наличием в ней значительного количества каротинов и ксантофиллов, а у свиней она желтая, иногда почти бесцветная, так как этих пигментов в ней мало.
100
ФОРМЕННЫЕ ЭЛЕМЕНТЫ
Размеры и количество форменных элементов в крови разных видов животных неодинаковы (табл. 9).
ТАБЛИЦА 9
Животные Эритроциты Лейкоциты Тромбоциты
диаметр, мкм количество в 1 мм3, млн. диаметр, мкм количество в 1 мм3, тыс. . диаметр, мкм количество в 1 мм3, тыс.
Корова Свинья ..... Овца ...... Коза Лошадь Кролик 5,1 6,2 5,0 4,0 5,6 6,0 6—10 6—8 6—11 14—18 8—10 6—7 От 4 до 20 00 со II II U о 3» ° 2—3 От 200 до 600
При выдерживании крови в спокойном состоянии и добавлении к ней противосвертывающих веществ форменные элементы постепенно осаждаются. Первыми оседают эритроциты (как наиболее тяжелые), образуя нижний слой, окрашенный в интенсивно красный цвет. Над ними скапливаются лейкоциты в виде серовато-белого слоя.
Скорость оседания эритроцитов приведена в табл. 10.
ТАБЛИЦА 10
Животные Скорость оседания эритроцитов (в мм) при продолжительности периода отстаивания крови, мин
15 30 45 60
Крупный рогатый скот 0,1 0,25 0,4 0,58
Овцы 0,2 0,4 0,6 0,8
Свиньи 3,0 8,0 20,0 30,0
Лошади . 38,0 49,0 60,0 64,0
Кролики .... 0,0 0,3 0,9 1,5
В производственных условиях форменные элементы отделяют от плазмы сепарированием.
Общий химический состав форменных элементов крови убойных животных приведен в табл. 11.
101
ТАБЛИЦА 11
Состав форменных элементов Суммарное содержание составных частей (в г) в 1000 г форменных элементов
крупного рогатого скота овец свиней лошадей
Вода 591,858 604,79 625,62 618,15
Сухой остаток 408,142 395,21 374,38 381,85
В том числе
гемоглобин 316,74 303,29 326,82 315,08
другие белки 64,20 78,45 19,19 56,78
холестерин 3,379 2,360' 0,489 0,388
лецитин 3,748 3,379 3,456 3,973
жирные кислоты . . . — — 0,062 —
натрий 2,322 2,135 — —
калий 4,722 4,679 4,957 4,935
окись железа 1,671 1,575 1,599 1,563
магний 0,0172 0,0403 0,150 0,0209
хлор 1,8129 1,480 1,475 1,949
общий фосфор .... 1,7348 1,699 2,058 1,901
неорганический фосфор 0,3502 0,279 1,653 1,48
ЭРИТРОЦИТЫ
Эритроциты разных животных отличаются по размерам и по концентрации в них основного белка — гемоглобина. Наиболее важной функцией эритроцитов является дыхательная. Они образуют громадную внутреннюю поверхность. При усиленном кровообращении общая поверхность эритроцитов, приходящая в соприкосновение с тканями, намного увеличивается, что обеспечивает быстрый перенос в теле животного газов и продуктов питания. Эритроциты непосредственно участвуют в транспортировке питательных веществ, адсорбируя их на своей поверхности. Оболочка эритроцитов, образованная уплотненной стромой, проницаема для воды, глюкозы, мочевины, анионов и способствует поддержанию определенного градиента концентраций различных катионов между плазмой и эритроцитами.
Основной составной частью эритроцитов является гемоглобин, количество которого колеблется от 30 до 41%. В одном эритроците может содержаться около 280 млн. молекул гемоглобина.
Гемоглобин в эритроцитах находится в трех состояниях: гемоглобин, связанный с белками стромы в достаточ
на
но прочный комплекс; гемоглобин, непрочно связанный с фосфатидами стромы; небольшая часть свободного гемоглобина. Для получения в необходимом количестве гемоглобина кровь, предварительно смешанную с антикоагулянтами (веществами, препятствующими свертыванию), центрифугируют для осаждения эритроцитов. После их очистки от примесей в изотоническом солевом растворе к ним добавляют дистиллированную воду, в результате чего они набухают и вскоре лопаются, а их содержимое переходит в окружающую среду. Оболочки эритроцитов и остатки клеток осаждают центрифугированием при высоких скоростях.
В строме, остающейся после удаления гемоглобина, содержится 70% белков и 25% липидов.
Среди белков стромы обнаружены нуклеопротеиды. Кроме того, в ней содержатся белки, бедные железом и серой, практически не расщепляемые пепсином и трипсином. В состав стромы входят также различные комплексы белков и липидов, свободные лецитины и кефалины, холестерин, его эфиры и нейтральные жиры. Азотистые небелковые вещества в качественном отношении во многом аналогичны азотистым веществам плазмы. Из минеральных веществ в эритроцитах преобладает калий, а из микроэлементов обнаружена медь, которая входит в состав сложного белка —• купреина, а также цинк, являющийся составной частью сложного белка — фермента карбоангидразы. В эритроцитах найдено большое количество ферментов. Наиболее активны из них каталаза, карбоангидраза, специфическая ацетилхолинэстераза и др.
ГЕМОГЛОБИН
Строение гемоглобина. Гемоглобин является сложным белком, состоящим из белковой части глобина и просте-тической — гема. Молекулярная масса 68 000.
Молекула гемоглобина состоит из четырех субъединиц. Каждой субъединице гемоглобина соответствует индивидуальная полипептидная цепь, соединенная с гемом. На четыре субъединицы молекулы гемоглобина приходится две а- и две р-цепи: a-цепь содержит 141 аминокислотный остаток, а р-цепь—146 аминокислотных остатков. Всего в глобине содержится 574 аминокислотные
103
единицы. Спиральные отрезки цепей в гемоглобине составляют около 75% всей белковой молекулы, они соединены неспиральными участками различной длины. Дальнейшее усложнение молекулярной структуры возникает вследствие изгибов и свертывания спиралей в пространстве, в результате чего образуется причудливая форма третичной структуры каждой из полипептидных цепей (субъединиц). Взаимная плотная упаковка четырех субъединиц в пространстве образует четвертичную структуру молекулы гемоглобина. Отдельные субъединицы гемоглобина удерживаются вместе за счет электростатического взаимодействия, а также за счет образования некоторого числа водородных связей. Специфические свойства гемоглобина определяются его четвертичной структурой.
Гем является комплексным соединением протопорфи-рина IX и железа:
Железо в геме находится в центральном ядре и связано с азотами пирроловых колец двумя главными и двумя добавочными валентностями. Биосинтез гема осуществляется за счет ацетата и глицина. В опытах с ядерными эритроцитами было найдено, что четыре азота пирроловых колец происходят из аминогрупп глицина. Из 34 атомов углерода в молекуле гема восемь атомов происходят из а-углеродов глицина, а остальные 26 — из углерода ацетата.
Гемоглобин выполняет роль дыхательного белка — переносчика кислорода. Концентрация его в крови раз
104
ных животных неодинакова вследствие значительных различий в количестве эритроцитов и их величины.
От легких к тканям кислород переносится в основном в форме оксигемоглобина и только 0,5% его растворено в плазме. Кислородная емкость крови животных зависит от содержания в ней эритроцитов и гемоглобина и характеризуется следующими данными (в объемных %).
Корова . . . 10,1—11,8 Овца .... 16,8 Лошадь ... 16,7 Кролик . . 15,3—19,4 Петух . . . 9,1—15,7
Образование оксигемоглобина называется оксигенацией. Каждый из четырех атомов железа в молекуле гемоглобина способен соединяться с одной молекулой (т. е. двумя атомами) кислорода, однако железо при этом не окисляется. Реакция эта обратима: кислород поглощается, когда он находится в избытке (например, в легких) и освобождается там, где его меньше (в тканях). Молекула гемоглобина при оксигенации претерпевает конформационные изменения. Глобин обеспечивает физиологически наиболее выгодное взаимодействие атомов железа гема с кислородом, благодаря чему молекула гемоглобина способна либо соединяться сразу с четырьмя молекулами кислорода, либо отщеплять их также все сразу; тем самым обеспечивается эффективное снабжение организма кислородом.
В переносе углекислоты от тканей к легким участвуют и эритроциты, и плазма крови. Часть углекислоты, образующейся в тканях при окислительных процессах, растворяется в плазме крови. Кроме того, частично она связывается белками плазмы, большая же часть диффундирует в эритроциты, где взаимодействует с основаниями, образуя бикарбонаты.
В легочных капиллярах бикарбонаты разлагаются с выделением свободной Н2СО3, которая благодаря наличию карбоангидразы быстро диссоциирует на СО2 и Н2О.
Наряду с указанным, при переносе углекислоты от тканей к легким 15—20% ее может связываться глобином через свободные аминогруппы посредством карбаминовой связи с образованием карбгемоглобина
105
R—NHH + HO—C—OH R—NH—C—OH + HaO
Эти соединения нестойки и быстро диссоциируют в легочных капиллярах, выделяя COs.
Специфичность гемоглобинов. Видовые различия гемоглобинов, столь сходных по общей структуре и по своей функции, обусловлены различным сочетанием аминокислот в молекуле глобина. Среднее число различий во всех полипептидных цепях гемоглобина лошади, свиньи, быка и кролика по сравнению с гемоглобином человека составляет около 22.
Получены многочисленные доказательства существования различных гемоглобинов у одного и того же вида. У человека и животных прежде всего различают нормальный гемоглобин, получивший название гемоглобина А (НЬА) и эмбриональный гемоглобин (HbF), который заменяется на НЬА вскоре после утробной жизни. В физиологических условиях сродство к кислороду у эмбрионального гемоглобина выше, чем у взрослого. Между этими формами гемоглобина имеются различия по аминокислотному составу и они проявляют неодинаковую абсорбцию в ультрафиолетовом свете.
Кроме нормального и эмбрионального гемоглобинов, у человека и животных обнаружены аномальные формы гемоглобинов. Так, у человека открыто свыше 30 аномальных форм, получивших соответственно название гемоглобинов S, С, D, Е и др. HbS благодаря своей плохой растворимости легко выпадает в осадок, который обратимо изменяет двояковогнутую дисковидную форму эритроцита на заостренную, серповидную. Отсюда такой гемоглобин получил название серповидного. HbS обладает меньшим сродством к кислороду, что и обусловливает вызываемую им особую форму анемии. Серповидноклеточная анемия — это наследственное заболевание, причиной которого является мутация в одном из генов, участвующих в биосинтезе гемоглобина. Эта мутация выражается в замене глютаминовой кислоты в положении 6 на валин в каждой из fj-цепей. Различия в первичной структуре выявлены и для других аномальных гемоглобинов. Большинство из них обладает пониженным сродством к кислороду по сравнению с нормальным гемоглобином.
106
Соединение гемоглобина с газами. Гемоглобин способен легко соединяться не только с кислородом, но и с другими газами, не изменяя при этом валентности железа.
Оксигемоглобин НЬО2 образуется в результате присоединения кислорода к гемоглобину. При этом меняются не только свойства простетической группы, но и физические и химические свойства глобина.
Карбоксигемоглобин (НЬСО)—более прочное (примерно в 200 раз) соединение, чем оксигемоглобин. Гемоглобин имеет большое сродство к СО. Если в воздухе находится 1% СО, то 95% гемоглобина переходит в карбоксигемоглобин. Окись углерода легко вытесняет из оксигемоглобина кислород, поэтому при вдыхании СО большая часть гемоглобина крови переходит в НЬСО, в результате чего нарушается процесс переноса кислорода от легких к тканям. В карбоксигемоглобине, как и в гемоглобине и оксигемоглобине, железо двухвалентное. Если в воздухе нет СО, карбоксигемоглобин разлагается с образованием гемоглобина. Поэтому вдыхание свежего чистого воздуха приводит к нормализации транспорта кислорода.
Метгемоглобин (НЬОН) образуется при воздействии окислителей на гемоглобин. В его состав входит трехвалентное железо. Метгемоглобин может образоваться в животном организме при продолжительном вдыхании окислов азота, паров нитробензола, анилина и других окислителей. Он не способен соединяться с кислородом, поэтому при образовании метгемоглобина нарушается нормальное питание тканей. В животном организме метгемоглобин медленно восстанавливается в гемоглобин. Отмечено, что аскорбиновая кислота ускоряет этот процесс.
Спектральные свойства гемоглобина и его производных. Окраска гемоглобина и его производных различная: гемоглобин красного цвета, оксигемоглобин ярко-красный, метгемоглобин темно-красный, а карбоксигемоглобин — розового цвета. Каждое из этих соединений характеризуется присущей ему абсорбцией (поглощением) света (рис. 20). Поэтому если на пути луча между источником света и призмой спектроскопа помещен раствор какого-нибудь из этих соединений, то в результате избирательной абсорбции лучей определенной длины волны
107
на спектре получатся неосвещенные, темные полосы. Та-кой спектр носит название спектра поглощения.
Раствор оксигемоглобина обладает резкой абсорбцией в видимой части спектра, обнаруживая две полосы поглощения, расположенные между фраунгоферовыми линиями D и Е. Середина полосы поглощения, лежащей ближе к линии D, соответствует длине волны 576 нм и называется полосой а. Вторая полоса, более широкая и с менее резкими краями, находится ближе к линии Е, ее середина соответствует длине волны 540 нм. Эта полоса называется полосой р.
Между ними при длине волны 560 нм находится минимум поглощения.
При добавлении к оксигемоглобину восстанавливающих веществ спектр его изменяется и вместо двух полос поглощения появляется одна более широкая полоса. Середина ее соответствует длине волны 555 нм. Это спектр гемоглобина.
Спектр метгемоглобина представляет собой три полосы поглощения: две из них находятся между линиями D и Е, а одна, наиболее резкая, соответствующая длине волны 630 нм, — между линиями С и D.
Спектр карбоксигемоглобина — две полосы поглощения при длине волны 572 и 537 нм между линиями D и Е —• очень сходен со спектром поглощения оксигемоглобина. Чтобы различить их, к растворам этих веществ добавляют раствор восстановителя. При этом в отличие от оксигемоглобина на спектре карбоксигемоглобина не наблюдается никаких изменений, так как он не переходит в гемоглобин.
Сульфгемоглобины, гемохромогены и другие соединения, образующиеся в результате превращений гемоглобина, характеризуются различной окраской и специфическими спектрами поглощения.
По спектрометрическим данным, гемоглобин разных животных не различается. Если и существует очень незначительная разница в расположении полос поглощения, то она отчетливо не улавливается.
Спектрометрический анализ гемоглобина и его производных имеет важное практическое значение, так как позволяет быстро устанавливать превращения гемпро-теина.
108
Физико-химические свойства гемоглобина и гема. Различные виды гемоглобинов отличаются по растворимос-тц. Растворимость их убывает в следующей последовательности: гемоглобин человека, затем быка, свиньи, ло-щади.
Способность к кристаллизации проявляется в обратном порядке.
Различаются гемоглобины и устойчивостью к щелочной денатурации. Гемоглобин кролика в 30 раз, а гемоглобин быка, свиньи и овцы в 1000 раз более устойчив к денатурации, чем гемоглобин человека.
Гем 1 является нестойким соединением. Отщепляясь от глобина, он легко окисляется с образованием гемина — комплекса порфирина с трехвалентным железом (феррипротопорфирин). При обработке растворов гемоглобина разведенными минеральными кислотами или щелочами выделяется окисленная форма гема — гематин (гидроокись феррипротопорфирина)
N N
Fe3+—ОН N \
При воздействии на растворы гемоглобина концентрированной уксусной кислоты в присутствии NaCl гем окисляется и выделяется в виде хлоргемина
‘ N N
Fe3+—Cl
Обработка растворов гемоглобина концентрированной серной кислотой приводит к образованию гематопорфирина — соединения тетрапирроловой структуры.
При денатурации глобина, даже частичной, увеличивается чувствительность гема к окислению.
1 Для удобства структуру гема и его производных обозначаем условными формулами, в которых четыре атома азота представляют собой соответствующие кольца порфирина.
109
При восстановлении гематина, например сернисты^ аммонием в присутствии денатурированного глобина, образуется гемохромоген — соединение денатурированного глобина с гемом
Разведенная кислота. или щелочь Нагревание при доступе Воздуха Восстановление
Гемоглобин (Fz2'] (Гем + нативный делок)
Гематин (Fe3B
+Денатурированный глодан в присутствии венштр рироданного глодана —
Гемохромоген (Гег)
В результате нагревания оксигемоглобина отщепляется гематин, образующий с органическими основаниями бурные парагематины.
Нативный глобин можно получить при осторожном прибавлении к раствору гемоглобина соляной или щавелевой кислоты. Отщепляющийся при этом гемин извлекают диэтиловым эфиром, а глобин осаждается в избытке ацетона или осаждением NaCl. Глобин сравнительно легко подвергается денатурации и диссоциации на составляющие полипептидные цепи.
ЛЕЙКОЦИТЫ И ТРОМБОЦИТЫ
Химический состав лейкоцитов убойных животных изучен еще недостаточно. Из белков в лейкоцитах обнаружены параглобулины, нуклеопротеиды, цитоглобин и др. В лейкоцитах содержится значительное количество протеолитических и липолитических ферментов, а из углеводов —• гликоген и некоторое количество сахара.
Лейкоциты как самостоятельная фракция при промышленной переработке крови пока не используются, но входят в состав препаратов, изготовляемых из форменных элементов.
Тромбоциты представляют собой весьма лабильные образования, которые при изъятии крови быстро разрушаются.
Разрушение тромбоцитов является начальным моментом свертывания крови, так как они содержат агенты, участвующие в этом процессе.
110
БИОХИМИЧЕСКИЕ ПРЕВРАЩЕНИЯ ИЗЪЯТОЙ
КРОВИ
СВЕРТЫВАНИЕ
Процесс свертывания
После изъятия из кровеносных сосудов кровь через несколько минут свертывается. При этом образуется сгусток из сетки нитей фибрина, заполненной форменными элементами и сывороткой. Через определенный промежуток времени начинается ретракция сгустка: нити фибрина укорачиваются, сгусток уменьшается в объеме, из него выжимается сыворотка.
Способность крови свертываться при травме кровеносных сосудов является одним из наиболее важных защитных приспособлений животного организма. При жизни животного в большом круге кровообращения кровь не свертывается благодаря наличию в ней физиологических антикоагулянтов. Кроме того, для предотвращения тотальной закупорки кровеносных сосудов тромбами имеется биохимический механизм их разрушения — фибринолиз при воздействии активного фермента — плазмина.
Скорость свертывания крови различных животных неодинакова: кровь крупного рогатого скота свертывается через 6,5—10 мин, свиней — через 3,5 — 5 мин, овец — через 4—8 мин, лошадей — через 11,5—15 мин, а скорость свертывания крови домашних птиц менее 1 мин Различная скорость свертывания крови обусловливается разной концентрацией естественных антикоагулянтов в плазме крови животных. Немаловажную роль играют и видовые различия в концентрации фибриногена.
Образование фибриновой основы сгустка — заключительный этап свертывания крови, которому предшествует ряд превращений, связанных с взаимодействием многих компонентов крови ферментативной и неферментативной природы. Реакции, протекающие при свертывании крови, находятся в тесной взаимосвязи, причем для осуществления каждой последующей реакции необходимо, чтобы произошли все предыдущие.
Все вещества, участвующие в процессе свертывания крови, кроме кальция (фактор IV), являются белками.
111
Их обычно обозначают римскими цифрами (I — XIII). Процесс свертывания крови состоит из профазы — образования полного тромбопластина (тромбокиназы) и двух основных фаз — образования тромбина из протромбина и превращения фибриногена в фибрин.
Для быстрого образования из неактивного тромбопластина тромбоцитов активной тромбокиназы (или полного тромбопластина) необходимы ионы кальция, антигемо-фильный глобулин А (VIII) и еще четыре фактора (IX — XII)—различные белковые вещества, находящиеся в плазме крови
Тромбопластин тромбоцитов (III) -f- Са2+ (IV) ->Полный тромбо-
-V । | | | Y
VIII, IX, X, XI, XII
пластин (тромбокиназа)
Превращение протромбина в тромбин осуществляется следующим образом:
Активная тромбокиназа, Са2+, акцелерин, конвертин Протромбин —-i-------i—► Тромбин
II Тромбопластин тканей
Тканевый тромбопластин — это вещество липопротеидной природы, освобождающееся при повреждении тканей. Акцелерин (VI) образуется из своего предшественника проакцелерина (V), а конвертин из проконвертш на (VII), находящихся в плазме крови.
Образовавшийся активный тромбин воздействует на фибриноген (I), превращая его в фибрин-мономер. В ходе превращения от молекулы фибриногена отщепляется четыре пептида — два пептида типа А и два пептида гги-па В. Строение фибринопептидов А, отщепляемых тромбином от различных фибриногенов:
19 18 17 16 15 14 13 12 11 10 9 8 7
Бык Глю-Асп-Гли-Сер-Асп-Про-Про-Сер-Гли-Асп-Фен-Лей-Тре-
6 5 4 3 2 1
Глю-Гли-Гли-Гли-Вал- Арг-
19 18 17 16 15 14 13 12 И 10 9 8 7
Овца Ала - Асп - Асп - Сер - Аси - Про - Вал - Гли -Г ли - Глю - Фен - Лей - Ала -
6 5 4 3 2 1
Глю-Гли-Гли (-Гли, Вал)-Арг-
112
ВС D ЕВ F
Рис. 20. Cuckipli 1101 лощения:
/ — солнечный спектр; 2 — оксигемоглобин; J — юмоглобин; 4— карбооксигемо* глобин; 5 — метгемоглобин (нейтральный); 6— гемохромоген (щелочной).
17
Свинья Ала-Глю-Вал-Гли-Асп-Лиз-Гли-Глю-Фен-Лей-Асп-
1
Глю(-Гли, Гли, Гли, Вал)-Арг-
16
Кролик Вал-Асп-Про-Гли-Глю-Тре-Сер-Фен-Лей (-Тре, Глю, Гли,
Гли)-Асп-Ала-Арг-
16
Человек Ала-Асп-Сер-Гли-Глю-Гли-Асп-Фен-Лей-Ала-Глю-
1
Гли-Гли-Гли-Вал-Арг-
Ниже приведена структура цепей фибриногена человека и фибрин-мономера, образующегося при воздействии тромбина,
Две
А-цепи.
Пептиды, отщепляемые тромбином
14 остатков , дла---------------
Связи, расщепляемые ТРОМБИНОМ
Арг—LfjiM
14 остатков А дла-——-------------
Цепи, остающиеся в молекуле фиврина
12 остатков • Пир - Глу —--------
Дрг-*~(ли
Две
В-цепи
„ _ 12 остатков
Пир - Глу —---------
Арг-г-Гли
Две
Тир
Тир
Фибрин
Фибриноген
Молекулы фибрин-мономеров при достижении определенной критической концентрации в присутствии ионов кальция начинают соединяться между собой по типу «конец с концом» и «бок о бок» с образованием трехмерной белковой сети, а затем и сгустка. Агрегация проис-
5-454
113
ходит за счет неполярных и водородных связей, взаимодействия ионных групп. Важная роль принадлежит образованию поперечных, так называемых «изопептидных» связей
!
сн2
сн2 сн2 сн2
о
Н II
,N. I /С-.
Ю N
СИ, н
сн.
Остаток лизина
СИ;
rH2N Остаток I глутамина!
сн2 и
I I
Трансглузаминаза
Тс?7 ”
сн.
ИзопептиднаяМ ' H связь |
‘NH3
сн;
сн, н
I сн2
I
,тч
Растворимый фибрин
N' I С I Н II н о
Нерастворимый фиврин
О
о
Н
Превращение неактивной трансглутаминазы (фактор XIII) в активный фермент — трансглутаминазу — происходит под действием тромбина.
Основные свойства
компонентов свертывания
Фибриноген. Содержание этого белка в крови разных животных неодинаково (см. табл. 7). Фибриногены быка, овцы, свиньи и лошади характеризуются слабой видовой специфичностью, но резко отличаются иммунологически от фибриногена птиц. Образование специфического фибринового сгустка свойственно только нативному фибриногену. Денатурация лишает фибриноген этой способности.
Фибрин. Первые стадии полимеризации фибрин-мо-номеров обратимы; после образования гептамеров или октамеров процесс становится необратимым. Фибрин, об-
114
^азованный в присутствии активной трансглутаминазы и ионов кальция, более устойчив к действию плазмина, чем растворимый фибрин.
Протромбин. Предшественник тромбина. Биосинтез его осуществляется с участием витамина К в печени, откуда он и поступает в кровь. Протромбин, являясь глюкопротеидом, при фракционировании выделяется с фракцией глобулинов плазмы. Основная часть его обнаруживается во фракции «2-глобулинов. Содержание протромбина в крови различных животных неодинаково. Протромбин может связываться некоторыми адсорбентами. Это используется для его выделения и количественного определения.
Тромбин. В циркулирующей крови здоровых животных тромбин не обнаружен. Появляется он при свертывании крови. Температурный оптимум действия тромбина 35—40°С. С понижением температуры активность его снижается, а при О°С вовсе не проявляется, хотя фермент не разрушается.
Тромбопластин (тромбокиназа). Выделяется при разрушении тромбоцитов. Образование активного тромбопластина значительно ускоряется в присутствии тромбина.
Тромбопластин представляет собой лабильный, очень сложный липопротеидный комплекс, состоящий из белка, рибонуклеиновой кислоты и ацетальфосфатидов. Тромбопластин легко расщепляется, теряя активность при удалении фосфатида.
Антигемофильный глобулин. Обнаружен во фракции Рг-глобулинов. В процессе свертывания крови он почти полностью используется и поэтому в сыворотке не обнаруживается. Антигемофильный глобулин очень лабилен, его можно получить из стабилизированной плазмы. Препараты хранят при отрицательных температурах.
Проконвертин и конвертин. Активный конвертин образуется при взаимодействии своего предшественника про-конвертина с тромбопластином с участием ионов кальция. Проконвертин синтезируется в печени при участии витамина К- В сыворотке крови крупного рогатого скота и других животных проконвертин содержится в относительно больших количествах, поэтому она является хорошим источником для его выделения. Выделенный проконвертин стабилен при хранении.
5*
115
Проакцелерин и акцелерин. В циркулирующей крови и стабилизированной плазме содержится проакцелерин, который в процессе свертывания крови активируется тромбином, превращаясь в активный акцелерин. Этот компонент свертывания ускоряет образование активного тромбина из протромбина. Проакцелерин синтезируется в печени. Концентрация его в плазме крови разных животных неодинакова. Акцелерин обладает свойствами глобулина. В крови крупного рогатого скота проакцелерина содержится 0,05%, что составляет 0,7% всех белков плазмы.
СТАБИЛИЗАЦИЯ ИЗЪЯТОЙ КРОВИ
Для предотвращения или замедления свертывания кровь стабилизируют, для чего исключают или нарушают активацию одного из компонентов системы свертывания крови. Роль ингибиторов выполняют вещества различной химической природы, получившие название стабилизаторов, или антикоагулянтов.
Физиологические антикоагулянты. Основными физиологическими антикоагулянтами, предотвращающими прижизненное свертывание крови, являются гепарин, антитромбин, антитромбопластин и др. Эти естественные антикоагулянты замедляют также свертывание изъятой крови.
Гепарин резко снижает активность тромбина, образуя с ним неактивный обратимый комплекс, и тормозит активацию протромбина, соединяясь с тромбопластином также в неактивный комплекс.
По химической природе гепарин является мукополисахаридом, в состав которого входят глюкозамин, глюкуроновая кислота и эфирносвязанная серная кислота. Относительно много гепарина в печени, легких, мышцах, в меньшем количестве он содержится в селезенке, сердце, почках, кишечнике и других органах и тканях.
Препараты гепарина широко используются в качестве естественного стабилизатора крови при ее переливании. Активность их обозначают титром, т. е. количеством миллилитров крови, которое стабилизируется 1 г гепарина в течение 24 ч при комнатной температуре. Кроме того, препараты гепарина являются лечебным средством, ускоряющим процесс фибринолиза.
116
А н т и т р о м б и и — вещество белковой природы, инактивирующее тромбин. Антитромбиновое действие плазмы и сыворотки крови связано с альбуминовой фракцией. Антитромбин осаждается сернокислым аммонием при 65% насыщения. Антитромбиновая активность плазмы сохраняется без изменений при температуре 4°С в течение двух недель.
Антитромбопластин инактивирует тромбопластин в присутствии ионов кальция. По химической природе антитромбопластин является белком фракции глобулинов плазмы, осаждается 40—50%-ным раствором сернокислого аммония, растворим в воде, термолабилен.
Нефизиологические стабилизаторы. При промышленной переработке крови в качестве ее стабилизаторов широко применяют оксалаты (щавелевокислый калий), цитраты (лимоннокислый натрий), одно- и двухзамещенные фосфаты, пирофосфаты, сульфаты и другие стабилизаторы, действие которых сводится к связыванию ионов кальция и тем самым к выключению их из системы свертывания крови. Для предотвращения свертывания крови достаточно удалить половину ионов кальция. На этом основана стабилизация крови с помощью ионообменной адсорбции (кальций крови заменяется натрием ионообменной смолы).
При удалении ионов кальция из системы свертывания затормаживается образование тромбина. Это подтверждается тем, что введение готового тромбина в кровь, освобожденную от кальция, приводит к свертыванию крови.
Другую группу стабилизаторов составляют катионы магния и бериллия, резко угнетающие активность тромбопластина.
При использовании крови на пищевые цели в качестве стабилизатора применяют хлористый натрий, который угнетает тромбин и тормозит превращение фибрин-моно-меров в фибрин-полимеры. Однако стабилизирующий эффект его для крови разных животных оказывается неодинаковым. Так, кровь крупного рогатого скота при добавлении хлористого натрия не свертывается в течение 24 ч, а свиная коагулирует через 10 ч.
Многочисленные синтетические полимерные эфиры сложных углеводов (крахмала, целлюлозы, декстринов и других соединений), получившие название сипантринов,
117
характеризуются сходным с гепарином Протййосйерты-вающим действием. Однако ввиду токсичности они не находят широкого применения.
ДЕФИБРИНИРОВАНИЕ
В ряде случаев при промышленном использовании кровь животных дефибринируют. При дефибринировании изъятой крови путем взбивания фибрин выделяется в виде нитей, которые удаляют. С помощью другого способа дефибринирования собранную кровь обрабатывают в специальных аппаратах — дефибринаторах — с целью разрушения образовавшихся сгустков крови. При этом фибриновые нити разрываются, а заключенная в сгустке кровь освобождается.
При сепарировании стабилизированной цельной крови получают плазму и форменные элементы, а при сепарировании дефибринированной крови — сыворотку и форменные элементы.
Сыворотка по химическому составу близка к плазме крови и приближенно ее можно рассматривать как плазму, лишенную фибриногена. В процессах изъятия фибриногена из плазмы и при отделении форменных элементов разрушаются тромбоциты и их тромбопластические агенты переносятся в сыворотку крови, что приводит к переходу тромбогена в тромбин.
ГЕМОЛИЗ
В процессе хранения и переработки крови при определенных условиях гемоглобин может переходить из эритроцитов в плазму и, растворяясь в ней, окрашивать ее в более или менее интенсивный красный цвет. Такое явление называется гемолизом.
Различают г е м о г л о б и н о л и з — переход в плазму только лабильно связанного гемоглобина — и строма-тол и з — переход в плазму значительной части прочно связанного гемоглобина. Гемоглобинолиз вызывается увеличением проницаемости поверхностного слоя эритроцитов при понижении осмотического давления плазмы, воздействии поверхностно-активных веществ, а также под влиянием других причин. Строматолиз наступает при полном разрушении поверхностного слоя эритроцитов,
118
разрыве липидной связи между стромой и гемоглобином. Причиной такого явления могут быть различные факторы, в частности воздействие органических растворителей, поверхностно-активных веществ, химических агентов, механическое воздействие и т. п.
Наиболее часто при переработке крови гемолиз происходит в результате ее разбавления. Устойчивость эритроцитов разных животных к понижению осмотического давления окружающей среды неодинакова. Наиболее устойчивы эритроциты кроликов, менее устойчивы эритроциты лошадей, крупного рогатого скота и еще менее устойчивы эритроциты свиней. Гемолиз может быть вызван различными солями, в том числе и солями железа. Поэтому во избежание гемолиза следует поддерживать чистоту используемого оборудования.
АВТОЛИТИЧЕСКИЕ ПРЕВРАЩЕНИЯ
Изъятая кровь животных подвержена различным изменениям. При хранении крови большая часть изменений вызывается ферментами( автолитические изменения), а некоторые связаны с естественной неустойчивостью компонентов крови. Если кровь хранить при низкой положительной температуре, то эти превращения можно свести до минимума. При 0°С в случае длительного хранения осаждается значительное количество фибриногена и нерастворимого на холоду глобулина, поэтому более приемлемой для хранения крови является температура несколько выше 0°С.
При хранении в эритроцитах крови происходят гликолитические превращения, приводящие к накоплению молочной кислоты. Кроме того, в результате распада органических фосфорных соединений в плазме увеличивается содержание неорганических фосфатов. Результатом этих превращений является понижение pH крови с 7,3—7,4 до 6,8—7,0.
Понижение кислотности приводит к активации протеиназ лизосом лейкоцитов и выходу их из ограничивающих структур. Активируются и протеиназы эритроцитов. Важными автолитическими изменениями являются и фибринолитические превращения в результате активации плазмина.
119
Протеолитическая активность протеаз тормозится содержащимися в крови антипротеазами. В изъятой крови образованию активного плазмина способствует разрушение его ингибиторов (антипротеаз). При изъятии крови в плазму переходят тканевые активаторы, способствующие активации плазмина. Кроме того, образование плазмина из плазминогена ускоряется автокаталитически. При автолизе крови тромбин способен катализировать превращение плазминогена в плазмин.
К числу факторов, ускоряющих образование активного плазмина, относится также действие ряда ферментов бактериального происхождения, активирующих плазменный проактиватор и превращающих его в активатор (скорость таких превращений повышается с повышением температуры), а также некоторые химические вещества (хлороформ, цианистый и роданистый калий, эфир, тимол, мочевина, салициловокислый натрий и другие солюбилизирующие вещества), которые разрушают ингибиторы плазмина.
Совместное воздействие всех протеиназ вызывает специфический распад фибриногена и фибрина, а также распад других белков крови. В результате этого в плазме нарастает количество белковых фрагментов,- количество остаточного азота при этом увеличивается незначительно, что объясняется специфичностью протеиназ крови.
При хранении крови заметно изменяются липопротеиды плазмы. Хранение сыворотки при 4°С в течение 3 суток в условиях, близких к стерильным, вызывает нарушение устойчивости связи между липидом и белком, в результате чего возрастает скорость экстрагирования липидов эфиром. Наряду с этим происходит окисление липидов, прежде всего каротиноидов, а затем эфиров ненасыщенных жирных кислот, входящих в состав несвязанных липидов и липопротеидов..
БИОХИМИЧЕСКИЕ ПРЕВРАЩЕНИЯ ПОД ВОЗДЕЙСТВИЕМ МИКРОБОВ
Изъятая кровь, будучи хорошей питательной средой для микрофлоры, может быстро подвергаться микробной порче.
Превращения под действием ферментов микробов, опережая собственно автолитические процессы, сводятся
420
большей частью к гнилостному разложению белков крови, при этом выделяются дурно пахнущие вещества: скатол, индол, фенол, меркаптаны и другие вещества распада.
В результате накопления продуктов распада часто происходит гемолиз. Освобождающийся гемоглобин окисляется и переходит в метгемоглобин и другие производные. При воздействий бактерий на продукты распада белков, содержащих серу, образуется сероводород. В присутствии сероводорода и кислорода гемоглобин и оксигемоглобин превращаются в зеленые пигменты — сульфгемоглобин, холеглобин и др. Образовавшиеся пигменты придают испортившейся крови черный оттенок.
Под воздействием ферментов микроорганизмов в крови независимо от превращений гемоглобина протекают процессы окисления ненасыщенных липидов. Однако эти процессы могут вызвать реакции взаимного окисления, ускоряющие как прогоркание липидов, так и окисление гемоглобина.
Легкость бактериального загрязнения крови и чрезвычайно быстрый рост бактерий даже при минимальном загрязнении могут приводить к образованию в крови значительного количества пирогенных веществ. Поэтому во избежание порчи кровь, предназначенную для пищевых целей и особенно для лечебно-питательных препаратов, необходимо перерабатывать очень быстро. Если же сразу после изъятия кровь не перерабатывают, то ее обрабатывают нетоксичными консервантами: поваренной солью или фибризолом (смесь 30% ортофосфата, 30% пирофосфата натрия и 40% хлористого натрия). Эти консерванты одновременно являются и стабилизаторами крови. Кровь, предназначенную для технических целей, консервируют крезолом, фенолом или другими сильными антисептиками.
ИСПОЛЬЗОВАНИЕ КРОВИ
ПИЩЕВАЯ ЦЕННОСТЬ КРОВИ
По биологической ценности среди белковых продуктов питания одно из первых мест принадлежит белкам крови, которые в большей мере, чем другие белки, обладают способностью восстанавливать белки плазмы и гемогло
121
бина. Содержание белков в цельной крови крупного рогатого скота составляет 17,41%, баранов 16,59%, свиней 22,25%.
Цельная кровь убойных животных является сырьем для производства многих колбасных изделий, зельцев, консервов и других продуктов питания. Сыворотка крови также используется как полноценное белковое сырье. В качестве источника белков используют сухие продукты сыворотки крови, получившие название светлого альбумина.
По аминокислотному составу не все белки крови равноценны (табл. 12).
ТАБЛИЦА 12
Аминокислоты
Содержание незаменимых аминокислот, % к общему количеству их в белках крови
альбу мины
глобулины
фибрИ' ноген
гемоглобин
Валин .............................
Гистидин ..........................
Лейцин ............................
Изолейцин
Лизин .............................
Метионин...........................
Треонин ...........................
Триптофан .........................
Фенилаланин........................
Аргинин ...........................
2,5 3,8
13,7
2,9
12,4
1,3
6,5 0,6
6,2
6,2
5,5
3,5
|18,7
6,2
1,0
8,4
2,3
3,8
5,2
3,9 2,3
14,3 5,0 9,0 2,6
7,9 3,5 7,0
6,7
9,1
2,9
16,6
7,5
1,6
6,8
1,2
5,3
2,4
Плазма крови отличается от гемоглобина более высоким содержанием таких незаменимых аминокислот, как триптофан, метионин и изолейцин, В составе гемоглобина нет изолейцина. Вместе с тем в нем содержится много других незаменимых аминокислот, и поэтому в сочетании с другими белками крови его можно рассматривать как важный источник незаменимых аминокислот. Наиболее ценным белком по аминокислотному составу является фибриноген. В нем много триптофана, фенилаланина, метионина, лейцина. Таким образом, использование стабилизированной плазмы позволяет получать белковые продукты большой пищевой ценности. В тех случаях, ког
122
да продукты изготовляют из сыворотки или дефибрини-рованной крови, важно использовать для пищевых целей остающийся фибрин.
Кровь убойных животных является источником многих витаминов. По содержанию витамина А она может быть использована и для лечебных целей. Содержание жира в крови невелико, но он тонко эмульгирован и хорошо усваивается, а фосфолипиды, сопутствующие нейтральным триглицеридам, способствуют лучшему усвоению пищи.
В результате технологической переработки компоненты крови претерпевают ряд превращений. При этом наибольшие качественные сдвиги связаны с превращениями белков. Важным является характер их денатурации. Различные фракции белков неодинаково устойчивы к воздействию повышенной температуры. Так, растворы фибриногена и глобулинов в 10 %-ном хлористом натрии свертываются соответственно при 52—55 и 75°С; раствор альбумина в 5%-ном хлористом натрии свертывается при 75°С, а в чистой воде при 50°С. Скорость денатурации белков резко возрастает при сдвиге реакции в кислую сторону.
Высушивать кровь необходимо таким образом, чтобы белки как можно меньше подвергались тепловой денатурации и не теряли способности растворяться. С этой целью используют распылительные сушилки, так как вследствие чрезвычайно малой величины жидкостных частичек тепловое воздействие на жидкую фазу в зоне распыления кратковременно.
БИОЛОГИЧЕСКИЕ ПРЕПАРАТЫ ИЗ КРОВИ
Кровезаменители изготовляют из крови крупного рогатого скота, специально изъятой в момент убоя или прижизненно (в некоторых случаях после предварительного кровепускания на разных стадиях регенерации крови). Главным в процессе их получения является снятие антигенных свойств белков крови. Из сыворотки крови получают препарат БК-8. Из цельной крови или отдельных ее частей получают гидролизаты, которые используют как средство парентерального питания. К числу таких белковых гидролизатов относится раствор гидролизина,
123
получающийся при кислотном гидролизе, препарат аминопептид, производство которого основано на ферментативном гидролизе белков.
Из крови убойных животных изготовляют фибринные пленки (пластический материал при ожогах, плохо заживающих ранах и язвах), из сухой крови получают активированный уголь (при различных желудочно-кишечных заболеваниях, плохо заживающих гнойных ранах и т. д. используется как вещество, адсорбирующее газы и растворенные вещества).
Для изготовления лечебно-питательных препаратов (жидкого или сухого гематогена) используют дефибри-нированную жидкую или сухую кровь, а также предварительно стабилизированную сухую кровь. Гематоген применяется при лечебно-профилактическом питании и в комплексной терапии, направленной к стимуляции кроветворения.
Г лава III.
БИОХИМИЯ СОЕДИНИТЕЛЬНОЙ, ЖИРОВОЙ, КОСТНОЙ И ПОКРОВНОЙ ТКАНЕЙ
Соединительная ткань принимает участие в построении органов животного и его скелета, объединяет отдельные части организма, участвует в передаче механических усилий. Кроме того, она выполняет защитные функции и играет роль запасного депо жировых веществ, необходимых для жизнедеятельности организма. Некоторые соединительнотканные элементы участвуют в построении разнообразных тканей, в частности мышечной, покровной, пищеварительного тракта и др.
В зависимости от функционального назначения соединительная ткань в процессе эмбрионального развития дифференцируется. При этом образуются ткани, резко различающиеся по свойствам и строению: собственно соединительная, хрящевая и костная.
Соединительная ткань представляет собой систему, состоящую из аморфного основного (межклеточного) вещества, тончайших волокон и форменных элементов — клеток (рис. 21). В зависимости от вида соединительной ткани основное вещество может находиться в. различном состоянии. Так, у собственно соединительной ткани оно полужидкое, слизеподобное, с различимыми под электронным микроскопом тончайшими мембранами. В результате химических изменений основное вещество уплотняется с сохранением некоторой эластичности, превращаясь в хрящевую ткань. Дальнейшее уплотнение основного вещества в результате накопления минеральных солей приводит к образованию весьма прочной костной ткани.
125
В межклеточном веществе в виде хаотических переплетений, а иногда упорядоченно (в виде пучков) находятся разнообразные по строению и химической природе волоконца. В соединительной ткани некоторых видов (например, в сухожилиях) они заполняют все межклеточное пространство.
Рис. 21. Строение рыхлой соединительной ткани:
7— коллагеновые волокна; 2 — эластиновые волокна; 3— клетка; 4— ядро.
Различают три вида волоконец: коллагеновые, эластиновые, ретикулиновые. Свойства собственно соединительной ткани меняются в зависимости от преобладания тех или иных волоконец. Между волоконцами находится небольшое количество форменных элементов — клеток соединительной ткани, играющих важную роль в развитии, питании и жизнедеятельности ткани.
Соединительная ткань составляет в среднем около 16% мясной туши большинства домашних животных, причем распределение ее по частям туши и качественный состав весьма разнообразны. От этого в значительной мере зависят потребительские достоинства мяса.
Соединительная ткань как сырье используется в колбасном, кулинарном, желатиновом, клееварочном и других производствах.
По эмбриональному развитию, строению морфологических компонентов и по содержанию (в преобладающем количестве) однотипных белковых веществ — склеропротеинов — к соединительной ткани близка покровная ткань.
1¥
СОБСТВЕННО
СОЕДИНИТЕЛЬНАЯ
ТКАНЬ
В зависимости от соотношения основного вещества и разнообразных волоконец, а также химических особенностей составных частей в организме различают следующие разновидности соединительной ткани: рыхлую (подкожная клетчатка), плотную (сухожилия), эластическую (шейная, или выйная, связка) и слизистую.
Химический состав различных видов собственно соединительной ткани в зависимости от ее строения и функциональных особенностей неодинаков (табл. 13).
ТАБЛИЦА 13
Химический состав соединительной ткани Содержание составных частей, %
плотная (сухожилия) эластическая (выйная связка)
Вода 62,9 57,6
Органические вещества В том числе: 36,6 41,9
жиры и другие липиды .... 1,0 1,1
белки (альбумины и глобулины) 0,2 0,6
тендомукоид . 1,3 0,5
эластин 1,6 31,7
коллаген 31,6 7,5
экстрактивные вещества .... 0,9 0,8
Неорганические вещества 0,5 0,5
Воды в соединительной ткани содержится значительно меньше, чем в мышечной. В составе сухого остатка преобладают органические вещества, особенно белки, относящиеся к группе протеиноидов, или склеропротеинов, содержание которых варьирует. В сухой остаток входит также некоторое количество углеводов, липидов, экстрактивных и минеральных веществ.
БЕЛКОВЫЕ ВЕЩЕСТВА
Наиболее характерными компонентами соединительной ткани являются специфические белковые вещества, главным образом структурные белки — склеропротеины: кол
127
лаген, эластин, ретикулин, образующие прочные и эластические волокнистые структуры. Особенностью белков этой группы является удлиненная форма молекулы, обусловленная параллельно расположенными полипептидны-ми цепями. В составе элементарных волоконец склеропротеинов имеются мукополисахариды.
В состав основного вещества соединительной ткани входят специфические белки муцины и мукоиды, отличающиеся от других склеропротеинов по строению и физико-химическим свойствам. В соединительной ткани содержатся в меньшем количестве также и другие белки — альбумины, глобулины, нуклеопротеиды и т. п.
Коллаген
Коллаген (греч. colla — клей, gennao — порождаю) является клейдающим веществом, которое при нагревании с водой образует клей или желатин.
Коллаген — наиболее распространенный представитель группы протеиноидов. Он составляет около 30% всех белков животного организма. Коллаген входит в состав рыхлой и плотной соединительной, костной, хрящевой и покровной тканей, участвует в образовании сухожилий, связок, фасций. Распределение коллагена в различных тканях характеризуется следующими данными (в % к сырой ткани).
Сухожилия............25—35
Кости................10—20
Хрящи...............10—15
Кожа................15—25
Стенки сосудов .... 5—12
Скелетные мышцы . 1—2
Почки.............0,4—1
Печень............0,1—1
Мозг .............0,2—0,4
По различию образования желатина под действием горячей воды коллаген подразделяют на волокнистый (в дерме и сухожилиях), гиалиновый (в костной ткани — оссеин), хондриновый (в составе хрящей), ихтуллино-вый (в составе рыбьего пузыря).
Ихтуллиновый коллаген переходит в клей уже при 40°С.
Коллаген — основа коллагеновых волокон (диаметр их 2—10 мкм), представляющих собой пучки мельчай-
128
Ших фибрилл, для которых характерна значительная ме
ханическая прочность: они лишь слегка растяжимы-— предел упругости влажных волокон составляет 7% к ис-
ходному состоянию.
Период поперечной исчерченности коллагеновых волокон 64 нм, что свидетельствует о повторяемости опре
деленных химических групп в структуре молекулы (рис. 22). Согласно результатам рентгеноструктурного
анализа короткие промежутки вдоль оси волокон коллагена с периодом идентичности 0,28 нм соответствует длине аминокислотного остатка в цепи, расстояние между главными цепями равно 0,46 и 1,1 нм. Рентгеноструктура коллагена иная, чем у кератина.
Коллаген имеет фибриллярное строение и состоит главным образом из нитевидных частиц (протофибрилл), для которых характерно явление двойного лучепреломления. По данным электронной микроскопии, диаметр протофибрилл 50— 100 нм.
Рис. 22. Электронная микро грамма коллагеновой фибриллы.
По элементарному химическому составу (табл. 14) (оллаген отличается от боль-
щинства белков (например, альбуминов, глобулинов) повышенным содержанием азота — в среднем 17,6% (колебания от 17,0 до 18,3%). Коэффициент пересчета азота на белок для коллагена равен 5,68.
Коллаген характеризуется некоторыми особенностями аминокислотного состава. В отличие от других белков в коллагене не содержатся триптофан, цистин и цистеин, очень мало тирозина и метионина, но преобладают гли-кокол, пролин и оксипролин 1 (табл. 15), а также оксили-
1 Содержание коллагена определялось по оксипролину.
129
ТАБЛИЦА 14
Элементарный химический состав Содержание химических элементов в белках, % к абсолютно сухой ткани1
коллаген ретикулин эластин
Вода 20,00 12,50 18,00
Азот 17,60 11,96 16,20
Углерод 47,58 45,09 54,20
Водород 6,85 6,43 7,26
Сера 0,47 1,37 0,40
Кислород — — 16,80
1 Данные получены при анализе соединительной ткани, освобожденной от растворимых белков и полисахаридов.
ТАБЛИЦА 15
Аминокислоты Содержание аминокислот, % от массы белка
коллаген желатин проколлаген эластин ретикулин
Аланин 9,1/107* 9,0 8,5 18,9 7,7
Аргинин 10,0/49 10,0 8,8 0,89 14,4
Аспарагиновая кислота . . 6,8/47 6,7 5,3 0,63 4,2
• Валин 4,0/29 2,5 _— 17,4 2,1
•Гистидин 0,8/5 0,7 2,5 0,07 1,3
Гликокол 26,0/363 26,0 26,0 29,9 24,6
Глютаминовая кислота . . 11,8/77 11,8 11,4 2,1 6,1
• Лейцин 3,22/28 5,3** -—. 12,7 4,3
• Изолейцин 1,66/15 — — - —
'Лизин 4,1/31 4,0 4,6 0,39 3,4
’ Метионин 0,8/5 0,6 0,62 0,03 0,6
’ Оксилизин 1,3/7 1,3 .— — 1,9
Оксипролин 13,2/107 14,7 20,0 1,92 3,6
Пролин 15,16/131 17,5 — 17,0 7,7
Серин 3,9/32 3,1 — 0,82 3,4
Тирозин 1,0/5 0,4 0,0 1,61 0,2
* Треонин 2,3/19 2,2 — 0,96 1,7
•Триптофан 0,0/0 0,0 0,0 0,01 —
Фенилаланин 3,5/15 2,5 2,4 5,0 1,4
• Цистин 0,0/0 0,0 0,0 0,15 —
Цитруллин — 0,0 0,2 — —
* Вторые цифры — числа аминокислотных остатков на одну молекулу белка.
** Лейцин-j-изолейцин.
130
Йин, не обнаруженный в других белках. Следовательно, ро аминокислотному составу коллаген не является полноценным белком.
Гликокол составляет почти 'Д, пролин и оксипролин также ’Д часть всех аминокислотных остатков коллагена. Оксипролин в таких больших количествах найден только в коллагене.
Для первичной структуры коллагена характерно наличие такой последовательности чередования 18 аминокислот в полипептидной цепи: Гли-Про-К-Гли-Опро-Д-Гли-Про-R (R— другие аминокислоты):
Пролим или Другие
оксипролин Глицин аминокислоты
0,85 нм
Присутствие пролина и оксипролина обусловливает наличие, кроме пептидной связи, связи типа —СО—N\ с иными свойствами. Остатки пролина и оксипролина не участвуют в образовании а-спирали в связи с отсутствием у них NH-группы, а так как на долю этих аминокислот приходится 22% остатков, то в молекуле коллагена нет а-спирали. В коллагене в значительном количестве находятся диамино- и аминодикарбоновые кислоты с наличием полярных остатков. Среди пептидов, выделенных из коллагена, имеются такие, в которых полярные аминокислоты связаны между собой. Это дает основание предполагать, что распределение тяжелых полярных аминокислот возможно в одной, а легких — в другой области молекулы.
Общее количество аминокислот в полипептидной цепи — первичной структуре коллагена составляют около 1000. Молекулярная масса такой цепи около 120000.
На основании рентгеноструктурного анализа считают, что молекула коллагена построена из трех полипептид-ных цепочек (триплет), скрученных вместе вокруг общей оси (рис. 23). Они образуют третичную структуру коллагена с молекулярной массой около 360 000, длиной 280 и диаметром 1,4 нм. Такую молекулу называют «тропо-
131
коллагеном» (возможно он идентичен проколлагену). Частицы указанного размера и строения представляют собой структурную единицу — «мономер», или молекулу
коллагена.
Рие. 23. Спираль коллагена из трех цепей аминокис-
В результате агрегации молекул тропоколлагена в продольном (конец с концом) и поперечном направлениях происходит образование четвертичной структуры коллагена — протофибрилл, представляющих собой тончайшие волоконца, обладающие поперечной ис-черченностью (рис. 24). Протофибриллы объединяются в фибриллы — более крупные единицы, имеющие диаметр в пределах сотен нанометров, видимые в электронном микроскопе.
В построении тропоколлагена, протофибрилл и фибрилл участвуют глюкоза, различные мукополисахариды (гиалуроновая кислота, хондроитинсульфат С), выполняющие роль стабилизирующего, цементирующего вещества. Под действием ультразвука
лот- коллагеновые волоконца расщепляют-
ся на отдельные фибриллы, обладающие поперечной исчерченностью (см. рис. 22). Природа исчерченности пока еще не нашла исчерпывающего объ-
о
о проторшбрилла
о
Молекулы тропоколлагена МО нм *1 Анн)
о-<|оЧ ~ °55 \fuSPiwa
---о<-----
-----------
— 0<-
Рис. 24. Схема агрегации молекул тропоколлагена с образованием . . коллагеновых волокон.
132
яснения. Исчерченность могла возникнуть за счет агрегации тропоколлагена; при этом получается определенная чередуемость аминокислотных остатков — участки полярных кислот образуют светлое, а неполярных — темное поле. Возникновение исчерченности можно также объяснить тем, что участвующие в образовании фибрилл полисахариды размещаются у концов контактирующих молекул тропоколлагена; полосатость исчезает при извлечении полисахаридов.
В составе коллагена имеется 0,86% углеводов и 0,05% гексозаминов. Изоэлектрическая точка коллагена животных разного возраста неодинакова.
Коллаген pH
из шкуры теленка . ................ 6,36
из шкуры крупного рогатого скота 7,0
Желатин из шкуры крупного рогатого скота .......................... . 4,7—5,2
Изоэлектрическая точка желатина (продукт деструкции коллагена) сдвинута в более кислую сторону, что связано с освобождением кислотных групп при деструкции молекул коллагена во время его нагревания.
Коллаген может сильно набухать, причем масса его увеличивается в 1,5—2 раза. По этому свойству он уступает миозину, но резко превосходит такие протеиноиды, как ретикулин, эластин, кератин и др. Данные о набухании волокнистых белков при pH 5—7 (масса набухшего белка в % к массе сухого) приведены ниже.
Коллаген...........200
Миозин ...... 300
Ретикулин .... 30
Эластин ..... 25
Кератин (конский
волос) ..... 40
Связывание воды коллагеном обусловлено гидратацией функциональных групп, пептидных связей белка за счет образования водородных связей: ОН-группа связывает 2—3 молекулы воды; СООН — 3—4, СО—2- NH2—1; NH —2.
Способность коллагена к набуханию имеет большое практическое значение для мясного, желатинового и ко
133
жевенного производства (из набухших волокон получается желатин лучшего качества).
Нативный коллаген нерастворим в воде и органических растворителях и в очень слабой степени подвергается воздействию разведенных кислот, щелочей и протеолитических ферментов. Иногда этими свойствами пользуются для выделения коллагена из ткани; с помощью гидролизирующих агентов можно удалить все белки, кроме коллагена. Однако более продолжительное воздействие кислот, щелочей и ферментов вызывает необратимое изменение коллагена. Нерастворимость и устойчивость коллагена объясняются наличием особых поперечных связей в его молекуле. Такие связи образованы прежде всего при участии оксипролина. Между пептидными цепями в молекуле коллагена возникают водородные связи между СО-группами пептидной связи и ОН-группами оксипролина
—С—NH— II
Р н
Й-0—J----|Н2О
Н|| н2\ /—C-NH-NH
В модельных опытах показано, что возникновение поперечных связей в нативных фибриллах происходит через шиффовы основания. Внутримолекулярные и межмолекулярные поперечные связи образованы и сложными эфирными связями. В последнее время показано участие в построении сложных эфирных связей молекул гексоз за счет их гидроксильных групп.
Для коллагена характерно взаимодействие с рядом химических соединений, называемых дубителями [танни-ды, хромовые соли, альдегиды (формальдегид), хиноны и др.].
В результате дубления коллаген становится инертным к действию кипящей воды, весьма стабильным по отношению к протеолитическим ферментам и к механическим воздействиям.
Нативный коллаген, находясь в составе соединительнотканных образований (сухожилия, шкура и др.), довольно медленно переваривается пепсином. Скорость пе’
134
реварйвайия зайисит От степени изМельйения коллагейо* вого сырья (чем мельче объект, тем скорее гидролизуется белок) и pH среды (переваривание ускоряется в кислой среде, вызывающей набухание коллагена).
Нативный коллаген довольно стойко противостоит также воздействию трипсина, химотрипсина, катепсинов. Благодаря этому трипсин нередко применяют для очистки коллагена от других белков. Из поджелудочной железы выделили фермент коллагеназу, активный и специфический по отношению к коллагену.
Для структуры коллагеназы характерно высокое содержание оксипролина (1%) и пролина (7,5%), что коррелирует с соотношением данных аминокислот и в коллагене. Избирательная активность в действии этого фермента (расщепляет связи, образованные пролином) на коллаген видна из следующего сопоставления. Расщепление коллагена (в %) за одинаковое время составляет при действии коллагеназы 75—87,5%, трипсина — 29%; эластазы — 12%. Препарат коллагеназы получают на мясокомбинатах.
Коллагеназа входит в состав некоторых бактерий, чем объясняется гнилостный распад коллагена. Недавно выделенный из бактерий препарат проназа (комплекс ферментов) может расщеплять поперечные связи молекулы тропоколлагена с высвобождением мономерных цепочек из тройной спирали. По-видимому, таким же свойством обладает и другой препарат — фермент протелин.
При нагревании коллагена с водой (до 63—64°С) его волокна деформируются, изгибаются, длина их сокращается до Уз первоначальной величины. Одновременно с этим они теряют поперечную исчерченность, становятся более эластичными (каучукоподобными) и прозрачностекловидными. Под микроскопом можно обнаружить очень сильную гомогенизацию их микроструктуры.
Такое изменение свойств коллагена при нагревании (называемое свариванием) — явление необратимое. В результате сваривания повышается количество таннидов, фиксируемых коллагеном, в результате разрыва некоторых поперечных солевых мостиков и водородных связей между пептидными цепочками белка, и освобождения скрытых функциональных групп.
Сваренный или перешедший в желатин коллаген легко переваривается трипсином, так как ввиду нарушения
135
водородных связей у молекулы коллагена и потери, пространственной ориентации полипептидных цепей, разрушения четвертичной, третичной структуры увеличивается доступность пептидных связей белка для ферментативного воздействия.
При сваривании коллагена в раствор переходит около 60% мукоидов, содержащихся в ткани, и это обусловливает потерю полосатости волокон коллагена.
Имеется связь между температурой сваривания и содержанием оксипролина в коллагенах, так как оксипролин участвует в образовании поперечных связей. Чем больше оксипролина содержится в коллагене, тем выше температура сваривания. Предварительное разрушение поперечных связей щелочью снижает температуру сваривания.
При разрыве большинства поперечных связей коллаген переходит в водорастворимое вещество — желатин (глютин). Это наблюдается в том случае, если коллаген в течение долгого времени нагревать в воде при температуре 65—90°С.
Скорость перехода коллагена в желатин зависит от вида животного, вида сырья, температуры и предварительной обработки главным образом щелочами и кислотами.
Различают желатин щелочного и кислотного способов обработки. Чем больше разрыхлен коллаген, тем ниже температура его перехода в раствор. Так, для выделения глютина из нативной шкуры крупного рогатого скота надо 120°, а из шкуры, обработанной Са(ОН) в течение месяца и обеззоленной, достаточно 60°С.
Изоэлектрическая точка желатина щелочного метода 4,5—5,1, а кислотного 7,5—9,1. Величина изоэлектрической точки в первом случае объясняется гидролизом амидов, удалением NH3 и частичным разрушением гуанидиновых групп аргинина. Механизм повышения изоточки до pH 9,0 при кислотном методе не выяснен.
Набухший коллаген разваривается значительно быстрее, более полно и при менее высокой температуре (55— 60°С), что используется при получении желатина'высокого качества.
Переход коллагена в желатин осуществляется в основном в три стадии: 1) плавление полипептидных спиралей, 2) разрыв межцепочных связей, 3) гидролиз пептидных
136
связей. В зависимости от предварительной обработки коллагена кислотой или щелочью такая последовательность может нарушаться.
Препараты желатина, полученные после предварительной кислотной или щелочной обработки, различаются между собой. У желатина щелочной обработки частипы преимущественно состоят из одной цепочки, а у желатина кислотной обработки представляют собой пачки цепочек, соединенных поперечными связями.
Золи желатина в отличие от золей природных белков полидисперсны. Средняя масса его частиц в различных препаратах может варьировать от 10000 до 360 000. Растворы желатина очень вязкие. Характерно для желатина образование студня — геля. Гель желатина представляет собой сетку макромолекул и мицелл, соединенных между собой предельным количеством слабых связей — ван-дер-вальсовым притяжением или водородными мостиками. При нагревании до 45°С студень растворяется, так как повышение температуры и колебательные движения молекул способствуют разрыву лабильных связей.
Характерным свойством геля желатина является его способность к набуханию. Минимальное набухание происходит при изоэлектрическом состоянии желатина (pH 4,7). Набухание усиливается и достигает 100— 1000% при сдвиге pH в кислую сторону до 3,3—3,6, а при сдвиге реакции в щелочную сторону это увеличение менее значительно.
Желатин, как и другие белки, обратимо осаждается спиртом, нейтральными солями, т. е. водоотнимающими средствами. Характерно для желатина осаждение танни-ном, пикриновой кислотой и солями тяжелых металлов. В отличие от большинства белков желатин не осаждается трихлоруксусной и метафосфорной кислотами.
При кипячении со слабыми кислотами или в воде желатин быстро гидролизуется и теряет способность к образованию геля.
Продукты промежуточного гидролитического распада желатина при длительном его нагревании (термолизе) — полипептиды — получили название желатоз. Их много образуется при длительной обработке коллагена горячей водой. Такой продукт называется клеем. Растворы желатина образуют гель при низкой концентрации (1%) й низкой температуре (10°С), растворы клея — при более
137
высокой концентрации (свыше 1%) и более низкой температуре (ниже 10°С). В холодной воде высушенный желатин только набухает, а в горячей хорошо растворяется.
Нормальное развитие соединительной ткани и новообразование коллагена в организме некоторых животных и человека связано с потреблением аскорбиновой кислоты. В отсутствии витамина С в соединительной ткани оксипролин не образуется. При поступлении аскорбината происходит образование оксипролина с одновременным уменьшением содержания пролина и глицина.
В образовании оксипролина и оксилизина, характерных для коллагена аминокислот, участвует особый фермент протоколлагенгидроксилаза, который гидроксилирует лизин в оксилизин, а пролин — в оксипролин.
Аскорбиновая кислота в результате модификации переходит в идуроновую кислоту, участвующую в построении полисахаридов ткани.
Желатин используется для изготовления различных кулинарных блюд, колбасных, кондитерских изделий, фотоматериалов. В последнее время специальным образом обработанный желатин применяется в качестве одного из ценных кровезаменяющих препаратов.
Раньше считали, что желатин не обладает антигенными свойствами, но они приобретаются при введении в него остатков тирозина. Теперь обнаружено, что антигенные свойства присущи тропоколлагену. Они обусловлены наличием особых пептидов в структуре коллагеновых волокон.
Выделенные из соединительной ткани различных видов животных с помощью экстракции буферными растворами белки, близкие к коллагену, получили название проколлагенов. В дальнейшем было показано, что тропоколлаген и проколлаген это одно и то же вещество. При помощи изотопов было установлено, что проколлагены образуются значительно быстрее, чем коллаген. По-види-мому, проколлагены являются биологическими предшественниками коллагена в организме животных (отсюда и название).
Особенность аминокислотного состава проколлагена (см. табл. 15) состоит в том, что в нем нет тирозина, в то время как в коллагене его содержится около 1,0%. Фенилаланина в проколлагене значительно меньше, чем
138
й коллагене, а гистидина, наоборот, больше. В молекуле проколлагена содержится меньше гексозамина (0,02%), чем в молекуле коллагена (0,05%).
Проколлагены нерастворимы в воде и сравнительно слабо растворяются в подкисленной воде и кислых буферных растворах с невысокой концентрацией солей. При нагревании в воде проколлагены, как и коллаген, переходят в желатин. В отличие от коллагена они сравнительно хорошо расщепляются трипсином.
Эластин
Эластин входит в состав эластических волокон, имеющих желтоватую окраску, совершенно не похожих на коллагеновые. Они бесструктурны, способны разветвляться и соединяться между собой. Длина эластических волокон в отличие от коллагеновых при растяжении может увеличиваться вдвое. По механическим свойствам эластин очень похож на каучук. Волокна его участвуют в образовании тканей (связки), для которых характерны длительные напряжения и возвращение по окончании растяжения в первоначальное состояние. Из скопления эластических волокон, оплетенных рыхлой соединительной тканью, образуется эластическая ткань, упругие свойства которой зависят в основном от эластина (например, выйная связка быка, см. табл. 13). Значительное количество эластина содержится, помимо связок, в стенках артерий, аорты, в брюшных мышцах. Эластические элементы иногда могут встречаться в брюшных мышцах в виде пластинок или зерен.
Эластин очень устойчив. Он не растворяется в холодной и горячей воде, в растворах солей, разведенных кислотах и щелочах; даже крепкая серная кислота оказывает на него слабое действие. В противоположность коллагену из эластина не образуется желатин. По аминокислотному составу (см. табл. 15) эластин отчасти сходен с коллагеном благодаря присутствию в нем оксипролина (хотя и в значительно — в 10 раз — меньшем количестве), высокому содержанию глицина и пролина, очень низкому содержанию гистидина, триптофана, цистеина. Однако в отличие от коллагена в нем низкое содержание аргинина, аспарагиновой, глютаминовой кислот и высокое — аланина, валина.
139
Внедрение оксипролина в молекулу эластина, как и у коллагена, происходит за счет преобразованного пролина, что показано с помощью пролина С14 и оксипролина С14,
В составе эластина содержатся специфические аминокислоты, не известные для других белков,— десмозин и изодесмозин; каждая из них возникает из четырех молекул лизина. Десмозин и изодесмозин образуют поперечные связи (сшивки) между полипептидными цепями эластина.
~СО2 z , 1 ' 4 /М1Дсг>2 СО2 . . . , . ^СО2
,>снсн2Пн2скусн2сн2)псн_+Хнсн^н.с^-сщфн^сн^н*
kJ ^NH3NH3 kkCH2(CH^CH<N^
(CH2)1 (CH2)n
CH CH
tsh3 co; inh; co;
Десмозин Изодесмозин
Эластин содержит 7% полярных боковых групп (коллаген 34%), что, по-видимому, обусловливает^ низкую гидратацию эластина (см. с. 133).
По аминокислотному составу эластин относится к неполноценным белкам. В нем отсутствуют триптофан, метионин, очень мало лизина. Установлено, что в его состав входит глюкозамин, галактозамин, хондроитин, серная кислота (0,1—0,4% серы), сиаловая кислота (0,29%) — продукт конденсации N-глюкозамина и пировиноградной кислоты и гексуроновая кислота (0,23%)-.Эти кислоты, по-видимому, равномерно распределены по волокну и упрочняют его. По строению эластин близок к мукоидам.
Молекула эластина состоит из двух компонентов: а-протеина с молекулярной массой 60—84 тыс. и (3-протеина с молекулярной массой 5500. В а-протеине содержатся две пептидные цепи из 27 аминокислот, а в (3-протеине— 17 цепей из 37 аминокислот каждая.
Предполагают, что волокна эластина состоят из внутренней и наружной оболочек. Внутренняя оболочка— из линейного агрегата (проэластина). Наружная оболочка, защищающая внутреннюю, образована муко-протеидом—эластомуцином, построенном из проэласти-
140
на и полисахаридов; эти элементы придают большую прочность волокну.
Нативный эластин, подвергнутый нагреванию (кулинарной обработке), а также измельченный в порошок, не поддается действию трипсина, но гидролизуется фицином, папаином, бромеллином. В последнее время получены важные данные о ферментативном гидролизе эластина. Из поджелудочной железы выделен фермент эластаза — панкреатопептидаза. Препарат ее не однороден: в нем содержится несколько ферментов, два из которых оказывают последовательное действие на молекулу эластина, вначале освобождая из его структуры полисахарид, а затем расщепляя белковую часть. Благодаря открытию этого фермента удалось выяснить возможность переваривания эластина в желудочно-кишечном тракте животных, а также более глубоко изучить структуру эластина.
Панкреатопептидаза полностью растворяет эластин за 42 ч при температуре 37°С с образованием прозрачного раствора.
Установлено также, что пепсин обладает слабым эла-столитическим действием, приблизительно равным 78 активности эластазы.
Ретикулин
Ретикулин обнаружен в составе ретикулиновых волокон, находящихся в структуре как соединительной, так и ретикулярной ткани. Ретикулярная ткань, в которой ретикулиновые волокна находятся в виде сети, образует основу кроветворных органов: костного мозга, селезенки, лимфатических узлов, а также участвует в построении ткани легких и т. д. Ретикулин входит в структуру сарколеммы. Рентгенограмма его подобна рентгенограмме коллагена.
Ретикулин состоит из тонких поперечноисчерченных фибрилл с периодом повторяемости 64 нм (как у коллагена). Структура ретикулина разных животных аналогична. По химическому и аминокислотному составу (см. табл. 14 и 15) ретикулин значительно отличается от коллагена: в нем меньше азота, больше серы (до 2%), но наличие в его молекуле оксилизина и высокое содержа-
141
Нйё йролйна й оксипролина объёДийяет эти Протеиды в одну коллагеновую группу.
Помимо аминокислот, в молекуле ретикулина содержится 4,5% углеводов, 10,12% липидов и 0,16% гексоза-мина. Характерным признаком ретикулина является его способность к восстановлению солей серебра, что, по-видимому, объясняется присутствием в его молекуле серы. Ретикулин — сложный белок (простетическая группа — полисахарид), почти не набухает в воде, а также довольно устойчив (не растворяется в течение многих часов в крепких кислотах, щелочах и в горячей воде) .В присутствии сернистого натрия ретикулиновые волокна частично разрушаются.
Муцины и мукоиды
Муцины и мукоиды содержатся в составе соединительной ткани в сравнительно небольшом количестве. В составе межуточного вещества эти белки совместно с мукополисахаридами образуют комплексы, назначение которых удержание фибриллярных и клеточных компонентов в определенном структурном взаиморасположении. Вместе с тем муцины являются обязательной составной частью многих секретов: слюны, слизистой желудка и др. В слизистой соединительной ткани муцинов и мукоидов довольно много. Они относятся к группе сложных белков — глюкопротеидов. В качестве простетической группы у этих белков встречаются мукополисахариды, которые непрочно связаны с белком и легко от него отделяются. Иногда эти сложные углеводы встречаются в тканях в свободном виде.
В состав простетической группы муцинов и мукоидов входят галактоза, глюкоза, глюкозамин или галактозамин и глюкуроновая кислота, а также уксусная и серная кислоты. Элементарный состав мукоида из плотной соединительной ткани (в %): углерод 47,47, водород 6,68, азот 12,58, кислород 31,07, сера 2,2.
Муцины и мукоиды имеют явно выраженный кислый характер, поэтому для извлечения их из тканей применяют растворы щелочей. Для последующего разделения муцинов и мукоидов экстракт подкисляют. Из щелочных растворов муцины осаждают крепкой уксусной кислотой, а мукоиды при этом остаются в растворе. Муцины и мукоиды дают характерные цветные реакции на белки, но
142
не свертываются при нагревании и растворяются в спирте.
В соединительной ткани, главным образом в ее клетках, встречаются белки, обладающие свойствами альбуминов и глобулинов. Содержание их по сравнению с другими белками невелико. В составе этой группы белков имеются также и ферменты соединительной ткани.
МУКОПОЛИСАХАРИДЫ
В соединительной ткани и ее производных широко представлены различные сложные полисахариды, которые выполняют роль цементирующего компонента межклеточного вещества, участвуют в образовании межмолекулярных связей пептидных цепей коллагена, ретикулина, эластина, входят в состав муцинов и мукоидов, а также встречаются в свободном виде. Эти же вещества выполняют и защитную роль в соединительной и других тканях и органах по отношению к микроорганизмам. К числу кислых мукополисахаридов относится значительное число химически родственных, но различных по строению соединений. Они специфически распределены в различных тканях. Все они представляют собой полианионы. Кислые мукополисахариды разделены на три группы:
полиуроновые кислоты — гиалуроновая кислота (молекулярная масса 20 тыс. — 10 млн.) и хондроитин:
полисульфаты полиуроновых кислот — хондроитинсульфат (хондроитинсерная кислота) ХСК — виды А, В, С (молекулярная масса 19—50 тыс.), гепаринсульф ат, му-коитинсульфат;
полисульфаты — кератосерная кислота и др.
Наиболее распространены в тканях животных кислоты: гиалуроновая, мукоитинсерная, гепарин, кератосерная и хондроитинсерная. Последняя представлена разновидностями А, В, С, отличающимися происхождением, углом вращения (ХСК А—30°, ХСК В—50°, ХСК С—20°) и некоторыми другими свойствами.
В составе хондроитинсерной кислоты А и С имеется глюкуроновая кислота, а в составе ХСК В — идуроновая кислота. Идуроновая кислота является производным аскорбиновой кислоты, что подтверждает особо важное значение витамина в формировании соединительной ткани. Строение всех этих мукополисахаридов аналогично. Большинство из них образует в организме сильно гидратированные гели и очень вязкие растворы.
143
Общий принцип построения мукополисахаридов приведен в следующей схеме:
гиалуроновая кислота
[N — ацетилглюкозамин — глюкуроновая кислота]^
хондроитинсерная кислота
rFN—ацетилгалактозамин—1 серная 1
LL — глюкуроновая кислотаJ кислота]п
кератосерная кислота
FFN — ацетилглюкозамин —1 серная
LL — галактоза J кислота^
Содержание мукополисахаридов в соединительной ткани приведено в табл. 16.
ТАБЛИЦА 16
Соединительная ткань
Гиалуроновая кислота
Хондроитинсерная кислота
АВС
Гиалиновый хрящ ................
Сухожилия ......................
Аорта...........................
Кожа ...........................
Примечание. Знак «-}-» кислота содержится; знак «—» кис-
лоты нет.
Одним из самых распространенных мукополисахаридов является гиалуроновая кислота, выделенная из кожи, стекловидного тела, пупочного канатика и некоторых видов соединительной ткани. Чаще встречается в свободном виде.
По химическому строению она представляет собой полимер, состоящий из эквимолярных количеств глюкуроновой кислоты и ацетилглюкозамина. Ниже приводится структура фрагмента гиалуроновой кислоты.
сн2он соон
Н IINCOCH, н он
144
Растворы гиалуроновой кислоты очень вязкие (в 0,9%-ном растворе NaCI). Угол вращения их 70—80°. В результате полимеризации молекулярная масса полисахарида колеблется от 200 000 до 500 000.
Являясь основным веществом межтканевых и межклеточных образований организма, гиалуроновая кислота выполняет важные биологические защитные функции. Из некоторых тканей животного организма выделен комплекс ферментов (гиалуронидаза), катализирующих постепенный гидролитический распад гиалуроновой кислоты до ацетилглюкозамина и глюкуроновой кислоты.
Многие патогенные микроорганизмы богаты гиалуроновой кислотой, покрывающей их оболочку.
Мясная промышленность выпускает препараты гиалуронидазы («лидаза»), гиалуроновой кислоты, а также гепарина, нашедшие применение в лечебной практике.
Минеральные вещества находятся в небольшом количестве в собственно соединительной ткани и принимают участие в процессах, протекающих в клетках ткани. Разнообразные липиды входят в незначительном количестве, главным образом в структурные элементы клеток различных тканей. Большое накопление липидов характерно для жировой ткани.
ЖИРОВАЯ ТКАНЬ
Жировая ткань (рис. 25) является разновидностью рыхлой соединительной ткани. Жировые клетки возникают в соединительной ткани из малодифференцированных фибробластов, ретикулярных клеток. В протоплазму их включены мельчайшие капли жира, постепенно сливающиеся в одну крупную каплю, оттесняющую протоплазму и ядро к периферии клетки. Жировые клетки при этом увеличиваются (диаметр их иногда достигает 120 мкм) и могут заполнить почти все пространство между соединительнотканными волокнамц,-
Жир накапливается главным образом в соединительной ткани брюшной полости (сальник, брыжейка, околопочечная область), под кожей (подкожная клетчатка особенно развита у свиней), между мышцами и в других местах. При плохом питании и голодании жира в ткани содержится мало.
6—454
145
Основное биологическое значение жировой ткани, обладающей высокой метаболической активностью, заклю
чается в том, что она выполняет роль «запасного депо» для накопления питательного материала, имеющего большой запас потенциальной энергии. В ряде участков тела
I
Рис. 25. Строение жировой ткани:
/ — жировые клетки; 2 — ядро;
3 — основное вещество.
животного жировая ткань вы-полняет механические функции. Она является своего рода мягкой прокладкой, защищающей внутренние органы от механического воздействия, а также, будучи плохим проводником тепла, предохраняет организм от охлаждения. В составе жировой ткани имеются биологически ценные для питания организма непредельные жирные кислоты, а также витамины.
Жировая ткань в качестве одного из основных компонентов входит в состав мяса и мясопродуктов, применяется как
сырье для изготовления специальных пищевых продуктов (шпик, колбасы) и для
получения топленых пищевых и технических жиров.
ОБЩИЙ ХИМИЧЕСКИЙ СОСТАВ ЖИРОВОЙ ТКАНИ
Наиболее важными химическими компонентами жировой ткани являются жиры, составляющие иногда до 98% массы ткани. В небольшом количестве в ней содержатся другие липиды, белки, ферменты, а также витамины и некоторые органические и минеральные вещества (табл. 17).
Содержание химических соединений в жировой ткани значительно колеблется в зависимости от вида, породы, возраста, пола и упитанности животного, а также от анатомического расположения ткани.
Общий химический состав жировой ткани в разных участках тела животного также неодинаков, что связано
146
Т АТ Л И Ц А Л-
Химический состав ткани (околопочечной)
Содержание составных частей % в ткани
крупного рогатого скота свиней
Влага Белок Жир Зола
2,0—21,0 0,76—4,2 74,0—97,0 0,08—1,0
2,6—9,8 0,39—7,2 81,0—97,0
с морфологическими и функциональными особенностями ткани< Химический состав жировой ткани свиньи сальной упитанности приведен в табл. 18.
ТАБЛИЦА 18
Содержание составных частей, %
Состав ткани в околопочечной ткани в сальнике в шпике
Влага 2,61 6,84 7,15
Белок 0,34 1,56 1,70
Жир 97,0 91,6 91,15
Белковые вещества жировой ткани, содержащиеся в сравнительно небольшом количестве, являются в основном соединительнотканными белками: коллаген, эластин, муцины, в меньшем количестве альбумины и глобулины. Из ферментов наиболее характерны для жировой ткани липазы, играющие существенную роль в диссимиляции жиров.
Жиры, выделяемые из тканей экстрагированием органическими растворителями или каким-либо иным путем, состоят в основном из триглицеридов, но в небольшом количестве в них содержится ряд веществ, растворимых в жирах, например углеводороды, каротиноиды, стероиды, витамины, пигменты. Эти вещества, инертные к действию щелочей и нерастворимые в воде, составляют неомыляемую фракцию. Количество их в жире обычно невелико, но они существенно влияют на его физико-химические свойства, пищевую ценность и сохраняемость.
6* 147
ХИМИЧЕСКИЙ СОСТАВ
И СВОЙСТВА ТРИГЛИЦЕРИДОВ
Жиры разных животных различаются между собой по физико-химическим свойствам, что обусловлено неодно родным составом химических компонентов жиров—триглицеридов.
Постоянной составной частью триглицеридов является глицерин, а количество жирных кислот в них изменяется. В состав триглицеридов тканевых жиров входят преимущественно жирные кислоты, содержание которых приведено в табл. 19. :
ТАБЛИЦА 19
Жирные кислоты Содержание кислот (в %) в жире
говяжьем бараньем СВИНОМ КОН- СКОМ курином молочном топленом
Миристиновая 2,0—2,5 2,0—4,0 1,0 3—6 0,1 9—10
Пальмитиновая 27—29 25-27 25—30 25 24—27 24—26
Стеариновая 24—29 25-31 12—16 7 4—7 10—11
Олеиновая . . 43—44 36—43 41—51 55 37—43 31—34
Линолевая . . 2—5 3—4 3—11 7—12 18—23 3—4
Линоленовая 0,3—0,7 0,4—0,9 0,3—0,6 5 —
Арахидоновая . 0,09— —0,20 0,27— —0,28 До 2,0 — 0,3 0,6—1,5
Указанные в табл. 19 кислоты в основном содержат 16—18 углеродных атомов.
В меньшем количестве в составе жиров триглицеридов имеются жирные кислоты, содержащие от 2 до 14 или от 20 до 22 углеродных атомов. Эти одноосновные кислоты могут быть насыщенными и ненасыщенными. Большое значение имеют входящие в состав жиров ненасыщенные кислоты с 18 углеродами.
Олеиновая кислота имеет одну двойную связь, линолевая две двойные связи, линоленовая — три двойные связи, арахидоновая состоит из 20 углеродов с четырьмя связями у 5, 8, 11 и 14-го атомов:
СН3—(СН2)4—СН=СН—СН2—СН=СН—СН2—СН=СН—СН2—
—СН=СН—(СН2)3—СООН.
Арахидоновая кислота в животных жирах содержится в небольшом количестве. Наибольшее ее количество
148
(20%) содержится в липидах (фосфатидах) надпочечников быка.
В топленом молочном жире, кроме арахидоновой кислоты, содержатся низкомолекулярные (летучие) кислоты — масляная, капроновая, каприловая, каприновая, лауриновая и другие кислоты, суммарный состав которых составляет 12—15%.
Биологические свойства и значение жирных кислот определяются их строением, физическими и химическими свойствами.
Физические свойства жирных кислот. Характерный физический показатель жирных кислот — температура плавления — составляет: каприловой 31,6° С, пальмитиновой 61,1° С, олеиновой 13,4° С, линолевой 5° С. Так как даже небольшое количество примесей влияет на этот показатель, то температура плавления свидетельствует о степени чистоты кислоты.
Другой характерный показатель жирных кислот — коэффициент рефрации (показатель преломления) составляет: капроновой кислоты 1,3931 при 80° С, олеиновой 1,4585 при 20° С, пальмитиновой 1,4272, стеариновой 1,4299, линолевой 1,4699, линоленовой 1,800.
Характерным свойством жирных кислот является поглощение излучений в ультрафиолетовой и инфракрасной областях спектра.
В видимой части спектра кислоты излучения не поглощают.
Насыщенные жирные кислоты слабо поглощают излучения в области волн 204—207 нм. Эта слабая абсорбция обусловлена наличием карбоксильных групп. Но данное поглощение не имеет четко выраженного максимума, что не позволяет использовать его при исследованиях.
Наличие в составе ненасыщенных кислот сопряженных двойных связей делает их способными к существенной избирательной абсорбции излучений в пределах волн 200—400 нм. Эти поглощения имеют четко выраженный максимум: у кислот с двумя двойными связями — один максимум при длине волны 234 нм, у кислот с тремя — три максимума.
Интенсивность поглощения (коэффициент экстинкции) при определенной длине волны дает возможность установить количественное содержание вещества. Осо
149
бенно интенсивно поглощают лучи изомеризованные' ненасыщенные жирные кислоты, причем в характере поглощения между ними наблюдается существенное различие, что облегчает их аналитическое исследование. На этом принципе основан современный спектрофотометрический метод определения содержания в жирах ненасыщенных жирных кислот. Спектрофотометрическим методом были обнаружены не найденные до этого в животных жирах жирные кислоты — арахидоновая и линоленовая.
Химические свойства жирных кислот. Эти свойства определяются двумя различными по составу, строению и свойствам частями молекулы — карбоксильной группы и углеводородным радикалом. В реакции может участвовать та или другая часть кислоты.
Карбоксильная группа обусловливает реакции, связанные с образованием солей. На основании реакций нейтрализации в промышленности применяется метод определения кислотного числа1 2.
Благодаря наличию карбоксильной группы возможно образование пар молекул, связанных водородными связями,
....... . НОХ
RC CR,
ХОН..........
Реакции жирных кислот, зависящие от углеводородного радикала, предопределяются его составом и строением. Особой реакционной способностью обладают ненасыщенные жирные кислоты, что связано с наличием двойных связей. Одна из связей обладает энергией 62,7, другая — 38,38 ккал, т. е. значительно меньше, чем энергия одной метиленовой связи — 88 ккал. В результате действия реагентов слабая связь разрушается и происходит насыщение кислот. По месту всех двойных связей присоединяются галоиды, например йод:
RXCH : CHR2 + J2 -> RjCHJ — CHJR2.
1 Изомеризация производится путем нагревания щелочных солей кислот при температуре 180°С в глицерине; при этом (благодаря способности перемещения) возникает сопряженная система двойных связей, более доступная спектральному исследованию.
2 Кислотным+числом + называют + количество + миллиграммов + едкого кали, идущего на нейтрализацию свободных жирных кислот, содержащихся в 1 г жира.
150
На свойстве присоединения йода по месту двойных связей основан метод определения йодного числа в жирах1. Благодаря двойным связям ненасыщенные жирные кислоты могут взаимодействовать с роданом (SCN). Родан к двойным связям присоединяется избирательно. Если у олеиновой жирной кислоты происходит присоединение родана аналогично галогенам, т. е. анионы родана насыщают одну двойную связь, то у линолевой кислоты родан насыщает только одну из двух двойных связей, причем образуется смесь двух изомеров:
СН3(СН2)4СН=СНСН2СН=СН(СН2)7СООН + (SCN)2
СН3(СН2)4СН—СН—НСН2СН=СН(СН2)7СООН или II
SCN SCN
СН3(СН2)4СН=СНСН2СН—СН(СН2)7ССОН II
SCN SCN
В линоленовой кислоте из трех двойных связей родан насыщает только две, а третья, расположенная в центре цепочки, в результате действия сил взаимного отталкивания остается свободной.
Зная йодное и родановое числа, можно хотя бы приближенно решить вопрос о количественном составе смеси кислот, входящих в состав жира, используя уравнение Кауфмана из приближенного вычислительного анализа.
Двойная связь значительно ослабляет энергию соседней с ней связи с метильными (—СН3) или метиленовыми (—СН2) группами. Поэтому атомы водорода метиленовых групп становятся значительно реактивнее й в отдельных случаях вступают в реакцию легче, чем углероды с двойными связями. Двойные связи могут насыщаться водородом. На этом основан процесс гидрогенизации растительных масел.
Современными методами анализа жирных кислот, получившими широкое применение в научных исследованиях, являются хроматография на бумаге, хроматография в тонком слое и жидкостно-газовая хроматография.
1 Йодное число показывает, какое количество граммов йода может присоединяться к 100 г жира.
151
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ЖИРОВ
Животные жиры представляют собой смесь однокислотных и разнокислотных триглицеридов в разных соотношениях. Разнокислотные триглицериды могут отличаться по месту расположения жирной кислоты. В животных жирах находятся преимущественно триглицериды; ди- и моноглицериды встречаются в них редко.
Физико-химические свойства триглицеридов определяются составом и соотношением входящих в них жирных кислот. Чем разнообразнее состав жирных кислот, входящих в состав жира, тем больше возможно вариантов образования триглицеридов. Так, из пяти жирных кислот может образоваться 75 вариантов триглицеридов, из семи кислот — 288, из девяти — 550.
При кристаллизации жиров разных животных из растворов органических растворителей образуются кристаллы, имеющие строение, характерное для каждого вида жира.
Резко выраженной температуры плавления у жиров нет (в отличие от химически чистых веществ), поэтому при нагревании они постепенно переходят из твердого состояния в жидкое. Однако по температуре плавления все же можно различать животные жиры различного происхождения. Температура плавления жира будет тем ниже, чем больше в его составе непредельных и чем меньше насыщенных кислот, особенно стеариновой. Поэтому температура плавления бараньего жира, содержащего до 62% насыщенных кислот, выше, чем свиного жира, в составе которого насыщенных кислот только 47%. Низкая температура плавления молочного жира зависит от значительного содержания в нем ненасыщенных и низкомолекулярных кислот.
Температура плавления (в °C) некоторых животных жиров приведена ниже.
Бараний . . . . . . . .44—55 Коровье масло . . . . .28—30
Говяжий . . . . . . . .40—50 Гусиный . . .26—34
Свиной . . . . . . . .28—40 Конский . . .30—43
Биохимические свойства жиров во многом зависят от содержания в них непредельных жирных кислот — соеди-
152
нений, активных в химическом и биологическом отношениях. Для характеристики степени ненасыщенности жира определяют йодное число.
Молочный жир . . . .25—27
Бараний.............31—46
Говяжий ' ...... .33—47
Свиной . .......46—66
Конский жир .... 71—86
Льняное масло . . . 175—192
Подсолнечное масло . 127—136
Липиды, витамины. Помимо нейтральных триглицеридов, из жировой ткани извлекаются и другие липиды, среди которых обнаружены главным образом фосфатиды (холинфосфатиды, серин и этанолфосфатиды), стерины и стериды. Содержание их в жирах сравнительно невелико (табл.20).
ТАБЛИЦА 20
Жир Содержание, %
холинфосфатиды суммы стери- дов и стеринов
Свиной 0,03 0,07—0,13
Бараний 0,012 0,03
Говяжий 0,035 0,08
В жирах содержатся также каротины, близкие по свойствам к липидам. Они поступают в организм животных с растительными кормами. Наиболее важными являются каротины а, р, у, различающиеся между собой по длине углеводородной цепи, строению колец. Благодаря наличию большого количества двойных связей каротины химически активны и могут окисляться кислородом воздуха.
В животном организме каротины а, р, у являются провитаминами А. В витамин они переходят под действием фермента каротиназы. Особенно активно этот процесс протекает в слизистой кишечника и печени. У крупного рогатого скота в жировой ткани может избирательно накапливаться р-каротин.
Каротины являются пигментами, благодаря чему большинство животных жиров, в которых содержатся каротины, окрашены в желтый цвет. В неокрашенных жирах (свином и козьем) каротинов мало.
153
Окраска каротинов зависит от наличия в их составе хромофорной группы — длинная цепь углеродных атомов с системой сопряженных двойных связей. При значительном нарушении этой системы каротиноиды обесцвечиваются. Это происходит, например, при окислении пигментов.
Каротиноиды отличаются по максимуму поглощения. Для а-каротинов максимум поглощения соответствует длине волн 509 и 477 нм, ^-каротинов — 521 и 485,5 нм, для у-каротинов — 533,5 и 496 нм. Благодаря этому возможно непосредственное определение содержания каротиноидов в пищевых жирах.
Количество каротинов в жирах зависит главным образом от условий питания животных, особенностей обмена веществ (в жире лошади, свиньи и овцы каротина немного), кормового рациона животных (при пастбищном содержании количество каротинов в жире увеличивается).
Окраска жира изменяется в зависимости от содержания каротинов: в кремово-белом говяжьем жире содержится до 0,1 мг% каротинов, в желтом 0,2—0,3 мг%, в интенсивно желтом 0,5 мг%. У старых животных, а также при голодании окраска жира более интенсивна, так как при этом запас жира уменьшается и концентрация пигмента увеличивается.
Помимо витамина А (или каротина), в составе жиров встречаются витамины Е и D. Витамин Е — токоферол — обычно сопутствует каротинам. В настоящее время известно семь изомеров токоферола, близких один к другому по природе и биологическим свойствам. В составе жиров обнаружены четыре токоферола: а, р, у, д. Токоферол очень легко окисляется.
В небольшом количестве в жирах встречается витамин D3. Помимо поступления с кормом, он может образо-
Т А Б Л И Ц А -24
Жир Содержание (в мг%) витаминов
А D Е
Говяжий 1,37 + 1,0
Свиной 0,01—0,08 0,2—2,7
Бараний — + 0,5
Сливочное масло 2—12 + 3,0
154
вываться в коже животных из 7-дегидрохолестерина при облучении УФ-лучами. Содержание витаминов в животных жирах характеризуется данными, приведенными в табл. 21.
БИОХИМИЧЕСКИЕ И ФИЗИКОХИМИЧЕСКИЕ ИЗМЕНЕНИЯ ЖИРОВ
Во время переработки и хранения жировой ткани или выделенных из нее жиров происходят многообразные превращения их под влиянием биологических, физических и химических факторов. В результате этих превращений постепенно изменяется химический состав, ухудшаются органолептические показатели и пищевая ценность жиров, что может привести к порче жиров.
Различают гидролитическую и окислительную порчу. Нередко оба вида порчи протекают одновременно.
Порчу жиров исследуют различными химическими методами. Результаты определений обычно характеризуют условными единицами — кислотным, перекисным, ацетильным и другими числами.
Автолитические изменения тканевых жиров
Процесс автолиза происходит в тканевых жирах, жире-сырце (внутренний жир), жире мяса, соленом жире (шпик), жире сырокопченостей и т. п. Под влиянием тканевых липаз наблюдается гидролитический распад ; триглицеридов, в результате чего отмечается весьма нежелательное для качественной характеристики жира на- ( копление свободных жирных кислот, выражающееся в повышении кислотного числа жира.
В свежей жировой ткани, только что извлеченной из туши, кислотное число невелико — обычно не выше 0,05—0,2. '
Скорость и глубина гидролиза жира зависят от тем- пературы: процесс ферментативного катализа значительно ускоряется при температуре выше 10—20° С-(рис. 26)-. Снижение температуры замедляет процесс гидролиза, но даже при —40° С ферментативная активность проявляется, хотя и в очень слабой степени.
155
В случае хранения жировой ткани в неблагоприятных условиях (влага, повышенная температура примерно 20—30°С) автолиз может оказаться настолько глубоким,
что резко ухудшаются пищевые качества продукта, особенно если присоединится окислительная порча.
В результате автолиза может произойти гидролити-
ческая порча жиров, которая характеризуется накопле-
нием свободных жирных кислот. Гидролитическая порча
Рис. 26. Изменение кислотного числа почечного свиного жира-сырца при хранении.
жиров может быть не только следствием автолиза, но и результатом действия других факторов: кислот, щелочей, окислов металлов и других неорганических катализаторов, а также ферментов микроорганизмов.
Появление в жире при гидролитическом распаде небольшого количества высокомоле
кулярных жирных кислот не вызывает изменения вкуса и запаха продукта. Но если в составе триглицеридов (молочный жир) имеются низкомоле
кулярные кислоты, то при гидролизе могут появиться капроновая и масляная кислоты, характеризующиеся неприятным запахом и специфическим вкусом, резко ухудшающими органолептические свойства продукта.
В целях замедления нежелательных гидролитических изменений жировую ткань после извлечения из туши охлаждают для понижения скорости ферментативных процессов и тщательно промывают холодной водой. При этом удаляются белковые вещества, ферменты, содержащиеся в серозной жидкости, лимфе, в остатках крови.
В топленых жирах автолитического расщепления жира, как правило, не наблюдается. Это объясняется тем, что в процессе вытопки при температуре 60° С липаза, содержащаяся в жировой ткани, инактивируется. Гидролитическая порча топленого жира происходит при наличии влаги, в результате обсеменения микрофлорой, неполной денатурации белков при вытопке жира или наличии катализаторов.
156
Окислительные изменения жиров
В процессе хранения и переработки жиров возможны их окислительные изменения, которые могут протекать с различной скоростью, глубиной, иметь различную направленность в зависимости от природных свойств жира и условий окисления. Эти превращения могут привести к наиболее опасному виду порчи жиров — окислительной порче.
Окисление жиров — так называемое автоокисление — протекает при низких температурах, в присутствии газообразного кислорода.
Образование перекисей. Первичным продуктом окисления, обнаруживаемым аналитическим путем, являются перекиси. Вслед за перекисями возникают новые окисленные вещества, оказывающие существенное влияние на свойства продукта. Образовавшиеся перекиси активируют окисление других молекул
А -f- О2 AOgj АО2 -р В АО^-р ВО.
Благодаря этому реакция окисления, как было установлено позднее, носит цепной характер.
Теория цепных реакций разработана лауреатом Нобелевской премии академиком Н. Н. Семеновым при изучении кинетики химических процессов.
Существенную роль в начальных стадиях цепных реакций играют свободные радикалы, появляющиеся в жире в результате воздействия энергии. Свободный радикал— это частица, один из атомов которой имеет свободную валентность, например свободный радикал этила СН3—СНг. Точка над углеродом указывает на налит чие у него неспаренного электрона. Свободные атомы также обладают свойствами свободных радикалов. Образование первого свободного радикала является наиболее трудной частью цепной реакции. Она требует значительного заряда энергии для разрыва связей между атомами молекулы.
Молекула вещества (жир, жирная кислота), поглощая квант света, получает энергию (hv) и переходит в возбужденное состояние
RH+rftw -> R*H. (1)
157
Возбужденная молекула (R*H) сохраняет энергию и существует в виде активированной реакционноспособной молекулы, но крайне непрочна и обычно тотчас же распадается на радикалы
R*H -> R +Н. (2)
Эти радикалы очень активны в химическом отношении и обычно быстро вступают во взаимодействие — происходит рекомбинация радикалов. Если в системе присутствует кислород, то происходят реакции, в результате которых относительно стабильная молекула кислорода вовлекается в процесс и включается в состав очень реактивных перекисных радикалов
R+ О2 -> R-O-O. (3)
Возникший радикал реагирует с новыми молекулами окисляемого вещества, давая гидроокись и новый свободный радикал
R—О—О + RH -> ROOH + R. (4)
Свободный радикал вновь реагирует с кислородом и т. д., т. е. возникает цепная реакция.
В свою очередь свободный атом Н [формула (2)] также может взаимодействовать с молекулой кислорода с образованием свободного радикала
Н + О2 -> О —ОН. (5)
Этот радикал мало активен, но с увеличением концентрации возможно столкновение друг с другом, рекомбинация
• I
о—он + О—ОН -> Н—О—О—О—О—Н НООН + О2 (6) и распад сложной перекиси на перекись водорода и кислорода.
Каждый новый свободный радикал реагирует по тому же механизму, и таким образом возникает прямая, не-разветвленная свободная цепная реакция. В процесс окисления последовательно вовлекается огромное количество молекул.
158
В случае автоокисления жиров в процесс легче всего вовлекаются ненасыщенные жирные кислоты, активно поглощающие кванты света благодаря наличию в них двойных связей (хромофоры)
Ri—CH2CH=CHR2 + hv -> Ri—СН—СН=СН—R2 + Н. (7)
При этом обычно атом водорода отрывается, и образуется свободный радикал.
В свободном радикале количество энергии достаточно для того, чтобы взаимодействовать с молекулой кислорода с образованием перекисного радикала
Rx—СН—СН=СН—R2 + О2 -> Rx—СН—СН=СН—Ri 1—0—0
(8)
Перекисный радикал реагирует с новой молекулой ненасыщенной жирной кислоты, отрывая от нее атом водорода, в результате чего образуется гидроперекись и новый свободный радикал, который дает начало новому ряду реакций:
Rx—СН—СН=СН—R2 + R—CHjj—CH=CHR 1-0-6
(9)
Rx—СН—СН=СН—R2-J-Rt—СН—CH=CHR2 (10)
ООН
Атомарный водород [формула (7)] в свою очередь также подвергается дальнейшим превращениям [формулы (5), (6)].
В силу более высокой фотоактивности быстрее окисляются кислоты с большим количеством ненасыщенных связей. Так, линолевая кислота окисляется в 10—12 раз быстрее олеиновой; еще быстрее окисляется линоленовая кислота.
Установлено, что гидроперекиси образуются не по месту двойной связи, а преимущественно у соседнего с двойной связью более активного углеродного атома. Это объясняется тем, что у соседней с двойной связью мети
159
леновой группе связь ослаблена. Именно по месту этой связи и происходит окисление углерода
R1—CH=CH—CH—R2 (11)
ООН
Насыщенные кислоты, хотя и очень медленно, но также могут окисляться, переходя в гидроперекиси.
При глубоко зашедшем процессе окисления жиров возможно образование циклических перекисей [формула (12)] и эпоксидных соединений [формула (13)].
—СН—СН—СН—СН2— (12)
О---О
—СН—СН—СН2— (13)
' ''с/
О содержании перекисных соединений в жире обычно судят по величине перекисного числа !.
Индукционный период. Перекисное число является довольно чувствительным показателем; по величине его можно судить о начале и глубине окисления жира. В свежем жире перекисей нет. В начальных стадиях окисления в течение некоторого времени химические и органолептические показатели жира почти не изменяются. Взаимодействия жира с кислородом в это время либо еще не происходит, либо происходит очень незначительно. Этот период, имеющий различную продолжительность, называют индукционным периодом. После окончания индукционного периода жир начинает портиться (рис. 27). Это обнаруживается по росту перекисных чисел и изменению его органолептических свойств. Наличие индукционного периода объясняется тем, что в начале процесса молекул с повышенной кинетической энергией (возбужденных или свободных радикалов) очень мало. Обусловлено это также содержанием в жире естественных антиокислителей: каротиноидов, токоферола, лецити-
1 Число граммов йода, выделяемого в кислой среде из йодистого калия при действии перекисей, содержащихся в 100 г жира. Перекисное число выражают обычно в процентах йода или в миллилитрах раствора тиосульфата, иногда в миллимолях или в миллиэквивалентах активного кислорода перекисей.
160
нов, которые более активно взаимодействуют со свободными радикалами и с кислородом воздуха и тем самым препятствуют окислению жиров. Продолжительность индукционного периода зависит от концентрации антиокислителей, природы жира и условий хранения.
Животные жиры, в составе которых меньше непредельных жирных кислот, более устойчивы. Наименее стоек свиной жир, так как в нем содержится значитель-
Рис. 27. Накопление перекисей при окислении топленого свиного жира при 90°С.
венных антиокислителей: каротиноидов, токоферолов. Поэтому индукционный период свиного жира значительно короче, чем говяжьего.
Процесс автоокисления жиров значительно ускоряется в присутствии влаги, света и катализаторов. Такими катализаторами могут быть легкоокисляющиеся металлы (окислы или соли железа, меди, свинца, олова), находящиеся в микроколичествах в виде жирнокислых солей, а также органические соединения, содержащие железо: белки, гемоглобин, цитохромы и др.
Каталитическое действие металлов основано на способности их легко присоединять или отдавать электроны, что приводит к образованию свободных радикалов из гидроперекисей жирных кислот:
161
ROOH + Fe2+ -> Fe3+ + RO + OH;
ROOH + Fe3+ -> ROO + H+ + Fe2+.
Очень активными катализаторами являются ферменты, главным образом ферменты микроорганизмов. Поэтому всякое загрязнение жиров, особенно бактериальное обсеменение, ускоряет процесс окислительных изменений жиров.
Гидроперекиси в силу относительно малой энергии разрыва связи (30—40 ккал) являются неустойчивыми соединениями, поэтому вскоре после образования начинается постепенно их распад с появлением свободных радикалов, например: R—О—ОН—>RO + OH и др. При этом протекают последующие разнообразные реакции, в результате которых накапливаются оксисоединения, альдегиды, кетоны, низкомолекулярные кислоты и др., т. е. возникают вторичные продукты.
Многие из этих соединений появляются в виде свободных радикалов, которые в свою очередь вызывают возникновение дополнительных реакций. Все это способствует ускорению автоокисления и появлению разветвленных цепных реакций.
Образование альдегидов. Реакции образования альдегидов, по-видимому, имеют цепной характер. Механизм их возникновения еще окончательно не выяснен, но имеются следующие представления о возможном ходе моно-молекулярной реакции превращения гидроперекисей
—СН----> —СНО + ОН
ООН
с образованием двух радикалов — гидроксильного и карбонильного.
Гидроксильный радикал, взаимодействуя с другой молекулой вещества, порождает новый свободный радикал
ОН + — СН2---> Н2О -|-СН—
Альдегиды могут возникать также в результате распада циклических перекисей
162
RCH2— CH—CH—CHjRi—COOH -> RCH2C +
C—CH2Ri—COOH н/
При окислении жиров обнаружен ряд альдегидов, представляющих собой продукты распада цепи жирных кислот: нониловый, азелаиновый, гептиловый:
Z н\
СН3(СН2)7С + С(СН2)7СООН + Н2О2 ^н о^
Нониловый альдегид Азелаиновый альдегид
СН3(СН2)5-С ХН
Гептиловый альдегид
Некоторые из образовавшихся альдегидов летучи и могут быть отогнаны с парами воды.
При окислении жиров появляется также малоновый диальдегид НОССН2СОН, который определяют по реакции с 2-тиобарбитуровой кислотой. Продукт реакции окрашен в красный цвет, что позволяет производить фотоколориметрию. Проба с 2-тиобарбитуровой кислотой очень чувствительна и весьма характерна для оценки глубины и направленности окислительного изменения жиров. Показатель выражают в виде тиобарбитурового числа (ТБЧ) по величине экстинкции или в молях малонового альдегида.
Дальнейшее превращение низкомолекулярных альдегидов ведет к появлению низкомолекулярных спиртов, жирных кислот и новому разветвлению окислительной цепи
—СНО— + —СН2—СН2 >—СН 1---------СН2—СН—
I ОН
2СН3(СН2),СНО + О2 -э- 2СН3(СН2),СООН.
163
Образование кетонов. Как и альдегиды, кетоны образуются окислительным путем в результате дальнейших превращений перекисей, например в результате дегидратации
—СН—СН2----> —СО—СН2— + НаО
I
ООН
Предполагают, что в присутствии ферментов микроорганизмов кетоны могут образовываться по типу р-окис-ления, т, е. с участием воды.
Окислительная порча
жиров
Окисление жиров приводит к потере естественной окраски, специфического вкуса и запаха продукта, приобретения им постороннего, иногда неприятного привкуса, аромата, потере биологической ценности. Эти изменения вначале мало ощутимы, постепенно прогрессируют и могут меняться не только по интенсивности, но и по качеству.
Первичные продукты окисления — перекиси — не обнаруживаются органолептически. Однако по их содержанию можно судить о глубине порчи жира, пригодности его для длительного хранения и употребления в пищу. Ухудшение органолептических показателей жиров вызвано образованием вторичных продуктов окисления. При этом различают два основных направления порчи жиров — прогоркание и осаливание.
Прогоркание. Процесс прогоркания происходит в результате накапливания в жирах низкомолекулярных продуктов: альдегидов, кетонов, низкомолекулярных жирных кислот; в этом случае жир приобретает прогорклый вкус и резкий, неприятный запах.
Прогоркание жиров может происходить вследствие химических и биохимических процессов.
В первом случае порча является результатом контакта жира с кислородом воздуха и интенсивность развития процесса зависит от условий хранения жира. Во втором случае прогоркание жира развивается вследствие жизнедеятельности разнообразных микроорганизмов.
164
При химическом прогоркании обнаруживается увеличение перекисных чисел, накопление свободных жирных кислот, иногда низкомолекулярных, не свойственных данному жиру. Вещества, придающие продукту запах прогорклости, можно отгонять с паром. Добавление к свежему жиру отгона создает ощущение прогорклости. Запах прогорклости возникает из-за присутствия летучих карбонильных соединений — альдегидов и кетонов.
Прогоркание в результате биохимических процессов инициируется обычно плесенями. Развитию этого процесса благоприятствуют наличие воды, белков и оптимальная температура. Процесс, протекающий вначале под действием липаз; освобождающих жирные кислоты, переходит в процесс р-окисления последних с образованием кетокислот и метилалкилкетонов
R—СО—СН2СООН’->- R—СО—СН3 +[СО2.
При этом из кислот возникают кетоны, содержащие на один углерод меньше, чем в исходной кислоте: из капроновой — метилпропилкетон, каприновой —• метилгеп-тилкетон, лауриновой — метилонилкетон и т. д.
Кетонное прогоркание иногда называют «душистым прогорканием» в связи со своеобразным запахом продуктов окислительной порчи. В последнее время большое внимание уделяют методам количественного определения карбонильных соединений — альдегидов и кетонов. Установлена прямая связь между накоплением этих соединений и интенсивностью изменения органолептических свойств жира.
В этом отношении весьма ценными, помимо пробы с 2-тиобарбитуровой кислотой, оказались методы определения карбонильных чисел и карбонильного индекса'. Оба определения основаны на спектрофотометрическом измерении интенсивности поглощения света продуктом, появляющимся в результате взаимодействия между карбонильными соединениями и 2,4-динитрофенилгидра-зином.
1 Карбонильное число обозначает общее содержание карбонильных соединений в микромолях на 1 кг жира, а карбонильный индекс — содержание летучих карбонильных соединений (отгоняемых с током азота) в 0,0001 ммоль карбонила на 1 кг жира.
165
Сравнительная характеристика карбонильных показателей, перекисей и органолептических свойств при порче жиров приведена в табл. 22.
ТАБЛИЦА 22
Перекисное число Карбонильное число Карбонильный индекс Запах жира
1,2 7 23 Хороший
5,0 6 14 Очень хороший
9,0 8,5 60 Слабо прогорклый
15,3 11,5 . 94 » »
20,0 13 70 » »
10,0 13 370 Очень прогорклый
Из данных табл. 22 видно, что изменение органолептических качеств жира не соответствует содержанию перекисей, но хорошо сочетается с изменением карбонильного индекса.
Осаливание жиров. Процесс окисления иногда сопровождается исчезновением окраски, уплотнением жира, появлением салистой консистенции. Такой процесс порчи, еще мало изученный, получил название осаливания.
Для осаливания характерно образование значительного количества оксисоединений, которые возникают в результате распада на свету первичных органических перекисей, а также в результате появления свободных радикалов ОН, НОг при фотохимическом воздействии на жир
RjCH—СН=СН—R2 -> RjCH—CH=CHR2 + О
ООН ОН 1
Возникшие радикалы [например, формула (5)], взаимодействуя с молекулами жирных кислот, дают оксикислоты:
СН3 . . . СН2СН=СН . . . СООН + НОО ->
СН3 . . . СНСН=СН . . . СООН + он
он
Содержание оксигрупп определяют по количеству ацетила, который присоединяется к жиру при ацетили
166
ровании. Результаты выражают ацетильным числом, которое возрастает с увеличением количества оксигрупп.
Образовавшиеся оксикислоты вовлекаются в процесс полимеризации, который носит характер цепной реакции
Ri + R -> RXR и т. д.
В результате полимеризации оксикислот образуются высокомолекулярные соединения и жир приобретает характерную салистую, мазеобразную консистенцию. Оса-лившийся жир характеризуется также специфическим неприятным запахом и вкусом.
Изменение окраски жиров. До начала окислительных изменений триглицеридов разрушаются каротиноиды, и поэтому в итоге окисления жир обесцвечивается, иногда принимает зеленоватую (фисташковую) окраску, изменяется его спектр поглощения. Эти изменения каротиноидов позволяют обнаружить окислительные изменения жиров на ранних стадиях.
Вместе с отмеченными процессами протекает и деструкция витамина—токоферола.
Наиболее интенсивно окислительная порча происходит при продолжительном нагреве жиров при высоких температурах 180—300° С. Такой нагрев сопровождается снижением содержания ненасыщенных жирных кислот и накоплением перекисей, карбонильных соединений, летучих кислот и продуктов сополимеризации.
Направление окислительной и гидролитической порчи жиров схематически представлено на рис. 28.
Изменение биологической ценности жиров. В результате окислительных превращений жиров изменяются не только их органолептические свойства, но и пищевая и биологическая ценность. Прежде всего в окислительные процессы вовлекаются Жизненно необходимые, ненасыщенные жирные кислоты, т. е. наиболее ценная составная часть триглицеридов и фосфатидов.
Окислительные разрушения каротиноидов и токоферолов еще больше снижают биологическую ценность жиров. Кроме того, жиры приобретают дополнительно нежелательные свойства. Первичные продукты окисления, перекиси оказывают токсическое действие на организм. Появление перекисей может привести к образованию и других (вторичных), иногда токсичных продуктов окис-
167
лительной порчи жиров. К таким соединениям относят некоторые вещества, содержащие карбонилы, а также полимерные соединения, возникающие из продуктов окислительной деструкции или модификации жирных кислот. Накопление подобных продуктов, по-видимому, специфического состава и строения происходит наиболее
неорганические, органические
Гидролитические превращения
Прогоркание Реал икание
Рис. 28. Схема порчи жиров.
Мирные \ кислоты J Глицерин Л
Моно-и ОигтЬ. цериРы )
интенсивно при продолжительном нагревании жиров при высоких температурах (180—408°С). В результате этого снижается их биологическая ценность, усвояемость и протекает образование токсических веществ, обладающих иногда канцерогенными свойствами.
ХИМИЧЕСКИЕ ПРИНЦИПЫ
ПРЕДОХРАНЕНИЯ ЖИРОВ ОТ ПОРЧИ
Для предотвращения окислительных изменений жиров необходимо уменьшить или исключить контакт жира с кислородом воздуха и с источниками энергии — светом, теплом.
168
Жир целесообразно хранить в герметической таре, в вакууме или в атмосфере инертного газа при отрицательной температуре. Жиры, вытопленные при правильном технологическом режиме, характеризуются более длительным индукционным периодом.
В жирах не должно быть легко окисляющихся металлов (меди, железа, марганца), их солей или органических производных, соединений свинца, олова и других металлов, даже в ничтожных количествах, значительно ускоряющих порчу жиров.
Антиокислители. В последние годы применяют искусственные антиокислители (ингибиторы окисления), добавление которых в минимальных количествах в жиры удлиняет продолжительность их хранения.
К антиокислителям предъявляют ряд требований: они не должны обладать вредными для организма свойствами; при введении в жир они не должны вызывать нежелательных органолептических изменений.
К антиокислителям относят различные вещества — одни из них естественного происхождения, другие синтетические. Среди последних преобладают производные фенолов (допустимые в пищу). Действие антиокислителей зависит от их строения, наличия в их структуре подвижного атома водорода, специфических по взаимодействию с кислородом функциональных групп, двойных сопряженных связей и др.
Сущность действия антиокислителей заключается в том, что они вступают в реакцию со свободными радикалами, образовавшимися во время цепной реакции окисления жиров. Передавая энергию антиокислителю, радикалы выводятся из цепи и цепь обрывается:
R -р hv -> R,
R4-А -> R 4- А,
где R — жирная кислота; А — антиокислитель; hv — энергия.
Активная молекула антиокислителя в результате взаимодействия с кислородом теряет энергию, переходя в неактивный окисленный продукт
А 4- О2 —> АО2.
Таким образом, антиокислитель препятствует возможности образования свободного перекисного радикала
169
R + 02—>R00 и развитию дальнейшего механизма цепной реакции.
Одни антиокислители в случае возникновения свободного радикала могут насытить его свободную валентность за счет подвижного атома водорода и тем самым затормозить развитие процесса. Другие антиокислители обладают способностью превращать уже возникшие гидроперекиси в неактивные соединения. Для этой цели может служить активная двойная связь в молекуле антиокислителя.
При наличии в смеси двух типов антиокислителей возникает синергизм. Синергизм в действии антиокислителей проявляется в том, что если один из антиокислителей ингибирует образование свободных радикалов, то другой способен разрушать уже возникшую гидроперекись. Существует и специальная группа веществ — синергистов антиокислителей. Они не все обладают способностью самостоятельно тормозить окисление, но усиливают действие антиокислителей.
Сильным антиокислителем животных жиров является галловая кислота, но она слабо растворяется в жирах, неустойчива и довольно быстро разлагается. По строению галлаты очень близки к полифенолам, содержащимся в чае, из которых наиболее важным является галло-катехин чая. Сильным антиокислительным действием, довольно близким по эффекту к действию галлатов, обладает нордигидрогваяретовая кислота (НДГК)
но
он
он
ф'з СН3 снг-сн-сн-сн
он
Менее распространены и менее изучены в качестве антиокислителей флавониды, кофейная кислота и др.
Простейшие антиокислители: гидрохинон, пирогаллол, гваякол — при введении в жир вызывают нежелательные органолептические изменения, поэтому неприменимы.
Из природных антиокислителей известны лецитин, каротиноиды, а также токоферол — витамин Е. Введение токоферола весьма желательно для увеличения продолжительности хранения и повышения биологической цен
170
ности жиров. Антиокислительная активность разных токоферолов неодинакова.
Известен ряд синтетических веществ, обладающих свойствами антиокислителей. Бутилоксианизол (БОА) в концентрации 0,01—0,02% хорошо предохраняет свиной жир от окисления. Синергистами бутилоксианизола являются метионин, лецитин, лимонная и пропионовая кислота, пропилгаллат. При добавлении бутилоксианизола продолжительность хранения жира увеличивается в несколько раз. Так, высокое качество образца жира при добавлении ингибитора хорошо сохранялось в течение 2 лет, в то же время контрольный образец испортился через 3—5 месяцев хранения.
Довольно близок по строению к БОА бутилокситолуол
сн. осн3 । 3 X7--C-CI!., L Г । он СНз
Бутилоксианизол
Бутилокситолуол тоже хорошо защищает от окисления свиной и говяжий жир; его эффективность возрастает в несколько раз в присутствии бутилоксианизола и лимонной кислоты.
К группе синергистов относятся органические кислоты, их эфиры и отдельные неорганические кислоты. Они являются одновременно и дезактиваторами металлов. Многие из этих синергистов препятствуют переносу электронов в цепи окисления.
В пищевой промышленности широко применяется аскорбиновая кислота, обладающая высоким окислительно-восстановительным потенциалом, способностью легко переходить в окисленную и восстановленную форму в результате дегидрирования и гидрирования. Следовательно, как донатор свободного водорода аскорбиновая кислота может восстанавливать окисленную форму антиокислителя.
Особенно широко применяются эфиры аскорбиновой кислоты с жирными кислотами — вещества, легко раст
171
воримые в жирах: эфиры пальмитиновой, миристиновой, лауриновой и других кислот:
ROCOCH2—НОНС-С—С=С—С=О
Н ОН ОН
(R — остаток жирной кислоты: аскорбиллаурат, аскор-билпальмитат и др.).
К синергистам относятся также ряд кислот, наиболее эффективных для растительных масел: лимонная, малоновая, фумаровая, щавелевая, фосфорная. Особенно эффективны их эфиры, например эфиры лимонной со стеариновой и другими кислотами.
Максимальные концентрации некоторых антиокислителей не должны превышать следующих величин (в %).
Токоферолы............0,3
Нордигидрогваяретовая кислота................0,01
Бутилоксианизол .... 0,01
Бутилокситолуол .... 0,01
Пропилгаллат .... 0,01
Аскорбилпальмитат ... 0,03
Другие вещества. Сильным антиокислительным действием обладают некоторые природные специи или экстракты из них. Так, при хранении смальца при 37°С тормозилось накопление перекисей и рост ТБЧ смесью из порошка белого перца и мускатного ореха или майорана в течение 112 дней, а при добавлении к этим компонентам аскорбиновой кислоты эффект усиливался — хранение продолжалось до 236—275 суток.
В последнее время проведены исследования по использованию ферментов для предохранения жиров от окисления. Для этой цели использована глюкозооксида-за — фермент, окисляющий глюкозу в присутствии кислорода. Добавление каталазы усиливает эффект действия. Химизм последовательного действия фермента можно представить так:
Глюкозооксидаза
1. Глюкоза + Н2О + О2-------------> Глюконовая кислота + Н2О2
Каталаза
2. Н2О2--------* H2O + V2O2
172
Препарат ферментов вместе с химическими реагентами наносится на поверхность топленого жира, упакованного в герметическую тару. Благодаря поглощению кислорода из воздуха над поверхностью свиной жир не окисляется при 20—25° С до 24 месяцев, а говяжий — 12 месяцев.
КОСТЬ
Кости входят в состав скелета и выполняют основную опорную функцию в организме.
Кости состоят из костной ткани, костного мозга и надкостницы, различных по структуре, химическому составу и выполняемым функциям.
В составе костей в отличие от других тканей и органов имеется много неорганических соединений: на их долю приходится 48—74% сухого остатка. Несмотря на высокую плотность, в костях содержится значительное количество воды, но в целом они беднее водой, чем другие ткани организма.
Содержание основных химических компонентов в свежих костях характеризуется данными табл. 23.
ТАБЛИЦА 23
Составные части Содержание (в %) bi [ОСТЯХ
бедра лопатки челюсти ребер
Вода . . 19,15 27,36 17,36 35,58
Жир 25,57 6,86 3,77 3,55
Органические вещества 15,99 26,07 22,74 20,21
Неорганические вещества 38,18 39,33 54,09 37,87
Содержание основных компонентов костей, особенно воды, жира и неорганических веществ с возрастом животных меняется (табл. 24).
В среднем кости имеют следующий химический состав: вода 13,8—44,4%, коллаген 32—32,8%, минеральные вещества 28—53%, жир 1,3—26,9%.
Наиболее важными и характерными структурными элементами костей, имеющими промышленное значение, являются костная ткань и костный мозг.
173
ТАБЛИЦА 24
Составные части Содержание (в %) в костях животных разного возраста
при рождении 1 месяц 1 год- 3—4 рода
Вода 65,67 56,11 20,88 21,45
Жир Органические вещества 0,57 1,92 18,05 16,28
растворимые в воде . . . 4,61 2,29 1,23 1,17
нерастворимые в воде . . 13,59 16,29 15,40 16,10
Неорганические вещества 15,56 23,39 37,17 45,00
КОСТНАЯ ТКАНЬ
В состав костной ткани входят костные клетки — остеопаты и межклеточная субстанция, состоящая из межуточного бесструктурного вещества и оформленных частиц — волокон. Межуточное вещество состоит из белковой основы — оссеомукоида, который в электронном микроскопе имеет вид аморфного вещества, обволакивающего, спаивающего или склеивающего коллагеновые волокна и заполняющего свободное пространство, а также из органических соединений, находящихся в тесной связи с минеральными веществами.
Из волокон коллагенового типа, расположенных параллельными рядами в виде тонких пучков, формируются изогнутые пластинки (толщиной 4,5—11,0 мкм), трубки.
Основной структурной единицей костной.ткани является остеон (рис. 29). Это — цилиндр с центральным каналом, в котором проходят кровеносные сосуды. Канал окружен пластинками, внутри и снаружи расположены высокоупорядоченные пучки волокон коллагена, пронизанные тончайшими кристаллами неорганической природы.
Костная ткань характеризуется значительной твердостью и упругостью, что объясняется ее особой структурой и своеобразным сочетанием морфологических компонентов, построенных из органических веществ, с минеральными соединениями, нерастворимыми в воде.
Благодаря своеобразию строения, химического состава и большой плотности костная ткань стойко противо
174
стоит разрушительному влиянию микроорганизмов и других факторов. Исследование скелетов ископаемых млекопитающих показало, что хотя содержание органических веществ в костях уменьшено, а минеральных увеличено,. выделяемый коллаген обладает характерными для него свойствами.
Рис. 29. Объемная схема строения остеона. В центре канал, содержащий кровеносные соСуды. Канал соединен узкими каналами с полостями, в которых присутствуют остеоциты. Концентрические слои состоят главным образом из гидроксилапатита, погруженного в различным образом ориентированные волокна коллагена (косая штриховка) .
Химический состав
В костной ткани содержится 20—25%' воды, 80—75% сухого остатка, в том числе 30% белков и 45% неорганических соединений. У животных некоторых видов наблюдаются значительные отклонения от этих показателей.
При обработке костной ткани слабыми кислотами (уксусной, разведенной соляной, фосфорной и др. ) минеральные вещества растворяются и остается мягкая, эластическая ткань — органическая часть костной ткани, так называемый оссеин.
Размягчение кости в результате удаления минеральных веществ называют мацерацией (лат. maceratio — размягчаю).
Органические вещества. Органическая основа костной ткани построена из белковых веществ, входящих главным образом в структуру оссеина. Основной белок костной ткани — коллаген — составляет 93 % всех белков ткани. Состав оссеина (в %): влага 70, белковые вещества 25—28, минеральные вещества 3, жиры 0,2.
175
Для очистки коллагена, входящего в состав оссеина, от других белков оссеин обрабатывают щелочью. На производстве эта операция называется золкой. Наиболее пригодна для этой цели кальциевая щелочь Са(ОН)2, так как при ее использовании снижается возможность гидролиза коллагена и его потеря благодаря небольшой растворимости Са(ОН)2 (0,15—0,18%) и pH раствора 12— 13. Более активные щелочи, например едкий натр, хотя и резко ускоряют процесс, но вызывают значительную деструкцию коллагена.
Во время обработки оссеина щелочью ткань разрыхляется; растворяются и удаляются органические и некоторые белковые вещества (альбумины, глобулины). Особенно важна операция золки для удаления муцинов и мукоидов, которые растворимы только в щелочной среде и не коагулируют при кипячении. Присутствие этих глюкопротеидов значительно снижает качество желатина. Во время золки коллаген набухает. После удаления минеральных и растворимых органических веществ коллаген оссеина путем нагревания можно перевести в желатин.
В основном веществе костной ткани содержится ос-сеомукоид, по строению и физико-химическим свойствам (растворимость в щелочах) сходный с хондромукоидом (содержит эфирносвязанную серную кислоту).
Элементарный состав оссеомукоида (в %): углерод 47,43, водород 6,63, азот 12,22, сера 2,32, кислород 31,40.
Стенки костных канальцев выстланы особым белком, более прочным, чем коллаген, похожим по свойствам на кератин, но растворимым в 1%-ном КОН и легко гидролизуемым пищеварительными ферментами. Остальные белки (альбумины, глобулины) присутствуют в незначительных количествах.
Из других органических соединений в составе костной ткани в небольшом количестве имеются липиды, в частности 0,177—0,195% лецитина. В составе эпифизов обнаружено 0,0169% гликогена, извлекаемого КОН, а в составе диафизов— 0,0071%.
Специфической особенностью костной ткани является содержание в ней значительного количества солей лимонной кислоты — 70% от всего запаса ее в организме, что обусловлено особенностями биосинтеза ткани..
176
Минеральные вещества. Наиболее характерными компонентами костной ткани являются минеральные вещества, составляющие 74 объема, или у2 массы ткани. После прокаливания в кости остаются только минеральные вещества. Кость сохраняет свою форму, но лишенная органических веществ, становится весьма непрочной, хрупкой, легко растирается в порошок; под микроскопом на шлифе такой кости в местах расположения костных канальцев видны большие пустоты. Минеральные вещества представлены главным образом кальциевыми солями угольной и фосфорной кислоты, в меньшем количестве обнаружены магниевые соли фосфорной кислоты и еще меньше фтористого кальция. Около 99% всего кальция находится в составе скелета.
Ниже приведен солевой состав минеральных веществ костной ткани (в %).
Са,(РО4)2............. 85 СаС12 .................. 0,2
СаСО3................. 10 Mg(PO4)2..................1,5
CaF2.................... 0,3
Элементарный состав зольных элементов костной ткани характеризуется следующими данными (в %).
СаО.............'. 52 К2О...............
MgO .......... . 1,2 Cl................
0,2 0,1
0,1
5,0
Р2О6 ..................40,3 F
Na2O.................. 1,1 СО2
Соотношение солей основных минеральных соединений костной ткани напоминает состав минерала апатита в форме гидроапатита
Са
Са
уРО4
Са^
(ОН)2
3
В костной ткани образуются тончайшие кристаллы этого соединения, видимые под электронным микроскопом. Кристаллы имеют вид палочек или игл толщиной от 1,5—3,0 нм и длиной до 20—40 нм. В 1 г кости содер
7—454
177
жится около 1016 кристаллов; общая поверхность их, доступная для взаимодействия с окружающей средой, составляет около 100 м2.
Кроме того, в составе ткани обнаружены многие микроэлементы: А1, Мп, Си, РЬ и др.
Остальные соли не входят в состав кристаллов, а адсорбируются на их поверхности. По-видимому, эти ультрамикрокристаллы находятся в тесной связи с органическими соединениями ткани. С возрастом животного наряду с общим увеличением содержания минеральных веществ в костной ткани нарастает содержание карбонатов и уменьшается количество фосфатов. В результате такого изменения кости утрачивают упругость и становятся более хрупкими.
Биохимические процессы
Несмотря на видимую инертность, прочность и неподвижность костей, в них происходит постоянный обмен веществ и возобновление тканевых элементов. При жизни животного костная ткань образуется как из соединительной, так и из хрящевой ткани.
В образовании костной ткани большую роль играют костные клетки — остеобласты, богатые РНК, что связано с участием их в синтезе белков. В явлениях минерализации огромное значение имеет фермент фосфатаза (щелочная), для которой характерна высокая активность именно в костной ткани. Фосфатаза катализирует гидролиз фосфатных эфиров органических соединений, главным образом гексозофосфата или глицерофосфата, поступающих в костную ткань с током крови
+ н2о
-------► R-CH2OH + Н3РО4
Фосфатаза
В дальнейшем фосфорная кислота взаимодействует с кальциевыми солями, в результате чего СаНРО4 осаждается, а затем в результате адсорбции ионов кальция образуется Са3(РО4)2. В процессах переноса кальция активная роль принадлежит лимонной кислоте.
Осадок изменяется, приближаясь по структуре к апатиту. Вслед за этим фосфаты адсорбируют из раствора
ОН
R—СН2—О—Р=О
ОН
178
карбонаты. Кристаллы формируются в каких-то определенных участках коллагеновой структуры, центрах конденсации кристаллов, расположенных вдоль оси волокна через регулярные интервалы.
С помощью Р32 и Са45 было показано, что ежедневно обновляется от 10 до 20% минерального состава костной ткани. Обмен коллагена протекает медленнее, как это было установлено с помощью меченого глицина.
На процесс образования костной ткани влияют гормоны зобной и паращитовидных желез, гипофиза, половые гормоны, а также витамины D и С (витамин D участвует в регуляции обмена кальция и фосфата и тем самым способствует процессу окостенения).
При нарушении фосфорно-кальциевого обмена (в случае недостатка витамина D) кости утрачивают твердость, так как содержание минеральных солей снижается до 34—19% массы сухой кости (рахит).
КОСТНЫЙ мозг
Костный мозг заполняет костномозговые полости. Его основой является сетчатая (ретикулярная) ткань, в петлях которой расположены разнообразные клеточные элементы: эритроциты, эритробласты, лимфоциты, лейко-бласты и различные по форме и возрасту кровяные клетки. Кроме того, здесь располагаются большие жировые клетки.
При небольшом количестве жировых клеток костный мозг окрашен в красный цвет, а при преобладании их он приобретает желтоватый оттенок. В связи с этим различают красный и желтый костный мозг. Красному костному мозгу принадлежит основная роль в кроветворении. Эта функция мозга регулируется сложным нервно-гуморальным механизмом. Важное значение имеют также витамины В12, В6, фолиевая и аскорбиновая кислоты, ионы железа.
Оба вида мозга различаются и по химическому составу. В желтом костном мозге, являющемся запасным питательным веществом, содержатся в основном жиры и в меньшем количестве холинфосфатиды, холестерин, белки и минеральные вещества. Воды в мозге 1,5—21%, в среднем 14,7%. В сухом остатке желтого мозга 98,1% жира, 0,30% холестерина, 0,18% лецитина и 0,17% золы.
7* 179
Красный костный мозг характеризуется следующим соотношением основных компонентов (в %): вода 67,4, сухое вещество 32,6, в том числе белок 11,6, жир 17,9, минеральные вещества 3,0.
В составе жиров костного мозга преобладают пальмитиновая, олеиновая, стеариновая кислоты (табл. 25).
ТАБЛИЦА 25
Кислота Содержание кислот (в %) в мозге
красном желтом
Олеиновая 47,4 78,0
Стеариновая 36,3 14,2
Пальмитиновая 16,4 7,8
Помимо компонентов, общих с желтым мозгом, в составе красного мозга встречаются в значительном количестве белки, а также различные экстрактивные вещества: инозит, молочная и лимонная кислоты, гипоксантин. Из белков содержится 0,39% (к свежему веществу) фибриногена, 1% глобулина, 1,52% альбумина. Характерно также наличие особых железосодержащих белков, в частности фееритина, — вероятных предшественников гемоглобина. В красном мозгу обнаружен также протромбин.
ИСПОЛЬЗОВАНИЕ КОСТЕЙ
Кости убойных животных составляют до 20% массы туши крупного и мелкого рогатого скота и используются для пищевых целей. На мясокомбинатах из них выделяют пищевой костный жир.
Большое количество олеиновой кислоты, белков и экстрактивных веществ в костном жире создает условия для его сравнительно быстрой гидролитической и окислительной порчи. Вместе с тем костный мозг, особенно красный, благодаря наличию белков и экстрактивных веществ представляет собой чрезвычайно благоприятную среду для развития микрофлоры и весьма быстро может подвергаться гнилостным изменениям. Чаще всего порча жиров в костях протекает одновременно с развитием гнилостных процессов.
180
Как уже отмечалось, костная ткань после извлечения жира подвергается мацерации, золке и затем используется для получения желатина и клея. В последнее время из костной ткани стали изготовлять один из кровезаменяющих препаратов — оссеиноль.
ХРЯЩЕВАЯ ТКАНЬ
Хрящевая ткань является одним из компонентов скелета. Она состоит из сильно развитого аморфного межклеточного (основного) плотного вещества, в котором встречаются клетки, тончайшие волоконца, капельки жира и глыбки гликогена.
Хрящи имеют различное строение в зависимости от выполняемых функций. Различают хрящи гиалиновый (стекловидный), волокнистый (соединительнотканный) и эластический. По внешнему виду гиалиновый хрящ (например, трахеи) — вещество однородное по строению, полупрозрачное, молочно-белого или синеватого цвета.
После обработки поверхности хряща марганцовокислым калием выступает его волокнистая основа.
В составе эластического хряща (ушная раковина) преобладают эластические волокна, а в волокнистом хряще (встречается в месте перехода сухожилий в гиалиновый хрящ) содержатся коллагеновые волокна, объединенные в параллельные пучки.
В хрящевой ткани воды содержится больше, а минеральных веществ меньше, чем в костной ткани. Об этом свидетельствуют приводимые ниже показатели (в %).
Вода................................ 40—70
Минеральные вещества ........ 2—10
Органические вещества .............. 28
В том числе: белки........................ . 17—20
жиры.......................... 3—5
гликоген и др. . . . .'......... 1
Наиболее важными составными частями основного вещества хрящей являются хондромукоид, мукополисахариды (хондроитинсерная кислота), коллаген, протеиноид (неизвестный по свойствам), отличный от кератина и коллагена, а также другие органические и минеральные вещества.
181
Хондромукоид — сложный белок, характерный для хрящевой ткани глюкопротеид, по-видимому, продукт деструкции коллагена, связанный с хондроитинсерной кислотой. Элементарный состав его (в %): углерод 47,40, водород 6,42, азот 12,58, сера 2,42, кислород 31,28.
В образовании соединения коллагена с хондроитинсерной кислотой участвуют солеобразные связи между отрицательными функциональными группами коллагена и положительными группами мукополисахарида. Хондромукоид и свободная хондроитинсерная кислота составляют цементирующую (стекловидную) основу хрящей.
Хондроинтинсерная кислота (мукополисахарид) является высокополимерным соединением, молекулярная масса которого 260 000. Состоит он из эквимолекулярных количеств глюкуроновой кислоты, ацетильного производного аминогалактазы и серной кислоты, довольно легко растворяется в воде; при осаждении образуется белый аморфный осадок
сн2—о—so2oh
1 Остаток серной кислоты
но-с-н
н-с
HOO2S-O-CH2 но-с-н
I ' н-с----
н-с-он
Ц.С- C Н
н I I .
н-с-он
ЩС-C-N-C-H
Остаток ‘ уксусной Н кислоты
ноос-с-с-с—с-с-о-с—с—с-с—с—соон
I I I I I I I I I I
Н H..OI! II н н н онн н
Остаток глюкуроновой кислоты
Хондроитинсерная кислота
Хондроинтинсерная кислота является парной эфиро-серной кислотой. Водные растворы ее солей характеризуются высокой вязкостью. Мукополисахарид быстро деградирует в присутствии щелочей, особенно при температуре выше 0°С. При нагревании с разведенной соляной кислотой хондроитинсерная кислота расщепляется на хондроитин и серную кислоту. В случае отщепления уксусной кислоты образуется хондрозин, который при дальнейшем гидролизе распадается на основные компоненты — глюкуроновую кислоту и аминогалактозу.
182
Важным свойством хондроитинсерной кислоты является ее способность образовывать солеобразные соединения с различными белками. Помимо коллагена, такие соединения получены с проколлагеном, яичным альбумином, эдестином, нуклеопротеидами и другими белками. По-видимому, этим объясняется цементирующая роль мукополисахаридов в хрящевой ткани.
Хондроитинсерная кислота встречается преимущественно в гиалиновом хряще. С возрастом в ткани гиалинового хряща откладываются соли кальция (обызвествление). Эластический хрящ в отличие от гиалинового не обызвествляется.
Хрящи используют в пищевых целях и направляют на выработку желатина и клея.
При нагревании хрящей в воде температурой свыше 70° С коллаген переходит в желатин и затем в жела-тозы.
Значительное содержание мукополисахаридов и му-копротеидов в хряще затрудняет его переработку при получении желатина. Мукополисахариды и мукопротеиды не коагулируют при кипячении, поэтому в случае неполного удаления из ткани могут при нагревании перейти в раствор вместе с желатином. Наличие в растворе желатина глюкополисахаридов и протеидов уменьшает его вязкость и снижает прочность студня. Поэтому из хрящей трудно получить желатин и клей высокого качества. Из хрящей трахеи и носа изготовляется препарат «Хонсу-рид», состоящий в основном из калиевой соли хондроитинсерной кислоты. Препарат стимулирует восстановительные процессы при заживлении ран, синтез коллагена, мукополисахаридов.
ПОКРОВНАЯ ТКАНЬ И ЕЕ
ДЕРИВАТЫ
Покровная ткань-—кожа (шкура) —защищает тело животных от физических и химических воздействий окружающей среды, механических повреждений, потери тепла и воды, проникновения в организм разнообразных болезнетворных начал. Кожа выполняет функции органа выделения некоторых продуктов метаболизма и органа осязания.
183
В коже имеются потовые, сальные железы и волосяные луковицы, к производным покровной ткани относятся роговые образования: волосы, шерсть, щетина, перья, пух, рога, когти, копыта и т. п.
Шкура состоит из трех слоев: наружного — эпидермиса, среднего — дермы, нижнего — подкожной клетчатки. Эпидермис включает много рядов эпителиальных клеток, ороговевших на поверхности.
Дерма — средний, наиболее толстый, основной слой шкуры. Она представлена двумя слоями: верхним сосочковым и нижним сетчатым. Сосочковый слой построен из рыхлой соединительной ткани, в которой расположены сосуды, питающие эпителий и нервный аппарат. Тонкие пучки сосочкового слоя переходят в плотный нижний сетчатый слой дермы, представляющий собой плотную соединительную ткань, построенную из толстых переплетающихся пучков коллагеновых волокон. Среди пучков коллагена расположены отдельные эластиновые волокна, остальное пространство заполнено бесструктурным межуточным веществом.
Нижний слой кожного покрова представляет собой рыхлую соединительную ткань.
Каждый из слоев шкуры выполняет особые функции и имеет особый химический состав.
БЕЛКОВЫЕ ВЕЩЕСТВА
Белковый состав основной части шкуры — дермы — характеризуется следующими данными (в % к сырой шкуре). ____________________
Коллаген ... 33,2
Эластин .... 0,34
Альбумины и глобулины ... 0,70
Мукоиды .... 0,16
По составу дерма очень похожа на плотную соединительную ткань (см. табл. 13). Основные химические компоненты ее — соединительнотканные белки, а специфическими белками шкуры и ее производных являются эпи-дермин и кератин.
Эпидермин. Это белок, образующийся в поверхностном слое эпидермиса, по свойствам близок к кератинам.
184
По структуре он подобен кератину, поэтому для него возможен переход a-формы в 0-форму.
Эпидермин упруг и способен к сверхсокращению до 20% при нагревании до 70—85° С. Он не является индивидуальным белком, не растворяется в воде, нейтральных солях, но полностью переходит в раствор под действием 6 М раствора мочевины. Молекулы эпидермина асимметричны (коэффициент дисимметрии 3,5). Молекулярная масса основного компонента белка, выделенного при помощи мочевины, 60000. В молекуле белка растущего эпителия имеются SH-группы, а в ороговевших клетках — S—S-. Под действием мочевины происходит разрыв водородных связей и эпидермин распадается на структурные единицы. После этого дополнительная дезагрегация части белка может быть достигнута под действием сульфидов, которые разрывают — S—S-мостики с восстановлением SH-rpynn.
Кератин. Белок прочных образований (производных) шкуры: рогов, копыт, волос, шерсти, щетины, пуха, пера и т. д. В зависимости от происхождения физико-химические свойства и химический состав кератинов существенно меняются.
Кератины относятся к группе протеиноидов — наиболее прочных, устойчивых белков. Они нерастворимы ни в воде, ни в растворах солей, кислот, спирте, эфире и т. п., не гидролизуются под действием пищеварительных фер-
ТАБЛИЦА 26
Аминокислоты Содержание аминокислот» Аминокислоты Содержание аминокислот,
% к белку % к белку
1 щетины шерсти пера щетины шере- | ти пера ।
Аланин 4,14 Треонин . . . 6,3 6,42 4,4
Глицин — 6,58 — Цистеин . . . 14,4 11,9 8,2
Валин 5,9 4,64 8,3 Метионин . . . 0,5 0,7 0,5
Лейцин 8,3 11,3 8,0 Аргинин .... 10,9 10,4 7,5
Изолейцин . . . 4,7 11,3 6,0 Гистидин ... 1,1 1,1 0,4
Пролин 9,6 9,5 8,8 Лизин .... 3,8 2,76 1,3
Фенилаланин . . . 2,7 3,65 5,2 Аспарагиновая
Тирозин 3,5 4,65 2,2 кислота . . . 8,0 7,2 7,0
Триптофан .... — 1,8 — Глютаминовая 14,1 9,7
Серин 7,6 10,01 10,2 кислота . . . 17,9
Амидный азот . — 1,17 —.
185
ментов. Такая устойчивость этих протеиноидов объясняется своеобразием строения и сочетания аминокислот в данных белках (табл.26).
В кератинах содержится от 4 до 14,4% цистеина, в связи с чем в их составе много серы — от 2 до 6%, что обнаруживается при горении. Запах горелой шерсти, рога обусловлен образованием из цистеина летучих меркаптанов. В кератинах много пролина и глицина, а также своеобразно сочетание основных аминокислот — гистидина, лизина и аргинина (1 :4: 12). Нерастворимость и устойчивость кератинов обусловлена наличием в них большого количества цистеина, который образует дисульфидные мостики между пептидными цепочками белка по следующей схеме
-СО—NH—СНСО—NH-CH—
I
сн2—S
S—сн2
I
—СН—СО—NH—СН—СО—
Наличие дисульфидных мостиков в молекуле кератина придает белку большую прочность, делает его нерастворимым подобно вулканизированному каучуку. Поэтому иногда кератин называют «вулканизированным белком». Помимо дисульфидных связей, полипептидные цепочки кератина связываются и водородными связями
—S—S— —S—S—
—S—S— —S—S—
I i М I Ср : Ujl : С/5 СО : с/5 : сП I ; I i I _s—S—
-S—S- _ s—S—
-S—S—
Высокое содержание полярных гидрофильных групп в структуре волокон кератина позволяет предположить, что прочность его, по-видимому, зависит и от межмолекулярного взаимодействия между этими группировками.
186
Под действием сероводорода, сульфидов, цианидов, тиогликолевой кислоты и т. п. дисульфидные связи восстанавливаются с образованием сульфгидрильных групп по следующей реакции:
R—S—S—Rx + NaCN -> RSNa + NC—S—Rx.
Восстановленный растворимый кератин получил название кератеина. Он может расщепляться протеолитическими ферментами. Использование кератеина для питания некоторыми насекомыми (личинками моли и др.) объясняется наличием в их пищеварительном тракте особого фермента кератиназы, расщепляющего дисульфидные связи кератеина.
На практике для удаления шерсти применяют вещества, разрушающие—S—S—связи, препараты сульфидов и других подобных веществ. Под действием окислителей Н2О2, Вг2, гипохлорида и других дисульфидные связи тоже распадаются, но при этом в процесс вовлекаются и другие группы белка, в результате чего образуются растворимые продукты, легко вступающие в химические реакции. Механическая деструкция кератеинов (например, тонкое растирание шерсти) также частично переводит кератин в растворимую форму и состояние, доступное для воздействия протеолитических ферментов.
При действии на кератин надуксусной кислоты можно получить растворимый дериват кератина, в котором цистеин окислен в цистеиновую кислоту
RSSR, + 6 [О] + 2с—> 2RSO3 .
Это так называемые кератозины (а, р, у), различающиеся по аминокислотному составу и молекулярной массе (от 10 до 80 тыс.).
Для получения максимально растворимого протеида применяют ряд методов, например обработку тиогликоля-том в присутствии концентрированной мочевины при pH 10,5 и комнатной температуре.
Под действием щелочи в кератинах возможен разрыв дисульфидного мостика гидролитическим путем
н2о
R—S—S—Rx <---> RSOH + HSRi
Остаток сульфеновой кислоты
187
Сульфеновая кислота неустойчива в щелочных растворах и может претерпевать дальнейшие превращения. Сульфгидрильные группы в этих условиях могут вступать в реакцию с полярными группами белка, образуя, например, лантионин
NH NH NH NH
1 1 СН—СН2—SH + носн2-сн > 1 1 1 1 - СН—СН2—S—СН2—СН + Н2О 1 1
1 1 со со 1 1 1 1 со со Остаток лантионина
Для растворения кератинов (при кипячении) применяют вещества, получившие название детергентов, например додецилсульфат натрия (С]2 H25OSO3Na). Молекулярная масса растворимых частиц 75 000, причем они состоят на 60% из кератина и примерно на 40% из присоединенного детергента. С помощью детергентов удалось более глубоко изучить структуру кератина. На основании анализа концевых аминокислот кератина и продуктов его деструкции показано, что молекула кератина состоит из 37 пептидных цепей с общей минимальной массой около 2000 000.
На основании данных рентгеноструктурного анализа, изучения с помощью электронно-оптического метода и результатов исследования физико-химических свойств кератина и продуктов его деструкции предлагают следующую модель-схему строения кератина (рис. 30).
Основой фибриллярной структуры кератина является микрофибрилла (рис. 30, б). Под электронным микроскопом установлены ее диаметр около 80 нм и длина до 1 мкм.
Микрофибриллы отстоят одна от другой на расстояние (от центра) 90 нм.
Внутри каждой микрофибриллы имеются субструктуры— протофибриллы диаметром 20 нм. Микрофибрилла состоит из 11 протофибрилл — две внутри и девять по окружности. В свою очередь каждая протофибрилла представляет собой тройную спираль из трех а-цепей
188
(рис. 30, а). Таким образом, первичным мономером кератина является триплет — прекератин (протофибрилла) подобный тропоколлагену, но с другим аминокислотным составом, структ}фой и физико-химическими свойствами. Микрофибрилл^\ построена из протофибрилл подобных, но не идентичных субъединиц.
Для упрочения кератиновых образований, например шерсти, их обрабатывают формальдегидом, который
«сшивает» цепи белков путем образования метиленовых
(—СН2—) мостиков. Последние, как установлено, образуются между е-аминогруппами лизина и ^СН-группами тирозина. Формальдегид может быть введен в молекулу кератина также после
действия восстановителей по сле-
дующей схеме:
н2 RSSR --RSH + HSR;
2RSH + НСОН -> RS—СН2—SR + Н2О.
В этом случае разорванные цистеиновые связи воссоединяются в более прочные с помощью формалина.
Кератин эластичен, способен растягиваться во влажном состоянии и сокращаться при высыхании. Растягивание кератина, как показали рентгеноструктурные исследования (шерсти, волос, рогов), объясняется переходом a-конфигурации кератина в 0-конфигурацию. сгФорма — складчатая; в изгибе размером 0,51 нм (период идентичности) содержится три остатка аминокислоты. При растяжении обнаруживается 0-форма с периодом идентичности 0,33 нм
и О
Рис. 30. Модель молекулярной структуры сс-ке-ратина:
а — протофибрилла, состоящая из трех а-спиралей, закрученных вместе и входящих в свою очередь в канат; б — микрофибрилла, содержащая И протофибрилл.
189
При растяжении на 100% цепь развертывается полностью (0,515X2). Набухание и растяжение волос и шерсти во влажной атмосфере связано, по-видимому, с разрывом (обратимым) солеобразных или водородных связей между пептидными цепями
При нагревании кератинов в горячей воде большее количество слабых связей разрывается (дисульфидные при этом сохраняются), что приводит к денатурации и необратимому сжатию волокон. Такое явление наблюдается при усадке шерсти и горячей обработке роговых изделий.
В результате таких превращений кератин становится более прочным.
Основная масса кератиновых производных используется в легкой промышленности, но значительное количество отходов (некондиционные рога, копыта, отходы щетины и т. д.) является сырьем для получения пенообразователя, кератинового клея. Пенообразователь получают в результате неглубокого щелочного гидролиза, под давлением. При этом разрушаются — S—S —связи. Продукты деструкции кератинов являются поверхностно-активными
190
веществами. Они стабилизируют пену в противопожарных жидкостях. Подобным методом получают и кератиновый клей. Продукты деструкции кератинов используются для получения кератиновых пленок, лаков, изготовления пластмасс, эмульгаторов. \
Кератины являются ценным^ источником различных аминокислот: глютаминовой, циб^еина, тирозина и др. По аминокислотному составу кератиц является полноценным белком. \
В настоящее время в мясной промышленности СССР организовано промышленное производство некоторых аминокислот на основе гидролиза кератиновых отходов.
Некоторые аминокислоты (например, глютаминовая) получили широкое применение в медицине при лечении ряда заболеваний, связанных с нарушением нервной деятельности. Глютаминовая кислота в виде мононатриевой соли широко используется для улучшения вкуса пищевых продуктов. Добавление к продукту 0,1—0,3% моно-глютамата натрия способствует раскрытию естественного вкуса пищевых продуктов. Большие перспективы имеет получение таких незаменимых аминокислот, как треонин, валин, лизин, лейцин, изолейцин, а также цистина и смесей аминокислот.
МЕЛАНИНЫ
Меланины — это особые пигменты, которые обусловливают в основном окраску кожи. Они откладываются в эпителиальном слое в виде микроскопических аморфных глыбок — зерен.
Образования подобного рода придают окраску волосам, шерсти, перьям и т, и. Меланины трудно растворимы (нерастворимы в воде, солевых растворах, некоторые — в щелочах), похожи в этом отношении на кератины, хотя не содержат серы, а количество азота не превышает 8,8%. Пигменты растворимы в серной кислоте и обесцвечиваются крепкой азотной кислотой, перекисью водорода, сернистой кислотой, хлорной водой. Меланины являются продуктами последовательного окисления тирозина и конденсации продуктов окисления в пигмент-полимер, в основе которого лежит индольное кольцо
191
2 НО
Тирозиназа |.|q Nh2 соон Тирозин / 3,4-Диоксифенилаланин
' • ' ' /' _____________0=^4-^ _____________ / —* СН
NH?COOH
Допатхинон Пигмент
Меланины образуются в тканях с участием тканевых ферментов (тирозиназы и др.).
Характерной особенностью кожных придатков является наличие в их составе Fe, SiO2 (содержание достигает '/з всех минеральных веществ), придающего еще большую прочность кератинам, а также Са, Р.
ПОТОВЫЕ И САЛЬНЫЕ ЖЕЛЕЗЫ
Функцией потовых желез является удаление с потом значительных количеств воды (иногда до '/3 воды, выделяемой из организма) и некоторых продуктов обмена. Сухой остаток пота составляет около 1,2%, из которых '/з— */2 минеральных веществ. Из органических соединений с потом выделяются мочевина, креатин, креатинин, мочевая кислота, а также летучие жирные кислоты (в том числе масляная, капроновая и др.), придающие поту характерный запах.
Секрет сальных желез — густая масса белого цвета, предназначенная для защиты поверхностного слоя ткани от высыхания, участвующая в регуляции теплообмена и предохранении от проникновения микроорганизмов.
Секрет сальных и потовых желез, соединяясь вместе, образует жиропот. Практическое значение имеет жиропот овец (составляет несколько десятков процентов от массы шерсти). Его получают промыванием шерсти в мыльной воде или Извлекают органическими растворителями, которые, однако, ухудшают качество шерсти. Очищенный жиропот овец — ланолин — светло-желтое, мазеобразное вещество (смесь липидов).
В состав жиропота входят в виде эфиров (воски) высокомолекулярные спирты (цериловый, ланолиновый, 192
карнаубовый), холестерин (особенно много), глицерин с высокомолекулярными жирными кислотами, главным образом пальмитиновой, церотиновой (26 углеродных атомов) и миристиновой, а также белки и минеральные вещества. Широкое применение в медицине нашел ланолин как основа для мазей и кремов, способный поглощать значительное количество воды (200—300%) и устойчивый при хранении.
Глава IV.
БИОХИМИЯ НЕРВНОЙ ткани И ВНУТРЕННИХ ОРГАНОВ
НЕРВНАЯ ТКАНЬ
Нервная ткань является одной из самых сложных по структуре, химическому составу и биохимическим процессам. Ей принадлежит ведущая роль в регуляции процессов жизнедеятельности организма, во взаимосвязи организма с внешней средой. Наибольшее внимание при изучении нервной системы уделяется головному и спинному мозгу. В составе других весьма многочисленных элементов нервной системы, нервных стволов, нервных узлов и сплетений, нервных окончаний, пронизывающих все ткани организма, также имеются элементы, характерные для мозговой ткани.
Головной и спинной мозг является ценным пищевым продуктом и сырьем для получения биологических препаратов.
ГОЛОВНОЙ мозг
Головной мозг разделяется на большой и ромбовидный. Большой мозг состоит из двух полушарий, промежуточного и среднего мозга. Ромбовидный мозг включает в себя мозжечок и продолговатый мозг.
На поперечном разрезе головного мозга резко различаются по цвету два образования: серое вещество, в частности кора больших полушарий, в основном построенное из нервной ткани, и белое вещество, состоящее главным образом из отростков нейронов (аксонов, проводящих путей).
194
Рис. 31. Строение нейрона:
1 — ядро; 2 — дендриты;
3 — протоплазма; 4 — аксон.
Основной структурной единицей нервной ткани является нейрон (рис. 31).
Нейроны — наибольшие клетки организма. Их объем достигает от 10 000 до 100 000 нм3. Для сравнения, объем эритроцита составляет 90 нм3. Внутри тела нейрона, кроме ядра, в протоплазме имеется большое количество различных мембранных структур, митохондрий, рибосом. От тела нейрона отходят протоплазматические отростки двух типов: многочисленные древовидные разветвления — ден-риты и один длинный отросток, нервное волокно — аксон. Аксон может достигать 1—1,5 м при толщине меньше 0,025 мм. Внутри он содержит аксоплазму и покрыт сложными миелиновыми оболочками, в которых много липидов. Нейроны окружены большим количеством мелких глиальных клеток, которые и соприкасаются непосредственно с кровеносными капиллярами. Нейроны и их глиальные клетки — сателлиты— образуют единую метаболическую систему. Сами тела нейронов даже в коре больших полушарий головного мозга составляют всего 12— 13% от общей ее массы.
Химический состав цельного мозга млекопитающих характеризуется следующими средними данными (в %): вода 78, белки 8, липиды 12— 15, углеводы 0,1, органические экстрактивные вещества 1—2, неорганические экстрактивные вещества 1.
Серое и белое мозговые вещества.' существенно различаются по химическому составу (табл 27).
Это различие обнаруживается, прежде всего, в соотношении белков и липидов в сухом остатке. В сером веществе (в коре) преобладают белковые вещества, а в белом — липиды. Содержание экстрактивных, минеральных веществ и воды находится в корреляционной зависимости от белкового состава.
Химический состав мозговой ткани весьма неоднороден. Особенно велики различия (в содержании белков,
195
ТАБЛИЦА 27
Составные части
Химический состав больших полушарий, % к сухому остатку
серое вещест- белое вещест-
во во
Белок ......................... . .
Экстрактивные вещества.............
Липиды ............................
В том числе: холинфосфатиды ....................
этаноламинфосфатиды ...........
Холестерин ........................
Цереброзиды........................
Минеральные вещества ..............
44
6
44
20
6
6
6
6
27
3
67
17
13
17
17
3
Примечание. В сером веществе содержится 84% воды, в бе лом — 74%.
липидов и т. д.) между отдельными участками мозга, выполняющими специфические функции. Сухой остаток мозга весьма богат липидами, среди них особенно разнообразны фосфатиды.
Белки. Среди белковых веществ мозга встречаются как простые (альбумины, глобулины и др.), так и сложные белки. Простые белки входят главным образом в состав плазмы нейронов, аксонов и др. Масса белков мозга, как предполагают, находится в основном в связанном состоянии с липидами в виде белково-липидных комплексов. Такие комплексы входят во внутриклеточные мембраны, но главная часть их участвует в построении сложных оболочек (миелиновых), покрывающих дендриты, аксоны и нервные волокна — стволы. Белково-липидные комплексы различаются по способности к растворению. Комплексы, растворимые в воде и нерастворимые в органических растворителях, называют липопротеидами, а — нерастворимые в воде и растворимые в органических растворителях — протеолипида-М и.. И те и другие комплексы удается при соответствующем воздействии разделить на белковую и липидную часть.
Протеолипиды можно разделить на несколько фракций с различным соотношением белка и липидной части. Различно и строение их липидного и белкового компонента.
196
Значительная часть белков мозга содержит фосфор.
Как было установлено (А. Я- Данилевский, 1891), в составе нейроглобулина содержится 0,5% фосфора. Им выделен новый белок—нейростромин, содержание которого в ткани с возрастом животных повышается. При дальнейшем изучении этих белков установлено, что нейроглобулин является дезоксирибонуклеопротеидом, а нейростромин представляет собой рибонуклеопротеид.
Характерной особенностью белков мозга является также преобладание в ядрах клеток рибонуклеиновых кислот, в то время как в других тканях их мало.
В составе белого вещества мозга находится белок нейрокератин, напоминающий по свойствам кератины. Нейрокератины отличаются от кератинов пониженным содержанием серы (1,0—3,0%) и азота (до 8,8%). Нейрокератины — это скорее белково-липидные комплексы. Несмотря на высокое содержание белка (60—70%), они растворимы в хлороформе, устойчивы к действию трипсина. Вместе с липидами они входят в состав оболочек нервных волокон. В составе мозга находится также небольшое количество коллагена и эластина. В белках мозга много (до 26%) глютаминовой кислоты.
Ферменты. В мозговом веществе обнаружены разнообразные ферменты из группы гидролаз: амилаза, мальтаза, сахараза, липаза лецитиназа, холинэстераза (в нейронах— ацетилхолинэстераза, в глиальных клетках — неспецифическая холинэстераза), протеазы, рибонуклеазы, адено^интрифосфатаза и др. Из окислительно-восстановительных ферментов обнаружены пероксидаза, каталаза, цитохромы, а также ферменты гликолиза и др.
Липиды. Наиболее характерной и весьма разнообразной составной частью мозга является его липидная часть. Липиды входят в состав структурных образований внутри клеток мозга и многочисленных отростков с их оболочками.
Они подразделяются на следующие группы: 1) фосфолипиды, 2) глюколипиды, 3) сульфатиды, 4) стерины. Из общего числа липидов около половины приходится на группу фосфолипидов (холинфосфатиды, этаноламинфос-фатиды, серинфосфатиды, ацетальфосфатиды, инозит-фосфатиды, сфингофосфатиды). Следующей по количественному содержанию группой липидов являются стерины, представленные в основном свободным холестерином.
197
Своеобразной группой липидов мозга, весьма значительной по количеству, являются глюколипиды. Среди них в наибольшем количестве находятся различные по составу цереброзиды (цереброн, нервон, керазин и др.), характеризующиеся содержанием аминоспирта сфингозина и высших жирных кислот — лигноцериновой С24, це-реброновой (оксикислота) С24, нервоновой (ненасыщенная) С24:
NH—COR «- Остаток жирной кислоты
СН3(СН)12СН=СН—СН—СН2ОН
J
Цереброзид С6НцО5 <- Остаток галактозы
Из серого вещества выделены особые глюколипиды — ганглиозиды. В состав их входят сфингозин, стеариновая кислота, три остатка гексоз и нейраминовая кислота. Последняя представляет продукт альдольной конденсации п-ацетилглюкозамина и нервоновой кислоты (сходна по строению с сиаловыми кислотами). К глюколипидам относится содержащийся в мозгу страндин. В группу сульфатидов входят производные цереброзидов и серной кислоты. В составе липидов мозга практически отсутствуют триглицериды.
В структуре липидов преобладают полиненасыщен-ные жирные кислоты. В различных участках серого вещества липиды неодинаковы по составу (ненасыщенные жирные кислоты) и строению. Значительная часть липидов мозга находится в связанном виде в комплексе с белками.
Углеводы и экстрактивные вещества. Содержание гликогена (свободного и связанного) в мозговой ткани невелико— 70—150 мг°/о, причем распределен он весьма неравномерно. Азотистые экстрактивные вещества сосредоточены главным образом в клетках в сером веществе. У взрослых животных их больше, чем у молодых. Из нервной ткани выделены аденозинтрифосфорная кислота, фосфокреатин, креатин, ацетилхолин, норадреналин, до-фалин, серотонин, пуриновые основания, аммиак, глютаминовая кислота, а также глютамин. Последние составляют (в сумме около 200 мг%) больше половины свободных аминокислот мозга. Специфической для мозга явля
198
ется у-аминомасляная кислота — продукт декарбоксилирования глютаминовой кислоты.
Из безазотистых экстрактивных веществ в нервной ткани содержатся глюкоза (около 100 мг%), молочная кислота, инозит и др.
Минеральные вещества. В головном мозге обнаружен ряд макроэлементов. Количество их следующее (в мг%): фосфор 360 (в основном в виде фосфата входит в состав органических веществ), натрий 312, калий 530, хлор 171, кальций 15. Высокое содержание калия характерно для нервной ткани. Кроме того, обнаружены медь, цинк, марганец, йод. Эти элементы, особенно йод, распределены в ткани крайне неравномерно. Для мозга характерно присутствие в сером веществе микроэлемента молибдена.
СПИННОЙ мозг
В спинном мозге также имеется скопление клеток в виде серого вещества и белое вещество, образованное аксонами. В сером веществе содержится значительное количество холестерина и ненасыщенных фосфатидов. Особенно богаты холестерином задние и передние корешки спинного мозга. Сухой остаток спинного мозга крупного рогатого скота составляет 35—37 % • Состав его следующий (в %).
Белки............................ 8,0—8,7
Липиды........................... 25,5—28,6
В том числе: холестерин..................... 3,8—4,1
холинфосфатиды............... 3,7—6,9
этанолфосфатиды.............. 5,5—8,5
Цереброзиды и сфингомиелины . . . 5,7—6,8
БИОХИМИЧЕСКИЕ ПРОЦЕССЫ НЕРВНОЙ ТКАНИ
Дыхание. В мозговой ткани, особенно в нейронах, при жизни животного весьма активно протекают окислительно-восстановительные процессы, связанные с освобождением энергии. В отличие от многих органов, в частности мышц, в мозговой ткани преобладают не процессы гликолиза, а аэробное окисление глюкозы, являющейся основ-
199
ным источником энергии, до СО2 и Н2О. Поэтому мозговые клетки очень активно поглощают кислород, доставляемый кровью. Так, в спокойном состоянии поглощение кислорода мозгом почти в 20 раз выше, чем мышечной тканью. Мозг и нервы потребляют около 20—25% всего кислорода, утилизируемого организмом. Этой особенностью объясняется высокая чувствительность мозга к отсутствию кислорода (гипоксия). При введении наркотиков уменьшается потребление кислорода мозгом — происходит общее угнетение жизнедеятельности нервной ткани.
Изучение условий торможения деятельности головного мозга животных имеет существенное практическое значение. В СССР на механизированных предприятиях наиболее распространен способ предубойного оглушения животных электрическим током. В последние годы в практику переработки свиней входит метод газового оглушения. С этой целью применяется кратковременная (40—50 с) ингаляция ими углекислого газа или смеси СО2 и NO2. При этом нарушается нормальный газообмен, тормозятся окислительные биохимические процессы, резко снижается возбудимость, т. е. наблюдается угнетение нервной ткани.
Помимо окисления глюкозы, в мозговой ткани возможно также окисление гликогена. При этом распад его происходит в значительной мере не путем фосфоролиза, а преимущественно гидролитическим путем с помощью амилазы.
Основные макроэргические вещества, накапливающиеся в нервной ткани при окислении глюкозы, — АТФ и креатинфосфат — в значительном количестве расходуются при нервном возбуждении.
Протеолиз. Наряду с активно протекающими процессами окисления углеводов в центральной нервной системе совершаются процессы, связанные с превращением белковых веществ. Протеолитическая активность различных отделов мозга неодинакова: в сером веществе она в 5 раз выше, чем в белом.
В результате протеолиза при активации нервной деятельности в ткани обычно повышается содержание аминного азота, а также и аммиака за счет гидролиза амидных групп белков и глютамина. Источником аммиака может быть и адениловая кислота. При снижении дея-200
тельности мозга содержание аммиака уменьшается. Обезвреживание аммиака в мозговой ткани происходит с участием свободной глютаминовой кислоты, которая при связывании NH3 переходит в глютамин, а также за счет амидирования карбоксильных групп в белках.
В метаболизме NH3 основную роль играют весьма активные в мозге ферменты •— глютаминаза и глютаминсин-тетаза.
Важную функциональную роль в мозгу выполняет специфическая для него у-аминомасляная кислота (ГАМК). Она оказывает тормозящее влияние на процесс возбуждения нервной ткани.
Нервный импульс. Одной из основных функций нервной ткани является передача возбуждения — нервного импульса. Она осуществляется в результате освобождения в нервных окончаниях особых веществ, получивших название передатчиков нервного возбуждения, или нейромедиаторов, — ацетилхолина, норадреналина, дофамина, серотонина, ГАМК, возможно и некоторых других свободных аминокислот.
Окончание нервного волокна приходит в соприкосновение с рабочим органом с помощью синапса — концевой пластинки. У мышечной ткани синапс расположен под сарколеммой. В синапсе имеется мембрана, отделяющая мышечное волокно от полости нерва. Жидкость, находящаяся по обе стороны мембраны, содержит различное количество ионов К и Na. Внутренняя жидкость в покое имеет положительный, а внешняя отрицательный заряд, как говорят, она поляризована. В результате нервного импульса происходит освобождение ацетилхолина из связанного с белком состояния и взаимодействие его с белком рецептором мембраны (с SH-группами рецептора).
В результате этого проницаемость мембраны для ионов очень быстро (0,3 мс) изменяется, например для Na увеличивается в 500 раз. Происходит перераспределение ионов и изменение полярности зарядов — деполяризация, возникает электрический ток. Это и составляет суть нервного импульса. Однако выделившийся ацетилхолин немедленно (спустя 2—3 мс) распадается под действием фермента холинэстеразы на холин и ацетил. Мембрана переходит в нормальное состояние, и ионы К и Na диффундируют через мембраны до исходного уров
2Q1
ня. В промежутке между передачей импульса ацетилхолин вновь синтезируется под действием холинаце-тилазы. В момент, когда в синапсе возникает деполяризация в саркоплазматическом ретикулуме освобождается ион Са и происходит активация процесса мышечного сокращения.
Автолитические превращения. После убоя животного в мозговой ткани в результате деятельности ферментных систем происходят автолитические процессы, сущность которых изучена еще недостаточно. Установлено, что в условиях хранения мозга при температуре 0—2ЮС активная реакция среды изменяется.
В первые 24 ч после убоя животного pH мозговой ткани находится в пределах 6,3—6,0, а через 48 ч реакция сдвигается в щелочную сторону — до 6,5. В результате автолиза несколько снижается способность мозговой ткани к набуханию в воде: через 24—48 ч набухание ткани составляет 77—76% к исходной, а в дальнейшем изменения этого показателя несущественны. При продолжительном хранении головного мозга в охлажденном состоянии его кулинарные достоинства частично снижаются. Эти изменения обусловлены и другими физико-химическими и биохимическими особенностями превращений ткани. Поэтому срок хранения охлажденного мозга не должен превышать 3—5 суток.
ИСПОЛЬЗОВАНИЕ НЕРВНОЙ ТКАНИ
Пищевая ценность мозга
В пищевом отношении головной и спинной мозг представляет большую ценность, так как содержит значительное количество необходимых для организма липидов, главным образом фосфатидов, особенно холина и инозитфосфатидов (холин и инозит являются витаминами), а также ненасыщенных жирных кислот. Однако большое количество холестерина в ткани несколько ограничивает ее использование.
Благодаря большому содержанию липидов калорийность мозговой ткани выше калорийности других органов (см. табл. 29).
202
В белках мозга содержатся (см. табл. 34) все жизненно необходимые аминокислоты, особенно такие дефицитные во многих пищевых продуктах, как лизин, метионин, валин,треонин.
Большинство белков мозга относится к полноценным, хотя имеется и небольшое количество неполноценных соединительных белков (см. табл. 29). В составе мозга имеются ценные для питания микро- и ультрамикроэлементы.
Биологические препараты из мозговой ткани
Головной и спинной мозг домашних животных является ценным сырьем для получения многих биоактивных препаратов, применяемых в качестве лечебных средств, и химических соединений, которые используются для синтеза фармацевтических препаратов или в пищевых производствах.
Из органических веществ головного и спинного мозга наибольшую ценность представляют соединения группы липидов.
Выделение их из мозга и разделение представляет собой ряд последовательных операций. Для эффективного извлечения липидов очищенную и измельченную мозговую ткань обезвоживают, применяя различные способы. Используя различную растворимость липидов (табл. 28), их экстрагируют из высушенного мозга органическими растворителями и фракционируют. Иногда из ткани выделяют только холестерин, подвергая ее многократной экстракции, чаще всего ацетоном. Полученный экстракт упаривают, выпавшие кристаллы холестерина растворяют, очищают от примесей путем кипячения с активированным углем и перекристаллизовывают из горячего спирта.
Все липиды мозга экстрагируют дихлорэтаном при 50—55СС, затем фракционируют по мере понижения температуры.
203
ТАБЛИЦА 28
ВНУТРЕННИЕ ОРГАНЫ
ПЕЧЕНЬ
Печень — крупный паренхиматозный орган, составляющий около 1,4—1,5% массы тела животного. Она является ценным питательным продуктом и сырьем для биоактивных препаратов.
При жизни животного в печени осуществляется много сложнейших биохимических процессов. Она обильно снабжается кровью (около */4—'/5 общего объема крови находится в печени), которая доставляется не только артериями, но и воротной веной, приносящей продукты всасывания из кишечника.
Железистая паренхима печени представлена сетью концевых секреторных отделов, печеночных клеток, желчных и кровеносных капилляров. Печеночные клетки вы-204
полняют секреторные функции двоякого рода: часть веществ они выделяют в желчь, а остальные — в кровь. Выделяемые из гомогената печени субмикроскопические образования митохондрии составляют 15—20%, а микросомы— 20—25% от сухого вещества. Такое высокое содержание их связано с активно протекающими процессами ассимиляции и диссимиляции.
Химический состав печени
Химический состав печени характеризуется' данными, приведенными в табл. 29. По сравнению с другими органами в ней содержится меньше воды.
ТАБЛИЦА 29
Химический состав, %
Орггны
Головной мозг . .
Печень .........
Почки . . . . .
Легк ие.........
78,9 9,5 9,46 2,04 0,03 1,32 3,56 125,3
72,9 4,5 17,36 Г, 61 0,04 1,5 9,50 132,7
77,0 4,5 17,51 1,85 0,04 1,08 5,60 113,6
80,8 2,5 15,15 4,64 1,04 1,5 1,66 88,9
1 Белковый показатель.
Белки. Основную массу сухого остатка печени составляют белки, причем около 25% общего азота их сосредоточено в митохондриях и 20—25%—в микросомах, т. е. около половины белков входит в состав этих органелл. Белковый состав печени исключительно разнообразен, так как в ней синтезируются и резервируются не только белки печени и разнообразные ферменты, но и белки крови.
Белки представлены главным образом глобулинами около 13% (из общего количества белков печени, составляющих 17%), на долю альбуминов приходится только около 1%. Для печени характерно значительное количество железосодержащих белков. В меньшем количестве в
205
ней обнаружены нуклеопротеиды, глюкопротеиды, липопротеиды, коллаген, эластин, муцины и другие белки.
Из глобулинов печени выделены две фракции, отличающиеся по температуре коагуляции: одна из них коагулирует при 68—7(ГС, а другая при 45—50°С. Один из глобулинов с изоточкой при pH 5,5—5,6 получен в кристаллическом виде с помощью диоксана.
Белки экстракта печени путем электрофореза можно разделить на шесть основных и ряд менее определенных фракций (табл. 30). По подвижности некоторые белки печени похожи на белки сыворотки крови: а-глобулинам соответствует 30—35% белков печени (фракции Б и В), Р- и у-глобулинам (фракции Г, Д, Е) —приблизительно 30%, меньшей подвижностью характеризуется 25% белков. На долю белков, подобных сывороточным альбуминам, приходится 6—13% (фракция А). В сыворотке доля таких белков составляет 60%.
ТАБЛИЦА 30
Фракция белков Содержание фракций (в % от общего количества белков) экстракта печени
кролика барана быка
А 6,37 12,90 12,71
Б 8,85 10,14 11,14
В 26,65 30,19 37,91
Г 19,09 10,65 10,87
д 11,04 6,75 5,13
Е 28,00 29,00 22,84
Железосодержащие белки печени являются запасными источниками железа, необходимого для синтеза гемоглобина (кроме печени, подобные белки содержатся в селезенке и костном мозге). Наиболее известен белок ферритин, молекулярная масса которого 545 000. Его можно выделить в кристаллическом виде при нагревании экстракта печени до 80°С и последующем осаждении фильтрата сернокислым аммонием до полунасыщения. Кристаллизацию ведут в присутствии солей кадмия. Ферритин растворим в воде и осаждается спиртом при 50% насыщения. Белок стабилен при pH 7,0 и неустойчив при рН<4 и>10. В ферритине содержится около 17—23 % железа, 10—11% азота и около 1—2% фосфора. Простетической группой ферритина является неорганическое
206
соединение окисного железа (FeO-OH)8 (РеО-ОРОзН2). Из аминокислот в молекуле белка имеется 10% аргинина, 6,4% тирозина, 8,2% пролина и оксипролина, 2,5% лизина, 3,4% дикарбоновых кислот, 1,48% метионина, а также гликокол, фенилаланин, триптофан, цистеин (около 1% каждой) и 0,25% гистидина.
Из печени выделен также медьсодержащий белок гематокупреин, в котором 0,34% меди.
Ферменты. Разнообразный состав ферментов печени объясняется многообразием совершающихся в ней биохимических превращений. В печени содержатся ферменты углеводного (амилолиза, гликолиза и аэробного окисления углеводов), белкового и липидного обмена. Особенно характерна для печени группа протеаз катепсинов, наиболее активная в печени и почках, что видно из сравнительной протеолитической активности различных тканей (в условных единицах).
Почки .......1,900
Печень .......1,500
Легкие ......1,000
Сердце ......0,330
Мышцы........0,025
В печени обнаружены также ферменты синтеза и распада нуклеопротеидов, окисления пуринов, синтеза мочевины, окисления жиров, каротиназа и ряд других.
Значительная часть их локализована в митохондриях, это сукцинатдегидрогеназа, ферменты трикарбонового цикла, глютаминдегидрогеназа, дегидрогеназа щавелево-уксусной кислоты, цитохромоксидаза, НАД и НАДФ-ци-тохромредуктаза, АТФ-аза, каталаза, цитохром С и др., т. е. разнообразные окислительно-восстановительные ферменты.
Липиды. Кроме белков, в составе печени имеются липиды, главным образом фосфатиды и холестерин. Количество их в говяжьей печени характеризуется следующими данными (в %).
Общий жир . . 6,2
Холинфосфати-ды.......... 1,56
Кефалинфосфа-тиды ... 1,5
Общий холес-
терин . . . 0,15—0,2
207
Особенно богаты фосфолипидами (до 25% к сухому остатку) структурные элементы печени (табл. 31): митохондрии, микросомы, ядра.
ТАБЛИЦА 31
Органеллы Содержание липидов в печени, %
к сухому веществу К общему количеству липидов
фосфолипиды холестерин нейтральный жир
Митохондрии 21 94 5,5 1,4
Микросомы 32 93 5,8 0
Ядра 16 95 4,5 2,5
Углеводы. В печени имеется больший, чем в других органах, запас углеводов в виде гликогена. В зависимости от состояния животного количество его составляет от 4—10 до 17% к массе органа. В печени в небольшом количестве находится также глюкоза (около 100 мг%), разнообразные продукты ее окислительного распада и инозит.
В печени вырабатывается и содержится ряд мукополисахаридов, в том числе гепарин
Г \ Н\
I 1 —
HCNHSO3H о неон
X' с 1 i ) HOCH о
ncosoyi НС-'
нс нс
СН2ОН соон
Глюкуроновая кислота
н\
О HCNHSO3H
I---СН
I HCOSO3H
НС
I неон
I I носн о
нс----1
I соон
I СН2ОН
Глюкозамин
Основная функция гепарина — предотвращение свертывания крови. Молекулярная масса его 17 000.
Азотистые экстрактивные вещества. В печени имеется небольшое количество азотистых экстрактивных веществ (продукты промежуточного или конечного обмена): креатинин, холин, пуриновые основания, аминокислоты, АТФ и продукты ее превращения, мочевина, таурин, парные эфиросерные, эфироглюкуроновые кислоты и т. д.
208
Витамины. Печень богата витаминами, что, по-видимому, в значительной мере связано с выполнением ее клетками специфических функций.
В свежей печени крупного рогатого скота обнаружены следующие витамины (в мг%).
Тиамин . . . . . 0,4 Р-Аминобензойная
Рибофлавин . . 2,85—3,45 кислота .... 0,25
Пиридоксин . 1,65 Аскорбиновая ки-
Ниацин . . . Пантотеновая . . 2,1—2,75 ки- слота ..... 25—40 Противоанемичес-
слота . . . . . 0,8—1,8 кий .... . . 0,045
Холин . . . . . . 630 Ретинол 10—55
Фолиевая кислота .0,35 Токоферол ... 50 Антигеморрагичес-кий ...... 0,5
Как видно из приведенных данных, содержание витамина А (ретинол) в печени (30 мг%) во много раз выше, чем в мышцах (0,02 мг%), то же следует отметить и в отношении токоферола. Из водорастворимых витаминов в печени находится в значительном количестве витамин В2 (рибофлавин), Bi (тиамин), РР (ниацин), В6 (пиридоксин), К, биотин, холин, пантотеновая кислота.
Важное значение для животных организмов имеет обнаруженный в печени витамин В12 (антианемический — кобаламин)единственный витамин, в составе которого имеется металл (4,5% кобальта). Богатство витамином В12 печени и почек крупного рогатого скота по сравнению с мышёчной тканью видно из данных, приведенных в табл. 32. . .
ТАБЛИЦА 32
Органы Содержание витамина В12 (в мкг на 1 кг) в расчете
на сухое вещество на сырое вещество
Мышцы . ...... . . 55 14
Печень . . 1200—1800 340—450
Почки . . , . . . . . . 2000 500
8-454
209
Минеральные вещества. В печени крупного рогатого скота обнаружены (в мг% к сухой массе органа): кальций 8,1, сера 17,70, фосфор 17,70, железо до 26.
Из печени выделен железосодержащий пигмент гемосидерин, который откладывается в ткани в виде неправильных зерен цвета охры. Он экстрагируется кислотами. В состав гемосидерина входит 55% железа (трехвалентное в виде Fe(OH)3], 12, 15% водорода, 26% кислорода, меньше 1% углерода, меньше 0,1% азота, т. е. пигмент относится к неорганическим соединениям железа, но не является индивидуальным веществом. Для печени характерно наличие 3,9—6,0 мг% цинка, а также очень небольшие количества меди (0,00004 мг%), кобальта (26— 38 мг%), марганца и других веществ.
Желчь. Печень вырабатывает особый секрет — желчь. Она продуцируется печеночными клетками и по желчным канальцам поступает в желчный пузырь, откуда в процессе пищеварения изливается в кишечник. Накапливающаяся в желчном пузыре так называемая пузырная желчь отличается от печеночной желчи, находящейся в ткани печени. Пузырная желчь более концентрированная в результате удаления части воды. Она представляет собой густую горькую жидкость желтоватого или желтовато-бурого цвета плотностью 1,020; pH ее 7,5, величина сухого остатка желчи 14—16%. Составные части желчи (в %).
Вода ..................84
Желчные кислоты таурохолевая .... 1,94 гликохолевая .... 6,8
Жирные кислоты .... 1,06
Лецитин................0,14
Холестерин............0,87
Нейтральный жир ... 0,65
Муцины и красящие вещества ..............4,4
Минеральные вещества . 0,54
Желчные кислоты придают секрету горький вкус, поэтому загрязнение продуктов желчью или недостаточная промывка печени вызывает появление горького вкуса. По строению желчные кислоты относятся к стеринам, являются производными холановой кислоты и находятся обычно в виде парных желчных кислот: глико- или тауро-холевой, глико- или тауролитохолевой, глико- или тауро-дезоксихолевой. Для примера приводится строение тау-
210
рохолевой кислоты, так как строение других парных кислот аналогично
Парные желчные кислоты находятся в желчи в виде солей, обладающих сильным эмульгирующим действием по отношению к жирам и другим липидам.
Муцины, находящиеся в желчи, придают секрету некоторую вязкость и тягучесть. Окраска желчи зависит от желчных пигментов: билирубина, имеющего золотистожелтую окраску, и биливердина — вещества зеленого цвета. Свежая желчь желтоватого цвета. При длительном ее хранении билирубин окисляется под действием кислорода воздуха в биливердин, поэтому цвет желчи становится зеленовато-бурым.
Биливердин'
В желчном пузыре в результате патологических изменений образуются так называемые желчные камни. По химическому составу они различны. У крупного рогатого скота чаще встречаются пигментные камни—образования неправильной формы, массой до 10 г, темно-бурого цвета, тяжелее воды, хрупкие; в их состав входят биливердин, фосфорная кислота и щелочноземельные металлы. Реже встречаются белые или светло-желтые камни, более легкие, чем вода, построенные в основном из холестерина.
8*
211
Наконец, иногда обнаруживаются известковые камня — мелкие круглые камешки коричневого или желтого цвета, состоящие из углекислого кальция и магния с примесью фосфата. Из других минеральных веществ в желчи имеются главным образом Na2CO3 и Na2HPO4.
Биохимические процессы в печени
Печень играет огромную роль в организме животных. Можно указать на пять наиболее важных ее функций.
1. Печень участвует в регуляции кровообращения, пропуская и задерживая кровь, а следовательно, регулируя объем крови, поступающей в кровяное русло.
2. Роль печени в обмене веществ определяется прежде всего тем, что в нее вместе с током крови доставляются от кишечника почти все продукты гидролитического распада пищевых веществ. В значительной степени эти продукты в ней ассимилируются, а затем по мере надобности выделяются в кровяное русло. Печень регулирует обмен углеводов путем синтеза и диссимиляции гликогена. Аэробное окисление молочной кислоты, доставляемой с током крови из мышечной ткани, и ресинтез гликогена из молочной кислоты также происходят в основном в печени.
Печень активно участвует в обмене жиров и липидов. В ней синтезируются и временно накапливаются липиды (фосфатиды), а также холестерин и желчные кислоты, выделяемые с желчью. При нормальных условиях жиры окисляются в печени. Активно участвует печень в обмене белков: в ней синтезируются не только белки собственной ткани, но и многие белки крови. Некоторые белки и аминокислоты накапливаются в печени, а затем по мере необходимости переходят в кровь. Печень регулирует также обмен витаминов.
3. Большое участие печень принимает в кроветворении, осуществляя синтез белков плазмы: альбуминов, глобулинов, фибриногена, протромбина, тромбокиназы. Распад гемоглобина происходит также в печени.
В результате распада гемоглобина гем подвергается последовательной деструкции. При этом происходит выделение железа и разрыв порфиринового кольца с образованием желчных пигментов — биливердина, а затем би-212
лирубина — и других продуктов окисления, которые выводятся с желчью через кишечник1:
Гемоглобин------> Холеглобин-----> Вердогемоглобин
I
Биливердин Глобин
к 4 л
Ьилирубин
Железо, отщепляемое от гема, откладывается в печени (и селезенке) в виде железосодержащих комплексов коричневого цвета — гемосидерина с белками (возможно аналога или предшественника ферритина) и ферритина.
4. В печени осуществляется секреция желчи, необходимой для переваривания липидов.
5. Печень играет исключительно важную роль в защите организма от ядовитых соединений неорганической природы, поступающих из кишечника, алкалоидов, продуктов гнилостных превращений белков в кишечнике, которые обезвреживаются в виде парных соединений с серной и глюкуроновой кислотой. Путем синтеза мочевины в печени обезвреживается аммиак. Чужеродные белки, введенные в воротную вену, также задерживаются печенью.
ПОЧКИ
Почки — парный орган, выполняющий в организме функции выделения. Строение их железистое, микроструктура довольно сложна. В клетках почек находится большое количество митохондрий и эндоплазматического ретикулума.
В почках содержится 83% воды и 17% сухого вещества, главным образом белков—15—16% (глобулины, альбумины, нуклеопротеиды, муцины и мукоиды), а также 2—5% липидов и 1,1—1,2% углеводов.
В почках содержатся различные ферменты: гидролазы (амилаза, липаза), активные катепсины, специфический
1 Билирубин в кишечнике под действием микрофлоры превращается в конечные продукты распада — стеркобилиноген, стеркобилин.
213
фермент ренин, а также окислительно-восстановительные ферменты и др.
Из липидов в почках содержатся жиры, лецитины, холестерин (находятся в комплексе с белками), из углеводов— гликоген, глюкоза, из азотистых экстрактивных веществ — креатин, мочевина, пуриновые основания и т. п.
В почках обнаружен ряд витаминов: ниацин (РР), пантотеновая кислота, биотин, особенно много витамина В12 (до 0,5 мг%) и В2 — рибофлавина.
Почки удаляют из организма в растворенном виде посторонние вещества и конечные продукты тканевого обмена. В них конечные продукты обмена, поступающие с кровью, активно отделяются, концентрируются и образуется моча, которая выделяется в мочевой пузырь. С мочой удаляются почти все конечные продукты азотистого обмена и большая часть минеральных соединений, а также некоторые безазотистые вещества и значительное количество воды.
Почки потребляют около 0,1 всего кислорода, поступающего в организм животного. Это свидетельствует об активных окислительных процессах, связанных со значительным расходом энергии на покрытие большой осмотической работы, выполняемой органом.
Выделение мочи почками — сложный процесс. Благодаря особому устройству почечных канальцев жидкая (безбелковая) часть крови, протекающей через почки, подвергается ультрафильтрации и сгущается. При этом часть веществ вновь возвращается в кровь, а образовавшаяся моча, значительно отличающаяся по возросшей концентрации исходных веществ от плазмы крови выделяется из почек.
Почки являются не только органом экскреции. В их клетках протекают активные процессы, связанные с жизнедеятельностью органа: синтез гиппуровой и мочевой кислот, дезаминирование аминокислот, образование аммиака, креатинина, процессы протеолиза и др.
У млекопитающих основным конечным продуктом азотистого обмена является мочевина, а у птиц — мочевая кислота. Поэтому птичий помет используется в промышленности для препаративного получения мочевой кислоты, которая является сырьем для синтеза ряда фармацевтических средств.
214
ЛЕГКИЕ
Легкие — это парный орган, составляющей около 1% к массе тела животного. Они состоят из долек, разделенных соединительнотканными перегородками. Через дольки проходят разветвляющиеся бронхи (трубки), образованные хрящевыми пластинками или фиброзной тканью и заканчивающиеся альвеолами.
По химическому составу легкие отличаются от других органов высоким содержанием воды — 80% и меньшим содержанием белков, на долю которых приходится 15%. Из них в значительном количестве содержится коллаген — около 5 %, эластин — около 1 %. Кроме белков, в состав легких входит 2—5% липидов, в том числе (в мг% к сухой массе): фосфатидов 11,5 (кефалины 3,7, лецитины 3,3), сфингомиэлинов 2—3 и стероидов (холестерин) 2,2. В легких содержится гепарин. Минеральные вещества составляют около 1%.
Через легкие осуществляется газообмен между кровью и окружающим воздухом. Кроме того, они участвуют в регуляции температуры тела.
АВТОЛИТИЧЕСКИЕ ИЗМЕНЕНИЯ ВНУТРЕННИХ ОРГАНОВ
После убоя животного в паренхиматозных органах происходят автолитические изменения, специфические для каждого органа.
Содержание гликогена в печени при автолизе быстро уменьшается в течение первых суток. В дальнейшем (через 48 ч) низкий уровень гликогена остается стабильным. Одновременно с распадом гликогена к концу суток несколько увеличивается содержание редуцирующих сахаров; в дальнейшем (к концу вторых суток) количество их уменьшается. Содержание молочной кислоты при автолизе этого органа нарастает, но значительно медленнее, чем при автолизе мышц. Вместе с тем более заметно в ткани накапливается неорганический фосфат. В результате накопления кислот активная реакция среды печени
215
сдвигается в кислую сторону с pH 7,2—7,1 до pH 6,4—6,5 к 24 ч автолиза и до pH 6,3—6,5 к 48 ч, но все время остается более высокой, чем в мышечной ткани.
Вследствие автолиза — накопления кислот — изменяются свойства белков. В начальных стадиях хранения печень незначительно затвердевает, т. е. наблюдается ее окоченение, сопровождающееся помутнением протоплазмы. Вместе с тем изменяется окраска печени: из светло-коричневой она становится темно-коричневой, что связано с окислением гемоглобина в метгемоглобин. При хранении резко снижается способность печени набухать в воде. Уже через 24 ч набухание составляет 55% от исходного, а к 48 ч — 34%. Эти факты свидетельствуют об изменении физико-химических свойств ткани, связанном с изменением свойств ее белков. В результате протеолиза несколько увеличивается количество остаточного азота.
Автолитические процессы в печени сопровождаются изменением содержания восстановленного глютатиона: через сутки после убоя содержание его увеличивается по сравнению с исходным, а на вторые-третьи сутки понижается. Эти колебания свидетельствуют о том, что при автолизе печени протекают многообразные сложные окислительно-восстановительные процессы, в которые вовлекается этот трипептид.
При автолизе почек активная реакция среды сдвигается в кислую сторону: через 24 ч pH снижается до 6,6— 6,7, через 48 ч — до 6,5. Изменение pH сопровождается очень резким снижением способности ткани к набуханию. Через 24 ч после убоя набухание почечной ткани в воде составляет 69%, а через 48 ч — только 24% исходной величины.
Печень, почки и легкие при хранении в охлажденном состоянии менее стойки, чем мясо. Это обусловлено меньшей плотностью ткани, морфологическими, физико-химическими и биохимическими особенностями этих органов и связанными с ними физико-химическими превращениями, в частности более высоким значением pH, наличием более активных групп ферментов (например, катепсинов) и т. п.
При продолжительном хранении в замороженном состоянии автолитические процессы в тканях не прекращаются, о чем можно судить по изменению содержания сахаров и pH (табл. 33).
216
ТАБЛИЦА 33
Продолжительность хранения при — 18°С Изменение содержания сахара (в мг %) и pH при хранении
печени почек мозга
сахар pH сахар pH сахар pH
Сразу после убоя 6 месяцев 17 месяцев 2350 2140 6,35 6,1 6,1 163 101 6,5 6,35 6,45 100 47 6,3 6,4 6,3
При продолжительном (в течение 4—6 месяцев) хранении внутренних органов в замороженном состоянии в них не обнаружен аммиак или сероводород. Это свидетельствует о том, что очень глубоким превращениям при таком хранении белки не подвергаются. Однако органолептические свойства их ухудшаются, поэтому срок сохранения печени и почек в холодильниках не должен превышать 7 месяцев, а мозга — 4 месяцев.
ИСПОЛЬЗОВАНИЕ ВНУТРЕННИХ ОРГАНОВ
Пищевая ценность внутренних органов
Пищевая ценность печени и почек определяется прежде всего содержанием в них белков, жиров и калорийностью продуктов. В составе белков печени и почек имеются в значительном количестве все незаменимые аминокислоты (табл. 34). В этих органах содержатся также ценные в пищевом отношении липиды (особенно холин- и инозит-фосфатиды) и минеральные вещества (железо, фосфор, микроэлементы).
Печень является очень ценным продуктом по содержанию витаминов, главным образом водорастворимых группы В (особенно Bi2), холина, а также А, К, Е.
В почках также содержится значительное количество витаминов и важные минеральные элементы — железо и фосфор. По химическому составу они также представляют собой ценный пищевой продукт.
217
ТАБЛИЦА 34
Содержание аминокислот (на 16 г азота) в белках органов крупного рогатого скота
Аминокислоты мозг I 1 печень L ПОЧКИ легкие селезенка В сх 0) о
Аргинин 5,7 5,7 5,7 5,1 5,4 5,6
Гистидин 2,4 2,6 2,7 2,5 2,6 2,5
Лизин 6,3 7,5 7,4 6,9 7,1 8,1
Тирозин 4,7 3,6 2,6 3,0 2,2 3,2
Триптофан 1,3 1,6 1,3 1,8 1,2 1,4
Фенилаланин 5,1 5,1 5,1 5,1 4,5 5,0
Цистин 1,7 1,7 2,1 3,3 2,7 2,2
Метионин 2,4 2,3 2,1 1,7 1,7 2,3
Серин 7,0 5,4 6,9 6,5 6,1 6,2
Треонин 4,9 4,7 4,8 4,7 4,2 4,9
Лейцин 9,0 9,1 8,4 8,3 8,3 9,0
Изолейцин 4,8 5,0 4,0 4,0 4,3 4,8
Валин 5,4 6,1 6,5 5,9 5,6 6,0
Глютаминовая кислота . . 1,7 1,8 13,1 1,4 12,2 13,9
Аспарагиновая кислота . . 10,0 8,0 9,1 9,7 7,5 8,4
Глицин 6,4 4,6 5,1 4,1 4,2 5,2
Аланин 6,4 6,7 5,9 6,2 5,0 7,8
Пролин 5,2 5,0 6,5 5,8 5,5 6,1
Легкие содержат полноценные белки в меньшем количестве, чем печень и почки, поэтому содержание некоторых незаменимых аминокислот в легких ниже, чем в других органах. Кулинарная ценность легких по сравнению с печенью и почками невелика. Поэтому легкие используют в пищу главным образом в сочетании с другими тканями и с другим сырьем.
Биологические препараты из внутренних органов
Препараты из печени. В качестве основы для получения разнообразных биоактивных лечебных препаратов из печени используют ее водный экстракт.
Активным началом, входящим в состав препаратов из печени, применяемых главным образом для лечения
218
злокачественной анемии, является прежде всего витамин В12, стимулирующий синтез гемоглобина и повышающий усвоение железа, а также другие витамины, органические соединения и минеральные вещества.
Анти анемии получают из измельченной печени крупного рогатого скота. Измельченную печень экстрагируют подкисленной водой при 70°С. Экстракт подвергают высаливанию сернокислым аммонием. Осадок растворяют в спирте (80°). Антианемин выделяют из раствора 96%-ным спиртом и затем осадок растворяют в воде. В препарат добавляют сернокислый кобальт и фенол. После фильтрации через стерилизующие фильтры препарат разливают в ампулы.
К а мпо л он (или гепалон) — концентрированный водный экстракт печени, предназначенный для парентерального введения. Процесс получения препарата на первой стадии (экстракции) аналогичен изготовлению анти-анемина, но в дальнейшем дополнительно удаляют белки вначале путем упаривания экстракта (до половины), а затем осаждением спиртом. Отогнав спирт, сгущают экстракт, сухой остаток готового камполона 24—26%, 1 мл препарата соответствует 40 г свежей печени и содержит 1,3 мкг витамина В12-
Препараты из желчи. Из желчи выделяют желчные кислоты, являющиеся основой для изготовления лечебных препаратов, например хологона. Хол о гон является окисленным производным холевой кислоты, т. е. дегидро-холевой кислотой, молекулярная масса 402,51. Это белый кристаллический порошок, нерастворимый в воде, растворимый в спирте, температура плавления его 230—237°С.;
Кроме того, из желчи получают ряд других лечебных препаратов: аллохол, холензим и др. Действующим началом в них являются желчные кислоты в комбинации с другими компонентами. В состав холензима, кроме желчи, входят ферменты слизистой оболочки кишок и поджелудочной железы. Эти препараты употребляют при заболеваниях, связанных с нарушением деятельности желудочно-кишечного тракта и печени.
Препараты из легких. Из легких убойных животных получают гепарин (антитромбин) —препарат, используемый в качестве стабилизатора крови. Хотя гепарин содержится во многих тканях и органах (табл. 35), экономически целесообразно выделять его из легких.
219
ТАБЛИЦА 35
Ткань Количество очищенного препарата на 1 кг ткани, мл Единицы активности гепарина
Печень 190 1900
Селезенка 290 700
Кровь 66 60
Легкие 230 2200
Мышцы 600 1900
После очистки и промывки (важное значение имеет удаление крови, содержащей фермент гепариназу) легкие измельчают. Измельченные легкие экстрагируют 1%-ным NaCl при слабощелочной реакции. Последующая обработка экстракта заключается в многократных операциях переосаждения сырца гепарина из раствора спиртом, протеолизе, окончательной довольно сложной очистке (осаждение белков, очистка ионообменной смолой и др.) и сушке.
Нативный гепарин находится в ткани в комплексе с белком, поэтому одна из операций по выделению препарата связана с разрушением этого комплекса путем протеолиза и отделения гепарина от белков.
Готовый препарат гепарина представляет собой порошок или раствор, запаянный в ампулах. Выход его при титре 1 1 : 20 000 составляет около 0,5—0,6% к массе легких крупного рогатого скота.
1 Титр препарата показывает, что количество миллилитров крови может стабилизировать 1 г препарата (при комнатной температуре кровь не должна свертываться в течение суток).
Г л а в a V.
ПИЩЕВАЯ ЦЕННОСТЬ МЯСА
БИОЛОГИЧЕСКАЯ ЦЕННОСТЬ КОМПОНЕНТОВ
МЯСА
Пищевая ценность мяса зависит от соотношения тканей, входящих в его состав, которое при изготовлении мясопродуктов может быть искусственно изменено. Пищевая ценность каждой ткани определяется биологическим значением его компонентов. Наиболее ценны в этом отношении мышечная и жировая ткани.
Пищевая ценность мяса определяется в первую очередь содержанием биологически полноценных и легко усвояемых белков. Кроме того, мясо — хороший источник витаминов группы В и некоторых минеральных веществ.
Содержание в мясе различных компонентов в значительной степени зависит от соотношения мышечной, жировой й других тканей. Мясо, в котором жировая ткань как бы вкраплена в толщу мышечной ткани (мраморное мясо), является высококалорийным продуктом.Жировая ткань — источник жизненно необходимых ненасыщенных жирных кислот. В мясе содержатся также вкусовые и ароматические вещества. И. П. Павлов выявил исключительно большое значение мясного сока, навара из мяса для процесса переваривания белков, в частности мясных. Появление при варке мяса специфического вкуса и аромата обусловлено накоплением и изменением экстрактивных веществ, которые являются лучшими возбудителями секреции пищеварительных соков.
Содержание пищевых веществ в отрубах и их калорийность зависят от вида мяса, а различное содержание пищевых компонентов и калорийность одних и тех же отрубов также зависят от породы животного и его упитанности (табл. 36). ' .
221
ТАБЛИЦА 36
Компоненты мяса Содержание (в %) компонентов и калорийность (в ккал на 100 г)
говядина телятина свинина баранина
Белки .... 16,2—19,5 19,1—19,4 13,5—16,4 12,8—18,6
Вода 55—69 68—70 49—58 48—65
Жир Минеральные 11—28 5—12 25—37 16—37
вещества . . 0,8—1,0 1,0—1,3 0,7—0,9 0,8—0,9
Калорийность . 180—320 140—190 300—390 220—380
В мясе с небольшим содержанием жира, например в мясе молодняка, белков и влаги больше, чем в жирном мясе, поэтому общая калорийность его меньше. Содержание пищевых компонентов и калорийность готовых мясных продуктов зависят от соотношения тканей и методов технологической обработки.
Белки. Белки мяса как продукты питания характеризуются высокой способностью компенсировать непрерывную потерю белка организмом в результате постоянного распада тканевых белков в процессе обмена, а также при образовании различных секретов пищеварительного тракта и в других случаях выделения белков.
Животные белки усваиваются человеком полнее, чем растительные: например, для покрытия минимальных потребностей организма белков мяса требуется примерно вдвое меньше, чем растительных. Следовательно, животные пищевые белки обладают более высокой биологической ценностью, поскольку содержат оптимальные количества незаменимых аминокислот и других азотсодержащих компонентов, поддерживающих азотистый баланс у взрослого человека.
По аминокислотному составу мышцы одного и того же животного и одноименные мышцы свиней, крупного рогатого скота и овец аналогичны (табл. 37).
Заметно различаются по содержанию некоторых аминокислот отрубы мяса, в составе которых имеется много соединительной ткани. В них содержится относительно больше пролина, оксипролина и глицина и меньше триптофана и других незаменимых аминокислот. Это объяс-
222
ТАБЛИЦА 37
Содержание, % к общему белку Содержание* % к общему белку
Аминокислоты незаменимые говядина свинина баранина Аминокислоты заменимые говядина свинина баранина
Аргинин . . . Валин .... Гистидин . . . Изолейцин . . Лейцин . . . Лизин .... Метионин . . Треонин . . . Фенилаланин . Триптофан . . 6,6 5,7 2,9 5;1 8,4 8,4 2,3 4,0 4,0 1,1 6,4 5,0 3,2 4,9 7,5 7,8 2,5 5,1 4,1 1,4 6,9 5,0 2,7 4,8 7,4 7,6 2,3 4,9 3,9 1,3 Аланин ... Аспарагиновая кислота . . Глицин . . . Глютаминовая кислота . . Пролин . . . Серин .... Тирозин , . . Цистин . . . 6,4 8,8 7,1 14,4 5,4 3,8 3,2 1,4 6,3 8,9 6,1 14,5 4,6 4,0 3,0 1,3 6,3 8,5 6,7 14,4 4,8 3,9 3,2 1,3
няется своеобразным аминокислотным составом соединительных белков. Так, коллаген характеризуется значительным количеством глицина, пролина и оксипролина, отсутствием триптофана, цистина, цистеина и очень малым содержанием тирозина и метионина. В молекуле эластина мало аргинина, лизина, метионина и треонина, отсутствует триптофан.
При повышении содержания в мясе соединительнотканных белков его пищевая ценность снижается еще и потому, что протеазы желудочно-кишечного тракта хуже переваривают эти белки, чем мышечные. Чем больше в мясе соединительной ткани, тем больше непереваривае-мый остаток. Вместе с тем и белки относительно невысокой пищевой ценности все же играют большую роль. Аминокислоты, освобождающиеся из неполноценных белков в процессе пищеварения, дополняют аминокислотные смеси, образующиеся из других белков.
На содержание аминокислот в мясе и мясопродуктах могут влиять технологические приемы обработки и консервирования. Незначительное снижение содержания лизина, метионина и триптофана может наблюдаться при обычной варке мяса. Длительное автоклавирование приводит уже к значительным потерям аминокислот. При консервировании мяса и стерилизации мясных продуктов
223
несколько уменьшается их перевариваемость и увеличивается жесткость, что снижает биологическую ценность мясных белков. Методы посола не оказывают заметного влияния на питательную ценность белков; не наблюдается сколько-нибудь значительных потерь аминокислот и при варке посоленного мяса.
В результате замораживания, особенно быстрого, также не происходит изменений, существенно снижающих биологическую ценность белков мяса. Это же относится и к сублимации мясопродуктов.
Тепловое высушивание мясопродуктов в зависимости от применяемого метода оказывает различное влияние на перевариваемость и пищевую ценность, мясных белков. Происходящие при этом изменения белков связаны с продолжительностью и температурой обработки.
Жиры. С мясом в пищевой рацион вносится значительное количество жира. В среднем в различных отрубах мяса его содержится И—37% в зависимости от вида мяса, отруба и упитанности животного.
Компоненты пищевых жиров, переваренных в. желудочно-кишечном тракте, используются животным организмом в качестве энергетического и пластического материала. Поэтому жиры имеют большое значение в общем обмене. При окислении благодаря большому содержанию неокисленных углерода и водорода они дают больше энергии, чем другие пищевые компоненты. Пищевые животные жиры мало отличаются по калорийности один от другого. Однако не все жиры усваиваются одинаково ввиду их разного состава и свойств. Лучше всего усваиваются жиры, температура плавления которых ниже температуры организма. Вместе с тем биологическая ценность пищевых животных жиров зависит от содержания в них определенных жирных кислот. Жиры говядины, свинины и баранины состоят главным образом из пальмитиновой, стеариновой, пальмолеиновой, олеиновой, линолевой и относительно небольшого количества арахидоновой и линоленовой кислот (табл. 38).
Важное значение имеют ненасыщенные жирные кислоты, которые поступают в. организм с животными жирами. Человеку и некоторым.животным требуется определенное количество полиненасыщенных жирных кислот: линолевой, линоленовой и арахидоновой. Биологическая ценность этих кислот неодинакова, но многие из них не-
224
L
ТАБЛИЦА®
Мирные кислоты Содержание жирных кислот (в %) в жире
говяжьем свином бараньем
Пальмитиновая 29,0 28,0 25,0
Стеариновая . . . . . . . 20,0 13,0 25,0
Пальмолеиновая 2,0 3,0 —
Олеиновая ........ 42,0 46,0 39,0
Линолевая ........ 2,0 10,0 4,0
Линоленовая . 0,5 0,7 0,5
Арахидоновая ...... 0,1 2,0 1,5
обходимы в пище, так как за исключением олеиновой они не синтезируются в животном организме. Большая роль фосфолипидов и триглицеридов, содержащих жизненно-необходимые жирные кислоты, связана также с их анти-холестериновым свойством, т. е. способностью превращать отложения холестерина. В животных жирах мало полиненасыщенных жирных кислот, больше их содержится в растительных маслах, что определяет их значение как незаменимой составной части пищи.
Насыщенные жирные кислоты могут быть использованы в процессах обмена для синтеза углеводов, заменимых аминокислот и других компонентов, но большая часть их, подвергаясь окислительным превращениям, оказывается богатым источником энергии.
Животные жиры содержат жирорастворимые витамины и выполняют функцию растворяющего агента жирорастворимых витаминов A, D, Е,К, поступающих с пищевыми компонентами, способствуя их усвоению. _
Витамины. В мясе имеется широкий набор витаминов группы В и жирорастворимых витаминов. Важным является то, что при питании мясной пищей организм параллельно усваивает и использует продукты переваривания белка и витамины, необходимые для построения ферментов.
Количество витаминов в разных отрубах мяса одного и того же животного варьирует незначительно, а в мясе разных животных содержание витаминов неодинаково. Так как водорастворимых витаминов в мышечной ткани
225
содержится больше, чем в жировой ткани, относительное содержание их будет больше в мясе с меньшим содержанием жира (табл. 39).
ТАБЛИЦА 39
Витамины Содержание витамина. мг% на сырой продукт
говядина телятина свинина баранина
Тиамин . . . 0,07—0,10 0,14—0,19 0,74—0,94 0,13—0,16
Рибофлавин . . Никотиновая 0,13—0,17 0,30—0,40 0,18—0,19 0,18—0,22
кислота . . Пантотеновая 3,9—6,7 6,1—7,5 3,9—4,3 4,3—5,2
кислота . . Фолиевая кис- 0,41—1,0 — 0,72—2,0 0,59
лота .... 0,013—0,026 0,018—0,023 0,007—0,009 0,007—0,009
Биотин . . . 3,4—4,6 — 5,3—5,5 5,9
Витамин Ва . . 0,32—0,38 0,14—0,37 0,42—0,50 0,29
Витамин В12 2,0—2,7 — 0,9 2,5
В готовых продуктах содержание витаминов зависит от соотношения тканей, входящих в продукт, и технологической обработки.
Большинство витаминов относительно устойчиво к воздействию физических и химических факторов, но некоторые из них разрушаются. Так, тиамин частично разрушается при посоле, копчении, варке (остаток его в вареном мясе составляет до 75%), тепловом консервировании и тепловой сушке. Рибофлавин и никотиновая кислота более устойчивы во время варки (остаточный уровень их около 85%), витамин В5 сравнительно неустойчив (остаточный уровень его 45—60%), а пантотеновая кислота, биотин, фолиевая кислота и витамин I%2 весьма устойчивы. При тепловой обработке в бульон переходит до 10—15% водорастворимых витаминов, что обусловливает особую важность использования мясных отваров.
Минеральные вещества. В мясе содержится значительное количество фосфора и железа, но в нем сравнительно мало кальция (табл. 40).
Из микроэлементов мясо содержит медь, цинк, алюминий (табл.41).
226
ТАБЛИЦА 40
Минеральные вещества Содержание минеральных веществ, мг% на сырой продукт
говядина телятина свинина баранина
Кальций . . . Фосфор . . . Железо .... 9—12 130—186 2,4—3,0 6—11 200—343 2,9 8—10 157—168 2,2—2,5 9—10 138—213 2,2—2,7
ТАБЛИЦА 41
Мясо Содержание, мг на 1 кг мяса
медь алюминий ЦИНК
Г овядина Свинина Баранина Телятина 0,8—1,2 3,1 4,2 2,5 5,0 4,4 4,3 26—50
ВКУСОВАЯ ХАРАКТЕРИСТИКА МЯСОПРОДУКТОВ
Постоянное регулирующее участие нервной системы в акте пищеварения обусловливает особое значение вкусовых и ароматических свойств пищи, ее внешнего вида (цвета), нежности, сочности. Эти свойства пищи способны воздействовать на нервную систему путем возбуждения органов обоняния,вкуса и зрения.
Мясная пища — один из лучших возбудителей секреции пищеварительных желез (при сочетании условных и безусловных рефлексов). Секреция пищеварительных желез под влиянием внешних раздражителей не может обеспечить всего процесса переваривания пищи. Дополнительная секреция вызывается поступлением пищи в желудок, т. е. действием химических возбудителей. Такую роль выполняют вещества, содержащиеся в мясном отваре. Из них важную роль играют азотистые и без-азотистые экстрактивные вещества. Чем концентриро-
227
ваннее отвар, тем значительнее он влияет на деятельность пищеварительных желез.
Аромат и вкус. Свежее мясо имеет незначительный специфический запах и слегка сладковатый, слабосоленый вкус. Мясо разных видов животных и птиц, кроме вкуса, специфического для данного вида, обладает определенным привкусом, зависящим от условий содержания и корма. Запах мяса взрослых животных более сильный, чем мяса молодых животных той же породы. Несколько различен запах мяса зрелых животных разного пола.
Аромат и вкус вареного мяса проявляется более сильно. В результате нагревания мяса ряд его веществ изменяется или освобождается из связанного состояния. Эти вещества и участвуют в образовании вкуса и «букета» аромата. Аромат вареного мяса почти всегда исходит из мышечных волокон, немного от костей и костного жира. Многие вкусовые компоненты растворимы в воде, другие — жирорастворимы.
Главным источником веществ, участвующих в образовании вкуса и аромата, является мышечная ткань и в значительной мере — жировая ткань. Участвующие в создании аромата и вкуса вещества содержатся в тканях (они образуются и накапливаются в процессе автолитических превращений) или образуются из предшественников при нагревании.
Исследованиями показано, что предшественниками аромата и вкуса мяса являются: низкомолекулярные пептиды (глутатион, карнозин, ансерин и др.); углеводы, аминокислоты (глютаминовая кислота, треонин, цистеин, метионин, лейцин, изолейцин, валин, аланин, гистидин); нуклеотиды (инозиновая и гуаниловая кислоты или продукты их распада); азотистые экстрактивные вещества (таурин, креатин и креатинин); органические кислоты (молочная, пировиноградная и др.). В результате нагревания этих веществ отдельно или в составе мяса происходят сложные реакции, приводящие к образованию новых продуктов, обладающих вкусовыми и ароматическими свойствами.
Основные категории вкуса: кислый, соленый, сладкий, горький — создаются в мясе определенными веществами. Кислый — в основном молочной, фосфорной и пировиноградной кислотами. Соленый — солями этих же кислот и хлоридов. Горький — некоторыми свободными аминокис
228
лотами и азотистыми экстрактивными веществами. В образовании сладкого вкуса принимают участие глюкоза, рибоза, триозы и др. Композиция природного вкуса вареного или жареного мяса еще полностью не раскрыта.
Важнейшими компонентами аромата мяса считаются серусодержащие и азотсодержащие летучие вещества, но особое место отводится карбонильным соединениям. Кроме того, в состав этой смеси веществ входят также продукты вторичных реакций. Например, взаимодействие свободных аминокислот с глюкозой и глюкозофосфатами приводит к образованию продуктов, обладающих характерным запахом. Обладают определенным запахом и продукты взаимодействия аминокислот, углеводов и эфиров ненасыщенных жирных кислот.
Серусодержащие соединения обнаруживаются в мясных продуктах в очень небольших количествах, но значительно влияют на их аромат. Среди них большое значение имеют меркаптаны, тиоспирты, тиоэфиры.
К числу азотсодержащих летучих веществ относятся аммиак (образуется при дезаминировании АМФ и других компонентов) и амины (образуются при декарбоксилировании аминокислот). В мясопродуктах, подвергнутых обработке дымом, содержатся и сложные амины с циклическим строением.
Большое значение для образования аромата мясопродуктов имеют монокарбоновые летучие жирные кислоты Муравьиная и уксусная кислоты имеют сильный и резкий кислый запах. В ароматообразовании также участвуют пропионовая, масляная, валериановая и капроновая жирные кислоты.
По-видимому, определенное участие в ароматообразовании мясопродуктов принимают такие кетокислоты, как а-кетоглутаровая, щевелевоуксусная, а-кетомасляная и а-кетоизовалериановая.
Важнейшую роль в образовании аромата играют и другие карбонильные соединения: альдегиды, кетоны и др. Карбонильные соединения имеют резкий запах и жгучий вкус. Наиболее резок запах у низкомолекулярных, более приятен у высокомолекулярных и особенно приятен у ароматических карбонильных соединений. Среди карбонильных соединений в значительных количествах в мясопродуктах обнаруживаются: гликолевый аль
229
дегид, ацетоин, метилглиоксаль, фурфурол, формальдегид, диацетил, ацетон, пропионовый альдегид, масляный, изовалериановый, гексиловый, гептиловый, каприловый, нониловый и дециловый альдегиды и др.
При варке и жарении различных видов мяса образуются в основном идентичные карбонильные соединения в неодинаковых количествах, что и обеспечивает специфичность запаха. Более жирное мясо при нагревании дает больше карбонильных компонентов.
Введение ароматообразующих микробных культур при изготовлении мясопродуктов способствует накоплению продуктов, обладающих ароматом и вкусом. В результате жизнедеятельности определенных микроорганизмов и развития окислительных превращений углеводов, липидов и аминокислот при посоле окороков в них образуются вещества, обусловливающие специфический аромат и вкус. Наряду со свободными аминокислотами и такими азотсодержащими экстрактивными веществами, как пурины, креатин, креатинин, в образовании вкуса соленого мяса участвуют минеральные соли и, возможно, нитрозомиоглобин. Важное значение приписывается посолочным ингредиентам (хлористый натрий, нитраты и нитриты). Вкус мяса при посоле только чистой поваренной солью отличается от вкуса продуктов, посоленных с добавлением селитры или нитрита. В образовании аромата соленого мяса основная роль принадлежит карбонильным соединениям.
Нежность и сочность. Это одно из важнейших свойств, определяющих пищевые достоинства мяса. Нежность и сочность взаимосвязаны. Если различие в нежности отрубов свинины и баранины не очень велико, то нежность говядины в значительной мере зависит от отруба, породы, пола и возраста животного. Если в отрубах содержится много соединительной ткани, то из них получаются продукты более жесткие.
При прочих равных условиях на степень нежности мяса наибольшее влияние оказывают различные факторы после убоя животного, особенно продолжительность и температура хранения мяса и методы технологической обработки. Нежность мяса зависит от способности мускульных и соединительнотканных белков к гидратации. Более нежным и сочным оно становится при созревании.
230
Замораживание и хранение в замороженном состоянии по-разному влияют на нежность мяса в зависимости от температуры замораживания и продолжительности периода между убоем и замораживанием; снижение температуры замораживания и сокращение этого периода положительно сказываются на нежности мяса.
Одним из важных факторов, влияющих на сочность готовых мясопродуктов, является метод тепловой обработки. Методы обработки, обеспечивающие лучшее удержание жидкости и жира, обусловливают получение более сочных мясопродуктов.
Цвет. Привлекательность мясопродуктов зависит также от их цвета, который в основном обусловлен наличием миоглобина и его производных. Мышцы, содержащие больше миоглобина, окрашены в интенсивный ярко-красный (оксимиоглобин) и темно-красный (миоглобин) цвет. Кроме того, цвет мяса обусловливают цитохромы — красные гемпигменты, витамин Bi2 красного цвета, флавины — желтые коферменты и т. п.
Однако по сравнению с миоглобином роль их весьма незначительна.
Цвет вареного несоленого мяса в значительной степени зависит от содержания в нем производных миоглобина и продуктов их распада. Во время варки цвет мяса из темно-красного или ярко-красного постепенно становится более светлым, а затем при достижении достаточно высокой температуры — серым или коричневым. Коричневый цвет окончательно сваренного мяса вызван новыми пигментами, в том числе денатурированным гемпротеинами и продуктами их распада, а также продуктами взаимодействия углеводов с белками.
Коричневатая поверхность жареного мяса также обусловлена комплексом пигментов, образовавшихся из гем-протеинов, а также в результате полимеризации углеводов с белками. Ярко-красный цвет отдельных частей не-прожаренного мяса зависит от содержания оксимиоглобина.
Окраска сырого соленого мяса (при добавлении нитратов или нитритов) в основном связана с весьма стабильным пигментом — нитрозомиоглобином, образующимся в процессе посола, а вареного соленого мяса — с нитрозогемохромогенами, образующимися при тепловой денатурации нитрозомиоглобина.
231
ОСОБЕННОСТИ МЯСА ДОМАШНЕЙ ПТИЦЫ
Мясо птиц (тушки) представляет собой комплекс тканей: кожи, мышечной, жировой, соединительной и костной. Кроме того, в мясе птиц содержится небольшое количество нервной ткани и тканей кровеносных сосудов.
Общий химический состав съедобной части мяса птицы характеризуется данными табл. 42.
ТАБЛИЦА 42
Мясо Содержание в' тушке, %
белков ВОДЫ жиров ЗОЛЫ
Гусиное . . 16,5 53,4 29,0 1,1
Индейки . . . 24,5 65,8 8,5 1,2
Куриное . . 20,0 73,9 5,0 1,1
Утиное .... 15,8 58,6 26,8 0,8
Пищевые достоинства мяса птицы в основном определяются пищевой ценностью мышечной, жировой и соединительной тканей. Важнейшая составная часть мяса птиц — мышечная ткань.
Мышечная ткань птиц в отличие от мышечной ткани убойного скота содержит относительно больше легко усвояемых белков высокой биологической ценности, в их состав входят незаменимые аминокислоты в оптимальном соотношении. Это объясняется тем, что по сравнению с мясом убойных млекопитающих животных в мясе птиц слабо развита внутримышечная соединительная ткань. Она представлена лишь тонкими пленками, окружающими пучки мышечных волокон и иногда проникающими внутрь их. Небольшие соединительнотканные образования связывают мышечные волокна в пучки и мышцы. В связи с этим в мясе птиц содержится относительно меньше неполноценных белков — эластина и коллагена, чем в говядине и свинине. Наряду с этим белковые компоненты внутримышечной соединительной ткани мяса птиц — коллаген и эластин — являются более лабиль-
232
ними, т. е. быстрее образуют растворимые продукты распада при кулинарной обработке.
Жир птиц характеризуется невысокой температурой плавления, что связано с высоким содержанием в нем триглицеридов с ненасыщенными жирными кислотами. Это обусловливает более легкое его усвоение.
Окраска различных мышц у птиц неодинакова; она изменяется от светло-розовой (белое мясо) до темнокрасной (темное мясо) в зависимости от содержания в них гемпротеинов. Химический состав белого и красного мяса различен: в белом мясе больше полноценных белков, чем в красном. Белое мясо легко переваривается, поскольку оно меньше содержит соединительной ткани.
Мясо птиц обладает приятным запахом и вкусом. Это объясняется образованием при термической обработке специфического соотношения веществ, участвующих в создании «букета» вкуса и аромата. Мясо птиц отличается наличием большого количества ароматообразующих компонентов, многие из которых возникают при тепловой обработке. Например, летучие вещества вареной курятины включают нитросульфоновую кислоту, этанол, ацетальдегид, метилкетоны, альдегиды, моно-, ди- и поли-основные кислоты, аммиак, амины, маркаптаны, спирты, эфиры, сероводород, органические сульфиды и дисульфиды, энолы и фенолы, сульфиновые кислоты.
Глава VI.
ИЗМЕНЕНИЕ БИОХИМИЧЕСКИХ CBO*5!?y МЯСА ПОД ВЛИЯНИЕМ БИОЛОГИЧЕСКИХ И ФИЗИКО-ХИМИЧЕСКИХ ФАКТОРОВ
БИОХИМИЧЕСКИЕ ОСНОВЫ СОЗРЕВАНИЯ МЯСА
ПРОЦЕССЫ СОЗРЕВАНИЯ
в результате выдерживания в ^чен^ времени при низких положительных 1ем1*сРо^5пичуется приходит в состояние зрелости, которое хар Р более высокими пищевыми достоинствами. Ппиятный мясу присуща нежная консистенция и сочное , Р вкус и аромат. Качественные сдвиги в мясе в процессе его созревания обусловлены сложным ком ne4HOg ментативных, автолитических превращении
и соединительной тканях. . ,литРНсИв-
В начальных стадиях созревания наибол не„ не_ но подвергаются превращениям компоненты белковой природы, что и предопределяет хаРа* ₽ Поодук-ний белковых веществ. Интенсивное накоплР и^их тов автолитического распада небелковых „ gv.
взаимодействие с белками в значительной ипЛтоид-
словливают характерные физико-химические „ „окна но-химические изменения белков мышечп мяса
Протеолитические превращения б^*ов В те автоли-приводят к увеличению нежности, В РезУ ппевра-тического распада разных компонентов нар ду г,еств
щениями белков происходит накопление в мя улучшающих его вкус и аромат.
Пища, приготовленная из созревшего мяса, вует повышению аппетита. Такое мясо лучшер вается и усваивается. Установлено, что при ия
степени созревания мяса сокращается пери д• ива.
желудочного сока. Созревшее мясо быстре Р' PgBa.
ется в желудке и продукты переваривания г
234
куируются из него, т. е. переваривание созревшего мяса происходит с меньшей затратой энергии, чем переваривание несозревшего мяса. Это объясняется тем, что в процессе созревания белки мяса переходят в такое состояние, когда их перевариваемость пищеварительными ферментами значительно повышается.
В Советском Союзе начало систематическому и подробному изучению биохимических процессов, происходящих при созревании мяса, положили исследования И. А. Смородинцева и его сотрудников.
ИЗМЕНЕНИЕ КОНСИСТЕНЦИИ
Изменение нежности мяса в процессе созревания условно можно разграничить на два периода. В первый период созревания в мясе происходит интенсивный распад гликогена и АТФ, в значительной мере обусловливающий окоченение мышц. Резкие изменения сократительного аппарата, конформационные изменения и агрегационные взаимодействия белков, главным образом миофибрил-лярных, преобладают над процессами, приводящими к увеличению нежности мяса. Длительность этого периода для мышц различных видов мяса неодинакова, например для мышц крупного рогатого скота 1—2 суток, для мышц домашних птиц 4—6 ч. Во второй период созревания происходит разрешение окоченения мышц и последующее заметное увеличение нежности мяса. Эти изменения связаны с качественно новыми превращениями мышечных белков и изменениями белков и основного вещества внутримышечной соединительной ткани.
Изменение мышечных белков. Мышечные белки в первой фазе созревания претерпевают различные конформационные изменения и агрегационные взаимодействия, которые преобладают над деструктивными превращениями под воздействием тканевых протеолитических ферментов— катепсинов. В процессе созревания мяса происходит нарастание в мышцах свободной протеолитической активности вследствие высвобождения катепсинов из ограничивающих структур (лизосом). У мышц с высоким прижизненным метаболизмом при созревании свободная протеолитическая активность нарастает быстрее, чем и обусловливает интенсивные автолитические превращения белков в более ранние сроки их созревания, как, напри
235
мер, в мышцах домашних птиц. В мышцах крупного рогатого скота, свиней и овец наиболее интенсивное нарастание протеолитической активности происходит в период после 48 ч автолиза при температуре 0—2°С, что совпадает с окончанием окоченения и началом нарастания нежности мяса.
Под воздействием .высвободившихся катепсинов наиболее заметным изменениям подвергаются белки саркоплазмы. В результате повышается их извлекаемость и электрофоретическая подвижность, появляются пептидные фрагменты и свободные аминокислоты. Наряду с этим ограниченному протеолизу подвергаются и мио-фибриллярные белки. Расщепление хотя бы небольшого количества пептидных связей в этих белках уже достаточно для разрыхления их структур и увеличения нежности мышечной ткани. Признаками протеолиза миофиб-риллярных белков является нарастание N-концевых и С-концевых групп в этих белках. Исследованиями В. И. Соловьева показано, что повышение нежности мяса происходит параллельно накоплению N-концевых групп в белках фракции миозина; при этом обнаруживаются N-концевые группы дикарбоновых кислот, а-аланина, лейцина и других аминокислот.
Изменение белков и основного вещества соединительной ткани. В изменении нежности мяса важную роль играют количество и состояние компонентов соединительной ткани. В мясе в первый период созревания структурные белки (коллаген, эластин) и основное вещество (мукополисахариды и др.) внутримышечной соединительной ткани становятся менее лабильными по сравнению с их состоянием тотчас после забоя животного или птицы. Лабильность этих компонентов увеличивается во второй период созревания, когда интенсивно высвобождаются из ограничивающих структур (лизосом) гидролитические ферменты. В этот период образуются растворимые продукты коллагена и эластина, повышается растворимость основного вещества соединительной ткани и происходит некоторое накопление продуктов распада мукополисахаридов.
Состояние основного вещества соединительной ткани в значительной мере определяет гидротермическую устойчивость коллагена: чем более лабильно основное вещество, тем легче разваривается коллаген.
236
В процессе созревания различные компоненты мяса претерпевают неодинаковую степень превращений, характерным образом влияющих на изменение нежности. Поэтому при равных условиях созревания нежность различных отрубов мяса одного и того же животного, а также одинаковых отрубов разных животных оказывается различной. Нежность мяса, содержащего много соединительной ткани, относительно невелика. Такое мясо требует более длительного времени созревания. Например, белые мышцы кур созревают сравнительно быстро, красные мышцы кур, хотя и обладающие высокой активностью протеолитических ферментов, требуют для своего созревания более длительного времени, так как содержат в 2 раза больше соединительнотканных белков, чем белые мышцы. Процесс размягчения красных мышц кур условно можно разделить на две фазы. Во время первой (короткой) фазы, которая продолжается примерно 10— 20 ч, происходит сравнительно интенсивное размягчение. Окончательное размягчение красных мышц осуществляется во время второй фазы, которая продолжается в течение 4 суток автолиза при низких положительных температурах, и в значительной степени обусловлено превращениями белковых компонентов и основного вещества соединительной ткани.
При созревании мясо молодых животных и птиц становится нежным быстрее, чем старых. Это вызвано в первую очередь количеством и состоянием внутримышечной соединительной ткани, а также концентрацией тканевых протеаз и других гидролаз. В мышцах молодых животных и птиц, поскольку у них процессы прижизненного метаболизма весьма интенсивны, концентрация гидролитических ферментов более высока, чем в старых. Наряду с этим лабильность (ферментная атакуемость) соединительнотканных белков — коллагена и эластина — у молодых животных более высокая. Поэтому в мясе молодых животных и птиц интенсивны протеолитические превращения миофибриллярных и соединительнотканных белков, происходит более интенсивная деполимеризация основного вещества соединительной ткани, что обусловливает соответствующее повышение нежности мяса в более ранние сроки. Например, необходимая нежная консистенция при температуре 0—2°С достигается у мяса взрослых животных крупного рогатого скота к исходу 10—
12 суток созревания, а у мяса молодняка — через 3—4 суток. При этих же условиях для получения нежной консистенции мяса взрослых гусей необходимо 6 суток созревания, а для мяса гусят — 2 суток.
НАКОПЛЕНИЕ ВЕЩЕСТВ, ОБУСЛОВЛИВАЮЩИХ АРОМАТ И ВКУС
В процессе созревания в результате комплекса автолитических превращений различных компонентов мяса образуются и накапливаются так называемые предшественники или готовые вещества, участвующие затем в образовании аромата и вкуса кулинарно обработанного созревшего мяса. К ним относятся:
аминокислоты — глютаминовая кислота, треонин, цистеин, метионин, лейцин, изолейцин, гистидин и др. образующиеся при распаде белков и пептидов;
нуклеотиды •— инозиновая и гуаниловая кислоты и продукты их распада;
азотистые экстрактивные вещества — таурин, креатин и креатинин и др.;
органические кислоты — молочная, пировиноградная и другие; летучие жирные кислоты — муравьиная, уксусная, масляная, капроновая и др.;
кетокислоты — а-кетоглутаровая, щавелевоуксусная, ct-кетомасляная и др.;
карбонильные соединения — альдегиды, кетоны и др.
Наилучшие вкусовые и ароматические качества мяса при созревании достигаются в сроки, необходимые для получения нежной консистенции.
ИНТЕНСИФИКАЦИЯ СОЗРЕВАНИЯ
Мышцы крупного рогатого скота характеризуются сравнительно низкой концентрацией тканевых протеолитических ферментов( катепсинов). Кроме того, многие отруба говядины отличаются повышенным содержанием соединительной ткани, что обусловливает жесткость мяса и его медленное созревание. Поэтому для ускорения получения нежной консистенции говядины применяют протеолитические ферментные препараты животного и растительного происхождения.
238
При обработке небольших отрубов (полуфабрикатов) говядины препаратами протеолитических ферментов превращения, протекающие в мышечных волокнах и внутримышечной соединительной ткани, во многом такие же, как при воздействии тканевых протеаз. Однако эти превращения имеют и ряд особенностей.
Воздействие микробных ферментных препаратов. Характер воздействия препаратов, полученных из непатогенных бактерий или плесневых грибов, связан с их происхождением. В таких препаратах содержатся различные по специфичности активные ферменты. Большинство ферментных препаратов, полученных из бактерий и плесеней, воздействует в большей степени на мышечные волокна. Воздействие таких препаратов на компоненты соединительной ткани меньше, однако достаточно для получения необходимой нежности.
Отечественной ферментной промышленностью освоен выпуск следующих энзиматических препаратов протеолитического действия: терризин ПК (продуцент Aspergillus terricola, штамм 3374), оризин ПК (продуцент Aspergillus oryzae, штамм КС), субтилизин (продуцент Bacillus subtilis), мезентерии (продуцент Bacillus mesentericus) и др. Указанные препараты довольно эффективно повышают нежность мяса.
Воздействие растительных ферментных препаратов. Большое распространение получили ферментные препараты из млечного сока (латекса) или экстракта из листьев дынного дерева (папаин), фигового дерева (фицин) и из ананасов (бромелаин).
Растительные ферментные препараты сильно воздействуют на белки соединительной ткани мяса и в различной степени — на белки мышечных волокон. Так, папаин сильнее всего гидролизует миозин, а на актин действует ограниченно. Наиболее сильно влияют на волокна коллагена растворы бромелаина и фицина, но и папаин также вызывает коллагенолиз. Фицин, папаин и бромелаин (в порядке степени активности) существенно влияют на эластиновые волокна.
Растительные протеолитические ферментные препараты находят применение для увеличения нежности мяса, высушенного сублимацией. Регидратировать такое мясо удобно непосредственно в растворах препаратов. Преимущество этого метода заключается в быстром и одно
239
родном проникновении ферментов в мясо. Лучший эффект наблюдается при использовании раствора фермента в 2 %-ном NaCl. Высушенное мясо, регидратированное в этих условиях, поглощает воды больше и теряет ее при варке меньше, чем мясо, регидратированное только в чистой воде.
БИОХИМИЧЕСКИЕ
ИЗМЕНЕНИЯ КОМПОНЕНТОВ
МЯСА ПРИ ВОЗДЕЙСТВИИ МИКРОБОВ
В мясе и мясопродуктах, хранящихся или обрабатывающихся без специальной защиты, практически всегда имеются условия для развития микроорганизмов. В зависимости от состава микрофлоры и условий окружающей среды (влажность, температура, свет), а также от состояния продукта скорость и характер превращений компонентов тканей мяса могут быть весьма различными.
ПРЕВРАЩЕНИЯ БЕЛКОВ И АЗОТИСТЫХ ЭКСТРАКТИВНЫХ ВЕЩЕСТВ
Белки обычно подвергаются воздействию ферментов, выделяемых микроорганизмами во внешнюю среду. Продукты гидролитического распада белков мяса являются источником питания микроорганизмов. Расщепление бел: ков и их производных, вызываемое микроорганизмами, получило название гниения. Такие бактерии, как Clostridium, Bacillus, Pseudomonas и ряд других, содержат протеолитические ферментные системы, быстро гидролизирующие белковые молекулы с образованием растворимых пептидов и аминокислот.
Сложный комплекс протеолитических ферментов микроорганизмов недостаточно изучен и классифицирован в отношении их специфичности. Некоторые микроорганизмы выделяют ферменты, гидролизующие разнообразные белковые субстраты. Вместе с тем среди них есть и такие ферменты, которые довольно специфично гидролизуют коллаген.
В гнилостном разложении белков могут принимать
240
участие одновременно или последовательно аэробные и анаэробные микроорганизмы. Обычно в начальной стадии гнилостного распада на поверхности продуктов развиваются аэробные микроорганизмы, а позднее — строгие анаэробы. Накопление кислых продуктов в процессе автолитических превращений тканевых компонентов создает неблагоприятные условия для каталитического действия протеолитических ферментов некоторых микроорганизмов. Поэтому на поверхности мясопродуктов, имеющих достаточно кислую реакцию, развиваются плесени, активность протеаз которых проявляется в кислой среде. Жизнедеятельность плесеней сопровождается образованием конечных продуктов распада белковых веществ — аммиака и азотистых оснований, которые повышают pH и делают среду благоприятной для развития гнилостных микроорганизмов.
Гнилостный распад белковых веществ, вызываемый ферментными системами микроорганизмов, может протекать различно в зависимости от свойств разлагающихся белков, внешних условий и вида микроорганизмов. При гниении белков в начале образуются белковые фрагменты, более мелкие полипептиды и определенное количество свободных аминокислот. Многим микроорганизмам свойственны ферментные системы, катализирующие распад свободных аминокислот или малых пептидов.
Наиболее часто встречающимся процессом распада свободных аминокислот является их дезаминирование, причем из процессов, катализируемых ферментами микроорганизмов, преобладает окислительное дезаминирование, приводящее к образованию аммиака и а-кетокислот. Подобные превращения свободных аминокислот могут происходить по схеме
— 2Н
R—СН—СООН ------------------- R—С—СООН
] Оксидаза L-аминокислоты ||
NH2 NH
L-Аминокислота Иминокислота
Во второй фазе иминокислота, присоединяя молекулу воды, распадается на кетокислоту и аммиак
R—С—СООН -f- Н2О R—С—СООН + NH3
I I)
nh2 О
9—454
241
При гидролитическом дезаминировании аминокислот в результате каталитического воздействия ферментов микроорганизмов образуются аммиак и оксикислоты
+н2о
R—СН—СООН------> R—СН—СООН + NH3
I I
NH3 ОН
При восстановительном дезаминировании аминокислот под действием ферментов микроорганизмов образуются жирные кислоты и аммиак
+ 2Н
R—СН—СООН------> R—СН2—СООН + NH3
I
nh2
При распаде аминокислот по схеме так называемого внутримолекулярного дезаминирования образуются ненасыщенные жирные кислоты и аммиак
R—СН2—СН—СООН -> R—СН=СН—СООН 4- НН3
nh2
Таким образом, дезаминирование аминокислот под воздействием ферментов микроорганизмов приводит к образованию аммиака, насыщенных или ненасыщенных жирных кислот, кетокислот и оксикислот, причем некоторые кетокислоты и оксикислоты могут претерпевать дальнейшие превращения. Так, кетокислоты при каталитическом действии декарбоксилаз превращаются в альдегиды и углекислый газ
Z
R—С—СООН R—С + СО2
11 \н
о н
и оксикислоты — в спирт и углекислый газ
R—СН—СООН R—СН2—ОН 4- СО2
ОН
При распаде аминокислот в наибольшем количестве накапливаются уксусная и масляная кислоты, а затем муравьиная и пропионовая, придающие продукту неприятный запах.
242
Распространенным процессом распада аминокислот под воздействием декарбоксилаз микроорганизмов является их декарбоксилирование с образованием СО2 и соответствующих аминов
-со2
R—СНа—СН—СООН R—СН2—СН2—NHa
I
nh2
В числе образующихся аминов могут быть следующие.
Аминокислота Образующийся амин Аминокислота Образующийся амин
L-Валин Изобутиламин I.-Лизин Кадаверин
L-Гистидин Гистамин L-Аргинин Агматин
L-Тирозин Тирамин L-Орнитин Путресцин
L-Триптофан Триптамин L-Фенилаланин Фенилэтиламин
L-Цистеин Таурин
Многие амины, даже в очень малых количествах, обладают сильным фармакологическим действием, например, гистамин, триптамин, тирамин, кадаверин и путресцин.
Другие бактериальные ферменты вызывают специфические превращения ряда аминокислот. Так, при специфическом распаде триптофана образуются индол и скатол. При образовании скатола ферменты микроорганизмов постепенно разрушают боковую цепь триптофана, оставляя нетронутой кольцевую структуру
Под действием ферментов микроорганизмов из триптофана в результате отщепления боковой цепи (в виде аланина или серина) образуется индол
NH
сн2—сн-соон
NH
Триптофан
сн2—сн—соон он nh2
Серин
9»
243
При специфическом распаде тирозина под влиянием ферментов микроорганизмов образуются крезол и фенол
сн2—сн-соон
NHj
Тирозин
Специфические превращения тиоаминокислот под действием ферментов микроорганизмов приводят к образованию сероводорода и меркаптанов
сн2-$н сн2он
HC-NH2 -+2-НОН> НС-ОН + H2S + М!, соон соон
Цистеин Глицериновая
I2nij кислота
CH2-SH CH2-SH
HC-NH2------С Н3 + СО2 + NH3
СООН Этилмеркаптан
Цистеин
Индол, скатол, крезол, сероводород и меркаптаны — дурнопахнущие и ядовитые вещества, особенно индол и скатол.
Распад аминокислот под воздействием ферментов микробов приводит также к образованию ряда простых органических соединений, например метана.
Дезаминирование и декарбоксилирование аминокислот, как было показано, сопровождается образованием большого количества аммиака и углекислого газа. Образование аммиака возможно и при дезаминировании нуклеотидов, нуклеозидов и аминопуринов.
Азотистые экстрактивные вещества легко диффундируют через оболочки бактериальных клеток и подвергаются окислительному распаду, дезаминированию и декарбоксилированию с выделением аммиака и углекислого газа. Из некоторых азотистых соединений могут образоваться специфические продукты, в частности из креатина образуется ядовитый метилгуанидин, из карнозина — гистамин.
244
ИЗМЕНЕНИЯ ПИГМЕНТОВ
Поверхность свежего мяса, соприкасающаяся с воздухом, ярко-красного цвета, который характерен для оксимиоглобина и оксигемоглобина. Внутренние слои мяса обычно окрашены в темно-красный цвет, типичный для пигментов, лишенных кислорода.
Изменение окраски мяса до коричневой, серой или зеленой вызывается окислительными превращениями гем-протеинов. Окисление в геме двухвалентного железа до трехвалентного обусловливает образование коричневых производных гемпротеина. Окисление миоглобина в присутствии редуцирующих агентов приводит к образованию двух гемпигментов зеленого цвета. Так, при взаимодействии сульфида с миоглобином и кислородом образуется
Рис. 32. Схема превращений гемпигментов при микробной порче мясопродуктов.
245
сульфмиоглобин, который может быть снова переведен в первоначальный миоглобин. При окислении миоглобина веществами, не содержащими серы, в присутствии кислорода образуется холемиоглобин, который уже не может быть обращен в первоначальный миоглобин. В хо-лемиоглобине окислены порфириновые кольца. При дальнейшем окислении сульфмиоглобин и холемиоглобин распадаются на свободный глобин, железо и окисленные тет-рапиролловые структуры (порфирины), что приводит к появлению коричневой или желтой окраски или обесцвечиванию.
Зеленые гемпигменты и продукты их дальнейшего (окисления образуются в мясопродуктах большей частью при микробной порче (рис. 32). Пигменты изменяются в результате непосредственной химической реакции между мясными пигментами и продуктами, образующимися при микробно-ферментативных превращениях (перекиси, сероводород и др.) или в результате изменения окислительно-восстановительного потенциала при накоплении продуктов ферментативно-микробного распада компонентов тканей. Кроме того, сульфмиоглобин образуется непосредственно под воздействием специфических ферментов микроорганизмов. Обычно зеленые гемпигменты во внутренних слоях продукта образуются под действием 'окисляющих агентов бактериального происхождения, а на поверхности продуктов — под влиянием сероводорода.
Окисление ненасыщенных жирных кислот и гемпиг-ментов протекает независимо друг от друга, но между ними могут происходить также реакции взаимного окисления, ускоряющие прогоркание жира и обесцвечивание мясопродуктов.
ПРЕВРАЩЕНИЯ ЛИПИДОВ
Происходящие при длительном хранении гидролитические и окислительные превращения липидов большей частью не микробного происхождения. Однако у таких липолитических микроорганизмов, как Pseudomonas, и других грамотрицательных микробов, плесеней и ряда прочих видов микроорганизмов имеются ферментные системы, вызывающие гидролитические и окислительные превращения липидов. Липазы перечисленных микроорганизмов активно катализируют гидролиз липидов. Легче
246
всего окислительным превращениям подвергаются ненасыщенные жирные кислоты и насыщенные жирные кислоты с короткой цепью (Сг—Сю). Высокомолекулярные жирные кислоты более устойчивы к таким превращениям. Микробный распад жиров (триглицеридов) может вызвать накопление в мясопродуктах свободных жирных, кислот, органических перекисей, а в случае далеко зашедших изменений — альдегидов, кетонов, низкомолекулярных жирных кислот и оксикислот.
При бактериальном расщеплении лецитина высвобождающийся холин, окисляясь, образует ядовитые вещества: нейрин, мускарин и триметиламин
сн2сн2он
Мускарин
/СН3 N— СН, "'СН3
Три метиламин
Нейрин
ПРЕВРАЩЕНИЯ УГЛЕВОДОВ
В аэробных условиях Pseudomonas, плесени и дрожжи обычно довольно полно окисляют углеводы на поверхности мясопродуктов до СО2 и Н2О. Если окисление углеводов по каким-либо причинам неполное, то накапливаются промежуточные продукты — различные органические кислоты. Такие превращения углеводов обусловливают некоторое подкисление тканей, но образующиеся продукты оказывают относительно небольшое влияние на запах и вкус мяса. При аэробных превращениях углеводов микроорганизмы получают большое количество энергии для своего развития, и бурный рост их приводит к образованию пятен (повреждений) на поверхности продукта.
При анаэробных превращениях углеводов в мясопродуктах в зависимости от вида микроорганизмов могут образоваться различные продукты.
Гомоферментативные молочнокислые бактерии (стрептококки, некоторые лактобациллы и др,) расщепляют
247
глюкозу на две молекулы пировиноградной кислоты, которая не подвергается декарбоксилированию, как при спиртовом брожении, а происходит ее гидрирование, ведущее к образованию молочной кислоты.
Гетероферментативные молочнокислые бактерии (Leu-conostoc и некоторые бациллы) способствуют расщеплению углеводов с образованием эквимолекулярных количеств этанола, СО2 и молочной кислоты.
У многих видов Clostridium разнообразные активные ферментные системы способствуют образованию из углеводов большого количества газа (СО2 и Н2), уксусной и масляной кислот, ацетона, этанола и бутанола, иногда изопропилового спирта.
БИОХИМИЧЕСКИЕ ОСНОВЫ
ИСПОЛЬЗОВАНИЯ МИКРОФЛОРЫ
В ПРОИЗВОДСТВЕ МЯСОПРОДУКТОВ
С целью подавления деятельности нежелательной микрофлоры и интенсификации ферментативных превращений в необходимом направлении при производстве ряда мясопродуктов (сырокопченых и сыровяленых колбас, окороков и др.) вводятся искусственно подобранные бактериальные культуры. Наибольшее распространение получило использование для этих целей различных культур молочнокислой микрофлоры. Молочнокислые бактерии являются не только поставщиком протеолитических ферментов; сбраживая добавленные сахара, они создают условия (pH, окислительно-восстановительный потенциал), которые способствуют распаду лизосом и положительно влияют на энзиматические реакции, обусловленные активностью тканевых ферментов. Значительное накопление продуктов гликолитического распада сахаров вызывает улучшение вкуса и аромата продукта.
Наиболее важным является протеолитическая активность молочнокислых бактерий. Она определяется, во-первых, фильтрующимися протеазами клетки, во-вторых, внутриклеточными ферментами, освобождающимися при автолизе бактерий во время длительной выдержки культуры и сырья. Значение фильтрующихся протеаз, выделяемых в прижизненный период молочнокислыми бактериями, состоит в расщеплении белковых веществ среды
248
для того, чтобы образующиеся азотистые соединения могли проникать через оболочку клетки и использоваться в процессах обмена. Протеолитические системы внутриклеточных ферментов молочнокислых бактерий обладают более широкой специфичностью и играют важную роль в протеолизе белков тканей. Поэтому усиление лизиса молочнокислых бактерий необходимо рассматривать как одну из возможностей ускорения созревания мясопродуктов.
В процессе метаболизма, а также при воздействии на компоненты тканей ферментов, выделившихся в результате лизиса молочнокислых бактерий, образуются продукты (предшественники), создающие специфические аромат и вкус.
Ранее было указано на использование микробных ферментных препаратов для повышения нежности небольших отрубов говядины.
БИОХИМИЧЕСКИЕ
ИЗМЕНЕНИЯ МЯСА ПРИ
ХОЛОДИЛЬНОЙ ОБРАБОТКЕ
ОСНОВНЫЕ ИЗМЕНЕНИЯ ПРИ ЗАМОРАЖИВАНИИ
Искусственное охлаждение сырья животного происхождения является распространенным приемом торможения автолитических реакций, ведущих к глубокому распаду компонентов, а также средством предупреждения развития микрофлоры. Для длительного хранения животное сырье замораживают. Изменения в тканях при замораживании, хранении в замороженном виде и последующем размораживании вызываются сложным комплексом превращений. При этом характер изменений обусловливается автолитическими превращениями до холодильной обработки и в процессе ее, физическими и физико-химическими явлениями вымораживания воды, кристаллообразования и структурными изменениями в тканях.
Характер кристаллообразования при замораживании мяса зависит от скорости замораживания. При медленном замораживании кристаллы льда образуются между
249
пучками волокон и в межклеточных пространствах. Значительные образования льда при таком замораживании способствуют отжатию волокон и соединительнотканных образований в пучки.
Медленное замораживание сопровождается перемещением влаги из клеток в межклеточные пространства, так как первоначально вода замерзает во внеклеточных жидкостях, а осмотически активный материал концентрируется вне клетки. Для восстановления равновесия вода диффундирует из клетки до тех пор, пока дальнейший выход ее из протоплазматического геля окажется невозможным. Образующиеся крупные кристаллы льда давят на клетки, вызывая растяжение и частичное разрушение их структур. Однако считают, что сарколемма при этом останется интактной.
Сравнительно быстрое замораживание, например, при —35 4---40°С, приводит к образованию кристаллов льда
не только в межклеточных пространствах, но и в клетках, что сопровождается неполным выделением влаги из клеток. Внутри волокна кристаллы находятся часто не в центре, а как бы оттеснены к периферии, но в пределах сарколеммы.
В результате быстрого замораживания кристаллы равномерно распределяются в клетках и межклеточных пространствах. Скорость образования их выше скорости перемещения влаги, поэтому большая часть жидкости оказывается замороженной там, где она находилась до замораживания. При таком замораживании образуются мелкие кристаллы льда.
Если замораживаются крупные куски мяса, то в разных слоях кристаллы льда образуются по-разному, так как темп теплоотвода и скорость замораживания неодинаковы.
В быстрозамороженном мясе, хранящемся при температуре более высокой, чем температура замораживания, может происходить рост кристаллов льда благодаря вторичной кристаллизации. В этом случае повреждения вследствие изменения размеров кристаллов и их положения могут иметь меньшее значение, чем денатурация белковых структур, вызванная дегидратацией.
При длительном хранении тканей в замороженном виде на их состояние влияют различные изменения, сопутствующие кристаллизации льда. Наиболее важным из
250
них является увеличение концентрации электролитов в клеточном и межклеточном соке, которая зависит как от степени автолитических превращений до замораживания, так и от условий замораживания. При температуре —0,6-Е—1,2°С из тканевых жидкостей начинает вымораживаться вода и образуются гипертонические растворы, концентрация которых все время увеличивается по мере понижения температуры. Воздействие гипертонических растворов обусловливает денатурацию и распад белковых структур, прежде всего липопротеидов, а затем других белковых комплексов.
Степень указанных изменений зависит от продолжения воздействия гипертонической среды в процессе замораживания и длительного хранения в замороженном виде. Поэтому преимущество быстрого замораживания мяса или изолированных органов и тканей состоит прежде всего в том, что после выделения льда остается меньше времени для воздействия гипертонических растворов на биоструктуры, так как эвтектическая точка этих растворов будет достигнута быстрее.
Вредного влияния гипертонических растворов можно избежать, если ткани замораживать быстро и хранить при температуре —35 -= 40°С, когда соли уже не находятся в растворенном состоянии.
АВТОЛИТИЧЕСКИЕ ПРЕВРАЩЕНИЯ КОМПОНЕНТОВ
Долгое время считали, что в животных тканях при замораживании и хранении в замороженном виде никаких химических изменений автолитического характера не происходит. В настоящее время установлено, что при практически принятых температурах замораживания компоненты мяса подвержены некоторым ферментативным превращениям. В зависимости от автолитических изменений, происшедших до замораживания, эти превращения имеют ряд особенностей.
В процессе замораживания два важнейших фактора влияют на течение ферментативных превращений. Помимо снижения температуры, решающее влияние оказывает повышение концентрации солей, что приводит к ингибированию большинства биохимических реакций. Наряду с этим в результате выхода из ограничивающих структур ферментов и относительного увеличения концентрации
.251
активаторов наблюдается повышение некоторых биохимических превращений.
В процессе длительного хранения мороженого мяса на первый план выходят реакции неферментативной природы: денатурационные превращения, агрегационные взаимодействия и, по-видимому, реакции мелаидинооб-разования.
Размораживание мяса сопровождается интенсивными ферментативными превращениями. Это прежде всего обусловлено нарушением цитоплазматических мембран и высвобождением ферментов из структур. Объем биохимических превращений при размораживании определяется их глубиной до замораживания, в процессе замораживания, хранения в мороженом виде и особенно степенью сохранения активности ферментов. Поэтому один и тот же метод размораживания приводит к качественно различным результатам.
Превращения гликогена. Автолитические превращения мышечного гликогена в процессе замораживания мяса отличаются от превращений, происходящих при положительных температурах: нарушается обычное соотношение параллельно протекающих процессов фосфоролиза (с дальнейшим гликолизом) и амилолиза (гидролиза) мышечного гликогена.
При замораживании мяса гликолитический распад мышечного гликогена идет с тем меньшей скоростью, чем ниже температура. Замораживание мяса на ранних сроках автолиза и при более низкой температуре дает возможность свести к минимуму накопление продуктов гликолиза. Гликолитические превращения, хотя и в резко замедленном темпе, происходят и в замороженном мясе, заметнее при более высокой температуре замораживания и холодильного хранения.
Интенсивность гликолитических превращений в размороженных мышцах мяса в 2—3 раза выше, чем в немороженых, и она тем больше, чем выше был уровень гликогена в мышцах и чем ниже была температура замораживания и холодильного хранения.
При замораживании мышц обнаружено нарастание амилолитических (гидролитических) превращений гликогена, что может быть следствием выхода «кислых» гликозидаз из ограничивающих структур (лизосом) и активации всех гликозидаз ионами хлора.
252
В размороженных мышцах наряду с гликолитическими превращениями гидролиз является одним из важнейших путей ферментативного распада гликогена. Резкое повышение гликолитических превращений в размороженной ткани, очевидно, связано и с включением в эти процессы продуктов гидролиза гликогена (глюкозы).
При холодильном хранении мороженых мышц установлено значительное уменьшение редуцирующих сахаров, в основном расходуемых в реакциях меланоидино-образования. Для мышц с различной глубиной автолиза выявлена общая закономерность уменьшения содержания редуцирующих сахаров: чем больше хранятся мышцы в мороженом виде и чем выше температура их холодильной обработки, тем меньше они содержат редуцирующих углеводов.
В отличие от хранения мяса при положительных температурах, когда преобладает распад гликогена, в процессе замораживания обнаружен ресинтез гликогена, который более отчетливо наблюдается у мышц, содержащих значительное количество редуцирующих сахаров. Поэтому можно считать, что одним из путей ресинтеза гликогена в этих условиях может быть обращение фосфоролиза. Этому способствует увеличение концентрации редуцирующих сахаров, в том числе и глюкозофосфатов, в свободной воде при замораживании. Полученный экспериментальный материал показывает, что ресинтезиро-ванный в процессах замораживания гликоген при размораживании мышц снова вовлекается в гликолитические и гидролитические превращения.
Превращения аденозитрифосфорной кислоты. Автолитические превращения АТФ в мышцах при холодильной обработке характеризуются рядом особенностей.
Замораживание и хранение мышц в мороженом виде обусловливает резкое торможение распада АТФ. Мороженые мышцы (замороженные в горяче-парном виде) даже после очень длительного хранения сохраняют существенные количества АТФ. Все же при замораживании и хранении в мороженом виде выявляется определенная убыль АТФ.
Содержание АТФ в автолизирующих мышцах характеризует суммарный результат двух процессов — распада и ресинтеза. Основной источник пополнения АТФ — гликолитические превращения — ингибируются при за
253
мораживании и хранении в мороженом виде мышц. Поэтому уровень содержания этого нуклеозидтрифосфата на различных этапах хранения мороженого мяса характеризует в основном величину распада. Поскольку процессы, связанные с сокращением мышц, при замораживании и хранении в мороженом виде ингибируются, АТФ, очевидно, расходуется на процессы, не связанные с сокращением.
Размораживание мышц сопровождается распадом АТФ. В то же время происходит ресинтез АТФ, поскольку при размораживании мышц интенсивны гликолитические превращения.
ОСОБЕННОСТИ ОКОЧЕНЕНИЯ МЫШЦ
Агрегационные взаимодействия миофибриллярных белков при замораживании более интенсивны, чем при хранении мышц в условиях низких положительных температур. При замораживании и хранении мышц уменьшается извлекаемость белков актомиозинового комплекса, реактивность тиоловых групп миозина, резко уменьшается реактивность кислых и основных групп во всех белках, а также резко снижается водоудерживающая способность мышц. Однако характер агрегационных взаимодействий контрактильных белков при замораживании мышц несколько отличается от rigor mortis в чистом виде. Основные изменения при замораживании обусловлены вымерзанием воды. Поскольку миозиновая АТФ-аза при замораживании ингибируется, значительного сокращения структур контрактильных белков за счет энергии АТФ при замораживании, по-видимому, не происходит.
Наблюдаемое при размораживании специфичное окоченение является следствием сокращения, а также результатом агрегационных взаимодействий миофибриллярных белков, а выделение при размораживании сока представляет собой следствие структурных изменений этих белков и связывания их гидрофильных групп.
ИЗМЕНЕНИЕ СВОЙСТВ БЕЛКОВ МЫШЕЧНОЙ ТКАНИ
Разные методы замораживания вызывают различные изменения гидратации и зарядов мышечных белков, характер которых в значительной степени зависит от объема
254
автолитических превращений до замораживания. Наиболее эффективно быстрое 'замораживание горяче-парного мяса для сохранения нативных свойств белков.
Белки саркоплазмы. Акт замораживания не приводит к резким изменениям свойств белков саркоплазмы, при этом не происходит существенных изменений их растворимости.
Размораживание мышц тотчас после замораживания сопровождается неодинаковым повышением экстрагируемое™ белков саркоплазмы у разных видов мышц, что зависит от степени автолиза до замораживания. Агрегационные взаимодействия белков саркоплазмы вызываются повышением кислотности. Это характерно для мышц не-автолизированных перед замораживанием, у которых при размораживании происходят интенсивные гликолитические превращения. В то же время агрегационные превращения ослабляются воздействием гипертонической среды, что более характерно для мышц, автолизированных перед замораживанием.
Важным фактором для извлекаемости белков саркоплазмы в размороженных мышцах является уровень протеолитической активности, который различен для разных видов мышц. У мышц с высоким уровнем протеолитической активности извлекаемость белков саркоплазмы при размораживании значительна.
Извлекаемость белков саркоплазмы понижается при длительном хранении мышц в мороженом виде, поскольку для этого процесса характерны резкие агрегационные взаимодействия. Разные мышцы отличаются интенсивностью таких изменений, а уменьшение извлекаемости более выражено после 2—4 месяцев хранения мяса в мороженом виде.
Неодинакова и извлекаемость отдельных фракций белков саркоплазмы. Более заметным изменениям подвергаются белки фракций миоальбумина и глобулина X. Белки фракций миогеновой группы наиболее устойчивы к воздействиям холодильной обработки мышц.
Белки миофибрилл. Медленное замораживание, хранение мяса в мороженом виде и размораживание вызывают изменение молекулярных структур миофибриллярных белков, что наиболее четко проявляется в резком изменении реактивности их химических групп и ферментативной активности.
255
Наибольшим изменениям в процессе холодильной обработки мяса подвергается миозин. При замораживании мышц экстрагируемость миозина заметно снижается даже при высоком содержании АТФ. Уменьшение извлекаемости миозина в значительной степени происходит за счет межмолекулярного взаимодействия, которому способствует вымораживание воды.
При длительном хранении замороженных мышц происходит дальнейшее (после замораживания) снижение извлекаемости миозина, причем более заметное с увеличением времени хранения. Причиной таких изменений являются, кроме вымораживания воды, также и структурные изменения, способствующие агрегационным взаимодействиям. Экстрагируемость миозина в предварительно автолизированных перед замораживанием мышцах при одинаковом сроке хранения заметно ниже, чем у мышц, замороженных в неавтолизированном виде. Поскольку в автолизированных мышцах фактор окоченения не мог заметно влиять на изменение извлекаемости миозина, то это подтверждает представление о том, что вымораживание воды способствует лучшему контакту белковых частиц, создавая условия для агрегационных взаимодействий.
Длительное хранение мышц в мороженом виде сопровождается такими внутримолекулярными и межмолекулярными взаимодействиями миозина, в результате которых даже после обработки мочевиной реактивность (доступность) сульфгидрильных и дисульфидных групп у этого белка резко понижается.
Экстрагируемость миозина в процессе холодильной обработки мяса у различных видов мышц неодинакова, что объясняется различной степенью агрегационных взаимодействий вследствие не только особенностей структурных изменений, но также и специфичности структуры миофибрилл.
Длительное хранение мяса в мороженом виде связано с глубокими изменениями структур и интенсивными агрегационными взаимодействиями и других миофибрил-лярных белков. При этом происходит резкое уменьшение реактивности кислых и основных групп в белках мышц, более интенсивное для мяса, предварительно автолизированного перед замораживанием.
Характер изменения кислотности среды мяса в пер
256
вую очередь связан с изменением систем небелковой природы. Наряду с этим изменение кислотности в мясе в значительной степени обусловлено также особенностями изменений белков. В период наибольших структурных изменений белков проявляется более высокое связывание водородных ионов и убыль их в среде, что особенно четко наблюдается в процессе хранения мороженого мяса.
Размораживание мяса после хранения в мороженом виде сопровождается дальнейшими агрегационными взаимодействиями миофибриллярных белков, особенно выраженными при длительных сроках хранения. Указан-
Рис. 33. АТФ-азная активность миозина в размороженных после длительного хранения в мороженом виде мышц:
1,2 — крупного рогатого скота, соответственно парных и автолизированных (48 ч при 4° С) перед замораживанием; 3,4 — мышц кур, соответственно белых и красных.
ные изменения вызывают снижение экстрагируемости миозина, а также уплотнение миофибрилл.
Созревание размороженного мяса при сохранении активности протеолитических ферментов значительно ослабляет агрегационные взаимодействия. Увеличивается реактивность кислых и основных групп в белках мышц. Созревание размороженного мяса сопровождается деструктивными изменениями миозина, значительным повышением его экстрагируемости и резким снижением ферментативной активности.
Таким образом, процесс замораживания и размораживания мышц не вызывает больших деформаций моле
257
кул белков, при этом часто происходит повышение ферментной активности. Длительное хранение мяса в мороженом виде обусловливает инактивацию ферментов. Это характерно для большинства ферментов, однако особенно ясно проявляется у миозиновой АТФ-азы (рис. 33).
ОСОБЕННОСТИ ИЗМЕНЕНИЙ СВОЙСТВ МЯСА ПРИ
ХОЛОДИЛЬНОЙ ОБРАБОТКЕ
Водоудерживающая способность весьма специфично изменяется при различных способах холодильной обработки у одних и тех же мышц и зависит от состояния белков.
Замораживание и быстрое размораживание неавтоли-зированных мышц обусловливает более резкое снижение водоудерживающей способности, чем начальные стадии автолиза охлажденного мяса. Такие изменения вызываются интенсивными меж- и внутримолекулярным взаимодействием гидрофильных групп в белках в результате вымораживания воды. Хранение мяса в мороженом виде способствует дальнейшему снижению водоудерживающей способности, она уменьшается тем больше, чем длительнее срок хранения. Если для холодильной обработки берут мясо в состоянии окоченения, обладающее малой водоудерживающей способностью, гидрофильные группы которого уже израсходованы на образование меж- и внутримолекулярных связей, то замораживание и размораживание вызывает сравнительно небольшие изменения водоудерживающей способности.
Характер уменьшения водоудерживающей способности в процессах замораживания и хранения в мороженом виде соответствует изменениям реактивности кислых и основных групп в белках мышц и, в частности, реактивности сульфгидрильных групп в миозине.
Величина уменьшения и последующего нарастания водоудерживающей способности при холодильной обработке зависит от вида мышц. У мышц с глубоким и длительным окоченением наблюдается интенсивное долговременное уменьшение водоудерживающей способности. Оно связано как с характером окоченения вообще, так и со спецификой агрегационных взаимодействий.
Созревание размороженного мяса повышает водоудерживающую способность мышц. Это зависит от со
258
стояния белков, развития агрегационных взаимодействий и сохранения определенного уровня протеолитической активности. Все это в свою очередь обусловлено степенью автолиза перед холодильной обработкой, условиями замораживания и длительностью хранения в мороженом виде.
ОБРАЗОВАНИЕ МЫШЕЧНОГО СОКА ПРИ РАЗМОРАЖИВАНИИ
МЯСА
Часть воды, образующейся при таянии кристаллов льда при размораживании мяса, вследствие нарушения тонких структур миоплазмы,; а также клеточных мембран вновь не может связаться. Поэтому при оттаивании мяса выделяется мясной сок, содержащий различные экстрактивные вещества и растворимые белки. Вместе с тем установлено, что в результате только разрыва оболочки клетки при замораживании и размораживании не освобождается большого количества сока. Удерживание клеточной жидкости в значительной степени зависит от способности мышечных белков связывать свободную жидкость и прежде всего от состояния миофибриллярных белков. Даже небольшие денатурационные изменения в миофибрйллах и дегидратация миозина и актина при замораживании и хранении в замороженном виде обусловливают значительное уменьшение водоудерживающей способности мышечных волокон.
Величина потерь сока и содержание в нем белков при размораживании мяса увеличиваются в зависимости от глубины автолиза до замораживания и продолжительности хранения в мороженом виде. Разрушения клеточных структур в автолизированных мышцах при холодильной обработке более интенсивны, чем в мышцах, не подвергшихся автолизу перед замораживанием. С вытекающим соком в результате «выщелачивания» теряются в основном белки саркоплазмы. Электрофоретические исследования показали значительное сходство протеинограмм экстракта низкой ионной силы и сока, выделяющегося при размораживании мышц. С увеличением продолжительности хранения мышц в мороженом виде при размораживании увеличивается выщелачивание белков, принадлежащих к фракциям миогеновой группы белков, и
259
уменьшается выход белков фракции глобулина X. Кроме того, выявлено повышение содержания в соке малоподвижных высокомолекулярных белков. Последнее может быть следствием агрегации белковых частиц в вытекающем соке.
В мышечном соке содержатся азотистые и безазотис-тые экстрактивные вещества, а также различные минеральные вещества. При размораживании в него переходят и витамины (табл. 43).
ТАБЛИЦА 43
Витамины
Тиамин .............................
Рибофлавин..........................
Ниацин .............................
Витамин Вв..........................
Пантотеновая кислота ...............
Витамин В12 ......................
Фолиевая кислота....................
Потери витаминов с мышечным соком (замораживание ппи—18°С, воздушное медленное размораживание), %
свинина говядина
9,02 12,23
4,15 10,31
10,69 14,61
8,71 9,41
6,95 33,26
5,06 —
— 8,07
Способ размораживания влияет на величину потерь различных веществ с вытекающим соком, однако потери эти зависят прежде всего от условий замораживания и хранения мяса в мороженом виде, от продолжительности автолиза до замораживания. Вредно влияет на качество мяса колебание температуры его хранения в замороженном виде (особенно вторичное замораживание размороженного мяса), приводящее к увеличению повреждения тканей и, следовательно, увеличению потерь белков и различных экстрактивных веществ. Поэтому дважды замороженное мясо после повторного размораживания может быть лишено большого количества растворимых питательных веществ и характеризуется пониженными вкусовыми качествами.
260
ОСОБЕННОСТИ СОЗРЕВАНИЯ РАЗМОРОЖЕННОГО МЯСА
Размягчение размороженных мышц при созревании мяса различных сроков автолиза перед замораживанием неодинаково. Интенсивность ферментативных превращений при созревании размороженного мяса решающим образом определяется глубиной автолитических и деструктивных изменений до замораживания и в процессе холодильной обработки. Если активность ферментов во время длительного хранения мяса в мороженом виде сохранилась в достаточной мере, как при замораживании парного мяса, то характер процесса созревания размороженного мяса во многом аналогичен созреванию немороженого мяса. В размороженном мясе интенсивность гликолитических, амилолитических и, что особенно важно, протеолитических превращений выше, чем в немороженом. Это приводит к улучшению нежности мяса и накоплению продуктов, придающих вкус и аромат. Однако эти превращения развиваются на базе глубоко прошедших агрегационных превращений, особенно белков актомиозинового комплекса, при длительном хранении мороженого мяса. Несмотря на это, созревание размороженного мяса, замороженного без предварительного автолиза, является важным средством повышения его нежности и накопления продуктов, придающих вкус и аромат.
При созревании размороженного мяса, автолизированного перед замораживанием (и особенно находившегося в состоянии окоченения), происходят потери мясного сока, а мясо остается дряблым и вместе с тем жестким. Это объясняется нарушением в процессе предварительного автолиза многих микроструктур и целостности цитоплазматических и клеточных мембран, а также потерей активности ферментов при длительном хранении в мороженом виде, поскольку они до замораживания были высвобождены из «защитных» структур.
При длительном хранении мяса в мороженом виде (свыше 2—4 месяцев) происходит убыль (связывание) таких свободных аминокислот, как глютаминовая кислота, треонин, валин, гистидин, аланин и др., участвующих в образовании вкуса и аромата вареного мяса. Поэтому после длительного хранения мяса в мороженом виде оно теряет характерный вкус созревшего мяса. В процессе
241
созревания размороженного мяса происходит значительное повышение содержания свободных аминокислот. Однако такие изменения характерны для размороженного мяса, замороженного на первой стадии автолиза. При созревании размороженного мяса, подвергшегося предварительному автолизу перед замораживанием, накопление свободных аминокислот сравнительно невелико.
БИОХИМИЧЕСКИЕ
ИЗМЕНЕНИЯ МЯСА ПОД ВЛИЯНИЕМ ХИМИЧЕСКИХ
И ФИЗИЧЕСКИХ ФАКТОРОВ
При переработке мяса и мясопродуктов применяют разнообразные химические вещества и физические методы воздействия, вызывающие изменение физико-химического состояния, а в связи с этим и свойств компонентов тканей и ферментативных процессов в них. В результате сложных своеобразных биохимических изменений в зависимости от свойств используемых химических веществ и условий их применения мясо приобретает специфические органолептические свойства и лучше сохраняется.
Такая обработка влияет на последующую усвояемость продукта, его биологическую ценность.
ИЗМЕНЕНИЯ МЯСА В ПРОЦЕССЕ
ПОСОЛА
Посол — один из старейших способов консервирования, в процессе которого мясо приобретает ряд новых, полезных для производства свойств и своеобразную органолептику. Особо важные изменения, происходящие в мясе в процессе посола, связаны с цветообразованием и другими явлениями, возникающими вследствие разнообразных биохимических превращений, катализируемых тканевыми ферментами мяса и ферментами микроорганизмов.
Этот процесс используется при изготовлении разнообразных колбасных, ветчинных и других мясных изделий. При посоле в мясо в сухом виде или в виде рассола вводят чистую поваренную соль или в комбинации с нитратами, нитритами, иногда сахарами и другими соедине
262
ниями (специями). Посол может продолжаться от 6 ч до 7 суток (краткий) при производстве колбасного мяса и до 60 суток (длительный) при производстве свиного мяса для получения ветчины.
Физико-химические изменения. При посоле ионы поваренной соли и другие компоненты, находящиеся в растворе, начинают перемещаться в глубь мяса. Скорость этого процесса в основном подчиняется диффузионноосмотическим закономерностям, т. е. зависит от концентрации соли и температурных условий, а также от свойств мяса.
В мышечную ткань ионы соли проникают быстрее, чем в жировую и соединительную. При этом в мышечной ткани соль продвигается вдоль волокон по системе микро- и макрокапилляров быстрее, чем осмотическим путем — через мембраны и оболочки, покрывающие волокна и пучки их. В итоге повышается осмотическое давление внутри мышечного волокна, что увеличивает приток воды в него и способствует увеличению набухания мяса.
Наряду с перемещением ионов соли и воды вследствие диффузионно-осмотических процессов в сторону рассола передвигаются химические соединения ткани, растворимые в солевых растворах: белки, экстрактивные вещества и т. п.
Изменение белков. В результате проникновения соли и других веществ в ткани мяса и взаимодействия их с белками изменяется физико-химическое состояние протеинов, обусловливающее основные свойства соленого мяса (набухание, консистенцию, вязкость, пластичность фарша из мяса и пр.).
Физико-химические изменения белков в свою очередь сопровождаются изменением биохимических функциональных свойств ферментов. При невысокой концентрации соли (2—5%) в результате электростатических свойств функциональных групп белков ионы соли окружают эти группы и, притягивая диполи воды, несколько увеличивают гидратацию и растворимость белков. Указанные изменения влияют на увеличение содержания в мясе адсорбционно связанной воды (табл. 44).
Более высокие концентрации соли вначале могут либо растворять некоторые белковые вещества мяса (при наличии влаги — рассол), либо высаливать (другие из них).
263
ТАБЛИЦА 44
Мясо Содержание связанной воды (в % к влаге сырого мяса) при продолжительности посола
до посола 2 ч 2 дня 4 дня 7 дней
Говяжье высшего сорта 14,0 24,8 27,3 35,8 43,0
Говяжье I сорта 15,4 24,7 32,7 41,2 37,9
Свиное нежирное . 17,6 25,0 41,1 41,7 40,3
Часть белков саркоплазмы (главным образом миоген, миоальбумин, миоглобин и при посоле парного мяса, кроме того, миозин) переходит в рассол. У охлажденного и дефростированного мяса растворимость миозина понижена, так как он удерживается в структуре ткани в комплексе с актином.
При непродолжительном (колбасном) посоле белки мяса претерпевают некоторые денатурационные изменения в результате частичного разрыва внутримолекулярных связей между пептидными цепями белков.
Продолжительное воздействие соли (30 суток и выше) при мокром и сухом посоле мяса вызывает более глубокую денатурацию некоторых белков, главным образом глобулинов, и снижение их растворимости. Волокна коллагена при длительном посоле (на 20-й день) набухают в результате внедрения вслед за ионами соли молекул воды между пептидными цепочками белковых молекул, и структура их в значительной степени изменяется.
Удержание актомиозина в структуре миофибрилл ослабляется вследствие внедрения ионов соли и молекул воды. Поэтому, когда мясо, выдержанное в посоле, измельчают в присутствии воды, актомиозин выделяется из структуры мышечных волокон.
Как известно, молекулы актомиозина в растворе легко ассоциируют, образуя непрочные тикстропные структуры. Подобного рода структура возникает в измельченном посоленном мясе (хотя при измельчении далеко не все мышечные волокна разрушаются) в результате частичного перехода актомиозина в растворенное состояние.
264
При этом образуется пластичная студнеобразная масса большой вязкости, адгезии и влагоемкости. Эти качества весьма важны для изготовления колбасных изделий (формирования). После варки такое мясо удерживает больше влаги. Вязкость и пластичность увеличиваются при измельчении мяса до определенного предела, после чего они снижаются в результате денатурационных изменений белков.
В горяче-парном виде из-за высокого значения pH мяса белки находятся в ионизированном состоянии, близ-
Рис. 34. Изменение удержания влаги мясом при набухании и варке (при 70°С):
1 — мясо парное; 2 — мясо охлажденное.
ком к состоянию нативного белка. Благодаря наличию АТФ актин и миозин не связаны между собой. Все это способствует тому, что белки мяса легко гидратируются, набухают, хорошо удерживают влагу и легко переходят в раствор. Поэтому в колбасном производстве парное мясо нет необходимости выдерживать в посоле для улучшения набухания белков.
Для набухания и последующего удержания влаги соленым мясом при варке большое значение имеет величина pH. Искусственный сдвиг реакции среды у охлажденного соленого мяса только на 0,2—0,3 pH ближе к значению реакции среды парного мяса вызывает резкое увеличение гидратации (рис. 34) и влагоудерживающей
265
способности мяса. Однако это касается только соленого, а не свежего мяса.
На практике для сдвига pH мяса на 0,2—0,4 во время измельчения только что посоленного мяса добавляют 0,2—0,3% бикарбоната натрия, благодаря чему увеличивается набухание мяса, его адгезия и влагоудержание.
На набухание мяса существенно влияет состояние белков в структуре ткани. Так, гидратация мяса увеличивается в результате выделения актомиозина или миозина из структуры ткани. Такой процесс может быть быстро осуществлен путем искусственного введения АТФ или неорганического пирофосфата (пластифицирующий эффект) при измельчении мышечной ткани в присутствии соли и воды и сопровождается резким уменьшением вязкости массы (у охлажденного мяса вязкость с 12,8—28,0 снижается до 0,35—1,80 Па-с). На практике хорошие результаты получаются при добавлении к мясу препаратов полифосфатов (пирофосфат натрия, гексаметафосфат, триполифосфат и др.).
Введение большинства полифосфатов сопровождается изменением состояния белков в результате сдвига pH на 0,2—0,3 в сторону нейтральной реакции, а это значительно повышает гидратацию мяса. Кроме того, полифосфаты вызывают диссоциацию актомиозина с освобождением из структуры миозина и увеличением его растворимости. В итоге такое действие фосфатов обусловливает увеличение набухания, адгезии мяса и последующего влаго-удержания при варке мяса.
Недавно показано, что при хранении соленого мяса с пирофосфатом при 4° С через 3 суток происходит полное разрушение фосфата: 50% триполифосфата гидролизуется сразу после его введения в мясо. Этот распад происходит под действием ферментов — пирофосфатазы (пиро-фосфат-фосфогидролаза) и полифосфатазы.
Изменение экстрактивных веществ мяса. Во время посола мяса в рассол диффундируют азотистые и безазо-тистые экстрактивные вещества мышечной ткани, а также минеральные соединения и витамины. Установлено, что потеря таких азотистых экстрактивных веществ, как креатин, карнозин, карнитин и ряд нуклеотидов, мало зависит от крепости рассола и определяется главным образом соотношением рассола и мяса. При этом возможен переход в рассол до 50% экстрактивных веществ.
266
При мокром посоле из минеральных веществ в рассол диффундируют главным образом фосфаты и калий. В результате этого в мясе уже в первые дни посола быстро уменьшается содержание общего (главным образом неорганического) фосфата (табл. 45). В дальнейшем количество его в мясе существенно не изменяется, но вместе с тем наблюдается значительное уменьшение (почти в 3 раза) количества органических фосфорных соединений, экстрагируемых из мяса солевым раствором (гек-созо- и триозофосфаты, мононуклеотиды). Одновременно с этим наблюдается деструкция органических фосфорных соединений, перешедших в рассол. Возможно, что эти изменения органических фосфорных соединений являются следствием биохимических превращений.
ТАБЛИЦА 45
Фосфор Содержание фосфора (в % Р2О8) в мясе
охлажденном после посола через
10 дней 20 дней 30 дней
Общий Too 82,8 81,8 82,5
В рассоле 3,7 3,3 2,7
органический —
неорганический .... — 13,8 14,9 14,8
Извлекаемый из мяса
органический 26,0 13,4 14,9 9,6
неорганический .... 54,4 50,2 51,8 56,5
Неизвлекаемый из мяса . . 19,0 16,8 14,7 12,3
В мясе и в рассоле уменьшается содержание органических фосфорных соединений (фосфолипиды, нуклеопротеиды и др.) и возрастает фракция неорганического фосфора.
Изменение процесса автолиза. В результате воздействия компонентов посолочных смесей на белковые вещества и другие соединения мышечной ткани и изменения физико-химических условий среды ферментативные автолитические процессы существенно нарушаются, но не прекращаются. Так, при посоле горяче-парного мяса (NaCl и нитрат) тормозятся процессы гликолитического распада. В целом распад гликогена и накопление лакта-
267
та снижается на 20%. Вместе с тем резко усиливается накопление редуцирующих веществ, связанных с интенсивным амилолитическим распадом гликогена в начале посола вследствие активации амилазы хлористым натрием. В результате торможения процессов гликогенолиза реакция среды мышечной ткани сдвигается в кислую сторону менее резко, чем при обычном автолизе.
Химические соединения, вводимые в мясо, ингибируют гликолитические и другие ферменты; исключение составляют липолитические. Поваренная соль в концентрации 2—3% оказывает тормозящее действие на ферментную активность миозина. Высокие концентрации нитрата полностью ингибируют фермент. Вследствие ингибирования миозина и торможения распада АТФ уменьшается накопление органического фосфата при автолизе соленого парного мяса. И нитрит, и продукт его превращения — гидроксиамин — ингибируют каталазу.
При посоле охлажденного или дефростированного мяса изменения в углеводной системе и в содержании молочной кислоты не существенны, так как главные изменения уже свершились при автолизе до посола.
При длительном сухом посоле свиного мяса (окороков) в результате ферментативного протеолиза увеличивается содержание растворимых белков и накапливается остаточный азот.
Последовательное изучение изменения содержания свободных аминокислот при продолжительном сухом посоле окороков (24 недели) показало значительное увеличение и суммы (по нингидриновому индексу) и большинства индивидуальных аминокислот. Содержание серина, глютаминовой кислоты, треонина, лейцина, изолейцина, фенилаланина, пролина возросло примерно в 3 раза. Концентрация тирозина, аланина, глицина и гистидина повысилась почти в 2 раза. Уровень метионина, триптофана, таурина, аргинина, карнозина, орнитина, лизина, аспарагиновой кислоты сохранился. Все это подтверждает важную роль катепсинов в процессе созревания ветчины.
При мокром посоле мяса процесс протеолиза также происходит. Однако при этом большее значение приобретает развитие специфической микрофлоры, вызывающей своеобразные биохимические превращения его составных частей. Продукты этих превращений влияют на свойства
268
цяса. Отмеченное выше перераспределение ионов и экстрактивных веществ, несомненно, оказывает соответствующее влияние на течение биохимических процессов в системе.
Большое влияние на процессы, происходящие при посоле, оказывает pH, а также окислительно-восстановительный потенциал рассола. Величина pH свежего рассола обычно 6,0—7,0. Сдвиг реакции среды в более кислую сторону встречается редко, чаще наблюдается нежелательное отклонение pH в щелочную сторону под влиянием микрофлоры, вызывающей распад белков с накоплением оснований, что приводит к порче рассола. В результате развития микрофлоры, окисляющей молочную кислоту, понижается окислительно-восстановительный потенциал и наблюдается нежелательное избыточное разрушение нитратов и нитритов. В случае мокрого посола мяса при низких температурах под действием ферментов микроорганизмов очень незначительная часть белков, перешедших в рассол, распадается до полипептидов, аминокислот и продуктов их деструкции.
Образование специфической окраски. Одним из основных биохимических процессов при посоле мяса для изготовления колбасных и ветчинных изделий являются процессы, связанные с образованием и стабилизацией окраски мяса, обусловленные превращением его пигмента — белка миоглобина (Mb).
При посоле мяса миоглобин или оксимиоглобин (МЬО2) в присутствии поваренной соли окисляется и переходит в метмиоглобин (Met. Mb), который придает мясу коричнево-бурую окраску. После варки соленое мясо окрашено в серовато-коричневый цвет, так как в результате распада миоглобина, оксимиоглобина и метмио-глобина при тепловой денатурации образуется коричневый пигмент — гемохромоген.
Чтобы окраска соленого сырого и вареного мяса была розовато-красной, к рассолу или в посолочную смесь добавляют нитраты и нитриты. В мясе они подвергаются следующим последовательным превращениям:
Восстановительные условия
NaNO3--------------------► NaNO2
Кислая среда
NaNOa--------------------> HONO
269
Восстановительные условия
HONO ----------------► NO
NO + Mb------------------> NOMb
При наличии редуцирующих условий нитраты (NaNOg и KNOg) восстанавливаются до нитритов, В слабокислой среде (pH 6,5—5,5), характерной для мяса, нитриты под действием ферментов тканевых и микроорганизмов (денитрифицирующих), восстанавливаются с образованием окиси азота. Более кислая реакция среды (pH ниже 5,5) способствует слишком быстрому распаду нитритов и потере окислов азота в результате улетучивания.
Окислы азота, возникшие вследствие распада нитритов, связываются с железом гема в молекуле миоглобина или гемоглобина, образуя NO-миоглобин (нитрозомиоглобин) или NO-гемоглобин. Нитрозомиоглобин придает мясу розово-красную окраску. Красный цвет сохраняется и у вареного мяса, так как в результате тепловой денатурации нитрозомиоглобин превращается в денатуриро
Рис. 35. Схема образования производных миоглобина.
270
ванный глобин и NO-гемохромоген — пигмент также розово-красного цвета. Оптимальная среда для образования NOMb при pH 5,6.
Превращение миоглобина в оксимиоглобин, метмиоглобин и нитрозомиоглобин сопровождается изменением спектра поглощения раствора этих белков.
Процесс образования NO-миоглобина при посоле протекает значительно сложнее, с образованием промежуточных продуктов (рис. 35). В условиях слабокислой среды нитрит непосредственно взаимодействует с оксимиоглобином и в присутствии кислорода воздуха возникает не NO-миоглобин, а метмиоглобин
NO2 2МЬО2-------> NOg -f- Mb2O2 -р Vs О2
Нитрит Нитрат Метмиоглобин
Кроме того, при экспозиции NO-миоглобина в присутствии кислорода возможна следующая реакция:
Oa+NOMb-------> MetMb-f-NOS,
т. е. образование метмиоглобина. Эта реакция ускоряется в присутствии света и при низком pH. Поэтому при измельчении соленое мясо приобретает коричнево-серый цвет. В отсутствии кислорода (в глубине мяса) нитрит реагирует с Mb и порождает эквивалентное количество метмиоглобина и NO-миоглобина. Показано, что метмиоглобин в растворе в присутствии NO в анаэробных условиях может переходить в новое своеобразное соединение нитрозометмиоглобин с характерным спектром поглощения.
Таким образом, в результате указанных реакций возникает значительное количество метмиоглобина, что мешает образованию NO-миоглобина и поэтому процесс восстановления метмиоглобина при посоле мяса имеет существенное значение. Это возможно в результате взаимодействия протеида с некоторыми соединениями при участии тканевых ферментов. В качестве возможного субстрата-донатора электронов были проверены промежуточные продукты гликолиза, трикарбонового цикла и др. Эффективная роль, как было обнаружено, принадлежит при этом фосфату глицеринового альдегида и фруктозо-6-фос-фату. Восстановление метмиоглобина происходит при помощи НАД. Важное значение в транспорте электронов
271
принадлежит также диафоразе, хинонам (рис. 36), дегидрогеназе янтарной кислоты и др.
Установлено, что в тканях восстановление нитрита в окись азота протекает при действии митохондрий, т. е. в этом случае нитрит вместо кислорода замыкает дыхательную цепь. Показана также возможность непосредствен-
Продукты гшт
Другие
Продукты цикла трикарВонооых кислот
Рис. 36. Схема возможного пути переноса электронов и роль отдельных соединений в восстановлении метмиоглобина в ткани.
ного восстановления этой системой метмиоглобина в нитрозомиоглобин.
В модельных опытах на мясе было найдено, что при посоле происходит одновременное снижение содержания SH-групп и нитрита в результате их взаимодействия. Эти же опыты с низкомолекулярными тиолами (цистеин, глютатион) показали, что указанные соединения, реагируя с нитритом, дают нитрозотиолы с характерным спектром поглощения. По-видимому, подобные продукты возникают и в мясе, но влияния их на развитие окраски нельзя считать существенными.
272
Метмиоглобин частично восстанавливается в NO-мио-глобин во время последующего постепенного нагрева (обжарка, варка) соленого мяса, колбасного фарша. Образование NO-миоглобина в этом случае является результатом суммарного действия редуцирующих веществ и каталитического действия особого фермента нитритредуктазы, ускоряющего превращение нитритов в окись азота.
Применяя нитриты для посола (нитрит — ядовитый продукт), исходят из минимального количества его, которое необходимо для создания нормальной окраски продукта. Эмпирическим путем работами ВНИИМПа установлено, что эта минимальная доза составляет 5 мг на 100 г мяса.
Расход нитрита при посоле зависит не только от количества миоглобина (при этом NO расходуется не только на прямое образование NO-миоглобина, но и на побочные реакции — образование метмиоглобина и др.), но и от реакции среды, окислительно-восстановительного потенциала, активности ферментов мяса, обсемененности и состава микрофлоры и т. п. Например, чем ниже pH ткани и окислительно-восстановительный потенциал, тем больше расходуется нитрит.
Разнообразные превращения нитритов в мясе при посоле в конечном итоге сопровождаются значительным их разрушением, поэтому при изготовлении колбасных изделий свободного нитрата остается 45—25% по отношению к введенному количеству его.
Для образования NO — Mb используется 6—9% NO (от суммы введенного нитрита); в виде остаточного нитрита в саркоплазме удерживается 21—27% NO, а 4— 8% NO оказывается тесно связанным с актомиозином.
Для создания восстановительных условий в целях лучшего прокрашивания мяса, более полного использования NO применяют сахара (0,3—0,5%). Сами сахара, даже редуцирующие (глюкоза, мальтоза), не создают достаточных восстановительных условий, однако продукты промежуточного анаэробного распада их, образующиеся под действием ферментов бактерий, обладают значительным редуцирующим действием. Кроме того, такая ферментация сахара способствует поддержанию оптимального значения pH (в результате образования молочной кислоты) и окислительно-восстановительного потенциала.
Чг 11—454
273
Некоторые исследователи считают, что сахара и продукты их распада защищают NO-миоглобин и NO-гемохромоген от окисления.
Для посола используют сахарозу или глюкозу, но последняя быстрее вовлекается в окислительные превращения, поэтому применяется только при кратковременном посоле. В случае продолжительного посола применяют сахарозу. В присутствии сахара и нитрита развитие микроорганизмов принимает иногда нежелательное своеобразное направление. При этом наряду с окислами азота из нитритов образуются NH3 и гидроксиламин
- о -о + н2о
O=N—ОН------------ O=N-H-----------> H2N—ОН
Азотистая Азотноватистая Гидроксиламин
кислота кислота
Гидроксиламин (обнаружен в небольшом количестве в рассолах) влияет на дальнейшее направление биохимических превращений в тканях мяса, например он ингиби-
Рис. 37. Кривые поглощения, иллюстрирующие процесс превращения нитрозогемоглобина в метгемоглобин при окислении:
/ — нитрозогемоглобин перед окислением (pH 7,2); 2 — нитрозогемоглобин после окисления; 3 — метгемоглобин (pH 7,2).
рует каталазу. Гидроксиламин характеризуется большей реакционной активностью и легко вступает во взаимодействие с рядом веществ, в частности с карбонильными соединениями (образуются при окислении сахаров, жиров), давая новые продукты типа оснований.
Нитрозомиоглобин, находящийся в соленом сыром мясе, или нитрозогемохромоген, содержащийся в соленом
274
вареном мясе, т. е. в готовом изделии, при хранении в присутствии кислорода воздуха претерпевает изменения, сопровождающиеся нежелательным частичным или полным обесцвечиванием продукта. Обесцвечивание ускоряется при повышении температуры (15—20°С), под действием света и микрофлоры. Нитрозомиоглобин при этом переходит в метмиоглобин. На модельном опыте показано превращение NO-гемоглобина в метмиоглобин (рис. 37).
Нитрозогемохромоген в чистых растворах также весьма нестоек, но в мясе он устойчивее NO-миоглобина. При хранении готовых изделий все же возможно частичное обесцвечивание продукта в результате окисления NO-гемохромогена. При хранении сваренных соленых мясных изделий иногда появляется зеленая окраска, обусловленная образованием сульфмиоглобина в результате взаимодействия миоглобина с сероводородом или окислительными превращениями миоглобина, вызванными разрывом порфиринового кольца.
Для улучшения и сохранения окраски готовых продуктов при посоле применяют некоторые антиокислители, например аскорбиновую кислоту (обычно применяется ее натриевая соль — аскорбинат натрия), которая является сильным восстановителем. Аскорбинат легко взаимодействует с кислородом воздуха, поэтому введенная в ткань кислота в значительной мере защищает пигменты от окисления, поглощая кислород. При взаимодействии аскорбиновой кислоты (при высокой концентрации) и оксимиоглобина наблюдается дегидрирование аскорбината с переходом протонов на протеид и образование нестабильной гидроперекиси миоглобина, которая может затем распадаться на холеглобин и метмиоглобин
+ Аскорбиновая кислота
пМЬО2--------------------- Н2ОаМЬ 4- Дегидроаскорбиновая
/ I кислота
n/2 MetMb |
I
п/2 Холеглобин
Метмиоглобин, взаимодействуя с аскорбиновой кислотой, восстанавливается в миоглобин, который в присутствии кислорода превращается в оксимиоглобин
l/sll* 275
4- Аскорбиновая кислота
MetMb-------------------- Mb + Дегидроаскорбиновая кислота
1°«
мьо2
Нитрит натрия, взаимодействуя с аскорбиновой кислотой, восстанавливается до окиси азота
С6Н8Ов + 2HONO------- 2NO + 2НаО + С6НвОв.
Поэтому при посоле мяса с применением аскорбиновой кислоты ускоряется образование NO-миоглобина.
Как уже отмечалось, при посоле возможно образование метмиоглобина. Однако с применением аскорбината создаются восстановительные условия, способствующие прямому образованию NO-миоглобина. Это показано спектральными кривыми, полученными на модельных опытах с гемоглобином (рис. 38). Применение аскорбиновой кислоты при нитритном посоле ускоряет процесс цве-тообразования и стабилизирует окраску в процессе хранения готовых изделий.
Рис. 38. Действие аскорбиновой кислоты на раствор оксигемоглобина:
/—оксигемоглобин; 2 — оксигемоглобин + 0»02% NaNOa+0,1% аскорбиновой кислоты (типичный спектр нитрозогемоглобина); 3 — смесь оксигемогло-бина+0,02% NaNCh (спектр метмиоглобина); 4 — оксигемоглобин + 0,1% аскорбиновой кислоты (раствор зеленовато-коричневого цвета), смесь метгемоглобина и холеглобина.
276
Окислительные и гидролитические изменения жиров. При сухом, а отчасти и при мокром посоле мяса, особенно свиного, в присутствии кислорода воздуха частично развиваются процессы автокисления жира, в основном в поверхностные слоях. Благодаря наличию высокоактивных катализаторов главным образом биохимического происхождения (цитохромов, гемоглобина, NO-миоглобина, NO-гемохромогена), а также в присутствии солей, нитратов, нитритов и микрофлоры в этот процесс вовлекаются ненасыщенные жирные кислоты. В результате окисления жира образуются перекиси и карбонильные соединения.
При посоле мяса в производстве колбас обнаружено увеличение ТБЧ (см. с. 165). Резко возрастало ТБЧ в момент образования окрашенных продуктов (нитрозопигмента), что связано, по-видимому, с появлением летучих соединений, реагирующих с 2-ТБК- Величина ТБЧ может зависеть от присутствия нитрита в системе. Добавление последнего вызывает в начале снижение величины ТБЧ, а затем при посоле она может возрастать.
Имеющаяся в тканях липаза не только не ингибируется компонентами посола, но, наоборот, активируется ионами хлооистого натрия и в зависимости от температурных условий может заметно катализировать гидролиз жиров и выделение свободных жирных кислот. Количество перекисей и кислот в соленом мясе обычно увеличивается во время последующего копчения или созревания при комнатной температуре.
Изменение вкуса или аромата. В результате разнообразных, еще недостаточно изученных биохимических процессов, протекающих при автолизе соленого мяса, а также вследствие бактериальной деятельности органолептические свойства мяса изменяются, что сопровождается появлением вкуса и аромата соленого мяса. Особенно заметен специфический вкус и аромат при длительном посоле свиного мяса, получивший название «ветчин-ность».
Ветчинный запах появляется после варки соленого евиного мяса. Вещества, являющиеся источником этого запаха, извлекаются при водной экстракции соленой свинины. Максимальный аромат свойственен фракции, высаливающейся сернокислым аммонием в концентрации 50—60%. В создание вкуса и аромата при посоле свиного
10—454
277
мяса вовлекаются аминокислоты, переходящие в рассол (гистидин, глютаминовая кислота, аланин, серин, таурин, валин, метионин), а также NO-миоглобин. Эти соединения в результате биохимических превращений образуют компоненты, участвующие в формировании вкуса и аромата продукта.
К числу веществ, участвующих в создании аромата и вкуса ветчинности, относятся летучие соединения (содержатся в малых количествах). Они могут быть продуктами окислительной деструкции жиров, углеводов и других веществ (аминокислот и азотистых экстрактивных веществ). Относятся они к классам летучих жирных кислот, карбонильных или серусодержащих соединений, аминов и др.
Так, при ветчинном посоле было обнаружено накопление летучих оснований и альдегидов. Установлено накопление в беконных рассолах (мокрый посол) ацетил-метилкарбинола (ацетоин) (СН3СОСНОНСН3), который образуется в результате ферментации сахаров. При окислении ацетилметилкарбинола
— 2Н
СН3СОСНОНСН3------► СН3СОСОСН8
получается диацетил (СН3СО—СО—СН3) — соединение, обусловливающее натуральный запах !сливочного масла, который выявляется и в других естественных продуктах, например иногда при посоле говяжьего мяса.
При посоле окороков обнаружено изменение в соотношении ряда карбонильных соединений — уменьшение высокомолекулярной фракции и нарастание содержания низкомолекулярных соединений. В преобладающем количестве выявлено присутствие ацетальдегида, ацетона, пропионового альдегида. Увеличивается и содержание летучих кислот по мере нарастания срока посола окороков.
В создании аромата и вкуса соленого мяса принимают участие тканевые ферменты и, по-видимому, ферменты микпоорганизмов. Так, образование ацетилметилкаобино-ла связано с деятельностью Bacillus subtilis, Bacterium Halobicus, Micrococcus lipoliticus и др. В последнее время выделены чистые бактериальные культуры, которые при посоле вводят в мясо для улучшения вкуса и аромата готового посоленного продукта.
278
Изучение динамики развития отдельных форм микроорганизмов (лактобактерии, микрококки, педиакокки и др.) и динамики свободных аминокислот в течение 46-суточного созревания сырокопченых колбас показало интенсивное накопление аминокислот в первые 6 суток и меньший рост их содержания в последующий период. Сопоставление интенсивности развития микрофлоры и увеличения содержания аминокислот дает основание утверждать, что основная роль в накоплении последних принадлежит катепсинам ткани.
Применение сахаров при посоле способствует получению более вкусного и нежного продукта. Это объясняется тем, что сахара смягчают вкус соли и в то же время являются основным продуктом для развития специфической микрофлоры. В результате действия микрофлоры образуется ряд продуктов промежуточного и конечного окислительного распада гексоз, которые, возможно, участвуют в создании особого вкуса и аромата соленого мяса. Увеличение количества вводимого сахара (свыше 2%) может вызвать нежелательное развитие микрофлоры, что приведет к накоплению избыточного количества кислот и порче продукта (закисание).
Отмеченный ранее факт накопления аминокислот при длительном посоле окороков, а также присутствие сахаров имеет большое значение в образовании летучих компонентов, возникающих в продукте при нагревании в результате активации реакции Майара, о чем будет сказано ниже.
Биологическая оценка процесса посола. Происходящая в процессе посола небольшая деструкция части белков с выделением свободных аминокислот и последующим окислением последних обусловливает формирование вкуса и аромата мяса. Хотя подобная деструкция и приводит к незначительной утрате содержания части аминокислот, ее нельзя рассматривать как отрицательное явление. То же относится и к большому снижению содержания некоторых ненасыщенных жирных кислот из фракции липидов.
Вместе с тем происходящее при посоле мяса снижение содержания некоторых водорастворимых витаминов — тиамина до 28%, фолиевой кислоты до 35% (потери рибофлавина незначительны, а ниацин сохраняется полностью, так как находится в структуре ткани в связан
10*
279
ном состоянии) :— йельзй расценивать как положительный фактор.
Все изложенное, не вызывая отрицательной оценки процесса посола, свидетельствует о необходимости изыскания путей для снижения или компенсации отмеченных потерь. Иное значение имеет вопрос о роли отдельных ингредиентов, применяемых в процессе посола. В последние годы большое внимание уделяется изучению взаимодействия нитритов и нитратов с другими компонентами тканей, а также реакции организма (реципиента) в целом на поступление этих соединений с колбасными изделиями в качестве пищевых продуктов. При существовавшей до сих пор норме нитрита 10 мг на 100 г мяса при посоле в готовых изделиях было обнаружено содержание нитрита от 1 до 21 мг%. Интересно отметить, что наибольшее содержание нитрита было найдено в свиных сардельках (до 18 мг%) и в зельце красном (до 21 мг%). Увеличение содержания нитрита в готовом продукте по сравнению с исходным сырьем объясняется, по-видимому, тем, что для подготовки отдельных видов сырья использовалась селитра, которая могла в процессе изготовления послужить источником накопления нитрита.
При интенсивном кормлении подопытных животных колбасными изделиями было обнаружено, как следствие влияния нитритов, некоторое уменьшение усвоения липидов и белков, торможение активности панкреатической липазы, щелочной фосфатазы, энтерокиназы. В крови таких животных увеличивалось содержание метгемоглобина, что несколько снижало дыхательные функции ее. Если сам по себе нитрат в этом отношении не опасен, то, поступая в кишечник, он с помощью микрофлоры восстанавливается до нитрита и, следовательно, может быть причиной токсических явлений. В колбасных изделиях обнаружен и гидроксиламин, обладающий также способностью стимуляции метгемоглобинообразования.
Хотя образование небольшого количества метгемоглобина под влиянием нитритов не оказывает вредного влияния на здоровый организм, тем не менее отмеченное явление нежелательно.
В результате сложных превращений нитритов в мясе установлена возможность появления нитрозаминов. Некоторые из них, например, диметил- и диэтилнитрозами-ны являются не безвредными для организма. В этом же
280
аспекте заслуживает внимания и изучение возникающих при посоле нитрозотиолов.
Все эти факты, несмотря на данные многих исследователей, установивших, что нитраты способствуют процессам образования вкуса и аромата в производстве колбасных изделий, заставляют снижать нормы применения нитритов, исключить нитрат из процесса производства и стимулировать поиски других способов стабилизации окраски колбасных и ветчинных изделий.
Добавление полифосфатов в колбасные изделия, по-видимому, менее опасно, так как помимо деструкции их в мясе другие нежелательные последствия пока еще не выявлены.
Применение такого, казалось бы, безвредного, естественного продукта, как глютаминат натрия, широко используемого во многих странах в качестве вкусовой добавки в производстве мясных и других изделий, не всегда безопасно. Использование его в повышенных количествах в пищевом рационе, например в размере разовой дозы 1,5 г или 25 мг при введении в кровь, вызывает ряд, хотя и кратковременных, но ощутимых нарушений в состоянии человека.
ПРЕВРАЩЕНИЯ КОМПОНЕНТОВ МЯСА ПРИ КОПЧЕНИИ
Копчение является одним из способов консервирования продуктов, а также особым технологическим приемом для придания своеобразного вкуса и аромата готовым пищевым изделиям.
При копчении мясопродукты обрабатывают летучими веществами (дымом), образующимся при неполном сгорании древесины. Дым — это смесь мельчайших твердых и жидких частиц, взвешенных в газовой среде. В настоящее время применяется ряд способов копчения: сухой, мокрый, холодный, горячий, электрокопчение и др.
Под действием разнообразных химических соединений (их насчитывается около 200) и тепла, обычно используемого в процессе копчения, происходят сложные взаимно связанные химические, физико-химические и биохимические изменения компонентов пищевых продуктов, в результате которых готовые изделия приобретают харак
281
терные для них плотность, органолептические и пищевые свойства.
Помимо свойств исходного продукта, качество готовых изделий зависит от состава летучих веществ, температуры и продолжительности копчения.
В составе коптильных газов обнаружены следующие основные вещества: жирные кислоты — уксусная, пропионовая, муравьиная, капроновая; спирты—метиловый, амиловый, изоамиловый, бутиловый, изобутиловый; альдегиды и кетоны — формальдегид, ацетальдегид, диацетил, фурфурол, ацетон; фенолы (их выделено около 20) —фенол (карболовая кислота), о-, м-, н-крезолы, толуол, ксилол, пирокатехин и т. д. Кроме того, в дыме содержатся смолистые вещества и следы углеводородов. Соотношение перечисленных веществ может резко меняться в зависимости от вида древесного материала и режима горения. Большое значение для качества дыма имеет группа фенолов и смолистых веществ.
Биохимические изменения, происходящие в процессе копчения, обусловлены значительным обезвоживанием, т. е. подсушиванием продукта. Это-необходимо для получения характерных органолептических свойств и лучшей сохранности продукта.
В процессе копчения некоторые летучие вещества коптильных газов осаждаются на поверхности, а другие проникают внутрь продукта, постепенно диффундируя во время копчения и последующей сушки.
В коптильных газах содержится значительное количество летучих органических кислот, подкисляющих продукт (pH снижается с 6,34—5,79 до 5,87—5,29).
Биохимические изменения компонентов мяса зависят от того, что вещества, поступающие в продукт при копчении (альдегиды и др.), сорбируются или взаимодействуют с функциональными группами белков и с другими химическими соединениями. Например, формальдегид реагирует со свободными аминными группами пептидных цепочек белков, образуя в конечном итоге моно- и диме-тильные соединения: R—NHCH2OH или RN(CH2OH)2. Взаимодействуя с двумя аминогруппами двух пептидных цепей, формальдегид образует между ними метиленовые мостики R—NH—СН2—HN—R. Аналогично действуют другие альдегиды и кетоны. По своему характеру действие их похоже на процесс дубления. Дубящее действие
282
оказывают также фенолы, характеризующиеся полифунк-циональНыми свойствами.
Копчение мяса при высокой температуре (40—90°С) сопровождается частичной тепловой денатурацией белков и освобождением скрытых функциональных групп (SH, карбоксильных, амино, окси и др.), которые могут вступать во взаимодействие с летучими продуктами коптильных газов. В результате всех перечисленных процессов происходит необратимая дегидратация, коагуляция части белков саркоплазмы и миофибрилл, в связи с чем уменьшается влагоудерживающая способность ткани, продукт лучше обезвоживается и уплотняется.
Наиболее резко при копчении изменяется коллаген, входящий в структуру мяса, оболочек колбасных изделий и кожи, покрывающей свинокопчености. Коллагеновые волокна в результате термического воздействия претерпевают денатурационные изменения — сваривание и частичный гидролиз. Водородные связи разрываются и освобождаются функциональные группы, вступающие в реакции с химическими веществами коптильных газов. Происходят превращения, связанные с дублением коллагена. Коллаген оболочек в этом случае до некоторой степени играет защитную роль, связывая ряд активных веществ и препятствуя их глубокому проникновению внутрь продукта.
Поверхность копченого продукта приобретает характерный коричневый цвет, что связано с окислительными изменениями фенолов, фурфурола и смол (по-видимому, полифенолы), осаждающихся на поверхности оболочки.
Во время копчения в соленом мясе происходит ряд биохимических процессов. На первой стадии в зависимости от режима (до 40—50°С) ускоряются реакции, катализируемые ферментами микроорганизмов, — протеолиз, липолиз, денитрификация и др.; многие ферменты мяса ингибированы при посоле. По мере повышения температуры внутри продукта постепенно развивается денатурация белков и инактивация ферментов.
В результате денатурации освобождаются скрытые функциональные группы белков, в частности — SH-rpyn-пы, обладающие редуцирующими свойствами. Вначале под влиянием бактерий, а затем в связи с накоплением редуцирующих соединений, а также ввиду диффузии редуцирующих веществ, являющихся продуктами копчения,
283
из нитритов освобождаются окисли азота. Вследствие происшедших изменений во время горячего копчения увеличивается интенсивность окраски мяса.
Оксимиоглобин при нагревании мяса теряет адсорб-ционно связанный кислород (последний вовлекается в окислительные превращения) и переходит в миоглобин, а затем в результате взаимодействия с NO превращается в NO-миоглобин. Под действием высокой температуры последний подвергается деструкции с образованием NO-re-мохромогена, сообщающего розово-красную окраску копченому соленому мясу.
При холодном копчении (18—23°С) изменения миоглобина способствуют появлению вишнево-красной окраски, так как в результате неполного сгорания углерода возможно появление СО и образование СО-миоглобина, окрашенного в вишневый цвет.
Продолжительное холодное копчение сопровождается более глубокой ферментацией — протеолизом мышечной ткани; структура ткани, особенно ядер (происходит их гомогенизация), теряется, консистенция мяса становится мягче, нежнее.
Жиры, содержащиеся в мясопродуктах, в процессе копчения активно сорбируют ряд летучих продуктов копчения — карбонильные соединения и фенолы (количество фенола может достигать 15,4 мг°/о). В результате антиокислительного действия Фенолов в жирах тормозятся окислительные процессы. Сильным антиокислитель-ным действием обладают метиловые эфиры пирогаллола и.его гомологов. Во время копчения продукт приобретает специфический вкус и аромат, что в значительной мере связано с накоплением летучих веществ: органических кислот, альдегидов, фенолов и др.
Степень прокопченности характеризуется фенольным числом '. Запах копченостей в значительной мере обусловлен отдельными фракциями фенолов, например эйгено-лом (входит также в эфирные масла гвоздики), и некоторых карбонилов, например ванилином, диацетилом и т. п. В придании особого вкуса копченостям участвуют фенолы, кислоты и прочие соединения.
В процессе копчения мясопродуктов теряется некото-
1 Содержание миллиграммов фенолов в 100 г продукта,
2S4
рое Количество витаминов — 15—20% тиамина, рибофлавин, ниацин.
Биологическая оценка копченых продуктов. Основным требованием, предъявляемым к консервирующим средствам, в частности к коптильным агентам, является их совершенная безвредность для организма человека и отсутствие угнетающего действия на пищеварительные ферменты.
Некоторые химические соединения коптильных газов, например органические кислоты, карбонилы, (ацетон, ацетальдегид и др.), в том количестве, в котором они накапливаются в копченых продуктах, безвредны для организма человека. В то же время накопление формальдегида нежелательно, так как в процессе пищеварения под действием НС1 формальдегид освобождается из связанного состояния и может воздействовать на белковую структуру пищеварительных ферментов, снижая их активность. Формальдегид даже в очень незначительном количестве (меньше 0,001 %)—сильный ингибитор тиоловых ферментов.
Фенолы, содержащиеся в копченых продуктах (фенол, крезол и др.), также не являются индифферентными для человека соединениями и обезвреживаются в печени. Поэтому накопление в жировой ткани значительных количеств фенолов вряд ли можно считать благоприятным для биологической оценки продукта.
Даже небольшое количество 3,4-бензпирена, входящего иногда в состав коптильного дыма (при неправильном ведении процесса), недопустимо, так как это вещество оказывает канцерогенное действие. Поступление канцеро-j генных соединений даже в ничтожных количествах, не [ вызывающих отклонений от нормы, повышает восприим-I' чивость организма к последующему (возможно суммированному) воздействию подобных соединений. Бензойная кислота, близкая по строению к фенолам, нередко приме-Iнемая в качестве консерванта пищевых продуктов збнаружена и в продуктах копчения), способна специфи-ески ингибировать действие пепсина. Из приведенных анных очевидно, что количество фенолов и ряд других еществ в копченых продуктах должно быть сведено до минимума.
Целесообразно применять такие способы копчения, при которых образование и накопление нежелательных
285
веществ в копченых продуктах не превышало бы допустимых величин. Поэтому сухое копчение или электрокопчение имеет преимущества перед мокрым (продукт погружается в коптильную жидкость, что увеличивает возможность проникновения коптильных агентов внутрь продукта) и тем более перед копчением, основанном на введении коптильных агентов непосредственно в толщу пищевого продукта. Целесообразно продукты, подлежащие копчению, защищать покрытиями (колбасные оболочки, кожа), с тем, чтобы летучие ароматические и другие вещества коптильного дыма по возможности сорбировались на оболочке, а не на поверхности продукта.
Канцерогенно действующие вещества 3,-4-бензпирен и 1,-2,-5,-6-фенантрацен образуются из лигнина при температуре свыше 350°С. Имеются способы, позволяющие устранять канцерогены из дыма. Они основаны на том, что эти вещества нерастворимы в воде. На этом основано фракционирование компонентов дыма путем последовательной конденсации и дистилляции.
Дальнейшее совершенствование способов копчения с точки зрения повышения пищевых достоинств и биологической ценности продукта должно идти по пути использования искусственных или очищенных естественных коптильных смесей, содержащих наименьшее количество химических веществ, нежелательных для здоровья человека, применения связанных фенолов (типа фенилсерная, фенилглюкуроновая кислота и т. п.) и других веществ, имитирующих аромат и вкус коптильных агентов.
ИЗМЕНЕНИЯ КОМПОНЕНТОВ МЯСА ПРИ ТЕПЛОВОМ ВОЗДЕЙСТВИИ
При нагревании (варка, жаренье, пастеризация, консервирование и т. п.) в мясе происходят - специфические физико-химические превращения его компонентов и изменение их биологических свойств. Глубина этих сдвигов зависит от продолжительности теплового воздействия. В результате тепловой обработки мясо приобретает новые характерные вкусовые, ароматические качества, плотную консистенцию, становится более стойким при хранении и обычно лучше усваивается.
286
При этом в зависимости от вида обработки может происходить изменение его биологической ценности.
Изменение белков. Наиболее характерным и основным изменением белков всех тканей при нагревании является денатурация — изменение природных свойств белков. Она представляет собой комплекс явлений и может возникать в результате воздействия физических, химических и биологических факторов. В основе денатурации белков лежит нарушение упорядоченного расположения полипеп-тидных цепей во вторичной, третичной структуре молекулы (под действием различных факторов) в результате разрыва некоторых внутримолекулярных связей. Белки, подвергшиеся денатурации, а затем и агрегации обычно хуже растворяются, увеличивается их отрицательное оптическое вращение, теряется способность к кристаллизации, утрачиваются биологические свойства.
Тепловая энергия расходуется на нарушение структуры молекулы. Энергию активации, необходимую для разрыва связей, существующих между звеньями полипептид-ных цепей, измеряют температурным коэффициентом денатурации, составляющим 100—150 ккал/моль. При этом энергия может тратиться на разрыв малого количества прочных ковалентных связей и большого количества слабых межмолекулярных связей в молекуле белка. Более вероятен второй вариант, если учесть, что в молекуле белка имеется несколько сотен водородных связей, составляющих около 75—80% внутримолекулярных связей глобулярных белков. Для нарушения пространственной конфигурации полипептидных цепей достаточен разрыв 10—20% водородных связей.
В результате разрыва внутримолекулярных связей (водородных, солевых) пептидные цепи частично развертываются, в результате чего функциональные группы (SH-группы, фенольная группа тирозина, гуанидиновая группа аргинина, е-аминогруппа лизина и др.) становятся более активными или более доступными для воздействия реактивов. Для тепловой денатурации белков особенно характерно увеличение реактивности SH-rpynn. По величине содержания SH-групп нередко судят о глубине денатурации белка.
Вторичные процессы, происходящие после денатурации, по-видимому, связаны с хаотическим возникновением связей (водородных, солеобразных) между полипеп-
287
тидными цепями как внутри молекулы, так и между молекулами различных белков, а также с изменением электростатического состояния белков (обычно изоточка денатурированных белков сдвигается). В результате вторичных процессов уменьшается гидрофильность белков, теряется их устойчивость (растворимость) и происходит агрегация, коагуляция и т. п.
Закономерности денатурационных превращений индивидуальных белков, наблюдаемые в растворах, существенно изменяются при денатурации белков в составе сложных структур, какими являются ткани животных. В этом случае тепловая денатурация белков будет зависеть не только от лабильности того или иного белка, но и от взаимосвязи между белками и другими соединениями, а также от условий окружающей среды, например, от pH и т. п.
Мясо обычно нагревают в пределах от 60 до 180°С, поэтому в зависимости от условий процесса и конечной температуры нагрева характер изменения белков и свойства готовых продуктов будут существенно различаться. Скорость денатурации белков мышечной ткани в растворах неодинакова. Наиболее быстро, уже при комнатной температуре, денатурирует основной белок мышц — миозин. При нагревании до 37°С он тепяет ферментативную активность уже через 15—20 мин. В структуре мышечной ткани это нативное свойство миозина сохраняется более стойко. При нагревании в течение 3 ч при 40°С ферментативная активность миозина снижается только на 50%, а при нагревании свыше 40°С миозина денатурирует полностью.
Более тонкие денатурационные изменения миозина были обнаружены при нагревании его раствора (0,5%) в пределах 20—80°С. С помощью микрокалориметра отмечены два независимых процесса денатурации. Первый имеет максимум при 43°С, второй максимум 53°С. Оказалось, что первый этап связан с превращением компонента миозина ТММ, а второй ЛММ (см. с. 31). Аналогичное своеобразие (два максимума) было установлено и при изучении вязкости раствора миозина при нагревании, обусловленное поведение этих фрагментов белка. Белки саркоплазмы — миоген, глобулин X — коагулируют из раствора при нагревании до 45—50°С.
При тепловой обработке мышечной ткани очень важ-
288
и третья последовательная
; Лр1>0шшшельнш1б нагрева, мин
Рис. 39. Кривые денатурации миоглобина при нагревании мяса.
ное значение имеют изменения миоглобина, от чего зависит окраска мяса. В результате денатурации теряется окраска миоглобина, он становится нерастворимым и подвергается деструкции с выделением гематина.
Наблюдается три последовательные Лазы в изменении Mb при нагревании его раствора при pH 6—8 в интервале 40—90°С. Первая фаза связана с нарушением его структуры в области, связанной с группой гема. Вторая обусловлена развертыванием спирализованной области молекулы (в пределах до 80°С) ступенчатая полимеризация, заканчивающаяся осаждением белка. Миоглобин в мясе денатурируется постепенно в зависимости от температуры и продолжительности нагревания (рис. 39).
При 60°С красная окраска сохраняется внутри куска мяса, при 60— 70°С мясо окрашивается .в розовый цвет, а при 70— 80°С и выше в значительной степени становится серо-коричневым, что соответствует полной денатурации миоглобина.
Своеобразным биохимическим тестом для контроля заданной температуры нагрева мяса могут служить методы определения активности некоторых его ферментов. Кислая фосфатаза теряет свою активность при температуре 70°С. Следовательно, отсутствие в пробе активности, присущей этому ферменту, свидетельствует о том, что мясо было нагрето свыше 71°С. Для этой же цели в последнее время проводится проба на карбоксилэстеразу. Она инактивируется при нагреве мяса при 80°С в течение 10 мин или при 60°С 40 мин.
Белки мяса, денатурированные в результате теплового воздействия, легче подвергаются ферментативному гидролизу, так как в результате разрыва слабых внутримолекулярных связей создаются более благоприятные усло
вия для взаимодействия протеолитических ферментов с определенными пептидными группировками белковой молекулы, что особенно важно для коллагена.
С повышением температуры нагревания мяса от 20 до 80°С увеличивается количество остаточного азота, что, по-видимому, связано с образованием низкомолекулярных продуктов, отщепляющихся от молекул некоторых денатурированных белков.
Нагревание мяса с целью консервирования до более высокой температуры (до 100—180°С) сопровождается более глубокой деструкцией белков, которая может протекать в двух основных направлениях: во-первых, наиболее заметен гидролитический распад белков, отчетливо характеризующийся накоплением аминного азота при температуре свыше 120°С, и, во-вторых, наблюдается деструкция некоторых аминокислот и белков мяса с разрушением лабильных функциональных групп, например SH-групп цистеина, тиометильной группы метионина, особенно чувствительной е-аминогруппы лизина и др. Эти превращения сопровождаются появлением летучих продуктов: H2S, меркаптанов, NH3, СО2 и т. д. (табл. 46).
ТАБЛИЦА 46
Температура нагревания, СС Содержание, мг%
аминного азота H2S NHa
До нагревания 34,7 — 12,8
100 зь,з — 20,7
108 35,6 0,26 28,8
113 34,6 0,40 33,4
120 34,7 0,87 40,5
130 ......... 50,4 2,16 60,0
150 117,0 10,01 115,4
Изменения, связанные с деструкцией аминокислот, несколько снижают биологическую ценность белков мяса и ухудшают его органолептические свойства.
Изменения экстрактивных веществ. В результате денатурации дегидратации белков при тепловой обработке из мяса выделяется жидкость, в которой содержатся экстрактивные вещества, растворимые в воде и поддающиеся диализу, придающие вареному мясу характерные 290
вкусовые свойства. Белковый остаток, лишенный этих веществ (отмытый), безвкусен. Чувствительность экстрактивных веществ к нагреванию различна. Более устойчивы карнозин, молочная кислота, холин (распадается все го на 10—15%).
В процессе варки часть креатина распадается, а около ’/з его превращается в креатинин. При нагреве мясного экстракта при 100°С в течение 6 ч потери других соединений экстракта происходят с различной интенсивностью (в %): аргинин И, аланин 6,9, гистидин 21,8, креатинин 23,8, орнитин 28,5, фенилаланин 19,3, треонин 19,8. При этом аспарагиновая, глютаминовая кислоты, карнозин, метилгистидин — не разрушаются. Нагревание в течение 24 снижает уровень креатинина лишь на 8%.
Вместе с тем происходит некоторый распад глютатио-на, являющегося важным источником H2S при варке мяса кур, а при нагревании этого мяса до 90—113°С он полностью подвергается деструкции. При стерилизации говяжьего мяса (см. табл. 46) H2S накапливается в основном в результате деструкции цистеина, находящегося в составе белков. Глютатион при стерилизации подвергается лишь частичному разрушению. Накопление аммиака является следствием распада низкомолекулярных соединений (глютамина, адениловой кислоты) и белков. Значительная часть образовавшегося аммиака связывается кислотами. При нагревании мяса в результате распада уменьшается содержание органических фосфорных соединений.
В образовании вкуса вареного мяса, как уже отмечалось, важную роль играет глютаминовая кислота. Появление ее при тепловом воздействии на мясо возможно в результате освобождения аминокислот из белков и дезаминирования глютамина, который находится в мышечной ткани в лабильной связи с какими-то соединениями. Возможным источником образования глютаминовой кислоты является и глютатион. При варке мяса появляются микроколичества летучих продуктов: карбонильных соединений, летучих жирных кислот, H2S (а возможно и продукты вторичного взаимодействия с тиолами), участвующих в создании аромата вареного мяса.
В результате варки pH мяса незначительно сдвигается (на 0,3) в сторону нейтральной реакции, что связано отчасти с удалением СО2.
291
Изменение липидов. Нагревание мяса сопровождается выплавлением жира и частичным его эмульгированием. Длительное воздействие высокой температуры в присутствии воды и кислорода воздуха может вызвать гидролиз и окисление жиров. В результате нагревания до 190°С образуются эпоксиды. Одновременно с выплавлением жира освобождаются некоторые летучие соединения, связанные с жирами, что придает дополнительный аромат мясу и бульону.
Денатурационные изменения фракции белков (появление гемохромогена), а также освобождение липидов, особенно в свином мясе, при нагревании до 70°С способствует более быстрой окислительной порче жиров при хранении, что сопровождается ростом перекисей, резким подъемом тиобарбитурового числа (ТБЧ).
Липидная фракция вареной свинины подвергается более быстрой окислительной порче, чем липиды жировой ткани. Это объясняется отсутствием естественных антиокислителей и тем, что в процесс окисления очень быстро вовлекаются весьма лабильные фосфолипиды и фосфолипопротеиды. В результате окисления фосфолипидов образуются летучие продукты с неприятным запахом. Параллельно с увеличением их содержания повышается ТБЧ-индекс.
Изменение витаминов. Изменение содержания витаминов в мясе при нагревании зависит от их термолабильности, а также от условий обработки (табл. 47).
ТАБЛИЦА 47
Способ обработки мяса Потери, %
ниацина рибофлавина тиамина
Тушение 10 5 40
Жаренье 5 10 25
Запекание 5 10 30
Тепловая стерилизация при 112°С ...... 48
при 121°С ...... '— 67
Наиболее чувствителен- к тепловому воздействию тиамин, поэтому потери его наиболее значительны, хотя эта величина зависит от условий обработки мяса, главным образом от pH и кислорода. -
292
Таким образом, нагревание МяСа до 100вС положительно влияет на пищевые качества продукта —улучшаются bkvc, аромат, перевариваемость, усвоение и в значительной степени сохраняется его биологическая ценность. Нагревание мяса свыше 100° С связано с некоторой утратой его биологической ценности и поэтому менее выгодно.
Образование компонентов вкуса и аромата. При нагревании мяса происходит преобразование предшественников в соединения, непосредственно участвующие в создании специфического «букета» — вкуса и запаха — мяса и различных мясных продуктов.
При этих превращениях большая роль отводится в качестве предшественников углеводам (глюкоза, рибоза, отчасти фруктоза), аминокислотам, нуклеотидам мясного экстракта. В результате взаимодействия этих веществ при нагреве образуются соединения, обусловливающие появление характерного запаха: альдегиды, кетоны, летучие кислоты, серусодержащие соединения, амины и др.
Важное значение в образовании запаха мяса играет реакция Майара, т. е. реакция взаимодействия сахаров с компонентами, содержащими аминогруппу при нагревании. При этом происходит выделение летучих соединений и образование окрашенных продуктов (реакция мела-’ ноидинообразования). Механизм этой реакции еще полностью не раскрыт, но некоторые стадии ее считаются выясненными и могут быть представлены следующим образом:
НО NIIR NR
j II
С СНОН СН
I I -н,о |
(СНОН)Я +RNH2^=—i (СНОН)„ (CHOH)„
tlI2OH СН2ОН CH2OH
Альдоза Амин Основание
Шиффа
HNR
НС—---------1
(СНОН)Л_1 О
СН2ОН
N-замещенный гликозиламин
293
N-Замещенный альдозиламин претерпевает перегруппировку (так называемую перегруппировку Амадори), образуя амино- 1-дезокси-2-кетозу,
RHN I
СН---------
(СНОН)^!
сн--------
+ Н+
I СН2ОН
RN- Н
II СН
(СНОН)„
СН2ОН
NHR
I
СН
II СОН
I
(СНОН)П_1
СН2ОН
NHR
СН2
(СНОН)П_1
СН2ОН
Дальнейшие превращения еще не установлены.
В результате реакции Майара образуются альдегиды — формальдегид и метилглиоксаль, а также ацетон, диацетил, фурфурол, оксиметилфурфурол, метилфурфу-рол и др.
Алифатические альдегиды образуются также из аминокислот при их окислительном дезаминировании и декарбоксилировании (реакция Штрекера) при нагревании
[О]
R—СН—СООН------> RCHO + NH3 + СО2
nh2
Образующийся при этой реакции альдегид содержит на один атом углерода меньше, чем исходная аминокислота, например, из лейцина образуется рзовалериановый альдегид
NH2
Н3С I [OJ
}СН-СН2-СН-СООН-----
снзх
>СН-СН2-С сн/
+ NH3 4- СО2
294
из изолейцина — 2-метилмасляный альдегид и т. д. В результате реакции Штрекера цистеин, свободный и содержащийся в пептидах и белках, распадается с выделением сероводорода. Из метионина образуется метиональ, обладающий мясным ароматом,
NH2
I [О]
СН3—S—СН2—СН—СООН------->
О
II
——► сн3—s—сн2—сн2—сн + NH3 + со2
Из цистеина выделяется меркаптоацетальдегид, предоставляющий собой очень неустойчивое соединение, роль ^которого в аромате мяса еще не определена
[°J
HS—СН2—СН—СООН------HS—CH2—С" 4-NH3 + COa
Треонин при нагревании при 160°С в течение часа образует продукт, обладающий запахом бульона — это а-кетомасляная кислота.
Реакция Майара идет в широком интервале pH, но лучше при pH 7—9. Скорость ее повышается при подъеме температупы. Так, при 60°С она идет в 20 раз быстрее, чем при 37°С, но и при этой температуре скорость ее достаточна.
На специфичность запаха, образуемого при нагревании смеси аминокислот и сахаров, влияет природа аминокислоты, а не сахара.
При нагревании ряда аминокислот с глюкозой при 100 и 180°С в течение часа, получен ряд запахов: горелого сахара, ржаного хлеба, карамельный, шоколадный, горелой кукурузы и др., но «мясной» не был получен. При нагревании смеси, состоящей из водных растворов аминокислот (обязательно с /-цистеином), углеводов и эфиров ненасыщенных жирных кислот возникает запах, имитирующий мясной.
Установлено возникновение запаха при кипячении растворов аминокислот с простыми альдегидами: уксусным, пропионовым, глицериновым и производными фурана. Из аминокислот необходимыми для получения мяс-
295
кого запаха являются: цистеин, глютаминовая кислота, пролин, гистидин.
Как показано последними исследованиями, мясной аромат получается при нагревании смеси таурина и тиамина при температуре 95—220°С и добавлении этого продукта к смеси свободных аминокислот. Добавление сахаров 0,5—5% усиливает мясной запах.
В водном экстракте из свежего мяса эти соединения не обнаружены. Они появляются после кипячения экстракта в течение 2,5 ч. Установлено, что предшественниками их являются рибозо-5-фосфат и пролин или таурин. Путем экстракции мяса диэтиловым эфиром были выделены и разделены с помощью газо-жидкостной хроматографии и идентифицированы два соединения. Одно из них обладает запахом карамели и является по строению 4-гидрокси-2,5-диметил-3 (2Н) -фураноном
Другое соединение обладает запахом жареного цикория и является гомологом первого: 4-гидроокси-5-метил-3 (2Н)-фураноном.
Глава VII.
ЭНДОКРИННЫЕ И ПИЩЕВАРИТЕЛЬНЫЕ ЖЕЛЕЗЫ
ЭНДОКРИННЫЕ ЖЕЛЕЗЫ
И ГОРМОНЫ
К числу химических стимуляторов и регуляторов жизненных функций относятся гормоны (греч. hormao — возбуждаю, побуждаю), образующиеся в специфических клетках желез внутренней секреции и выделяющиеся непосредственно в кровь. Железы внутренней секреции, называемые также эндокринными железами (греч. еп-do—=внутри, krinein — выделяю), тесно связаны между собой и функционируют как единая цельная физиологическая система, деятельность которой регулируется нервной системой, прежде всего корой головного мозга.
В ответ на воздействие внешней и внутренней среды нервная система стимулирует эндокринные железы. Гормоны, доставленные кровью к месту их действия, обеспечивают химическую координацию работы органов, которая дополняет координацию, осуществляемую нервной системой. В результате выделения гормонов действие нервного импульса удлиняется.
По химическому строению многие гормоны представляют собой специфические белки, некоторые являются пептидами или производными тирозина; большая группа гормонов представлена стероидами.
Гормональная регуляция. Гормоны влияют на рост, развитие и формообразование животного организма, оказывают воздействие на функциональную деятельность других органов и тканей, особенно эндокринных желез, возбуждая или тормозя их деятельность.
Гормоны оказывают влияние на все стороны обмена веществ. Однако они не обусловливают появление новых биохимических реакций в тканях, а только усиливают или замедляют реакции, протекающие в организме. В боль
29/
шинстве случаев механизм действия гормонов заключается во влиянии их на активность ферментов и повышение проницаемости клеточных мембран.
Различные стороны обмена веществ регулируются несколькими группами гормонов; необходимо рассматривать действие не только каждого гормона, но и совместное их влияние на организм. Нарушение деятельности одной железы влечет за собой изменение функций других. Это создает сложные отношения в гормональной регуляции обмена веществ, поскольку каждая железа контролирует определенные стороны метаболизма.
При нарушении функций отдельных желез больным вводят гормональные препараты, полученные из одноименных эндокринных желез животных.
Парентеральное введение многих гормональных препаратов обусловлено возможностью разрушения гормонов в желудочно-кишечном тракте, снижением биологического действия их вследствие задержки в печени, а также необходимостью получения быстрого эффекта от их воздействия.
У большинства гормонов нет резкой видовой специфичности. Хотя при парентеральной инъекции гормонов животных другого вида и образуется некоторое количество антител, это, по-видимому, является ответом на введение высокомолекулярных веществ. Известно, что белки, выполняющие у различных животных очень близкие функции, характеризуются относительно сходным аминокислотным составом и строением. Этим, вероятно, и объясняются слабые антигенные свойства белков-гормонов. Низкомолекулярным пептидоподобным гормонам не присущи антигенные свойства, поэтому эффективность большинства их при введении животным другого вида сохраняется длительный период времени.
Активные гормональные вытяжки или препараты используются и в качестве физиологических стимуляторов, повышающих продуктивность животных. Зная деятельность желез внутренней секреции и умело используя воздействие гормональных препаратов, в перспективе можно будет еще эффективней управлять процессами размножения, ускорять рост, увеличивать продуктивность животных (надой молока, настриг шерсти и т. п.).
Автолитические превращения в эндокринных железах. Для получения гормональных препаратов используют 293
щитовидную, паращитовидные железы, надпочечники, поджелудочную, половые железы, гипофиз и другие эндокринные железы.
После убоя животного в эндокринных железах протекают интенсивные процессы автолиза, связанные прежде всего с протеолитическим распадом белковых структур. При этом гормоны белковой природы теряют биологическую активность. Установлено, что содержание АКТГ в изъятых железах резко снижается под влиянием автолитических процессов в тканях железы. Ввиду наличия в поджелудочной железе комплекса активных протеолитических ферментов при автолизе ее быстро инактивируется белковый гормон — инсулин. Быстрой инактивации при автолизе подвергаются и другие гормоны.
Такой гормон, как адреналин, легко окисляется, причем этот процесс усиливается под влиянием солнечных лучей (УФ-лучей). Поэтому при изъятии надпочечников, очистке и хранении необходимо избегать действия солнечных лучей, порезов и других нарушений целостности железы.
Важнейшим условием правильной организации сбора эндокринного сырья является быстрое извлечение его из туши животного, соблюдение условий, предотвращающих загрязнение и инфицирование.
Если эндокринное сырье не используется для производства препаратов сразу же, то его необходимо быстро заморозить, а для ряда эндокринных желез допускается лиофилизация или консервирование химическими реагентами (спиртом, ацетоном, поваренной солью). Выбор консерванта и его количество определяются природой гормонов и характером дальнейшей переработки. Это необходимо для предотвращения развития микроорганизмов и торможения биохимических (автолитических) превращений в тканях желез.
Замораживают эндокринное сырье в скороморозильных аппаратах или в камерах при возможно низкой температуре (—35 4 50°С). Хранить замороженное сырье следует при постоянной низкой температуре. В таких условиях химические и биологические свойства эндокринного сырья сохраняются лучше.
Перерабатывать замороженное эндокринное сырье также необходимо по возможности быстрее, так как при размораживании активность многих ферментных систем
299
возрастает, что обусловливает быструю инактивацию гормональных начал. Это особенно относится к железам внутренней секреции, продуцирующим гормоны белковой природы. Поэтому экстракцию гормонов лучше начинать из желез в замороженном состоянии.
ЩИТОВИДНАЯ ЖЕЛЕЗА
Щитовидная железа вырабатывает несколько специфических соединений, обладающих гормональным действием. Они оказывают влияние на общий обмен веществ, особенно белковый, а также на рост и морфогенез.
В состав так называемого коллоида железы входит йодсодержащий белок, получивший название тиреоглобулина. Он образуется в клетках эпителия, а депонируется в коллоиде фолликула. Молекулярная масса тиреоглобулина около 700 000. Важнейшей особенностью его является содержание 0,6% йода. Молекула тиреоглобулина состоит из 10 пептидных цепей, включающих 576 остатков аминокислот. В составе тиреоглобулина образуются активные йодтиронины — йодированные производные тирозина, обладающие гормональной активностью.
Процесс йодирования тирозина, образование моно- и дийодтирозина (йод этих соединений является резервным), а затем активных йодтиронинов: 3,3'-дийодтирони-на (Т2); 3,5, З'-трийодтиронина (Т3), 3,3', 5'-трийодтирони-на (Tz3) и 3, 5, 3', б'-тетрайодтиронина (Т4, тироксина) происходит интрамолекулярно, т. е. внутри белковой молекулы тиреоглобулина
О
сн2-сн-соон
3,3' -Дийодтиронин
d-Тироксйн (3,5,3',5'-тетра-йодтироиин)
О
J
inh2
сн2-сн-соон 3,5,3' -Трийодтиронин
300
Образовавшиеся активные йодтиронины под действием протеолитических ферментов освобождаются от белковой основы и поступают в кровь.
В табл. 48 приведен перечень йодтиронинов, обнаруженных при гидролизе тиреоглобулина.
ТАБЛИЦА 48
Йодированные производные Активность Обозначения Общее содержание йода. %
Тироксин (3,5,3',5'-тет- райодтиронин) 100* Т4 20
3,5,3'-Трийодтиронин . . 500 т? Низкое
3,3',5'-Трийодтиронин . . 10 Тз »
3,3'-Дийодтиронин .... 85 т2 »
Дийодтирозин — ДИТ 50—60
Монойодтирозин . — МИТ 10—15
* Активность тироксина принята за 100.
Иодирование тирозина происходит легко и в опытах in vitro. Из гидролизатов белков, предварительно обработанных йодом в щелочной среде (например, казеин, альбумины сыворотки и др.), получают продукты, обладающие тиреоидной активностью.
Усиление обмена веществ при гипертиреозе (тиреотоксикозе) объясняют тем, что тироксин и особенно трийодтиронин (Тз) разобщают окислительные процессы и образование макроэргических соединений. Макроэрги необходимы для синтеза белковых веществ и других анаболических продуктов (поэтому становится понятным похудение и другие дистрофические явления при базедовой болезни).
Влияние тироксина на нервную систему носит вторичный характер. Именно усиление окислительных процессов под воздействием тироксина, увеличение продуктов распада белков (особенно тирамина, фенилацетиламина и др.) оказывают влияние на вегетативную и центральную нервную системы.
Тиреоидные гормоны повышают активность амилазы, кислой фосфатазы, АТФ-азы, цитохромоксидазы, аргиназы и оксидаз аминокислот. В то же время тиреиодные
301
гормоны снижают активность холинэстераз и сукцинатдегидрогеназы нервной ткани.
Гипофункция железы обусловливает резкое понижение основного обмена животного. У человека при этом развивается болезнь микседема, выражающаяся в понижении обмена веществ, отечности, задержке воды в тканях, ожирении, вялости и внешнем постарении даже в молодые годы.
При пониженной деятельности щитовидной железы в лечебных целях применяют сухой активный препарат тиреоидин, активность которого сохраняется длительное время (содержит 0,17—0,23% йода). Получают его из высушенных и обезжиренных размолотых желез убойных животных и выпускают в дражированных таблетках.
Для установления биологической активности препарат испытывают на содержание йода.
ПАРАЩИТОВИДНЫЕ ЖЕЛЕЗЫ
Паращитовидные железы животных продуцируют гормон, основная роль которого состоит в регуляции содержания кальция и фосфора в крови, тканевых жидкостях и кристаллах оксиапатита костей. Считается, что гормон паращитовидной железы (паратгормон) проникает в стабильную часть костей, где он создает условия обмена минеральной части кости с кровью. Паратгормон влияет на различные стороны обмена в тканях. При удалении паращитовидных желез, особенно у плотоядных животных, резко снижается содержание кальция в крови и тканях, повышается содержание фосфора, резко возрастает возбудимость нервной системы, появляются судороги (тетания) и животные погибают.
Гормоны паращитовидных желез растворимы в воде, солевых растворах, алкоголе. Паратгормоны различных видов млекопитающих являются полипептидами, состоящими из 78—81 аминокислотных остатков.
Аминокислотный состав паратгормона быка (число аминокислотных остатков на молекулу белка): глицин 4, аланин 7, валин 8, лейцин 8, изолейцин 3, пролин 2, фенилаланин 2, тирозин 1, триптофан 1, серин 6, треонин 1, метионин 2, аргинин 5, гистидин 4, лизин 9, аспарагиновая кислота 9, глютаминовая кислота 11. Гормон не содержит цистина и цистеина. N-Концевой аминокисло
302
той паратгормона является а-аланин, С-концевой аминокислоты у него нет.
При гипофункции паращитовидных желез лечебный эффект оказывают инъекции активного экстракта паращитовидных желез в соединении с введением per os солей кальция и витамина D. Активный экстракт паратиреоидин (паратгормон) —водный раствор гормональных веществ — выделяют из паращитовидных желез крупного рогатого скота. Паратиреоидин получают при гидролизе желез. Активную фракцию осаждают в изоэлектрической зоне (pH 4,8—5,4), а раствор гормональных веществ консервируют фенолом.
В основу стандартизации препарата положена биологическая реакция повышения уровня кальция в крови при введении гормона в организм подопытных животных. За единицу действия (е. д.) принимают 0,01 часть того количества препарата, которое по истечении 15 ч после введения повышает содержание кальция в 100 мл крови на 5 мг, т. е. в среднем на 30%.
ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
Поджелудочная железа вырабатывает инсулин, глюкагон и другие гормоны. Эндокринную функцию выполняют изолированные группы специфических клеток, разбросанные среди ткани железы и названные островками Лангерганса. Они продуцируют инсулин и глюкагон. Биосинтез глюкагона происходит в а-клетках, а инсулина — в 0-клетках островков Лангерганса.
Инсулин. Из гормонов поджелудочной железы наиболее изучен инсулин (лат. insula — остров). Инсулин необходим для утилизации глюкозы и синтеза гликогена и белков в тканях. Влияние инсулина на жировую ткань выражается в понижении мобилизации жиров из жировых депо, ускорении, превращения глюкозы в жиры, усилении синтеза высших жирных кислот. Инсулин способствует ускорению включения аминокислот в белки за счет повышения окисления глюкозы с образованием энергии, необходимой для синтеза и изменения условий транспорта аминокислот через клеточные мембраны.
По химической природе инсулин является специфическим белком; изоэлектрическая точка его соответствует pH 5,3—5,4. Инсулин хорошо растворяется в разбавлен
303
ных кислотах и Щелочах, а также в водных (80%-ных) спиртовых растворах. Его биологическая активность в кислой среде более стабильна, чем в щелочной.
Молекулярная масса инсулина варьирует в зависимости от концентрации белка, типа и концентрации электролита и pH раствора. Такие различия объясняются разной степенью ассоциации субъединиц инсулина. Минимальная масса инсулина, соответствующая наименьшей элементарной частице, объединенной ковалентными связями и обладающей гормональной активностью, равна 6000. Молекула инсулина состоит из двух полипептидных цепей —А (21 аминокислотный остаток) и Б (30аминокислотных остатка). Цепь Б образует левоза-крученную спираль, а цепь А — правозакрученную
rNH2 rNH2 rNH2
уГир—-Глу—Лей—Глу—Асп—Тир—Цис—Асп —СООН
•Цис—Вал \ю Сер 1э j-NH2 А Цепь A №Н^Гди~Илей-Вал-Глу—Глу-Цис—Цис
Вал Лей Тир Лей Ала
гМН2г1\Н2 Глу у
Цепь Б №Н^Фен^ал~Асл—Глу~Цис~Лей~Цис^ли—Сер-Гис-Лей—
Гл и г 1 Глу
Арг I
Пли
Фен I
Фен
Тир
М
Тре
Про J
Диз
Ала сбои
Инсулины разных видов млекопитающих отличаются последовательностью аминокислотных остатков 8,9 и 10 цепи А. Так, в инсулине быка — Ала-Сер-Вал, овцы — Ала-Гли-Вал, лошади — Тре-Гли-Илей, человека, свиньи и кашалота — Тре-Сер-Илей. Различия наблюдаются также в С-концевом аминокислотном остатке Б-цепи; в инсулине человека это остаток треонина, а в инсулине кролика — остаток серина. Гормональная активность инсулина определяется его третичной структурой и особенно пятичленным дисульфидным кольцом полипептидной цепи А.
Действие инсулина в организме сопровождается увеличением интенсивности окислительного фосфорилирова-
304
ция, так как для процессов синтеза гликогена, жирный кислот, белков необходима энергия. Инсулин повышает активность глюкокиназы и УДФГ-гликоген-гликозил-трансферазы и этим ускоряет синтез гликогена.
Вследствие сравнительно быстрого потребления инсулина из кровеносного русла секреция инсулина происходит постоянно соответственно использованию углеводов. Инсулин разрушается инсулиназой печени, почек и мышц. Кроме того, инсулин разрушается тканевыми протеиназами и пептидазами.
При гипофункции железы наблюдается недостаток инсулина, что тормозит синтез гликогена в печени и тканях. Это приводит к повышенному содержанию сахара в крови (гипергликемия) и пропусканию почками сахара в мочу (глюкозурия). Поэтому заболевание, возникающее при недостатке инсулина, получило название сахарного мочеизнурения, или сахарного диабета.
Препараты инсулина получают из размельченных поджелудочных желез экстракцией подкисленным этиловым спиртом при pH 1,8—5,0. Подкисление растворителя необходимо для того, чтобы затормозить действие активных пищеварительных протеолитических ферментов поджелудочной железы, быстро разрушающих гормон. Для получения кристаллического инсулина необходимы соли цинка, хотя цинк и не входит в молекулу инсулина. Эффективность препаратов кристаллического инсулина животных разных видов относительно одинакова.
Препараты инсулина с пролонгированным действием получают при образовании комплексов инсулина с белками. Так, распространены препараты протамин-цинк-инсулин. Используется и препарат, представляющий собой смесь аморфного и кристаллического инсулина, обеспечивающий и быстрое, и затяжное действие. Такой препарат известен под названием инсулин-цинк-суспензия. Препараты инсулина, как, например, инсулин-цинк-сус-пензия, обладая пролонгированным действием, устраняют введение в организм чужеродного белка.
Препараты инсулина стандартизируют по вызываемому ими понижению сахара в крови кроликов или по развитию судорожного гипогликемического состояния мышей. Международной инсулиновой единицей считается такое количество инсулина, которое после впрыскивания снижает содержание сахара в крови у кролика массой
305
2 кг (предварительно голодавшего 24 ч) до 45 мг%.
Глюкагон. Гормон поджелудочной железы глюкагон по своему действию является антагонистом инсулина, так как стимулирует процессы распада запасов гликогена и появление избыточного количества глюкозы в крови — гипергликемию. В большинстве препаратов инсулина содержится небольшая примесь глюкагона, что обусловливает кратковременную легкую гипергликемию в первые минуты после их введения.
Глюкагон является полипептидом с молекулярной массой 3485, состоящим из 29 аминокислотных остатков: Гис-Сер-Глю- ЫГГТли-Тре-Фен-Тре-Сер-Асп-Тир-Сер-Диз-Тир-Асп-Сер-Арг-Арг-Ала-Глю- ПНа-Асп-Фен-Вал-Глю- NHa-Три-Лей-Мет-Асп- NHa-Tpe.
В клетках печени глюкагон увеличивает количество глюкозо-1-фосфата и глюкозо-6-фосфата, что свидетельствует об активации фосфорилазной системы. Кроме того, глюкагон активирует также фермент, расщепляющий 1,6-связи гликогена.
Глюкагон быстро проникает в большинство тканей организма и в них быстро распадается. Ферментная система, инактивирующая глюкагон, находится в растворимой части цитоплазмы.
Липокаин. В эпителии выводных мелких протоков поджелудочной железы вырабатывается липокаический фактор, регулирующий обмен жиров в печени, путем активации веществ для образования фосфолипидов. Препарат липокаина получают из поджелудочных желез после извлечения инсулина. Биологическую активность препарата определяют по степени торможения жировой инфильтрации печени у крыс и мышей.
Липокаин применяют при гиперкетонемии и гепатитах (воспалении печени). При сахарном диабете с наклонностью к кетозу препарат липокаина применяют одновременно с инсулином в сочетании с диетой, содержащей достаточное количество липотропных пищевых веществ.
ПОЛОВЫЕ ЖЕЛЕЗЫ
Гормоны половых желез оказывают большое влияние на общее развитие организма, стимулируя интенсивность клеточного обмена, деятельность нервной системы, поддержание определенного тонуса животного организма.
306
Половые гормоны специфически действуют на определенные ткани, способствуя половому созреванию и развитию вторичных половых признаков. Половые гормоны образуются главным образом в яичниках и семенниках.
Различные препараты половых гормонов получают из измельченных тканей половых желез путем экстракции липидорастворителями (этиловым спиртом, ацетоном и другими органическими неполярными растворителями). Многие из них получены синтетически, причем действие многих синтетических аналогов половых гормонов во много раз выше действия естественных гормонов.
Мужские половые гормоны (андрогены). Андрогенами являются тестостерон, андростерон и дегидроандростерон, которые вырабатываются в семенниках, а также андреностерон, андростендион и 11р-оксиандростендион, образующиеся в коре надпочечников,
Тестостерон является наиболее активным из всех андрогенов. В синтезе андрогенов из холестерина и уксусной кислоты участвует КоА. При участии р-гидрокси-дегидрогеназы из тестостерона возникают другие андрогены.
Андрогены влияют на белковый, минеральный и липидный обмены. Анаболическое действие андрогенов на белковый обмен является следствием повышения активности синтетаз. Андрогены изменяют также активность ферментов, участвующих в обмене нуклеиновых кислот. Андрогены повышают концентрацию липидов в крови, содержание фосфоро- и серусодержащих веществ, натрия, калия и кальция. Содержание холестерина в се
307
менниках при усилении образования стероидов понижается.
Препараты мужских половых гормонов применяют при недостаточности мужской половой функции, при импотенции и других нарушениях.
Препараты мужских половых гормонов получают из семенников половозрелого крупного и мелкого рогатого скота. Активность их устанавливают посредством специальных биологических тестов, наиболее распространенным из которых является рост гребня у кастрированных петушков после инъекции.
Женские половые гормоны (эстрогены). К эстрогенам относятся 170-эстрадиол, эстрон (фолликулин) и эстриол, синтезирующиеся из уксусной кислоты и холестерина в яичниках, коре надпочечников, семенниках и плаценте
Существуют а- и p-эстрадиолы. Они различаются по пространственному расположению оксигруппы в С17. 170-эстрадиол в 20—25 раз активнее эстрона. Эстриол по активности следует за эстроном.
Эстрогены оказывают специфическое действие на рост матки, слизистой оболочки влагалища, ороговение влагалищного эпителия и на развитие вторичных женских половых признаков. Эстрогены влияют на различные стороны обмена белков и повышают содержание натрия, калия, фосфора и кальция. Они активируют ферменты, участвующие в синтезе аминокислот, ферменты синтеза белков, активируют синтез нуклеотидов. Эстрогены обладают выраженным липотропным действием.
Выделение фолликулина из тканей желез затруднено, поэтому для промышленного получения препаратов используют мочу беременных кобыл. Другие препараты женских половых гормонов вырабатывают из яичников убойных животных. В качестве гормонального сырья используют также плаценту стельных коров вместе с ко
308
тиледонами (корункулами)—характерными образованиями слизистой оболочки тела и рогов матки.
К числу эстрогенов относится и гормон желтого тела яичников — прогестерон, существующий в виде двух изомеров: а- и 0-прогестерона
Синтез этого гормона также осуществляется из холестерина и уксусной кислоты. Образование его регулируется лютенизирующим гонадотропным гормоном, а в корковой части надпочечников — АКТГ. Прогестерон преобразует слизистую оболочку матки, подготавливая ее к восприятию яйцеклетки. Прогестерон оказывает катаболическое действие на обмен веществ.
Препараты прогестерона получают из желтого тела самок всех видов убойных животных. В период полного развития желтое тело круглой или продолговатой формы. У коров и овец на одном яичнике образуется только по одному желтому телу, а у свиней —до 6—10.
Активность препаратов эстрогенов устанавливают посредством биологических тестов на неполовозрелых мелких животных. Так, при введении фолликулина неполовозрелой мыши увеличиваются размеры матки и появляется ряд признаков течки (эструса). Введение прогестерона неполовозрелым крольчихам вызывает изменения в слизистой оболочке матки, соответствующие изменениям в начальном периоде беременности (так называемая ложная беременность).
Препараты эстрогенов применяют при ослаблении внутрисекреторной функции женских половых желез.
НАДПОЧЕЧНЫЕ ЖЕЛЕЗЫ
В надпочечниках различают два слоя: наружный — корковый (составляет около 2/з общей массы надпочечников) желтоватого цвета и внутренний — мозговой, окрашенный в более темный цвет. Эти слои построены из разных тка
.309
ней и выполняют различные внутрисекреторные функции. Мозговой слой вырабатывает гормойы адреналин и норадреналин, а корковый слой продуцирует большое количество гормонов, объединенных общим названием кортикальных (кортикоиды).
Гормоны коры надпочечников — кортикальные гормоны. По характеру действия кортикальные гормоны разделяют на глюкокортикостероиды и минералокортикостероиды.
Наиболее активными глюкокортикостероидами являются кортикостерон, гидрокортизон (17-оксикортикосте-рон) и кортизон (11-дегидро-17-оксикортикостерон)
К минералокортикостероидам относятся 11-дезоксикортикостерон (ДОКС) и альдостерон
При биосинтезе кортикостероидов из ацетил-КоА и холестерина образуется прогестерон, а затем — кортикостерон и гидрокортизон. В надпочечниках холестерин и прогестерон превращаются в другие кортикостероиды.
Глюкокортикостероиды оказывают влияние на белко-ный, углеводный и жировой обмены. Эти гормоны способствуют не только распаду белков, но и замедлению их синтеза. Аминокислоты, не использованные для синтеза
310
белков, могут идти на синтез углеводов, в результате чего увеличивается содержание гликогена в печени и отчасти в мышцах. Глюкокортикостероиды также способствуют усилению всасывания углеводов в кишечнике и уменьшению потребления их мышцами.
Под воздействием глюкокортикостероидов увеличивается количество липидов в крови. Введение этих гормонов при аддисоновой (бронзовой) болезни устраняет гипогликемию и гиполипемию и нормализует всасывание продуктов переваривания жиров.
Минералокортикостероиды способствуют поддержанию определенного содержания электролитов в крови. Альдостерон способствует регуляции реабсорбции почечными канальцами натрия и активной секреции калия. При аддисоновой болезни альдостерон повышает в плазме содержание натрия и хлора и выделение калия с мочой. Кроме того, альдостерон влияет на обмен магния и кальция. ДОКС также способствует выведению из организма калия и фосфора с мочой и задержке в тканях натрия, хлора и воды. В регуляции водно-солевого обмена альдостерон является синергистом вазопрессина.
Из коркового слоя надпочечников убойных животных получают препарат кортин — смесь гормонов. Методы испытания его сводятся к установлению выживаемости подопытных животных с удаленными надпочечниками при введении испытуемого препарата. За единицу действия принимают наименьшее количество препарата в расчете на 1 кг массы, которое способно при определенных условиях устранить патологические состояния животных с удаленными надпочечниками и продлить их жизнь.
Кортин выпускают в ампулах по 1 мл и применяют в зависимости от активности, выражаемой в единицах действия. Применение кортина устраняет патологические явления, наблюдающиеся при бронзовой болезни: мышечную и психическую слабость, нарушение в соотношении солей натрия и калия, в обмене белков, углеводов и пигментов. В настоящее время почти все основные гормональные соединения коры надпочечников получают синтетически, что значительно расширило возможность их клинического применения.
Гормоны мозгового вещества надпочечной железы — адреналин и норадреналин. Хромаффинными клетками мозгового вещества надпочечника вырабатываются гор-
311
моны адреналин и норадреналин.Адреналин (метиламиноэтанолпирокатехин) является продуктом биохимичг ского преобразования аминокислот тирозина и фенилаланина
сн-он
NH- СН3
В организме животных вырабатывается левовращающая форма адреналина, а правовращающий изомер характеризуется в 15 раз меньшей активностью. Синтетический препарат адреналина является рацематом.
Адреналин — гормон короткого действия, поэтому надпочечники непрерывно выделяют небольшие количества его. Секреция этого гормона находится под постоянным контролем нервной системы. При нервных возбуждениях адреналин усиленно поступает в кровь.
Физиологическое действие адреналина разносторонне. Под влиянием его усиливается сердечная деятельность, расширяются сосуды сердца, сокращаются периферические сосуды, в результате чего резко повышается кровяное давление. Этот гормон повышает содержание глюкозы в крови и уменьшает содержание гликогена в печени, активируя фосфорилазу. Кроме того, адреналин стимулирует обмен белков, жиров, минеральных соединений кальция и фосфора. Он легко окисляется, особенно под действием ультрафиолетовых лучей, но в крови имеется ряд соединений — стабилизаторы адреналина, предохраняющие его от окисления. К таким стабилизаторам относятся глютатион, цистеин, аскорбиновая кислота и т. п. Окислители являются инактиваторами адреналина. Продуктом окисления адреналина может быть так называемый дегидроадреналин
NHCIL,
Дегидроадреналин представляет собой обратимо окис-, ленную форму адреналина. Он физиологически неактивен, но под влиянием аскорбиновой кислоты может быть, легко восстановлен в адреналин. Дегидроадреналин со-
держится почти во всех тканях и является тканевым резервом гормонального вещества. н
При окислении адреналина может быть также образованы адренохром (биокатализатор ряда ферментативных процессов в организме). Такое окисление необратимо
NCH3
снон сн2
Адреналин легко связывается белками с образованием биологических комплексов, которые, как полагают, обусловливают в одних случаях физиологическую инактивацию гормона, а в других стимулируют превращения адреналина.
Из мозгового слоя надпочечников выделен также гормон норадреналин, представляющий собой диметилиро-ванный адреналин
Он оказывает сильное физиологическое действие на сердце и сосудистую систему, которое, однако, несколько отличается от действия адреналина. Норадреналин сильно влияет на обмен углеводов. Особое значение норадреналин имеет для функции некоторых отделов нервной системы, в которых он играет роль синаптического медиатора.
Препараты адреналина получают из измельченных тканей железы путем экстракции подкисленным спиртовым раствором после последующего сгущения полученного экстракта и очищения гормонов. Адреналин осаждается водным раствором аммиака. Выход адреналина из 1 кг желез колеблется от 1,2 до 1,5 г. Определение активности препарата основано на его способности повышать кровяное давление: силу действия испытуемого препарата сравнивают с силой действия стандартного раствора чистого солянокислого адреналина. Количество адреналина в испытуемых растворах может быть определено химиче-
312
12—454
313
скими методами: обратным титрованием тиосульфатом и с помощью колориметрических реакций.
Различные аналоги адреналина получают синтетическим путем. В медицинской практике препараты адреналина и его производных широко применяют в случаях падения кровяного давления, кровотечения, некоторых инфекционных заболеваниях, пневмонии, бронхиальной астмы и т. д.
ГИПОФИЗ
Гипофиз животных по гистологическому строению делится на три доли: переднюю, среднюю и заднюю. Каждая из них осуществляет своеобразную внутрисекреторную функцию. Передней доли гипофиза принадлежит роль главного регулятора сложной деятельности эндокринной системы (рис. 40).
Гормоны передней доли гипофиза (аденогипофиза). Гормонами аденогипофиза являются: адренокортико-
I Мелтоо 1 тело
! у —। —у.
Тиреотропин Гонадотропины Кортикотропин 'пролактин Соматотропин । птг) пг Фер (А кт г) (лншемрсиш) 'гормон роста/
Молочная железа
Щи/тиднач Темен- шшо кора Янинин | железа л ники Лt
Рост мягки х и костнь/х тканей и другие метаболические продессы
Тироксин Андрогены острогены Корти- \ прогестерон кшжраиЛо \
Альдостерон
Рис. 40. Схема, иллюстрирующая биологические свойства гормонов гипофиза.
314
гропный гормон (АКТГ), гонадотропные гормоны (ГТГ), которые представлены фолликулостимулирующим гормоном (ФСГ), лютеинизирующим гормоном (ЛГ) и пролактином, а также тиреотропный гормон (ТТГ) и соматотропный гормон (СТГ). Эти гормоны синтезируются различными клетками аденогипофиза. Его эозинофильные клетки продуцируют СТГ и пролактин, а базофильные клетки — все остальные гормоны.
Соматотропный гормон (СТГ). Среди гормонов передней доли гипофиза особое место занимает гормон роста (саматотропин от греч. soma — тело). При пониженном выделении гормона задерживается рост организма, повышенное выделение его вызывает у взрослых животных усиленный рост костей, который приводит к ассиметрической их деформации, а у молодых животных ускоряет рост костей и тканей при пропорциональном их развитии.
СТГ имеет ярко выраженную видовую специфичность. Молекулярная масса его у разных видов животных различна: у человека— 27100, обезьян—25 400, крупного рогатого скота— 45 000, овцы — 48000, свиньи — 42000.
СТГ человека представляет собой одиночную поли-пептидную цепь, состоящую из 245 аминокислот, на N- и С-концах которой находится фенилаланин
----(S—S)3----
Фен.
Фен
СТГ крупного рогатого скота состоит из двух открытых полипептидных цепей, построенных из 396 остатков аминокислот и соединенных дисульфидными мостиками
Н-Фен —----------1---------—
(S-U)4
Н-Ала------------L-----------
Фен-ОН
СТГ является анаболическим гормоном. Ускорение биосинтеза белков под его влиянием обусловлено повышением проницаемости клеток для аминокислот и интенсивности включения аминокислот в белки. Наряду с этим он задерживает превращение углеводов в жиры и ускоряет расщепление глюкозы до СОг, а также увеличивает коли
12* 315
чество гликогена в сердечной мышце и мало изменяет его содержание в печени. СТГ усиливает липолитические превращения. Влияние этого гормона на различные стороны обмена веществ проявляется в изменении активности соответствующих ферментов.
Препараты СТГ убойных животных неэффективны в терапии болезней человека, так как структура их иная. При введении СТГ животным того же вида увеличивается скорость синтеза белка и интенсивность обмена липидов.
Адренокортикотропный гормон (АКТГ). АКТГ стимулирует рост клеточных элементов коркового слоя надпочечников, усиливает образование кортикостероидов, что является следствием активации ферментных систем и изменения проницаемости клеток надпочечников. Введение препаратов АКТГ животному изменяет белковый, липидный и углеводный обмен, а большие дозы его могут вызвать сдвиги и в водно-солевом обмене. Эти изменения зависят от повышения выделения гормонов коры надпочечников. Выделение АКТГ из гипофиза обратно пропорционально концентрации кортикостероидов в крови.
АКТГ представляет собой полипептид, состоящий из 39 аминокислотных остатков. Последовательность первых 24 остатков аминокислот АКТГ неизменна у всех изученных организмов, тогда как последовательность остальных 15 остатков у разных видов варьирует.
Установлено, что активность связана с центральным гептапептидом, построенным из аминокислот в положениях от 4 до 10. Последовательность 4—10 в АКТГ та же, что и последовательность 3—9 в а-меланоцитстимулиру-ющем гормоне. Благодаря наличию в цепях кортикотропинов пептидных фрагментов меланостимулирующих гормонов кортикотропины обладают и слабо выраженной меланоцитстимулирующей активностью.
Структура АКТГ человека следующая: КН2-Сер-Тир-Сер-Мет-Глу-Гис-Фен-Арг-Три-Гли-Лиз-Про - Вал-Гли-Лиз-Лиз-Арг-Арг - Про-Вал-Лиз-Вал-Тир-Про-Асп - Ала-Гли-Глу-Асп-Глу-Сер-Ала-Глу-Ала - Фен-Про-Лей - Глу-Фен-СООН.
Препарат АКТГ из гипофиза свиньи получил название кортикотропина А, а из гипофиза овцы а-кортикотропина. Из гипофиза свиньи методом противоточного распределения был выделен и р-кортикотропин.
316
Последовательность чередования различных аминокислот в АКТГ различных видов убойных животных приведена в табл. 49.
ТАБЛИЦА 49
Аминокислотный остаток
Животное Название гормона 25 26 27 28 29 30 31 32 33
Бык Кортикотропин Асп-Гли-Глу Асп-Глу-Асп Сер-Ала-Глу
Овца а-Кортико- Ала-Гли-Глу Асп-Асп-Глу Ала-Сер-Глу
Свинья ’ Кортикотропин А р-Кортико-тропин Гли-Ала-Глу Асп-Гли-Ала Асп-Асп-Глу Глу-Асп-Глу Лей-Ала-Глу Лей-Ала-Глу
Содержание АКТГ в гипофизах различных животных неодинаково. В большом количестве он содержится в гипофизах свиней, меньше его в гипофизах мелкого рогатого скота, лошадей и крупного рогатого скота.
Препараты АКТГ получают из тканей передней доли гипофиза путем экстрагирования кислотно-ацетоновым раствором. После осаждения и высушивания полученный порошок служит исходным материалом для получения биологически чистого и клинически активного АКТГ. Выход гормона составляет 0,2—0,5% от массы передних долей гипофиза. Очищенные препараты АКТГ хорошо растворимы в воде, теплоустойчивы.
АКТГ-цинк-фосфат — это препарат длительного действия в виде суспензии АКТГ-цинк в фосфатном буфере. Его приготовляют из порошка адренокортикотропного гормона.
Активность препаратов кортикотропина можно определить несколькими методами. При введении кортикотропина у экспериментальных животных уменьшаются лимфатические железы и масса тимуса. На этом основан один из методов стандартизации препаратов АКТГ. Уменьшение содержания аскорбиновой кислоты в надпочечниках подопытных животных — один из наиболее употребительных тестов для определения биологической активности препарата.
317
Тиреотропный гормон (ТТГ). Под влиянием ТТГ разрастаются ткани щитовидной железы, усиливается поглощение ею йода, повышается активность протеолитических ферментов железы, что обусловливает усиление поступления активных йодтиронинов в кровь. Действие ТТГ на различные стороны обмена веществ осуществляется через тиреоидные гормоны. Выделение ТТГ из гипофиза обратно пропорционально содержанию йодтиронинов в крови.
ТТГ является глюкопротеидом с молекулярной массой 26 000 — 31 000. Соотношения аминокислот в ТТГ различных видов животных одинаковые. В углеводах ТТГ нет сиаловых кислот, в них входят манноза, галактоза и фруктоза, а также аминосахара — глюкозамин и галактозамин.
Для приготовления гормональных препаратов используют кислые, щелочные и спиртовые вытяжки из гипофизов свиней и крупного рогатого скота. Гормон осаждают из экстрактов 70%-ным спиртом или 80%-ным ацетоном. Из 1 кг обезвоженных ацетоном бычьих гипофизов получают около 2,6 г активного белка. Определение биологической активности препаратов тиреотропина основано на его способности активировать функции щитовидной железы. Наиболее распространенным и чувствительным тестом является увеличение массы щитовидной железы однодневных цыплят или цитологическая реакция щитовидной железы морской свинки.
Гонадотропные гормоны (ГТ Г). Один из гонадотропинов, получивший название фолликулостимулирующего гормона (ФСГ), вызывает рост и созревание фолликулов в яичниках и увеличение сперматогенеза у самцов. Лютеинизирующий гормон (ЛГ), или гормон, стимулирующий интерстициональные клетки (ГСИК), влияет на превращение фолликула в желтое тело, а у самцов стимулирует увеличение придаточных половых желез.
Лактогенный гормон (пролактин) включен в число гипофизарных гонадотропинов потому что, помимо стимуляции лактации молочных желез, он усиливает функции желтого тела яичников (стимулирует образование прогестерона). Для нормальной функции яичника необходимо воздействие ФСГ, ЛГ и пролактина.
ФСГ является глюкопротеидом, содержащим до 8%
318
углеводов, в состав которых входят гексозоамины, манноза, галактоза и глюкоза. Белковая часть состоит из следующих аминокислот (в %) аргинина 5,3, аспарагиновой кислоты 9,3, валина 5,8, гистидина 3,7, глютаминовой кислоты 13,4 изолейцина 9,2, лизина 11,1, метионина 1,0; пролина 5,2, тирозина 3,8, треонина 4,7, фенилаланина 5,8, цистина 4,4. Молекулярная масса ФСГ около 29,000, изоэлектрическая точка соответствует pH 4,5.
Препарат ФСГ получают из кислых или щелочных вытяжек измельченных тканей гипофиза при осаждении сернокислым аммонием. В отличие от других гипофизарных гормонов ФСГ растворяется в полунасыщенном растворе сернокислого аммония. При 0,75 насыщения сульфатом аммония получают осадок, который после высушивания в вакууме очищают растворением и фракционированием сернокислым аммонием. Препараты ФСГ различных животных отличаются по иммунобиологическим свойствам.
ЛГ также является глюкопротеидом. В состав углеводного компонента входят (в %): N-ацетилгалактоза-мин 12,26, N-ацетилглюкозамин 5,6, манноза 4,2, фруктоза 1,1, галактоза 0,8, N-ацетилнейраминовая кислота 0,5 и уроновые кислоты 0,14. Углеводный компонент соединен с аспарагиновой и глютаминовой кислотами полипептида ковалентной связью. Пептидная часть ЛГ составляет 65,4% от его молекулярной массы.
Препараты ЛГ получают из овечьих и свиных гипофизов, причем в железах овец гормона содержится больше, чем в железах свиней. В гипофизах крупного рогатого скота содержатся сравнительно малоактивные гормоны. Из 40%-ного спиртового экстракта гипофиза, предварительно высушенного в ацетоне, получают осадок (осаждают более концентрированным спиртом), который высушивают с помощью абсолютного спирта и эфира. Полученный порошок в дальнейшем очищают путем солевого растворения, повторного осаждения протеида в изоэлектрической области.
Из гипофизов различных видов препараты отличаются иммунологически, что, по-видимому, обусловлено различной формой их белковых молекул. Для проявления гормональной активности важно наличие свободных амино- и дисульфидных групп. Овечьи препараты ЛГ более активны, чем препараты из гипофизов свиней.
319
Хорионический гонадотропин (ХГ). Эг гормон по своему действию напоминает гонадотропи- гипофиза, образуется в плаценте во время беременное-'-Определяя его содержание в крови и моче, можно прё? дить раннюю диагностику беременности.
Получение эффективных препаратов гонадотропин-из гипофизов убойных животных связано со значителън ми трудностями. Клиническое применение нашли препа раты из сыворотки крови и из мочи животных.
Гонадотропный гормон сыворотки жеребых кобыл (ГТГСЖК) также является глюкопротеидом, содержа шим около 18% углеводов. В состав углеводного компо пента входят: 14,1 % гексозамина и 10,4% сиаловой (нейраминовой) кислоты, а также галактоза, манноза, глюкоза и рамноза. Гормональная активность ГТГСЖК аналогия на действию искусственной смеси ФСГ и ЛГ. Препараты этого гормона получают из сыворотки крови осаждением спиртом или ацетоном. Восстановление дисульфидных связей в молекуле гормона приводит к потере активности В результате воздействия амилазы гормон также инактивируется: следовательно, углеводы необходимы для про-явления гормональной активности.
Определение биологической активности препаратов гонадотропинов основано на их свойстве вызывать преждевременное развитие половых органов у неполовозрелых самок мышей и крыс.
Лактогенный гормон (пролактин). Этот гормон стимулирует лактацию молочных желез. Акт сосания и доения повышает нервно-рефлекторную возбудимость передней доли гипофиза, чем обусловливает повышенную секрецию пролактина, который вызывает отделение молока молочными железами. Однако это действие гормон оказывает лишь после стимуляции молочной железы эстрогеном и прогестероном. Важной функцией пролактина является стимуляция образования гормонов яичниками и желтым телом.
По химической природе пролактин является белком молекулярная масса которого 26 000. Изоэлектрическая точка пролактина соответствует pH 5,73. Молекула пролактина представляет собой одиночную полипептидную цепь, которая построена из 211 остатков аминокислот. На ее N-конце находится треонин. С-конец отсутствует, вместо него имеется кольцевая структура
320
1
МН2-ТРе-ПРо-Вал__П(,о1^11-1|ис—-—
S I
Цис—Асп—Лей-
в железах овец и крупного рогатого ск^а ПрлЛошадей. содержится больше, чем в свиных и ГИП°Ф п(УГНО.ацето-Препараты пролактина получают путем аценового экстрагирования, затем осаждают солевым
тоном, растворяют осадок и вновь осажд сексаго-раствором. Кристаллический пролактин в леННОго нальных кристаллов можно получать из ра Д . ацетонового раствора аморфного препарат • ' его Не
таллического пролактина небольшой, а аКТ Кислые выше активности луч1цих аморфных препар йсп0Льзу-растаоры лактогенного гормона устойчивы,
ется при изготовлении препаратов. -ппрпаоатов
Определение биологической активност Р зВИ.
пролактина основано 11а способности его вызь в 'ыШСй тие зоба у голубей и лактацию у кастриро
и морских свинок. стимуля-
Препараты пролактина применяются д ма-
пии лактации при недостатке молока У г
Гормон средней дпли гипофиза. Из сРе^е^ v п и о У10' физа наиболее изучен мел анонитсти У ли у у ший гормон (МСГ). Этот гормон Из
витие пигментированных клеток (меланоф V олипепти-средней доли гипофиза свиньи выделено Д о^озпаЧСны да, которые обладали активностью MCI. и „г.г,ака) и как а-МСГ (содержит 13 аминокислотных Q6c
В-МСГ (содержит 1g аминокислотных / ийИКе.
фракции МСГ синтезированы и приме меданости-Пентапептид’. Гис-Фед-Арг-ТриТли облаД более сла-
мулирующей активностью, хотя во много Pd
бой, чем МСГ. мСГ но В-МСГ
Не у всех животных обнаруживают а- ’ от гИПо-
находят всегда. В гипофизе человека в о проДУ'
физов животных нет средней доли, но есть
пирующие р-МСГ.
321
Ниже приводится последовательность аминокислотных остатков в р-МСГ, полученных из гипофизов пяти различных видов (замены аминокислот по отношению к р-МСГ человека подчеркнуты).
Человек
Ала-Глу-Лиз-Лиз-Асп-Глу-Гли-Про-Тир-Арг-Мет-Глу-Гис-Фен-Арг^ Три-Гли-Сер-Про-Про-Лиз-Асп, ;
Обезьяна . !
Асп-Глу-Гли-Про-Тир-Арг-Мет-Глу-Гис-фен-Арг-Три-Гли-Сер-Про.
Про-Лиз-Асп.
Лошадь
Асп-Глу-Гли-Про-Тир-Лиз-Мет-Глу-Гис-Фен-Арг-Три-Гли-Сер-Про-Арг-Лиз-Асп.
Бык
Асп-Сер-Гли-Про-Тир-Лиз-Мет-Глу-Гис-Фен- Арг-Три-Гли-Сер-Про-Про-Лиз-Асп.
Свинья
Асп-Глу-Гли-Про-Тир-Лиз-Мет-Глу-Гис-Фен-Арг-Три-Гли-Сер-Про-, Про-Лиз-Асп.
Из средней доли гипофиза получают препарат интермедин (МСГ), который применяют для лечения пигментной дегенерации. Его получают из щелочных экстрактов гипофизов крупного рогатого скота и свиней. Часто сырьем служит остаток измельченных гипофизов после извлечения АКТЕ и пролактина. Активность препарата проверяют по действию его на перепонку задней лапки лягушки (под микроскопом видно появление отростков пигментных клеток) и по почернению кожи на спинке и дорзальных отделах лапок.
Гормоны задней доли гипофиза. Из задней доли гипофиза (нейрогипофиза) млекопитающих выделены два нонапептида— окситоцин и вазопрессин. Окситоцин стимулирует сокращение гладкой мускулатуры стенки матки и отделение молока у лактирующих животных, а вазопрессин — сокращение стенок кровеносных сосудов, способствуя повышению кровяного давления. Кроме того, вазопрессин понижает диурез, контролируя абсорбцию воды и солей в канальцах почек.
Вазопрессин и окситоцин образуются в ядрах гипота-
322
ламической области и по мере надобности поступают в заднюю долю гипофиза и здесь депонируются
NH2 I
Цис-Тир-Илей
S I
S
Цис-Аспн-Глун
О
II
Про-Лей-Гли-С-ЫНа
Окситоцин быка
nh2
I
Цис-Тир-Фен
S
S
I
Цис-Аспн-Глун
О
II
Про-Арг-Гли-С-МНа
Вазопрессин быка
Оба эти гормона — совершенно разного действия, однако характеризуются сходным строением. Различия между окситоцином и вазопрессином касаются только двух аминокислотных остатков в положениях 3 и 8. Строение окситоцина у разных видов животных одинаково. Структуры нонапептидов, выполняющих функции вазопрессина, у разных видов животных различаются природой аминокислотных остатков в положении 8 и иногда в положении 3.
Из задней доли гипофиза убойных животных получают препарат питуитрин — очищенный экстракт, активным началом которого является окситоцин и вазопрессин. Питуитрин в качестве компонента входит в препарат мам-мофизина, используемого в акушерской практике. Наряду с этим питуитрин используют при гипотонии, атонии и некоторых случаях задержки мочеиспускания.
Для получения из экстракта задней доли гипофиза прессорных или окситоцических концентратов применяют различные адсорбционные методы, основанные на том, что разные адсорбенты предпочтительно адсорбируют одно из этих активных начал.
Препарат адиурекрин, активным началом которого является вазопрессин, получают в виде порошка из обезжиренной и обезвоженной ткани задней доли гипофиза свиней или крупного рогатого скота. Препарат применяется при несахарном мочеизнурении.
Препарат гифотоцин (очищенный экстракт задней доли гипофиза), активным началом которого является
323
окситоцин, используется как родовспомогательное средство при повышенном кровяном давлении.
Активность питуитрина и гифотоцина определяют по их действию на гладкую мускулатуру переживающей матки, взятой от девственной морской свинки. Кроме того, проверяют эффект воздействия препарата гифотоцина на кровяное давление. В основу определения активности адиурекрина положено его задерживающее действие на мочеотделение и повышение кровяного давления.
Синтезированные окситоцин и вазопрессин (в 1953 г.) по физиологическим, химическим и биологическим свойствам оказались идентичными природным гормонам. В настоящее время синтезируют не только окситоцин, вазопрессин и их аналоги, но и гормон-гибрид вазотоцин, характеризующийся свойствами одновременно обоих гормонов.
ПИЩЕВАРИТЕЛЬНЫЕ ЖЕЛЕЗЫ
Пищеварительные железы убойных животных являются богатым источником ферментного сырья, еще недостаточно изученного и далеко не полностью и целесообразно используемого. В мясной промышленности из этого сырья изготовляют лечебные и промышленные препараты. Для получения ферментных препаратов используют слюнные железы, слизистую желудка, поджелудочную и другие железы.
СЛЮННЫЕ ЖЕЛЕЗЫ
Околоушные, подъязычные и подчелюстные слюнные железы — парные органы. Основные ферменты этих желез— амилаза и лизоцим (комплекс ферментов).
Амилаза. Этот фермент извлекают из измельченной ткани железы водой или солевыми растворами, затем осаждают ацетоном, спиртом или сернокислым аммонием или адсорбируют на крахмале. Молекулярная масса кристаллической амилазы 20 000. В организме животных обнаружена а-амилаза. Препарат ее неустойчив в кислой среде, при pH ниже 3,8 полностью инактивируется. Оптимум pH для амилазы 6,8. Фермент не теряет активности при нагревании до 70°С. При диализе амилаза также инактивируется, но активность вновь восстанавливается,
324
если в раствор ввести поваренную соль. Оказалось, что NaCl препятствует образованию недеятельного комплекса муцина с амилазой и активирует фермент в концентрации 1—0,2 н.
Лизоцим (мурамидаза). Данный фермент вызывает цитолиз бактерий, гидролизируя прежде всего особые связи в мукополисахаридах и мукопептидах. Кристаллизуется в виде хлорида из раствора, pH которого ниже 7. Молекулярная масса белка 14400, изоэлектрическая точка находится при pH 10,5-11,0, что объясняется значительным содержанием (свыше 30%) в белке основных аминокислот. Фермент устойчив в кислой среде и неустойчив в щелочной. Лизоцим по специфическому действию — растворению (греч. lysis — растворение) бактериальных полисахаридов, входящих в состав оболочек клеток и, следовательно, губительному действию на бактерии — подобен антибиотикам. Оптимальная активность его наблюдается в нейтральной среде.
СЛИЗИСТАЯ ЖЕЛУДКА
Слизистая желудка (свиного или сычуга жвачных) довольно сложного строения. В ее составе находятся железы трех видов: фундальные, кардиальные и пилорические. Основное значение имеют фундальные (железы дна Желудка) железы, состоящие из главных клеток, секретом которых является пепсин, и обкладочных, выделяющих соляную кислоту. Секрет желудочных желез — желудочный сок — представляет собой прозрачную, бесцветную или слегка желтоватую жидкость резко кислой реакции (у крупного рогатого скота pH желудочного сока 2,17— 3,14). Сухой остаток желудочного сока составляет 0,5— 0,6% и состоит из белков, пепсина, аминокислот, соляной кислоты (в желудочном соке крупного рогатого скота 0,1—0,25%, свиней 0,3—0,4%, птицы 0,1—0,31%), минеральных солей (0,1%).
Пепсин. Основной фермент слизистой желудка был открыт в 1836 г., но только в 1930 г. получен в кристаллическом виде. В слизистой пепсин находится в неактивном состоянии в виде пепсиногена.
Молекула пепсиногена построена из одной неразветв-ленной полипептидной цепи, образующей две петли, фиксированные дисульфидными мостиками; N-концевой уча
325
сток — лизин, С-концевой — аланин. Пепсиноген в процессе пищеварения быстро активируется в пепсин
(пепсин)
Пепсиноген---------► Соединение пепсин-ингибитор (пептид)
(кислота)
pH > 5 И pH < 5
Пепсин + Ингибитор ' '
Для активации процесса достаточно подкислить раствор пепсиногена, так как в растворе всегда имеются следы пепсина. Ингибитор пепсина — полипептид, молекулярная масса которого 3000.
При активации от пепсиногена отщепляется около !/s исходной молекулы и, по-видимому, происходит разрыв нескольких пептидных связей в структуре белка, так как активный фермент становится более лабильным. Еще окончательно не выяснено, состоит ли молекула пепсина как и пепсиногена, из одной полипептидной цепи или из двух (в результате активации и разрыва связей).
ТАБЛИЦА 50
Аминокислоты Число остатков, моль
пепсин пепсиноген
Лизин 1 11
Гистидин . 1 3
Аргинин 2 4
Аспарагиновая кислота 40 46
Треонин 25 28
Серин . 43 47
Глютаминовая кислота 26 30
Пролин 16 19
Глицин 34 36
Аланин 16 21
Цистеин 6 6
Валин 20 25
Метионин 4 4
Изолейцин 23 25
Лейцин 28 33
Тирозин 16 17
Фенилаланин 14 15
Триптофан 6 6
Амиды 27 27
Фосфат 1 27
Всего остатков 321 376
326
Как видно из табл. 50, в процессе активации происходят существенные изменения в составе аминокислотных остатков пепсина по сравнению с пепсиногеном, связанные с отщеплением отдельных аминокислот и низкомолекулярных пептидов.
Для получения кристаллического фермента пепсин извлекают из измельченной слизистой путем настаивания с водой и последующего осаждения фильтрата сульфатом магния (0,6 насыщения) в кислой среде. Повторно его осаждают из слабокислого раствора (pH около 4,0), доводя pH до 2,5. Кристаллизуется фермент из раствора, pH которого 4,0, при медленном охлаждении. Кроме того, пепсин растворяется в 65 %-ном этиловом спирте и кристаллизуется из 20%-ного спиртового раствора. Кристаллический пепсин неоднороден; он представляет собой смесь нескольких белков. С помощью гельфильтрации можно получить очищенный пепсин. Молекулярная масса его 35500. В молекуле пепсина содержится всего 321 аминокислотный остаток (табл. 50), мало основных и много кислых аминокислот — аспарагиновой (16%) и глютаминовой (11,9%). Поэтому белок имеет изоэлектрическую точку в очень кислой среде — pH 1,1. В составе молекулы пепсина содержится большое количество гидроксильных групп (табл. 51), что объясняется высо-
ТАБЛИЦА 51
Показатели Пепсин Химотрипсин -
Молекулярная масса 35500 24000
Общее количество функциональных групп Количество групп 306 215
катионных • 6 19
анионных 37 25
амидных 32 27
Избыток катионных групп . —31 —6
Гидроксильные группы 68 47
ким содержанием оксиаминокислот (22% серина, треонина). N-Концевой группой пепсина является изолейцин, а С-концевой — аланин.
В молекуле пепсина в стехиометрическом соотношении (1 г-экв на 34 000 г) содержится фосфорная кислота, связанная с гидроксильной группой серина. В активном центре фермента функционируют две карбоксильные группы. Фермент наиболее активен при pH 2, но в интервале pH 2—4 подвергается автолизу. При автолизе в течение 24 ч при 45° С он инактивируется с выделением 40% тирозина, входящего в состав пепсина. Наиболее устойчив пепсин при pH 5,0—5,5; при более высоком значении pH (>6) белок быстро денатурируется. Пепсин способствует быстрому снижению вязкости казеина, желатина, а также свертыванию молока (как химозин). Кристаллический пепсин характеризуется высокой каталитической активностью: 1 г препарата за 2 ч «переваривает» 50 000 г сваренного яичного белка или свертывает 100 000 л молока.
Пепсин эффективно расщепляет связи, образованные ароматическими аминокислотами (фенилаланин, триптофан, тирозин), а также лизином. Фермент гидролизует также сложные эфирные связи.
Под действием пепсина на белки образуются крупные обломки в виде полипептидов с высокой молекулярной массой.
Ингибиторами пепсина являются вещества, денатурирующие белки: соли тяжелых металлов, некоторые кислоты (салициловая, карболовая), а также эфир, хлороформ, таннин.
При промышленном получении препарата слизистую желудка автолизируют в присутствии соляной кислоты при температуре 42°С. Пепсин, перешедший в раствор, выделяют методом высаливания или вакуум-упаривания и высушивают. Таким образом получают сухие препараты пепсина — пищевого (для свертывания молока в сыроделии) и медицинского (разбавленного индифферентным наполнителем — лактозой). Для лечебных целей выпускают также искусственный желудочный сок — раствор пепсина в соляной кислоте.
Ренин. Фермент ренин, или сычужный фермент (химозин), выделяют из слизистой желудка (сычуга жвачных) молодых животных (телят, ягнят). В желудке телят он появляется на третьем месяце эмбрионального развития, наиболее активным становится в молочном возрасте, а затем его активность постепенно снижается. В кристалли
323
ческом видё химозин получают путем последовательного насыщения сычужного сока (извлеченного из слизистой) хлористым натрием и диализа против поваренной соли. Полученный при этом осадок растворяют в воде. Кристаллизация фермента происходит на холоду.
Кристаллический ренин состоит из трех различных компонентов (разделение на ДЭАЭ — целлюлозе, иммуно-электрофорез), обладающих ферментативной активностью. Молекулярная масса кристаллического ренина 40 000, изоэлектрическая точка при pH 4,6. В составе ренина, как и пепсина, имеется много дикарбоновых кислот, но в отличие от пепсина в нем мало оксиаминокислот; N-концевая группа ренина — глицин, а С-концевая — лейцин или изолейцин.
Ренин катализирует свертывание молока. В основе этого процесса лежит превращение казеиногена в казеин в результате отщепления полипептида — сывороточной альбумозы. Казеин образует с ионами кальция нерастворимый осадок, который выделяется в виде сгустка.
Препарат ренина изготовляют в виде сухого порошка и используют в сыроделии.
Протеолитическое действие ренина выражено слабее, чем у пепсина. Оптимум его гидролитической активности проявляется при pH 4,0, хотя по специфичности действия они весьма сходны.
В рубце животных благодаря наличию разнообразной микрофлоры синтезируются различные витамины: тиамин, рибофлавин, аскорбиновая кислота, весьма ценный витамин В12 и др. В 1 кг сухого вещества рубца содержится 100—300 мкг витамина Вы, а в таком же количестве сычуга 1250 мкг.
ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
В поджелудочной железе различают две основные части: внешнесекреторную и инкреторную. Внешнесекреторная железа составляет главную массу железы и выделяет секрет (сок) через мельчайшие капилляры, которые объединяются в выводной проток, открывающийся в двенадцатиперстную кишку; инкреторная железа во много раз меньшая по объему, выделяет секрет в кровяное русло. В соке поджелудочной железы домашних животных содержится значительно больше плотных веществ (до 10%) ,
329
чем в желудочном соке (в основном белки); pH панкреатического сока крупного рогатого скота около 8,0.
Поджелудочная железа вырабатывает комплекс разнообразных ферментов. Ионообменной хроматографией удалось разделить около 80% всех выделяемых ферментов. Содержание их в соке характеризуется следующими данными (в %).
Протеолитические ферменты трипсиноген...............14
химотрипсиноген а . . 16 химотрипсиноген . . 16 прокарбопептидаза А .19 прокарбопептидаза В . 7 карбопептидаза .... 7
Расщепляющие нуклеиновые кислоты
рибонуклеаза .... 2,4
дезоксирибонуклеаза . 1,4
Амилолитические .... 1,4
Липолитические .........Очень
мало
Неидентифицированные . . 10
Промышленный интерес представляют ферменты белкового обмена: трипсин и химотрипсин. Для выделения их свежую железу быстро охлаждают, измельчают и помещают в раствор 0,25 н. серной кислоты, чтобы создать среду, неблагоприятную для действия ферментов. Экстракция продолжается в течение 24 ч при 5°С. Затем вытяжку отделяют и постепенно при охлаждении насыщают сернокислым аммонием. При этом происходит ступенчатое выделение белков, представляющих собой ферментные фракции (рис. 41). Таким образом можно получить восемь фракций ферментов: трипсиноген, трипсин, «-химотрипсиноген, а-химотрипсин, p-химотрипсиноген, р-хи-мотрипсин, рибонуклеазу, дезоксирибонуклеазу. Каждая фракция может быть получена в кристаллическом виде. В последнее время для разделения ферментов сока поджелудочной железы используют ионообменные смолы, например диэтиламиноэтилцеллюлозу.
Из экстракта поджелудочной железы в промышленности выделяют и получают новые препараты ингибитора трипсина, коллагеназу, эластазу, рибонуклеазу. .
Трипсиноген. Неактивная форма трипсина, которая при растворении в нейтральном растворе быстро превращается в активный трипсин. Активация происходит автокаталитически, так как, по-видимому, в препарате трипсиногена всегда содержится некоторое количество трипсина.
В организме животных трипсиноген активируется энтерокиназой, выделяемой слизистой кишечника. Актив-ззо
ними центрами трипсина являются остатки серина и гистидина, которые в молекуле трипсиногена находятся в скрытом состоянии. Переход трипсиногена в трипсин связан с гидролизом одной пептидной связи в молекуле белка и отщеплением гексапептида (рис. 42). В результате
Кислая бытяжка из поджелудочной железы быка
Осадок
Трипсин "‘Трипсиноген
Рис. 41. Относительное положение кристаллических ферментов при их последовательном выделении.
-0.1
-0,2
трипсин трипсин
удаления ингибитора спирализация пептидной цепи белка возрастает, благодаря чему происходит сближение центров — остатков серина и гистидина.
Трипсин. Молекула трипсина состоит из полипептид-ной цепочки, соединенней внутримолекулярными водородными и дисульфидными связями. Молекулярная масса фермента 34 000. Изоэлектрическая точка трипсина находится в щелочной зоне —при pH 10,4—10,8.
331
' В состав молекулы трипсина входят 223 аминокислотных остатка. Молекула имеет жесткое строение, поэтому она устойчива к действию горячих растворов разбавленных кислот- Каталитическое действие трипсина сводится к гидролизу пептидных связей белков и пептидов (при оп-
Рис. 42. Схема активирования трипсиногена:
А— аспарагиновая кислота; Гл —глицин; Ги и Н — гистидины; И — изолейцин; Л — лизин; Се — серин; В — валин.
тимальном значении pH 7—9), в которых карбонильные группы образованы из молекул лизина или аргинина.
Этим избирательным действием трипсина пользуются для изучения первичной структуры белков.
При хранении поджелудочной железы в условиях низкой температуры активность трипсина увеличивается в результате автоактивации. Продолжительный автолиз тканей поджелудочной железы вызывает снижение протеолитической активности фермента.
Химотрипсин. Вырабатывается железой в неактивной форме в виде химотрипсиногена. Химотрипсиноген активируется энтерокиназой или трипсином. При этом отщепляется ингибитор — полипептид (молекулярная масса 1200). Активация химотрипсиногена — сложный многоступенчатый процесс, связанный с освобождением нескольких промежуточных продуктов; в процессе активации последовательно образуются а-, (3-, у-химотрипсины. Молекула химотрипсина состоит из А-цепи (13 аминокислотных остатков), В-цепи (12 аминокислотных остатков) и С-цепи (97 аминокислотных остатков). Всего 239 аминокислотных остатков. Цепи стабилизированы S — S-связями. В активный центр фермента входят серин и, по-ви-димому, гистидин.
332
Наибольшая активность кристаллического химотрипсина проявляется при pH 7—9. Химотрипсин полнее, чем трипсин, гидролизует казеин и лактальбумин, но по другим пептидным связям—преимущественно по тем, у которых карбонильные группы образованы из молекул тирозина или фенилаланина.
Рибонуклеаза. Фермент рибонуклеаза расщепляет РНК. Пептидная цепь фермента (рис. 43) состоит из
!2
10
Ап^Ап—Лиз—Лен—Гпю^^рг^Гпн—Гис—Мш—Ас—Сер—Сер— Гре— Сер—Ал—АЛ—>
---------------. - у
^2222^2 lpC~-nip~DlH — Gep— Tup*— Gep~ Tpe— ААав~~
" Ace J
Глн —Ал—вал—Иас—сер^Глн—лаз^У вал,— |Г '•
Глю
Лиз ♦
NHl
СООН
By
-ВШ1—Ал~Цш;~Глн1~ Гли-МЯ-Лр/г-Тир ~Рлл~Лря~Р^Г-1йС~Фея~'Ас'~Ал~С1р
ИЗ
f/oe A^i
Af W цис Apr I
Тре Гяп
Гли
tin
'Лиз—АсЛ—АЛ~Глн—Тре—Тре—Лиз^Тир~АЛ~Ццс^АСН‘—Лро—Тар‘'‘~ЛаГ'~вар‘
гее^-Яал^Фен—7ре—ленивая—лрп—-Лез—1/лл~Арг~А(Е-лиз~Тре—/гей^Асн~Арг^/
Рис. 43. Схема первичной структуры молекулы рибонуклеазы: Дс — аспарагин; Гл — глютамин; цифры обозначают номера аминокислотных остатков»
124 аминокислотных остатков, соединенных четырьмя дисульфидными мостиками (см. рис. 4). Молекулярная масса 12 700. Белок довольно термоустойчив.
Эластаза (панкреатпептидаза е). Действие эластазы описано выше (см. с. 141). Фермент состоит из одной полипептидной цепи с четырьмя дисульфидными связями.
В мясной промышленности поджелудочную железу в первую очередь используют для выделения инсулина, а из остатка получают липокаин. Только небольшая часть сырья, в основном подвергшегося автолизу (возможно разрушение инсулина), используется для получения ферментных препаратов. Из поджелудочной железы, непригодной для производства инсулина, изготовляют медицинский и технический панкреатин (применяется в кожевенной промышленности в качестве кожевенного мягчителя).
333
Список рекомендуемой литературы
Бендолл Дж. Мышцы, молекулы и движение. М., «Мир», 1970. 256 с.
Бернхард С. Структура и функции ферментов. М., «Мир», 1971. 334 с.
Гауровиц Ф. Химия и функции белков. М., «Мир», 1965. 530 с.
Гуров В. А., Иноземцева М. А., Замиховский А. Б. Справочник по производству органопрепаратов. М., «Пищевая промышленность», 1970. 318 с.
Ж о л и М., Физическая химия денатурации белков. М., «Мир», 1968. 364 с.
ЗбарскийБ. И., ИвановИ. И., МардашеевС. Р. Биологическая химия. Л., «Медицина», 1972. 582 с.
Крылова Н. Н., Ляско вская Ю. Н. Физико-химические методы исследования продуктов животного происхождения. М., «Пищевая промышленность», 1965. 316 с.
Лозино-Лозинский Л. К. Очерки по криобиологии. Л., «Наука», 1972. 288 с.
Петровский К- С. Гигиена питания. Т. I. М., «Медицина», 1971. 512 с.
Райх Г. Коллаген. М., «Легкая индустрия», 1969. 328 с.
Соколов А. А. Физико-химические и биохимические основы технологии мясопродуктов. М., «Пищевая промышленность», 1965. 490 с.
Соловьев В. И. Созревание мяса (теория и практика процесса). М., «Пищевая промышленность», 1966. 338 с.
Суриков М., ГолендаИ. Гормоны и регуляция обмена веществ. Минск, «Беларусь», 1970. 144 с.
Химия белка. Ч. II. Изд. Ленинградского университета, 1971. 112 с. Авт.: И. П. Ашмарин, Н. В. Садикова, С. Е. Тукачинский, А. А. Мильберг.
Шестакова И. А. Структура и свойства коллагена. М-> «Легкая индустрия», 1968, 72 с.
Предметный указатель
А
Автолиз 64, 68, 70, 73, 74, 77, 79, 82, 119, 155, 202, 215, 251, 263 — внутренних органов 215 — жировой ткани 155 — крови 119 — мозговой ткани 202 — мышц 64, 70, 73, 74, 77, 78, 79, 82
---- гликогена 64
---- липидов 73
----миофибрилл 76
----мононуклеотидов 68
----саркоплазмы 74
----ферментов 78
— мяса при холодильной обработке 251, 267
— эндокринных желез 298
Аденилактиназа 62
Адениловая кислота (АМФ) 52, 54, 62, 69, 200
Аденозиндифосфорная кислота (АДФ) 29, 30, 52, 69
Аденозинтрифосфорная кислота (АТФ) 29, 54, 69, 71, 253
Аденозинтрифосфатаза (АТФ-аза) 30, 44, 52, 59, 254
Адиурекрин 323
Адреналин 299, 311
Адренокортикотропный гормон 315, 316
Адренохром 313
Азот 99, 129, 267
Аксон 195, 199
Актин 32, 41
Актомиозин 33, 41, 264
Акцелерин 116
Альбумины 27, 91, 99, 147, 184, 205
—крови 27
— мышц 27
Альдегиды 162, 165, 229, 238
— азелаиновый 163
— гептиловый 163
— нониловый 163
Альдестерон 311
Амилаза 324
Аминокислотный состав белков 22, 122, 129, 130, 140, 186
Аммиак 213, 229, 233, 241, 242
Андрогены—см. Мужские половые гормоны
Ансерин 48
Антигены 84, 138, 298
Антикоагулянты 116
Антиокислители 169
Антитела 84, 97, 298
Антитромбин 117, 219
Антитромбопластин 117
Арахидоновая кислота 148, 150
Аскорбиновая кислота 63, 138, 143, 169, 275
Аспарагиновая кислота 86, 291
Ацетилхолин 198, 201
Ацетильное число 167
Б
Белки 18, 84, 127, 147, 181, 184, 185, 196. 205, 213, 222, 236, 255, 263
— внутренних органов 205, 213
— жировой ткани 147
— крови 84, 86, 89, 90
— мышечной ткани 18, 21, 27, 39, 40, 254
— мяса 222, 235, 236, 255, 263, 287
•— нервной ткани 194, 196
— покровной ткани 184
— соединительной ткани 127
— хрящевой ткани 181, 184
Белое вещество 194, 196
Биливердин 100, 211, 213
Билирубин 100, 211, 213
Бромелаин 239
Бутилоксианизол 171
Бутилокситолуол 171
Буферная способность мышц 25, 73
Буферные системы крови 88,89
В
Вазопрессин 322
Витамины 100, 123, 153, 154, 167, 209, 214, 215, 217, 225, 260, 279, 285, 292
— А 100, 123, 153, 209, 217, 225
— В! 209
— В2 209, 214
— В6 179, 209, 226, 260
335
Витамины Bi2 179, 209, 217, 219, 226, 231, 260
__ С 179 914
— D ЮО’, 154, 179, 225
— Е 100, 154, 167, 170, 217, 225
— К ЮО, 209, 217, 225
— РР 209
Вода свободная 16
» связанная 16, 17
Водоудерживающая способность мышц 77, 258, 283
Выделение белков 18
Г
Гем 23, 103, 109, 245
Гаматин 109
Гемпигменты 245
Гематоген 124
Гемоглобин 86, 102, 103, 106, 107, 109, 118, 122
Гемолиз 118, 121
Гемоглобинолиз 118
Гемокупреин 94
Гемпигменты 245
Гепарин 116, 143, 145, 208, 214, 215, 220
Гиалуронидаза 145
Гиалуроновая кислота 143, 144,
145
Гидрокортизон 310
Гидролиз 68, 138, 156, 252, 277, 292
Гидролизаты 123
Гидролитическая порча жиров
156, 168, 277
Гидроперекиси 159
Гипофиз 314
Гипофункция желез 302, 303, 305
Гифотоцин 323
Гликоген 46, 64, 208, 252
Глиальные клетки 197
Гликогенолиз 60
Гликокол 129, 130
Гликолиз 60
Гликолитические превращения 47, 52, 68, 261, 267
Глобин 103, 109, НО
Глобулин 26, 41, 90, 92, 99, 115, 147, 205, 264
— антигемофильный 112, 115
—' а-глобулин 90, 92
— Р-глобулин 90, 92
— у-глобулин 92
— X 26, 41, 255, 260
Глюкагон 306
Глюкоза 46
Глюкокортикостероиды 310
Глюкооксидаза 172
Глюкопротеиды 126
Глютаминовая кислота 191, 238
291
Глюколипиды 197, 198
Глютатион 49, 198, 291
Головной мозг 194
Гонадотропный гормон (ГТГ) 309, 315, 318
Гормоны 297
— передней доли гипофиза 314
— средней доли гипофиза 321
— задней доли гипофиза 322
— надпочечников 309
— поджелудочной железы 303 306
— желез 306
— паращитовидных желез 302
— щитовидной железы 300
д
Дегидроадреналин 312
Денатурация белков 287
Дериваты 183
Дерма 184
Детергены 188
Дефибринирование 118, 124
Дийодтиронин 300
Дисульфидные связи 186, 187, 190
Ж
Желатин 136, 181
Желатозы 137
Желчные кислоты 219
Желудочный сок 325, 328
Желчь 210
Женские половые гормоны 308
Жирные кислоты 86, 148, 149, 150, 151, 168
Жировая ткань 145, 146, 148, . 152, 155, 157, 164, 168, 221 Жиропот 192
3
Замораживание мяса 249
Золка 176
И
Идуроновая кислота 143
Индол 243
Инсулин 299, 303, 333
Интермедин 322 йод 151 йодное число 151, 153
К
Калликреины 95
Каратиноиды 154, 170
Карбоксигемоглобин 107
Карбоксильная группа 150
Карбонильное число 165
Карбонильный индекс 147
Карбонильные соединения 162, 229, 284
Карнитин 49
Карнозин 48, 291
Каротин 153
Каратиназа 153
Каротиноиды 144, 154
Катепсины 79, 238, 268, 279
Катионы магния и бериллия 117
Каратеин 187
Кератин 185, 188
Кератосерная кислота 143
Кетоны 164, 229, 238
Кинины 95
Кислотное число 150
Кислый белок 40, 41
Коллаген 41, 128, 147, 175, 183,
206, 223, 232, 264
Коллагеназа 135
Комплемент 97
Конвертин 115
Копчение 281
Корковый слой надпочечников 310
Кортикальные гормоны (кортикоиды) 310
Кортикостерон 310
Кортин 311
Костная ткань 174, 175, 178
Костный мозг 179
Кость 173, 174, 179, 180
Креатин 50, 228, 238, 291
Креатинин 99, 208, 228, 238, 291
Креатинфосфат 50
Кровь 84, 89, 101, 111, 121
— автолиз 119
— биохимические функции 84
— гемолиз 118
— дефибринирование 118
— микробиальные изменения 120
— морфология 85
Кровь пищевая ценность 121
— препараты 123
— свертывание 111
— свойства 86
— состав 86
--- белки 90
--- небелковые компоненты
98
---ферменты 94
— — форменные элементы 101
— стабилизация 116
Л
Лактогенный гормон 318, 320
Ланолин 192, 193
Латекса 239
Легкие 215
Лейкоциты 101, ПО, 119
Лецитины 170
Лизосомы 15, 44, 68, 235, 236
Лизоцим 325
Лимонная кислота 176, 178, 180
Линоленовая кислота 150, 151, 159
Липаза 165, 246, 277
Липиды 45, 73, 99, 153, 199, 202, 203, 213, 246, 292
— внутренних органов 207, 214, 217
— жировой ткани 146
— мышечной ткани 45
• — мяса 292
— нервной ткани 195, 197, 199, 202, 203
— плазмы крови 99
Липокаин 306, 333
Липопротеиды 41, 94, 196, 206
Лютеин 100
Лютеинизирующий гормон
(ЛГ) 318, 319
М
Микроэрги 301
Мацерация кости 175
Межуточное вещество 174, 184
Меланины 191
Меланоцитстимулирующий гормон 321
Метгемоглобин 107, 216
Метмиоглобин 24, 269
Механохимия мышечного сокращения 36
Микробиальная порча мяса 240
Микросомы 205, 208
337
336
Микроэлементы IT^, 203 Минеральные вещ<еств;1 53, 100, . 177, 179, 181, 19*9, 226 Миоальбумин 26, 41, 255, 264 Миоген 21, 41, 255
Миоглобин 23 2-31, 264, 269, 284, 289
Миозин 27, 41 25^>< 257, 265
Миофибриллы’11, 27, 41, 76, 255
Митохондрии 13, 42, 205, 207,
Мозг 194, 199, 202!, 203 головной 194 — спинной 199
Мозговое веществ'-1 надпочечной железы 311
Молочная кислот,- 50, 119, 180, 215, 228, 273
Молочнокислые бяктеРии 248 Мочевая кислота 99, 214 Мочевина 81, 99, 208, 214 Мужские половые гормоны 307
Мукоиды 41, 142
Мукополисахарид)'1 143, 144, 183
Муцины 41, 142, 206
Мышечная ткань см. Мышцы Мышечное волокн0 9, 41, 82 Мышечный сок 21'4, 259
Мышцы 8
•— автолиз •— см. Автолиз мышц биохимические Функции 8 морфология 9
— окоченение 70, 254
— сокращение 36, 54
— состав 15
— — белки — см Белки мышечной ткани
— -- небелковые компоненты— см. Небелковые компоненты мышечной ткани
— — ферменты--см. Ферменты мышечной ткани
Мясо 221, 234
— вкусовая характеристика 227, 238, 269, 277, 279, 291, 293 замораживание 249 консистенция *35
— копчение 281 микробная по;’ча 240
— окислительные превращения 245
; пищевая цснь’сть 221
— посол 262
Размораживав 259, 261
'•— созревание 234, 237, 238, 261 — тепловая обработка 286
Н
Надпочечные железы 309 Небелковые компоненты 45, 98, Нейрокератин 197
Нейромедиаторы 201
Нейрон 195
Нервная ткань 194
Нервные клетки 195
Нитрозомиоглобин (NO-гемо-глобин) 231, 270
Нерадреналин 198, 313
Нуклеопротеиды 27, 39, 41, 183
Нуклеотиды 51, 238
О
Окисление жиров 157, 164, 166, 167, 277, 292
— углеводов в мозговой ткани 199
Оксалаты 117
Оксигемоглобин 107
Оксикислоты 166
Оксимиоглобин 24, 231, 269, 271, 284
Окситоцин 322
Окоченение мышц 70
Олеиновая кислота 159
Органические фосфорные соединения 51
Оризин 239
Орнитин 81
Осаливание жиров 166
Осмотическое давление крови 86
Оссеин 175
Оссеиноль 181
Оссеомукоиды 174, 176
Остаточный белок 40, 41
Остеобласты 178
Остеон 174
Остеоциды 175
П
Пальмитиновая кислота 148, 149, 180
Панкреатин 333
Панкреатопептидаза 141
Папаин 239
Паратгормон 302
Паращитовидные железы 302
Пепсин 144, 325
Пепсиноген 325
Переаминирование аминокислот 43, 82
Перекиси 157, 167, 227
Перекисное число 160, 166
Печень 204
Пигменты крови 100, 121, 154, 191, 211, 231, 245, 269
Пировиноградная кислота 61,
98
Питуитрин 323
Пищеварительные железы 324
Плазма крови 85, 89, 90, 94, 96, 98
Плазмин 95, 120
Плазминоген 95
Поджелудочная железа пищеварительной системы 329
----эндокринной системы 303
Покровная ткань 183
Половые железы 306
Посол 262
Потовые железы 192
Почки 213
Проакцелерин 116
Прогестерон 309, 310
Прогоркание жиров 164, 168
Проконвертин 115
Пролактин — см. Лактогенный гормон
Пролин 129
Пропердин 93
Протеиноиды 185
Протеолиз 79, 120, 200, 248, 255, 261, 284, 289
Протеолипиды 196
Протофибриллы 188
Протромбин 95, 112, 115, 180
Р
Радикал гидроксильный 162
— перекисный 158
------- свободный 158, 160, 162, 166
— углеводородный 150
Разделение белков 18
Реакция Майара 279, 293
Ренин 328
Ретикулин 141
Рибосомы 14
Родановое число 151
С
Сарколемма 10, 40
Саркоплазма 15, 21, 74, 255, 264
Сателлиты 195
Свертывание крови 111
Серин 243
Серое вещество 194, 196
Синантрин 117
Синергисты 170
Склеропротеины 126, 127
Слизистая желудка 325
Слюнные железы 324
Соединительная ткань 125, 127, 143
Созревание мяса 234, 261
Сокращение мышц 36, 54
Саматотропный гормон (СТГ) 315
Спектрофотометрический метод 150
Стабилизаторы крови 116, 117, 121
Стабилизация изъятой крови 116, 124
Стериды 153
Стерины 153, 197, 210
Стероиды 215, 297
Страдин 198
Строма 32
Строматолиз 118
Субтилин 239
Сульфатиды 197
Сыворотка крови 118, 120, 122, 123
Сывороточный альбумин 91
— глобулин 92
Сычужный фермент —см. Ренин
Т
Тепловая обработка мяса 286
Терризин 239
Тестостерон 307
Тиреоглобулин 300
Тиреоидин 301
Тиреотропный гормон (ТТГ) 315, 318
Тирозин 300
Тироксин 301
Ткань жировая 145
— костная 174
— мышечная 8
— нервная 194
338
339
Ткань соединительная 127
— покровная 184
— хрящевая 181
Трансферрин 94
Триглицериды 147, 148, 152, 233
Трийодтиронин 301
Трипсин 331
Триптофан 243
Трипсиноген 330
Тромбин 95, 112, 114, 115, 118
Тромбопластин 112, 115
Тромбоциты НО, 118
Тропомиозин 37, 41
Тропонин 38, 41
У
Углеводы 46
— внутренних органов 208, 213
— мышечной ткани 45
— мяса 247, 293
— нервной ткани 198
— плазмы крови 98
Ф
Фенольное число 284
Фенолы 245, 284, 285
Ферменты внутренних органов 207
— микроорганизмов 162, 240, 278, 283
— мышечной ткани 42
— нервной ткани 197
— пищеварительных желез 324
— плазмы крови 42, 94
Фибриллярные белки 289
Фибрин 95, 112, 114, 120, 123
Фибринные пленки 124
Фибриноген 90, 95, 111, 112, 114,
119, 120, 122, 123
Фибринолиз 95
Фолликостимулирующий гормон (ФСГ) 318
Фицин 239
Филликулин — см. Эстрон
Формальдегид 285
Форменные элементы крови 101
Фосфатаза 178
Фосфатиды 153, 178, 207
Фосфаты 51
Фосфолипиды 197
Фосфор 89, 102, 178, 267
Фракционирование белков плаз мы 96
X
Химотрипсин 332
Холестерин 202, 203, 207
Холин 49, 202, 208
Хологон 219
Холодильная обработка мяса 249, 251, 254, 258, 259, 261
Хондроитинсерная кислота 143 181, 182, 183
Хондромукоид 176, 181, 182, 183
Хонсурид 183
Хорионический гонадотропин (ХГ) 320
Хрящ 181
Хрящевая ткань 180
Ц
Цистеин 186
Цитраты 117
Цереброзиды 198
Щ
Щитовидная железа 300
Э
Экстрактивные вещества 47, 198, 208, 227, 228, 230, 238, 266, 290
Эластаза 333
Эластин 39, 41, 147, 183, 203, 232
Эпидермин 184
Эпидермис 183
Эритроциты 101, 102, 118, 119, 179
Эстрадиолы 308
Экстрогены — см. Женские половые гормоны
Эстриол 308
Эстрон 308
Я
Ядра белков мышечной ткани 19, 39, 208
340
ОГЛАВЛЕНИЕ
Введение ................................................. 3
ГЛАВА I
Биохимия мышечной ткани .................................. 8
Биохимические функции, строение и состав мышечной ткани................................................. 8
Биохимические функции мышечной ткани .... 8
Морфологическая характеристика мышечной ткани 9
Химический состав мышечной ткани............ 15
Белковые вещества мышечной ткани . ................... 18
Принципы выделения и разделения белков .... 18
Биологические и физико-химические свойства белков 21
Белки саркоплазмы........................ 21
Белки миофибрилл........................ 27
Белки ядер ................................. 39
Белки сарколеммы........................ 40
Ферменты мышечной ткани......................... 42
Небелковые компоненты................................ 45
Липиды ........................................... 45
Углеводы.................................... 46
Азотистые экстрактивные вещества............ 47
Органические фосфаты........................ 51
Минеральные вещества ............................ 53
Сокращение и расслабление мышц.................. 54
Автолитические превращения мышц................. 64
Превращения гликогена............................. 64
Превращения мононуклеотидов...................... 68
Мышечное окоченение и его разрешение.............. 70
Превращение липидов.............................. 73
Физико-химические изменения мышечной ткани при автолизе.......................................... 73
Изменение растворимости белков................... 74
Изменение водосвязывающей способности мышечной ткани............................................. 77
Изменение активности ферментов ........ 78
Протеолитические превращения...................... 79
Изменения ультраструктур в процессе автолиза . . 82
341
Г Л А В A II
Биохимия крови.............................................. * . . . • 84
Биохимические функции, свойства и состав крови ... 84
Биохимические функции крови ...................... 84
Морфологическая характеристика крови ..... 85
Химический состав и физико-химическйе свойства крови.......................................... 86
Плазма крови....................................... 89
Белки плазмы ............................•••„•• 90
Биохимические и физико-химическй6 свойства белков плазмы................................. 90
Ферменты плазмы............................... 94
Выделение и методы фракционирования белков плазмы........................................ 96
Небелковые компоненты плазмы .................... 98
Форменные элементы.................................
Эритроциты.....................................
Гемоглобин.....................................
'Лейкоциты й тромбоциты .......................... 4у
Биохимические превращения изъятой крови.............. 41
Свертывание .................................... 41
Процесс свертывания.......................... 41
Основные свойства компонентов свертывания 114
Стабилизация изъятой крови .... ................... 4Ь
Дефибринирование.................................. 48
Гемолиз .......................................... 48
Автолитические превращения ....................... 113
Биохимические превращения под воздействием микробов ........................................... 120
Использование крови............................... ' 121
Пищевая ценность крови........................... 121
Биологические препараты из крови . .............. 123
ГЛАВА III
Биохимия соединительной, жировой, костной и покровной укан®й
Собственно соединительная ткань .... ..............
Белковые вещества......................
Коллаген ...................................
Эластин ....................................
Ретикулин ....................... ..........
Муцины и мукоиды.....................
Мукополисахариды................................
Жировая ткань......................................
Общий химический состав жировой ткаЛИ . . . . Химический состав и свойства триглицеридов . . . Физико-химические свойства жиров . .............
Биохимические и физико-химические изменения жиров Автолитические изменения тканевых жиров . . Окислительные изменения жиров ..................
Окислительная порча жиров ..................
Химические принципы предохранения жиров от порчи Кость .............................................
Костная ткань ....................... ..........
Химический состав....................
125
127
127
128
139
141
142
143
145
146
148
152
155
155
157
164
168
173
174
175
342
Биохимические процессы . ...................
Костный мозг....................................
Использование костей ...........................
Хрящевая ткань......................................
Покровная ткань и ее дериваты . . . . ..............
Белковые вещества...............................
Меланины . . . . . . . ....... . . .
Потовые и сальные железы . . ...................
ГЛАВА IV 'Биохимия нервной ткани и внутренних органов . ........
Нервная ткань .................................
Головной мозг .............................. . .
Спинной мозг .............................. .
Биохимические процессы нервной ткани . . . . . Использование нервной ткани ...................
Пищевая ценность мозга................. . . .
Биологические препараты из мозговой ткани . . Внутренние органы . . . . ..........................
Печень .................................
Химический состав печени . .................
Биохимические процессы в печени . . .. . . .
Почки . ........................................
Легкие .........................................
Автолитические изменения внутренних органов . . Использование внутренних органов .......
Пищевая ценность внутренних органов .... Еялиотэдвдяж/л ярет/гф-дта чгь '(цп-ипиъ
ГЛАВА V
Пищевая ценность мяса ф '..............................
Биологическая ценность компонентов мяса.............
Вкусовая характеристика мясопродуктов...............
Особенности мяса домашней птицы.....................
ГЛАВА VI
Изменение биохимических свойств мяса под влиянием биологических и физико-химических факторов.............................
Биохимические основы созревания мяса................
Процесс созревания..............................
Изменение консистенции..........................
Накопление веществ, обусловливающих аромат и вкус ...........................................
Интенсификация созревания.......................
Биохимические изменения компонентов мяса при воздействии микробов ... .................................
Превращения белков и азотистых экстрактивных веществ ..........................................
Изменения пигментов ...........................
Превращения липидов.............................
Превращения углеводов..........................
Биохимические основы использования микрофлоры в производстве мясопродуктов....................
Биохимические изменения мяса при холодильной обработке ..............................................
Основные изменения при замораживании . . . .
178
179
180
181
183
184
191
192
194
194
194
199
199
202
202
203
204
204
205
212
213
215
215
217
217 Ч'А
221
221
227
232
234
234
234
235
238
238
240
240
245
246
247
248
249
249
343
Автолитические превращения компонентов .... 251
Особенности окоченения мышц .................... 254
Изменение свойств белков мышечной ткани .... 254
Особенности изменений свойств мяса при холодильной обработке................................. 258
Образование мышечного сока при размораживании мяса ........................................... 259
Особенности созревания размороженного мяса . . 261
Биохимические изменения мяса под влиянием химических и физических факторов............................. 262
Изменения мяса в процессе посола . ............. 262
Превращения компонентов мяса при копчении . . 281
Изменения компонентов мяса при тепловом воздействии ...................................... 286
ГЛАВА VII
Эндокринные и пищеварительные железы................. *297
Эндокринные железы и гормоны........................ 297
Щитовидная железа.............................. 300
Паращитовидные железы.......................... 302
Поджелудочная железа............................ 303
Половые железы.................................. 306
Надпочечные железы.............................. 309
Гипофиз....................................... 314
Пищеварительные железы.............................. 324
Слюнные железы.................................. 324
С5жж.та5. жгаудка............................... 325
Поджелудочная железа............................ 329
Список рекомендуемой литературы ....................... 334
Предметный указатель.................................. 335