Автор: Мур Дж.Т. Лэнгли Р.Х.
Теги: материальные основы жизни биохимия молекулярная биология биофизика
ISBN: 978-617-7874-64-4
Год: 2021
Текст
ВЕДЬ ЭТО ТАК ПРОСТО!
2-е издание
Биохимия
Для
Издательство ДИАЛЕКТИКА
Изучите
фундаментальные
биохимические
закономерности
Познакомьтесь с важными
соединениями и реакциями
Изучите принципы
энергетического обмена
в клетках
Джон Т. Мур,
д-р педагогических наук
Автор книги Химия для чайникое
Ричард X. Лэнгли,
д-р философии
Автор нескольких популярных книг по химии и биохимии
Биохимия
Джон Т. Мур
Ричард X. Лэнгли
ДЛЯ ®
чайников
КиТв
Комп’ютерне видавництво
"Д1АЛЕКТИКА"
2021
УДК 577.1
М91
Перевод с английского Ю.В. Жариковой
Под редакцией И.В. Василенко
Мур, Дж., Лэнгли, Р.
М91 Биохимия для чайников, 2-е изд./Джон Мур, Ричард Лэнгли;
пер. с англ. Ю.В. Жариковой. — Киев.: “Диалектика”, 2021. — 368 с.:
ил. — Парал. тит. англ.
ISBN 978-617-7874-64-4 (укр.)
ISBN 978-1-118-02174-3 (англ.)
В это обучающее пособие включен материал полного курса биохимии, ко-
торый преподается студентам колледжей, излагаемый предельно простым
языком. Книга содержит подробное описание всех основных биологических
процессов организма, рассматриваемых на молекулярном уровне. В материал
книги включено большое количество наглядных иллюстраций, упрощающих
изучение сложных понятий и концепций.
УДК 577.1
Все права защищены.
Никакая часть настоящего издания ни в каких целях не может быть воспроизведена в
какой бы то ни было форме и какими бы то ни было средствами, будь то электронные или
механические, включая фотокопирование и запись на магнитный носитель, если на это нет
письменного разрешения издательства Wiley US.
Copyright © 2021 by Dialektika Computer Publishing.
Authorized translation from the English language edition of Biochemistry For Dummies, 2nd
Edition (ISBN 978-1-118-02174-3), published by Wiley Publishing, Inc. © 2011 by Wiley Publishing,
Inc., Indianapolis, Indiana.
All rights reserved. No part of this publication may be reproduced, stored in a retrieval system or
transmitted in any form or by any means, electronic, mechanical, photocopying, recording, scanning
or otherwise, except as permitted under Sections 107 or 108 of the 1976 United States Copyright Act,
without either the prior written permission of the Publisher.
ISBN 978-617-7874-64-4 (укр.)
ISBN 978-1-118-02174-3 (англ.)
© “Диалектика”, перевод, 2021
© 2011 by Wiley Publishing, Inc.
Оглавление
Введение 17
Часть 1. Основы основ: базовые понятия 23
Глава 1. Что такое биохимия и почему она важна 25
Глава 2. Основа всего живого: гидрохимия и уровень pH 33
Глава 3. Игры с углеродом: органическая химия 51
Часть 2. Фундамент биохимии: белки 69
Глава 4. Аминокислоты: строительные блоки белков 71
Глава 5. Строение и функции белков 87
Глава 6. Ферментативная кинетика: ускоряемся 107
Часть 3. Углеводы, жиры, нуклеиновые кислоты
и другие соединения 131
Глава 7. Очень вкусно: углеводы 133
Глава 8. Липиды и мембраны 153
Глава 9. Полинуклеотиды и код жизни 171
Глава 10. Витамины: просто о сложном 181
Глава 11. Гормоны: информационная система организма 199
Часть 4. Биоэнергетическая химия и метаболизм 211
Глава 12. Жизнь и энергия 213
Глава 13. АТФ: энергетическая единица организма 225
Глава 14. Ароматная биохимия: азот и биологические системы 265
Часть 5. Генетика: почему мы такие, какие есть 287
Глава 15. Копирование ДНК 289
Глава 16. Расшифруй это! Транскрипция РНК 313
Глава 17. Трансляция: синтез белков 337
Часть 6. Великолепные десятки 353
Глава 18. Десять областей применения биохимии 355
Глава 19. Десять карьер биохимика 361
Содержание
Об авторах 15
Посвящение 16
Благодарности 16
Введение 17
Об этой книге 18
Принятые соглашения 18
Как пользоваться книгой 19
Простые предположения 19
Структура книги 20
Часть 1. Основы основ: базовые понятия 20
Часть 2. Фундамент биохимии: белки 20
Часть 3. Углеводы, жиры, нуклеиновые кислоты и другие соединения 20
Часть 4. Биоэнергетическая химия и метаболизм 21
Часть 5. Генетика: почему мы такие, какие есть 21
Часть 6. Великолепные десятки 21
Пиктограммы, используемые в книге 21
С чего начать 22
Ждем ваших отзывов! 22
Часть 1. Основы основ: базовые понятия 23
Глава 1. Что такое биохимия и почему она важна 25
Почему биохимия 25
С чего начинается биохимия? 26
Виды живых клеток 27
Прокариоты 27
Эукариоты 27
Животные клетки и их устройство 28
Краткий обзор растительной клетки 31
Глава 2. Основа всего живого: гидрохимия и уровень pH 33
Знакомство с водой 34
Не бойтесь промокнуть: физические свойства воды 34
Самая важная биохимическая функция воды: растворитель 36
Концентрация ионов водорода: кислоты и основания 38
Стремясь к равновесию 39
Шкала pH 40
Вычисление рОН 41
Теория Бренстеда-Льюиса 42
Буферы и контроль уровня pH 47
Известные физиологические буферы 47
Расчет буферной системы 48
Глава 3. Игры с углеродом: органическая химия 51
Роль углерода в изучении жизни 51
Все дело в количестве: углеродные соединения 52
Сила превыше всего: связь укрепляет 54
Есть у всех: межмолекулярные силы 54
Взаимодействие с водой: гидрофилы и гидрофобы 55
Сила связи и физические свойства веществ 56
Провоцируя реакцию: функциональные группы 57
Углеводороды 58
Функциональные группы, включающие кислород и серу 58
Функциональные группы, включающие азот 59
Функциональные группы, включающие фосфор 60
Реакции функциональных групп 60
Функциональные группы и pH 64
Одинаковые по форме, но структурно разные: изомеры 65
Цис- и трансизомеры 65
Хиральные углероды 66
Часть 2. Фундамент биохимии: белки 69
Глава 4. Аминокислоты: строительные блоки белков 71
Общие свойства аминокислот 72
Положительные и отрицательные аминокислоты:
образование цвиттер-ионов 72
Протонирование: pH и изоэлектрическая точка 73
Ассиметрия: хиральные аминокислоты 74
Двадцать волшебных аминокислот 75
Неполярные (гидрофобные) и незаряженные аминокислоты 76
Полярные (гидрофильные) и незаряженные аминокислоты 77
Кислые аминокислоты 78
Основные аминокислоты 78
Содержание 7
Вечная память: редкие аминокислоты 80
Базовые принципы взаимодействия аминокислот 80
Внутримолекулярные силы: взаимодействие аминокислоты с другими
молекулами 82
Зависимость взаимодействия от уровня pH 83
Объединение аминокислот: как оно происходит 85
Пептидная связь и дипептид 85
Трипептид: добавляем аминокислоту к дипептиду 86
Глава 5. Строение и функции белков 87
Белки: не только для питания 87
Первичная структура: есть у всех белков 89
Создаем белок: общий принцип 89
Упорядочивание аминокислот 90
Пример: первичная структура инсулина 91
Вторичная структура: есть у большинства белков 92
а-спираль 92
Р-складчастая листовая структура 93
P-виток и Q-петля 96
Третичная структура: есть у многих, но не всех белков 96
Четвертичная структура: есть только у некоторых белков 97
Анализ белка как исследовательский метод 97
Выделение белков в клетке 98
Все точнее и точнее: определение последовательности аминокислот 101
Глава 6. Ферментативная кинетика: ускоряемся 107
Классификация ферментов: предельно точно 108
Сразу в обе стороны: оксидоредуктазы 109
Вам здесь не место: трансферазы 110
Вода всему голова: гидролазы 111
Разбираем на составляющие: лиазы 111
Перетасуем колоду: изомеразы 112
Собираем все вместе: лигазы 112
Ферменты как катализаторы: когда быстро, это не так уж и быстро 113
Все о кинетике 115
Активность фермента: анализ в заданный срок и кинетический анализ 116
Скорость реакции: насколько быстро 116
Исследование ферментов: уравнение Михаэлиса-Ментен 119
Идеальное приложение 121
8 Содержание
Сложности практического применения 122
И снова математика: графики Лайнувивера-Берка 123
Ингибирование: подавление ферментов 125
Конкурентное ингибирование 126
Неконкурентное ингибирование 126
График ингибирования 126
Регуляция ферментов 126
Часть 3. Углеводы, жиры, нуклеиновые кислоты
и другие соединения 131
Глава 7. Очень вкусно: углеводы 133
Свойства углеводов 134
Хиральные углероды 134
Множественные хиральные центры 135
Сладкое на закуску: моносахариды 136
Самые устойчивые формы моносахаридов: пираноза и фураноза 138
Химические свойства моносахаридов 140
Производные моносахаридов 141
Наиболее распространенные моносахариды 142
Начало жизни: рибоза и дезоксирибоза 143
Сахара объединяются: олигосахариды 144
Все просто: дисахариды 144
Крахмал и целлюлоза: полисахариды 147
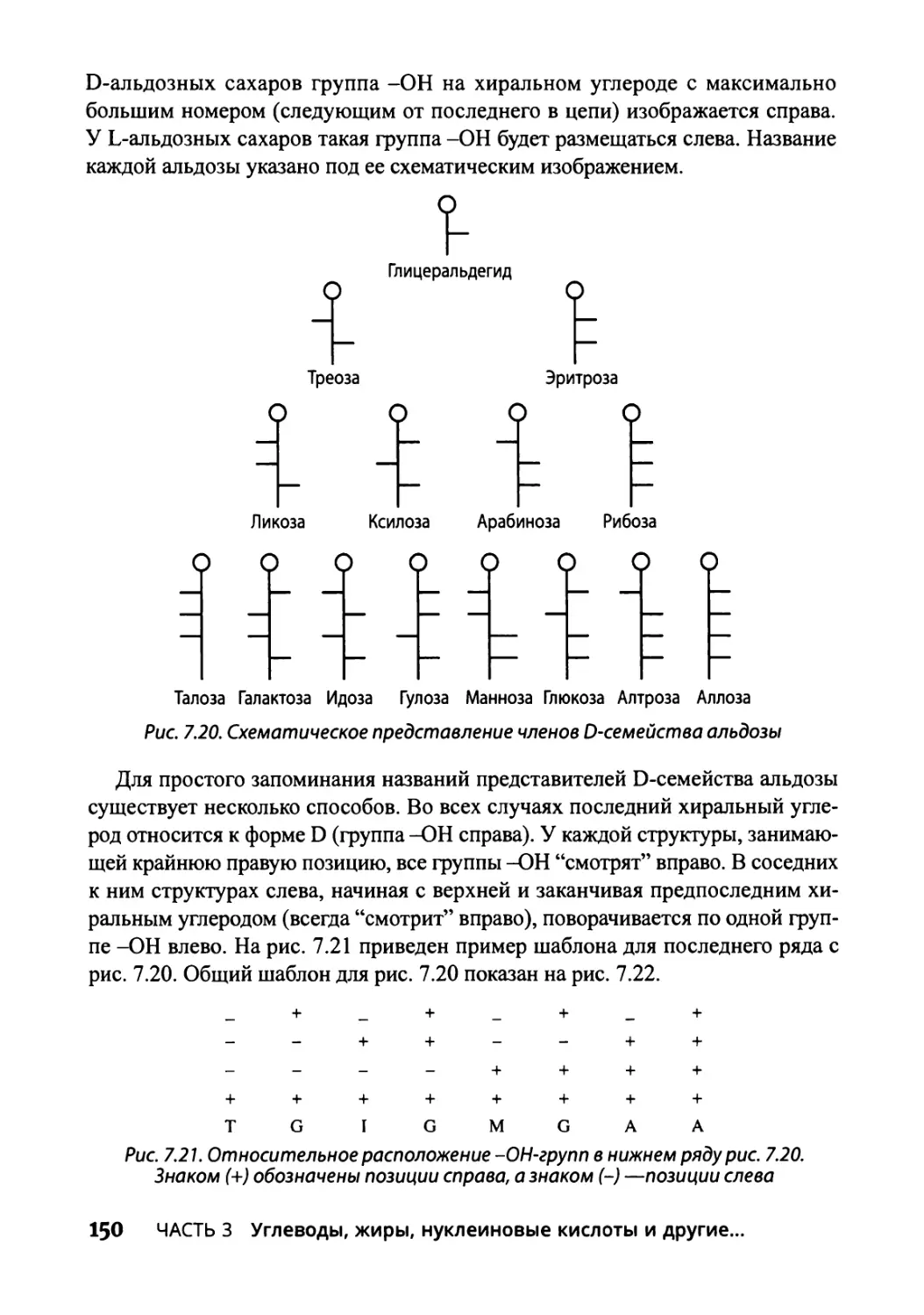
Альдозное семейство сахаров 149
Глава 8. Липиды и мембраны 153
Вездесущие липиды: обзор 153
Поведение липидов 154
Жирные кислоты в липидах 155
Толстяки в мире липидов: триглицериды 156
Свойства и структура жиров 157
Большая стирка: разрушение триглицерида 158
Простакам здесь не место: сложные липиды 159
Фосфоглицериды 159
Сфинголипиды 161
Сфингофосфолипиды 162
Мембраны: биполярные и бислойные 162
Пересечение границы: мембранный транспорт 165
Содержание 9
Стероиды: прокачиваемся 167
Простагландины, тромбоксаны и лейкотриены: зачистка 168
Глава 9. Полинуклеотиды и код жизни 171
Нуклеотиды: внутреннее устройство ДНК и РНК 172
Резервуар генетической информации: азотистые основания 172
Сладкая сторона жизни: сахара 173
Кислая сторона жизни: фосфорная кислота 174
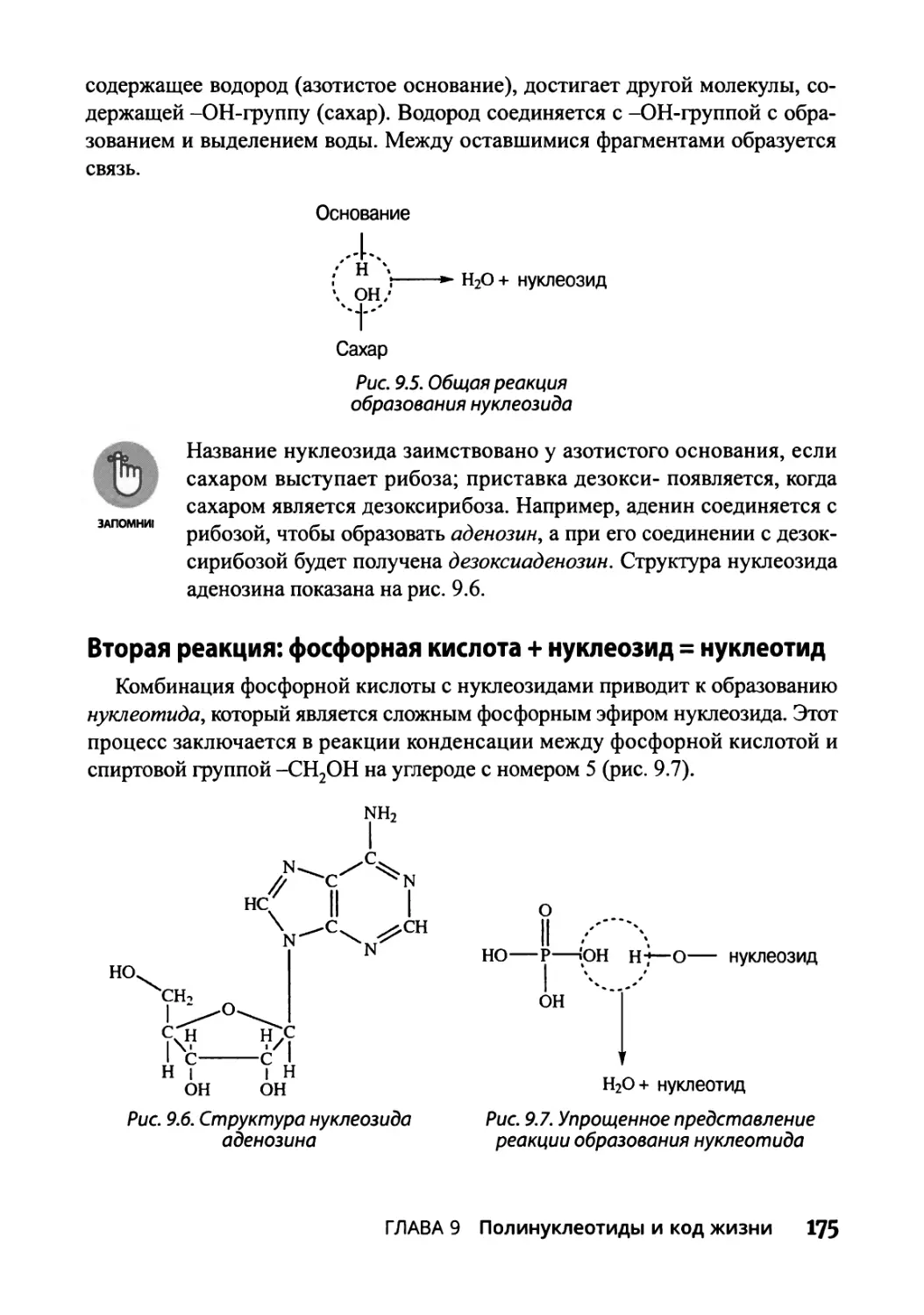
Долгий путь: от нуклеозида до нуклеотида и нуклеиновой кислоты 174
Первая реакция: азотистое основание + 5-углеродный сахар = нуклеозид 174
Вторая реакция: фосфорная кислота + нуклеозид = нуклеотид 175
Третья реакция: нуклеотиды образуют нуклеиновые кислоты 176
Главное о нуклеиновых кислотах 176
Роль ДНК и РНК в биологической жизни 178
Структура нуклеиновой кислоты 178
Глава 10. Витамины: просто о сложном 181
Больше одного: витамины 182
Быть или не быть: витамины группы В 183
Витамин В। (тиамин) 183
Витамин В2 (рибофлавин) 184
Витамин В3 (ниацин) 184
Витамин В6 (пиридоксин) 186
Биотин 188
Фолиевая кислота 188
Пантотеновая кислота 189
Удивительный витамин В j 2 190
Витамин А 191
Витамин С 193
Витамин D 194
Витамин Е 195
Витамин К 197
Глава 11. Гормоны: информационная система организма 199
Структура основных гормонов 200
Белковые гормоны 200
Стероиды 201
Аминовые гормоны 203
Про запас: прогормоны 203
10
Содержание
Проинсулин 203
Ангиотензиноген 205
Бей или беги: гормональное действие 206
Изучаем послание: гормональное регулирование 206
Модели гормонального действия 207
Часть 4. Биоэнергетическая химия и метаболизм 211
Глава 12. Жизнь и энергия 213
АТФ: энергетический обмен на молекулярном уровне 213
АТФ и свободная энергия 214
АТФ как переносчик энергии 215
Все познается в сравнении: молекулы, связанные с АТФ 218
Семейство нуклеозидтрифосфатов 219
Просто, как в школе: АМФ, АДФ и АТФ 221
Откуда это все берется 221
Глава 13. АТФ: энергетическая единица организма 225
Метаболизм первого типа: гликолиз 226
Глюкоза: там, где все начинается 226
Эффективность высвобождения энергии 230
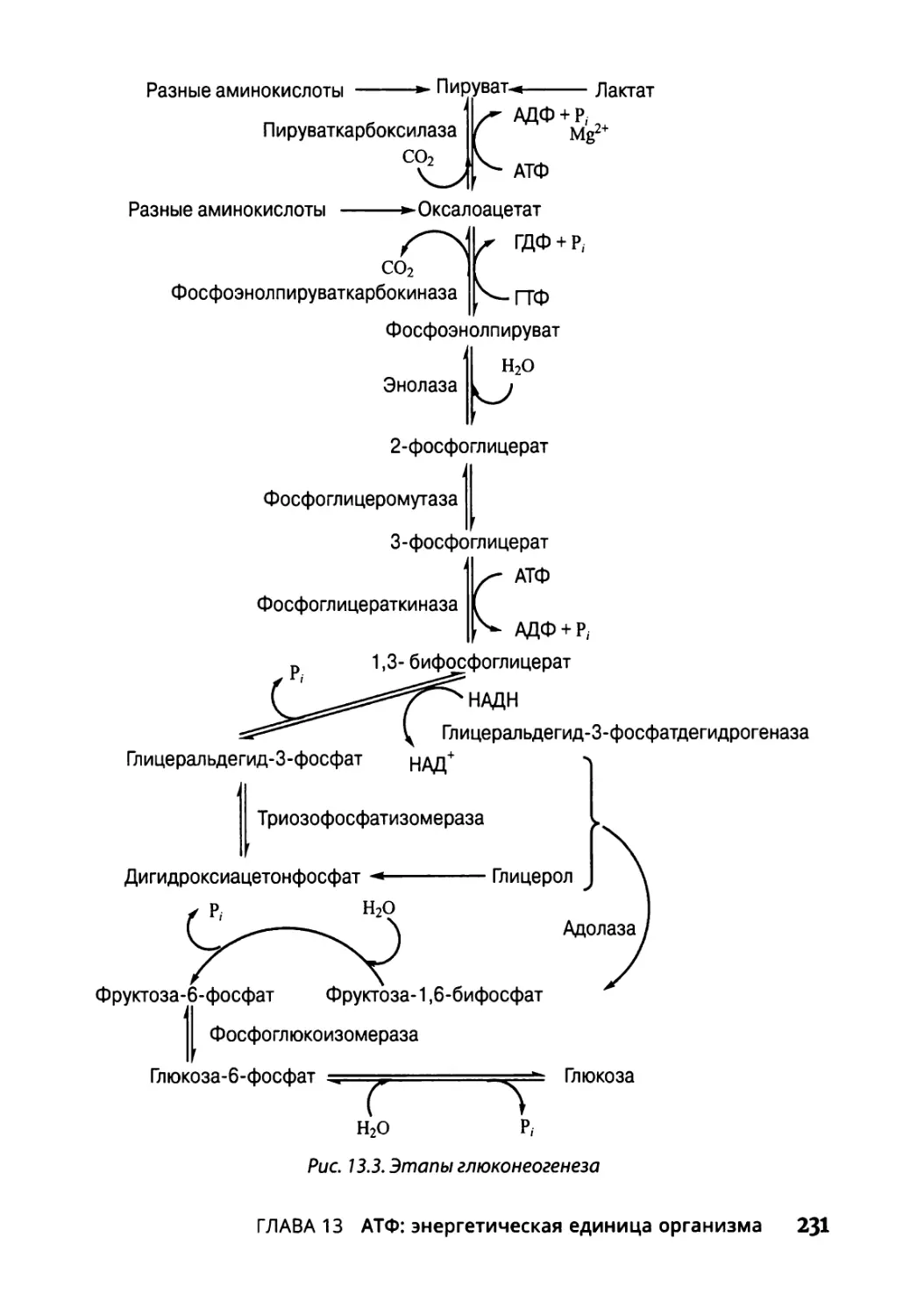
Возвращаемся обратно: глюконеогенез 230
Спиртовое брожение: величайшее достижение эволюции 230
Метаболизм второго типа: цикл лимонной кислоты (Кребса) 232
Пожалуй начнем: синтез ацетил-СоА 233
Трое - это уже толпа: трикарбоновые кислоты 237
Окислительное декарбоксилирование 237
Получение сукцината и ГТФ 237
Восстановление оксалоацетата 238
Аминокислоты как источник энергии 238
Транспорт электронов и окислительное фосфорилирование 240
Система транспорта электронов 240
Окислительное фосфорилирование 246
Предполагаемые механизмы 249
Выработка АТФ 249
Привлекаем жиры: цикл Р-окисления 249
Не такие уж и тяжелые: кетоновые тела 252
Взгляд в будущее: биосинтез 254
Жирные кислоты 254
Содержание 11
Мембранные липиды 257
Аминокислоты 258
Глава 14. Ароматная биохимия: азот и биологические системы 265
Азотное кольцо: пурины 265
Биосинтез пуринов 266
Стоимость синтеза 269
Синтез пиримидинов 270
Первый этап: карбамаилфосфат 271
Второй этап: оротат 272
Последний этап: цитидин 277
Обратно к истокам: катаболизм 277
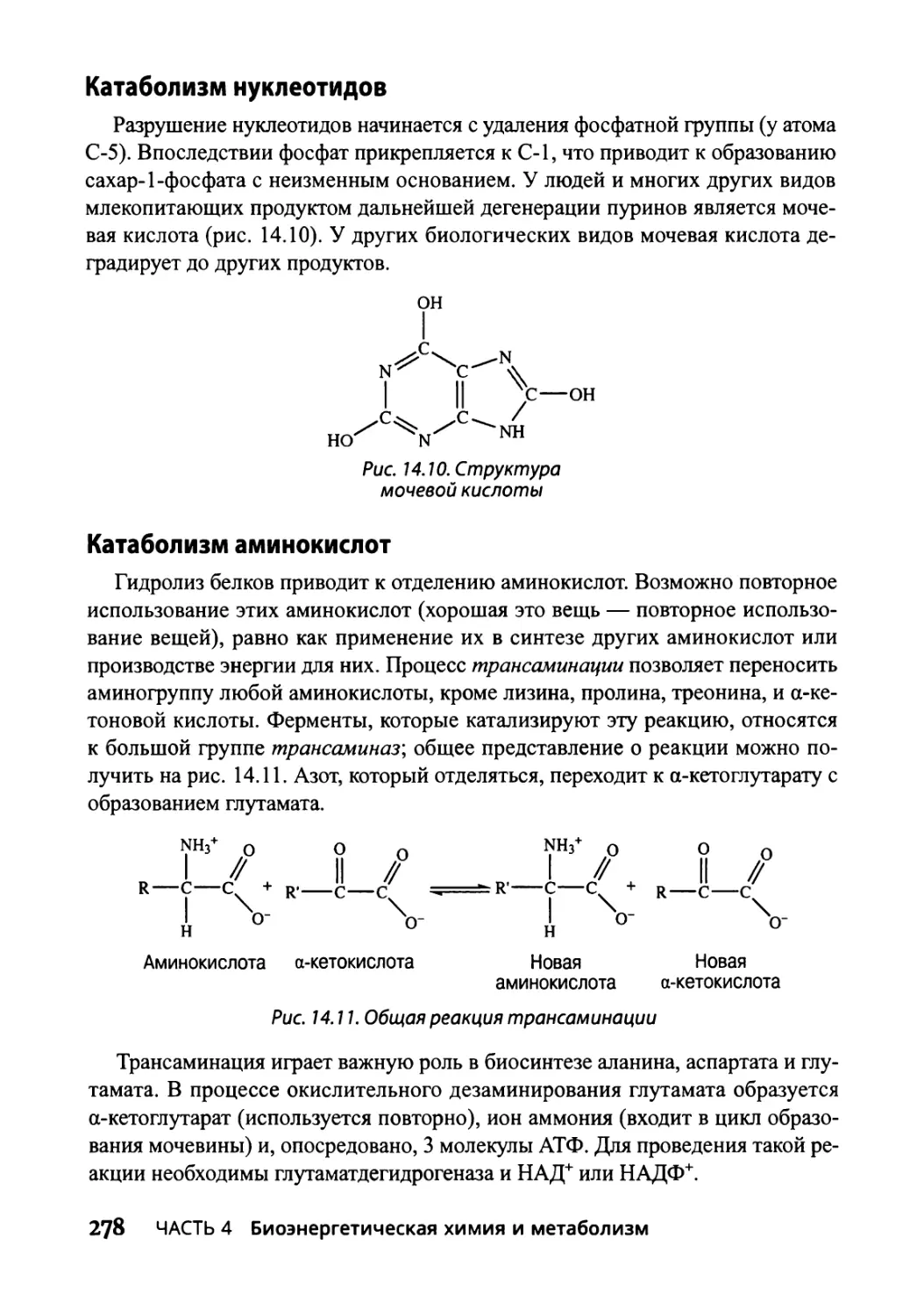
Катаболизм нуклеотидов 278
Катаболизм аминокислот 278
Катаболизм гема 279
Избавляемся от ненужного: цикл образования мочевины 280
Снова об аминокислотах 283
Нарушения метаболизма 284
Подагра 284
Синдром Леша-Нихана 284
Альбинизм 285
Алкаптонурия 285
Фенилкетонурия 285
Часть 5. Генетика: почему мы такие, какие есть 287
Глава 15. Копирование ДНК 289
Давайте сделаем это снова: репликация 290
ДНК-полимеразы 293
Общепринятая модель репликации 294
Механизмы восстановления ДНК 297
Мутации: хорошие, плохие и ужасные 299
Рестриктазы 301
Божий промысел: рекомбинация ДНК 302
Определение последовательности ДНК 303
Электрофорез в геле 303
Определение последовательности оснований 305
Известно все: судебно-медицинская экспертиза 306
Диагностика генетических заболеваний и другие ДНК-исследования 309
12
Содержание
Серповидно-клеточная анемия 310
Гемохроматоз 310
Муковисцидоз 310
Гемофилия 311
Болезнь Тея-Сакса 311
Глава 16. Расшифруй это! Транскрипция РНК 313
Виды РНК 314
Требования к РНК-полимеразе 314
Создание РНК: самое главное 315
Начало транскрипции РНК 315
Прокариотические клетки 317
Эукариотические клетки 321
Ничего секретного: генетический код 324
Кодоны 325
Коды запуска и завершения 327
Модель регуляции генов 328
Модель Жакоба-Моно 329
Регуляция генов у эукариот 332
Глава 17. Трансляция: синтез белков 337
Трудности перевода 337
Зачем нужна трансляция 338
Все вместе: рибосома 338
Участники трансляции 338
Капитан команды: рРНК 339
Перехват инициативы: иРНК 340
Игра в разгаре: тРНК 340
Выход в финал: активация аминокислот 342
Синтез белков 345
Активация 345
Инициация 345
Удлинение 346
Завершение 347
Гипотеза неоднозначного соответствия 347
Особенности трансляции в эукариотических клетках 349
Рибосомы 349
Инициатор тРНК 351
Инициация 351
Содержание 13
Удлинение и завершение 351
Часть 6. Великолепные десятки 353
Глава 18. Десять областей применения биохимии 355
Тест Эймса 355
Тест на определение беременности 356
Тест на ВИЧ 356
Диагностика рака груди 356
Внутриутробные исследования 357
ТестнаФКУ 357
Генетически модифицированная пища 357
Генная инженерия 358
Клонирование 358
Генная заместительная терапия 358
Глава 19. Десять карьер биохимика 361
Научный сотрудник 361
Селекционер 362
Специалист по контролю качества 362
Руководитель клинических исследований 362
Разработчик технической документации 363
Исследователь биотехнологий 363
Маркетолог 363
Патентный поверенный 364
Менеджер по продаже лекарственных препаратов 364
Специалист по биостатистике 364
14 Содержание
Об авторах
Джон Мур родом из западных предгорий Северной Каролины. Он успеш-
но окончил университет Северной Каролины в Эшвилле, получив степень
бакалавра по химии. Следующую научную степень — магистра Джон полу-
чил в частном университете “Фурман” в Гринвилле, Южная Каролина. Отслу-
жив в армии, он решил попробовать себя в преподавательской деятельности.
В 1971 Джон был принят преподавателем на факультет химии Государствен-
ного университета Стефана Ф. Остина в Нокодочесе, Техас, где он работает
до настоящего времени. В 1985 г. он возобновил обучение ив 1991 г. получил
докторскую степень в Техасском сельскохозяйственном университете. Вместе
с одним из своих бывших студентов Джон принял участие в редактировании
большой обзорной статьи Chemistry for Kids, опубликованной в популярном
журнале The Journal of Chemical Education. В 2003 г. в печать вышла его первая
книга, Химия для чайников, а вскоре и вторая — Chemistry Made Simple. Джон
страстно увлекается готовкой и изготовлением оригинальных рукояток для но-
жей из ценных пород дерева.
Ричард Лэнгли провел свое детство на юго-западе страны, в штате Огайо.
Он окончил Университет Майами в Оксфорде, шт. Огайо, где получил степень
бакалавра по химии и минералогии, а затем магистерскую степень отдельно
по химии. Следующим этапом обучения стал Университет штата Небраска, в
котором им была получена научная степень доктора химии. Получив в 1982 г.
соответствующую ученую должность в университет Висконсина в Ривер Фол-
лс, Ричард вскоре перевелся в Государственный университет Стефана Ф. Ости-
на. В последующие годы он, вместе с Джоном Муром, работал независимым
консультантом по составлению вопросов для экзаменов по углубленному изу-
чению химии. Вместе с Джоном он принимал участие в разработке нескольких
образовательных проектов, среди которых 5 Steps to а 5 on the АР: Chemistry,
Chemistry for the Utterly Confused и Organic Chemistry II For Dummies. Рич
увлекается изготовлением украшений и любит читать научную фантастику.
Введение
В ваших руках второе издание книги Биохимия для чайников. Мы при-
знательны, что вы выбрали именно ее для знакомства с удивительным миром
биохимии. Биохимия — это не самый простой раздел химии, понять который
на самом деле не так уж и сложно. Для этого достаточно проявить трудолюбие,
внимание к деталям, и огромное желания изучать и анализировать. Биохимия,
как и любой другой раздел химии, далеко не самая зрелищная научная дисци-
плина. Вы предстоит научиться работать с разными химическими материала-
ми, сравнивать предложенные объяснения и искать ответ на извечный вопрос,
почему реакция происходит так, а не иным образом.
Приложив достаточно усилий, вы успешно освоите первый курс биохимии.
Что более важно, он послужит основой для дальнейшего всестороннего изу-
чения невероятно сложных биохимических реакций, происходящих в живых
организмах — не важно, одноклеточные они, состоят из нескольких клеток
или представляют человеческий организм. Подобно вкладу отдельного музы-
кального инструмента в звучание оркестра, каждая химическая реакция нео-
бычайно важна для всего организма, и иногда является неотъемлемой частью
происходящих в нем сложных процессов. Если инструменты оркестра звучат
правильно и слажено, то проигрываемая мелодия вызывает неподдельное вос-
хищение, и ее хочется слушать снова и снова. Но если один или несколько
инструментов звучат неправильно или выбиваются из мелодии, то становит-
ся ясно, что оркестр играет разлажено. Мелодия оказывается испорченной, и
возникает непреодолимое желание помочь оркестру. Все то же справедливо в
отношении организма. Если реакции в нем происходят правильно и своевре-
менно, то организм работает четко и слаженно. Если же одна или несколько
реакций выполняются не так, как им положено, то организм начинает работать
с очевидными нарушениями. Чаще всего причинами сбоев в работе организма
выступают генетические заболевания, неправильный баланс электролитов и
другие расстройства. Но как они влияют на обмен веществ? Биохимия явля-
ется тем разделом знаний, который содержит ответы на этот и многие другие
вопросы, а также предоставляет информацию о способах восстановления ор-
ганизма и лечения многих распространенных заболеваний.
Об этой книге
Книга основана на материале стандартного курса биохимии, преподаваемо-
го студентам колледжей. Во второе издание включен самый последний обуча-
ющий материал, исправлены ошибки и восполнены пробелы первого издания.
Хочется верить, что настоящее издание стало более полным, чем первое. Мы
приложили максимум усилий, чтобы включить в него самый актуальный ма-
териал, но научные знания постоянно совершенствуются. Тем не менее, базо-
вые принципы любой научной дисциплины остаются неизменными. Как раз
на них мы и концентрируем ваше внимание. В книгу добавлены сведения о
практических аспектах применения биохимии, с которыми все мы встреча-
етесь в повседневной жизни: криминальная экспертиза, клонирование, генная
инженерия, генетическое тестирование, а также генетически модифицирован-
ные продукты.
Бегло просмотрев книгу, вы обнаружите в ней описание большого количе-
ства химических структур и реакций. Большая часть накопленных научных
знаний в биохимии основана на изучении структур молекул, вовлеченных в
биохимические реакции. Функция следует за формой. Если вам посчастливи-
лось изучать биохимию раньше, то вы, скорее всего, прослушали курс орга-
нической химии. Изучая органическую химию, вы узнали о существовании
множества химических структур и функциональных групп. Вскоре вы удосто-
веритесь, что многие из столь полюбившихся (или приводящих в бешенство)
механизмов органической химии прекрасно работают и в биохимии.
Если вы уже изучаете биохимию, то используйте эту, по-своему ценную
книгу, чтобы дополнить материал базовых учебников по этой дисциплине.
Если же вы приобрели ее в надежде получить общие познания в этом уди-
вительном разделе химии, то постарайтесь не запутаться в деталях. Сначала
бегло просмотрите материал каждой главы. Как только найдете заинтересо-
вавшую вас тему, остановитесь и принимайтесь за ее изучение. Акцентируйте
свое внимание на всем новом и интересном.
Принятые соглашения
Материал книги излагается в определенной логической последовательно-
сти, полностью согласующейся с принятой в академическом курсе биохимии.
Чтобы представить информацию в наиболее простом и понятном для изучения
виде, в нем используются следующие стилистические обозначения.
18 Введение
» Новые термины выделены курсивом и сопровождаются детальным
описанием.
» Ключевые слова в маркированных списках выделены полужирным
начертанием.
Кроме того в книге встречается большое количество формул и реакций. Во
время обучения попытайтесь уделять им самое пристальное внимание.
Как пользоваться книгой
Не тратьте время на изучение ненужного материала. Концентрируйтесь на
разделах, в которых приведена действительно важная для вас информация.
Если вам наиболее интересно знать об областях практического применения
биохимии, то в первую очередь обращайте внимание на разделы, которые со-
держат абзацы, предваряемые пиктограммой “На практике”. Однако, если вам
нужны исчерпывающие сведения о биохимических реакциях, то не стоит уде-
лять таким разделам слишком много времени.
Кроме того, некоторые интересные темы рассматриваются в специальных
врезках, которые вы найдете во многих главах. В них приводится более глу-
бокий взгляд на некоторые второстепенные, но весьма важные разделы био-
химии.
Простые предположения
Мы прекрасно осведомлены об опасности суждений, и все же предполага-
ем, что эта книга, скорее всего, окажется в руках:
» ученика, проходящего курс биохимии в колледже;
» студента, восполняющего знания биохимии для сдачи независимых
тематических экзаменов, например, квалификационных тестов;
» человека, интересующегося биохимией без привязки к профессио-
нальным обязанностям;
» постоянного зрителя всевозможных телевизионных шоу, в которых
описываются принципы проведения всевозможных экспертиз.
Если вы не относитесь ни к одной из перечисленных категорий, искренне
надеемся, что эта книга не только понравиться, но и принесет вам пользу.
Введение 19
Структура книги
Ниже приведен краткий обзор тем, рассматриваемых в различных частях
книги. Можете смело использовать его в качестве оглавления при составлении
стратегии обучения.
Часть 1. Основы основ: базовые понятия
В этой части рассматриваются основные аспекты и понятия, встречающи-
еся в химии и биохимии. В первой главе приводятся общие сведения о биохи-
мии, как научной дисциплине, и связи ее с другими разделами химии и биоло-
гии. Вы узнаете о различных видах клеток и составляющих их компонентах.
Во второй главе вам предстоит изучить отдельные концепции гидрохимии и
органической химии, имеющие непосредственное отношение к практическому
применению в биохимии, включая понятия уровня pH и буферной системы.
Последняя глава раздела включает краткий курс органической химии, начина-
ющийся с рассмотрения функциональных групп и заканчивающийся описани-
ем изомеров.
Часть 2. Фундамент биохимии: белки
В этой части основное внимание уделено белкам. В первой главе части вы
узнаете о существовании аминокислот — строительных блоков, из которых со-
стоят все белки. В следующей главе вы будет использовать полученные знания
для получения последовательностей аминокислот и построения различных ви-
дов белковых структур. Заканчивается часть описанием ферментивной кинети-
ки, работающей как катализатор (ускоритель), так и ингибитор (замедлитель)
реакций.
Часть 3. Углеводы, жиры, нуклеиновые
кислоты и другие соединения
В этой части вы узнаете о широком разнообразии биохимических соеди-
нений. Вы увидите, что углеводы устроены гораздо сложнее, чем круасан,
которым вы позавтракали сутра, и чтобы заставить вас поверить в это, более
детально остановимся на изучении “сладкой” биохимии! Затем вы познако-
митесь с жирами и узнаете о предназначении стероидов. На следующем этапе
вам предстоит изучить нуклеиновые кислоты и основу генокода биологической
жизни — молекулы ДНК и РНК. В конце части вы рассматриваются витами-
ны (те самые, с которыми все мы сталкиваемся каждый день) и гормоны (все
очень серьезно — они не так просты, как кажутся на первый взгляд).
20 Введение
Часть 4. Биоэнергетическая химия и метаболизм
Рано и поздно все превращается в энергию. В главах этой части мы рас-
смотрим энергетические потребности организма, и покажем, на что именно
в нем тратится энергия. Здесь вас ожидает встреча с наилучшим другом орга-
низма — АТФ и предстоит разобраться с невероятно сложным циклом Кребса
(трикарбоновых кислот). В конце части вам придется освоить множество дур-
но пахнущих химических реакций — в чем виноваты соединения азота — бу-
дет точно нелегко, и вы прольете не один литр пота.
Часть 5. Генетика: почему мы такие, какие есть
В этой части рассказывается о производстве ДНК, процессе репликации, а
также нескольких практических приложениях, основанных на секвентирова-
нии ДНК. Затем мы зразу же перейдем к описанию принципов синтеза РНК.
Часть б. Великолепные десятки
В заключительной части книги описано десять наиболее примечательных
областей применения биохимии в повседневной жизни и предложено десять
не совсем типичных для биохимии карьерных лестниц.
Пиктограммы, используемые в книге
Если вы счастливый обладатель других книг серии “...для чайников”, то ско-
рее всего знакомы в назначением пиктограмм, применяемых для обозначения
важной информации в материале книги.
НА ПРАКТИКЕ
ЗАПОМНИ!
СОВЕТ
Эта пиктограмма указывает на сведения, которые имеют практиче-
ское применение в повседневной жизни. Они помогут лучше разо-
браться в общей картине рассматриваемого вопроса, а также понять,
как именно реализуются биохимические механизмы в реальной
жизни.
Если вы видите такую пиктограмму, будьте внимательны: здесь вы-
делено то, о чем вы не должны забывать, или то, о чем говорилось
ранее и упоминается повторно, потому что это очень важно.
Этой пиктограммой отмечено то, что мы считаем интересным и
остроумным, или то, что настоятельно рекомендуется для дополни-
тельного изучения в биохимии.
Введение
21
~ Такая пиктограмма предостерегает об опасностях или указывает на
то, что может привести к неприятностям. Не пытайтесь повторить
это дома.
ВНИМАНИЕ!
С чего начать
Ответ на вопрос, с чего начать изучение биохимии, на самом деле зависит
от уровня базовых знаний и сложности поставленных задач. Как и в любых
других изданиях для начинающих, каждая глава этой книги содержит макси-
мально обособленный материал, так что вы можете сразу переходить к изуче-
нию тем, вызывающих у вас наибольшие затруднения.
Мы надеемся, что изучение биохимии принесет вам искреннее удоволь-
ствие, а эта книга сделает его предельно простым и увлекательным занятием,
независимо от причин, побудивших взять ее в руки.
Ждем ваших отзывов!
Вы, читатель этой книги, и есть главный ее критик. Мы ценим ваше мнение
и хотим знать, что было сделано нами правильно, что можно было сделать
лучше и что еще вы хотели бы увидеть изданным нами. Нам интересны любые
ваши замечания в наш адрес.
Мы ждем ваших комментариев и надеемся на них. Вы можете прислать нам
бумажное или электронное письмо либо просто посетить наш сайт и оставить
свои замечания там. Одним словом, любым удобным для вас способом дайте
нам знать, нравится ли вам эта книга, а также выскажите свое мнение о том,
как сделать наши книги более интересными для вас.
Отправляя письмо или сообщение, не забудьте указать название книги и ее
авторов, а также свой обратный адрес. Мы внимательно ознакомимся с вашим
мнением и обязательно учтем его при отборе и подготовке к изданию новых
книг.
Наши электронные адреса:
E-mail: info.dialektika@gmail.com
WWW: http://www.dialektika.com
22 Введение
V i
вы основ
зые
В ЭТОЙ ЧАСТИ...
Освежим в памяти базовые понятиям химии, органической
химии и биохимии. Прежде всего акцентируем свое внима-
ние на взаимосвязи биохимии с другими разделами химии
и биологии. Вначале рассмотрим виды клеток и постараем-
ся понять, из чего они состоят. Затем перейдем к изучению
химии воды в контексте таких биохимических понятий, как
уровень pH и буферная система. В конце части постараемся
вспомнить курс органической химии, составляющего основу
материала последующих частей.
Глава 1
Что такое биохимия
и почему она важна
В ЭТОЙ ГЛАВЕ...
» Важность биохимии
» Состав и назначение животных клеток
» Отличия между животными и растительными клетками
Если вы уже изучаете биохимию, то можете пропустить эту главу и сразу
перейти к изучению глав, в которых рассматриваются темы, вызываю-
щие очевидные затруднения с пониманием. Если же вы находитесь в са-
мом начале пути знакомства с биохимией или только планируете исследовать
новую область знаний, то обязательно ознакомьтесь со следующим материа-
лом. В этой главе приведены основные сведения о клетках и их составных ча-
стях, имеющих исключительную важность для биохимии.
Потеряться в материале, насыщенном техническими подробностями, и
забыть о конечной цели обучения не так уж и сложно. Эта глава призвана
сформировать базис знаний, на котором будет построено все последующее
обучение.
Почему биохимия
Легко предположить, что самым простым ответом на этот вопрос будет “По-
чему бы и нет?” или “Потому, что ее важно знать!”.
Первый ответ, на самом деле, не такой уж и уклончивый. Оглянитесь во-
круг — живая природа повсюду. Все процессы, отвечающие за рост, размно-
жение, старение и смерть, по своей сути имеют биохимическую природу. Для
стороннего наблюдателя живой мир, основанный на мириадах химических ре-
акций, которые протекают внутри всех без исключения организмов, кажется
невероятно сложным. Их слаженность и строгая последовательность вызывает
неподдельный интерес и искреннее удивление.
Джон был необычайно поражен, когда впервые узнал о минимальной разни-
це в структурах крахмала и целлюлозы: неужели столь “незначительное” отли-
чие в единственной связи может выступать основной причиной различий меж-
ду картофелем и деревом. Этот невероятный факт послужил толчком к углу-
бленному изучению биохимических процессов, происходящих внутри живых
существ, в попытках докопаться до их сути. Не забывайте время от времени
отстраняться от сложных научных подробностей, чтобы насладиться разноо-
бразием и красотой жизненных форм.
С чего начинается биохимия?
Биохимия — это химия живого организма. Биохимики изучают химические
реакции, происходящие в организме на молекулярном уровне. Биохимия выде-
ляется в отдельный раздел химии. В школах она может преподаваться в едином
курсе биологии, или же разделяться между курсами химии и биологии.
На самом деле биохимия сочетает в себе концепции всех известных разде-
лов химии. Как известно, строительными элементами всего живого являются
атомы углевода, что делает органическую химию необычайно важной дисци-
плиной для биохимии. Биохимикам часто приходится определять скорость
прохождения реакции — а это область ответственности физической химии.
В состав многих биохимических структур, например таких, как гемоглобин,
входят металлы. Изучением их поведения занимается неорганическая химия.
Чтобы определить количественный состав и структуру молекул, биохимики
применяют сложные инструменты аналитической химии. Кроме того биохимия
имеет много общего с молекулярной биологией — обе научные дисциплины из-
учают живые системы на молекулярном уровне, но биохимики акцентируют
свое внимание преимущественно на проходящих в них химических реакциях.
Зачастую биохимикам приходится изучать транспорт отдельных электронов
внутрь клетки или даже процессов, связанных с пищеварением. В область их
интересов входит все живое!
26 ЧАСТЬ 1 Основы основ: базовые понятия
Виды живых клеток
Все живые организмы состоят из клеток. Клетка чем-то сродни тюремной
камере. Рабочий аппарат клетки заключен за решетку, которая известна, как
клеточная мембрана. Как и заключенные, содержимое клетки может общаться
с внешним миром. Все заключенные получают питание — в каждую живую
клетку также регулярно поступают питательные вещества. У клетки даже есть
санитарная система, предназначенная для удаления отходов. И подобно тому,
как заключенные изготавливают товары для остального общества, клетка про-
изводит материалы для жизни вне клетки.
Клетки делятся на два основных вида: прокариоты и эукариоты. (Вирус
имеет некоторое сходство с живой клеткой, хотя и весьма отдаленное. Факти-
чески многие ученые не относят вирусы к отдельной форме жизни.) Прока-
риоты — это самый простой вид клеток. Многие одноклеточные организмы
являются прокариотами.
Проще всего отличить один вид клеток от другого по оформленному
клеточному ядру: оно наблюдается только у эукариотов, а у прока-
риотов его нет.
Прокариоты
Большинство наиболее распространенных бактерий относятся к прокари-
отам. Несмотря на отсутствия ядра, у прокариотических клеток наблюдают-
ся свои явно выраженные структуры. Их клеточная мембрана состоит из трех
компонентов: клеточная стенка, внешняя мембрана и плазматическая мем-
брана. Такая клеточная мембрана контролирует проход веществ из и в клетку.
Вещества, обеспечивающие нормальное функционирование клетки, плавают
внутри нее в бульоне, называемом цитоплазмой. Упрощенный вариант прока-
риотической клетки показан на рис 1.1.
Эукариоты
К эукариотам относятся животные, растения, грибы и простейшие (орга-
низмы, которые не относятся к растениям, животным или грибам; многие из
них — одноклеточные, в то время как другие — многоклеточные, например во-
доросли). Все мы — тоже эукариоты! Кроме ядра в клетках эукариотов содер-
жатся многочисленные окруженные собственными мембранами компоненты,
называемые органеллами. Эукариотические организмы могут быть как одноя-
дерными, так и многоядерными. В общем случае, клетки-эукариоты вмещают
больше генетического материала, чем клетки-прокариоты.
ГЛАВА 1 Что такое биохимия и почему она важна 27
Плазматическая мембрана
Клеточная
стенка
Рибосомы
ДНК
Рис. 1.1. Простая прокариотическая клетка
Животные клетки и их устройство
Все животные клетки, с которыми вы знакомы, относятся к эукариотам.
Они состоят из большого количества компонентов, большинство из которых
представлено органеллами. Эти компоненты, а также некоторые другие, можно
найти в растительных клетках (см. далее). Упрощенный вид животной клетки
приведен на рис. 1.2.
К первичным относятся следующие компоненты животных клеток.
ЗАПОМНИ!
» Плазматическая мембрана. Отделяет внутренний материал клет-
ки от всего, что ее окружает. Плазма или цитоплазма — это жид-
кая часть внутреннего материала клетки. Чтобы клетка оставалась
здоровой, эта жидкость должна находиться внутри нее. Однако при
этом все необходимые клетке вещества должны проходить через
мембрану внутрь, а ненужные вещества, включая отходы, должны
беспрепятственно проникать через мембрану наружу. (Только пред-
ставьте, какой помойной ямой станет клетка, если отходы не будут
удаляться из нее!)
Перенос, или транспорт вещества через мембрану может быть ак-
тивным и пассивным. В активном способе переноса за поступление
или удаления вещества из клетки вносится оплата, которая взыма-
ется энергией. Пассивный способ переноса в оплате не нуждается.
К пассивным методам переноса относятся диффузия, осмос и филь-
трация.
28 ЧАСТЬ 1 Основы основ: базовые понятия
Цитоплазма
Пузырьки
Реснички
Ядрышко
Ядро
Вакуоль
Эндоплазматическая //
гранулярная сеть
Митохондрии
Рибосомы
Аппарат Гольджи
Гладкая
эндоплазматическая сеть
Плазматическая
мембрана
Лизосомы
Центриоль
Рис. 1.2. Упрощенное изображение животной клетки
» Центриоли. Работают в клетке как проводники. Центриоли обра-
зуют внутри нее такие структурные элементы как микротрубочки,
способствующие лучшему перемещению материала клетки во вре-
мя деления.
» Эндоплазматическая сеть. Клетку можно рассматривать как хо-
рошо отлаженную производственную единицу. Главной частью
клеточной фабрики выступает эндоплазматическая сеть. Это обра-
зование состоит из двух основных частей: гранулярная эндоплазма-
тическая сеть, которая содержит рибосомы, и гладкая эндоплазма-
тическая сеть, в которой рибосом нет (подробно о рибосомах и их
функциях см. далее). Гранулярная эндоплазматическая сеть, больше
напоминает отдел сбыта, обеспечивающий поставку продуктов ре-
акций, происходящих внутри клетки, с помощью аппарата Гольджи.
» Аппарат Гольджи. Эта структура служит клетке почтовой системой.
Она слегка напоминает лабиринт, внутри которого производимый
клеткой материал упаковывается в пузырьки — маленькие, заклю-
ченные в мембрану мешочки. Эти мешочки отсылаются другим орга-
неллам или экспортируются из клетки через мембрану. У клеточной
мембраны есть "таможенные посты" под названием каналы, которые
дают добро на выделение содержимого из клетки. Секретируемые
вещества становятся доступны другим клеткам и органам.
ГЛАВА 1 Что такое биохимия и почему она важна 29
» Лизосомы. Выполняют роль свалок в клетках. В них содержатся
пищеварительные ферменты (см. главу 6), разрушающие вещества,
которые могут повредить клетку. Продукты переваривания веществ
могут беспрепятственно выходить из лизосом обратно в клетку.
Лизосомы также переваривают мертвые органеллы. Этот слегка
деструктивный процесс получил название самопереваривания и
на самом деле заключается в переваривании клетки самой себя.
(Не дай бог нам испытать настолько сильный голод!)
» Митохондрии. Эти структуры являются энергетическими уста-
новками, в которых в клетке производится энергия. Митохондрии
(единичному митохондриону) для производства энергии требуется
пища — в первую очередь карбогидрат глюкозы, который возника-
ет главным образом при расщеплении аденозинтрифосфата, или
АТФ, описанию которого посвящена глава 13.
» Ядро/ядрышко. У каждой клетки есть ядро, внутри которого нахо-
дится ядрышко. Они функционируют как центр управления и явля-
ются зародышами будущим поколениям. Ядрышко покрыто двой-
ной оболочкой, называемой ядерной мембраной. Ядро заполнено
специальным веществом, которое называется хроматином. Как
только клетка вступает в стадию размножения (деления), хроматин
разделяется на хромосомы.
Наряду с переносом генетической информации будущим поколени-
ям ядро производит две важные молекулы для интерпретации этой
информации: рибонуклеиновая информационная кислота (иРНК) и
транспортная рибонуклеиновая кислота (тРНК). Ядрышко выраба-
тывает третий тип нуклеиновой кислоты, называемой рибосомной
рибонуклеиновой кислотой (рРНК). Детальному описанию послед-
ней посвящена вся глава 9.
» Рибосомы. В рибосомах содержатся аминокислоты и строительные
компоненты рибонуклеиновой кислоты. В рибосомах аминокис-
лоты объединяются в белки. Многие из этих белков являются фер-
ментами, которые принимают участие во всех процессах, происхо-
дящих в организме. Аминокислотам, белкам и ферментам всецело
посвящена вторая часть книги.
» Маленькие вакуоли. Также известны как простые вакуоли; они
выполняют самые разные функции, включая хранение и транспор-
тировку веществ. Могут накапливать материалы для дальнейшего
использования или аккумулировать больше ненужные клетке ве-
щества.
30 ЧАСТЬ 1 Основы основ: базовые понятия
Краткий обзор растительной клетки
Растительная клетка состоит из таких же компонентов, что и животная клет-
ка, но дополнительно включает клеточную стенку, большую вакуоль, и (в слу-
чае зеленых растений) хромопласта. Типичная растительная клетка схематиче-
ски показана на рис. 1.3.
Тельца Клеточная
Митохондрии Гольджи стенка
Ядерная мембрана
Свободные
рибосомы
Гладкая эндо-
плазматическая
сеть
Вакуоль
Ядрышко
Ядерный хроматин
Гранулярная эндо-
плазматическая
сеть
Хлоропласт
Рис. 1.3. Упрощенный вид растительной клетки
Клеточная стенка построена из целлюлозы. Целлюлоза, как и крахмал, —
это полимер глюкозы. Стенка клетки обеспечивает целостность и прочность
всей клетки.
Большая вакуоль выступает складом молекул крахмала. Глюкоза (см. гла-
ва 7), которая производится в процессе фотосинтеза, превращается в крах-
мал — полимер глюкозы. Некоторое время спустя этот крахмал становится
надежным источником энергии.
Хлоропласты, содержащиеся в зеленых растениях, представляют собой
специализированные химические фабрики. Это место, где происходит реакция
фотосинтеза, который заключается в сборе хлорофиллом солнечного света и
использовании полученной энергии для соединения углекислого газа и воды
в молекулы глюкозы и высвобождения кислорода.
Листья многих растений окрашены в зеленый цвет, который они
приобретают благодаря хлорофиллу, содержащему соединения
_ „ магния.
СОВЕТ
Теперь, получив представление о живых клетках, можно смело переходить
непосредственно к изучению биохимии!
ГЛАВА 1 Что такое биохимия и почему она важна 31
Глава 2
Основа всего
живого: гидрохимия
и уровень pH
В ЭТОЙ ГЛАВЕ...
» Роль и свойства воды
» Отличие кислоты от щелочи
» Контроль уровня pH в буфере
Вода — это самое важное вещество для всего живого на нашей планете.
Люди в ней моются, купаются, плавают на кораблях и ловят рыбу. Она
используется для уборки жилых помещений и при производстве элект-
роэнергии. Люди потребляют воду в разных формах: читая вода, чай, кофе,
пиво, другие напитки и блюда. Так или иначе, вода регулирует температуру
поверхности планеты и человеческого тела.
В биохимии вода выступает одним из главных действующих веществ. Чело-
веческое тело на 70% состоит из воды. Вода играет важную роль в переносе
веществ внутрь и из клетки. А многочисленные водные соединения участвуют
во всевозможных реакциях организма.
В этой главе мы исследуем структуру молекулы воды и ее свойства. Опи-
шем ее свойства как универсального растворителя. Кроме того рассмотрим
свойства кислот и щелочей и возможные равновесные состояния. Наконец по-
знакомимся со шкалой pH и буферами, включая скандально известное уравне-
ние Гендерсона-Хассельбаха. Итак, усаживайтесь поудобней, возьмите в руки
стакан с любимым напитком (водой?) и приготовьтесь к полному погружению!
Знакомство с водой
Вода крайне важна для всех форм жизни. Фактически, люди — это напол-
ненные водой емкости большого размера. Вода заполняет от 60 до 95% объема
живых клеток организма, и 55% от этого количества содержится во внутрикле-
точных жидкостях. Остальные (внеклеточные) 45% воды находятся в следую-
щих органах и веществах:
» плазма (8%);
» интерстициальное (межклеточное) пространство и лимфа (22%);
» соединительная ткань, хрящи и кости (15%).
Вода нужна как растворитель во многих процессах, происходящих в орга-
низме.
» Действует как транспортный посредник при пересечении мембран,
пронося вещества внутрь и удаляя их из клетки.
» Помогает поддерживать постоянную температуру тела.
» Выступает в качестве растворителя, перенося растворенные в
ней химические вещества в пищеварительной и выделительной
системах.
Здоровые люди потребляют и выделяют около двух литров воды в сутки.
При этом 45% воды поступает вместе с выпиваемыми жидкостями, 40% —
вместе с едой, а остальная вода уходит на окисление пищи. Вместе с мочой
из организма выводится приблизительно 50% воды, а в кале ее содержится
всего 5%. Оставшаяся часть воды испаряется через кожу и легкие. Водный ба-
ланс внутри тела поддерживается на постоянном уровне. Если потери воды
значительно превышают ее потребление, то организм обезвоживается. При су-
щественном преобладании потребления воды над ее потерей она не успевает
выводиться из организма, вызывая отечность, заключающуюся в накоплении
воды в тканях.
В следующих разделах описаны свойства самой востребованной организ-
мом жидкости и ее наиболее важные биохимические функции.
Не бойтесь промокнуть: физические свойства воды
Вода — это основная среда, в которой работают биологические системы, а
ее физические свойства оказывают на них чрезвычайно сильное влияние. По-
этому перед тем как продолжить крайне важно вспомнить основные свойства
воды, известные из курса общей химии.
34 ЧАСТЬ 1 Основы основ: базовые понятия
Полярная молекула
Молекула воды имеет не линейную, а изогнутую форму (рис. 2.1). При этом
у атомов водорода положительный заряд (8+), а атом кислорода заряжен отри-
цательно (8-). Такое распределение заряда вызвано разницей электроотрица-
тельности между атомами водорода и кислорода, обуславливающей силу, с
которым атом притягивает связывающую пару электронов. На рис 2.1 показана
молекула воды, изогнутая под углом 105°.
н н
Рис. 2.1. Схематическое
изображение молекулы воды
Сильные внутримолекулярные связи
Как правило заряды атомов, подобные входящим в состав молекулы воды,
обуславливают возникновение молекулярной силы, называемой диполъ-ди-
польной, которая притягивает положительный конец одной молекулы к отрица-
тельному концу другой молекулы. Высокая электроотрицательность кислоро-
да, наряду с существованием у атома водорода всего одного электрона, приво-
дит к возникновению заметно большей разницы в заряде, чем стоило ожидать.
Такая разница в заряде в свою очередь становится причиной возникновения
необычайно сильных внутримолекулярных сил со специальным названием —
водородные связи.
ЗАПОМНИ!
Термин “водородные связи” относится не к фактической связи атома
водорода с кислородом, а к суммарному взаимодействию атома во-
дорода с атомами кислорода, азота или фтора с атомами кислорода,
азота или фтора в этой же (внутримолекулярное взаимодействие)
или другой (межмолекулярное взаимодействие) молекуле. Отсюда и
термин межмолекулярная сила. (Заметьте, что о водородных связях
говорят всегда, когда водород связывается с фтором, хотя в норме
подобные соединения в биологических системах не возникают.)
В биохимии кислород- и азотсодержащие связи в молекулах играют край-
не важную роль, поскольку влияют на реакции между такими молекулами
и определяют структуру этих молекул. Образование водородных связей при
взаимодействии воды с другими молекулами объясняет такие ее свойства, как
растворимость, и реакции с участием веществ, в которых вода выступает рас-
творителем (см. далее).
ГЛАВА 2 Основа всего живого: гидрохимия и уровень pH 35
Необычайно важным следствием возникновения водородных связей
в молекуле воде является уменьшение ее плотности при замерзании.
Вода менее плотная в твердой форме, чем в жидкой. Вследствие это-
го лед, как в виде мелкой крошки, так и монолитного айсберга боль-
шого размера, никогда не тонет в воде. В подавляющем большин-
стве других веществ, твердая фаза всегда плотнее жидкой, а потому
твердое всегда тонет в жидком. Но только не у воды! Почему это
столь важно для живой природы? Спросите у любителей подледной
рыбной ловли! Слой льда, который формируется на поверхности хо-
лодных водоемов, изолирует воду от воздействия холодного воздуха,
защищая организмы, живущие подо льдом от замерзания.
Высокая удельная теплоемкость
Удельная теплоемкость воды определяет количество тепла, необходимого
для изменения температуры одного ее грамма на один градус Цельсия. Высо-
кая теплоемкость указывает на то, что изменение температуры воды не такая
уж и простая задача. Помимо того у воды высокая теплота испарения. Все мы
избавляемся от избыточного тепла, испаряя пот с кожи, что делает этот при-
родный механизм весьма эффективным способом охлаждения. (По достоин-
ству оценить его можно как на спортивных соревнованиях, так и на экзаменах
по биохимии!)
Озера и океаны поглощают и выделяют огромное количество теп-
ла без значительного изменения своей температуры, потому что у
воды высокая теплоемкость и большая теплота испарения. Работая
в единой связке, обе характеристики позволяют поддерживать тем-
пературу планеты на относительно постоянном уровне. С помощью
этого же механизма стабильная температура поддерживается у всех
теплокровных животных. (Такие холоднокровные обитатели плане-
ты, как адвокаты и преподаватели химии, научились поглощать до-
статочно тепла в течение дня, чтобы не мерзнуть всю последующую
ночь.)
Самая важная биохимическая функция воды: растворитель
Полярность молекул воды предопределяет притягивание (поглощение) ими
других полярных веществ. Воду часто называют универсальным растворите-
лем за то, что она растворяет неимоверно большое количество других веществ.
Многие ионные вещества растворяются в воде благодаря тому, что отрицатель-
ные заряженные концы молекул воды притягивают катионы (положительно
Зб ЧАСТЬ 1 Основы основ: базовые понятия
заряженные ионы) ионного соединения (соединение, получаемое в результате
реакции металла с неметаллом), а ее положительно заряженные концы притя-
гивают анионы (негативно заряженные ионы) такого соединения. Ковалентно
связанные (в результате реакций между неметаллами) полярные вещества, та-
кие как спирты и сахара, также растворяются в воде вследствие диполь-ди-
польного взаимодействия (образования водородных связей). Тем не менее, ко-
валентно связанные неполярные вещества, такие как жиры и масла, в воде не
растворяются.
gjh Ввиду своей способности взаимодействовать с молекулами воды по-
лярные молекулы классифицируются как гидрофильные (поглоща-
ющие воду). Неполярные молекулы, которые слабо взаимодейству-
ют (растворяются) с молекулами воды, называются гидрофобными
(водоотталкивающими). Существуют молекулы, которые называют-
ся амфипатическими, из-за того, что обладают как гидрофильными,
так и гидрофобными свойствами.
На рис. 2.2 показана структура типичной амфипатической молекулы. В ле-
вой части рисунка изображена молекула с ее гидрофильными и гидрофобными
участками. А в правой части рисунка приведена графическая интерпретация
такой молекулы. Круглая “голова” — это гидрофильная часть молекулы, а
длинный хвост представляет ее гидрофобную часть.
Альтернативное
представление
= Гидрофильный
= Гидрофобный
Рис. 2.2. Структура типичной амфипатической (обладающей
как гидрофильными, так и гидрофобными свойствами) молекулы
ГЛАВА 2 Основа всего живого: гидрохимия и уровень pH 37
Определенные ампифатические молекулы, такие как молекулы мыла, фор-
мируют мицеллу, или мельчайшие капли, окружающие нерастворимые веще-
ства. На этом их свойстве основана моющая сила мыла и всевозможных очи-
стителей. Гидрофобная часть молекулы (длинная углеводная цепочка) раство-
ряется в неполяризованном веществе таком, как жировая смазка или масло, а
ее гидрофильная часть, называемая ионным концом, остается в воде. Мыло
или очиститель расщепляет жировое вещество или масло и задерживает ее в
растворе, позволяя осесть.
Мицелла ведет себя как большая поляризованная молекула (рис. 2.3). Струк-
тура мицеллы во многом напоминает клеточную мембрану.
Полярное
вещество (вода)
Гидрофильная головка
Гидрофобный хвост
Рис. 2.3. Структура мицеллы, состоящей из амфипатических молекул с
направленными наружу "головами"
Концентрация ионов водорода:
кислоты и основания
В водных растворах, особенно встречающихся в биологических системах,
первостепенную важность представляет концентрация ионов водорода (Н+).
Во многих биологических системах часто приходится прилагать невероятные
усилия, чтобы обеспечить неизменность концентрации ионов водорода, опре-
деляемой показателями [Н+] или pH (кислотность раствора).
Даже незначительное изменение концентрации ионов водорода может ока-
заться губительным для живого организма. Например, чтобы организм чело-
века нормально функционировал, в его крови должно содержаться совсем не-
большое количество ионов водорода. Повышенная или пониженная их концен-
трация может стать причиной смерти.
38 ЧАСТЬ 1 Основы основ: базовые понятия
Ввиду сильной зависимости живых организмов от уровня pH давайте уде-
лим этому показателю более пристальное внимание.
Стремясь к равновесию
Если ионы водорода (Н+) и гидроксильные ионы (ОН") имеют одинаковые
концентрации, то такой раствор называется нейтральным. Если же концентра-
ция ионов водорода больше, чем концентрация гидроксильных ионов, то рас-
твор становится кислым. Если выше оказывается концентрация гидроксильных
ионов, то раствор становится щелочным. Эти химические состояния связаны с
химическим равновесием.
Кислые растворы, такие как лимонный сок, вполне ожидаемо имеют
кислый вкус. Щелочные растворы, подобные тонизирующим напит-
кам, слегка горьковатые. (Добавление джина не приводит к измене-
нию их горьковатого привкуса!)
Равновесие ионов водорода наблюдается во всех водных растворах. Вода
может выступать главным источником ионов водорода, но это происходит да-
леко не всегда (что обычно и наблюдается). Вода способствует повышению
концентрации ионов водорода, поскольку она подвержена самоионизации, как
показывает следующее уравнение.
Н2О(моны)<=*Н+ {вода) + ОН" {вода).
СОВЕТ
Очень часто Н+(вода) представляется в форме Н3О+.
Двухсторонняя стрелка (<—>) указывает на то, что описываемая уравнением
реакция является равновесной. Следовательно должно наблюдаться постоян-
ство, вызванное равновесием (К). Константа равновесия в предыдущем урав-
нении равна Kw и рассчитывается, как произведение концентрации ионов водо-
рода и гидроксильных ионов.
Kw = [Н+] • [ОН’] = 1,0 • IO’14 (при t = 25 °C)
Значение постоянной Kw, как и многих других констант, остается неизмен-
ным только при постоянной температуре. Для организма человека с темпера-
турой 37 °C величина Kw равна 2,4 • 10-14.
В дистиллированной воде при температуре 25 °C концентрация [Н+] рав-
на 1,0- 10"7 М (1,6- 10"7 М при 37 °C). Концентрация гидроксильных ио-
нов точно такая же, как и ионов водорода, поскольку они образуются в рав-
ГЛАВА 2 Основа всего живого: гидрохимия и уровень pH 39
ных количествах в процессе самоионизации. Не забывайте, что равенство
[Н+] = [ОН-] оказывается верным только для дистиллированной воды.
ЗАПОМНИ!
Символом М обозначается концентрация или молярность вещества.
Молярность указывает число молей растворенного вещества в литре
раствора.
Шкала pH
Выражение концентрации ионов водорода в экспоненциальной форме, по-
добной 1,0 • IO'7, не всегда удобно. К счастью, существует более простой спо-
соб указать концентрацию ионов водорода — через значения pH. Для вычисле-
ния уровня pH раствора применяется такое уравнение.
pH =-log [Н+].
Например, уровень pH раствора с концентрацией ионов водорода
1,0 • 10"7 М вычисляется следующим образом.
pH=-log (1,0 • IO’7) = 7,0.
В табл. 2.1 представлены подобные расчеты для нескольких типичных зна-
чений концентрации ионов водорода.
Таблица 2.1. Соответствие значений pH и концентраций ионов водорода
[Н+] pH Тип раствора
1,0-10° м 0 Кислый
1,0-10-’м 1 Кислый
1,0-10~2М 2 Кислый
1,0-1(Г3М 3 Кислый
1,0-1(Г*М 4 Кислый
1,0-10~5 м 5 Кислый
1,0-10-6 м 6 Кислый
1,0-10-7М 7 Нейтральный
1,0-10-8 м 8 Щелочной
1,0-10~9М 9 Щелочной
1,0 • 10-’° м 10 Щелочной
40 ЧАСТЬ 1 Основы основ: базовые понятия
Окончание табл. 2.1
[Н+] pH Тип раствора
1,0-10-" м 11 Щелочной
1,0 • 10-’2 м 12 Щелочной
1,0-10-,3М 13 Щелочной
1,0-10-,4М 14 Щелочной
ЗАПОМНИ!
Растворы с pH > 7 считаются щелочными, а растворы с pH < 7 —
кислыми. Если pH = 7, то раствор нейтральный. У дистиллирован-
ной воды pH = 7. Однако не забывайте, что не каждый раствор с
pH = 7 является дистиллированной водой! Например, если добавить
в воду соль, то pH раствора останется равной 7, но он не будет дис-
тиллированной водой.
Шкала pH является открытой с двух сторон, означая, что pH раствора может
быть большим 14 или меньшим нуля. Например, pH раствора 1,0 • 101 молей
соляной кислоты равна -1. Джону нравится задавать вопросы по этой теме
своим студентам! Диапазон от 0 до 14 является лишь частью общей шкалы pH
и характерен для растворов, которые встречаются в реальной жизни, в частно-
сти биохимических. Уровень pH большинства биологических систем прибли-
зительно равен 7, хотя у этого правила есть заметные исключения (например,
pH вашего желудочного сока ближе к 1).
Вычисление рОН
По такой же формуле, что и pH, можно рассчитать уровень рОН, основан-
ный на концентрации гидроксильных ионов. Для этого применяется уравнение
рОН = -log [ОН-]. Концентрацию гидроксильных ионов также можно вычис-
лить, исходя из соотношения концентрации ионов водорода и Kw (константы
равновесия).
[ОН-] = ^/[Н+].
Q Намного проще вычислить значение рОН по известному pH с по-
мощью формулы рН + рОН = 14, где 14 =pKw =-log Kw = -log 1,0 х
x Ю’14.
СОВЕТ
Например, если [Н+] раствора равно 6,2 • 10-6, то его pH рассчитывается как
pH =-log [Н+],
ГЛАВА 2 Основа всего живого: гидрохимия и уровень pH Д1
pH = -log [6,2 • IO-6],
pH = 5,21.
Получить pOH такого раствора очень просто.
рОН = 14,00 - pH = 14,00 - 5,21 = 8,79.
Располагая известным значением pH или рОН, можно определить соответ-
ствующее значение [Н+] или [ОН-].
[н+] = iorpH и [он-] = ю-р°н.
Например, концентрация ионов водорода раствора с pH, равным 7,35, вы-
числяют по такой формуле.
[Н+] = 10-7-35 = 2,2 • IO’7.
Теория Бренстеда-Льюиса
Ввиду высокой важности уровня кислотности (pH) в биологических систе-
мах давайте рассмотрим наиболее признанную теорию, описывающую свой-
ства кислот и оснований, — теорию Бренстеда-Льюиса. Согласно этой теории,
кислоты являются донорами ионов водорода (Н+), а щелочи — реципиентами.
Обмен водородом между кислотами и основаниями
Кислота увеличивает концентрацию ионов водорода в растворе, или, други-
ми словами, снижает pH. Некоторые кислоты, называемые сильными, очень
сильно меняют концентрацию ионов водорода; они практически полностью
распадаются на ионы в воде. Большинство кислот, в частности биологически
важные кислоты, не столь эффективны в производстве ионов водорода; они
только частично ионизируются в воде. Такие кислоты известны, как слабые.
Основания больше принимают или реагируют с ионами водорода в рас-
творе, чем отдают. Они уменьшают концентрацию ионов водорода в растворе
потому, что вступают в реакцию с ними. Сильные основания несмотря на то,
что очень хорошо присоединяют ионы водорода, не так уж и важны для биоло-
гических систем. Большинство биологически значимых оснований по своему
воздействию является слабым.
Теория Бренстеда-Льюиса объясняет поведение кислот и основа-
РЛ ний с позиции равновесия. Кислота Бренстеда-Льюиса — это донор
гидрокисльных ионов (Н+), а основание Бренстеда-Льюиса — это
реципиент ионов водорода. Уксусная кислота, слабая кислота, вхо-
дящая в состав уксуса, частично ионизируется в растворе, что опи-
сывается следующим уравнением.
ЧАСТЬ 1 Основы основ: базовые понятия
СН3СООН<=±Н+ + СН3СОО".
Двойная стрелка указывает на то, что уксусная кислота ионизируется не
полностью. (Если кислота сильная, то происходит полная ионизация, что пока-
зывается с помощью одинарной стрелки.) Равновесная стрелка указыва-
ет на то, что в растворе присутствует все три химических компонента: уксус-
ная кислота, ионы водорода, ионы ацетата.
По теории Бренстеда-Льюиса ионы ацетата выступают основанием, пото-
му что могут принимать ионы водорода, превращаясь в уксусную кислоту.
Согласно этой теории, два вещества, которые отличаются только по одному
иону водорода (Н+), например уксусная кислота и ацетат-ион, составляют
сопряженную пару кислота-основание. Вещества с дополнительным ионом
водорода — это сопряженная кислота (СК), а вещество с недостающим ионом
водорода — сопряженное основание (СО).
СОВЕТ
Вы можете рассчитать такое равновесие на примере уксусной кис-
лоты точно так же, как в любых других случаях, — согласно закону
действия масс, но только тогда, когда между веществами поддержи-
вается баланс. Описывающее его выражение представляет формулу
вычисления коэффициента реакции или константы равновесия.
Для уксусной кислоты оно имеет следующий вид.
[н+][сн3соо-’
К“ ~ [СН3СООН]
Индекс а говорит о том, что вычисления проводятся для кислоты (acid).
Квадратные скобки указывают на то, что в расчетах принимаются во внимание
молярные концентрации веществ. Величину Ка можно выразить через значе-
ние $Ка, которое в свою очередь рассчитывается так же, как и pH.
Р^, = -log ка.
С точки зрения сопряженных кислот и оснований значение Ка можно опре-
делить так:
ЗАПОМНИ!
к ДН*ДСВ1
‘ [СА] '
В этом уравнении переменными выступают формулы вычисления
концентраций сопряженных кислоты и основания.
ГЛАВА 2 Основа всего живого: гидрохимия и уровень pH 43
Помимо кислоты коэффициент реакции Кь можно вычислить для основания
(base) (обратите внимание на b в нижнем индексе). Слабое основание, напри-
мер аммиак, может входить в следующее уравнение.
NH3 + Н2О<=±ОН" + NH4.
Константа равновесия для него вычисляется по такой формуле.
Общее выражения вычисления Кь принимает следующий вид.
ь ~
ОН' |[СА]
[св]
Как и Ка, коэффициент Кь изменяется только вследствие изменения концен-
траций сопряженных кислоты и основания.
Коэффициент ^рассчитывается для каждой кислоты; ему соответствует ко-
эффициент ^сопряженного основания. Коэффициенты Ка и Кь сопряженной
пары кислота-основание связаны между собой — их можно выразить через
общий коэффициент Kw — константу ионизации воды.
кЛ = к„=1,ою-14.
Наряду с этим для описания их взаимосвязи можно применять более корот-
кую формулу.
р^о + р^=14.
(Вам ведь нравится математика? В биохимии проводится немногим больше
математических расчетов, чем в органической химии, но, конечно же, не так
много, как в общей химии, так что держитесь!)
Коэффициент Кь основания, сопряженного с уксусной кислотой, непосред-
ственно связан со следующим равновесным уравнением.
СН3СОО" + Н2О<=±ОН" + СН3СООН.
При этом коэффициент Ка ионов аммония, сопряженных с аммиачной кис-
лотой, связан с таким уравнением.
NH4 + <=>H++NH3.
Кислота должна быть способна отдавать больше, чем один ион водорода.
Важным примером такой кислоты в биологии является фосфорная кислота
(Н3РО4), представляющая собой трипротонную кислоту (отдает сразу три
ЧАСТЬ 1 Основы основ: базовые понятия
иона водорода, по одному за раз). Эта кислота описывается следующим урав-
нением.
Ка1: Н3РО4<=»Н+ + Н2РО4";
Ка2: Н2РС>4 <=±Н++ НРО4";
Ка3: НРО^<=±Н+ + РО’’.
Цифры в нижним индексе коэффициента Ка указывают на последователь-
ную потерю сначала первого, затем второго и, наконец, третьего иона водоро-
да. Соответствующие выражения поэтапного расчета коэффициента Ка осно-
ваны на общей формуле.
а
н+|[св]
[СА]
Ниже приведены отдельные формулы Ка для каждого этапа расщепления
Н3РО4.
н2ро;
al
а2 “
н
-[Н3РО4]
н+]Гнро*’
'н2ро;
аЗ
н+II ро^
’нро*-’
ЗАПОМНИ!
Каждое следующее значение константы равновесия обычно значи-
тельно меньше предыдущего. В табл. 2.2 приведены значения кон-
стант равновесия для некоторых биологически важных кислот. Ее
можно использовать в качестве справочника, работая с буферными
системами или определяя, какая из кислот сильнее.
Таблица 2.2. Значения Ка некоторых биологически важных кислот
Вещество К. К.
al az аЗ
Уксусная кислота 1,7-10"5
(СН3СООН)
Пировиноградная кислота 3,2 • 10"3
(СН3СОСООН)
ГЛАВА 2 Основа всего живого: гидрохимия и уровень pH 45
Окончание табл. 2.2
Вещество *02 Коз
Молочная кислота (СН3СНОНСООН) 1,4- 1СГ4
Янтарная кислота (НООССН2СН2СООН) 6,2-10-5 2,3 -10’6
Углекислота (Н2СО3) 4,5-10’7 5,0-10’11
Лимонная кислота (НООССН2С(ОН)(СООН) - СН2СООН) 8,1 -КГ4 1,8 -10-5 3,9-10'6
Фосфорная кислота (Н3РО4) 7,6-10’3 6,2-10-8 2,2 -10-’3
Кислота или основание?
Некоторые вещества не в состоянии определиться с собственной ориента-
цией — они реагируют и как кислота, и как основание. Химики называют та-
кие вещества амфотерными или амфипротными. Например, как кислота и
основание реагируют бикарбонат-ионы (НСО3).
НСО3 <=>Н+ + СО3";
НСОз + Н2О<=±ОН“ + Н2СО3.
Важные с точки зрения биохимии молекулы также часто демонстрируют
амфотерное поведение. Аминокислоты включают сразу обе группы — щелоч-
ную аминовую (-NH2) и кислотную карбоксильную (-СООН). Именно поэ-
тому они могут действовать и как щелочь, и как кислота. Например, глицин
(H2N-CH2-COOH) демонстрирует следующие реакции.
H2N-CH2-COOH <=> Н+ + H2N-CH2-COO“;
H2N-CH2-COOH + H2O^OH" + +H3N-CH2-COOH.
Фактически аминокислоты подвергаются переносу протона от карбоксиль-
ного конца к аминовому, формируя в целом нейтральное вещество с положи-
тельным и отрицательным концами. Подобные вещества называются цвит-
тер-ионы (не путать с твиттерионами — людьми, которые твитят до тех пора,
пока не перестают слушаться большие пальцы рук).
H2N-CH2-COOH <=> +H3N-CH2-COO"
46 ЧАСТЬ 1 Основы основ: базовые понятия
Буферы и контроль уровня pH
Буферным называется раствор, которые содержит сопряженную кислот-
но-основную пару любой слабой кислоты или основания в пропорции, позво-
ляющей противостоять изменению pH при добавлении в раствор небольшого
количества кислоты или основания. Многие биологические процессы эффек-
тивно проходят только в ограниченном диапазоне значений pH. Буферные си-
стемы позволяют удерживать pH в заданных границах.
Известные физиологические буферы
Поддержание pH различных жидкостей в человеческом теле на заданном
уровне является очень важной задачей. Например, pH крови равно 7,4, у желу-
дочной кислоты оно составляет 1-2, а в кишечнике — принимает значение 8-9
единиц. Если pH крови снижается больше, чем на 0,2 единиц, то это приводит
к состоянию, известному как ацидозу соответствующее возрастание pH на та-
кую же величину называется алкалозом. Ацидоз и алкалоз, которые вызывают
серьезные осложнения, проявляются в двух разных формах.
» Респираторный ацидоз является результатом многих заболеваний,
которые поражают дыхательную систему, включая пневмонию, эм-
физему и астму. Эти заболевания отмечаются низкой эффективно-
стью вывода из организма двуокиси углерода, что приводит к нако-
плению к ней углекислоты, Н2СО3.
» Метаболический ацидоз возникает по причине снижения концен-
трации НСО3 (ионов бикарбоната). Оно может быть вызвано забо-
леваниями почек, неконтролируемым диабетом и рвотой некислы-
ми жидкостями. К метаболическому ацидозу также часто приводит
отравление соляной кислотой.
» Респираторный алкалоз может возникать вследствие гипервенти-
ляции — избыточного выделения углекислого газа, вызывающего
снижение концентрации Н2СО3. Неотложное лечение включает ды-
хание через бумажный пакет, что приводит к повышению концен-
трации углекислоты во вдыхаемом воздухе, а, следовательно, и в
крови.
» Метаболический алкалоз развивается при обильной рвоте и потере
желудочной кислоты.
Чтобы противостоять изменению уровня pH, кровь располага-
ет сразу несколькими буферными системами, которые поддержи-
вают стабильность pH, при необходимости вступая в реакцию как
НА ПРАКТИКЕ
ГЛАВА 2 Основа всего живого: гидрохимия и уровень pH 47
с избыточными кислотами, так и с основаниями. В общем случае
в качестве таких буферных систем применяются амфотерные веще-
ства или смеси слабых кислот и слабых оснований. В человеческом
организме они представлены отдельными белками в плазме крови
и бикарбонатной буферной системой.
Бикарбонатная буферная система является главной внеклеточной буфер-
ной системой. Она непосредственно участвует в выводе углекислого газа из
организма. Растворение углекислого газа в водных системах основано на сле-
дующем уравнении.
СО2 + Н2О<=>Н2СО3 «=»Н+ + НСО3
На то, что оно описывает буферную систему, указывает присутствие сопря-
женной пары кислота-основание (Н2СО3 и НСО3). Соотношение сопряженных
кислоты и основания составляет примерно 20 к 1 при pH крови равном 7,4.
Буферная система связывается со следующим равновесным состоянием (отво-
да углекислого газа из легких).
СО2 СО2 ( легкие)
Основная внутриклеточная буферная система основана на второй иониза-
ции фосфорной кислоты, Ка2. Уровень pH такой сопряженной пары кисло-
та-основание (Н2РО; и НРО4") равен 7,21 при равных концентрациях обоих
веществ.
Расчет буферной системы
Чтобы определить pH, нужно рассчитать коэффициент Ка или Кь, как это
делалось ранее или с помощью уравнения Гендерсона-Хассельбаха, которое
заметно короче.
Уравнение Гендерсона-Хассельбаха имеет сразу две формы записи,
[св]
рН = рК. + log^
И
[СА1
рОН = ?КЬ + logLJ
Используемые в них обозначения полностью совпадают с определенными
ранее в этой главе. Предположим, что требуется вычислить pH буфера, состо-
ящего из 0,15 молей пировиноградной кислоты и 0,25 молей пирувата натрия.
Обратившись к табл. 2.2, можно определить Ка пировиноградной кислоты:
3,2 • IO’3.
48 ЧАСТЬ 1 Основы основ: базовые понятия
Таким образом $Ка будет равняться 2,50. Следовательно:
, [св]
рН = р^ + 108[сХ];
, Гсн,сосоо_]
pH = -log!3,2 • 10-31 + log]?-----4;
н > [СН3СОСООН]
pH = 2,50 + logi^|l;
1^ V, 1 J J
pH = 2,50 + log 1,67;
pH = 2,50+ 0,22 = 2,72.
ЗАПОМНИ!
Чем выше значения [СА] и [СВ], тем больше буферная емкость раст-
вора. Буферная емкость указывает, сколько кислоты или основания
можно добавить к буферу до того, как он перестанет функциони-
ровать. В буфере, в котором [СА] = [СВ] = 1,0, заметно больше бу-
ферная емкость для добавления как кислот, так и щелочей, чем в
буфере с [СА] = [СВ] = 0,1. Если в имеющемся буфере [СА] = 1,0,
а [СВ] = 0,1 , то у него будет большая буферная емкость для добавле-
ния оснований, чем для добавления кислот, поскольку исходно в
нем содержится больше кислоты, чем основания. Концентрация со-
пряженной пары кислота-основание должна быть как можно ближе
к максимально возможной для того, чтобы сделать буфер предельно
гибким.
ГЛАВА 2 Основа всего живого: гидрохимия и уровень pH 49
Глава 3
Игры с углеродом:
органическая химия
В ЭТОЙ ГЛАВЕ...
» Углерод как базовый химический элемент в биохимии
» Сила взаимодействия различных видов связей
» Изучение функциональных групп
» Изомерия
Большинство важных с биохимической точки зрения органических моле-
кул, состоит из атомов углерода. Следовательно, посвятив себя биохи-
мии, вам нужно иметь уверенные знания органической химии, которая
описывает поведение углеводных соединений в достаточной степени для по-
нимания функций и поведения биохимических молекул. В этой главе нам пред-
стоит рассмотреть базовые концепции органической химии, познакомиться с
разными функциональными группами и изомерами, играющими очень важную
роль в биохимии. (Вне всяких сомнений вам придется вспомнить лекции и ла-
бораторные занятия по “органике”.)
Роль углерода в изучении жизни
В прежние времена ученые верили, что все без исключения углеродные со-
единения являются результатом биологических процессов. Это означало, что
органическая химия выступала синонимом биохимии в рамках так называемой
теории жизненных сил. Однако, в средине 19 столетия такие исследователи,
как Фредерик Велер доказали несостоятельность такого представления. Син-
тез мочевины из неорганических веществ (цианата аммония, NH4OCN) указал
на существование других способов получения углеродных соединений. В на-
стоящее время органическая химия позволяет синтезировать многие важные
органические соединения без использования биологического сырья. Тем не
менее биосинтез по-прежнему остается важным источником компонентов для
многих органических соединений.
Чему мы обязаны столь большому многообразию углеводных соединений?
У него есть две основные причины, и обе связаны с удивительной способно-
стью углерода к созданию устойчивых связей.
» Углерод-углеродные связи. Атомы углерода образуют устойчи-
вые связи с другими атомами углерода. Процесс, в течение кото-
рого одни атомы связываются с другими атомами этого же вида,
называется образованием цепочек. Множество других частиц могут
образовывать цепочки, но лучше всего это получается у углерода.
Считается, что у углерода нет ограничений на количество атомов,
объединяющихся в такие цепочки. Подобные соединения могут
принимать линейную, разветвленную или кольцевую формы, как
показано на рис. 3.1.
» Углеродные связи с другими элементами. Углерод способен об-
разовывать устойчивые соединения с множеством элементов. К ним
относятся такие важные для биохимии элементы, как водород, азот,
кислород и сера. Последние три элемента составляют основу наибо-
лее важных функциональных групп (активных молекулярных групп),
необходимых для жизни. Соединения между углеродом и водоро-
дом обычно неактивные с точки зрения биохимического взаимо-
действия; однако водород часто выступает в качестве "инертного"
заместителя.
Все дело в количестве:
углеродные соединения
ЗАПОМНИ!
Углерод может образовывать четыре связи. При образовании со-
единений углерода с углеродом и другими элементами возможны
различные способы гибридизации. При образовании связи с дру-
гой молекулой, содержащей углерод, возможны следующие спо-
собы гибридизации: четыре одинарных связи, две одинарных и
одна двойная связь, одна тройная и одна одинарная связь или две
двойных связи. Во многих биохимических процессах особенно
52 ЧАСТЬ 1 Основы основ: базовые понятия
важными оказываются двойные связи углерода с атомами кислоро-
да. В табл. 3.1 собраны сведения о количестве возможных связей
углерода с некоторыми неметаллами, а также указаны способы ги-
бридизации таких связей.
н н н н н н
н—с—с—с—с—с—с—н
н н н н н н
сн —сн— сн —сн — сн — сн3
н3с —сн—сн—сн—сн—сн3
I
сн3
Гексан
Гексан
2-метилгексан
ХСН2\
сн2 сн2 ..
I । 2 Циклогексан
сн2 сн2
чсн2х
Рис. 3.1. Неразветвленное углеводородное соединение (вверху),
разветвленное углеводородное соединение (по середине),
кольцевое углеводородное соединение (внизу)
Таблица 3.1. Возможные связи между углеродом и неметаллами
Элемент Число возможных связей с углеродом Количество способов гибридиза- ций у элементов второго периода
Углерод (С) 4 4 одинарных (sp3) 2 одинарных, 1 двойная (sp2) 1 двойная, 1 тройная (sp) 2 двойных (sp)
Азот (N) 3 3 одинарных (sp3), 1 одинарная, 1 двойная (sp2) 1 тройная (sp)
Кислород (О) 2 2 одинарных (sp3), 1 двойная (sp2)
Сера (S) 2 2 одинарных (sp3), 1 двойная (sp2)
Водород(Н) 1 1 одинарная
ГЛАВА 3 Игры с углеродом: органическая химия 53
Окончание табл. 3.1
Элемент Число возможных связей с углеродом Количество способов гибридиза- ций у элементов второго периода
Фтор (F) 1 1 одинарная
Хлор (CI) 1 1 одинарная
Бром (Вг) 1 1 одинарная
Йод (I) 1 1 одинарная
Сила превыше всего: связь укрепляет
В биохимии ковалентные связи образуются внутримолекулярными сила-
ми (существующими только внутри молекулы). Интерес также представляют
межмолекулярные силы, возникающие между химическими веществами. Кро-
ме всего прочего межмолекулярные силы в большой степени определяют
гидрофильные (водовосприимчивые) и гидрофобные (водоотталкивающие)
взаимодействия.
Есть у всех: межмолекулярные силы
Все межмолекулярные взаимодействия определяются силами Ван-дер-Ва-
альса — они не образуют настоящие связи, предполагающие обмен или пере-
нос электронов, и характеризуются более слабой силой притяжения. К таким
силам относятся лондоновские дисперсионные силы, диполь-дипольные силы,
водородные связи и силы ионного взаимодействия.
Лондоновские дисперсионные силы
Лондоновские дисперсионные силы, возникающие тогда, когда облако элек-
тронов атома одной молекулы начинает взаимодействовать с ядром атома дру-
гой молекулы, являются очень слабыми и недолговечными. Они настолько
слабы, что учитываются только в отсутствии других типов межмолекулярных
взаимодействий.
Диполь-дипольные силы
Диполь-дипольные силы существуют между полюсами различных молекул.
Образование диполя предполагает формирование у молекулы частично поло-
жительного (5+) и частично отрицательного (5-) концов. Противоположно за-
ряженные концы притягивают друг друга, в то время как концы с одинаковым
54 ЧАСТЬ 1 Основы основ: базовые понятия
зарядом — отталкиваются. В большинстве случаев в биологических системах
задействуется специальный вид диполь-дипольных сил — водородные связи
(см. следующий раздел).
Водородные связи
Водородная связь, как подразумевает название, образуется у водорода. Атом
водорода связывается либо с атомом кислорода, либо с атомом азота. (В неор-
ганической химии водородная связь тоже возможна и возникает при соедине-
нии атома водорода с атомом фтора.) Водородные связи сильнее обычного ди-
поль-дипольного взаимодействия, и намного сильнее лондоновских дисперси-
онных сил. Водород, который связывает как атом азота, так и атом кислорода,
вполне ожидаемо сильно притягивается к различным соединениям, включаю-
щим атомы азота и кислорода. Водородная связь может быть как внутримоле-
кулярной, так и межмолекулярной.
Ионные взаимодействия
В биологических системах ионные взаимодействия определяют как вну-
тримолекулярные, так и межмолекулярные связи. В отдельных случаях они
устанавливаются между катионами металлов, например Na+, и анионами,
подобными С1". Но чаще всего катионом выступает аммоний-ион аминогруп-
пы такой, как RNH3, а анион берется из уксусной кислоты — например
RCOO". Противоположно заряженные ионы обладают очень большой силой
притяжения.
Взаимодействие с водой: гидрофилы и гидрофобы
Основной фактор, указывающий на гидрофобные свойства молекулы, — это
существование участков, содержащей только атомы углерода или водорода.
Углеводородные части молекулы неполярные и притягиваются к другим непо-
лярным участкам с помощью лондоновских дисперсионных сил.
В общем случае, включение в молекулу любого атома, отличного от
гИ углерода и водорода, приводит к ее поляризации. Кислород и азот
являются наиболее сильнодействующими веществами в биохимии,
ЗАПОМНИ!
приводящими к поляризации молекул. Самыми неактивными сре-
ди биологически важных элементов, обеспечивающих полярность,
выступают атомы серы. Диполь-дипольные силы, водородные связи
и силы ионного притяжения относятся к гидрофильным взаимодей-
ствиям. Лондоновские дисперсные силы — это всегда гидрофобные
взаимодействия.
ГЛАВА 3 Игры с углеродом: органическая химия 55
ЗАПОМНИ!
Чем больше в молекуле цепочка атомов углерода и водорода без
примесей других атомов, тем сильнее ее гидрофобная природа и тем
больше она оказывает влияние на свойства всей молекулы. Заметь-
те, что молекула может включать одновременно как гидрофильные,
так и гидрофобные участки, и оба они в одинаковой степени опре-
деляют поведение молекулы. В частности, формирование мицеллы
(см. глава 2) возможно только в молекулах с обоими типами участ-
ков — гидрофильных и гидрофобных. Мыло и другие моющие сред-
ства эффективно растворяют жировые и масляные загрязнения и,
образуя мицеллы, позволяют осаждаться полученным соединениям.
Сила связи и физические свойства веществ
Физические свойства биологических веществ определяются всеми возмож-
ными типами внутримолекулярных сил. Наблюдается следующий порядок сил:
Ионное притяжение => водородные связи => диполь-дипольные
силы => лондоновские дисперсионные взаимодействия.
Самые сильные внутримолекулярные взаимодействия основаны на притя-
жении ионов. Следующими по силе выступают водородные связи. Взаимодей-
ствие полярных веществ определяется диполь-дипольными связями, которые
гораздо слабее водородных связей. Любые биологические вещества, в состав
которых входит кислород, азот, сера или фосфор являются полярными. Лондо-
новские дисперсионные силы, самые слабые из внутримолекулярных взаимо-
действий, играют существенную роль только в неполярных веществах. Заметь-
те, что углеводородные участки биологических молекул всегда неполярные.
Точка плавления, точка кипения и растворимость
По мере уменьшения силы взаимодействия снижается точка плавления, точ-
ка кипения и растворимость вещества в воде. Наряду с этим возрастает давле-
ние пара и растворимость в неполярных растворах.
Вещества с высокой растворимостью в воде относятся к гидрофиль-
ным, а вещества с низкой растворимостью называются гидрофоб-
ными.
ЗАПОМНИ!
Молекулы может содержать участки обоих типов — и гидрофильные, и ги-
дрофобные. При этом преобладает участок, который занимает большую часть
молекулы. По такому принципу молекула
СН3СООН
56 ЧАСТЬ 1 Основы основ: базовые понятия
будет более гидрофильной, чем молекула
СН,СН9СН9СН9СН9СН9СН9СН9СН9СН,СООН,
J it Л/ Л/ Л* А* А* Л» Л/ л»
поскольку гидрофильный конец (-СООН) — это куда более значимая часть в
целой молекуле в первом случае, чем во втором.
Рассмотрим еще один пример. Молекула
НОСН2СН2СН2СН2СН2СН2ОН
более гидрофильная, чем
СН3СН2СН2СН2СН2СН2ОН
ввиду наличия второго гидрофильного участка (-ОН).
Запахи реального мира
Многие функциональные группы определяются характерный запах
у соединений. Малые органические кислоты пахнут как уксусная
кислота (винегрет), в то время как запах крупных кислот весьма не-
приятный. Большинства эфиров, если они летучие, обладают при-
ятным запахом, из-за чего они широко применяются в пищевой и
парфюмерной промышленности. У большинства серосодержащих
соединений противный, сильно отталкивающий запах. Малые ами-
нокислоты пахнут аммиаком, в то время как у крупных аминокислот
дурной и очень резкий запах. Вот почему рыбу часто готовят с лимо-
ном — лимонная кислота взаимодействует с основными аминокис-
лотами, образуя соль аммония без противного запаха. (Поверьте на
слово, существуют запахи похуже рыбьего — например трупный!)
Провоцируя реакцию:
функциональные группы
У большинства углеродов есть один или несколько химически активных
участков, состоящих из специфически сгруппированных атомов. Как раз в та-
ких местах и происходят химические реакции. Химически активные объедине-
ния атомов называются функциональными группами. Функциональные группы
содержат атомы, отличные от атомов углерода и водорода, и/или двойные или
тройные связи, которые определяют реактивность органической молекулы.
ГЛАВА 3 Игры с углеродом: органическая химия 57
Углеводороды
Алканы — это углеводородные соединения, которые содержат только угле-
род и водород, без функциональных групп в привычном понимании, что
определяет их слабую реакционную способность. Алкены и алкины — это
тоже углеводороды. Они отличаются соответственно двойными и тройными
углерод-углеродными связями. Реакционная способность соединения повы-
шается с увеличением количества таких связей. Ароматические углеводоро-
ды — обычно кольцевые структуры с меняющимися одинарными и двойными
углерод-углеродными связями — содержат одну или больше ароматических
систем, которые заметно менее реактивные, чем остальные системы с двойны-
ми связями. Алкены в биологических системах встречаются не часто. Структу-
ра таких соединений показана на рис. 3.2.
сн3—сн—сн—сн—сн—сн3
Алкан
сн — сн=сн—сн — сн — сн3
сн — с=с—сн—сн2—сн3
Рис. 3.2. Примеры алканов, алкенов, алкинов и ароматических углеводородов
Алкен
Алкин
Ароматический углеводород
Функциональные группы, включающие кислород и серу
Многие функциональные группы включают кислород. К ним относятся
спирты, эфиры, альдегиды и кетоны. Вы сталкивались со многими из этих
кислородсодержащих функциональных групп при изучении углеродов (наши
любимые соединения). В углеводородах эфирные группы многократно повто-
ряются, соединяясь между собой с помощью гликозидных связей (см. глава 7).
Кроме того карбоновые кислоты и эфиры являются важными функциональны-
ми группами, проявляющимися у жирных кислот, жиров и масел.
В состав спиртов и эфиров входят атомы кислорода только с простыми
одиночными связями. Фенол образуется при прикреплении спиртовой группы
к ароматическому кольцу. Как органические кислоты, так и эфиры содержат
атомы кислорода с простыми одиночными и двойными связями. Комбинация
атома углерода, связанного с атомом кислорода двойной связью, представляет
собой карбонильную группу.
Сера, элемент, расположенный в периодической таблице сразу под кисло-
родом, может вытеснять кислород как из спиртов, так и из эфиров, с обра-
зованием тиолов (меркаптан) и тиоэфиров. Многие из этих серосодержащих
58 ЧАСТЬ 1 Основы основ: базовые понятия
соединений реально дурно пахнут! Сера также может образовывать дисульфид
со связью между двумя атомами серы. Структуры таких соединений показаны
на рис. 3.3.
R = Любая органическая (углеводородная) группа
R' = Любая органическая группа, совпадающая или не совпадающая с R
R— ОН
Спирт
О
II
R—С —Н
Альдегид
О
II
R—С —ОН
Карбоксильная кислота
R—О—R'
Эфир
О
II
R— С — R'
Кетон
О
II
R— С — О— R'
Сложный эфир
Фенол
R— S — R'
R—SH
Тиол
R— S— S— R'
Тиоэфир Дисульфид
Рис. 3.3. Кислород- и серосодержащие функциональные группы
Функциональные группы, включающие азот
Амины и амиды относятся к наиболее важным функциональными группа-
ми, которые содержат азот. Амины представлены в аминокислотах и алкалои-
дах. Амиды есть в белках, где они известны благодаря пептидным связям.
Отличие между аминами и амидами в наличии у амидов карбонильной
группы рядом с атомом азота. Амины являются производными аммиака NH3,
в котором одна или несколько органических групп замещают атомы водоро-
да. В первичных аминах органическая группа замещает всего один атом во-
дорода. Во вторичных и третичных аминах две или три органические группы
ГЛАВА 3 Игры с углеродом: органическая химия 59
замещают два или три атома водорода. На рис. 3.4 показаны структуры таких
соединений, как анилин и аммиак.
Н— N— Н R— N— Н
I I
н н
Аммиак Первичный амин
R—N—Н
R— N— R"
Третичный амин
Вторичный амин
Анилин
О
II
R—С—N —R’
I
R"
Амид
Рис. 3.4. Некоторые азотсодержащие группы
НА ПРАКТИКЕ
Алкалоиды — это соединения, которые в основном производятся
растениями. Например, никотин, кофеин и морфин.
Функциональные группы, включающие фосфор
Фосфор также относится к важным элементам в биологических системах и
обычно рассматривается, как неотъемлемая часть фосфатной группы. Фосфат-
ные группы происходят от фосфорной кислоты, Н3РО4, и могут рассматривать-
ся как отдельные элементы или входить в состав дифосфатов, трифосфатов
или сложных фосфатных эфиров.
Фосфаты присутствуют в зубах и костях, а также являются частью
АТФ и АДФ — транспортных энергетических молекул (см. гла-
ва 12). Структуры некоторых функциональных групп, содержащих
НА ПРАКТИКЕ 1 1 с О
фосфор, изображены на рис. 3.5.
Реакции функциональных групп
При изучении различных биохимических молекул и их функций вне живых
организмов легко заметить, что их поведение во многом определяется вклю-
ченными в структуру функциональными группами. Не поленитесь потратить
60 ЧАСТЬ 1 Основы основ: базовые понятия
немного времени, чтобы восполнить знания по органической химии и познако-
миться с типичными реакциями основных функциональных групп.
О О
II II
НО—Р —он
НО— Р — О— Р — он
он он
Фосфорная кислота
Дифосфорная кислота
ООО
II II II
НО—Р —О—Р —О—Р —он
он он он
Трифосфорная кислота
НО—Р —OR
НО—Р —OR
OR’
ОН OR’
Монофосфорный сложный эфир Фосфорный сложный эфир
RO—Р —OR'
OR'
Фосфорный сложный триэфир
Рис 3.5. Функциональные группы, содержащие фосфор
Спирты
Спирты подвергаются окислению (теряют электрон, присоединяют кисло-
род, теряют водород). При умеренном окислении первичного спирта, при кото-
ром -ОН присоединяется к углеродному концу, получается альдегид, который
может подвергаться дальнейшему окислению до карбоновой кислоты. В анало-
гичных условиях из вторичного спирта (-ОН присоединяется к углероду, свя-
занному с двумя другими атомами углерода) получаются кетоны. Третичные
спирты (-ОН присоединяется к углероду, связанному с тремя другими атомами
углерода) не вступают в реакцию. Такое поведение предопределяет поведение
очень многих углеводов.
ГЛАВА 3 Игры с углеродом: органическая химия 61
ЗАПОМНИ!
Наличие группы -ОН часто приводит к ошибочному убеждению,
что спирты являются основаниями. Ничего подобного! Спирты в
биологических системах всегда являются нейтральными соединени-
ями. Наряду с этим фенолы, в которых группа -ОН присоединяется
к ароматическому кольцу, относятся к слабым кислотам.
Альдегиды и кетоны
Альдегиды легко подвергаются окислению до карбоновых кислот, а кетоны
не окисляются. Восстановить альдегиды и кетоны до соответствующих спир-
тов очень сложно — разве что с помощью ферментов (биологических катали-
заторов).
При восстановлении сахара ведут себя, как при умеренном окислении кар-
бонильной группы. При проведении пгестпа Топлена используют нитрат сере-
бра, который взаимодействует с восстановленными сахарами до образования
серебряного зеркала на внутренней поверхности стенки контейнера. В тестах
Бенедикта и Феллинга применяются соединения меди, а восстановленный са-
хар выпадает в виде красного осадка. Эти простые органические качественные
тесты будут применяться нами при поведении биохимических опытов, рассма-
триваемых в последующих главах.
Карбонильные группы альдегидов и кетонов могут взаимодействовать со
спиртами, образуя ацетали и полуацетали. В современной органической хи-
мии используется только термины ацетали и полуацетали, хотя в ранних источ-
никах можно встретить термин гемикиталь — специальный вид полуацеталя,
и кеталь — подвид ацеталя. Структуры этих соединений приведены на рис 3.6.
ОН ОН
I I
R—С—Н R—С—R
I I
OR OR
Полуацеталь Гемикеталь
OR OR
I I
R—С—H R—C—R
I I
OR OR
Ацеталь Кеталь
Рис. 3.6. Ацетали, полуацетали,
гемикитали и кетали
62 ЧАСТЬ 1 Основы основ: базовые понятия
Карбоксильные кислоты
Карбоксильные кислоты наряду с фосфорной кислотой относятся к наибо-
лее значащим биологическим веществам. Они, вступая в реакцию с такими
основаниями, как амины, образуют соли. В образованных солях содержится
ион аммиака из амина и карбоксильный ион из кислоты.
Карбоксильные кислоты вступают в соединение со спиртами, образуя эфи-
ры, а также могут опосредованно соединяться с аминами и образовывать ами-
ды. Гидролиз эфиров или амидов водой приводит к разрушению связей. Для
катализации гидролиза необходима кислота, основание или фермент. В кислых
условиях из амина можно выделить кислоту, а также спирт или ион аммиака.
В щелочной среде из него выделяется карбоксильный ион, а также спирт или
амин.
Тиолы и амины
При умеренном окислении соединение двух тпиолов образует дисульфид.
При умеренном восстановлении, катализируемом ферментами или опреде-
ленными восстанавливающими веществами, происходит обратный процесс.
Процесс образования дисульфидных связей является очень важной реакцией в
химии многих белков, например инсулина.
Амины — это наиболее важные биологические основания. Как осно-
вания они вступают в реакцию с кислотами. В растворах ведут себя
подобно аммиаку.
ЗАПОМНИ!
NH3 + Н+(из кислоты) —> NHJ (ион аммиака)
NRH2 + Н+ (из кислоты) —> NRH3 (ион аммиака)
NR2H + Н+ (из кислоты) —> NR2H2 (ион аммиака)
NR3 + Н+(из кислоты) -> NR3H+ (ион аммиака)
Аминовая группа присутствует у многих лекарственных препаратов.
Преобразование многих аминов в ионы аммиака повышает их рас-
творимость. Например, в результате взаимодействия лекарственного
вещества с соляной кислотой образуется хлорид, который указан в
инструкции, как гидрохлорид.
Если заменить все атомы водорода в ионе аммония, NHJ, то будет получен
ион четвертичного аммония, NR4.
ГЛАВА 3 Игры с углеродом: органическая химия 63
Фосфорная кислота
Фосфорная кислота, Н3РО4, часто ведет себя подобно карбоксильным кис-
лотам и приводит к образованию эфиров. У таких эфиров есть органическая
группа R, замещающая один, два или три атома водорода. Конечными соеди-
нениями этих реакций будут моноэфиры, диэфиры и триэфиры. Оставшиеся
в них атомы водорода являются кислотными.
Функциональные группы и pH
Биологические функции многих веществ зависят от уровня pH. Следова-
тельно крайне важно понимать, какие из групп будут кислотными, а какие —
щелочными или нейтральными. Нейтральные функциональные группы ведут
себя одинаково вне зависимости от уровня pH. В табл. 3.2 указываются тип
функциональной группы (кислотная, нейтральная или щелочная) и их сила
(умеренная, слабая или очень слабая). Чем слабее вещество, тем менее вероят-
но его влияние на pH раствора. Атомы водорода из моно- и диэфиров являются
кислотными.
Таблица 3.2. Кислотно-щелочные свойства биологически важных
функциональных групп
Функциональная группа Тип Сила взаимодействия 1
Монофосфатные и дифосфатные сложные эфиры Кислотная Умеренная
Карбоновые кислоты Кислотная Слабая
Фенолы Кислотная Очень слабая
Тиолы Кислотная Очень слабая
Аминовые соли Кислотная Очень слабая
Амины Щелочная Слабая
Карбоксилат-ионы Щелочная Очень слабая
Спирты Нейтральная
Карбоксилат-эфиры Нейтральная
Эфиры Нейтральная
Трифосфатные сложные эфиры Нейтральная
Тиоэфиры Нейтральная
64 ЧАСТЬ 1 Основы основ: базовые понятия
Окончание табл. 3.2
Функциональная группа Тип Сила взаимодействия
Дисульфиды Нейтральная
Амиды Нейтральная
Кетоны Нейтральная
Альдегиды Нейтральная
Одинаковые по форме, но
структурно разные: изомеры
ЗАПОМНИ!
Изомеры — это соединения с одинаковой молекулярной формулой,
но разным строением. (Отличия проявляются в том, как вещества
соединяются между собой.) Некоторые органические и биохимиче-
ские соединения представлены в виде сразу нескольких изомеров.
В биологических системах (и не только в них) такие изомеры обла-
дают разными свойствами. Наиболее распространенные виды био-
логических изомеров — это цис-, трансизомеры и изомеры, образо-
ванные с участием хирального углерода.
Цис- и трансизомеры
Существование двойной углерод-углеродной связи предопределяет возмож-
ность получения изомеров. Двойные связи весьма ограничивают и сдерживают
движение молекул. Если группы по одну сторону от двойной связи стремят-
ся остаться в таком положении, то такое соединение называют цис-изомером.
Если же группы стараются “разбежаться” по разные стороны образованной
ими связи, то такое соединение будет трансизомером. Внимательно изучите
рис. 3.7, чтобы лучше понять структуру цис-изомеров и трансизомеров.
нн С1 н
с=с с=с
С1 С1 Н С1
Цис-изомер Трансизомер
Рис. 3.7. Цис- и трансизомеры
ГЛАВА 3 Игры с углеродом: органическая химия 65
Если две группы, прикрепленные двойной связью к другим атомам углеро-
да, размещаются в одной плоскости, то образование цис- и трансизомеров в
таком соединении невозможно. Цис-изомеры представлены обычными жир-
ными кислотами, хотя в процессе приготовления пищи некоторые из них часто
преобразуются в трансизомеры.
Цис- и трансизомеры также возможны в кольцевых структурах. В цис-изо-
мерах одинаковые группы размещаются вдоль одной стороны кольца, а в тран-
сизомерах они распределяются в верхней и нижней частях кольца.
Хиральные углероды
В попытке надеть перчатку не на ту руку перейдем к изучению еще одного
свойства биологических соединений: направленности. Левовращающие моле-
кулы поворачивают поляризованный световой пучок влево, а правовращающие
молекулы — поворачивают его вправо.
Определение хиральных молекул
Наличие ассиметричных или хиральных атомов углерода — это верный при-
знак “направленной” молекулы.
ЗАПОМНИ!
К хиральному атому углерода прикрепляется четыре разных группы.
У подавляющего большинства биологических молекул присутствует
больше одного хирального атома, что, собственно, и делает их на-
правленными. На рис. 3.8 показана хиральная структура молекулы
глюкозы.
сно
I
н—с—он
I
но—с—н
I
н—с—он
I
н—с—он
I
СН2ОН
D-глюкоза
Хиральный углерод
Хиральный углерод
Хиральный углерод
Хиральный углерод
Рис. 3.8. Схематическое изображение молекулы глюкозы —
сахара с четырьмя хиральными атомами углерода
Хиральные формы: энантомеры или стереоизомеры?
У всего на свете (вампиры не считаются!) есть зеркальное отражение. Если
в соединении присутствует хотя бы один атом хирального углерода, то всегда
66 ЧАСТЬ 1 Основы основ: базовые понятия
есть и его неоспоримое зеркальное отражение. Вытяните левую и правую руки
ладонями вверх — они являются неоспоримыми зеркальными отражениями
друг друга. В химии подобные зеркальные соединения называются энантоме-
рами. Различные хиральные формы отличаются друг от друга двумя аспектами.
» Влиянием на свет.
» Взаимодействием с другими хиральными веществами (чаще всего
именно хиральные формы определяют биологическую активность
вещества).
Для того, чтобы определить как конкретные формы воздействуют на свет,
необходимо работать с плоскополяризованными световым излучением, ориен-
тированным в одной плоскости. Если применить такой источник освещения,
то хиральные вещества будет поворачивать плоскость ориентации световых
волн — правовращающий изомер, d (+), будет поворачивать ее вправо, а ле-
вовращающий изомер, I (-), — влево. Вместе обе формы, d и /, называются
стереоизомерам и являются оптически активными.
Изображение хирального соединения: проекция
пространственной модели молекулы
Эмиль Фишер, химик по образованию, разработал метод изображения сое-
динения, с помощью которого можно показать, какой из стереоизомеров в нем
присутствует. В биохимии проекционные изображения или формулы Фишера
применяются очень часто. В них хиральный углерод помещается в центр изо-
бражения. В проекции Фишера все горизонтальные линии (связи) направлены
в сторону наблюдателя, а вертикальные — удалены от наблюдателя (рис 3.9).
Фишер обозначил символом D форму, в которой наиболее важная группа (чей
центральный атом имеет наибольшее атомное число) расположена справа от
атома углерода, и буквой L форму, в которой наименее важная группа (чей цен-
тральный атом имеет наименьшее атомное число) находится слева от углерода.
На рис. 3.10 показаны два примера проекционной формулы Фишера.
Рис. 3.9. Построение проекции Фишера
ГЛАВА 3 Игры с углеродом: органическая химия
сно
I
н—с—он
I
СН2ОН
сно
I
но—с—н
I
СН2ОН
D-глицеринальдегид L-глицеринапьдегид
Рис. 3.10. Проекционные формулы Фишера
различных стереоизомеров
уу. В органической химии буквы d и I обозначают не только формы D
гЧ j| и L. Их использование в рассматриваемом контексте может приве-
сти к неправильным результатам. Старайтесь по возможности избе-
гать обозначений dulB проекциях Фишера. Более того символы D
и L постепенно замещаются буквами R и 5 в системах обозначения
изомеров. Старая система обозначений обычно применяется, если
в форме присутствует хотя бы один хиральный атом углеводорода.
Ух ты, вся важная для нашего курса биохимии информация из учебника по
органической химии вместилась всего в одну главу. А сколько станиц было
в вашем пособии по органической химии? Эта книга настоящая находка!
68 ЧАСТЬ 1 Основы основ: базовые понятия
В ЭТОЙ ЧАСТИ...
Далее нас ожидает знакомство с белками, начиная с амино-
кислот — строительных блоков всех белков. Мы детально
разберем процесс построения последовательности амино-
кислот и познакомимся с различными свойствами белковых
структур. В завершение части изучим ферментативную ки-
нетику, описав действие катализаторов, ускоряющих реак-
ции, и ингибиторов, замедляющих их.
Глава 4
Аминокислоты:
строительные
блоки белков
В ЭТОЙ ГЛАВЕ...
» Строение и свойства аминокислот
» Классификация основных аминокислот
» Принципы взаимодействия аминокислот
» Основы комбинирования аминокислот
Все клетки состоят из нескольких тысяч видов белков, и аминокислоты
являются их строительными блоками. Порядок организации, число и
химическая идентичность аминокислот в белке определяет его строение
и функции. Вот почему столь важно понимать химические свойства аминокис-
лот прежде, чем перейти к изучению свойств и функций белков.
ЗАЛОМНИ1
Аминокислоты — это относительно простые молекулы, которые
включают как аминогруппу, так и кислотную группу. Биологиче-
ски важными оказываются а-аминокислоты, у которых аминогруп-
па и кислотная группа присоединяются к одному и тому же атому
углерода. В природе существует более ста аминокислот, но только
20 из них участвуют в белковом синтезе. Францис Крик вместе
с Джеймсом Уотсоном, определившие структуру ДНК, говорили об
этом числе, как о волшебной двадцатке (звучит, как отсылка к филь-
му о Гарри Поттере). Остальные аминокислоты, встречающиеся
в конкретных белках, образуются в результате изменений в одной из
этих двадцати волшебных аминокислотах уже после формирования
белка.
В этой главе мы проанализируем строение и свойства аминокислот на при-
мере наиболее распространенных соединений, а также проследим за их соче-
танием и взаимодействием.
Общие свойства аминокислот
Функциональные группы, присутствующие в каждом органическом соеди-
нении, в значительной степени определяют свойства его молекулы. В биологи-
ческих системах у аминокислот выделяют следующие важные свойства.
» Объединяются в белки. Средний вес молекулы аминокислоты ра-
вен приблизительно 135. Белки имеют молекулярную массу в диа-
пазоне от 6 тысяч до нескольких миллионов. Этот факт говорит о
том, что в образовании белка принимает участие очень большое
количество аминокислот.
» Включают как аминогруппу, так и кислотную группу. Конечный
атом углеродной цепи, а-углерод, представляет не только амино-
группу (-NH2) и группу карбоновой кислоты (-СООН), но еще две
другие группы: атом водорода и R-группу. Боковая цепочка, R-rpyn-
па, обозначает аминокислоту.
» В зависимости от pH раствора и оставшейся части молекуляр-
ной структуры все аминокислоты обладают изменчивостью
в протонированном участке.
» Имеют хиральную природу (за исключением глицина), посколь-
ку четыре разных группы прикрепляются к одному атому угле-
рода, что определяет реакции, в которые вступает соединение.
Положительные и отрицательные аминокислоты:
образование цвиттер-ионов
Одновременное присутствие кислоты и основания (амина) в одной молеку-
ле приводит к их взаимодействию, а потому переносу иона водорода из кислот-
ной части в основную. Аминокислота, обладающая как положительными, так
и отрицательными участками, называется цвитптер-ионом. Суммарный заряд
цвиттер-иона, тем не менее, равняется нулю. Кислотный конец аминокислоты
заряжен отрицательно (-СОО-), а у щелочного конца заряд положительный
(-NH3). Депротонированная часть (потерявшая ион водорода) представлена
72 ЧАСТЬ 2 Фундамент биохимии: белки
карбоксильной группой, а протонированная часть (получившая ион водоро-
да) — аммиачной группой. Наличие заряда у аминокислоты делает ее водорас-
творимой. Процесс образования цвиттер-иона схематически показан на рис. 4.1.
но но
I II I II
R—С—С. -------► R—С— С.
I О 1-0
nh2 н^ nh3+
Рис. 4.1. Образование цвиттер-иона
СОВЕТ
Неионизированная молекула аминокислоты, показанная на рис. 4.1,
на самом деле не существует. Однако во многих учебниках и ру-
ководствах для упрощения ее изображают так, будто ионизации не
произошло.
Протонирование: pH и изоэлектрическая точка
Природа аминокислот определяет то, как они вступают в реакцию в раство-
рах с разным pH. В этой части рассматриваются некоторые важные послед-
ствия изменения pH раствора. При определенном уровне pH, который назы-
вается изоэлектрической точкой (pl), преобладающей формой аминокислоты
будет цвиттер-ион. Изоэлектрическая точка — это среднее значение между
двумя граничными значениями рКа. В большинстве физиологических сред изо-
лированная аминокислота существует преимущественно в форме цвиттер-иона
(рис. 4.2, а). Чистые аминокислоты также представляются цвиттер-ионами, и
потому относятся к твердым телам с ионной связью.
» Если pH опускается ниже изоэлектрической точки, то прото-
нированию подвергаются отдельные карбоксильные группы
(рис. 4.2, б). Уровень pH, необходимый для того, чтобы вызвать та-
кое протонирование, зависит от Ка кислоты. Вследствие этого боль-
шое значение имеет значение рКа карбоксильной группы. Обычно
оно задается в диапазоне от 1 до 3. Например, если рКа равняет-
ся 2,5 при pH = 2,5, то протонированными оказываются 50% карбок-
сильных групп. Общий заряд протонированной формы равен +1.
» Если pH поднимается выше изоэлектрической точки, то некото-
рые аммиачные группы депротонируются (рис. 4.2, в). Уровень
pH, необходимый для начала депротонирования зависит от Ка ам-
миачной группы. И здесь большое значение имеет рКа аммиачной
группы. Обычно она устанавливается на уровне 8-11 единиц. Если,
например, рКа равняется 10 при pH = 10, то депротон и руется 50%
аммиачных групп. При этом суммарный заряд депротонированной
формы равен -1.
ГЛАВА 4 Аминокислоты: строительные блоки белков 73
Н О
I II
R— С—
NH/
но но
I II I II
R—С—R— С—
I ОН 1-0
NHf NH2
а) б) в)
Рис. 4.2. Цвиттер-ион (а), протонированная форма (б)
и депротонированная форма (в)
Некоторые из боковых цепей также могут иметь кислотную или основную
природу. В таких случаях, рКа получает отдельное значение, характерное толь-
ко для реакций, в которые вступают такие молекулы, что усложняет описание
поведения аминокислоты.
Ассиметрия: хиральные аминокислоты
В обычной а-аминокислоте к а-углероду крепятся четыре разных группы:
-СООН, -NH2, -R и —Н. Это делает а-углерод ассиметричным или хиральным.
Единственным исключением является глицин, у которого R-группа представ-
лена атомом водорода. Наличие двух атомов водорода у а-углерода в случае
глицина говорит о том, что атом углерода будет ахиральным. Хиральные ве-
щества являются оптически активными; различные формы по-разному вза-
имодействуют со светом (подробно хиральные свойства молекул описаны в
главе 3).
ЗАПОМНИ!
Особую важность представляет порядок расположения групп во-
круг хирального атома углерода. Подобно тому, как вашей левой
руке подходит только левая перчатка, приемлемым считается только
определенное расположение групп вокруг хирального атома углеро-
да (определяет направленность). (Теперь понятно, почему двухпа-
лые перчатки столь популярны среди родителей малышей — они
двухсторонние, или ненаправленные.)
Хиральные аминокислоты бывают двух форм: D и L. Но только L-форма
входит в состав белков. D-форма встречается в некоторых антибиотиках и кле-
точных стенках отдельных видов бактерий. Обычно, чтобы показать последо-
вательность расположения групп вокруг хирального углерода, применяют про-
екционные изображения Фишера, описанные в главе 3. На рис. 4.3 изображены
проекционные формулы Фишера для аминокислотных структур.
Ассиметричные атомы углерода присутствуют у немногих аминокислот.
В подобных случаях возможны сразу четыре изомера (см. глава 3). Тем не ме-
нее биологическая активность аминокислоты обычно предопределяется реак-
тивностью только одного из таких изомеров.
74 ЧАСТЬ 2 Фундамент биохимии: белки
D-аминокислота
L-аминокислота
R
I
H2N —С—H
COOH
R
I
H—c—nh2
COOH
nh2 h
I I
R —C—COOH R —C—COOH
I I
H nh2
R H
I I
H2N — C — COOH H2N — C—COOH
H R
Puc. 4.3. Разные способы изображения
аминокислоты в виде проекции Фишера
Двадцать волшебных аминокислот
В зависимости от природы боковой цепи (групп, прикрепленных к а-углеро-
ду) и общих свойств аминокислоты делятся на четыре подгруппы.
» Неполярные (гидрофобные) и незаряженные
» Полярные (гидрофильные) и незаряженные
» Кислые (полярные и заряженные)
» Основные (полярные и заряженные)
ЗАПОМНИ!
Свойства боковой цепи определяют не только поведение конкретной
аминокислоты, но также свойства белков, которые образуются в ре-
зультате объединения определенных аминокислот.
Ниже описаны структуры отдельных аминокислот. Аминокислоты можно
обозначать как трехбуквенной аббревиатурой, так и одним символом. Подобно
названиям химических элементов они являются общепринятыми. Трехбуквен-
ное обозначение намного проще соотнести с полным названием аминокисло-
ты. Например, термином Gin обозначается глутамин. Однобуквенные обозна-
чения короче, но далеко не всегда однозначно соотносятся с полными названи-
ями соединений. Например, глутамин имеет однобуквенное название Q.
ГЛАВА 4 Аминокислоты: строительные блоки белков 75
Неполярные (гидрофобные) и незаряженные аминокислоты
К неполярным относятся следующие аминокислоты.
» Аланин (Ala, А)
» Изолейцин (lie, I)
» Лейцин (Leu, L)
» Метионин (Met, М)
» Фенилаланин (Phe, F)
» Пролин (Pro, Р)
» Триптофан (Trp, W)
» Валин (Vai, V)
Некоторые из упомянутых выше аминокислот показаны на рис. 4.4.
У пролина необычная циклическая структура, которая оказывает сильное
влияние на структуру белка. Триптофан представляет промежуточное соеди-
нение, поскольку -NH-группа его кольцевой структуры может вступать в ре-
акцию с водой.
ИЗОБРАЖЕНИЕ СТРУКТУРЫ АМИНОКИСЛОТЫ
На самом деле аминокислоты, упрощенный вид которых показан на рис. 4.4,
в биологических (как и в небиологических) системах не встречается. Амино-
кислоты всегда возникают в виде ионов. Они могут принимать форму цвит-
тер-ионов (имеющих сразу оба заряда — положительный и отрицательный),
катионов (при низким pH) или анионов (при высоком pH). При низких или вы-
соких уровнях pH один конец аминокислоты сохраняет свой заряд, а осталь-
ные становятся нейтральными. На следующем рисунке изображаются все воз-
можные ионы, встречающиеся у всех аминокислот. Значения pH, необходимые
для преобразования цвиттер-иона в одну из других форм, разные для всех
аминокислот.
Цвиттер-ион
Катион (в кислоте)
Анион (в основании)
У многих аминокислот боковые цепи, или R-группы тоже являются кислотными
или основными. Эти группы также могут представляться в специальной форме:
катиона, аниона или быть нейтральными — в зависимости от pH раствора.
76 ЧАСТЬ 2 Фундамент биохимии: белки
О О о
II II II
H2N —сн—с —он H2N —сн—с —он H2N—сн—с —он
сн3 сн—сн3 сн2
сн3 сн—сн3
сн3
Аланин Валин Лейцин
о
II
H2N—сн—с —он
сн—сн3
I
сн2
I
СН3
о
II
H2N—сн—с —он
сн2
I
сн2
I
S
I
сн3
Метионин
Изолейцин
Фенилаланин
Триптофан
Рис. 4.4. Неполярные аминокислоты
Полярные (гидрофильные) и незаряженные аминокислоты
Полярные и незаряженные аминокислоты, кроме глицина, могут образовы-
вать водородные связи с водой. По этой причине они обладают гораздо лучшей
растворимостью, чем неполярные аминокислоты. К этой группе относятся сле-
дующие аминокислоты.
» Аспарагин (Asn, N)
» Цистеин (Cys, С)
ГЛАВА 4 Аминокислоты: строительные блоки белков 77
» Глутамин (Gin, Q)
» Глицин (Gly, G)
» Серин (Ser, S)
» Треонин (Thr,T)
» Тирозин (Туr, Y)
Может показаться, что глицин попал в эту группу случайно. Маленький раз-
мер R-группы глицина обуславливает доминирование аминовой и карбоксиль-
ной функциональных групп, что делает глицин схожим с другими аминокис-
лотами группы. Амиды, спирты и сульфгидрильные группы (-SH) остальных
членов этой группы обладают выражено полярной и нейтральной природой.
При очень высоких значениях pH наблюдается ионизация фенольной группы
тирозина с образованием полярной заряженной группы. Все аминокислоты
этой группы изображены на рис. 4.5.
Кислые аминокислоты
К кислым аминокислотам относят следующие соединения.
» Аспарагиновую аминокислоту (Asp, D)
» Глутаминовую аминокислоту (Glu, Е).
В боковых группах обеих аминокислот содержится карбоксильная кислот-
ная группа. Вторичная карбоксильная кислотная группа представляет собой
более слабую кислоту (с более высоким p/Q, чем первичная карбоксильная
кислотная группа. Это дополнительная карбоксильная группа обеспечивает
суммарный заряд -1 при физиологических значениях pH тогда, как у “нор-
мального” цвиттер-иона общий заряд равен нулю. Карбоксильная боковая цепь
играет важную роль во многих белках, обеспечивая взаимодействие с ионами
металла и выступая в роли нуклеофила (богатая электронами группа, замещаю-
щая одну из групп, присоединенных к углероду) во многих ферментах, а также
в ионных взаимодействиях. Аминокислоты этого типа изображены на рис. 4.6.
Основные аминокислоты
К основным относят следующие аминокислоты.
» Аргинин (Arg, R)
» Гистидин (His, Н)
» Лизин (Lys, К)
78 ЧАСТЬ 2 Фундамент биохимии: белки
о
II
h2n —сн—с—он
н
Глицин
о о
II II
h2n—сн— с—он h2n—сн— с—он
сн2 сн2
I I
он с=о
I
nh2
Серин Аспарагин
о
II
H2N —сн—с —он
сн2
I
сн2
I
с=о
I
nh2
о
II
h2n—сн—с—он
сн—он
I
сн3
Глутамин Треонин
о
II
h2n —сн—с—он
сн2
I
SH
Тирозин
Рис. 4.5. Полярные аминокислоты
Цистеин
Хотя согласно классификации все они считаются основным аминокислотам,
резкое изменение pH сказывается на их реактивности. В наибольшей степени
это касается гистидина. Все три аминокислоты включают основную группу,
способную принимать ион водорода. В случае лизина речь идет о простом
ионе аммония.
У аргинина формируется гуанидная группа. Гистидин образует имидазо-
лиевую группу. (Сложно даже представить, как можно было выдумать такие
названия!) Как и в кислых аминокислотах, боковые цепи аминокислот этой
ГЛАВА 4 Аминокислоты: строительные блоки белков 79
о
II
H2N —сн—с —он
сн2
I
с=о
I
он
Аспарагиновая
кислота
О
II
H2N —сн—с —он
сн2
I
сн2
I
с=о
I
он
Глутаминовая
кислота
Рис. 4.6. Кислые аминокислоты
группы характеризуются величиной рКа. Боковые цепи аргинина и лизина
обычно протонируются при физиологически нормальных значениях pH. В по-
добных случаях общий заряд равен +1. Такой уровень заряда обеспечивает все
необходимые условия для взаимодействия белков. Значение Ка боковой цепи
гистидина ниже, чем у других основных групп. Гистидин лучше протонирует-
ся при более низких значениях pH. Во многих белках гистидин не протониру-
ется, но выступает важным компонентом, включенным в ферментативный про-
цесс переноса ионов водорода. Основные аминокислоты показаны на рис. 4.7.
Вечная память: редкие аминокислоты
В редких случаях аминокислоты подвергаются изменению уже после вхож-
дения в состав белков. Коллаген и желатин — белки, присутствующие у выс-
ших позвоночных, содержат гидроксилизин и гидроксипролин. Обе эти амино-
кислоты выделяются дополнительной -ОН-группой в боковой цепи.
Некоторые виды аминокислот в белках не встречаются. Например, нейро-
медиатор гамма аминомасляная кислота, ГАМК. Цитруллин — это аминокис-
лота, которая служит предшественником, или прекурсором (вещество, которое
используется при создании) аргинина. Орнитин, гомоцистеин и гомосерин яв-
ляются важными промежуточными соединениями в метаболизме. Две из таких
аминокислот показаны на рис. 4.8.
Базовые принципы взаимодействия
аминокислот
Аминокислоты — это ингредиенты из рецепта приготовления белков. По-
добно тому, как кулинарные ингредиенты определяют вкусовые характеристики
80 ЧАСТЬ 2 Фундамент биохимии: белки
II
H2N—сн—с —он
сн2
I
сн2
I
сн2
I
сн2
nh2
Лизин
II
H2N —сн—с —он
сн2
I
сн2
I
сн2
I
NH
I
C=NH
I
nh2
Аргинин
о
II
Гистидин
Рис. 4.7. Основные аминокислоты
II
H2N—СН—С —ОН
сн2
I
сн2
I
сн2
I
nh2
Орнитин
о
II
H2N —сн—с —он
сн2
I
сн2
I
НС —он
I
сн2
nh2
Гидроксилизин
Рис. 4.8. Редко встречающиеся аминокислоты
того, что в конечном итоге появляется на обеденном столе, аминокислоты вно-
сят важный вклад в свойства белков. И также, как нельзя заменить муку на
ГЛАВА 4 Аминокислоты: строительные блоки белков 81
перец в кулинарном рецепте, вы не можете подставить одну аминокислоту в
белке вместо другой. В обоих случаях конечный продукт будет разным. В этом
разделе рассматриваются основные принципы взаимодействия аминокислот.
Это описание послужит основой для обсуждения свойств связей, устанавлива-
емых между аминокислотами, далее в этой главе.
Внутримолекулярные силы: взаимодействие
аминокислоты с другими молекулами
Аминокислоты могут вступать в реакцию с другими молекулами различны-
ми способами. Под другими молекулами подразумеваются иные соединения,
включая жидкости, аминокислоты или даже биологические молекулы. В об-
щих чертах внутримолекулярные связи описаны в главе 3, а в этом разделе
основное внимание уделяется внутримолекулярным силам, проявляющимся
во взаимодействиях с участием аминокислот. Карбоновая кислота и аминовая
часть аминокислоты определяют большую часть активных молекулярных вза-
имодействий, но в реакцию с другими молекулами также могут вступать боко-
вые цепи. Ниже рассмотрены три основных способа взаимодействия боковых
цепей.
» Гидрофобные взаимодействия. Группы неполярного участка яв-
ляются гидрофобными и притягиваются друг к другу с помощью
лондоновских дисперсионных сил (см. глава 3). Неполярные группы
стремятся держаться вместе (собираться в кластер) и вытеснять не
только воду, но также другие виды боковых цепей.
» Гидрофильные взаимодействия. Полярные и незаряженные бо-
ковые цепи являются гидрофильными. Наличие нескольких таких
групп повышает растворимость белка. Эти группы объединяются
водородной связью не только с водой, но также друг с другом. По-
лярные группы во что бы то ни стало стремятся взаимодействовать
друг с другом и "выталкивают" неполярные группы.
» Ионные взаимодействия. Наличие кислотных и основных боковых
цепей приводит к возникновению ионных зарядов, а противополож-
ные заряды всегда притягиваются. Карбоксильная группа одной бо-
ковой цепи притягивается к иону аммония другой боковой цепи с по-
мощью сил ионного притяжения. Такие ионные связи очень сильные.
Аминокислота цистеин может взаимодействовать с другой молекулой сразу
несколькими способами (рис. 4.9). Умеренное окисление двух сульфгидриль-
ных групп цистеина приводит к образованию цистина. Дисульфидные связи
соединяют две аминокислоты ковалентной связью. Умеренное восстановление
запускает обратный процесс.
82 ЧАСТЬ 2 Фундамент биохимии: белки
NH3+
I
-ooc—C—CH2— SH
H
Восстановление
Окисление
H
C—COO-
NH3
NHf н
I I
“OOC — C — CH2— S — S —CH — С—COO"
H NH3+
Pug 4.9, Объединение двух молекул цистеина
и образование цистина
Реакции окисления и восстановления путем создания дисульфидных
связей применяются при завивке волос. Чем больше дисульфидных
связей, тем больше локонов! (И... характерного запаха!)
НА ПРАКТИКЕ
Зависимость взаимодействия от уровня pH
Как было показано в главе 3, функции многих веществ, особенно биохими-
ческих, зависят от уровня pH. В большинстве биохимических реакций прини-
мают участие молекулы кислорода, азота, серы или фосфора. Изменяя pH, вы
будет влиять на образованные связи. В этом разделе мы поговорит о том, как
такие изменения сказываются на поведении аминокислот.
Как и многие другие молекулы аминокислоты, в зависимости от вида, могут
включать две или три функциональные группы. Среди них встречаются груп-
пы, содержащие кислород, серу и даже азот. С точки зрения способа взаимо-
действий изменение уровня pH оказывает влияние на поведение от одной до
трех таких групп. Таким образом, если у аминокислоты есть функциональная
группа, которая переходит от диполь-дипольного взаимодействия к ионному,
то свойства этой аминокислоты меняются.
НА ПРАКТИКЕ
Наглядной демонстрацией последствий перехода от диполь-диполь-
ного взаимодействия к ионному выступает процесс свертывания мо-
лока. Если добавить кислоту в молоко, то оно непременно свернет-
ся. Изоэлектрическая точка казеина наблюдается при pH = 4,6, следо-
вательно, добавление кислоты вызывает образование ионных связей
между молекулами. Они направлены противоположно диполь-ди-
польним взаимодействиям с водой, поэтому белок осаждается.
ГЛАВА 4 Аминокислоты: строительные блоки белков 83
В табл. 4.1 указаны значения рА*а для разных групп, которые встречаются у
аминокислот. Если pH раствора соответствует указанным значениям, то поло-
вина вещества находится в протонированной, а вторая половина — в депрото-
нированной форме. При более низких значениях pH количество протонирован-
ного вещества уменьшается, а при более высоких уровнях pH большая часть
вещества переходит в депротонорованную форму.
Таблица 4.1. Значения рКа у аминокислот
Аминокислота рК ,-СООН Рка, -nh; рКо R-rpynna 1
Аланин 2,35 9,69
Аргенин 2,17 9,04 12,48
Аспарагин 2,02 8,80
Аспаратиновая кислота 2,09 9,82 3,86
Цистеин 1,71 10,78 8,33
Глутаминовая кислота 2,19 9,67 4,25
Глутамин 2,17 9,13
Глицин 2,34 9,60
Гистидин 1,82 9,17 6,00
Изолейцин 2,36 9,68
Лейцин 2,36 9,60
Лизин 2,18 8,95 10,53
Метионин 2,28 9,21
Фенилаланин 1,83 9,13
Пролин 1,99 10,60
Серин 2,21 9,15
Треонин 2,63 10,43
Триптофан 2,38 9,39
Тирозин 2,20 9,11 10,07
Валин 2,32 9,62
84 ЧАСТЬ 2 Фундамент биохимии: белки
ЗАПОМНИ!
Зависимость процесса протонирования аминокислот от уровня pH
помогает правильно идентифицировать аминокислоты и отнести к
разным группам. Поскольку аминокислоты, объединяясь в белковые
структуры, используют два конца — карбоновой кислоты и амина,
дополнительные взаимодействия и реакции предопределяются толь-
ко значениями рА*а боковых цепей.
Объединение аминокислот:
как оно происходит
Белок — это цепочка из 150 соединенных вместе аминокислот (остатков).
Базовые принципы получения белков описаны в главе 5, но перед тем, как пе-
реходить к ней, внимательно изучите этот раздел, в котором показано, как из-
начально связываются две аминокислоты, и как к звеньям имеющейся цепи
присоединяются другие аминокислоты. Это процесс является полностью об-
ратимым (как показывает пищеварение).
ecu При изображении химической структуры аминокислот и связей в
ней придерживаются следующего общепринятого соглашения: сна-
чала рисуются структуры из аммониевой группы первой аминокис-
ЗАЛОМНИ1 z х
лоты (концевой атом азот), затем слева направо все остальные сое-
динения, заканчивая карбоксильной группой (концевой атом углеро-
да) последней аминокислоты.
Пептидная связь и дипептид
Пептидная связь является одной из самых важных связей во всей биохимии.
Этот вид связи характерен для синтеза белков. Взаимодействие двух амино-
кислот при физиологических уровнях pH приводит к образованию пептидной
связи, как показано на рис. 4.10.
Два остатка взаимодействуют с выделением молекулы воды — очень рас-
пространенная реакция дегидратации в органической химии. Обратной к такой
конденсации будет реакция гидролиза. Образующаяся в результате амидная
группа представляет пептидную связь. Если таких аминокислотных остатка
два, то вещество является дипептидом.
Пептидная связь является плоской (планарной) структурой. Она стабилизи-
руется резонансом, старым добрым “органическим” другом. Процесс стаби-
лизации показан на рис. 4.11. Резонанс увеличивает полярность азота и кис-
лорода. Такое усиление полярности приводит к образованию более прочных
водородных связей, чем в большинстве других соединений. Двойной характер
ГЛАВА 4 Аминокислоты: строительные блоки белков 85
связи между углеродом и азотом предотвращает вращение вокруг нее. Именно
это становится причиной планарности пептидной связи.
О О
II II
+H3N—СН— С—О" +H3N—СН— С—О-
Н СН3
+Н2О -Н2О
f
о о
II II
+H3N —СН — С — N — СН—С—0“
Н Н СН3
Пептидная связь
Рис. 4.10. Образование пептидной связи
:0: Ю:*
II .. I
— С—N— ► —C=N+—
I I
Н н
Рис. 4.11. Резонансная стабилизация пептидной связи
Трипептид: добавляем аминокислоту к дипептиду
Повторив процесс, показанный на рис. 4.10, к цепочке можно присоединить
третью аминокислоту и получить трипептид. Например, в результате соеди-
нения глицина, аланина и серина можно получить структуру, изображенную
на рис. 4.12. Заметьте, что все начинается с концевого атома азота и концевых
атомов углерода. Применяя трехбуквенное обозначение, этот трипептид можно
обозначить, Gly-Ala-Ser.
ООО
II II II
+H3N —СН — С — N — СН— С— N — СН— С— О
Н Н СН3 Н СН2ОН
I J V ~ J
Пептидная связь Пептидная связь Рис. 4.12. Трипептид
Белок создается в результате многократного (несколько сотен и даже тысяч
раз) повторения процесса присоединения аминокислот. Детально эта операция
рассматривается в следующей главе.
86 ЧАСТЬ 2 Фундамент биохимии: белки
Глава 5
Строение и функции
белков
В ЭТОЙ ГЛАВЕ...
» Функции белков
» Различия в структурах белков
» Последовательность аминокислот в белке
В главе 4 было показано, что аминокислоты могут соединяться друг с дру-
гом с помощью пептидных связей, и подмечено, что при объединении
вместе не менее 150 аминокислот будет получена структура, называемая
белком. Однако получить белок, образовав для него аминокислотную цепь, не
так просто. Подобно тому, как письмо на обычном языке представляет собой
набор разных слов, составленных из букв алфавита, включающего всего 26
символов, белки состоят из крайне разнообразного набора биохимических ком-
понентов, полученных в результате комбинирования всего 20 аминокислот.
В этой главе вы как можно детальнее познакомитесь с белками: узнаете
о четырех видах структур белков, определяющих их функции, и исследуете
последовательности аминокислот в отдельных белках.
Белки: не только для питания
Белки делятся на две большие группы.
» Волокнистые или фиброзные белки обнаруживаются только
у животных. Обычно они выступают структурными элементами
соединительной ткани, сухожилий и мышечных волокон. В норме
не растворяются в воде.
» Глобулярные белки не всегда выполняют структурные функции.
Они могут выступать в качестве транспортеров, как гемоглобин,
и часто являются ферментами. Обычно они водорастворимые.
В живых организмах белки имеют разное назначение.
» Структура. Кожа и кости содержат коллаген, волокнистый белок.
» Катализ. Белки, которые называются ферментами, обеспечивают
протекание реакций в организме в умеренных условиях и с боль-
шой специфичностью.
» Движение. Белки составляют большую часть мышечных волокон
и обеспечивают движение различных частей вашего тела.
» Транспорт. Белки переносят небольшие молекулы по организму.
Транспортным белком является гемоглобин — белок, доставляю-
щий кислород в клетки организма.
» Гормоны. Гормоны, которые также являются белками, помогают
контролировать рост клеток.
» Защита. Белки, называемые антителами, помогают телу избав-
ляться от чужеродных повреждающих веществ.
» Запасы. Некоторые белки помогают запасать организму другие
вещества. Например, железо запасается в печени вместе с белком
ферритином.
» Регуляция. Белки содействуют клеточному ответу, например ро-
допсин, обнаруженный в глазах и участвующий в процессах обеспе-
чения зрения.
Функции, которые возлагаются на отдельные белки, во многих случаях на-
прямую связаны с их структурой. Белковая структура может насчитывать до
четырех уровней (здесь ключевым является понятие уровня, а не структуры),
в каждом из которых компоненты размещаются в позиции, обеспечивающей
наиболее эффективное внутримолекулярное взаимодействие. Мы будем назы-
вать эти уровни, детально рассматриваемые в следующих разделах, первич-
ным, вторичным, третичным и четвертичным. Первичный уровень, являясь
фундаментальным, есть у всех белков; четвертичный уровень — самый специ-
фический и наблюдается только у отдельных белков. Силы внутримолекуляр-
ного воздействия сами по себе оказывают сильное влияние для функций бел-
ков, но расположение молекул играет куда более значимую роль.
В случае существования вторичную, третичную и четвертичная структуры
белка можно разрушить несколькими способами.
88 ЧАСТЬ 2 Фундамент биохимии: белки
» Нагревание (в процессе приготовления еды) приводит к разруше-
нию водородных связей.
» Изменение уровня pH вызывает протонирование или депротониро-
вание молекул и разрыв ионных связей.
» Восстанавливающие вещества разрывают дисульфидные связи.
В отдельных случаях процесс полностью обратимый.
Теперь вы знаете, почему Джон и я считаем себя белковыми организмами.
Не столько за любовь к стейкам, шашлыку и омлету, как за то, что по большей
части состоим из белков. Давайте разбираться, что же они из себя представляют.
Первичная структура: есть у всех белков
ЗАПОМНИ!
Первичная структура белка — это последовательность аминокис-
лот, из которых состоит его молекула. Все белки имеют первичную
структуру, потому что все они по определению состоят из последо-
вательности аминокислот. Первичная структура служит фундамен-
том, на котором строятся остальные, более высокие белковые уров-
ни. Но каким образом аминокислоты соединяются в определенном
порядке?
В следующем разделе вы узнаете, как образуется белок из отдельных ами-
нокислот.
Создаем белок: общий принцип
В процессе синтеза белка строится цепочка из аминокислот, которые присо-
единяются к имеющейся структуре по одной за раз, как описано ниже.
*]. Молекула транспортной РНК (тРНК) переносит целевые аминокислоты
в рибосомы клетки, чтобы присоединить к образуемой цепочке.
2. Каждая аминокислота присоединяется к цепочке, образуя пептидную
связь (см. глава 4).
3. Первая пептидная связь присоединяет две аминокислоты для образова-
ния дипептида.
4. Чтобы получился трипептид, вторая пептидная связь должна связать
три аминокислоты.
5. Для образования полипептида — белка, этот процесс должен продол-
жаться несколько сотен, а то и тысяч раз.
ГЛАВА 5 Строение и функции белков 89
При связывании двух или большего количества аминокислот выделяется
молекула воды. То, что остается от каждой аминокислоты, называется остат-
ком, в котором не достает атома водорода либо в аминогруппе, либо -ОН кар-
боксильной группы или же в них обеих.
Последовательность соединения аминокислот полностью контролируется
молекулой ДНК клетки. Информация из нее передается в информационную
РНК (иРНК), которая выступает шаблоном первичной белковой структуры.
Процесс сродни нанизыванию жемчужного ожерелья, в котором жемчужины
представляют отдельные аминокислоты. Однако белковое ожерелье, состав-
ленное из аминокислот, невероятно длинное! Для синтеза белка требуется
очень много энергии.
Упорядочивание аминокислот
Как вы знаете, на одном конце первичной структуры размещается амино-
группа, а на ее другом конце — карбоксильная группа. Обычно, конец с амино-
группой рассматривается, как “начало” белка. Придерживаясь общепринятого
соглашения, при изображении или обозначении цифрами первичной струк-
туры всегда нужно начинать с аминокислотного (N-концевого) остатка, а за-
канчивать карбоксильным (С-концевым) остатком. Например, в гексапептиде
Met-Thr-Ser-Val-Asp-Lys (перечень сокращенных названий аминокислот см. в
главе 4) TV-концевой аминокислотой будет метионин (Met), а С-концевой ами-
нокислотой — лизин (Lys). Заметьте, что перестроение последовательности в
обратном порядке — Lys-Asp-Val-Ser-Thr-Met, приведет к получению гекса-
пептида с таким же составом, но другими химическими свойствами, посколь-
ку начинается с другой аминокислоты. Таким образом аминокислота, которая
теряет атом водорода в первом случае, потеряет группу -ОН во втором случае.
У полипептидной цепи есть основа, которая состоит из подобных, довольно
простых, повторяющихся единиц. Эта повторяющаяся последовательность по-
казана на рис. 5.1. Вариации проявляются в форме боковых цепей — R-rpynn
аминокислот. Заметьте, что повторяющаяся единица (обозначаемая скобками),
представлена амино-углерод-карбонильной последовательностью, а к атому
углерода могут присоединяться разные R-группы
НО НО НО но
I II I II I II I II
—N—С —С—N—С—С—N—С—С —N—С—С —
II II II II
н н н н
Рис. 5.1. Повторяющаяся последовательность
белковой основы
90 ЧАСТЬ 2 Фундамент биохимии: белки
У белковой основы есть много мест формирования водородных связей.
У каждого остатка, кроме аминокислоты пролина, есть NH-конец, который
может служить донором водородной связи. Также каждый остаток имеет кар-
бонильную группу, которая может выступать акцептором водородной связи.
Наличие доноров и акцепторов позволяет образовывать многочисленные водо-
родные связи. (Теперь вы понимаете, насколько важными являются внутримо-
лекулярные взаимодействия, особенно водородные связи.)
Пептидные связи не вращаются свободно вокруг углерод-азотной связи вви-
ду образования резонансной формы с двойной связью. Таким образом, основа
представляет планарное соединение из четырех атомов, и почти всегда, атом
кислорода переходит к атому водорода. Оставшаяся часть основы может вра-
щаться. Вращение определяет конфигурацию трехмерной структуры белка.
Такое вращение строго ограничено ввиду возможности боковых цепей “стал-
киваться” друг с другом — этот эффект получил название стерического несо-
ответствия. Жесткость пептидной связи и ограничение на вращение заметно
снижают энтропию трехмерной структуры белка по сравнению со случайной
цепью аминокислот. Согласно законам термодинамики снижение энтропии
приводит к стабилизации структуры.
Пример: первичная структура инсулина
Впервые первичная структура белка была выделена у соединения бычьего
инсулина. Она имеет вид, подобный показанному на рис. 5.2. Со времени этого
знаменательного события первичную структуру определили более чем у 100
тысяч белков.
Gln-Glu-Val-Ile-Gly
Cys
S-----S
Cys-Ala-Ser-Val-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn
Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe
Leu-His-Gln-Asn-V al-Phe
-Val-Phe Ala-Lys-Pro-Thr-Tyr
Puc. 5.2. Структура бычьего инсулина
ГЛАВА 5 Строение и функции белков 91
Вторичная структура: есть
у большинства белков
Давайте вернемся немного назад, снова обратившись к аналогии с жемчуж-
ным ожерельем. Его можно обернуть вокруг себя. Это не повлияет на порядок
следования жемчужин, но придаст ожерелью совершенно другой вид. То же
самое можно проделать с цепочкой аминокислот. Две пептидные связи могут
связываться одна с другой с помощью водородной связи, как продемонстриро-
вано на рис. 5.3. В случае существования большого количества таких водород-
ных связей белок приобретает вторичную белковую структуру. Водородные
связи относятся к внутримолекулярным взаимодействиям в том понимании,
что возникают между участками одной и той же молекулы.
— N—Н.....О=С—
I I
Рис. 5.3. Водородная связь между
двумя пептидными связями
Ко вторичным структурам относятся а-спираль и 0-складка, которые про-
являются в процессе формирования водородных связей. Вторичная структура
может составлять лишь небольшую часть всей белковой структуры, а может
занимать более 75% ее размера.
а-спираль
В а-спирали (рис. 5.4) первичная структура закручивается в результате
продольного загибания, приобретая форму скрученного в пружину стержня.
Чаще всего ее представляют в виде закрученной вокруг продольной оси лен-
ты. Каждый “завиток” такой ленты состоит из 3,6 аминокислотных остатков.
Эти завитки возникают вследствие возникновения водородных связей между
остатками, расположенными со всех четырех сторон. Каждая пептидная связь
принимает участие в двух водородных связях: одна из них устанавливается
между сторонней NH-группой и соседней карбонильной группой, а вторая —
между соседней NH-группой и сторонней карбонильной группой.
Структурно спирали могут быть как правозакрученными, так и левозакру-
ченными (см. глава 3). В базе все известные полипептиды являются правоза-
крученными. В левозакрученной спирали присутствует небольшое простран-
ственное затруднение, которое делает такую структуру менее стабильной.
Кератин — белок, входящий в состав меха, волос и ногтей — содержит три
правозакрученных а-спирали, скрученные между собой в левостороннем на-
правлении.
92 ЧАСТЬ 2 Фундамент биохимии: белки
Рис. 5.4. Общая структура а-спирали и представление ее в виде
закрученной в спираль ленты
Отдельные аминокислоты дестабилизируют а-спираль. Например, пролин
образует дуги или “изгибы” в первичной структуре, которые подавляют обра-
зование водородных связей. Группа остатков изолейцина разрывает вторичную
структуру вследствие пространственного затруднения, причиной которого яв-
ляется большой размер его R-групп. Небольшие R-группы глицина, располо-
женные только со стороны водорода, допускают излишнюю пространствен-
ную свободу, обуславливающую дестабилизацию спирали. Наличие остатков
аспарагиновой кислоты и/или глутаминовой кислоты также дестабилизирует
структуру, поскольку отрицательный заряд боковых цепей отталкивает их друг
от друга. Аналогично к дестабилизации спирали приводят остатки других ами-
нокислот — лизина, аргинина, серина и треонина.
Р-складчастая листовая структура
0-складчатый лист, или просто 0-лист — это еще один распространенный
вид вторичной белковой структуры. Она образуется в результате простран-
ственного разнесения первичной структуры, (в противоположность плотному
ГЛАВА 5 Строение и функции белков 93
Параллельная структура
। —
1 —
Рис. 5.5. Параллельная и антипараллельная ft-складчатые листовые структуры
(см. продолжение далее)
закручиванию в а-спирали). У такой структуры есть две формы, известные как
параллельный 0-складчатый лист и антипараллельный р-складчатый лист. (Ух,
ты! Параллельный и антипараллельный — звучит как постулат из научно-фан-
тастического фильма, не правда ли?)
Как и в предыдущем случае, причиной образования таких структур являют-
ся водородные связи, р-складчатый лист возникает при объединении двух или
большего количества цепочек аминокислот с помощью водородных связей. За-
метьте, что объединяемые цепочки аминокислот относятся к разным участкам
одной и той же первичной структуры.
В параллельной структуре соседние полипептидные цепочки выравнива-
ются в одном и том же направлении: от N-терминального к С-терминальному
концу. В антипараллельной структуре выравнивание выполняется так, что одна
цепочка следует от N-терминального к С-терминальному концу, а соседняя
с ней цепочка — от С-терминального к N-терминальному концу (рис. 5.5).
94 ЧАСТЬ 2 Фундамент биохимии: белки
Антипараллельная структура
Рис. 5.5. Продолжение
В структуре 0-складчатого листа боковые цепи расположенных рядом ами-
нокислот направлены противоположно. В результате в параллельной форме во-
дородные связи формируют сложную пространственную структуру. NH-rpynna
одного остатка связывается с СО-группой соседней цепочки первого остатка, и
в это же время СО-группа первого остатка связывается с NH-группой соседней
цепочки — и так попарно далее по всей цепочке. В антипараллельной структу-
ре NH- и СО-группы одного остатка связываются с соответствующими NH- и
СО-группами одного остатка сопредельной цепочки.
СОВЕТ
Схематически 0-складчатые структуры обозначают широкими
стрелками: стрелки, направленные в одну и ту же сторону, обознача-
ют параллельную структуру, а разнонаправленные стрелки — анти-
параллельную структуру. Как правило 0-листы включают от четырех
или пяти цепочек аминокислот (в ширину), но в отдельных случаях
их может быть более 10. В одной структуре может наблюдаться толь-
ко параллельная, только антипараллельная или смешанная формы.
ГЛАВА 5 Строение и функции белков 95
P-виток и Q-петля
Остальные вторичные структуре характеризуются возникновением допол-
нительных водородных связей между существующими пептидными связями.
Такие структуры имеют очень маленький размер. Больше других известны
р-завиток (крутой разворот) и Q-петля. р-завиток представляет собой резкий
поворот первичной структуры, удерживаемой водородной связью, а Q-петля
получила название за пространственное сходство с формой одноименной гре-
ческой буквы. Оба формирования наблюдаются на внешней части белковой
структуры. Отдельные белки могут включать больше одного вида вторичных
структур.
Третичная структура: есть
у многих, но не всех белков
Первичная и вторичная структуры белка, а также связи между боковыми
цепями, определяют общую форму белка. Наряду с этим все они дают начало
третичной структуре. (Чтобы понять, как она возникает, представьте оберну-
тое вокруг себя жемчужное ожерелье, которое завязывается в несколько узлов.)
Неполярные боковые цепи являются гидрофобными, и несмотря на то, что от-
талкиваются от воды, притягиваются друг к другу. Полярные боковые цепи
притягивают другие полярные боковые цепи с помощью диполь-дипольных
сил или сил водородного связывания (рис. 5.6).
н
СН3Х\ сн5
Гидрофобное снз
взаимодействие
сн,
снч I сн,
о с
о н сн,
I
Q
Дисульфидная »
связь J
Водородное
связывание
н
н
о
R Н
о
R
Рис. 5.6. Отдельные третичные структуры, встречающиеся в белках
96 ЧАСТЬ 2 Фундамент биохимии: белки
Например, аспарагиновая и глутаминовая кислоты включают боковые цепи
с отрицательным зарядом, которые сильно притягиваются к положительному
заряду боковой цепи лизина и аргинина. Два цистеиновых остатка могут свя-
заться с образованием дисульфидной связи, которая будет ковалентной.
Что заставляет белок принимать весьма специфичную третичную струк-
туру? Исследование структуры многих белков указывает на преобладание не-
полярных боковых цепей во внутренней части с множеством полярных или
ионных боковых цепей на внешней части. В водных средах гидрофобные (не-
полярные) группы заставляют белок складываться, пряча гидрофобные группы
от воды и оставляя гидрофильные группы рядом с водой. В результате образу-
ется мицеллоподобная структура. Необычайно часто такие образования появ-
ляются в структурных и транспортных белках.
Четвертичная структура: есть
только у некоторых белков
Четвертичная структура, обнаруженная у некоторых белков, появляется
в результате взаимодействий двух или большего количества полипептидных
цепей — взаимодействий, которые обычно дают начало третичной структуре.
Чаще всего они представляются водородными и дисульфидными связями. Чет-
вертичная структура замыкает белковый комплекс в особую геометрическую
фигуру. Примером является гемоглобин, у которого есть четыре полипептид-
ных цепи: две одинаковые a-цепи и две одинаковые 0-цепи. (Здесь греческие
буквы обозначают две разные полипептидные цепи, субъединицы, и никак не
соотносятся с вторичными структурами.)
Анализ белка как исследовательский метод
В предыдущих разделах мы рассматривали разные виды белковых струк-
тур. Теперь давайте попробуем разобраться в том, как биохимики определя-
ют структуры отдельных белков. (Держу пари, в детстве многие из подающих
надежды биохимиков до мельчайших деталей разбирали все свои игрушки и
даже кое-что из родительских вещей, чтобы понять, как они устроены. И толь-
ко самые толковые из них смогли собрать все обратно!)
Дополнительную информацию о белковой структуре предоставляет имму-
нология. В ответ на инородные вещества, известные как антигены, у живот-
ных образуются антитела — белки, легко обнаруживаемые в плазме крови.
Антигены собираются на поверхности эритроцитов или красных кровяных
ГЛАВА 5 Строение и функции белков 97
телец. Воздействие бактерий, вирусов, определенных химических веществ и
аллергенов вызывает образование определенных антител. На каждый антиген
вырабатывается свое антитело.
У антител, умеющих распознавать последовательности аминокислот анти-
генов, наблюдается выраженное родство со своими антигенами. Процесс напо-
минает подбор ключа к конкретному замку. Организм животных вырабатывает
антитела к многочисленным антигенам, с которыми ему приходилось сталки-
ваться в течение жизни. При проведении анализа крови антигены и антитела
определяются за один подход, что особенно актуально в судебной экспертизе.
Выделение белков в клетке
В каждой клетке присутствуют тысячи разных белков. Чтобы проанали-
зировать и изучить некоторые из них, вам понадобиться отделить их друг от
друга. В общем случае методы, применяемые для выделения белков, могут
использоваться для отделения других биохимических соединений. Сначала
выполняется фильтрация и растворение, что позволяет удалить из раствора яв-
ные загрязнения. Но для полной очистки вещества нужно прибегнуть к более
совершенным технологиям. Целевые методы сепарации и очистки зависят от
двух основных физических свойств белков: размера и заряда.
Выделение белков по размеру
К способам, применяемым для выделения белков по размеру и массе, отно-
сят ультрафильтрацию, ультрацентрифугирование и эксклюзионную хромато-
графию. Ультрафильтрация — это модификация диализа, в котором молекулы
меньше определенного размера, проникают через полупроницаемую мембра-
ну, а более крупные молекулы — нет. Ультрафильтрация позволяет отделить
небольшие молекулы от крупных загрязнений или крупные молекулы от за-
грязнений меньшего размера.
Ультрацентрифугирование основано на процессе быстрого осаждения тя-
желых молекул, помещенных в мощную центрифугу, что позволяет эффектив-
но отделить их от остальных соединений. Принцип такой же, как при отде-
лении более легкой воды от тяжелых листьев латука в центрифуге для сушки
салатных листьев. Этот метод также используется при определении молярной
массы белка.
СУДЕБНАЯ ЭКСПЕРТИЗА: АНАЛИЗ ПЯТЕН КРОВИ
Исследование белков приобрело широкое распространение в кри-
миналистике. Одна из областей его назначения заключается в ана-
лизе пятен крови, поскольку кровь является самым распространенным дока-
98 ЧАСТЬ 2 Фундамент биохимии: белки
зательством, с которыми приходится работать судебно-криминалистическим
экспертам. Наличие пятен крови может указать на связь подозреваемого как
с жертвой, так и с местом преступления. Пятна крови также могут говорить
о том, как именно было совершено преступление. Само собой, преступники
придают большое значение таким уликам и всячески стараются скрыть их.
Кровь состоит преимущественно из воды, но в ней содержится большое ко-
личество других веществ, среди которых клетки, белки и ферменты. Жидкая
часть крови, или плазма, большей частью состоит из воды. А сыворотка, име-
ющая выраженный желтоватый оттенок, содержит красные и белые кровяные
тельца. Красные кровяные тельца или эритроциты многочисленнее белых кро-
вяных собратьев приблизительно в 500 раз. Белые кровяные тельца играют
важную роль в медицинских исследованиях, в то время как красные кровяные
тельца и в меньшей степени сыворотка чаще становятся предметом исследо-
вания экспертов-серологов. Из-за сильной сворачиваемости крови под воз-
действием кислорода, сыворотку предварительно очищают от свертывающих
веществ. Сыворотка содержит антитела, значимые для криминалистической
экспертизы, а на поверхностях эритроцитов в дополнение к ДНК располага-
ются такие вещества, как антигены — соединения, также представляющие
большой интерес для криминалистов. Антитела и антигены часто выступают
ключевыми доказательствами в криминалистической экспертизе — даже у
близнецов с идентичной ДНК разный набор антител. Как вы уже знаете, ан-
титела и некоторые антигены — это белки, а их анализ часто представляется
задачей чрезвычайной важности.
Анализируя пятна крови, специалисты с самого начала пытаются ответить на
пять следующих вопросов.
• Это точно кровь? Чтобы ответить на этот вопрос исследователи проводят
много тестов. Такие тесты имеют общее название: предварительные пробы.
В тесте Касл-Мейера используется фенолфталеин, который при контак-
те с гемоглобином или некоторыми другими веществами приобретает яр-
ко-розовый оттенок, вызванный выделением фермента пероксидазы. (Вы
могли наблюдать за проведением этого теста в одном из многочисленных
телевизионных шоу.) Люминольный тест применяется для обнаружения
невидимой крови — при контакте с кровью или некоторыми другими ве-
ществами люминол излучает свет, видимый в темной комнате. Тесты Ваген-
хаара, Такаямы и Тейхмана основаны на том факте, что высушенная в тече-
ние длительного времени кровь кристаллизуется или может быть подвер-
гнута принудительной кристаллизации.
• Это кровь человека или животного? Судебно-криминалистический экс-
перт отвечает на этот вопрос (и следующий, если это нужно) по результа-
там теста с иммунной сывороткой. При его проведении важно ответить на
вопрос, чей образец крови исследуется: человека или животного, напри-
мер домашнего питомца? Стандартным является преципитиновый тест.
ГЛАВА 5 Строение и функции белков 99
Инъекционное введение человеческой крови животному приводит к вы-
работке антител в кровяном русле животного, а выделяя эти антитела из
крови животного, получаем иммунную сыворотку. Если человеческая им-
мунная сыворотка сворачивается в образце крови, то это должен быть об-
разец человеческой крови.
• Если это кровь животного, то какого? Иммунную сыворотку можно со-
здать подобным образом и протестировать для каждого вида животных.
• Если кровь человеческая, то какой она группы? Процедура получения
ответа на этот вопрос зависит от количества и качества образца крови. Если
с качеством все в порядке, проводится прямое определение вида крови;
в противном случае применяются косвенные методы, (Более детально о
прямых методах типирования на основе классификации крови по системе
АВО см. далее врезку "Коротко об определении группы крови") Для высу-
шенных пятен крови обычно проводится косвенное типирование. Наибо-
лее распространенным методом косвенного типирования является тест
абсорбции-десорбции. Обработка образца антителами имунной сыворотки
дает раствор, который при добавлении к известному образцу вызывает
коагуляцию.
• Можно ли определить пол, расу, а возраст источника крови? Здесь от-
веты становятся менее точными. Возраст пятен определяется по сверты-
ванию и кристаллизации. Тестирование уровней тестостерона и хромосом
позволяет определить пол. И с некоторой осторожностью расовые и гене-
тические белковые маркеры, а также ферменты дают возможность опреде-
лить расовую принадлежность.
Антитела и антигены, обнаруженные в крови, могут находиться и в других жид-
костях тела. Следовательно, эти тесты применимы также и к ним.
В эксклюзионной хроматографии, еще известной как хроматография на
молекулярных ситах, гельфильтрационная хроматография или колоночная
хроматография, раствор проходит через колонку хроматографа, заполненную
пористыми шариками. Слишком большие молекулы не проходят через поры.
Молекулы, которые могут пройти через поры, замедляются. Прошедшие через
поры молекулы разделяются в зависимости от того, насколько быстро они пре-
одолели сита.
Выделение белков по заряду
Для разделения белков по заряду применяются методы ионообменной хро-
матографии, электрофореза и растворимости. Каждый из этих методов осно-
ван на анализе уровня pH.
Белки наименее растворимы в своей изоэлектрической точке. {Изоэлектри-
ческая точка — это значение pH, при котором общий заряд белка равен нулю;
100 ЧАСТЬ 2 Фундамент биохимии: белки
см. глава 4.) В изоэлектрической точке многие белки в растворе оседают. При
pH ниже изоэлектрической точки у белка положительный общий заряд, в то
время как pH выше изоэлектрической точки сообщает белку отрицательный
общий заряд. Стоит заметить, что величина заряда зависит не только от pH, но
и от структуры белка. Таким образом, два белка с одной и той же изоэлектри-
ческой точкой не обязательно имеют одинаковый общий заряд при уровне pH,
который на единицу меньше изоэлектрической точки.
Как в ионообменной хроматографии, так и в электрофорезе, анализу повер-
гается средний общий заряд белка. В ионообменной хроматографии чем боль-
ше заряд, тем медленнее проходит белок через колонку. Здесь ионообменные
процессы сходны с происходящими в установке для смягчения воды.
В электрофорезе образец раствора помещается в электростатическое поле.
Незаряженные молекулы остаются неподвижными, вещества с положитель-
ным общим зарядом движутся по направлению к негативному электроду, а ве-
щества с отрицательным зарядом направляются к положительно заряженному
электроду. Чем больше заряд, тем быстрее движутся исследуемые вещества.
На характер движения влияют другие факторы, но заряд оказывает ключевое
воздействие. Существует много разных тестов, основанных на методе электро-
фореза (включая многомерный).
ЗАПОМНИ!
При анализе белков биохимики редко применяют только одну техни-
ку. У двух белков может быть одинаковый размер, но разный заряд,
и наоборот, потому что у них разная структура (комбинация амино-
кислот). Чтобы подтвердить исходные предположения, обычно при-
меняют сразу несколько исследовательских методик.
Все точнее и точнее: определение
последовательности аминокислот
Получив в свое распоряжение образец с чистым белком, можно попытаться
определить последовательность аминокислот, чтобы идентифицировать вид
белка. Общая процедура с незначительными изменениями применима для ис-
следования других биохимических соединений.
Шаг 1. Разделение и очищение полипептидных цепей
Если в белке определяется больше одной полипептидной цепи, то нужно
разделить и очистить цепи так, чтобы можно было упорядочить каждую из
них. (Этот шаг не всегда выполняется, поскольку у многих белков всего одна
полипептидная цепь). Обычно достаточно денатурации белка в результате раз-
рушения его трехмерной структуры без разрыва пептидных связей. Для вы-
полнения этой задачи нужно повысить pH до экстремального значения. Если
ГЛАВА 5 Строение и функции белков 101
между цепями установлены дисульфидные связи, то для их разделения приме-
няется процедура, описанная в следующем шаге.
Шаг 2. Разрыв дисульфидных связей внутри цепей
На этом шаге выполняется разрыв (расщепление) дисульфидных связей. За-
дача решается обычным восстановлением. Однако связи впоследствии могут
возобновиться, поэтому их нужно не только расщепить, но и предупредить их
восстановление, проведя процедуру восстановительного расщепления с после-
дующим алкилированием. Обратный процесс предотвращает окислительное
расщепление, при котором сера окисляется до -SOj.
Шаг 3. Определение концентрации аминокислот в цепи
Эта задача легко выполняется с помощью аминокислотного анализатора —
автоматического инструмента, который определяет набор аминокислот в белке
меньше, чем за один час. Для работы ему требуется меньше одного наномоля
белка. Анализатор выдает процентное содержание каждой присутствующей в
белке аминокислоты. Однако он определяет только состав белка, а не порядок
соединения аминокислот.
Шаг 4. Определение концевых аминокислот
На этом этапе можно не только определить концевые аминокислоты, но и
узнать, присутствует ли в белке больше одной цепи. У полипептидной цепи
есть всего одна N-концевая и одна С-концевая аминокислота. Следовательно,
при определении более одной N- или С-концевых аминокислот делается вы-
вод, что в белке больше одной полипептидной цепи.
Вы можете определить N-концевой остаток разными путями. В общем
случае процедуру начинают, добавляя реагент, который вступает в реакцию с
N-концевой аминокислотой и помечает ее. Последующий гидролиз разруша-
ет полипептид, позволяя провести разделение и идентификацию помеченных
остатков. В этом методе применяют реагент Зангера, дансилхлорид и лейци-
наминопептидазу. На сегодняшний день эта задача выполняется с помощью
метода расщепления по Эдману. Подобно другим методам в нем помечаются
N-концевые остатки, однако только концевые аминокислоты отщепляются от
цепи, поскольку оставшаяся часть не разрушается, как в других методах. Про-
цедуру можно повторить на укороченной цепи, чтобы определить следующий
остаток. В принципе, повторение расщепления по Эдману может указать всю
последовательность, но в большинстве случаев пределом является определе-
ние первых 30-60 остатков.
Подобным образом можно также определить С-концевой остаток. Для
этих целей выполняются реакции Акабори (гидразинолиз) и восстановления
с литиево-алюминиевым гидридом. Кроме того для выборочного отщепления
102 ЧАСТЬ 2 Фундамент биохимии: белки
С-концевого остатка можно использовать фермент карбоксипептидазу в раз-
личных доступных модификациях. К несчастью, действие фермента не огра-
ничивается одним отщеплением — если время реакции достаточно велико, то
он воздействует далее на всю оставшуюся цепь.
Шаг 5 и 6. Разделение цепи на фрагменты
На шаге 5 полипептид расщепляется на меньшие фрагменты и определяется
аминокислотный состав и последовательность каждого фрагмента. Действия
шага 6 повторяют предыдущие за тем лишь исключением, что на нем прово-
дятся иные расщепляющие реакции и получаются несколько отличные наборы
фрагментов. Оба шага, 5 и 6, необходимы для получения фрагментов как мож-
но меньшего размера, что значительно облегчает их последующую идентифи-
кацию.
Большинство методов основано на применении ферментов, однако в неко-
торых случаях действенными оказываются менее специфические способы. Ча-
стичный гидролиз кислоты случайным образом расщепляет белковую цепь на
многочисленные фрагменты. Трипсин, пищеварительный фермент, специфиче-
ски отщепляет С-часть аргинина или лизина. Использование трипсина позво-
ляет дополнительно узнать о том, что общее число присутствующих остатков
аргинина и лизина на единицу меньше, чем число получившихся фрагментов.
Пищеварительный фермент трипсин преимущественно отщепляет остатки,
содержащие ароматические кольца: тирозин, фенилаланин и триптофан. Дру-
гие остатки, особенно лейцин, отщепляется с его помощью очень медленно.
Клострипаин отщепляет положительно заряженные аминокислоты, особенно
аргинин. Медленнее всего отщепляет остатки лизин. Фрагменты с С-конце-
вой аспарагиновой или глутаминовой кислотой образуются в результате вза-
имодействия стафилококковой протеазы на белок в фосфатном буфере. При
наличии бикарбонатного или ацетатного буфера получаются только фрагмен-
ты С-концевой глутаминовой кислоты. Множество менее специфических фер-
ментов, включая эластазу, субтилизин, термолизин, пепсин и папин завершают
разбивку фрагментов.
КОРОТКО ОБ ОПРЕДЕЛЕНИИ ГРУППЫ КРОВИ
Определение групп крови по системе АВО, вошедшее в практику с
1901 года, основано на реакции антиген-антитело. Спустя годы были
открыты другие, более точные реакции. Свыше 256 известных антигенов пре-
допределяют образование 23 различных групп крови. Каждая группа крови
определяется присутствием антител в сыворотке и антигенов в красных кро-
вяных клетках. В базовом методе типирования применяются две иммунные
ГЛАВА 5 Строение и функции белков 103
сыворотки, помеченные как анти-А и анти-В. Добавление капли одной из
них в образец крови вызывает коагуляцию, если в этом образце присутствует
соответствующий антиген. Сыворотка анти-А взаимодействует с антигенами
крови типов А и АВ. Сыворотка анти-В вступает в реакцию с антигенами крови
типов В и АВ. Ни одна из сывороток не взаимодействует с типом 0. Приблизи-
тельное распространение типов крови имеет следующий вид: 43-45%—тип 0,
10-12% — тип В и 3-5% — тип АВ. Кроме того, выделяются подгруппы с обо-
значениями 01 и 02, а также определяются другие, очень редкие типы крови.
Резус-фактор (Rh) выступает дополнительным критерием типизации крови.
Он (название заимствовано у одного из видов обезьян) представляет собой
антиген на поверхности красных кровяных телец. У людей с положительным
резус-фактором в крови встречается белок (антитело), который исходно был
обнаружен в крови макаки-резус. Около 85% людей являются резус положи-
тельными. А те, у которых такого белка нет, считаются резус отрицательными.
Оценка образцов крови как резус положительных или резус отрицательных
имеет важное практическое применение. Существует около 30 возможных
комбинаций факторов.
Дополнительные критерии позволяют определить, принадлежала ли кровь
конкретному человеку, — для этого проводится идентификация ферментов
и белков, находящихся в крови. Судебный эксперт (см. врезку "Судебная экс-
пертиза: анализ пятен крови" выше) проводит такое исследование в каждом
случае, когда позволяет качество образцов. Одна из отличительных характе-
ристик белков и ферментов крови — это полиморфизм или способность суще-
ствования в виде изоферментов; другими словами, белок может представлять-
ся в разнообразных формах и видах. Один хорошо известный пример — это
полиморфизм гемоглобина, который вызывает серповидно-клеточную ане-
мию. Среди широко известных полиморфизмов следующие соединения.
Аденилкиназа Аденозиндеаминаза Кислофосфатазный эритроцит Эстераза D Глюкоза-6-фосфатдегидрогеназа Аланинаминотрансфераза Фосфоглюкомутаза 6-фосфоглюконатдегидрогеназа Трансферрин АК ADA ЕАР EsD G-6-PD GPT PGM 2-1 6-PGD Tf
На сегодняшний день хорошо исследована распространенность каждой их по-
лиморфных форм среди людей. Определение каждого из возможных допол-
нительных факторов позволяет сузить область дальнейшего расследования.
104 ЧАСТЬ 2 Фундамент биохимии: белки
Химические способы расщепления фрагментов включает обработку бром-
цианом и гидроксиламином с последующим нагреванием в растворе кисло-
ты. Бромциан по-особенному действует на метионин. Если раствор с pH = 2,5
нагреть до 40 °C, то будет происходить избирательное расщепление кислот-
но-пролиновой связи.
СОВЕТ
Метод фрагментирования по Эдману можно применить отдельно к
каждому фрагменту. Это упрощает расшифровку последовательно-
стей аминокислот в крупных белках.
Шаг 7. Сопоставление информации для
определения общей последовательности
На шаге 7 собирают информацию, полученную в результате проведения
всех исследовательских процедур. Это как собирать древнюю керамическую
вазу из найденных черепков. Например, исследуем простой фрагмент окта-
пептида белковой структуры. По завершению гидролиза из него выделяются
по одной молекуле аминокислот аланина (Ala), аспарагиновой кислоты (Asp),
глицина (Gly), лизина (Lys), фенилаланина (Phe) и валина (Vai), а также две
молекулы цистеина (Cys). Кроме того в результате неполного гидролиза были
получены такие фрагменты: Gly-Cys, Phe-Val-Gly, Cys-Asp, Cys-Ala, Lys-Cys и
Cys-Asp-Lys. Нужно сопоставить фрагменты, подобрать аминокислотную по-
следовательность в октапептиде и записать его первичную структуру.
Cys-Asp Lys-Cys
Cys-Asp-Lys Cys-Ala
Gly-Cys
Phe-Val-Gly
Phe-Val-Gly-Cys-Asp-Lys-Cys-Ala
Шаг 8. Расстановка дисульфидных связей
Последний шаг не имеет отношения к анализу первичной структуры белка,
но тем не менее связан с ней. Если дисульфидные связи оставить нетронуты-
ми, отказавшись от выполнения шага 2, то в результате будут получены разные
фрагменты. Это позволяет точно определить общую форму белка. В некоторых
случаях более детальную информацию предоставляют сложные аналитические
инструменты.
ГЛАВА 5 Строение и функции белков 105
Глава 6
Ферментативная
кинетика: ускоряемся
В ЭТОЙ ГЛАВЕ...
» Классификация ферментов
» Кинетика ферментов
» Ингибирование и регуляция
Ферменты — это комплекс биологических молекул, состоящих в основ-
ном или полностью из белка, которые ведут себя как биологический
катализатор. Как катализаторы они увеличивают скорость протека-
ния химической реакции без непосредственного участия в ней. Чаще всего
ферменты сильно ограничены областью действия, нацеливаясь только на опре-
деленные специфически реагирующие вещества, называемые субстратами.
Такое поведение ферментов зачастую определяется стереоспецифично-
стью — расположением атомов субстрата в определенном порядке в трехмер-
ном пространстве. Стереоспецифичность проявляется в том, что если, напри-
мер, заменить D-глюкозу на ее энантомер, L-глюкозу, то мы с вами не могли бы
усваивать его вместе с остальными продуктами питания. (Обязательно узнай-
те, что представляет собой раствор глюкозы, предназначенный для внутривен-
ного введения!)
Ферменты существуют во многих формах. Некоторые ферменты состоят
полностью из белков, в то время как у других есть небелковые части, назы-
ваемые кофакторами. Кофактором может выступать ион металла, например
магния, или органическое вещество. Органический кофактор называется ко-
энзимом (у металлического кофактора специального названия нет). Фермент
без кофактора относятся к апоферментам, а сочетание апофермента и его ко-
фактора представляют собой голофермент. В металлоферменте присутствует
апофермент и кофактор в виде иона металла. Фермент с прочными связями —
это простетическая группа. (Ух ты, как много “умных” терминов, но с фер-
ментами никогда не бывает просто!)
Одна из частей фермента, активный участок, отвечает непосредственно
за взаимодействие молекул. Реакция возникает, когда реагирующая молекула,
субстрат, соединяется с этим активным участком. Кроме фермента и субстрата
для возникновения реакции могут понадобиться другие вещества.
Во многих случаях клетка изначально производит фермент в неактивной
форме под названием профермент или зимоген, который нужно активировать,
чтобы он начал действовать. Важность образования неактивной формы фер-
мента можно проследить на примере трипсина. Трипсин — это один из фер-
ментов, который в норме присутствует в желудке и отвечает за переваривание
белков. В неактивной форме его вырабатывают клетки желудочной стенки, а
активация происходит после выделения фермента в желудок. Если бы трип-
син вырабатывался в активной форме, то немедленно начал бы переваривать
клетки, которые его и произвели. Поедание себя — это не самая удачная идея!
Таким образом, проферменты и подобные структуры наподобие прогормонов
и препрогормонов, придают этим белкам большую пространственную и вре-
менную гибкость в действиях.
Активация неактивной формы фермента служит одной из форм
РЛ ферментативного контроля. Ингибирование — это еще один метод
контроля ферментов. К двум основным его видам относится конку-
ЗАПО1ИНИ1
рентное ингибирование, при котором другие вещества конкурируют
с субстратом за взаимодействие с активным участком фермента, и
неконкурентное ингибирование, при котором другие вещества свя-
зываются с неактивными участками. Такое связывание изменяет в
целом структуру фермента так, что он перестает действовать, как
усилитель.
Классификация ферментов: предельно точно
Вы когда-нибудь задумывались, кто дает названия химическим элементам?
Самые разные организации, но в случае ферментов это Комиссия по фермен-
там при Международном биохимическом союзе (Enzyme Commission of the
International Union of Biochemistry). Обычно название фермента начинается
с некоторого описания его действия и заканчивается суффиксом -аза. (Этому
108 ЧАСТЬ 2 Фундамент биохимии: белки
соглашению не подчиняются ферменты, которые получили свои имена до вне-
дрения системы унификации названий, например трипсин.) Комиссия также
развивает цифровую систему классификации ферментов. В цифровом виде на-
звания ферментов начинаются с аббревиатуры ЕС (Enzyme Commission), после
которых указываются четыре цифры, разделенные точками, которые однознач-
но идентифицируют фермент согласно принятой классификации. В качестве
примера рассмотрим номенклатурный номер ЕС 2.7.4.4.
Первая цифра в обозначении указывает, какому из шести основных классов
принадлежит фермент (табл. 6.1). Например, цифра 2 в названии ЕС 2.7.4.4
определяет фермент, как трансферазу. Вторая цифра, 7, указывает группу, ко-
торую переносит фермент. Третья цифра, первая 4, определяет место назначе-
ния переносимой группы. И последняя цифра, вторая 4, уточняет информацию,
которую предоставляет третья цифра.
Таблица 6.1. Шесть основных классов ферментов
Класс фермента Выступает катализатором реакции
Оксидоредуктазы Окисления
Трансферазы Передачи группы атомов
Гидролазы Гидролиза
Лиазы Образования или присоединения к двойной связи
Изомеразы Изомеризации молекул
Лигазы или синтетазы Соединения двух молекул
В следующих разделах мы отдельно рассмотрим каждый класс ферментов.
Сразу в обе стороны: оксидоредуктазы
Оксидоредуктазы катализируют одновременно реакции окисления и вос-
становления. Окисление подразумевает увеличение валентности элемента, в то
время как восстановление связано с уменьшением его валентности. Один про-
цесс невозможен без другого. В табл. 6.2 перечисляются виды реакций, отно-
сящиеся к процессам окисления и восстановления. В целом, вещество подвер-
гается либо окислению, либо восстановлению, а фермент временно все делает
наоборот, но в конце концов возвращается к своей первоначальной формуле.
ГЛАВА 6 Ферментативная кинетика: ускоряемся 109
Таблица 6.2. Некоторые из возможных
окислительно-восстановительных реакций
Окисление Восстановление
Потеря одного или более электронов Получение одного или больше электронов
Получение кислорода Потеря кислорода
Потеря атома водорода Получение атома водорода
Рассмотрим реальный пример: сукцинатдегидрогеназа катализирует окис-
ление иона сукцината. В этом случае окисление заключается в потере двух
атомов водорода с образованием транс-двойной связи. Фермент алкогольдеги-
дрогеназа удаляет два атома водорода из спирта, что приводит к образованию
альдегида. Ниже приведен общий несбалансированный вид этих реакций:
~ООССН2СН2СОО - Сукцинатдегидр°геназа^- QQCCH = CHOO'
СН3СН2ОН ---------Алкогольдегидрогеназа > СН3СНО
Вам здесь не место: трансферазы
Функция трансферазы заключается в активировании переноса группы от
одной молекулы к другой. Аминотрансфераза переносит аминогруппу, а фос-
фотрансфераза переносит фосфорильную группу. Общая, несбалансирован-
ная форма этих реакций приведена на рис. 6.1.
R—сн—СОО" о
। * || Аминотрансфераза
NH3+ R'— С —СОСГ
R—СН—ССЮ" О
I + II
NH3* R— С —СОО"
О О
о__р____о- + R'OH Фосфотрансфераза -о___р__о
R О- О- R'
Рис. 6.1. Общая несбалансированная форма двух катализированных
реакций переноса
110 ЧАСТЬ 2 Фундамент биохимии: белки
Вода всему голова: гидролазы
Гидролазы выступают катализатором расщепления связей в результате при-
соединения молекулы воды (как к Н, так и ОН). Протекание реакции зависит
от уровня pH и сопровождается потерей ионов водорода. Фосфатаза катали-
зирует гидролиз монофосфатных сложных эфиров, а пептидаза катализирует
гидролиз пептидной связи. Общая форма этих реакций показана на рис. 6.2.
о о
R--С---N---R' + НОН ПептиДаза r----с---О- + +H3N--R'
I
н
о
о—р—о- + нон фосФатаза R—он + НРо42-
R о-
Рис. 6.2. Общая форма двух катализированных реакций гидролиза
Разбираем на составляющие: лиазы
Лиазы выступают катализаторами отделения групп. Этот процесс сопрово-
ждается образованием двойной связи или присоединением группы к двойной
связи. Дезаминаза помогает отделить аммоний, а декарбоксилаза выступает
катализатором потери СО2. В общем виде эти реакции проиллюстрированы на
рис. 6.3.
R---СН2-СН--R' Дезаминаза R--CH=CH-R' + NH3
nh2
н
r—i—coo- Декарбоксилаза R_CH2 + o==c=o
NH3+ NH3+
Рис. 6.3. Общая форма двух реакций, катализированных лиазами
ГЛАВА 6 Ферментативная кинетика: ускоряемся 111
Перетасуем колоду: изомеразы
Рацемаза и эпимераза относятся к изомерам. Ферменты изомеразы катали-
зируют переход одного изомера в другой. Рацемаза, изображенная в верхней
части рис. 6.4, катализирует реакцию рацемизации энантомеров. Эпимераза,
подобная показанной в нижней части рис. 6.4, выступает катализатором пре-
образования одного эпимера в другой. Как и другие реакции катализации эти
процессы равновесные.
но сн3 о
h2n—с—с—он Рацемаза —с——он
сн3 н
L-аланин D-аланин
СН2-ОН
с=о
।Эпимераза
н—с—он о
сн2-о—Р О-
О"
О-рибулоза-5-фосфат
сн2-он
с=о
но—с—н
I
н—с—он о
СН-О---Р--О"
О"
□-ксилулоза-5-фосфат
Рис. 6.4. Примеры реакций, катализируемых рацемазой
и эпимеразой
Собираем все вместе: лигазы
Фермент лигаза является катализатором объединения двух молекул, меж-
ду которыми формируется ковалентная связь. При протекании такой реакции
часто образуются высокоэнергетические связи, подобные задействованным
в АТФ. Рис. 6.5 иллюстрирует действие двух лигаз: пируваткарбоксилазы и
ацетил-СоА-синтетазы. Пируваткарбоксилаза катализирует образование С-С
связи, а ацетил-СоА-синтетаза — образование С-S связи.
112 ЧАСТЬ 2 Фундамент биохимии: белки
Пируват + СО2 + Н2О + АТФ
Пируваткарбоксилаза
Оксалоацетаза + АДФ + Р,
Ацетил-СоА-синтетаза
Ацетат + CoA-SH + АТФ ---------- Ацетил-S-CoA + АМФ + РР,
Рис. 6.5. Реакции, иллюстрирующие действие лигаз: пируваткарбоксилазы
и ацетил-СоА-синтетазы
Ферменты как катализаторы: когда
быстро, это не так уж и быстро
Действие ферментов начинается с образования фермент-субстратного
комплекса. В этом образовании субстрат определенным образом связывается с
активной частью фермента. Структура белков рассматривалась нами в главе 5.
Важную роль в фермент-субстратном взаимодействии играет вид белковой
структуры (первичная, вторичная и т.д.). Взаимодействие фермента с субстра-
том должно происходить таким образом, чтобы облегчать реакцию, открывая
для реакции новые возможности.
В структуре фермента активный участок занимает очень небольшую часть.
Аминокислотные остатки, входящие в состав активного участка, могут проис-
ходить из удаленных частей белка (первичной структуры), и только через вза-
имодействия, приводящие к образованию структуры более высокого уровня,
они приближаются друг к другу. Остатки аминокислот, не находящиеся в ак-
тивном месте, выполняют много дополнительных функций, помогая действию
фермента.
Первая попытка объяснить этот процесс привела к созданию модели за-
мок-ключ, в которой субстрат ведет себя как ключ, который подходит к зам-
ку — ферменту (рис. 6.6). Модель замок-ключ отчасти объясняет специфич-
ность ферментов. Только правильный ключ подходит к замку, и только пра-
вильный субстрат подходит к ферменту.
Первый недостаток модели замок-ключ заключается в том, что она
не объясняет, почему возникает реакция, а второй ее недостаток свя-
зан с тем, что в действительности ферменты пластичные, а не жест-
ВНИМАНИЕ!
кие, как предполагает теория.
Модель индуцированного соответствия преодолевает некоторые ограниче-
ния модели замок-ключ. В ней субстрату также нужно подходить к ферменту
как к ключу, но вместо простого соответствия некоторые виды модификаций
ГЛАВА 6 Ферментативная кинетика: ускоряемся ИЗ
индуцируются в субстрате, в ферменте или в них обоих. Модификации запу-
скают процесс реакции. На рис 6.7 проиллюстрирован принцип применения
модели индуцированного соответствия для описания такого же фермент-суб-
стратного комплекса как на рис. 6.6.
Субстрат
Фермент
Фермент-субстратный
комплекс
Рис. 6.6. Модель замок-ключ, описывающая катализ ферментов
Субстрат
Фермент
Фермент-субстратный
комплекс
Рис. 6.7. Модель индуцированного соответствия для катализа ферментов
114 ЧАСТЬ 2 Фундамент биохимии: белки
Все о кинетике
Как известно, реакции протекают в результате преобразования энергии. Они
начинаются с определенного энергетического уровня, дополнительное коли-
чество энергии поглощается для достижения переходного состояния (обозна-
чаемого символом “звездочка” в записи AG*), после чего энергия выделяется
в продукт. Величина AG рассчитывается, как разница между энергетическими
уровнями реагента и продукта.
ЗАПОМНИ!
Если у продукта энергетический уровень выше, чем у реагентов
(энергия поглощается), то реакция является эндергонической и не-
спонтанной. Если у продукта энергетический уровень ниже, чем у
реагентов (энергия выделяется), то реакция называется экзергониче-
ской и спонтанной.
Спонтанная реакция не всегда протекает очень быстро. Ее скорость зависит
от значения AG*. Чем оно больше, тем медленнее реакция. Фермент как любой
катализатор понижает значение AG*, и, следовательно, увеличивает скорость
реакции. Различие между взаимодействующими веществами и продуктами
остается неизменным так же, как и их равномерное распределение. Фермент
способствует образованию промежуточного комплекса (рис. 6.8).
Рис. 6.8. Влияние фермента на протекание реакции
В промежуточном состоянии у вещества есть две возможные участи (если
бы жизнь была такой же простой и у людей): потерять энергию и вернуться в
реактивную форму или потерять энергию и перейти в форму продукта. Каж-
дый вариант приводит к своему равновесному состоянию. В одном из таких
состояний пребывает вещество, вступающее в реакцию (субстрат), и про-
ГЛАВА 6 Ферментативная кинетика: ускоряемся 115
межуточное соединение, а во втором — продукт(ы) и промежуточные соеди-
нения. Быстрое отщепление продукта(ов) не позволяет веществу быстро вер-
нуться к состоянию равновесия, что упрощает анализ кинетических данных.
ЗАПОМНИ!
Ферменты как катализаторы способствуют реакциям обоих типов —
прямым и обратным. Снижение значения AG* приводит к ускоре-
нию любых реакции. Итоговое равновесие концентрации субстрата
и продукта остается таким же вне зависимости от наличия фермен-
та; фермент меняет только количество времени, затрачиваемого для
достижения такого состояния.
Активность фермента: анализ в заданный
срок и кинетический анализ
Согласно определению анализ фермента заключается в исследовании ка-
талитической активности фермента. Он измеряется как скоростью исчезно-
вения субстрата, так и скоростью появления продукта. Лабораторный способ
определения зависит от частных химических и физических свойств субстрата
или продукта, а скорость — это изменение концентрации за единицу времени.
В анализе в заданный срок измеряется скорость реакции за определенный от-
резок времени. В кинетическом анализе отслеживается весь процесс протека-
ния реакции. После определения скорости изменения концентрации каждого
действующего вещества или продукта можно узнать скорость изменения лю-
бого другого действующего вещества или продукта.
СОВЕТ
Очень важно полностью контролировать условия проведения ре-
акций. Даже незначительные изменения в таких переменных как
температура или pH могут повысить или снизить каталитическую
активность фермента. В частности, биологически важные для чело-
века ферменты исследуются при температуре 37 °C (98,6 °F) — нор-
мальной температуре человеческого тела.
Скорость реакции: насколько быстро
Кинетические исследования требуют тщательного контроля условий прове-
дения экспериментов. После проведения базовых исследований обычно выпол-
няется ряд опытов с фиксированной концентрацией фермента и разными кон-
центрациями субстрата. До определенного момента повышение концентрации
субстрата способствует увеличению скорости реакции. Повышение скорости
наблюдается до насыщения фермента. Точка насыщения обозначает концентра-
цию, при которой все молекулы фермента включаются в фермент-субстратный
комплекс. Как только она достигается, повышение концентрации субстрата
116 ЧАСТЬ 2 Фундамент биохимии: белки
не вызывает увеличения скорости реакции, потому что в растворе не остается
фермента, который в состоянии взаимодействовать с дополнительными моле-
кулами субстрата. Скорость большинства реакций стремиться к уровню насы-
щения по гиперболической кривой. Теоретически, скорость реакции достигает
насыщения только при бесконечной концентрации субстрата.
Действительный график скорости реакции, И, в зависимости от концентра-
ции субстрата (рис. 6.9) предоставляет мало полезных (а зачастую совершенно
неинформативных) сведений. Соответствующий опыт проводится при посто-
янной концентрации фермента. Особый интерес вызывает уровень максималь-
но возможной скорости реакции, Итах. Действительная скорость реакции стре-
миться к Ктах асимптотически. При низкой концентрации субстрата реакция
наблюдаются кинетические процессы первого порядка, когда скорость реакции
зависит только от концентрации реагентов. При высоких концентрациях ки-
нетический процесс переходит в фазу нулевого порядка — скорость реакции
не зависит от концентрации реагентов. (Позже в этой главе показано, как из-
меняется график при более сложных взаимодействиях фермент-субстратной
системы.) В области между участком нулевого порядка и участком первого по-
рядка проходят смешанные кинетические процессы, которые сложно отделить
один от другого. Ключевыми для участков с низкой концентрацией (первый
порядок) с точки зрения анализа выступают значения и Км9 где Км — это
Скорость реакции (Г)
---------------------------------------------------------------------------------------------------- у
.•••••••••*--------------------------------------r max
- Л------------У2Утм
Концентрация субстрата
Км
Рис. 6.9. Зависимость скорости реакции от концентрации субстрата
ГЛАВА 6 Ферментативная кинетика: ускоряемся 117
константа Михаэлиса, которая обозначает концентрацию субстрата, произво-
димого со скоростью l/2Vmax. Константа Михаэлиса, измеренная в молях, явля-
ется грубой мерой сходства фермента и субстрата. Значения Км варьируются
в широком диапазоне. (Глубоко выдохните и попытайтесь переосмыслить все
вышесказанное!)
СОВЕТ
При низких значениях величина V зависит от концентрации субстра-
та линейным образом. Однако при высоких концентрациях субстра-
та скорость реакции изменяется незначительно. Участок графика
для низкой концентрации субстрата описывается уравнением Миха-
элиса-Ментен (см. следующий раздел).
В реакции, протекающей в отсутствие катализации, повышение концентра-
ции субстрата не приводит к насыщению и ограничению Ктах. Скорость про-
должает увеличиваться с увеличением концентрации субстрата. Такое поведе-
ние выступает косвенным доказательством присутствия фермент-субстрат-
ного комплекса — тесно связанного объединения фермента и субстрата. Предел
достигается, когда все молекулы фермента становятся частью комплекса, и нет
свободных молекул, способных вступать в реакцию с дополнительными моле-
кулами субстрата. Наглядно убедиться в образовании фермент-субстратного
комплекса позволяют рентгеновские и спектроскопические исследования.
НА ПРАКТИКЕ
ФЕРМЕНТЫ В МЕДИЦИНСКОЙ ДИАГНОСТИКЕ И ТЕРАПИИ
Поскольку уровень концентрации ферментов часто указывает на
проблемы со здоровьем, ферментный анализ выступает важным ин-
струментом диагностики и лечения многих заболеваний. В качестве примера
рассмотрим креатинкиназу (СК) — фермент, участвующий в синтезе и распаде
креатинфосфата.
СК существует в виде трех разных изоферментов. Каждый состоит из двух по-
липептидных цепей. У мышечной СК, обозначаемой как СК-MM, цепи одина-
ковые по строению. У СК, обнаруженной в головном мозге и обозначаемой
как СК-ВВ, цепи также одинаковые, но они заметно отличаются от таковых в
СК-MM. Наконец, СК, обнаруженная в сердце, представляет собой гибрид кре-
атинкиназ с М- и В-цепями. Именно поэтому она обозначается как СК-МВ.
В норме в сыворотке крови содержится немного СК-MM, и почти отсутствует
СК-ВВ или СК-МВ. Однако при повреждении тканей некоторое количество вну-
триклеточных ферментов попадает в кровь, где их концентрацию можно легко
измерить. Повышенный уровень СК (все три изофермента) могут указывать на
скелетно-мышечную травму или инфаркт миокарда (ИМ или сердечный при-
118 ЧАСТЬ 2 Фундамент биохимии: белки
ступ). Анализ каждого фермента предоставляет дополнительные сведения о
заболевании.
Например, человек упал с лестницы и получил перелом сразу нескольких ко-
стей и потерял сознание. Его забрали в больницу, где измерили концентрацию
СК в сыворотке крови. Как и ожидалось, она оказалась повышенной. Опытный
врач сразу же направит пациента на анализ концентрации СК-MB. Если СК-МВ
также оказывается намного выше нормы, то это указывает на то, что вероятной
причиной падения с лестницы был сердечный приступ. Поставив правильный
диагноз, врач назначит своевременную терапию, которая с большой вероят-
ностью предотвратит необратимое повреждение сердечной мышцы.
Исследование ферментов:
уравнение Михаэлиса-Ментен
Одним из прорывов в изучении ферментивной кинетики было получение
уравнения Михаэлиса-Ментен. Сегодня биохимики могут применять его для
обработки кинетических данных и описания поведения множества ферментов.
(Существуют исключения, в которых график зависимости скорости реакции от
концентрации субстрата отличается от приведенного на рис. 6.9.) В общем слу-
чае результаты кинетических опытов описывают поведение аллостерических
(регуляторных) ферментов. Уравнение Михаэлиса-Ментен имеет следующий
вид.
_[s]+V
где V — скорость реакции, [S] — концентрация субстрата, Итах — максималь-
ная скорость реакции, а Км— константа Михаэлиса. Как показано на рис. 6.9,
скорость катализа, К, увеличивается линейно при низкой концентрации суб-
страта, но начинает выравниваться при повышении концентрации. Интерпре-
тация начинается с проверки следующего общего пути реакции.
Е + 5< k' >ES< *г >Е + Р,
k-i к_2
где Е — это фермент, 5 — субстрат, ES — фермент-субстратный комплекс,
а Р — продукт. Различные частные случаи к относятся к константам скорости
разных этапов; отрицательная константа скорости характерна для обратного
процесса. На первом этапе отдельные фермент и субстрат объединяются, об-
разуя фермент-субстратный комплекс (переходное соединение). Скорость об-
разования ES равняется кх. После образования ES может распасться на Е и S
ГЛАВА 6 Ферментативная кинетика: ускоряемся 119
(со скоростью k-J или привести к образованию продукта (со скоростью к2).
(Примечание: в некоторых источниках к2 обозначается как kcat.)
Из-за способности ферментов выступать катализаторами обратного про-
цесса Е и Р соединяются и обновляют комплекс (со скоростью Л_2). Если на
обратную реакцию (Л_2) не обращать внимания, то интерпретировать данные
становится очень просто. Но так можно поступать только в начале реакции,
когда концентрация Р еще очень низкая. Предположение, что к_2 настолько
мало, что им можно пренебречь, ведет к упрощению предыдущего уравнения
до следующего вида.
Е + 5< к> >ES к2 >Е + Р,
Благодаря такому упрощению химики Леонор Михаэлис и Мод Ментен
смогли описать кинетические свойства множества ферментов. Благодаря их
работе было получена формула, описывающая зависимость скорости катали-
тической реакции от концентраций фермента и субстрата, а также скоростей
протекания индивидуальных реакций. Отправной точкой для него стало выра-
жение, устанавливающее отношение между скоростью реакции и концентра-
цией фермент-субстратного комплекса.
V = ^[ES].
Проще говоря, скорость образования ES составляет кх [£][S], а скорость рас-
щепления ES равняется (к_} + £2)[Е5]. На протяжении всей реакции концентра-
ция ES остается почти неизменной. Это сравнительно устойчивое предположе-
ние, которое принимает в расчет, что во время реакции концентрация любых
промежуточных продуктов практически не меняется. Такое предположение оз-
начает, что скорость образования ES равняется скорости расщепления ES, или
^,[Е][5] = + *2) [ES],
В результате исходное уравнение приводится к следующему виду.
№] (fc_,+fr2)
[Е5] Л, м'
Сочетание трех констант скорости дает в результате новую постоянную —
константу Михаэлиса, Км, которая не зависит от фактической концентрации
фермента и субстрата, однако связана с соотношением концентраций. По этой
причине Км является важной характеристикой фермент-субстратного взаимо-
действия. Через константу Михаэлиса можно выразить концентрацию ES.
120 ЧАСТЬ 2 Фундамент биохимии: белки
Когда концентрация фермента намного ниже, чем субстрата, значение [S]
становится очень близким к общей концентрации субстрата. Концентрация
фермента, [£], равняется общей концентрации фермента, [£]р минус концен-
трация фермент-субстратного комплекса, или [£] = [Е]г- [Е5]. Если подста-
вить это соотношение в предыдущее уравнение, то можно показать, что
[ю]=п-мм
Преобразование этого уравнения приводит к получению такой формулы.
[ES] = L т/. . м = rL J .
1 J 1+ [$]/*„ [$]+к„
При подстановке этого выражения в формулу V = *2[Е$]или(И=*и|[Е$])
можно получить:
Максимальная скорость реакции Ктах достигается, когда все молекулы
фермента связаны с субстратом. То есть [ES] = [Е]г. Это позволяет заменить
V = £2[Е5] на Ктах = к2[Е]т. Такая подстановка приводит к преобразованию
предыдущей формулы в уравнение Михаэлиса-Ментен.
[$]+V
Это уравнение хорошо описывает данные, приведенные на рис. 6.9. При
очень низких концентрациях [S] « Км, V= (Итах/Х’м)[5']. Если [5] больше Км
(высокая концентрация [S]), то V= Kmax. Если [S] = Ки, то V= Kmax/2.
Идеальное приложение
Уравнение Михаэлиса-Ментен объясняет поведение многих ферментов.
Значения КЛ1 и Итах определяются относительно просто. Обычно эта задача за-
ключается в анализе графика с помощью компьютерных программ, подбираю-
щий наиболее подходящую кривую.
Значения Км варьируются в широких пределах. Значение зависит от при-
роды фермента и субстрата, а также от различий во внешних факторах таких,
как температура, сила ионного взаимодействия и уровень pH. Поскольку Км
обозначает концентрацию субстрата, необходимого для заполнения полови-
ны активных участков фермента, его можно рассматривать как минимальную
концентрацию субстрата, обеспечивающую должный уровень каталитической
ГЛАВА 6 Ферментативная кинетика: ускоряемся 121
активности. Долю заполненных участков,^, можно определить как функцию
значения К.
м
В свою очередь Км связана с константами скорости протекания реакций.
is _ ^-1 + ^2
f
Если к_х значительно превышает Л2, то Км = k_x/kx, что соответствует равно-
весной точке реакции диссоциации фермент-субстратного комплекса.
к = №] _
“ [ES] к, ’
Км — это мера связывания в фермент-субстратном комплексе. Высо-
кое значение Км указывает на то, что связывание слабое, в то время
ЗАломни1 как низкое значение свидетельствует о сильном связывании.
Значение Ктах определяет число оборотов фермента — количество молекул
субстрата, которые преобразуются в продукт за единицу времени до полно-
го насыщения фермента. На его основе можно определить к2. (Константу к2
также часто называют каталитической константой, £cat.) Если концентрация
активных участков, [Е]г, известна, то для вычисления применяется следующие
формулы.
V = UE\T
max 2L J Г
И
^/^It-
Сложности практического применения
Идеи, рассмотренные в предыдущем разделе, наталкивают на серьезные
размышления о поведении многих ферментов. Как оказалось, в клетках фер-
менты редко насыщаются субстратом. В обычных условиях значение [S]/KM
обычно находится в диапазоне от 1,0 до 0,01. Если Км значительно больше,
чем [S'], то каталитическая скорость kC3i или к2 значительно меньше идеаль-
ного значения, поскольку субстрат присоединяется только к небольшой части
активных участков. Соотношение kcajKM позволяет оценить субстратное пред-
почтение фермента.
Максимальная скорость каталитической активности ограничена скоростью
диффузии при соединении субстрата и фермента. Некоторые ферменты могут
122 ЧАСТЬ 2 Фундамент биохимии: белки
превышать этот лимит путем образования совокупностей. В таких группах
продукт одного фермента является субстратом для близко связанного фермен-
та. Это позволяет субстрату проникать в группу и проходить от фермента к
ферменту так, если бы он продвигался по конвейерной ленте. (Генри Форд гор-
дился бы таким достижением!)
Еще одна сложность состоит в том, что многим ферментам требуется боль-
ше одного субстрата. Чтобы задействовать множественные субстраты, приме-
няется техника последовательного или двойного замещения. В последователь-
ном замещении весь субстрат должен одновременно связаться с ферментом
перед выходом продукта. В таком замещении порядок, в котором оно происхо-
дит, не играет особой роли. В двойном замещении, или попеременном взаимо-
действии перед полным связыванием субстрата образуется один или больше
продуктов. Механизм двойного замещения временно модифицирует фермент.
И снова математика: графики Лайнувивера-Берка
Давным-давно, до изобретения компьютеров, нахождение Км и Ктах было
весьма нетривиальной задачей. Сегодня, программы по построению соответ-
ствующих кривых позволяют проводить анализ данных и определять целевые
значения очень быстро. Тем не менее в биохимии существует относительно
простой способ аналитического определения значений этих двух констант. Он
заключается в построении графика Лайнувивера-Берка, также известного как
график двойной обратной зависимости. График основан на преобразовании
уравнения Михаэлиса-Ментен до следующего вида.
l = bc_L+J_
у rmax[s] ктах'
Построение графика Лайнувивера-Берка сопряжено с определенными труд-
ностями. Одна из них состоит в том, что в предложенной процедуре умыш-
ленно переоценивается низкая скорость взаимодействия субстрата. По этой
причине небольшие погрешности в измерениях приводят к получению недо-
пустимо больших ошибок на графике. В результате такой график можно при-
менять только для получения общего представления о величинах Км и Ктах.
Современные компьютеры позволяют аппроксимировать данные в гиперболу
с гораздо большей точностью.
Уравнение имеет форму у = тх + Ъ и описывает линейную зависимость.
График обратной величины скорости 1/Кот обратной величины концентрации
субстрата 1/[5] представляется прямой линией, пересекающей ось у в точке
1 /Гтах, а ось х — в точке -1/A*W (рис. 6.10).
График Лайнувивера-Берка — это наиболее популярный графический
способ нахождения значений Км и Ктах. Тем не менее существуют и другие
ГЛАВА 6 Ферментативная кинетика: ускоряемся 123
методы. График Вулфа, показанный на рис. 6.11, строиться на основе такого
уравнения.
Рис. 6.11. График Вулфа
124 ЧАСТЬ 2 Фундамент биохимии: белки
Зависимость [5]/V от [S] также описывается линейным законом. В методе
Иди-Хофсти строиться график (рис. 6.12) для следующего уравнения.
к/м
Рис 6.12. График Иди-Хофсти
Как и в предыдущем случае, зависимость V от K/[S] представляется прямой
линией. (Химики и математики просто обожают прямые линии!)
Ингибирование: подавление ферментов
Ингибиторы — это вещества, которые снижают активность ферментов.
Они делятся на два больших класса: конкурентные ингибиторы, которые кон-
курируют с субстратом, и неконкурентные ингибиторы, которые соответствен-
но с ним не конкурируют. (Звучит как тавтология, но с этим ничего не поде-
лаешь —определения такие, какие есть.) Смешанные ингибиторы обладают
характеристиками как конкурентных, так и неконкурентных ингибиторов. (Не-
конкурентные ингибиторы очень специфичны и встречаются крайне редко.)
В целом процессы носят обратимый характер, но существуют также необра-
тимые ингибиторы, которые значительно видоизменяют фермент или связь
с ним на постоянной основе. Любое ингибирование служит для регуляции
ферментативной активности. У ингибирования широкая область применения
ГЛАВА 6 Ферментативная кинетика: ускоряемся 125
в медицине. Наиболее примечательными примерами выступают противоэпи-
лептические средства и препараты химиотерапии, наряду с неизменно попу-
лярной виагрой. Многие яды также действуют как ингибиторы.
Конкурентное ингибирование
Конкурентный ингибитор проникает в активное место фермента и таким
образом предупреждает субстрат от входа в реакцию. Такая помеха приводит к
снижению числа формирующихся фермент-субстратных комплексов, а значит
уменьшает скорость катализа. В большинстве случаев часть ингибитора ими-
тирует участок субстрата. Увеличение концентрации субстрата перекрывает
это ингибирование, из-за чего увеличивается вероятность того, что в активное
место проникнут молекулы субстрата, а не молекулы ингибитора.
Неконкурентное ингибирование
Неконкурентные ингибиторы не проникают в активные центры, но вместо
этого связывают некоторые другие участки фермента. Такие вещества обыч-
но не имитируют субстрат. Этот вид ингибирования понижает число оборотов
фермента. В отличие от конкурентного ингибирования увеличение субстрата
не приводит к подавлению неконкурентного ингибирования. У этого вида ин-
гибирования имеется множество форм и не существует простой описательной
модели.
График ингибирования
Для изучения ферментного ингибирования строятся графики Лайнувивера-
Берка. На рис. 6.13 и 6.14 показано, как изменяется график в случае добав-
ления неконкурентного и конкурентного фермента. По графику ферментного
ингибирования можно легко определить его класс. В неконкурентном фер-
ментном ингибировании значение Км остается неизменным. В случае конку-
рентного ингибирования постоянной оказывается величина Ктах.
Регуляция ферментов
В общем случае нерегулированное увеличение концентрации субстрата
приводит к повышению скорости реакции. Наряду с этим увеличение концен-
трации продукта вызывает обратный эффект. Регуляция продукта выступает
способом контроля реакции по принципу обратной связи. Тщательное регули-
рование активности ферментов оказывается востребованным во многих случа-
ях. Такое регулирование осуществляется четырьмя способами.
126 ЧАСТЬ 2 Фундамент биохимии: белки
Неконкурентное ингибирование
1/И
Рис. 6.13. ГрафикЛайнувивера-Берка, иллюстрирующий неконкурентное
ингибирование
Рис. 6.14. ГрафикЛайнувивера-Берка, иллюстрирующий конкурентное
ингибирование
ГЛАВА 6 Ферментативная кинетика: ускоряемся 127
» Аллостерический контроль. У аллостерически контролируемого
фермента есть регуляторное место. Когда небольшая молекула,
которая называется регулятором, связывается с этим местом, она
вызывает конформационное изменение в ферменте, приводя его в
активную форму.
» Многочисленные ферментные формы. Некоторые ферменты
можно представить в нескольких формах, известных как изомеры
или изоферменты. Все они имеют несколько отличную структуру,
что обуславливает различия в значениях Км и Утах, а потому и общей
активности.
» Ковалентная модификация. В этой форме регуляции ферментная
активность изменяется в результате присоединения группы, часто
фосфорильной. Процесс характеризуется потенциально обратимой
формой контроля. В нем активация катализируется протеинкиназа-
ми, а дезактивация выполняется с участием других ферментов.
» Протеолитическая активация. В таком виде регуляции неактив-
ная форма фермента — профермент или зимоген — проходит не-
обратимое превращение для перехода в активную форму, часто в
результате гидролиза одной или нескольких пептидных связей.
ГДЕ ЖЕ ПРИБЫЛЬ: ДЕНЬГИ ИЗ ФЕРМЕНТОВ
Внедрение ферментов в промышленность началось с производства продуктов
питания, вина и пива. (В эти отрасли промышленности во все время инвестиро-
вались огромные средства.) Ученые, такие как Луи Пастер, стали первопроход-
цами технологий, находящих применение в производстве пищевых продуктов
по сегодняшний день.
Наиболее востребованными в пищевой промышленности оказались иммоби-
лизованные ферменты, которые ковалентно связываются с нерастворимой
основой, такой как целлюлоза или стеклянные бусы. Иммобилизация фермен-
та приводит к его стабилизации и увеличивает срок действия. Ниже описаны
только некоторые промышленно важные ферменты.
Карбогидразы
Амилазы. Применяются как пищевая добавка при приготовлении пищи.
Амилоглюкозидаза. Преобразует крахмал в декстрозу.
Целлюлаза и гемицеллюлаза. используется для преобразования древесной
муки в сахар и в производстве жидких концентратов кофе.
Глюкоизомераза. Используется при производстве фруктозы из кукурузного
крахмала.
128 ЧАСТЬ 2 Фундамент биохимии: белки
Глюкозооксидаза. Удаляет глюкозу из яичного порошка.
Инвертаза. Стабилизирует сахара в конфетах с мягкой начинкой.
Лактаза. Препятствует кристаллизации лактозы в мороженом.
Пектиназа. Очищает вино и фруктовый сок.
Каталаза
Удаляет Н2О2 при "холодной пастеризации" молока.
Протеазы
Алкалаза. Добавляется в моющие средства для удаления пятен белковой при-
роды.
Бромелин. Смягчает структуру мяса.
Фицин, стрептодорназа и трипсин. Применяются при обработке ран.
Липаза. Способствует выделению сырного аромата
Липоксигеназа. Отбеливает хлеб
Папаин. Смягчает мясо и стабилизирует пиво.
Пепсин. Применяется как пищевая добавка в готовой пище.
Реннин. Применяется в производстве сыров.
ГЛАВА 6 Ферментативная кинетика: ускоряемся 129
Углев<ды, жиры
iJHI в&
К? fe. ^.. ЙЙ1^к
ну
кислот и другие
* <?ЙжЬ, .Яг -
- Д
пения
овые
...ж
В ЭТОЙ ЧАСТИ...
Переходим к изучению сложных биохимических веществ.
Начнем с углеводов и продолжим менее благозвучными для
человеческого уха липидами и стероидами. Следующие на
очереди — полинуклеотиды, а также удивительные соеди-
нения, заключенные внутри каждой клетки человеческого
организма, — генетический код жизни с яркими звездами:
ДНК и РНК. Закончим материал части повествованием о ви-
таминах и гормонах.
Глава 7
Очень вкусно:
углеводы
В ЭТОЙ ГЛАВЕ...
» Худеем на углеводах
» Жизнь слаще с моносахарами
» Усложняемся до олигосахаридов
» Детально об альдозных сахарах
Согласитесь, углеводы нравятся всем. От простых сахаров до сложных
углеводов — день, прожитый без углеводов, превращается в пытку.
Углеводы вездесущи. В пересчете на массу углеводы являются самыми
распространенными биохимическими соединениями.
Углеводы — это продукт фотосинтеза, в процессе которого неорганиче-
ская двуокись углерода с помощью солнечной энергии превращается в орга-
нический углерод с выделением кислорода. Превращение солнечной энергии
в химическую энергию сопровождается производством углеводов, которые
выступают первичным энергетическим ресурсом в обменных процессах. Угле-
воды важны не только как источник энергии, но также являются исходным ма-
териалом в синтезе других биохимических соединений. Они применяются в
качестве структурных элементов и являются незаменимым компонентом поли-
нуклеотидных кислот.
ЗАПОМНИ!
Изначально углевод, исходя из общей формулы СлН2иОл или
Сл(Н2О)л, назывался гидроокисью углерода. Тем не менее некото-
рые вещества, описываемые такой общей формулой, углеводами
не являются, а некоторые углеводы имеют другую общую форму-
лу. Определение углеводов как полигидроксиальдегидов и полиги-
дроксикетонов с производными, хотя и более точное, но не намно-
го убедительней и к тому же сложное для произношения.
Природные углеводы подразделяются на моносахариды или простые сахара,
содержащие от трех до девяти атомов углерода, и промежуточный класс олиго-
сахаридов, в состав которых входит от двух до десяти моносахаридных еди-
ниц. С экономической и биологической точек зрения самыми важными олиго-
сахаридами для человека являются дисахариды. Подробно с обоими классами
углеводов вы познакомитесь далее.
Свойства углеводов
В этом разделе описаны только отдельные физические свойства углеводов
и некоторые их химические свойства.
41 В целом, названия большинства углеводов включают суффикс -оза.
РЛ Например, альдоза — моносахарид с карбонильной группой, пред-
ставленной альдегидом. При этом у кетозы карбонильной группой
ЗАПОМНИ! т-г
является кетон. При именовании органических соединении химики
часто указывают число атомов углерода в них. Например, пентоза
включает пять атомов углерода, а гексоза содержит шесть атомов
углерода. Указанные соединения представляют большой интерес
ввиду природного происхождения и участия во многих биохимиче-
ских реакциях. Кроме того в природе встречаются такие углероды,
как триоза, тетроза и т.д. В результате комбинирования этих об-
щих названий можно получить более информативные термины, в
частности альдогексоза и кетопентоза.
Хиральные углероды
Хиральными считаются углероды, к которым присоединяется четыре раз-
ных группы, атома и/или группы атомов. Большинство углеводов содержат
один или больше хиральных углеродов. По этой причине они оптически ак-
тивные'. поворачивают поляризованный свет в разных направлениях и часто
по-разному активны в биологических системах. Проекции Фишера играю
важную роль в обозначении асимметричности структур, образуемых вокруг
каждого из хиральных атомов углерода. (Детально проекция Фишера, пока-
занная на рис. 7.1, описана в главе 3.) В проекции Фишера вертикальные связи
134 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
удаляются за проекционную плоскость, а горизонтальные связи выступают
перед этой плоскостью. Вокруг хирального центра изображаются две группы.
В таком представлении они называются энантомероми, являясь несовпадаю-
щими при наложении зеркальными отражениями, как левая и правая перчатки.
Энантомеры состоят из D/L-пары, где D-форма поворачивает поляризованный
свет вправо, а L-форма — поворачивает его влево.
или
Рис. 7. /. Взаимосвязь трехмерных структур, образованных вокруг
хирального центра, и проекция Фишера
СОВЕТ
Проекции Фишера применяются не только для изображения хираль-
ных углеродов, но и для определения энантомерных форм, присут-
ствующих в соединении. Чтобы определить являются две проекции
энантомерами или выступают двумя изображениями одной и той же
молекулы, нужно сравнить два рисунка. Поверните одну из проек-
ций на 180° вокруг оси, перпендикулярной плоскости бумажного
листа (иными словами, поверните лист бумаги, лежащий на столе).
Если после такого поворота схемы изображений остаются идентич-
ными, то перед вами два изображения одной молекулы. Если изо-
бражения не совпадают, то на них представлены энантомеры.
Множественные хиральные центры
Поскольку у многих углеводов больше одного хирального центра (больше
одного хирального углерода), в них может присутствовать больше двух сте-
реоизомеров. Число стереоизомеров равно 2я, где п — это число хиральных
углеродов. Например, если у соединения два хиральных углерода, то у него
также имеется четыре стереоизомера или две пары энантомеров. И хотя груп-
пы одной пары называются энантомерами, группы разных пар по отношению
друг к другу будут диастереомерам.
Структура типичного моносахарида, D-глюкозы, показана на рис. 7.2. В ней
(в проекции Фишера) все атомы углерода, за исключением одного вверху и од-
ного внизу, являются хиральными. Это стандартный способ представления мо-
носахаридов. Атомы углерода изображаются в виде вертикальной цепи с кар-
бонильным углеродом как можно ближе к верхней части (у альдозы он самый
ГЛАВА 7 Очень вкусно: углеводы 135
верхний). Нумерация атомов углерода начинается с верхней части, на что ука-
зывает верхний углерод, обозначенный Сг В рассматриваемом случае самый
большой номер, назначаемый хиральному углероду, — 5. Согласно соглаше-
нию, если -ОН отображается у атома углерода справа, то перед вами D-форма
моносахарида; если же слева, то — его L-форма.
Рис. 7.2. Структура D-глюклозы
Хиральный углерод с максимальным
порядковым номером
сн2он
ЗАПОМНИ!
Любое изменение относительной позиции групп, прикрепленных к
любому из хиральных атомов углерода, при построении проекции
Фишера приводит к изображению иного энантомера или диасте-
реомера (в том случае, если результат является не просто другим
способом изображения первоначальной структуры). У глюкозы
с четырьмя хиральными центрами имеется 16 структур. Одна из
них — это D-глюкоза, а другая — ее энантомер, L-глюкоза. Осталь-
ные 14 структур являются диастереомерами, состоящими из 7 пар
энантомеров. Каждая из этих пар состоит из разных моносахаридов.
В случае с глюкозой они представлены аллозой, алыпрозой, глюко-
зой, маннозой, гулозой, идозой, галактозой и талозой, как показано
на рис. 7.3. Различные D-кетогексозы изображены на рис. 7.4.
Сладкое на закуску: моносахариды
Моносахариды или простые сахара — это важный класс биохимических
соединений. Например глюкоза, один из самых распространенных моноса-
харидов, выступает первичным источником энергии в организме. Почти все
13б ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
моносахариды сладкие на вкус. Относительно большое количество гидрок-
сильных групп и полярных карбонильных групп указывает на то, что боль-
шинство этих соединений водорастворимые. И как отмечалось ранее, почти
все они оптически активные. В следующем разделе мы поговорим о структуре,
свойствах и производных моносахаридов.
СНО сно сно сно
н—с —он НО—с —Н Н—с —ОН НО—с —Н
н—с—он Н—с—ОН НО —с —Н но—с —н
н—с—он Н—с —ОН Н—с —ОН Н—с —он
н—с —он Н—с —он Н—с —ОН Н — с—он
сн2он сн2он сн2он сн2он
Ь-аллоза D-альтроза D-глюкоза D-манноза
сно сно сно сно
Н—с —°Н НО—с —н н—с —он но—с —Н
Н—с —ОН н—с —он НО—j —н но—с —Н
но—с —Н НО—с —н но—с —Н но—с —Н
Н — с —ОН н—j —он н—j —он Н — с —ОН
сн2он сн2он сн2он сн2он
D-гулоза D-идоза D-галактоза D-талоза
Рис. 7.3. Структуры D-альдогексоз
ГЛАВА 7 Очень вкусно: углеводы 137
сн,он
сн2он
снрн
СН2ОН
С : = 0 о =с С =0 о =с
н—с : —он НО с : —н Н—с —он но ( : —н
Н—( :—он Н—( ; ОН НО с : —н но с г —н
н—( : —он Н—с : —он Н—( : —он н с : —он
( D-nci :н2он 1коза ( О-фр> зн,он 'ктоза СН2ОН D-сорбоза ( D-таг ЗН2ОН атоза
Рис. 7.14. Структуры D-кетогексоз
Самые устойчивые формы моносахаридов:
пираноза и фураноза
Один из самых важных моносахаридов — это D-глюкоза (одна из форм
D-глюкозы, показанных на рис. 7.2). D-глюкоза играет очень важную роль,
выступая строительным блоком для других углеводов. Структурно она пред-
ставлена двумя кольцевыми формами, характеризующимися небольшими от-
личиями. Кольцевая форма обусловлена внутренней реакцией циклизации, в
процессе которой две группы одной и той же молекулы соединяются, обра-
зуя кольцо. (Кольцо только выглядит как плоская структура; в реальности она
объемная.) Циклизация заключается во взаимодействии карбонильных групп
с хиральным углеродом с наибольшим номером, в результате которой обра-
зуется одна из следующих структур: полуацеталь, ацеталь, гемикеталь или
кеталь. В случае D-глюкозы кольцевидная структура имеет пиранозную фор-
му (рис. 7.5). Кольцевые формы моносахаридов лучше изображать с помощью
проекционных формул Хеуорса, так как проекции Фишера могут выглядеть
слишком громоздкими ввиду высокой сложности кольцевой структуры.
Рис. 7.5. Кольцевая
форма пиранозы
138 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
У пиранозной структуры D-глюкозы (рис. 7.6) и других моносахаридов воз-
можны два варианта структуры. Чтобы понять почему, изучим проекции Фи-
шера для D-глюкозы.
» Структура 1. Гидроксильная группа углерода (крайнего правого
атома) размещается сверху.
» Структура 2. Гидроксильная группа соответствующего углерода на-
ходится внизу.
Рис. 7.6. Проекции Хеуорса пиранозной структуры D-глюкозы
Если “свернуть” карбонильную группу вокруг, а затем допустить реакцию
с хиральным углеродом с наибольшим номером, то снова можно получить два
варианта структур — с загибом вправо или влево. Эти формы, называемые
аномерами, обозначаются в химии сахаров символами аир.
Карбонильный углерод Cj в данном случае является аномерным углеродом
и размещается справа на проекции Хеуорса. По взаимному расположению кон-
цов -Н и -ОН аномерного углерода можно определить форму моносахарида.
Гидроксильная группа внизу указывает на a-форму, а гидроксильная группа
вверху обозначает P-форму. (Если изображение кольцевой структуры перевер-
нуть, то можно получить структуру с обратным расположением групп отно-
сительно аномерного углерода.) В растворе каждый из аномеров находится в
равновесии с открытой формой, представленной проекцией Фишера. Таким
образом поддерживается взаимный переход между а- и P-формами, называе-
мый мутаротацией.
ГЛАВА 7 Очень вкусно: углеводы 139
Существует возможность получения пятичленного кольца, называемого фу-
ранозным. Упрощенная фуранозная структура показана на рис. 7.7. Рибоза —
это пример моносахарида, который может образовывать фуранозное кольцо.
Рис. 7.7. Фуранозное
кольцо
ЗАПОМНИ!
Пиранозная и фуранозная формы являются термодинамически ста-
бильными структурами моносахаридов. В общем случае в равнове-
сии кольцевых и открытых форм менее 10% молекул приходится на
открытые формы. Фруктоза — это кетоза, которая может образовы-
вать фуранозное кольцо. Формы D-фруктозы обозначены на рис. 7.8.
сн2он
I
с=о
I
но—с----н
I
н—с----он
I
н—с —он
I
СН2ОН
a-D-фруктоза
Рис. 7.8. Две формы D-фруктозы
D-фруктоза
Химические свойства моносахаридов
Реакция моносахаридов с метанолом, СН3ОН, в присутствии соляной кис-
лоты, НС1, вызывает замещение атома водорода гидроксильной группы С\ ме-
тильной группой, что приводит к образованию гликозидной связи. (Частью гли-
козидной связи также может быть азот.) После образования гликозида кольцо
“замыкается”, чтобы больше не открыться — мутаротация становится невоз-
можной. Первоначально редуцированный сахар больше не является таковым.
Многие альдозы ввиду наличия альдегидной группы являются ре-
дуцированными сахарами, то есть выступают восстановителями
в определенных реакциях окисления-восстановления. В много-
НА ПРАКТИКЕ
140 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
численных исследованиях по восстановлению сахаров применяют
реактив Фелинга или Бенедикта. Такие тесты проводятся для опреде-
ления содержания глюкозы в моче у больных диабетом (см. глава 3).
Производные моносахаридов
Разнообразные производные моносахаридов образуются в результате изме-
нения одной или большего количества функциональных групп. Давайте иссле-
дуем некоторые из таких производных, используя в качестве базового моно-
сахарида D-рибозу. Структуры двух форм D-рибозы представлены на рис. 7.9.
сн2он он
I н н I
с----С
н j | н
он он
н\
с '
Н---с ОН
I
Н--с —он
Н---с ОН
сн2 он
Рус. 7.9. Два варианта структуры D-рибозы
Восстановление карбонильной группы до спирта приводит к восстановле-
нию сахара (многоатомный спирт). Восстановление D-рибозы вызывает обра-
зование рибитола (рис. 7.10).
н
I
Н-----с ОН
I
Н-----с ОН
I
Н-----с ОН
I
Н-----с ОН
СН2ОН
Рис. 7.10. D-рибитол
ГЛАВА 7 Очень вкусно: углеводы 1Д1
Моносахарид также можно окислить до карбоновой кислоты. Два наиболее
примечательных варианта такой реакции — это окисление альдегида (альдозы)
до альдоновой кислоты и окисление спирта у атома углерода с наибольшим
номером до уроновой кислоты. В случае с D-рибозой возможно образование
D-рибоновой кислоты (рис. 7.11) или D-рибоуроновой кислоты (рис. 7.12).
Н---С----ОН
н—с—он
н—с —он
СН2ОН
Рис. 7.11. D-рибоновая или
альдоновая кислота
Н----с----он
I
Н----с----он
I
Н----с----ОН
I
соон
Рис. 7.12. D-рибоуроновая
или уроновая кислота
Моносахариды, подобно всем спиртам, могут вступать в реакцию с кис-
лотами с образованием сложных эфиров. Биологически важной оказывается
реакция с фосфорной кислотой (с образованием сахарофосфата). В реакцию
может вступать любая из спиртовых групп. На рис. 7.13 приведена структу-
ра D-рибоза-!-фосфата. (1 указывает на присоединение фосфатной группы
к атому Cj).
он он
Рис. 7.13. D-рибоза-1 -фосфат
о
I
Р—он
I
он
Наиболее распространенные моносахариды
Глюкоза, сахар крови, известна под названием декстроза. Ее аномерный
углерод — это часть полуацеталя, а пиранозная структура называется глюко-
пиранозой.
ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
НА ПРАКТИКЕ
При проведении общего анализа крови обычно определяют содер-
жимое глюкозы в ней. Уровень глюкозы в крови регулируется гор-
моном инсулином, который вырабатывается поджелудочной желе-
зой. У здорового человека уровень глюкозы в крови незначительно
повышается после приема пиши. Чтобы предотвратить чрезмерное
повышение уровня глюкозы в крови, поджелудочная железа начина-
ет высвобождать инсулин. Натощак у здорового человека определя-
ется от 70 до 99 миллиграммов глюкозы на децилитр (100 см3) кро-
ви, и от 70 до 145 миллиграммов глюкозы на децилитр крови через
два часа после приема пищи. Американская диабетическая ассоциа-
ция рассматривает уровень глюкозы крови, равный 126 миллиграмм
на децилитр (натощак) или 200 миллиграмм на децилитр (через два
часа после приема пищи), как признак диабета — неспособно-
сти поджелудочной железы вырабатывать достаточное количество
инсулина.
Самая простая альдоза — это глицераль (глицеральдегид), а самая простая
кетоза — это дигидроацетон. Структуры этих двух соединений показаны на
рис 7.14.
СН2"ОН
D-глицеральдегид
сн2—он
с=о
I
сн2-он
Дигидроацетон
Рис. 7.14. Глицераль и дигидроацетон
Начало жизни: рибоза и дезоксирибоза
Моносахариды D-рибоза и D-дезоксирибоза являются важными составля-
ющими полинуклеотидных кислот. Они присутствуют в этих сложных мо-
лекулах в форме фуранозного кольца. Вдобавок к этому они представлены
0-аномерами. Разница между двумя моносахаридами в том, что у дезоксирибо-
зы на один атом кислорода меньше (отсюда и приставка дезокси). Атом кисло-
рода отсутствует у атома С2. Структура обоих сахаров изображена на рис. 7.15.
ГЛАВА 7 Очень вкусно: углеводы 143
СН2ОН
|н
1 , --0
I'1
11~
Н I
он
он
Рибоза Дезоксирибоза
Рис. 7.15. Стрелками показано расположение спиртовых
групп, обеспечивающих образование [5-аномеров
Сахара объединяются: олигосахариды
Присоединение двух или большего количества моносахаридов приводит к
образованию олигосахаридов, включающих от двух до десяти моносахаридов,
или полисахарида — полимера из множества моносахаридных единиц. Вме-
сте моносахариды удерживают гликозидные связи — одна или большее коли-
чество. Самыми простыми и распространенными олигосахаридами являются
дисахариды.
Все просто: дисахариды
Дисахариды — это олигосахариды, состоящие из двух моносахаридных
единиц. Хорошо известный дисахарид (и, безусловно, самый вкусный) — это
сахароза, которую вы знаете как столовый или тростниковый сахар. Каждая
молекула такого сахара представляет собой комбинацию, состоящую из мо-
лекулы глюкозы и молекулы фруктозы. Существуют и другие важные для
биохимии дисахариды. Среди них мальтоза (солодовый сахар) и целлобио-
за — в каждом из них по две молекулы глюкозы. Чтобы проиллюстрировать
характерные черты дисахаридов и частично других олиго- и полисахаридов,
рассмотрим мальтозу, имеющую предельно простую структуру, которая пока-
зана на рис. 7.16.
Атом кислорода, соединяющий два глюкозных кольца молекулы мальтозы
на рис. 7.16, представляет гликозидную связь — а (1-4)-связь. Греческая буква
а обозначает аномерическую форму кольцевой структуры слева. Если вместо
нее использовать P-D-глюкозу, то будет получена целлобиоза (рис. 7.17). Циф-
ровой диапазон 1^4- указывает на то, что атом Cj левого кольца связывается с
атомом С4 правого кольца. Потеря молекулы воды сопровождается образовани-
ем связи, которая замыкает левое кольцо так, что мутаротация становится не-
возможной. Замкнутое кольцо представляет невосстанавливаемый сахар. При
этом для кольца справа мутаротация по-прежнему возможна.
ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
Рис. 7.16. Структура мальтозы, основанная на а (1-4)-связи
СН2ОН
Рис. 7.17. Целлобиоза с Р (1-4)-связью
Сахароза — это дисахарид, подобный мальтозе. Он образуется, когда
D-глюкоза связывается с D-фруктозой посредством а (1-2)-связи. В таком слу-
чае оба кольца замыкаются так, что мутаротация не возникает ни в одном из
них. Образование сахарозы показано на рис. 7.18.
ГЛАВА 7 Очень вкусно: углеводы 1Д5
СН2ОН
н он
a-D-глюкоза
w
СН2ОН
Сахароза
Рис. 7.18. Структура сахарозы, образованной в результате соединения
a-D-глюкозы с fl-D-фруктозой с помощью а (1-2) связи
146 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
Если представить шкалу определения сладкого вкуса и оценить сахарозу в
100 баллов, то уровень сладости глюкозы составит 74 балла, а у фруктозы он
будет равен 173 баллам. Фруктоза из кукурузной патоки — самый сладкий из
обычных сахаров. Это означает, что для подслащивания пищи ее нужно мень-
ше всего. Существуют и другие природные белки со сладким вкусом в сотни
раз слаще сахара.
В коммерческих продуктах применяется всего лишь несколько ис-
кусственных подсластителей. Больше всего известен сахарин (при-
мерно в 500 раз слаще сахарозы), аспартам (в 200 раз слаще саха-
розы) и сукралоза (на этикетках обозначается как низкокалорийный
сахар или искусственный заменитель сахара), которая слаще сахаро-
зы больше, чем в 600 раз. Сукралоза получается в результате заме-
щения трех гидроксильных групп сахарозы хлором.
Крахмал и целлюлоза: полисахариды
Два самых важных полисахарида — это крахмал и целлюлоза. Оба являются
полимерами D-глюкозы. Основное различие между этими двумя полимерами
заключается в связях между глюкозными остатками. Крахмал связан с мальто-
зой, а целлюлоза — с целлобиозой.
Хлеб, макароны и картофель: крахмал везде
Из всех углеводов крахмал является выбором многих гурманов. (Чего толь-
ко стоят картофель и макароны!) Разные виды этих чудесных, вкусных поли-
сахаридов очень плотно упакованы связями, образуемыми между их мономер-
ными остатками. Крахмал — это полимер a-D-глюкозы. К обычным его ви-
дам относится амилоза, амилопектин и гликоген. Амилоза — это комбинация
а (1-4)-групп глюкозы. У амилопектина, как и у амилозы, есть а (1^4)-глюкоз-
ные связи, но также присутствуют а (1-6)-ветви. Все три позволяют накапли-
вать глюкозу в организме и окрашиваются в насыщенный темно-синий цвет
в присутствии ионов йода (простой и полезный тест).
Счастье каждого термита: целлюлоза
Вы когда-нибудь задавались вопросом, почему можно съесть картофель,
но нельзя дерево? Целлюлоза очень похожа на крахмал, за исключением
Р (1^)-глюкозных связей (показаны на рис. 7.16 и 7.17). Природное примене-
ние целлюлозы вызвано ее структурой. Расщепление связей возможно только
под воздействием ферментов, которые производят определенные виды бакте-
рий и грибов. По этой причине только определенные виды животных, такие
как термиты или крупные жвачные, например коровы (“разводят” необходимые
ГЛАВА 7 Очень вкусно: углеводы 1Д7
бактерии в своем пищеварительном тракте), могут переваривать и усваивать
целлюлозу, извлекая из нее энергию. Целлюлоза — это одно из самых распро-
страненных биохимических соединений на планете.
Соединительная ткань: кислые полисахариды
Больше всего полисахаридов организму нужно для формирования соедини-
тельной ткани — соединений, которые удерживают части организма вместе.
К ней относятся сухожилия, связки и коллаген (да-да, тот самый, инъекция-
ми которого увеличивают губы). Кислые полисахариды играют важную роль
в структуре и функциях соединительной ткани. Повторяющиеся остатки этих
производных полисахаридов — это дисахариды. Одним из компонентов дис-
ахарида выступает аминосахар (в котором аминогруппа замещает спиртовую
группу). У одной или большего количества составляющих дисахаридного
остатка есть отрицательно заряженная группа (как сульфатная, так и карбок-
сильная). Примерами являются гиалуроновая кислота и гепарин. Повторяющи-
еся структуры этих двух веществ изображены на рис. 7.19.
Гиалуроновая кислота
Гепарин
Рис. 7.19. Повторяющиеся дисахариды в структурах гиалуроновой
кислоты и гепарина
1Д8 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
Гепарин применяется для лечения и предупреждения образования
тромбов, особенно в легких и ногах. Обычно его используют после
диализа, перед оперативными вмешательствами или если пациент
не может двигаться в течение продолжительного времени. Он дей-
ствует как антикоагулянт, связываясь с одним из белков, которые
препятствуют свертыванию крови, до тысячи раз повышая его эф-
фективность.
Гликопротеины
Большинство белков, появляющихся в сыворотке крови, относятся к гли-
копротеинам — белкам с прикрепленными к ним углеводами. Наличие угле-
водов способствует увеличению гидрофильных свойств белков. В целом свя-
зывание происходит путем присоединения к остаткам аспарагина, серина или
терионина. Некоторые растворимые и мембранные белки являются гликопро-
теинами (в частности гормональные белки и мембранные рецепторы). Мы еще
неоднократно вернемся к изучению гликопротеина в последующих главах.
Альдозное семейство сахаров
В материале книги многократно упоминаются два очень важных альдоз-
ных сахара: глюкоза и рибоза. Наряду с ними существует огромное количество
других альдозных сахаров. Важной подгруппой таких сахаров является D-ce-
мейство. Самый простой альдозный сахар такого семейства — это триозогли-
церальдегид (3 атома углерода). Также встречаются соединения с двумя тетро-
зами (4 атома углерода), четырьмя пентозами (5 атомов углерода) и восемью
гексозами (6 атомов углерода).
На рис. 7.20 продемонстрированы структуры всех соединений из семейства
D-альдозы. У каждого из этих альдозных сахаров есть энантомер. Зеркальное
отражение каждой альдозы представлено L-энантомером. Впрочем, L-энанто-
меры не являются биологически важными.
Изображения на рис. 7.20 являются проекциями Фишера. В верхней ча-
сти каждой проекции нарисована окружность. Эта окружность, или “голова”,
представляет альдегидную группу, присутствующую во всех альдозах. Аль-
дегидный углерод обозначен номером 1, а остальные атомы углерода нуме-
руются в направлении от него. Последний атом углерода, в самом основании,
относится к группе -СН2ОН. Ни верхний, ни нижний атомы углерода не яв-
ляются хиральными, хотя все промежуточные атомы имеют хиральную при-
роду. К каждому промежуточному атому углерода прикрепляется группа -Н
или -ОН. Короткий штрих вправо или влево обозначает -ОН группу. У всех
ГЛАВА 7 Очень вкусно: углеводы 1Д9
D-альдозных сахаров группа -ОН на хиральном углероде с максимально
большим номером (следующим от последнего в цепи) изображается справа.
У L-альдозных сахаров такая группа -ОН будет размещаться слева. Название
каждой альдозы указано под ее схематическим изображением.
Треоза
Глицеральдегид
Эритроза
Рис. 7.20. Схематическое представление членов D-семейства альдозы
Для простого запоминания названий представителей D-семейства альдозы
существует несколько способов. Во всех случаях последний хиральный угле-
род относится к форме D (группа -ОН справа). У каждой структуры, занимаю-
щей крайнюю правую позицию, все группы -ОН “смотрят” вправо. В соседних
к ним структурах слева, начиная с верхней и заканчивая предпоследним хи-
ральным углеродом (всегда “смотрит” вправо), поворачивается по одной груп-
пе -ОН влево. На рис. 7.21 приведен пример шаблона для последнего ряда с
рис. 7.20. Общий шаблон для рис. 7.20 показан на рис. 7.22.
А
G г
G
G
А
м
Рис. 7.21. Относительное расположение -ОН-групп в нижнем ряду рис. 7.20.
Знаком (+) обозначены позиции справа, а знаком (-) —позиции слева
150 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
G
T E
L X A R
TGI G M G A A
Puc. 7.22. Общий шаблон для рис. 7.20
Подробно о том, как получить нижний ряд обозначений на рис. 7.20.
1 ф Начните с восьмой проекции Фишера (к верхнему углероду присоедине-
на группа -СНО, а к нижнему — группа -СН2ОН).
2. У атома С5 (размещен над-СН2ОН) группа -ОН "смотрит" вправо.
У атома С4 первые четыре группы -ОН "смотрят" влево, а следующие че-
тыре — вправо.
4. У атома С3 две группы -ОН развернуты влево, две вправо, две влево
и две вправо.
5. У атома С2 направленность -ОН-групп попеременно чередуется.
Если ничего не получилось, обратитесь к профильным специалистам!
ГЛАВА 7 Очень вкусно: углеводы 151
Глава 8
Липиды и мембраны
В ЭТОЙ ГЛАВЕ...
» Жизнь с липидами
» Знакомство с триглицеридами
» Немного о мембранах
» Назначение стероидов и других липидов
В сегодняшнем мире у липидов, как и у холестерина, сложилась плохая
репутация, и это несмотря на то, что они играют незаменимую роль в
обменных процессах организма. К липидам относятся разные группы
биологически важных веществ, которые отличаются растворимостью. Эти ве-
щества входят в группу нерастворимых (частично растворимых) в воде соеди-
нений, которые хорошо растворяются в неполярных растворителях или раство-
рителях с низкой полярностью. Липиды имеют неполярную природу, посколь-
ку большая часть их молекул заполнена только углеродом или водородом. Если
бы в их структуре присутствовало значительное количество атомов кислорода
или азота, то вещество стало бы полярным, а потому растворимым в воде.
Вездесущие липиды: обзор
Липиды выступают важным компонентом многих биологических структур:
высокоемких источников энергии, мембран и молекулярных сигнальных си-
стем. На рис. 8.1 приведена диаграмма, на которой изображены взаимоотно-
шения между различными видами липидов. Арахидоновая кислота — жирная
кислота — включена в ней дважды: как предшественник (вещество, приводя-
щее к образованию) лейкотриенов и простагландинов и еще раз — в составе
группы жирных кислот (не показана). Повторное упоминание арахидоновой
кислоты не случайно — у нее сразу несколько ролей в каждой категории (см.
раздел “Простагландины, тромбоксаны и лейкотриены: зачистка”).
Рис. 8.1. Взаимосвязи между разными видами липидов
Поведение липидов
ЗАПОМНИ!
В организме человека липиды служат аккумуляторами энергии, вы-
ступают структурными компонентами (материал клеточной мембра-
ны) и регулируют его функции. Действие многих липидов основано
на тех же принципах, что мыла и других моющих средств. Как у
мыла, у липидов есть неполярная область, обычно представленная
жирной кислотой, и полярная область. Представление о структуре
мыла можно получить, изучив рис. 8.2.
Жирная кислота (неполярная)
О
О Na'
Полярный участок
Рис. 8.2. Структурное изображение мыла
154 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
В воде мыло образует мицеллу (см. глава 2), в которой неполярные части
разных молекул объединяются, собираясь в центре образования, а полярные
части выставляются наружу — к воде. Если в растворе присутствуют иные не-
полярные вещества, подобные жирам на грязной посуде, то они всячески ста-
раются присоединиться к внутренней части мицеллы. С полярной наружной
“шапкой” мицелла выглядит скорее как одна огромная полярная молекула, а не
многочисленное объединение молекул меньшего размера с полярными и непо-
лярными участками. (Теперь вы знаете, как химия помогает в мытье посуды.)
Причина того, что мыло удаляет слой жира с кожи рук или одежды
заключается в двойной природе растворимости мыла. Жир или мас-
ло тоже неполярны, а потому нерастворимы в воде. Мыло включает
НА ПРАКТИКЕ
мицеллы, заключающие жир или другие загрязнения в своих непо-
лярных областях. Полярные концы мицелл растворяются в воде, по-
зволяя смывать жир и масло во время ополаскивания.
Несмотря на существование большого количества видов липидов, в этой
главе мы уделим внимание только четырем из них.
» Жирные кислоты и их производные (сложные эфиры). Жиры,
масла и воски.
» Сложные липиды. Фосфоглицерин и сфинголипиды.
» Стероиды. Арахидоновая кислота и ее производные: простаглан-
дины, тромбоксаны и лейкотриены.
» Арахидоновая кислота и ее производные. Простагландины,
тромбоксаны и лейкотриены.
Жирные кислоты в липидах
Липиды важны не только как отдельные структуры, но и как биохимиче-
ские компоненты, взаимодействующие с другими липидами и нелипидами при
образовании двойных молекулярных слоев и клеточных мембран. Такие взаи-
модействия возникают как на границе клетки, так и вокруг некоторых ее вну-
тренних структур. Химические и физические свойства липидов в наибольшей
степени определяются участками с жирными кислотами. Все жирные кислоты
природного происхождения имеют несколько общих черт.
» Прямую цепь и обычно 10-20 атомов углерода.
» Четное число атомов углерода.
» При наличии двойной углерод-углеродной связи представлены
только цис-изомером.
В табл. 8.1 приведен список самых распространенных жирных кислот.
ГЛАВА 8 Липиды и мембраны 155
Таблица 8.1. Распространенные жирные кислоты
Химическое название Структурная формула
Лауриновая кислота СН3(СН2)10СООН
Миристиновая кислота СН3(СН2)12С00Н
Пальмитиновая кислота СН3(СН2)14С00Н
Пальмитинолеиновая кислота СН3(СН2)5СН=СН(СН2)7С00Н
Стеариновая кислота СН3(СН2)16С00Н
Олеиновая кислота СН3(СН2)7СН=СН(СН2)7С00Н
Линолевая кислота СН3(СН2)3(СН2СН=СН)2(СН2)7С00Н
Линоленовая кислота СН3(СН2СН=СН)3(СН2)7С00Н
Арахидоновая кислота СН3(СН2)4(СН=СНСН2)4(СН2)2С00Н
НА ПРАКТИКЕ
Воск представляет собой простой эфир жирной кислоты и длинно-
цепочечного спирта. Обычно жирная кислота состоит как минимум
из 10 атомов углерода, в то же время как в спиртовой части находит-
ся 16-39 атомов углерода. В общем случае воск, такой как в ушах,
служит защитным покрытием. В растительном мире воски защища-
ют от вредителей и предотвращают потерю влаги. Мы не будем под-
робно рассматривать воски в этой книге, поскольку они не являются
активными реагентами (наши уши в полной безопасности).
Толстяки в мире липидов: триглицериды
Жиры (и масла) относятся к триглицеридам или триацилглицеринам. Это
значит, что они являются триэфирами жирных кислот с глицерином. Глице-
рин — это трехатомный спирт (рис. 8.3). В жире каждая из спиртовых групп
становится частью эфира, вступая в реакцию с жирной кислотой. В состав триг-
лицерида могут включаться как одинаковые, так и разные жирные кислоты.
сн2-сн—сн2
он он он
Рис. 8.3. Структура
глицерина
156 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
Свойства и структура жиров
Практическое различие между жиром и маслом в том, что при комнатной
температуре жир твердый, а масло — жидкое. При этом жир от масла отлича-
ют два важных структурных фактора: размер жирных кислот и наличие или от-
сутствие двойных связей. В общем случае, чем длиннее цепь жирной кислоты,
тем выше точка плавления. При этом, чем больше число углерод-углеродных
связей, тем ниже точка плавления.
Насыщенные жиры состоят из жирных кислот в отсутствие угле-
род-углеродных двойных связей. У ненасыщенных жирных кислот
есть одна углерод-углеродная двойная связь, а у полиненасыщенной
ЗАПОМНИ)
кислоты таких двойных связей множество.
Известно более 70 жирных кислот природного происхождения. В большин-
стве натуральных жиров двойные связи имеют цис-форму. Наличие двойных
связей придает углеродной цепи “волнистость”, которая предотвращает скла-
дывание цепочек жирных кислот и слипание их друг с другом в условно па-
раллельных цепях. Неспособность цепей ненасыщенных жирных кислот сле-
пливаться вместе препятствует застыванию жира при комнатной температуре.
Помните об этом, когда приобретаете готовую еду. Спустя некоторое время
масло в ней может затвердеть, указывая, что в еде присутствуют более насы-
щенные жиры. (Это не относится к жидкому оливковому маслу, которое счита-
ется чрезвычайно полезным во всех известных смыслах.)
Обогащение ненасыщенных жиров или масел водородом в присут-
ствии катализаторов, таких как никель, ведет к гидрогенизации ча-
сти или всех углерод-углеродных двойных связей, формируя оди-
НА ПРАКТИКЕ гч
парную углерод-углеродную связь. Это превращает ненасыщенные
жиры в насыщенные. В большинстве случаев происходит только
частичная гидрогенизация. Гидрогенизация повышает точку плав-
ления соединения. В этом процессе возможно превращение масла
(жидкая форма) в жир (твердая форма). Неполная гидрогенизация
может изменить некоторые цис-формы в транс-формы, что приве-
дет к образованию трансжиров. (Вы наверняка наслышаны о роли
трансжиров в снижении уровня ЛПВП, “хорошего” холестерина, и
повышении уровня ЛПНП, “вредного” холестерина. Надо же, два
в одном — маркетологи будут счастливы!) Именно в такой способ
растительное масло превращается... в маргарин.
На рис. 8.4 показана структура типичного жира. Заметьте, что две верхние
цепи жирной кислоты (насыщенные) “склеиваются” друг с другом, а нижняя
цепь (ненасыщенная) — нет.
ГЛАВА 8 Липиды и мембраны 157
о
Н || .СН2 /СН, /СН2 /СН2 /СН2 /СН,
| .о—с 'сн2 'сн2 'сн2 'сн2 'сн2
н—о о
I || .СН2 ХСН2 /СН2 ХСН2 ХСН2 ХСН3
н—с—о—с 'сн2 'сн2 'сн2 'сн2 "сн2
I .СН2 /СН2 /СН=СН /СН, /СН3
н—с—о—с 'сн=сн 'сн2 '''сн, "сн2
н о
Рус. 8.4. Структура типичных жиров: верхние цепи насыщенные,
а нижняя цепь — ненасыщенная
Большая стирка: разрушение триглицерида
Обогащение жиров (преимущественно животного происхождения)
с применением сильного базового катализатора (в основном щелочи
или едкого натра) столетиями проводилось для производства мыла.
Бабушка Джона делала мыло из свиного жира с древесной золой, в
которой содержится гидроокись калия и едкий натр. Она вычерпы-
вала образованное мыло из емкости с раствором и прессовала его
в формочки. К сожалению, бабушка плохо соблюдала пропорции,
и чаще всего мыло получалось слишком щелочным. В такой реак-
ции, называемой сапонификацией, гидролиз групп сложных эфиров
в присутствии основания приводит к образованию глицерина и кар-
боксилат-ионов трех жирных кислот. В нашей с вами жизни мыло
представлено натриевой или калиевой солью жирной кислоты. С
другой стороны, кальциевые и магниевые аналоги оказываются не-
растворимыми. Если мыло использовать с жесткой водой, содержа-
щей ионы кальция или магния, то оно будет оседать в виде жирной
пены на стенках ванны.
Кислоты также катализируют гидролиз жиров, что приводит к образованию
глицерина и трех жирных кислот. Кислотный гидролиз обратим, но избыточ-
ная концентрация основания обуславливает подавление реакции, обратной са-
понификации. При переваривании пищи липазы расщепляют триглицериды,
а соли желчных кислот делают часть жирных кислот растворимыми. Липаза
представляет собой фермент, который катализирует распад жиров. Желчные
кислоты — это продукты окисления холестерина, который действует как де-
тергент, делающий продукты распада растворимыми. У людей всасывание по-
лезных веществ происходит в тонком кишечнике.
158 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
Простакам здесь не место: сложные липиды
До настоящего момента мы рассматривали только простые липиды. Однако
некоторые липиды представляют собой очень сложные структуры. (Вы же не
думали, что будет легко?) В общем случае сложные липиды — это сложные
эфиры глицерина или других спиртов. Две большие группы составляют фос-
фоглицериды и сфинголипиды. К фосфоглицеридам относятся плазмалогены
и фосфатидаты, а к сфинголипидам — гликосфинголипиды и сфингофосфоли-
пиды. (Общее деление на подгруппы приведено на рис. 8.1.)
Как фосфоглицериды, так и сфингофосфолипиды относятся к фосфоли-
пидам, которые выступают основным компонентом клеточных мембран. Лю-
бой углевод, содержащий липид, относится к гликолипидам. В классификации
липидов наблюдается дублирование — один и тот же липид может попадать
сразу в несколько категорий. (Как вы могли заметить, в биохимии нет ничего
действительно простого.)
Фосфоглицериды
Здесь спиртом является глицерин, к которому в виде сложных эфиров при-
крепляются две жирные кислоты и фосфорная кислота. Эта базовая структу-
ра является фосфатидатом — важным промежуточным звеном при синтезе
многих фосфоглицеридов. Наличие дополнительной группы, прикрепленной
к фосфату, дает возможность использовать фосфоглицериды в качестве строи-
тельных блоков самых разнообразных соединений.
По соглашению эти соединения изображаются в виде структуры из трех
вертикально расположенных атомов углерода глицерина, в которой к треть-
ему (от основания) атому углерода прикреплен фосфат. Фосфоглицериды, в
частности плазмагены и фосфотидаты, встречаются в мембранах почти любых
растительных и животных клеток. Они также известны под названием глице-
рофосфолипиды.
Плазмагены
Плазмагены — это один из видов фосфоглицеридов. У первого углерода
глицерина есть углеводородная цепь, прикрепленная с помощью простой, а не
сложной, эфирной связи. Простые эфирные связи оказываются более устой-
чивыми к химическим воздействиям, чем сложные. Ко второму (центрально-
му) атому углерода с помощью сложного эфира присоединена жирная кислота.
Третий атом углерода чаще всего связывается с этаноламином или холином с
помощью фосфатного эфира. Эти соединения являются ключевыми компонен-
тами мембран мышечных и нервных клеток.
ГЛАВА 8 Липиды и мембраны 159
Фосфатидаты
Фосфатидаты — это липиды, в которых первые два атома углерода глице-
рина представлены сложными эфирами жирной кислоты, а третий — простым
эфиром. Фосфат служит связью с другим спиртом, обычно этаноламином, хо-
лином, серином или углеводом. Соединение спирта определяет вид фосфатида-
та. У фосфата отрицательный заряд, и в случае холина или серина к нему при-
соединен положительный четвертичный ион аммония. (В состав серина также
включена отрицательная карбоксильная группа.) Весь заряд концентрируется
в “голове” соединения, которая включает фосфатный эфир и является гидро-
фобной (водоотталкивающей). Фосфатидаты — это структурные компоненты
липидных бислоев, которые присутствуют во всех клетках организма.
Фосфатидилэтаноламины, фосфатидилхолины и другие фосфолипиды —
это все примеры фосфатидатов. На рис. 8.5 показаны структуры фосфатидилэ-
таноламина и фосфатидилхолина.
сн2-0— Жирная кислота 1
СН—О— Жирная кислота 2
I о
сн2-о. |
р—о—ch2ch2n+h3
О-
сн2-0— Жирная кислота 1
СН—О— Жирная кислота 2
I о
сн2-о. I
Р-------------О----CH2CH2N+(CH3)3
О-
Фосфатидилэтаноламин
Фосфатидилхолин
Рис. 8.5. Примеры общих формул фосфатидилэтаноламина
и фосфатидилхолина
Структуры некоторых спиртов, содержащихся в липидах, приведены на
рис. 8.6.
HO-CH2CH2-N+(CH3)3
сн2-сн—сн2
он он он
Холин Глицерин
HOCH2CH2NH2
НОСН2СН-СООН
I
nh2
Этанолами н
Серин
Рис. 8.6. Спирты, входящие в состав липидов
160 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
Фосфатидилэтаноламины
Фосфатидилэтаноламины — это очень распространенные в растительном
и животном мире фосфоглицериды. У животных они чаще всего представлены
цефалинами, входящими в состав нервной и мозговой тканей. Кроме всего про-
чего они оказывают влияние на свертываемость крови. Как вы знаете, у фосфа-
тов отрицательный заряд, а азот этаноламина представляет четвертичный ион
аммония с положительным зарядом.
Фосфатидилхолины
Фосфатидилхолины — это лецитины. Холином называют спирт, в котором
положительно заряженный ион четвертичного аммония связан с фосфатом,
имеющим отрицательный заряд. Лецитины присутствуют во всех живых ор-
ганизмах. Например очень много лецитинов содержится в яичном желтке, ко-
торый имеет важное коммерческое значение в пищевой промышленности, в
частности выступая эмульгирующим агентом в таких продуктах, как майонез.
В организме человека лецитины входят в состав мозговой и нервной тканей, а
также служат эмульгатором в легких.
Другие фосфолипиды
Существует множество других фосфолипидов, многие из которых являются
гликолипидами. К гликолипидам относятся фосфатидиловые сахара, в которых
спиртовая функциональная группа является частью углеводного соединения.
Фосфатидиловые сахара присутствуют в растениях и в некоторых микроор-
ганизмах. Из-за большого числа гидроксильных групп этот углевод обладает
выраженными гидрофильными качествами.
Сфинголипиды
Сфинголипиды имеются и у растений, и у животных; особенно богаты на
них ткани головного мозга и нервные соединения. У таких липидов глицерин
замещается сфингозином (рис. 8.7). Спиртовая группа в сфингозине может об-
разовывать сложный эфир, как и другие подобные группы в глицерине. Амино-
группа позволяет образовывать амиды. Объединение жирной кислоты и сфин-
гозина с помощью амидной связи приводит к возникновению церамида, высту-
пающего промежуточным веществом при образовании других сфинголипидов.
СН3(СН2) 12-сн=сн—сн—сн—сн2
он nh2 он
Рис. 8.7. Структура сфингозина
ГЛАВА 8 Липиды и мембраны 161
Гликосфинголипиды и цереброзиды
Гликосфинголипид — это важный мембранный липид, в котором один из
углеводов прикреплен к церамиду. В таком соединении углевод выступает по-
лярной (гидрофильной) “головой”. Углевод может быть как моносахаридом,
так и олигосахаридом. По углеводной последовательности олигосахарида ча-
сто определяют порядок объединения соединений в общую структуру в про-
цессе выполнения множества биохимических реакций. Углеводная часть всег-
да находится на внешней части мембраны.
Цереброзид состоит из моносахарида, прикрепленного к церамиду. В роли
углевода может быть как глюкоза, так и галактоза. Цереброзиды присутствуют
в нервных клетках и клетках головного мозга, а в большинстве других живот-
ных клеток наблюдаются очень редко.
Ганглиозиды
Ганглиозиды — это сфинголипиды со сложной структурой. К церамиду
прикрепляется олигосахарид, содержащий от трех до восьми моносахарид-
ных единиц, которые либо замещаются, либо нет. Ганглиозиды очень часто
включаются в состав наружной мембраны нервных клеток, где последователь-
ность расположения сахара крайне важна для правильного опознания веществ
и дальнейшего взаимодействия с ними. Небольшое количество ганглиозидов
содержится в наружных мембранах других клеток. При наличии в мембране
углеводной части, она всегда располагается вне клетки.
Сфингофосфолипиды
Сфингофосфолипиды содержат сфингозин, жирную кислоту, фосфат и хо-
лин. Примером является сфингомиелин — важный составной элемент мие-
линовой оболочки, окружающей аксоны всех нервных клеток. Среди прочих
заболеваний рассеянный склероз чаще всего вызывается повреждением миели-
новой оболочки. Сфингомиелин является самым распространенным из сфинго-
липидов, хотя в мембранах обнаруживается исключительно сфингозин.
Мембраны: биполярные и бислойные
Одно из назначений липидов заключается в обустройстве мембран. Мем-
браны разделяют области внутри и снаружи клеток. Типичная мембрана, как
показано на рис. 8.8, представляет собой липидный бислой, или двойной моле-
кулярный лист. Полярная липидная часть, или голова, расположена с внешней
стороны бислоя, в то время как неполярная часть, хвосты, — на внутренней.
Голова обозначена на рисунке кружком, а хвосты — в виде нитей. В качестве
162 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
хвостов обычно выступают длинные цепи жирных кислот. Гидрофильные голо-
вы (упоминаемые ранее в разделе “Фосфатидаты”), зачастую заряженные, взаи-
модействуют с водой, а гидрофобные хвосты обычно отталкивают ее. Ключевым
фактором, определяющим образование липидного бислоя, является взаимодей-
ствие между гидрофобными хвостами. Липидные бислои, как правило, формиру-
ют закрытые структуры или отсеки, предотвращающие обнажение гидрофобных
концов. Мембраны обладают свойством самоуплотнения. В первую очередь
это относится к липидным бислоям. Давайте рассмотрим их более детально.
Рис. 8.8. Упрощенное представление
липидного бислоя
В реальной клетке мембраны не так хорошо и симметрично выровнены,
как показано на рис. 8.8. Асимметрия в структуре возникает вследствие при-
сутствия других компонентов и частично обуславливается разницей между
внутриклеточной и внеклеточной поверхностями. Если участки с жирной кис-
лотой ненасыщенные, то хвосты не формируют параллельные структуры, и
внутри бислоя появляются “дырки”. Именно эти дыры делают мембрану гиб-
кой. Особое значение имеют белки и холестерин, поскольку углеводная часть
гликолипидов находится на внешней стороне бислоя, а не внутри клетки.
У лосося подобное изменение в структуре клеточных мембран на-
блюдается при движении в воде с сильно изменяющейся темпера-
турой. Поскольку рыбы — холоднокровные животные, их тела при-
НА ПРАКТИКЕ <-
способились контролировать уровень холестерина в клетках при
движении в воде с разной температурой, чтобы поддерживать мыш-
цы в гибком, но в то же время упругом состоянии вне зависимости
от условий окружающей среды.
Полярные вещества спокойно проходят через гидрофобные области мем-
бран, а неполярные вещества — останавливаются гидрофильными участками
ее наружных областей. Вследствие маленьких размеров и высокой концентра-
ции молекулы воды пересекают бислой быстрее, чем ионы большинства по-
лярных молекул. В реальных клетках задействуются специальные механизмы,
ГЛАВА 8 Липиды и мембраны 163
чтобы позволить сторонним веществам проходить бислой, но для этого он дол-
жен включать другие компоненты. Эти компоненты, в большинстве своем бел-
ки, определяют выборочную проницаемость мембранам. Остальные функции
и свойства мембраны, например ее упругость, задаются такими специальными
веществами, как холестерин.
В мембранах содержится 20-80% белков: периферических — находящихся
на поверхности мембраны и интегральных — растянутых внутри или прохо-
дящих через мембрану. Интегральные белки хорошо взаимодействуют с гидро-
фобной частью бислоя, как показано на рис. 8.9 и 8.10.
Рис. 8.9. Интегральный белок, который
не проходит через мембрану
Рис. 8.10. Периферический белок, который
проходит через мембрану
Периферические белки обычно связываются с поверхностью электроста-
тическими или водородными связями, хотя здесь возможны и ковалентные
взаимодействия. Белки играются важную роль в большинстве мембранных
процессов. Если белок представлен гликопротеином, то его углеводная часть
находится на внешней стороне мембраны, что важно при межклеточном рас-
познавании веществ.
164 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
Пересечение границы: мембранный транспорт
По своей природе липидный бислой непроницаем для полярных молекул и
ионов (гидрофильные вещества). Тем не менее в клетках предусмотрен меха-
низм его преодоления для получения и вывода наружу гидрофильных веществ.
Для преодоления бислоя применяется сразу два средства: насос — активный
транспорт, расходующий энергию для противодействия градиенту концентра-
ции, и каналы — часть пассивной транспортной системы, обеспечивающей
диффузию за счет изменения градиента концентрации.
Неполярные молекулы являются липофильными и растворимыми в липидах
бислоя. В общем случае липофильные вещества проходят через мембрану, ис-
пользуя механизм диффузии вдоль градиента концентрации. Насос и каналы
задействуются, чтобы перенести через бислой гидрофильные вещества.
Насосы
Для нормальной работы насосам нужна энергия. Она вырабатывается в до-
статочных количествах в процессе гидролиза АТФ. Такой вид насоса называ-
ется АТФазой P-типа. Название происходит от переноса фосфата от АТФ к
промежуточному веществу — первый шаг, выполняемый насосной функцией.
Кроме ионов, наносы переносят и другие вещества.
Внутри большинства животных клеток наблюдается высокая концентрация
калия и низкая концентрация ионов натрия по сравнению с внеклеточным про-
странством. Воспроизведение и поддержание такого градиента требует затрат
энергии. Транспортная система представляет собой Na+/K+ насос, также на-
зываемый Na*IК* АТФазой. Гидролиз АТФ обеспечивает энергией транспорт
ионов калия внутрь клетки и ионов натрия из клетки. Оба вида ионов, калия и
натрия, связываются с насосом одновременно. Насос сразу транспортирует три
иона натрия из клетки и два иона калия внутрь клетки.
Не все насосы обеспечиваются энергией в результате гидролиза АТФ. Неко-
торые насосы транспортируют одни вещества за счет переноса других. Транс-
порт одних веществ по концентрации градиента позволяет прокачивать дру-
гие вещества против концентрации градиента. Ответственные за такой способ
прокачки мембранные белки называются котранспортерами или вторичными
транспортерами. Котранспортером может выступать любой симпортер или
антипортер. В случае задействования симпортера оба транспортируемых ве-
щества движутся в одном направлении, в то время как антипортер применяет-
ся для переноса веществ в противоположных направлениях. Натриево-кальци-
евый насос — это пример антипортера, который закачивает три иона натрия в
клетку на два выкачанных из клетки иона кальция. Симпортеры применяются
в некоторых животных клетках для закачки соединенной с ионами натрия глю-
козы. Ну-ка, сделайте пару глубоких вдохов и глоток воды и поразмышляйте
ГЛАВА 8 Липиды и мембраны 165
над этим удивительно действенным продуктом эволюции, прежде чем двигать-
ся дальше!
Каналы
Каналы обеспечивают пассивную транспортировку веществ через мембра-
ну. Транспортирование веществ через каналы выполняется в 1000 раз быстрее,
чем с помощью насоса. Канал технически представляет собой трубку из бел-
ков, проходящую через мембрану, но его поведение значительно сложнее.
Каналы высокоизбирательные. У одних критерием служит размер — атом
натрия меньше атома калия, в то время как другие различают анионы и ка-
тионы. Каналы могут пребывать как в открытом состоянии (транспорт разре-
шен), так и в закрытом (транспорт блокируется). Некоторые виды регуляции
основаны на изменении состояния канала (открытый/закрытый). Химический
потенциал позволяет управлять каналом подобно воротам с электромагнитным
замком. Часто управление каналом выполняется с помощью специфических
химических веществ. Такое химически контролируемое регулирование назы-
вается основанным на лигандах. После удаления соответствующего регулятора
открытые каналы закрываются самостоятельно.
ТЕКУЧЕСТЬ МЕМБРАНЫ: МОДЕЛЬ ЖИДКОЙ МОЗАИКИ
Изучая липидный бислой, можно понять структуру мембран, но очень сложно
разобраться в ее функциях. Многие функции мембраны, зависящие от ее те-
кучести, лучше все описываются с помощью модели жидкой мозаики. В такой
модели мембрана рассматривается одновременно как проницаемый барьер
и как растворитель многих интегральных белков. Диффузия компонентов в
плоскости мембраны — латеральная диффузия — очень быстрая. В общем
случае липиды движутся быстрее, чем белки, а некоторые белки вообще оста-
ются неподвижными. Диффузия компонентов через мембрану — поперечная
диффузия — обычно медленная.
Текучесть мембраны зависит от многих факторов. В бактериях текучесть ре-
гулируется с помощью цепи жирных кислот. (Наличие двойных связей делает
мембрану более текучей.) В животных клетках текучесть контролирует холе-
стерин: чем выше концентрация холестерина, тем меньше текучесть мембра-
ны. Переход из твердого состояния в жидкое происходит при температуре,
называемой температурой плавления, Тт.
НА ПРАКТИКЕ
Самый распространенный тип каналов, управляемых лигандами, —
это ацетилхолиновые рецепторы, которые регулируют прохождения
нервных импульсов. Как только нервный импульс достигает сое-
динения нервного окончания — синапса, — он вызывает реакцию
166 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
высвобождения ацетилхолина, который переходит небольшой зазор
до следующего нервного окончания и соединяется с ацетилхоли-
новыми рецепторами. Такое соединение открывает канал, приводя
к диффузии ионов натрия внутрь и ионов калия наружу нервной
клетки. Изменение концентрации ионов обеспечивает прохождение
нервного импульса к клеткам следующего нерва.
Увеличение концентрации ионов натрия во втором нервном окончании за-
пускает механизм удаления ионов натрия из нервной клетки. Позже через дру-
гие ворота в клетку заходят ионы калия. Это называется электрохимической
связью, в которой сигнал передался электрическим путем, затем химическим
путем через синапс, а затем опять с помощью электрических сил. Такой меха-
низм обеспечивает быстрое взаимодействие одной нервной клетки с другой.
Стероиды: прокачиваемся
Стероиды — это еще один класс липидов. У всех стероидов наличествует
сердцевина, показанная на рис. 8.11. Буквами А, В, С и D обычно обознача-
ют кольцевые структуры. У разных стероидов свои дополнения к основной
структуре — это могут быть боковые цепи, другие функциональные группы и
ненасыщенные или ароматические кольца.
Рис. 8.11. Базовая структура
стероида
Самым распространенным предшественником стероидов является холесте-
рин. Этот мембранный компонент служит источником образования многих сте-
роидов и связанных с ними веществ. Холестерин поступает с пищей, но если
его недостаточно, то организм начинает синтезировать холестерин в печени.
Стероидные гормоны — это химические регуляторы или лиганды, образован-
ные из холестерина.
Желчные кислоты — это группа веществ, полученных путем окисления
холестерина. В отличие от холестерина и других липидов желчные кислоты
растворимы в воде. Они участвуют в пищеварении и функционально подобны
моющим средствам.
ГЛАВА 8 Липиды и мембраны 167
Стероиды, о которых часто рассказывают в медиа и которые приме-
Л* няют атлеты и бодибилдеры, — это анаболические стероиды, уси-
ливающие способность тела предупреждать разрушение мышечной
ткани и увеличивающие объем мышц. Структурно они подобны те-
стостерону, одной из функций которого является усиление мужских
черт, проявляющихся в активном росте волос на лице и наборе мы-
шечной массы. Однако прием стероидов в больших дозах чреват се-
рьезными осложнениями: импотенцией, уменьшением размера яи-
чек, возникновением опухоли печени, увеличением размера сердца,
ростом груди у мужчин, агрессивным поведение и т.д. (Звучит жиз-
неутверждающе, не так ли?) Их применение без соответствующих
показаний во многих странах считается противозаконным, начиная
с 1991 года.
Простагландины, тромбоксаны
и лейкотриены: зачистка
Арахидоновая кислота — полиненасыщенная жирная кислота с 20 атомами
углерода — применяется в качестве основного или вспомогательного старто-
вого вещества при синтезе простагландинов, тромбоксанов и лейкотриенов.
Из арахидоновой кислоты клетки получают два вида веществ: лейкториены
и простагландины. Дополнительные простагландины и тромбоксаны получа-
ются из простагландинов — производных арахидоновой кислоты. Все классы
этих соединений относятся к гормонам местного действия. В отличие от дру-
гих гормонов они не поступают в кровоток и относятся к молекулам с корот-
ким сроком жизни, которые изменяют активность как производящей их клетки,
так и соседних клеток.
Все эти соединения являются чрезвычайно действенными химическими ве-
ществами, выступающими гормональными медиаторами. У них много других
медицинских применений, и они также могут вызвать проблемы со здоровьем.
Их часто называют эйкозаноидами (от греческого “двадцать”) за содержание
ровно 20 атомов углерода (рис. 8.12).
Название простагландины пришло от убеждения, что источником соеди-
нений является предстательная железа — впервые простагландины были вы-
делены в 1935 году из семенной жидкости. Простагландины незначительно
отличаются друг от друга, но у всех них есть кольцо из пяти углеродов. Ми-
нимальные структурные различия ведут к разному поведению, хотя все про-
стагландины понижают артериальное давление, вызывают сокращение мягких
мышц и являются частью системного ответа на воспалительные процессы.
168 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
сн=сн
_„.сн=сн
Сг12
соон
сн2
\ _ ХСН2 ХСН2 /СН2 /СН3
сн—сн сн—СН "СН2 'сн2
Арахидоновая кислота
с—сн
соон
\ хСН2
сн-сн ^сн-сн2 'СН2
но7 сн
СНз
Простагландин (PGE2)
сн
| ^сн
сн2 I
усн2
СН =СН^ / 2х ^zCOOH
сн2 сн2
/Сн3
СН2
Тромбоксан (А2)
он он
I I
/СН /СН /СН /СН /СН2 /СОО-
сн2 ^сн^ ^сн^ ^сн=сн ^сн2 'сн2
СН^ /СН2 /СН2 /СНз
'"'сн 'сн2 'сн2
Лейкотриен (В4)
Рис. 8.72. Структуры арахидоновой кислоты, обычного
простагландина, тромбоксана и лейкотриена
Многочисленные медицинские препараты основаны на искус-
ственно синтезированных простагландинах. Например, произво-
дная простагландина PGE2 применяется для стимуляции схваток.
НА ПРАКТИКЕ т-r
Простагландины, связанные с воспалительными процессами орга-
низма, выступают главной причиной покраснений, соответствую-
щих болевых ощущений и отечности. Период полураспада многих
простагландинов меньше нескольких минут. Тромбоциты крови
ГЛАВА 8 Липиды и мембраны 169
производят тромбоксаны, которые применяются как сосудосужи-
вающее средство и вещество, угнетающее агрегацию тромбоцитов,
обеспечивая двухэтапное образование кровяного сгустка. Тромбок-
сан А2 является одним из веществ, способствующих сворачиванию
крови. Белые кровяные тельца, лейкоциты, и некоторые клетки дру-
гих тканей вырабатывают лейкотриены, чье название образовано от
названия клеток (лейкоциты), в которых они обнаружены впервые, и
названия присутствующих в них тройных конъюгированных связей
(триенов). Лейкотриены связаны с острыми появлениями аллергии.
НА ПРАКТИКЕ
Аспирин предотвращает синтез простагландинов и тромбоксанов.
Этот препарат относится к противовоспалительным веществам, по-
скольку противодействует воспалительным реакциям, вызванным
простагландинами. Способность к подавлению процесса образова-
ния тромбоксанов позволяет использовать малые дозы аспирина для
предотвращения сердечного приступа и инсульта. Снижение уровня
тромбоксанов приводит к ухудшению свертываемости крови. Дру-
гой противовоспалительный препарат, кортизон, подавляет выделе-
ние арахидоновой кислоты из клеточных мембран, что в свою оче-
редь предотвращает образование эйкозаноидов. Жирные кислоты
из рыбьего жира угнетают образование более сильнодействующих
лейкотриенов и тромбоксанов.
170 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
Глава 9
Полинуклеотиды
и код жизни
В ЭТОЙ ГЛАВЕ.,.
» Структура нуклеотидных кислот
» Последовательность нуклеиновых кислот
» Секвенирование аминокислот
Нуклеиновые кислоты получили свое название из-за того, что впервые
были обнаружены в клеточном ядре. ДНК {дезоксирибонуклеиновая
кислота) — самая известная из нуклеиновых кислот — это неотъем-
лемая часть хромосом, содержащая гены с информацией, на основе которой
выполняется синтез белка. Многие из этих белков являются ферментами —
каждый из них катализирует специфическую химическую реакцию, протекаю-
щую в организме. Такое суждение дало начало гипотезе “один ген — один фер-
мент”, в основе которой лежит понимание того, что каждый ген ответственен
за синтез одного фермента. Сейчас эта гипотеза трактуется скорее, как “один
ген — один белок”, так как гены способствуют образованию белков в самых
разнообразных структурах и функциональных механизмах организма.
У ДНК есть две прямые функции: воспроизводить новую ДНК {реплика-
ция — это то, в чем заинтересовано большинство людей) так, чтобы предо-
ставить новым поколениям клеток необходимую для выживания информацию,
и производить РНК {рибонуклеиновую кислоту) посредством транскрип-
ции. РНК участвует в непосредственном синтезе белков, который называется
трансляцией. Такие белки необходимы для подержания жизни.
Нуклеотиды: внутреннее
устройство ДНК и РНК
Как ДНК, так и РНК являются полимерами нуклеотидов. Нуклеотид пред-
ставляет собой комбинацию азотистых оснований, 5-углеродного сахара и фос-
форной кислоты. В состав нуклеотидов входят пять разных оснований и два
сахара. В этом разделе мы детально изучим компоненты нуклеотидов и пока-
жем, как они уживаются вместе.
Резервуар генетической информации: азотистые основания
Азотистые основания делятся на две большие группы, общие структуры ко-
торых показаны на рис. 9.1.
» Пурины (аденин и гуанин), состоящие из двух конденсированных
кольцевых структур, имеющих в своем составе по два атома азота
в каждом кольце.
» Пиримидины (цитозин, тимин и урацил), состоящие из одинарного
кольца с двумя атомами азота в кольцевой структуре.
Рис. 9.1. Базовые структуры пурина (слева)
и пиримидина (справа)
ЗАПОМНИ!
Аденин (А), гуанин (Г) и цитозин (Ц) встречаются как в ДНК, так и в
РНК. Тимин (Т) обнаруживается только в ДНК, аурацил (У) встреча-
ется исключительно в РНК. Модифицированные формы некоторых
из этих оснований присутствуют в отдельных молекулах нуклеино-
вой кислоты. Обведенные кружком атомы водорода, показанные на
рис. 9.1, во время производства нуклеиновой кислоты утрачиваются
при комбинировании с другими компонентами. Полная структура
пяти оснований изображена на рис. 9.2. Последовательность этих
оснований хранит генетическую информацию.
172 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
nh2
Аденин (A)
Гуанин (Г) Цитозин (Ц)
Тиамин (Т) Урацил (У)
Рис. 9.2. Аденин (А), гуанин (Г), цитозин (Ц),
тимин (Т) и урацил (У)
Атомы азота и кислорода на азотистых основаниях, обеспечивают ряд мест,
в которых возможно водородное связывание. Оно самое эффективное и легко
образуется между определенными комбинациями азотистых оснований. Такие
комбинации представляют шаблоны, согласно которым передается информа-
ция. Атомы на азотистых основаниях обычно нумеруются стандартным обра-
зом, а составляющие сахара обозначаются простыми числами.
Сладкая сторона жизни: сахара
К 5-углеродным сахарам, присутствующим в нуклеиновых кислотах, от-
носятся D-рибоза и D-дезоксирибоза. Различие между двумя этими сахара-
ми состоит в том, что у дезоксирибозы у второго атома углерода нет атома
кислорода. Структура этих сахаров приведена на рис. 9.3. Стрелки на рисунке
ГЛАВА 9 Полинуклеотиды и код жизни 173
указывают спиртовую группу первого атома углерода — аномерический угле-
род. Это то место, к которому прикрепляется основание. Оба сахара могут при-
нимать P-форму фуранозного кольца. Нумерация сахара начинается с аномери-
ческого углерода (1) и продолжается по часовой стрелке до пятого углерода
с группой -СН2ОН.
Кислая сторона жизни: фосфорная кислота
Третьим компонентом нуклеотида является фосфорная кислота (рис. 9.4).
При физиологическом значении pH она не может существовать в полностью
протонированной форме, показанной на рисунке. Отвечает за “кислотность” в
нуклеиновых кислотах. Разные нуклеотиды связываются вместе своими участ-
ками фосфорной кислотой.
сн2он он^*
н| I н
он он
Рибоза
сн2он он
Н | | Н
он н
Дезоксирибоза
Рис. 9.4. Структура
фосфорной кислоты
Рис. 9.3. Структуры 5-углеродных сахаров,
представленных нуклеиновыми кислотами
Долгий путь: от нуклеозида до нуклеотида
и нуклеиновой кислоты
Любите играть конструкторами? Складывать разные детали и каждый раз
получать что-то новенькое? Подобным образом собираются и нуклеиновые
кислоты. Вначале азотистое основание соединяется с 5-углеродным сахаром,
чтобы образовать нуклеозид, а затем нуклеозид присоединяет фосфорную кис-
лоту, чтобы сформировать нуклеотид, и наконец, комбинация нуклеотидов дает
нуклеиновую кислоту.
Первая реакция: азотистое основание +
5-углеродный сахар = нуклеозид
Комбинация азотистого основания и 5-углеродного сахара дает нуклеозид.
Общий ход реакции изображен на рис. 9.5. Это реакция конденсации. Помните
реакции конденсации, которые изучались при образовании сложных эфиров
в курсе органической химии? Это точно такая же реакция. Здесь соединение,
174 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
содержащее водород (азотистое основание), достигает другой молекулы, со-
держащей -ОН-группу (сахар). Водород соединяется с -ОН-группой с обра-
зованием и выделением воды. Между оставшимися фрагментами образуется
связь.
Основание
/ н'\____
\ ОН/
‘Т
Сахар
Н2О+ нуклеозид
Рис. 9.5. Общая реакция
образования нуклеозида
ЗАПОМНИ)
Название нуклеозида заимствовано у азотистого основания, если
сахаром выступает рибоза; приставка дезокси- появляется, когда
сахаром является дезоксирибоза. Например, аденин соединяется с
рибозой, чтобы образовать аденозин, а при его соединении с дезок-
сирибозой будет получена дезоксиаденозин. Структура нуклеозида
аденозина показана на рис. 9.6.
Вторая реакция: фосфорная кислота + нуклеозид = нуклеотид
Комбинация фосфорной кислоты с нуклеозидами приводит к образованию
нуклеотида, который является сложным фосфорным эфиром нуклеозида. Этот
процесс заключается в реакции конденсации между фосфорной кислотой и
спиртовой группой -СН2ОН на углероде с номером 5 (рис. 9.7).
Рис. 9.6. Структура нуклеозида
аденозина
О
I
НО—Р—Юн Н-?—О— нуклеозид
ОН
v
Н2О + нуклеотид
Рис. 9.7. Упрощенное представление
реакции образования нуклеотида
ГЛАВА 9 Полинуклеотиды и код жизни 175
Аденозинмонофосфат (АМФ) является самым ярким примером нуклео-
тида (рис. 9.8). Нуклеотиды — это мономеры, из которых образуются формы
нуклеиновых кислот. АМФ выступает одним из строительных блоков РНК, а
также играет важную роль в переносе энергии в клетки (подробно об АМФ см.
часть 4).
nh2
он он
Рис. 9.8. Структура аденозинмонофосфата (АМФ)
СОВЕТ
Если сахар представлен рибозой, то будет образовано от одного до
четырех рибонуклеотидов. Если сахаром является дезоксирибоза, то
будет получено от одного до четырех дезоксирибонуклеотидов.
Третья реакция: нуклеотиды образуют нуклеиновые кислоты
Нуклеиновые кислоты образуются в результате присоединения нуклеоти-
дов в процессе все те же реакций конденсации, что рассматривались выше.
Реакция конденсации предполагает, что фосфат одного нуклеотида реагиру-
ет со спиртовой группой углерода с номером 3 другого нуклеотида (рис. 9.9).
Заметьте, что нижняя группа -ОН, обведенная кружком, происходит от фос-
форной кислоты, прикрепленной к пятому атому углерода. Верхняя группа -Н
спиртовой группы располагается на третьем атоме углерода.
Полимер начинается с атома с номером 5, а заканчивается атомом с номе-
ром 3. На рис. 9.10 показаны атомы углерода с номерами 5 и 3 соединения
аденозинмонофосфата.
Главное о нуклеиновых кислотах
Нуклеиновые кислоты ответственны за хранение и управление инфор-
мацией, которая используется клетками при воспроизводстве и росте. Они
176 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
представляют собой большие молекулы, обнаруживаемые в клетках ядра. Ге-
нетическая информация содержится в ДНК, зашифрованная в виде первичной
и вторичной структуры. Подобно тому, как клетки делятся и размножаются,
генетическая информация из них копируется в новые клетки, которые должны
воспроизводиться предельно точно — ошибки здесь недопустимы. Роль РНК
заключается в передаче генетической информации из ДНК в рибосомы, в ко-
торых происходит синтез белка. ДНК и РНК позволяют жить всем нам. Такое
утверждение известно как главная аксиома генетики.
Н
О
I
нуклеотид
О
...4-,
I Т /
\.о./
нуклеотид
О
I
н
Н2О + о
Рис. 9.9. Упрощенное представление реакции
объединения двух нуклеотидов
Рис. 9.10. Атомы углерода с номерами 5
и 3 аденозинмонофосфата
ГЛАВА 9 Полинуклеотиды и код жизни 177
Роль ДНК и РНК в биологической жизни
Как ДНК, так и РНК являются полимерами, состоящими из нуклеотидных
субъединиц. Однако молекула ДНК намного больше, чем молекула РНК. У мо-
лекулы ДНК молекулярный вес выражается в миллиардах единиц. Геном чело-
века содержит 3 миллиарда нуклеотидов.
Для упрощения структура отдельной нуклеиновой кислоты может записы-
ваться как 5’-Ц-Г-Т-А-3’. Эта аббревиатура указывает, что начинается она с кон-
ца, обозначенного номером 5, заканчивается концом с номером 3, а азотистые
основания в нуклеотиде следуют в таком порядке: цитозин (Ц), гуанин (Г),
тимин (Т) и аденин (А).
РНК представляется тремя формами, у каждой из которых свое назначение:
» рибосомальная РНК (рРНК) является самой распространенной —
рибосомы клетки состоят из нее на 75-80%;
» транспортная РНК (тРНК) составляет 10-15% от общего количества
РНК;
» информационная РНК (иРНК) составляет оставшуюся часть.
Все три вида РНК чрезвычайно важны в белковом синтезе, который проис-
ходит в рибосомах, наполненных рибосомальной РНК (рРНК). Аминокисло-
ты, необходимые для белкового синтеза, переносятся в рибосомы с помощью
транспортной РНК (тРНК). Сообщение, указывающее рибосомам, как пра-
вильно собирать белок, доставляется из ДНК в рибосому с помощью инфор-
мационной РНК (иРНК). В этом сообщении обозначена последовательность
аминокислот для производства белка с особыми свойствами.
В транспортной РНК содержится самое маленькое количество нуклеотидов:
от 70 до 90. В среднем в иРНК присутствует 1200 нуклеотидов. Рибосомальная
РНК бывает трех подвидов, которые включают от 120 до 3700 нуклеотидов.
(В ДНК обычно содержится 1-100 млн нуклеотидов, хотя вирусная ДНК за-
метно меньше.) Кроме того рибонуклеотиды применяются не только при стро-
ительстве РНК. Они присутствуют в энергетических молекулах (АТФ), внутри-
клеточных гормональных факторах (циклических АМФ) и определенных ко-
ферментах (ФАД и НАД+). ДНК и РНК есть как у растений, так и у животных.
Структура нуклеиновой кислоты
Структура каждой аминокислоты задает ее функцию в организме. Напри-
мер, структура отдельной тРНК определяет, какую именно аминокислоту она
переносит в рибосому для белкового синтеза. Фактически, различие между
ДНК и РНК состоит в структуре молекул. Ввиду высокой сложности этих мо-
лекул возможно широкое видовое разнообразие их структур.
178 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
Первичная структура нуклеиновой кислоты определяет последовательность
нуклеотидов или порядок, в котором соединяется отдельные нуклеотиды. Та-
кая последовательность расположения задает форму водородных связей, ко-
торые в свою очередь контролируют функцию нуклеиновых кислот. В ДНК
также имеется вторичная структура — последовательность с водородными
связями между азотистыми основаниями в нитях ДНК. В результате ДНК со-
стоит из двойной спирали, которая выглядит как закрученная по всей длине
лестница, где водородные связи (ступени лестницы) удерживают вместе две
первичные структуры.
ЗАПОМНИ!
Водородные связи между двумя нитями ДНК образуют две компле-
ментарные нити (спаренные). В основной паре каждый А (аденин)
комплементарен Т (тимину), а каждый Г (гуанин) является компле-
ментарным Ц (цитозину). Такие пары фундаментальным образом
определяют функции нуклеиновых кислот.
Две нити ДНК являются антипараллельными. Это означает, что конец с но-
мером 5 одной нити соединяется с концом с номером 3 комплементарной нити.
Такое спаривание приводит к размещению более полярных (гидрофильных)
сахаров и фосфатных групп с внешней стороны, а менее полярных (гидрофоб-
ных) азотистых оснований — внутри. (Заметьте, что понятия гидрофильного и
гидрофобного в упоминаемом здесь значении являются относительными.) Ан-
типараллельная форма структуры молекулы влияет на то, как ДНК производит
новые ДНК и РНК.
И хотя для формирования водородных связей исключительную важность
представляют все азотистые основания, определенные комбинации оказывают-
ся значимее остальных. В ДНК аденин способен формировать две водородные
связи с тимином (рис. 9.11), а гуанин может образовывать три водородные свя-
зи с цитозином (рис. 9.12).
При взаимодействии ДНК и РНК или при взаимодействии двух молекул
РНК аденин может образовывать водородные связи и урацилом. Взаимодей-
ствие между аденином и урацилом показано на рис. 9.13.
О
Рис. 9.11. Водородные связи (пунктирные линии), образуемые
между аденином (справа) и тимином (слева)
ГЛАВА 9 Полинуклеотиды и код жизни 179
Рис. 9.12. Водородные связи (пунктирные линии), образуемые
между гуанином (справа) и цитозином (слева)
Рис. 9.13. Водородные связи (пунктирные линии), образуемые
между аденином (справа) и урацилом (слева)
НА ПРАКТИКЕ
Способность формировать такие специфические комбинации очень
важна в реальной жизни; это тот самый генетический код, о котором
все наслышаны. Последовательность нуклеотидов в нуклеиновых
кислотах и последовательность аминокислот в белках полностью
зависит от образуемых водородных связей. Без них соответствую-
щая информация не передавалась бы точно, а люди могли бы рожать
котят, а не детей. Как природа передает этот генетический код? С по-
мощью ДНК, структуры жизни (рис. 9.14).
Рис. 9.14. Структура ДНК
180 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
Глава 10
Витамины: просто
о сложном
В ЭТОЙ ГЛАВЕ...
» Важные функции витаминов
» Витамины группы В
» Назначение других витаминов и питательных веществ
Для жизни организму необходимы самые разные вещества, многие из
которых выделяются в отдельную категорию — продукты питания —
определенно одну из любимейших категории всех нас, особенно Джо-
на. Продукты питания, которое требуется организму для жизни и роста, отно-
сятся к питательным веществам. Питательные вещества — это вещества из
рациона питания, необходимые для роста, обмена веществ и получения энер-
гии. Ниже представлены шесть основных классов питательных веществ.
» Углеводы
» Жиры
» Минералы
» Белки
» Витамины
» Вода
При пищеварении большие молекулы из поглощенной пищи разбиваются
на молекулы меньшего размера, которые впоследствии всасываются и перера-
батываются организмом. В процессе пищеварения углеводы (за исключением
моносахаридов), жиры и белки распадаются на компоненты (см. предыдущие
главы). Представители животного мира получают энергию преимущественно
из углеводов и жиров, но белки также могут служить источником энергии.
Кроме того, организму нужны органические витамины и неорганические
минералы. Еще всем живым организмам для выживания требуется вода.
Вода — это чудесная субстанция. Удивительным свойствам воды посвящены
многие научные работы и книги.
Больше одного: витамины
Витамины представляют собой органические соединения, которые в не-
больших количествах нужны для обеспечения нормального метаболизма.
Термином “активная форма” описывают структуру, в данном случае молеку-
лы витаминов, выполняющую свою функцию или проявляющую активность
в организме. В общем случае человеческий организм не умеет самостоятель-
но синтезировать достаточное количество витаминов, поэтому получает их из
других источников — с продуктами питания и/или в виде лекарственных пре-
паратов. Недостаток витаминов в пище приводит к проблемам со здоровьем.
К общим симптомам нехватки витаминов относится болезненность, медленное
заживление ран и сильная утомляемость. Потребность человеческого организ-
ма в таких питательных веществах, как витамины и минералы, была определе-
на медициной только в начале прошлого столетия.
ЗАПОМНИ)
НА ПРАКТИКЕ
Витамины делятся на две категории: водорастворимые и жирора-
створимые. У водорастворимых витаминов отмечается тенденция
к включению в структуру большего количества атомов кислорода
и азота, чем у жирорастворимых витаминов, в структуре которых
преобладают атомы водорода. К водорастворимым относятся вита-
мин С и витамины группы В. Витамины A, D, Е и К относятся к
категории жирорастворимых. Большинство водорастворимых ви-
таминов действует как коферменты или выступает важными компо-
нентами синтеза коферментов. Жирорастворимые витамины выпол-
няют различные биохимические функции.
Из организма водорастворимые витамины удаляются без особых за-
труднений, обычно с мочой. На этот факт указывает ярко-желтый
цвет мочи у пациентов, принимающих большие дозы витамина С.
Поскольку водорастворимые витамины не запасаются организмом,
их необходимо постоянно восполнять. При этом жирорастворимые
витамины накапливаются в жировой ткани про запас, и полностью
вывести их из организма не представляется возможным. Чрезмерное
182 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
накопление жирорастворимых витаминов до токсичных для ор-
ганизма уровней называется гипервитаминозом. Не забывайте об
этом, принимая жирорастворимые витамины без консультации с ле-
чащим врачом.
Быть или не быть: витамины группы В
Витамины В, или витамины группы В, представляют собой комплекс водорас-
творимых витаминов, содержащихся в самых разных продуктах. Первоначально
все они считалась одним витамином — витамином В. Все витамины этой группы,
за исключением витамина В6, считаются малотоксичными. В основном витами-
ны группы В отвечают за состояние кожи и функционирование нервной ткани.
Витамин В1 (тиамин)
Тиамин (витамин Bj) участвует в углеводном обмене. В теле не накаплива-
ется, как и остальные витамины группы В. Кроме того, продолжительная тер-
мическая обработка пищи приводит к разрушению этого витамина. После вса-
сывания в организме тиамин преобразуется в биологически активную форму
за счет присоединения пирофосфатной (дифосфатной) группы и, как результат,
образования тиаминпирофосфата (ТПФ). На рис. 10.1 показаны структуры
витамина Bj и тиаминпирофосфата.
сн2-сн2-он
Тиамин
Тиаминпирофосфат (ТПФ)
Рис. 10.1. Структуры витамина Bj (тиамина) и тиаминпирофосфата (ТПФ)
ГЛАВА 10 Витамины: просто о сложном 183
ТПФ — это кофермент, применяемый при декарбоксилировании пирувата
до ацетил-СоА и а-кетоглутарата до сукцинил-СоА. Кроме того, ТПФ участву-
ет в синтезе рибозы.
Недостаток тиамина становится причиной болезни бери-бери (али-
ментарный полиневрит), которая вызывает повреждение нервной
системы. Бери-бери распространена преимущественное в регионах,
в которых основным продуктом питания выступает рис. Рис, осо-
бенно шлифованный, содержит очень мало тиамина. Проблема ре-
шается переходом на коричневый рис, тиамина в котором намного
больше. Особенно большому риску подвержены младенцы, мамы
которых недополучают тиамин с продуктами питания. С подобными
проблемами также сталкиваются больные алкоголизмом, поскольку
в их “рационе” с высоким содержанием алкоголя содержится незна-
чительное количество любых витаминов.
СОВЕТ
Хорошими источниками тиамина считаются такие продукты пита-
ния, как печень, шпинат, зеленый горошек, турецкие бобы, фасоль
пинто,1 цельнозерновая крупа и большинство овощей.
Витамин В2 (рибофлавин)
Рибофлавин (витамин В2) незаменим при синтезе флавин-мононуклеотида
(ФМН) и флавин-адениндинуклеотида (ФАД). На рис. 10.2 показаны струк-
туры этих веществ. ФМН и ФАД — это важные коферменты, вовлеченные в
многочисленные биохимические восстановительные процессы. В названии
рибофлавина кроется отсылка к рибитолу — спирту, полученному из рибозы.
Остальная часть рибофлавина представляет кольцевое образование изоаллок-
сазина, производного флавина.
Заболеваний, вызванных недостатком рибофлавина, не существует;
однако, его нехватка приводит к воспалению и раздражению слизи-
стой оболочки глаз, дерматитам и анемии. К источникам этого ви-
тамина относятся соевые бобы, печень, молоко, сыр и зеленые
листовые овощи. Рибофлавин устойчив к термической обработке, но
разрушается под воздействием солнечного освещения.
Витамин В3 (ниацин)
Термин ниацин (витамин В3) связан с двумя соединениями: никотино-
вой кислотой и никотинамидом. Эти два углевода, наряду никотинамид-аде-
1 Фасоль пинто — сорт фасоли с пестрой окраской.
184 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
ниндинуклеотидом (НАД+), изображены на рис. 10.3. Никотинамид — это
часть кофермента НАД+ и никотинамид-динуклеотидфосфата (НАДФ+). Эти
коферменты работают в связке с многочисленными ферментами в реакциях
катализации самых разных восстановительных процессов организма.
nh2
Флавин-
мононуклеотид
Рис. 10.2. Полная структура флавин-адениндинуклеотида и структуры его
составных элементов: флавин-мононуклеотида и рибофлавина
Ниацин — это один из немногих витаминов, которые синтезируются в че-
ловеческом организме. Для синтеза используется триптофан, но он не сильно
распространен.
Дефицит ниацина вызывает заболевание, известное как пеллагра. К его сим-
птомам относят потерю аппетита, психические расстройства, диарею и ино-
гда глухоту. В начале 1900-х годов заболевание приобрело массовый харак-
тер в южных штатах США, поскольку тогда рацион питания большей части
ГЛАВА 10 Витамины: просто о сложном 185
населения состоял преимущественно из кукурузы, которую нельзя назвать хо-
рошим источником ниацина и триптофана.
Никотиновая кислота
о
^сн —nh2
сн
Никотинамид
Никотинамид-адениндинуклеотид (НАД+)
Рис. 10.3. Структуры никотиновой кислоты, никотинамида
и никотинамид-адениндинуклеотида (НАД+)
СОВЕТ
Ценными источниками ниацина считаются такие продукты питания:
молоко, сыр, большинство видов мяса и овощей, а также зерновые.
Витамин Вб (пиридоксин)
Витамин В6 состоит из трех компонентов: пиридоксина, пиридоксаля и пи-
ридоксамина. Все три соединены в пиридоксальфосфат — форму, которая про-
являет биологическую активность в организме. Структуры этих соединений
показаны на рис. 10.4. Пиридоксальфосфат выступает в качестве кофермента
186 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
во многих процессах, включая взаимные превращения а-кетокислот и амино-
кислот.
н ,О
сн2-он
НО. ^СН2-ОН НО. .сн2-он
ЧУ ^СУ хг
Пиридоксин
Пиридоксаль
ch2-nh2
НО. ,сн2-он
ЧУ ^(У
Пиридоксамин
Пиридоксальфосфат
Рис. 10.6. Структуры пиридоксина, пиридоксаля,
пиридоксамина и пиридоксальфосфата
Авокадо, куриное мясо, рыба, орехи, печень и бананы — особо ценные ис-
точники витамина В6. Термическая обработка снижает его концентрацию в пи-
щевых продуктах. (Все же не стоит есть сырое куриное мясо только ради того,
чтобы восполнить недостаток витамина В6 в организме.)
Заболевания, вызванные дефицитом витамина В6, медицине неиз-
вестны, но его низкое потребление приводит к раздражительности,
депрессии и спутанности сознания. Доказано, что большие дозы
НА ПРАКТИКЕ
ГЛАВА 10 Витамины: просто о сложном 187
витамина В6, в отличие от остальных водорастворимых витаминов,
могут вызывать проблемы со здоровьем. Избыточное накопление
витамина В6 может привести к необратимому повреждению тканей
нервной системы.
Биотин
Биотин (рис. 10.5) является важным коферментом многочисленных реакций
карбоксилирования. Биотин — это переносчик углерода в жировом и углевод-
ном обмене.
сн—сн ~
I \ I
"Н сн ।
СН2-СН2-СН2-СН2-С
он
Рис, 10.5. Структура биотина
В достаточных количествах биотин синтезируются бактериями ки-
шечника, компенсируя его недостаток в организме. Антибиотики
могут угнетать рост таких бактерий и вызвать дефицит биотина. В
НА ПРАКТИКЕ г- г-
подобных случаях возникает заболевание со следующими симпто-
мами: тошнота, дерматит, депрессия и анорексия. Биотин устойчив
к термической обработке.
Фолиевая кислота
Фолиевую кислоту вырабатывают бактерии в нашем кишечнике, но поми-
мо того она в больших количествах содержится в листовых овощах зеленого
цвета, сушеной фасоли и печени (один из любимых продуктов питания Джо-
на). Восстановление фолиевой кислоты переводит ее в активную форму — те-
трагидрофолиевую кислоту. Обе структуры показаны на рис. 10.6. Кофермент
переносит углерод, обычно метил или формил, при синтезе гема, нуклеиновой
кислоты, холина и некоторых других соединений. И хотя соединение легко раз-
рушается при термической обработке, кишечные бактерии обычно вырабаты-
вают достаточное количество фолиевой кислоты для нормального протекания
обменных процессов.
188 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
Фолиевая кислота
Тетрагидрофолиевая кислота
Рис. 10.6. Структуры фолиевой и тетрагидрофолиевой кислот
НА ПРАКТИКЕ
Фолиевая кислота играет чрезвычайно важную роль в предотвраще-
нии повреждений головного мозга (анэнцефалия) и спинного мозга
(спинальный дизрафизм). Нехватка фолиевой кислоты угнетает син-
тез пуринов — к симптомам болезни относят желудочно-кишечные
расстройства и анемию. Беременным женщинам обычно назначают
повышенные дозы фолиевой кислоты, чтобы помочь нормальному
развитию плода, особенно его спинного и головного мозга. Сульфа-
ниламидные препараты путем конкурентного ингибирования пода-
вляют образование фолиевой кислоты, вырабатываемой некоторыми
патогенными видами бактерий.
Пантотеновая кислота
Название пантотеновая кислота (рис. 10.7) происходит от греческого
слова, означающего “отовсюду”. Вполне ожидаемо ее источником выступает
очень большое количество продуктов питания, в том числе мука, яйца и мясо.
ГЛАВА 10 Витамины: просто о сложном 189
Случаи недостаточности пантотеновой кислоты медицине практически неиз-
вестны. Витамин не разрушается в процессе нагревания только до умеренных
температур — сильное термическое воздействие дестабилизирует соединение.
СНт он о
Г I
но—сн2-с—с—с—N—сн2-сн2-с
СН3 Н Н
он
Рис. 10.7. Структура пантотеновой кислоты
Пантотеновая кислота участвует в синтезе кофермента А. Этот ко-
фермент играет важную роль во многих биологических процессах,
перенося ацильные группы.
Удивительный витамин В12
Витамин В{2 — это единственное известное природное органическое соеди-
нение, в состав которого входит металл. Он не образуется у высших растений,
и, по всей видимости, синтезировать его умеют только бактерии, живущие в
симбиозе со своими хозяевами. К несчастью, у высших животных, включая
человека, такие бактерии не обнаружены. Следовательно, нам приходится по-
лучать витамин В12 с пищей.
Название соединения цианокобаламин указывает на вхождение в его со-
став цианида. Цианид искусственно образуется при выделении соединения и
не существует в природном состоянии. Витамин В12 необходим для образо-
вания двух коферментов: метилкобаламина (рис. 10.8) и 5-дезоксиаденозил-
кобаламина.
Оба кофермента принимают участие в реакциях с перегруппировками. Ме-
тил кобаламин участвует в реакциях с переносом метила. Кофермент 5-дезок-
сиаденозилкобаламин задействуется в некоторых заместительных реакциях,
в которых атом водорода и группа, прикрепленная к расположенному рядом
углероду, меняются местами.
При плохом всасывании витамина В12 обычно развивается перни-
циозная анемия. Здоровые клетки желудка вырабатывают гликопро-
теин, который способствует всасыванию витамина в кишечнике.
К витаминной недостаточности приводит нехватка именно этого
внутреннего фактора, а не самого витамина в питательном рационе.
У людей старшего возраста могут возникать трудности с выработкой
необходимого количества внутреннего фактора. Кроме того симпто-
мы дефицита витамина могут развиться у строгих вегетарианцев.
190 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
К проявлениям пернициозной анемии относят повреждения позво-
ночника, ведущие к потере мышечной координации, и желудоч-
но-кишечные расстройства. Нехватку В12 обычно связывают с об-
разованием крупных, хрупких и незрелых эритроцитов. К ценным
источникам витамина В12 относят мясо, яйца, молоко и крупы. Этот
витамин устойчив к термическому воздействию.
Рис. 10.8. Структура метилкобаламина
Витамин А
Витамин А — это не одно соединение, а целый комплекс биологически ак-
тивных веществ, которые подвергаются биологическим реакциям внутри ор-
ганизма. Родительским соединением витамина А выступает 11 -трансретинол,
обнаруженный в молоке и яйцах. Витамин А встречается только у животных,
а у растений его предшественником является Р-каротин (рис. 10.9), выступаю-
щий провитамином. При расщеплении Р-каротина образуются два активных
вещества витамина А. Любой Р-каротин, который не становится витамином А,
используется в организме как антиоксидант.
ГЛАВА 10 Витамины: просто о сложном 191
11-трансретинол
0-каротин
Рис. 10.9. Структуры 11 -трансретинола и ft-каротина. Заметьте, что
11 атом углерода располагается на пятой позиции основной цепочки
Витамин А особенно ценен для зрения. Важный этап обеспечения зритель-
ного процесса состоит в поглощении света, которое на химическом уровне вы-
зывает изменение геометрии двойной связи между 11 и 12 атомами углерода,
изменяя цис-форму на транс-форму. Изомеризация запускает серию событий,
приводящих к созданию нервного импульса. Фермент обеспечивает такую изо-
меризацию, что молекула может использоваться повторно. Кроме того, будучи
непосредственно вовлеченным в реакции обеспечения зрительного процесса,
витамин А способствует развитию эпителиальных клеток, которые защищают
слизистые оболочки и многие другие ткани глаз от инфекции и раздражителей.
Витамин А также предотвращает структурные изменениях костей, часто наб-
людаемые у младенцев.
Недостаток витамина А сначала проявляется в виде ухудшения зре-
ния в сумерках, а затем развивается в заболевания глаз, вызываю-
щие слепоту. Запущенный дефицит витамина А может привести к
ксерофтальмии — воспалению век и глаз, приводящей к инфициро-
ванию глазных яблок и слепоте. Молодым животным витамин А не-
обходим для роста; взрослые особи способны запасать его в печени,
при необходимости расходуя в течение нескольких месяцев. В пе-
чени некоторых животных, таких как полярные медведи и котики,
настолько высокое содержание витамина А, что она токсична для
людей. (Кому сэндвич с печенью полярного медведя?) Избыточные
дозы витамина А ведут к острой интоксикации — как жирораство-
римый витамин он трудно выводится из организма. К ее симптомам
192 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
относят тошноту, рвоту, нечеткое зрение и головную боль. Высокие
дозы витамина связывают с врожденными дефектами плода и само-
произвольными абортами. Провитамин Р-каротин не токсичен, хотя
и является жирорастворимым. В больших количествах он содержит-
ся в моркови, поедание которой в большом количестве может приве-
сти к пигментации кожи в оранжевый или желтый цвет.
Витамин С
Витамин С — это еще одно название аскорбиновой кислоты (рис. 10.10).
Дегидроаскорбиновая кислота также обладает свойствами витамина С. Ви-
тамин С относится к водорастворимым витаминам, поэтому организм легко
устраняет его избыток, и он совершенно нетоксичен при передозировке. Ви-
тамин С является антиоксидантом. Как и витамин Е он помогает предотвра-
щать повреждения, вызываемые окислителями. Также витамин С нужен для
всасывания железа и удержания его в двухвалентном состоянии. Витамин С
способствует преобразованию некоторых видов пролинов из коллагена С в ги-
дроксипролины, которые стабилизируют коллагеновые волокна.
но—сн2-сн /О
I 'сн хс
он \ /
но
он
Рис. 10.10. Структура
витамина С
НА ПРАКТИКЕ
Нехватка витамина С приводит к развитию цинги, симптомы кото-
рой связаны с ослаблением коллагена — важного белка в составе
соединительной ткани связок и сухожилий. Витамин С содержится
во многих продуктах растительного происхождения, особенно ци-
трусовых, поэтому предотвратить цингу легко. На протяжении не-
скольких столетий британские моряки спасались от цинги, получая
витамина С вместе с лаймами, которые всегда находились в трюмах
их кораблей (что, кстати, привело к сленговому прозвищу британ-
ских моряков — “лайм и”). Многие млекопитающие, кроме прима-
тов, синтезируют витамин С из глюкозы. Продолжительная терми-
ческая обработка разрушает витамин С.
ГЛАВА 10 Витамины: просто о сложном 193
Витамин D
Витамин D иногда называют солнечным витамином. Организм может вы-
рабатывать его под влиянием солнечного света (ультрафиолетовой части его
спектра). Люди, которые работают и отдыхают полу- или полностью разде-
тыми (привет нудистам!) никогда не испытывают недостатка в витамине D.
И действительно, достаточно находиться на открытом солнце 15 минут в день,
одетым в шорты и рубашку, чтобы восполнить суточный запас витамина D.
К сожалению, большинство людей получают витамин D преимущественно с
продуктами питания — особенно много его в молоке.
Функции витамина D демонстрируют несколько соединений. Два из них,
на самом деле являющиеся провитаминами, поступают в организм вместе с
пищей. Речь идет о эргостероле и 7-дигидрохолестероле. Под воздействием
ультрафиолетового света эргостерол превращается в витамин D2, эргокалифе-
рол. Ультрафиолетовое излучение, особенно попадающее на кожу животных,
превращает 7-дигирохолестерол в витамин D3 или холекалъциферол. (Чтобы
запутать вас окончательно: витамин Dj — это комбинация витаминов D2
и D3.) Структуры эргостерола и витамина D2 показаны на рис 10.11, а структу-
ры 7-дигидрохолестерола и витамина D3 — на рис. 10.12.
НА ПРАКТИКЕ
ВНИМАНИЕ
С витамином D связана способность организма усваивать кальций и
фосфор. В костях и зубах содержится большое количество этих двух
элементов, и они первыми начинают страдать от недостатка вита-
мина D. Следствием дефицита витамина также может быть остео-
маляция — заболевание костей, при котором они деформируются,
теряя прочность. (У младенцев и детей остеомаляция называется
рахитом). Дефицит витамина D для детей имеет более серьезные
последствия, чем для взрослых, поскольку для роста скелета требу-
ются большие количества кальция и фосфора. У людей, часть тела
которых постоянно не прикрыта одеждой, такая недостаточность
встречается крайне редко. Однако с увеличением применения солн-
цезащитных средств наблюдается рост дефицита витамина D среди
здорового населения.
Избыток витамина D приводит интоксикации организма. Удаление
этого жирорастворимого витамина из организма является сложной
задачей. К симптомы переизбытка витамина D относят тошноту, ди-
арею, камни в почках и другие отложения. Повышенное содержание
витамина D в организме может вызвать даже смерть.
194 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
СН3
СН3 I
\ /СН\ /СН /СНз
СНз сн ^сн ^сн
/СН2 I
сн2 хс^
СН, | |
,СН2 /СН /СН^
СЪ '<Г сн’
СН3
СН2
,СН /СН
нет ^сн2 сн
Эргостерол
СНз
СН /СНз
""сн
I
СНз
Рис. 10.11. Структуры эргостерола и витамина D2
Витамин D2
Витамин Е
Токоферолы — это группа соединений, которые обладают функциями вита-
мина Е. Самым эффективным из них является а-токоферол (рис. 10.13). Вита-
мин Е поступает в организм вместе с самыми разными продуктами питания:
растительными маслами, орехами, цельнозерновыми крупами, листовыми ово-
щами и др. Недостаточность витамина Е развивается крайне редко — чаще
всего она наблюдается у людей, придерживающихся специфических диет или
ГЛАВА 10 Витамины: просто о сложном 195
принимающий определенные медицинские препараты, которые предотвращают
его усвоение. Сложности с усвоением жиров наблюдаются при муковисцидозе.
7-дегидрохолестерол
Рис. 11.12. Структуры 7-дигидрохолестерола и витамина D3
Витамин D3
СНз
| СНз СНз
СН3 ^°\1 I
"С ^(2 с—сн2-сн2-сн2-сн— сн2-сн2
,С /СН2 СН2
нет хт гн2 |
I СН-СНз
СНз I
СНз СН2
СНз-СН-СН2-СН2
Рис. 10.13. Структура а-токоферола (витамина Е)
196 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
НА ПРАКТИКЕ
Витамин Е выступает эффективным антиоксидантом. Антиоксидан-
ты минимизируют повреждения, вызванные присутствующими в
организме окислителями. Согласно современным представлениям
окислители напрямую или косвенно связаны с процессами старе-
ния организма. На сегодня не зафиксированы случаи возникновения
проблем со здоровьем при приеме больших доз витамина Е, однако
некоторые исследования (достаточно спорные) предостерегают от
приема витамина Е в повышенных количествах.
Витамин К
Витамин Kj (рис. 10.14) — это одно из многочисленных соединений, отно-
сящихся группе витаминов К. Виды витамина К различаются боковыми цепя-
ми, прикрепленными к кольцевой структуре. Одна цепь — это обычно метил, а
в остальных, как правило, содержится не менее 20 атомов углерода.
сн с сн2-сн
о
СНз
сн—сн2-сн2-сн2
сн3 сн3-сн
сн2
сн2
с—сн2-сн2-сн2-сн—сн2
СНз СНз
Рис. 10.14. Структура витамина К1
Витамин К необходим для выработки профермента протромбина,
который способствует сворачиваемости крови. Недостаток витами-
на К встречается редко, поскольку кишечные бактерии вырабаты-
вают достаточное его количество. Некоторые продукты также яв-
ляются хорошим источником этого витамина, например листовые
овощи, цветная капуста, брокколи, субпродукты (печень — наше
все!), молоко, соевые бобы, авокадо и бананы. Две чайные ложки
петрушки содержат рекомендуемую дневную дозу витамина К. (Вы
ведь любите петрушку? До последнего момента я считал, что она
нужна только для украшения блюд!) Продолжительное применение
ГЛАВА 10 Витамины: просто о сложном 197
антибиотиков приводит к снижению числа бактерий, вырабатываю-
щих витамин К, а потому и к снижению его концентрации в организ-
ме. Один из симптомов недостатка витамина К — это увеличение
времени образования кровяного сгустка (предрасположенность к
развитию выраженных кровоподтеков даже в случае незначитель-
ных повреждений кожи). Известный факт: младенцы с недостатком
витамина К часто умирают от кровоизлияния в мозг. Для его пре-
дотвращения будущей матери прописывают усиленный курс вита-
мина К.
Витамин К также применяется в ветеринарии. Если животное случайно
съедает крысиный яд (препятствует сворачиванию крови), то ветеринар не-
пременно введет ему очень большую дозу витамина К, чтобы нейтрализовать
действие токсина.
198 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
Глава 11
Гормоны:
информационная
система организма
В ЭТОЙ ГЛАВЕ...
» Структура гормонов
» Активизация прогормонов
» Принцип действия гормонов
Гормоны — это вещества, которые вырабатываются одними частями орга-
низма, а используются другими. Они выступают молекулярными сообще-
ниями, которые синтезируются в специальных железах и путешествуют
вместе с кровотоком к целевым органам. Некоторые гормоны обладают ауто-
кринным или паракринным действием, например факторы роста и дифферен-
цировки клеток (GDF), которые обеспечивают обмен биохимической инфор-
мацией внутри определенного органа (немного напоминает передачу записок
в классе). Передача сопровождается простой диффузией на небольшие рассто-
яния. Некоторые из этих молекулярных сообщений передаются на большие
расстояния вместе с кровью (эндокринные) или на более короткие расстояния
только внутри клеток (паракринные и аутокринные).
Большинство гормонов, но далеко не все, вырабатывается эндокринными
железами. К ним (ограничимся коротким списком) относятся: гипоталамус,
гипофиз, поджелудочная железа, надпочечники, печень, яички и яичники. Уди-
вительно, правда?! Некоторые железы вырабатывают всего один гормон, в то
время как другие — сразу целую их когорту. В упрощенном понимании (если
бы в действительности все было так просто) гипофиз представляется единым
органом, ответственным за управление эндокринной системой. Гормоны гипо-
физа заставляют другие железы вырабатывать гормоны, управляющие работой
других систем. Но при детальном изучении оказывается, что в человеческом
организме существуют другие органы, дублирующие гормональные функции
гипофиза.
Структура основных гормонов
Гормоны условно делятся на три группы:
» белковые, такие как инсулин;
» стероиды, вещества, производные холестерина;
» аминовые, подобные эпинефрину.
Эти вещества оказывают влияние на происходящее в самых разных частях
организма. Их молекулы настолько действенны, что достаточно крайне низких
их концентраций (обычно от 10-7 до 1О-10) для воздействия на абсолютно лю-
бые процессы, протекающие в организме. Это на самом деле маленькое число!
Низкая концентрация затрудняет выделение и идентификацию этих веществ.
ЗАПОМНИ!
В общем случае белковые и аминные гормоны обладают гидрофиль-
ными свойствами, в то время как стероидные гормоны демонстриру-
ют липофильные качества. Давайте вспомним, что клетка окружена
мембраной — гидрофобным бислоем, препятствующим явному про-
никновению гормонов. Во многих случаях действие гормонов за-
ключается во взаимодействии с рецепторными участками наружной
части клеточной мембраны, что приводит к образованию вторичного
мессенджера с противоположной (внутренней стороны) бислоя. Ли-
пофильные гормоны обычно проникают через клеточную мембрану
в результате пассивной диффузии. Пройдя через мембрану, такие
гормоны могут беспрепятственно путешествовать к месту располо-
жения целевых рецепторных участков.
Белковые гормоны
Белковые гормоны, или полипептиды, обычно вырабатываемые гипофизом
и гипоталамусом, варьируются от простых трипептидов до больших молекул
с более чем 200 аминокислотными остатками. Белковые гормоны представ-
ляют разнообразную коллекцию углеводных молекул, среди которых инсулин
(см. глава 5).
200 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
Одним из наиболее важных белковых гормонов является тиреотро-
пин-высвобождающий фактор — трипептид, который содержит глутамин
(модифицированный), гистидин и пролин (модифицированный). Еще один
важный белковый гомон — это ингибирующий высвобождение гормона ро-
ста фактор, который подавляет высвобождение или выработку химических
веществ. Вместе (рис. 11.1) эти виды гормонов составляют механизм запуска
и завершения самых разных процессов. Их назначение состоит в том, чтобы
удерживать постоянный контроль над биохимическими процессами, например
роста, в организме.
H3N Ala—Gly —Cys—Lys “ Asn—Phe
S phe
1 Trp
\
/Lys
6 C Cys “Ser — Thr — Phe~Thr
О
Ингибирующий высвобождение гормона роста фактор
Тиреотропин-высвобождающий фактор
Рис. 11.1. Структуры ингибирующего высвобождение гормона
роста фактора и тиреотропин-высвобождающего фактора
Стероиды
Скорее всего вы уже знакомы со стероидами, которые применяются атле-
тами для увеличения (или “накачивания”) мышечной массы. Стероидные гор-
моны, вырабатываемые в теле яичниками, яичками и надпочечниками явля-
ются производными холестерина с молекулой примерно такой же величины.
К ним относятся эстрогены (женские половые гормоны), андрогены (мужские
ГЛАВА 11 Гормоны: информационная система организма 201
половые гормоны) и гормоны коркового слоя надпочечников, такие как альдо-
стерон и кортизол. Эстрогены и андрогены отвечают за развитие вторичных
половых признаков соответственно у женщин и мужчин. К таким признакам
относится рост груди у женщин и появление волос на лице у мужчин.
У гормонов, вырабатываемых корковым слоем надпочечников (рис. 11.2), к
которым относятся глюкокортикоиды и минералкортикоиды, невероятно боль-
шое количество функций. Глюкокортикоиды, такие как кортизол, участвуют в
разных метаболических процессах и обычно выделяются в стрессовых ситуа-
циях (во время экзамена по биохимии выброс кортизола гарантирован!). Ми-
нералкортикоиды, такие как альдостерон, играют важную роль в транспорте
неорганических веществ, например, ионов натрия или калия.
Прогестерон
Тестостерон
сн2-он
с=о
I
с—он
Альдостерон
Рис. 11.2. Структуры прогестерона (эстрогена), тестостерона (андрогена)
и гормонов коркового слоя надпочечников (альдостерона и кортизола)
Кортизол
202 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
Аминовые гормоны
Аминовые гормоны, обычно вырабатываемые щитовидной железой и над-
почечниками, представляют собой маленькие молекулы, многие из которых
является производными тирозина. К таким гормонам относятся тироксин и
трийодтиронин, вырабатываемые щитовидной железой, а также адреналин
и норадреналин, вырабатываемые надпочечниками. Рис. 11.3 иллюстрирует
структуру этих гормонов. Тироксин и трийодтиронин являются важными регу-
ляторами скорости метаболизма. Фактически, тироксин — это одно из самых
важных веществ в организме. Он влияет как на углеводный обмен, так и на
белковый синтез, а также определяет функции сердечно-сосудистой, нервной
и выводящей систем организма. Адреналин и норадреналин контролируют ча-
стоту сердечных сокращений, циркуляцию крови и скорость обмена веществ.
Про запас: прогормоны
Синтез некоторых гормонов, например отдельных ферментов, начинается
не с выработки активной формы молекулы. Вместо этого сначала образуется
прогормон, который остается неактивным до тех пор, пока не будет активиро-
ван, как и все мы, пока не заварим утреннюю чашку кофе. Такой подход позво-
ляет организму создавать оперативный запас гормонов, которые можно быстро
активировать в случае такой необходимости. Активация прогормона занимает
намного меньше времени, чем полноценный синтез молекулы гормона.
Проинсулин
Примером прогормона является инсулин, с помощью которого кон-
' -Н тролируется уровень глюкозы в крови. При слишком большом коли-
честве инсулина в крови наблюдается гипогликемия — недопусти-
мо сильное падение уровня глюкозы. Если инсулина в крови очень
мало, то возникает гипергликемия — чрезмерно сильное повышение
уровня глюкозы. Съев сладкий десерт, например кусок торта, вы
вынудите организм задействовать весь доступный запас инсулина.
Если бы весь инсулин находился в кровотоке, то у вас сразу раз-
вилась бы гипогликемия. Если бы в крови вообще не содержалось
инсулина, то наступила бы гипергликемия, которая прекратилась бы
только после синтеза достаточного количества инсулина из отдель-
ных аминокислот. Как гипогликемия, так и гипергликемия приводят
к серьезным проблемам со здоровьем. Простое решение проблемы
заключается в накоплении достаточного количества неактивного ин-
сулина, готового мгновенно вступить в действие
ГЛАВА 11 Гормоны: информационная система организма 203
I
Тироксин
сн-сн
О
—сн2-сн-с—о
NH3+
Трийодтиронин
/СН .с—ch2-nh
сн 'Ч: н
он
Адреналин
он
I
хсн .с—ch2-nh2
сн н
II I
НО^
он
Норадреналин
Рис, 11,3, Структуры тироксина, трийодтиронина,
адреналина и норадреналина
204 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
Бычий или говяжий инсулин (инсулин, получаемый из коровьего белка) со-
держит полипептидные цепи, А и В, связанные дисульфидными связями, с 51
аминокислотными остатками. У бычьего проинсулина на 30 аминокислотных
остатков больше, чем у инсулина. Проинсулин представляет собой одинарную
полипептидная цепь с дисульфидными инсулиновыми связями. Инсулин об-
разуется при удалении полипептидной последовательности из центрального
участка этой цепи (с 31 по 60 остаток). Вырезанная часть первоначально сое-
диняла один конец цепи А с концом цепи В инсулина. Превращение проинсу-
лина в инсулин требует расщепления всего двух пептидных связей.
Ангиотензиноген
Ангиотензиноген — это прогормон ангиотензина II, гормона, который дает
команду коре надпочечников выделять альдостерон. (Кроме того ангиотен-
зин II является самым сильным известным сосудосуживающим средством.).
Превращение прогормона в гормон выполняется в два этапа. На первом этапе
задействуется фермент ренин. Эта пептидаза, вырабатываемая в почках, рас-
щепляет определенную пептидную связь между двумя остатками лейцина, в
результате чего образуется декапептид-ангиотензин I. На втором этапе задей-
ствуется пептидаза, известная, как ангиотензин конвертирующий фермент.
Этот фермент, изначально образующийся в легких, расщепляет С-концевой ди-
пептид-ангиотензин I для образования ангиотензина И. Такие биохимические
реакции протекают очень быстро, обеспечивая экстремально быструю актива-
цию гормона.
АНГИОТЕНЗИН, АЛЬДОСТЕРОН И АРТЕРИАЛЬНОЕ ДАВЛЕНИЕ
Гормон ангиотензин вызывает сужение кровяных сосудов, что в
свою очередь приводит к повышению кровяного давления. Кро-
ме того этот белок стимулирует кору надпочечников высвобождать гормон
альдостерон. Альдостерон усиливает накопление натрия и потерю калия, что
также способствует повышению кровяного давления.
Оба вещества, ангиотензин и альдостерон, являются важными регуляторами
кровяного давления. Однако при очень сильном повышении их уровня может
возникнуть артериальная гипертензия. По этой причине действие многих ле-
карственных препаратов от повышенного (артериального) давления направ-
лено на выработку или высвобождение одного или сразу обоих этих гормонов.
Уровень альдостерона в крови измеряется в единицах РАС (Plasma Aldosterone
Concentration — концентрация альдостерона в плазме).
ГЛАВА 11 Гормоны: информационная система организма 205
Бей или беги: гормональное действие
Эндокринная система, которая вырабатывает гормоны, состоит из ряда со-
вершенно разных органов: печени, яичников или яичек, щитовидной железы,
панкреатической железы и целого ряда других желез — компонентов слож-
ной взаимосвязанной сети. Отказ одного из них оказывает влияние на работу
остальных. Гормоны эпинефрин и норэпинефрин выступают важными компо-
нентами механизма с условным названием “бей или беги”. Оба гормона регу-
лируют множество функций организма.
Изучаем послание: гормональное регулирование
Регуляция гормонов выполняется с помощью нескольких механизмов. Сис-
тема регулирования, основанная на цикле обратной связи, очень простая. Во
многих случаях один гормон стимулирует выработку других так, что ряд дей-
ствий происходит до начала регулирования.
Простая регуляторная петля
С принципами регулирования знаком каждый из нас. Вы усердно готовитесь
к экзамену, но получаете среднюю оценку. Чтобы улучшить ее, вы начинаете
учиться еще усерднее и сдаете повторный экзамен. Ваша оценка обеспечивает
обратную связь, стимулируя улучшение навыков обучения (оптимистичный
сценарий). В организме человека система регулирования начинается с опреде-
ления стимула, который сигнализирует железе выработать гормон. Сам гормон
оказывает влияние только на целевой орган или процесс. Действие гормона
приводит к необходимому изменению, что является сигналом для железы пре-
кратить его выработку. Отрицательную обратную связь задает гормон, стиму-
лирующий прекращение выработки исходного гормона.
~ Наглядный пример такого вида обратной связи — выработка инсу-
* лина поджелудочной железой. Повышение уровня глюкозы в крови
является сигналом для железы начать выделять инсулин. Вбрасыва-
НА ПРАКТИКЕ
емыи в кровь инсулин снижает уровень глюкозы в ней, что в свою
очередь выступает сигналом для поджелудочной железы прекратить
выделение инсулина. Здесь отрицательная обратная связь задает-
ся низким уровнем глюкозы. Конечно, процесс описан з заметным
упрощением, ведь спровоцировать выделение инсулина могут дру-
гие факторы. Кроме того повышение уровня глюкозы может послу-
жить толчком для запуска других биохимических процессов, напри-
мер, синтеза гликогена в печени.
206 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
Гнпоталамо-гипофизарное регулирование
Гипоталамо-гипофизарная система — это очень сложный пример совершен-
но иного способа гормонального регулирования. Гипоталамус и гипофиз рас-
положены настолько близко, что ведут себя почти как одно целое.
Изначально центральная нервная система дает сигнал гипоталамусу выс-
вободить гормон, называемый гормон-высвобождающим фактором, переда-
ющий сообщение гипофизу. Гипофиз, оповещенный таким образом, высво-
бождает в кровь другой гормон. Этот гормон направляется в определенный
орган или извещает другой компонент эндокринной системы о необходимости
выделения еще одного гормона. Присутствие такого заключительного гормона
служит отрицательной обратной связью для гипоталамуса, указывая прекра-
тить выработку гормон-высвобождающего фактора для гипофиза. Действия
гормонов оказывают влияние друг на друга — это каскад сдержек и противо-
весов, позволяющий точно отрегулировать степень конечного воздействия —
не слишком сильное или очень слабое. Опять же, мы рассмотрели процесс
в сильно упрощенном виде. В качестве аналогии можно привести родитель-
ский контроль над экзаменационными оценками своего чада. В случае плохой
оценки они сильно расстраиваются и всячески настаивают на более при-
лежном обучении.
Общее представление о рассмотренной выше системе можно получить, из-
учив рис 11.4. На нем она изображена с определенными упрощениями. Напри-
мер, фолликулостимулирующий гормон (ФСГ) высвобождается как у мужчин,
так и у женщин, но у мужчин основным результатом его воздействия будет вы-
работка тестостерона. Несмотря на то, что главной железой обычно называют
гипофиз, на рис. 11.4 этой чести удостоен гипоталамус.
Модели гормонального действия
Чтобы рассчитать молекулярное действие гормонов, были предложены две
модели. Первая — это гипотеза вторичных мессенджеров, которая в основ-
ном относится к белковых и аминовым гормонов. Вторая — стероидное регу-
лирование, касающееся прежде всего стероидов. Чтобы подчеркнуть базовые
положения для каждой модели, обратимся к предельно простому подходу —
правилу KISS,1 которое утверждает, что большинство простых систем рабо-
тает лучше сложных. Реальные процессы требуют внесения в него множества
корректировок.
1 KISS (Keep It Simple, Silly — сделай это просто, глупышка); мнемонический прием
для запоминания.
ГЛАВА 11 Гормоны: информационная система организма 207
Рис. 11.4. Схема гормонального регулирования
Модель вторичных мессенджеров: как электронная почта
Исследование гормонального действия эпинефрина (адреналина) привело к
развитию модели вторичных мессенджеров. Более поздние работы показали,
что модель также применима к другим гормональным системам. В этой модели
гормон связывается с рецепторным местом снаружи клетки. Такое связывание
индуцирует высвобождение другого вещества внутри клетки. Гормон — это
первичный мессенджер, а другое вещество — это вторичный мессенджер.
Например, у позвоночных животных мозговой слой надпочечника выде-
ляет эпинефрин — гормон с типом действия “бей или беги” (см. выше). Это
действие инициирует ряд реакций, включая гликогенолиз — расщепление гли-
когена. В процессе гликогенолиза высвобождается глюкоза, используемая при
быстром производстве энергии. Как и в случае с другими гормонами для запу-
ска целевого действия требуется очень низкая концентрация гормона. В случае
208 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
эпинефрина она приблизительно равна 10"9 моль/л. Выделенный эпинефрин
действует как первичный мессенджер (внешний по отношению к клетке). Мо-
лекулы эпинефрина связываются с участками на определенных рецепторах,
расположенных на поверхности целевых клеток, прежде всего скелетной му-
скулатуры и в меньшей степени печени. Связывание эпинефрина со специфи-
ческими рецепторами клеток печени запускает процесс синтеза циклической
АМФ из аденилатциклазы — фермента, прикрепленного к внутренней части
клеточной мембраны (рис. 11.5). Циклическая АМФ, или цАМФ — это вто-
ричный мессенджер (внутриклеточный). Вторичный мессенджер запускает ряд
событий, прекращающих высвобождение глюкозы (гликогенолиз).
Рис, 11.5. Структура циклической АМФ
Вначале цАМФ связывается с регуляторной субъединицей протеинкиназой,
что приводит к активизации привязанного к мембране фермента. Затем высво-
божденная протеинкиназа активирует киназу фосфорилазы. Этот процесс ну-
ждается в свободных ионах кальция и АТФ. (При мышечных движениях выде-
ляются ионы кальция, которые способствуют процессу.) Киназа фосфорилазы
с участием АТФ и ионов магния приводит неактивную фосфорилазу в актив-
ную форму. Повышенное содержание фермента обеспечивает активное рас-
щепление гликогена с высвобождением D-глюкоза-!-фосфата. Впоследствии
фосфоглюкомутаза превращает D-глюкозу-!-фосфат в D-глюкозу-б-фосфат.
Наконец D-глюкоза-б-фосфат катализирует потерю фосфата с высвобожде-
нием глюкозы, которая может использоваться клеткой или, что более важно,
может поступать в кровь. Фуф!
Фермент протеинкиназа также катализирует превращение гликоген син-
тетазы (активная форма) в фосфо-гликогенсинтетазу (неактивная форма). Та-
ким образом, несмотря на высокий уровень протеинкиназы, выработка нового
ГЛАВА 11 Гормоны: информационная система организма 209
гликогена прерывается. Угнетение синтеза гликогена также означает, что ор-
ганизму доступно больше глюкозы для совершения немедленного действия,
например бегства от разъяренного питбуля.
АМПЛИФИКАЦИЯ
Прикрепление гормона к рецепторному участку провоцирует ответ, который
будет повторяться до тех пор, пока не будет разорвана связь с гормоном. На-
пример, если ответом будет образование молекулы, то запускающий этот про-
цесс гормон будет вызывать образование не одной молекулы, а непрерывного
потока молекул. Такой непрерывный синтез не прекращается до тех пор, пока
гормональная молекула будет оставаться на рецепторе. Согласно этому меха-
низму одна молекула гормона может индуцировать образование тысяч других
молекул. Этот процесс, называемый амплификацией, приводит к более эффек-
тивному результату, чем можно судить по низкой концентрации гормона.
Стероидное регулирование
В отличие от механизма вторичных мессенджеров в стероидном регулиро-
вании гормоны проходят через мембрану и заходят в клетку. Этот механизм
применим к некоторым другим гормонам, например вырабатываемым щито-
видной железой.
Впервые этой моделью было описано действие эстрадиола на ткани матки
у млекопитающих. Эстрадиол или эстроген проходит через клеточную бис-
лойную мембрану, где связывается с эстроген-рецепторным белком. При этом
ковалентная связь не создается, а вместо этого индуцируется конформацион-
ное изменение белка. Изменение формы позволяет белку пройти через обра-
зованный “проем” внутрь клеточного ядра. Затем в клеточное ядро проходит
гормон-протеиновый комплекс, где связывается с определенным участком на
хромосоме. Такое объединение с хромосомой стимулирует транскрипцию для
производства иРНК, которая выходит из ядра и обеспечивает синтез белковых
молекул с помощью механизма трансляции.
У стероидной системы есть три отличительных преимущества перед меха-
низмом вторичных мессенджеров. Во-первых, при стероидном регулировании
гормон проходит непосредственно через клеточную мембрану. Во-вторых, в
цитоплазме (внутриклеточной жидкости) присутствует готовый стероидный
молекулярный рецептор. И наконец, гормон действует на хромосомном уровне.
210 ЧАСТЬ 3 Углеводы, жиры, нуклеиновые кислоты и другие...
lAiEMUogeiaw и
Г®Я; IMF Е
ШгЖЖЯ > .Яж’Ч
»,«^w
JL
вв
ajdi
В ЭТОЙ ЧАСТИ...
Для совершения действия необходима энергия. В этой части
мы сфокусируем свое внимание на том, как клетки получают
и расходуют энергию. Рассмотрим энергетические потреб-
ности организма и попытается понять, куда и с какой целью
тратится энергия. Основным действующим лицом этой гла-
вы будет наш лучший друг и незаменимый помощник —
АТФ. Познакомимся с циклом лимонной кислоты (циклом
Кребса), а в конце — с химическими реакциями, связанными
с образованием азотных соединений.
Глава 12
Жизнь и энергия
В ЭТОЙ ГЛАВЕ...
» Связь АТФ и энергии
» Семейство нуклеозидтрифосфатов
» Переваривание пищи
В этой главе нам предстоит изучить метаболизм, который определяется
как комплекс процессов, обеспечивающих жизнеспособность клетки.
У метаболизма есть две составляющие: катаболизм и анаболизм (ни в
коем случае не проводить параллель с каннибализмом!). Катаболизм — это
процесс разрушения молекул, а анаболизм — процесс их построения. В клетке
одновременно происходят оба процесса. Все метаболические процессы энер-
гозависимые: они происходят либо с поглощением энергии (эндотермические),
либо с ее выделением (экзергонические).
ЗАПОМНИ)
Ключевой молекулой, накапливающей энергию, выступает молекула
аденозинтрифосфата, которая образуется как продукт общего ката-
литического процесса и обозначается аббревиатурой АТФ.
АТФ: энергетический обмен
на молекулярном уровне
Под биоэнергетикой понимается описание основных реакций, задейство-
ванных в выработке и расходовании энергии. Это исследовательское поле по-
ложило начало разработке биоэнергетических принципов, позволяющих уче-
ным исследовать энергетический обмен на микроскопическом уровне.
СОВЕТ
Во многих исследованиях, посвященных биоэнергетике, за еди-
ницу энергии принимают калорию, а не джоуль (Дж). 1 калория =
= 4,184 Дж или 1 килокалория = 4,184 КДж.
При проведении исследований лучше работать с величиной AG°’. Она пред-
ставляет изменение AG° при биологически более оправданном значении pH =
= 7([Н+] = 10“7 М), а не стандартном pH = 0([Н+] = 1 М). В табл. 12.1 приведено
несколько сопоставимых пар значений К и AG°’.
Таблица 12.1. Соотношение между AG°' и К
Дб°' КДж • моль-’ К
-17,1 1000
-11,4 100
-5,7 10
0 1
5,7 0,1
11,4 0,01
17,1 0,001
Как видно в табл. 12.1, чем больше значение К, тем более экзергонической
(спонтанной) будет реакция. Например, при К = 1 концентрация продукта В в
1000 раз превышает концентрацию реагента А, и при этом выделяется 17 КДж
энергии на 1 моль вещества. Не забывайте, что в биологических системах кро-
ме А6°’ также необходимо учитывать различия между [А] и [В]. Например,
повышение концентрации реагента приводит к усилению реакции, тогда как
увеличение концентрации продукта — к ее угнетению.
АТФ как переносчик энергии
Экзергонические процессы позволяют клеткам получать энергию, необхо-
димую для жизни, а основным поставщиком такой энергии выступает АТФ
(рис. 12.1). АТФ обеспечивает клетку энергией, которая расходуется на усиле-
ние эндергонических (неспонтанных) реакций, проходящих в процессе дви-
жения (мышечные сокращения), светового излучения (у жуков-светлячков)
и нагревания (поддержания постоянной температуры) тела.
ГЛАВА 12 Жизнь и энергия 215
Аденозинтрифосфат (АТФ)
Рис. 12.1. Структура АТФ
Гидролиз концевого фосфата АТФ приводит к образованию АДФ и неор-
ганического фосфата, обозначаемого как Р;. На рис. 12.2 показана структура
молекулы АДФ. При таком гидролизе высвобождается 30,5 КДж энергии на
моль вещества.
nh2
О
"О
н | | н
он он
Аденозиндифосфат (АДФ)
Рис. 12.2. Структура АДФ
ЗАПОМНИ!
Изменение концентрации обычно не приводит к сильному измене-
нию количества высвобождаемой энергии.
216 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
Гидролиз концевого фосфата АДФ вызывает образование А МФ и неор-
ганического фосфата, обозначенного как Р;. Структура АМФ приведена на
рис. 12.3. В процессе такой реакции высвобождается 30,5 КДж энергии на
моль вещества. (С биохимической точки зрения эта реакция имеет меньшую
значимость, чем гидролиз АТФ с получением АДФ.)
Аденозинмонофосфат (АМФ)
Рис. 12.3. Структура АМФ
Непосредственное превращение АТФ в АМФ также возможно — в резуль-
тате отщепления пирофосфата (Р2О7") от фосфатной цепи. В биохимии пиро-
фосфат обозначается как PPZ. В процессе такой реакции образуется энергии
немного больше, чем при простом гидролизе с освобождением Р. (около
33,5 КДж на моль вещества). В физиологических условиях фосфатная часть
АТФ и АДФ образует комплекс с ионами магния. При определенных обстоя-
тельствах ионы магния Mg2+ могут быть замещены двухвалентными ионами
марганца Мп2+. На рис. 12.4 показано, как магниевые комплексы включается в
структуры АТФ и АДФ.
Выделение последнего фосфата влечет за собой потерю минимального
количества энергии: 14,2 КДж на моль1. При таком гидролизе расщепляется
эфирная, а не ангидридная связь. В общем случае гидролиз эфирной связи дает
меньше энергии, чем гидролиз ангидридной связи.
ГЛАВА 12 Жизнь и энергия 217
nh2
он он
Аденозинтрифосфат (АТФ)-Мд2+
Аденозиндифосфат (АДФ)-Мд2+
Рис. 12.4. Магниевые комплексы в АТФ и АДФ
Все познается в сравнении:
молекулы, связанные с АТФ
Мало какие биомолекулы в состоянии предоставить столько энергии,
сколько высвобождается при гидролизе АТФ. Одна из них ГТФ. Сравнимое
количество энергии предоставляют некоторые другие молекулы. В табл. 12.2
приводится сравнение некоторых высокоэнергетических молекул с АТФ, а на
рис. 12.5 показаны их структуры.
218 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
Таблица 12.2. Энергия (AG°'h выделяемая некоторыми
высокоэнергетическими молекулами по сравнению с АТФ
Биомолекула Выделенная энергия (КДж на моль-1)
АТФ 30,5
Фосфоаргинин 32,2
Ацетилфосфат 43,3
Фосфокреатинин 43,3
1,3-бифосфоглицерат 49,6
Фосфоэнолпируват 62,2
Фосфоэнолпируват, 1,3-бифосфоглицерат и ацетилфосфат задействованы в
переносе и сохранении химической энергии. Фосфоаргинин и фосфокреати-
нин — это важные молекулы, предназначенные для хранения энергии, полу-
ченной в процессе обмена веществ. Фосфокреатин накапливается в мышцах и
может быстро превращаться в АТФ, чтобы предоставить энергию мышцам для
сокращения. Выработка фосфокреатинина происходит при высокой концентра-
ции АТФ, когда необходимо превысить дефицит энергии в 12,8 КДж на моль
вещества. Обратный процесс переноса фосфата от АТФ к АДФ возникает при
низкой концентрации АТФ. Фосфоаргинин ведет себя аналогично у некоторых
беспозвоночных (у них “стальные” мышцы!).
Семейство нуклеозидтрифосфатов
Как мы уже говорили, основная молекула-переносчик энергии — это АТФ.
Но другие нуклеозидтрифосфаты, такие как ЦТФ, ГМФ, ТТФ и УТФ также
могут выполнять функцию переноса энергии. Кроме того эти пять молекул
частично обеспечивают необходимой энергией процесс синтеза ДНК и РНК.
Все нуклеозидтрифосфаты дают примерно одинаковое количество энергии.
(Заметьте, АТФ необходима для синтеза других нуклеозидтрифосфатов.)
Биосинтез рибонуклеозидтрифосфата с общим названием НТФ начина-
ется с выработки соответствующего монофосфата — НМФ. Для поэтапного
добавления следующих двух фосфатных групп требуется два узкоспецифич-
ных фермента. Такими ферментами являются нуклеозидмонофосфаткиназа и
нуклеозиддифосфаткиназа. (Термином киназа обозначаются трансферазные
ферменты, которые переносят фосфатную группу нуклеозидтрифосфата.) На
рис. 12.6 приведен общий вид такой реакции.
ГЛАВА 12 Жизнь и энергия 219
MH NH2
HN---C--NH-CH2-CH2-CH2-CH2-CH
O I
1 г
-P=O I
I OH
0 Фосфоаргинин
О О
I
сн3-с—О Р—О"
сг
Ацетилфосфат
мн о
HN---С--N---СН2-С--0"
СН3
-О—Р=0
I.
Фосфокреатинин
О
н2с—сн—с
О ОН
О=р—0“ "О—Р=0
О" О"
1,3-бифосфоглицерат
/
СН2=С-С
0=Р----О"
О"
Фосфоэнолпируват
Рис. 12.5. Структуры некоторых
высокоэнергетических молекул
220 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
Нуклеозидмонофосфаткиназа
НМФ + АТФ НДФ + АДФ
Нуклеозиддифосфаткиназа
НДФ + АТФ НТФ + АДФ
Рис. 12.6. Две реакции, катализируемые
киназными ферментами
Образование деоксирибонуклеозидтрифосфата, дНТФ, происходит дву-
мя разными путями. В одном из них мультиферментная система превращает
соответствующий нуклеозиддифосфат в аналогичный деоксирибонуклеозид-
дифосфат. Затем нуклеозиддифосфаткиназа катализирует образование деок-
сирибуноклеозидтрифосфата. Второй путь реализован только у отдельных
микроорганизмов, у которых осуществляется прямой переход НТФ в дНТФ.
Просто, как в школе: АМФ, АДФ и АТФ
АТФ можно подвергнуть гидролизу как до АДФ + Р., так и до АМФ + PPz.
(Пирофосфат подвергается дальнейшему гидролизу до двух фосфатов, 2PZ.)
АДФ и Р. выступают промежуточными соединениями в преобразовании АТФ.
Для производства АТФ из АМФ требуется фермент аденилаткиназа. Этот фер-
мент катализирует перенос фосфатной группы от АТФ к АДФ. Такая реакция
заканчивается образованием двух молекул АДФ. (Аденилаткиназа также ката-
лизирует обратную реакцию.)
Незатрудненный перенос фосфатных групп между нуклеотидами
РЛ создает метаболическую сеть для переноса энергии. Ключевым про-
цессом в такой сети выступает внутриклеточное производство АТФ.
ЗАПОМНИ)
Откуда это все берется
Всем известно, что для снабжения организма энергией необходимо хорошо
кушать. При этом главные источники энергии — это углеводы и жиры. В про-
цессе переваривания полисахариды распадаются на глюкозу и другие моно-
сахариды, жиры расщепляются до глицеринов и жирных кислот. Катаболизм
обеспечивает превращение этих источников энергии в АТФ. В свою очередь
белки расщепляются до аминокислот, которые обычно не выступают источни-
ком энергии. (Детально все реакции описаны в следующих главах.) Из глюко-
зы производится 36 молекул АТФ — в среднем по 6 молекул АТФ на углерод.
ГЛАВА 12 Жизнь и энергия 221
В табл. 12.3 описаны пошаговые изменения при преобразовании молекулы
глюкозы. Схожий механизм присущ другим углеводам.
Таблица 12.3. Количество АТФ на каждом этапе метаболизма глюкозы
Количество
Химические преобразования образованных
молекул АТФ
Активация (превращение глюкозы в 1,6-фруктозодифосфат) -2
Окислительное фосфорилирование 2 (глицеральдегид-3-фос- 4
фат -> 1,3-дифосфоглицерат) с образованием 2НАДФ + Н+
в цитозоле
Дефосфорилирование, 2 (1,3-дифосфоглицерат -> пируват) 4
Окислительное декарбоксилирование 2 (пируват -> ацетил СоА) 6
с образованием НАДФ + Н+ в митохондриях
Окисление двух фрагментов С2 в лимонной кислоте и окисли- 24
тельное фосфорилирование по общим правилам с образовани-
ем 12 АТФ на каждый фрагмент С2
Всего 36
ЧТО ПРОИСХОДИТ ПРИ ПОЛНОМ ГОЛОДАНИИ
Полное голодание — это отказ от потребления пищи. Во время голодания про-
исходит следующее: вначале организм израсходует запасы гликогена. Затем
он примется за сжигание жировых запасов — в первую очередь накопленных
вокруг сердца и почек. Наконец, организм перейдет на резервы питательных
веществ, находящихся в мышцах и костном мозге.
Вначале полного голодания тело усваивает белок с высокой скоростью. Ами-
нокислоты превращаются в глюкозу, поскольку именно ее потребляет голов-
ной мозг. Белки заимствуются из скелетных мышц, плазмы крови и других
источников, что сопровождается производством азотсодержащих продуктов,
подлежащих обязательному выводу из организма. Выделение сторонних ве-
ществ требует большого количества воды — потеря слишком большого ее ко-
личества может привести к смерти в силу обезвоживания.
Если голодание продолжить, то мозг перестроиться на метаболизм жирных
кислот, в которых хранятся последние запасы жиров. После этого организм
начнет потреблять собственные структурные белки, его системы начнут вы-
ходить из строя, и наступит быстрая смерть.
222 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
Любая молекула жира гидролизуется до глицерина и трех молекул жирных
кислот. На одну молекулу глицерина приходится 20 молекул АТФ. Производ-
ство энергии из жирных кислот отличается в зависимости от свойств моле-
кул получаемой кислоты. Стеариновая кислота С18Н36О2 производит в це-
лом 146 АТФ на одну молекулу — в среднем 8,1 АТФ на один атом углерода.
В табл. 12.4 описаны пошаговые изменения при преобразовании стеариновой
кислоты. Схожий механизм наблюдается и у других жирных кислот.
Таблица 12.4. Количество АТФ на каждом этапе метаболизма
стеариновой кислоты
Химические преобразования Количество повторений шага Количество образованных молекул АТФ
Активация (стеариновая кислота -> стеарил-СоА) 1 -2
Дегидрогенизация (ацил-СоА -> трансеноил-СоА) с образованием ФАДН2 8 16
Дегидрогенизация (гидроксиацил-СоА кето- ацил-СоА) с образованием НАДН + Н+ 8 24
Фрагмент С2 (ацетил-СоА -> общий катаболизм) с образованием 12 АТФ на каждый фрагмент С2 9 108
Всего 146
ГЛАВА 12 Жизнь и энергия 223
Глава 13
АТФ: энергетическая
единица организма
В ЭТОЙ ГЛАВЕ...
» Углеводный обмен и цикл лимонной кислоты
» Транспорт электронов и окислительное
фосфорилирование
» Биосинтез
В этой главе нам предстоит познакомиться с рядом общих биохимических
процессов, которые сопровождаются как высвобождением, так и погло-
щением энергии. Выделение энергии обычно происходит при расще-
плении молекул. При этом расщепление одной молекулы нередко сопряжено с
синтезом другой, и часто такой вновь синтезированной молекулой выступает
аденозинтрифосфат, или АТФ. Под катаболизмом понимают процесс расще-
пления молекул с выделением энергии, а под анаболизмом — процесс обра-
зования молекул. Рассматриваемые вместе, оба процесса составляют метабо-
лизм, предопределяющий реакции, происходящие в биологических системах.
Как известно из главы 12, АТФ является энергетической единицей организ-
ма. Существуют и другие молекулы, накапливающие энергию, но АТФ — это
эталон, на который равняются они все. Расщепление определенных молекул
приводит к высвобождению АТФ, которая включается в синтез других моле-
кул. Полисахариды и жиры напоминают “аккумуляторные батареи”, хранящие
запасы энергии для дальнейшего использования.
Метаболизм первого типа: гликолиз
В самом простом понимании путь Эмбдена-Мейергофа (звучит как назва-
ние немецкой автомагистрали), или гликолиз — это процесс извлечения энер-
гии из органических молекул. Этот процесс анаэробный, т.е. происходит без
участия кислорода, а глюкоза превращается на две молекулы молочной кис-
лоты. Практически все биологические формы жизни, будь то человек или,
например, медуза используют глюкозу. Все углеводы проходят такой путь.
В аэробном преобразовании углеводов принимает участие производная глю-
козы — пируват. (Пируват и глюкоза также вырабатываются в процессе спир-
тового брожения. Глюкоза преобразуется в две молекулы этанола и две моле-
кулы СО2.) Процесс гликолиза выполняется в два этапа, которые далее будут
обозначаться, как фаза I и фаза II. На рис. рис. 13.1 и 13.2 проиллюстрирован
процесс гликолиза, предваряя предстоящее, признаемся честно, непростое его
обсуждение. По мере изучения дальнейшего материала мы будем возвращаться
к этим рисункам снова и снова.
Глюкоза: там, где все начинается
Гликолиз проходит два этапа — первую и вторую фазы.
Фаза I
Поступая в клетку, глюкоза сразу же подвергается фосфорилированию с об-
разованием глюкоза-6-фосфата. Это первый шаг фазы I. Фосфат выделяется
из АТФ, а перенос катализируется ферментом гексокиназа с помощью ионов
Mg2+. Таким образом, первый шаг в производстве энергии сопровождается
потреблением энергии, необходимой для активирования глюкозы в реакции,
которую не так уж и легко обратить в исходную форму. Кроме того, наличие
заряженной фосфатной группы затрудняет диффузию этого и других промежу-
точных веществ из клетки.
Затем фермент фосфоглюкоизомераза катализирует реакцию изомеризации
глюкоза-6-фосфата до фруктоза-6-фосфата. В результате появляется соедине-
ние с первичной спиртовой группой, которая легче поддается фосфорилирова-
нию, чем изначально присутствующий в клетке гемиацеталь. Потом фрукто-
за-6-фосфат вступает в реакцию с другой молекулой АТФ, чтобы образовать
фруктоза-1,6-бифосфат. Ферментом на этом этапе является фосфофруктокина-
за (постарайтесь произнести ее название как можно быстрее!) — этому фер-
менту для активизации требуются ионы Mg2+. АТФ ингибирует этот фермент,
в то время как АМФ — активирует. Это главный регуляторный шаг в реакции
гликолиза.
226 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
Глюкоза
С АТФ
АДФ + Р,
Глюкоза-6-фосфат
Фосфоглюкоизомераза
Фруктоза-6-фосфат
С АТФ
АДФ + Р,
Фруктоза-1,6-бифосфат
Альдолаза v
Дигидроксиацетонфосфат
Глицеральдегид-З-фосфат
‘ /- НАД+ + Р/
Глицеральдегид-З-фосфатдегидрогеназа I
НАДН + Н
1,3-бифосфатглицерат
‘l/- АДФ + Р,
Фаза!
Фаза II
Фосфоглицераткиназа
АТФ
3-фосфоглицерат
Фосфоглицеромутаза
2-фосфоглицерат
Энолаза
г
Фосфоэнолпируват
' х- АДФ + Р,
Пируваткиназа
АТФ
Пируват
Рис. 13.1. Этапы гликолиза
ГЛАВА 13 АТФ: энергетическая единица организма 227
о
он н
Фруктоза-6-фосфат Фруктоза-1,6-бифосфат
О
/О—Р—0“
сн2 I
I °"
о=с
сн2
\)Н
Дигидроацетонфосфат
н—с—он
I о-
СН2 I
'о—Р О"
о
н—с—он
I т
СН2 |
'О--Р--О"
Глицеральдегид-З-фосфат
н—с—он
I °-
сн2
'о— -О"
о
2-фосфоглицерат
3-фосфоглицерат
о
0 о 1,3-бифосфоглицерат
о
с—о—р—О"
сн2 о- о о-
Фосфоэнолпируват Пируват
с=о
сн3
Рис. 13.2. Молекулы, участвующие в гликолизе
Альдолаза ферментативным путем расщепляет фруктоза-1,6-бифосфат
на два триозофосфата: дигидроксиацетонфосфат и глицеральдегид-3-фос-
фат. Чтобы завершить фазу I дигидроксиацетонфосфат изомеризуется до
228 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
глицеральдегид-3-фосфата. Эту изомеризацию катализирует триозофосфати-
зомераза. (Теперь вы понимаете, насколько важны рис. 13.1 и 13.2.)
По завершению фазы I образуются две молекулы глицеральде-
ду гид-3-фосфата, которые обходятся в две молекулы АТФ и не произ-
заломни! В°ДЯТ энергии.
Фаза //
Фаза II начинается с синхронного фосфорилирования и окисления глиу-
реальдегид-3-фосфата с образованием 1,3-бифосфоглицерата. Катализатором
такого преобразования выступает глицеральдегид-3-фосфатдегидрогеназа.
Источником фосфатов является неорганический фосфат. НАД+ — вещество,
которое может служить как ферментом, так и окислителем. Он восстанавлива-
ется до НАДН.
У 1,3-бифосфоглицерата есть высокоэнергетическая связь. В присутствии
ионов Mg2+ фосфоглицераткиназа катализирует прямой перенос фосфата из
1,3-бифосфоглицерата к АДФ. В результате образуется АТФ и 3-фосфоглице-
рат. Поскольку образование АТФ сопровождается прямым переносом фосфата,
процесс называется субстратным фосфорилированием (не путайте с окисли-
тельным фосфорилированием, описанным ниже). Затем фосфоглицеромутаза
катализирует перенос фосфатной группы от С-3 к С-2, таким образом превра-
щая 3-фосфоглицерат в 2-фосфоглицерат.
В результате дегидратации происходит выделение воды с образованием
фосфоэнолпирувата (ФЭП), который включает высокоэнергетическую связь.
Ферментом, который катализирует реакцию, выступает энолаза.
Последним необратимым шагом является субстратное фосфорилирование.
Здесь, молекула АДФ получает фосфатную группу от ФЭП. Этому ферменту
нужны не только ионы Mg2+, но и ионы К+. Вторым продуктом реакции являет-
ся пируват. Ух, ты! Глубоко вдохните перед тем, как двигаться дальше.
В течение фазы II две молекулы глицеральдегид-3-фосфата (из
фазы I) образуют две молекулы пирувата с образованием четырех
запомни! молекул АТФ и двух молекул НАДН.
Перед пируватом, образовавшимся в процессе гликолиза, открывается не-
сколько перспектив. При достаточном количестве доступного кислорода пи-
руват переходит в цикл Кребса, цепь транспорта электронов, и становится на
путь окислительного фосфорилирования в виде ацетил-СоА. Это приводит к
повышенному образованию АТФ и общего числа молекул СО2. Если кислорода
недостаточно, то у позвоночных, включая нас с вами, пируват преобразуется в
сопутствующее вещество — лактат. У других организмов, таких как дрожжи,
ГЛАВА 13 АТФ: энергетическая единица организма 229
пируват трансформируется в этанол и СО2 — так варят пиво (тут просто обязан
звучать пивной тост!). Последние два пути позволяют добыть меньше энергии,
чем в механизме окисления.
Эффективность высвобождения энергии
Гликолиз — это начальный этап преобразования углеводов в энергию. За
ним следует производство двух молекул АТФ, двух молекул НАДН и двух мо-
лекул пирувата. Энергетическая ценность молекул АТФ составляет только 2%
от общего количества энергии в каждой молекуле глюкозы. Это число указы-
вает на чрезвычайно низкую эффективность анаэробного способа получения
энергии. К счастью, молекулы пирувата подвергаются дальнейшему аэробному
воздействию — окислению, позволяя увеличить количество высвобождаемой
энергии. Общий энергетический выход анаэробного и аэробного окисления
глюкозы составляется 36 молекул АТФ, которые составляют 30% от общей
энергии, запасенной молекулой глюкозы. У теплокровных животных большая
часть оставшейся энергии расходуется в виде тепла.
Возвращаемся обратно: глюконеогенез
Глюконеогенез представляет собой серию реакций, приводящих к образо-
ванию глюкозы из неуглеводных ресурсов. Он нужен для обеспечения орга-
низма глюкозой в случае недополучения углеводов вместе с продуктами пита-
ния (разве сейчас такое встречается?). К неуглеводным источникам относится
лактат, пируват, некоторые аминокислоты и глицерин. В большинстве случа-
ев глюконеогенез — это процесс, обратный гликолизу. Этапы глюконеогенеза
проиллюстрированы на рис. 13.3. (В растениях глюкоза образуется в процессе
фотосинтеза.)
В гликолизе и глюконеогенезе участвует большое количество похожих про-
межуточных соединений, допускающих использование одинаковых фермен-
тов. Регуляция обеспечивается разницей (всего четыре фермента) между этими
двумя системными процессами, поэтому один процесс ни в коей мере не отме-
няет другой.
Спиртовое брожение: величайшее достижение эволюции
В анаэробных условиях грибки и другие организмы преобразуют пируват
в этанол и углекислый газ. (Верный индикатор процесса — это реакция фер-
ментации, сопровождающаяся появлением пузырьков в пиве и шампанском.)
Такой процесс, делающий возможным окислении НАДН до НАД+, запускается
и в гликолизе. В результате производятся две молекулы АТФ.
230 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
Разные аминокислоты
Пируваткарбоксилаза
со2
*- Пируват-.-------Лактат
АДФ + Р,,+
Mg2
АТФ
Разные аминокислоты
►Оксалоацетат
Фосфоэнолпируваткарбокиназа |-рф
Фосфоэнолпируват
' Н2О
Энолаза
2-фосфоглицерат
Фосфоглицеромутаза
3-фосфоглицерат
' s- АТФ
Фосфоглицераткиназа
АДФ + Р,
1,3- бифосфоглицерат
НАДН
Глицеральдегид-З-фосфатдегидрогеназа
Глицеральдегид-З-фосфат НАД+
Триозофосфатизомераза
Дигидроксиацетонфосфат **-
Р н2о
Фруктоза-6-фосфат Фруктоза-1,6-бифосфат
Глицерол
Адолаза
Фосфоглюкоизомераза
Глюкоза-6-фосфат
Р,
Н2О
Глюкоза
Рис. /3.3. Этапы глюконеогенеза
ГЛАВА 13 АТФ: энергетическая единица организма 2J1
На первом этапе спиртового брожения пируват подвергается декарбоксили-
рованию с образованием углекислого газа и ацетальдегида. Фермент пируват-
декарбоксилаза вместе с кофактором в виде ионов Mg2+ и ТПФ (триаминпи-
рофосфат) катализирует этот шаг. Преобразование ацетальдегида до этанола
катализируется с помощью фермента алкогольдегидрогеназы вместе с кофер-
ментом НАДН. Рис. 13.4 дает общее представление об этапах процесса.
1. Реакция пируватдекарбоксилазы
ТПФ
С =0
I
сн3
Пируват
Mg24
С02 + сн3
Ацетальдегид
2. Реакция алкогольдекарбоксилазы
Рис. 13.4. Этапы спиртового брожения
сн3
Этанол
о
Метаболизм второго типа: цикл
лимонной кислоты (Кребса)
Цикл лимонной кислоты и окислительное фосфорилирование — это аэроб-
ные процессы катаболизма, которые приводят к высвобождению энергии
(АТФ). Цикл лимонной кислоты еще называют циклом Кребса, или циклом
трикарбоновых кислот (ТКК). Молекула, с которой все начинается в этой
цепи реакций, — ацетил-СоА (сокращенно от ацетил-коэнзим А). Источником
ацетил-СоА выступает пируват, полученный в процессе гликолиза, отдельные
аминокислоты или жирные кислоты, входящие в состав жиров. Структура аце-
тил-СоА показана на рис. 13.5. Примечание'. Описанные процессы протекают в
митохондриях — клеточных энергетических фабриках.
232 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
Фосфорилированный АДФ
Пантотенат
Цистеин Ацетил
Рис. 13.5. Структура ацетил-СоА
Выступая источником энергии, ацетил-СоА также является стартовым мате-
риалом для синтеза множества биомолекул. В следующих нескольких разделах
мы обсудим цикл лимонной кислоты. В общих чертах этот цикл проиллюстри-
рован на рис. 13.6, а его структуры — на рис. 13.7.
Пожалуй начнем: синтез ацетил-СоА
Синтез молекулы ацетил-СоА — это многоэтапный процесс. Этапы объеди-
няются по принципу “захвата” энергии, полученной в результате декарбокси-
лирования. На первом этапе пируват соединяется с ТПФ (тиаминпирофосфа-
том) и подвергается декарбоксилированию. Катализатором этого этапа высту-
пает компонент мультиферментного комплекса — пируватдегидрогеназа. На
втором этапе производная ТПФ окисляется и образует ацетильную группу, ко-
торая перемещается к липоамиду. В этой реакции образуется ацетиллипоамид,
ГЛАВА 13 АТФ: энергетическая единица организма 233
а окислителем является дисульфидная группа липоамида. Эту реакцию ка-
тализирует все та же пируватдегидрогеназа. На завершающем шаге ацетиль-
ная группа ацетиллипоамида переходит к коэнзиму А, чтобы образовать аце-
тил-СоА. Катализатором этой реакции выступает дигидролипоилтрансаце-
тилаза (другой компонент пируватдегидрогеназного комплекса). На рис. 13.8
показан упрощенный вариант всех этапов процесса.
Рис. 13.6. Цикл лимонной кислоты (Кребса)
234 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
Цитрат
Изоцитрат
а-кетоглутарат
Сукцинил-СоА Сукцинат
Фумарат
Малат
Оксалоацетат
Рис. 13.7. Структуры молекул, участвующих в цикле лимонной кислоты
ГЛАВА 13 АТФ: энергетическая единица организма 235
С02 2 е”
СН3-С----S----СоА
Ацетил-СоА
Рис. 13.8. Упрощенная схема поэтапного образования ацетил-СоА
Однако на образовании ацетил-СоА процесс не завершается. Окисленная
форма липоамида должна восстановиться. Катализирует этот шаг фермент
дигидролипоилдегидрогеназа. Два электрона при окислении перемещаются к
ФАД, а затем — к НАД+. Важные промежуточные вещества, образуемые на
этом шаге, показаны на рис. 13.9.
NH2
Тиаминпирофосфат (ТПФ)
Липоамид
О
Ацетиллипоамид
Рис. 13.9. Структуры ТПФ, липоамида и ацетиллипоамида
236 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
Трое — это уже толпа: трикарбоновые кислоты
Включаясь в цикл лимонной кислоты, ацетил-СоА взаимодействует с окса-
лоацетазой в присутствии цитратсинтазы. Это взаимодействие приводит к пе-
реносу ацетильной группы от цитрата к оксалоацетату. Гидролиз тиоэфирной
связи ацетил-СоА высвобождает огромное количество энергии.
Фермент аконитаза с кофактором Fe2+ катализирует изомеризацию цитра-
та до изоцитрата. Долгое время считалось, что неотъемлемой частью цикла
лимонной кислоты является цис-аконитаза, производная аконитазы. Однако
оказалось, что промежуточной структурой в образовании изоцитрата и частью
цикла лимонной кислоты выступает вещество цис-аконитат. Структура цис-
аконитата показана на рис. 13.10.
Рис. 13.10. Структура
цис-аконитата
Окислительное декарбоксилирование
Следующий шаг заключается в преобразовании изоцитрата в а-кетоглутарат
с промежуточным состоянием, представленным оксалосукцинатом. Изоцитрат
связывается с ферментом изоцитратдегидрогеназой. В это же время кофермент
НАД+ подвергается реакции восстановления. Как АТФ, так и НАДН относятся
к отрицательным факторам аллостерической регуляции активности изоцитрат-
дегидрогеназы, а АДФ выступает ее положительным фактором. Это важный
механизм регуляции в производстве АТФ.
Получение сукцината и ГТФ
Преобразование а-кетоглутарата в сукцинат проходит в два этапа. Для обра-
зования комплекса а-кетоглутарат должен связаться с а-кетоглутаратдегидро-
геназой. Для реакции необходимы те же кофакторы, что и при образовании
ацетил-СоА. В результате ее проведения удаляется углекислота и образуется
ГЛАВА 13 АТФ: энергетическая единица организма 237
сукцинил-СоА. В физиологических условиях этот процесс является необра-
тимым.
На втором этапе сукцинил-СоА отделяется, чтобы образовать сукцинат и
выделить энергию, которая используется при превращении ГДФ в ГТФ. Та-
кое фосфорилирование субстрата катализируется сукцинил-СоА-синтетазой.
(В ГТФ содержится примерно столько же энергии, как и в АТФ; эта молекула
может замещать АТФ.)
Восстановление оксалоацетата
Восстановление оксалоацетата завершает цикл, для чего требуется проведе-
ния трех реакций, которые сообща превращают метилен в карбонильную груп-
пу. Во-первых, атом водорода удаляется из каждых двух соседних атомов угле-
рода, что в итоге приводит к образованию двойной связи. Потом к этой связи
добавляется молекула воды. Наконец, удаление двух атомов водорода приводит
к образованию соответствующей а-кетоновой группы. Сукцинатдегидрогеназа
катализирует первую из этих реакций. Простетическая группа, ФАД, принима-
ет два атома водорода посредством ковалентных связей, образованных с фер-
ментом. Следующий этап катализируется фумаразой. Финальное окисление
выполняется с участием фермента малатдегидрогеназы с двумя коферментами
НАД+. Оксалоацетат готов включиться в цикл заново.
Аминокислоты как источник энергии
Процесс получения энергии из аминокислот начинается с удаления ами-
ногруппы. Обычно эта реакция связана с трансаминированием — переходом
аминогруппы от одной молекулы к другой. Ему подвергаются все аминокисло-
ты, кроме треонина, пролина и лизина. Обычно аминогруппы переходят к угле-
род-связанному кетоновому комплексу а-кетоглутарата, оксалоацетата или пи-
рувата, чтобы образовать соответственно глутамат, аспартат или аланин . Здесь
востребованными оказываются специфические трансаминазы, а катализаратором
процесса выступает кофермент пиридоксальфосфат. Второе трансаминирование
выполняется как часть процесса преобразования аспартата и аланина в глутамат.
В процессе окислительного дезаминирования глутамат преобразуется в
а-кетоглутарат. В результате этого процесса, изначально возникающего в пече-
ни, высвобождаются ионы аммония. Обратная реакция — синтез глутамата —
представляет одну или несколько реакций, протекающих у животных, в кото-
рых неорганический азот заключается в органическую форму. Ион аммония,
полученный в окислительном дезаминировании, может принимать участие в
одной или нескольких каскадных биохимических реакциях или в цикле обра-
зования мочевины. У большинства позвоночных ион аммония преобразуется
до мочевины, которая выводится с мочой. Большинство морских организмов,
238 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
включая рыб, выделяют аммиак непосредственно, в то время как птицы, насе-
комые и рептилии преобразуют аммоний в мочевую кислоту.
Продукты трансаминирования, окислительного дезаминирования и даль-
нейшего преобразования остатков аминокислот являются промежуточными
веществами в гликолизе или цикле лимонной кислоты. Такую участь постига-
ют все аминокислоты — некоторые из них выступают промежуточным соеди-
нением только единожды, в то время как другие — заметно чаще. На рис. 13.11
Глюкоза
” Аланин
Лейцин
Лизин
Фенилаланин
Тирозин
Пируват
Цистеин
л Глицин
Серин
Треонин
Ацетоацетил-СоА
Изолейцин
►Ацетил-СоА-*-------- Лейцин
Аргинин
Глутамат
Глутамин
Гистидин
Пролин
Рис. 13.11. Роль аминокислот в гликолизе
ГЛАВА 13 АТФ: энергетическая единица организма 239
НА ПРАКТИКЕ
показано, как и когда каждая аминокислота принимает участие в гликолизе;
некоторые аминокислоты делают это больше одного раза.
И хотя углеводы относятся к наиболее доступным источникам энер-
гии, в некоторых ситуациях в их роли могут использоваться ами-
нокислоты. Эта возможность особенно важна для плотоядных (по-
добных человеку), рацион питания которых включает большое коли-
чество белковой пищи. Кроме того использование аминокислот как
источника энергии оказывается важным компенсаторным механиз-
мом, задействуемым организмом при гипогликемии, во время поста
или голодания.
Транспорт электронов и окислительное
фосфорилирование
Производство НАДН и ФАДН2 в цикле лимонной кислоты позволяет обе-
спечить материалами следующую фазу — окислительное фосфорилирование.
Эти восстановленные ферменты переносят электроны, полученные при окис-
лении пирувата. Окончательная судьба таких электронов заключается в восста-
новлении кислорода до воды.
Детально изучить процесс окислительного фосфорилирования не так про-
сто, как гликолиз и цикл лимонной кислоты, поскольку он происходит в ми-
тохондриях, а большинство вовлеченных в него белков встроены в их стенки.
Кроме того, многие процессы связаны между собой. Отдельные проявления
спаренных процессов настолько близки, что требуют специального порядка
рассмотрения.
Система транспорта электронов
Окислительно-восстановительным реакциям подвергаются многочис-
ленные вещества, находящиеся в митохондриях. При окислении электроны
теряются, а при восстановлении приобретаются. Это вызвано тем, что чис-
ло потерянных электронов всегда должно равняться числу приобретенных
электронов. Восстановительный потенциал указывает на то, насколько легко
молекула подвергается окислению или восстановлению. К молекулярным ве-
ществам, принимающим участие в системе транспорта электронов, относятся
пиридиновые дегидрогеназы, флавиновые дегидрогеназы, белки, содержащие
серу и железо, убихиноны (кофермент Q) и цитохромы.
2Д0 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
Соблюдаем меры безопасности: восстановительные потенциалы
Для восстановительных потенциалов стандартной считается реакция сле-
дующего вида.
2Н+(вода) + 2е"^=^ Н2(г).
При нормальных условиях (температуре Т = 25 °C, давлении Р = 1 атм и
концентрации ионов водорода [Н+] = 1 моль) стандартный восстановительный
потенциал равняется Е° = О В. У людей при физиологических условиях это
значение равняется -0,42 В (обозначается как Е'°), поскольку такие условия не
относятся к стандартным.
В табл. 13.1 приведены значения физиологических восстановительных по-
тенциалов для некоторых реакций. О том, как их применять в расчетах, будет
показано далее. Значение в таблице приведены в порядке увеличения потенци-
ала. Чем выше значение, тем эффективнее реакция окисления, и чем оно ниже,
тем эффективнее реакция восстановления.
Таблица 13.1. Некоторые физиологические восстановительные
потенциалы (F'°)
Восстановительный потенциал Е'°,В
Ферредоксин-Ре3+ + е" ферредоксин-Ре2+ -0,43
2Н+(вода) + 2е-±5 Н2(г) -0,42
а-кетоглутарат + СО2 + 2Н+ + 2е“ изоцитрат -0,38
НАД+ + Н+ + 2е" НАДН -0,32
ФАД + 2Н+ + 2е- *5 ФАДН2 -0,22
Рибофлавин + 2Н+ + 2е" рибофлавин-Н2 -0,20
Дигидроацетонфосфат + 2Н+ + 2е“ глицерол-3-фосфат -0,19
Пируват + 2Н+ + 2е" лактат -0,19
Оксалоацетат + 2Н+ + 2е" *5 L-малат -0,17
Фумарат + 2Н+ 4- 2е" сукцинат +0,03
Цитохром b-Fe3+ 4- е" цитохром b-Fe2+ +0,08
Цитохром c-Fe3+ + е~ цитохром c-Fe2+ +0,22
Цитохром c1-Fe3+ + е- цитохром q-Fe2* +0,23
ГЛАВА 13 АТФ: энергетическая единица организма 2Д1
Окончание табл. 13.1
Восстановительный потенциал Е'°, В
Цитохром a-Fe3+ + е цитохром a-Fe2+ +0,29
Цитохром a3-Fe3+ + е“ цитохром a3-Fe2+ +0,38
У2О2 + 2Н+ + 2е“ Н2О +0,82
Каждая реакция из табл. 13.1 называется полуреакцией. Две полуреакции —
окисление и восстановление — незаменимые составляющие общей окисли-
тельно-восстановительной реакции. Количество утраченных при окислении
электронов должно равняться количеству электронов, присоединенных при
восстановлении. По этой причине электроны рассматриваются только в полу-
реакциях, и никогда — в общей.
Обычно все реакции из табл. 13.1 считаются восстановительными
полуреакциями. Чтобы преобразовать их в окислительные полуре-
акции, необходимо сделать две вещи. Сначала обратить реакцию, а
затем поменять знак у величины Е . В окислительно-восстанови-
тельных процессах общие реакции рассчитываются как комбинация
(сумма) окислительных и восстановительных реакций. Перед сум-
мированием реакций убедитесь, что в каждой из них указано одина-
ковое число электронов. Для этого может потребоваться умножить
одну или обе реакции на величину, обеспечивающую уравнение ко-
личества электронов. (Умножению подлежат только реакции, но не
величина £’° — у нее всего лишь изменяется знак на противополож-
ный.) Например, изучим следующие реакции, описанные в таблице.
НАД+ + Н+ + 2е~ НАДН -0,32 В
Цитохром b-Fe3+ + е~ цитохром b-Fe2+ +0,08 В
Теперь заменим первую реакцию окислительной реакцией.
НАДН НАД+ + Н+ + 2е~ +0,32 В
Перед комбинированием этих реакции нужно умножить реакцию преобра-
зования цитохрома на 2 (чтобы с обеих сторон вовлекалось по два электрона).
2 цитохром b-Fe3+ + 2е~ 2 цитохром b-Fe2+ +0,08 В
Число потерянных электронов должно равняться количеству присоединен-
ных электронов. Также обратите внимание, что удваивается реакция, но не
2Д2 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
заряд. Теперь можно комбинировать эти две реакции, удаляя электроны с обе-
их сторон.
НАДН НАД+ + Н+ + 2е~
2 цитохром b-Fe3+ + 2е 2 цитохром b-Fe2+
+0,32 В
+0,08 В
НАДН + 2 цитохром b-Fe3+ 2 цитохром b-Fe2+ + НАД+ + 2Н+ +0.40 В
ЗАПОМНИ!
В конце преобразования по обе стороны от стрелок не остается ни
электронов, ни веществ. Всякий раз, когда сумма двух потенциалов
оказывается положительной, в результате реакции вырабатывается
энергия. И наоборот, отрицательное значение указывает на проте-
кание реакции с поглощением энергии. Чем выше суммарное значе-
ние, тем большее количество энергии производится.
Дегидрогеназы, связанные с пиридином
Для работы ферментов необходимы коферменты НАД+ или НАДФ+, кото-
рые существуют как в окисленной, так и в восстановленной форме. Если об-
щую форму субстрата в восстановленной форме обозначить как Z-H2, а в окис-
ленной — как Z, то можно записать следующую реакцию.
Z-H2 + НАД+ (или НАДФ+) Z + НАДН(или НАДФН) + Н+
Существует более 200 пиридиновых дегидрогеназ. Большинство НАД+-де-
гидрогеназ участвуют в клеточном дыхании. Большинство НАДФ+-дегидроге-
наз принимают участие в биосинтезе.
Флавиновые дегидрогеназы
Ферментам этого типа (Е) нужна ФАД или ФМН в виде простетических
групп с прочными связями или коферментами. Опять же, вещества могут быть
как в окисленной, так и в восстановленной форме. С общей формой записи
реакции этого типа можно познакомиться ниже.
Z-H2 + Е-ФАД Z + Е-ФАДН2
Z-H2 + Е-ФМН Z + Е-ФМНН2
НАДН-дегидрогеназа, в состав которой входит простетическая группа
ФМН, является ферментом, отвечающим за перенос электронов от НАДН к
следующему акцептору в цепи транспорта электронов. Существуют и другие
флавиновые дегидрогеназы такие, как сукцинатдегидрогеназа.
ГЛАВА 13 АТФ: энергетическая единица организма 243
Белки, содержащие серу и железо
Эти белки характеризуются наличием железа или серы в виде ионов S2".
Способность таких белков переносить электроны обеспечивается парой
Fe2+/Fe3+. Некоторые из белков связаны с цепью транспорта электронов, в кото-
рой они объединяются с другими дыхательными молекулами, например сукци-
натдегидрогеназой с двумя железо-серными кластерами или НАДН-дегидроге-
назой с четырьмя железо-серными кластерами.
Убихиноны
Убихиноны — это группа жирорастворимых коферментов. Примером уби-
хинона является кофермент Q (CoQ). Окислительно-восстановительным цен-
тром в нем выступает производная хинона, а жирорастворимость усиливается
наличием длинной гидрокарбонатной цепи, состоящей из серии изопреновых
единиц. Все убихиноны отличаются только разным количеством изопреновых
единиц. Окисленная форма кофермента Q — это простой CoQ, в то же время
его окисленная форма представлена соединением CoQH2. На рис. 13.12 показа-
на общая структура окисленной и восстановленной форм убихинона.
Цитохромы
Цитохромы представляют группу белков, содержащих гемовую группу.
У них, как и у белков, содержащих железо и серу, сопряженной парой будет
Fe2+/Fe3+. Существует три класса цитохромов: а, b и с. Названия классов были
получены в ходе изучения спектральных данных, проводимого во время пер-
вого выделения этих молекул. Цитохромы возникают как в митохондриях, так
и в эндоплазматическом ретикулуме. Гемовая группа, присутствующая во всех
цитохромах, такая же, как в миоглобине и гемоглобине. У всех них общее ядро
(центральная часть), а различия проявляются в боковых цепях, прикрепленных
к нему. На рис. 13.13 показаны ядро гема и место, к которому обычно крепятся
боковые цепи.
В цепь переноса электронов у млекопитающих вовлечено пять цитохромов:
а, а3, Ь, с и сг Цитохром с или cyt с легко извлекается из клетки, поэтому из-
учен лучше всего. Структура цитохрома с представляет интерес с точки зре-
ния биохимической эволюции. Отличия в ядрах цитохромов анализируются
эволюционными генетиками для отслеживания связи между биохимическими
молекулами и популяциями видов.
Цитохромы а и а3, или cyt а и cyt а3 возникают вместе как общий комплекс,
который кроме привычных двух гемовых групп также содержит два иона меди.
Ионы меди относятся к еще одной окислительно-восстановительной паре —
Cu+/Cu2+. Такой комплекс, называемый цитохромоксидазой, выступает терми-
нальным цитохромом, переносящим электроны к О2.
244 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
Окисленный убихинон
сн3 о
-2Н + 2Н
СН3 ОН
СН3 ОН
Восстановленный убихинон
Рис. 13.12. Общие структуры окисленной
и восстановленной форм убихинона
Взаимоотношения компонентов
Звенья цепи переноса электронов сгруппированы в четыре комплекса
с ферментом Q (CoQ) и цитохромом с (cyt с) в качестве связующего звена.
Один из способов определения последовательности событий при транспорте
электронов показан на рис. 13.14. Эта же последовательно проиллюстрирова-
на на рис. 13.15 — на этот раз в виде, подчеркивающем циклическую приро-
ду отдельных этапов. Процесс происходит в четырех комплексах, связанных
ГЛАВА 13 АТФ: энергетическая единица организма 2Д5
ферментом CoQ и цитохромом с. Такие комплексы являются частью внутрен-
ней митохондриальной мембраны.
Рис. 13.13. Ядро гема и места привязки (R)
Окислительное фосфорилирование
Процесс окислительного фосфорилирования тесно связан с транспортом
электронов. Окисление восстановленных форм коферментов ФАДН2 и НАДН
возможно только в присутствии АДФ. Фосфорилирование происходит, когда
продукты окисления соединяются с АДФ, трансформируясь в АТФ.
Изучая окислительно-восстановительный потенциал НАДН и ФАДН2 для
восстановления кислорода, нужно провести следующие расчеты.
НАДН НАД+ + Н+ + 2е~
-О,+2Н++2е“ Н,0
2 * 2 2
-О2 + Н+ + НАДН Н2О + НАД+
2,
+0,32 В
+0,82 В
+1.14 В
2Д6 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
Комплекс II
НАДН—►ФМНСЗ Fe-S)-
НАДН-дегидрогеназа
-►Fe-S
CoQ-<---Fe-S
OAflH2(Fe-S)
Комплекс I
АТФ
cyt b
АТФ — Комплекс III •<
Fe-S
< cytq
cyt c
cyt aa3
АТФ ------Комплекс VI <
O2
Puc. 13.14. Этапы цепи передачи электронов
и
ФАДН2 ФАД + 2Н+ + 2е~ +0,22 В
-О2 + 2Н+ + 2е~ «=> Н2О +0,82 В
-О2 + ФАДН2^Н2О + ФАД +1.04 В
^2
В обоих случаях комбинация потенциалов будет положительной. Каждая
молекула НАДН способна обеспечить энергией выработку трех молекул АТФ,
а каждая молекула ФАДН2 может произвести две молекулы АТФ.
ГЛАВА 13 АТФ: энергетическая единица организма 2Д7
Рис. 13.15. Цепь передачи электронов
и цикличность каждого этапа
ФАДН2л
248 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
Предполагаемые механизмы
В настоящее время механизм окислительного фосфорилирования объясня-
ется с помощью хемиосмотической теории. Она предполагает, что на преобра-
зование АДФ в АТФ, существенно влияет концентрация ионов водорода. Про-
цессы, происходящие в четырех комплексах на внутренней митохондриальной
мембране, в конце концов приводят к перемещению ионов водорода по сети.
В результате такого перемещения увеличивается концентрация ионов водо-
рода в межмембранном пространстве. Обратное перемещение ионов водорода
через мембрану является необходимым условием синтеза АТФ.
Выработка АТФ
В результате реакции окисления глюкозы (гликолиз) и окисления пирувата
из каждой молекулы глюкозы образуется 36 молекул АТФ. Ниже приведено
описание этих реакции.
Окисление глюкозы:
Глюкоза + 2 НАД+ + 2 АДФ + 2 Р. —* 2 пирувата +
+ 2 НАДН + 2 Н+ + 2 Н2О + 6 АТФ.
Окисление пирувата:
2 пирувата + 5 О2 + 30 АДФ +
+ 30 Pz -► 6 СО2 + 34 Н2О + 30 АТФ.
Общая реакция:
Глюкоза + 2 НАД+ + 5 О2 + 32 АДФ +
+ 32 Р, -► 6 СО2 + 36 Н2О +
+ 2 НАДН + 2 Н++ 36 АТФ.
Последнее уравнение иллюстрирует общий принцип производства АТФ.
Подробно все реакции, включенные в него, рассмотрены в предыдущей главе.
Привлекаем жиры: цикл р-окисления
Источником АТФ также могут служить жирные кислоты (вот почему жи-
вотик — это не так уж и плохо). Для разрушения молекулы жирной кислоты
выполняется ряд реакций, называемых Р-окислением или деградацией жирных
кислот. Эти реакции циклические. Важная часть процесса — это окисление
с участием необходимых коферментов НАД+ и ФАД. Сам процесс протекает
в митохондриях, а для начала окисления жирных кислот требуется активация
относительно неактивной формы молекулы жирной кислоты. Активирован-
ная форма молекулы аналогична молекуле ацетил-СоА. В этом случае СоА
ГЛАВА 13 АТФ: энергетическая единица организма 249
связывается с жирной кислотой и образует ацетил-СоА-производную жирной
кислоты. Для ее активации требуется фермент ацетил-СоА-синтетаза и одна
молекула АТФ. АТФ захватывает две молекулы фосфата и становится АМФ.
На внутренней митоходриальной мембране ацил-СоА-производные жирных
кислот соединяются с молекулами карнитина. Эту реакцию катализирует кар-
нитин-ацилтрансфераза. Жирный ацилкарнитин проходит в митохондриаль-
ный матрикс, где преобразуется обратно до ацил-СоА-производной жирных
кислот. Серия из этих четырех реакций вместе с митохондриальным матрик-
сом получила название 0-окисления. Название процесс получил из-за окисле-
ния второго (0) атома углерода с последующей потерей двух атомов углерода у
карбоксильного конца ацил-СоА-производной жирной кислоты. Каждое повто-
рение цикла приводит к удалению двух атомов углерода, а сам цикл продолжа-
ется до полной потери углеродных атомов. На рис. 13.16 проиллюстрированы
общие принципы выполнения цикла.
На первом этапе цикла происходит окисление, катализируемое ацил-Со-
А-дегидрогеназой. Во время этого этапа кофермент ФАД принимает два атома
водорода: первый — из а-углерода, а второй — из 0-углерода. Это стереоспец-
ифический процесс, приводящий к получению транс-формы соединения. В
другой реакции ФАДН2 подвергается повторному окислению до ФАД с выра-
боткой 1,5 молекул АТФ.
На втором этапе транс-алкены подвергаются гидратации с образованием
вторичного спирта. Катализатором этой реакции выступает эноил-СоА-гидра-
таза — стереоспецифический фермент, взаимодействующий только с L-изо-
мером. Затем вторичный спирт окисляется и образует кетоны. Окислителем
выступает НАД+, а ферментом, катализирующем такое окисление, — 0-гидрок-
сиацетил-СоА-дегидрогеназа. Повторное окисление в цепи транспорта элек-
тронов НАДН и НАД+ обеспечивает получение двух молекул АТФ.
На последнем этапе проводится расщепление (нет, не то самое!) 0-кетоа-
цил-СоА с молекулой СоА. В результате образуется ацетил-СоА и ацил-СоА
жирной кислоты с укороченной на два атома углерода структурой. На этом эта-
пе задействуется фермент 0-кетотиолаза (или просто тиолаза). Вновь образо-
ванные молекулы ацил-СоА жирной кислоты повторяют цикл и сокращаются
на две молекулы углерода. Ненасыщенные жирные кислоты также проходят
подобные этапы, но с двумя дополнительными ферментами.
Жирные кислоты дают больше энергии, чем глюкоза. Процесс начинается
с активации жирных кислот, который эквивалентно равняется двум молеку-
лам АТФ. Каждый повтор цикла дает десять молекул АТФ, молекулу ФАДН2
и молекулу НАДН. Молекулы НАДН и ФАДН2 в конечном счете дают четыре
дополнительных молекулы АТФ. Таким образом, при каждом повторе цикла
250 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
вырабатывается четырнадцать молекул АТФ. Кроме того, заключительный
финальный проход приводит к образованию не одной, а двух молекул аце-
тил-СоА.
О
I
R----СН2-СН2-С----О"
Жирная кислота
Ацил-СоА-синтетаза
О
R----СН2-СН2-С-----S-
Ацил-СоА жирной кислоты
°
R---С----S----СоА
/ о
/ II
СН3-С----S----СоА
I Ацетил-СоА-ацетилтрансфераза
\ CoA-SH
О О
I I
R---С----СН2-С-----S---СоА
р-кетоацил-СоА
Рис. 13.16. Основные этапы цикла ft-окисления
ГЛАВА 13 АТФ: энергетическая единица организма 251
Не такие уж и тяжелые: кетоновые тела
Некоторые из выделяющихся молекул ацетил-СоА формируют группу отно-
сительно маленьких молекул, которые называются кетоновыми телами. Осо-
бенную важность кетоновые тела имеют при накоплении ацетил-СоА. Такое
может случиться при очень высокой скорости образования или при неэффек-
тивном использовании ацетил-СоА. Две молекулы ацетил-СоА соединяются в
обратной последовательности на последнем этапе Р-окисления, чтобы образо-
вать ацетоацетил-СоА. Молекула ацетоацетил-СоА взаимодействует с водой
или другой молекулой ацетил-СоА с образованием р-гидрокси-Р-метилглута-
рил-СоА, который в свою очередь расщепляется на ацетоацетат и ацетил-СоА.
Большинство молекул ацетоацетата подвергаются восстановлению до Р-ги-
дроксибутирата, а из оставшихся путем декарбоксилирования получается аце-
тон и углекислый газ. Эти этапы изображены на рис. 13.17.
ДРУГИЕ ВОЗМОЖНОСТИ
В результате расщепления триглицеридов образуется глицерин и три молеку-
лы жирной кислоты. Эти молекулы заходят в цикл Р-окисления и обеспечивают
выделение энергии. Катаболизм глицерина также позволяет получить допол-
нительную энергию. Во-первых, глицерин преобразуется в глицерин-1-фосфат
путем фосфорилирования (или в глицерин-3-фосфат). На это требуется 1 мо-
лекула АТФ. При окислении глицерин-1-фосфата образуется дигидроксиаце-
тонфосфат, который может участвовать в гликолизе. Чистой энергии при этом
производится от 16,5 до 18,5 молекул АТФ.
К группе кетоновых тел относятся ацетон, р-гидроксибутират и аце-
тоацетат.
ЗАПОМНИ!
Образование кетоновых тел в организме происходит изначально в печени,
а затем Р-гидроксибутират и ацетоацетат попадают через общий кровоток в
другие органы. Во время продолжительного голодания кетоновые тела служат
главным источником энергии для некоторых тканей. Избыток кетоновых тел
выводится через почки. В норме в 100 мл крови содержится около 1 мг кето-
новых тел.
При голодании или сахарном диабете, одной из разновидностей диабета,
клетки страдают от недостатка углеводов для обеспечения энергией, что при-
водит к увеличению скорости окисления жирных кислот для компенсации
энергетического дефицита. По мере увеличения количества ацетил-СоА, воз-
никает дефицит оксалоацетата, необходимого для окисления этого ацетил-СоА
252 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
в цикле лимонной кислоты (концентрация оксалоацетата снижается, поскольку
он участвует в синтезе глюкозы). Это приводит к увеличению выработки кето-
новых тел и повышению их уровня в крови. При 3 миллиграммах кетоновых
тел в 100 миллилитрах жидкости возникает состояние, известное как кетоне-
мия — повышенная концентрация кетоновых тел в моче. Кетонемия и кетону-
рия — два условия развития кетоза.
CoA-SH О
2 СН3-С , СН3-С СН2-С\
---Со A S Со А
Ацетоацетат
Р -гидроксибутират
Рис. 13.17. Образование кетоновых тел
Ацетон
Два кетоновых тела представлены кислотами. Накопление кетоновых тел ве-
дет к перегрузке буферных систем крови. Уровень pH крови может опуститься
ГЛАВА 13 АТФ: энергетическая единица организма 253
на 0,5 единиц ниже нормального значения (7,4), вызывая ацидоз — тяжелое
состояние, в котором, кроме всего прочего, затрудняется перенос кислорода
гемоглобином. В результате наступает обезвоживание организма, так как поч-
ки — в попытке удалить избыток кислот — начинают выводить намного боль-
ше жидкости, чем в обычном состоянии. Тяжелый ацидоз может закончиться
комой и последующей смертью.
в
В млекопитающих ацетил-СоА в углеводы не преобразуется. Угле-
воды превращаются в жиры, но не наоборот.
ЗАПОМНИ!
Взгляд в будущее: биосинтез
В процессе катаболизма — одного из проявлений метаболизма — организм
обеспечивается энергией, необходимой для жизни. В свою очередь в процессе
анаболизма — другом аспекте метаболизма — организм снабжается вещества-
ми, необходимыми для роста и замещения. Весь необходимый для метаболиз-
ма материал предоставляется вместе с пищей. Гибкость системы регулируется
рядом путей. Чтобы преодолеть принцип Лешателье, часть путей блокируют-
ся — отчасти из-за того, что ферменты способны катализировать как прямые
и обратные реакции.
Как в катаболических, так и анаболических процессах участвуют почти
одинаковые промежуточные вещества. Молекулы с легкостью меняют один
путь на другой. В целом в анаболических процессах потребляется энергия, вы-
рабатываемая катаболическими процессами. Вы уже успели познакомиться с
одним из анаболических процессов — глюконеогенезом (см. раздел “Возвра-
щаемся обратно: глюконеогенез” выше). Известно, что в процессе гликолиза
возможно восстановление глюкозы и других углеводов. В этом разделе мы ис-
следуем некоторые другие процессы биосинтеза.
Жирные кислоты
Жирные кислоты нужны для образования мембранных липидов. Тем не ме-
нее главной причиной синтеза жирных кислот является преобразование избыт-
ка углеводов пищи в запас жиров (живот не даст соврать). Ключевая молекула
процесса — ацетил-СоА.
У человека жирные кислоты изначально образуются в печени; наш
, W организм умеет синтезировать все жирные кислоты, кроме двух:
линолиевой и линоленовой. Более того линолиевая и линоленовая
на практике кислоты относятся к незаменимым жирным кислотам и должны
254 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
поступать в организм с пищей. Ацетил-СоА, полученный в резуль-
тате гликолиза или р-окисления, вступает в реакцию с ионами би-
карбоната при поддержке АТФ и активировании ацетил-СоА-кар-
боксилазой, образуя молекулу малонил-СоА с тремя атомами угле-
родами (рис. 13.18).
Малонил-СоА
Рис. 13.18. Синтез малонил-СоА
Высвобождение инсулина запускает каскад процессов, в результате кото-
рых активируется ацетил-СоА-карбоксилаза. Выделение инсулина связано с
получением организмом большой порции пищи. Подавляется оно в результате
проведения каскада реакций с помощью двух ферментов: глюкагона и адрена-
лина. У млекопитающих ферменты, необходимые для синтеза пальмитиновой
кислоты из ацетил-СоА и малонил-СоА, собраны в ферментном комплексе с
названием синтаза жирных кислот. В растениях и бактериях эти ферменты
находятся в виде отдельных молекул. Предпосылкой для синтеза являются два
атома углерода, из-за чего у всех природных жирных кислот четное число ато-
мов углерода.
Синтез начинается, когда молекула ацетил-СоА связывается с ацил-пере-
носящим белком (АПБ), а молекула малонил-СоА — со своим АПБ. Затем две
АПБ-связанные молекулы соединяются и высвобождают молекулу диоксида
углерода, АПБ и ацетоацетил-АПБ. Далее следуют три этапа, обратные пер-
вым трем этапам Р-окисления. Во-первых, НАДФН восстанавливает кетоно-
вую группу до спирта. После отщепления спиртовой группы остается двойная
связь между вторым и третьим атомами углерода. Кофермент НАДФН опять
ГЛАВА 13 АТФ: энергетическая единица организма 255
служит как восстанавливающий агент при производстве бутирил-АПБ. После-
довательность повторяется с бутилил-АПБ вместо ацетил-АПБ. Описанные
этапы наглядно проиллюстрированы на рис. 13.19.
Ацетил-СоА
г
N- CoA-SH
/°
СН3-(^
^АПБ
Ацетил-АПБ
Малонил-СоА
Малонил-АПБ
Рис. 13.19. Синтез жирных кислот
256 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
Каскад реакций синтеза продолжается до получения пальмитиновой кисло-
ты с 16 атомами углерода. Общий вид реакции приведен ниже:
8 ацетил-СоА + 14 Н+ + 14 НАДФН +
+ 7 АТФ —► пальмитиновая кислота + 8 Со А +
+ 14 НАДФ+ + 7 АДФ + 7 Pf
После образования пальмитиновой кислоты при необходимости цепь может
укорачиваться или удлиняться в процессе дополнительных реакций. Для этого
применяются разные ферментные комплексы. В результате частичного окисле-
ния насыщенных жирных кислот получаются ненасыщенные жирные кислоты.
Мембранные липиды
Липиды в мембране, как и другие молекулы, синтезируются из составляю-
щих ее компонентов. Подробное описание синтеза жирных кислот приведено
в предыдущих разделах. Для получения соответствующего ацил-СоА жирные
кислоты нужно активировать с помощью ацетил-СоА. Восстановление диги-
дроацетона в процессе гликолиза приводит к образованию глицерол-3-фос-
фата, который при комбинации с соответствующей молекулой ацил-СоА дает
диглицерол-3-фосфат (фосфотидат) (рис. 13.20). Затем фосфотидат вступает в
реакцию с неактивным серином или активированным холином для того, чтобы
образовать соответствующий фосфоглицерид.
Таким же путем образуются сфинголипиды. В этом случае сфинголизин за-
мещает глицерол. Синтез сфингозина начинается с реакции пальмитоила-СоА
с серином в присутствии кислоты. Эта реакция приводит к образованию ко-
энзима А, углекислого газа и прекурсора сфингозина. Окисление прекурсора
приводит к образованию сфингозина (рис. 13.21).
Ацил-СоА может присоединить жирную кислоту к аминовой группе и об-
разовать N-ацилсфингозин (церамид). Реакция спиртовой группы третьего
атома углерода церамида с активированным фосфотидилхолином дает сфин-
гомиелин.
В результате реакции церамида с активированным моносахаридом запуска-
ется синтез гликолипидов. Для завершения синтеза требуются дополнительно
активированные моносахара (например УДФ-глюкоза).
Холестерол — это еще один мембранный липид. Он помогает контролиро-
вать текучесть клеток мембран, а также является предшественником стероид-
ных гормонов. Полный цикл происходит в печени, где соединяются молекулы
ацетил-СоА. Таким образом, молекула холестерола состоит одновременно из
двух атомов углерода.
ГЛАВА 13 АТФ: энергетическая единица организма 257
СН2“ОН
о
сн—он о
СН2“О---Р
о
Глицерол-З-фосфат
R----с-----s----СоА
Ацил-СоА
Фосфатидат
Рис. 13.20. Образование фосфогидратов
Аминокислоты
Синтез аминокислот запускается в случаях, когда рацион питания обеднен
белками. В организме взрослого человека синтезируется 11 из 20 аминокислот.
Аминокислоты, которые подлежат синтезу организмом, известны как незаме-
нимые аминокислоты, и они должны содержаться в рационе питания. Список
заменимых и незаменимых кислот приведен в табл. 13.2.
258 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
о
сн2 -он
сн3
Сфингозин
Рис. 13.21. Образование сфингозина
Таблица 13.2. Заменимые и незаменимые аминокислоты
Незаменимые аминокислоты Заменимые аминокислоты
Гистидин Аланин
Изолейцин Аспарагин
Лейцин Аспартат
Лизин Цистеин
Метионин Глутамат
Фенилаланин Глутамин
Треонин Глицин
ГЛАВА 13 АТФ: энергетическая единица организма 259
Окончание табл. 13.2
Незаменимые аминокислоты Заменимые аминокислоты
Триптофан Пролин
Валин Серин
Вы могли заметить, что в табл. 13.2 указано только 18 аминокислот, а где
же еще две? Заметим, что аргинин является незаменимым для детей, но заме-
нимый для взрослых. Тирозин заменим при наличии достаточного количества
фенилаланина. Глутамат нужен для синтеза пяти аминокислот и может обра-
зовываться при восстановлении а-кетоглутаровой кислоты — промежуточного
соединения в цикле Кребса. Процесс показан на рис. 13.22.
НАДН + н
+ nh4+
сн2
а-кетоглутаровая кислота
НАД + н2о
Глутамат
Рис. 13.22. Равновесие между глутаматом
и а-кетоглутаровой кислотой
По большому счету, это реакция синтеза, в то время как обратная реакция —
это окислительное дезаминирование, выступающее важным этапом катаболиз-
ма белков. Глутамат при необходимости служит в качестве промежуточного со-
единения при биосинтезе аланина, аспарагина, аспартата, глутамина, пролина
и серина. Трансаминирование, проиллюстрированное на рис. 13.23, приводит
к образованию аланина.
В предыдущей реакции замещение пирувата на оксалоацетат даст аспартат.
Избыток фенилаланина можно преобразовать в тирозин путем простого
окисления в присутствии фенилаланингидроксилазы (рис. 13.24).
2б0 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
Глутамат
Пируват
а-кетоглутаровая кислота
сн3
+ НС-----NH3+
Аланин
Рис. 13.23. Образование аланина
+ 1/2 О2
Фенилаланин
Фенилаланингидроксилаза
Рис. 13.24. Синтез тирозина
Метионин служит источником серы в синтезе цистеина, а основой остав-
шейся части молекулы выступает серин — продукт трехэтапного процесса,
начинающегося с 3-фосфоглицерата. Этот процесс запускается с окисления
НАД+ второй спиртовой группы. Затем образованный кетон подвергается тран-
саминированию с глутаматом и образует 3-фосфосерин. Наконец, гидролиз
фосфатного эфира дает серин (рис. 13.25).
ГЛАВА 13 АТФ: энергетическая единица организма 261
с
| 3-фосфоглицератдегидрогеназа
н—с—он
I
СН2“ОРО32’
3-фосфоглицерат НАД+ НАДН+ Н +
С
С=о
СН2-ОРО32-
3-фосфогидроксипируват
СН2~ОРО32'
3-фосфосерин
Серин
Рис. 13.25. Синтез серина
Образование пролина — это четвертый этап процесса, начинающегося
с глутамата, и показанный на рис. 13.26.
2б2 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
сн2-сн2
Пролин
Рис. 13.26. Синтез пролина
ГЛАВА 13 АТФ: энергетическая единица организма 263
Глава 14
Ароматная биохимия:
азот и биологические
системы
В ЭТОЙ ГЛАВЕ...
» Синтез пуринов и пиримидинов
» Катаболизм и цикл образования мочевины
» Аминокислоты
» Метаболические нарушения
В этой главе вы познакомитесь с назначением азота в биомолекулах. Азот
изначально заимствуется у аминокислот (белки) и нуклеиновых кис-
лот (пурины и пиримидины), часто обладающих специфическим, ярко
выраженным ароматом — отсюда и название главы. Азот также содержится в
некоторых других молекулах, например гемоглобине. Из организма азот выде-
ляется преимущественно в виде мочевины.
Азотное кольцо: пурины
Аденин и гуанин относятся к азотистым основаниям с пуриновой кольцевой
структурой (рис. 14.1). Образование этих молекул крайне важно для синтеза
как ДНК, так и РНК. При биосинтезе пуринов образуются молекулы воды. При
биосинтезе нуклеотидной формы пуринов образуется молекулы воды вместо
основания.
Аденин
о
Гуанин
Рис. 14.1. Азотистые основания с пуриновой
кольцевой структурой
Биосинтез пуринов
Синтез пуринов начинается с активации Э-рибоза-5-фосфата путем фосфо-
рилирования. Во время реакции фосфатная группа от АТФ переходит к перво-
му атому углерода Cj в а-В-рибоза-5-фосфате, что приводит к образованию
5-фосфат-а-О-рибоза-1 -пирофосфата (ФРПФ) и АМФ. Реакция интересна тем,
что фосфатная группа переходит в неизмененном состоянии (рис. 14.2). ФРПФ
также востребована в синтезе пиримидинов (см. раздел “Синтез пиримидинов”
далее).
О
он он
а-О-рибоза-5-фосфат
5-фосфат-а-0-рибоза-1-пирофосфат
Рис. 14.2. Активация
5-фосфат-а-О-рибоза-1-пирофосфата (ФРПФ)
266 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
Синтез инозина
ФРПФ проходит десять этапов для того, чтобы стать инозин-5-фосфатом
или инозиновой кислотой (ИМФ) (рис. 14.3). Заметьте, что на протяжении всех
десяти этапов Э-рибоза-5-фосфатная часть ФРПФ не меняется. В табл. 14.1 пе-
речислены десять ферментов, принимающих участие в обозначенных этапах.
Два дополнительных этапа выделяются под преобразование ИМФ как в АМФ,
так и в ГМФ.
Таблица 14.1. Ферменты, участвующие в синтезе инозиновои кислоты
Номер
фермента
Название
1 Амидофосфорибозилтрансфераза
2 Фосфорибозилглицинамидсинтеттаза
3 Фосфорибозилглицинамидформилтрансфераза
4 Фосфорибозилглицинамидсинтетаза
5 Фосфорибозиламиноимидазолсинтетаза
б Фосфорибозиламиноимидазолкарбоксилаза
7 Фосфорибозиламиноимидазол-сукцинокарбоксамид
8 Аденилосукцинатлиаза
10 Фосфорибозиламиноимидазолкарбоксамидформилтрансфераза
11 ИМФ-циклогидролаза
Синтез АМФ
Чтобы преобразовать ИМФ в АМФ (аденозинмонофосфат), необходимо пе-
ренести аминогруппу от аспартата. На это тратиться два этапа и энергия от ги-
дролиза ГТФ (гуазинтрифосфата), которая уходит на присоединение аспартата
к ИМФ. Заканчивается все потерей молекулы фумарата. Фермент аденилсук-
цинатсинтетаза катализирует первый шаг, а фермент аденилсукцинатлиаза
участвует в катализации второго этапа. Детально описанные выше реакции
проиллюстрированы на рис. 14.4.
ГЛАВА 14 Ароматная биохимия: азот и биологические системы 267
о
-о—р—о—СН2 V
с^н и
су \ II
| о—р—о—р—сг
он I I
0“
н I
он
О"
5-фосфо-а-0-рибоза-1 -пирофосфат
Глутамин+Н2О-^
О-
Первый фермент
Глутамат + РР,
О
~о—р—о—СН2 „ 7Нг
°\|
С„Н Н,С
Гн
он
сг
Н I
он
АТФ + глицин
Mg2+
Второй фермент
о
АДФ + Р,
О
О
-О—Р—о—сн2
О"
с—сн2
NH
°\J
с5н
н | | н
он он
Рис. 14.3. Десять этапов превращения ФРПФ
в инозиновую кислоту (ИМФ) (см. далее)
Синтез ГМФ
Превращение ИМФ в ГМФ (гуанозинмонофосфат) начинается с окисления
до ксантозин-5-фосфата, катализируемого ИМФ-дегидрогеназой. Кофермен-
том на этом этапе выступает ион НАД+. Следующий этап — перенос аминовой
группы от глутамата, который катализируется ГМФ-синтетазой. Энергией этот
этап обеспечивается за счет гидролиза молекулы АТФ (рис. 14.5).
268 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
1Ч10-формил-ТГФ
Третий фермент
'NH
сн=о
он он
Глутамин + АТФ +Н2о —.
Mg2+
Глутамат + АДФ + Р,
Четвертый фермент
он он
Рис. 14.3. Продолжение
Стоимость синтеза
Для биосинтеза АМФ и ГМФ нужна энергия, получаемая в результате ги-
дролиза нескольких высокоэнергетических связей. Чтобы получить ИМФ из
Э-рибоза-5-фосфата, достаточно гидролиза шести высокоэнергетических свя-
зей: одной — в АТФ и пяти — в пирофосфате. Для преобразования ИМФ в
АМФ понадобится гидролизовать еще одну высокоэнергетическую связь
(в ГТФ). При этом преобразование ИМФ в ГМФ выполняется за счет гидроли-
за двух высокоэнергетических связей: в АТФ и в пирофосфате.
Чтобы удовлетворить потребности в энергии, анаэробные организмы, на-
пример бактерии, вызывающие столбняк или ботулизм, окисляют четыре мо-
лекулы глюкозы — по 2 молекул АТФ на одну молекулу глюкозы. При этом
аэробным организмам, подобных вашим, для этих целей требуется окислить
всего одну молекулу глюкозы, из которой производится 36 молекул АТФ. Эти
ГЛАВА 14 Ароматная биохимия: азот и биологические системы 2б9
Пятый фермент
АДФ + Р,
О
О—Р—о—
I
О"
он он
Шестой фермент
Рис. 14.3. Продолжение
процессы требуют значительного количества энергии. Уменьшить потребности
в энергии позволяют специальные метаболические механизмы, называемые
спасательными путями. В спасательных путях азотные основы перерабатыва-
ются, а не синтезируются, а затем преобразуются в нуклеотиды.
Синтез пиримидинов
Принципы синтеза пиримидинов заметно отличаться от принятых в синтезе
пурина, рассмотренном выше. В этом случае перед присоединением к рибозе
синтезируются основания. Для синтеза кольцевой структуры нужны ионы би-
карбоната, аспарагиновой кислоты и аммиака. Хотя возможно непосредствен-
ное использование аммиака, обычно он образуется в результате гидролиза бо-
ковой цепи глутамина.
270 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
Аспартат + АТФ
Седьмой фермент
сосг
он он
Фумарат
о
о-
Восьмой фермент
о
он он
Рис. 14.3. Продолжение
Первый этап: карбамаилфосфат
Начальным шагом в синтезе пиримидинов является перенос фосфата от
АТФ к иону бикарбоната для образования карбоксифосфата, который в свою
очередь подвергается обмену, в котором аммиак замещается фосфатом и обра-
зуем карбаминовую кислоту. Фух! Вы еще следите за ходом изложения? Затем
АТФ переносит фосфат к карбаминовой кислоте, чтобы образовать карбамаил-
фосфат. На рис. 14.6 приведены основные этапы этого процесса.
Ведущим ферментом в процессе, показанном на рис. 14.6, выступает карба-
маилсинтетаза. Один участок фермента отвечает за синтез карбаминовой кис-
лоты, а еще один — отщепляет аммиак от глутамина в результате гидролиза.
Третий участок фермента завершает процесс, а канал обеспечивает соединение
всех трех частей.
ГЛАВА 14 Ароматная биохимия: азот и биологические системы 271
Девятый фермент
Десятый фермент
Инозиновая кислота (ИМФ)
Рис. 14.3. Окончание
Второй этап: оротат
Следующим этапом в синтезе пиримидинов будет образование оротата,
который присоединяется к рибозе. Процесс начинается с присоединения ас-
партата к карбамаилфосфату с участием транскарбамаилазы с потерей фосфа-
та. Это способствует образованию карбамаиласпартата, который циклизуется
в дигидрооротат, окисляющийся при помощи НАД+ до оротата (рис. 14.7).
272 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
о
о
I
-о—Р—о—
I
О"
Инозиновая кислота
он он
Аспартат + ГТФ
ГТФ + Р,
Аденилосукцинатсинтетаза
о о
он он
Фумарат
и
Аденилосукцинатлиаза
nh2
он он
Рис. 14.4. Преобразование ИМФ в АМФ
ГЛАВА 14 Ароматная биохимия: азот и биологические системы 273
о
о
I
о—Р—о—
I
О"
Инозиновая кислота
ОН он
НАД++ Н2О
НАДН + Н+
Инозин-5-монофосфат-дегидрогеназа
о
Глутамин + АТФ + Н2О
Mg2+
Глутамат + АМФ + РР,
ГМФ-синтетаза
о
он он
Рис. 14.5. Преобразование ИМФ в АМФ
274 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
ATP
ADP
NH3 Pi
Карбамоилфосфат
Рис. 14.6. Синтез карбамаилфосфата
Оротат
Рис. 14.7. Образование оротата из карбамаилфосфата
ГЛАВА 14 Ароматная биохимия: азот и биологические системы 275
Оротат соединяется с ФРПФ (см. раздел “Биосинтез пуринов” выше) для
образования оротидилатпа, предоставляя необходимую энергию, которая
высвобождается при гидролизе пирофосфата. Эта реакцию становится воз-
можно благодаря ферменту пиримидинфосфорибозилтрансфераза. Фермент
оротидилатдекарбоксилаза катализирует декарбоксилирование оротидилата
до уридилата (УМФ). Эти этапы изображаются на рис. 14.8.
Оротат
1 5-фосфорибозил-1-пирофосфат
РР,
Оротидилат
ОН он
Уридилат (УМФ)
Рис. 14.8. Преобразование оротата в уридилат (УМФ)
276 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
Последний этап: цитидин
Финальный нуклеотид, цитидин (ЦТФ), образуется из уридинмонофосфата
(УМФ). Вначале УМФ видоизменяется до УТФ (уридинтрифосфат). УМФ-ки-
наза и нуклеозиддифосфокиназа обеспечивает преобразование УМФ в УТФ.
На рис. 14.9 показан конечный этап — преобразование УТФ в ЦТФ.
Рис. 14.9. Преобразование УТФ в ЦТФ
Обратно к истокам: катаболизм
Как известно, катаболизм — это разрушение молекул с выделением энер-
гии. Во многих случаях в полном разрушении соединений нет никакой необ-
ходимости, так как после частичного разрушения продукты реакций могут ис-
пользоваться повторно.
ГЛАВА 14 Ароматная биохимия: азот и биологические системы 277
Катаболизм нуклеотидов
Разрушение нуклеотидов начинается с удаления фосфатной группы (у атома
С-5). Впоследствии фосфат прикрепляется к С-1, что приводит к образованию
сахар-1-фосфата с неизменным основанием. У людей и многих других видов
млекопитающих продуктом дальнейшей дегенерации пуринов является моче-
вая кислота (рис. 14.10). У других биологических видов мочевая кислота де-
градирует до других продуктов.
он
Рис. 14.10. Структура
мочевой кислоты
Катаболизм аминокислот
Гидролиз белков приводит к отделению аминокислот. Возможно повторное
использование этих аминокислот (хорошая это вещь — повторное использо-
вание вещей), равно как применение их в синтезе других аминокислот или
производстве энергии для них. Процесс трансаминации позволяет переносить
аминогруппу любой аминокислоты, кроме лизина, пролина, треонина, и а-ке-
тоновой кислоты. Ферменты, которые катализируют эту реакцию, относятся
к большой группе тпрансаминаз\ общее представление о реакции можно по-
лучить на рис. 14.11. Азот, который отделяться, переходит к а-кетоглутарату с
образованием глутамата.
Аминокислота а-кетокислота
Рис. 14.11. Общая реакция трансаминации
Новая
а-кетокислота
Новая
аминокислота
Трансаминация играет важную роль в биосинтезе аланина, аспартата и глу-
тамата. В процессе окислительного дезаминирования глутамата образуется
а-кетоглутарат (используется повторно), ион аммония (входит в цикл образо-
вания мочевины) и, опосредовано, 3 молекулы АТФ. Для проведения такой ре-
акции необходимы глутаматдегидрогеназа и НАД+ или НАДФ+.
278 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
Подвергшаяся дезаминированию аминокислота — а-кетокислота — даль-
ше может расщепляться на пируват и некоторые другие вещества, которые в
организме преобразуются до глюкозы. Такие вещества называются глюкоген-
ными кислотами. Альтернатива заключается в расщеплении а-кетокислоты до
ацетил-СоА и ацетоуксусной кислоты. Эти кислоты называются кетогенными.
Чтобы еще больше запутать вас, некоторые аминокислоты одновременно отно-
сятся и к глюкогенной, и к кетогенной группе (табл. 14.2). Это две возможные
судьбы углеродного скелета аминокислот. Распад аминокислоты превращает
его в промежуточные продукты в цикле лимонной кислоты или в вещества,
преобразование которых дает глюкозу.
Таблица 14.2. Глюкогенные и кетогенные аминокислоты
Глюкогенные Аланин, аргинин, аспарагин, аспартат, цистеин, глутамат, глута-
аминокислоты мин, глицин, гистидин, метионин, пролин, серин, треонин, валин
Кетогенные
аминокислоты
Лейцин
Аминокислоты
обоих типов
Изолейцин, лизин, фенилаланин, триптофан, тирозин
Общий процесс катаболизма аминокислот носит циклический характер, а
сами аминокислоты могут включаться в него в разные моменты. На рис. 14.12
показана базовая схема.
Катаболизм гема
Еще одним важным соединением азота является гем, присутствующий в
красных кровяных тельцах. Он встречается как в гемоглобине, так и в мио-
глобине. Гемоглобин выделяется при разрушении старых эритроцитов. Гло-
биновая часть гидролизируется до соответствующих аминокислот. Железо от-
деляется от гема и накапливается в ферритине. Спустя ряд этапов из гема об-
разуется билирубин. Временным хранилищем билирубина — до тех пор, пока
организм не удалит его, выступает желчный пузырь.
Описанный процесс происходит при образовании синяка. При травме воз-
никает повреждение кровяных сосудов и образуется скопление крови. Боль-
шие синяки изменяют цвет из-за распада гемоглобина, присутствующего в
кровяных скоплениях. Цвет, за который все так любят синяки, образуется при
последовательном распаде гемоглобина (красно-синий цвет) до биливердина
(зеленый), а затем до билирубина (желтый) и, наконец, до гемосидерина (золо-
тисто-коричневый). По мере рассасывания этих продуктов в теле синяк блед-
неет и исчезает.
ГЛАВА 14 Ароматная биохимия: азот и биологические системы 279
Глюкоза
” Аланин
Цистеин
< Глицин
Серин
[ Треонин
Лейцин
Лизин
Фенилаланин
Тирозин
♦
Пируват
Оксалоацетат
Цитрат
Аспарагин
Аспартат
- Фумарат
Изоцитрат
Фенилаланин
Тирозин
Сукцинил-СоА
а-кетоглутарат
' Аргинин
Глутамат
< Глутамин L
Гистидин
Пролин
Изолейцин
Метионин
Треонин
Валин
Рис. 14.12. Катаболизм аминокислот
Избавляемся от ненужного: цикл
образования мочевины
Катаболизм азотсодержащих соединений приводит к получению повтор-
но используемых азотистых соединений и аммиака. Временным хранилищем
и транспортом для азота служит глутамин. Однако из-за токсичности даже
небольших доз аммиака для человека перед удалением его нужно привести
в менее ядовитую форму. Первый этап включает преобразование аммиа-
ка, представленного ионом аммония, в карбамаилфосфат. В преобразовании
280 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
участвует фермент карбамаилфосфатсинтетаза. Реакция проиллюстрирована
на рис. 14.13.
2АТФ 2АДФ
। Г о о
NH? + С°2 > NH2-C----О---Р---О’ +
О"
Р/
Карбамоилфосфат
Рис. 14.13. Образование карбамаилфосфата
Карбамаилфосфат включается в цикл образования мочевины, соединяясь
с орнитином для получения цитруллина, а реакцию катализирует фермент ор-
нитинтранскарбамаилаза. Фермент аргиносукцинатсинтетаза с энергией,
полученной при гидролизе АТФ, соединяет аспартат с цитруллином и обра-
зует аргиносукцинат. Затем аргиносукциназа катализирует реакцию деления
аргиносукцината на фумарат и аргинин. Фермент аргиназа завершает цикл,
расщепляя аргинин на мочевину (для выведения) и орнитин (для повторного
использования). На рис. 14.14 и 14.15 показан полный цикл образования моче-
вины и указаны соединения, участвующие в нем.
Фурумат
Рис. 14.14. Общее представление цикла образования мочевины
ГЛАВА 14 Ароматная биохимия: азот и биологические системы 281
о
NH3+
СН2
сн2
сн2
Н---С----NH3+
Н—N—С—NH2
СН2
СН2
СН2
Н--С--NH3+
+H3N---С---Н
СН2
Орнитин
Аспартат
Агриносукцинат
:чн2+
Н---N----С---NH2
СН2
сн2
сн2
Н---С----NH3+
ст сг
Агринин
Фумарат
h2n—с—nh2
Мочевина
Рис. 14.15. Соединения, принимающие участие
в цикле образования мочевины
282 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
Снова об аминокислотах
Для синтеза белков нужно 20 аминокислот. В случае необходимости чело-
веческий организм может синтезировать 10 из них. Такие аминокислоты от-
носятся к заменимым. Оставшиеся 10 аминокислот, называемые незамени-
мыми, должны поступать с пищей. Все аминокислоты систематизированы
в табл. 14.3.
Таблица 14.3. Незаменимые и заменимые аминокислоты
Незаменимые аминокислоты Заменимые аминокислоты
Аргинин* Аланин
Гистидин Аспарагин
Изолейцин Аспартат
Лейцин Цистеин
Лизин Глутамат
Метионин Глутамин
Фенилаланин Глицин
Треонин Пролин
Триптофан Серин
Валин Тирозин
* Заменимая у взрослых
НА ПРАКТИКЕ
Полноценный (нативный) белок полностью состоит из незаменимых
аминокислот. Не все белки имеют нативную природу, многие из них
являются неполноценными по составу. Чтобы избежать дефицита
аминокислот, людям необходимо употреблять пищу, включающую
полноценные белки.
Реакция трансаминации участвует в биосинтезе пролина, аланина, аспар-
тата и глутамата. Преобразование аспартата в аспарагин и глутамата в глута-
мин выполняется очень просто. Синтез пролина происходит в четыре этапа, на
первом из которых происходит преобразование глутамата. Образование сери-
на начинается с гликолиза промежуточного соединения — 3-фосфоглицерата.
ГЛАВА 14 Ароматная биохимия: азот и биологические системы 283
В результате трехэтапного преобразования получается серин, который легко
превращается в глицин. При достаточном количестве фенилаланина происхо-
дит его преобразование до тирозина — в результате реакции гидроксилирова-
ния с участием катализаторов. Избыточный метионин в организме превраща-
ется в цистеин. Аргинин является продуктом цикла образования мочевины, но
у младенцев синтез аргинина находится на недостаточном уровне.
Нарушения метаболизма
В случае нарушения обменных процессов организма возникают проблемы
со здоровьем, которые подлежат медикаментозному лечению. В этом разделе
рассматриваются только некоторые из них.
Подагра
Подагра возникает в результате чрезмерной выработки мочевой кислоты,
что ведет к отложению мочекислого натрия на участках тела с температурой
ниже нормальной (37 °C). Такие участки с пониженной температурой нахо-
дятся в суставах конечностей. Мочекислый натрий может оседать в почках в
виде камней. Терапия включает соблюдение диеты и применение лекарствен-
ных препаратов. Диета сводится к ограничению приема алкоголя и богатой
белками пищи (мяса), которые ухудшают состояние. Также часто назначаются
препараты, которые подавляют действие фермента, способствующего выработ-
ке мочевой кислоты.
Подагра также может возникать вследствие нарушения углеводного обмена.
Дефицит глюкоза-6-фосфата обязывает фосфорилированные углеводы образо-
вывать рибоза-5-фосфат вместо глюкозы. Избыток этого соединения приводит
к превышению допустимого уровня ФРПФ, что в конечном итоге сказывается
на синтезе пуринов. Избыток пуринов приводит к выработке чрезмерно боль-
шего количества мочевины.
Синдром Леша-Нихана
Синдром Леша-Нихана — еще один пример нарушения пуринового ката-
болизма, приводящего к избытку мочевой кислоты. Пациенты с таким нару-
шением выделяют мочевины в 4-5 раз больше, чем пациенты, страдающие по-
дагрой. Эта врожденная патология связана с Х-хромосомой; нарушение пере-
дается от матери к детям. В настоящее время болезнь считается неизлечимой.
284 ЧАСТЬ 4 Биоэнергетическая химия и метаболизм
Альбинизм
В основе альбинизма, черты, которая передается по рецессивному типу, ле-
жит врожденное нарушение механизма синтеза тирозина. Тирозин является
предшественником меланина — пигмента, определяющего цвет волос и кожи.
Как минимум один вид альбинизма вызван дефицитом фермента тирозиназы.
Отдельный тип альбинизма предопределяется термочувствительной формой
тирозиназы: фермент эффективно действует только в участках тела с понижен-
ной температурой, в частности конечностях. Такая форма тирозиназы отвечает
за окраску шерсти у сиамских котов.
Алкаптонурия
Алкаптонурией называется доброкачественное состояние, характеризую-
щееся выделением мочи темного цвета. Состояние вызывается нарушениями
катаболического распада фенилаланина и тирозина. Неправильное действие
фермента приводит к накоплению и последующему выделению одного из про-
межуточных соединений реакции.
Фенилкетонурия
Фенилкетонурия, или ФКУ является результатом недостатка фермента фе-
нилаланин-4-монооксигеназы, который в конечном счете приводит к наруше-
нию обмена фенилаланина. Следствием является накопление фенилаланина
в крови. Высокие уровни фенилаланина усиливают реакцию трансаминации
и приводят к образованию патологически высоких уровней фенилпирувата,
большие количества которого вызывает повреждение головного мозга у мла-
денцев.
Повышенные уровни фенилаланина ведут к конкурентному ингибированию
ферментов, ответственных за образование меланина из тирозина. У больных
детей светлые волосы и кожа, как при альбинизме, потому что у них в меланин
превращается лишь небольшое количество тирозина.
Ранняя диагностика ФКУ у новорожденных играет важную роль в преду-
преждении повреждений головного мозга. В настоящее время всем ново-
рожденным проводят обязательный анализ крови на подверженность ФКУ.
В качестве дополнительного исследования проверяют активность фенилала-
нин-4-монооксигеназы. Лечение состоит в строгой диете, призванной поддер-
живать низкий уровень фенилаланина как минимум до трехлетнего возраста.
ГЛАВА 14 Ароматная биохимия: азот и биологические системы 285
В ЭТОЙ ЧАСТИ...
Закатываем рукава и возвращаемся к детальному изучению
генов и ДНК. Вначале изучим принципы саморепликации
ДНК и познакомимся с рядом приложений, основанных на
секвенировании ДНК. Затем перейдем к описанию принци-
пов транскрипции РНК, а также синтеза и трансляции белков.
Глава 15
Копирование ДНК
В ЭТОЙ ГЛАВЕ:
» Репликация
» Рекомбинантная ДНК
» Секвенирование ДНК
» Генетические заболевания
В 1958 году Фрэнсис Крик постулировал утверждение, которое стало
“центральной догмой молекулярной биологии”. В этом постулате он, а
позже и другие авторы, сделал умозаключение, что ДНК выступает цен-
тральным хранилищем генетической информации и что некоторое количество
этой информации передается при образовании РНК, которая, в свою очередь,
использует ее для синтеза белка. Эта центральная догма является расширением
гипотезы “один ген — один белок”. ДНК должна передавать хранящуюся в ней
информацию как последующему поколению {репликация), так и РНК {транс-
крипция), которая завершает процесс образования соответствующих белков
{трансляция).
Некоторые виды РНК, в частности отдельных вирусов, подвергаются репли-
кации и даже обратной транскрипции. Таким образом, РНК может производить
как РНК, так и ДНК. Генетические исследователи первоначально считали, что
эта способность находится в конфликте с центральной догмой, но Крик аргу-
ментировал, что РНК, создающая ДНК, является расширением этого постулата.
Многие вирусы, способные к обратной транскрипции, могут вызы-
вать онкологические заболевания.
НА ПРАКТИКЕ
В этой главе мы детально исследуем репликацию — процесс воспроизвод-
ства ДНК и передачи генетического кода.
Давайте сделаем это снова: репликация
Первичная структура ДНК состоит из двух полинуклеотидных нитей, удер-
живаемых вместе водородными связями. Аденин образует водородные связи с
тимином, а цитозин — с гуанином (рис. 15.1). Последовательность азотистых
оснований несет в себе генетическую информацию. Молекулы ДНК оберты-
ваются вокруг белка под названием гистон; комбинация восьми гистонов с
соответствующей ДНК называется нуклеосомой, (см. глава 16).
ТТАЦЦГГТТАЦЦГАТГЦЦАТЦГА
Водородные связи
Рис. 15.1. Схематическое представление основных пар, присутствующих
в сегменте ДНК
Ген — это часть молекулы ДНК, которая несет специфическую ин-
формацию. Часть гена, которая кодирует эту информацию, называ-
запомни! ется экзоном’ а та часть> которая не кодирует ее, — интроном.
Репликацией (рис. 15.2) называется процесс производства новой копии мо-
лекулы ДНК. Одна молекула ДНК разворачивается и раскрывается подобно
молнии, образуя две свои точные копии. Новые нуклеотиды связываются с ос-
нованием каждой нити открытой молекулы ДНК, образуя соединения с уже
присутствующими нуклеотидами (по аналогии — зубчикам молнии). Процесс
продолжается вдоль открывающейся нити ДНК до тех пор, пока у каждой по-
ловинки исходной ДНК не появится комплементарная нить, соединенная с ней
водородными связями. Результатом являются две двойные спирали ДНК, в ка-
ждой их которых половина от старой ДНК, а половина от новой. Звучит не
очень жизнеутверждающе, но в случае с ДНК работает до сих пор.
290 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
Материнская ДНК Новая ДНК Новая ДНК
Рис. 15.2. Упрощение представление
процесса репликации
Из-за специфичности водородных связей новая нить содержит нуклеотиды
в последовательности, которая комплементарна последовательности в старой
нити. Таким образом, создается точный дубликат оригинальной ДНК.
Такое описание репликации сильно упрощенное. Оно затрагивает всего
лишь малую часть этого сложного процесса, но предоставляет достаточно све-
дений для изучения дальнейшего материала.
Первым шагом в понимании принципов репликации ДНК стало открытие
ДНК-полимеразы кишечной палочки, больше известной под названием Е. coli.
Ряд последовательных исследований показал, что для выполнения своих функ-
ций этому ферменту нужен образец ДНК и все четыре дезоксирибозидтрифос-
фата — дАТФ, дЦТФ, дГТФ и дТТФ, а также короткий участок РНК, назы-
ваемый праймером. Фермент отдает предпочтение одинарной нити ДНК, как
шаблону, для того, чтобы произвести комплементарную нить.
Во время репликации происходит одновременное удвоение двух нитей ДНК
(рис. 15.3). Из-за того, что нити ДНК не параллельны, режим синтеза разный
у каждой нити, но в целом процесс синхронный при продвижении от одного
конца к другому. Для одной нити синтез происходит в направлении от 5 —► 3.
На другой нити он продвигается в направлении 3 —► 5, но в действительности
происходит в таком же направлении 5 —► 3. Построение нити для направления
3 —► 5 сопряжено с определенными сложностями, которые будут рассмотрены
несколько позже.
Репликация инициируется в определенном месте, после чего вдоль ка-
ждой из нитей выстраиваются последовательности, составленные из корот-
ких фрагментов ДНК. Такие отдельные фрагменты, называемые фрагмен-
тами Оказаки, включают от 1000 до 2000 нуклеотидов. Синтез фрагментов
ГЛАВА 15 Копирование ДНК 291
всегда выполняется в направлении 5^3. Детально процесс проиллюстриро-
ван рис. 15.4.
Исследователи неожиданно обнаружили, что репликацию ДНК предваряет
синтез РНК. Изначально праймер РНК. обычно длиной 20-30 нуклеотидов,
образует одну нить ДНК. После этого дезоксирибонуклеотиды добавляются
292 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
к третьему концу. Позже праймер РНК удаляется, а для образования полной
ДНК к нити прикрепляются соответствующие фрагменты ДНК.
Как минимум часть двойной нити ДНК должна быть отделена перед на-
чалом репликации, чтобы послужить в качестве шаблона. За такое отделение
отвечают специальные ферменты, называемые геликазами. На сегодня не до
конца понятен и исследован механизм такого отделения — изучить его все еще
предстоит. По всей видимости геликаза связывается с одной из нитей более
прочно, что позволяет ферменту оттолкнуть другую нить. Энергия для продви-
жения фермента вдоль одной из нитей обеспечивается в результате гидролиза
АТФ. Процесс понуклеотидного продвижения фермента приводит к открытию
ДНК подобно молнии, как упоминалось раньше.
ДНК-полимеразы
ДНК-полимеразы — это ферменты, отвечающие за присоединение фраг-
ментов нуклеотида-трифосфата, выступающих основными строительными
блоками нити ДНК. Этот процесс возможен исключительно в присутствии ша-
блона ДНК (родительская ДНК). Перед тем, как фермент сможет соединиться
с нуклеотидом, этот нуклеотид должен связаться с соответствующим местом
в шаблоне.
В клетке должно присутствовать больше одной полимеразы. Например, у
Е. coli задачу по присоединению фрагментов нуклеотида-трифосфата выпол-
няют три разных фермента. Эти ферменты могут также действовать как экзо-
нуклеазы, которые функционально противоположны полимеразам — они уда-
ляют нуклеотиды из нити ДНК.
Добавляются нуклеотиды всегда к третьему концу полинуклеотидной цепи.
ДНК-полимераза не может начать построение нуклеотида с нуля — полину-
клеотид должен находиться рядом. Напротив, РНК-полимераза строит нить
с нуля. РНК-полимераза создает РНК-праймер, используя рибонуклеотиды в
начале репликации. Затем настает черед ДНК-полимеразы, которая добавляет
дезоксинуклеотиды к праймеру РНК. Для полимеризации необходимо присут-
ствие двух ионов металла, чтобы сделать возможным присоединение нуклео-
тида к полинуклеотиду.
Репликация ДНК должна осуществляться безошибочно, чтобы обеспечить
точную передачу генетической информации. Как оказалось, ДНК-полимеразы
выполняют свои функции с очень высокой точностью. Фермент прочно связы-
вается с матрицей и поступающим нуклеотидом. Этот нуклеотид изначально
соединяется с шаблоном с помощью водородной связи. Если встраивается не-
правильный нуклеотид, то последующее связывание с помощью полимеразы
оказывается неэффективным, и такой нуклеотид “отвергается”. Помимо этой
проверки ДНК-полимераза также проверяет предыдущий нуклеотид, чтобы
ГЛАВА 15 Копирование ДНК 293
убедиться в его правильности. Если встроенный нуклеотид не подходит долж-
ным образом к соответствующему месту, то он будет удален из полинуклеоти-
да, чтобы позволить правильному нуклеотиду занять его место. Эту функцию
выполняет экзонуклеазная часть полимеразы. Полимераза проверяет полину-
клеотидную цепь по мере протекания процесса полимеризации. Проверка про-
водится в обратном направлении (3 —> 5). Нуклеотид должен быть встроен,
прежде чем полимераза сможет проверить результат. (Хочется верить, что вы
поняли хотя бы общий принцип происходящего.)
Общепринятая модель репликации
Исследования in vitro на Е. coli показали, что репликация начинается тогда,
когда белок связывается с областью ДНК, в которой содержится четыре специ-
альных места для связывания. Это точка начала репликации (инициации). По-
сле инициации белок связывается, а фермент геликаза атакует ДНК и начинает
раскручивать ее, разделяя две нити. Затем в действие вступает третий белок,
удерживающий нити ДНК открытыми, чтобы сделать возможным продолже-
ние репликации. Он называется SSB-белком или белком, связывающимся с
одноцепочечной ДНК. Частично открытая ДНК и соответствующие белки на-
зываются предзатравочным комплексом (рис. 15.5).
Рис. 15.5. Упрощенное представление предзатравочного комплекса
294 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
Таким образом заполняются шаблоны ДНК. На нити ДНК может быть боль-
ше одного места для начала репликации; что позволяет ей возникать одновре-
менно сразу в нескольких местах. Синхронная репликация обеспечивает обра-
зование всей нити за очень короткое время.
Репликация не может продолжаться пока открытый шаблон не будет запол-
нен. Специальный вид РНК-полимеразы, называемый праймазой, связывается
с предзатравочным комплексом в участке, известном как праймосома. Прайма-
за синтезирует короткий сегмент РНК примерно из пяти нуклеотидов. Прайма-
за выполняет эту задачу очень быстро, поскольку не снабжена инструментами
корректировки нити, присутствующими в ДНК-полимеразе, и сам нуклеотид
проверке не подвергается. Поскольку праймер состоит из рибонуклеотидов, а
не из дезоксирибонуклеотидов, он является временным — по завершению про-
цесса непременно определяется и удаляется. После его удаления в освободив-
шееся место встраивается соответствующий дезоксирибонуклеотид, завершая
формирование нити ДНК (рис. 15.6).
Рис. 15.6. Образование праймера РНК
Хотя в качестве шаблона выступают обе нити ДНК, процесс репликации
для каждой нити различный. Точка, в которой нити расходятся и возникает
репликация, называется репликационной вилкой для репликационного глазка.
Из-за того, что две нити не параллельны, а ДНК-полимераза работает исклю-
чительно в направлении 5 —► 3, прямая репликация работает только на одной
нити, которая называется опережающей нитью. Другая нить называется отс-
тающей. (Похоже на выгул моих собак: лабрадор впереди, а шнауцер отстает.)
По мере отделения нитей появляется достаточное пространство для мо-
лекулярного механизма, чтобы начать синтез в обратном направлении на
ГЛАВА 15 Копирование ДНК 295
отстающей нити. (Обратное направление на антипараллельной отстающей
нити остается прежним: 5 —* 3.) Репликация на отстающей нити носит преры-
вистый характер; фрагменты состоят примерно из 1000 нуклеотидов и назы-
ваются, как отмечалось ранее, фрагментами Оказаки. ДНК-лигаза соединяет
фрагменты, чтобы сформировать непрерывную нить.
ДНК-полимераза III, голофермент или полный фермент, одновременно про-
изводит ДНК как на опережающей, так и на отстающей нити, хотя механизм
для этих двух нитей разный. На опережающей нити процесс непрерывный, в
то время как на отстающей он дискретный и более сложный. Чтобы сделать
возможной полимеризацию отстающая нить образует обратную петлю так,
что полимеризация осуществляется в направлении 5 —► 3. После присоедине-
ния около 1000 нуклеотидов — фрагмента Оказаки — полимераза выпрямля-
ет петлю и продолжает процесс на новой петле и со следующим фрагментом.
У каждого фрагмент Оказаки есть РНК-праймер. ДНК-полимераза I синтези-
рует ДНК в “выемках” между фрагментами и удаляет секции праймера. Затем
ДНК-лигаза соединяет фрагменты (рис. 15.7). (Ух ты! Если бы только люди
умели строить настолько точно и слаженно!)
Рис. 15.7. Детальное представление репликационной вилки
На концах ДНК-нитей происходят процессы, отличные от наблюдаемых в
остальных, регулярных их частях — в наибольшей степени это относится к
отстающей нити. Если не проявлять осторожность, то в каждом цикле репли-
кации нить ДНК будет укорачиваться, что в конце концов приведет к потере
важного генетического материала. Для решения этой проблемы на концах ДНК
присутствуют теломеры — сегменты ДНК, которые содержат сотни повторяю-
щихся компонентов. У людей такие повторяющиеся компоненты представлены
296 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
гексануклеотидом АГГГТТ. Фермент теломераза в наших клетках обнаружи-
вает последовательность праймера ГГТТ и многократно присоединяет компо-
ненты гексануклеотида, завершая нить ДНК.
Механизмы восстановления ДНК
Для восстановления ДНК в клетках задействуются специальные ме-
ханизмы, которые необходимы, чтобы починить нарушенную ДНК
и обеспечить сохранение генетической информации. Повреждение
НА ПРАКТИКЕ ттттт/-
ДНК может возникнуть во время репликации или под действием ра-
диации либо сторонних химических веществ. Редкая генетическая
ошибка, известная как пигментная ксеродерма, нарушает эти восста-
новительные механизмы. Люди, которые страдают таким недугом,
чрезвычайно предрасположены к развитию онкологических заболе-
ваний, особенно рака кожи. В конце концов рак кожи метастазирует-
ся, приводя к смерти.
ТЕЛОМЕРЫ И СТАРЕНИЕ
Од
У каждой хромосомы есть повторяющаяся последовательность ДНК
на практике на К0Нце, называемая теломером. Эта последовательность служит
для защиты окончаний хромосомы от распада. Чтобы понять важность теломе-
ров, нужно проследить за процессом репликации, проходящем в направлении
5 -> 3. По достижения точки, в которой праймер становится ненужным, репли-
цировать последние несколько нуклеотидов не представляется возможным,
что вызывает потерю информации на концах нити ДНК. В случае присутствия
теломера на конце нити будет утеряна только его часть, но она не несет важ-
ной генетической информации. Впоследствии фермент теломераза обращает
транскриптазу, которая восстанавливает утраченную часть теломера.
В течение человеческой жизни большинство теломеров непременно восста-
навливается. (У небольшого количества клеток, таких, как белые кровяные
тельца, сперматозоиды, стволовые клетки, теломеразы очень активные.) По-
степенное укорачивание теломеров ограничивает способность клеток к де-
лению. Предполагается, что это лежит в основе механизма старения и огра-
ничивает срок жизни организма. Органы, содержащие большую долю клеток,
которые не способны к дальнейшему делению, не могут нормально функцио-
нировать или самостоятельно восстанавливаться.
Теломеры также удерживают хромосомы от слияния и перестройки участков
хромосом. Любое такое отклонение от нормы может привести к развитию
рака. Быстрое деление раковых клеток ведет к преждевременному отмира-
нию органа. В некоторых случаях раковые клетки в состоянии восстанавливать
длину своих теломер, делая себя "бессмертными".
ГЛАВА 15 Копирование ДНК 297
К трем основным механизмам восстановления относятся:
» прямая репарация;
» эксцизионная репарация;
» эксцизионная репарация нуклеотидов.
Одним из примеров повреждения, нуждающегося в репарации, является
образование тиаминового димера под воздействием ультрафиолетового излу-
чения (рис. 15.8). Тиаминовый димер — это пример пиримидинового димера,
а его наличие вызывает нарушение участков ДНК. Базовой парой для тимина
(пиримидин) является аденин (пурин). Другие проблемы связаны с несоответ-
ствием или пропуском дополнительных оснований.
Рис, 15.8. Структура тиаминового димера
Прямая репарация
При прямой репарации исправление ошибки происходит прямо на месте.
Фотореактивирующий фермент — ДНК-фотолиаза — связывается с циклобу-
тановым кольцом, присутствующим в тиаминовом димере, используя энергию
света для расщепления этого димера на составляющие основания.
Эксцизионная репарация
В этом виде репарации исправление проблемы состоит в удалении и заме-
щении основания. Эта операция выполняется по отношению к измененному
основанию. Изменение основания вызывается многими причинами, например
радиационным облучением или определенными химическими веществами.
Наличие измененных оснований обычно приводит к распознаванию повреж-
дений в молекуле ДНК. Фермент, ведущий себя подобно гликолазе, расще-
пляет гликозидную связь между основанием и дезоксирибозой с выделением
основания. В результате образуется АР-сайт, где АР обозначает апуриновый
или апиримидиновый. В апуриновом сайте отсутствует пуриновое основа-
ние, а в апиримидиновом нет пиримидинового основания. АР-эндонуклеаза
распознает такое место и разрезает основную цепь ДНК в соответствующем
участке. Эндонуклеаза-фосфодиэстераза завершает удаление оставшейся
298 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
дезоксирибоза-фосфата. Затем ДНК-полимераза I вставляет в комплементар-
ной нити ДНК заменяемый нуклеотид в основной нуклеотидной паре. Нако-
нец, ДНК-лигаза соединяет блоки, чтобы восстановить нить (подобно радио-
инженеру, который выпаивает на плате “сгоревший” компонент и заменяет его
исправным).
Эксцизионная репарация нуклеотидов
В эксцизионной репарации нуклеотидов исправление нарушений заключа-
ется в удалении сегмента ДНК в месте нарушения и последующем его заме-
щении. Этот механизм предполагает вырезание участков последовательности
ДНК с обеих сторон повреждения в нити. Обычно удаляется секция из 12 ну-
клеотидов с помощью фермента экзонуклеазы. Затем ДНК-полимераза I син-
тезирует сменный фрагмент нити, а ДНК-лигаза завершает восстановление.
Мутации: хорошие, плохие и ужасные
Известно несколько видов мутаций. Механизм восстановления ДНК пыта-
ется предотвратить новые мутации, но он оказывается эффективным далеко не
всегда. К известным мутациям относится замещение одной пары оснований
другой парой, вставка и удаление одной или большего количества пар основа-
ний. Изменения, особенно неразличимые, могут возникать во время или даже
после восстановления.
Замена одной пары оснований на другую — это обычное явление. Она мо-
жет протекать в двух формах: переход и трансверсия. В переходе пурины за-
мещаются на другие пурины или пиримидины замещаются на другие пирими-
дины (рис. 15.9-15.10). При трансверсии пурины замещают пиримидины или
наоборот.
Гуанин Аденин
Рис. 15.9. Пурины
НА ПРАКТИКЕ
Любое неисправленное расхождение в генетическом коде стано-
вится “нормальным” у всех последующих поколений. Такой новый
генетический код называется мутацией. Изменение последова-
тельности оснований может влиять на аминокислоту, для которой
ГЛАВА 15 Копирование ДНК 299
кодируется триплет, а может и нет. Например, изменение ГТТ (ко-
дирование для лейцина) на ГТГ (тоже кодирование для лейцина) ре-
зультат не изменит. Однако если изменения вызывают кодирование
других аминокислот, то это приводит к получению белков с разными
функциями. Если новый белок получает функциональные улучше-
ния, то это приносит пользу организму. Если же новый белок обла-
дает нарушенной функцией, то изменения, скорее всего, принесут
организму только вред. Болезни, вызванные нарушениями функций
белков, считаются наследственными. В табл. 15.1 перечисляются не-
которые из них.
Цитозин
о
СНз
NH
Тимин
Рис. 15.10. Пиримидины
Таблица 15.1. Некоторые наследственные болезни человека
Болезни Поврежденный белок
Акаталазия Каталаза
Альбинизм Тирозиназа
Муковисцидоз Трансмембранный регулятор муковисцидоза
Болезнь Фабри а-галактозидаза
Болезнь Гоше Глюкоцереброзидаза
Зоб Йодтирозиндегалогеназа
Гемосидероз Гемосидероз
Гемофилия Антигемофильный фактор (Фактор VIII)
Гипераммонемия Орнитин-транскарбомилаза
Синдром Тимоти Мышечная фосфорилаза
Болезнь Ниманна-Пика Сфингомиелиназа
300 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
Окончание табл. 15.1
Болезни Поврежденный белок
Фенилкетонурия Фенилаланин-гидроксилаза
Легочная эмфизема а-глобулин крови
Серповидно-клеточная анемия Гемоглобин
Болезнь Тея-Сакса Гексаминидаза А
Болезнь Вильсона Церулоплазмин (белок крови)
Рестриктазы
Рестриктазы являются важными генетическими инструментами в генетиче-
ских исследованиях, хотя и не имеют прямой связи с репликацией. Рестрик-
тазы или рестрикционые нуклеазы способны разрезать ДНК на фрагменты.
Рестриктазы впервые были обнаружены в клетках таких прокариотов, как
Е. coli, в которых эти ферменты находят и разрушают чужую ДНК, например
у бактериофагов, но не затрагивают ДНК собственной клетки. Последние ис-
следования обращают внимание на тот факт, что такими фрагментами можно
распорядиться так, что ДНК-лигазы смогут соединить их в новую нить ДНК.
Рестриктазы являются важным исследовательским инструментом in vitro, дей-
ствующим как высокоточный молекулярный скальпель. В результате расще-
пления обе нити ДНК могут остаться одинаковой длины или одна нить может
стать длиннее другой (ступенчатый разрыв).
Исследователи идентифицировали более 100 рестриктаз. Такие ферменты
опознают специфические участки и расщепляют ДНК на отдельные фрагмен-
ты. Полученные фрагменты намного меньше, чем материнская ДНК, поэтому
с ними проще работать и подвергать дальнейшему анализу. Тестирование нити
ДНК при помощи ряда рестриктаз позволяет выделить характерный признак
отщепленного фрагмента. Фактически, такой подход позволяет построить точ-
ную карту ДНК-структуры.
ЗАПОМНИ!
Изучая описания генетических определений и их видов, вы много-
кратно встречались с терминами in vivo и in vitro. В биохимии тер-
мин in vivo означает “в клетке”, a in vitro — “в пробирке”.
ГЛАВА 15 Копирование ДНК 301
Божий промысел: рекомбинация ДНК
Технология рекомбинации ДНК позволяет синтезировать нити ДНК, в ко-
торые включается больше одного изначально отсутствующего гена. Добав-
ление новых генов позволяет организму производить новые биохимические
материалы. Например, Е. coli была реконструирована так, чтобы производить
человеческий инсулин. Кроме того технология рекомбинантной ДНК позволя-
ет биохимикам добавлять гены, призванные компенсировать существующие
дефекты.
Рестриктазы способны удалять интересуемые фрагменты ДНК. Чтобы про-
изошла репликация, один из таких фрагментов должен соединиться (или вос-
соединиться) с другой нитью ДНК. ДНК, к которой прикрепляется фрагмент,
называется вектором. Обычно в качестве вектора используют плазмиды —
обособленные круговые ДНК естественного происхождения. Первым шагом
по добавлению фрагмента является создание ступенчатого разрыва в ДНК век-
тора. Более длинный конец ступенчатого разрыва называется липким или коге-
зивным концом, поскольку к нему может прикрепляться любой фрагмент ДНК
с комплементарной последовательностью. Для получения комплементарного
липкого конца интересующий фрагмент подвергается воздействию рестрик-
тазами. ДНК-лигаза завершает соединение фрагмента с вектором (рис. 15.11).
Рис. 15.11. Открывание плазмиды с помощью рестриктазы кишечной палочки
ДНК-линкер связывается с молекулой ДНК, чтобы сделать ее восприим-
чивой к определенной рестриктазе. Этот метод позволяет добавить когезив-
ные окончания, характерные для любой рестриктазы, к почти любой молекуле
ДНК. Репликации подвергаются ДНК с завершенной структурой.
Плазмиды в некоторой степени являются добавочными хромосомами. Они
могут реплицироваться независимо от хозяйских хромосом. Таким образом,
клетка может иметь несколько копий определенной плазмиды. Как правило,
такая репликация делает плазмиды более полезными в качестве векторов, чем
хозяйские хромосомы. До настоящего момента значимость плазмид была по-
казана только для бактерий.
302 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
Добавление “новых” генов приводит к появлению трансгенного организма,
который может рассматриваться как новый вид. Такие организмы могут инфи-
цировать человека и привести к возникновению новой болезни, у которой нет
эффективного лечения. Чтобы свести к минимуму потенциальные риски, свя-
занные с распространением таких организмов, исследователи работают либо
с ослабленными, либо безопасными для человека формами.
Определение последовательности ДНК
Рестриктазы являются главным инструментом определения последователь-
ностей оснований в структуре ДНК. Отщепленные фрагменты ДНК значи-
тельно меньше по размеру, чем материнская ДНК, что существенно облегчает
дальнейший анализ и работу с ними. Для отделения фрагментов после рас-
щепления часто применяется электрофорез в геле, еще больше упрощающий
дальнейший анализ.
Электрофорез в геле
Электрофорез в геле — это биохимическая техника, применяемая для от-
деления и очищения белков и нуклеиновых кислот, различающихся по заряду,
размеру или структуре (рис. 15.12). Образец помещается в лунку внутри геля,
который представляет собой полимер, специально разработанный для этого
Анод
Q Q О
Большой слабоположительный заряд
Маленький слабоположительный заряд
Большой сильноположительный заряд
Маленький сильноположительный заряд
Катод
Рис. 15.12. Гель-электрофорез
ГЛАВА 15 Копирование ДНК 303
вида анализа. Такие гели имеют консистенцию джема (на вкус, скорее всего,
не так хороши) и раскатываются в тонкую пластинку. Гель действует как мо-
лекулярное сито. Чтобы отделить белки или маленького размера нуклеиновые
кислоты (ДНК, РНК и другие), биохимики применяют полиэтилен сетчатой
структуры. Для отделения больших нуклеиновых кислот используется агаро-
за — экстракт из морских водорослей.
Гелевая пластинка погружается в буферный состав, а на ее концы подается
электрическое напряжение. Зараженные частицы внутри образца перемещают-
ся по направлению к одному или другому электроду. У белков может быть, как
положительный, так и отрицательный заряд, но при соответствующем уровне
pH нуклеиновые кислоты заряжены только отрицательно. Положительно заря-
женные формы двигаются к отрицательно заряженному концу геля, а отрица-
тельно заряженные формы — к положительно заряженному концу. Обычно pH
буфера регулируется так, что все вещества имеют либо положительный, либо
отрицательный заряд.
Разные молекулы движутся через гель с разной скоростью. Когда более бы-
стрые молекулы меньшего размера приближаются к краю гелевой пластины,
процесс останавливается, а молекулы окрашиваются и становятся видимыми.
Иногда исследователи добавляют химические агенты, чтобы вызвать флуорес-
ценцию (свечение) под воздействием ультрафиолетового излучения и сфото-
графировать полученную картину. Размещение рядом нескольких образцов,
включая маркеры известной молекулярной массы, позволяет определить точ-
ный молекулярный вес отдельного компонента. Это один из этапов идентифи-
кации неизвестных соединений.
Метод гель-электрофореза для разделения фрагментов ДНК позволяет легко
распознать соединения с даже незначительными отличиями. Некоторые геля
более оказываются более полезными для разделения крупных фрагментов, чем
мелких, а другие — помогают различать фрагменты, которые отличаются всего
одним основанием из нескольких сотен. Дополнительные модификации мето-
да гель-электрофореза позволяют повысить точности дальнейшего разделения.
У каждого вида ДНК своя последовательность, что делает его четко отличи-
мым от других образцов. Два образца с идентичными шаблонами должны при-
надлежать одному и тому же источнику или однояйцевым близнецам.
При анализе и работе с генетическим материалом всегда полезно
определить последовательность нуклеотидов в нем. Общий метод
нахождения последовательности нуклеотидов в ДНК был разрабо-
тан Эдвином Саузерном, и потому называется Саузерн-блотптингом.
В этом методе в качестве легко обнаруживаемой метки применяют
радиоактивный 32Р. Этот радиоизотоп входит в состав некоторых
304 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
нуклеотидов. Определение последовательности нуклеотидов в РНК
выполняется с помощью нозерн-блоттинга, а идентификация бел-
ка — с помощью вестерн-блоттинга, названия которых не связаны
с фамилиями их разработчиков.
Определение последовательности оснований
С момента первого выделения ДНК был разработан ряд методик по опреде-
лению последовательностей оснований. В настоящее время все остальные ме-
ханизмы успешно вытеснил дидезокситерминаторный метод Сэнгера. В его
основу легло контролируемое прерывание репликации модифицированными
нуклеотидами, содержащими дидезоксирибозу вместо дезоксирибозы.
Фрагменты ДНК, полученные с помощью рестриктаз, денатурируются для
получения однонитевой ДНК. (Денатурация обычно предполагает нагревание
ДНК-содержащего раствора до 96 °C (205 °F) в течение нескольких секунд.)
Четыре образца такой ДНК обрабатываются отдельно путем репликации для
получения двухнитиевой ДНК, а в каждом образце содержится небольшое ко-
личество различных дидезоксидных нуклеотидов, а в дидезокси-нуклеотиде
содержится дидезоксирибоза. Отсутствие дополнительного атома кислорода в
дидезоксирибозе означает отсутствие 3-гидроксильной группы для продолже-
ния репликации. Таким образом, включение дидезоксинуклеотида завершает
нить ДНК (рис. 15.13).
но
он он
Рибоза
он н
Дезоксирибоза
Дидезоксирибоза
Рис. 15.13. Структуры рибозы и дидезоксирибозы
Один из четырех образцов будет содержать небольшое количество дидезок-
си-аналога нуклеотида dGTP. Эта “дефектная” единица входит в состав но-
вой нити ДНК как дополнение к основанию цитозина в исходном фрагменте.
ГЛАВА 15 Копирование ДНК 305
Отделение нового материала от исходного приводит к получению набора фраг-
ментов ДНК различной длины. Впоследствии эти фрагменты отделяются ме-
тодом электрофореза в соответствии с длиной (размером). Длина каждого из
фрагментов определяет положение основания Ц в исходной нити. Оставшиеся
три образца определяют положения оснований А, Т и Г в исходной нити.
Q Полезной модификацией этого метода является флуоресцентное ме-
чение. Каждый из дидезоксидных нуклеотидов получает свою флу-
оресцентную метку. Все четыре эксперимента после прикрепления
СОВЕТ „ _
меток можно проводить в одном контейнере. В результате разделе-
ния фрагментов методом электрофореза и последующего изучения
меток можно получить цветную схему, на которой изображаются
последовательности всех оснований. Этот метод работает для фраг-
ментов, составленных не больше, чем из 500 оснований.
Для проведения этих исследований вам понадобится достаточное
количество генетического материала. Отсутствие достаточного ко-
личества образцов было проблемой особенно при сборе судебно-ме-
на практике дИЦИНСКИХ доказательств. Поэтому ученые разработали способы
быстрого дублирования достаточного количества идентичных фраг-
ментов ДНК или получения ряда нитей ДНК из образца очень ма-
ленького размера. Полимеразная цепная реакция (ПЦР) — полезный
метод амплификации специфических последовательностей ДНК.
ПЦР относится к процедурам in vitro и требует знания базовых по-
следовательностей, примыкающих к определенной последователь-
ности-мишени (а именно, фланкирующих последовательностей).
Однако знать последовательность оснований в целевой области нет
необходимости. В результате денатурации образца ДНК получаются
две отдельные последовательности. В смесь добавляются два прай-
мера, которые прикрепляются к фланкирующей последовательности
каждой нити. ДНК-полимераза запускает репликацию, начиная с
каждого из праймеров. При повторении этих этапов быстро образу-
ется большое количество ДНК. Примерно через 30 циклов происхо-
дит усиление в миллион раз. Вся процедура занимает меньше часа
времени.
Известно все: судебно-медицинская экспертиза
Исследователи могут идентифицировать вещество, выделяя и изучая
ДНК-последовательности, специфические для этого вещества. Например, ана-
лиз ДНК может проводиться с целью идентификации организмов, таких как
ЗОб ЧАСТЬ 5 Генетика: почему мы такие, какие есть
бактерии, загрязняющие воду, продукты питания и другие образцы. Анализ
ДНК применяется для определения родословной у племенного скота, а также
для идентификации исчезающих видов животных в судебных процессах над
браконьерами. Однако наибольшее распространение метод получил в области
криминалистики.
Поскольку каждый человек получает ДНК как от матери, так и от отца, она
уникальна и присуща только ему одному (за исключением однояйцевых близ-
нецов). Даже братья и сестры, включая разнояйцевых близнецов, демонстри-
руют определенную вариативность в ДНК. Этот факт делает анализ ДНК неве-
роятно ценным инструментов в криминалистической экспертизе.
Для идентификации личности судебно-медицинские эксперты исследуют 13
участков (маркеров) образца ДНК, которые существенно отличаются у всех
людей. В данных 13 участках два человека могут иметь одинаковый образец
ДНК с вероятностью всего 1 к 1 млрд. Изучение дополнительных маркеров
позволяет повысить точность метода еще больше. Результаты исследований
заносятся в ДНК-профиль человека, называемый ДНК-фингерпринтом.
Образцы ДНК выделяются из крови, волос, костей, ногтей, зубов и
любой жидкости человеческого тела. В обычном анализе на месте
преступления собираются образцы из улик и у всех подозреваемых,
на практике а дНК извлекается и анализируется на предмет наличия специфи-
ческих маркеров. Совпадение одного маркера не доказывает, что
человек находился на месте преступления, но совпадение четырех
или пяти таких маркеров указывает на повышенную вероятность его
пребывания там. Если образец очень маленький, то может потребо-
ваться провести ПЦР-исследование (см. предыдущий раздел).
Методы анализа
Для анализа ДНК применяется несколько методик. К наиболее распростра-
ненным из них относят ПДРФ, ПЦР и ДНК-типирование STR-методом. В ПДРФ
(полиморфизм длин рестрикционных фрагментов) образец ДНК переварива-
ется специфическим ферментом — рестрикционной эндонуклеазой. Этот фер-
мент разрезает ДНК в определенной последовательности. Наличие или отсут-
ствие таких мест в образце ДНК приводит к изменению длины ДНК-фрагмен-
тов. Затем фрагменты отделяются с помощью метода гель-электрофореза.
ПДРФ — это один из методов генетического анализа ДНК, применяемых в
криминалистике. Он требует относительно большого количества ДНК-мате-
риала, а образцы, содержащие грязь и плесень, анализировать с его помощью
сложно. Отчасти он был заменен более совершенной ПЦР-методикой, а затем
типированием STR-методом.
ГЛАВА 15 Копирование ДНК 307
Полимеразная цепная реакция, или ПЦР (см. предыдущий раздел) относит-
ся к важным исследовательским методикам со сниженными требованиями к
размерам образца, который является определяющим в ПДРФ. По сути ПЦР
выступает свое рода генератором ДНК-материала. С его помощью быстро соз-
даются миллионы точных копий образца ДНК. Используя ПЦР, ученые могут
проводить анализ ДНК в образцах размером всего в несколько клеток или в
сильно деградировавших образцах. После проведения ПЦР образцы подверга-
ются ПДРФ-исследованиям или типированию по методу STR.
ПЦР играет важную роль в криминалистике. До появления ПЦР ис-
следованию подлежали только образцы ДНК достаточно больших
размеров. В случае ПЦР размер образца не играет особой роли, по-
скольку перед идентификацией ДНК подвергается принудительному
размножению. Появление ПЦР позволило снять обвинения и осво-
бодить от отбывания наказания (в отдельных случаях даже смертной
казни) большого количества невинных заключенных.
В STR-методике (основанной на коротком тандемном повторе)
быстрому исследованию подвергается образец ДНК из 13 опреде-
ленных участков. ФБР использует STR-профили в своей программе
напрактике coDIS (Combined DNA Index System — Объединенная индексная
система ДНК), в которую объединены национальные, государствен-
ные и местные базы данных профилей ДНК преступников, про-
павших без вести людей и участников нераскрытых преступлений.
В каталоге CODIS содержится более 3 миллионов профилей ДНК.
Тестирование на определение отцовства
НАПРАКТИКЕ
Тестирование на отцовство, наряду с анализом улик с места престу-
пления, относится к наиболее часто проводимым ДНК-исследовани-
ям. Процедура начинается со сбора образцов ДНК матери, ребенка и
предполагаемого отца (отцов). Сначала определяются профили ДНК
ребенка и матери. Маркеры, не унаследованные от матери, долж-
ны быть отобраны у биологического отца. Впоследствии профиль
ДНК предполагаемого отца сравнивается с профилем ребенка. Если
в ДНК-профиле мужчины присутствуют маркеры, встречающиеся
в профиле ребенка и отличные от таковых в материнском профи-
ле, то вероятность того, что он является биологическим отцом,
очень высока. На рис. 15.14 проиллюстрирована ситуация, в ко-
торой предполагаемый отец под номером 2 имеет большую веро-
ятность быть биологическим отцом ребенка, чем предполагаемый
отец под номером 1.
308 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
Мать
„ „ Предполагаемый
Ребенок отец т
Предполагаемый
отец 2
Рис. 15.14. Сравнение результатов генетического исследования
Диагностика генетических заболеваний
и другие ДНК-исследования
Со временем ДНК-исследования находят все более широкое практическое
применение. Например, уже несколько лет они проводятся для определения
пола спортсменов. В дополнение к этому при проведении последних суперкуб-
ков по американскому футболу было принято историческое решение маркиро-
вать нитью синтетической ДНК все игровые мячи, чтобы предотвратить вынос
со стадионов спортивных памятных вещей. Начиная с 2000 года, ДНК-мате-
риал добавляется в красители, применяющиеся при производстве официаль-
ной атрибутики летних Олимпийских игр. Эта же технология применяется для
маркировки оригинальных произведений искусства и отслеживания путей по-
ставки слоновой кости, добытой браконьерским способом.
Генетические заболевания возникают вследствие патологических измене-
ний в структуре ДНК. Такие заболевания наследственные, хотя есть люди, в
которых они никак не проявляются, хотя они выступают их носителями. В по-
следнее время было проведено большое количество исследований, направлен-
ных на определение генетических причин возникновения таких заболеваний
и поиск путей предотвращения передачи их последующим поколениям. Тем
не менее на сегодняшний день человечество не располагает инструментами
эффективного лечения большинства генетических недугов. Скорее всего, такие
инструменты будут основаны на методах генетической модификации биологи-
ческих структур — в медицине такие технологии называются генной терапи-
ей. На сегодня хорошо изучены только некоторые из генетических заболева-
ний. Давайте кратко рассмотрим наиболее распространенные из них.
ГЛАВА 15 Копирование ДНК 309
Серповидно-клеточная анемия
Серповидно-клеточная анемия — это наследственное врожденная патоло-
гия компонента эритроцитов. Серповидно-клеточная анемия является резуль-
татом изменения одной из аминокислот в белковой последовательности ге-
моглобина, заключающегося в замещении валина (неполярного) глютаминовой
кислотой (полярной). Заболевание возникает у миллионов людей во всем мире;
особенно часто оно регистрируется у выходцев из Африки, Южной Америки,
Кубы, Саудовской Аравии и некоторых других стран. В Соединенных Штатах
от него страдают около 72 000 человек. Серповидная клетка встречается при-
мерно у одного афроамериканца из 500 и одного латиноамериканца из 1200.
Гемоглобин отвечает за перенос кислорода из легких в клетки. У человека,
страдающего серповидно-клеточной анемией, дефектные молекулы гемоглоби-
на сливаются воедино, в результате чего эритроциты принимают серповидную
форму, откуда и название болезни. Такие аномальные клетки с трудом проти-
скиваются сквозь узкие кровеносные сосуды, вызывая кислородное голодание
органов и конечностей, а также острые болевые ощущения. Срок жизни серпо-
видных структур намного короче, чем у обычных эритроцитов, что приводит
к появлению хронической анемии. Тестирование новорожденных на признаки
серповидно-клеточной анемию проводят во многих странах.
Гемохроматоз
Гемохроматоз — это одно из наиболее распространенных генетических
расстройств в США. Является наследственным заболеванием, при котором
организм всасывает и запасает слишком много железа. Избыток железа нака-
пливается в печени, поджелудочной железе и коже (да, кожа тоже считается
органом!). Гемохроматоз вызывается мутацией гена HFE, регулирующего ус-
ваивание железа из пищи. У человека гемохроматоз развивается в случае на-
следования дефектного гена сразу от обоих родителей. Если мутировавший
ген наследуется только от одного родителя, то человек будет только носителем
болезни, но сама она не будет проявляться. Примерно у 5 кавказцев из 1000
присутствуют оба мутировавших гена, а каждый десятый выступает носите-
лем. Генетическое тестирование позволяет выявить гемохроматоз примерно в
90% случаев.
Муковисцидоз
Муковисцидоз — это хроническое и обычно смертельное генетическое забо-
левание, при котором нарушается работа слизистых желез. При муковисцидозе
поражается пищеварительная и дыхательная системы. Около 55 тыс. человек
по всему миру страдают от муковисцидоза. Большинство из них — выходцы с
310 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
Кавказа, чьи предки прибыли туда из Северной Европы. Для получения забо-
левания необходимо унаследовать мутировавший ген от обоих родителей. Со-
гласно исследованиям такой дефектный ген есть у каждого двадцатого амери-
канца. Большинство из людей не знают, что являются носителями дефектного
гена муковисцидоза. Точность генетического тестирования в случае муковис-
цидоза равна 80%.
Гемофилия
Гемофилия — это генетическое нарушение, вызванное отсутствием факто-
ра свертывания крови, возникающего вследствие мутации гена, сцепленного с
Х-хромосомой. У женщин две Х-хромосомы, поэтому, если одна из них связа-
на с поврежденным геном, то вероятность того, что второй ген также имеет де-
фект, очень небольшая. Но такая женщина является носителем заболевания. У
мужчин, тем не менее, только одна Х-хромосома — при повреждении связан-
ного гена у него развивается гемофилия. Если женщина является носителем,
то ее сыновья получат гемофилию с вероятностью 50%, а дочери с такой же
вероятностью будут выступать носителями заболевания. Носителями гемофи-
лии также будут дочери болеющего мужчины. Аномальный ген определяется в
результате генетических исследований.
Болезнь Тея-Сакса
Болезнь Тея-Сакса — это наследственное заболевание, при котором вслед-
ствие мутации определенного гена в тканях мозга накапливается производная
жирной кислоты — липид с названием ганглиозид. Хотя этот аномальный ген
распространен преимущественно среди евреев, некоторые французские канад-
цы и потомки французов из Луизианы также являются его носителями. Сим-
птомы заболевания начинают проявляться еще в младенчестве. Смерть обычно
наступает до 5 лет. Хотя болезнь Тея-Сакса встречается очень редко, это одно
из первых генетических заболеваний, для которого было разработано массовое
и недорогое генетическое обследование. Первые скрининг-тесты были получе-
ны еще в 1970-х годах, и сразу же в Израиле была запущена программа по бес-
платному проведению генетического исследования среди населения. Благодаря
проведению интенсивного тестирования и консультированию сегодня болезнь
практически искоренена среди еврейского населения по всему миру.
ЭТИЧЕСКИЕ ТРУДНОСТИ ГЕНЕТИЧЕСКИХ ИССЛЕДОВАНИЙ
Развитие биоинженерии приводит к постановке многих этических вопросов,
включая дискуссии о необходимости исследования стволовых клеток, генети-
ческой модификации сельскохозяйственных культур, отбора детей по гендер-
ГЛАВА 15 Копирование ДНК 311
ному признаку, внесения изменений в генокод для усиления положительных
черт и т.д. На обсуждение также выносятся вопросы государственно финанси-
рования — программы по внедрению технологий генетических исследований,
как правило, обходятся недешево. Нужно ли обеспечивать равный доступ к
таким процедурам всем делающим или только тем, кто может себе их позво-
лить? Насколько безопасны генетически модифицированные культуры? Как и
кем должно регулироваться их распространение? В области патентного права
есть много "серых" областей, касающихся урегулирования спорных вопросов
в отрасли генетики. Пока что вопросов намного больше, чем однозначных от-
ветов на них.
Хотя успех с искоренением синдрома Тея-Сакса напрямую связан с прогрес-
сом во внедрении технологий генетического исследования населения, прове-
дение такого тестирования обнажает ряд этических вопросов. Главной про-
блемой остается конфиденциальность исследований. Образцы и профили
ДНК могут быть использованы для определения родства и предрасположен-
ности к определенным генетическим заболеваниям. Многие опасаются, что
правительство, страховые компании, работодатели, банки, школы и другие
организации будут использовать такую информацию для умышленной дискри-
минации определенных слоев населения. Известен прецедент, когда жителю
Великобритании было отказано в оплате лечения гемохроматоза страховой
компанией, утверждавшей, что такое состояние здоровья наблюдалось у него
всегда. Люди, страхующие свою жизнь, сообщают о других случаях генетиче-
ской дискриминации. Какие организации получают доступ к генетической ин-
формации, и кто имеет право проводить исследования? Это лишь некоторые
из актуальных вопросов, ответы на которые предстоит выработать в течение
ближайших лет.
312 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
Глава 16
Расшифруй это!
Транскрипция РНК
В ЭТОЙ ГЛАВЕ...
» Назначение ДНК-полимеразы
» Транскрипция у прокариот и эукариот
» Корректировка генов
В этой главе мы сконцентрируемся на синтезе РНК — процессе, который
в биохимии называется транскрипцией и заключается в производстве
РНК из ДНК. Сначала раскрывается часть (ген) двойной нити ДНК, а
затем к обнаженным нуклеотидам разделенной молекулы ДНК с помощью
процесса, подобного репликации, присоединяются внешние, комплементар-
ные нуклеотиды. Однако транскрипция имеет несколько ключевых отличий от
репликации: открывается только часть ДНК, а в составе присоединяемых ну-
клеотидов тимин заменен урацилом. Кроме того один ген становится донором
одной молекулы РНК, которая в свою очередь обеспечивает синтез одного или
нескольких белков.
В процессе реакций синтеза РНК, который происходит внутри клеточного
ядра, нуклеотиды соединяются с помощью фермента РНК-полимеразы. Про-
цесс запускается с инициирующего сигнала, направленного на 5 конец РНК и
продолжается в направлении терминирующего кодона у конца 3.
“проанализировать” результат своих действий и устранить неправильно по-
добранные нуклеотиды, заменив их корректными формами. РНК-полимераза
работает в отсутствие праймеразы.
nh2
Внутренний фосфат
Группа ОН третьего конца
Рис. 16.1. Структура АТФ
В простых организмах, таких как Е. coli, все формы РНК синтезируются с
помощью единственного вида РНК-полимеразы. У более сложных организмов,
таких как человеческий, РНК-полимераза бывает нескольких видов. Обычно в
клетках млекопитающих можно обнаружить не менее трех различных видов
РНК-полимеразы.
Создание РНК: самое главное
Область молекулы ДНК, которая кодирует белок, называется структурным
геном. Активность этого гена регулируют другие области ДНК (см. далее). Что-
бы начать транскрипцию, РНК-полимераза должна обнаружить определенный
ген в длинной нити ДНК. Поиск начинается с определения ферментом места
в нити ДНК, называемого сайтом инициации транскрипции и расположенного
далее по ходу самого гена — на 5 гидроксильной группе пентозы нуклеотида.
РНК-полимераза плотно связывается с этим участком, и с этого начинается сам
процесс транскрипции.
Начало транскрипции РНК
В прокариотических клетках промоторные участки транскрипции сконцен-
трированы в областях -35 и -10 (бокс Прибнова). У бокса Прибнова согла-
сованная последовательность ТАТААТ имеет центр в области -10. У второго
ГЛАВА 16 Расшифруй это! Транскрипция РНК 315
участка согласованная последовательность определена как ТТГАЦА. (У каж-
дого организма свои согласованные последовательности.) В эукариотических
клетках сайт инициации сконцентрирован приблизительно в области -25 (бокс
ТАТА или бокс Хогнесса), а иногда даже в области -75 (бокс ЦААТ). Согласо-
ванная последовательность в боксе Хогнесса — это ТАТААА. В боксе ЦААТ
такой последовательностью будет ГГХЦААТЦТ. Кроме того, эукариотические
гены могут иметь ген-усилитель, в некоторых случаях размещенный на рассто-
янии в нескольких тысяч оснований до сайта инициации в обоих направлениях
(рис. 16.2).
Прокариотический промотор
Бокс Прибнова
Шаблон ДНК ТТГАЦА ТАТААТ Ген
-35 -10 +1
Эукариотический промотор
Бокс Хогнесса
Бокс ЦААТ (присутствует непостоянно)
Рис. 16.2. Сайты инициации у прокариотов и эукариотов
ЗАПОМНИ!
Транскрипция последовательности вдоль нити ДНК начинается в
начале гена. Первый нуклеотид гена имеет номер +1. Отсчет вверх
по гену (по направлению к концу 5) соответствует отрицательному
направлению. Таким образом участок за десять нуклеотидов до на-
чала гена определяется как -10.
Транскрипция продолжается по мере продвижения РНК-полимеразы по
цепочке ДНК. Работа фермента прекращается по сигналу завершения. У про-
кариотических клеток возможны два сигнала завершения. Первый сигнал
представлен петлей (шпилькой) из парных оснований, которая состоит из са-
мокомплементарной последовательности, богатой на Ц и Г, за которой следует
последовательность из нескольких единиц У. После формирования последо-
вательности новая РНК отделяется от шаблона. Во втором случае сигналом
завершения выступает rho-фактор.
Биохимики не очень хорошо понимают, как заканчивается транскрипция
в эукариотических клетках, поскольку в них после транскрипции иРНК под-
вергается дальнейшей модификации. К пятому концу РНК прикрепляется
316 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
“колпачок” (cap), а к другому концу — поли(А)хвост, что позволяет увеличить
срок жизни иРНК.
Синтез РНК включает три этапа: инициация, удлинение и прерывание.
В процессе их прохождения РНК-полимераза выполняет ряд задач. Сначала
она перемещается по цепочке ДНК до тех пор, пока не найдет промоторный
сайт. Прилипая к нему, РНК-полимераза разматывает короткий сегмент двой-
ной спирали ДНК и разделяет нити, чтобы достичь шаблона. Затем присоеди-
няет соответствующий рибонуклеозидтрифосфат, получая энергию для этой
реакции из гидролиза фосфата.
Каждый следующий рибонуклеозидтрифосфат включается в процесс по
мере продвижения РНК-полимеразы по цепочке ДНК. (ДНК разматывается
при прохождении фермента и обратно переплетается после ухода фермента.)
Транскрипция продолжается до тех пор, пока РНК-полимераза не встретит
сигнал к завершению. Фермент также взаимодействует с транскрипционными
факторами или транс-активными факторами для регулирования скорости
инициирования транскрипции — белками, которые действуют как активаторы
или репрессоры.
Понимание принципов работы РНК-полимеразы стало возможным благо-
даря исследованиям прокариотических клеток кишечной палочки. Эукарио-
тические клетки ведут себя подобным, хотя и более сложным образом. Одно
из главных различий между ними заключается в том, что в прокариотических
клетках транскрипция и трансляция (белковый синтез) могут происходить
почти одновременно, тогда как в эукариотических наблюдается разрыв между
этими двумя процессами во время движения иРНК от ядра к рибосоме. Другое
важное отличие состоит в том, что в эукариотических клетках синтезирован-
ная РНК почти всегда подвергается процессингу, тогда как прокариотическая
РНК готова к выполнению своих обязанностей сразу после синтеза. Во время
процессинга к молекуле добавляется колпачок, поли(А)хвост и, практически
всегда, выполняется сплайсинг для удаления интронов (сегментов, не кодиру-
ющих белок).
Прокариотические клетки
РНК-полимераза Е. coli содержит четыре субъединицы, которые объединя-
ются в голофермент, обозначенный как а2РР'о. Субъединица о обеспечивает
нахождение промотора и инициацию синтеза РНК. После запуска синтеза эта
субединица оставляет напоминание о себе в виде минимального фермента.
Каталитический участок минимального фермента содержит два двухвалент-
ных иона металла, один из которых остается с ядром, а другой проникает в
рибонуклеозидтрифосфат и соединяется с отщепленным пирофосфатом.
Три аспартатных остатка способствуют связыванию ионов металла. Хотя
ГЛАВА 16 Расшифруй это! Транскрипция РНК 317
у ДНК-полимеразы и РНК-полимеразы в целом разное строение, их активные
участки схожи.
Без субъединицы о РНК-полимераза в любой момент будет плотно связы-
ваться с ДНК. При наличии субъединицы о плотность связывания на других
участках, кроме промотора, значительно ниже. Уменьшение сродства позволя-
ет голоферменту скользить по цепочке ДНК до тех пор, пока субъединица о не
обнаружит промотор. РНК-полимераза связывается с ним сильнее, чем с дру-
гими местами нити ДНК. Эффективность такого связывания является одной
из форм регулирования транскрипции. Существует несколько субъединиц о,
каждая из которых предназначена для распознавания разных промоторов.
Обозначенный процесс связывания похож на подъем водолаза вверх по
страховочному канату. Водолаз продвигается вверх, держась за веревку, на ко-
торой узлами обозначаются места остановки для декомпрессии.
После того, как РНК-полимераза попадает на сайт инициации, 17 базовых
парных сегментов двойной нити разворачиваются, а между парами разрывает-
ся связь. В процессе такого раскручивания закрытый промоторный комплекс
преобразуется в открытую структуру. Теперь РНК-полимераза может присту-
пать к построению нити РНК путем присоединения первого нуклеотидтри-
фосфата. (Здесь, в отличие от репликации ДНК, праймер не нужен.) Первый
нуклеотидтрифосфат обычно представлен меткой рррГ или рррА, которая
остается в нити на протяжении всей транскрипции. Эта метка прикрепляется
к концу 5 новой молекулы РНК, а удлинение начинается с присоединения но-
вого нуклеотида к концу 3 (рис. 16.3).
После присоединения первых двух нуклеотидов с помощью фосфат-диэ-
фирной связи субъединица о уходит, позволяя минимальному ферменту бо-
лее плотно связаться с субстратом. Образуется транскрипционный глазок, в
котором сдержится РНК-полимераза, раскрученная часть ДНК и быстро фор-
мирующаяся РНК. Первоначально короткий сегмент новой РНК образует ги-
бридную спираль с ДНК. Этот сегмент обычно состоит примерно из восьми
пар оснований или одного оборота двойной нити. Скорость роста составляет
порядка 50 нуклеотидов в секунду. (Заметьте, что репликация ДНК протекает
со скоростью около 800 нуклеотидов в секунду.)
ЗАПОМНИ1
РНК-полимераза не проверяет РНК на правильность структуры,
поэтому ошибки закрадываются в молекулу задолго до завершения
репликации. Но поскольку они не всегда передаются следующему
поколению, количество мутаций или долговременных эффектов не-
велико. В любом случае следующая нить РНК будет сформирова-
на без повторения дефектов, получив стандартную структуру. Одна
“плохая” РНК среди несколько сотен или даже тысяч стандартных
318 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
копий одного и того же гена не окажет заметного влияния на метабо-
лизм клетки. К тому же РНК структурно менее стабильна, чем ДНК,
а потому менее долговечна, что не так уж и плохо.
О
Уходящий пирофосфат
о о
I
-О--- --О---Р—ст
СГ О"
Рис. 16.3. Связывание второго нуклеотида с меткой рррГ (вверху)
и присоединенные нуклеотиды в начале нити (внизу)
ГЛАВА 16 Расшифруй это! Транскрипция РНК 319
Удлинение нити продолжается до тех пор, пока РНК-полимераза не получит
сигнал о завершении, который инициирует ряд новых действий. На этом эта-
пе прекращается образование новых фосфатных диэфиров, гибридная струк-
тура РНК-ДНК разделяется, часть цепи ДНК все еще остается открытой, но
РНК-полимераза отделяется от ДНК.
Сигналы к завершению бывают разные. Один из самых простых — это па-
линдромная (одинаковая в обоих направлении) метка с высоким содержани-
ем оснований ГЦ, сопровождающаяся областью с высоким содержанием ос-
нований АТ. Палиндромная область всегда самокомплементарная, а высокая
концентрация водородных связей в ней вызывает образование петли в виде
шпильки. Богатая основаниями АТ область обуславливает появление ряда пар
Урнк“Аднк с менее сильными взаимодействиями на уровне водородных свя-
зей. Формирование такой “шпильки” и АТ-области приводит к дестабилиза-
ции общей структуры гибрида РНК-ДНК и отщеплению зарождающейся РНК
(рис. 16.4).
Рис. 16.4. Петля "шпилька" и часть
последовательности РНК
Не все сигналы завершения представлены петлей в виде шпильки и бога-
тым на основания У сегментом. В отдельных случаях РНК-полимеразе нужно
оказать помощь в прекращении работы. Об этом свидетельствуют наблюде-
ния, показывающие, что нити in vitro часто длиннее нитей in vivo у одной и
той же РНК. Это говорит о том, что РНК-полимераза in vitro не способна са-
мостоятельно прервать процесс удлинения молекулы. Все дело в отсутствии
320 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
помощника, которым выступает белок с названием rho-фактор (р-фактор).
Этот белок оборачивается вокруг зарождающейся РНК вскоре после того, как
она выходит из формы транскрипционного глазка. Для обеспечения реакции
энергией р-фактор принимает участие в гидролизе АТФ в присутствии РНК.
Вначале он присоединяется к бедному гуанином и богатому цитозином сег-
менту РНК, а затем продвигается вдоль зарождающейся РНК до тех, пока не
натолкнется на транскрипционный глазок. В этой точке он разрушает гибрид
РНК-ДНК и отделяет зарождающуюся РНК. Функции rho-фактора иногда вы-
полняют другие белки.
В прокариотических клетках иРНК готова или почти готова к работе сразу
после выхода из этапа транскрипции (не стоит забывать, что трансляция может
начаться до окончания транскрипции). Однако для получения тРНК и рРНК
нужно провести расщепление и другие изменения в зарождающейся нити
РНК. РНК прицельно расщепляют разных виды нуклеаз. Из длинной зарожда-
ющейся нити РНК можно получить несколько белков. Для обработки может
потребоваться соединение нескольких нуклеотидов. Например, ко всем моле-
кулам тРНК для правильного сбора нуклеотидов нужно добавить хвост ЦЦА.
В отдельных случаях достаточно изменить основания или рибозные единицы.
Эукариотические клетки
В отличие от прокариотических клеток, транскрипция и трансляция в эу-
кариотических клетках проходит в разных областях, что обеспечивает более
строгий контроль за экспрессией генов. Другое отличие состоит в том, что в
эукариотических клетках наряду с рРНК и тРНК интенсивно вырабатывается
иРНК. Под воздействием РНК-полимеразы у иРНК образуется “колпачок” и
поли(А)хвост. Почти все молекулы иРНК сплайсированы, т.е. из них удалены
интроны, а оставшиеся экзоны (кодирующие белок) объединены между собой.
В виде интронов может представляться до 90% зарождающейся РНК.
Обычно в эукариотических клетках содержится три вида РНК-полимеразы.
» Тип I вырабатывает большинство форм РНК в ядрышках.
» Тип II вырабатывает иРНК и мяРНК в нуклеоплазме.
» Тип III производит тРНК и небольшое количество рРНК в нуклео-
плазме. (Справедливости ради стоит заметить, что эта полимераза
производит только пре-формы РНК указанных молекул.)
У каждой из трех полимераз свой тип сайта инициации, или промотора. Эти
сайты, как и у прокариот, находятся на верхних, на нижних участках или вну-
три самих генов. Помимо промоторов у полимераз встречаются гены-усилите-
ли (энхансеры). Гены усилители повышают эффективность промоторов. Они
применяются для регуляции генов, и у одного промотора они могут находиться
ГЛАВА 16 Расшифруй это! Транскрипция РНК 321
в разных местах цепи ДНК. Как промоторы, так и большинство генов-усили-
телей размещаются на одной нити ДНК с геном, который они регулируют; по-
этому они по сути выступают цис-активными элементами. Как обсуждалось
ранее, обычно промоторами являются блоки ТАТА (обычно располагаются
между участками -30 и -100), ЦААТ и ГЦ (оба расположены между участками
-40 и -150). Гены-усилители могут находиться перед, после или внутри гена,
который будет подвергнут транскрипции. Если гены-усилители присутству-
ют в противоположной цепи ДНК, то они называются транс-активными, или
транскрипционными факторами другой нити ДНК.
В наиболее распространенном случае транскрипционный фактор TFIID (TF
обозначает транскрипционный фактор, а цифра II — РНК-полимеразу II) свя-
зывается с блоком ТАТА. Связывание становится возможным благодаря на-
личию у TFIID небольшого компонента, обозначаемого аббревиатурой ТВР
(TATA-box-binding protein — связывающий блок ТАТА белок), который име-
ет чрезвычайно высокое структурное сродство с ТАТА. Присоединение ТВР к
ДНК приводит к существенным изменениям в ДНК, включая раскручивание ее
на несколько градусов.
Позже к ТВР присоединяются другие компоненты, используемые в процес-
се транскрипции, в таком порядке: TFIIA, TFIIB, TFIIF, РНК-полимераза II и,
наконец, TFIIE. Последняя группа представляет собой базовый транскрипци-
онный комплекс. Это только одна из возможных комбинаций многочисленных
факторов инициации транскрипции.
В эукариотических клетках все или почти все продукты транскрипции (пре-
курсоры) подвергаются дальнейшему преобразованию, прежде чем достигают
конечной активной формы. В общем случае у прекурсоров тРНК удаляется на-
чальный конец 5, в процессе сплайсинга извлекаются все интроны, поли(У)-
хвост заменяется последовательностью ЦЦА, а иногда даже изменяются не-
которые основания. Каждая из операций выполняется с помощью одного или
нескольких ферментов.
Очень часто прекурсоры различных форм иРНК подвергаются значитель-
ным изменениям. В частности, у них добавляется “колпачок” к концу 5 и по-
ли(А)хвост к концу 3. Колпачки нумеруются как 0, 1 и 2, где число указывает
количество метилированных рибозных сахаров (рис. 16.5). У тРНК, мяРНК
или рРНК такие колпачки отсутствуют.
У большинства иРНК есть поли(А)хвост, не закодированный ДНК. Обыч-
но перед добавлением этого хвоста расщепляется интронная часть прекурсо-
ра иРНК. Последовательность ААУАА указывает место, где происходит такое
расщепление. Эта последовательность представляет собой только часть сиг-
нала; что является остальной частью сигнала, пока достоверно не известно.
После расщепления поли(А)полимераза добавляет около 250 аденилатных
322 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
остатков к концу 3. Точное назначение хвоста не ясно, но предполагается, что
он усиливает трансляцию и увеличивает срок службы молекулы иРНК.
иРНК
Рис. 16.5. Колпачки в общей структуре иРНК
В некоторых случаях прекурсоры иРНК нуждаются в редактировании. Под
редактированием понимается изменение последовательности оснований на
отличную от заданной в процессе сплайсинга. Для примера рассмотрим хи-
мическое преобразование одного основания в другое. Редактирование проис-
ходит в иРНК, кодирующей аполипопротеин В (аро-В), который состоит из
4536 остатков. Однако в метаболизме очень важной оказывается форма, обра-
зованная из 2152 таких остатков. Наряду с этим востребована и более длинная
форма белка, синтезируемая в печени, — она играет важную роль в транспорте
ГЛАВА 16 Расшифруй это! Транскрипция РНК 323
липидов. Укороченная форма, синтезируемая в тонком кишечнике, нужна для
взаимодействия с жирами, поступающими вместе с пищей. В любом случае за
образование обеих форм белка отвечает одна и та же иРНК. В тонком кишеч-
нике дезаминаза воздействует на цитозин и преобразует его в урацил, который
заменяет ЦАА-кодон (Gin) на УАА-кодон (стоп), усекающий белковую цепь до
более короткой формы.
Чаще всего для изменения формы РНК проводится сплайсинг. Сплайсинг —
это процесс удаления интронов и последовательного соединения экзонов для
получения окончательной структуры молекулы РНК. Сплайсинг должен быть
очень точным, так как извлечение всего одного основания сказывается на
структуре всей последовательности кодонов молекулы.
Обычно удалению подвергаются сразу несколько различных интронов.
В эукариотических клетках интрон начинается с основания ГУ и заканчивает-
ся основанием АГ. Другие модификации встречаются только у позвоночных,
где основание ГУ выступает концом последовательности АГГУААГУ. У выс-
ших эукариотических клетках встречаются другие последовательности с осно-
ванием АГ. В общем случае один конец интронной нити огибает и соединяется
с точкой ответвления интронной цепи. Процесс продолжается операцией объ-
единения экзонов.
В сплайсинге прекурсора иРНК важную роль играют сплайсингсомы. Эти
комплексы включают прекурсоры иРНК, несколько мяРНК и белок, известный
под названием фактор сплайсинга. В процессе принимают участие мяРНК
группы У1, У2, У4, У5 и Уб. У1 связывается с концом 5 участка сплайсинга, а
затем с концом 3. У2 привязывается к точке ответвления, У4 блокирует рабо-
ту Уб до определенного момента, У5 привязывается к концу 5 соединения, а
Уб катализирует сплайсинг. Возможны и другие варианты сплайсинга.
ЗАПОМНИ!
Другие способы сплайсинга обеспечивают производство разных
белков из одной и той же РНК.
Ничего секретного: генетический код
Подобно тому как ДНК служит шаблоном для генерации РНК, иРНК вы-
ступает шаблоном для производства белка. Для того чтобы синтезировать
соответствующий белок, необходимо обеспечить взаимодействие исходных
соединений с шаблоном для получения нужной аминокислоты. Соединени-
ем, обеспечивающим взаимодействие структур, обычно является тРНК. Эта
относительно небольшая РНК включает две важные области: участки распоз-
навания шаблона и соответствующей аминокислоты. Участок распознавания
324 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
представляет собой антикодон, дополняющий кодон в иРНК. Присоединение
аминокислоты к тРНК происходит под действием аминоацил-тРНК-синтетазы.
У каждой из 20-ти аминокислот есть не менее одной специфической синтета-
зы. Такой фермент прикрепляет специфическую аминокислоту к концу 3 аде-
нозина тРНК (рис. 16.6).
тРНК
Н---С----NH,+
Рис. 16.6. Прикрепление аминокислоты
к конечному аденозину
Кодоны
Генетический код содержит информацию, применяемую при син-
РЛ тезе белков, и состоит из трехкомпонентных наборов (триплетов),
для обозначения которых используется четыре разные буквы. Под
ЗАПОМНИ! х г-
кодоном понимают набор из трех компонентов, каждый из которых
представлен своей буквой. Терминологический словарь универсален
и применим к генетическим структурам всех известных организмов.
Для кодировки кодонов применяется алфавит их следующих четырех буквы.
А — аденин
Ц — цитозин
Г — гуанин
У — урацил
Из четырех букв можно составить словарь, включающий в общей сложности
64 слова. Из них шестьдесят одно слово обозначает конкретные аминокислоты,
ГЛАВА 16 Расшифруй это! Транскрипция РНК 325
а остальные три слова указывают на отсутствие аминокислот. Кодоны, которые
указывают на отсутствие аминокислот, называются стоп-кодами.
Поскольку известно всего 20 подлежащих кодированию аминокислот, суще-
ствование шестого кодона говорит о том, что некоторые аминокислоты состав-
ляются из нескольких кодонов.
Все возможные генокоды перечислены в таблице 16.1.
Таблица 16.1. Стандартный генетический код
Кодон Амино- кислота Кодон Амино- кислота Кодон Амино- кислота Кодон Амино- кислота
АУА Изолей АЦА Тре ААА Лиз АГА Apr
АУЦ Изолей АЦЦ Тре ААЦ Асн АГЦ Сер
АУГ Мет АЦГ Тре ААГ Лиз АГГ Apr
АУУ Изолей АЦУ Тре ААУ Асн АГУ Сер
ЦУА Лей ЦЦА Про ЦЦА Гл и ЦГА Apr
ЦУЦ Лей ЦЦЦ Про ЦАЦ Гис ЦГЦ Apr
ЦУГ Лей ЦЦГ Про ЦАГ Гл и цгг Apr
ЦУУ Лей ЦЦУ Про ЦАУ Гис ЦГУ Apr
ГУА Вал ГЦА Ала ГАА Глн ГГА Гл и
ГУЦ Вал ГЦЦ Ала ГАГ Асп ГГЦ Гл и
ГУГ Вал ГЦГ Ала ГАЦ Глн ггг Гл и
ГУУ Вал ГЦУ Ала ГАУ Асп ГГУ Гл и
УУА Лей УЦА Сер УАА Стоп УГА Стоп
УУЦ Фен УЦЦ Сер УАЦ Тир УГЦ Цис
УУГ Лей УЦГ Сер УАГ Стоп УГГ Трп
УУУ Фен УЦУ Сер УАУ Тир УГУ Цис
Анализ генетического кода показывает, что две аминокислоты — метионин
(рис. 16.7) и триптофан — представлены только одним кодоном. С другой сто-
роны, у трех аминокислот — аргинина, лейцина и серина — сразу шесть ко-
донов. Остальные пятнадцать аминокислот имеют как минимум по два кодона
326 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
каждая. Аминокислоты с большим количеством кодонов в избытке присутству-
ют в белках. Табл. 16.1 показывает, что большинство синонимичных кодонов
(кодирующих одну и ту же аминокислоту) сгруппированы вместе и различают-
ся только последним основанием в кодоне. Сходство синонимичных кодонов
предотвращает нанесение вреда организму возможными мутациями. В таблице
приведены и другие корреляции; внимательно изучите ее, чтобы найти их.
о
h2n—сн—с—он
сн,
S
I
сн,
Метионин
о о
,С--N---СН—С----ОН
i 1н,
сн,
S
I
сн,
Формилметионин
Рис. 16.7. Структуры метионина и формилметионина
Коды запуска и завершения
Хотя тРНК не считывает конечные кодоны (УАА, УАГ и У ГА), это делают
специфические белки, называемые рилизинг-факторами. Связывание рили-
зинг-фактора с рибосомой приводит к высвобождению синтезированного бел-
ка, что сигнализирует о начале нового синтеза.
В табл. 16.1 стоп-коды указаны в явном виде, а что насчет стартовых ко-
дов? Что является сигналом для начала синтеза белка? Сигналом инициа-
ции процесса обычно выступает последовательность АУГ, кодон метионина
(рис. 16.8). В эукариотических клетках в действие вступают дополнительные
факторы. У многих бактерий исходной аминокислотой, которую обычно ко-
дирует АУГ, является Шет (формилметионин), однако иногда для этих целей
применяется кодон ГУГ.
Генетический код практически универсален; в большинстве случаев кодоны
соответствуют одной и той же аминокислоте, но есть несколько исключений.
Например, код митохондриальной ДНК несколько отличается от ядерной ДНК.
В митохондриальной ДНК кодон У ГА выступает не стоп-кодом, а кодоном
триптофана.
В прокариотических клетках, в отличие от эукариотических собратьев, ко-
дирование белков происходит непрерывно. У некоторых млекопитающих и
птиц гены прерывистые. Например, в генах, кодирующих Р-глобин, некото-
рые участки не принимают участие в кодировке белка. В этом гене содержится
ГЛАВА 16 Расшифруй это! Транскрипция РНК 327
около 1660 пар оснований. Кодируют белок (экзоны) примерно 250 пар на ка-
ждом конце плюс дополнительно 500 парных сегментов. Два сегмента — один
из примерно 120 пар оснований и второй из примерно 550 пар оснований — не
кодируют белок (интроны). Весь ген состоит из последовательно заданных 240
пар экзонов, 120 пар интронов, 500 пар экзонов, 550 пар интронов и 250 пар
экзонов.
Стартовый код у прокариот
fMetzvv\/v\/>j4/vvvx^^ Белок
5 Островки пурина АУГ иРНК
-10
Связаны с рРНК
Стартовый код у эукариот
Met Белок
5 Колпачок
АУГ иРНК
Тот же АУГ, что и в начале
Рис. 16.8. Стартовый код
ЗАПОМНИ1
Если иРНК происходит из гена, включающего интроны, то перед
тем, как стать пригодной, она подвергается преобразованию. Чтобы
получить окончательную молекулу иРНК, которую сможет считать
тРНК, интроновые участки вырезаются из иРНК, а экзоновые концы
соединяются вместе. В большинстве случаев интроновая часть на-
чинается с основания ГУ и заканчивается богатым пиримидинами
сегментом, заканчивающимся основаниями АГ, — комбинацией, ко-
торая сигнализирует о присутствии нитронового домена.
Модель регуляции генов
Организму не нужно вырабатывать белки постоянно. Для запуска процесса
синтеза белков в строго заданное время требуется некая форма генной регуля-
ции. Представьте, насколько неудобным для женщин была бы постоянная, а
не только в период послеродового вскармливания, выработка грудного моло-
ка. Как только у организма возникает потребность в определенном белке, он
“включает” соответствующий ген, но при достаточном количестве этого бел-
ка такой ген должен “выключаться”. Контроль осуществляется как на уровне
транскрипции (генной регуляции), так и на уровне трансляции.
328 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
В этом разделе мы исследуем такие процессы в прокариотических клетках,
а затем перейдем к изучению более сложных закономерностей в эукариотиче-
ских клетках. Рассмотрение простых механизмов, свойственных прокариоти-
ческим клеткам, позволит лучше понять сложные процессы в эукариотических
клетках, хотя в своей основе они очень схожи.
Как и ранее будем изучать поведение прокариотической клетки на примере
кишечной палочки. Исследователи получили четкое представление о генной
регуляции, когда заменили богатый глюкозой рацион Е. coli рационом, состо-
ящим преимущественно из лактозы. Для использования этого альтернативно-
го источника энергии клетки должны вырабатывать фермент Р-галактозидазу.
Этот фермент обычно синтезируется многими микроорганизмами, но ситуация
усложняется при замене глюкозы на лактозу. Одна из ключевых задач нового
механизма состоит в увеличении выработки Р-галактозидазы, галактозидпер-
меазы (переносит лактозу в клетку) и тиогалактозидтрансацетилазы (обезвре-
живает другие вещества, переносимые галактозидпермеазой). Таким образом
всего одно изменение в окружающей среде вызывает образование множества
ферментов. Изучение скоординированного механизма регулирования экспрес-
сии генов стало возможным благодаря открытию оперона.
Модель Жакоба-Моно
Одновременное изменение уровней трех различных ферментов в результате
изменения единственного фактора окружающей среды предполагает наличие
связи между клеточными механизмами регуляции. Для объяснения принципов
генной регуляции биологи Франсуа Жакоб и Жак Моно предложили оперон-
ную модель. В такой модели участвуют регулирующий ген, который воздей-
ствует на ряд структурных генов, и контрольный сайт. Оператор и связанные с
ним структурные гены составляют оперон. Регулирующий ген отвечает за про-
изводство репрессорного белка. Репрессорный белок связывается с контроль-
ным сайтом и предотвращает экспрессию структурных генов, как показано на
рис. 16.9 (надпись “и т.д.” предполагает возможность регуляции большего ко-
личества структурных генов, выполняемой по такой же схеме).
Многочисленные структурные гены отвечают за производство одной боль-
шой иРНК, и эта единственная нить РНК способна генерировать набор бел-
ков. иРНК, кодирующая множество белков, называется полигенной или поли-
цистр онной.
Недостаток оперонов
Лактозный оперон (1ас-оперон) — это самый изученный оперон, который с
момента открытия в 1961 году расширил представление о механизме регуля-
ции своего генома. Он представляет образцовую регуляторную систему. Лак-
тозный оперон изображен на рис. 16.10.
ГЛАВА 16 Расшифруй это! Транскрипция РНК 329
Регулирующий г SКонтрольный Структурный Структурный ит.д.
ген S s сайт ген 1 ген 2
Оператор и промотор
Рис. 16.9. Схема стандартного оперона
Промотор Оператор
Рис. 16.10. Диаграмма 1ас-оперона
Лактозный оператор (lac-onepamop) представляет собой палиндромную
последовательность ДНК с симметрией второго порядка. Повторение палин-
дрома не всегда точное. (Совпадение симметрии наблюдается у многих взаи-
модействий ДНК-белок.) Лактозный оператор представляет собой следующую
последовательность с центральной осью, выделенной буквами полужирного
начертания.
5'-ТГТГТГГААТТГТГАГЦГГАТААЦААТТТЦАЦАЦА-3'
3’-АЦАЦАЦЦТТААЦАЦТЦГЦТААТГТТАААГТГТГТ-5'
Лактозный репрессор — это димерный белок, который может соединяться
и образовывать тетрамер. В отсутствие лактозы репрессор плотно связывается
с оператором. Наличие репрессора не позволяет РНК-полимеразе разматывать
нить ДНК для инициации транскрипции. По своей сути репрессор выполняет
функции предохранителя.
Для лактозного оперона триггером является аллолактоза, а не лактоза. И лак-
тоза, и аллолактоза — это дисахариды, состоящие из галактозы и глюкозы
(рис. 16.11), которые отличаются расположением a-связи: у галактозы связь
а (1-4), а в аллолактозы — а (1-6). Аллолактоза возникает тогда, когда не-
сколько молекул р-галактозидазы, обычно присутствующих в клетке, впервые
сталкиваются с лактозой. Вместе с несколькими подобными молекулами этот
дисахарид выступает индуктором лактозы. Индуктор связывается с репрессо-
ром и уменьшает сродство последнего с оператором в ДНК. С уменьшением
сродства репрессор отделяется от оператора, и сегмент ДНК открывается для
дальнейших преобразований.
330 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
Лактоза
Аллолактоза
Рис. 16.11. Дисахариды лактоза и аллолактоза
При запуске транскрипции все три структурных гена становятся активны-
ми, и клетка начинает производить р-галактозидазу, галактозидпермеазу и ти-
огалактозидтрансацетилазу. Это продолжается до тех пор, пока концентрация
лактозы и аллолактозы не снизится, — только тогда репрессорные белки ста-
нут доступными для повторного прикрепления к ДНК.
Другие регуляторы у прокариот
Руг-репрессор влияет на гены, ответственные за биосинтез пуринов и,
в меньшей степени, пиримидинов. По своей структуре этот белок похож на
1ас-репрессор; однако, руг-репрессор связывается с оператором только после
того, как к репрессору присоединится другая молекула. Таким образом, свя-
зывание такой другой молекулы одновременно освобождает 1ас-репрессор и
вызывает присоединение руг-репрессора. Еще одна молекула будет оказывать
противоположный эффект. В случае с руг-репрессором она выступает коре-
прессором.
Существуют регуляторы, которые стимулируют транскрипцию вместо того,
чтобы подавлять ее. Одним из примеров является белок-активатор катабо-
литных оперонов (САР). Этот белок взаимодействует с промотором и вместе
ГЛАВА 16 Расшифруй это! Транскрипция РНК 331
с двумя молекулами цАМФ взаимодействует с РНК-полимеразой. Такое взаи-
модействие приводит к инициации транскрипции определенных генов.
Регуляция генов у эукариот
Регуляция генов в эукариотических клетках выполняется по схожей схеме,
но она несколько сложнее, чем в прокариотических клетках. Одна из причин за-
ключается в том, что типичный эукариотический ген намного больше типичного
прокариотического гена. Вторая сложность связана с тем, что многие эукарио-
тические клетки являются частью более крупного организма, и поэтому много-
функциональны. Несмотря на схожее строение многих белков, клеткам печени
необходимо производить белки, отличные по структуре от требующихся сердцу.
Гистоны
У эукариотической ДНК есть группа связанных с ней белков. Эти неболь-
шие, составленные из основных аминокислот белки, называются гистонами.
Приблизительно 25% остатков из присутствующих в них аминокислот состав-
ляют аргинин либо лизин. Они тесно связаны с ДНК и в сумме обеспечивают
приблизительно половину массы хромосомы. Клеточная ДНК и связанный с
ней белок образуют комплекс, называемый хроматином, который включает 5
важных гистонов: Hl, Н2А, Н2В, НЗ и Н4 (последние четыре взаимосвязаны
друг с другом).
Хроматин, по всей видимости, состоит из повторяющихся единиц, каждая
из которых включает по две копии Н2А, Н2В, НЗ и Н4, а также примерно 200
пар оснований нити ДНК, плотно обернутых вокруг октамера гистонов. Ка-
ждая из таких повторяющихся единиц называется нуклеосомой. Заворачивание
ДНК в нуклеосому позволяет значительно уплотнить ее структуру. Детальные
исследования показывают, что около 145 из 200 пар оснований связаны с ги-
стоновым октамером, а остальные пары оснований образуют линкерную ДНК,
которая связывает октамеры гистонов между собой. Гистон Н1 сразу связыва-
ется с линкерной ДНК.
Восемь гистонов в октамерном гистоне скомпонованы в тетрамер с соста-
вом (НЗ)2(Н4)2 и в два димера с составом (Н2А)(Н2В). У всех гистоновых бел-
ков длинные хвосты, которые богаты остатками аргинина и лизина и выходят
за пределы ядра. Для генной регуляции важное значение имеет возможность
изменения таких хвостов.
Хроматин выступает важным фактором генной регуляции у эукариот. Плот-
но упакованная структура хроматина должна быть открыта, для того чтобы
ген был доступен для запуска механизма транскрипции. Кроме того, хроматин
контролирует доступ к регулирующим участкам ДНК. Гены-усилители нару-
шают целостность этой структуры, что объясняет их влияние на экспрессию
332 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
генов даже при расположении на расстоянии в несколько тысяч пар основа-
ний от гена. Некоторые гены-усилители встречаются только в определенных
клетках, поэтому усиливаемые ими гены проявляются только в таких клетках.
Например, ген для производства инсулина проявляется только в клетках под-
желудочной железы.
Кроме того экспрессию генов подавляет изменение ДНК. У млекопитаю-
щих примерно 70% последовательностей 5’-ЦрГ-3‘ содержат метилированный
цитозин. Распределение метилированных цитозинов (рис. 16.12) меняется в за-
висимости от типа клетки. Хроматиновые области, необходимые для экспрес-
сии гена в этой клетке, при сравнении с аналогичными областями в клетках,
где экспрессия гена не происходит, оказываются гипометилироваными (в них
меньше метилированных цитозинов). Наличие метильной группы препятству-
ет связыванию генов-усилителей и промоторов.
nh2
Рис. 16.12. Структура мети-
лированного цитозина
ЗАПОМНИ1
В клетках содержится одинаковая генетическая информация, но ис-
пользуется она по-разному. Например, у нейрона такие же функции,
как и у остальных нейронов, а у клетки печени — как у других пе-
ченочных клеток. Следовательно, генетическая информация в клет-
ках регулируется по-разному. Кроме того в разные периоды жизни
организма даже у сходных клеток может возникнуть необходимость
к доступу к генетической информации о синтезе специальных видов
белков (например при внутриутробном развитии плода, в период по-
лового созревания и т.д.). Но доступность этой информации силь-
но разная даже в подобных клетках. В многоклеточном организме
доступ к генетической информации (как во временном, так и про-
странственном аспектах) регулируется с помощью генов-усилителей
и метилирования.
Посредники транскрипции
Инициация транскрипции в эукариотических клеткам выполняется под вли-
янием различных факторов. При этом ни один из транскрипционных факторов
ГЛАВА 16 Расшифруй это! Транскрипция РНК 333
не регулирует процесс в одиночку. Такое взаимодействие факторов называется
комбинаторным контролем, который проявляется в многоклеточных организ-
мах и отдельных эукариотических клетках.
Некоторые неполярные молекулы, подобные стероидным гормонам, мо-
гут легко проходить через гидрофобную клеточную мембрану и связываться
с рецепторными белками. Такие молекулы оказывают специфичное действие.
Одним из примеров стероидных гормонов является эстроген (рис. 16.13). По-
добные ему соединения получили название лиганд.
Рис. 16.13. Структура эстрогена
Лиганд связывается с определенным местом, называемым лиганд-связываю-
щим участком, которое находится рядом с концом рецепторного белка. В этой
части белка содержится множество неполярных остатков, функционально
сходных с гидрофобными молекулами. Большинство стероидов связываются
с ядерными гормональными рецепторами. В таком случае в участке связыва-
ния ДНК рядом с белковым центром содержится восемь остатков цистеина,
необходимых для связывания ионов цинка — по четыре остатка на каждый
ион. Ионы цинка стабилизируют структуру и дают такому участку название до-
мена цинкового пальца (поблизости находятся другие остатки цистеина и ионы
цинка). Присоединение молекулы к лиганд-связывающему участку приводит к
значительной структурной реорганизации белка. Процесс может показаться по-
хожим на транскрипционную регуляцию с помощью 1ас-репрессоров в прокари-
отических клетках, но детальные исследования показывают, что это не так.
Следующими в действие вступают мелкие белки, называемые коактивато-
рами. Рядом с центром каждого из них находятся три области, включающие
структуры Leu-X-X-Leu-Leu. Каждая из таких областей генерирует короткую
гидрофобную а-спираль. Три такие спирали связываются с гидрофобной ча-
стью лиганд-связывающего участка. Присутствие лиганда по всей видимости
усиливает действие коактиватора. (Рецепторный белок может действовать как
репрессор, особенно в присутствии корепрессора.)
334 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
Какую роль играют коактиваторы и корепрессоры? Скорее всего их эффек-
тивность связана со способностью образовывать ковалентные связи с хвоста-
ми гистонов. Гистонацетилтрансферазы (ГАТ) катализируют такое изменение
хвостов гистонов (в противоположность ферментам гистондеацетилазам; см.
рис. 16.14). В результате амид с выраженной полярностью (положительно за-
ряженный лизин) изменяется на менее полярный (нейтральный) амид, что зна-
чительно снижает взаимодействие хвоста с ассоциированной ДНК. В меньшей
степени в этом процессе снижается взаимодействие всего гистона с ассоцииро-
ванной ДНК, что позволяет запустить ее частичную транскрипцию.
н о
| | СоА
^^-NH-C----С---О’ + 0
NH + $
СН2 /1 з С
" сн - сн - сн, |
сн3
ГАТ
у
н о
I
^NH-C—С—O’ + СоА—S
ГМ zNH-C\ И
' СН,- сн - СН,
+ н+
Рис. 16.14. Реакция, катализированная гистонацетилтрансферазой (ГАТ)
Остатки ацетилированного лизина также оказывают влияние на ацетилли-
зин-связывающий домен (бромодомен), который присутствует во многих регу-
ляторных белках, принимающих участие в транскрипции в эукариотической
клетке.
Есть два важных белка, содержащих бромодомен. Один из них представлен
целым комплексом из десяти факторов, которые присоединяются к белку, свя-
зывающему ТАТА-блоки, и отвечают за транскрипцию многих генов. Другие
белки, содержащие бромодомены, входят в состав крупных комплексов, из-
вестных как факторы реконструирования хроматина. Как следует из назва-
ния, эти белки изменяют структуру хроматинов, тем самым перенастраивая их
функции.
Все рассмотренные вышек факторы влияют на доступность отдельных
частей ДНК для транскрипции. После раскрывания ДНК в силу вступают про-
цессы, рассмотренные ранее в этой главе.
ГЛАВА 16 Расшифруй это! Транскрипция РНК 335
Глава 17
Трансляция:
синтез белков
В ЭТОЙ ГЛАВЕ...
» Принципы трансляции в прокариотических клетках
» Основы синтеза белков
» Особенности трансляции в эукариотических клетках
В филологии термином “трансляция” обозначается перевод текста с одно-
го языка на другой. В биохимии этот термин применяется для описания
сходных процессов. В этой главе нам предстоит рассмотреть процесс
трансляции и понять его место в синтезе белков.
Трудности перевода
В биохимической трансляции четырехбуквенный алфавит, применяемый
для обозначения нуклеиновых кислот, переводится в двадцатибуквенный ал-
фавит описания белков — именно так передается генетическая информация
на клеточном уровне. Трансляция происходит в рибосомах клетки, которые
содержат рибосомную РНК (рРНК). Информация, необходимая для трансля-
ции, передается из ядра клетки в рибосомы с помощью информационной РНК
(иРНК). Информационная РНК связывается с рибосомой меньшего размера,
а транспортная РНК (тРНК) переносит аминокислоты к иРНК.
Зачем нужна трансляция
Целью трансляции является сбор строго заданного набора аминокислот в
определенном порядке для получения специфического белка (“специфиче-
ского” означает обладающего специальными функциями). В этом процессе
информационная РНК выступает шаблоном или программой действий. Для
выполнения такой программы нужно как-то переместить аминокислоты к
иРНК — задача, рассчитанная на транспортную РНК.
У транспортной РНК есть два важных участка. Один из них предназначен
для прикрепления определенной аминокислоты. Например, только один спец-
ифический вид тРНК переносит аминокислоту метионин. Другой участок, на-
зываемый участком распознавания, содержит антикодон, представляющий
последовательность из трех оснований, комплементарных к кодону в иРНК.
Последовательность АУГ кодона в иРНК совпадает с последовательностью
УАЦ антикодона в тРНК. Все действия происходят в рибосоме — месте син-
теза рРНК.
Все вместе: рибосома
Рибосома — это фабрика по производству белков. Даже в самых простых
клетках содержатся тысячи рибосом. Это сложные единицы, состоящие из
РНК и белка. У прокариот рибосому можно разделить на две отдельные части
или субъединицы. Одна, большая субъединица называется 50S, а вторая, мень-
шая — 30S. В большой субъединице рибосомы содержится 34 различных бел-
ка, обозначенных последовательностью названий от L1 до L34, и две молекулы
РНК — 23S и 5S. Маленькая субъединица включает 21 белка, обозначенных
последовательностью названий от S1 до S21, и молекулу РНК — 16S.
Прокариотическая рибосома содержит три формы молекулы рРНК (23S,
16S и 5S), один набор белков S1-S21 (21 белок), один набор белков L1-L34
(34 белка) и по две копии белков L7 и L12. В общем случае у белка L7 такая
же структура, как и у белка L12, за исключением ацетилированной N-концевой
аминогруппы. Также идентичны белки S20 и L26. Смешивание всех компонен-
тов in vitro приводит к воссозданию обеих субъединиц. В качестве примера на
рис. 17.1 приведена структура формы 16S рибосомальной РНК.
Участники трансляции
Для образования молекулы белка необходимо скоординированное взаимо-
действие ряда участников процесса с рРНК. Кроме того, важную роль в кон-
троле за синтезом белка играет структура рибосомы. В свою очередь структура
338 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
рибосомы определяется как самой рРНК, так и молекулами белков. Самой про-
стой аналогией процесса трансляции в реальной жизни может быть игра в
футбол.
Рис 17.1. Упрощенное строение
формы 16S рибосомальной РНК
Капитан команды: рРНК
Масса рРНК равна приблизительно двум третьим массы рибосомы. Фор-
ма и функции рибосомы определяются преимущественно тремя молекулами
рРНК (белки только уточняют и детализируют их). Такие рРНК образуются
в результате расщепления и обработки транскрибированных субъединиц 30S.
У значительной части молекул рРНК имеются многочисленные дуплексные об-
ласти (короткие участки спаренных оснований РНК).
Рибосому формы 70S, которая удерживает иРНК на месте во время трансля-
ции, образуют субъединицы 30S и 50S молекулы рРНК. У нее есть три участка
для прикрепления разных молекул тРНК: Е, Р и А.
» Сайт Е. Сайт выхода, или позиция, которую занимает тРНК после до-
ставки целевой аминокислоты сразу перед выходом из рибосомы.
» Сайт Р. Пептидил-связывающий сайт, который удерживает тРНК —
как с целевой аминокислотой, так и С-концевой аминокислотой бел-
ковой цепи.
» Сайт А. Аминоацильный сайт, удерживающий тРНК, которая при-
креплена к следующей аминокислоте последовательности.
Объединение субъединиц 30S и 50S приводит к образованию сайтов А и Е
на их контактной поверхности. Сайт Р субъединицы 50S представляет собой от-
крытый туннель, через который из рибосомы выходит растущая белковая цепь.
ГЛАВА 17 Трансляция: синтез белков 339
Перехват инициативы: иРНК
Последовательность оснований в иРНК считывается в направлении 5 —► 3;
транскрипция происходит в этом же направлении. (Этим вызван запуск транс-
ляции еще до окончания процесса транскрипции у прокариот. В эукариоти-
ческих клетках такое невозможно из-за физического разделения процессов
транскрипции и трансляции.) Перед тем, как выйти из ядра для перехода в ри-
босому, полученная в результате транскрипции иРНК приобретает “колпачок”
и поли(А)хвост (см. глава 16).
Трансляция не начинается автоматически с пятого конца иРНК. Запуск
трансляции, как и ее завершение, начинается по специальному коду. Конец 5
образует комплементарные пары оснований с концом 3 формы 16S молекулы
рРНК. Обычно длина такой области равна 30 нуклеотидам (эта ее часть, бога-
тая пурином, называется последовательностью Шайна-Даль гарно}.
Стартовый код размещается сразу после последовательности Шайна-Даль-
гарно. В большинстве случаев стартовый код представлен кодоном АУГ (мети-
онин), но в некоторых случаях он может выражаться последовательность ГУГ
(валин). В Е. coli стартовой аминокислотой является формилметионин (обычно
удаляется вскоре после начала трансляции), а не метионин. У прокариотиче-
ских клеток больше одного стартового и стоп-кода, поскольку многие молеку-
лы иРНК обладают полигонными или полицистронными функциями, позволяя
образовывать больше одного белка. На рис. 17.2 показаны структуры метиони-
на и формилметионина, присоединенных к тРНК.
о
HN----СН-С----О
I I
СН, тРНК
сн,
S
I
сн,
о о
II II
,С N сн—С О
I I I
н сн, трнк
сн,
S
I
сн,
Метионин Формилметионин
Рис. 17.2. Структуры метионина и формилметионина,
присоединенных к тРНК
Игра в разгаре: тРНК
У всех форм тРНК есть несколько общих характерных черт. Каждая форма
тРНК — это однонитиевая молекула, содержащая от 73 до 93 нуклеотидов.
340 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
В одной молекуле тРНК содержится от 7 до 15 нехарактерных (отличных от
стандартных А, Ц, Г или У) оснований. Примерно у половины присутству-
ющих нуклеотидов есть парные основания. К гидроксильной группе конца 3
нити присоединена активированная аминокислота. На аденозиновом остатке
сегмента ЦЦА находится гидроксильная группа. Конец 5 нити подвергается
фосфорилированию, которое обычно обозначается как рГ (фосфорилирован-
ное основание Г). Антикодон содержится в петле вблизи центра молекулы,
форма которой напоминает клеверный лист.
Многие из нехарактерных оснований представляют собой метилированные
или диметилированные формы А, Ц, Г и У, обычно возникающие при изме-
нении молекул в процессе транскрипции. Метильные группы препятствует
образованию некоторых пар оснований, что предохраняет молекулу от опре-
деленных взаимодействий. Их неполярная природа делает области тРНК ги-
дрофобными, что оказывает непосредственное влияние на способность к вза-
имодействию метильных групп с рибосомальными белками. К нехарактерным
основаниям относят такие соединения: дигидроуридин, диметилгуанозин, ино-
зин, метилгуанозин, метилинозин, псевдоуридин, риботимидин. Инозин, по-
казанный на рис. 17.3, является частью антикодона. Многие из нехарактерных
оснований размещаются рядом или на изгибах структуры тРНК.
о
Рис. 17.3. Структура инозина
В пяти областях, показанных на рис. 17.4, комплементарно-связанные пар-
ные основания отсутствуют. (Заметьте, что структура, показанная на рис. 17.4,
не отражает реальное трехмерное строение молекулы тРНК.) Начиная с конца 5
к неспаренным участкам относятся: петля ДГУ, петля антикодона, дополнитель-
ная петля, псевдоуридиновая петля и ЦЦА конца 3. (Петля ДГУ получила на-
звание благодаря наличию нескольких остатков дигидроуридина; петля антико-
дона содержит сегмент, который распознает кодон в иРНК; в дополнительной
петле содержится переменное количество остатков; псевдоуридиновая петля
ГЛАВА 17 Трансляция: синтез белков
получила название благодаря включению последовательности риботимин-псев-
доурацил-цитозин.) Такие петли придают индивидуальность каждой тРНК,
характеризующейся одинаковым общим строением. Их назначение заключа-
ется во взаимодействии одним концом с иРНК, а другим — с аминокислотой.
Антикодон ориентирован в направлении 5 — 3, а комплементарно-связан-
ные с кодоном основания — в направлении 3 — 5. Таким образом первое осно-
вание антикодона соответствует третьему основанию кодона. (Не забывайте об
общем принципе обозначения последовательностей оснований в направлении
5 — 3.)
Выход в финал: активация аминокислот
Присоединение правильной аминокислоты к тРНК — это чрезвычайно важ-
ная задача. Перенос не той аминокислоты или полное отсутствие ее при транс-
порте полностью нарушает процесс трансляции. Присоединяясь к тРНК, ами-
ноксилота активируется. Прикрепление свободных аминокислот выполняется
строго упорядоченным образом. Связываясь с тРНК, аминокислота изменяет
ЧАСТЬ 5 Генетика: почему мы такие, какие есть
свободную форму на более реактогенную эфирную. Результатом объединения
аминокислоты и тРНК будет аминоацил-тРНК, или тРНК, несущая электри-
ческий заряд (рис. 17.5).
Альтернативный участок привязки
Рис. 17.5. Пример структуры аминоацил-тРНК
Реакцию активации катализируют специфические аминоацил-тРНК-синте-
тазы, относящиеся к активирующим ферментам. Процесс начинается с ами-
нокислоты и АТФ, образующих аминоациладенилат (рис. 17.6) с высвобожде-
нием пирофосфата.
АМФ
О
Рис. 17.6. Структура аминоациладенилата
ГЛАВА 17 Трансляция: синтез белков 343
ЗАП0МНИ1
У каждой аминокислоты своя характерная аминоацил-тРНК-синте-
таза.
Существует два класса аминоацил-тРНК-синтетаз: мономерные (класс I) и
обычные, димерные (класс II). В каждом из них по десять аминокислот. При
взаимодействии с аминокислотами из разных классов плечо ЦЦА и молекула
АТФ принимают различные пространственные формы. Большинство синтетаз
класса II прикрепляют аминокислоту так, как показано на рис. 17.5. В то же
время коферменты класса I прикрепляют аминокислоту к альтернативному
участку привязки.
Дальнейшее преобразование вновь образованного аминоациладенилата
полностью определяется синтетазой и продолжается до образования аминоа-
цил-тРНК.
Для того чтобы удостовериться, что аминоацил-тРНК-синтетаза связывается
с правильной аминокислотой, ферменту необходимо уметь распознать ключевые
особенности аминокислот. Некоторое представление о процессе выбора было
получено в результате изучения поведения аминокислот серина, валина и тре-
онина. На рис. 17.7 эти три аминокислоты изображены так, чтобы подчеркнуть
сходство строений их боковых цепей. (Как вы знаете, хиральная боковая цепь
есть только у треонина.). Обозначенные аминокислоты различаются размерами
(-Н или -СН3) и водородными связям (с -ОН, но не с -СН3). Участок распозна-
вания должен в полной мере использовать эти особенности для присоединения
целевых структур. Наиболее значимым веществом участка распознавания явля-
ется ион цинка, который взаимодействует и с ферментом, и с аминокислотой.
о
h2n—сн—с—он
сн-н
I
он
Серин
о
H,N--СН—С---ОН
I
сн—сн3
сн3
Валин
о
H_N СН—С ОН
I
сн—сн,
I
он
Треонин
Рис. 17.7. Структура серина, валина и треонина
Треонин, несмотря на структурные различия, иногда может заменять серин.
К счастью, фермент снабжен функцией редактирования целевых соединений.
Участок редактирования находится рядом с реакционным центром, но они не
совпадают. Аналогичное редактирование умеют выполнять другие аминоа-
цил-тРНК-синтетазы. У таких аминокислот как триптофан нет близких анало-
гов, поэтому редактирование в подобных случаях не представляется возможным.
344 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
Чтобы удостовериться во взаимодействии с правильной тРНК, амино-
ацил-тРНК-синтетазы распознают концевые антикодоны, сопоставляя тРНК
с целевой аминокислотой. Эти ферменты способны распознавать другие струк-
турные особенности тРНК, например размер дополнительного плеча и гидро-
фобные свойства отдельных участков, определяемые метилированием некото-
рых рибонуклеотидов
Синтез белков
В синтезе белков или полипептидов выделяются следующие основные этапы.
1. Активация
2. Инициация
3. Удлинение
4» Завершение
ЗАПОМНИ!
Эти основные этапы выделяются у любых живых организмах —
трансляция выполняется одинаково у людей, тюльпанов и даже гри-
бов. Синтез белка выполняется в направлении от аминовой конце-
вой группы к карбоксильной концевой группе.
В этом разделе мы детально рассмотрим все этапы синтеза, в которых при-
нимают участие тРНК, иРНК и рРНК, а также ряд белковых факторов.
Активация
Как упоминалось ранее, во время активации аминокислота взаимодейству-
ет с АТФ, образуя аминоациладенилат. В свою очередь аминоациладенилат
вступает в реакцию с определенной тРНК для образования аминоацил-тРНК
и АМФ — одного из главных игроков трансляционного процесса.
Инициация
Во время инициации иРНК прикрепляется к рибосоме, взаимодействуя с
субъединицей 30S молекулы рРНК, используя для этого последовательность
Шайна-Дальгарно. Затем антикодон первой тРНК присоединяется к кодону
АУГ (или ГУГ) иРНК. Этот кодон представляет сайт Р субъединицы 30S. Ами-
нокислота прикрепляется к сайту Р субъединицы 50S. Субъединицы 30S и 50S
молекулы рРНК объединяются для образования рибосомы 70S (сжимаясь и
высвобождая пространство для взаимодействия структур иРНК, тРНК и АА).
Комбинация двух субъединиц позволяет тРНК взаимодействовать сразу с обе-
ими компонентами.
ГЛАВА 17 Трансляция: синтез белков 345
Чтобы инициировать трансляцию, иРНК и первая тРНК доставляются в
рибосому. Эту задачу выполняют три белка, называемые факторами иници-
ации: IF1, IF2 и IF3. Вначале рибосомальная субъединица 30S образует ком-
плекс вместе с факторами IF 1 и IF3. Если нужная иРНК отсутствует, то два
фактора инициации, связанные с субъединицей 30S, препятствуют преждевре-
менному соединению субъединиц 30S и 50S. Оставшийся фактор инициации
IF2 связывается с ГТФ. Комплекс 1Е2-ГТФ присоединяется к тРНК, а потом
блок 1Е2-ГТФ-тРНК связывается с молекулой иРНК. Взаимодействие последо-
вательности Шайна-Дальгарно и субъединицы 16S молекулы рРНК позволяет
направить входящую группу в правильное место.
Комбинация всех блоков и субъединицы 30S образуют комплекс инициа-
ции 30S. В результате гидролиза ГТФ по мере приближения субъединицы 50S
факторы инициации вытесняются, а с их удалением к стартовому комплексу
субъединицы 70S присоединяются оставшиеся фрагменты. (Ну-ка, произнеси-
те это в три раза быстрее!) С образования этого комплекса начинается процесс
удлинения.
Удлинение
В процессе удлинения вторая активированная тРНК связывается с соответ-
ствующим кодоном в сайте А (который примыкает к сайту Р) субъединицы 30S,
куда ее переносит белок, называемый фактором удлинения. (Ти у эукариот
и EF-Tu у прокариот). Комплекс из EF-Tu и активированной тРНК (в форме
ГТФ) защищает эфирную связь, удерживающую аминокислоту в тРНК. Кроме
того этот комплекс не позволяет активированной тРНК прикрепиться к сайту А,
если кодон не соответствует антикодону. Белок EF-Tu взаимодействует со всеми
тРНК, кроме инициирующей. Энергия, необходимая белку EF-Tu для того, что-
бы доставить тРНК в рибосому, высвобождается при гидролизе молекулы ГТФ,
индуцированном белком, который называется фактором удлинения Ts.
Две аминокислоты проникают в центр рибосомальной пептидилтрансфера-
зы. Аминогруппа аминоацил-тРНК на сайте А удерживается в позиции, удоб-
ной для атаки эфирной связи комплекса аминоацил-тРНК на сайте Р. На этом
фоне образуется пептидная связь, что сопровождается отделением тРНК от
сайта Р. Теперь белок присоединяется к сайту А (субъединицы 30S).
Потеряв аминокислоту, тРНК больше не взаимодействует с рибосомой. Она
перемещает к сайту Е субъединицы 50S, а следующая РНК с прикрепленным
полипептидом движется к сайту Р (туннелю) этой же субъединицы. Теперь
рибосома должна переместиться, или, выражаясь научно, транслоцироваться
на один кодон. Для транслокации необходим фермент фактора удлинения G
(EF-G, или транслоказа — белок, способствующий транслокации). Вся необ-
ходимая для этого этапа энергия высвобождается при гидролизе ГТФ до ГДФ.
346 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
В результате блок пептидил-тРНК связывается с сайтом Р субъединицы 30S.
В то же самое время “пустая” тРНК отделяется от иРНК и перемещается на
сайт Е этой же субъединицы. В течение всего этого процесса полипептидная
цепь удерживается на сайте Р субъединицы 50S.
Первая тРНК покидает сайт Е. Цикл удлинения может начаться снова с по-
явлением новой тРНК, транспортирующей следующую аминокислоту. Про-
цесс продолжается до тех пор, пока не будет распознан кодон с сигналом за-
вершения.
Завершение
Сигнал завершения означает высвобождение белка, последней тРНК и иРНК.
Не забывайте, что сигнал завершения представляется кодонами
УАА, УГА и УАГ.
ЗАПОМНИ!
В нормальной клетке у тРНК нет антикодона комплементарного кодонам за-
вершения. Однако эти три кодона распознаются белками, называемыми высво-
бождающими факторами (RF). Первый из них, высвобождающий фактор RF1,
распознает кодоны УАА и УАГ. Второй высвобождающий фактор (RF2) распоз-
нает кодоны УАА и УГА. Третий высвобождающий фактор, или RF3 выполня-
ет роль посредника между RF1, RF2 и рибосомой. Высвобождающие факторы
способствуют замещению аминокислоты в рибосоме молекулой воды.
Последняя реакция, в результате которой высвобождает вновь образован-
ный белок, заключается в гидролизе последней сложноэфирной связи с тРНК.
Для протекания этой реакции нужна вода, приносимая высвобождающими
факторами.
Комплекс 70S рибосомы существует непродолжительное время. Диссо-
циация комплекса запускается фактором высвобождения рибосомы и EF-G,
а энергия для ее проведения предоставляется молекулой ГТФ.
Гипотеза неоднозначного соответствия
Экспериментальные исследования показали, что даже чистые молекулы
тРНК могут опознать больше одного кодона. Для объяснения такого поведения
биохимики разработали гипотезу неоднозначного соответствия, которая под-
тверждалась последующими исследованиями.
Ключом к пониманию этой гипотезы стало изучение поведения нестан-
дартного основания, например инозина (см. рис. 17.3), в петле антикодо-
на. Это основание способно образовывать пару с аденином, цитозином или
урацилом, что вносит некоторые вариации или, другими словами, создает
ГЛАВА 17 Трансляция: синтез белков 347
неоднозначности в соответствии кодона с антикодоном. Присутствие инозина
увеличивает количество возможных кодонов, которые может считать отдель-
ная тРНК. Первые два основания в паре кодонов всегда соединяются с соот-
ветствующими основаниями антикодона. Несоответствие возникает у третьего
основания.
СОВЕТ
Сверьтесь с таблицей кодонов (см. глава 16), чтобы понять, какие
аминокислоты зависят только от первых двух оснований. (Подсказ-
ка'. уделите пристальное внимание валину.)
В подтверждение гипотезы неоднозначного соответствия в табл. 17.1 при-
ведены правила объединения оснований в пары. Наличие А или Ц в первом
основании позволяет считывать только один кодон. Присутствие Г или У обе-
спечивает считывание двух кодонов. При этом включение основания И позво-
ляет считывать сразу три кодона. Инозин вызывает несоответствия, но они не
наблюдаются в случае, когда первым антикодонным основанием выступает А
или Ц, как показано в табл. 17.1. В целом неоднозначные соответствия приво-
дят к образованию более слабых водородные связей, чем обычно, что способ-
ствует потере тРНК после доставки аминокислоты.
Таблица 17.1. Правила согласования оснований согласно гипотезе
неоднозначного соответствия
Основания антикодона Основания, распознаваемые в кодоне
(первое основание) (третье основание)
Валин кодирует четыре кодона, образуя семейство из четырех кодонов. Если
рассмотреть три кодона для валина (ГУУ, ГУЦ и ГУА), то можно выяснить,
что вместо антикодонов ЦАА, ЦАГ и ЦАУ, они образуют пары с антикодоном
ЦАИ. Таким образом один антикодон ЦАИ заменяет три остальных антикодо-
на. Последний кодон для валина — ГУГ — требует синтеза всего лишь двух из
четырех видов тРНК. Подобным образом работают другие четырехкодонные
семейства.
348 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
Семейства из шести кодонов (аргинин, лейцин и серин) представляют ис-
ключительный случай, в котором кодоны для отдельной аминокислоты разли-
чаются первыми двумя основаниями, — для них нужны три разных тРНК.
Неоднозначности уменьшают количество нужных видов тРНК в клетке с 61
до 31. Чаще всего реальное количество разных видов тРНК, содержащихся
в клетках, ограничивается этими двумя цифрами. Для всех видов тРНК,
кодирующих отдельную аминокислоту, требуется всего один вид аминоацил-
тРНК-синтетазы.
Особенности трансляции
в эукариотических клетках
Трансляция происходит во всех клетках по одному и тому же принципу.
Однако в эукариотических клетках проявляются свои особенности. В них в
процессе трансляции принимает участие большее количество белков, а сами
этапы, как правило, более сложные.
Рибосомы
В рибосомах эукариотических клеток содержатся субъединицы 60S и 40S,
вместе образующие рибосому 80S. Субъединица 40S содержит форму 18S мо-
лекулы рРНК, аналогичную форме 16S в субъединице 30S. Субъединица 60S
состоит из трех компонентов рРНК: 5S и 23S, выступающих аналогами 5S и
23S в прокариотической субъединице 50S, и уникального 5,8S рРНК.
ПРОЕКТ'ТЕНОМ ЧЕЛОВЕКА"
Проект Теном человека" был запущен правительством США в 1990 году. Из-
начально планировалось, что он будет осуществляться в течение 15 лет, но
ввиду быстрого развития биотехнологий он был успешно завершен на 2 года
раньше положенного срока — в 2003 году. Курировали проект Министерство
энергетики США и Национальный институт здравоохранения.
Преследуемые цели
Проект преследовал следующие цели:
• идентифицировать все 20 000-25 000 гена человеческой ДНК;
• определить последовательность примерно 3 миллионов пар оснований
человеческой ДНК;
• обеспечить сохранение полученной информации в базах данных;
ГЛАВА 17 Трансляция: синтез белков 349
• усовершенствовать инструментарий, применяемый для анализа данных;
• сделать генные технологии доступными для всеобщего использования;
• разрешить этические, правовые и социальные проблемы, связанные с ре-
ализацией проекта.
Помимо человеческой ДНК исследователи изучали геном кишечной палоч-
ки — широко распространенной бактерии, часто встречающейся у человека,
а также у мышей и фруктовых мух. Исходно планировалась сделать технологии
общедоступными, чтобы стимулировать разработку новых медицинских при-
ложений и дать серьезный толчок к развитию биотехнологической отрасли.
Предполагаемые выгоды
Проекта "Геном человека" предполагал следующие выгоды:
• совершенствование диагностики заболеваний;
• раннее определение генетической предрасположенности к заболеванию;
• разработка препаратов и механизмов генной терапии;
• создание нового биотоплива;
• эффективные способы обнаружения загрязнения окружающей среды;
• изучение эволюции по мутациям в родословной;
• судебно-медицинское исследование образцов посредством анализа ДНК;
• определение отцовства;
• установление соответствия между донорами и реципиентами органов;
• выведение устойчивых к болезням и вредителям культур;
• создание биопестицидов;
• повышение объема производства сельскохозяйственных культур и жи-
вотных.
Многие из перечисленных выгод стали повседневностью в современной жизни.
Этические, правовые и социальные аспекты
Уникальность проекта Теном человека" заключается в том, что он был первым
масштабным научным исследованием, в рамках которого изучались потенци-
альные этические, правовые и социальные последствия сбора и обработки
генетических данных. Были рассмотрены следующие вопросы.
• Кому можно предоставлять доступ к персональной генетической инфор-
мации?
• Кто имеет право собирать и распоряжаться генетической информацией?
• Как определить достоверность результатов внутриутробного генетическо-
го тестирования?
350 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
• Как удостовериться в точности генетического исследования?
• Есть ли у родителей право подвергать своих детей генетическим исследо-
ваниям на наличие заболеваний, развивающихся во взрослом возрасте?
• Влияют ли гены человека на его поведение?
• Где проходит граница между генетическим заболеванием и отклонением?
• Насколько безопасна генетически модифицированная пища для людей?
В рамках проекта было поднято намного больше вопросов, чем получено от-
ветов даже на сегодняшний день.
Инициатор тРНК
В эукариотических клетках аминокислотой-инициатором является метио-
нин, а не формилметионин. Как и в прокариотических клетках первая тРНК
должна обладать специальными функциями — полноценного связывания и пе-
реноса метионина.
Инициация
В эукариотических клетках единственным инициирующим кодоном высту-
пает АУГ, расположенный у ближайшего пятого конца иРНК. В отличие от
покариотических клеток кодон АУГ не предваряется богатой пурином после-
довательностью. Субъединица рибосомы 40S прикрепляется к колпачку иРНК
и последовательно перемещает основания в направлении конца 3 до тех пор,
пока не достигнет кодона АУГ. Процесс сопровождается гидролизом АТФ,
катализируемый геликазой. В эукариотических клетках встречается гораздо
больше факторов инициации, называемых elF, а не IF.
Удлинение и завершение
Аналогами факторов удлинения EF-Tu и EF-Ts прокариотических клеток
у эукариот являются белки EFla и EFiPy. Транслокация проходит с участием
эукариотического фактора EF2 в присутствии ГТФ. В отличие от прокариоти-
ческих клеток, в которых удлинение выполняется с участием двух факторов
высвобождения, в эукариотических клетках присутствует всего один рели-
зинг-фактор — eRFl. Белок eIF3 действует подобно фактору IF3 в прокари-
отических клетках, предотвращая повторное объединение двух рибосомных
субъединиц.
ГЛАВА 17 Трансляция: синтез белков 351
ли
В ЭТОЙ ЧАСТИ...
В заключение рассмотрим темы, которым не уделялось при-
стальное внимание. Последняя часть включает две главы,
содержащие краткие сведения об областях практического
применения биохимии и возможностях карьерного роста у
тех, кто решил посвятить ей свою жизнь.
Глава 18
Десять областей
применения
биохимии
В ЭТОЙ ГЛАВЕ:
» Мутации и заболевания
» ГМО
» Клонирование
В этой главе вы познакомитесь с биохимическим технологиями, нашедши-
ми важное практическое применение, и исследовательских методиках,
изменивших нашу повседневную жизнь. И хотя приведенные далее при-
меры представляют собой лишь малую часть научных достижений, их вполне
достаточно, чтобы продемонстрировать неоспоримую важность биотехноло-
гий в дальнейшем развитии человечества. Разумеется, наука не стоит на ме-
сте — ученые совершают новые открытия, находящие применение в решении
самых серьезных научных и прикладных задач.
Тест Эймса
Тест Эймса показывает, оказывает ли вещество влияние на структуру ДНК
(вызывает ли оно мутации). В этом тесте бактерии сальмонеллы подвергаются
воздействию целевого химического вещества (в частности пищевых добавок).
Впоследствии регистрируются изменения в характере и размере популяции
бактерий. Многие вещества, вызывающие мутации у бактерий, часто становят-
ся причиной возникновения онкологических заболеваний у животных и людей.
Сегодня тест Эймса используется преимущественно для составления перечня
канцерогенных химических веществ.
Тест на определение беременности
Тесты на беременность бывают двух типов: в одном из них анализу подвер-
гается образец мочи, а в другом — образец крови. В обоих случаях определя-
ется наличие гормона хорионического гонадотропина человека (ХГЧ), выра-
батываемого плацентой вскоре после имплантации эмбриона в стенки матки.
В первые несколько дней после имплантации гормон быстро накапливается в
организме. При проведении теста на беременность по анализу мочи, который
выполняется в домашних условиях, в течение двух недель после имплантации
эмбриона его точность составляет около 97%. Соответствующий анализ крови,
выполняемый в лабораторных условиях, стоит несколько дороже, но позволяет
выявить беременность на более ранних сроках — менее чем за неделю после
имплантации.
Тест на ВИЧ
На сегодня разработаны эффективные тесты определения наличия в чело-
веческом организме вируса иммунодефицита человека (ВИЧ), вызывающего
синдром приобретенного иммунодефицита (СПИД). Анализу подвергаются
образцы мочи, сыворотки крови или слюны, а определяются антигены, анти-
тела или нуклеиновые кислоты (входящие в состав РНК) ВИЧ. В исследова-
ниях нуклеиновых кислот (NAT) распознается последовательность из 142-х
оснований, присутствующих в одном из генов ВИЧ. Для большей надежности
большинство банков крови подвергают хранящиеся у них образцы комбиниро-
ванному тестированию на ВИЧ.
Диагностика рака груди
Большинство видов рака молочной железы не передается по наследству, но
в 5-10% случаев наследственная связь все же просматривается. В подобных
случаях мутации чаще всего происходят в двух участках ДНК — гене BRCA1
(рака молочной железы 1) и гене BRCA2 (рака молочной железы 2), которые
356 ЧАСТЬ 6 Великолепные десятки
были обнаружены соответственно в 1994 и 1995 годах. У женщин, унаследо-
вавших мутацию в любом из этих генов, вероятность развития рака молочной
железы на протяжении всей жизни значительно повышена. Получение поло-
жительных результатов в этом тесте предопределяет проведение пациентами
более частого планового скрининга, чем предписывается регулярным календа-
рем исследований.
Внутриутробные исследования
В пренатальных исследованиях анализу обычно подвергаются образцы кро-
ви или ткани плода для выявления потенциальных генетических аномалий. За-
бор материала для этих тестов поводится в процессе амниоцентеза — взятия
образцов амниотической жидкости, содержащей клетки плода или крови из
пуповины. Подобные исследования выполняются для выявления хромосомных
отклонений, подобных синдрому Дауна или врожденных дефектов, приводя-
щих к спинальному дизрафизму.
Тест на ФКУ
Фенилкетонурия (ФКУ)— это обменное нарушение, вызванное отсутстви-
ем фермента с названием фенилаланингидроксилаза. У людей с таким заболе-
ванием в организме накапливается фенилаланин, что приводит к умственной
отсталости. В США тест на ФКУ проводится в обязательном порядке у всех
новорожденных. Младенцам с положительным результатом рекомендована
строгая диета с низким содержанием фенилаланина, что позволяет им нор-
мально развиваться. (Если вы проверите этикетки на банках с газированными
напитками, то обнаружите на многих из них предупреждение о содержании
фенилаланина.)
Генетически модифицированная пища
Биохимики научились переносить гены из одного организма в другой, вклю-
чая растения и животных. Такие технологии позволяет создавать сельскохо-
зяйственные культуры и скот, устойчивые к болезням и вредителям. Техно-
логия генетической модификации организмов применяется для повышения
производства молока, яиц и мяса. В 1993 году Управление по контролю за про-
дуктами и лекарственными препаратами США выдало лицензию на первый
ГЛАВА 18 Десять областей применения биохимии 357
генетически модифицированный продукт питания, разрешенный для потре-
бления человеком. Им стал новый сорт помидоров, устойчивых к гниению,
названный Flavr Savr. Как бы там ни было, общество не спешит с включением
генетически модифицированных продуктов в свой рацион питания, опасаясь
непредсказуемых последствий для здоровья и окружающей среды.
Генная инженерия
Под генной инженерией подразумевается изъятие гена у одного организма
и помещение его в другой. При этом реципиентом может выступать бактерия,
растение или животное. Один из самых известных примеров эффективного
применения технологий генной инженерии — это производство инсулина.
Раньше диабет лечился с помощью инсулина, получаемого от свиней или ко-
ров, и хотя он очень похож на человеческий инсулин, во многих случаях его
применение вызывало определенные проблемы со здоровьем. Биохимики ре-
шили задачу, поместив ген человеческого инсулина в клетки бактерий. В ре-
зультате такие бактерии начали вырабатывать человеческий инсулин в процес-
се трансляции (см. глава 17).
Клонирование
В 1996 году была клонирована овечка Долли — первое млекопитающее,
удачно клонированное из клеток взрослых животных. Разумеется, клониро-
ванная овца была генетически идентична взрослой. Для создания клона ис-
пользовались клетки из вымени 6-летней овцы, выращенные в лабораторных
условиях. Впоследствии из них извлекался генетический материал, который
помещался в неоплодотворенные яйцеклетки другой 6-летней овцы (собствен-
ный генетический материал из последних был полностью удалён). Так поя-
вилась Долли. После рождения Долли ученые успешно клонировали многих
других животных, а вот идея клонирования человека вызвала бурные споры во
всем мире, которые, вне всяких сомнений, не будут прекращаться еще несколь-
ко десятилетий.
Генная заместительная терапия
В генной заместительной терапии, часто называемой просто генной те-
рапией, болезнетворный аномальный ген замещается модифицированным
358 ЧАСТЬ 6 Великолепные десятки
или здоровым геном. Для доставки здорового гена в целевые клетки пациента
обычно используется вирус, модифицированный для переноса человеческой
ДНК. Впервые такая терапия был успешно применена в 1990 году у 4-летнего
пациента с сильным расстройством иммунной системы, которое было вызвано
редким генетическим заболеванием — тяжелым комбинированным иммуно-
дефицитом (SCID). У людей, страдающих SCID, наблюдается патологическая
склонность к инфекционным заболеваниям. Им приходится жить изолирован-
но, избегать людей и принимать ударные дозы антибиотиков. Ученые извлекли
лейкоциты у пациента, вырастили их в лабораторных условиях и внедрили в
клетки недостающий ген. После этого генетически модифицированная кровь
была введена пациенту обратно. Процесс позволил ребенку нормально разви-
ваться и даже посещать школу, но лечение приходилось повторять каждые не-
сколько месяцев.
ГЛАВА 18 Десять областей применения биохимии 359
Глава 19
Десять карьер
биохимика
В ЭТОЙ ГЛАВЕ...
» Научный сотрудник
» Биоинженерия и медицинские исследования
» Карьерный рост в маркетинге и статистике
Благодаря последним достижениям биохимии и быстрому развитию био-
технологий перед студентами, изучающими биохимию, открываются
широкие карьерные перспективы. Те из них, кто прекратит обучение на
бакалаврской степени, сможет выбирать карьеру инженера в различных отрас-
лях промышленности, а те, кто продолжит учебу и “дослужится” до степени
магистра или даже кандидата наук, получат совершенно иные возможности.
Выпускники с разной степенью подготовки найдут применения своим знаниям
в самых разных научных и прикладных областях, среди которых криминалистика,
промышленная химия, молекулярная биология, фармакология, вирусология, сель-
ское хозяйство, иммунология, торговля высокотехнологичным оборудовани-
ем и препаратами, лесное хозяйство и т.д. Ранее мы упоминали о нескольких
явных карьерных лестницах для биохимиков; далее вам предстоит узнать об
отраслях и дисциплинах, которые слабо ассоциируются карьерой биохимика.
Научный сотрудник
Научные сотрудники часто включаются в состав исследовательских групп,
работающих в области биоинженерных технологий. Они могут разрабатывать
новые генетические методики, участвовать в проектах по клонированию и
даже помогать в создании новых лекарств или протоколов их применения.
Помимо выполнения профессиональных обязанностей — проведения биохи-
мических процедур — научные сотрудники часто занимаются анализом полу-
ченных данных и подготовкой технических отчетов и презентаций. Они также
принимают участие в исследованиях, которые впоследствии защищаются па-
тентами. По мере карьерного роста могут возглавить собственные исследова-
тельские группы.
Селекционер
Совместно с другими исследовательскими организациями селекционеры
разрабатывают и реализуют проекты по селекции растений. Они принимают
участие в разработке новых сортов сельскохозяйственных культур, устойчивых
к болезням и неблагоприятным погодным условиям, а также ищут пути повы-
шения урожайности с применением биохимических технологий. Нередко вов-
лекаются в процесс управления производством, налаживают связи с другими
производственными подразделениями и/или проводят консультации с целью
продвижения наиболее перспективных селекционных проектов.
Специалист по контролю качества
Специалисты по контролю качества проводят анализ поступающего сырья
и готовой продукции, выпускаемой предприятием. Они собирают данные в
рамках процедуры контроля качества и определяют причины обнаруженных
отклонений. Вместе с инженерами по контролю качества аналитики следят за
качеством выпускаемой продукции. Особую важность их работа представляет
в таких высокотехнологических отраслях, как производство генетически моди-
фицированных вирусов или генетически измененных продуктов питания.
Руководитель клинических исследований
Руководители клинических исследований отвечают за разработку и реали-
зацию клинических исследовательских проектов, например новых протоколов
использования лекарственных препаратов или применения модифицирован-
ных вирусов в генной терапии. Курируемые ими проекты часто требуют про-
ведения клинических исследований, координации и/или контроля за соблю-
дением строгих исследовательских протоколов. В их задачи входит анализ и
Зб2 ЧАСТЬ 6 Великолепные десятки
оценка данных, полученных в ходе целевых исследований. Специалисты по
клиническим исследованиям приобретают бесценный опыт по уходу за боль-
ными и работе с медицинскими препаратами.
Разработчик технической документации
Только тот, кому доводилось изучать плохо составленный набор инструкций
или некачественные руководства, сможет по достоинству оценить работу раз-
работчика технической документации. Такие специалисты в биохимической
отрасли описывают и корректируют рабочие протоколы, разрабатывают лабо-
раторные руководства, составляют отчеты клинических исследований и рабо-
тают с другими типами технической документации. Они следят за тем, что-
бы содержимое документов соответствовало научной и законодательной базе.
Могут разрабатывать программы повышения квалификации для сотрудников и
составлять пресс-релизы. В их рабочие обязанности также входит составление
обзорных научных отчетов, представленных в предельно простой форме, для
руководства компании и широкого круга общественности.
Исследователь биотехнологий
Разработчики технологий изучают биохимические процессы в лаборатор-
ных условиях и масштабируют полученные результаты на пилотные проекты,
который впоследствии выводятся на производственный уровень. Они опреде-
ляют набор инструментов и оборудования, обеспечивающих проведение всех
необходимых биотехнических процессов, и устраняют несоответствия, вы-
званные их масштабированием. Биоинженеры отвечают за повышение эффек-
тивности производственных линий с заявленным уровнем качества. Они могут
работать в смежных отраслях, применяя знания биохимии в самых разных про-
изводственных циклах.
Маркетолог
Специалисты по маркетинговым исследованиям отвечают за анализ рынков,
на которых работает их компания, определяют ассортимент ее продукции и
оценивают конкурентную среду. Они подготавливают технические презента-
ции и пресс-релизы, а также собирают для руководства компании данные о
новых рыночных направлениях. Кроме того такие специалисты занимаются
ГЛАВА 19 Десять карьер биохимика 3^3
прогнозированием тенденций на рынках на основе проводимых маркетинго-
вых исследований, в которых могут принимать самое активное участие.
Патентный поверенный
Патентные поверенные собирают информацию и подготавливают докумен-
тацию по патентным заявкам. Они отслеживают успехи компании в исследова-
тельской деятельности и рекомендуют подачу патентных заявок, подготавлива-
ют вспомогательную документацию и ведут переговоры по патентным лицен-
зиям и другим правовым соглашениям. Также они могут принимать участие в
слушаниях по вопросам патентного права и в апелляционных тяжбах.
Менеджер по продаже
лекарственных препаратов
Для человека с ученой степенью в области биохимии вполне естественно
строить карьеру в фармацевтическом бизнесе. Торговые представители фарма-
цевтических компаний большую часть рабочего времени проводят в команди-
ровках, взаимодействуя с работниками клиник, врачами, фармацевтами и дру-
гими вовлеченными в отрасль людьми. Они хорошо разбираются в продукции
компании и стараются как можно убедительнее ознакомить все заинтересован-
ные стороны в ее конкурентных преимуществах. Для успешного общения с
потенциальными клиентами они должны быть знакомы со статистическими
показателями и разбираться в сложных технических вопросах, интересующих
медицинское сообщество.
Специалист по биостатистике
Специалисты по биостатистике работают в отраслях, связанных с охраной
здоровья. Они обосновывают выбор направлений медицинских исследований,
а также занимаются сбором и анализом данных по решению таких актуаль-
ных проблем, как прогрессирование болезни, обеспечение безопасности но-
вых препаратов или протоколов лечения, влияние отдельных факторов риска
на состояние здоровья пациентов и т.п. Кроме того они участвуют в разработ-
ке медицинских проектов и оценке их стоимости, определяя затраты, которые
обеспечивают должный уровень медицинского обслуживания. Специалисты
по биостатистике играют важную роль в проектировании исследований, пре-
доставляя экспертную оценку тестируемого протокола, определяя параметры
образцов и устанавливая другие важные аспекты проекта.
364 ЧАСТЬ 6 Великолепные десятки
У цей навчальний поабник, який написано дуже простою мовою, вклю-
чено матер!ал повного курсу 6ioxiMii, що викладаеться студентам коледж!в.
Книга мктить докладний опис Bcix основних бюлопчних процеав оргашзму,
яю розглядаються на молекулярному piBHi. У матер!ал книги включено вели-
ку KbibKicTb наочних ыюстрацш, що спрощують вивчення складних понять i
концепцш.
Науково-популярне видання
Мур, Джон, Ленги!, Р1чард.
Бюхшы для чайнивдв
2-е видання
(Рос. мовою)
Зав. редакщею С. М. Тригуб
1з загальних питань звертайтеся до видавництва “Д1алектика” за адресою:
info@dialektika.com, http://www.dialektika.com
ГПдписано до друку 01.03.2021. Формат 60x90/16
Ум. друк. арк. 23,0. Обл.-вид. арк. 19,0
Зам. №21-0460
Видавець ТОВ “Комп’ютерне видавництво “Д1алектика”
03164, м. Ки!в, вул. Генерала Наумова, буд. 23-Б.
Свщоцтво суб’екта видавничо! справи ДК № 6758 вщ 16.05.2019.
Надруковано ТОВ “АЛЬФА ГРАФ1К ”
03067, м. Ки!в, вул. Машинобуд1вна, 42
Свщоцтво суб’екта видавничо! справи ДК № 6838 вщ 09.07.2019.
BESTSELLING
BOOK
SERIES
биохимия
1
СЕРИЯ
ГК И1УЛЯРПЫХ
книг от
Д11АЛ1-.КТ1 IKII
тм
<№ чайншсое'
о
о
о
FLN —СН—С —ОН
H.N —СН—С —ОН
H.N—СН—С —ОН
СН
NH
NH
о
о
с—он
H.N —СН—С —ОН
H.N — СН— С — ОН
СН
сн
HN
СН,
S
Пролин
СН
Фенилаланин
Метионин
Основные алшнокисло^пы
сн2 СН2
сн2 сн2
сн2 сн2
сн2 NH
nh2 С—
Лизин NH,
Аргинин
Гистидин
Неполякные (гиакофовные) алшнокисловм
О II H,N—СН—С —ОН | О II H2N—СН—С —ОН О II H,N —СН—С —ОН О II H2N —СН—С —
СН3 СН—СН3 | сн2 сн—сн3
Аланин СНз СН—СН3 сн2
Валин СН3 СНз
Лейцин Изолейцин
ОН
H,N — СН— С — ОН
Триптофан
BESTSELLING
BOOK
SERIES
Тмохилшл
для чайншсов ? аимлиил «и
/ z-е издание
Кислые олшиокисло^пы
о
о
H2N —СН—С —ОН
H2N —СН—С —ОН
сн2
сн2
с=о
сн2
он
с=о
Аспарагиновая
кислота
он
Глутаминовая
кислота
Лоля/гиые и неза[гяжеииые алсинокисло1пы
H2N —СН—С —ОН
Глицин
h2n —
О 0 О
II II II
СН—С —ОН H2N —СН—С —ОН H2N—сн—с-
сн2 сн2 сн2
он С=О сн2
Серин nh2 С=О
Аспарагин nh2
Глутамин
О
О
ОН
о
н
О
H2N—СН—С —ОН
H2N—СН—с —он
H2N —СН—С —ОН
сн—он
СН2
сн3
SH
Треонин
Цистеин
сн2
ОН
Тирозин