Текст
Э. А. СТЕПАНОВ
А. Ф. ДРОНОВ
ОСТРЫЙ
АППЕНДИЦИТ
У ДЕТЕЙ
РАННЕГО
ВОЗРАСТА
<3
гБ
Э. А. СТЕПАНОВ,
А. Ф. ДРОНОВ
ОСТРЫЙ
АППЕНДИЦИТ
У ДЕТЕЙ
РАННЕГО
ВОЗРАСТА
Москва «Медицина» 1974
УДК 616.346.2-002.1-053.4
РЕФЕРАТ
Монография основана на опыте наблюдений острого аппендицита
у детей в возрасте до 3 лет в Клинике детской хирургии II Московского ордена Ленина медицинского института имени Н. И. Пирогова. В ней изложены особенности хирургической анатомии правой
подвздошной области у детей раннего возраста. Эти знания необходимы хирургу как при диагностике данного заболевания, так и
при выполнении оперативного вмешательства. Освещены вопросы
этиологии, патогенеза и патологической анатомии при остром аппендиците у детей в возрасте до 3 лет. Рассмотрены особенности клиники и диагностики острого аппендицита в раннем детском возрасте. При диагностических трудностях авторами предложен простой, безопасный и эффективный метод осмотра детей во время медикаментозного сна.
В книге нашли отражение вопросы дифференциальной диагностики. Отдельная глава посвящена лечению острого аппендицита в
раннем детском возрасте. Особое внимание уделено патофизиологии
перитонита, предоперационной подготовке, оперативному вмешательству и послеоперационному лечению.
Монография рассчитана на детских хирургов, педиатров и хирургов общего профиля.
51 100-268
С 181—74
039(01)—74
© Издательство «Медицина». Москва. 1974
ВВЕДЕНИЕ
До настоящего времени остаются малоизученными
вопросы острого аппендицита у детей раннего возраста.
Особые трудности вызывает диагностика заболевания,
что связано не только с возрастными особенностями
психики, но и с целым рядом анатомо-физиологических
особенностей ребенка. Клинические проявления часто не
имеют определенного симптомокомплекса из-за склонности организма ребенка к генерализованным реакциям на
любой воспалительный процесс. При различных заболеваниях у детей первых лет жизни, как правило, имеются
сходные клинические симптомы. На протяжении многих
лет в печати публиковались единичные сообщения, не
позволяющие выявить и обобщить наиболее характерные
особенности течения острого аппендицита у детей первых
лет жизни.
Поздняя диагностика и быстрота деструктивных изменений в отростке у детей раннего возраста обусловливают высокий процент осложненных форм острого
аппендицита — от 45 до 71.
Трудность лечения осложненных форм аппендицита
у детей ранней возрастной группы определяется малыми
компенсаторными возможностями организма ребенка и
быстрым вовлечением в патологический процесс всех
органов и систем. Уже с первых часов от начала развития перитонита появляются метаболические нарушения,
которые затем усугубляются и могут привести к необратимым изменениям. Внешние же признаки декомпенсации важнейших функций организма при перитоните у
детей раннего возраста выявляются гораздо позднее, чем
у старших детей и взрослых.
В связи с этим необходима тщательная коррекция
этих нарушений как до операции, так и после оперативного вмешательства.
За последние годы наблюдается рост приобретенной
резистентности микробов к антибиотикам, особенно
стафилококков и кишечной палочки, что связано с более
широким и порой необоснованным применением анти¬
3
биотиков. Следствием этого являются значительное увеличение количества осложнений и даже некоторый рост
летальности при этом заболевании (А. И. Ленюшкин
и др., 1964; Л. М. Рошаль, 1966; Salzberg А. М. с. а.,
1968).
Работа отражает опыт наблюдений над 2500 детьми
в возрасте до 3 лет, направленных с подозрением на острый аппендицит, из которых 330 больным произведена
аппендэктомия в Клинике детской хирургии 2-го Московского ордена Ленина государственного медицинского
института имени Н. И. Пирогова на базе Детской больницы № 13 имени Н. Ф. Филатова Москвы с 1959 по
1968 г.
Г л а в а I.
ОСОБЕННОСТИ ХИРУРГИЧЕСКОЙ АНАТОМИИ
ПРАВОЙ ПОДВЗДОШНОЙ ОБЛАСТИ
У ДЕТЕЙ РАННЕГО ВОЗРАСТА
Знание анатомо-топографических особенностей правой подвздошной области у детей раннего возраста
имеет большое практическое значение как для диагностики острого аппендицита, так и для оперативного
вмешательства.
Первые описания анатомического строения слепой кишки и червеобразного отростка относятся к первой половине XVI века (Carpi,
1524; Vesalius, 1543 — цит. по Collins, 1931). Более детальное изучение этого отдела кишечника связано с именем Lieberkuhn (1739).
С установлением истинной причины воспалительных процессов
в правой подвздошной области значительно возрос интерес к изучению топографии слепой кишки и червеобразного отростка
(Н. П. Гундобин, 1891; Г. И. Турнер, 1892; МсВигпеу, 1891; Spren-
gel, 1906).
Особая тяжесть течения аппендицита в детском возрасте заставила многих исследователей заняться изучением возрастных топографо-анатомических особенностей (И. С. Дергачев, 1932; А. А. Фа-
санович, 1935; А. А. Хонду, 1936; Ф. И. Валькер, 1938, 1951).
Строение передней брюшной стенки имеет отличительные анатомические особенности в первые три года жизни
ребенка. Кожа живота нежная, эластичная и упругая.
Подкожная жировая клетчатка хорошо развита в основном на первом году жизни. Поверхностная фасция имеет
всего один листок и становится выраженной после 7 лет.
Недостаточно четко отделяются друг от друга мышечные слои, которые без резкой границы переходят в
апоневроз. Надбрюшинный жировой слой в большинстве
случаев отсутствует. Брюшина очень тонкая и нежная.
Конечный отдел подвздошной кишки довольно подвижен,
и строение его анатомически мало отличается
от строения остальных отделов тонкого кишечника.
Место же впадения ileum в colon имеет различные
варианты.
Большой практический интерес представляет топография слепой кишки и червеобразного отростка.
Слепая кишка (coecum). Встречаются большие индивидуальные колебания в отношении формы и положения
5
1
3
2
*
Рис. 1. Развитие слепой кишки и червеобразного отростка во внутриутробном периоде.
1 — 7 недель; 2 — 9 недель; 3 — 4 месяца; 4 — • к моменту рождения.
слепой кишки, которые большей частью зависят от степени ее развития. Даже у одного и того же ребенка размер и положение coecum меняется в зависимости от ее
наполнения газами или каловыми массами. В раннем
детском возрасте слепая кишка обычно подвижна из-за
тонкости брюшины и длинной брыжейки, лишь в редких случаях (2%) она неподвижна, плотно фиксирована
к задней брюшной стенке (Ф. И. Валькер, 1951; А. А.
Хонду, 1936).
Значительную изменчивость величины, формы и топографии слепой кишки можно объяснить особенностями
развития кишечника, изменением его положения и пово
ротом в процессе эмбриогенеза.
Уже на втором месяце эмбрионального развития в области первой петли кишки появляется зачаток слепой кишки в виде небольшого выпячивания (рис. 1). С этого момента весь кишечный канал
разделяется на тонкую кишку, которая располагается краниально,
и толстую кишку, находящуюся каудально от coecum (П. Ф. Иванов). Формирование и положение кишечника в брюшной полости
в известной степени связано с его поворотом в процессе эмбрионального развития.
В. Ташовский, О. Вихитил (1954) и другие авторы весь процесс
нормального поворота кишечника делят на три периода.
Первый период. Примерно с 5-й недели внутриутробной
жизни кишечная трубка растет быстрее целомной полости, в связи
с чем часть средней кишки располагается вне брюшной полости и
имеет место временная «физиологическая пупочная грыжа». При
этом кишечник находится в сагиттальной плоскости и фиксируется
на первичной дорсальной брыжейке. Затем петля срединной кишки
из сагиттальной плоскости постепенно переходит в горизонтальную,
совершая поворот против часовой стрелки на 90° (рис. 2, а, б).
Второй период. После 10-й недели петли кишечника поворачиваются против хода часовой стрелки на 180°. Брюшная полость к этому времени увеличивается в объеме, срединная кишка
б
постепенно погружается в нее, а к П-й неделе внутриутробной жизни полностью находится в ней.
Терминальный отдел подвздошной кишки, слепая кишка, восходящая и часть поперечно-ободочной располагаются в левой половине живота. Ротация кишечника происходит до тех пор, пока слепая кишка не достигает вначале эпигастральной области, а затем
погрузится в правый верхний отдел латерального канала брюшной
полости (рис. 2, в).
Третий период. В этот период слепая кишка из печеночного угла постепенно опускается в правую подвздошную ямку
(рис. 2, г).
Третий период может не закончиться к моменту рождения ребенка, и процесс опускания слепой кишки в этих
случаях продолжается в течение первых лет жизни.
В результате расстройства этого процесса могут возникнуть следующие аномалии: 1) высокое положение слепой
кишки; 2) ретроцекальное расположение червеобразного
отростка; 3) подвижная слепая кишка (coecum mobile).
Форма слепой кишки у эмбрионов имеет вид конуса
или воронки. Такую «эмбриональную» форму слепой
кишки можно часто встретить у новорожденных.
Еще в 1885 г. Treves, давая обзор основных вариантов слепой
кишки и червеобразного отростка, разделил их на два типа: тип
А — незрелая, эмбриональная форма, характерная для новорожденных, и тип Б, который встречается у взрослых.
Автор, исследуя 20 трупов новорожденных, нашел тип А у всех
детей. В возрасте до одного года еще остается значительное преобладание в строении слепой кишки и червеобразного отростка типа
А. Так, Wangensteen (1939) на аутопсии детей этого возраста в
15 случаях из 20 обнаружила тип А.
Ф. И. Валькер (1951) отмечает, что слепая кишка у новорожденных имеет воронкообразную форму, причем отверстие, ведущее
в червеобразный отросток, не так выражено, как в более старшем
возрасте. Слепая кишка изменяет свою форму по мере развития
кишечника в онтогенезе. Эти изменения уже заметны к концу первого года жизни, а к 7 годам coecum имеет форму, характерную для
взрослых.
Нами проведено исследование 25 трупов новорожденных. У 22 из них обнаружен эмбриональный тип слепой
кишки и червеобразного отростка (рис. 3).
При вскрытии 10 трупов более старшего возраста (от
4 до 7 лет) во всех случаях отмечено, что илео-цекаль-
ный угол приближался по форме к таковому у взрослых
(рис. 4).
В связи с изменением формы и положения слепой
кишки с возрастом меняются и топографические соотношения с соседними органами. Так, у новорожденных и
недоношенных детей coecum соприкасается с печенью,
7
Рис. 2. Внутриутробный поворот кишечника.
а — кишечник до начала поворота находится в сагиттальной плоскости, часть
средней кишки выходит через пупочное кольцо; б — начало поворота, петля
средней кишки поворачивается на 90° против часовой стрелки из сагиттальной
плоскости в горизонтальную; в — продолжение поворота еще на 180° и одновременное самовправление пупочной грыжи, слепая кишка в эпигастральной
области; г — дальнейшее развитие поворота, кишечник повернулся всего на 270°.
Рис. 3. Илео-цекальный угол
новорожденного 3 дней. Эмбриональный тип слепой
кишки и червеобразного отростка.
Рис. 4. Илео-цекальный угол
ребенка 7 лет.
иногда с печеночным углом ободочной кишки, с петлями
тонких кишок. И только к 12—14 годам устанавливаются
ге топографо-анатомические взаимоотношения, которые
наблюдаются у взрослых. В течение всей жизни происходят изменения и в стенке слепой кишки. У новорожденных и недоношенных детей, как правило, слабо развиты
полулунные складки. Аппендикулярный клапан часто
отсутствует, имеется лишь округлое отверстие, которое
ведет в червеобразный отросток. В связи с этим у ново¬
9
рожденных жидкая пища довольно легко попадает в
червеобразный отросток и так же легко выбрасывается
обратно в слепую кишку. В старшем возрасте этому отделу кишечника предъявляются новые функциональные
требования, появляется аппендикулярная заслонка, которая у взрослого совершенно закрывает вход в червеобразный отросток.
Отверстие между губами баугиниевой заслонки у
недоношенных и новорожденных детей имеет округлую
треугольную форму. В более старшем возрасте оно становится щелевидным.
А. А. Фасанович (1935) изучил анатомию и топографию слепой
кишки и червеобразного отростка у 100 погибших детей в возрасте
от 1 дня до 2 лет. В 29% случаев слепая кишка имела воронкообразную и в 7% — мешковидную форму (по классификации В. Н. Шев-
куненко), причем воронкообразная форма слепой кишки наиболее
часто отмечалась у детей в возрасте до 3 мес.
Автор различает три положения слепой кишки, исходя из общей
длины, формы и фиксации ее.
1. Высокое положение — дно слепой кишки стоит выше lin. Ыс-
ristarum (32%).
2. Среднее положение — между lin. bicristarum и lin. bispinarum
(19%).
3. Низкое — ниже lin. bispinarum (49%).
В большинстве случаев фиксированная coecum занимает высокое положение, но и при подвижной кишке автор в 18% случаев отметил ее высокое положение.
Большая вариабельность в топографическом положении слепой кишки и червеобразного отростка является
основанием для понимания многообразной клинической
картины и учитывается при оперативных вмешательствах. В большинстве случаев (90—96%) coecum со всех
сторон покрыта брюшиной, т. е. располагается интрапе-
ритонеально, что обусловливает известную степень ее
подвижности, особенно у детей раннего возраста, и позволяет без особых затруднений извлечь ее из брюшной
полости в операционную рану. В области coecum и всего
илео-цекального угла брюшина часто образует три кармана: recessus ileocoecalis superior, recessus ileocoecalis
inferior, recessus retrocoecalis s. fossa subcoecalis. У детей раннего возраста они выражены слабо (Ф. И. Валь-
кер, 1938; Н. И. Таренецкий, 1883).
Червеобразный отросток (process, vermiformis) отходит от задне-внутренней поверхности слепой кишки в
месте схождения thenia ниже впадения терминального
отдела тонкой кишки. Формирование его относится к
10
3-му месяцу утробной жизни. Генетически отросток является суженным концом coecum и возникает в результате
отставания в росте нижнего отдела слепой кишки. Червеобразный отросток по строению идентичен слепой
кишке.
У места впадения отростка в слепую кишку имеется
серповидная складка слизистой оболочки, называемая,
клапаном или заслонкой Герлаха (Valvula processus ver-
iniformis Herlachi). В грудном возрасте она отсутствует
II бывает хорошо выражена только к 9 годам (Б. М. Храмов, 1959; Ф. И. Валькер, 1959). Это имеет определенное
значение в возникновении застойных явлений в отростке.
У детей до 1 года appendix относительно длинный и,
но данным А. А. Хонду (1936), иногда достигает длины
11 —12 см, но средняя длина отростка, по исследованиям
многих авторов, в первые годы жизни ребенка составляет 5,3—5,4 см (Н. Г. Гундобин, Ф. И. Валькер, П. П. Кулик, 1957).
Отсутствие червеобразного отростка — исключительная редкость. Collins (1963) на 10 000 аппендэктомий
(детей и взрослых) отметил отсутствие червеобразного
отростка в одном случае, а всего в мировой литературе
им обнаружен 71 подобный случай.
Как еще большая редкость может встретиться удвоение червеобразного отростка. До настоящего времени
всего в литературе описано 30 случаев подобной патологии (Pester, 1965).
Постоянное положение червеобразного отростка можно отметить лишь при фиксированных отростках, при
длинной же брыжейке и отсутствии спаек с соседними
органами отросток может перемещаться самостоятельно, следуя движениям слепой кишки.
Несмотря на такое возможное многообразие положения червеобразного отростка, в литературе отмечают
наиболее часто встречающиеся варианты его места нахождения. Г. И. Уткин (1948) выделяет следующие типы
локализации отростка:
1. Нисходящее положение — отросток направляется
в сторону малого таза (35%).
2. Медиальное, или срединное, положение — отросток
лежит кнутри от слепой кишки и своей верхушкой направлен к срединной линии (26%).
3. Ретроцекальное положение — отросток располагается позади слепой кишки и прикрыт ею (20%).
11
4. Латеральное положение — червеобразный отросток
располагается кнаружи от слепой кишки, между нею и
передне-боковой стенкой живота (15%).
А. И. Ленюшкин с соавторами (1964) предлагают
свою классификацию, различая следующие положения
червеобразного отростка: нисходящее (50%), передневосходящее (20%), задневосходящее (ретроцекальное)
(15%), латеральное (10%), медиальное (5%).
Форма червеобразного отростка также изменяется с
возрастом. У новорожденных он имеет вид конуса, без
резкой границы между слепой кишкой и отростком
(Ф. И. Валькер, 1958; Б. А. Рогальский, 1928; А. А. Хонду, 1936, и др.). Подобная форма червеобразного отростка может наблюдаться до 2 лет, а в более старшем
возрасте встречается довольно редко (по данным
М. И. Ростовцева, в 75% случаев).
Возрастные особенности имеет и строение стенки
червеобразного отростка. Разделение на слои можно
отметить уже у эмбрионов 4—6 мес. Слизистая оболочка
не имеет глубоких крипт и не образует складок. Мышечная оболочка бедна мышечными элементами и эластическими волокнами (Е. Н. Исакова, 1959).
Большой интерес представляет возрастное развитие
фолликулов в отростке. В возрасте до 1 мес фолликулов
в отростке нет, и лишь к 1—6 мес они обнаруживаются
в количестве 4—5 в каждом поперечном срезе. Постепенно число фолликулов увеличивается, достигая к 3 годам 7—8, причем появляются четкие реактивные центры
(А. И. Ленюшкин и др., 1964).
Увеличение количества фолликулов с возрастом
объясняется бактериально-токсическим раздражением
слизистой оболочки в местах, где происходит задержка
кишечного содержимого (Б. А. Рогальский, 1928). Таким
образом, отмечается возрастная зависимость развития
фолликулов в отростке, что безусловно имеет определенное значение в патогенезе острого аппендицита.
Кровоснабжение червеобразный отросток получает от a. ileocolica — ветви верхней брыжеечной артерии
(a. mesenterica superior). От восходящей ветви е. ileocolica, а в некоторых случаях и от самой артерии отходит
отдельная веточка к червеобразному отростку — а. ар-
pendicularis. В зависимости от места отхождения этой
артерии, ее направления по отношению к отростку и
характеру ее ветвления различают несколько типов и
12
форм a. appendicularis: магистральную, петлистую, рассыпную и смешанную (Б. В. Огнев, 1935; И. А. Иоффе,
1937; А. А. Флоринская). A. appendicularis всегда проходит по свободному краю брыжейки отростка, отдавая
большое количество ветвей к верхушке и средней трети
отростка. Базальные же отделы отростка получают дополнительное питание от коллатеральных ветвей, снабжающих слепую кишку, и ветвей подвздошно-ободочной
артерии.
Исследуя сосуды червеобразного отростка на трупах, Б. В. Огнев получил следующие данные: в 50% случаев a. appendicularis
имела магистральный тип строения, в 25% — рассыпной, в 20% —
петлистый и в 2%—смешанный. Наиболее часто встречающийся
первый тип — магистральный — обычно наблюдался при наиболее
подвижном отростке и низком расположении всего илео-цекального
угла. Второй тип встречается в случаях, когда отросток фиксирован
п располагается довольно высоко.
Вены отростка впадают в v. ileocolica, которая вливается в верхнюю брыжеечную вену (v. mesenterica superior). Вены илео-цекальной области одиночны и идут
вместе с артериальными стволами. Наблюдающиеся
иногда случаи гематурии после аппендэктомии можно
объяснить наличием анастомозов между венами правого
мочеточника и слепой кишки.
Сети лимфатических сосудов всех слоев слепой
кишки и червеобразного отростка бывают сформированы
в возрасте одного года, и в последующие годы происходит постепенное их развитие (И. А. Кавуненко, 1965).
Из слепой кишки и червеобразного отростка лимфоотток
происходит в лимфатические узлы, которые располагаются по ходу основного ствола ветвей a. ileocolica в виде
нескольких групп (Д. А. Жданов, 1952; Б. В. Огнев,
1935).
Немалое значение имеет связь лимфатической системы илео-цекальной области с лимфатической системой
внутренних органов брюшной полости и забрюшинного
пространства в переходе воспалительного процесса при
остром аппендиците на другие органы (Д. А. Жданов,
1952; В. В. Огнев, 1935). Необходимо также помнить о
функциональной и анатомической связи лимфатической
системы илео-цекального угла брыжеечными и подвздошными лимфатическими узлами, воспаление которых порой ведет к воспалительному процессу в червеобразном
отростке.
13
Иннервация червеобразного отростка, как и всего илео-цекального угла, происходит за счет ветвей
верхнего брыжеечного сплетения (plexus mesentericus
superior). В стенке отростка имеется большое количество
нервных элементов, образующих два сплетения: ауэрба-
хово (мышечное) и Мейснера (подслизистое). Наиболее
мощно выражено межмышечное сплетение, которое располагается между продольными и циркулярными слоями,
образуя густую мелкопетлистую сеть.
Работами многих исследователей (Г. Н. Захарова,
1953; Б. А. Бондарь, 1956, и др.) доказано, что нервные
элементы червеобразного отростка в раннем детском
возрасте отличаются значительными особенностями.
Основную массу составляют небольшие недифференцированные нервные клетки. Все сплетение имеет эмбриональный характер. Волокна сплетений обычно очень
тонкие, нежные. В ганглиях наблюдаются исключительно клетки типа нейробластов, зрелые же элементы в этом
возрасте не встречаются. Сплетение Мейснера, располагающееся в подслизистом слое, развито слабо. Процесс
дифференцировки совершается очень медленно: к 14 годам нервные сплетения червеобразного отростка характеризуются своей незрелостью. В связи с этим Г. Н. Захарова (1953) особую тяжесть течения острого аппендицита у детей первых трех лет жизни связывает с низкой
дифференцировкой нейронов.
Практическое значение имеет знание анатомии
сальника, который играет известную роль в отграничении воспалительного очага при остром аппендиците.
В зависимости от возраста ребенка сальник имеет различное положение и величину. Особенно недоразвит он
у детей первых лет жизни: тонкий, беден жировой клетчаткой, короткий (рис. 5).
При вскрытии трупов детей первых лет жизни Ф. И. Валькер
(1959) отметил, что сальник к 2—3 годам опускается лишь несколько
ниже поперечно-ободочной кишки и в некоторой степени покрывает петли тонкой кишки.
На основании результатов вскрытия 104 детских трупов
С. Р. Слуцкая (1957) делает выводы, что сальник до трехлетнего
возраста недоразвит, тонок, мал и опускается только до уровня пупка.
Наблюдения А. Г. Лайкова (1956) показали, что к 2 годам
нижний край сальника располагается на уровне пупка и в возрасте 10 лет еще не достигает правой подвздошной области.
Используя богатый опыт собственных клинических наблюдений,
А. И. Ленюшкин с соавторами утверждают, что у детей до трехлетнего возраста сальник анатомически недоразвит, представляет собой
14
Рис. 5. Топография
сальника, слепой кишки и червеобразного
отростка ребенка
2 лет 4 мес.
топкую пластинку и не достигает правой подвздошной ямки. В то
же время, указывая на характер развития сальника, авторы отмечают значительные индивидуальные колебания его размера.
Этим объясняется меньшая возможность сальника у
детей, особенно раннего возраста отграничивать воспалительные процессы в брюшной полости. В то же время
при оперативных вмешательствах по поводу острого
аппендицита даже у самих маленьких пациентов мы не
так уж редко обнаруживали, что червеобразный отросток
бывает окутан сальником (по нашим данным, в 9%).
Брюшина маленького ребенка обладает пониженной сопротивляемостью, весьма чувствительна ко всем
влияниям внешней среды, что нередко приводит к осложнениям, отягощающим течение заболевания.
Таким образом, при рассмотрении анатомии и топографии правой подвздошной области у детей первых лет
жизни можно выделить ряд особенностей, основными из
которых являются:
1) высокое расположение купола слепой кишки;
2) широкий просвет червеобразного отростка;
3) недостаточное развитие лимфоидного и нервного
аппарата отростка;
4) недоразвитие сальника и слабые пластические
свойства брюшины.
15
Глава II.
ЭТИОЛОГИЯ, ПАТОГЕНЕЗ
И ПАТОЛОГИЧЕСКАЯ АНАТОМИЯ
ПРИ ОСТРОМ АППЕНДИЦИТЕ
У ДЕТЕЙ В ВОЗРАСТЕ ДО 3 ЛЕТ
ЭТИОЛОГИЯ и ПАТОГЕНЕЗ
За многолетнюю историю хирургии червеобразного
отростка накопилось большое число клинических и патологоанатомических наблюдений, однако вопрос о причине и механизме развития патологического процесса
при остром аппендиците до настоящего времени остается
неразрешенным.
Предложены всевозможные теории патогенеза заболевания, но ни одна из них не получила всеобщего
признания. Наиболее правильное и точное определение
этиологии и патогенеза аппендицита дает И. В. Давыдовский (1959), который рассматривает «острый аппендицит как аутоинфекцию сенсибилизированного организма в результате прорыва иммунитета». Специфического
микробного возбудителя при остром аппендиците нет.
Многие авторы считают, что микробы, которые принимают участие в развитии воспаления червеобразного
отростка, находятся в самом отростке: кишечная палочка, энтерококк, стафилококк, стрептококк и многие другие (И. В. Давыдовский, В. И. Колесов, 1959; Aschoff,
1908; Wangensteen, 1939).
При определенных условиях эти микробы, проникая
в толщу отростка, находят благоприятную среду для
жизнедеятельности, вызывая локальные изменения и общую реакцию организма.
Возможен гематогенный и лимфогенный пути распространения инфекции (Stanley-Brown, 1960; Stauber,
Wurdisch, 1962). Подтверждением этому является возникновение острого аппендицита после различных инфекционных заболеваний (корь, скарлатина и особенно
ангина).
Развитие местного инфекционного процесса в червеобразном отростке связывают со многими причинами,
16
Рис. 6. Катаральный аппендицит (макропрепарат).
Рис. 8. Флегмонозный апйейдиЦйт (макропрейарат).
Рис. 10. Гангренозный аппендицит (макропрепарат).
Рис. 12. Гангренозно-перфоративный аппендицит (псрфоративно
отверстие указано стрелкой).
среди которых важное значение придают алиментарному
фактору.
Отмечено, что режим питания играет определенную роль в возникновении аппендицита. Значительное сокращение в рационе мясной или жирной пищи приводит к снижению возможности заболевания. Так, Д. А. Арапов, И. И. Гусаров и В. Н. Розанов отметили
значительное снижение заболеваемости аппендицитом в годы войны.
Отсюда напрашивается вывод, что в профилактике
аппендицита у детей важное значение имеют правильный
режим питания и регулярное отправление кишечника.
Определенная роль в возникновении аппендицита отводится врожденным аномалиям червеобразного отростка (перекруты, изгибы), инородным телам в нем, попаданию в отросток кишечных паразитов.
С момента выполнения первых аппендэктомий и до
настоящего времени хирургов всех стран не перестает
волновать механизм развития патологического процесса
при остром аппендиците. Среди всевозможных теорий
патогенеза острого аппендицита, предложенных в последние годы, господствующее место занимают инфекционная и нервно-сосудистая.
Основатель инфекционной теории известный немецкий патологоанатом Aschoff (1909) и его последователи
считают, что в возникновении аппендицита основную
роль играет флора отростка, которая активизируется (в
результате застойных явлений) и при понижении сопротивляемости червеобразного отростка проникает в его
ткани, вызывая воспаление.
Более широкое признание получила нервно-сосудистая теория (Н. Н. Еланский, 1952; А. В. Русаков, 1952;
II. В. Давыдовский, 1958; Rikker, 1926). Авторы считают,
что различные нарушения функции желудочно-кишечного тракта (запоры, энтероколит и т. д.) вызывают дисфункцию нервнорегуляторного аппарата отростка. Возникающие при этом отек, сосудистый стаз и нарушение
кровообращения приводят к трофическим изменениям в
отростке, вплоть до некроза отдельных участков. В свою
очередь степень деструктивных изменений зависит от
длительности спазма сосудов червеобразного отростка.
При кратковременном и умеренном спазме возникает
лишь функциональное нарушение, при продолжительном
и сильном спазме могут развиться более глубокие деструктивные изменения, которые приводят к полному
некрозу стенок отростка.
17
Нервно-сосудистая теория позволяет объяснить возможность возникновения гангренозных изменений в
отростке в первые часы заболевания и отсутствие морфологических изменений в нем при явной картине острого
аппендицита. Однако эта теория пока не дает ответа на
вопрос: с чем связано избирательное действие патологических импульсов на червеобразный отросток.
В последние годы (А. Г. Бржозовский, 1960; А. И. Ле-
нюшкин и др., 1964) не проводят границы между инфекционной и нервно-сосудистой теориями и рассматривают
обе теории в целом: в результате сосудистого спазма
наступают трофические изменения в отростке, что создает 'благоприятную среду для активизации собственной
флоры. Последняя, проникая в патологические ткани
appendix, вызывает в нем воспаление.
Л. М. Шор с соавторами (1966) считают, что на возникновение воспалительных и деструктивных изменений
в червеобразном отростке оказывают влияние сочетания
неблагоприятных моментов: инфекции, обтурации просвета, расстройства иннервации и кровоснабжения и др.
Этому способствуют анатомические и физиологические
особенности червеобразного отростка.
Для острого аппендицита у детей раннего возраста
наиболее характерными являются два признака:
1) аппендицит крайне редко возникает у детей
грудного возраста, особенно в первые 6 мес жизни ребенка. С возрастом постепенно нарастает частота
заболевания, достигая максимума к 8—И годам; 2) воспалительные изменения в отростке у детей первых лет
жизни развиваются значительно быстрее, чем в более
старшем возрасте, и чем моложе ребенок, тем эта особенность более выражена.
Н. П. Гундобин (1898), Shinaberger (1958) редкость
аппендицита в грудном возрасте объясняют характером
пищи в этом периоде (преимущественно жидкая молочная пища).
Другие авторы придают большое значение отсутствию
застоя кишечного содержимого в червеобразном отростке вследствие особенностей его анатомического строения
(А. А. Хонду, 1936; Snyder, 1952).
Фолликулярный аппарат червеобразного отростка
играет определенную роль в возникновении воспалительного процесса. У детей первого года жизни в слизистой оболочке отростка имеется малое количество фол-
18
лпкулов. С возрастом число фолликулов увеличивается,
и параллельно с этим увеличивается заболеваемость
аппендицитом (И. С. Дергачев, 1932; Б. В. Огнев,
С. Р. Слуцкая, 1948; С. Н. Майз ель, 1953).
На наш взгляд, главную причину редкой заболеваемости аппендицитом детей до одного года следует искать
п анатомических особенностях строения червеобразного
отростка и характера пищи в этом возрасте.
Более быстрое развитие воспалительного процесса у
маленького ребенка объясняется возрастными особенностями строения нервного аппарата червеобразного
отростка.
ПАТОЛОГИЧЕСКАЯ АНАТОМИЯ
Патологоанатомические изменения в червеобразном
отростке настолько многообразны, что порой не уклады-
маются в определенные схемы, классификации, стадии.
Предложено большое количество классификаций патологоанатомических изменений в червеобразном отростке при остром аппендиците, но в большинстве случаев
они слишком громоздки.
И. В. Давыдовский (1958) различает формы и стадии острого аппендицита. К стадии развития он относит
первичный аффект, флегмонозный, флегмоно-язвенный и
диффузный, гнойно-язвенный аппендицит. Отклонение
процесса от типового развития автор рассматривает как
формы заболевания (абортивные формы аппендицита,
гангренозный аппендицит).
Простой и удобной является классификация Шпрен-
гслн, согласно которой различают четыре формы процесса при остром аппендиците: простую (катаральную),
флегмонозную, гангренозную и перфоративную.
При простом катаральном аппендиците макроскопически червеобразный отросток несколько напряжен, серозная оболочка его умеренно гиперемирована,
сосуды инъецированы (рис. 6). В просвете отростка
нередко можно обнаружить каловые камни, слизистая
оболочка с кровоизлияниями, набухшая, иногда имеются
мелкие изъязвления. Слизистая оболочка может быть
изменена не на всем протяжении, а лишь на отдельных
участках и чаще всего на верхушке отростка.
При микроскопическом исследовании червеобразного
отростка при простом аппендиците можно отметить де-
19
Рис. 7. Гистологии*
ская картина при ка
таральном аппендици
те у ребенка 1 год
9 мес. Ок.Х8, об. X/
а —(лупа); б—детал
препарата: катаральны
экссудат на слизисто
оболочке, гиперсекреци
слизистых желез.
j
фекты слизистой оболочки, покрытые пленками фибрина
II лейкоцитами. В подслизистом слое гнойного расплавления тканей не отмечается, а имеется лишь лейкоцитарная инфильтрация. В ряде случаев можно обнаружить
первичный аффект Ашоффа, который находится в глубине борозд слизистой оболочки и имеет форму клина,
широким основанием распространяясь в глубжележащие
ткани. При дальнейшем развитии процесса происходит
слияние клиньев, постепенно захватывается вся толща
отростка (рис. 7, а, б).
Иногда можно отметить изменения и в брыжеечной
части отростка в виде отека и расширения сосудов.
Микроскопически париетальная брюшина, как правило, не изменена, экссудат в брюшной полости всегда
стерилен.
В наших наблюдениях из 330 оперированных детей
и возрасте до 3 лет катаральный аппендицит при гистологическом исследовании установлен у 53 больных
(16%). Процент катаральных форм аппендицита у детей
старшего возраста и взрослых значительно выше (по
А. И. Ленюшкину и др. — 51,0, по В. И. Колесову —
55,8). Видимо, это объясняется более быстрым развитием воспалительного процесса в отростке у детей раннего возраста.
Катаральные изменения отростка при остром аппендиците могут быть вторичными, поэтому необходимо
убедиться в отсутствии других заболеваний. В 6 наших
наблюдениях после установления на операции катарального аппендицита г последующем выявлены пневмония
(у 2 детей), острая респираторная инфекция (у 3) и
энтероколит (у 1).
Флегмонозный аппендицит характеризуется
гнойным воспалением всех слоев червеобразного отростка. Брюшина нередко бывает гиперемирована, мутна и
утолщена.
В брюшной полости часто обнаруживается экссудат,
который может быть серозным, кровянистым, серозногнойным и гнойным. По данным А. И. Ленюшкина с соавторами, экссудат при этой форме был обнаружен в
46% и в 9% дал рост микробов.
Макроскопически отросток на всем протяжении или
на отдельных участках гиперемирован, напряжен и
утолщен, иногда покрыт фибринозно-гнойным налетом
(рис. 8). Встречаются вздутие и флюктуация отростка за
21
Рис. 9. Флегмонозн
аппендицит у ребе*
IV2 лет.
а — утолщение сте]
отростка и его брыже:
(лупа); б —деталь г
парата: слизистая (
лочка диффузно инфк
трирована гнойным ;
судатом; видны едий
ные слизистые желез
участок гнойного \
правления слизистой с
лочки; диффузная га
ная инфильтрация
щечных слоев, сероз!
покрова и брыжейк:
«■чет скопления в нем гноя (эмпиема отростка). Брыжей-
k;i отростка в большинстве случаев инфильтрирована и
утолщена.
При микроскопическом исследовании обнаруживается
лейкоцитарная инфильтрация всех слоев отростка с множественными первичными аффектами Ашоффа. Со стороны слизистой оболочки наблюдаются изъязвления,
плгноения и нередко ее частичное отторжение (рис.
Ч я, б).
При флегмонозном аппендиците возможно образование аппендикулярного инфильтрата, представляющего
гобой опухолевидное образование, покрытое фибрином
и состоящее из инфильтрированного отростка, петель
топкой кишки сальника и слепой кишки. По нашим данным, флегмонозный аппендицит был у 81 ребенка раннего возраста (24,5%). Экссудат в брюшной полости при
згой форме аппендицита отмечен в 52% случаев, рост
микробов — в 18%.
Г ангренозный аппендицит характеризуется глубокими деструктивными изменениями всей стенки чер-
мсобразного отростка. При этом отмечается поражение
п брюшной полости. Париетальная брюшина чаще
бывает изменена. При вскрытии брюшной полости, по
данным А. И. Ленюшкина с соавторами, в 75% случаев
выделяется серозно-гнойный или гнойный экссудат,
иногда с колибациллярным запахом.
Макроскопически сам отросток значительно утолщен,
землисто-серого цвета, с гнойными наложениями. Стенка его довольно дряблая, и при манипуляциях может
легко наступить перфорация (рис. 10). При осмотре
слепой и подвздошной кишок отмечается воспалительная
инфильтрация их стенок с гиперемией серозы.
Микроскопическое исследование отростка всегда
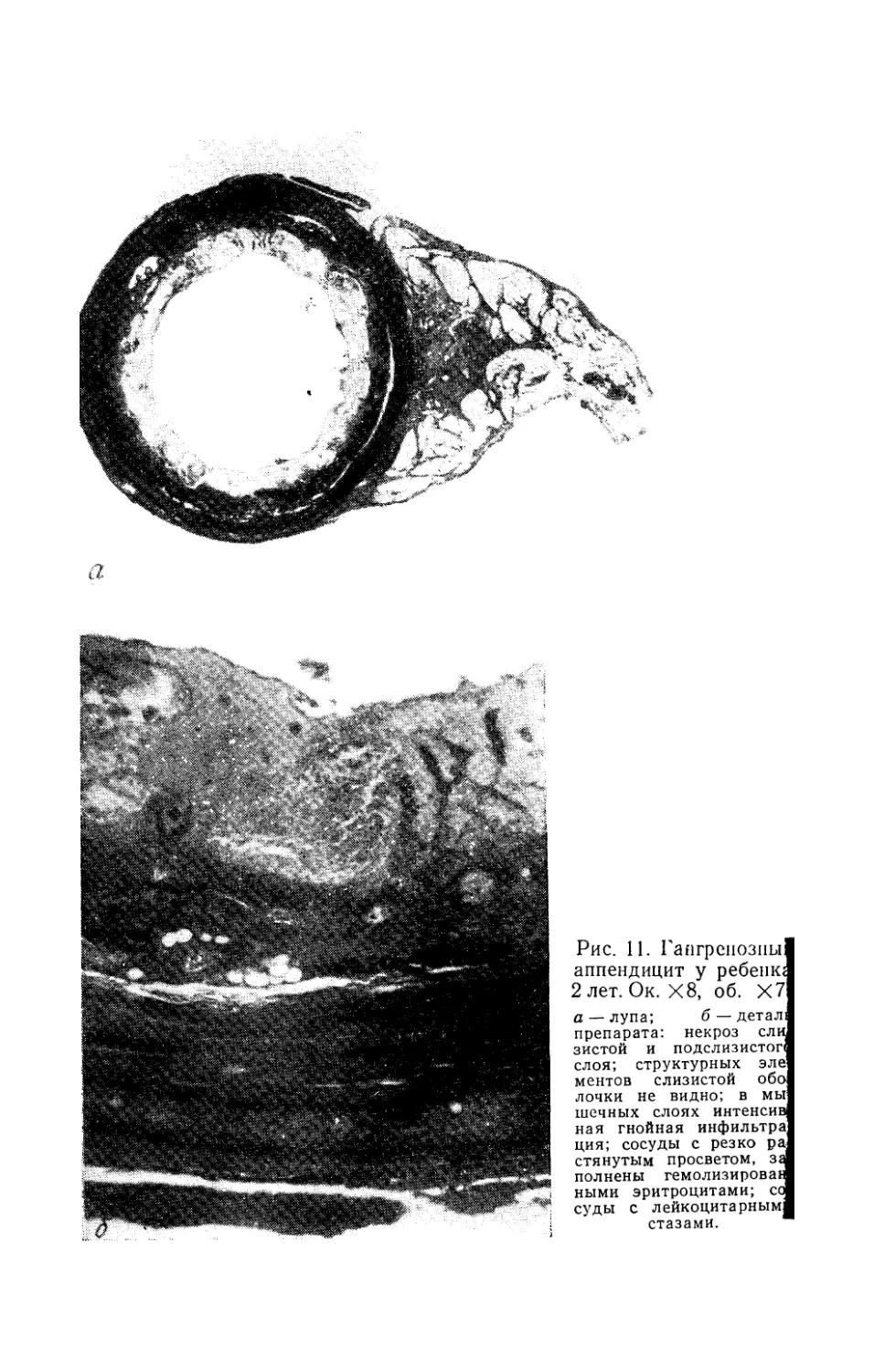
позволяет установить отек, кровоизлияния, лейкоцитарную инфильтрацию и некроз его стенок (рис. 11, а, б).
При гангрене отростка, как и при флегмонозном аппендиците, иногда наблюдается образование инфильтрата.
В связи с более быстрым развитием воспалительного
процесса в отростке у детей раннего возраста при оперативном вмешательстве, как правило, уже отмечается
перфорация червеобразного отростка. Так, из 196 наших
больных с гангренозной и гангренозно-перфоративной
формой аппендицита гангрена отростка без перфорации
была обнаружена только у 13% больных.
23
Рис. 11. Гангренозны
аппендицит у ребенка
2 лет. Ок. Х8, об. Х7
а —лупа; б — детал
препарата: некроз ели
зистой и подслизистог
слоя; структурных эле
ментов слизистой обо
лочки не видно; в мы
шечных слоях интенсив
ная гнойная инфильтра
ция; сосуды с резко ра
стянутым просветом, за
полнены гемолизирован
ными эритроцитами; со
суды с лейкоцитарным
стазами.
Перфоративный аппендицит возникает в ре-
|\.'и.тате гангрены или гнойного расплавления стенки
мужеобразного отростка. Эта форма заболевания часто
наблюдается у детей раннего возраста, что связано с
пшоздалой диагностикой и быстротой возникновения и
нарастания деструктивных изменений в отростке.
Прободение червеобразного отростка у маленьких
ineii, как правило, приводит к тяжелому генерализованному перитониту. Инфильтрат образуется довольно редко ввиду недоразвития сальника и малой пластичности
брюшины и отмечен у 11% из 196 больных с гангренозно перфоративной формой аппендицита. Причем инфильтрат, как правило, находился в стадии абсцедирования. Деструктивные изменения в отростке почти всегда
сопровождаются воспалительными явлениями самой
брюшной полости. Во всех ее отделах определяется гной
с резким каловым запахом, дающим в большинстве
случаев рост В. coli. Париетальная брюшина отечна,
I пперемирована, несколько утолщена, легко рвется.
11ерфоративное отверстие всегда располагается на стороне, противоположной брыжейке, и чаще находится у
верхушки вследствие худших условий питания в этом
отделе отростка (рис. 12). В просвете отростка обнаруживаются также гной, каловые камни.
Микроскопическое исследование отростка дает те же
изменения, что и при гангренозном аппендиците. Разница
сводится лишь к тому, что в прободном отростке могут
выявиться микроперфорации, которые обычно не обнаруживаются при макроскопическом обследовании.
Перфорация отростка была обнаружена у 171 больного, что составляет 51,86% по отношению ко всем оперированным больным.
По данным А. И. Ленюшкина с соавторами (1964),
процент перфораций отростка у детей старшего возраста
(после 3 лет) составил всего 8,0, т. е. более чем в 6 раз
меньше, чем у детей раннего возраста.
Таким образом, у детей раннего возраста характерным являются бурное прогрессирование изменений в
отростке и быстрое распространение процесса на всю
брюшную полость, что связано с возрастными анатомофизиологическими особенностями: незрелостью нервного
аппарата червеобразного отростка и недостаточностью
механизмов отграничения воспалительного процесса.
Глава III.
КЛИНИКА И ДИАГНОСТИКА
НЕКОТОРЫЕ СТАТИСТИЧЕСКИЕ ДАННЫЕ
В хирургии детского возраста экстренные оперативные вмешательства, выполненные по поводу острого
аппендицита, по своей частоте занимают первое место
и по отношению к остальным операциям составляют в
среднем 39% (А. И. Ленюшкин и др.).
Острый аппендицит в первые 3 года жизни ребенка
встречается довольно редко — у 3,7—7% оперированных
детей с острым аппендицитом (А. П. Биезинь, Т. Р. Чемс,
1966; Л. И. Счастливцева, Р. В. Горкавченко, 1966;
3. А. Шувалова, А. Г. Шмелев, 1962; Г. В. Чистович,
1958, и др.)* В наших наблюдениях аппендицит у детей
ранней возрастной группы составил 4,3%.
У детей старшего возраста имеются некоторые сезонные колебания частоты заболеваемости острым аппендицитом. В зимний и весенний периоды аппендэктомии
производятся значительно чаще. Объясняется это увеличением числа простудных заболеваний, изменением
режима и характера пищи (С. Д. Терновский, 1958;
В. И. Киселев, 1959; Gross, 1958; Kollermann и др., 1967).
В летнее время, когда уменьшается количество простудных заболеваний, а сопротивляемость организма
ребенка повышается, отмечается снижение заболеваемости аппендицитом (А. И. Ленюшкин и др., 1964; Ruiz,
1960). В отличие от детей более старшего возраста в
младшей возрастной группе отмечено увеличение заболеваемости аппендицитом в начале летнего периода, что
связано с возрастанием кишечных заболеваний и ослаб-
ленностью детей в это время года.
В возрасте до одного года было всего лишь 4 детей,
что составляет 1,02% ко всем наблюдениям. Самому
маленькому пациенту, оперированному по поводу флегмонозного аппендицита, было 10 мес. У остальных 3
больных (И мес и двух— 1 года) на операции оказался
гангренозно-перфоративный аппендицит и перитонит. Во
2G
всех наблюдениях после оперативного вмешательства
наступило выздоровление.
В отечественной и зарубежной литературе случаи аппендицита
у детей первого года жизни представлены как единичные наблюдения (С. А. Ширшин, 1962; Р. Н. Храмов, 1964; Stauber, Wurdisch,
l%2; Freedel, 1964). Имеются описания случаев аппендицита и у
новорожденных (А. Д. Першхава, 1960; Н. С. Керницкая, А. С. Булл, 1972; Walker, 1959; Firor, Myers, 1964).
После одного года заболеваемость аппендицитом
постепенно возрастает. В возрасте до 2 лет в нашей
клинике оперировано 83 ребенка (25%)—в 22 раза
Польше по сравнению с детьми грудного возраста, в возрасте от 2 до 3 лет — 243 больных, что составило 74% от
мсех оперированных детей до трехлетнего возраста.
Из оперированных нами детей мальчиков было 54,5%
и девочек — 45,5%. У детей старшего возраста отмечается обратное соотношение — преобладание заболевае:
мости острым аппендицитом у девочек. А. И. Ленюшкин
указывает на большую частоту (в 2 раза) простых форм
пппендицита и диагностических ошибок у девочек, чем у
мальчиков.
У детей первых трех лет жизни процент деструктивных форм аппендицита значительно выше, чем у детей
старшего возраста.
Таблица 1
Частота отдельных форм острого" аппендицита у мальчиков и девочек
Мальчики
Девочки
Всего
Форма острого
аппендицита
абс.
число
%
абс.
число
%
абс.
число
%
11ростая (катаральная)
22
12,5
31
20,1
53
16,0
Деструктивная
(флегмонозная и
гангренозно-перфоративная) . .
154 _
87,5
123
79,9
277
84,0
Итого . . .
176
100,0
154
100,0
330
100,0
В наших наблюдениях деструктивные формы аппендицита у детей до 3 лет наблюдались в 84%, т. е. почти в
2 раза чаще, чем у более старших детей (табл. 1).
27
Грубые деструктивные изменения отростка (гангрена и перфорация) в первые IV2 года жизни ребенка достигают очень высоких цифр и составляют 70,8%
(табл. 2).
Таблица 2
Частота гангрен и перфораций червеобразного отростка
в зависимости от возраста
Гангрена и
перфорация
червеобразного отростка
Возраст
Всего
случаев
абс. число
%
До I1/2 лет
24
17
70,8
IV2—3 года
306
179
58,4
I
Итого ...
330
196
1
59,3 S
Большинство авторов значительную частоту гангренозно-перфоративных форм аппендицита у детей до 3 лет объясняют возрастными особенностями анатомического строения червеобразного
отростка и органов брюшной полости.
В последние годы ряд зарубежных авторов (Snyder, Shaffinj
1952; Foster, Edwards, '1957; Lichti, Snyder, 1963) связывают частоту грубых деструктивных форм не с возрастом, а лишь с поздними
сроками оперативного вмешательства. <
По-видимому, следует считать, что в причинах прет
обладания деструктивных форм аппендицита у детей
раннего возраста в равной степени играют определенную
роль оба эти фактора. В этом отношении представляют
интерес данные сотрудников нашей клиники Л. А. Воро1
хобова и Г. А. Костомаровой (1962): в 1950—1954 гг;
деструктивные формы аппендицита у детей первых тре^
лет жизни составляли 54,5%, а в 1955—1958 гг. — 76,1 %|
В своей работе мы продолжили эту статистику и отметили, что в 1959—1968 гг. процент повысился до 84,0. Срок
от начала заболевания до операции у детей до 3 лет
остается высоким.
Число детей, поступающих в стационары в первьк
сутки от начала заболевания, очень незначительно, чтс
в большой степени связано с трудностями диагностик!
аппендицита у детей раннего возраста: наибольшее ко
личество детей поступило в клинику после суток о1
28
11. i ч «* i л а заболевания (201), из них 95 — в сроки от 2 до
5 гут, а 7 детей — свыше 5 сут от начала заболевания.
Число поздних операций (свыше суток) все годы
метается очень высоким, составляя 67,9%.
О чрезвычайной трудности диагностики аппендицита
\ детей раннего возраста свидетельствует факт, что из
детей, поступивших в клинику, сразу же были оперированы только 60%. У остальных диагноз острого
аппендицита был поставлен только в результате динамического наблюдения в условиях стационара.
Таким образом, острый аппендицит встречается у
детей всех возрастных групп, но реже всего у грудных
детей; в более в старшем возрасте частота заболевания
постепенно нарастает.
Подавляющее число больных поступают в стационар
м поздние сроки от начала заболевания. Установление
диагноза нередко затруднительно даже в условиях стационара и требует динамического наблюдения.
Трудность распознавания острого аппендицита и особенности его течения у детей раннего возраста приводят
к тому, что на операции чаще всего обнаруживаются
грубые деструктивные изменения.
В связи с указанными обстоятельствами наибольшее
значение приобретает своевременная и правильная диагностика острого аппендицита.
КЛИНИЧЕСКАЯ СИМПТОМАТОЛОГИЯ
Разнообразие клинического течения и отсутствие
объективных симптомов острого аппендицита у детей
младшей возрастной группы долгое время создавали
чрезвычайные трудности в прижизненной диагностике
этого заболевания.
На протяжении многих лет заболевание в раннем возрасте распознавалось только при секционном исследовании (Ф. Е. Мокриц-
кий, 1875; Т. П. Краснобаев, 1902; Goyens, 1890; Griffith, 1898). Пермью случаи прижизненной диагностики были опубликованы лишь в
начале XX века (Cosh, 1904; Howland, 1904). Небольшое количество
наблюдений не позволяло выявить и обобщить наиболее характерные особенности течения острого аппендицита у детей первых лет
жизни.
Впервые в многотомном руководстве «Русская хирургия»
/М.И. Ростовцев (1904) посвящает аппендициту у детей отдельную главу. Автор подчеркивает, что воспаление червеобразного отростка в
м детском возрасте имеет свои характерные особенности: заболевание
29
протекает тяжело и сопровождается высокой смертностью, особенно
у детей первых лет жизни.
Первой работой, специально посвященной аппендициту у детей
раннего возраста, следует считать статью американского хирурга
Abt (1917) в журнале «Archives of Pediatrics». Автор собрал в мировой литературе за 70 лет сообщения о 80 случаях аппендицита
у детей в возрасте до 2 лет и подчеркнул, что заболевание в данной возрастной группе протекает бурно, атипично и довольно часто
приводит к разлитому гнойному перитониту.
Начиная с 20-х годов нашего столетия на страницах медицинской печати появляется все больше работ, в которых указывается
на особые трудности диагностики аппендицита в раннем возрасте —
отмечается, что дети раннего возраста оперируются поздно и летальность остается крайне высокой: от 20 до 37% (А. Мангейм,
1928; Н. В. Шварц, 1929; В. П. Вознесенский, 1944; И. К- Ахунба-,
ев, 1956; Chamberlein, 1939; Ladd, Gross, 1941; Jacobson, 1942,
и др.). В последующем эти выводы подтверждены на более значительном материале (С. Д. Терновский, 1956; А. Г. Богина, 1956;
Л. А. Ворохобов и Г. А. Костомарова, 1962; Filds е. а., 1957; Stau-
ber, Wurdisch, 1962). Однако вопросы диагностики острого аппендицита у детей младшего возраста до настоящего времени остаются
исключительно трудными, что в основном определяется сложностью
выявления кардинальных признаков заболевания.
Клиническая картина острого аппендицита у детей
младшего возраста характеризуется преобладанием общих симптомов, что объясняется генерализованной реакцией детского организма на выраженный воспалитель-'
ный процесс независимо от его локализации. Многие из
этих общих симптомов (температура, рвота и т. д.)
встречаются не только при остром аппендиците, но
при целом ряде других заболеваний, что значительн
затрудняет правильную диагностику.
Полиморфизм, атипичность и своеобразие течени
острого аппендицита у маленьких детей зависят не толь-]
ко от реактивности детского организма, но и от возраст-j
ных анатомо-топографических особенностей. Тем не менее анализ большого количества наблюдений позволяет
нам выделить ряд симптомов, которые, хотя и не являются специфичными для острого аппендицита, но встречаются при данном заболевании с наибольшим постоянством. N j
Клинические симптомы (боль, повышение температур
ры, рвота и т. д.), как правило, выявляются из анамнеза!
Однако родители нередко сообщают не совсем точны*
данные, стараясь связать заболевание с простудные
фактором, погрешностями в диете’и т. д. В связи с этие!
чрезвычайно важно не только тщательно собрать анам
30
him, но и критически его оценить, выявив достоверные
признаки заболевания.
Нели у детей старшего возраста ведущее значение
имеют жалобы на боли в правой подвздошной области,
ту детей первых трех лет жизни прямых указаний на
поли нет и судить о наличии этого симптома можно
лишь по ряду косвенных признаков. Наиболее важным
среди них является изменение поведения р е-
г» е п к а. По нашим данным, в 76% случаев родителями
отмечено, что ребенок становится малоконтактным, капризным. Подобное поведение больного свидетельствует о
наличии боли.
Причиной возникновения болей является вовлечение
и воспалительный процесс париетальной брюшины и
орыжейки отростка. Непрерывность боли ведет к нарушению сна, что является характерной особенностью
.заболевания у детей младшего возраста и отмечейо в
!>Г>,3% случаев. Наблюдение за больными показывает,
что боли в большинстве случаев носят постоянный характер. Об этом свидетельствует наличие описанных
выше косвенных признаков. Лишь у 6,3% детей можно
предположить приступообразный характер болей: периоды спокойного поведения сменяются приступами резкого
двигательного беспокойства, плача, отказа от приема
пищи и т. д.
К таким же выводам в отношении постоянного характера болей при аппендиците у детей пришли и другие
авторы (Р. А. Варшавер, 1961; И. Г. Градаускас, 1963;
Bunton, 1953; Deower, 1962).
Наряду с указанными косвенными признаками, свидетельствующими о наличии болей, определенное значение имеет ряд симптомов (повышение температуры,
рвота, изменение характера стула). Приведем сравнительную частоту клинических симптомов.
Симптомы
Изменение поведения ребенка (беспокой-
ство и пр.)
100,0
Нарушение сна
55,3
Повышение температуры
94,6
Рвота
76,6
Стул: нормальный
76,6
задержка
11,7
жидкий
11,7
Повышение температуры почти всегда имеет
место при остром аппендиците у детей до 3 лет. По на-
31
шим данным, оно отмечалось у 94,4% больных. Обычно]
температура нарастает постепенно и ко 2—3-му дню?
заболевания достигает высоких цифр. При значительных
деструктивных процессах в червеобразном отростке (при
гангрене или перфорации его) температура выше 38°
отмечалась в 72,5%, причем почти в 15% случаев оставалась высокой с первого дня заболевания. В 6% всех
форм воспалительного процесса в отростке у детей не
было повышения температуры в первый день заболевания, хотя в последующие дни она достигла высоких
цифр.
Обращает на себя внимание тот факт, что даже при
катаральном аппендиците температурная реакция обычно бывает выраженной (95,6%), что, по-видимому, связано с чрезвычайно лабильной системой теплопродукции
и теплоотдачи у детей этого возраста. Вообще отсутствие
температурной реакции при остром аппендиците следует
считать нетипичным, хотя и нужно помнить о такой возможности, особенно в случаях локально протекающих
воспалительных процессов в отростке.
Кроме того, характер температурной реакции зависит
не только от форм аппендицита, но и от индивидуальных
особенностей нервной системы ребенка, состояния питания, изменения реактивности в результате перенесенных
инфекций, применения антибиотиков и т. д.
Рвота является довольно постоянным симптомом
при остром аппендиците у детей до 3 лет. В совокупности с другими симптомами она имеет большое значение
для установления диагноза у данной группы детей, так
как в старшем возрасте и у взрослых рвота встречается
значительно реже.
Наличие рвоты в начале заболевания объясняется
нервно-рефлекторным фактором, а в далеко зашедших
случаях этот симптом может свидетельствовать об интоксикации. У детей до 3 лет в отличие от больных более
старшего возраста рвота нередко является многократной. Содержимое рвотных масс, как правило, желудочное, примесь желчи наблюдается в поздних стадиях
заболевания уже при развившемся перитоните, причем
существует определенная зависимость между частотой
рвоты, формой аппендицита и распространенностью воспалительного процесса в брюшной полости: многократная рвота чаще отмечается при деструктивных формах
аппендицита с перфорацией отростка. Однако в ряде
32
i i учись рвота может отсутствовать, что отмечено у 20%
tи 1/|1.11ых с деструктивными формами аппендицита. Это
иГичоятельство еще раз подтверждает атипичность и
мидиипдуальные различия клинических проявлений острит аппендицита у детей младшего возраста. Даже та-
iniii характерный симптом, как рвота, отличается извест-
инй мариабельностью и имеет диагностическое значение
iiiiiii. в сочетании с другими клиническими симптомами.
Стул. При остром аппендиците у детей раннего возраста в большинстве случаев не отмечается нарушений
функции кишечника. По нашим данным, стул был нормальным у 76,6% больных. У части больных (11,7%),
иднако, был жидкий стул. Сравнивая характер его при
различных формах аппендицита, можно отметить, что
жидкий стул чаще наблюдался при осложненных формах аппендицита (16,7% случаев).
11одобную частоту жидкого стула у детей этого возраста отмечают и другие авторы (Н. Г. Садыков, 1955;
Г, И. Макленцов, 1957; Guluzzi, Gianelli, 1952; Bertrand,
1959; Lansden, 1963). О возможности наличия жидкого
стула необходимо помнить еще и потому, что эти случаи
вызывают наибольшие дифференциал ьно-диагностиче-
< кие трудности.
Итак, при всем многообразии клинических проявлении острого аппендицита детей первых трех лет жизни
можно отметить некоторые признаки, встречающиеся с
наибольшей частотой: беспокойное поведение ребенка,
нарушение сна, свидетельствующие о наличии боли.
Хотя совокупность указанных симптомов и позволяет
ыподозрить острый аппендицит, следует помнить, что у
детей раннего возраста они могут наблюдаться в различных сочетаниях при целом ряде соматических заболеваний.
Наташа С., 1 года 9 мес, доставлена в приемное отделение
клиники с диагнозом: острое респираторное заболевание (?). Ди-
нчггерия (?). Больна 2-й день. Заболевание началось с повышения
и’миературы до 38,8°, двукратной рвоты, беспокойства, отказа от
нищи. Вызванный на дом врач установил острое респираторное за-
полевание и назначил лечение. На следующий день температура
повысилась до 39,6°, рвота повторилась еще дважды, присоединился
частый жидкий стул. Участковый врач заподозрил дизентерию и
направил ребенка в терапевтическое отделение нашей клиники для
консультации и решения вопроса о госпитализации.
Состояние ребенка при поступлении тяжелое, температура
IN,!)’, он вял, бледен, выражены явления токсикоза и эксикоза.
И приемном покое был жидкий стул с зеленью. Язык суховат, обло¬
714
33
жен. Пульс соответствует температуре. Девочка капризничает, сопротивляется осмотру, плачет. Живот болезненный во всех отделах
Симптом Щеткина неясный. Ребенок госпитализирован в боксиро-
ванное отделение с диагнозом: токсическая дизентерия. В отделении
ребенок повторно осмотрен хирургом, установлен диагноз остроге
аппендицита и перитонита, который подтвержден на операции.
Таким образом, выявление описанных выше симпто^
мов хотя и имеет определенное диагностическое значение, но ввиду распространенности их при многих другие
заболеваниях не является решающим для установления
диагноза острого аппендицита. Наиболее достоверные
данные могут быть получены только в процессе объективного исследования больного, включая дополнитель^
ные методы исследования.
Объективные сведения о клинических симптомам
удается получить при наблюдении за больным в условрг
ях стационара, но длительное наблюдение нежелательнс
из-за опасности быстрого прогрессирования воспалительного процесса. В связи с этим основную диагностическую ценность представляет выявление местных симпто;
мов, которые являются обязательными при наличш
воспаления в червеобразном отростке.
По нашим и литературным данным, наиболее посто
янными и достоверными признаками острого аппендицита у детей являются болезненность при пальпации и на;
пряжение мышц в правой подвздошной области.
Следует выделять активное напряжени<
мышц брюшной стенки, возникающее в результате не
гативного отношения ребенка к обследованию (беспо;
койство, плач, сопротивление осмотру) или сознательно
го локального щажения правой подвздошной облает*
из-за болезненности, возникающей при пальпации живо
та. Активное напряжение мышц второго вида, связанно*
с болезненностью, необходимо принимать во вниманий
при постановке диагноза. Наиболее объективным при
знаком, указывающим на воспалительный процесс i
правой подвздошной области, является пассивно!
мышечное напряжение (defense musculaire).
Механизм возникновения defense musculaire в лите
ратуре объясняется раздражением брюшины (В. П. ВоЗ
несенский, 1944; В. И. Колесов, 1959; А. П. Попов, 1963)
Некоторые авторы придают определенное значение так
же изменениям, наступающим в мышцах переднем
брюшной стенки (Е. А. Кузьмина, 1952; Е. Д. Двужиль!
34
и,ш, 1965), но исследования механизма мышечного напряжения предпринимались только у взрослых.
Но нашему мнению, у детей defense musculaire возникнет рефлекторным путем за счет вовлечения брюшины и воспалительный процесс. Однако только этим объ-
ш нить генез пассивного мышечного напряжения нельзя.
(> целью выявления изменения в мышцах передней
|(рюшной стенки при остром аппендиците проведено их
I шдологическое исследование.
Материал был получен во время выполнения аппендэктомии:
имекались кусочки поперечной мышцы (размером 1x0,5 см) в молим г ее разъединения до вскрытия брюшины. Окраска гистологических препаратов производилась гематоксилин-эозином. Нами уста-
что при катаральном аппендиците выявляется лишь незна-
чм тельный отек мышечных волокон. Заметных воспалительных изме-
mUi не обнаружено (рис. 13, а,б).
При флегмонозном аппендиците отмечаются выраженные вос-
ммлительные изменения: отек мышц, потеря исчерченности и лейко-
иимфиая инфильтрация (рис. 14, а,б).
1н)лее глубокие изменения выявлены при гангренозно-перфора-
|мимом аппендиците. Уже макроскопически мышцы выглядят отечными, тусклыми, легко разволокняются и рвутся. При микроскопическом исследовании обнаружены отек мышечных волокон, потеря
мл поперечной исчерченности, расширение кровеносных сосудов.
• 1мределяются участки с обильной круглоклеточной инфильтрацией и
чч/ке дегенерацией мышечных волокон (рис. 15, а, б).
Таким образом, механизм возникновения пассивного
мышечного напряжения зависит не только от изменений
н брюшине, но и от воспалительных явлений в самих
мышцах (миозит). Появление последних мы объясняем
[переходом воспаления с червеобразного отростка на
теедиие ткани (брюшину и мышцы), клиническим выражением чего является напряженность передней брюшной
сIемки при пальпации.
Полученные нами данные свидетельствуют в пользу
тетояиства этого симптома при остром аппендиците.
Но данным А. П. Биезинь (1959), Л. В. Прокопова (1959), 3. А.
Иумюиша и А. Г. Шмелева (1962), И. К. Градаускас (1963), Sny-
ki и Shaffin (1952), Bunton (1958), defense musculaire при остром
|цич1дмците у детей младшего возраста встречается в 75—92% случим
Отсутствие данного симптома, по мнению ряда хирургов
• Д. Терновский, 1958; А. П. Биезинь, 1959), обусловлено тем, что
• "и,, а в связи с этим и мышечное напряжение могут исчезнуть
• этапе болезни в результате некроза и гибели чув-
I пи гсльпых нервных волокон и рецепторов.
Пам представляется возможным отсутствие defense
niisenlaire в крайне редких случаях. Обычно же в пери-
35
I’пс. 14. Участок поперечной мышцы живота у ребенка 2 лет при
флегмонозном аппендиците (поперечный срез).
и — отек межмышечных прослоек и небольшое скопление полиморфноядер-
||i*iх лейкоцитов; видна пролиферация оболочек мышечных волокон с потерей поперечной исчерченности; б — детали препарата: ок. Х20, об. Х7.
d
Рис. 15. Участок поперечной мышцы живота при гангренозно-пер- ,
форативом аппендиците ребенка 1 года 9 мес (продольный срез).
а — ок. Х8, об. Х7; б — детали препарата ок. Х20, об. Х7. j
mi m проза чувствительных нервных волокон отростка
щтисходит некоторое ослабление defense musculaire, но
• ш шитое его исчезновение, так как рецепторный аппарат
• "храмнется в окружающих отросток тканях, вовлеченных и воспалительный процесс. Пассивное напряжение
при метром аппендиците у детей до 3 лет установлено у
и» г\ польных.
Мы полностью разделяем мнение А. И. Ленюшкина с
|* * in и горами о том, что при остром аппендиците у детей
нирнду с пассивным мышечным напряжением всегда су-
иич гпуст и болезненность.
Локальная болезненность в правой подписанной области и ее усиление при пальпации (симп-
|мм Филатова), по нашим данным, отмечались у 72%
11МЛМ1МХ, в остальных случаях она была разлитой.
Эти симптомы у взрослых и детей старшего возраста
1МИМЛЫЮ легко выявляются путем пальпации передней
тринипой стенки. Однако обнаружить указанные признаем у детей первых лет жизни чрезвычайно трудно. Они
■Щтломлены возрастными особенностями психики, и в
И'риую очередь двигательным возбуждением и беспокой-
шмм при осмотре. В этих условиях почти невозможно
шределить локальную болезненность и отдифференци-
minm, активное мышечное напряжение от пассивного.
Поскольку эти симптомы являются наиболее важными, а у маленьких детей нередко и единственными,
к и читающими на локализацию -патологического про-
гсса, мы придаем особенно важное значение способам
\ выявления. Определенную роль играет умение найти
ми га кт с маленьким ребенком. Это касается детей, ко-
мрыг уже начинают говорить. Обследованию ребенка
ргдпк'ствуют беседы, доступные его пониманию. Ребе-
ми при этом постепенно успокаивается, и представляет-
н возможность относительно спокойного обследования.
< ’.лсдует подчеркнуть, что важное значение имеет и
I мп методика пальпации передней брюшной стенки.
Им-додоиать живот ребенка необходимо не спеша, мяг-
1МИ, нежными движениями теплой руки, вначале еле
п ата» брюшной стенки и затем постепенно увеличивая
hi,name. При этом пальпацию необходимо проводить с
ишпммо здорового места, а не с места предполагаемой
i ir икашости, т. е. начинать ее с левой подвздошной
Miami, переходя к правой подвздошной ямке по ходу
• па ми кишки (рис. 16). В этом случае подобная щадя-
39
Рис. 16. Этапы пальпаторного исследования брюшной стенки.
щая пальпация позволяет выявить локализацию hi
большей болезненности. При этом не следует спрашив*
ребенка о боли, а нужно наблюдать за выражением (
лица и все время отвлекать внимание разговорами
расспросами об играх, игрушках и т. д. Требуется rj
тельное терпеливое ожидание, пока ребенок успокоит!
и чем беспокойнее он, тем больше должна быть подоз|
тельность врача в отношении острого аппендицита. ;
В наших наблюдениях 48% детей при осмотре ве!
себя беспокойно, сопротивлялись осмотру, плакав
отталкивали руку врача, причем у 90% из них оказалй
тяжелые деструктивные изменения в червеобразн*
отростке. j
Еще Н. Мондор (1939) указывал: «Чем упорнее кп
ки ребенка, чем сильнее возбуждение и враждебн
противодействие исследованию, тем внимательнее ну]
но отнестисть к данному случаю, так как причина в<
буждения и криков почти всегда сосредоточена в брю
ной полости. В эти моменты и проявляется умение вра
которое прежде всего заключается в способности bi
шить доверие».
В случаях острого аппендицита даже при поверхно
ной пальпации правой подвздошной области ребе*
начинает беспокоиться, на лице появляется грим*
боли, усиливается плач. При этом ребенок нередко
талкивает руку врача (симптом правой руки). Одн*
этот симптом нельзя считать достоверным, так как
наличие может объясняться не только болезненност
но и негативной реакцией ребенка на осмотр. Безусло:
40
Рис. 17. Сравнительная пальпация живота.
наиболее важным является выявление локальной болезненности в правой подвздошной области и пассивного
мышечного напряжения.
Для определения состояния брюшной стенки можно
мпепользоваться следующей методикой: пальцы обеих
рук кладут на правую и левую подвздошную области
(лепня рука на правую, правая — на левую сторону житии). Производится поочередное нежное давление обеими руками (рис. 17). При наличии острого аппендицита
ми глубоком вдохе ребенка в правой подвздошной облает (а при разлитом перитоните с обеих сторон) определяется ощутимое сопротивление мышц передней
причиной стенки. При отсутствии аппендицита такие явления не наблюдаются, и на глубоком вдохе ребенка
пальцы обеих рук хирурга как бы проваливаются в
прюшную полость. На этот прием указывал еще в 1935 г.
Г, II. Краснобаев.
Некоторые авторы отмечают, что defense musculaire
лучше выявляется при умеренном одновременном давлении па обе половины живота. На вдохе, когда брюшная
| генкл расслабляется, разница в напряжении более ясно
iiiiiVTiiMa (Г. В. Чистович, 1956; А. Л. Зайченко и др.,
I'liiii).
Преди приемов, облегчающих диагностику, большое
шипение мы придаем очистительной клизме. Практиче-
| км у всех больных, направленных с подозрением на острим аппендицит в тех случаях, когда имеется указание
ми задержку стула, мы считаем обязательным очистить
мнмечипк с помощью клизмы. Это особенно целесооб-
рн мю п необходимо у детей раннего возраста при взду¬
41
тии кишечника. Так, в 16,1% случаев этот сравнительнс
простой диагностический прием позволил установит!
диагноз копростаза и исключить острый аппендицит. Hi
в одном случае не наблюдалось непосредственного ухуд
шения, связанного с очистительной клизмой. Напротив
при наличии острого аппендицита после этого легч<
уточняется локальная болезненность и послеоперацион
ный период протекает благоприятнее из-за отсутствш
газов и каловых масс в толстой кишке. Однако все прие
мы, о которых шла речь, хотя и могут помочь в диагно
стике аппендицита, но по отношению к больным раннеп
возраста нередко оказываются несостоятельными.
В 1936 г. С. Д. Терновский рекомендовал осмотр бес
покойных детей во сне, так как при этом болезненност!
и истинное напряжение сохраняются и улавливаются бо
лее четко. В нашей клинике этот прием получил широко!
распространение при подозрении на острый аппендицит
и применяется до последнего времени. Мы высоко оце
ниваем этот диагностический прием. Достаточно ска
зать, что у 29% наших больных диагноз острого аппен-
дицита был поставлен именно на основании данньи
осмотра больного во время сна. Аналогичные данньк
приводят Г. В. Чистович (1956), Л. А. Ворохобов \
Г. А. Костомарова (1962).
Осмотр ребенка во время сна требует довольно дли
тельного выжидания. Многие дети засыпают далеко н<
сразу и в среднем, по нашим данным, для установлена
диагноза потребовалось 10 ч наблюдения в условия}
стационара. Учитывая динамику воспалительных изме;
нений в брюшной полости, у детей раннего возраст;
столь длительное выжидание является особенно нежела
тельным из-за возможности реально быстрого прогрео
сирования воспаления и развития тяжелых деструктив
ных форм аппендицита. Таким образом, поиски методик
позволяющих в кратчайшие сроки установить диагноз
острого аппендицита у маленькиих детей, особенно акту
альны. В исследованиях последних лет делаются попыт
ки использовать у детей для выявления defense muscu
laire эфирный наркоз (И. И. Неймарк, Л. Н. Камардин
1963; С. М. Славкина, Ю. А. Козлов, 1964), наркотические средства и барбитураты — секонал, пентобарбита;
(Clauthlin, Packard, 1961; Benson, 1962).
Нами разработан и с 1964 г. применяется в клинике
при подозрении на острый аппендицит метод осмотр;
42
I’lir. 18. Введение раствора хлоралгидрата в прямую кишку.
Папиного после введения per rectum раствора хлорал-
шдрата. Методика сводится к следующему: ребенку
нанят очистительную клизму. После того как дистальный отдел толстой кишки очищен, в прямую кишку
иггапляют резиновый катетер (примерно на 15 см) и по
нему шприцем вводят теплый раствор 3% хлоралгидра-
|/|, подогретого до температуры тела (рис. 18). Дозирован и зависимости от возраста следующая: до 1 года —
К) 15 мл, от 1 года до 2 лет — 15—20 мл, от 2 до 3
дет 20—25 мл. Через 15—20 мин после введения хло¬
ралгидрата наступает сон и можно приступить к осмотру
Пилимого.
Наиболее ценным является то, что под влиянием
нлоралгидрата пассивное напряжение мышц передней
Ирининой стенки и локальная болезненность при остром
аппендиците сохраняются. Они легко выявляются,
in/скольку исчезают двигательное возбуждение, пси-
so эмоциональные реакции и активное напряжение
мышц.
Данное исследование позволяет не только выявить
кардинальные симптомы острого аппендицита и дифференцировать активное и пассивное напряжение, но и
определить наличие симптома Щеткина.
Ира У., 2 лет 2 мес., поступила в клинику на 3-и сутки заботимая, которое началось с повышения температуры до высоких
цифр; больная жаловалась на боли в животе, плохо спала ночью,
mi пи оралась рвота (всего 5 раз). Стул оставался нормальным. При
43
поступлении температура 38,6°. Явления токсикоза и эксикоза не I
выражены. Девочка неохотно вступает в контакт, сопротивляется ■]
осмотру хирурга, напрягает живот. После очистительной клизмы в
прямую кишку по тонкому резиновому катетеру введено 20 мл по- :
догретого 3% раствора хлоралгидрата. Спустя 15 мин девочка ус- <
нула. При осмотре во сне определялось напряжение мышц всего;
живота (больше справа). При более глубокой пальпации правой под-'
вздошной области девочка стонет, отталкивает руку врача. Сим- ■
птом Щеткина резко положительный. Больная оперирована. На:
операции обнаружен гангренозно-перфоративный аппендицит: раз-:
литой гнойный перитонит. Наступило выздоровление.
Важно подчеркнуть, что хлоралгидрат в применяем
мых нами дозировках не только не вызывает никаких
побочных и токсических реакций, но вообще не оказывает заметного влияния на важнейшие системы организма
(сердечно-сосудистую, дыхательную, выделительную).
Поэтому данный метод практически не имеет противопоказаний. Мы произвольно вызываем достаточно глубокий сон и тем самым создаем оптимальные условия ДЛЯ;
осмотра ребенка.
Исследование больного во время медикаментозного
сна дает возможность получить достоверные данные о
частоте пульса, дыхания, облегчает аускультацию.
Данный метод применен у 120 больных в возрасте до
3 лет, поступивших с подозрением на острый аппендицит;
По возрасту дети распределились следующим образом:
до 1 года — 15 больных, от 1 года до 2 лет — 47, от 2 дс
3 лет — 58.
Исследование после клизмы с хлоралгидратом 3f
больных позволило тут же снять диагноз острого аппендицита, поскольку defense musculaire не было выявлено:
В этой группе больных были выявлены следующие заболевания: острые респираторные инфекции, отит, ангина
пневмония, энтероколит и др.
Следует отметить, что у всех перечисленных больны?
на основании клинических симптомов и данных объек
тивного исследования до хлоралгидратовой клизмы от
вергнуть диагноз острого аппендицита не представля
лось возможным. Вполне вероятно, что эти дети ране:
были бы оперированы. У остальных 82 больных при ос
мотре после введения хлоралгидрата совершенно четю
выявились пассивное мышечное напряжение, локальна
болезненность, а в ряде случаев и положительный симг
том Щеткина. На операции диагноз острого аппендицит
подтвержден у 75 больных. Гистологически катаральны
44
аппендицит обнаружен у 1 больного, флегмонозный — у
'.!(), гангренозный и гангренозно-перфоративный — у 54.
V (> больных на операции выявлена следующая патологии: диплококковый перитонит (2), мезаденит с резким
увеличением лимфатических узлов (3), флегмонозно-
гангренозный холецистит (1).
Таким образом, и в случаях расхождения диагноза
речь шла о заболеваниях, которые, как правило, сопро-
мождаются болезненностью при пальпации и защитным
мышечным напряжением. Дифференциальная диагностика с острым аппендицитом в данных случаях весьма
затруднительна и почти не имеет практического значения. Лишь в одном случае на операции была обнаружена подковообразная почка. До операции ставился диагноз аппендикулярного инфильтрата из-за наличия опухолевидного образования в правой подвздошной области
и повышения температуры. Мы далеки от мысли о том,
что осмотр ребенка во время сна после введения хлоралгидрата является приемом, который полностью разрешает все вопросы диагностики.
Нам представляется весьма интересным и заслуживающим внимания такой метод, как электромиография
(А. В. Лившиц, 1963; Н. И. Рассуждай, 1965; В. Д. Двужильная, 1965). Работами указанных авторов, основанных на наблюдениях у взрослых, подтверждено, что в
результате воспалительного процесса в брюшной полости
электрическая активность мышц живота значительно
повышается. Поскольку миография является объективным методом, можно предположить, что в дальнейшем
она получит распространение и у детей, но в настоящее
время возможности широкого применения электромио-
I рафии ограничены.
Наряду с этим исследование ребенка после хлоралгидрата является простым, общедоступным и надежным
вепомогательным методом, значительно облегчающим
диагностику.
Интересным и важным с нашей точки зрения является сопоставление диагностических ошибок, допущенных
при оперативном лечении острого аппендицита у детей
раннего возраста до применения хлоралгидрата и за период его применения (табл. 3).
Анализ приведенных данных показывает, что применение хлоралгидрата позволило снизить процент диагностических ошибок с 17 до 5,1.
45
Таблица ЦЭ
Характер диагностических ошибок до применения
и с применением хлоралгидратовой клизмы
Окончательный диагноз
До применения хлоралгидрата
(1959-1963)
С применением хлоралгидрата
(1964—1968)
Всего
Диплококковый перитонит ....
9
2
11
Мезаденит
4
3
7
Опухоль правой подвздошной области
1
_
1
Илео-цекальная инвагинация . . .
1
—
1
Перфоративный дивертикул Мек-
келя
1
1
Кишечная непроходимость ....
2
—
2
Забрюшинная гематома
1
—
1
Перекрут кисты
1
—
1
Подковообразная почка
—
1
1
Гангренозно-флегмонозный холецистит
_
1
1
Причина заболевания на операции
не установлена
10
—
10
Общее количество оперированных
175
155
Процент диагностических ошибок
17 '
5,1
Весьма важным является то, что исследование
хлоралгидратом позволило значительно сократить срок!
наблюдения больного до установления окончательной
диагноза (табл. 4).
Итак, применение клизмы с хлоралгидратом позволи
ло сократить средние сроки наблюдения за больным i
стационаре с 10 до 2 ч.
Определенный интерес представляют сведения о мор
фологических изменениях в червеобразном отростке ;
больных, оперированных по поводу острого аппендицит;
до и после применения хлоралгидратовой клизм!
(табл. 5).
Следует обратить внимание на тот факт, что процен
деструктивных форм аппендицита остается высоким, не
смотря на сокращение сроков наблюдения больного :
стационаре. Мы считаем, что это связано с поздней диа
гностикой и поздним направлением больных в стацис
нар.
46
Таблица 4
Сроки установления диагноза у больных, госпитализированных
с подозрением на острый аппендицит, до применения
и с применением хлоралгидратовой клизмы
Сроки установления (в часах)
Методика
обследования
До 2
2-6
6-12
42—24
свыше
24
среднее
коли-
ч еСтво
часов
Всего
боль¬
ных
До применения
хлоралгидратовой
клизмы (1959—
1963)
5
36
15
9
7
10
72
применением хлоралгидратовой
клизмы (1964—
1968)
72
3
1
2
821
1 У остальных 38 больных диагноз острого аппендицита был снят и в дальнейшем выявлены другие соматические заболевания.
С применением хлоралгидрата сократилось (в процентном отношении) количество катаральных форм аппендицита. Мы не претендуем на окончательную оценку
тгого факта, но можно предположить, что катаральные
изменения в отростке у больных, оперированных ранее
(1959—1963), в ряде случаев были вторичными. Под-
Таблица 5
Частота различных форм аппендицита до и после применения
хлоралгидратовой клизмы
Годы
1959—1963
1964-1968
Всего
Форма острого аппендицита
абс.
число
%
абс.
число
%
К /тральный аппендицит
42
24,5
И
7,0
53
Флегмонозный аппендицит
1 /нм ренозный и перфоратив¬
32
18,2
49
31,6
81
ный аппендицит
101
57,3
95
61,2
196
Итого ...
175
100,0
155
100,0
330
47
тверждением является то, что у 14% больных, оперированных в эти годы, в послеоперационном периоде были
диагностированы такие заболевания, как острая респираторная инфекция (3), пневмония (2) и энтероколит (1).
Важным этапом клинического обследования больного
является выявление симптомов раздражения брюшины.
Симптом Щетки на—Блюмберга был положительным у 35% больных. В основном он определяется
у больных с деструктивными формами аппендицита, когда воспалительный процесс уже переходит на брюшину.’
Чрезвычайно важно его обнаружить и правильно оце-1
нить. Выявляется симптом Щеткина—Блюмберга путем
медленного постепенного и глубокого надавливания
двумя — тремя пальцами на брюшную стенку с последующим быстрым отведением руки. При этом необходимо
наблюдать за реакцией ребенка, не спрашивая его о
боли. О положительном симптоме Щеткина—Блюмберга
свидетельствует усиление болезненной реакции, проявляющейся у детей по-разному (гримаса, плач и т. д.).’
Определение симптома Щеткина—Блюмберга во время
естественного или медикаментозного’ сна проводится
после тщательной пальпации брюшной стенки в заключение исследования. При положительном симптом<
Щеткина—Блюмберга ребенок или просыпается, илр
болезненно реагирует, продолжая спать.
Симптом Щеткина—Блюмберга следует дифференци
ровать на локальный (при ограниченной заинтересованности брюшины) и разлитой, определяемый во все>
отделах брюшной стенк i при диффузном перито;
ните. Это определяет дальнейшую тактику хирургу
как в предоперационной подготовке, так и во врем?
операции.
Определенное диагностическое значение имеют i
другие методики, позволяющие установить раздраженш
брюшины: перкуссия живота, поглаживание живота че
рез рубашку.
Симптом расхождения пульса и темпе
р а туры, являясь важным объективным признаком тя
жести заболевания в более старшем возрасте, у малень
ких детей имеет меньшее значение, так как во многи:
случаях, даже при деструктивных формах аппендицит
с явлениями перитонита, частота пульса соответствуй
новы шени ю те м пер ату р ы.
48 ;
Расхождение пульса и температуры нами было установлено лишь в 8% случаев при сильно запущенных перитонитах.
Пальцевое исследование per rectum имеет
большую ценность у детей старшего возраста, но при
аппендиците в младшем возрасте вносит ясность в по-
становку диагноза лишь при наличии аппендикулярного
инфильтрата, который в этом возрасте встречается относительно редко. Выявить пассивное напряжение мышц
брюшной стенки при бимануальном исследовании у маленьких детей чрезвычайно сложно. Тем не менее пальцевое исследование прямой кишки необходимо, так как
но многих случаях помогает отдифференцировать
другие заболевания (копростаз, кишечную инфекцию,
инвагинацию и т. д.).
Изменения в белой крови при аппендиците
н младшем возрасте, как и у более старших детей, не
всегда бывают характерными, но в сочетании с другими
симптомами безусловно имеют большое значение.
Как и при всяком воспалительном процессе, в большинстве случаев наблюдаются повышенное содержание
лейкоцитов и сдвиг влево лейкоцитарной формулы.
Shinaberger (1958), Liechti и Snyder (1963) считают, что
для аппендицита у маленьких детей характерно значительное повышение количества лейкоцитов (в среднем
до 24 000).
У большинства детей (42,3%) отмечался лейкоцитоз
м пределах от 10 000 до 15 000, у 24% имело место повышение количества лейкоцитов от 15 000 до 20 000. Гипер-
леикоцитоз (свыше 20 000) установлен у 10,7% детей.
У остальных 14,5% детей количество лейкоцитов было
ниже нормы, хотя у половины из них оказались тяжелые
деструктивные формы аппендицита. Достоверных различии в числе лейкоцитов при различных формах острого
аппендицита нам установить не удалось.
При всех формах аппендицита в значительном проценте случаев имеет место увеличение количества лейкоцитов от 15 000 до 20 000 и даже выше, что является
* принтерным для детей младшего возраста. В зависимо-
| in от выраженности воспалительного процесса изменяется н лейкоцитарная формула. При осложненных
формулах аппендицита чаще всего наблюдается сдвиг
дсГихоцитарной формы влево, иногда до юных форм и
миелоцитов.
49
КЛИНИЧЕСКОЕ ТЕЧЕНИЕ
До последнего времени в литературе широко распространено мнение, что аппендицит у детей раннего возраста начинается внезапно (В. С. Панушкин, 1955;
Г. П. Маклецов, 1957; М. Л. Дмитриев и В. С. Топузов,
1966; Bertrand, 1959; Zaka, Nevole, 1961). Однако
тщательное изучение анамнеза у наших больных показало, что заболевание в данном возрасте, как правило, начинается постепенно (в 76% случаев). Дело в том, что
родители отмечают начало болезни лишь на высоте приступа, когда появляются такие, симптомы, как рвота,
гипертермия, резкое беспокойство. Но и в этих случаях
при дополнительном расспросе нередко удается выявить
начальные микросимптомы (недомогание, капризы, отказ от пищи, нарушение сна), которым не придавалось
значения.
Для дальнейшего течения острого аппендицита у детей первых лет жизни характерно бурное развитие
воспалительного процесса, характеризующегося быстротой наступающих деструктивных изменений в отростке
и поражением брюшины, даже при ретроцекальном или
тазовом расположении червеобразного отростка в патологический процесс чаще вовлекается вся брюшная
полость, т. е. возникает разлитой перитонит.
Другой особенностью аппендицита в раннем детском
возрасте является быстрое вовлечение в патологический
процесс ряда органов и систем. Это проявляется прежде
всего обменными нарушениями, которые особенно выражены у больных с осложненными формами аппендицита. Безусловно характер морфологических изменений
в брюшной полости окончательно выявляется лишь во
время операции. Однако очень важно уже до операции
решить вопрос о том, имеется ли в данном случае неосложненный аппендицит или следует предположить наличие тяжелых осложнений.
При деструктивных формах аппендицита, а
тем более при перитонитах, как правило, можно выявить
ряд клинических признаков, свидетельствующих о наличии токсикоза и эксикоза. Анамнестические данные (дли- i
тельность заболевания более суток, повторная рвота,
высокая температура, частый жидкий стул) указывают
на более тяжелое течение. При объективном исследовании в таких случаях выявляется сухость кожных покро-:
мов и слизистых, ребенок бледен, вял, пульс учащен,
кровяное давление снижено. Наряду с этим определи-
|<>тся разлитое напряжение передней брюшной стенки,
резкая болезненность при пальпации, симптомы раздражения брюшины. При наличии указанных клинических
симптомов возникает необходимость более точного определения характера и степени обменных нарушений, поскольку в этих случаях необходима тщательная предоперационная подготовка, имеющая целью коррекцию указанных расстройств.
ОСТРЫЙ АППЕНДИЦИТ У ДЕТЕЙ
ГРУДНОГО ВОЗРАСТА И НОВОРОЖДЕННЫХ
Как уже указывалось, острый аппендицит у детей
первого года жизни встречается крайне редко. Отечественные и зарубежные авторы располагают лишь единичными наблюдениями (У. А. Арипов, 1961; С. А. Ширшин,
1!)()2, Р. Н. Храмов, 1964; А. Ф. Дронов, 1966; Stauber,
Wurdisch, 1962; Freedel, 1964; Hofmann, Schmidt, 1972).
Сложность диагностики острого аппендицита у детей
лого возраста обусловливается в основном двумя факторами: редкостью заболевания и идентичностью клинических проявлений острого аппендицита и большинства
соматических заболеваний, сопровождающихся абдоминальным синдромом. При этих заболеваниях, как и при
остром аппендиците, обычно отмечаются высокая температура, многократная рвота и беспокойство ребенка,
нарушается стул. Трудности в диагностике связаны также п со сложностью обследования детей грудного возраста и выявления у них главных объективных признаком острого аппендицита.
Анамнезу в диагностике острого аппендицита у детей
иермого года жизни следует придавать особое значение,
поращая внимание на такие моменты, как начало проявления беспокойства ребенка, поведение ребенка во время
Ппдрствования и сна (сон, как правило, нарушен), отказ
пт приема пищи, характер и частоту рвоты, наличие
стула и т. д. Необходимо при этом помнить, что родители часто склонны преувеличивать выраженность тех или
иных симптомов и нередко связывают причину заболевании с погрешностями в диете.
Г)пльшинство авторов отмечают острое начало забо-
ichhiiiih. Ребенок становится беспокойным, часто плачет,
51
отказывается от еды, сучит ногами. Для начала заболевания характерна рвота, чаще многократная. Температура обычно повышается до 38—39°. Отмечается диспеп-
тический стул, но иногда возможны запоры.
В начальных стадиях заболевания такие важные
объективные симптомы, как болезненность в правой
подвздошной области и пассивное напряжение мышц
живота, выражены слабо. К тому же выявление этих
симптомов затрудняется беспокойством ребенка. При
исследовании живота нельзя получить правильное впечатление о степени и локализации болей, отличить активное напряжение и истинное пассивное напряжение
подчас бывает невозможно.
Чаще всего диагноз острого аппендицита в грудном
возрасте ставится поздно, только тогда, когда отмечается вздутие и напряжение живота, нарастают явления токсикоза и эксикоза, т. е. развиваются явные
признаки перитонита.
Поставить диагноз аппендицита на ранней стадии
заболевания помогает осмотр больного во время естественного и медикаментозного сна. Во время сна более
четко улавливается локальное пассивное мышечное
напряжение в правой подвздошной области даже при
поверхностной пальпации. При более глубокой пальпации правой подвздошной области ребенок кряхтит, отталкивает руку врача, очень легко пробуждается и
беспокоится.
За последние 20 лет мы наблюдали в клинике 11 случаев острого аппендицита у детей грудного возраста.
Все дети поступили в клинику поздно, в среднем на 3—
4-е сутки от начала заболевания. На операции у 75%
больных был выявлен гангренозно-перфоративный аппендицит с явлениями перитонита.
Приводим в качестве примера одно из наших наблюдений.
Олег К-, 9 мес, поступил в клинику на 4-е сутки от начала заболевания с диагнозом: инвагинация (?). Острый аппендш 'т (?).
Заболевание началось остро, с высокой температурой (до* 38,9°),
многократной рвотой. Ребенок стал беспокойным, капризным, отказывался от еды. Участковый врач поставил диагноз острого респираторного заболевания и назначил антибиотики (пенициллин и
стрептомицин). В последующие дни состояние не улучшалось, держалась высокая температура, повторялась несколько раз рвота, ребенок оставался периодически беспокойным, плохо спал, часто просыпался. На 3-й день заболевания присоединился частый жидкий
стул с прожилками крови.
52
Состояние ребенка при поступлении тяжелое. Температура 38, Г-
РгГкмюк бледный, вялый. Язык сухой, обложен. В легких дыхание
тчикулярное, хрипов нет. Тоны сердца несколько приглушены.
Пульс 128 уд/мин, удовлетворительного наполнения и напряжения.
Артериальное давление 75/40 мм рт. ст. Живот равномерно вздут,
и.! и ряжен. На пальпацию ребенок реагирует плачем, сопротивляется
«•смотру. Патологии не выявлено.
По катетеру в прямую кишку введено 15 мл теплого 3% pari нора хлоралгидрата. Спустя 20 мин проведено исследование ре-
гм'мка во сне. При поверхностной пальпации четко определяется пас-
' никое напряжение мышц передней брюшной стенки. На глубокую
пальпацию живота ребенок реагирует плачем, отталкивает руку
мрача. После предоперационной подготовки произведена операция.
Обнаружен гангренозно-перфоративный аппендицит, разлитой гнойный перитонит. Послеоперационное течение тяжелое. Выздоровление.
Аппендицит у новорожденных встречается
казуистически редко. Parsons с соавторами (1970) нашли в мировой литературе описание 31 случая аппендицита у новорожденных. До 1973 г. нами обнаружено
описание еще 9 случаев. Почти для всех описанных наблюдений характерно, что острый аппендицит обычно
обнаруживался уже во время оперативных вмешательств,
предпринятых по поводу другого заболевания (чаще
перитонита), или на аутопсии (Н. И. Поркшеян, 1950;
II. И. Пивень, 1962; Н. С. Керницкая, А. С. Буда, 1972;
Schinaberger, 1957; Firor, Myers, 1964; Schutze, 1972).
Исключительно редко диагноз острого аппендицита
у новорожденных ставится и до операции (Г. А. Баиров,
1963; Bartlett и др., 1970).
В нашей клинике с 1950 по 1973 г. по поводу острого
импеидицита было оперировано 3 детей периода ново-
рожденности (9, 14 и 21 дня). Во всех наблюдениях на
операции обнаружен гангренозно-перфоративный аппендицит с явлениями перитонита.
Клиническая картина в начальных стадиях заболевания у новорожденных и грудных детей во многом одинакова. Ребенок становится беспокойным, отказывается
от груди, значительно повышается температура (38—
3!)°). Возникает рвота, которая прогрессирует и содержит желчь. Живот вздут, напряжение брюшных мышц
иыражено во всех отделах. В дальнейшем отмечаются
также гиперемия и отечность брюшной стенки, нарастание явлений токсикоза и эксикоза, сухость языка, заостренные черты лица, западение большого родничка.
Симптомы раздражения брюшины и расхождение
кривых пульса и температуры в постановке диагноза
53
значения почти не имеют. Со стороны крови чаще отмечается выраженный лейкоцитоз, иногда до высоких
цифр, со сдвигом лейкоцитарной формулы влево.
В постановке диагноза помогает рентгенологическое
исследование брюшной полости. При этом нередко можно отметить уровни жидкости в тонком кишечнике, а при
перфорации отростка и свободный газ в брюшной полости.
Мальчик в возрасте 21 дня доставлен в клинику на 3-й день болезни с диагнозом: кишечная непроходимость (?). Заболел остро,
когда заметно ухудшилось общее состояние. Ребенок стал беспокойным, плохо спал, отказывался от груди. Температура повысилась до
38,Зр, была дважды рвота и три раза жидкий стул. В последующие
дни ребенок оставался периодически беспокойным, плохо спал. Температура оставалась повышенной (в пределах 37,6—37,8°), ребенок
плохо брал грудь. Повторялась несколько раз рвота, появилось
вздутие живота. Стула в течение двух последних дней не было.
Состояние ребенка при поступлении довольно тяжелое, бледноват. Температура 37,8°. Язык обложен, суховат, большой родничок
запавший. Тоны сердца звучные. Пульс 140 уд/мин, удовлетворительного наполнения. Живот равномерно вздут, напряжен во всех
отделах. Отмечается умеренная отечность передней брюшной стенки. При пальпации живота ребенок становится беспокойным, плачет. Перистальтика кишечника вялая.
При исследовании крови выявлен лейкоцитоз (21 000), нейтро-
филез с умеренным сдвигом влево. РОЭ 24 мм в час. После очистительной клизмы получен нормальный стул, отошли газы. На обзорном снимке брюшной и грудной полостей, произведенном в вертикальном положении, в брюшной полости под диафрагмой обнаружено небольшое количество свободного газа. Петли тонкой кишки
умеренно вздуты, имеются единичные уровни жидкости. Поставлен
предположительный диагноз: перфорация толстой кишки, перитонит. После предоперационной подготовки ребенок был оперирован,
обнаружен гангренозно-перфоративный аппендицит, перитонит.
Послеоперационное течение тяжелое. Выздоровление.
Глава IV
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Вопросы дифференциальной диагностики острого
аппендицита у детей до 3 лет являются особенно актуальными, поскольку целый ряд заболеваний начинается
с. повышения температуры, болей в животе и рвоты,
т. е. симптомов, характерных и для острого аппендицита.
По данным многих авторов, острый аппендицит у
старших детей приходится дифференцировать с аскаридозом, гриппом, заболеваниями моче-половой системы,
инфекционными заболеваниями (эпидемический гепатит,
дизентерия, корь, брюшной тиф, эпидемический паротит),
инфекционно-аллергическими заболеваниями (ревматизм, атромбопеническая пурпура) и пр. Однако ни в
отечественной, ни в зарубежной литературе мы не встретили работ, специально посвященных дифференциальной
диагностике аппендицита у детей первых лет жизни.
Трудность обследования маленького ребенка может
привести к двум противоположным диагностическим
ошибкам: 1) за острый аппендицит принимается какое-
либо другое заболевание, при этом в отдельных случаях
клиническое течение настолько напоминает острый аппендицит, что производится ненужная операция; 2) острый аппендицит принимается за другое заболевание, и
липендэктомия производится с опозданием, в сильно
мл пущенных случаях.
Подтверждением изложенного является тот факт, что
мл период с 1959 по 1968 г. в приемное отделение клиники было доставлено 2500 детей в возрасте до 3 лет с
подозрением на острый аппендицит. Из них оперировано
лишь 14,6%. Ошибки в диагнозе при направлении установлены у 2132 детей (табл. 6). Из 368 больных, которые
были оперированы, диагноз гистологически подтвержден
v 330. Следовательно, ошибки в диагностике были допущены у 2170 больных (86,8%). Это в 2—3 раза превышает процент диагностических ошибок при аппендиците
V старших детей (по данным В. И. Киселева, 32%).
Как видно из табл. 6, дифференциальную диагностику у детей раннего возраста приходится проводить с
55
Таблица 6
Заболевания, при которых ошибочно диагностирован
острый аппендицит
Наименование заболевания
В % от общего
количества
больных
Острые респираторные заболевания
27,0
Копростаз
16,1
Желудочно-кишечные заболевания
9,5
Отит
8,2
Пневмония
6,2
Ангина
3,6
Инфекционные заболевания
0,8
Диплококковый перитонит
0,5
Заболевания моче-половой системы
0,4
Мезаденит
0,3
Заболевания печени и желчного пузыря
0,2
Инвагинация
0,05
Прочие заболевания
27,2
целым рядом терапевтических заболеваний. Чаще всего
за острый аппендицит принимаются острые респираторные заболевания, копростаз, желудочно-кишечные заболевания, отит, пневмония и ангина. Все инфекционные
заболевания составляют лишь 0,8% от общего числа
диагностических ошибок, что в несколько раз меньше,
чем у детей старшего возраста. Это связано, во-первых,
с тем, что инфекционные заболевания у детей раннего
возраста встречаются значительно реже, чем в старшем
возрасте, и, во-вторых, они имеют более выраженные
клинические проявления, что облегчает диагностику.
Еще меньший процент составляют заболевания мочеполовой системы (0,4) и болезни печени и желчного
пузыря (0,2), что также можно объяснить их редкостью
в этом возрасте.
В отдельную группу нами выделены заболевания,
при которых диагноз острого аппендицита был снят и
поставлены лишь предположительные диагнозы, в достоверности которых можно сомневаться (кишечная колика,
аскаридоз, дискинезии желудочно-кишечного тракта
и др.). Указанная категория больных составила по отношению к больным с другими заболеваниями 27,2%. Это
означает, что более чем у 4Д больных, направленных в
56
клинику с острым аппендицитом, диагноз не был подтвержден и эти больные направлены в терапевтические
отделения стационара пли поликлиники для обследования и уточнения диагноза.
Представляет интерес тот факт, что среди больных
этой категории детей до 1 года было 11,4%, от 1 года до
2 лет — 23,7%, от 2 до 3 лет—32,3%. Это указывает,
что определенная настороженность при заболевании
грудных детей и в связи с этим их тщательное обследо-
мание с привлечением смежных специалистов (педиатр,
отоларинголог) дают возможность чаще всего уточнить
истинный характер заболевания.
Остановимся более подробно на дифференциальной
диагностике при некоторых патологических состояниях.
Острые респираторные заболевания —
это довольно большая, этиологически неоднородная
группа заболеваний, которая особенно часто поражает
детей раннего возраста. В настоящее время выделены
следующие самостоятельные формы: аденовирусная,
парагриппозная, риновирусная, синцитиально-вирусная
инфекция. К числу гриппоподобных относят энтеровирусы (Коксаки и ECHO). Особенно высока восприимчивость к этим инфекциям детей в возрасте от 6 мес до
3 лет.
По данным С. Д. Носова (1966), за последние 5 лет в Москве
показатель заболеваемости острыми респираторными инфекциями
детей в первые три года жизни был в 3—4 раза выше, чем среди
школьников, и в 6—8 раз выше, чем среди взрослого населения.
Установлено, что в организованных детских коллективах каждый
ребенок ежегодно болеет несколько раз (5—10 раз и более) различными катарами верхних дыхательных путей (Н. П. Тривус, 1966).
В связи с этим не случайно острые респираторные
заболевания занимают первое место среди заболеваний,
послуживших поводом к ошибочной диагностике острого
аппендицита у детей до 3 лет. Чаще всего причиной,
приведшей к ошибочному направлению детей в клинику,
служило наличие в аламнезе абдоминального синдрома,
т. е. триады симптомов, характерных и для острого аппендицита (боли в животе, рвота, повышение температуры). Для острых респираторных инфекций типичным
является острое начало заболевания. Весьма характерен
п внешний вид больного: одутловатость лица, бледность,
вялость, сонливость, отсутствие интереса к окружающему. К наиболее постоянным симптомам относятся ринит
с серозно-слизистым отделяемым, гиперемия и разрых-
57
ленность зева, конъюнктивит и нередко отек век. На
первый план выступают явления интоксикации и нарушения общего состояния.
Острый аппендицит в этом возрасте начинается менее
остро, симптомы интоксикации вначале не выражены и
выявляются, как правило, при наличии осложненных
форм.
Решающим при постановке диагноза наряду с указанными выше признаками являются данные осмотра и
обследования ребенка. С практической точки зрения
очень важно подчеркнуть, что нарушение общего состояния и наличие интоксикации при острых респираторных
заболеваниях не соответствуют выраженности локальных симптомов со стороны живота. Болезненность при
пальпации в правой подвздошной области и пассивное
напряжение в этих случаях отсутствуют.
Диагностические ошибки связаны с трудностями, возникающими при обследовании ребенка: зачастую активное напряжение мышц принимается за defense musculai-
ге. В случаях, когда удается войти в контакт с ребенком,
болезненность при пальпации выявляется чаще в области
пупка или по всему животу. Пассивного же напряжения
и болезненности при пальпации в правой подвздошной
области не наблюдается.
Наиболее надежным методом, позволяющим установить отсутствие указанных симптомов при острых респираторных заболеваниях, является осмотр ребенка после
клизмы с хлоралгидратом.
Таня Б., 2 лет 1 мес, поступила в приемное отделение клиники через 10 ч от начала заболевания с диагнозом острого аппендицита. Заболевание началось остро, с повышения температуры до
38,4°, однократной рвоты, болей в животе, беспокойства. Стул и
мочеиспускание в норме. Состояние при поступлении довольно тяжелое, температура 38,8°, лейкоцитоз 13 400. Кожные покровы без сыпи. Зев гиперемирован, миндалины разрыхлены. Живот несколько
вздут, напряжен, болезнен в правой подвздошной области. Симптом
Щеткина неясный. Сделана хлоралгидратовая клизма (20 мл 3%
раствора). При осмотре во сне живот мягкий, доступный пальпации
во всех отделах, мышечного напряжения нет. Диагноз острого аппендицита был снят. Ребенок консультирован педиатром. С диагнозом острой респираторной инфекции девочка госпитализирована в
боксированное отделение.
Копростаз, задержка стула, нередко встречается
в детском возрасте и составляет 10% всех заболеваний,
ошибочно принятых за острый аппендицит (А. И. Ле-
нюшкин и др., 1964). У детей раннего возраста копростаз
58
встречается значительно чаще (по нашим данным, в
16,1%), занимая второе место по частоте среди всех
диагностических ошибок.
Задержка стула сопровождается болями в животе,
вызывает беспокойство ребенка, однако общее состояние,
как правило, не страдает и остается удовлетворительным. Лишь в очень запущенных случаях могут быть выражены явления каловой интоксикации. Повышение
температуры при копростазе наблюдается в редких случаях (по нашим данным, в 6%, в пределах 37,3—37,6°).
Количество лейкоцитов, как правило, бывает нормальным, и лишь в единичных наблюдениях удается отметить
значительный лейкоцитоз (до 12 000—15 000).
При исследовании ребенка зачастую можно наблюдать некоторое вздутие живота и разлитую болезненность с большей локализацией в левой подвздошной
области, у некоторых больных отмечается и активное
напряжение мышц передней брюшной стенки.
При подозрении на копростаз решающее значение
для установления правильного диагноза имеет очистительная клизма, которая, применялась нами во всех случаях, когда в анамнезе отмечается задержка стула в
течение суток и более. Если имеет место копростаз, то
после очистительной клизмы удается получить обильный
стул; боли уменьшаются или совсем исчезают, а живот
становится мягким, безболезненным, доступным пальпации во всех отделах.
Игорь М., 2 лет 3 мес, поступил в приемное отделение клиники
<■ подозрением на острый аппендицит. Болен около суток. Ребенок
периодически беспокоен, сучит ногами, жалуется на боли в животе.
Была однократная рвота. Температура 37,2°. Стула не было в течение 3 сут. Лейкоцитоз 10 100. Состояние при поступлении удовлет-
иорительное. Живот равномерно вздут, болезнен во всех отделах.
Симптом Щеткина неясный. Сделана очистительная клизма — получен обильный стул, отошли газы. Живот стал мягким, безболезненным во всех отделах. Ребенок отправлен домой с диагнозом:
копростаз.
Следовательно, в этой ситуации очистительная клизма имеет не только диагностическое, но и лечебное значение. В тех случаях, когда после очистительной клизмы
метаются сомнения в отношении острого аппендицита,
необходимо прибегнуть к хлоралгидратовой клизме.
Ж е л у д о ч н о-к ишечныезаболевания. В раннем детском возрасте довольно часто встречаются диспепсии и гастроэнтероколиты. В этих случаях нередко
59
возникает подозрение на острый аппендицит, поскольку
наблюдаются рвота, боли в животе и повышение температуры. По нашим наблюдениям, желудочно-кишечные
заболевания имитировали картину острого аппендицита
в 9,5% случаев.
При дифференциальной диагностике следует иметь в
виду, что общее состояние в случаях желудочно-кишечного заболевания, как правило, тяжелое. Выражены
явления токсикоза и эксикоза уже в первые часы болезни. Рвота многократная, нередко неукротимая, затем
присоединяется жидкий стул с примесыо слизи. Нередко
в анамнезе выявляются погрешности в диете.
Для острого аппендицита характерна рефлекторная :
рвота не более 3—5 раз. Интоксикация, эксикоз, частый I
жидкий стул могут наблюдаться и при аппендиците в ^
особо тяжелых, осложненных случаях, когда при объек—;
тивном исследовании выявляется наличие локальной ]
болезненности и пассивное напряжение брюшной стенки. I
Обычно подобная клиническая симптоматика при остром I
аппендиците отмечается в более поздние сроки заболе-J
вания.
Таким образом, при диспепсии и энтероколитах так-:
же отмечается расхождение между общей тяжестью со-:
стояния и отсутствием локальных симптомов воспаления:
органов брюшной полости.
Отит — частое заболевание в раннем детском возрасте, особенно среди грудных детей. Этому способству-1
ют физиологические и анатомические особенности орга-1
низма маленького ребенка: короткая и широкая глоточ-
но-барабанная труба, частые нарушения нормального;
носового дыхания вследствие разрастания лимфатического аппарата носоглотки, частые срыгивания — все это ;
приводит к проникновению инфекции в барабанную по-i
лость (А. В. Болотов, 1960; С. И. Вульфсон, 1961; 1
Т. Даугирдас, 1963; Н. И. Кабанец, 1964). !
Клиническая картина отита некоторыми проявления-j
ми сходна с острым аппендицитом у детей первых лет1
жизни: обычно ребенок становится беспокойным, кап-J
ризным, отказывается от груди, сучит ногами, повышает- ’
ся температура (до 38° и выше), присоединяется одно-,<
двукратная рвота. Дети этого возраста обычно не могут
указать локализацию боли, в связи с чем у врача при
первичном осмотре ребенка создается впечатление о
наличии катастрофы со стороны брюшной полости.
60
Диагностические ошибки возникают тем чаще, чем
меньше возраст ребенка. Так, из больных, направленных
с диагнозом острого аппендицита, при обследовании
совместно с педиатром и оториноларингологом у 8,2%
выявлен острый отит (одно- и двусторонний), причем из
них до 1 года — у 102, от 1 года до 2 лет — у 39, от 2 до
3 лет — у 17.
При всем сходстве общих симптомов у больного острым отитом можно отметить некоторые признаки, характерные для этого заболевания: дети становятся беспокойными, особенно ночью, вздрагивают во сне, часто
просыпаются, крутят головой. Важно то, что при пальпации живот у этих детей мягкий, безболезненный во
всех отделах. Пассивного напряжения и локальной болезненности, как правило, не наблюдается. В то же
время надавливание на козелок вызывает боль, что выражается резким усилением беспокойства и плачем.
Алеша Р., 1 года 2 мес, поступил в клинику с диагнозом острого аппендицита. Болен 2-е сутки. Из анамнеза установлено, что
заболевание началось довольно остро, с повышения температуры до
38,5°, двукратной рвоты. Ночь провел беспокойно, часто просыпался,
плакал, сучил ногами. При осмотре в приемном отделении состояние ребенка средней тяжести. Температура 38,2°. Мальчик периодически становится беспокойным, вскрикивает, крутит головой. При
исследовании живот мягкий, безболезненный во всех отделах. Мышечного напряжения и симптомов раздражения брюшины не выявлено. При надавливании на козелки ушей ребенок вскрикивает, сучит ногами. Больной осмотрен отоларингологом, поставлен диагноз:
двусторонний гнойный отит.
В некоторых случаях даже при подтвержденном диагнозе отита невозможно полностью исключить острый
аппендицит из-за беспокойства ребенка и сложности
дифференцирования характера мышечного напряжения.
В этой ситуации показан осмотр ребенка во время медикаментозного сна, вызванного введением хлоралгидрата.
Пневмония. Трудности дифференциальной диагностики пневмонии с острым аппендицитом обусловлены
тем, что при воспалительном процессе в легких отмечается болезненность в правой подвздошной области и
даже напряжение мышц живота. Это связано с раздражением межреберных нервов, ветви которых участвуют
в иннервации диафрагмы, а также кожи и мышц живота.
В большинстве случаев правильный диагноз можно
установить лишь при динамическом наблюдении. По
нашим данным, пневмония выявляется у 6,2% на-
61
правляемых с подозрением на острый аппендицит.
Наиболее важными моментами, позволяющими дифференцировать эти заболевания, являются следующие:
при пневмонии обращает на себя внимание вид больного
ребенка — он обычно спокоен, выражена одышка, отмечаются раздувание крыльев носа и цианоз носо-губного
треугольника. Общее состояние довольно тяжелое. Вместе с тем мышечное напряжение брюшной стенки непостоянно и при отвлечении внимания, а также после
введения хлоралгидрата полностью исчезает. При объективном исследовании часто удается выявить ослабление
дыхания на стороне поражения, иногда прослушиваются
влажные хрипы. Установить диагноз пневмонии помогают также данные рентгенологического исследования.
Все указанные особенности в течении пневмонии дают возможность при дифференциальной диагностике с
острым аппендицитом поставить правильный диагноз.
Игорь П., 1 года 10 мес, доставлен в приемное отделение клиники через 23 ч от начала заболевания с диагнозом острого аппендицита. Заболевание началось довольно внезапно с повышения температуры до 38,5°. Выражена одышка. В легких жесткое дыхание,
прослушиваются единичные влажные хрипы. Язык влажный, обложен беловатым налетом. Ребенок сопротивляется осмотру, плачет,
напрягает живот, выявить локализацию болезненности не удается.
Ребенку сделана хлоралгидратовая клизма. При осмотре во сне
живот мягкий, доступный пальпации, мышечного напряжения и
болезненности выявить не удалось. Диагноз острого аппендицита
был снят и ребенок госпитализирован в терапевтическое отделение
для лечения по поводу пневмонии.
Ранее, до применения хлоралгидрата, не всегда удавалось отдифференцировать активную мышечную защиту от пассивного напряжения (defense musculaire), что
иногда приводило к диагностической ошибке.
Боря В., 2 лет 4 мес, поступил в приемное отделение клиники
через 18 ч от начала заболевания. Родители отметили, что ребенок
стал беспокойным, повысилась температура до 38,9°, дважды была
рвота. Мальчик пожаловался на боли в животе. Стул и мочеиспускание без отклонений от нормы. Состояние при поступлении средней тяжести, температура 38,3°. Отмечается небольшая гиперемия
лица, в легких жестковатое дыхание, хрипов нет. Пульс 132 уд/мин,
удовлетворительного наполнения. Мальчик беспокоен, сопротивляется осмотру. Живот резко напряженный и болезненный во всех отделах. Симптом Щеткина трудно определить из-за беспокойства
ребенка. Лейкоцитоз 24 000. На операции червеобразный отросток
оказался без воспалительных явлений, произведена аппендэктомия.
На 2-е сутки после операции клинически и рентгенологически выявлена пневмония.
62
При применении хлоралгидратовой клизмы подобных
диагностических ошибок не отмечается.
Вместе с тем мы хотели бы подчеркнуть, что наличие
пневмонии не исключает абсолютно диагноза острого
аппендицита: в клинике оперированы 13 больных, у которых эти заболевания были диагностированы одновременно. Определить показания к операции в этих случаях
особенно трудно, поскольку врач, уверенный в наличии
пневмонии, не думает об остром аппендиците и может
неправильно оценить некоторые симптомы. У большинства наблюдавшихся нами больных только длительное
динамическое наблюдение ряда специалистов (хирурга,
педиатра и рентгенолога) дало возможность выбрать
правильную тактику.
В последнее время применение клизмы с хлоралгидратом позволило значительно сократить сроки наблюдения, поскольку выявление defense musculaire, локальной
болезненности и симптомов раздражения брюшины служило показанием к срочной операции.
Вова К-, 2 лет 7 мес, поступил в приемное отделение клиники
с диагнозом острого аппендицита. Болен 4-е сутки. Заболевание началось с повышения температуры до 38,2°, трехкратной рвоты, беспокойства. В последующие дни температура держалась на высоких
цифрах, периодически жаловался на боли в животе, рвота повторялась еще три раза. Стул все время оставался нормальным. При поступлении состояние тяжелое. Температура 39,3°, ребенок бледный,
вялый, выражены явления токсикоза. Дыхание кряхтящее, отмечается одышка (44 дыхания в минуту) и цианоз носо-губного треугольника. В легких жестковатое дыхание, прослушиваются сухие
и влажные хрипы. Тоны сердца приглушены. Пульс 134 уд/мин,
удовлетворительного наполнения. Живот умеренно вздут, при попытке пальпации ребенок сопротивляется осмотру, напрягает брюшную стенку. При исследовании per rectum патологии обнаружено не
было. При рентгеноскопии грудной клетки выявлена двусторонняя
пневмония. Сделана хлоралгидратовая клизма.
При осмотре во сне отчетливо определяется напряжение мышц
всего живота. При постепенном углублении пальпации в правой
подвздошной области мальчик стонет, просыпается. Выражен симптом Щеткина. Ребенок был оперирован: обнаружены гангренозноперфоративный аппендицит и разлитой гнойный перитонит. Послеоперационное течение тяжелое. Выздоровление.
Таким образом, случаи сочетания острого аппендицита и пневмонии являются хотя и редкими, но представляют наибольшую трудность в диагностическом отношении. Эти больные поступают в поздние сроки от начала
заболевания с запущенными формами аппендицита, как
правило, осложненного перитонитом.
63
Ангина. Дифференциальную диагностику между
острым аппендицитом и ангиной приходится проводить
реже, чем с указанными выше заболеваниями (острые
респираторные заболевания, копростаз, желудочно-кишечные заболевания, пневмония), хотя ангины у детей
первых трех лет жизни стоят по частоте на втором месте,
уступая лишь острым респираторным заболеваниям
(В. И. Смоликова, 1964). Между ангинами и острым
аппендицитом издавна установлена связь. Как червеобразный отросток, так и миндалины богаты лимфоидной
тканью. В литературе описаны случаи, когда воспалительный процесс в миндалинах (ангина) является причиной возникновения острого аппендицита.
И. В. Давыдовский высказал предположение о сходстве патогенеза ангины и острого аппендицита.
Ангина у детей грудного возраста является довольно
редким заболеванием, и некоторые авторы (Н. И. Нисе-
вич, 1961) объясняют это возрастной особенностью
строения небных миндалин (слабое развитие лимфоидной ткани, отсутствие крипт). Начало заболевания при
ангинах, как правило, острое. Внезапно повышается
температура до 38—39°. Дети становятся вялыми, беспокойными, капризными. Они отказываются от еды, что
объясняется болью при глотании и общим тяжелым состоянием. Однако у маленьких детей жалобы на боли
при глотании отсутствуют, а наличие общих симптомов,
вызывает подозрение на острый аппендицит, поскольку !
нередко выявляется негативная реакцией на пальпацию I
живота. Ангина была диагностирована у 3,6% больных, !
направленных с подозрением на острый аппендицит.
Следует подчеркнуть, что всегда при подозрении на
острый аппендицит необходимо тщательно исследовать^
состояние полости рта и зева. Это позволяет при ангине
обнаружить гиперемию, отечность дужек, разрыхлен- i
ность миндалин и наличие наложений. Преобладание
этих признаков над локальными симптомами со стороны
живота позволяет исключить острый аппендицит.
Прочие заболевания. Прочие заболевания со- ;
ставляют довольно значительный процент (27,2) от всех
других диагностических ошибок, регистрируемых в клинике. Учитывая последние работы (М. А. Бачевская,
1969; И. В. Казанская, 1970; Т. П. Кашина, 1971; Hof- ■
mann, Schmidt, 1972), можно с уверенностью сказать, j
что треть так называемых прочих заболеваний относится |
64
к нераспознанной патойогии мочевыводящих путей. При
этом пороки развития этой системы у детей раннего возраста, по-видимому, являются основной причиной возникновения неясных болей в животе. В этом отношении
представляют интерес данные Campbell (1951), согласно
которым врожденные дефекты органов моче-половой системы встречаются чаще аномалий других систем организма ребенка и составляют 35—40% анатомических
пороков эмбрионального развития. Современный уровень
диагностических нефро-урологических исследований (инфузионная урография, цистография, скеннирование почек и др.) позволяет выявить эту патологию даже у
детей раннего возраста и избежать неоправданного оперативного вмешательства. В настоящее время в сомнительных случаях, если позволяет состояние ребенка,
указанные выше исследования проводим в срочном
порядке.
В этой группе встретились такие инфекционные заболевания, как корь, скарлатина, ветряная оспа, паротит. По-видимому, в самом начале детских инфекционных заболеваний (продрома) могут отмечаться боли в
животе, симулирующие картину острого аппендицита.
В целях их исключения показан тщательный осмотр
кожных покровов, слизистых. При удовлетворительном
общем состоянии ребенка, отсутствии явлений токсикоза
и нарастающих воспалительных явлений со стороны
живота необходимо динамическое наблюдение хирурга
п педиатра в боксе. Что касается дифференциальной
диагностики с такими заболеваниями, как диплококко-
вый перитонит (0,55% случаев), мезаденит, инвагинация
кишечника (0,05%), то, за исключением случаев инвагинации, установить точно диагноз на основании клинической картины до операции чрезвычайно трудно. При
наличии данных за инвагинацию и в случаях диплокок-
кового перитонита и мезаденита, когда выявляются
пассивное мышечное напряжение и симптомы раздражения брюшины, необходимо оперативное вмешательство.
В заключение необходимо отметить, что дифференциальную диагностику при подозрении на острый аппендицит чаще всего приходится проводить с такими заболеваниями, как острые респираторные инфекции, копростаз,
желудочно-кишечные заболевания, отит, пневмония,
пороки развития мочевыводящей системы.
;; 744
65
В отличие от аппендицита во всех указанных
случаях отмечается преобладание общих симптомов и
отсутствие признаков воспаления органов брюшной
полости — пассивного мышечного напряжения и локальной болезненности.
Другим важным условием установления правильного
диагноза является целесообразность консультации смежных специалистов (педиатра, отоларинголога, рентгенолога). Ошибочные диагнозы зависят, с одной стороны,
от недостаточной подготовки практических врачей в
вопросах вариантов клинического течения острого
аппендицита и в связи с этим неумения правильно оценить данные анамнеза и объективного исследования, с
другой — от трудностей диагностики этого заболевания'
у детей, особенно раннего и младшего возраста.
Диагноз должен не ставиться, а строиться на основании имеющихся фактов и сведений, с тем чтобы каждо|
му симптому найти место и объяснение в определяемой
картине заболевания. |
В сомнительных случаях вопрос об оперативном!
вмешательстве может быть решен двояко. Выжидатель-1
ная тактика возможна лишь в условиях детского хирург
гического стационара, если состояние ребенка нетяжелое!
нет признаков эксикоза и токсикоза и не нара|
стают, а уменьшаются локальные симптомы со сторонь|
живота. я
В случаях же, не объяснимых с точки зрения симпто|
матического заболевания, ухудшения состояния, нара!
стания токсикоза и эксикоза, повторной рвоты, высокощ
температуры и пусть даже сомнительных локальный
признаков со стороны живота показано оперативной
вмешательство с обязательной предоперационной гтодго|
товкой. Предоперационную подготовку следует прово|
дить не только с целью создания максимально благо-(
приятных условий для выполнения операции, но и для
установления окончательного диагноза. Так как провоп
димая предоперационная подготовка нередко снимает
общие симптомы, на первый план выступают локальные:
симптомы, наиболее четко отражающие истинный харак-;
тер заболевания. В этих случаях при тяжелых состояниях больных более оправдано проведение оперативного
вмешательства, чем длительная выжидательная тактика.
Именно к этой группе тяжелых больных следует приме-,
нять формулу «сомневаешься—оперируй». ь
Глава V
ЛЕЧЕНИЕ
Тактика лечения острого аппендицита менялась на
протяжении истории в зависимости от взглядов на сущность патологического процесса.
В 30-х годах XIX века француз Dupuytren (1833) и немецкий
хирург Albers (1838) создали учение о воспалении слепой кишки как
первоисточнике возникновения гнойников в правой подвздошной области. Для обозначения болезни были предложены термины «тифлит», «пери-» и «паратифлит».
Основное место в лечении занимал консервативный метод (покой, местное применение холода, опий внутрь). Разрез допускался
лишь при наличии флюктуации. Летальность взрослых составляла
26—30% (Fitz, 1886), детей — 70% (Matterstock, 1880).
Наряду с этим уже в 1827 г. Melier подчеркнул возможность
связи плео-цекальных абсцессов с воспалением аппендикса. Он обнаружил на секции прободение червеобразного отростка у ребенка
4 лет и высказался за оперативное лечение. Ф. Е. Мокрицкий
(1875) привел случай смерти ребенка 3 лет от перитонита в результате прободения червеобразного отростка.
К концу XIX века анализ значительного патологоанатомического материала позволил признать ведущую роль червеобразного отростка в происхождении воспалительных заболеваний правой подвздошной области (Fitz, 1886; McBurney, 1891; Г. И. Турнер, 1892;
А. А. Бобров, 1896).
До недавнего времени считалось, что первые операции удаления
червеобразного отростка были произведены в 1884 г. Mahomed (в
Лондоне) и Kronlein (в Цюрихе). Однако в 1953 г. Creese обнаружил в трудах Claudius (1736) сообщение о том, что еще в 1735 г.
он оперировал 11-летнего мальчика по поводу мошоночной грыжи.
Содержимым грыжевого мешка оказался перфорированный червеобразный отросток. Были выполнены аппендэктомия и грыжесечение
с благоприятным исходом. В России первую аппендэктомию у ребенка 3 лет произвел К. Л. Домбровский в 1887 г.
Об успешном оперативном вмешательстве по поводу острого
аппендицита у детей раннего возраста сообщил Howland (1904).
Автор описал два случая аппендэктомии у детей 1 года 9 мес и
1 года 10 мес. После предпринятой операции наступило выздоровление.
Среди отечественных хирургов большой вклад в учение об остром аппендиците у детей внесен Т. П. Красно-
баевым. Он одним из первых стал на позиции раннего
оперативного лечения при данном заболевании в детском возрасте. Официальное признание эта тактика
получила на состоявшейся в 1934 г. в Ленинграде кон¬
з*
G7
ференции, посвященной вопросам лечения острого
аппендицита. Если до этого времени оставался дискута-
бельным вопрос о преимуществе консервативного и оперативного лечения аппендицита у детей, то на этой
конференции после доклада Т. П. Краснобаева было
решено, что лишь наличие плотного инфильтрата при
нормальной или субфебрильной температуре является
противопоказанием к оперативному вмешательству. Во
всех остальных случаях по установлении диагноза показана срочная операция. Такая тактика привела вскоре
к резкому снижению летальности у взрослых и
детей. Однако если у взрослых летальность снизилась
до 1,8% (Ю. Ю. Джанелидзе, 1939), то среди детей
она составляла в этот период 14% (Т. П. Краснобаев,
1935).
В связи с этим в последующие годы вопросам лечения острого аппендицита уделяется все больше внимания
(М. И. Кокочашвили, 1956; Л. В. Прокопова, 1960;
А. И. Ленюшкин, 1960, 1961; С. Я. Долецкий и М. М.
Кучегурова, 1962; Allen, 1942; Scott, Ware, 1945; Deaver,
1952).
Ранняя диагностика, неотложная операция, а также
применение антибиотиков в послеоперационном периоде
позволили снизить летальность от острого аппендицита у
детей старшего возраста до 0,3% (С. Д. Терновский,
1958; С. Я. Долецкий, 1960). Однако трудности диагностики, «злокачественное» течение аппендицита у детей
первых лет жизни приводят к тому, что в этом возрасте
летальность еще остается очень высокой (по данным
А. И. Ленюшкина с соавторами, почти в 60 раз выше,
чем у старших детей).
Особую сложность представляет лечение аппендицита, осложненного перитонитом, который у детей до 3 лет
встречается более чем в половине случаев. Так, из 330
оперированных детей у 50,1% оказался гангренозно-перфоративный аппендицит с явлениями перитонита, причем у 82,2% этих больных был выявлен разлитой гнойный перитонит.
Как указывалось выше, преобладание деструктивных
и осложненных форм аппендицита обусловлено возрастными анатомо-физиологическими особенностями червеобразного отростка, сальника и брюшины, а также запоздалой диагностикой с поздним поступлением детей в
стационар.
Одной из важных особенностей в развитии острого
аппендицита у детей раннего возраста является недостаточная способность к ограничению воспалительного процесса в брюшной полости, в связи с чем очень редко
образуются аппендикулярные инфильтраты (по нашим
данным, лишь в 7%). При этом следует отметить, что
если и происходит отграничение воспалительного процесса, то при диагностике инфильтрат бывает, как правило, «горячим» в стадии абсцедирования, так как дети
обычно поступают в поздние сроки от начала заболевания (после 3—4 суток). Из анамнеза удается выявить
чаще постепенное нарастание симптомов заболевания.
Повышается температура, нарастают явления токсикоза
и эксикоза, учащается рвота, нередко присоединяется
жидкий стул. Постоянным симптомом являются беспокойство ребенка, нарушение сна.
Локально, как правило, удается определить местный
дефанс и резкую болезненность. Четко отграниченный
инфильтрат, определяемый при пальпации через брюшную стенку или пальцевом исследовании через прямую
кишку, удается выявить в 15%. Консервативная тактика
у детей раннего возраста представляет значительную
опасность и не должна применяться ввиду возможного
прорыва абсцедирующего инфильтрата в свободную
брюшную полость. В связи с этим у детей этого возраста
инфильтраты следует рассматривать как отграниченные
абсцессы, требующие оперативного вмешательства.
В происхождении осложненных форм аппендицита
наряду с указанными выше факторами определенное
значение имеет необоснованное применение антибиотиков до установления диагноза (по поводу предполагавшегося терапевтического заболевания). Антибиотики в
большинстве случаев не только не предупреждают развития деструктивного процесса в отростке, но, наоборот,
снижают местную защитную реакцию. Вместе с тем
антибиотики нивелируют такие клинические проявления,
как болевой синдром, пассивное напряжение, температуру.
Тактика лечения при неосложненных формах аппендицита в раннем возрасте практически не отличается от
таковой у более старших детей. В тех случаях, когда
общее состояние больных удовлетворительное, отсутствуют признаки токсикоза и эксикоза, а при объективном
исследовании выявляются болезненность и пассивное нага
пряжение только в правой подвздошной области, нет
оснований думать об осложненной форме аппендицита.
Оперативное вмешательство у этих больных должно
быть произведено сразу же при поступлении ребенка в
стационар.
Принципиально отличается тактика при остром аппендиците, осложненном перитонитом. Наличие перитонита очень важно заподозрить еще до операции. Нередко у больных этой группы в анамнезе отмечается повторная рвота, высокая температура, частый жидкий стул.
При осмотре выявляется сухость кожных покровов и
слизистых, частый малый пульс. При пальпации брюшной стенки обнаруживаются разлитое напряжение, бо-;
лезненность по всему животу и симптомы раздражения]
брюшины. I
Предполагать наличие перитонита важно главным!
образом потому, что у маленьких детей в воспалитель-1
ный процесс быстро вовлекается целый ряд органов!
и систем. Это приводит к резким нарушениям обмена,!
что оказывает существенное влияние на исход забо-|
левания. |
В начальных стадиях перитонита создается впечатление, что общее состояние ребенка не внушает особого^
опасения и нередко расценивается как удовлетворитель^
ное, несмотря на выраженный местный воспалительный'!
процесс. Это объясняется большими компенсаторными]
возможностями детского организма, главным образом]
сердечно-сосудистой системы. Тем не менее, несмотря на j
кажущееся благополучие, в организме ребенка возника-j:
ет ряд значительных патофизиологических нарушений.
ПАТОФИЗИОЛОГИЯ ПЕРИТОНИТА
Дегидратация, расстройства циркуляции
Необходимо прежде всего учесть, что поверхность
брюшины у детей первых лет жизни относительно больше, чем у взрослых, и равняется площади поверхности кожи. В начальных стадиях перитонита всасывание из брюшной полости повышено, что зависит от
обезвоживания ребенка и увеличения внутрибрюшного
давления из-за скопления в брюшной полости гнойного
выпота. Вследствие этого происходит огромное всасыва-
70
нйе в кровь и лимфу бактериальных токсинов й продуктов распада микробных тел. Обладая протеолитическим
действием, эти вещества вызывают распад белка и выделение большого количества гистамина и гистаминоподобных веществ. Увеличивая проницаемость сосудистой стенки и обладая сосудорасширяющим действием,
они способствуют выходу воды и низкомолекулярных
белков из сосудистого русла. Благодаря этому усиливается экссудация жидкости и белка в брюшную полость.
Параллельно происходит значительная потеря воды и
другими путями — частой рвотой, жидким стулом, испарением кожными покровами и легкими. При парезе кишечника происходит массивное скопление жидкости в
его просвете. Большая потеря жидкости кровеносным
руслом приводит к значительному уменьшению объема
циркулирующей крови и, следовательно, повышению гемоконцентрации. Возникает состояние, именуемое гипо-
волемией, приводящее к снижению снабжения органов
и тканей кислородом. В ответ на это происходит спазм
периферических сосудов и сосудов почек, вызывающий
перераспределение кровотока с сохранением питания
важных органов, главным образом сердца и головного
мозга («централизация крови»). Ввиду затруднения кровотока отмечается снижение минутного объема крови и
замедление кругооборота крови. В ответ на это возникающая компенсаторная тахикардия приводит к перенапряжению сердечной мышцы и, следовательно, нарушению работы сердца.
Снижение почечного кровотока способствует уменьшению фильтрации мочи в почечных клубочках и
возникновению почечной ишемии. Выделяющиеся
в юкстамедуллярной зоне почек ренин и ангиотензин
оказывают влияние на выработку альдостерона. Действие этого гормона на канальцы вызывает активную реабсорбцию натрия и соответственно задержку жидкости
в кровеносном русле. Вследствие повышения осмотического давления гипофиз начинает выделять антидиурети-
ческий гормон, который повышает проницаемость почечных канальцев и способствует усилению реабсорбции
воды. Выделение мочи уменьшается. В последующем
нарушения функции почек приводят к гидроионным и метаболическим нарушениям. Спазм кожных сосудов нарушает нормальную теплоотдачу в организме ребенка и
оказывает влияние на развитие гипертермии.
71
Гипертермия
Значительное повышение температуры тела (39—40°
и выше) отмечается у большинства больных гнойным
перитонитом. В основном это связано с нарушением равновесия между процессами теплопродукции и теплоотдачи, а также расстройством внутритканевого обмена.
В то же время при дегидратации и нарушении периферического кровообращения имеет место снижение теплоотдачи, несмотря на значительное повышение теплопродукции. Это приводит к гипертермии. Подъем температуры тела на 1° вызывает увеличение основного обмена на
13% (Я. Ошацкий, 1968). У детей раннего возраста при
гипертермии в связи с повышенным расходом энергии;
очень быстро наступает истощение энергетических запа-i
сов с возникновением обменных нарушений и нарушени-j
ем функции дыхания и сердечно-сосудистой системы,]
В ряде случаев наступают недостаточность надпочечни-1
ков, отек и кровоизлияния в мозг.
Нарушения метаболизм
Основным источником образования энергии в орга-|
низме являются углеводы. При перитоните происходит]
нарушение восполнения энергетических ресурсов с пи-]
щей и начинают использоваться углеводы из собствен-!
ных запасов организма. Это происходит главным обра-i
зом за счет гликогена печени, постепенно приводя к]
нарушению ее дезинтоксикационной функции. В началь-^
ных стадиях перитонита, как при каждой стрессовой:
реакции, отмечается временная гипергликемия с последующим истощением запасов углеводов. В качестве
источника энергии начинаются использоваться белки и
жиры, распад которых в условиях тканевой гипоксии
приводит к накоплению окси- и кетокислот.
Образование кислых продуктов изменят pH крови в
кислую сторону — возникает метаболический ацидоз.
Вначале метаболические сдвиги pH в кислую сторону
компенсируются в достаточной степени дыханием (за
счет компенсаторной одышки, ввиду усиленного выделения углекислого газа) и почками (путем реабсорбции
натрия и выделения избыточных кислых радикалов). При
этом необходимо учесть, что у детей первых лет жизни
концентрационная способность почек снижена и воз-
72
можности реабсорбции бикарбоната ограничены (Fet-
terman е. а., 1965).
В условиях перитонита из-за ограничения дыхательных экскурсий (болевой рефлекс со стороны брюшины,
вздутие живота, высокое стояние диафрагмы) и гемодинамических нарушений очень быстро истощаются компенсаторные механизмы и ацидоз переходит в стадию
декомпенсации.
Электролитные нарушения
При перитоните происходят значительные нарушения
электролитного обмена. Рвота и частый жидкий стул
приводят к потере жидкости и электролитов (калий, натрий, хлор). Возникающая гипокалиемия и гипохлоремия
на фоне уменьшения объема плазмы приводят к нарушению кислотно-щелочного равновесия (КЩР), заключающемуся в развитии внутриклеточного ацидоза на
фоне внеклеточного алкалоза (механизм Дарроу). Обеднение клетки калием вызывает нарушение синтеза АТФ
и уменьшение запасов энергии. Это приводит к ослаблению сократительной силы мышц сердца и дыхательной
мускулатуры. Возникают одышка, тахикардия, снижается
ударный объем сердца и развивается недостаточность
кровообращения с явлениями общей гипоскии тканей.
Дефицит калия ухудшает усвояемость аминокислот,
косвенно снижая отложение гликогена в печени, что в
свою очередь ведет к нарушению печеночной функции.
Кроме того, гипокалиемия, вызывая паралич гладкой
мускулатуры, ведет к развитию и прогрессированию
пареза желудочно-кишечного тракта. Следовательно, в
основе генеза клинических проявлений перитонита лежат гиповолемия, нарушения электролитного и водного
баланса и кислотно-щелочного равновесия.
В зависимости от степени выраженности обменных
нарушений и изменений в брюшной полости Ю. Ф. Исаков с соавторами (1966) выделяют три основные фазы
в клиническом течении аппендикулярного перитонита у
детей как до операции, так и после нее.
1-я фаза — нарушение клеточного метаболизма с
преобладанием явлений общей интоксикации, дегидратации. Вследствие снижения гемодинамики и легочной вентиляции (парез кишечника и желудка, болевой синдром-
рефлекс, токсические продукты) в крови накапливается
углекислота и метаболический ацидоз углубляется респираторным. Чем меньше возраст ребенка и интенсивнее
гнойный процесс в брюшной полости, тем нарушения
будут более выражены. Эта фаза наблюдается в течение
первой недели развития перитонита.
2- я фаза. При дальнейшем, более медленном течении
перитонита в связи с потерей калия и хлора (продолжающиеся рвоты, поносы, нарушения всасывания) возникает прогностически неблагоприятное состояние метаболического алкалоза (равновесие Дарроу), коррекция
которого должна вестись под контролем водно-солевого
обмена и кислотно-щелочного равновесия, иначе может
возникнуть сердечно-сосудистая недостаточность, которая является основной причиной смертельных исходов в
течение 2—3-й недели заболевания перитонитом у детей.
3- я фаза — осложнения аппендикулярного перитонита (межпетлевые абсцессы, абсцессы печени, пневмония,
непроходимость кишечника, септикопиемия).
Знание фазовой закономерности в течении перитонита имеет не только теоретическое, но и большое практическое значение, поскольку это позволяет выбрать
наиболее рациональную тактику в предоперационном
периоде, в момент оперативного вмешательства и после
операции.
ПРЕДОПЕРАЦИОННАЯ ПОДГОТОВКА
До недавнего времени в нашей стране и за рубежом
предоперационной подготовке не уделялось должного
внимания. В последние годы ряд авторов (С. Я. Долец-
кий, 1962; И. В. Бурков, 1967; Benson е. а., 1952; Occhi-
pinti е. а., 1961; Liecht, Snyder, 1963) придают вопросам
предоперационной подготовки особо важное значение и
считают, что операция при аппендикулярном перитоните
у детей без определенной подготовки представляет большой риск.
Патофизиологические процессы, особенно у детей
раннего возраста, клинически могут не всегда рано проявляться, так как нарушения функции сердечно-сосудистой системы, по которым обычно судят о тяжести
состояния больного, в этом возрасте не всегда явно
выражены. В то же время ввиду лабильности физиологических функций маленького ребенка их декомпенсация,
как уже указывалось выше, может наступить довольно
74
быстро, даже от незначительных патологических сдвигов, возникших в результате оперативного вмешательства.
По нашим наблюдениям, в оценке тяжести состояния
больного до операции имеют определенное значение
клинические симптомы и данные объективного* исследования. Это позволяет определить показания к проведению предоперационной подготовки, объем которой в
каждом случае зависит от характера и степени выраженности гиповолемии, кислотно-щелочного равновесия и
гидроионных нарушений.
По данным Ю. Ф. Исакова с соавторами (1967),
скрытые метаболические, респираторные и гидроионные
нарушения возникают уже с первых часов развития перитонита. В дальнейшем эти изменения прогрессируют
и в тех случаях, когда предоперационная коррекция их
отсутствует, операция может усугубить имеющиеся
расстройства и привести к необратимым сдвигам. В связи с этим считаем обязательным проведение комплекса
исследований, позволяющих рано выявить возможные
нарушения с целью их своевременной коррекции.
О степени эксикоза, гиповолемии, гемоконцентрации
судили по таким показателям, как гемоглобин, гемато-
крит, температура тела, артериальное и венозное
давление.
Нарушение гемодинамики и периферического кровообращения определялось по частоте пульса, артериального и центрального венозного давления.
Гидроионные нарушения выявлялись путем определения калия, натрия, хлора в плазме крови. Степень
метаболических нарушений устанавливалась изменениями кислотно-щелочного равновесия, напряжением кислорода и углекислого газа в крови.
Определение водно-солевого обмена (содержание в
крови К, Na, Cl) у детей проводилось до операции, в 1-й
день и на 3—7-е сутки после оперативного вмешательства. Содержание электролитов в исследуемой сыворотке
выражалось в миллиэквивалентах на 1 л раствора
(мэкв/л).
В зависимости от тяжести и выраженности токсикоза, показателей водно-минерального обмена все больные
были распределены на две основные группы.
К первой группе отнесены дети без выраженных
явлений токсикоза и эксикоза, у которых состояние было
75
средней тяжести или удовлетворительным. Длительность заболевания больных колебалась от 16 до 48 ч.
Группу составляли дети в основном с неосложненными
деструктивными формами аппендицита. Только у некоторых отмечались явления начинающегося перитонита
(I степени). Водно-солевой обмен у них не был нарушен, содержание солей было в пределах возрастной
нормы.
Вторую группу составляли больные с разлитым гнойным перитонитом. Длительность заболеваний у них
составляет от 1 !/2 до 8 сут.
У большинства больных уже при поступлении общее
состояние было тяжелым, с выраженными явлениями
токсикоза и эксикоза, одышкой, тахикардией. Температура, как правило, высокая (38° и выше). Гематокрит
чаще был повышен. У ряда больных отмечалось снижение артериального и повышение центрального венозного
давления. У больных этой группы имелось снижение
содержания натрия в среднем до 126 мэкв/л (при норме
130—135 мэкв/л), хлора — до 86 мэкв/л (при норме
95 мэкв/л).
Снижение содержания калия (от 4 до 3,5 мэкв/л при
норме от 4,5 до 5 мэкв/л) было отмечено в основном при
тяжелых формах перитонита с длительностью заболевания более 2—3 сут.
Уже с первых часов развития перитонита в организме
возникают метаболические нарушения. Наступающие
нейро-гуморальные стрессовые реакции усиливают энергетический обмен. В свою очередь нарушения желудочно-кишечного пищеварения (прекращение приема пищи,
рвота) увеличивают основной обмен веществ, что приводит к гликемии. При истощении углеводных запасов в
организме происходит распад белков и жиров до кето-
кислот, которые, не претерпевая окисления в клетках,
выбрасываются в кровеносное русло, в результате чего
возникает метаболический ацидоз.
Изменения циркуляции крови, а также ухудшение
дыхательной функции вследствие повышения внутри-
брюшного давления (парез желудка и кишечника, скопление жидкости в брюшной полости, утомление дыхательных мышц) могут привести к респираторному
ацидозу.
Клинические симптомы метаболического и респираторного ацидоза не являются специфичными, так как на
76
них наслаиваются проявления токсикоза и гидроионных
нарушений, обычно сопутствующих ацидозу при перитоните у детей. Однако можно выделить наиболее часто
встречающиеся симптомы ацидоза. К ним относятся
вялость, адинамия, снижение мышечного тонуса, артериального давления и учащение пульса. Характерньум
является расстройство дыхания, которое получило название ацидотического. Это дыхание — редкое, глубокое,
шумное, так называемое большое — связано со стремлением организма компенсировать ацидоз путем усиленного выведения углекислоты через легкие. Циркуляторные
нарушения при ацидозе связаны с изменением тонуса
сосудов и мышц вследствие активизации протеолитических ферментов и нарушения сократимости мышц
(С. Я- Капланский, 1939; Д. Л. Фердман, 1962; К. Блажа и С. Кривда, 1963). Чем выраженнее ацидоз, тем
описанные симптомы проявляются более отчетливо. По
степени компенсации различают компенсированный и
некомпенсированный ацидоз.
При недостатке калия и хлора, что можно наблюдать при продолжающейся рвоте и частом жидком стуле,
возникает метаболический алкалоз — прогностически неблагоприятный признак при тяжелых, сильно запущенных перитонитах. Клинически он проявляется беспокойством, эйфорией, повышением сухожильных рефлексов,
частым поверхностным дыханием (К. Блажа и
С. Кривда, 1963). По степени компенсации метаболический алкалоз разделяется на компенсированный и де-
компенсированный.
Выявлена прямая зависимость между нарушениями кислотно-щелочного равновесия и длительностью
заболевания: чем меньше возраст ребенка, тем быстрее наступают метаболические и респираторные нарушения.
В зависимости от показателей кислотно-щелочного
равновесия больные были разделены на две основные
группы. В первую группу вошли больные, у которых
изменений со стороны кислотно-щелочного равновесия не
обнаружено (30%). Состояние их при поступлении было
нетяжелым, без выраженных явлений эксикоза и токсикоза. Длительность заболевания -не превышала 1—2 сут.
При оперативном вмешательстве воспалительный процесс ограничивался местными изменениями в области
отростка и брюшины.
77
Вторую группу составили больные с некомпенсированным метаболическим ацидозом (70%). Выраженность
этих изменений прямо пропорциональна длительности
заболевания и обширности поражения брюшной полости.
Обычно это были дети, поступившие в стационар позже
2 сут от начала заболевания с явлениями разлитого
гнойного перитонита и выраженным токсикозом и экси-
козом. Неустраненный эксикоз усиливает метаболические
нарушения и ухудшает гемодинамику: замедляется время кровотока, уменьшается минутный объем и увеличивается вязкость крови, что приводит к гипоксии тканей
и задержке в них продуктов обмена.
Таким образом, 70% детей в возрасте до 3 лет
требуют специальной длительной предоперационной
подготовки с устранением ацидоза и водно-солевых
изменений.
Предоперационная подготовка включает
в себя комплекс мероприятий, направленных на устранение вышеуказанных нарушений. Отсутствие интенсивной терапии с коррекцией патофизиологических сдвигов
значительно увеличивает летальность. Так, из 4 детей,
умерших в клинике, трое были оперированы до 1966 г.,
когда вопросам предоперационной подготовки не придавалось должного внимания.
По данным Г. А. Баирова (1966), наибольшая летальность также отмечена в группе детей, оперированных без предварительной подготовки, причем больные
умирали в первые часы после операции или даже на
операционном столе.
Весь комплекс предоперационных мероприятий должен быть выполнен в довольно сжатые сроки (не более
2—3 ч). Ниже в виде схемы приводится комплекс лечебных мероприятий, проводимых в период предоперационной подготовки (см. также рис. 19).
Предоперационную подготовку следует начинать с
декомпрессии желудочно-кишечного тракта — введения
постоянного зонда в желудок и газоотводной трубки в
прямую кишку. С целью постоянного внутривенного введения жидкости производится венесекция или пунктируются крупные вены с введением постоянного хлорвинилового катетера по Сельдингеру (глубокая вена бедра
или подключичная вена). Особенно важно введение
жидкости в крупные вены при явлениях гиповолемии и
сосудистого спазма.
78
ПРЕДОПЕРАЦИОННАЯ ПОДГОТОВКА ПРИ ПЕРИТОНИТЕ
(по А. А. Овчинникову и И. В. Буркову, 1972).
I. Борьба с гиповолемией и
«централизацией» кровообращения
II. Борьба с эксикозом,
восполнение энергетических ресурсов и электролитов
III. Борьба с инфекционнотоксическим влиянием
IV. Борьба с гипертермией
V. Улучшение функции почек
VI. Коррекция метаболических сдвигов:
А. Метаболический ацидоз
Б. Метаболический алкалоз
Вливание высокомолекулярных белковых препаратов или их заменителей — коллоидных растворов (кровь,
плазма, желатиноль полиглюкин,
поливинол, альбумин) под контролем
гематокрита
Вливание 10—20% растворов глюкозы с инсулином (1 единица инсулина на 4 г сухой глюкозы), полиион-
ного раствора
Антигистаминные препараты (пи-
польфен, супрастин, димедрол), плазма, трасилол, антибиотики
Коррекция гиповолемии и дегидратации, регуляция периферического
кровообращения, воздействие на
кожную капиллярную сеть — растирание кожи спиртом на фоне ган-
глиоблокирующего действия антигис-
таминных препаратов или ганглио-
блокаторов (в тяжелых случаях).
Антипиретики центрального действия
(1—4% раствор пирамидона, 25—
50% раствор анальгина)
Восполнение объема циркулирующей
крови, улучшение почечного кровотока (эуфиллин, кофеин), мочегонные, блокада по Лорин — Эпштейну,
фторотановый наркоз
Улучшение буферных систем крови
(4% раствор соды), улучшение функции почек, окислительно-восстановительных процессов в тканях (витамины группы В и С, кокарбоксилаза,
АТФ, кислород), восполнение энергетических затрат (глюкоза с инсулином), улучшение легочной функции
(зонд в желудок, опорожнение кишечника, обезболивание)
Восполнение дефицита калия (5—
7,5% раствор хлористого калия),
улучшение функции почек
Восполнение объема циркулирующей крови при перитоните приобретает первостепенное значение в связи с
выраженными циркуляторными нарушениями. С этой
целью вводятся такие высокомолекулярные коллоидные
растворы, как кровь, плазма, полиглюкин, макродекс,
поливинол, альбумин и др. Эти препараты, поддерживая
79
Рис. 19. Схема предоперационной подготовки.
коллоидно-осмотическое давление в кровяном русле, обладают и дезинтоксикационным действием, адсорбируя
токсины микробов. Введение же одних водных растворов
глюкозы и солей приводит к выходу воды в экстрава-
зальное пространство из-за повышенной проницаемости
сосудов. К тому же плазма обладает и иммунологическими свойствами, формируя из белковых фракций
антитела.
В среднем количество плазмы вводится не менее 15—
20 мл на 1 кг веса больного. Наиболее точный расчет
плазмы производится по следующей формуле:
OIXKxHt в норме
^-'•ЦА гг ^ j
П t больного
30
где: ОЦК — объем циркулирующей крови, высчитанный
на основании норм для данного больного по таблице
Абердина (рис. 31); #t в норме — нормальная гемато-
критная величина для данного возраста; Н% больного —
истинная гематокритная величина у больного.
При наиболее выраженных явлениях эксикоза вначале коллоидные растворы вводятся струйно (100—
150 мл), затем темп введения доводится до 60—100 капель в минуту.
Борьба с эксикозом и восполнение энергетических
ресурсов проводится путем внутривенного введения 10%
раствора глюкозы на растворе Рингера из расчета
50 мл/кг. Вводить растворы глюкозы меньшей концентрации нецелесообразно ввиду опасности гипергидратации (К. Блажа и С. Кривда, 1963; Ю. Ф. Исаков и др.,
1966; Л. А. Пашерстник и Е. М. Штейнгольд, 1966). Для
лучшей утилизации глюкозы добавляется к вводимому
раствору инсулин—1 единица на 4 г сухой глюкозы и
витамины С, Вь В6, Bi2 в возрастной дозировке.
Дефицит электролитов восполняется вливанием по-
лиионного раствора1, раствора Рингера1 2 или раствора
Рингера—Локка3. Введение только растворов хлористого
натрия приводит к увеличению дефицита калия из-за
антагонизма этих ионов.
Расчет суточного введения жидкости производится по
таблице Абердина с учетом имевшихся потерь (рвота,
понос, скрытые потери жидкости).
Степень обезвоживания (Ht) определяется по следующей формуле:
Ht больного — Ht в норме Вес тела
Х= 77^ х к >
в норме 5
вес тела
где = внеклеточному объему жидкости.
5
Назначение антигистаминных препаратов (супрастин,
пипольфен, димедрол) направлено на снижение токсического воздействия микробов и подуктов белкового
1 Полиионный раствор. Состав: хлористого натрия 1,8; хлористого калия 0,9; рибофлавина 0,006; дистиллированной воды 300 мл.
2 Раствор Рингера. Состав: хлористого натрия 8,6; хлористого
кальция 0,33; хлористого калия 0,3; дистиллированной воды до 1 л.
3 Раствор Рингера—Локка. Состав: хлористого натрия 9,0; двууглекислого натрия, хлористого кальция, хлористого калия по 0,2;
глюкозы 1,0; дистиллированной воды до 1 л.
81
распада. Эти препараты, нейтрализуя действие гистамина и ему подобных веществ, играют важную роль в
уменьшении воспалительного процесса. Введение траси-
лола способствует инактивации протеолитических ферментов, снижая активность белковых субстанций. Вследствие этого применение трасилола ведет к снижению
токсикоза и устранению сосудистых нарушений. Траси-
лол вводится в расчете 1000—1500 ед/кг. В тяжелых
случаях токсикоза эту дозу следует соответственно увеличить.
Мероприятия по борьбе с гипертермией необходимо
начинать проводить с методов физического охлаждения
(раскрытие больного, охлаждение с помощью электровентилятора и обтирания поверхности тела 96° раствором спирта, холодные клизмы, укладывание пузырей со
льдом на внутренние поверхности бедер, промывание
желудка холодной водой). Снижение гиповолемии и нормализация периферического кровообращения сами по
себе способствуют уменьшению гипертермии. При отсутствии тенденции к понижению температуры применяются
антипиретики центрального действия — 1% раствор пирамидона (0,5 мл/кг) и 50% раствор анальгина (0,1 мл
на каждый год жизни ребенка), которые вводятся внутримышечно. При стойкой гипертермии целесообразно
внутривенное введение гидрокортизона (4 мг/кг) или
преднизолона (1 мг/кг).
Ликвидация явлений «централизации» кровообращения и борьба с гиповолемией способствуют улучшению
функции почек. Как правило, потребности во введении
мочегонных препаратов не возникает. Так как при тяжелом перитоните имеет место снижение артериального
давления, для нормализации почечного кровотока более
целесообразно введение кофеина, нежели эуфиллина.
Устранению метаболических нарушений кислотнощелочного равновесия уже способствуют такие мероприятия, как опорожнение желудочно-кишечного тракта,
кислородотерапия, устранение гиповолемии и изменений
со стороны водно-солевого баланса, нормализация функции почек и восполнение энергетических затрат. Применение кокарбоксилазы и АТФ также улучшает окислительно-восстановительные процессы в тканях.
При выраженном метаболическом ацидозе
необходимо внутривенное введение растворов, ощелачи-
вающих плазму крови. Наиболее распространенным и
доступным из них является бикарбонат натрия, 4%
раствор которого вводится по следующей формуле:
Вес больного
X = X BE,
где BE — дефицит буферных оснований по методике
Аструпа. При отсутствии возможностей определения дефицита буферных оснований (BE) можно воспользоваться следующим расчетом: 0,1 г сухого вещества
бикарбоната натрия на 1 кг веса больного. При выраженных явлениях токсикоза эта доза несколько завышается (0,15 г/кг). Введение соды должно быть медленным
из-за возможности возникновения нарушения нервной
проводимости в миокарде. Для предотвращения этого
осложнения следует одновременно с содой вводить 10%
раствор хлористого калия (5—10 мл).
При метаболическом алкалозе имеет место
снижение калия и хлора. Восполнение этого дефицита
достигается введением 7,5% раствора хлористого калия
(1 мл раствора содержит 1 мэкв калия). Недостаток
калия вычисляется по формуле:
Вес тела
л = Калий в норме — Калий у больного х
5
(средненормальное содержание калия в сыворотке крови— 5 мэкв). К расчетному количеству калия добавляется ежедневная норма, которая указана в таблице
Абердина (рис. 20). При клинических симптомах гипо-
калиемии и невозможности определения ионного состава
плазмы крови можно допустить введение хлористого
калия по следующему расчету исходя из веса больного
(0,5 мл 7,5% раствора КС1 на 1 кг веса в сутки). Раствор хлористого калия вводится также капельно под
контролем электрокардиограммы и его содержания в
сыворотке крови. Быстрое введение или передозировка
калия могут привести к целому ряду осложнений (парестезии, мышечная гипотония, паралич конечностей и даже остановка сердца). При этом на электрокардиограмме удается выявить повышение зубца Т, исчезновение
зубца Р, а при резко выраженной гиперкалиемии (свыше
10 мэкв/л) ЭКГ становится двухфазной. В целях профилактики указанных осложнений предполагаемую дозу
7,5% раствора хлористого калия рационально вводить
в разведении до 1%.
83
Потребление S су гни
£
Оо
+ *
t
1
1
8
160
.110
-105
- 20
140
120
1
' 18
100
1 90
- 16
80
- 80
70
- 70
: 15
60
- 60
50
- 5Л
-40
- 14
Потери В сутки
$
30
25
§
I!
Й§
15
13 T
Рост, см
Вес, кг
Возраст, год о^г/г 1 2 з 4
Общий „объем
крови
5 6 7 8 9 10 11 12 13 14
I I
0,3
0,6 0,9 12 16 18 20 22 26 34 42 48 52 56 60 68 Литр
Объем красной кроВи
0,2 0,3 0,4
Ж 28 34 46 48 52 56 60
0,5 0.6 10 12 14 16 18 20 22 24
Гематонрит
(Венозный)
60 33 35 37
38
И 0.8 10 12 14 16 18 20 22 24
39 40 М 41 42 43 44 44
Гемоглобин, г% ю 12 13
13,5
Ж 4014
40
Ц 40 (М)
1г Nace• 17мэнб Na+ 1 г
1 г нее-135 мэнб Н+ 1 г
1 г
глюкозы 4 нал и 0,55 мл боды окисления
бел но —— 4 нал и 0,41 мл боды окисления
жира 9 нал и 1,07 мл боды окисления
Рис. 20. Таблица Абердина.
Показателями эффективности проводимой предоперационной подготовки являются: а) нормализация или
тенденция к нормализации артериального давления,
пульса и дыхания; б) улучшение показателей гематокри-
та и гемоглобина; в) снижение температуры; г) коррекция декомпенсированных расстройств кислотно-щелочного равновесия и водно-минерального баланса.
Продолжительность проводимой терапии зависит от
тяжести состояния больного, длительности заболевания,
а также от скорости исчезновения или уменьшения явлений интоксикации.
В среднем предоперационная подготовка при осложненных формах аппендицита занимает 2—3 ч.
Света Г., 2 лет 8 мес, поступила в клинику на 3-и сутки от
начала заболевания. Состояние при поступлении тяжелое: девочка
вялая, бледная, черты лица запавшие. Жажды нет. Температура
39,8°. Язык суховат, с белыми налетами. Дыхание глубокое, до 32 в
минуту. Пульс 148 ударов в минуту, среднего наполнения. Артери-
84
альное давление 70/40 мм рт. ст. Живот умеренно вздут, активно
напряжен во всех отделах, на пальпацию ребенок реагирует криком.
Симптом Щеткина невозможно определить из-за беспокойства ребенка при осмотре. Сделана хлоралгидратовая клизма (20 мл 3%
раствора). При осмотре во сне живот напряжен во всех отделах.
Симптом Щеткина положительный. Особое беспокойство проявляет
при углублении пальпации в правой подвздошной области. Диагноз:
острый аппендицит, разлитой перитонит. Определено содержание
электролитов сыворотки крови (Na 124 мэкв/л, С1 84 мэкв/л, К
4,6 мэкв/л). При исследовании кислотно-щелочного равновесия установлен некомпенсированный метаболический ацидоз: pH 7,28;
рС02 26,8; ВН=12,6; SB = 14; С02 = 24,2.
Проведена предоперационная подготовка: путем венесекции
внутривенно капельно перелито 300 мл 4% раствора бикарбоната
натрия, 8 мл 10% раствора NaCl, 4 мл 0,25% раствора новокаина,
гипотонический раствор плазмы (100 мл плазмы разведено в 200 мл
раствора Рингера), 25 мг кокарбоксилазы, витамины группы В и С.
Внутримышечно введено 0,3 мл 50% раствора анальгина и 7 мл 1%
раствора пирамидона. На крупные сосуды в паховых областях наложены пузыри со льдом.
Спустя 2 ч от начала предоперационной подготовки состояние
ребенка улучшилось. Девочка стала более активной, кожные покровы порозовели. Температура снизилась до 37,7°. Пульс 128 уд/мин.
удовлетворительного наполнения. Артериальное давление 85/55 мм
рт. ст. Дыхание 28 в минуту. Установлен компенсированный метаболический ацидоз: pH 7,4; рС02 23,1; BE — 4,2; SB 16,8; С02 16,1.
Произведено оперативное вмешательство: обнаружен гангренозно измененный червеобразный отросток с двумя перфоративными
отверстиями. В брюшной полости обнаружено значительное количество ихорозного гноя.
При перитоните у детей первых лет жизни часто
можно наблюдать развитие дыхательного ацидоза, который возникает из-за ограничения диафрагмального
дыхания (парез диафрагмы, переполнение желудка
и кишечника). В этих случаях необходимо провести
декомпрессию желудка путем введения через нос желудочного зонда и назначить оксигенотерапию.
Алеша Щ., 3 лет, поступил в клинику на 2-е сутки от начала
заболевания в тяжелом состоянии. Выражены явления токсикоза
и эксикоза. Живот значительно вздут, напряжен, болезненный во всех
отделах, особенно в правой подвздошной области; в дыхании не
участвует. Симптом Щеткина положительный. Температура 38,8°.
Пульс 136 ударов в минуту, среднего наполнения. Артериальное давление 76/60 мм рт. ст. Диагноз: острый аппендицит, разлитой перитонит. При определении кислотно-щелочного равновесия выявлен
субкомпенсированный дыхательный ацидоз: pH 7,38; рС02 39,2;
BE —4; SB 28,3; С02 26.
Через нос в желудок вставлен тонкий резиновый зонд, по которому отошло значительное количество зеленоватой коричневой
жидкости с неприятным запахом и большое количество газов. Желудок промыт до чистой воды. Дан увлажненный кислород (4 л/мин
через носовой катетер). После этих мероприятий вздутие живота
85
Значительно уменьшилось, дыхание стало глубоким (до 30 в мину*
ту). К концу предоперационной подготовки (внутривенно 10% раствор глюкозы на растворе Риигера, 10 мл 10% хлористого натрия,
50 мл плазмы и витамины), которая продолжалась 2 ч, удалось
перевести субкомпенсированный дыхательный ацидоз в компенсированный: :рН 7,41; рС02 36,8; BE+ 4; SB 28,5; С02 23,4.
Следовательно, принципы проведения рациональной
предоперационной терапии для всех больных одинаковы
и исходят из характера основных патофизиологических
сдвигов, возникающих при гнойном перитоните у ребенка. Тем не менее в каждом конкретном случае необходимо учитывать тяжесть общего состояния, длительность
заболевания и данные объективного исследования: чем
тяжелее состояние больного, тем дольше и интенсивнее
необходимо готовить его к операции. К оперативному
лечению приступают лишь после устранения гиповоле-
мии, коррекции кислотно-щелочного равновесия, водносолевого обмена и ликвидации респираторных нарушений. При этом большое значение следует придавать
снижению гипертермии. Проведение комплекса этих мероприятий позволяет уменьшить опасность декомпенсации
нарушенных функций под влиянием наркоза, самого
оперативного вмешательства и значительно улучшает
послеоперационное течение и прогноз.
ОБЕЗБОЛИВАНИЕ
Обезболивание у детей раннего возраста должно
быть только общим ввиду низких сознательно-волевых
качеств ребенка. Весьма важным моментом, предшествующим проведению наркоза, является психическая
подготовка больного. Необходимо, чтобы анестезист
установил контакт с маленьким пациентом, что уменьшает страх ребенка перед операцией.
В качестве промедикации для снижения секреции
слюнных желез и успокаивающего действия на нервную
систему за 30—50 мин до операции вводится подкожно
1% раствор пантопона и 0,1% раствор атропина из расчета по 0,1 мл раствора на год жизни. В последнее
время ввиду холинолитического действия атропина (особенно у детей с лабильной гипертермической реакцией)
применяются пипольфен и супрастин.
Увеличение количества осложнений в момент проведения наркоза, а также в ближайшем послеоперацион¬
86
ном периоде заставляет в настоящее время при перитонитах у детей шире применять интубационный наркоз.
Несмотря на то что до недавнего времени из многочисленных наркотических средств наибольшее распространение в детской практике получил эфир, последний вызывает целый ряд нежелательных побочных явлений:
снижает содержание печеночного гликогена, увеличивает
потребность тканей в кислороде, способствует возникновению гипертермии и судорог.
В последние годы наиболее широкое применение получил фторотан в сочетании с закисью азота.
ОПЕРАТИВНОЕ ВМЕШАТЕЛЬСТВО
Наиболее удобным доступом к червеобразному
отростку является разрез по Мак-Бернею—Волковичу—
Дьяконову. Необходимо лишь отметить, что у детей первых трех лет жизни он должен производиться на 2—3 см
выше проекционной линии, принятой у старших детей и
взрослых, что связано с более высоким расположением
слепой кишки.
Длина разреза должна быть не менее 6—8 см, что
позволяет при различных формах аппендицита и при
любом расположении отростка выполнить аппендэкто-
мию без особого труда.
После рассечения кожи, подкожной клетчатки и апоневроза наружной косой мышцы живота двумя анатомическими пинцетами по
ходу волокон до брюшины тупо расслаиваются внутренняя косая и
поперечная мышцы живота, которые при перитоните бывают отечными, тусклыми. Края раны расширяют тупыми крючками, париетальную брюшину (при осложненном аппендиците обычно утолщенная, отечная) приподнимают анатомическими пинцетами в виде конуса, надсекают скальпелем или ножницами и захватывают зажимами Микулича. При наличии гноя или гнойного экссудата последний сразу же удаляют с помощью электроотсоса и только после
этого в рану выводят слепую кишку с червеобразным отростком.
После перевязки кетгутом брыжейки отростка приступают к его
удалению (рис. 21, а, б).
Большинство детских хирургов (И. К. Ахунбаев,
1946; С. Р. Слуцкая, 1948; С. Д. Терновский, 1949, 1958;
Я. Н. Элькина, 1958; А. И. Ленюшкин, 1961; С. Я. Долец-
кий и М. М. Кучегурова, 1962) и некоторые хирурги,
лечащие взрослых (Б. А. Петров, 1958; А. Г. Бржозов-
ский, 1960), считают, что у детей в связи с очень тонкой
стецкой кищки и возможностью прокола ее при наложе-
а
й
Рис. 21. Аппендэктомия лигатурным способом.
а — проведение лигатуры у основания отростка; б — перевязка брыжейки червеобразного отростка; в — отжатие основания червеобразного отростка; г—перевязка основания отростка шелковой лигатурой; д — проверка прочности
наложения лигатуры после удаления отростка
нии кисетного шва следует применять метод простой
перевязки культи без перитонизации—лигатурный метод.
В связи с этим у детей раннего возраста лигатурный
метод особенно показан. Противопоказанием к примене¬
89
нию этого метода является лишь деструктивное Изменение основания червеобразного отростка.
Приводим описание лигатурного метода обработки культи, применяемого в клинике.
Зажим Кохера накладывают на основание червеобразного отростка у места перехода последнего в стенку слепой кишки. На
0,5 см выше места пережатия накладывают второй зажим. По борозде, образованной от первого отжатия, отросток перевязывают
шелковой лигатурой (шелк № 5). Вслед за этим отросток отсекают
скальпелем непосредственно по нижнему краю второго зажима. Слизистую оболочку культи обрабатывают 5% раствором йодной настойки. Концы нити отрезают на 0,5 см от узла, и культю червеобразного отростка вместе с куполом слепой кишки погружают в брюшную полость (рис. 21, в,г,д).
Лигатурным методом нами оперировано 84% больных, и лишь у 16% ввиду выраженных изменений основания отростка применен погружной метод, заключающийся в погружении перевязанной культи в стенку
слепой кишки с помощью кисетного, а иногда и Z-образ-
ного шва. Во всех случаях не отмечено осложнений, связанных с техникой обработки культи.
При абсцедирующих инфильтратах или отграниченных абсцессах оперативное вмешательство должно заключаться в их вскрытии, аспирации гноя и аппендэкто-
мии, если червеобразный отросток можно легко удалить,
не нарушая сращений, отграничивающих воспалительный процесс. В противном случае. следует прибегать
лишь к дренированию абсцесса рыхло поставленным
тампоном без удаления червеобразного отростка.
До 1964 г. в нашей клинике широко пользовались
тампонированием брюшной полости. Операционную
рану закрывали с оставлением катетера и тампона не
только при ограниченных перитонитах и периаппендику-
лярных абсцессах, но и при тяжелых формах разлитого
перитонита (порой с оставлением 2, а в некоторых случаях и 3 тампонов).
Широкое применение тампонов при перитонитах нередко приводило к послеоперационным осложнениям
(кишечные свищи, инфильтраты брюшной полости).
В связи с этим были выработаны следующие показания
для подведения тампона:
1) ограниченные перитониты и периаппендикулярные
абсцессы; 2) кровотечение из ложа отростка при разрушении спаек во время операции; 3) при выраженных воспалительных явлениях купола слепой кишки из-за опас¬
90
ности прорезывания погружных швов или расхождения
культи отростка.
Однако при разлитом гнойном перитоните при ушивании брюшной полости наглухо с оставлением лишь
микроирригаторов в течение послеоперационного периода часто наблюдались местные и общие осложнения.
Ввиду этого с 1966 г. мы применяем в клинике длительное промывание брюшной полости как во время
операции, так и в течение нескольких суток после нее
(И. В. Бурков, 1967).
Этот метод имел две разновидности: «лаваж» и диализ. Первый осуществлялся сравнительно небольшим
количеством жидкости. При этом использовались «сигарные» дренажи. Несовершенное дренирование не позволяло судить о составе оттекающей жидкости и ее влиянии на гомеостазис. Применение больших количеств
промывных растворов и усовершенствование дренажей
дали возможность получить диализирующий эффект. Это
позволило с полным правом назвать данный метод
брюшным диализом. Особенно показано применение
этих методов при значительном нарушении общего состояния, парезе кишечника и выраженной инфильтрации
кишечной стенки. Это позволяет не только постоянно
выводить продукты воспаления, создавать оптимальную
концентрацию антибиотиков, но и служит дезинтоксици-
рующим фактором.
ЛАВАЖ1
Необходимые приспособления и растворы
1. Полиэтиленовые или полихлорвиниловые трубки (микроирригаторы) диаметром 0,3—0,7 см и длиной не менее 30 см для инстилляции жидкости в брюшную полость. Можно использовать также тонкие резиновые катетеры. Как показал наш опыт, пластмассовые
трубки обладают хорошей эластичностью, почти не забиваются фиб-
ринными пленками; при изъятии резиновых катетеров из брюшной
полости в их отверстиях всегда отмечается наличие плотных сгустков фибрина. Ввиду сказанного выше при использовании резиновых
ирригаторов необходимо на концах, которые вводятся в брюшную
полость, сделать несколько отверстий, располагая их как можно
дистальнее. Таким образом, в случае закупорки одного из отверстий другие будут функционировать. Если же сделать отверстие
далеко от дистального конца, то жидкость может выливаться, не
доходя до верхних отделов боковых брюшинных каналов, что имеет существенное значение.
1 Лаваж (от франц lavage) — промывание.
91
Рис. 22 «Сигарный» дренаж.
/ — марля; 2 — резина от перчаток; 3 — полиэтиленовый катетер.
2. Металлические канюли, предназначенные для насадки на
шприц Люэра. На широкие части канюль надеваются резиновые
трубки диаметром 0,5—0,6 см для лучшего соединения со шприцем
Жане. Обычно трубки плотно фиксируются к насадке шелковой
нитью.
3. Шприц Жане.
4. Электроотсос с металлическим наконечником.
Как показал наш опыт, лучше всего пользоваться наконечником, имеющим на конце круглую головку с несколькими отверстиями. При использовании такого наконечника ввиду отсутствия острых граней и небольшой его величины травмирование серозных покровов незначительное. Наличие нескольких отверстий дает возможность реже и не сильно присасывать стенку кишки.
5. «Сигарные» дренажи. Техника их изготовления следующая
(рис. 22). На резиновую полоску от хирургической перчатки размером 10x15 см накладывают два — три слоя марли такого же размера. Затем полоски скручивают с одного края, как листья сигары.
В середину дренажа целесообразно вставить полиэтиленовую трубку с тонкими стенками от системы для переливания крови. Это
дает возможность промывать при необходимости дренаж и малый таз.
«Сигарные» дренажи в отличие от марлевых тампонов и резиновых трубок, более мягкие, функционируют, несмотря на отложение фибрина. Принцип их действия заключается в том, что между
ослизняющимся марлевым слоем и резиновой полоской образуются
капиллярные щели, которые способствуют активному отсасыванию
жидкости из брюшной полости.
6. Система для капельного введения жидкости с тройником (емкость резервуара желательна большая—до 1000 мл). Для лучшего
соединения системы с микроирригаторами в конце разветвлений
вставляются канюли (насадки для шприца Люэра).
7. Фурацилин на физиологическом растворе хлористого натрия
(1:5000) не менее 5—б л. Раствор фурацилина не должен быть холодным во избежание быстрого снижения температуры тела больного благодаря значительной поверхности брюшины. Он не должен
быть также слишком горячим, так как уже при температуре 55°
может произойти тромбоз сосудов брыжейки. Мы использовали раствор температуры тела.
92
8. Раствор для инстилляции в брюшную полость после операции. Обычно использовался изотоничный по отношению к плазме
раствор Рингера из расчета 100 мл/кг в сутки. Такой объем жидкости обеспечивал безболезненное ее введение при постоянном выделении ее из дренажей. Для предупреждения усиления фибринообра-
зования добавлялся гепарин по 5000 ME на каждые 100 мл раствора. Комнатная температура жидкости способствовала умеренному
охлаждению брюшной полости. Как было показано в работе
3. К- Забегальской (1971), этот фактор способствует уменьшению
застойной гиперемии кишечника и улучшению абдоминальной гемодинамики. Положительное влияние на местное кровообращение, на
наш взгляд, могло бы способствовать быстрому восстановлению пассажа по кишечнику. Как будет показано далее, эти предположения
полностью подтвердились.
Промывание брюшной полости во время операции.
После вскрытия брюшной полости удаляют первичный
очаг инфекции, делают разрезы в обеих подвздошных
областях. В брюшную полость через операционный разрез вводят два пальца в направлении правой реберной
дуги. Под контролем пальца троакаром или скальпелем
делают отверстие в подреберной области по сосковой
линии, проникающее в брюшную полость. Точно так же
делают отверстие в левом подреберье. Через трубку
троакара вводят микроирригаторы — по одному с каждой стороны. Ирригаторы необходимо подвести к самой
верхней точке боковых брюшинных каналов. Правый
ороситель заводят по боковой и задней поверхности печени в надпеченочное пространство, левый — между селезенкой и диафрагмой. Такое расположение микроирригаторов обеспечивало хорошее орошение промывным
раствором основных мест скопления гноя: поддиафрагмальное пространство и боковые брюшинные каналы.
По капиллярным щелям между петлями кишечника
инстиллируемая жидкость распространяется по всей
брюшной полости, омывая ее и смывая продукты воспаления в нижние отделы, к дренажам.
Ирригаторы фиксируют к коже шелковыми швами за
манжетки, при этом обращают особое внимание на герметичность брюшной стенки в этих местах. Для этого
иногда, особенно у больных с выраженным подкожным
жировым слоем, приходится накладывать через всю
брюшную стенку узловые стягивающие швы по сторонам
от ирригаторов. Если для нанесения отверстия использовался не прокол, а разрез, то стягивающие швы накладывают в два ряда: до подкожной клетчатки и на клетчатку вместе с кожей.
93
Наложение герметизирующих шелковых швов производится под контролем пальца, введенного в брюшную
полость, а при широкой лапаротомии — визуальным.
Манипуляция считается выполненной правильно, если
при умеренном потягивании за ирригатор он не выходит
из раны.
По окончании фиксации во избежание сдавления
трубки проверяется ее проходимость и производится
промывание брюшной полости. Для этого на микроирригаторы насаживают канюли с резиновыми трубками и
через них шприцем Жане в брюшную полость вводят
раствор фурацилина в достаточно значительном количестве так, чтобы он вытекал через операционную рану.
Для лучшего стекания раствора головной конец операционного стола приподнимают. Жидкость, смешанную с
гноем, фибрином и продуктами распада, удаляют электроотсосом через рану. Особое внимание уделяется санации обычных мест скопления гноя: латеральных
каналов, полости малого таза, правой подвздошной
области.
При широкой лапаротомии целесообразно после
новокаиновой блокады корня брыжейки, отведя петли
кишечника в сторону, тщательно промыть малый таз, а
затем и кишечник. При этом оправдано разделение
рыхлых фибринозных сращений и удаление неплотно
соединенных пластинок фибрина, а также разделение
рыхлых межпетлевых абсцессов, если они сочетаются с
разлитым перитонитом. Введение раствора фурацилина
повторяется несколько раз до получения совершенно
чистой жидкости. Обычно на это уходит до 2—6 л.
После промывания брюшной полости через подвздошные области в малый таз вводят по одному «сигарному»
дренажу с каждой стороны. Операционные раны послойно ушивают до дренажей. Положение и фиксация дренажей играет важную роль, поэтому на этом следует
остановиться подробнее. Для более полного удаления
жидкого содержимого из нижних отделов брюшной полости дренажи должны обязательно подводиться ко дну
малого таза.
При ушивании ран вокруг дренажей стремились
создать достаточную герметичность шва, однако ни в
коем случае не сдавливая дренаж. Последний при проверке должен свободно, без всякого усилия, подтягиваться и вводиться в брюшную полость.
94
Рис. 23. Силиконовый катетер.
Для перитонеального диализа использовались те же приспособления, что при лаваже, кроме
«сигарных» дренажей. Вместо последних применены
«желобоватые» (И. В. Бурков, 1971), изготовленные из
силиконового каучука, которые не обладают раздражающим действием. Таким образом, вокруг дренажа откладывается незначительное количество фибрина, а хлопья
внутри трубки легко могут быть удалены. Наружный
диаметр дренажей от 7 до 15 мм (в зависимости от возраста больного), длина — не менее 13—15 см. Дренаж
имеет рабочую поверхность 7—10 см (рис. 23). Последняя состоит из 6—8 лунок глубиной 1 мм на наружной
стенке трубки. На дне лунок находятся сквозные отверстия диаметром 0,3—0,5 мм, общее количество отверстий
на рабочей части дренажа не менее 200—250. Наличие
лунок и значительного количества отверстий обеспечивает хорошую дренажную функцию.
Техника оперативного вмешательства не отличается
от таковой при лаваже, за исключением того, что вместо
«сигарных» дренажей применяются «желобоватые».
Дренажи обязательно подводятся к малому тазу, где
взаимно перекрещиваются.
Для брюшного диализа применялся несколько гипе-
росмотичный диализирующий раствор: к жидкости Петрова или раствору Рингера добавлялось 5% глюкозы
или полиглюкина. Общее количество жидкости составляло 200—500 мл/кг сутки в зависимости от тяжести состояния.
ПОСЛЕОПЕРАЦИОННОЕ ЛЕЧЕНИЕ
Ведение послеоперационного периода при аппендэк-
томии, выполненной по поводу катарального аппендицита, обычное. Назначается щадящая диета соответственно
возрасту. В первые двое суток после операции применяются обезболивающие средства (промедол). После
95
флегмонозного аппендицита в течение 5—7 дней следует
назначать антибиотики.
В первые сутки после операции в связи с возможностью аспирации рвотных масс за ребенком требуется
тщательное наблюдение медицинской сестры. В остальном лечение при указанных формах мало чем отличается
от лечения в более старшем возрасте.
Особого внимания после операции заслуживают маленькие дети с деструктивными формами аппендицита и
разлитым перитонитом. Больному создается возвышенное положение в кровати путем поднятия ее головного
конца под углом 30°, что облегчает дыхание ребенка и
способствует оттоку экссудата в нижние отделы живота.
Под согнутые колени подкладывают валик, чтобы ребенок не сползал вниз.
У больных с перитонитом после операции, как и в
предоперационном периоде, необходимо проводить тщательный контроль за состоянием сердечной деятельности (пульс, артериальное давление, ЭКГ), дыханием,
белковым составом крови, гидроионным балансом, кислотно-щелочным равновесием крови. В течение первых
2—3 сут через каждые 2—4 ч контролируются температура тела, пульс, кровяное давление, частота дыханий в
минуту, рвота, стул. Тщательно измеряется объем выпитой и парентерально введенной жидкости и выделенной
с рвотными массами, стулом и мочой.
Чрезвычайно важными показателями течения воспалительного процесса брюшной полости, помимо общего
состояния (реакция ребенка на окружающее, аппетит,
нормализации функции желудочно-кишечного тракта),
являются температурная реакция, боли в животе, формула крови. Комплекс лечебных мероприятий складывается из следующих моментов: борьба с токсикозом и
инфекцией, устранение гемодинамических нарушений и
гиповолемии, коррекция гидроионных и метаболических
сдвигов, ликвидация анемии и гипопротеинемии.
Большое значение следует уделять профилактике и
лечению респираторных нарушений. В комплекс этих
мероприятий входит декомпрессия желудка путем введения в него зонда. Постоянное нахождение зонда в течение первых 2—3 сут после операции предупреждает
аспирацию и способствует снижению внутрибрюшного
давления, повышая этим вентиляционные возможности
дыхательной системы. Предупреждение и лечение дыха¬
96
тельной недостаточности необходимо проводить в течение всего ближайшего послеоперационного периода. По
показаниям проводится катетеризация трахео-бронхиаль-
ного дерева с последующим отсасыванием слизи и введением антибиотиков. Это дает возможность предупредить развитие ателектазов и как их следствие4— пневмонию.
В раннем послеоперационном периоде вновь могут
возникнуть нарушения гомеостазиса, обусловленные анестезией, операционной травмой и продолжающимся воспалительным процессом. Основными из них являются
нарушение циркуляции крови по периферическим сосудам, изменение кислотно-щелочного равновесия и
водно-солевого баланса. Исследования показали, что
более чем у трети больных, как правило, с разлитым
перитонитом отмечаются подобные нарушения с явлениями выраженного метаболического ацидоза.
Крайне редко, при очень тяжелых формах перитонита,
имеются явления и метаболического алкалоза. Коррекция гемодинамических изменений и метаболического
ацидоза не отличается от таковой, проводимой в предоперационном периоде, и достигается внутривенным
введением крови, плазмы, высокомолекулярных препаратов, 4% раствора бикарбоната натрия.
Метаболический алкалоз корригируется путем внутривенного введения 7,5% раствора хлористого калия в
среднем от 8,0 до 10,0 мл (0,5 мл/кг) в разведении.
Респираторный ацидоз, возникший в послеоперационном периоде, устраняется дозированной оксигенотерапи-
ей и эвакуацией желудочного содержимого с помощью
постоянного зонда.
В послеоперационном периоде у больных с осложненными формами аппендицита необходим также контроль
за показателями водно-минерального обмена. Чаще всего наблюдается гипонатриемия (в 1—2-е сутки после
операции) и гипокалиемия (3—4-е сутки), особенно у
больных с перитонеальным диализом.
Коррекция нарушений водно-солевого обмена в послеоперационном периоде не отличалась от таковой, проводимой перед оперативным вмешательством.
Обычно в первые сутки после операции, по данным
многих авторов (В. К- Сологуб, 1963; А. Г. Ярмаше-
вич, 1964; В. Н. Шубин, 1965), содержание калия в сыворотке увеличено, что связано с повышенным распадом
4—744
97
белка на фоне угнетения почечной функции. Лаваж способствует выведению калия через брюшину, в связи с
чем необходимы тщательный контроль за содержанием
калия и хлора и своевременная коррекция гипокалиемии.
Это положение имеет важное значение, так как в условиях гипокалиемии возникают нарушение проводимости
миокарда и стойкий парез кишечника.
Успех лечения во многом зависит от рационального
применения антибиотиков. У детей с наличием перитонита необходимо вводить антибиотики широкого спектра
действия (сигмамицин, неомицин, мономицин, канамицин
и др.).
Смена антибиотиков производится в зависимости
от чувствительности микрофлоры. В брюшную полость
по катетеру также вводят антибиотики широкого спектра
действия один раз в сутки в 20—25 мл 0,25% раствора
новокаина.
В тех случаях, когда в брюшной полости остается
катетер для введения антибиотиков его удаляют на
4—5-е сутки после операции. Тампоны необходимо подтягивать со 2—3-х суток и удалять на 5—6-е сутки.
При использовании методов промывания брюшной
полости больному придается полусидячее положение.
При лаваже промывная жидкость вводится в брюшную
полость со скоростью, не превышающей 20—30 капель
в минуту. Увеличение скорости инстилляции приводит,
как правило, к болевым ощущениям и «френикус-симп-
тому».
«Сигарные» дренажи постоянно промокают, поэтому
смена повязок вокруг дренажей требуется через каждые
3—4 ч. Дренажи необходимо 2—3 раза в день осторожно
шевелить, не подтягивая их из раны.
При диализе ввиду хорошего дренирующего эффекта
скорость инстилляции может быть увеличена до 60—70
капель в минуту. К наружным отверстиям желобковых
дренажей присоединяются удлиняющие трубки, отводящие диализат в специальные емкости (рис. 24). Дренаж
необходимо промывать 3—4 раза в сутки форсированным введением жидкости как через микроирригаторы,
так и ретроградно, через дренажи.
Очень важно следить за тем, чтобы количество введенной жидкости примерно соответствовало количеству
выделенной через дренажные трубки. Дефицит не должен превышать 200—300 мл.
'98
Рис. 24. Методика наложения перитонеального «лаважа».
При отсутствии примеси гноя в отделяемой жидкости, уменьшении пареза кишечника, токсикоза и деком-
пенсированных обменных нарушений введение жидкости
в брюшную полость прекращают. Для этого извлекают
микроирригаторы, а дренажи оставляют еще на 2—
3 сут, отсасывая содержимое шприцем. Наиболее целесообразно проводить внутрибрюшинное введение антибиотиков и перитонеальный лаваж в течение первых 3—5
сут после операции. В дальнейшем эффективность этого
лечения снижается, да и надобность в нем чаще всего
отпадает.
Применение длительного промывания брюшной полости после операции дало весьма положительные результаты. У подавляющего большинства больных уже
к концу первых суток отсутствуют жалобы на боли в
животе, у всех отмечено отхождение тазов, у болыдинст-
4*
99
ва детей появляется самостоятельный стул. Исчезает
вздутие живота.
Осложнения, возникающие в связи с применением
«лаважа», зависят в большинстве случаев от нарушения
дренажной функции, слишком свободной фиксации дренажа или вызваны присутствием дренажа, как инородного тела, в брюшной полости. Мы наблюдали следующие осложнения: скопление промывной жидкости в
брюшной полости, образование тазовых абсцессов, непроходимость кишечника, подкожную эвентрацию петли
кишки.
Скопление жидкости в брюшной полости клинически
проявлялось с начала 2—3-х суток жалобами больного
на умеренную тяжесть и чувство распирания в животе.
Брюшная стенка становилась в нижних и боковых отделах отечной и пастозной. При пальпации можно было
обнаружить зыбление в нижней половине брюшной полости. Указанные явления почти не сопровождаются
болезненностью при пальпации живота, протекают без
выраженного подъема температуры и при отсутствии
значительного нарушения пассажа кишечного содержимого. Скопление жидкости в брюшной полости может
произойти вследствие обволакивания дренажей фибрином, чаще всего в том случае, если инстилляция жидкости в брюшную полость проводилась нерегулярно, с перерывами. Осложнение устраняется промыванием
дренажей перекисью водорода посредством шприца и
длинной иглы, вводимой в толщу дренажа в нескольких
местах. Кроме того, дренажи необходимо после распускания 1—2 швов довольно активно подтягивать и вновь
погружать в брюшную полость, производя одновременно
вращение их вокруг длинной оси. Слишком плотное ушивание раны может также вызвать сдавление дренажей.
Устранение этого рода осложнений не отличалось от
описанного выше.
Более серьезной причиной скопления жидкости является высокое расположение дренажей. При этом жидкость, стекающая в нижние отделы брюшной полости,
не удаляется и в дальнейшем может осумковываться.
Другим осложнением, наблюдавшимся у больных в
ходе лаважа, были имбибиция жидкости подкожной
клетчатки и подтекание раствора из ран из-за негерметичного ушивания раны вокруг микроирригатора.
Кроме этого, причиной имбибиции мягких тканей
100
жидкостью может быть подтекание из бокового отверстия трубки, находящейся на уровне брюшной стенки.
Мероприятия по устранению этого осложнения заключались в обязательной ревизии части микроирригатора,
находящегося в раневом канале, с целью установления
наличия высоко расположенных боковых отверстий, в
проталкивании катетера в брюшную полость на 1—2 см
и наложении дополнительных герметизирующих швов.
Если речь шла о дефекте герметизации раны вокруг
«сигарного» дренажа, то приходилось делать ревизию
раны до брюшины с последующим послойным наложением швов.
Третья группа осложнений — частичная эвентрация
сальника или петли кишки — наблюдалась при извлечении «сигарных» дренажей.
Маша Р., 2 лет, оперирована по поводу аппендикулярного перитонита. Наложена система лаважа, при котором отмечено хорошее
выделение жидкости из брюшной полости не только по дренажам,
но и через раны, помимо них. На 3-и сутки инстилляция раствора
прекращена, микроирригаторы удалены, дренажи оставлены. Как выяснилось при ретроспективном анализе, постепенное подтягивание
последних не производилось. Извлечение дренажей (на 5-е послеоперационные сутки) производилось с трудом из-за значительной фиксации их в брюшной полости. При извлечении на них найдены
большие наложения фибрина, к которым справа припаян участок
большого сальника, вышедший наружу вместе с дренажом. Удаление сопровождалось довольно значительным кровотечением из
раны. В образовавшийся зияющий раневой канал шириной 4 см виден большой сальник и инфильтрированный участок кишки, десеро-
зированный и слегка кровоточащий.
Под рауш-наркозом произведено вправление участка сальника
в брюшную полость. После подведения к десерозированному участку тонкой марлевой полоски с мазью Вишневского наложены два
кетгутовых шва на брюшину вместе с мышцами и две шелковые
лигатуры на апоневроз. Наступило выздоровление.
Указанное осложнение связано с оставлением большого зазора между раной и дренажем, а также с форсированным подтягиванием дренажа лишь в момент его
извлечения. При возникновении этого осложнения необходимо вправление эвентрировавшегося органа с
последующим наложением сближающих швов на брюшину вместе с мышцами и апоневрозом.
Применение лаважа там, где он не показан, скорее
относится к тактическим ошибкам, чем к осложнениям.
Лаваж был ошибочно применен у 2 больных.
Славик К., 3 лет, поступил на 4-е сутки от начала заболевания
с жалобами на боли в животе, неоднократную рвоту, учащенное
101
болезненное мочеиспускание. Состояние средней тяжести. Живот
слегка вздут, болезнен в нижней половине его, особенно справа.
Через прямую кишку определяются резкая болезненность и уплотнение.
После соответствующей предоперационной подготовки произведена лапаротомия косым разрезом в правой подвздошной области.
Выделилось значительное количество желтого, прозрачного выпота,
без запаха. Петли кишечника розового цвета, слегка вздуты, не
инфильтрированы, фибринозных наложений нет. Купол слепой кишки не выводится, фиксирован в малом тазу. Рана расширена книзу
и медиально. В малом тазу обнаружен абсцесс, который вскрыт после отграничения брюшной полости стерильными пеленками. В полости абсцесса найден гангренозно измененный червеобразный отросток с перфорационным отверстием. Произведена аппендэктомия.
Осуществлен лаваж во время операции. Справа «сигарный» дренаж подведен в полость абсцесса, слева — в малый таз. Производился послеоперационный лаваж. Общее состояние больного значительно улучшилось уже в первые сутки. По левому дренажу уже
с самого начала отделялся только промывной раствор, по правому—
только густой гной. К началу вторых суток выделение гноя прекратилось, что было расценено как нарушение функции дренажа: после промывания перекисью водорода дренаж стал вновь функционировать, но недолго. Повторные промывания не улучшили дренажные функции. Выделение гноя прекратилось. Ввиду того что общее
состояние больного было близким к удовлетворительному, гнойные выделения прекратились к концу вторых суток. Лаваж отменен.
На 3-и сутки после операции отмечались гипертермия до 39,2*,
боли внизу живота и вздутие его. Первый дренаж подтянут, вслед
за этим выделилось значительное количество густого зловонного
гноя. Дренаж извлечен, между слоями его найдены значительное
количество густого, зловонного гноя, фибрин, сгустки крови. Рана
расширена, промыта раствором перекиси водорода, рыхло тампонирована. Через левый дренаж до 5-х послеоперационных суток продолжалось выделение прозрачной жидкости.
В данном случае характер выпота, отсутствие фибрина, застойных явлений и пареза кишечника противоречат
диагнозу разлитого перитонита, что подтвердилось стерильностью выпота и свободной брюшной полости.
Использование «сигарного» дренажа в данной ситуации
не было оправдано, так как промывной раствор не попадал в полость абсцесса, а густой гной, фибрин и сгустки
крови привели к тому, что дренаж стал играть роль
пробки, препятствующей выходу гноя.
Таким образом, использование послеоперационного
«лаважа» у больных с абсцессами брюшной полости,
ограниченными плотными, организовавшимися спайками,
малоэффективно.
При проведении брюшного диализа больному также
придавалось полусидячее положение. Тщательно контролировалось количество введенной и выведенной жидко¬
102
сти. Задержка раствора в брюшной полости не должна
превышать 300—400 мл. Необходимо регулярное, 3—4
раза в сутки, промывание дренажей. Хорошие дренирую- •
щие свойства позволили определить качественный состав
диализата. Оказалось, что концентрация антибиотика в
растворе до диализа и после практически не изменялась (Л. Я. Бодункова, И. П. Фомина, И. В. Бурков,
1972). Это свидетельствовало о снижении резорбции под
влиянием диализирующей жидкости и поддержании высокой концентрации антибиотиков в брюшной полости.
К 3-м суткам у подавляющего большинства больных
диализ можно было прекратить.
Естественно, что описанные положительные сдвиги
нельзя рассматривать отдельно от комплексной терапии,
однако форсированное вымывание из брюшной полости
значительных количеств гноя и удаление кислых продуктов сыграли положительную роль. Следует отметить, что
прекращение введения жидкости в брюшную полость
вызывало температурную реакцию. Как и К. С. Симонян
(1971), мы расцениваем это явление как реакцию терморегулирующей системы на прекращение охлаждения
брюшины.
По мере улучшения состояния больного внутривенное и внутрибрюшинное введение антибиотиков сменяют
на внутримышечное. Если выздоровление больного
затягивается, возникает необходимость смены антибиотиков, которую производят не чаще 1 раза в 8—10 дней.
Такая методика ведения больных с диффузным и
разлитым перитонитом дает хорошие результаты и является особенно показанной у детей раннего возраста, так
как позволяет регулировать температуру тела больного,
постоянно удалять микробы и продукты распада из
брюшной полости, уменьшить парез кишечника.
Важным звеном в послеоперационном периоде является нормализация функции кишечника. При тяжелом
перитоните парез кишечника нередко держится в течение
нескольких дней. Он сопровождается мучительным для
больного вздутием живота, отрыжкой, повторной рвотой.
При наличии последней в желудок вводят постоянный
зонд, который извлекают через каждые 4—6 ч на 1 —
17г ч для профилактики отита и отдыха больного. Зонд
вводят через носовой ход, предварительно проведя анестезию слизистой 10% раствором новокаина или дикаина. Сам зонд смазывают мазью с дикаином для умень¬
103
шения глоточного рефлекса и позывов на рвоту. Необхо-
димость в зонде отпадает после того, как по нему
перестает отходить застойное желудочное содержимое
зеленого цвета.
Для борьбы с послеоперационным парезом кишок
применяют повторные гипертонические клизмы, подкожно назначают средства, стимулирующие перистальтику
(0,05% раствор прозерина, 0,1% раствор физостигмина
по 0,3—0,5 мл через каждые 6 ч), внутривенно переливают гипертонические растворы глюкозы (15—20 мл
40% раствора), вводят 10% раствор поваренной соли
(10—15 мл) и растворы хлористого калия. Инфузия последнего осуществляется в растворе глюкозы медленно,
капельно. Наиболее безопасная концентрация хлорида
калия — 0,5—0,7%. У лежачего больного необходимо
следить за регулярностью стула, при его задержке раз
в два дня делают очистительную клизму.
В послеоперационном периоде довольно часто возникают нарушения со стороны системы дыхания. В основном они связаны со скоплением слизи в трахео-бронхи-
альном дереве и развитием пневмонии. В этих случаях
для восстановления нормального дыхания, кроме оксигенации, необходимо достаточное обезболивание.
При стойком нарушении бронхиальной проходимости
из-за значительного скопления мокроты показана бронхоскопия под наркозом с последующим отсасыванием
содержимого трахеи и бронхов. Для предупреждения
этих осложнений необходимо больному создать возвышенное полусидячее положение в постели и как можно
раньше начать занятия лечебной физкультурой. Назначаются также откашливающие и разжижающие мокроту
препараты.
Учитывая возможность образования в послеоперационном периоде инфильтратов и абсцессов в брюшной
полости, необходим контроль за температурной реакцией, содержанием лейкоцитов в крови и динамикой щелочной фосфатазы.
У всех больных даже при отсутствии жалоб необходимо периодически производить пальцевое исследование прямой кишки для своевременного выявления тазового инфильтрата или абсцесса, так как применение
антибиотиков сглаживает клинические их проявления.
Перед выпиской всем детям, перенесшим деструктивный аппендицит, делают контрольный общий анализ
104
крови. Повышение температуры, ускорение РОЭ и увеличение количества лейкоцитов и щелочной фосфатазы
указывают на наличие возможного воспалительного
очага в брюшной полости. При стойкой нормализации
температуры после отмены антибиотиков, заживлении
операционной раны, нормальных показателях лабораторных исследований и хорошем общем состоянии ребенок выписывается на амбулаторное лечение.
ПОСЛЕОПЕРАЦИОННЫЕ ОСЛОЖНЕНИЯ
В последние годы отмечается резкое увеличение количества осложнений после деструктивных аппендицитов у
детей. Судя по данным антибиотикограмм, это связано с
повышением резистентности микробов к большинству
антибиотиков (М. Л. Дмитриев, Ю. А. Кузьмичев, 1966;
С. Р. Слуцкая и др., 1966). Процент осложнений значительно выше после аппендэктомий у детей первых трех
лет жизни и в среднем составляет от 10 до 30%, что
связано с более тяжелым течением заболевания и поздним поступлением больных этого возраста в клинику
(Н. Д. Корабельников, 1966; А. Д. Христич, 1966;
С. Н. Стаховская, 1971; Lansden, 1963; Daum е. а., 1969).
Частота и характер осложнений у 330 наших больных
представлены в табл. 7.
Таблица 7
Послеоперационные осложнения
Количество наблюдений
Вид осложнения
абс. число
% к больным
с перфорацией
отростка
(171)
% к числу
всех оперированных
больных
(330)
Инфильтрат брюшной полости
11
6,4
3,3
Абсцесс брюшной полости
7
4,0
2,1
Кишечный свищ
11
6,4
3,4
Кишечная непроходимость
1
0,5
0,3
Инфильтрат послеоперационного рубца
4
2,3
1,2
Всего. . .
34
19,6
10,3
5-744
105
Из приведенных данных следует, что общее количество больных с осложнением после аппендэктомий составляет 10,3% от всех оперированных детей и 19,6%
от больных с гангренозно-перфоративным аппендицитом.
При анализе осложнений у детей с разлитым перитонитом оказалось, что метод послеоперационного промывания брюшной полости позволил значительно снизить
количество осложнений и летальных исходов (табл. 8).
Таблица 8
Местные осложнения и летальные исходы
при различных методах лечения
Осложнения и летальные
исходы
Контрольная
группа
(44 больных)
(до 1966)
Лаваж
(30 больных)
(1966—1969)
Перитонеальный диализ
(36 больных)
(1970—1973)
Инфильтрат и абсцесс брюш¬
ной полости
14
3
2
Кишечный свищ
6
0
0
Ранняя спаечная послеопера¬
ционная непроходимое гь
5
2
1
Затяжное течение перитони¬
та
4
2
1
Летальные исходы
4
0
0
При этом брюшной диализ дает лучшие результаты, так
как он лишен ряда специфических осложнений, характерных для «лаважа», ввиду лучшего дренирования, герметичности ушивания ран и массивности санации.
Диагностика и лечение местных осложнений на фоне
антибактериальной и инфузионной терапии может представлять значительные сложности. Наиболее часто
встречались инфильтраты и абсцессы брюшной полости,
кишечные свищи и непроходимость кишечника.
Инфильтраты брюшной полости встречаются наиболее часто и, по нашим данным, составляют 3,3% среди
всех послеоперационных осложнений у детей раннего
возраста. Нередко инфильтраты достигают больших
размеров, локализуясь в правой подвздошной области
или малом тазу. Клинически они чаще выявляются на
6—9-е сутки после операции, но возможно образование
инфильтрата и в более поздние сроки. Так, у 40% боль¬
106
ных инфильтраты были установлены на 10— 15-е сутки
послеоперационного периода.
Общее состояние больных при развитии инфильтрата
постепенно ухудшается: повышается температура до 38°
и выше, появляются периодические нерезкие боли в животе, иногда отмечаются учащенное и болезненное мочеиспускание и тенезмы. Общее состояние обычно не очень
тяжелое. Количество лейкоцитов, как правило, повышено, и РОЭ ускорена. Явления токсикоза не выражены.
При пальпации живота справа или по средней линии в
нижних его отделах удается установить болезненность,
легкое напряжение мышц и плотное образование без
четких границ. Пальцевое исследование per rectum дает
возможность выявить болезненность передней стенки
прямой кишки и нередко прощупать плотное образование.
При пальпации живота и пальцевом исследовании
через прямую кишку инфильтрат определялся в 60% случаев. Инфильтраты и абсцессы отмечались в основном
при деструктивном аппендиците, осложненном перитонитом, причем инфильтраты в 2 раза чаще были у больных, у которых операция заканчивалась оставлением
марлевого тампона.
При обнаружении инфильтрата во всех случаях назначались антибиотики и физиотерапевтическое лечение
(УВЧ, грелка, тепловые клизмы). Рассасывание инфильтратов наступало обычно в сроки от 6 до 14 дней, но в
18% случаев произошло их абсцедирование, что потребовало оперативного вмешательства.
Абсцесс брюшной полости наблюдался в
2,1% случаев. В зависимости от места расположения
различают абсцесс илео-цекальный, дугласова пространства, межпетлевой и поддиафрагмальный. Наиболее
частой локализацией гнойников является илео-цекальная
область и дугласово пространство. Клинически абсцесс
выявляется обычно на второй неделе послеоперационного периода. При этом состояние ребенка прогрессивно
ухудшается, больного начинает сильно лихорадить, температура принимает гектический характер. Нарастают
явления токсикоза. Дети становятся беспокойными, нередко отказываются от приема пищи, иногда указывают
на наличие болей в животе. Функция кишечника, как
правило, нарушается: может быть парез кишечника, в
некоторых случаях отмечается частый жидкий стул. На
5;
107
пальпацию живота дети начинают реагировать более
болезненно, иногда удается выявить симптомы раздражения брюшины. Наибольшая болезненность и резкое напряжение мышц определяются в зоне расположения
гнойника. В некоторых случаях удается выявить выбухание в этой области. Флюктуации абсцесса через брюшную стенку, а порой и через прямую кишку обычно
установить не удается. При лабораторном исследовании
крови отмечаются резкое увеличение количества лейкоцитов и ускоренная РОЭ.
Чрезвычайную сложность в некоторых случаях представляет дифференциальная диагностика между инфильтратом и сформировавшимся абсцессом. Быстрое
нарастание тяжести состояния, токсикоза, отсутствие
тенденции к снижению температуры, появление более
выраженной локальной мышечной защиты и симптомов
раздражения брюшины говорят об абсцедировании.
Лечение заключается во вскрытии абсцесса через
брюшную стенку или прямую кишку в зависимости от
его локализации. В некоторых сомнительных случаях
возможна предварительная пункция гнойника. После
опорожнения абсцесса рана дренируется. Вскрытие и
дренаж гнойника производятся по общехирургическим
правилам.
Межпетлевые и поддиафрагмальные
абсцессы у детей раннего возраста отмечаются хотя
и редко (0,5%), но являются грозным осложнением.
Обычно они возникают на второй неделе послеоперационного периода, распознавание их чрезвычайно сложно
ввиду глубокого залегания.
Клиническая картина вначале характеризуется общими симптомами: ухудшением состояния, нарастанием
токсикоза, ремиттирующей лихорадкой, рвотой, вздутием
живота и расстройством функции кишечника.
Межпетлевые абсцессы через брюшную стенку, как
правило, не прощупываются, и лишь по месту наибольшей болезненности, локальному напряжению, отечности
и некоторому выбуханию брюшной стенки удается предположить наличие гнойника. В сомнительных случаях
для выявления абсцесса следует прибегать к пальпации
живота под наркозом с применением миорелаксантов.
При поддиафрагмальных абсцессах небольшая болезненность и напряжение отмечаются в верхнем квадрате живота и области реберных дуг, обычно даже
108
поколачивание которых вызывает резкое беспокойство
ребенка. При этом нередко развивается плеврит и появляется кряхтящее дыхание. На рентгеноскопии, которую
всегда следует проводить в послеоперационном периоде
особенно осложненных форм острых аппендицитов, при
наличии поддиафрагмального абсцесса обычно определяют затемнение в области синуса, малую подвижность
и высокое стояние купола диафрагмы.
Диагностированные гнойники должны быть вскрыты.
Хирургические вмешательства ничем не отличаются от
операций, проводимых у детей более старшего возраста.
Необходимо только подчеркнуть, что выполнение этих
операций следует осуществлять обязательно под общим
обезболиванием и рана должна быть самым тщательным
образом отграничена от остальных отделов брюшной
полости марлевыми салфетками. Кроме того, подход к
гнойнику и разделение спаек следует проводить на отграниченном участке в целях предупреждения инфицирования всей брюшной полости.
Кишечный свищ после аппендэктомии у взрослых и детей более старшего возраста является редким
осложнением и составляет десятые доли процента
(В. И. Колесов, 1959; А. И. Ленюшкин и др., 1964;
Г. М. Славина и др., 1966; С. Н. Стаховская, 1971).
В раннем детском возрасте это осложнение встречается
значительно чаще и, по нашим наблюдениям, составило
3,3%.
Во всех наших наблюдениях кишечные свищи сформировались при тяжелых деструктивных аппендицитах
(давность заболевания более 2 сут), особенно при гангренозно-перфоративном аппендиците с периаппендику-
лярным абсцессом (72%), когда производилось тампонирование брюшной полости с оставлением катетера.
Методика обработки культи червеобразного отростка
не играла существенной роли в образовании свищей.
Открывались кишечные свищи обычно в области послеоперационной раны. В таких случаях нередко уже после
удаления тампона в глубине раны можно было увидеть
предлежащие петли кишки, покрытые фибрином. Длительное время отмечалось гнойное отделяемое, раневая
поверхность плохо гранулировала, а затем открывался
свищ. Иногда же кишечный свищ открывался через
сформированный рубец, при этом локально появились
припухлость, покраснение и флюктуация. Одновременно
109
отмечалось повышение температуры и беспокойство ребенка. В последующем степень тяжести состояния ребенка определяется уровнем расположения кишечного свища на кишке: при высоких тонкокишечных свищах наблюдается быстрое истощение, при низких — состояние
ребенка страдает мало.
В большинстве случаев низкие свищи закрываются
самостоятельно и не требуют специального хирургического лечения. Необходимы только санация кожи в области
свища и постоянный туалет раны. Очень важно добиваться ежедневного регулярного акта дефекации через
прямую кишку, для этого необходимы клизмы с гипертоническим раствором, которые усиливают перистальтику толстой кишки и способствуют ее опорожнению.
Высокие тонкокишечные свищи следует закрывать
хирургическим путем, причем оперативное вмешательство необходимо производить сразу же после исчезновения
острых воспалительных явлений вокруг свища, не допуская истощения ребенка. Только при низких свищах с
небольшим отделяемым и толстокишечных свищах не
следует спешить с операцией и закрытие их производят
через 3—4 мес после возникновения.
Кишечная непроходимость в послеоперационном периоде может встретиться как механическая, так
и динамическая. Если спаечная кишечная непроходимость, по литературным данным, у детей старшего возраста колеблется от 0,1 до 4% (Г. А. Баиров и др., 1965;
В. П. Рой, 1966; 3. И. Шваюк, 1966), то у детей раннего
возраста она встречается относительно редко — в 0,3%
случаев. Наши наблюдения показали, что в ближайшем
послеоперационном периоде встречается кишечная непроходимость, как правило, динамического характера.
Парез желудка приводит к нарастанию явлений
интоксикации и к респираторным расстройствам из-за
высокого стояния диафрагмы. Клинически это проявляется одышкой, повторной рвотой желудочным содержимым, редко с примесью желчи, наступающей на 3—4-е
сутки после операции.
При рентгенологическом исследовании определяется
значительное скопление газа в кишечнике, который равномерно распределяется по всем его отделам, могут
отмечаться неглубокие уровни жидкости.
Динамическую непроходимость приходится в основном дифференцировать с механической непроходимо¬
стью. Кроме того, аналогичные симптомы могут иметь
место при прогрессировании перитонита и возникновении
таких осложнений, как инфильтраты и абсцессы. Характер непроходимости устанавливается окончательно после
контрастного рентгенологического исследования, проводимого динамически на протяжении не менее 5—6 ч.
При наличии описанных выше симптомов следует
проводить комплекс консервативных мероприятий, которые при наличии динамической непроходимости оказываются эффективными и являются, таким образом, дифференциально-диагностическим тестом. Эти мероприятия
включают: промывание желудка, внутривенное введение
гипертонических солевых растворов, внутримышечное
введение прозерина, гипертонические клизмы, а при отсутствии эффекта — и сифонные. Положительное воздействие оказывают также паранефральная блокада и
перидуральная анестезия. Для проведения последней в
качестве анестезирующего вещества применяем 1 %
раствор тримекаина в количестве 8—10 мг/кг.
Отсутствие эффекта от указанных мероприятий заставляет подозревать раннюю спаечную непроходимость.
Только в редких случаях при продолжающихся воспалительных явлениях в брюшной полости (вяло текущий
перитонит) парез кишечника консервативным лечением
устранить не удается. При прогрессирующем ухудшении
состояния больного, продолжающемся вздутии живота
в последние годы прибегаем к оперативному вмешательству — наложению гастростомы с декомпрессией желудочно-кишечного тракта путем его интубации. Методика
оперативного вмешательства предложена Ю. М. Дадере-
ром (1971) для лечения острой кишечной непроходимости у взрослых.
После предварительной предоперационной подготовки, промывания желудка и обезболивания (интубационный наркоз) производят релапаротомию. Брюшную полость вскрывают транс- или па-
раректальным доступом слева. Срединного доступа следует избегать в целях предупреждения повторных эвентраций. Выполняется
одномоментная санация брюшной полости промыванием раствором
фурацилина. Через переднюю брюшную стенку в области левого
подреберья трансректально путем небольшого разреза кожи и прокола острым зажимом со стороны брюшной полости в нее проводят
тонкий зонд или трубку из мягкой резины диаметром 0,5—0,7 см с
8—10 отверстиями от начала зонда на протяжении 40—60 см
(рис. 25, а). Общая длина зонда должна быть не менее 1 м. На переднюю стенку желудка в бессосудистом месте накладывают два
шелковых кисетных шва. Производят гастротомию с проведением
Рис. 25. Интубация кишечника через
гастростому.
а — лапаротомия и проведение резиновой
трубки через переднюю брюшную стенку;
б — наложение гастростомы и проведение
трубки в тонкую кишку; в — подшивание
желудка к передней брюшной стенке.
трубки через желудок, двенадцатиперстную кишку и верхний отдел
тощей кишки. На 5—6 см выше последнего отверстия зонд туго
обвязывают кетгутовой нитью и подшивают к ране желудка
(рис. 25, б). Кисетные швы завязывают и вместе с гастротомиче-
ской трубкой выводят на кожу брюшной стенки через ранее сделанное отверстие. Желудок по окружности шелковыми швами подшивают к брюшине в области стомы (рис. 25, в). Некоторые затруднения может вызвать проведение зонда через пилорический отдел желудка. В этих случаях пользуются металлическим проводником,
вставленным в зонд. Особой сложности проведения зонда через две¬
112
надцатиперстную кишку не возникает, если зонд при продвижении
из двенадцатиперстной в тощую кишку упирается в ее стенку, следует, приподняв поперечный ободочный отдел толеЯэй кишки, направить пальцем конец зонда в тощую кишку. Дальнейшее проведение
зонда осуществляется путем нанизывания кишки на зонд. Обычно
бывает достаточно интубации 40—50 см тощей кишки. Дальнейшее
опорожнение из нижележащих отделов кишки происходит путем отсасывания ее содержимого, а затем как по сифону. Операционная
рана зашивается наглухо.
В послеоперационном периоде при затруднении оттока зонд периодически промывается. Рационально 2—3
раза в сутки вводить раствор антибиотиков через зонд,
зажимая его на 15—20 мин. При появлении признаков
перистальтики на 2—3-е сутки после операции зонд
пережимается вначале на 15—20 мин через каждые 1,5—
2 ч, а затем сроки увеличиваются. На 8—10-й день при
благоприятном течении зонд удаляется медленно на
протяжении 5—10 мин. При наличии зонда ребенка можно поить со вторых суток после операции. Чрезвычайно
важно измерять количество выделенного кишечного
содержимого для последующего парентерального восполнения. Необходим также регулярный контроль (не
менее 2—3 раз в сутки) электролитов и белков плазмы
крови со своевременной их коррекцией.
Применение описанной методики обеспечивает, как
правило, гладкое течение тяжелых форм паралитической
непроходимости на фоне вяло текущего перитонита.
С., 2 лет 8 мес, поступил в клинику на 2-е сутки от начала заболевания с явлениями перитонита аппендикулярного происхождения. После предоперационной подготовки произведена аппендэкто-
мия. На операции выявлены явления местного перитонита и вскрывшегося периаппендикулярного абсцесса. После аппендэктомии в
брюшную полость введены антибиотики, к ложу отростка подведен
марлевый тампон. В свободную брюшную полость вставлен резиновый микроирригатор. Послеоперационный период протекал тяжело, нарастали явления динамической непроходимости. На 3-и сутки
у ребенка появилась рвота, живот резко вздут, болезнен, симптом
Щеткина положительный. Перистальтические шумы прослушать не
удается. При подтягивании тампона выделяется гноевидная жидкость. Под масочным наркозом разрезом в левой подвздошной области вскрыта брюшная полость. Выделилось небольшое количество
гноевидной жидкости. К малому тазу подведен «сигарный» дренаж.
Состояние после повторной операции не улучшилось, оставалась
рвота, тахикардия, частый малый пульс, снизилось артериальное
давление (80/50 мм рт. ст.). Явления пареза кишечника и вяло текущего перитонита оставались, несмотря на массивную антибактериальную терапию, общую интенсивную терапию с коррекцией обменных нарушений и борьбу с парезом кишечника (неоднократные сти¬
113
муляции в виде внутривенного введения гипертонических растворов,
прозерина, растворов калия и проведения сифонных и гипертонических клизм). На 4-е сутки после первой операции произведена релапаротомия с интубацией желудочно-кишечного тракта. На операции было отмечено наличие резкого вздутия петель тонкой кишки,
местами в области серозы определялись темные пятна, в просвете
кишки значительное количество газа и жидкого содержимого. В свободной брюшной полости имеется умеренное количество гноевидной
жидкости, на петлях кишки — фибринозные наложения. После санации брюшной полости произведена интубация желудочно-кишечного тракта по описанной выше методике. Операционная рана ушита с оставлением микроирригатора для введения антибиотиков. По
зонду одномоментно отошло около 1 л темного кишечного содержимого, живот значительно спал. Послеоперационное течение гладкое.
На 2-е сутки появилась перистальтика. Дренаж удален на 8-е сутки, гастростома самостоятельно закрылась. Наступило выздоровление.
При механической непроходимости, возникшей в результате спаечного процесса в брюшной полости, клинические проявления заболевания более выражены. Очень
быстро нарастают явления токсикоза и эксикоза, присоединяется неукротимая рвота, боли носят приступообразный характер. Ребенок беспокоен, мечется. Живот вздут,
болезнен, временами активно напряжен, иногда при
внимательном его осмотре удается определить подкожные кишечные валы. Газы и стул отсутствуют. При
обзорной рентгеноскопии отмечается резкое вздутие отдельных петель кишечника. Наряду с этим наблюдается
затемнение брюшной полости. Уровни жидкости обычно
появляются на 2—3-е сутки от начала развития непроходимости. В сомнительных случаях, если позволяет
состояние ребенка, показано контрастное рентгенологическое исследование желудочно-кишечного тракта
взвесью бария. В случае подтверждения диагноза механической непроходимости показано оперативное вмешательство, заключающееся в лапаротомии и устранении
причины непроходимости. В случаях механической непроходимости с явлениями тяжелого вторичного пареза
кишечника считаем целесообразным проведение интубации желудочно-кишечного тракта через гастростому.
При операции необходимо бережное отношение к кишечнику и брюшине. Не следует прибегать к разделению
спаек, не являющихся непосредственной причиной непроходимости.
У детей раннего возраста показания к наложению
энтеростомы должны быть крайне ограничены из-за
быстрого наступления истощения даже при наложении
114
ее на терминальный отдел тонкой кишки. Кишечный
свищ накладывается лишь при непроходимости, обусловленной воспалительным инфильтратом, разделение
которого может повлечь к инфицированию брюшной
полости.
Течение и лечение инфильтратов послеоперационной раны у детей раннего возраста особенностей не представляет. Обычно назначаются антибиотики и физиотерапевтические процедуры (УВЧ,
УФО). При наличии признаков абсцедирования показано вскрытие.
Анализируя характер и частоту послеоперационных
осложнений, мы естественно задумывались над причинами их возникновения. Обращает на себя внимание тот
факт, что наиболее серьезные из них — инфильтраты,
абсцессы брюшной полости и кишечные свищи — наблюдаются лишь при аппендицитах, осложненных перитонитом. Почти во всех этих случаях брюшная полость
зашивалась с оставлением тампона и катетера, но едва
ли это имеет решающее значение в генезе осложнений.
Мы считаем, что основной причиной возникновения
осложнений после*аппендэктомий является наличие высоковирулентной инфекции, о чем свидетельствует
отсутствие чувствительности определяемой флоры к существующим антибиотикам, а также сам факт образования инфильтратов и абсцессов на фоне массивной антибактериальной терапии. Немалую роль в происхождении
осложнений играет и угнетение обменных процессов в
организме, особенно у детей первых лет жизни.
Среди других факторов, способствующих развитию
осложнений, следует назвать нарушение самой техники
оперативного вмешательства (грубые манипуляции, приводящие к травматизации серозного покрова кишки и
брюшной стенки). Не исключена возможность, что определенное значение имеют трофические расстройства со
стороны кишки, например, при длительном пребывании
тампона в полости аппендикулярного абсцесса. В соответствии с этим в профилактике осложнений мы придаем
большое значение следующим моментам: тщательному
механическому промыванию брюшной полости растворами антисептиков, бережным манипуляциям во время
операции (использование влажных салфеток, электроотсоса) и рациональному применению антибиотиков с
учетом чувствительности микрофлоры. Поскольку наибо¬
115
лее тяжелые осложнения связаны с разлитым гнойным
перитонитом, нам представляется весьма перспективным
применение в этих случаях в послеоперационном периоде методов массивного промывания брюшной полости.
Тщательная санация и дренирование брюшной полости, комплексная патогенетически обусловленная консервативная терапия являются тем звеном в лечении больных детей с острым аппендицитом, которые могут
предупредить возникновение тяжелых осложнений после
операции и повысить сопротивляемость макроорганизма
к инфекции.
ЛЕТАЛЬНОСТЬ
Послеоперационная летальность у детей в возрасте
до 3 лет остается очень высокой и колеблется от 2,9 до
12%, т. е. в 20—30 раз больше, чем у детей старшего
возраста (А. П. Богина, 1956; 3. А. Шувалова и
А. Р. Шмелев, 1962; П. Н. Булатов, 1966; А. Л. Ческис и
Н. Д. Градус, 1969; Holder Y. М. е. а., 1963; Salzberge. а.,
1968).
Если в первую половину XX века с внедрением в
практику раннего оперативного метода лечения и антибактериальной терапии летальность упала более чем в
100 раз, то в последние 20 лет подобного снижения
летальности при остром аппендиците, особенно у детей
раннего возраста, не наблюдается.
По данным Г. А. Баирова и Г. В. Чистович (1966),
запоздалая диагностика из-за несвоевременного обращения родителей составляет лишь 9%.
Летальность в нашей клинике от острого аппендицита
составила 1,2% (из 330 перенесших аппендэктомий детей
умерли 4).
Анализ летальных исходов показал, что все эти дети
поступили в клинику с явлениями сильно запущенного
разлитого гнойного перитонита в очень поздние сроки —
на 4—20-е сутки от начала заболевания.
Непосредственными причинами летальных исходов
являлись вяло текущие формы перитонита на фоне сепсиса и иногда кишечных свищей. Торпидность динамики
воспаления была связана с длительным симптоматическим лечением до установления правильного диагноза у
поздно поступивших больных. Обычно применялись
средства, устраняющие желудочно-кишечные расстройства, снижающие температуру, болевые ощущения. Про¬
116
водилась также антибиотикотерапия, обычно препаратами тетрациклина через рот. Указанное лечение стушевывало остроту клинических проявлений, в то же время
существенно не влияя на сам деструктивный и гнойный
процесс. В результате состояние больных несколько
улучшалось, стихали болевые ощущения, снижалась
температурная реакция, становились менее выраженными местные объективные признаки перитонита. Период
временного улучшения через несколько суток сменялся
быстро прогрессирующим нарушением общего состояния, интоксикацией на фоне пареза кишечника. При этом
важно отметить, что выраженного напряжения мышц
передней брюшной стенки не отмечалось. При поступлении в хирургический стационар у этих больных обнаруживались глубокие нарушения белковообразовательной
функции печени, истинная почечная недостаточность,
фазовые сдвиги коры надпочечников, глубокие сдвиги
энергетических процессов. Все это выражалось в резкой
гипопротеинемии, диспротеинемии, гипохолестеринемии,
расстройствах гемодинамики, дезминерализации водных
пространств и глубоких респираторных и метаболических
нарушениях. Приводим одно из наших наблюдений,
отражающее ошибки, допущенные в постановке диагноза
на различных этапах осмотра и лечения ребенка.
Наташа К., 1 года 4 мес, поступила в клинику на 21-е сутки
от начала заболевания. Заболевание началось довольно остро, с
повышения температуры до 30,4°. На 2-й день присоединились частая рвота и жидкий стул. Родители обратились в районную поликлинику, и девочка была госпитализирована уже на 3-е сутки в хирургическое отделение местной больницы для взрослых больных с подозрением на острый аппендицит. Однако вскоре ребенок был переведен в терапевтическое отделение с диагнозом: энтерит. В течение
всего времени пребывания в больнице (18 дней) состояние девочки
оставалось тяжелым, температура держалась на высоких цифрах
(38—39°). Стул в первые 4 дня был жидким, затем нормализовался. Периодически была рвота (1—2 раза в сутки), но в последние
дни она приняла упорный характер. Под рауш-наркозом больная
осмотрена хирургом и урологом. Обнаружена опухоль брюшной полости, в связи с чем девочка доставлена в нашу клинику.
Состояние при поступлении крайне тяжелое: температура 39,6°,
больная вялая, сознание затемнено. Кожные покровы бледные, с
землистым оттенком, сухие. В легких прослушиваются единичные
сухие хрипы, тоны сердца глухие. Пульс 152 у д/мин, среднего наполнения. Живот значительно вздут, напряжен, перистальтика кишечника вялая. На пальпацию живота больная не реагирует. Печень и селезенка увеличены в размерах, выступает из-под реберного края на 4—5 см.
117
Лабораторные данные: ЭКГ — увеличение продолжительности
электрической систолы (Q—Т) до 0,32 с, двухфазность зубца Т, выраженность волны U в прекордиальных отведениях. Белок 3,8 г%,
альбумины 39%, глобулины 61%, А/Г показатель 0,64. Общий холестерин 102 мг%. Натрий плазмы 104 мэкв/л, калий 2,9 мэкв/л. Натрий эритроцитов 89 мэкв/л, калий эритроцитов 94 мэкв/л, pH крови
7,29, BE (—14), ipC02 52 мм рт. ст.
После тщательной предоперационной подготовки в течение 4 ч
девочка была оперирована. На операции обнаружен разлитой гнойный перитонит. После аппендэктомии и осушения брюшной полости
подведены два катетера для инстилляции антибиотиков. Через
контраппертуры в подвздошных областях вставлены марлевые тампоны. Послеоперационный период протекал крайне тяжело, через
15 сут после операции больная умерла. На аутопсии обнаружены
глубокие дистрофические изменения в паренхиматозных органах.
Несмотря на тщательную предоперационную подготовку и массивную терапию, проводимую в послеоперационном периоде, желаемого результата не было достигнуто, так как в органах и тканях
произошли глубокие необратимые дистрофические изменения.
Дети с подозрением на острый аппендицит- должны
наблюдаться в детском хирургическом стационаре. Если
диагноз острого аппендицита остается под сомнением, а
тяжесть состояния больного нарастает, лучше произвести
операцию, так как риск от оперативного вмешательства — неоправданной аппендэктомии — во много раз
меньше риска длительного наблюдения. В этом отношении следует придерживаться принципа «сомневаешься —
оперируй».
Наряду с улучшением диагностики большую роль в
дальнейшем снижении летальности должна сыграть рациональная подготовка к операции, заключающаяся в
устранении эксикоза, токсикоза, гипертермии и вообще
нормализации гомеостаза. По данным ряда авторов,
отсутствие подобной подготовки приводит к увеличению
летальности на операционном столе или в первые часы
после операции (до 16%, по данным Г. А. Баирова н
Г. В. Чистович, 1966).
Одной из важнейших причин торпидно протекающего
перитонита является неэффективность воздействий на
местный процесс. Постоянное всасывание продуктов
воспаления из брюшной полости длительное время после
операции поддерживает интоксикацию, способствует
дальнейшей генерализации инфекции и токсико-септиче-
скому состоянию организма. На аутопсии у всех умерших больных в брюшной полости найдены гной и фибрин.
Показательно, что у этих больных местное лечение ограничивалось лишь фракционным введением небольшой
118
дозы антибиотиков, а иногда оставлением марлевых тампонов. Ни одному из умерших детей не применялся
метод послеоперационного промывания брюшной полости.
Наиболее тяжелую группу составили больные с множественными тонкокишечными свищами на фоне вяло
текущего перитонита. Принимая во внимание погрешности оперативной техники, которые могли способствовать
возникновению кишечных свищей, все же следует отметить, что это осложнение наблюдалось при применении
тампонов и при эвентрации. Низкие репаративные свойства и продолжающееся гнойное воспаление сводили на
нет попытки хирургического закрытия свищей. Свищевые отверстия увеличивались в размерах, больные теряли жидкость, электролиты, ферменты, питательные вещества. При этом, однако, следует еще раз подчеркнуть, что
нарушение техники при операции у маленького ребенка
играет немаловажную роль в течение послеоперационного периода. 'Мы полностью отказались при аппендикулярном перитоните от срединного лапаротомного доступа, так как при нем наиболее часто в условиях инфицирования брюшной полости наблюдается эвентрация.
Грубые манипуляции во время операции в виде осушения
брюшной полости салфетками нередко приводят к интенсивному образованию спаек и развитию в последующем ранней и поздней непроходимости.
Подводя итог сказанному, следует признать, что
успех лечения острого аппендицита у детей раннего
возраста и снижение летальности определяют следующие
основные моменты: 1) ранняя диагностика, своевременная госпитализация и раннее оперативное вмешательство; 2) выявление и коррекция нарушений водно-солевого
обмена и кислотно-щелочного равновесия в предопрера-
ционном периоде, в момент оперативного вмешательства
и после операции у больных с осложненными формами
острого аппендицита; 3) бережные манипуляции на кишечнике во время операции, тщательная и массивная
санация брюшной полости во время операции и в послеоперационном периоде; 4) своевременное выявление
осложнений в послеоперационном периоде и их рациональное лечение.
ЗАКЛЮЧЕНИЕ
Острый аппендицит в раннем детском возрасте является тяжелым заболеванием, диагностика которого вызывает чрезвычайные трудности. Они обусловлены в
первую очередь тем, что в клинической картине преобладают общие симптомы, присущие многим заболеваниям
детей этого возраста. Анамнестические данные и жалобы
больных, позволяющие предположить острый аппендицит, в большинстве случаев отсутствуют или малодостоверны. Только в процессе объективного исследования
можно определить главные симптомы, позволяющие поставить диагноз острого аппендицита.
Однако сложность выявления этих симптомов и преобладание общих признаков нередко приводят к ошибкам и позднему распознаванию истинного заболевания.
Чем меньше возраст ребенка, тем больше выражены
трудности в диагностике. В то же время воспалительный
процесс, развивающийся в червеобразном отростке у
детей раннего возраста, имеет отличия, связанные с анатомо-физиологическими особенностями организма ребенка. Незрелость нервного аппарата обусловливает быстрое развитие и прогрессирование воспаления в отростке;
недостаточность механизмов отграничения (короткий
сальник, слабые пластические свойства брюшины) определяет быстроту перехода процесса на брюшину и развитие перитонита. При этом у детей рано наступают и
быстро прогрессируют обменные нарушения, от которых
во многом зависит исход лечения. Указанные особенности объясняют большое количество осложненных форм
острого аппендицита и довольно высокую летальность у
детей первых лет жизни.
При всем многообразии клинических проявлений
острого аппендицита можно отметить некоторые признаки, встречающиеся с наибольшей частотой. Беспокойное
поведение ребенка, нарушение сна свидетельствуют о наличии боли и отмечаются у большинства больных. Одним
из наиболее постоянных симптомов, наблюдающихся
почти во всех случаях, является повышение температуры
120
до 38—39°, у 2/з больных отмечается повторная рвота
(3—5 раз). Стул чаще нормальный, однако у ряда больных имеются нарушения функции кишечника (у 23,4%).
Указанные симптомы не являются патогномоничными
для острого аппендицита, однако их сочетание позволяет
заподозрить это заболевание.
Решающее же значение в постановке диагноза имеют
данные объективного исследования. Наиболее постоянными и достоверными признаками острого аппендицита
у детей являются болезненность при пальпации и пассивное напряжение мышц в правой подвздошной области.
Эти симптомы — самые ценные, а у маленьких детей нередко единственные, указывающие на локализацию
воспалительного процесса.
Вместе с тем выявление пассивного мышечного напряжения и локальной болезненности у детей раннего
возраста крайне затруднительно. Двигательное беспокойство ребенка, возрастные особенности психики снижают достоверность данных осмотра и затрудняют диагностику.
Учитывая решающее значение для диагностики данных объективного исследования, следует уделять особое
внимание способам их выявления.
При подозрении на острый аппендицит нами предложен метод осмотра и исследования больного после клизмы с хлоралгидратом. Через 15—20 мин после клизмы
наступает сон, снимаются двигательное возбуждение и
эмоциональные реакции. Наиболее же важным и ценным
является то, что после клизмы с хлоралгидратом исчезает активное напряжение и сохраняется defense musculai-
ге. В этих условиях при пальпации у больных с острым
аппендицитом удается четко определить локальную
болезненность, пассивное напряжение, а при перитоните
и симптомы раздражения брюшины.
Опыт применения клизмы с хлоралгидратом свидетельствует о высокой диагностической ценности этого
исследования именно у детей младшей возрастной группы: количество диагностических ошибок сократилось
более чем в два раза, изменился и их характер.
Если до применения клизмы с хлоралгидратом у многих больных, оперированных с диагнозом острого аппендицита, воспалительных изменений не было обнаружено,
то диагноз острого аппендицита, установленный с
помощью хлоралгидратовой клизмы, во всех случаях
121
был подтвержден гистологически. Метод позволил сократить сроки наблюдения больного в стационаре: во всех
случаях диагноз острого аппендицита был установлен
или отвергнут в течение первых двух часов с момента
поступления ребенка в клинику. Таким образом, исследование больного после клизмы с хлоралгидратом является простым, общедоступным и надежным методом,
который при подозрении на острый аппендицит у детей
раннего возраста мы считаем обязательным.
Произведенные нами гистологические исследования
показали, что при остром аппендиците у детей раннего
возраста во всех случаях обнаруживаются воспалительные изменения в мышцах передней брюшной стенки.
Возможно, этим и объясняется стойкий характер мышечного напряжения.
Дифференциальную диагностику острого аппендицита следует проводить с заболеваниями, наиболее часто
встречающимися у детей раннего возраста: острыми
респираторными заболеваниями (27 %), копростазом
(16,1 %), заболеваниями желудочно-кишечного тракта
(9,5%), отитом (8,2%), пневмонией (6,2%) и ангиной
(3,6%). При дифференциальной диагностике острого
аппендицита с перечисленными заболеваниями имеют
значение анамнестические данные, осмотр, перкуссия,
аускультация и другие диагностические приемы. Однако
ведущим методом исследования, позволяющим в сомнительных случаях исключить острый аппендицит у детей
раннего возраста, является осмотр ребенка после клизмы с хлоралгидратом. Во время медикаментозного сна
мышечное напряжение выявляется и при сочетании острого аппендицита с другими заболеваниями (пневмония,
ангина и т. д.).
Лечение острого аппендицита у детей раннего возраста представляет трудную задачу главным образом
потому, что преобладают тяжелые осложненные формы.
Гангренозно-перфоративный аппендицит с перитонитом
отмечается в 50,1% случаев.
Анамнестические данные (длительность заболевания
более суток, повторная рвота, высокая температура, частый жидкий стул) свидетельствуют о тяжелом течении
заболевания. При объективном исследовании выявляются симптомы эксикоза и токсикоза: сухость кожных
покровов и слизистых, частый пульс, низкое кровяное
давление. Определяются разлитое напряжение мышц
122
передней брюшной стенки, болезненность при пальпации,
симптомы раздражения брюшины.
Своевременное выявление этих признаков до операции определяет показания и объем предоперационной
подготовки. Если в неосложненных случаях при установлении диагноза можно сразу же приступить к выполнению аппендэктомии, то больные с осложнениями нуждаются в тщательной подготовке к операции. В противном
случае оперативное вмешательство может усугубить
имеющиеся расстройства и привести к необратимым
сдвигам. Важно выявить до операции не только симптомы интоксикации, но и установить характер обменных
нарушений и их степень. Установлено, что при перитоните у детей первых лет жизни чаще выявляется некомпенсированный метаболический ацидоз. При очень
тяжелом течении заболевания (частые рвоты, жидкий
стул) отмечается метаболический алкалоз. При изучении
водно-солевого обмена обнаруживается выраженная
дегидратация с потерей натрия и хлора.
Проведенные исследования позволили выработать
рекомендации по рациональной предоперационной подготовке и проводить целенаправленную коррекцию имеющихся нарушений.
Предоперационная подготовка индивидуально различна и зависит от степени выраженности нарушений,
однако постоянными ее компонентами являются: а) меры, направленные на борьбу с гипертермией; б) борьба
с токсикозом и эксикозом путем капельного внутривенного введения плазмы, глюкозы и других растворов;
в) коррекция кислотно-щелочного равновесия и нарушений водно-солевого обмена; г) симптоматическая терапия
(сердечные средства, оксигенация, витаминотерапия,
гормоны).
Продолжительность предоперационной подготовки
также определяется индивидуально, но в большинстве
случаев она составляет не более 2—3 ч.
Операция в неосложненных случаях выполняется по
лигатурному методу. Более сложным является оперативное вмешательство при гангренозно-перфоративном
аппендиците и связанных с этим осложнениях. Поскольку широкое применение тампонов при перитонитах часто
являлось причиной кишечных свищей, инфильтратов
брюшной полости, динамической непроходимости, показания к ним были сужены. Тампонирование применя¬
123
лось лишь при отграниченных перитонитах, кровотечении
из ложа отростка при разрушении спаек, а также если
имелись выраженные воспалительные явления в области
купола слепой кишки.
Разлитые формы перитонита требовали массивной
санации брюшной полости как во время операции, таки
в течение нескольких послеоперационных суток. Фракционное введение антибиотиков в небольших дозах и
малом количестве растворителя нередко было недостаточным, что обусловливало значительное количество
местных послеоперационных осложнений. При этих формах воспаления брюшины с успехом применяется метод
длительного промывания брюшной полости, разработанный в клинике. Создание хорошего оттока жидкости,
инстиллируемой в брюшную полость, позволило не только постоянно вымывать гной и другие продукты воспаления, но и длительно поддерживать высокую местную
концентрацию антибиотиков, ускорить восстановление
пассажа по желудочно-кишечному тракту, уменьшить
болевые ощущения. Применение «лаважа» и брюшного
диализа дают лишь минимальные побочные эффекты.
Наблюдающаяся при этом умеренная потеря электролитов и белка легко устранима соответствующей «стандартной» терапией.
Система промывания брюшной полости функционирует в течение 2—4 сут послеоперационного периода в
зависимости от тяжести состояния ребенка и характера
промывной жидкости. Такое воздействие на местный
процесс, особенно перитонеальный диализ, способствовало значительному снижению осложнений со стороны
брюшной полости и уменьшению летальных исходов.
Особенно снизился процент послеоперационных асбцес-
сов и инфильтратов, почти перестали встречаться кишечные свищи, уменьшилось количество больных с ранней
послеоперационной непроходимостью.
В послеоперационном периоде ведется контроль за
изменением кислотно-щелочного равновесия и водно-солевого обмена. Для возмещения энергетических ресурсов
вводится 10% раствор глюкозы, АТФ. Применяются
антибиотики (в тяжелых случаях внутривенно), сердечные средства, проводится переливание крови, плазмы
и т. д. Учитывая значительную нагрузку на функцию коры
надпочечников, применялся короткий курс (4—6 дней)
поддерживающей стероидной терапии.
124
Поскольку промывание брюшной полости способствует гипокалиемии и потере белка, необходим контроль
за содержанием калия и белка крови. Методика обследования и лечения больных с перитонитом, принятая в
настоящее время в клинике, безусловно имеет преимущества над применявшимися ранее.
Таким образом, расширение возможностей диагностики острого аппендицита у детей первых лет жизни,
раннее выявление и коррекция метаболических гидроионных нарушений в пред- и послеоперационном периоде,
а также применение перитонеального лаважа и диализа
при аппендикулярном перитоните позволяют избежать
многих тяжелых осложнений и снизить летальность у
данной группы больных.
ЛИТЕРАТУРА
Авалиани Л. В. Аппендицит у детей. Дисс. докт. Тбилиси, 1971.
Арапов Д. А. Патогенез, клиника и лечение острого аппендицита.—
В кн.: Острый аппендицит, тромбофлебит и некоторые вопросы
пластической хирургии. Куйбышев, 1958, с. 10—21.
Арипов У. А. Операция по поводу перфорации червеобразного отростка в строму яичка у 17-дневного ребенка. — «Хирургия»,
1961, № 2, с. 134—135.
Ахунбаев И. К. Аппендицит детского возраста. Дисс. канд. Фрунзе,
1946.
Ахунбаев И. /(. Аппендицит детского возраста. Фрунзе, 1949.
Баиров Г. А. Перитонит при остром гнойном аппендиците. — В кн.:
Неотложная хирургия новорожденных. Л., Медгиз, 1963, с. 195—
196.
Баиров Г. А., Веревитина Т. П. и др. Послеоперационная спаечная
кишечная непроходимость у детей. — «Вести, хир.», 1965, № 11,
с. 80—84.
Барадулин Г. И. Аппендицит. Дисс. докт. М., 1903.
Бачевская М. А. Инфузионно-капельная экскреторная урография у
детей. Дисс. канд. М., 1969.
Биезинь А. П. Об особенностях острого аппендицита у детей. —
«Тезисы докл. 5-й республиканской научной конференции хирургов Эстонск. ССР». Тарту, 1957, с. 44—48.
Биезинь А. П., Чемс Т. Р. Особенности острого аппендицита у детей
раннего возраста. Материалы докл. Второй Всероссийской конференции детских хирургов. Калининград, 1966, с. 42—43.
Бобров А. А. Аппендицит и его лечение. — «Медицинское обозрение», 1896, т. 46, кн. 16, с. 281—283.
Богина А. Г. Острый аппендицит у детей до 4 лет. — В кн.: Острый
аппендицит, тромбофлебит и некоторые вопросы пластической
хирургии. Куйбышев, 1958, с. 125—127.
Богорад С. Острый аппендицит у детей. — «Нов. хир. арх.», 1938,
т. 41, № 2, с. 232—240.
Бодункова Л. Е., Фомина И. П., Бурков И. В. Всасывание канами-
цина при перитонеальном диализе у детей с разлитым гнойным
перитонитом. — «Антибиотики», 1972, т. 17, с. 658—663.
Бондарь В. А. Патоморфологические изменения в интрамуральном
аппарате червеобразного отростка при остром аппендиците у
детей. Дисс. канд. Харьков, 1956.
Брегадзе И. Л. Острые аппендициты. — «Нов. хир. арх.», 1929, т. 19,
с. 75.
Булатов П. Н., Мифтахов Н. А., Акинфиев А. В. Острый аппендицит у детей до 3 лет. — «Материалы докл. Второй Всероссийск.
конференции детских хирургов». Калининград, 1966, с. 44—45.
Булыгина Н. В. Острый аппендицит у детей младшего возраста. —
«Материалы областной научной конференции по вопросам острой
хирургии заболеваний брюшной полости». Иваново, 1963, с. 38—
42.
126
Булыгина Н. В. Сравнительная оценка лечения перитонитов аппендикулярного происхождения с применением тампонов и без них.
— «Материалы докл. Второй Всероссийск. конференции детских
хирургов». Калининград, 1966, с. 87—88.
Бржозовский А. Г. Аппендицит. Куйбышев, 1960.
Брегадзе И. М. Острые аппендициты. — «Нов. хир. арх.», 1929,
т. 19, кн. 1, с. 75—78.
Бурков И. В. Инфузионная терапия и оперативное лечение разлитого аппендикулярного перитонита у детей. Дисс. канд. М., 1968.
Бурков И. В. К вопросу о патогенезе аппендикулярного перитонита
у детей. — «Материалы 8-й конференции хирургов Сев. Кавказа». Орджоникидзе, 1971, с. 26—27.
Валъкер Ф. И. Развитие органов у человека после рождения. М.,
Медгиз, 1951.
Валькер Ф. Я. Морфологические особенности развивающегося организма. М.—Л., Медгиз, 1959.
Варшавер Р. А. Острый аппендицит у детей раннего возраста. —
«Тезисы и рефераты областной научно-практической конференции». Харьков, 1961, с. 17—18.
Вельтищев Ю. Е. Водно-солевой обмен ребенка. М., «Медицина»,
1967.
Вознесенский В. М. Острый живот. Томск, 1949.
Вознесенский В. П. Неотложная хирургия детского возраста. —
В кн.: «Острый живот. Руководство для врачей». М., 1944.
Волкович Н. М. К вопросу о разрезах брюшных покровов при чревосечении. — «Врач», 1898, № 5, с. 123—125.
Ворохобов Л. А., Костомарова Г. А. Диагностика и клиника острого аппендицита у детей раннего возраста. — «Педиатрия»,
1962, № 5, с. 65—70.
Ворохобов Л. А., Костомарова Г. А. Особенности диагностики острого аппендицита у детей раннего возраста. — «Труды 2-й Украинской научно-практической конференции хирургов детского возраста». Одесса, 1963, с. 42—44.
Вулырсон С. Я. Особенности воспаления среднего уха у детей грудного и раннего возраста. — «Мед. сестра», 1966, № 3, с. 20—23.
Горохов Д. Е. Учебник детской хирургии. М., 1913.
Градаускас Я. К. Особенности течения острого аппендицита у детей раннего возраста по данным больницы. — «Тезисы докл.
2-й научно-практической конференции». Вильнюс, 1963, с. 93—94.
Греков А. А. К лечению аппендицита. Избранные труды. Л., 1952.
Г уз А. А. К вопросу об аппендицитах в грудном возрасте. —
«Журн. по изучению раннего детского возраста», 1925, № 8,
с. 446—456.
Гундобин Н. П. Строение кишечника у детей. М., 1891.
Давыдов П. Д. К этиологии, патогенезу, клинике детских аппендицитов и аппендикулярных перитонитов. Махачкала, 1940.
Давыдовский Я. В. Аппендицит. Перитонит. — В км.: «Патологическая анатомия и патогенез болезней человека». Т. 2, М., 1958,
с. 346—394.
Даугирдас Т. Диагностика и лечение воспаления среднего уха в
грудном возрасте. — «Тезисы докл. 7-й республиканской конференции врачей педиатров Литовск. ССР». Вильнюс, 1963,
с. 122—123.
Двужильная Е. Д. Клиника и морфология острого аппендицита.
Киев, 1964.
12^
Дедерер Ю. М. Патогенез и лечение острой кишечной непроходимости. М., 1971.
Дергачев И. С. О строении и функции аппендикса в грудном возрасте и об аппендиците. — «Журн. по изучению раннего детского возраста», 1932, т. 12, кн. 11—12, с. 438—448.
Дмитриев М. Л., Топу зов В. С. Некоторые вопросы диагностики и
лечения острого аппендицита у детей до 3 лет. — «Клин, хир.»,
1966, № 4, с. 43—46.
Долецкий С. ЯКучегурова М. М. Некоторые вопросы лечения острого аппендицита у детей. — «Хирургия», 1962, № 6, с. 81—89.
Долецкий С. Я., Ленюшкин А. И. Аппендицит. — В кн.: Гнойно-воспалительные заболевания новорожденных». М., 1965, с. 203—205.
Дронов А. Ф. Аппендицит в грудном возрасте. — В кн.: «Современные вопросы хирургии детского возраста». М., 1965, с. 209—213.
Дронов А. Ф. Трудности диагностики острого аппендицита у детей
в грудном возрасте. — В кн.: Аппендицит. Киев, 1966, с. 190—
193.
Еланский И. Н. Нейрорефлекторная теория происхождения аппендицита. — «Воен.-мед. ж.», 1952, № 7, с. 8—13.
Жданов Д. А. Общая анатомия и физиология лимфатической системы. М., 1952.
Забегальская 3. К. Течение и исходы экспериментального аппендикулярного инфильтрата. — «Экспер. хир.», 1971, № 3, с. 23—24.
Зайченко И. Л., Уткин Г. И., Воронин Г. Н. Распознавание и лечение острого аппендицита у детей. Киев, «Здоров’я», 1966.
Захарова Г. И. Изменение нервного аппарата червеобразного отростка при его воспалении у детей. Дисс. канд. Саратов, 1950.
Захарова Г. И. Изменения нервного аппарата червеобразного отростка при аппендиците у детей. — «Труды Саратовск. мед. ин-та,
посвящ. памяти С. Р. Миротворцева». Саратов, 1953, с. 83—94.
Иванов Г. Ф. Основы нормальной анатомии человека. Т. 1—2. М.,
Медгиз, 1949.
Иоффе И. Л. Хирургическая анатомия артерий червеобразного отростка. — «Вести, хир.», 1937, т. 54, кн. 141, с. 55—62.
Исаков П. Ф., Маневич А. 3., Климкович И. Г., Гранова Л. ВГо-
ровая Г. П. Аппендикулярный перитонит у детей. — «Материалы
докл. Второй Всероссийск. конференции детских хирургов». Калининград, 1966, с. 17—23.
Исаков Ю. Ф., Бурков И. ВДронов А. Ф. Коррекция метаболических нарушений при аппендикулярном перитоните и его оперативное лечение у детей. — «Труды 10-й научной конференции хирургов Эстонской ССР, посвящ. 50-летию Советской власти».
Таллин, 1967, с. 184—185.
Исакова Е. И. Особенности строения червеобразного отростка и
морфологические изменения его при разных клинико-анатомических формах аппендицита у детей. — «Нов. хир. арх.», 1958,
№ 1, с. 70—74.
Кабанец Н. И. О клиническом течении отитов и отоантритов у детей раннего возраста в зависимости от этиологии. — «Ж- ушн.,
нос. и горл, бол.», 1964, № 6, с. 29—34.
Кавуненко И. А. Возрастная морфология лимфатических сосудов и
лимфатических фолликулов слепой кишки и червеобразного придатка человека. — «Материалы Седьмой научной конференции
по вопросам возрастной морфологии, физиологии и биохимии».
М., 1965, с. 76—77.
128
Казанская И. В. Клинико-рентгенологическая диагностика хронического пиелонефрита у детей. Дисс. канд. М., 1970.
Капланский С. Я. Минеральный обмен. М.—Л., Медгиз, 1938.
Кашина Т. П. Значение урологической патологии при болях в животе, симулирующих острый аппендицит у детей. Дисс. канд. М.,
1971.
Керницкая Н. С., Буда А. С. К казуистике перфоративного аппендицита у новорожденных. — «Клин, хир.», 1972, № 2, с. 62.
Кирик М. Ф. Гистопатология нервных элементов червеобразного отростка при аппендиците (Протоколы заседания Моек. хир. об-ва
от 2*3/1 V 1936 г.). — «Сов. хир.», 1936, № 8, с. 357.
Киселев В. И. Дифференциальная диагностика острого аппендицита
у детей. Дисс. канд. М., 1955.
Коен Я. И. Некоторые мысли об остром аппендиците у детей, —
«Вестн. хир.», 1934, т. 32, с. 95—96.
Кокочашвили М. И. Неотложная хирургия брюшной полости у детей. Тбилиси, 1956.
Корабельников И. Д. Осложнения острого аппендицита у детей. —
«Материалы докл. Второй Всероссийск. конференции детских хирургов». Калининград, 1966, с. 84—85.
Краснобаев Т. П. Случай воспаления червеобразного отростка у
5-месячного ребенка, окончившийся смертельным перитонитом.—
«Детская медицина», 1902, № 4, с. 60—62.
Краснобаев Т. П. О так называемом остром аппендиците у детей.—
«Вестн. хир.», 1935, т. 40, кн. 112—ИЗ, с. 106—112.
Кузьмичев Ю. А. Результаты лечения гнойного разлитого перитонита аппендикулярного происхождения у детей. — «Материалы
докл. Второй Всероссийск. конференции детских хирургов». Калининград, 1966, с. 100—101.
Кулик П. П. К анатомо-клинической характеристике червеобразного
отростка у детей. — «Врач, дело», 1957, № 7, с. 733—736.
Лайков А. Г. Острый аппендицит у детей по материалам клиники.—
«Здравоохр. Белоруссии», 1956, № 4, с. 31—33.
Ленюшкин А. И. О методике обработки культи червеобразного отростка при аппендэктомии у детей. — «Хирургия», 1960, № 2,
с. 75—81.
Ленюшкин А. И. Методика обработки культи червеобразного отростка при аппендэктомии у детей. Дисс. канд. М., 1961.
Ленюшкин А. И. Заживление культи червеобразного отростка после
аппендэктомии разными методами в эксперименте. — «Экспер.
хир.», 1964, № 1, с. 53-54.
Ленюшкин А. И., Ворохобов Л. АСлуцкая С. Р. Острый аппендицит у детей. М., «Медицина», 1964.
Лившиц А. В. Определение электрической активности мышц передней брюшной стенки при остром аппендиците. — «Экспер. хир.»,
1963, с. 31—36.
Майзель С. Н. Возрастные особенности строения нервных элементов червеобразного отростка. — «Труды кафедры нормальной
анатомии Ташкентск. мед. ин-та». Ташкент, 1953, с. 61—71.
Маклецов Г. П. Особенности течения аппендицита в детском возрасте. — «Труды научной конференции Ростовск.-на-Дону мед.
ин-та», 1957, с. 707—709.
Мангейм А. К симптоматологии и диагностике детского аппендицита. — «Врач, дело», 1928, № 21, с. 1670—1674.
129
Маневич А. 3. Педиатрическая анестезиология с элементами реанимации и интенсивной терапии. М., «Медицина», 1970.
Мокрицкий Ф. Е. Случай засорения песком, смешанным с известью,
червеобразного отростка слепой кишки, последовательное воспаление брюшины и смерть. — «Воен.-мед. ж.», 1875, 122. № 4,
с. 376—379.
Мондор Г. Аппендицит. — В кн.: Неотложная диагностика. М., 1939,
с. 44—134.
Иеймарк И. И., Камардин Л. Н. Диагностика и лечение острых заболеваний органов брюшной полости. Барнаул, 1963.
Нисевич Н. И. К вопросу об ангинах у детей первого года жизни.—
«Вопр. охр. мат.», 1961, т. 6, № 4, с. 37—43.
Носов С. Д. Респираторные вирусные инфекции в раннем детском
возрасте. — «Вести. АМН СССР», 1966, № 7, с. 30—36.
Овчинников А. А., Бурков И. В. Разлитой гнойный перитонит у детей (Предоперационная подготовка и послеоперационная терапия). М., 1972.
Огнев Б. В. Тончайшие кровеносные сосуды червеобразного отростка и их клиническое значение. — «Вести, хир.», 1935, т. 40,
с. 112—113.
Огнев Б. В. О значении фолликулярного аппарата в патологии червеобразного отростка. — «Вести, хир.», 1938, т. 55, № 5, с. 577—
580.
Острый аппендицит. Под ред. В. И. Колесова, Л., 1959.
Панушкин В. С. Острый аппендицит в раннем детском возрасте. —
«Тезисы докл. Ленинградск. педиатрического ин-та, 4-й научной
сессии». Л., 1953, т. 60.
Пашерстник Л. А., Штенгольд Е. Ш. Проблема анестезии при аппендикулярном перитоните у детей. — «Материалы докл. Второй Все-
российск. конференции детских хирургов». Калининград, 1966,
с. 24—30.
Першхава А. А. Случай острого аппендицита у новорожденного. —
«Педиатрия», 1960, № 10, с. 77—78.
Петров Б. А. Заключительное слово председателя на 1-й Всерос-
сийск. конференции хирургов. — В кн.: Острый аппендицит,
тромбофлебит и некоторые вопросы пластической хирургии. Куйбышев, 1958.
Пивень И. И. Острый аппендицит у новорожденного. — «Хирургия»,
1962, N2 6, с. 128.
Попов А. П. К вопросу о механизме возникновения защитного напряжения мышц брюшной стенки при остром аппендиците в эксперименте.—«Труды 1-й Украинск. научно-практической конференции детского возраста». Киев, 1963, с. 53—56.
Поркшеян Н. И. Флегмонозный перфоративный аппендицит у младенца 23-дневного возраста. — «Педиатрия», 1960, № 5, с. 63.
Прокопова Л. В. Острый аппендицит у детей. Дисс. канд. Одесса,
1959.
Рассуждай Н. И. Защитное напряжение мышц живота при остром
аппендиците. — В кн.: Актуальные вопросы грудной и брюшной
хирургии. Киев, 1965, с. 136—137.
Рогалъский Б. А. Об инволюции червеобразного отростка. — «Вести,
хир.», 1928, № 12, с. 35—36.
Рой В. П. Спаечная кишечная непроходимость после аппеидэктомии
у детей. — В кн.: Аппендицит. Киев, 1966, с. 230—236.
Ростовцев М. И. Учение о перитифлите. СПб., 1902.
130
Русаков А. В. К вопросу об этиологии, патогенезе и классификации
Аппендицита. — «Хирургия», 1952, № 5, с. 83—84.
Садыков Н. М. Острый гангренозно-перфоративный аппендицит у
ребенка 6 месяцев. — «Вести, хир.», 1955, т. 76, № 8, с. 116.
СаидалиевлА. И. Возрастные особенности слепой кишки, червеобразного отростка, их сосудов и нервов. Дисс. канд. Л., 1956.
Симонян К. С. Перитонит. М., «Медицина», 1971.
Славкина Г. М., Козлов Ю. А. Острый аппендицит у детей. — Труды Саратовск. мед. ин-та». Саратов, 1964, т. 43, с. 79—86.
Славкина Г. М., Козлов Ю. А., Ярмашевич А. Г. Осложнения острого аппендицита у детей. — «Материалы докл. Второй Всерос-
сийск. конференции детских хирургов». Калининград, 1966,
с. 85—86.
Слуцкая С. Р. Клиника острого аппендицита у детей. — «Педиатрия». 1940, № 2—3, с. 68—71.
Слуцкая С. Р. Развитие фолликулярного аппарата червеобразного
отростка и частота аппендицита у детей. — «Труды 6-го Всесо-
юзн. съезда детских врачей». М., 1948, с. 465—466.
Слуцкая С. Р., Кучегурова М. М„ Стехина Л. Г., Размахова В. И.
Осложнения при остром аппендиците у детей. — «Материалы
докл. Второй Всероссийск. конференции детских хирургов». Калининград, 1966, с. 89—90.
Смоликова В. И. Клиника и лечение ангин у детей раннего возраста. — Сборник научных работ Московск. детск. гор. клин,
больницы им. Н. Ф. Филатова. М., 1964, с. 184—187.
Сологуб В. К. Нарушения водного и электролитного обмена при
перитоните и методы их нормализации. — «Труды объединенных
краевых конференций хирургов и онкологов». Красноярск, 1963,
с. 66—71.
Стаховская С. Н. Осложнения и летальность при остром аппендиците у детей, их причины и пути предупреждения. Дисс. канд.
М., 1971.
Счастливцева Л. И., Горкавченко Р. В. Особенности острого аппендицита у детей ясельного возраста. — «Материалы докл. Второй Всероссийск. конференции детских хирургов». Калининград,
1966, с. 45-46.
Таренецкий А. И. К значению слепой кишки и червеобразного отростка в практическом и антропологическом отношениях. —
«Врач», 1883, т. 23, кн. 4, с. 353—355.
'Герновский С. Д. Клиника острого аппендицита у детей. — «Вести,
хир.», 1936, т. 48, кн. 129, с. 27—33.
Терновский С. Д. Особенности диагностики и лечения острого аппендицита у детей. — В кн.: Острый аппендицит, тромбофлебит
и некоторые вопросы пластической хирургии. Куйбышев, 1958,
с. 114—120.
Терновский С. Д. Аппендицит. — В кн.: Хирургия детского возраста. М., 1959, с. 348—370.
Топографо-анатомические особенности раннего возраста. Вып. 1.
Под ред. Ф. И. Валькера. М.—Л., Медгиз, 1936.
Турнер Г. И. К анатомии слепой кишки и червеобразного отростка
в отношении патологии перитонита. Дисс. СПб., 1892.
Уткин Г. И. К вопросу о ретроцекальных аппендицитах. Дисс. канд.
Донецк, 1948.
131
Фасанович А. Л. Типовая и возрастная анатомия слепой кишки и
червеобразного отростка у грудных детей и их значение в патогенезе аппендицита. — «Сов. пед.», 1935, т. 45, № 4, с. 18—24.
Фердман Д. Л. Биохимия. М., 1962.
Хонду А. А. Особенности течения аппендицита у детей.гЛ — «Вести,
хир. им. Грекова», 1936, т. 47, кн. 127, с. 35—43.
Храмов Р. Н. Перитонит на почве перфоративного аппендицита у
6-дневного ребенка. — «Педиатрия», 1964, № 11, с. 66—67.
Христич А. Д. Особенности течения острого аппендицита у детей
раннего возраста. — В кн.: Аппендицит. Киев, 1966, с. 193—203.
Христич А. Д. Клиническое и патоморфологические особенности течения острого аппендицита у детей раннего возраста. — «Материалы докл. Второй Всероссийск. конференции детских хирургов». Калининград, 1966, с. 43—44.
Хромов Б. М. Острый аппендицит у детей. — В кн.: Острый аппендицит. Под ред. В. И. Колесова. Л., 1959, с. 18—22.
Чистович Г. В. Острый аппендицит у детей в возрасте до 3 лет.—
В кн.: Острый аппендицит, тромбофлебит и некоторые вопросы
пластической хирургии. Куйбышев, 1958, с. 121 —125.
Шаак В. А. Острый аппендицит у детей. — «Вести, хир.», 1935,
т. 40, кн. 112—113, с. 99—105.
Шварц Н. В. Об остром аппендиците в детском возрасте. — «Врач,
газета», 1929, № 5, с. 291—295.
Шваюк 3. И. Профилактика спаечной кишечной непроходимости
после аппендэктомии. — «Материалы докл. Второй Всероссийск.
конференции детских хирургов». Калининград, 1966, с. 76.
Ширшин С. А. Случай острого аппендицита у 2-месячного ребенка. — «Педиатрия», 1962, № 4, с. 86.
Шор Л. М., Томчин Я. Н., Седнев Н. А. Патогенез, клиника и лечение острого аппендицита у детей. — «Материалы докл. Второй
Всероссийск. конференции детских хирургов». Калининград, 1968,
с. 5-13.
Шувалова 3. А., Шмелев А. Г. Особенности течения острого аппендицита у детей раннего возраста. — В кн.: Вопросы хирургии
детского возраста. Сборник работ Свердловск, мед. ин-та. Вып.
37. Свердловск, 1962, с. 156—163.
Шубин В. Н. До- и послеоперационный период. Казань, 1965.
Шуринок А. Р. Пути снижения летальности при остром аппендиците у детей раннего возраста. Материалы докл. Второй Всероссийск. конференции детских хирургов. Калининград, 1966, с. 102—
103.
Шуринок А. Р., Ситковский Н.Б., Третьякова Е.И., Зарубина Ю.Ф.
Острый аппендицит у детей до 3 лет. — В кн.: Аппендицит, Киев, «Здоров’я», 1966, с. 202—206.
Элькин Я. А. О лигатурном методе обработки культи червеобразного отростка. — Сборник научных трудов Харьковск. мед. ин-та.
Харьков, 1958, с. 50—55.
Ярмашевич А. Г. Изменение содержания Na и К в плазме и эритроцитах при некоторых видах обезболивания у детей. — «Материалы конференции молодых научных работников Саратовск.
мед. ин-та». Саратов, 1964, с. 152—154.
Abt J. A. Appendicitis in infants. — “Arch. Pediat.”, '1917, v. 34,
p. 641—657.
132
Allen P. D. Acute appendicitis in children. — “Am. J. Surg.”, 1942,
v. 55, p. 495—499.
Aschoff L. Die Wurmfortsatzentzundung. Eine pathologisch-histologi-
sche und pathogenetische Studie. Jena, 1908, S. 114.
Aschoff L. Der appendicitische Anfall seine Atiologie und Pathoge-
nese. Berlin, 1930, 125 S.
Bartlett R. H., Eraklis A. J., Wilkinson R. H. Appendicitis in infancy. — „Surg. Gynec. Obstet.”, 1970, v. 130, p. 99—104.
Benson C. D., Coury JHagge D. R. Acute appendicitis in infants.
Fifteen year study. „Arch. Surg.”, 1952, v. 64, p. 561—570.
Benson C. D. Appendicitis. In: Pediatric Surgery, Chicago, 1962, v. 2,
p. 790—801.
Bertrand L. L’appendicite aigue chez l’enfant. — “Concours med.”,
1959, v. 81, p. 3921—3924.
(Braja C., Crivda S.) Блажа К., Кривда С. Теория и практика
оживления в хирургии. Бухарест, 1963.
Bunion G. L. Acute appendicitis in infancy and learly childhood —
“Brit. med. J.”, 1953, v. 2, p. 71—73.
Campbell M. Hydronephrosis in infants and children. — ,,J. Urol.
Baltimore”, 1951, v. 65, p. 734—747.
Collins D. C. Historic Phases of appendicitis. — „Ann. Surg.”, 1931,
v. 94, p. 179—196.
Collins D. C. 71 000 human appendix specimens. A final report, summarizing forty years’ study. — „Am. J. Proctol.”, 1963, v. 14,
p. 265—281.
Creese P. G. The first appendectomy. — “Surg. Gynec. Obstet.”, 1953,
v. 97, p. 643—652.
Daum R., Hecker W. C., Tessmar /. Appendicitis perforata im San-
glings- und kindesalter. Ergebnisse der Behandlung von 585 Fallen der Jahre 1943—1968. — „Munch, med. Wschr.”, 1969, Md. Ill,
S. 2193—2197.
Deaver J. M. Acute appendicitis in children. — “Ann. Surg.”, 1952,
v. 136, p. 243—249.
Dupuytren. Lesons orales de la clinique chirurgicale faites a l’Hotel—
dieu de Pasis. V. 3. Paris, 1833, p. 516.
Eufrate S. A., Gordon D. L. Acute appendicitis in children. Study of
consecutive cases. — “N. Y. St. J. Med.”, 1964, v. 64, p. 2981—2987.
Galluzzi W., Gianelli A. L’appendicite acuta nei primi anni di vita.—
“Minerva pediat.”, 1952, v. 4, p. 350—366.
Goyens. Цит. no Abt. J. (1917).
Gross R. E. The surgery of infancy and childhood. Philadelphia, 1958.
Hofmann S., Schmidt H. D. Zur Problematik der perforierten. Appendicitis in den ersten vier Lebensmonaten. — “Z. Kinderchir.”,
1972, Bd 11, suppl., s. 117—122.
Holder T. M., Leape L. L. The acute surgical abdomen in children.—
“New Engl. J. Med.”, 1967, v. 277, p. 921—923.
Howland /. Цит. no Abt. J. (1917).
Firor H. V., Myers H. A. P. Perforating appendicitis in premature
infants. — “Surgery”, 1964, v. 56, p. 581—583.
Fitz R. Perforating inflammation of the vermiform appendix. — „Am.
J. Med.”, 1886, v. 92, p. 321.
Foster J. H., Edwards W. H. Acute appendicitis in infancy and childhood: a twenty year study in a general hospital. — “Ann. Surg ”,
1957, v. 146, p. 70—77.
Fredell С. H. Appendicitis in an infant due to an ingested foreign
body. — “Arch. Surg.”, 1964, v. 88, p. 209—212.
Jacobson S. S. Childhood appendicitis. — “Am. J. Dis. Child.”, 1942,
v. 63, p. 1110—1122.
Керпель-Фрониус Э. Патология и клиника водно-солевого обмена.
Будапешт, 1964.
Koch Р. Appendizitis wahrend ersten zum Lebensjahre. — „Medizinis-
che”, 1959, N 4, S. 141—143.
Kollermann M. W., Aprin R., Szymanska H. Zur Diagnose der Appendicitis acute des Sauglings und Kleinkindes. — “Z. Kinder-
chir.”, 1967, Bd 4, S. 22—28.
Kranlein. Uber die operative Behandlung der acutenm diffusern jauchi-
geitrigen Peritonitis. — “Arch. klin. Chir.”, 1866, Bd 33, S. 507.
Kuhlmayer R. Die St6rungen der Elektrolytstruktur bei Ileus und
Peritonitis. — „Wien. klin. Wschr.”, 1960, Bd 72, S. 41—42.
Ladd W. E., Gross R. E. Abdominal surgery of infancy and childhood.
Philadelphia — London, 1941.
Lansden F. Acute appendicitis in children. — “Am. J. Surg.”, 1963,
v. 106, p. 938—942.
Liechti R. E„ Snyder W. H. Acute appendicitis under age two. —
“Am. Surg.”, 1963, v. 29, p. 92—96.
Mac Burney C. The indications for early laparotomy in appendicitis. — “Ann. Surg., 1891, v. 13, p. 233.
McCosh. Acute appendicitis in infancy. — “J. Am. Med. Ass.”, 1904,
v. 28, p. 857.
Maddox J., Johnson W., Sergeant C. Appendectomies in a children’s
hospital. — „Arch. Surg.”, 1964, 89, p. 223—225.
Matterstock С. K. Perityphlitis. — “In: C. Gerhardt. Handbuch der
Kinderheilk. Tubingen, 1880, Bd. 4, Abt 2, s. 893—915.
McLauthlin С. H., Packard G. B. Acute appendicitis in children. —
“Am. J. Surg.”, 1961, v. 101, p. 619—625.
McLauthlin С. H., Packard G. B. Acute appendicitis in children.—
“J. Pediat.”, 1958, v. 52, p. 324—328.
Occhipinti S., Magliulo V. L’appendicite acute nel bambino. Conside
razioni zu 160 casi (con 7 figure nel testo). — “Chir. ital.”, 1959,
v. 11, p. 123—146.
Ombredanne L. Precis clinique et operatoire de chirurgie infantile. Paris, 1925.
Parsons /. M.f Miscall B. GMcSherry С. K. Appendicitis in the
newborne infant. — “Surgery”, 1970, v. 67, p. 841—843.
Pester G. H. Congenital absence of the vermiform appendix. — “Arch.
Surg.”, 1965, v. 91, p. 461—462.
Richter H., Lorenz D., Coldeway T. Zur Differentialdiagnose der Appendizitis im Kindesalter. — “Arch. Kinderheilk.”, 1966, Bd 174,
s. 37—44.
Ricker G. Nerves of vessels and local disturbances of circulation; law
of degrees, stasis, leuko- and erythrodiapedesis; second reply to
tannenberg and Fisher. — “Frankfurt. Z. Path.”, 1926, Bd 33,
s. 428—453.
Salzberg A. M., White N. К. Current mortality appendicitis in infants
and children. — “Am. J. Surg.”, 1968, v. 115, p. 651—652.
Schaupp W., Clausen E., Ferrier P. Appendicitis during the first
month of life. — „Surgery”, 1960, v. 48, p. 805—811.
134
Schiitze U., Daum R., Tessmar J. Die Problematik der Appendicitis
im Sauglings- und Kindesalter. — „Arch. klin. Chir.”, 1972, Bd 330,
s. 259—272.
Scott II. W., Ware P. E. Acute appendicitis in childhood. — “Arch.
Surg.” 1945, v. 50, p. 258—268.
Shinaberger J. HTomsovic E. J., Butz W. C. Fatal acute appendicitis
in a fifteen-day-old infant. — “J. Pediat.”, 1957, v. 51, p. 422—
428.
Smith R. M. Anesthesia for infants and children. St. Louis, 1968.
Snyder W. H., Chaffin L. Appendicitis during first 2 years of life.—
„Arch. Surg.’’, 1952, v. 64, p. 549—560.
Sprengel 0. Appendititis. Stuttgart, 1906.
Stanley-Brown E. The diagnosis of acute appendicitis in infants and
children. — ,,G. P. (Kansas)”, 1960, v. 21, p. 124—128.
Stauber R., Wurditsch H. Dir Appendizitis in Sauglings- und Klein-
kinderallcr. — “Wien. med. Wschr.”, 1962, Bd 112, s. 997—981.
(Tnsnvsky V., Vychytil О. V.) Тошовский В., Вихитил О. Острые
процессы м брюшной полости при врожденных аномалиях у детей. М, Медгп.ч, 1957, Мер. с чешек.
Treves. Цнт. по ,1. Snyder, L. Shaffin (1952).
Walker R. //. Appendicitis in the newborn infant. — J. Pediat.”, 1957,
v. 51, p. 429 431
Wengensteen ()., Dennis C. Experimental proof of the obstructive
origin of appendicitis in man. — “Ann. Surg.”, 1939, v. 110,
p. 629—647.
Zak R. Nevole M. Apendikalni peritonitidy u deti ve veky do dvou
let. — “Csl. Pediat.”, 1961, v. 16, s. 1064—1069.
ОГЛАВЛЕНИЕ
Введение 3
Глава I. Особенности хирургической анатомии правой подвздошной области у детей раннего возраста . 5
Глава II. Этиология, патогенез и патологическая анатомия
при остром аппендиците у детей в возрасте до
3 лет 16
Глава III. Клиника и диагностика ... 26
Некоторые статистические данные 26
Клиническая симптоматология . 29
Клиническое течение .... 50
Глава IV. Дифференциальная диагностика 55
Глава V. Лечение 67
Патофизиология перитонита . 70
Предоперационная подготовка 74
Обезболивание .... 86
Оперативное вмешательство . 87
Послеоперационное лечение . 95
Послеоперационные осложнения 105
Летальность ... . . 116
Заключение . 120
Литература 126
Степанов Эдуард Александрович, Дронов Анатолий Федорович
ОСТРЫЙ АППЕНДИЦИТ У ДЕТЕЙ РАННЕГО ВОЗРАСТА
Редактор А. Ф. Бухны. Художественный редактор О. А. Четверикова
Корректор Л. В. Кудряшова Техн. редактор Я. И. Людковская
Сдано в набор 30/IV 1974 г. Подписано к печати 25/VI 1974 г.
Формат бумаги 84ХЮ87з2 печ. л. 4,25 (условных 7,24 л.)
7,99 уч.-изд. л. Бум. тип. № 2. Тираж 15 000 экз. Цена 42 коп. МБ-55
Издательство «Медицина», Москва, Петроверигский пер., 6/8
Заказ 744. Московская типография № 32 Союзполиграфпрома
при Государственном комитете Совета Министров СССР
по делам издательств, полиграфии и книжной торговли.
Москва, К-51, Цветной бульвар, д. 26,