Текст
ХИРУРГИЧЕСКИЕ
БОЛЕЗНИ
В двух томах
Под редакцией
B.C. Савельева, А.И. Кириенко
Учебник
с компакт-диском
Москва
Издательская группа «ГЭОТАР-Медиа»
2006
ХИРУРГИЧЕСКИЕ
БОЛЕЗНИ
Под редакцией
B.C. Савельева, А.И. Кириенко
Учебник
с компакт-диском
Рекомендовано УМО по медицинскому
и фармацевтическому образованию
вузов России в качестве учебника
для медицинских вузов
■»■! .1;,, _ .
Москва
Издательская группа «ГЭОТАР-Медиа»
2006
Том 2
УДК 617.5(075.8)
ББК 54.5я73
Х50
Рецензенты:
Шойхет Я.Н. — зав. кафедрой факультетской хирургии с курсом хирургии
ФПК и ППС им. И.И. Неймарка ГОУ ВПО Алтайский государственный
медицинский университет, проф., чл.-кор. РАМН.
Луцевич Э.В. — профессор кафедры хирургических болезней и новых
эндохирургических технологий ГОУ ВПО Московский государственный
медико-стоматологический университет, чл.-кор. РАМН.
Х50 Хирургические болезни: учеб.: в 2 т. / под ред. B.C. Савельева,
А.И. Кириенко. - 2-е изд., испр. - М.: ГЭОТАР-Медиа, 2006. -Т. 2.
- 400 с.: ил.
ISBN 5-9704-0153-6 (т. 2)
ISBN 5-9704-0154-4 (общ.)
В учебнике, предназначенном для студентов медицинских вузов,
изложены вопросы этиологии, патогенеза, диагностики и лечения
распространенных хирургических заболеваний; отражены некоторые общие
вопросы хирургии, знание которых необходимо для восприятия курса
хирургических болезней. Для лучшего усвоения учебного материала
прилагается компакт-диск, содержащий краткий анатомический атлас,
контрольные тесты и задачи, схему написания истории болезни и вариант
программированного экзамена.
Том II посвящен торакальной, сердечно-сосудистой и эндокринной
хирургии, а также заболеваниям молочных желез.
УДК 617.5(075.8)
ББК 54.5я73
Права на данное издание принадлежат издательской группе «ГЭОТАР-Медиа».
Воспроизведение и распространение в каком бы то ни было виде части или целого
издания не могут быть осуществлены без письменного разрешения
издательской группы.
© Коллектив авторов, 2005
ISBN 5-9704-0153-6 (т. 2) © Иллюстрации. Воскресенский П.К., 2005
ISBN 5-9704-0154-4 (общ.) © Издательская группа «ГЭОТАР-Медиа*, 2006
Аббревиатуры 7
ЧАСТЬ III. Торакальная хирургия 8
Глава 24. Травма груди (В.А.Черкасов) 8
Глава 25. Доброкачественные заболевания
и повреждения пищевода (М.Ф. Черкасов, Ю.М. Старцев) 26
Глава 26. Рак пищевода {М.Б. Скворцов, Е.Г. Григорьев) 56
Глава 27. Нагноительные заболевания
легких и плевры (Е.Г. Григорьев) 67
Глава 28. Рак легкого (В.И. Чиссов, А.Х. Трахтенберг) 91
ЧАСТЬ IV. Сердечно-сосудистая хирургия 121
Глава 29. Врожденные пороки сердца
и крупных сосудов (Ю.Л. Шевченко, В.Г Гудымович) 121
Глава 30. Приобретенные
пороки сердца (Ю.Л. Шевченко, В.Г. Гудымович) 137
Глава 31. Перикардиты
(Ю.Л. Шевченко, А.Д. Кучеренко, С.А. Матвеев) 156
Глава 32. Ишемическая
болезнь сердца (Ю.Л. Шевченко, И.А. Борисов, А.Н. Блеткин) 166
Глава 33. Хирургическое лечение
аритмий (A.M. Кириенко, В.Г. Гудымович) 172
Глава 34. Острая артериальная
непроходимость (И.И. Затевахин, М.Ш. Цициашвили) 179
Глава 35. Хронические облитерирующие заболевания
аорты и ее ветвей (И.И. Затевахин, М.Ш. Цициашвили, В.Н. Золкин) 196
Глава 36. Аневризмы аорты и магистральных
артерий (И.И. Затевахин, М.Ш. Цициашвили, А.В. Матюшкин) 211
Глава 37. Острые венозные
тромбозы (B.C. Савельев, В.В. Андрияшкин) 227
Глава 38. Тромбоэмболия
лёгочных артерий (А.И. Кириенко, А.А. Матюшенко) 261
6 ♦ Хирургические болезни ♦ Оглавление
Глава 39. Хроническая венозная недостаточность
нижних конечностей (A.M. Кириенко, Р.А. Григорян) 283
ЧАСТЬ V. Эндокринная хирургия 310
Глава 40. Зоб (A.M. Шулутко) 310
Плава 41. Опухоли надпочечников (В.Н. Егиев) 332
ЧАСТЬ VI. Хирургия молочных желёз 342
Глава 42. Острый мастит (А. П. Чадаев, А.А. Зверев) 342
Глава 43. Дисгормональные заболевания
молочных желёз (Д.Д. Пак, С.К. Джубалиева) 361
Глава 44, Рак молочной железы (Д.Д. Пак, В.В. Евтягин) 372
Рекомендуемая литература 395
Предметный указатель 396
АД — артериальное давление
АКТГ — адренокортикотропный гормон
ИБС — ишемической болезни сердца
КТ — компьютерная томография
МРТ — магнитно-резонансная томография
СВ — сердечный выброс
ТЗ — трийодтиронин
Т4 — тироксин
ТТГ — тиреотропный гормон
ТЭЛА — тромбоэмболия лёгочной артерии
УЗИ — ультразвуковое исследование
ЦНС — центральная нервная система
ЧСС — частота сердечных сокращений
ЭКГ — электрокардиография
Травма груди включает в себя повреждения грудной клетки и
органов грудной полости. Учение об этом разделе хирургии как
самостоятельной проблеме сформировалось лишь в последние
десятилетия XX века, хотя интерес к ней прослеживается на протяжении всей
истории медицины. Особенности современного травматизма в
условиях роста дорожно-транспортных происшествий, падений с
высоты, техногенных катастроф, локальных военных конфликтов,
террористических актов с использованием взрывных устройств выдвигают
травму груди, в особенности сочетанную, на одно из первых мест по
тяжести течения и числу неблагоприятных исходов.
Основные черты патологии
Патологические изменения, возникающие при травме груди,
включают весь спектр механических повреждений тканей грудной
клетки и органов грудной полости: от сотрясения и ушиба до
разрывов, переломов, размозжений и ранений (мягкие ткани грудной
стенки, рёбра, лёгкие, бронхи, перикард и сердце, крупные сосуды,
диафрагма, нервные стволы и др.). Эти изменения в тканях и органах
относятся как к прямым повреждениям, возникающим в месте
приложения силы, так и к травме рёбер, лёгочной ткани, сосудов,
возникающим в отдалении. Они могут быть изолированными (один орган
или одно ребро) или множественными (несколько рёбер, ранение
лёгкого и перикарда, лёгкого и диафрагмы и т.п.).
Анатомические особенности грудной клетки, органов средостения
и лёгких в определённой мере отражаются на характере их
повреждений, диагностике и лечебной тактике. По строению рёбра имеют вид
дуг, слегка наклонённых книзу. Сдавление грудной клетки в передне-
заднем направлении нередко вызывает переломы как в области
прямого приложения силы, так и в зоне сгибания или даже с
противоположной стороны (рис. 24-1). Все рёбра взрослых, кроме I и II, на всём
протяжении имеют губчатое строение, заполнены красным костным
Рис. 24-1. Варианты переломов рёбер в зависимости от места приложения
силы при закрытой травме груди.
мозгом. Поэтому в месте перелома всегда возникает гематома, даже
если межрёберные сосуды не повреждены. Объём такой гематомы
составляет в среднем 100 мл. Это позволяет легко рассчитать общую
кровопотерю при множественных переломах рёбер.
Особенностью травмы груди является и то, что рёберный каркас,
защищающий органы груди от внешних воздействий, в ряде случаев
становится источником вторичных их повреждений отломками
рёбер, при этом чаще всего страдают лёгкие. Состояние лёгких после
травмы во многом определяется стороной повреждения (правое или
левое лёгкое) и обусловлено шириной бронхов, начиная с главного,
углами их отхождения и длиной. Слева условия для вентиляции
всегда хуже, чем справа, так же, как и для эвакуации крови и мокроты из
просвета бронхов, поэтому опасность развития ателектаза и
пневмонии всегда больше.
Органы средостения достаточно хорошо защищены от
травматических воздействий. И всё-таки характерная горизонтальная
конфигурация груди с позвоночным столбом, выступающим кпереди
почти на треть передне заднего поперечника грудной клетки, иногда
создаёт условия для типичных повреждений главных бронхов и
начального отдела нисходящей аорты как раз у позвоночного столба.
Это чаше случается у молодых людей при «локальных», но достаточ-
10 Ф- Хирургические болезни -О Том 2 О- Часть III ♦ Глава 24
но интенсивных ударах (дети — на качелях, молодые люди — в
дорожно-транспортных происшествиях).
Функции органов, заключённых в грудной полости,
многообразны, но главными из них являются дыхание и кровообращение. В
основе всех патофизиологических нарушений при травме груди лежат
кардиореспираторные расстройства, они требуют неотложной
профилактики и лечения. При торакальной травме эти нарушения чаще
всего являются взаимообусловленными. Они и сегодня остаются
главными причинами смерти каждого третьего пострадавшего с сочетан-
ными повреждениями груди, хотя 15% погибших не имеют абсолютно
смертельных поражений. Расстройства дыхания, возникающие при
травме груди, развиваются в результате нарушения дыхательных
экскурсий рёбер и диафрагмы, коллабирования лёгочной ткани за счёт
крови или воздуха, скопившегося в плевре, непосредственного
поражения лёгких или бронхов. Во всех случаях это сопровождается
гипоксией, значительным повышением лёгочного сосудистого
сопротивления и гипертензией малого круга кровообращения, что ограничивает
венозный возврат к левому предсердию. Страдает диастолическая, а
затем и систолическая функция левого и правого желудочков.
Непосредственное повреждение сердца ещё более снижает СВ.
Одним из самых серьёзных синдромов, развивающихся при
травме груди, является шок. Он обусловлен, прежде всего,
множественным характером поражения органов. Прямое травматическое
воздействие на широкую сеть нервно-сосудистых образований, включая
структуры вегетативной нервной системы, регулирующие функции
кардиореспираторного комплекса, ещё более увеличивает «шоко-
генность» травмы. Наиболее выраженные изменения гемодинамики
отмечаются на 2-е и 3-й сутки после травмы. Именно в этот период
достигают максимума расстройства вентиляции и газообмена,
обусловленные поражениями лёгких и бронхов.
Независимо от причины поражения, у пострадавших при травме
груди формируется несколько типичных синдромов, определяющих
диагностику, тактику лечения и характер типичных осложнений.
Главными среди них являются пневмоторакс, гемоторакс, подкожная
эмфизема и эмфизема средостения. Они имеют свои особенности при
различном характере травмы.
Гемоторакс — скопление крови в плевральной полости.
Источником кровотечения могут быть сосуды межреберий или
повреждённого лёгкого. Принято различать малый гемоторакс — кровь в пределах
рёберно-диафрагмального синуса, средний — скопление крови от угла
Травма груди ♦ 11
до уровня середины лопатки, большой — уровень крови выше
середины лопатки. Гемоторакс, возникающий в связи с повреждением
лёгких или бронхов, почти всегда сопровождается скоплением
воздуха в плевральной полости и коллапсом лёгкого, т.е. развитием ге-
мопневмоторакса. Только при нетяжёлых закрытых травмах возникает
пневмоторакс без гемоторакса. Основная опасность этого
осложнения при закрытой травме — возможность формирования клапанного
пневмоторакса. Он развивается тогда, когда дефект в лёгком не
слишком велик и воздух поступает в плевральную полость лишь при
кашле, разговоре, реже — при вдохе. На выдохе же путь выхода воздуха
из плевральной полости в бронхи оказывается закрытым
своеобразным клапаном (спадающаяся рана лёгкого или лоскут плевры,
который прикрывает дефект в момент выдоха). В результате лёгкое кол-
лабируется за счёт избыточного давления воздуха в плевральной
полости, органы средостения смещаются в противоположную
сторону, происходит сдавление крупных сосудов, прежде всего полых вен,
что является основной причиной тяжёлых кардиореспираторных
расстройств, возникающих в этот момент.
Проявлениями травмы лёгкого или крупных бронхов являются
также эмфизема средостения и подкожная эмфизема. Они
развиваются чаще при заращённой плевральной полости (вследствие
предшествующих болезней или травм) и возникают тогда, когда
повреждение лёгкого или бронха расположено близко к корню, на участках,
прикрытых медиастинальной плеврой, или в зоне переломов
рёбер, отломками которых повреждаются внутригрудная фасция,
плевральные листки и лёгкое. При массивном и быстром поступлении
воздуха может возникнуть ситуация, обозначаемая как
«напряжённая медиастинальная эмфизема», чреватая сдавлением крупных
венозных стволов (лёгочные и полые вены) и уменьшением притока
крови к сердцу.
Подкожная эмфизема может быть ограниченной,
распространённой и тотальной. Распространённая подкожная эмфизема и эмфизема
средостения без напряжения серьёзной угрозы для жизни больного
не представляют, так как не вызывают существенных
кардиореспираторных расстройств.
Открытые повреждения груди подразделяют на непроникающие и
проникающие. Последние характеризуются нарушением
целостности париетальной плевры, независимо оттого, имеются сращения
лёгкого с грудной стенкой в зоне ранения или нет. При непроникающих
ранениях повреждаются лишь мягкие ткани грудной стенки. Они от-
12 ♦ Хирургические болезни 4- Том 2 ♦ Часть III ♦ Глава 24
носятся чаще всего к категории лёгких, хотя иногда и могут
сопровождаться значительной наружной кровопотерей. Проникающие
ранения всегда опасны в связи с возможностью травмы органов
грудной клетки, брюшной полости и забрюшинного пространства. Для
проникающих ранений патогномоничны те же синдромы, что и при
закрытых травмах. Однако механизмы их возникновения,
клиническая картина и тактика лечения несколько иные.
Источником кровотечения и формирования гемоторакса при
открытой травме груди могут быть межрёберные сосуды, внутренняя
грудная артерия, сосуды лёгкого, средостения и раны сердца.
Следует отметить, что количество определяемой в момент исследования
крови не всегда даёт основание определить источник кровотечения и
сформулировать тактику лечения. Решающее значение иногда
приобретает темп кровопотери, определяемый по количеству крови,
вытекающей по дренажам за 1 ч.
Характерным признаком проникающего ранения груди является
открытый пневмоторакс. Он возникает, когда рана груди достаточно
широка, раневой ход идёт в зонах груди с относительно небольшой
толщиной мышц (нижняя передняя и нижняя задняя области груди),
а по отношению к грудной стенке — в радиальном направлении.
Воздух в плевральную полость попадает на вдохе через рану, на выдохе
он частично выходит обратно. С каждым вдохом давление в
плевральной полости стремится к выравниванию с атмосферным давлением
за счёт коллабирования лёгкого. Расстройства дыхания и
кровообращения при этой ситуации также могут стать угрожающими, хотя они
менее выражены, чем при напряжённом пневмотораксе. Возможно
формирование и клапанного механизма, когда воздух в плевру
поступает через рану, которая приоткрывается на вдохе и оказывается
«прикрытой» в момент выдоха за счёт смещения слоев мышц вслед за
экскурсией рёбер. Формирование клапанного пневмоторакса
возможно и при ранении лёгкого, когда воздух в плевре накапливается по
тому же механизму, что и при закрытой травме.
Классификация
Характер травмы груди:
• закрытая;
• открытая (проникающая): ранения колото-резаные,
огнестрельные; слепые, сквозные.
Травма грули ♦ 13
Состояние костного скелета:
• повреждения рёбер, грудины или позвоночника;
• без повреждений.
Повреждение внутренних органов:
• ранения лёгкого, трахеи, бронхов, сердца, крупных сосудов,
непарной вены, грудного протока, пищевода;
• отсутствуют.
Осложнения:
• пневмоторакс: открытый, закрытый, клапанный, напряжённый;
• эмфизема: подкожная, медиастинальная;
• ателектаз лёгкого;
• пневмония;
• респираторный дистресс-синдром;
• гемоторакс: малый, средний, большой (тотальный);
• тампонада сердца;
• хилоторакс;
• абсцесс лёгкого, эмпиема плевры, гнойный медиастенит.
Диагностика
■■:
Определение характера повреждений при травме груди
основывается на планомерном и тщательном физикальном обследовании
больного, применении необходимых инструментальных методик,
использовании лабораторных исследований и средств медицинской
визуализации (рентгенологических, ультразвуковых и др.). Всё это
должно обеспечить правильную диагностику в период первичного
обследования больного или в максимально короткие сроки и
установление всех характеристик полученной больным травмы.
При клиническом обследовании следует обратить внимание на
обстоятельства травмы и динамику развития болезненных
проявлений. При этом врачу следует быть наиболее внимательным в случаях
раннего обращения пострадавшего и относительно нетяжёлого его
состояния, так как многие опасные синдромы могли просто ещё не
сформироваться.
Жалобы на боли в груди, усиливающиеся при вдохе, движениях и
кашле, характерны для повреждений рёберного каркаса. Появление
нелокализованных болей на стороне поражения, не стихающих при
изменении положения тела, и беспокойное поведение больного чаще
свидетельствуют о наличии крови в плевральной полости. Острое на-
14 ♦ Хирургические болезни О Том 2 ♦ Часть III ♦ Глава 24
чало боли и постепенное её «притупление» наряду с нарастающей на
этом фоне одышкой заставляют предположить наличие
пневмоторакса. Одышка и затруднённое дыхание имеют место практически всегда,
их стихание спустя 2—3 сут не должно успокаивать внимание врача,
т.к. и в этом случае необходимо полноценное обследование больного.
Нарушения гемодинамики идентичны при различных видах
поражений, они требуют к себе самого пристального внимания. Очень
важны использование и комплексная оценка физикальных,
электрофизиологических и ультразвуковых методик.
При обнаружении подкожной эмфиземы всегда следует обращать
внимание на локализацию её в яремной ямке, на шее, появление
осиплости голоса, что свидетельствует о развитии эмфиземы средостения.
Несмотря на сложность оценки результатов перкуссии и аускульта-
ции, особенно при обширной подкожной эмфиземе, они должны
проводиться. Особое внимание следует уделять границам
средостения, характеру изменений тонов сердца и дыхания не только на
стороне поражения, но и на контрлатеральной.
У 15% госпитализированных в стационар по поводу травмы груди
имеются повреждения органов брюшной полости, поэтому физикаль-
ное обследование живота также обязательно. Необходимо
внимательное изучение локализации ран, однако расположение раны само по
себе не может быть основополагающим для исключения тех или иных
внутригрудных или сочетанных поражений внутренних органов, так
как характер использующихся сегодня средств и приёмов нанесения
ран нередко непредсказуем. Тем более это невозможно при
огнестрельном характере ранения.
Широкое использование лабораторных методов повышает точность
диагностики. Речь идёт не только о стандартном определении
количественных показателей крови, позволяющих оценить кровопотерю.
Имеющиеся сегодня в клиниках приборы дают возможность
объективно оценить степень насыщения крови кислородом, следить за
быстро меняющимися пульсом и АД. Методы мониторного
наблюдения позволяют зарегистрировать изменения сократительной
способности миокарда и нарушения центральной гемодинамики.
Обследование больного обязательно включает рентгенологическое
исследование. Начинать его следует с рентгенографии грудной
клетки в двух проекциях (обзорный снимок и боковые снимки правой и
левой сторон). Этого в большинстве случаев бывает достаточно,
чтобы установить диагноз или обосновать необходимость
дополнительных исследований. Обширную информацию о характере поражений
Травма груди ♦ 15
внутренних органов при множественных повреждениях даёт КТ, Ею
иногда и завершают обследование.
В последние годы всё шире стали использовать УЗИ. Оно
позволяет неинвазивным способом выявить, прежде всего, наличие и
характер скоплений крови (и сгустков) в плевральной полости, их
локализацию, сопутствующий пневмоторакс. Методика применима
даже у больных, находящихся в бессознательном состоянии, когда
провести полипозиционное рентгенологическое обследование
сложно. Ещё более информативен этот метод для выявления скоплений
крови в полости перикарда.
В экстренных ситуациях при стремительном ухудшении
состояния больного и клинической картине пневмоторакса полезной
оказывается плевральная пункция, которая носит в этом случае не только
диагностический, но и лечебный характер. При подозрении на
тампонаду сердца вследствие кровотечения в полость перикарда, что
проявляется резким снижением АД, быстрым и значительным
повышением центрального венозного давления и значительным
ослаблением тонов сердца, пункция перикарда становится совершенно
необходимой. Место для пункции плевральной полости выбирают с учётом
данных физикального и рентгенологического исследований.
Пункции перикарда проводятся в типичных точках (рис. 24-2).
Торакоскопия необходима для установления факта
продолжающегося кровотечения в плевральную полость и выявления источника
кровотечения. Её также используют в качестве способа
хирургической остановки кровотечения путём электрокоагуляции или клипиро-
вания сосудов. При невозможности выполнить подобные манипуляции
эндоскопическим способом торакоскопия позволяет чётко
аргументировать показания к торакотомии. Торакоскопия всегда
заканчивается эвакуацией крови и дренированием плевральной полости.
Бронхоскопия и эзофагоскопия в диагностике внутригрудных
поражений показаны при обоснованных подозрениях на разрыв
главных бронхов и повреждение пищевода.
Необходимость дифференциальной диагностики основных
патологических синдромов травмы груди в остром периоде возникает
редко. Наиболее часто в этой стадии допускаются ошибки в
распознавании разрыва левого купола диафрагмы с перемещением желудка в
грудную полость в связи с тем, что воздушный пузырь желудка над
уровнем жидкости, иногда располагающийся на уровне угла лопатки
и выше, принимают за гемопневмоторакс. У больных, перенёсших
ранее травмы или плевриты с обширными плевральными изменени-
16 ♦ Хирургические болезни О Том 2 О Часть III О- Глава 24
Рис. 24-2. Методика пункции
перикарда. Прикосновение иглы к
эпикарду вызывает выраженные
изменения ЭКГ. Стрелкой
указана типичная точка введения
иглы.
ями, рентгенолотическая картина иногда напоминает малый или даже
средний гемоторакс. Методически правильно выполненное
рентгенологическое исследование, контрастирование пищевода и желудка
позволяют устранить все сомнения.
Лечение
Лечебная тактика при травме груди определяется тяжестью
состояния пострадавшего, выраженностью нарушений дыхания и
кровообращения, характером повреждений, прежде всего рёберного
каркаса и органов грудной полости. Во всех случаях основными задачами
являются ликвидация опасных для жизни состояний, восстановле-
Травма груди О 17
ние целостности и функций поражённых органов, профилактика
осложнений. Дискуссия о тактике лечения (консервативные методы
или «максимально хирургические») разрешилась в последние годы
в пользу всё более широкого использования эндоскопических
методик. Это позволяет сформулировать основной тактический принцип:
лечение пострадавших при травме груди должно быть активным, с
применением малотравматичных способов устранения основных
патологических синдромов и своевременным выполнением по
обоснованным показаниям торакотомии. Обязательным должно быть
строгое обоснование как показаний к торакотомии, так и отказа от неё.
Особенности патологических синдромов, возникающих при
закрытой и открытой травмах груди, требуют лечебных мероприятий,
ориентированных на каждый из этих видов поражений.
Закрытая травма груди
При закрытой травме груди, особенно сочетанной, жизнеугрожа-
ющие состояния обусловлены нарушениями проходимости верхних
дыхательных путей вследствие скопления в них мокроты, рвотных
масс или крови, компрессией лёгких при скоплении в плевре крови
и воздуха или из-за нарушений экскурсии грудной клетки в связи с
множественными переломами рёбер. Во всех случаях имеет место
выраженный болевой синдром. При развёрнутой картине
сердечнососудистой и дыхательной недостаточности лечение начинается с
восстановления проходимости дыхательных путей путём интубации
трахеи и бронхоскопии.
Обязательно проводится обезболивание. При переломе одного или
двух рёбер это возможно путём введения местных анестетиков в
место перелома или за счёт паравертебральной блокады межреберий выше
и ниже повреждённого ребра (рёбер) либо с помощью вагосимпати-
ческой блокады. При множественных переломах рёбер эта методика
не даёт надёжного результата. Её применяют только в период
транспортировки больного в специализированный стационар, где может
быть осуществлена перидуральная блокада с оставлением катетера в
перидуральном пространстве для повторного введения анестетиков.
Клинические проявления напряжённого пневмоторакса диктуют
необходимость выполнения пункции и дренирования плевральной
полости. Кардиореспираторные нарушения в остром периоде
купируют введением сердечньрс средств и дыхательных аналептиков, плаз-
мозамещающих растворов, ингаляцией кислорода. Лечение гемото-
18 ♦ Хирургические болезни ♦ Том 2 О- Часть III ♦ Глава 24
ракса и пневмоторакса может быть осуществлено повторными
пункциями или дренированием плевральной полости. Лучшие результаты
удаётся получить путём выполнения лечебной торакоскопии уже в
момент госпитализации пострадавшего в стационар. В процессе
выполнения этой процедуры можно осуществить остановку
кровотечения, герметизацию небольших дефектов лёгкого, удалить все сгустки
крови и установить дренажи таким образом, чтобы они наиболее
эффективно обеспечивали эвакуацию воздуха и экссудата из
плевральной полости.
Широкая торакотомия при закрытой травме груди должна быть
выполнена в связи со следующими обстоятельствами.
I. Гемостатические показания: 1) продолжающееся внутриплев-
ральное кровотечение; 2) внутриперикардиальное кровотечение с
развитием тампонады сердца; 3) кровоизлияния в клетчатку
средостения со сдавлением воздухопроводящих путей, смещением и сдав-
лением магистральных кровеносных сосудов.
II. Аэростатические показания возникают при безуспешном
откачивании пневмоторакса и беспрерывном его восстановлении,
несмотря на дренажи и постоянно действующую эндоплевральную
аспирацию. В особо срочном порядке надо оперировать пострадавших
с напряжённым пневмотораксом, сопровождающимся смещением
средостения, нарастающей эмфиземой последнего и развитием эк-
страперикардиальной тампонады сердца.
III. Дополнительные показания: 1) повреждение диафрагмы; 2)
прогрессивное ухудшение состояния пострадавшего, несмотря на
применение комплекса консервативных мероприятий.
Из «частных» проблем лечения закрытой травмы груди следует
отметить переломы рёбер и грудины, травмы лёгких, сердца,
разрывы крупных сосудов и бронхов.
Переломы рёбер и грудины
Основное требование при лечении пострадавших с переломами
рёбер — эффективное обезболивание. Это необходимое условие даже
при одиночных переломах, особенно у лиц, страдающих
хроническим бронхитом. Неустранённая боль и вследствие этого
неэффективный кашель способны в очень короткие сроки осложнить течение
травмы обострением гнойно-воспалительных процессов в бронхах и
лёгких. Сложную проблему представляет лечение «флотирующих
переломов». Как правило, они являются показанием к длительной ИВЛ.
Травма груди ♦ 19
Переломы грудины обычно редко требуют специальных приёмов
репозиции или оперативных вмешательств. При эффективном
обезболивании путём введения анестетиков в место перелома и
укладывании больного на валик отломки «встают» на место.
Повреждения лёгких
Повреждения лёгких при закрытой травме груди представлены
ушибами, гематомами и разрывами. Первые две формы требуют
проведения всех мероприятий, улучшающих проходимость бронхов. Для этого
необходимы ингаляции аэрозолей, содержащих бронхолитики, муко-
литики и антисептики. Показаны периодические санационные
бронхоскопии с введением в просвет бронхов смесей этих же препаратов.
Более сложной проблемой лечения являются разрывы лёгкого.
Наличие разрывов само по себе ещё не является показанием к торакото-
мии, так как раны лёгкого склонны закрываться достаточно быстро
самостоятельно или вследствие применения менее травматичных
методик (коагуляция, клипирование, наложение швов через торакопорт
под контролем торакоскопии). Лечение начинают с эффективного
дренирования плевральной полости и контроля за восстановлением её
герметичности. Степень герметичности плевры оценивают по сбросу
воздуха через дренажи. Возможны три варианта: а) воздух выходит при
каждом вдохе; б) воздух выходит при разговоре; в) воздух выходит
только при кашле. По изменению условий «продувания» можно сделать
заключение: идёт процесс восстановления герметичности лёгкого или
нет. При отсутствии каких-либо положительных сдвигов или при
отрицательной динамике используют методику расправления лёгкого
путём временной окклюзии поролоновым обтуратором долевого или
главного бронха негерметичного лёгкого с активной аспирацией
воздуха из плевры. Обтуратор вводят в бронх и извлекают посредством
бронхоскопии жёстким бронхоскопом под наркозом. В течение 2—
3 сут дефекты на лёгком успевают прикрыться фибрином,
грануляциями, и после удаления обтуратора у большинства больных
пневмоторакс не возобновляется. Если этого не происходит, становится
необходимой торакотомия, особенно у пострадавших с исходно
нарушенными показателями вентиляции лёгкого. Обычно выполняют
боковую или переднебоковую торакотомию в V—VII межреберье.
Объём вмешательства определяется обширностью дефектов лёгочной
ткани и может заключаться в ушивании ран или резекции
разрушенных участков лёгкого.
20 ♦ Хирургические болезни ♦ Том 2 <0* Часть III ♦ Глава 24
Разрывы трахеи и крупных бронхов
Разрывы трахеи и крупных бронхов относятся к редким
повреждениям при закрытой травме груди. Разрывы бронхов могут быть
полными (отрыв), частичными или в виде переломов хрящевого каркаса
без повреждения слизистой оболочки. Диагностика их в остром
периоде травм основывается на неэффективности всех мероприятий по
восстановлению герметичности плевральной полости и на данных
бронхоскопического обследования. При своевременно
установленном диагнозе возможно выполнение восстановительных операций в
остром периоде. Между тем, чаще повреждения бронхов выявляют
на более поздних стадиях при уже формирующихся Рубцовых
стенозах или окклюзиях бронхов в месте их повреждения. Резекция
суженного участка бронха с наложением межбронхиального анастомоза
обычно даёт хорошие результаты.
Травма сердца
Травма сердца встречается довольно часто — у 8% больных,
госпитализированных по поводу закрытой травмы груди. Патомор-
фологические исследования показывают, что тяжёлая травма груди
сопровождается структурными и метаболическими нарушениями
в миокарде даже при отсутствии видимых его повреждений. Для
уточнения диагноза иногда необходимы специальные
исследования. Лечебная тактика при закрытой травме сердца определяется
характером повреждения и тяжестью расстройств сердечной
деятельности. При ушибах проводят в основном консервативное лечение,
напоминающее терапию коронарной недостаточности или
инфаркта миокарда. Оно предполагает создание покоя, нормализацию
ритма, проводимости, электрической активности и
сократительной способности миокарда, купирование болевого синдрома,
нормализацию гемодинамики, противовоспалительную терапию.
Продолжительность постельного режима зависит от тяжести состояния
и составляет 2—3 нед. Необходимо проводить санацию верхних
дыхательных путей, оксигенотерапию. Назначают седативные и
болеутоляющие средства. Переливание крови или кровезаменяющих
жидкостей должно быть ограниченным и проводиться строго по
показаниям.
Необходимость оперативного лечения при ушибах сердца
возникает только в случаях поздних осложнений — нарастании сердечной
Травма груди ♦ 21
недостаточности в связи с формированием аневризмы или наличием
сдавливающего перикардита.
При разрывах мышечной стенки сердца, в том числе сквозных,
смерть не всегда наступает моментально. Некоторые такие больные
поступают в стационар и подлежат срочному оперативному
вмешательству, независимо от времени, прошедшего с момента травмы.
Показания к операции — гемоперикард, подтверждённый
клинически, рентгенологически или пункцией; тампонада сердца; внутриплев-
ральное кровотечение.
При внутренних травматических разрывах (например,
повреждение клапанов) вначале проводят консервативную терапию,
направленную на лечение сердечной недостаточности. В случаях прогрес-
сирования нарушений гемодинамики показана первичная
реконструктивная операция.
Разрывы аорты
Разрывы аорты относятся к наиболее тяжёлым повреждениям при
закрытой травме груди. Большая часть пострадавших погибают,
вместе с тем до 20% из них поступают в стационар живыми.
Клинические проявления возможны в двух вариантах: 1) массивное
кровотечение в плевральную полость; 2) неясная клиническая картина,
дефицит пульса на сонных артериях слева, расширение средостения на
рентгенограмме, смешение пищевода и трахеи вправо. При первом
варианте разрыв аорты обнаруживают обычно во время операции,
предпринятой по поводу массивного внутригрудного кровотечения.
Диагностика при втором типе, соответствующем повреждению
аорты без разрыва адвентиции, основывается на данных КТ и аорто-
графии. Во всех случаях выявления повреждений аорты (или при
обоснованных подозрениях) показаны немедленная торакотомия и
выполнение восстановительных операций.
Повреждения диафрагмы
Установленный диагноз закрытого разрыва диафрагмы должен
считаться основанием для срочной операции. Нельзя предвидеть
время опасного для жизни ущемления и некроза переместившихся в
плевральную полость органов. Операцию выгоднее производить чрез-
плеврально. Оптимальным является разрез по VII или VIII межребе-
рью из бокового доступа. Неушитые раны диафрагмы, как правило,
приводят к образованию диафрагмальной грыжи.
22 ♦ Хирургические болезни -О* Том 2 ^ Часть III <0> Глава 24
Открытая травма груди
Лечение раненых при открытых травмах груди во многом
определяется характером ранящего снаряда (огнестрельные ранения,
взрывные поражения, колото-резаные ранения), а объём
хирургической помощи определяется обширностью и особенностями
поражения внутренних органов. Лечебные мероприятия при
непроникающих ранениях включают в себя хирургическую обработку раны,
профилактику инфекционных осложнений, оперативные способы
закрытия раневых дефектов и пластические операции в более
позднем периоде при формировании стойких изменений в мягких
тканях и рёберном каркасе грудной стенки.
Проникающие ранения
Проникающие ранения, сопровождающиеся открытым
пневмотораксом, требуют ушивания раны грудной стенки. Полезно в этот
момент выполнить торакоскопию для обнаружения возможных ранений
органов груди, диафрагмы и источника кровотечения, если оно
продолжается. Операцию всегда заканчивают дренированием
плевральной полости. Оно включает в себя установку двух дренажей: нижнего,
ближе к синусу, направленного кзади, и верхнего, дренирующего пе-
реднебоковые отделы плевральной полости. Первый дренаж
обеспечивает отток экссудата, появление которого возможно вследствие
инфицированное™ плевральной полости, а второй создаёт условия для
эвакуации воздуха и максимально быстрого расправления лёгкого.
Показания к срочной торакотомии при проникающих ранениях
груди возникают при: 1) большом гемотораксе; 2) продолжающемся
внутриплевральном кровотечении, когда по дренажу выделяется 250—
300 мл крови в час; 3) ранениях сердца и диафрагмы; 4) ухудшении
состояния больного на фоне комплексной терапии и в связи с
возникающим подозрением на повреждение органов груди. В комплексе
лечебных мероприятий при проникающих ранениях груди должны
быть предусмотрены меры по адекватному обезболиванию,
восполнению кровопотери, борьбе с дыхательными и циркуляторными
расстройствами, а также антимикробная терапия.
Ранение лёгкого
Хирургическая тактика при ранении лёгкого, которое не
сопровождается продолжающимся к моменту госпитализации
кровотечением, принципиально не отличается от таковой при закрытой трав-
Травма груди ♦ 23
ме груди. Показания к торакотомии возникают при отсутствии
тенденции к восстановлению герметичности плевральной полости и
повторных коллапсах лёгкого.
Повреждения трахеи и бронхов
Повреждения трахеи и бронхов чаще наблюдают при
огнестрельных ранениях. Это очень тяжёлые ранения, диагностика которых
строится на тех же принципах, что и в случаях закрытой травмы
груди. В связи с одновременными ранениями крупных сосудов факт
ранения трахеи или крупных бронхов чаще выявляют в процессе
неотложной торакотомии, предпринятой по поводу кровотечения.
К сожалению, в связи с особенностями течения огнестрельной
раны первичное восстановление целостности трахеи или бронхов
часто осложняется несостоятельностью анастомозов и швов, что в
последующем, если удаётся ликвидировать гнойно-септические
осложнения, требует проведения ряда реконструктивно-восстанови-
тельных операций.
Ранения перикарда и сердца
Ранения перикарда и сердца стоят на втором месте по частоте. При
этом только у трети пострадавших имеется изолированное
повреждение перикарда, а у остальных одновременно поражается и сердце.
Клиническая картина и хирургическая тактика обусловлены
локализацией раны на сердце, её размером и глубиной. Диагностика
строится с учётом локализации раны на грудной стенке, общего
состояния больного, особенностей кровотечения и признаков тампонады
сердца. Чем ближе рана к проекции сердца на переднюю стенку
груди, тем более вероятно его ранение. Обращают на себя внимание
стремительное нарастание бледности, появление холодного пота на лице,
обморочного состояния. При этом чаще всего определяют большой
гемоторакс, набухание шейных вен, глухие тоны сердца,
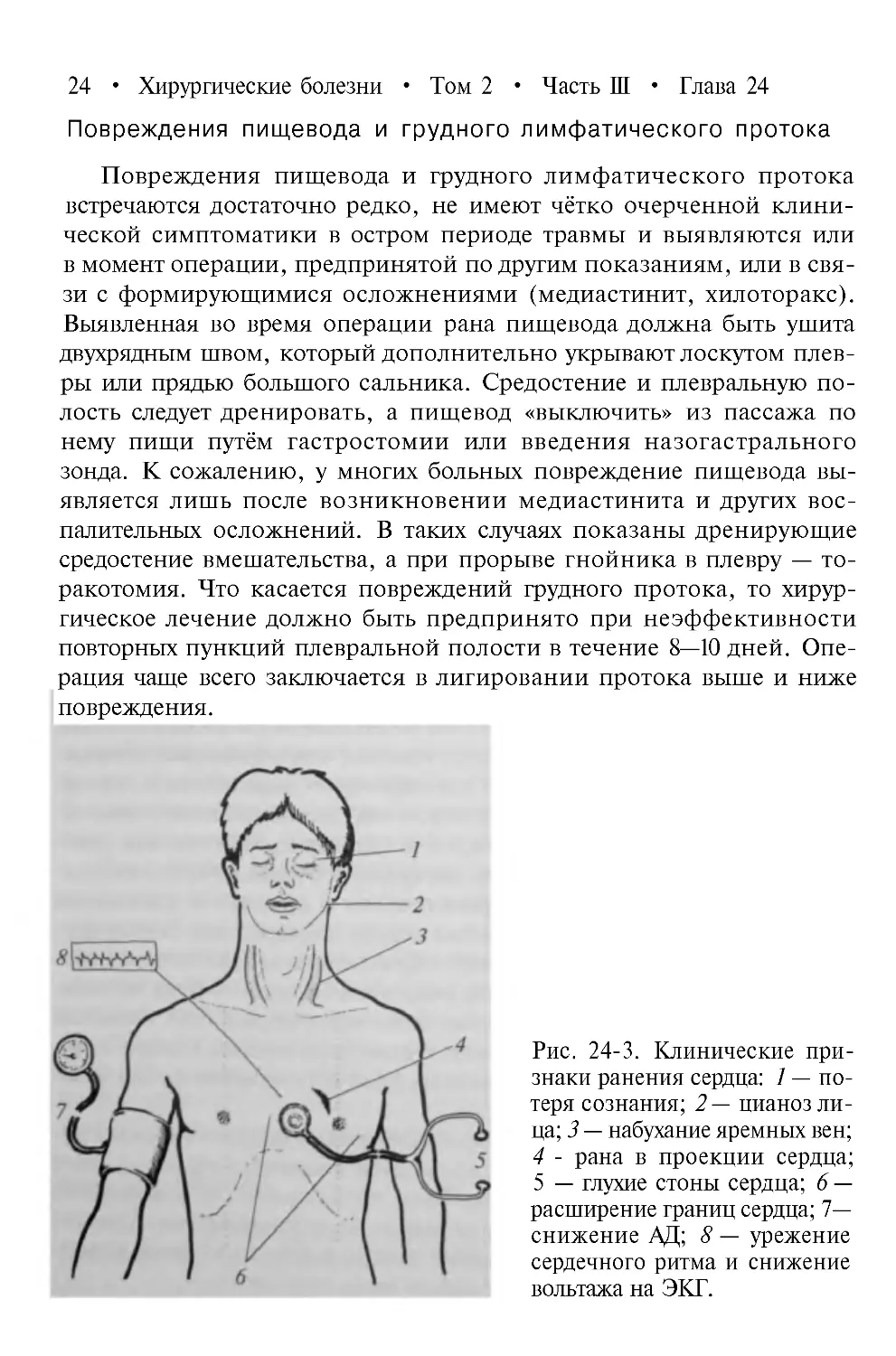
парадоксальный пульс (рис. 24-3), что свидетельствует о скоплении крови в
перикарде и сдавлении сердца.
Лечение ранений сердца должно быть только хирургическим,
пункция перикарда преследует цель временной декомпрессии его на этапе
вводного наркоза и торакотомии. Раны сердца ушивают отдельными
швами, иногда используют «прокладки» из аутоперикарда. Следует
обратить внимание на обязательный осмотр и ревизию задней
поверхности сердца, так как ранение может быть сквозным.
24 ♦ Хирургические болезни ♦ Том 2 ♦ Часть III ♦ Глава 24
Повреждения пищевода и грудного лимфатического протока
Повреждения пищевода и грудного лимфатического протока
встречаются достаточно редко, не имеют чётко очерченной
клинической симптоматики в остром периоде травмы и выявляются или
в момент операции, предпринятой по другим показаниям, или в
связи с формирующимися осложнениями (медиастинит, хилоторакс).
Выявленная во время операции рана пищевода должна быть ушита
двухрядным швом, который дополнительно укрывают лоскутом
плевры или прядью большого сальника. Средостение и плевральную
полость следует дренировать, а пищевод «выключить» из пассажа по
нему пищи путём гастростомии или введения назогастрального
зонда. К сожалению, у многих больных повреждение пищевода
выявляется лишь после возникновении медиастинита и других
воспалительных осложнений. В таких случаях показаны дренирующие
средостение вмешательства, а при прорыве гнойника в плевру — то-
ракотомия. Что касается повреждений грудного протока, то
хирургическое лечение должно быть предпринято при неэффективности
повторных пункций плевральной полости в течение 8—10 дней.
Операция чаще всего заключается в лигировании протока выше и ниже
повреждения.
Рис. 24-3. Клинические
признаки ранения сердца: 1 —
потеря сознания; 2 — цианоз
лица; 3 — набухание яремных вен;
4 - рана в проекции сердца;
5 — глухие стоны сердца; 6 —
расширение границ сердца; 7—
снижение АД; 8 — урежение
сердечного ритма и снижение
вольтажа на ЭКГ.
Осложнения
У пострадавших с травмой груди имеется определённая
закономерность возникновения ближайших и отдалённых осложнений. В
остром периоде наиболее частой причиной гибели больных служит
острая кровопотеря. В раннем постшоковом периоде на первое
место выходят лёгочные осложнения, причинами которых могут быть
неадекватное дренирование плевральной полости, плохое
обезболивание, и недостаточная вентиляция лёгких. Наиболее частое и
опасное осложнение этого периода — формирование респираторного
дистресс-синдрома взрослых. Он сопровождается нарушением функций
сердечно-сосудистой системы, ЦНС и жизненно важных
паренхиматозных органов. Исход его характеризуется очень высокой
летальностью (до 50%), но ранняя диагностика и своевременно начатое
лечение позволяют получить обнадёживающие результаты. Методы
профилактики респираторного дистресс-синдрома взрослых при
травме груди включают адекватное обезболивание, устранение гемоп-
невмоторакса, восстановление каркасной функции грудной клетки
и обеспечение адекватной вентиляции лёгких.
Пневмония — типичное раннее осложнение травм груди. В
основе этого осложнения лежат микроэмболии сосудов малого круга
кровообращения, поражение сурфактантной системы и нарушения
дренажной функции бронхов. С учётом перечисленных факторов должны
строиться мероприятия по профилактике и лечению пневмонии.
В более позднем периоде возможно развитие острой и
хронической эмпиемы плевры, причиной которой является неполное
устранение гемоторакса, длительно существующая негерметичность
лёгкого, неадекватное дренирование плевральной полости и подавление
механизмов иммунной защиты.
По мере роста числа пострадавших сформировалась устойчивая
группа пациентов с поздними осложнениями: стенозами и окклюзи-
ями трахеи и бронхов, пищеводно-бронхиальными свищами, диаф-
рагмальными грыжами и др. Часто они требуют проведения сложных
реконструктивных вмешательств.
ДОБРОКАЧЕСТВЕННЫЕ
ЗАБОЛЕВАНИЯ
И ПОВРЕЖДЕНИЯ ПИЩЕВОДА
В этой главе рассматриваются разнообразные по своей природе
патологические состояния, которые обусловливают нарушения
функционирования пищевода, по которому пища поступает в ЖКТ. Это, в
первую очередь, нервно-мышечные заболевания, грыжи пищеводного
отверстия диафрагмы и дивертикулы пищевода, последствия ожогов
и травм.
Основные черты патологии
Физиологическая роль пищевода заключается в проведении
пищи из полости глотки в желудок. Основную роль в этом процессе
играют три механизма: впрыскивающий эффект глотки, сила
тяжести и гидростатическое давление пищи, а также перистальтика
пищевода. В зависимости от характера пищи тот или иной механизм
имеет преобладающее значение в продвижении пищи по пищеводу.
Так, глоток воды быстро, за 2—3 сек, попадает в желудок,
значительно опережая активную перистальтику пищевода. Считают, что
прохождение жидкой пищи обеспечивается в основном силой тяжести,
гидростатическим давлением и впрыскивающим эффектом глотки.
При прохождении по пищеводу плотного пищевого комка (оно
продолжается от 8 до 12 сек) ведущая роль принадлежит
перистальтической волне.
В спокойном состоянии в пищеводе поддерживается
относительно стабильное давление. Верхний и нижний пищеводные сфинктеры
отделяют зону слабо отрицательного давления от положительного
давления в глотке и желудке. Тоническое напряжение циркулярных
волокон этих сфинктеров создаёт в норме верхнюю и нижнюю зоны
повышенного давления покоя, что является довольно мощным ан-
тирефлюксным барьером, благодаря, в основном, односторонней
проходимости зоны нижнего пищеводного жома. Для того, чтобы
пища из пищевода попала в желудок, достаточно повышения
давления на 4 мм рт.ст. Для регургитации необходим подъём давления
на 80 мм рт.ст. В предотвращении заброса содержимого желудка в
Доброкачественные заболевания и повреждения пишевода ♦ 27
пищевод имеют значение несколько механизмов: нижний
пищеводный сфинктер, создающий зону повышенного давления; острый угол
Хиса, образованный стенкой пищевода и дном желудка; клапан,
представляющий собой складку слизистой оболочки в месте
перехода многослойного плоского неороговевающего эпителия
пищевода в цилиндрический эпителий желудка, и связка, удерживающая
пищевод в одноимённом отверстии диафрагмы.
Различные заболевания нарушают этот стройный механизм. Они
характеризуются в основном симптомами, связанными с
затруднением прохождения пищи по пищеводу, а также рефлюксом в
пищевод содержимого желудка.
Дисфагия — ощущение замедления или препятствия при
продвижении пищи по глотке и пищеводу в желудок. Дисфагия может быть
органической и функциональной. Органическая дисфагия
возникает при раке (см. главу 26), постожоговых и пептических стриктурах
пищевода, обтурации просвета пищевода инородным телом, остром
эзофагите, дивертикулах, доброкачественных новообразованиях
пищевода, наружном сдавлении органа (опухолями лёгких и
средостения, заглоточным или медиастинальным абсцессом, увеличенной
щитовидной железой, аневризмой грудной аорты).
Функциональная дисфагия развивается при ахалазии кардии,
кардиоспазме, диффузном спазме пищевода, может наблюдаться
при нарушении глотательного рефлекса вследствие поражения
глотательного центра, миастении, сахарном диабете, а также быть
следствием острого нарушения мозгового кровообращения или
полиомиелита.
Одинофагия — болезненное проглатывание или появление боли
при прохождении пищи по пищеводу, часто наблюдается совместно
с дисфагией. Одинофагия — признак воспаления слизистой
оболочки пищевода.
Изжога — специфическое ощущение жжения за грудиной,
которое распространяется снизу вверх из надчревья до шеи. Изжога
усиливается в положении лёжа, после еды, при наклонах туловища,
напряжении мышц брюшного пресса. Изжога — характерный симптом
гастроэзофагеальной рефлюксной болезни.
Регургитация — появление содержимого пищевода или желудка во
рту. Наблюдается при ахалазии кардии и кардиоспазме, больших
дивертикулах, органических стенозах пищевода, гастроэзофагеальной
рефлюксной болезни. Регургитация может привести к аспирации
содержимого в верхние дыхательные пути.
28 ♦ Хирургические болезни ♦ Том 2 *0> Часть III ^ Глава 24
Боли в грудной клетке некоронарного происхождения в
большинстве случаев связаны с патологией пищевода. Они наиболее часто
встречаются при нервно-мышечных заболеваниях, гастроэзофагеаль-
ной рефлюксной болезни, раке пищевода.
Нервно-мышечные заболевания пищевода
К этой группе заболеваний относят кардиоспазм, ахалазию
пищевода (кардии), диффузный эзофагоспазм (синдром Барсони-Тешен-
дорфа) и некоторые другие моторные расстройства, связанные с
нарушением иннервации пищевода.
Ахалазия пищевода и кардиоспазм
Ахалазия пищевода (кардии) заключается в отсутствии
расслабления нижнего пищеводного сфинктера во время акта глотания.
Выключение физиологического рефлекса его раскрытия приводит к
нарушению тонуса и моторики пищевода, что вызывает задержку пищи.
Кардиоспазм — стойкое спастическое сужение терминального
отдела пищевода, проявляющееся дисфагией и в далеко зашедших
стадиях сопровождающееся органическими изменениями его
вышележащих отделов.
Этиология и патогенез
Этиология и патогенез нервно-мышечных заболеваний пищевода
окончательно не выяснены. Существуют теории врождённого
спазма, патологических изменений в окружающих органах,
инфекционная, рефлекторная, психогенная теории и др. В последнее время
большое значение в их развитии придают нарушениям синтеза оксида
азота, что приводит к нарушениям обмена ионов кальция и
передачи нервно-мышечного импульса. В настоящее время кардиоспазм и
ахалазию кардии рассматривают как два различных патологических
состояния.
• При кардиоспазме наблюдается повышенное давление в области
нижнего пищеводного сфинктера, градиент пищеводно-желудочно-
го давления может достигать 20 мм рт.ст. и более. Для начальных
стадий кардиоспазма характерна усиленная непропульсивная
моторика пищевода. Морфологически находят
дегенеративно-дистрофические изменения в преганглионарных нейронах дорсальных ядер
Доброкачественные заболевания и повреждения пищевода ♦ 29
блуждающих нервов и в меньшей степени — постганглионарных
нейронах ауэрбахова сплетения пищевода. Считают, что в связи с
нарушением центральной иннервации при кардиоспазме гладкая
мускулатура нижнего пищеводного сфинктера становится более, чем
обычно, чувствительной к своему физиологическому регулятору —
эндогенному гастрину. Таким образом, при данном варианте
течения заболевания возникает истинный спазм кардии. Длительные
спастические сокращения ведут к нарушению кровоснабжения и
рубцовому перерождению гладкой мускулатуры, формированию
органического стеноза кардиоэзофагеальной зоны.
• При ахалазии кардии, напротив, поражаются преимущественно
постганглионарные нейроны, в результате выпадает рефлекс
раскрытия кардии на глоток. Манометрически находят нормальный или даже
сниженный градиент пищеводно-желудочного давления,
наблюдают значительное ослабление моторики пищевода. При ахалазии нет
условий для возникновения повышенной чувствительности гладкой
мускулатуры нижнего пищеводного сфинктера к гастрину —
сохраняется центральная иннервация. Необходимо отметить, что
нарушение рефлекса раскрытия кардии и нарушение моторики
пищевода — два параллельных процесса, идущих одновременно.
Классификация
Согласно наиболее распространённой классификации (рис. 25-1.),
различают четыре стадии ахалазии и кардиоспазма.
• I стадия — пищевод не расширен, рефлекс раскрытия кардии
сохранён, но моторика пищевода усилена и дискоординирована.
Рис. 25-1. Стадии ахалазии кардии (пищевода) и кардиоспазма,
30 •♦■ Хирургические болезни <0> Том 2 -0- Часть III О- Глава 25
• II стадия — рефлекс раскрытия кардии отсутствует, отмечается
расширение пищевода до 4—5 см.
• III стадия — значительное расширение пищевода до 6—8 см,
задержка в нём жидкости и пищи, отсутствие пропульсивной
моторики.
• IV стадия — резкое расширение, удлинение и искривление
пищевода с атонией стенок, длительной задержкой жидкости и пищи.
Клиническая картина и диагностика
Ахалазия кардии и кардиоспазм проявляются дисфагией, регур-
гитацией, болями в груди.
• Дисфагия часто носит интермиттирующий характер, может
усиливаться при волнении, нередко имеет парадоксальный характер:
хорошо проходит твёрдая пища, жидкость задерживается. Больные
отмечают, что для того чтобы пища проходила, им приходится
запивать её водой или прибегать к другим приёмам, например,
повторным глотательным движениям.
• Регургитация возникает вначале сразу после еды, а при прогресси-
ровании заболевания через более или менее значительное время
после приёма пищи. Она может наблюдаться во время сна
(симптом «мокрой подушки»), что грозит опасностью аспирации и
развитием лёгочных осложнений.
• Боль обычно носит распирающий характер, появляется во время
или после еды по ходу пищевода, иррадиирует в спину, между
лопатками. Иногда сильный спазм пищевода во время приёма пищи
может быть расценён как приступ стенокардии.
Рентгенологическое исследование (рис. 25-2) позволяет в
большинстве случаев правильно поставить диагноз. Характерный
рентгенологический признак — расширение пищевода в той или иной
степени с наличием узкого сегмента в терминальном его отделе (симптом
«перевёрнутого пламени свечи»). Стенки пищевода, в том числе и в
суженной части, сохраняют эластичность. Газовый пузырь желудка
обычно отсутствует. При эзофагоскопии в начальных стадиях
заболевания каких-либо характерных изменений в пищеводе не находят.
В далеко зашедших стадиях болезни виден большой зияющий
просвет пищевода, иногда с жидкостью, слизью, остатками пищи.
Слизистая оболочка пищевода обычно воспалена, утолщена, могут
выявляться эрозии, язвы, участки лейкоплакии, изменения нарастают
в дистальном направлении. Эндоскоп практически всегда проходит
Рис. 25-2. Ахалазия кардии III
стадии (рентгенограмма в прямой
проекции). Видно значительное
расширение пищевода выше суженного
участка.
в желудок. Если этого не происходит, следует думать об
органическом стенозе (пептическая стриктура, рак).
Дифференциально-диагностические критерии ахалазии
пищевода (кардии) и кардиоспазма представлены в табл. 25-1.
Таблица 25-1. Критерии диагностики кардиоспазма и ахалазии пищевода
Кардиоспазм
1
Ахалазия пищевода (кардии)
2
Клиническая симптоматика
Обычно дисфагия проявляется
неожиданно
Характерна парадоксальная
дисфагия
Характерна интенсивная
спастическая боль за грудиной
Регургитация во время
или сразу после еды
В большинстве случаев дисфагия
развивается постепенно
Парадоксальная дисфагия
не наблюдается
Распирающая боль за грудиной
возникает редко
Регургитация возникает в
горизонтальном положении или при наклоне
туловища вперёд, через несколько
часов после еды
Окончание табл. 25-1
1 2
Рентгенологическая симптоматика
Пищеводная моторика усилена,
выражены сегментарные сокращения
пищевода
Терминальная часть пищевода имеет
конусовидную форму
Пищевод опорожняется путём
продавливания контраста через
узкий сегмент — симптом «шприца»
Расслабление нижнего пищеводного
сфинктера в ответ на введение
холинолитиков
Моторная активность пищевода
снижена, сегментарные сокращения
отсутствуют
Терминальная часть пищевода
закруглена, сужение часто расположено
эксцентрично
Начало опорожнения определяется
высотой столба бариевой взвеси и
наблюдается при повышении
гидростатического давления по типу «провала»
Отрицательный фармакологический
тест на холинолитики
Большое значение в диагностике нервно-мышечных заболеваний
пищевода придают эзофагоманометрии, позволяющей провести
окончательную дифференциальную диагностику между ахалазией
кардии и кардиоспазмом (в I и IV стадиях клиническая и
рентгенологическая картина не позволяют чётко дифференцировать эти
патологические процессы). При кардиоспазме градиент пищеводно-
желудочного давления составляет более 20 мм рт.ст. При ахалазии
кардии он меньше 20 мм рт.ст., отсутствует рефлекс раскрытия
нижнего пищеводного сфинктера на глотание.
Лечение
В начальных стадиях ахалазии пищевода (кардии) и кардиоспазма
возможно применение консервативного лечения. В настоящее время
наибольшее распространение получили препараты из группы
нитратов (нитроглицерин, изосорбида динитрат) и антагонистов кальция
(верапамил, нифедипин), в ряде случаев используют седативные
препараты. Необходимо обращать внимание на соблюдение больными
чёткого режима питания с 4- или 5-разовым приёмом пищи, а при
необходимости и более частым. Есть необходимо медленно,
тщательно пережёвывая пищу.
В последние годы появилось новое перспективное направление в
лечении больных ахалазией (пищевода) кардии и кардиоспазмом —
применение препаратов ботулотоксина, которые вводят через фиб-
роэзофагогастроскоп в зону нижнего пищеводного сфинктера, что
способствует его расслаблению.
Основной метод лечения ахалазии кардии (пищевода) и
кардиоспазма в настоящее время — кардиодилатация, которая при
повторных проведениях приводит к разрыву рубцовой ткани, уменьшая тем
самым градиент пищеводно-желудочного давления и обеспечивая
восстановление пассивного (за счёт силы тяжести) пассажа пищи.
Пневматический кардиодилататор состоит из резинового или
пластмассового зонда с баллоном, укреплённым на конце, диаметром 25, 35 и 45
мм. Кардиодилатацию проводят под рентгеновским контролем,
начиная с дилататора диаметром 25 мм и давления в нём от 180 до 240 мм
рт.ст. Сеансы подобного лечения обычно проводят через день,
постепенно увеличивая диаметр баллона и повышая давление до 320 мм рт.ст.
В среднем курс лечения состоит из 5—6 процедур, в некоторых случаях
число кардиодилатаций приходится увеличивать до 10—12. Об
эффективности кардиодилатации судят по клиническим проявлениям
(исчезновение дисфагии) и снижению градиента
пищеводно-желудочного давления (градиент давления не следует уменьшать ниже 7-8 мм
рт.ст., так как это может привести к развитию рефлюкс-эзофагита).
Показания к оперативному лечению ахалазии кардии и
кардиоспазма — невозможность проведения кардиодилататора через кардию,
неуверенность в правильном диагнозе при обоснованном
подозрении на рак кардиоэзофагеальной зоны, неадекватное восстановление
проходимости кардии после законченного курса пневматической
кардиодилатации, неэффективность трёх курсов кардиодилатации,
сочетание с другими заболеваниями,
требующими оперативного лечения.
В настоящее время оптимальной
операцией считают экстрамукозную (внеслизис-
тую) эзофагокардиомиотомию по Хеллеру
(рис. 25-3) с неполной фундопликацией.
Операция может быть выполнена как
открытым, так и видеоэндоскопическим
способом. Производят рассечение продольных и
циркулярных мышечных волокон передне-
левой стенки пищевода на протяжении 6—
7 см, разрез на 1,5—2 см переходит на кар-
диальный отдел желудка, что ведёт к расши- рИс. 25-3. Схема операции
рению области пищеводно-желудочного эзофагокардиомиотомии.
34 ♦ Хирургические болезни ♦ Том 2 ♦ Часть III ♦ Глава 25
перехода. Важное условие — пересечение как продольных, так и
циркулярных мышечных волокон пищевода, что служит профилактикой
рецидива заболевания. Операцию дополняют передней фундопликаци-
ей, которая не требует пересечения связочного аппарата и коротких
сосудов желудка, её производят путём подшивания стенки дна желудка к
краям разреза мышечной оболочки тремя—четырьмя отдельными
узловыми швами с предварительно введённым в просвет пищевода зондом.
При IV стадии заболевания, особенно у больных, уже перенёсших
неудачные операции, осложнившиеся развитием рефлюкс-эзофаги-
та и пептической стриктуры, операцией выбора является
субтотальная резекция пищевода с одномоментной эзофагопластикой.
Диффузный спазм пищевода
Диффузный спазм пищевода, или синдром Барсони—Тешендор-
фа, — заболевание пищевода, обусловленное спастическими
сокращениями его стенки при сохранении нормальной сократительной
способности нижнего пищеводного сфинктера. Выделяют первичный
и вторичный эзофагоспазм. Под вторичным понимают эзофагоспазм,
развившийся на фоне других заболеваний пишевода. Ведущими
клиническими симптомами диффузного спазма пищевода являются дис-
фагия и боль в грудной клетке. Реже встречаются регургитация,
похудание, общая слабость.
Диагностика
Рентгенологически при диффузном эзофагоспазме выявляют «чёт-
кообразный», а в других случаях «штопорообразный» пищевод,
задержки в пищеводе контрастного вещества и сужения дистального
отдела пишевода не бывает (рис. 25-4). Эндоскопическое
исследование не выявляет характерных признаков заболевания. При эзофаго-
манометрии по всему длиннику пищевода наблюдают сегментарные
непропульсивные сократительные волны, возникающие
одновременно на разных уровнях независимо от глотка, цифры градиента пище-
водно-желудочного давления нормальные.
Лечение
Лечение первичного эзофагоспазма консервативное, кардиодила-
тация не даёт выраженного эффекта. Комплексная консервативная
терапия включает в себя назначение антагонистов кальция (верапамил,
Доброкачественные заболевания и повреждения пишевола ♦ 35
Рис. 25-4. Рентгенограмма при
диффузном эзофагоспазме.
нифедипин), нитратов, седативных препаратов, витаминов,
спазмолитических препаратов (дротаверин, платифиллин, папаверин),
физиопроцедур (электрофорез с прокаином, сульфатом магния,
хлоридом калия).
При неэффективности консервативного лечения выполняют
операцию — экстрамукозную эзофагомиотомию (рассечение адвентици-
ального и мышечного слоев пищевода) на протяжении от дуги аорты
до нижнего пищеводного сфинктера. К оперативному лечению
диффузного спазма пищевода прибегают достаточно редко. Операция
может быть выполнена эндоскопическим путём из правостороннего
торакального доступа.
Грыжи пищеводного отверстия
диафрагмы и рефлюкс-эзофагит
Грыжами пищеводного отверстия диафрагмы называют смещение
какого-либо органа брюшной полости, покрытого брюшиной, через
это отверстие в заднее средостение. Выделяют скользящие
(аксиальные) и параэзофагеальные грыжи. Содержимым скользящей грыжи
пищеводного отверстия диафратмы могут быть не только кардиаль-
ный отдел желудка и его дно, но и большая часть этого органа. В
состав параэзофагеальных грыж могут входить как часть желудка
(обычно его дно), так и участки кишечника, большой сальник.
Этиология
Причины образования приобретённых грыж пищеводного
отверстия диафрагмы — инволюционные и дистрофические процессы в
связочном аппарате пищеводного отверстия диафрагмы, в
результате чего оно расширяется и образуются своего рода грыжевые ворота.
Эти изменения наиболее часто встречают у стариков, беременных,
больных, страдающих ожирением. Непосредственной причиной,
вызывающей возникновение грыж пищеводного отверстия
диафрагмы, служит повышение внутрибрюшного давления. Подобные
грыжи в ряде случаев сочетаются с другими заболеваниями
пищеварительной системы. Сочетание с хроническим холециститом и язвенной
болезнью двенадцатиперстной кишки носит название триады Касте-
на, а сочетание с хроническим холециститом и дивертикулёзом
толстой кишки — триады Сайнта.
Рефлюкс-эзофагит — наиболее частое осложнение скользящей
грыжи пищеводного отверстия диафрагмы. Причинами возникновения
рефлюкс-эзофагита могут быть также язвенный стеноз
привратника, состояние после резекции желудка и гастроэнтеростомии,
предшествующие операции в области пищеводно-желудочного перехода,
тяжёлая рвота, длительное трансназальное дренирование желудка.
В основе развития этого осложнения лежит недостаточность кардии,
нарушение функций нижнего пищеводного сфинктера. При тяжёлом
рефлюкс-эзофагите может развиться пептическая стриктура пищевода.
В развитии пептических стриктур большое значение придают
также синдрому Баррета — эктопии слизистой оболочки желудка в
пищевод. При рефлюкс-эзофагите в зоне воспаления может полностью
разрушаться плоскоклеточный эпителий, регенерация слизистой
Доброкачественные заболевания и повреждения пишевода О- 37
оболочки происходит за счёт кардиальных желёз, что приводит к
замещению плоскоклеточного эпителия цилиндрическим. В некоторых
случаях встречается врождённая эктопия желудочного эпителия. Одно
из возможных осложнений грыж пищеводного отверстия
диафрагмы — ущемление.
Клиническая картина
Клиническая картина грыж пищеводного отверстия диафрагмы
очень разнообразна. Симптомами грыж пищеводного отверстия
диафрагмы могут быть изжога, боль, отрыжка, регургитация, дисфагия,
икота. Изжога возникает обычно после еды, при перемене
положения тела, чаще в ночное время. Боли за грудиной появляются и
усиливаются при горизонтальном положении или наклоне туловища
вперёд, часто сопровождаются регургитацией желудочного
содержимого («симптом шнурка»). При грыжах пищеводного отверстия
диафрагмы нередко возникает рефлекторная стенокардия. Боли могут
локализоваться также в подложечной и межлопаточной областях.
Иногда при грыжах пищеводного отверстия диафрагмы возникает
кровотечение, обычно незначительное. Развитие пептической
стриктуры пищевода проявляется стойкой дисфагией. При грыжах
небольших размеров клинические проявления могут отсутствовать.
Диагностика
Основной метод выявления грыж пищеводного отверстия
диафрагмы — рентгенологическое исследование (рис. 25-5).
Рентгенологические симптомы определяются типом грыжи. При аксиальной
грыже в грудную полость смещена вся область желудочно-пище-
водного перехода и часть желудка пролабирует в заднее
средостение. Кардия находится над диафрагмой. При параэзофагеальной
грыже пищеводно-желудочный переход располагается в брюшной
полости, а часть желудка выходит через пищеводное отверстие
диафрагмы в грудную полость рядом с пищеводом. Большие грыжи
распознают сравнительно легко, для выявления небольших грыж
необходимо исследование как в вертикальном, так и в
горизонтальном положении больного, а также в положении Тренделенбурга.
Рентгенологическое исследование играет важную роль в
распознавании осложнений хиатальной грыжи и, прежде всего, рефлюкс-
эзофагита.
Рис. 25-5. Рентгенограмма
больного с грыжей пищеводного
отверстия диафрагмы. Часть
желудка находится выше
диафрагмы (указана стрелкой).
Эндоскопическое исследование также весьма важно, так как
позволяет выявить недостаточность кардии, оценить тяжесть эзофа-
гита, обнаружить осложнения и сопутствующие заболевания. По
эндоскопической классификации различают четыре степени рефлюкс-
эзофагита: 1) лёгкий; 2) средней тяжести; 3) тяжёлый; 4) пептическая
стриктура пищевода.
Ценный функциональный метод диагностики скользящих грыж
пищеводного отверстия диафрагмы — эзофагоманометрия,
позволяющая определить зону повышенного давления в области пищевод-
но-желудочного перехода, смещённого выше уровня диафрагмы.
Важным методом диагностики представляется рН-метрия,
особенно 24-часовая, которая даёт возможность получить достоверную
информацию о частоте и длительности эпизодов эзофагеального
заброса, их зависимости от положения тела, приёма пищи, времени
суток и т.п.
Лечение
Лечение скользящих грыж пищеводного отверстия диафрагмы
начинают с консервативных мероприятий. Необходимо соблюдать
режим приёма пищи, избегать переедания, не рекомендуются
тяжёлые физические нагрузки, ношение тугой одежды. Из лекарственных
препаратов используют блокаторы Н2-гистаминовых рецепторов
Доброкачественные заболевания и повреждения пишевода <> 39
(ранитидин, фамотидин и др.), ингибиторы протонного насоса (омеп-
разол, лансопразол и др.), прокинетики (например, домперидон),
антацидные средства (алгелдрат + магния гидроксид, алюминия
фосфат и др.).
При сформировавшейся пептической стриктуре на фоне
проводимых консервативных мероприятий проводят бужирование
пищевода, чаще всего в качестве предоперационной подготовки.
Оперативное вмешательство необходимо проводить при осложнённых
формах и безуспешности предшествующих медикаментозных
мероприятий. Наиболее целесообразная операция — фундопликация по
Ниссену (рис. 25-6). При этой операции производят выделение
правой и левой стенок пищевода, клетчатку позади него тупо разделяют,
ножки диафрагмы сводят отдельными узловыми швами,
накладываемыми позади пищевода с предварительно введённым в его просвет
толстым зондом. Затем выполняют мобилизацию дна и верхней
части большой кривизны желудка, короткие желудочные артерии
пересекают. Стенку желудка захватывают введённым позади пищевода
зажимом и протягивают слева направо вперёд, образуя циркулярную
манжетку. Задний лоскут подшивают двумя—тремя узловыми швами
к дну желудка, выведенному спереди от пищевода, с обязательным
захватыванием в шов стенки пищевода для предотвращения
соскальзывания созданной манжетки. Подобную операцию в настоящее
время выполняют путём лапароскопии.
Рис. 25-6. Схема операции фундопликации по Ниссену, применяющейся при
скользящих грыжах пищеводного отверстия диафрагмы и рефлюкс-эзофа-
гите: а — низведение пищевода и наложение швов на переднюю и заднюю
стенки дна желудка с захватыванием его стенки; б— после завязывания швов
сформирована манжета вокруг абдоминального отдела пищевода.
40 <? Хирургические болезни О Том 2 ^ Часть III О- Глава 25
При протяжённых стриктурах выполняют резекцию пищевода.
Параэзофагеальные грыжи подлежат оперативному вмешательству в
связи с опасностью тяжёлых осложнений. Производят низведение
грыжевого содержимого в брюшную полость, иссечение грыжевого
мешка, крурорафию. Операцию завершают фундопликацией.
Дивертикулы пищевода
Дивертикулы пищевода представляют собой мешковидные
выпячивания стенки данного органа в полость средостения. По
результатам массового рентгенологического обследования населения они
встречается у 2% взрослых людей.
Классификация
Происхождение дивертикулов: врождённые, приобретённые.
Механизм развития: пульсионные, тракционные.
Локализация: глоточно-пищеводные (ценкеровские),
бифуркационные, наддиафрагмальные.
Строение: истинные, ложные.
Патогенез
В подавляющем большинстве случаев эзофагеальные
дивертикулы носят приобретённый характер, врождёнными они бывают
чрезвычайно редко.
Пульсионные дивертикулы возникают за счёт выбухания стенки
пищевода, обусловленного повышением внутрипищеводного
давления по тем или иным причинам (гипермоторная дискинезия органа).
Тракционный механизм возникновения заболевания предполагает
наличие сращений, в основном воспалительного характера, между
пищеводом и окружающими органами (в первую очередь
лимфатическими узлами корня лёгкого или бифуркации трахеи).
Перистальтика пищевода в условиях фиксации его к лимфатическим узлам
вызывает локальное выпячивание стенки пищевода.
Глоточно-пищеводные и наддиафрагмальные дивертикулы по
механизму своего возникновения являются пульсионными, их
развитие связано с повышением давления в области верхнего и нижнего
пищеводных сфинктеров, бифуркационные дивертикулы обычно
Доброкачественные заболевания и повреждения пищевода ♦ 41
тракшюнные. Вместе с тем, в возникновении любого дивертикула
играют роль оба указанных механизма развития, лишь на начальных
этапах их формирования тракционный или пульсионный механизм
встречают в чистом виде.
Истинными называют такие дивертикулы, стенка которых
состоит из всех слоев пищевода, ложные дивертикулы не содержат
мышечного слоя.
Клиническая картина и диагностика
Ценкеровские (глоточно-пищеводные) дивертикулы в течение
длительного времени могут ничем себя не проявлять. По мере
увеличения их размеров попадание в него пищи ведёт к сдавлению
пищевода и появлению характерных симптомов — дисфагии (вплоть до
полной непроходимости пищи), срыгиванию, неприятному запаху
изо рта. При больших дивертикулах в области левой половины шеи
может появляться эластическое выпячивание, при надавливании на
которое определяется характерное урчание. В редких случаях
наблюдают такие симптомы, как одышка, сердцебиение, набухание
шейных вен, осиплость голоса, синдром Хорнера. Срыгивание и заброс
содержимого глоточно-пищеводного дивертикула в трахеобронхиаль-
ное дерево могут приводить к развитию аспирационных пневмоний,
зачастую абсцедирующих.
Бифуркационные и эпифренальные дивертикулы небольших
размеров протекают обычно бессимптомно, их выявляют случайно при
выполнении эзофагоскопии или рентгенологического исследования.
При увеличении размеров дивертикулов и затруднении их
опорожнения появляются боль за грудиной и в спине, гиперсаливация,
отрыжка. Дисфагия развивается редко и связана со спазмом пищевода.
К осложнениям дивертикулов пищевода относят дивертикулит,
который может привести к изъязвлению и перфорации дивертикула
с развитием медиастинита или пищеводно-респираторных свищей.
Дивертикулит может приводить и к кровотечению. В редких случаях
перфорация дивертикула может произойти в верхнюю полую вену,
лёгочную артерию, аорту, вызвав смертельное кровотечение.
Описаны случаи малигнизации дивертикулов.
Ведущая роль в диагностике дивертикулов пищевода принадлежит
полипозиционному рентгеноконтрастному исследованию (рис. 25-7),
позволяющему выявить локализацию, форму, размеры дивертикула,
сопутствующие заболевания. При задержке бариевой взвеси в поло-
42 ♦ Хирургические болезни ♦ Том 2 О- Часть III ♦ Глава 25
Рис. 25-7. Наддиафрагмальный
дивертикул пищевода
(рентгенограмма в прямой проекции).
сти дивертикула более 2 мин можно предположить развитие дивер-
тикулита. Эзофагоскопическое исследование способствует
уточнению диагноза, позволяет выявить различные осложнения.
Лечение
Консервативное лечение показано при небольших неосложнён-
ных дивертикулах, а также при наличии противопоказаний к
операции. Оно направлено на уменьшение либо ликвидацию явлений ди-
вертикулита. Больному рекомендуют неторопливый приём пищи,
диета должна быть механически, термически и химически щадящей,
но полноценной по аминокислотному и витаминному составу.
Целесообразно периодическое промывание полости дивертикула
растворами антисептиков (перманганат калия, нитрофурал и др.).
Оперативное вмешательство выполняют у больных с выраженной
клинической симптоматикой. Оперативному лечению обычно
подвергают больных с большими дивертикулами пищевода, в которых
длительно задерживается бариевая взвесь и возникают явления ди-
вертикулита. Дивертикул размером до 3 см инвагинируют: после
.Доброкачественные заболевания и повреждения пишевода ♦ 43
выделения его погружают в просвет пищевода кисетным или
одиночными узловыми швами, наложенными в продольном направлении.
При наличии осложнений и при размерах дивертикула более 3 см
необходима дивертикулэктомия. Для этого его выделяют из
окружающих тканей до шейки, отсекают и удаляют. Образовавшийся дефект
ушивают непрерывным или узловыми швами. Дивертикулэктомию
(особенно при видеоэндохирургических операциях) осуществляют с
помощью линейных сшивающих аппаратов.
Повреждения пищевода
Изолированные открытые и закрытые повреждения пищевода
встречаются достаточно редко из-за глубокого залегания органа и
тесных взаимоотношений с другими структурами. Чаще такие
повреждения бывают сочетанными и сопровождаются опасными для
жизни кровотечениями и нарушениями проходимости дыхательных
путей. Это может привести к несвоевременной диагностике
повреждений пищевода и развитию медиастинита.
Классификация
• Уровень повреждения: шейный, грудной, абдоминальный отделы
пищевода.
• Локализация: передняя, задняя, левая или правая стенка,
противоположные стенки, циркулярные.
• Причина повреждения: внешняя травма (ранения колотые, резаные,
рваные, огнестрельные), инородные тела, хирургические операции
или инструментальные манипуляции (ятрогенные повреждения),
спонтанные разрывы.
• Сопутствующие повреждения: медиастинальной плевры, трахеоб-
ронхиального дерева, крупных сосудов; ложный ход в средостении.
Клиническая диагностика
Помимо ранений пищевода, в последние годы значительно чаще
наблюдают повреждения пищевода, связанные с проведением
различных диагностических и лечебных манипуляций (эзофагогастроско-
пия, бужирование пищевода, кардиодилатация, интубация трахеи во
время проведения наркоза). При рвоте из-за значительного повыше-
44 ♦ Хирургические болезни ♦ Том 2 ^ Часть III О Глава 25
ния внутрибрюшного давления может произойти спонтанный
(гидравлический) разрыв нижнегрудного отдела пищевода.
Клинически повреждения пищевода проявляются болью, дисфа-
гией, кровотечением из пищевода, образованием подкожной
эмфиземы. При развитии медиастинита ухудшается общее состояние
больного, возникают боли за грудиной, в грудной клетке и надчревье,
появляются признаки системной воспалительной реакции.
Для диагностики повреждений пищевода и их осложнений
применяют обзорное рентгенологическое исследование шеи, грудной
клетки и брюшной полости, рентгеноконтрастное исследование
пищевода, при необходимости — фиброэзофагоскопию. Для уточнения
диагноза могут быть использованы УЗИ плевральных полостей и
сердца. КТ средостения, торакоскопия и лапароскопия.
Лечение
Консервативное лечение проникающих повреждений пищевода
проводят лишь при малых дефектах стенки пищевода (до 0,5 см),
небольших затёках контрастного вещества (до 2 см) за контуры
пищевода в условиях их хорошего опорожнения, а также при отсутствии
гнойного процесса в средостении, плевральных полостях,
околопищеводной клетчатке на шее. Лечение заключается в исключении
питания через рот (проводят зондовое или парентеральное питание),
назначении массивной антибактериальной терапии. Ежедневно
проводят лабораторный и рентгенологический контроль.
Для хирургического лечения повреждений пищевода используют
несколько доступов. Чресшейный доступ применяют во время
операций на шейном и верхнегрудном отделах пищевода, а также на
верхней части средостения (чресшейная медиастинотомия). Разрез
производят по переднему краю грудино-ключично-сосцевидной мышцы,
начиная от яремной ямки, чаще слева. К нижнегрудному и
абдоминальному отделам пищевода, а также к заднему средостению
наиболее удобен чрезбрюшинный доступ, дополненный сагиттальной ди-
афрагмотомией. Операции на среднегрудном отделе пищевода
производят через торакотомный разрез. При необходимости
применяют сочетание нескольких доступов.
Оперативное лечение при повреждениях шейного отдела
пищевода заключается в ушивании раны с укреплением линии швов
мышцей на ножке и дренированием области вмешательства. Операции на
шейном отделе менее опасны, ушивание повреждения можно произ-
Доброкачественные заболевания и повреждения пишевода ♦ 45
водить даже в поздние сроки, так как образование свиша в этой
области не является обычно серьёзной проблемой. При свежих
повреждениях грудного отдела выполняют ушивание раны с укреплением
линии швов лоскутом плевры или перикарда, а также диафрагмаль-
ным лоскутом на ножке. В случаях повреждений абдоминального
отдела пищевода оперативное вмешательство производят через ла-
паротомный доступ, линию швов укрепляют стенкой желудка,
выполнив фундопликацию. Для питания пациента необходимо
проведение в желудок зонда (при травме на уровне шейного отдела) либо
наложение гастростомы в сочетании с фундопликацией (при
повреждениях грудного отдела пищевода).
При свежих обширных повреждениях у сравнительно крепких
пациентов может быть выполнена экстирпация пищевода. Пластику
трансплантатом из желудка или толстой кишки производят обычно
вторым этапом, спустя несколько месяцев.
При общем тяжёлом состоянии пациента, поступлении в поздние
сроки после повреждения выполняют минимальные оперативные
вмешательства, направленные на спасение жизни. Широко
дренируют клетчаточные пространства шеи, средостение, плевральные
полости, накладывают гастростому в сочетании с фундопликацией с
целью исключения питания через рот и профилактики заброса в
пищевод содержимого желудка.
Успех лечения больных с повреждениями пищевода во многом
зависит от эффективности дренирования зоны повреждения. В
последнее время с успехом применяют метод закрытого аспирационно-
промывного лечения повреждений пищевода, в том числе
осложнённых медиастинитом.
Причиной попадания инородных тел могут быть привычка
держать различные предметы во рту, поспешная еда, алкогольное
опьянение, преднамеренное проглатывание предметов психически
больными. Более чем в 50% случаев инородные тела свободно проходят
по пищеводу и другим отделам ЖКТ и выходят естественным путём.
Обычно они задерживаются в местах физиологических сужений,
наиболее часто (около 70%) в области глоточно-пищеводного перехода.
При Рубцовых и опухолевых стриктурах, дивертикулах пищевода
инородные тела могут локализоваться в месте патологического процесса.
46 <> Хирургические болезни ♦ Том 2 О Часть III О Глава 25
Клиническая симптоматика
Клиническая симптоматика может быть обусловлена как самим
инородным телом, так и вызванными им осложнениями. Обычно
пациенты предъявляют жалобы на боль в горле, дисфагию,
неприятные ощущения при глотании, повышенное слюноотделение
(гиперсаливацию). При длительном нахождении инородных тел
вышеописанные симптомы становятся более выраженными из-за нарастания
реактивного отёка вокруг инородного тела. Вместе с тем, описаны
случаи длительного бессимптомного нахождения инородных тел в
пищеводе. Чаще удалённое не сразу инородное тело вызывает
тяжёлые осложнения: некроз и перфорацию стенки пищевода с
развитием флегмоны шеи, медиастинита, плеврита, остеомиелита позвонков,
сепсиса, аррозионных кровотечений из крупных сосудов.
Для диагностики инородных тел применяют эндоскопическое и
рентгенологическое исследования (обзорные снимки и исследование
с водорастворимым контрастом). При перфорации пищевода
отмечают затекание контрастного вещества за его контуры, наличие ме-
диастинальной эмфиземы, при образовании свищей — попадание
контраста в трахеобронхиальное дерево.
Лечение
В настоящее время методом выбора удаления инородных тел
пищевода служит эндоскопия. Инородное тело захватывают
специальными щипцами и удаляют из пищевода вместе с фиброэзофагоско-
пом. При необходимости инородное тело (булавку, кость и т.д.)
поворачивают в пищеводе для того, чтобы захватить его за тупой
конец. Если развернуть инородное тело в пищеводе не представляется
возможным, то его сначала низводят в желудок тупым концом вниз,
а затем разворачивают на 180°. В ряде случаев приходится прибегать
к фрагментации и поэтапному удалению инородного тела.
После удаления инородного тела проводят контрольную
эзофагоскопию для исключения повреждения стенки пищевода,
кровотечения, других инородных тел, а при сомнении — рентгенологическое
исследование с водорастворимым контрастом. Из-за опасности
развития осложнений все больные с инородными телами пищевода
должны быть госпитализированы.
Если извлечь инородное тело с помощью эндоскопа невозможно,
проводят оперативное вмешательство. При отсутствии осложнений
выполняют рассечение стенки пищевода, извлекают инородное тело
и ушивают рану с укреплением линии швов. В случаях гнойных
осложнений широко дренируют клетчаточные пространства шеи,
плевральные полости, средостение, выполняют гастростомию в
сочетании с фундопликацией.
Свищи пищевода
Приобретённые свищи как осложнение различных повреждений
и заболеваний пищевода могут располагаться в любом его отделе. Они
могут возникать вследствие опухолей, травм, специфического и
неспецифического воспаления. Различают наружные и внутренние
свищи. Внутренние свищи могут сообщаться с органами дыхания,
средостением, плевральной и брюшной полостями.
Клинические проявления
Клинические проявления зависят от этиологии, локализации,
размеров свища. Часто на первый план выходят симптомы основного
заболевания (рак или тяжёлая рубцовая стриктура). Пищеводно-рес-
пираторные свищи проявляются мучительным кашлем во время еды.
Аспирация пищи может приводить к развитию пневмонии и
абсцесса лёгкого. Пищеводно-плевральные свищи приводят к эмпиеме
плевры. При пищеводно-медиастинальных свищах (без нарушения
целостности плевры) клиника менее отчётлива, свищи могут
выявляться только при рентгеноконтрастном исследовании.
Диагностика
Диагноз наружных пищеводных свищей подтверждают пробой с
красящим веществом (метилтионина хлорид). Окрашенная
жидкость, принятая через рот, выделяется через некоторое время из
наружного отверстия свища или по дренажу. Проводят также
полипозиционное рентгенологическое исследование с водорастворимым
контрастом, а при необходимости и фистулографию. Диагностику
пишеводно-респираторных свищей производят при
рентгеноконтрастном и эндоскопическом исследованиях (выполняют трахеобронхо-
скопию с одновременным введением в пищевод по зонду
метилтионина хлорида).
Лечение
Наружные пищеводные свищи обычно лечат консервативно,
проводя антибактериальную, общеукрепляющую и дезинтоксикационную
терапию. Питание осуществляют через зонд или гастростому (при её
наличии). Такое лечение приводит к заживлению свища в течение 7—14 дней.
Для лечения пищеводно-респираторных свищей накладывают
гастростому с целью полноценного энтерального питания больного. Её
целесообразно сочетать с фундопликацией для предотвращения
заброса содержимого желудка в пищевод. Если свищ после гастросто-
мии и интенсивной терапии не закрывается, то необходимо
выполнение радикальной операции. Доступ осуществляют в зависимости
от локализации свища. Операция заключается в выделении и
пересечении свища, ушивании дефекта трахеи или бронха и отверстия
в стенке пищевода с обязательным укрытием линии швов лоскутом
из мышцы, плевры, диафрагмы, большого сальника, плевро-надкост-
ничным лоскутом и т.д. При тяжёлых органических изменениях в
лёгких, возникших из-за длительного существования
пищеводно-респираторных свищей, может потребоваться сочетанная операция —
атипичная резекция лёгкого, лобэктомия или даже пневмонэктомия.
При пищеводно-респираторных свищах, возникших вследствие
Рубцовых стриктур пищевода, целесообразно выполнять полное удаление
(экстирпацию) пищевода. При свищах пищевода опухолевого
происхождения выполнение радикальной операции возможно лишь в
единичных случаях из-за распространённости опухолевого процесса.
Ожоги и рубцовые сужения пищевода
Чаше всего приходится сталкиваться с химическими ожогами
пищевода, гораздо реже наблюдают термические его повреждения.
Химические ожоги возникают при случайном или преднамеренном
(суицидальная попытка) приёме различных химических веществ, чаще
всего концентрированных кислот или щелочей. Ожоги пищевода
могут вызывать и некоторые другие соединения (соли тяжёлых
металлов, перманганат калия, фенол, ацетон и т.д.).
Тяжесть химического ожога, а также его общее токсическое
воздействие на организм зависят от концентрации принятого вещества,
его количества, химической природы, времени воздействия на
слизистые оболочки пищеварительного тракта, сроков оказания первой
помощи, реактивности организма.
Доброкачественные заболевания и повреждения пишевода ♦ 49
• Щёлочи вызывают глубокий и обширный колликвационный некроз
(мягкое омертвение) тканей пищеварительного тракта,
сопровождающийся растворением белков и омылением жиров, что приводит
к диффузии принятого вещества в глубже лежащие ткани.
• Кислоты обладают прижигающим и денатурирующим действием и
ведут к возникновению менее глубокого коагуляционного некроза.
В связи с длительной задержкой химических веществ наиболее
выраженные изменения обычно отмечаются в местах
физиологических сужений пищевода.
В зависимости от глубины поражения тканей различают три
степени химического ожога пищевода:
• I степень (лёгкая) — повреждение поверхностных слоев эпителия
слизистой оболочки;
• II степень (средней тяжести) — поражение слизистой оболочки на
всю глубину с распространением процесса на подслизистый слой;
• III степень (тяжёлая) — распространение повреждения на все слои
пищевода, нередко с вовлечением околопищеводной клетчатки и
соседних структур (плевра, перикард, трахея).
В клиническом течении ожогов пищевода различают четыре
периода:
1) острый период, который длится до 2 нед и характеризуется
выраженными воспалительными и дегенеративно-дистрофическими
изменениями в стенке пищевода;
2) период мнимого благополучия продолжительностью 2—3 нед, в
течение которого происходят отторжение некротических масс и
образование грануляционной ткани, что приводит к уменьшению
или полному исчезновению дисфагии;
3) период формирования рубцовой стриктуры (начиная с 4—5-й
недели), когда происходит замещение грануляций плотной
фиброзной соединительной тканью, вновь возникает дисфагия (при
химических ожогах I степени заживление происходит без
формирования рубца);
4) период поздних осложнений (облитерация просвета пищевода,
развитие рака и др.).
Клиническая картина
Сразу после проглатывания химического вещества (острый
период) отмечается многократная рвота, часто с примесью крови,
возникает сильная боль в полости рта, за грудиной, в надчревье, появляется
50 О- Хирургические болезни ♦ Том 2 -0- Часть III О- Глава 25
рефлекторная дисфагия. Во время рвоты возможна аспирация, в
результате развивается ожог гортани, трахеи, бронхов, что может
привести к тяжёлой пневмонии. У пострадавшего возникают страх,
возбуждение, характерны бледность кожи, обильное слюноотделение,
часто наблюдают осиплость голоса (вследствие распространения
отёка с глотки на гортань), появляются одышка, тахикардия,
артериальная гипотензия. При тяжёлых ожогах пищевода общее состояние
больного быстро ухудшается, возбуждение сменяется адинамией,
появляются холодный пот, акроцианоз, нарастают тахикардия,
одышка, могут возникнуть спутанное сознание, бред. К концу первого дня
температура тела повышается до 38—39 °С, уменьшается количество
мочи, гемолитическое действие некоторых химических веществ
может привести к почечной недостаточности. При глубоких некрозах
возможна перфорация пищевода с развитием медиастинита. В
наиболее тяжёлых случаях пострадавшие погибают в первые часы или
дни вследствие шока или полиорганной недостаточности
(летальность в остром периоде достигает 10%).
Через 7—14 дней после ожога дисфагия и боль при глотании
уменьшаются (период мнимого благополучия), начинается отторжение не-
кротизированных тканей пищевода. В случае глубокого некроза
возможно возникновение кровотечения или перфорации пищевода. Этот
опасный для жизни больного период обычно длится 2—3 нед, после
чего острое воспаление стихает и начинается процесс регенерации за
счёт развития грануляционной ткани. Общее состояние больного
стабилизируется, дисфагия уменьшается или даже исчезает вовсе,
больной начинает осторожно принимать пищу через рот, что может
ввести в заблуждение врачей, которые ошибочно прекращают лечение в
эту стадию патологического процесса.
Через 4—5 нед после ожога пищевода грануляции начинают
замещаться плотной фиброзной соединительной тканью, которая
постепенно превращается в рубец (период формирования рубцовой
стриктуры). Стриктуры пищевода чаще всего локализуются в
области физиологических сужений. Выше рубцового сужения стенка
пищевода со временем расширяется, истончается и склеротически
изменяется в результате длительной задержки пищи, поддерживающей
воспалительный процесс. Рубцовые сужения могут быть полными и
неполными, короткими (до 3—5 см) и протяжёнными.
Длительно существующая стриктура пищевода может привести к
развитию рака (период поздних осложнений), частота которого в
обожжённом пищеводе превышает таковую у здоровых людей.
Доброкачественные заболевания и повреждения пишевода -0- 51
Клинические проявления рубцовой стриктуры зависят от
степени нарушения проходимости пищевода. Основным симптомом
служит дисфагия, которая обычно сопровождается гиперсаливацией и
регургитацией. Если пациент своевременно не обращается за
медицинской помощью, рубцовая стриктура пищевода приводит к
алиментарному истощению. Указание в анамнезе на приём
химического вещества, появление через некоторое время дисфагии позволяют
заподозрить образование рубцового сужения пищевода.
Диагностика
Для определения локализации, протяжённости и
выраженности стриктуры проводят рентгеноконтрастное исследование
пищевода и желудка с использованием жидкой взвеси сульфата бария
или водорастворимого контрастного
вещества. Основные рентгенологические
признаки рубцовой стриктуры
пищевода — неравномерное сужение его
просвета вплоть до полной облитерации,
неровный зазубренный контур на
протяжении стриктуры, деформация рельефа
слизистой оболочки, ригидность стенок,
наличие супрастенотического
расширения (рис. 25-8). Рентгенологическое
исследование также позволяет выявить
сопутствующие ожоговые деформации
желудка. При полной облитерации
пищевода желудок и отрезок пищевода ниже
сужения заполняют контрастным
веществом через гастростому.
Эзофагоскопия даёт возможность
определить степень и форму сужения,
характер расширения пищевода над
участком стеноза, локализацию рубцов,
границы неизменённой слизистой
оболочки. Ретроградная эзофагоскопия (через
гастростому) позволяет уточнить
нижнюю границу сужения, состояние пост-
стенотического отдела пищевода и
желудка.
Рис. 25-8. Протяжённая
рубцовая стриктура средней и
нижней третей пищевода
(рентгенограмма в боковой
проекции).
52 ♦ Хирургические болезни <0 Том 2 -0- Часть III ♦ Глава 25
Лечение
Неотложная помощь заключается в обезболивании, удалении
остатков химических веществ, попавших в пищевод и желудок, и их
нейтрализации. Это достигается путём введения анальгетиков, вплоть
до наркотических, а также промыванием пищевода и желудка
большим количеством (не менее 10 л) тёплой воды или слабого раствора
нейтрализующего соединения.
Лечение химических ожогов пищевода должно быть комплексным
и проводиться в специализированных отделениях. Необходимо
применение инфузионно-трансфузионной, противошоковой терапии,
парентерального питания, антибактериальных средств. Назначают
глюкокортикоиды (гидрокортизон, преднизолон), обеспечивающие
противовоспалительный эффект и лучшую регенерацию тканей.
Значительно улучшают репаративные процессы сеансы гипербарической
оксигенации, местное облучение через эндоскоп ожоговой
поверхности гелий-неоновым лазером. При сопутствующем ожоге
дыхательных путей необходимы аспирация слизи из трахеи и бронхов и
поддержание проходимости дыхательных путей, при необходимости
производят трахеостомию. Развитие печёночно-почечной
недостаточности диктует необходимость применения эфферентных методов
лечения (гемодиализ, плазмаферез).
С первых дней после ожога рекомендуют приём жидких масел
(подсолнечное, оливковое, облепиховое, рыбий жир). Если в
течение 5-7 дней после ожога пациент не в состоянии принимать хотя
бы жидкую пищу и отсутствуют условия для проведения длительного
парентерального питания, необходимо выполнять гастростомию.
Спустя 8-10 дней с момента ожога начинают бужирование
пищевода, которое проводят на протяжении 1 — 1,5 мес.
Использование раннего бужирования в 90% случаев предупреждает образование
рубцового стеноза. Существует несколько методик проведения этой
процедуры. Бужирование вслепую через рот представляется самой
опасной из них, так как наиболее часто осложняется перфорацией
пищевода. В современных условиях его обычно проводят полыми рен-
тгеноконтрастными бужами по металлической струне-проводнику,
который проводят под рентгенологическим контролем или под
контролем фиброэзофагоскопа. Бужирование показано всем больным,
которым удаётся провести через сужение в желудок металлический
проводник, и абсолютно противопоказано при стриктурах,
осложнившихся образованием свищей пищевода.
Доброкачественные заболевания и повреждения пишевода ♦ 53
В результате заживления образовавшихся во время бужирования
надрывов в зоне рубцового поражения у большинства больных в
последующем в различные сроки развивается рестеноз, поэтому после
первичного курса подобного лечения требуется проведение
поддерживающих курсов бужирования в течение 1 — 1,5 лет для получения
стойкого длительного расширения просвета в зоне сужения. При
неэффективности поддерживающего лечения в течение этого времени
необходимо решать вопрос о хирургической операции.
Оперативное лечение показано при полной облитерации
просвета пищевода, невозможности провести буж из-за плотных рубцов,
быстро возникающих после повторных курсов бужирования рецидивах
стриктуры (через 3—6 мес), сочетании ожоговой стриктуры
пищевода, глотки и желудка; ожоговых стриктурах, осложнённых
пищеводными свищами, перфорации пищевода во время бужирования.
Выбор метода операции зависит от локализации, протяжённости
и степени стриктуры, наличия осложнений, сопутствующих
поражений глотки и желудка, предыдущих операций, общего состояния
больного. Оперативное вмешательство может производиться в один
или несколько этапов. У ослабленных пациентов первым этапом
накладывают гастростому для полноценного питания. При
постожоговом стенозе выходного отдела желудка вначале выполняют пилоро-
пластику, гастроэнтеростомию или резекцию желудка в сочетании с
гастростомией. Соединение трансплантата с пищеводом или глоткой
чаще всего осуществляют одномоментно, но оно может быть
отложено на второй этап при сомнении в адекватности кровоснабжения
трансплантата или при недостаточной его длине.
В зависимости от локализации и протяжённости стриктуры,
длины выкраиваемого трансплантата производят местную,
сегментарную, субтотальную и тотальную пластику пищевода. Местная
пластика может быть выполнена при коротких (протяжённостью до 3 см)
стриктурах. Производят циркулярную резекцию суженного отдела
пищевода с эзофагоанастомозом «конец в конец» или продольное
рассечение стриктуры с ушиванием разреза пищевода в поперечном
направлении.
При ограниченном рубцовом поражении пищевода может быть
выполнена так называемая сегментарная пластика, для которой
используют короткие трансплантаты из тонкой или толстой кишки. При
протяжённых сужениях пищевода показана субтотальная или
тотальная пластика пищевода трансплантатом из толстой кишки, желудка
или тонкой кишки. В зависимости от локализации и протяжённости
54 ♦ Хирургические болезни О- Том 2 ♦ Часть III ♦ Глава 25
стриктуры анастомоз между пищеводом и трансплантатом может быть
сформирован или в грудной полости, или на шее.
Для субтотальной и тотальной пластики пищевода часто
используют трансплантат из толстой кишки. Он может быть сформирован
как из правой, так и из левой половины толстой кишки,
располагаться либо в изоперистальтическом, либо в антиперистальтическом
направлении. Трансплантат из толстой кишки проводят позади
желудка, а затем на шею, чаще всего в загрудинном тоннеле в переднем
средостении. Нижний конец трансплантата соединяют с желудком
(в некоторых случаях с двенадцатиперстной или тощей кишкой),
верхний конец — с пищеводом или глоткой. Непрерывность кишечника
восстанавливают путём наложения анастомоза.
В настоящее время для пластики пищевода широко применяют
желудок (рис. 25-9), используя как трубчатые трансплантаты, распо-
Рис. 25-9. Схема
формирования искусственного
пищевода из большой кривизны
желудка: а — используемые
доступы; б — объём удаления
изменённого пищевода; в —
желудок перемещён в
плевральную полость и анастомо-
зирован с проксимальной
порцией пищевода. Выполнена
внеслизистая пилоротомия для
предотвращения гастростаза.
Доброкачественные заболевания и повреждения пишевода ♦
латающиеся изоперистальтически, так и целый желудок. Пассаж
пищи после желудочной пластики считают более физиологичным, так
как он обеспечивает участие в акте пищеварения всех отделов ЖКТ.
Кроме того, при желудочной пластике формируют лишь один
анастомоз (между пищеводом или глоткой и желудком), что позволяет
избежать многих осложнений. К сожалению, для пластики
пищевода желудок удаётся использовать не всегда из-за выполненных ранее
операций (резекция, гастроэнтеростомия, гастростомия).
В последние годы достаточно широко применяют метод удаления
рубцово изменённого пищевода. Данная операция является
наиболее радикальной, но к выполнению этого вмешательства
необходимо подходить индивидуально, так как оно достаточно травматично и
значительно отягощает течение послеоперационного периода.
Трансплантат проводят в заднем средостении в ложе удалённого пищевода.
При стриктурах нижней трети пищевода может быть выполнена
резекция поражённого участка с наложением анастомоза между
пищеводом и желудком в грудной полости. Несостоятельность
анастомоза в грудной полости приводит к развитию медиастинита,
сопровождающегося высокой летальностью, поэтому большинство
хирургов предпочитают тотальную и субтотальную пластику
пищевода, при которых формирование анастомоза между пищеводом и
трансплантатом производят на шее. Несостоятельность анастомоза
на шее обычно не приводит к тяжёлым осложнениям.
Рак пищевода — злокачественная опухоль, исходящая из
слизистой оболочки этого органа. Со временем, постоянно увеличиваясь в
массе, опухоль прорастает в толщу органа, как правило, циркулярно
захватывая его стенки. Возникает дисфагия, которая нарастает
гораздо быстрее, чем рост и метастазирование самой опухоли. Болезнь
завершается непроходимостью пищевода и следующим за ней
алиментарным истощением.
Среди опухолей ЖКТ рак пищевода занимает 3-е место после рака
желудка и толстой кишки, среди всех опухолей — 7—8-е место.
Основные черты патологии
Рак пищевода может локализоваться в любом сегменте органа, но
чаще всего развивается в местах физиологических сужений.
Виды роста: эндофитный — опухоль растёт в стенку органа, экзо-
фитный — в просвет пищевода.
По макроскопической картине различают три основные формы
роста рака пищевода: 1) язвенный (кратерообразный); 2) узловой (па-
пилломатозный); 3) инфильтрирующий или склерозирующий (скир-
розный) рак. Встречаются смешанные формы.
Распространение рака происходит в результате инвазии в
соседние структуры, гематогенной диссеминации и лимфогенного мета-
стазирования. Разрастаясь, раковая опухоль захватывает все большие
участки стенки пищевода, прорастает постепенно все её слои и
врастает в окружающие ткани и органы. В верхней трети пищевода — в
трахею, что становится наиболее частой причиной неоперабельнос-
ти опухолей этой зоны. Рак средней трети органа может прорастать
аорту, непарную и лёгочные вены. Прорастание одного из
прилежащих органов и последующий распад опухоли могут привести к
образованию свищей между пищеводом и бронхами (трахеей), плеврой,
перикардом и аортой. Метастазирование рака пищевода идёт в
основном соответственно току лимфы. Опухоли верхнего отдела мета-
стазируют в медиастинальные, над- и подключичные лимфатические
узлы. Опухоли нижней трети — в околокардиальные лимфатические
Рак пищевода ♦ 57
узлы и по ходу левой желудочной артерии в забрюшинную клетчатку,
печень. Возможно метастазирование и в другие самые различные
области. Метастазы существенно утяжеляют состояние больных и
ускоряют летальный исход.
Существенный момент развития рака пищевода — механическое
нарушение проходимости органа. Нередко алиментарные нарушения,
вызванные дисфагией, опережают развитие раковой кахексии,
приводят к существенному ухудшению состояния больных.
Осложнения рака пищевода: 1) раковое и алиментарное истощение;
2) кровотечение из изъязвленной опухоли; 3) перфорация пищевода
с развитием медиастинита; 4) образование пищеводно-органных (пи-
щеводно-трахеальных, пищеводно-бронхиальных, пищеводно-плев-
ральных, пищеводно-аортальных) свищей.
Продолжительность болезни от первых признаков до момента
установления диагноза, как правило, колеблется от 2 до 10 мес. Ранние
формы рака пищевода на основании клинической картины
практически не выявляются. От момента установления диагноза при
неоперабельных формах рака пищевода люди живут в среднем 9-12 мес.
Смерть наступает от кахексии либо от других осложнений опухоли.
Причины развития рака пищевода столь же малоизвестны, как и
рака других органов. Заболеваемость среди мужчин после 70 лет
почти в 4 раза выше, чем на шестом десятилетии, а в период шестого
десятилетия в 4 раза выше, чем на пятом, и т.д. Большую роль в
развитии рака пищевода играет хроническое воздействие на слизистую
оболочку пищевода различных раздражающих веществ (алкоголь,
горячая, твёрдая пища, табак и т.д.). Считают, что некоторые
заболевания могут предшествовать возникновению рака пищевода,
например синдром Пламмера—Винсона, сочетающий дисфагию,
ахилию, хронический глоссит, хейлит, выпадение волос, гипохромную
анемию, потерю зубов. К предраковым заболеваниям относят
кардиоспазм, рубцовые сужения пищевода после химических ожогов,
длительно текущий рефлюкс-эзофагитпри недостаточности замыкатель-
ной функции нижнего пищеводного жома.
Классификация
По гистологическому строению выделяют: а) плоскоклеточный (вы-
сокодифференцированный — ороговевающий, умеренно
дифференцированный — с наклонностью к ороговению, низкодифференциро-
ванный — без ороговения) рак; б) аденокарциному; в)
железисто-плоскоклеточный рак (аденокарцинома); г) недифференцированный (ов-
сяноклеточный) рак. Плоскоклеточный рак поражает верхнюю и
среднюю трети пищевода, но встречается также и в дистальном сегменте,
Аденокарцинома обычно локализуется в дистальном отделе пищевода.
Клиническая классификация. В нашей стране принято деление
рака пищевода на четыре стадии.
• I стадия — опухоль в слизистом и подслизистом слоях
протяжённостью не более 3 см. Сужения просвета пищевода нет. Регионарные
метастазы не определяются.
• ПА стадия — опухоль протяжённостью 3—5 см в слизисто-подслизи-
стом слое, врастающая в мышечные слои стенки пищевода, но без
полного прорастания её. Регионарные метастазы не определяются.
• ПБ стадия — опухоль той же или меньшей степени местного
распространения с одиночным регионарным метастазом.
• ША стадия — опухоль протяжённостью более 5 см, врастающая в
мышечную стенку пищевода без полного прорастания её, или
опухоль любой протяжённости, полностью прорастающая стенку
пищевода. Регионарные метастазы не определяются.
• ШБ стадия — опухоль той же или меньшей степени местного
распространения с множественными регионарными метастазами.
• IVA стадия — опухоль любой протяжённости, врастающая в
соседние органы. Регионарные метастазы не определяются.
• IVB стадия — опухоль той же степени местного распространения с
любыми вариантами регионарного метастазирования или опухоль
меньшей степени местного распространения с несмещаемыми
регионарными метастазами, или опухоль любой степени местного
распространения с клинически определяемыми отдалёнными метастазами.
Международная классификация по системе TNM
Необходимо гистологическое подтверждение диагноза.
Анатомическое расположение опухоли должно быть точно указано,
поскольку от её локализации зависят тактика лечения и прогноз.
Клиническая стадия (cTNM) зависит от распространённости
первичной опухоли, которую можно установить при обследовании до
начала специального лечения. Обследование должно включать в себя
анамнез, клинический осмотр, стандартные лабораторные
исследования, эндоскопическое и рентгенологическое исследования. УЗИ с
эндоскопическим датчиком и КТ помогают уточнить расположение,
глубину инвазии опухоли и наличие поражения лимфатических узлов.
Рак пищевода ♦ 59
Патоморфологическая стадия (pTNM) определяется на основании
данных, полученных во время операции, исследования
резецированного участка пищевода и лимфатических узлов. Для установления pN,
медиастинальная лимфаденэктомия должна быть проведена с
удалением не менее шести лимфатических узлов. Распространённость опухоли
и наличие отдалённых метастазов должны быть тщательно
задокументированы. Для всех отделов пищевода используют единую
классификацию как для клинической, так и патолого-морфологической TNM.
Т — первичная опухоль.
ТХ —недостаточно данных для оценки первичной опухоли.
ТО —первичная опухоль не определяется.
Tis — карцинома in situ.
Т1 —опухоль прорастает слизистую оболочку или подслизистый
слой.
Т2 —опухоль прорастает мышечный слой.
ТЗ —опухоль прорастает адвентицию.
Т4 —опухоль прорастает прилежащие структуры.
N —регионарные лимфатические узлы.
NX — недостаточно данных для оценки поражения регионарных
лимфатических узлов.
N0 —нет метастазов в регионарных лимфатических узлах.
N1 —имеются метастазы в регионарных лимфатических узлах.
М —отдалённые метастазы.
MX — недостаточно данных для определения отдалённых метастазов.
МО —нет отдалённых метастазов.
Ml —имеются отдалённые метастазы.
Группировка по стадиям
Стадия 0
Стадия I
Стадия ПА
Стадия ИВ
Стадия III
Стадия IV
Стадия IVA
Стадия IVB
Tis
Т1
Т2
ТЗ
Т!
Т2
ТЗ
Т4
Любая Т
Любая Т
Любая Т
N0
N0
N0
N0
N1
N1
N1
Любая N
Любая N
Любая N
Любая N
МО
МО
МО
МО
МО
МО
МО
МО
Ml
Mia
Mlb
60 ♦ Хирургические болезни ♦ Том 2 ♦ Часть III ♦ Глава 26
Клинические проявления
Основной клинический симптом рака пищевода — дисфагия. К
сожалению, он не может считаться ранним, поскольку возникает, как
правило, при стенозирующей опухоли значительных размеров.
Различают четыре степени дисфагии:
• 1-я степень — по пищеводу проходит любая пища, но больной
испытывает неприятные ощущения, прохождение пищи замедлено,
иногда появляется болезненность за грудиной, в межлопаточном
пространстве, в надчревье;
• 2-я степень — проходит любая пища, но больной вынужден
запивать её водой;
• 3-я степень — проходит только жидкая пища;
• 4-я степень — пища не проходит (афагия).
Боли при раке пищевода локализуются за грудиной, в
межлопаточном пространстве, в эпигастральной области, могут симулировать
стенокардию, спондилит. Болевой синдром, обусловленный раком
пищевода, трудно отличить от проявлений ишемической болезни
сердца, тем более что возраст большинства больных превышает 60 лет.
Отмечено, что симптомы, похожие на стенокардию, возникают у
больных с прорастанием опухоли в диафрагму, перикард и другие
структуры средостения.
Реже при раке пищевода отмечают гиперсаливацию, регургитацию,
тошноту, отрыжку, изжогу. Рвота встречается редко. Очень важный
клинический синдром рака пищевода — резкое снижение массы тела.
Признаком метастазирования опухоли в печень является желтуш-
ность кожных покровов.
Диагностика
Диагноз рака пищевода следует заподозрить на основании
клинических симптомов — дисфагии, неопределённых болей за грудиной
или в межлопаточном пространстве, либо у больных с предраковыми
болезнями пищевода (рефлюкс-эзофагитом, кардиоспазмом,
Рубцовыми сужениями пищевода после химических ожогов,
дивертикулами и др.) при изменении характера жалоб. Пациенты с этими
заболеваниями должны ежегодно осматриваться врачом.
Основные методы диагностики рака пищевода —
рентгенологический и эндоскопический. Эти два метода не конкурируют, но до-
Рак пишевода ♦ 61
полняют друг друга. При рентгеновском исследовании удаётся
выявить характерные для рака пищевода признаки — сужение просвета,
«дефект наполнения», супрастенотическое расширение, замедление
проходимости контрастной массы разной консистенции, неровность
или нечёткость контуров пищевода, их зазубренность (рис. 26-1).
Метод, подтверждающий диагноз рака пищевода, —
эзофагоскопия, которая позволяет оценить внешние изменения слизистой
оболочки, состояние входа в пищевод (жом Килиана) и зоны пищевод-
но-желудочного перехода, длину органа. С её помощью определяют
размеры опухоли и её протяжённость, проводят забор материала для
гистологического и цитологического исследований.
КТ позволяет выявить опухоль в пищеводе, сопутствующую ей
лимфаденопатию средостения и верхнего этажа брюшной полости.
Она выявляет метастазы рака в печени, лёгких, других органах.
Дифференциальная
диагностика
'М
Дифференциальную диагностику
приходится проводить с пептическими и после-
ожоговыми стриктурами, кардиоспазмом
и ахалазией пищевода, дивертикулами.
Особого внимания при
дифференциальной диагностике требуют пептические
стриктуры пищевода. Большинство
проблем решает эндоскопическая биопсия.
Лечение
До настоящего времени нет
убедительных доказательств возможности
излечения рака пищевода методами лучевой
терапии или химиотерапии. Поэтому
основным методом лечения остаётся
хирургическое вмешательство. Оно
позволяет получить достоверное излечение
больных раком пищевода на продолжительные
сроки. Вместе с тем, расположение орга-
Рис. 26-1. Рентгенограмма
при раке пищевода.
62 Ф- Хирургические болезни ^ Том 2 ♦ Часть III О- Глава 26
на глубоко в грудной полости и характер строения его стенки
обусловливают высокий риск несостоятельности пищеводных
анастомозов, а быстрое алиментарное истощение больных нередко делает
радикальную хирургическую операцию очень опасной и трудно
переносимой для них. Поэтому при этом заболевании достаточно
часто приходится прибегать к паллиативным хирургическим
вмешательствам.
Радикальные операции
Радикальные операции предпринимают при наличии
доказанного рака пищевода, если нет противопоказаний. Противопоказания к
радикальной операции:
• локальные — метастазы в отдалённые органы, пищеводно-ор-
ганные свищи, массивное метастатическое поражение
регионарных лимфатических узлов, переход опухоли пищевода на другие
органы (Т4);
• общие — истощение, сердечная и дыхательная недостаточность,
нарушения функций паренхиматозных органов.
К настоящему времени описано много различных методов
радикального хирургического лечения заболевания, сущность которых
состоит в разных подходах к полному или частичному удалению
органа, одномоментному или этапному восстановлению его
проходимости, выбору способа создания искусственного пищевода.
Экстирпацию или резекцию пищевода вместе с опухолью осуществляют
через трансплевральный (правосторонний или левосторонний),
абдоминальный (чрездиафрагмальный) и шейный доступы или с
помощью их комбинации. Для восстановления проходимости
пищеварительного тракта после удаления пищевода используют желудок
либо выкроенные из его стенки изо- или антиперистальтические
трубки, участок тонкой или толстой кишки. Трансплантаты проводят
через заднее средостение, внутриплеврально, загрудинно или анте-
торакально.
В настоящее время применяют следующие операции.
• Резекция или экстирпация пищевода вместе с опухолью с
одновременным созданием эзофагостомы на шее и гастростомы (операция
Добромыслова—Торека).
• Резекция нижней половины пищевода из левостороннего торако-
абдоминального доступа с одновременным наложением пищевод-
но-желудочного внутригрудного анастомоза.
Рак пищевода О 63
• Резекция пищевода вместе с опухолью с одновременной
реконструктивной операцией и восстановлением проходимости для пиши
по Льюису.
• Резекция или экстирпация пищевода из абдоминального и
шейного доступов с одномоментной пластикой пищевода изоперисталь-
тической трубкой из большой кривизны желудка или целым
желудком с анастомозом на шее.
Операцию Добромыслова—Торека проводят в несколько этапов.
Через правостороннюю боковую торакотомию выделяют пищевод
кверху и книзу от опухоли и удаляют его вместе с лимфатическими
узлами и клетчаткой средостения в пределах здоровых тканей,
отступя не менее 6 см от края опухоли. Проксимальный конец нижней
половины оставшегося пищевода герметизируют швами. Рану
грудной стенки послойно ушивают, оставив в плевральной полости
дренажные трубки для контроля гемостаза, удаления экссудата и
воздуха. Вслед за этим производят лапаротомию, ревизию брюшной
полости и накладывают гастростому. Рану брюшной стенки
ушивают. Затем, используя левосторонний шейный доступ, оральную
культю пищевода выводят наружу и формируют эзофагостому.
Искусственный пищевод создают во время повторного хирургического
вмешательства, что представляется главным недостатком подобной
операции. Поэтому к ней прибегают лишь в тех случаях, когда риск
одномоментного пластического замещения пищевода слишком высок.
При локализации опухоли в нижнегрудном или абдоминальном
отделе предпочтение отдают резекции пищевода и проксимального
отдела желудка из комбинированного левостороннего торакоабдоми-
нального доступа с одномоментным наложением пищеводно-желу-
дочного анастомоза. При этом вместе с окружающей клетчаткой
удаляют параэзофагеальные лимфатические узлы. Недостатком этой
операции являются трудности наложения пищеводно-желудочного
анастомоза. В настоящее время эту операцию применяют при карди-
оэзофагеальном раке.
Резекция пищевода с одномоментной пластикой его целым желудком
(операция Льюиса) состоит из двух основных этапов —
абдоминального и торакального. Сначала выполняют верхнюю срединную
лапаротомию. После ревизии органов брюшной полости производят
тотальную мобилизацию желудка с сохранением его кровоснабжения
за счёт правых желудочной и желудочно-сальниковой артерий. Рану
брюшной стенки зашивают. Больного поворачивают на левый бок,
выполняют правостороннюю торакотомию. Так же, как и при опера-
64 ♦ Хирургические болезни <> Том 2 ♦ Часть III О- Глава 26
Рис. 26-2. Схема операции
резекции пищевода с
одномоментной пластикой его
желудком.
ции Добромыслова, мобилизуют и
удаляют пищевод. Через пищеводное
отверстие диафрагмы в плевральную полость
выводят из живота мобилизованный
желудок, накладывают пищеводно-желу-
дочный анастомоз (рис. 26-2). Рану
грудной стенки ушивают наглухо, оставляя
в плевральной полости дренажные
трубки. Операция Льюиса сочетает в себе
радикальность и одномоментное
пластическое восстановление пищевода, что
делает её одним из наиболее
популярных видов хирургического лечения рака
пищевода.
Резекцию пищевода из
абдоминального и шейного доступов с одномоментной
пластикой выполняют следующим
образом. После верхней срединной лапаротомии производят
сагиттальную диафрагмотомию — рассекают диафрагму на 8—10 см кпереди от
пищеводного отверстия. С помощью специальных длинных
инструментов и расширителей широко раскрывают средостение и из
брюшной полости под контролем зрения через рану в диафрагме
производят мобилизацию пищевода вместе с окружающими лимфатическими
узлами и жировой клетчаткой до уровня бифуркации трахеи.
Левосторонним шейным доступом выделяют пищевод и пересекают его на
шее, после этого низводят его в живот. Вместе с пищеводом удаляют
малую кривизну желудка с малым сальником. Затем формируют из
большой кривизны желудка трубку шириной 2—4 см с основанием у
привратника, которую через заднее средостение проводят на шею,
где накладывают анастомоз. Иногда при этой операции для
пластики пищевода используют целый желудок. Подобная операция
относительно легко переносится больными, но достаточно сложна и
трудоёмка для хирурга. С её помощью иногда невозможно соблюсти
принцип абластичности.
Паллиативные вмешательства
Паллиативные вмешательства направлены на восстановление
возможности энтерального питания больного. Этого добиваются с
помощью гастростомии либо путём частичного разрушения опухоли,
выполняя бужирование, протезирование или лазерную реканализа-
цию пищевода.
Гастростомия заключается в образовании искусственного хода в
желудок для питания больных с непроходимостью пищевода (рис. 26-3).
Поскольку при раке пищевода гастростома, как правило, служит в
течение относительно длительного времени, она должна быть
герметична, не требовать постоянного ношения трубки и не должна
«зарастать» в период, когда трубка извлечена. Этим требованиям
соответствует методика Штамма—Сенна—Кадера.
Рис. 26-3. Гастростомия по Кадеру (схема операции).
Бужирование пищевода — малоэффективное мероприятие,
поскольку при этом способе лечения дисфагия не исчезает, она лишь
уменьшается на несколько дней, затем требуется повторение
процедуры. При бужировании ракового сужения пищевода существует
опасность перфорации и кровотечения.
Протезирование пищевода предполагает механическое расширение
суженного опухолью сегмента с оставлением в его просвете
эластичной трубки — стента. Благодаря интубации восстанавливается про-
66 $> Хирургические болезни О- Том 2 ♦ Часть III ♦ Глава 26
ходимость пищеварительного тракта естественным путём. Такой
способ нормализации питания значительно лучше для морального
состояния больных, чем наложение гастростомы. Продолжительность
жизни больных после интубации пищевода при раке составляет 5—14
мес. Недостатки интубации — значительная травма, которая
наносится пищеводу проводниками и самими трубками, особенно с
винтовой нарезкой, опасность перфорации пищевода и образования
пролежней в стенке органа.
Лазерная реканализация пищевода. Для этого через эзофагоскоп к
опухоли по специальному световоду подводят пучок
высокоэнергетического лазерного излучения, которое денатурирует ткань
опухоли. К недостаткам метода следует отнести невозможность контроля
глубины некроза стенки органа и опухоли. Трудно исключить и
предотвратить перфорацию органа.
* * *
Как видно из изложенного, рак пищевода — трудноизлечимое
заболевание. Основным способом его лечения служит обширное и
травматичное хирургическое вмешательство, которое далеко не всегда
эффективно и безопасно. Ведутся поиски оптимальных сочетаний
операции с лучевой терапией и химиотерапией. Тем не менее,
результаты хирургического лечения до настоящего времени оставляют
желать лучшего. Статистика свидетельствует о поздней диагностике
рака пищевода — он часто диагностируется в IV стадии, когда
радикальное лечение становится невозможным. Смерть от рака
пищевода — голодная смерть, один из самых мучительных видов умирания.
В таких условиях даже гастростомия становится в какой-то мере
спасительной. Выполнение обезболивающих процедур, в том числе
назначение наркотических препаратов для уменьшения мучений,
становится актуальным.
НАГНОИТЕЛЬНЫЕ
ЗАБОЛЕВАНИЯ ЛЁГКИХ И ПЛЕВРЫ
Острый абсцесс и гангрена лёгкого
Абсцесс лёгкого — ограниченная грануляционным валом и зоной
перифокальной инфильтрации внутрилёгочная полость,
образовавшаяся в результате распада некротизированных участков лёгочной
ткани и содержащая гной.
Гангрена лёгкого — некроз значительного участка лёгочной ткани,
чаще доли, двух долей или всего лёгкого, без демаркации, имеющий
тенденцию к дальнейшему распространению. Полости деструкции
при гангрене лёгкого всегда содержат некротические секвестры.
Абсцесс и гангрену лёгкого как отдельные нозологические формы
выделил Рене Лаэннек в 1819 г. Фердинанд Зауэрбрух (1920)
предложил объединить эти заболевания под общим названием «лёгочные
нагноения». Последние 10—15 лет проблема нагноительных
заболеваний лёгких редко обсуждается в зарубежной литературе, но
остаётся по-прежнему актуальной для России. При распространённой
деструкции лёгких, вызванной ассоциацией высоковирулентных
полирезистентных микроорганизмов, до настоящего времени
результаты лечения остаются неудовлетворительными и сохраняется
высокая летальность. При остром абсцессе она составляет 4%, при
гангренозном абсцессе — 10%, при распространённой гангрене — 50%.
Классификация
Классификация нагноительных заболеваний лёгких учитывает
причину поражения, клинико-морфологическую характеристику и
наличие осложнений.
/. Этиология:
• постпневмонические;
• посттравматические;
• аспирационные;
• обтурационные;
• гематогенные.
68 ♦ Хирургические болезни О- Том 2 Ф Часть III ^> Глава 27
//. Кминико-морфологическая характеристика:
• острый абсцесс:
— единичный;
— множественный (односторонний или двусторонний);
• гангрена лёгкого:
— ограниченная (гангренозный абсцесс);
— распространённая.
///. Осложнения:
• эмпиема плевры (острая и хроническая);
• лёгочное кровотечение;
• аспирационное воспаление противоположного лёгкого;
• тяжёлый сепсис, септический шок.
Этиология и патогенез
При реализации любого этиологического фактора нагноительных
заболеваний лёгких сначала развивается острая пневмония с
известными клиническими проявлениями. В большинстве наблюдений в
результате своевременной рациональной терапии острый
воспалительный процесс обратим — подавляется инфекция, резорбируется
альвеолярный экссудат, рассасывается воспалительный инфильтрат.
В противном случае при определённых условиях и неблагоприятных
обстоятельствах развивается некроз лёгочной ткани с последующим
формированием полостей деструкции.
Респираторный тракт располагает эффективными локальными и
системными механизмами, которые поддерживают стерильность
терминальных бронхиол и паренхимы лёгкого. Возбудитель контамини-
рует дыхательные пути в результате вдыхания аэрозоля мелких
частиц, аспирации орофарингеального секрета либо гематогенным
путём. Аспирация орофарингеального содержимого
предупреждается за счёт кашлевого и надгортанного рефлексов. Механическая
задержка на уровне верхних отделов трахеобронхиального дерева в
комбинации с мукоцилиарным транспортом предупреждает
контаминацию периферических отделов дыхательных путей. Если
инфекционный агент достигает альвеолярного уровня, активируются
клеточные и гуморальные механизмы, призванные элиминировать
патогенные микроорганизмы.
При определённых состояниях механизмы защиты бронхопульмо-
нальных структур повреждаются и развивается воспалительный
процесс. Предрасполагающими к этому факторами считают алкоголизм.
Нагноительные заболевания легких и плевры <> 69
наркоманию, эпилепсию, черепно-мозговую травму, передозировку
седативных средств, общую анестезию, комы любого происхождения
и другие состояния, обусловливающие нарушения сознания.
Именно при них дыхательные пути легко контаминируются агрессивной
микрофлорой ротоглотки. В этиопатогенезе острых лёгочных
нагноений лидирующую роль играют неспорообразующие анаэробные
микроорганизмы. Известно более 300 видов возбудителей этой группы,
способных вызывать деструкцию лёгких. Из гнойных очагов
наиболее часто выделяют Bacteroides, Fusobacterium, Peptostreptococcus, Рер-
tococcus и другие, т.е. флору, обычно колонизирующую назофаренги-
альную область. При остром абсцессе и гангрене лёгкого
неспорообразующие анаэробы всегда встречаются в ассоциации с аэробными
госпитальными штаммами. Чаще всего это Pseudomonas aeruginosa,
Escherichia coli, Klebsiella pneumoniae, Staphylococcus aureus и т.д.
В патогенезе бактериальной деструкции лёгкого большое
значение придают нарушению проходимости бронхиальных разветвлений
с формированием ателектазов, а также нарушению кровообращения
по бронхиальным и лёгочным сосудам с развитием ишемии бронхо-
лёгочных структур.
Клинические проявления и диагностика
Острый абсцесс и гангрена лёгкого развиваются чаще у мужчин
(70%) трудоспособного возраста — 45—55 лет. Большинство
пациентов в социальном отношении не благополучны, злоупотребляют
алкоголем и табакокурением. Две трети этих пациентов страдают
наркоманией. Деструкция лёгких у них довольно часто сочетается с
бактериальным эндокардитом. Гематогенные (всегда двусторонние)
абсцессы лёгких возникают при ангиогенном сепсисе.
В целом клиническая картина острого абсцесса и гангрены
лёгкого идентична, но есть и различия, прежде всего в тяжести состояния
пациентов, выраженности эндогенной интоксикации и
полиорганной недостаточности.
Абсцесс лёгкого
Клинические проявления острого абсцесса зависят от стадии и
периода болезни. Деструкция лёгкого не развивается внезапно. Этому
всегда предшествует острая, как правило, затянувшаяся пневмония
разной этиологии. Абсцедирование лёгкого заметно ухудшает состо-
70 ♦ Хирургические болезни <> Том 2 О* Часть III ♦ Глава 27
яние больного. Усиливаются слабость, недомогание, появляется феб-
рильная лихорадка. Позднее присоединяются боли в грудной клетке,
усиливающиеся на вдохе, непродуктивный кашель. По мере прогрес-
сирования инфекционного процесса и увеличения объёма
деструкции температура тела становится гектической, её подъёмы
сопровождаются проливными потами. Усиливается непродуктивный кашель,
который носит характер мучительного пароксизмального.
Нарастают интоксикация, дыхательная недостаточность. Перечисленные
клинические признаки характерны для абсцесса лёгкого, не
сообщающегося с трахеобронхиальным деревом. Если на этой стадии болезни
не начато квалифицированное лечение, то следующим этапом
болезни является спонтанный прорыв гнойника в регионарный (как
правило, сегментарный) бронх. У больного на фоне надсадного кашля
внезапно, полным ртом откашливается дурно пахнущая гнойная
мокрота. В течение суток после этого состояние пациента несколько
улучшается — уменьшаются признаки интоксикации, боли в грудной
клетке, одышка, снижается температура тела.
При осмотре больного с острым абсцессом лёгкого обнаруживают
бледность кожных покровов с сероватым оттенком, цианотичность губ
и ногтевых лож. Из-за болей в грудной клетке дыхание поверхностное.
Перкуссия может выявлять укорочение звука, если гнойник
расположен в плаще лёгкого, аускультация — ослабление дыхания,
сухие и влажные хрипы.
В результате интоксикации, дыхательной недостаточности, болей
в грудной клетке у пациента определяется тахикардия, возможна
артериальная гипотензия. В анализе крови выявляют выраженный
лейкоцитоз, нейтрофильный сдвиг лейкоцитарной формулы,
увеличение соэ.
Гангрена лёгкого
Ещё более манифестные проявления лёгочной деструкции
обнаруживают у больного гангреной лёгкого. Состояние тяжёлое или крайне
тяжёлое. Выраженная слабость, частое поверхностное дыхание, феб-
рильная или гектическая температура тела, анорексия. Больной
истощён, кожные покровы бледные с синюшно-серым оттенком. На ощупь
кожа сухая. Положение вынужденное — больной сидит, опираясь на
вытянутые руки. Рёбра рельефно контурируются под мягкими
тканями. Грудная стенка на стороне поражения не участвует в дыхании,
межрёберные промежутки сужены. Главная особенность заболевания —
Нагноительные заболевания легких и плевры ♦ 71
непрерывно, полным ртом откашливается нетерпимо зловонная
гнойная мокрота с фибрином, мелкими секвестрами лёгочной ткани в
суточном объёме от 500 до 1500 мл (!) и более (за счёт множественных
бронхиальных свищей, через которые в дыхательные пути
дренируется гнойное содержимое плевральной полости при эмпиеме плевры).
При перкуссии выявляют укорочение звука над поражённым
лёгким. Аускультация определяет резкое ослабление дыхания или его
отсутствие на стороне патологии. Над контрлатеральным лёгким
выслушиваются рассеянные сухие и влажные хрипы за счёт аспирации
гнойной мокроты из бронхов поражённого лёгкого.
В клиническом анализе крови обнаруживают выраженную
анемию, гиперлейкоцитоз, сдвиг лейкоцитарной формулы до юных
форм, токсическую зернистость нейтрофилов, увеличение СОЭ.
Инструментальная диагностика
По-прежнему базовым методом подтверждения клинического
диагноза бактериальной деструкции лёгкого служат полипозиционная
рентгеноскопия и рентгенография грудной клетки, позволяющие
подтвердить диагноз и определить локализацию процесса. При
остром абсцессе лёгкого до сообщения его с бронхиальным деревом
выявляют правильную округлую гомогенно затемнённую полость с пе-
рифокальной инфильтрацией (рис. 27-1). После опорожнения
гнойника в дыхательные пути визуализируется полость с уровнем
жидкости (рис. 27-2).
Рис. 27-1. Рентгенограмма
грудной клетки в прямой проекции.
Блокированный абсцесс
средней доли правого лёгкого
(отмечен стрелкой).
72 ♦ Хирургические болезни ♦ Том 2 Ф- Часть III <> Глава 27
Рентгенологическая картина гангренозного абсцесса
характеризуется полостью в пределах доли лёгкого с бухтообразным
неправильным очертанием внутреннего контура за счёт некротических
секвестров лёгочной ткани (рис. 27-3). Для распространённой гангрены
лёгкого характерны тотальное затенение половины грудной клетки
на стороне поражения с мелкими неправильного очертания
воздушными полостями, гидропневмоторакс (рис. 27-4).
Современным стандартом лучевой диагностики заболеваний
лёгких следует считать КТ, которая позволяет детально изучить
структуру полостного образования, его локализацию и провести
дифференциальную диагностику нагноительных и других заболеваний, в
■ частности рака и туберкулёза лёгких (рис. 27-5).
С появлением современных цифровых визуализирующих
технологий определённое значение для диагностики субплевральных
образований лёгких и заболеваний плевры приобрела ультрасоногра-
фия (рис. 27-6).
Рис. 27-2. Обзорная рентгенограмма Рис. 27-3. Обзорная рентгенограм-
I грудной клетки в правой боковой ма грудной клетки в правой бо-
проекиии. Абсцесс верхней доли ковой проекции. Гангренозный аб-
правого лёгкого (отмечен стрелкой), сцесс верхней доли правого лёг-
содержащий газ. кого.
Нагноительные заболевания легких и плевры ♦ 73
Рис. 27-4. Обзорная
рентгенограмма грудной клетки в
прямой проекции.
Распространённая гангрена правого
лёгкого.
Рис. 27-5. Компьютерная
томограмма грудной клетки при
распространённой гангрене
правого лёгкого.
В перечень обязательных инструментальных исследований,
используемых для диагностики нагноительных заболеваний лёгких,
должна быть включена фибробронхоскопия. Она позволяет оценить
выраженность и распространённость эндобронхита, обнаружить
инородные тела, бронхолит или опухоль бронха, провести забор
материала для микробиологического и цитологического исследований.
Весьма ценным диагностическим методом при остром абсцессе
лёгкого, особенно осложнённом лёгочным кровотечением, является
бронхиальная артериография, которая даёт возможность оценить
выраженность и стадию воспалительного процесса, локализовать
74 О- Хирургические болезни О Том 2 ♦ Часть III О- Глава 27
источник геморрагии. Исследование проводят в рентгеноперацион-
ной. Рентгеноконтрастный катетер по методике Сельдингера через
бедренную артерию ретроградно вводят в нисходящий сегмент
грудной аорты, устанавливают его в устье бронхиальной артерии,
которую контрастируют, и выполняют серию ангиограмм.
Дифференциальная диагностика
Дифференцировать острый абсцесс и гангрену лёгкого
приходится, прежде всего, с деструктивными формами туберкулёзного
процесса. Определённые трудности возникают при дифференциальной
диагностике острого абсцесса и периферического рака лёгкого с
распадом (полостная форма опухоли). Нередко нагноение с
формированием внутрилёгочных полостей развивается у больных центральным
раком сегментарного, долевого или главного бронха. Это
происходит в результате инфицирования ателектазированных участков
лёгочной ткани (обструктивный пневмонит), естественная эвакуация
содержимого из которых становится невозможной из-за опухолевой
обтурации. В дифференциальный ряд должны быть включены также
аспергиллёмма, эхинококкоз лёгкого и другие болезни с клинико-
рентгенологическим синдромом острого нагноения.
Анамнез, клинические проявления и данные современных
методов лучевой диагностики лежат в основе дифференциальной
диагностики заболеваний лёгких, однако окончательный диагноз устанав-
Рис. 27-6. Ультрасонограмма
грудной клетки при абсцессе
верхней доли правого лёгкого
(отмечен стрелкой).
Нагноительные заболевания легких и плевры О 75
ливают на основании изучения результатов микробиологического,
цитологического и гистологического исследований. Материал для
исследования забирают из трахеобронхиального дерева во время фиб-
робронхоскопии либо при транскутанной пункции патологических
образований лёгкого и плевры под контролем КТ или УЗИ.
Осложнения
Наиболее типичное осложнение острых бактериальных
деструкции лёгкого — эмпиема плевры. Она развивается в результате
прорыва внутрилёгочного гнойника в плевральную полость. Как правило,
полость эмпиемы сообщается через очаг деструкции с трахеобронхи-
альным деревом (бронхо-плевральные свищи), что обусловливает
формирование пиопневмоторакса с выраженным коллапсом
лёгкого. Эмпиема плевры ухудшает состояние больного за счёт усиления
резорбции токсинов, ухудшения газообмена в непоражённых зонах
спавшегося лёгкого и смещения средостения в здоровую сторону.
При остро возникшей эмпиеме больной ощущает резкую боль в
грудной клетке. Усиливается одышка, появляется цианоз. При аус-
культации на стороне поражения дыхание не прослушивается или
сильно ослаблено. Перкуторно выявляют тимпанит над верхними
отделами половины грудной клетки и укорочение звука в базальных
отделах. На обзорных рентгенограммах (прямая и боковая проекции)
обнаруживают картину гидропневмоторакса с горизонтальным
уровнем жидкости и коллапсом лёгкого (рис. 27-7).
Рис. 27-7. Обзорная
рентгенограмма грудной клетки в
прямой проекции. Левосторонняя
эмпиема плевры.
Определяется уровень жидкости с газом
над ним.
76 О Хирургические болезни ♦ Том 2 ♦ Часть III ♦ Глава 27
Лёгочное кровотечение — наиболее драматичное осложнение
острых бактериальных деструкции лёгкого. При остром абсцессе
источником геморрагии чаще бывают гиперплазированные бронхиальные
артерии, которые отходят непосредственно от аорты, при гангрене —
разветвления лёгочных артерий и вен.
Классификация лёгочного кровотечения.
I степень (кровохарканье):
а — 50 мл/сут;
б — от 50 до 200 мл/сут;
в — от 200 до 500 мл/сут.
II степень (массивное кровотечение):
а — от 30 до 200 мл/ч;
б - от 200 до 500 мл/ч.
/// степень (профузное кровотечение):
а — 100 мл и более одномоментно, сопровождается выраженными
нарушениями вентиляции лёгких;
б — острая обструкция трахеобронхиального дерева и асфиксия
независимо от объёма кровопотери.
Клинические проявления лёгочного кровотечения зависят от его
интенсивности. При кровохаркании (I степень) состояние больного,
как правило, не страдает. При массивном и, тем более, профузном
кровотечении кровь поступает полным ртом, пациент не успевает её
откашливать, быстро появляются признаки дыхательной
недостаточности из-за аспирации геморрагической жидкости в бронхи здорового
лёгкого, развивается асфиксия. Топическая диагностика источника
кровотечения (сегмент, доля, лёгкое) возможна только при
проведении неотложной трахеобронхоскопии. Кровоточащий сосуд
устанавливают после проведения бронхиальной артериографии (рис. 27-8).
Бронхогенное аспирационное воспаление противоположного лёгкого
формируется у ослабленных больных с выраженным угнетением каш-
левого рефлекса. Гнойная мокрота инфицирует бронхи здорового
лёгкого, где образуются воспалительные очаги с последующей
деструкцией лёгочной ткани.
Пневмогенный тяжёлый сепсис чаще развивается у больных с
осложнённым абсцессом и распространённой гангреной лёгкого.
Системная воспалительная реакция с формированием
полиорганной недостаточности — результат прогрессирующей обширной
деструкции бронхолёгочных структур. При недостаточной санации
первичного очага состояние больного быстро ухудшается. Сохраняется
Рис. 27-8. Бронхиальные артериограммы: а — на высоте кровотечения; б —
после эндоваскулярной окклюзии бронхиальных артерий; 1 — катетер в
устье общего бронхиального ствола; 2 — экстравазация контрастированной
крови в паренхиму лёгкого.
гектическая лихорадка, усиливаются тахикардия и одышка,
усугубляется гипоксемия, нарастают признаки нарушения сознания и
почечной недостаточности. В анализе крови выявляют
гиперлейкоцитоз со сдвигом лейкоцитарной формулы влево до юных форм.
Лечение
Лечение острых бактериальных деструкции лёгкого —
безусловная прерогатива хирургов. Лучших результатов достигают в условиях
специализированных торакальных отделений. Тяжесть состояния
пациентов предполагает проведение разнообразной интенсивной
терапии, парахирургических процедур и неотложных оперативных
вмешательств при возникновении осложнений.
Консервативное лечение
Консервативное лечение включает применение инфузионных сред
и лекарственных препаратов, способных корригировать нарушения
гомеостаза, развивающиеся в результате длительной интоксикации,
78 ♦ Хирургические болезни О* Том 2 ♦ Часть III О Глава 27
гипоксемии и анорексии. Используют методы эфферентной терапии
и гравитационной хирургии при условии, что гнойники
адекватно дренированы.
Немедленно при поступлении больного с острой бактериальной
деструкцией лёгких в хирургический стационар назначают
эмпирическую антибактериальную терапию, основанную на данных о
полимикробной этиологии плевропульмональной инфекции, В
последующем проводят коррекцию назначений с учётом результатов
микробиологического исследования содержимого гнойников.
В лечении острого абсцесса и гангрены лёгкого чаще используют
комбинированную (два и более препарата) антибактериальную
терапию. Примерами таких сочетаний могут быть:
1) цефалоспорин III поколения + аминогликозид (амикацин) +
метронидазол;
2) аминогликозид (амикацин) + клиндамицин;
3) фторхинолон III—IV поколения + метронидазол.
Вместе с тем, возможна и монотерапия с использованием це-
фоперазона + сульбактама или карбопенемов. В остром периоде
болезни антибиотики назначают преимущественно внутривенно. В
отдельных клиниках получены хорошие многолетние результаты
селективной инфузии антибактериальных препаратов в бронхиальные
артерии. Непременное условие проведения антибактериальной
терапии — профилактика системного микоза антигрибковыми
средствами (например, флуконазол и т.д.).
Ведущую роль в патогенезе бактериальной деструкции лёгкого
играет нарушение бронхиальной проходимости. Для
восстановления бронхиального дренажа необходимо использовать
разнообразные методы санации трахеобронхиального дерева. Простым и
достаточно эффективным приёмом опорожнения гнойной полости служит
постуральный дренаж. Для его реализации больному придают
положение, при котором гнойник оказывается выше дренирующего
бронха. Например, при локализации абсцесса во II или VI сегменте
лёгкого (задние сегменты) больного укладывают на живот с несколько
опущенным головным концом кровати, что создаёт условия для
естественного оттока инфицированного содержимого в дыхательные
пути с последующим активным его откашливанием. Дренаж
положением целесообразно сочетать с вибрационным массажем грудной
клетки. Этот метод оказывается недостаточно эффективным, если
густая гнойная мокрота и секвестры лёгочной ткани блокируют
дренирующий бронх. В этих ситуациях целесообразно применять
агноительные заболевания легких и плевры ♦ 79
селективную санацию патологического очага с использованием
катетера, который транскутанно вводят в трахею.
Под местной анестезией выполняют пункцию перстневидно-ши-
товидной связки (fossa canind), через иглу в трахею по методике Сель-
дингера проводят рентгеноконтрастный, специально
моделированный катетер, кончик которого под контролем
электронно-оптического преобразователя или фибробронхоскопа устанавливают в
дренирующий бронх или гнойную полость. Через катетер проводят
лаваж (12-14 капель в минуту) патологической зоны растворами
комнатной температуры с добавлением в них антисептиков,
антибиотиков и пролонгированных протеолитических ферментов.
У больных с большими и гигантскими субплевральными
гнойниками, содержащими детрит, фибрин, секвестры лёгочной ткани,
целесообразно сочетать интрабронхиальную санацию с чрескожным
дренированием инфицированной полости. На основании
полипозиционного рентгенологического исследования либо под контролем
УЗИ выбирают место для проведения дренажа. Под местной
анестезией через соответствующее межреберье в гнойник устанавливают
троакар, а после удаления стилета проводят дренажную трубку. При
небольших и труднодоступных полостях пункцию и дренирование
целесообразно выполнять под контролем КТ.
Парахирургические процедуры
Прорыв гнойника в плевральную полость предполагает
проведение дополнительных парахирургических процедур. Некоторые
методы лечения эмпиемы известны со времён Гиппократа. Следуя
своему принципу «ubi pus ibi evacua», великий врач прокалывал
грудную клетку больного раскалённым железным прутом или
ножом и вводил в плевральную полость бронзовые трубки для
удаления гноя.
Аналогичным образом поступают и в настоящее время, используя
современные приборы и инструменты. При тотальной эмпиеме
плевры устанавливают два дренажа: один — во второе межреберье по
средней ключичной линии, второй — в седьмое межреберье по задней
подмышечной линии. Содержимое плевральной полости
эвакуируют путём активной аспирации. При эмпиеме плевры с бронхоплев-
ральными сообщениями она оказывается недостаточно
эффективной — лёгкое расправить не удаётся. Кроме того, развивается синдром
обкрадывания за счёт обильного уклонения воздуха из дыхательных
80 ♦ Хирургические болезни ♦ Том 2 <> Часть III ♦ Глава 27
путей, усиливается гипоксемия. В этом случае целесообразно
провести селективную окклюзию свищнесущего бронха пенополиуретаном
(поролоном). Окклюдер проводят через тубус ригидного бронхоско-
па и устанавливают под контролем зрения в устье сегментарного или
долевого бронха, дренирующего гнойник. Бронхоплевральное
сообщение прекращается, наступает реэкспансия лёгкого за счёт
расправления здоровых сегментов.
Особенное место в лечении острых нагноительных заболеваний
лёгкого занимает терапия лёгочного кровотечения — осложнения,
которое чаще других заканчивается смертью больного. Пациенты с
массивным лёгочным кровотечением погибают в результате затопления
кровью дыхательных путей (объём трахеобронхиального дерева
составляет не более 80-120 см3) и асфиксии.
Первая задача при массивном лёгочном кровотечении —
прекратить поступление крови в здоровые отделы трахеобронхиального
дерева. Для этого экстренно выполняют ригидную трахеобронхоско-
пию, определяют сторону кровотечения и, если это возможно,
долевую или сегментарную локализацию источника. После обтурации
главного или долевого бронха поролоновым окклюдером
дыхательные пути освобождают от излившейся крови.
Вторая задача — обнаружить кровоточащий сосуд и выполнить
эндоваскулярную окклюзию. Как правило, это удаётся сделать у
пациентов с острым абсцессом лёгкого, у которых при выполнении
селективной ангиографии обнаруживают гиперплазию
бронхиальной артерии с выраженной гиперваскуляризацией патологической
зоны, экстравазацией контрастированной крови. Изменённую
бронхиальную артерию окклюзируют фрагментами поролона,
введёнными через рентгеноконтрастный катетер (см. рис. 27-7 б). Если рент-
геноэндовакулярная окклюзия бронхиальных артерий оказалась
успешной, то проводят повторную бронхоскопию, удаляют
окклюдер, выполняют тщательную санацию трахеобронхиального
дерева и продолжают консервативное лечение основного заболевания.
В противном случае предпринимают неотложное хирургическое
вмешательство.
Сложнее складывается ситуация у больных гангреной лёгкого,
поскольку источником массивного, как правило, лёгочно-плеврального
кровотечения оказываются разветвления лёгочной артерии и притоки
лёгочных вен. Возможность эндоваскулярной хирургии в этих случаях
ограничена. В редких случаях удаётся прекратить кровотечение
имплантацией в ветви лёгочной артерии спиралей Гиантурко.
Нагноительные заболевания легких и плевры ♦ 81
Хирургическое лечение
Целенаправленное консервативное и парахирургическое лечение
у большинства больных с острым абсцессом лёгкого (95%) позволяет
избежать неотложной операции. Показанием к хирургическому
вмешательству при рассматриваемой патологии служит
продолжающееся кровотечение.
Напротив, при гангрене лёгкого альтернативы неотложной
операции нет, поскольку консервативное и парахирургическое лечение
заканчивается смертью абсолютного большинства больных. У
пациентов с ограниченной гангреной (гангренозный абсцесс) возможно
применение щадящей, органосохраняющей операции по типу
пневмотомии или торакоплевроабсцессостомии. Операция заключается
в проекционной ограниченной торакотомии через ложе
резецированных одного—двух рёбер в зоне наиболее близкой к патологическому
процессу. Удаляют гной и секвестры лёгочной ткани. Края
париетальной плевры и кожи сшивают, формируя плевроабсцессостому для
последующей длительной открытой санации гнойной полости.
Недостатком этой операции считают большую вероятность развития
флегмоны грудной стенки, остеомиелита рёбер, аррозивного
кровотечения. Кроме того, ограниченная гангрена лёгкого встречается
нечасто в отличие от распространённого процесса, когда
хирургическое вмешательство через ограниченный доступ провести невозможно.
Поэтому, несмотря на очень тяжёлое состояние больных,
приходится выполнять радикальную операцию, как правило, в объёме
анатомической пневмонэктомии. Эти операции сопровождаются
тяжёлыми осложнениями и высокой летальностью, но другого пути
решения проблемы нет.
Для предупреждения затекания гнойной мокроты в
противоположное лёгкое (больной находится на операционном столе в положении
на здоровом боку) накануне операции проводят эндоскопическую
окклюзию главного бронха на стороне поражения. Наряду с этим
выполняют раздельную интубацию бронхов. Хирургический доступ — пере-
днебоковая торакотомия в пятом межреберье. Из плевральной полости
удаляют гной, фибрин и секвестры лёгочной ткани. Последовательно
обрабатывают лёгочную артерию, верхнюю и нижнюю лёгочные вены.
Максимально бережно, без обширной скелетизации выделяют
главный бронх, прошивают аппаратом и отсекают. Лёгкое удаляют, культю
бронха дополнительно прошивают монофильными атравматичными
нитями и по возможности плевризируют. Тщательно санируют
плевральную полость, устанавливают дренажи, накладывают послойные
82 ♦ Хирургические болезни <& Том 2 ♦ Часть III ♦ Глава 27
швы на рану. Удалённое лёгкое обычно представляет собой
неструктурную некротизированную паренхиму и обнажённые сегментарные
бронхи, артерии и вены (именно поэтому гангрена лёгкого часто
осложняется профузным лёгочно-плевральным кровотечением).
Наиболее частым осложнением послеоперационного периода при
анатомической резекции лёгкого оказывается несостоятельность
культи бронха (свыше 50%). Основные причины её возникновения —
выраженный воспалительный процесс в стенке бронха (панбронхит),
распространённая аэробно-анаэробная эмпиема плевры. Немаловажно и
то, что репаративные процессы у больных гангреной лёгкого угнетены
в результате грубых нарушений гомеостаза, вторичного
иммунодефицита. Несостоятельность культи бронха диагностируют на основании
значительного поступления воздуха по плевральному дренажу во
время кашля и форсированного дыхания, нарастания дыхательной
недостаточности. Подтверждают этот диагноз фибробронхоскопией.
Для лечения возникшего осложнения выполняют реторакотомию,
ререзекцию культи бронха с повторным наложением швов. К
сожалению, во многих случаях наступает рецидив несостоятельности. Если
удаётся стабилизировать состояние пациента, подавить острый
инфекционный процесс в плевральной полости, то формируется брон-
хоплевральный свищ с хронической эмпиемой плевры.
Очередную операцию, направленную на прекращение бронхоплев-
рального сообщения, выполняют в плановом порядке после
стабилизации состояния больного, санации хронической эмпиемы
плевры. Обычно её проводят через 4—6 мес после пневмонэктомии.
Существует несколько вариантов операций на культе бронха.
Предпочтение отдают трансстернальному, трансперикардиальному и
трансторакальному со стороны здорового лёгкого доступам.
В течение последних 15—20 лет отдельные авторы разрабатывают
пластические внутрипросветные методы закрытия культи главного
бронха и бронхиального свища у больных, перенёсших пневмонэкто-
мию по поводу гангрены лёгкого, с использованием ротационных
лоскутов широчайшей мышцы спины или большого сальника с
сохранённым осевым кровотоком. Получены удовлетворительные результаты.
Хронический абсцесс лёгкого
Примерно в 5% наблюдений острый абсцесс лёгкого не
заканчивается выздоровлением, болезнь принимает хронический
характер с типичными ремиссиями и обострениями. Определённо судить
Нагноительные заболевания легких и плевры *♦> 83
о сроках трансформации острого абсцесса в хронический
трудно, однако принято считать, что не излеченный в течение 2 мес
острый абсцесс следует относить к группе хронических лёгочных
нагноений.
Причины, способствующие переходу острого абсцесса в
хронический, — неадекватное дренирование гнойной полости в лёгком через
бронхи, а также наличие внутриполостных секвестров. Безусловно,
играют роль особенности микробного пейзажа и состояние
реактивности организма. Наиболее часто хронические абсцессы
развиваются в задних сегментах лёгких.
Основной морфологический признак хронического абсцесса
лёгкого — наличие соединительнотканной (пиогенной) капсулы,
формирование которой происходит к исходу 6-8-й недели от начала
болезни. Образовавшаяся пиогенная капсула, утолщаясь за счёт
разрастающейся соединительной ткани, становится ригидной.
Уплотняется также лёгочная ткань вокруг полости деструкции. Образуется
своеобразный порочный круг: усиливающиеся процессы пневмоскле-
роза ведут к нарушению трофики лёгочной ткани, что усугубляет
течение заболевания и способствует непрекращающемуся
воспалительному процессу, который в свою очередь является причиной развития
и распространения деструктивных изменений.
Клиническая симптоматика
Клиническая симптоматика зависит от фазы клинического
течения абсцесса — ремиссии или обострения. Во время ремиссии
проявления заболевания минимальны. Пациенты жалуются на кашель с
умеренным количеством слизисто-гнойной вязкой мокроты, иногда
на сохраняющуюся слабость, потливость и похудание. Обострение
может быть спровоцировано вирусной инфекцией (грипп, острая
респираторная вирусная инфекция), переохлаждением, сильным
утомлением, стрессом. У больных поднимается температура тела,
усиливается кашель, появляются одышка, боли в груди, недомогание.
Увеличивается количество мокроты, приобретающей неприятный
запах. Нередко присоединяется кровохарканье. При длительном
течении заболевания и частых обострениях у больных развивается
выраженная гипопротеинемия, появляются признаки хронической
гипоксии и интоксикации (утолщения ногтевых фаланг в виде
барабанных палочек, ногти в виде часовых стёкол). Хроническая гнойная
интоксикация характерна для этого заболевания. Она проявляется
84 ♦ Хирургические болезни ♦ Том 2 ♦ Часть III О- Глава 27
неспецифическими, свойственными и другим нагноениям лёгких
признаками.
Часто встречающиеся при хронических абсцессах нарушения
функций почек характеризуются альбуминурией, цилиндрурией.
Тяжёлые, длительно протекающие формы хронических абсцессов лёгких,
сопровождающиеся амилоидозом внутренних органов, вызывают
более глубокие изменения функций почек.
Инструментальная диагностика
При рентгенологическом исследовании отмечают наличие одной
или нескольких толстостенных внутрилёгочных полостей с
неровными контурами, наличием горизонтального уровня жидкости (при
обострении), окружённых зоной пневмосклероза. Видимые при
бронхографии или КТ бронхи, проникающие в патологически изменённые
участки лёгкого, деформированы, просвет их неравномерно сужен
или расширен. В период обострения становится заметной
воспалительная инфильтрация, количество жидкости в полостях
увеличивается. При бронхоскопии отмечают наличие гнойного эндобронхита,
наиболее выраженного на стороне поражения.
Лечение и профилактика
Больные с хроническим абсцессом лёгкого нуждаются в
интенсивном консервативном лечении, которое является и подготовкой к
радикальному оперативному вмешательству. Основные задачи лечения
состоят в следующем: 1) уменьшение гнойной интоксикации и
ликвидация обострения воспалительного процесса в лёгких; 2)
коррекция белковых, волемических, электролитных нарушений и анемии;
3) повышение иммунологического статуса организма. Наиболее
актуальной представляется комплексная санация трахеобронхиально-
го дерева с адекватной эвакуацией гнойного содержимого из
полостей деструкции.
Хронический абсцесс является показанием к резекции лёгкого,
которую выполняют после предоперационной подготовки в
плановом порядке, как правило, в объёме лобэктомии.
Профилактика хронических абсцессов заключается в
своевременном и адекватном лечении острых абсцессов лёгких в условиях
специализированных стационаров, а также квалифицированном
наблюдении за пациентами с сухими остаточными полостями в лёгких.
Нагноительные заболевания легких и плевры -О- 85
Хроническая эмпиема плевры
Хроническая эмпиема плевры — результат неэффективного
лечения острых лёгочных нагноений, осложнившихся пиопневмотораксом.
Из-за неадекватного дренирования плевры создаются условия для
неполного расправления лёгкого и формирования инфицированной
остаточной полости. Как правило, не удаётся добиться реэкспансии
лёгкого при наличии выраженных бронхо-плевральных сообщений,
которые образуются в результате бактериальной деструкции лёгочной
паренхимы. На стенках эмпиемной полости (висцеральная и
париетальная плевра) образуются массивные наложения фибрина, которые
с течением времени (1,5—3 мес) организуются и трансформируются
в волокнистую соединительную ткань — шварты, которые прочно
фиксируют коллабированное лёгкое, препятствуя его расправлению.
Диагностика
Диагностировать хроническую эмпиему плевры несложно на
основании анамнеза, клинических проявлений, результатов
специальных исследований. Со времени перенесённого эпизода острого
нагноения и хронизации процесса (1,5-3 мес) больного постоянно
беспокоят слабость, быстро наступающая усталость при
незначительной физической нагрузке, кашель с гнойной мокротой,
периодически повышающаяся температура тела. Выраженность этих
проявлений зависит от длительности и периода болезни — ремиссии или
обострения.
Осмотр обнаруживает нездоровый цвет лица, одышку в покое,
тахикардию, пониженное питание. Грудная клетка на стороне болезни
отстаёт при дыхании от здоровой половины, уменьшена в объёме,
деформирована (западает подключичная область, сужены
межрёберные промежутки). При аускультации степень ослабления дыхания
зависит от распространённости гнойной полости, перкуторно
определяется укорочение звука. В анализе крови обнаруживают анемию,
лейкоцитоз, увеличение СОЭ.
Диагноз подтверждают полипозиционной рентгенографией
грудной клетки. Исчерпывающую информацию, касающуюся точной
локализации остаточной полости, её объёма и изменений структур кол-
лабированного лёгкого, позволяет получить КТ. Дополнительные
сведения даёт торакоскопия, оценивающая выраженность
воспалительных изменений и особенности бронхоплевральных сообщений.
Лечение
Консервативное и парахирургическое лечение хронической
эмпиемы плевры, за редким исключением, неэффективно, особенно если
в полость открывается бронхиальный свищ. Эти методы используют
в комплексе предоперационной подготовки.
Основная задача хирургического лечения — устранение причины
болезни, например прекращение бронхо-плеврального сообщения,
а также ликвидация остаточной полости.
Для освобождения лёгкого от шварт и создания условий для его
расправления используют операцию, которую называют
декортикацией лёгкого. Сущность вмешательства заключается в том, что после
торакотомии висцеральные шварты несколькими разрезами
рассекают до здоровой плевры. После этого тупым и острым путями
намеченные фрагменты рубцовой ткани отслаивают от лёгкого и удаляют,
что в итоге обеспечивает его подвижность и возможность полного
расправления. Отрицательный момент подобного вмешательства —
сохранение париетальной шварты — реального источника реинфи-
цирования плевральной полости.
Более сложный вариант операции при хронической эмпиеме
плевры — плеврэктомия — удаление висцеральной и париетальной шварт.
Для её выполнения используют широкий доступ (от парастерналь-
ной до лопаточной линии) в проекции пятого или шестого межребе-
рья. Мягкие ткани рассекают до париетальной шварты. При
выраженном сужении межрёберных промежутков резецируют одно ребро.
Острым и тупым путями париетальную шварту отслаивают от
грудной стенки, диафрагмы и структур средостения. После этого эмпи-
емный мешок вместе с висцеральной швартой отделяют от лёгкого и
удаляют. Лёгкое расправляется и заполняет плевральную полость.
Больным с бронхо-плевральным свищом приходится расширять
объём операции, дополняя плеврэктомию резекцией лёгкого (плев-
ролобэктомия) или пневмонэктомией. После санации плевральной
полости и установления дренажей накладывают швы на рану
грудной стенки.
Бронхоэктатическая болезнь
Бронхоэктазии — необратимые морфологические изменения
(расширение, деформация) и функциональная неполноценность
бронхов, приводящие к хроническому нагноительному заболеванию
Нагноительные заболевания легких и плевры •$■ 87
лёгких. Весь комплекс лёгочных и внелёгочных изменений при
наличии бронхоэктазов называют бронхоэктатической болезнью. Брон-
хоэктазы бывают врождёнными и приобретёнными.
Этиология
Врождённые бронхоэктазы встречаются сравнительно редко и
развиваются в связи с нарушениями формирования
бронхиального дерева. Гистологический признак врождённых бронхоэктазов —
беспорядочное расположение в их стенке структурных элементов
бронха. Основным этиологическим фактором приобретённых
бронхоэктазов является всё же генетически детерминированная
неполноценность бронхиального дерева (недоразвитие элементов
бронхиальной стенки — гладкомышечных структур, эластической и
хрящевой тканей, недостаточность механизмов защиты и т.д.), которая
в сочетании с нарушением бронхиальной проходимости и
появлением воспаления приводит к стойкой деформации бронхов.
Формированию бронхоэктазии в значительной степени способствуют
грипп, острые респираторные заболевания, корь, коклюш,
бронхиты, пневмонии, абсцессы лёгких, туберкулёз лёгких,
несвоевременное удаление из трахеобронхиального дерева аспирированных
инородных тел и т.д.
Классификация бронхоэктазии
/. По происхождению:
• первичные (врождённые);
• вторичные (приобретённые).
2. По виду расширения бронхов:
• цилиндрические;
• мешотчатые;
• кистоподобные;
• смешанные.
3. По распространению:
• ограниченные или распространённые;
• односторонние или двусторонние.
4. По тяжести клинических проявлений:
• с невыраженной симптоматикой;
• лёгкая форма;
• среднетяжёлая форма;
88 О- Хирургические болезни ♦ Том 2 <> Часть III ♦ Глава 27
• тяжёлая форма;
• тяжёлая осложнённая форма.
5. По клиническому течению:
• фаза ремиссии;
• фаза обострения.
Клиническая картина
Основные жалобы при бронхоэктазиях — кашель с мокротой,
кровохарканье (наблюдается у 30% пациентов), дискомфорт и боли в
грудной клетке на стороне поражения, одышка, лихорадка, потливость,
снижение работоспособности, потеря массы тела и общая слабость.
В качестве наиболее характерного и раннего симптома этого
заболевания выступает кашель. Обычно кашель усиливается по утрам
или сразу после физической нагрузки и сопровождается выделением
большого количества мокроты.
Во время ремиссии мокрота приобретает слизистый или слизис-
то-гнойный характер, легко отходит, её количество значительно
уменьшается. Характерно, что одномоментно в большом количестве
(«полным ртом») мокрота отходит при определённом, так
называемом дренажном положении тела пациента, которое зависит от
локализации очагов поражения и непременно должно использоваться для
улучшения дренажной функции бронхов.
Дискомфорт или тупые, усиливающиеся в период обострения
процесса боли в грудной клетке связаны в основном с реактивным
плевритом. Болевой синдром отмечают почти у каждого второго
пациента. Одышка наблюдается у 40% больных и нарастает по мере
прогрессирования заболевания.
При обострении процесса и задержке эвакуации мокроты из
бронхиального дерева температура тела по вечерам может повышаться до
39-40 °С. В фазе ремиссии сохраняется лишь вечерний
субфебрилитет, но в отдельные дни возможно повышение температуры тела до
38 °С и более.
В далеко зашедших стадиях болезни появляются цианоз кожного
покрова, губ и ногтевых лож, деформация пальцев кистей и стоп по
типу барабанных палочек и изменения ногтей в виде часовых стёкол.
Возможны асимметрия грудной клетки за счёт уменьшения объёма
поражённой стороны, углубление надключичной ямки, сужение
межрёберных промежутков. Над зоной обширных и прилегающих к
грудной стенке патологически изменённых участков лёгких можно опре-
Нагноительные заболевания легких и плевры -<> 89
делить притупление перкуторного звука, ослабленное или жёсткое
дыхание с различным количеством полиморфных (сухих и влажных)
хрипов. Звучные разнокалиберные влажные хрипы сохраняются и в
период ремиссии.
Осложнения
Бронхоэктазии часто осложняются лёгочным кровотечением, аб-
сцедированием, развитием на фоне пневмофиброза и эмфиземы
лёгких выраженной лёгочно-сердечной недостаточности и «лёгочного
сердца», амилоидоза внутренних органов. Нередко течение этого
заболевания отягощается бронхиальной астмой и туберкулёзом лёгких.
Диагностика
В фазе обострения появляются анемия, высокий лейкоцитоз в
периферической крови с палочкоядерным сдвигом, увеличение СОЭ,
гипоальбуминемия, угнетение фибринолитической активности
крови, повышение агрегационных свойств эритроцитов и тромбоцитов.
В распознавании, определении локализации,
распространённости и вида бронхоэктазии ведущая роль принадлежит
рентгенологическим методам исследования. При рентгеноскопии, рентгенографии
и томографии, которые необходимо проводить в прямой и боковой
проекциях, отмечают уменьшение объёма и уплотнение тени
поражённых отделов лёгкого, ячеистость и сетчатость лёгочного рисунка,
сегментарные и долевые ателектазы, наличие плевральных шварт,
гиперплазию и уплотнение лимфатических узлов корня лёгкого.
Кроме того, выявляется повышение воздушнбсти его непоражённых
отделов за счёт викарной эмфиземы, смещение тени средостения в
сторону поражения. До недавнего времени основным
рентгенологическим методом, подтверждающим наличие и уточняющим
локализацию бронхоэктазии, была бронхография с обязательным и полным
контрастированием бронхов обоих лёгких. Сегодня бронхографию
проводят редко, поскольку исчерпывающую информацию можно
получить при проведении КТ лёгких.
Дифференциальная диагностика
Бронхоэктазии следует дифференцировать с туберкулёзом лёгких,
хронической пневмонией, хроническим бронхитом, хроническими
абсцессами, раком и кистами лёгких.
90 ♦ Хирургические болезни ♦ Том 2 ♦ Часть III ♦ Глава 27
Лечение
Учитывая необратимость процесса, а следовательно —
бесперспективность консервативной терапии, единственным радикальным
методом лечения бронхоэктатической болезни следует считать
хирургическое вмешательство, объём которого зависит от
распространённости бронхоэктазий.
Рак лёгкого — собирательное понятие, объединяющее различные
по происхождению, гистологической структуре, клиническому
течению и результатам лечения злокачественные эпителиальные
опухоли. Развиваются они из покровного эпителия слизистой оболочки
бронхов, желёз бронхиол и лёгочных альвеол. Отличительные черты
рака лёгкого — многообразие клинических форм, склонность к
раннему рецидиву, лимфогенному и гематогенному метастазированию.
Рак лёгкого — наиболее распространённое в мировой популяции
злокачественное новообразование. С начала XX века заболеваемость
населения выросла в несколько десятков раз. Особенно выражен её
рост в индустриально развитых странах, где в структуре
онкологической заболеваемости эта злокачественная опухоль занимает первое
место. Более чем в 20 странах рак лёгкого является одной из главных
причин смертности от злокачественных новообразований у мужчин.
В России заболеваемость раком лёгкого за последние 20 лет
увеличилась более чем в 2 раза. Ежегодно рак лёгкого диагностируют у
63000 пациентов (43,4 на 100000), заболевание занимает первое
место (15%) в структуре заболеваемости населения злокачественными
новообразованиями. Мужчины болеют значительно чаще, чем
женщины (в соотношении 8,7:1).
Этиология
Ни одно из широко рапространнённых онкологических
заболеваний не имеет столь очевидной связи с факторами окружающей среды,
условиями производства, вредными привычками и индивидуальным
стилем жизни, как рак лёгкого. Рост заболеваемости отражает
нарастание вредного воздействия современной индустрии на организм
человека, что особенно заметно в странах Европы и Северной Америки.
Канцерогенное действие на лёгочную ткань оказывают многие
химические вещества: полициклические ароматические
углеводороды, входящие в состав продуктов термической обработки угля и
нефти (смолы, коксы, газы и др.), ряд простых органических веществ
92 О Хирургические болезни ♦ Том 2 ♦ Часть III ♦ Глава 28
(хлорметиловые эфиры, винилхлорид и др.), некоторые металлы и их
соединения (мышьяк, хром, кадмий).
Существенное загрязнение окружающей воздушной среды
канцерогенами вызывают двигатели внутреннего сгорания и
промышленные выбросы в атмосферу. Особенно много бензпирена образуется
при форсированной работе двигателей, разгоне и торможении
автотранспорта, при взлёте и посадке реактивных лайнеров. Следует
упомянуть о производственных вредностях. Ещё в начале XX века было
установлено, что высокая заболеваемость раком лёгкого у шахтёров
Саксонии связана с высоким содержанием радиоактивных примесей
в руде. Влияние ионизирующей радиации доказано при
обследовании шахтёров урановых рудников в США.
Повышена заболеваемость раком лёгкого у рабочих сталелитейной,
деревообрабатывающей, металлургической промышленности,
керамического астбестно-цементного и фосфатного производства; улиц,
контактирующих с соединениями хрома, подвергающихся воздействию
каменной пыли, занятых в никелевой и алюминиевой
промышленности, у шофёров. Между тем, промышленное загрязнение и
профессиональные вредности не играли бы столь большой роли в росте
заболеваемости, если бы не сочетались с крайне вредной привычкой —
курением. Курящие шахтёры в урановых рудниках, как и курящие
рабочие астбестовой промышленности, заболевают раком лёгкого гораздо
чаще, чем некурящие. Увеличение заболеваемости раком лёгкого во
всех странах находится в прямой зависимости от роста потребления
сигарет и числа курящих. У курящих более двух пачек в сутки риск в 25
раз выше. Рост заболеваемости среди женщин также связывают с
распространением привычки женщин курить, однако нельзя исключить
влияние возросшего потребления гормональных препапатов.
Совокупные неблагоприятные воздействия вызывают фоновые предраковые
изменения слизистой оболочки бронхов, играющие важную роль в
патогенезе центрального рака лёгкого. Не вызывает сомнений факт
значительной частоты возникновения рака лёгкого из рубца у лиц с
воспалительными заболеваниями лёгких в анамнезе.
Основными факторами риска развития рака лёгкого признаны
следующие.
/. Генетические факторы.
• Первичная множественность опухолей (излеченный пациент от
злокачественной опухоли).
• Три и более случаев развития рака лёгкого в семье (у ближайших
родственников).
Рак легкого ♦ 93
//. Модифицирующие факторы.
• Экзогенные.
- Курение.
— Загрязнение окружающей среды канцерогенами.
- Профессиональные вредности.
• Эндогенные.
— Возраст более 50 лет.
— Хронические лёгочные заболевания (туберкулёз, пневмония,
бронхит, локализованный пневмофиброз и др.).
- Эндокринные заболевания.
Перечисленные факторы определяют одно из главенствующих
направлений в борьбе с этим недугом — профилактику рака лёгкого.
Классификации и морфологическая характеристика
Клинико-анатомическая классификация
/. Центральная форма:
• экзофитный (эндобронхиальный);
• эндофитный (экзобронхиальный);
• разветвлённый (перибронхиальный).
//. Периферическая форма:
• узловой;
• пневмониеподобный;
• рак Пэнкоста (верхушки лёгкого).
///. Медиастинальная форма — множественное метастатическое
поражение средостенньгх лимфатических узлов без установленной
локализации первичной опухоли в лёгком.
IV. Диссеминированная форма (первичный канцероматоз) —
множественное поражение лёгких без установленной локализации
первичной опухоли в других органах.
Различают центральный рак лёгкого, возникающий в крупных
бронхах (главном, промежуточном, долевом, сегментарном и
субсегментарном), и периферический, исходящий из эпителия более мелких
бронхов или локализующийся в паренхиме лёгкого. При
центральном раке по направлению роста выделяют: экзофитный
(эндобронхиальный) рак, когда опухоль растёт в просвет бронха; эндофитный
(экзобронхиальный) рак с преимущественным ростом опухоли в
толщу лёгочной паренхимы; разветвлённый рак с муфтообразно периб-
94 О Хирургические болезни О- Том 2 О* Часть III -О Глава 28
ронхиальным ростом опухоли вокруг бронхов. На практике чаще
наблюдают смешанный характер роста опухоли с преобладанием того
или иного компонента. При периферическом раке различают
узловую округлую опухоль, пневмониеподобный рак и рак верхушки
лёгкого с синдромом Пэнкоста.
Правое лёгкое поражается несколько чаще (56%), чем левое (44%).
Преимущественная локализация — верхние доли.
Гистологическая структура
Гистологическая структура рака лёгкого отличается большим
разнообразием. Общепринята Международная гистологическая
классификация (ВОЗ, 1999).
/. Плоскоклеточный (эпидермоидный) рак:
а) веретеноклеточный (плоскоклеточный) рак.
//. Мелкоклеточный рак:
а) овсяноклеточный;
б) рак из клеток промежуточного типа;
в) комбинированный овсяноклеточный рак.
///. Железистый рак (аденокарцинома):
а) ацинарная аденокарцинома;
б) папиллярная аденокарцинома;
в) бронхиолоальвеолярный рак;
г) солидный рак с образованием слизи.
IV Крупноклеточный рак:
а) гигантоклеточный;
б) светлоклеточный.
V. Железисто-плоскоклеточный (диморфный) рак.
VI. Рак бронхиальных желёз:
а) аденокистозный рак;
б) мукоэпидермоидный рак;
в) другие типы.
VII. Другие.
С клинической точки зрения, типы рака лёгкого различают по темпу
роста и прогнозу. Медленнее всего развивается
дифференцированный плоскоклеточный или железистый рак, быстрее —
недифференцированный (мелкоклеточный, крупноклеточный).
Недифференцированные формы рака лёгкого характеризуются бурным развитием,
быстрым и обильным лимфогенным, а также ранним гематогенным
метастазированием.
Рак легкого ♦ 95
У мужчин преобладает плоскоклеточный рак (68%), аденокарци-
нома всречается редко (9,0%). У женщин аденокарцинома возникает в
4 раза чаще (до 40%). При среднем соотношении заболевших раком
лёгкого мужчины и женщины 8,7:1, при плоскоклеточном раке это
соотношение составляет 14,8:1, при недифференцированном — 11:1, при
аденокарциноме — только 2:1. При центральном раке лёгкого в
большинстве случаев встречают плоскоклеточную и
недифференцированные формы, а аденокарциному в 4 раза чаще при периферическом раке.
Лица моложе 40 лет чаще болеют недифференцированным раком.
Морфологическими свойствами бронхиолоальвеолярного рака,
составляющего 3,6% всех наблюдений, являются: незначительная
способность ракового эпителия к разрушению тканей, в связи с чем
сохраняются межальвеолярные сосуды и перегородки; слабость
межклеточных связей, способность клеток опухоли к отторжению в
просвет альвеол и миграция с образованием новых очагов роста
(аэрогенное метастазирование). Выделяют локализованную (одноузловую
и пневмониеподобную) и распространённую (многоузловую, диссеми-
нированную) формы этой злокачественной опухоли. Она
характеризуется более благоприятным прогнозом после хирургического лечения.
Рак лёгкого метастазирует по лимфатическим путям и гематоген-
но. Лимфогенное метастазирование во внутригрудные
лимфатические узлы идёт по путям лимфооттока. Существует закономерность и
последовательность лимфогенного регионарного метастазирования
рака правого и левого лёгких и их долей. В некоторых ситуацих
(ранее перенесённые воспалительные заболевания) последовательность
метастазирования нарушается, т.е. метастазы могут поражать
лимфатические узлы последующего этапа, минуя первоначальные группы
узлов («скачущий» вариант метастазирования), или поражение
метастазами узлов против тока лимфы (ретроградное метастазирование).
Гематогенные метастазы рака лёгкого локализуются чаще всего в
печени, головном мозге, костях и надпочечниках. Быстрое и
обильное метастазирование особенно характерно для мелкоклеточного рака
лёгкого и малодифференцированной аденокарциномы.
Классификация TNM
В настоящее время общепринята Международная классификация
рака лёгкого по системе TNM (2002).
Т — первичная опухоль:
ТХ — недостаточно данных для оценки первичной опухоли, наличие
которой доказано только на основании выявления клеток рака
96 О Хирургические болезни ♦ Том 2 О* Часть III ♦ Глава 28
в мокроте или смыве из бронхов; рентгенологически и
бронхоскопически опухоль не визуализируется;
ТО — первичная опухоль не определяется;
Tis — внутриэпителиальный (преинвазивный) рак (carcinoma in situ)\
Tl — микроинвазивный рак, или опухоль до 3 см в наибольшем
измерении, окружённая лёгочной тканью или висцеральной
плеврой, без поражения последней и бронхоскопических
признаков инвазии проксимальнее долевого бронха;
Т2 — опухоль более 3 см в наибольшем измерении или
распространяющаяся на главный бронх не менее чем на 2 см от киля
бифуркации трахеи (carina trachealis), или прорастающая в
висцеральную плевру, или сопровождающаяся ателектазом, но не
всего лёгкого;
ТЗ — опухоль любого размера, непосредственно
распространяющаяся на грудную стенку, диафрагму, медиастинальную плевру,
перикард; или опухоль, распространяющаяся на главный бронх
менее чем на 2 см от киля бифуркации трахеи, но без
вовлечения последнего, или опухоль с ателектазом всего лёгкого;
Т4 — опухоль любого размера, непосредственно
распространяющаяся на средостение, сердце (миокард), магистральные
сосуды (аорта, общий ствол лёгочной артерии, верхняя полая вена),
трахею, пищевод, тела позвонков, киль трахеи; или опухоль
со злокачественным цитологически подтверждённым
плевральным выпотом.
N — регионарные лимфатические узлы:
NX —регионарные лимфатические узлы не могут быть оценены;
N0 — нет метастазов во внутригрудных лимфатических узлах;
N1 — метастатическое поражение ипсилатеральных пульмональных,
бронхопульмональных и/или лимфатических узлов корня
лёгкого, включая их вовлечение путём непосредственного
распространения самой опухоли;
N2 — метастатическое поражение ипсилатеральных средостенных
лимфатических узлов;
N3 — поражение контрлатеральных средостенных и/или корневых
лимфатических узлов, прескаленных и/или надключичных на
стороне поражения или противоположной стороне.
М — отдалённые метастазы:
MX — отдалённые матастазы не могут быть оценены;
МО — нет отдалённых метастазов;
Ml — отдалённые метастазы имеются.
Рак легкого -О- 97
G — гистопатологическая градация (обычно определяется после-
операционно):
GX — степень дифференцировки клеток не может быть оценена;
G1 — высокая степень дифференцировки;
G2 — умеренная степень дифференцировки
G3 — низкодифференцированная опухоль
G4 — недифференцированная опухоль
Соотношение группировки рака лёгкого по стадиям
(отечественная) и Международной классификации (1997, 2002*)
Стадия
Скрытый рак
0
IA
IB
ПА
II В
III A
III В
IV
Т
Тх
Tis
Tl
Т2
Tl
Т2
ТЗ
Т1
Т2
ТЗ
Т любое
Т4
Т любое
N
N0
N0
N0
N0
N1
N1
N0
N2
N2
N1-2
N3
N любое
N любое
М
МО
МО
МО
МО
МО
МО
МО
МО
МО
МО
МО
МО
Ml
* Согласно последней классификации: Т4 — отдельный (второй)
опухолевый узел в той же доле лёгкого; Ml — одиночные опухолевые узлы в
разных долях (ипсилатерально и контрлатерально); при N0 —
гистологическое исследование лимфаденэктомического операционного препарата
должно включать изучение шести лимфатических узлов и более.
Клиническая семиотика
Клиническая симптоматика зависит от клинико-анатомической
формы и гистологической структуры, локализации, размеров и типа
роста опухоли, характера метастазирования, сопутствующих
воспалительных изменений в бронхах и лёгочной ткани.
98 ^ Хирургические болезни ♦ Том 2 ♦ Часть III ♦ Глава 28
Центральный рак лёгкого
Клинические симптомы
Клинические симптомы центрального рака лёгкого по
патогенетическому механизму подразделяют на три группы.
• Первичные или местные, обусловленные появлением в просвете
бронха первичного опухолевого узла (кашель, кровохарканье,
одышка и боли в грудной клетке). Эти симптомы, как правило, ранние.
• Вторичные, которые развиваются в результате сопутствующих брон-
хогенному раку осложнений воспалительной природы либо
обусловлены регионарным или отдалённым метастазированием,
вовлечением соседних органов — эти симптомы обычно более поздние
и появляются при относительно распространённом опухолевом
процессе.
• Общие (слабость, утомляемость, похудание, снижение
трудоспособности и др.) являются следствием общего воздействия на
организм опухоли и сопутствующих воспалительных осложнений.
Характер симптомов, время их проявления и степень
выраженности определяются исходной локализацией опухоли в одном из
бронхов, формой её роста (эндо- или перибронхиального) и
распространённостью процесса. Чем крупнее поражённый бронх, особенно при
экзофитном (эндобронхиальном) росте опухоли, тем ярче начальные
симптомы заболевания и тяжелее клиническая картина осложнений,
обусловленных стенозом бронха(ов).
Кашель, который возникает рефлекторно в самом начале
развития опухоли в бронхе, возникает у 80—90% больных. Вначале кашель
сухой, временами надсадный. Позднее, с нарастанием обтурации
бронха, он сопровождается выделением слизистой или слизисто-
гнойной мокроты.
Кровохарканье, наблюдаемое у половины больных, проявляется в
виде прожилок алой крови в мокроте; реже мокрота диффузно
окрашена кровью. В поздних стадиях заболевания мокрота приобретает
вид «малинового» желе.
Одышка, выявляемая у 30—40% больных, выражена тем ярче, чем
крупнее просвет поражённого бронха. Она нередко обусловлена сдав-
лением крупных вен и артерий лёгкого, сосудов средостения,
плевральным выпотом, т.е. носит гемодинамический характер.
Боли в грудной клетке различной интенсивности на стороне
поражения встречаются у 60% больных; изредка (10%) они могут
возникать с противоположной стороны.
Рак легкого -0* 99
Наиболее характерной чертой клинической картины
центрального рака лёгкого являются признаки обтурационного пневмонита,
который имеет ряд типичных черт: быстротечность, рецидивирование,
а также развитие на фоне сегментарного или долевого ателектаза со
специфической рентгенологической семиотикой. У мужчин старше
50 лет, особенно курящих, появление рецидивирующего
пневмонита позволяет предположить рак лёгкого.
Объективное обследование
Объективное обследование (наружный осмотр, перкуссия, аускуль-
тация) имеет при раке лёгкого второстепенное значение, особенно
для его распознавания на ранних этапах заболевания. В поздней
стадии клиническая картина центрального рака соповождается
симптомами его распространения за пределы поражённого лёгкого с
вовлечением в процесс плевры, возвратного и диафрагмального нервов, а также
признаками метастазирования в отдалённые органы. Эти симптомы,
естественно, имеют не столько диагностическое, сколько
прогностическое значение. В таких случаях методы физикального
исследования могут сыграть ведущую роль, заменив более сложные методики.
Осмотр больного позволяет выявить асимметрию грудной клетки
и отставание одной из её половин при дыхании, увеличение
надключичных лимфатических узлов, расширение вен шеи и грудной стенки.
Пальпация может выявить увеличение печени и периферических
лимфатических узлов. Пренебрежение этим простым методом
зачастую ведёт к диагностическим и тактическим ошибкам. При
незамеченном увеличении периферических узлов врач нередко вместо
пункции последних назначает сложные, порой инвазивные методы
диагностики.
Перкуссия даёт возможность определить ателектаз лёгкого,
заподозрить наличие жидкости в плевральной полости.
Аускультация, один из ведущих методов клинического
обследования (ослабленное дыхание, хрипы стенотического характера), имеет
определённое значение при оценке динамики развития рака лёгкого
и диагностики осложнений.
Если при ателектазе доли или всего лёгкого, поражении внутри-
грудных лимфатических узлов метастазами данные осмотра и
физикального исследования достаточно отчётливы, то при сегментарном
ателектазе и в отсутствие метастазов они мало выражены и не
характерны для рака лёгкого.
100 ♦ Хирургические болезни <$> Том 2 ♦ Часть III ♦ Глава 28
Периферический рак лёгкого
Периферический рак лёгкого долгое время протекает без
клинических симптомов и, как правило, распознаётся довольно поздно.
Первые симптомы выявляют лишь тогда, когда опухоль начинает
оказывать давление на рядом расположенные структуры и органы или
прорастает их. Наиболее характерными симптомами
периферического рака лёгкого являются боли в грудной клетке и одышка.
Боли в грудной клетке, наблюдаемые у 20—50% больных,
постоянные или перемежающиеся, не связаны с актом дыхания, обычно
локализованы на стороне поражения. Чаще они возникают при
развитии новообразования в плащевой зоне лёгкого, особенно при
прорастании висцеральной плевры и грудной стенки.
Выраженность одышки зависит от размера опухоли, степени сдав-
ления анатомических структур средостения, особенно крупных
венозных стволов, бронхов и трахеи. Одышку наблюдают
приблизительно у 50% больных, из которых только 10% — с начальными стадиями
заболевания.
Прорастание бронха сопровождается кашлем и кровохарканьем,
эти симптомы в отличие от центрального рака не являются ранними.
Нередко отмечают симптомы общего воздействия опухоли на организм
больного: слабость, повышение температуры тела, быстрая
утомляемость, снижение трудоспособности и др.
В более поздней стадии заболевания, когда опухоль
распространяется на крупный бронх и сужает его просвет, клиническая картина
периферического рака становится сходной с таковой центрального.
На данной стадии заболевания результаты физикального
исследования одинаковы при обеих формах рака лёгкого. Вместе с тем, в
отличие от центрального рака, при рентгенологическом исследовании на
фоне ателектаза выявляют тень самой периферической опухоли. При
периферическом раке опухоль нередко распространяется по плевре с
образованием плеврального выпота.
«Полостная» форма периферического рака является результатом
некроза и расплавления тканей в центре опухоли. Эта форма рака
сопровождается признаками воспалительного процесса (кашель,
необильное отхождение мокроты, кровохарканье, повышение
температуры тела). Деструкция опухоли чаще возникает у лиц мужского пола,
в возрасте старше 50 лет, при больших размерах опухолевого узла.
Рак верхушки лёгкого представляет собой разновидность
периферического рака. Его клиническая симптоматика является результатом
Рак легкого ♦ 101
прорастания опухоли через купол плевры плечевого сплетения,
поперечных отростков и дужек нижних шейных позвонков, а также
симпатического ствола: боли в плечевом суставе и плече, прогрессирующая
атрофия мышц дистальных отделов предплечья и синдром Бернара—
Хорнера (миоз, птоз, энофтальм). Данный симптомокомплекс описал
Пэнкост в 1924 п, он может наблюдаться при различных опухолевых
процессах, локализующихся в верхней апертуре грудной клетки.
Атипичные клинико-анатомические формы рака лёгкого
встречаются реже. Медиастинальная форма рака лёгкого проявляется
множественными метастазами в лимфатических узлах средостения, при
этом первичную опухоль в лёгком всеми доступными клиническими
методами выявить не удаётся. Рентгенологически она симулирует
опухоль средостения с клиническими признаками сдавления его органов
и сосудов — синдром сдавления верхней полой вены (отёчность лица
и шеи, расширение вен передней грудной стенки и шеи, цианоз),
охриплость, афония, попёрхивание жидкой пищей и др. Первичный кар-
циноматоз характеризуется множественными узлами в лёгких, когда
первичный узел рака неизвестен. Клинически он проявляется
одышкой и общими симптомами, а рентгенологически напоминает мили-
арный туберкулёз лёгких и другие диссеминированные заболевания.
При раке лёгкого выделяют паранеопластические синдромы,
связанные с гиперпродукцией гормонов (синдром секреции адренокор-
тикотропного [АКТГ], антидиуретического, паратиреоидного
гормонов, эстрогенов, серотонина). Эти синдромы в большей степени
характерны для мелкоклеточного рака. Кроме того, рак лёгкого
может сопровождаться тромбофлебитом, различными вариантами ней-
ро- и миопатии, своеобразными дерматозами, нарушениями липид-
ного обмена.
Гормоноподобные субстанции — своеобразные маркёры малигни-
зации, их можно обнаружить радиоиммунологическими методами.
Чаще всего опухоль секретирует АКТГ или его метаболические
предшественники. Уровень глюкокортикоидов в сыворотке крови и моче
таких больных нередко выше, чем при синдроме Кушинга, и его
труднее блокировать медикаментозно. Клинически у 3—5% больных
раком лёгкого выявляют артралгический и ревматоидный синдромы,
лёгочную остеоартропатию, гинекомастию, невриты, дерматомиози-
ты, сосудистые тромбозы. Подобные проявления часто исчезают
после излечения больного.
Рак лёгкого первоначально часто может проявляться
своеобразным синдромом — гипертрофической лёгочной остеоартропатией
102 ♦ Хирургические болезни ♦ Том 2 ♦ Часть III ♦ Глава 28
Мари—Бамбергера, заключающейся в утолщении и склерозе длинных
трубчатых костей голеней и предплечий, мелких трубчатых костей
кистей и стоп, припухлости суставов (локтевых, голеностопных), кол-
бовидном утолщении концевых фаланг пальцев кистей («барабанные
палочки»). Некоторые авторы считают паранеопластическим
синдромом язвенную болезнь желудка и двенадцатиперстной кишки,
которая иногда возникает у таких больных.
Диагностика
При установлении диагноза рака лёгкого, помимо тщательного
анализа особенностей течения заболевания и патогенетического
подхода к основным клиническим симптомам, решающая роль
принадлежит специальным методам исследования. Применение
обязательных и дополнительных методов исследования имеет некоторые
отличия в зависимости от клинико-анатомической формы рака.
Обязательные методы исследования
(первичная диагностика)
I. Общеклиническое обследование.
II. Рентгенологическое исследование органов грудной клетки, в
том числе:
1) рентгенография в двух проекциях (прямой и боковой);
2) контрастное исследование пищевода для оценки состояния
бифуркационных лимфатических узлов;
3) томо(зоно)графия:
а) в прямой проекции в срезе бифуркации трахеи (оценка
состояния трахеи,главных и промежуточного бронхов, а также
основных групп внутригрудных лимфатических узлов);
б) в косых проекциях (получение изображения
верхнедолевых бронхов и их сегментарных ветвей) — при
центральном раке;
в) в боковой проекции (получение изображения
промежуточного, нижнедолевых и среднедолевого бронхов) — при
центральном раке;
г) прицельная в прямой и/или боковой проекциях (в срезе
патологической тени) — при периферическом раке;
4) КТ.
Рак легкого -О 103
III. Цитологическое исследование мокроты (5—6 анализов),
особенно после бронхоскопии.
IV. Бронхологическое исследование с получением материала для
морфологического исследования (отпечатки опухоли и прямая
биопсия — при центральном раке; транстрахеобронхиальная пункция
лимфатических узлов; зондирование бронхов под
рентгенологическим контролем и катетеризационная биопсия — при
периферическом раке).
V. Трансторакальная (чрескожная) пункция опухоли — при
периферическом раке.
VI. УЗИ органов грудной и брюшной полостей, забрюшинного
пространства, надключичных зон.
Клиническое, стандартное рентгенологическое и
бронхологическое исследования, а также трансторакальная пункция и
цитологическое исследование мокроты не всегда дают возможность
морфологически верифицировать диагноз и установить степень распространения
опухолевого процесса. Для уточняющей диагностики нередко
необходимо применение по показаниям специальных дополнительных
методов исследования.
Дополнительные методы (уточняющая диагностика)
1. Рентгенологическое исследование:
а) рентгеноскопия — изучение функциональных симптомов,
подвижности тени опухоли по отношению к другим органам и
структурам;
б) суперэкспонированная рентгенография;
в) бронхография;
г) ангиография (ангиопульмонография, селективная ангиография
бронхиальных артерий);
д) диагностический пневмоторакс;
е) исследование скелета грудной стенки (КТ и МРТ);
ж) КТ других органов.
2. Радионуклидные методы (сканирование костей и других органов).
3. Чреспищеводное УЗИ (эндосонография).
4. Хирургические методы:
а) пункция или биопсия (прескаленная) надключичных
лимфатических узлов;
б) медиастиноскопия;
в) парастернальная медиастинотомия;
104 0* Хирургические болезни ♦ Том 2 ♦ Часть III ♦ Глава 28
г) лапароскопия или диагностическая лапаротомия;
д) диагностическая видеоторакоскопия;
е) диагностическая торакотомия.
4. Пункция костного мозга.
5. Лабораторные исследования (определение опухолевых маркёров и др.).
Необходимо отметить, что при мелкоклеточном раке лёгкого к
обязательным методам, наряду с перечисленными, следует относить
сцинтиграфию костей, сканирование и/или КТ головного мозга,
пункцию или трепанобиопсию костного мозга.
На основании результатов перечисленных исследований
устанавливают клинико-анатомическую форму заболевания и его стадию,
гистологическую структуру опухоли, степень её дифференцировки,
фунциональные возможности жизненно важных органов и систем
организма больного.
Применение всего арсенала методов диагностики у каждого
больного нецелесообразно. Необходим индивидуальный план
обследования, который включал бы минимальное количество диагностических
процедур и одновременно обеспечивал бы необходимой информацией.
Рентгенологическое исследование
Рентгенологическое исследование — один из основных методов
диагностики опухолей лёгкого, оно позволяет у 80% больных
выявить заболевание, предположить характер опухоли, определить её
распространённость, выяснить состояние внутригрудных
лимфатических узлов.
Рентгенологическая семиотика основных двух форм рака лёгкого
состоит из сочетания анатомических изменений и функциональных
нарушений, обусловленных возникшей в лёгком опухолью и
сопутствующими воспалительными изменениями. Следовательно,
симптомы рака лёгкого являются отображением как самой опухоли, так и
нарушения бронхиальной проходимости, вовлечения в опухолевый
процесс сосудистой системы лёгких, соседних органов и структур, а
также воспалительных осложнений.
Диагностика центрального рака лёгкого
Решающее значение в рентгенологической диагностике
центрального рака лёгкого имеют симптомы стеноза бронха (сегментарного
или долевого). Стеноз проявляется экспираторной эмфиземой, гипо-
Рак легкого <>• 105
вентиляцией, ателектазом, которые отчётливо видны на обзорных
рентгенограммах в прямой и боковой проекциях (рис. 28-1). Эти
симптомы раньше обнаруживают при эндобронхиальном росте
новообразования. При экзобронхиальном распространении опухоль
увеличивается вначале экспансивно в форме узла и лишь по достижении
им определённых размеров, при сдавлении или прорастании
бронха рентгенологически проявляются нарушения бронхиальной
проходимости. Томография, особенно в специальных проекциях,
позволяет получить исчерпывающую информацию о состоянии
бронхиального дерева (стеноз, окклюзия, протяжённость поражения),
характере и степени распространения опухоли на лёгочную ткань,
окружающие органы и структуры (средостение, плевра, грудная
стенка, диафрагма, внутригрудные лимфатические узлы). Поэтому
у всех больных с заболеваниеями лёгких томография является
неотъемлемой составной частью рентгенологического исследования,
позволяющей выявить или заподозрить стеноз, окклюзию бронха
(бронхов) и оценить состояние проксимальных отделов
бронхиального дерева.
Экспираторная эмфизема сохраняется в течение 1—2 мес, гипо-
вентиляция — 6—8 мес, ателектаз — 4—8 мес. От появления первых
симптомов заболевания до установления рентгенологического
диагноза рака лёгкого проходит в среднем 20—24 мес. Примерно у 30—
Рис. 28-1. Рентгенограмма в прямой (а) и боковой (б) проекциях при
центральном раке верхней доли левого лёгкого. Видна тень ателектаза.
106 О- Хирургические болезни О- Том 2 О- Часть III ♦ Глава 28
40% больных центральный рак лёгкого диагностируют в стадии ги-
повентиляции и у половины, уже при возникновении
рентгенологического симптома ателектаза, являющегося лишь завершающим
этапом бронхостеноза.
Диагностика периферического рака лёгкого
Диагностика периферического рака лёгкого сложна вследствие
схожести его рентгенологических симптомов с проявлениями
многих заболеваний. Рентгенологическую диагностику этой формы рака
лёгкого у абсолютного большинства больных начинают с анализа
патологических изменений, ранее обнаруженных на флюорограммах.
Распространённое мнение о преимущественно шаровидной форме
периферического рака лёгкого относится к опухолям, диаметр которых
превышает 3-4 см (рис. 28-2). Опухоль диаметром до 2 см чаще
представляет собой полигональную тень в лёгочной паренхиме с
неодинаковыми по протяжённости сторонами, напоминая звёздчатый
рубец. Относительно редко опухоль с самого начала имеет овальную или
округлую форму. Характерна нечёткость, как бы размытость
контуров тени. Опухолевая инфильтрация окружающей лёгочной ткани
приводит к образованию вокруг узла своеобразной лучистости — так
называемой corona maligna. Полицикличность и лучистость контуров
более характерны для недифференцированных форм рака, что
обусловлено быстрым ростом и высокими инвазивными свойства этих
Рис. 28-2. Рентгенограмма
в прямой проекции при
периферическом раке нижней
доли левого лёгкого.
Рак легкого ♦ 107
опухолей. Подобная картина лучше всего выявляется на
томограммах, особенно комьютерных.
Медленное увеличение тени в размерах, наличие кальцинатов на
её фоне, как и отсутствие «дорожки» к корню, вовсе не являются
основанием для исключения диагноза периферического рака.
Наибольшие трудности для диагностики представляет пневмониеподобная
форма периферического рака лёгкого, особенно бронхиолоальвеоляр-
ного. По мере роста опухоли в процесс вовлекаются бронхи,
возникают вентильный стеноз, гиповентиляция, ателектаз, поэтому
рентгенологическая картина начинает напоминать проявления
центрального рака. Важно определение распространения опухоли на
крупные сосуды корня лёгкого (лёгочные артерия и вены) с
прорастанием перикарда, вплоть до левого предсердия, грудной стенки и
диафрагмы. При этой гистологической форме рака тень
малоинтенсивная, но хорошо видна на томограммах.
При «полостной» форме периферического рака на рентгеновских
снимках и компьютерных томограммах видны толщина стенок
полости, внутренняя их поверхность — шероховатая, бугристая, часто
наблюдаются перемычки, воспалительные явления в окружающей
лёгочной ткани (рис. 28-3). В подобных случаях рентгенологического
исследования недостаточно, поэтому показаны другие
инструментальные методы диагностики.
Рентгенологическая диагностика периферического рака
верхушки лёгкого несложна. Тень имеет слегка дугообразно выпуклую книзу
Рис. 28-3. Компьютерная
томограмма при
«полостном» периферическом раке
нижней доли правого
лёгкого.
108 ♦ Хирургические болезни ♦ Том 2 <> Часть III ♦ Глава 28
границу, верхние очертания сливаются с окружающими тканями,
может наблюдаться деструкция задних отрезков 1—III рёбер,
поперечных отростков нижних шейных и верхних грудных позвонков.
Характерен клинический синдром Пэнкоста.
Медиастинальная форма рака лёгкого рентгенологически
характеризуется значительным расширением тени верхнего средостения
вследствие симметричного или одностороннего увеличения средос-
тенных лимфатических узлов, нередко сопровождающегося
клиническими признаками компрессионного медиастинального синдрома.
Контуры тени средостения, как правило, полицикличные, реже
прямые, слегка волнистые. Увеличение лимфатических узлов
одноимённого корня лёгкого позволяет предположить в первую очередь меди-
астинальную форму опухоли.
Для милиарного карциноматоза лёгких на рентгенограммах, а
особенно — компьютерных томограммах, характерна картина
множественных мелко- и среднеочаговых теней в лёгочной ткани при
почти полном отсутствии лёгочного рисунка. Отсутствие опухоли других
органов позволяет утверждать, что речь идёт о данной первичной
атипичной форме рака лёгкого. Дифференциальную диагностику
необходимо проводить с множественными метастазами опухолей других
органов, милиарным туберкулёзом, пневмокониотической и
другими лёгочными диссеминациями.
Все рентгенологические данные необходимо рассматривать в
сочетании с результатами детального клинического обследования и
других методов диагностики (эндоскопического, хирургического и др.).
Решающее значение в подтверждении диагноза рака лёгкого имеют
морфологические (гистологический, цитологический) методы.
Цитологическое исследование мокроты
Цитологическое исследование мокроты является одним из первых
диагностических мероприятий у больных с лёгочной патологией и
одновременно простым способом подтверждения диагноза. Раковые
клетки обнаруживают у 70% больных центральным и у 40% —
периферическим раком лёгкого. Это исследование позволяет выявить даже
прединвазивный доклинический рак {carcinoma in situ). Выявляемость
рака по мокроте, полученной после бронхоскопии, возрастает до
90% и 70% соответственно, а корреляцию цитологических и
гистологических данных в отношении типа рака лёгкого отмечают в 82%
наблюдений.
Рак легкого ♦ 109
Бронхологическое исследование
Бронхологическое исследование относят к основным и
обязательным методам диагностики рака лёгкого. Оно позволяет не
только визуально исследовать гортань, трахею и все бронхи, увидеть
непосредственно опухоль, определить границы её распространения,
косвенно судить об увеличении лимфатических узлов корня лёгкого
и средостения, но и произвести биопсию для гистологического
исследования, получить материал (браш-биопсия, мазки-отпечатки, со-
скоб или смыв из бронхиального дерева, транстрахеобронхиаль-
ная пункция) для цитологического изучения, т.е. удаётся установить
как топический, так и морфологический диагноз, уточнив
гистологическую структуру опухоли. Морфологическая верификация
диагноза достигается в 100% при центральной и в 60% случаев при
периферической форме заболевания. Направленная катетеризация
бронхов под рентгенологическим контролем повышает частоту
морфологической верификации диагноза периферического рака до 95%.
Информативность цитологического исследования пунктатов
увеличенных средостенных лимфатических узлов при транстрахеоброн-
хиальной пункции достигает 90%. Различают прямые и косвенные,
анатомические и функциональные бронхоскопические признаки
рака лёгкого.
• К прямым анатомическим признакам рака относят: 1)
инфильтраты слизистой оболочки в виде возвышения с бугристой,
шероховатой или ровной поверхностью; 2) бугристые, папилломатозные
опухолевые разрастания различной формы и цвета с грибовидной
гранулематозной и бугристой поверхностью; 3) сужение просвета
бронха эксцентрического или концентрического характера с
ригидностью стенок. Эти признаки характерны для центрального рака с
эндобронхиальным ростом и периферического с прорастанием
бронхов (рис. 28-4),
• Косвенными анатомическими признаками рака являются: 1)
седлообразная, уплощённая шпора бифуркации трахеи и главных
бронхов; 2) уплотнение стенок бронхов, определяемое
инструментальной пальпацией; 3) деформация гребня межсегментарной или
субсегментарной шпоры; 4) стёртость рисунка хрящевых колец;
5) рыхлая, отёчная с локальной гиперемией, легко кровоточащая
слизистая оболочка; 6) ограниченное расширение сосудов
петлеобразного характера. Эти признаки бывают при центральном раке
с перибронхиальным ростом, периферическом с подрастанием к
110 ♦ Хирургические болезни ^ Том 2 ♦ Часть III ♦ Глава 28
Рис. 28-4. Деформация и
утолщение межсегментарной шпоры
верхней доли справа при центральном
раке лёгкого (эндофото).
стенкам бронхов и метастазах во внутригрудных
лимфатических узлах.
• Косвенные функциональные признаки рака выражаются в
неподвижности одной из половин гортани, стенок трахеи и бронхов,
локальном выпячивании мембранозной части крупных бронхов;
отсутствии ограниченной или респираторной подвижности устьев
сегментарных бронхов; отсутствии передаточной пульсации сердца
и крупных сосудов.
Перспективны высокоинфорамативные специальные бронхологи-
ческие методики: хромобронхоскопия, флюоресцентная
бронхоскопия с использованием дериватов гематопорфирина и криптонового
лазера, бронхорадиометрия с помощью кремниевых датчиков. Эти
методики позволяют выявить рентгенонегативный и самые
начальные, доклинические формы центрального рака — прединвазивный
(carcinoma in situ) и микроинвазивный, т.е. повышают
результативность истино ранней диагностики рака лёгкого.
Трансторакальная пункция опухоли
Трансторакальную (чрескожную) пункцию опухоли под УЗИ,
рентгенологическим или КТ контролем с цитологическим исследованием
пунктата применяют при периферическом раке лёгкого и отсутствии
морфологического подтверждения другими методами. С помощью
этого метода диагноз рака удаётся установить в 80% случаев (при
локализации опухоли в прикорневой зоне — у 60%, в средней — у 80%,
плащевой — почти у 90% больных). При диаметре новообразования
Рак легкого ♦ 111
до 3 см (Т1) результативность метода составляет около 70%, более 3 см
(Т2—ТЗ) — 90%. Цитологическое исследование пунктата позволяет
определить гистологическую структуру опухоли примерно у 65%
больных, причём у 40% из них удаётся установить степень её дифферен-
цировки. Возможны осложнения метода: пневмоторакс,
гидроторакс, кровохарканье. Описаны крайне редкие осложнения —
гемоторакс, воздушная эмболия, имплантационное метастазирова-
ние. Метод не применяют при патологической тени в
единственном лёгком, подозрении на эхинококковую кисту, геморрагических
диатезах, выраженной сердечно-сосудистой недостаточности и
лёгочной гипертензии.
Диагностическая торакотомия
Диагностическая торакотомия показана больным с очаговым
поражением лёгкого, когда совокупность результатов перечисленных
выше методов не позволяет исключить рак. Удельный вес этой
операции среди всехторакотомий по поводу рака лёгкого составляет 10%.
У каждого второго пациента выявляют относительно ранние (I-II)
стадии заболевания, что даёт возможность у 90% больных выполнить
органосохраняющую операцию. С целью морфологической
верификации характера процесса во время операции выполняют пункцию
или «тотальную биопсию» (плоскостная, клиновидная, сегментарная
резекции). Срочное интраоперационное гистологическое
исследование более информативно, чем цитологическое. В последние годы эту
операцию заменяет видеоторакоскопия с аналогичными
результатами. Следует отметить, что длительное динамическое наблюдение в
сомнительных случаях нецелесообразно, поскольку диагностическая
видеоторакоскопия или торакотомия менее опасны, чем угроза
пропустить ранний рак лёгкого.
С целью уточняющей диагностики, т.е. определения символов N
и М, применяют по показаниям дополнительные методы
исследования в зависимости от поставленной задачи. Последовательность их
применения должна планироваться по принципу: от простых
методик к более сложным. В задачу клинициста входит составление
правильного индивидуального плана обследования, который включал бы
минимальное количество диагностических процедур и
одновременно обеспечивал бы необходимую информацию для верификации
диагноза рака лёгкого, стадирования (включая систему TNM) и
выработки оптимальной лечебной тактики.
112 <> Хирургические болезни ♦ Том 2 ♦ Часть III О Глава 28
Дифференциальная диагностика
Дифференциальный диагноз рака лёгкого необходимо проводить
с большим количеством заболеваний лёгких, средостения, плевры и
грудной стенки. Наиболее часто приходится его дифференцировать
с хронической неспецифической пневмонией, нагноительными
процессами в лёгких, туберкулёзом, доброкачественными опухолями,
паразитарными кистами, очаговым пневмосклерозом и метастазами
опухолей другой локализации. Большое значение имеет
сопоставление клинической симптоматики с результатами
рентгенологического, бронхологического и цитологического исследований. При
сомнении в доброкачественности опухоли больному показана
диагностическая видеоторакоскопия или торакотомия.
Лечение
Лечебная тактика при раке лёгкого в силу биологических
особенностей заболевания и многообразия морфологических типов
неоднозначна. Для правильного выбора метода лечения следует знать
основные факторы прогноза: стадию заболевания в соответствии с
Международной классификацией по системе TNM, гистологическую
структуру опухоли и степень анаплазии, характер и тяжесть
сопутствующих заболеваний, функциональные показатели жизненно
важных органов и систем. Метод лечения сам по себе является одним из
решающих прогностических факторов, значение которого тем
больше, чем ближе вариант к радикальному. При лечении больных немел-
коклеточным раком лёгкого применяют следующие методы:
хирургическое лечение, лучевая терапия, химиотерапия, комбинированное
лечение (операция и лучевая терапия или химиотерапия), химиолу-
чевое лечение. В стадии клинической апробации находится
иммунотерапия, особенно в сочетании с другими методами.
Хирургическое лечение
Хирургическое лечение больных с резектабельными формами рака
лёгкого представляется наиболее радикальным методом, дающим
реальные перспективы полного излечения. Основные условия
радикализма операции — удаление единым блоком лёгкого или доли и
регионарно зависимых лимфатических узлов с окружающей клетчаткой
Рак легкого ♦ 113
в пределах здоровых тканей; отстояние линии пересечения бронха на
1,5—2 см от видимого края опухоли; отсутствие опухолевых клеток в
краях пересечённых бронха, сосудов и дополнительно
резецированных органов и тканей.
При резектабельных формах немелкоклеточного рака лёгкого (I—III
стадии) хирургическое лечение является методом выбора. Под
уточнением показаний к операции при раке лёгкого имеют в виду не столько
определение целесообразности, сколько установление
принципиальной возможности выполнения хирургического пособия, что
достигается путём оценки противопоказаний.
Абсолютными онкологическими противопоказания к операции на
лёгком при раке служат морфологически потверждённые метастазы
в отдалённых органах (исключая надпочечник и головной мозг) и
лимфатических узлах; обширное прорастание опухоли или метастазов в
аорту, верхнюю полую вену, пищевод и противоположный главный
бронх, не позволяющее выполнить их резекцию; метастатическое
поражение париетальной плевры со специфическим канцероматозным
плевритом. Комбинированная операция с резекцией бифуркации
трахеи, предсердия, пищевода, аорты, верхней полой вены нередко
позволяет выполнить радикальное оперативное вмешательство.
Среди противопоказаний к оперативному вмешательству
наибольшее значение придают функциональной недостаточности жизненно
важных органов и систем больного, т.е. «функциональной
неоперабельное™»; декомпенсированная сердечная недостаточность II и III
степеней; выраженные органические изменения в сердце,
гипертоническая болезнь III степени, почечная или печёночная
недостаточность. Перечисленные противопоказания имеют относительный
характер, поскольку необоснованный отказ от операции может лишить
больного перспектив выздоровления. Современные возможности
анестезиологии и интенсивной терапии позволяют предотвратить
нарушения функций органов и систем, особенно при адекватной
предоперационной подготовке. Отказ от операции с онкологических
позиций также должен быть серьёзно мотивирован. Этот вопрос нео-
ходимо решать коллегиально с обязательным участием торакального
хирурга, имеющего опыт хирургического лечения рака лёгкого.
Основными операциями при раке лёгкого являются пневмонэкто-
мия и лобэктомия, а также их варианты (расширенная и
комбинированная операции, лобэктомия с циркулярной резекцией бронхов и
др.). Бронхопластические операции расширяют возможности
хирургического метода и способствуют повышению резектабельности, со-
114 <0> Хирургические болезни ♦ Том 2 0> Часть III ♦ Глава 28
ставляющей не более 20% среди впервые выявленных больных раком
этой локализации. Выбор объёма и характера операции зависит от
локализации и распространённости первичной опухоли, её
отношения к окружающим органам и структурам, состояния внутригрудных
лимфатических узлов.
При ранних формах центрального рака лёгкого (carcinoma in situ,
микроинвазивный рак) в последние годы проводят
фотодинамическую терапию. После введения фотосенсибилизатора (гидроксиалю-
миния трисульфофталоцианин и др.), который накапливается в
раковых клетках, с помощью бронхоскопа осуществляют облучение опухоли
лучом лазера определённой длины волны. Полученные
удовлетворительные отдалённые 5-летние результаты свидетельствуют о
перспективности такого метода радикального лечения без торакотомии.
При периферическом раке лёгкого и размерах опухоли до 3 см
допустима экономная сублобарная резекция — классическая сегментэк-
томия с раздельной обработкой элементов корня сегмента,
обязательной ревизией лёгочных и бронхопульмональных лимфатических узлов
и срочным морфологическим исследованием. При выявлении в них
метастазов минимальным объёмом операции должна быть лобэкто-
мия. В последние годы также выполняют видеоторакоскопические
операции типа сублобарной резекции без торакотомии или с видео-
ассистированной миниторакотомией, особенно при необходимости
лобэктомии. Метод находится в стадии клинических испытаний.
Операции на лёгких таят много опасностей, что иногда приводит
к интраоперационным и/или послеоперационным осложнениям, а
также послеоперационной летальности. Совершенствование
оперативной техники и анастезиологического пособия, а также
проведение комплексной интенсивной терапии до и в раннем периоде после
операции способствовали в последние годы снижению частоты
послеоперационных осложнений: в ведущих торакальных клиниках она
не превышает 20% при уровне летальности около 3%.
Лучевое лечение
Лучевое лечение немелкоклеточного рака лёгкого осуществляют
по радикальной программе или с паллиативной целью. Радикальная
лучевая терапия предусматривает получение длительного и стойкого
эффекта в результате гибели всех клеток первичной опухоли и
внутригрудных метастазов. При малодифференцированных формах рака
в поле облучения включают и надключичные зоны.
Рак легкого ♦ 115
Лучевую терапию проводят с помощью дистанционных
гамма-установок, бетатрона и линейных ускорителей, генерирующих
тормозное и электронное излучение. С целью увеличения
радиочувствительности опухоли применяют так называемые радиомодификаторы:
гипербарическую оксигенацию, искусственную гипертермию, метро-
нидазол и др. С целью повышения устойчивости нормальных тканей
облучение проводят в условиях гипоксии.
Лучевая терапия по радикальной программе (суммарная очаговая
доза не менее 60—80 Гр) возможна у больных раком лёгкого I—II
стадии, которым хирургическое лечение противопоказано или которые
отказались от него. Лучевую терапию по паллиативной программе
(суммарная очаговая доза не более 45 Гр) планируют при раке
лёгкого III стадии.
Противопоказаниями к лучевому лечению обычно являются:
обильное кровохарканье или кровотечение, опухолевый плеврит,
множественные отдалённые метастазы, обширное прорастание
первичной опухоли или метастазов в сосуды средостения, пищевод,
трахею, лейкопения (менее 3109/л), тромбоцитопения (ниже 10-109/л),
тяжёлая стенокардия, инфаркт миокарда, декомпенсированные
формы лёгочно-сердечной, сердечно-сосудистой, печёночной и
почечной патологии.
Лучевая терапия сопровождается общими и местными лучевыми
реакциями и осложнениями. При лучевом пневмоните лечение
прекращают и проводят активную терапию антибиотиками,
сульфаниламидными препаратами, глюкокортикоидами, витаминами и др.
Эзофагит требует лечения спазмолитиками, диетой, приёмом внутрь
алгелдрата + магния гидроксида + бензокаина, оливкового масла и
т.д. Развитие эзофагита является поводом для коррекции полей
облучения. Симптомы общей лучевой реакции (общая слабость,
снижение аппетита, нарушение сна, лейко- и тромбоцитопения, анемия,
нарушения со стороны сердечно-сосудистой системы) обычно носят
временный характер и требуют соответствующего лечения. Для их
профилактики применяют витамины групп А, В, С, антигистамин-
ные препараты, бронхолитические средства.
Непосредственный эффект лучевого лечения зависит от
распространённости процесса, гистологической структуры опухоли,
величины суммарной очаговой дозы, т.е. облучения по радикальной или
паллиативной программе. У половины больных удаётся добиться
резорбции опухоли, у 40% — уменьшения первичной опухоли и
регионарных метастазов.
116 ♦ Хирургические болезни ♦ Том 2 О- Часть III ♦ Глава 28
Химиотерапия
Химиотерапию при немелкоклеточном раке лёгкого проводят при
противопоказаниях к хирургическому и лучевому лечению.
Полихимиотерапию проводят следующими препаратами в различных
сочетаниях: доксорубицин, цисплатин, винкристин, этопозид, цик-
лофосфамид, метотрексат, блеомицин, нитрозометилмочевина, ви-
норелбин, паклитаксел, доцетаксел, гемцитабин и др. Обычно
проводят до 6 курсов химиотерапии с интервалами 3—4 нед.
Объективное улучшение (частичная резорбция первичной
опухоли, регионарных и отдалённых метастазов) наступает у 6—30%
больных, однако полная резорбция наступает редко. Химиотерапия
малоэффективна при метастазах в костях, головном мозге и печени.
Лучшие результаты достигаются при сочетании химиотерапии с
лучевым лечением, при этом возможно одновременное или
последовательное их применение. Химиолучевое лечение основано на
возможности получения как аддитивного эффекта, так и синергизма, без
суммации побочного токсического действия.
К возможным ранним токсическим реакциям при химиотерапии
относятся тошнота, рвота, энтерит, диарея, флебит, цистит, дерматит
и др. Наиболее частым поздним осложнением является угнетение
кроветворения. Поэтому анализы крови повторяют не реже 2 раз в
неделю и в течение 2 нед после завершения химиотерапии.
При раке лёгкого, осложнённом метастатическим плевритом,
после эвакуации жидкости оправдано внутриплевральное введение хи-
миопрепаратов (циклофосфамид, цисплатин), хлорохин по 250 мг
(3—4 введения) ежедневно или через день, тетрациклина в дозе 1 г.
Повторные курсы лечения проводят по мере накопления жидкости в
плевральной полости. В случаях объективного эффекта целесообразно
проводить системную полихимиотерапию или химиолучевое лечение.
Комбинированное лечение
Повышение эффективности хирургического лечения больных
немелкоклеточным раком лёгкого II—III стадии связано с
разработкой методов комбинированного лечения, предусматривающего
сочетание радикальной операции с лучевой терапией либо с
лекарственным противоопухолевым лечением, или иммунотерапией.
Дополнительные методы применяют до или после операции, во время
неё, а также в пред- и послеоперационном периодах.
Прогноз
Прогноз результатов лечения больных немелкоклеточным раком
лёгкого весьма сложен. Лечебная тактика вследствие биологических
особенностей заболевания и многообразия гистологических структур
неоднозначна. Хирургическое лечение даёт возможность излечить
больного. Среди оперированных больных средний показатель 5-летней
выживаемости составляет около 35%. Основными факторами
прогноза являются стадия заболевания, гистологическая структура опухоли
и степень дифференцировки, радикальность лечения (рис. 28-5).
При IA— IB стадии (Т1— 2N0M0) хирургический метод позволяет
добиться излечения 70—80% больных, т.е. операция радикальна не
только в клиническом, но и в биологическом смысле слова.
Предпочтительны органосохраняющие, функционально щадящие
операции — лобэктомия, нередко с резекцией и пластикой бронхов, при
периферическом раке — сублобарная резекция типа классической
сегментэктомии с обязательным удалением клечтатки и
лимфатических узлов регионарных зон. При микроинвазивном и прединвазив-
ном раке (carcinoma in situ) более 5 лет живут 90% больных. При этих
формах допустима эндоскопическая хирургия в виде лазерной или
фотодинамической терапии.
Рис. 28-5. Выживаемость больных после хИРУРгического лечения больных
со злокачественными опухолями лёгких.
118 ♦ Хирургические болезни О Том 2 ♦ Часть III <0> Глава 28
При ПА и ПВ стадиях (Т1— 2N1M0, T3N0M0) оперативное
вмешательство позволяет продлить жизнь на 5 лет и более 50% больных.
При невозможности хирургического лечения применяют лучевую или
химиолучевую терапию по радикальной программе, но 5-летняя
выживаемость больных не превышает 15%, При периферическом раке
допустима лоб(билоб)эктомия, а при центральном раке — с
резекцией и пластикой бронхов. Медиастинальная лимфаденэктомия
является обязательным элементом операции.
При HIA или ШБ стадии прогноз после хирургического лечения
неудовлетворительный, более 5 лет живут 15—25% больных.
Распространённость процесса требует выполнения больших операций типа
расширенной, комбинированной пневмонэктомии с резекцией
бифуркации трахеи, перикарда, предсердия, грудной стенки,
пищевода, верхней полой вены, аорты и др. Лучшие результаты отмечают при
плоскоклеточном раке, чем при железистом или крупноклеточном.
Выживаемость больных выше при высокодифференцированных
формах рака, свыше 5 лет живут около 30% больных. Сочетание
операции с лучевой терапией или химиотерапией способствует
уменьшению частоты внутригрудного рецидива и увеличению 5-летней
выживаемости больных на 10%.
Методы консервативной противоопухолевой терапии уступают
хирургическому. Отдалённые результаты колеблются в значительных
пределах и зависят от методики облучения, контингента больных с
разной распространённостью процесса. Более 3 лет после лучевой
терапии живут 4-28%, более 5 — не свыше 1-14,5%.
Существенными факторами прогноза являются гистологическая структура
опухоли, непосредственный эффект и величина суммарной очаговой дозы.
После химиотерапии все больные погибают в сроки до 3 лет.
При немелкоклеточном раке лёгкого IV стадии возможна лишь
лекарственная противоопухолевая или симптоматическая терапия.
Мелкоклеточный рак лёгкого характеризуется быстрым развитием,
ранним интенсивным лимфогенным и гематогенным метастазирова-
нием и плохим прогнозом. У 80—90% больных диагностируют
распространённый опухолевый процесс. Поэтому многие годы
мелкоклеточный рак считали «терапевтическим» и противопоказанием к
хирургическому лечению.
В настоящее время при I—II стадиях, особенно неовсяноклеточ-
ном морфологическом подтипе, общепризнана тактика
хирургического лечения с последующей полихимиотерапией (до 6 курсов), а
также целесообразность неоадъювантной полихимиотерапии (2—4 курса)
Травма грули ♦ 119
при III стадии с послеоперационной химиотерапией. При
мелкоклеточном раке III стадии с поражением средостенных лимфатических
узлов (N2) проводят химиолучевое лечение с повторными курсами
юлихимиотерапии. Современные методики такого лечения
позволяют у 80—90% больных получить непосредственный объективно
регистрируемый эффект, у 20—50% из них — полную регрессию
опухоли. Достижение полной клинической ремиссии после основного
курса лечения увеличивает выживаемость больных и открывает
перспективу излечения.
Аутотрансплантация костного мозга, стволовых костномозговых
клеток периферической крови и применение колониестимулирую-
щих факторов (например, молграмостим) способствуют повышению
интенсивности химиотерапии, увеличению процента полных
ремиссий и 2-летней выживаемости. После 2—3 курсов эффективной
полихимиотерапии нередко проводят лучевую терапию.
По сводным данным отечественных и зарубежных публикаций при
мелкоклеточном раке I стадии 5-летние благоприятные исходы
после хирургического лечения составляют около 25%, адьювантная
полихимиотерапия способствует улучшению результатов до 47%, при II
стадии — 11,0 и 28,7%, III стадии — 5,0 и 12,9% соответственно. Хи-
миолучевая и/или полихимиотерапия способствует продлению
жизни больных мелкоклеточным раком лёгкого III стадии, из них
единичные (до 5%) пациенты живут 5 лет и более. При IV стадии этого
вида рака лёгкого оправдано проведение полихимиотерапии, но
прогноз плохой.
Профилактика
Согласно терминологии ВОЗ, профилактические мероприятия
предусматривают первичную и вторичную профилактику.
• Первичной (онко-гигиенической, иммунобиологической, закона-
дательно-правовой) профилактикой является система
государственных и медицинских мероприятий, направленных на устранение или
резкое уменьшение воздействия на организм веществ и факторов,
признаваемых в настоящее время канцерогенными и играющих
значительную роль в возникновении и развитии злокачественного
процесса. Основной целью гигиенической профилактики рака лёгкого
является борьба с загрязнением вдыхаемого воздуха или хотя бы
уменьшение степени его загрязнения, борьба с производственны-
120-0^ Хирургические болезни О- Том 2 ♦ Часть III О Глава 24
ми (профессиональными) вредностями и крайне вредной
привычкой — курением табака.
• Вторичная, или медицинская, профилактика предусматривает
планово-организационную систему обследования (диспансеризацию)
населения с целью выявления, учёта и лечения фоновых процессов
и предопухолевых заболеваний лёгких — факторов повышенного
риска рака лёгкого. К категории «повышенного риска» относят
пациентов, болеющих хроническим бронхитом, пневмонией или
туберкулёзом, длительно курящих мужчин в возрасте 50 лет и старше,
а также излеченных от злокачественного заболевания.
Диспансерное наблюдение с периодическим обследованием этого
контингента больных направлено одновременно на выявление истинно
ранних форм рака лёгкого, лечение которых даёт хорошие отдалённые
результаты.
СЕРДЕЧНО-СОСУДИСТАЯ
ХИРУРГИЯ
За последние 25 лет хирургия сердца и сосудов из нового небольшого
раздела хирургии превратилась в одну из основных областей
медицины, сохраняющую сотни тысяч жизней и восстанавливающую
трудоспособность миллионов больных, страдающих
сердечно-сосудистыми заболеваниями. Сегодня кардиоваскулярная хирургия — сложная
научно-практическая дисциплина, интегрирующая комплекс вполне
самостоятельных клинических направлений. Среди них хирургия
врождённых и приобретённых пороков сердца, ишемической болезни сердца
и нарушений сердечного ритма, трансплантация донорского и
имплантация искусственного сердца, ангиохирургия и флебология, эндо-
васкулярная сердечно-сосудистая хирургия и некоторые другие.
МГЛП1ЧП ВРОЖДЁННЫЕ ПОРОКИ
I \\MUM СЕРДЦА И КРУПНЫХ СОСУДОВ
Врождённые пороки — изменения нормального строения сердца
и магистральных сосудов, возникающие вследствие нарушения
внутриутробного развития и незавершённости анатомического строения
сердца при окончательном формировании постнатального
кровообращения. Пороки развития сердца и крупных сосудов выявляют
почти у 0,5% детей, родившихся живыми, и у 0,2 % детей, оставшихся в
живых после первых 2 лет жизни.
Аномалии развития сердца и крупных сосудов приводят к
нарушениям гемодинамики, обусловленным различными причинами,
которые определяют клиническую картину порока и методы его
коррекции. Основным признаком большинства врождённых пороков
сердца бывает отсутствие строгого разделения на системы малого и
большого кругов кровообращения, обусловленное наличием
дефекта в перегородках или сохраняющимся эмбриональным соустьем.
Реже встречают врождённые пороки сердца с необычным отхожде-
нием или впадением крупных сосудов, а также сужением аорты или
лёгочного ствола. Учитывая основные патологоанатомические
признаки и характер нарушения внутрисердечной гемодинамики,
условно их можно объединить в три большие группы.
122 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV О- Глава 29
• I группа — пороки, имеющие внутрисердечное патологическое
сообщение со сбросом венозной крови в артериальное русло (пороки
синего типа: тетрада и триада Фалло, комплекс Эйзенменгера,
транспозиция сосудов).
• II группа — пороки с внутрисердечным сообщением (или в
пределах начальной части крупных сосудов) и сбросом артериальной
крови в малый круг кровообращения (пороки бледного типа: открытый
артериальный проток, дефекты межпредсердной, межжелудочковой
и аортолёгочной перегородок).
• III группа— пороки без смешивания венозной и артериальной
крови, при которых нарушения гемодинамики вызваны сужением
магистральных сосудов (сужение лёгочного ствола, стеноз устья
аорты, коарктация аорты).
Известно более 100 врождённых пороков сердца и крупных
сосудов, а также их сочетаний. Наибольшее клиническое и практическое
значение имеют некоторые из них, выявляемые достаточно часто.
Зная их симптоматологию, можно распознать или заподозрить
другие аномалии развития сердца и крупных сосудов.
Специальные методы исследования
сердца и крупных сосудов
Зондирование (катетеризация) сердца — метод исследования при
помоши введения в камеры сердца специальных рентгеноконтраст-
ных зондов. В зависимости от поставленных задач зондирование
проводят через венозные или артериальные сосуды. Метод позволяет
измерять давление в полостях сердца, производить его запись в виде
кривой для последующего анализа и расчётов, брать пробы крови для
изучения газового состава. Возможно также определение
патологического сообщения между полостями при прохождении зонда через
дефект в перегородке. Путём введения через катетеры контрастных
веществ возможно рентгеноконтрастное исследование камер сердца
и сосудов (киноангиокардиография). Продвижение контрастного
вещества по ходу тока крови даёт возможность получать
последовательные изображения всех сосудов и полостей сердца. На основе этих
данных составляют представление об анатомической и гемодинами-
ческой сущности порока сердца.
Всё большее развитие получают неинвазивные методы
исследования (УЗИ, КТ, МРТ, сцинтиграфия). Современную диагностику
Врожденные пороки сердца и крупных сосудов ♦ 123
патологии сердца трудно представить без УЗИ. Под термином «эхо-
кардиография» понимают комплексное УЗИ, включающее различные
методы: одномерную, двухмерную, допплеровскую эхокардиографию
и контрастную эхокардиографию, а также цветное допплеровское
картирование. Усовершенствование эхокардиографического
исследования привело к появлению чреспищеводной и внутрисосудистой
методик, сделало возможным пространственную реконструкцию
ультразвукового изображения.
По совокупности данных, получаемых при обычных врачебных
методах исследования больных и при использовании
инструментальных методов, можно достичь весьма точной диагностики
большинства пороков сердца и принять решение о возможности
оперативного лечения.
Открытый артериальный (боталлов) проток
Порок характеризуется сохранением соустья между аортой и
лёгочным стволом, существующего во время внутриутробного периода
развития плода. Вскоре после рождения проток обычно облитериру-
ется и превращается в артериальную связку. Функционирование
артериального протока в течение первого года жизни считают
врождённым пороком. Эту аномалию развития встречают наиболее часто, она
составляет до 25% всех врождённых пороков.
Гемодинамическая сущность порока
Гемодинамическая сущность порока состоит в постоянном
сбросе артериальной крови в малый круг кровообращения, вследствие чего
происходит перемешивание артериальной и венозной крови в
лёгких и развивается гиперводемия малого круга, сопровождающаяся
постепенным возникновением необратимых морфологических
изменений сосудов лёгких и последующим возникновением лёгочной гипер-
тензии. При этом левый желудочек вынужден работать интенсивнее
для поддержания устойчивой гемодинамики, что приводит к
гипертрофии левых отделов сердца. Прогрессирующее повышение
сопротивления сосудов малого круга вызывает перегрузку правого
желудочка сердца, обусловливая его гипертрофию и последующую дистрофию
миокарда. Степень нарушения кровообращения зависит от диаметра
протока и объёма сбрасываемой через него крови.
124 <> Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 29
Клиническая картина и диагностика
Характер клинических проявлений зависит, прежде всего, от
диаметра и протяжённости протока, угла его отхождения от аорты и
формы, что определяет величину сброса крови в лёгочную артерию.
Жалобы обычно появляются с развитием декомпенсации
кровообращения и заключаются в быстрой утомляемости и одышке. Для
порока характерны частые респираторные заболевания и пневмонии на
первом и втором годах жизни ребёнка, отставание его в физическом
развитии. При обследовании больного обнаруживают систоло-ди-
астолический шум над сердцем с эпицентром над лёгочной артерией.
Характер шума часто сравнивают с «шумом волчка», «шумом
мельничного колеса», «машинным шумом», «шумом поезда,
проезжающего через тоннель». С развитием лёгочной гипертензии в этой же
точке появляется акцент II тона. Как правило, шум становится
интенсивнее при выдохе или физической нагрузке.
Электрокардиографические признаки нехарактерны. При рентгенологическом
исследовании определяют признаки переполнения кровью малого круга
кровообращения и умеренно выраженную митральную
конфигурацию сердца за счёт выбухания дуги лёгочной артерии. Отмечают
гипертрофию левого желудочка. В поздние сроки естественного
течения порока становятся более выраженными рентгенологические
признаки склерозирования сосудов лёгких и обеднение их рисунка. Эхо-
кардиография иногда позволяет визуализировать функционирующий
открытый артериальный проток (обычно у маленьких детей). У
взрослых пациентов этому мешает ограничение «ультразвукового окна»
вследствие прилегания левого лёгкого. Катетеризация камер сердца
необходима лишь в осложнённых или неясных случаях. При
введении контрастного вещества в восходящую аорту оно через проток
попадает в лёгочные артерии. В целом диагностика этого порока
больших трудностей не представляет.
Частым осложнением открытого артериального протока
(особенно малого диаметра) бывает воспаление стенок протока (боталлинит)
или, в более старшем возрасте, его обызвествление.
Лечение
Спонтанное закрытие артериального протока наблюдают
довольно редко. Как правило, оно происходит вследствие боталли-
нита. Поэтому в настоящее время во всех случаях такого порока
Врожденные пороки сердца и крупных сосудов О- 125
считают показаным оперативное лечение.
Из левосторонней заднебоковой торако-
томии перевязывают проток двумя-тремя
лигатурами, клипируют (рис. 29-1) или
пересекают ето с последующим
прошиванием и перевязкой обеих культей. В
последнее время развивается транскатетерная
эмболизация открытого артериального
протока при помощи специальных
конструкций—окклюдеров. Суть метода заклю- рис# 29-1. Клиппирова-
чается в доставке окклюдера при помощи ние открытого артериаль-
специальных зондов к функционирую- ного протока,
щему артериальному протоку и
установке конструкции в просвете боталлова протока таким образом,
чтобы он перекрывал сообщение между аортой и лёгочной артерией.
Прогноз
Наилучших результатов хирургического вмешательства
достигают после операций в возрасте до 5 лет. В более старшем возрасте
после перевязки открытого артериального протока сохраняется
остаточная лёгочная гипертензия в результате необратимых
морфологических изменений лёгких. Кроме того, операция у взрослых
более опасна из-за возможного кровотечения вследствие
прорезывания склерозированной или кальцинированной стенки протока
лигатурой.
Дефект межпредсердной перегородки
Дефект межпредсердной перегородки — патологическое соустье
между правым и левым предсердиями. Он составляет около 20% всех
врождённых пороков сердца. Дефект может располагаться в
различных отделах перегородки, иметь разнообразные форму и размеры.
Условно различают первичные и вторичные (высокие) дефекты
межпредсердной перегородки (рис. 29-2). Первичный дефект возникает
вследствие недоразвития в эмбриогенезе первичной перегородки. Его
отличительная особенность — локализация на уровне фиброзного
кольца атриовентрикулярных клапанов, они становятся нижней
стенкой такого дефекта. Порок иногда сочетается с расщеплением мит-
рального и трикуспидального клапанов, являясь компонентом так
называемого открытого атриовентрикулярного канала. Вторичный
дефект формируется вследствие нарушений эмбриогенеза вторичной
перегородки. Нижний край такого дефекта составляет межпредсерд-
ная перегородка.
Гемодинамическая сущность порока
Гемодинамическая сущность порока заключается в сбросе
артериальной крови из левого предсердия в правое, что вызывает гипер-
волемию малого круга кровообращения, а в дальнейшем — развитие
лёгочной гипертензии. Лёгочная гипертензия при дефекте межпред-
сердной перегородки носит весьма злокачественный характер, так как
необратимые изменения в лёгких развиваются быстро, приводя к
тяжёлой декомпенсации правых отделов сердца. Частым осложнением
такого порока становится септический эндокардит.
Клиническая картина и диагностика
Обычно жалобы больных связаны с декомпенсацией
кровообращения. Тяжесть её зависит от выраженности перегрузки правых
отделов и развития лёгочной гипертензии. Больных беспокоят быстрая
утомляемость и одышка, они подвержены простудным заболевани-
Врожденные пороки сердца и крупных сосудов ♦ 127
ям, особенно в раннем детском возрасте. Аускультатывно дефект
межпредсердной перегородки проявляется нежным систолическим
шумом с эпицентром над лёгочной артерией. Шум обусловлен
относительным стенозом основания лёгочного ствола, через который
протекает избыточный объём крови. II тон над лёгочной артерией
усилен и часто расщеплён. На ЭКГ заметны признаки перегрузки правых
отделов сердца с гипертрофией правого желудочка и предсердия.
Весьма часто обнаруживают неполную или полную блокаду правой
ножки пучка Хиса.
При рентгенологическом исследовании определяют увеличение
размеров сердца за счёт правых предсердия, желудочка и ствола
лёгочной артерии. Выявляют также повышенную пульсацию корней
лёгких и усиление общего сосудистого рисунка лёгочной ткани.
С помощью эхокардиографинеского исследования можно
визуализировать дефект межпредсердной перегородки (рис. 29-3), уточнить
его характер (первичный или вторичный), оценить направление
сброса крови через дефект.
При зондировании сердца обнаруживают повышение давления в
правом предсердии, правом желудочке и лёгочном стволе. Зонд
может переходить из правого предсердия в левое. Контрастное
вещество, введённое в левое предсердие, через дефект
межпредсердной перегородки попадает в правое предсердие и далее — в малый
круг кровообращения. На основании рентгенологических данных
можно рассчитать объём сброса крови, определить локализацию
Рис. 29-3. Эхокардиография в В-режиме больного с дефектом
межпредсердной перегородки (ASD) (LA — левое предсердие, RA — правое предсердие).
128 О Хирургические болезни О Том 2 ♦ Часть IV ♦ Глава 29
Рис. 29-4. Ушивание
дефекта межпредсердной
перегородки в условиях
искусственного
кровообращения. Дефект щелевидной
формы ушивают
непрерывным обвивным
двухрядным швом.
Рис. 29-5. Пластика
большого дефекта
межпредсердной перегородки
синтетической заплатой.
и размеры дефекта. Продолжительность
жизни при дефекте межпредсердной
перегородки без операции в среднем
составляет около 25 лет.
Лечение
Лечение только оперативное.
Преимущественно выполняют операции на
открытом сердце в условиях
искусственного кровообращения или гипотермии
(общей или краниоцеребральной).
Вторичные дефекты средней величины
можно ушить (рис, 29-4). Большие вторичные
и все первичные дефекты, как правило,
закрывают с использованием заплаты из
ауто- или ксеноперикарда либо
синтетических тканей (рис. 29-5). В
последнее десятилетие развивается методика
транскатетерного закрытия дефекта
межпредсердной перегородки при помощи
«пуговичных устройств». Суть метода
заключается в доставке и установке в область
дефекта под рентгеновским контролем
специальными инструментами-зондами
двух конструкций-дисков,
напоминающих пуговицы. Причём одну из
конструкций (так называемый контр-окклюдер)
устанавливают со стороны правого, а
другую (окклюдер) — со стороны левого
предсердия. Конструкции соединяют
между собой в области дефекта при помощи специальной
нейлоновой петли, вследствие чего они перекрывают сообщение между
предсердиями.
Прогноз
Хорошие результаты операции могут быть получены лишь при её
выполнении в раннем детском возрасте. Проведение операции в
более поздние сроки не позволяет добиться всесторонней реабилитации
Врожденные пороки сердца и крупных сосудов -О- 129
пациентов вследствие формирования вторичных морфологических
изменений в лёгких, миокарде и печени. Более того, развитие
тяжёлой лёгочной гипертензии со сбросом справа налево —
противопоказание к оперативному лечению.
Дефект межжелудочковой перегородки
Дефекты межжелудочковой перегородки могут располагаться в её
мембранозной или мышечной части (рис. 29-6), иногда выявляют
полное отсутствие перегородки между желудочками.
Гемодинамическая сущность порока
Гемодинамическая сущность порока состоит в сбросе в фазу
систолы артериальной крови из левого желудочка в правый, вследствие
чего в систему малого круга попадает избыточный объём крови, что
приводит к развитию гиперволемии
сосудов лёгких с возникновением в
последующем склеротической гипертензии.
Прогрессирование гипертензии зависит
главным образом от величины дефекта в
перегородке, но необратимые изменения
в лёгких могут развиться довольно
быстро и обусловить функциональную неопе-
рабельность больного, несмотря на
отсутствие субъективных ощущений.
Клиническая картина
Клиническая картина у больных с
дефектом межжелудочковой перегородки
разнообразна и определяется главным
образом размерами соустья и величиной
сброса артериальной крови в систему
малого круга. Наиболее частые жалобы —
быстрая утомляемость, одышка, боли в
области сердца и ощущение перебоев в
его работе. В большинстве случаев
происходит отставание ребёнка в физичес-
Рис. 29-6. Схема
локализации основных типов
дефектов межжелудочковой
перегородки (сверху вниз):
надгребешковый, подгре-
бешковый, канальный и
мышечный типы.
130 О Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 29
ком развитии. С прогрессированием лёгочной гипертензии давление
в лёгочной артерии становится выше, чем в аорте, и изменяется
направление шунта: венозная кровь смешивается с артериальной уже в
левом желудочке, у больных появляется цианоз. Но, как правило, они
редко доживают до этой (терминальной) стадии порока, так как
развивается декомпенсация правого желудочка или естественное течение
порока обрывается присоединяющимся инфекционным
эндокардитом. Средняя продолжительность жизни детей с дефектом
межжелудочковой перегородки без операции составляет около 15 лет.
Диагностика
Диагностика порока не представляет трудностей. Дефект
межжелудочковой перегородки проявляется довольно интенсивным грубым
систолическим шумом с эпицентром, соответствующим проекции
отверстия в перегородке на передней грудной стенке. Как правило, это
левый край тела грудины. Часто отмечают распространение шума
вправо соответственно направлению струи крови, проходящей через
дефект межжелудочковой перегородки. При гипертензии малого
круга возникает акцент II тона над лёгочной артерией. ЭКГ указывает
на комбинированную перегрузку желудочков с преобладанием
перегрузки левого желудочка. Рентгенологическое исследование органов
грудной клетки выявляет увеличение сердца за счёт правого
желудочка, правого предсердия, выбухания лёгочного ствола. Лёгочный
сосудистый рисунок обычно значительно усилен, а корни
подчёркнуты и могут пульсировать. Вместе с тем, эти рентгенологические
признаки нельзя считать патогномоничными. При неопределённости
аускультативной картины необходимы катетеризация камер сердца,
измерение давления в его полостях и сосудах, а также
киноангиокардиография. Дефект межжелудочковой перегородки можно
визуализировать с помощью эхокардиографии.
Лечение
Лечение только оперативное, в условиях искусственного
кровообращения. Дефект ушивают различными приёмами или закрывают с
помощью каких-либо пластических материалов (рис. 29-7).
Ушивание небольших дефектов межжелудочковой перегородки можно
выполнить и без искусственного кровообращения — в условиях общей
или краниоцеребральной гипотермии. При своевременном
выполнении оперативного пособия результаты лечения, как правило, хорошие.
Врожденные пороки сердца и крупных сосудов ♦ 131
Тетрада Фалло
Это наиболее часто встречающийся порок синего типа. Его
анатомическая сущность заключается в сочетании сужения выходного
отдела правого желудочка, высокого дефекта межжелудочковой
перегородки, смещения устья аорты вправо (декстрапозиция) и
гипертрофии миокарда правого желудочка (рис. 29-8).
Гемодинамическая сущность порока
Основные нарушения гемодинамики при тетраде Фалло
обусловлены тем, что венозная кровь из правого желудочка по время его
систолы с трудом и в недостаточном количестве попадает в лёгочный
ствол, вследствие чего возникает гиповолемия малого круга
кровообращения. Большая часть венозной крови из правого желудочка через
дефект межжелудочковой перегородки попадает в левый желудочек
и аорту, смешиваясь с артериальной, что обусловливает цианоз
кожных покровов.
Клиническая картина и диагностика
Тетрада Фалло сопровождается одышкой даже в состоянии покоя.
Обращает на себя внимание цианоз кожных покровов и слизистых
оболочек различной интенсивности. Пальцы рук деформированы в
виде «барабанных палочек», ногти — в виде «часовых стёкол». Дети
Рис. 29-7. Пластика дефекта
межжелудочковой перегородки
синтетической заплатой.
к^
♦ Том 2 ♦ Часть IV ♦ Глава 29
Рис. 29-8, Тетрада Фало (схема): ]
—стеноз устья лёгочного ствола; 2 — дек-
страпозиция аорты; 3 — высокий
дефект межжелудочковой перегрородки;
4 — гипертрофия миокарда правого
желудочка.
обычно значительно отстают в физическом развитии, часто болеют
различными респираторными заболеваниями, ангинами и т.п.
Грудная клетка, как правило, деформирована. После физической
нагрузки возникают одышечно-цианотические приступы. Они бывают
следствием хронической субпороговой ишемии мозга, проявляются
одышкой, тахикардией, нередко с аритмией и усилением цианоза.
Часто больные принимают положение на корточках, что облегчает
их состояние, так как в этих условиях, по-видимому, увеличивается
сопротивление в большом круге кровообращения, благодаря чему
возрастает лёгочный кровоток.
Аускулыпативно порок проявляется грубым пансистолическим
шумом с максимумом звучания в четвёртом межреберье слева от
грудины. II тон над лёгочной артерией ослаблен. На ЗЛТотмечают
признаки значительной перегрузки и гипертрофии правого желудочка, а
рентгенологически выявляют характерную конфигурацию сердца —
западание лёгочной артерии с высоко приподнятой и закруглённой
верхушкой сердца (в виде «голландского башмачка»), лёгочный
рисунок значительно обеднён. В боковых позициях определяют
выраженное увеличение правого желудочка. При зондировании катетер
не удаётся провести в лёгочную артерию, и он легко проходит из
правого желудочка в аорту. Контрастное вещество, введённое в правый
желудочек, попадает и в лёгочную артерию, и в аорту, причём
степень контрастирования этих сосудов зависит от величины
транспозиции аорты.
Продолжительность жизни больных тетрадой Фалло без
хирургического лечения определяется степенью кислородного голодания и в
среднем составляет около 10—14 лет.
Врожденные пороки сердиа и крупных сосудов ♦ 133
Лечение
Лечение только оперативное. Во время одышечно-цианотическо-
го приступа больному следует придать коленно-локтевое положение,
дать кислород, ввести тримеперидин и препараты, снижающие
сопротивление малого круга кровообращения. Радикальную коррекцию
порока выполняют в условиях искусственного кровообращения. Она
заключается в расширении выходного отдела правого желудочка (т.е.
в ликвидации препятствия оттока крови в малый круг) и закрытии
дефекта межжелудочковой перегородки с перемещением аорты в
левый желудочек. Операция сопровождается довольно высокой
летальностью в ближайшем послеоперационном периоде. Однако у
выживших, как правило, отдалённые результаты вполне оправдывают риск
вмешательства. Если тяжесть состояния больных или анатомические
особенности порока не позволяют выполнить его радикальную
коррекцию, применяют паллиативные операции. Смысл их заключается
в обогащении кровью малого круга кровообращения (создают
соустье между аортой и лёгочной артерией или между полыми венами и
лёгочной артерией). У части больных, кроме сужения собственно
выходного отдела правого желудочка, отмечают тяжёлое сужение
лёгочного ствола и его артерий вплоть до гипоплазии. Этим больным
можно выполнить только паллиативную операцию.
Коарктация аорты
Порок характеризуется врождённым сужением или полным
закрытием просвета аорты на ограниченном участке. Чаще всего (95%)
это сужение располагается в области перешейка аорты, под которым
понимают отрезок от левой подключичной артерии до первой пары
межрёберных артерий (рис. 29-9). Возможны и другие локализации
сужений — в восходящей, нисходящей грудной или брюшной аорте.
Коарктация аорты составляет до 30% всех врождённых пороков сердца.
Гемодинамическая сущность порока
Нарушения гемодинамики заключаются в затруднении тока
крови через суженный участок, в результате чего значительно возрастает
АД в аорте и её ветвях выше места сужения (до 200 мм рт.ст. и более).
Развивается синдром артериальной гипертензии в сосудах головного
мозга и верхней половины тела, что влечёт за собой систолическую
134 ♦ Хирургические болезни О- Том 2 ♦ Часть IV ♦ Глава 29
Рис. 29-9. Коарктация
аорты (схема): 1 — левая
внутренняя грудная
артерия; 2 — зона сужения;
3 — расширенные
межрёберные артерии.
перегрузку левого желудочка,
гипертрофию миокарда с последующей его
дистрофией. Последняя усугубляется
присоединением со временем коронарной
недостаточности. В итоге развивается тяжёлая
декомпенсация левого желудочка. Гипер-
тензия в системе сосудов мозга приводит
к появлению церебральных симптомов.
Ниже места сужения АД значительно
снижено, и кровоснабжение нижней части
тела осуществляется преимущественно за
счёт коллатерального кровообращения,
которое не всегда бывает достаточным.
Клиническая картина
и диагностика
Жалобы, как правило, отсутствуют. Лишь с достижением возраста
половой зрелости могут появиться общая слабость, головокружение,
головные боли, парестезии и зябкость ног. Диагностика заболевания
весьма простая: знание этой патологии и внимательное
обследование позволяют точно поставить диагноз в подавляющем
большинстве случаев. Отсутствие пульсации на артериях ног при постоянном
повышенном давлении в артериях верхних конечностей — патогно-
моничный признак коарктации аорты. При неполной окклюзии
просвета аорты в области коарктации пульсация на артериях ног может
сохраняться, но быть ослабленной, что подтверждается и
сниженным АД (у здорового человека АД на нижних конечностях на 20-
40 мм рт.ст. выше, чем на верхних). При осмотре, кроме
соответствующей формы тела (нередко атлетический тип сложения у мужчин,
пикнический — у женщин), можно заметить пульсацию
расширенных межрёберных артерий. Границы сердца, как правило,
расширены влево за счёт гипертрофии левого желудочка. При аускульта-
ции слышен систолический шум по всему левому краю грудины, а
также со стороны спины над проекцией сужения аорты, а иногда
и над расширенными, пульсирующими межрёберными артериями.
ЭКГ-данные у детей могут выявить лишь признаки систолической
перегрузки левого желудочка, у взрослых — его гипертрофию и
коронарную недостаточность, нередко с диффузными
изменениями миокарда.
Врожденные пороки сердца и крупных сосудов ♦ 135
На рентгенограммах определяют преимущественно аортальную
конфигурацию сердца за счёт расширения левого желудочка.
Характерный признак коарктации аорты — наличие узур нижнего края 3—
4-х пар рёбер. Узурация рёбер развивается вследствие деформации
кости в области нижней бороздки резко расширенными и извитыми
межрёберными артериями. Как пульсацию межрёберных артерий, так
и узурацию рёбер можно выявить при пальпации грудной клетки
больного. На томограмме обычно хорошо видно место сужения аорты.
Ангиокардиография показана в неясных случаях или при подозрении
на сочетание коарктации аорты с другими пороками. Наиболее
частые из них — открытый артериальный проток и стеноз устья аорты. В
более поздние сроки может развиться недостаточность аортального
клапана вследствие дистрофических изменений в основании
восходящей аорты.
Средняя продолжительность жизни неоперированных больных
25-30 лет. Наиболее частая причина смерти — внутричерепные
кровоизлияния, разрывы аорты, инфаркт миокарда, острая сердечная
недостаточность и инфекционный эндокардит.
Дифференциальную диагностику коарктации аорты следует
проводить с вегето-сосудистой дистонией, гипертонической болезнью,
вазоренальной гипертонией, другими пороками сердца и
заболеваниями почек, сопровождающимися артериальной гипертензией.
Наибольшее количество ошибок в распознавании этого порока связано с
забвением основных клинических проявлений заболевания,
недооценкой общих врачебных методов исследования, пренебрежением
к пальпации артерий конечностей, а также измерению АД на ногах и
сравнительной оценкой полученных данных.
Лечение
Лечение только оперативное. Идеальный вид операции,
особенно у растущих детей, — резекция суженного участка аорты с её
анастомозом по типу «конец в конец» (рис. 29-10). Однако такая
операция нередко невыполнима при выраженной протяжённости сужения
и тяжёлых склеротических изменениях стенки сосуда. В
подобной ситуации проводят протезирование аорты синтетическим
протезом, а также пластику места сужения синтетической заплатой
(рис. 20-11) или левой подключичной артерией. Части пациентов
можно выполнить баллонную дилатацию коарктации в условиях
рентгеноперационной.
136 ♦ Хирургические болезни ♦ Том 2 О- Часть IV ♦ Глава 29
Прогноз
Рис. 29-10. Наложение
анастомоза «конец в конец»
после резекции коаркта-
ции аорты.
Рис. 29-11. Непрямая ист-
мопластика грудной аорты
синтетической заплатой.
Результаты оперативного лечения в
значительной степени зависят от
возраста больного. Наилучшими они
оказываются у детей, оперированных в возрасте
до 3 лет, когда нет тяжёлых изменений
стенки аорты и межрёберных артерий,
а также имеются более благоприятные
условия для радикальной коррекции
порока, устранение которого обычно
приводит к нормализации АД. Операция у
взрослых значительно сложнее в
техническом отношении и, как правило, даёт
значительно менее выраженный
гипотензивный эффект, так как в генезе
артериальной гипертензии значительную роль
играют изменения в центральной
регуляции сосудистого тонуса и почечные
механизмы формирования гипертензии.
Вместе с тем, после устранения коарк-
тации артериальная гипертензия
становится «более управляемой»
медикаментозными средствами, что позволяет
предупредить развитие перечисленных выше
тяжёлых осложнений. Через 1,5—3
года после коррекции порока
артериальная гипертензия становится менее
выраженной. Таким образом, оперативное
лечение коарктации аорты у взрослых в
комплексе с антигипертензивной
медикаментозной терапией в
послеоперационном периоде позволяет значительно
продлить жизнь больных и улучшить её
качество.
ПРИОБРЕТЕННЫЕ
ПОРОКИ СЕРДЦА
К приобретённым относят группу пороков сердца, возникших как
осложнение какого-либо заболевания или в результате травмы. Они
характеризуются различными патологическими изменениями
клапанного аппарата, приводящими к расстройству функций органа и
всей системы кровообращения.
Чаще всего приобретённые пороки сердца формируются при
ревматизме. Стенозирующие поражения клапанного аппарата почти в
100% случаев бывают результатом течения ревматического процесса.
Вторая по частоте причина — инфекционный эндокардит, приводящий
к разрушению створок клапанов и формированию их
недостаточности. У 30-40% таких больных выявляют факторы,
предрасполагающие к развитию септического поражения, — наличие
предшествующих внутрисердечных патологических изменений (ревматический
порок, опухоль, дефекты перегородок и др.).
Значительно реже пороки сердца могут формироваться за счёт
ишемической болезни сердца (дисфункция сосочковых мышц иногда
приводит к формированию недостаточности митрального клапана),
дегенеративных изменений соединительной ткани (например,
синдромы Марфана, Элерса—Данло и др.), атеросклероза
(обызвествление фиброзного кольца аортального или, реже, митрального клапана
с формированием его стенотического поражения), тупой травмы
грудной клетки или ранения венечного сосуда.
Кроме органического поражения клапанов сердца, возможно
формирование относительной недостаточности, обусловленной
расширением фиброзного клапанного кольца в результате каких-либо
заболеваний (миокардита, гипертонической болезни) или вследствие ге-
модинамических нарушений, вызываемых пороками других клапанов.
Митральный стеноз
Порок характеризуется сужением левого атриовентрикулярного
отверстия вследствие срастания между собой створок
двустворчатого клапана, изменения подклапанных структур и фиброзной дегене-
138 О Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 30
рации клапанного кольца (рис. 30-1). Эти изменения создают
препятствия току крови из левого предсердия в левый желудочек, что
сопровождается уменьшением ударного и минутного объёмов
кровообращения. Митральный стеноз ведёт к возникновению синдрома
лёгочной гипертензии.
Основная причина возникновения митрального стеноза —
ревматизм. Стенозирование левого атриовентрикулярного отверстия
отмечают у 25% больных с заболеваниями сердца ревматического генеза.
Приблизительно у 40% пациентов формируется комбинированный
митральный порок — сочетание стеноза и недостаточности.
Рис. 30-1. Иссечённый
митральный клапан. Створки резко фиб-
розно изменены. Отверстие
митрального клапана щелевидное.
В толще створок — отложения
солей кальция.
К сужению левого атриовентрикулярного отверстия могут также
приводить опухоли (например, миксома), шаровидный тромб в
полости левого предсердия, крупные вегетации при инфекционном
эндокардите митрального клапана.
Классификация
Наиболее широкое распространение в России получила
классификация митрального стеноза, предложенная А.Н. Бакулевым и
Е.А. Дамир, Она включает пять стадий развития порока.
♦ I стадия — полная компенсация кровообращения. Больной не
предъявляет никаких жалоб, но при объективном обследовании
обнаруживают признаки, характерные для митрального стеноза.
Площадь митрального отверстия составляет 3—4 см2, размер левого
предсердия не более 4 см.
• II стадия — относительная недостаточность кровообращения.
Больной жалуется на одышку, возникающую при физической нагрузке,
выявляют признаки гипертензии в малом круге кровообращения,
несколько повышено венозное давление, однако выраженных
признаков недостаточности кровообращения нет. Площадь митрального
отверстия около 2 см2. Размер левого предсердия от 4 до 5 см.
• III стадия — начальная стадия выраженной недостаточности
кровообращения. Появляются признаки застоя в малом и большом
кругах кровообращения. Сердце увеличено в размерах. Венозное
давление значительно повышено. Отмечают увеличение печени.
Площадь митрального отверстия составляет 1 — 1,5 см2. Размер
левого предсердия 5 см и более.
• IV стадия — резко выраженная недостаточность кровообращения
со значительным застоем в большом круге. Сердце дилатировано,
печень больших размеров, плотная. Отмечают высокое венозное
давление, иногда небольшой асцит и периферические отёки. Для
этой стадии характерно появление мерцательной аритмии.
Терапевтическое лечение даёт временное улучшение. Митральное отверстие
менее 1 см2, размер левого предсердия превышает 5 см.
• V стадия соответствует терминальной дистрофической стадии
недостаточности кровообращения по В.Х, Василенко и Н.Д. Стражес-
ко. Отмечают выраженное увеличение размеров сердца, большую
печень, резко повышенное венозное давление, асцит, значительные
периферические отёки, постоянную одышку, даже в покое.
Терапевтическое лечение не даёт эффекта. Площадь митрального отверстия
менее 1 см2, размер левого предсердия более 5 см.
Клиническая картина
Основной жалобой больных митральным стенозом бывает
одышка как следствие уменьшения минутного объёма кровообращения и
нарушения механизма внешнего дыхания. Интенсивность её
находится в прямой зависимости от степени сужения митрального
отверстия. Сердцебиение — второй после одышки признак митрального
стеноза, представляет собой проявление одного из компенсаторных
механизмов, возникающих в ответ на недостаточность СВ.
Кровохарканье и отёк лёгких встречают реже, они возникают главным образом
при сочетании ревматического васкулита с выраженным застоем в
лёгочных венах и бронхиальных сосудах. Реже кровохарканье связано с
инфарктом лёгкого. Отёк лёгких обусловлен выраженной гипертен-
зией малого круга кровообращения в сочетании с левожелудочко-
вой недостаточностью. Возникающая при этом гипоксия приводит к
140 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV О* Глава 30
повышению проницаемости сосудистой стенки и проникновению
жидкой фракции крови в альвеолы. Кашель — частый признак
митрального стеноза, он обычно связан с застойным бронхитом. Боли в
области сердца — менее постоянный признак этого порока, они
появляются лишь при значительном увеличении левого предсердия,
сопровождающегося сдавлением левой венечной артерии. Общая
физическая слабость весьма характерна для митрального стеноза, она
бывает следствием хронической гипоксии организма, в частности
скелетной мускулатуры.
Диагностика
В типичных случаях отмечают бледность кожных покровов с
цианозом губ, щёк, кончика носа. Аускультативные данные весьма
характерны: «хлопающий», «пушечный» I тон, акцент и раздвоение II
тона над лёгочной артерией. Второй компонент этого тона
регистрируется в виде «щелчка». Диастолический шум с пресистолическим
усилением над верхушкой сердца — характерный аускультативный
признак митрального стеноза, если сохраняется синусовый ритм. При
тахикардии указанные аускультативные признаки могут
отсутствовать. Поэтому при обследовании больного необходимо добиться
уменьшения ЧСС (успокоить, придать больному горизонтальное
положение, возможно, прибегнуть к медикаментозным средствам),
после чего повторить аускультацию и фонокардиографию.
Рентгенологические признаки достаточно характерны: сердце
митральной конфигурации с резким расширением лёгочной артерии и
ушка левого предсердия, выраженный застой в сосудах лёгких
смешанного характера, в тяжёлых случаях — признаки гемосидероза. На
рентгенограмме в правой боковой проекции видно увеличение
правого желудочка с заполнением ретростернального пространства. Кон-
трастированный пищевод в этой проекции отклоняется по дуге
малого радиуса (до 6 см), что свидетельствует об увеличении левого
предсердия.
Характерные электрокардиографические признаки — отклонение
электрической оси сердца вправо, признаки гипертрофии правого
желудочка и левого предсердия, а также мерцательной аритмии в
более поздние стадии заболевания. Фонокардиографические
признаки, как правило, соответствуют данным аускультации. Весьма
характерны эхокардиографические данные, позволяющие с большой
точностью измерить митральное отверстие, составить представление о
Приобретенные пороки сердца <> 141
характере анатомических изменений клапана, распознать наличие
тромбоза левого предсердия и оценить функциональное
состояние сердца.
Лечение
Основной метод лечения больных с митральным стенозом
хирургический. Оперативное лечение показано пациентам во II—IV
стадиях заболевания. Больные в 1 стадии в операции не нуждаются.
Пациентам с V стадией митрального стеноза хирургическое лечение
абсолютно противопоказано, так как оно сопряжено с очень
высоким риском и не улучшает состояния больных из-за выраженных
органических изменений сосудов малого круга кровообращения,
миокарда и печени.
При митральном стенозе возможно выполнение как закрытых (т.е.
без использования искусственного кровообращения), так и
открытых (в условиях искусственного кровообращения) оперативных
вмешательств. При неосложнённом митральном стенозе чаще всего
выполняют закрытую митральную комиссуротомию. Операция
заключается в пальцевом или инструментальном расширении левого
венозного отверстия путём разделения сращений клапанных створок в
области комиссур. Закрытая митральная комиссуротомия может быть
выполнена из левосторонней или правосторонней торакотомии. При
левостороннем доступе хирург вводит палец в левое предсердие
через предсердное ушко и проводит ревизию митрального клапана.
Комиссуротомию выполняют инструментом, проводимым в левый
желудочек через прокол в верхушке сердца (рис. 30-2).
Рис. 30-2. Схема выполнения
закрытой инструментальной
митральной комиссуротомии
из левостороннего доступа.
142 -0- Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 30
Выполняя вмешательство из правостороннего доступа, палец и
инструмент подводят к митральному клапану через межпредсердную
борозду. Правосторонний доступ обеспечивает более удобный
переход к коррекции порока в условиях искусственного кровообращения.
Это необходимо при обширном кальцинозе митрального клапана,
наличии в левом предсердии тромба, неэффективности попыток
закрытой комиссуротомии, а также при возникновении выраженной
недостаточности клапана (II степень и более) после разделения ко-
миссур или повреждения клапанных структур.
Выполнение открытой митральной комиссуротомии заключается
в рассечении комиссур и подклапанных сращений стенозированно-
го митрального клапана под контролем зрения в условиях
искусственного кровообращения. При невозможности сохранения клапана
(тяжёлые подклапанные сращения, массивный кальциноз, признаки
активного инфекционного эндокардита), а также в случае
возникновения недостаточности митрального клапана после предшествующих
комиссуротомии выполняют его протезирование с использованием
искусственных или биологических протезов.
Один из возможных методов коррекции митрального стеноза при
его неосложнённом течении — чрескожная баллонная дилатация
клапана. Суть метода заключается в подведении к левому венозному
отверстию под рентгеновским и ультразвуковым контролем
специального баллонного катетера и его расширении посредством резкого
раздувания баллона. Это обеспечивает разделение створок клапана и
ликвидацию стеноза. Инструмент к митральному клапану может быть
доставлен через бедренную вену путём пункции межпредсердной
перегородки или через бедренную артерию и левый желудочек.
Прогноз
Результаты оперативного лечения неосложнённого
митрального стеноза в целом хорошие. Сразу же после операции больные
отмечают уменьшение одышки, постепенно исчезают явления
недостаточности кровообращения. Отдалённые результаты зависят от
исходного состояния больных и стадии порока, в которой предпринято
оперативное вмешательство. Они наилучшие, если операция
выполнена во II—III стадии, когда вторичные изменения во внутренних
органах, обусловленные недостаточностью кровообращения, носят
обратимый характер. Подавляющее большинство таких больных
возвращаются к своей прежней работе. Оперативное лечение в стадии
тяжёлых расстройств кровообращения с необратимыми
морфологическими изменениями внутренних органов (склеротическая фаза
лёгочной гипертензии, тяжёлые дистрофические изменения миокарда,
кардиальный цирроз печени и пр.) не позволяет добиться
достаточно полной реабилитации пациентов и стабильности достигнутых
результатов в отдалённые сроки.
Все больные, перенёсшие оперативное лечение, должны
находиться под наблюдением ревматолога и получать сезонное
противоревматическое лечение, так как сохраняется опасность развития
митрального рестеноза или формирования недостаточности
клапана, по поводу которых часто необходимо повторное оперативное
вмешательство.
Недостаточность митрального клапана
Сущность порока состоит в нарушении замыкательной функции
клапана вследствие фиброзной деформации створок, изменений под-
клапанных структур, дилатации фиброзного кольца или нарушения
целостности элементов митрального клапана (рис. 30-3), что
обусловливает возврат части крови во время систолы из левого
желудочка в предсердие (рис. 30-4). Эти нарушения внутрисердечной
гемодинамики сопровождаются уменьшением минутного объёма
кровообращения, развитием синдрома лёгочной гипертензии.
Митральная недостаточность иногда может возникнуть остро за счёт
травмы фиброзного кольца, створок и подклапанных структур во
время закрытой комиссуротомии; образования парапротезной фистулы
вследствие прорезывания швов, фиксирующих искусственный клапан,
или инфекционного эндокардита; ишемического повреждения
папиллярных мышц, обусловленного инфарктом миокарда, и т.д.
Рис. 30-3. Препарат митрального
клапана, иссечённого во время операции.
Створки разрушены с формированием
недостаточности клапана, видны
массивные вегетации.
144 ♦ Хирургические болезни <> Том 2 ♦ Часть IV О Глава 30
Класификация
С целью градации недостаточности
митрального клапана применяют
классификацию, основанную на величине
трансклапанной регургитации крови.
Выделяют три степени митральной
недостаточности.
• I степень — регургитация
невыраженная, обратный ток крови в систолу
желудочков определяют только у клапана.
• II степень — обратный ток крови
определяют в середине левого предсердия,
отмечают умеренное расширение
предсердия.
• III степень — струя регургитации
достигает задней стенки левого предсердия,
предсердие значительно дилатировано.
диагностика
При митральной недостаточности в отличие от митрального
стеноза одышка менее выражена и появляется в более поздние сроки
формирования порока. Кровохарканье возникает редко,
недостаточность кровообращения развивается значительно позже. На ЭКГ
обычно отсутствуют признаки изолированной гипертрофии правого
желудочка. Аускультативно и фонографически определяют
систолический шум с эпицентром звучания над верхушкой сердца,
распространяющийся в левую подмышечную область.
Клиническая симптоматика во многом связана со степенью
нарушения кровообращения, зависящей главным образом от объёма
регургитации крови из левого желудочка в предсердие, выраженности
лёгочной гипертензии и состояния сократительной функции миокарда.
С появлением тяжёлой недостаточности кровообращения
медикаментозная терапия становится неэффективной вследствие необратимых
изменений внутренних органов, прежде всего, сердца, возникающих в
результате его хронической перегрузки и ревматического кардита.
Рентгенологически характерен застой в лёгких по венозному типу.
При недостаточности митрального клапана левое предсердие
отклоняет пищевод по дуге большого радиуса (более 7 см), преобладает
Рис. 30-4. Схема гемодина-
мических нарушений при
митральной
недостаточности. В момент систолы
желудочка часть крови через
недостаточный
митральный клапан возвращается в
левое предсердие, вызывая
его постепенную дилатацию.
Клиническая картина и
Приобретенные пороки сердца ♦ 145
увеличение левого желудочка над правым. Характерно
систолическое увеличение (пульсация) тени левого предсердия, определяемое
при рентгеноскопии.
В диагностике недостаточности митрального клапана
существенную роль играет эхокардиография. Применение трансторакального и
чреспишеводного сканирований позволяет определить характер
патологических изменений клапана (инфекционный эндокардит, мик-
соматозная дегенерация и т.д.), оценить выраженность нарушений
внутрисердечной гемодинамики (степень регургитации, её характер).
Данные эхокардиографического исследования вместе с
клиническими проявлениями заболевания позволяют сформулировать
показания к хирургическому лечению.
Оперативное лечение
Показанием к хирургическому лечению митральной
недостаточности считают возникновение регургитации II—III степени.
Хирургическую коррекцию порока проводят в условиях искусственного
кровообращения, её задача — восстановление запирательной
функции митрального клапана. Чаще всего этого достигают
протезированием клапана (рис. 30-5) механическим или биологическим
протезом. При ограниченных изменениях клапана могут быть выполнены
клапаносохраняющие операции: шовная вальвулопластика или ану-
лопластика, сужение фиброзного
кольца специальным жёстким синтетическим
кольцом, восстановление подклапанных
структур, а также изолированное
протезирование створок клапана ауто- или ксе-
ноперикардом. Результаты
хирургического лечения недостаточности митрального
клапана в значительной степени зависят
от своевременности определения
показаний к оперативному лечению.
Аортальный стеноз
Порок заключается в фиброзной
деформации створок аортального
клапана и срастании их между собой в
области комиссур, что приводит к сужению
Рис. 30-5. Этап
протезирования митрального
клапана: после его иссечения
наложены швы на
фиброзное кольцо, фиксирующие
искусственный клапан.
146 О- Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 30
устья аорты, затруднению и уменьшению
выброса крови в неё левым желудочком
(рис. 30-6). Естественное течение
порока сопровождается хронической
систолической перегрузкой левого желудочка
с прогрессированием гипертрофии
миокарда и его дистрофией, усугубляющей
недостаточность кровообращения.
Основной причиной возникновения
стеноза клапана аорты бывает ревматизм,
второй по частоте этиологический фактор —
атеросклероз.
Клиническая картина
Клиническое течение аортального
стеноза характеризуется наличием
достаточно длительного скрытого периода, когда
пациенты практически не предъявляют
жалоб. Это обусловлено значительными компенсаторными
возможностями левого желудочка. Основная жалоба больных — одышка,
возникающая при физических нагрузках и нарастающая по мере прогресси-
рования порока. За счёт снижения СВ и, как следствие, ухудшения
кровоснабжения миокарда возникают боли в области сердца. В
дальнейшем присоединяются головокружение, обмороки, нарушения
ритма. Возможно развитие острой левожелудочковой недостаточности в
виде «сердечной астмы», отёка лёгких.
Верхушечный толчок обычно хорошо виден. При пальпации у
пациентов определяют систолическое дрожание. Лускультативно
аортальный стеноз проявляется грубым систолическим шумом с
эпицентром звучания над устьем аорты, распространяющимся в правую
подключичную область и на сосуды шеи. Электрокардиографические
данные всегда свидетельствуют о гипертрофии и перегрузке левого
желудочка, коронарной недостаточности (относительной или
вследствие сопутствующего поражения венечных артерий). Для
рентгенологической картины характерна аортальная конфигурация сердца за
счёт увеличения левого желудочка и выраженной талии сердца.
Нередко выявляют и постстенотическое расширение восходящей
аорты. Эхокардиографическое исследование позволяет визуализировать
морфологические изменения клапанного аппарата (характер стеноза,
Рис. 30-6. Иссечённый во
время операции клапан у
больного с аортальным
стенозом. Видны обызвеств-
лённые рыхлые вегетации.
Створки резко
обезображены, утолщены.
его выраженность, степень обызвествления створок), а также
определить параметры гемодинамики, оценить миокардиальные резервы
(рассчитать фракцию выброса, толщину стенок левого желудочка).
При наличии стеноза клапана аорты перед оперативным
вмешательством обязательно выполнение коронарографии, а также вентрикулог-
рафии левого желудочка.
Лечение
Показания к хирургическому лечению аортального стеноза:
появление одного или нескольких симптомов из характерной триады
(обмороки, ангинозные боли, сердечная астма), выявление кардио-
мегалии и выраженной перегрузки левого желудочка, наличие
систолического трансвальвулярного градиента давления более 50 мм
рт.ст. Оперативное лечение обычно заключается в протезировании
клапана в условиях искусственного кровообращения.
Аортальная недостаточность
Сущность порока заключается в нарушении замыкательной
функции аортального клапана в результате рубцовой деформации и
укорочения створок, повреждения или расширения фиброзного
кольца основания аорты, что приводит к возврату части крови в фазу
диастолы из аорты в левый желудочек. При этом пороке наряду с
уменьшением минутного объёма кровообращения возникает
постоянная объёмная перегрузка левого желудочка в сочетании с
коронарной недостаточностью. В отличие от аортального стеноза, при
котором кровообращение длительно остаётся компенсированным за
счёт гипертрофии левого желудочка, при аортальной
недостаточности декомпенсация кровообращения, как правило, наступает
довольно быстро в результате интенсивно прогрессирующей
дистрофии миокарда.
Следует отметить особенности течения остро развившейся
аортальной недостаточности. Полулунные клапаны аорты несут очень
большую функциональную нагрузку. В случае острого разрушения
створок из-за высокого диастолического градиента между восходящей
аортой и левым желудочком возникает значительная регургитация
крови в диастолу через несостоятельный клапан. При этом дилата-
ция левого желудочка возникает очень быстро, компенсаторные ме-
148 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 30
ханизмы включиться не успевают. В конце концов мощная объёмная
(диастолическая) перегрузка приводит к истощению миокардиаль-
ных резервов и развитию острой левожелудочковой недостаточности
с последующим отёком лёгких и быстрым летальным исходом. Как
правило, без хирургического лечения никто из пациентов с остро
развившейся аортальной недостаточностью не живёт более 1 года от
начала заболевания.
Наиболее частые жалобы на сердцебиение, одышку. В дальнейшем
присоединяются боли в области сердца. Возможны неприятные
ощущения усиленной пульсации сосудов шеи и конечностей, а также
головокружение, обмороки.
При осмотре заметны бледность кожных покровов, синхронное с
пульсацией сонных артерий сотрясение головы (симптом де Мюс-
си), усиленная пульсация сонных артерий («пляска каротид»). Аус-
культативно недостаточность аортального клапана проявляется
преимущественно диастолическим шумом под устьем аорты и на
верхушке сердца, а также ослаблением II тона над аортой. При
выслушивании периферических сосудов (бедренной артерии) могут
определяться двойной тон Траубе и двойной шум Дюрозье. Характерным
клиническим признаком гемодинамически значимой аортальной
недостаточности служит увеличение пульсового АД за счёт выраженного
уменьшения диастолического и умеренного повышения
систолического давления. Диастолическое АД при этом может снижаться до
нуля, что свидетельствует о тяжёлой недостаточности аортального
клапана. Электрокардиографическая картина характеризуется
выраженной гипертрофией левого желудочка с явлениями нарушения
трофики миокарда. Рентгенологические данные дают представление об
аортальной конфигурации сердца, а также нередко свидетельствуют
о застое в малом круге кровообращения. Эхокардиографическое
исследование: гипертрофия миокарда, дилатация левого желудочка,
расширение аорты. Возможна визуализация морфологических
изменений клапана (вегетации, перфорации, разрыв, пролабирование), а
также определение степени регургитации.
Лечение
Основной метод хирургического лечения пороков клапана
аорты — протезирование. В настоящее время широко используют как
механические, так и биологические протезы. В последнем случае
применяют каркасные или бескаркасные модели (ксеноаортальные
Приобретенные пороки сердиа ♦ 149
ондуиты). Биологические клапаны наиболее часто имплантируют
пациентам пожилого возраста, так как их гемодинамические
свойства несколько лучше. Кроме того, у этой категории больных они в
меньшей степени подвергаются обызвествлению и дегенеративным
изменениям, при имплантации таких протезов не требуется
проведения пожизненной антикоагулянтной терапии. В ряде случаев,
особенно у детей, возможно изолированное протезирование отдельных
створок аортального клапана ауто- или ксеноперикардом.
Коррекцию пороков аортального клапана осуществляют в
условиях искусственного кровообращения, холодовой и
фармакологической кардиоплегии.
Прогноз
Результаты оперативного лечения зависят от сроков
вмешательства, наилучшими они бывают в случаях выполнения вмешательства
до развития тяжёлых дистрофических изменений миокарда и других
органов. В случае протезирования клапанов сердца искусственными
протезами больные должны находиться под наблюдением
кардиолога. Таким пациентам показана профилактика инфекционного
эндокардита, включающая мероприятия, уменьшающие возможность
контаминации инфекции, а также превентивный приём
антибактериальных препаратов широкого спектра действия при
возникновении потенциально опасных состояний и манипуляций (острые
респираторные инфекции, инвазивные стоматологические и
эндоскопические манипуляции и др.).
Всем больным, перенёсшим протезирование клапана сердца
искусственным протезом, пожизненно назначают приём
антикоагулянтов (варфарин), дозировку которых подбирают, ориентируясь
на показатели свёртывающей системы крови (так называемое
международное нормализованное отношение, характеризующее
уровень протромбина в крови, необходимо поддерживать в пределах
2,0-2,6).
Пороки трёхстворчатого клапана
Длительное время считали, что пороки трёхстворчатого
клапана — большая редкость. Между тем, по данным ряда исследователей,
они составляют до 25% всех приобретённых пороков сердца.
150 ♦ Хирургические болезни ♦ Том 2 Ф- Часть IV -0- Глава 30
Клиническая картина и диагностика
Больные предъявляют жалобы на одышку при физической
нагрузке, боли в области сердца. Наиболее типичным симптомом служит
ощущение тяжести в правом подреберье вследствие повышенного
кровенаполнения и увеличения печени. При осмотре отмечают
расширение и пульсацию шейных вен. Выявление аускультативной
симптоматики затруднено из-за невыраженности звуковых феноменов.
Вместе с тем, при тщательном выслушивании у основания
мечевидного отростка определяют диастолический шум при стенозе,
систолический шум — при недостаточности трёхстворчатого клапана.
Интенсивность шумов часто связана с дыханием — усиливается на вдохе.
Для электрокардиографической картины характерны гипертрофия и
перегрузка правых камер сердца. При рентгенологическом
исследовании выявляют увеличение правых отделов, уменьшение нижнего
отдела ретрокардиального пространства, выбухание лёгочной
артерии. Ценный метод исследования — эхо кардиография, позволяющая
оценить как морфологические изменения трёхстворчатого клапана,
так и нарушения гемодинамики в правых отделах сердца.
Оперативное лечение
Особенности анатомического строения трикуспидального
клапана позволили разработать широкий спектр оперативных
вмешательств на нём. Они включают как различные пластические и клапа-
носохраняющие операции (рис. 30-7), так и замену клапана
искусственным протезом. Показания к протезированию клапана —
резкая деформация створок клапана, массивные разрушения, не
позволяющие выполнить клапаносохраняющую коррекцию,
неэффективная аннулопластика, значительная дилатация правого желудочка.
Учитывая низкую скорость кровотока в правых отделах сердца, при
протезировании трикуспидального клапана особенно важно
пожизненное проведение антикоагулянтной терапии. Погрешности в приёме
непрямых коагулянтов могут повлечь тромбоз искусственного протеза.
Проблема инфекционного эндокардита
Последние десятилетия характеризуются возрастанием частоты
инфекционного эндокардита. Заболеваемость увеличивается при
ухудшении социально-бытовых условий жизни. По данным эпиде-
Рис. 30-7. Пластические вмешательства при трикуспидальных пороках
сердца: а — пластика клапана по Бойду (бикуспидализация); б — аннулоп-
ластика клапана опорным кольцом по Карпентье; в — аннулопластика по
Амосову.
миологических исследовании, септический эндокардит встречают в
17-25 случаях на 1 млн жителей в год. Протезирование клапанов
сердца, открыв новую эру в лечении больных врождёнными и
приобретёнными пороками сердца, вместе с тем привело к возникновению
различных осложнений, наиболее опасное из них — инфекционный
эндокардит клапанных протезов. Даже в лучших кардиохирургичес-
ких клиниках это осложнение возникает в 1—4% случаев.
Для развития заболевания необходимы исходное повреждение
эндокарда, бактериемия и снижение иммунологической
резистентности организма.
Повреждение эндокарда может быть вызвано следующими
факторами:
• длительным нахождением катетера в центральной вене;
• струёй регургитации крови при врождённых пороках сердца;
• ревматическим поражением эндокарда;
• внутривенным применением наркотических средств (введением
взвеси инородных частиц);
• циркуляцией в кровотоке микробных токсинов и вирусов.
Если на изменённый эндокард попадают микроорганизмы,
инфекционный эндокардит развивается с большой долей вероятности. При-
152 О- Хирургические болезни -О Том 2 ^ Часть III О Глава 24
чинами бактериемии могут быть эндогенные инфекционные очаги
(хронический периодонтит, тонзиллит, гайморит, фурункулёз, дис-
бактериоз кишечника и др.), госпитальная инфекция (нагноение ран,
катетерный сепсис, использование нестерильных растворов),
острые респираторные заболевания. Бактериемия может возникать и у
совершенно здоровых людей (например, после чистки зубов,
постановки клизмы), но различные операции и инвазивные лечебные
процедуры в значительной степени увеличивают её частоту и
интенсивность. Катетеры в центральных венах инфицируются приблизительно
в 10% наблюдений, причиной сепсиса они становятся
приблизительно в 2,5 % случаев.
Важную роль в развитии инфекционного эндокардита играет
состояние иммунной системы организма. Её ослабление в результате
переохлаждения, плохого питания, стрессов может способствовать
развитию инфекционного эндокардита.
Диагностика
Диагностика инфекционного эндокардита, особенно на ранних
этапах развития заболевания, крайне сложна. Именно поэтому
ранние стадии заболевания, когда возможен хороший эффект
консервативной терапии или выполнение клапаносохраняющих операций,
чаше всего бывают упущенными. Вот почему у 40% больных
поражение сердца инфекционным процессом остаётся длительное время
нераспознанным или не диагностируется вообще.
Основные клинические проявления инфекционного эндокардита
включают три группы симптомов.
• Проявления инфекционно-септической интоксикации: лихорадка,
озноб, слабость, потливость, артромиалгии.
• Нарушение гемодинамики вследствие поражения клапанного
аппарата и миокарда.
• Специфические осложнения: тромбоэмболии, гломерулонефрит,
вас кул и т.
За последние десятилетия клиническая картина инфекционного
эндокардита существенно изменилась. У части пациентов
классические симптомы могут отсутствовать. В последние десятилетия всё
большее значение приобретают новые (неклассические) формы этого
заболевания. К ним можно отнести инфекционный эндокардит правых
камер сердца нозокомиальной природы (катетерный, после
имплантации электрокардиостимуляторов, при системном гемодиализе и др.)
Приобретенные пороки сердца <> 153
или возникающий у наркоманов, инфекционный эндокардит
клапанных протезов, абсцессы сердца.
Диагностика инфекционного эндокардита основывается на
подтверждении инфекционной природы заболевания и верификации
внутрисердечных поражений. Бактериологическая верификация
заболевания очень важна, поэтому необходимо соблюдать следующие
правила исследования больных с подозрением на это заболевание.
• Обязательный посев артериальной и венозной крови.
• Забор крови осуществляют до начала активной антибактериальной
терапии.
• Количество посевов — от 3 до 7 раз и отдельно на высоте лихорадки
и озноба.
• Использование умеренной физической нагрузки при отсутствии
противопоказаний (переход из положения лёжа в положение сидя
3-5 раз) перед забором крови.
• Бактериологическое исследование операционного материала.
Такой подход позволяет получить положительные результаты
исследования гемокультуры у 85% больных инфекционным
эндокардитом.
Из инструментальных методов диагностики наибольшее значение
на современном этапе получила эхокардиография. С её помощью
можно изучить состояние морфологических структур сердца, что
значительно улучшило выявление основных признаков инфекционного
эндокардита: вегетации и внутрисердечных абсцессов. В настоящее
время возможности метода расширились за счёт чреспищеводной и
внутрисердечной эхокардиографии.
Хирургическое лечение
Несмотря на успехи консервативного лечения хирургических
инфекций, в последние годы при ряде форм септического эндокардита
летальность достигает 80 и даже 100%. Это обусловлено
изменениями структуры заболевания. Современное его лечение немыслимо без
хирургического вмешательства. Основная тенденция — раннее
хирургическое вмешательство на сердце до развития тяжёлых
осложнений. Показания к хирургическому лечению инфекционного
эндокардита следующие.
• Острое разрушение клапанов сердца.
• Артериальные тромбоэмболии (их опасность или рецидивирование).
154 ^ Хирургические болезни О Том 2 ♦ Часть IV -О Глава 30
• Признаки формирования абсцесса сердца.
• Грибковый эндокардит.
• Инфекционный эндокардит клапанного протеза (в том числе
возникновение гемодинамически значимой параклапанной
недостаточности).
• Внутрисердечные и внутрисосудистые очаги инфекции вследствие
ранений сердца и крупных сосудов.
• Неэффективность этиотропной антибактериальной терапии в
течение 3 нед.
Во время операции хирург должен провести санацию камер
сердца и коррекцию нарушений внутрисердечной гемодинамики.
Различают механические, химические и физические методы санации.
• Механическая санация заключается в максимально возможном
удалении вегетации, иссечении поражённых и разрушенных
инфекционным процессом внутрисердечных структур и образований
(клапанов, вегетации пристеночного эндокардита, инфицированных
тромбов и кальциевых конгломератов, абсцессов и т.д.).
• Химическая санация предполагает обработку камер сердца
антисептиками.
• Физическая санация осуществляется путём обработки недоступных
иссечению тканей низкочастотным ультразвуком.
В каждом конкретном случае техника и объём санации камер
сердца индивидуальны. Однако общим при её выполнении должно быть
стремление к максимальной радикальности.
Наиболее частым вариантом коррекции нарушений
внутрисердечной гемодинамики остаётся операция протезирования клапанов. К её
особенностям относят необходимость тщательного иссечения
инфицированных и разрушенных тканей, а также оставление тканей, из
которых затем будет сформирована опора для клапанного протеза,
функционально более выгодным для больного вариантом служит
клапаносохраняюшая операция. Пластические вмешательства чаще
возможны при поражении трёхстворчатого клапана. В среднем такие
операции возможны у 10% больных.
Профилактика рецидива инфекционного эндокардита
Профилактику можно разделить на раннюю и отдалённую. К
ранней профилактике относят особенности техники оперативного
вмешательства, заключающиеся в щадящем отношении к тканям, низ-
Приобретенные пороки сердца ♦ 155
кой травматичности операции, тщательной санации камер сердца,
использовании серебра и антибиотиков в оплётке протеза. Большое
значение имеет своевременная и адекватная коррекция сердечной и
дыхательной недостаточности, анемии, гипопротеинемии.
Профилактика и своевременное лечение нагноения операционной раны и
других гнойных осложнений, применение антибиотиков в
адекватных дозах и соблюдение необходимой продолжительности их
использования также играют важную роль в предупреждении
инфекционного эндокардита после операций на сердце.
Пациентов, перенёсших инфекционный эндокардит и, тем более,
оперативное лечение по поводу этого заболевания, относят к группе
риска по развитию рецидива. В связи с этим в отдалённые сроки
необходимо проводить профилактику рецидива заболевания при
различных инвазивных процедурах, вызывающих бактериемию
(стоматологические процедуры, эндоскопия и др.).
^1 MU&fl ПЕРИКАРДИТЫ
Перикардит — воспаление серозных оболочек околосердечной
сумки, характеризующееся появлением экссудата в её полости с
возможным образованием сращений и их рубцовым перерождением.
Основные черты патологии
В норме в полости перикарда, выстланной изнутри мезотелием,
всегда есть незначительное количество жидкости (не более 30 мл).
Развитие перикардита вследствие воздействия повреждающего серозную
оболочку фактора (возбудителя инфекции, аллергена, токсических
метаболитов и пр.) нарушает обычное функционирование
околосердечной сумки и внутриперикардиальную циркуляцию жидкости.
Чрезмерное кровенаполнение (гиперемия) серозной оболочки и
выпадение плазменного белка на её поверхности изменяют соотношение
образования и резорбции перикардиальной жидкости. Экссудация
значительно преобладает над всасыванием. В перикардиальной щели
начинает скапливаться жидкость, содержащая фибрин и форменные
элементы крови. Так возникает выпотной (экссудативный) перикардит.
При медленном накоплении экссудата в околосердечной сумке
более интенсивно растягивается её левая боковая стенка. Если темп
образования экссудата опережает перестройку перикарда и
расширение его полости, жидкость скапливается больше справа от сердца
и над диафрагмой. В такой ситуации может возникнуть острое
состояние, приводящее к резкому падению насосной функции сердца,
— так называемая тампонада сердца. При относительно небольшой
скорости экссудации и незначительном количестве выпота, богатого
фибриногеном, происходит выпадение фибрина на серозных
листках, преимущественно на верхушке сердца и эпикарде. Возможно
формирование целого пласта фибриноидной массы, окружающего
сердце в виде капюшона. В последующем происходят организация
экссудата, образование рубцовой ткани с частичным или полным
сращением листков перикарда и облитерацией его полости — слип-
чивый перикардит.
Значительная инфильтрация серозных оболочек (на всю глубину)
приводит к рубцовым изменениям листков околосердечной сумки,
что чревато иммобилизацией сердца вследствие сращения эпикарда
и перикарда, превращающихся в единую сдавливающую оболочку —
констриктивный перикардит.
Иногда в полости перикарда может скапливаться жидкость
невоспалительного характера. При тяжёлых декомпенсированных
заболеваниях сердца с выраженной недостаточностью кровообращения в
полости перикарда, как и в других серозных полостях,
накапливается транссудат — развивается гидроперикард. Патология
лимфатической системы перикарда (лимфангиэктазии с нарушением
целостности их стенок, реже — травмы грудного лимфатического протока)
может привести к скоплению лимфы с развитием хилоперикарда.
Инфицирование скопившегося содержимого вызывает развитие
гнойного перикардита.
Патоморфология
Морфологические изменения перикарда зависят от остроты
воспаления серозных оболочек, интенсивности и выраженности экссу-
дативных и пролиферативных процессов. При умеренной
интенсивности экссудации, сохранении всасывательной способности по
отношению к воде, электролитам и мелкодисперсным белкам
основные изменения перикарда и эпикарда проявляются гиперемией,
набуханием и десквамацией мезотелия. Наложения фибрина
умеренные, но по мере прогрессирования процесса их количество может
возрастать. Тяжи фибрина располагаются между листками
околосердечной сумки, соединяя их так, что при отделении перикарда от
эпикарда сердце имеет вид «ворсинчатого» или «волосатого» (corvillosum).
Если интенсивность экссудации более значительна, в полости
околосердечной сумки начинает накапливаться жидкий выпот,
содержащий пласты слущенного мезотелия, клетки крови, хлопья фибрина.
При гнойном перикардите наряду с клетками, клеточным детритом
и хлопьями фибрина в выпоте обнаруживают различные
микроорганизмы и простейших, патогенные грибы, гистоплазмы.
Организация выпота с последующим рубцеванием может
завершиться обызвествлением и оссификацией рубцовой ткани
(особенно часто при туберкулёзном перикардите). Очаги таких изменений
могут располагаться не только в перикарде, но и в эпикарде в местах
наибольшей выраженности воспалительной инфильтрации (венечная
158 О Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 31
борозда, диафрагмальная поверхность сердца). Иногда они
охватывают всё сердце, создавая как бы костный панцирь («панцирное
сердце»), и могут распространяться до эндокарда. Толщина рубцово-из-
вестковых образований в этих случаях может доходить до 1—2 см.
Рубцово-изменённые и сросшиеся листки перикарда и эпикарда,
пропитанные солями кальция, препятствуют нормальным сердечным
сокращениям, ограничивая их амплитуду как в систолу, так и в
диастолу. Постепенно развивается иммобилизация сердца, его насосная
функция осуществляется только за счёт движений межжелудочковой
перегородки.
Классификация
Характер перикардита:
• острый:
— экссудативный (выпотной);
— сухой (фибринозный);
• хронический:
— экссудативный;
— слипчивый;
— сдавливающий (констриктивный).
Природа заболевания:
• инфекционный неспецифический:
— бактериальный (стафилококковый, стрептококковый,
анаэробный, менингококковый, брюшнотифозный);
— вирусный;
— риккетсиозный;
— грибковый;
— протозойный;
• инфекционный специфический:
— туберкулёзный;
— сифилитический;
• инфекционно-аллергический, аллергический или аутоиммунный
(ревматический, волчаночный, склеродермический, ревматоидный,
лекарственный);
• токсический:
— уремический;
— подагрический;
— панкреатический и др.;
Перикардиты ♦ 159
• опухолевый (при опухолях лёгкого, плевры, средостения,
лимфогранулематозе);
• лучевой (при лучевой болезни, местной лучевой терапии);
• постинфарктный;
• посттравматический (после ранений сердца, перикарда и
хирургических вмешательств).
Характер экссудата:
• серозный;
• серозно-фибринозный;
• гнойный;
• гнилостный;
• хилёзный.
Осложнения:
• тампонада сердца;
• недостаточность кровообращения.
Клиническая картина
Клиническая симптоматика острого перикардита обусловлена
нарушениями гемодинамики, имеющими экстракардиальную
(тампонада сердца) или миокардиальную (изменения самой сердечной
мышцы) природу, раздражением нервных окончаний листков
околосердечной сумки и общими проявлениями воспалительного
процесса. Эти симптомы могут быть малозаметными на фоне
основного заболевания, особенно если оно носит системный характер
(ревматизм, коллагенозы, туберкулёз) либо когда перикардит возникает
в связи с очагами инфекции, локализованными рядом с сердцем (ме-
диастинит, эмпиема плевры, абсцессы в окружающих сердце
органах) или в самом миокарде.
Для распространённого по серозным оболочкам фибринозного
перикардита характерны давящие боли в области сердца постоянного
характера, не купируемые нитратами. Интенсивность кардиалгии
меняется при дыхательных движениях, поворотах туловища, но не
зависит от физической нагрузки. Боли усиливаются при
надавливании рукой или фонендоскопом на грудину больного. Иногда эти боли
появляются при глотании, сопровождаясь разнообразными
ощущениями, вплоть до дисфагии.
Второй кардинальный симптом фибринозного перикардита — шум
трения перикарда, выявляемый у трёх четвертей больных этой фор-
160 ♦■ Хирургические болезни ♦ Том 2 О- Часть IV ♦ Глава 31
мой заболевания. Он носит непостоянный характер,
синхронизирован с сокращениями сердца и не исчезает при задержке дыхания. Шум
локализован в зоне абсолютной сердечной тупости, плохо
проводится за её пределы и так же, как и боль в прекардиальной области,
может усиливаться при надавливании фонендоскопом на зону аускуль-
тации. Если болевой синдром отсутствует, на первый план выступают
симптомы интоксикации (слабость, недомогание, повышение
температуры тела), а об изменениях перикарда свидетельствует шум
трения перикарда в сочетании с данными специальных исследований.
Клиническая картина выпотного перикардита определяется
выраженностью и распространённостью воспалительных изменений
в перикарде, темпом накопления экссудата и его количеством,
нарушением функций органов, окружающих сердце (лёгких, трахеи,
пищевода), впадающих в сердце крупных сосудов, особенно полых вен.
Для экссудативного перикардита характерны отставание в
дыхании левой половины грудной клетки, выпячивание надчревной
области, расширение подкожных вен шеи и верхней половины
туловища. Даже при крайних степенях расширения яремных вен их
пульсация отсутствует.
Стойкая, резистентная к проводимому лечению тахикардия
сочетается с парадоксальным пульсом (снижение наполнения и даже
полное исчезновение пульса на вдохе). Верхушечный толчок ослаблен,
при большом объёме выпота в перикарде он определяется выше, чем
обычно (в III—IV межреберье). Отмечают несоответствие между
относительно удовлетворительным наполнением пульса и
значительным ослаблением верхушечного толчка. Площадь сердечной тупости
расширена как вправо (до среднеключичной линии), так и влево (до
средней подмышечной линии). Сердечная тупость сливается с
печёночной, а границы абсолютной и относительной тупости совпадают.
Тоны сердца умеренно ослаблены, отмечают снижение
систолического АД при возрастании венозного давления (до 30—40 см вод.ст.),
увеличиваются размеры печени, главным образом левой доли,
появляются признаки асцита, обычно предшествующие появлению
отёков нижних конечностей. При значительном выпоте в
околосердечной сумке выявляют симптомы сдавления соседних органов: дисфагию,
упорный кашель, одышку (возможен ателектаз нижней доли левого
лёгкого). Одновременно отмечают укорочение лёгочного звука над
левым лёгким с усилением голосового дрожания или бронхофонии
в левой подлопаточной области, которое исчезает в коленно-локте-
вом положении.
Перикардиты *<> 161
Тампонада сердца может произойти и при относительно
небольшом объёме выпота (до 400 мл), когда перечисленные клинические
признаки скопления жидкости в перикарде могут отсутствовать. В
основе этого грозного осложнения перикардита лежит быстрое
возрастание внутриперикардиального давления. Характерные признаки
тампонады сердца — падение артериального и быстрое нарастание
венозного давления. У таких больных наряду с давящими болями в
области сердца появляется чувство страха смерти. Для облегчения
своего состояния пациенты занимают вынужденное положение: сидя
с наклоном туловища вперёд или полулёжа. Кожа бледная, покрыта
холодным потом. Нарастает цианоз губ и лица, вены шеи
расширены, но не пульсируют. Пульс малый, едва прощупывается, частый,
носит парадоксальный характер, систолическое и пульсовое АД
снижено. Печень увеличена, резко болезненна. Вследствие
критического падения СВ возникают симптомы нарушения мозгового
кровообращения, и лишь неотложные мероприятия по эвакуации выпота из
полости перикарда позволяют спасти жизнь больного.
Наиболее характерные проявления слипнивого перикардита (без
сдавления сердца) включают колющие или режущие боли в области
сердца, возникающие при неловких движениях, сердцебиение с
резкой лабильностью пульса и АД. При осмотре больного обращает
внимание отсутствие признаков недостаточности кровообращения, а
анамнестические данные свидетельствуют о перенесённом
фибринозном или выпотном перикардите той или иной природы.
Сдавливающий перикардит возникает, когда доминирующий фиб-
ропластический процесс в оболочках околосердечной сумки
приводит к их резкому утолщению и сморщиванию. Иммобилизация
сердца может возникать как на фоне продолжающегося
воспалительного процесса, так и при развитии Рубцовых изменений и кальциноза.
В отличие от слипчивого перикардита, протекающего без
сдавления сердца и полых вен, при констриктивном перикардите
клиническую картину определяют нарушения кровообращения в связи с
иммобилизацией сердца. В основе этих нарушений лежит не просто
сдавление сердца утолщённым и рубцово изменённым перикардом,
а именно нарушение его подвижности за счёт сращений между
изменённым эпикардом и склерозированным, нередко
кальцинированным перикардом, что ограничивает как диастолу, так и систолу
желудочков. Иммобилизация предсердий, сдавление устьев полых
и печёночных вен играют в генезе нарушений кровообращения
менее значимую роль.
162 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 31
В начальной стадии больные всегда однотипно реагируют на
физическую нагрузку появлением одышки и тахикардии, снижением
системного АД, но ортопноэ для них не характерно. Венозный застой
характеризуется стойким набуханием шейных вен, одутловатостью
лица, увеличением печени, повышением венозного давления. В
развёрнутой стадии сдавливающего перикардита одышка носит
постоянный характер, появляется пульсация яремных вен, выявляют
стойкую венозную гипертензию до 30 см вод.ст. Отмечают тенденцию к
системной артериальной гипотензии с сохранением обычного
уровня диастолического давления. Тахикардия сменяется пароксизмами
мерцательной аритмии с последующим переходом её в постоянную
форму. Тоны сердца становятся лабильными, резко увеличивается
печень, и появляется асцит, не возникающий так рано ни при каком
другом варианте недостаточности кровообращения. В дальнейшем
наряду с асцитом и выпотом в плевральных полостях возникают
массивные периферические отёки, лимфостаз нижних конечностей,
дистрофические изменения внутренних органов, гипопротеинемия. При
прогрессировании гипопротеинемии и гипоальбуминемии (ниже
20 г/л) болезнь переходит в дистрофическую стадию.
Клиническое течение
Развитие фибринозного перикардита зависит от этиологических
факторов и условий возникновения воспалительного процесса в
оболочках околосердечной сумки. Особенно длительное течение
свойственно туберкулёзному перикардиту, по ходу его развития
возможны повторные обострения и периоды стихания воспаления, когда
сохраняется лишь шум трения перикарда. При благоприятном
течении асептического перикардита (при инфаркте миокарда,
ревматизме) он иногда может закончиться полным выздоровлением в течение
1—2 нед, не оставив никаких следов, но чаще трансформируется в
слипчивый перикардит.
Исчезновение ярких клинических проявлений заболевания может
свидетельствовать не только о разрешении воспалительного процесса
в околосердечной сумке, но и о накоплении в ней выпота. Течение
выпотного перикардита всегда длительное (недели, месяцы), что
определяется этиологией заболевания, выраженностью и глубиной
воспалительных изменений. Лишь в лёгких случаях может произойти
полное рассасывание выпота, но часто в результате его организации
происходит сращение листков перикарда (частичное или полное) либо
Перикардиты ♦ 163
развивается сдавление сердца. Иногда возможно изменение характера
выпота: при проникновении в перикардиальную полость гноеродной
флоры серозно-фибринозный выпот превращается в гнойный. Чаще
всего возникновение гнойного перикардита определяется
поступлением инфекции извне (раневой, послеоперационный перикардит) либо
из очагов, расположенных рядом с околосердечной сумкой
(пневмония, пиопневмоторакс, гнойный медиастинит или перитонит,
абсцессы печени и др.), либо из отдалённых регионов (гематогенным или
лимфогенным путём) с развитием септического перикардита. У таких
больных не только более выражены клинические проявления
поражения перикарда и быстрота развития критического состояния, но и в
значительно большей степени выражены признаки системной
воспалительной реакции: лейкоцитоз, увеличение СОЭ, анемия и пр.
Диагностика
На ранних стадиях перикардита большое значение имеет
сопоставление данных физикального обследования с анамнестическими
сведениями. Упоминания о туберкулёзе, ревматизме, полисерозите
при больших коллагенозах, травме области сердца или лучевой
терапии в этой зоне позволяют обоснованно заподозрить воспаление
околосердечной сумки.
Результаты лабораторных исследований крови позволяют
конкретизировать остроту воспалительного процесса. Обязательно
проведение серологических исследований, в том числе и с
туберкулёзным антигеном.
Клиническое обследование и результаты простых
инструментальных исследований (запись ЭКГ) предоставляют достаточно
оснований для постановки диагноза. Электрокардиографические изменения
характерны для субэпикардиальной ишемии в виде конкордантного
смещения интервала S-T, изменения зубца Т (уплощённый или
отрицательный). По мере накопления выпота наблюдают снижение
вольтажа зубцов ЭКГ, выраженную электрическую альтернацию.
Характерны для сдавливающего перикардита пароксизмальные
нарушения ритма — мерцание или трепетание предсердий.
Рентгенологически при выпотном перикардите выявляют
увеличение размеров сердечной тени в поперечнике, укорочение
сосудистого пучка. Изменяется силуэт сердца: он становится симметричным,
талия сглаживается, отмечают расширение границ вправо. Сердеч-
164 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 31
ная тень закруглена и напоминает кисет или напряжённый мешок,
форма которого приближается к шаровидной. Пульсация контуров
сердечной тени ослаблена. Применение эхокардиографии позволяет
определить объём экссудата в околосердечной сумке. При этом
выявляют симптом «плавающего сердца».
КТи МРТ не только позволяют выявить увеличение размеров тени
сердца и наличие жидкости в полости перикарда, но также дают
возможность уточнить характер содержимого полости (жидкость или
фиброзная ткань), толщину и плотность сдавливающих оболочек.
Пункция перикарда с удалением выпота и последующим
введением газа в его полость, а также рентгенологическое исследование на фоне
пневмоперикарда позволяют оценить истинные размеры сердца,
состояние серозных поверхностей, наличие фибринозных наложений.
Дифференциальная диагностика
Боли в области сердца при фибринозном перикардите,
усиливающиеся при глотании и приводящие к боязни приёма пищи, могут
послужить основанием для предположения о наличии кардиоспазма,
грыжи пищеводного отверстия и даже новообразования пищевода.
При большом объёме экссудата в полости перикарда необходимо
проводить дифференциальную диагностику с декомпенсированными
ревматическими многоклапанными пороками, гипертрофической и
дилатационной кардиомиопатией, диффузными миокардитами, ише-
мической болезнью сердца с развитием постинфарктной аневризмы
сердца.
Лечение
Консервативная медикаментозная терапия с использованием
антибактериальных и противовоспалительных препаратов играет
существенную роль при фибринозном и выпотном перикардитах с
небольшим количеством экссудата. Тампонада сердца — показание к
неотложной пункции полости перикарда, не только служащей
основной мерой неотложной помощи таким больным, но и позволяющей
уточнить этиологию заболевания. Пункцию целесообразно завершать
дренированием полости перикарда для проведения локальной
антибактериальной, фибринолитической и противовоспалительной
терапии. При значительном скоплении гноя в околосердечной сумке.
признаках сепсиса показана
экстраплевральная перикардиостомия с
последующей санацией околосердечной сумки.
Сдавливающий перикардит — прямое
показание к хирургическому лечению
(учитывая прогрессирование
заболевания и бесперспективность
консервативной терапии). Оперативное вмешательство
предусматривает выполнение
субтотальной перикардэктомии —
последовательного освобождения левого желудочка, затем
устья лёгочного ствола, аорты, правого
желудочка и устьев полых вен от фиб-
розно-кальциевой капсулы (рис. 31-1).
Такая очерёдность предупреждает в
период операции перегрузку правых
отделов сердца и развитие отёка лёгких.
Чаще всего подобное вмешательство выполняют путём
продольного рассечения грудины либо торакотомии по пятому межреберью.
Показаниями к использованию искусственного кровообращения
при перикардэктомии считают выраженный кальциноз перикарда,
сопутствующий сдавливающий эпикардит и повторный характер
операции. Операция в условиях искусственного кровообращения
позволяет добиться максимального освобождения обоих желудочков
сердца от сдавливающих оболочек с положительными гемодинамическим
и клиническим эффектами. Искусственное кровообращение
обеспечивает адекватную гемодинамику во время манипуляций на сердце и
обширной резекции перикарда, в значительной степени снижая риск
развития тяжёлых осложнений, а в случае их возникновения создаёт
благоприятные условия для их ликвидации.
Ближайшие и отдалённые результаты оперативного лечения
пациентов со сдавливающим перикардитом в подавляющем
большинстве случаев хорошие.
Перикардиты ♦ 165
Рис. 31-1. Перикард
острым путём отделяют от
стенки сердца. Стрелками
указаны направления разрезов
перикарда при
перикардэктомии.
ИШЕМИЧЕСКАЯ
БОЛЕЗНЬ СЕРДЦА
Хирургические вмешательства при ишемической болезни сердца
(ИБС) в настоящее время получили повсеместное распространение
и прочно вошли в арсенал средств лечения этого заболевания.
Восстановление кровотока в миокарде осуществляют путём прямой
операции на сердце с помощью аортокоронарного шунтирования либо
используют непрямую (эндовазальную) баллонную дилатацию
(ангиопластику) стенозированных венечных артерий. Таким образом,
лечением ИБС сейчас занимаются не только терапевты, как это было
принято на протяжении большей части прошлого XX столетия, но и
кардиохирурги совместно с кардиологами. Такой подход открыл
новые перспективы в решении проблемы самой распространённой
сердечно-сосудистой патологии.
Основные черты патологии
В основе подавляющего большинства случаев ИБС и её
осложнений лежит атеросклеротическое поражение (сужение или полная
окклюзия) коронарных артерий, приводящее к значительному
уменьшению кровоснабжения миокарда в определённой части сосудистого
русла сердца. На первых этапах заболевания недостаточное
кровоснабжение миокарда больной ощущает во время физической
нагрузки, когда возникает типичный приступ стенокардии. По мере про-
грессирования коронарного атеросклероза появляется стенокардия
покоя. Если коронарный кровоток не восстанавливается, следующий
закономерный этап — инфаркт миокарда, развитие которого чаще
всего происходит вслед за формированием тромба в зоне атероскле-
ротического сужения венечной артерии. В свою очередь инфаркт
миокарда может стать причиной митральной недостаточности (за счёт
поражения папиллярных мышц), дефекта межжелудочковой
перегородки, внутрисердечного тромбоза и тромбоэмболии артерий
большого круга кровообращения, аневризмы левого желудочка, которые
сами по себе могут стать объектами хирургического вмешательства,
так как реально угрожают жизни больного.
Ишемическая болезнь сердиа О- 167
Поскольку атеросклероз -- системное заболевание, следует по-
мнить, что у одного и того же больного могут быть признаки ИБС,
хронической артериальной недостаточности нижних конечностей
(см. главу 35), нарушения кровоснабжения головного мозга и т.д.
Диагностика
В коронарной хирургии широко применяют весь арсенал
диагностических методов, традиционно используемых в кардиологической
практике (ЭКГ, в том числе в сочетании с физической нагрузкой и
медикаментозными пробами, рентгенологические и радионуклид-
ные методы, УЗИ). Катетеризация левых отделов сердца позволяет
определять конечное диастолическое давление в левом
желудочке — показатель, имеющий большое значение для оценки
функциональных возможностей миокарда, особенно если это исследование
сочетать с измерением СВ. Левая вентрикулография предоставляет
возможность изучить движение стенок левого желудочка, а также
рассчитать его систолический и диастолический объёмы,
толщину стенок, оценить сократительную функцию, рассчитать фракцию
выброса. Селективная коронарография предназначена для
визуализации коронарных артерий и их основных ветвей, изучения
анатомического и функционального состояния сосудистого русла,
степени и характера поражения атеросклеротическим процессом,
компенсаторного коллатерального кровообращения. В 95% случаев
она точно и объективно отражает анатомическое состояние
венечного русла.
Показания к рентгеноконтрастному исследованию коронарных
артерий и левого желудочка следующие,
• Ишемия миокарда, выявленная с помощью неинвазивных методов
диагностики.
• Наличие любого типа стенокардии, подтверждённого неинвазив-
ными методами исследования (изменения на ЭКГ в покое, проба с
дозированной физической нагрузкой, суточное ЭКГ-мониториро-
вание).
• Инфаркт миокарда в анамнезе с последующей постинфарктной
стенокардией.
• Инфаркт миокарда в острой фазе.
• Предоперационная оценка состояния коронарного русла у
пациентов старше 40 лет с пороками клапанов сердца.
168 ♦ Хирургические болезни <^ Том 2 О Часть III <? Глава 32
Принципы хирургического лечения
Выбор способа хирургической реваскуляризации миокарда при ИБС
достаточно сложен. Баллонную ангиопластику обычно выполняют при
гемодинамически значимом поражении коронарных артерий в их
проксимальных отделах (кроме устьевых стенозов) в тех случаях, когда
отсутствует выраженный калыдиноз, а проходимости дистального
сосудистого русла сохранена. Для уменьшения частоты рецидивов это
вмешательство дополняют имплантацией в место стеноза
специальных атромбогенных каркасных конструкций — стентов (рис. 32-1).
В современной кардиохирургической практике это оперативное
вмешательство выполняют в 2 раза чаще, чем прямую операцию на
коронарных сосудах. Необходимое условие выполнения
ангиопластики венечных артерий — наличие готовой операционной и
хирургической бригады для выполнения прямой экстренной операции на
сердце в случае появления осложнений.
Прямые оперативные вмешательства при ИБС предполагают
выполнение шунтирующих операций, т.е. восстановление кровотока в
обход стенозированного или окклюзированного участка венечных
артерий. Чаще всего шунт (используют большую подкожную вену
бедра или голени, внутреннюю грудную или лучевую артерии)
накладывают между аортой и венечными артериями дистальнее зоны
Рис. 32-1. Баллонная дилатация и стентирование коронарной артерии:
а — видна тень стента, установленного в зоне стеноза после его дилатации;
б — после эндоваскулярного вмешательства просвет сосуда восстановлен.
Ишемическая болезнь сердиа -0- 169
Рис. 32-2. Шунтирование
коронарных артерий ау-
товенозными
трансплантатами.
атеросклеротической окклюзии (стено- v4*-/ C^-^
за), т.е. выполняют аортокоронарное
шунтирование. Обычно хирургам
приходится одновременно накладывать несколько
шунтов (рис. 32-2).
В настоящее время при определении
показаний к аортокоронарному
шунтированию учитывают следующие моменты.
• Клиническая картина заболевания, т.е.
выраженность стенокардии, её
устойчивость к лекарственной терапии.
• Анатомические особенности
поражения коронарного русла (степень и
локализация атеросклеротических бляшек,
количество поражённых сосудов, тип
коронарного кровоснабжения).
• Состояние сократительной функции
миокарда.
От этих факторов зависит прогноз заболевания при
естественном его течении и лекарственной терапии, а также степень
операционного риска. На основании оценки данных
предоперационного обследования определяют показания и противопоказания к
хирургическому лечению ИБС. Обычно оно показано в следующих
случаях:
• множественное поражение коронарных артерий;
• стволовой стеноз левой коронарной артерии;
• наличие устьевых стенозов левой или правой коронарных
артерий;
• стеноз передней межжелудочковой артерии при невозможности
выполнить её ангиопластику.
Главные противопоказания к оперативному лечению:
• диффузное поражение периферических коронарных артерий;
• резко сниженная сократительная функция миокарда (фракция
выброса менее 0,3);
• наличие тяжёлой сердечной недостаточности (11Б—III стадии);
• ранние сроки после инфаркта миокарда (до 4 мес).
В большинстве случаев аортокоронарное шунтирование
выполняют в условиях искусственного кровообращения. Основные этапы
такой операции:
170 ♦ Хирургические болезни ♦ Том 2 ♦ Часть III <► Глава 32
• наложение дистального анастомоза шунта по типу «конец в бок»
с коронарной артерией после подключения аппарата искусственного
кровообращения, остановки сердца и ревизии коронарного русла;
• создание проксимального анастомоза шунта с аортой после
восстановления сердечной деятельности (с помощью бокового отжатия
стенки аорты).
Учитывая травматичность стандартной операции в условиях
искусственного кровообращения, в последние десятилетия
развиваются хирургические вмешательства на работающем сердце из малых
доступов. При этом стенку сердца фиксируют при помощи
различных стабилизаторов (вакуумных или механических).
Отдельную проблему представляет хирургическое лечение острого
инфаркта миокарда. Стандартное аортокоронарное шунтирование в
этих условиях сопровождается крайне высокой летальностью.
Поэтому современный подход предполагает экстренное выполнение коро-
нарографии и проведение катетерного внутрикоронарного тромбо-
лизиса (используют активаторы эндогенного фибринолиза —
стрептокиназу, урокиназу, тканевые активаторы плазминогена). Как
только тромб растворяется, выполняют баллонную ангиопластику и
стентирование этого участка коронарной артерии. Если подобное
вмешательство удаётся провести в первые часы инфаркта,
происходит быстрое улучшение состояния больных, исчезают клинические и
электрокардиографические проявления заболевания,
предотвращаются возможные осложнения. В последующем больным назначают
дезагрегантную и липидокорригирующую терапию.
Аневризмы левого желудочка, как правило, бывают осложнением
острого инфаркта миокарда. В большинстве случаев аневризмы
располагаются по передней или переднебоковой стенке левого желудочка
либо в области его верхушки. Анатомически они представляют
собой участок истончённой рубцовой ткани с выпячиванием
стенки желудочка в этой области. С функциональной точки зрения
аневризма — зона миокарда, потерявшего сократительную способность,
выбухающая при систолических сокращениях. Ложная аневризма
желудочка образуется при разрыве зоны инфаркта миокарда и
формировании полости, ограниченной сращениями в перикарде. В 40%
случаев аневризматический мешок тромбируется, что чревато
тромбоэмболией артерий большого круга кровообращения. В стенке
мешка, как правило, выявляют воспалительные изменения — тром-
боэндокардит. При длительно существующих аневризмах нередко
возникают очаги кальциноза.
Ишемическая болезнь сердца ♦ 171
Аневризма возникает у каждого пятого больного, перенёсшего
трансмуральный инфаркт миокарда. Факторы, предрасполагающие
к её формированию, — артериальная гипертензия в остром периоде
инфаркта, несоблюдение постельного режима, применение глюкокор-
тикоилов. При консервативной терапии за 5-летний период
наблюдения выживаемость при развитии этого осложнения составляет 20%.
Оперативное лечение предполагает геометрическую коррекцию
левого желудочка, устранение или ограничение несокращающей-
ся части миокарда (путём иссечения аневризмы и пластики
стенки желудочка), нормализацию коронарного кровотока (рис. 32-3).
Рис. 32-3. Хирургическое лечение постинфарктной аневризмы левого
желудочка: а — вскрыт просвет аневризмы; б — после резекции аневризмы рана
сердца ушита, выполнено аортокоронарное шунтирование.
Операцию выполняют в условиях искусственного кровообращения.
Устранение аневризмы позволяет существенно повысить фракцию
выброса желудочка, снижает опасность тяжёлых нарушений ритма.
Аритмии — нарушения деятельности сердца, связанные с
изменением функций проводящей ткани, обеспечивающей ритмичное и
последовательное сокращение его отделов. Нарушения ритма
сердечных сокращений — частые и прогностически серьёзные проявления
сердечно-сосудистых заболеваний, значительно ухудшающие
состояние больных.
Хирургия нарушений сердечного ритма — одно из наиболее
молодых и стремительно развивающихся направлений кардиохирургии.
Она ровесница первой в мире пересадки сердца у человека, её успехи
неразрывно связаны с достижениями современной
электрофизиологии. В свою очередь электрофизиологические исследования в ходе
оперативных вмешательств на сердце позволили понять природу
многих видов нарушений ритма сердца и предложить
высокоэффективные методы их хирургической коррекции.
Основные черты патологии
■ Минутный объём кровообращения зависит от ударного объёма
сердца и ЧСС. Он поддерживается в широком диапазоне сердечного
ритма. Аритмии становятся гемодинамически значимыми, и СВ
может критически снижаться при пульсе менее 40 и более 160 в мину-
|ту. Это может приводить к ишемии головного мозга и нарушениям
сознания. Выраженные брадикардия и тахикардия чреваты
неэффективностью кровообращения со всеми вытекающими
неблагоприятными последствиями. Длительные асистолия и фибрилляция
желудочков — основные механизмы танатогенеза при различных
нарушениях сердечного ритма.
Ритмичную физиологическую деятельность сердца обеспечивает
проводящая система сердца, обладающая автоматизмом,
возбудимостью и проводимостью. Нормальный автоматизм сердца (т.е.
способность к самопроизвольному образованию электрических потенциалов
действия) связан с деятельностью синусового узла, генерирующего
импульсы с наибольшей частотой. Частота пульса возрастает во время
ХИРУРГИЧЕСКОЕ
ЛЕЧЕНИЕ АРИТМИЙ
физической нагрузки и уменьшается в состоянии покоя и во время сна.
По мере удаления от синусового узла в дистальном направлении
(проводящая ткань предсердий, область атриовентрикулярного соединения,
пучок Хиса, волокна Пуркинье) автоматизм уменьшается.
Патологическое замедление сердечного ритма может быть связано с
синдромом слабости синусового узла и атриовентрикулярной блокадой.
Синдром слабости синусового узла включает выраженную
синусовую брадикардию, синоатриальную блокаду, остановку синусового
узла (асистолию) и пароксизмальные предсердные тахиаритмии
(синдром бради-тахикардии). Этиология этого синдрома до настоящего
времени не вполне ясна. Чаще всего его встречают у пожилых людей,
он может быть обусловлен старческим амилоидозом и другими ин-
фильтративными заболеваниями, поражающими миокард
предсердий. Атрыовентрикулярная блокада (АВ-блокада) заключается в
нарушении проведения электрических импульсов от предсердий к
желудочкам. Различают три степени такой блокады.
• Первая степень характеризуется замедлением АВ-проведения
(интервал PQ более 0,20 с).
• При 2-й степени часть импульсов к желудочкам не проводится
(периодическое выпадение комплексов QRS с предшествующим
прогрессирующим удлинением интервала PQ или без него).
• 3-я степень — полная АВ-блокада. При ней электрические
импульсы вообще не проводятся от предсердий к желудочкам. АВ-блокаду
обнаруживают при инфаркте миокарда, коронарокардиосклерозе,
миокардите, саркоидозе, амилоидозе; передозировке сердечных гли-
козидов, антогонистов кальция и в-адреноблокаторов. Она может
носить врождённый характер. Тяжёлая брадикардия
сопровождается симптомами, обусловленными низким СВ: выраженной
утомляемостью, приступами головокружения и обмороками.
В качестве причин тахикардии рассматривают три основных
механизма: аномальный автоматизм, повторный вход возбуждения
(reentry) и триггерный автоматизм.
• Аномальный автоматизм формирует эктопический ритм. Он
возникает в клетках, в нормальных условиях не обладающих
свойствами водителя ритма. Возможен также вариант, когда истинные
водители ритма становятся очагом ускоренной активности.
• Аритмии повторного входа, в котором часто участвуют
дополнительные пути проведения между желудочками и предсердиями,
развиваются при возникновении в какой-то части миокарда волны
электрического возбуждения, фактически существующей постоян»
174 ♦ Хирургические болезни ♦ Том 2 О- Часть III ♦ Глава 33
но. Электрическая активность в петле re-entry характеризуется
наличием волны медленного продвижения импульса к участкам
миокарда, которые уже перестали быть возбудимыми.
• Триггерная активность — следствие аномального возникновения
импульса и волны активности от одного очага (фокуса). В отличие
от автоматизма она возникает не спонтанно, а имеет в качестве
источника предшествующее возбуждение. Триггерную активность
можно индуцировать различными методами, в том числе быстрой и
учащающей стимуляцией сердца.
В зависимости от ЧСС, продолжительности приступа пароксиз-
мальной тахикардии и сопутствующих заболеваний сердца
клинические проявления заключаются в ощущении сердцебиения, обмороках
или признаках недостаточности кровообращения.
Диагностика
Диагностика нарушений ритма сердца основана на данных
анамнеза, клинической картине и результатах инструментальных методов
исследования: ЭКГ, холтеровского мониторирования,
электрофизиологического исследования сердца.
Наибольшее практическое значение имеют чреспищеводное и эн-
докардиальное электрофизиологические исследования.
• При чреспищеводном электрофизиологическом исследовании
специальный многополюсный зонд-электрод вводят пациенту в
пищевод. После установки электрода его подключают к наружному
электрокардиостимулятору, генерирующему импульсы в заданном режиме.
При этом регистрируют электрокардиографические показатели.
• При проведении эндокардиального электрофизиологического
исследования электроды под рентгеновским контролем вводят в полость
сердца (в область септальной створки трёхстворчатого клапана, полость
правого желудочка, область боковой стенки правого предсердия).
Лечение
Хирургическое лечение брадиаритмий заключается во временной
(при остром развитии АВ-блокады во время инфаркта миокарда или
побочном действии лекарственных препаратов) или постоянной
электрокардиостимуляции.
Хирургическое лечение аритмий О 175
Для временной стимуляции зонд-электрод обычно вводят через
один из притоков верхней полой вены и после установки в области
верхушки правого желудочка подключают его к наружному
водителю ритма, с помощью которого навязывают необходимый ритм
сердечных сокращений. Основные показания к имплантации
постоянного электрокардиостимулятора следующие.
• Приобретённая предсердно-желудочковая блокада III степени у
взрослых.
• Устойчивая предсердно-желудочковая блокада II степени или
предсердно-желудочковая блокада III степени сердца, возникшая после
инфаркта миокарда с блокадой в системе Хиса—Пуркинье.
• Би- и трифасцикулярная блокада.
• Синдром слабости синусового узла с приступами Адамса—Стокса—
Морганьи (периоды асистолии с потерей сознания).
Постоянную электрическую стимуляцию сердца можно
осуществлять эндокардиальным или миокардиальным способом.
Наибольшее распространение в настоящее время получил эндокар-
диальный способ, как менее травматичный и легче переносимый
больными. Подобную операцию выполняют под местной анестезией. В
подключичной области из небольшого разреза обнажают один из
притоков подключичной вены, через него вводят специальный
зонд-электрод. Под рентгеновским контролем его проводят в правый
желудочек и имплантируют в области верхушки сердца (рис. 33-1). Под
большой грудной мышцей или под молочной железой (у женщин) го-
Рис. 33-1. Внутривенный электрод,
введённый через v. cephalica и
постоянный
электрокардиостимулятор, вшитый под грудную мышцу
(схема операции).
176 О- Хирургические болезни О- Том 2 <> Часть III О- Глава 33
товят ложе, в которое помещают электрокардиостимулятор.
Операционную раны ушивают наглухо. Современные модели
стимуляторов, работающие на литиевых батареях, обеспечивают их
функционирование в течение 5—7 лет. В дальнейшем необходима замена
аппарата хирургическим путём.
Миокардиальный доступ электрокардиостимуляции используют
в основном в следующих случаях:
• у детей раннего возраста при отсутствии достаточно
сформированной венозной системы;
• во время повторных вмешательств у больных с брадиаритмиями
при наличии инфекционных осложнений (например,
инфицирование эндокардиального электрода, электродный сепсис,
бактериальный эндокардит);
• при выполнении сочетанных операций при пороках сердца и ИБС.
Противопоказаниями к выполнению миокардиального доступа,
кроме общехирургических, считают выраженную декомпенсацию
сердечно-сосудистой системы и наличие массивных спаек в полости
перикарда. Относительным противопоказанием служит вялотекущий
миокардит любой этиологии.
В настоящее время разработано большое количество моделей
искусственного водителя ритма для устранения различных нарушений
ритма и проводимости. Их можно разделить на однокамерные,
двухкамерные и частотно-адаптивные.
• Однокамерные стимуляторы используют один электрод,
размещаемый или в правом предсердии, или в правом желудочке.
• Двухкамерные стимуляторы воспринимают электрическую
активность предсердий и стимулируют сокращения желудочков либо
стимулируют как предсердия, так и желудочки. Для большинства
двухкамерных электрокардиостимуляторов необходимо два электрода,
при этом один из них расположен в правом предсердии, а другой —
в правом желудочке.
• Частотно-адаптивные стимуляторы могут быть как
однокамерными, так и двухкамерными. Особенность этих аппаратов — наличие
специального датчика (или нескольких датчиков) для определения
необходимой частоты пульса. Таким образом, такой
электрокардиостимулятор может увеличивать или уменьшать частоту своей
работы в зависимости от изменения физиологических потребностей
организма.
В настоящее время применяют различные методы
электрокардиостимуляции (рис. 33-3 и 33-3). Как правило, они осуществляются в
Хирургическое лечение аритмий ♦ 177
а 6
Рис. 33-2. Рентгенограммы пациента с имплантированным однокамерным
стимулятором: а — вид стимулятора; б — расположение электрода в правом
желудочке.
Рис. 33-3. Рентгенограммы пациента с имплантированным двухкамерным
стимулятором; а — вид стимулятора; б — расположение электродов в
правом предсердии и правом желудочке.
режиме demand (по требованию), т.е. стимуляторы включаются при
значительном снижении частоты собственного сердечного ритма
больного (обычно менее 60 в минуту). Существуют определённые
преимущества постоянной электростимуляции предсердий (AAI) или
178 <0> Хирургические болезни О Том 2 О Часть III ♦ Глава 33
синхронизированной двухкамерной стимуляции (DDD, DDDR)
перед постоянной электростимуляцией только желудочков (VVI).
Основные параметры работы современных электрокардиостимуляторов
можно проконтролировать и изменить без дополнительного
оперативного вмешательства с помощью специального наружного
электромагнитного устройства — программатора.
Хирургическое лечение тахиаритмий осуществляют
преимущественно тремя методами:
• имплантацией антитахикардийных электрокардиостимуляторов
и кардиовертеров-дефибрилляторов;
• эндокардиальной высокочастотной катетерной абляцией
(разрушением) проводящих путей сердца;
• с помощью операции на открытом сердце, устраняющей
дополнительные пути проведения .
Наиболее разработаны операции при синдроме Вольфа-Паркин-
сона-Уайта. В основе этой патологии лежит наличие
дополнительного проводящего пути в обход основного предсердно-желудочково-
го. По имени автора, впервые описавшего это образование
(соединение), оно получило название «пучок Кента». Техника
операции состоит в том, чтобы прервать этот дополнительный путь.
Ранее такие операции выполняли только в условиях искусственного
кровообращения. В последние годы их осуществляют с применением
методов рентгенэндоваскулярной хирургии. Аномальные соединения
проводящей системы подвергают трансвенозной деструкции с
помощью электрического разряда, низких температур или
радиочастотного воздействия.
В диагностике и лечении нарушений ритма за последнее
десятилетие произошёл настоящий переворот. Категория совершенно ин-
курабельных больных перешла в разряд пациентов, для лечения
которых существует широкий спектр пособий, благодаря чему лечение
может быть индивидуализировано. Общие тенденции
свидетельствуют также о том, что прогресс во всех разделах клинической арит-
мологии идёт очень высокими темпами и следует ожидать
дальнейшего улучшения результатов, что приведёт к повышению качества и
росту продолжительности жизни многих страдающих уже в
обозримом будущем.
ОСТРАЯ АРТЕРИАЛЬНАЯ
НЕПРОХОДИМОСТЬ
Острая артериальная непроходимость — синдром,
характеризующийся внезапным нарушением кровотока в определённом сосудистом
бассейне. Её можно обнаружить в артериальном русле конечностей (о
чём пойдёт речь в этой главе), головного мозга (приводя к развитию
ишемического инсульта), внутренних органов (вызывая инфаркты
кишечника, почек, селезёнки и т.д.). Острая артериальная
непроходимость — одно из наиболее опасных осложнений заболеваний сердца и
магистральных сосудов (таких как ревматические пороки сердца,
ИБС, атеросклероз аорты и крупных артерий). Вызывают острую
артериальную непроходимость эмболии (60%) и острые тромбозы (40%).
Основные черты патологии
Эмболия — термин, введённый в практику Рудольфом Вирховым
для обозначения ситуации, при которой происходит отрыв тромба от
места его первоначального образования, «перенос» его по току
крови с последующей закупоркой артерии.
Острый тромбоз — развитие обтурирующего тромба на месте
изменённой в результате заболевания (атеросклероза, тромбангиита)
или травмы сосудистой стенки.
Типичные уровни эмболических окклюзии — зоны бифуркаций, в
частности бифуркация аорты, подвздошных, бедренных,
подколенных, подключичных и плечевых артерий. Чаще всего эмболия
поражает бедренные артерии (до 40% случаев), на долю бифуркации
аорты и подвздошных артерий приходится 25%, окклюзия артерий
верхних конечностей происходит реже. В 25% наблюдений
встречают этажную эмболию (тромбоэмболы локализуются на разных
уровнях артериального русла одной конечности), комбинированную
(одновременное поражение двух и более конечностей) или сочетанную
(закупорка артерий конечностей, сопровождающаяся поражением
церебральных или висцеральных сосудов). В случаях острого тромбоза
уровень окклюзии зависит от расположения зоны предшествующего
поражения артериальной стенки.
180 ♦ Хирургические болезни <^ Том 2 ♦ Часть IV ♦ Глава 34
Этиология и патогенез
В 95% случаев наблюдают тромбоэмболию, т.е. эмболию тром-
ботическими массами. Её причиной становятся заболевания
сердца, такие как атеросклеротические кардиопатии, острый инфаркт
миокарда и ревматические пороки сердца. До 70% эмболии
связано с ИБС и её осложнениями, причём у каждого 7-го
больного её причиной бывает постинфарктная аневризма левого
желудочка сердца. При ревматических пороках тромботические массы чаще
локализуются в левом предсердии или его ушке, в то время как при
атеросклеротической кардиопатии — в левом желудочке. В 80%
случаев тромбоэмболии вне зависимости от характера основного
заболевания выявляют мерцательную аритмию, что позволяет
говорить о её значении в формировании и мобилизации внутрисердеч-
ных тромбов.
Более редкие источники эмболии — искусственные клапаны
сердца (тромбы при определённых условиях могут образовываться на
фиксирующем их кольце); аневризмы аорты и её ветвей,
осложнённые пристеночным тромбозом; изъязвлённые атеросклеротические
бляшки, расположенные в проксимальном отделе сосудистого русла.
Одной из причин эмболии артерий верхних конечностей становится
добавочное шейное ребро, способное привести к сегментарному
стенозу подключичной артерии и развитию постстенотического
расширения, в котором формируются пристеночные тромбы. Иногда
причинами эмболии бывают предсердная миксома и вегетации на
клапанах у больных эндокардитами.
Наиболее частая причина острого артериального тромбоза —
атеросклероз, при котором тромбоз формируется на фоне
длительно существующего клинически проявляющегося окклюзионно-сте-
нотического процесса либо в зоне бессимптомной изъязвлённой
бляшки. Существенно реже тромбоз возникает при эндартериите
и травме артерий. В любом случае острые тромбозы всегда
вторичны по отношению к поражению патологическим процессом
сосудистой стенки.
После возникновения острой обструкции магистральной артерии
возможны следующие варианты развития процесса.
• Проксимальный (редко) или дистальный (значительно чаще) рост
тромба, приводящий к закрытию коллатеральных сосудов и
нарастанию ишемии конечности. При этом тромб может как возникать в
Острая артериальная непроходимость -Ф- 181
зоне эмболии, так и образовываться самостоятельно в дистальных
артериях поражённой конечности.
• Фрагментация тромбоэмбола с последующей миграцией в более
дистальные отделы сосудистого русла, что ведёт к уменьшению зоны
ишемии. Частичный спонтанный лизис фрагментированного тромба
может служить объяснением регресса ишемии у некоторых
пациентов с артериальной эмболией.
При острой ишемии конечности развивается кислородное
голодание тканей, в связи с чем нарушаются все виды обмена. В первую
очередь возникает ацидоз, связанный с образованием избыточного
количества недоокисленньгх продуктов обмена (молочной и пирови-
ноградной кислот).
Нарушение проницаемости клеточных мембран, влекущее за
собой гибель клеток, приводит к тому, что внутриклеточные ионы
калия попадают в межклеточную жидкость и затем в кровь, следствием
чего становится гиперкалиемия. В ишемизированных тканях
конечности появляются активные ферменты (кинины, креатининфосфо-
киназа), а при тяжёлой ишемии в результате разрушения мышечных
клеток в межтканевой жидкости накапливается миоглобин.
Последовательность изменений при синдроме острой ишемии
выглядит следующим образом. Сначала появляются умеренные
нарушения макрогемодинамики. В дальнейшем наступает резкое
ухудшение микроциркуляции, служащей важным звеном в цепи
компенсации гемодинамических расстройств. Вслед за этим происходят
качественные изменения функционального состояния
нервно-мышечного аппарата конечности, выраженные метаболические и
структурные нарушения в тканях. Как следствие нарушения клеточной
проницаемости развивается субфасциаяьный отёк мышц со значительным
сдавлением тканей, находящихся в фасциальном футляре, что в свою
очередь ещё более ухудшает тканевой кровоток.
В ишемизированных тканях возникают факторы, способствующие
местному тромбообразованию: стаз крови, ацидоз, наличие активных
клеточных ферментов. Возникает тромботическое состояние,
характеризующееся гиперкоагуляцией, гиперагрегацией и торможением
фибринолиза. Образование макроагрегатов форменных элементов и
микротромбов в мелких артериях и капиллярах значительно
усугубляет ишемию и способствует развитию необратимых изменений в
тканях конечности. Большое значение имеет тот факт, что в мелких,
а в 5% наблюдений и в крупных магистральных венах развивается
тромбоз, способный привести к ТЭЛА.
182 <> Хирургические болезни ♦ Том 2 4- Часть IV ^ Глава 34
Клиническая картина
Острая артериальная непроходимость проявляется синдромом
острой ишемии конечности, отличающимся значительным
полиморфизмом. Для него характерны следующие симптомы.
• Боль в поражённой конечности — в большинстве случаев первый
признак острой артериальной непроходимости. Особенно ярко
выражен болевой синдром при эмболиях.
• Чувство онемения, похолодания, парестезии — патогномоничные
симптомы этого патологического состояния. Пациенты жалуются
на ощущение того, что они «отсидели ногу», им кажется, что по
конечности у них «ползают мурашки», «проходит электрический ток»,
«в ногу вонзается множество мелких иголок» и т.д.
• Изменение окраски кожи. Почти во всех случаях выявляют бледность
кожных покровов. Впоследствии присоединяется синюшный
оттенок, который может превалировать. При тяжёлой ишемии
отмечают «мраморный рисунок».
• Отсутствие пульсации артерий на всех уровнях дистальнее
окклюзии. Этот симптом — единственный клинический признак,
позволяющий определить локализацию эмбола или тромба без каких-либо
дополнительных инструментальных методов исследования (рис. 34-1).
Наряду с пальпацией следует проводить аускультацию аорты и
крупных магистральных артерий. Выслушивание систолического
шума позволяет заподозрить стенотическое поражение проксимально
Рис. 34-1. Зоны пальпации бедренной артерии, задней большеберцовой
артерии и артерии тыла стопы.
Острая артериальная непроходимость <> 183
расположенных сосудов, что может принципиально изменить
тактику обследования и лечения больных.
- Отсутствие пульсации бедренной артерии в паху
свидетельствует об окклюзии подвздошной артерии. Если она не определяется
с двух сторон, это означает, что препятствие кровотоку возникло
на уровне бифуркации аорты.
- Эмболия (тромбоз) бедренной артерии приводит к отсутствию
пульсации в подколенной ямке (рис. 34-2).
- Если она определяется, но нет пульса на артериях стопы, окклю-
зирована бифуркация подколенной артерии.
- Окклюзия подключичной артерии приводит к исчезновению
пульсации на всём протяжении конечности, начиная с подмышечной
ямки (рис. 34-3).
- Если пульсация в этой зоне определяется, а дистальнее — нет,
препятствие кровотоку локализуется в плечевой артерии. Наличие
пульса на плечевой артерии в области локтевого сгиба и его
отсутствие на уровне лучезапястного сустава свидетельствует об
окклюзии бифуркации плечевой артерии.
• Снижение температуры кожи, наиболее выраженное в дистальных
отделах.
184 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV О Глава 34
Рис. 34-3. Пальпация
артерий верхней конечности
при подозрении на острую
артериальную
непроходимость.
• Расстройство поверхностной и
глубокой чувствительности от лёгкого
снижения до полной анестезии.
Нарушение чувствительности всегда по типу
«чулка».
• Нарушения активных движений в ко-
нечности характерны для выраженной
ишемии и проявляются в виде снижения
мышечной силы (парез) или отсутствия
активных движений (паралич) сначала
в дистальных, а затем и в
расположенных проксимальнее суставах вплоть до
полной обездвиженности
конечности. Проксимальная граница ишемичес-
ких нарушений зависит от уровня
окклюзии.
• Болезненность при пальпации ишемизи-
рованных мышц наблюдают при тяжёлой
ишемии, это неблагоприятный
прогностический признак. Чаще отмечают
болезненность икроножных мышц (мышц предплечья), при высоких
окклюзиях выявляют болезненность мышц бедра (плеча).
• Субфасциальный отёк мышц голени — признак тяжёлой ишемии.
Он характеризуется чрезвычайной плотностью и не
распространяется выше коленного сустава на ногах. Отёк может охватывать все
мышцы голени (тотальный) или же быть ограниченным передней
или задней группой мышц.
• Ишемическая мышечная контрактура — самый грозный симптом
острой артериальной непроходимости, он свидетельствует о
начинающихся некробиотических явлениях. Различают дистальную
(частичную) контрактуру, при которой пассивные движения
невозможны лишь в дистальных суставах конечности, и тотальную (полную)
контрактуру, когда движения отсутствуют во всех суставах
поражённой конечности, находящейся при этом в состоянии, весьма
сходном с трупным окоченением.
Разнообразие клинических проявлений и степень их
выраженности зависят от многих факторов, прежде всего, от состояния
кровообращения в поражённой конечности. Чем тяжелее расстройства
кровообращения, тем более выражены проявления ишемии.
Острая артериальная непроходимость -О" 185
Классификация
/. Причина артериальной окклюзии:
• эмболия;
• тромбоз.
//. Степень ишемии конечности (по клиническим признакам).
1. Онемение, парестезии, боль (в покое или при физической нагрузке).
2. Двигательные расстройства и/или отёк.
- 2А. Парез (снижение мышечной силы).
- 2Б. Паралич (отсутствие активных движений).
- 2В. Субфасциальный отёк.
3. Развитие контрактуры.
- ЗА. Парциальная контрактура.
- ЗБ. Тотальная контрактура.
///. Течение ишемии:
• прогрессирующее;
• стабильное;
• регрессирующее.
Выраженность ишемических расстройств определяют по
клиническим признакам. В классификации указаны наиболее характерные
симптомы для каждой из степеней. Наряду с ними сохраняются
признаки, характерные для менее выраженной ишемии.
• / степень ишемии при стабильном течении в ближайший период
времени не угрожает жизнеспособности конечности.
• 2 степень характеризуется появлением двигательных расстройств и
субфасциального отёка. Прогрессирование подобной ишемии
неминуемо ведёт к гангрене конечности.
• 3 степень — финальная стадия ишемии конечности, прежде всего,
мышц, но ещё не гангрена. В то же время повреждение тканей при
этом носит необратимый характер. Клиническое проявление этой
стадии — развитие мышечных контрактур на разном уровне. Кроме
того, для тромботической окклюзии, возникающей на фоне
хронических облитерирующих заболеваний артерий конечностей,
характерны более или менее распространённые некротический дефекты
тканей. Восстановление магистрального кровотока при подобной
ишемии всегда чревато развитием постишемического синдрома (см.
ниже). Как показывают многочисленные клинические наблюдения,
реваскуляризаиия конечности при тотальных контрактурах
смертельна. При ограниченных контрактурах (голеностопный сустав, пальцы
186 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 34
стопы) речь может идти о необратимых повреждениях только мышц
голени (частичном или полном). Восстановление магистрального
кровообращения в этих случаях, безусловно, целесообразно,
поскольку последующая ампутация на более низком уровне или даже некрэк-
томия значительно повышает шансы на выживание таких больных.
Инструментальная диагностика
В диагностической программе при острой артериальной
непроходимости необходимо учесть, что время обследования крайне
ограничено. В связи с этим необходимо использовать наиболее
информативные методики, позволяющие уточнить уровень, характер и
распространённость окклюзии, а также установить состояние
магистральных артерий, расположенных как проксимально, так и дисталь-
но по отношению к тромбу или эмболу. Этим требованиям отвечают
УЗИ и ангиография.
УЗИ пациентов с острой артериальной непроходимостью должно
включать аускультативный анализ кровотока и измерение
регионарного систолического давления на различных уровнях. Дуплексное
сканирование, позволяющее визуализировать сосудистую стенку,
внутрисосудистые структуры и кровоток, может быть ценным
методом для выявления наличия, уровня и характера обструкции
артериального русла.
Выполнение ангиографии (рис. 34-4) целесообразно в следую
щих случаях:
Рис. 34-4. Тромбоэмбол в подколенной
артерии (ангиограмма).
Острая артериальная непрохолимость <> 187
• для уточнения диагноза и выбора метода лечения у пациентов с
исходной хронической артериальной недостаточностью;
• при подозрении на наличие сочетанной либо «этажной» эмболии;
• при несоответствии уровня отсутствия пульса и границ ишемии;
• в случаях затруднений в дифференциальной диагностике между
эмболией и тромбозом;
• при подозрении на добавочное шейное ребро.
Дифференциальная диагностика
Для установления характера острой артериальной
непроходимости необходимо прежде всего провести дифференциальный диагноз
между эмболией и острым тромбозом.
При эмболии начало заболевания в большинстве случаев
внезапное, острое, особенно сильные боли возникают в момент закупорки
артерии. Ишемия всегда выражена резко, быстро прогрессирует и без
адекватного лечения приводит к развитию гангрены в ближайшие
несколько суток.
При остром тромбозе она обычно выражена умеренно и не столь
чревата развитием гангрены. Начало заболевания при остром
тромбозе на фоне облитерирующего атеросклероза или артериита не столь
бурное, как при эмболии. Вместе с тем артериальный тромбоз
иногда может протекать молниеносно, это обусловлено так называемой
тромботической готовностью (наличием значительных изменений
сосудистой стенки на большом протяжении, резкой
гиперкоагуляцией и т.д.).
В части случаев приходится проводить дифференциальную
диагностику с острым илиофеморальным флеботромбозом, который может
сопровождаться резким артериальным спазмом. Начало заболевания
по остроте схоже с картиной эмболии — внезапно появляются
сильные боли в конечности, в дальнейшем присоединяется чувство
онемения. Кожа становится бледно-цианотичной. Нередко развивается
картина вялого паралича конечности с потерей всех видов
чувствительности. Основной диффренциально-диагностический признак
венозного тромбоза — отёк конечности, который возникает сразу
вслед за появлением болей и доходит до паховой складки, а иногда и
распространяется на нижнюю половину брюшной стенки, что
никогда не происходит при острой артериальной непроходимости. По
консистенции отёк более мягкий, захватывает подкожную жировую
клетчатку. При эмболии отёк всегда плотный и только субфасциальный.
188 <> Хирургические болезни ♦ Том 2 ^> Часть IV О Глава 34
Возникает он значительно позже, при наступлении тяжёлых
органических изменений в мышцах голени.
Острое расслоение аорты может симулировать эмболию
бифуркации аорты. Это патологическое состояние характеризуется
внезапным возникновением резких болей, преимущественно в области
спины и поясницы. Они, как правило, иррадиируют в нижние
конечности. Существенно выявление выраженной артериальной гипер-
тензии и расширения тени средостения на рентгенограмме. Ишемия
конечностей при расслоении аорты не столь резкая, как при
эмболии (сохраняются движения, отсутствует мраморная пятнистость
кожных покровов). При расслаивающей аневризме аорты
расстройства чувствительности локализуются значительно выше уровня
похолодания. Особые диагностические трудности представляют случаи
расслоения аорты с образованием интрамурального тромба и
закрытием устьев обеих подвздошных артерий. Диагноз подтверждают
ультразвуковым ангиосканированием, аортографией, КТ, МРТ и
транспищеводной эхокардиографией.
Кроме заболеваний сосудов, острую артериальную
непроходимость необходимо дифференцировать с патологией центральной и
периферической нервной системы. В частности, поперечный миелит
может привести к ошибочной диагностике эмболии бифуркации
аорты. Заболевание характеризуется развитием в течение 1—2 ч вялого
паралича нижних конечностей, сопровождающегося потерей
чувствительности. Правильный диагноз позволяют установить анамнез и
исследование пульсации артерий (она всегда сохранена).
Лечение
Алгоритм действия врача у постели больного последовательно
складывается из решения следующих задач:
■ • выявление синдрома острой артериальной непроходимости;
• установление характера окклюзии — эмболия, острый тромбоз,
эмболия на фоне хронической артериальной непроходимости;
• определение степени ишемического повреждения тканей
конечности.
Лечебно-диагностическая тактика при острой артериальной
непроходимости представлена в табл. 34-1.
При первой степени ишемии (без её прогрессирования)
необходимости в экстренной операции нет. Существует возможность для
Острая артериальная непроходимость ♦ 189
Таблица 34-1. Тактика ведения больных с острой артериальной
непроходимостью
Степень
ишемии
1
1
3
А
Б
В
А
Б
Характер артериальной окклюзии
Эмболия
Экстренная или
отсроченная (до 24 ч) эмболэктомия
Экстренная эмболэктомия
Острый тромбоз
Обследование (УЗИ,
ангиография), консервативная
терапия или
реваскуляризирующая операция
Срочное обследование (до 24 ч),
реваскуляризирующая операция
Экстренная реваскуляризирующая операция
Экстренная реваскуляризирующая операция + фасциотомия
Экстренная реваскуляризирующая операция + фасциотомия,
некрэктомия. Отсроченная ампутация
Первичная ампутация
обследования больного, проведения пробной консервативной
терапии и выбора окончательного метода лечения: будь то простая
эмболэктомия, сложная артериальная реконструкция, тромболизис или эн-
довазальные вмешательства. Между тем, если есть полная уверенность
в диагнозе «эмболия» и позволяет состояние пациента,
целесообразно выполнить экстренную восстановительную операцию.
При 2А степени ещё есть время для пробной антикоагулянтной или
тромболитической терапии при неуверенности в диагнозе «эмболия».
Существует возможность для полноценного обследования,
включающего УЗИ и ангиографию. В результате может быть принято
оптимальное для каждого конкретного больного тактическое решение. Это
может быть тромболитическая терапия с чрескатетерным введением
фибринолитического средства непосредственно в тромб, катетерная
аспирационная тромбэктомия, различного рода эндовазальные
вмешательства или открытые операции с необходимым объёмом
реконструкции сосудов, обеспечивающие реваскуляризацию поражённой
конечности.
Ишемия 2Б степени — показание к незамедлительной реваскуля-
ризации. Только при этом конечность, а подчас и жизнь больного,
могут быть спасены. Продолжительность обследования и
подготовки к операции не должна превышать 2—2,5 ч. При уверенности в
эмболическом характере окклюзии потеря времени вообще
недопустима. В случаях острого тромбоза экстренная операция также не имеет
190 <£ Хирургические болезни ♦ Том 2 ♦ Часть IV <> Глава 34
альтернативы, поскольку при промедлении с ней придётся выбирать
уже не способ реваскуляризации, а уровень ампутации.
Ишемия 2В степени, характеризующаяся отёком мыши, помимо
сосудистой восстановительной операции, служит показанием к фас-
циотомии.
Ишемия 3-й степени — финальная стадия ишемических
повреждений тканей конечностей, прежде всего, мышц. Ишемия при этом
носит необратимый характер. Клиническое проявление этой
стадии — развитие мышечных контрактур. При парциальной (дисталь-
ной) контрактуре показана экстренная восстановительная сосудистая
операция с последующей отсроченной ампутацией или некрэктоми-
ей. Тотальная контрактура конечности приводит к необходимости
первичной высокой ампутации.
Изложенный выше тактический алгоритм целесообразно
дополнить следующими положениями, которые необходимо учитывать при
принятии решения в каждой конкретной ситуации.
• Лучшее решение проблемы острой окклюзии — возможно быстрое
восстановление артериального кровотока.
• Только полноценное устранение окклюзии обеспечивает
сохранение жизнеспособности конечности и восстановление её функций.
• У больных с эмболией и исходно непоражёнными сосудами метод
выбора — эмболэктомия баллонным катетером через поверхностно
расположенные и легко доступные под местной анестезией артерии.
Такие вмешательства оправданы даже у соматически очень тяжёлых
больных.
• Острая окклюзия (эмболия или тромбоз), возникающая на фоне
хронической артериальной недостаточности в результате
исходного поражения сосудистого русла, может быть надёжно и
радикально устранена только с помощью реконструктивной операции.
Характер хирургического вмешательства и его объём определяют на
основании результатов специальных методов исследования.
• Абсолютные противопоказания к оперативному лечению —
атональное состояние пациента и крайне тяжёлое общее состояние
больного при первой степени ишемии.
• При тотальной ишемической контрактуре конечности {ишемия ЗБ
степени) восстановительная операция противопоказана в связи с
развитием некорригируемого постишемического синдрома.
Экстренная первичная ампутация конечности может быть единственной
возможной мерой борьбы за жизнь пациента.
Острая артериальная непроходимость ♦ 191
• Лечение больных с острой артериальной непроходимостью
необходимо начинать с немедленного введения гепарина в приёмном
покое тотчас после установления диагноза.
Консервативная терапия
Консервативная терапия применима для пациентов с острой
артериальной непроходимостью в качестве самостоятельного метода
лечения или в сочетании с оперативным вмешательством для
предоперационной подготовки и послеоперационного ведения. Её
направления:
• профилактика нарастания тромбоза;
• лизис тромба;
• улучшение кровообращения в ишемизированных тканях;
• поддержание функций жизненно важных органов (сердца,
почек, лёгких, печени), поражённых первичным патологическим
процессом.
Первую задачу решают путем назначения антикоагулянтов. Не-
фракционированный (обычный) гепарин вводят внутривенно в виде
непрерывной инфузии в начальной дозе 1000-1500 ЕД в час либо
дробно подкожно каждые 8 ч в дозе 450—500 ЕД на кг массы тела
больного в сутки. Регулярно исследуют систему гемостаза по
активированному частичному тромбопластиновому времени и корригируют
вводимую дозу гепарина. Этот показатель должен быть в 2 раза выше
нормального значения через 4 ч после инъекции. Низкомолекулярные
гепарины вводят подкожно, обычно 2 раза в сутки. Их дозируют по
массе тела больного, при этом нет необходимости в столь
тщательном лабораторном контроле. На 4—5-е сутки гепаринизации
назначают непрямые антикоагулянты (варфарин, синкумар). Гепарин
отменяют по достижении международного нормализованного
отношения 2,0. В дальнейшем дозу непрямого антикоагулянта
подбирают индивидуально, при этом международное нормализованное
отношение должно быть в пределах от 2,0 до 3,0. Необходимость в
длительном приёме непрямых антикоагулянтов возникает особенно
в случаях острого тромбоза на фоне атеросклеротического
поражения сосудистой стенки или при эмболической окклюзии в условиях
нарушений сердечного ритма и внутрисердечного тромбоза, когда
вероятность повторной тромбоэмболии высока.
Тромболитическую терапию можно использовать при остром
тромбозе сегментарного характера с применением активаторов эндоген-
192 <> Хирургические болезни ♦ Том 2 <> Часть IV О Глава 34
ного фибринодиза: препаратов стрептокиназы, урокиназы,
тканевого активатора плазминогена. Непреложное условие тромболитичес-
кой терапии — селективное введение фибринолитиков
(непосредственно в толщу тромботических масс). Препараты инфузируют от
нескольких часов до 2—3 сут в стандартных дозировках, в
зависимости от быстроты восстановления проходимости сосуда по данным
контрольных ангиографических исследований. После тромболизиса
необходимо использование эндоваскулярных вмешательств (внутри-
просветной баллонной ангиопластики или катетерной аспирацион-
ной тромбэктомии) с последующим стентированием поражённого
атеросклерозом участка артерии.
Поскольку в генезе артериального тромбоза особое значение
имеет тромбоцитарный фактор, целесообразно длительное назначение
одного из дезагрегантов в суточной дозе: ацетилсалициловая
кислота по 50—100 мг, тиклопидин по 500 мг, клопидогрел по 75 мг, дипи-
ридамол по 400 мг.
Хирургическое лечение
Хирургическое лечение пациентов с острой артериальной
непроходимостью необходимо проводить только в специализированных
отделениях сосудистой хирургии. Вид восстановительных
оперативных вмешательств зависит от характера артериальной окклюзии.
При тромбоэмболической окклюзии выполняют прямую или
непрямую эмболэктомию.
• Под прямой эмболэктомией понимают удаление эмбола через
доступ непосредственно к зоне острой окклюзии.
• В настоящее время чаще всего выполняют непрямую
эмболэктомию, т.е. извлечение эмболов и тромботических масс из
артериальных сегментов, расположенных проксимальнее и дистальнее
артериотомического отверстия, с помощью баллонного катетера,
который позволяет эффективно удалять эмболы и продолженные
тромбы через поверхностные, легко доступные артерии.
Эмболэктомию из бедренной и подвздошной артерий выполняют
из доступа в верхней трети бедра с обнажением бифуркации
бедренной артерии (рис. 34-5).
При эмболии бифуркации аорты применяют двусторонний
бедренный доступ, позволяющий путём повторного ретроградного
зондирования фрагментировать и по частям удалить проксимально
расположенный эмбол.
Рис. 34-5, Схема эмболэктомии из
подвздошной артерии с помощью
баллонного катетера.
Эмболэктомию из подколенной артерии осуществляют из тибио-
медиального доступа. Им же пользуются для ретроградного удаления
эмболов и тромбов из берцовых артерий. Доступом позади
медиальной лодыжки обнажают заднюю большеберцовую артерию. Ревизию
передней большеберцовой артерии выполняют через тыльную
артерию стопы.
Для эмболэктомии из артерий верхней конечности используют
единый доступ — в локтевой ямке с обнажением бифуркации плечевой
артерии. Прямой доступ применяют чрезвычайно редко, например
для резекции шейного ребра. В части случаев, при невозможности
адекватного восстановления кровотока из-за распространённого
продолженного тромбоза артерий предплечья, приходится обнажать
артерии на запястье.
Оперативные вмешательства при острых тромбозах и эмболии на
фоне атеросклероза принципиально отличаются необходимостью
выполнения тех или иных артериальных реконструкций
одновременно с тромбэктомией.
При остром тромбозе аорты или подвздошных артерий обычно
выполняют различные шунтирущие операции. В зависимости от
тяжести состояния больного и объёма окклюзионно-стенотического
194 ♦ Хирургические болезни ♦ Том 2 О Часть IV ♦ Глава 34
поражения это может быть аорто-бедренное или подвздошно-бедрен-
ное шунтирование, либо экстраанатомическое (перекрёстное под-
вздошно-бедренное, бедренно-бедренное или подмышечно-бедрен-
ное) шунтирование (см. главу 35).
При остром тромбозе бедренно-подколенного сегмента
возможны бедренно-подколенное и бедренно-тибиальное шунтирование, а
также различные виды профундопластики (расширение просвета сте-
нозированной глубокой артерии бедра).
Осложнения
Изменения, возникающие в организме после восстановления
кровообращения в конечности (эмбол- или тромбэктомии), принято
называть постишемическим синдромом. Он имеет много общего с так
называемым краш-синдромом, или синдромом жгута. Тяжесть
выраженности постишемического синдрома, как правило, прямо
пропорциональна степени ишемии конечности, однако зависит также от
полноты восстановления кровообращения и компенсаторных
возможностей организма. Условно постишемические расстройства
можно разделить на общие и местные.
Под местными проявлениями постишемического синдрома
подразумевают развитие отёка дистальных отделов конечности, при этом отёк
может быть тотальным, захватывающим мышцы и подкожную
клетчатку или субфасциальным — поражающим лишь мышцы.
Внезапное поступление оксигенированной крови к ишемически
поражённым мышцам вызывает появление и освобождение свободных
радикалов кислорода и дальнейшие повреждения клеток. Общие
нарушения обусловлены попаданием в кровоток большого количества
веществ, обладающих токсическим действием, и заключаются в
поражении всех систем и нарушением всех функций организма.
Попадание в общий кровоток большого количества недоокисленных
продуктов из очага ишемии ведёт к тяжёлому метаболическому ацидозу.
Миоглобин из разрушенной мышечной ткани выводят почки. Миогло-
бинурия в условиях ацидоза способствует развитию миоглобинуричес-
кого тубулярного нефроза, приводящего к острой почечной
недостаточности. Её развитию способствуют эпизоды артериальной гипотензии,
способные сопровождать период реваскуляризации. Вымывание из
венозного отдела капиллярного русла и вен в зоне ишемии
макроагрегатов форменных элементов и микротромбов ведёт к эмболизации
лёгочного сосудистого русла и дыхательной недостаточности.
Острая артериальная непроходимость -О 195
Ацидоз, поступление большого количества токсических
продуктов повреждённых тканей приводят к развитию сердечно-сосудистой
недостаточности, проявляющейся артериальной гипотензией и
появлением инфарктоподобных изменений на электрокардиограмме.
Постишемический синдром может проявляться как поражением всех
трёх систем, так и возможным превалированием острой почечной,
дыхательной или сердечно-сосудистой недостаточности.
Профилактика
Проблема предотвращения эмболии артерий большого круга
кровообращения связана с коррекцией эмбологенных заболеваний
(клапанные пороки левых отделов сердца, ИБС). Своевременное
протезирование сердечных клапанов, реваскуляризация миокарда
путём аортокоронарного шунтирования или стентирования венечных
артерий и устранение нарушений сердечного ритма препятствуют
возникновению внутрисердечных тромбов, тем самым предотвращая
развитие тромбоэмболии магистральных артерий. Если кардиохирурги-
ческие вмешательства невозможны, следует рассмотреть вопрос о
длительном (пожизненном) приёме больными непрямых
антикоагулянтов, что в 2 раза снижает частоту развития эмболии у подобного
контингента больных.
В плане профилактики тромбоза большое значение имеют
назначение дезагрегантов больным облитерирующим атеросклерозом и
проведение коррекции дислипидемии.
Прогноз
В отношении сохранения жизнеспособности конечности прогноз
у больных с артериальной тромбоэмболией при условии быстрого
восстановления магистрального кровотока благоприятный. Вместе с
тем летальность, обусловленная декомпенсацией кровообращения,
достигает 25%. Отдалённый прогноз неблагоприятный: в течение 5
лет до 40% больных погибают от прогрессирования заболеваний
сердца и рецидива эмболии церебральных и висцеральных сосудов.
При остром тромбозе прогноз также достаточно серьёзный.
Около 30% больных подвергаются ампутации конечности в связи с
развитием её гангрены. Летальность за счёт гангрены и тяжёлых
фоновых заболеваний сердечно-сосудистой системы также достигает 30%.
ХРОНИЧЕСКИЕ
ОБЛИТЕРИРУЮЩИЕ
ЗАБОЛЕВАНИЯ АОРТЫ
И ЕЁ ВЕТВЕЙ
Наиболее распространённые заболевания, ведущие к
постепенному сужению и полной окклюзии просвета аорты и магистральных
артерий, — облитерирующий атеросклероз, облитерирующий тром-
бангиит и неспецифический аортоартериит. Несмотря на различную
их природу, все они проявляются синдромом хронической ишемии
конечностей или внутренних органов.
Частота этой патологии варьирует от 2,2% в общей популяции
населения до 17% в возрастной группе 55-70 лет.
Основные черты патологии
■
Облитерирующий атеросклероз — хроническое заболевание, в
основе которого лежат системные дегенеративные изменения
сосудистой стенки с образованием атером в субинтимальном слое с
последующей их эволюцией.
Факторы риска атеросклероза — артериальная гипертензия,
сахарный диабет, курение, нарушения липидного обмена, высокое
содержание фибриногена, повышение содержания гомоцистеина в
плазме, гиподинамия, нерациональное питание.
Условно последовательность патогенетических расстройств
можно описать следующими стадиями. Дислипидемия с развитием
микротромбоза, появлением жировых и желатиновых пятен. Далее
развивается склероз (пролиферация клеток соединительной ткани). Из
жировых пятен, скоплений холестерина, альбумина, глобулинов и
фибрина образуется атерома (атеросклеротические бляшки обычно
возникают в крупных и средних артериях, чаще в области
бифуркаций). И наконец происходит изъязвление атеромы или
кровоизлияние в неё, образуется локальный тромб, приводящий к облитерации
артерии. Распространённая тромботическая окклюзия приводит к
острой артериальной непроходимости (см. главу 34).
Атеросклероз — системное заболевание, поражающее артерии
самых различных сосудистых регионов. Для клинической практики
наиболее значим этот патологический процесс, протекающий в коронар-
Хронические облитерируюшие заболевания аорты и ее ветвей О 197
ных артериях (проявляется признаками ИБС), сонных артериях
(основная причина ишемических инсультов головного мозга), брюшной
аорте и артериях нижних конечностей (вызывает хроническую
ишемию ног и потенциально — их гангрену). Врач любой специальности
должен осознавать, что все эти заболевания — звенья одной цепи,
одного патологического процесса, который имеет разные проявления,
протекающие параллельно либо с доминированием одного из них. В этой
главе облитерирующий атеросклероз рассмотрен в качестве причины
хронической артериальной недостаточности нижних конечностей.
Облитерирующий тромбангиит — системное
иммунопатологическое воспалительное заболевание артерий и вен, преимущественно
мелкого и среднего калибров, с вторичными элементами
аутоиммунной агрессии. Поражает, как правило, мужчин в возрасте до 40 лет.
Существует несколько теорий возникновения облитерирующего
тромбангиита: инфекционная, нейроэндокринная, неврогенная,
аутоиммунная, наследственная, что свидетельствует о том, что
этиология заболевания до конца не ясна. К предрасполагающим
факторам относят курение табака, травмы, отморожения, перенесённые
инфекции (например, вирусная или хламидийная). Заболевание имеет
волнообразное течение с периодами ремиссии и обострения.
Для облитерирующего тромбангиита характерны следующие
моменты;
• поражение сосудистого русла развивается по воспалительному
сценарию;
• в патологический процесс, начиная с ранних этапов развития
заболевания, вовлекаются сосуды дистального русла, включая мик-
роциркуляторное звено;
• поражению артериального русла всегда сопутствуют
тождественные воспалительные изменения в поверхностных и глубоких венах
конечностей;
• поражение сосудистого русла конечности чаще всего имеет
восходящий характер, т.е. с течением времени распространяется отдис-
тальных отделов артерий и вен на проксимальные сегменты;
• в периоды стихания острой фазы васкулита в дистальном
сосудистом русле происходит развитие коллатеральной сосудистой сети,
возрастает количество артерио-венозных анастомозов.
Неспецифический аортоартериит — системное заболевание
аутоиммунного генеза, ведущее чаще всего к стенозированию аорты и
магистральных артерий. Характеризуется поражением не только
брюшной, но и грудной аорты и её дуги. Нередко ведущим синдромом
198 ♦ Хирургические болезни -0- Том 2 ♦ Часть IV *0 Глава 35
бывает стеноз почечных артерий. Гистологически выявляют панар-
териит с выраженной гиперплазией интимы, медии и адвентиции.
Этиология не совсем ясна, существует туберкулёзная концепция,
базирующаяся на схожести гигантских клеток гранулём при
неспецифическом аортоартериите и туберкулёзе. Характерное образование
аневризматических расширений объясняют развитием
аутоиммунного медионекроза. Среди пациентов преобладают женщины
репродуктивного возраста, что позволяет говорить о роли гормонального
влияния. Кроме этого, на сегодняшний день есть доказательства
аутоиммунного механизма возникновения неспецифического аортоарте-
риита. Тем не менее антигены, ответственные за активацию этих
процессов, до сих пор не выявлены.
Классификация
Локализация поражения:
• аорто-подвздошный сегмент — синдром Лериша (облитерирую-
щий атеросклероз, неспецифический аортоартериит);
• бедренно-подколенный сегмент (облитерирующий атеросклероз);
• подколенно-берцовый сегмент (облитерирующий атеросклероз,
облитерирующий тромбангиит);
• многоэтажное поражение (облитерирующий атеросклероз);
• мультифокальное поражение — артерии конечностей,
головного мозга, внутренних органов (облитерирущий атеросклероз,
неспецифический аортоартериит).
Характер поражения:
• стеноз;
• окклюзия.
Стадии хронической артериальной недостаточности нижних
конечностей (по Фонтейну—Покровскому):
• первая — дистанция перемежающейся хромоты непостоянная,
более 1000 м;
• вторая — дистанция лимитирующей перемежающейся хромоты:
-А-от 200 до 1000 м;
-Б-от25до200м;
• третья — больной может пройти несколько шагов, боли в покое;
• четвёртая — трофические нарушения (язвы, некрозы, гангрена).
Третью и четвёртую стадии принято объединять под общим на-
ванием «критическая ишемия».
Хронические облитерируюшие заболевания аорты и ее ветвей ♦ 199
Клиническая картина
Облитерируюшие заболевания брюшной аорты и артерий
нижних конечностей проявляются синдромом хронической
артериальной недостаточности, складывающимся из ряда симптомов. На
ранних стадиях характерны жалобы на повышенную чувствительность
к низким температурам, чувство онемения, парестезии и усталости
поражённой конечности. Патогномоничен для этого синдрома
симптом перемежающейся хромоты. Он заключается в появлении во
время ходьбы достаточно резких болей, ощущаемых в
определённой группе мышц нижних конечностей и заставляющих больного
прекратить движение. Это связано с недостаточным притоком
артериальной крови для удовлетворения метаболических
потребностей мышц при нагрузке. После небольшого отдыха боль
прекращается, и больной вновь может пройти определённое расстояние.
Дистанция, проходимая до начала боли в конечности,
поразительно повторяется.
Правда следует отметить, что примерно половина пациентов с ге-
модинамическими изменениями, достаточными для развития
перемежающейся хромоты, самостоятельно не жалуются на этот симптом.
Причин этого феномена несколько. Во-первых, стареющие пациенты
воспринимают увеличивающиеся трудности в ходьбе как нормальное
состояние для своего возраста, что требует от врача активного сбора
жалоб. Во-вторых, это связано с малоподвижным образом жизни
таких больных. В-третьих, данный факт объясняется широкими
возможностями коллатерального кровообращения для относительной
компенсации кровотока без провокации ишемических симптомов.
Когда кровоток становится недостаточен для удовлетворения
метаболических потребностей тканей конечности в отсутствие
движений, появляется боль в покое. Она обычно ощущается в пальцах и
стопе. Часто боль появляется ночью. В горизонтальном положении
происходит потеря компонента гидростатического давления,
вызванного силой тяжести столба крови между сердцем и зоной сужения
сосуда. Связанное с этим снижение регионарного АД может вызывать
уменьшение кровотока через стенозированный участок сосуда до
критического порога, после чего возникает болевой синдром. Он
приводит к пробуждению пациента. Боль в покое — грозный симптом,
предвестник развития гангрены конечности.
Трофические расстройства дистальных отделов конечности
проявляются развитием язв. Язвы считают ишемическими, если они воз-
200 0* Хирургические болезни ♦ Том 2 О Часть IV <> Глава 35
никают на фоне окклюзионно-стенотического поражения артерий и
не поддаются лечению в течение 6 нед. Их чаше обнаруживают на
подошвенной поверхности стопы или между пальцами, пальцы
также могут подвергаться некрозу целиком. Это происходит в
результате травмы кожи, даже незначительной. На ишемизированной
конечности малейшее повреждение не поддаётся местному лечению и часто
прогрессирует. Последняя стадия артериальной недостаточности
проявляется некрозами кожи и гангреной. Присоединение вторичной
инфекции может привести к развитию влажной гангрены и стать
источником сепсиса.
Окклюзия бифуркации аорты и подвздошных артерий (синдром
Лериша) характеризуется следующими проявлениями:
• «высокой» перемежающейся хромотой (боль при ходьбе
возникает как в икроножных мышцах, так и в области ягодиц и задней
поверхности бёдер);
• симптомами артериальной недостаточности мышц тазового дна
(недержание газов);
• развитием импотенции;
• симметричным снижением либо отсутствием пульсации
бедренных артерий.
Окклюзию бедренных и подколенных артерий встречают
наиболее часто. При изолированном поражении поверхностной бедренной
артерии клиническая картина скудная, так как сохранение
кровотока по глубокой артерии бедра через анастомозы с подколенной
артерией достаточно компенсирует кровообращение в дистальных
отделах конечности. При сочетании данного поражения с окклюзией
аорты или подвздошных артерий клиническая картина более
выражена — от болей в икроножных мышцах при ходьбе на короткие
дистанции до появления некротических очагов.
В процессе диагностики хронической артериальной
недостаточности необходимо выявить локализацию стеноза или
окклюзии, установить их причину, оценить стадию заболевания, тяжесть
сопутствующей патологии и степень поражения других сосудистых
бассейнов.
При сборе анамнеза важно выяснить характер течения
заболевания (длительное монотонное течение либо чередование периодов
ремиссии и обострения).
При осмотре поражённой конечности выявляют мышечную
гипотрофию, бледность кожных покровов, атрофическое
истончение кожи, выпадение волос на голени, гипертрофию и слоистость
Хронические облитерируюшие заболевания аорты и ее ветвей <> 201
ногтевых пластинок, гиперкератоз. При пальпации конечности
обращают внимание на снижение кожной температуры, наличие или
отсутствие пульсации бедренной и подколенной артерий, а также
артерий стопы (см. рис. 34-1—34-3). Для выявления стеноза
необходимо произвести аускультацию брюшной аорты и общей бедренной
артерии. Наличие систолического шума свидетельствует о стеноти-
ческом поражении соответствующего сосуда. Помимо исследования
всех конечностей как нижних, так и верхних (а не только
поражённых), следует выяснить наличие нарушений кровотока в других
сосудистых регионах. В частности, при обследовании больных облите-
рирующим атеросклерозом необходима аускультация сонных
артерий (рис. 35-1).
Инструментальные методы диагностики
В первую очередь пациенту следует выполнить ультразвуковое
допплеровское исследование. Это наиболее простой и доступный
метод диагностики, позволяющий по показателям регионарного
систолического давления объективно оценить функциональное
состояние периферического кровообращения. Общее представление о
состоянии периферической гемодинамики нижних конечностей даёт
определение лодыжечно-плечевого индекса. Индекс рассчитывают
как отношение максимального артериального систолического
давления на одной из берцовых артерий к этому показателю на плечевой
артерии. В норме его значения превышают 1,0. Уменьшение
величины индекса — показатель стенозирующего или окклюзирующего
МЛА
Рис. 35-1. Аускультация сонной
артерии при её атеросклероти-
ческом стенозе выявляет
систолический шум.
процесса в артериях. Снижение этого показателя ниже 0,3 отражает
критическое состояние кровообращения в поражённой конечности.
Определение лодыжечно-плечевого индекса не только в покое, но
и в сочетании с тредмил-тестом позволяет оценить состояние
коллатерального кровотока и компенсаторные возможности
кровообращения конечности. Ходьба на тредмиле вызывает физиологически
необходимый приток крови к мышцам нижних конечностей. Если
приток крови ограничен проксимальным стенозом, давление в дис-
тальных отделах падает. Этот тест позволяет уточнить стадию
заболевания и выделить среди больных с перемежающейся хромотой
пациентов, близких к критической ишемии.
Наиболее перспективным представляется ультразвуковое
дуплексное сканирование. Современные ультразвуковые сканеры способны
одновременно показывать в режиме реального времени
ультразвуковую структуру сосуда и анализ разделённых по направлению
выявленных потоков крови в просвете сосуда. Это даёт возможность
визуализировать окклюзии и стенозы, зоны турбулентного кровотока,
вызванные поражением сосудистой стенки; выявить участки
нарушения кровотока в области гемодинамически значимых стенозов
(рис. 35-2). Помимо поражённой конечности, у пациентов с обли-
терирующим атеросклерозом следует обследовать сонные артерии.
Рис. 35-2. Ультразвуковая сканограмма при атеросклерозе бедренной артерии.
Хронические облитерируюшие заболевания аорты и ее ветвей ♦ 203
Для обследования больных с критической ишемией
используют чрескожное измерение напряжения кислорода, позволяющее
оценить жизнеспособность тканей и прогнозировать заживление
трофических язв.
Заключительным этапом обследования служит ангиография. С
помощью этого метода можно визуализировать всё сосудистое дерево
от аорты до стопы. Целесообразно выполнение снимков в двух
проекциях (прямой и боковой).
Ангиографические симптомы атеросклероза: неравномерное
сужение магистральных артерий, «изъеденность» контура артерий,
сегментарная обтурация артерий, кальциноз артерий; коллатеральные
сосуды крупные, прямые, хорошо развитые (рис. 35-3). В части
случаев для выбора правильной тактики хирургического лечения
предпринимают коронарную артериографию.
Ангиографические симптомы облитерирующего тромбангиита:
равномерное сужение артерий, вовлечение в патологический процесс
сосудов малого и среднего калибров, сегментарные окклюзионные
поражения, развитие штопорообразных коллатералей вокруг
участков окклюзии, отсутствие признаков атеросклероза, коническая
форма культи сосуда.
Рис. 35-3. Синдром Лериша (ан-
гиограмма). Отмечается
«изъеденность» контуров аорты и
артерий (атеросклеротические
бляшки), окклюзия правой
подвздошной артерии.
204 ♦ Хирургические болезни О- Том 2 ♦ Часть IV ♦ Глава 35
Отличительными ангиографическими признаками аортоартерии-
та служат сужение аорты и других основных артерий, которое может
быть коротким и сегментарным, протяжённым и диффузным вплоть
до полной окклюзии; дилатация артерий и формирование аневризм,
как веретенообразных, так и мешковидных.
Если дооперационная ангиография не предоставила достаточной
информации, после прямой ревизии сосудов при необходимости вы-
полняют интраоперационное ангиографическое исследование.
В качестве дополнительных методов инструментальной
диагностики используют электрокардиографию и велоэргометрию.
Дифференциальная диагностика
■
Наиболее часто приходится дифференцировать между собой три
основные причины хронической артериальной недостаточности
нижних конечностей (табл. 35-1).
Таблица 35-1. Дифференциально-диагностические критерии различных
причин хронической артериальной недостаточности
Клинические
признаки
1
Контингент
больных
Локализация
поражения
В анамнезе:
курение
переохлаждение
полиартриты,
полиневриты
и миокардиты;
ИБС
Перемежающаяся
хромота
Облитерирующий Облитерирующий Неспецифический
атеросклероз тромбангиит аортоартериит
2 3 4
Мужчины Мужчины Женщины
старше 40 лет 20—30 лет 20—30 лет
Брюшная аорта, Артерии голени, Брюшная аорта,
артерии: бедрен- глубокая артерия подвздошные
арные и подколен- бедра терии; возможно
ные, сонные, коро- поражение груд-
нарные, висцера- ной аорты, почеч-
льные ных артерий
Да Да Нет
Нет Да Нет
Нет Нет Да
Да Нет Нет
Да Низкая (боли Выражена
в стопе и голени) незначительно
Хронические облитерируюшие заболевания аорты и ее ветвей -0* 205
Окончание табл. 35-1
1
Тромбофлебиты
поверхностных
вен
Лабораторная
диагностика
Течение
заболевания
2
Нет
Нарушения
липидного обмена
Медленно
прогрессирующее
3
Да
Повышение СОЭ,
лейкоцитоз,
повышение
концентрации
циркулирующих
иммунных комплексов,
содержания
иммуноглобулинов
классов G и М при
обострении
Периоды
обострения и ремиссии
4
Нет
Повышение СОЭ,
небольшая
анемия, лейкоцитоз,
тромбоцитоз,
повышение
содержания <х2-глобулина,
положительная
реакция на С-реак-
тивный белок
Волнообразное
Лечение
Задачи лечения — замедление патологического процесса,
устранение болевого синдрома, восстановление трудоспособности,
предотвращение потери конечности и инвалидизации пациента.
Лечебная тактика зависит от стадии хронической артериальной
недостаточности.
• I и ПА стадии — показано только консервативное лечение.
• ПБ, III стадии — хирургическое лечение (реконструктивные
операции).
• IV стадия — хирургическое лечение (реконструктивная операция в
сочетании с некрэктомией или малой ампутацией). При
невозможности реваскуляризации у больных с критической ишемией
выполняют ампутацию конечности.
Консервативное лечение
Консервативное лечение необходимо всем больным независимо от
стадии заболевания, оно должно быть непрерывным и пожизненным.
Лечение включает амбулаторный, стационарный и
санаторно-курортный этапы. Первые рекомендации пациентам с перемежающейся хро-
206 ^ Хирургические болезни О- Том 2 ♦ Часть IV ♦ Глава 35
мотой включают полное прекращение курения, контроль массы тела,
регулярное выполнение программы упражнений
продолжительностью не менее 1 ч в день (ходьба до появления болей, отдых, затем
вновь продолжение ходьбы). Соблюдение этих рекомендаций часто
приводит к удвоению или даже большему увеличению проходимой
дистанции. Медикаментозное лечение включает следующие пункты.
• Средства, улучшающие реологические свойства крови, и антиаг-
реганты (низкомолекулярные декстраны, аспирин, дипиридамол,
различные производные пентоксифилина, тиклопедин, клопидо-
грел и др.).
• Лечение дислипопротеинемии при атеросклерозе — диета, гиполи-
пидемическая терапия (правастин, ловастин, симвастин, клофиб-
рат, никотиновая кислота и др.).
• Средства, активирующие метаболические процессы в тканях
поражённой конечности (солкосерил, актовегин, танакан, витамины).
• Препараты простагландина Е1 (вазапростан, алпростан).
• Глюкокортикоиды, НПВС и иммунотерапия при обострениях тром-
бангиита.
• Антивирусная и противохламидийная терапия (ацикловир, сума-
мед) при тромбангиите.
• Физиотерапевтическое лечение (диатермия на область поясницы,
диадинамические токи, магнитные поля).
• Санаторно-курортное лечение (сероводородные, радоновые,
нарзанные, хвойные, жемчужно-кислородные ванны; грязевые
аппликации на поясничную область, лечебная физкультура).
Оперативное лечение
Оперативное лечение включает эндоваскулярные вмешательства,
открытые реконструктивные операции и ампутации конечностей.
Эндоваскулярные вмешательства
В настоящее время широко используют бужирование стенозиро-
ванных (окклюзированных) артерий и баллонную ангиопластику.
Методика заключается в чрескожном пункционном введении внутрь
поражённой артерии двухпросветного баллонного катетера Грюн-
цига и раздувании баллона внутри просвета поражённой артерии.
Это приводит к увеличению просвета посредством разрыва интимы.
Хронические облитерируюшие заболевания аорты и ее ветвей ♦ 207
«запрессовывания» атеросклеротической бляшки и растягивания
сосудистой стенки. Метод успешен при стенозах и даже при окклюзиях
протяжённостью до 10 см (рис. 35-4). Дополнительное внутрипрос-
ветное стентирование улучшает результаты баллонной
ангиопластики и снижает риск развития повторного стеноза зоны дилатации.
Открытые операции
Открытые (прямые) операции применяют уже в течение
нескольких десятков лет. Их методика постоянно усовершенствуется, но
принципы остаются неизменными.
Эндартерэктомию используют при локализованных поражениях
бедренной артерии. После удаления атеросклеротически изменённого
участка интимы и восстановления кровотока выполняют боковую
пластику сосуда аутовенозной заплатой.
Рис. 35-4. Ангиограммы больного с облитерирующим атеросклерозом до (а)
и после (б) бужирования и баллонной ангиопластики бедренной артерии.
208 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 35
Шунтирование — наиболее распространённый вид прямого
оперативного восстановления магистрального кровотока путём
наложения искусственного обходного пути с использованием различных
материалов (аутовены, синтетического протеза). При вмешательствах
выше паховой складки для этой цели обычно применяют
синтетический трансплантат (рис. 35-5).
Рис. 35-5. Схема операции аорто-бедренного шунтирования при синдро
ме Лериша.
Если вмешательство выполняют на артериях ниже паховой склад]
предпочтение отдают шунтированию с помощью аутовены (рис. 35-6),
что обеспечивает лучший долгосрочный прогноз.
Существуют две альтернативные методики аутовенозного
шунтирования: реверсированной веной либо веной in situ. Первая методика
предусматривает выделение вены на всём протяжении, её реверсию,
т.е. поворот на 180°, чтобы венозные клапаны не мешали
артериальному кровотоку, и вшивание выше и ниже зоны окклюзии арте-
Хронические облитерируюшие заболевания аорты и ее ветвей ♦ 209
риального сосуда. При второй методике
подкожная вена остаётся на своём месте,
мобилизуют только проксимальные и ди-
стальные её сегменты для наложения
анастомозов. Венозные клапаны разрушают
специальным инструментом (вальвулото-
мом), вводимым через конец
трансплантата или через его ветви. Притоки вены
необходимо перевязать для предотвращения
послеоперационного артериовенозного
сброса крови. Преимущества этой
техники — возможность использования вены
меньшего диаметра и лучшая геометрия
шунта. Синтетические материалы при
реконструкциях на нижних конечностях
рекомендуют применять только в том случае,
если нет адекватной аутовены или
предполагаемая продолжительность жизни
пациента не превышает 2 лет.
Протезирование — замещение участка
поражённого сосуда искусственным
протезом с помещением трансплантата в ложе
иссечённой артерии. Эту операции
используют редко из-за её травматичности.
Непрямые методы реваскуляризации —
трансплантация большого сальника на
голень (на сосудистой ножке либо
свободная) в расчёте на образование нового
коллатерального русла.
В IV стадии заболевания наиболее
частая операция — ампутация конечности,
при этом выбирают оптимальный её
уровень с учётом зоны адекватного
кровоснабжения и границ ишемических
расстройств.
Операции обычно проводят под общей
или регионарной анестезией. Эпидураль-
ную блокаду предпочитают многие хирурги и анестезиологи, так как
этот метод позволяет добиться эффективной аналгезии с
минимальным сердечно-сосудистым риском. Продолжительное (в течение не-
Рис. 35-6. Схема
операции бедренно-подколен-
ного аутовенозного
шунтирования.
210 ♦ Хирургические болезни ♦ Том 2 О Часть IV ♦ Глава 35
скольких дней) введение анестетиков через катетер, установленный
в эпидуральном пространстве, обеспечивает в послеоперационном
периоде эффективную аналгезию и дистальную вазодилатацию.
После операции больные нетрудоспособны в течение 1-3 мес.
Курсы консервативного лечения необходимо проводить не реже
2 раз в год.
Осложнения
Раневые гнойные осложнения развиваются у 1—2% больных,
подвергшихся артериальному шунтированию. Частота ранних
послеоперационных тромбозов при реконструкциях аорто-подвздошного
сегмента составляет не более 3%, бедренно-подколенного — 8%.
Летальность после плановых сосудистых операций не
превышает 3%.
Прогноз
У пациентов в первой стадии хронической артериальной
недостаточности при проведении только консервативного лечения в 75%
случаев ишемические расстройства не прогрессируют. Частота
ампутаций в сроки до 8 лет составляет менее 7%.
Результаты реконструктивных операций во многом зависят от зоны
(уровня) вмешательства. После реконструктивных операций на аор-
то-подвздошном сегменте проходимость синтетических протезов в
сроки до 10 лет достигает 80—90%. Через 2 года после баллонной
ангиопластики остаются проходимыми 85% подвздошных артерий,
подвергшихся вмешательству, и 50% бедренных.
Наиболее частая причина летальности пациентов с хронической
артериальной недостаточностью нижних конечностей — прогресси-
рование атеросклеротического поражения других сосудистых
бассейнов и сопровождающие его осложнения. Риск смерти от ИБС
достигает примерно 60% всех летальных исходов у этой группы больных.
Смертность от ишемического инсульта составляет 10—15%. Другие
сосудистые причины, такие как висцеральный инфаркт и разрыв
аневризмы аорты, вызывают 10% смертей.
АНЕВРИЗМЫ АОРТЫ
И МАГИСТРАЛЬНЫХ АРТЕРИЙ
Аневризмой называют постоянно существующее расширение
артерии, превышающее нормальный диаметр сосуда в 2 раза и более.
Для инфраренального отдела аорты (рис. 36-1), где наиболее часто
встречают эту сосудистую патологию, правомочно считать
аневризмой любое его расширение свыше 3 см.
Основные черты патологии
По происхождению и структуре различают истинные и ложные
аневризмы.
• Истинные аневризмы содержат все обычные слои сосудистой
стенки (правда, в значительной мере изменённые) и имеют вид
веретенообразных либо мешотчатых образований.
• Ложные аневризмы возникают после травмы либо сосудистых
реконструктивных операций и формируются из пульсирующих гема-
Рис. 36-1. Аневризма брюшной аорты (фото момента операции). Аорта
пережата зажимом, указательный палец хирурга находится у шейки аневризмы.
212 ♦ Хирургические болезни ♦ Том 2 О* Часть IV ♦ Глава 36
том, полость которых непосредственно сообщается с просветом
артериального сосуда. Они имеют фиброзную капсулу,
образующуюся вследствие организации гематомы.
Истинные аневризмы чаще всего развиваются в дистальной части
абдоминальной аорты, подвздошных, общих бедренных и
подколенных артериях. Локализация ложных аневризм может быть любой, она
зависит от расположения повреждённых артериальных сосудов.
Общая черта всех аневризм — неуклонное их прогрессирование с
исходом в разрыв. Сочетание повышенной нагрузки на стенку
артерии (артериальная гипертензия, изменение конфигурации сосуда,
возникновение «реактивной» струи крови дистальнее стенозирован-
ного участка сосуда) и факторов, способствующих ослаблению
среднего её слоя (воспаление, инфекция, атеросклеротическая
деградация либо наследственный дефект структурных белков), приводит к
постепенному увеличению размеров аневризмы. Наибольшей
способностью к «росту» имеют так называемые «микотические» аневризмы,
возникновение которых связывают с хроническим инфекционным
процессом в стенке артерии.
В большинстве случаев в просвете длительно существующего анев-
ризматического мешка формируется плотный пристеночный тромб,
как бы выстилающий стенки аневризмы и сохраняющий обычный
просвет сосуда. Он возникает из-за резкого замедления кровотока при
увеличении диаметра аневризмы. Раньше полагали, что тромб
уменьшает нагрузку на стенку сосуда, играя своего рода защитную роль.
В настоящее время установлено, что он не предохраняет аневризму
от разрыва, более того, в этой зоне активно протекает протеолиз
стенки артерии из-за депонирования в тромбе активных лейкоцитов.
Разрыв аневризмы приводит к массивной кровопотере, что иногда
в течение нескольких минут заканчивается необратимым
геморрагическим шоком и гибелью больного. При разрыве аневризмы аорты в
забрюшинное пространство образуется гематома. В условиях
падения АД гематома может тампонировать область разрыва, в результате
чего состояние пациента стабилизируется, давление постепенно
начинает повышаться, и кровотечение возобновляется вновь. В
клинической практике такое развитие этого осложнения определяют как
двух- или трехэтапный разрыв аорты. Подобная ситуация
предоставляет хирургам возможность успешного оперативного вмешательства.
Разрыву аневризмы часто предшествует более или менее
продолжительный период усугубления симптоматики в виде болей в проекции
аневризмы, а также её быстрого увеличения. Это обусловлено рас-
Аневризмы аорты и магистральных артерий ♦ 213
слоением кровью волокон среднего слоя сосудистой стенки, несущего
основную нагрузку в противодействии давлению.
Разрыв аневризмы не следует путать с её расслоением. При
расслаивающих аневризмах внутри стенки аорты в результате надрыва
внутреннего слоя образуется второй просвет, который заканчивается
слепо либо вновь сообщается с истинным просветом аорты.
При сочетании аневризмы с атеросклеротическим сужением дис-
тального артериального русла тромбоз аневризматического мешка
нередко вызывает симптомы ишемии конечностей. Фрагментация
пристеночного тромба проявляется признаками дистальной эмболизации
артериального русла. Аневризма может прорываться в соседние
полые органы, тогда образуются внутренние свищи (аортокавальный,
аортодуоденальный и др.).
Важнейшее клиническое значение имеют аневризмы
абдоминальной аорты. Это связано с их распространённостью и склонностью
к разрыву, сопровождающемуся высокой летальностью (до 95%).
За последние 30 лет частота этого заболевания неуклонно
прогрессирует и в настоящее время достигает 25—40 случаев на 100 000
населения в год. Мужчины более подвержены развитию аневризм, чем
женщины. Соотношение полов в возрасте 60—65 лет составляет 13:1,
в возрасте старше 80 лет оно снижается до 4:1. Наибольший риск
возникновения аневризм брюшной аорты присущ курящим
мужчинам старше 65 лет, страдающим артериальной гипертензией:
частота аневризм среди них составляет 12%. Около 10% аневризм
абдоминального отдела аорты — так называемые «воспалительные».
Они сопровождаются выраженной периаортальной воспалительной
реакцией, часто ретроперитонеальным фиброзом с вовлечением в
процесс окружающих структур — двенадцатиперстной кишки и
мочеточников.
Структура аневризм (происхождение):
• истинные (врождённые, дегенеративные, инфекционные);
• ложные (травматические, послеоперационные).
Локализация:
• аортальные;
• артериальные: периферические (артерии конечностей),
висцеральные, церебральные.
Форма:
• мешковидная;
• веретенообразная.
Клиническое течение:
• неосложнённое;
• осложнённое разрывом, расслоением, тромбозом,
образованием внутренних свищей (артериовенозных, артериоинтестинальных).
Этиология и патогенез
Для истинных аневризм характерно частое сочетание
дегенеративных изменений сосудистой стенки в зоне поражения с
атеросклерозом аорты и артерий нижних конечностей. Это обусловило
возникновение бытовавшей до недавнего времени «атеросклеротической»
теории их образования. Теперь можно считать доказанным, что связь
этих двух заболеваний не является патогенетической. Аневризмы
относят к полиэтиологичным заболеваниям, генез большинства из них
связан с взаимодействием двух факторов — усилением нагрузки на
стенку артерии и уменьшением её способности противостоять
действию этого патогенетического фактора. Вместе с тем., при
травматических и послеоперационных (в зоне сосудистых анастомозов)
аневризмах ведущим этиологическим моментом становится дефект
артериальной стенки, возникающий без какой-либо необычной гемо-
динамической перегрузки. Напротив, в случаях постстенотических
аневризм наибольшее значение имеет возникающий при стенозах
эффект «реактивной струи» крови, воздействующей на стенку сосуда.
В дегенеративных аневризмах расширение сосуда возникает на
фоне ослабления стенки вследствие разрушения и ремоделирования двух
основных протеинов — коллагена и эластина. Ключевой момент в
развитии таких аневризм — инфильтрация сосудистой стенки клетками
воспаления, неконтролируемое образование ими цинк-зависимых
ферментов (металлопротеаз). Они разрушают эластин и коллаген, что
вызывает развитие и прогрессирование аневризмы. Содержание
эластина при аневризмах неуклонно уменьшается: так, в норме в аорте
его доля составляет 35% сухого веса, а при аневризме снижается до
8% (в нормальных условиях эластин имеет период полураспада,
равный примерно 70 годам, и он не может восстанавливаться у
взрослого человека). Артериальная гипертензия — второй важный фактор
появления и быстрого роста дегенеративных аневризм.
Аневризмы аорты и магистральных артерий ♦ 215
Генетическая предрасположенность играет важную роль в развитии
заболевания. У родственников больных с аневризмами
абдоминальной аорты риск развития этой патологии в 3—5 раз превышает
среднестатистические значения- Связь наследственного дефекта в структуре
протеина аортальной стенки (фибриллина) и возникновения аневризм
аорты при синдроме Марфана очевидна. При синдроме Элерса—
Данло выявляют структурную неполноценность коллагена 3-го типа.
Микотические (инфекционные) аневризмы развиваются как
следствие бактериемии и проникновения микроорганизмов в артериальную
стенку с развитием выраженного воспаления, что сопровождается
массивным образованием ферментов, вызывающих деградацию
эластина и коллагена. Чаще всего причиной развития инфекционных
аневризм становятся штаммы Salmonella, Streptococcus и Klebsiella. Для
аневризм такой природы характерны мешковидная форма, быстрое
увеличение и склонность к формированию внутренних свищей.
Клиническая картина
Классическими признаками любой аневризмы считают наличие
пульсирующего образования в проекции крупного артериального
ствола с выслушиваемым над ним систолическим шумом (рис. 36-2).
Вместе с тем сосудистый шум может не выслушиваться и пульсация
аневризмы быть не столь очевидной при тромбозе аневризматичес-
кой чаши. Симптомы заболевания во многом зависят от локализа-
[ ции аневризмы.
Рис. 36-2. Клиническое распознавание аневризмы брюшной аорты. В брюш
J ной полости пальпируется пульсирующее образование, над которым выслу
шивается систолический шум.
216 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV <0> Глава 36
При аневризмах грудного отдела аорты и торакоабдоминальных
аневризмах основными симптомами могут быть следующие
проявления.
• Боль в грудной клетке с иррадиацией в спину и лопатки.
• Охриплость голоса и кашель.
• Дисфагия из-за сдавления пищевода.
• Аортальная регургитация, связанная с расширением клапанного
кольца.
• Синдром верхней полой вены (одутловатость лица, отёк верхней
половины туловища) при сдавлении её аневризмой.
У части больных клинические симптомы вообще отсутствуют, и
тогда аневризма бывает случайной находкой во время
рентгенологического исследования или УЗИ. Для травматических аневризм
грудной аорты (часто возникают при ударе водителя о руль при
автотравмах) характерна локализация поражения — чуть дистальнее от-
хождения ле-вой подключичной артерии. При разрыве аневризмы
грудного отдела быстро возникает коллапс с признаками тампонады
сердца и гемоторакса.
У больных с аневризмами абдоминальной аорты заболевание
проявляется следующими симптомами.
• Боль в животе с возможной иррадиацией в позвоночник.
• Дизурия при сдавлении мочеточника.
• Болезненная пульсация в животе.
• Отёк нижних конечностей при сдавлении нижней полой или
подвздошных вен.
Тромбоз аневризматического мешка может быть причиной
тромбоэмболии дистального сосудистого русла, что проявляется
симптомами острой непроходимости артерий нижних конечностей, при
эмболии мелкими фрагментами тромботических масс возникает
синдром «синего пальца» — цианоз, некрозы дистальных фаланг
пальцев стоп при сохранённой пульсации на уровне лодыжки. Разрыв
аневризмы наряду с усилением болей в животе проявляется быстрым
развитием коллапса. Возможно возникновение внутрикожных
гематом в поясничной и паховой областях, а из-за сдавления гематомой
мочеточника и низкого АД — анурия.
Образование свищей с окружающими органами встречают в 3-7%
всех осложнений. Оно характеризуется клинической картиной
массивных рецидивирующих желудочно-кишечных кровотечений (при
образовании аортодуоденального свища). Прорыв аневризмы в ниж-
Аневризмы аорты и магистральных артерий О- 217
нюю полую вену приводит к внезапному возникновению острой пра-
вожелудочковой недостаточности, увеличению печени, отёкам
нижних конечностей.
Приблизительно в 50% случаев аневризмы абдоминальной аорты
бессимптомны, обычно их случайно обнаруживают при УЗИ органов
брюшной полости.
Аневризмы периферических артерий клинически проявляются, как
правило, при достижении ими значительных размеров либо при
развитии осложнений. Основным симптомом служит наличие
видимого или пальпируемого округлого пульсирующего образования в
проекции магистральной артерии. Боль возникает за счёт компрессии
окружающих тканей и проходящих рядом нервных стволов.
Из осложнений наиболее часто встречают тромбоз аневризмы, что
проявляется симптомами острой артериальной недостаточности
сосудистого бассейна, снабжаемого поражённой артерией. Дисталь-
ная эмболизация вызывает развитие синдрома «синего пальца», а
тромбоэмболия в бассейне сонных артерий — клиническую картину
ишемического инсульта. При разрыве аневризмы магистральной
артерии быстро возникает массивная гематома мягких тканей области
аневризмы.
Аневризмы висцеральных ветвей чаще всего бессимптомны, лишь
изредка они проявляются болями в животе. Разрыв,
сопровождающийся коллапсом, острыми болями в животе и признаками внутри-
брюшного кровотечения, часто бывает первым их проявлением.
Прорыв аневризмы селезёночной артерии в желудок вызывает симптомы
массивного желудочно-кишечного кровотечения.
Лабораторная и инструментальная диагностика
Лабораторные методы имеют значение в диагностике врождённых
дефектов соединительной ткани и в случаях аневризм, возникающих
при некоторых коллагенозах (системной красной волчанке, гиган-
токлеточном артериите, узелковом периартрите). Как правило, у
таких больных определяют наличие С-реактивного белка, повышение
СОЭ, лейкоцитоз. Иммунологические тесты выявляют дефекты
клеточного и гуморального звеньев иммунитета. При инфекционных
аневризмах посев крови нередко подтверждает септицемию.
Обычная рентгенография органов грудной клетки в передне-задней
проекции часто позволяет заподозрить диагноз аневризмы грудного
218 <0» Хирургические болезни <0> Том 2 ♦ Часть IV О Глава 36
отдела аорты в связи со значительным расширением тени
средостения. Наибольшее значение в диагностике торакальных и торакоаб-
доминальных аневризм имеют КТ (желательно с
контрастированием), рентгеноконтрастная и магнитно-резонансная ангиография.
Эхокардиография даёт важную информацию о состоянии начального
отдела аорты, а исследование транспищеводным датчиком
визуализирует нисходящую часть грудной аорты.
Современная компьютерная обработка данных, полученных с
помощью спиральной КТ, даёт возможность трёхмерной обработки
срезов (ЗО-реконструкция), что позволяет выстраивать
пространственный объёмный макет аневризмы.
Наибольшее значение для скрининга аневризм абдоминальной
аорты, её висцеральных ветвей и периферических артерий имеет УЗИ,
позволяющее за считанные минуты установить факт наличия
аневризмы и определить её размеры (рис. 36-3). Диагностическая точность
УЗИ в определении истинных размеров аневризмы находится в
пределах 3 мм. Другими методами диагностики аневризм
абдоминальной аорты служат КТ с контрастным усилением,
рентгеноконтрастная ангиография и МРТ.
Решающее значение в диагностике разрыва аневризм
абдоминальной аорты имеет классическая триада симптомов — боль в животе,
коллапс и наличие пульсирующего образования в животе. Для
подтверждения диагноза необходимо УЗИ, особенно в тех ситуациях,
Рис. 36-3. Ультразвуковая сканограмма больного с аневризмой аорты.
когда системная гипотензия и гиперстеническое телосложение
больного делают результаты пальпации сомнительными.
Наличие забрюшинной гематомы, характерной для разрыва
аневризмы абдоминальной аорты и подвздошных артерий, наилучшим
образом выявляет КТ (рис. 36-4). В этом отношении УЗИ обладает
Рис. 36-4. Компьютерная томограмма при забрюшинном разрыве
аневризмы аорты.
меньшей чувствительностью и специфичностью. В экстренной
хирургии при неясной причине острого живота диагностическое
значение может иметь лапароскопия, выявляющая у таких больных заб-
рюшинную гематому.
Дифференциальная диагностика
Аневризмы грудного отдела аорты и торакоабдоминальные
аневризмы следует дифференцировать с опухолями средостения, также
способными проявляться симптомами сдавления пищевода и
окружающих структур. Аневризмы абдоминальной аорты следует
дифференцировать с опухолями забрюшинного пространства и почек, при
которых может определяться передаточная пульсации образования
от подлежащей неизменённой аорты. Часто девиацию (извитость)
брюшной аорты вследствие атеросклероза принимают за аневризму.
Подковообразная почка, лежащая на аорте, нередко приводит к п
становке неверного диагноза «аневризмы абдоминальной аорты».
УЗИ позволяет уточнить характер образования, измерить внутренний
просвет аорты и верифицировать диагноз.
Иногда серьёзные диагностические сложности возникают при
разрывах аневризмы абдоминальной аорты, когда ситуация требует
безотлагательных тактических решений, а тяжёлое состояние больного
препятствует проведению дополнительного инструментального
обследования. Перитонит различной этиологии может симулировать
клинику разрыва аневризмы абдоминальной аорты, если диагноз
аневризмы был ранее поставлен больному. В ряду заболеваний, с
которыми приходится дифференцировать разрыв аневризмы, стоят
также почечная колика, панкреонекроз, инфаркт миокарда
(абдоминальная форма), кишечная непроходимость.
Аневризмы бедренной артерии следует дифференцировать с
паховым лимфаденитом и бедренной грыжей. Аневризмы
анастомозов могут протекать под маской послеоперационной серомы или
лимфаденита.
Киста заднего заворота суставной сумки коленного сустава (киста
Беккера) — основная патология, часто принимаемая за аневризму
подколенной артерии. Для дифференциальной диагностики в этом
случае наибольшее значение имеет ультразвуковое дуплексное
сканирование подколенной артерии.
Аневризмы висцеральных артерий необходимо
дифференцировать с опухолями брюшной полости и кистами поджелудочной
железы. Наличие кровотока в образовании по данным ультразвукового
дуплексного сканирования и ангиографии подтверждает диагноз
аневризмы.
Лечение
В выборе тактики лечения принципиальное значение имеют
такие характеристики аневризмы, как её диаметр, наличие
симптомов, скорость увеличения размеров и возникновение осложнений.
При бессимптомных аневризмах небольшого размера
рекомендуют наблюдение за больным, контроль факторов риска прогрес-
сирования аневризмы (артериальная гипертензия, курение), при
разрывах аневризмы показана экстренная операция. В остальных
случаях предпринимают плановое оперативное лечение с учётом
Аневризмы аорты и магистральных артерий О 221
всех факторов риска дальнейшего роста и разрыва аневризмы, с
одной стороны, и переносимости операции для конкретного
больного—с другой.
Хирургическое лечение заключается в резекции аневризмы и
замещении поражённого участка сосуда синтетическим протезом.
В последние годы активно разрабатывают методы эндоваскулярного
лечения заболевания с помощью специальных эндопротезов,
вводимых в просвет аневризмы через периферические артерии. Эта
процедура существенно снижает риск оперативного вмешательства, но
возможна далеко не во всех случаях.
Аневризмы грудной аорты,
торакоабдоминальные аневризмы
При бессимптомных аневризмах диаметром менее 6 см показаны
лечение артериальной гипертонии и наблюдение с помощью КТ и
эхокардиографии, возможно также периодическое выполнение
транспищеводного УЗИ.
Показания к оперативному лечению:
• диаметр аневризмы более 6 см при наличии жалоб либо
увеличение аневризмы за время наблюдения (особенно при сопутствующей
артериальной гипертензии);
• посттравматический характер аневризмы;
• синдром Марфана при диаметре аневризмы более 6 см, даже при
бессимптомном течении;
• разрыв аневризмы (показание к экстренному хирургическому
вмешательству).
Хирургическое вмешательство при аневризме грудной аорты
(резекция аневризмы и протезирование аорты), как правило, сочетают
с одновременной заменой аортального клапана и восстановлением
кровотока по коронарным артериям. Выполняют в условиях
искусственного кровообращения. Подобная операция чрезвычайно
травматична и сопровождается довольно высокой летальностью.
Основные осложнения — инфаркт миокарда, медиастинит, кровотечение.
При мешковидных аневризмах иногда возможна частичная резекция
аорты с её пластикой.
Торакоабдоминальные аневризмы при вовлечении дуги аорты про-
ксимальнее устья левой подключичной артерии обычно приводят к
необходимости проведения операции в условиях искусственного
кровообращения, дистальнее — в условиях гипотермии или вспомога-
222 ♦ Хирургические болезни ♦ Том 2 О Часть IV О Глава 36
тельного кровообращения. Изменённую аорту протезируют
искусственным протезом (дакрон, велюр) с реплантацией всех
висцеральных ветвей — чревного ствола, верхней брыжеечной и почечных
артерий, а также ветвей, снабжающих спинной мозг (артерия
Адамкевича). Иногда необходимо дополнительное протезирование
ветвей дуги аорты. Оперативный доступ — торакофренолапаротомия
или торако-френолюмботомия. Основные послеоперационные
осложнения — инфаркт миокарда, острая почечная недостаточность,
нижняя па-раплегия. Послеоперационная летальность при плановых
операциях постепенно снижается, в крупных сердечно-сосудистых
центрах при аневризмах восходящей аорты она составляет 5—10%, при
аневризмах нисходящей аорты — менее 5%.
Несмотря на очевидный прогресс медицинских технологий,
летальность при экстренных операциях по поводу разрыва аневризмы
превышает 50%. Таким образом, эффективность планового лечения
этой патологии на порядок выше результатов оперативных
вмешательств, проводимых при развитии осложнений, что служит лучшим
обоснованием активной хирургической тактики.
Аневризмы абдоминальной аорты
При бессимптомных аневризмах с максимальным диаметром
менее 3 см рекомендуют наблюдение за больными: выполнение УЗИ 1
раз в год, при размерах от 3 до 5,5 см — каждые полгода. Обязательно
проведение медикаментозной коррекции артериальной гипертензии.
Показания к операции:
• диаметр более 5,5 см, наличие симптомов либо увеличение
аневризмы за время наблюдения более чем на 0,6 см в год (особенно при
сопутствующей артериальной гипертензии);
• мешковидный характер;
• осложнения (тромбоз, расслоение, аорто-кавальная фистула);
• сочетание с окклюзионно-стенотическим поражением
подвздошных и бедренных артерий;
• разрыв аневризмы (показание к экстренному оперативному
вмешательству).
Операцию при инфраренальных аневризмах в большинстве случаев
выполняют посредством срединной лапаротомии либо из внебрю-
шинного доступа. Основной вид операции — резекция аневризмы
с внутрипросветным протезированием. Применяют синтетические
протезы из велюра, дакрона, политетрафторэтилена (рис. 36-5). Дис-
невризмы аорты и магистральных артерий ♦
тальныи анастомоз можно выполнять как
с неизменённой бифуркацией аорты, так
и с подвздошными или бедренными
артериями. Основные осложнения
включают послеоперационный инфаркт
миокарда, острую лёгочную и почечную
недостаточность.
С начала 90-х годов при аневризмах
брюшной аорты применяют эндоваску-
лярное протезирование. Для этого
используют металлический каркас (стент),
покрытый снаружи синтетическим «граф-
том» (протезом); это устройство в
свёрнутом состоянии вводят в аорту через
бедренную артерию, где его раскрывают,
изолируя полость аневризматического
мешка от кровотока (рис. 36-6).
Достоинства такой непрямой операции
заключаются в малой травматичности и
возможности выполнения вмешательства под
местной анестезией, что позволяет её
выполнить даже пациентам с
выраженной тяжёлой сопутствующей патологией.
К недостаткам следует отнести
отсутствие у части больных соответствующих
анатомических условий для выполнения
вмешательства, высокую стоимость эндо-
васкулярного устройства и возможные
осложнения (сохранение кровотока в
аневризматическом мешке отмечают у
25% больных).
Разрыв аневризмы — показание к
экстренной операции. Залог её успеха —
быстрое пережатие аорты выше разрыва и
остановка кровотечения перед
протезированием сосуда. Возможна экстренная
установка стент-графта при разрыве (в
настоящее время в мировой практике
выполнено несколько сотен подобных
операций). Осложнения после операций
Рис. 36-6. Эндоваскуляр-
ное протезирование
брюшной аорты при её аневризме
224 ♦ Хирургические болезни <> Том 2 ♦ Часть IV ♦ Глава 36
по поводу разрыва аневризмы возникают в 75% случаев. Среди них
наиболее частые — острая сердечно-сосудистая недостаточность,
декомпенсированная кровопотеря, острая почечная недостаточность,
полиорганнная дисфункция. Летальность при плановых операциях
по поводу неосложнённых аневризм составляет 3—5% (эндоваску-
лярных — 1-2%), при плановых оперативных вмешательствах в
случае осложнённых аневризм — 5—25%. Экстренные операции при
разрыве аневризмы сопровождаются чрезвычайно высокой
летальностью — 50-75%.
Аневризмы периферических артерий
При бессимптомных аневризмах с максимальным диаметром до
2 см (подвздошных — до 3 см) возможно наблюдение с помощью УЗИ
1 раз в полгода.
Показания к операции:
• дегенеративные аневризмы диаметром более 2 см (при
поражении подвздошных артерий — более 3 см) при наличии клинической
симптоматики;
• ложные аневризмы, в том числе возникшие после сосудистых
реконструктивных операций в зоне анастомозов;
• разрыв аневризмы (показание к экстренной операции).
Оперативное вмешательство заключается в резекции аневризмы с
протезированием сегмента артерии при помощи аутовенозного или
синтетического (велюр, политетрафторэтилен) шунта. При ложных
аневризмах предпочтительнее использование вены больного. Во
время операции возможна тромбоэмболия дистального сосудистого
русла, в послеоперационном периоде — тромбоз шунта. Летальность при
плановых операциях не превышает 3%, при плановых операциях по
поводу осложнённых аневризм — 10%, при экстренных операциях,
выполняемых в связи с разрывом, — 25%.
Аневризмы висцеральных артерий
Наблюдение возможно при бессимптомных аневризмах с
помощью УЗИ — 1 раз в полгода.
Показания к операции:
• наличие симптомов, обусловленных аневризмой;
• аневризмы, выявленные у беременных (операция в срочном
порядке) и женщин, планирующих беременность (в плановом порядке);
• разрыв аневризмы (показание к экстренной операции).
В зависимости от расположения аневризмы и бассейна,
питаемого артерией, несущей аневризму, операция может ограничиваться
перевязкой сосудов либо ушиванием полости аневризмы, в части
случаев необходима резекция аневризмы с восстановлением
кровотока по артерии. При аневризмах селезёночной артерии показано
простое лигирование (выключение из кровотока) аневризмы. Такую
процедуру можно выполнить эндоваскулярно, путём эмболизации
через катетер полости аневризмы либо ствола селезёночной артерии.
Аневризмы сонной артерии, чревного ствола и печёночной артерии
приводят к необходимости восстановления кровотока после
резекции аневризмы.
Послеоперационные осложнения — сердечно-сосудистая
недостаточность, ишемический инсульт, инфаркт кишечника, некроз
печени. Летальность при плановых операциях составляет не
более 2%, при экстренных вмешательствах по поводу разрыва — 30%.
В то же время разрыв висцеральных аневризм у беременных
сопровождается материнской смертностью в 70% случаев, гибелью
плода в-75%.
Прогноз
Прогноз у больных, успешно прооперированных по поводу
аневризмы, благоприятный. Средняя продолжительность их жизни не
отличается от основной популяции. У неоперированных пациентов
сна зависит от локализации и размеров аневризмы.
Аневризмы грудной аорты. 5-летняя выживаемость больных
составляет от 25 до 50%. Основные причины смерти — разрыв
аневризмы, инфаркт миокарда и нарушение мозгового кровообращения. Риск
разрыва возрастает при аневризмах более 6 см в диаметре (особенно
на фоне повышенного АД): он превышает 50%.
Аневризмы брюшной аорты. Разрыв аневризмы — самая частая
причина смерти больных. Опасность развития этого осложнения
зависит от размеров аневризмы. Она значительна при диаметре
аорты более 5 см: вероятность разрыва в течение года составляет 30%.
Дальнейшее увеличение размеров аневризмы ведёт к возрастанию
частоты разрыва: при диаметре аорты от 7 до 10 см — 45%, более
10 см-60%.
226 ♦ Хирургические болезни О Том 2 ♦ Часть IV ♦ Глава 36
Аневризмы периферических артерий. Опасность тромбоза
аневризмы и дистальных эмболии в среднем достигает 25-30%. При
плановых операциях по поводу аневризм периферических артерий
5-летняя проходимость шунтов составляет 80-95%, когда операцию
выполняют по экстренным показаниям — 45-55%.
Аневризмы висцеральных артерий. Риск разрыва при
аневризмах селезёночных артерий составляет в среднем 5%, при аневризмах
чревного ствола достигает 12%. Частота разрыва аневризм
печёночных артерий намного выше — до 40%.
ОСТРЫЕ
ВЕНОЗНЫЕ ТРОМБОЗЫ
Острые венозные тромбозы и их осложнения, в первую очередь
ТЭЛА, представляют сегодня одну из наиболее серьёзных медико-
социальных проблем. Венозный тромбоз возникает в самых
разнообразных клинических ситуациях, он осложняет течение многих
заболеваний и оперативных вмешательств. Возрастающая частота
тромботического поражения вен обусловлена увеличением среднего
возраста населения; распространённостью онкологических
заболеваний, наследственных и приобретённых нарушений системы
гемостаза; ростом травматизма, неконтролируемым приёмом
гормональных средств.
При оценке экономических затрат общества на лечение острых
венозных тромбозов необходимо учесть материальные и моральные
потери от длительного и не всегда успешного лечения хронической
венозной недостаточности нижних конечностей, становящейся
частым исходом заболевания, значительного снижения социальной
активности больных и качества их жизни.
Основные черты патологии
Тромбоз может возникать как в глубоких, так и в поверхностных
сосудах систем верхней и нижней полых вен (тромбозы воротной
вены, несмотря на сходный патогенез, ввиду существенных отличий
клинических проявлений и способов лечения рассмотрены отдельно
в главе 12, посвященной мезентериальному тромбозу). В
медицинской практике, помимо понятия «венозный тромбоз» (или тромбоз вен
какой-либо локализации), используют два различных термина для
обозначения тромботического поражения венозной системы: «фле-
ботромбоз» и «тромбофлебит». Ранее полагали, что при
тромбофлебите первично происходит поражение венозной стенки, поэтому
тромб с момента своего возникновения плотно спаян с ней, в связи
с чем опасность его отрыва и эмболизации лёгочного
артериального русла отсутствует. Флеботромбоз, напротив, рассматривали как
заболевание, в основе которого лежит процесс, протекающий без
228 ♦ Хирургические болезни О- Том 2 ♦ Часть IV ♦ Глава 37
реакции сосудистой стенки, с малосимптомным течением и высокой
угрозой развития лёгочной эмболии. С позиций современной
флебологии нет сколько-нибудь значимых отличий патогенеза
тромбофлебита и флеботромбоза. Структурное или функциональное
повреждение какого-либо участка венозной стенки обычно становится
пусковым моментом тромбообразования. С другой стороны,
дальнейший рост тромба и его более или менее длительное нахождение в
просвете сосуда сопровождается реакцией эндотелия, флебитом и пе-
рифлебитом. Эти процессы происходят при поражении как
поверхностных, так и глубоких вен. Вместе с тем, понимая условность
подобного деления венозного тромбоза, хирурги пользуются термином
«тромбофлебит» для обозначения поражения подкожных вен, при
котором клинически доминируют местные симптомы асептического
воспаления поверхностно расположенных сосудов и паравазальной
клетчатки. Термин «флеботромбоз» обычно применяют при тромбо-
тическом поражении глубоких вен, проявляющемся признаками
острого нарушения венозного оттока из поражённой конечности, хотя
при этом отмечают воспаление в сосудистой стенке и окружающих
тканях. Исключение составляют лишь крайне редкие в наши дни
случаи гнойного расплавления тромботических масс, способного
возникнуть как в поверхностной, так и в глубокой венозной системе. Во
всех остальных случаях флебит, как правило, носит асептический
характер, и роль инфекционного процесса, если он присутствует,
ограничивается вторичными изменениями гемокоагуляции.
Развитие тромбоза возможно на любом участке венозного русла,
при этом тромботический процесс может переходить из
поверхностной венозной системы (через соустья или коммуникантные вены) в
глубокую и наоборот. Возможно одновременное возникновение
тромбоза сразу в нескольких участках венозной системы (биполярный, или
мультиполярный, тромбоз), на разных уровнях одной конечности либо
в разных конечностях — как верхних, так и нижних.
Существуют типичные зоны, в которых в связи с различными
анатомическими и патофизиологическими особенностями первичные
тромбы формируются чаще. К ним относят вены голени и таза.
Тромбоз, возникший в венах голени, принято называть периферическим.
При первичном поражении как глубоких, так и поверхностных вен
тромбоз может стать восходящим и распространиться на
подколенную и бедренную вены. При первичном поражении илиокавально-
го сегмента говорят о центральном, или внутритазовом, тромбозе.
Тромбоз подвздошных вен развивается преимущественно с левой
Острые венозные тромбозы ♦ 229
стороны (в 3 раза чаще). В основе этого лежат гипертензия и
замедление кровотока, обусловленные механическим препятствием,
встречающимся в устье левой общей подвздошной вены. Это
связано со сдавлением подвздошной вены перекрещивающей её правой
общей подвздошной артерией. Большое значение имеет характер
костно-хрящевой площадки, на которой лежит вена (передняя
поверхность LiV—Lv). При наличии на ней выступов (экзостозах, ос-
сифицированном межпозвонковом диске или крае тела позвонка)
общая подвздошная вена сдавливается в гораздо большей степени.
В этой же зоне в просвете сосуда часто находят фиброзные тяжи или
перегородки, которые, как полагают, могут носить врождённый или
приобретённый характер. Тромбоз, возникший в тазовом сегменте
венозного русла, может распространяться как в проксимальном, так и
в дистальном направлении. В последнем случае говорят о
нисходящем тромбозе.
Тромбоз подкожных вен чаще всего возникает в варикозно
расширенных поверхностных венах нижних конечностей. Такую
форму тромбофлебита обозначают термином «варикотромбофлебит».
Варикозные вены представляют особо благодатную почву для
развития тромбоза, так как в подкожной венозной сети нижних
конечностей создаётся целый комплекс условий, приводящих к развитию
тромботического процесса. Этому способствуют фиброзное
перерождение и лёгкая ранимость стенок сосудов, застой крови за счёт дила-
тации вен и несостоятельности клапанного аппарата. Иногда
тромбофлебит носит ятрогенный характер: он может возникнуть после
внутривенного введения концентрированных растворов (например,
глюкозы) или после длительной катетеризации вен. В силу ряда
причин (о них будет сказано ниже) тромбоз в подавляющем
большинстве случаев развивается в венах нижних конечностей, кроме того,
эта его локализация представляет наибольшую опасность развития
эмболии лёгочных артерий. Вот почему от лечебной катетеризации
как поверхностных, так и глубоких вен нижних конечностей
лучше воздержаться.
Варикотромбофлебит в подавляющем большинстве случаев
(около 90%) начинается в стволе большой подкожной вены либо её
притоках в верхней трети голени или нижней трети бедра, значительно
реже — в бассейне малой подкожной вены. Наиболее опасна так
называемая восходящая форма тромбофлебита, чреватая
распространением тромбоза на глубокие вены через сафено-феморальное соустье.
Скорость нарастания такого тромбоза зависит от многих факторов,
230 0> Хирургические болезни О Том 2 О- Часть IV ♦ Глава 37
и прогнозировать её трудно. В некоторых случаях она может
достигать 20 см в сутки. Следует учитывать, что у 30% больных истинная
распространённость тромбоза подкожных вен на 15—20 см
превышает клинически определяемые границы тромбофлебита, что
обязательно нужно учитывать для правильного решения вопросов
хирургической тактики.
Венозный тромбоз как источник лёгочной эмболии.
Наибольшую угрозу для жизни больного представляет не сам тромбоз, а его
осложнение — ТЭЛА. Вместе с тем не каждый флеботромбоз
осложняется эмболией, поэтому важно знать, в каком случае тромбоз
реально угрожает эмболией, а в каком нет. Эмболоопасным считают так
называемый флотирующий тромб, имеющий единственную точку
фиксации в своём дистальном отделе. Остальная его часть
расположена свободно и на всём протяжении не связана со стенками вены
(рис. 37-1). Развитие флотирующих тромбов обычно обусловлено
распространением процесса из вен меньшего диаметра в более крупные.
Длина таких тромбов достигает 15—20 см и более. Диаметр
основания флотирующего тромба часто меньше свободной его части, что
придаёт ему подвижность. Интенсивный поток крови,
препятствующий адгезии такого тромба к сосудистой стенке, обтекает его со всех
сторон. Эмболоопасный тромб может быть как сегментарным, так и
распространённым, с флотирующей проксимальной частью.
Варианты форм венозного тромбоза, при которых угроза
лёгочной эмболии практически отсутствует, — окклюзивный и
пристеночный тромбозы.
• При окклюзивном тромбозе кровотока в вене нет, тромботические
массы за счёт флебита спаяны со стенкой вены на всём протяжении.
Рис. 37-1. Типы венозного тромбоза (схема): а — флотирующий
(эмболоопасный) тромб; б — окклюзивный тромбоз; б— пристеночный тромбоз.
Острые венозные тромбозы О 231
• Пристеночный тромб также на значительном протяжении сращён
со стенкой вены, вместе с тем остаётся пространство между тром-
ботическими массами и стенкой сосуда. Подобная фиксация
препятствует превращению тромба в эмбол.
Последствия тромбоза. Тромбоз — весьма динамичный процесс.
Его возникновение, прогрессирование и стабилизация зависят от
многих факторов (изложены ниже). Исследования с мечеными тром-
ботропными препаратами показали, что при определённых условиях
протяжённость тромбоза может довольно быстро увеличиваться,
иногда до десятков сантиметров в течение нескольких часов.
Длительность активного процесса тромбообразования обычно
составляет около 3 нед, хотя этот период может быть и существенно
продолжительнее. После стабилизации границ распространения тромбоза
продолжается эволюция тромбов, происходят процессы гуморального
и лейкоцитарного лизиса, организации тромботических масс и река-
нализации просвета поражённого венозного сосуда. В результате
через некоторое время проходимость тромбированных вен может
восстановиться (частично или полностью). Эти процессы продолжаются
в течение нескольких месяцев, во время которых возможен рецидив
тромбоза. Реканализация тромбированных вен, хотя и
восстанавливает проходимость сосуда, сопровождается разрушением клапанного
аппарата вен. Указанные изменения венозного русла обычно
приводят к развитию хронической венозной недостаточности (см. главу 39).
Этиология и патогенез
В 1856 г. немецкий патолог Рудольф Вирхов сформулировал
ставшую классической триаду причин внутрисосудистого
тромбообразования.
1. Изменение состава крови.
2. Повреждение сосудистой стенки.
3. Замедление тока крови.
Все научные открытия в этой сфере за истекшие полтора столетия
стали лишь детализацией того или иного звена вирховской триады.
Что касается значимости каждого из них, то большинство
исследователей, даже считая ведущим тот или иной фактор, признают
необходимым для образования тромба наличие других условий.
Стабильное жидкое состояние крови и сохранение её текучих
свойств, физиологический гемостаз и развитие внутрисосудисто-
232 ♦ Хирургические болезни ♦ Том 2 О- Часть IV <? Глава 37
го тромбоза непосредственно связаны с сосудистым тонусом,
системами коагуляции и фибринолиза, функционирование каждой из
которых жизненно необходимо организму. Тромбоз возникает, когда
нарушается баланс между тромбогенными факторами и защитными
реакциями. Эти механизмы имеют глубокую филогенетическую
природу, сложны и многообразны, в связи с чем существуют
многочисленные «узловые точки» инициации тромбоза.
Изменение состава крови
(тромбофилические состояния)
К тромбообразованию предрасполагают дефицит естественных
ингибиторов коагуляции, нарушения в системе эндогенного
фибринолиза, заболевания, сопровождающиеся полицитемией и
увеличением вязкости крови, повышенная адгезивная и агрегационная
способность тромбоцитов и других форменных элементов крови,
аутоиммунные, неопластические и инфекционные процессы.
Генетически обусловленные изменения включают врождённый дефицит
антитромбина III, протеинов С и S; мутации гена протромбина,
фактора V и многие другие. Они могут быть и приобретёнными —
возникнуть под влиянием различных внешних и внутренних факторов
(например, антифосфолипидный синдром).
Механизмы инициации тромбоза, имеющие приобретённый
характер, в большинстве случаев одновременно влияют на разные
звенья каскада коагуляции и фибринолиза. В первую очередь к ним
относят оперативные вмешательства, травмы, беременность и роды, те.
состояния, сопровождающиеся повреждением тканей и
кровотечением. Изменения гемостаза при беременности имеют своей
конечной целью подготовку к родам, следовательно, в числе прочего и к
кровопотере. В результате происходит мобилизация коагуляцион-
ного потенциала. Тромбофилическим эффектом обладают эстроген-
содержащие гормональные препараты, применяемые в качестве пе-
роральных контрацептивов или с заместительной целью в период
менопаузы.
Значительно повышают риск флеботромбоза новообразования,
особенно злокачественные. У этой категории больных тромбоз может
поражать вены самой различной локализации, как поверхностные,
так и глубокие. Организм реагирует на появление опухоли синтезом
тромбопластиноподобных соединений и снижением фибринолити-
ческой активности. Кроме того, сами опухоли могут синтезировать
Острые венозные тромбозы ♦ 233
тромбогенные субстанции. На более поздних стадиях
онкологического процесса имеют значение сдавление и прорастание вен
опухолью и её метастазами.
Повреждение венозной стенки
Травма сосудистой стенки, нарушение целостности эндотелия и
обнажение субэндотелиального слоя — важные механизмы,
инициирующие тромбоз. Среди этих факторов — прямое повреждение
венозных сосудов при переломах, операциях, постановке эндовазаль-
ных катетеров и внутрисосудистых устройств (фильтров, стентов и
пр.), протезировании вен. К повреждению эндотелия ведут
гипоксия, воздействие вирусов и эндотоксинов. Выделяемые
опухолевыми клетками вещества также могут вызывать изменения и
повреждения венозной стенки.
Обширные оперативные вмешательства, тяжёлые механические
травмы, массивная кровопотеря, распространённые ожоги,
инфекционные заболевания, сепсис включают механизм, получивший
название системной воспалительной реакции, заключающийся в
синтезе и выделении в кровоток большого количества биологически
активных соединений (медиаторов). Каскад цитокинов активирует
лейкоциты и способствует их адгезии к эндотелию. Мощные окси-
данты, выделяемые активированными лейкоцитами, вызывают гибель
эндотелиальных клеток с последующим обнажением
субэндотелиального слоя.
В экспериментальных и клинических условиях установлено, что
во время любых операций в венах, даже значительно отстоящих от
места вмешательства, происходят адгезия лейкоцитов и их инвазия в
сосудистую стенку на всём её протяжении. Зафиксировано
образование множества мельчайших отверстий и дефектов, проникающих
через эндотелий и базальную мембрану и обнажающих субэндоте-
лиальный слой коллагена, обладающего выраженными тромбоген-
ными свойствами, в числе которых положительный электрический
заряд (возможно влияние электростатических сил на адгезию
форменных элементов крови, имеющих отрицательный электрический
заряд). Причина подобных нарушений — значительная дилатация
вен, превышающая допустимый предел их растяжимости. Изменения
венозной стенки связывают с образованием и выделением в
кровоток большого количества биологически активных соединений — ги-
стамина, серотонина, комплемента, лейкотриенов, брадикинина,
234 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV О Глава 37
фактора релаксации сосудов. Все эти вещества участвуют в
каскаде процессов, составляющих суть синдрома системной
воспалительной реакции.
Нарушения кровотока
Худшие условия оттока крови из системы нижней полой вены по
сравнению с верхней полой в силу влияния фактора гравитации
определяют превалирование тромбозов именно этого сосудистого
бассейна. На его долю приходится более 90% всех тромбозов. Помимо
этого, существует множество причин замедления или нарушения тока
крови. К ним относят варикозное расширение вен, сдавление сосудов
(опухолями и метастазами, кистами, воспалительными
инфильтратами, маткой во второй половине беременности, костными экзостозами
и фрагментами костей после травмы), разрушение венозного
клапанного аппарата после перенесённого ранее флеботромбоза. Во время
второй половины беременности и в родах скорость кровотока в
подвздошных венах в результате их компрессии замедляется в 2—3 раза.
Серьёзный фактор риска возникновения венозного тромбоза —
иммобилизация. Ограничение или невозможность движений наряду
с прочими предпосылками к тромбообразованию определяет
причину высокой частоты флеботромбоза после обширных оперативных
вмешательств, при переломах нижних конечностей, протезировании
бедренных и коленных суставов (до 80% больных), у больных с
инфарктом миокарда, параличами и парезами нижних конечностей,
длительно соблюдающих постельный режим. Недостаточность
кровообращения, кроме замедления тока крови, приводит к повышению
венозного давления, вазодилатации, увеличению вязкости крови.
Застой крови в нижних конечностях препятствует нормальному
функционированию защитных механизмов: разведению
активированных факторов коагуляции кровью, их вымыванию и смешиванию с
ингибиторами. Одновременно стаз крови способствует накоплению
тромботического материала на стенке сосуда, ведёт к гипоксии эн-
дотелиальных клеток и их повреждению.
Существует тесная связь между вязкостью и током крови.
Физические свойства крови как неоднородной жидкости способствуют
повышению её вязкости при замедлении кровотока. Такие
состояния, как полицитемия, эритроцитоз, дегидратация, диспротеинемия,
значительное увеличение содержания фибриногена, становятся
возможной причиной тромбоза.
Острые венозные тромбозы -О- 235
При множестве заболеваний и клинических ситуаций факторы,
способствующие тромбообразованию, можно встретить в самых
различных комбинациях. Наряду с перечисленными моментами следует
отметить влияние возраста. У детей тромбозы представляют собой
казуистику, все они связаны с генетическими аномалиями в системе
гемостаза. У пациентов старше 40 лет каждое последующее
десятилетие вдвое увеличивает риск тромбообразования. Это обусловлено
накоплением приобретённых тромбофилических состояний, менее
подвижным образом жизни, структурными изменениями венозной
стенки, усиливающими её дилатацию, снижением фибринолитиче-
кой активности крови. Сходные причины увеличивают риск флебо-
тромбоза при ожирении (им страдает значительная часть населения).
Женщины в молодом возрасте заболевают венозным тромбозом
примерно в 2 раза чаще мужчин, что определяется влиянием комплекса
различных предрасполагающих факторов.
Определённые особенности имеет патогенез тромбозов в системе
верхней полой вены. Как правило, они осложняют течение различных
заболеваний или лечебных манипуляций, приводящих к
повреждению венозной стенки и нарушениям кровотока. Ятрогенные
тромбозы после пункции или катетеризации центральных вен связаны как с
механической травмой сосудистой стенки, так и с химическим или
бактериальным её повреждением. Следует помнить, что
проксимальная часть инфузионных катетеров, установленных в подключичную
или яремную вены, располагается обычно в верхней полой вене или
даже в правом предсердии. Поэтому тромб, сформировавшийся на
катетере, может стать источником эмболии лёгочных артерий (к
счастью, обычно немассивной).
Наиболее частая причина нарушения проходимости вен
средостения — внутригрудные неопластические процессы (как первичные,
так и метастатические), обусловливающие развитие синдрома
верхней полой вены. Примерно в половине случаев это центральный рак
правого лёгкого, что объясняется непосредственной близостью
полой вены и правого главного бронха. Периферический рак лёгкого
(рак Пенкоста) в силу своей локализации, возможности прорастания
париетальной плевры и сосудистого пучка может осложниться
тромбозом подключичной вены.
Первичное тромботическое поражение подключичной вены
известно как болезнь Педжета—Шреттера. Ей присущи молодой возраст
пациентов, преобладание мужчин (болеют в 4 раза чаще женщин) с
хорошо развитой мускулатурой плечевого пояса, одностороннее
236 ♦ Хирургические болезни О Том 2 О Часть IV ♦ Глава 37
(чаще справа) поражение. Окружающие подключичную вену
костные и сухожильно-мышечные образования, а также фиксация вены
к I ребру создают условия для постоянной травматизации стенки
сосуда и его сдавления во время движений руки. Причиной сужения
промежутка между ключицей и I ребром может стать мышечная
гиперплазия у спортсменов или лиц, занимающихся тяжёлым
физическим трудом. Иногда источником болезни бывает добавочное шейное
ребро. Постоянное перерастяжение стенки вены и её компрессия
приводят к расстройству кровообращения в сосудах венозной
стенки, надрывам интимы, соединительнотканной деформации стенки
вены, формированию стеноза с последующим наложением тромбо-
тических масс.
Ещё одной из причин тромбоза венозных магистралей верхних
конечностей может стать позиционное сдавление. Это происходит
при длительном нефизиологическом положении руки (когда она
закинута за голову) во время глубокого сна, вызванного приёмом седа-
тивных препаратов или алкоголя, во время наркоза при положении
пациента на боку. Аналогичный эффект наблюдают в случаях, когда
компрессия вен вызвана положением головы женщины на плече
мужчины (так называемая «рука молодожёна»).
Классификация
Классификация необходима для точной формулировки диагноза
и выбора оптимальной тактики лечения. Выделяют следующие
наиболее важные характеристики венозного тромбоза.
Локализация.
• Сосудистый бассейн: верхняя или нижняя полая вена.
• Венозная система: поверхностная, глубокая, перфорантная.
• Вены, поражённые тромботическим процессом (проксимальный и
дистальный уровни поражения; моно- или мультиполярный).
Направление распространения.
• Проксимальное (восходящее).
• Дистальное (нисходящее).
Характер тромбоза.
• Окклюзивный.
• Неокклюзивный: пристеночный, флотирующий (эмболоопасный).
Степень гемодинаминеских расстройств.
• Лёгкая.
Острые венозные тромбозы ♦ 237
• Средней тяжести.
• Тяжёлая.
Осложнения.
• ТЭЛА.
• Венозная гангрена.
• Посттромбофлебитическая болезнь (хроническая венозная
недостаточность).
Клиническая картина
Клинические проявления — основа для предварительного
заключения о наличии венозного тромбоза. Вместе с тем необходимо
учитывать, что формирование тромба в венозной магистрали происходит
не одномоментно. На начальных этапах тромбоз носит локальный,
весьма ограниченный (в подавляющем большинстве случаев неокк-
люзивный — флотирующий или пристеночный) характер. В этой
стадии отсутствуют признаки нарушения венозного оттока, обычно нет
симптомов выраженной воспалительной реакции венозной стенки и
окружающих сосудистый пучок тканей. Поэтому в течение
определённого времени (обычно несколько дней) тромбоз протекает
бессимптомно. Продромальная стадия венозного тромбоза может
характеризоваться недомоганием и субфебрильной температурой тела.
Иногда первым проявлением такого бессимптомного тромбоза
становятся признаки ТЭЛА (см. главу 38). После распространения
тромбоза на более значительный сосудистый регион появляются местные
симптомы, зависящие от локализации тромбоза.
Тромбоз глубоких вен нижних конечностей и таза
Клинические проявления тромбоза глубоких вен складываются из
комплекса симптомов, характеризующих внезапно развившееся
нарушение венозного оттока из поражённой конечности при
сохранённом притоке артериальной крови. Отёк, цианоз конечности,
распирающие боли, локальное повышение температуры кожи, усиление
рисунка подкожных вен (они начинают функционировать как кол-
латерали), боли по ходу сосудистого пучка характерны в той или иной
степени для тромбоза любой локализации. Движения в суставах
конечности и чувствительность практически не изменяются. Общие
признаки асептического флебита и перифлебита, такие как субфеб-
238 О- Хирургические болезни ♦ Том 2 ♦ Часть IV О- Глава 37
рильная температура тела, слабость, адинамия, небольшой
лейкоцитоз, наблюдают у большей части больных.
Выраженность симптоматики зависит от степени расстройств
регионарной флебогемодинамики, что зависит от локализации и
протяжённости тромботического поражения. Наиболее трудна
диагностика тромбоза глубоких вен голени, поскольку окклюзия двух-трёх
из них при сохранённой проходимости остальных берцовых сосудов
не вызывает значительных нарушений венозного оттока из
конечностей. Заболевание не вызывает у больного, а порой и у врача,
ощущения опасности. Часто единственным симптомом бывают умеренные
боли в икроножных мышцах, усиливающиеся при ходьбе или просто
в вертикальном положении пациента. Внешний вид голени
изменяется мало, возможен незначительный отёк стопы в области лодыжек.
При физикальном осмотре обнаруживают положительный симптом
Хоманса (боли в икроножных мышцах при тыльном сгибании стопы)
и симптом Мозеса (болезненность при сдавлении голени в
передне-заднем направлении). Диагноз поставить легче, когда процесс
распространяется на подколенную вену. При этом существенно
нарушается венозный отток из голени, она становится отёчной,
напряжённой, появляется выраженный болевой синдром, возникают чувство
распирания, тяжести, напряжения в конечности и цианоз стопы. На
голени проступает сеть расширенных подкожных вен.
Тромбоз общей бедренной и подвздошных вен обычно
сопровождается наиболее яркой клинической симптоматикой. Такой тромбоз
принято называть подвздошно-бедренным (илиофеморальным) флебо-
тромбозом. Полная окклюзия этого венозного сегмента
характеризуется выраженным отёком голени и бедра, цианозом кожных
покровов, интенсивность которого возрастает по направлению к периферии
(рис. 37-2). При пальпации сосудистый пучок болезненный на всём
протяжении бедра. Симптоматика тромбоза во многом зависит не
только от его локализации и протяжённости, но и от степени
сужения просвета сосуда тромбом. Окклюзивный тромбоз
сопровождается выраженным отёком и цианозом конечности. При неокклюзив-
ном тромбозе нарушения венозной гемодинамики и, соответственно,
клиническая симптоматика выражены гораздо менее ярко.
Первичный тромбоз в системе внутренней подвздошной вены до
перехода процесса на общую подвздошную вену имеет скрытое
течение и вообще не сопровождается отёком конечности. Основные его
признаки — «необъяснимое» повышение температуры тела и боли в
нижних отделах живота и пояснично-крестцовой области. При от-
Острые венозные тромбозы ♦ 239
Рис. 37-2. Тромбоз глубоких
вен левой нижней
конечности (фото больного).
Отмечается выраженный отёк
стопы и голени.
сутствии симптомов нарушения венозного оттока болевой синдром
часто не связывают с тромбозом, что приводит к диагностическим
ошибкам.
Полная тромботическая окклюзия нижней полой вены
сопровождается отёком и цианозом обеих ног, нижней половины туловища,
половых органов, расширением поверхностных вен передней
брюшной стенки. Между тем, при неокклюзивном её тромбозе, исходящем
из одной из общих подвздошных вен (подобная ситуация возникает
у каждого третьего пациента с илиофеморальным тромбозом),
клиническая картина соответствует признакам одностороннего под-
вздошно-бедренного флеботромбоза, даже если тромб
распространяется до правого предсердия. Флотирующие тромбы, исходящие из
почечных или гонадных вен, в условиях проходимого
периферического сосудистого русла не вызывают клинических симптомов
нарушения оттока по нижней полой вене.
Тромбоз глубоких вен верхних конечностей и средостения
Тромбоз подключичной вены проявляется отёком,
распространяющимся на всю верхнюю конечность от кисти до ключицы. Он
сопровождается цианозом руки и усилением венозного рисунка на плече
и в области плечевого сустава. Пациентов беспокоят тупые боли,
чувство тяжести и распирания в руке. При пальпации отмечают
болезненность в подмышечной ямке и по ходу сосудистого пучка на
плече. Отёк достигает максимальной выраженности в первые дни
заболевания. «Катетерный» тромбоз подключичной вены
проявляется сходными признаками, но наличие инородного тела в сосудистом
русле довольно часто обусловливает присоединение симптомов
тромбоза внутренней яремной вены — болей в соответствующей поло-
240 О Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 37
вине шеи по ходу грудино-ключично-сосцевидной мышцы, отека
половины лица.
Окклюзия верхней полой вены характеризуется значительным отё
ком и цианозом лица, шеи (в виде тугого воротника), верхней
половины туловища и обеих рук. Они максимально выражены утром и
немного уменьшаются днём, когда больной пребывает в
вертикальном положении. Значительно расширяются подкожные вены, на
туловище возникают телеангиэктазии. Нередко пациентов беспокоит
постоянная головная боль. Эти симптомы наряду с цианозом
усиливаются при наклоне туловища вперёд. Повышение внутричерепного
давления и отёк периорбитальной клетчатки приводят к снижению
остроты зрения, диплопии и экзофтальму.
Тромбоз подкожных вен
Обычно превалируют яркие местные симптомы, общее
самочувствие большинства больных остаётся удовлетворительным.
Пациентов беспокоят тянущие боли по ходу тромбированных подкожных вен,
в части случаев недомогание, озноб, субфебрильная температура тела.
В проекции поражённой вены видна
полоса гиперемии, пальпируется плотный
болезненный шнуровидный тяж.
Определяют местное повышение температуры,
гиперестезию кожных покровов. В
подавляющем большинстве случаев тром-
ботический процесс развивается в ва-
рикозно расширенных поверхностных
венах нижних конечностей (рис. 37-3).
Контуры и размеры пальпируемого
инфильтрата не изменяются при
переводе больного из вертикального положения
в горизонтальное, в то время как нетром-
бированные венозные узлы имеют мяг-
*. кую консистенцию и, опорожняясь от
крови, спадаются в положении лёжа.
Яркая гиперемия кожи, характерная для
п ~- ~ п н первых дней заболевания, к 6—7-му дню
Рис. 37-3. Восходящий тром- ^ J
бофлебит в бассейне боль- обычно проходит, кожа в зоне флебита
шой подкожной вены (фо- приобретает сначала синюшный, а затем
то больного). коричневатый оттенок. При варикотром-
Острые венозные тромбозы О- 241
бофлебите отёк конечности бывает только местным (в зоне
воспаления). Если у больного определяется диффузный отёк
конечности, значит, у него тромбоз глубоких вен. О нём же свидетельствуют
симптомы ТЭЛА, источником которой становится исключительно
тромбоз глубоких венозных магистралей. Варикотромбофлебит в 10%
случаев сопровождается тромбозом глубоких вен, возникающим
вследствие распространения тромботического процесса через са-
фено-феморальное (наиболее часто) или сафено-поплитеальное
соустье либо через перфорантные вены. Иногда он носит
симультанный характер. Как правило, сопутствующий тромбоз глубоких вен
протекает бессимптомно и может быть выявлен только с помощью
специальных методов исследования.
Дифференциальная диагностика
Тромбоз глубоких вен чаще всего приходится дифференцировать
от иных патологических состояний, сопровождающихся отёком
конечности.
Недостаточность кровообращения. Отёки нижних конечностей при
сердечной недостаточности всегда развиваются постепенно на обеих
нижних конечностях у больных, страдающих тяжёлой сердечной
патологией. Появление отёков сопровождается тахикардией и
одышкой при незначительных физических нагрузках, увеличением печени,
скоплением жидкости в серозных полостях и олигурией. Отёк
клетчатки мягкий, после пальпации ног остаются вдавления от пальцев
исследующего врача. Болевой синдром не характерен, цианоза нет, кожная
температура конечностей часто понижена. Пальпация сосудистого
пучка безболезненна, симптомы Хоманса и Мозеса отрицательные.
Лимфостазу предшествуют различные патологические состояния,
ухудшающие отток лимфы из конечности: рожа, паховый
лимфаденит, оперативные вмешательства в паховых областях, лучевая
терапия. Приобретённый лимфостаз чаще поражает одну конечность.
В отличие от острого венозного тромбоза лимфостаз обычно
развивается медленно, в течение нескольких месяцев. Отёк конечности
мягкий, безболезненный, при пальпации остаются глубокие ямки в
подкожной клетчатке. Кожные покровы при лимфостазе бледные и
обычно прохладные. Отёк не спадает со временем, а напротив,
прогрессирует и может достигать огромных размеров.
Травматический отёк. Постановка диагноза может быть
затруднена при закрытых травматических повреждениях, у пациентов
242 О Хирургические болезни ♦ Том 2 О Часть IV ♦ Глава 37
пожилого и старческого возрастов, на фоне предшествующей
неврологической патологии, при атипичных, патологических переломах.
Данные осмотра и объективного исследования (напряжённый отёк
конечности, болезненность, лёгкий цианоз) вполне укладываются в
клиническую картину тромбоза глубоких вен. Лишь при тщательном
выяснении анамнеза можно поставить этот диагноз под сомнение.
Помочь заподозрить перелом шейки бедра позволяют такие
симптомы, как укорочение конечности, наружная ротация стопы,
болезненность при осевой нагрузке, симптом «прилипшей пятки» — когда
больной не может поднять ногу. Рентгеновское исследование в таких
случаях — решающий метод диагностики.
Отёк конечности может развиться и после незначительной
травмы, без повреждения опорно-двигательного аппарата. Особенно
напоминает венозный тромбоз спонтанная межмышечная гематома,
возникающая у пациентов с изменённой сосудистой стенкой после
неловкого прыжка, при резком движении, травме икроножных мышц.
Кроме подробного сбора анамнеза, заподозрить гематому позволяют
напряжённый характер локального отёка голени и резкая
болезненность при пальпации, в том числе и по передней поверхности
голени. Через 2—3 сут гематома «спускается» вниз, и в области лодыжек
можно увидеть кровоподтёк.
Артрозоартриты. Клинические проявления этого патологического
состояния характеризуются болями в конечности, гиперемией кожи,
отёком тканей, ограничением движений в суставах, гипертермией, что
можно принять за симптомы венозного тромбоза. Отёк и
болезненность наиболее выражены в области поражённых суставов. В них
отмечают болевое ограничение и утреннюю скованность движений,
возможен выпот в суставную полость. Иногда можно обнаружить
деформацию сустава, склерозирование его капсулы, разрастание
краевых остеофитов. Болезненность по ходу сосудистого пучка,
гиперемия кожи вне проекции изменённого сустава отсутствуют. Отёк
распространяется лишь на близлежащие к поражённым суставам
ткани. На рентгенограмме — сужение суставной щели, уплотнение и
деформация суставных поверхностей.
Водянка беременных. Отёк нижних конечностей при водянке
всегда двусторонний, развивается постепенно. Появление отёков не
сопровождается болями. При дальнейшем развитии этого
патологического состояния отекают бёдра, туловище, верхние конечности, лицо.
Уже на начальной стадии водянку легко замечают сами женщины с
помощью «симптома обручального кольца» (оно становится тесным).
Острые венозные тромбозы <> 243
Отсутствуют цианоз конечностей, местная гипертермия и
компенсаторное расширение подкожных вен. Выявляют артериальную
гипертензию, нарушения функций печени, изменения глазного дна,
протеинурию. В целом, гораздо опаснее расценить острый
венозный тромбоз как патологическое течение беременности, чем
наоборот, поскольку ценой такой ошибки может стать фатальная лёгочная
эмболия.
Опухоли костей и мягких тканей. Заподозрить опухоль позволяет
более длительный, в отличие от венозного тромбоза, анамнез
заболевания (иногда до 5—8 мес). Иной характер носят боли в
конечности; по мере развития болезни они усиливаются и становятся
постоянными. Кожа над новообразованием напряжена, горячая на
ощупь. В то же время дистальные отделы конечности могут быть
не отёчны, обычной окраски и температуры. Часто появляются
нарушения функций конечности — хромота, ограничение подвижности
в расположенном по соседству суставе и сгибательная контрактура.
Ведущим методом диагностики костных опухолей служит
рентгенологическое исследование. При опухоли мягких тканей диагностику
облегчают УЗИ и цитологическое исследование пунктата из опухоли,
а также биопсия.
Синдром длительного раздавливания тканей конечности
представляет собой ишемический некроз мышц с последующим развитием
острой почечной, дыхательной и сердечно-сосудистой
недостаточности. Появлению отёка предшествует характерный анамнез,
имеющий указание на длительное сдавление конечности. Иногда это сдав-
ление может быть обусловлено только массой собственного тела,
например, при сильном алкогольном опьянении (позиционный
синдром), а не обязательно являться результатом стихийного бедствия
или техногенной катастрофы.
Освобождённая конечность сначала бледная, на ощупь холоднее
здоровой, резко понижена чувствительность, чего не бывает при
венозных тромбозах, пульс на периферических артериях не
прощупывается. Общее состояние больного в этот период страдает мало.
Однако уже в ближайшие сутки в связи с распадом повреждённых тканей
и всасыванием продуктов аутолиза общее состояние резко
ухудшается: отмечают вялость, сонливость с периодами резкого возбуждения,
возникают рвота, жажда, боли в пояснице, желтуха, бред.
Выраженный отёк конечности появляется одновременно с развитием общих
симптомов. Ткани плотные, напряжённые; активные движения
отсутствуют, нарушена глубокая чувствительность. На коже конечности.
244 -О* Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 37
чаще по задней поверхности — множественные синюшные пятна,
иногда серозно-кровянистые пузыри. Характерный симптом — оли-
гурия, моча приобретает кровянистый цвет, в ней выявляют миогло-
бин. Быстро развиваются азотемия, анурия и уремия.
Клиническая картина острого варикотромбофлебита весьма
характерна, диагностические ошибки при этом заболевании допускают
редко. Вместе с тем иногда приходится проводить дифференциальный
диагноз с другими патологическими процессами, чаще
воспалительной природы, локализующимися в коже и подкожной клетчатке.
Лимфангиит характеризуется появлением ярко-красных полос,
направленных от первичного очага (язвы, раны стопы,
межпальцевые трещины) к регионарным лимфатическим узлам. Они
обусловлены распространением инфекционного воспалительного процесса
по лимфатическим сосудам, проекция которых на нижних
конечностях совпадает с проекцией большой подкожной вены. Поставить
правильный диагноз позволяет наличие гнойного очага, гипертермии
(до 39-40 °С), озноба. Боли по ходу поражённых лимфатических
сосудов обычно незначительные или даже отсутствуют. Больных
беспокоят кожный зуд и чувство жжения. Плотный шнуровидный тяж,
всегда пальпируемый при варикотромбофлебите, в случаях лимфан-
гиита не определяется.
Рожа. Отличить рожу помогает характерное начало,
сопровождающееся выраженными общими симптомами: внезапным
потрясающим ознобом, резким и быстрым повышением температуры тела до
39-40 °С, головной болью, общей слабостью, нередко рвотой,
бредом и даже помрачением сознания. Признаки общей интоксикации
предшествуют локальным симптомам. Участок гиперемии имеет
неровные, зазубренные (или в виде «языков пламени») края, по
очертаниям напоминает географическую карту. В области покрасневшего
участка больной ощущает чувство жара, напряжения и жгучей боли.
Столь яркие общие проявления и местная реакция не характерны для
варикотромбофлебита, даже если имеется тромботическое
поражение конгломерата варикозных вен. Плотные болезненные тяжи по
ходу подкожных вен при роже не определяются.
Узловатая эритема чаще возникает у подростков и молодых
женщин, когда значительного расширения подкожных вен, как правило,
не бывает. Проявляется узловатая эритема плотными
воспалительными инфильтратами полушаровидной формы, отёчными,
напряжёнными, иногда болезненными при пальпации, размерами от
горошины до грецкого ореха. Они имеют характерную ярко-красную окраску,
Острые венозные тромбозы О- 245
в процессе формирования узлов меняющую оттенки — от синюшной
до зеленовато-жёлтой и бурой. Отличить узловатую эритему от
тромбофлебита помогает прослеживающийся в большинстве случаев ин-
фекционно-аллергический генез этого патологического состояния,
развивающегося после перенесённых инфекционных заболеваний
(грипп, ангина, скарлатина, корь, туберкулёз). Появлению
высыпаний предшествует продромальный период, сопровождающийся
повышением температуры тела, ознобом, слабостью, болями в костях,
суставах и мышцах. Узлы при эритеме никогда не сливаются,
локализуются симметрично, преимущественно по передней поверхности
голеней вне проекции подкожных вен.
Аллергический дерматит возникает при местном применении
медикаментов в виде электрофореза, присыпок, мазей, растворов, а
также контакте с химическими соединениями. Он может развиться
после укуса насекомого. Основные жалобы при дерматите — выраженный
кожный зуд и жжение. Боли в области воспаления отсутствуют или
бывают незначительными. Кроме гиперемии, на коже возникают
папулёзные и микровезикулёзные элементы, иногда мацерация,
корки, чешуйки. Шнуровидные болезненные тяжи в зоне гиперемии при
дерматите не пальпируются.
У многих больных тромботическое поражение вен протекает со
скудной клинической симптоматикой или на фоне тяжёлой
сопутствующей патологии, затушёвывающей видимые проявления флебо-
тромбоза. Кроме того, даже при самом внимательном физикальном
исследовании невозможно точно определить протяжённость и
характер тромбоза, степень опасности развития лёгочной эмболии,
причину развития заболевания. В связи с этим необходимо
использование специальных диагностических методов.
Задачи инструментального исследования.
• Подтвердить или отвергнуть наличие венозного тромбоза.
• Определить локализацию тромбоза и его протяжённость.
• Установить характер проксимальной части тромба, оценить
опасность лёгочной эмболии.
• Обнаружить бессимптомно протекающий венозный тромбоз в
других сосудистых бассейнах.
• Выявить причину венозного тромбоза.
246 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 37
Для обнаружения очага тромбообразования применяют экспресс-
тесты, позволяющие определить появление избыточного количества
фибрина-мономера, продуктов деградации фибрина и
фибриногена в плазме. В качестве первого этапа экстренной диагностики
острых венозных тромбозов используют определение содержания D-du-
мера в плазме, представляющего собой продукт распада
стабилизированного фибрина. Степень его нарастания в плазме служит
маркёром внутрисосудистого свёртывания крови. Увеличение
содержания D-димера отмечают почти у всех больных с острыми
венозными тромбозами. Тест имеет высокую чувствительность (до 99%),
но, к сожалению, низкую специфичность. Образование фибрина и,
соответственно, высокое содержание D-димера возможны не
только при тромбозе, но и при опухолях, воспалительных процессах,
некрозе, во время беременности и после перенесённых оперативных
вмешательств.
Получить информацию о наличии в организме очага
тромбообразования можно с помощью радионуклидного исследования с меченым
фибриногеном. Фибриноген, меченый радиоактивными изотопами,
после введения в общий кровоток сам «разыскивает» скрытый
источник тромбообразования, накапливаясь в нём. Путём наружной
радиометрии можно обнаружить очаг радиоактивности в нижних
конечностях, по его локализации судят о местонахождении тромбоза.
Радионуклидные исследования позволяют выявить бессимптомно
протекающие тромбозы в различных бассейнах. К недостаткам
метода относят опасность его использования у беременных и
кормящих, а также вероятность диагностических ошибок при наличии
операционных ран, гематом и травматических повреждений, где тоже
происходит накопление фибриногена.
Наиболее информативный метод обнаружения венозного
тромбоза — дуплексное ультразвуковое ангиосканирование с
использованием цветового допплеровского картирования кровотока. При
локализации тромбоза дистальнее уровня паховой связки эта методика
позволяет правильно решать все задачи, определяющие тактику
лечения. Исследование даёт возможность многократного
повторного осмотра венозной системы, что позволяет наблюдать в динамике
процессы формирования, нарастания, лизиса и организации
тромба. Основной признак тромбоза — обнаружение эхопозитивных
тромботических масс в просвете сосуда. Эхоплотность возрастает
по мере увеличения «возраста» тромба. На фоне тромбоза перестают
дифференцироваться створки клапанов, диаметр поражённой ве-
Острые венозные тромбозы 4- 247
ны увеличивается в 2,0—2,5 раза по сравнению с контралатераль-
ным сосудом, вена перестаёт реагировать на компрессию датчиком
(рис. 37-4). Возникает уплотнение и утолщение стенок за счёт
флебита. При исследовании можно увидеть колебательные движения
верхушки флотирующего тромба.
При ультразвуковом ангиосканировании подкожных вен
наиболее тщательно осматривают приустьевые отделы большой и малой
подкожных вен, чтобы исключить или выявить переход тромба на
глубокую венозную систему. Обязательно исследуют проходимость
типичных перфорантных вен, поскольку через них возможно
распространение тромботического процесса на глубокие магистрали.
В тех случаях, когда тромбоз распространяется на подвздошные
вены, необходимо выполнение рентгеноконтрастной ретроградной
илиокавографии, поскольку эхолокация сосудов выше проекции
паховой связки затруднена из-за кишечного газа. Метод позволяет
чётко определить проксимальную границу тромба и его характер. Кроме
того, во время ангиографии возможен переход от диагностического
этапа процедуры к лечебному (имплантации кава-фильтра, катетер-
ной тромбэктомии и др.).
Окклюзивный тромбоз характеризуется отсутствием
контрастирования магистральной вены и её «ампутацией» на том или ином
уровне. Обрыв визуализируемого сосуда имеет практически ровную
границу. Пристеночный тромб выглядит как дефект наполнения,
суживающий просвет вены в дистальном направлении, в результате чего
она перестаёт визуализироваться. При флотирующем тромбе
отмечают отсутствие контрастирования магистральной вены, а из её
проекции исходит верхушка тромба, обтекаемая контрастом с трёх сто-
Рис. 37-4. Флотирующий
тромб общей бедренной
вены. Ультразвуковая ангио-
сканограмма. Тромб исходит
из устья большой
подкожной вены. Верхушка имеет
овальную форму, не
фиксирована к стенкам сосуда.
рон. Дефект контрастирования чаще всего имеет языкообразную
форму и ровные контуры (рис. 37-5).
Наиболее серьёзный недостаток ангиографического
исследования — лучевая нагрузка, что ограничивает применение метода у
беременных.
Последняя по порядку, но отнюдь не по значению, задача —
выявление причины тромбообразования. Когда отсутствует явная
предпосылка для возникновения тромбоза (травма, беременность,
послеоперационный период и др.), в первую очередь необходимо исключить
онкологическую патологию. Для этого после устранения
непосредственной угрозы лёгочной эмболии больному необходимо провести
обследование, включающее гастродуоденоскопию, УЗИ органов
брюшной полости, забрюшинного пространства и малого таза,
исследование на наличие опухолевых биохимических маркёров; при
необходимости выполнить колоноскопию. При подозрении на
врождённые или приобретённые нарушения системы гемостаза (тромбо-
филии) проводят их лабораторную диагностику.
Рис. 37-5. Флотирующий тромб
инфраренального отдела
нижней полой вены (ретроградная
илиокавограмма).
стрые венозные тромбозы ♦ 249
Лечение
Задачи лечения венозного тромбоза вне зависимости от
конкретной его локализации могут быть сформулированы следующим образом.
• Остановить распространение тромбоза.
• Предотвратить ТЭЛА.
• Не допустить прогрессирования отёка.
• Восстановить проходимость вен.
• Предупредить рецидив тромбоза.
В лечении венозного тромбоза используют как хирургические, так
и терапевтические методы. Основу составляют консервативные
мероприятия.
Консервативное лечение
Консервативное лечение предполагает активное ведение больных
с применением эластической компрессии поражённой конечности,
что способствует улучшению венозного оттока. Если пациент лежит
в постели, конечность необходимо приподнять под углом 15—20°.
Применение локальной гипотермии на зону проекции сосудистого
пучка способствует стиханию флебита и уменьшению болей.
Основой всех лечебных мероприятий при тромбозах глубоких вен
служит антикоагулянтная терапия. Это наиболее действенное
средство прекращения прогрессирования тромбоза с доказанным
лечебным эффектом. Антикоагулянтная терапия предполагает
последовательное применение прямых (стандартный, нефракционированный
или низкомолекулярный гепарин) и непрямых (антивитамины К)
антикоагулянтов. Её необходимо проводить с учётом
противопоказаний к препаратам.
Начальную суточную дозу обычного, нефракционированного
гепарина определяют, умножая массу тела больного в кг на 450 ЕД.
Предпочтительна постоянная капельная инфузия препарата под
контролем лабораторного определения активированного частичного
тромбопластинового и тромбинового времени. Значения этих
показателей должны быть в 1,5—2 раза выше нормы. При подкожном
введении суточную дозу делят на 3 инъекции.
Главные преимущества низкомолекулярных гепаринов по
сравнению с нефракционированным гепарином — высокая биодоступность
(не менее 90%) при подкожном введении, более продолжительное
250 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 37
действие (в 4—5 раз), меньшая частота геморрагических осложнений,
остеопороза и значительно менее выраженное влияние на функции
тромбоцитов. Оптимально подкожное введение низкомолекулярных
гепаринов (эноксапарин, далтепарин, надропарин и др.) в
подобранной по массе пациента дозе. Суточная лечебная доза эноксапа-
рина натрия составляет 2 мг/кг, надропарина кальция — 0,02 мл/кг,
далтепарина натрия — 200 МЕ/кг (но не более 18 000 ME). При
лечебном применении низкомолекулярные гепарины вводят
подкожно 1—2 раза в сутки.
Длительность гепаринотерапии зависит от клинической ситуации
и составляет в среднем 5—7 сут. За 3 дня до предполагаемой отмены
гепарина назначают непрямые антикоагулянты (варфарин, аценоку-
марол). Эффективную дозу непрямых антикоагулянтов подбирают по
величине протромбинового времени. Гепарин можно отменить,
когда международное нормализованное отношение будет
соответствовать терапевтическому уровню (2,0—3,0) в течение 2 дней подряд.
Чувствительность больных к пероральным антикоагулянтам
неодинакова, зависит от нескольких факторов: состояния ЖКТ,
особенностей метаболизма в печени, диеты и т.д. Поэтому их дозировку
необходимо подбирать индивидуально.
Необходимо помнить, что непрямые антикоагулянты
противопоказаны при беременности, поскольку на ранних её сроках возможен
тератогенный эффект, а на поздних они вызывают геморрагические
осложнения у родильниц и новорождённых. У лиц,
злоупотребляющих алкоголем, страдающих циррозом печени и пациентов старше
75 лет от назначения непрямых антикоагулянтов также
целесообразно воздержаться и использовать другие, менее опасные антитромбо-
тические средства (например, дезагреганты).
В настоящее время разработан и начинает входить в клиническую
практику новый класс антикоагулянтов: пероральные прямые
ингибиторы тромбина. Они созданы на основе мелаготрана, имеют широкое
терапевтическое «окно», легко дозируются и способны, вероятно, у
части больных заменить как гепарин, так и непрямые антикоагулянты.
Оптимальная продолжительность лечения антикоагулянтами для
предотвращения рецидива тромбоза у больных с обратимыми
факторами риска (тромбоз после операции, травмы, родов) составляет не
менее 3—6 мес. Для пациентов с постоянно сохраняющимися
факторами риска (врождённые тромбофилии, неопластические процессы)
продолжительность приёма непрямых антикоагулянтов — не менее
года. В некоторых случаях обоснована пожизненная терапия. Про-
Острые венозные тромбозы <> 251
ведение антикоагулянтной терапии показано всем больным с
тромбозом глубоких вен (если нет противопоказаний). При тромбозе
поверхностных вен её используют ограниченно (см. ниже).
В фармацевтическом арсенале существуют средства, способные
растворять фибриновую основу тромба (тромболитики). К ним
относят препараты стрептокиназы, урокиназы и тканевого активатора
плазминогена, активирующие эндогенный фибринолиз. Тромболи-
тическая терапия эффективна лишь в первые несколько суток от
начала заболевания, когда её применение в части случаев позволяет
восстановить проходимость сосуда, сохранить неизменёнными
интиму и венозные клапаны. К недостаткам метода относят
значительное количество абсолютных противопоказаний (его нельзя применять
до 10-х суток послеоперационного и послеродового периодов, во
время беременности, при наличии новообразований, язвенной болезни
и т.д.), геморрагических осложнений, значительные экономические
затраты. Кроме того, введение тромболитиков в общий кровоток чаще
всего бывает неэффективно, поэтому используют их регионарную
инфузию по катетеру, установленному непосредственно в зоне
тромбоза, что предполагает проведение ангиографического исследования.
Регионарную тромболитическую терапию успешно применяют при
болезни Педжета—Шреттера. После её окончания велика опасность
повторного тромбоза, поэтому помимо назначения антикоагулянтов
больным выполняют эндоваскулярные вмешательства, направленные
на устранение стеноза проксимального отдела подключичной вены.
Наибольшее применение тромболитики нашли в лечении массивной
ТЭЛА (см. главу 38).
Наряду с антикоагулянтами при венозном тромбозе
используют неспецифические противовоспалительные средства, дезагреган-
ты, флебоактивные препараты, улучшающие периферическую
микроциркуляцию, венозный и лимфатический отток и способствующие
уменьшению отёка. Применение антибиотиков при венозном
тромбозе бессмысленно. Исключение необходимо сделать для больных
с воспалительными очагами, инфарктной пневмонией, «входными
воротами» для инфекции (открытыми переломами, операционной
травмой и др.), а также пациентов с высоким риском септических
осложнений.
Не следует применять всевозможные согревающие спиртовые и
мазевые компрессы, усиливающие приток крови к поражённой
конечности. Они могут способствовать сохранению флебита и прогрес-
сированию тромбоза.
252 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV <♦- Глава 37
Хирургическое лечение
Хирургическое лечение направлено на предотвращение
массивной лёгочной эмболии и восстановление проходимости венозного
русла. Совместное решение этих задач возможно при выполнении
радикальной тромбэктомыи. Однако значительная частота повторных
тромбозов магистральных вен, обусловленных флебитом, плотной
фиксацией тромботических масс к сосудистой стенке,
распространением процесса на дистальное русло, послужила причиной отказа
большинства хирургов от этого вида оперативных вмешательств.
Вместе с тем в отдельных случаях, при малом сроке заболевания и
сегментарном тромбозе, радикальная тромбэктомия приводит к
отличным ближайшим и отдалённым результатам.
В настоящее время чаще всего выполняют паллиативные
операции, направленные исключительно на предотвращение массивной
лёгочной эмболии. Показаниями к ним считают эмболоопасные
(флотирующие) тромбы системы нижней полой вены. С этой целью
применяют следующие виды оперативных вмешательств.
• Эндоваскулярные операции.
• Пликация нижней полой вены.
• Перевязка вен.
• Паллиативная тромбэктомия.
Эндоваскулярные операции
В настоящее время при локализации флотирующего тромба в ин-
фраренальном илиокавальном сегменте широко используется чрес-
кожная имплантация проволочных кава-фильтров различных
моделей, изготовленных на основе различных сплавов (рис. 37-6).
Современные фильтрующие устройства обладают высокой эмбо-
лоулавливающей способностью (до 98%), биологической
инертностью, атромбогенностью, способностью к безопасной фиксации и
самоцентрированию в просвете вены. Конструкция фильтров позволяет
помещать их в сложенном виде в гильзу диаметром менее 3 мм, что
даёт возможность имплантировать их чрескожно. В качестве вены
доступа чаще всего используются левая подключичная и правая
внутренняя яремная вены. Кава-фильтр устанавливают после окончания
диагностического этапа ангиографического исследования, его
помещают тотчас дистальнее устьев почечных вен, чтобы предотвратить
их окклюзию и образование «слепого мешка», в котором может сфор-
Острые венозные тромбозы ♦ 253
Рис. 37-6. Кава-фильтр «песочные
часы».
мироваться тромб. Этот уровень имплантации фильтра считается
универсальным, поскольку позволяет предотвратить лёгочную
тромбоэмболию из вен таза и обеих нижних конечностей.
Использование кава-фильтра существенно уменьшает риск эмболии в течение
4-6 нед с момента развития тромбоза. В то же время наличие
инородного тела в просвете сосуда приводит к более частым рецидивам
тромбоза в отдалённом периоде. Поэтому расширять показания для
его применения нецелесообразно.
Большинство моделей фильтров устанавливается пожизненно.
Дальнейшее совершенствование методик эндовазальных
вмешательств позволило создать фильтрующие устройства, которые можно
после устранения угрозы лёгочной эмболии достаточно просто и
безопасно удалять из нижней полой вены с помощью специального
инструмента (временные кава-фильтры). Период возможного
пребывания такого фильтра в нижней полой вене может составлять до 6 нед.
В последующем процесс фиброза и образования неоэндотелия в
местах соприкосновения кава-фильтра и стенок полой вены препятствует
его удалению.
Наиболее сложные задачи приходится решать при «высоких»
тромбозах нижней полой вены, когда флотирующая проксимальная часть
254 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV <> Глава 37
тромба располагается в её ренальном или супраренальном отделе.
Имплантация кава-фильтра в такой ситуации возможна лишь в суп-
раренальную позицию, что чревато нарушением оттока крови из
почечных вен. Перспективы эффективного лечения этой категории
больных открывают методы катетерной тромбэктомии. Тромбэкто-
мическое устройство Amplatz позволяет полностью фрагментировать
и аспирировать тромб. Другим устройством для решения данной
задачи служит эндоваскулярный тромбоэкстрактор, представляющий
собой конусообразный синтетический «капюшон», помещённый на
конце специального катетера. В сложенном виде этот инструмент
проводят через внутреннюю яремную вену в нижнюю полую выше
верхушки флотирующего тромба. Затем открытый «капюшон»
надевают на флотирующую часть тромба, затягивают металлическую
петлю у его основания и срезанный тромб оказывается внутри тромбо-
экстрактора. В таком положении инструмент вместе с тромбом
удаляют через флеботомию в яремной вене.
Пликация нижней полой вены
Методика операции заключается в прошивании просвета нижней
полой вены тотчас ниже устьев почечных вен П-образными швами
таким образом, что просвет вены разделяется на ряд каналов. Для
этого чаще всего применяют механический шов с наложением
металлических скобок в продольном
относительно оси сосуда направлении. В
результате пликации образуются каналы
диаметром около 5 мм, достаточные для
оттока венозной крови, но не
пропускающие крупные тромбоэмболы (рис. 37-7).
Пликацию выполняют в тех случаях,
когда имплантация фильтрующих
устройств невозможна по различным
причинам анатомического и технического
характера. В ходе этого оперативного
вмешательства возможно в качестве
первого этапа удалить флотирующий тромб из
супраренального отдела нижней полой
вены или кава-фильтр, располагающийся
Рис. 37-7. Нижняя полая ве- в неправильной позиции. Пликацию мож-
на после пликации (схема). но выполнить и при беременности по
Острые венозные тромбозы ♦ 255
здних сроков, когда сложно имплантировать кава-фильтр в
сдавленную маткой нижнюю полую вену. В этих случаях первоначально
осуществляют родоразрешение путём кесарева сечения. Ещё одним
показанием к данной операции является сочетание диагностированных
операбельных опухолей брюшной полости и забрюшинного
пространства с эмболоопасными венозными тромбозами, когда ллика-
ция нижней полой вены может быть проведена в ходе
абдоминального хирургического вмешательства.
Перевязка вен
Перевязка вен выше тромба также предотвращает эмболизацию
лёгочного сосудистого русла. Это наиболее старая из
профилактических операций, впервые её выполнили более 100 лет назад. В
настоящее время лигируют только те вены, прекращение кровотока по
которым не вызывает серьёзных нарушений венозного оттока из
конечности. В первую очередь это относится к перевязке большой
подкожной вены при восходящем варикотромбофлебите. Эта
операция предотвращает распространение тромба на бедренную вену и, тем
самым, возможную эмболию. При выявлении флотирующих
тромбов в бедренно-подколенном венозном сегменте производят
перевязку поверхностной бедренной вены. В этих случаях есть возможность
блокировать только ту часть венозного русла, откуда угрожает
лёгочная эмболия. Перевязку выполняют тотчас дистальнее места
впадения глубокой вены бедра, по которой будет осуществляться
венозный отток, поэтому её проходимость является обязательным условием
для данного вида оперативного вмешательства. При
распространении флотирующей части тромба на общую бедренную вену перед
перевязкой вены удаляют проксимальную часть тромба.
Паллиативная тромбэктомия
Попытки полного удаления тромботических масс из венозного
русла, в том числе и с использованием баллонного катетера Фогарти,
очень часто заканчиваются ретромбозом (особенно при большой
длительности заболевания), который развивается на фоне флебита и
попутного разрушения клапанов при проведении катетера. В
настоящее время часто выполняют тромбэктомию лишь той части
флотирующего тромба, которая препятствует перевязке магистральной вены
проксимальнее тромба (из общей бедренной, общей подвздошной
вены) либо выполнению пликации.
256 О- Хирургические болезни Ф Том 2 ♦ Часть IV ♦ Глава 37
Особенности лечения тромбозов
глубоких вен системы нижней полой вены
При ведении больных в первую очередь необходимо учитывать
опасность развития ТЭЛА, локализацию тромбоза и его
распространённость, длительность заболевания, наличие сопутствующей
патологии и тяжесть состояния больного. На основе этого определяют
тактику лечения пациента в каждом конкретном случае.
Подозрение на острый тромбоз глубоких вен, а тем более
подтверждённый диагноз — показание к экстренной госпитализации
больного. Проводимая в амбулаторных условиях антитромботическая
терапия, включая антикоагулянтную, может лишь препятствовать
прогрессированию тромбоза, однако не в состоянии защитить
больного с уже имеющимся флотирующим тромбом от лёгочной
эмболии. Она возможна лишь при полной уверенности врача
(подтверждённой инструментальным обследованием) в отсутствии угрозы
массивной лёгочной эмболии и наличии условий для динамического
ультразвукового контроля состояния венозного русла.
До инструментального обследования следует всегда исходить
из предположения, что у пациента есть флотирующий тромб.
Транспортируют больного в стационар в положении лёжа, до
обследования необходимо соблюдение больным постельного режима.
Опасность венозного тромбоза ещё и в том, что он не создаёт у больного
впечатления угрожающего жизни заболевания, и часть пациентов
принимают субъективное улучшение самочувствия (уменьшение
отёка и болей) за начинающееся выздоровление. Между тем
смертельная лёгочная эмболия может развиться даже во время
прогулки по коридору.
Для пациентов с окклюзивными и пристеночными формами
венозного тромбоза угрозы тромбоэмболии нет, им не нужен
постельный режим. Обычно им назначают консервативное лечение, иногда
в амбулаторных условиях. При выявлении эмболоопасного
тромбоза предотвращение лёгочной эмболии становится первостепенной
задачей, её необходимо срочно решить с помощью прямых или эн-
доваскулярных хирургических вмешательств. В послеоперационном
периоде проводят лечение антикоагулянтами по изложенным выше
принципам. Обязательно длительное использование
компрессионного бандажа, накладываемого с помощью эластических бинтов, либо
применение компрессионного трикотажа (подробности
компрессионного лечения изложены в главе 39).
Острые венозные тромбозы О- 257
Особенности лечения тромбозов системы верхней полой вены
При лечении тромбоза подключичной вены необходимо не
только прекратить процесс тромбообразования, но также ликвидировать
стеноз сосуда и устранить причины его компрессии. Попытки тромб-
эктомии из подключичной вены, аутовенозное шунтирование или
пластика сосуда, резекция ключицы редко бывают успешными из-за
чрезвычайно большого количества повторных тромбозов. Неудачи
хирургического лечения привели к тому, что доминирующим стало
консервативное направление. Применение антикоагулянтов
останавливает распространение тромбоза, что способствует спонтанному
тромболизису и реканализации венозного сосуда. Параллельно
назначают флебопротекторы, рекомендуют возвышенное положение
конечности. В верхних конечностях, в отличие от нижних, в связи с
особенностями оттока крови крайне редко возникают явления
тяжёлой хронической венозной недостаточности.
Более эффективно сочетание регионарного тромболизиса с
последующей баллонной ангиопластикой стеноза и эндопротезировани-
ем. Такой подход избавляет пациента от рецидивов заболевания и
позволяет получить лучшие функциональные результаты.
Особенности лечения варикотромбофлебита
Лечебные мероприятия при остром варикотромбофлебите
должны способствовать решению следующих задач.
• Предотвратить распространение тромбоза на глубокие вены и
возможную эмболию лёгочных артерий.
• Быстро купировать воспалительные явления в стенке вены и
окружающих тканях.
• Исключить рецидив тромбофлебита.
Пациентов с локализацией тромботического процесса в
подкожных венах голени в бассейне большой подкожной вены можно
лечить консервативно в амбулаторных условиях. Непосредственной
угрозы перехода тромбоза на сафенофеморальное соустье у этой
категории больных нет, хотя, разумеется, они должны находиться под
наблюдением хирурга. Применяют локальную гипотермию,
эластическую компрессию, неспецифические противовоспалительные
средства, дезагреганты, флеботоники. Использование антибактериальных
средств совершенно не оправданно, поскольку при тромбофлебите
воспалительный процесс имеет асептический характер. В
большинстве случаев нет никакой необходимости в системном применении
258 ♦ Хирургические болезни -0- Том 2 ♦ Часть IV ♦ Глава 37
антикоагулянтов. Их используют в случаях тромбоза поверхностных
вен, осложняющего течение посттромбофлебитической болезни, и
при рецидивирующем характере тромбофлебита у больных с тромбо-
филическими состояниями.
При восходящих формах тромбофлебита стволов большой
(распространение процесса на бедро) или малой подкожной вены
возникает непосредственная угроза перехода тромбоза на глубокие вены и
лёгочной эмболии. Таких больных необходимо неотложно
госпитализировать в хирургический стационар и оперировать в экстренном
порядке после выполнения ультразвукового ангиосканирования.
Хирургическое лечение может быть паллиативным или
радикальным. Цель паллиативных операций — предотвращение перехода
тромбоза на глубокие вены через сафено-феморальное или сафено-поп-
литеальное соустье. Для этого выполняют приустьевую перевязку
подкожных магистралей. При поражении большой подкожной вены
выполняют операцию Троянова—Тренделенбурга (точнее, её
современную модификацию) — высокое лигирование большой подкожной
вены с обязательной перевязкой всех приустьевых притоков и
иссечением ствола подкожной вены в пределах раны. В последние годы в
литературе для обозначения этой операции чаще используют термин
кроссэктомия.
При соматически неотягощённом анамнезе возможно
радикальное хирургическое лечение. Оно заключается в удалении всех вари-
козно расширенных (тромбированных и нетромбированных) вен с
обязательной перевязкой перфорантных вен при их клапанной
недостаточности.
Осложнения
Наиболее опасное осложнение острого венозного тромбоза —
массивная ТЭЛА. Ей посвящена следующая глава учебника. Другое
осложнение — венозная гангрена — редкое, но чрезвычайно тяжёлое и
опасное. В основе его развития лежит тотальная тромботическая
окклюзия как магистральных, так и коллатеральных путей венозного
оттока из поражённой конечности. Полная блокада венозного
оттока приводит к крайне тяжёлым нарушениям гемодинамики, как
регионарной (в поражённой конечности), так и центральной. В
конечности депонируется огромное количество крови, способное достигать
3-4 л. Это, в свою очередь, приводит к гиповолемическому шоку —
Острые венозные тромбозы ♦ 259
наиболее частой причине смерти. Тяжесть состояния больных
усугубляется местными изменениями поражённой конечности.
Среди этой категории пациентов до 40% составляют больные со
злокачественными новообразованиями, около 30% — лица,
страдающие выраженными тромбофилическими состояниями. Прогноз при
венозной гангрене чрезвычайно тяжёлый, летальность достигает 60%.
Лечение заключается в проведении мероприятий по выведению
больного из быстро прогрессирующего гиповолемического шока. При их
неэффективности в течение суток необходима высокая ампутация
конечности.
Посттромбофлебитическая болезнь — отдалённое осложнение или,
точнее, последствие нелеченного (или леченного неадекватно)
венозного тромбоза. Особенности её клинического течения, диагностики
и лечения изложены в главе 39.
Исходы
Венозный тромбоз — не статичное состояние, а динамичный
процесс. Возникнув в каком-либо сегменте, тромбоз претерпевает
определённую эволюцию, от чего зависят функциональные
возможности поражённой конечности, прогноз трудоспособности
пациента, а порой и его жизнь. Возможны следующие варианты течения
заболевания.
Спонтанный лизис образовавшегося тромба. Такой исход наиболее
характерен для пристеночных или сегментарных тромбов,
сформировавшихся в венах малого диаметра. Способствуют спонтанному
лизису назначение антикоагулянтов, эластическая компрессия
конечности и активная работа мышечно-венозной помпы, что приводит к
увеличению фибринолитической активности крови за счёт более
интенсивного образования тканевого активатора плазминогена.
Прогрессирование процесса тромбообразования с
распространением тромбоза в проксимальном и/или дистальном направлении.
Такой исход наблюдают наиболее часто в отсутствие адекватной анти-
коагулянтной терапии.
Отрыв тромба (или его части) и его миграция по току крови,
завершающаяся эмболизацией артерий малого круга кровообращения.
В связи со значительным размером флотирующих тромбов подобное
развитие заболевания примерно в 30% случаев заканчивается
фатальным исходом.
260 О Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 37
Организация тромботинеских масс с последующей реканализацией
поражённой вены или формированием стойкой её окклюзии. Процессы
ретракции, гуморального и клеточного лизиса начинаются уже через
2-3 нед от начала заболевания и способствуют уменьшению
размеров тромба. Параллельно идут процессы его организации и рекана-
лизации. Постепенно проходимость большинства сосудов
восстанавливается. Между тем клапанный аппарат вен разрушается, а остатки
тромбов в виде пристеночных соединительнотканных бляшек и
тяжей деформируют сосудистую стенку. Реканализация венозного
русла редко бывает полной. На некоторых участках формируются
стенозы, а иногда сохраняется и полная окклюзия венозных сосудов. Эти
патоморфологические изменения становятся причиной развития
посттромбофлебитической болезни и появления признаков
хронической венозной недостаточности.
Рецидив тромбоза в том же либо другом сосудистом регионе. Пост-
тромботические изменения венозного русла наряду с иными
провоцирующими факторами предрасполагают к рецидиву тромбоза. При
отсутствии лечения непрямыми антикоагулянтами примерно у 30%
больных в течение 3 мес возникает рецидив тромбоза. Через год
частота ретромбоза в этой группе достигает 70% (по сравнению с 4-5%
при проведении лечения).
Своевременная диагностика и эффективные лечебные
мероприятия, проводимые как в остром, так и в посттромботическом периоде,
определяют благоприятный прогноз заболевания и исход венозного
тромбоза, позволяют сохранить социальную активность пациентов и
достойный уровень качества их дальнейшей жизни.
ТРОМБОЭМБОЛИЯ
ЛЁГОЧНЫХ АРТЕРИЙ
Одно из наиболее распространённых острых сосудистых
заболеваний — тромбоэмболия лёгочных артерий (ТЭЛА). Под этим
термином понимают окклюзию лёгочного ствола или его ветвей
различного калибра тромбом, первично образовавшимся в венах большого
круга кровообращения либо правых полостях сердца и принесённым
в сосудистое русло лёгких током крови. ТЭЛА следует отличать от
первичного их тромбоза, встречаемого достаточно редко и
возникающего в дистальном сосудистом русле лёгких в условиях застоя,
например, при декомпенсированных пороках сердца.
ТЭЛА — причина большего количества летальных исходов, чем
несчастные случаи на дорогах, рак лёгких и пневмония вместе
взятые. В общей структуре причин внезапных летальных исходов эта
патология занимает третье место. Смертность от неё в общей
популяции колеблется от 2 до 6%. Лёгочную эмболию прижизненно не
диагностируют у 40—70% больных. Эти данные указывают на
огромную значимость данной патологии для клинической медицины.
Этиология и патогенез
Источником ТЭЛА в подавляющем большинстве случаев (более
90%) становится тромбоз в системе нижней полой вены.
Значительно реже тромбоз, обусловивший развитие тромбоэмболии,
локализуется в верхней полой вене и её притоках, а также в правом
предсердии в условиях его дилатации и мерцательной аритмии. Причины
мобилизации тромба с последующей его миграцией в малый круг
кровообращения изучены недостаточно. Они связаны с особенностями
формирования и распространения тромбоза, процессами ретракции и
эндогенного фибринолиза, а также колебаниями внутрисосудистого
давления и связанным с этим смещением тромба при изменении
положения тела, ходьбе, повышении внутрибрюшного давления и т.д.
ТЭЛА, как правило, возникает у больных с эмболоопасными
формами венозного тромбоза. К ним относят флотирующие (плавающие)
тромбы. Они имеют единственную точку фиксации к венозной стен-
262 ♦ Хирургические болезни ♦ Том 2 ^ Часть IV ♦ Глава 38
ке в дистальном отделе, а остальная их часть расположена свободно
и может быть легко смыта потоком крови (см. главу 37).
Локализация тромбоэмболов в сосудистом русле лёгких во
многом зависит от их размеров. Обычно эмболы задерживаются в местах
деления артерий, вызывая частичную или, реже, полную окклюзию
дистальных ветвей. Характерно поражение лёгочных артерий обоих
лёгких, что вызвано повторной эмболизацией малого круга
кровообращения и фрагментацией тромба-эмбола в момент прохождения
через правый желудочек. Даже полная эмболическая окклюзия
одной из лёгочных артерий не всегда приводит к развитию инфаркта
лёгких. Если же инфаркт возникает, то его зона почти всегда
значительно меньше бассейна обтурированного сосуда. Это объясняется
функционированием бронхолёгочных сосудистых анастомозов на
уровне прекапилляров.
Ведущую роль в генезе гемодинамических расстройств, гипоксе-
мии, выраженности клинических признаков ТЭЛА, её течении и
исходе играет фактор механической обструкции. Распространённая
окклюзия артериального русла лёгких ведёт к увеличению
лёгочного сосудистого сопротивления, что препятствует выбросу крови из
правого желудочка сердца (увеличение постнагрузки) и
недостаточному заполнению левого желудочка (снижение преднагрузки).
У больных без сопутствующих заболеваний сердца и лёгких гипер-
тензия малого круга кровообращения (систолическое давление выше
30 мм рт.ст.) возникает при обструкции около 50% лёгочного
артериального русла. Окклюзия 75% лёгочной циркуляции —
критический уровень поражения, так как вызывает правожелудочковую
недостаточность и падение минутного объёма кровообращения. До
определённого времени увеличенное сопротивление большого круга
поддерживает стабильный уровень системного АД. Если лёгочный
кровоток не восстанавливается, прогрессирующее снижение СВ
приводит к системной гипотензии и в конечном счёте к гибели больно
го (схема).
В острой стадии заболевания массивная эмболия может привести
к подъёму давления в малом круге кровообращения не выше 70 мм
рт.ст. Негипертрофированный правый желудочек из-за ограниченных
резервных возможностей не способен генерировать более высокий
уровень гемодинамической активности в условиях острой блокады
лёгочного кровотока. Превышение уровня этого параметра указыва
ет на длительный характер эмболической окклюзии пли наличие
сопутствующей сердечно-лёгочной патологии.
Тромбоэмболия лёгочных артерий <> 263
Схема патогенеза гемодинамических нарушений при массивном
эмболическом поражении лёгочных артерий.
В ситуациях массивной ТЭЛА (поражение лёгочного ствола и/или
главных лёгочных артерий), сопровождающихся существенной
лёгочной гипертензией, происходит реверсия межпредсердного градиента
давления (в правом оно становится выше). За счёт этого у больных с
открытым овальным окном (оно анатомически не заращено у 25%
взрослого населения) начинает функционировать право-левый шунт
на уровне предсердий. Такое шунтирование крови предотвращает
264 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава
необратимую дилатацию правых отделов сердца и асистолию, но
чревато развитием парадоксальной эмболии артерий большого круга
кровообращения.
В части случаев, несмотря на массивное эмболическое поражение
лёгочных артерий, пациентам удаётся пережить острую стадию
заболевания. Даже в отсутствие специфического лечения (антикоагулянты
и тромболитические средства) наблюдают постепенное
восстановление проходимости лёгочных сосудов за счёт эндогенного
гуморального и лейкоцитарного лизиса тромбов, процессов их ретракции и
васкуляризации. В ряде случаев постэмболическая обтурация
лёгочных артерий сохраняется на протяжении длительного времени. Это
обусловлено рецидивирующим характером заболевания,
недостаточностью эндогенных литических механизмов либо выраженными
явлениями соединительнотканной трансформации тромбоэмбола к
моменту попадания его в лёгочное русло.
Персистирующая окклюзия крупных лёгочных артерий вызыва-ет
развитие тяжёлой гипертензии в малом круге кровообращения и
хронического «лёгочного сердца». Они могут стать причиной смерти
больных спустя месяцы и даже годы с момента возникновения эмболии.
Клиническая картина
Клинические проявления ТЭЛА зависят от ряда факторов:
локализации эмболов, степени нарушения лёгочной перфузии и
гемодинамики, наличия инфаркта лёгкого и инфарктной пневмонии,
исходного состояния больного, сопутствующих заболеваний, а также
времени, прошедшего с момента эмболии. Клинические признаки,
несмотря на их неспецифичность, дают основание заподозрить
заболевание и ориентировочно судить о локализации поражения.
Эмболия дистальных ветвей лёгочных артерий у подавляющего
большинства больных проявляется симптомами инфарктной
пневмонии. Для неё характерны резкие «плевральные» боли в груди,
усиливающиеся при дыхании, умеренная одышка, кашель со скудной
мокротой, гипертермия. Кровохарканье, считающееся типичным
симптомом, наблюдают лишь в трети случаев. При физикальном
исследовании выявляют притупление перкуторного звука, влажные
хрипы, иногда шум трения плевры.
В значительной доле случаев ТЭЛА инфаркт лёгкого не
развивается, что затрудняет диагностику. Клинические симптомы полное-
Тромбоэмболия лёгочных артерий ♦ 265
тью отсутствуют у 60% больных с эмболией долевых и сегментарных
лёгочных артерий. При появлении признаков инфарктной
пневмонии следует учитывать, что тромбоэмболия произошла за 2—3 дня до
этого момента (время, необходимое для формирования инфаркта).
На фоне сопутствующей патологии сердца эмболическая
окклюзия дистальных отделов сосудистого русла лёгких может
проявляться коллапсом и симптомами правожелудочковой недостаточности.
Особое значение представляет симптоматика тромбоэмболии
лёгочного ствола и его главных ветвей, которую обычно называют
массивной. Известен классический синдром массивной эмболии:
внезапный коллапс, появление болей за грудиной, удушье, цианоз лица
и верхней половины туловища. Но этот полный симптомокомплекс
наблюдают лишь у 15% больных с тромбоэмболией главных
лёгочных артерий. Значительно чаще встречают один или два признака.
Коллапс или обморочное состояние регистрируют в 50% случаев.
Диффузный цианоз можно обнаружить при осмотре менее чем у
трети пациентов. Развитие последнего связано с обширной
эмболической блокадой сосудистого русла лёгких и выраженной гипоксемией.
Гипоксемия может усугубляться сбросом крови через открытое
овальное окно, начинающее функционировать в условиях остро
развившейся гипертензии малого круга кровообращения. В 50%
наблюдений массивной тромбоэмболии отмечают выраженную бледность
кожных покровов. Этот симптом возникает вследствие спазма
периферических сосудов в ответ на резкое снижение СВ. Акцент II тона
над лёгочной артерией регистрируют, как правило, при
систолическом давлении в малом круге выше 50 мм рт.ст. Признаки
правожелудочковой недостаточности (увеличение печени, набухание и
пульсация яремных вен) выявляют в тех случаях, когда из кровоснабжения
выключается более 60% артериального русла лёгких.
Обычно наблюдают прямую пропорциональную зависимость
между объёмом эмболической обструкции, частотой дыхания и
пульсом. Значительные тахипноэ (более 40 дыхательных движений
в минуту) и тахикардия (более 120 в минуту) — крайне
неблагоприятные прогностические признаки. Несмотря на выраженную
одышку, больные с лёгочной эмболией предпочитают лежать и не
занимают положение ортопноэ, что отличает их от пациентов с одышкой
кардиальной природы. Между тем иногда встречают случаи
массивной ТЭЛА без существенной одышки, но с симптомами малого СВ;
стойкой артериальной гипотензией, тахикардией, бледностью
кожных покровов.
266 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 38
У 30% больных с ТЭЛА симптомы малого СВ сочетаются с
признаками инфаркта лёгких (плевральные боли, гипертермия,
кровохарканье). Это объясняется фрагментацией большого тромбоэмбола
и миграцией его частей в дистальные отделы артериального русла, а
также предшествующими мелкими ТЭЛА. Анамнез и данные физи-
кального исследования позволяют достаточно уверенно заподозрить
ТЭЛА у пациентов без тяжёлых сопутствующих заболеваний сердца
и лёгких. Внезапное начало болезни с развитием коллапса, боли за
грудиной, диффузный цианоз или резкая бледность кожных
покровов, набухание и пульсация шейных вен, акцент II тона над лёгочной
артерией, быстрое увеличение печени и границ сердца с появлением
эпигастральной пульсации указывают на массивный характер
поражения артериального русла лёгких. Об этом же свидетельствует
значительное увеличение частоты дыхания (свыше 30 в минуту) и
пульса (более ПО в минуту).
При сопутствующей сердечно-лёгочной патологии на ТЭЛА
указывают внезапное ухудшение состояния, выраженная одышка и
тахикардия. Диагноз лёгочной эмболии легче поставить при наличии
признаков венозного тромбоза (см. главу 37), но следует иметь в виду,
что в 50% случаев ТЭЛА клинические симптомы тромботического
поражения системы нижней полой вены отсутствуют, т.е. оно
протекает бессимптомно.
Дифференциальная диагностика
Клинические признаки, характерные для ТЭЛА, могут быть
обусловлены другими патологическими состояниями. Диапазон
диагностических ошибок достаточно широк. Часто возможны как ложно-
отрицательные, так и ложноположительные заключения о наличии
лёгочной эмболии.
У больных с распространённым эмболическим поражением вас-
кулярного русла лёгких чаще всего ошибочно диагностируют инфаркт
миокарда. Электрокардиографическое исследование часто не вносит
ясности в понимание истинной сути имеющейся патологии, если
центральная локализация окклюзии лёгочных артерий
сопровождается падением СВ, что приводит к развитию ишемии миокарда.
В связи с этим появляется необходимость в регистрации ЦВД и
параметров внутрисердечной и лёгочной гемодинамики, что можно осз
ществить в отделении интенсивной терапии с помощью «плавающе-
го» (баллонного) катетера Суона—Ганца. Для тромбоэмболии
характерны повышение давления в малом круге кровообращения и
правых отделах сердца, возрастание лёгочного сосудистого
сопротивления, снижение СВ и нормальная величина ДЗЛА. Окончательно
диагноз тромбоэмболии можно подтвердить только после оценки
кровотока в лёгких с помощью радионуклидного сканирования либо рен-
тгеноконтрастного исследования лёгочных артерий.
Вместо тромбоэмболии главных лёгочных артерий иногда
ошибочно ставят диагноз обширной пневмонии, которая действительно есть
у больного, но носит инфарктный характер и чаще развивается на
фоне сопутствующей сердечной патологии. Истинная причина
происхождения острых симптомов сердечно-лёгочной недостаточности
становится ясной только во время ангиопульмонографии.
Исходная кардиальная патология затрудняет клиническую
трактовку возникающих симптомов. Во время осмотра необходимо
обращать внимание на признаки венозного тромбоза, наличие набухания
и пульсации шейных вен, электро- и эхокардиографические
симптомы перегрузки правых отделов сердца.
Серьёзные диагностические проблемы могут возникать при мик-
соме — доброкачественной опухоли сердца, исходящей из
эндокарда, которая может локализоваться в любой его полости. Возникающая
вследствие неё острая сердечно-сосудистая и лёгочная
недостаточность обусловлена нарушениями внутрисердечного кровотока. За счёт
фрагментации миксомы возможна эмболия не только большого,
но и малого круга кровообращения. У таких больных отсутствуют
признаки периферического венозного тромбоза. Ухудшение состояния
большинства из них связано с переменой положения тела. Основные
методы обнаружения миксомы — эхо- и ангиокардиография.
В целом гиподиагностика ТЭЛА обусловлена невозможностью
правильной интерпретации клинической симптоматики у пациентов,
страдающих различными заболеваниями сердца и лёгких и латентно
протекающим острым тромбозом системы нижней полой вены.
Под маской лёгочной эмболии могут протекать самые различные
заболевания. У лиц с инфарктом миокарда, возникшим на фоне
варикозного расширения поверхностных вен или варикотромбофлебита
нижних конечностей, часто подозревают ТЭЛА — об этом
свидетельствуют явления правожелудочковой недостаточности и
сомнительные электрокардиографические данные. Определённую помощь в
такой сложной диагностической ситуации может оказать
регистрация кривой ДЗЛА. По высоте осцилляции можно косвенно судить о
268 ♦ Хирургические болезни ♦ Том 2 ♦■ Часть IV ♦ Глава 38
выраженности гемодинамических изменений в левом предсердии,
возникающих из-за ослабления контрактильности миокарда левого
желудочка. При инфаркте правого желудочка повышается правопред-
сердное давление и резко ухудшается пропульсивная деятельность
сердца. С дифференциально-диагностической целью необходимо
использовать весь арсенал методов исследования, имеющийся в
кардиологии. Обследование больного с подозрением на ТЭЛА при
наличии симптомов коронарной недостаточности следует начинать со
скрининговой оценки лёгочного кровотока радионуклидным
сканированием. Только так может быть достоверно исключён диагноз
массивной лёгочной эмболии.
За ТЭЛА нередко принимают позиционный синдром (синдром
длительного раздавливания), так как его обязательный компонент —
тяжёлая дыхательная недостаточность, возникающая в ответ на микро-
эмболизацию сосудистого русла лёгких. Наличие отёка поражённой
нижней конечности и резких болей в ней, симулирующих острый
венозный тромбоз, заставляет думать о тромбоэмболической окклюзии
центральных лёгочных артерий. Между тем травматический
токсикоз протекает на фоне отёка конечности «деревянистого» характера.
На задней поверхности ноги видны кровоподтёки. Моча имеет
характерный красный оттенок. До развития системной гипотензии
возникает анурия. Правильной диагностике способствует тщательно
собранный анамнез заболевания.
Тяжёлая бактериальная плевропневмония так же, как и инфаркт
лёгкого эмболического генеза, характеризуется сходными
клиническими признаками. Рентгенологические изменения также могут
совпадать. Доказать тромбоэмболическую причину инфаркта можно только
рентгеноконтрастным исследованием лёгочных артерий.
Рентгенологически нетрудно обнаружить пневмо- или гидроторакс,
способный стать причиной тяжёлых дыхательных нарушений, но,
обследуя подобного больного, необходимо помнить, что экссудатив-
ный плеврит и пневмоторакс изредка осложняют течение ТЭЛА.
Гемо- и гидроперикард различного генеза также могут
симулировать лёгочную эмболию, вызывая резкий цианоз лица, набухание
шейных вен и ухудшение сердечной деятельности. Важными
дифференциально-диагностическими критериями служат вынужденное
положение больных на правом боку или ортопноэ, увеличение
границ сердца, выраженная глухость тонов и отсутствие эпигастральной
пульсации, что не характерно для эмболии. Гемодинамически
тампонада сердца характеризуется снижением системного АД, наличи-
Тромбоэмболия лёгочных артерий ♦ 269
ем парадоксального пульса (ослабление или исчезновение пульсовой
волны на вдохе) и падением СВ. Величина давления в правом
предсердии равна значению ДЗЛА. Окончательная диагностика
возможна с помощью эхокардиографии.
Известны случаи, когда тромбоз верхней полой вены расценивали
как ТЭЛА, несмотря на отсутствие выраженной одышки,
расширения границ сердца, увеличения печени и наличие расширенных
подкожных вен на грудной клетке.
В редких ситуациях неправильно трактуют симптомы
септического шока. При нём интоксикация вызывает значительные цир-
куляторные и дыхательные расстройства. Истинную причину
тяжёлого состояния таких больных можно понять, лишь тщательно
изучая историю заболевания и результаты специальных методов
исследования.
Заканчивая освещение особенностей дифференциальной
диагностики ТЭЛА, вкратце можно констатировать следующее. Анамнеза и
данных физикального осмотра обычно вполне достаточно для
достоверного диагноза лёгочной эмболии у исходно здоровых лиц с
явными признаками острого тромбоза вен нижних конечностей.
Симптомы, связанные с внезапным снижением СВ, развитием значительной
гипертензии малого круга кровообращения и правожелудочковой
недостаточности, указывают на значительный объём
эмболического поражения васкулярного русла лёгких и, как правило, на
центральную локализацию окклюзии. Наличие тяжёлой сопутствующей
сердечно-лёгочной патологии затрудняет распознавание данного
заболевания.
В целом следует признать, что зачастую клиническая
симптоматика позволяет лишь с большей или меньшей долей вероятности
предположить диагноз ТЭЛА и ориентировочно судить о её характере
(массивная она или нет). Надёжная нозологическая и топическая
диагностика возможна только с помощью современных
инструментальных методов исследования.
Как только высказано предположение о наличии ТЭЛА, врач
должен в кратчайшие сроки решить следующие диагностические задачи:
• подтвердить наличие тромбоэмболии;
• установить локализацию ТЭЛА;
• определить объём поражения сосудистого русла лёгких;
• выяснить степень гемодинамических расстройств, возникающих
в ответ на тромбоэмболию;
• оценить вероятность рецидива заболевания.
270 ♦ Хирургические болезни <0 Том 2 ♦ Часть IV ♦ Глава 38
Инструментальная диагностика
Наиболее доступные и широко распространённые методы
диагностики ТЭЛА — ЭКГ и бесконтрастная рентгенография.
ЭКГ в большинстве случаев помогает лишь заподозрить
распространённую эмболическую окклюзию васкулярного русла лёгких.
Возникновение признаков острого «лёгочного сердца» (внезапной
перегрузки правого желудочка) обусловлено повышением сосудистого
сопротивления и уровнем давления в малом круге кровообращения
выше 50 мм рт.ст., что можно объяснить тяжёлыми нарушениями
лёгочной перфузии. К этим признакам относят синдром Мак-Гинна-
Уайта (появление S,QinT|n), а также смещение переходной зоны
(глубокий SV5 6) в сочетании с отрицательным TV1_4.
Центральная локализация эмболической окклюзии в 8 раз
чаще сопровождается изменениями, характерными для острой
коронарной недостаточности, по сравнению с поражениями долевых и
сегментарных ветвей. Остро возникшие ЭКГ-симптомы,
обусловленные ТЭЛА, нередко связывают с проявлениями инфаркта
задней стенки левого желудочка. С трудностями трактовки данных ЭКГ
обычно сталкиваются при обследовании лиц пожилой и
старческой возрастных групп с органическими поражениями коронарных
артерий.
Эмболия дистальных лёгочных артерий без выраженных
нарушений перфузии лёгких и гемодинамики или не проявляется
электрокардиографически совсем, или вызывает изменения
неспецифического характера.
ЭКГ необходимо использовать во всех случаях, подозрительных
на тромбоэмболическую окклюзию лёгочных артерий, так как она
позволяет с определённой долей вероятности судить о тяжести гемо-
динамической ситуации и помогает в выборе тактики дальнейшего
обследования больного. Между тем её диагностические
возможности ограничены, отсутствие ЭКГ-изменений не исключает наличия
лёгочной эмболии.
Обзорная рентгенография органов грудной клетки также
лишена должной диагностической специфичности в отношении ТЭЛА.
С одной стороны, острая дилатация правых отделов сердца с
расширением путей венозного притока, высокое стояние купола
диафрагмы на стороне окклюзии и симптом Вестермарка (обеднение
сосудистого рисунка лёгких в зоне острой эмболической обструкции)
свидетельствуют о массивном характере эмболического поражения;
Тромбоэмболия лёгочных артерий О 271
с другой стороны, все вышеперечисленные изменения могут быть
отражением совершенно иной патологии.
Вышеизложенное свидетельствует о недостаточной
информативности рутинных методов обследования для установления диагноза
лёгочной эмболии. Между тем для решения вопросов лечебной
тактики нужна точная информация о локализации и объёме поражения
сосудистого русла лёгких, гемодинамических расстройствах и
источнике эмболизации. Получить эти данные можно только с помощью
специальных методов.
Перфузионное сканирование (сцинтиграфия лёгких),
выполняемое после внутривенного введения макросфер альбумина, меченых
99тТс, признано всеми специалистами наиболее адекватным методом
скрининга ТЭЛА. Распределение радиоактивного препарата
отражает обусловленные эмболической окклюзией артерий изменения
лёгочного кровотока (рис. 38-1). В идеале именно с этого метода
необходимо начинать обследование больного с подозрением на ТЭЛА.
Отсутствие нарушений лёгочного кровотока на перфузионных сцин-
тиграммах, выполненных как минимум в двух проекциях (передней
и задней), полностью исключает диагноз ТЭЛА.
В отсутствие исходной патологии лёгких и плевры точность ска-
нографического диагноза ТЭЛА у пациентов молодого возраста с
выявленным периферическим венозным тромбозом достигает 100%.
Кроме того, сцинтиграфия позволяет получить количественную
информацию об объёме эмболического поражения лёгочного русла.
Рис. 38-1. Перфузионная сцинтиграмма лёгких в передней (а) и задней (б)
проекциях. Отмечаются выраженные изменения кровотока в обоих лёгких.
272 ♦ Хирургические болезни ♦ Том 2 О Часть IV О Глава 38
Радионуклидный метод — незаменимый и безопасный способ
контроля за состоянием артериального русла в постэмболическом
периоде и оценки эффективности различных лечебных мероприятий.
Основной его недостаток — невозможность получения точной
информации о состоянии крупных лёгочных артерий. Между тем она
чрезвычайно важна для планирования лечебных мероприятий при
массивном поражении. С помощью сканирования трудно судить о
наличии тромбоэмболии у больных с сопутствующей патологией
лёгких. Лучевая нагрузка ограничивает применение сканирования у
беременных.
Эхокардиография — неинвазивный метод первичной
диагностики ТЭЛА, наглядно демонстрирующий возникновение острого
«лёгочного сердца», исключающий патологию клапанного аппарата
сердца и миокарда левого желудочка. Её нужно использовать для
определения выраженности гипертензии в малом круге
кровообращения, оценки структурного и функционального состояния правого
желудочка, обнаружения тромбоэмболов в полостях сердца и
главных лёгочных артериях, а также для визуализации открытого
овального окна. С помощью допплеровского сканирования можно
получить развёрнутую информацию об изменениях внутрисердечной
гемодинамики не только в остром периоде заболевания, но и в
процессе лечения ТЭЛА, а также в отдалённом постэмболическом
периоде. Вместе с тем отрицательный результат эхокардиографии ни в коей
мере не исключает диагноза лёгочной эмболии. Внедрение в
клиническую практику внутрисосудистого ультразвукового сканирования
позволит повысить качество визуализации тромбоэмболов в
проксимальном сосудистом русле.
Решающую роль в топической диагностике ТЭЛА и оценке гемо-
динамических расстройств в малом круге кровообращения играют
катетерные методы диагностики.
Рентгеноконтрастное исследование остаётся «золотым
стандартом» в топической диагностике лёгочной эмболии. Проведение
ангиографии показано при неубедительных результатах сканирования.
Серийную ангиопульмонографию выполняют после введения 50-
80 мл водорастворимого рентгеноконтрастного препарата по
катетеру, установленному в лёгочном стволе. Ангиографический катетер
проводят через один из притоков верхней полой вены (обычно чрес-
кожно катетеризируют подключичную или внутреннюю яремную
иену). При использовании цифровой субтракционной
ангиографический установки, созданной на основе компьютерной технологии,
Тромбоэмболия лёгочных артерий <0 273
рентгеноконтрастный препарат может быть введён в меньшем
объёме в периферические вены. Вместе с тем точность данных такой
методики пока уступает разрешающей способности серийной ангио-
пульмонографии, выполняемой путём селективной катетеризации
лёгочных артерий.
Ангиопульмонография позволяет визуализировать сосудистое
русло лёгких, определять локализацию и размер тромбоэмболов, а
также характер эмболии (рис. 38-2).
Диагноз ТЭЛА основывается на выявлении прямых ангиографи-
ческих признаков: дефектов наполнения и обрывов
контрастирования лёгочных сосудов. Центральный дефект наполнения характерен
для недавней эмболии. Наличие пристеночного дефекта указывает
на длительное нахождение тромбоэмбола в сосуде. Такие ангиогра-
фические признаки, как расширение лёгочных артерий, наличие зон
олигемии, неравномерное распределение и задержка контрастного
вещества в артериальную фазу, нарушения венозного оттока, нельзя
считать строго специфичными, хотя они и отражают влияние
эмболии на лёгочный кровоток.
Ангиопульмонография даёт возможность характеризовать
эмболическое поражение лёгочного артериального русла не только
качественно, но и количественно. Для этой цели целесообразно
вычисление ангиографического индекса Миллера. Его величина
складывается из балльной оценки различной локализации тромбоэмболов
(поражение сегментарной ветви лёгочной артерии выражают 1 баллом,
Рис. 38-2. Ангиопульмонограм
ма. Тромбоэмболия главных лё
точных артерий.
274 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 38
левой главной артерии — 7, правой — 9 баллами) и степени
нарушения васкуляризации лёгких в каждой из трёх лёгочных зон:
верхней, средней и нижней (полное отсутствие контрастированных
сосудов в такой зоне оценивают 3 баллами). Общая сумма баллов
может составлять от 0 (отсутствие поражения) до 34 (эмболы в
обеих главных лёгочных артериях или лёгочном стволе, сосуды обоих
лёгких не контрастируются). Количественная характеристика ан-
гиопульмонограмм необходима для прогнозирования течения
заболевания, разработки адекватной лечебной тактики и оценки
результатов лечения.
Обязательная составная часть ангиографического исследования
при ТЭЛА — регистрация параметров гемодинамики при
катетеризации сосудов малого круга, что необходимо для выяснения
функционального состояния сердечно-сосудистой системы. При этом
следует определить степень лёгочной гипертензии, величину СВ,
состояние сократимости правого желудочка сердца и тяжесть гипоксе-
мии с учётом системного АД.
Установление источника эмболизации не менее важно для
успешного лечения больных с ТЭЛА. С этой целью выполняют
ретроградную илиокаваграфию. Тот же катетер, при помощи которого
осуществили ангиопульмонографию, ретроградно проводят из правого
предсердия в нижнюю полую вену и её притоки. По нему вводят рент-
геноконтрастный препарат. Результаты такого флебографического
исследования позволяют определить необходимость и характер
профилактического вмешательства на венозной системе (тромбэктомия,
перевязка или пликация вен, имплантация фильтрующих устройств).
Источником массивной лёгочной эмболии в двух третях случаев
становится неокклюзивный тромбоз илиокавального сегмента.
Таким образом, комплексное ангиографическое исследование,
включающее регистрацию давления в правых отделах сердца,
ангиопульмонографию и ретроградную илиокаваграфию, позволяет решить
весь круг диагностических задач при ТЭЛА.
В настоящее время стали использовать методы диагностики
лёгочной эмболии с помощью меченых тромботропных средств, КТ,
прямой ангиоскопии лёгочных артерий.
Ультразвуковое сканирование надёжно выявляет источник ТЭЛА —
тромбоз глубоких вен нижних конечностей. Относительным
недостатком метода можно считать затруднения, возникающие при УЗИ
илиокавального сегмента. Его тщательный осмотр возможен после
специальной подготовки кишечника.
Тромбоэмболия лёгочных артерий ♦ 275
Радионуклидная флебография также может быть использована для
диагностики периферического венозного тромбоза.
Радиофармпрепарат вводят в вены тыла стопы дистальнее наложенного на уровне
лодыжки жгута. Сначала получают флебограммы ног, затем
оценивают перфузию лёгких.
Классификация ТЭЛА
В классификации (табл. 38-1) учтены такие факторы, как
локализация и распространённость эмболической обструкции, а также
состояние гемодинамики. Эти критерии влияют на прогноз и
определяют выбор метода лечения. При определении локализации эмболии
учитывают её проксимальный уровень, определяющий тяжесть
заболевания и тактику лечения. Для ТЭЛА характерно множественное
поражение с полной или частичной окклюзией сосудов различного
калибра, определяемое на основании оценки степени нарушения
перфузии лёгких. Этот показатель оценивают по ангиограммам с
помощью ангиографического индекса Миллера и по радионуклидным ска-
нограммам с помощью оценки перфузионного дефицита. При лёгкой
степени нарушения перфузии их величины — до 16 баллов и 29%
соответственно. При таком объёме поражения у исходно здоровых лиц
показатели давления в правых полостях сердца и лёгочном стволе не
выходят за пределы нормы. Это позволяет считать указанные
величины тем пороговым уровнем, превышение которого вызывает
возникновение гипертензии в малом круге кровообращения.
Величины ангиографического индекса и перфузионного
дефицита 27 баллов и 60% (и выше) характеризуют крайне тяжёлую степень
нарушения лёгочной перфузии (критический уровень), при которой
распространённость эмболической окклюзии ведёт к значительному
снижению СВ, эта степень прогностически наиболее неблагоприятна.
При тяжёлой степени, когда ангиографический индекс составляет
от 22 до 26 баллов, а перфузионный дефицит от 45 до 59%, обычно
нет непосредственной опасности для жизни больного, но персисти-
рующая артериальная окклюзия приводит к выраженной
хронической лёгочной гипертензии.
При одной и той же распространённости эмболической
окклюзии реакция сердечно-сосудистой системы может быть различной.
Поэтому в качестве третьего критерия взяты гемодинамические
расстройства, их выраженность определяет прогноз. Тяжесть этих
расстройств оценивают по результатам измерения давления в правом
276 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV О Глава 38
Таблица 38-1. Классификационно-оценочные критерии ТЭЛА (по B.C.
Савельеву, 1985)
I. Локализация
А. Проксимальный уровень эмболической окклюзии:
• сегментарные артерии;
• долевые артерии;
• главные лёгочные артерии и лёгочный ствол.
Б. Сторона поражения:
• левая;
• правая;
• двустороннее
II. Степень нарушения перфузии лёгких
Степень
1 (лёгкая)
2 (средняя)
3 (тяжёлая)
4 (крайне тяжёлая)
Ангиографический
индекс, баллы
До 16
17-21
22-26
27 и более
Перфузионный дефицит,
%
До 29
30-44
45-59
60 и более
III. Характер гемодинамических расстройств
Гемодинамические
расстройства
Умеренные
или без них
Выраженные
Резко выраженные
Давление
желудочке
систолическое
Ниже 40
40-59
60 и выше
в правом
, мм рт.ст.
конечное
диастолическое
Ниже 10
10-20
21 и выше
Сердечный
индекс, л/мин-м2
3,0 и выше
2,5-2,9
Ниже 2,5
IV. Осложнения
Инфаркт лёгкого (инфарктная пневмония).
Парадоксальная эмболия большого круга кровообращения.
Хроническая постэмболическая лёгочная гипертензия
желудочке и лёгочном стволе. Используют и данные определения СВ.
Гемодинамические расстройства у пациентов с системной
артериальной гипотензией считают резко выраженными при любом уровне
давления в малом круге кровообращения.
В острой стадии заболевания величину систолического давления
в нравом желудочке, равную 60 мм рт.ст., считают критической. Сие-
Тромбоэмболия лёгочных артерий О- 277
толическое давление выше 75 мм рт.ст., зарегистрированное в
ближайшем постэмболическом периоде, всегда указывает на наличие
сопутствующей сердечно-лёгочной патологии либо отражает
рецидивирующий характер эмболии.
Четвёртым критерием классификации служат осложнения
тромбоэмболии. Иногда термин «инфаркт лёгкого» употребляют в качестве
синонима эмболии лёгочной артерии. Отождествлять эти понятия
нельзя, так как инфаркт развивается далеко не во всех случаях
тромбоэмболии. Поэтому он и отнесён к осложнениям ТЭЛА. Учитывают и
парадоксальную эмболию большого круга кровообращения. У
больных, перенёсших массивную эмболию, весьма реальна опасность
развития такого осложнения, как хроническая лёгочная гипертензия.
При невозможности проведения рентгеноконтрастного
исследования лёгочных артерий и измерения гемодинамических параметров
допустимо подразделение ТЭЛА на массивную, протекающую с
явлениями сердечно-лёгочной недостаточности, и немассивную
(эмболию мелких лёгочных артерий), проявляющуюся симптомами
инфарктной пневмонии.
Выбор метода лечения
Тяжесть клинических проявлений ТЭЛА и её прогноз
непосредственно зависят от объёма эмболического поражения сосудистого
русла и выраженности гемодинамических расстройств в большом и
малом кругах кровообращения. О степени лёгочной гипертензии
можно судить, используя не только результаты катетеризации правых
отделов сердца, но и эхокардиографические критерии.
Большинству больных с эмболией долевых и сегментарных
ветвей достаточно назначения адекватной антикоагулянтной терапии по
следующим соображениям.
• Во-первых, у них, как правило, величина лёгочно-артериального
давления не приближается к опасному уровню.
• Во-вторых, малый круг кровообращения обладает большими
компенсаторными возможностями.
• В-третьих, высока вероятность спонтанного лизиса тромбоэмболов
в результате активизации собственных фибринолитических
механизмов.
Гепарин назначают, как только заподозрено наличие тромбоэмбо-
лических осложнений. За счёт этого предотвращается развитие про-
278 ♦ Хирургические болезни ♦ Том 2 О- Часть IV О Глава 38
долженного тромбоза в лёгочно-артериальном русле, происходит
фиксация границ тромботической окклюзии в магистральных венах
и улучшается микроциркуляция. Продолжительность применения
гепарина должна быть не менее 10—14 дней. Целесообразно
использовать низкомолекулярные формы гепарина, например эноксапарин,
в отличие от нефракционированного гепарина обладающий большей
антитромбогенной активностью. Он даёт хороший терапевтический
эффект, не вызывает резких «скачков» временных показателей
коагуляции и прост в применении.
Перед снижением дозы гепарина и его полной отменой следует
назначить непрямые антикоагулянты. Учитывая довольно частые
рецидивы венозного тромбоза, целесообразно продолжить антикоагулян-
тную терапию после выписки больного из стационара в течение 3-
6 мес. Маркёром, свидетельствующим о достижении эффективного и
безопасного уровня гипокоагуляции, считают международное
нормализованное отношение. Это отношение протромбинового времени
больного к протромбированному времени нормальной плазмы. Во
время приёма непрямых антикоагулянтов величина международного
нормализованного отношения должна находиться в пределах от 2,0 до 3,0.
Массивная ТЭЛА подлежит тромболитической терапии
практически во всех клинических ситуациях. Этот метод лечения принят как
основной, его широко используют в стационарах. Для восстановления
проходимости лёгочных артерий используют активаторы эндогенного
фибринолиза: различные препараты стрептокиназы (стрептазу, каби-
киназу), урокиназу, тканевой активатор плазминогена. Применение
тромболитических препаратов небезопасно, так как они разрушают
не только фибриновую основу тромба, но и фибриноген, что
приводит к повышенной кровоточивости. Тяжёлые геморрагии,
приводящие к необходимости переливания крови, возникают в 5—10%
случаев, малые (гематомы в местах венепункций, инъекций, местах
незаживших ран) — у всех больных без исключения. В связи с этим
проведение тромболитической терапии противопоказано в
ближайшем послеоперационном и послеродовом периодах. После
завершения тромболизиса назначают гепарин для предотвращения прогрес-
сирования тромбообразования в венозной системе и малом круге
кровообращения.
Эмболэктомию из лёгочных артерий проводят при крайне тяжёлых
расстройствах гемодинамики (стойкая системная гипотензия
либо высокая лёгочная гипертензия — систолическое давление выше
60 мм рт.ст.) больным с тромбоэмболией лёгочного ствола и/или обеих
Тромбоэмболия лёгочных артерий -О- 279
лёгочных артерий (величина ангиографического индекса Миллера
более 27 баллов). Её желательно выполнять в условиях
искусственного кровообращения (рис. 38-3), используя трансстернальный
доступ. При отсутствии такой возможности приходится выполнять
оперативное вмешательство путём временной окклюзии полых вен, что
сопровождается крайне высокой летальностью. По относительным
показаниям при одностороннем поражении возможно проведение
дезобструкции из бокового доступа после пережатия
соответствующей главной ветви лёгочной артерии с целью полной нормализации
гемодинамики в малом круге кровообращения.
Рис. 38-3. Схема эмболэктомии из лёгочной артерии в условиях
искусственного кровообращения: а — под местной анестезией обнажают и канюлиру-
ют бедренные сосуды, начинают вспомогательное искусственное
кровообращение; б — после вскрытия грудной клетки канюлируют верхнюю полую
вену, нижнюю полую пережимают. Эмболэктомию выполняют в условиях
полного искусственного кровообращения.
280 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 38
Прогноз
Прогноз заболевания полностью определяется состоянием
кровотока в малом круге кровообращения в отдалённом периоде и зависит
от исходного объёма поражения васкулярного русла лёгких, метода
лечения и его эффективности.
Если тромбоэмболы не лизируются, а подвергаются
соединительнотканной трансформации, формируется персистирующая окклюзия
(полная или частичная — стеноз), становящаяся причиной развития
хронической постэмболической лёгочной гипертензии. Она
развивается у 10% лиц, перенёсших тромбоэмболию крупных лёгочных
артерий. В случае поражения лёгочного ствола и его главных ветвей
лишь 20% больных имеют шансы прожить более 4 лет. Поэтому
пациенты, лечившиеся по поводу ТЭЛА, должны быть в обязательном
порядке взяты под диспансерное наблюдение кардиолога и хирурга.
Помимо общего клинического обследования, им следует выполнять
перфузионное сканирование лёгких, что позволяет своевременно
распознать постэмболическую окклюзию главных лёгочных артерий
и формирование хронической постэмболической лёгочной гипертен-
зии. Заподозрить её следует при появлении прогрессирующей
одышки и признаков правожелудочковой недостаточности. Отсутствие
признаков, свидетельствующих о перенесённой ТЭЛА, и
клинической картины посттромботической болезни нижних конечностей не
исключает данную патологию. Окончательная верификация диагноза
возможна только с помощью специальных методов исследования (ан-
гиопульмонография, контрастная КТ, фиброангиопульмоноскопия).
Добиться снижения уровня лёгочжьартериального давления при
хронической постэмболической гипертензии можно с помощью
хирургической дезобструкции сосудов путём тромбинтимэктомии. Она
технически выполнима в случаях постэмболической окклюзии
центральных лёгочных артерий, существующей не более 3 лет,
сопровождающейся повышением систолического давления малого круга
кровообращения в пределах 100 мм рт.ст. с относительно сохранной
функцией миокарда правого желудочка.
Профилактика
Такое тяжёлое заболевание, как ТЭЛА, гораздо легче предупредить,
чем лечить. Поэтому вопросам профилактики эмболии необходимо
уделять самое пристальное внимание.
Тромбоэмболия лёгочных артерий -О- 281
Различают первичную профилактику лёгочной эмболии (к ней
относят методы, направленные на предотвращение развития острого
тромбоза в системе нижней полой вены) и вторичную —
предотвращение миграции тромбоэмболов в систему лёгочных артерий при уже
сформированном венозном тромбозе.
Первичная профилактика предусматривает применение
специфических и неспецифических мер. Рекомендуют активный
режим для стационарных больных с факторами риска тромбоза,
возвышенное положение нижних конечностей и их эластическое
бинтование, прерывистую пневматическую компрессию или
электрическую стимуляцию икроножных мышц. Эти неспецифические
меры следует применять у всех больных вне зависимости от
характера основного заболевания. Для предупреждения
возникновения эмболоопасных форм венозного тромбоза необходимо
своевременное хирургическое лечение варикозной болезни вен нижних
конечностей.
Для пациентов группы риска (возраст старше 50 лет, наличие
злокачественных новообразований и сердечной недостаточности,
перенесённые ранее венозные тромбозы и лёгочные эмболии,
планируемые продолжительные хирургические вмешательства под
общим обезболиванием с миорелаксантами и пр.) наряду с
вышеперечисленными методами необходимо использование специфической
профилактики, заключающейся в назначении антитромбогенных
средств. Наиболее эффективно назначение низкомолекулярного
гепарина, его применение позволяет существенно снизить угрозу
развития тромбоэмболических осложнений, не увеличивая
опасности геморрагии.
При сформировавшемся венозном тромбозе необходимо
предупредить возможный отрыв и миграцию тромба в артериальное русло
лёгких (вторичная профилактика). Опыт показывает, что
соблюдение строгого постельного режима не предохраняет от возникновения
тромбоэмболии. Проведение антикоагулянтной терапии способно
остановить распространение венозного тромбоза, тем не менее,
антикоагулянты не способны предотвратить отрыв и миграцию в
систему лёгочных артерий сформировавшегося флотирующего тромба,
свободно плавающего в потоке крови. Исключить попадание в
сосудистое русло лёгких такого тромба можно только с помощью
хирургических мер: удаления тромба или создания на пути его
продвижения препятствия (перевязка, пликация вен, установка различных
фильтрующих устройств).
282 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV О Глава 38
Для больных с массивной эмболией оптимальным методом хирур.
гической профилактики рецидива считают непрямую чрезвенозную
имплантацию кава-фильтра. Современные модели фильтра
позволяют проводить имплантацию путём чрескожной пункции и
катетеризации подключичной или яремной вены.
Существуют съёмные модели фильтрующих устройств, их
можно удалить из нижней полой вены непрямым (эндоваскулярньщ)
путём в течение 4-6 нед, если опасность рецидива эмболии ми-
Хроническая венозная недостаточность (ХВН) -- синдром,
возникающий при нарушениях венозного возврата из нижних
конечностей. Причинами его в подавляющем большинстве случаев бывают
варикозная (90% наблюдений) и посттромбофлебитическая (около
10%) болезни. Редкая причина ХВН — врождённое нарушение
развития венозной системы (флебодисплазия).
Хроническая венозная недостаточность — уникальная патология
в спектре хирургических заболеваний. Во многом она связана с
воздействием гравитации, затрудняющей отток венозной крови из ног в
условиях прямохождения людей. То есть это патологическое
состояние представляется своеобразной платой человечества за эволюцию.
ХВН чрезвычайно распространена в современном мире.
Эпидемиологическое исследование, проведённое на промышленных
предприятиях Москвы в 2002 г., выявило признаки этого патологического
состояния у 60% работающих.
Кажущаяся безобидность варикозных вен или отёка конечности,
существующих у пациента в течение нескольких лет и даже
десятилетий, не вызывая его беспокойства, весьма обманчива. Тяжёлые
осложнения ХВН, такие как трофические язвы, приводят многих
больных к инвалидности и выключению из активной социальной
жизни. Более того, при ХВН возможна и смерть пациента в результате
кровотечения из варикозно-расширенных вен или при
возникновении и прогрессировании варикотромбофлебита, переходе
тромбоза на систему глубоких вей и последующем развитии эмболии
лёгочных артерий.
При кажущейся простоте диагностики и лечения синдрома ХВН
хорошие результаты на деле способен получить лишь врач,
обладающий знаниями анатомии и физиологии венозной системы нижних
конечностей, владеющий широким набором довольно
специфических оперативных навыков и ориентирующийся в способах
нехирургического лечения ХВН.
ХРОНИЧЕСКАЯ ВЕНОЗНАЯ
НЕДОСТАТОЧНОСТЬ
НИЖНИХ КОНЕЧНОСТЕЙ
284 ♦ Хирургические болезни О Том 2 О Часть IV <0> Глава 39
Особенности венозного оттока
из нижних конечностей
Важнейший фактор венозного возврата — адекватная деятельность
так называемой мышечно-венозной помпы. Ещё Гарвей,
основываясь на том факте, что глубокие вены находятся в тесном контакте
со скелетными мышцами, предположил, что последние участвуют в
осуществлении продвижения крови по венозному руслу. Эта мысль
нашла подтверждение в прошлом веке, когда была окончательно
сформирована теория функционирования «периферического
сердца» — мышечно-венозной помпы. Она состоит из отдельных единиц,
каждая из которых включает миофасциальные образования, сегмент
глубокой вены, связанный через перфорант с соответствующим
участком поверхностной венозной системы. При сокращении мышц их
компрессионное усилие приводит к повышению давления, прежде
всего, в глубокой вене (в поверхностной вене это увеличение
существенно меньше), и продвижению крови центрипетально.
Обратному движению потока препятствуют состоятельные клапаны. При
мышечном расслаблении давление в венах падает. В определённый
момент давление в глубокой вене становится меньше, чем в
поверхностной. В результате кровь в глубокий венозный сегмент поступает
как из нижележащего участка, так и из подкожных сосудов по ком-
муникантным венам. Происходит своего рода «выдаивание» крови из
венозного сегмента и поступательное продвижение её вверх,
облегчаемое уменьшением гидростатического давления столба крови в
проксимальных отделах.
По локализации мышечно-венозную помпу разделяют на помпу
стопы, голени, бедра и брюшной стенки. Преимущественное
значение имеет ритмическое сокращение мышц голени, что хорошо
иллюстрируется следующим примером. При испытаниях в центрифуге,
когда происходит резкое увеличение силы тяжести в направлении от
головы к ногам, может произойти понижение зрения и даже потеря
сознания. Подобные явления можно предотвратить энергичной
работой ног.
Другие факторы, способствующие венозному возврату, —
сократительная деятельность миокарда и дыхательные движения
диафрагмы. Работа сердца влияет на венозный кровоток двумя путями. Во-
первых, положительное давление, создаваемое во время изгнания
крови из левого желудочка, хотя и редуцируется, но всё же
передаётся на венозное ложе капиллярной сети, составляя 12—15 мм рт.ст.
Хроническая венозная недостаточность нижних конечностей ♦ 285
Этого достаточно для обеспечения адекватного венозного возврата в
условиях покоя. Второй механизм участия сердечных сокращений в
этом процессе — «засасывание» крови из полых вен после систолы
желудочков в правое предсердие, где происходит значительное
падение давления. Экскурсия лёгких и движения диафрагмы также
обеспечивают поступление крови из полых вен в сердце за счёт снижения
внутригрудного давления во время выдоха.
Основные черты патологии
Синдром хронической венозной недостаточности вызывают три
заболевания.
Варикозная болезнь характеризуется преимущественным
поражением поверхностных вен, расположенных в подкожной клетчатке над
фасцией. При развитии заболевания они теряют линейный ход, их
стенка подвергается узловатой трансформации (varix — узел).
Варикозная болезнь — полиэтиологичное заболевание, в его развитии
играет роль несколько факторов. Определённое значение имеет
генетическая предрасположенность. «По наследству» передаётся
врождённая слабость венозной стенки — исследованиями последних лет
доказано снижение синтеза коллагена 3-го типа у больных с
варикозной болезнью. Имеют значение гормональные воздействия
(беременность, приём эстроген-гестагенов), значительные статические
нагрузки на венозную систему у лиц, работа которых связана с
длительным пребыванием в неподвижном ортостазе или регулярным
подъёмом тяжестей, половая принадлежность (женщины болеют в 2—
3 раза чаще). У каждого пациента можно выявить один или
несколько возможных причинных факторов варикозной болезни.
Посттромбофлебитическая болезнь развивается у больных,
перенёсших тромбоз глубоких вен. После прекращения (спонтанно или
под влиянием проводимой терапии) процесса тромбообразования
начинается реканализация тромбированной вены, в процессе
которой происходит разрушение венозных клапанов либо формируются
участки окклюзии сосуда, обусловленные соединительнотканной
трансформацией тромботических масс. Варикозное изменение
поверхностных вен носит вторичный характер и появляется лишь через
несколько месяцев или лет. Наиболее тяжёлые варианты
хронической венозной недостаточности встречают именно при посттромбоф-
лебитической болезни.
286 <> Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 39
Принципиальным отличием варикозной и посттромбофлебити-
ческой болезней служит первичное поражение поверхностных вен в
первом случае, глубоких вен — во втором.
Редкая причина, приводящая к развитию хронической венозной
недостаточности, — врождённые нарушения развития венозной
системы нижних конечностей (флебодисплазии). Наиболее частые
варианты — аплазия глубоких вен и врождённые артериовенозные
свищи. Варикозное расширение поверхностных вен в этих случаях
появляется уже в первые недели или месяцы жизни ребёнка.
Вне зависимости от непосредственной причины, вызвавшей
хроническую венозную недостаточность, патогенез этого синдрома в
принципиальных моментах сходен. Инициирует каскад
патологических реакций обратный ток крови по глубоким, поверхностным
или перфорантным венам. При варикозной болезни он развивается
в результате постепенной деградации гладкомышечных и
эластических волокон стенки подкожных и перфорантных вен, что приводит
к их расширению. Возникает относительная недостаточность
клапанов (т.е. при анатомической сохранности створки их смыкаются не
полностью). При посттромбофлебитической болезни
недостаточность клапанов называют абсолютной, что указывает на их
полное разрушение вследствие организации и реканализации тромботи-
ческих масс.
В результате недостаточности клапанов возникает патологический
венозный рефлюкс, т.е. движение крови в обратном направлении: из
проксимальных отделов венозной системы — в дистальные, из
глубоких вен — в поверхностные. Это приводит к застою крови и
депонированию её избыточного объёма, достигающему максимальных
величин в голени (до 1,5 л к концу дня), что чревато перегрузкой и
снижением эффективности работы венозной помпы. Большое
значение в генезе последующих нарушений имеет рефлюкс крови по
перфорантным венам голени, обусловливающий развитие наиболее
тяжёлых осложнений этого патологического состояния.
Указанные процессы приводят к увеличению сопротивления на
венозном конце капиллярного русла и флебостазу. В результате
повышается объём интерстициальной жидкости, что, в свою очередь,
способствует перегрузке лимфатического русла. Формируется отёк
конечности, паравазальные ткани имбибируются белками плазмы и
лейкоцитами. Возникает хронический воспалительный процесс,
способный усугубиться развитием инфекции после присоединения
патогенной микрофлоры. Эти изменения нарушают нормальный мета-
Хроническая венозная недостаточность нижних конечностей ♦ 287
болизм на уровне микроциркуляторного русла и приводят к
прогрессирующему нарушению трофики тканей и развитию характерных
осложнений ХВН — целлюлита и трофической язвы.
" ■" ■- ■■■
Классификация
В последние годы в отечественной флебологической практике
используют классификацию СЕАР, предложенную группой
международных экспертов в 1994 г. Основу структуры классификации
составляют клинический (С — clinical), этиологический (Е — etiological),
анатомический (А — anatomical) и патофизиологический (Р —
pathophysiological) разделы.
Клиническая часть классификации учитывает основные,
наиболее часто встречающиеся признаки хронических заболеваний вен
нижних конечностей. Всего выделяют семь клинических классов:
• класс 0 — нет видимых симптомов болезни вен при осмотре и
пальпации, но есть характерные жалобы;
• класс 1 — телеангиэктазии и ретикулярные вены;
• класс 2 — варикозно-расширенные вены;
• класс 3 — отёк, боли, тяжесть и быстрая утомляемость в
икроножных мышцах;
• класс 4 — трофические расстройства (пигментация кожи, липодер-
матосклероз);
• класс 5 — кожные изменения, указанные выше, + зажившая
трофическая язва;
• класс 6 — кожные изменения, указанные выше, + открытая язва.
В более тяжёлых классах, помимо симптома, служащего
критерием причисления случая именно к этой стадии, встречают все или
некоторые из признаков, характерных для предыдущих классов.
Как показало практическое применение классификации СЕАР,
клинического раздела вполне достаточно для удовлетворения
потребностей прикладной флебологии. Остальные разделы классификации
имеют значение в стандартизации результатов современных научных
исследований в этой области хирургии.
Примеры формулировки диагноза с использованием
классификации СЕАР.
• Варикозная болезнь обеих нижних конечностей. Хроническая
венозная недостаточность левой нижней конечности — С2, правой —
СЗ по СЕАР.
• Посттромбофлебитическая болезнь левой нижней конечности.
Хроническая венозная недостаточность С5 по CEAR
Клиническая картина
Осмотр больного с ХВН необходимо начинать с выяснения
клинической симптоматики и тщательного сбора анамнестических
сведений. Симптомы хронической венозной недостаточности можно
разделить на объективные и субъективные. Наиболее яркие
субъективные симптомы хронической венозной недостаточности — боль,
тяжесть и быстрая утомляемость поражённой конечности. Эти
ощущения появляются во второй половине дня, достигают максимума к
вечеру, а после ночного отдыха полностью исчезают. Реже встречают
ночные судороги в икроножных мышцах, локальные болевые
ощущения в венозных узлах, парестезии.
К числу объективных симптомов относят, прежде всего,
варикозное расширение поверхностных вен. Изменения можно выявить как
в сосудах кожи и верхнего слоя подкожной клетчатки (телеангиэкта-
зии и ретикулярный варикоз), так и в крупных притоках или самих
стволах магистральных подкожных вен (типичный варикоз).
Объективный симптом — отёк дистальных отделов конечности, один из
первых признаков декомпенсации заболевания. Признаком тяжёлых
нарушений венозного оттока считают трофические расстройства —
гиперпигментацию кожи, склероз (уплотнение) подкожной
клетчатки и кожную язву. Типичное место их локализации при хронической
венозной недостаточности — медиальная поверхность нижней трети
голени. Трофические расстройства при венозной патологии имеют
чёткую стадийность течения — от пигментации кожи к липодерма-
тосклерозу и венозной язве.
Во время сбора анамнеза особое внимание необходимо обращать
на последовательность появления беспокоящих больного симптомов.
При варикозной болезни первым признаком заболевания обычно
становится узловатая трансформация подкожных вен (рис. 39-1). Со
временем (обычно через 5—10 лет от начала заболевания) появляются и
другие симптомы ХВН. Редко, в основном у пациентов с
повышенной массой тела, субъективная симптоматика предшествует
манифестации варикоза. У полных людей эти вены обычно скрыты глубоко
в подкожной клетчатке и не доступны осмотру и пальпации.
Иная последовательность развития симптомов характерна для пост-
тромбофлебитической болезни. Первый и самый яркий признак
ироническая венозная недостаточность нижних конечностей ♦ 289
д
этого заболевания — отёк. Варикозная
трансформация подкожных вен
развивается только по прошествии нескольких
лет от начала заболевания, в то время как
до их появления отмечают типичные
явления венозного застоя — отёк, боли,
трофические расстройства (рис. 39-2).
Определённое значение в клинической
иагностике венозной патологии имеет
оценка суточной динамики некоторых
субъективных симптомов (таких как боль,
тяжесть, быстрая утомляемость,
судороги в икроножных мышцах). Как правило,
утром, после ночного отдыха пациенты
с ХВН не испытывают неприятных
ощущений в нижних конечностях.
Симптоматика венозного застоя развивается во
второй половине дня, после длительной
нагрузки (особенно ортостатической).
В социально-бытовом анамнезе
пациента важно выявить факторы,
предрасполагающие к развитию и рецидиву ХВН, —
тяжёлый физический труд, беременность
(в том числе и перенесённая), приём гормональных контрацептивов
или средств заместительной гормонотерапии в периоде менопаузы.
В течение нескольких десятилетий непременным атрибутом фле-
бологического обследования считали проведение так называемых
функциональных проб, направленных на выявление особенностей
Рис. 39-1. Фото пациента с
варикозной болезнью.
Видно варикозное расширение
вен в бассейне большой
подкожной вены.
Рис. 39-2. Фото пациента с посттромбофлебитической болезнью.
Отмечаются выраженный отёк нижней конечности и обширные трофические
расстройства.
290 ♦ Хирургические болезни ♦ Том 2 -О- Часть IV ♦ Глава 39
поражения венозной системы физикальным путём. На сегодняшний
день необходимости в проведении большинства этих приёмов нет.
Определённое практическое значение сохранили лишь кашлевая (Гак-
кенбруха), пальпаторно-перкуссионная и трёхжгутовая пробы.
• Первый приём (рис. 39-3) проводят, пальпируя проекцию
приустьевого отдела большой подкожной вены в верхней трети бедра при
покашливании пациента. Если остиальный клапан несостоятелен,
определяют обратную волну крови.
• Недостаточность клапанного аппарата большой подкожной вены
демонстрирует пальпаторно-перкуссионная проба (рис. 39-4)
• С помощью трёхжгутовой пробы можно определить зоны
локализации несостоятельных перфорантных вен. Для этого
больному, находящемуся в горизонтальном положении, после опо-
Рис. 39-3. Кашлевая
проба Гаккенбруха; при
несостоятельности клапанов
большой подкожной
вены кашлевой толчок
определяется по ходу сосуда на
бедре.
Рис. 39-4. Пальпаторно-перкуссионная проба
ощущение сосудистого толчка, воспринимае--
мое пальцами кисти врача, pacпoлaгae^fыми на j
медиальной поверхности голени, при
толчкообразных движениях, наносимых на бедро дру-,
гой рукой, свидетельствует о несостоятельн
сти клапанов большой подкожной вены.
Хроническая венозная недостаточность нижних конечностей <>• 291
рожнения поверхностных вен
накладывают три жгута: первый — на
верхнюю треть бедра, второй — над
коленом, третий — тотчас ниже коленного
сустава. После наложения жгутов
больного переводят в вертикальное
положение. Заполнение вен между жгутами
свидетельствует о наличии в этом
сегменте несостоятельных перфорантных вен.
Для более точного определения их
расположения требуется поступательное
смещение жгутов в соответствующем
направлении. Опытный хирург
выявляет недостаточные перфорантные вены
путем пальпации дефектов фасции
голени (рис. 39-5).
Бурное развитие диагностических
технологий во второй половине XX века
привело к появлению высокоточных
способов инструментального исследования
венозного русла нижних конечностей.
Инструментальная диагностика
Задачи инструментальной диагностики ХВН.
• Оценка состояния глубоких вен, их проходимости и функций
клапанного аппарата.
• Обнаружение рефлюкса крови через остиальные клапаны большой
и малой подкожных вен.
• Определение протяжённости поражения клапанного аппарата
стволов подкожных вен, а также уточнение особенностей их
анатомического строения.
• Выявление и точная локализация недостаточных перфорантных вен.
Основой современной диагностики ХВН служат ультразвуковые
способы — допплерография и ангиосканирование.
Ультразвуковая допплерография основана на эффекте Допплера —
изменении частоты звукового сигнала при отражении его от
движущегося объекта (в данном случае — от форменных элементов крови).
Разницу между генерированной и отражённой волнами
регистрируют в виде звукового или графического сигнала.
Рис. 39-5. Пальпация
дефекта в фасции голени,
через который проходит
недостаточная перфорантная
вена.
292 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 39
Обследование проводят в горизонтальном и вертикальном поло
жениях пациента. Стандартными «окнами» для исследования служат
позадилодыжечная область (лоцируют задние большеберцовые вены),
подколенная ямка (лоцируют подколенную и малую подкожные вены)
и верхняя треть бедра (зона локации бедренной и большой
подкожной вен). Изучают спонтанный и стимулированный кровоток по
глубоким и подкожным венам.
Спонтанный (антеградный) кровоток определяют в венах крупного
калибра. Его отличительная особенность — связь с дыхательными
движениями грудной клетки, поэтому его звук напоминает шум
ветра, усиливающегося в фазу выдоха и ослабевающего при вдохе.
Стимулированный венозный кровоток необходим для оценки функций
клапанного аппарата магистральных вен. При исследовании
проксимально расположенных сосудов (бедренной и большой подкожной
вен) используют пробу Вальсальвы. У здоровых людей во время
вдоха происходит ослабление венозного шума, в момент натуживания
он полностью исчезает, а при последующем выдохе резко усиливается.
На недостаточность клапанов обследуемой вены указывает шум
ретроградной волны крови, возникающий при натуживании пациента.
Состояние берцовых, подколенной и малой подкожной вен
оценивают с помощью проксимальной и дистальной компрессионных
проб. В первом случае выполняют мануальную компрессию сегмента
конечности выше ультразвукового датчика. При этом повышается
внутривенозное давление и в случае недостаточности клапанов
регистрируется сигнал ретроградного потока крови. При дистальной
компрессионной пробе сжимают сегмент конечности ниже датчика. Это
приводит сначала к появлению антеградной, а после декомпрессии
ретроградной волны крови.
Ультразвуковое ангиосканырование позволяет получать
изображение исследуемых вен в реальном масштабе времени. Ценность
исследования возрастает при одновременном использовании режимов
допплерографии или цветового допплеровского картирования.
Стандартные «окна» и пробы для проведения исследования венозной
системы аналогичны описанным выше. Ретроградный кровоток
определяют при реверсии звукового или графического допплеровского
сигнала или на основании изменения цвета потока крови при
цветовом картировании.
На сегодняшний день ультразвуковое ангиосканирование —
наиболее информативный метод диагностики, позволяющий
визуализировать практически всё венозное русло от вен стопы до нижней по-
-
Хроническая венозная недостаточность нижних конечностей О- 293
лой вены. Результаты исследования позволяют с высокой степенью
точности установить причину хронической венозной
недостаточности, обнаружив последствия венозного тромбоза в глубоких венах
(окклюзия вены или реканализация её просвета) или, напротив,
неизменённую их стенку с состоятельными клапанами. При
варикозной болезни определяют протяжённость рефлюкса крови по стволам
магистральных поверхностных вен. Помимо этого, ультразвуковое
ангиосканирование даёт возможность достоверно локализовать
недостаточные перфорантные вены (рис. 39-6), что облегчает их поиск
во время хирургического вмешательства.
Рис. 39-6. Ультразвуковая ангиосканограмма пациента с варикозной
болезнью. Лоиируется несостоятельная перфорантная вена, соединяющая
глубокую вену с поверхностной.
Радыонуклыдная флебография. Отличительная черта этого малоин-
вазивного исследования — возможность получения информации об
особенностях функционирования венозного русла нижних
конечностей. Исследование проводят в вертикальном положении пациента.
После наложения над лодыжками жгута, перекрывающего просвет
подкожных вен, в вену тыла стопы вводят радионуклид. Затем
пациент начинает ритмично сгибать и разгибать стопу, не отрывая пятки
от опоры. Такая имитация ходьбы «включает» мышечно-венозную
помпу голени, и радиофармпрепарат начинает перемещаться по
глубоким венам. Детектор гамма-камеры регистрирует его движение
294 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV -О- Глава 39
(рис. 39-7), фиксируя перфорантный сброс в поверхностные вены,
зоны задержки изотопа (сегменты с клапанной недостаточностью)
или его отсутствия (участки окклюзии). Большое диагностическое
значение имеет скорость эвакуации препарата из разных отделов
венозного русла, позволяющая судить о масштабе нарушения
венозного оттока в той или иной зоне.
Реитгеиокоитрастная флебография. Для её выполнения
необходимо введение в магистральные вены водорастворимого рентгеноконт-
растного препарата. Этот способ считают одним из самых
информативных, но вместе с тем достаточно травматичным и небезопасным
для больного (аллергические реакции на контрастное вещество,
венозные тромбозы, гематомы). Рентгенофлебография даёт наиболее
полную картину анатомо-морфологических особенностей венозного
русла, поэтому она по-прежнему незаменима при планировании
реконструктивных операций на глубоких венах (пластика клапанов,
транспозиция вен и пр.) у больных с посттромбофлебитической
болезнью. При варикозной болезни в настоящее время этот метод
исследования не применяют, поскольку информации, получаемой при
УЗИ и радионуклидном исследовании, достаточно для определения
тактики лечения больного.
Рис. 39-7. Радиоизотопная фле-
босцинтиграмма. Снимок
пациента с левосторонней окклюзией
подвздошных вен. Отток крови
из поражённой конечности по
коллатералям в надлобковой
области осуществляется через
правые подвздошные вены.
Хроническая венозная недостаточность нижних конечностей ♦ 295
Дифференциальная диагностика
Для клинициста важно не только исключить заболевания,
сходные по клиническим проявлениям с ХВН, но и дифференцировать
нозологические причины развития этого синдрома.
Поводы для проведения дифференциально-диагностических
мероприятий:
• заболевания сосудистой системы (острый венозный тромбоз,
лимфедема, хроническая ишемия нижних конечностей);
• поражение опорно-двигательного аппарата (пояснично-крест-
цовый остеохондроз, деформирующий остеоартроз);
• болезни внутренних органов, сопровождающиеся
недостаточностью кровообращения или нефротическим синдромом (ИБС,
пороки сердца, миокардиты, кардиомиопатии, хроническое лёгочное
сердце, острый и хронический гломерулонефриты, диабетический
гломерулосклероз, системная красная волчанка, нефропатии
беременных, цирроз или рак печени);
• различные заболевания, приводящие к развитию
язвенно-некротических поражений нижних конечностей (периферические
полиневропатии, васкулиты и др.).
Острый венозный тромбоз. Доминирующий симптом этого
заболевания — отёк нижней конечности. Он появляется внезапно и
нарастает в течение нескольких часов или дней, сопровождается
умеренным болевым синдромом. Боль чаще локализуется в икроножных
мышцах, усиливается при ходьбе, носит распирающий характер.
Возможно появление болевых ощущений по ходу сосудисто-нервного
пучка на бедре.
Для острого венозного тромбоза не характерно варикозное
расширение вен. Этот симптом появляется через несколько месяцев или
даже лет, при формировании посттромбофлебитической болезни и
развитии синдрома хронической венозной недостаточности.
Исключение составляют случаи возникновения тромбоза на фоне
предшествующей варикозной болезни.
Лимфедема характеризуется, прежде всего, специфическим
отёчным синдромом, приводящим к значительным изменениям
конфигурации конечности, в особенности голени и стопы. Увеличивается
объём только надфасциальных тканей — кожи и подкожной
клетчатки, происходит сглаживание позадилодыжечных ямок. При
надавливании на отёчные ткани остаётся чёткий след от пальца. Один из наи-
296 О- Хирургические болезни ♦ Том 2 ^> Часть IV ♦ Глава 39
более ярких симптомов — «подушкообразный» отёк тыла стопы. Кожу
на тыле пальцев и стопы невозможно собрать в складку. Для лимфе-
демы не характерны варикозное расширение вен и трофические
расстройства кожи голеней.
Хроническая артериальная недостаточность нижних конечностей.
Поводом для дифференциальной диагностики с ХЕШ обычно
становится боль в нижних конечностях. Болевой синдром при
хронических облитерирующих заболеваниях артерий чаще всего развивается
после ходьбы на довольно ограниченное расстояние. Дистанция
«безболевой» ходьбы порой составляет всего лишь десятки метров. Боль
возникает, как правило, в икроножных мышцах, вынуждает
пациента остановиться, чтобы отдохнуть и дождаться исчезновения
болевых ощущений, которые, впрочем, снова возникают после
преодоления очередного отрезка пути. Этот симптом носит название
«перемежающейся хромоты», его выявление требует лишь внимательного
опроса пациента.
При хронической ишемии может развиться отёк нижних
конечностей. Отёк подкожной клетчатки нередко бывает следствием
реваскуляризации конечности после оперативного вмешательства,
а субфасциальный (мышечный) отёк характерен для критическо
ишемии.
Пояснично-крестцовый остеохондроз. Болевые ощущения в ко
нечности при корешковом синдроме нередко связывают с
поражением глубоких вен. Между тем, они локализуются по задней
поверхности бедра от ягодицы до подколенной ямки, т.е. по ходу
седалищного нерва. Часто появляются внезапно и могут ограничивать
двигательную активность пациента. Если при ХВН болевой
синдром возникает во второй половине дня и исчезает во время
ночного отдыха, то при пояснично-крестцовом остеохондрозе боли
часто появляются ночью. Для патологии позвоночника не характерны
отёк нижней конечности, варикозное расширение вен и
трофические расстройства.
Деформирующий остеоартроз, артриты. Суставная патология
сопровождается болевым синдромом и отёком периартикулярных
тканей. Боль резко выражена, значительно ограничивает объём
движений в суставах конечности. Отёк при воспалительном или
дегенеративно-дистрофическом поражении суставов всегда носит
локальный характер. Он появляется в области поражённого сустава
в остром периоде и проходит после курса терапии. Часто в
результате неоднократных обострений заболевания формируется стой-
Хроническая венозная недостаточность нижних конечностей ♦ 297
кое увеличение тканей в области сустава, приводящее к его дефигу-
рации (псевдоотёк).
Недостаточность кровообращения и нефротический синдром. Отёк
нижних конечностей может быть симптомом некоторых
заболеваний внутренних органов. При этом он появляется в любое время
суток, симметричен на обеих ногах, выраженность его зависит от
тяжести основного заболевания. Яркая манифестация симптоматики
последнего, как правило, не оставляет сомнений в природе
отёчного синдрома.
Периферические полиневропатии. Нарушения иннервации нижних
конечностей (посттравматические, постинфекционные, токсические)
могут приводить к развитию трофических язв. От развивающихся при
ХВН язв их отличает несколько признаков. Нейротрофические язвы
локализуются в местах плотного контакта кожи с обувью, например,
на крае стопы. Они существуют годами и плохо поддаются лечению.
Характерно отсутствие болевых ощущений в области дефекта тканей
в результате нарушения болевой чувствительности.
Дифференциальная диагностика заболеваний, вызывающих синдром
ХВН. Основные дифференциально-диагностические критерии
представлены в табл. 39-1.
Таблица 39-1. Дифференциально-диагностические критерии заболеваний,
вызывающих ХВН
Клинические
симптомы
1
Начало
заболевания
Варикозное
расширение вен
Варикоз
над лобком и на
брюшной стенке
Отёк
Варикозная
болезнь
2
Чаще в возрасте
20-40 лет
Чаще в бассейне
большой
подкожной вены
Никогда
Появляется через
5—Шлет, вдисталь-
ных отделах, к
вечеру, преходящий
Посттромбо-
флебитическая
болезнь
3
Чаще в возрасте
40-70 лет
В бассейне
большой и малой
подкожных вен
Часто
Первый симптом,
локализуется на
голени и бедре,
постоянный
Венозные
дисплазии
4
В младенческом
возрасте
Чаще на
латеральной поверхности
бедра и голени
Часто
Возникает в
младенческом
возрасте или позже,
носит постоянный
характер
298 О Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 39
Окончание табл. 39-1
1
Трофические
расстройства
Врождённые
пигментные
пятна
Морфологические изменения
конечности
2
Развиваются через
5—10 лет,
прогрессируют медленно,
локализуются в
нижней трети
голени на
медиальной поверхности
Отсутствуют
Отсутствуют
3
Развиваются через
3—5 лет после
начала заболевания,
часто до появления
варикоза, быстро
профессируют,
нередко циркулярные
Отсутствуют
Отсутствуют
4
Редко,
появляются после 30 лет,
чаще локализуются
на латеральной
поверхности голени
Отмечают более
чем у 90% больных
Поражённая
конечность длиннее
на 2-5 см,
характерен гипертрихоз
Лечение
Основными целями лечения ХВН следует считать устранение её
симптомов, профилактику рецидивов заболеваний вен, сохранение
или восстановление трудоспособности и улучшение качества жизни
пациентов. Чем раньше начато лечение этого патологического
состояния, тем в большей степени можно рассчитывать на полное
выздоровление больных. Его осуществляют с помощью компрессионной
терапии, фармакологических средств, флебосклерозирования и
хирургических вмешательств.
Указанных целей достигают решением прикладных задач, для чего
используют различные лечебные подходы.
• Устранение факторов риска ХВН в определённой мере достигают
разумной коррекцией образа жизни больного (ограничение
статических нагрузок, лечение ожирения).
• Улучшение флебогемодинамики возможно с помощью
компрессионной терапии, хирургического пособия и, отчасти, флебосклеро-
обл итерации.
• Нормализацию функций венозной стенки обеспечивают
адекватной фармакотерапией.
• Коррекцию нарушений микроциркуляции, гемореологии илимфо-
оггока достигают компрессионным лечением и фармакотерапией.
Хроническая венозная недостаточность нижних конечностей ♦ 299
• Достижение хорошего косметического эффекта возможно с
помощью миниинвазивных оперативных вмешательств и флебосклеро-
облитерации.
Эластическая компрессия
Обязательный компонент любой лечебной программы при ХВН —
эластическая компрессия. Её эффективность определяется
следующими механизмами.
• Снижением патологической венозной ёмкости нижних
конечностей за счёт компрессии межмышечных венозных сплетений,
поверхностных и перфорантных вен.
• Улучшением функциональной способности относительно
недостаточного клапанного аппарата в связи с уменьшением диаметра вены,
вследствие чего устраняется или уменьшается ретроградный и
значительно возрастает антеградный кровоток.
• Возрастанием обратного всасывания тканевой жидкости в
венозном колене капиллярной сети и снижением её фильтрации в
артериальном за счёт повышения тканевого давления. В результате
наступает регресс отёка.
• Увеличением фибринолитической активности крови за счёт
активизации синтеза тканевого плазминогена. Этот механизм очень важен
для профилактики варикотромбофлебита и тромбоза глубоких вен.
Абсолютных противопоказаний к компрессионной терапии нет.
В качестве относительного противопоказания можно рассматривать
сопутствующие облитерирующие заболевания артерий со
снижением давления на берцовых артериях ниже 80 мм рт.ст.
Для компрессионного лечения используют два вида изделий —
эластические бинты и медицинский трикотаж. Эластические бинты
по степени их удлинения разделяют на три класса: короткой (не
более чем на 70% исходной длины бинта), средней (диапазон
увеличения первоначальной длины в пределах 70—140%) и длинной (более
140%) растяжимости. Для купирования симптоматики ХВН
применяют первые два типа бинтов, последний используют после флебэк-
томии с целью профилактики гематом и предупреждения венозных
тромбозов. При наложении компрессионного бандажа с помощью
бинтов верхний его уровень должен (по возможности) быть
расположен на 8—10 см проксимальнее зоны клапанной недостаточности.
Бандаж, сформированный из эластических бинтов, обладает
существенным недостатком. Адекватность компрессии напрямую за-
300 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 39
ю-
висит от навыков пациента в бинтовании конечности. Часто больные
формируют бандаж столь неудачно, что отмечают вместо
ожидаемого облегчения симптомов лишь их усугубление. Вот почему для
большинства больных предпочтительнее использование компрессионного
трикотажа (гольфы, чулки, колготы). Принципиальные преимущества:
• физиологическое распределение давления, постепенно убыва
щего в проксимальном направлении;
• учёт естественных анатомических особенностей конечности при
изготовлении изделий;
• высокая прочность и длительное сохранение исходной степени
компрессии;
• отсутствие необходимости приобретения больным
специфических навыков.
В зависимости от степени компрессии выделяют четыре класса
лечебного трикотажа (табл. 39-2).
Таблица 39-2. Классификация компрессионного трикотажа и показания
к его применению
Класс
компрессии
I
II
III
IV
Величина давления
(на уровне
лодыжек, мм рт. ст.)
18-21
23-32
34-46
Более 49
Показания к применению при ХВН
Ретикулярный варикоз, телеангиэктазии,
профилактика варикозной болезни у
беременных
Варикозная и посттромбофлебитическая
болезни, в т.ч. и у беременных; состояние после
флебэктомии, склеротерапии; при эпители-
зирующихся трофических язвах
ХВН с трофическими расстройствами и
стойким отёком, острый варикотромбофлебит
Врождённые пороки развития венозной
системы (флебодисплазии)
Фармакотерапия
Фармакотерапию используют при появлении клинической симп
томатики венозного застоя (боли, тяжесть, быстрая утомляемость в
икроножных мышцах, отёки, ночные судороги). Безусловное пока
зание к применению фармакологических средств — осложнения ХВ
(варикотромбофлебит и трофические расстройства). Основой лекар
Хроническая венозная недостаточность нижних конечностей ♦ 301
ственной терапии ХВН служат средства, традиционно называемые
флеботониками. Наиболее эффективно влияют на венозный тонус и
лимфатический отток микронизированный диосмин (диосмин + гес-
перидин) и гидроксирутозиды (троксерутин, рутозид). Выбор
конкретного препарата проводят с учётом доминирования в клинической
картине того или иного симптома. Так, при венозных отёках, болях и
тяжести в икроножных мышцах наиболее эффективно
использование диосмина. Ночной судорожный синдром хорошо купируется гид-
роксирутозидами. При необходимости длительного, порой
многомесячного приёма (как правило, у больных с посттромбофлебитической
болезнью) оптимальным вариантом также служит назначение мик-
ронизированного диосмина.
Средства местного лечения (мази, кремы и гели) выполняют
вспомогательную роль, поскольку их активные компоненты
недостаточно проникают через кожу и их самостоятельное использование
малоэффективно. Предпочтительный вариант применения топических
средств — гели, поскольку они обеспечивают лучшее поступление
действующих веществ в подкожную клетчатку. Использование
местных средств помогает в купировании некоторых симптомов
заболевания, имеющих субъективный характер (болевые ощущения в
венозных узлах и икроножных мышцах, тяжесть в ногах).
Флебосклерозирующее лечение
Флебосклерозирующее лечение (склеротерапия) заключается во
введении в просвет варикозной вены специальных препаратов,
вызывающих необратимое повреждение стенок сосуда. Последующая
эластическая компрессия обеспечивает надёжную адгезию их друг к
другу и, как следствие этого, последующую облитерацию вены.
Показаниями к проведению склеротерапии считают случаи расширения
внутрикожных и подкожных вен без патологического вено-венозного
рефлкжса через соустья магистральных подкожных вен с глубокими
или по перфорантным венам. В связи с этим можно чётко
обозначить клинические ситуации, когда склеротерапия может быть
эффективной и безопасной.
• Телеангиэктазии и ретикулярный варикоз.
• Варикозное расширение притоков магистральных подкожных вен
без поражения стволов.
• Не удалённые во время комбинированной флебэктомии
расширенные притоки магистральных подкожных вен.
302 ♦ Хирургические болезни <♦> Том 2 ♦ Часть IV ♦ Глава 39
Для проведения склеротерапии используют шприцы с двух- или
трёхсекционным поршнем, что обеспечивает необходимую плавность
хода, и короткие тонкие иглы (калибр 25—30 G). В качестве флебоск-
лерозирующих средств используют препараты на основе тетрадецил-
сульфата натрия (фибровейн, тромбовар) или полидоканола (это-
ксисклерол). Концентрацию склерозанта подбирают с учётом калибра
варикозной вены. Для ликвидации телеангиэктазий и
ретикулярного варикоза применяют 0,2—0,5% растворы. Облитерации
варикозных притоков достигают 1—3 % концентрацией склерозанта.
Техника склеротерапии варикозных вен заключается в следующем.
В вертикальном положении пациента маркёром намечают точки
предполагаемых инъекций. После этого пациента укладывают на
кушетку. Первую инъекцию проводят в наиболее дистальной из
намеченных точек. Точность пункции вены определяют по появлению в шприце
тёмной венозной крови. Введение препарата строго интравазаль-
но — принципиальный момент, поскольку попадание его в
подкожную жировую клетчатку может вызвать некроз. Объём склерозанта
на одно введение составляет 0,3—0,5 мл. После инъекции её место
прижимают марлевой салфеткой или латексной подушечкой и
проводят эластическое бинтование этого сегмента конечности. Затем
инъекции выполняют в остальных намеченных точках. Для
обеспечения стабильности бандажа поверх эластических бинтов
целесообразно надеть компрессионный чулок. Продолжительность
непрерывной компрессии составляет 5—7 дней.
Превышение показаний к склеротерапии, нарушение техники её
проведения и неадекватный компрессионный режим — причины
развития осложнений. Наиболее тяжёлые из их — некроз кожи в месте
инъекции и восходящий тромбофлебит поверхностных вен.
Хирургическое лечение
Операция — наиболее радикальный метод лечения ХВН. При
варикозной болезни хирургический способ позволяет во многих
случаях добиться излечения пациентов. Показаниями к операции при этом
заболевании считают выраженный варикозный синдром с наличием
патологических вено-венозных рефлюксов. Операция абсолютно
необходима при прогрессировании трофических расстройств и
рецидивирующем варикотромбофлебите.
При посттромбофлебитической болезни добиться полного
излечения хирургическим путём невозможно, В связи с этим показаниями
Хроническая венозная недостаточность нижних конечностей ♦ 303
к оперативному лечению признаны недостаточная эффективность
консервативных мероприятий и неуклонное прогрессирование ХВН
с развитием трофических язв.
Все хирургические вмешательства можно разделить на две
группы: операции разобщения, ликвидирующие патологический рефлюкс
крови из глубоких вен в поверхностные, и операции, направленные
на удаление (облитерацию) варикозных вен.
Операции разобщения
Высокая приустьевая перевязка и пересечение большой подкожной
вены (операция Троянова—Тренделенбурга, кроссэктомия).
Показанием к ней считают недостаточность остиального клапана с рефлюк-
сом крови через сафено-феморальное соустье.
Доступ для проведения этого вмешательства — разрез по паховой
складке, позволяющий обнажить большую подкожную вену точно
около устья. Во время вмешательства обязательно должны быть
перевязаны все приустьевые притоки, а сама вена лигирована тотчас у
места впадения в бедренную (рис. 39-8). Это позволяет избежать
оставления длинной культи большой подкожной вены, способной стать
причиной рецидива заболевания или даже ТЭЛА (при развитии
тромбоза в культе).
Рис. 39-8. Схема приустьевой
перевязки большой подкожной
вены: /— паховая связка; 2—
подвздошные артерия и вена; 3—
место наложения лигатуры; 4-боль-
шая подкожная вена.
304 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 39
Пересечение и перевязку малой подкожной вены выполняют в
случае рефлюкса через сафено-подколенное соустье. Особенность этой
манипуляции — вариабельность места впадения малой подкожной
вены и5 соответственно, доступа к ней. В связи с этим перед
выполнением перевязки необходимо проведение ультразвуковой локации
подколенной ямки, чтобы точно определить расположение соустья.
Пересечение недостаточных перфорантных вен выполняют надфас-
циально из отдельных разрезов (операция Коккетта) или подфасци-
ально.
Первый вариант вмешательства выполняют при неосложнённой
варикозной болезни, когда отсутствуют трофические изменения
кожи. Выполняют отдельные небольшие разрезы (около 1 см).
Помогает в поиске перфорантных вен предоперационное
ультразвуковое картирование с разметкой мест их выхода из-под фасции.
Подфасциальное лигирование проводят пациентам с трофическими
расстройствами, когда выполнение разрезов в зоне изменённой кожи
чревато развитием гнойно-некротических осложнений в
послеоперационном периоде. Для подфасциального пересечения используют
эндоскопическую технику. Разрез выполняют на несколько
сантиметров проксимальнее границы трофических изменений. В
подфасциальное пространство проводят операционный эндоскоп (рис. 39-9).
Контроль за ходом вмешательства осуществляют путём трансляции
изображения на монитор. Выявляют несостоятельные перфорантные
вены и пересекают их после предварительной коагуляции.
Рис. 39-9. Момент эндоскопической диссекции перфорантных вен. В
операционную рану введён эндоскоп (а); в эндоскоп видна недостаточная пер-
форантная иена (в).
При наличии выраженного рефлюкса по глубоким венам
выполняют пластические вмешательства^ направленные на восстановление
нормальных функций клапанного аппарата. Следует отметить, что
показанием к выполнению этих вмешательств считают протяжённый
рефлюкс (от верхней трети бедра до подколенной области) при условии,
что ранее выполненная флебэктомия в комплексе с адекватным
консервативным лечением не способна сдержать прогрессирование ХВН,
Удаление подкожных вен (флебэктомия)
Удаление стволов малой и большой подкожных вен проводят с
помощью специальных металлических или пластиковых зондов
(операция Бэбкокка). Большую подкожную вену в большинстве случаев
удаляют на протяжении бедра и верхней трети голени. Этот вариант
вмешательства называют коротким стриппингом (рис. 39-10).
Экстирпация вены в нижней и средней третях голени часто приводит к
повреждению интимно прилежащих к сосуду чувствительных кожных
нервов и лимфатических сосудов. Поэтому тотальное удаление
большой подкожной вены (длинный стриппинг) выполняют только при
получении ультразвуковых данных о недостаточности клапанов вены
на всем её протяжении. Аналогичным образом поступают и с малой
подкожной веной, удаляя её в верхней трети голени.
Операция Бэбкокка — простой, надёжный и очень эффективный
метод удаления магистральных поверхностных вен. Единственный
минус этого вмешательства — травматичность. На протяжении
десятилетий продолжаются поиски альтернативного метода, лишённого
306 ♦ Хирургические болезни ♦ Том 2 ♦ Часть IV ♦ Глава 39
этого недостатка. Сегодня существует несколько способов, исполь
зующих облитерацию вены вместо её удаления, — интраоперацион-
ная склерооблитерация, лазерная и радиочастотная облитерация.
Первая из названных методик не оправдала возложенных на неё
ожиданий, поэтому в последние годы её не применяют. Лазерная и
радиочастотная методики перспективны, в настоящее время активно
изучают их ближайшие и отдалённые результаты.
Варикозно расширенные притоки удаляют из небольших
разрезов с туннелированием между ними (операция Нарата). Чаще это
вмешательство выполняют с помощью специальных инструментов —
минифлебэкстракторов. При этом варикозные притоки удаляют
через проколы кожи (рис. 39-11). Наложения швов после такой
операции не требуется.
Рис, 39-11. Схема минифлебэктомии.
Осложнения
К осложнениям ХВН относят варикотромбофлебит (принципы его
диагностики и лечения описаны в главе 37), кровотечение из
венозного узла и трофическую язву. Все они возникают при
декомпенсации венозного оттока из поражённой конечности.
Кровотечение
Кровотечение из варикозных вен бывает спонтанным и
травматическим, наружным и подкожным. Наибольшую опасность
представляет наружное кровотечение, обычно обусловленное изъязвлением
Хроническая венозная недостаточность нижних конечностей ♦ 307
истончённой кожи над варикозной веной. Такое кровотечение чаше
возникает из варикозных вен, расположенных в нижней трети
голени и области лодыжек. В этой зоне расположены крупные перфоран-
тные вены, давление в просвете которых в вертикальном положении
пациента может достигать 100 мм рт.ст. Венозная кровь обладает
пониженной свёртываемостью, а кровотечение из варикозных вен не
сопровождается болевыми ощущениями. В связи с этим описаны
случаи смертельных исходов при развитии этого осложнения во время
сна. В вертикальном положении больного венозное кровотечение
бывает особенно обильным, кровопотеря в течение считанных
минут может достигать 1 л и более.
Неотложные мероприятия включают немедленный перевод
пациента в горизонтальное положение, придание конечности
возвышенного положения и тугое эластическое бинтование (но не наложение
жгута!). В последующем проводят окончательную остановку
кровотечения прошиванием сосуда или его склерооблитерацией.
Трофическая язва
Трофическая язва — длительно не заживающий дефект кожи,
возникающий, как правило, в нижней трети медиальной поверхности
голени — зоне максимально выраженных трофических расстройств.
Первоначально на коже голени, обычно в области медиальной лодыжки и
несколько выше неё, в результате накопления в дерме гемосидерина
(продукта деградации гемоглобина эритроцитов, вышедших в
межуточную ткань в связи с повышенной проницаемостью сосудов)
появляется участок гиперпигментации. Спустя некоторое время в центре
пигментированной зоны возникает уплотнённый участок кожи,
имеющий белесоватый, лаковый вид, напоминающий натёк парафина. Это
так называемая «белая атрофия» кожи, её можно рассматривать как
предъязвенное состояние. В дальнейшем любая, даже минимальная
травма приводит к возникновению язвенного дефекта. Постепенно
площадь и глубина язвы прогрессивно увеличиваются,
присоединяется перифокальная воспалительная реакция мягких тканей — острый
индуративный целлюлит. Возможно вторичное инфицирование с
развитием локальных и системных гнойно-воспалительных реакций.
Для венозной трофической язвы характерно длительное
рецидивирующее течение. При сохранении гемодинамических условий (фле-
богипертензия, венозный застой) она возникает вновь и вновь.
Поэтому оптимальная тактика лечения предполагает первоочередное
308 ^ Хирургические болезни ♦ Том 2 ф Часть IV ♦ Глава 39
закрытие трофической язвы с помощью консервативных
мероприятий с последующим выполнением хирургического вмешательства на
венозной системе, направленного на профилактику её рецидива.
Консервативное лечение заключается в адекватной эластической
компрессии, назначении различных фармакологических средств,
местном воздействии на язву и окружающие ткани, способствующих
её санации и закрытию.
Характер лечебных мероприятий зависит от стадии раневого
процесса. Фаза экссудации характеризуется обильным гнойным
отделяемым, выраженной перифокальной воспалительной реакцией
мягких тканей и значительной бактериальной обсеменённостью язвы.
Главная задача лечения в этих условиях — очищение трофической
язвы от патогенной микрофлоры и некротических тканей, а также
купирование системной и местной воспалительной реакции. Для
этого используют антибиотики широкого спектра действия
(парентерально или перорально). При длительно существующих трофических
язвах с признаками микотического поражения стопы в
антибактериальную терапию целесообразно включать противогрибковые
препараты и производные нитроимидазола (флагил, метронидазол).
Наличие сопутствующего острого индуративного целлюлита диктует
необходимость назначения неспецифических
противовоспалительных средств (диклофенака, кетопрофена) внутримышечно или в
свечах. Дополнительно проводят инфузии гемореологически активных
препаратов (реополиглюкина, трентала).
Местное лечение включает ежедневный туалет язвенной
поверхности с помощью мягкой губки и антисептического раствора (диок-
сидина, хлоргексидина, раствора перманганата калия, эплана).
После этого накладывают повязку с водорастворимой мазью, обладающей
осмотической активностью (хлорамфеникол + метилурацил + суль-
фадиметоксин + тримекаин, хлорамфеникол + метилурацил, гидро-
ксиметилхиноксилиндиоксид + тримекаин + метилурацил и пр.),
специальные сорбирующие повязки (карбонет) и эластический бандаж.
Его адекватное формирование — залог успешной терапии
трофической язвы. Уже на этом этапе назначают поливалентные флеботони-
ческие препараты (диосмин + гесперидин, гидроксирутозиды), ан-
тиоксиданты (витамин Е).
Переход язвы в фазу репарации характеризуется очищением
раневой поверхности, появлением грануляций, стиханием перифокаль-
ного воспаления и уменьшением экссудации. Основной задачей
лечения становится стимуляция роста и созревания соединительной
Хроническая венозная недостаточность нижних конечностей <► 309
ткани. Для этого применяют гиалуронат цинка. Хорошо
зарекомендовали себя биодеградирующие раневые покрытия (аллевин, альги-
пор, альгимаф). Обязательным компонентом остаётся адекватная
эластическая компрессия.
В фазу эпителизации необходимо надёжно защитить
формирующийся соединительнотканный рубец от возможного механического
повреждения. Этого достигают постоянным ношением
компрессионного бандажа. Пациенту следует рекомендовать продолжить
приём флеботонических средств.
После заживления трофической язвы при отсутствии
противопоказаний необходимо выполнение хирургической операции,
направленной на коррекцию нарушений венозной гемодинамики. В тех
случаях, когда язва длительное время не эпителизируется, прибегают к
оперативному вмешательству, не дожидаясь её полного закрытия.
В такой ситуации после эндоскопической диссекции перфорантных
вен выполняют аутодермопластику язвенной поверхности. Если
проведение оперативного вмешательства невозможно, пациенту
предписывают пожизненную эластическую компрессию и длительный
курсовой приём флеботоников.
Прогноз
Варикозную и посттромбофлебитическую болезни относят к
категории хронических, поэтому прогноз в отношении полного
излечения у многих больных сомнителен. После оперативного лечения
варикозной болезни возможен рецидив заболевания. Излечения от
посттромбофлебитической болезни у подавляющего большинства
пациентов добиться практически невозможно в силу характера и
масштаба поражения венозной системы.
Прогноз для жизни больного, как правило, благоприятен. Вместе
с тем, отсутствие своевременного и адекватного лечения
хронической венозной недостаточности может привести к смерти пациента от
её осложнений (варикотромбофлебит, тромбоз глубоких вен с
развитием ТЭЛА; наружное кровотечение).
Прогноз в отношении качества жизни пациентов зависит от
адекватности проводимых лечебных и профилактических мероприятий —
частота рецидивов или скорость прогрессирования заболевания,
выраженность клинической симптоматики снижаются до минимальных
величин при регулярном использовании современных
компрессионных и медикаментозных средств.
ЭНДОКРИННАЯ ХИРУРГИЯ
ЗОБ
Зобом называют любое увеличение щитовидной железы. По
данным ВОЗ, на Земном шаре зарегистрировано около 300 млн больных
зобом, из них в России — более 1 млн. Частота пальпаторного
выявления узловых образований в щитовидной железе среди здорового
населения составляет не менее 5%. С помощью УЗИ их
обнаруживают у 15% взрослых. В эндемичных по зобу регионах эта цифра может
быть существенно выше.
Основная причина развития заболевания — дефицит йода в
окружающей среде. Клиническое и социальное значение йододефицит-
ных состояний заключается не только в увеличении щитовидной
железы и формировании зоба, но и в снижении её функциональной
активности — гипотиреозе, оказывающем негативное влияние на
физическое и умственное развитие людей.
Основные черты патологии
Существуют клиническое и морфологическое определения
понятия «зоб». С позиций морфолога этот термин обозначает любое
узловое или диффузное увеличение щитовидной железы, обусловленное
избыточным накоплением коллоида в фолликулах (коллоидный зоб) или
гиперплазией (увеличением количества клеток) фолликулярного
эпителия (макро- или микрофолликулярный, пролиферирующий,
клеточный зоб). Часто наблюдают сочетание обеих форм, тогда говорят о
макро-микрофолликулярном, в различной степени пролиферирую-
щем коллоидном зобе. С точки зрения клинициста зоб —
собирательное понятие, так как этим термином называют различные по
происхождению заболевания щитовидной железы гиперпластического,
неопластического или воспалительного характера,
сопровождающиеся узловым или диффузным увеличением этого органа
(макро-микрофолликулярный коллоидный зоб, доброкачественные аденомы и рак
железы, кисты, тиреоидит). Только в случаях макро-микрофоллику-
лярного коллоидного зоба морфологическое и клиническое заклю-
Зоб ♦ 311
чения о характере патологии совпадают. Таким образом, для
клинициста понятие «зоб» по существу не может служить диагнозом. Оно
лишь означает, что у больного выявлено то или иное заболевание
щитовидной железы, сопровождающееся её увеличением. Основная
задача врача — выяснение истинной причины заболевания.
Этиология и патогенез
Общепринята теория, согласно которой дефицит йода или
изменения его метаболизма (нарушения всасывания в ЖКТ либо
окисления при генетических дефектах в энзимной системе и др.) приводят
к снижению концентрации тиреоидных гормонов в крови, что по
механизму обратной связи увеличивает образование тиреотропного
гормона (ТТГ) гипофиза, и щитовидная железа подвергается
мощной стимуляции. В результате развивается компенсаторная
гипертрофия щитовидной железы, способствующая восполнению
недостатка тиреоидных гормонов, и в гипоталамо-гипофизарно-тиреоидной
системе наступает временное равновесие. При продолжающемся
воздействии первичных этиологических факторов такое равновесие
быстро нарушается, наступает новый виток тиреотропной стимуляции.
В конечном итоге компенсаторный процесс переходит в
патологический, что знаменуется образованием зоба.
Известно два механизма гипертрофии щитовидной железы при
дефиците йода: повышенное накопление коллоида в фолликулах
(коллоидный зоб) и пролиферация клеток фолликулярного эпителия
(паренхиматозный зоб). Чаще всего выявляют их сочетание, в
результате чего развивается коллоидный в разной степени пролиферирующий
зоб. Вместе с тем представленная теория не может полностью
объяснить процесс образования зоба. Остаётся не совсем понятным,
почему в одних случаях развивается диффузное увеличение щитовидной
железы, а в других она подвергается узловой трансформации.
Возможно, это связано с несовершенством механизмов компенсаторной
гиперплазии. Отдельные тиреоциты могут приобретать свойства
автономии, проявляющейся в секреции тиреоидных гормонов
независимо от эффектов ТТГ либо в форме их бесконтрольного деления и
роста (неоплазии).
В последние годы большую роль в патогенезе различных
заболеваний щитовидной железы отводят аутоиммунным механизмам.
Развитие зоба связывают с влиянием ТТГ-подобных факторов, иммуно-
312 ♦ Хирургические болезни ♦ Том 2 0> Часть V > Глава 40
глобулинов (IgG), стимулирующих рост щитовидной железы, но не
влияющих на её функциональное состояние, а также с образованием
тиреоидстимулирующих и тиреоидингибирующих антител, что
имеет место при диффузном токсическом зобе и зобе Хасимото.
Вероятнее всего, в развитии зоба имеет значение несколько
факторов. В одних случаях преобладает роль недостаточности йода, в
других на первое место выходят аутоиммунные механизмы.
Классификация
№><v:S»:s:*№:.4
Происхождение зоба:
• эндемический;
• спорадический.
Степень увеличения железы.
• 0 — нормальной величины, не видна и не пальпируется.
• I — отчётливо прощупывается, но не заметна при глотании.
• II — прощупывается и видна при глотании.
• III — хорошо заметна при осмотре («толстая шея»).
• IV — значительно изменяет форму шеи, возможно сдавление
соседних органов.
• V — достигает гигантских размеров, нередко сдавливает трахею и
пищевод с нарушением дыхания и глотания.
Форма зоба:
• диффузный;
• узловой;
• многоузловой (полинодозный);
• смешанный.
Функциональное состояние железы:
• эутиреоидное;
• гипотиреоидное;
• гипертиреоидное (тиреотоксический зоб).
Степени тяжести тиреотоксикоза:
• субклинический (лёгкое течение);
• манифестный (среднетяжёлое);
• осложнённый (тяжёлое).
Аберрантные локализации зоба:
• корень языка;
• переднее средостение (загрудинный зоб);
• яичник.
Зоб О 313
В основе эндемического зоба лежит абсолютный или
относительный дефицит йода, приводящий к нарушению тиреоидного гормо-
ногенеза и пролиферации тиреоцитов, а регионы с недостаточным
содержанием йода в почве называют биогеохимическими
провинциями, эндемичными по зобу. В России к ним относят Алтай, верховья
Волги, ряд районов Забайкалья и Дальнего Востока, долины
больших сибирских рек, Северный Кавказ, Московский регион.
Спорадический зоб связан с врождёнными (генетическими) или
приобретёнными дефектами образования и секреции тиреоидных
гормонов, приводящими к пролиферации тиреоцитов. Как
эндемический, так и спорадический зоб классифицируют по степени
увеличения щитовидной железы, форме и функциональным
проявлениям.
Более точное представление о наличии зоба и степени
увеличения щитовидной железы можно получить по данным УЗИ:
определить размеры железы, диагностировать смещение трахеи. Объём
каждой доли рассчитывают по формуле:
V = AxBxCxO,52,
где, А— длина доли (см); В — толщина доли (см); С — ширина
доли (см); 0,52 — поправочный коэффициент на эллипсоидную
форму доли.
Нормальный объём щитовидной железы для женщин не
превышает 18 мл, а для мужчин — 25 мл.
По форме различают диффузный, узловой, многоузловой,
смешанный (диффузно-узловой, диффузно-многоузловой) и
конгломератный многоузловой зоб.
• Узловой зоб представлен солитарным узловым образованием.
• При многоузловом зобе в щитовидной железе выявляют
множественные (не менее двух) узловые образования, не спаянные между
собой.
• Многоузловой конгломератный зоб характеризуется наличием
нескольких узлов, интимно спаянных между собой и формирующих
единый конгломерат.
Для хирурга важно различать степени тяжести тиреотоксикоза, так
как от этого зависит предоперационная подготовка больных.
Различают следующие степени тяжести тиреотоксикоза.
• Субклинический (лёгкого течения) тиреотоксикоз характеризуется
тахикардией от 80 до 100 в минуту, слабым тремором рук,
психоэмоциональной лабильностью. Лабораторно выявляют сниженное со-
314 О Хирургические болезни ♦ Том 2 ♦ Часть V ♦ Глава 40
держание ТТГ при нормальной концентрации ТЗ (трийодтирони-
на) и Т4 (тироксина).
• Манифестный (средней тяжести) тиреотоксикоз проявляется
развёрнутой клинической картиной. ЧСС достигает 100—120 в минуту,
увеличивается пульсовое давление, определяют выраженный
тремор рук, похудание до 20% исходной массы тела. Гормональный
профиль: сниженный или полностью подавленный синтез ТТГ в
сочетании с повышенным содержанием ТЗ и Т4.
• При осложнённом (тяжёлом) тиреотоксикозе пульс превышает 120
в минуту, пульсовое давление высокое, характерны мерцательная
аритмия, сердечная недостаточность, тиреогенная надпочечнико-
вая недостаточность, дистрофические изменения паренхиматозных
органов. Масса тела резко снижена, вплоть до кахексии.
Гормональный профиль: резко сниженное содержание ТТГ в сочетании с очень
высокой концентрацией ТЗ и Т4.
Узловой зоб
Под термином «узел» в клинической практике подразумевают
очаговое образование в щитовидной железе любого размера, имеющее
капсулу, определяемое пальпаторно или с помощью любого
инструментального метода исследования. Величина пальпируемого
узлового образования в щитовидной железе, как правило, превышает 1 см.
С помощью УЗИ, применяя высокочастотные датчики (не менее 7,5
мГц), можно обнаружить образования диаметром менее 1 см. Кроме
того, удаётся выявить основной признак узла — наличие капсулы. Из
всех узловых заболеваний на долю коллоидных узлов приходится
около 60%, аденом — 15%, рака — 10%, кист — 10%. Узловую форму ти-
реоидита встречают достаточно редко. К сожалению, с помощью УЗИ
нельзя точно выяснить природу узла, что требует применения
дополнительных методов исследования.
Обследуя больного с узловым зобом, врач должен решить вопрос:
нуждается пациент в операции или можно ограничиться
консервативным лечением и динамическим наблюдением. Исходя из этой
цели, необходимо определить размеры узлового образования и его
локализацию, влияние на деятельность органов и систем
(тиреотоксикоз, затрудненное дыхание, дисфагия), морфологическую
структуру узла. От решения поставленных задач зависит дальнейшая ле-
Зоб ♦ 315
Клиническая картина
Обычно больные с узловым зобом не предъявляют никаких
жалоб, а если жалобы есть, они чаше всего неспецифичны. Первые
симптомы, обусловленные нетоксическим зобом, имеют локальный
характер. Больные отмечают дискомфорт в области шеи, чувство
давления при ношении высокого воротничка. Жалобы на одышку и дис-
фагию появляются при зобе IV и V степеней или при загрудинной
локализации узлов.
Из анамнеза нельзя извлечь надёжных и специфических указаний
на характер узлового процесса в щитовидной железе, но можно
выяснить наличие факторов высокого онкологического риска. О
злокачественном характере образования могут свидетельствовать
следующие признаки:
• возраст моложе 20 или старше 60 лет;
• мужской пол;
• облучение области головы и шеи в анамнезе;
• проживание в условиях природного йодного дефицита;
• быстрое увеличение размеров узла (особенно на фоне приёма
L-тироксина);
• охриплость голоса;
• спаяние плотного узла с окружающими тканями;
• наличие увеличенных шейных лимфатических узлов.
Под быстрым ростом подразумевают увеличение объёма узла
более чем в 2 раза в течение 6 мес. Стремительное (в течение
нескольких часов) увеличение размеров узлового образования, которое
обычно сопровождается внезапными, интенсивными болями, характерно
для спонтанного кровоизлияния. Появление охриплости голоса
может быть связано как с прорастанием опухолью возвратного
гортанного нерва, так и с его сдавлением извне растущим
доброкачественным узловым образованием. Появление одиночного узла улиц
молодого возраста, а также у пожилых пациентов, особенно мужчин,
с большей степенью вероятности указывает на злокачественную
природу заболевания.
Физикальное обследование
Осмотр позволяет обнаружить локальную припухлость,
соответствующую узловому образованию, а при больших размерах узла —
деформацию передней поверхности шеи. При загрудинной (внутригрудной)
локализации наблюдают синдром «верхней полой вены» — отёк шеи
и лица, расширение яремных вен и вен передней грудной стенки.
Пальпацию щитовидной железы лучше всего проводить в
положении больного сидя спиной к врачу II—V пальцами обеих рук, при
этом I пальцы обхватывают шею пациента сзади. Для расслабления
мышц шеи голову больного необходимо наклонить вперёд и вниз. При
подозрении на загрудинную локализацию щитовидной железы
больного осматривают в положении лёжа с подложенным под плечи
валиком, что приводит к выведению нижних полюсов долей выше
уровня ключиц и делает их доступными пальпации. Легко смещаемые,
эластической консистенции образования характерны для
доброкачественных форм узлового зоба, тогда как плотные, бугристые и
ограниченно смещаемые — для рака. Со временем коллоидные узлы и
аденомы также могут становиться очень плотными вследствие
развития склеротических процессов и кальцификации. При
пальпируемом солитарном узловом образовании всегда высока вероятность
наличия аденомы или злокачественной опухоли. Обследуя больного
с узловым зобом, необходимо обращать внимание на наличие
увеличенных лимфатических узлов на шее, их консистенцию, смещаемость
и плотность, так как злокачественные опухоли щитовидной железы,
любых размеров часто метастазируют по лимфатическим путям.
В процессе физикального исследования следует также оценить
функциональное состояние щитовидной железы. Симптомы
тиреотоксикоза свидетельствуют о доброкачественной автономно
функционирующей аденоме (тиреотоксическая аденома), а гипотиреоз —
скорее о хроническом аутоиммунном тиреоидите Хасимото.
Большинство больных с узловыми формами зоба находятся в эутиреоид-
ном состоянии, за исключением регионов с тяжёлой зобной
эндемией, где очень часто выявляют гипотиреоз.
Лабораторная и инструментальная диагностика
Исследование в сыворотке крови концентрации ТЗ, Т4 и ТТГ с
помощью радиоиммунного анализа позволяет лишь определить
функциональное состояние щитовидной железы, так как между
различными морфологическими формами зоба и содержанием тиреоидных
гормонов не существует корреляции. Исключение составляют
больные с тиреоидитом Хасимото, при котором, как правило,
определяют высокое содержание ТТГ на фоне сниженных концентраций ТЗ
и Т4. Повышенная концентрация тиреоидных антител также свиде-
Зоб <> 317
гельствует в пользу тиреоидита. Исследование гормонального про-
фияя в большей степени важно для выбора адекватной дозы
пМаратов тиреоидных гормонов при лечении больных после оперший
Радионумидное сканирование, выполняемое с помощью »| ,пи «Тс
позволяет полнить представление о расположении щитовидной же*
лезы, её форме, размерах и контурах. Распределение и интенсивность
накопления радионуклида указывают на диффузное или очаговое
поражение, характеризуют функциональную активность узловых
образований. В зависимости от интенсивности накопления
радиофармпрепарата узлы разделяются на «горячие», «холодные» и «теплые».
Минимальный размер узлового образования, выяатяемого на скано-
грамме, составляет 1 см. Многие годы сканированию с
радиоактивным йодом придавали основное значение при обследовании
пациентов с новообразованиями щитовидной железы, так как «холодный»
узел, не накапливающий радиоактивный изотоп, считали особенно
подозрительным в отношении злокачественной опухоли. Между тем
оказалось, что большинство узлов (до 90%). в том числе кисты,
коллоидные узлы, аденомы и узлы при тиреоидите Хасимото, не
накапливают радиоактивные препараты. Исключение составляют больные
с тиреотоксической аденомой, определяемой на сканограмме в виде
«горячего» узла, при этом другая доля щитовидной железы
полностью блокирована и не накапливает радиофармпрепарат. Поскольку
сканирование не позволяет дифференцировать доброкачественные и
злокачественные узлы, в настоящее время его не признают скрининг-
тестом при узловом зобе. Поэтому следует отказаться от широкого
применения этого метода исследования, использовать его
целесообразно только в определённых ситуациях, например при подозрении
на атипичную локализацию зоба, для выявления автономно
функционирующих узлов и контроля адекватности выполненной операции.
Рентгенологическое исследование. Обзорная рентгенография шеи it
ФУДНОй клетки в прямой и боковой проекциях позволяет выявлять
смещение трахеи при зобе больших размеров, а также
диагностировать загрудиннын (внугригрудной зоб), при котором на
рентгенограммах выявляют расширение тени средостения. Рентгенография
пищевода с барием лаёт возможность обнаружить смешение и славление пише-
fioaa зобом и таким образом определить истинную причину дясфагии.
Непрямая ларингоскопия и фиброларингоскопия позволяют оценить
локализацию и подвижность голосовых связок при охриплости ГОЛО-
еа V больных зобом, что особенно важно после операции для лиагно-
СТИКИ пареза (паралича) возвратного гортанного нерва.
318 ♦ Хирургические болезни -О- Том 2 ♦ Часть V ♦ Глава 40
AT w МРГ щитовидной железы не получили широкого
распространения в силу высокой стоимости и малодоступности
соответствующей аппаратуры, а также наличия более простых и
высокоинформативных методов исследования.
Ведущими методами в диагностике природы узловых образований
щитовидной железы в наши дни признаны УЗИ ы тонкоигольная ас-
пирационная пункцыонная биопсия.
Дифференциальная диагностика
Несмотря на то, что уже на этапе клинического обследования
можно предположить характер узлового поражения щитовидной железы,
окончательный диагноз ставят при помощи дополнительных
методов исследования, главные из которых УЗИ и тонкоигольная аспи-
рационная пункционная биопсия.
УЗИ щитовидной железы практически всегда позволяет
диагностировать кисту. Она выглядит как анэхогенное образование с чёткой
капсулой, дающее эффект дорсального усиления ультразвука. В
большинстве других случаев на основании УЗИ можно лишь
предположительно судить о морфологической природе узлового образования.
Диагностические возможности УЗИ значительно расширились с
появлением метода цветного допплеровского картирования,
позволяющего определить интенсивность васкуляризации тиреоидной ткани.
Коллоидные узлы при УЗИ чаще всего выявляют в виде изоэхо-
генных (75%) или гипоэхогенных (25%) образований с чёткими
контурами, интенсивность их васкуляризации низкая (рис. 40-1).
Рис. 40-1. Ультразвуковая ска
н о г ра м м а п р и к о л л о иди
зобе.
Зоб ♦ 319
Аденомы определяют как изоэхогенные (75%) узлы с чётким ги-
поэхогенным ободком по периферии, реже как гипоэхогенные узлы
(25%) с чёткими контурами (рис. 40-2). Интенсивность васкуляриза-
ции очень высокая.
Типичное ультразвуковое изображение злокачественных опухолей
соответствует гипоэхогенному узловому образованию (80%),
контуры нечёткие, часто наблюдают множественные гиперэхогенные
включения (рис. 40-3). Интенсивность кровотока в них небольшая.
Между тем существуют данные о том, что интенсивность васкуляризации
в большей степени зависит от размеров узлового образования, а не
от его морфологической структуры.
Рис. 40-2. Ультразвуковая
сканограмма при аденоме
щитовидной железы.
Рис. 40-3. Ультразвуковая
сканограмма при раке
щитовидной железы.
320 ♦ Хирургические болезни ♦ Том 2 ♦ Часть V ^ Глава 40
Наиболее информативный метод диагностики морфологической
структуры узлового образования щитовидной железы —
тонкоигольная аспирационная пункционная биопсия. Выполнение
манипуляции под контролем УЗИ (рис. 40-4) значительно повышает точность
исследования (достигает 98%).
Рис. 40-4. Пункционная биопсия узлового образования щитовидной желе
зы под контролем УЗИ (схема).
В большинстве случаев цитологическое исследование позволяет
поставить правильный морфологический диагноз. С его помощью, к
сожалению, невозможно дифференцировать фолликулярную
аденому и высокодифференцированный фолликулярный рак, так как
диагноз последнего ставят на основании инвазии клеток в капсулу узла
и сосуды. В настоящее время УЗИ + тонкоигольная аспирационная
пункционная биопсия служит стандартной процедурой в
диагностике морфологической структуры узловых образований щитовидной
железы на дооперационном этапе.
Лечение
Раньше диагноз «узловой зоб» подразумевал абсолютную
необходимость оперативного лечения, так как любое узловое образование
щитовидной железы рассматривали как облигатный предрак. В
последние десятилетия лечебная тактика изменилась. Хирурги стали
придерживаться дифференцированного подхода по отношению к
узловому зобу, определяя показания к операции, прежде всего, в
зависимости от морфологической структуры образований. Можно ска
зать> что УЗИ + тонкоигольная аспирационная пункиионная биопсия
совершили революцию в эндокринной хирургии, значительно со-кра-
тив число напрасных «профилактических» операций при
узловом зобе.
Узловой коллоидный в разной степени пролиферирующий зоб.
Многочисленные клинико-морфологические исследования убедительно
показали, что вероятность малигнизации коллоидного зоба крайне
низка. В связи с этим операция показана только при узловых
образованиях больших размеров (зоб не менее III степени), наличии
компрессионного синдрома (сдавление трахеи, пищевода), а также
быстром росте узлового образования. Оптимальным объёмом
оперативного вмешательства следует считать гемитиреоидэктомию.
При узлах коллоидного строения диаметром менее 2-2,5 см нет
необходимости в оперативном вмешательстве. В таких ситуациях
можно ограничиться наблюдением за больными с контрольными УЗИ
1-2 раза в год. В последнее время разрабатывали малоинвазивные
методы лечения подобных образований, такие как склеротерапия и
лазерное воздействие под контролем УЗИ. Суть методов заключается
в локальной деструкции нодулярно изменённой ткани щитовидной
железы химическим (96% этиловый спирт) или физическим
(тепловым) воздействием. Этиловый спирт вызывает тромбоз сосудов
узлового образования, что приводит к его некрозу с последующим
замещением соединительной тканью. Эффективность метода достигает 80%.
Киста щитовидной железы. Оптимальный метод лечения —
пункция с аспирацией содержимого и последующим склерозированием
этиловым спиртом. Результаты лечения зависят не столько от
размеров кисты, сколько от толщины её капсулы. Если она тонкая,
эффективность метода приближается к 100%. Показания к операции:
накопление жидкости после двух- или трёхкратной пункции; наличие
толстой, фиброзированной капсулы либо многокамерной полости.
Фолликулярная аденома щитовидной железы. Учитывая
возможность малигнизации, а также трудности дифференциальной
диагностики с фолликулярным раком, показано оперативное лечение. Объём
операции — гемитиреоидэктомия.
Папиллярная аденома щитовидной железы (цистаденома). Ввиду
возможной малигнизации также показано оперативное лечение —
гемитиреоидэктомия.
Тиреотоксическая аденома щитовидной железы (болезнь Пламмера).
После компенсации тиреотоксикоза тиреостатическими
препаратами показано оперативное лечение — гемитиреоидэктомия.
322 ♦ Хирургические болезни ♦ Том 2 ♦ Часть V ♦ Глава 40
Узловая форма аутоиммунного тиреоидита Хасимото. Лечение
консервативное — заместительная терапия препаратами тиреоидных
гормонов. Оперативное лечение показано в случаях невозможности
исключить рак с помощью всех доступных методов исследования либо
при наличии компрессионного синдрома.
Многоузловой зоб
Всё сказанное об узловом зобе справедливо относительно и
многоузлового зоба. Вместе с тем положение усугубляется тем, что в
большинстве случаев происходит поражение обеих долей щитовидной
железы, и часто наблюдают сочетание различных морфологических
форм узлового поражения. Это требует от врача более тщательной
диагностики и онкологической настороженности, так как на фоне
доброкачественных узловых образований могут скрываться
злокачественные опухоли, диагностика которых в многоузловом зобе крайне
трудна. С течением времени некоторые из узловых образований могут
приобретать функциональную автономию, т.е. синтезировать в
большом количестве тиреоидные гормоны независимо от образования ТТГ
В таком случае зоб становится токсическим. Доказано, что некоторые
йодсодержащие препараты (амиодарон, кордарон, йодистый калий в
больших дозах) при длительном приёме могут провоцировать
развитие тиреотоксикоза, особенно у больных пожилого возраста с
множественными узловыми образованиями щитовидной железы.
При многоузловом эутиреоидном зобе без компрессионного
синдрома и изменения формы шеи показано наблюдение или лечение
препаратами йода и L-тироксином. При этом необходимо помнить о
возможности развития функциональной автономии узлов у больных
пожилого возраста. Увеличение одного из узлов на фоне лечения —
неблагоприятный прогностический признак в плане развития
злокачественной опухоли. Вследствие трудностей диагностики опухоли в
подобных ситуациях следует придерживаться более активной
тактики, и в случаях невозможности исключить злокачественный процесс
направлять больных на оперативное лечение. Операция абсолютно
показана при зобе IV и V степеней вне зависимости от его
морфологического строения. При многоузловом токсическом зобе также
показано оперативное лечение. Объём операции при поражении обеих
долей варьирует в зависимости от степени распространённости
промесса от субтотальной резекции щитовидной железы до тотальной
Зоб ♦ 323
гпреоидэктомии. Операцией выбора следует считать субтотальную
резекцию щитовидной железы. Тотальную тиреоидэктомию
выполняют как вынужденную операцию при отсутствии непоражённой ти-
реоидной ткани, поскольку это вмешательство сопровождается
повышенным риском осложнений и приводит к тяжёлому гипотиреозу.
Диффузные формы зоба
Диффузный нетоксический зоб
При увеличении щитовидной железы I—III степени показано
назначение йодида калия (по 100-200 мкг йода в сутки). Оперативное
лечение в объёме субтотальной резекции щитовидной железы
необходимо только при зобе больших размеров.
Диффузный токсический зоб
Диффузный токсический зоб (болезнь Грейвса-Парри-Базедо-
ва) — генетически детерминированное аутоиммунное заболевание.
Оно проявляется стойким чрезмерным образованием тиреоидных
гормонов диффузно увеличенной щитовидной железой под
влиянием специфических тиреоидстимулирующих аутоантител с
нарушением функционального состояния различных органов и систем, в
первую очередь сердечно-сосудистой и ЦНС. Заболевание чаще
манифестирует в возрасте от 16 до 40 лет, преимущественно у лиц
женского пола.
Этиология и патогенез
Основное значение в развитии болезни придают наследственной
предрасположенности. У 15% больных диффузным токсическим
зобом есть родственники с таким же заболеванием, примерно у
половины родственников в крови определяют циркулирующие тиреоид-
ные аутоантитела. Провоцирующие факторы — психическая травма,
инфекционные заболевания, беременность, приём больших доз йода,
массивная инсоляция и др.
Согласно современным представлениям, при этом заболевании
ТТГ-рецепторы тиреоцитов служат первичными аутоантигенами.
Врождённая недостаточность Т-супрессоров способствует
выживанию и пролиферации «запрещённых» клонов Т-лимфоцитов, взаи-
324 ♦ Хирургические болезни ♦ Том 2 ♦ Часть V ♦ Глава 40
одействующих с аутоантигенами. В результате в иммунную
реакцию вовлекаются В-лимфоциты, отвечающие за образование ауто-
антител. При участии Т-хелперов В-лимоциты и плазматические
клетки выделяют тиреоидстимулирующие аутоантитела (аутоанти-
тела к ТТГ-рецептору). Они связываются с ТТГ-рецепторами тире-
оцитов и оказывают на щитовидную железу стимулирующее
действие, подобное действию ТТГ: активизируют аденилатциклазу и
стимулируют образование цАМФ. В результате увеличиваются
масса и васкуляризация щитовидной железы, усиливается образование
тиреоидных гормонов. Чрезмерный синтез тиреоидных гормонов
активизирует катаболические процессы, изменяется окислительное
фосфорилирование, что приводит к нарушению накопления
энергии в клетках. В результате этих процессов развивается мышечная
слабость, появляется субфебрильная температура тела, больные
прогрессивно худеют.
Клиническая картина
Клиническая симптоматика обусловлена влиянием избытка
тиреоидных гормонов на различные органы и системы организма.
Сложность и многочисленность факторов, участвующих в
патогенезе, обусловливают разнообразие клинических проявлений
заболевания. При анализе жалоб и результатов объективного
обследования выявляют симптомы, которые можно объединить в
определённые синдромы.
Щитовидная железа, как правило, увеличена за счёт обеих долей и
перешейка, пальпаторно эластической консистенции,
безболезненная, смещается при глотании.
Синдром поражения сердечно-сосудистой системы проявляется
тахикардией, мерцательной аритмией, развитием дисгормональной
миокардиодистрофии («тиреотоксическое сердце»), высоким
пульсовым давлением. Кардиальные нарушения связаны как с
непосредственным токсическим влиянием гормонов на миокард, так и с
усиленной работой сердца в связи с возросшими потребностями
периферических тканей в кислороде в условиях чрезмерно
интенсивного обмена. В результате увеличения ударного и минутного
объёмов сердца и ускорения кровотока повышается систолическое АД,
на верхушке сердца и над сонными артериями выслушивают
систолический шум. Механизм снижения диастолического АД связан
с развитием недостаточности коры надпочечников и недостаточного
м
Зоб О 325
синтеза глюкокортикоидов — основных регуляторов тонуса
сосудистой стенки.
Синдром гипокортицизма* кроме сниженного АД, характеризуется
также гиперпигментацией кожных покровов. Часто появляется
пигментация вокруг глаз — симптом Еллинека.
Синдром поражения других желёз внутренней секреции. Кроме
надпочечников, часто происходит поражение поджелудочной железы
с развитием тиреогенного сахарного диабета. Усиленный распад
гликогена с поступлением большого количества глюкозы в кровь
заставляет работать поджелудочную железу в режиме
максимального напряжения, что в конечном итоге приводит к истощению
компенсаторных механизмов и развитию инсулиновой недостаточности.
Течение уже имевшегося сахарного диабета у больных диффузным
токсическим зобом значительно ухудшается. Для коррекции
гипергликемии перед операцией таких больных часто приходится
переводить с пероральных сахароснижающих препаратов на дробное
введение инсулина.
Из других эндокринных нарушений, способных развиться у
больных диффузным токсическим зобом, следует отметить дисфункцию
яичников с нарушением менструального цикла, фиброзно-кистозную
мастопатию (тиреотоксическая мастопатия, болезнь Вельяминова),
у мужчин может появиться гинекомастия.
Синдром поражения центральной и периферической нервной
системы. Отмечают повышенную возбудимость, психоэмоциональную
лабильность, снижение концентрации внимания, плаксивость,
быструю утомляемость, нарушение сна, тремор пальцев рук (симптом
Мари) и всего тела (синдром «телеграфного столба»), повышенную
потливость, стойкий красный дермографизм, повышение
сухожильных рефлексов.
Синдром катаболинеских нарушений проявляется похуданием при
повышенном аппетите, субфебрильной температурой тела и
мышечной слабостью.
Синдром поражения органов пищеварительной системы
проявляется неустойчивым стулом со склонностью к диарее, приступами
болей в животе, иногда желтухой, связанной с нарушением функций
печени.
Глазной синдром проявляется следующими симптомами.
• Симптом Дальримпля (тиреогенный экзофтальм) — расширение
глазной щели с появлением белой полоски склеры между радужной
оболочкой и верхним веком.
326 ♦ Хирургические болезни ♦ Том 2 ♦ Часть V ♦ Глава 40
• Симптом Грефе — отставание верхнего века от радужной оболочки
при фиксации взгляда на медленно перемещающимся вниз
предмете, при этом между верхним веком и радужной оболочкой
остаётся белая полоска склеры.
• Симптом Кохера — при фиксации взгляда на медленно
перемещающемся вверх предмете между нижним веком и радужной
оболочкой остаётся белая полоска склеры.
• Симптом Штельвага — редкое мигание век.
• Симптом Мёбиуса — потеря способности фиксировать взгляд на
близком расстоянии, вследствие слабости приводящих глазных
мышц фиксированные на близко расположенном предмете глазные
яблоки расходятся и занимают исходное положение.
• Симптом Репнева—Мелехова — «гневный взгляд».
В основе их развития лежит гипертонус мышц глазного яблока и
верхнего века вследствие нарушения вегетативной иннервации под
влиянием избытка тиреоидных гормонов в крови.
Тиреогенный экзофтальм при диффузном токсическом зобе
следует отличать от эндокринной офтальмопатии — аутоиммунного
заболевания, которое не является проявлением диффузного
токсического зоба, но часто (40—50% случаев) сочетается с ним. При
эндокринной офтальмопатии аутоиммунный процесс поражает пе-
риорбитальные ткани. Вследствие инфильтрации тканей орбиты
лимфоцитами, отложения кислых гликозаминогликанов, выделяемых
фибробластами, развиваются отёк и увеличение объёма ретробуль-
барной клетчатки, миозит и разрастание соединительной ткани в
экстраокулярных мышцах. Постепенно инфильтрация и отёк
переходят в фиброз, изменения глазных мышц становятся необратимыми.
Эндокринная офтальмопатия клинически проявляется
нарушениями функционирования глазодвигательных мышц, трофическими
расстройствами и экзофтальмом. Больные жалуются на боли, двоение и
ощущение «песка» в глазах, слезотечение. Часто развиваются конъ-
Ьйктивит и кератит с изъязвлением роговой оболочки вследствие её
щхания при неполном смыкании век. Иногда заболевание
примет злокачественное течение, развивается асимметрия протру-
■азных яблок вплоть до полного выпадения одного из них из
ты. Согласно отечественной классификации, выделяют три ста-
^^Индокринной офтальмопатии:
f- припухлость век, ощущение «песка» в глазах, слезотечение;
I— диплопия, ограничение отведения глазных яблок, парез взора
Верху;
Зоб ♦ 327
• III — неполное закрытие глазной щели, изъязвление роговицы,
стойкая диплопия, атрофия зрительного нерва.
Другое аутоиммунное заболевание, сопровождающее диффузный
токсический зоб, — претибиальная микседема (1—4%). При этом
происходит поражение кожи передней поверхности голени, она
становится отёчной и утолщённой. Состояние часто сопровождается
зудом и эритемой.
Диагностика
Диагностика диффузного токсического зоба, как правило, не
вызывает затруднений. Характерная клиническая картина, повышение
содержания ТЗ, Т4 и специфических антител, а также значительное
снижение количества ТТГ (иногда но полного отсутствия) в крови
позволяют поставить диагноз. При УЗИ отмечают диффузное
увеличение щитовидной железы, ткань гипоэхогенная, «гидрофильная»,
особенно в передних отделах долей и области перешейка.
Характерно повышенное кровенаполнение железы — картина «тиреоидно-
го пожара». УЗИ важно также для расчёта объёма щитовидной
железы, что необходимо для определения показаний к операции и
контроля лечения.
Лечение
В настоящее время применяют три метода лечения диффузного
токсического зоба — консервативный, хирургический и радионук-
лидный (лечение радиоактивным йодом).
Если диффузный токсический зоб впервые выявлен, следует
предпринять попытку консервативного лечения. Оно направлено на
блокаду синтеза тиреоидных гормонов. Для этого используют тире-
остатические препараты: мерказолил, метимазол, тиамазол, тиро-
зол, пропицил. Они блокируют синтез гормонов на уровне самой
щитовидной железы, ингибируя фермент пироксидазу и угнетая
процесс окисления йода, что препятствует его включению в
молекулу тирозина. В зависимости от степени тяжести тиреотоксикоза
мерказолил назначают в дозе до 30—60 мг/сутки, пропицил — до
100-400 мг/сутки. Отрицательное свойство тиреостатиков — зобо-
генный эффект, поскольку на фоне снижения синтеза ТЗ и Т4
щитовидная железа подвергается тиреотропной стимуляции. Поэтому
после достижения эутиреоидного состояния дозу тиреостатика они-
328 <> Хирургические болезни ♦ Том 2 ♦ Часть V Ф Глава 40
жают до поддерживающей (5 мг/сут) и дополнительно вводят
заместительную терапию L-тироксином (25—50 мкг/сут). Курс лечения
продолжают в течение 1 — 1,5 лет под контролем содержания ТТГ,
При стойкой тахикардии, экстрасистолии и мерцательной
аритмии лечение тиреостатиками целесообразно сочетать с
назначением (3-адреноблокаторов (анаприлина, обзидана, атенолола). При
надпочечниковой недостаточности и эндокринной офтальмопа-
тии обязательно назначают глюкокортикоиды (преднизолон по 5-
30 мг/сут и др.). Также проводят седативную терапию. Стойкая
ремиссия в течение нескольких лет после отмены тиреостатиков
свидетельствует о выздоровлении. При небольшом объёме щитовидной
железы вероятность положительного эффекта от консервативной
терапии достигает 70%.
Лечение радиоактивным йодом (13iI) основано на способности
р-лучей вызывать гибель фолликулярного эпителия щитовидной
железы с последующим замещением его соединительной тканью.
Вследствие полной девитализации тиреоцитов с течением времени
развивается глубокий, трудно компенсируемый гипотиреоз, что,
несомненно, отражается на качестве жизни пациентов. Лечение
показано при высоком операционном риске (тяжёлые сопутствующие
заболевания, старческий возраст), категорическом отказе больного от
операции и рецидиве заболевания после хирургического лечения.
Лечение радиоактивным йодом противопоказано в молодом
возрасте (до 40 лет), во время беременности и кормления.
Хирургическое лечение показано при отсутствии стойкого эффекта
от консервативной терапии, большом объёме щитовидной железы,
когда заведомо ясно, что эффект от консервативной терапии
сомнителен, при тяжёлом тиреотоксикозе, зобе IV—V степени вне
зависимости от степени тяжести токсикоза. Объём операции —
субтотальная резекция щитовидной железы с оставлением суммарно 4-7 г
тиреоидной паренхимы с обеих сторон от трахеи. Считают, что
сохранение такого количества ткани адекватно обеспечивает организм
тиреоидными гормонами.
В связи с необходимостью профилактики тиреотоксического криза
операцию выполняют после специальной подготовки, направленной
на компенсацию тиреотоксикоза. В основе подготовки лежат те же
принципы, что и при лечении больных диффузным токсическим
зобом. Приём мерказолила в дозе до 30—60 мг/сут комбинируют для
снижения кровенаполнения щитовидной железы с назначением
L-тироксина в дозе 50-100 мкг/сут. При непереносимости тиреоста-
Зоб О 329
тиков используют большие дозы йода, обладающие тиреостатичес-
ЕИМ эффектом. С этой целью проводят короткий курс подготовки
раствором Люголя, в течение 5 дней дозировку препарата увеличивают
с 1,5 до 3,5 чайных ложек в день с обязательным приёмом 100 мкг/сут
L-тироксина. Проводят кардиальную терапию. При тяжёлом
тиреотоксикозе в курс предоперационной подготовки включают глюко-
кортикоидьг, плазмаферез.
Хирургическое лечение зоба
Модифицированный (воротникообразный) разрез Кохера
ограничен грудино-ключично-сосцевидными мышцами, его проводят
перпендикулярно средней линии шеи на 1—2 см выше яремной вырезки.
После вскрытия платизмы между двумя зажимами обязательно лиги-
руют подкожные вены шеи (это делают во избежание воздушной
эмболии, так как они не имеют клапанов). После рассечения между
зажимами Кохера или разведения в стороны коротких мышц шеи
открывается щитовидная железа.
Существует две основные методики оперативного вмешательства
на щитовидной железе: экстрафасциалъная и субфасциальная.
При экстрафасциальной методике верхние и нижние щитовидные
артерии перевязывают на протяжении, и обескровленную железу или
её долю удаляют вместе с капсулой. Во время такой операции
необходим зрительный контроль возвратного гортанного нерва и пара-
щитовидных желёз.
В нашей стране более широкое распространение получила
субфасциальная методика О. В. Николаева. По этой методике можно
выполнить как резекцию доли, так и её полное удаление. После
продольного рассечения перешейка множество зажимов накладывают на
мелкие сосудистые веточки под фасцией, последнюю смещают
кнаружи, таким образом возвратные гортанные нервы и паращитовид-
ные железы остаются вне зоны операции.
После послойного ушивания раны в образовавшуюся полость
устанавливают тонкий перфорированный силиконовый дренаж для
активной аспирации отделяемого. Он необходим для удаления
скапливающейся крови и контроля гемостаза. Операцию заканчивают
наложением танталовых скоб на кожу, их в отличие от швов можно
расслабить через сутки после операции, что уменьшает отёк раны и
создаёт лучшие условия для заживления. Дренаж обычно удаляют на
2-е сутки после операции, а скобы снимают на 3-й сутки.
330 О- Хирургические болезни <♦• Том 2 ♦ Часть V ♦ Глава 40
В результате травмы возвратного гортанного нерва в 0,3—5%
случаев выявляют парез или паралич голосовых связок. При травме
одного гортанного нерва возникает осиплость голоса или афония. Как
правило, в течение 6—12 мес после занятий с фониатром голос
восстанавливается. При травме обоих гортанных нервов обе голосовые
связки смещаются к средней линии, ширина голосовой щели
катастрофически сужается, закрывается вход в гортань. Внезапное
нарушение проходимости дыхательных путей после экстубации трахеи
приводит к острой дыхательной недостаточности и асфиксии. В таких
случаях показана экстренная трахеостомия.
Гипопаратиреоз транзиторного или постоянного характера
развивается в 0,5-3% случаев. Он связан с нарушением кровоснабжения
или удалением паращитовидных желёз, в результате чего развивается
кальциевая недостаточность. Больные жалуются на ощущение
покалывания в пальцах, появляются парестезии, в тяжёлых случаях
возникают судороги вплоть до тетании. При постукивании по скуловой
дуге возникает судорожное сокращение мышц носогубного
треугольника (симптом Хвостека). При сдавлении мышц плеча происходит
судорожное сокращение кисти (симптом Труссо, «рука акушера»).
Показана заместительная терапия препаратами кальция.
Кровотечение в послеоперационном периоде развивается в 0,3-1%
случаев. Риск кровотечения наиболее высок в первые часы после
операции. При кровотечении после операций на щитовидной железе на
первый план выступают не симптомы острой кровопотери, а
дыхательная недостаточность, так как даже небольшая гематома,
локализующаяся в замкнутом пространстве, сдавливает возвратные
гортанные нервы и трахею. В связи с этим появляются одышка, цианоз,
нарастают явления острой дыхательной недостаточности вплоть до
асфиксии. Экстренные мероприятия заключаются в немедленном
раскрытии раны с целью декомпрессии, после чего выполняют
повторную интубацию трахеи и остановку кровотечения.
Трахеомаляция — редкое осложнение струмэктомии. При
длительно существующем зобе вследствие постоянного давления его на тра-
■о возникают дегенеративные изменения в кольцах трахеи, их ис-
нчение и размягчение — трахеомаляция. После удаления зоба на
Кохе может произойти сближение стенок трахеи и внезапное суже-
Кие её просвета. Если хирург не успевает выполнить экстренную тра-
Ьостомию, больной может погибнуть от асфиксии.
Зоб ^331
Тиреотоксический криз возможен после операций, выполняемых
о поводу токсических форм зоба, в связи с неадекватной
предоперационной подготовкой. В настоящее время это осложнение
возникает крайне редко. Основную роль в механизме развития криза
отводят надпочечниковой недостаточности и быстрому увеличению
свободных фракций ТЗ и Т4. Осложнение характеризуется резким
нарастанием проявлений тиреотоксикоза с прогрессивным
нарушением функций органов и систем, в частности ЦНС,
сердечно-сосудистой, гипоталамо-гипофизарно-надпочечниковой, а также печени и
почек. Больные беспокойны, возникает гипертермия до 40 °С,
кожные покровы влажные, горячие и гиперемированные, появляются
выраженная тахикардия, мерцательная аритмия, высокое пульсовое
давление. Быстро развивается сердечно-сосудистая недостаточность,
становящаяся причиной летальных исходов. Лечение проводят в
условиях реанимационного отделения, оно включает назначение
больших доз глюкокортикоидов, тиреостатиков, раствора Люголя, Р-ад-
реноблокаторов, проведение дезинтоксикационной и седативной
терапии, коррекцию водно-электролитных нарушений и
сердечнососудистой недостаточности. Летальность при тиреотоксическом
кризе очень высокая — достигает 50%.
Послеоперационный гипотиреоз и рецидив тиреотоксикоза едва ли
можно отнести к осложнениям, так первый — закономерное
следствие операции, а второй — повторение того же заболевания.
Щг\ ГААМ ОПУХОЛИ НАДПОЧЕЧНИКОВ
Надпочечники состоят из двух слоев — коркового и мозгового.
В корковом слое происходит синтез стероидных гормонов (кортизо-
ла, альдостерона, эстриола) из холестерина. В мозговом веществе
надпочечников из аминокислоты тирозина образуются катехоламины —
адреналин, норадреналин, дофамин. Регуляция образования этих
гормонов осуществляется с помощью АКТГ, синтезируемого в
гипофизе. На образование катехоламинов может влиять содержание глю-
кокортикоидных гормонов, выделяемых корой. Эти гормоны
воздействуют как на деятельность других органов внутренней секреции
(гипоталамуса, щитовидной железы, поджелудочной железы,
гипофиза), так и на работу большинства органов и систем.
Опухоли надпочечников — достаточно уникальные
новообразования, поскольку в большинстве случаев они гормонально-активны,
что придаёт их клиническим проявлениям своеобразный характер,
зависящий от вида секретируемого гормона.
Классификация
Опухоли коры надпочечников:
• доброкачественные: альдостерома, андростерома, инциденталома;
• злокачественные: рак коры надпочечников, карциносаркома.
Опухоли мозгового вещества:
• феохромоцитома;
• невральные и нейробластические опухоли.
Опухоли коры надпочечников
Предшественником кортикостероидов служит холестерин, посту
лающий с пищей или синтезируемый в организме. В результате трёх
различных путей биосинтеза образуются глюкокортикоиды (корти-
зол), минералокортикоиды (альдостерон) и надпочечниковые андро-
гены Oicj идроэлиандростерон). Все они синтезируются в разных зо-
Опухоли надпочечников О- 333
нах коры надпочечников. Избыток кортизола приводит к синдрому
Кушинга, избыток альдостерона — к гиперальдостеронизму, избыток
надпочечниковых андрогенов — к вирилизации женшин и
преждевременному половому развитию мальчиков. В части случаев у одного
больного выявляют симптомы избытка всех этих гормонов.
Альдостерома
Альдостерома в большинстве случаев бывает небольших
размеров и поражает один из надпочечников. Опухоль вызывает
первичный гипералъдостеронизм. Альдостерон оказывает четыре основных
эффекта на обменные процессы: повышает реабсорбцию натрия в
почечных канальцах, увеличивает экскрецию калия, увеличивает
секрецию протонов водорода и оказывает ингибирующй эффект
на юкстагломерулярный аппарат почек, снижая секрецию ренина.
Задержка выделения натрия повышает его содержание в крови, что
приводит к увеличению чувствительности мышечных клеток арте-
риол к вазоактивным веществам. В конечном итоге формируется
стойкая артериальная гипертензия, особенно повышается диасто-
лическое давление. Другое действие альдостерона — гипокалиеми-
ческий эффект. При этом развиваются внутриклеточный ацидоз и
внеклеточный алкалоз. Нарушается деятельность миокарда,
развивается миопатия.
Клинические проявления альдостеромы и альдостерон-секрети-
рующей карциномы надпочечников известны как синдром Кона.
Довольно часто он бывает обусловлен не опухолью, а диффузной
мелкоузелковой дисплазией коры надпочечников.
Клиническая симптоматика. Опухоль проявляется типичной
триадой признаков: гипокалиемической артериальной гипертензией,
нейро-мышечными расстройствами и нарушениями функций почек.
Артериальная гипертензия — наиболее частый синдром, при этом она,
как правило, имеет постоянный и злокачественный характер,
отмечается более высокая частота развития кардиомиопатий и сердечной
недостаточности, инсульта, ретинопатии. Минералокортикоидная
гипертензия более склонна к кризовому течению.
Водно-электролитный дисбаланс сопровождается мышечной слабостью, связанной
с гипокалиемией, и психоневрологическими синдромами. При этом
наблюдают астенический тревожно-депрессивный синдром,
парестезии, судороги, могут развиться парезы и даже параличи.
Поражение почек обусловлено гипокалиемией и одновременной гипернат-
334 ♦ Хирургические болезни 4* Том 2 ♦ Часть V ♦ Глава 41
риемией. Выявляют полиурию, гипоизостенурию, развитие
хронического пиелонефрита.
Диагностику альдостеромы проводят в несколько этапов.
Первый этап основывается на клинической картине и проведении
простых лабораторных анализов. У больных со злокачественным
течением артериальной гипертензии, при нарушении функций почек
и неврологических проявлениях определяют концентрацию калия и
натрия в сыворотке крови и/или слюне, проводят ЭКГ (для
обнаружения признаков гипертрофии левого желудочка и косвенных
проявлений гипокалиемии), исследуют кислотно-основное состояние
крови. Для минералокортицизма характерны гипокалиемия ниже 3,0
ммоль/л, гипернатриемия, метаболический алкалоз. Увеличение ОЦК
может сопровождаться никтурией в результате нарушения суточного
ритма выделения натрия и воды.
При наличии обоснованного подозрения на альдостерому
проводят второй этап диагностики: осуществляют исследование
гормонов крови и лучевую визуализацию надпочечников с помощью
УЗИ, КТ или МРТ. Лучевые методы исследования позволяют
выявить одиночные узлы или гиперплазию надпочечников. Наиболее
информативна КТ. Одновременно определяют содержание альдо-
стерона в крови и активность ренина плазмы (для исключения
вторичного гиперальдостеронизма). На этом этапе обычно удаётся
обнаружить наличие опухоли надпочечников и синдром
минералокортицизма.
Третий этап диагностики необходим при разноречивых данных,
полученных на первых двух этапах. Выполняют сложные
биохимические исследования, такие как определение суточного ритма
секреции альдостерона, проведение маршевой пробы, определение
содержания 18-гидроксикортикостерона. При необходимости проводят
катетеризацию надпочечниковых вен с забором оттекающей по ней
крови для анализа гормонов.
Лечение. При альдостероме, особенно при одностороннем
поражении надпочечников, наиболее эффективно хирургическое
вмешательство. При поражении обоих надпочечников показанием к
операции считают неэффективность консервативной терапии в
течение 6—12 мес. Методом выбора служит эндоскопическая адре-
налэктомия.
Основу консервативного лечения составляют низкосолевая диета
в сочетании с антагонистом альдостерона спиронолактоном (эпле-
реноном, карненоном) или средствами, ингибирующими его синтез
Опухоли надпочечников ♦ 335
(аминоглютетимидом). Одновременно применяют калийсберегаюшие
диуретики, препараты калия. Для мужчин длительный приём спиро-
нолактона чреват побочными эффектами — гинекомастией,
снижением полового влечения, импотенцией.
Болезнь (синдром) Иценко-Кушинга
Болезнь (синдром) Иценко-Кушинга в большинстве случаев
обусловлена гиперсекрецией АКТГ гипофизом (в подавляющем
большинстве этих случаев выявляют опухоли в области турецкого седла) или
его эктопическим синтезом негипофизарными опухолями (например,
рак лёгкого, бронхов, опухоли поджелудочной железы, карциноиды
и др.), при этом отмечают двустороннюю гиперплазию коры
надпочечников. В 25% наблюдений данный синдром связан с
новообразованиями надпочечников (аденомы, рак). Так или иначе, все формы
эндогенного синдрома Кушинга обусловлены избыточным
образованием кортизола корой надпочечников. Поэтому основные сведения
об этом заболевании изложены в этом разделе учебника.
Синдром, описанный Кушингом, включает ожирение туловища,
артериальную гипертензию, мышечную слабость, аменорею, гирсу-
тизм, стрии на животе, отёки, глюкозурию и остеопороз. У женщин
гипофизарный синдром Кушинга встречают в 3 раза чаще, чем у
мужчин. В клинической практике этот синдром в подавляющем
большинстве случаев бывает осложнением терапии глюкокортикоидами.
Клиническая картина. Характерно центрипетальное ожирение —
жировые отложения в основном наблюдают в области лица, шеи,
живота. На этом фоне конечности представляются истончёнными.
Лицо «лунообразное», между лопатками — «бычий горб». На коже
живота появляются багровые стрии. Наблюдают мышечную слабость
и быструю утомляемость за счёт усиленного распада белка в
мышцах, нарушение половой функции. Отмечают синдром артериальной
гипертензии, отличающийся стабильным течением, отсутствием
кризов и резистентностью к гипотензивной терапии. У большинства
больных выражен остеопороз позвоночника, рёбер и т.д., в 30%
случаев происходят патологические переломы костей. Если синдром
Кушинга возникает в результате длительной стероидной терапии, у
больных развивается вторичное иммунодефицитное состояние.
Диагностика заключается в выявлении симптомов, характерных
для гиперкортицизма, подтверждении его эндогенной природы и
установлении причины (нозологической формы) заболевания. В связи
336 ♦ Хирургические болезни <& Том 2 ♦ Часть V ♦ Глава
с достаточно характерными признаками синдром Кушинга, как
правило, диагностируют уже при осмотре пациента. Для уточнения
диагноза определяют содержание АКТГ и кортизола в крови.
Достаточно точным методом диагностики считают исследование суточного
ритма их секреции. В норме концентрация кортизола в плазме утром
в 2—5 раз выше, чем вечером. У пациентов с болезнью Иценко-Ку-
шинга отмечают повышение вечернего уровня секреции кортизола
по сравнению с утренним. Для топической диагностики заболевания
применяют лучевые методы. Наиболее точный метод — КТ. С его
помощью выявляют гормонально-активные опухоли гипофиза,
надпочечников и других органов (лёгких, поджелудочной железы,
яичников, щитовидной железы). Для первичной диагностики
используют УЗИ надпочечников.
Лечение. При аденоме или раке надпочечников выполняют адре-
налэктомию. В случаях двусторонней гиперплазии коры
надпочечников цель лечения заключается в снижении содержания АКТГ,
поэтому секретирующая его опухоль вне зависимости от локализации
подлежит удалению. Больным с аденомой гипофиза выполняют
транссфеноидальную аденомэктомию или гипофизэктомию. В части
случаев прибегают к лучевой терапии (протонотерапии).
В далеко зашедших случаях болезни может потребоваться
двусторонняя адреналэктомия, после неё необходима пожизненная
заместительная терапия минералокортикоидами и глюкокортикоидами.
В настоящее время в подобных ситуациях стали прибегать к
пересадке больным эмбриональной надпочечниковой ткани.
Андростерома
Андростерома — гормонально-активная вирилизирующая
опухоль, характеризующаяся чрезмерным образованием андрогенов и их
метаболитов. Как правило, андростеромы секретируют и другие
гормоны (кортико-андростеромы).
Клиническая картина в первую очередь характеризуется
ненормально быстрым половым и физическим развитием детей. У них уже
в раннем возрасте происходит окостенение хрящей. У мальчиков рано
развиваются вторичные половые признаки, у девочек —
маскулинизация, низкий грубый голос. У взрослых женщин выявляют
маскулинизацию, атрофию молочных желёз, прекращение менструации.
Диагноз устанавливают на основании перечисленных симптомов,
обычно появляющихся достаточно быстро, в течение 1—2 лет. Лабо-
Опухоли надпочечников <> 337
раторная диагностика основывается на анализе экскреции 17-кетос-
тероидов с суточной мочой. При андростероме происходит
значительное повышение их концентрации в моче, одновременно возрастает
содержание андростерона, тестостерона в крови. Диагноз
подтверждают при УЗИ и КТ.
Лечение только оперативное. Операция выбора — адреналэктомия.
При своевременном удалении опухоли происходит быстрое обратное
развитие симптомов вирилизации.
Инциденталомы
Инциденталомы — «гормонально-неактивные» опухоли
надпочечников. Обычно их выявляют случайно, при отсутствии явных
клинических признаков. Необходимо осознавать, что название
«гормонально-неактивные» не случайно взято в кавычки. Как правило, эти
опухоли секретируют гормоны, что можно выявить при тщательном
клиническом обследовании. Именно поэтому такие опухоли часто
называют «пре-Кушинг синдром», и к ним надо относиться как к гор-
мон-синтезирующим.
Инциденталомы в последние годы диагностируют всё чаще, что
связано с повышением разрешающей способности лучевых методов
и, в первую очередь, с широким внедрением КТ.
«Гормонально-неактивные» опухоли могут иметь как доброкачественный, так и
злокачественный генез.
Клиническая картина характеризуется симптомами гормонально-
активных опухолей, но в стёртой форме. У части больных
регистрируют умеренную артериальную гипертензию. АД повышается в
период кризов до 180/100 мм рт.ст., что легко купируется приёмом
гипотензивных препаратов. Возможны симптомы вирилизации.
Диагностика. Термин «гормонально-неактивные» указывает на то,
что базальная секреция гормонов при этих образованиях находится в
переделах нормы. Тем не менее необходимо полное исследование
содержания гормонов крови (АКТГ, кортизола, 17-оксикортикосте-
роидов, тестостерона, активности ренина плазмы, катехоламинов и
т.д.). Основное значение в диагностике «гормонально-неактивных»
образований имеют лучевые методы исследования. В качестве скри-
нингового метода применяют УЗИ, окончательный диагноз
устанавливают с помощью КТ надпочечников. Определённую роль в
диагностике, а также в установлении гистологической структуры опухоли
может иметь МРТ.
338 О- Хирургические болезни ♦ Том 2 -О Часть V ♦ Глава 41
Лечение. С учётом того, что эти образования синтезируют
гормоны, выжидательная тактика нецелесообразна. В настоящее время всё
чаще удаляют поражённый надпочечник. После удаления
новообразования, как правило, происходит снижение АД (если оно было
повышенным).
Рак коры надпочечников
Рак коры надпочечников — наиболее частое злокачественное
новообразование надпочечников. Как правило, он
гормонально-неактивен, характеризуется быстропрогрессирующим течением. У 40%
больных при обнаружении рака коры надпочечников уже есть
отдалённые метастазы. Клиническая картина при гормонально-активной
опухоли зависит от синтезируемых гормонов (гиперкортизолемия,
вирилизация и т.д.), при гормонально-неактивной опухоли
клиническая картина заключается в болях, наличии в животе
пальпируемого образования, синдроме сдавления нижней полой вены,
одышке. Критериями злокачественности служат метастазы опухоли и
прорастание её в окружающие ткани. Считают, что опухоли
надпочечников размером более 5 см чаще всего злокачественные.
Основу диагностики злокачественных новообразований
надпочечников составляют КТ, МРТ, УЗИ. На основании данных лучевых
методов исследования можно судить о злокачественности процесса. На
это указывает неровность контура опухоли, неоднородность её
внутренней структуры, наличие очагов некроза и кальциноза. Опухоль
часто прорастает в нижнюю полую вену. Для оценки прорастания
опухоли в окружающие ткани более предпочтительно использование
МРТ. Если диагноз поставлен своевременно, необходимо удаление
надпочечника вместе с поражёнными окружающими тканями.
Опухоли мозгового вещества надпочечников
Феохромоцитома (хромаффиннома)
Название произошло от способности опухолевых клеток
окрашиваться солями хрома, приобретая бурый цвет. В 80% случаев опухоль
бывает одиночной и односторонней (чаще локализуется в правом
надпочечнике), в 10% поражает оба надпочечника, ещё в 10%
развивается из хромаффипных клеток симпатических ганглиев (вненадпо-
чечниковая феохромоцитома, или параганглиома). Отличается тем,
Опухоли надпочечников ♦ 339
что синтезирует катехоламины (адреналин, норадреналин, дофамин),
играющие определяющую роль в патогенезе артериальной гипертен-
зии. В половине наблюдений возникают тяжёлые угрожающие жизни
гипертонические кризы. Патологоанатомические данные указывают
на то, что большую часть опухолей прижизненно не диагностируют.
У 5% больных развитие феохромоцитомы генетически
детерминировано. В этих случаях она обычно поражает оба надпочечника.
Вненадпочечниковые опухоли в диаметре не превышают 5 см,
локализуются в брюшной полости или забрюшинном пространстве.
В клинической картине феохромоцитомы главный признак —
артериальная гипертензия, чаще всего имеющая пароксизмальный
характер с повышением давления до 300 мм рт.ст. Кроме того,
встречают стабильную и смешанную формы артериальной гипертензии. Если
приступ гипертензии развивается после еды, возникают тошнота и
рвота. Приступы продолжаются до нескольких часов, затем
происходит улучшение самочувствия, может возникнуть эйфория. Важные
признаки катехоламинового криза — гипергликемия, глюкозурия,
лейкоцитоз.
Достаточно часто гипертензия носит стабильный характер,
поэтому любой случай стойкой артериальной гипертензии с отсутствием
эффекта от применения гипотензивных препаратов должен заставить
врача подумать о патологии надпочечников. Кроме артериальной
гипертензии, характерны головная боль, синдром
нервно-психической астении (быстрая утомляемость, потливость, плохой аппетит),
тошнота, расстройства кишечника. В связи со снижением объёма
циркулирующей плазмы и ослаблением гемодинамических
рефлексов возникает ортостатическая гипотензия.
Следует помнить, что наркотические анальгетики и гистамин
могут спровоцировать у больных развитие тяжёлого катехоламинового
криза. Препараты, ингибирующие обратный захват катехоламинов,
например трициклические антидепрессанты, усиливают действие
катехоламинов.
Для диагностики феохромоцитомы применяют биохимические
методы определения содержания катехоламинов и их производных
(ванилилминдальная кислота) в моче и крови. Достоверным
признаком считают повышение концентрации катехоламинов в 3 раза и
более по сравнению с нормой. Из лучевых методов диагностики
наиболее широко применяют КТ и УЗИ.
Лечение феохромоцитомы оперативное: надпочечник удаляют
вместе с опухолью. Обязательно необходимо искать и удалять метаста-
340 ♦ Хирургические болезни ^ Том 2 ^ Часть V <> Глава 41
зы, иначе адреналэктомия не даст заметного терапевтического
эффекта. Больные нуждаются в предоперационной подготовке. Для
этого назначают а-адреноблокаторы, отменяют ограничение
потребления соли. Подготовка должна продолжаться не менее 2 нед. За это
время восстанавливается объём циркулирующей плазмы. В качестве
гипотензивных средств эффективны также нитропруссид натрия и
антагонисты кальция. Катехоламиновые кризы купируют внутривен-
|ным введением фентоламина.
Особенности хирургических вмешательств
Основной способ лечения новообразований надпочечников —
хирургическое удаление поражённого надпочечника вместе с
опухолью. При односторонних доброкачественных образованиях удаление
поражённого надпочечника обеспечивает излечение от самого
образования и значительное уменьшение (или ликвидацию)
гормональных проявлений заболевания.
Методика и техника операции несколько различаются в
зависимости от стороны поражения.
Для правосторонней адреналэктомии используют
лапароскопический трансабдоминальный доступ. При этом мобилизуют нижнюю
полую вену до нижнего края печени. Наиболее важный этап
операции — выделение и перевязка центральной вены надпочечника.
Обычно её рекомендуют проводить до манипуляций на самом
органе. Это связано с тем, что при выделении надпочечника с
гормонально-активной опухолью (особенно при феохромоцитоме) возможен
выброс большого количества гормонов в кровь с развитием
гипертонического криза. После перевязки центральной вены манипуляции
на органе не приводят к поступлению гормонов в кровь.
Во время операций на левом надпочечнике чаще используют
задний ретроперитонеоскопический доступ, также с использованием
эндовидеохирургических технологий. Иногда применяют
лапароскопический трансабдоминальный или торакоскопический трансдиаф-
рагмальный доступ. При любом доступе техника операции не
отличается от операции на правом надпочечнике. При возможности
первоначально выделяют и пересекают центральную вену
надпочечника (с левой стороны она впадает в почечную вену).
Опухоли больших размеров удаляют прямым лапаро- или торако-
томным доступом. При двусторонних доброкачественных поражениях
пухоли надпочечников О
надпочечников обычно первым этапом удаляют наиболее
изменённый орган, однако может встать вопрос и об одномоментной
двусторонней адреналэктомии. Удаление обоих надпочечников
сопровождается развитием тяжёлой гормональной недостаточности, вследствие
чего необходима пожизненная заместительная гормональная терапия.
Что касается редких новообразований надпочечников, то
операции при них выполняют в связи с невозможностью при лучевых
методах исследования провести чёткую дифференциальную диагностику
между липомой и раком или другой патологией надпочечников.
Рак надпочечника — прямое показание к операции, при этом
также удаляют надпочечник с окружающими тканями. При метастазах в
надпочечник показания к операции зависят от первичного
заболевания. Если первичная опухоль удалена и других метастазов не
выявлено, показано удаление надпочечника с опухолью. При двусторонних
метастазах в надпочечники, как правило, оперативное лечение не
выполняют из-за его паллиативного характера и тяжёлых гормональ
ных нарушений после такой операции.
ХИРУРГИЯ
МОЛОЧНЫХ ЖЕЛЁЗ
42 гшд
ОСТРЫЙ МАСТИТ
Мастит {mastitis) — воспаление ткани молочной железы, которое
в подавляющем большинстве случаев возникает у женщин во время
лактации. По образному выражению одного из основоположников
отечественной гнойной хирургии В.Ф. Войно-Ясенецкого
«Грудница (так раньше называли на Руси мастит) стара, как
человеческий род; многие миллионы женщин болеют ею, и с незапамятных
времен врачи изощрялись в лечении её.,.». И сегодня хирургичес-
|кие операции при гнойном лактационном мастите — одно из
самых распространённых вмешательств, выполняемых широким
кругом хирургов.
В разные годы отношение количества случаев лактационного
мастита к числу родов колеблется от 3 до 18%. Это заболевание
занимает одно из первых мест в структуре послеродовых
гнойно-воспалительных осложнений. Последствиями перенесённого гнойного
мастита могут быть существенные нарушения функции и
эстетического состояния молочной железы. Нарушения лактации, изменения
качественного состава и обсеменение молока патогенной
микрофлорой при гнойно-воспалительном процессе в молочной железе
существенно сказываются на нормальном развитии ребёнка и могут
привести к его тяжёлым заболеваниям. Наличие любых дефектов
молочной железы, в том числе и грубых рубцов после операции,
оказывает негативное влияние на психику женщины, а в ряде случаев
требует сложных пластических операций
Классификация
Генез мастита.
• Лактационный (послеродовой)
• Нелактационный:
- мастит беременных;
— масчи! новорожденных.
Острый мастит ♦ 343
Характер воспалительного процесса.
• Негнойный:
— серозный;
— инфильтративный.
• Гнойный:
— абсцедирующий;
— инфильтративно-абсцедируюший;
— флегмонозный;
— гангренозный.
Локализации гнойника:
• субареолярный;
• подкожный;
• интрамаммарный;
• ретромаммарный.
Распространённость процесса.
• ограниченный (один квадрант железы);
• диффузный (два—три квадранта железы);
• тотальный (четыре квадранта железы).
Этиология и патогенез
Лактационный (послеродовой) мастит — воспаление молочной
железы, возникающее у женщины в послеродовом периоде на фоне
лактации. На его долю приходится до 95—99% всех воспалительных
поражений железы. Лактационный мастит может развиться в
различные сроки послеродового периода, но чаще на 2—3-й нед после
родов. В 75—85% случаев мастит бывает у первородящих, существенно
реже — после повторных родов. Это объясняется тем, что при
повторных родах молочная железа быстрее приспосабливается к
функциональным изменениям, которые происходят в ней в конце
беременности, а также определённым опытом женщин по уходу за молочными
железами, правильному кормлению ребёнка, соблюдению личной
гигиены в пред- и послеродовом периодах. Кроме того, у первородящих
при патологии беременности, родов или послеродового периода чаще
происходит снижение иммунологической реактивности, что
приводит к повышенной восприимчивости гнойной инфекции.
Возбудителем гнойного мастита более чем в 90% случаев является
золотистый стафилококк как монокультура или в ассоциации с
другой микрофлорой (кишечной и синегнойной палочками, протеем,
стрептококком). Реже мастит могут вызывать условно-патогенные
344 ♦ Хирургические болезни ♦ Том 2 ♦ Часть VI ♦ Глава 42
грамотрииательные бактерии, роль которых значительно повысилась
в последние годы.
Стафилококк, вызывающий гнойный мастит, характеризуется
выраженной патогенностью, полирезистентностью ко многим
антибактериальным препаратам.
Непосредственным источником инфицирования молочной
железы является новорождённый, который передаёт инфекцию матери при
прикладывании его к груди. Ребёнок же инфицируется от
медицинского персонала, предметов ухода за ним, белья и т.п. Возможна также
и перекрёстная инфекция: перенос патогенных стафилококков от
матери к ребёнку и затем вновь к матери.
Входными воротами инфекции при лактационном мастите могут
быть устья молочных протоков, трещины и экскориации сосков,
различные повреждения кожи молочной железы. Соответственно входным
воротам, инфекция распространяется галактогенным, лимфогенным
или гематогенным путём. Факторами, способствующими
возникновению мастита, являются лактостаз, патология беременности, родов,
послеродового периода, различные сопутствующие заболевания.
Лактостаз (застой молока, нагрубание молочных желёз, молочная
лихорадка) предшествует маститу в 85% случаев. Лактостаз и обсеме-
нённость молочных желёз гноеродной микрофлорой являются
основной причиной возникновения и прогрессирования мастита. В этом
сочетании лактостаз играет роль «пускового фактора» заболевания.
При регулярном и достаточном сцеживании грудного молока
микрофлора частично выводится с молоком из протоков. Микробы,
оставшиеся в протоках в небольшом количестве, не способны вызвать
воспаление железы. Но при лактостазе возникают молочнокислое
брожение и внутрипротоковое свёртывание молока, повреждение
эпителия молочных протоков. Молочные ходы обтурируются
свернувшимся молоком, что резко затрудняет сцеживание. Микрофлора,
продолжая развиваться в замкнутом пространстве молочных
протоков и альвеол, достигает «критического уровня», возникает
воспалительный процесс. У большинства больных длительность лактостаза
развития мастита составляет 3—4 сут. Отёчные ткани, сдавливая
очные протоки соседних долек, затрудняют отток молока и из них,
зывая лактостаз и в других, смежных отделах молочной железы.
ому способствует также недостаточное сцеживание грудного мо-
ка из-за болей вследствие развивающегося воспаления.
Трещины сосков, которые наблюдаются у 15% больных гноимым
шститом, служат «входными воротами» инфекции и её резервуа
Острый мастит <> 345
ром. Они существенным образом нарушают функции молочной
железы, вынуждая женшин отказаться от кормления этой грудью и
тщательного сцеживания. Основные причины возникновения трещин
сосков — несоответствие между избыточным отрицательным
давлением в ротовой полости ребёнка, эластичностью и растяжимостью
ткани соска. Имеет значение длительный и частый контакт соска
с бюстгальтером, пропитанным молоком, что вызывает
раздражение и мацерацию кожи, способствует образованию и прогрессиро-
ванию трещин.
Большое значение в патогенезе лактационного мастита придают
нарушению реактивности иммунной системы, а также
сенсибилизации организма женщин к различным лекарственным препаратам,
стафилококку и аутоиммунным реакциям к органоспецифическим
антигенам: молоку и тканям молочной железы. При извращённой
иммунной реакции на указанные антигены воспалительный процесс в
молочной железе протекает более тяжело, вплоть до развития
тяжёлого сепсиса.
Воспаление в железе из-за дольчатого её строения большого
количества естественных полостей (альвеол, синусов и т.п.), широкой
сети молочных и лимфатических протоков, обилия жировой
клетчатки плохо отграничивается и имеет склонность к распространению на
соседние участки молочной железы.
Течение лактационного мастита характеризуется быстрой
динамикой воспалительного процесса, т.е. быстрым переходом серозной и
инфильтративной его форм в гнойную с одновременным поражением
всё новых участков ткани молочной железы. Гнойно-воспалительный
процесс чаще расположен интрамаммарно, нередко имеет затяжное
течение с частыми рецидивами заболевания и поражением двух и более
квадрантов железы. В последние годы увеличилось количество
больных с двусторонними маститами, возросла частота случаев
септических осложнений. Среди гнойных форм острого лактационного
мастита чаще встречаются инфильтративно-абсцедирующая и флегмонозная.
Клинические проявления
Серозный мастит
Серозный мастит характеризуется образованием в тканях
железы воспалительного экссудата без каких-либо очаговых
изменений, вокруг кровеносных сосудов отмечаются скопления лейкоци-
346 -О- Хирургические болезни ♦ Том 2 ♦ Часть VI ♦ Глава 42
тов. Заболевание начинается остро с появления болей и чувства
тяжести в молочной железе, озноба и повышения температуры
тела до 38 °С и выше. Женщины также жалуются на слабость,
головную боль. Молочная железа увеличивается в объёме, появляется
незначительная гиперемия кожи в зоне воспаления. Сцеживание
грудного молока из молочной железы и пальпация в области
гиперемии кожи болезненны. Количество сцеживаемого молока
уменьшается. Отмечаются небольшое увеличение количества лейкоцитов
крови и СОЭ.
Инфильтративная форма мастита
При инфильтративной форме мастита все указанные выше
симптомы сохраняются, но в тканях железы определяется
болезненный инфильтрат без чётких границ, участков размягчения и
флюктуации.
Высокая температура тела и озноб при начальных стадиях
мастита (серозная и инфильтративная формы) объясняются, прежде всего,
лактостазом, при котором через повреждённые молочные протоки в
кровь всасывается молоко, обладающее пирогенным действием. При
проведении десенсибилизирующей терапии и мероприятий, купиру
ющих лактостаз, у большинства больных температура тела снижает
ся до 37,2-37,5 °С.
В отсутствие лечения или при неадекватной терапии серозная
и инфильтративная формы мастита в течение 3—4 дней переходят
в гнойную.
Абсцедирующий мастит
Абсцедирующий мастит проявляется ухудшением самочувствия
больных, усугублением всех общих и местных симптомов
заболевания, нарастанием интоксикации. Более чем у трети больных
температура тела выше 38 °С. Гиперемия кожи усиливается, появляется её
отечность (рис. 42-1). В молочной железе пальпируется резко
болезненный инфильтрат, который имеет полость (абсцесс) с пиогенной
капсулой и у 50% больных занимает более одного квадранта. В 60.Я6
случаев абсцесс расположен интрамаммарно, реже — под ареолой или
подкожно. Часто в центре инфильтрата определяется размягчение, а
в его зоне — симптом флюктуации. У многих больных лейкоцитоз
i авляет более 10 10ч/л
Инфильтративно-абсцедирующий мастит
Инфильтративно-абсцедируюший мастит протекает более
тяжело, чем абсцедирующая форма заболевания. Однако выраженность
гиперемии кожи, отёка тканей, самостоятельной и пальпаторной
болезненности соответствует абсцедируюшему маститу. Инфильтра-
тивно-абсцедирующая форма мастита характеризуется наличием
плотного инфильтрата в тканях молочной железы, состоящею из
множества мелких абсцессов различной величины по типу
«пчелиных сот». Вот почему при этой форме гнойника редко определяется
симптом флюктуации. У половины больных инфильтрат кшимаст
не менее двух квадрантов молочной железы.
Флегмонозный мастит
При флегмонозной форме воспаления выражены признаки ниток
сикации, самочувствие и обшее состояние больных значительно
ухудшаются. Усиливаются боли в молочной железе и головная боль,
нарастает слабость, снижается аппетит, отмечается бледность кожных
покровов. У 80% больных температура тела выше 38 °С, а у трети более
39 "С Молочная железа резко увеличена в объеме, ткани ее отёчны кожа
интенсивно гииеремирована. напряжена, местами с пианотичным от-
тен! осок железы часто втянут. При пальпации определяются
резкая болезненность и пастозность тканей. В I учаев в гнойный
воспалительный процесс вовлечено три-четыре квадранта МОЛОЧНОЙ же-
ы. У всех больных количество лейкоцитов крови превышает НН0ч/л,
во многих случаях г нижается содержание гемоглобина крови,
имеются существенные изменения показателей общего анализа мочи.
348 ♦ Хирургические болезни ♦ Том 2 ♦ Часть VI ♦ Глава 42
Гангренозная форма мастита
Гангренозная форма мастита характеризуется очень тяжёлым
состоянием больных и обширным некрозом кожи и глублежащих тканей.
Процесс протекает злокачественно, с быстрым гнойным
расплавлением тканей и распространением на клетчаточные пространства грудной
клетки, сопровождается выраженной системной воспалительной
реакцией. У большинства пациенток температура тела поднимается выше
39 °С. Все указанные выше общие и местные симптомы заболевания
резко выражены. В воспалительный процесс вовлечены все
квадранты молочной железы. Кожа её с участками синюшно-багрового
цвета и отслоившегося эпидермиса с образованием пузырей,
заполненных геморрагической жидкостью, имеются очаги некроза. У всех
больных значительно увеличено количество лейкоцитов крови и
снижено содержание гемоглобина до 80—90 г/л. В общем анализе мочи
всех пациенток имеются белок и повышенное количество
эритроцитов, а в 75% случаев — гиалиновые и зернистые цилиндры.
В некоторых случаях гангрена молочной железы является
местным проявлением аутосенсибилизации организма к органоспецифи-
ческим антигенам: молоку и воспалённой ткани молочной железы.
Диагностика
Выраженные местные и общие симптомы гнойного воспаления
молочной железы (гиперемия и отёчность кожи, пальпируемый резко
болезненный инфильтрат с участком флюктуации, высокая
температура тела и выраженная интоксикация) не оставляют сомнений в
диагнозе заболевания. Необходимость оперативного лечения в таких
случаях не вызывает сомнений. В случаях длительного лечения больных
антибиотиками в поликлинике или женской консультации возможно
стёртое (латентное) течение гнойного воспалительного процесса. Оно
характеризуется несоответствием между клиническими
проявлениями заболевания и истинной тяжестью патологического процесса в
тканях железы, т.е. могут отсутствовать некоторые местные признаки
воспаления: флюктуация или размягчение инфильтрата, гиперемия кожи
и отёчность тканей, так же как повышенная температура тела и
лейкоцитоз. Вместе с тем даже у таких больных всегда сохраняются
самостоятельные боли в молочной железе, а в её тканях определяется
плотный болезненный инфильтрат. Часто встречается вариант, когда одни
гнойные очаги воспаления в молочной железе протекают латентно на
фоне других, имеющих выраженную воспалительную реакцию.
Острый мастит -О 349
Ведущий симптом абсцедирующего мастита — флюктуация,
которая определяется в 99% случаев. Ценное диагностическое
значение имеют пункция инфильтрата иглой с широким просветом и УЗИ.
При инфильтративно-абсцедирующей форме мастита из-за
небольшого объёма абсцессов в подавляющем большинстве случаев
(95%) симптом флюктуации бывает отрицательным, он
определяется только при формировании более крупной полости. По этой же
причине невелика диагностическая ценность пункции гнойного
очага. В таких случаях ведущее значение имеет УЗИ.
Дифференциальная диагностика
Мастит следует отличать от лактостаза. При лактостазе также
повышается температура тела, молочная железа увеличивается в объёме,
при пальпации определяется болезненность во всех её отделах, но
никогда не бывает отёка и гиперемии кожи. Вопрос о необходимости
оперативного лечения в этих случаях целесообразно решить в течение
3—4 ч после тщательного сцеживания грудного молока из молочной
железы. Если имеется только лактостаз, то после опорожнения
железы боли в ней стихают, начинают пальпироваться небольшого размера
безболезненные дольки с чёткими контурами и мелкозернистой
структурой, снижается температура тела. При длительности лактостаза
более 3 сут, как правило, развивается мастит. Если лактостаз сочетается
с гнойным маститом, то после сцеживания в тканях железы
продолжает определяться плотный болезненный инфильтрат,
мелкозернистая структура молочных долек не определяется, температура тела
остаётся высокой, самочувствие больных не улучшается.
Лечение
Негнойные формы лактационного мастита лечат консервативно,
при гнойных показано хирургическое лечение. Лечение лактостаза
не отличается от лечения негнойных форм мастита.
Схема лечения лактостаза и негнойных форм мастита
1. Сцеживание молока из обеих молочных желёз через каждые 3 ч
(8 раз в сутки). В первую очередь молоко сцеживают из здоровой
железы, затем — из больной.
350 ♦ Хирургические болезни ♦ Том 2 ♦ Часть VI ♦ Глава 42
2. Внутримышечное введение 2,0 мл дротаверина на протяжении
3 сут через равные промежутки времени: 3 раза в день за 20 мин до
сцеживания молока из больной молочной железы, а за 5 мин — 0,5 мл
окситоцина, что улучшает молокоотдачу.
3. Ежедневные ретромаммарные новокаиновые блокады (100-
150 мл 0,25% раствора прокаина) с добавлением антибиотиков
широкого спектра действия в половинной суточной дозе. Блокаду
выполняют следующим образом: молочную железу оттягивают рукой
вперёд, у наружного основания её, предпосылая раствор прокаина, вводят
длинную иглу параллельно грудной клетке под заднюю фасцию
молочной железы в жировую клетчатку до зоны проекции ареолы. Затем
вводят раствор прокаина с антибиотиками. Сразу после блокады боли
купируются, расширяются молочные протоки, что облегчает
сцеживание, создаётся высокая концентрация антибиотика в молочной
железе. Сцеживают молоко из железы через 20—30 мин после блокады.
4. Назначение антибиотиков.
5. Десенсибилизирующая терапия (внутримышечное введение ан-
тигистаминных средств 2—3 раза в сутки).
6. Витаминотерапия (С и группы В).
7. Полуспиртовые повязки на молочную железу (не следует
применять какие-либо мазевые согревающие компрессы).
8. Ультразвуковая или ультравысокочастотная терапия (при
положительной динамике заболевания через сутки после начала
консервативной терапии).
Проведение консервативной терапии возможно при
удовлетворительном состоянии больной, температуре тела до 37,5 °С,
нормальных показателях общего анализа крови, длительности заболевания
менее 3 сут, наличии инфильтрата, занимающего не более одного
квадранта железы, и отсутствии других местных симптомов
гнойного воспаления. Если положительная динамика в течение 2 сут
лечения отсутствует, показано оперативное лечение.
Хирургическое лечение гнойного мастита
Операцию следует выполнить в стационаре под общим
обезболиванием. Основные принципы хирургического лечения острых
гнойных лактационных маститов на современном этапе следующие.
1. Выбор рационального доступа к гнойному очагу с учётом
необходимости максимального сохранения функции и эстетики
молочной железы.
Острый мастит О- 351
2. Радикальная хирургическая обработка гнойного очага.
3. Адекватное дренирование гнойного очага, в том числе с
применением дренажно-промывной системы.
4. Закрытие раны первичным швом, а при противопоказаниях —
наложение вторичных швов и применение кожной пластики.
5. Длительное капельное промывание раны через дренажно-про-
мывную систему в послеоперационном периоде растворами
антисептиков.
Выбор доступа к гнойному очагу должен учитывать локализацию
и распространённость гнойного процесса, анатомические
особенности строения молочной железы (рис. 42-2). При локализации
гнойного очага под ареолой наиболее рациональным является параарео-
лярный доступ: разрез делают параллельно и отступя от края ареолы
на 1—2 мм. При локализации воспалительного процесса в нижних
квадрантах молочной железы (или одном из них) наилучшим
доступом служит разрез, который выполняют на 1—2 см выше и
параллельно нижней переходной складке молочной железы. Тотальное
поражение молочной железы или ретромаммарное расположение
гнойника делает необходимым выполнение разреза по ходу нижней
переходной складки молочной железы.
Рис. 42-2. Разрезы при гнойном мастите: 1 — наружно-боковой; 2 —
радиальные; 3 — параареолярный; 4 — по ходу нижней переходной складки
молочной железы.
Для вскрытия гнойного очага, расположенного на границе
наружных квадрантов или занимающего оба наружных квадранта,
выполняют разрез дугообразно по наружному основанию молочной
железы. При глубокой и узкой межмаммарной складке для вскрытия
гнойника во внутренних квадрантах предпочтительней дугообразный
разрез по наружному основанию молочной железы.
352 О Хирургические болезни ♦ Том 2 ♦ Часть VI <г Глава 42
Описанные выше разрезы не нарушают эстетического состояния
молочной железы, позволяют широко вскрыть и осмотреть гнойную
полость, достаточно полно иссечь нежизнеспособные ткани. При
некрозе кожи следует иссечь его двумя полуовальными разрезами и
из этого доступа выполнить хирургическую обработку гнойного очага.
Радиальный разрез является универсальным и применяется при
любой локализации гнойного очага, кроме субареолярного его
расположения. Однако рубцы после выполнения радиальных разрезов в
верхних квадрантах трудно скрываются одеждой, а в нижних — часто
приводят к выраженной деформации молочной железы, поэтому
использование их следует ограничить.
После выполнения разреза иссекают все нежизнеспособные
гнойно-некротические ткани, что ускоряет купирование
воспалительного процесса. Хирургическая обработка гнойного очага является
наиболее ответственным и трудным этапом операции. Оставшаяся после
хирургической обработки нежизнеспособная ткань становится
причиной рецидива заболевания. В то же время чрезмерный радикализм
и иссечение жизнеспособной ткани могут привести к нарушению
функций и внешнего вида молочной железы. Поскольку для абсцедирую-
щей формы мастита характерно наличие чёткой границы между
гнойным очагом и остальной тканью молочной железы, то полное иссечение
пиогенной оболочки и фиброзной капсулы гарантирует радикальность
хирургической обработки. При инфильтративно-абсцедирующей
форме мастита необходимо иссечь весь пальпируемый инфильтрат до
здоровых тканей. Он представляет собой плотную белесоватого цвета ткань
с мелкими абсцессами, реже образован рыхлой, синюшного цвета
тканью. Полноценность выполненной хирургической обработки
контролируют пальпацией молочной железы как со стороны раны, так и со
стороны кожи. При флегмоне молочной железы нежизнеспособной
следует считать ткань, пропитанную гноем. Она всегда рыхлая и
отёчная, имеет тусклый серый вид, не кровоточит. Кровотечение из
отдельного крупного сосуда, проходящего среди пропитанных гноем
тканей, не является признаком жизнеспособности этого участка
молочной железы. Критерием полноценно выполненной некрэктомии
является появление капиллярного кровотечения из здоровой ткани.
При гангренозной форме мастита после иссечения некрозов могут
образоваться обширные дефекты кожи, требующие в дальнейшем
закрытия одним из способов аутодермопластики.
Хирургическую обработку гнойного очага дополняют
промыванием раны растворами антисептиков с использованием электроотсоса,
Острый мастит О- 353
что снижает её микробную обсеменённость. Этап радикальной не-
крэктомии завершают сменой перчаток, инструментов,
отгораживающего материала и повторной обработкой операционного поля.
Выполняют тщательное, но не грубое сцеживание молока из молочной
железы. Это необходимо сделать, поскольку полноценное
сцеживание молока до операции и в первые часы послеоперационного
периода неосуществимо из-за резкой болезненности молочной железы.
Кроме того, при сцеживании молока до вскрытия и санации
гнойника имеется реальная опасность проникновения микробной флоры в
повреждённые воспалительным процессом молочные протоки и
распространения её на другие участки молочной железы.
Большое значение в хирургическом лечении острых гнойных
маститов имеет адекватное дренирование гнойной полости
наложением дренажно-промывной системы, состоящей из раздельных
разнокалиберных полихлорвиниловых трубок, имеющих отверстия на
боковых поверхностях (рис. 42-3). Дренирование полости абсцесса и
длительное промывание её в послеоперационном периоде растворами
антисептиков обеспечивают механическое удаление микробной
флоры и мелких некротизированных участков ткани молочной железы.
В то же время растворы антибактериальных препаратов и протеолити-
Рис. 42-3. Дренажно-промывная
система.
354 О Хирургические болезни ♦ Том 2 О- Часть VI ♦ Глава 42
ческих ферментов оказывают непосредственное действие на
микрофлору и некротические ткани. Всё это способствует быстрому
очищению раны и ускоряет купирование воспалительного процесса.
Радикальная хирургическая обработка гнойного очага с
последующим постоянным промыванием полости растворами антисептиков
через дренажно-промывную систему позволяет закрыть рану
первичным швом (рис. 42-4) и таким образом сократить сроки заживления
её, улучшить функциональный и эстетический результаты лечения.
Рис. 42-4. Интрамаммарный абсцедирующий мастит: а — наложены дренаж-
но-промывная система и первичные швы; б — локализация гнойника и
вариант дренажно-промывной системы.
Швы накладывают только на подкожную клетчатку и кожу. В
результате образуется замкнутая полость (неушитая внутренняя часть раны)
на месте имевшегося гнойного очага, которая сообщается с внешним
пространством через дренажи. Грануляционная ткань, заполняя полость,
сохраняет объём молочной железы, что очень важно в эстетическом
отношении. Противопоказания к наложению первичных швов на рану —
анаэробный компонент инфекции и обширный дефект кожи, из-за
чего сблизить края раны без натяжения не представляется возможным.
В послеоперационном периоде через оба конца ирригатора
постоянно капельно промывают полости водным раствором хлоргексиди-
на с интенсивностью 10—15 капель в минуту. Введение раствора
антисептика в оба конца ирригатора способствует заполнению его
просвета жидкостью на всём протяжении, благодаря чему гнойная
Острый мастит ♦ 355
полость равномерно орошается через все отверстия трубки. Всего в
сутки требуется не более 3 л раствора. Более существенное значение
имеет длительность промывания полости, а не скорость введения
растворов антисептиков.
В течение первых 5 сут после операции выполняют ежедневные
перевязки с целью контроля течения раневого процесса и выявления
гнойных раневых осложнений. В дальнейшем, по мере стихания
воспалительных явлений в молочной железе перевязки можно делать
через 1—2 дня. Во время них полость промывают через трубки
растворами пероксида водорода и хлоргексидина, при этом обращают
внимание на её объём, функционирование дренажно-промывной
системы и характер отделяемого. Дренажно-промывную систему
удаляют в сроки от 5 до 12 сут после операции. Показанием для этого
являются полное купирование воспалительного процесса и наличие
остаточной полости объёмом не более 5 мл. В ранки, оставшиеся
после удаления трубок, на 1—2-е сутки вводят резиновые полоски. При
неосложнённом течении послеоперационного периода швы
снимают на 8—9-е сутки после операции.
Если рана не закрывалась первичными швами, то перевязки
делают с использованием различных местных средств в зависимости от
фазы раневого процесса. В фазе гнойного воспаления применяют
мази на водорастворимой основе (хлорамфеникол + метилурацил,
хлорамфеникол + метилурацил + сульфадиметоксин + тримекаин,
гидроксиметилхиноксилиндиоксид + тримекаин + метилурацил), в
фазе регенерации — препараты, стимулирующие процессы
заживления (метилурациловая мазь, винилин и др.). После купирования
признаков острого воспаления накладывают вторичные швы.
В общую терапию гнойного лактационного мастита включают
антибактериальные и иммунокорригирующие препараты. При тяжёлом
течении заболевания проводят коррекцию метаболических и гемо-
динамических нарушений, детоксикационную терапию (см.
принципы лечения сепсиса, глава 3).
Одна из важных задач послеоперационного периода —
купирование лактостаза, который всегда сопровождает гнойный мастит. Для
этого необходимо сцеживать молоко из обеих молочные желёз через
каждые 3 ч: сначала — из здоровой, затем — из больной. Вопрос о
возможности более редкого сцеживания решают индивидуально, но
не ранее стихания воспаления. Перед сцеживанием молока из
больной железы в течение 3—4 дней 3 раза в сутки через равные
промежутки времени внутримышечно вводят дротаверин и окситоцин. При
356 ♦ Хирургические болезни ♦ Том 2 ♦ Часть VI ♦ Глава 42
более длительном применении этих препаратов возможно усиление
лактации, что нецелесообразно при лактостазе и мастите.
При мастите следует воздержаться от прикладывания ребёнка к
больной и здоровой молочным железам. Естественное
вскармливание можно продолжить только после купирования воспаления и при
отрицательном результате бактериологического исследования молока.
Молоко, сцеженное из больной железы, утилизируют, а из
здоровой — после пастеризации пригодно для кормления ребёнка из
бутылочки через соску. Следует иметь в виду, что молоко до
пастеризации и после него не подлежит хранению.
Показания к прерыванию лактации: 1) тяжёлое течение
воспалительного процесса в молочной железе (гангренозный или тотальный
флегмонозный мастит, сепсис), 2) двусторонний мастит, 3) рецидив
заболевания, 4) наличие каких-либо причин, по которым
невозможно кормление ребёнка молоком матери после её выздоровления,
5) настоятельная просьба матери. Лактацию можно прерывать
только после купирования лактостаза.
Прерывание лактации путём тугого бинтования молочных желёз
крайне опасно, так как продукция молока некоторое время ещё
продолжается и всегда возникает лактостаз, а нарушение
кровообращения в молочной железе способствует развитию тяжёлых форм
гнойного мастита. Наиболее эффективным способом прерывания лактации
является назначение препаратов, которые ингибируют секрецию про-
лактина (каберголин, бромокриптин).
Осложнения и прогноз
Острый гнойный лактационный мастит может осложниться
сепсисом и распространением гнойного процесса на грудную клетку с
развитием флегмоны. Последствиями гнойного мастита могут быть
формирование молочного свища, деформация молочной железы и
уменьшение её объёма, существенное снижение или прекращение
лактации.
Профилактик
Профилактика мастита предполагает выполнение ряда условий.
Во-первых, соблюдение строгого санитарно-гигиенического режима
в родильном стационаре. Во-вторых, повышение иммунологической
Острый мастит ♦ 357
реактивности организма женщины. В-третьих, соблюдение личной
гигиены во время беременности и в послеродовом периоде.
В-четвёртых, правильный уход за молочными железами, предотвращение
появления и своевременное лечение трещин сосков и лактостаза.
Перспективным решением проблемы представляется организация
боксированных палат для женщин и новорождённых, в которых они
находятся на всех этапах пребывания в родильном стационаре от
госпитализации до выписки. Это создаёт возможность предотвращения
контактов беременных, рожениц и родильниц между собой и с
широким кругом медицинского персонала, а также между
новорождёнными. После выписки женщины и новорождённого выполняют
полную дезинфекцию боксированной палаты, что существенно снижает
уровень госпитальной инфекции.
К группе риска развития лактационного мастита относятся
женщины:
• имевшие патологию беременности, родов и ближайшего
послеродового периода;
• имеющие в анамнезе гнойно-септические заболевания;
• больные мастопатией;
• имеющие аномалии развития молочной железы и соска;
• перенёсшие ранее травму молочной железы или операции на ней;
• склонные к образованию трещин кожи и слизистых оболочек;
• с патологическим предменструальным синдромом,
сопровождающимся диффузным увеличением и болезненностью молочных
желёз во второй фазе менструального цикла.
Благоприятное психоэмоциональное состояние женщины в семье,
отдых, прогулки на свежем воздухе — важные факторы
профилактики мастита. С беременностью и послеродовым периодом
несовместимы курение и употребление алкоголя.
В особом уходе нуждаются молочные железы. Во время
беременности рекомендуют дополнительно обмывать их водой
комнатной температуры с последующим растиранием чистым махровым
полотенцем. Это способствует закаливанию молочных желёз и
повышению устойчивости сосков к механическим повреждениям,
которые могут возникнуть при кормлении ребёнка. Со второй
половины беременности и в послеродовом периоде полезны
ежедневные воздушные ванны для молочных желёз в течение 15—20 мин,
летом — под прямыми солнечными лучами у открытого окна,
зимой — в сочетании с небольшими дозами ультрафиолетового
облучения. В этот период беременности и после родов следует также
358 ♦ Хирургические болезни ♦ Том 2 ♦ Часть VI ♦ Глава 42
рекомендовать женщинам выполнять лёгкий массаж сосков и
молочных желёз.
Большое значение для профилактики лактостаза и нарушения
лактации имеет ношение бюстгальтера, который должен быть сшит из
хлопчатобумажной или хлопковой ткани, так как синтетическое белье
раздражает и травмирует соски и может привести к образованию
трещин. Кроме того, бюстгальтер из синтетического материала нельзя
гладить горячим утюгом. Бюстгальтер должен хорошо поддерживать,
но не сдавливать молочную железу. Его следует ежедневно стирать
отдельно от другого белья и надевать после проглаживания
горячим утюгом.
Для предотвращения возникновения трещин сосков необходимо
тщательно соблюдать технику кормления и не держать ребёнка у
груди длительное время. Если ребёнок сосёт грудь вяло и медленно, то
целесообразно периодически делать короткие перерывы. После
каждого кормления молочные железы необходимо обмыть тёплой водой,
просушить чистым полотенцем и оставить открытыми на 10-15 мин.
При этом не следует пользоваться мылом и сильно растирать
молочные железы жёстким полотенцем. Между бюстгальтером и ареолой
железы прокладывают стерильную марлевую салфетку или
свернутый кусочек стерильного бинта, который меняют при пропитывании
молоком. При уходе за молочными железами и кожей других
участков тела не рекомендуют применять лосьоны, кремы и другие
средства, обладающие запахом, так как ребёнок в дальнейшем будет
неохотно брать грудь или отказываться от кормления.
Для успешного лечения трещин необходимо, прежде всего,
временно прекратить кормление ребёнка грудью, следить за тем, чтобы
не было длительного контакта молока с трещиной. Молоко
сцеживают руками в стерильную посуду, ребёнка кормят из бутылочки через
соску с очень маленьким отверстием. При большом отверстии в
соске ребёнок может в дальнейшем отказаться брать грудь. Хороший
результат даёт лечение трещины накладыванием на соски
стерильной марлевой салфетки с маслом облепихи или шиповника.
Для установления нормальной лактации и профилактики
лактостаза, успешного и продолжительного вскармливания ребёнка грудью
необходимо учитывать физиологические механизмы, стимулирующие
отделение молока. Этому способствует раннее прикладывание
новорождённого к груди (в течение 30 мин после рождения), что
активизирует выброс в кровь матери пролактина, стимулирующего выработку
молока. Положительное влияние на лактацию оказывает частое при-
Острый мастит ♦ 359
кладывание ребёнка к груди — приблизительно каждые 2 ч. При этом
происходит постоянное опорожнение молочной железы, что
является профилактикой лактостаза и увеличивает выделение пролактина.
При установившейся лактации после каждого кормления ребёнка
рекомендуют сцеживать остатки молока. Это связано с тем, что
молоко при кормлении в первую очередь оттекает из молочных долек,
имеющих широкие и прямые молочные ходы. Дольки с извитыми и
тонкими канальцами опорожняются недостаточно, в них может
возникнуть застой молока и, как следствие этого, — воспалительный
процесс. Опорожнить их можно дополнительным сцеживанием. Ручной
метод сцеживания наиболее эффективен в плане профилактики
лактостаза. При этом очень важно соблюдать правильную технику
кормления и сцеживания молока. Для более полной отдачи молока можно
рекомендовать тёплый циркулярный душ на молочную железу за 20
мин до кормления. Если женщина склонна к развитию лактостаза, то
каждое кормление надо проводить из обеих молочных желез.
Особенности диагностики и лечения
нелактационного мастита
Нелактационный мастит встречается значительно реже
лактационного. Инфекция, чаще золотистый стафилококк, проникаете ткань
молочной железы через молочные протоки или повреждённую
кожу. Заболевание может возникнуть в любом возрасте и не имеет
связи с лактацией.
Гнойный воспалительный процесс при нелактационном мастите
у взрослых обычно протекает менее тяжело, чаще в виде абсцесса,
склонен к отграничению, быстрее купируется. Иммунологическая
реактивность при нелактационном мастите редко бывает сниженной,
отсутствуют проблемы, связанные с функциональной активностью
молочной железы. Принципы хирургического лечения
нелактационного мастита те же, что и лактационного. Обязательно выполняют
гистологическое исследование иссечённой ткани для исключения
туберкулёза молочной железы и распадающегося рака,
осложнённого нагноением.
Мастит беременных
Мастит беременных бывает очень редко, развивается на фоне
перестройки молочных желёз в период беременности.
360 ♦ Хирургические болезни ♦ Том 2 ♦ Часть VI ♦ Глава 42
Мастит новорождённых
Мастит новорождённых возникает в течение первых 2-3 нед
жизни, как у девочек, так и у мальчиков на фоне физиологического на-
грубания желёз, развивающегося вследствие поступления в кровь
новорождённого экстрогенов матери. В ткань железы инфекция
проникает через повреждённую кожу или гематогенно. Часто
заболеванию предшествуют опрелости, различные гнойно-воспалительные
процессы в коже и глубжележащих тканях. Заболевание начинается
остро, воспалительный процесс быстро прогрессирует и в конце 1-х —
начале 2-х суток приобретает гнойный характер. Ребёнок ведёт себя
беспокойно, отказывается от еды. Температура тела достигает 38-
39 °С. В области железы видны гиперемия кожи и отёчность
тканей, определяется симптом флюктуации. Заболевание может
осложниться развитием флегмоны передней грудной стенки, тяжёлым
сепсисом.
Лечение гнойного мастита новорождённых — оперативное.
ДИСГОРМОНАЛЬНЫ
ЗАБОЛЕВАНИЯ
МОЛОЧНЫХ ЖЕЛЁЗ
В клинической практике по отношению к доброкачественным
заболеваниям молочных желёз обычно употребляют термин фиброзно-
кистозная мастопатия, который объединяет большую группу
различных по морфологическому строению дисгормональных гиперплазии,
частота малигнизации которых довольно высока. Поэтому знание
особенностей их возникновения и клинических проявлений
необходимо для практикующего врача.
Существуют различные формы гормонального дисбаланса,
способствующие возникновению гиперплазии в этом органе.
Подтверждением такого представления является большое разнообразие
патоморфологических и клинических форм фиброаденоматоза,
структурная организация которого, по-видимому, обусловлена
различным гормональным фоном. Фиброзно-кистозная болезнь, по
определению ВОЗ, представляет собой комплекс процессов,
характеризующихся широким спектром пролиферативных и регрессивных
изменений тканей молочных желёз с формированием
ненормальных соотношений эпителиального и соединительнотканного
компонентов и образованием в молочной железе изменений фиброзного,
кистозного и пролиферативного характера, которые часто, но не
обязательно, сосуществуют. Различают непролиферативную и пролифе-
ративную формы фиброзно-кистозной болезни. Риск малигнизации
при непролиферативной форме не превышает 1%, при умеренной
пролиферации — не более 2,5%, а при резко выраженной
пролиферации возрастает до 30%.
Клинико-морфологическая характеристика дисгормональных
гиперплазии. Среди различных форм дисгормональной гиперплазии
молочной железы клиницисты выделяют диффузные (мелко- или
крупноочаговые), узловые (локальные) и смешанные, когда на фоне
диффузных изменений определяются более или менее выраженные
по величине узлы. Фиброаденоматоз молочной железы — наиболее
362 ♦ Хирургические болезни ♦ Том 2 ♦ Часть VI -О- Глава 43
распространенная разновидность диффузной дисплазии. Главным
классификационным критерием может служить наличие или
отсутствие пролиферации.
• Диффузная форма — наиболее ранняя стадия развития мастопатии.
При гистологическом исследовании выявляют гиперплазированные
и атрофичные дольки, расширенные протоки и ацинусы, мелкие
кисты, разрастание и огрубение соединительной ткани, коллагеноз
и участки нормального строения молочной железы.
• Узловая форма мастопатии характеризуется многообразием
морфологической картины дисгормональной гиперплазии. В ней могут
преобладать процессы гиперплазии железистых долек, кистообра-
зования, фиброз, пролиферация клеточных элементов,
выстилающих кисты и протоки. Обнаружение в препаратах удалённой,
патологически изменённой части молочной железы пролифератов
эпителия в просвете железистых полостей даёт основание
расценивать заболевание как локализованную мастопатию с
пролиферацией. Выявление в указанных пролиферациях единичных атипических
клеток служит поводом для диагноза локализованной мастопатии
с пролиферацией и атипией и отнесения этих форм к предраковым
состояниям.
• Фиброаденомы молочной железы также относят к локальным
доброкачественным опухолям. Гистологически различают несколько
форм фиброаденом.
1. Интраканаликулярная — с преобладанием разрастающегося
эпителия, среди которого располагаются сдавленные протоки в виде
железистых ветвистых тяжей.
2. Периканаликулярная — с параллельным разрастанием
соединительной ткани эпителия, образующего железистые трубочки; при
этом выявляют расширенные протоки и кисты, как при мастопатии.
3. Листовидная, или филлоидная — растет быстро, достигая
больших, даже гигантских размеров. На разрезе обнаруживают слоистое
строение, напоминающее листы сложенной книги. При
гистологическом исследовании выявляют разрастание соединительной ткани,
богатой клеточными элементами, отмечают железистые ходы и
кисты, выстланные пролиферирующим эпителием.
4. Внутрипротоковая папиллома (кровоточащая молочная
железа, болезнь Минца) локализуется в крупных протоках, чаще вблизи
соска и за ареолой. Папиллома представляет собой разрастание
эпителия внутри расширенного выводного протока молочной железы,
легко травмируется при сдавливании или ушибах с последующим
Лисгормональные заболевания молочных желез ♦ 363
кровянистым выделением из соска. Основной клинический
симптом — выделение зеленовато-жёлтого или кровянистого
содержимого из соска.
• Аденома характеризуется избыточным разрастанием железистых
ходов (ацинусов) с образованием микроаденом из тесно
расположенных гиперплазированных железистых элементов. По мере
нарастания пролиферации эпитерия ацинуса развивается дисплазия
третьей степени, которая переходит в карциному in situ, а затем в
инвазивный рак. Эти опухоли молочной железы бедны стромой, у
них преобладает разрастание железистого эпителия. Для них
характерны менее чёткие контуры, они более мягкой консистенции, чем
фиброаденомы.
В настоящее время не вызывает сомнений тот факт, что дисгор-
мональная дисплазия (мастопатия), в особенности с атипической
пролиферацией эпителия, в определённом проценте случаев может
являться предшественником рака молочной железы. Риск рака
молочной железы возрастает при дольчатой и протоковой гиперплази-
ях, множественных больших кистах. Раннее выявление рака
представляется важной стратегией снижения смертности от этого заболевания
и является целью программ скрининга, проводимых в целом ряде
стран. В нашей стране пока, к сожалению, в 90% случаев
патологические образования в молочных железах выявляют у себя сами
женщины, и лишь в 10% — врачи при проведении профилактических
осмотров.
Этиология
Физиология молочных желёз у женщин такова, что они находятся
в состоянии постоянной смены процессов пролиферации и
инволюции, связанных с фазами менструального цикла. На процессы
пролиферации эпителия молочных желёз оказывают влияние эстрогены
и прогестерон, вырабатываемые яичниками, а также гонадотропные
гормоны передней доли гипофиза. У женщин с фиброзно-кистозной
мастопатией выявляют различные нарушения гормонального
статуса: 1) гестагенную недостаточность; 2) гиперэстрогению; 3)
снижение или повышение уровня гонадотропинов, изменение
соотношения фолликулостимулирующего и лютеинизирующего гормонов.
Деятельность желёз внутренней секреции, от которых зависят
процессы физиологической пролиферации эпителия молочных желёз,
364 ♦ Хирургические болезни ♦ Том 2 ♦ Часть VI О Глава 43
регулируется диэнцефальным отделом и корой головного мозга.
Разнообразные воздействия нарушают нейрогуморальную регуляцию
(аборты, воспалительные заболевания половых органов, поражение
нервной системы и пр.), ведут к развитию дисгормональных
расстройств. Нарушения гормонального равновесия вызывают
перестройку молочных желёз, которая лежит в основе разнообразных
патологических процессов. Под влиянием гормональных сдвигов
нарушаются процессы физиологической эволюции и инволюции
молочных желёз, развиваются очаги патологической пролиферации
эпителия.
Известно влияние функциональной активности щитовидной
железы на лютеинизирующую функцию гипофиза. У ряда больных
мастопатией изменение состояния тиреотропной функции
гипофиза может вызвать угнетение секреции лютеинизирующего гормона
и нарушения овариального цикла, которые способствуют
возникновению патологических процессов в молочных железах.
Функциональные и морфологические изменения печени могут лежать в
основе изменений молочных желёз, поскольку нарушают инактивацию
эстрогенов.
Приведённые выше данные позволяют сделать заключение, что
гиперпластические процессы в молочной железе могут возникнуть
на самом различном гормональном уровне. К патологическому
процессу могут привести и высокая концентрация эстрогенов в
организме, и высокая концентрация прогестерона при недостатке
эстрогенов, и относительная эстрогенизация при недостатке андрогенов
и прогестерона, и различные нарушения функций гипофиза, а
также качественные изменения в образовании и метаболизме
стероидных гормонов, нарушение функциональных ритмов в
репродуктивной системе.
Классификация
• Диффузная мастопатия:
— простая;
— с умеренной внутрипротоковой пролиферацией эпителия;
— с умеренно выраженной атипией эпителия.
• Узловая мастопатия:
— с пролиферацией;
— с пролиферацией и атипией.
Лисгормональные заболевания молочных желез ♦ 365
• Фиброаденома молочной железы:
— интраканаликулярная;
— периканаликулярная;
— листовидная (филлоидная);
— внутрипротоковая папиллома (кровоточащая молочная железа,
болезнь Минца).
• Аденома.
■
Клинические проявления и диагностика
У больных с дисгормональными гиперплазиями молочной
железы имеется причинно-следственная связь между психическими и
гормональными факторами. Часто женщины сонливы днём, а ночью
страдают бессонницей, ипохондричны, склонны к конфликтам,
раздражительны, жалуются на головные боли, уплотнение в молочной
железе; их часто беспокоят боли, чувство распирания, набухания в
молочных железах, особенно перед менструацией.
Анамнез заболевания
При сборе анамнеза заболевания необходимо проследить
динамику развития болезни с момента первых её проявлений. Из анамнеза
жизни больной врачу должны быть известны перенесённые и
сопутствующие заболевания (особенно половых органов, печени,
щитовидной железы), гинекологический и сексуальный анамнез,
социально-бытовые условия больной, её характер и темперамент; наличие
признаков неврастении, наследственные заболевания, особенно по
линии отца и матери.
Объективное обследование больной
При осмотре следует обращать внимание на развитие молочных
желёз, их симметрию, размеры, взаиморасположение сосков, их
деформацию, сосудистый рисунок, цвет кожных покровов. Пальпацию
следует проводить очень тщательно, начиная с верхневнутреннего
квадранта молочной железы и двигаясь от периферии к соску.
Пальпацию молочных желёз осуществляют в нескольких позициях: в
положении лёжа на спине, стоя и в положении на правом либо
левом боку с заложенной под голову рукой на стороне пальпации. При
этом обращают внимание на болезненность, температуру кожи над
366 ♦ Хирургические болезни ♦ Том 2 ♦ Часть VI ♦ Глава 43
опухолью, её контуры, подвижность. Необходимо проверить
выделения из сосков, пропальпировать регионарные лимфатические узлы
(см. рис. 44-3-44-6).
Лабораторные и специальные методы
Лабораторные и специальные методы исследования позволяют
выявить состояние менструальной функции по цитологической
картине вагинальных мазков и тиреоидную активность по йодсвязыва-
ющим белкам; изучить активность корковового слоя надпочечников
с помощью определения АКТГ, гонадотропина, рецепторов к
стероидным гормонам. Для определения активности симпатоадреналовой
системы исследуют катехоламины, изучению подвергают также
белковый и липидный обмен. Цитологические методы исследования
проводят путём пункции очаговых уплотнений молочной железы,
увеличенных лимфатических узлов и анализа выделений из сосков.
К специальным инструментальным методам исследования относят
маммографию, пневмографию, термографию, УЗИ, галактографию,
дуктографию, пневмоцистографию, с помощью которых
определяются мелкокистозные образования молочной железы,
множественные округлые тени, кальцинаты, полости. При поражении протоков
могут наблюдаться их расширенные тени, деформации.
Диффузная мастопатия
Диффузная мастопатия возникает в возрасте до 35 лет. В анамнезе
выявляют нарушения менструальной функции, многочисленные
аборты, кратковременную лактацию либо отсутствие беременностей.
Среди жалоб преобладают боли в одной или обеих молочных
железах, иррадиирующие в смежные части тела (ключицу, плечо, лопатку,
подреберье, шею). Они появляются перед наступлением
менструации. С её началом или окончанием боли уменьшаются или совсем
исчезают. При осмотре каких-либо изменений в молочных железах
выявить не удаётся. Пальпаторно обнаруживают различные по
величине и протяженности болезненные, без чётких границ уплотнения.
Поверхность их зернистая или дольчатая. При последующих
менструациях болезненность постепенно становится меньше, но более
отчётливо пальпируются уплотнения без чётких границ, при
надавливании на сосок иногда видны выделения в виде молозива. Выделения
могут также быть прозрачными, бурыми или кровянистыми.
Лисгормональные заболевания молочных желез О- 367
При рентгенологическом исследовании картина довольно пёстрая:
отдельные участки округлых просветлений чередуются с усиленной
тяжистостью. Иногда тени молочных желёз приобретают гомогенный
характер. Выделяются лишь наружные полициклические контуры
уплотнений.
Узловая мастопатия
Клинические проявления узловой мастопатии характеризуются
наличием в поражённой молочной железе одного или нескольких
очагов уплотнений с довольно чёткой границей. Узлы болезненны при
пальпации, чётко определяются в вертикальном положении, в
горизонтальной позиции они как бы исчезают в диффузно уплотнённых
тканях (отрицательный симптом Кенига). Отсутствуют также изменения
кожи. Эти признаки являются ключевыми в дифференциальном
диагнозе узловой мастопатии и рака. Нередко при надавливании на ареолу
из соска выделяется жидкость различной окраски и консистенции.
Фиброаденомы
Фиброаденомы чаще развиваются у женщин молодого (до 30 лет)
и даже юношеского возраста. Клинически фиброаденомы
распознаются довольно легко. При пальпации они определяются в виде
плотных, с гладкой поверхностью, легко смещаемых образований, не
спаянных кожей. Именно это обстоятельство послужило основанием для
введения в практику симптома «плавания». Ни при каком другом
заболевании молочной железы этого симптома выявить не удаётся. Реже
фиброаденомы имеют крупнобугристую поверхность. Диаметр их
различен: от нескольких миллиметров до нескольких сантиметров в
диаметре. В некоторых случаях фиброаденомы растут быстро,
достигая больших размеров, занимая один или более квадрантов железы и
выступая над кожей в виде узла. Сложнее обстоит дело с
диагностикой непальпируемых фиброаденом. В этих случаях эффективным
методом их распознавания является маммография.
Аденомы
Аденомы молочной железы бедны стромой, в них преобладает
разрастание железистого эпителия. Клинически напоминают
фиброаденомы, но для них характерны менее чёткие контуры, они более
мягкой консистенции.
368 ♦ Хирургические болезни Ф- Том 2 ♦ Часть VI ♦ Глава 43
Дифференциальная диагностика
Дифференциальную диагностику чаще проводят со
злокачественными опухолями молочной железы, реже — для исключения
сифилиса, туберкулёза, кандидомикоза, маститов (плазмоклеточного,
инфекционного, посттравматического и др.).
Клинический диагноз. Для диагностики мастопатии применяют
клинические, лабораторные, морфологические, рентгенологические
и специальные методы исследования, которые приобретают особо
важное значение при дифференциальной диагностике узловых форм
мастопатии и рака молочной железы.
Окончательный диагноз устанавливают преимущественно на
основании клинического осмотра. Вместе с тем, если с помощью
клинических и других указанных методов исследования диагноз
установить не удаётся, то прибегают к хирургическому способу, т.е. к
секторальной резекции молочной железы с последующим изучением
мазков-отпечатков на стекле или, чаще, срочному гистологическому
исследованию удалённого опухолевого образования.
Лечение
Диффузную мастопатию лечат консервативно. Терапия должна
быть патогенетической, комплексной, многоплановой и длительной.
Прежде чем приступить к ней, необходимо выявить факторы
(экзогенные и эндогенные), лежащие в основе развития заболевания.
Нередко это сопряжено с определёнными трудностями, поскольку
часто они носят интимный характер, что требует достаточного опыта,
искусства врача и знания им основ деонтологии.
К экзогенным факторам, устранение которых может способствовать
профилактике и лечению мастопатии, относят психотравмирующие
ситуации, нарушающие сложные механизмы нейроэндокринной
регуляции, нарушения питания, беспорядочную половую жизнь,
применение гормональных контрацептивов, попадание в пищу пестицидов,
недостаток микроэлементов в организме (например, селена),
нарушение лактации (искусственное вскармливание ребёнка), курение,
злоупотребление спиртным. Если не исключить воздействие
экзогенных факторов и связанных с ними сопутствующих заболеваний,
которые ведут к расстройству нейроэндокринной регуляции, никакие
лекарственные препараты не дадут положительных результатов.
Дисгормональные заболевания молочных желез -О- 369
Питание. По данным Национального ракового института США,
около 90% случаев возникновения рака связано с образом жизни и
факторами окружающей среды. Один из них — фактор питания.
Имеют значение недоедание либо переедание, избыточное употребление
белковой пищи (свинины, говядины), сливочного масла (более 50—
75 г/сут), ожирение и повышенное содержание в крови
холестерина — свыше 5,2 ммоль/л (200 мг%). Жиры и жирные продукты
снижают содержание в плазме крови андрогенов и повышают
концентрацию эстрогенов. Рекомендуют вводить в рацион больных яйца,
молоко, печень, рыбу, овощи с тёмно-зелёными листьями, томаты,
морковь, картофель и кукурузу. Особое значение приобретает
употребление продуктов, содержащих калий. Необходимо ограничивать
использование копчёных, вяленых, консервированных и
маринованных продуктов и, наоборот, увеличить в рационе количество
свежих овощей и фруктов, капусты, продуктов из цельных зёрен злаков.
Витаминотерапия. По мнению многих учёных, предупредить
возникновение доброкачественных и злокачественных опухолей
молочных желёз можно с помощью витаминов А, С, Е, В2 и В6, а также
некоторых микроэлементов: селена, железа, цинка, марганца, меди. Они
должны поступать в организм с продуктами либо путём назначения
курса поливитаминотерапии.
Седативную терапию назначают при нервно-психических
расстройствах. Обычно больным рекомендуют одно из следующих
медикаментозных средств: микстуру Кватера по 1 столовой ложке 2—3 раза в
день, настойку пустырника по 20 капель 2—3 раза в день, отвар
успокоительного чая по 100 мл 1—2 раза в день, бромкамфору по 0,25 г
2—3 раза в день. Больным с выраженным эмоциональным
возбуждением, особенно при астеническом синдроме, проводят лечение
транквилизаторами в течение длительного времени.
Общеукрепляющую терапию проводят при снижении
реактивности и сопротивляемости организма, которые предшествуют
опухолевому процессу. В этих случаях назначают препараты, стимулирующие
защитные реакции организма: настойки женьшеня, лимонника,
экстракты элеутерококка, пантокрина, левзеи, родиолы, настойки
заманихи, аралии.
Гормонотерапия может быть осуществлена только после изучения
гормонального профиля больной. Эмпирическое назначение
гормональных средств способно принести больше вреда, чем пользы. Вот
почему у большинства больных используют негормональные
препараты. В зависимости от особенностей клинических проявлений за-
370 ♦ Хирургические болезни ♦ Том 2 ♦ Часть VI ♦ Глава 43
болевания, анамнеза, уровня эстрогенной насыщенности, состояния
щитовидной железы и гинекологического статуса применяют
различные схемы гормонотерапии.
1. При повышенной эстрогенной активности используют в
основном препараты андрогенного действия (тестостерон, метилтесто-
стерон) в физиологических дозах в фолликулиновой фазе
менструального цикла. Если гиперэстрогения сочетается с гипофункцией
яичников, добавляют прогестины (прогестерон) в лютеиновую фазу
цикла.
2. Больным, имеющим нормальный уровень эстрогенов, но
недостаточную функцию жёлтого тела, в лютеиновую фазу цикла
назначают только прогестерон.
3. Женщинам до 45 лет с выраженной эстрогенной
недостаточностью показаны эстрогенные препараты (в фолликулиновой фазе
менструального цикла). Так как в большинстве случаев гипоэстрогения
сопровождается понижением активности лютеинизирующего
гормона, во второй половине менструального цикла назначают прогестины.
4. У больных с гипофункцией щитовидной железы применяют
тиреоидин.
5. При галакторее различного генеза, нарушении функций
яичников и бесплодии, синдроме предменструального напряжения, нагру-
бании молочных желёз, сопровождающихся высоким уровнем пролак-
тина, назначают средства, снижающие его секрецию (бромокриптин).
Их применение приводит к регрессии узловых образований в ткани
молочной железы, уменьшению болей и выделений из сосков.
Используют также тамоксифен. Он способствует снижению
концентрации пролактина, а также лютеинизирующего, фолликулостимули-
руюшего гормонов и гонадолиберина. Лечение тамоксифеном ведёт
к излечению мастопатии у 70% больных.
Узловая форма мастопатии подлежит хирургическому лечению.
Оперативное вмешательство устраняет источник болезненных
проявлений и служит мерой предотвращения возможной бластоматоз-
ной трансформации. Кроме того, операция необходима как способ
окончательного установления точного диагноза, так как в ряде
случаев под маской мастопатии скрывается рак молочной железы. Тогда
правильный диагноз устанавливают только после экстренного
гистологического исследования удалённого участка железы.
Как правило, выполняют секторальную резекцию молочной
железы. При этом соблюдают определённые правила иссечения
железистой ткани: дно раны должно быть не конусообразным, а совпала-
Лисгормональные заболевания молочных желез ♦ 371
юшим по ширине с кожным разрезом удалённой поверхностной
фасции и соответствующего участка грудной мышцы; разрез
необходимо выполнять, отступая на 2 см от края уплотнённого участка. При
множественных кистах молочной железы приходится проводить
более обширное удаление ткани молочной железы во избежание
дальнейших повторных оперативных вмешательств в связи с ростом
мелких фиброматозных очагов или кист. Между тем, оперативное
вмешательство устраняет следствие заболевания, а причина
возникновения опухоли остаётся. Поэтому после секторальной резекции
необходимо проведение длительной консервативной терапии. У
пациенток, не получавших длительного консервативного лечения
мастопатии, возникновение рака отмечено в 75 % случаев, а у
лечившихся женщин — в 25%.
При фиброаденомах лечебная тактика должна быть
индивидуализирована. Например, у молодых девушек и женщин в возрасте до 25 лет
при фиброаденомах до 2 см в диаметре желательно проводить
консервативную терапию и динамическое наблюдение. Беременность
может способствовать рассасыванию небольших фиброаденом (до 1 см).
Больным более старшего возраста показана вначале секторальная
резекция, а затем патогенетическая консервативная терапия на
протяжении 3—5 лет.
Профилактика
Первичная профилактика мастопатии заключается в полноценном
питании женщин, нормализации сексуальной жизни, своевременном
осуществлении ими детородной функции, грудном вскармливании
ребёнка.
Вторичная профилактика предполагает выявление и лечение
различных нарушений эндокринной системы, функций печени и
щитовидной железы, заболеваний женских половых органов.
РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
Во всех экономически развитых странах отмечается неуклонный
рост заболеваемости раком молочной железы, который с начала 80-х
годов XX века стал наиболее частой формой онкологической
патологии у женщин. В России в структуре заболеваемости злокачественными
новообразованиями у женщин рак молочной железы (РМЖ) вышел на
первое место и в 2000 г. составил 19,3%. В 2001 г. стандартизованный
показатель заболеваемости достиг 38,5 на 100 000 женского населения;
прирост по сравнению с 1992 г. составил 22,2%. Несмотря на
улучшение результатов лечения, смертность от рака молочной железы не
снижается из-за несвоевременной диагностики. В 2001 г. рак молочной
железы I—Па стадий диагностирован у 60% больных, в
трети случаев первично выявлен в поздние (III—IV) стадии заболевания.
Самая высокая заболеваемость раком молочной железы
зарегистрирована в США: 103 случая на 100 000 человек среди белого
населения (1997 г.). Этот показатель в Западной Европе значительно ниже,
максимален он во Франции (86 на 100 000). Самая низкая
заболеваемость отмечается в странах Африки (Алжир — 10 на 100 000) и Азии
(Таиланд — 14,6 на 100 000). Чаще всего заболевают женщины в
возрасте 50—60 лет. Рак грудной железы у мужчин — редкое
заболевание, составляет менее 1% числа этих опухолей у женщин.
Врачи любой специальности — терапевты, хирурги, гинекологи,
дерматологи и др. — должны проявлять онкологическую
настороженность и осматривать во время приёма молочные железы у женщин. При
подозрении на опухоль врач должен направить пациентку к
онкологу, который проведёт дообследование и установит точный диагноз.
Этиологические факторы
и предраковые заболевания
Всё многообразие факторов риска развития опухолей молочной
железы можно свести к трём основным группам.
1. Факторы, характеризующие состояние репродуктивной
системы организма женщины (менструальная, половая, детородная и
лактационная функции), а также сопутствующие заболевания женской
Рак молочной железы ♦ 373
половой сферы, оказывающие влияние на функционирование
данной системы. В районах с низкой заболеваемостью женщины
раньше начинают половую жизнь, не делают абортов, рано и часто рожают,
длительно кормят младенцев грудью. В местах с высокой
заболеваемостью женщины поздно вступают в половую жизнь, реже рожают,
часто имеют поздние роды, делают много абортов, рано прерывают
лактацию, менструации у них начинаются в более молодом возрасте.
Защитная роль лактации состоит в уменьшении эстрогенной
активности в этот период. Отсутствие лактации сопровождается
повышением риска возникновения рака молочной железы в 1,5 раза. Ранняя
первая беременность способствует резкому увеличению продукции
гормона эстриола, который является продуктом метаболизма эст-
радиола и эстрона, происходящего в печени. Эстриол тормозит
канцерогенное воздействие эстрадиола и эстрона. Под влиянием
различных заболеваний возникают расстройства функций яичников,
надпочечников, гипофиза. Наиболее значимы острые и хронические
воспаления яичников, дисфункция которых служит основой
развития предопухолевых процессов и рака молочной железы.
2. Генетические факторы (наличие злокачественных опухолей,
главным образом молочной железы, по линии отца или матери, т.е.
носительство генов BRCA-1 или BRCA-2). Наследственный РМЖ
встречается в 25% случаев.
3. Предшествующие и сопутствующие заболевания, связанные с
изменением эндокринно-обменного фона организма (гипотиреоз,
гиперкортицизм, сахарный диабет, раннее ожирение и т.п.).
Патоморфологня
Рак молочной железы развивается из эпителия млечных протоков
и альвеол. Патоморофологическая характеристика рака молочной
железы включает такие параметры, как размер первичного очага, его
локализацию в молочной железе, тип роста, морфологическое
строение, степень дифференцировки, наличие регионарных и
отдалённых метастазов.
Правая и левая молочные железы поражаются одинаково часто.
Размер первичного очага является показателем биологической
активности опухоли. С увеличением массы опухоли нарастает её агрессивность.
Опухоль чаще всего локализуется в верхненаружном квадранте
(60—65% больных), далее по частоте идут верхневнутренний квадрант
(12%), нижневнутренний (6%), нижненаружный (10%) и централь-
374 ♦ Хирургические болезни ♦ Том 2 ♦ Часть VI ♦ Глава 44
ный (12%). Локализация рака в молочной железе имеет
прогностическое значение. Расположение опухоли в верхненаружном
квадранте чаще приводит к метастазированию в подмышечные
лимфатические узлы, при локализации опухоли в центральном и медиальном
отделах метастазы в парастернальных лимфатических узлах
выявляют в 15-60% наблюдений.
Тип роста опухоли отражает степень её злокачественности.
Различают две основные формы рака: узловую и диффузную. Последняя
в свою очередь подразделяется на отёчно-инфильтративную,
панцирную и инфламаторную (мастито- и рожеподобную). Диффузные
формы рака обладают быстрым ростом и плохо поддаются лечению.
Темп роста опухоли характеризует степень агрессивности.
Клинически его определяют приблизительно, используя анамнестические
данные, по увеличению размера за определённые промежутки
времени. Различают быстрый рост — время удвоения размера опухоли
1-3 мес, средний — 3-12 мес, медленный —12 мес и более.
Морфологическое строение опухолей молочной железы имеет
определённое значение для прогноза заболевания. Наиболее часто (до
80%) встречается инвазивный протоковый рак.
Независимо от гистологического строения на основании степени
тканевой и клеточной атипии, определяемой признаками образования
канальцев, гиперхроматозом, митозами и полиморфизмом ядер,
выраженными в баллах, различают три степени злокачественности опухоли:
• I степень: 3-5 баллов (высокодифференцированный рак);
• II степень: 6—7 баллов (умереннодифференцированный рак);
• III степень: 8—9 баллов (низкодифференцированный и
недифференцированный рак).
Степень злокачественности опухоли имеет существенное
значение для прогноза заболевания.
Термин «мультицентричный рак» означает обнаружение
множественных фокусов неинвазивного или инвазивного рака в разных
(нескольких) квадрантах молочной железы. При мультицентрической
природе рака опухолевые фокусы развиваются синхронно в разных
квадрантах молочной железы. По различным данным, частота
наблюдаемой мультицентричности рака молочной железы колеблется от 2,4
до 75%. Столь значительная вариабельность объясняется различным
толкованием этого понятия.
Метастазирование рака молочной железы происходит главным
образом лимфогенным и гематогенным путями. Наиболее часто
отдалённые метастазы обнаруживают в костях, лёгких и плевре.
Рак молочной железы О 375
Различают три основных пути лимфогенного метастазирования
рака молочной железы.
• Подмышечный — по ходу лимфатических сосудов от подареоляр-
ного сплетения к подмышечным лимфатическим узлам. Этот путь
основной, поскольку в подареолярное сплетение попадает лимфа
от всех отделов молочной железы.
• Парастернальный — от глубоких отделов центральной и
медиальной частей железы по лимфатическим сосудам вдоль ветвей
внутренней грудной артерии в парастернальные лимфатические узлы.
• Подключичный — от лимфатических сплетений верхнезадних
отделов железы к подключичным лимфатическим узлам (уровни И—
III, минуя I).
При блокаде опухолевыми метастазами основных путей метаста-
зирование может происходить по ходу межрёберных сосудов к
задним межрёберным узлам, по кожной и подкожной лимфатическим
сетям в подмышечные лимфатические узлы противоположной
стороны, надключичные лимфатические узлы, по ходу ветвей
надчревных сосудов в печень, яичники, забрюшинные и паховые
лимфатические узлы.
Классификация
Классификация рака молочной железы по распространённости
процесса способствует составлению рационального плана лечения,
проведению единообразного учёта и оценки отдалённых результатов.
Новая классификация рака молочной железы по системе TNM
введена с января 2003 г.
Т — первичная опухоль
Tis — рак in situ.
Tla — опухоль до 0,5 см в наибольшем измерении.
Tib— опухоль до 1 см в наибольшем измерении.
Tic — опухоль до 2 см в наибольшем измерении.
Т2 — опухоль до 5 см в наибольшем измерении.
ТЗ — опухоль более 5 см в наибольшем измерении.
Т4 — опухоль любого размера с прямым распространением на
грудную стенку или кожую.
N — регионарные лимфатические узлы
Nx — недостаточно данных для оценки поражения регионарных
лимфатических узлов.
376 ♦ Хирургические болезни ♦ Том 2 ♦ Часть VI ♦ Глава 44
Стадия 0
Стадия I
Стадия ПА
Стадия ИВ
Стадия IIIA
Стадия IIIB
Стадия ШС
Стадия IV
Tis
Tl
ТО
Tl
Т2
Т2
ТЗ
ТО
Т1
Т2
ТЗ
ТЗ
Т4
Т4
Т4
Любая Т
Любая Т
N0
N0
N1
N1
N0
N1
N0
N2
N2
N2
N1
N2
N0
N1
N2
N3
Любая N
МО
МО
МО
МО
МО
МО
МО
МО
МО
МО
МО
МО
МО
МО
МО
МО
M 1
NO — нет метастазов в регионарных лимфатических узлах.
N1 — метастазы в смещаемых подмышечных лимфатических узлах
(на стороне поражения).
N2 — метастазы в подмышечных лимфатических узлах на стороне
Ь поражения, спаянные между собой или фиксированные, либо
клинически определяемые метастазы во внутригрудные
лимфатические узлы при отсутствии клинически явного
поражения подмышечных лимфатических узлов.
N3 — метастазы в подключичные лимфатические узлы на стороне
поражения либо клинически определяемые метастазы во внут-
ригрудные лимфатические узлы при наличии клинически
явного поражения подмышечных лимфатических узлов, либо
метастазы в надключичные лимфатические узлы на стороне
поражения (независимо от состояния подмышечных и внут-
ригрудных лимфатических узлов).
М — отдалённые метастазы
Мх — недостаточно данных для определения отдалённых метастазов.
МО — нет признаков отдалённых метастазов.
М1 — имеются отдалённые метастазы (включая метастазы в
надключичных лимфатических узлах).
Рак молочной железы О 377
G — степень дифференцировки ткани
Gx — степень дифференцировки нельзя установить.
G1 — высокая степень дифференцировки ткани.
G2 — умеренная степень дифференцировки ткани.
G3 — низкая степень дифференцировки ткани.
G4 — недифференцированная опухоль.
Клиническая симптоматика
Клиническая картина рака молочной железы разнообразна и
зависит от многих факторов — стадии заболевания, типа роста
опухоли, локализации её в молочной железе, наличия регионарных и
отдалённых метастазов.
Узловая форма
Узловая форма характеризуется наличием плотной бугристой
опухоли, обычно безболезненной, с неровной поверхностью и
нечёткими контурами. Морщинистость кожи над опухолью может
появляться уже на ранних стадиях рака. Этот симптом указывает, что опухоль
растёт наиболее интенсивно по направлению к коже. По мере
увеличения размера опухоли происходит втяжение кожи — симптом «ум-
биликации». Деформацию соска, его втяжение выявляют при
распространении опухоли по млечным протокам (рис. 44-1). Симптом
лимонной корки (рис. 44-2) — признак распространения
опухолевого процесса в глубоких кожных лимфатических щелях, при этом
Рис. 44-1. Деформация и
втяжение соска при раке
молочной железы.
378 О Хирургические болезни ♦ Том 2 ♦ Часть VI О Глава 44
Рис. 44-2. Отёчная форма рака
молочной железы. Определяется
симптом «лимонной корки».
появляется отёк кожи молочной железы. Неподвижность молочной
железы по отношению к большой грудной мышце указывает на
прорастание в неё опухоли.
Диффузные формы рака молочной железы
Диффузные формы рака молочной железы встречаются
сравнительно редко (2-4% всех больных раком молочной железы) и
подразделяются на отёчно-инфильтративную, панцирную и инфламаторную
(мастито- и рожеподобную).
1. Отёчно-инфильтративная форма рака чаще развивается у
молодых женщин в период беременности и лактации. Течение острое.
Боль чаще отсутствует. Характерен отёк ткани молочной железы и
кожи в результате распространения раковых клеток по внутри-
кожным лимфатическим сосудам и внутридольковым
лимфатическим щелям. В регионарных лимфатических узлах рано появляются
метастазы.
2. Панцирный рак: плотная инфильтрация распространяется на
железистую ткань, кожу и подкожную жировую клетчатку
железы. Молочная железа уменьшена в размерах, ограниченно
подвижна, кожа над ней уплотнена, поверхность неровная, напоминающая
панцирь.
3. Маститоподобный рак встречается у молодых женщин —
беременных и кормящих. Заболевание проявляется подъёмом
температуры тела, увеличением молочной железы, отёком, гиперемией кожи.
Болезнь быстро прогрессирует. Рано появляются метастазы.
4. Рожеподобный (эризипелоидный) рак протекает с
уплотнением молочной железы, её инфильтрацией, гиперемией кожи в виде
пятна с неровными, языкообразными краями, местным повышени-
Рак молочной железы ♦ 379
ем температуры. Опухолевый узел не выявляется при пальпации.
Раковые клетки распространяются преимущественно по внутрикож-
ным лимфатическим сосудам (раковый лимфангиит).
Рак соска молочной железы
Рак соска молочной железы (рак Педжета) — поверхностный рак
соска и ареолы молочной железы, проявляющийся гиперкератозом
вследствие интрадермального роста опухоли, а также мокнутием и эк-
земоподобными изменениями кожи с участками изъязвления. Рак
Педжета составляет 3—5% заболеваний раком молочной железы.
Опухоль развивается из эпителия млечных протоков, по которым и
распространяется в сторону соска, поражая его кожу и ареолу. В
дальнейшем в процесс инфильтрации вовлекаются глубоко расположенные
млечные протоки молочной железы, в ней появляется раковый узел.
Метастатическая форма
В редких случаях первым симптомом рака молочной железы
могут быть метастазы в регионарных лимфатических узлах. Такая
метастатическая, или скрытая (оккультная), форма рака наблюдается у 2%
больных раком молочной железы.
Диагностика
На сегодняшний день признанным эффективным комплексом
диагностики рака молочной железы являются клиническое
обследование, маммография, УЗИ, верификация рака с помощью
цитологического метода.
Клиническое обследование
Клиническое обследование слагается из осмотра и пальпации
молочных желёз и зон регионарного лимфооттока. Чувствительность
пальпации в выявлении рака молочной железы составляет 65—95%.
Обычно женщина сама обнаруживает опухоль в молочной железе.
При осмотре следует обращать внимание на симметричность,
размеры и форму молочных желёз, уровень стояния сосков,
деформации молочной железы, состояние кожи, соска и ареолы. Втяжения
соска, его деформация, мацерация или эрозия соска и ареолы (при
раке Педжета), кровянистые выделения из соска, нарушения
конфигурации молочной железы, втяжения кожи на различных её
участках (симптом «умбиликации»), частичный или тотальный отёк кожи
(симптом «лимонной» корки»), её гиперемия, уплотнение
(инфильтрация) ткани указывают врачу на возможность злокачественной
опухоли.
Осмотр следует проводить при опущенных руках, затем при
отведённых руках и руках, закинутых за голову. Вслед за осмотром
производят пальпацию, причём следует одинаково тщательно прощупывать
обе молочные железы. Вначале ощупывают молочные железы в
положении стоя (рис. 44-3). Изучают состояние сосков и ареол,
утолщение или уплотнение, наличие или отсутствие выделений из сосков,
их характер. Особенное внимание следует обратить на кровянистые
выделения, которые являются патогномоничным симптомом
внутри протоковой папилломы и рака молочной железы. Осторожно
собирая кожу молочной железы в складки, выявляют наличие или
отсутствие кожных симптомов — патологической морщинистости,
«площадки» или «умбиликации». После поверхностной пальпации
более глубоко изучают состояние молочных желёз. При этом ткань
молочных желёз последовательно захватывают между пальцами во всех
отделах, а также производят исследование кончиками пальцев. Это даёт
возможность выявить ограниченный участок уплотнения или опухоль
Рак молочной железы ♦ 381
в молочной железе. При обнаружении уплотнения или опухоли этот
участок молочной железы придавливают ладонью к грудной стенке
(удобнее при этом стоять позади больной). Если уплотнение не
исчезает, это свидетельствует о наличии рака или фиброаденомы
(симптом Кенига). В положении больной стоя определяют форму,
размеры, консистенцию, характер поверхности, отношение опухоли к
окружающим тканям, её подвижность, болезненность.
После исследования в вертикальном положении больную следует
уложить на кушетку и повторить осмотр в положении на спине и на
боку в той же последовательности. Пальпация молочной железы
одной ладонью в положении лёжа позволяет определить подвижность
опухоли (рис. 44-4). Её консистенция может быть оценена путём
пальпации, проводимой двумя пальцами (рис. 44-5). Уменьшение или
Рис. 44-4. Пальпация
молочной железы ладонью в
положении лёжа для
определения подвижности
опухоли.
Рис. 44-5. Консистенцию
опухоли оценивают при
пальпации опухоли двумя
пальцами.
исчезновение уплотнения в молочной железе (симптом Кенига)
свидетельствует о его доброкачественной природе. Смещение опухоли
вслед за соском при потягивании за последний говорит о
злокачественной природе опухоли (симптом Прибрама).
После тщательного исследования молочных желёз производят
осмотр и пальпациию регионарных зон (подмышечных, подлопаточ-
382 ♦ Хирургические болезни ♦ Том 2 ♦ Часть VI ♦ Глава 44
ных, надключичных и подключичных) с обеих сторон с целью
выявления возможно существующих метастазов в лимфатические узлы
(рис. 44-6).
Рентгеновская маммография
Рентгеновская маммография является высокоэффективным
методом диагностики. Исследование проводят в двух проекциях: прямой
и боковой. При маммографии различают первичные и вторичные
признаки злокачественности. Первичными и основными
рентгенологическими признаками РМЖ служат наличие опухолевой тени и
микрокальцинатов (рис. 44-7). Наиболее чётко тень опухоли диффе-
Рис. 44-6. Методика исследования Рис. 44-7. Маммограмма. Видна тень
подмышечных лимфатических узлов. опухоли диаметром 2,5 см.
ренцируется у женщин старшей возрастной группы на фоне инволю-
тивно изменённой ткани молочной железы. Тень опухоли, как
правило, неправильной, звёздчатой или амебовидной формы, с
неровными нечёткими контурами, характерной радиарной тяжистостью. Очень
часто опухолевый узел сопровождается «дорожкой» к соску и втяже-
нием последнего, утолщением кожи железы, иногда с её втяжением.
Одним из наиболее достоверных и ранних признаков рака
является наличие микрокальцинатов, являющихся отображением
отложения солей в стенке протока. Иногда они служат единственным
рентгенологическим проявлением раннего рака молочной железы.
Обычно микрокальцинаты размерами менее 1 мм напоминают песчинки.
Рак молочной железы ♦ 383
Чем их больше и чем онн мельче, тем выше вероятность рака. Мик-
рокальцинаты могут встречаться и при мастопатии, и даже в норме,
однако их характер значительно отличается от вышеописанного: их
немного, они значительно крупнее (свыше 3-5 мм), более
бесформенные и глыбчатые.
Точность маммографии колеблется от 79 до 94%,
чувствительность — 75—91 ^г. специфичность составляет около 40%.
Ограничения для проведения: фоновые изменения — отёк, фиброз, плотная
железистая ткань, небольшие размеры очага (менее 1 см). Как
показывает практика, маммография далеко не безразлична для тканей
молочной железы, особенно в молодом возрасте. Её невозможно
использовать при беременности. Нельзя не учитывать и такое явление,
как радиофобия.
Ультразвуковое исследование
Метод УЗИ совершенно безвреден для пациентов, атравматичен,
позволяет проводить многократные динамические исследования.
Эффективность его достигает 90—99%, снижаясь при инволютивных
изменениях и больших размерах молочной железы, она также
зависит от разрешающих способностей аппаратуры. Более
информативно УЗИ при изучении патологии молочных желёз у женщин в
молодом возрасте, при мастопатии, беременности, лактации.
Классическими ультразвуковыми критериями рака молочной
железы можно считать отражения сниженной интенсивности,
гетерогенность внутренней структуры, вариабельные нечёткие края, наличие
дистальных акустических теней различной интенсивности от задней
стенки. В настоящее время УЗИ стало обязательным методом
диагностики рака молочной железы и введено в схему обследования
сложных больных дополнительно к маммографии, либо применяется как
самостоятельный метод после проведения клинического осмотра.
Показания к проведению УЗИ
1. Обследование молочных желёз у пациенток с увеличенным
содержанием железистой фиброзной ткани (молодые женщины,
беременные и кормящие, подростки).
2. Уточнение характера пальпируемых образований (кист и
солидных опухолей).
3. Оценка неясных уплотнений в молочных железах.
4. Коррекция движении иглы при биопсии непальпируемых или
нечётко локализуемых опухолей.
5. Контроль за эффектом проводимого лечения.
6. Наблюдение за состоянием имплантированных протезов.
При направлении на УЗИ необходимо указать предварительный
диагноз и цель исследования, желательно провести маркировку
участка железы (на коже), подозрительного на наличие опухоли.
Цитологический метод
С помощью цитологического метода устанавливают правильный
диагноз у 97% больных. У 70% больных удаётся определить
гистологическую форму опухоли, а степень дифференцировки — почти у 90%.
Морфологическая верификация рака необходима при любом
подозрении на злокачественный процесс в молочной железе. Материал
для цитологического исследования получают при пункции опухоли,
выделениях из соска, соскобе с соска при раке Педжета.
Всем больным проводят также УЗИ печени, рентгенографию
грудной клетки, консультацию гинеколога, радионуклидную
визуализацию скелета (она позволяет на 2—12 мес раньше рентгенологического
исследования обнаружить метастазы в кости, а также
визуализировать их в большем, чем при рентгенографии, количестве).
Клиническое течение рака молочной железы трудно
предсказуемо. При одной и той же клинической стадии и гистологической
форме опухоли некоторые пациенты живут после хирургического
лечения много лет без рецидива заболевания, другие, несмотря на
проводимую комплексную терапию, быстро погибают. Вот почему
имеется насущная необходимость изучения агрессивности опухоли,
её биологической сущности, что позволит выявлять больных с
высоким риском местного рецидива и метастазирования, которым
необходимо проведение массивной адъювантной терапии.
Маркёры
Для решения задач ранней диагностики и выбора оптимальной
тактики лечения больных РМЖ ведётся поиск генетических,
биохимических и иммунологических маркёров опухолевых клеток,
способных «выявлять» наличие и прогрессирование опухолевого процесса.
Опухолевый маркёр — специфическое вещество, продуцируемое
злокачественными клетками или клетками «хозяина» в ответ на
присутствие злокачественной опухоли. В настоящее время достаточно
широко используют серологические опухолевые маркёры, представ-
Рак молочной железы
ляюшие собой, как правило, сложные белки, вырабатываемые и сек-
ретируемые в тканевые жидкости, в том числе в сыворотку крови, в
больших концентрациях опухолевыми клетками по сравнению с
нормальными. Наибольшей прогностической значимостью для больных
РМЖ отличаются такие опухолевые маркёры, как СА 15-3, РЭА, ТРА,
MCA, TPS, Tag 12.
Дифференциальная диагностика
Рак молочных желёз необходимо дифференцировать с различными
формами мастопатии, фиброаденомами, липомами, липогранулёма-
ми, галактоцеле, ангиоматозными опухолями, саркомами.
Значительные трудности возникают при дифференцировке маститоподобных
форм рака и острого мастита. Цитологическое исследование пункта-
та из уплотнения и выделений из сосков при их наличии может иметь
решающее значение в установлении правильного диагноза.
Туберкулёз и актиномикоз молочных желёз встречается редко, при этом чаще
всего имеется соответствующий диагноз. Заболевание
диагностируют по нахождению палочек Коха и друз актиномикоза в пунктатах из
образований. Поражения молочных желёз системными
заболеваниями (ретикулёзом, лимфогранулематозом, острым лейкозом)
никогда не бывают первичными.
Лечение
План лечения составляют с учётом стадии опухолевого процесса,
морфологической структуры опухоли, возраста больной,
сопутствующих заболеваний, общего состояния пациентки.
Применяют следующие методы лечения: хирургический,
комбинированный (сочетание операции с лучевой или лекарственной
терапией) и комплексный (сочетание операции с лучевой,
лекарственной и гормонотерапией).
Хирургический метод лечения
Хирургический метод лечения доминирует. В зависимости от
объёма удаляемых тканей различают следующие варианты операций.
1. Радикальная мастэктомия по Холстеду — удаление поражённой
молочной железы вместе с большой и малой грудными мышцами и
386 ♦ Хирургические болезни ♦ Том 2 ♦ Часть VI ♦ Глава 44
их фасциями, подключичной, подмышечной и подлопаточной
жировой клетчаткой с лимфатическими узлами (рис. 44-8). Показанием
к выполнению мастэктомии по Холстеду в недавнее время был рак
молочной железы всех стадий, но в последние годы к ней прибегают
только при опухолевой инфильтрации большой грудной мышцы.
2. Расширенная подмышечно-грудинная радикальная мастэктомия
предусматривает одноблочное удаление молочной железы с
грудными мышцами или без них, подключично-подлопаточной и
подмышечной жировой клетчаткой, а также с парастернальными
лимфатическими узлами и внутренними грудными сосудами, для удаления
которых резецируют два-три рёберных хряща по парастернальной
линии. Показанием к расширенной мастэктомии является рак,
расположенный во внутренних и центральном отделах молочной
железы при I, ПА, ИВ стадиях. Выявление во время мастэктомии
Рак молочной железы ♦ 387
множественных подмышечных метастазов делает иссечение парастер-
нальных лимфатических узлов нецелесообразным, так как это не
влияет на прогноз заболевания. В настоящее время разработана
значительно менее травматичная методика видеоторакоскопической
парастернальной лимфаденэктомии.
3, Сверхрадикальная расширенная мастэктомия предусматривает
удаление не только парастернального коллектора, но и
лимфатических узлов и клетчатки надключичной области и переднего
средостения. Данная операция не повышает выживаемость больных и
оставлена всеми хирургами.
4. Модифицированная радикальная мастэктомия по Пэйти-Дай-
сону (рис. 44-9) отличается от мастэктомии Холстеда сохранением
большой грудной мышцы или обеих грудных мышц. Обоснованием
для оставления грудных мышц явилась редкость наблюдений
прорастания их опухолью. При оставлении мышц мастэктомия протекает
менее травматично и с меньшей кровопотерей, послеоперационная
рана лучше заживает. Сохранение мышц приводит к лучшему
косметическому результату и не отражается на функции верхней
конечности. Поэтому такие операции получили название функционально-
388 ♦ Хирургические болезни ♦ Том 2 <0 Часть VI <^ Глава 44
щадящих. Показаниям для них являются не только начальные, но и
местно-распространённые стадии заболевания при условии
отсутствия инфильтрации опухолью грудных мышц.
5. Мастэктомия с подмышечной лимфаденэктомией может быть
как радикальным, так и паллиативным оперативным вмешательством.
Показанием к такой операции являются начальные (I—IIA) стадии
заболевания при локализации опухоли в наружных квадрантах
молочной железы у пожилых ослабленных больных с тяжёлыми
сопутствующими заболеваниями.
6. Простая мастэктомия — удаление молочной железы с фасцией
большой грудной мышцы с онкологических позиций не может быть
отнесена к радикальному онкологическому вмешательству.
Показаниями к такой операции являются распадающаяся опухоль,
преклонный возраст больной, тяжёлые сопутствующие заболевания.
7. Секторальная резекция молочной железы как самостоятельный
метод лечения при раке молочной железы не имеет обоснования к
выполнению. Она возможна при одиночных очагах неинвазивного
(in situ) рака.
До последнего времени онкологи, занимающиеся проблемой
лечения рака молочной железы, обращали внимание только на
показатели 5- и 10-летней выживаемости. Мало кто обращал внимание на
то, что для большинства больных излечение от рака достигается
путём выполнения калечащих операций, какими являются мастэкто-
мии Холстеда и (в меньшей степени) Пэйти—Дайсона. Подобные
операции имеют существенный недостаток — потерю молочной
железы, которая у многих, особенно молодых женщин, приводит к
тяжёлой психологической травме, нередко пагубно влияя на всю её
дальнейшую жизнь. Этот фактор явился одним из основных мотивов
к разработке новых подходов к лечению рака молочной железы,
связанных с уменьшением объёма оперативного вмешательства на
молочной железе, разработке органосохраняющей операции —
радикальной резекции молочной железы — в плане комбинированного
или комплексного лечения. Операция заключается в удалении
сектора ткани молочной железы с опухолью, отступя от её краёв не
менее чем на 3 см, в едином блоке с жировой клетчаткой
подмышечной, подлопаточной и подключичной областей с лимфатическими
узлами. При этих операциях, исходя из эстетической
целесообразности, необходимо сохранение не менее двух третей объёма железы.
Для выполнения подобных операций важно соблюдать критерии
отбора больных. Основными критериями являются: I и ПА стадии за-
Рак молочной железы 0 389
болевания, размер опухоли не более 3 см в наибольшем измерении,
медленный темп и моноцентричный характер роста опухоли, а также
желание больной сохранить молочную железу. Соблюдение этих
критериев ограничивает широкое применение таких операций.
Стремление одномоментно с выполнением радикального
онкологического вмешательства при раке молочной железы добиться
восстановления формы и объёма органа является перспективным
направлением модификации онкологических операций. Поэтому
достижения пластической хирургии в реконструкции молочный желёз
стали необычайно актуальными. Реконструкция молочной железы
может быть проведена как одномоментно с радикальной операцией
на железе, так и в отсроченном варианте. Одномоментная
реконструкция хотя и увеличивает тяжесть и длительность оперативного
вмешательства, в то же время не подвергает больную «психологическому
коллапсу», связанному с утратой молочной железы.
Современные методики реконструкции молочной железы после
мастэктомии сталкиваются со сложной задачей формирования
заново формы и объёма железы, создания сосково-ареолярного
комплекса. Поэтому разработаны радикальные оперативные вмешательства
на молочной железе, альтернативные мастэктомиям, которые
выполняются с одномоментной реконструкцией железы.
1. Субтотальная радикальная резекция молочной железы, при
которой удаляют от 75 до 90% ткани молочной железы с опухолью
вместе с жировой клетчаткой и лимфатическими узлами подмышечной,
подлопаточной, подключичной областей, с сохранением обеих
грудных мышц, сосково-ареолярного комплекса, субмаммарной складки
и части молочной железы.
2. Подкожная радикальная мастэктомия с удалением
сосково-ареолярного комплекса или без него — производят удаление всей
железистой ткани молочной железы в едином блоке с жировой клетчаткой
и лимфатическими узлами подмышечной, подлопаточной,
подключичной областей.
Возникающий дефект молочной железы восстанавливают кожно-
мышечным или мышечным лоскутами широчайшей мышцы спины,
кожно-жировыми лоскутами на прямой мышце живота, эндопроте-
зами или сочетанием их с аутотрансплантатами (рис. 44-10).
Возможность выполнения реконструктивных операций с хорошими
результатами не только способствует популяризации их среди хирургов и
пациенток, но и стимулирует совершенствование методик реконст-
руктивно-пластической хирургии.
390 ♦ Хирургические болезни ♦ Том 2 -О- Часть VI ♦ Глава 44
Лучевая терапия
Лучевая терапия является одной из основных составляющих
комплексного лечения больных раком молочной железы. Она способна
вызывать повреждения в химической структуре молекул (наиболее
важной в этом отношении является структура ДНК). Разнообразны цели
и задачи, формы и методики лучевого лечения, которые зависят от
клинической формы опухоли, гистологических и биологических её
особенностей, размеров первичного очага и распространённости по
регионарным лимфатическим узлам, объёма оперативного вмешательства.
Существует три способа применения лучевой терапии: облучение в
предоперационном периоде с последующим оперативным
вмешательством; операция с последующей лучевой терапией; лучевая терапия как
перед, так и после операции. Лучевая терапия показана при раке с
метастазами в регионарных лимфатических узлах, при изолированных
метастазах в кости и неоперабельных опухолях как подготовительный
этап к возможной операции. Чаще всего используют гамма-терапию.
Молочную железу облучают с двух встречных тангенциальных полей,
зоны регионарного метастазирования — через фигурное поле (надклю-
чично-подмышечное). Суммарная очаговая доза на основание
молочной железы составляет 60 Гр, на зоны регионарного лимфооттока —
45—48 Гр. Послеоперационное облучение начинают после полного
заживления раны. Время появления кожных лучевых реакций и их
тяжесть зависят от индивидуальных особенностей организма.
Появляющаяся эритема кожных покровов может перейти в сухой или влажный
эпидермит. Обычно кожные реакции в зависимости от их тяжести
проходят в течение 1—1,5 мес после облучения.
Рис. 44-10. Фото больной
после подкожной мастэктомии с
одномоментной
реконструкцией молочной железы.
Рак молочной железы О 391
Химиотерапия
Химиотерапия в отличие от лучевой терапии обладает не только
местным, но и обшим противоопухолевым иитостатическим
действием на раковые клетки, распространяющиеся гематогенно по всему
организму больной. Каждый химиопрепарат действует только на те
клетки, которые находятся в определённой фазе клеточного цикла.
Поэтому монохимиотерапия менее эффективна, чем
полихимиотерапия в виде сочетания нескольких препаратов с различной фазово-
специфичностью и механизмом действия.
Химиотерапию рекомендуют в тех случаях, когда имеются
метастазы в регионарных лимфатических узлах. Если химиотерапию
проводят после операции, её называют адъювантной и её целью
является длительное подавление микрометастазов рака. Если химиотерапию
предпринимают до операции, её основной целью является
уменьшение размеров опухоли, что создаёт более благоприятные
условия для выполнения хирургического вмешательства. Наиболее
эффективны при раке молочной железы циклофосфамид, метотрексат,
фторурацил, доксорубицин, препараты таксанового ряда. Чаще
всего применяют комбинированную химиотерапию: схемы CMF
(циклофосфамид, метотрексат, фторурацил) и CAF (циклофосфамид,
доксорубицин, фторурацил), АС (доксорубицин, циклофосфамид).
РАС (циклофосфамид, доксорубицин, фторурацил), ТАС
(доксорубицин, циклофосфамид, доцетаксел). Адъювантная химиотерапия
является неотъемлемым звеном лечебных мероприятий для
подавляющего большинства больных раком молочной железы, и от
качества её проведения во многом зависят отдалённые результаты
лечения больных.
Таксаны (паклитаксел, доцетаксел) эффективны и при
проведении второй линии химиотерапии, а также у многократно леченных
больных с резистентными к антрациклинам опухолями, т.е. в группе
пациенток, практически не имевших ранее перспектив влечении.
Основой комбинированной химиотерапии больных РМЖ
сегодня являются антрациклины. В настоящее время лишь таксаны
(паклитаксел и доцетаксел) могут претендовать на включение в первую
линию химиотерапии. Исследования показали, что комбинация док-
сорубицина и паклитаксела или доксорубицина и доцетаксела имеет
преимущество перед стандартными доксорубицин-содержащими
комбинациями с точки зрения как частоты объективных эффектов,
так и продолжительности жизни до прогрессирования и продолжи-
392 О Хирургические болезни ♦ Том 2 ♦ Часть VI ♦ Глава 44
тельности жизни в целом. «Расплатой» за эти преимущества служит
большая токсичность, в первую очередь гематологическая,
указанных схем.
Гормонотерапия
Гормонотерапия служит компонентом комплексного лечения
больных с распространёнными формами заболевания и направлена на
подавление продукции эстрогенов и фолликулостимулирующего
гормона гипофиза, стимулирующего рост рака молочной железы. В случае
гормонозависимой формы РМЖ гормонотерапия приводит к
замедлению роста опухоли, а у некоторых больных — к уменьшению уже
существующих опухолевых масс вплоть до их полного исчезновения.
Гормонотерапия эффективна в среднем у трети больных РМЖ. При
наличии в опухоли обоих видов рецепторов (эстрогеновых и про-
гестероновых) эффективность этого метода достигает 50—70%, если
присутствуют рецепторы одного вида (эстрогеновых или прогесте-
роновых), эффективность снижается до 33%, но даже в случае
рецептор-отрицательных опухолей в небольшом проценте случаев (около
11%) гормонотерапия может быть успешной.
На сегодняшний день «золотым стандартом» при проведении
гормонотерапии I линии по-прежнему остаётся тамоксифен,
относящийся к антиэстрогенам. Механизм действия тамоксифена обусловлен
блокадой эстрогенов на уровне рецепторов опухолевой клетки.
Назначают его по 20 мг/сут в течение длительного времени.
Кроме того, в настоящее время широко используют
нестероидные (аминоглутетимид) и стероидные ингибиторы ароматазы. В
отличие от антиэстрогенов, назначение которых допустимо при
сохранных функциях яичников, ингибиторы ароматазы нельзя
назначать менструирующим женщинам, поскольку снижение продукции
эстрогенов в жировой ткани и паренхиматозных органах
неизбежно приведёт к повышению их синтеза в функционирующих
яичниках, регуляция деятельности осуществляется по принципу
обратной связи.
Перспективно использование двух представителей ингибиторов
ароматазы третьего поколения — летрозола и анастрозола, которые
сегодня уже вошли в повседневную клиническую практику.
Результаты лечения аримидексом оказались лучше по сравнению с тамок-
сифеиом: частота объективного эффекта составила 59 и 46%, время
до лрогрессирования — 11 и 5,7 мес соответственно.
Рак молочной железы О- 393
Новые ингибиторы ароматазы (летрозол и анастрозол) сегодня
оттеснили позиции прогестинов во II (после антиэстрогенов) линии
гормонотерапии, благодаря не только большей эффективности, но и
меньшей токсичности.
Комбинированное и комплексное лечение
При неинвазивной карциноме in situ может быть применено одно
хирургическое лечение — секторальная резекция молочной железы.
При начальных формах рака молочной железы в I (T1N0M0) и ПА
(TON 1 МО, T1N1M0, T2N0M0) стадиях у больных с размерами
опухоли до 3 см проводят комбинированное или комплексное лечение:
выполняют радикальную резекцию молочной железы с
послеоперационным облучением, а по показаниям проводят химиотерапевти-
ческое лечение.
Больным ИВ (T2N1M0, T3N0M0) и ША (T0N2M0, T1N2M0,
T3N1M0) стадий проводят комплексное лечение, включающее
радикальную мастэктомию или реконструктивно-пластическую
операцию, лучевое лечение, химиогормональное лечение.
Больным с отёчно-инфильтративной формой рака молочной
железы ШВ (T4BN1—2М0) стадии проводят комплексное лечение:
два курса полихимиотерапии, лучевую терапию, радикальную
мастэктомию, адъювантную химиотерапию, а по показаниям и
гормонотерапию.
Рак молочной железы у мужчин
Рак молочной железы у мужчин — возникает чаще в пожилом
возрасте, обычно на фоне гинекомастии. В настоящее время можно
говорить о следующих условиях в генезе РМЖ у мужчин: наличие
андрогенной недостаточности, наблюдаемой в андропаузе, при крип-
торхизме, вторичной тестикулярной атрофии, а также нарушениях
обмена андрогенов и эстрогенов при циррозе печени и
печёночной недостаточности. В патогенезе РМЖ у мужчин многие
отмечают также роль наследственности, повторных травм, обменных
нарушений.
Малые размеры молочной железы создают условия для быстрого
распространения опухоли на окружающие ткани и метастазирования
в регионарные лимфатические узлы.
394 ♦ Хирургические болезни ♦ Том 2 ♦ Часть VI ♦ Глава 44
Лечение — на ранних стадиях показана радикальная мастэктомия
При наличии метастазов в регионарных лимфатических узлах
показано комбинированное или комплексное лечение.
Прогноз
Результаты лечения принято оценивать по 5-летней
выживаемости больных. Выживаемость больных во многом зависит от стадии
заболевания, при котором начато лечение. Современные методы
лечения позволяют получить 5-летнюю выживаемость при I стадии
рака - 96% больных, ПА - 90%, ИВ - 80%, ША - 87%, IIIB - 67%
(данные МНИОИ им. П.А. Герцена, 2000 г.).
1. Блохин Н.Н., Петерсон Б.Е. Клиническая онкология: т. 1-2. — М.:
Медицина, 1979.
2. Бураковский В.И., Бокерия ЛА. Сердечно-сосудистая хирургия.
Руководство. — М.: Медицина, 1996.
3. Григорьев Е.Г., Коган А.С Хирургия тяжелых гнойных процессов. —
Новосибирск: Наука, 2000.
4. Давыдовский И.В. Общая патология человека. - М.: Медицина, 1969.
5. Колесников И.С., Лыткин М.И. Хирургия легких и плевры. — Л.:
Медицина, 1988.
6. Лукомский Г.И., Шулутко М.Л., Виннер М.Г.У Овчинников А,А. Бронхо-
пульмонология. — М.: Медицина, 1982.
7. Мартынов А.И., Мухин НА., Моисеев B.C. Внутренние болезни: т. 1-
2. - ML: ГЭОТАР-МЕД, 2002.
8. Петровский Б.В. Избранные лекции по клинической хирургии. - М.:
Медицина, 1968.
9. Покровский А.В. Клиническая ангиология. Руководство для врачей:
т. 1-2. - М.: Медицина, 2004.
10. Савельев B.C. 50 лекций по хирургии. - М.: Триада-Х, 2004.
11. Савельев B.C. Флебология. - М.: Медицина, 2001.
12. ТрахтенбергА.Х., Чиссов В.И. Клиническая онкопульмонология. - М.:
ГЭОТАР-МЕД, 2000.
13. Федоров В.Д., Емельянов СИ. Хирургические болезни (руководство для
интернов). — М.: МИА, 2005.
14. Чадаев А.П.У Зверев А.А. Острый гнойный лактационный мастит. — М.:
Медицина, 2003.
15. Чиссов В.И.У Дарьялова С.Л. Избранные лекции по клинической
онкологии. - М.: Фонд паллиативной медицины, 2000.
16. Шевченко Ю.Л. Частная хирургия: т. 1—2. - СПб: Специальная
литература, 1998.
17. Щетинин В.В., Майстренко НА., Егиев В.Н. Новообразования
надпочечников. - М.: Медпрактика, 2002.
Абсцесс лёгкого 67
Альдостерома 333
Андростерома 336
Аневризма 211
аорты 216
Аортоартериит
неспецифический 197
Аритмии 172
Атеросклероз облитерирующий 196
Ахалазия пишевода 28
Болезнь
варикозная 285
Иценко-Кушинга 335
посттромбофлебитическая 285
сердца ишемическая 166
Бронхоэктазии 86
в
Варикотромбофлебит 229
Гангрена лёгкого 67
Гемопневмоторакс 11
Гемоторакс 10
Грыжа
пищеводного отверстия
диафрагмы 36
д
Дефект
межжелудочковой перегородки
129
межпредсердной перегородки
125
Дивертикулы пищевода 40
Дисфагия 27
Зоб 310
многоузловой 322
токсический диффузный 323
узловой 314
и
Изжога 27
Инфекционный эндокардит 137
Инциденталома 337
к
Кардиоспазм 28
Коарктация аорты 133
м
Мастит 342
абсцедирующий 346
беременных 359
гангренозный 348
инфильтративно-
абсцедирующий 347
лактационный 343
нелактационный 357, 359
новорождённых 360
серозный 345
флегмонозный 347
Мастопатия 362
диффузная 365, 366
узловая 367
Миксома 267
н
Недостаточность
аортальная 147
венозная хроническая 283
митрального клапана 142, 143
Непроходимость
артериальная острая 179
о
Одинофагия 27
п
Папиллома внутрипротоковая 362
Перикардит 156
выпотной 156
гнойный 157
констриктивный 157
слипчивый 156
фибринозный 159
Пневмоторакс 11
открытый 12
Повреждения
лёгких 19
пищевода 43
Предметный указатель Ф- 397
Пороки врождённые сердца 121
Проток артериальный открытый
122, 123
Р
Разрыв аневризмы 223
Рак
коры надпочечников 338
лёгкого 88, 91
молочной железы 372
Педжета 377, 379
пищевода 56
Ревматизм 137
Регургитация 27
Рефлюкс-эзофагит 36
с
Свищи
пищевода 44
Синдром
Барсони-Тешендорфа 34
Кушинга 335
Лериша 198
паранеопластический 101
Стеноз
аортальный 145
митральный 137
т
Тампонада сердца 156
Тетрада Фалло 131
Травма
аорты 21
груди 8
сердца 20
трахеи 19, 20
Тромбангиит облитерирующий 197
Тромбоз
венозный 227
острый 179
Тромбоэмболия 180
Тромбоэмболия лёгочных артерий
261
Ф
Феохромоцитома 338
Фиброаденома молочной железы
362, 367
Эмболия 179
Эмфизема
подкожная 11
средостения 11
Эндокардит
инфекционный 150
Язва трофическая 307
Учебное издание
ХИРУРГИЧЕСКИЕ
БОЛЕЗНИ
II том
Подписано в печать 01.12.05. Формат 60х90'/16-
Бумага офсетная. Печать офсетная. Объем 25 п.л
Тираж 5000 экз. Заказ № 3016.
Издательская группа «ГЭОТАР-Медиа».
119828, Москва, ул. Малая Пироговская, 1а,
тел./факс: (095) 101-39-07,
info@geotar.ru, http://www.geotar.ru
Отпечатано в ОАО «Типография "Новости"».
105005, Москва, ул. Ф. Энгельса, 46.
ISBN 5-9704-0153-6
9 7в5970'Ч0153в